RU2412166C1 - Cytotoxic linear heterocyclic derivatives of anthracenedione having in side chain cyclic diamines, active towards tumour cells with multidrug resistance - Google Patents
Cytotoxic linear heterocyclic derivatives of anthracenedione having in side chain cyclic diamines, active towards tumour cells with multidrug resistance Download PDFInfo
- Publication number
- RU2412166C1 RU2412166C1 RU2009122411/04A RU2009122411A RU2412166C1 RU 2412166 C1 RU2412166 C1 RU 2412166C1 RU 2009122411/04 A RU2009122411/04 A RU 2009122411/04A RU 2009122411 A RU2009122411 A RU 2009122411A RU 2412166 C1 RU2412166 C1 RU 2412166C1
- Authority
- RU
- Russia
- Prior art keywords
- alkyl
- amino
- group
- methyl
- dione
- Prior art date
Links
- 0 *=CCC1CN(Cc2c[n]c(c(O)c3C(c4ccccc44)=O)c2c(O)c3C4=O)CC1 Chemical compound *=CCC1CN(Cc2c[n]c(c(O)c3C(c4ccccc44)=O)c2c(O)c3C4=O)CC1 0.000 description 1
- VIWFVVNPTSSQSC-UHFFFAOYSA-N CC(C)(C)OC(N(CC1)CC1NCc(c1c(c(C(c2ccccc22)=O)c3C2=O)NCCNC)c[s]c1c3OC)=O Chemical compound CC(C)(C)OC(N(CC1)CC1NCc(c1c(c(C(c2ccccc22)=O)c3C2=O)NCCNC)c[s]c1c3OC)=O VIWFVVNPTSSQSC-UHFFFAOYSA-N 0.000 description 1
- HPIWKAZDFHQXBE-UHFFFAOYSA-N CCC(C1)N=CC1NCc1c[nH]c(c(O)c2C(c3c4cccc3)=O)c1c(NCCNC)c2C4=O Chemical compound CCC(C1)N=CC1NCc1c[nH]c(c(O)c2C(c3c4cccc3)=O)c1c(NCCNC)c2C4=O HPIWKAZDFHQXBE-UHFFFAOYSA-N 0.000 description 1
- QBEBJCPIVUDRFM-UHFFFAOYSA-N CNCCNc(c(C(c1ccccc11)=O)c2C1=O)c(c(CN1C(C3)C=NC3C1)c[nH]1)c1c2O Chemical compound CNCCNc(c(C(c1ccccc11)=O)c2C1=O)c(c(CN1C(C3)C=NC3C1)c[nH]1)c1c2O QBEBJCPIVUDRFM-UHFFFAOYSA-N 0.000 description 1
- LSGIXBHSKMUNNP-UHFFFAOYSA-N NCc(c1c(c(C(c2ccccc22)=O)c3C2=O)O)c[nH]c1c3O Chemical compound NCc(c1c(c(C(c2ccccc22)=O)c3C2=O)O)c[nH]c1c3O LSGIXBHSKMUNNP-UHFFFAOYSA-N 0.000 description 1
- OXGGLHDXLPJMDZ-UHFFFAOYSA-N Oc(c(C(c1ccccc11)=O)c2C1=O)c(c(CN1C(C3)C=NC3C1)c[nH]1)c1c2O Chemical compound Oc(c(C(c1ccccc11)=O)c2C1=O)c(c(CN1C(C3)C=NC3C1)c[nH]1)c1c2O OXGGLHDXLPJMDZ-UHFFFAOYSA-N 0.000 description 1
Landscapes
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
Description
Изобретение относится к фармацевтической промышленности и касается линейных тетрациклических гетероциклических производных антрахинона (гетероциклические аналоги 5,12-нафтаценхинона), их структуры, методов получения и медицинского использования в качестве цитотоксических агентов.The invention relates to the pharmaceutical industry and relates to linear tetracyclic heterocyclic derivatives of anthraquinone (heterocyclic analogues of 5,12-naphthaquinquinone), their structure, methods of preparation and medical use as cytotoxic agents.
Известно, что выделенные из некоторых штаммов микроорганизмов производные 5,12-нафтаценхинона и ряд их синтетических аналогов обладают высокой биологической активностью. Антрациклиновые антибиотики, являющиеся гликозидами тетрагидронафтаценхинона, например доксорубицин, карминомицин, идарубицин (формулы 1а-в), используется в химиотерапии для лечения широкого спектра онкологических заболеваний [Гаузе Г.Ф. Противоопухолевые антибиотики. - М.: Медицина, 1987, 18-48]. Также известны тетрациклические линейные производные антрахинона с аннелированным бензольным или гетероциклическим ядром А, обладающие высокой цитотоксичностью. Так, антибиотики UCE6 и топопирон В (формулы 2а, б) превосходят по активности препарат сравнения камптотецин [Fujii N., et. al. Molecular Pharmacology, 1997, 57, 269; Khan Q.A., et. al. J. Amer. Chem. Soc., 2008, 130, 12888].It is known that derivatives of 5,12-naphthacenquinone and a number of their synthetic analogues isolated from certain strains of microorganisms have high biological activity. Anthracycline antibiotics, which are tetrahydronaphthacinquinone glycosides, for example, doxorubicin, carminomycin, idarubicin (formulas 1a-c), are used in chemotherapy to treat a wide range of oncological diseases [Gauze G.F. Antitumor antibiotics. - M .: Medicine, 1987, 18-48]. Also known are tetracyclic linear derivatives of anthraquinone with annelated benzene or heterocyclic nucleus A, which have high cytotoxicity. So, the antibiotics UCE6 and topopyron B (formulas 2a, b) are superior in activity to the comparison drug camptothecin [Fujii N., et. al. Molecular Pharmacology, 1997, 57, 269; Khan Q.A., et. al. J. Amer. Chem. Soc., 2008, 130, 12888].
Наряду с ценными свойствами клинически значимые антрациклины имеют некоторые недостатки, основными из которых являются высокая кардиотоксичность и развитие множественной лекарственной устойчивости (МЛУ) в опухолевых клетках. В связи с этим ведутся исследования по химической модификации природных антибиотиков и синтезу новых препаратов с улучшенными химиотерапевтическими свойствами. Поиски более доступных и эффективных противоопухолевых препаратов с пониженной кардиотоксичностью привели к появлению антрациклинов и их аналогов нового поколения. Однако для всех соединений этого класса, разрешенных к клиническому использованию, характерна низкая активность в отношении опухолевых клеток с МЛУ, что зачастую значительно ограничивает их терапевтический потенциал. [Hill В.Т., et al. Cancer Chemolher. Pharmacol. 1989, 23, 140]. Известно, что экспрессия трансмембранного транспортера Р-гликопротеина (Pgp) и инактивация р53-опосредованного пути программируемой гибели клеток (апоптоза) являются наиболее распространенными механизмами развития МЛУ опухолевых клеток при химиотерапии [Sarkadi В., et al. FEBS Lett. 2004, 567 (1), 116]. Поэтому для создания противоопухолевых средств нового поколения особенно интересны препараты, активные в отношении клеточных линий с генетически детерминированными механизмами МЛУ. Несмотря на обширные поиски противоопухолевых агентов в ряду антрациклиновых антибиотиков и производных антрахинонов, приведшие к открытию синтетических аналогов антрациклинов (например, препаратов митоксантрона и аметантрона (3а-б) [Zee-Cheng, R.К.Y.; Cheng С.С. Drugs Future. 1983, 8, 228]), биологическая активность линейных гетероциклических производных антрацендиона осталась малоизученной.Along with valuable properties, clinically significant anthracyclines have some disadvantages, the main of which are high cardiotoxicity and the development of multidrug resistance (MDR) in tumor cells. In this regard, studies are underway on the chemical modification of natural antibiotics and the synthesis of new drugs with improved chemotherapeutic properties. The search for more affordable and effective antitumor drugs with reduced cardiotoxicity has led to the emergence of a new generation of anthracyclines and their analogues. However, all compounds of this class, approved for clinical use, are characterized by low activity against tumor cells with MDR, which often significantly limits their therapeutic potential. [Hill V.T., et al. Cancer Chemolher. Pharmacol 1989, 23, 140]. It is known that expression of the transmembrane transporter of P-glycoprotein (Pgp) and inactivation of the p53-mediated pathway of programmed cell death (apoptosis) are the most common mechanisms for the development of MDR of tumor cells during chemotherapy [Sarkadi B., et al. FEBS Lett. 2004, 567 (1), 116]. Therefore, drugs that are active against cell lines with genetically determined MDR mechanisms are especially interesting for creating new-generation antitumor agents. Despite the extensive search for antitumor agents in the series of anthracycline antibiotics and anthraquinone derivatives, which led to the discovery of synthetic analogues of anthracyclines (for example, mitoxantrone and amethantrone preparations (3a-b) [Zee-Cheng, R.K.Y .; Cheng, C.S. Drugs Future. 1983, 8, 228]), the biological activity of linear heterocyclic derivatives of anthracenedion remained poorly understood.
Настоящее изобретение призвано получить новые линейные тетрациклические производные антрацендиона с гетероциклическим кольцом А, обладающие цитотоксическими свойствами и активные в отношении опухолевых клеток с активированными механизмами резистентности. Настоящее изобретение включает соединения, соответствующие формуле 4, и их фармакологически приемлемые соли, пригодные для терапии онкологических заболеваний:The present invention is intended to obtain new linear tetracyclic derivatives of anthracenedion with a heterocyclic ring A, possessing cytotoxic properties and active against tumor cells with activated resistance mechanisms. The present invention includes compounds corresponding to formula 4, and their pharmacologically acceptable salts, suitable for the treatment of cancer:
где W - означает фрагмент пятичленного гетероциклического ядра (кольцо А), конденсированного с антрацендионовым ядром по связи 2-3 (кольца B-D) и являющегося гетероциклом, содержащим от одного до трех гетероатомов, выбранных из N, О, S, и не менее трех атомов углерода, два из которых общие с антрацендионовым ядром, а третий связан с функциональной группой X. Примеры гетероциклического ядра (кольцо А) включая фрагмент пиррола, фурана, тиофена, пиразола, изоксазола, изотиазола, не обязательно замещенный заместителем, выбранным из алкила, алкокси, амино, аминоалкила, ациламино, ацилокси, галогена, галогеналкила, гидрокси, гидроксиалкила, имино, оксо. Подразумевается, что кратные связи в гетероциклическом фрагменте могут принимать различные резонансные формы;where W is a fragment of a five-membered heterocyclic nucleus (ring A) condensed with an anthracenedione nucleus in a bond of 2-3 (BD rings) and being a heterocycle containing from one to three heteroatoms selected from N, O, S, and at least three atoms carbon, two of which are common with the anthracenedione nucleus, and the third is linked to functional group X. Examples of a heterocyclic nucleus (ring A) including a pyrrole, furan, thiophene, pyrazole, isoxazole, isothiazole fragment optionally substituted with a substituent selected from alkyl, alkoxy, ami o, aminoalkyl, acylamino, acyloxy, halo, haloalkyl, hydroxy, hydroxyalkyl, imino, oxo. It is understood that multiple bonds in a heterocyclic fragment can take various resonant forms;
Y - означает остаток диамина, являющегося моноциклическим диамином, содержащим экзоциклическую аминогруппу, или полициклическим диамином, содержащим мостиковые аминогруппы. Примеры моноциклических диаминов с экзоциклическими аминогруппами, используемыми в настоящем изобретении в фрагменте Y формулы 4, включают аминопроизводные азетидина, пирролидина, пиперидина, гомопиперидина и т.п. Бициклические диамины, которые могут быть использованы в настоящем изобретении в фрагменте Y формулы 4, представляют собой соединения, в которых две аминогруппы вовлечены в образование 4- и 6-членных кольцевых систем, содержащих от 2 до 6 атомов углерода и связанных между собой одним, двумя или тремя мостиковыми атомами. Предпочтительные примеры диаминов Y включают соединения формул 5-8 (моноциклические диамины с экзоциклическими аминогруппами) и 9-11 (полициклические диамины с мостиковыми аминогруппами).Y - means the remainder of the diamine, which is a monocyclic diamine containing an exocyclic amino group, or a polycyclic diamine containing bridging amino groups. Examples of monocyclic diamines with exocyclic amino groups used in the present invention in fragment Y of formula 4 include amino derivatives of azetidine, pyrrolidine, piperidine, homopiperidine and the like. The bicyclic diamines that can be used in the present invention in fragment Y of formula 4 are compounds in which two amino groups are involved in the formation of 4- and 6-membered ring systems containing from 2 to 6 carbon atoms and connected by one, two or three bridging atoms. Preferred examples of diamines Y include compounds of formulas 5-8 (monocyclic diamines with exocyclic amino groups) and 9-11 (polycyclic diamines with bridging amino groups).
Диамин Y может быть необязательно замещенный одним или несколькими заместителями, связанными с остатком диамина через атом азота или углерода, выбранными из алкила, алкенила, алкокси, арила, ацила, галогена, галогеналкила, гетероарила, гидрокси, гидроксиалкила, карбамоила, карбоксиалкила, циклоалкила. Очевидно, что некоторые циклические диамины могут существовать в виде стереоизомеров. Настоящее изобретение включает все возможные стереоизомеры и геометрические изомеры в виде оптически чистых соединений или смесей с различным содержанием оптических изомеров, включая их рацемические смеси.Diamine Y may be optionally substituted with one or more substituents linked to the diamine moiety through a nitrogen or carbon atom selected from alkyl, alkenyl, alkoxy, aryl, acyl, halogen, haloalkyl, heteroaryl, hydroxy, hydroxyalkyl, carbamoyl, carboxyalkyl, cycloalkyl. Obviously, some cyclic diamines may exist as stereoisomers. The present invention includes all possible stereoisomers and geometric isomers in the form of optically pure compounds or mixtures with different contents of optical isomers, including racemic mixtures thereof.
X означает спейсерную группу, связывающую остаток указанного диамина Y с указанным гетероциклическим ядром А тетрациклического производного антрацендиона, выбранную из алкилена, СО, SO, SO2.X is a spacer group linking the remainder of said diamine Y to said heterocyclic nucleus A of a tetracyclic derivative of anthracenedione selected from alkylene, CO, SO, SO 2 .
n и m означает число заместителей Z1 и Z2 в антрацендионовом фрагменте, независимо равное от 0 до 2.n and m mean the number of substituents Z 1 and Z 2 in the anthracenedione fragment, independently equal to from 0 to 2.
Заместители Z1 в кольце В соединений формулы 4 означают заместители, независимо выбранные из алкила, алкокси, амино, аминоалкиламино, ациламино, галогена, галогеналкила, гидрокси, нитро, алкилсульфониламино.The substituents Z 1 in ring B of the compounds of formula 4 mean substituents independently selected from alkyl, alkoxy, amino, aminoalkylamino, acylamino, halogen, haloalkyl, hydroxy, nitro, alkylsulfonylamino.
Кольцо D соединений формулы 4 необязательно содержит заместители Z, независимо выбранные из группы: гидрокси, алкокси, фтор. Известно, что наличие таких групп в пери-положениях хинонового фрагмента (например, в кольце D антрациклинов la-в или в кольце С их синтетических аналогов 3а-б), не вызывающих существенных стерических затруднений при связывании с ДНК, в ряде случаев приводит к росту или к изменению спектра противоопухолевой активности антрахинонсодержащих препаратов [Lown J.W. (Ed.) Anthracycline and Anthracendione based Anticancer Agents (Bioactive molecules), Elsevier, Science Publishers B.V.: Amsterdam, 1988, 6, 738 pp; Krohn K. (Ed.) Anthracycline chemistry and biology II. Mode of action, clinical aspects and new drugs. In Topics Current Chemistry; Springer: Heidelberg, 2008, 283, 224 pp; Swenton J.S. et. al. US pat. №4663445].Ring D of compounds of formula 4 optionally contains Z substituents independently selected from the group: hydroxy, alkoxy, fluoro. It is known that the presence of such groups at the positions of the quinone fragment (for example, in ring D of anthracyclines la-b or in ring C of their synthetic analogues 3a-b), which do not cause significant steric difficulties in binding to DNA, in some cases leads to growth or a change in the spectrum of antitumor activity of anthraquin-containing drugs [Lown JW (Ed.) Anthracycline and Anthracendione based Anticancer Agents (Bioactive molecules), Elsevier, Science Publishers B.V .: Amsterdam, 1988, 6, 738 pp; Krohn K. (Ed.) Anthracycline chemistry and biology II. Mode of action, clinical aspects and new drugs. In Topics Current Chemistry; Springer: Heidelberg, 2008, 283, 224 pp; Swenton J.S. et. al. US pat. No. 4663445].
Очевидно, что соединения формулы 4 могут существовать в форме таутомеров, отличающихся положением кратных связей и атомов водорода, и подразумевается, что настоящее изобретение включает все таутомерные формы соединений.Obviously, the compounds of formula 4 can exist in the form of tautomers that differ in the position of multiple bonds and hydrogen atoms, and it is intended that the present invention include all tautomeric forms of the compounds.
Кроме того, настоящее изобретение относится к применению таких соединений в качестве терапевтически активных для лечения заболеваний человека, связанных с повышенной скоростью роста клеток (т.е. гиперпролиферацией), прежде всего онкологических заболеваний различного генеза. В дополнение к настоящему изобретению относится способ лечения, заключающийся во введении указанной выше фармацевтической композиции субъекту с заболеванием.In addition, the present invention relates to the use of such compounds as therapeutically active for the treatment of human diseases associated with an increased cell growth rate (i.e., hyperproliferation), especially oncological diseases of various origins. In addition to the present invention, there is provided a method of treatment comprising administering the above pharmaceutical composition to a subject with a disease.
Соединения по настоящему изобретению могут быть получены различными способами, некоторые из них, описанные ниже, лишь иллюстрируют методы их синтеза и модификации функциональных групп. Исходные материалы и реагенты, которые используются при получении соединений формулы 4, являются коммерческими химическими препаратами, поставляемыми фирмами, такими как Aldrich Chemical Co., или их можно получить методами, известными специалисту в данной области, по методикам, описанным в литературе, при необходимости используя защитные группы.The compounds of the present invention can be obtained in various ways, some of which are described below only illustrate the methods for their synthesis and modification of functional groups. The starting materials and reagents used in the preparation of compounds of formula 4 are commercial chemicals supplied by firms such as Aldrich Chemical Co., or they can be prepared by methods known to one skilled in the art, by the procedures described in the literature, using, if necessary protective groups.
Если не указано иное, реакции, приведенные в описании заявки, проводят при атмосферном давлении от приблизительно -78°С до 180°С в инертном растворителе или без него.Unless otherwise indicated, the reactions described in the application description are carried out at atmospheric pressure from about −78 ° C. to 180 ° C. in or without an inert solvent.
Типичные схемы получения соединений по настоящему изобретению основаны на взаимодействии тетрациклических линейных гетероциклических производных антрахинона, содержащих в боковой цепи группу -X-LG, с циклическими диаминами, содержащими остаток Y (схема А). При этом подразумевается, что LG означает уходящую группу, например, алкилсульфонилокси, амино, арилсульфонилокси, ацилокси, галоген, триалкиламонийную группы и т.п. Кроме того, подразумевается, что диамин Y, так же как и гетероциклическое производное антрахинона, может необязательно содержать защитные или активирующие группы для повышения эффективности синтеза, удаляемые или модифицируемые на последующих стадиях синтеза.Typical schemes for the preparation of the compounds of the present invention are based on the interaction of tetracyclic linear heterocyclic derivatives of anthraquinone containing an —X-LG group in the side chain with cyclic diamines containing residue Y (Scheme A). It is understood that LG means a leaving group, for example, alkylsulfonyloxy, amino, arylsulfonyloxy, acyloxy, halogen, trialkylammonium groups and the like. In addition, it is understood that diamine Y, as well as the heterocyclic derivative of anthraquinone, may optionally contain protective or activating groups to increase the efficiency of the synthesis, removed or modified in subsequent stages of the synthesis.
Схема АScheme A
В других, менее предпочтительных вариантах схемы синтеза соединений формулы 4, возможно образование гетероциклического фрагмента (кольца А) циклизацией производных антрацендиона с соединениями, содержащими фрагмент диамина Y, или образование колец B-D, циклизацией ациклических или циклических полупродуктов, содержащих остаток диамина Y и один, два или три цикла конечной конденсированной тетрадиклической системы соединений формулы 4.In other less preferred embodiments of the synthesis scheme for compounds of formula 4, the formation of a heterocyclic fragment (ring A) is possible by cyclization of anthracenedione derivatives with compounds containing a diamine Y fragment, or the formation of BD rings, cyclization of acyclic or cyclic intermediates containing a diamine Y residue and one, two or three cycles of a final condensed tetradicyclic system of compounds of formula 4.
Если не указано иное, формы единственного числа, используемые в описании и пунктах формулы, включают также формы множественного числа.Unless otherwise indicated, the singular forms used in the description and claims also include the plural forms.
Термины, используемые в описании заявки и пунктах формулы изобретения, имеют значения, указанные ниже.The terms used in the description of the application and the claims have the meanings indicated below.
"Алкил" означает одновалентный насыщенный углеводородный радикал с прямой или разветвленной цепью, включающий только атомы углерода и водорода и содержащий от 1 до 6 атомов углерода включительно. Примеры алкильных радикалов включают метил, этил, пропил, изопропил, изобутил, втор-бутил, трет-буил, пентил, неопентил, гексил и т.п.“Alkyl” means a straight or branched chain monovalent saturated hydrocarbon radical containing only carbon and hydrogen atoms and containing from 1 to 6 carbon atoms, inclusive. Examples of alkyl radicals include methyl, ethyl, propyl, isopropyl, isobutyl, sec-butyl, tert-butyl, pentyl, neopentyl, hexyl and the like.
"Алкенил" означает одновалентный углеводородный радикал, содержащий от 2 до 6 атомов углерода, включающий, по меньшей мере, одну двойную связь, например, этенил, пропенил, аллил и т.п."Alkenyl" means a monovalent hydrocarbon radical containing from 2 to 6 carbon atoms, including at least one double bond, for example, ethenyl, propenyl, allyl, and the like.
"Алкилен" означает насыщенный двухвалентный углеводородный радикал с прямой цепью, содержащий от 1 до 6 атомов углерода, или насыщенный двухвалентный углеводородный радикал с разветвленной цепью, содержащий от 3 до 6 атомов углерода. Например, С2-С3 алкилен включает метилен, этилен, 2,2-диметилэтилен, пропилен, 2-метилпропилен.“Alkylene” means a straight chain saturated divalent hydrocarbon radical containing from 1 to 6 carbon atoms or a branched chain saturated divalent hydrocarbon radical containing from 3 to 6 carbon atoms. For example, C2-C3 alkylene includes methylene, ethylene, 2,2-dimethylethylene, propylene, 2-methylpropylene.
"Алкокси" означает радикал -OR, где R - указанный выше алкильный радикал. Примеры алкоксирадикалов включают метокси, этокси, изопропокси и т.п."Alkoxy" means the radical -OR, where R is the above alkyl radical. Examples of alkoxy radicals include methoxy, ethoxy, isopropoxy, and the like.
"Алкилсульфонилокси" означает радикал -OSO2R, где R означает алкильную группу, указанную выше.“Alkylsulfonyloxy” means the radical —OSO 2 R, where R is an alkyl group as defined above.
"Алкилтио" означает радикал -SR, где R - указанный выше алкил. Примеры алкилтиорадикала включают метилтио, этилтио и т.п.“Alkylthio” means the radical —SR, where R is the above alkyl. Examples of the alkylthio radical include methylthio, ethylthio and the like.
"Амино" означает группы -NH2, -NHR1, -NR1R2, где R1 и R2 каждый независимо означает алкильные радикалы. Примеры аминорадикалов включают, метиламино, этиламино, диметиламино, метилэтиламино, диэтиламино и т.п.“Amino” means the groups —NH 2 , —NHR 1 , —NR 1 R 2 , where R 1 and R 2 each independently mean alkyl radicals. Examples of amino radicals include methylamino, ethylamino, dimethylamino, methylethylamino, diethylamino, and the like.
"Аминоалкил" означает алкильный радикал, указанный выше, замещенный аминогруппой, указанной выше. Примеры аминоалкильных радикалов включают аминометил, метиламинометил, диметиламинометил и т.п.“Aminoalkyl” means an alkyl radical as defined above substituted by an amino group as defined above. Examples of aminoalkyl radicals include aminomethyl, methylaminomethyl, dimethylaminomethyl and the like.
"Аминоалкиламино" означает насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от одного до шести атомов углерода, связанный с двумя аминогруппами, указанными выше, при условии, что к одному углеродному атому присоединено не более одной аминогруппы. Примеры аминоалкиламино радикалов включают 2-аминоэтиламино, 2-(метиламино)этиламино, 2-(этиламино)этиламино, 2-[(2-гидроксиэтил)амино]этиламино, 2-(диметиламино)этиламино, 2-аминопропиламино, 3-аминопропиламино.“Aminoalkylamino” means a straight or branched chain saturated hydrocarbon radical containing from one to six carbon atoms bonded to the two amino groups indicated above, provided that no more than one amino group is attached to one carbon atom. Examples of aminoalkylamino radicals include 2-aminoethylamino, 2- (methylamino) ethylamino, 2- (ethylamino) ethylamino, 2 - [(2-hydroxyethyl) amino] ethylamino, 2- (dimethylamino) ethylamino, 2-aminopropylamino, 3-aminopropylamino.
"Арил" означает одновалентный циклический ароматический углеводородный радикал, содержащий один или более конденсированных циклов, из которых, по меньшей мере, один цикл является ароматическим, который необязательно замещен заместителем, выбранным из группы, включающей алкил, амино, аминосульфонил, алкокси, алкилтио, галоген, галогеналкил, гидрокси, гидроксиалкил, гетероарил, нитро, карбоксиалкил, карбамоил, сульфониламино и/или циано. Примеры арильных радикалов включают, фенил, нафтил, бифенил и т.п.“Aryl” means a monovalent cyclic aromatic hydrocarbon radical containing one or more condensed rings, of which at least one ring is aromatic, which is optionally substituted with a substituent selected from the group consisting of alkyl, amino, aminosulfonyl, alkoxy, alkylthio, halogen , haloalkyl, hydroxy, hydroxyalkyl, heteroaryl, nitro, carboxyalkyl, carbamoyl, sulfonylamino and / or cyano. Examples of aryl radicals include phenyl, naphthyl, biphenyl, and the like.
"Арилсульфонилокси" означает радикал -OSO2R, где R означает арильную группу, указанную выше.“Arylsulfonyloxy” means the radical —OSO 2 R, where R is an aryl group as defined above.
"Ацил" обозначается группу, соответствующую формуле: -COR, -CSR, где R означает, водород или алкил, алкенил, арил, гетероарил.“Acyl” means a group corresponding to the formula: —COR, —CSR, where R is hydrogen or alkyl, alkenyl, aryl, heteroaryl.
"Ациламино" означает -N(R1)COR2, -N(R1)CSR2, где R1 и R2 каждый независимо означает водород, алкил, алкенил или гидроксиалкил, аминоалкил.“Acylamino” means —N (R 1 ) COR 2 , —N (R 1 ) CSR 2 , where R 1 and R 2 each independently mean hydrogen, alkyl, alkenyl or hydroxyalkyl, aminoalkyl.
"Ацилокси" обозначается группу, соответствующую формуле: -OCOR, -OCSR, где R означает водород или алкил, алкенил, арил, указанный выше.“Acyloxy” means a group corresponding to the formula: —OCOR, —OCSR, where R is hydrogen or alkyl, alkenyl, aryl, as defined above.
"Галоген" означает радикал фтор, бром, хлор, иод."Halogen" means the radical fluoro, bromo, chloro, iodo.
"Галогеноалкил" означает алкильный радикал, имеющий значения, указанные выше, замещенный в любом положении одним или более атомами галогена. Примеры галогеналкильного радикала включают 1-фторметил, 1,2-дифторметил, трифторметил, 2,2,2-трифторэтил, хлорметил.“Haloalkyl” means an alkyl radical as defined above, substituted at any position with one or more halogen atoms. Examples of the haloalkyl radical include 1-fluoromethyl, 1,2-difluoromethyl, trifluoromethyl, 2,2,2-trifluoroethyl, chloromethyl.
"Гетероарил" означает одновалентный ароматический карбоциклический радикал, содержащий один или более циклов, включающих в цикле от 1 до 4 гетероатомов (выбранных из N, О или S), и необязательно замещенный заместителем, выбранным из группы, включающей алкил, алкокси, амино, аминосульфонил, галоген, галогеналкил, гидрокси, гидроксиалкил, карбоксиалкил, карбамоил, нитро, сульфониламино, тиоалкил и/или циано. Примеры гетероарильных радикалов включают имидазолил, оксазолил, оксадиазолил, тиазолил, изотиазолил, изоксазолил, изотиазолил, пиразинил, тиофенил, фурил, пиранил, пиридинил, хинолинил, изохинолинил, бензофурил, бензотиофенил, бензимидазолил, бензоксазолил, бензотиазолил, бензопиранил, индазолил, индолил, индолинил, изоиндолил, хинолинил, изохинолинил.“Heteroaryl” means a monovalent aromatic carbocyclic radical containing one or more rings containing from 1 to 4 heteroatoms (selected from N, O or S) in the ring, and optionally substituted with a substituent selected from the group consisting of alkyl, alkoxy, amino, aminosulfonyl , halogen, haloalkyl, hydroxy, hydroxyalkyl, carboxyalkyl, carbamoyl, nitro, sulfonylamino, thioalkyl and / or cyano. Examples of heteroaryl radicals include imidazolyl, oxazolyl, oxadiazolyl, thiazolyl, isothiazolyl, isoxazolyl, isothiazolyl, pyrazinyl, thiophenyl, furyl, pyranyl, pyridinyl, quinolinyl, isoquinolinylindinol, benzothiolazolinyl, benzothiolazolinyl, benzothiolazolinyl, benzothiolazolinyl, benzothiolazolinyl, benzothiolazolinyl, benzothiolazinyl, isoindolyl, quinolinyl, isoquinolinyl.
"Гидроксиалкил" означает алкильный радикал, указанный выше, замещенный одной, двумя или тремя гидроксигруппами при условии, что к одному углеродному атому присоединено не более одной гидроксигруппы. Примеры гидроксиалкильных радикалов включают гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 2,3-дигидроксипропил и т.п.“Hydroxyalkyl” means an alkyl radical as defined above substituted with one, two or three hydroxy groups, provided that no more than one hydroxy group is attached to one carbon atom. Examples of hydroxyalkyl radicals include hydroxymethyl, 2-hydroxyethyl, 2-hydroxypropyl, 3-hydroxypropyl, 2,3-dihydroxypropyl and the like.
"Гидроксиалкиламино" означает радикал -NR1R2, где R1 означает водород, алкил или гидроксиалкил, a R2 означает указанный выше гидроксиалкил.“Hydroxyalkylamino” means the radical —NR 1 R 2 where R 1 is hydrogen, alkyl or hydroxyalkyl, and R 2 is the above hydroxyalkyl.
"Иминоалкил" обозначает группу, соответствующую формуле: -C(=NH)R, где R означает алкил или галогеноалкил.“Iminoalkyl” means a group corresponding to the formula: —C (═NH) R, where R is alkyl or haloalkyl.
"Карбамоил" обозначает группу, соответствующую формуле: -CONR1R2, где R1 и R2 каждый независимо означает водород, алкил, арил, гидроксиалкил, аминоалкил.“Carbamoyl” means a group corresponding to the formula: —CONR 1 R 2 , where R 1 and R 2 each independently mean hydrogen, alkyl, aryl, hydroxyalkyl, aminoalkyl.
"Карбоксиалкил" обозначает группу, соответствующую формуле: -CO2R, где R означает алкил или гидроксиалкил.“Carboxyalkyl” means a group corresponding to the formula: —CO 2 R, where R is alkyl or hydroxyalkyl.
"Сульфониламино" означает радикал -N(R1)SO2R2, где R1 означает водород или алкильный радикал, указанный выше, a R2 означает алкил, галогеноалкил, арил, гетероарил. Примеры алкилсульфониламино радикалов включают метилсульфониламино, трифторметилсульфониламино, фенилсульфониламино и т.п.“Sulfonylamino” means the radical —N (R 1 ) SO 2 R 2 , where R 1 is hydrogen or an alkyl radical as defined above, and R 2 is alkyl, haloalkyl, aryl, heteroaryl. Examples of alkylsulfonylamino radicals include methylsulfonylamino, trifluoromethylsulfonylamino, phenylsulfonylamino, and the like.
"Триалкиламмоний" означает положительно заряженную четвертичную аммонийную группу [-NR1R2R3]+, где R1-R3 каждый независимо означает алкильные или алкиленовые радикалы, например триметиламмоний, триэтиламоний."Trialkylammonium" means a positively charged quaternary ammonium group [-NR 1 R 2 R 3 ] + , where R 1 -R 3 each independently means alkyl or alkylene radicals, for example trimethylammonium, triethylammonium.
"Циклоалкил" означает насыщенный одновалентный циклический углеводородный радикал, содержащий в цикле от 3 до 7 атомов углерода и необязательно замещенный заместителями, выбранными из группы, включающей алкил, галогенил, амино, алкиламино, арил, гетероарил и т.п. Термин циклоалкил включает, например, циклопропил, циклобутил, циклопентил, циклогексил и т.п.“Cycloalkyl” means a saturated monovalent cyclic hydrocarbon radical containing from 3 to 7 carbon atoms in the cycle and optionally substituted with substituents selected from the group consisting of alkyl, halogen, amino, alkylamino, aryl, heteroaryl and the like. The term cycloalkyl includes, for example, cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl and the like.
Термин "биоизостер" используется в значении, обычно применяемом в области медицинской химии [Lipinski C.A. Bioisosterism in Drug Design. Annual Reports in Medicinal Chemistry. 1986, 21, pp.283-291]. В соответствии с этим общепринятым значением биоизостерами называют заместители или группы атомов с близким физическими или химическими свойствами, способные придавать подобные биологические свойства химическим соединениям. Биоизостерическое замещение позволяет модулировать биологические или физические свойства соединений, не делая существенных изменений в химической структуре биологически активных препаратов. В соответствии с общепринятой терминологией "классическими биоизостерами" называют атомы или группы атомов, имеющие близкие размер, форму, количество атомов и электронную плотность. "Неклассическими биоизостерами" принято считать атомы или группы атомов, не обладающие структурным подобием, характерным для классических биоизостеров, однако имеющие сходную биологическую активность. Примеры классических биоизостеров включают замещение аминогруппы на гидроксильную, замену связи -СН= в аренах или гетероаренах на фрагмент -N= и т.п. Примеры неклассических биоизостеров включают замену гидроксигруппы на ациламино или сульфониламино группы; замещение атома галогена на трифторметильную или цианогруппы; замену карбоксильной группы на сульфамидную группу или на ядро тетразола; замену -СН=СН- группировки ароматических ядер на гетероатом -S- и т.п. Указанные примеры и ряд других биоизостеров хорошо известен для различных классов биологически активных веществ и описан в соответствующей литературе [например, в Silverman R.B. The Organic Chemistry of Drug Deign and Drug Action. 2-nd Edition. Elsevier, Academic Press: Amsterdam, 2004, 29-34; Lima L.M., Barreiro E.J. Bioisosterism: A Useful Strategy for Molecular Modification and Drug Design. Current Medicinal Chemistry, 2005,12, 23-49].The term "bioisostere" is used in a meaning commonly used in the field of medical chemistry [Lipinski C.A. Bioisosterism in Drug Design. Annual Reports in Medicinal Chemistry. 1986, 21, pp. 283-291]. In accordance with this generally accepted meaning, bioisosteres are called substituents or groups of atoms with similar physical or chemical properties that can impart similar biological properties to chemical compounds. Bioisosteric substitution allows modulating the biological or physical properties of compounds without making significant changes in the chemical structure of biologically active drugs. In accordance with generally accepted terminology, "classical bioisosteres" refers to atoms or groups of atoms having similar size, shape, number of atoms and electron density. “Nonclassical bioisosteres” are considered to be atoms or groups of atoms that do not have the structural similarity characteristic of classical bioisosteres, but which have similar biological activity. Examples of classical bioisosteres include substitution of the amino group with a hydroxyl group, replacement of the —CH═ bond in arenes or heteroarenes with the —N = fragment, and the like. Examples of non-classical bioisosteres include replacing a hydroxy group with an acylamino or sulfonylamino group; substitution of a halogen atom for trifluoromethyl or cyano groups; replacing the carboxyl group with a sulfamide group or with a tetrazole core; replacing -CH = CH- groups of aromatic nuclei with a heteroatom -S-, etc. These examples and a number of other bioisosteres are well known for various classes of biologically active substances and are described in the relevant literature [for example, in Silverman R.B. The Organic Chemistry of Drug Deign and Drug Action. 2-nd Edition. Elsevier, Academic Press: Amsterdam, 2004, 29-34; Lima L.M., Barreiro E.J. Bioisosterism: A Useful Strategy for Molecular Modification and Drug Design. Current Medicinal Chemistry, 2005,12, 23-49].
Термин "изомеры" означает соединения с одинаковой молекулярной формулой, но отличающиеся природой или последовательностью химических связей или пространственным расположением атомов. Изомеры, которые различаются пространственным расположением атомов, называются "стереоизомерами". Атом углерода, связанный с четырьмя разными заместителями, называется "хиральным центром".The term "isomers" means compounds with the same molecular formula, but differing in the nature or sequence of chemical bonds or spatial arrangement of atoms. Isomers that differ in the spatial arrangement of atoms are called “stereoisomers”. A carbon atom bonded to four different substituents is called a “chiral center”.
"Хиральное соединение" означает соединение с одним или более хиральными центрами. Это соединение имеет две энантиомерные формы с противоположной хиральностью и может существовать как в виде отдельных энантиомеров, так и в виде смеси энантиомеров. Смесь, содержащая равные количества отдельных энантиомеров, называется "рацемической смесью". Соединения, содержащие более одного хирального центра, могут существовать в виде индивидуального диастереомера или в виде смеси диастереомеров, которая называется "диастереомерной смесью". При наличии хирального центра стереизомеры можно охарактеризовать абсолютной конфигурацией (R или S), означающей пространственное расположение заместителей у хирального центра. Указанные заместители, связанные с хиральным центром, классифицируются по правилу Кана, Ингольда и Прелога [Cahn et al., Angew. Chem., 1966, 75, 413].“Chiral compound” means a compound with one or more chiral centers. This compound has two enantiomeric forms with opposite chirality and can exist both as individual enantiomers and as a mixture of enantiomers. A mixture containing equal amounts of individual enantiomers is called a "racemic mixture." Compounds containing more than one chiral center may exist as an individual diastereomer or as a mixture of diastereomers, which is called a "diastereomeric mixture". In the presence of a chiral center, stereoisomers can be characterized by the absolute configuration (R or S), which means the spatial arrangement of the substituents at the chiral center. These substituents associated with the chiral center are classified according to the rules of Kahn, Ingold and Prelog [Cahn et al., Angew. Chem., 1966, 75, 413].
"Таутомеры" означает соединения, структуры которых отличаются пространственным расположением атомов, но находятся в равновесном состоянии. Соединения формулы 4 могут содержать группы, которые могут находиться в таутомерном равновесии. Подразумевается, что, если соединения формулы 4 могут существовать в таутомерных формах, то настоящее изобретение включает все таутомерные формы, а названия соединений не исключают любую таутомерную форму."Tautomers" means compounds whose structures differ in the spatial arrangement of atoms, but are in equilibrium. The compounds of formula 4 may contain groups that may be in tautomeric equilibrium. It is understood that, if the compounds of formula 4 can exist in tautomeric forms, the present invention includes all tautomeric forms, and the names of the compounds do not exclude any tautomeric form.
"Необязательный" или "необязательно" означает, что последующее событие или обстоятельство может произойти, но необязательно произойдет и что описание включает случаи, когда это событие или обстоятельство произойдет, и случаи, когда оно не произойдет. Например, термин "необязательно замещенный" при использовании в связи с термином "арил", "гетероарил" означает арил или гетероарил, который необязательно и независимо содержит от одного до четырех заместителей, выбранных из группы, включающей алкил, алкокси, амино, ацилокси гидрокси, галоген, галогеналкил, гидроксиалкил, карбоксиалкил, карбамоил, нитро, циано.“Optional” or “optionally” means that a subsequent event or circumstance may occur, but does not necessarily occur, and that the description includes instances where this event or circumstance will occur and instances where it will not occur. For example, the term "optionally substituted" when used in connection with the term "aryl", "heteroaryl" means aryl or heteroaryl, which optionally and independently contains from one to four substituents selected from the group consisting of alkyl, alkoxy, amino, acyloxy hydroxy, halogen, haloalkyl, hydroxyalkyl, carboxyalkyl, carbamoyl, nitro, cyano.
"Уходящая группа" означает группу, название которой обычно ассоциируется с ее использованием в синтетической органической химии, т.е. означает атом или группу, которая замещается в условиях реакции. Примеры уходящей группы включают алкилсульфонилокси или арилсульфонилокси (такие, как метансульфонилокси, трифторметансульфонилокси, этансульфонилокси, бензолсульфонилокси, тозилокси), ацилокси, галоген, амино, триалкиламонийная группы и т.п.“Leaving group” means a group whose name is usually associated with its use in synthetic organic chemistry, i.e. means an atom or group that is substituted under reaction conditions. Examples of the leaving group include alkylsulfonyloxy or arylsulfonyloxy (such as methanesulfonyloxy, trifluoromethanesulfonyloxy, ethanesulfonyloxy, benzenesulfonyloxy, tosyloxy), acyloxy, halogen, amino, trialkylammonium groups and the like.
Термином "защитная группа" обозначается группа, подходящая для блокирования функциональной группы в условиях проведения реакций, как описано литературе [Green T.W., Wuts P.G.M. Protective Groups in Organic Synthesis. J.Wiley & Sons, N.-Y., 1991, 351 pp]. Пример таких групп для блокирования аминогруппы включает трет-бутоксикарбонильную (Boc), адамантилоксикарбонильную (Adoc), флуоренилметилоксикарбонильную (Fmoc) и карбонибензилокси (Cbz), этоксикарбонильную, ацетильную группы и т.п. Пример таких групп для блокирования карбоксигруппы включает трет-бутильную, метальную, этильную, бензильную группы и т.п. Пример таких групп для блокирования гидроксигруппы включает метильную, этильную, бензильную, метоксиметильную, бензилоксиметильную, триметилсилильную, ацетильную и т.п.The term "protective group" refers to a group suitable for blocking a functional group under the conditions of the reactions, as described in literature [Green T.W., Wuts P.G.M. Protective Groups in Organic Synthesis. J. Wiley & Sons, N.-Y., 1991, 351 pp]. Examples of such groups for blocking an amino group include tert-butoxycarbonyl (Boc), adamantyloxycarbonyl (Adoc), fluorenylmethyloxycarbonyl (Fmoc) and carbonibenzyloxy (Cbz), ethoxycarbonyl, acetyl groups and the like. An example of such groups for blocking a carboxy group includes tert-butyl, methyl, ethyl, benzyl groups and the like. An example of such groups for blocking a hydroxy group includes methyl, ethyl, benzyl, methoxymethyl, benzyloxymethyl, trimethylsilyl, acetyl and the like.
"Инертный органический растворитель" означает растворитель, инертный в условиях реакции описываемой в тексте, включающий, например, бензол, толуол, ацетонитрил, тетрагидрофуран, N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидон, диметилсульфоксид, сульфолан, хлороформ, дихлорметан, дихлорэтан, этилацетат, ацетон, метилэтилкетон, метанол, этанол, пропанол, изопропанол, трет-бутанол, диоксан, пиридин и т.п. Если не указано иное, растворители, использованные в реакциях по настоящему изобретению, являются инертными растворителями."Inert organic solvent" means a solvent inert under the reaction conditions described herein, including, for example, benzene, toluene, acetonitrile, tetrahydrofuran, N, N-dimethylformamide, N, N-dimethylacetamide, N-methylpyrrolidone, dimethyl sulfoxide, sulfolane, chloroform, dichloromethane, dichloroethane, ethyl acetate, acetone, methyl ethyl ketone, methanol, ethanol, propanol, isopropanol, tert-butanol, dioxane, pyridine and the like. Unless otherwise indicated, the solvents used in the reactions of the present invention are inert solvents.
"Фармацевтически приемлемый" означает материал, который используют при получении фармацевтической композиции и который обычно является нетоксичным, безопасным в биологическом или ином отношении и включает материал, приемлемый как в ветеринарии, так и в фармацевтике."Pharmaceutically acceptable" means a material that is used in the manufacture of a pharmaceutical composition and which is usually non-toxic, biologically or otherwise safe and includes material that is acceptable in both veterinary medicine and pharmaceuticals.
"Фармацевтически приемлемые соли" соединения означают соли, которые являются фармацевтически приемлемыми и которые обладают необходимой фармакологической активностью исходного соединения. Такие соли включают: (1) кислотно-аддитивные соли неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота и т.п., или органических кислот, таких как уксусная кислота, бензойная кислота, лимонная кислота, фумаровая кислота, глутаминовая кислота, гликолевая кислота, молочная кислота, малеиновая кислота, яблочная кислота, метансульфоновая кислота, пропионовая кислота, салициловая кислота, янтарная кислота, винная кислота, толуолсульфоновая кислота и т.п. или (2) соли, образующиеся при замене кислотного протона (в О-Н, N-H или S-H-группах), присутствующего в исходном соединении, на ион металла, например, ион щелочного металла, ион щелочно-земельного металла или ион алюминия, или при образовании протоном координационного соединения с органическим или неорганическим основанием. Приемлемые органические основания включают диэтаноламин, этаноламин, триэтаноламин и т.п. Приемлемые неорганические основания включают гидроксид алюминия, гидроксид кальция, гидроксид калия, карбонат натрия и гидроксид натрия и т.п. Подразумевается, что фармацевтически приемлемые соли включают сольваты или кристаллические формы (полиморфные образования) указанной кислотно-аддитивной соли. Предпочтительными фармацевтически приемлемыми солями являются соли уксусной кислоты, соляной кислоты, серной кислоты, метансульфоновой кислоты, малеиновой кислоты, фосфорной кислоты, винной кислоты, лимонной кислоты, соли натрия, калия, кальция, цинка и магния."Pharmaceutically acceptable salts" of a compound means salts that are pharmaceutically acceptable and which possess the necessary pharmacological activity of the parent compound. Such salts include: (1) acid addition salts of inorganic acids such as hydrochloric acid, hydrobromic acid, sulfuric acid, phosphoric acid and the like, or organic acids such as acetic acid, benzoic acid, citric acid, fumaric acid , glutamic acid, glycolic acid, lactic acid, maleic acid, malic acid, methanesulfonic acid, propionic acid, salicylic acid, succinic acid, tartaric acid, toluenesulfonic acid, and the like. or (2) salts formed by replacing an acidic proton (in OH, NH or SH groups) present in the parent compound with a metal ion, for example, an alkali metal ion, alkaline earth metal ion or aluminum ion, or the formation of a proton coordination compound with an organic or inorganic base. Suitable organic bases include diethanolamine, ethanolamine, triethanolamine and the like. Suitable inorganic bases include aluminum hydroxide, calcium hydroxide, potassium hydroxide, sodium carbonate and sodium hydroxide, and the like. Pharmaceutically acceptable salts are intended to include solvates or crystalline forms (polymorphic formations) of said acid addition salt. Preferred pharmaceutically acceptable salts are salts of acetic acid, hydrochloric acid, sulfuric acid, methanesulfonic acid, maleic acid, phosphoric acid, tartaric acid, citric acid, sodium, potassium, calcium, zinc and magnesium salts.
Термин "сольваты" означает сольватированные формы, содержащие стехиометрическое или нестехиометрическое количество растворителя. Некоторые соединения способны удерживать в кристаллической решетке фиксированное количество молекул растворителя, образуя сольват. Гидраты образуются в том случае, если в качестве растворителя используется вода, а алкоголяты образуются в том случае, если растворителем является спирт.The term “solvates” means solvated forms containing a stoichiometric or non-stoichiometric amount of solvent. Some compounds are able to retain a fixed number of solvent molecules in the crystal lattice, forming a solvate. Hydrates are formed if water is used as the solvent, and alcoholates are formed if the solvent is alcohol.
"Субъект" означает млекопитающих, т.е. означает любого члена класса млекопитающих, включая человека, приматов, сельскохозяйственных животных, таких как крупный рогатый скот, лошади, овцы, козы и свиньи, домашних животных, таких как кролики, собаки и кошки, лабораторных животных, включая грызунов, таких как крысы, мыши и морские свинки и т.п. Термин субъект не означает конкретный возраст или пол.“Subject” means mammals, i.e. means any member of the mammalian class, including humans, primates, farm animals such as cattle, horses, sheep, goats and pigs, domestic animals such as rabbits, dogs and cats, laboratory animals, including rodents such as rats, mice and guinea pigs, etc. The term subject does not mean a specific age or gender.
"Терапевтически эффективное количество" означает количество соединения, которое при введении субъекту для лечения патологического состояния является достаточным для оказания фармакологического действия при лечении патологического состояния субъекта. Терапевтически эффективное количество варьирует в зависимости от типа соединения, патологического состояния, подлежащего лечению, тяжести болезни, возраста и относительного состояния здоровья субъекта, от способа и формы введения, от мнения лечащего врача или практикующего ветеринара и других факторов.“Therapeutically effective amount” means an amount of a compound that, when administered to a subject to treat a pathological condition, is sufficient to exert a pharmacological effect in the treatment of the pathological condition of the subject. The therapeutically effective amount varies depending on the type of compound, the pathological condition to be treated, the severity of the disease, the age and relative health of the subject, the method and form of administration, the opinion of the attending physician or practicing veterinarian, and other factors.
Термин "фармакологическое действие", используемый в описании заявки, включает результаты воздействия на субъект, при которых достигается предполагаемая цель терапии. Например, фармакологическое действие означает такие результаты воздействия, которые приводят к излечению или замедлению развития, предупреждению рецидива заболевания.The term "pharmacological action" used in the description of the application includes the results of exposure to the subject, in which the intended purpose of therapy is achieved. For example, a pharmacological action means such effects that lead to a cure or slow development, to prevent relapse of the disease.
Типичные соединения по изобретению и некоторые схемы их синтеза приводятся в ряде примеров, описанных ниже.Typical compounds of the invention and some schemes for their synthesis are provided in a number of examples described below.
Схема БScheme B
Пример 1Example 1
(S)-4,11-Дигидрокси-3-[(пирролидин-3-иламино)метил]-1H-нафто(2,3-f]индол-5,10-дион дигидрохлорид(S) -4,11-dihydroxy-3 - [(pyrrolidin-3-ylamino) methyl] -1H-naphtho (2,3-f] indol-5,10-dione dihydrochloride
Раствор 50 мг (0.1 ммоль) иодометилата 4,11-дигидрокси-3-[(диметиламино)метил]-1H-нафто[2,3-f]индол-5,10-диона (а, схема Б), полученного по ранее описанному методу [Shchekotikhin A.E. et. al., Bioorg. Med. Chem., 2005, 13, 2285] и 0.1 г (2.5 ммоль) (S)-трет-бутил 3-амино-1-пирролидинкарбоксилата в хлороформе (10 мл) кипятят 1 ч. Смесь разбавляют хлороформом, промывают водой, раствором NaHCO3, сушат и упаривают. Остаток очищают колоночной хроматографией (хлороформ - метанол, 10:1→2:1). Получают 33 мг (70%) Вос-производного b, которое растворяют в метаноле (0.5 мл) и прибавляют 0.5 мл раствора (1H) HCl в эфире. Смесь перемешивают 6 ч и отфильтровывают красный осадок дигидрохлорида с. Выход 26 мг (56%). Т.пл. 254-255°С (разл.). Спектр ЯМР 1Н (400 МГц, D2O), δ, м. д.: 7.72 (1Н, д, J=7.5, Н9), 7.59 (1Н, д, J=7.5, Н6), 7.45 (2Н, м, Н7,8), 7.18 (1Н, с, Н2), 4.17 (3Н, м, CH2NCH2CH), 3.83 (1Н, м, NCH2CH), 3.62 (1Н, м, NCH2CH2), 3.50 (2Н, м, NCH2CH2, СН), 2.62 (1Н, м, J=7.5, СН2СН2СН), 2.29 (1Н, м, J=7.0, СН2СН2СН). Масс-спектр, m/z (Ioтн., %): 377 (12) [М]+, 358 (12), 308 (20), 293 (100), 279 (90), 263 (14). Найдено, %: С 53.30, Н 5.17, N 8.81. C21H19N3O4·2HCl·H2O. Вычислено, %: С 53.86, Н 4.95, N 8.97, М 377.12.A solution of 50 mg (0.1 mmol) of 4,11-dihydroxy-3 - [(dimethylamino) methyl] -1H-naphtho [2,3-f] indole-5,10-dione iodomethylate ( a , Scheme B ), prepared as previously the described method [Shchekotikhin AE et. al., Bioorg. Med. Chem., 2005, 13, 2285] and 0.1 g (2.5 mmol) of (S) -tert-butyl 3-amino-1-pyrrolidinecarboxylate in chloroform (10 ml) are boiled for 1 hour. The mixture is diluted with chloroform, washed with water, with a NaHCO 3 solution. , dried and evaporated. The residue was purified by column chromatography (chloroform-methanol, 10: 1 → 2: 1). Obtain 33 mg (70%) of Boc derivative b , which is dissolved in methanol (0.5 ml) and 0.5 ml of a solution of (1H) HCl in ether is added. The mixture was stirred for 6 hours and the red precipitate of dihydrochloride was filtered off . Yield 26 mg (56%). Mp 254-255 ° C (decomp.). 1 H NMR (400 MHz, D 2 O), δ, m. D .: 7.72 (1H, d, J = 7.5, 9 H), 7.59 (1H, d, J = 7.5, 6 H), 7.45 ( 2H, m, H 7.8 ), 7.18 (1H, s, H 2 ), 4.17 (3H, m, CH 2 NCH 2 CH), 3.83 (1H, m, NCH 2 CH), 3.62 (1H, m, NCH 2 CH 2 ), 3.50 (2H, m, NCH 2 CH 2 , CH), 2.62 (1H, m, J = 7.5, CH 2 CH 2 CH), 2.29 (1H, m, J = 7.0, CH 2 CH 2 CH). Mass spectrum, m / z ( Irel ,%): 377 (12) [M] + , 358 (12), 308 (20), 293 (100), 279 (90), 263 (14). Found,%: C 53.30, H 5.17, N 8.81. C 21 H 19 N 3 O 4 · 2HCl · H 2 O. Calculated,%: C 53.86, H 4.95, N 8.97, M 377.12.
Пример 2Example 2
(R)-4,11-Дигидрокси-3-[(пирролидин-3-иламино)метил]-1H-нафто[2,3-f]индол-5,10-дион дигидрохлорид(R) -4,11-dihydroxy-3 - [(pyrrolidin-3-ylamino) methyl] -1H-naphtho [2,3-f] indol-5,10-dione dihydrochloride
Получают по методике, аналогичной приведенной в примере 1, из иодометилата 4,11-дигидрокси-3-[(диметиламино)метил]-1H-нафто[2,3-f]индол-5,10-диона (а, схема Б) и (R)-трет-6утил 3-амино-1-пирролидинкарбоксилата. Выход 55%. Т. пл. 255-256°С (разл.). ВЭЖХ (колонка GraseSmart RP-18, 6×250 мм, LW=260 нм; элюент: А - H3PO4 (0.01 м), Б - MeCN; градиент Б 10→40% (30 мин)): время выхода 19.3 мин, чистота 99.8%. Спектр ЯМР 1Н (400 МГц, D2O), δ, м. д.: 7.76 (1Н, д, J=7.5, Н9), 7.64 (1Н, д, J=7.5, Н6), 7.45 (2Н, м, Н7,8), 7.13 (1Н, с, Н2), 4.40 (3Н, м, СН2СН2СН), 3.88 (1Н, м, NCH2CH), 3.60 (2Н, м, NCH2CH2, СН), 3.50 (1Н, м, NCH2CH2), 2.64 (1Н, м, J=7.5, СН2СН2СН), 2.32 (1Н, м, J=7.0, СН2СН2СН). Масс-спектр, m/z (Ioтн., %): 377 (12) [М]+, 358 (14), 308 (23), 293 (100), 279 (92), 263 (15). Найдено, %: С 53.75, Н 5.31, N 9.18. C21H19N3O4·2HCl·H2O. Вычислено, %: С 53.86, Н 4.95 N 8.97. М 377.12.Obtained by a method similar to that described in example 1, from 4,11-dihydroxy-3 - [(dimethylamino) methyl] -1H-naphtho [2,3-f] indole-5,10-dione iodomethylate ( a , Scheme B ) and (R) -tert-6utyl 3-amino-1-pyrrolidinecarboxylate. Yield 55%. T. pl. 255-256 ° C (decomp.). HPLC (GraseSmart RP-18 column, 6 × 250 mm, LW = 260 nm; eluent: A — H 3 PO 4 (0.01 m), B — MeCN; gradient B 10 → 40% (30 min)): exit time 19.3 min, purity 99.8%. 1 H NMR (400 MHz, D 2 O), δ, m. D .: 7.76 (1H, d, J = 7.5, 9 H), 7.64 (1H, d, J = 7.5, 6 H), 7.45 ( 2H, m, H 7.8 ), 7.13 (1H, s, H 2 ), 4.40 (3H, m, CH 2 CH 2 CH), 3.88 (1H, m, NCH 2 CH), 3.60 (2H, m, NCH 2 CH 2 , CH), 3.50 (1H, m, NCH 2 CH 2 ), 2.64 (1H, m, J = 7.5, CH 2 CH 2 CH), 2.32 (1H, m, J = 7.0, CH 2 CH 2 CH). Mass spectrum, m / z ( Irel ,%): 377 (12) [M] + , 358 (14), 308 (23), 293 (100), 279 (92), 263 (15). Found,%: C 53.75, H 5.31, N 9.18. C 21 H 19 N 3 O 4 · 2HCl · H 2 O. Calculated,%: C 53.86, H 4.95 N 8.97. M 377.12.
Пример 3Example 3
(S)-3-[(3-Аминопирролидин-1-ил)метил]-4,11-дигидрокси-1H-нафто[2,3-f]индол-5,10-дион дигидрохлорид(S) -3 - [(3-Aminopyrrolidin-1-yl) methyl] -4,11-dihydroxy-1H-naphtho [2,3-f] indole-5,10-dione dihydrochloride
Получают по методике, аналогичной приведенной в примере 1, из иодометилата 4,11-дигидрокси-3-[(диметиламино)метил]-1H-нафто[2,3-f]индол-5,10-диона (а, схема Б) и (S)-3-(трет-бутоксикарбониламино)пирролидина. Выход 64%. Т. пл. 255-258°С (разл.). ВЭЖХ (колонка Gemini 100A С-18, 6×250 мм, LW=260 нм; элюент: А - HCO2NH4 (0.2%), Б - MeCN; градиент Б 10→50% (30 мин)): время выхода 22.6 мин, чистота 99.4%. Спектр ЯМР 1Н (400 МГц, D2O), δ, м. д.: 7.61 (1Н, д, J=7.5, Н9), 7.52 (1Н, д, J=7.5, Н6), 7.40 (1Н, т, J=7.5, Н5), 7.35 (1Н, т, J=7.5, Н7), 7.13 (1Н, с, Н2), 4.37 (2Н, с, CH2N), 4.16 (1Н, дд, J=7.4, NCH2CH), 3.85 (1Н, м, NCH2CH), 3.60 (1Н, м, NCH2CH2), 3.49 (2Н, м, NCH2CH2, СН), 2.59 (1Н, м, J=7.4, СН2СН2СН), 2.28 (1Н, м, J=7.0, СН2СН2СН). Масс-спектр, m/z (Ioтн., %): 377 (12) [М]+, 358 (14), 293 (100), 279 (80), 263 (15). Найдено, %: С 54.08, Н 4.78, N 9.25. C21H19N3O4·2HCl·H2O. Вычислено, %: С 53.86, Н 4.95, N 8.97. М 377.12.Obtained by a method similar to that described in example 1, from 4,11-dihydroxy-3 - [(dimethylamino) methyl] -1H-naphtho [2,3-f] indole-5,10-dione iodomethylate ( a , Scheme B ) and (S) -3- (tert-butoxycarbonylamino) pyrrolidine. Yield 64%. T. pl. 255-258 ° C (decomp.). HPLC (Gemini 100A C-18 column, 6 × 250 mm, LW = 260 nm; eluent: A — HCO 2 NH 4 (0.2%), B — MeCN; gradient B 10 → 50% (30 min)): exit time 22.6 min, 99.4% purity. 1 H NMR (400 MHz, D 2 O), δ, m. D .: 7.61 (1H, d, J = 7.5, 9 H), 7.52 (1H, d, J = 7.5, 6 H), 7.40 ( 1H, t, J = 7.5, H 5 ), 7.35 (1H, t, J = 7.5, H 7 ), 7.13 (1H, s, H 2 ), 4.37 (2H, s, CH 2 N), 4.16 (1H dd, J = 7.4, NCH 2 CH), 3.85 (1Н, m, NCH 2 CH), 3.60 (1Н, m, NCH 2 CH 2 ), 3.49 (2Н, m, NCH 2 CH 2 , СН), 2.59 (1H, m, J = 7.4, CH 2 CH 2 CH), 2.28 (1H, m, J = 7.0, CH 2 CH 2 CH). Mass spectrum, m / z ( Irel ,%): 377 (12) [M] + , 358 (14), 293 (100), 279 (80), 263 (15). Found,%: C 54.08, H 4.78, N 9.25. C 21 H 19 N 3 O 4 · 2HCl · H 2 O. Calculated,%: C 53.86, H 4.95, N 8.97. M 377.12.
Пример 4Example 4
(R)-3-[(3-Аминопирролидин-1-ил)метил]-4,11-дигидрокси-1H-нафто[2,3-f]индол-5,10-дион дигидрохлорид(R) -3 - [(3-Aminopyrrolidin-1-yl) methyl] -4,11-dihydroxy-1H-naphtho [2,3-f] indole-5,10-dione dihydrochloride
Получают по методике, аналогичной приведенной в примере 1, из иодометилата 4,11-дигидрокси-3-[(диметиламино)метил]-1H-нафто[2,3-f]индол-5,10-диона (а, схема Б) и (R)-3-(трет-бутоксикарбониламино)пирролидина. Выход 65%. Т.пл. 255-256°С (разл.). Спектр ЯМР 1Н (400 МГц, D2O), δ, м. д.: 7.62 (1Н, д, J=7.5, Н9), 7.52 (1Н, д, J=7.5, Н6), 7.42 (1Н, т, J=7.5, Н5), 7.38 (1Н, т, J=7.5, Н7), 7.13 (1Н, с, Н2), 4.35 (2Н, с, CH2N), 4.18 (1Н, дд, J=7.4, NCH2CH), 3.82 (1Н, м, NCH2CH), 3.60 (1Н, м, NCH2CH2), 3.44 (2Н, м, NCH2CH2, СН), 2.63 (1Н, м, J=7.4, СН2СН2СН), 2.22 (1Н, м, J=7.0, CH2CH2CH). Масс-спектр, m/z (Ioтн., %): 377 (11) [М]+, 358 (16), 293 (100), 279 (89), 263 (19). Найдено, %: С 53.72, Н 5.14, N 8.82. C21H19N3O4·2HCl·H2O. Вычислено, %: С 53.86, Н 4.95, N 8.97. М 377.12.Obtained by a method similar to that described in example 1, from 4,11-dihydroxy-3 - [(dimethylamino) methyl] -1H-naphtho [2,3-f] indole-5,10-dione iodomethylate ( a , Scheme B ) and (R) -3- (tert-butoxycarbonylamino) pyrrolidine. Yield 65%. Mp 255-256 ° C (decomp.). 1 H NMR (400 MHz, D 2 O), δ, m. D .: 7.62 (1H, d, J = 7.5, 9 H), 7.52 (1H, d, J = 7.5, 6 H), 7.42 ( 1H, t, J = 7.5, H 5 ), 7.38 (1H, t, J = 7.5, H 7 ), 7.13 (1H, s, H 2 ), 4.35 (2H, s, CH 2 N), 4.18 (1H dd, J = 7.4, NCH 2 CH), 3.82 (1Н, m, NCH 2 CH), 3.60 (1Н, m, NCH 2 CH 2 ), 3.44 (2Н, m, NCH 2 CH 2 , СН), 2.63 (1H, m, J = 7.4, CH 2 CH 2 CH), 2.22 (1H, m, J = 7.0, CH 2 CH 2 CH). Mass spectrum, m / z ( Irel ,%): 377 (11) [M] + , 358 (16), 293 (100), 279 (89), 263 (19). Found,%: C 53.72, H 5.14, N 8.82. C 21 H 19 N 3 O 4 · 2HCl · H 2 O. Calculated,%: C 53.86, H 4.95, N 8.97. M 377.12.
Пример 5Example 5
3-({(1S,4S)-2,5-Диазабицикло[2.2.1]гептан-2-ил}метил)-4,11-дигидрокси-1H-нафто-[2,3-f]индол-5,10-дион дигидрохлорид3 - ({(1S, 4S) -2,5-Diazabicyclo [2.2.1] heptan-2-yl} methyl) -4,11-dihydroxy-1H-naphtho [2,3-f] indole-5, 10-dione dihydrochloride
Получают по методике, аналогичной приведенной в примере 1, из иодометилата 4,11-дигидрокси-3-[(диметиламино)метил]-1H-нафто[2,3-f]индол-5,10-диона (а, схема Б) и (1S,4S)-N-(трет-бутоксикарбонил)-2,5-диаза-бицикло[2.2.1]гептана. Выход 61%. Т.пл. 246-247°С (разл.). Спектр ЯМР 1Н (400 МГц, D2O), δ, м. д., J=(Гц): 7.48 (1Н, уш. с, Н9), 7.38-7.24 (3Н, уш. м, Н6,7,8), 7.12 (1Н, с, Н2), 4.68 (1Н, с, СН), 4.57 (1Н, с, СН), 4.39 (1Н, д, J=15.2, CH2N), 4.30 (1Н, д, J=14.1, CH2N), 3.75 (2Н, т, J=12.6, NCH2CH), 3.61 (2Н, д, J=12.6, NCH2CH), 2.63 (1Н, д, J=12.3, СНСН2СН), 2.32 (1Н, д, J=12.3, СНСН2СН). Масс-спектр, m/z (Ioтн, %): 389 (8) [М]+, 370 (13), 293 (100), 279 (83), 263 (16). Найдено, %: С 55.22, Н 5.09, N 9.01. C22H19N3O4·2HCl·H2O. Вычислено, %: С 55.01, Н 4.83, N 8.75. М 389.12.Obtained by a method similar to that described in example 1, from 4,11-dihydroxy-3 - [(dimethylamino) methyl] -1H-naphtho [2,3-f] indole-5,10-dione iodomethylate ( a , Scheme B ) and (1S, 4S) -N- (tert-butoxycarbonyl) -2,5-diaza-bicyclo [2.2.1] heptane. Yield 61%. Mp 246-247 ° C (decomp.). 1 H NMR (400 MHz, D 2 O), δ, ppm, J = (Hz).. 7.48 (. 1H, br s, 9 H), 7.38-7.24 (3H, br m, H 6. , 7.8 ), 7.12 (1H, s, H 2 ), 4.68 (1H, s, CH), 4.57 (1H, s, CH), 4.39 (1H, d, J = 15.2, CH 2 N), 4.30 (1H, d, J = 14.1, CH 2 N), 3.75 (2H, t, J = 12.6, NCH 2 CH), 3.61 (2H, d, J = 12.6, NCH 2 CH), 2.63 (1H, d, J = 12.3, CHCH 2 CH), 2.32 (1H, d, J = 12.3, CHCH 2 CH). Mass spectrum, m / z ( Irel ,%): 389 (8) [M] + , 370 (13), 293 (100), 279 (83), 263 (16). Found,%: C 55.22, H 5.09, N 9.01. C 22 H 19 N 3 O 4 · 2HCl · H 2 O. Calculated,%: C 55.01, H 4.83, N 8.75. M 389.12.
Схема ВScheme B
Пример 6Example 6
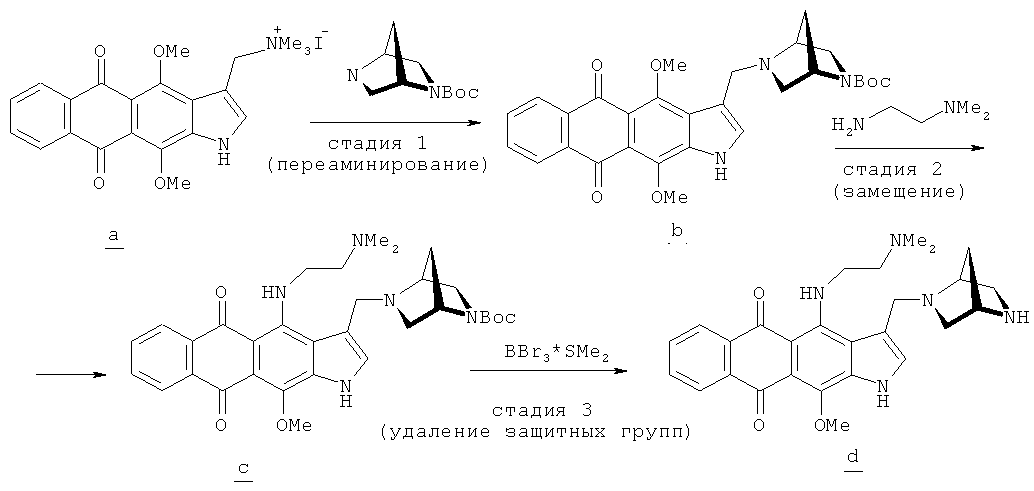
3-{(1S,4S)-2,5-Диазабицикло[2.2.1]гептан-2-ил}метил-11-гидрокси-4-[2-(диметиламино)этил]амино-1H-нафто[2,3-f]индол-5,10-дион3 - {(1S, 4S) -2,5-Diazabicyclo [2.2.1] heptan-2-yl} methyl-11-hydroxy-4- [2- (dimethylamino) ethyl] amino-1H-naphtho [2,3 -f] indole-5,10-dione
Стадия 1Stage 1
3-({(1S,4S)-5-(трет-Бутоксикарбонил)-2,5-диазабицикло[2.2.1]гептан-2-ил}метил)-4,11-диметокси-1H-нафто[2,3-f]индол-5,10-дион3 - ({(1S, 4S) -5- (tert-butoxycarbonyl) -2,5-diazabicyclo [2.2.1] heptan-2-yl} methyl) -4,11-dimethoxy-1H-naphtho [2,3 -f] indole-5,10-dione
Раствор 100 мг (0.2 ммоль) иодометилата 4,11-диметокси-3-[(диметиламино)метил]-1H-нафто[2,3-f]индол-5,10-диона (а, схема В), полученного по ранее описанному методу (Shchekotikhin A.E. et. al., Bioorg. Med. Chem., 2007, 15, 2651) и 0.2 г (5 ммоль) (1S,4S)-N-(трет-бутоксикарбонил)-2,5-диаза-бицикло[2.2.1]гептана в хлороформе (10 мл) кипятят 30-40 мин. Смесь разбавляют хлороформом, промывают водой, раствором NaHCO3, сушат и упаривают. Остаток очищают колоночной хроматографией (хлороформ - метанол - конц. NH4OH, 10:2:0→10:3:1). Выход 76 мг (74%). Спектр ЯМР 1Н (400 МГц, CDCl3), 8, м.д., J=(Гц): 9.58 (1Н, уш. 1, NH), 8.21 (2Н, м, Н6'9), 7.69 (2Н, м, Н7,8), 7.36 (1Н, уш. д. Н2), 4.39 (0.5Н, с, СН), 4.28 (0.5Н, с, СН), 4.10 (2Н, м, СН2Н), 4.06 (3Н, с, ОМе), 4.02 (3Н, с, ОМе), 3.58 (1Н, м, NCH2CH), 3.27 (1Н, м, NCH2CH), 2.89 (1Н, м, NCH2CH), 2.80 (1Н, м, NCH2CH), 1.86 (1Н, м, CHCH2CH), 1.70 (1Н, м, CHCH2CH), 1.45 (9Н, с, трет-Bu). Найдено, %: С 67.10, Н 6.23, N 8.27. C29H31N3O6. Вычислено, %: С 67.30, Н 6.04, N 8.12.A solution of 100 mg (0.2 mmol) of 4,11-dimethoxy-3 - [(dimethylamino) methyl] -1H-naphtho [2,3-f] indole-5,10-dione iodomethylate ( a , Scheme B ), prepared as previously the described method (Shchekotikhin AE et. al., Bioorg. Med. Chem., 2007, 15, 2651) and 0.2 g (5 mmol) (1S, 4S) -N- (tert-butoxycarbonyl) -2,5-diaza- bicyclo [2.2.1] heptane in chloroform (10 ml) is boiled for 30-40 minutes. The mixture was diluted with chloroform, washed with water, NaHCO 3 solution, dried and evaporated. The residue was purified by column chromatography (chloroform — methanol — conc. NH 4 OH, 10: 2: 0 → 10: 3: 1). Yield 76 mg (74%). 1 H NMR (400 MHz, CDCl 3), 8, ppm, J = (Hz): 9.58 (. 1H, broad 1, NH), 8.21 (2H, m, H 6 '9), 7.69 ( 2H, m, H 7.8 ), 7.36 (1H, br.sd.H 2 ), 4.39 (0.5H, s, CH), 4.28 (0.5H, s, CH), 4.10 (2H, m, CH 2 H), 4.06 (3H, s, OMe), 4.02 (3H, s, OMe), 3.58 (1H, m, NCH 2 CH), 3.27 (1H, m, NCH 2 CH), 2.89 (1H, m, NCH 2 CH), 2.80 (1H, m, NCH 2 CH), 1.86 (1H, m, CHCH 2 CH), 1.70 (1H, m, CHCH 2 CH), 1.45 (9H, s, t-Bu). Found,%: С 67.10, Н 6.23, N 8.27. C 29 H 31 N 3 O 6 . Calculated,%: С 67.30, Н 6.04, N 8.12.
Стадия 2Stage 2
3-({(1S,4S)-5-(трет-Бутоксикарбонил)-2,5-диазабицикло[2.2.1]гептан-2-ил}метил)-4-[2-(диметиламино)этил]амино-11-метокси-1H-нафто[2,3-f]индол-5,10-дион3 - ({(1S, 4S) -5- (tert-butoxycarbonyl) -2,5-diazabicyclo [2.2.1] heptan-2-yl} methyl) -4- [2- (dimethylamino) ethyl] amino-11 -methoxy-1H-naphtho [2,3-f] indole-5,10-dione
Раствор 65 мг (0.125 ммоль) 3-({(1S,4S)-5-(трет-бутоксикарбонил)-2,5-диаза-бицикло[2.2.1]гептан-2-ил}метил)-4,11-диметокси-1H-нафто[2,3-f]индол-5,10-диона (b, схема В)в 50 мл ТГФ и 0.3 мл N,N-диметилэтилендиамина нагревают при 30°С 4-5 ч. В течение этого времени цвет реакционной смеси меняется от темно-желтого до малинового. Смесь охлаждают и разбавляют водой и прибавляют уксусную кислоту до рН 8.0. Основной продукт экстрагируют хлороформом (4×20 мл), экстракт промывают водой, сушат и упаривают. Остаток очищают колоночной хроматографией (хлороформ - метанол, 10:0→2:1) и кристаллизуют продукт из смеси бензол - н-гептан (1:4). Выход 38 мг (53%) в виде малиновых кристаллов. Т.пл. 145-149°С.Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м. д., J=(Гц): 9.42 (1Н, уш. с, NH), 9.20 (1Н, уш. с, NH), 8.24 (2Н, м, Н6,9), 7.67 (2Н, м, Н7,8), 7.22 (1Н, уш. с, Н2), 4.43 (0.5Н, с, СН), 4.28 (0.5Н, с, СН), 4.03 (3Н, с, ОМе), 3.93 (2Н, м, CH2N), 3.60 (2Н, м, СН), 3.20-2.80 (5Н, м, СН), 2.59 (2Н, м, CH2NMe2), 2.28 (3Н, с, NMe2), 2.27 (3Н, с, NMe2), 1.92 (1Н, м, СНСН2СН), 1.73 (1Н, м, СНСН2СН), 1.48 (9Н, с, t-Bu). Масс-спектр, m/z (Ioтн., %): 573 (12) [М]+, 473 (100). C32H39N5O5. Вычислено М: 573.22.Solution 65 mg (0.125 mmol) 3 - ({(1S, 4S) -5- (tert-butoxycarbonyl) -2,5-diaza-bicyclo [2.2.1] heptan-2-yl} methyl) -4.11- dimethoxy-1H-naphtho [2,3-f] indole-5,10-dione ( b , Scheme B ) in 50 ml of THF and 0.3 ml of N, N-dimethylethylenediamine are heated at 30 ° C. for 4-5 hours. During this time, the color of the reaction mixture changes from dark yellow to raspberry. The mixture is cooled and diluted with water and acetic acid is added to pH 8.0. The main product is extracted with chloroform (4 × 20 ml), the extract is washed with water, dried and evaporated. The residue was purified by column chromatography (chloroform-methanol, 10: 0 → 2: 1) and the product was crystallized from benzene-n-heptane (1: 4). Yield 38 mg (53%) as raspberry crystals. Mp 145-149 ° C. 1 H NMR spectrum (400 MHz, CDCl 3 ), δ, ppm, J = (Hz): 9.42 (1H, br.s, NH), 9.20 (1H, br.s, NH), 8.24 (2H, m, H 6.9 ), 7.67 (2H, m, H 7.8 ), 7.22 (1H, br.s, H 2 ), 4.43 (0.5H, s, CH), 4.28 (0.5H, s, CH), 4.03 (3H, s, OMe), 3.93 (2H, m, CH 2 N), 3.60 (2H, m, CH), 3.20-2.80 (5H, m, CH), 2.59 (2H, m, CH 2 NMe 2 ), 2.28 (3H, s, NMe 2 ), 2.27 (3H, s, NMe 2 ), 1.92 (1H, m, CHCH 2 CH), 1.73 (1H, m, CHCH 2 CH), 1.48 (9H, s, t-Bu). Mass spectrum, m / z ( Irel ,%): 573 (12) [M] + , 473 (100). C 32 H 39 N 5 O 5 . Calculated M: 573.22.
Стадия 3Stage 3
3-{(1S,4S)-2,5-Диазабицикло[2.2.1]гептан-2-ил}метил-11-гидрокси-4-[2-(диметил-амино)этил]амино-1H-нафто[2,3-f]индол-5,10-дион дигидрохлорид3 - {(1S, 4S) -2,5-Diazabicyclo [2.2.1] heptan-2-yl} methyl-11-hydroxy-4- [2- (dimethyl-amino) ethyl] amino-1H-naphtho [2 , 3-f] indole-5,10-dione dihydrochloride
К перемешиваемому раствору 30 мг (0.05 ммоль) 3-({(1S,4S)-5-(трет-бутоксикарбонил)-2,5-диазабицикло[2.2.1]гептан-2-ил}метил)-4-[2-(диметиламино)этил]-амино-11-метокси-1H-нафто[2,3-f]индол-5,10-диона (c, схема В) в 20.0 мл сухого дихлорэтана прибавляют 1.5 мл (1.5 ммоль) 1M-ного раствора BBr3×SMe2 в дихлометане, кипятят 30 мин, охлаждают, прибавляют по каплям метанол (2.0 мл) и упаривают. Остаток распределяют в теплой смеси н-бутанола (50 мл) и 2%-ного водного раствора Na2CO3 (30 мл). Экстракт промывают водой, сушат и упаривают. Малиновое масло, полученное после упаривания раствора, растворяют в метаноле (3.0 мл) и прибавляют 5.0 мл раствора (1н) HCl в эфире. Смесь выдерживают в течение ночи в морозильнике и отфильтровывают темно-малиновый кристаллический осадок. Выход 15 мг (51%) тригидрохлорида d (схема В) с т.пл. 229-231°С (разл.). Спектр ЯМР 1Н (400 МГц, D2O), δ, м. д., J=(Гц): 7.76 (1Н, уш. с, Н9), 7.46 (1Н, с, Н2), 7.39-7.25 (3Н, уш. м, Н6,7,8), 4.50 (2Н, с, СН), 4.40 (2Н, м, СН), 3.64 (1Н, м, СН), 3.50 (5Н, м, СН), 3.24 (2Н, м, СН), 2.78 (6Н, с, NMe2), 2.45 (1Н, д, J=12.3, СНСН2СН), 2.34 (1Н, д, J=12.3, СНСН2СН). Найдено, %: С 53.46, Н 5.99, N 12.11. C26H29N5O3·3HCl·H2O. Вычислено, %: С 53.20, Н 5.84, N 11.93.To a stirred solution 30 mg (0.05 mmol) 3 - ({(1S, 4S) -5- (tert-butoxycarbonyl) -2,5-diazabicyclo [2.2.1] heptan-2-yl} methyl) -4- [2 - (dimethylamino) ethyl] amino-11-methoxy-1H-naphtho [2,3-f] indole-5,10-dione ( c , Scheme B ) 1.5 ml (1.5 mmol) of 1M- are added to 20.0 ml of dry dichloroethane solution of BBr 3 × SMe 2 in dichloromethane, boiled for 30 minutes, cooled, methanol (2.0 ml) was added dropwise and evaporated. The residue was partitioned between a warm mixture of n-butanol (50 ml) and a 2% aqueous solution of Na 2 CO 3 (30 ml). The extract was washed with water, dried and evaporated. The raspberry oil obtained after evaporation of the solution was dissolved in methanol (3.0 ml) and 5.0 ml of a solution of (1N) HCl in ether was added. The mixture was kept in the freezer overnight and a dark crimson crystalline precipitate was filtered off. Yield 15 mg (51%) of trihydrochloride d (Scheme B ) with mp. 229-231 ° C (decomp.). 1 H NMR (400 MHz, D 2 O), δ, ppm, J = (Hz).. 7.76 (. 1H, br s, 9 H), 7.46 (1H, s, 2 H), 7.39- 7.25 (3H, br. M, H 6.7.8 ), 4.50 (2H, s, CH), 4.40 (2H, m, CH), 3.64 (1H, m, CH), 3.50 (5H, m, CH) ), 3.24 (2H, m, CH), 2.78 (6H, s, NMe 2 ), 2.45 (1H, d, J = 12.3, CHCH 2 CH), 2.34 (1H, d, J = 12.3, CHCH 2 CH) . Found,%: C 53.46, H 5.99, N 12.11. C 26 H 29 N 5 O 3 · 3HCl · H 2 O. Calculated,%: C 53.20, H 5.84, N 11.93.
Схема ГScheme D
Пример 7Example 7
4,11-Дигидрокси-2-метил-N-(3-пирролидинил)антра[2,3-b]фуран-5,10-дион-3-карбоксамид гидрохлорид4,11-dihydroxy-2-methyl-N- (3-pyrrolidinyl) anthra [2,3-b] furan-5,10-dione-3-carboxamide hydrochloride
Суспензию 100 мг (0.3 ммоль) 4,11-дигидрокси-2-метилантра[2,3-b]фуран-5,10-дион-3-карбоновой кислоты (а, схема Г), полученной по ранее описанному методу [Горелик М.В., Мишина Е.В., ЖОрХ, 1983,19, 2185] в 10 мл толуола и 0.2 мл (2.8 ммоль) SOCl2 кипятят при интенсивном перемешивании 40 мин, после чего реакционную массу упаривают. Остаток растворяют в горячем хлороформе и прибавляют 0.18 г (1 ммоль) трет-бутил 3-амино-1-пирролидинкарбоксилата. Реакционную массу кипятят 10 мин промывают раствором (1%-ным) NaHCO3, водой, разбавленным раствором HCl, водой, сушат и упаривают. Остаток очищают колоночной хроматографией (хлороформ - метанол, 10:1→5:1), полученный красный порошок растворяют в горячем хлороформе и прибавляют 3.0 мл раствора (1н) HCl в метаноле. Смесь перемешивают 6 ч и отфильтровывают красный осадок. Выход 73 мг (55%) гидрохлорида 4,11-дигидрокси-2-метил-N-(3-пирролидинил)антра[2,3-b]фуран-5,10-дион-3-карбоксамида. Т.пл. 228-231°С.Спектр 1Н ЯМР (400 МГц, ДМСО-d6), δ, м. д., J=(Гц): 9.29 (1Н, уш. с, NH2), 8.93 (1Н, д, J=6.0, NH), 8.16 (2H, м, Н6,9), 7.90 (2Н, м, Н7,8), 4.55 (1Н, м, СН), 3.50 (2Н, м, СН2), 3.33 (1Н, м, CH2), 3.17 (1Н, м, CH2), 2.62 (3Н, с, СН3), 2.23 (1Н, м, J=7.3, СН2СН2СН), 1.99 (1Н, м, J=8.4, CH2CH2CH). Масс-спектр, м/z (Ioтн., %): 406 (7) [M]+, 337 (38), 321 (100), 304 (71), 290 (24). Найдено, %: С 59.78, Н 4.21, N 6.20. C22H18N2O6.HCl. Вычислено, %: С 59.67, Н 4.32, N 6.33. М406.14.A suspension of 100 mg (0.3 mmol) of 4,11-dihydroxy-2-methylanthra [2,3-b] furan-5,10-dion-3-carboxylic acid ( a , Scheme D ) obtained by the previously described method [Gorelik M .V., Mishina EV, ZhORKh, 1983.19, 2185] in 10 ml of toluene and 0.2 ml (2.8 mmol) of SOCl 2 are boiled with vigorous stirring for 40 minutes, after which the reaction mass is evaporated. The residue was dissolved in hot chloroform and 0.18 g (1 mmol) of tert-butyl 3-amino-1-pyrrolidinecarboxylate was added. The reaction mass is boiled for 10 minutes, washed with a solution of (1%) NaHCO 3 , water, dilute HCl, water, dried and evaporated. The residue was purified by column chromatography (chloroform-methanol, 10: 1 → 5: 1), the resulting red powder was dissolved in hot chloroform, and 3.0 ml of a solution of (1N) HCl in methanol was added. The mixture was stirred for 6 hours and the red precipitate was filtered off. Yield 73 mg (55%) of 4,11-dihydroxy-2-methyl-N- (3-pyrrolidinyl) anthra [2,3-b] furan-5,10-dion-3-carboxamide hydrochloride. Mp 228-231 ° C. 1 H NMR spectrum (400 MHz, DMSO-d 6 ), δ, ppm, J = (Hz): 9.29 (1H, br.s, NH 2 ), 8.93 (1H, d , J = 6.0, NH), 8.16 (2H, m, H 6.9 ), 7.90 (2H, m, H 7.8 ), 4.55 (1H, m, CH), 3.50 (2H, m, CH 2 ) , 3.33 (1H, m, CH 2 ), 3.17 (1H, m, CH 2 ), 2.62 (3H, s, CH3), 2.23 (1H, m, J = 7.3, CH 2 CH 2 CH), 1.99 (1H , m, J = 8.4, CH 2 CH 2 CH). Mass spectrum, m / z ( Irel ,%): 406 (7) [M] + , 337 (38), 321 (100), 304 (71), 290 (24). Found,%: C 59.78, H 4.21, N 6.20. C 22 H 18 N 2 O 6 .HCl. Calculated,%: C 59.67, H 4.32, N 6.33. M406.14.
Пример 8Example 8
4.11-Дигидрокси-2-метил-3-[(3-амино-1-пирролидинил)карбонил]антра[2,3-b]фуран-5,10-дион гидрохлорид4.11-dihydroxy-2-methyl-3 - [(3-amino-1-pyrrolidinyl) carbonyl] anthra [2,3-b] furan-5,10-dione hydrochloride
Получают по методике, аналогичной приведенной в примере 7, из 4,11-дигидрокси-2-метилантра[2,3-b]фуран-5,10-дион-3-карбоновой кислоты (а, схема Г) и 3-(трет-бутоксикарбониламино)пирролидина. Выход 59% гидрохлорида. Т.пл. 244-246°С.Спектр ЯМР 1Н (400 МГц, D2O), 6, м. д.: 7.16 (4Н, м, Н6,9,7,8), 3.89 (1Н, м, NCH2), 3.80 (1Н, м, NCH2), 3.58 (1Н, м, NCH2), 3.49 (1Н, м, NCH2), 3.29 (1Н, м, СН), 2.35 (3Н, с, Me), 2.23 (1Н, м, J=7.1, СН2СН2СН), 1.19 (1Н, м, J=8.6, СН2СН2СН). Масс-спектр, m/z (Ioтн. %): 406 (21) [М]+, 389 (45), 321 (100), 294 (82), 265 (23). Найдено, %: С 59.38, Н 4.15, N 6.45. C22H18N2O6.HCl. Вычислено, %: С 59.67, Н 4.32, N 6.33. М 406.14.Obtained by the method similar to that described in example 7, from 4,11-dihydroxy-2-methylanthra [2,3-b] furan-5,10-dion-3-carboxylic acid ( a , scheme D ) and 3- (tert β-butoxycarbonylamino) pyrrolidine. Yield 59% hydrochloride. Mp 244-246 ° S.Spektr 1 H NMR (400 MHz, D 2 O), 6 m. D .: 7.16 (4H, m, H 6,9,7,8), 3.89 (1H, m, NCH 2 ), 3.80 (1H, m, NCH 2 ), 3.58 (1H, m, NCH 2 ), 3.49 (1H, m, NCH 2 ), 3.29 (1H, m, CH), 2.35 (3H, s, Me), 2.23 (1H, m, J = 7.1, CH 2 CH 2 CH), 1.19 (1H, m, J = 8.6, CH 2 CH 2 CH). Mass spectrum, m / z ( Irel. %): 406 (21) [M] + , 389 (45), 321 (100), 294 (82), 265 (23). Found,%: C 59.38, H 4.15, N 6.45. C 22 H 18 N 2 O 6 .HCl. Calculated,%: C 59.67, H 4.32, N 6.33. M 406.14.
Схема ДScheme D
Пример 9Example 9
4,11-Дигидрокси-3-[(пирролидин-3-иламино)метил]антра[2,3-b]тиофен-5,10-дион4,11-dihydroxy-3 - [(pyrrolidin-3-ylamino) methyl] anthra [2,3-b] thiophene-5,10-dione
Стадия 1Stage 1
3-{[1-(трет-Бутоксикарбонил)пирролидин-3-ил]амино}метил-4,11-диметокси-антра[2,3-b]тиофен-5,10-дион3 - {[1- (tert-Butoxycarbonyl) pyrrolidin-3-yl] amino} methyl-4,11-dimethoxy-anthra [2,3-b] thiophen-5,10-dione
Кипятят 1 ч при перемешивании раствор 0.10 г (0.24 ммоль) 3-бромметил-4,11-диметоксиантра[2,3-b]тиофен-5,10-диона (а, схема Д), полученного по ранее описанному методу [Синкевич Ю.Б. и др., ХГС, 2007, 1478], 0.085 г (0.5 ммоль), трет-бутил 3-амино-1-пирролидинкарбоксилата и 0.5 мл (0.6 ммоль) N,N-диизопропилэтиламина в 20.0 мл хлороформа. Промывают раствор водой, сушат и упаривают. Остаток очищают колоночной хроматографией (хлороформ - метанол, 10:0→3:1). Выход 101 мг (80%), желтое медленно кристаллизующееся масло. Выход 62%, желтые кристаллы. Т.пл. 139-142°С. Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м. д.: 8.25 (2Н, м, Н6,9), 7.77 (2Н, м, Н7,8), 7.56 (1Н, с, Н2), 4.19 (2Н, с, CH2N), 4.13 (3Н, с, ОМе), 4.08 (3Н, с, ОМе), 3.48 (2Н, м, CH2), 3.30 (2Н, м, СН2), 3.13 (1Н, м, СН), 2.12 (1Н, уш. с, NH), 2.00 (1Н, м, СН2), 1.73 (1Н, м, СН2), 1.42 (9Н, с, t-Bu). Спектр ЯМР 13С (100 МГц, CDCl3), δ, м. д.: 182.99 (С=О), 182.68 (С=О), 154.55, 154.48 (NCO2), 152.87, 144.25,138.29,138.15, 137.77, 134.51,134.04, 122.02, 120.84, 79.12, 133.61 (2CH), 129.42, 129.26 (СН), 126.71 (СН), 126.51 (СН), 56.62, 55.61 (СН), 51.85, 51.15 (СН2), 47.30 (СН2), 44.37, 44.03 (СН2), 32.17, 31.33 (СН2), 63.60 (СН3), 61.99 (СН3), 28.44 (t-Bu). Масс-спектр, m/z (Ioтн. %): 522 (100) [M]+. Найдено, %: С 64.11, Н 5.65, N 5.43. C28H30N2O6S. Вычислено, %: С 64.35, Н 5.79, N 5.36. М 522.18.A solution of 0.10 g (0.24 mmol) of 3-bromomethyl-4,11-dimethoxyantra [2,3-b] thiophene-5,10-dione ( a , Scheme D ) obtained according to the previously described method [Sinkevich Yu. .B. et al., CGS, 2007, 1478], 0.085 g (0.5 mmol), tert-butyl 3-amino-1-pyrrolidine carboxylate and 0.5 ml (0.6 mmol) of N, N-diisopropylethylamine in 20.0 ml of chloroform. Wash the solution with water, dry and evaporate. The residue was purified by column chromatography (chloroform-methanol, 10: 0 → 3: 1). Yield 101 mg (80%), yellow, slowly crystallizing oil. Yield 62%, yellow crystals. Mp 139-142 ° C. 1 H NMR (400 MHz, CDCl 3), δ, m. D .: 8.25 (2H, m, 6.9 H), 7.77 (2H, m, 7.8 H), 7.56 (1H, s, H 2 ), 4.19 (2H, s, CH 2 N), 4.13 (3H, s, OMe), 4.08 (3H, s, OMe), 3.48 (2H, m, CH 2 ), 3.30 (2H, m, CH 2 ), 3.13 (1Н, m, СН), 2.12 (1Н, br.s, NH), 2.00 (1Н, m, СН 2 ), 1.73 (1Н, m, СН 2 ), 1.42 (9Н, s, t- Bu). 13 C NMR spectrum (100 MHz, CDCl 3 ), δ, ppm: 182.99 (С = О), 182.68 (С = О), 154.55, 154.48 (NCO 2 ), 152.87, 144.25,138.29,138.15, 137.77 , 134.51,134.04, 122.02, 120.84, 79.12, 133.61 (2CH), 129.42, 129.26 (СН), 126.71 (СН), 126.51 (СН), 56.62, 55.61 (СН), 51.85, 51.15 (СН 2 ), 47.30 ( CH 2 ), 44.37, 44.03 (CH 2 ), 32.17, 31.33 (CH 2 ), 63.60 (CH 3 ), 61.99 (CH 3 ), 28.44 (t-Bu). Mass spectrum, m / z ( Irel. %): 522 (100) [M] + . Found,%: C 64.11, H 5.65, N 5.43. C 28 H 30 N 2 O 6 S. Calculated,%: C 64.35, H 5.79, N 5.36. M 522.18.
Стадия 2Stage 2
4,11-Дигидрокси-3-[(пирролидин-3-иламино)метил]антра[2,3-b]тиофен-5,10-дион дигидрохлорид4,11-dihydroxy-3 - [(pyrrolidin-3-ylamino) methyl] anthra [2,3-b] thiophene-5,10-dione dihydrochloride
К раствору 70 мг (0.19 ммоль) антратиофендиона 270 в 20.0 мл АсОН прибавляют 5.0 конц. раствора HBr, кипятят 4 ч при интенсивном перемешивании и упаривают. Остаток распределяют в горячей смеси н-бутанола (50 мл) и 1%-ного водного раствора NaHCO3 (20 мл). Экстракт промывают водой, сушат и упаривают. Остаток очищают колоночной хроматографией (CHCl3-МеОН-конц. NH4OH, 10:2:0→10:3:1). Остаток растворяют в теплом растворе (1н) HCl, осаждают продукт ацетоном, промывают Et2O, сушат. Выход 41 мг (68%) красных кристаллов дигидрохлорида 278. Т.пл. 252-254°С (разл.). Спектр ЯМР 1Н (400 МГц, D2O), δ, м. д., J=(Гц): 7.93 (1Н, с, Н2), 7.61 (2Н, м, Н6,9), 7.46 (2Н, м, Н7,8), 4.42 (2Н, м, CH2N), 4.24 (1Н, дд, J=7A, NCH2CH), 3.90 (1Н, дд, J=5.1, J=8.2, NCH2CH), 3.63 (1Н, м, NCH2CH2), 3.56 (1Н, м, СН), 3.49 (1Н, м, NCH2CH2), 2.65 (1Н, м, J=7.0, CH2CH2CH), 2.27 (1Н, м, J=7.1, CH2CH2CH). Масс-спектр, m/z (Ioтн. %): 394 (18) [М]+, 310 (100), 296 (76). Найдено, %: С 52.14, Н 4.76, N 5.95, S 6.74. C21H18N2O4S. 2HCl. H2O. Вычислено, %: С 51.96, Н 4.57, N 5.77, S 6.61. М 394.10.To a solution of 70 mg (0.19 mmol) of anthratiophenedione 270 in 20.0 ml of AcOH, 5.0 conc. HBr solution, boil for 4 hours with vigorous stirring and evaporate. The residue was partitioned in a hot mixture of n-butanol (50 ml) and a 1% aqueous solution of NaHCO 3 (20 ml). The extract was washed with water, dried and evaporated. The residue was purified by column chromatography (CHCl 3 -MeOH-conc. NH 4 OH, 10: 2: 0 → 10: 3: 1). The residue was dissolved in a warm solution of (1N) HCl, the product precipitated with acetone, washed with Et 2 O, and dried. Yield 41 mg (68%) of red crystals of dihydrochloride 278. mp. 252-254 ° C (decomp.). 1 H NMR spectrum (400 MHz, D 2 O), δ, ppm, J = (Hz): 7.93 (1Н, s, Н 2 ), 7.61 (2Н, m, Н 6.9 ), 7.46 ( 2H, m, H 7.8 ), 4.42 (2H, m, CH 2 N), 4.24 (1H, dd, J = 7A, NCH 2 CH), 3.90 (1H, dd, J = 5.1, J = 8.2, NCH 2 CH), 3.63 (1H, m, NCH 2 CH 2 ), 3.56 (1H, m, CH), 3.49 (1H, m, NCH 2 CH 2 ), 2.65 (1H, m, J = 7.0, CH 2 CH 2 CH), 2.27 (1H, m, J = 7.1, CH 2 CH 2 CH). Mass spectrum, m / z ( Irel. %): 394 (18) [M] + , 310 (100), 296 (76). Found,%: C 52.14, H 4.76, N 5.95, S 6.74. C 21 H 18 N 2 O 4 S. 2HCl. H 2 O. Calculated,%: C 51.96, H 4.57, N 5.77, S 6.61. M 394.10.
Пример 10Example 10
3-[(3-Аминопирролидин-1-ил)метил]-4,11-дигидроксиантра[2,3-b]тиофен-5,10-дион3 - [(3-aminopyrrolidin-1-yl) methyl] -4,11-dihydroxyantra [2,3-b] thiophen-5,10-dione
Стадия 1Stage 1
3-{[3-(трет-Бутоксикарбониламино)пирролидин-1-ил]метил}-4,11-диметоксиантра[2,3-b]тиофен-5,10-дион3 - {[3- (tert-Butoxycarbonylamino) pyrrolidin-1-yl] methyl} -4,11-dimethoxyanthra [2,3-b] thiophen-5,10-dione
Получают по методике, аналогичной приведенной в примере 9, стадия 1, из 3-бромметил-4,11-диметоксиантра[2,3-b]тиофен-5,10-диона (а, схема Д) и 3-(трет-бутоксикарбониламино)пирролидина. Выход 85%, желтые кристаллы. Т.пл. 98-99°С.Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м. д., J=(Гц): 8.25 (2Н, м, Н6,9), 7.76 (2Н, м, Н7,8), 7.62 (1Н, с, Н2), 5.22 (1Н, уш. д, J=6.4, NH), 4.22 (1H, м, CH), 4.08 (5Н, с, CH2N, ОМе), 4.04 (3Н, с, ОМе), 2.97 (1Н, м, CH2), 2.82 (1Н, м, СН2), 2.71 (1Н, д, J=7.4, CH2), 2.51 (1Н, дд, J=7.4, J=8.4, СН2), 2.33 (1Н, м, СН2), 1.68 (1Н, м, СН2), 1.43 (9Н, с, трет-Bu). Спектр ЯМР 13(С, 400 МГц, CDCl3), δ, м. д.: 182.93 (С=O), 182.71 (С=О), 155.32 (NCO2), 155.28, 152.65, 143.77, 138.02, 137.57, 134.55, 134.02, 121.88, 120.55, 79.21, 133.49 (CH), 133.43 (CH), 130.00 (CH), 126.65 (CH), 126.43 (CH), 49.81 (CH), 61.52 (СН2), 54.78 (СН2), 52.95 (СН2), 32.51 (СН2), 63.05 (СН3), 61.89 (СН3), 28.31 (трет-Bu). Найдено, %: С 64.02, Н 5.43, N 5.22. C28H30N2O6S. Вычислено, %: С 64.35, Н 5.79, N 5.36.Obtained by the method similar to that described in example 9, stage 1, from 3-bromomethyl-4,11-dimethoxyanth [2,3-b] thiophene-5,10-dione ( a , Scheme D ) and 3- (tert-butoxycarbonylamino ) pyrrolidine. Yield 85%, yellow crystals. Mp 98-99 ° C. 1 H NMR spectrum (400 MHz, CDCl 3 ), δ, ppm, J = (Hz): 8.25 (2H, m, H 6.9 ), 7.76 (2H, m, N 7.8 ), 7.62 (1H, s, H 2 ), 5.22 (1H, br.s.d, J = 6.4, NH), 4.22 (1H, m, CH), 4.08 (5H, s, CH 2 N, OMe ), 4.04 (3H, s, OMe), 2.97 (1H, m, CH 2 ), 2.82 (1H, m, CH 2 ), 2.71 (1H, d, J = 7.4, CH 2 ), 2.51 (1H, dd , J = 7.4, J = 8.4, CH 2 ), 2.33 (1H, m, CH 2 ), 1.68 (1H, m, CH 2 ), 1.43 (9H, s, t-Bu). NMR spectrum 13 (С, 400 MHz, CDCl 3 ), δ, ppm: 182.93 (С = O), 182.71 (С = О), 155.32 (NCO 2 ), 155.28, 152.65, 143.77, 138.02, 137.57, 134.55, 134.02, 121.88, 120.55, 79.21, 133.49 (CH), 133.43 (CH), 130.00 (CH), 126.65 (CH), 126.43 (CH), 49.81 (CH), 61.52 (CH 2 ), 54.78 (CH 2 ), 52.95 (CH 2 ), 32.51 (CH 2 ), 63.05 (CH 3 ), 61.89 (CH 3 ), 28.31 (t-Bu). Found,%: C 64.02, H 5.43, N 5.22. C 28 H 30 N 2 O 6 S. Calculated,%: C 64.35, H 5.79, N 5.36.
Стадия 2Stage 2
3-[(3-Аминопирролидин-1-ил)метил]-4,11-дигидроксиантра[2,3-b]тиофен-5,10-дион дигидрохлорид3 - [(3-Aminopyrrolidin-1-yl) methyl] -4,11-dihydroxyantra [2,3-b] thiophen-5,10-dione dihydrochloride
Получают по методике, аналогичной приведенной в примере 9, стадия 2, из 3-{[3-(трет-бутоксикарбониламино)пирролидин-1-ил]метил} -4,11-диметоксиантра[2,3-b]тиофен-5,10-диона (b, схема Д). Выход 41% дигидрохлорида, красные кристаллы. Т.пл. 245-247°С (разл.). Спектр ЯМР 1Н (400 МГц, D2O), δ, м. д.: 8.00 (1Н, с, Н2), 7.63 (2Н, м, Н6,9), 7.48 (2Н, м, Н7,8), 4.65 (2Н, с, CH2N), 4.25 (1Н, м, NCH2CH), 3.95 (1Н, м, NCH2CH), 3.73 (1Н, м, NCH2CH2), 3.59 (2Н, м, NCH2CH2, CH), 2.69 (1Н, м, СН2СН2СН), 2.28 (1Н, м, СН2СН2СН). Масс-спектр, m/z (Ioтн. %): 394 (11) [М]+, 367 (32), 310 (100), 296 (71). Найдено, %: С 52.10, Н 4.67, N 6.03, S 6.43. C21H18N2O4S. 2HCl. H2O. Вычислено, %: С 51.96, Н 4.57, N 5.77, S 6.61. М 394.10.Obtained by the method similar to that described in example 9, stage 2, from 3 - {[3- (tert-butoxycarbonylamino) pyrrolidin-1-yl] methyl} -4,11-dimethoxyanth [2,3-b] thiophen-5, 10-dione ( b , Scheme D ). Yield 41% dihydrochloride, red crystals. Mp 245-247 ° C (decomp.). 1 H NMR (400 MHz, D 2 O), δ, m. D .: 8.00 (1H, s, 2 H), 7.63 (2H, m, 6.9 H), 7.48 (2H, m, H 7 , 8 ), 4.65 (2H, s, CH 2 N), 4.25 (1Н, m, NCH 2 CH), 3.95 (1Н, m, NCH 2 CH), 3.73 (1Н, m, NCH 2 CH 2 ), 3.59 (2H, m, NCH 2 CH 2 , CH), 2.69 (1H, m, CH 2 CH 2 CH), 2.28 (1H, m, CH 2 CH 2 CH). Mass spectrum, m / z ( Irel. %): 394 (11) [M] + , 367 (32), 310 (100), 296 (71). Found,%: C 52.10, H 4.67, N 6.03, S 6.43. C 21 H 18 N 2 O 4 S. 2HCl. H 2 O. Calculated,%: C 51.96, H 4.57, N 5.77, S 6.61. M 394.10.
Пример 11Example 11
3-{[(2S,4S)-4-Амино-2-(гидроксиметил)пирролидин-1-ил]метил}-4,11-дигид-роксиантра[2,3-b]тиофен-5,10-дион дигидрохлорид3 - {[(2S, 4S) -4-amino-2- (hydroxymethyl) pyrrolidin-1-yl] methyl} -4,11-dihydroxyantra [2,3-b] thiophen-5,10-dione dihydrochloride
Стадия 1Stage 1
4,11-Диметокси-3-{[(2S,4S)-4-(этоксикарбониламино)-2-(гидроксиметил)пирролидин-1-ил]метил}-антра[2,3-b]тиофен-5,10-дион4,11-Dimethoxy-3 - {[((2S, 4S) -4- (ethoxycarbonylamino) -2- (hydroxymethyl) pyrrolidin-1-yl] methyl} -antra [2,3-b] thiophen-5,10- dion
Получают по методике, аналогичной приведенной в примере 9, стадия 1, из 3-бромметил-4,11-диметоксиантра[2,3-b]тиофен-5,10-диона (а, схема Д) и (2S,4S)-4-(этоксикарбониламино)-2-(гидроксиметил)пирролидина. Выход 72%, желтые кристаллы. Т.пл. 144-147°С. Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м. д., J=(Гц): 8.20 (2Н, м, Н6,9), 7.73 (2Н, м, Н7,8), 7.66 (1Н, с, Н2), 5.77 (1Н, уш. д, J=8.1, NH), 4.44 (1Н, д, J=14.3, СН), 4.21 (1Н, м, СН2), 4.11 (3Н, с, ОМе), 4.03 (3Н, с, ОМе), 4.02 (2Н, м, СН2) 3.85 (2Н, т, СН2), 3.57 (1Н, д, J=11.4, СН), 3.01 (1Н, д, J=11.4, СН), 2.85 (1Н, м, СН2), 2.57 (1Н, м, СН2), 2.44 (1Н, м, СН2), 1.80 (1Н, м, СН2), 1.43 (3Н, т, J=7.1, СН3). Найдено, %: С 63.11, Н 5.64, N 5.12. C29H32N2O7S. Вычислено, %: С 63.03, Н 5.84, N 5.07.Obtained by a method similar to that described in example 9, stage 1, from 3-bromomethyl-4,11-dimethoxyanth [2,3-b] thiophene-5,10-dione ( a , Scheme D ) and (2S, 4S) - 4- (ethoxycarbonylamino) -2- (hydroxymethyl) pyrrolidine. Yield 72%, yellow crystals. Mp 144-147 ° C. 1 H NMR (400 MHz, CDCl 3), δ, ppm, J = (Hz).. 8.20 (2H, m, 6.9 H), 7.73 (2H, m, 7.8 H), 7.66 (1Н, s, Н 2 ), 5.77 (1Н, br.s.d, J = 8.1, NH), 4.44 (1Н, d, J = 14.3, СН), 4.21 (1Н, m, СН 2 ), 4.11 (3Н , s, OMe), 4.03 (3Н, s, OMe), 4.02 (2Н, m, СН 2 ) 3.85 (2Н, t, СН 2 ), 3.57 (1Н, d, J = 11.4, СН), 3.01 (1Н d, J = 11.4, CH), 2.85 (1H, m, CH 2 ), 2.57 (1H, m, CH 2 ), 2.44 (1H, m, CH 2 ), 1.80 (1H, m, CH 2 ), 1.43 (3H, t, J = 7.1, CH 3 ). Found,%: C 63.11, H 5.64, N 5.12. C 29 H 32 N 2 O 7 S. Calculated,%: C 63.03, H 5.84, N 5.07.
Стадия 2Stage 2
3-{[(2S,4S)-4-Амино-2-(гидроксиметил)пирролидин-1-ил]метил}-4,11-дигид-роксиантра[2,3-b]тиофен-5,10-дион дигидрохлорид3 - {[(2S, 4S) -4-amino-2- (hydroxymethyl) pyrrolidin-1-yl] methyl} -4,11-dihydroxyantra [2,3-b] thiophen-5,10-dione dihydrochloride
К раствору 70 мг (0.13 ммоль) 4,11-диметокси-3-{[(2S,4S)-4-(этоксикарбониламино)-2-(гидроксиметил)пирролидин-1-ил]метил}-антра[2,3-b]тиофен-5,10-диона (b, схема Д), в 20.0 мл АсОН прибавляют 4.0 мл конц. раствора HBr, кипятят 8 ч при интенсивном перемешивании и упаривают. Остаток разбавляют водой (10 мл), кипятят 1 ч, нейтрализуют 1%-ным водным раствором NaHCO3 до рН7 и экстрагируют продукт горячим н-бутанолом (2×30 мл). Экстракт промывают водой, сушат и упаривают. Остаток очищают колоночной хроматографией (хлороформ - метанол - конц. NH4OH, 10:2:0→5:3:1). Остаток обрабатывают 5 мл раствора (1н) HCl в МеОН, кипятят 10 мин, охлаждают и отфильтровывают красный осадок, промывают МеОН, сушат. Выход 38 мг (65%) дигидрохлорида, красные кристаллы. Выход 44%, красные кристаллы. Т.пл. 246-249°С (разл.). Спектр ЯМР 1Н (400 МГц, D2O), δ, м. д.: 8.06 (1Н, с, Н2), 7.74 (2Н, м, Н6,9), 7.60 (2Н, м, Н7,8), 4.83 (1Н, д, J=7A, CH2N), 4.43 (1Н, д, J=7A, CH2N), 4.30 (1Н, м, СН), 4.09 (2Н, м, NCH2), 3.98 (1Н, м, СН), 3.81 (1Н, м, NCH2), 3.66 (1Н, м, NCH2), 2.90 (1Н, м, CH2), 2.24 (1Н, м, СН2СН2СН). Найдено, %: С 49.87, Н 4.74, N 5.44, S 6.21. C22H20N2O5S. 2HCl. 2H2O. Вычислено, %: С 49.54, Н 4.91, N 5.25, S 6.01.To a solution of 70 mg (0.13 mmol) 4,11-dimethoxy-3 - {[(2S, 4S) -4- (ethoxycarbonylamino) -2- (hydroxymethyl) pyrrolidin-1-yl] methyl} -antra [2,3- b] thiophene-5,10-dione ( b , Scheme D ), in 20.0 ml of AcOH, 4.0 ml of conc. HBr solution, boil for 8 hours with vigorous stirring and evaporate. The residue was diluted with water (10 ml), boiled for 1 h, neutralized with a 1% aqueous solution of NaHCO 3 to pH7, and the product was extracted with hot n-butanol (2 × 30 ml). The extract was washed with water, dried and evaporated. The residue was purified by column chromatography (chloroform — methanol — conc. NH 4 OH, 10: 2: 0 → 5: 3: 1). The residue is treated with 5 ml of a solution of (1N) HCl in MeOH, boiled for 10 minutes, cooled and the red precipitate is filtered off, washed with MeOH, dried. Yield 38 mg (65%) of dihydrochloride, red crystals. Yield 44%, red crystals. Mp 246-249 ° C (decomp.). 1 H NMR (400 MHz, D 2 O), δ, m. D .: 8.06 (1H, s, 2 H), 7.74 (2H, m, 6.9 H), 7.60 (2H, m, H 7 , 8 ), 4.83 (1H, d, J = 7A, CH 2 N), 4.43 (1H, d, J = 7A, CH 2 N), 4.30 (1H, m, CH), 4.09 (2H, m, NCH 2 ), 3.98 (1H, m, CH), 3.81 (1H, m, NCH 2 ), 3.66 (1H, m, NCH 2 ), 2.90 (1H, m, CH 2 ), 2.24 (1H, m, CH 2 CH 2 CH). Found,%: C 49.87, H 4.74, N 5.44, S 6.21. C 22 H 20 N 2 O 5 S. 2HCl. 2H 2 O. Calculated,%: C 49.54, H 4.91, N 5.25, S 6.01.
Пример 12Example 12
4,11-Дигидрокси-3-[(пиперидин-4-иламино)метил]антра[2,3-b]тиофен-5,10-дион4,11-dihydroxy-3 - [(piperidin-4-ylamino) methyl] anthra [2,3-b] thiophene-5,10-dione
Стадия 1Stage 1
4,11-Диметокси-3-({[1-(этоксикарбонил)-4-пиперидинил]амино}метил)-антра[2,3-b]тиофен-5,10-дион4,11-dimethoxy-3 - ({[[1- (ethoxycarbonyl) -4-piperidinyl] amino} methyl) anthra [2,3-b] thiophen-5,10-dione
Получают по методике, аналогичной приведенной в примере 9, стадия 1, из 3-бромметил-4,11-диметоксиантра[2,3-b]тиофен-5,10-диона (а, схема Д) и этил 4-амино-1-пиперидинкарбоксилата. Выход 66%, желтые кристаллы. Т.пл. 151-152°С.Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м. д., J=(Гц): 8.25 (2Н, м, Н6,9), 7.78 (2Н, м, Н7,8), 7.61 (1Н, с, Н2), 4.24 (2Н, с, CH2N), 4.13 (3Н, с, ОМе), 4.12 (4Н, м, ОСН2, N(CH2)2), 4.08 (3Н, с, ОМе), 2.85 (2Н, т, J=11.6, N(CH2)2), 2.72 (1Н, м, NHCH), 1.93 (2Н, д, J=10.3, СН2), 1.40 (2Н, м, СН2), 1.45 (3Н, т, J=7.1, Me). Найдено, %: С 63.43, Н 5.31, N 5.43. C29H32N2O7S. Вычислено, %: С 63.76, Н 5.55, N 5.51.Obtained by the method similar to that described in example 9, stage 1, from 3-bromomethyl-4,11-dimethoxyanth [2,3-b] thiophene-5,10-dione ( a , Scheme D ) and ethyl 4-amino-1 -piperidinecarboxylate. Yield 66%, yellow crystals. Mp 151-152 ° S.Spektr 1 H NMR (400 MHz, CDCl 3), δ, ppm, J = (Hz).. 8.25 (2H, m, 6.9 H), 7.78 (2H, m, H 7.8 ), 7.61 (1H, s, H 2 ), 4.24 (2H, s, CH 2 N), 4.13 (3H, s, OMe), 4.12 (4H, m, OCH 2 , N (CH 2 ) 2 ), 4.08 (3H, s, OMe), 2.85 (2H, t, J = 11.6, N (CH 2 ) 2 ), 2.72 (1H, m, NHCH), 1.93 (2H, d, J = 10.3, CH 2 ), 1.40 (2H, m, CH 2 ), 1.45 (3H, t, J = 7.1, Me). Found,%: C 63.43, H 5.31, N 5.43. C 29 H 32 N 2 O 7 S. Calculated,%: C 63.76, H 5.55, N 5.51.
Стадия 2Stage 2
4,11-Дигидрокси-3-[(пиперидин-4-иламино)метил]антра[2,3-b]тиофен-5,10-дион дигидрохлорид4,11-dihydroxy-3 - [(piperidin-4-ylamino) methyl] anthra [2,3-b] thiophene-5,10-dione dihydrochloride
Раствор 90 мг (0.18 ммоль) 4,11-диметокси-3-({[1-(этоксикарбонил)-4-пиперидинил]амино}метил)-антра[2,3-b]тиофен-5,10-диона (b, схема Д) в смеси 20.0 мл АсОН и 4.0 мл конц. раствора HBr, кипятят при интенсивном перемешивании 12 ч и упаривают. Остаток разбавляют водой 20 мл, нейтрализуют 1%-ным водным раствором NaHCO3 до рН 7 и экстрагируют продукт горячим н-бутанолом (2×30 мл). Экстракт промывают водой, сушат и упаривают. Остаток очищают колоночной хроматографией (хлороформ - метанол - конц. NH4OH, 10:2:0→10:3:1). Остаток обрабатывают 5 мл раствора HCl (1н) в МеОН, кипятят 5 мин, охлаждают и отфильтровывают красный осадок, промывают МеОН, сушат. Выход 40 мг (49%) дигидрохлорида, красные кристаллы. Т.пл. 263-265°С (разл.). Спектр ЯМР 1Н (400 МГц, D2O), δ, м. д. J=(Гц): 7.90 (1Н, с, Н2), 7.55 (4Н, м, Н6,7,8,9), 4.38 (2Н, с, CH2N), 3.70 (3Н, м, N(CH2)2, NH2CH), 3.23 (2Н, т, J=12.2, N(CH2)2), 2.51 (2Н, д, J=13.7, CH2), 2.05 (2Н, м, СН2). Найдено, %: С 53.15, Н 4.71, N 5.54, S 6.62. C22H20N2O4S. 2HCl. H2O. Вычислено, %: С 52.91, Н 4.84, N 5.61, S 6.42.A solution of 90 mg (0.18 mmol) of 4,11-dimethoxy-3 - ({[1- (ethoxycarbonyl) -4-piperidinyl] amino} methyl) anthra [2,3-b] thiophene-5,10-dione ( b Scheme D ) in a mixture of 20.0 ml of AcOH and 4.0 ml of conc. HBr solution, boil with vigorous stirring for 12 hours and evaporated. The residue was diluted with 20 ml of water, neutralized with a 1% aqueous NaHCO 3 solution to pH 7, and the product was extracted with hot n-butanol (2 × 30 ml). The extract was washed with water, dried and evaporated. The residue was purified by column chromatography (chloroform — methanol — conc. NH 4 OH, 10: 2: 0 → 10: 3: 1). The residue is treated with 5 ml of a solution of HCl (1N) in MeOH, boiled for 5 minutes, cooled and the red precipitate is filtered off, washed with MeOH, dried. Yield 40 mg (49%) of dihydrochloride, red crystals. Mp 263-265 ° C (decomp.). 1 H NMR (400 MHz, D 2 O), δ, ppm: J = (Hz).. 7.90 (1H, s, 2 H), 7.55 (4H, m, H 6,7,8,9) 4.38 (2H, s, CH 2 N), 3.70 (3H, m, N (CH 2 ) 2 , NH 2 CH), 3.23 (2H, t, J = 12.2, N (CH 2 ) 2 ), 2.51 ( 2H, d, J = 13.7, CH 2 ), 2.05 (2H, m, CH 2 ). Found,%: C 53.15, H 4.71, N 5.54, S 6.62. C 22 H 20 N 2 O 4 S. 2HCl. H 2 O. Calculated,%: C 52.91, H 4.84, N 5.61, S 6.42.
Схема ЕScheme E
Пример 13Example 13
11-Гидрокси-4-[2-(диметиламино)этил]амино-3-[(пирролидин-3-иламино)метил]антра[2,3-b]тиофен-5,10-дион11-Hydroxy-4- [2- (dimethylamino) ethyl] amino-3 - [(pyrrolidin-3-ylamino) methyl] anthra [2,3-b] thiophen-5,10-dione
Стадия 1Stage 1
3-{[1-(трет-Бутоксикарбонил)пирролидин-3-ил]амино}метил-4-[2-(диметиламино)этил]амино-11-метоксиантра[2,3-b]тиофен-5,10-дион3 - {[1- (tert-butoxycarbonyl) pyrrolidin-3-yl] amino} methyl-4- [2- (dimethylamino) ethyl] amino-11-methoxyanthra [2,3-b] thiophen-5,10-dione
Получают из 3-{[1-(трет-бутоксикарбонил)пирролидин-3-ил]амино}метил-4,11-диметоксиантра[2,3-b]тиофен-5,10-диона (пример 9, стадия 1) и N,N-диметилэтилендиамина по методике, аналогичной приведенной в примере 6, стадия 2. Основной продукт из смеси после экстракции выделяют колоночной хроматографией (хлороформ - метанол - конц. NH4OH, 10:2:0→10:3:1). Выход 72%, бордовые кристаллы. Т.пл. 165-167°С (разл.). Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м. д., J=(Гц): 9.02 (1Н, уш. с, NH), 8.24 (2Н, м. H6,9), 7.73 (2Н, м, Н7,8), 7.47 (1Н, с, Н2), 4.17 (2Н, с, CH2N), 4.07 (3Н, с, ОМе), 3.49 (2Н, м, СН2), 3.32 (2Н, м, СН2), 3.16 (3Н, м, NCH2, СН2), 2.51 (2Н, м, CH2NMe2), 2.23 (6Н, с, NMe2), 2.20 (2Н, м, NH, СН2), 1.75 (1Н, м, СН2), 1.44 (9Н, с, трет-Bu). Масс-спектр, m/z (Iотн. %): 578 (4) [М]+, 478 (45), 394 (47), 380 (33), 306 (100), 292 (23). Найдено, %: С 63.13, Н 6.60, N 10.01. C31H38N4O5S. Вычислено, %: С 64.34, Н 6.62, N 9.68. М 578.72.Prepared from 3 - {[1- (tert-butoxycarbonyl) pyrrolidin-3-yl] amino} methyl-4,11-dimethoxyanth [2,3-b] thiophen-5,10-dione (Example 9, Step 1) and N, N-dimethylethylenediamine according to the procedure similar to that described in example 6, stage 2. The main product from the mixture after extraction is isolated by column chromatography (chloroform - methanol - conc. NH 4 OH, 10: 2: 0 → 10: 3: 1). Yield 72%, burgundy crystals. Mp 165-167 ° C (decomp.). 1 H NMR spectrum (400 MHz, CDCl 3 ), δ, ppm, J = (Hz): 9.02 (1H, br.s, NH), 8.24 (2H, m, H 6.9 ), 7.73 ( 2H, m, H 7.8 ), 7.47 (1H, s, H 2 ), 4.17 (2H, s, CH 2 N), 4.07 (3H, s, OMe), 3.49 (2H, m, CH 2 ), 3.32 (2H, m, CH 2 ), 3.16 (3H, m, NCH 2 , CH 2 ), 2.51 (2H, m, CH 2 NMe 2 ), 2.23 (6H, s, NMe 2 ), 2.20 (2H, m , NH, CH 2 ), 1.75 (1H, m, CH 2 ), 1.44 (9H, s, t-Bu). Mass spectrum, m / z ( Irel. %): 578 (4) [M] + , 478 (45), 394 (47), 380 (33), 306 (100), 292 (23). Found,%: C 63.13, H 6.60, N 10.01. C 31 H 38 N 4 O 5 S. Calculated,%: C 64.34, H 6.62, N 9.68. M 578.72.
Стадия 2Stage 2
11-Гидрокси-4-[2-(диметиламино)этил]амино-3-[(пирролидин-3-иламино)метил]-антра[2,3-b]тиофен-5,10-дион тригидробромид11-Hydroxy-4- [2- (dimethylamino) ethyl] amino-3 - [(pyrrolidin-3-ylamino) methyl] anthra [2,3-b] thiophene-5,10-dione trihydrobromide
К раствору 75 мг (0.13 ммоль) 3-{[1-(трет-бутоксикарбонил)пирролидин-3-ил]амино}метил-4-[2-(диметиламино)этил]амино-11-метоксиантра[2,3-b]тиофен-5,10-диона в 20.0 мл АсОН прибавляют 3.0 конц. раствора HBr, кипятят 3 ч при перемешивании и упаривают. Остаток растворяют в горячей воде и экстрагируют примеси теплым н-бутанолом. Водную фазу упаривают до объема 3-4 мл и осаждают продукт избытком ацетона. Отфильтровывают осадок, промывают ацетоном и сушат. Выход 42 мг (45%) тригидробромида, бардовые кристаллы. Т.пл. 225-228°С (разл.). Спектр ЯМР 1Н (400 МГц, D2O), δ, м. д., J=(Гц): 8.26 (1Н, с, Н2), 8.10 (1Н, д, Н9), 7.79 (1Н, д, Н6), 7.73 (1Н, т, Н8), 7.63 (1Н, т, Н7), 4.76 (2Н, с, CH2N), 4.24 (1Н, дд, J=7.4, NCH2CH), 3.85 (1Н, дд, J=5.1, J=8.2, NCH2CH), 3.68 (2Н, м, НСН2СН2, СН), 3.58 (2Н, м, HNCH2CH2), 3.49 (1Н, м, NCH2CH2), 3.42 (2Н, м, CH2NMe2), 2.96 (6Н, с, NMe2), 2.65 (1Н, м, СН2СН2СН), 2.33 (1Н, м, СН2СН2СН). Найдено, %: С 40.74, Н 4.66, N 7.78, S 4.54. C25H28N4O3S. 3HBr. 2H2O. Вычислено, %: С 40.39, Н 4.75, N 7.54, S 4.31.To a solution of 75 mg (0.13 mmol) 3 - {[1- (tert-butoxycarbonyl) pyrrolidin-3-yl] amino} methyl-4- [2- (dimethylamino) ethyl] amino-11-methoxyanthra [2,3-b ] thiophene-5,10-dione in 20.0 ml of AcOH add 3.0 conc. HBr solution, boil for 3 hours with stirring and evaporate. The residue was dissolved in hot water and the impurities were extracted with warm n-butanol. The aqueous phase is evaporated to a volume of 3-4 ml and the product precipitated with an excess of acetone. The precipitate is filtered off, washed with acetone and dried. Yield 42 mg (45%) of trihydrobromide, burgundy crystals. Mp 225-228 ° C (decomp.). 1 H NMR (400 MHz, D 2 O), δ, ppm, J = (Hz).. 8.26 (1H, s, H 2), 8.10 (1H, d, H 9), 7.79 (1H, d, H 6 ), 7.73 (1H, t, H 8 ), 7.63 (1H, t, H 7 ), 4.76 (2H, s, CH 2 N), 4.24 (1H, dd, J = 7.4, NCH 2 CH ), 3.85 (1Н, dd, J = 5.1, J = 8.2, NCH 2 CH), 3.68 (2Н, m, НСН 2 СН 2 , СН), 3.58 (2Н, m, HNCH 2 CH 2 ), 3.49 (1Н m, NCH 2 CH 2 ), 3.42 (2Н, m, CH 2 NMe 2 ), 2.96 (6Н, s, NMe 2 ), 2.65 (1Н, m, СН 2 СН 2 СН), 2.33 (1Н, m, CH 2 CH 2 CH). Found,%: C 40.74, H 4.66, N 7.78, S 4.54. C 25 H 28 N 4 O 3 S. 3HBr. 2H 2 O. Calculated,%: C 40.39, H 4.75, N 7.54, S 4.31.
Примеры, подтверждающие наличие биологической активностиExamples of biological activity
Пример АExample A
Изучение антипролиферативной активности заявленных соединений проводилось в тестах in vitro на культурах опухолевых клеток мышиного лейкоза L 1210/0 и злокачественных Т-лимфоцитов человека линий Molt4/C8, СЕМ/0. Данные об антипролиферативной активности (IC50 - концентрация, ингибирующая рост клеток на 50%) заявленных по изобретению соединений приводятся в таблице 1, где для каждого соединения указана структура и номера примеров (описанных выше), а также приводятся данные антипролиферативной активности препарата сравнения адриамицин (ADR). Определение IC50 проводилось с помощью МТТ-теста по методике, описанной в литературе [Mossman, Т.J.Immunol. Methods, 1983, 65, 55].The study of the antiproliferative activity of the claimed compounds was carried out in vitro tests on tumor cell cultures of murine leukemia L 1210/0 and malignant human T-lymphocytes of the lines Molt4 / C8, СЕМ / 0. Data on antiproliferative activity (IC 50 is a concentration that inhibits cell growth by 50%) of the compounds of the invention are shown in Table 1, where the structure and numbers of examples (described above) are indicated for each compound, as well as data on the antiproliferative activity of the adriamycin comparison drug ( ADR). The determination of IC 50 was carried out using the MTT test according to the method described in the literature [Mossman, T.J. Immmunol. Methods, 1983, 65, 55].
Как видно из представленных данных, соединения, являющиеся предметом настоящего изобретения и описанные в примерах, обладают антипролиферативным действием в микромолярных и субмикромолярных концентрация, превосходя в некоторых случаях препарат сравнения адриамицин.As can be seen from the data presented, the compounds that are the subject of the present invention and described in the examples have antiproliferative action in micromolar and submicromolar concentrations, in some cases exceeding the comparison drug adriamycin.
Пример БExample B
Изучение антипролиферативной активности соединений по настоящему изобретению проводилось также на культуре опухолевых клеток линий лейкоза К562 и ее сублинии К562/4 с экспрессией Р-гликопротеина. Экспрессия подобных транспортеров на поверхности клеток является одним из наиболее распространенных механизмов возникновения множественной лекарственной устойчивости опухолей [Shtil A.A., Grinchuk T.M., et. al. Int. J. Oncol. 2000, 17, 387-392]. Данные этих экспериментов, включая IC50 (µM) для соединений заявленных по изобретению и препарата сравнения адриамицина (ADR), а также значение индекса резистентности (IR - отношение IC50 для сублинии К562/4 к IC50 для линии К562) приводятся в таблице 2.The study of the antiproliferative activity of the compounds of the present invention was also carried out on a culture of tumor cells of the K562 leukemia lines and its subline K562 / 4 with expression of P-glycoprotein. The expression of such transporters on the cell surface is one of the most common mechanisms for the emergence of multidrug resistance of tumors [Shtil AA, Grinchuk TM, et. al. Int. J. Oncol. 2000, 17, 387-392]. The data of these experiments, including the IC 50 (µM) for the compounds of the invention and the adriamycin comparison drug (ADR), as well as the resistance index value (IR - ratio of IC 50 for subline K562 / 4 to IC 50 for line K562) are given in table 2 .
Как видно из представленных данных, соединения, являющиеся предметом настоящего изобретения и описанные в примерах по активности в отношении клеток с множественной лекарственной устойчивостью, обусловленной экспрессией P-gp транспортера, превосходят препарат сравнения адриамицин и/или имеют меньший индекс резистентности.As can be seen from the data presented, the compounds that are the subject of the present invention and described in the examples for activity against cells with multidrug resistance, due to the expression of the P-gp transporter, are superior to the comparison drug adriamycin and / or have a lower resistance index.
Пример ВExample B
Изучение антипролиферативной активности соединений по настоящему изобретению проводилось также на культуре опухолевых клеток рака толстой кишки НСТ116 и ее сублинии НСТ116р53КО ее изогенной сублинии с делецией гена р53. Хорошо известно, что мутации, приводящие к инактивации р53, часто встречаются в опухолевых клетках и могут приводить к развитию МЛУ к ряду химиотерапевтических агентов, включая ADR [Wang Q., Beck W.T. Cancer Res., 1998, 58, 5762]. Данные этих экспериментов, включая IC50 для соединений, заявленных по изобретению и препарата сравнения адриамицина (ADR), а также значение индекса резистентности (IR - отношение IC50 для сублинии НСТ116р53КО к IC50 для линии НСТ116) приводятся в таблице 3.A study of the antiproliferative activity of the compounds of the present invention was also carried out on a culture of tumor cells of colon cancer HCT116 and its subline HCT116p53CO of its isogenic subline with deletion of the p53 gene. It is well known that mutations leading to inactivation of p53 are often found in tumor cells and can lead to the development of MDR for a number of chemotherapeutic agents, including ADR [Wang Q., Beck WT Cancer Res., 1998, 58, 5762]. The data of these experiments, including the IC 50 for the compounds of the invention and the adriamycin comparison drug (ADR), as well as the resistance index value (IR is the ratio of IC 50 for subline HCT116r53CO to IC 50 for line HCT116) are shown in Table 3.
Как видно из представленных данных, соединения, являющиеся предметом настоящего изобретения и описанные в примерах по активности в отношении клеток с множественной лекарственной устойчивостью, обусловленной делецией гена р53, превосходят препарат сравнения адриамицин и имеют меньший индекс резистентности.As can be seen from the data presented, the compounds of the present invention and described in the examples for activity against multidrug-resistant cells caused by deletion of the p53 gene are superior to the comparison drug adriamycin and have a lower resistance index.
Пример ГExample D
Противоопухолевая активность дигидрохлорида (R)-4,11-дигидрокси-3-[(пирролидин-3-иламино)метил]-1H-нафто[2,3-f]индол-5,10-дион при однократном примененииAntitumor activity of (R) -4,11-dihydroxy-3 - [(pyrrolidin-3-ylamino) methyl] -1H-naphtho [2,3-f] indole-5,10-dione dihydrochloride with a single use
Противоопухолевая активность дигидрохлорида (R)-4,11-дигидрокси-3-[(пирролидин-3-иламино)метил]-1H-нафто[2,3-f]индол-5,10-диона (описанный в примере 2) исследовалась при однократном введении на мышах с лимфомой Р388. Самцы мышей BDF1 привиты внутрибрюшинно по 106 клеток асцитной лимфомы Р388 в день 0. Препарат растворяли в физиологическом растворе 0.1-0.2% концентрации и вводили однократно внутрибрюшинно через сутки после трансплантации.The antitumor activity of the dihydrochloride of (R) -4,11-dihydroxy-3 - [(pyrrolidin-3-ylamino) methyl] -1H-naphtho [2,3-f] indole-5,10-dione (described in Example 2) was investigated with a single administration in mice with P388 lymphoma. Male BDF1 mice were vaccinated intraperitoneally with 10 6 P388 ascites lymphoma cells per day 0. The drug was dissolved in physiological saline at 0.1-0.2% concentration and was administered once intraperitoneally one day after transplantation.
При применении нафтоиндолдиона, описанного в примере 2, в диапазоне доз от 10 до 90 мг/кг получено дозозависимое достоверное увеличение продолжительности жизни мышей. Средняя продолжительность жизни при этом достигла 11.3-14.2 дня, соответственно, что соответствует Т/С=124-140% (р<0,05) при отсутствии признаков токсичности. В дозе 80 мг/кг (R)-4,11-дигидрокси-3-[(пирролидин-3-иламино)метил]-1H-нафто[2,3-f]индол-5,10-дион равноэффективен доксорубицину, примененному в однократной дозе 8 мг/кг по уровню эффекта и контролю за генерализацией процесса.When using the naphthoindoldione described in Example 2, a dose-dependent significant increase in the life span of mice was obtained in the dose range from 10 to 90 mg / kg. The average life expectancy reached 11.3-14.2 days, respectively, which corresponds to T / C = 124-140% (p <0.05) in the absence of signs of toxicity. At a dose of 80 mg / kg (R) -4,11-dihydroxy-3 - [(pyrrolidin-3-ylamino) methyl] -1H-naphtho [2,3-f] indole-5,10-dione is equally effective with doxorubicin used in a single dose of 8 mg / kg according to the level of effect and control over the generalization of the process.
Пример ДExample D
Противоопухолевая активность дигидрохлорида (R)-4,11-дигидрокси-3-[(пирролидин-3-иламино)метил]-1H-нафто[2,3-f]индол-5,10-дион при многократном примененииAntitumor activity of dihydrochloride of (R) -4,11-dihydroxy-3 - [(pyrrolidin-3-ylamino) methyl] -1H-naphtho [2,3-f] indole-5,10-dione with repeated use
Противоопухолевая активность дигидрохлорида (R)-4,11-дигидрокси-3-[(пирролидин-3-иламино)метил]-1H-нафто[2,3-f]индол-5,10-диона (описанный в примере 2) исследовалась при пятикратном введении на мышах с лимфомой Р388. Самцы мышей BDF1 привиты внутрибрюшинно по 106 клеток асцитной лимфомы Р388 в день 0. Препарат растворяли в физиологическом растворе 0.1-0.2% концентрации и вводили внутрибрюшинно через сутки после трансплантации пятикратно, через каждые сутки.The antitumor activity of the dihydrochloride of (R) -4,11-dihydroxy-3 - [(pyrrolidin-3-ylamino) methyl] -1H-naphtho [2,3-f] indole-5,10-dione (described in Example 2) was investigated when administered five times in mice with P388 lymphoma. Male BDF1 mice were inoculated intraperitoneally with 10 6 P388 ascites lymphoma cells per day 0. The drug was dissolved in physiological saline at 0.1-0.2% concentration and was administered intraperitoneally five times every 24 hours after transplantation.
При пятикратном применении нафтоиндолдиона, описанного в примере 2, в дозе 25 мг/кг (суммарная доза 125 мг/кг) получено достоверное увеличение продолжительности жизни мышей. Средняя продолжительность жизни при этом достигла 13.3-16.2 дней соответственно, что соответствует Т/С=145-150% (р<0,05) при отсутствии признаков токсичности.When five times the use of naphthoindoldione described in example 2, at a dose of 25 mg / kg (total dose of 125 mg / kg), a significant increase in the life expectancy of mice was obtained. The average life expectancy in this case reached 13.3-16.2 days, respectively, which corresponds to T / C = 145-150% (p <0.05) in the absence of signs of toxicity.
Claims (1)
где W - означает фрагмент пятичленного гетероцикла, конденсированного с антрацендионовым ядром по связи 2-3 и являющегося гетероциклом, содержащим от одного до двух гетероатомов, выбранных из N, О, S, и не менее трех атомов углерода, два из которых общие с антрахиноновым ядром, а третий связан с функциональной группой X, включая фрагмент пиррола, фурана, тиофена, пиразола, изоксазола, изотиазола, не обязательно замещенный алкилом, галогеном;
Y - означает остаток моноциклического диамина, содержащего экзоциклическую аминогруппу, или полициклического диамина с мостиковыми аминогруппами, который представляет собой соединение, в котором две аминогруппы вовлечены в образование 4-6-членных кольцевых систем, содержащих от 2 до 6 атомов углерода и связанных между собой одним, двумя или тремя мостиковыми атомами, включая диамины формул
,
где Y может быть необязательно замещен одним или несколькими заместителями, связанными с остатком диамина через атом азота или углерода, выбранными из алкила, галогеноалкила, галогена, гидроксила, гидроксиалкила, карбамоила и карбоксиалкила;
X - означает группу, связывающую остаток указанного диамина с указанным гетероциклическим производным антрацендиона, выбранную из алкилена и СО, SO2;
n и m означает число заместителей Z1 и Z2, независимо равное от 0 до 2; заместители Z1 независимо выбраны из гидрокси, алкокси, амино и аминоалкиламино, галогено;
заместители Z2 независимо выбраны из гидрокси и алкокси, фтор;
где карбоксиалкил означает группу -CO2R, где R представляет собой алкил;
где амино означает группы -NH2, -NHR1, -NR1R2, где R1 и R2 каждый независимо означает алкильные радикалы;
где аминоалкиламино означает насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от одного до шести атомов углерода, связанный с двумя аминогруппами, указанными выше, при условии, что к одному углеродному атому присоединено не более одной аминогруппы. Linear heterocyclic derivatives of anthracenedion containing cyclic diamines in the side chain, as well as their pharmacologically acceptable salts, suitable for the treatment of cancer and corresponding to the formula:
where W is a fragment of a five-membered heterocycle condensed with an anthracenedione nucleus in a 2-3 bond and being a heterocycle containing from one to two heteroatoms selected from N, O, S, and at least three carbon atoms, two of which are common with the anthraquinone nucleus and the third is linked to functional group X, including a fragment of pyrrole, furan, thiophene, pyrazole, isoxazole, isothiazole, optionally substituted with alkyl, halogen;
Y - means the residue of a monocyclic diamine containing an exocyclic amino group, or a polycyclic diamine with bridged amino groups, which is a compound in which two amino groups are involved in the formation of 4-6-membered ring systems containing from 2 to 6 carbon atoms and connected by one two or three bridging atoms, including diamines of the formulas
,
where Y may be optionally substituted with one or more substituents linked to the diamine residue via a nitrogen or carbon atom selected from alkyl, haloalkyl, halogen, hydroxyl, hydroxyalkyl, carbamoyl and carboxyalkyl;
X - means a group linking the remainder of the specified diamine with the specified heterocyclic derivative of anthracenedione, selected from alkylene and CO, SO 2 ;
n and m mean the number of substituents Z 1 and Z 2 independently equal to from 0 to 2; Z 1 substituents are independently selected from hydroxy, alkoxy, amino and aminoalkylamino, halo;
Z 2 substituents are independently selected from hydroxy and alkoxy, fluoro;
where carboxyalkyl means a —CO 2 R group, where R is alkyl;
where amino means the groups —NH 2 , —NHR 1 , —NR 1 R 2 , where R 1 and R 2 each independently mean alkyl radicals;
where aminoalkylamino means a straight or branched chain saturated hydrocarbon radical containing from one to six carbon atoms bonded to the two amino groups indicated above, provided that no more than one amino group is attached to one carbon atom.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2009122411/04A RU2412166C1 (en) | 2009-06-15 | 2009-06-15 | Cytotoxic linear heterocyclic derivatives of anthracenedione having in side chain cyclic diamines, active towards tumour cells with multidrug resistance |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2009122411/04A RU2412166C1 (en) | 2009-06-15 | 2009-06-15 | Cytotoxic linear heterocyclic derivatives of anthracenedione having in side chain cyclic diamines, active towards tumour cells with multidrug resistance |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2009122411A RU2009122411A (en) | 2010-12-20 |
| RU2412166C1 true RU2412166C1 (en) | 2011-02-20 |
Family
ID=44056302
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2009122411/04A RU2412166C1 (en) | 2009-06-15 | 2009-06-15 | Cytotoxic linear heterocyclic derivatives of anthracenedione having in side chain cyclic diamines, active towards tumour cells with multidrug resistance |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2412166C1 (en) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2527459C1 (en) * | 2013-03-27 | 2014-08-27 | Федеральное государственное бюджетное учреждение "Научно-исследовательский институт по изысканию новых антибиотиков им. Г.Ф. Гаузе" Российской академии медицинских наук (ФГБУ "НИИНА" РАМН) | Novel heteroarene anthracenedione-based g-quadruplex ligands inhibiting tumour cell growth |
| RU2527273C1 (en) * | 2013-02-27 | 2014-08-27 | Федеральное государственное бюджетное учреждение "Научно-исследовательский институт по изысканию новых антибиотиков им. Г.Ф. Гаузе", Российской академии медицинских наук (ФГБУ "НИИНА" РАМН) | Multitarget inhibitors of tumour growth based on linear heteroarene anthracenediones |
| RU2581022C1 (en) * | 2015-02-18 | 2016-04-10 | Федеральное государственное бюджетное научное учреждение "Научно-исследовательский институт по изысканию новых антибиотиков имени Г.Ф. Гаузе" | Anticancer pharmaceutical compositions and method of treating breast cancer |
| RU2631100C1 (en) * | 2016-11-24 | 2017-09-18 | Федеральное государственное бюджетное научное учреждение "Научно-исследовательский институт по изысканию новых антибиотиков имени Г.Ф. Гаузе" | New heteroarenanthracene-2-carboxamide derivatives inhibiting tumour growth |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2535926C1 (en) * | 2013-09-30 | 2014-12-20 | Федеральное государственное автономное образовательное учреждение высшего образования "Новосибирский национальный исследовательский государственный университет" (Новосибирский государственный университет, НГУ) | 4-isopropyl-7-methoxy-2a1-methyl-2,2a,2a1,3,5a,9b-hexahydrofluorene[9,1-bc]furan-8-ol, having antitumor activity |
| RU2554939C1 (en) * | 2014-04-16 | 2015-07-10 | Федеральное государственное бюджетное учреждение "Научно-исследовательский институт по изысканию новых антибиотиков им. Г.Ф. Гаузе" Российской академии медицинских наук (ФГБУ "НИИНА" РАМН) | Antitumour anthrafurandione and based pharmaceutical compositions |
-
2009
- 2009-06-15 RU RU2009122411/04A patent/RU2412166C1/en not_active IP Right Cessation
Non-Patent Citations (1)
| Title |
|---|
| DEZHENKOVA L.G. ET AL. Bulletin of experimental biology and medicine, 2008, 145(3), 334-337. SHCHEKHOTIKHIN A.E. ET AL. Bioorganic & Medicinal Chemistry, 2005, 13(6), 2285-2291. ЩЕКОТИХИН A.E. И ДР. Журнал органической химии, 2007, 43, 11, 1687-1695. SHCHEKHOTIKHIN A.E. ET AL. Bioorganic & Medicinal Chemistry, 2007, 15(7), 2651-2659. SHCHEKHOTIKHIN A.E. ET AL. Bioorganic & Medicinal Chemistry, 2006, 14(15), 5241-5251. ЩЕКОТИХИН А.Е. И ДР. Химия гетероциклических соединений, 2001, 8, 1030-1034. ВОРОБЬЕВА С.Л. И ДР. Химия гетероциклических соединений, 1989, 6, 813-815. ВОРОБЬЕВА С.Л. И ДР. Журнал всесоюзного химического общества им. Д.И.Менделеева, 1989, 34, 1, 129-130. * |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2527273C1 (en) * | 2013-02-27 | 2014-08-27 | Федеральное государственное бюджетное учреждение "Научно-исследовательский институт по изысканию новых антибиотиков им. Г.Ф. Гаузе", Российской академии медицинских наук (ФГБУ "НИИНА" РАМН) | Multitarget inhibitors of tumour growth based on linear heteroarene anthracenediones |
| RU2527459C1 (en) * | 2013-03-27 | 2014-08-27 | Федеральное государственное бюджетное учреждение "Научно-исследовательский институт по изысканию новых антибиотиков им. Г.Ф. Гаузе" Российской академии медицинских наук (ФГБУ "НИИНА" РАМН) | Novel heteroarene anthracenedione-based g-quadruplex ligands inhibiting tumour cell growth |
| RU2581022C1 (en) * | 2015-02-18 | 2016-04-10 | Федеральное государственное бюджетное научное учреждение "Научно-исследовательский институт по изысканию новых антибиотиков имени Г.Ф. Гаузе" | Anticancer pharmaceutical compositions and method of treating breast cancer |
| RU2631100C1 (en) * | 2016-11-24 | 2017-09-18 | Федеральное государственное бюджетное научное учреждение "Научно-исследовательский институт по изысканию новых антибиотиков имени Г.Ф. Гаузе" | New heteroarenanthracene-2-carboxamide derivatives inhibiting tumour growth |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2009122411A (en) | 2010-12-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN112513036B (en) | Fused bicyclic compounds useful as ubiquitin-specific peptidase 30 inhibitors | |
| WO2021063346A1 (en) | Kras g12c inhibitor and application thereof | |
| RU2412166C1 (en) | Cytotoxic linear heterocyclic derivatives of anthracenedione having in side chain cyclic diamines, active towards tumour cells with multidrug resistance | |
| ES2339676T3 (en) | HETEROCICLICOS CONDENSED WITH 1,4-DIHYDROPIRIDINE, PROCEDURE TO PREPARE THEM, USE AND COMPOSITIONS CONTAINING THEM. | |
| EA023350B1 (en) | Antimicrobial compounds, methods of making and using the same | |
| JP5892620B2 (en) | Pyrazole derivative | |
| WO2016021629A1 (en) | Heterocyclic and carbocyclic derivative having trka-inhibiting activity | |
| KR102106765B1 (en) | Polyene macrolide derivative | |
| KR20210092804A (en) | Heterocyclic compound serving as fgfr4 inhibitor | |
| CN110770242B (en) | Heteroaromatic compounds as VANIN inhibitors | |
| AU2023251449A1 (en) | Amine-substituted heterocyclic compounds as EHMT2 inhibitors and derivatives thereof | |
| CA3149891A1 (en) | 3,5-disubstituted pyrazole compounds as kinase inhibitors and uses thereof | |
| CN114430740A (en) | EGFR inhibitor, composition and preparation method thereof | |
| CN113677680A (en) | EGFR inhibitor and composition and application thereof | |
| BR112014020212B1 (en) | AMINOPIRAZINE, PHARMACEUTICAL FORMULATION, METHOD TO PREVENT OR TREAT MALARIA IN A PATIENT, PROCESS FOR THE PREPARATION OF AN AMINOPIRAZINE DERIVATIVE, AND, INTERMEDIATE | |
| RU2129546C1 (en) | 6,9-bis-(aminosubstituted)-benzo[g]isoquinoline-5,10-diones, method of their synthesis, pharmaceutical composition on their basis, a method of tumor suppression in mammals | |
| US20090111776A1 (en) | Novel tetracycline derivatives as antibacterial agents | |
| CN110028508B (en) | Antitumor diazo bicyclic apoptosis protein inhibitor | |
| RU2640304C1 (en) | Derivatives of 1,4-dioxide of quinoxaline-2-carbonitrile inhibiting tumour cells growth | |
| TW202345836A (en) | Pyrido-[3,4-d]pyridazine amine derivatives useful as nlrp3 derivatives | |
| Shchekotikhin et al. | Synthesis and structure–activity relationship studies of 4, 11-diaminonaphtho [2, 3-f] indole-5, 10-diones | |
| US20060079677A1 (en) | Novel tricyclic azepine derivatives, method for production thereof and pharmaceutical compositions comprising the same | |
| KR20230104614A (en) | Acetamido-phenylbenzamide derivatives and methods of use thereof | |
| US20130184280A1 (en) | Substituted thiazoles as vegfr2 kinase inhibitors | |
| RU2631100C1 (en) | New heteroarenanthracene-2-carboxamide derivatives inhibiting tumour growth |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20120616 |
|
| NF4A | Reinstatement of patent |
Effective date: 20130910 |
|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20180616 |