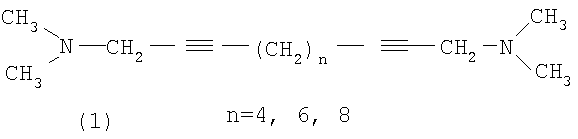RU2373189C2 - Method of producing n,n,n,n-tetramethylalkadiynediamines - Google Patents
Method of producing n,n,n,n-tetramethylalkadiynediamines Download PDFInfo
- Publication number
- RU2373189C2 RU2373189C2 RU2007128474/04A RU2007128474A RU2373189C2 RU 2373189 C2 RU2373189 C2 RU 2373189C2 RU 2007128474/04 A RU2007128474/04 A RU 2007128474/04A RU 2007128474 A RU2007128474 A RU 2007128474A RU 2373189 C2 RU2373189 C2 RU 2373189C2
- Authority
- RU
- Russia
- Prior art keywords
- acac
- diacetylene
- producing
- synthesis
- compounds
- Prior art date
Links
Landscapes
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Description
Предлагаемое изобретение относится к органической химии, в частности к способу получения N,N,N,N-тетраметилалкадиин-α,ω-диаминов общей формулы (1):The present invention relates to organic chemistry, in particular to a method for producing N, N, N, N-tetramethylalkadiene-α, ω-diamines of the general formula (1):
α,ω-Аминометилированные диацетилены могут найти применение в тонком органическом синтезе, в частности в синтезе труднодоступных полициклических соединений (А.Т.Бабаян. Внутримолекулярные перегруппировки солей четырехзамещенного аммония. Ереван: Изд.АН АрмССР, 1976, с.159-348).α, ω-aminomethylated diacetylenes can be used in fine organic synthesis, in particular in the synthesis of hard-to-reach polycyclic compounds (A.T. Babayan. Intramolecular rearrangements of tetra-substituted ammonium salts. Yerevan: Ed. AN ArmSSR, 1976, p. 159-348).
Известен способ (G.W.Kabalka, L.L.Zhou, L.Wang, M.Pagni. A microwave-enhanced, solventless Mannich condensation of terminal alkynes and secondary amines with para-formaldehyde on cuprous iodide doped aluminia. Tetrahedron (2006), V 62, p.857-867) получения аминометилированных диацетиленов, в частности 1,4-ди(2-алкинил)пиперазинов общей формулы (2), взаимодействием терминальных ацетиленов с пиперазином и формальдегидом в присутствии стехиометрических количеств иодида меди и окиси алюминия при ультразвуковом облучении с выходом 49-65% по схеме:The known method (GWKabalka, LLZhou, L.Wang, M.Pagni. A microwave-enhanced, solventless Mannich condensation of terminal alkynes and secondary amines with para-formaldehyde on cuprous iodide doped aluminum. Tetrahedron (2006), V 62, p .857-867) for the preparation of aminomethylated diacetylenes, in particular 1,4-di (2-alkynyl) piperazines of the general formula (2), by the reaction of terminal acetylenes with piperazine and formaldehyde in the presence of stoichiometric amounts of copper iodide and aluminum oxide under ultrasonic irradiation with a yield of 49 -65% according to the scheme:
Известным способом не могут быть получены N,N,N,N-тетраметилалкадиин-α,ω-диамины общей формулы (1).In a known manner cannot be obtained N, N, N, N-tetramethylalkadiene-α, ω-diamines of General formula (1).
Известен способ (G.W.Kabalka, L.L.Zhou, L.Wang, M.Pagni. A microwave-enhanced, solventless Mannich condensation of terminal alkynes and secondary amines with para-formaldehyde on cuprous iodide doped aluminia. Tetrahedron V.62, p.857-867) получения аминометилированных диацетиленов (3) взаимодействием 1 экв. диацетиленового соединения с избытком параформальдегида и 2 экв. вторичного амина в присутствии стехиометрических количеств иодида меди и окиси алюминия при ультразвуковом облучении с выходом 51-56% по схеме:The known method (GWKabalka, LLZhou, L.Wang, M.Pagni. A microwave-enhanced, solventless Mannich condensation of terminal alkynes and secondary amines with para-formaldehyde on cuprous iodide doped aluminum. Tetrahedron V.62, p.857- 867) obtaining aminomethylated diacetylenes (3) by the interaction of 1 equiv. diacetylene compound with an excess of paraformaldehyde and 2 equiv. secondary amine in the presence of stoichiometric amounts of copper iodide and alumina under ultrasonic irradiation with a yield of 51-56% according to the scheme:
где R1=R2=С6Н5-C4H8N2,where R 1 = R 2 = C 6 H 5 -C 4 H 8 N 2 ,
где R1=R2=СН3(СН2)3.where R 1 = R 2 = CH 3 (CH 2 ) 3 .
Известным способом могут быть получены N,N,N,N-тетраметилалкадиин-α,ω-диамины общей формулы (1) при условии вовлечения в реакцию в качестве вторичного амина (HNR1R2) газообразного диметиламина [HN(СН3)2)]. В этом случае необходимо проведение реакции в сосудах, работающих под давлением.A known method may be prepared by N, N, N, N-tetrametilalkadiin-α, ω-diamines of the general formula (1) under the condition involving in the reaction as a secondary amine (HNR 1 R 2) of gaseous dimethyl amine [HN (CH 3) 2) ]. In this case, it is necessary to carry out the reaction in vessels operating under pressure.
Предлагается новый способ получения N,N,N,N-тетраметилалкадиин-α,ω-диаминов общей формулы (1).A new method is proposed for producing N, N, N, N-tetramethylalkadiene-α, ω-diamines of the general formula (1).
Сущность способа заключается во взаимодействии α,ω-диацетиленалканов с избытком бисамина (N,N,N,N-тетраметилметандиамин) в присутствии ванадиевого катализатора (VO(асас)2), взятыми в соотношении α,ω-диацетиленалкан: бисамин: VO(асас)2=10:(25-35):(0.2-0.4), предпочтительно 10:30:0.3 ммолей, в атмосфере аргона в растворе толуола при температуре 80°С и атмосферном давлении в течение 4-8 ч. Выход N,N,N,N-тетраметилалкадиин-α,ω-диаминов (1) составляет 82-98%. Реакция протекает по схеме:The essence of the method consists in the interaction of α, ω-diacetylenealkanes with an excess of bisamine (N, N, N, N-tetramethylmethanediamine) in the presence of a vanadium catalyst (VO (acac) 2 ), taken in the ratio α, ω-diacetylene alkane: bisamine: VO (acac ) 2 = 10: (25-35) :( 0.2-0.4), preferably 10: 30: 0.3 mmol, in an argon atmosphere in a toluene solution at a temperature of 80 ° C and atmospheric pressure for 4-8 hours. Yield N, N , N, N-tetramethylalkadiene-α, ω-diamines (1) is 82-98%. The reaction proceeds according to the scheme:
N,N,N,N-тетраметилалкадиин-α, ω-диамины (1) образуются только лишь с участием α,ω-диацетиленалканов и бисамина. В присутствии дизамещенных ацетиленов или других диаминов целевые продукты (1) не образуются.N, N, N, N-tetramethylalkadiene-α, ω-diamines (1) are formed only with the participation of α, ω-diacetylenealkanes and bisamine. In the presence of disubstituted acetylenes or other diamines, the desired products (1) are not formed.
Проведение указанной реакции в присутствии катализатора VO(acac)2 больше 0.4 ммолей на 10 ммоль диацетилена не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора VO(асас)2 менее 0.2 ммолей на 10 ммоль диацетилена снижает выход (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при температуре 80°С. При более высокой температуре (например, 100°С) снижается селективность реакции, а при меньшей температуре (например, 70°C) снижается скорость реакции.Carrying out this reaction in the presence of a VO (acac) 2 catalyst greater than 0.4 mmol per 10 mmol of diacetylene does not lead to a significant increase in the yield of the target product (1). The use of a VO (acac) 2 catalyst of less than 0.2 mmol per 10 mmol of diacetylene decreases the yield (1), which is possibly associated with a decrease in catalytically active sites in the reaction mass. The reaction was carried out at a temperature of 80 ° C. At higher temperatures (for example, 100 ° C), the selectivity of the reaction decreases, and at lower temperatures (for example, 70 ° C), the reaction rate decreases.
Изменение соотношения исходного бисамина в сторону увеличения его содержания по отношению к исходному α,ω-диацетиленалкану не приводит к существенному повышению выхода целевых продуктов (1).A change in the ratio of the starting bisamine in the direction of increasing its content relative to the starting α, ω-diacetylenealkane does not significantly increase the yield of the target products (1).
Существенные отличия предлагаемого способаSignificant differences of the proposed method
В известном способе используются в качестве исходных соединений параформальдегид и вторичные амины, в стехиометрических количествах применяется CuI и Al2O3, при этом выход целевых продуктов не превышает 56%.In the known method, paraformaldehyde and secondary amines are used as starting compounds, CuI and Al 2 O 3 are used in stoichiometric amounts, while the yield of the target products does not exceed 56%.
В предлагаемом способе в качестве исходного реагента применяется выпускаемый промышленностью бисамин, а в качестве катализатора выступает VO(acac)2. Выход целевого продукта достигает 98%.In the proposed method, a commercially available bisamine is used as a starting reagent, and VO (acac) 2 acts as a catalyst. The yield of the target product reaches 98%.
Способ поясняется следующими примерамиThe method is illustrated by the following examples.
ПРИМЕР 1. В стеклянный реактор, установленный на магнитной мешалке, в атмосфере аргона помещают 10 ммолей 1,9-декадиина. 30 ммолей бисамина, 0.3 ммолей катализатора VO(асас)2, перемешивают 6 ч при температуре 80°С. Из реакционной массы выделяют N1,N1,N12,N12-тетраметил-2,10-додекадиин-1,12-диамин с выходом 93%.EXAMPLE 1. In a glass reactor mounted on a magnetic stirrer, in an argon atmosphere, 10 mmol of 1.9-decadiene is placed. 30 mmol of bisamine, 0.3 mmol of catalyst VO (acac) 2 , stirred for 6 hours at a temperature of 80 ° C. N 1 , N 1 , N 12 , N 12 -tetramethyl-2,10-dodecadiin-1,12-diamine are isolated from the reaction mass in 93% yield.
Спектральные характеристики N1,N1,N12,N12-тетраметил-2,10-додекадиин-1,12-диамина (1):Spectral characteristics of N 1 , N 1 , N 12 , N 12 -tetramethyl-2,10-dodecadiin-1,12-diamine (1):
Спектр ЯМР 13С (CDCl3, δ, м.д.) N1,N1,N12,N12-тетраметил-2,10-додекадиин-1,12-диамина (1): 18.29, 27.60, 28.30, 43.33, 48.18, 75.66, 84.91. Другие примеры, подтверждающие способ, приведены в табл. 13 C NMR Spectrum (CDCl 3 , δ, ppm) N 1 , N 1 , N 12 , N 12 -Tetramethyl-2,10-dodecadiene-1,12-diamine (1): 18.29, 27.60, 28.30, 43.33, 48.18, 75.66, 84.91. Other examples confirming the method are given in table.
где 8' - реакция проведена при t=70°C, 9” - реакция проведена при t=70°.where 8 'is the reaction carried out at t = 70 ° C, 9 ”is the reaction carried out at t = 70 °.
Все остальные реакции проводили при температуре 80°С в растворе толуола.All other reactions were carried out at a temperature of 80 ° C in a toluene solution.
Claims (1)
с использованием диацетиленалканов и катализатора в среде растворителя при повышенной температуре, отличающийся тем, что соответствующий диацетиленалкан общей формулы
,
где n=4, 6, 8, подвергают взаимодействию с избытком N,N,N,N-тетраметилметандиамина в присутствии катализатора ацетилацетоната ванадила (VO(acac)2), при мольном соотношении диацетиленалкан: N,N,N,N-тетраметилметандиамин: VO(acac)2=10:(25-35):(0,2-0,4) в атмосфере аргона при температуре 70-100°С, преимущественно 80°С, и атмосферном давлении в течение 4-8 ч. The method of obtaining N, N, N, N-tetramethylalkadiene diamines of the General formula (1)
using diacetylenealkanes and a catalyst in a solvent at elevated temperature, characterized in that the corresponding diacetylenealkane of the General formula
,
where n = 4, 6, 8, is reacted with an excess of N, N, N, N-tetramethylmethanediamine in the presence of a vanadyl acetylacetonate catalyst (VO (acac) 2 ), with a molar ratio of diacetylene alkane: N, N, N, N-tetramethylmethanediamine: VO (acac) 2 = 10: (25-35) :( 0.2-0.4) in an argon atmosphere at a temperature of 70-100 ° C, mainly 80 ° C, and atmospheric pressure for 4-8 hours
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2007128474/04A RU2373189C2 (en) | 2007-07-24 | 2007-07-24 | Method of producing n,n,n,n-tetramethylalkadiynediamines |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2007128474/04A RU2373189C2 (en) | 2007-07-24 | 2007-07-24 | Method of producing n,n,n,n-tetramethylalkadiynediamines |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2007128474A RU2007128474A (en) | 2009-01-27 |
| RU2373189C2 true RU2373189C2 (en) | 2009-11-20 |
Family
ID=40543812
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2007128474/04A RU2373189C2 (en) | 2007-07-24 | 2007-07-24 | Method of producing n,n,n,n-tetramethylalkadiynediamines |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2373189C2 (en) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2448951C2 (en) * | 2010-07-28 | 2012-04-27 | Учреждение Российской Академии Наук Институт Нефтехимии И Катализа Ран | Method of producing n1,n1,n4,n4-tetramethyl-2-butyne-1,4-diamine |
| RU2727138C1 (en) * | 2019-05-29 | 2020-07-21 | Федеральное государственное бюджетное научное учреждение Уфимский федеральный исследовательский центр Российской академии наук | N,n'-di(alkadinyl)diazacycloalkanes and method of producing n,n'-di(alkadinyl)diazacycloalkanes exhibiting fungicidal activity with respect to fungi bipolaris sorokiniana and rhizoctonia solani |
-
2007
- 2007-07-24 RU RU2007128474/04A patent/RU2373189C2/en not_active IP Right Cessation
Non-Patent Citations (1)
| Title |
|---|
| Кузнецов С.Г. и др. - Журнал Органической Химии, 1970, 6(3), 442-446. Fegley M.F. et al. Journal of the American Chemical Society, 1957, 79, 4140-4144. Kabalka G.W. et al. Tetrahedron, 2006, 62, 857-867. * |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2448951C2 (en) * | 2010-07-28 | 2012-04-27 | Учреждение Российской Академии Наук Институт Нефтехимии И Катализа Ран | Method of producing n1,n1,n4,n4-tetramethyl-2-butyne-1,4-diamine |
| RU2727138C1 (en) * | 2019-05-29 | 2020-07-21 | Федеральное государственное бюджетное научное учреждение Уфимский федеральный исследовательский центр Российской академии наук | N,n'-di(alkadinyl)diazacycloalkanes and method of producing n,n'-di(alkadinyl)diazacycloalkanes exhibiting fungicidal activity with respect to fungi bipolaris sorokiniana and rhizoctonia solani |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2007128474A (en) | 2009-01-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Climent et al. | Aluminophosphates oxynitrides as base catalysts: nature of the base sites and their catalytic implications | |
| Wang et al. | Transformylating amine with DMF to formamide over CeO 2 catalyst | |
| CN109331872B (en) | Application of n-butyl lithium in catalyzing imine and borane hydroboration reaction | |
| RU2373189C2 (en) | Method of producing n,n,n,n-tetramethylalkadiynediamines | |
| RU2408572C2 (en) | Method of producing n1,n1,n4,n4-tetramethyl-2-butyne-1,4-diamine | |
| RU2402516C2 (en) | 1-AMINOMETHYL-α,ω-ALKADIINE SYNTHESIS METHOD | |
| CN110655495A (en) | Method for synthesizing 1-methylpiperidine by supported metal catalysis | |
| JP6646761B2 (en) | Dehydration reaction catalyst for producing N-substituted maleimide, method for producing the same, and method for producing N-substituted maleimide | |
| RU2448951C2 (en) | Method of producing n1,n1,n4,n4-tetramethyl-2-butyne-1,4-diamine | |
| RU2349579C1 (en) | Method of producing n,n-dimethyl-3-phenyl-2-propyne-1-amine | |
| RU2496777C2 (en) | Method for preparing n-(1,5,3-dithiazocynan-3-yl)amides | |
| RU2443694C2 (en) | Method of producing n-aryl-1,3,5-dithiazinanes | |
| RU2409544C2 (en) | Method for synthesis of asymmetric (-di(aminomethyl)alkadiines | |
| RU2440322C2 (en) | METHOD OF PRODUCING α,ω-DI(AMINOMETHYL)ALKADIINES | |
| RU2551668C1 (en) | Method of obtaining 3-(1-adamantyl)- and 3-[1-(1-adamantyl)ethyl]-1,5,3-dithiazepinanes | |
| Yoon et al. | Cu-Catalyzed electrophilic amination of internal alkynes via hydroalumination | |
| CN109251217B (en) | Application of o-methoxyanilino lithium in catalysis of imine and borane hydroboration reaction | |
| CN109232622B (en) | Application of 2, 6-diisopropylaniline lithium in catalyzing imine and borane hydroboration reaction | |
| CN109180714B (en) | Application of anilino lithium in catalysis of imine and borane hydroboration reaction | |
| RU2382027C2 (en) | Method of producing symmetrical gem-diamines | |
| RU2404165C2 (en) | N,n-dimethyl-n-(4-quinolinenylmethyl)amine synthesis method | |
| WO2020073182A1 (en) | Application of 4-mephnhli in catalyzing hydroboration reaction of imine and borane | |
| RU2559367C2 (en) | Method of producing (1,5,3-dithiazepan-3-yl)-alkanediols | |
| RU2640202C2 (en) | METHOD OF PRODUCING 3,8-DIARYL-2,3,4,7,8,9-HEXAHYDROBENZO[1,3]OXAZINO[5,6-h][1,3]BENZOXAZINES | |
| US9328080B2 (en) | Preparation of dihydroxyethyl piperazine |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20091005 |