RU2207373C1 - Способ получения человеческого гранулоцитарного колониестимулирующего фактора - Google Patents
Способ получения человеческого гранулоцитарного колониестимулирующего фактора Download PDFInfo
- Publication number
- RU2207373C1 RU2207373C1 RU2002111017/13A RU2002111017A RU2207373C1 RU 2207373 C1 RU2207373 C1 RU 2207373C1 RU 2002111017/13 A RU2002111017/13 A RU 2002111017/13A RU 2002111017 A RU2002111017 A RU 2002111017A RU 2207373 C1 RU2207373 C1 RU 2207373C1
- Authority
- RU
- Russia
- Prior art keywords
- csf
- milk
- transgenic
- protein
- animal
- Prior art date
Links
Images
Landscapes
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
Предложен способ получения чГ-КСФ с молоком трансгенных животных. В качестве трансгенных животных были использованы кролики с гибридным геном h-GM-1 человека, который содержит геномную копию гена гранулоцитарного колониестимулирующего фактора человека и регуляторные элементы генов молока, направляющие выделение белка чГ-КСФ в молоко. Способ позволяет получать очищенный белок чГ-КСФ в гомогенном состоянии, пригодном для дальнейшего использования в фармакологии и получении лекарственной формы препарата чГ-КСФ. 4 з.п. ф-лы, 3 ил.
Description
Изобретение относится к биотехнологии.
Гранулоцитарный колониестимулирующий фактор человека (чГ-КСФ) является гликопротеином, состоящим из 174 аминокислот. чГ-КСФ необходим для прогрессии от плюрипотентной стволовой клетки до зрелых дифференцированных клеток крови и обладает также способностью влиять на функцию последних.
чГ-КСФ широко используется в онкологии для лечения нейтропении, а также с целью предупреждения миелосупрессии при интенсификации химиотерапии. Применение этого препарата позволяет резко уменьшить число опасных для жизни инфекционных осложнений, которые могут развиться у больных с нейтропенией, получающих цитостатики при злокачественных немиелоидных опухолевых заболеваниях, а также при трансплантации костного мозга (Morstyn G, et al. Clinical studies with granutients receiving cytoxic chemoterapy. Behring Inst. mitt., 1988, Aug. (83), 234-239.).
Известен метод получения чГ-КСФ из таких источников, как кровь, где он присутствует в норме. Этот метод трудоемок и дорог в связи с низкой концентрацией биологически активных веществ и ограниченным количеством исходного сырья (Werner RG, Berthold W. Purification of proteins produced by biotechnological process. Arzneimittelforschung, 1988, Mart, 38(3):422-428). Другим недостатком этого метода является возможность присутствия в конечной продукции инфекционных для человека агентов, например, таких как вирусы.
Известен также способ получения чГ-КСФ с использованием рекомбинантных микроорганизмов. Обычно в качестве продуцента используется адаптированный штамм Escherichia coli (Perez-perez J., et al. Supplementation improves the periplasmic production of human granulocyte-colony stimulating factor in Escherichia coli, Biochem. Biophys. Reg. Commun, 1995, 16, 210 (2), 524-529). Однако получение рекомбинантных белков с использованием прокариот не обеспечивает таких посттрансляционных модификаций как гликолизилирование, силиконирование, правильный фолдинг белка и отщепление лишнего метионина с N-конца белка, что приводит к снижению устойчивости и биологической активности получаемого препарата. В настоящее время имеется импортный препарат нейпоген (Neupogen, фирма Hofman la Roche), который представляет собой негликолизированный рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор, имеющий на N-конце аминоскислотной цепи дополнительный метионин. Это высокоочищенный белок биологически активен, хотя и в меньшей степени, в сравнении с его гликозилированной формой чГ-КСФ.
Известен метод получения гликолизированной формы гранулоцитарного колониестимулирующего фактора путем использования в качестве продуцента культуры клеток млекопитающих. Обычно для этого используется культура клеток яичника китайского хомячка (СНО) (Rotondaro L. et al., High-level expression of a cDNA for human granulocyte colony - stimulating factor in Chinese Hamster ovary cells. Effect ot 31-noncoding seguences mol. Biotechnol., 1997, Jun; 7(3), 231-240; Nolloway W. DNA technology in the production of glycosylated recombinant human granulocyte colony stimulating factor, Eur. J. Cancer, 1994; 30A Suppl. 3, 2-6; Nissen C. Glycosylation of recombinant human granulocyte colony stimulating factor: implications for stability and potency. Eur. J. Cancer, 1994, 30A, Suppl. 3, 12-14). Гликозилированная форма гранулоцитарного колониестимулирующего фактора в 2 раза превосходит по способности стимулировать рост колоний гранулоцитов и в 4 раза быстрее обеспечивает проявление положительного эффекта по сравнению с негликолизированным рекомбинантным белком, получаемым с использованием микроорганизмов.
Несмотря на то, что в рекомбинантном белке в культуре клеток млекопитающих происходят все необходимые посттрансляционные модификации, концентрация получаемого рекомбинантного белка очень низкая, а сам процесс культивирования дорогостоящий и требует высокого технологического обеспечения.
Известен метод получения рекомбинантных белков с использованием трансгенных животных, которые секретируют эти вещества с молоком (патент RU # 2157846 С1 "Способ получения трансгенного животного, экспрессирующего в молочной железе гранулоцитарный колониестимулирующий фактор человека и гибридный ген h-GM-1 для осуществления способа"). Метод базируется на микроинъекции генетической конструкции в пронуклеус оплодотворенной яйцеклетки в половые пути ложно беременной самки. Генетическая конструкция обеспечивает секрецию рекомбинантного белка только в молочной железе лактирующей трансгенной самки. Для этого структурный ген в генетической конструкции помещен под контроль регуляторных элементов генов белков молока. Этот метод, в отличие от использования культуры бактериальных клеток, обеспечивает получение высокой идентичности рекомбинантного белка нативному, выделенному из крови, и, по сравнению с использованием метода культуры клеток млекопитающих, значительно снижает стоимость получаемого продукта. Это обусловлено тем, что в молочной железе плотность продуцирующих клеток в 100 раз выше, чем в жидкой культуре: в тканях органа содержится 109 клеток/грамм, тогда как в культуре тканей 107 клеток/мл (Н. Meade а. С. Ziomer, Urine as a substitute for milk. Nature Biotechnology, 1998, v. l6, January, 21-22). К тому же стоимость содержания и доения трансгенных животных составляет лишь 1/10 часть стоимости обслуживания биореактора.
Предложен способ получения гранулоцитарного колониестимулирующего фактора человека (чГ-КСФ) с молоком трансгенных животных. Последовательность ДНК гена, кодирующего белок чГ-КСФ представлена на фиг.1.
Получение трансгенных животных является одним из наиболее перспективных направлений для получения различных рекомбинантных белков. Существует большое количество научно-исследовательских работ, позволяющих использовать данную технологию для получения трансгенных животных-продуцентов биологически активных белков человека.
Спектр видов животных, способных выступить в роли продуцентов, достаточно широк: кролик (Brem G. et al. Expression of synthetic cDNA sequences encoding human insulin-like grows factor-1 in the mammary gland of transgenic rabbits. Gene, 1994, v. 149, p. 351-355), корова (Rudolph N.S. Biopharmaceutical production in transgenic livestock. Trends in Biotechnology, 1999, sept., v. 17, p. 367-374; van Berkel P.H. et al. Large scale production of recombinant human lactoferrin in the milk of transgenic cows. Nature biotechnology, 2002, v. 20, p. 484-487), коза (Ebert K.M. et al. Transgenic production of a variant of human tissue-type plasminogen activator in goat milk: generation of transgenic goats and analysis of expression. Biotechnology, 1991, v. 9, sept., p. 835-838), овца (Wright G. et al. High level expression of active human alpha-1-antiyrypsin in the milk of transgenic sheep. Biotechnology, 1991, v. 9, sept., p. 830-834), свинья (Velander W. et al. High-level expression of a heterologous protein in the milk of transgenic swine using the cDNA encoding human protein C. Proc. Natl. Acad. Sci. USA, 1992, v. 89, p. 12003-12007). Использование мышей для этих целей ограничено тем, что получаемый за время лактации объем молока не превышает 2-5 мл, что абсолютно нетехнологично. С точки зрения технологии получения трансгенных животных принципиального различия между перечисленными видами нет. Во всех случаях используется микроинъецирование генетической конструкции в пронуклеус оплодотворенной яйцеклетки с последующей подсадки ее в половые пути синхронизированной самки-реципиента.
Введение генетического материала в животное с целью дальнейшей его экспрессии может осуществляться несколькими способами.
- Микроинъецирование раствора генетического материала в пронуклеус оплодотворенной яйцеклетки является наиболее ранним разработанным методом. Этим методом получено наибольшее количество трансгенных животных в мировой практике (Juhani Janne et. al. Transgenic Animals as Bioproducers of Therapeutic Proteins Trends in Molecular Medicine, Annals of Medicine, 1992, v. 24, p. 273-280).
- Инфекция ранних яйцеклеток, бластоцист, ранних предимплантационных эмбрионов и тканей взрослого животного (например, молочной железы) различными вирусными векторами. Наиболее часто используют ретровирусные и лентивирусные вектора (Rudolf Jaenisch. Transgenic Animals Science, 1988, v. 240, р. 1468-1473).
- Перенос трансфецированных ядер эмбриональных или соматических клеток в энуклеированную яйцеклетку. Метод позволяет с большой эффективностью получать заведомо трансгенных животных с использованием заранее трансфецированной и проверенной культуры клеток соответствующего вида (Angelika E. Schnieke et. al. Human Factor IX Transgenic Sheep Produced by Transfer of Nuclei from Transfected Fetal Fibroblasts Science, 1997, v. 278, p. 2130-2133).
В качестве трансгенных животных были использованы кролики с гибридным геном h-GM-1 человека, который содержит геномную копию гена гранулоцитарного колониестимулирующего фактора человека и регуляторные элементы генов молока, направляющие выделение белка чГ-КСФ в молоко.
Исходных трансгенных самцов спаривали с нетрансгенными самками и получили трансгенное потомство. Определение трансгенности потомства проводили методом полимеразной цепной реакции с праймерами специфичными к последовательности вектора h-GM-1. Трансгенных самок спаривали с нетрансгенными или трансгенными самцами и, после родов, собирали молоко для выделения чГ-КСФ. Сбор молока проводили ручным или машинным доением после предварительной обработки животного окситоцином.
Концентрацию и биологическую активность чГ-КСФ человека в молоке трансгенных кроликов определяли несколькими методами. Биологическую активность тестировали по степени стимулирования пролиферации и колониеобразования стволовых гранулоцитарных клеток костного мозга человека. Концентрацию белка чГ-КСФ в молоке тестировали иммуноферментным методом с использованием моноклональных антител против чГ-КСФ (ELISA).
Выделение чГ-КСФ из молока трансгенных кроликов проводили следующим образом: молоко, собранное от крольчихи, центрифугировали на лабораторной центрифуге при 10 тыс. g в течение 30 минут. Удаляли жировую фракцию, отбирали супернатант и использовали его для дальнейшего выделения чГ-КСФ.
Полученный раствор разводили в два раза буфером А (20мМ фосфат калия рН 6.5, 3.5М мочевины, 200мМ ЕДТА, 0.2мМ ДТТ) и интенсивно перемешивали на мешалке для. Эти достигалось разрушение мицелл молока и превращение его в истинный раствор белков. В полученный раствор добавляли 1/5 объема насыщенного раствора сульфата аммония (4М) до конечной концентрации 1М.
Для контроля потерь белка чГ-КСФ в процессе выделения определяли его количество в растворе методом иммуноферментного анализа ELISA.
Затем полученный раствор наносили на колонку К-16 (размер 20 см) заполненную октил-сефарозой (Octyl Sepharose 4 Fast Flow, кат 17-0946-10, фирмы "Амершам-Фармация"), уравновешенной в буфере В (10 мМ фосфата калия рН 6.5, 1.8М мочевины, 10мМ ЕДТА, 1М сульфата аммония, 0.2мМ ДТТ). Скорость прохождения раствора через колонку составляла 20 мл/час.
Элюцию проводили с использованием линейного градиента с понижающейся концентрацией сульфата аммония до нуля и при повышении рН до 7.5, а детергента Tween-20 до 0.2% от буфера В к буферу С (10 мМ калий фосфата рН 6.5, 1.8М мочевины, 10мМ ЕДТА, 1М сульфата аммония, 0.2мМ ДТТ, 0.2% Tween-20). Скорость прохождения раствора через колонку составляла 20 мл/час. Всего собирали 22 фракции. Основная часть балластных белков выходит во фракциях 10-19. чГ-КСФ элюируется в конце градиента во фракциях 20-21. Потери активности чГ-КСФ в этом процессе составили 30%.
Элюаты, содержащие чГ-КСФ, объединяли, разводили в 4 раза буфером (2мМ фосфат калия рН 7.2, 0.15М хлорид калия), и наносили на колонку К-9 (размер 6 см) наполненную иммуносорбентом с иммобилизованными на нем моноклональными антителами против чГ-КСФ (носитель активированная бромцианом sepharose 4B фирмы "Амершам-Фармация"). Промывали колонку буфером (2мМ фосфат калия рН 7.2, 0.5М хлорид калия) около 10 объемов колонки. Элюцию с колонки проводили 0.1М лимонной кислотой.
Полученный элюат диализовали против буфера (2мМ фосфат калия рН 7.5), концентрировали различными методами и использовали для дальнейшей работы.
Пример 1
Образцы молока для тестирования на присутствие чГ-КСФ и его биологическую активность брали от трансгенных кроликов. Молоко трансгенных кроликов перед тестированием фракционировали центрифугированием для отделения жировой фракции и испытывали в различных разведениях.
Образцы молока для тестирования на присутствие чГ-КСФ и его биологическую активность брали от трансгенных кроликов. Молоко трансгенных кроликов перед тестированием фракционировали центрифугированием для отделения жировой фракции и испытывали в различных разведениях.
Моделью для тестирования служили стволовые гемопоэтические клетки доноров костного мозга, культивируемые в полужидких питательных средах. Ядерные клетки костного мозга культивировали in vitro в среде RPMI 1640 с 0,3% агаром, 30% эмбриональной бычьей сывороткой (FBS) и содержащей необходимые компоненты для поддержания роста гемопоэтических клеток в краткосрочной культуре (14 дней) при 37oС в атмосфере 5% СО2.
Результат роста клеток в соответствующих условиях оценивали по их количеству на 14 день культивирования визуальным подсчетом в камере Горяева. В качестве положительного контроля клетки культивировали с гранулоцитарным колониестимулирующим фактором человека, полученным из культуры клеток млекопитающих - стандартным коммерческим препаратом, используемым в клинической практике Granocyte (международное наименование филграстим, производство фирмы Rhone Poulenc Rorer).
Отрицательным контролем считали рост клеток в присутствии экстрактов из молока нетрансгенного кролика в соответствующих разведениях, а также без исследуемых добавок.
Одновременно прослеживали способность исследуемых клеток костного мозга в присутствии экстрактов из молока кроликов трансгенных по чГ-КСФ образовывать гранулоцитарно-макрофагальные колонии культивированием их в полужидкой среде с метилцеллюлозой (Metho Cult Medium), используемой для анализа гемопоэтических клеток на колониеобразование по методу, предложенному The Terry Fox Laboratory Media Preparation Service (1992).
В качестве отрицательного контроля использовали интактные клетки (ИТК), а в качестве положительного контроля - коммерческий препарат чГ-КСФ Granocyte в разведениях от 1:10 до 1:10000.
В культурах клеток, инкубированных с образцами экстрактов молока трансгенных кроликов, число жизнеспособных клеток в 2-3 раза превышало аналогичный показатель в контрольной интактной культуре стволовых клеток (с базовым содержанием ростового фактора) и в культуре с добавлением молока нетрансгенных кроликов.
По морфологическим признакам клетки, выращенные в культуре с добавлением экстрактов из молока трансгенных кроликов, обладали более высокой степенью дифференцировки, чем клетки в культурах с отрицательным контролем.
Ориентировочная концентрация белка чГ-КСФ, полученная на основе сравнения удельной биологической активности с препаратом Granocyte, в протестированных образцах молока составляет 50-100 мг/л в эквиваленте на активность препарата филграстим.
Пример 2
Определение концентрации чГ-КСФ иммуноферментным методом проводили в иммунологических плашках на наборе ProCon G-CSF (производство фирмы 000 "Протеиновый контур", г. Санкт-Петербург). Буфера А, В и С поставляются в составе набора.
Определение концентрации чГ-КСФ иммуноферментным методом проводили в иммунологических плашках на наборе ProCon G-CSF (производство фирмы 000 "Протеиновый контур", г. Санкт-Петербург). Буфера А, В и С поставляются в составе набора.
Первые антитела (АТ-1) разводили в буфере Ар (100 мкл антител на 10 мл буферы). Вносили в лунку планшета 1 по 100 мкл раствора первых антител.
Инкубировали планшет при непрерывном встряхивании в течение одного часа при комнатной температуре. Конъюгат вторых антител (АТ-2) разводили в 20 раз в буфере С. В лунку А2 добавляли 25 мкл стандарта чГ-КСФ (0,5 мкг/мл), тщательно перемешивали и титровали кратно 2, перенося по 25 мкл в следующую ячейку и тщательно перемешивали, до лунки Е1 (до концентрации стандарта 31,25 нг/мл). Лунка А1 оставалась для отрицательного контроля. В остальные лунки планшета 2 вносили по 25 мкл образцов обезжиренного молока. Во все ячейки планшета 2, содержащие образцы стандарта и испытуемые образцы, добавляли по 100 мкл раствора вторых антител. Планшет 2 инкубировали в течение 40-60 мин при комнатной температуре при непрерывном встряхивании. Удаляли жидкость из ячеек планшета 1 и трижды промывали буфером В 300 мкл на одну ячейку (состав буфера В согласно производителя набора). Проводили полную аспирацию оставшейся жидкости. Дважды промывали ячейки планшета струей дистиллированной воды. Осушали планшет путем постукивания по поверхности лабораторного стола. Готовили раствор субстрата с красителем. Для этого смешивали в равных отношениях растворы с маркировкой "Субстрат" и "Реагент", учитывая, что на 1 стрип требуется 3,2 мл готового раствора. Вносили во все лунки по 100 мкл раствора субстрата с красителем. Инкубировали стрипы 5-15 мин при комнатной температуре на шейкере. Наблюдали развитие голубой окраски. Останавливали реакцию добавленем 50 мкл раствора 1N серной кислоты в каждую лунку. Производили учет результатов с использованием автоматического фотометра для микропланшетов при длине волны 450 нм. Строили калибровочную кривую "оптическая плотность-концентрация" пользуясь данными по концентрациям, указанным для растворов стандартов. Определяли концентрацию чГ-КСФ в образцах.
В качестве отрицательного контроля использовали молоко нетрансгенного кролика, а в качестве положительного контроля - коммерческий препарат чГ-КСФ, Granulocyte производства фирмы Rone Poulenc Rorer.
Содержание чГ-КСФ в различных пробах молока трансгенных кроликов варьировало в пределах 20-100 мг/л.
При сравнении данных по определяемому количеству чГ-КСФ в молоке с интактными казеиновыми мицеллами и в образцах с разрушенными мицеллами было получено увеличение показаний в 1,6 раза. Это говорит о том, что значительная часть белка чГ-КСФ содержится внутри мицеллярной структуры.
Пример 3
Идентификацию чГ-КСФ в молоке трансгенных кроликов проводили методом электрофореза белков в полиакриламидном геле с последующим переносом на мембрану и окраской моноклональными антителами против чГ-КСФ конъюгированными с щелочной фосфатазой.
Идентификацию чГ-КСФ в молоке трансгенных кроликов проводили методом электрофореза белков в полиакриламидном геле с последующим переносом на мембрану и окраской моноклональными антителами против чГ-КСФ конъюгированными с щелочной фосфатазой.
В качестве отрицательного контроля использовали молоко нетрансгенного кролика, а в качестве положительного - коммерческий препарат негликозилированного чГ-КСФ Neupogen (фирма Amgen).
Негликозилированная форма чГ-КСФ имеет молекулярную массу 19,6 кДа. Гликозилированная форма имеет молекулярную массу 23-24 кДа в зависимости от вариантов гликозилирования (Nicola N.A., J. Cell. physiol., 1981, 109, 253).
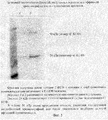
На электрофорез наносили обезжиренные фракции молока от трансгенных и нетрансгенных кроликов, а также положительный контроль Neupogen в чистом виде и в смеси с молоком нетрансгенного кролика (фиг.2).
После окраски мембраны специфическими антителами было обнаружено, что в пробах положительного контроля содержится белок размером около 20 кДа, а в пробах молока трансгенных кроликов содержится белок размером около 24 кДа, специфически связывающийся с моноклональными антителами против чГ-КСФ.
Данные результаты показывают, что в молоке трансгенных кроликов содержится гликозилированная форма чГ-КСФ.
Пример 4
Выделение чГ-КСФ из молока трансгенных кроликов проводили следующим образом: молоко, собранное от крольчихи, цент рифугировали на лабораторной центрифуге при 10 тыс. g в течение 30 минут. Удаляли жировую фракцию, отбирали супернатант и использовали его для дальнейшего выделения чГ-КСФ.
Выделение чГ-КСФ из молока трансгенных кроликов проводили следующим образом: молоко, собранное от крольчихи, цент рифугировали на лабораторной центрифуге при 10 тыс. g в течение 30 минут. Удаляли жировую фракцию, отбирали супернатант и использовали его для дальнейшего выделения чГ-КСФ.
Полученный раствор разводили в два раза буфером А (20мМ фосфат калия рН 6.5, 3.5М мочевины, 200мМ ЕДТА, 0.2мМ ДТТ) и интенсивно перемешивали на мешалке для. Эти достигалось разрушение мицелл молока и превращение его в истинный раствор белков. В полученный раствор добавляли 1/5 объема насыщенного раствора сульфата аммония (4М) до конечной концентрации 1М.
Для контроля потерь белка чГ-КСФ в процессе выделения определяли его количество в растворе методом иммуноферментного анализа ELISA.
Затем полученный раствор наносили на колонку К-16 (размер 20 см), заполненную октил-сефарозой (Octyl Sepharose 4 Fast Flow, кат 17-0946-10, фирмы "Амершам-Фармация"), уравновешенной в буфере В (10мМ фосфата калия рН 6.5, 1.8М мочевины, 10мМ ЕДТА, 1М сульфата аммония, 0.2мМ ДТТ). Скорость прохождения раствора через колонку составляла 20 мл/час.
Элюцию проводили с использованием линейного градиента с понижающейся концентрацией сульфата аммония до нуля и при повышении рН до 7.5, а детергента Tween-20 до 0.2% от буфера В к буферу С (10 мМ калий фосфата рН 6.5, 1.8М мочевины, 10мМ ЕДТА, 1М сульфата аммония, 0.2мМ ДТТ, 0.2% Tween-20). Скорость прохождения раствора через колонку составляла 20 мл/час. Всего собирали 22 фракции. Основная часть балластных белков выходит во фракциях 10-19. чГ-КСФ элюируется в конце градиента во фракциях 20-21. Потери активности чГ-КСФ в этом процессе составили 30%.
Элюаты, содержащие чГ-КСФ, объединяли, разводили в 4 раза буфером (2мМ фосфат калия рН 7.2, 0.15М хлорид калия), и наносили на колонку К-9 (размер 6 см), наполненную иммуносорбентом с иммобилизованными на нем моноклональными антителами против чГ-КСФ (носитель активированная бромцианом sepharose 4B фирмы "Амершам-Фармация"). Промывали колонку буфером (2мМ фосфат калия рН 7.2, 0.5М хлорид калия) около 10 объемов колонки. Элюцию с колонки проводили 0.1М лимонной кислотой.
Фракции нейтрализовали 1М гидроксида калия и образцы наносили на PAG-SDS электрофорез.
Часть проб осаждали трихлоруксусной кислотой, центрифугировали, осадки промывали 70% метанолом, растворяли в электродном буфере, доводили буфером для нанесения до требуемого объема, прогревали и наносили на гель. Окрашивали с помощью красителя Кумаси G-250 (фиг.3).
Как видно на электрофореограмме в элюате содержится две полосы белка с молекулярной массой примерно 25 000 и 50 000 дальтон. Более легкая полоса соответствует размеру гликозилированного чГ-КСФ. Минорная тяжелая полоса является димерной формой чГ-КСФ.
Данная технология может применяться для получения субстанции чГ-КСФ, используемой для приготовления лекарственной формы препарата.
Список литературы
1. Morstyn G, et al. Clinical studies with granutients receiving cytoxic chemoterapy. Behring Inst. mitt., 1988, Aug. (83), 234-239.
1. Morstyn G, et al. Clinical studies with granutients receiving cytoxic chemoterapy. Behring Inst. mitt., 1988, Aug. (83), 234-239.
2. Werner RG, Berthold W. Purification of proteins produced by biotechnological process. Arzneimittelforschung 1988 Mar; 38(3):422-428.
3. Perez-perez J., et al. Supplementation improves the periplasmic production of human granulocyte-colony stimulating factor in Escherichia coli, Biochem. Biophys. Reg. Commun, 1995, 16, 210 (2), 524-529.
4. Rotondaro L. et al. High-level expression of a cDNA for human granulocyte colony - stimulating factor in Chinese Hamster ovary cells. Effect ot 31-noncoding seguences mol., Biotechnol., 1997, Jun; 7(3) 231-240.
5. Nollowway DNA technology in the production of glycosylated recombinant human granulocyte colony stimulating factor, Eur. J. Cancer, 1994; 30A Suppl. 3., 2.
6. Nissen С. Glycosylation of recombinant human granulocyte colony stimulating factor: implications for stability and potency. Eur. J. Cancer, 1994, 30A, Suppl. 3, 12-14.
7. H. Meade а. С. Ziomer. Urine as a substitute for milk. Nature Biotechnology, 1998, v. l6, Jannary, 21-22.
8. Патент RU #2157846 Cl "Способ получения трансгенного животного, экспрессирующего в молочной железе гранулоцитарный колониестимулирующий фактор человека и гибридный ген h-GM-1 для осуществления способа".
9. Nicola N.A. J. Cell. physiol, 1981, 109, 253.
10. Brem G. et al. Expression of synthetic cDNA sequences encoding human insulin-like grows factor-1 in the mammary gland of transgenic rabbits. Gene, 1994, v. 149, p. 351-355.
11. Rudolph N.S. Biopharmaceutical production in transgenic livestock. Trends in Biotechnology, 1999, sept., v. 17, p. 367-374.
12. van Berkel P.H. et al. Large scale production of recombinant human lactoferrin in the milk of transgenic cows. Nature biotechnology, 2002, v. 20, p. 484-487.
13. Ebert K.M. et al. Transgenic production of a variant of human tissue-type plasminogen activator in goat milk: generation of transgenic goats and analysis of expression. Biotechnology, 1991, v. 9, sept., p. 835-838.
14. Wright G. et al. High level expression of active human alpha-1-antiyrypsin in the milk of transgenic sheep. Biotechnology, 1991, v. 9, sept., p. 830-834.
15. Velander W. et al. High-level expression of a heterologous protein in the milk of transgenic swine using the cDNA encoding human protein C. Proc. Natl. Acad. Sci. USA, 1992, v. 89, p. 12003-12007.
16. Juhani Janne et. al. Transgenic Animals as Bioproducers of Therapeutic Proteins Trends in Molecular Medicine, Annals of Medicine, 1992, v. 24, p. 273-280.
17. Rudolf Jaenisch. Transgenic Animals Science, 1988, v. 240, p. 1468-1473.
18. Angelika E. Schnieke et. al. , Human Factor IX Transgenic Sheep Produced by Transfer of Nuclei from Transfected Fetal Fibroblasts Science, 1997, v. 278, p. 2130-2133.
Claims (5)
1. Способ получения человеческого гранулоцитарного колониестимулирующего фактора (чГ-КСФ), являющегося гликозилированной формой, идентичной нативному белку Г-КСФ человека, включающий стадии создания генетической конструкции ДНК, обеспечивающей экспрессию чГ-КСФ, которая несет геномные последовательности чГ-КСФ, приведенные на фиг.1, и включающей в себя некодирующие белок последовательности, введения конструкции в животное, получения трансгенного животного, продуцирующего чГ-КСФ в молоке лактирующей самки, выделения указанного чГ-КСФ, включающего центрифугирование, хроматографию и конечную доочистку целевого продукта.
2. Способ по п.1, отличающийся тем, что введение генетической конструкции в животное производится методами микроинъецирования в ядра эмбриональных клеток, различными способами трансфекции в клетки эмбрионов или взрослого животного.
3. Способ по п.1, в котором указанным животным является кролик, корова, коза, овца, свинья.
4. Способ по п. 1, отличающийся тем, что на стадии выделения чГ-КСФ проводят обезжиривание молока путем центрифугирования с последующей экстракцией гептаном, октаном или иным органическим растворителем, образующим с водой двухфазную структуру.
5. Способ по п.4, в котором обезжиренное молоко хроматографируют и доочищают на иммуносорбенте, несущем специфические антитела против чГ-КСФ.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2002111017/13A RU2207373C1 (ru) | 2002-04-25 | 2002-04-25 | Способ получения человеческого гранулоцитарного колониестимулирующего фактора |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2002111017/13A RU2207373C1 (ru) | 2002-04-25 | 2002-04-25 | Способ получения человеческого гранулоцитарного колониестимулирующего фактора |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2207373C1 true RU2207373C1 (ru) | 2003-06-27 |
Family
ID=29211849
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2002111017/13A RU2207373C1 (ru) | 2002-04-25 | 2002-04-25 | Способ получения человеческого гранулоцитарного колониестимулирующего фактора |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2207373C1 (ru) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2302664C2 (ru) * | 2005-09-28 | 2007-07-10 | ГУ Научно-исследовательский институт фармакологии Томского научного центра Сибирского отделения Российской академии медицинских наук (ГУ НИИ фармакологии ТНЦ СО РАМН) | Способ коррекции нарушений эритропоэза при экспериментальной энцефалопатии |
| RU2422529C1 (ru) * | 2010-02-12 | 2011-06-27 | Учреждение Российской академии наук Институт цитологии и генетики Сибирского отделения РАН (ИЦиГ СО РАН) | ГЕННО-ИНЖЕНЕРНАЯ КОНСТРУКЦИЯ pGoatcasGCSF, ОБЕСПЕЧИВАЮЩАЯ ПРОДУКЦИЮ ГРАНУЛОЦИТ-КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА В МОЛОКО ТРАНСГЕННЫХ ЖИВОТНЫХ |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2139084C1 (ru) * | 1994-02-04 | 1999-10-10 | Ф.Хоффманн-Ля Рош Аг | Продукт, содержащий гранулоцитарный колониестимулирующий фактор (g - csf) и tnf-связующий протеин |
-
2002
- 2002-04-25 RU RU2002111017/13A patent/RU2207373C1/ru not_active IP Right Cessation
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2139084C1 (ru) * | 1994-02-04 | 1999-10-10 | Ф.Хоффманн-Ля Рош Аг | Продукт, содержащий гранулоцитарный колониестимулирующий фактор (g - csf) и tnf-связующий протеин |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2302664C2 (ru) * | 2005-09-28 | 2007-07-10 | ГУ Научно-исследовательский институт фармакологии Томского научного центра Сибирского отделения Российской академии медицинских наук (ГУ НИИ фармакологии ТНЦ СО РАМН) | Способ коррекции нарушений эритропоэза при экспериментальной энцефалопатии |
| RU2422529C1 (ru) * | 2010-02-12 | 2011-06-27 | Учреждение Российской академии наук Институт цитологии и генетики Сибирского отделения РАН (ИЦиГ СО РАН) | ГЕННО-ИНЖЕНЕРНАЯ КОНСТРУКЦИЯ pGoatcasGCSF, ОБЕСПЕЧИВАЮЩАЯ ПРОДУКЦИЮ ГРАНУЛОЦИТ-КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА В МОЛОКО ТРАНСГЕННЫХ ЖИВОТНЫХ |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Shakweer et al. | A review of transgenic animal techniques and their applications | |
| EP0807170B1 (en) | Transgenic pigs expressing human coagulation factor viii | |
| Ebert et al. | Transgenic farm animals: progress report | |
| Ghiara et al. | In vitro generated mast cells express natural cytotoxicity against tumour cells | |
| KR100397244B1 (ko) | 거핵구분화인자 | |
| AU721132B2 (en) | Method for development of transgenic goats | |
| JP2007507232A (ja) | 乳汁中に外因性タンパク質を産生するトランスジェニック哺乳動物を作製するプロセスおよびそれによって産生されるトランスジェニック哺乳動物 | |
| Carvalho et al. | Production of transgenic cattle by somatic cell nuclear transfer (SCNT) with the human granulocyte colony-stimulation factor (hG-CSF) | |
| Freitas et al. | The establishment of two transgenic goat lines for mammary gland hG-CSF expression | |
| JP2010528678A (ja) | トランスジェニック哺乳動物の乳中に外因性タンパク質を産生させるための方法 | |
| RU2207373C1 (ru) | Способ получения человеческого гранулоцитарного колониестимулирующего фактора | |
| Schrader et al. | In vitro studies on lymphocyte differentiation: II. Generation of terminal deoxynucleotidyl transferase-positive cells in long-term cultures of mouse bone marrow | |
| Gough et al. | Molecular biology of the leukaemia inhibitory factor gene | |
| Matsuo et al. | New human oral squamous carcinoma cell line and its tumorigenic subline producing granulocyte colony‐stimulating factor | |
| CN1970771B (zh) | 一种利用家畜乳腺高效生产人溶菌酶的方法 | |
| AU2004281642A1 (en) | Expression of dominant negative transmembrane receptors in the milk of transgenic animals | |
| RU2422529C1 (ru) | ГЕННО-ИНЖЕНЕРНАЯ КОНСТРУКЦИЯ pGoatcasGCSF, ОБЕСПЕЧИВАЮЩАЯ ПРОДУКЦИЮ ГРАНУЛОЦИТ-КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА В МОЛОКО ТРАНСГЕННЫХ ЖИВОТНЫХ | |
| Webber | Effects of serum on the growth of prostatic cells in vitro | |
| US6331403B1 (en) | Use of mCRP to slow cell growth and to promote maturation of cells | |
| KR20230092097A (ko) | 돼지 GGTA1, CMAH, β4GalNT2 및 CD40 유전자가 결손된 이종장기이식을 위한 형질전환 복제돼지 및 이의 제조방법 | |
| Stinnakre et al. | Quantitative collection of milk and active recombinant proteins from the mammary glands of transgenic mice | |
| Kim et al. | Ectopic expression of tethered human follicle-stimulating hormone (hFSH) gene in transgenic mice | |
| US8030537B1 (en) | Somatic cloning gene transfer for the production of recombinant proteins, cells and organs | |
| RU2390562C2 (ru) | Способ получения трансгенных млекопитающих, которые продуцируют экзогенные белки в молоке, и трансгенные млекопитающие, полученные таким способом | |
| KR100790514B1 (ko) | Csf를 유선에서 발현하는 형질전환 복제 돼지 및 그의제조 방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20040426 |