KR20220080098A - 항-세린 프로테아제 억제제 카잘(spik) 항체의 에피토프 - Google Patents
항-세린 프로테아제 억제제 카잘(spik) 항체의 에피토프 Download PDFInfo
- Publication number
- KR20220080098A KR20220080098A KR1020227011715A KR20227011715A KR20220080098A KR 20220080098 A KR20220080098 A KR 20220080098A KR 1020227011715 A KR1020227011715 A KR 1020227011715A KR 20227011715 A KR20227011715 A KR 20227011715A KR 20220080098 A KR20220080098 A KR 20220080098A
- Authority
- KR
- South Korea
- Prior art keywords
- spik
- antibody
- ser
- sequence
- gly
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/40—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against enzymes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/38—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against protease inhibitors of peptide structure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57407—Specifically defined cancers
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57407—Specifically defined cancers
- G01N33/57438—Specifically defined cancers of liver, pancreas or kidney
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57484—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/576—Immunoassay; Biospecific binding assay; Materials therefor for hepatitis
- G01N33/5761—Hepatitis B
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/576—Immunoassay; Biospecific binding assay; Materials therefor for hepatitis
- G01N33/5767—Immunoassay; Biospecific binding assay; Materials therefor for hepatitis non-A, non-B hepatitis
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6893—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids related to diseases not provided for elsewhere
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/10—Immunoglobulins specific features characterized by their source of isolation or production
- C07K2317/14—Specific host cells or culture conditions, e.g. components, pH or temperature
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/81—Protease inhibitors
- G01N2333/8107—Endopeptidase (E.C. 3.4.21-99) inhibitors
- G01N2333/811—Serine protease (E.C. 3.4.21) inhibitors
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/08—Hepato-biliairy disorders other than hepatitis
- G01N2800/085—Liver diseases, e.g. portal hypertension, fibrosis, cirrhosis, bilirubin
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/50—Determining the risk of developing a disease
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/70—Mechanisms involved in disease identification
- G01N2800/7095—Inflammation
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Organic Chemistry (AREA)
- Urology & Nephrology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Biochemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Cell Biology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Pathology (AREA)
- General Physics & Mathematics (AREA)
- Food Science & Technology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Oncology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Gastroenterology & Hepatology (AREA)
- Virology (AREA)
- Communicable Diseases (AREA)
- Epidemiology (AREA)
- Hospice & Palliative Care (AREA)
- Endocrinology (AREA)
- Mycology (AREA)
Abstract
2개 상이한 형태적 에피토프 중 하나에 특이적으로 결합하는 항-AS-SPIK 항체의 2개 부류가, 상기 항체, 상기 항체를 포함하는, 약학적 조성물을 포함하는, 상기 조성물의 제조 방법, 및 AS-SPIK의 발현을 특징으로 하는 장애 (예를 들면, 간암)를 진단 및/또는 치료하기 위한 그들의 용도와 함께 개시된다. 항-AS-SPIK 항체를 포함하는 진단적 방법 및 키트가 또한 개시된다.
Description
관련된 출원에 대한 교차-참조
본원은 2019년 9월 11일 출원된 미국 가특허 출원 시리얼 번호 62/899,024의 출원일의 우선권 이익을 주장하고, 이 출원의 개시내용은 이 전체가 참고로 본원에 편입된다.
정부 권리
본 발명은 소기업 혁신 연구 (SBIR) 프로그램 하에 국립 보건원 (NIH)에 의해 수여된 교부 번호 2R44CA165314-02A1 및 FAIN 번호 R44CA165314 하에서 정부 지원으로 실시되었다. 정부는 본 발명에서 특정 권리를 갖는다.
발명의 분야
본 발명은 2개 상이한 형태적 에피토프들 중 하나에 특이적으로 결합하는 항-AS-SPIK 항체의 2개 부류와, 상기 항체, 상기 항체를 포함하는, 약학적 조성물을 포함하는, 상기 조성물의 제조 방법, 및 AS-SPIK의 발현을 특징으로 하는 장애 (예를 들면, 간암)를 진단 및/또는 치료하기 위한 그들의 용도에 관한 것이다. 항-AS-SPIK 항체를 포함하는 진단적 방법 및 키트가 또한 개시된다.
배경
간은 신체에서 가장 큰 기관 중 하나이다. 간은 음식의 소화에 필요한 효소 및 담즙의 생산, 글리코겐 저장의 조절, 혈장 단백질 합성, 호르몬 생산, 및 다양한 대사산물의 해독화를 포함하는 많은 기능을 갖는다. 간 장애는 간암 예컨대 간세포 암종 (HCC) 및 간내 담관암종 (ICC), 바이러스성 감염, 간경변, 및 전 세계 수백만 명의 사람들에게 영향을 미치는 간의 기타 염증성 장애를 포함한다. 예를 들어, 미국에서 500만 명 초과의 개인 그리고 전 세계적으로 4억 5천만 명 초과의 개인이 B형 간염 바이러스 (HBV) 및 C형 간염 바이러스 (HCV) 감염으로 고통받고, 이들 감염된 개인의 30% 이상이 간암 발병의 높은 위험에 처해 있다. (1-4) 진단 및 치료에서 진전에도 불구하고, 간암은 양쪽 이환율 및 사망률의 중요한 원인으로 남아있다. 원발성 간암, 또는 간에서 기원하는 암은 10% 미만의 5-년 생존율을 갖는다. 하지만, 간암이 초기에 검출되고 이의 가장 치료가능한 병기 중이면, 생존율이 거의 40%까지 증가한다. 초기 간암을 가진 환자는 증상이 거의 없거나 무 증상을 가질 수 있다. 현행 검출 방법, 예컨대 혈청학적 방법, 초음파, 컴퓨터 단층촬영 (CT) 스캔, 자기 공명 영상 (MRI), 및 혈관조영술은 낮은 감수성 및 작업자 오류의 잠재성으로 인해 신뢰할 수 없다. 비용이 많이 드는 영상 기법은 더 작은, 초기 단계 종양의 검출에 덜 정확할 수 있다 (1, 2). 아직까지 양성 종양과 악성 종양을 구별하는 가장 신뢰할만한 방법으로 여겨지는 간 생검은 침습적이고 수술이 필요하다 (3). 특히 간 간경변, 바이러스성 감염, 및 간의 염증성 장애에 의해 영향받는 이들에 대하여, 간암을 진단하고 치료하는 새로운 방법이 계속해서 필요하다
세린 프로테아제 억제제 카잘 (SPIK/SPINK1)은 79개 아미노산을 가진 작은 분비된 단백질이다 (4). 트립시노겐의 자가활성화의 억제제로서 췌장에서 처음 발견되었다 (5, 6). 최근 연구는 SPIK의 발현이 간암 예컨대 간세포 암종 (HCC) 및 간내 담관암종 (ICC)에서 상승되지만, 췌장의 외부를 제외한, 간을 포함하는 정상 조직에서 제한된 또는 무 활성을 갖는다는 것을 시사하였다 (7-9). 암 바이오마커로서 SPIK의 용도는 혈청 SPIK의 수준이 기타 질환, 특별히 췌장염의 존재 하에서 또한 상승된다는 사실에 의해 훼방되었다 (10-12). 우리는 간암 세포에 의해 분비된 SPIK에 대하여, N-말단에서 추가의, 적어도 9-잔기 긴 단편이 유지되는 반면, 정상 세포 예컨대 췌장 세포로부터 분비된 SPIK에서 제거되는 것을 알아내었다 (13). 우리는 이러한 종류의 SPIK를 NS-SPIK (정상 분비된 SPIK)로서 부른다. 하지만, 우리는 간암 세포에 의해 분비된 SPIK가 NS-SPIK보다 더 크고, 이러한 23개 아미노산의 추가의, 적어도 9-잔기 긴 단편이 분비 중 유지되는 것을 알아내었다 (11). 우리는 간암 세포에 의해 분비된 SPIK를 AS-SPIK 또는 LC-SPIK (비정상 분비된 SPIK 또는 간암 분비된 SPIK)로서 칭하였다. 본원에 AS-SPIK 및 LC-SPIK는 동일한 의미를 갖는다. 우리의 추가 연구는 사실 SPIK (서열번호: 6)의 N- 말단에 9개 아미노산 뿐 아니라, 추가의 23개 아미노산이 AS-SPIK에서 유지되는 반면, NS-SPIK로부터 제거되는 것을 알아내었다. 암 세포가 미-절단 SPIK를 분비하는 이유는 알려지지 않는다. 우리의 작업 가설은 SPIK가 세린 프로테아제 억제제이기 때문에, 암 세포에서 SPIK의 과-발현이, 세린 프로테아제의 1개 종류인, 신호 펩타이드 펩티다제의 활성을 억압하여, 암 세포로부터 분비되는 약독화되지 않은, 전장 단백질을 초래한다는 것이다. 우리는 AS-SPIK의 발현 중 발생하는 특정 이벤트를 우리가 이해한다고 믿지만, 본 발명의 조성물 및 방법은 임의의 특정한 세포성 기전에 영향을 미침으로써 작업하는 것들로 제한되지 않는다. 그러므로, 이러한 도메인을 인식할 수 있고 이에 특이적으로 결합할 수 있는 항체를 사용함으로써, 암성 간 세포로부터 생산된 SPIK와 기타 비-암성 질환에 의해 생성된 SPIK 사이를 차별하는 것이 가능해야 한다. 이러한 목적을 위하여, 우리는 고 감수성 및 특이성을 가진, 정상 SPIK (NS-SPIK, 정상 분비된 SPIK)가 아닌, 암성 SPIK (NS-SPIK, 비정상 분비된 SPIK)를 단독으로 인식하는 일련의 단클론성 항체를 개발하였다. 이러한 항체를 사용하여, 우리는 추가로 ELISA 테스트 키트 (SERAVUE®)를 개발하였고, HCC를 기타 간 질환 예컨대 HBV 및 HCV 감염, 간 간경변, 및 비-간 질환 예컨대 췌장염 및 뿐만 아니라 건강한 대상체와 구별하기에서 AS-SPIK의 성능을 사정하였다. 임상적 연구 결과는 대상체 항체 및 관련된 방법이, 기타 간 또는 비-간 질환으로부터 방해 없이, 이의 극초기에서 조차, HCC를 선택적으로 그리고 신뢰할만하게 검출하는데 사용될 수 있음을 시사하고, 이는 HCC의 진단 및 치료를 굉장히 개선할 것이다.
발명의 개요
본 발명의 양태는 AS-SPIK 단백질의 형태적 에피토프에 특이적으로 결합하고, NS-SPIK 단백질에 특이적으로 결합하지 않는 단리된 항체를 포함하고, 여기서 AS-SPIK 단백질의 형태적 에피토프는 서열번호: 2의 L14, L15, S16, L17, D24 및 S25로 이루어지는 군으로부터 선택된 하나 이상의 아미노산; 및 서열번호: 2의 C58, V59, L60, C61, 및 F62로 이루어지는 군으로부터 선택된 하나 이상의 아미노산을 포함한다.
일부 구현예에서, 형태적 에피토프는 서열번호: 2의 아미노산 L14, L15, S16, 및 L17을 포함한다. 일부 구현예에서, 형태적 에피토프는 서열번호: 2의 아미노산 L60 및 C61을 포함한다. 일부 구현예에서, 형태적 에피토프는 서열번호: 2의 아미노산 L14, L15, S16, L17, L60, 및 C61을 포함한다. 일부 구현예에서, 형태적 에피토프는 추가로 서열번호: 2의 아미노산 D24 및 S25를 포함한다. 일부 구현예에서, 형태적 에피토프는 추가로 서열번호: 2의 아미노산 C58, V59 및 F62를 포함한다. 일부 구현예에서, 형태적 에피토프는 서열번호: 2의 아미노산 L14, L15, S16, L17, D24, S25, C58, V59, L60, C61 및 F62를 포함한다.
일부 구현예에서, 단리된 항체는 S6을 포함하는 CDRH1 서열; 및/또는 I2, G5, G6, Y10 및 K16을 포함하는 CDRH2 서열; 및/또는 G4 및 Y7을 포함하는 CDRH3 서열; 및/또는 Q4 및 S9를 포함하는 CDRL1 서열; 및/또는 A2, S3, T4 및 S7을 포함하는 CDRL2 서열; 및/또는 Q1, Q2, Y4 및 S5를 포함하는 CDRL3 서열을 포함한다.
일부 구현예에서, 단리된 항체는 S6을 포함하는 CDRH1 서열; I2, G5, G6, Y10 및 K16을 포함하는 CDRH2 서열; G4 및 Y7을 포함하는 CDRH3 서열; Q4 및 S9를 포함하는 CDRL1 서열; A2, S3, T4 및 S7을 포함하는 CDRL2 서열; 및 Q1, Q2, Y4 및 S5를 포함하는 CDRL3 서열을 포함한다.
본 발명의 양태는 AS-SPIK 단백질의 형태적 에피토프에 특이적으로 결합하고, NS-SPIK 단백질에 특이적으로 결합하지 않는 단리된 항체를 포함하고, 여기서 AS-SPIK 단백질의 형태적 에피토프는 서열번호: 2의 L36, N37, I42 및 Y43으로 이루어지는 군으로부터 선택된 하나 이상의 아미노산; 및 서열번호: 2의 R67, Q68, I71 및 L72로 이루어지는 군으로부터 선택된 하나 이상의 아미노산을 포함한다.
일부 구현예에서, 형태적 에피토프는 서열번호: 2의 아미노산 L36 및 N37을 포함한다. 일부 구현예에서, 형태적 에피토프는 서열번호: 2의 아미노산 I42 및 Y43을 포함한다. 일부 구현예에서, 형태적 에피토프는 서열번호: 2의 아미노산 L36, N37, I42 및 Y43을 포함한다. 일부 구현예에서, 형태적 에피토프는 서열번호: 2의 아미노산 R67, Q68, I71 및 L72를 포함한다. 일부 구현예에서, 형태적 에피토프는 서열번호: 2의 아미노산 L36, N37, I42, Y43, R67, Q68, I71 및 L72를 포함한다.
일부 구현예에서, 및 항체는 Y3, S7 및 W9를 포함하는 CDRH1 서열; 및/또는 A1, I2, G4, G6 및 Y10을 포함하는 CDRH2 서열; 및/또는 R1 및 D7을 포함하는 CDRH3 서열; 및/또는 A2, S3, Q4, I6, Y9, L10 및 S11을 포함하는 CDRL1 서열; 및/또는 A2, S3, L5 및 S7을 포함하는 CDRL2 서열; 및/또는 Q1, Q2, 및 T5를 포함하는 CDRL3 서열을 포함한다.
일부 구현예에서, 항체는 Y3, S7 및 W9를 포함하는 CDRH1 서열; A1, I2, G4, G6 및 Y10을 포함하는 CDRH2 서열; R1 및 D7을 포함하는 CDRH3 서열; A2, S3, Q4, I6, Y9, L10 및 S11을 포함하는 CDRL1 서열; A2, S3, L5 및 S7을 포함하는 CDRL2 서열; 및 Q1, Q2, 및 T5를 포함하는 CDRL3 서열을 포함한다.
일부 구현예에서, 항체는 다중-특이적이다. 일부 구현예에서, 항체는 이중특이적이다. 일부 구현예에서, 항체는 효과기 세포에 결합 친화성을 갖는다. 일부 구현예에서, 항체는 T-세포 항원에 결합 친화성을 갖는다. 일부 구현예에서, T-세포 항원은 CD3 단백질을 포함한다. 일부 구현예에서, 항체는 단클론성 항체이다. 일부 구현예에서, 항체는 CAR-T 형식이다.
본 발명의 양태는, 세포독성 제제에 공유적으로 부착된, 본원에 기재된 경우에 항체를 포함하는 면역접합체를 포함한다. 일부 구현예에서, 세포독성 제제는 독소, 화학치료적 제제, 약물 모이어티, 항생제, 방사성 동위원소 및 핵산분해 효소로 이루어지는 군으로부터 선택된다.
일부 구현예에서, 면역접합체는 식 Ab-(L-D)p를 갖고, 여기서 Ab는 본원에 기재된 경우에 항체이고; L은 링커이고; D는 약물 모이어티이고; p는 1 내지 8 범위인 정수이다. 일부 구현예에서, D는 메이탄시노이드, 아우리스타틴 및 돌로스타틴으로 이루어지는 군으로부터 선택된다. 일부 구현예에서, L은 6-말레이미도카프로일 (MC), 말레이미도프로파노일 (MP), 발린-시트룰린 (val-cit), 알라닌-페닐알라닌 (ala-phe), p-아미노벤질옥시카르보닐 (PAB), N-숙신이미딜 4-(2-피리딜티오)펜타노에이트 (SPP), N-숙신이미딜 4-(N-말레이미도메틸)시클로헥산-1 카르복실레이트 (SMCC), 4-(2-피리딜디티오)부티르산-N-히드록시숙신이미드 에스테르 (SPDB), 및 N-숙신이미딜 (4-요오도-아세틸)아미노벤조에이트 (SIAB)로 이루어지는 군으로부터 선택된 하나 이상의 링커를 포함한다.
본 발명의 양태는 본원에 기재된 경우에 및 항체 또는 면역접합체를 포함하는 약학적 조성물을 포함한다.
본 발명의 양태는, 상기 장애를 가진 대상체에 본원에 기재된 경우에 항체 또는 면역접합체, 또는 본원에 기재된 경우에 약학적 조성물을 투여하는 단계를 포함하는, AS-SPIK의 발현을 특징으로 하는 장애의 치료 방법을 포함한다.
본 발명의 양태는 AS-SPIK의 발현을 특징으로 하는 장애의 치료를 위한 약제의 제조에서, 본원에 기재된 경우에 항체 또는 면역접합체의 용도를 포함한다.
본 발명의 양태는 AS-SPIK의 발현을 특징으로 하는 장애의 치료에서 사용을 위한 본원에 기재된 경우에 항체 또는 면역접합체를 포함한다.
일부 구현예에서, 장애는 간 장애이다. 일부 구현예에서, 간 장애는 간세포 암종이다. 일부 구현예에서, 간 장애는 간내 담관암종이다. 일부 구현예에서, 간 장애는 바이러스성 감염이다. 일부 구현예에서, 간 장애는 염증성 간 장애이다. 일부 구현예에서, 염증성 간 장애는 간의 간경변이다.
본 발명의 양태는 본원에 기재된 경우에 항체를 인코딩하는 폴리뉴클레오타이드를 포함한다. 본 발명의 양태는 본원에 기재된 경우에 폴리뉴클레오타이드를 포함하는 벡터를 포함한다. 본 발명의 양태는 본원에 기재된 경우에 벡터를 포함하는 숙주 세포를 포함한다.
본 발명의 양태는, 항체의 발현을 허용하는 조건 하에서 본원에 기재된 경우에 숙주 세포를 성장시키는 단계, 및 항체를 세포로부터 단리시키는 단계를 포함하는, 본원에 기재된 경우에 항체 또는 면역접합체의 생산 방법을 포함한다.
본 발명의 양태는 대상체가 AS-SPIK의 발현을 특징으로 하는 장애를 갖거나 상기 발병의 위험에 처한 지를 결정하는 진단적 방법을 포함하고, 상기 방법은 대상체로부터의 생물학적 테스트 샘플을 본원에 기재된 경우에 AS-SPIK 항체와 접촉시켜 AS-SPIK-항체 복합체를 생성하는 단계; 생물학적 테스트 샘플에서 AS-SPIK-항체 복합체의 농도를 검출하는 단계; 및 AS-SPIK-항체 복합체의 농도를 기준값에 비교하여 대상체가 장애를 갖거나 상기 발병의 위험에 처한 지를 결정하는 단계를 포함한다.
본 발명의 양태는 대상체가 AS-SPIK의 발현을 특징으로 하는 장애를 갖거나 상기 발병의 위험에 처한 지를 결정하는 진단적 방법을 포함하고, 상기 방법은 대상체로부터의 생물학적 테스트 샘플을 SPIK에 특이적으로 결합하는 제1 항체 또는 항원-결합 단편과 접촉시켜 SPIK-항체 복합체를 형성하는 단계; SPIK-항체 복합체를 본원에 기재된 경우에 AS-SPIK 항체 또는 항원-결합 단편과 접촉시켜 AS-SPIK-항체 복합체를 생성하는 단계; AS-SPIK-항체 복합체의 농도를 생물학적 테스트 샘플에서 검출하는 단계; 및 AS-SPIK-항체 복합체의 농도를 기준값에 비교하여 대상체가 장애를 갖거나 상기 발병의 위험에 처한 지를 결정하는 단계를 포함한다.
일부 구현예에서, 항체 또는 항원-결합 단편은 검출가능한 표지를 포함한다. 일부 구현예에서, 장애는 간 장애이다. 일부 구현예에서, 간 장애는 간세포 암종, 간내 담관암종, 간의 바이러스성 감염, 간의 염증성 장애, 및 간의 간경변으로 이루어지는 군으로부터 선택된다.
본 발명의 양태는 본원에 기재된 경우에 항체 또는 면역접합체를 포함하는 키트를 포함한다. 일부 구현예에서, 키트는 추가로 SPIK에 특이적으로 결합하는 항체를 포함한다.
도면의 간단한 설명
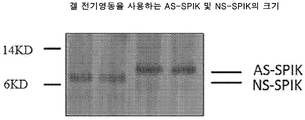
도 1은 겔 전기영동을 이용하여 AS-SPIK 및 NS-SPIK의 크기를 도시한다.
도 2는 Edman N-말단 분석에 의한 AS-SPIK의 N-말단 서열을 도시한다.
도 3은 AS-SPIK 및 NS-SPIK의 아미노산 서열의 비교를 도시한다.
도 4는 AS-SPIK의 3D 구조의 NS-SPIK의 것과의 비교를 도시한다.
도 5는 AS-SPIK 및 NS-SPIK에 결합하는 항체의 결합 활성의 테스트 결과를 도시한다.
도 6은 합성된 펩타이드에 항-AS-SPIK 항체의 결합 테스트의 결과를 도시한다.
도 7은 AS-SPIK 및 이의 에피토프의 3D 구조 (결정체 모델)를 도시한다.
도 8은 부류 I 항-AS-SPIK 항체의 결합 부위를 찾기 위한 억제 테스트의 결과를 도시한다.
도 9는 부류 I 항-AS-SPIK 항체에서 CDR의 공통 아미노산을 도시한다.
도 10은 부류 II 항-AS-SPIK 항체에서 CDR의 공통 아미노산을 도시한다.
도 11은 AS-SPIK 검출 키트를 위한 기전의 예시를 제공한다.
도 12, 패널 A는 IM-CA22가 NS-SPIK가 아닌 AS-SPIK에 특이적으로 결합하는 반면, 항체 IM-BA2가 양쪽 AS-SPIK 및 NS-SPIK에 결합하는 것을 보여주는 그래프이다. 패널 B는 AS-SPIK가 췌장염 또는 건강한 환자가 아닌 HCC에서 상승되는 것을 보여주는 그래프이다. 패널 C는 NS-SPIK가 췌장염 환자에서 상승되지만 AS-SPIK-기반된 검출 키트의 성능을 방해하지 않는다.
도 13은 부류 I 및 부류 II 항-AS-SPIK 항체의 결합 특징을 보여주는 표 (표 1)이다.
도 14는 CLIPS 분석 연구에 의해 예측된 항-AS-SPIK 결합을 위한 영역, 및 그안에 에피토프를 구성하는 아미노산 잔기를 보여주는 표 (표 2)이다.
도 15는, 본원에 추가로 기재된 경우에, 에피토프 I에 결합하는 4개 예시 부류 I 항체의 아미노산 서열을 보여주는 표 (표 3)이다.
도 16은, 본원에 추가로 기재된 경우에, 에피토프 II에 결합하는 4개 예시 부류 II 항체의 아미노산 서열을 보여주는 표 (표 4)이다.
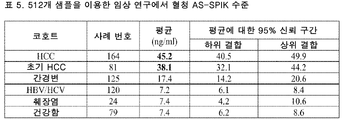
도 17은 512개 샘플을 이용한 임상적 연구에서 혈청 AS-SPIK 수준을 보여주는 표 (표 5)이다.
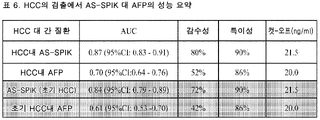
도 18은 HCC의 검출에서 AS-SPIK 대 AFP의 성능 요약을 제공하는 표 (표 6)이다.
도 19는 초기 대 말기 HCC에서 AS-SPIK 수준을 보여주는 표 (표 7)이다.
도 20은 BCLC 병기에 의해, HCC에서 AS-SPIK 수준을 보여주는 표 (표 8)이다.
도 1은 겔 전기영동을 이용하여 AS-SPIK 및 NS-SPIK의 크기를 도시한다.
도 2는 Edman N-말단 분석에 의한 AS-SPIK의 N-말단 서열을 도시한다.
도 3은 AS-SPIK 및 NS-SPIK의 아미노산 서열의 비교를 도시한다.
도 4는 AS-SPIK의 3D 구조의 NS-SPIK의 것과의 비교를 도시한다.
도 5는 AS-SPIK 및 NS-SPIK에 결합하는 항체의 결합 활성의 테스트 결과를 도시한다.
도 6은 합성된 펩타이드에 항-AS-SPIK 항체의 결합 테스트의 결과를 도시한다.
도 7은 AS-SPIK 및 이의 에피토프의 3D 구조 (결정체 모델)를 도시한다.
도 8은 부류 I 항-AS-SPIK 항체의 결합 부위를 찾기 위한 억제 테스트의 결과를 도시한다.
도 9는 부류 I 항-AS-SPIK 항체에서 CDR의 공통 아미노산을 도시한다.
도 10은 부류 II 항-AS-SPIK 항체에서 CDR의 공통 아미노산을 도시한다.
도 11은 AS-SPIK 검출 키트를 위한 기전의 예시를 제공한다.
도 12, 패널 A는 IM-CA22가 NS-SPIK가 아닌 AS-SPIK에 특이적으로 결합하는 반면, 항체 IM-BA2가 양쪽 AS-SPIK 및 NS-SPIK에 결합하는 것을 보여주는 그래프이다. 패널 B는 AS-SPIK가 췌장염 또는 건강한 환자가 아닌 HCC에서 상승되는 것을 보여주는 그래프이다. 패널 C는 NS-SPIK가 췌장염 환자에서 상승되지만 AS-SPIK-기반된 검출 키트의 성능을 방해하지 않는다.
도 13은 부류 I 및 부류 II 항-AS-SPIK 항체의 결합 특징을 보여주는 표 (표 1)이다.
도 14는 CLIPS 분석 연구에 의해 예측된 항-AS-SPIK 결합을 위한 영역, 및 그안에 에피토프를 구성하는 아미노산 잔기를 보여주는 표 (표 2)이다.
도 15는, 본원에 추가로 기재된 경우에, 에피토프 I에 결합하는 4개 예시 부류 I 항체의 아미노산 서열을 보여주는 표 (표 3)이다.
도 16은, 본원에 추가로 기재된 경우에, 에피토프 II에 결합하는 4개 예시 부류 II 항체의 아미노산 서열을 보여주는 표 (표 4)이다.
도 17은 512개 샘플을 이용한 임상적 연구에서 혈청 AS-SPIK 수준을 보여주는 표 (표 5)이다.
도 18은 HCC의 검출에서 AS-SPIK 대 AFP의 성능 요약을 제공하는 표 (표 6)이다.
도 19는 초기 대 말기 HCC에서 AS-SPIK 수준을 보여주는 표 (표 7)이다.
도 20은 BCLC 병기에 의해, HCC에서 AS-SPIK 수준을 보여주는 표 (표 8)이다.
상세한 설명
본 발명의 실시는, 달리 명시되지 않는 한, 분자 생물학 (재조합 기법 포함), 미생물학, 세포 생물학, 생화학, 및 면역학의 기존 기술을 이용할 것이고, 이들은 당업계의 기술 내에 있다. 상기 기법은 문헌, 예컨대, "Molecular Cloning: A Laboratory Manual", second edition (Sambrook 등, 1989); "Oligonucleotide Synthesis" (M. J. Gait, ed., 1984); "Animal Cell Culture" (R. I. Freshney, ed., 1987); "Methods in Enzymology" (Academic Press, Inc.); "Current Protocols in Molecular Biology" (F. M. Ausubel 등, eds., 1987, and periodic updates); "PCR: The Polymerase Chain Reaction", (Mullis 등, ed., 1994); "A Practical Guide to Molecular Cloning" (Perbal Bernard V., 1988); "Phage Display: A Laboratory Manual" (Barbas 등, 2001); Harlow, Lane 및 Harlow, Using Antibodies: A Laboratory Manual: Portable Protocol No. I, Cold Spring Harbor Laboratory (1998); 및 Harlow 및 Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory; (1988)에서 충분히 설명된다.
값의 범위가 제공되는 경우, 그 범위의 상한과 하한 사이, 문맥이 명확하게 달리 명시하지 않는 한 하한의 단위의 1/10까지, 각 개재 값 그리고 그 진술된 범위에서 임의의 기타 진술된 또는 개재 값이 본 발명 내에서 포괄되는 것이 이해된다. 이들 더 작은 범위의 상한 및 하한은 더 작은 범위에서 독립적으로 포함될 수 있고 진술된 범위에서 임의의 구체적으로 배제된 한계에 따라, 본 발명 내에서 이다 또한 포괄된다. 진술된 범위가 한계의 한쪽 또는 양쪽을 포함하는 경우, 그들 포함된 한계의 어느 한쪽 또는 양쪽을 배제하는 범위는 본 발명에서 또한 포함된다.
달리 명시되지 않는 한, 본원에 항체 잔기는 Kabat 넘버링 시스템 (예를 들면, Kabat 등, Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991))에 따라 넘버링된다.
하기 설명에서, 수많은 구체적 상세는 본 발명의 더욱 철저한 이해를 제공하기 위해 제시된다. 하지만, 본 발명이 이들 구체적 상세의 하나 이상 없이 실시될 수 있음이 당업자에 명백해질 것이다. 기타 사례에서, 잘-알려진 속성 및 당업자에 잘 알려진 절차는 본 발명 모호함을 피하기 위해 설명되지 않았다.
특허 출원 및 공개를 포함하는, 본 개시내용 도처에 인용된 모든 참고문헌은 그들 전체가 본원에 참고로 편입된다.
정의
본 명세서를 해석하기 위해, 하기 정의가 적용할 것이고 적절할 때마다, 단수형으로 사용된 용어들은 복수형을 또한 포함할 것이고 그 반대도 마찬가지이다. 제시된 임의의 정의가 참고로 본원에 편입된 임의의 문헌과 상충하는 경우에, 하기 제시된 정의가 지배할 수 있다.
"에피토프"는 단일 항체 분자가 결합하는 항원 분자의 표면에서의 부위이다. 일반적으로, 항원은 몇몇 또는 많은 상이한 에피토프를 갖고 많은 상이한 항체와 반응한다. 상기 용어는 구체적으로 선형 에피토프 및 형태적 에피토프를 포함한다. 상기 용어는 항체에 특이적 결합할 수 있는 임의의 분자성 결정인자를 포함한다. 특정 구현예에서, 에피토프 결정인자는 분자 예컨대 아미노산, 당 측쇄, 포스포릴, 또는 술포닐의 화학적으로 활성 표면 그룹화를 포함하고, 특정 구현예에서, 특이적 3차원 구조적 특징, 및/또는 특이적 전하 특징을 가질 수 있다. 에피토프는 항체에 의해 결합되는 항원의 영역이다. "결합 영역"은 결합 분자에 의해 결합된 결합 표적에서의 영역이다.
"에피토프 맵핑"은 그들의 표적 항원에서 항체의 결합 부위, 또는 에피토프 식별하기의 공정이다. 항체 에피토프는 선형 에피토프 또는 형태적 에피토프일 수 있다. 선형 에피토프는 단백질에서 아미노산의 연속 서열에 의해 형성된다. 형태적 에피토프는 단백질 서열에서 불연속이지만, 단백질을 이의 3-차원 구조로 폴딩시 결합되는 아미노산으로 형성된다.
본원에 정의된 경우에 "에피토프 비닝"은 이들이 인식하는 에피토프에 기반된 항체 그룹화의 공정이다. 더욱 특히, 에피토프 비닝은 그들의 에피토프 인식 특성에 기반된 항체 클러스터링하기 그리고 뚜렷한 결합 특이성을 갖는 항체 식별하기를 위하여 컴퓨터 공정과 조합된, 상이한 항체의 에피토프 인식 특성을 분간하는 방법 및 시스템을 포함한다.
항체는 2개 항체가 동일한 또는 입체적으로 중첩 에피토프를 인식하는 경우 참조 항체로서 "본질적으로 동일한 에피토프"를 결합시킨다. 2개 에피토프가 동일한 또는 입체적으로 중첩 에피토프에 결합하는 지를 결정하는 가장 널리 사용되고 신속한 방법은 어느 한쪽 표지화된 항원 또는 표지화된 항체를 사용하여, 임의의 수의 상이한 형식으로 구성될 수 있는, 경쟁 검정이다. 보통, 항원은 96-웰 플레이트에서 부동화되고, 표지화된 항체의 결합을 차단하는 미표지화된 항체의 능력은 방사성 또는 효소 표지를 사용하여 측정된다.
본원에 사용된 경우에, 아미노산 잔기/위치의 "변형"은 출발 아미노산 서열과 비교된 경우에 일차 아미노산 서열의 변화를 지칭하고, 여기서 변화는 상기 아미노산 잔기/위치를 포함하는 서열 변경에서 비롯한다. 예를 들어, 전형적 변형은 잔기의 (또는 상기 위치에서의) 또 다른 아미노산으로의 치환 (예를 들면, 보존적 또는 비-보존적 치환), 상기 잔기/위치에 인접한 하나 이상의 (일반적으로 5 또는 3개 미만) 아미노산의 삽입, 및 상기 잔기/위치의 결실을 포함한다. "아미노산 치환" 또는 이의 변이는 예정된 (출발) 아미노산 서열에서 기존 아미노산 잔기의 상이한 아미노산 잔기로의 대체를 지칭한다. 일반적으로 및 바람직하게는, 변형은 출발 (또는 "야생형") 아미노산 서열을 포함하는 폴리펩타이드와 비교하여 변이체 폴리펩타이드의 적어도 하나의 물리적 또는 생화학적 활성에서의 변경을 초래한다. 예를 들어, 항체의 경우에서, 변경되는 물리적 또는 생화학적 활성은 표적 분자에 대한 결합 친화성, 결합 능력 및/또는 결합 효과일 수 있다.
용어 "항체"는 단클론성 항체 (면역글로불린 Fc 영역을 갖는 전장 항체 포함), 단일-쇄 분자, 뿐만 아니라 항체 단편 (예를 들면, Fab, F(ab')2, 및 Fv)을 포함한다. 용어 "면역글로불린" (Ig)은 본원에 "항체"와 교환가능하게 사용된다. 염기성 4-쇄 항체 단위는 2개 동일한 경 (L) 쇄 및 2개 동일한 중 (H) 쇄로 구성된 헤테로사량체성 당단백질이다. 달리 언급되지 않는 한, 용어 "항체"는 가장 넓은 의미로 본원에 사용되고 구체적으로 IgG, IgM, IgA, IgD, 및 IgE 항체 및 그들의 단편, 바람직하게는 항원-결합 단편을 포함하는 항체의 모든 아이소타입, 하위-부류 및 형태를 포함한다.
달리 진술되지 않는 한, 용어 "항체"는 구체적으로 자연 발생 변이체를 포함하는 천연 인간 및 비- 인간 IgG1, IgG2 (IgG2a, IgG2b), IgG3, IgG4, IgE, IgA, IgD 및 IgM 항체를 포함한다.
용어 "단클론성 항체"는 본원에 사용된 경우에 실질적으로 동종 항체의 집단으로부터 수득된 항체를 지칭한다, 즉, 집단을 포함하는 개별 항체는 소량으로 존재할 수 있는 가능한 자연 발생 돌연변이를 제외하고 동일하다. 단클론성 항체는 단일 항원 부위에 대해 지시되는, 매우 특이적이다. 게다가, 상이한 결정인자 (에피토프)에 대해 지시된 상이한 항체를 전형적으로 포함하는 종래 (다클론성) 항체 제조물과 대조적으로, 각 단클론성 항체는 항원에서 단일 결정인자에 대해 지시된다. 수식어 "단클론성"은 항체의 실질적으로 동종 집단으로부터 수득되는 것으로 항체의 성격을 나타내고, 임의의 특정한 방법에 의해 항체의 생산을 요구하는 것으로 해석되지 않아야 한다. 예를 들어, 본 발명에 따라 사용될 단클론성 항체는 Kohler 등. (1975) Nature 256:495에 의해 처음 설명된 하이브리도마 방법에 의해 만들어질 수 있거나, 재조합 DNA 방법 (예를 들면, 미국 특허 번호 4,816,567, 참고)에 의해 만들어질 수 있다. "단클론성 항체"는 Clackson 등. (1991) Nature 352:624-628 및 Marks 등. (1991) J. Mol. Biol. 222:581-597에, 예를 들어 설명된 기법을 사용하여 파지 항체 라이브러리로부터 또한 단리될 수 있다.
본원에 단클론성 항체는 구체적으로 중쇄 및/또는 경쇄의 한 부문이 특정한 종에서 유래된 항체에서 상응하는 서열과 동일하거나 상동인 반면, 쇄(들)의 나머지가 또 다른 종에서 유래된 항체에서 상응하는 서열과 동일하거나 상동인 "키메라" 항체 (면역글로불린), 뿐만 아니라 상기 항체의 단편을, 이들이 원하는 생물학적 활성을 나타내는 한, 포함한다 (미국 특허 번호 4,816,567; 및 Morrison 등. (1984) Proc. Natl. Acad. Sci. USA 81:6851-6855).
비-인간 (예를 들면, 쥣과) 항체의 "인간화된" 형태는 비-인간 면역글로불린에서 유래된 최소 서열을 함유하는 항체이다. 대부분의 경우, 인간화된 항체는 수령체의 초가변 영역으로부터의 잔기가 원하는 특이성, 친화성, 및 능력을 갖는 비-인간 종 (공여체 항체) 예컨대 마우스, 랫트, 토끼 또는 비인간 영장류의 초가변 영역으로부터의 잔기에 의해 대체되는 인간 면역글로불린 (수령체 항체)이다. 일부 사례에서, 인간 면역글로불린의 Fv 프레임워크 영역 (FR) 잔기는 상응하는 비-인간 잔기에 의해 또한 대체된다. 게다가, 인간화된 항체는 수령체 항체에서 또는 공여체 항체에서 찾아지지 않는 잔기를 포함할 수 있다. 이들 변형은 항체 성능을 추가로 개선하기 위해 실시된다. 일반적으로, 인간화된 항체는 적어도 1개, 및 전형적으로 2개, 가변 도메인의 실질적으로 모두를 포함할 것이고, 여기에서 초가변 루프의 모두 또는 실질적으로 모두는 비-인간 면역글로불린의 것들에 상응하고 FR 영역의 모두 또는 실질적으로 모두는 인간 면역글로불린 서열의 것들이다. 인간화된 항체는 임의로 또한 면역글로불린 불변 영역 (Fc)의 적어도 한 부문, 전형적으로 인간 면역글로불린의 것을 포함할 것이다. 추가 상세에 대하여, Jones 등. (1986) Nature 321:522-525; Riechmann 등. (1988) Nature 332:323-329; 및 Presta (1992) Curr. Op. Struct. Biol. 2:593-596 참고.
참조 폴리펩타이드 서열에 관하여 "퍼센트 (%) 아미노산 서열 동일성"은 최대 퍼센트 서열 동일성을 달성하기 위해, 필요하면, 서열을 정렬하고 갭을 도입한 후, 참조 폴리펩타이드 서열에서 아미노산 잔기와 동일하고, 임의의 보존적 치환을 서열 동일성의 일부로서 고려하지 않는 후보 서열에서 아미노산 잔기의 백분율로서 정의된다. 퍼센트 아미노산 서열 동일성 결정하기의 목적을 위한 정렬은 당업계의 기술 내에 있는 각종 방식으로, 가령, 공공으로 이용가능한 컴퓨터 소프트웨어 예컨대 BLAST, BLAST-2, ALIGN 또는 Megalign (DNASTAR) 소프트웨어를 사용하여 달성될 수 있다. 당업자는 비교되는 서열의 전장보다 최대 정렬을 달성하는데 필요한 임의의 알고리즘을 포함하는, 서열을 정렬하기 위하여 적절한 파라미터를 결정할 수 있다. 본원에 목적을 위하여, 하지만, % 아미노산 서열 동일성 값은 서열 비교 컴퓨터 프로그램 ALIGN-2를 사용하여 생성된다.
본원에 사용된 경우에, 용어 "퍼센트 서열 상동성"은 임의의 주어진 쿼리 서열과 대상체 서열 사이 상동성의 정도를 지칭한다. 예를 들어, 자연 발생 AS-SPIK 폴리펩타이드 또는 NS-SPIK 폴리펩타이드는 쿼리 서열일 수 있고 AS-SPIK 폴리펩타이드 또는 NS-SPIK 폴리펩타이드의 단편은 대상체 서열일 수 있다. 유사하게, AS-SPIK 폴리펩타이드 또는 NS-SPIK 폴리펩타이드의 단편은 쿼리 서열일 수 있고 이의 생물학적으로 활성 변이체는 대상체 서열일 수 있다.
용어 "공통 서열"은 본원에 사용된 경우에 최대 서열 매치를 달성하기 위해, 필요하면, 서열을 정렬하고 갭을 도입한 후, 서열 정렬에서 각 위치에 찾아진 가장 빈번한 잔기를 나타내고, 임의의 보존적 치환을 서열 동일성의 일부로서 고려하지 않는 아미노산 또는 뉴클레오타이드 잔기의 서열을 의미한다.
본원에 "단리된" 항체는 재조합 숙주 세포에서 이의 자연 환경의 구성요소로부터 식별되고 분리되고/거나 회수된 것이다. 이의 자연 환경의 오염물 구성요소는 항체에 대하여 진단적 또는 치료적 용도를 방해하는 물질이고, 효소, 호르몬, 및 기타 단백질성 또는 비-단백질성 용질, 뿐만 아니라 생산의 원하지 않는 부산물을 포함할 수 있다. 바람직한 구현예에서, 본원에 단리된 항체는 (1) SDS-PAGE 또는 SEC- HPLC 방법에 의해 결정된 경우에, 95중량% 초과, 또는 98중량% 초과, 또는 99중량% 초과로, (2) 아미노산 시퀀서를 사용하여 N-말단 또는 내부 아미노산 서열의 적어도 15개 잔기를 수득하기에 충분한 정도로, 또는 (3) 쿠마씨 블루 또는, 바람직하게는, 은 염색을 사용하여 환원 또는 비-환원 조건 하에서 SDS-PAGE에 의한 동종성으로 정제될 것이다. 대개, 단리된 항체는 적어도 하나의 정제 단계에 의해 제조될 것이다.
IgG의 경우에서, 4-쇄 단위는 일반적으로 약 150,000 달톤이다. 각 L 쇄는 1개 공유 디술피드 결합에 의해 H 쇄에 결합되는 반면, 2개 H 쇄는 H 쇄 아이소타입에 의존하여 하나 이상의 디술피드 결합에 의해 서로에 결합된다. 각 H 및 L 쇄는 또한 규칙적으로 이격된 쇄내 디술피드 브릿지를 갖는다. 각 H 쇄는 N-말단에, α 및 γ 쇄의 각각에 대하여 가변 도메인 (VH) 이어서 3개 불변 도메인 (CH) 그리고 μ 및 ε 아이소타입에 대하여 4개 CH 도메인을 갖는다. 각 L 쇄는 N-말단에, 가변 도메인 (VL) 이어서 이의 다른 단말에 불변 도메인을 갖는다. VL은 VH와 정렬되고 CL은 중쇄 (CH1)의 제1 불변 도메인과 정렬된다. 특정한 아미노산 잔기는 경쇄 및 중쇄 가변 도메인들 사이 계면을 형성한다고 믿어진다. VH 및 VL의 페어링은 단일 항원-결합 부위를 함께 형성한다.
용어 "폴리펩타이드"는 가장 넓은 의미로 본원에 사용되고 펩타이드 서열을 포함한다. 용어 "펩타이드"는 일반적으로 펩타이드 결합에 의해 공유적으로 결합된 최대 약 60, 바람직하게는 최대 약 30개 아미노산을 함유하는 아미노산의 선형 분자성 쇄를 설명한다.
용어 "특이적 결합" 또는 "에 특이적으로 결합하다" 또는 "에 특이적"은 표적 항원에 항체의 결합, 예를 들면, 특정한 폴리펩타이드, 펩타이드, 또는 기타 표적 (예를 들면, 당단백질 표적)에서 에피토프를 지칭하고, 비-특이적 상호작용과 상이하게 측정가능한 결합을 의미한다 (예를 들면, 비-특이적 상호작용은 소 혈청 알부민 또는 카세인에 결합일 수 있다). 특이적 결합은, 예를 들어, 대조군 분자에 결합하기와 비교하여 표적 분자에 항체의 결합하기를 결정함으로써 측정될 수 있다. 예를 들어, 특이적 결합은 표적과 유사한 대조군 분자, 예를 들어, 과량의 비-표지화된 표적과 경쟁에 의해 결정될 수 있다. 이러한 경우에, 특이적 결합은 프로브에 표지화된 표적의 결합이 여분의 미표지화된 표적에 의해 경쟁적으로 억제된다면 표시된다. 본원에 사용된 경우에 특정한 폴리펩타이드 또는 특정한 폴리펩타이드 표적에서의 에피토프 용어 "특이적 결합" 또는 "에 특이적으로 결합하다" 또는 "에 특이적"은, 예를 들어, 표적에 대하여 적어도 약 200 nM, 대안적으로 적어도 약 150 nM, 대안적으로 적어도 약 100nM, 대안적으로 적어도 약 60 nM, 대안적으로 적어도 약 50 nM, 대안적으로 적어도 약 40 nM, 대안적으로 적어도 약 30 nM, 대안적으로 적어도 약 20 nM, 대안적으로 적어도 약 10 nM, 대안적으로 적어도 약 8 nM, 대안적으로 적어도 약 6 nM, 대안적으로 적어도 약 4 nM, 대안적으로 적어도 약 2 nM, 대안적으로 적어도 약 1 nM, 또는 그 이상의 Kd를 갖는 분자에 의해 나타내질 수 있다. 특정 사례에서, 용어 "특이적 결합"은 분자가 임의의 기타 폴리펩타이드 또는 폴리펩타이드 에피토프에 실질적으로 결합 없이 특정한 폴리펩타이드 또는 특정한 폴리펩타이드에서 에피토프에 결합하는 결합을 지칭한다.
"결합 친화성"은 분자 (예를 들면, 항체)의 단일 결합 부위와 이의 결합 파트너 (예를 들면, 항원) 사이 비공유 상호작용의 총 합계의 강도를 지칭한다. 달리 명시되지 않는 한, 본원에 사용된 경우에, "결합 친화성"은 결합 쌍 (예를 들면, 항체 및 항원)의 구성원들 사이 1:1 상호작용을 반영하는 고유 결합 친화성을 지칭한다. 분자 X의 이의 파트너 Y에 대한 친화성은 일반적으로 해리 상수 (Kd)에 의해 대표될 수 있다. 예를 들어, Kd는 약 200 nM, 150 nM, 100 nM, 60 nM, 50 nM, 40 nM, 30 nM, 20 nM, 10 nM, 8 nM, 6 nM, 4 nM, 2 nM, 1 nM, 또는 그 이상일 수 있다. 친화성은 본원에 기재된 것들을 포함하는, 당업계에 알려진 흔한 방법에 의해 측정될 수 있다. 저-친화성 항체는 일반적으로 항원을 느리게 결합시키고 용이하게 해리하는 경향인 반면, 고-친화성 항체는 일반적으로 항원을 빠르게 결합시키고 더 오래 결합된 상태를 유지하는 경향이다. 결합 친화성의 다양한 측정 방법은 당업계에 알려진다.
본원에 사용된 경우에, "Kd" 는 "Kd 값"은, 예를 들어 표면 플라스몬 공명 검정을 사용하여, 예를 들어, 약 10 반응 단위 (RU)에 부동화된 항원 CM5 칩이 있는 25℃에서 BIAcore™ 2000 또는 BIAcore™ 3000 (BIAcore, Inc., Piscataway, N.J.)을 사용하여 항체 및 표적 쌍에 적절한 기법에 의해 측정된 해리 상수를 지칭한다.
용어 "가"는 본원에 사용된 경우에 항체에서 특정된 수의 결합 부위의 존재를 나타낸다. 이와 같이, 용어 "2가"는 2개 결합 부위의 존재를 나타낸다.
"폴리에피토프 특이성"은 동일하거나 상이한 표적(들)에서의 2개 이상의 상이한 에피토프에 특이적으로 결합하는 능력을 지칭한다. "단일특이성"은 하나의 에피토프만을 결합시키는 능력을 지칭한다. 일부 구현예에서, 항체는 적어도 10-7 M, 또는 10-8 M 또는 그 이상의 친화성으로 각 에피토프에 결합한다.
용어 "표적" 또는 "결합 표적"은 가장 넓은 의미로 사용되고 구체적으로, 제한 없이, 이들이 자연에 실재하는 경우에 생물학적 기능이 있거나 없이 폴리펩타이드, 핵산, 탄수화물, 지질, 세포, 및 기타 분자를 포함한다.
용어 "항원"은, 항체에 결합할 수 있거나 세포성 면역 반응을 촉발시킬 수 있는 실체 또는 이의 단편을 지칭한다. 면역원은 유기체, 특히 동물, 더욱 특히 인간을 포함하는 포유동물에서 면역 반응을 이끌어낼 수 있는 항원을 지칭한다. 용어 항원은, 상기 정의된 경우에 항원 결정인자로서 알려진 영역 또는 에피토프를 포함한다.
본원에 사용된 경우에, 용어 "면역원성"은 항체의 생산을 이끌어내고/거나, 면역원의 항원에 대해 지시된 T-세포 및/또는 기타 반응성 면역 세포를 활성화시키는 서브스턴스를 지칭한다.
본 발명의 항체의 "항원-결합 부위" 또는 "항원-결합 영역"은 전형적으로 항원에 대하여 결합 부위의 친화성에 다양한 정도로 기여하는 6개 초가변 영역 (HVR)을 함유한다. 용어 "상보성 결정 영역" 또는 "CDR"은 용어 "초가변 영역" 또는 "HVR"과 본원에 교환가능하게 사용된다. 3개 중쇄 가변 도메인 HVR (HVR-H1, HVR-H2 및 HVR-H3) 및 3개 경쇄 가변 도메인 HVR (HVR-L1, HVR-L2 및 HVR-L3)이 있다. HVR 및 프레임워크 영역 (FR)의 정도는 항체/항원 복합체로부터 구조적 정보 및/또는 서열 중에서 가변성에 따라 그들 영역이 정의된 아미노산 서열의 컴파일링된 데이터베이스와 비교에 의해 결정된다. 더 적은 HVR (즉, 결합 특이성이 3, 4 또는 5개 HVR에 의해 결정되는 경우)로 포함된 기능적 항원 결합 부위가 본 발명의 범위 내에서 또한 포함된다. 6개 HVR의 완전 세트보다 더 적은 것이 일부 결합 표적에 결합하기에 충분할 수 있다. 그래서, 일부 사례에서, VH 또는 VL 도메인 단독의 HVR은 충분할 것이다. 게다가, 특정 항체는 항원에 대하여 비-HVR-회합된 결합 부위를 가질 수 있다. 그러한 결합 부위는 본 정의 내에서 구체적으로 포함된다.
본원에 목적을 위하여 "노출된 항체"는 세포독성 모이어티 또는 방사표지에 접합되지 않는 항체이다.
"항체-약물 접합체" (ADC) 또는 면역접합체는 세포독성 제제, 예컨대 화학치료적 제제, 약물, 성장 억제성 제제, 독소 (예를 들면, 박테리아, 진균, 식물, 또는 동물 기원, 또는 이의 단편의 효소적으로 활성 독소), 또는 방사성 동위원소 (즉, 방사접합체)에 접합된 항체, 또는 이의 항원-결합 단편을 의미한다.
용어 "숙주 세포"는 본원에 사용된 경우에 현행 발명에 따라 항체를 생성하도록 조작될 수 있는 임의의 종류의 세포성 시스템을 나타낸다. 일 구현예에서, 중국 햄스터 난소 (CHO) 세포가 숙주 세포로서 사용된다.
본원에 사용된 경우에, 표현들 "세포", "세포주", 및 "세포 배양물"은 교환가능하게 사용되고 모든 그러한 명칭은 자손을 포함한다. 그래서, 단어 "형질전환체" 및 "형질전환된 세포"는 전달 횟수와 상관없이 일차 대상체 세포 및 이로부터 유래된 배양물을 포함한다. 모든 자손이 고의적이거나 우발적인 돌연변이로 인해 DNA 함량에서 정밀하게 동일하지 않을 수 있음이 또한 이해된다. 원래 형질전환된 세포에서 스크리닝된 바와 동일한 기능 또는 생물학적 활성을 갖는 변이체 자손이 포함된다.
핵산은 또 다른 핵산 서열과 기능적 관계에 있는 경우 "작동가능하게 결합된"다. 예를 들어, 이전-서열 또는 분비성 리더에 대한 DNA는 폴리펩타이드의 분비에 참여하는 이전-단백질로서 발현된다면 폴리펩타이드에 대한 DNA에 작동가능하게 결합되거나; 프로모터 또는 인핸서는 서열의 전사에 영향을 미친다면 코딩 서열에 작동가능하게 결합되거나; 리보솜 결합 부위는 번역을 용이하게 하도록 위치된다면 코딩 서열에 작동가능하게 결합된다. 일반적으로, "작동가능하게 결합된"은 결합되는 DNA 서열이 인접하고, 분비성 리더의 경우에, 인접하고 판독 프레임에 있음을 의미한다. 하지만, 인핸서는 인접하지 않아야 한다. 결합은 편리한 제한 부위에 결찰에 의해 성취된다. 그러한 부위가 실재하지 않는다면, 합성 올리고뉴클레오타이드 어댑터 또는 링커는 종래 실시에 따라 사용된다.
용어들 "항-AS-SPIK 항체", "AS-SPIK 항체", 또는 "AS-SPIK에 결합하는 항체" 모두는 항체가 AS-SPIK 표적화에서 진단적 및/또는 치료적 제제로서 유용하도록 충분한 친화성으로 AS-SPIK를 결합시킬 수 있는 항체를 지칭한다.
용어 "가변"은 가변 도메인의 특정 세그먼트가 항체 중에 서열에서 광범위하게 상이하다는 사실을 지칭한다. "가변" 또는 "V" 도메인은 항원 결합을 매개하고 이의 특정한 항원에 대하여 특정한 항체의 특이성을 정의한다. 하지만, 가변성은 가변 도메인의 110-아미노산 범위에 걸쳐서 고르게 분포되지 않는다. 대신에, V 영역은 각 9-12 아미노산 길이인 "초가변 영역"이라고 하는 극단적 가변성의 더 짧은 영역에 의해 분리된 15-30 아미노산의 프레임워크 영역 (FR)이라고 하는 상대적으로 불변 스트레치로 이루어진다. 천연 중쇄 및 경쇄의 가변 도메인은, β-시트 구조를 연결하는, 그리고 일부 경우에 이의 일부를 형성하는 루프를 형성하는, 3개 초가변 영역에 의해 연결된, β-시트 형태를 주로 채택하는, 4개 FR을 각각 포함한다. 각 쇄에서 초가변 영역은 FR에 의해 매우 밀접하게 함께 유지되고, 기타 쇄로부터 초가변 영역과, 항체의 항원-결합 부위의 형성에 기여한다 (Kabat 등, Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991) 참고).
"온전한" 항체는 항원-결합 부위 뿐만 아니라 특정한 항체 부류의 경쇄 불변 도메인 (CL) 및 적어도 중쇄 불변 도메인을 포함하는 것이다. 예를 들어, 온전한 IgG 항체는 항원-결합 부위, 경쇄 불변 도메인 CL, 및 적어도 중쇄 불변 도메인 CH1 (Cγ1), CH2 (Cγ2) 및 CH3 (Cγ3)을 포함한다. 온전한 IgM 항체는 항원-결합 부위, 경쇄 불변 도메인 CL, 및 적어도 중쇄 불변 도메인 CM1 (Cμ1), CM2 (Cμ2), CM3 (Cμ3) 및 CM4 (Cμ4)를 포함한다. 온전한 IgA 항체는 항원-결합 부위, 경쇄 불변 도메인 CL, 및 적어도 중쇄 불변 도메인 CA1 (Cα1), CA2 (Cα2) 및 CA3 (Cα3)을 포함한다. 온전한 IgD 항체는 항원-결합 부위, 경쇄 불변 도메인 CL, 및 적어도 중쇄 불변 도메인 CD1 (Cδ1), CD2 (Cδ2) 및 CD3 (Cδ3)을 포함한다. 온전한 IgE 항체는 항원-결합 부위, 경쇄 불변 도메인 CL, 및 적어도 중쇄 불변 도메인 CE1 (Cε1), CE2 (Cε2), CE3 (Cε3) 및 CE4 (Cε4)를 포함한다. 불변 도메인은 천연 서열 불변 도메인 (예를 들면, 인간 천연 서열 불변 도메인) 또는 이의 아미노산 서열 변이체일 수 있다. 바람직하게는, 온전한 항체는 하나 이상의 효과기 기능을 갖는다.
"항체 단편" 또는 항체의 "항원-결합 단편"은 온전한 항체의 한 부문, 바람직하게는 온전한 항체의 항원 결합 또는 가변 영역을 포함한다. 항체 단편의 비- 제한 예는 Fab, Fab', F(ab')2, 및 Fv 단편; 디아바디; 선형 항체 (미국 특허 번호 5,641,870, 실시예 2; Zapata 등, Protein Eng. 8(10): 1057-1062 (1995) 참고); 단일-쇄 항체 분자; 및 항체 단편으로부터 형성된 다중-특이적 항체를 포함한다. 일 구현예에서, 항체 단편은 온전한 항체의 항원 결합 부위를 포함하고 그래서 항원을 결합시키는 능력을 보유한다. 당업자는 항체 단편이, 항원-결합 단편을 창출하기 위해 이의 경쇄 및 중쇄의 나머지로부터 항체의 적어도 한 항원-결합 부문을 분리시킴으로써, 임의의 온전한 항체로부터, 예를 들면, IgG, IgM, IgA, IgD, 또는 IgE 항체로부터 생성될 수 있음을 이해할 것이다. 특정 구현예에서, 항체 단편은 항체의 항원-결합 영역, 뿐만 아니라 항체의 경쇄 및/또는 중쇄의 하나 이상의 추가의 도메인을 포함할 수 있다. 예를 들어, 일부 구현예에서, 항체 단편은 VH 및 VL 도메인, 경쇄 불변 도메인 CL, 및 하나 이상의 중쇄 불변 도메인, 예를 들면, CH1 (Cγ1) 도메인, CM1 (Cμ1) 도메인, CA1 (Cα1) 도메인, CD1 (Cδ1) 도메인, 또는 CE1 (Cε1) 도메인을 포함하는 항원-결합 영역을 포함할 수 있다.
IgG 항체 단편의 경우에서, 파파인 소화는 "Fab" 단편이라고 하는 2개 동일한 항원- 결합 단편, 및 용이하게 결정화하는 능력을 반영하는 명칭인, 잔류 "Fc" 단편을 생산한다. Fab 단편은 H 쇄의 가변 영역 도메인 (VH), 및 하나의 중쇄의 제1 불변 도메인 (CH1)과 함께 전체 L 쇄로 이루어진다. 각 Fab 단편은 항원 결합에 관하여 1가이다, 즉, 단일 항원-결합 부위를 갖는다. IgG 항체의 펩신 처리는 2가 항원-결합 활성을 갖는 2개 디술피드 결합된 Fab 단편에 거의 상응하고 항원을 여전히 가교시킬 수 있는 단일 대형 F(ab')2 단편을 산출한다. Fab' 단편은 항체 힌지 영역으로부터 하나 이상의 시스테인을 포함하는 CH1 도메인의 카르복시 말단에 추가의 소수 잔기를 가짐으로써 Fab 단편과 상이하다. Fab'-SH는 불변 도메인의 시스테인 잔기(들)가 유리 티올 기를 보유하는 Fab'에 대하여 본원에서 명칭이다. F(ab')2 항체 단편은 원래 이들 사이 힌지 시스테인을 갖는 Fab' 단편의 쌍으로서 생산되었다. 항체 단편의 기타 화학적 커플링은 또한 알려진다.
IgG 항체의 Fc 단편은 디술피드에 의해 함께 유지된 양쪽 H 쇄의 카르복시-말단 부문을 포함한다. 항체의 효과기 기능은 Fc 영역에서 서열에 의해 결정되고, 이 영역은 또한 특정 유형의 세포에서 찾아진 Fc 수용체 (FcR)에 의해 인식된 부분이다.
"천연-서열 Fc 영역"은 자연에서 찾아진 Fc 영역의 아미노산 서열과 동일한 아미노산 서열을 포함한다. 천연-서열 인간 Fc 영역은, 예를 들어, 천연-서열 인간 IgG1 Fc 영역 (비-A 및 A 알로타입); 천연-서열 인간 IgG2 Fc 영역; 천연-서열 인간 IgG3 Fc 영역; 및 천연-서열 인간 IgG4 Fc 영역, 뿐만 아니라 이들의 자연 발생 변이체를 포함한다.
"변이체 Fc 영역"은 적어도 하나의 아미노산 변형, 바람직하게는 하나 이상의 아미노산 치환(들)의 덕분에 천연-서열 Fc 영역의 것과 상이한 아미노산 서열을 포함한다. 바람직하게는, 변이체 Fc 영역은 천연-서열 Fc 영역에 또는 모체 폴리펩타이드의 Fc 영역에 비교하여 적어도 하나의 아미노산 치환, 예를 들면, 천연-서열 Fc 영역에서 또는 모체 폴리펩타이드의 Fc 영역에서 약 1 내지 약 10개 아미노산 치환, 및 바람직하게는 약 1 내지 약 5개 아미노산 치환을 갖는다. 본원에 변이체 Fc 영역은 천연-서열 Fc 영역과 및/또는 모체 폴리펩타이드의 Fc 영역과 적어도 약 80% 상동성, 및 가장 바람직하게는 이와 적어도 약 90% 상동성, 더욱 바람직하게는 이와 적어도 약 95% 상동성을 바람직하게는 소유할 것이다.
인간 IgG1 아미노산 서열은 이 전체가 본원에 참고로 편입되는 UniProtKB No. P01857에 의해 제공된다. 인간 IgG2 아미노산 서열은 이 전체가 본원에 참고로 편입되는 UniProtKB No. P01859에 의해 제공된다. 인간 IgG3 아미노산 서열은 이 전체가 본원에 참고로 편입되는 UniProtKB No. P01860에 의해 제공된다. 인간 IgG4 아미노산 서열은 이 전체가 본원에 참고로 편입되는 UniProtKB No. P01861에 의해 제공된다.
"Fv"는 완전 항원-인식 및 결합 부위를 함유하는 최소 항체 단편이다. 이러한 단편은 빡빡한, 비-공유 회합으로 하나의 중-쇄 및 하나의 경-쇄 가변 영역 도메인의 이량체로 이루어진다. 단일-쇄 Fv (scFv) 종에서, 하나의 중-쇄 및 하나의 경-쇄 가변 도메인은 경쇄 및 중쇄가 2-쇄 Fv 종에서의 것과 유사한 "이량체성" 구조에서 회합할 수 있도록 가요성 펩타이드 링커에 의해 공유적으로 결합될 수 있다. 항원 결합을 위하여 아미노산 잔기에 기여하고 항원 결합 특이성을 항체에 부여하는 6개 초가변 루프 (H 및 L 쇄 각각으로부터 3개 루프)가 이들 2개 도메인의 폴딩으로부터 나온다. 하지만, 심지어 단일 가변 도메인 (또는 항원에 특이적인 3개 HVR만을 포함하는 Fv의 절반)은, 전체 결합 부위보다 더 낮은 친화성에서라도, 항원을 인식하고 결합시키는 능력을 갖는다.
"sFv" 또는 "scFv"로서 또한 약칭된 "단일-쇄 Fv"는 단일 폴리펩타이드 쇄에 연결된 VH 및 VL 항체 도메인을 포함하는 항체 단편이다. 바람직하게는, sFv 폴리펩타이드는 sFv가 항원 결합을 위하여 원하는 구조를 형성할 수 있는 VH 및 VL 도메인 사이 폴리펩타이드 링커를 추가로 포함한다. sFv의 검토를 위하여, Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); Borrebaeck 1995, 하기 참고.
용어 "키메라 항원 수용체" 또는 "CAR"은, 막-스패닝 및 세포내-신호전달 도메인에 원하는 결합 특이성 (예를 들면, 단클론성 항체 또는 기타 리간드의 항원-결합 영역)을 그라프팅하는, 조작된 수용체를 지칭하기 위해 가장 넓은 의미로 본원에 사용된다. 전형적으로, 수용체는 키메라 항원 수용체 (CAR)를 창출하기 위해 T 세포에 단클론성 항체의 특이성을 그라프팅하는데 사용된다. (Dai 등, J Natl Cancer Inst, 2016; 108(7):djv439; 및 Jackson 등, Nature Reviews Clinical Oncology, 2016; 13:370-383.).
본원에 사용된 경우에, 용어 "효과기 세포"는 면역 반응의 인지 및 활성화 상과 반대로, 면역 반응의 효과기 상에서 연루되는 면역 세포를 지칭한다. 일부 효과기 세포는 특이적 Fc 수용체를 발현시키고 특이적 면역 기능을 실시한다. 일부 구현예에서, 효과기 세포 예컨대 자연 살해 세포는 항체-의존적 세포성 세포독성 (ADCC)을 유도할 수 있다. 예를 들어, FcR을 발현시키는 단핵구 및 대식세포는 표적 세포의 특이적 사멸 그리고 면역계의 기타 구성요소에 항원 제시하기, 또는 항원을 제시하는 세포에 결합하기에 연루된다. 일부 구현예에서, 효과기 세포는 표적 항원 또는 표적 세포를 포식할 수 있다.
"인간 효과기 세포"는 수용체 예컨대 T 세포 수용체 또는 FcR을 발현시키고 효과기 기능을 수행하는 백혈구이다. 바람직하게는, 세포는 적어도 FcγRIII을 발현시키고 ADCC 효과기 기능을 수행한다. ADCC를 매개하는 인간 백혈구의 예는 자연 살해 (NK) 세포, 단핵구, 세포독성 T 세포 및 호중구를 포함하고; NK 세포가 바람직하다. 효과기 세포는 이의 천연 공급원으로부터, 예를 들면, 본원에 기재된 경우에 혈액 또는 PBMC로부터 단리될 수 있다.
용어 "면역 세포"는, 제한 없이, 골수양 또는 림프양 기원의 세포, 가령 림프구 (예컨대 세포용해성 T 세포 (CTL)를 포함하는 B 세포 및 T 세포), 살해 세포, 자연 살해 (NK) 세포, 대식세포, 단핵구, 호산구, 다형핵 세포, 예컨대 호중구, 과립구, 비만 세포, 및 호염기구를 포함하여, 가장 넓은 의미로 본원에 사용된다.
항체 "효과기 기능"은 항체의 Fc 영역 (천연 서열 Fc 영역 또는 아미노산 서열 변이체 Fc 영역)에 기인하는 그들 생물학적 활성을 지칭한다. 항체 효과기 기능의 예는 C1q 결합; 보체 의존적 세포독성; Fc 수용체 결합; 항체-의존적 세포-매개된 세포독성 (ADCC); 포식작용; 세포 표면 수용체 (예를 들면, B 세포 수용체; BCR)의 하향 조절, 등을 포함한다.
"항체-의존적 세포-매개된 세포독성" 및 "ADCC"는 Fc 수용체 (FcR)를 발현시키는 비특이적 세포독성 세포 (예를 들면, 자연 살해 (NK) 세포, 호중구, 및 대식세포)가 표적 세포에서 결합된 항체를 인식하고 후속적으로 표적 세포의 용해를 야기시키는 세포-매개된 반응을 지칭한다. ADCC를 매개하기 위한 일차 세포, NK 세포는 FcγRIII만을 발현시키고, 반면에 단핵구는 FcγRI, FcγRII 및 FcγRIII을 발현시킨다. 조혈 세포에서 FcR 발현은 Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991)의 464쪽에서 표 3에 요약된다. 관심 분자의 ADCC 활성을 사정하기 위해, 시험관내 ADCC 검정, 예컨대 미국 특허 번호 5,500,362 또는 5,821,337에 기재된 것은 수행될 수 있다. 그러한 검정에 유용한 효과기 세포는 말초 혈액 단핵 세포 (PBMC) 및 자연 살해 (NK) 세포를 포함한다. 대안적으로, 또는 추가적으로, 관심 분자의 ADCC 활성은 생체내에서, 예를 들면, 동물 모델 예컨대 Clynes 등. PNAS (USA) 95:652-656 (1998)에 개시된 것에서 사정될 수 있다.
"보체 의존적 세포독성" 또는 "CDC"는 보체의 존재 하에서 표적을 용해시키는 분자의 능력을 지칭한다. 보체 활성화 경로는 동족 항원과 복합된 분자 (예를 들면, 항체)에 보체 시스템의 제1 구성요소 (C1q)의 결합에 의해 개시된다. 보체 활성화를 사정하기 위해, CDC 검정은, 예를 들면, Gazzano-Santoro 등, J. Immunol. Methods 202:163 (1996)에 기재된 경우에, 수행될 수 있다.
"차단" 항체 또는 "길항제" 또는 "길항적" 항체는 그것이 결합하는 항원의 생물학적 활성을 억제시키거나 감소시키는 것이다. 바람직한 차단 항체 또는 길항제 항체는 항원의 생물학적 활성을 실질적으로 또는 완전히 억제시킬 수 있다.
관심 항원, 예를 들면, AS-SPIK 또는 NS-SPIK 폴리펩타이드를 "결합시키는" 항체는 항체가 항원을 발현시키는 세포 또는 조직 표적하기에서 치료적 제제로서 유용하고, 기타 단백질과 상당히 교차-반응하지 않도록 충분한 친화성으로 항원을 결합시키는 것이다. 표적 분자에 항체의 결합에 관하여, 용어 "특이적 결합" 또는 특정한 폴리펩타이드 또는 특정한 폴리펩타이드 표적에서 에피토프"에 특이적으로 결합하다" 또는 "에 특이적이다"는 비- 특이적 상호작용과 상이하게 측정가능한 결합을 의미한다. 특이적 결합은, 예를 들어, 일반적으로 결합 활성을 갖지 않는 유사한 구조의 분자인, 대조군 분자의 결합과 비교하여 분자의 결합을 결정함으로써 측정될 수 있다. 예를 들어, 특이적 결합은 표적, 예를 들어, 과량의 비- 표지화된 표적에 유사한 대조군 분자와 경쟁에 의해 결정될 수 있다. 이러한 경우에, 특이적 결합은 프로브에 표지화된 표적의 결합이 과도한 미표지화된 표적에 의해 경쟁적으로 억제된다면 표시된다. 일 구현예에서, 용어 "특이적 결합"은 임의의 기타 폴리펩타이드 또는 폴리펩타이드 에피토프에 실질적으로 결합 없이 특정한 폴리펩타이드 또는 특정한 폴리펩타이드에서의 에피토프에 분자가 결합하는 결합을 지칭한다.
용어들 "암" 및 "암성"은 미조절된 세포 성장을 전형적으로 특징으로 하는 포유동물에서 생리학적 병태를 지칭하거나 설명한다. "종양"은 하나 이상의 암성 세포를 포함한다. 암의 예는, 비제한적으로, 암종, 림프종, 모세포종, 육종, 및 백혈병 또는 림프양 악성종양을 포함한다. 상기 암의 더욱 특정한 예는 편평 세포 암 (예를 들면, 상피 편평 세포 암), 피부암, 흑색종, 소-세포 폐암, 비-소 세포 폐암 ("NSCLC")을 포함하는 폐암, 폐의 선암종 및 폐의 편평 암종, 복막의 암, 위장암을 포함하는 위의 또는 위 암, 췌장암 (예를 들면, 췌장 도관 선암종), 교모세포종, 자궁경부암, 난소암 (예를 들면, 고급 장액성 난소 암종), 간암 (예를 들면, 간세포 암종 (HCC), 간내 담관암종 (ICC)), 방광암 (예를 들면, 요로상피 방광암), 고환 (생식 세포 종양) 암, 간암, 유방암, 뇌암 (예를 들면, 성상세포종), 결장암, 직장암, 결장직장암, 자궁내막 또는 자궁 암종, 침샘 암종, 신장 또는 신암 (예를 들면, 신세포 암종, 신모세포종 또는 윌름스 종양), 전립선암, 외음부암, 갑상선암, 간 암종, 항문 암종, 음경 암종, 뿐만 아니라 두경부암을 포함한다. 암의 추가의 예는, 제한 없이, 망막모세포종, 포막종, 남성모세포종, 간종양, 비-호지킨 림프종 (NHL), 다발성 흑색종 및 급성 혈액학적 악성종양을 포함하는 혈액학적 악성종양, 자궁내막 또는 자궁 암종, 자궁내막증, 섬유육종, 융모막암종, 침샘 암종, 외음부암, 갑상선암, 식도 암종, 간 암종, 항문 암종, 음경 암종, 비인두 암종, 후두 암종, 카포시 육종, 흑색종, 피부 암종, 신경초종, 희소돌기아교종, 신경모세포종, 횡문근육종, 골형성 육종, 평활근육종, 및 요로 암종을 포함한다.
용어 "전이성 암"은 조직 기원의 암 세포가 혈관 또는 림프관에 의해 원래 부위에서 신체의 다른 곳에 하나 이상의 부위로 전이되어 조직 기원 이외의 하나 이상의 장기에서 하나 이상의 이차 종양을 형성하는 암의 상태를 의미한다.
본원에 사용된 경우에, "AS-SPIK의 발현을 특징으로 하는 장애"의 "AS-SPIK-연관된 장애"는, 적당한 대조군 세포에 비해, AS-SPIK의 정상 또는 상승된 수준을 발현시키는 세포를 특징으로 하는 임의의 장애일 수 있는, AS-SPIK 유전자 또는 유전자 산물 (AS-SPIK 폴리펩타이드)의 발현 또는 과-발현과 연관되는 장애이다. 적당한 대조군 세포는 AS- SPIK-발현 또는 과-발현 암으로 영향받지 않는 개체로부터 세포일 수 있거나, 이들은 어느 한쪽 필요로 하는 대상체로부터 비-암성 세포일 수 있거나, 이들은 AS-SPIK-발현 또는 과-발현 암으로 영향받는 또 다른 개체로부터 비-암성 세포일 수 있다. AS-SPIK-연관된 장애의 하나의 두드러진 예는 간암이다.
용어들 "세포 증식적 장애" 및 "증식적 장애"는 어느 정도의 비정상 세포 증식과 연관되는 장애를 지칭한다. 일 구현예에서, 세포 증식적 장애는 암이다.
"종양"은, 본원에 사용된 경우에, 악성 또는 양성이든, 모든 신생물성 세포 성장 및 증식, 그리고 모든 전-암성 및 암성 세포 및 조직을 지칭한다.
용어들 "예측적" 및 "예후적"은 본원에 사용된 경우에, 예측 또는 예후를 위한 방법이 본 방법을 실시하는 사람이 항-AS- SPIK 항체를 포함하는, 항-암 제제를 이용한 치료에 반응할 가능성이 더 높은 것으로 간주되는 (보통 치료 전이지만 반드시 그런 것은 아님) 환자를 선택하도록 한다는 의미에서, 또한 교환가능하다.
용어들 "치료하다", "치료" 또는 "치료하기"는 본원에 사용된 경우에 양쪽 치료적 치료 및 예방적 조치의 예방법을 지칭하고, 여기서 목적은 표적화된 병리학적 병태 또는 장애를 예방하거나 둔화 (약화)시키는 것이다. 치료를 필요로 하는 대상체는 특정한 병태 또는 장애를 이미 갖는 이들, 뿐만 아니라 장애를 갖기 쉬운 이들 또는 장애가 예방되어야 하는 이들을 포함한다.
발명의 상세한 설명
본원에 논증된 경우에, AS-SPIK는 유전적 SPIK의 완전 아미노산 서열을 갖지만, NS-SPIK는 분비 동안 이의 N-말단에서 23개 아미노산의 제거로 인해 AS-SPIK보다 짧다. 크기에서 이러한 차이는 겔 전기영동 및 Edman Degradation 단백질 서열분석에 의해 확인되었다.
추가적으로, 본원에 데이터는 AS-SPIK 및 NS-SPIK의 3D 형태가 상이하다는 것을 논증한다. 이의 N-말단에서 추가의 23개 아미노산 보유하기는 NS-SPIK에 비해 AS-SPIK의 형태를 상당히 변경시킨다. 3개 구조적/형태적 변화는 AS-SPIK 및 NS-SPIK의 3D 구조 (결정체)의 비교를 통해서 시각화된다. 첫번째 변화는 단백질의 N-말단에서이다. AS-SPIK에서 여분의 23-잔기 단편은 바깥쪽으로 내밀고 단백질의 본체를 지나 확장하고; 대조적으로, NS-SPIK의 N-말단은 단백질의 본체로부터 돌출하는 추가의 단편을 갖지 않는다. 두번째, AS-SPIK의 더 긴 N-말단으로 인해, AS-SPIK에서 제1 루프는 NS-SPIK에서 상응하는 루프에 비교하여 더 평평하고 각도가 상이하다. 이러한 차이는 AS-SPIK에서 제1 루프와 알파 나선 사이 더 많은 공간을 초래하고, 이는 NS-SPIK에서 내부에 있고 접근불가능한 아미노산을 노출시킨다. 마지막으로, AS-SPIK의 더 긴 N-말단은 단백질의 N-말단과 알파-나선 사이 상대적 위치 및 거리를 또한 변화시켜, 이러한 국소 영역내 공간을 증가시킨다 (도 4).
크기 및 형태에서의 이들 차이로 인해, AS-SPIK에 특이적으로 결합하지만, NS-SPIK에 결합하지 않는 많은 상이한 항체를 생성하는 것이 가능하다. 이것은, AS-SPIK에 특이적으로 결합하지만, NS-SPIK에 결합하지 않는, 마우스 및 토끼에서 대략 20개 상이한 단클론성 항체를 개발함으로써 확인되었다. 도 5는, 마우스 또는 토끼이든, 개발된 단클론성 항체들 중 8개 (IM-A1, IM-B10, IM-C6, IM-E2, IM-CA22, IM-CA18, IM-CA46, 및 IMCA77)가 (음성 대조군과 유사한) NS-SPIK와의 결합 활성이 무시할만 내지 없으면서 AS-SPIK에 강하게 결합한다는 것을 도시한다. 양에서 개발된 다클론성 항체인, Poly S는, 각종 에피토프에 결합하는 여러 항체를 함유함에 따라, 양쪽 AS-SPIK 및 NS-SPIK에 강하게 결합한다.
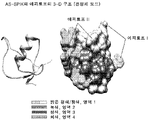
상기언급된 8개 항체의 추가의 분석을 통해서, 우리는 그들 모두가 형태적 에피토프에 결합한다고 결정하였다. 이것은 AS-SPIK 및 NS-SPIK의 선형 에피토프 영역의 각종 조합에 결합하는 그들의 잠재력을 평가하기 위해 각종 합성된 펩타이드로 각 항체를 테스트함으로써 뒷받침된다. AS-SPIK의 전체 서열을 함유하지만 시스테인 측기의 불활성화로 인해 임의의 디술피드 결합이 없는, 펩타이드 A를 포함하여, AS-SPIK의 상이한 영역으로부터 서열을 각각 함유하는 4개 펩타이드는 BioMatik (Wilmington DE)에 의해 합성되었다. 펩타이드 B는 AS-SPIK 단편 M1- G50을 함유하고, 펩타이드 C는 AS-SPIK 단편 D23-G50을 함유하고, 펩타이드 D는 AS-SPIK 단편 N51-C79를 함유한다. 테스트 결과는 이들 8개 항체들 중 어느 것도 합성 펩타이드의 임의의 것에 결합하지 않음을 보여주고, 우리가 개발하였던 항-AS-SPIK 항체가 형태적 에피토프에 결합한다는 가설을 뒷받침한다 (도 6).
본원에 제공된 데이터는 본원에 기재된 항-AS-SPIK 항체가 2개 부류: 부류 I 및 부류 II로 분할될 수 있음을 논증한다. 부류 I 항체는 IM-CA22와 유사하게 기능하고, IM-A1, IM-B10, IM-CA18, IM-D2, IM-D3, IM-D5 및 IM-G2를 포함한다. 부류 II 항체는 IM-E2와 유사하게 기능하고, IM-C6, IM-CA46, IM-CA77, IM-A6, IM-B3, IM-F5 및 IM-G6을 포함한다. 가장 중요하게, 우리는 임의의 부류 I 항체가 샌드위치 ELISA 테스트에서 쌍으로서 임의의 부류 II 항체와 작업할 있음을 논증하고, 그 반대도 마찬가지이다. 이것은 부류 II 항체가 결합하는 형태적 에피토프와 상이한 형태적 에피토프에 부류 I 항체가 결합한다는 사실 때문이다. 추가적으로, 샌드위치 ELISA에서 쌍으로서 사용된 경우, 부류 I에서 항체는 임의의 기타 부류 I 항체와 결합을 전적으로 억제시키고, 부류 II에서 항체는 임의의 기타 부류 II 항체와 결합을 전적으로 억제시킨다 (도 13; 표 1).
본원에 기재된 경쟁 테스트 결과 이외에, 우리는 CLIPS (화학적으로 결합된 스캐폴드상의 펩타이드) 펩타이드 검정과 정밀 에피토프 맵핑을 수행하여 부류 I 항체의 결합 에피토프가 부류 II 항체의 것과 다르다는 것을 보다 결정적으로 보여주었다. CLIPS 에피토프 맵핑은 부류 I 항체가 AS-SPIK 내에서 적어도 2개 별도 영역으로 구성된 불연속, 형태적 에피토프인 에피토프 I에 결합한다는 것을 시사한다. 유사하게, 부류 II 항체는 AS-SPIK 내에서 또 다른 2개 별도 영역으로 구성된 또한 불연속, 형태적 에피토프인 에피토프 II에 결합한다 (도 14; 표 2).
CLIPS 연구는 모든 부류 I 항체에 대하여 필수 결합 부위로서 7FLLSALALLSLSGNTGADSLGREA29 (서열번호: 7) 및 58CVLCFENRKRQ68, (서열번호: 8)을 식별하였다. 에피토프 I의 이들 결합 부위 내에서, 결정적 잔기는 14LLSL17 (서열번호: 12), 24DS25 (서열번호: 13), 및 58CVLCF62 (서열번호: 14)이다 (도 14; 표 2).
CLIPS 연구는 모든 부류 II 항체에 대하여 필수 결합 부위로서 36LNGCTKIYD44 (서열번호: 9) 및 64NRKRQTSILIQ74 (서열번호: 10)를 또한 식별하였다. 에피토프 II의 이들 결합 부위 내에서, 결정적 잔기는 36LN37 (서열번호: 15), 42IY43 (서열번호: 16), 67RQ68 (서열번호: 17), 및 71IL72 (서열번호: 18)이다 (도 14; 표 2).
항체의 양쪽 부류에 대하여 에피토프 정의하기 이외에, 그들의 각각의 항체 속의 정의하는 특징인, 항체의 각 부류 중에 구조적 유사성이 본원에 또한 제공된다. 부류 I 항체는 그들의 CDR에서 현저한 유사성을 갖고 하기 잔기는 고도로 보존된다: a) CDRH1에서 S6, b) CDRH2에서 I2, G5, G6, Y10 및 K16, c) CDRH3에서 G4 및 Y7, d) CDRL1에서 Q4 및 S9, e) CDRL2에서 A2, S3, T4 및 S7, 및 f) CDRL3에서 Q1, Q2, Y4 및 S5 (도 9). 부류 II 항체는 그들의 CDR에서 현저한 유사성을 또한 갖고 하기 잔기는 고도로 보존된다: a) CDRH1에서 Y3, S7 및 W9, b) CDRH2에서 A1, I2, G4, G6 및 Y10, c) CDRH3에서 R1 및 D7, d) CDRL1에서 A2, S3, Q4, I6, Y9, L10 및 S11, e) CDRL2에서 A2, S3, L5 및 S7, 및 f) CDRL3에서 Q1, Q2, 및 T5 (도 10). 일부 구현예에서, 항-AS-SPIK 항체는 상기 열거된 보존된 아미노산 잔기를 포함하는 CDR 서열의 임의의 적당한 조합을 포함할 수 있다. 예를 들어, 일부 구현예에서, 부류 I 항-AS-SPIK 항체는 하기 CDR 서열의 의 1, 2, 3, 4, 5, 또는 모두 6개, 또는 이의 임의의 조합을 포함할 수 있다: a) CDRH1에서 S6, b) CDRH2에서 I2, G5, G6, Y10 및 K16, c) CDRH3에서 G4 및 Y7, d) CDRL1에서 Q4 및 S9, e) CDRL2에서 A2, S3, T4 및 S7, 및 f) CDRL3에서 Q1, Q2, Y4 및 S5 (도 9). 일부 구현예에서, 부류 II 항-AS-SPIK 항체는 하기 CDR 서열의 의 1, 2, 3, 4, 5, 또는 모두 6개, 또는 이의 임의의 조합을 포함할 수 있다: a) CDRH1에서 Y3, S7 및 W9, b) CDRH2에서 A1, I2, G4, G6 및 Y10, c) CDRH3에서 R1 및 D7, d) CDRL1에서 A2, S3, Q4, I6, Y9, L10 및 S11, e) CDRL2에서 A2, S3, L5 및 S7, 및 f) CDRL3에서 Q1, Q2, 및 T5 (도 10).
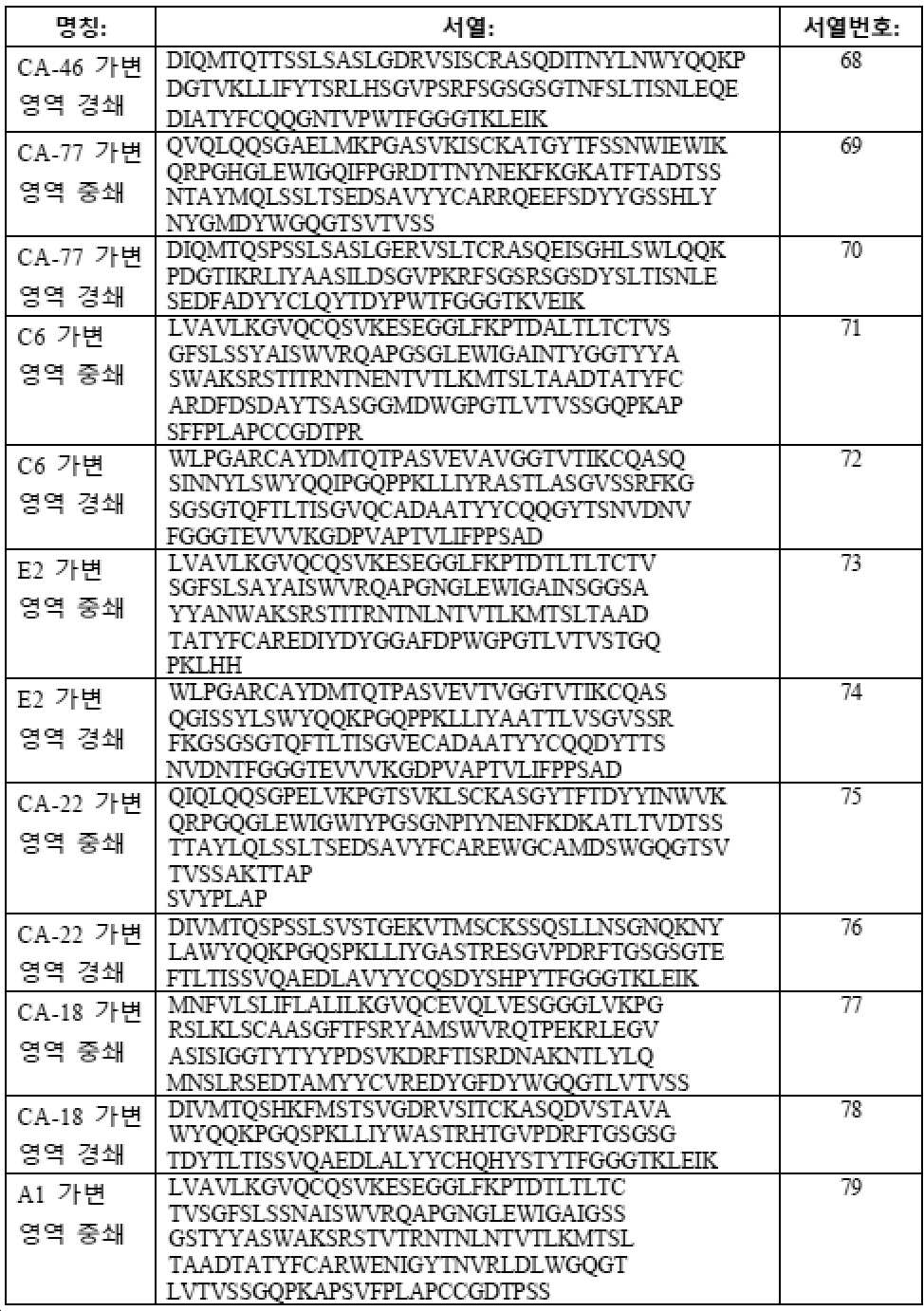
에피토프 I에 결합하는 부류 I 항체의 다양한 예의 아미노산 서열은 표 3 (도 15)에서 제공된다. 에피토프 II에 결합하는 부류 II 항체의 다양한 예의 아미노산 서열은 표 4 (도 16)에서 제공된다.
본 발명의 양태는, 적어도 부분적으로, 특정 장애가 고유 형태 즉 세린 프로테아제 억제제 카잘 (SPIK)의 발현을 특징으로 한다는 발견에 기초한다. 일단 두드러진 예는, 제한 없이, 간세포 암종 (HCC) 및 간내 담관암종 (ICC)을 포함하는 간암이다. 더욱 구체적으로, 본 발명자는 특정 암, 예컨대 간암이 분비된 SPIK 폴리펩타이드의 N-말단에 추가의 23개 아미노산을 포함하는 SPIK의 한 형태를 발현시킨다는 것을 알아내었다. 이러한 23개 아미노산 세그먼트 (서열번호: 6)는 정상 세포, 예컨대 췌장 세포로부터 분비된 SPIK 폴리펩타이드에서 찾아지지 않았다. 이것은 이러한 23개 아미노산 세그먼트 중 첫 9개 아미노산이 간암 세포주에 의해 분비된 미가공된 SPIK에서 실재할 수 있다는 우리의 이전 보고와 일치한다. Lu 등, Immunology 2011; 134(4):398-408. 우리는 SPIK의 더 긴 형태를 AS-SPIK 또는 비정상 분비된 SPIK로서 지칭할 수 있다. 우리는 또한 간암 세포에 의해 생산된 AS-SPIK를 LC-SPIK 또는 간암 분비된 SPIK로서 지칭할 수 있다. 용어들 AS-SPIK 및 LC-SPIK는 본원에 교환가능하게 사용된다. 예시적 AS-SPIK 폴리펩타이드는 서열번호: 2의 아미노산 서열을 가질 수 있다. 우리는 정상 세포, 예컨대 췌장 세포에 의해 분비된 SPIK의 형태를 NS-SPIK 또는 정상 분비된 SPIK로서 지칭할 수 있다. 예시적 NS-SPIK 폴리펩타이드는 서열번호: 4의 아미노산 서열을 가질 수 있다.
본 발명자는 AS-SPIK가 양쪽 이의 크기 및 형태 (3-차원 구조)의 면에서 NS-SPIK와 상이하다는 것을 본원에 논증하였다. NS-SPIK가 아닌, AS-SPIK에 선택적으로 결합하는 항체는 이들이 결합하는 에피토프에 따라 2개 부류 (부류 I 및 부류 II)로 분할될 수 있다. 부류 I 항-AS-SPIK 항체는 에피토프 I에 결합하고 부류 II 항-AS-SPIK 항체는 에피토프 II에 결합하고, 이들 에피토프의 양쪽은 본원에 기재된다. AS-SPIK의 3D 구조의 에피토프 맵핑 및 분석은 각 에피토프가, 적어도 2개 별도 영역으로 이루어지는, 형태적이고 불연속이고, 특이적 에피토프 서열이 또한 식별되는 것을 보여준다. 이외에도, 각 부류의 항체의 추가 분석은 그들의 기능성에 결정적인 부류 I 및 부류 II 항체에 대하여 공통 서열을 식별하였다. AS-SPIK의 발현을 특징으로 하는 장애 (예를 들면, 간암)를 진단 및/또는 치료하기 위한 상기 항체의 사용 방법이 본원에 또한 기재된다.
따라서, 본 발명의 양태는 AS-SPIK에 특이적으로 또는 우선적으로 결합하고, NS-SPIK에 결합하지 않는 조성물, 예컨대 항체를 포함한다. AS-SPIK 복합체가 또한 제공된다. 본 발명의 구현예에 따른 AS-SPIK 복합체는 AS-SPIK, 및 AS-SPIK 폴리펩타이드, 또는 이들의 단편에 특이적으로 또는 우선적으로 결합하는 항체를 포함한다.
본 발명의 양태는 본원에 기재된 경우에 항체 (Ab), 링커 (L), 및 약물 모이어티 (D)를 포함하는 항체-약물 접합체 (ADC)를 포함한다. 일부 구현예에서, ADC는 식 Ab-(L-D)p를 갖고, 식중 p는 1 내지 8 범위인 정수이다.
본 발명의 양태는 또한 AS-SPIK의 발현을 특징으로 하는 장애, 예를 들면, 간 장애, 예컨대 간암, 예를 들어, HCC 또는 ICC의 검출을 위하여 대상체 항체의 사용 방법을 포함한다.
우리가 AS-SPIK의 발현 동안 발생하는 특정 이벤트를 이해한다고 믿지만, 본 발명의 조성물 및 방법은 임의의 특정한 세포성 기전에 영향을 미침으로써 작업하는 것들에 제한되지 않는다. 이론에 구속됨 없이, 본 발명자는 SPIK가 프로테아제 억제제이기 때문에, 암 세포에서 SPIK의 과-발현이 프로테아제의 일 종류인 신호 펩티다제의 활성을 억압하여, 암 세포로부터 분비되는 미약독화된, 전장 단백질을 초래한다는 것을 가정한다.
조성물
본원에 제공된 조성물은 AS-SPIK에 특이적으로 또는 우선적으로 결합하고 NS-SPIK에 결합하지 않는 항체를 포함한다.
SPINK1, PSTI, 및 TATI로서 또한 알려진 세린 프로테아제 억제제 카잘 (SPIK)은 많은 세포성 프로테아제, 예컨대 트립신-유사 프로테아제 및 키모트립신-유사 프로테아제의 활성을 폭넓게 조절하는 것으로 나타난 작은 단백질이다. Greene, LJ, J Surg Oncol. 1975;7(2):151- 154; Horii 등, Biochemical and biophysical research communications 1987;149(2):635-641; Stenman, UH, Clin Chem. 2002;48(8):1206-1209. SPIK는 또한 세포자살의 억제에서 역할을 할 수 있다. Lu 등, Immunology 2011;134(4):398-408. 예시적 인간 SPIK 아미노산 서열은 GenBank 수탁 번호: M11949, GI Number: 190687; GenBank 수탁 번호: NM003122, GI: 657940887; 및 GeneBank 수탁 번호: BC025790, GI: 19343607을 포함한다.
항체
본원에 제공된 항체는 AS-SPIK 단백질에서 형태적 에피토프에 특이적으로 또는 우선적으로 결합하는 항체를 포함할 수 있다. 일부 구현예에서, 항체는 상기 기재된 경우에 불연속, 형태적 에피토프에 특이적으로 또는 우선적으로 결합한다. 본 발명의 구현예에 따른 항체는 다클론성 또는 단클론성, 특히 단클론성일 수 있고, 인간, 마우스, 토끼, 양 또는 염소 세포에 의해, 또는 이들 세포에서 유래된 하이브리도마에 의해 생산될 수 있다. 일부 구현예에서, 항체는 인간화된, 또는 키메라일 수 있다.
본 발명의 구현예에 따른 항체는 각종 형상을 추정할 수 있고 면역글로불린 유전자에 의해 실질적으로 인코딩된 하나 이상의 폴리펩타이드로 이루어지는 단백질을 포괄할 수 있다. 온전한 항체, 항체 다량체, 또는 항체 단편 또는 항체의 기능적, 항원-결합 영역을 포함하는 이의 기타 변이체를 포함하는, 다양한 항체 구조들 중 어느 하나가 사용될 수 있다. 용어 "면역글로불린"은 "항체"와 동의적으로 사용될 수 있다. 항체는 단클론성 또는 다클론성 기원일 수 있다. 항체의 공급원에 관계 없이, 적당한 항체는 온전한 항체, 예를 들어, 2개 중 (H) 쇄 및 2개 경 (L) 쇄를 갖는 IgG 사량체, 단일 쇄 항체, 키메라 항체, 인간화된 항체, 상보적 결정 영역 (CDR)-그라프팅된 항체 뿐만 아니라 항체 단편, 예를 들면, Fab, Fab', F(ab')2, scFv, Fv, 및 상기 단편에서 유래된 재조합 항체, 예를 들면, 카멜바디, 마이크로항체, 디아바디 및 이중특이적 항체를 포함한다.
온전한 항체는 항원-결합 가변 영역 (VH 및 VL) 뿐만 아니라 경쇄 불변 도메인 (CL) 및 중쇄 불변 도메인, CH1, CH2 및 CH3을 포함하는 것이다. 불변 도메인은 천연 서열 불변 도메인 (예를 들면 인간 천연 서열 불변 도메인) 또는 이의 아미노산 서열 변이체일 수 있다. 당업계에서 잘 알려진 바와 같이, VH 및 VL 영역은 더욱 보존된 프레임워크 영역 (FR)으로 산재된, "상보성 결정 영역" (CDR)으로 칭하는, 초가변성의 영역으로 추가로 세분된다. 항체의 CDR은 전형적으로 천연 면역글로불린 결합 부위의 자연 Fv 영역의 결합 친화성 및 특이성을 함께 정의하는 아미노산 서열을 포함한다.
항-AS-SPIK 항체는 면역글로불린의 임의의 부류, 예를 들어, IgA, IgG, IgE, IgD, IgM (뿐만 아니라 이의 아형 (예를 들면, IgG1, IgG2, IgG3, 및 IgG4)) 출신일 수 있고, 면역글로불린의 경쇄는 카파 또는 람다 유형일 수 있다. 인식된 인간 면역글로불린 유전자는 카파, 람다, 알파 (IgA1 및 IgA2), 감마 (IgG1, IgG2, IgG3, IgG4), 델타, 엡실론, 및 뮤 불변 영역 유전자, 뿐만 아니라 무수한 면역글로불린 가변 영역 유전자를 포함한다.
면역글로불린 또는 항체의 용어 "항원-결합 부문"은 표적, 이 경우에서, AS-SPIK 단백질의 형태적 에피토프에 특이적으로 또는 우선적으로 결합하는 면역글로불린의 한 부문을 일반적으로 지칭한다. 면역글로불린의 항원-결합 부문은 그러므로 하나 이상의 면역글로불린 쇄가 전장이 아니지만, 표적에 특이적으로 또는 우선적으로 결합하는 분자이다. 항원-결합 부문 또는 단편의 예는 (i) VLC, VHC, CL 및 CH1 도메인으로 이루어지는 1가 단편인, Fab 단편; (ii) 힌지 영역에서 디술피드 브릿지에 의해 결합된 2개 Fab 단편을 포함하는 2가 단편인, F(ab')2 단편; (iii) 항체의 단일 아암의 VLC 및 VHC 도메인으로 이루어지는 Fv 단편, 및 (v) 예를 들면, 가변 영역의 항원 결합 부문을 특이적으로 또는 우선적으로 결합시키기에 충분한 프레임워크를 갖는 단리된 CDR을 포함한다. 경쇄 가변 영역의 항원-결합 부문 및 중쇄 가변 영역의 항원 결합 부문, 예를 들면, Fv 단편의 2개 도메인, VLC 및 VHC는 VLC 및 VHC 영역이 페어링하여 (단일 쇄 Fv (scFv)로서 알려진 1가 분자를 형성하는 단일 단백질 쇄로서 이들이 만들어지게 하는 합성 링커에 의해, 재조합 방법을 사용하여, 합쳐질 수 있다. 그러한 scFv는 항체의 용어 "항원-결합 부문"에 의해 포괄된다.
"Fv" 단편은 완전 항원- 인식 및 결합 부위를 함유하는 최소 항체 단편이다. 이러한 영역은 빡빡한, 콘-공유 회합에서 1개 중쇄 및 1개 경쇄 가변 도메인의 이량체로 이루어진다. 각 가변 도메인의 3개 초가변 영역이 상호작용하여 VH-VL 이량체의 표면에서 항원-결합 부위를 정의하는 것이 이러한 형상에 있다. 6개 초가변 영역이 항원-결합 특이성을 부여하는 반면, 심지어 단일 가변 도메인 (또는 항원에 대하여 특이적인 3개 초가변 영역만을 포함하는 Fv의 절반)은, 전체 결합 부위보다 낮은 친화성에서라도, 항원을 인식하고 결합시키는 능력을 갖는다. 안정성을 개선하기 위해, VH-VL 도메인은 가요성 펩타이드 링커 예컨대 (Gly4Ser)3에 의해 연결되어 단일 쇄 Fv 또는 scFV 항체 단편을 형성할 수 있거나 프레임워크 영역에서 2개 시스테인 잔기를 도입함으로써 디술피드 결합을 형성하도록 조작되어 디술피드 안정화된 Fv (dsFv)를 산출할 수 있다.
항체의 단편은 이들이 전장 항체의 원하는 에피토프 특이성 및/또는 NS-SPIK가 아니고 AS-SPIK를 결합시키는 충분한 특이성을 보유하는 한 제공된 방법에서 사용에 적당하다.
본원에 기재된 항체의 항원-결합 도메인은 T-세포 인게이저 분자 (예를 들면, 이중특이적 T-세포 인게이저, 별칭 BiTE 분자) 뿐만 아니라 CAR-T 구조의 생산에서 활용될 수 있다. T-세포 인게이저 분자는, 예를 들어, Huehls 등, Bispecific T cell engagers for cancer immunotherapy, Immunol Cell Biol. 2015 Mar; 93(3):290-296에 기재된다. 결합 (표적화) 도메인으로서 단일-도메인 항체를 포함하는 CAR-T 구조는, 예를 들어, Iri-Sofla 등, 2011, Experimental Cell Research 317:2630-2641 및 Jamnani 등, 2014, Biochim Biophys Acta, 1840:378-386에 기재된다.
항체 단편을 제조하는 방법은 양쪽 생화학적 방법 (예를 들면 화학적 가교가 뒤따를 수 있는 온전한 항체의 단백질분해 소화) 및 면역글로불린 서열이 유전적으로 조작되어 원하는 단편의 합성을 지시하는 재조합 DNA-기반된 방법을 포괄한다. 항체 단편은 비-특이적 티올프로테아제, 파파인에 의해 전체 면역글로불린의 단백질분해에 의해 수득될 수 있다. 파파인 소화는, 단일 항원-결합 부위, 및 잔류 "Fc 단편"을 각각 가진, "Fab 단편으로 칭하는, 2개 동일한 항원-결합 단편을 산출한다. 각종 분획은 단백질 A-세파로스 또는 이온 교환 크로마토그래피에 의해 분리될 수 있다. 토끼 및 인간 기원의 IgG로부터 F(ab')2 단편의 제조를 위한 일반 절차는 효소 펩신에 의해 제한된 단백질분해이다. 온전한 항체의 펩신 처리는 2개 항원-조합 부위를 갖고 항원을 여전히 가교시킬 수 있는 F(ab')2 단편을 산출한다. Fab 단편은 경쇄의 불변 도메인 및 중쇄의 제1 불변 도메인 (CH1)을 함유한다. Fab' 단편은 항체 힌지 영역으로부터 하나 이상의 시스테인(들)을 포함하는 중쇄 CH1 도메인의 카르복실 말단에 몇몇 잔기의 부가에 의해 Fab 단편과 상이하다. F(ab')2 항체 단편은 이들 사이 힌지 시스테인을 갖는 Fab' 단편의 쌍으로서 원래 생산되었다.
항-AS-SPIK 항체의 제조 방법이 또한 본 발명의 범위 내이다. 예를 들어, 가변 영역은 면역글로불린 쇄를 인코딩하는 DNA 서열을 변경하기 위해 PCR 돌연변이유발 방법을 사용하여 (예를 들면, 인간화된 면역글로불린을 생성하기 위해 이용된 방법을 사용하여 작제될 수 있다.
단클론성 항체는 항체-생산 세포의 단일 클론에 의해 생산된 동일한 항원 특이성의 동종 항체이고, 다클론성 항체는 일반적으로 동일한 항원에서 상이한 에피토프를 인식하고 항체 생산 세포의 1개 초과 클론에 의해 생산된다. 각 단클론성 항체는 항원에서 단일 결정인자에 대해 지시된다. 수식어, 단클론성은 항체의 실질적으로 동종 집단으로부터 수득되는 것으로 항체의 특징을 나타내고, 임의의 특정한 방법에 의해 항체의 생산을 요구하는 것으로 해석되지 않아야 한다.
본원에 단클론성 항체는 키메라 항체, 즉, 특정한 종에서 유래된 또는 특정한 항체 부류 또는 하위부류에 속하는 항체에서 상응하는 서열과 동일하거나 상동인 중쇄 및/또는 경쇄의 한 부문을 전형적으로 갖는 반면, 쇄(들)의 나머지가 또 다른 종에서 유래된 또는 또 다른 항체 부류 또는 하위부류에 속하는 항체에서 상응하는 서열과 동일하거나 상동인 항체, 뿐만 아니라 상기 항체의 단편을, 이들이 원하는 생물학적 활성을 나타내는 한, 포함할 수 있다. 관심 키메라 항체는 비-인간 영장류 (예를 들면 유인원, 구세계 원숭이, 신세계 원숭이, 원원류)에서 유래된 가변 도메인 항원-결합 서열 및 인간 불변 영역 서열을 포함하는 영장류화된 항체를 포함한다.
쥣과 및 토끼 단클론성 항체는, 양쪽 NS-SPIK 및 AS-SPIK에서 찾아진 아미노산 서열인, 공통 영역 (서열번호: 4) 이외에, NS-SPIK에서 찾아지지 않은 AS-SPIK (서열번호: 6)에서 찾아진 여분의 23개 아미노산 서열을 갖는, 특이적으로 설계된 재조합 단백질로 마우스 또는 토끼의 면역화를 통해서 생성되었다. 일부 구현예에서, 재조합 단백질은 NS-SPIK가 아닌 AS-SPIK에만 결합에서 효과적인 항체를 생성하기 위해 전체 23개 아미노산 서열 (서열번호: 6)을 가질 필요는 없을 수 있다.
단클론성 항체를 생산하는 방법은 정제 단계를 포함할 수 있다. 예를 들어, 항체는 일반적으로, 예를 들어, 여과, 원심분리 및 각종 크로마토그래피 방법, 예컨대 HPLC 또는 친화성 크로마토그래피를 사용하여 추가로 정제될 수 있고, 이들 모두는 당업자에게 잘 알려진 기법이다. 이들 정제 기법은 각각 혼합물의 기타 구성요소로부터 원하는 항체를 분리하기 위한 분획화를 포함한다. 항체의 제조에 특히 적합해진 분석적 방법은, 예를 들어, 단백질 A-세파로스 및/또는 단백질 G-세파로스 크로마토그래피를 포함한다.
본 발명의 항-AS-SPIK 항체는 인간 또는 비- 인간 공급원으로부터 CDR을 포함할 수 있다. "인간화된" 항체는, 인간 불변 및/또는 가변 영역 도메인 또는 특이적 변화를 보유하는, 마우스, 랫트, 햄스터, 토끼 또는 기타 종으로부터 일반적으로 키메라 또는 돌연변이체 단클론성 항체이다. 면역글로불린의 프레임워크는 인간, 인간화된, 또는 비-인간 (예를 들면, 인간에서 항원성을 감소시키도록 변형된 쥣과 프레임워크), 또는 합성 프레임워크 (예를 들면, 공통 서열)일 수 있다. 인간화된 면역글로불린은 프레임워크 잔기가 인간 생식계열 서열에 상응하고 CDR이 V(D)J 재조합 및 체세포 돌연변이에서 비롯하는 것들이다. 하지만, 인간화된 면역글로불린은 인간 생식계열 면역글로불린 핵산 서열에서 인코딩되지 않은 아미노산 잔기 (예를 들면, 생체외 랜덤 또는 부위-특이적 돌연변이유발에 의해 도입된 돌연변이)를 또한 포함할 수 있다. 생식계열 서열에 기반되지만, 예를 들어, 생체내 체세포 돌연변이 공정에 의해 도입된 프레임워크 돌연변이를 소유하는 항체 가변 도메인 유전자는 "인간"으로 칭해진다.
인간화된 항체는 예를 들어 (1) 비-인간 상보성 결정 영역 (CDR)을 인간 프레임워크 및 불변 영역에 그라프팅하기 (당업계에서 인간화로서 지칭된 공정), 또는, 대안적으로, (2) 전체 비-인간 가변 도메인 이식하기, 그러나 표면 잔기의 대체에 의해 인간-유사 표면을 이들에 제공하기 (당업계에서 베니어링으로서 지칭된 공정)를 포함하는 당업계에서 알려진 다양한 방법에 의해 조작될 수 있다. 인간화된 항체는 양쪽 인간화된 및 베니어링된 항체를 포함할 수 있다. 유사하게, 인간 항체는 인간 면역글로불린 유전자좌를 유전자이식 동물, 예를 들면, 내인성 면역글로불린 유전자가 부분적으로 또는 완전히 불활성화된 마우스에 도입함으로써 만들어질 수 있다. 공격시, 인간 항체 생산은 관찰되고, 이는 유전자 재배열, 조립, 및 항체 레퍼토리를 포함하는 모든 면에 있어서 인간에서 보여진 것을 매우 닮는다.
키메라 및 인간화된 항체 이외에, 완전히 인간 항체는 인간 면역글로불린 유전자를 갖는 유전자이식 마우스에서 유래될 수 있다. 일부 구현예에서, 항체는 scFv-파지 디스플레이 라이브러리에 의해 생산 및 식별될 수 있다.
항-AS-SPIK 항체는 그들의 항원 결합 친화성, 그들의 효과기 기능, 또는 그들의 약동학을 조정하도록 변형될 수 있다. 특히, 랜덤 돌연변이는 더 높은 친화성 및/또는 더 높은 특이성을 가진 항체를 식별하도록 스크리닝된 산물 및 CDR에서 실시될 수 있다. 전형적으로, CDR은 1 또는 2개 아미노산에서 상이할 수 있다.
CDR 셔플링 및 이식화 기술은 본원에 제공된 항체와, 예를 들어 사용될 수 있다. CDR 서플링은 CDR 서열을 특이적 프레임워크 영역에 삽입시킨다. CDR 이식화 기법은 CDR 서열의 단일 마스터 프레임워크로의 랜덤 조합을 허용한다. 상기 기법을 사용하여, 항-AS-SPIK 항체의 CDR 서열은, 예를 들어, 복수의 상이한 서열을 창출하도록 돌연변이유발될 수 있고, 이는 원하는 특징, 예를 들면, 더 높은 친화성에 대하여 스크리닝된 스캐폴드 서열 및 생성된 항체 변이체에 편입될 수 있다.
우리의 SPIK의 기능 연구는 SPIK가 그랜자임 A (GzmA)를 결합시킬 수 있고 이것을 세포자살 유도로부터 억제시킬 수 있다는 것을 보여준다. Lu 등, Immunology 2011;134(4):398-408. GzmA는 면역 감시 중 표적 세포를 사멸시키기 위해 활성화된 CTL 및 NK 세포에 의해 분비된 세포독성 세린 프로테아제이다. 악성 세포, 예컨대 종양 전구체/종양 생식 세포의 제거에서 GzmA-유도된 세포자살의 역할은 확인되었다. Pardo 등, Eur J Immunol 2002;32(10):2881-2887. 그러므로, 간암 세포에서 AS-SPIK의 과-발현이 세포를 면역-제거 중 GzmA에 의해 유도된 세포자살에 내성이도록 야기시킬 것이 가능하다. 이것은 면역 경로에 의해 사멸로부터 이들 암 세포의 탈출을 초래한다. Lu 등, Immunology 2011;134(4):398-408. 이러한 가정에 기초하여, 그리고 이론에 구속됨 없이, 우리는 AS-SPIK의 과-발현의 억압, 또는 과-발현된 AS-SPIK의 활성의 억제가 인체 면역 제거 중 GzmA에 의해 유도된 암 세포의 면역-사멸을 복원할 수 있는 것으로 결론낸다.
본 발명의 구현예에 따른 항-AS-SPIK 항체는, 이의 개시내용이 그 전체가 참고로 본원에 편입되는 PCT 출원 번호 PCT/US19/20999의 개시내용에 의해 논증된 경우에, AS-SPIK의 활성을 억제시킬 수 있다. 그러므로, AS-SPIK의 결합을 GzmA로 차단시키고, GzmA를 자유화하고, 이들 암 세포의 세포자살적 사멸을 면역-제거를 통해 복원하기 위해 항-AS-SPIK 항체를 사용하는 것이 가능하다. 이러한 목적을 위하여, 항-SPIK 항체는, 비제한적으로, 암, 바이러스성 감염, 및 염증을 포함하는, AS-SPIK의 발현을 특징으로 하는 장애의 치료에서 사용될 수 있다.
항체의 하나의 치료적 용도는 인간화를 통해서이다. 인간화된 단클론성 항체를 이용한 요법은 신속하게 개발되고 있는 영역이고 그들의 특이성 및 효율은 잘 연구된다. Rothernberg, ME, Cell 2016;165(3):509. 비제한적으로 IM-CA22, IM-A1, IM-B10, IM-CA18, IM-D2, IM-D3, IM-D5, IM-G2, IM-E2, IM-C6, IM-CA46, IM-CA77, IM-A6, IM-B3, IM-F5 및 IM-G6을 포함하는 대상체 항-AS-SPIK 단클론성 항체, 및 본 발명의 기타 항체, 예컨대 본원에 기재된 경우에, 에피토프 I 또는 에피토프 II에 결합하는, 그리고 SPIK의 활성을 억제시킬 수 있는 항체는 또한 인간화될 수 있고 질환의 치료에 사용될 수 있다.
예를 들어 파지미드 기술을 사용하는 재조합 기술은 다양한 항체를 인코딩하는 재조합 유전자로부터 원하는 특이성을 갖는 항체의 제조를 허용한다. 특정 재조합 기법은 면역화된 동물의 비장으로부터 단리된 RNA로부터 제조된 조합 면역글로불린 파지 발현 라이브러리의 면역학적 스크리닝에 의한 항체 유전자의 단리를 포함한다. 상기 방법의 경우에, 조합 면역글로불린 파지미드 라이브러리는 면역화된 동물의 비장으로부터 단리된 RNA로부터 제조될 수 있고, 적절한 항체를 발현시키는 파지미드는 항원을 발현시키는 세포 및 대조군 세포를 패닝함으로써 선택될 수 있다.
상기 개시된 조합 면역글로불린 파지 발현 라이브러리 이외에, 하나의 분자 클로닝 접근법은 인간 항체 라이브러리를 함유하는 유전자이식 마우스로부터 항체를 제조하는 것이다. 상기 유전자이식 동물은 단일 아이소타입, 더욱 구체적으로 B 세포 성숙화에 필수인 아이소타입, 예컨대 IgM 및 가능하게 IgD의 인간 항체를 생산하는데 이용될 수 있다.
항-AS-SPIK 면역글로불린은 글리코실화를 감소 또는 폐지하도록 변형될 수 있다. 글리코실화가 부족한 면역글로불린은 전혀 글리코실화되지 않은; 완전히 글리코실화되지 않은; 또는 비전형적으로 글리코실화되는 면역글로불린일 수 있다 (즉, 돌연변이체에 대한 글리코실화 패턴은 상응하는 야생형 면역글로불린의 글리코실화 패턴과 상이하다). IgG 폴리펩타이드는 글리코실화를 약독화하는 하나 이상의 (예를 들면, 1, 2, 또는 3 또는 그 이상) 돌연변이, 즉, 글리코실화가 부족하거나, 완전히 글리코실화되지 않거나 비전형적으로 글리코실화되는 IgG CH2 도메인을 초래하는 돌연변이를 포함한다. 올리고당 구조는, 예를 들어, N-결합된 글리칸으로부터 푸코스 모이어티를 제거함으로써 또한 변형될 수 있다.
항체는 비-단백질 중합체, 예를 들면, 폴리에틸렌 글리콜에 접합에 의해 생체내 그들의 안정성 및 또는 용해도를 증가시키도록 또한 변형될 수 있다. 임의의 PEG화 방법은 항-AS-SPIK 항체가 NS-SPIK가 아니고 AS-SPIK를 선택적으로 결합시키는 능력을 보유하는 한 사용될 수 있다.
매우 다양한 항체/면역글로불린 프레임워크 또는 스캐폴드는 생성된 폴리펩타이드가 표적, 즉, AS-SPIK에 특이적인 적어도 하나의 결합 영역을 포함하는 한 이용될 수 있다. 상기 프레임워크 또는 스캐폴드는 인간 면역글로불린, 또는 이의 단편 (예컨대 본원에 다른 곳에 개시된 것들)의 5개 주요 이디오타입을 포함하고, 바람직하게는 인간화된 양태를 갖는, 기타 동물 종의 면역글로불린을 포함한다. 단일 중- 쇄 항체 예컨대 낙타과에서 식별된 것들은 이와 관련하여 특히 관심이다.
본 발명의 항-AS-SPIK 항체는 AS-SPIK에서 에피토프에 특이적으로 또는 우선적으로 결합하고 NS-SPIK에서 에피토프에 결합하지 않는다. 에피토프는 파라토프, 즉, 항체의 결합 부위에 의해 특이적으로 결합되는 표적에서 항원 결정인자를 지칭한다. 에피토프 결정인자는 보통 분자 예컨대 아미노산 또는 당 측쇄의 화학적으로 활성 표면 그룹화로 이루어지고, 전형적으로 특이적 3-차원 구조적 특징, 뿐만 아니라 특이적 전하 특징을 갖는다. 에피토프는 일반적으로 약 4 내지 약 10개, 바람직하게는 4 내지 8개, 연속 아미노산 (선형 또는 연속 에피토프)을 갖거나, 대안적으로 특정한 구조 (예를 들면, 형태적 에피토프)를 정의하는 비연속 아미노산의 세트일 수 있다. 그래서, 에피토프는 적어도 4, 적어도 6, 적어도 8, 적어도 10, 및 적어도 12개 상기 아미노산으로 이루어질 수 있다. 아미노산의 공간적 형태의 결정 방법은 당업계에서 알려지고, 예를 들어, x-선 결정학, 2-차원 핵 자기 공명, 및 CLIPS (화학적으로 결합된 스캐폴드상의 펩타이드) 펩타이드 검정과 정밀 에피토프 맵핑을 포함한다 (Timmerman, Puijk 등, J Mol Recognit, 20(5), 283-299, (2007).
항체가 결합할 수 있는 기타 잠재적 에피토프의 예측 방법은 비제한적으로, Kyte-Doolittle Analysis (Kyte 및 Dolittle, J. Mol. Biol. 157:105-132 (1982)), Hopp and Woods Analysis (Hopp and Woods, Proc. Natl. Acad. Sci. USA 78:3824-3828 (1981); Hopp 및 Woods, Mol. Immunol. 20:483-489 (1983); Hopp, J. Immunol. Methods 88:1-18 (1986)), Jameson-Wolf Analysis (Jameson and Wolf, Comput. Appl. Biosci. 4:181-186 (1988)), 및 Emini Analysis (Emini 등, Virology 140:13-20 (1985)), Chou and Fasman Analysis (Ponomarenko & Regenmortel, Structural Bioinformatics, 2009), Karplus and Schulz Analysis (Kolaskar and Tongaonkar Analysis Kolaskar & Tongaonkar, FEBS Letters, 172-174 (1990)), 및 Parker 분석을 포함할 수 있다. 일부 구현예에서 잠재적 에피토프는 기타 연구로부터 알려진 항원 부위와 상관관계를 통해서 결정되고 이들 예측적 기법은 구조적 데이터, 예컨대 X-선 결정학적 데이터와 조합될 수 있다. 에피토프 예측은 양쪽 연속 및 불연속 에피토프를 예측하는 기법을 또한 포함할 수 있다. 불연속 에피토프의 예측 방법은 비제한적으로 하기: DiscoTope, BEpro, ElliPro, SEPPA, EPITOPIA, EPCES, Bpredictor, 및 EPMeta (Yao 등, PLOS ONE, (2013))를 포함한다. 일부 구현예에서, 잠재적 에피토프는 이론적 세포외 도메인을 결정함으로써 식별된다. 분석 알고리즘 예컨대 TMpred (Hofmann 및 Stoffel, Biol. Chem. 374:166 (1993) 참고) 또는 TMHMM (Krogh 등, J. Mol. Biol., 305(3):567-580 (2001))은 상기 예측하는데 사용될 수 있다. 기타 알고리즘, 예컨대 SignalP 3.0 (Bednsten 등, J. Mol. Biol. 340(4):783-795 (2004))은 신호 펩타이드의 존재를 예측하는데 그리고 그들 펩타이드가 전장 단백질로부터 개열될 것을 예측하는데 사용될 수 있다. 세포의 외부에서 단백질의 부문은 항체 상호작용을 위한 표적의 역할을 할 수 있다.
본 발명의 조성물은 (1) 결합 활성의 역치 수준을 나타내는; (2) 알려진 관련된 폴리펩타이드 분자와 상당히 교차-반응하지 않는; (3) AS-SPIK에 결합하는 그리고 (4) NS-SPIK에 결합하지 않는 본원에 기재된 항체를 포함한다. 항체의 결합 친화성은 당업자에 의해, 예를 들어, Scatchard 분석 (Scatchard, Ann. NY Acad, Sci. 51:660-672 (1949))에 의해 용이하게 결정될 수 있다.
일부 구현예에서, 항-AS-SPIK 항체는 AS-SPIK에 일부 상동성을 갖도록 예측된 기타 단백질, 예를 들어, NS-SPIK보다 표적 AS-SPIK에 대하여 적어도 1.5-배, 2-배, 5-배, 10-배, 100-배, 103-배, 104-배, 105-배, 106-배 또는 그 이상 그들의 표적 에피토프 또는 모방 유인물에 결합할 수 있다.
일부 구현예에서, 항-AS-SPIK 항체는 10-4 M 이하, 10-7 M 이하, 10-9 M 이하의 높은 친화성으로 또는 서브나노몰 친화성 (0.9, 0.8, 0.7, 0.6, 0.5, 0.4, 0.3, 0.2, 0.1 nM 또는 심지어 그 이하)으로 결합한다. 일부 구현예에서, 그들의 각각의 표적에 대하여 항-AS-SPIK 항체의 결합 친화성은 적어도 1 x 106 Ka이다. 일부 구현예에서 AS-SPIK에 대하여 항-AS-SPIK 항체의 결합 친화성은 적어도 5x106 Ka, 적어도 1x107 Ka, 적어도 2x107 Ka, 적어도 1x108 Ka, 또는 그 이상이다. 항체는 AS-SPIK에 그들의 결합 친화성의 면에서 또한 기재 또는 특정될 수 있다. 일부 구현예에서 결합 친화성은 5x10-2 M, 10-2 M, 5x10-3 M, 10-3 M, 5x10-3 M, 10-4 M, 5x10-5 M, 10-5 M, 5x10-6 M, 10-6 M, 5x10-7 M, 10-7 M, 5x10-8 M, 10-8 M, 5x10-9 M, 10-9 M, 5x10-10 M, 10-10 M, 5x10-11 M, 10-11 M, 5x10-12 M, 10-12 M, 5x10-13 M, 10-13 M, 5x10-14 M, 10-14 M, 5x10-15 M, 또는 10-15 M 미만, 또는 그 이하의 Kd를 가진 것들을 포함한다.
본 발명의 항체는 10-4 M 이하, 10-7 M 이하, 10-9 M 이하의 친화성으로 또는 서브-나노몰 친화성 (0.9, 0.8, 0.7, 0.6, 0.5, 0.4, 0.3, 0.2, 0.1 nM 또는 심지어 그 이하)으로 결합할 수 있다. 일부 구현예에서, 그들의 각각의 표적에 대하여 항-AS-SPIK 항체의 결합 친화성은 적어도 1 x 106 Ka이다. 일부 구현예에서, AS-SPIK에 대하여 항-AS-SPIK 항체의 결합 친화성은 적어도 5x106 Ka, 적어도 1x107 Ka, 적어도 2x107 Ka, 적어도 1x108 Ka, 또는 그 이상이다. 일부 구현예에서, 결합 친화성은 5x10-2 M, 10-2 M, 5x10-3 M, 10-3 M, 5x10-3 M, 10-4 M, 5x10-5 M, 10-5 M, 5x10-6 M, 10-6 M, 5x10-7 M, 10-7 M, 5x10-8 M, 10-8 M, 5x10-9 M, 5x10-10 M, 10-10 M, 5x10-11 M, 10-11 M, 5x10-12 M, 10-12 M, 5x10-13 M, 10-13 M, 5x10-14 M, 10-14 M, 5x10-15 M, 또는 10-15 M 미만, 또는 그 이하의 Kd를 가진 것들을 포함한다. 이에 대조적으로, 예를 들면 NS-SPIK에 용어 "비-특이적으로 결합하기"는, 본원에 사용된 경우에 예를 들면 AS-SPIK에 "특이적 결합하기"에 대하여 결정된 것보다 적어도 1.5, 2, 5, 10, 100, 103, 104, 105, 106 또는 그 이상의 인자만큼 더 적은 결합 친화성을 지칭한다. 친화성, 예컨대 Kd는 관심 항체 및 이의 항원의 Fab-버전으로 수행된 방사성-표지화된 항원-결합 검정 (방사면역 검정, RIA)에 의해 측정될 수 있다. 또 다른 구현예에 따라, Kd는 부동화된 항원과 표면 플라스몬 공명 검정을 사용하여 측정될 수 있다. 바람직한 구현예에서, 본 발명의 항체는 AS-SPIK에 특이적으로 또는 우선적으로 결합하고 NS-SPIK에 특이적으로 결합하지 않고, 여기서 AS-SPIK에 항체의 친화성은 NS-SPIK보다 적어도 1.5-배, 2-배, 5-배, 10-배, 100-배, 103-배, 104-배, 105-배 또는 106-배 더 크다.
일부 구현예에서, 항체는 알려진 관련된 폴리펩타이드 분자에 결합하지 않고; 예를 들어, 이들은 알려진 관련된 폴리펩타이드, 예를 들어, NS-SPIK가 아닌 AS-SPIK를 결합시킨다. 항체는 알려진 관련된 폴리펩타이드에 대해 스크리닝되어 AS-SPIK를 특이적으로 또는 우선적으로 결합시키는 항체 집단을 단리시킬 수 있다. 예를 들어, AS-SPIK에 특이적인 항체는 적절한 완충액 조건 하에서 불용성 매트릭스에 부착된 NS-SPIK를 포함하는 컬럼을 통해서 유동할 것이다. 그러한 스크리닝은 밀접하게 관련된 폴리펩타이드에 비- 교차-반응성인 다클론성 및 단클론성 항체를 단리시킨다. 특이적 항체의 기타 스크리닝 및 단리 방법은, 제한 없이, 예를 들어, 동시 면역전기영동, 방사면역검정 (RIA), 방사면역침전, 효소-결합 면역흡착 검정 (ELISA), 도트 블롯 또는 웨스턴 블롯 검정, 억제 또는 경쟁 검정, 및 샌드위치 검정을 포함한다.
본 발명의 구현예에 따른 항체는, 리포터 (예를 들면, 검출가능한 리포터)로서 또한 지칭될 수 있는, 검출가능한 표지를 포함할 수 있다. 일부 구현예에서, 검출가능한 표지는 태깅된 펩타이드의 발현 또는 활성의 정성적 및/또는 정량적 사정을 허용하는 항체 (예를 들면, 항-AS-SPIK 항체) 또는 이의 생물학적으로-활성 단편에 공유적으로 결합되는 임의의 분자일 수 있다. 활성은 생물학적 활성, 물리-화학적 활성, 또는 이들의 조합을 포함할 수 있다. 검출가능한 표지의 양쪽 형태 및 위치는, 표지화된 항체가 생물학적 활성을 보유하는 한, 다양할 수 있다. 많은 상이한 표지는 사용될 수 있고, 특정한 표지의 선택은 원하는 응용에 의존할 것이다. 표지화된 항-AS-SPIK 항체는, 예를 들어, 생물학적 샘플, 예를 들면, 소변, 타액, 뇌척수액, 혈액 또는 생검 샘플에서 AS-SPIK의 수준 사정하기에 사용될 수 있다.
검출가능한 표지는 효소, 광-친화성 리간드, 방사성동위원소, 및 형광성 또는 화학발광성 화합물을 포함할 수 있다. 예시적 효소 표지는 양고추냉이 퍼옥시다제, 알칼리 포스파타제, β-갈락토시다제, 및 우레아제를 포함할 수 있다. 효소에 항-AS-SPIK 항체의 공유 결합은 상이한 방법, 예를 들어, 유리 아미노기를 통해 글루타르알데히드와의 커플링에 의해 수행될 수 있다. 대안적으로, 항-AS-SPIK 항체는 당 잔기를 통해 효소에 커플링될 수 있다. 탄수화물을 함유하는 기타 효소는 이러한 방식으로 항체에 또한 커플링될 수 있다. 효소 커플링은, 헤테로이작용성 링커, 예컨대 숙신이미딜 6-(N-말레이미도) 헥사노에이트를 사용하여, 효소, 예컨대 β-갈락토시다제의 유리 티올 기와 항체의 아미노 기를 인터링크함으로써 또한 수행될 수 있다. 양고추냉이-퍼옥시다제 검출 시스템은, 예를 들어, 450 nm에 검출가능한 과산화수소의 존재 하에서 가용성 생성물을 산출하는, 발색 기질 테트라메틸벤지딘 (TMB)과 사용될 수 있다. 알칼리 포스파타제 검출 시스템은, 예를 들어, 405 nm에 용이하게 검출가능한 가용성 생성물을 산출하는, 발색 기질 p-니트로페닐포스페이트와 사용될 수 있다. 유사하게, β-갈락토시다제 검출 시스템은, 410 nm에 검출가능한 가용성 생성물을 산출하는, 발색 기질 o- 니트로페닐-P-D-갈락토피라녹시드 (ONPG)와 사용될 수 있다. 우레아제 검출 시스템은 기질, 예컨대 우레아-브로모크레졸 퍼플과 사용될 수 있다.
검출가능한 표지는, 비제한적으로, 플루오레세인 이소티오시아네이트, 로다민, 피코에리테린, 피코시아닌, 알로피코시아닌, o-프탈데히드 및 플루오레스카민; 루미놀, 이소루미놀, 방향족 아크리디늄 에스테르, 이미다졸, 아크리디늄 염 및 옥살레이트 에스테르로 이루어지는 군으로부터 선택된 화학발광성 화합물; 리포솜 또는 덱스트란; 또는 생물발광성 화합물 예컨대 루시페린, 루시페라제 및 에쿼린을 포함하는 형광성 표지일 수 있다. 대안적으로 또는 이외에도, 검출가능한 표지는, 비제한적으로, 방사선 불투과성 또는 조영 제제 예컨대 바륨, 디아트리조에이트, 에티오드화 오일, 구연산갈륨, 이오카름산, 이오세탐산, 이오다미드, 이오디파미드, 이오독삼산, 이오굴아미드, 이오헥솔, 이오파미돌, 이오파노산, 이오프로셈산, 이오세팜산, 이오세르산, 이오술라미드 메글루민, 이소세메트산, 이오타술, 이오테트르산, 이오탈람산, 이오트록산, 이옥사글산, 이옥소트리조산, 이포데이트, 메글루민, 메트리자미드, 메트리조에이트, 프로필리오돈, 및 탈로스 클로라이드를 포함한다.
표지는 합성 중 또는 합성후에 첨가될 수 있다. 재조합 항-AS-SPIK 항체 또는 이의 생물학적으로 활성 변이체는 형질전환된 세포가 성장되는 배양 배지에 표지화된 전구체 (예를 들면, 방사성표지화된 아미노산)의 첨가에 의해 또한 표지화될 수 있다. 일부 구현예에서, 펩타이드의 유사체 또는 변이체는 검출가능한 마커의 편입을 용이하게 하기 위해 사용될 수 있다. 예를 들어, 임의의 N-말단 페닐알라닌 잔기는, 125I로 쉽게 표지화될 수 있는 밀접하게 관련된 방향족 아미노산, 예컨대 티로신으로 대체될 수 있다. 일부 구현예에서, 효과적 표지화를 지원하는 추가의 작용기는 항-AS-SPIK 항체 또는 이의 생물학적으로 활성 변이체의 단편에 첨가될 수 있다. 예를 들어, 3-트리부틸틴벤조일 기는 천연 구조의 N-말단에 첨가될 수 있고; 트리부틸틴 기의 125I로의 후속적 대체는 방사성표지화된 요오도벤조일 기를 생성할 것이다.
항체 약물 접합체 (ADC)
본 발명의 양태는 세포독성 제제 예컨대 화학치료적 제제, 약물, 성장 억제성 제제, 독소 (예를 들면, 박테리아, 진균, 식물, 또는 동물 기원, 또는 이의 단편의 효소적으로 활성 독소), 또는 방사능 동위원소 (즉, 방사성접합체)에 접합된 항체를 포함하는 면역접합체, 또는 항체-약물 접합체 (ADC)를 포함한다. 또 다른 양태에서, 본 발명은 추가로 면역접합체의 사용 방법을 제공한다. 일 양태에서, 면역접합체는 세포독성 제제 또는 검출가능한 제제에 공유적으로 부착된 상기 항-AS-SPIK 항체들 중 임의의 것을 포함한다. ADC는, 예를 들어, 미국 특허 번호 8,362,213에 기재되고, 이의 개시내용은 이 전체가 본원에 참고로 편입된다.
세포독성 또는 세포억제 제제, 즉, 암의 치료에서 종양 세포를 사멸 또는 억제시키는 약물의 국소 전달을 위한 ADC의 용도 (Lambert, J. (2005) Curr. Opinion in Pharmacology 5:543-549; Wu 등 (2005) Nature Biotechnology 23(9):1137-1146; Payne, G. (2003) Cancer Cell 3:207-212; Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drug Del. Rev. 26:151-172; 미국 특허 번호 4,975,278)는 약물 모이어티의 종양에의 표적화된 전달, 및 그안에 세포내 축적을 허용하고, 여기에서 이들 미접합된 약물 제제의 전신 투여는 정상 세포 뿐만 아니라 제거하고자 하는 종양 세포에 허용불가능한 수준의 독성을 초래할 수 있다 (Baldwin 등 (1986) Lancet pp. (Mar. 15, 1986):603-05; Thorpe, (1985) "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review," in Monoclonal Antibodies '84: Biological And Clinical Applications, A. Pinchera 등 (ed.s), pp. 475-506). ADC의 치료적 지수, 즉, 최대 효능 및 최소 독성을 개선하기 위한 노력은 다클론성 (Rowland 등 (1986) Cancer Immunol. Immunother., 21:183-87) 및 단클론성 항체 (mAb)의 선택성 뿐만 아니라 약물-결합 및 약물-방출 특성 (Lambert, J. (2005) Curr. Opinion in Pharmacology 5:543-549)에 집중하였다. ADC에서 사용된 약물 모이어티는 박테리아성 단백질 독소 예컨대 디프테리아 독소, 식물 단백질 독소 예컨대 리신, 작은 분자 예컨대 아우리스타틴, 겔다나마이신 (Mandler 등 (2000) J. of the Nat. Cancer Inst. 92(19):1573-1581; Mandler 등 (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler 등 (2002) Bioconjugate Chem. 13:786-791), 메이탄시노이드 (EP 1391213; Liu 등 (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623), 칼리키아미신 (Lode 등 (1998) Cancer Res. 58:2928; Hinman 등 (1993) Cancer Res. 53:3336-3342), 다우노마이신, 독소루비신, 메토트렉세이트, 및 빈데신 (Rowland 등 (1986) 상기)을 포함한다. 약물 모이어티는 튜불린 결합, DNA 결합, 또는 토포이소머라제 억제를 포함하는 세포독성 및 세포억제 기전에 영향을 미칠 수 있다. 일부 세포독성 약물은 큰 항체 또는 단백질 수용체 리간드에 접합된 경우 불활성적이거나 덜 활성적인 경향이다.
돌라스타틴의 합성 유사체 (WO 02/088172)인, 아우리스타틴 펩타이드, 아우리스타틴 E (AE) 및 모노메틸아우리스타틴 (MMAE)은 (i) (암종에서 루이스 Y에 특이적인) 키메라 단클론성 항체 cBR96; (ii) 혈액학적 악성종양에서 CD30에 특이적인 cAC10 (Klussman, 등 (2004), Bioconjugate Chemistry 15(4):765-773; Doronina 등 (2003) Nature Biotechnology 21(7):778-784; Francisco 등 (2003) Blood 102(4):1458-1465; US 2004/0018194; (iii) CD20-발현 암 및 면역 장애의 치료를 위한 항-CD20 항체 예컨대 리툭산 (WO 04/032828); (iv) 결장직장암의 치료를 위한 항-EphB2R 항체 2H9 (Mao 등 (2004) Cancer Research 64(3):781-788); (v) E-셀렉틴 항체 (Bhaskar 등 (2003) Cancer Res. 63:6387-6394); (vi) 트라스투주맙 (HERCEPTIN®, US 2005/0238649), 및 (vi) 항-CD30 항체 (WO 03/043583)에 약물 모이어티로서 접합되었다. 아우리스타틴 E의 변이체는 미국 특허 번호 5,767,237 및 미국 특허 번호 6,124,431에 개시된다. 단클론성 항체에 접합된 모노메틸 아우리스타틴 E는 2004년 3월 28일 제시된, Senter 등, Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 623에 개시된다. 아우리스타틴 유사체 MMAE 및 MMAF는 각종 항체에 접합되었다 (US 2005/0238649).
항체에 약물 모이어티의 종래 부착 수단, 즉, 공유 결합을 통한 결합하기는 일반적으로 약물 모이어티가 항체에서 다수의 부위에 부착되는 분자들의 이종 혼합물을 초래한다. 예를 들어, 세포독성 약물은 항체의 종종-수많은 라이신 잔기를 통해서 항체에 전형적으로 접합되어, 이종 항체-약물 접합체 혼합물을 생성한다. 반응 조건에 의존하여, 이종 혼합물은 전형적으로 0 내지 약 8, 또는 그 이상, 부착된 약물 모이어티를 가진 항체의 분포를 함유한다. 이외에도, 약물 모이어티 대 항체의 특정한 정수 비를 가진 접합체의 각 서브그룹 내에는, 약물 모이어티가 항체에서 각종 부위에 부착되는 잠재적으로 이종 혼합물이 있다. 분석적 및 예방적 방법은 접합 반응에서 비롯하는 이종 혼합물 내에서 항체-약물 접합체 종 분자를 분리 및 특성규명하는데 불충분할 수 있다. 항체는 많은 반응성 작용기를 종종 가진, 크고, 복잡하고 구조적으로 다양한 생물분자이다. 링커 시약 및 약물-링커 중간체와 그들의 반응성은 인자 예컨대 pH, 농도, 염 농도, 및 공-용매에 의존적이다. 게다가, 다단계 접합 공정은 반응 조건 제어하기 그리고 반응물 및 중간체 특성규명하기에서 어려움으로 인해 비-재현가능성일 수 있다.
시스테인 티올은, 양성자화되고 pH 7 근처에서 덜 친핵성인 대부분의 아민과 달리, 중성 pH에서 반응성이다. 유리 티올 (RSH, 술프하이드릴) 기가 상대적으로 반응성이므로, 시스테인 잔기를 가진 단백질은 종종 디술피드-결합된 올리고머로서 그들의 산화된 형태로 실재하거나 내부적으로 브릿징된 디술피드 기를 갖는다. 세포외 단백질은 일반적으로 유리 티올을 갖지 않는다 (Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London, at page 55). 항체 시스테인 티올 기는 항체 아민 또는 하이드록실 기보다 친전자성 접합 시약에 대해 일반적으로 더욱 반응성, 즉 더욱 친핵성이다. 시스테인 잔기는 리간드에 공유 부착을 형성하기 위해 또는 새로운 분자내 디술피드 결합을 형성하기 위해 유전 공학 기법에 의해 단백질에 도입되었다 (Better 등 (1994) J. Biol. Chem. 13:9644-9650; Bernhard 등 (1994) Bioconjugate Chem. 5:126-132; Greenwood 등 (1994) Therapeutic Immunology 1:247-255; Tu 등 (1999) Proc. Natl. Acad. Sci. USA 96:4862-4867; Kanno 등 (2000) J. of Biotechnology, 76:207-214; Chmura 등 (2001) Proc. Nat. Acad. Sci. USA 98(15):8480-8484; 미국 특허 번호 6,248,564). 하지만, 단백질의 각종 아미노산 잔기의 시스테인 아미노산으로의 돌연변이에 의한 시스테인 티올 기에서의 조작은 특히 미페어링된 (유리 Cys) 잔기나 반응 또는 산화에 상대적으로 접근가능한 것들의 경우에서 잠재적으로 문제적이다. E. 콜리의 주변세포질, 배양 상청액, 또는 부분적으로나 완전히 정제된 단백질이든, 단백질의 농축된 용액에서, 단백질의 표면에서 미페어링된 Cys 잔기는 페어링 및 산화하여 분자간 디술피드, 따라서 단백질 이량체 또는 다량체를 형성할 수 있다. 디술피드 이량체 형성은 새로운 Cys가 약물, 리간드, 또는 기타 표지에의 접합에 대하여 비반응성으로 만든다. 게다가, 단백질이 새롭게 조작된 Cys와 기존의 Cys 잔기 사이 분자내 디술피드 결합을 산화적으로 형성한다면, 양쪽 Cys 티올 기는 활성 부위 참가 및 상호작용에 대하여 이용불가능하다. 게다가, 단백질은 3차 구조의 미스폴딩 또는 상실에 의해 불활성 또는 비-특이적이게 될 수 있다 (Zhang 등 (2002) Anal. Biochem. 311:1-9).
시스테인-조작된 항체는 FAB 항체 단편 (thioFab)으로서 설계되었고 전장, IgG 단클론성 (thioMab) 항체로서 발현되었다 (Junutula, J. R. 등. (2008) J Immunol Methods 332:41-52; US 2007/0092940, 이의 내용은 참고로 편입된다). ThioFab 및 ThioMab 항체는 항체 약물 접합체 (Thio ADC)를 제조하기 위해 티올-반응성 링커 시약 및 약물-링커 시약으로 새롭게 도입된 시스테인 티올에 링커를 통해서 접합되었다.
특허 출원 및 공개를 포함하는, 본원에 인용된 모든 참고문헌은 그들 전체가참고로 편입된다.
폴리펩타이드
본 발명의 양태는 SPIK 폴리펩타이드, 예를 들어, 서열번호: 1의 핵산 서열에 의해 인코딩된 AS-SPIK 폴리펩타이드를 포함하는 조성물을 포함한다. 용어들 "펩타이드", "폴리펩타이드", 및 "단백질"은, 전형적으로 이들이 다양한 크기의 펩타이드 서열을 지칭하여도, 본원에 교환가능하게 사용된다. 우리는 이들이 아미노산 잔기의 선형 중합체임을 전하기 위해, 그리고 이들을 전장 단백질과 구별하기 위해 본 발명의 아미노산-기반된 조성물을 "폴리펩타이드"로서 지칭할 수 있다. 본 발명의 구현예에 따른 폴리펩타이드는 AS-SPIK 폴리펩타이드 또는 NS-SPIK 폴리펩타이드의 단편을 "구성"할 수 있거나 "포함"할 수 있고, 본 발명은 AS-SPIK 폴리펩타이드 또는 NS-SPIK 폴리펩타이드의 생물학적으로 활성 변이체를 구성하거나 포함하는 폴리펩타이드를 포괄한다. 폴리펩타이드가 그러므로 AS-SPIK 폴리펩타이드 또는 NS-SPIK 폴리펩타이드 (또는 이의 생물학적으로 활성 변이체)의 단편만을 포함할 수 있지만 추가의 잔기를 또한 포함할 수 있음이 이해될 것이다. 생물학적으로 활성 변이체는 프로테아제를 억제하기에 충분한 활성을 보유할 것이다.
아미노산 잔기들 사이 결합은 종래 펩타이드 결합 또는 또 다른 공유 결합 (예컨대 에스테르 또는 에테르 결합)일 수 있고, 폴리펩타이드는 아미드화, 인산화 또는 글리코실화에 의해 변형될 수 있다. 변형은 폴리펩타이드 백본 및/또는 하나 이상의 측쇄에 영향을 미칠 수 있다. 화학적 변형은 폴리펩타이드를 인코딩하는 mRNA의 번역 이후 생체내 만들어진 자연 발생 변형 (예를 들면, 박테리아성 숙주에서 글리코실화) 또는 시험관내 만들어진 합성 변형일 수 있다. AS-SPIK 폴리펩타이드 또는 NS-SPIK 폴리펩타이드의 생물학적으로 활성 변이체는 자연 발생의 (즉, 생체내 자연적으로 만들어진) 및 합성 변형 (즉, 시험관내 만들어진 자연 발생 또는 비-자연 발생 변형)과의 임의의 조합에서 비롯하는 하나 이상의 구조적 변형을 포함할 수 있다. 변형의 예는, 비제한적으로, 아미드화 (예를 들면, C-말단에서 유리 카르복실 기의 아미노 기에 의한 대체); 비오틴화 (예를 들면, 라이신 또는 기타 반응성 아미노산 잔기의 비오틴 분자와의 아실화); 글리코실화 (예를 들면, 당단백질 또는 당펩타이드를 생성하기 위해 어느 한쪽 아스파라긴, 하이드록실리신, 세린 또는 트레오닌 잔기에 글리코실 기의 첨가); 아세틸화 (예를 들면, 전형적으로 폴리펩타이드의 N-말단에서, 아세틸 기의 첨가); 알킬화 (예를 들면, 알킬 기의 첨가); 이소프레닐화 (예를 들면, 이소프레노이드 기의 첨가); 리포일화 (예를 들면 리포에이트 모이어티의 부착); 및 인산화 (예를 들면, 세린, 티로신, 트레오닌 또는 히스티딘에 포스페이트 기의 첨가)를 포함한다.
생물학적으로 활성 변이체에서 아미노산 잔기들 중 하나 이상은 비- 자연 발생 아미노산 잔기일 수 있다. 자연 발생 아미노산 잔기는 유전 코드 뿐만 아니라 비-표준 아미노산 (예를 들면, L-형상 대신에 D-형상을 갖는 아미노산)에 의해 자연적으로 인코딩된 것들을 포함한다. 본 펩타이드는 표준 잔기의 변형된 버전인 아미노산 잔기를 또한 포함할 수 있다 (예를 들면 피롤리신은 라이신 대신에 사용될 수 있고 셀레노시스테인은 시스테인 대신에 사용될 수 있다). 비-자연 발생 아미노산 잔기는 자연에서 찾아지지 않지만, 아미노산의 기본 식에 따르고 펩타이드에 통합될 수 있는 것들이다. 이들은 D-알로이소류신(2R,3S)-2- 아미노-3-메틸펜탄산 및 L-사이클로펜틸 글리신 (S)-2-아미노-2-사이클로펜틸 아세트산을 포함한다. 기타 예의 경우에, 교과서 또는 전세계 웹사이트를 참고할 수 있다 (사이트는 현재 캘리포니아 공과대학에서 관리되고 기능적 단백질에 성공적으로 통합된 비-천연 아미노산의 구조를 표시한다).
대안적으로, 또는 이외에도, 생물학적으로 활성 변이체에서 아미노산 잔기들 중 하나 이상은 야생형 서열에서 상응하는 위치에 찾아진 자연 발생 잔기와 상이한 자연 발생 잔기일 수 있다. 다시 말해서, 생물학적으로 활성 변이체는 하나 이상의, 특히 1개 또는 2개, 아미노산 치환을 포함할 수 있다. 우리는 야생형 서열의 돌연변이로서 아미노산 잔기의 치환, 부가, 또는 결실을 지칭할 수 있다. 언급된 경우에, 치환은 자연 발생 아미노산 잔기를 비-자연 발생 잔기 또는 단지 상이한 자연 발생 잔기로 대체할 수 있다. 추가로 치환은 보존적 또는 비-보존적 치환을 구성할 수 있다. 보존적 아미노산 치환은 전형적으로 하기 그룹: 글리신 및 알라닌; 발린, 이소류신, 및 류신; 아스파르트산 및 글루탐산; 아스파라긴, 글루타민, 세린 및 트레오닌; 라이신, 히스티딘 및 아르기닌; 그리고 페닐알라닌 및 티로신 내에서 치환을 포함한다.
AS-SPIK의 생물학적으로 활성 변이체인 폴리펩타이드는 그들의 서열이 상응하는 야생형 폴리펩타이드와 유사하거나 상동인 정도의 면에서 특성규명될 수 있다. 예를 들어, 생물학적으로 활성 변이체의 서열은 야생형 폴리펩타이드에서 상응하는 잔기에 적어도 또는 약 80% 상동 (또는 동일)할 수 있다. 예를 들어, AS-SPIK 폴리펩타이드 또는 NS-SPIK 폴리펩타이드의 생물학적으로 활성 변이체는 AS-SPIK 또는 NS-SPIK 폴리펩타이드 (서열번호: 2, 4)에 또는 이들의 상동체 또는 동원체에 적어도 또는 약 80% 서열 상동성 (예를 들면, 적어도 또는 약 85%, 90%, 95%, 96%, 97%, 98%, 또는 99% 서열 상동성) (또는 인용된 백분율 동일성)을 가진 아미노산 서열을 가질 수 있다.
AS-SPIK 폴리펩타이드 또는 NS-SPIK 폴리펩타이드의 생물학적으로 활성 변이체는 본 방법에서 유용하기에 충분한 생물학적 활성을 보유할 것이다. 생물학적으로 활성 변이체는 프로테아제 활성의 억제제로서 기능하기에 충분한 활성을 보유할 것이다. 생물학적 활성은 당업자에 알려진 방식으로 사정될 수 있고, 제한 없이, 시험관내 개열 검정 또는 기능적 검정을 포함한다.
폴리펩타이드는 예를 들어, 재조합 기법 또는 화학적 합성을 포함하는 다양한 방법에 의해 생성될 수 있다. 일단 생성되면, 폴리펩타이드는 임의의 원하는 정도로 단리 및 정제될 수 있다. 예를 들어, 동결건조를, 예를 들어, 역상 (바람직하게는) 또는 순상 HPLC, 또는 다당류 겔 배지 예컨대 Sephadex G-25에서 크기 배제 또는 분배 크로마토그래피 이후 사용할 수 있다. 최종 폴리펩타이드의 조성은 표준 수단에 의한 펩타이드의 분해 후 아미노산 분석에 의해, 아미노산 서열분석에 의해, 또는 FAB-MS 기법에 의해 확인될 수 있다. 폴리펩타이드의 아미노 기의 산 염을 포함하는 염, 에스테르, 아미드, 및 N-아실 유도체는 당업계에서 알려진 방법을 사용하여 제조될 수 있고, 상기 펩타이드는 본 발명의 맥락에서 유용하다.
AS-SPIK 복합체가 또한 제공된다. 본 발명의 구현예에 따른 AS-SPIK 복합체는, 본원에 기재된 경우에, AS-SPIK, 및 AS-SPIK 폴리펩타이드 또는 이의 단편에 특이적으로 또는 우선적으로 결합하는 본 발명의 항체를 포함한다. 항체는 본원에 기재된 항-AS-SPIK 항체의 임의의 것일 수 있다. AS-SPIK 폴리펩타이드 또는 이의 단편은 본원에 기재된 AS-SPIK 폴리펩타이드 또는 이의 단편일 수 있다. 일부 구현예에서, 항체는 본원에 기재된 경우에 에피토프 I 또는 에피토프 II에 결합하는 항-AS-SPIK 단클론성 항체이다. 일부 구현예에서, AS-SPIK 폴리펩타이드는 서열번호: 2의 아미노산 서열에 적어도 98% 상동성 (또는 동일성)을 갖는 아미노산 서열을 가진 폴리펩타이드이다. 일부 구현예에서, AS-SPIK 폴리펩타이드는 서열번호: 2의 아미노산 서열을 갖는 폴리펩타이드이다.
항-AS-SPIK 항체 예컨대 에피토프 I 또는 에피토프 II에 결합하는 항체의 특이적 결합은, 본원에 기재된 경우에, 특정 조건 하에서 AS-SPIK 또는 AS-SPIK 펩타이드와 면역-복합체를 형성할 수 있다. 복합체는, 예를 들어, 샌드위치 ELISA 테스트로 추가 분석을 위하여 용액으로부터 침전될 수 있다. 담체로서 제2 항-SPIK 항체로 부동화된 96-웰 플레이트를 사용하여, 면역 복합체는 플레이트에 의해 포착될 수 있다. 만일 복합체에서 항체가 리포터 예컨대 양고추냉이 퍼옥시다제 (HPR)로 표지화된다면, 형성된 AS-SPIK 면역-복합체의 양은 그 다음 결정될 수 있다. AS-SPIK 면역- 복합체는 또한 웨스턴 블롯 분석을 위하여 단백질 A 또는 G와 아가로스 비드 결합에 의해 포착될 수 있다.
핵산
용어들 "핵산" 및 "폴리뉴클레오타이드"는, cDNA, 게놈성 DNA, 합성 DNA, 및 핵산 유사체를 함유하는 DNA (또는 RNA)를 포함하는, 양쪽 RNA 및 DNA를 지칭하기 위해 본원에 교환가능하게 사용되고, 이들 중 임의의 것은 본 발명의 폴리펩타이드를 인코딩할 수 있고 이들 모두는 본 발명에 의해 포괄된다. 폴리뉴클레오타이드는 본질적으로 임의의 3- 차원 구조를 가질 수 있다. 핵산은 이중-가닥 또는 단일-가닥 (즉, 센스 가닥 또는 안티센스 가닥)일 수 있다. 폴리뉴클레오타이드의 비-제한 예는 유전자, 유전자 단편, 엑손, 인트론, 메신저 RNA (mRNA) 및 이의 부문, 전이 RNA, 리보솜 RNA, siRNA, 마이크로-RNA, 리보자임, cDNA, 재조합 폴리뉴클레오타이드, 분지형 폴리뉴클레오타이드, 플라스미드, 벡터, 임의의 서열의 단리된 DNA, 임의의 서열의 단리된 RNA, 핵산 프로브, 및 프라이머, 뿐만 아니라 핵산 유사체를 포함한다. 본 발명의 맥락에서, 핵산은 자연 발생 AS-SPIK 폴리펩타이드 또는 NS-SPIK 폴리펩타이드 또는 이들의 생물학적으로 활성 변이체의 단편을 인코딩할 수 있다. 본 발명의 구현예에 따른 핵산 서열의 비-제한 예는 서열번호: 1 및 3, 또는 이들의 생물학적으로 활성 단편 또는 변이체를 포함한다.
"단리된" 핵산은, 예를 들어, 자연-발생 DNA 분자 또는 이의 단편일 수 있고, 다만 자연-발생 게놈에서 그 DNA 분자를 바로 측접하여 정상적으로 찾아진 핵산 서열들 중 적어도 하나는 제거되거나 없다. 그래서, 단리된 핵산은, 비제한적으로, 기타 서열에 관계 없이, 별도 분자로서 실재하는 DNA 분자 (예를 들면, 화학적으로 합성된 핵산, 또는 폴리머라제 연쇄 반응 (PCR) 또는 제한 엔도뉴클레아제 처리에 의해 생산된 cDNA 또는 게놈성 DNA 단편)를 포함한다. 단리된 핵산은 또한 벡터, 자율적으로 복제하는 플라스미드, 바이러스에, 또는 원핵생물 또는 진핵생물의 게놈성 DNA에 통합되는 DNA 분자를 지칭한다. 이외에도, 단리된 핵산은 조작된 핵산 예컨대 하이브리드 또는 융합 핵산의 부분인 DNA 분자를 포함할 수 있다. 예를 들어, cDNA 라이브러리 또는 게놈성 라이브러리, 또는 게놈성 DNA 제한 다이제스트를 함유하는 겔 슬라이스 내에서 기타 핵산의 다수 (예를 들면, 수십, 또는 수백 내지 수백만) 중에 실재하는 핵산은 단리된 핵산이 아니다.
단리된 핵산 분자는, 예를 들어, 본원에 기재된 폴리펩타이드를 인코딩하는 뉴클레오타이드 서열을 포함하여, 본원에 기재된 뉴클레오타이드 서열을 함유하는 단리된 핵산을 수득하는데 사용될 수 있는, 폴리머라제 연쇄 반응 (PCR) 기법에 의해 생산될 수 있다. PCR은 총 게놈성 DNA 또는 총 세포성 RNA로부터 서열을 포함하는, DNA 뿐만 아니라 RNA로부터 특이적 서열을 증폭시키는데 사용될 수 있다. 일반적으로, 관심 영역의 끝 또는 그 이상으로부터 서열 정보는 증폭될 템플레이트의 반대 가닥과 서열이 동일하거나 유사한 올리고뉴클레오타이드 프라이머를 설계하는데 이용된다. 부위-특이적 뉴클레오타이드 서열 변형이 템플레이트 핵산에 도입될 수 있는 각종 PCR 전략이 또한 이용가능하다.
단리된 핵산은 또한 어느 한쪽 단일 핵산 분자로서 (예를 들면, 포스포라미다이트 기술을 사용하여 3'에서 5' 방향으로 자동화된 DNA 합성 이용) 또는 일련의 올리고뉴클레오타이드로서 화학적으로 합성될 수 있다. 예를 들어, 원하는 서열을 함유하는 긴 올리고뉴클레오타이드 (예를 들면, >50-100개 뉴클레오타이드)의 하나 이상의 쌍이 합성될 수 있고, 각 쌍은 올리고뉴클레오타이드 쌍이 어닐링되는 경우 듀플렉스가 형성되도록 상보성의 짧은 세그먼트 (예를 들면, 약 15개 뉴클레오타이드)를 함유한다. DNA 폴리머라제는 올리고뉴클레오타이드를 확장하는데 사용되어, 올리고뉴클레오타이드 쌍 당 단일, 이중-가닥 핵산 분자를 초래하고, 이는 그 다음 벡터에 결찰될 수 있다. 본 발명의 단리된 핵산은 또한, 예를 들면, (예를 들어, 상기 식에 따른) AS-SPIK- 또는 NS-SPIK-인코딩 DNA의 자연 발생 부문의 돌연변이유발에 의해 수득될 수 있다.
2개 핵산 또는 이들이 인코딩하는 폴리펩타이드는 서로에 어느 정도의 상동성 또는 동일성을 갖는 것으로서 기재될 수 있다. 예를 들어, AS-SPIK 폴리펩타이드 또는 NS-SPIK 폴리펩타이드 및 이들의 생물학적으로 활성 변이체는 어느 정도의 상동성 또는 동일성을 나타내는 것으로서 기재될 수 있다. 정렬은 단백질 정보 연구 (PIR) 사이트 (http://pir.georgetown.edu)에서 짧은 AS-SPIK 폴리펩타이드 또는 NS-SPIK 폴리펩타이드 서열을 찾고 이어서 NCBI 웹사이트 (http://www.ncbi.nlm.nih.gov/blast)에서 "짧은 거의 동일한 서열" Basic Local Alignment Search Tool (BLAST) 알고리즘으로 분석함으로써 조립될 수 있다.
서열 상동성 또는 동일성을 결정하기 위해, 쿼리 핵산 또는 아미노산 서열은, 상기 기재된 경우에, 컴퓨터 프로그램, 예컨대, 예를 들어, 핵산 또는 단백질 서열의 정렬이 그들의 전체 길이에 걸쳐서 실시되도록 하는 (전면적 정렬), BioEdit (버전 4.8.5, 노스캐롤라이나 주립대학교), 또는 ALIGN-2를 사용하여, 하나 이상의 대상체 핵산 또는 아미노산 서열, 각각으로 정렬될 수 있다.
BioEdit는 쿼리와 하나 이상의 대상체 서열 사이 최상의 매치를 계산하고 동일성, 유사성 및 차이가 결정될 수 있도록 이들을 정렬시킨다. 하나 이상의 잔기의 갭은 쿼리 서열, 대상체 서열, 또는 양쪽에 삽입되어, 서열 정렬을 최대화할 수 있다. 핵산 서열의 빠른 쌍별 정렬을 위하여, 하기 디폴트 파라미터가 사용된다: 단어 크기: 2; 창 크기: 4; 채점 방법: 백분율; 상단 대각선의 수: 4; 및 갭 페널티: 5. 핵산 서열의 다중 정렬을 위하여, 하기 파라미터가 사용된다: 갭 개방 페널티: 10.0; 갭 확장 패널티: 5.0; 및 가중치 전환: 예. 단백질 서열의 빠른 쌍별 정렬을 위하여, 하기 파라미터가 사용된다: 단어 크기: 1; 창 크기: 5; 채점 방법: 백분율; 상단 대각선의 수: 5; 갭 패널티: 3. 단백질 서열의 다중 정렬을 위하여, 하기 파라미터가 사용된다: 가중치 매트릭스: 블로섬; 갭 개방 페널티: 10.0; 갭 확장 패널티: 0.05; 친수성 갭: 켜짐; 친수성 잔기: Gly, Pro, Ser, Asn, Asp, Gln, Glu, Arg 및 Lys; 잔기-특이적 갭 페널티: 켜짐. 출력은 서열 사이 관계를 반영하는 서열 정렬이다.
쿼리 서열과 대상체 서열 사이 퍼센트 상동성을 결정하기 위해, BioEdit는 최상 정렬에서 동일성의 수를 비교된 잔기의 수로 나눗셈하고 (갭 위치는 배제됨), 그 결과에 100을 곱셈한다. 출력은 쿼리 서열에 관하여 대상체 서열의 퍼센트 상동성이다. 퍼센트 상동성 값이 가장 가까운 10분의 1로 반올림될 수 있음이 주목된다. 예를 들어, 78.11, 78.12, 78.13, 및 78.14는 78.1로 반내림되고, 반면 78.15, 78.16, 78.17, 78.18, 및 78.19는 최대 78.2로 반올림된다.
본원에 기재된 핵산 및 폴리펩타이드는 "외인성"으로서 지칭될 수 있다. 용어 "외인성"은 핵산 또는 폴리펩타이드가 재조합 핵산 작제물의 부분이거나, 상기에 의해 인코딩되거나, 이의 자연 환경에 있지 않음을 나타낸다. 예를 들어, 외인성 핵산은 또 다른 종, 즉, 이종 핵산에 도입된 하나의 종으로부터의 서열일 수 있다. 전형적으로, 그와 같은 외인성 핵산은 재조합 핵산 작제물을 통해 기타 종에 도입된다. 외인성 핵산은 또한 유기체에 고유하고 그 유기체의 세포에 재도입된 서열일 수 있다. 천연 서열을 포함하는 외인성 핵산은 외인성 핵산에 결합된 비-자연 서열, 예를 들면, 재조합 핵산 작제물에서 천연 서열을 측접하는 비-천연 조절성 서열의 존재에 의해 자연 발생 서열과 종종 구별될 수 있다. 이외에도, 안정하게 형질전환된 외인성 핵산은 전형적으로 천연 서열이 찾아지는 위치 이외의 위치에서 통합된다.
재조합 작제물이 본원에 또한 제공되고 AS-SPIK를 발현하기 위해 세포를 형질전환시키는데 사용될 수 있다. 재조합 핵산 작제물은 특정한 세포에서 AS-SPIK 또는 NS-SPIK 발현시키기에 적당한 조절성 영역에 작동가능하게 결합된 AS-SPIK 또는 NS-SPIK 서열을 인코딩하는 핵산을 포함한다. 핵산의 수가 특정한 아미노산 서열을 갖는 폴리펩타이드를 인코딩할 수 있음이 인식될 것이다. 유전 코드의 퇴화는 당업계에 잘 알려진다. 많은 아미노산의 경우에, 아미노산에 대하여 코돈의 역할을 하는 하나 초과의 뉴클레오타이드 삼중항이 있다. 예를 들어, AS-SPIK 또는 NS-SPIK에 대하여 코딩 서열에서의 코돈은 특정한 유기체에서의 최적 발현이, 그 유기체에 대하여 적절한 코돈 편향 표를 사용하여, 수득되도록 변형될 수 있다.
핵산 예컨대 본원에 기재된 것들을 함유하는 벡터가 또한 제공된다. "벡터"는, 또 다른 DNA 세그먼트가 삽입된 세그먼트의 복제를 가져오기 위해 삽입될 수 있는 레플리콘, 예컨대 플라스미드, 파지, 또는 코스미드이다. 일반적으로, 벡터는 적합한 대조군 요소와 회합된 경우 복제할 수 있다. 적당한 벡터 백본은, 예를 들어, 당업계에서 일상적으로 사용된 것들 예컨대 플라스미드, 바이러스, 인공 염색체, BAC, YAC, 또는 PAC를 포함한다. 용어 "벡터"는 클로닝 및 발현 벡터, 뿐만 아니라 바이러스성 벡터 및 통합 벡터를 포함한다. "발현 벡터"는 조절성 영역을 포함하는 벡터이다. 매우 다양한 숙주/발현 벡터 조합은 본원에 기재된 핵산 서열을 발현시키는데 사용될 수 있다. 적당한 발현 벡터는, 비제한적으로, 예를 들어, 박테리오파지, 배큘로바이러스, 및 레트로바이러스에서 유래된 플라스미드 및 바이러스성 벡터를 포함한다.
본원에 제공된 벡터는 또한, 예를 들어, 복제의 기원, 스캐폴드 부착 영역 (SAR), 및/또는 마커를 포함할 수 있다. 마커 유전자는 숙주 세포에 선택가능한 표현형을 부여할 수 있다. 예를 들어, 마커는 살생물제 내성, 예컨대 항생제 (예를 들면, 카나마이신, G418, 블레오마이신, 또는 하이그로마이신)에 대한 내성을 부여할 수 있다. 상기 언급된 경우에, 발현 벡터는 발현된 폴리펩타이드의 조작 또는 검출 (예를 들면, 정제 또는 국소화)을 용이하게 하도록 설계된 태그 서열을 포함할 수 있다. 태그 서열, 예컨대 녹색 형광성 단백질 (GFP), 글루타티온 S-트랜스퍼라제 (GST), 폴리히스티딘, c-myc, 헤마글루티닌, 또는 Flag™ 태그 (Kodak, New Haven, CT) 서열은 전형적으로 인코딩된 폴리펩타이드와의 융합으로서 발현된다. 상기 태그는 어느 한쪽 카르복실 또는 아미노 말단에 포함하여, 폴리펩타이드 내에서 어느 곳에 삽입될 수 있다.
추가의 발현 벡터는 또한, 예를 들어, 염색체성, 비-염색체성 및 합성 DNA 서열의 세그먼트를 포함할 수 있다. 적당한 벡터는 SV40의 유도체 및 알려진 박테리아성 플라스미드, 예를 들면, E. 콜리 플라스미드 col E1, pCR1, pBR322, pMal-C2, pET, pGEX, pMB9 및 그들의 유도체, 플라스미드 예컨대 RP4; 파지 DNA, 예를 들면, 파지 1의 수많은 유도체, 예를 들면, NM989, 및 기타 파지 DNA, 예를 들면, M13 및 사상 단일 가닥 파지 DNA; 효모 플라스미드 예컨대 2μ 플라스미드 또는 이의 유도체, 진핵성 세포에서 유용한 벡터, 예컨대 곤충 또는 포유류 세포에서 유용한 벡터; 플라스미드 및 파지 DNA, 예컨대 파지 DNA 또는 기타 발현 대조군 서열을 이용하도록 변형된 플라스미드의 조합에서 유래된 벡터를 포함한다.
벡터는 조절성 영역을 또한 포함할 수 있다. 용어 "조절성 영역"은 전사 또는 번역 개시 및 속도, 그리고 전사 또는 번역 산물의 안정성 및/또는 이동성에 영향을 주는 뉴클레오타이드 서열을 지칭한다. 조절성 영역은, 비제한적으로, 프로모터 서열, 인핸서 서열, 반응 요소, 단백질 인식 부위, 유도성 요소, 단백질 결합 서열, 5' 및 3' 미번역된 영역 (UTR), 전사적 시작 부위, 종료 서열, 폴리아데닐화 서열, 핵 국소화 신호, 및 인트론을 포함한다.
본원에 사용된 경우에, 용어 "작동가능하게 결합된"은 그와 같은 서열의 전사 또는 번역에 영향을 주기 위해 핵산에서 전사되도록 조절성 영역 및 서열의 위치화를 지칭한다. 예를 들어, 코딩 서열을 프로모터의 통제 하에 두기 위해, 폴리펩타이드의 전사적 판독 프레임의 번역 개시 부위는 전형적으로 프로모터의 하류에 1 내지 약 50개 뉴클레오타이드 사이 위치된다. 프로모터는, 하지만, 번역 개시 부위의 상류에 약 5,000개 뉴클레오타이드 또는 전사 시작 부위의 상류에 약 2,000개 뉴클레오타이드 만큼 위치될 수 있다. 프로모터는 전형적으로 적어도 코어 (기본) 프로모터를 포함한다. 프로모터는 또한 적어도 하나의 대조군 요소, 예컨대 인핸서 서열, 업스트림 요소 또는 업스트림 활성화 영역 (UAR)을 포함할 수 있다. 포함될 프로모터의 선택은, 비제한적으로, 효율성, 선택성, 유도성, 원하는 발현 수준, 및 세포- 또는 조직-우선적 발현을 포함하는 몇몇 인자에 의존한다. 코딩 서열에 비해 프로모터 및 기타 조절성 영역을 적절하게 선택하고 위치시킴으로써 코딩 서열의 발현을 조절하는 것이 당업자에게 일상적인 문제이다.
AS-SPIK 또는 NS-SPIK 핵산 서열을 포함하는 벡터는 세포, 즉, 원핵 또는 진핵 세포, 예를 들어, 포유류 세포에 의한 흡수를 촉진시키는 방식으로 제형화될 수 있다. 유용한 벡터 시스템 및 제형은 상기 기재된다. 일부 구현예에서 벡터는 조성물을 특이적 세포 유형에 전달할 수 있다. 하지만 본 발명은 그렇게 제한되지 않고, 예를 들어 인산칼슘, DEAE 덱스트란, 리포솜, 리포플렉스, 계면활성제, 및 퍼플루오로 화학 액체를 사용하는, 기타 DNA 전달 방법 예컨대 화학적 형질감염은, 물리적 전달 방법, 예컨대 전기천공법, 미세 주사, 탄도 입자, 및 "유전자 총" 시스템과 같이, 또한 고려된다. 일부 구현예에서, 본 발명의 폴리뉴클레오타이드는 미세전달 비히클 예컨대 양이온성 리포솜, 기타 지질-함유 복합체, 및 폴리뉴클레오타이드의 숙주 세포로의 전달을 매개할 수 있는 기타 거대분자성 복합체와 또한 사용될 수 있다. 또 다른 전달 방법은 발현된 산물을 세포내로 생산할 수 있는 단일 가닥 DNA 생산 벡터를 사용하는 것이다.
본원에 기재된 항체의 생산 방법을 제공하는 것이 본 발명의 또 다른 양태이다. 항체가 화학적 합성에 의해 제조될 수 있어도, 이들은 재조합 DNA 기술의 방법, 예컨대 단일 재조합 숙주 세포에서 단백질을 구성하는 모든 쇄의 공-발현, 또는 중쇄 폴리펩타이드 및 항체, 예를 들면, 인간 항체의 공-발현에 의해 전형적으로 생산된다. 이외에도, 항체 중쇄 및 경쇄는 단일 폴리시스트론성 발현 벡터를 사용하여 또한 발현될 수 있다. 개별 폴리펩타이드의 정제는 표준 단백질 정제 기술 예컨대 친화성 (단백질 A) 크로마토그래피, 크기 배제 크로마토그래피 및/또는 소수성 상호작용 크로마토그래피를 사용하여 달성된다.
적당한 약학적으로 허용가능한 담체와의 혼합물에서 본 발명의 하나 이상의 단백질을 포함하는 약학적 조성물을 제공하는 것이 본 발명의 또 다른 양태이다. 본원에 사용된 경우에 약학적으로 허용가능한 담체, 비제한적으로, 아쥬반트, 고체 담체, 물, 완충액, 또는 치료적 구성요소를 보유하기 위해 당업계에서 사용된 기타 담체, 또는 이들의 조합이 예시된다.
본 발명에 따라 사용된 단백질 (예를 들면, 항체)의 치료적 제형은 원하는 정도의 순도를 갖는 단백질을 임의적 약학적으로 허용가능한 담체, 부형제 또는 안정화제와 (예를 들면 Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980), 참고), 예컨대 동결건조된 제형 또는 수용액의 형태로 혼합시킴으로써 보관을 위하여 제조된다. 허용가능한 담체, 부형제, 또는 안정화제는 이용된 투약량 및 농도에서 수령체에 비독성이고, 완충액 예컨대 포스페이트, 시트레이트, 및 기타 유기 산; 아스코르브산 및 메티오닌을 포함하는 항산화제; 보존제 (예컨대 옥타데실디메틸벤질 암모늄 클로라이드; 헥사메토늄 클로라이드; 벤잘코늄 클로라이드, 벤제토늄 클로라이드; 페놀, 부틸 또는 벤질 알코올; 알킬 파라벤 예컨대 메틸 또는 프로필 파라벤; 카테콜; 레조르시놀; 사이클로헥산올; 3-펜탄올; 및 m-크레졸); 저분자량 (약 10개 미만 잔기) 폴리펩타이드; 단백질, 예컨대 혈청 알부민, 젤라틴, 또는 면역글로불린; 친수성 중합체 예컨대 폴리비닐피롤리돈; 아미노산 예컨대 글리신, 글루타민, 아스파라긴, 히스티딘, 아르기닌, 또는 라이신; 단당류, 이당류, 및 글루코스, 만노오스, 또는 덱스트린을 포함하는 기타 탄수화물; 킬레이트 제제 예컨대 EDTA; 당류 예컨대 수크로스, 만니톨, 트레할로스 또는 소르비톨; 염-형성 반대-이온 예컨대 나트륨; 금속 복합체 (예를 들면 Zn- 단백질 복합체); 및/또는 비-이온성 계면활성제 예컨대 TWEEN™, PLURONICS™ 또는 폴리에틸렌 글리콜 (PEG)을 포함한다.
사용 방법
본원에 개시된 조성물은 AS-SPIK의 발현을 특징으로 하는 장애의 진단 및/또는 치료에 일반적으로 및 다양하게 유용하다. 상기 장애는, 비제한적으로, 암, 바이러스성 감염, 및 염증성 장애를 포함한다. 하나의 두드러진 예는 간암이다. 기타 비-제한 예는 용어 "암"의 정의와 관련하여 본원에 기재된 그들 암을 포함한다. 따라서, 본 발명의 양태는 상기 암을 갖는, 또는 상기 암 발병의 위험에 처한 대상체에서 암 (예를 들면, 간암)을 진단하고/거나 치료하는 방법을 포함한다. 용어들 "대상체", "환자", 및 "개체"는 본원에 교환가능하게 사용된다.
일부 구현예에서, 본 방법은 대상체로부터 생물학적 테스트 샘플을 AS-SPIK 항체 또는 항원-결합 단편과 접촉시켜 AS-SPIK-항체 복합체를 생성하는 단계; 생물학적 테스트 샘플에서 AS-SPIK-항체 복합체의 농도를 검출하는 단계; 및 AS-SPIK-항체 복합체의 농도를 기준값에 비교하여 대상체가 장애를 갖거나 상기 발병의 위험에 처한 지를 결정하는 단계를 포함한다. 특정 구현예에서, 본 방법은 생물학적 테스트 샘플을 SPIK에 결합하는 제1 항체 또는 항원-결합 단편과 접촉시켜 SPIK-항체 복합체를 생성하는 단계; SPIK-항체 복합체를 AS-SPIK 항체 또는 항원-결합 단편과 접촉시켜 생물학적 테스트 샘플에서 AS-SPIK-항체 복합체를 생성하는 단계; 및 AS-SPIK-항체 복합체의 농도를 기준값에 비교하여 대상체가 장애를 갖거나 상기 발병의 위험에 처한 지를 결정하는 단계를 포함한다. 상기 방법에서 활용될 수 있는 항체의 몇몇 비-제한 예는 본원에 기재된다.
일부 구현예에서, 본 방법은, 본원에 기재된 경우에, 항체, 또는 이의 항원-결합 단편, 또는 항체-약물 접합체의 치료적으로 유효량을 AS-SPIK의 발현을 특징으로 하는 질환 또는 장애로 고통받는 환자에 투여하는 단계를 포함한다.
간암
AS-SPIK의 발현을 특징으로 하는 장애의 하나의 두드러진 예는 간암이다. 간암은 간에 손상 또는 약화된 간 기능을 초래하는 광범위한 병태를 포괄한다. 간암은, 예를 들어, 감염원, 질환, 외상, 또는 유전적 병태나 감염원, 질환, 외상, 및 유전적 병태의 조합에서 비롯할 수 있다.
간암은 비정상 세포 성장을 포함하는 질환, 예컨대 원발성 간암, 예를 들어, 간세포 암종, 담관암종, 혈관육종, 및 간모세포종을 포함할 수 있다. 상기 암은 질환 진행의 임의의 병기, 예컨대 초초기로부터 HCC (바르셀로나 클리닉 간암 시스템 (BCLC) 0 기 및 종양 크기 < 2cm), 초기 (BCLC A 기, 2cm 내지 5cm의 종양 크기), 중기 (BCLC B 기, 중간 종양 크기 > 5cm), 말기 (BCLC C 및 D 기, 진전된 병기), 또는 전이성 병기, (Pons 등, HPB 2005;7(1):35-41 및 ICC 초기 (I, II 및 IIIa 기, 종양 크기 < 2cm), 중기 (IIIb 및 IIIc 기, 종양 크기 > 2cm), 및 말기 (IV 기)로부터 ICC (Farges 등, Cancer 2011; 117(10):2170-2177)에서 암을 포함할 수 있다.
간암은 바이러스, 예컨대 B형 간염, C형 간염, 및 D형 간염에 의해 야기된 감염성 질환에 의해 또한 유도될 수 있다. 특정 간염 바이러스에 관계 없이, 상기 감염은 어느 한쪽 급성 또는 만성일 수 있다.
간암은 간 손상, 예를 들어, 간 간경변으로부터 또한 발생할 수 있다. 말기의 반흔 또는 간 섬유증인, 간경변은 많은 형태들의 간 질환 및 병태에 의해 야기될 수 있다. 간경변은 유전적 병태, 예를 들어 혈색소 침착증, 낭포성 섬유증, 윌슨병, 및 자가면역 장애의 결과로서 발생할 수 있다. 간경변은 간염 바이러스성 감염 및 알코올 소비로부터 또한 발생할 수 있다.
간암은 또한 비제한적으로 알코올성 간 질환, 간에서 비정상 지방 함량에 관련된 장애 예컨대 지방 간, 비-알코올성 지방 간 질환, 비-알코올성 지방증, 및 간 섬유증을 포함하는 기타 질환에 의해 야기될 수 있다.
생물학적 샘플
"생물학적 샘플", "테스트 샘플" 또는 "샘플"은 환자에서 수득된 또는 유래된 샘플을 지칭한다. 샘플은, 예를 들어, 체액 샘플일 수 있다. 예시적 체액 샘플은 혈액, 혈청, 혈장, 소변, 타액, 정액, 대변, 가래, 뇌척수액, 눈물, 점액, 양수, 또는 이들의 임의의 조합을 포함한다. 일부 구현예에서, 생물학적 샘플은 조직 샘플일 수 있다. 예시적 조직 샘플은 생검 표본, 예컨대 간 생검 표본, 또는 환자의 세포로부터 제조된 일차 세포 배양 표본, 또는 일차 배양으로부터 상청액을 포함한다.
면역검정
본 발명의 양태는 테스트 샘플에서 AS-SPIK의 존재 또는 부재를 검출하는데 사용될 수 있는 진단적 검정 방법, 예를 들면, 진단적 면역검정을 포함한다. AS-SPIK의 검출에 사용된 면역검정 형식은 다양한 방식으로 구성될 수 있다. 면역검정은 양쪽 동종 및 이종 검정, 경쟁적 및 비-경쟁적 검정, 직접 및 간접 검정, 그리고 "샌드위치" 검정을 포함할 수 있다. 유용한 형식은, 비제한적으로, 효소 면역검정, 예를 들어, 효소 결합 면역흡착 검정 (ELISA), 화학발광 면역-검정 (CLIA), 전기화학발광 검정, 방사면역검정, 면역형광, 형광 이방성, 면역침전, 평형 투석, 면역확산, 면역블롯팅, 응집, 발광 근접 검정, 및 비구측정법을 포함한다.
형식에 관계 없이, 생물학적 샘플은 본 발명의 항-AS-SPIK 항체와 접촉된다. 일부 구현예에서, 생물학적 샘플은 고체 지지체에서 부동화될 수 있다. 일부 구현예에서, 생물학적 샘플은 고체 지지체에서 부동화된 본 발명의 항-SPIK 항체와 접촉된다. 고체 지지체는, 예를 들어, 플라스틱 표면, 유리 표면, 종이 또는 섬유성 표면, 또는 입자의 표면일 수 있다. 더욱 구체적으로, 지지체는 마이크로플레이트, 비드, 폴리비닐리덴 디플루오라이드 (PVDF) 막, 니트로셀룰로오스 막, 나일론 막, 다공성 막, 비다공성 막을 포함할 수 있다. 기질의 조성은 가변될 수 있다. 예를 들어, 기질 또는 지지체는 유리, 셀룰로스-기반된 물질, 열가소성 중합체, 예컨대 폴리에틸렌, 폴리프로필렌, 또는 폴리에스테르, 미립자 물질 (예를 들면, 유리 또는 각종 열가소성 중합체)로 구성된 소결 구조, 또는 니트로셀룰로스, 나일론, 또는 폴리술폰으로 구성된 캐스트 막 필름을 포함할 수 있다. 일반 구현예에서, 기질은, 고체 지지체 (예를 들면, 유리 예컨대 유리 슬라이드 또는 코팅된 플레이트, 실리카, 플라스틱 또는 유도체화된 플라스틱, 상자성 또는 비-자성 금속), 반-고체 지지체 (예를 들면, 중합체성 물질, 젤, 아가로스, 또는 기타 매트릭스), 및/또는 다공성 지지체 (예를 들면, 필터, 나일론 또는 니트로셀룰로스 막 또는 기타 막) 중 하나 이상을 포함하는, 항체 또는 폴리펩타이드가 부동화될 수 있는 임의의 표면 또는 지지체일 수 있다. 일부 구현예에서, 합성 중합체는, 예를 들면, 폴리스티렌, 폴리프로필렌, 폴리글리시딜메타크릴레이트, 아민화 또는 카르복실화 폴리스티렌, 폴리아크릴아미드, 폴리아미드, 및 폴리비닐클로라이드를 포함하여, 기질로서 사용될 수 있다.
일부 구현예에서, 면역검정 형식은 2개 항체 "샌드위치" 검정일 수 있다. 생물학적 샘플은 고체 지지체, 예를 들어, 미량정량판에서 부동화된 본 발명의 항-SPIK 항체와 접촉된다. 샘플 및 제1 항체는 SPIK-항체 복합체의 특이적 결합 및 형성을 선호하는 조건 하에서 인큐베이션된다. 접촉하기 단계 이후, 생물학적 샘플의 미결합된 구성성분은 제거된다. 그 다음, 복합체는 제2 항-SPIK 항체와 접촉된다. 제2 항체는 제1 항체에 의해 결합된 에피토프보다 상이한 SPIK 에피토프에 결합한다. 그래서, 제1 및 제2 항체는 SPIK에 결합에 대하여 서로 경쟁적으로 억제시키지 않는다. 일부 구현예에서, 제1 항체는 양쪽 AS-SPIK 및 NS-SPIK에 존재하는 에피토프, 즉, 항원 결정인자를 인식할 수 있다. 우리는 이와 같은 항체를 "범-SPIK" 항체로서 지칭할 수 있다. 대안적으로, 제1 항체는 AS-SPIK에서만 존재하는 에피토프를 인식할 수 있다. 일부 구현예에서, 제2 항체는 양쪽 AS-SPIK 및 NS-SPIK에서 존재하는 에피토프, 즉, 항원 결정인자를 인식할 수 있다. 대안적으로, 제2 항체는 AS-SPIK 또는 NS-SPIK에서만 존재하는 에피토프를 인식할 수 있다. 그래서, 샌드위치 검정은 제1 항체가 범-SPIK 항체이고 제2 항체가 AS-SPIK에 특이적으로 또는 우선적으로 결합하고 NS-SPIK에 특이적으로 결합하지 않도록 구성될 수 있다. 대안적으로, 샌드위치 검정은 양쪽 제1 및 제2 항체가 AS-SPIK에 특이적으로 또는 우선적으로 결합하고 NS-SPIK에 특이적으로 결합하지 않도록 구성될 수 있다.
항체 결합은 다양한 방식으로 측정될 수 있다. 예를 들어, 검출가능한 표지에 의해 생성된 신호는 분석될 수 있고, 적용가능하면, 복합체 형성과 연관된 신호, 예를 들어 형광성 신호 발광성 신호, 또는 인광성 신호, 또는 방사능 신호의 측정을 허용하는 광학 스캐너 또는 기타 이미지 획득 장치 및 소프트웨어를 사용하여 정량화될 수 있다. 검출가능한 신호를 측정하기 위한 예시적 기기장치는 비제한적으로 마이크로플레이트 판독기, 형광계, 분광광도계 및 감마 계수기를 포함할 수 있다.
참조 샘플
생물학적 샘플에서 AS-SPIK의 수준은 참조 샘플의 것과 비교될 수 있다. 표준 참조 수준은 전형적으로 개체들의 집단에서 유래된 평균 AS-SPIK 수준을 대표한다. 참조 집단은 해당 개체와 비슷한 연령, 신체 크기, 민족 배경 또는 일반적인 건강의 개체를 포함할 수 있다. 그래서, 환자의 샘플에서 AS-SPIK 수준은 1) 간암을 갖는 것으로 알려지고 AS-SPIK를 발현시키고 체액이 AS-SPIK를 함유하는 개체; 2) 간암을 갖지 않고 체액이 낮은 수준의 AS-SPIK를 함유하는 개체에서 유래된 값과 비교될 수 있다.
일반적으로, AS-SPIK의 상승된 수준은 어느 한쪽 대조군 샘플에서 찾아진 AS-SPIK의 수준보다 더 큰, 바람직하게는 적어도 1, 2, 3, 4 또는 5% 더 큰, 더욱 바람직하게는 적어도 5% 더 큰 또는 간암을 갖지 않는 정상 건강한 개체의 집단으로부터 샘플에서 찾아진 AS-SPIK의 평균 수준 (기준값)보다 더 큰 AS-SPIK의 임의의 수준일 수 있다. AS-SPIK의 감소된 수준은 어느 한쪽 대조군 샘플에서 찾아진 AS-SPIK의 수준보다 적은 또는 간암을 갖는 개체의 집단으로부터 샘플에서 찾아진 AS-SPIK의 평균 수준보다 적은 AS-SPIK의 임의의 수준일 수 있다. 임의의 집단 크기는 정상 건강한 개체의 집단으로부터 샘플에서 찾아진 AS-SPIK의 평균 수준을 결정하는데 사용될 수 있다. 예를 들어, 2 내지 250, 예를 들면, 2, 3, 4, 5, 10, 15, 20, 25, 30, 40, 50, 100, 150, 200, 250 또는 그 이상 개체들의 집단은, 더 큰 샘플 집단에서 나오는 측정에서 더 큰 정확도로, 정상 건강한 개체의 집단으로부터 샘플에서 AS-SPIK의 평균 수준을 결정하는데 사용될 수 있다.
일부 구현예에서, 참조 차트는 샘플에서 AS-SPIK의 특정한 수준이 대조군 샘플 또는 더 큰 집단에 비해 상승되는지 아닌지 여부를 결정하는데 사용될 수 있다. 예를 들어, 참조 차트는 해당 개체와 동일 연령, 민족 배경 또는 일반적인 건강의 건강한 개체에서 찾아진 AS-SPIK의 정상 범위를 함유할 수 있다. 이러한 참조 차트를 사용하여, 샘플에서 측정된 AS-SPIK의 임의의 수준은 대조군 샘플에 비해 또는 더 큰 집단에서 유래된 평균 값에 비해 낮은, 정상, 또는 상승된 것으로서 분류될 수 있다. 용어 "상승된 수준"은 참조 수준보다 더 높은, 바람직하게는 적어도 2% 더 높은, 더욱 바람직하게는 적어도 5% 더 높은 수준으로서 정의된다.
대안적으로, 또는 이외에도, 생물학적 샘플에서 AS-SPIK의 수준은 하나 이상의 추가의 생물학적 마커, 예를 들어 발현이 AS-SPIK의 발현에 독립적인 또 다른 마커의 수준에 대해 "정규화"될 수 있다. 즉, 추가의 마커의 수준은 어느 한쪽 동일한 시간에 또는 별도 경우에 AS-SPIK의 것들과 병행하여 평가될 수 있다. 추가의 마커는 샘플 제조, 취급 및 보관 뿐만 아니라 나날의 검정 변동성에 대하여 내부 제어의 역할을 할 수 있다. 수준 AS-SPIK 및 추가의 마커에 대한 값은 비율로서 표현될 수 있고 비율은 참조 샘플 또는 집단에 대하여 수득된 유사한 비율과 비교될 수 있다. 유용한 제2 마커는 알파-태아단백질일 수 있다.
일부 구현예에서, 본 방법은 표준 참조 세트의 사용을 포함할 수 있다. 참조 세트는 정제된 SPIK 폴리펩타이드 또는 이의 단편의 하나 이상의 샘플을 포함할 수 있다. 여러 샘플이 사용되는 경우, 이들은 상이한 농도일 수 있다. 일 구현예에서, 참조 세트는 AS-SPIK의 50ng/ml, 30ng/ml, 8ng/ml, 3ng/ml, 1ng/ml 및 0 ng/ml의 농도에서 재조합 AS-SPIK의 6개 샘플을 포함할 수 있다. 재조합 AS-SPIK는 어느 한쪽 항-AS-SPIK 항체 예컨대 IM-CA22 또는 항-태그 항체를 사용하여 친화성 크로마토그래피 (HPLC)로 정제될 수 있다. 혈액 또는 기타 체액에서 기준값은 가변할 수 있다. 하지만, 숙련된 사람은 각각의 집단의 상이한 체액에서 AS-SPIK의 평균 수준을 결정하는 그리고 각각의 기준값을 결정하는 위치에 있고, 이는 결정될 간암을 갖는 환자에서 AS-SPIK의 수준이 기준값보다 훨씬 높은 반면, 검출될 간암으로 고통받지 않는 환자의 또는 건강한 개체의 수준이 각각의 기준값보다 훨씬 낮다는 것을 보장한다. 바람직한 구현예에서, 기준값은 정상 건강한 개체의 집단으로부터 샘플에서 찾아진 AS-SPIK의 평균 수준보다 약 5%, 더욱 바람직하게는 약 7%, 더더욱 바람직하게는 약 10% 더 높다. 비교가능성이 주어지도록, 생물학적 샘플에서 그리고 대조군 샘플에서 AS-SPIK의 수준이 동일한 방법을 통해 결정되는 것이 유의된다. 예를 들면 AS-SPIK 수준의 절대 값은 상기 기재된 경우에 재조합 AS-SPIK를 사용하여 보정 곡선을 통해 결정될 수 있다.
대조군 샘플
일부 구현예에서, 양성 대조군은 진핵 세포 또는 세포주에 의해 생산된 AS-SPIK의 샘플을 포함할 수 있다. 예를 들어, 유용한 대조군은 안정한 세포주 S2-3으로부터 AS-SPIK의 100 ng/ml를 함유하는 배지일 수 있다. 이것은 AS-SPIK를 과-발현시켰던 인공 촉진물의 제어 하에서 HCC 세포의 염색체에 AS-SPIK의 DNA 서열을 삽입함으로써 본 발명자에 의해 창출되었다.
본원에 개시된 방법은 간암을 갖는 것으로 의심되거나 상기 위험에 처한 환자에 있어서 간암의 검출에서 유용하다. 본 방법은, 환자가 간세포 암종의 관해를 경험하기 위하여 위험에 처한 지를 결정하기 위해, 간암, 예를 들어, 간세포 암종으로 치료된 환자로부터 샘플의 분석에서 또한 사용될 수 있다. 본 방법은 치료의 효능을 결정하기 위해 그리고 필요하면 관리하는 임상의에게 치료를 변경시키게 하기 위해 치료, 예를 들어 치료적 제제 예컨대 작은 분자 약물 또는 치료적 항체, 화학요법, 방사선 요법 또는 수술을 이용한 치료의 과정을 모니터링하는데 또한 사용될 수 있다. 본 방법은 환자로부터 수득된 생물학적 샘플, 예를 들어, 혈액 또는 혈청 샘플에 있어서 AS-SPIK의 수준에서 조정, 예를 들어 증가와 연관되는 임의의 장애로 고통받거나 상기 위험에 처한 환자의 검출, 모니터링, 또는 분석에서 또한 사용될 수 있다.
본원에 개시된 방법은 기타 표준 진단적 방법, 예를 들어 간 효소 또는 알파-태아단백질의 혈청학적 분석, 초음파 (초음파촬영), 컴퓨터 단층촬영 (CT 스캔), 자기 공명 영상 (MRI), 혈관조영술, 복강경, 또는 생검과 함께 사용될 수 있다.
제조 물품
본원에 기재된 조성물은, 예를 들어, 생물학적 샘플에서 AS-SPIK의 검출, 식별, 및 정량화에서 사용을 위하여 표지화된 적당한 용기에 패키징될 수 있다. "키트"로서 또한 지칭된 제조 물품은 항체, 항체의 항원-결합 단편, 및/또는 본 발명의 항체-약물 접합체, 배지, 양성 대조군으로서 사용을 위한 항원의 정제된 샘플, 또는 이들의 임의의 조합을 포함할 수 있다. 키트에서 포함된 용기는 NS-SPIK가 아닌 AS-SPIK에 특이적으로 또는 우선적으로 결합하는 본 발명의 항체를 포함하는 조성물을 포함할 수 있다. 키트는 양쪽 AS-SPIK 및 NS-SPIK에 결합하는 항체를 또한 포함할 수 있다. 테스트 샘플 및 항체를 희석하기 또는 재구성하기에 적당한 완충액이 또한 제공될 수 있다. 구성요소들의 일부는 건조 형태로 제공될 수 있고, 재구성을 필요로 할 수 있다. 항-SPIK 항체는 검정 장치, 예를 들어, 마이크로플레이트에 사전-결합될 수 있다. 그래서, 일 구현예에서, AS-SPIK의 검출, 식별 및 정량화를 위한 키트는 항-AS-SPIK 항체 및 범-SPIK 항체를 포함한다. 키트는 검출가능한 표지를 임의로 포함할 수 있다.
따라서, 본 발명의 적어도 하나의 조성물, 예를 들면, 항-AS-SPIK 항체를 포함하는, 패키징된 제품 (예를 들면, 본원에 기재된 조성물들 중 하나 이상을 함유하고 농축된 또는 즉시 사용가능한 농도로 저장, 선적, 또는 판매를 위하여 패키징된 멸균 용기) 및 키트가 또한 본 발명의 범위 내에 있다. 제품은 본 발명의 하나 이상의 조성물을 함유하는 용기 (예를 들면, 바이알, 단지, 병, 백, 또는 기타 등등)를 포함할 수 있다. 이외에도, 제조 물품은 추가로, 예를 들어, 진단 또는 치료가 필요한 병태를 치료하기 또는 모니터링하기 위하여 패키징 물질, 사용 설명서, 주사기, 전달 장치, 완충액 또는 기타 대조군 시약을 포함할 수 있다.
특정한 유형의 검정을 위한 시약은 본 발명의 키트에서 또한 제공될 수 있다. 그래서, 본 키트는 (예를 들면, 응집 검정 또는 측면 유동 검정에 적당한) 비드, 또는 플레이트 (예를 들면, ELISA 검정에 적당한 플레이트)의 집단을 포함할 수 있다. 기타 구현예에서, 본 키트는 장치, 예컨대 측면 유동 면역검정 장치, 분석 회전자, 또는 전기화학, 광학, 또는 광전자 센서를 포함한다. 비드, 플레이트, 및 장치의 집단은 면역검정을 수행하는데 유용하다. 예를 들어, 이들은 제1 제제-분석물-제2 제제 복합체의 형성을 검출하는데 유용할 수 있다.
이외에도, 본 키트는 각종 희석제 및 완충액, 특이적으로 결합된 항원 또는 항체의 검출을 위한 표지화된 접합체 또는 기타 제제, 및 기타 신호-생성 시약, 예컨대 효소 기질, 보조인자 및 발색체를 포함할 수 있다. 본 키트는 가변하는 농도의 하나 이상의 참조 샘플, 예를 들어, 정제된 재조합 AS-SPIK를 포함할 수 있다. 본 키트는 양성 대조군, 예를 들어 AS-SPIK를 과발현시키는 세포주로부터 세포 상청액을 또한 포함할 수 있다. 키트의 기타 구성요소는 코팅 시약, 테스트될 항원 또는 분석물에 특이적인 다클론성 또는 단클론성 포착 항체, 또는 항체들의 2개 이상의 칵테일, 표준으로서 이들 항원들의 정제된 또는 절반-정제된 추출물, 단클론성 항체 검출기 항체, 거기에 접합된 지시약 분자가 있는 항-마우스, 항-개, 항-닭, 또는 항-인간 항체, 비색 비교를 위한 지표 차트, 일회용 장갑, 오염 제거 지침, 어플리케이터 스틱 또는 용기, 샘플 준비 컵 등을 포함할 수 있다. 일 구현예에서, 키트는 펩타이드-항체 복합체의 형성을 허용하는 반응 배지를 구성하는데 적절한 완충액 또는 기타 시약을 포함한다.
상기 키트는 대상체가 간암을 갖거나 상기 위험에 처한 지를 결정하기 위해 임상의에 편리한, 효율적인 방식을 제공한다. 그래서, 특정 구현예에서, 본 키트는 추가로 사용 설명서를 포함한다. 제품은 범례 (예를 들면, 제품 사용을 설명하는 인쇄된 표지 또는 삽입물 또는 기타 매체 (예를 들면, 오디오- 또는 비디오테이프))를 또한 포함할 수 있다. 범례는 용기와 연관 (예를 들면, 용기에 부착)될 수 있고 검정이 수행되어야 하는 방식, 그에 대한 표시, 및 기타 용도를 설명할 수 있다.
하기 실시예는 실례적 목적으로만 제공되고, 임의의 방식으로 본 발명의 범위를 제한하기 위한 것은 아니다. 몇몇 구현예가 본 개시내용에서 제공되었어도, 개시된 조성물 및 방법이 본 개시내용의 사상 또는 범위에서 이탈 없이 많은 기타 특이적 형태로 구체화될 수 있음이 이해되어야 한다. 본 실시예는 제한적이지 않고 실례적으로 간주되어야 하고, 본 발명은 본원에 주어진 상세에 제한되지 않아야 한다. 변화, 치환, 및 변경의 각종 예는 당업자에 의해 확인가능하고 본원에 개시된 사상 및 범위에서 이탈 없이 실시될 수 있다.
실시예
실시예 1. AS-SPIK는 NS-SPIK보다 더 크다
세린 프로테아제 억제제 카잘 (SPIK/SPINK1)은 79개 아미노산을 가진 작은 분비된 단백질이다 (4). 정상적으로, 분비된 SPIK 단백질은, 56개 잔기만을 함유하는 분비된 단백질을 초래하는, 신호 펩타이드로서 작용한다고 믿어지는, 이의 N-말단에서 23개 아미노산의 제거로 인해 유전적 SPIK보다 더 짧다 (14, 15). 하지만, 간암 세포에서, AS-SPIK는 이러한 추가의 단편을 보유하고 그러므로 NS-SPIK보다 더 크다. AS-SPIK와 NS-SPIK 사이 이러한 조성적 차이는 크기 분석 (겔 전기영동) 및 Edman Degradation-기반된 단백질 서열분석에 의해 확인된다. 간단히, AS-SPIK는 AS-SPIK의 높은 수준을 발현시키는 우리가 작제하였던 세포주인, S2-3 세포의 배지로부터 정제되었고 (16), NS-SPIK는 HPLC를 사용하여 췌장 세포의 배지로부터 정제되었다. 1μg의 각 단백질은 5-15% 구배 SDS-PAGE 겔 (Invitrogen, Carlsbad, CA)에서 운용되었다. PVDF 막으로 옮긴 후, 단백질은 Coomassie Blue 염색에 의해 시각화되었다. 이러한 테스팅으로부터 결과를 포착하는 도 1은 췌장 세포에 의해 생산된 NS-SPIK의 크기가 약 6.5KD이었음을 도시하고, 이는 공개된 서열 데이터 (서열번호: 4)와 일치하여, NS-SPIK에서 첫 23개 아미노산이 분비 동안 제거되는 것을 확인한다 (14, 17). 대조적으로, AS-SPIK의 크기는 대략 10 KD이었고 NS-SPIK보다 더 컸으며, 이는 전장 SPIK 단백질 (서열번호: 2)의 크기와 재차 일치한다.
AS-SPIK의 정확한 서열을 결정하기 위해, 상기 겔 전기영동으로부터 AS-SPIK 밴드는 막으로부터 절단되었다. Alphalyse Inc. (Palo Alto, CA)는, 도 2에서 도시된 결과로, Edman 분해 서열 분석을 수행하였다. 여기에서, S2-3 세포-분비된-SPIK의 N-말단에서 Edman 분해에 의해 예측된 서열은 적색으로 나타난다. Edman 분해 데이터는 AS-SPIK의 N-말단이 SPIK의 잔기 2-6의 서열을 매칭하였음 나타내어 (시작 코돈의 제1 메티오닌을 배제함) (도 2 참고), NS-SPIK에서 제거되는, ((M)K로 시작하는) SPIK의 N-말단에서 전체 23개 아미노산 서열이 분비 후 AS-SPIK에서 보유되었음을 시사한다. 양쪽 NS-SPIK 및 AS-SPIK의 전체 아미노산 서열은 도 3에서 도시되어, 이러한 차이를 강조한다.
실시예 2. AS-SPIK의 형태는 NS-SPIK의 것과 상이하다
AS-SPIK의 N-말단에서 이들 추가의 23개 잔기의 포함은 차례로 단백질의 형태를 변화시킨다. 이러한 변화는 AS-SPIK 및 NS-SPIK의 3D 구조를 비교함으로써 시각화된다. AS-SPIK의 결정체 구조는 CLISP 단백질 에피토프 맵핑 연구 (Pepscan, Lelystad, Netherlands)에 의해 결정되었고 NS-SPIK의 결정체 구조는 Hecht 등에 의해 동료-검토된 간행물로부터 취득되었다 (18). 양쪽 구조는 도 4에서 나란히 도시된다. 가시적 비교를 통해서, AS-SPIK와 NS-SPIK 사이 3개 형태적 차이는 식별될 수 있고, 이는 적색으로 윤곽이 그려진다. 박스 I은 양쪽 NS-SPIK 및 AS-SPIK의 N-말단을 보여준다. AS-SPIK에서 여분의 23-잔기 단편은 바깥쪽으로 내밀고 단백질의 본체를 지나 확장하고; 대조적으로, NS-SPIK의 N-말단은 단백질의 본체로부터 돌출하는 추가의 단편을 이다 갖지 않는다. 이러한 노출된 단편은 NS-SPIK가 아니고 AS-SPIK와 선택적으로 상호작용하는 기타 단백질, 예컨대 항체의 가능성을 크게 증가시킨다. 박스 II는 AS-SPIK의 더 긴 N-말단으로 인해, AS-SPIK에서 제1 루프가 NS-SPIK에서 상응하는 루프에 비교하여 더 평평하고 각도가 상이하다는 것을 보여준다. 이러한 차이는 AS-SPIK에서 제1 루프와 알파 나선 사이 더 많은 공간을 초래하고 (도 4, 박스 II), 이는 NS-SPIK에서 내부에 있고 접근불가능한 아미노산을 노출시킨다. 마지막으로, AS-SPIK의 더 긴 N-말단은 단백질의 N-말단과 알파-나선 사이 상대적 위치 및 거리를 또한 변화시킨다. AS-SPIK에서 알파 나선에 비해 N-말단의 낮은 위치는 박스 III에 결정체 구조에서 강조된다. 3차 구조에서 이들 형태적 변화 및 차이는 상이한 형태적 항체가 SPIK의 어느 한쪽 형태를 특이적으로 표적화하도록 생성될 수 있음을 시사한다.
실시예 3. NS-SPIK가 아닌 AS-SPIK에 선택적으로 결합하는 항체의 개발
상기에서 기재된 AS-SPIK와 NS-SPIK 사이 차이로 인해, NS-SPIK가 아닌, AS-SPIK를 단독으로 인식하는 항체를 개발하는 것이 가능하다. 이것의 증거로서, 우리는 양쪽 마우스 및 토끼에서 NS-SPIK가 아닌 AS-SPIK만을 결합시키는 대략 20개 단클론성 항체를 개발하였다. 동시에, 우리는 양쪽 AS-SPIK 및 NS-SPIK에 결합하는, 양으로부터 다클론성 항체를 개발하였다. 간단히, 마우스 및 토끼는 1) 태그 2) 링커 서열, 3) 서열번호: 6의 서브세트인 다양한 길이의 서열, 및 4) AS-SPIK 및 NS-SPIK (서열번호: 4)의 공통 영역으로 이루어진 일련의 재조합 단백질로 면역화되었다. 단클론성 항체를 개발하기 위해, 동물은 상기 기재된 서열을 가진 재조합 단백질로 주사되었다. 혈액은 4회 주사 후 테스트되었고, 단일 클론은 양성으로 테스트된 샘플에 대하여 확립되었다. NS-SPIK가 아닌 AS-SPIK에만 결합하는 항체를 식별하기 위해, 클론은 부분적으로 정제된 AS-SPIK 및 NS-SPIK로 코팅된 플레이트를 사용하는 ELISA 테스트에 의해 스크리닝되었다. AS-SPIK에 양성이지만 NS-SPIK에 음성으로 테스트된 것들이 그 다음 선택되었다. AS-SPIK에 최고 결합 친화성을 가진 세포주는 확장되었고 하이브리도마는 확립되었다. 생성된 항체는 그 다음 단백질 G 친화성 컬럼을 사용하여 세포 배양 배지로부터 정제되었다. 양에서 다클론성 항체를 생성하기 위해, 양은 상기 기재된 재조합 단백질들 중 하나로 면역화되었다. 4회 주사 후, 혈청은 수집되었고 다클론성 항체는 혈청으로부터 정제되었다.
도 5는 20개 단클론성 항체들의 이러한 그룹으로부터 8개 예시 항체: IM-A1, IM-B10, IM-C6, IM-E2, IM-CA22, IM-CA18, IM-CA46, IM-CA77 및 IM-Poly S (양으로부터 다클론성 항체)의 결합 테스트 결과를 도시하고 (이들 8개 항체의 서열은 표 3 및 4 (도 15 및 16) 제공되고, 미국 가특허 출원 시리얼 번호 62/639,850, PCT 특허 출원 번호 PCT/US19/20999 및 미국 가특허 출원 시리얼 번호 62/871565에서 또한 제공되고, 이들 출원의 개시내용은 그들 전체가 본원에 참고로 편입된다. 도 5는 이들 예시 단클론성 항체의 모두 8개가, 이들이 마우스 또는 토끼에서 개발되었든, AS-SPIK에 강하게 결합한다는 것을 도시한다. 대조적으로, NS-SPIK에 결합 활성은 음성 대조군 (도 5, Neg 대조군)과 유사한, 배경 수준에 있다. 예상된 대로, 다클론성 항체가 양쪽 NS-SPIK 및 AS-SPIK (도 5, Poly S)에 걸쳐서 공통일 수 있는 것들을 포함하여, 다양한 에피토프에 결합하는 여러 상이한 항체를 함유함에 따라, 다클론성 양 항체는 양쪽 AS-SPIK 및 NS-SPIK에 강하게 결합한다. 이러한 데이터는 NS-SPIK가 아닌 AS-SPIK에 선택적으로 결합하는 항체가 여러 동물 모델에서 개발될 수 있다는 것을 확인한다.
대조군으로서, 우리는, 양쪽 AS-SPIK 및 NS-SPIK (서열번호: 4)에서 공통 서열이고 도 4에서 녹색으로 채색되는, 서열 36ELNGCTKIYDPV47을 함유하는 펩타이드를 사용하여, 마우스에서 일련의 단클론성 항체를 동시에 개발하였다. 이것은, 양쪽 AS-SPIK 및 NS-SPIK (데이터 도시되지 않음)에 결합하는, 항체 IM-BA2의 생산으로 이어졌다. 하지만, 우리는 이러한 방법을 사용하여 NS-SPIK가 아닌 AS-SPIK에 특이적으로 결합하는 항체를 생성할 수 없어서, AS-SPIK에 특이적인 에피토프가 형태적이고 선형이 아님을 시사한다.
실시예 4. 항-AS-SPIK 항체는 형태-의존적이다
NS-SPIK가 아닌 AS-SPIK에 특이적인 에피토프가 형태-의존적이라는 관찰을 추가로 뒷받침하기 위해, 각종 합성된 펩타이드에 항체 결합을 평가하는 추가의 테스트는 완료되었다. AS-SPIK의 상이한 영역으로부터 서열을 각각 함유하는 4개 펩타이드는 BioMatik (Wilmington DE)에 의해 합성되었다. 펩타이드 A는 AS-SPIK의 전체 서열을 함유하지만, 시스테인 측기의 불활성화를 통해 임의의 디술피드 결합의 형성은 없었다. 펩타이드 B는 M1- G50으로부터 AS-SPIK의 단편의 서열을 함유하고, 펩타이드 C는 D23-G50으로부터 AS-SPIK의 단편의 서열을 함유하고 펩타이드 D는 N51-C79로부터 AS-SPIK의 단편의 서열을 함유한다. AS-SPIK 및 기타 펩타이드에 우리의 단클론성 항체의 결합 활성은 ELISA에 의해 테스트되었고 IM-CA22에 대한 결과는 도 6에서 도시된다. 유사한 결과는, IM-CA18, IM-CA46, IM-CA77, IM-A1, IM-A6, IM-B10, IM-C6, IM-D3, IM-D5, IM-E2, IM-F5, IM-G6 및 IM-G7을 포함하는, 우리가 개발하였던 모든 기타 단클론성 항-AS-SPIK 항체로부터 수득되었다. 간단히, 96-웰 플레이트는 천연 AS-SPIK 및 상이한 펩타이드로 코팅되었고, 플레이트는 그 다음 HRP로 표지화된 항-AS-SPIK 항체 (본원에 IM-CA22)와 반응되었다. OD450nm는 기질, TMB로 플레이트 인큐베이션 후 결정되었다. 도 6은 항체 IM-CA22가 천연 단백질만을 인식하지만, 전체 천연 AS-SPIK 서열을 함유하는, 펩타이드 A를 포함하는, 합성된 펩타이드들 중 임의의 것을 인식하지 않는다는 것을 도시한다. 이러한 결과는 추가로 항-AS-SPIK 항체가 형태-의존적 항체라는 관찰을 뒷받침한다. 대조적으로, 우리의 다클론성 항체 Poly S는 모든 합성된 펩타이드 뿐만 아니라 천연 AS-SPIK를 인식하여 (도 6, Poly S), Poly S에서 양쪽 선형 에피토프 항체 뿐만 아니라 형태-의존적 에피토프 항체가 있다는 것을 시사한다. 하지만, 이들 테스트 결과와 함께, 우리가 상기 식별하였던 형태에서 차이는 본원에 기재된 단클론성 항체가 형태-의존적 에피토프를 갖는다는 것을 강하게 논증한다.
실시예 5. 부류 I 및 부류 II 항-AS-SPIK 항체
항-AS-SPIK 항체의 가능한 결합 에피토프를 식별하기 위해, 우리는 우리가 개발하였던 항-AS-SPIK 항체들의 모두가 동일한 에피토프에 결합하는지를 시험하기 위해 ELISA 테스트 시스템을 확립하였다. 간단히, 우리는 한 플레이트를 1개 항체로 코팅하였고, 그 다음 상기 플레이트를 S2-3 세포로부터 천연 AS-SPIK로 인큐베이션시켰다. AS-SPIK가 플레이트에서 포착된 후, HRP로 표지화된 제2 항-AS-SPIK, 이어서 기질이 첨가되었다. OD 값은 색채가 발색된 후 결정되었다. 음성 결과가 수득되었다면, 이것은 포착 및 신호 항체가 동일한 에피토프에 또는 하나에 대한 그 결합이 다른 하나에 대한 결합을 억제할 만큼 충분히 가까운 에피토프에 결합한다는 것을 시사한다. 대조적으로, 양성 결과가 수득되었다면, 이는 이들 2개 항체가 상이한 에피토프에 결합한다는 것을 시사하고, 이는 양쪽이 동시에 상이한 항체에 의해 접근될 수 있도록 충분히 떨어져 있다. Poly S는 대조군으로서 사용되었다. 우리의 데이터는 우리가 개발하였던 항-AS-SPIK 항체들의 모두가 2개 부류: IM-CA22, IM-A1, IM-B10, IM-CA18, IM-D2, IM-D3, IM-D5 및 IM-G2를 포함하는 부류 I 항체, 및 IM-E2, IM-C6, IM-CA46, IM-CA77, IM-A6, IM-B3, IM-F5 및 IM-G6을 포함하는 부류 II 항체로 분할될 수 있다는 것을 논증한다. 이들 항체 부류의 정의하는 속성은 부류 I에서 임의의 항체가 부류 II에서 임의의 항체와 작업할 수 있다는 것이고, 그 반대도 마찬가지이다. 이것은 이들이 상기 기재된 ELISA 테스트에서 양성 결과를 제공하고, 샌드위치 ELISA에서 항체 쌍으로서 양호하게 기능할 수 있다는 것을 의미한다. 우리의 데이터는 또한 이들 항체들의 모두가 1개 또는 2개 상이한 형태적 에피토프에 결합한다는 것을 논증한다. 표 1 (도 13)은 4개 부류 I 항체: IM-A1, IM-B10, IM-CA22 및 IM-CA18, 및 4개 부류 II 항체: IM-C6, IM-E2, IM-CA46 및 IM-CA77을 사용하여 이들 경쟁 ELISA 테스트로부터 결과를 보여준다. 간단히, 플레이트는 100ng/ml로 부류 II로부터 각 항체로 코팅되었고 그 다음 AS-SPIK와 반응되었다. 세정 후, 부류 I로부터 (HRP로 표지화된) 신호 항체는 첨가되었고, 결합 활성은 결정되었다. 이것의 결과는 표 1A (도 13)에서 보여진다. 이들 테스트는 그 다음, 표 1B (도 13)에서 보여진 부류 I-부류 I 쌍의 결과 및 표 1C (도 13)에서 보여진 부류 II-부류 II 쌍의 결과와, 양쪽 포착 항체 및 신호 항체에 대하여 동일한 부류 내에서 항체를 사용하여 반복되었다. 모든 세포의 경우에, 열거된 농도는 양성 결과를 여전히 제공하는 신호 항체의 최저 농도를 대표하고, 더 낮은 농도는 더 강한 결합 친화성을 시사한다. 이들 결과에 기초하여, 부류 I에서 모든 항체가 부류 II에서 임의의 항체와 작업할 수 있는 한편, 신호 항체가 매우 높은 농도 (500ng/ml)에서 존재하는 경우조차, 동일한 부류에서 항체가 표적 결합을 거의 완전히 억제시킨다는 것이 명확하다. 마지막으로, 그리고 놀랍지 않게도, 여기에서 열거된 모든 항체는 우리의 다클론성 항체 Poly S와 작업할 수 있어서, 테스트 시스템이 매우 효율적이라는 것을 시사한다.
실시예 6. AS-SPIK의 에피토프 I 및 에피토프 II
동일한 부류 내에서 항체가 매우 유사한 에피토프에 결합할 가능성이 있다는 이해로, 다음 단계는 부류 I 및 부류 II 항-AS-SPIK 항체에 대하여 정확한 결합 부위를 결정하는 것이다. 이것을 달성하기 위해, 우리는 4개 부류 I 항체 (IM-CA22, IM-CA18, IM-A1 및 IM-B10) 및 4개 부류 II 항체 (IM-CA46, IM-CA77, IM-C6 및 IM-E2)를 포함하는 8개 단클론성 항-AS-SPIK 항체를 사용하여 에피토프 맵핑을 수행하였다. IM-CA22. IM-CA18, IMCA46 및 IMCA77은 마우스에서 생성되었고 IM-A1, IM-B10, IM-C6 및 IM-E2는 토끼에서 생성되었다. 에피토프 맵핑은 양으로부터 다클론성 항체인 Poly S에서 또한 수행되었다. CLIPS (화학적으로 결합된 스캐폴드상의 펩타이드) 펩타이드 어레이 (19)를 이용한 정밀 에피토프 맵핑은 Pepscan (Lelystad, Netherlands)에 의해 실시되었다.
CLIPS 기술은 펩타이드를 한정된 3D 구조로 구조적으로 고정시킨다. CLIPS 반응은 CLIPS 스캐폴드의 브로모 기와 펩타이드 작제물에 도입된 시스테인의 티올 측쇄 사이 발생한다. 반응은 초고속이고, 매우 특이적이며 온화한 조건에서 수행된다. 이러한 세련된 화학을 사용하여, 천연 단백질 서열은 다양한 구조를 가진 CLIPS 작제물로 형질전환된다. CLIPS 기술은 이제 일상적으로 사용되어 펩타이드 라이브러리를 단일, 이중 또는 삼중 루프화된 구조 뿐만 아니라 시트- 및 나선-유사 폴드를 형상화하고, 이는 형태적 및 불연속 결합 부위 모방을 허용한다. 서열 의존적, 형태적 의존적 및 불연속 형태적 에피토프는 그래서 결정될 수 있다.
2,400개 초과 독립적 펩타이드의 어레이는 합성되었고 단클론성 항체 IM-CA18, IM-CA22, IM-CA46, IM-CA77, IM-A1, IM-B10, IM-C6, IM-E2 및 다클론성 항체 Poly S의 결합은 테스트되었고 분석되었다. 이러한 에피토프 맵핑의 결과는 막대 도표, 히트맵, 표를 사용하여, 그리고 PDB 엔트리 1HPT.pdb를 사용하여 Swiss 모델에서 모델링된 구조에서 시각화된다. 선형, 형태-의존적, 및 불연속 형태-의존적 에피토프를 포함하는, 각 항체에 대하여 AS-SPIK 내에서 가능한 결합 영역은 예측된다. 이들 AS-SPIK 결합 영역의 3D 구조 (결정체 모델)은 또한 시각화된다.
AS-SPIK가 79개 아미노산을 가진 작은 단백질이기 때문에, CLIPS에 의해 결정된 경우에 형태적 의존적 에피토프 작제하기는 4개 항원 영역만을 필요로 한다. 이들 영역은 도 7에서 강조된다. 제1 영역은 G5-A29이고, 이는 2개 파트를 포함한다: AS-SPIK에서만 실재하는, 밝은 청색으로 표시되는, 파트 I (G5-A23). 황색으로 표시되는 파트 II (D24-A29)는 양쪽 AS-SPIK 및 NS-SPIK (서열번호 4)에서 실재하고; 제2 영역은 녹색으로 표시된 K31-C47이고; 제3 영역은 청색으로 표시된 I42- N56이고; 제4 영역은 회색으로 표시된 D50-C79이다. 하지만, CLIPS로부터 결과는 영역 1, 2, 및 4만이 AS-SPIK 및 항-AS-SPIK 항체의 결합에서 직접적으로 관여된다는 것을 시사한다. 표 2 (도 14)는 CLIPS에 의해 예측된 경우에 항-AS-SPIK 항체에 대하여 가능한 결합 영역을 포함하는 아미노산을 보여준다. CLIPS 연구는 또한 각 항체가 적어도 2개 별도 영역에 결합한다는 것을 보여주어, 본원에 기재된 모든 항-AS-SPIK 항체가 불연속, 형태적 에피토프에 결합한다는 것을 암시한다. 이것은 항-AS-SPIK 항체가 배타적으로 형태적 의존적 항체라는 우리의 이전 관찰과 일치한다.
실시예 7. 에피토프 I 및 에피토프 II의 결정적 잔기
항체의 양쪽 부류에 대하여 AS-SPIK의 잠재적 결합 영역 식별하기 이외에, CLIPS 연구는 또한 이의 결합 친화성에 대한 각 영역 내에서 아미노산의 상대적 중요성을 평가한다. 영역 1 (7FLLSALALLSLSGNTGADSLGREA29, 서열번호: 7) 및 영역 4 (58CVLCFENRKRQ68, 서열번호: 8)는 모든 부류 I 항체에 대하여 필수 결합 부위를 포함한다. 영역 1에서 결합 기능성에 대하여 가장 결정적 아미노산은 14LLSL17 (서열번호: 12)이고, 더 낮은 정도로는 24DS25 (서열번호: 13)이다. 영역 4에서, 결정적 잔기는 58CVLCF26 (서열번호: 14)이다. 함께, 이들 아미노산은 에피토프 I (표 2 (도 14) 및 도 7)이라고 하는, 모든 부류 I 항체에 대하여 불연속 형태적 에피토프를 포함한다. 이러한 에피토프의 불연속 성질은 (도 8에서 도시된) 이들 발견을 확인하기 위해 우리가 수행했던 억제 테스트에 의해 추가로 뒷받침된다. 여기에서, 우리는 14LLSL17을 함유하는 9개 아미노산을 가진 짧은 펩타이드를 합성하였고, 이는 이러한 영역에서 천연 AS-SPIK와 부류 I 항체 사이 결합을 억제시킬 수 있다. 하지만, 결합의 억제는 불완전하여, 결합을 책임지는 AS-SPIK의 뚜렷한 제2 영역이 있다는 것을 시사한다. 이것은 항-AS-SPIK가 AS-SPIK에서 적어도 2개 별도 영역을 포함해야 하는 불연속 형태적 의존적 에피토프를 결합시킨다는 우리의 가정과 일치한다. CLIPS 연구는 또한 영역 2 (36LNGCTKIYD44, 서열번호: 9) 및 영역 4 (64NRKRQTSILIQ75, 서열번호: 10)에서 아미노산이 모든 부류 II 항체에 대하여 필수 결합 부위를 포함한다는 것을 보여준다. 영역 2에서 결합 기능성에 대하여 가장 결정적 아미노산은 36LN37 (서열번호: 15) 및 42IY43 (서열번호: 16)이다. 영역 4에서, 결정적 잔기는 67RQ68 (서열번호: 17) 및 71IL72 (서열번호: 18)이다. 함께, 이들 아미노산은 에피토프 II (표 2 (도 14) 및 도 7)라고 하는, 모든 부류 II 항체에 대하여 불연속 형태적 에피토프를 포함한다. Poly S에 대하여 결합 에피토프에 관한 CLIPS 연구로부터 결과는 poly S에서 우성 항체가 부류 II 항-AS-SPIK 항체로서 카테고리화될 수 있는 것은, 이것이, 기타 부류 II 항체와 유사한, 에피토프 II에 결합하기 때문인 것을 시사한다.
실시예 8. 부류 I 및 부류 II 항체 CDR 내에서 공통 서열
우리가 에피토프 I 및 II를 정의하였고 이들에 결합하는 항체의 예시를 식별했으므로, 다음 단계는 각 부류 내에서 항체들 사이 구조적 유사성을 식별하는 것이다. 4개 부류 I 항체 (IM-A (토끼), IM-B10 (토끼), IM-CA22 (마우스) 및 IM-CA18 (마우스))에서 CDR은 비교되었고 분석되었다. 그들의 CDR의 공통 서열은 소프트웨어 BioEdit (노스캐롤라이나 주립대학교)를 사용하여 결정되었고, 도 9에서 제시된다. 흥미롭게, 여기에서 2개 항체가 마우스 출신이고 또 다른 2개 항체가 토끼 출신이어도, 우리는 그들의 CDR에서 적어도 1개 아미노산이 항체들의 모두에서 보존되는 것을 알아내었다. 이들 4개 부류 I 항체에서 가장 보존된 CDR은 CDRL2이다. 이러한 CDR에서 4/7 (57%) 아미노산은 동일하다. 이들 CDR의 각각 내에서 보존된 잔기는 이러한 항체 (부류 I) 속의 한정 특징이다. 부류 II 항체 IM-C6 (토끼), IM-E2 (토끼), IM-CA46 (마우스) 및 IMCA77 (마우스)의 유사한 연구는 똑같이 중요한 발견으로 이어진다. 도 10은 이들 4개 부류 II 항체에 대하여 CDR 공통 서열을 열거한다. 부류 II 항체의 CDR에서 보존된 아미노산의 수는 부류 I에서보다 높다. 우리는 그들의 CDR의 각각에서 적어도 2개 아미노산이 보존되는 것을 알아내었다. 이들 4개 부류 II 항체에서 가장 보존된 CDR은 동일한 이 CDR에서 7/11 (64%) 아미노산을 가진 CDRL1이다. 이들 CDR의 각각 내에서 보존된 잔기는 이러한 항체 (부류 II) 속의 한정 특징이다.
실시예 9. 임상적 평가
포착 항체로서 AS-SPIK에, 그리고 신호 항체로서 HRP-접합된 다클론성 항-AS-SPIK 항체 (Poly S)에 단독으로 결합하는, 샌드위치 ELISA (효소-결합된 면역흡착 검정)에 기반되고 단클론성 항체 (IM-CA22)를 활용하는 AS-SPIK 테스트 키트는 임상적 평가에 사용되었다. 이러한 키트의 기전은 도 11에서 예시된다.
연구 설계 및 샘플 집단:
혈청 샘플은 전향적, 맹검된 연구에서 총 512명 고유한 연구 대상체로부터 수집되었고, 각 사이트의 기관 감사 위원회 (IRB)에 의해 승인된 연구 프로토콜 하에 각종 연구 기관을 통해서 얻어졌다. 정보제공된 환자 동의는 모든 연구 참가자에 대하여 수득되었다. 512개 샘플 중, 164개는 생검, CT, 및/또는 MRI를 사용하여 양성으로 진단되었던 HCC 환자 출신이었다. 이것은 또한 구체적으로 초기 HCC (BCLC 0 및 A 기)를 가진 81명 환자를 포함하였다. 남아있는 348명 대상체는 간경변, 비-간경변성 만성 HBV/HCV, 췌장염, 및 건강한 대상체를 포함하는 각종 대조군의 부분이었다.
AS-SPIK의 혈청 수준은, 아미노산 서열 정보가 본원에 제공되는 (서열번호: 75 및 서열번호: 76), 단클론성 항체 IM-CA22를 활용하는, ELISA-기반된 테스트 키트를 사용하여 정량화되었다. HCC에 대하여 가장 흔히 사용된 바이오마커인 AFP는, 그들의 인증된 임상적 실험실에서 FDA-승인된 AFP 테스트를 사용하여, 각 연구 기관에 의해 모든 환자에 대하여 정량적으로 결정되었다. 수신자 작동 곡선 (ROC)은 양쪽 AS-SPIK 및 AFP에 대하여 작제되었고, 그들의 감수성, 특이성, 및 AUC (곡선하 면적)은 비교되었다. 이 분석을 위하여, 의도된 사용 집단, 간 질환을 가진 이들만이 고려되었다 (HCC, 간경변, 및 HBV/HCV). 췌장염 환자는 정상 췌장 SPIK (NS-SPIK)가 AS-SPIK 테스트를 방해하지 않는 반면, 건강한 환자가 기준선 음성 대조군으로서 사용되었다는 것을 확인하기 위해 별도로 평가되었다.
결과:
A). 혈청 AS-SPIK는 초기 HCC를 포함하는 HCC 환자에서 상당히 상승된다
결과는 모든 HCC에서 AS-SPIK의 평균 혈청 수준 (45.2 ng/mL, 95% CI: 40.5 내지 49.9)이 모든 대조군 그룹에서보다 상당히 더 높다는 것을 논증하였다 (p < 0.001) (도 17; 표 5). 초기 HCC (BCLC 0 및 A 기)를 가진 81명 환자의 경우에, 혈청 AS-SPIK의 평균 농도는 38.1 ng/mL (95% CI: 32.1 내지 44.2)이었고, 모든 대조군 그룹에서 혈청 AS-SPIK 수준과 상당히 상이하였다 (P < 0.001) (도 17; 표 5). 이들 결과는 WO2019/173503의 실시예 12 및 13, 뿐만 아니라 도 15 및 16에 기재된 이전 연구와 일치하고, 이의 개시내용은 그 전체가 본원에 참고로 편입된다.
B). 기타 간 질환과 HCC 구별하기에서 AS-SPIK 및 AFP의 성능.
전반적으로, AS-SPIK는 AFP보다 상당히 더 양호한 감수성 및 특이성을 논증하였고 표 6 (도 18)에 나타난다. 간 질환 환자를 대조군으로서 사용하는 HCC 검출에서 AS-SPIK에 대하여 AUC는, AFP에 대하여 0.70 (95% CI: 0.64 내지 0.76)와 비교하여, 0.87 (95% CI: 0.83 내지 0.91)이었다. 혈청 AS-SPIK에 대하여 컷오프 값으로서 21.5 ng/mL를 사용하여, AS-SPIK의 감수성 및 특이성은 80% 및 90%, 각각이었다. 상대적으로, 혈청 AFP의 컷오프 값으로서 표준 20.0 ng/mL를 사용하여, 감수성 및 특이성은 겨우 52% 및 86%, 각각이었고, 이는 AS-SPIK의 것보다 상당히 더 낮다 (P<0.05). 초기 HCC의 경우에, AS-SPIK에 대하여 AUC는, AFP에 대하여 겨우 0.61 (95% CI: 0.53 내지 0.70)와 비교하여, 0.84 (95% CI: 0.79 내지 0.89)이었다. 컷오프 값으로서 21.5 ng/mL를 사용하여, 이의 초기에 있어서 HCC 검출에서 AS-SPIK의 감수성은 72%이었고 특이성이 90%이었고, 이는 AFP에 대하여 42% 감수성 및 86% 특이성보다 상당히 더 높다 (도 18; 표 6).
C). 테스트는 HCC 병기의 예측 및 모니터링/예후를 위하여 사용될 수 있다.
본 연구에서, AS-SPIK 수준과 암 진행의 병기 사이 상관관계는 관찰되었다 (도 19; 표 7). 초기 그룹에서 환자에 대하여 AS-SPIK의 평균 수준은 38.1 ng/mL (95% CI: 32.1 - 44.1)이었던 반면, 말기 그룹에서 AS-SPIK의 평균 수준은 52.2 ng/mL (95% CI: 45.3 - 59.1)이었다. 이들 값을 비교하여, 우리는 2개 그룹 사이 통계적으로 상당한 차이를 이해하여 (P < 0.05), 병기에 의한 HCC의 진행과 AS-SPIK의 증가된 수준 사이 상관관계가 있다는 것을 보여준다 (도 19; 표 7).
이것은 AS-SPIK의 평균 값이 BCLC 병기에 의해 분할된 경우 말기 및 더욱 진전된 병기에 대하여 지속적으로 더 높았던 관찰에 의해 추가로 뒷받침된다. 초초기 그룹 (BCLC 0 기)에서 환자는 겨우 33.7 ng/mL의 최저 평균 AS-SPIK 값을 가졌던 반면, 말기 D 환자는 65.6 ng/mL의 최고 평균 AS-SPIK 값을 가졌다. BCLC 분류에 엄격하게 기반된 분석은, 하지만, 특히 모집하기 어려운 그룹 예컨대 BCLC 0 기 (초초기) 및 D 기 (말기) 그룹에 대하여 과-계층화 및 불균일 샘플 크기를 초래하였다. 그래서, 결과는 통계적으로 유의미하지 않았다 (P > 0.05) (도 20; 표 8). 이들 결과는 AS-SPIK가 HCC 진행을 모니터링하는 도구로서 잠재력을 가질 수 있다는 것을 시사한다.
D). AS-SPIK 검출 키트는 환자의 혈청에서 NS-SPIK가 아닌, AS-SPIK를 단독으로 검출하였다
AS-SPIK가, 이의 N-말단에서 추가의 단편을 함유하는, SPIK의 간-암 특이적 동형이기 때문에, 우리는 NS-SPIK (췌장 SPIK)가 본원에 기재된 AS-SPIK 테스트를 방해하는 지를 평가하였다. 도 12, 패널 A는 2개 단클론성 항체, (AS-SPIK만을 인식하는) IM-CA22 및 (양쪽 AS-SPIK 및 NS-SPIK를 인식하는) IM-BA2가 플레이트를 코팅하는데 사용되었고, 그 다음 어느 한쪽 AS-SPIK 또는 NS-SPIK와 반응되었다는 것을 도시한다. IM-CA22 및 AS-SPIK 테스트 키트는 AS-SPIK만을 인식하는 반면, IM-BA2는 양쪽 AS-및 NS-SPIK의 존재를 검출하고 확인한다. 도 12, 패널 B는, 췌장 SPIK의 상승된 수준을 갖는 것으로 예상되는, 임상적 연구로부터 24명 췌장염 환자에서 AS-SPIK의 혈청 수준을 도시한다. 데이터는 이들 환자에서 AS-SPIK 수준 (7.4 ng/mL)이 건강한 환자의 것들 (7.4 ng/mL, P > 0.99)과 유사하였고, 임상적 연구의 HCC 환자 (45.2 ng/mL, P < 0.001)에서 상당히 더 낮았다는 것을 논증한다. 도 12, 패널 C는 췌장염 환자에서 NS-SPIK의 상승된 혈청 수준 그리고 본원에 기재된 AS-SPIK 검출 키트를 방해하지 않는다는 관찰을 확인한다.
서열 정보:
참고문헌:
1.
Yu NC, Chaudhari V, Raman SS, Lassman C, Tong MJ, Busuttil RW, Lu DS. CT and MRI improve detection of hepatocellular carcinoma, compared with ultrasound alone, in patients with cirrhosis. Clin Gastroenterol Hepatol 2011;9:161-167.
2.
Bruix J, Sherman M. Management of hepatocellular carcinoma. Hepatology 2005;42:1208-1236.
3.
Lok AS, Heathcote EJ, Hoofnagle JH. Management of hepatitis B: 2000--summary of a workshop. Gastroenterology 2001;122:2092-2093.
4.
Greene LJ, Pubols MH, Bartelt DC. Human pancreatic secretory trypsin inhibitor. Methods Enzymol 1976;45:813-825.
5.
Stenman UH. Tumor-associated trypsin inhibitor. Clin Chem 2002;48:1206-1209.
6.
Greene LJ. Pancreatic exocrine secretory proteins. J Surg Oncol 1975;7:151-154.
7.
Lee YC, Pan HW, Peng SY, Lai PL, Kuo WS, Ou YH, Hsu HC. Overexpression of tumour-associated trypsin inhibitor (TATI) enhances tumour growth and is associated with portal vein invasion, early recurrence and a stage-independent prognostic factor of hepatocellular carcinoma. Eur J Cancer 2007;43:736-744.
8.
Lu X, Lee M, Tran T, Block T. High level expression of apoptosis inhibitor in hepatoma cell line expressing Hepatitis B virus. Int J Med Sci 2005;2:30-35.
9.
Ohmachi Y, Murata A, Matsuura N, Yasuda T, Yasuda T, Monden M, Mori T, et al. Specific expression of the pancreatic-secretory-trypsin-inhibitor (PSTI) gene in hepatocellular carcinoma. Int J Cancer 1993;55:728-734.
10.
Hirota M, Ohmuraya M, Baba H. The role of trypsin, trypsin inhibitor, and trypsin receptor in the onset and aggravation of pancreatitis. J Gastroenterol 2006;41:832-836.
11.
Playford RJ, Hanby AM, Quinn C, Calam J. Influence of inflammation and atrophy on pancreatic secretory trypsin inhibitor levels within the gastric mucosa. Gastroenterology 1994;106:735-741.
12.
Kobayashi K, Horiuchi M, Saheki T. Pancreatic secretory trypsin inhibitor as a diagnostic marker for adult-onset type II citrullinemia. Hepatology 1997;25:1160-1165.
13.
Lu F, Lamontagne J, Sun A, Pinkerton M, Block T, Lu X. Role of the inflammatory protein serine protease inhibitor Kazal in preventing cytolytic granule granzyme A-mediated apoptosis. Immunology 2011;134:398-408.
14.
Bartelt DC, Shapanka R, Greene LJ. The primary structure of the human pancreatic secretory trypsin inhibitor. Amino acid sequence of the reduced S-aminoethylated protein. Arch Biochem Biophys 1977;179:189-199.
15.
Kikuchi N, Nagata K, Yoshida N, Tanaka T, Yamamoto M, Saitoh Y. Purification and complete amino acid sequence of canine pancreatic secretory trypsin inhibitor. FEBS Letters 1985;191:269-272.
16.
Lu X, Lamontagne J, Lu F, Block TM. Tumor-associated protein SPIK/TATI suppresses serine protease dependent cell apoptosis. Apoptosis 2008;13:483-494.
17.
Horii A, Kobayashi T, Tomita N, Yamamoto T, Fukushige S, Murotsu T, Ogawa M, et al. Primary structure of human pancreatic secretory trypsin inhibitor (PSTI) gene. Biochem Biophys Res Commun 1987;149:635-641.
18.
Hecht HJ, Szardenings M, Collins J, Schomburg D. Three-dimensional structure of a recombinant variant of human pancreatic secretory trypsin inhibitor (Kazal type). J Mol Biol 1992;225:1095-1103.
19.
Timmerman P, Puijk WC, Meloen RH. Functional reconstruction and synthetic mimicry of a conformational epitope using CLIPS technology. J Mol Recognit 2007;20:283-299.
SEQUENCE LISTING
<110> IMCARE BIOTECH, LLC.
<120> EPITOPES OF ANTI-SERINE PROTEASE INHIBITOR KAZAL (SPIK)
ANTIBODIES
<130> IMC-0003-WO
<140> PCT/US2020/046782
<141> 2020-08-18
<150> 62/899,024
<151> 2019-09-11
<160> 125
<170> PatentIn version 3.5
<210> 1
<211> 237
<212> DNA
<213> Homo sapiens
<400> 1
atgaaggtaa caggcatctt tcttctcagt gccttggccc tgttgagtct atctggtaac 60
actggagctg actccctggg aagagaggcc aaatgttaca atgaacttaa tggatgcacc 120
aagatatatg accctgtctg tgggactgat ggaaatactt atcccaatga atgcgtgtta 180
tgttttgaaa atcggaaacg ccagacttct atcctcattc aaaaatctgg gccttgc 237
<210> 2
<211> 79
<212> PRT
<213> Homo sapiens
<400> 2
Met Lys Val Thr Gly Ile Phe Leu Leu Ser Ala Leu Ala Leu Leu Ser
1 5 10 15
Leu Ser Gly Asn Thr Gly Ala Asp Ser Leu Gly Arg Glu Ala Lys Cys
20 25 30
Tyr Asn Glu Leu Asn Gly Cys Thr Lys Ile Tyr Asp Pro Val Cys Gly
35 40 45
Thr Asp Gly Asn Thr Tyr Pro Asn Glu Cys Val Leu Cys Phe Glu Asn
50 55 60
Arg Lys Arg Gln Thr Ser Ile Leu Ile Gln Lys Ser Gly Pro Cys
65 70 75
<210> 3
<211> 168
<212> DNA
<213> Homo sapiens
<400> 3
gactccctgg gaagagaggc caaatgttac aatgaactta atggatgcac caagatatat 60
gaccctgtct gtgggactga tggaaatact tatcccaatg aatgcgtgtt atgttttgaa 120
aatcggaaac gccagacttc tatcctcatt caaaaatctg ggccttgc 168
<210> 4
<211> 56
<212> PRT
<213> Homo sapiens
<400> 4
Asp Ser Leu Gly Arg Glu Ala Lys Cys Tyr Asn Glu Leu Asn Gly Cys
1 5 10 15
Thr Lys Ile Tyr Asp Pro Val Cys Gly Thr Asp Gly Asn Thr Tyr Pro
20 25 30
Asn Glu Cys Val Leu Cys Phe Glu Asn Arg Lys Arg Gln Thr Ser Ile
35 40 45
Leu Ile Gln Lys Ser Gly Pro Cys
50 55
<210> 5
<211> 69
<212> DNA
<213> Homo sapiens
<400> 5
atgaaggtaa caggcatctt tcttctcagt gccttggccc tgttgagtct atctggtaac 60
actggagct 69
<210> 6
<211> 23
<212> PRT
<213> Homo sapiens
<400> 6
Met Lys Val Thr Gly Ile Phe Leu Leu Ser Ala Leu Ala Leu Leu Ser
1 5 10 15
Leu Ser Gly Asn Thr Gly Ala
20
<210> 7
<211> 24
<212> PRT
<213> Homo sapiens
<400> 7
Phe Leu Leu Ser Ala Leu Ala Leu Leu Ser Leu Ser Gly Asn Thr Gly
1 5 10 15
Ala Asp Ser Leu Gly Arg Glu Ala
20
<210> 8
<211> 11
<212> PRT
<213> Homo sapiens
<400> 8
Cys Val Leu Cys Phe Glu Asn Arg Lys Arg Gln
1 5 10
<210> 9
<211> 9
<212> PRT
<213> Homo sapiens
<400> 9
Leu Asn Gly Cys Thr Lys Ile Tyr Asp
1 5
<210> 10
<211> 11
<212> PRT
<213> Homo sapiens
<400> 10
Asn Arg Lys Arg Gln Thr Ser Ile Leu Ile Gln
1 5 10
<210> 11
<211> 17
<212> PRT
<213> Homo sapiens
<400> 11
Phe Leu Leu Ser Ala Leu Ala Leu Leu Ser Leu Ser Gly Asn Thr Gly
1 5 10 15
Ala
<210> 12
<211> 4
<212> PRT
<213> Homo sapiens
<400> 12
Leu Leu Ser Leu
1
<210> 13
<211> 2
<212> PRT
<213> Homo sapiens
<400> 13
Asp Ser
1
<210> 14
<211> 5
<212> PRT
<213> Homo sapiens
<400> 14
Cys Val Leu Cys Phe
1 5
<210> 15
<211> 2
<212> PRT
<213> Homo sapiens
<400> 15
Leu Asn
1
<210> 16
<211> 2
<212> PRT
<213> Homo sapiens
<400> 16
Ile Tyr
1
<210> 17
<211> 2
<212> PRT
<213> Homo sapiens
<400> 17
Arg Gln
1
<210> 18
<211> 2
<212> PRT
<213> Homo sapiens
<400> 18
Ile Leu
1
<210> 19
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 19
Ser Ser Asn Ala Ile Ser
1 5
<210> 20
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 20
Ser Ser Tyr Gly Val Ser
1 5
<210> 21
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 21
Gly Tyr Thr Phe Thr Asp Tyr Tyr Ile Asn
1 5 10
<210> 22
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 22
Gly Phe Thr Phe Ser Arg Tyr Ala Met Ser
1 5 10
<210> 23
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 23
Ala Ile Gly Ser Ser Gly Ser Thr Tyr Tyr Ala Ser Trp Ala Lys Ser
1 5 10 15
<210> 24
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 24
Ser Ile Trp Ser Gly Gly Thr Thr Asp Tyr Ala Ser Trp Ala Lys Ser
1 5 10 15
<210> 25
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 25
Trp Ile Tyr Pro Gly Ser Gly Asn Pro Ile Tyr Asn Glu Asn Phe Lys
1 5 10 15
Asp
<210> 26
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 26
Ser Ile Ser Ile Gly Gly Thr Tyr Thr Tyr Tyr Pro Asp Ser Val Lys
1 5 10 15
Asp
<210> 27
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 27
Arg Trp Glu Asn Ile Gly Tyr Thr Asn Val Arg Leu Asp Leu
1 5 10
<210> 28
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 28
Arg Gly Gly Tyr Asp Tyr Gly Tyr Ala Ser Asn Ile
1 5 10
<210> 29
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 29
Glu Trp Gly Cys Ala Met Asp Ser
1 5
<210> 30
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 30
Glu Asp Tyr Gly Phe Asp Tyr
1 5
<210> 31
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 31
Gln Ala Ser Gln Ser Ile Ser Thr Ala Leu Ala
1 5 10
<210> 32
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 32
Gln Ala Ser Glu Ser Ile Ser Ser Tyr Leu Ser
1 5 10
<210> 33
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 33
Lys Ser Ser Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu
1 5 10 15
Ala
<210> 34
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 34
Lys Ala Ser Gln Asp Val Ser Thr Ala Val Ala
1 5 10
<210> 35
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 35
Gly Ala Ser Thr Leu Ala Ser
1 5
<210> 36
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 36
Arg Ala Ser Thr Leu Ala Ser
1 5
<210> 37
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 37
Gly Ala Ser Thr Arg Glu Ser
1 5
<210> 38
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 38
Trp Ala Ser Thr Arg His Thr
1 5
<210> 39
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 39
Gln Gln Gly Tyr Ser Thr Ser Asp Val Asp Asn Ala
1 5 10
<210> 40
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 40
Gln Gln Gly Tyr Ser Val Ser Asn Val Asp Asn Ile
1 5 10
<210> 41
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 41
Gln Ser Asp Tyr Ser His Pro Tyr Thr
1 5
<210> 42
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 42
His Gln His Tyr Ser Thr Tyr Thr
1 5
<210> 43
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 43
Ser Tyr Ala Ile Ser Trp
1 5
<210> 44
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 44
Ser Ala Tyr Ala Ile Ser Trp
1 5
<210> 45
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 45
Gly Tyr Thr Phe Thr Ser Tyr Trp Met Gln
1 5 10
<210> 46
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 46
Gly Tyr Thr Phe Ser Ser Asn Trp Ile Glu
1 5 10
<210> 47
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 47
Ala Ile Asn Thr Tyr Gly Gly Thr Tyr Tyr Ala Ser Trp Ala Lys Ser
1 5 10 15
<210> 48
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 48
Ala Ile Asn Ser Gly Gly Ser Ala Tyr Tyr Ala Asn Trp Ala Lys Ser
1 5 10 15
<210> 49
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 49
Ala Ile Tyr Pro Gly Asp Gly Asp Thr Arg Tyr Thr Gln Lys Phe Glu
1 5 10 15
Asp
<210> 50
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 50
Gln Ile Phe Pro Gly Arg Asp Thr Thr Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 51
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 51
Arg Asp Phe Asp Ser Asp Ala Tyr Thr Ser Ala Ser Gly Gly Met Asp
1 5 10 15
Pro
<210> 52
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 52
Arg Glu Asp Ile Tyr Asp Tyr Gly Gly Ala Phe Asp Pro
1 5 10
<210> 53
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 53
Gly Ala Asn Tyr Ala Asn Ile Arg Phe Ala Tyr
1 5 10
<210> 54
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 54
Arg Gln Glu Glu Phe Ser Asp Tyr Tyr Gly Ser Ser His Leu Tyr Asn
1 5 10 15
Tyr Gly Met Asp Tyr
20
<210> 55
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 55
Gln Ala Ser Gln Ser Ile Asn Asn Tyr Leu Ser
1 5 10
<210> 56
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 56
Gln Ala Ser Gln Gly Ile Ser Ser Tyr Leu Ser
1 5 10
<210> 57
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 57
Arg Ala Ser Gln Asp Ile Thr Asn Tyr Leu Asn
1 5 10
<210> 58
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 58
Arg Ala Ser Gln Glu Ile Ser Gly His Leu Ser
1 5 10
<210> 59
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 59
Arg Ala Ser Thr Leu Ala Ser
1 5
<210> 60
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 60
Ala Ala Thr Thr Leu Val Ser
1 5
<210> 61
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 61
Tyr Thr Ser Arg Leu His Ser
1 5
<210> 62
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 62
Ala Ala Ser Ile Leu Asp Ser
1 5
<210> 63
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 63
Gln Gln Gly Tyr Thr Ser Asn Val Asp Asn Val
1 5 10
<210> 64
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 64
Gln Gln Asp Tyr Thr Thr Ser Asn Val Asp Asn Thr
1 5 10
<210> 65
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 65
Gln Gln Gly Asn Thr Val Pro Trp Thr
1 5
<210> 66
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 66
Leu Gln Tyr Thr Asp Tyr Pro Trp Thr
1 5
<210> 67
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 67
Gln Gly His Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Gln Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asp Gly Asp Thr Arg Tyr Thr Gln Lys Phe
50 55 60
Glu Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Asn Leu Ala Ser Glu Asp Ser Ala Tyr Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Asn Tyr Ala Asn Ile Arg Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ala
115 120
<210> 68
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 68
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Ser Ile Ser Cys Arg Ala Ser Gln Asp Ile Thr Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Phe Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asn Phe Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Val Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 69
<211> 130
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 69
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Met Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Thr Gly Tyr Thr Phe Ser Ser Asn
20 25 30
Trp Ile Glu Trp Ile Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Gln Ile Phe Pro Gly Arg Asp Thr Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Phe Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gln Glu Glu Phe Ser Asp Tyr Tyr Gly Ser Ser His Leu
100 105 110
Tyr Asn Tyr Gly Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
115 120 125
Ser Ser
130
<210> 70
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 70
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Ser Leu Thr Cys Arg Ala Ser Gln Glu Ile Ser Gly His
20 25 30
Leu Ser Trp Leu Gln Gln Lys Pro Asp Gly Thr Ile Lys Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Ile Leu Asp Ser Gly Val Pro Lys Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Ser Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Ser
65 70 75 80
Glu Asp Phe Ala Asp Tyr Tyr Cys Leu Gln Tyr Thr Asp Tyr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 71
<211> 152
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 71
Leu Val Ala Val Leu Lys Gly Val Gln Cys Gln Ser Val Lys Glu Ser
1 5 10 15
Glu Gly Gly Leu Phe Lys Pro Thr Asp Ala Leu Thr Leu Thr Cys Thr
20 25 30
Val Ser Gly Phe Ser Leu Ser Ser Tyr Ala Ile Ser Trp Val Arg Gln
35 40 45
Ala Pro Gly Ser Gly Leu Glu Trp Ile Gly Ala Ile Asn Thr Tyr Gly
50 55 60
Gly Thr Tyr Tyr Ala Ser Trp Ala Lys Ser Arg Ser Thr Ile Thr Arg
65 70 75 80
Asn Thr Asn Glu Asn Thr Val Thr Leu Lys Met Thr Ser Leu Thr Ala
85 90 95
Ala Asp Thr Ala Thr Tyr Phe Cys Ala Arg Asp Phe Asp Ser Asp Ala
100 105 110
Tyr Thr Ser Ala Ser Gly Gly Met Asp Trp Gly Pro Gly Thr Leu Val
115 120 125
Thr Val Ser Ser Gly Gln Pro Lys Ala Pro Ser Phe Phe Pro Leu Ala
130 135 140
Pro Cys Cys Gly Asp Thr Pro Arg
145 150
<210> 72
<211> 132
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 72
Trp Leu Pro Gly Ala Arg Cys Ala Tyr Asp Met Thr Gln Thr Pro Ala
1 5 10 15
Ser Val Glu Val Ala Val Gly Gly Thr Val Thr Ile Lys Cys Gln Ala
20 25 30
Ser Gln Ser Ile Asn Asn Tyr Leu Ser Trp Tyr Gln Gln Ile Pro Gly
35 40 45
Gln Pro Pro Lys Leu Leu Ile Tyr Arg Ala Ser Thr Leu Ala Ser Gly
50 55 60
Val Ser Ser Arg Phe Lys Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu
65 70 75 80
Thr Ile Ser Gly Val Gln Cys Ala Asp Ala Ala Thr Tyr Tyr Cys Gln
85 90 95
Gln Gly Tyr Thr Ser Asn Val Asp Asn Val Phe Gly Gly Gly Thr Glu
100 105 110
Val Val Val Lys Gly Asp Pro Val Ala Pro Thr Val Leu Ile Phe Pro
115 120 125
Pro Ser Ala Asp
130
<210> 73
<211> 136
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 73
Leu Val Ala Val Leu Lys Gly Val Gln Cys Gln Ser Val Lys Glu Ser
1 5 10 15
Glu Gly Gly Leu Phe Lys Pro Thr Asp Thr Leu Thr Leu Thr Cys Thr
20 25 30
Val Ser Gly Phe Ser Leu Ser Ala Tyr Ala Ile Ser Trp Val Arg Gln
35 40 45
Ala Pro Gly Asn Gly Leu Glu Trp Ile Gly Ala Ile Asn Ser Gly Gly
50 55 60
Ser Ala Tyr Tyr Ala Asn Trp Ala Lys Ser Arg Ser Thr Ile Thr Arg
65 70 75 80
Asn Thr Asn Leu Asn Thr Val Thr Leu Lys Met Thr Ser Leu Thr Ala
85 90 95
Ala Asp Thr Ala Thr Tyr Phe Cys Ala Arg Glu Asp Ile Tyr Asp Tyr
100 105 110
Gly Gly Ala Phe Asp Pro Trp Gly Pro Gly Thr Leu Val Thr Val Ser
115 120 125
Thr Gly Gln Pro Lys Leu His His
130 135
<210> 74
<211> 133
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 74
Trp Leu Pro Gly Ala Arg Cys Ala Tyr Asp Met Thr Gln Thr Pro Ala
1 5 10 15
Ser Val Glu Val Thr Val Gly Gly Thr Val Thr Ile Lys Cys Gln Ala
20 25 30
Ser Gln Gly Ile Ser Ser Tyr Leu Ser Trp Tyr Gln Gln Lys Pro Gly
35 40 45
Gln Pro Pro Lys Leu Leu Ile Tyr Ala Ala Thr Thr Leu Val Ser Gly
50 55 60
Val Ser Ser Arg Phe Lys Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu
65 70 75 80
Thr Ile Ser Gly Val Glu Cys Ala Asp Ala Ala Thr Tyr Tyr Cys Gln
85 90 95
Gln Asp Tyr Thr Thr Ser Asn Val Asp Asn Thr Phe Gly Gly Gly Thr
100 105 110
Glu Val Val Val Lys Gly Asp Pro Val Ala Pro Thr Val Leu Ile Phe
115 120 125
Pro Pro Ser Ala Asp
130
<210> 75
<211> 130
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 75
Gln Ile Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Ser Gly Asn Pro Ile Tyr Asn Glu Asn Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Thr Thr Ala Tyr
65 70 75 80
Leu Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Trp Gly Cys Ala Met Asp Ser Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser Ala Lys Thr Thr Ala Pro Ser Val Tyr Pro Leu
115 120 125
Ala Pro
130
<210> 76
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 76
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ser Val Ser Thr Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Gly Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Ser
85 90 95
Asp Tyr Ser His Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 77
<211> 135
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 77
Met Asn Phe Val Leu Ser Leu Ile Phe Leu Ala Leu Ile Leu Lys Gly
1 5 10 15
Val Gln Cys Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys
20 25 30
Pro Gly Arg Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Ser Arg Tyr Ala Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu
50 55 60
Glu Gly Val Ala Ser Ile Ser Ile Gly Gly Thr Tyr Thr Tyr Tyr Pro
65 70 75 80
Asp Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn
85 90 95
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ser Glu Asp Thr Ala Met
100 105 110
Tyr Tyr Cys Val Arg Glu Asp Tyr Gly Phe Asp Tyr Trp Gly Gln Gly
115 120 125
Thr Leu Val Thr Val Ser Ser
130 135
<210> 78
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 78
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Leu Tyr Tyr Cys His Gln His Tyr Ser Thr Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 79
<211> 151
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 79
Leu Val Ala Val Leu Lys Gly Val Gln Cys Gln Ser Val Lys Glu Ser
1 5 10 15
Glu Gly Gly Leu Phe Lys Pro Thr Asp Thr Leu Thr Leu Thr Cys Thr
20 25 30
Val Ser Gly Phe Ser Leu Ser Ser Asn Ala Ile Ser Trp Val Arg Gln
35 40 45
Ala Pro Gly Asn Gly Leu Glu Trp Ile Gly Ala Ile Gly Ser Ser Gly
50 55 60
Ser Thr Tyr Tyr Ala Ser Trp Ala Lys Ser Arg Ser Thr Val Thr Arg
65 70 75 80
Asn Thr Asn Leu Asn Thr Val Thr Leu Lys Met Thr Ser Leu Thr Ala
85 90 95
Ala Asp Thr Ala Thr Tyr Phe Cys Ala Arg Trp Glu Asn Ile Gly Tyr
100 105 110
Thr Asn Val Arg Leu Asp Leu Trp Gly Gln Gly Thr Leu Val Thr Val
115 120 125
Ser Ser Gly Gln Pro Lys Ala Pro Ser Val Phe Pro Leu Ala Pro Cys
130 135 140
Cys Gly Asp Thr Pro Ser Ser
145 150
<210> 80
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 80
Trp Leu Pro Gly Ala Arg Cys Ala Tyr Asp Met Thr Gln Thr Pro Ala
1 5 10 15
Ser Val Glu Val Ala Val Gly Gly Thr Val Thr Ile Lys Cys Gln Ala
20 25 30
Ser Gln Ser Ile Ser Thr Ala Leu Ala Trp Tyr Gln Gln Lys Pro Gly
35 40 45
Gln Pro Pro Lys Leu Leu Ile Tyr Gly Ala Ser Thr Leu Ala Ser Gly
50 55 60
Val Ser Ser Arg Phe Lys Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu
65 70 75 80
Thr Ile Ser Gly Val Glu Cys Ala Asp Ala Ala Thr Tyr Tyr Cys Gln
85 90 95
Gln Gly Tyr Ser Thr Ser Asp Val Asp Asn Ala Phe Gly Gly Gly Thr
100 105 110
Glu Gly
<210> 81
<211> 135
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 81
Leu Val Ala Val Leu Lys Gly Val Gln Cys Gln Ser Val Lys Glu Ser
1 5 10 15
Glu Gly Gly Leu Phe Lys Pro Thr Asp Thr Leu Thr Leu Thr Cys Thr
20 25 30
Val Ser Gly Phe Ser Leu Ser Ser Tyr Gly Val Ser Trp Val Arg Gln
35 40 45
Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly Ser Ile Trp Ser Gly Gly
50 55 60
Thr Thr Asp Tyr Ala Ser Trp Ala Lys Ser Arg Ser Thr Ile Thr Arg
65 70 75 80
Asn Thr Asn Glu Asn Thr Val Thr Leu Lys Val Thr Ser Leu Thr Ala
85 90 95
Ala Asp Thr Ala Thr Tyr Phe Cys Ala Arg Gly Gly Tyr Asp Tyr Gly
100 105 110
Tyr Ala Ser Asn Ile Trp Gly Pro Gly Thr Leu Val Thr Val Ser Ser
115 120 125
Gly Gln Pro Lys Ala Pro Ser
130 135
<210> 82
<211> 134
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 82
Leu Trp Leu Pro Gly Ala Arg Cys Ala Tyr Asp Met Thr Gln Thr Pro
1 5 10 15
Ala Ser Val Glu Val Ala Val Gly Gly Thr Val Thr Ile Lys Cys Gln
20 25 30
Ala Ser Glu Ser Ile Ser Ser Tyr Leu Ser Trp Tyr Gln Gln Lys Pro
35 40 45
Gly Gln Pro Pro Lys Leu Leu Ile Tyr Arg Ala Ser Thr Leu Ala Ser
50 55 60
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr
65 70 75 80
Leu Thr Ile Ser Asp Gly Gln Cys Asp Asp Ala Ala Thr Tyr Tyr Cys
85 90 95
Gln Gln Gly Tyr Ser Val Ser Asn Val Asp Asn Ile Phe Gly Gly Gly
100 105 110
Thr Glu Val Val Val Lys Gly Asp Pro Val Ala Pro Thr Val Leu Ile
115 120 125
Phe Pro Pro Ser Ala Asp
130
<210> 83
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 83
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 84
<211> 12
<212> PRT
<213> Homo sapiens
<400> 84
Glu Leu Asn Gly Cys Thr Lys Ile Tyr Asp Pro Val
1 5 10
<210> 85
<211> 5
<212> PRT
<213> Homo sapiens
<400> 85
Lys Val Thr Gly Ile
1 5
<210> 86
<211> 79
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 86
Met Lys Val Thr Gly Ile Phe Leu Leu Ser Ala Leu Ala Leu Leu Ser
1 5 10 15
Leu Ser Gly Asn Thr Gly Ala Asp Ser Leu Gly Arg Glu Ala Lys Cys
20 25 30
Tyr Asn Glu Leu Asn Gly Cys Thr Lys Ile Tyr Asp Pro Val Cys Gly
35 40 45
Thr Asp Gly Asn Thr Tyr Pro Asn Glu Cys Val Leu Cys Phe Glu Asn
50 55 60
Arg Lys Arg Gln Thr Ser Ile Leu Ile Gln Lys Ser Gly Pro Cys
65 70 75
<210> 87
<211> 51
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 87
Met Lys Val Thr Gly Ile Phe Leu Leu Ser Ala Leu Ala Leu Leu Ser
1 5 10 15
Leu Ser Gly Asn Thr Gly Ala Asp Ser Leu Gly Arg Glu Ala Lys Cys
20 25 30
Tyr Asn Glu Leu Asn Gly Cys Thr Lys Ile Tyr Asp Pro Val Cys Gly
35 40 45
Thr Asp Gly
50
<210> 88
<211> 28
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 88
Asp Ser Leu Gly Arg Glu Ala Lys Cys Tyr Asn Glu Leu Asn Gly Cys
1 5 10 15
Thr Lys Ile Tyr Asp Pro Val Cys Gly Thr Asp Gly
20 25
<210> 89
<211> 28
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 89
Asn Thr Tyr Pro Asn Glu Cys Val Leu Cys Phe Glu Asn Arg Lys Arg
1 5 10 15
Gln Thr Ser Ile Leu Ile Gln Lys Ser Gly Pro Cys
20 25
<210> 90
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 90
Ser Ala Leu Ala Leu Leu Ser Leu Ser Gly Asn Thr Gly Ala Asp Ser
1 5 10 15
Leu Gly Arg Glu Ala
20
<210> 91
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 91
Gly Asn Thr Gly Ala Asp Ser Leu Gly
1 5
<210> 92
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 92
Ser Gly Asn Thr Gly Ala Asp Ser Leu
1 5
<210> 93
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 93
Leu Ser Gly Asn Thr Gly Ala Asp Ser
1 5
<210> 94
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 94
Ser Leu Ser Gly Asn Thr Gly Ala Asp
1 5
<210> 95
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 95
Leu Ser Leu Ser Gly Asn Thr Gly Ala
1 5
<210> 96
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 96
Leu Leu Ser Leu Ser Gly Asn Thr Gly Ala Asp Ser Leu
1 5 10
<210> 97
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 97
Ser Leu Ser Gly Asn Thr Gly Ala Asp Ser Leu Gly Arg
1 5 10
<210> 98
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 98
Ser Gly Asn Thr Gly Ala Asp Ser Leu Gly Arg Glu Ala
1 5 10
<210> 99
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 99
Ala Leu Leu Ser Leu Ser Gly Asn Thr Gly
1 5 10
<210> 100
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 100
Ser Ala Leu Ala Leu Leu Ser Leu Ser Gly
1 5 10
<210> 101
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 101
Asp Leu Val Pro Arg Gly Ser Pro Gly Ile
1 5 10
<210> 102
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 102
Gly Leu Val Pro Arg Gly Ser Pro Gly Ile
1 5 10
<210> 103
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 103
Leu Glu Asp Pro Gly Tyr Arg Gly Arg Thr
1 5 10
<210> 104
<211> 26
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 104
Gly Ile Phe Leu Leu Ser Ala Leu Ala Leu Leu Ser Leu Ser Gly Asn
1 5 10 15
Thr Gly Ala Asp Ser Leu Gly Arg Glu Ala
20 25
<210> 105
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 105
Ser Leu Ser Gly Asn Thr Gly Ala Asp Ser Leu Gly Arg Glu
1 5 10
<210> 106
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 106
Leu Leu Ser Leu Ser Gly Asn Thr Gly Ala Asp Ser Leu Gly Arg
1 5 10 15
<210> 107
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 107
Gly Ile Phe Leu Leu Ser Ala Leu Ala Leu Leu
1 5 10
<210> 108
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 108
Phe Leu Leu Ser Ala Leu Ala Leu Leu
1 5
<210> 109
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 109
Asp Gly Asn Thr Tyr Pro Asn Glu Cys Val Leu Cys Phe Glu Asn Arg
1 5 10 15
Lys Arg Gln
<210> 110
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 110
Asp Gly Asn Thr Tyr Pro Asn Glu Cys Val Leu Cys
1 5 10
<210> 111
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 111
Gly Asn Thr Tyr Pro Asn Glu Cys Val Leu Cys Phe Glu Asn Arg Lys
1 5 10 15
Arg Gln Glu
<210> 112
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 112
Cys Val Leu Cys Phe Glu Asn Arg Lys Arg Gln
1 5 10
<210> 113
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 113
Leu Cys Phe Glu Asn Arg Lys Arg Gln
1 5
<210> 114
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 114
Lys Cys Tyr Asn Glu Leu Asn Gly Cys Thr Lys Ile Tyr Asp Pro Val
1 5 10 15
Cys
<210> 115
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 115
Lys Cys Tyr Asn Glu Leu Asn Gly Cys Thr Lys Ile Tyr Asp
1 5 10
<210> 116
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 116
Lys Cys Tyr Asn Glu Leu Asn Gly Cys Thr Lys Ile Tyr
1 5 10
<210> 117
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 117
Asn Gly Cys Thr Lys Ile Tyr Asp
1 5
<210> 118
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 118
Leu Asn Gly Cys Thr Lys Ile Tyr Asp Pro Val
1 5 10
<210> 119
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 119
Cys Thr Lys Ile Tyr Asp Pro Val Cys Gly Thr
1 5 10
<210> 120
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 120
Asp Gly Asn Thr Tyr Pro Asn Glu Cys Val Leu Cys Phe Glu Asn Arg
1 5 10 15
Lys Arg Gln Thr Ser Ile Leu Ile Gln Lys Ser Gly Pro Cys
20 25 30
<210> 121
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 121
Gly Asn Thr Tyr Pro Asn Glu Cys Val Leu
1 5 10
<210> 122
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 122
Asn Arg Lys Arg Gln Thr Ser Ile Leu Ile Gln Lys Ser Gly Pro
1 5 10 15
<210> 123
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 123
Arg Lys Arg Gln Thr Ser Ile Leu Ile Gln
1 5 10
<210> 124
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 124
Asn Arg Lys Arg Gln Thr Ser Ile Leu Ile Gln
1 5 10
<210> 125
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 125
Cys Phe Glu Asn Arg Lys Arg Gln Thr Ser Ile Leu Ile
1 5 10
Claims (50)
- AS-SPIK 단백질의 형태적 에피토프에 특이적으로 결합하고, NS-SPIK 단백질에 특이적으로 결합하지 않는 단리된 항체에 있어서, 상기 AS-SPIK 단백질의 상기 형태적 에피토프가
서열번호: 2의 L14, L15, S16, L17, D24 및 S25로 이루어지는 군으로부터 선택된 하나 이상의 아미노산; 및
서열번호: 2의 C58, V59, L60, C61, 및 F62로 이루어지는 군으로부터 선택된 하나 이상의 아미노산
을 포함하는, 단리된 항체. - 제 1 항에 있어서, 상기 형태적 에피토프가 서열번호: 2의 아미노산 L14, L15, S16, 및 L17을 포함하는, 단리된 항체.
- 제 1 항에 있어서, 상기 형태적 에피토프가 서열번호: 2의 아미노산 L60 및 C61을 포함하는, 단리된 항체.
- 제 1 항에 있어서, 상기 형태적 에피토프가 서열번호: 2의 아미노산 L14, L15, S16, L17, L60, 및 C61을 포함하는, 단리된 항체.
- 제 2 항에 있어서, 상기 형태적 에피토프가 서열번호: 2의 아미노산 D24 및 S25를 추가로 포함하는, 단리된 항체.
- 제 3 항에 있어서, 상기 형태적 에피토프가 서열번호: 2의 아미노산 C58, V59 및 F62를 추가로 포함하는, 단리된 항체.
- 제 1 항에 있어서, 상기 형태적 에피토프가 서열번호: 2의 아미노산 L14, L15, S16, L17, D24, S25, C58, V59, L60, C61 및 F62를 포함하는, 단리된 항체.
- 제 1 항 내지 제 7 항 중 어느 한 항에 있어서,
S6을 포함하는 CDRH1 서열; 및/또는
I2, G5, G6, Y10 및 K16을 포함하는 CDRH2 서열; 및/또는
G4 및 Y7을 포함하는 CDRH3 서열; 및/또는
Q4 및 S9를 포함하는 CDRL1 서열; 및/또는
A2, S3, T4 및 S7을 포함하는 CDRL2 서열; 및/또는
Q1, Q2, Y4 및 S5를 포함하는 CDRL3 서열
을 포함하는, 단리된 항체. - 제 8 항에 있어서,
S6을 포함하는 CDRH1 서열;
I2, G5, G6, Y10 및 K16을 포함하는 CDRH2 서열;
G4 및 Y7을 포함하는 CDRH3 서열;
Q4 및 S9를 포함하는 CDRL1 서열;
A2, S3, T4 및 S7을 포함하는 CDRL2 서열; 및
Q1, Q2, Y4 및 S5를 포함하는 CDRL3 서열
을 포함하는, 단리된 항체. - AS-SPIK 단백질의 형태적 에피토프에 특이적으로 결합하고, NS-SPIK 단백질에 특이적으로 결합하지 않는 단리된 항체에 있어서, 상기 AS-SPIK 단백질의 상기 형태적 에피토프가
서열번호: 2의 L36, N37, I42 및 Y43으로 이루어지는 군으로부터 선택된 하나 이상의 아미노산; 및
서열번호: 2의 R67, Q68, I71 및 L72로 이루어지는 군으로부터 선택된 하나 이상의 아미노산
을 포함하는, 단리된 항체. - 제 10 항에 있어서, 상기 형태적 에피토프가 서열번호: 2의 아미노산 L36 및 N37을 포함하는, 단리된 항체.
- 제 10 항에 있어서, 상기 형태적 에피토프가 서열번호: 2의 아미노산 I42 및 Y43을 포함하는, 단리된 항체.
- 제 10 항에 있어서, 상기 형태적 에피토프가 서열번호: 2의 아미노산 L36, N37, I42 및 Y43을 포함하는, 단리된 항체.
- 제 10 항에 있어서, 상기 형태적 에피토프가 서열번호: 2의 아미노산 R67, Q68, I71 및 L72를 포함하는, 단리된 항체.
- 제 10 항에 있어서, 상기 형태적 에피토프가 서열번호: 2의 아미노산 L36, N37, I42, Y43, R67, Q68, I71 및 L72를 포함하는, 단리된 항체.
- 제 10 항 내지 제 15 항 중 어느 한 항에 있어서, 상기 항체가
Y3, S7 및 W9를 포함하는 CDRH1 서열; 및/또는
A1, I2, G4, G6 및 Y10을 포함하는 CDRH2 서열; 및/또는
R1 및 D7을 포함하는 CDRH3 서열; 및/또는
A2, S3, Q4, I6, Y9, L10 및 S11을 포함하는 CDRL1 서열; 및/또는
A2, S3, L5 및 S7을 포함하는 CDRL2 서열; 및/또는
Q1, Q2, 및 T5를 포함하는 CDRL3 서열
을 포함하는, 단리된 항체. - 제 16 항에 있어서, 상기 항체가
Y3, S7 및 W9를 포함하는 CDRH1 서열;
A1, I2, G4, G6 및 Y10을 포함하는 CDRH2 서열;
R1 및 D7을 포함하는 CDRH3 서열;
A2, S3, Q4, I6, Y9, L10 및 S11을 포함하는 CDRL1 서열;
A2, S3, L5 및 S7을 포함하는 CDRL2 서열; 및
Q1, Q2, 및 T5를 포함하는 CDRL3 서열
을 포함하는, 단리된 항체. - 제 1 항 내지 제 17 항 중 어느 한 항에 있어서, 다중-특이적인, 항체.
- 제 18 항에 있어서, 이중특이적인, 항체.
- 제 19 항에 있어서, 효과기 세포에 결합 친화성을 갖는, 항체.
- 제 19 항에 있어서, T-세포 항원에 결합 친화성을 갖는, 항체.
- 제 21 항에 있어서, 상기 T-세포 항원이 CD3 단백질을 포함하는, 항체.
- 제 1 항 내지 제 22 항 중 어느 한 항에 있어서, 단클론성 항체인, 항체.
- 제 1 항 내지 제 22 항 중 어느 한 항에 있어서, CAR-T 형식인, 항체.
- 세포독성 제제에 공유적으로 부착된, 제 1 항 내지 제 23 항 중 어느 한 항에 따른 항체를 포함하는, 면역접합체.
- 제 25 항에 있어서, 상기 세포독성 제제가 독소, 화학치료적 제제, 약물 모이어티, 항생제, 방사성 동위원소 및 핵산분해 효소로 이루어지는 군으로부터 선택되는, 면역접합체.
- 식 Ab-(L-D)p를 갖는 면역접합체로서,
(a) Ab가 제 1 항 내지 제 23 항 중 어느 한 항에 따른 항체이고;
(b) L이 링커이고;
(c) D가 약물 모이어티이고;
(d) p가 1 내지 8 범위인 정수인,
면역접합체. - 제 27 항에 있어서, D가 메이탄시노이드, 아우리스타틴 및 돌로스타틴으로 이루어지는 군으로부터 선택되는, 면역접합체.
- 제 27 항에 있어서, L이 6-말레이미도카프로일 (MC), 말레이미도프로파노일 (MP), 발린-시트룰린 (val-cit), 알라닌-페닐알라닌 (ala-phe), p-아미노벤질옥시카르보닐 (PAB), N-숙신이미딜 4-(2-피리딜티오)펜타노에이트 (SPP), N-숙신이미딜 4-(N-말레이미도메틸)시클로헥산-1 카르복실레이트 (SMCC), 4-(2-피리딜디티오)부티르산-N-히드록시숙신이미드 에스테르 (SPDB), 및 N-숙신이미딜 (4-요오도-아세틸)아미노벤조에이트 (SIAB)로 이루어지는 군으로부터 선택된 하나 이상의 링커를 포함하는, 면역접합체.
- 제 1 항 내지 제 29 항 중 어느 한 항에 따른 항체 또는 면역접합체를 포함하는, 약학적 조성물.
- AS-SPIK의 발현을 특징으로 하는 장애의 치료 방법으로서, 상기 장애를 가진 대상체에 제 1 항 내지 제 29 항 중 어느 한 항의 항체 또는 면역접합체, 또는 제 30 항의 약학적 조성물을 투여하는 단계를 포함하는, 방법.
- AS-SPIK의 발현을 특징으로 하는 장애의 치료를 위한 약제의 제조에서, 제 1 항 내지 제 29 항 중 어느 한 항의 항체 또는 면역접합체의 용도.
- AS-SPIK의 발현을 특징으로 하는 장애의 치료에서 사용을 위한, 제 1 항 내지 제 29 항 중 어느 한 항의 항체 또는 면역접합체.
- 제 31 항 내지 제 33 항 중 어느 한 항에 있어서, 상기 장애가 간 장애인, 방법 또는 용도.
- 제 34 항에 있어서, 상기 간 장애가 간세포 암종인, 방법 또는 용도.
- 제 34 항에 있어서, 상기 간 장애가 간내 담관암종인, 방법 또는 용도.
- 제 34 항에 있어서, 상기 간 장애가 바이러스성 감염인, 방법 또는 용도.
- 제 34 항에 있어서, 상기 간 장애가 염증성 간 장애인, 방법 또는 용도.
- 제 38 항에 있어서, 상기 염증성 간 장애가 간의 간경변인, 방법 또는 용도.
- 제 1 항 내지 제 24 항 중 어느 한 항의 항체를 인코딩하는, 폴리뉴클레오타이드.
- 제 40 항의 상기 폴리뉴클레오타이드를 포함하는, 벡터.
- 제 41 항의 상기 벡터를 포함하는, 숙주 세포.
- 제 1 항 내지 제 29 항 중 어느 한 항의 항체 또는 면역접합체의 생산 방법으로서, 상기 항체의 발현이 허용되는 조건 하에서 제 42 항에 따른 숙주 세포를 성장시키는 단계, 및 상기 항체를 상기 세포로부터 단리시키는 단계를 포함하는, 방법.
- 대상체가 AS-SPIK의 발현을 특징으로 하는 장애를 갖거나 상기 발병의 위험에 처한 지를 결정하는 진단적 방법으로서,
(a) 상기 대상체로부터의 생물학적 테스트 샘플을 제 1 항 내지 제 23 항 중 어느 한 항에 따른 AS-SPIK 항체와 접촉시켜 AS-SPIK-항체 복합체를 생성하는 단계;
(b) 상기 AS-SPIK-항체 복합체의 농도를 상기 생물학적 테스트 샘플에서 검출하는 단계; 및
(c) 상기 AS-SPIK-항체 복합체의 농도를 기준값에 비교하여 상기 대상체가 상기 장애를 갖거나 상기 발병의 위험에 처한 지를 결정하는 단계
를 포함하는, 방법. - 대상체가 AS-SPIK의 발현을 특징으로 하는 장애를 갖거나 상기 발병의 위험에 처한 지를 결정하는 진단적 방법으로서,
(a) 상기 대상체로부터의 생물학적 테스트 샘플을 SPIK에 특이적으로 결합하는 제1 항체 또는 항원-결합 단편과 접촉시켜 SPIK-항체 복합체를 형성하는 단계;
(b) 상기 SPIK-항체 복합체를 제 1 항 내지 제 23 항 중 어느 한 항에 따른 AS-SPIK 항체 또는 항원-결합 단편과 접촉시켜 AS-SPIK-항체 복합체를 생성하는 단계;
(c) 상기 AS-SPIK-항체 복합체의 농도를 상기 생물학적 테스트 샘플에서 검출하는 단계; 및
(d) 상기 AS-SPIK-항체 복합체의 농도를 기준값에 비교하여 상기 대상체가 상기 장애를 갖거나 상기 발병의 위험에 처한 지를 결정하는 단계
를 포함하는, 방법. - 제 44 항 또는 제 45 항에 있어서, 상기 항체 또는 항원-결합 단편이 검출가능한 표지를 포함하는, 진단적 방법.
- 제 44 항 또는 제 45 항에 있어서, 상기 장애가 간 장애인, 진단적 방법.
- 제 47 항에 있어서, 상기 간 장애가 간세포 암종, 간내 담관암종, 상기 간의 바이러스성 감염, 상기 간의 염증성 장애, 및 상기 간의 간경변으로 이루어지는 군으로부터 선택되는, 진단적 방법.
- 제 1 항 내지 제 29 항 중 어느 한 항에 따른 항체 또는 면역접합체를 포함하는, 키트.
- 제 49 항에 있어서, SPIK에 특이적으로 결합하는 항체를 추가로 포함하는, 키트.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201962899024P | 2019-09-11 | 2019-09-11 | |
| US62/899,024 | 2019-09-11 | ||
| PCT/US2020/046782 WO2021050217A1 (en) | 2019-09-11 | 2020-08-18 | Epitopes of anti-serine protease inhibitor kazal (spik) antibodies |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20220080098A true KR20220080098A (ko) | 2022-06-14 |
Family
ID=72243286
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020227011715A Pending KR20220080098A (ko) | 2019-09-11 | 2020-08-18 | 항-세린 프로테아제 억제제 카잘(spik) 항체의 에피토프 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20240043512A1 (ko) |
| EP (1) | EP4028132A1 (ko) |
| JP (1) | JP2022547574A (ko) |
| KR (1) | KR20220080098A (ko) |
| CN (1) | CN114901699A (ko) |
| CA (1) | CA3150538A1 (ko) |
| WO (1) | WO2021050217A1 (ko) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN114174341A (zh) * | 2019-07-08 | 2022-03-11 | 英凯尔生物科技有限责任公司 | 抗丝氨酸蛋白酶抑制剂kazal(spik)抗体、免疫缀合物和使用方法 |
Family Cites Families (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| IL85035A0 (en) | 1987-01-08 | 1988-06-30 | Int Genetic Eng | Polynucleotide molecule,a chimeric antibody with specificity for human b cell surface antigen,a process for the preparation and methods utilizing the same |
| US4975278A (en) | 1988-02-26 | 1990-12-04 | Bristol-Myers Company | Antibody-enzyme conjugates in combination with prodrugs for the delivery of cytotoxic agents to tumor cells |
| EP0940468A1 (en) | 1991-06-14 | 1999-09-08 | Genentech, Inc. | Humanized antibody variable domain |
| US5767237A (en) | 1993-10-01 | 1998-06-16 | Teikoku Hormone Mfg. Co., Ltd. | Peptide derivatives |
| US5641870A (en) | 1995-04-20 | 1997-06-24 | Genentech, Inc. | Low pH hydrophobic interaction chromatography for antibody purification |
| US6248564B1 (en) | 1997-08-29 | 2001-06-19 | Harvard University | Mutant MHC class I molecules |
| US20040018194A1 (en) | 2000-11-28 | 2004-01-29 | Francisco Joseph A. | Recombinant anti-CD30 antibodies and uses thereof |
| US6884869B2 (en) | 2001-04-30 | 2005-04-26 | Seattle Genetics, Inc. | Pentapeptide compounds and uses related thereto |
| AU2002363939A1 (en) | 2001-11-20 | 2003-06-10 | Seattle Genetics, Inc. | Treatment of immunological disorders using anti-cd30 antibodies |
| WO2004032828A2 (en) | 2002-07-31 | 2004-04-22 | Seattle Genetics, Inc. | Anti-cd20 antibody-drug conjugates for the treatment of cancer and immune disorders |
| EP1391213A1 (en) | 2002-08-21 | 2004-02-25 | Boehringer Ingelheim International GmbH | Compositions and methods for treating cancer using maytansinoid CD44 antibody immunoconjugates and chemotherapeutic agents |
| BR122018071808B8 (pt) | 2003-11-06 | 2020-06-30 | Seattle Genetics Inc | conjugado |
| CN101065151B (zh) | 2004-09-23 | 2014-12-10 | 健泰科生物技术公司 | 半胱氨酸改造的抗体和偶联物 |
| JP2011501946A (ja) * | 2007-10-25 | 2011-01-20 | ヴィヴェンティア バイオテクノロジーズ インコーポレーティッド | 変異体HnRNPGの癌関連エピトープに対する抗体およびその使用法 |
| CA2756988A1 (en) | 2009-04-01 | 2010-10-07 | Genentech, Inc. | Anti-fcrh5 antibodies and immunoconjugates |
| US20140308657A1 (en) * | 2010-12-09 | 2014-10-16 | Philadelphia Health & Education Corporation D/B/A Drexel University College Of Medicine | Serine protease inhibitor kazal antibodies |
| WO2014127200A1 (en) * | 2013-02-15 | 2014-08-21 | Immunomedics, Inc. | Chimeric and humanized anti-histone antibodies |
| WO2015164757A1 (en) * | 2014-04-25 | 2015-10-29 | Oregon Health & Science University | Methods of viral neutralizing antibody epitope mapping |
| US11041017B2 (en) * | 2016-03-29 | 2021-06-22 | Obi Pharma, Inc. | Antibodies, pharmaceutical compositions and methods |
| JP7328261B2 (ja) | 2018-03-06 | 2023-08-16 | インケア バイオテック, エルエルシー | セリンプロテアーゼ阻害剤カザル(spik)組成物および方法 |
| CN109678950B (zh) * | 2019-01-08 | 2022-05-10 | 灏灵赛奥(天津)生物科技有限公司 | spink1抗原、能够特异性结合spink1的抗体及其功能片段及其应用和产品 |
| CN114174341A (zh) * | 2019-07-08 | 2022-03-11 | 英凯尔生物科技有限责任公司 | 抗丝氨酸蛋白酶抑制剂kazal(spik)抗体、免疫缀合物和使用方法 |
-
2020
- 2020-08-18 US US17/641,780 patent/US20240043512A1/en active Pending
- 2020-08-18 KR KR1020227011715A patent/KR20220080098A/ko active Pending
- 2020-08-18 CN CN202080071514.XA patent/CN114901699A/zh active Pending
- 2020-08-18 EP EP20762027.9A patent/EP4028132A1/en active Pending
- 2020-08-18 WO PCT/US2020/046782 patent/WO2021050217A1/en not_active Ceased
- 2020-08-18 CA CA3150538A patent/CA3150538A1/en active Pending
- 2020-08-18 JP JP2022516046A patent/JP2022547574A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| JP2022547574A (ja) | 2022-11-14 |
| EP4028132A1 (en) | 2022-07-20 |
| WO2021050217A1 (en) | 2021-03-18 |
| US20240043512A1 (en) | 2024-02-08 |
| CN114901699A (zh) | 2022-08-12 |
| CA3150538A1 (en) | 2021-03-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CA3027417C (en) | Anti-human trop-2 antibody having an antitumor activity in vivo | |
| TWI432452B (zh) | 針對her-3之抗體類及其用途 | |
| US12377162B2 (en) | Anti-serine protease inhibitor kazal (SPIK) antibodies, immunoconjugates, and methods of use | |
| JP7539536B2 (ja) | セリンプロテアーゼ阻害剤カザル(spik)組成物および方法 | |
| CN103492418B (zh) | 针对肾相关抗原1的抗体及其抗原结合片段 | |
| KR102197478B1 (ko) | 식도암을 검출 및 치료하기 위한 조성물 및 방법 | |
| AU2022263503B2 (en) | Compositions and methods for detecting and treating gastric cancer | |
| EP3954999B1 (en) | Compositions and methods for detecting and treating ovarian cancer | |
| CN105007941A (zh) | 抗-lamp1抗体和抗体药物偶联物及其用途 | |
| EP3543259A2 (en) | Antibody binding to carbonic anhydrase and use thereof | |
| CN117098548A (zh) | 抗b7-h3抗体及其用途 | |
| US9840560B2 (en) | Monoclonal antibodies to EGFR, and uses therefor | |
| US20240043512A1 (en) | Epitopes of anti-serine protease inhibitor kazal (spik) antibodies | |
| US20190194319A1 (en) | Anti-ascl1 antibodies and methods of use | |
| US20250340655A1 (en) | Epha2-targeting antibodies and their applications in cancer treatment | |
| JP2019526227A (ja) | 卵巣がんおよび膵臓がんのためのバイオマーカーとしてムチン様タンパク質(mlp)を検出するためのモノクローナル抗体、組成物および方法 | |
| KR20230086712A (ko) | 항-trop-2 항체, 이의 항원-결합 단편 또는 이의 돌연변이체, 및 이의 의학적 용도 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0105 | International application |
St.27 status event code: A-0-1-A10-A15-nap-PA0105 |
|
| PG1501 | Laying open of application |
St.27 status event code: A-1-1-Q10-Q12-nap-PG1501 |
|
| E13-X000 | Pre-grant limitation requested |
St.27 status event code: A-2-3-E10-E13-lim-X000 |
|
| P11-X000 | Amendment of application requested |
St.27 status event code: A-2-2-P10-P11-nap-X000 |
|
| P13-X000 | Application amended |
St.27 status event code: A-2-2-P10-P13-nap-X000 |
|
| PA0201 | Request for examination |
St.27 status event code: A-1-2-D10-D11-exm-PA0201 |
|
| PE0902 | Notice of grounds for rejection |
St.27 status event code: A-1-2-D10-D21-exm-PE0902 |