KR20210144946A - 파킨슨병의 운동동요의 빠른 경감 - Google Patents
파킨슨병의 운동동요의 빠른 경감 Download PDFInfo
- Publication number
- KR20210144946A KR20210144946A KR1020217038097A KR20217038097A KR20210144946A KR 20210144946 A KR20210144946 A KR 20210144946A KR 1020217038097 A KR1020217038097 A KR 1020217038097A KR 20217038097 A KR20217038097 A KR 20217038097A KR 20210144946 A KR20210144946 A KR 20210144946A
- Authority
- KR
- South Korea
- Prior art keywords
- patient
- levodopa
- fpd
- dose
- administration
- Prior art date
Links
- 208000018737 Parkinson disease Diseases 0.000 title claims abstract description 57
- 206010030312 On and off phenomenon Diseases 0.000 title 1
- WTDRDQBEARUVNC-LURJTMIESA-N L-DOPA Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-LURJTMIESA-N 0.000 claims abstract description 296
- WTDRDQBEARUVNC-UHFFFAOYSA-N L-Dopa Natural products OC(=O)C(N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-UHFFFAOYSA-N 0.000 claims abstract description 295
- 229960004502 levodopa Drugs 0.000 claims abstract description 276
- 238000000034 method Methods 0.000 claims abstract description 78
- 230000002685 pulmonary effect Effects 0.000 claims abstract description 58
- 229940068196 placebo Drugs 0.000 claims abstract description 40
- 239000000902 placebo Substances 0.000 claims abstract description 40
- 210000004789 organ system Anatomy 0.000 claims abstract description 13
- 239000002245 particle Substances 0.000 claims description 96
- 239000002775 capsule Substances 0.000 claims description 39
- 208000012661 Dyskinesia Diseases 0.000 claims description 32
- 210000004072 lung Anatomy 0.000 claims description 28
- 239000011859 microparticle Substances 0.000 claims description 26
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 claims description 24
- KILNVBDSWZSGLL-KXQOOQHDSA-N 1,2-dihexadecanoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCCCCCCCCC KILNVBDSWZSGLL-KXQOOQHDSA-N 0.000 claims description 20
- 230000002829 reductive effect Effects 0.000 claims description 16
- 208000024891 symptom Diseases 0.000 claims description 14
- 239000011780 sodium chloride Substances 0.000 claims description 12
- 229940112141 dry powder inhaler Drugs 0.000 claims description 11
- 229940071648 metered dose inhaler Drugs 0.000 claims description 10
- 239000010419 fine particle Substances 0.000 claims description 8
- 230000006872 improvement Effects 0.000 claims description 8
- 210000003437 trachea Anatomy 0.000 claims description 2
- 239000008194 pharmaceutical composition Substances 0.000 claims 11
- 230000036470 plasma concentration Effects 0.000 description 52
- 229960004205 carbidopa Drugs 0.000 description 43
- TZFNLOMSOLWIDK-JTQLQIEISA-N carbidopa (anhydrous) Chemical compound NN[C@@](C(O)=O)(C)CC1=CC=C(O)C(O)=C1 TZFNLOMSOLWIDK-JTQLQIEISA-N 0.000 description 43
- 239000003814 drug Substances 0.000 description 40
- 229940079593 drug Drugs 0.000 description 38
- 239000000843 powder Substances 0.000 description 29
- 238000011282 treatment Methods 0.000 description 19
- 238000010521 absorption reaction Methods 0.000 description 15
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 15
- 239000000443 aerosol Substances 0.000 description 14
- 239000000203 mixture Substances 0.000 description 12
- 206010001497 Agitation Diseases 0.000 description 11
- 238000013019 agitation Methods 0.000 description 11
- 230000008859 change Effects 0.000 description 10
- 238000012216 screening Methods 0.000 description 10
- 238000004458 analytical method Methods 0.000 description 9
- 230000008021 deposition Effects 0.000 description 9
- 230000000694 effects Effects 0.000 description 9
- 230000004044 response Effects 0.000 description 9
- 229940081615 DOPA decarboxylase inhibitor Drugs 0.000 description 8
- 238000009826 distribution Methods 0.000 description 8
- 239000000534 dopa decarboxylase inhibitor Substances 0.000 description 8
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 8
- 210000002345 respiratory system Anatomy 0.000 description 8
- 230000009885 systemic effect Effects 0.000 description 8
- 229960003638 dopamine Drugs 0.000 description 7
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 7
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 7
- 238000012360 testing method Methods 0.000 description 7
- 238000013461 design Methods 0.000 description 6
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 6
- 230000009467 reduction Effects 0.000 description 6
- 150000003839 salts Chemical class 0.000 description 6
- 230000001684 chronic effect Effects 0.000 description 5
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 5
- 238000001647 drug administration Methods 0.000 description 5
- 238000009472 formulation Methods 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- 230000033001 locomotion Effects 0.000 description 5
- 238000002560 therapeutic procedure Methods 0.000 description 5
- BNQDCRGUHNALGH-UHFFFAOYSA-N benserazide Chemical compound OCC(N)C(=O)NNCC1=CC=C(O)C(O)=C1O BNQDCRGUHNALGH-UHFFFAOYSA-N 0.000 description 4
- 229960000911 benserazide Drugs 0.000 description 4
- 230000007423 decrease Effects 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 238000011156 evaluation Methods 0.000 description 4
- 229940126701 oral medication Drugs 0.000 description 4
- 150000003904 phospholipids Chemical class 0.000 description 4
- 239000002243 precursor Substances 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- 230000002618 waking effect Effects 0.000 description 4
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 206010057249 Phagocytosis Diseases 0.000 description 3
- 206010044565 Tremor Diseases 0.000 description 3
- 230000036772 blood pressure Effects 0.000 description 3
- 238000004364 calculation method Methods 0.000 description 3
- 238000011260 co-administration Methods 0.000 description 3
- 230000008030 elimination Effects 0.000 description 3
- 238000003379 elimination reaction Methods 0.000 description 3
- 230000036961 partial effect Effects 0.000 description 3
- 230000024159 perception of rate of movement Effects 0.000 description 3
- 230000008782 phagocytosis Effects 0.000 description 3
- 238000011002 quantification Methods 0.000 description 3
- 238000001694 spray drying Methods 0.000 description 3
- IVTMXOXVAHXCHI-YXLMWLKOSA-N (2s)-2-amino-3-(3,4-dihydroxyphenyl)propanoic acid;(2s)-3-(3,4-dihydroxyphenyl)-2-hydrazinyl-2-methylpropanoic acid Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1.NN[C@@](C(O)=O)(C)CC1=CC=C(O)C(O)=C1 IVTMXOXVAHXCHI-YXLMWLKOSA-N 0.000 description 2
- SLKDGVPOSSLUAI-PGUFJCEWSA-N 1,2-dihexadecanoyl-sn-glycero-3-phosphoethanolamine zwitterion Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OCCN)OC(=O)CCCCCCCCCCCCCCC SLKDGVPOSSLUAI-PGUFJCEWSA-N 0.000 description 2
- NRJAVPSFFCBXDT-HUESYALOSA-N 1,2-distearoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCCCCCCCCCCC NRJAVPSFFCBXDT-HUESYALOSA-N 0.000 description 2
- BIABMEZBCHDPBV-MPQUPPDSSA-N 1,2-palmitoyl-sn-glycero-3-phospho-(1'-sn-glycerol) Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@@H](O)CO)OC(=O)CCCCCCCCCCCCCCC BIABMEZBCHDPBV-MPQUPPDSSA-N 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- -1 DPPC Chemical class 0.000 description 2
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 230000006399 behavior Effects 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 229940052036 carbidopa / levodopa Drugs 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 238000007405 data analysis Methods 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 210000005064 dopaminergic neuron Anatomy 0.000 description 2
- 230000005713 exacerbation Effects 0.000 description 2
- 235000020937 fasting conditions Nutrition 0.000 description 2
- 230000005021 gait Effects 0.000 description 2
- 230000030136 gastric emptying Effects 0.000 description 2
- 230000001788 irregular Effects 0.000 description 2
- 238000001294 liquid chromatography-tandem mass spectrometry Methods 0.000 description 2
- 230000004199 lung function Effects 0.000 description 2
- 210000002540 macrophage Anatomy 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 238000002483 medication Methods 0.000 description 2
- 230000003340 mental effect Effects 0.000 description 2
- 230000037230 mobility Effects 0.000 description 2
- 230000007659 motor function Effects 0.000 description 2
- 210000002569 neuron Anatomy 0.000 description 2
- 230000002746 orthostatic effect Effects 0.000 description 2
- 230000000242 pagocytic effect Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 238000010079 rubber tapping Methods 0.000 description 2
- 238000005070 sampling Methods 0.000 description 2
- PUZPDOWCWNUUKD-UHFFFAOYSA-M sodium fluoride Chemical compound [F-].[Na+] PUZPDOWCWNUUKD-UHFFFAOYSA-M 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- CYDQOEWLBCCFJZ-UHFFFAOYSA-N 4-(4-fluorophenyl)oxane-4-carboxylic acid Chemical compound C=1C=C(F)C=CC=1C1(C(=O)O)CCOCC1 CYDQOEWLBCCFJZ-UHFFFAOYSA-N 0.000 description 1
- WSVLPVUVIUVCRA-KPKNDVKVSA-N Alpha-lactose monohydrate Chemical compound O.O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O WSVLPVUVIUVCRA-KPKNDVKVSA-N 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 208000019693 Lung disease Diseases 0.000 description 1
- 208000008238 Muscle Spasticity Diseases 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 206010034010 Parkinsonism Diseases 0.000 description 1
- 206010071390 Resting tremor Diseases 0.000 description 1
- 206010039424 Salivary hypersecretion Diseases 0.000 description 1
- 208000032140 Sleepiness Diseases 0.000 description 1
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 1
- 206010041349 Somnolence Diseases 0.000 description 1
- 101100289792 Squirrel monkey polyomavirus large T gene Proteins 0.000 description 1
- 206010042458 Suicidal ideation Diseases 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 238000012387 aerosolization Methods 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 1
- 210000001132 alveolar macrophage Anatomy 0.000 description 1
- 230000001668 ameliorated effect Effects 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- VMWNQDUVQKEIOC-CYBMUJFWSA-N apomorphine Chemical compound C([C@H]1N(C)CC2)C3=CC=C(O)C(O)=C3C3=C1C2=CC=C3 VMWNQDUVQKEIOC-CYBMUJFWSA-N 0.000 description 1
- 229960004046 apomorphine Drugs 0.000 description 1
- 210000004227 basal ganglia Anatomy 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 230000019771 cognition Effects 0.000 description 1
- 230000002301 combined effect Effects 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 210000000172 cytosol Anatomy 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 230000003291 dopaminomimetic effect Effects 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000001667 episodic effect Effects 0.000 description 1
- 238000013210 evaluation model Methods 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 230000008921 facial expression Effects 0.000 description 1
- 239000011888 foil Substances 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 230000009246 food effect Effects 0.000 description 1
- 235000021471 food effect Nutrition 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 238000011990 functional testing Methods 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 238000004442 gravimetric analysis Methods 0.000 description 1
- 238000012388 gravitational sedimentation Methods 0.000 description 1
- 229960003943 hypromellose Drugs 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 230000005032 impulse control Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 238000002664 inhalation therapy Methods 0.000 description 1
- 231100000037 inhalation toxicity test Toxicity 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000031891 intestinal absorption Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 229960001375 lactose Drugs 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 229960001021 lactose monohydrate Drugs 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 238000012417 linear regression Methods 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 230000036651 mood Effects 0.000 description 1
- 230000004899 motility Effects 0.000 description 1
- 230000008450 motivation Effects 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 239000006199 nebulizer Substances 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 230000010355 oscillation Effects 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 210000001539 phagocyte Anatomy 0.000 description 1
- 230000003285 pharmacodynamic effect Effects 0.000 description 1
- JTJMJGYZQZDUJJ-UHFFFAOYSA-N phencyclidine Chemical class C1CCCCN1C1(C=2C=CC=CC=2)CCCCC1 JTJMJGYZQZDUJJ-UHFFFAOYSA-N 0.000 description 1
- WTJKGGKOPKCXLL-RRHRGVEJSA-N phosphatidylcholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCC=CCCCCCCCC WTJKGGKOPKCXLL-RRHRGVEJSA-N 0.000 description 1
- 230000008092 positive effect Effects 0.000 description 1
- 230000001144 postural effect Effects 0.000 description 1
- 230000036544 posture Effects 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000009256 replacement therapy Methods 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 230000029058 respiratory gaseous exchange Effects 0.000 description 1
- 230000036387 respiratory rate Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 230000000630 rising effect Effects 0.000 description 1
- 208000026451 salivation Diseases 0.000 description 1
- 230000035807 sensation Effects 0.000 description 1
- 230000001953 sensory effect Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 239000004332 silver Substances 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 229940001089 sinemet Drugs 0.000 description 1
- 208000019116 sleep disease Diseases 0.000 description 1
- 208000022925 sleep disturbance Diseases 0.000 description 1
- 230000004622 sleep time Effects 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 235000011083 sodium citrates Nutrition 0.000 description 1
- 239000011775 sodium fluoride Substances 0.000 description 1
- 235000013024 sodium fluoride Nutrition 0.000 description 1
- 239000001540 sodium lactate Substances 0.000 description 1
- 229940005581 sodium lactate Drugs 0.000 description 1
- 235000011088 sodium lactate Nutrition 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 235000011008 sodium phosphates Nutrition 0.000 description 1
- 229910052938 sodium sulfate Inorganic materials 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- 208000018198 spasticity Diseases 0.000 description 1
- 238000013125 spirometry Methods 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 239000007785 strong electrolyte Substances 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 230000003746 surface roughness Effects 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 230000009747 swallowing Effects 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 239000004408 titanium dioxide Substances 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 238000002562 urinalysis Methods 0.000 description 1
- 230000001755 vocal effect Effects 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/197—Carboxylic acids, e.g. valproic acid having an amino group the amino and the carboxyl groups being attached to the same acyclic carbon chain, e.g. gamma-aminobutyric acid [GABA], beta-alanine, epsilon-aminocaproic acid or pantothenic acid
- A61K31/198—Alpha-amino acids, e.g. alanine or edetic acid [EDTA]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
- A61K9/0075—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy for inhalation via a dry powder inhaler [DPI], e.g. comprising micronized drug mixed with lactose carrier particles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Veterinary Medicine (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Epidemiology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Otolaryngology (AREA)
- Pulmonology (AREA)
- Psychology (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicinal Preparation (AREA)
Abstract
본 발명은 레보도파를 환자의 폐 기관계에 투여하는 단계를 포함하는 파킨슨병 환자에서 오프 에피소드의 치료방법을 제공하되, 투여 후에, 상기 환자의 통합 파킨슨병 척도 파트 3 스코어는 위약 대조군에 비해 그리고/또는 투여 전의 상기 환자의 UDPRS 파트 3 스코어에 비해, 예를 들어 적어도 5점만큼 개선된다. 본 발명은 또한 파킨슨 환자에서 평균 1일 오프 시간을 감소시키는 방법을 제공한다.
Description
파킨슨병(또한 본 명세서에서 "PD"로서 지칭됨)은 신경병리학적으로 기저핵 내 도파민 뉴런의 변성 그리고 신경학상 쇠약성 미진, 느린 움직임 및 균형 문제를 특징으로 한다. 백만명 이상의 사람들이 파킨슨병으로 고통받고 있는 것으로 추정된다. 거의 모든 환자는 종종 도파-데카복실라제 저해제인 카비도파와 함께 도파민 전구체 레보도파 또는 "L-도파(L-Dopa)"를 받는다. L-도파는 질환의 초기 단계에서 파킨슨병의 증상을 적절하게 제어한다. 그러나, 이는 질환 과정에서 몇 개월로부터 몇 년까지 다를 수 있는 기간 후에 덜 효과적이 되는 경향이 있다.
L-도파의 감소되는 유효성의 일 예는 치료를 받는 대상에서 운동동요의 발생이다. "운동동요"는 일정 시간 기간 동안 치료제가 양호한 효능 및 파킨슨 증상의 적절한 제어(본 명세서에서 "온(ON)" 타임/에피소드" 또는 "온"으로서 지칭됨)를 나타내는 반면, 다른 시간 기간 동안 제제가 효과를 거의 갖지 않는 것으로 나타나고 본 명세서에서 또한 오프(OFF) 시간/에피소드" 또는 "오프"로서 지칭되는 파킨슨 병 증상의 악화가 있도록 대상체가 도파민 대체 치료법에 대해 가변적 반응을 나타내기 시작하는 것을 의미한다. 운동동요는 효능의 '약효소진(wearing-off)'으로서 나타낼 수 있고, L-도파 치료법의 효능은 초기에 관찰되고, 환자가 이동성의 장애를 유발하는 동요를 경험하는 '온-오프' 증후군이 계속해서 일어난다면, 지속되지 않는다. 점진적으로, 일정 시간에 걸쳐, L-도파의 효능("온 타임")은 도파민 작용성 치료의 유용성이 심각하게 제한되는 정도로 감소될 수 있다.
파킨슨병 환자에서 L-도파의 다양한 효과는 심지어 카비도파와 공동투여될 때조차, 1 내지 3시간의 범위로 매우 짧은 경향이 있는 L-도파의 혈장 반감기와 적어도 부분적으로 관련되는 것으로 여겨진다. 질환의 초기 단계에서, 이 인자는 표적화된 선조체 뉴런의 도파민 저장 능력에 의해 완화된다. L-도파는 뉴런에 의해 받아들여지고, 저장되며, 시간에 따라 방출된다. 그러나, 질환이 진행됨에 따라, 도파민 작용성 뉴런은 퇴행되어 도파민 저장 능력을 감소시켰다.
따라서, L-도파의 긍정적 효과는 L-도파의 혈장 수준의 동요와 더욱 더 관련된다. 추가로, 환자는 L-도파의 위배출 및 불량한 장 흡수를 수반하는 문제가 발생하는 경향이 있다. 레보도파의 불규칙한 위배출은 이동성의 무작위 동요에 기여한다. 환자는 혈장 수준이 떨어질 때 고전적 파킨슨병 증상으로의 복귀로부터 L-도파 투여 후 혈장 수준이 너무 높아질 때 소위 이상운동증의 범위까지 파킨슨병 증상에서 더욱 더 뚜렷한 흔들림을 나타낸다.
효과가 임상적으로 의미있는 시간 기간에 생기고, 효과가 환자에서 충분한 지속기간을 허용하는 파킨슨 환자에서 운동동요 및 오프 에피소드의 빠른 경감을 제공할 필요가 남아있다.
본 발명은 환자의 폐 기관계에 레보도파를 투여하는 단계를 포함하는 파킨슨병 환자에서 오프 에피소드를 치료하는 방법을 제공하되, 투여 후에, 통합 파킨슨병 평가척도(Unified Parkinson's Disease Rating Scale: UPDRS) 파트 3(또한 본 명세서에서 "UPDRS 파트 III" 또는 "UDPRS III"으로서 지칭됨) 스코어는 위약 대조군에 비해, 예를 들어, 적어도 약 5점만큼 개선되고/되거나 투여 후에 환자의 통합 파킨슨병 척도(UPDRS) 파트 3 스코어는 투여 전 환자의 UDPRS 부분 3 스코어에 비해, 예를 들어, 적어도 약 5점만큼 개선된다. 바람직한 실시형태에서, 환자의 UPDRS 파트 3 스코어는, 예를 들어, 레보도파 투여의 약 60분 이내에 개선된다. 본 발명은 또한 평균 1일 오프 시간을 감소시키는 방법 및 환자에게 레보도파를 전달하는 방법을 제공한다. 본 발명은 파킨슨 환자에서 평균 1일 오프 시간 및 오프 에피소드의 지속기간을 감소시킴에 있어서 특히 유용하다.
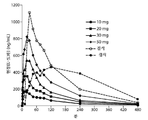
도 1: 90/8/2 흡입 및 경구 레보도파 투여 후의 평균 혈장 레보도파 농도 대 시간 데이터를 도시한 도면.
도 2: 경구 투여에 비해 90/8/2 흡입 후의 평균 혈장 레보도파 농도 대 시간 데이터를 도시한 도면.
도 3: 섭식 및 절식 상태 하에서 50㎎ 90/8/2의 흡입 또는 100㎎ 레보도파(CD/LD 25/100㎎)의 경구 투여 후 개개 대상체에서 혈장 레보도파 농도를 도시한 도면.
도 4: 레보도파 AUC0-∞ 대 90/8/2 미세입자 용량을 도시한 도면.
도 5: 레보도파 Cmax 대 90/8/2 미세입자 용량을 도시한 도면.
도 6: 평균 혈장 농도의 약동학적 모델링을 도시한 도면. 기호는 관찰한 평균 농도를 나타내고, 선은 모델에 의해 예측되는 농도를 나타낸다.
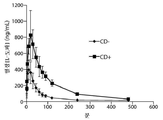
도 7: 카비도파(CD) 전처리가 있는 그리고 카비도파 전처리가 없는 평균 레보도파 혈장 농도.
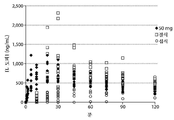
도 8: 환자 혈장 레보도파 농도를 UPDRS 스코어에 비교한 것을 도시한 도면.
도 9: 50㎎의 90/8/2 미세입자 용량인 용량 수준 2로 연구 약물을 받은 환자와 위약을 받은 환자 사이의 주 종말점(Primary Endpoint)인 6회차 방문시 UPDRS 파트 3 스코어의 평균 변화 대 시간(분)을 나타내는 선형 그래프를 도시한 도면.
도 10: 35㎎의 90/8/2 미세입자 용량인 용량 수준 1로 연구 약물을 받은 환자와 위약을 받은 환자 사이의 주 종말점인 4회차 방문시 UPDRS 파트 3 스코어의 평균 변화 대 시간(분)을 나타내는 선형 그래프를 도시한 도면.
도 11: 이상운동증에 의해 온(ON) 시간에서 악화가 없음을 나타내는 도면. 도 11A는 위약에 비해 90/8/2 사이에 시간(주)에 따른 비고질적 이상운동증 시간(hr)의 변화를 도시한 도면. 도 11B는 90/8/2와 위약 사이의 시간 기간(주)에 따른 고질적 이상운동증 시간(hr)의 변화를 나타낸다.
도 2: 경구 투여에 비해 90/8/2 흡입 후의 평균 혈장 레보도파 농도 대 시간 데이터를 도시한 도면.
도 3: 섭식 및 절식 상태 하에서 50㎎ 90/8/2의 흡입 또는 100㎎ 레보도파(CD/LD 25/100㎎)의 경구 투여 후 개개 대상체에서 혈장 레보도파 농도를 도시한 도면.
도 4: 레보도파 AUC0-∞ 대 90/8/2 미세입자 용량을 도시한 도면.
도 5: 레보도파 Cmax 대 90/8/2 미세입자 용량을 도시한 도면.
도 6: 평균 혈장 농도의 약동학적 모델링을 도시한 도면. 기호는 관찰한 평균 농도를 나타내고, 선은 모델에 의해 예측되는 농도를 나타낸다.
도 7: 카비도파(CD) 전처리가 있는 그리고 카비도파 전처리가 없는 평균 레보도파 혈장 농도.
도 8: 환자 혈장 레보도파 농도를 UPDRS 스코어에 비교한 것을 도시한 도면.
도 9: 50㎎의 90/8/2 미세입자 용량인 용량 수준 2로 연구 약물을 받은 환자와 위약을 받은 환자 사이의 주 종말점(Primary Endpoint)인 6회차 방문시 UPDRS 파트 3 스코어의 평균 변화 대 시간(분)을 나타내는 선형 그래프를 도시한 도면.
도 10: 35㎎의 90/8/2 미세입자 용량인 용량 수준 1로 연구 약물을 받은 환자와 위약을 받은 환자 사이의 주 종말점인 4회차 방문시 UPDRS 파트 3 스코어의 평균 변화 대 시간(분)을 나타내는 선형 그래프를 도시한 도면.
도 11: 이상운동증에 의해 온(ON) 시간에서 악화가 없음을 나타내는 도면. 도 11A는 위약에 비해 90/8/2 사이에 시간(주)에 따른 비고질적 이상운동증 시간(hr)의 변화를 도시한 도면. 도 11B는 90/8/2와 위약 사이의 시간 기간(주)에 따른 고질적 이상운동증 시간(hr)의 변화를 나타낸다.
정의
반감기(T½)는 체액 또는 조직 내 약물 농도(C)가 농도 C/2에 도달하는 시간이다.
"Cmax폐"는 폐 전달 후 측정한 바와 같은 최대 관찰 혈장 농도(Cmax)를 의미한다. "Cmax경구"는 경구 전달 후에 측정한 바와 같은 최대 관찰 혈장 농도를 의미한다.
곡선하 면적, 즉, AUC는 주어진 시간 간격에 걸친 혈장 농도의 적분에 대응한다. AUC는 질량 단위(㎎, g) x 리터-1 x 시간의 단위로 표시하며, 약물의 생체이용가능성의 측정이다.
"AUC폐"는 폐 전달 후 측정한 바와 같은 시간 대한 혈장 농도 곡선하 면적(AUC)을 의미한다. "AUC경구"는 경구 전달 후 측정한 바와 같은 시간에 대한 혈장 농도 곡선하 면적(AUC)을 의미한다.
용어 CV%로서 표현하는 "변동계수"(CV)는 표준 편차 σ 대 평균 X의 비로서 정의한다:
Cν = σ/μ
본 명세서에서 사용되는 바와 같은, 어구 "공칭 용량" 또는 "공칭 분말 용량"은 리셉터클 내에 수용된 입자의 총 질량으로 제공되고 환자에 대한 투여를 위해 이용가능한 레보도파의 최대 양을 나타내는 레보도파의 백분율을 의미한다.
미세입자 분획" 또는 "FPF"는 공기 역학 직경이 5.6㎛ 미만인, 리셉터클 내에 존재하는 입자의 질량에서의 입자의 백분율에 대응한다.
본 명세서에서 사용되는 바와 같은 용어 "미세입자 용량"은 공칭 용량 곱하기 FPF로서 정의된다.
본 명세서에서 사용되는 바와 같은, 환자에서 "평균 1일 오프 시간의 감소"는 환자 다이어리에 기록한 바와 같은 또는 임상의에 의해 관찰한 바와 같은 1일 오프 시간의 평균 감소를 지칭한다.
본 명세서에서 사용되는 바와 같은 통합 파킨슨병 척도(UPDRS)는 파킨슨병의 징후 및 증상을 측정하기 위한 잘 확립된 도구이다. 총 UPDRS는 네(4) 부분으로 이루어진다. 파트 1, 2 및 3은 44개의 질문을 포함한다. 달리 표시되지 않는 한, 모든 항목은 0(정상)으로부터 4(중증으로 영향받음)로 등급화되며, 각각의 항목은 짧은 문장으로 표시된다. UPDRS는 임상의(운동 검사)에 의한 스코어링과 일상생활의 정신 기능 및 활동의 이력 보고(환자에 대한 질문에 의해 얻은 ADL)를 포함한다. 부분 1은 지적 기능장애, 사고장애, 동기부여/자주성 및 우울증을 포함하는, 정신 작용, 거동 및 기분을 측정한다. 파트 2는 언어 능력, 타액 분비, 연하, 필기, 음식 자르기, 옷 벗기, 보행동결, 미진 및 감각 통증을 포함하는 일상 생활 활동(ADL)을 측정한다. 파트 3은 운동 검사이고, 측정은 언어 능력, 얼굴 표정, 휴식 시 미진, 행동 미진, 경직, 손가락 두드림, 손동작, 손 회내 및 회외, 다리 민첩성, 의자에서 일어섬, 자세, 걸음걸이, 자세 안정성 및 신체 운동완서를 포함한다. 파트 4는 특히 이상운동증 지속기간, 장애 통증, 오프 기간 및 지속기간, 수면 장애를 포함하는 치료법의 합병증을 측정한다.
약어 목록
본 발명의 특징 및 다른 상세한 설명은 이제 더 구체적으로 기재되며 청구범위에서 언급될 것이다. 본 발명의 특정 실시형태는 예시로서 나타내며 본 발명의 제한은 아닌 것으로 이해될 것이다. 본 발명의 원칙적 특징은 본 발명의 범주로부터 벗어나는 일 없이 다양한 실시형태에서 사용될 수 있다. 본 명세서에서 그리고 첨부된 청구범위에서 사용되는 바와 같은, 단수 형태는 문맥에서 달리 명확하게 표시되지 않는 한 복수의 대상을 포함한다.
본 발명에 따라서, 본 명세서에서 사용되는 용어 "레보도파의 용량"은 흡입에 의해 환자에게 전달하는데 적합한 제형 내에 레보도파의 양을 포함하는 제형을 의미한다. 일 실시형태에서, 본 발명에 따른 레보도파의 용량은 레보도파를 함유하는 입자를 포함한다. 호흡계에 레보도파를 전달하기 위한 입자 및 방법은, 예를 들어, 미국 특허 제6,514,482호 및 미국 특허 재발행 번호 RE43711에서 기재되며, 이들 둘 다 본 명세서에 그들의 전문이 참고로 포함된다. 입자는 바람직하게는 건조 분말 형태이고, 이하에 추가로 기재하는 바와 같은 미세입자 분획(FPF), 기하학적 및 공기 역학 차원을 특징으로 한다.
캐스케이드 임팩터를 이용하는 중량 측정 분석은 공기로 운반되는 입자의 크기 분포를 측정하는 방법이다. 안데르센 캐스케이드 임팩터(Andersen Cascade Impactor: ACI)는 공기 역학 크기에 기반한 9개의 별도의 분획으로 에어로졸을 분리시킬 수 있는 8단계 임팩터이다. 각각의 단계의 크기 컷오프는 ACI가 작동되는 유속에 의존한다. 바람직하게는 ACI는 60ℓ/분으로 조정된다.
일 실시형태에서, 2단계 붕괴 ACI는 입자 최적화를 위해 사용된다. 2단계 붕괴 ACI는 8단계 ACI의 0, 2 및 F 단계로 이루어지며, 2개의 별도의 분말 분획 수집을 가능하게 한다. 각각의 단계에서, 에어로졸 스트림은 노즐을 통과하며, 표면 상에 나쁜 영향을 준다. 충분히 큰 관성을 지니는 에어로졸 스트림 내의 입자는 플레이트 상에 영향을 미칠 것이다. 플레이트 상에 영향을 미치는데 충분한 관성을 갖지 않는 더 작은 입자는 에어로졸 스트림에 남으며, 다음 단계로 운반될 것이다.
ACI는 제1 단계에서 수집된 분말의 분획이 미세입자 분획 FPF(5.6)로서 지칭되도록 조정된다. 이 FPF는 공기 역학 직경이 5.6㎛ 미만인 입자의%에 대응한다. ACI의 제1 단계를 통과하고 수집 필터 상에 침착된 분말의 분획은 FPF(3.4)로서 지칭된다. 이는 공기 역학 직경이 3.4㎛ 미만인 입자의 %에 대응한다.
FPF(5.6) 분획은 환자의 폐에 침착된 분말의 분획과 상관관계가 있는 것으로 입증된 반면, FPF(3.4)는 환자의 폐 심부에 도달되는 분말의 분획과 상관관계가 있는 것으로 입증되었다.
본 발명의 입자의 적어도 50%의 FPF는 약 5.6㎛ 미만이다. 예를 들어, 이하로 제한되는 것은 아니지만, 입자의 적어도 60%, 또는 70%, 또는 80%, 또는 90%의 FPF는 약 5.6㎛ 미만이다.
공기로 운반되는 입자의 크기 분포를 측정하기 위한 다른 방법은 다중 단계 액체 집진 장치(multi-stage liquid impinger: MSLI)이다. 다중 단계 액체 집진 장치(MSLI)는 안데르센 캐스케이드 임팩터(ACI)와 동일한 원리로 작동하지만, 8 단계 대신 MSLI에서의 5단계가 있다. 추가적으로, 고체 플레이트로 이루어진 각각의 단계 대신에, 각각의 MSLI 단계는 메탄올 습윤 유리 프릿으로 이루어진다. 습윤 단계는 ACI를 이용하여 생길 수 있는 바운싱 및 재비산(re-entrainment)을 방지하기 위해 사용된다. MSLI는 분말의 유속 의존도의 표시를 제공하기 위해 사용된다. 이는 30, 60 및 90ℓ/분에 MSLI를 작동시킴으로써 그리고 단계 1에서 수집한 분말의 분획 및 수집 필터를 측정함으로써 달성될 수 있다. 각각의 단계에서 분획이 상이한 유속에 걸쳐 상대적으로 일정하게 남아있다면, 분말은 유속 독립성에 접근하는 것으로 고려된다.
본 발명의 입자는 탭밀도가 약 0.4g/㎤ 미만이다. 탭밀도가 약 0.4g/㎤ 미만인 입자는 본 명세서에서 "공기 역학적으로 가벼운 입자"로서 지칭된다. 예를 들어, 입자는 탭밀도가 약 0.3g/㎤ 미만, 또는 탭밀도가 약 0.2g/㎤ 미만, 탭밀도가 약 0.1g/㎤ 미만이다. 탭밀도는 이중 플랫폼 마이크로프로세서 제어기 탭밀도 시험기(노스캐롤라이나주에 소재한 반켈(Vankel)) 또는 GEOPYC(상표명) 기기(조지아주 30093 노르크로스에 소재한 마이크로메트릭스 인스트루먼트 코포레이션(Micrometrics Instrument Corp.))와 같은 당업자에게 잘 공지된 기기를 이용하여 측정될 수 있다. 탭밀도는 포정(envelope) 질량 밀도의 표준 측정이다. 탭밀도는 문헌[United States Pharmacopia convention, Rockville, MD, 10th 부록, 4950-4951, 1999]의 USP 전용적 밀도 및 탭 밀도 방법을 이용하여 결정될 수 있다. 낮은 탭밀도에 기여할 수 있는 특징은 불규칙적 표면 질감 및 다공성 구조를 포함한다.
등방성 입자의 포정 질량 밀도는 입자의 질량을, 입자를 둘러쌀 수 있는 최소 구형 포정 용적으로 나눈 것으로 정의된다. 본 발명의 일 실시형태에서, 입자는 포정 질량 밀도가 약 0.4g/㎤ 미만이다.
본 발명의 입자는, 예를 들어 용적 중앙값 기하학적 직경(volume median geometric diameter: VMGD)이 적어도 약 1 마이크론(㎛)인 바람직한 크기를 가진다. 일 실시형태에서, VMGD는 약 1㎛ 내지 30㎛, 또는 약 1㎛ 내지 30㎛, 예를 들어, 이하로 제한되는 것은 아니지만, 약 5㎛ 내지 약 30㎛, 또는 약 10㎛ 내지 30㎛에 의해 포함되는 임의의 하위 범위이다. 예를 들어, 입자는 VMGD가 약 1㎛ 내지 10㎛, 또는 약 3㎛ 내지 7㎛, 또는 약 5㎛ 내지 15㎛ 또는 약 9㎛ 내지 약 30㎛의 범위에 있다. 입자는 중앙값 직경, 질량 중앙값 직경(mass median diameter: MMD), 질량 중앙값 포정 직경(mass median envelope diameter: MMED) 또는 질량 중앙값 기하학적 직경(mass median geometric diameter: MMGD)이 적어도 1㎛, 예를 들어, 5㎛ 또는 약 10㎛ 근처이거나 더 크다. 예를 들어, 입자는 MMGD가 약 1㎛ 초과이고, 약 30㎛의 범위에 있거나, 또는 임의의 하위 범위는 약 1㎛ 내지 30㎛, 예를 들어, 이하로 제한되는 것은 아니지만, 약 5㎛ 내지 30㎛ 또는 약 10㎛ 내지 약 30㎛에 포함된다.
분무 건조 입자의 직경, 예를 들어, VMGD는 레이저 회절 기기(예를 들어 뉴저지주 프린스턴에 소재한 심파텍(Sympatec)에 의해 제조된 헬로스(Helos))를 이용하여 측정될 수 있다. 입자 직경을 측정하기 위한 다른 기지는 당업계에 잘 공지되어 있다. 샘플 내 입자의 직경은 범위가 입자 조성 및 합성 방법과 같은 인자에 따를 것이다. 샘플 내 입자의 크기 분포는 호흡관 내 표적화된 부위에 최적의 침착을 허용하도록 선택될 수 있다.
공기역학적으로 가벼운 입자 바람직하게는 "질량 중앙값 공기 역학 직경"(MMAD)을 가지며, 또한 본 명세서에서 약 1㎛ 내지 약 5㎛, 또는 1㎛ 내지 약 5㎛에 포함되는 임의의 하위 범위의 "공기 역학 직경"으로서 지칭된다. 예를 들어, MMAD는 약 1㎛ 내지 약 3㎛, 3㎛ 내지 약 5㎛이다.
실험적으로, 공기 역학 직경은 중력침강 방법을 사용함으로써 결정될 수 있고, 이에 의해 입자의 집합이 특정 거리로 침강되는 시간을 사용하여 입자의 공기 역학 직경을 직접적으로 추론한다. 질량 중앙값 공기 역학 직경(MMAD)을 추론하기 위한 간접적 방법은 다중 단계 액체 집진 장치(MSLI)이다.
공기 역학 직경인 d aer 은 하기 식으로부터 추정할 수 있다:
daer = dg √ρ탭
식 중, dg는 기하학적 직경, 예를 들어 MMGD이고, ρ는 분말 밀도이다.
탭밀도가 약 0.4g/㎤ 미만이고, 중앙값 직경이 적어도 약 1㎛, 예를 들어, 적어도 약 5㎛이며, 공기 역학 직경이 약 1㎛ 내지 약 5㎛, 바람직하게는 약 1㎛ 내지 약 3㎛인 입자는 구강인두 영역에서 관성 및 중력 침착을 더 벗어날 수 있으며, 기도, 특히 폐 심부로 표적화된다. 더 크고, 더 다공성인 입자의 사용이 유리한데, 그들이 흡입 치료법을 위해 현재 사용되는 것과 같은 더 작고, 더 조밀한 에어로졸 입자보다 더 효율적으로 에어로졸화될 수 있기 때문이다.
더 작고, 상대적으로 조밀한 입자에 비해, 바람직하게는 중앙값 직경이 적어도 약 5㎛인 더 큰 공기 역학적으로 가벼운 입자는 또한 잠재적으로, 식세포의 사이토졸 공간으로부터의 입자의 크기 배제에 기인하여, 폐포 대식세포에 의한 식세포 탐식(engulfment) 및 폐로부터의 클리어런스를 더 성공적으로 회피할 수 있다. 폐포 대식세포에 의한 입자의 식세포작용은 입자가 약 3㎛ 이상으로 증가됨에 따라 가파르게 감소된다. 문헌[Kawaguchi, H., et al., Biomaterials, 7: 61-66 (1986); Krenis, L.J. and Strauss, B., Proc. Soc. Exp. Med., 107: 748-750 (1961); 및 Rudt, S. and Muller, R.H., J. Contr. Rel, 22: 263-272 (1992)] 참조. 거친 표면을 지니는 구체와 같은 통계학적으로 등방성 형상의 입자에 대해, 입자 포정 용적은 완전한 입자 식세포작용을 위해 대식세포 내에서 필요한 사이토졸 공간의 용적과 거의 동일하다.
입자는 호흡관의 선택된 영역, 예컨대 폐 심부 또는 상기도 또는 중심기도에 대한 국소화된 전달을 위해 적절한 물질, 표면 거칠기, 직경 및 탭밀도를 이용하여 제작될 수 있다. 예를 들어, 더 높은 밀도 또는 더 큰 입자는 상기도에 대해 사용될 수 있으며, 동일 또는 상이한 치료제와 함께 제공되는 샘플 내의 다양한 크기 입자의 혼합물은 1회 투여로 폐 내의 상이한 영역을 표적화하기 위해 투여될 수 있다. 약 3 내지 약 5㎛ 범위의 공기 역학 직경을 갖는 입자는 중심 및 상부 기도에 대한 전달에 바람직하다. 약 1 내지 약 3㎛ 범위의 공기 역학 직경을 갖는 입자는 폐 심부에 대한 전달에 바람직하다.
에어로졸의 관성충돌 및 중력침강은 정상 호흡 상태 동안 폐의 기도 및 선포에서 우세한 침착 메커니즘이다. 문헌[Edwards, D.A., J. Aerosol Sci., 26: 293-317 (1995)]. 침착 메커니즘 둘 다의 중요성은 에어로졸의 질량에 비례하여 증가한다(입자(또는 포정) 용적에 비례하지 않음). 폐 내의 에어로졸 침착 부위는 에어로졸 질량에 의해 결정되기 때문에(적어도 평균 공기 역학 직경의 입자가 대략 1㎛ 초과임), 입자 표면 불규칙 및 입자 다공성을 증가시킴으로써 탭밀도를 감소시키는 것은 폐 내로 거대 입자 포정 용적을 전달하게 하며, 모든 다른 물리적 매개변수는 동일하다.
낮은 탭밀도 입자는 실제 포정 구체 직경에 비해 작은 공기 역학 직경을 가진다. 공기 역학 직경인 d aer 은 단순화된 하기 식에 의해 포정 구체 직경인 d와 관련된다(문헌[Gonda, I., "Physico-chemical principles in aerosol delivery", Topics in Pharmaceutical Sciences 1991 (eds. D.J.A. Crommelin and K.K. Midha), pp. 95-117, Stuttgart: Medpharm Scientific Publishers, 1992)]):
d aer = d√ρ
식 중, 포정 질량 밀도는 단위가g/㎤이다.
인간 폐의 폐포 영역에서 단분산 에어로졸 입자의 최대 침착(대략 60%)은 대략 d aer =3㎛의 공기 역학 직경에 대해 생긴다. 문헌[Heyder, J. et al., J. Aerosol Sci., 17: 811-825 (1986)]. 그들의 작은 포정 질량 밀도에 기인하여, 최대 폐 심부 침착을 나타내는 단분산 흡입 분말을 포함하는 공기 역학적으로 가벼운 입자의 실제 직경 d는 하기와 같다:
d = 3/√ρ㎛(여기서 ρ는 1g/㎤ 이하임);
식 중, d는 항상 3㎛ 초과이다. 예를 들어, 포정 질량 밀도인 μ = 0.1g/㎤를 나타내는 공기 역학적으로 가벼운 입자는 포정 직경이 9.5㎛만큼 큰 입자에 대해 최대 침착을 나타낼 것이다. 증가된 입자 크기는 입자간 접착력을 감소시킨다. 문헌[Visser, J., Powder Technology, 58: 1-10]. 따라서, 거대 입자 크기는 더 낮은 식세포 상실에 기여하는 것에 추가로 낮은 포정 질량 밀도의 입자에 대해 폐 심부에 대한 에어로졸화 효능을 증가시킨다.
공기 역학 직경은 폐 내에서 최대 침착을 제공하도록 계산될 수 있다. 이전에 이는 직경이 약 5마이크론 미만, 바람직하게는 약 1 내지 약 3 마이크론인 매우 작은 입자의 사용에 의해 달성되었고, 이어서, 식세포작용을 받았다. 더 큰 직경을 갖지만, 충분히 가벼운(따라서 "공기 역학적으로 가벼운" 특징) 입자의 선택은 폐에 대한 동일한 전달을 야기하지만, 더 큰 입자는 식세포 작용을 하지 않는다. 개선된 전달은 매끄러운 표면을 지니는 것에 비해 거친 또는 울퉁불퉁한 표면을 지니는 입자를 이용함으로써 얻어질 수 있다.
본 발명의 다른 실시형태에서, 입자는 약 0.4g/㎤ 미만의 포정 질량 밀도를 가진다(본 명세서에서 또한 "질량 밀도"로서 지칭된다). 일부 실시형태에서, 입자 밀도는 약 0.01, 0.02, 0.03, 0.04, 0.05, 0.06, 0.07, 0.08, 0.09, 0.1 미만, 0.02 내지 0.05, 0.02 내지 0.06g/㎤이다. 질량 밀도 및 질량 밀도 간의 관계, 평균 직경과 공기 역학 직경은 본 명세서에 전문이 참고로 포함되는 에드워즈(Edwards) 등에 의해 2001년 7월 3일자로 발행된 미국 특허 제6,254,854호에서 논의된다.
상기 기재한 조성물 및 공기 역학 특성을 갖는 입자는 분무 건조를 포함하지만, 이들로 제한되지 않는 몇몇 방법에 의해 생성될 수 있다. 일반적으로, 분무 건조 기법은, 예를 들어, 문헌[K. Masters in "Spray Drying Handbook", John Wiley & Sons, New York, 1984]에 기재되어 있다.
본 명세서에서 사용되는 바와 같은, 용어 "유효량" 또는 "치료적 유효량"은 목적으로 하는 효과 또는 효능을 달성하는데 필요한 양을 의미한다. 약물의 실제 유효량은 이용 중인 특정 약물 또는 이의 조합물, 제형화된 특정 조성물, 투여 방식 및 환자의 연령, 병태, 및 치료 중인 에피소드의 중증도에 따라 다를 것이다. 도파민 전구체, 효현제 또는 이의 조합물의 경우에, 치료법이 필요한 파킨슨 증후군을 감소시키는 양이다. 특정 환자에 대한 투약량은 본 명세서에 기재되어 있으며, 통상적인 고려사항을 이용하여(예를 들어, 적절하고, 통상적인 약학적 프로토콜에 의해) 당업자에 의해 결정될 수 있다.
호흡계에 대한 입자의 투여는 당업계에 공지된 것과 같은 수단에 의할 수 있다. 예를 들어, 입자는 건조 분말 흡입기(dry powder inhaler: DPI)와 같은 흡입 장치로부터 전달된다. 정량 흡입기(Metered-dose-inhaler: MDI), 네뷸라이저 또는 점적주입 기법이 또한 사용될 수 있다.
일 실시형태에서, 입자의 폐시스템에 대한 전달은 미국 특허 제6,858,199호(발명의 명칭: "High Efficient Delivery of a Large Therapeutic Mass Aerosol", 및 미국 특허 제7,556,798호(발명의 명칭: "Highly Efficient Delivery of a Large Therapeutic Mass Aerosol")에 기재된 방법에 의한다. 이들 특허 둘 다의 전문은 본 명세서에 참고로 포함된다. 그들에 개시된 바와 같이, 입자는 리셉터클 내에 보유되거나, 수용되거나, 저장되거나 또는 동봉된다. 리셉터클, 예를 들어, 캡슐 또는 블리스터는 용적이 적어도 약 0.37㎤이며, 건조 분말 흡입기에서 사용하는데 적합한 설계를 가질 수 있다. 용적이 적어도 약 0.48㎤, 0.67㎤ 또는 0.95㎤인 더 큰 리셉터클이 또한 사용될 수 있다. 본 명세서에서 사용되는 바와 같은, 용어 "리셉터클"은, 예를 들어, 캡슐, 블리스터, 필름이 덮인 용기 웰, 챔버 및 당업자에게 공지된 흡입 장치에서 입자, 분말 또는 호흡가능한 조성물을 저장하는 다른 적합한 수단을 포함하지만, 이들로 제한되지 않는다. 일 실시형태에서, 리셉터클은 캡슐, 예를 들어, 특정 캡슐 크기, 예컨대 2, 1, 0, 00 또는 000으로 표기된 캡슐이다. 적합한 캡슐은, 예를 들어, 시오노기사(Shionogi)(메릴랜드주 락빌에 소재)로부터 얻을 수 있다. 일 실시형태에서, 캡슐 껍질은 하이드록시프로필 메틸셀룰로스(HPMC)를 포함할 수 있다. 추가 실시형태에서, 캡슐 껍질은 하이드록시프로필 메틸셀룰로스(HPMC) 및 이산화티타늄을 포함할 수 있다. 블리스터는, 예를 들어, 훼크 포일스(Hueck Foils)(뉴저지주 월에 소재)로부터 얻을 수 있다. 다른 리셉터클 및 본 발명에서 사용하는데 적합한 이들의 다른 용적은 당업자에게 공지되어 있다.
일 실시형태에서, 본 발명은 소수의 단계에서, 바람직하게는 단일, 호흡 활성화 단계에서 폐 기관계에 L-도파를 투여하는 단계를 제공한다. 일 실시형태에서, 흡입기 리셉터클 내에 저장된 입자 질량의 적어도 50%는 단일, 호흡-활성화 단계에서 대상체의 호흡계에 전달된다. 일 실시형태에서, 흡입기 리셉터클 내에 저장된 입자의 적어도 60%, 바람직하게는 적어도 70% 및 바람직하게는 적어도 80%는 단일, 호흡-활성화 단계에서 대상체의 호흡계에 전달된다. 다른 실시형태에서, 적어도 1 내지 80 밀리그램의 L-도파는 리셉터클에 동봉된 대상체의 호흡관 입자에 대해 단일 호흡으로 투여함으로써 전달된다. 바람직하게는 적어도 10 15, 20, 25, 30, 35, 40, 50, 60, 75 및 80 밀리그램이 또한 바람직하게 전달될 수 있다.
단일, 호흡-작동 단계에서 입자의 폐 기관계에 대한 전달은, 예를 들어, 대상체의 흡입에 의해 전형적으로 공급되는 에너지와 같은 상대적으로 저에너지에서 분산되는 입자를 사용함으로써 향상된다. 이러한 에너지는 본 명세서에서 "저"로서 지칭된다. 본 명세서에서 사용되는 바와 같은, "저에너지 투여"는 입자를 분산 및/또는 흡입하기 위해 적용되는 에너지가 흡입 동안 대상체에 의해 전형적으로 공급되는 범위에 있는 투여를 지칭한다.
본 발명은 또한 폐 기관계에 분말 입자를 효율적으로 전달하는 방법에 관한 것이다. 예를 들어, 이하로 제한되는 것은 아니지만, 적어도 약 60%, 바람직하게는 적어도 약 70% 또는 바람직하게는 적어도 약 80%의 공칭 분말 용량이 실제로 전달된다.
일 실시형태에서, 본 발명에서 사용되는 조성물은 약 60 내지 99중량%(건조 중량)의 레보도파를 포함하는 폐 전달에 적합한 건조 분말 입자와 같은 입자를 포함한다. 약 75중량% 이상의 레보도파를 포함하는 입자가 특히 바람직하며, 훨씬 더 바람직하게는 약 90중량% 이상의 레보도파를 포함한다. 입자는 완전히 L-도파로 이루어질 수 있거나 또는 하나 이상의 추가적인 성분을 추가로 포함할 수 있다. 이러한 적합한 추가적인 성분의 예는 인지질, 아미노산, 당 및 염을 포함하지만, 이들로 제한되지 않는다. 인지질의 구체적 예는 포스파티딜콜린 다이팔미토일 포스파티딜콜린(DPPC), 다이팔미토일 포스파티딜에탄올아민(DPPE), 다이스테아로일 포스파티딜콜린(DSPC), 다이팔미토일 포스파티딜 글리세롤(DPPG) 또는 이들의 임의의 조합물을 포함하지만, 이들로 제한되지 않는다. 본 발명의 입자 내에 존재하는 인지질, 예를 들어, DPPC의 양은 일반적으로 10중량% 미만이다.
염은 소량의 강한 전해질 염, 예컨대 이하로 제한되는 것은 아니지만, 염화나트륨(NaCl)을 포함한다. 사용될 수 있는 다른 염은 시트르산나트륨, 락트산나트륨, 인산나트륨, 플루오린화나트륨, 황산나트륨 및 탄산칼슘을 포함한다. 일반적으로 입자 내에 존재하는 염의 양은 10중량% 미만, 예를 들어, 5중량% 미만이다.
일 바람직한 실시형태에서, 흡입에 의해 환자에 대한 폐 전달에 적합한 제형은 레보도파 90중량%, 다이팔미토일 포스파티딜콜린(DPPC) 8중량% 및 염화나트륨 2중량%를 포함하며, 본 명세서에서 "90/8/2"로서 지칭된다.
일 실시형태에서, 본 발명은 환자의 폐 기관계에 레보도파를 투여하는 단계를 포함하는 파킨슨병 환자에서 오프 기간을 치료하는 방법을 제공하되, 투여 후에, 환자의 통합 파킨슨병 척도(UPDRS) 파트 3 스코어는, 예를 들어, 위약 대조군에 비해 적어도 약 5점만큼 개선된다. 일 실시형태에서, 환자 UPDRS III 스코어는, 예를 들어, 위약 대조군에 비해 적어도 약 8점, 바람직하게는 적어도 약 10점 및 바람직하게는 적어도 약 12점 개선된다. 일 실시형태에서, 환자는 약 30 내지 약 60㎎ 미세입자 용량(FPD)의 레보도파, 바람직하게는 90/8/2 FPD 레보도파가 투여된다. 일 바람직한 실시형태에서, 환자는 폐 기관계에 35㎎ FPD의 레보도파가 투여된다. 다른 바람직한 실시형태에서, 환자는 50㎎ FPD의 레보도파가 투여된다. 일 실시형태에서, 환자는 레보도파의 폐 투여 전의 이상운동증 수준에 비해 증가된 이상운동증을 경험하지 않는다. 일 실시형태에서, 환자는 레보도파의 투여 전날에 약 3 내지 약 4의 오프 에피소드를 가진다. 일 실시형태에서, 환자는 레보도파의 투여 전날에 약 4 내지 약 8의 오프 에피소드를 가진다. 일 실시형태에서, 레보도파의 FPD는 오프 증상의 발생 시 투여된다.
일 실시형태에서, 본 발명은 환자의 폐 기관계에 레보도파를 투여하는 단계를 포함하는 파킨슨병 환자에서 오프 기간을 치료하는 방법을 제공하되, 투여 후에, 환자의 통합 파킨슨병 등급(UPDRS) 파트 3 스코어는, 예를 들어, 폐 투여 전 환자의 UPDRS III 스코어에 비해 적어도 약 5점만큼 개선된다. 일 실시형태에서, 환자 UPDRS III 스코어는, 예를 들어, 위약 대조군에 비해 적어도 약 8점, 바람직하게는 적어도 약 10점 및 바람직하게는 적어도 약 12점만큼 개선된다. 일 실시형태에서, 환자는 약 30 내지 약 60㎎ 미세입자 용량(FPD)의 레보도파, 바람직하게는 90/8/2 FPD 레보도파가 투여된다. 일 실시형태에서, 환자는 폐 기관계에 대해 35㎎ FPD의 레보도파가 투여된다. 다른 실시형태에서, 환자는 50㎎ FPD의 레보도파가 투여된다. 일 실시형태에서, 환자는 레보도파의 폐 투여 전 이상운동증 수준에 비해 증가된 이상운동증을 경험하지 않는다. 일 실시형태에서, 환자는 레보도파의 투여 전날 약 3 내지 약 4의 오프 에피소드를 가진다. 일 실시형태에서, 환자는 레보도파의 투여 전날에 약 4 내지 약 8시간의 오프 에피소드를 가진다. 일 실시형태에서, 레보도파의 FPD는 오프 증상의 발생 시 투여된다.
일 실시형태에서, 본 발명은 적어도 1일 1회 및 바람직하게는 적어도 1일 2회 환자의 폐 기관계에 레보도파를 투여하는 단계를 포함하는 파킨슨병 환자에서 평균 1일 오프 시간을 감소시키는 방법을 제공하되, 투여 후에, 환자의 평균 1일 오프 시간은 적어도 약 1시간만큼, 바람직하게는 적어도 약 2시간, 바람직하게는 적어도 약 3시간만큼, 바람직하게는 적어도 약 4시간만큼, 바람직하게는 적어도 약 5시간 이상만큼 감소된다. 일 실시형태에서, 환자는 약 30 내지 약 60㎎ 미세입자 용량(FPD)의 레보도파, 바람직하게는 90/8/2 FPD 레보도파가 투여된다. 일 바람직한 실시형태에서, 환자는 폐 기관계에 대해 35㎎ FPD의 레보도파가 투여된다. 다른 바람직한 실시형태에서, 환자는 50㎎ FPD의 레보도파가 투여된다. 일 실시형태에서, 환자는 레보도파의 폐 투여 전 이상운동증 수준에 비해 증가된 이상운동증을 경험하지 않는다. 일 실시형태에서, 환자는 레보도파의 투여 전날 약 3 내지 약 4의 오프 에피소드를 가진다. 일 실시형태에서, 환자는 레보도파의 투여 전날 약 4 내지 약 8시간의 오프 에피소드를 가진다. 일 실시형태에서, 레보도파의 FPD는 오프 증상의 발생 시 투여된다.
일 실시형태에서, 본 발명은 환자의 폐 기관계에 레보도파를 투여하는 단계를 포함하는 파킨슨병 환자에게 레보도파를 전달하는 방법을 제공하되, 투여 후에, 환자는, 예를 들어 상기 레보도파의 폐 투여 전 환자의 UPDRS III 스코어에 비해 적어도 약 5 내지 약 12점만큼의 환자의 통합 파킨슨병 척도(UPDRS) 파트 3 스코어의 개선을 가진다. 일 실시형태에서, 환자는 약 30 내지 약 60㎎ 미세입자 용량(FPD)의 레보도파, 바람직하게는 90/8/2 FPD 레보도파가 투여된다. 일 바람직한 실시형태에서, 환자는 폐 기관계에 35㎎ FPD의 레보도파가 투여된다. 다른 바람직한 실시형태에서, 환자는 50㎎ FPD의 레보도파가 투여된다. 일 실시형태에서, 환자는 레보도파의 폐 투여 전 이상운동증 수준에 비해 증가된 이상운동증을 경험하지 않는다. 일 실시형태에서, 환자는 레보도파의 투여 전날 약 3 내지 약 4의 오프 에피드를 가진다. 일 실시형태에서, 환자는 레보도파의 투여 전날 약 4 내지 약 8시간의 오프 에피소드를 가진다. 일 실시형태에서, 레보도파의 FPD는 오프 증상의 발생 시 투여된다.
일 실시형태에서, 레보도파의 폐 투여 후에, 환자의 UPDRS 파트 3 스코어는 위약 대조군에 비해 적어도 약 5 내지 약 15점만큼, 바람직하게는 적어도 약 5 내지 약 12점만큼, 바람직하게는 적어도 약 5 내지 약 10점만큼, 바람직하게는 적어도 약 5 내지 약 8점만큼 개선된다. 일 실시형태에서, 레보도파의 폐 투여 후에, 환자의 UPDRS 파트 3 스코어는 위약 대조군에 비해 적어도 약 2 내지 약 15점만큼, 바람직하게는 적어도 약 2 내지 약 12점만큼, 바람직하게는 적어도 약 2 내지 약 10점만큼, 바람직하게는 적어도 약 2 내지 약 8점만큼, 바람직하게는 적어도 약 2 내지 약 5점만큼, 바람직하게는 적어도 약 3 내지 약 15점만큼, 바람직하게는 적어도 약 3 내지 약 12점만큼, 바람직하게는 적어도 약 3 내지 약 10점만큼, 바람직하게는 적어도 약 3 내지 약 8점만큼, 바람직하게는 적어도 약 3 내지 약 5점만큼, 바람직하게는 적어도 약 4 내지 약 15점만큼, 바람직하게는 적어도 약 4 내지 약 12점만큼, 바람직하게는 적어도 약 4 내지 약 10점만큼, 그리고 바람직하게는 적어도 약 4 내지 약 8점만큼 개선된다.
일 실시형태에서, 환자의 UPDRS 파트 3 스코어는 레보도파의 폐 투여 후 약 60분 내에, 바람직하게는 투여 후 약 30분 내에, 바람직하게는 투여 후 약 20분 내에, 그리고 바람직하게는 투여의 약 10분 내에 위약 대조군에 비해 개선된다. 일 실시형태에서, 환자의 UPDRS 파트 3 스코어는 위약 대조군에 비해 레보도파의 투여 후, 약 60분 내에, 바람직하게는 약 30분 내에, 바람직하게는 약 20분 내에 그리고 바람직하게는 약 10분 내에 적어도 약 2점만큼, 바람직하게는 적어도 약 5점만큼, 그리고 바람직하게는 적어도 약 8점만큼, 바람직하게는 적어도 약 10점만큼, 바람직하게는 적어도 약 12점만큼 그리고 바람직하게는 적어도 약 15점만큼 개선된다. 일 실시형태에서, 환자는 레보도파의 폐 투여 전 이상운동증 수준에 비해 증가된 이상운동증을 경험하지 않는다. 일 실시형태에서, 환자는 레보도파의 투여 전날 약 3 내지 약 4의 오프 에피소드를 가진다. 일 실시형태에서, 환자는 레보도파의 투여 전날 약 4 내지 약 8시간의 오프 에피소드를 가진다.
일 실시형태에서, 투여 후 환자의 UPDRS 파트 3 스코어는 레보도파의 폐 투여 전 환자 UPDRS 파트 3 스코어에 비해 적어도 2점만큼, 바람직하게는 적어도 약 3점만큼, 바람직하게는 적어도 약 4점만큼, 바람직하게는 적어도 약 5점만큼, 바람직하게는 적어도 약 6점만큼, 바람직하게는 적어도 약 7점만큼, 바람직하게는 적어도 약 8점만큼, 바람직하게는 적어도 약 9점만큼, 바람직하게는 적어도 약 10점만큼, 바람직하게는 적어도 약 11점만큼, 바람직하게는 적어도 약 12점만큼, 바람직하게는 적어도 약 13점만큼, 바람직하게는 적어도 약 14점만큼, 바람직하게는 적어도 약 15점만큼 개선된다.
일 실시형태에서, 환자의 UPDRS 파트 3 스코어는 상기 레보도파의 폐 투여 전 환자의 UPDRS III 스코어에 비해 레보도파의 투여 후 약 60분 내에, 바람직하게는 약 30분 내에, 바람직하게는 약 20분 내에 그리고 바람직하게는 약 10분 내에 개선된다. 일 실시형태에서, 환자의 UPDRS 파트 3 스코어는 레보도파의 폐 투여 전 환자의 UPDRS III 스코어에 비해 레보도파의 투여 후 약 60분 내에, 바람직하게는 약 30분 내에, 바람직하게는 약 20분 내에 그리고 바람직하게는 약 10분 내에, 적어도 약 2점만큼, 바람직하게는 적어도 약 5점만큼, 바람직하게는 적어도 약 8점만큼, 바람직하게는 적어도 약 10점만큼, 바람직하게는 적어도 약 12점만큼 및 바람직하게는 적어도 약 15점만큼 개선된다. 일 실시형태에서, 환자는 레보도파의 폐 투여 전 이상운동증 수준에 비해 증가된 이상운동증을 경험하지 않는다. 일 실시형태에서, 환자는 레보도파의 투여 전날 약 3 내지 약 4의 오프 에피소드를 가진다. 일 실시형태에서, 환자는 레보도파의 투여 전날 약 4 내지 약 8시간의 오프 에피소드를 가진다. 일 실시형태에서, 레보도파의 FPD는 오프 증상의 발생 시 투여된다.
일 실시형태에서, 상기 FPD의 레보도파를 함유하는 적어도 하나의 캡슐의 내용물은 흡입을 통해 환자에게 투여된다. 일 실시형태에서, 레보도파의 상기 FPD, 바람직하게는 90/8/2 FPD 레보도파를 함유하는 적어도 2개의 캡슐의 내용물은 흡입을 통해 환자에게 투여된다. 일 실시형태에서 레보도파의 미세입자 용량은 흡입 장치에 의해 폐 기관계에 적어도 하나의 캡슐로부터 전달된다. 일 실시형태에서, 흡입 장치는 건조 분말 흡입기(DPI) 또는 정량 흡입기(MDI)이다.
일 실시형태에서, 본 발명의 방법은 파킨슨병 환자에서 운동동요의 빠른 경감을 제공한다. 본 발명의 방법은 환자에서 불량하게 제어된 레보도파 혈장 수준의 결과로서 생기는 운동동요 치료에 특히 유용하다.
일 실시형태에서, 본 발명의 방법은 환자의 혈장 레보도파 농도가 레보도파의 흡입 전 환자의 혈장 중의 레보도파 농도에 비해 흡입 후 약 10분 이하에 적어도 약 200ng/mL만큼 증가되고, 상기 환자의 혈장 농도는 흡입 후 적어도 약 15분의 시간 기간 동안 적어도 약 200ng/mL만큼 증가된 채로 남아있도록, 치료적으로 유효한 농도로 흡입에 의한 레보도파의 폐 투여를 포함한다.
일 실시형태에서, 환자의 혈장 레보도파 농도는 투여 후 적어도 약 20분의 시간 기간 동안 적어도 약 200ng/mL의 증가를 유지한다. 일 실시형태에서, 환자의 혈장 레보도파 농도는 투여 후 적어도 약 30분의 시간 기간 동안 적어도 약 200ng/mL의 상기 증가를 유지한다. 일 실시형태에서, 환자의 혈장 레보도파 농도는 투여 후 적어도 약 60분의 시간 기간 동안 적어도 약 200ng/mL의 상기 증가를 유지한다. 다른 실시형태에서, 증가는 200ng/mL, 200 내지 500ng/mL, 300 내지 400ng/mL 또는 250 내지 450ng/mL 초과이다. 일 실시형태에서, 환자의 혈장 레보도파 농도는 10분 내에 약 1000ng/mL 초과로 증가하지 않는다.
일 실시형태에서, 본 발명의 방법은 환자에 대해 흡입에 의해 약 20㎎ 내지 약 75㎎의 레보도파를 투여하는 단계를 포함하여 파킨슨병 환자에서 운동동요의 빠른 경감을 제공하되, 상기 환자는 상기 흡입의 10분 내에 운동동요의 즉시 경감을 받으며, 상기 환자는 적어도 30분의 기간 동안 상기 경감을 유지한다.
임의의 본 발명의 방법에 따르면, 흡입에 의한 레보도파 용량의 투여 후 약 10분에 환자 혈장 중의 레보도파의 곡선하 면적(AUC)은 흡입에 의한 레보도파의 투여 전 환자의 혈장 레보도파 농도에 비해 투여된 레보도파의 4㎎마다 적어도 약 1000 ng-분/mL만큼 증가된다. 일 실시형태에서, 흡입에 의한 레보도파 용량의 투여 후 약 10분에 혈장 중의 상기 레보도파의 AUC는 흡입에 의한 레보도파의 투여 전 환자의 혈장 레보도파 농도에 비해 투여된 레보도파의 4㎎마다 적어도 약 1000 내지 1500 ng-분/mL만큼 증가된다.
본 발명의 임의의 방법에 따르면, 흡입에 의한 레보도파 용량의 투여의 약 10분 내에, 환자의 혈장 레보도파 농도는 흡입에 의한 레보도파 용량의 투여 전 환자의 혈장 레보도파 농도에 비해 전달된 레보도파의 10㎎마다에 대해 적어도 약 175ng/mL만큼 증가되되, 상기 환자의 혈장 레보도파 농도는 투여 후 적어도 약 15분, 바람직하게는 약 20분, 바람직하게는 약 25분, 바람직하게는 약 30분, 바람직하게는 약 45분 또는 바람직하게는 약 60분의 시간 기간 동안 적어도 약 175ng/mL의 상기 증가를 유지한다.
일 실시형태에서, 본 발명은 환자에 대해 흡입에 의해 약 20㎎ 내지 약 75㎎의 레보도파를 투여하는 단계를 포함하는 파킨슨병 환자에서 운동동요의 빠른 경감을 제공하는 방법을 제공하되, Cmax폐/AUC폐를 Cmax경구/AUC경구로 나눈 것은 1 초과이되, 경구로 주어진 레보도파의 용량은 폐 전달을 통해 주어진 용량과 상대적으로 동일하다.
일 실시형태에서, 본 발명은 흡입에 의해 레보도파의 1회 이상의 용량을 투여하는 단계를 포함하는, 파킨슨병 환자에서 운동동요의 빠른 경감을 제공하는 방법을 제공하되, T1/2/Tmax의 비는 1/2 미만이고, 바람직하게는 1/5 미만이다.
일 실시형태에서, 임의의 본 발명의 방법에서 사용되는 용량은 환자에게 전달되는 약 10㎎ 내지 약 75㎎의 레보도파를 포함한다. 일 실시형태에서, 용량은 약 12㎎ 내지 약 35㎎의 레보도파를 포함한다. 일 실시형태에서, 레보도파의 용량은 적어도 약 10㎎의 레보도파, 바람직하게는 적어도 약 25㎎의 레보도파, 바람직하게는 적어도 약 35㎎의 레보도파, 바람직하게는 적어도 약 50㎎의 레보도파 및 바람직하게는 적어도 약 75㎎의 레보도파를 포함한다.
일 실시형태에서, 폐 기관계에 전달되는 레보도파의 양은 하나 이상의 캡슐의 흡입 후 약 25 내지 약 60㎎의 레보도파이다. 다른 실시형태에서, 폐 기관계에 전달되는 레보도파의 양은 하나 이상의 캡슐의 흡입 후 약 35 내지 55㎎, 약 30 내지 50㎎, 약 40 내지 50㎎, 약 45 내지 55㎎이다.
일 실시형태에서, 본 발명의 방법 중 임의의 하나에서 사용되는 레보도파의 용량은 레보도파의 약 30㎎ 내지 약 60㎎ FPD를 포함한다. 일 실시형태에서, 임의의 본 발명의 방법에서 사용되는 용량은 레보도파의 약 35㎎ FPD이다. 일 실시형태에서, 본 발명의 방법 중 임의의 하나에서 사용되는 용량은 레보도파의 약 50㎎ FPD이다.
일부 실시형태에서, 레보도파의 빠른 운동 경감 또는 혈장 증가는 레보도파의 하나의 캡슐 내 분말의 흡입 후에 일어난다. 다른 실시형태에서, 레보도파의 빠른 운동 경감 또는 혈장 증가는 2, 3, 4 또는 5개의 캡슐 내 분말의 흡입 후에 일어난다.
일 실시형태에서, 임의의 본 발명의 방법에서 사용되는 용량은 염을 함유한다. 일 실시형태에서, 용량은 인지질을 함유한다.
일 실시형태에서, 임의의 본 발명의 방법은 추가로 환자에게 도파 데카복실라제 저해제를 공동투여하는 단계를 포함한다. 일 실시형태에서, 도파 데카복실라제 저해제는 흡입에 의한 레보도파의 투여 전에, 흡입에 의한 레보도파의 투여와 동시에 또는 흡입에 의한 레보도파의 투여 후에 투여된다.
일 실시형태에서, 임의의 본 발명의 방법은 상기 환자에게 레보도파의 경구 투약량을 투여하는 단계를 추가로 포함할 수 있다.
일 실시형태에서, 임의의 본 발명의 방법은 적어도 2시간, 바람직하게는 적어도 3시간, 바람직하게는 적어도 4시간, 바람직하게는 적어도 5시간 및 더 바람직하게는 적어도 6시간 이상의 기간 동안 운동동요의 경감을 유지하는 단계를 포함한다.
일 실시형태에서, 본 발명의 임의의 방법에 따라 치료되는 파킨슨병 환자는 2기, 3기 또는 4기 파킨슨병 환자이다.
본 발명의 임의의 방법에 따르면, 레보도파의 투약량은 중추 신경계 식품 효과에 의해 영향받지 않는다.
일 바람직한 실시형태에서, 임의의 본 발명의 방법에서 사용되는 레보도파의 용량은 90중량% 레보도파, 8중량% 다이팔미토일포스파티딜콜린(DPPC) 및 2중량%의 염화나트륨을 포함한다.
L-도파, 카비도파, 아포몰핀 및 벤세라자이드를 포함하지만, 이들로 제한되지 않는 하나 초과의 도파민 전구체, 도파 데카복실라제 저해제 또는 이들의 조합물의 투여는 본 발명에 따라 흡입에 의한 레보도파의 투여 시간과 동시에 또는 순차적으로 제공될 수 있다. 일 실시형태에서, 하나 초과의 도파민 전구체 또는 도파 데카복실라제 저해제의 투여는 근육내, 피하, 경구 및 기타 투여 경로에 의해 투여될 수 있다. 일 실시형태에서, 이들 다른 제제는 또한 폐 기관계를 통해 공동투여된다. 이들 화합물 또는 조성물은 흡입에 의한 레보도파의 폐 투여 전에, 후에 또는 동시에 투여될 수 있고, 본 명세서에 기재된 방법에 따른 흡입을 통한 레보도파의 투여와 함께 사용될 때 "공동투여되는" 것으로 여겨진다.
일 실시형태에서, 환자는 도파 데카복실라제 저해제의 공동투여를 필요로 하지 않거나 또는 도파 데카복실라제 저해제의 더 낮은 또는 더 적은 빈도의 용량을 허용한다. 다른 실시형태에서, 환자는 카비도파의 공동투여를 필요로 하지 않거나 또는 경구로 L-도파를 받는 환자에 비해 카비도파의 더 낮은 또는 더 적은 빈도의 용량을 허용한다. 추가 실시형태에서, 환자는 벤세라자이드의 공동투여를 필요로 하지 않거나 또는 L-도파를 경구로 받는 환자에 비해 벤세라자이드의 더 낮은 또는 더 적은 빈도의 용량을 허용한다. 일 실시형태에서, 카비도파에 대한 의존도와 폐 경로를 통해 투여되는 레보도파와 경구 경로를 통해 투여되는 레보도파 사이의 카비도파에 대한 의존도 사이의 관계는 다음과 같다:
식 중, "w/o CD"는 카비도파 없음을 의미하며, "w/CD"는 카비도파 있음을 의미하고, "INN"은 폐 경로를 지칭하며, 경구는 환자에 대한 레보도파의 경구 경로를 지칭한다.
일 실시형태에서, 레보도파의 정확한 용량이 환자를 온(on)으로 바꾸는데 필요하다. 예를 들어, 일 실시형태에 대해, 레보도파의 용량은 약 200ng/mL 내지 500ng/mL의 환자의 혈장 레보도파 농도를 증가시켜야 한다. 흥미롭게도, 레보도파 농도에서 이런 적은 증가는 광범위한 환자 투약 스케줄에 적용된다. "온"이 되는데 레보도파 1500 내지 2000ng/mL의 혈장 수준을 갖는 것이 필요할 수 있는 환자는 혈장 중의 레보도파의 200 내지 500ng/mL에 의해 온으로 바뀔 수 있는 반면, "온"이 되는데 레보도파 500 내지 1000ng/mL의 혈장 수준을 갖는 것이 필요할 수 있는 환자는 혈장 중의 레보도파의 200 내지 500ng/mL에 의해 온으로 바뀔 수 있다. 더 구체적으로, 환자는 환자 혈장 농도를 200 내지 400ng/mL, 250 내지 450ng/mL, 300 내지 400ng/mL 또는 약 375 내지 425ng/mL만큼 증가시킴으로써 온으로 바뀔 수 있다.
200 내지 500ng/mL만큼 환자의 혈장 농도를 증가시키는 것은 다양한 방법에 의해 행해질 수 있다. 환자는 경구로, 폐 경로를 통해 또는 비경구로 레보도파가 제공될 수 있다. 폐 경로에 의해 제공된다면, 환자는 환자의 폐 기관계에 대해 25 내지 50㎎의 레보도파 용량이 제공될 수 있었다. 일 실시형태에서, 환자의 폐 기관계에 제공되는 용량은 25 내지 35㎎, 27 내지 32㎎, 28 내지 32㎎, 29 내지 31㎎, 또는 약 30㎎일 수 있었다. 환자의 폐 기관계에 대해 용량을 제공하는 것은 다양한 방법으로 행해질 수 있다. 일 실시형태에서, 캡슐은 35 내지 40㎎의 레보도파 분말을 함유하며, 상기 캡슐은 환자의 폐 기관계에 대해 캡슐 내 분말 40 내지 60%를 제공하며, 상기 분말은 레보도파 75 내지 98%를 포함한다.
다음의 실시예는 본 발명의 예시하기 위한 의도이지만, 이들의 범주를 제한하는 것으로 해석될 수 없다.
실시예 1
요약
90/8/2 건조 분말 레보도파 제형을 건강한 성인 지원자에서의 경구 레보도파에 비교하여 90/8/2 폐 레보도파 분말의 투여 후 안전성, 내약성 및 레보도파 약동학(PK)을 평가하기 위해 제공하였다. 이들 실시예에 기재한 폐 레보도파 분말은 90% 레보도파, 8% 다이팔미토일포스파티딜콜린 및 2% 염화나트륨의 입자를 포함하며(이들 모두 건조 중량임), 본 명세서에서 90/8/2로서 지칭한다. 이 데이터는 90/8/2의 단일 흡입 용량 후 레보도파의 PK의 설명 및 절식 또는 섭식 상태에서 경구로 투여한 레보도파(LD)에 대한 비교뿐만 아니라 카비도파(CD)에 의한 전처리가 있는 그리고 전처리가 없는 PK의 비교를 제공한다. 이는 다음과 같은 건강한 성인 남성 및 여성 대상체에서 2부분 연구였다: 파트 A- 경구 레보도파에 비교하여 용량 상승 부분; 및 파트 B-90/8/2 플러스 또는 마이너스 카비도파 전처리 부분.
파트 A는 개방 표지, 3-기간 크로스오버, 단일-상승 용량 연구였다. 각각의 대상체는 1 세션에 섭식 또는 절식 상태로 단일 경구 용량의 CD/LD(25/100㎎) 및 2회의 상이한 치료 세션에 단일 상승 용량으로 2회의 상이한 흡입 용량의 90/8/2(10 및 30㎎ 또는 20 및 50㎎ 레보도파 미세입자 용량(FPD)을 받았다. 각각 9명의 2 그룹을 등록하였다.
파트 B는 개방 표지, 무작위, 2-기간, 기간 균형 크로스오버 연구였다. 8명의 대상체는 CD에 의한 전처리와 함께 그리고 전처리 없이 단일 흡입 90/8/2 용량(40㎎ 레보도파 FPD)의 투여 후 안전성, 내약성 및 레보도파 PK의 평가를 받았다.
혈액 샘플을 24기간에 걸쳐 수집하고 나서, 혈장 레보도파 농도를 9.84ng/mL의 정량화의 하한으로 입증된 액체 크로마토그래피-이중질량 분석법(LC-MS-MS) 분석을 이용하여 심벡 리서치 리미티드(Simbec Research Limited)(영국)에 의해 결정하였다. 비구획 방법을 이용한 다음에 지체 시간을 이용하는 2구획 모델을 이용하는 PK 모델링에 의해 약동학적 분석을 수행하였다. 10 내지 50㎎ 레보도파 FPD의 용량으로 흡입에 의해 투여한 90/8/2는 빠르게 상승하는, 용량 비례 혈장 레보도파 농도를 생성하여, 건강한 성인에서 20 내지 50㎎의 미세입자 용량 후 5 내지 10분 내에 잠재적으로 치료적으로 적절한 수준을 달성하였다.
90/8/2 흡입 후 레보도파 혈장 농도는 절식 상태에서 경구 투여 후의 농도보다 더 빠르게 그리고 섭식 상태 하에서의 농도보다 훨씬 더 빠르게 증가되었다. 시간에 대한 부분적 혈장 농도 곡선하 부분 면적, 0 내지 10분의 AUC(AUC0-10분)로서 그리고 처음 10분 용량 후에 걸쳐 관찰한 최대 혈장 농도(Cmax, 10분)로서 표현한 약물 투여 후 처음 10분에 걸친 노출은 경구 투여에 비해 90/8/2 흡입 후 훨씬 더 빠른 전신 노출을 나타내었다.
혈장 농도에서 가변성을 받은 대상체는 경구 투여 및 폐 투여에 의해 예상한 것에 비해 흡입에 의해 크게 감소되었다. 분석은 또한 절식 상태에서 경구 투여가 섭식 상태에 비해 더 빠른 흡수를 야기하지만, 여전히 흡입 후보다 훨씬 더 느리다는 것을 나타내었다. 약동학적 모델링은 90/8/2 흡입 후 0.5분 미만의 지체 시간에 비해 섭식 또는 절식 상태에서 경구 투여 후 대략 9 내지 10분의 지체 시간을 나타내었다. 더 나아가, 흡수 반감기는 경구 투여에 비해 흡입 후 더 짧았다.
90/8/2 흡입 후에, 전신 레보도파 노출은 투여한 90/8/2 용량에 비례하였다. 용량-정규화 Cmax 및 AUC는 투여한 90/8/2 용량에 걸쳐 매우 유사하였다. 흡입 후 용량-정규화된(추정된 미세입자 용량을 기준으로 함) 노출은 경구 투여에 비해 AUC에 기반하여 1.3 내지 1.6배였고, Cmax를 기준으로 1.6 내지 2.9배였다. 문헌에 기재된 바와 같이, 경구 투여 후에, Cmax의 상당한 감소 및 Tmax의 연장이 섭식 대상체에서 관찰되었지만; 그러나, AUC는 섭식 대상체와 절식 대상체 사이에 유사하였다.
40㎎ 미세입자 용량의 90/8/2는 크로스오버 설계에서 카비도파 전처리와 함께 또는 전처리 없이 흡입된 연구의 파트 B로부터의 혈장 농도는 잠재적으로 치료적 수준을 달성하는 혈장 농도에 의한 빠른 흡수를 입증하였다. 혈장 레보도파 클리어런스는 CD 전처리 없이 대략 4배 더 빨랐다. 대응적으로, Cmax 및 AUC는 더 낮았고, Tmax 및 T1/2는 CD 전처리 없이 다소 더 짧았다. 이 연구의 주된 발견점은 다음과 같다:
도입
이 예에서, 90/8/2는 표준 경구 의약에 대해 간헐적인 부적절한 반응을 경험한 파킨슨병을 지니는 환자에서 운동동요("오프 에피소드")의 에피소드 치료로서 시험되었다. 90/8/2를 환자의 기존의 도파데카복실라제 저해제(즉, 카비도파 또는 벤세라자이드)-포함 파킨슨병 의약 치료법에 대한 부가물로서 사용할 수 있다. 이 연구는 90/8/2를 이용하는 인간에서의 첫 번째 연구이며, 건강한 성인 지원자에서의 경구 레보도파에 비해 90/8/2의 투여 후 안전성, 내약성 및 레보도파 약동학(PK) 을 평가하기 위해 설계하였다.
안전성 및 내약성 결과를 임상 시험에서 시험하였다. 이 PK 데이터 분석은 90/8/2의 단일 흡입 용량 후 레보도파의 PK의 설명 및 절식 또는 섭식 상태에서 경구로 투여한 레보도파(LD; L-도파)와의 비교뿐만 아니라 카비도파(CD)에 의한 전처리가 있는 그리고 전처리가 없는 레보도파의 PK의 비교를 제공한다. 경구 레보도파는 일상적으로 처방되는 병용 카비도파/레보도파 제제로서 투여하였다.
연구 설계 및 목적
이는 다음과 같이 건강한 성인 남성 및 여성 대상체에서 2부분 연구였다:
연구의 파트 A의 일차 약동학적 목적은 건강한 성인에서 90/8/2의 단일, 흡입 용량의 투여 후 레보도파의 약동학을 조사하는 것이다. 2차적 목적은 단일 흡입 용량 투여 후 레보도파의 용량 비례를 연구하는 것 및 절식 상태 또는 섭식 상태에서 투여한 경구 레보도파에 90/8/2의 PK를 비교하는 것이었다. 파트 B의 목적은 카비도파 전처리와 함께 그리고 전처리가 없는 90/8/2의 내약성 및 약동학을 비교하는 것이었다.
파트 A는 개방 표지, 3-기간 크로스오버, 단일-상승 용량 연구였다. 모든 대상체는 연구 약물 치료 1일 전에 그리고 연구 약물 치료일에 경구 카비도파로 치료하였다. 각각의 대상체는 1 세션에 섭식 또는 절식 상태로 단일 경구 용량의 CD/LD(25/100㎎) 및 2회의 상이한 세션에 단일 상승 용량으로 2회의 상이한 흡입 용량의 90/8/2를 받았다. 각각 9명의 2개 그룹을 등록하였다. 파트 A에 대한 연구 설계를 이하의 표 1에 약술한다:
파트 B는 개방 표지, 2-기간, 기간 균형 크로스오버 연구였다. 파트 A로부터의 안전성 및 PK 데이터의 예비 검토 후에, 동일한 수의 대상체가 다음과 같이 정의되는 2회 투약 순서 A->B 또는 B->A 중 하나를 받도록, 8명의 대상체는 무작위, 균형 방식으로 CD에 의한 전처리와 함께 그리고 전처리 없이 단일 흡입 90/8/2 용량(40㎎ 레보도파 FPD)의 투여 후 안전성, 내약성 및 레보도파 PK의 평가를 받았다:
요법 A: CD 전처리가 있는 90/8/2
요법 B: CD 전처리가 없는 90/8/2
연구의 파트 A 및 B에서 카비도파 치료를 표 2의 스케줄에 따라 표준화하였다.
파트 A에서, 혈액 샘플을 투약 전 및 10, 20, 30, 45, 60, 75, 90, 120분, 4, 8, 16 및 24시간에 경구 CD/LD 투여 후에 수집하였다. 파트 A 및 B에서 90/8/2 흡입 치료 세션 동안, 샘플을 동시에 + 1, 2 및 5분에 추가적 샘플에서 수집하였다. 혈장 레보도파 농도를 9.84ng/mL의 정량화의 하한으로 입증된 액체 크로마토그래피-이중질량 분석법(LC-MS-MS) 분석을 이용하여 심벡 리서치 리미티드에 의해 결정하였다(2, 3).
약동학적 분석 방법
비구획 분석
각각의 대상체 및 각각의 치료에 대해 혈장 농도 및 시간에 대한 데이터 분석을 수행하였다. 비구획 분석을 윈논린(WINNONLIN)(등록상표) 전문가 버전 5.3을 이용하여 수행하였다. 시점 0으로부터 마지막 측정가능한 시점(AUC0-t)까지의 곡선하 면적을 선형 사다리꼴 방법을 이용하여 추정하였다. 마지막 3 이상의 시점에 걸친 선형 회귀를 사용하여 다음의 식으로부터 최종 반감기(T1/2) 및 0 내지 무한대의 AUC(AUC0-∞)를 추정하는데 사용한 제거 속도 상수(λ)를 추정하였다:
T1/2 = ln(2)/λ
AUC0-∞ = AUC0-t + Ct/λ
식 중, Ct는 회귀 선에 의해 예측되는 마지막 측정가능한 농도이다. 혈청 클리어런스를 생체이용가능성으로 나눈 것(CL/F) 및 최종 단계에서 분포의 겉보기 용적을 생체이용가능성으로 나눈 것(Vz/F)을 이하의 식으로부터 추정하였다:
CL/F = 용량/AUC0-∞
Vz/F = 용량/(λ*AUC0-∞)
최대 농도(Cmax) 및 그것이 관찰된 시간(Tmax)을 데이터로부터 직접 결정하였다.
약물 투여 후 처음 10분에 걸친 부분적 AUC(AUC0-10분)을 사다리꼴 방법에 의해 계산하였다. 처음 10분에 걸쳐 관찰한 최대 혈장 농도(Cmax,10분)를 투약으로부터 10분의 샘플링 시간을 포함하는 것까지 관찰한 가장 높은 혈장 농도로서 결정하였다. 흡입-대-경구 노출비를 90/8/2 흡입 후 용량-정규화 Cmax 또는 AUC를 경구 투여 후 용량-정규화 매개변수로 나눔으로써 각각의 대상체에 대해 계산하였다. AUC에 기반한 노출비는 흡입 약물 대 경구 약물의 상대적 생체이용가능성이다.
추가적인 매개변수인 최대 관찰 혈장 농도의 절반을 달성하는 시간(TCmax50)을 Cmax를 2로 나눈 것으로부터 계산한 혈장 농도를 구간 축소하여(bracketing) 혈장 농도에 따라 두 점 사이의 선형 보간에 의해 계산하였다(마이크로소프트 엑셀).
약동학적 모델링
약동학적 모델링을 WINNONLTN(등록상표), 전문가 버전 5.3을 이용하여 수행하였다. 지체 시간을 이용하여 그리고 지체 시간 없이 1- 및 2-구획 모델을 포함하는 다수의 상이한 모델을 평가하였다. 모든 평가 모델은 1차 입력이었다. 모델을 아이카이케 정보 기준(Aikaike Information Criterion), 잔차 제곱합, 추정 매개변수의 상대적 값 및 그들 각각의 표준 오차 추정 값, 관찰 농도와 예측 농도의 상관관계 및 예측 농도와 관찰 농도 사이 변수의 일반적 경향을 포함하는 다수의 진단 기준에 기반하여 평가하였다.
대부분의 혈장 농도 대 시간 곡선을 가장 잘 설명하는 모델은 지체 시간을 이용하는 2 구획 모델(윈논린(등록상표) 모델 12)이었다. 흡입 90/8/2를 받은 대상체로부터의 대부분의 데이터 세트는 또한 지체 시간이 없는 모델에 의해 잘 설명되는데, 이들 대상체로부터의 추정 지체 시간은 매우 짧으며, 대부분의 경우에 1분 미만이었다. 그러나, 경구 투여로부터의 데이터 세트에 비해, 지체 시간 모델을 모든 대상체 및 모든 치료에 대해 사용하였다. 대부분의 데이터 세트는 1-구획 모델보다 2-구획 모델에 의해 더 잘 설명되었다. 일부 경우에, 1-구획 모델은 적합할 수 없었다. 통계적 진단 기준에 기반하여 1-구획 모델이 더 양호한 경우에, 두 모델 사이의 차이는 매우 작았다. 따라서, 2-구획 모델을 이용하는 모델링의 결과를 본 명세서에 제시한다. 2-구획 모델 계획 1의 모델은 분포 용적에 대한 추정 값을 흡수 용량으로 나눈 것(V/F), 지체 시간(Tlag), 흡수 및 제거와 관련된 속도 상수(각각 k01 및 k10) 및 내부 구획 속도 상수(k12 및 k21)를 생성한다. 곡선의 분포 및 제거 단계와 관련된 속도 상수(α 및 β)를 k12, k21 및 k10으로부터 계산한다. 1차 매개변수로부터 계산한 다른 2차 매개변수는 AUC, Cmax, Tmax, CL/F 및 곡선의 흡수, 분포 및 제거 단계와 관련된 반감기(T1/2k01, T1/2α, T1/2β)를 포함한다. 모델을 하기 식으로 나타낸다:
Ct = Ae-αt + Be-βt + Ce-k01t
Ct는 투여 후 시간 t에 혈장 레보도파 농도이고, A, B 및 C는 곡선의 분포, 제거 및 흡수 단계의 y-축 절편이며, 용량, 용적 및 속도 상수로부터 계산한다.
계획 1
모든 분석에서 균일한 가중치를 사용하였고, 분석의 정량화 수준 미만으로서 보고한 혈장 농도(BLQ, <9.84ng/mL)를 상실 값으로서 처리하였다. 데이터 지점은 분석으로부터 제외하지 않았다.
결과 및 논의
10 내지 50㎎ 레보도파 FPD의 용량에서 흡입에 의해 투여한 90/8/2는 빠르게 증가되는, 용량 비례 혈장 레보도파 농도를 생성하여 건강한 성인에서 20 내지 50㎎ 레보도파의 미세입자 용량 후 5 내지 10분 내에 잠재적으로 치료적으로 적절한 수준(400 내지 500ng/mL)을 달성하였다.
도 1은 90/8/2 흡입 후 그리고 섭식 및 절식 상태 하에서 100㎎ 경구 용량 후 평균 레보도파 혈장 레보도파 농도를 제시한다. 개개 값 및 농도 대 시간 플롯을 섭식 및 절식 조건 하에서 카비도파 전처리와 함께 그리고 전처리 없이 각각 10㎎, 20㎎, 30㎎ 및 50㎎ 레보도파의 각각의 흡입 용량뿐만 아니라 경구로 100㎎ 레보도파에 대해 계산하였다.
90/8/2 흡입 후 혈장 레보도파 농도는 절식 상태에서 경구 투여 후 농도보다 더 빠르게 그리고 섭식 상태 하의 농도보다 훨씬 더 빠르게 증가되었다. 잠재적으로 치료적으로 적절한 혈장 농도는 90/8/2 흡입 후 대략 5분까지 달성되었다. 90/8/2, 20 내지 50㎎ FPD의 흡입 5분 내에, 혈장 농도는 잠재적인 치료적 관련성(4)이 있는 것으로 관찰된 범위인 400 내지 500ng/mL 이상이었다. 90/8/2 후에 달성된 혈장 농도인 40 및 50㎎ FPD는 경구 CD/LD(25/100㎎) 투약 후 관찰한 것과 동일한 수준이었다(도 3).
도 2는 경구 투여 후 농도에 비교하여 처음 10분에 걸친 평균 혈장 농도를 나타낸다. 약물 투여 후 처음 10분에 걸친 노출은 표 3에서 0 내지 10분(AUC0-10분)의 AUC로서 그리고 처음 10분에 걸쳐 관찰한 최대 혈장 농도(Cmax,10분)로서 표현한다. 일부 개체에서, Cmax,10분을 10분 미만에 관찰하였다.
절식 상태에서 경구 투여는 섭식 상태에 비해 더 빠른 흡수를 야기하였지만, 흡입 후 훨씬 더 느렸다. 문헌(5)에서 기재한 바와 같이, 경구 투여 후, Cmax의 상당한 감소 및 Tmax의 연장을 섭식 대상체에서 관찰하였지만; 그러나, AUC(표 5)는 섭식과 절식 대상체 간에 유사하였다.
치료 후 혈장 농도에서 대상체 간의 가변성은 경구 투여 후보다 90/8/2 흡입 후에 훨씬 더 적었다. 도 3에서 알 수 있는 바와 같이, 흡입 후(속이 채워진 기호), 50㎎ 90/8/2를 받은 대부분의 대상체에서 혈장 농도는 투약 10분 후에 400ng/mL 초과였으며, 일부는 5분에 400ng/mL 초과였고, 모두 20분까지였다. 경구 투여(속이 빈 기호) 후, 반응은 훨씬 더 느렸고 투약 10분 내에 400ng/mL에 접근한 대상체는 없었다. 다른 용량 그룹에 대한 개개 혈장 농도 및 가변성 데이터는 레보도파 FPD 용량 20㎎에서 그리고 400ng/mL 초과의 상기 혈장 농도에서 투약 5 내지 10분 내에 일부 대상체에서 달성되었고, 반응은 경구 투여 후보다 훨씬 덜 가변적이었다는 것을 나타낸다. 표 4에 나타낸 주어진 샘플링 시간에 처리군 내의 혈장 농도의 CV%로서 표현한 가변성 정도는 투약의 처음 30분 내에 90/8/2 처리 대상체에서 가변성이 절식 경구 그룹에서 보이는 것의 절반 미만이었고 모든 경구 대상체(섭식과 절식 조합)보다 대략 5배 미만이라는 것을 입증한다.
비구획 분석에 의해 추정된 약동학적 매개변수의 요약을 표 5에 나타낸다. 개체에 대한 매개변수 추정을 절식 및 섭식 조건 하에서 CD 전처리와 함께 그리고 전처리 없이 각각 10㎎, 20㎎, 30㎎ 및 50㎎의 흡입 투약량뿐만 아니라 100㎎ 경구 투약량에 대해 비구획 PK 분석으로부터 결정하였다. 결과는 레보도파 노출이 투여한 90/8/2 용량에 비례한다는 것을 나타낸다. 용량-정규화된 Cmax 및 AUC는 모든 90/8/2 용량에 대해 매우 유사한다. 용량 비례를 도 4 및 도 5에서 추가로 도시한다. T1/2은 모든 용량에 대해 유사하다.
경구 레보도파에 대한 흡입 90/8/2의 생체이용가능성을 용량-정규화 AUC0-∞의 비로부터 개개 대사체에 대해 계산하였다. 파트 A의 각각의 대상체는 1회 경구 및 2회 흡입 용량을 받았기 때문에, 두 생체이용가능성 추정을 각각의 대상체에 대해(각각의 흡입 용량에 대해 하나씩) 결정하였다. 상대적 노출 계산을 또한 용량-정규화 Cmax 값에 대해 수행하였다. 섭식 및 절식 조건 하에 투여한 경구 용량에 대해 계산을 별도로 수행하였다. 상대적 생체이용가능성 계산에 대한 평균 및 표준 편차를 표 6에 제시한다. 개개 값을 용량-정규화 Cmax로부터 계산한 카비도파/레보도파(25/100㎎)에 비교하여 90/8/2(10 내지 50㎎ 레보도파 미세입자 용량)의 흡입 후 상대적 레보도파 노출로서 계산하였다. 섭식과 절식 대상체 사이의 또는 투약 그룹 사이의 주된 차이는 나타나지 않는다. 흡입 후 용량-정규화(추정된 미세입자 용량에 기반함) 노출은 경구 투여에 비해 AUC에 기반하여 대략 1.3 내지 1.6 및 Cmax에 기반하여 1.6 내지 2.9이었다.
혈장 농도 대 시간 프로파일은 1차 입력 및 지체 시간을 이용하는 2 구획 모델에 의해 가장 잘 설명되었다. 개개 데이터 세트 상에서 모델링을 수행하였고, 시간 플롯에 대해 관찰 및 예측한 농도를 윈논린(등록상표) 모델 12를 이용하여 제조하였다. 일부 경우에, 최종 반감기(T1/2β)의 추정은 편평한 기울기를 초래하는 유사한 또는 변동있는 농도를 갖는 곡선의 최종 단계에서의 몇몇 지점에 기인하여 매우 컸다. 다수의 이들 경우에, 거대 T1/2β는 AUC에 대해 매우 큰 추정값을 생성하였다. 모델로부터의 매개변수 추정에서 다른 변동은 일부 매개변수 추정에서 몇몇 비정상적 값을 야기하였다. 이들 값은 데이터 분석으로부터 제외시키지 않았거나 또는 통계적으로 이상점으로서 처리하지 않았다. 대신에, 데이터는 평균보다는 중앙값으로 요약한다. 따라서 보통이 아닌 높은 또는 낮은 값은 제시한 데이터에 남아있지만, 그룹 요약 통계에 과도한 영향을 발휘하지 않는다.
표 7에 나타낸 약동학적 모델링 결과는 경구 투여 후 대략 9분의 지체 시간이 있었다는 것을 나타낸다. 비교에 의해, 흡입 90/8/2와 관련된 지체 시간은 0.5분 미만으로 무시할 만하였다. 더 나아가, 흡입 90/8/2의 흡수 속도는 절식 상태에서의 경구 투여 후 속도보다 더 빨랐고(더 짧은 T1/2k01), 섭식 상태에서 흡수보다 대략 10배 더 빨랐다. 90/8/2 흡입 후의 훨씬 더 짧은 지체 시간 및 더 빠른 흡수율은 경구 투여에 비교하여, 투약 후 처음 5 내지 10분 내에 관찰한 더 큰 전신 노출을 설명한다. 계산한 매개변수, Cmax의 50%에 도달하는 시간(Tcmax50)은 또한 90/8/2 흡입이 경구 투여 보다 더 조기의 레보도파 전신 노출을 생성한다는 것을 나타낸다. 섭식 상태에서 경구 투여를 제외하고, 흡수는 제거보다 훨씬 더 빨랐다.
투여 후 처음 몇 분 내에 혈장 농도에 대한 지체 시간 및 흡수 속도의 조합 효과를 평균 혈장 농도 데이터의 약동학적 모델링을 제시하는 도 6에 도시한다. 이 플롯은 투약 후 처음 60분에 걸쳐 90/8/2 흡입 및 경구 레보도파 투여를 위한 약동학적 모델에 의해 예측되는 농도를 나타낸다. 기호는 관찰한 평균 농도를 나타내고, 선은 약동학적 모델에 의해 예측되는 농도를 나타낸다. 예측 및 관찰한 값의 양호한 상관관계는 모델이 데이터를 매우 잘 설명한다는 것을 나타낸다. 도면은 또한 90/8/2 흡입이 혈장 레보도파 농도의 빠른 증가를 초래하고, 잠재적으로 임상적으로 적절한 혈장 농도가 투약 5 내지 10분 내이 달성되며, 노출은 용량-비례한다는 연구로부터의 다른 관찰을 도시한다.
파트 B
90/8/2, 40㎎ 레보도파 FPD가 크로스오버 설계에서 카비도파 전처리와 함께 또는 전처리 없이 흡입되는 연구의 파트 B로부터의 혈장 농도를 도 7에 나타낸다. 최대 혈장 농도 및 노출은 카비도파 전처리보다 더 높았다. 혈장 레보도파 클리어런스는 CD 전처리 없이 대략 4배 더 빨랐다. 대응적으로, Cmax 및 AUC는 더 낮았고, Tmax 및 T1/2는 CD 전처리 없이 다소 더 짧았다(표 8).
결론
이 연구의 주된 발견은 (i) 흡입 90/8/2가 혈장 레보도파 농도의 빠른 증가를 야기하며; (ii) Cmax 및 AUC에 기반한 레보도파에 대한 전신 노출이 경구 약물 투여에 비해 90/8/2 흡입에 의해 투약 후 처음 10분에 걸쳐 훨씬 더 크고; (iii) 잠재적으로 치료적으로 적절한 혈장 레보도파 농도가 건강한 성인에서 20 내지 50㎎ 레보도파 미세입자 용량의 90/8/2 투약 후 5 내지 10분 내에 달성되었으며; (iv) 혈장 레보도파 농도의 가변성을 받은 대상체는 경구 투여에 비해 흡입 후에 상당히 더 적었고; (v) 전신 레보도파 노출은 투여한 레보도파 미세입자 용량에 비례하며; (vi) 약동학적 모델링은 흡입 90/8/2가 경구 투여보다 훨씬 더 짧은 지체 시간 및 흡수 속도를 가진다는 것을 나타내고; vii) 흡입 후용량-정규화(추정 미세입자 용량에 기반) 노출은 AUC에 기반하여 1.3 내지 1.6배 그리고 경구 투여에 비해 1.6 내지 2.9배 더 크며; 그리고 viii) 혈장 레보도파 클리어런스는 대략 4배 더 크고, 레보도파 노출은 카비도파 전처리 없이 감소되었다는 것이었다.
실시예 2
2 용량의 폐 레보도파(25㎎ 및 50㎎의 연구 약물)를 시험하는 2상 연구 시험은 다중심, 무작위, 이중맹검, 위약 통제, 단일 용량, 3 아암(arm)(위약, 25㎎ 및 50㎎)을 이용하는 크로스오버 설계였고, "개방 표지" 경구 시네메트(Sinemet) 아암을 포함하였다. 이 연구에서 치료한 스물 네명 PD(24) 환자는 각각의 방문 시 L-도파 혈장 수준, 운동 반응 및 안전성의 연속적 평가를 받았다. 환자에게 오프 상태로 연구 약물을 투여하였고, 연속 평가를 투약 전 시작해서 투약 후 180분까지 계속하였다. 탭핑 검사(tapping test), 통합 파킨슨병 척도 파트 III(UPDRS III) 및 "의미있는" 온 및 오프의 대상 평가를 이용하여 운동 기능을 측정하였다. 모니터링한 안전성 매개변수는 폐 기능, 임상 실험 데이터, EGC 및 활력 징후(혈압, 심박수 및 기립성 혈압)를 포함하였다. 이 연구를 파킨슨병 환자에서 폐 레보도파의 안전성 및 내약성을 평가하기 위해 운동 기능에 대한 폐 레보도파 효과의 시간, 규모 및 지속성을 측정하도록 설계하였다.
약력학적 매개변수에 대한 약동학적 매개변수의 비교에서, 본 발명자들은 오프 상태인 환자와 온 상태인 환자 사이에 상당히 가파른 곡선을 발견하였다. 도 8에서, 환자의 혈장 레보도파 농도를 UPDRS 스코어와 비교한다. UPDRS는 파킨슨병 환자에 대해 약물 치료 및 그들의 질환 진행에 대한 그들의 반응을 시험하기 위한 표준 시험이다. 도 8로부터 알 수 있는 바와 같이, 온 환자와 오프 환자 사이에 매우 적은 레보도파 혈장 농도 차이가 있다. 200 내지 400ng/mL만큼 적은 레보도파 혈장 농도는 오프 상태와 온 상태 사이의 차이를 만들었다. 용이하게 두드러진 것은 본 명세서에 나타낸 4명의 상이한 환자에 있으며, 그들은 모두 레보도파의 상당히 상이한 기준 혈장 농도를 가진다. 레보도파 혈장의 상이한 기준 수준은 각각의 환자에 대해 효과를 갖기 위해 각각의 환자가 상이한 유효 용량 또는 유효 농도를 가진다는 사실과 관련된다. 환자 집단 중에서 상이한 유효 용량 또는 유효 농도에도 불구하고, 오프로부터 온까지 필요한 혈장 농도의 증가는 매우 적었다.
실시예 3
위약 2(b) 무작위, 이중 맹검 위약 통제 연구
2b상 연구 설계 및 90/8/2를 이용하는 방법
본 연구는 운동동요(오프 에피소드)를 경험한 파킨슨병(PD) 대상체에서 1일 당 3회까지의 오프 에피소드의 치료를 위한 흡입(흡입 레보도파[LD] 분말) 또는 위약의 무작위, 이중맹검, 위약통제, 다중심 연구였다. 대상체를 흡입 90/8/2(또한 본 명세서에서 "연구 약물"로서 지칭됨) 또는 위약을 받도록 1:1 비로 무작위로 할당하였고; 무작위를 각각의 그룹에서의 질량 중증도에 대한 균형을 위해 대상체의 호앤야(Hoehn and Yahr) 단계(2.5 미만 대 2.5 이상)에 의해 계층화시켰다.
90/8/2 LD FPD는 90% LD, 8% 다이팔미토일 포스파티딜콜린(DPPC) 및 2% 염화나트륨(NaCl)으로 구성되는 균질한 입자를 포함한다. 90/8/2를 본 명세서에 참고로 포함되는 미국 특허 제8,496,002호에 기재된 바와 같은 분말의 흡입을 위한 흡입기 장치를 이용하여 전달한다. 90/8/2는 크기 00 하이프로멜로스(하이드록시프로필 메틸셀룰로스 [HPMC]) 캡슐로 제공되며, 각각 32㎎의 공칭 충전 중량에서(캡슐 당 27.6㎎ LD), 폐에 LD 17㎎ FPD의 근사치의 호흡가능한 용량을 전달하도록 설계하였다.
두 선택한 90/8/2 용량 수준(대략 34㎎ FPD 및 50㎎ FPD)은 건강한 지원자에서의 연구로부터의 안전성 및 약동학적(PK) 데이터 및 본 명세서의 실시예 1의 안정성, 건강한 성인 지원자 및 안전성에 대해 실시예 1에서 수행한 연구로부터의 PK, 실시예 2에 기재한 바와 같은 PD 환자에서 수행한 연구로부터의 PK 및 약동학 데이터에 기반하였다. 맹검을 유지하기 위해, 모든 환자에게 동일하게 보이는 연구 약물 키트를 제공하고 나서, 각각의 용량에 대해 동일한 수의 캡슐을 흡입하도록 지시하였다(1 및 2주 동안 2개 캡슐, 및 3 및 4주 동안 3개 캡슐). 필요하다면 환자는 캡슐 흡입 사이에 물을 한 모금씩 마시도록 허용하였다.
위약 흡입 분말을 크기 00 HPMC 캡슐에 공급하고, 각각은 공칭 충전 중량이 10㎎이었다. 위약 흡입 분말은 흡입 등급 락토스 일수화물인 NF이다. 흡입 분말의 비슷한 헤드 침착을 제공하고, 흡입 감각을 모방하도록 락토스의 입자 크기를 선택하였다.
연구 동안 두 90/8/2 용량 수준을 시험하였다: 치료 에피소드 당 용량 수준 1(DL1), 대략 35㎎ LD 미세입자 용량(FPD) 및 용량 수준 2(DL2) 대략 50㎎ LD FPD. 맹검 흡입 연구 약물의 제1 용량인 DL1은 3회차 방문 시 병원에서 제공하며(즉, 90/8/2 또는 위약 중 하나의 2개 캡슐 흡입); 각각의 90/8/2 캡슐은 대략 17.5㎎ LD FPD를 전달한다. DL2에서 맹검 연구의 제1 용량을 5회차에 병원에서 투여하였다(즉, 90/8/2 또는 위약 중 하나의 3개 캡슐 흡입).
연구는 3가지 기간이 있다: 선별, 치료 및 후속조치(총 7회 방문(2회의 선별 방문, 4회의 치료 방문 및 1회의 후속조치 방문)). 각각의 대상에 대해, 치료 기간은 대략 4주였고, 연구 지속기간은 대략 8 내지 10주의 범위에 있다. 각각의 환자는 4주 동안 1일 당 흡입 연구 약물의 3용량까지 자가 투여할 것이다. 대상체의 보통의 PD 의약의 용량 또는 투약 스케줄의 변화는 선별로부터 최종 연구 방문까지 허용되지 않았다.
대상체 적격성
30 내지 80세 사이의 남성 및 여성 대상체는 그들이 30세 후에 특발성 PD로 진단되었다면 자격이 있으며; UK 브레인 뱅크(UK Brain Bank) 기준의 단계 1 및 2를 충족시키고; 온 상태에서 변형된 호앤야 1 내지 3기로서 분류하였으며; 자기 보고에 의해 깨어 있는 날마다 최소 2시간의 평균 1일 오프 시간(이른 아침의 오프 시간을 제외)에 대해 운동동요를 경험하였고, PD 다이어리에 의해 확인하였으며; 허용가능한 LD 반응성을 나타내었다. 대상체는 선별 1회차 방문의 적어도 2주 전에 안정한 경구 LD-함유 치료법 용량/요법을 가져야 하며; LD/도파민데카복실라제 저해제(DDI)-함유 요법은 깨어있는 날 동안 적어도 4회의 용량 스케줄 투여를 포함하여야 한다. 대상체는 선별 1회차 방문 전 적어도 4주 동안 다른 PD 의약에 대해 안정하여야 한다. 대상체는 선별 시 그들의 온 및 오프 상태로 기록한 UPDRS 파트 3 스코어 사이에 25% 이상의 차이를 가져야 했다. 대상체는 (간병인의 도움에 의해 또는 도움 없이) 연구 동안 그들의 1일 의약 용량을 이해하고 변경시키지 않아야 한다. 대상체는 간이 정신상태 검사(Mini-Mental State Examination: MMSE)에 대해 25% 이상의 스코어에 의해 확인되는 정상 인지를 가져야 한다. 대상체는 선별 시 온 상태이며 폐질환의 이력 없이, 페활량측정법에 의해 선별 FEV1가 60% 초과, FEV1/FVC 비가 75% 이상으로 예측되어야 한다.
평가 기준 및 종말점
연구 목적 및 변수를 표 9에 기재한다.
효능을 다음의 기준에 의해 약술하는 바와 같이, 입원 중인 그리고 집에 있는 환자(외래환자) 평가 둘 다로부터 평가하였다:
입원 중 기준: UPDRS 파트 3 운동 스코어; 연구 약물을 병원에서 투여한 후 오프 에피소드의 온 상태로의 해결에 대한 시간(시험자 평가마다); 연구 의약 투여 후 이상운동증의 발생, 지속기간 및 중증도.
집에서의 기준: 연구 약물을 (흡입 의약 치료 로그로부터) 투여 한 후 오프 에피소드의 온 상태로의 해결에 대한 대상체 보고 시간, 이상운동증이 없는 1일 온 시간에 대한 PD 다이어리 정보, 이상운동증에 의한 온 시간(고질적 및 비고질적), 및 오프 시간.
다음 중의 탐구 평가를 수행하였다: PGI-C, PDQ-39, 상기 언급한 바와 같은 효능 기준(90/8/2 치료 아암에서 2가지 용량 수준 사이의 잠재적 차이를 평가하기 위함).
안전성을 신체검사, 유해 사건(AE) 보고, 표준 및 기립성 활력징후(혈압, 및 심박수), 호흡률, 임상 실험값(혈액학, 생화학 및 요검사), 심전도(ECG) 및 폐 기능의 평가를 위한 폐기능검사로부터 평가하였다. 추가로, 자살경향성, 경면, 및 충동조절 거동을 평가하기 위한 평가를 기준 및 후속 방문 시 수행하였다.
기준 특징
여든 여섯명 환자(86)를 연구에 등록하였다. 2회차 방문 전 3연속일 동안, 환자는 그들의 깨어있는 온/오프 상태(오프 시간, 이상운동증이 없는 온 시간, 고질적 이상운동증이 있는 온 시간) 및 수면 시간을 보고하는, 선별 PD 다이어리를 완료하였다. 추가로, 환자는 깨어있는 날 동안 경험한 각각의 오프 에피소드에 대한 다음의 정보를 보고하는, 2회차 방문 7일 전 동안 선별 온/오프 에피소드 및 의약을 완료할 것이다: 오프 에피소드의 시작 시간, 다음의 온 시작 시간, 및 그들의 표준 LD 의약을 사용하는 방법.
환자가 대략 3시간마다 현재의 레보도파 치료 요법을 취함에도 불구하고; 이들 환자는 그들의 깨어있는 시간의 대략 1/3 내지 1/2에 오프인 것으로 보고하였다(표 10 및 표 11 참조).
따라서, 오프 기간의 관리가 표 12 및 표 13에서 나타내는 바와 같이 PD 환자에 대해 상당한 충족되지 않은 필요로 남아있다는 것은 명확하다. 표 12는 연구 약물 또는 위약을 받기 전 각각의 환자에 대한 평균 투약 요법을 제공한다.
표 13은 연구 약물 또는 위약을 받기 전 다이어리에서 환자에 의해 보고되는 바와 같은 평균 1일 오프 및 온 시간을 제공한다.
기준 UPDRS 파트 3 스코어를 2b상 연구의 선별 단계 동안 그리고 연구 약물 또는 위약 중 하나를 받은 그룹 전에 측정하였다. 데이터를 표 14에 나타낸다.
연구 약물 또는 위약 중 하나에 대한 노출의 총 보고 연구일은 약 6.5 환자 년수(2,369 환자 일수)였다. 치료한 오프 기간의 총 수는 투여한 총 용량과 동일하며, 약 4,484이었으며, 위약은 2314 용량을 투여하고, 연구 약물은 2369 용량을 투여하였다. 전체 연구에 대한 사용한 위약 또는 연구 약물의 총 캡슐은 11, 115였다. 한 명의 환자는 고질적 이상운동증에 대한 용량 감소를 경험하였지만, 해당 환자는 위약이었다. 연구 약물의 한 명의 환자는 구역 때문에 용량을 감소하여 제공하였다. 환자 자신의 기록에 기반하여, 1일 당 연규 약물의 평균 사용은 이른 아침 "오프" 시간을 제외하고 1일 당 2.1일 이었다.
결과
2b상 연구의 주 종말점은 6회차 방문 시(DL2) 사전 용량 평균 UPDRS 파트 3 스코어(투약 후 10 내지 60분)로부터의 평균 변화에서 연구 약물과 위약 간의 차이를 평가하는 것이었다. DL1을 이용하는 4회차 방문 및 5회차 방문(DL2의 첫 번째 투약)에서 동일한 차이를 2차 종말점으로서 사용하였다. UPDRS와 일치되게, UPDRS 운동 스코어에 대한 임상적으로 중요한 차이(clinically important difference: CID)는 최소에 대해 2.5점, 중간에 대해 5.2점 및 거대 CID에 대해 10.8점이다(Shulman et al, Arch Neurol, Vol. 67 (Jan 2010)).
90/8/2는 50㎎ 용량으로 6회차 방문에서 위약으로부터의 (투약 후 10 내지 60분의 시간 기간에 걸쳐) 평균 UPDRS 파트 3 운동 스코어의 통계적으로 유의한 감소의 주 종말점을 충족시킨다. 87%의 환자는 60분 시점에 UPDRS III의 임상적으로 의미있는 감소를 달성하였다. 추가로, 90/8/2는 4, 5 및 6회차 방문 시 시험 용량 둘 다(35㎎ 및 50㎎)에 대해 평가한 모든 시점에(즉, 10, 20, 30 및 60분) 임상적으로 적절하고 통계적으로 유의한 감소를 입증하였다. 임상적으로 적절한 UPDRS III 개선은 투약 후 10분만큼 빠르게 명확하였다. 6회차 방문 시, 90/8/2에 의한 치료 후(50㎎ 용량), 투약 후 적어도 60분까지 임상적으로 유의한 반응이 지속되었다. 90/8/2와 위약 사이의 차이는 각각의 투약 후 시점에서 통계적으로 유의하였다.
표 15는 사전선별 및 4회차 방문(V4), 5회차 방문(v5) 및 6회차 방문(v6) 시 연구 약물 그룹과 위약 그룹 사이의 UPDRS 사전 용량 스코어의 비교를 제공한다. 용량 수준 1(DL1)을 4회차 방문 시 전달한 반면, 용량 수준 2(DL2)를 5회차 및 6회차 방문 시 전달하였다.
도 9 및 도 10에서 나타낸 바와 같이, 매 시점에 50㎎ FPD(도 9)와 35㎎(도 10)으로 투여한 연구 간의 통계적 차이가 있었다.
표 16은 각각 4 내지 6회차 방문에 대해 최고 UPDRS 파트 3 평균을 제공한다.
표 17은 각각 4 내지 6회차 방문에 대해 최고 UPDRS 파트 3 평균 백분율(%)을 나타낸다.
개요
본 명세서에 제공되는 데이터에 따라, 2b상 연구는 위약에 비해 6회차 방문 시 10 내지 60분에 평균 UPDRS 파트 3 스코어에서 사전용량으로부터 통계적으로 유의한 평균 변화를 나타내는 그의 주 종말점을 달성하였다. 데이터는 또한 UPDRS 시간 곡선의 형상은 50㎎ 용량(DL2)과 유사한 크기를 갖지만 잠재적으로 약간 더 짧은 지속기간의 효과를 갖는 35㎎ 용량(DL1)에 의해 빠르고 지속적인 반응을 나타낸다는 것을 나타내었다. UDPRS 파트 3 스코어에서 최고의 변화 및 최고의 백분율 변화%는 또한 위약 반응의 약화 전 V4(DL1)에서 상당한 분리와 함께 모든 방문 및 용량에 걸쳐 통계적으로 유의하였다.
종합하면, 데이터는 도 11에 나타내는 바와 같은 이상운동증에 의한 온 시간의 증가 없이 1일 오프 시간의 강한 임상적으로 의미있고 통계적으로 유의한 개선을 나타내었다. 도 11은 위약 그룹에 비해 연구 약물 그룹을 시험한 환자에서 (각각의 PD 다이어리에서 자기 보고한 바와 같이) 고질적 및 비-고질적 이상운동증을 보고하는 데이터를 나타낸다. 실시예 1 및 2의 연구 및 본 실시예는 또한 상기 약물이 안전하며 모든 1, 2a 및 2b상 연구에서 시험한 모든 용량 수준을 잘 용인하였다는 것을 나타낸다.
본 명세서에서 언급되는 특허 및 과학 문헌은 당업자에 대해 이용가능한 지식을 확립한다. 본 명세서에 인용된 모든 미국 특허 및 공개 또는 비공개 미국 특허 출원은 참고로 포함된다. 본 명세서에 인용된 모든 공개 외국 특허 및 특허 출원은 본 명세서에 참고로 포함된다. 본 명세서에 인용된 모든 다른 공개 참고문헌, 문헌, 사본 및 과학적 문헌은 본 명세서에 참고로 포함된다.
본 발명은 특히 이의 바람직한 실시형태와 관련하여 나타내고 기재하였지만, 당업자는 형태 및 상세한 설명의 다양한 변화가 첨부하는 청구범위에 의해 포함되는 본 발명의 범주로부터 벗어나는 일 없이 이들로부터 이루어질 수 있다는 것을 이해할 것이다. 또한 본 명세서에 기재된 실시형태는 상호간에 배타적이며, 다양한 실시형태로부터의 특징이 본 발명에 따라 전체적으로 또는 부분적으로 조합될 수 있다는 것이 이해되어야 한다.
Claims (33)
- 환자의 폐 기관계에 투여되는 35㎎ 미세입자 용량(fine particle dose: FPD)의 레보도파를 포함하는 약제학적 조성물로서 상기 투여 후에, 상기 환자의 통합 파킨슨병 척도(Unified Parkinson's Disease Rating Scale: UPDRS) 파트 3 스코어가 위약 대조군에 비해 적어도 5 내지 10점 만큼 개선되며, 상기 환자는 상기 레보도파의 폐 투여 전 이상운동증(dyskinesis) 수준과 비교하여 이상운동증의 증가를 경험하지 않으며, 상기 환자의 평균 일일 OFF 시간이 1시간 이상 감소되고, 상기 용량은 90% 건조 중량 레보도파, 8% 건조 중량 DPPC(dipalmitoyl phosphatidylcholine) 및 2% 건조 중량 염화나트륨을 포함하며, 상기 FPD 입자는 5.6 ㎛ 미만의 공기역학적 직경을 갖는, 상기 약제학적 조성물을 사용하여 파킨슨병(Parkinson's Disease: PD) 환자에서 오프(OFF) 에피소드를 치료하기 위한 약제학적 조성물의 제조방법.
- 제1항에 있어서, 상기 환자의 평균 일일 OFF 시간이 3시간 이상 감소되는, 방법.
- 제1항에 있어서, 상기 환자는 1일에 3 내지 4회의 OFF 에피소드를 갖는, 방법.
- 제1항에 있어서, 상기 환자는 1일에 4 내지 8시간의 OFF 에피소드를 갖는, 방법.
- 제1항에 있어서, 상기 FPD의 레보도파를 함유하는 적어도 하나의 캡슐의 내용물이 흡입을 통해 상기 환자에게 투여되는, 방법.
- 제5항에 있어서, 상기 FPD의 레보도파를 포함하는 적어도 2개의 캡슐의 내용물이 흡입을 통해 상기 환자에게 투여되는, 방법.
- 제5항에 있어서, 상기 미세입자 용량의 레보도파는 흡입 장치에 의해 상기 적어도 하나의 캡슐로부터 상기 폐 기관계로 전달되는, 방법.
- 제7항에 있어서, 상기 흡입 장치는 건조 분말 흡입기(DPI) 또는 정량 흡입기(MDI)인, 방법.
- 제1항에 있어서, 상기 투여는 오프 증상의 발생 시 일어나는, 방법.
- 환자의 폐 기관계에 투여되는 35㎎ 미세입자 용량(FPD)의 레보도파를 포함하는 약제학적 조성물로서 상기 레보도파의 FPD 투여 후 60분 내에 상기 환자의 UPDRS 파트 3 스코어가 상기 레보도파의 FPD의 투여 전의 상기 환자의 UPDRS 스코어에 비해 적어도 5 내지 12점 개선되며, 상기 환자는 상기 레보도파의 폐 투여 전 이상운동증(dyskinesis) 수준과 비교하여 이상운동증의 증가를 경험하지 않으며, 상기 환자의 평균 일일 OFF 시간이 1시간 이상 감소되고, 상기 용량은 90% 건조 중량 레보도파, 8% 건조 중량 DPPC(dipalmitoyl phosphatidylcholine) 및 2% 건조 중량 염화나트륨을 포함하며, 상기 FPD 입자는 5.6 ㎛ 미만의 공기역학적 직경을 갖는, 상기 약제학적 조성물을 사용하여 파킨슨병(Parkinson's Disease: PD) 환자에서 오프(OFF) 에피소드를 치료하기 위한 약제학적 조성물의 제조방법.
- 제10항에 있어서, 상기 환자의 평균 일일 OFF 시간이 3시간 이상 감소되는 것인, 방법.
- 제10항에 있어서, 상기 환자는 1일에 3 내지 4회의 오프 에피소드를 갖는, 방법.
- 제10항에 있어서, 상기 환자는 1일에 4 내지 8시간의 오프 에피소드를 갖는, 방법.
- 제10항에 있어서, 상기 환자의 UPDRS 파트 3 스코어는 상기 FPD의 레보도파의 투여 후 60분 내에 적어도 8점만큼 개선되는, 방법.
- 제10항에 있어서, 상기 FPD의 레보도파를 함유하는 적어도 하나의 캡슐의 내용물이 흡입을 통해 상기 환자에게 투여되는, 방법.
- 제15항에 있어서, 상기 FPD의 레보도파를 포함하는 적어도 2개의 캡슐의 내용물이 흡입을 통해 상기 환자에게 투여되는, 방법.
- 제15항에 있어서, 상기 미세입자 용량은 흡입 장치에 의해 상기 적어도 하나의 캡슐로부터 상기 폐 기관계로 전달되는, 방법.
- 제17항에 있어서, 상기 흡입 장치는 건조 분말 흡입기(DPI) 또는 정량 흡입기(MDI)인, 방법.
- 제10항에 있어서, 상기 투여는 오프 증상의 발생 시 일어나는, 방법.
- 제10항에 있어서, 상기 환자의 UPDRS 파트 3 스코어는 상기 FPD의 레보도파의 투여 전의 상기 환자의 UPDRS 스코어에 비해 적어도 8점 개선되는, 방법.
- 환자의 폐 기관계에 적어도 1일 2회 투여되는 35㎎ 미세입자 용량(FPD)의 레보도파를 포함하는 약제학적 조성물로서 상기 환자의 평균 1일 오프 시간은 1시간 이상 감소되며, 상기 환자는 상기 레보도파의 폐 투여 전의 이상운동증 수준에 비해 증가된 이상운동증을 경험하지 않으며, 상기 용량은 90% 건조 중량 레보도파, 8% 건조 중량 DPPC(dipalmitoyl phosphatidylcholine) 및 2% 건조 중량 염화나트륨을 포함하고, 상기 FPD 입자는 5.6 ㎛ 미만의 공기역학적 직경을 갖는, 상기 약제학적 조성물을 사용하여 파킨슨병(Parkinson's Disease: PD) 환자에서 평균 1일 오프 시간을 감소시키기 위한 약제학적 조성물의 제조방법.
- 제21항에 있어서, 상기 환자의 평균 1일 오프 시간은 3시간 이상 감소되는, 방법.
- 제21항에 있어서, 상기 환자는 1일에 3 내지 4회의 OFF 에피소드를 갖는, 방법.
- 제21항에 있어서, 상기 환자는 1일에 4 내지 8시간의 오프 에피소드를 갖는, 방법.
- 90 wt% 레보도파, 8 wt% DPPC(dipalmitoyl phosphatidylcholine) 및 2 wt% 염화나트륨을 포함하는 90/8/2 레보도파의 약 35 mg 미세 입자 용량(FPD)을 환자의 폐 기관계에 투여하는 것을 포함하는 파킨슨병(Parkinson's Disease: PD) 환자를 치료하기 위한 약제학적 조성물의 제조방법으로서, 여기서 상기 FPD 입자는 5.6 ㎛ 미만의 공기역학적 직경을 가지며, 상기 환자의 UPDRS 파트 3 스코어는 투여 전 환자의 UPDRS 점수와 비교하여 상기 레보도파의 FPD 투여 후 60분 이내에 8점 이상 개선되고, 상기 환자는 상기 레보도파의 폐 투여 전의 이상운동증 수준에 비해 증가된 이상운동증을 경험하지 않으며, 상기 환자의 평균 일일 OFF 시간은 1시간 이상 감소되는, 방법.
- 제25항에 있어서, 상기 환자의 평균 일일 OFF 시간이 3시간 이상 감소되는, 방법.
- 90 wt% 레보도파, 8 wt% DPPC(dipalmitoyl phosphatidylcholine) 및 2 wt% 염화나트륨을 포함하는 90/8/2 레보도파의 약 35 mg 미세 입자 용량(FPD)을 환자의 폐 기관계에 투여하는 것을 포함하는 파킨슨병(Parkinson's Disease: PD) 환자를 치료하기 위한 약제학적 조성물의 제조방법으로서, 여기서 상기 FPD 입자는 5.6 ㎛ 미만의 공기역학적 직경을 가지며, 투여 후에 상기 환자의 UPDRS 파트 3 스코어는 위약 대조군과 비교하여 상기 레보도파의 FPD 투여 후 60분 이내에 5점 이상 개선되고, 상기 환자는 상기 레보도파의 폐 투여 전의 이상운동증 수준에 비해 증가된 이상운동증을 경험하지 않으며, 상기 환자의 평균 일일 OFF 시간은 1시간 이상 감소되는, 방법.
- 제27항에 있어서, 상기 레보도파의 FPD를 함유하는 적어도 하나의 캡슐의 내용물이 흡입을 통해 상기 환자에게 투여되는, 방법.
- 제28항에 있어서, 상기 레보도파의 FPD를 포함하는 적어도 2개의 캡슐의 내용물이 흡입을 통해 환자에게 투여되는, 방법.
- 제28항에 있어서, 상기 미세 입자 용량의 레보도파가 흡입 장치에 의해 상기 적어도 하나의 캡슐로부터 폐 기관계로 전달되는, 방법.
- 제30항에 있어서, 상기 흡입 장치가 건조 분말 흡입기(DPI) 또는 정량 흡입기(MDI)인 방법.
- 제27항에 있어서, 상기 투여는 OFF 증상의 출현 시에 발생하는, 방법.
- 제27항에 있어서, 상기 환자의 평균 일일 OFF 시간이 3시간 이상 감소되는,방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020167032453A KR20170008754A (ko) | 2014-04-21 | 2014-04-21 | 파킨슨병의 운동동요의 빠른 경감 |
| PCT/US2014/034778 WO2015163840A1 (en) | 2014-04-21 | 2014-04-21 | Rapid relief of motor fluctuations in parkinson's disease |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167032453A Division KR20170008754A (ko) | 2014-04-21 | 2014-04-21 | 파킨슨병의 운동동요의 빠른 경감 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20210144946A true KR20210144946A (ko) | 2021-11-30 |
Family
ID=54332876
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167032453A KR20170008754A (ko) | 2014-04-21 | 2014-04-21 | 파킨슨병의 운동동요의 빠른 경감 |
| KR1020217038097A KR20210144946A (ko) | 2014-04-21 | 2014-04-21 | 파킨슨병의 운동동요의 빠른 경감 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167032453A KR20170008754A (ko) | 2014-04-21 | 2014-04-21 | 파킨슨병의 운동동요의 빠른 경감 |
Country Status (14)
| Country | Link |
|---|---|
| US (2) | US20170296498A1 (ko) |
| EP (2) | EP3831375A1 (ko) |
| JP (1) | JP2017513866A (ko) |
| KR (2) | KR20170008754A (ko) |
| CN (2) | CN113209055A (ko) |
| AU (2) | AU2014391721B2 (ko) |
| BR (1) | BR112016024502A8 (ko) |
| CA (1) | CA2946165C (ko) |
| IL (2) | IL309959A (ko) |
| MX (1) | MX2016013741A (ko) |
| RU (1) | RU2698330C2 (ko) |
| SG (1) | SG11201608608PA (ko) |
| WO (1) | WO2015163840A1 (ko) |
| ZA (1) | ZA201607833B (ko) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014074797A1 (en) | 2012-11-09 | 2014-05-15 | Civitas Therapeutics, Inc. | Ultra low density pulmonary powders |
| BR112020013749A2 (pt) * | 2018-01-05 | 2020-12-01 | Impel Neuropharma, Inc. | dispensação intranasal de pó de levodopa por dispositivo olfativo de precisão |
| US11517548B2 (en) | 2018-07-19 | 2022-12-06 | Impel Pharmaceuticals Inc. | Respiratory tract delivery of levodopa and DOPA decarboxylase inhibitor for treatment of Parkinson's Disease |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6254854B1 (en) | 1996-05-24 | 2001-07-03 | The Penn Research Foundation | Porous particles for deep lung delivery |
| US6858199B1 (en) | 2000-06-09 | 2005-02-22 | Advanced Inhalation Research, Inc. | High efficient delivery of a large therapeutic mass aerosol |
| US6514482B1 (en) | 2000-09-19 | 2003-02-04 | Advanced Inhalation Research, Inc. | Pulmonary delivery in treating disorders of the central nervous system |
| US6613308B2 (en) * | 2000-09-19 | 2003-09-02 | Advanced Inhalation Research, Inc. | Pulmonary delivery in treating disorders of the central nervous system |
| ES2389156T3 (es) * | 2002-03-20 | 2012-10-23 | Civitas Therapeutics, Inc. | Administración pulmonar de levodopa |
| AR044007A1 (es) * | 2003-04-11 | 2005-08-24 | Newron Pharmaceuticals Inc | Metodos para el tratamiento de la enfermedad de parkinson |
| US8496002B2 (en) | 2007-06-12 | 2013-07-30 | Civitas Therapeutics, Inc. | Powder inhaler devices |
| GB2454480A (en) * | 2007-11-07 | 2009-05-13 | Vectura Group Plc | Pulmonary inhalation of levodopa containing compositions in the treatment of Parkinsons disease and other central nervous system disorders |
| CN103212078A (zh) * | 2008-06-30 | 2013-07-24 | 诺瓦提斯公司 | 用于治疗帕金森病的包含mGluR调节剂的组合产品 |
| US8399513B2 (en) * | 2008-10-20 | 2013-03-19 | Xenoport, Inc. | Levodopa prodrug mesylate hydrate |
| TW201304822A (zh) * | 2010-11-15 | 2013-02-01 | Vectura Ltd | 組成物及用途 |
| AU2013334949B2 (en) * | 2012-10-22 | 2018-08-09 | Civitas Therapeutics, Inc. | Levodopa formulations for rapid relief of Parkinson's disease |
| US8545878B1 (en) * | 2012-11-09 | 2013-10-01 | Civitas Therapeutics, Inc. | Capsules containing high doses of levodopa for pulmonary use |
-
2014
- 2014-04-21 CA CA2946165A patent/CA2946165C/en active Active
- 2014-04-21 IL IL309959A patent/IL309959A/en unknown
- 2014-04-21 US US15/500,608 patent/US20170296498A1/en not_active Abandoned
- 2014-04-21 CN CN202110185196.6A patent/CN113209055A/zh active Pending
- 2014-04-21 MX MX2016013741A patent/MX2016013741A/es unknown
- 2014-04-21 RU RU2016144340A patent/RU2698330C2/ru active
- 2014-04-21 JP JP2016563193A patent/JP2017513866A/ja active Pending
- 2014-04-21 BR BR112016024502A patent/BR112016024502A8/pt not_active Application Discontinuation
- 2014-04-21 EP EP21150770.2A patent/EP3831375A1/en active Pending
- 2014-04-21 KR KR1020167032453A patent/KR20170008754A/ko active Application Filing
- 2014-04-21 CN CN201480079968.6A patent/CN106659685B/zh active Active
- 2014-04-21 WO PCT/US2014/034778 patent/WO2015163840A1/en active Application Filing
- 2014-04-21 AU AU2014391721A patent/AU2014391721B2/en active Active
- 2014-04-21 EP EP14889874.5A patent/EP3134077A4/en not_active Ceased
- 2014-04-21 KR KR1020217038097A patent/KR20210144946A/ko not_active IP Right Cessation
- 2014-04-21 SG SG11201608608PA patent/SG11201608608PA/en unknown
-
2016
- 2016-10-20 IL IL248445A patent/IL248445A0/en unknown
- 2016-11-14 ZA ZA2016/07833A patent/ZA201607833B/en unknown
-
2020
- 2020-09-24 AU AU2020239754A patent/AU2020239754B2/en active Active
-
2022
- 2022-01-26 US US17/584,663 patent/US20230053976A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| US20230053976A1 (en) | 2023-02-23 |
| EP3134077A1 (en) | 2017-03-01 |
| EP3134077A4 (en) | 2017-12-20 |
| AU2020239754A1 (en) | 2021-01-14 |
| CA2946165C (en) | 2022-10-18 |
| JP2017513866A (ja) | 2017-06-01 |
| SG11201608608PA (en) | 2016-11-29 |
| AU2014391721B2 (en) | 2020-07-16 |
| KR20170008754A (ko) | 2017-01-24 |
| BR112016024502A8 (pt) | 2021-06-29 |
| IL248445A0 (en) | 2016-12-29 |
| EP3831375A1 (en) | 2021-06-09 |
| IL309959A (en) | 2024-03-01 |
| RU2016144340A3 (ko) | 2018-05-22 |
| US20170296498A1 (en) | 2017-10-19 |
| AU2014391721A1 (en) | 2016-11-03 |
| BR112016024502A2 (pt) | 2017-08-15 |
| WO2015163840A1 (en) | 2015-10-29 |
| CA2946165A1 (en) | 2015-10-29 |
| RU2016144340A (ru) | 2018-05-22 |
| AU2020239754B2 (en) | 2022-06-23 |
| MX2016013741A (es) | 2017-04-06 |
| CN106659685B (zh) | 2021-02-05 |
| CN113209055A (zh) | 2021-08-06 |
| RU2698330C2 (ru) | 2019-08-26 |
| CN106659685A (zh) | 2017-05-10 |
| ZA201607833B (en) | 2018-08-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2018253538B2 (en) | Levodopa formulations for rapid relief of parkinson's disease | |
| US20230053976A1 (en) | Rapid relief of motor fluctuations in parkinson's disease | |
| AU2020250280B2 (en) | Reducing Inter-Patient Variability of Levodopa Plasma Concentrations | |
| JP2019108379A (ja) | パーキンソン病の運動症状変動の迅速な緩和 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| AMND | Amendment | ||
| X601 | Decision of rejection after re-examination |