KR20210122140A - (-)-시벤졸린 숙신산염의 결정다형 - Google Patents
(-)-시벤졸린 숙신산염의 결정다형 Download PDFInfo
- Publication number
- KR20210122140A KR20210122140A KR1020210039212A KR20210039212A KR20210122140A KR 20210122140 A KR20210122140 A KR 20210122140A KR 1020210039212 A KR1020210039212 A KR 1020210039212A KR 20210039212 A KR20210039212 A KR 20210039212A KR 20210122140 A KR20210122140 A KR 20210122140A
- Authority
- KR
- South Korea
- Prior art keywords
- cybenzoline
- succinate
- crystalline form
- present
- solvent
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/04—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member
- C07D233/06—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, directly attached to ring carbon atoms
- C07D233/08—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, directly attached to ring carbon atoms with alkyl radicals, containing more than four carbon atoms, directly attached to ring carbon atoms
- C07D233/10—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, directly attached to ring carbon atoms with alkyl radicals, containing more than four carbon atoms, directly attached to ring carbon atoms with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, directly attached to ring nitrogen atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/13—Crystalline forms, e.g. polymorphs
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
본 발명은 (-)-시벤졸린 숙신산염의 결정형에 관한 것이다. 본 발명은 또한 (-)-시벤졸린 숙신산염 및 이의 결정형의 제조 공정을 제공한다. 본 발명에 따른 (-)-시벤졸린 숙신산염의 결정형은 흡습성이 낮고, 가속조건 및 장기보관 조건에 따른 안정성이 우수하며, 장기간 함량의 변화없이 안정적으로 유지될 수 있다.
Description
본 발명은 (-)-시벤졸린 숙신산염의 결정다형에 관한 것이다.
또한, 본 발명은 (-)-시벤졸린 숙신산염의 결정다형의 제조 공정을 제공한다.
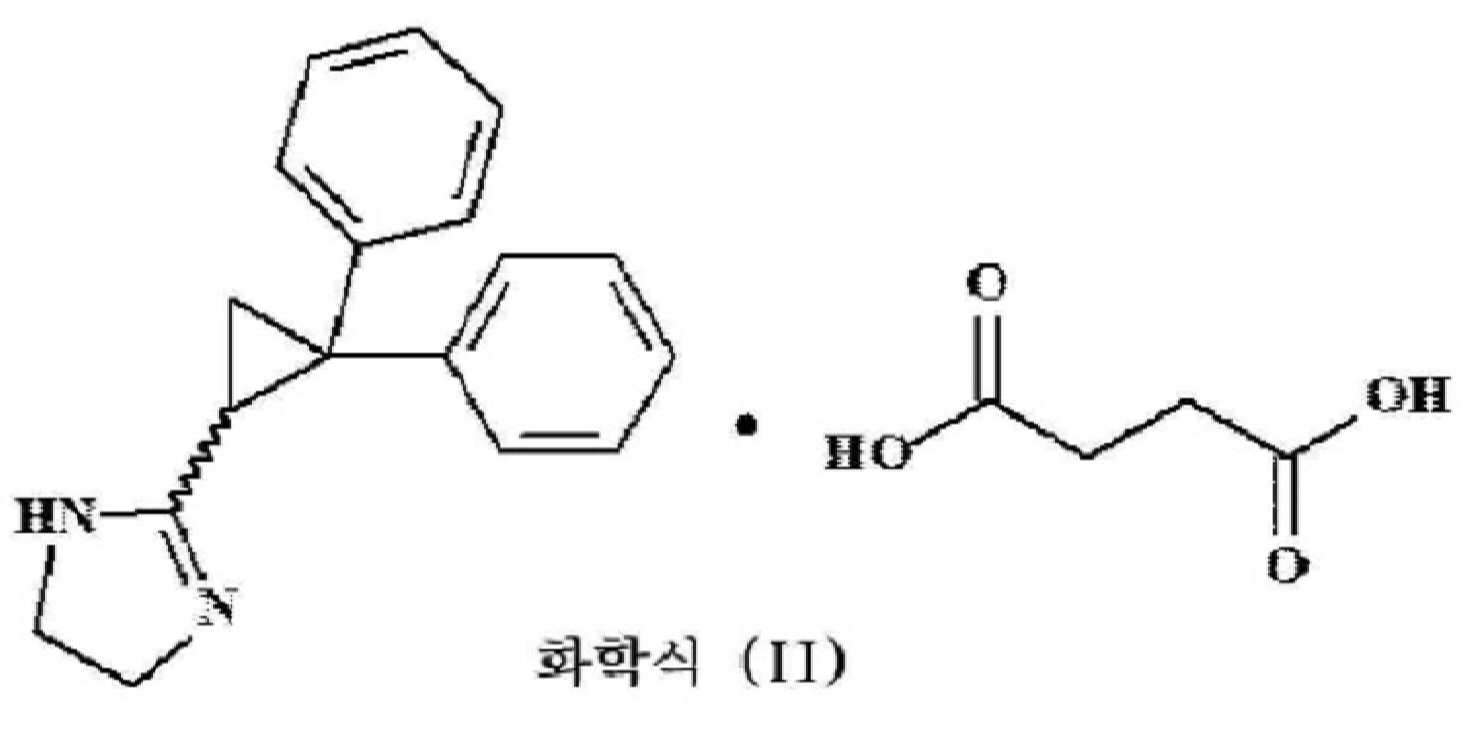
시벤졸린 숙신산염(라세미)은 화학적으로 화학식 (II)로 표시되는 구조를 갖는 (±)-2-(2,2-다이페닐사이클로페닐)-2-이미다졸린 숙신산염으로 알려져 있으며, Bristol-Myers Squibb(BMS)에 의해 Cipralan® 및 프랑스 XO 연구소에 의해 Exacor®로 개발되어 판매되었다. 시벤졸린 숙신산염(라세미)은 Cipralan과 Exacor라는 상표명으로 판매되는 항부정맥제이다. 라세미 시벤졸린 숙신산염은 1983년 10월 21일 프랑스에서 부정맥 심장질환을 환자를 치료하기 위해 승인되었다. 시벤졸린은 부정맥 심장질환(Eur J Clin Pharmacol.1984;26(3):297-302) 및 심부전(Circ J.2006 May;70(5):588-92) 치료에 효과적이다.
상기 시벤졸린 숙신산염(라세미)에 대한 결정형다형에 대해서만 연구가 진행(일본공개공보 JP2010132561)된 바 있을 뿐이다.
한편, 순수한 거울상 이성질체인 약물의 사용은 더 단순하고 보다 선택적인 약리학적 프로파일, 향상된 치료 지수(therapeutic indices), 다른 거울상 이성질체의 상이한 대사 속도에 따른 더 단순한 약리 역학, 및 감소된 약물 상호 작용을 이끌 수 있어, 제약회사는 마케팅 전략으로서 키랄 스위칭(chiral switching)을 점차적으로 더 많이 사용하고 있다. 또한, 상이한 약리학적 활성으로 인해, 키랄 약물의 거울상 이성질체들은 라세미 약물에 비해 독성 측면에서 상이할 수 있다.
결정다형이 존재하는 화합물에서는 각 결정형마다 다른 물성을 나타내는 것으로 알려져 있다. 특히 의약품에 있어서는 각 결정형에 따라 용해도, 용해 속도, 안정성, 흡수성 등에 차이가 발생한다. 결정형 차이에 따라 동일 화합물을 사용했을 경우에도 제형화 공정, 저장 안정성, 생체이용율, 및 약효 발현의 속도나 작용 강도의 차이가 발생할 수 있다.
따라서, 결정다형이 존재하는 화합물을 의약품으로서 이용하는 경우 일정한 생체이용율을 확보하기 위해, 화합물의 균일한 결정형을 안정적으로 제공하는 것이 필요하다. 이에, 본 발명자들은 (-)-시벤졸린 및 이의 염의 결정다형을 연구하여 신규하고 안정한 결정형을 개발하였다.
본 발명은 하기의 분말 X-선 회절분광도 패턴(XRPD)으로 이루어진 군으로부터 선택되는 어느 하나의 (-)-시벤졸린 숙신산염의 결정형을 제공한다.
i) 분말 X선 회절 스펙트럼에 있어서, 9.7°, 14.9°, 21.5°, 23.4° 및 24.1° (2θ±0.2°) 회절 피크 포함하는 결정형(이하, 「결정형 1」이라고 함);
ii) 분말 X선 회절 스펙트럼에 있어서, 20.6°, 21.1°, 22.9°, 25.2° 및 37.4° (2θ±0.2°) 회절 피크 포함하는 결정형(이하, 「결정형 2」이라고 함); 및
iii) 분말 X선 회절 스펙트럼에 있어서, 13.0°, 14.8°, 23.3°, 25.5° 및 26.1° (2θ±0.2°) 회절 피크 포함하는 결정형(이하, 「결정형 3」이라고 함).
본 발명은 삼사정계(Triclinic) 결정이고, 결정형 공간 군(Space group)이 P1인 (-)-시벤졸린 숙신산염의 결정형을 제공한다.
본 발명은 a)
화학식 (IA)로 표시되는 (-)-시벤졸린 숙신산염을 극성 용매(polar solvent)에 녹이는 단계; 및
b) 단계 a)의 용액에 탄소수 6 이상의 탄화수소용매를 첨가하여, 시벤졸린 숙신산염 결정형 3을 석출하는 단계;
를 포함하는 (-)-시벤졸린 숙신산염 결정형 3의 제조 공정을 제공한다.
본 발명은 (-)-시벤졸린 숙신산염의 결정형 및 약학적으로 허용 가능한 담체, 희석제 또는 부형제를 포함하는 약학적 조성물을 제공한다.
본 발명의 첫번째 구현예는, 하기의 분말 X-선 회절분광도 패턴(XRPD)으로 이루어진 군으로부터 선택되는 어느 하나의 (-)-시벤졸린 숙신산염의 결정형을 제공하는 것이다.
i) 분말 X선 회절 스펙트럼에 있본 발명의 첫번째 구현예는, 하기의 분말 X-선 회절분광도 패턴(XRPD)으로 이루어진 군으로부터 선택되는 어느 하나의 (-)-시벤졸린 숙신산염의 결정형을 제공하는 것이다.
i) 분말 X선 회절 스펙트럼에 있어서, 9.7°, 14.9°, 21.5°, 23.4° 및 24.1° (2θ±0.2°) 회절 피크 포함하는 결정형(이하, 「결정형 1」이라고 함);
ii) 분말 X선 회절 스펙트럼에 있어서, 20.6°, 21.1°, 22.9°, 25.2° 및 37.4° (2θ±0.2°) 회절 피크 포함하는 결정형(이하, 「결정형 2」이라고 함); 및
iii) 분말 X선 회절 스펙트럼에 있어서, 13.0°, 14.8°, 23.3°, 25.5° 및 26.1° (2θ±0.2°) 회절 피크 포함하는 결정형(이하, 「결정형 3」이라고 함).
본 발명의 일 구현에 따르면, 상기 (-)-시벤졸린 숙신산염의 결정형은 무수물이며, 13.0°, 14.8°, 23.3°, 25.5° 및 26.1° (2θ±0.2°)에서의 회절 피크를 포함하는 XRPD 패턴을 가질 수 있다.
본 발명의 일 구현에 따르면, 상기 (-)-시벤졸린 숙신산염의 결정형은 무수물이며, 9.7°, 12.8°, 14.6°, 16.1°, 16.3°, 17.5°, 19.4°, 22.4°, 22.7°, 23.5° 및 25.4° (2θ±0.2°)로 이루어진 군에서 선택되는 1개 이상의 회절 피크를 추가로 포함하는 XRPD 패턴을 가질 수 있다.
본 발명의 일 구현에 따르면, 상기 (-)-시벤졸린 숙신산염의 결정형은 무수물이며, 승온속도가 10℃/min인 경우 190 내지 193℃ 온도에서 시차주사열량(DSC) 흡열 피크를 가질 수 있다.
본 발명의 일 구현에 따르면, 상기 (-)-시벤졸린 숙신산염의 결정형은 입자의 50%[D50]가 10 ㎛ 내지 50 ㎛ 의 입자 크기를 가질 수 있다.
본 발명의 일 구현에 따르면, 상기 (-)-시벤졸린 숙신산염의 결정형은 하기의 동적 증기 수착/탈착 (DVS) 패턴을 특징으로 가질 수 있다.
i) 흡착 주기에서 0.3%의 수분을 흡착;
ii) 80% 상대 습도에서 0.2% 수분을 흡착; 및
iii) 탈착 주기에서 흡수된 0.3%의 수분을 모두 방출
본 발명의 두번째 구현예는, 삼사정계(Triclinic) 결정이고, 결정형 공간 군(Space group)이 P1인 (-)-시벤졸린 숙신산염의 결정형을 제공하는 것이다.
본 발명의 일 구현에 따르면, 상기 (-)-시벤졸린 숙신산염의 결정형은 삼사정계(Triclinic) 결정이고, 하기 격자상수 파라미터를 가지는 것일 수 있다.
a = 7.87(6)Å
b = 8.00(9)Å
c = 9.36(12)Å
α = 96.71(5)°
β = 95.47(7)°
γ = 118.51(6)°
V = 507.06(10)Å3
Z = 1(1)
본 발명의 세번째 구현예는,
a)
화학식 (IA)로 표시되는 (-)-시벤졸린 숙신산염을 극성 용매(polar solvent)에 녹이는 단계; 및
b)
단계 a)의 용액에 탄소수 6 이상의 탄화수소용매를 첨가하여, 시벤졸린 숙신산염 결정형 3을 석출하는 단계;
를 포함하는 (-)-시벤졸린 숙신산염 결정형 3의 제조 공정을 제공하는 것이다.
본 발명의 일 구현에 따르면, 단계 a) 의 극성 용매(polar solvent)는 물, 알코올계 용매, 알데하이드계 용매, 에스테르계 용매, 아미드계 용매 및 이의 혼합물일 수 있다.
본 발명의 일 구현에 따르면, 상기 알코올계 용매는 소메탄올, 에탄올, 직쇄 또는 분지쇄의 프로판올, 직쇄 또는 분지쇄의 부탄올, 직쇄 또는 분지쇄의 펜탄올, 또는 이들의 혼합물일 수 있다.
본 발명의 일 구현에 따르면, 상기 탄소수 6 이상의 탄화수소용매는 시클로헥산, 시클로헥탄, n-헥산, n-헵탄 또는 이들의 혼합물일 수 있다.
본 발명의 네번째 구현예는, (-)-시벤졸린 숙신산염의 결정형을 유효량으로 포함하는 약학적 조성물을 제공하는 것이다.
본 발명의 일 구현에 따르면, 상기 조성물은 경구 투여용 캡슐 또는 정제의 형태일 수 있다.
(-)-시벤졸린 숙신산염의 제조
본 발명의 화학식 (IA)로 표시되는 순수한 거울상 이성질체인 (-)-시벤졸린 숙신산염의 다음과 같은 단계를 포함하는 하기 공정을 통해 제조될 수 있다.
a)
화학식 (II)로 표시되는 라세미 시벤졸린 숙신산염과 염기를 반응시켜 화학식 (III)으로 표시되는 라세미 시벤졸린 유리 염기를 제조하는 단계;
b)
상기 화학식 (III)로 표시되는 라세미 시벤졸린 유리 염기를 용매 존재 하에서 키랄 산과 반응시켜 화학식 (IIIA)로 표시되는 라세미 시벤졸린·키랄 산 염을 수득하는 단계;
c)
화학식 (IVA)로 표시되는 (-)-시벤졸린·키랄 산 염을 분리하는 단계;
d)
화학식 (IVA)로 표시되는 (-)-시벤졸린·키랄 산 염을 염기로 중화시켜 화학식 (VA)로 표시되는 (-)-시벤졸린 유리 염기를 제조하는 단계; 및
e)
화학식 (VA)로 표시되는 (-)-시벤졸린 유리 염기를 용매 존재 하에서 숙신산과 반응시켜 화학식 (IA)로 표시되는 (-)-시벤졸린 숙신산염을 제조하는 단계.
상기 제조 공정의 단계 b)는, 화학식 (IIIA)로 표시되는 라세미 시벤졸린·키랄 산 염은 (+)-시벤졸린·키랄 산 염과 (-)-시벤졸린·키랄 산 염을 포함할 수 있으며, (+)-시벤졸린·키랄 산 염과 (-)-시벤졸린·키랄 산 염은 서로 부분입체이성질체일 수 있다. 예를 들면, 상기 키랄 산이 D-타르타르산인 경우, 상기 화학식 (IIIA)로 표시되는 라세미 시벤졸린·키랄 산 염은 라세미 시벤졸린-D-타르타르산 염일 수 있으며, 상기 라세미 시벤졸린-D-타르타르산 염은 서로 부분입체이성질체인 (+)-시벤졸린-D-타르타르산 염과 (-)-시벤졸린-D-타르타르산 염을 포함할 수 있다.
상기 제조 공정의 단계 b)는, 화학식 (II)로 표시되는 라세미 시벤졸린 숙신산염과 염기를 0 내지 30분 동안 0 내지 30℃의 온도에서 반응시켜 화학식 (III)으로 표시되는 라세미 시벤졸린 유리 염기를 제조하는 공정을 포함한다.
상기 제조 공정의 단계 b)는, 화학식 (III)으로 표시되는 라세미 시벤졸린 유리 염기를 용매 존재 하에서 적합한 온도에서 키랄 산과 반응시켜 화학식 (IIIA)로 표시되는 라세미 시벤졸린·키랄 산 염을 수득하는 단계를 포함하며, 상기 반응에서 온도는 약 20 내지 65℃이고 상기 반응은 30분 내지 6시간 동안 수행될 수 있다.
상기 제조 공정의 단계 c)에서, 화학식 (IVA)로 표시되는 상기 (-)-시벤졸린·키랄 산 염은 여과 또는 원심분리 등과 같은 기술에 의해 분리될 수 있으며, 화학식 (IVA)로 표시되는 상기 (-)-시벤졸린·키랄 산 염은 트레이 건조기(tray dryer), 진공 오븐(vacuum oven), 유동층 건조기(fluidized bed dryer) 및 스핀 플래쉬 건조기(spin flash dryer)를 사용하여 추가적으로 건조될 수 있다.
상기 제조 공정의 단계 d)는, 화학식 (IVA)로 표시되는 (-)-시벤졸린·키랄 산 염을 염기로 중화시켜 화학식 (VA)로 표시되는 (-)-시벤졸린 유리 염기를 제조하는 단계를 포함하고, 상기 반응은 10 내지 50℃의 온도에서 30분 내지 5시간 동안 수행될 수 있다.
상기 제조 공정의 단계 e)는, 화학식 (VA)로 표시되는 (-)-시벤졸린 유리 염기를 0 내지 65℃의 온도에서 숙신산과 반응시키고 10분 내지 5시간 동안 교반하여 화학식 (IA)로 표시되는 (-)-시벤졸린 숙신산염을 제조하는 단계를 포함한다.
(-)-시벤졸린 숙신산염의 결정형
본 발명의 첫번째 구현예는, 하기의 분말 X-선 회절분광도 패턴(XRPD)으로 이루어진 군으로부터 선택되는 어느 하나의 (-)-시벤졸린 숙신산염의 결정형을 제공하는 것이다.
1) 분말 X선 회절 스펙트럼에 있어서, 9.7°, 14.9°, 21.5°, 23.4° 및 24.1° (2θ±0.2°) 회절 피크 포함하는 결정형(이하, 「결정형 1」이라고 함);
2) 분말 X선 회절 스펙트럼에 있어서, 20.6°, 21.1°, 22.9°, 25.2° 및 37.4° (2θ±0.2°) 회절 피크 포함하는 결정형(이하, 「결정형 2」이라고 함); 및
3) 분말 X선 회절 스펙트럼에 있어서, 13.0°, 14.8°, 23.3°, 25.5° 및 26.1° (2θ±0.2°) 회절 피크 포함하는 결정형(이하, 「결정형 3」이라고 함).
본 발명의 구현예에 따르면, (-)-시벤졸린 숙신산염의 결정형 1은 9.7°, 14.9°, 21.5°, 23.4° 및 24.1° (2θ±0.2°)에서의 회절 피크를 포함하는 분말 X-선 회절분광도 패턴(XRPD)을 갖는다.
본 발명의 구현예에 따르면, (-)-시벤졸린 숙신산염의 결정형 1은 9.7°, 14.9°, 21.5°, 23.4° 및 24.1° (2θ±0.2°)에서의 XRPD 회절 피크에 더하여, 16.5°, 17.2° 및 26.1° (2θ±0.2°)로 이루어진 군에서 선택되는 1개 이상의 회절 피크를 더 포함하는 XRPD 패턴을 가질 수 있다.
본 발명의 구현예에 따르면, (-)-시벤졸린 숙신산염의 결정형 1은 하기 표 1과 같이, 8.98°, 9.67°, 13.35°, 14.12°, 14.90°, 16.53°, 17.18°, 18.36°, 19.05°, 20.07°, 21.50°, 23.40°, 24.06°, 24.78°, 25.38°, 26.08°, 27.44°, 28.24°, 29.41°, 30.20°, 31.20°, 32.52°, 33.80°, 35.29° 및 38.33° (2θ±0.2°)에서의 회절 피크를 포함하는 XRPD 패턴을 가질 수 있다.
| (-)-시벤졸린 숙신산염 결정형 1 | ||
| 2-theta(°) | D-값(Å) | 강도% |
| 8.98 | 12.37 | 28 |
| 9.67 | 11.49 | 100 |
| 13.35 | 8.33 | 28 |
| 14.12 | 7.88 | 34 |
| 14.90 | 7.47 | 68 |
| 16.53 | 6.74 | 66 |
| 17.18 | 6.48 | 53 |
| 18.36 | 6.07 | 18 |
| 19.05 | 5.85 | 21 |
| 20.07 | 5.55 | 19 |
| 21.50 | 5.19 | 78 |
| 23.40 | 4.77 | 90 |
| 24.06 | 4.64 | 69 |
| 24.78 | 4.51 | 34 |
| 25.38 | 4.41 | 27 |
| 26.08 | 4.29 | 58 |
| 27.44 | 4.08 | 31 |
| 28.24 | 3.97 | 29 |
| 29.41 | 3.81 | 30 |
| 30.20 | 3.72 | 20 |
| 31.20 | 3.60 | 17 |
| 32.52 | 3.46 | 17 |
| 33.80 | 3.33 | 17 |
| 35.29 | 3.19 | 20 |
| 38.33 | 2.95 | 15 |
본 발명의 구현예에 따르면, (-)-시벤졸린 숙신산염의 결정형 2는 20.6°, 21.1°, 22.9°, 25.2° 및 37.4° (2θ±0.2°)에서의 회절 피크를 포함하는 분말 X-선 회절분광도 패턴(XRPD)을 갖는다.
본 발명의 구현예에 따르면, (-)-시벤졸린 숙신산염의 결정형은 하기 표 2와 같이, 16.72°, 19.06°, 20.58°, 21.14°, 22.87°, 24.13°, 25.16°, 27.07°, 28.64°, 32.68°, 34.54°, 37.35°, 39.44° 및 40.95° (2θ±0.2°)에서의 회절 피크를 포함하는 XRPD 패턴을 가질 수 있다.
| (-)-시벤졸린 숙신산염 결정형 2 | ||
| 2-theta(°) | D-값(Å) | 강도% |
| 16.72 | 6.66 | 17 |
| 19.06 | 5.85 | 23 |
| 20.58 | 5.42 | 100 |
| 21.14 | 5.28 | 35 |
| 22.87 | 4.88 | 55 |
| 24.13 | 4.63 | 23 |
| 25.16 | 4.44 | 35 |
| 27.07 | 4.14 | 13 |
| 28.64 | 3.91 | 24 |
| 32.68 | 3.44 | 9 |
| 34.54 | 3.26 | 10 |
| 37.35 | 3.02 | 25 |
| 39.44 | 2.87 | 17 |
| 40.95 | 2.77 | 9 |
본 발명의 구현예에 따르면, (-)-시벤졸린 숙신산염의 결정형 3은 무수물이며, 13.0°, 14.8°, 23.3°, 25.5° 및 26.1° (2θ±0.2°)에서의 회절 피크를 포함하는 분말 X-선 회절분광도 패턴(XRPD)을 갖는다.
본 발명의 구현예에 따르면, (-)-시벤졸린 숙신산염의 결정형 3은 무수물이며, 13.0°, 14.8°, 23.3°, 25.5° 및 26.1° (2θ±0.2°)에서의 XRPD 회절 피크에 더하여, 9.7°, 12.8°, 14.6°, 16.1°, 16.3°, 17.5°, 19.4°, 22.4°, 22.7°, 23.5° 및 25.4° (2θ±0.2°)로 이루어진 군에서 선택되는 1개 이상의 회절 피크를 더 포함하는 XRPD 패턴을 가질 수 있다.
본 발명의 구현예에 따르면, (-)-시벤졸린 숙신산염의 결정형은 하기 표 3과 같이, 무수물이며, 9.68°, 12.84°, 13.00°, 14.57°, 14.81°, 16.14°, 16.29°, 17.47°, 19.38°, 21.19°, 21.41°, 22.38°, 22.50°, 22.68°, 23.29°, 23.50°, 25.42°, 25.53°, 25.80°, 26.11°, 26.26°, 27.80°, 28.00°, 28.53°, 29.27°, 31.38°, 34.38° 및 34.91° (2θ±0.2°)에서의 회절 피크를 포함하는 XRPD 패턴을 가질 수 있다.
| (-)-시벤졸린 숙신산염 결정형 3 | ||
| 2-theta(°) | D-값(Å) | 강도% |
| 9.68 | 9.13 | 26 |
| 12.848 | 6.89 | 22 |
| 13.00 | 6.81 | 88 |
| 14.57 | 6.07 | 40 |
| 14.81 | 5.98 | 100 |
| 16.14 | 5.49 | 20 |
| 16.29 | 5.44 | 23 |
| 17.47 | 5.07 | 38 |
| 19.38 | 4.58 | 37 |
| 21.19 | 4.19 | 12 |
| 21.41 | 4.15 | 13 |
| 22.38 | 3.97 | 30 |
| 22.50 | 3.95 | 16 |
| 22.68 | 3.92 | 36 |
| 23.29 | 3.82 | 49 |
| 23.50 | 3.78 | 34 |
| 25.42 | 3.50 | 23 |
| 25.53 | 3.49 | 42 |
| 25.80 | 3.45 | 16 |
| 26.11 | 3.41 | 78 |
| 26.26 | 3.39 | 15 |
| 27.80 | 3.21 | 11 |
| 28.00 | 3.13 | 10 |
| 28.53 | 3.13 | 10 |
| 29.27 | 3.05 | 11 |
| 31.38 | 2.85 | 10 |
| 34.38 | 2.61 | 15 |
| 34.91 | 2.57 | 13 |
본 발명의 구현예에 따르면, 상기 (-)-시벤졸린 숙신산염의 결정형 3은 무수물이며, 시차주사열량(DSC)의 그래프는 10℃/min의 승온속도에서 약 190 내지 193℃의 온도에서의 흡열 피크를 가질 수 있고, 일반적으로, 용융점 및 흡열 전이 온도의 측정은 ±2℃ 또는 일반적으로 ±1℃의 허용 오차 내에 있는 값을 제공한다.
본 발명의 일 구현에 따르면, 상기 (-)-시벤졸린 숙신산염의 결정형 3의 입자 크기 분포는 입자의 10%[D10]이 10㎛ 미만, 입자의 50%[D50]가 10㎛ 내지 50㎛, 입자의 10%[D10]이 50㎛ 초과하는 입자 크기를 가질 수 있다. 예를 들면 D10: 8.8㎛, D50: 30.44㎛ 및 D90: 60.72㎛를 가질 수 있다. 또한 D50을 기준으로 10㎛ 내지 50㎛, 15㎛ 내지 45㎛, 20㎛ 내지 40㎛ 또는 25㎛ 내지 35㎛의 입자 크기를 가질 수 있다. 상기 (-)-시벤졸린 숙신산염의 결정형 3의 입자 크기는 매우 미세한 것을 확인할 수 있다. 상기 결정형 3은 분쇄(miling)와 같은 추가적인 공정 없이 제제화될 수 있다.
본 발명의 일 구현에 따르면, 상기 (-)-시벤졸린 숙신산염의 결정형은 하기의 동적 증기 수착/탈착(DVS) 패턴을 특징으로 가질 수 있다.
i) 흡착 주기에서 0.3%의 수분을 흡착;
ii) 80% 상대 습도에서 0.2% 수분을 흡착; 및
iii) 탈착 주기에서 흡수된 0.3%의 수분을 모두 방출
상기 (-)-시벤졸린 숙신산염의 결정형 3은 실온 80% 상대 습도에서 0.2%의 수분을 흡수하는 것을 확인할 수 있다. 상기 결정형 3은 비흡수성(유럽 약전 비흡성 분류 참조, European Pharmacopeia 5.0, 5.11. CHARACTERS SECTION IN
MONOGRAPHS, Hygroscopicity classification) 임을 확인하였다.
본 발명의 구현예에 따르면, (-)-시벤졸린 숙신산염의 결정형 3은 도 4와 같이, 삼사정계(Triclinic) 결정이고, 결정형 공간 군(Space group) P1일 수 있다.
본 발명의 구현예에 따르면, (-)-시벤졸린 숙신산염의 결정형 3은 삼사정계(Triclinic) 결정이고, 하기 격자상수 파라미터를 가질 수 있다.
a = 7.87(6)Å
b = 8.00(9)Å
c = 9.36(12)Å
α = 96.71(5)°
β = 95.47(7)°
γ = 118.51(6)°
V = 507.06(10)Å3
Z = 1(1)
또한, 본 발명의 (-)-시벤졸린 숙신산염의 결정형 3은 가속조건에 따른 안정성이 우수하여, 장기간 함량의 변화없이 안정적으로 결정형이 유지되었다. 따라서 본 발명의 (-)-시벤졸린 숙신산염의 결정형 3은 고순도의 원료 물질로 수득이 가능하며, 장기간 보관 시에도 높은 순도 및 결정형의 형태를 장기간 유지할 수 있다.
본 발명의 (-)-시벤졸린 숙신산염의 결정형 1 내지 3은 고체 C-NMR 피크, 결정 격자면 간격에서의 특정 회절 피크, 고체 결정형의 전자 또는 광학 현미경 사진 상의 형태, 고체 결정형의 전자 또는 광학 현미경 사진 상의 입자 크기, 브루나우어-에멧-텔러(BET) 비표면적(SSA), 역상 가스 크로마토그래피(IGC) 표면 에너지 또는 입도 분포(particle size distribution, D-value)와 같은 추가적인 물리적 성질 등을 통해 정의될 수 있다.
본 발명의 두번째 구현예는, 삼사정계(Triclinic) 결정이고, 결정형 공간 군(Space group)이 P1인 (-)-시벤졸린 숙신산염의 결정형을 제공하는 것이다.
본 발명의 구현예에 따르면, 상기 삼사정계(Triclinic) 결정은 하기 격자상수 파라미터를 가질 수 있다.
a = 7.87(6)Å
b = 8.00(9)Å
c = 9.36(12)Å
α = 96.71(5)°
β = 95.47(7)°
γ = 118.51(6)°
V = 507.06(10)Å3
Z = 1(1)
상기 삼사정계(Triclinic)란 결정학에서 3개의 벡터로 묘사되는 7 결정계 중의 하나이다. 삼사정계에서 3개의 벡터는 길이가 모두 다를 뿐만 아니라, 벡터가 이루는 각도 서로 다르며 직각이 아닌 결정을 의미한다.
상기 결정형 공간 군은 결정 구조의 대칭성을 수학적으로 기술한 것으로, P1은 단순 평행사변형 격자(Simple Parallelogram Lattices) 구조로서, 단순평행이동변환만 가지며, 회전, 반사, 미끄럼 반사 변환을 가지지 않는다. 공간 영역을 구성하는 두 평행이동변환은 서로 다른 길이를 가질 수 있으며, 사이각도 임의의 각을 이룰 수 있다.
(-)-시벤졸린 숙신산염의 결정형의 제조 공정
본 발명의 세번째 구현예는
a) 화학식 (IA)로 표시되는 (-)-시벤졸린 숙신산염을 극성 용매(polar solvent)에 녹이는 단계; 및
b) 단계 a)의 용액에 탄소수 6 이상의 탄화수소용매를 첨가하여, 시벤졸린 숙신산염 결정형 3을 석출하는 단계;
를 포함하는 (-)-시벤졸린 숙신산염 결정형의 제조 공정을 제공하는 것이다.
본 발명의 구현예에 따르면, 상기 (-)-시벤졸린 숙신산염 결정형 3은 무수물이며, 13.0°, 14.8°, 23.3°, 25.5° 및 26.1° (2θ±0.2°)에서의 XRPD 회절 피크에 더하여, 9.7°, 12.8°, 14.6°, 16.1°, 16.3°, 17.5°, 19.4°, 22.4°, 22.7°, 23.5° 및 25.4° (2θ±0.2°)로 이루어진 군에서 선택되는 1개 이상의 회절 피크를 더 포함하는 XRPD 패턴을 가질 수 있다.
본 발명의 구현예에 따르면, 상기 (-)-시벤졸린 숙신산염 결정형 3은 상기 표 3과 같이, 무수물이며, 9.68°, 12.84°, 13.00°, 14.57°, 14.81°, 16.14°, 16.29°, 17.47°, 19.38°, 21.19°, 21.41°, 22.38°, 22.50°, 22.68°, 23.29°, 23.50°, 25.42°, 25.53°, 25.80°, 26.11°, 26.26°, 27.80°, 28.00°, 28.53°, 29.27°, 31.38°, 34.38° 및 34.91° (2θ±0.2°)에서의 회절 피크를 포함하는 XRPD 패턴을 가질 수 있다.
본 발명의 구현예에 따르면, 상기 (-)-시벤졸린 숙신산염 결정형 3은 무수물이며, 시차주사열량(DSC)의 그래프는 10℃/min의 승온속도에서 약 190 내지 193℃의 온도에서의 흡열 피크를 가질 수 있고, 일반적으로, 용융점 및 흡열 전이 온도의 측정은 ±2℃ 또는 일반적으로 ±1℃의 허용 오차 내에 있는 값을 제공한다.
본 발명의 구현예에 따르면, 상기 (-)-시벤졸린 숙신산염 결정형 3은 도 4와 같이, 삼사정계(Triclinic) 결정이고, 결정형 공간 군(Space group) P1일 수 있다.
본 발명의 구현예에 따르면, 상기 (-)-시벤졸린 숙신산염 결정형 3은 삼사정계(Triclinic) 결정이고, 하기 격자상수 파라미터를 가질 수 있다.
a = 7.87(6)Å
b = 8.00(9)Å
c = 9.36(12)Å
α = 96.71(5)°
β = 95.47(7)°
γ = 118.51(6)°
V = 507.06(10)Å3
Z = 1(1)
본 발명의 구현예에 따르면, 상기 (-)-시벤졸린 숙신산염 결정형 3의 제조 공정은 추가적으로, 분리 또는 건조 공정을 포함할 수 있다.
본 발명의 구현예에 따르면, 상기 분리 공정은 여과 또는 원심분리 등을 사용하여 분리할 수 있다.
본 발명의 구현예에 따르면, 상기 건조 공정은 건조기(tray dryer), 진공 오븐(vacuum oven), 유동층 건조기(fluidized bed dryer) 및 스핀 플래쉬 건조기(spin flash dryer)를 사용하여 건조될 수 있다.
본 발명의 구현예에 따르면, 상기 (-)-시벤졸린 숙신산염 결정형 3의 제조 공정은 추가적으로, 냉각 공정을 포함할 수 있다.
본 발명의 구현예에 따르면, 상기 냉각은 상온 약 20 내지 30℃에서 1주 또는 2주간 진행하는 것일 수 있으며 또는 5℃에서 짧게는 몇 분에서, 길게는 평형을 위해 2주간 진행하는 것일 수 있다.
본 발명의 구현예에 따르면, 상기 단계 a)는 화학식 (IA)로 표시되는 (-)-시벤졸린 숙신산염을 용매에 첨가한 뒤 가열하여 용해시키는 공정으로, 본 공정에서 사용할 수 있는 용매로서는 물, 알코올계 용매, 알데하이드계 용매, 에스테르계 용매, 아미드계 용매 및 이의 혼합물 등이 사용될 수 있으나, 이에 한정되는 것은 아니다.
본 발명의 구현예에 따르면, 상기 알코올 용매는 직쇄 또는 분지쇄의 C1 내지 C5의 알코올일 수 있으며, 예를 들어 메탄올, 에탄올, 직쇄 또는 분지쇄의 프로판올, 직쇄 또는 분지쇄의 부탄올, 직쇄 또는 분지쇄의 펜탄올, 또는 이들의 혼합물일 수 있고, 구체적으로는 메탄올, 에탄올, 직쇄 또는 분지쇄의 프로판올, 또는 이들의 혼합물일 수 있으며, 더 구체적으로는 메탄올, 직쇄 또는 분지쇄의 프로판올, 또는 이들의 혼합물일 수 있다.
본 발명의 구현예에 따르면, 상기 단계 a) 는 20 내지 80℃에서 수행될 수 있으며, 반응 시간은 짧게는 몇 분에서, 길게는 평형을 위해 2주일 이상 반응할 수 있다.
본 발명의 구현예에 따르면, 상기 단계 b)에서 탄소수 6 이상의 탄화수소용매를 첨가하는 것은 (-)-시벤졸린 숙신산염의 용해도가 낮은 탄소수 6 이상의 탄화수소용매를 용해 공정의 용매의 양의 25 내지 400%까지 첨가하여 침전을 형성하는 것일 수 있다.
본 발명의 구현예에 따르면, 상기 단계 b)의 탄소수 6 이상의 탄화수소용매는 시클로헥산, 시클로헥탄, n-헥산, n-헵탄 또는 이들의 혼합물일 수 있다.
(-)-시벤졸린 숙신산염의 결정형을 포함하는 약학적 조성물
본 발명의 세 번째 구현예는 약학적으로 허용 가능한 담체, 희석제 또는 부형제와 함께 유효 성분으로서 상기 (-)-시벤졸린 숙신산염의 결정형을 유효한 양으로 포함하는 약학적 조성물을 제공한다.
상기 조성물은 통상의 기술자에 의해서 공지된 통상의 제제화 방법에 따라, 산제, 과립제, 정제, 캅셀제, 현탁액, 에멀젼, 시럽, 에어로졸, 연고, 크림, 좌제, 점안제(Eye drop) 및 주사제로 이루어진 군에서 선택된 제형 형태로 제형화될 수 있다.
상기 조성물은 심장병, 부정맥 심장 질환 및 심부전증으로 이루어진 군에서 선택된 적어도 하나의 질환에 대하여 예방 또는 치료 효과를 나타낼 수 있다.
본 발명의 구현예에 따르면, 상기 약학적 조성물은 당해 발명이 속하는 기술분야에서 통상의 지식을 가진 자가 용이하게 실시할 수 있는 방법에 따라, 약제학적으로 허용 가능한 담체를 이용하여 제제화하여 단위 용량 형태로 제조되거나 다용량 용기에 내입시켜 제조될 수 있다.
본 발명의 구현예에 따르면, 상기 약학적 조성물에 포함되는 첨가제의 함량은 특별히 제한되는 것은 아니며 통상의 제제화에 사용되는 범위 내에서 적절하게 조절될 수 있다.
본 발명의 구현예에 따르면, 상기 약학적 조성물은 다양한 경로, 예를 들면, 경구 투여 또는 비경구 투여를 통해 유효한 양으로 환자에게 투여될 수 있다. 바람직하게, 본 발명의 조성물은 캡슐, 정제, 분산액 및 현탁액과 같은 경구 투여용 형태로 제조될 수 있다.
본 발명의 구현예에 따른 약학적 조성물의 바람직한 투여량 및 투여주기는 환자의 체중, 연령, 성별, 건강상태, 식이, 투여시간, 투여방법, 투여기간 또는 간격, 배설율, 체질 특이성, 제제의 성질, 질환의 중증도 등에 따라 달라질 수 있으며, 통상의 기술자에 의해 적절하게 선택될 수 있다.
본 발명에 따른 (-)-시벤졸린 숙신산염의 결정형은 흡습성이 낮고, 가속조건 및 장기보관 조건에 따른 안정성이 우수하며, 장기간 함량의 변화없이 안정적으로 유지될 수 있다. 따라서 상기 본 발명의 (-)-시벤졸린 숙신산염의 결정형은 고순도의 원료 물질로 수득이 가능하며, 장기간 보관 시에도 높은 순도 및 결정형의 형태를 장기간 유지할 수 있다.
도 1은 실시예 1에 따라 제조되는 (-)-시벤졸린 숙신산염의 무정형의 분말 X-선 회절분광도(XRPD) 패턴을 보여주는 도이다.
도 2는 실시예 2 내지 4에 따라 제조되는 (-)-시벤졸린 숙신산염의 결정형 1 내지 3의 분말 X-선 회절분광도(XRPD) 패턴을 보여주는 도이다.
도 3은 실시예 4에 따라 제조되는 (-)-시벤졸린 숙신산염의 결정형 3의 단결정의 고분해능 X-선 회절분광도(XRPD) 패턴을 보여주는 도이다.
도 4는 (-)-시벤졸린 숙신산염의 결정형 3의 광학현미경 상의 입자 모양 및 격자 구조 모식도를 나타낸 도이다.
도 5는 (-)-시벤졸린 숙신산염의 결정형 3의 동적 증기 수착/탈착(Dynamic vapor sorption, DVS) 분석 결과를 나타낸 도이다.
도 2는 실시예 2 내지 4에 따라 제조되는 (-)-시벤졸린 숙신산염의 결정형 1 내지 3의 분말 X-선 회절분광도(XRPD) 패턴을 보여주는 도이다.
도 3은 실시예 4에 따라 제조되는 (-)-시벤졸린 숙신산염의 결정형 3의 단결정의 고분해능 X-선 회절분광도(XRPD) 패턴을 보여주는 도이다.
도 4는 (-)-시벤졸린 숙신산염의 결정형 3의 광학현미경 상의 입자 모양 및 격자 구조 모식도를 나타낸 도이다.
도 5는 (-)-시벤졸린 숙신산염의 결정형 3의 동적 증기 수착/탈착(Dynamic vapor sorption, DVS) 분석 결과를 나타낸 도이다.
본 발명의 공정 세부 사항은 하기 실시예에서 제시되나, 이는 단지 예시의 방식으로 제공되는 것이므로 본 발명의 내용이 실시예에 의해 한정되는 것은 아니다.
<기기 분석 및 측정 조건>
1. 키랄 순도(HPLC) 분석
제조된 화합물의 광학 순도 (e.e)는 고성능 액상 크로마토그래피(HPLC)로 측정하였으며, 측정 조건은 하기 표 4와 같다.
| HPLC 조건 | |
| Column | 키랄pak IC, 250 X 4.6mm, 5μm, column 온도: 35℃ |
| 이동상 | 80:10:10:0.1 (v/v/v/v)의 비율의n-헥산, 이소프로필 알코올, 에탄올 및 다이에틸 아민의 혼합물 |
| 유속 | 0.8mL/min. |
| 검출이기 | 220nm. |
| 기기 세부사항 | System 제조사: Shimadzu. LC-2030C, i-services. |
2.
1
H-NMR 및
13
C-NMR 분석
Bruker advance-III FT-NMR를 사용하여 (-)-시벤졸린 숙신산염의 핵자기 공명 스펙트럼을 얻었으며, 1H-NMR은 400MHz(DMSO-D6)에서, 그리고 13C-NMR은 400MHz(CD3OD)에서 측정되었다.
3. IR(적외선 분광학) 분석
PerkinElmer spectrum FT-IR spectrophotometer를 사용하여 (-)-시벤졸린 숙신산염의 IR 분석을 수행하였으며, IR 스펙트럼은 KBr disc를 사용하여 기록되었다.
4. 질량 스펙트럼(Mass spectral) 분석
Electro Spray Ionization(ESI)가 장착된 Agilent LCQ Fleet Thermo-ion trap mass spectrometer를 사용하여 (-)-시벤졸린 숙신산염의 질량 스펙트럼 분석을 수행하였다.
5. 자외선-가시광선 분광학(UV-Visible spectroscopy) 분석
Perkin-Elmer(model Lambda 25)의 자외선-가시광선 분광학 분석기를 사용하여 (-)-시벤졸린 숙신산염의 자외선-가시광선 분광학 분석을 수행하였다. 메탄올을 용매로 (-)-시벤졸린 숙신산염을 용해시켜 10μg/ml의 용액을 제조하고 200부터 400nm까지 스캔하여 분석을 수행하였다.
6. 비선광도(Specific Optical Rotation) 분석
1.401g/100ml(메탄올)농도의 (-)-시벤졸린 숙신산염 용액에 대하여 상온에서 Agilent Autopol V, Serial #81225로 비선광도 분석을 수행하였다.
7. 단결정 XRD (Single crystal X-ray diffraction) 분석
결정형 3의 단결정 XRD는 하기의 조건 및 모델링 방법으로 분석하였다.
- 제조사: Bruker, USA
- 모델명: Nonius Kappa-CCD
- 측정 온도: 296K
- 완전 구형 정보 측정: θ = 32.6° 지점 측정 반사광 측정
- 단결정 구조 규명 모델링 방법
1) Data reduction: HKL Scalepack (Otwinowski & Minor 1997)
2) Cell parameter: Denzo and Scalepak (Otwinowski & Minor, 1997)
3) Structure soving method: SHELXT-2014/7 (Sheldrick, G. M., 2015a)
4) Square full matrix refinement: SHELXL-2014/7 (Sheldrick, G. M., 2015b)
8. 고성능 XRD (High Throughput X-ray diffraction) 분석
결정형의 고성능 XRD는 하기의 조건으로 분석하였다.
- 제조사: Bruker, USA
- 모델명: General Area Detector Diffraction System (GADDS)
- 측정 온도: 25℃(RT)
- 2θ 측정 범위: 1.5 내지 41.5°
- 노출 시간: 90초
- 기타 사항: VÅNTEC-500 gas area detector(Bruker, USA)로 강도 및 기하학적 변수 측정
9. 고분해능 XRD (High Resolution X-ray diffraction) 분석
결정형의 고분해능 XRD는 하기의 조건 및 모델링 방법으로 분석하였다.
- 제조사: Bruker, USA
- 모델명: D8 Advance diffractometer
- 측정 방사능: Cu Kα1 radiation(1.54056Å)
- 측정 온도: 25℃(RT)
- 2θ 측정 범위: 2 내지 41.5°
- 검출기: LynxEye detector(Bruker, USA)
- 검출 속도: 5sec/step (1step = 0.016°)
- 샘플 측정: 8mm long glass capillary with 0.5mm outer diameter
- 노출 시간: 90초
10. 열중량 질량 (Thermogravimetric analysis coupled with mass spectroscopy, TGMS) 분석
결정형의 열중량 질량은 하기의 조건으로 분석하였다.
- 제조사: Mettler-Toledo GmbH, Switzerland
- 모델명: TGA/DSC 3+ STARe system
- 온도 범위: 25 내지 300℃
- 승온 속도: 10℃/min
- 질량분석기: mass spectrometer Omnistar GSD 301 T2 (Pfeiffer Vacuum GmbH, Germany)
11. 시차주사열량기(Differential scanning calorimetry, DSC) 분석
결정형의 열량 분석은 시차주사열량기(DSC) 로 측정하였으며, 측정 조건은 아래와 같다.
- 제조사: Metter Toredo GmbH, Switzerland
- 모델명: heat flux DSC3+ STARe system
- 승온속도: 10℃/min
- 온도 범위: 25 내지 300℃
- N2 속도: 50 ml/min.
12. 칼 피셔 적정법(Karl Fischer titration) 분석
결정형의 수화물 및 수분 함량은 칼 피셔 적정법으로 측정하였으며, 측정 조건은 아래와 같다.
- 제조사: SI Analytics, Germany
- 모델명: Titroline 7500 KF trace titrator
- 용매: 메탄올
13. 편광현미경(Polarized light microscopy) 분석
결정형의 모양은 편광현미경으로 측정하였으며, 측정 조건은 아래와 같다.
- 제조사: Leica Microsystems GmbH, Germany
- 모델명: Leica DM 2500M optical microscope
14. 질량분석기가 결합된 초고성능 액체 크로마토그래피(ultra-performance liquid chromatography-mass spectrometer, UPLC-MS) 분석
결정형의 질량은 질량분석기가 결합된 초고성능 액체 크로마토그래피로 측정하였으며, 측정 조건은 아래와 같다.
- 제조사: Agilent, USA
- 모델명: Agilent 1290
- 검출기 1: UV detector set at 224 nm
- 검출기 2: MSD XT in Positive Scan Mode
- 측정 온도: 25℃(RT)
- 컬럼: Agilent Eclipse Plus C18 HD (50 x 2.1mm; 1.8μm)
- 컬럼 온도: 35℃
- Flow cell: 10 mm path
- Gradient: Mobile phase A: 10 mM Ammonium acetate / Mobile phase B: Acetonitrile
- Flow: 0.8ml/min
- 시료 농도: 0.8mg/ml
- 용매: Water: Acetonitrile (50:50 v/v)
- 주입량: 1μl
- Retention time: 1.54min
15. 입자 크기 분포(Particle Size Distribution, PSD 분석
결정형의 입자 크기는 레이저 회절 입자 분석기(Laser Diffraction Particle Size Analyzer)로 측정하였으며, 측정 조건은 아래와 같다.
- 제조사: Malvern Instruments Limited, UK
- 모델명: Mastersizer 2000
- 시료 채취기(Sampler): Hydro 2000 G/S
기기 조건:
- 입자 굴절률(Particle Reflection Index (RI)): 1.52
- 분산제: Heptane
- 흡수도: 0.1
- 분산제의 굴절률: 1.39
- 분석 모델: General purpose
- 민감도: Enhanced
- 흡광 한계: 10-15%
- 측정 시간: 30초(시료당 3회 반복)
- 교반 속도: 3500 RPM
시료 준비:
약 150 mg의 CT-G20을 50 mL 비커에서 20 mL의 0.2% Span 85 포함된 헵텐(heptane) 첨가하여 용해한다. 약 10초간 초음파 처리를 하고 시료 채취기에 넣어 흡광 한계가 10-15%일 때 측정한다.
16. 동적 증기 수착/탈착(Dynamic vapor sorption, DVS) 분석
동적 증기 수착/탈착은 증기 수착 분석기(Vapor Sorption Analyzer)를 이용하여 측정하였으며, 측정 조건은 아래와 같다.
- 제조사: Surface Measurement Systems Ltd, UK
- 모델명: DVS Adventure-I system
- 수득된 고체의 결정형 분석: HT-XRPD
상대 습도 순환:
상대 습도는 40%에서 95% (흡착), 95% ~ 0% (탈착) 및 다시 40% (흡착 2)에서로 순환되었으며, 각 단계별로, 25℃의 일정한 온도에서 10%로 변화되었다. 중량 평형은 0.002%/min의 dm/dt로 설정되었다.
<제조예>
제조예 1 (-)-시벤졸린 숙신산염의 제조
제조예 1-1 (±)-시벤졸린 유리 염기의 제조
50g의 (±)-시벤졸<제조예>
제조예 1 (-)-시벤졸린 숙신산염의 제조
제조예 1-1 (±)-시벤졸린 유리 염기의 제조
50g의 (±)-시벤졸린 숙신산염의 현탁액을 200ml의 물에서 교반하고, 25 내지 30℃의 온도에서 30분 동안 10% 수산화나트륨 용액으로 pH 10.5 내지 10.8로 염기성화한 후, 에틸 아세테이트 400ml로 추출하였다. 상기 수득된 유기층을 무수황산나트륨으로 건조하고, 45℃ 이하에서 감압(400-20 mmHg)하에 농축하여 백색의 고체 형태의 (±)-시벤졸린 유리 염기 30g을 수득하였다.
[키랄 HPLC에 의해 측정된 키랄 순도: (-)-시벤졸린 48.76% 및 (+)-시벤졸린 51.24%의 혼합물]
제조예 1-2. (-)-시벤졸린-D-타르타르산염의 제조
제조예 1-1에 따라 제조된 (±)-시벤졸린 유리 염기 15g을 250ml의 아세토나이트릴에 용해시킨 후 25 내지 30℃의 온도에서 15분 동안 교반하고, 30ml의 물에 용해된 D-(-)-타르타르산(1.0 m.eq.) 용액을 25 내지 30℃의 온도에서 20분 동안 첨가하여 혼합물을 수득하였다. 30분 동안 상기 혼합물을 교반한 후, 상기 혼합물에 메틸 삼차 부틸 에테르(MTBE) 250ml를 20분 동안 첨가하고, 2시간 30분 동안 상온에서 교반하여 혼합물을 제조하였다. 상기 혼합물을 50 내지 55℃의 온도로 가열하고, 1시간 동안 교반한 후, 25 내지 30℃로 냉각하고 1시간 동안 교반하였다. 상기 수득된 고체를 여과하고, 아세토나이트릴 23ml로 세척하여 키랄 HPLC로 측정한 결과 99.0%의 키랄 순도를 갖는 (-)-시벤졸린-D-타르타르산 염 6.4g을 수득하였다(수율: 41(w/w)%).
1H-NMR (400 MHz, CD3OD): 7.38(m, 6H); 7.29(m, 3H); 7.20(m, 1H); 4.40(s, 2H); 3.71(m, 2H); 3.52(m, 2H); 2.83(t, 1H); 2.34(t, 1H); 1.90(t, 1H) ppm.
13C-NMR (100 MHz, CD3OD): 177.01, 170.68, 144.71, 139.88, 130.73, 129.82, 129.72, 128.90, 128.77, 128.19, 74.21, 45.52, 42.54, 23.02, 20.11.
IR (cm-1): 1731.23, 3531.63.
제조예 1-3. (-)-시벤졸린 유리 염기의 제조
제조예 1-2에 따라 제조된 (-)-시벤졸린-D-타르타르산 염 5g을 25ml의 물에 첨가하고, 25 내지 30℃의 온도에서 포화 중탄산 나트륨(sodium bicarbonate) 용액 50ml로 염기성화한 후, 다이클로로메탄 200ml로 추출하였다. 추출된 다이클로로메탄 층을 무수 황산나트륨으로 건조하고, 40℃ 이하에서 감압(500-20 mmHg)하에서 증류하여 [α]D -153.82 및 키랄 HPLC 측정결과 99.09%의 키랄 순도를 갖는 반고체 형태의 (-)-시벤졸린 유리 염기 3.0g을 수득하였다.
제조예 1-4. (-)-시벤졸린 숙신산염의 제조
제조예 1-3에 따라 제조된 (-)-시벤졸린 염기 2.5g을 25ml의 이소프로판올에 용해시킨 후, 50 내지 55℃의 온도에서 교반하고, 12.5ml의 메탄올에 용해된 숙신산(1.0m.eq.) 용액을 10분 동안 첨가하고, 25 내지 30℃의 온도에서 30분 동안 교반 후 1시간 30분 동안 0 내지 5℃의 온도에서 냉각하였다. 제조된 백색 고체를 여과하고, 이소프로판올 3.75ml로 세척한 후, 진공 조건에서 40 내지 45℃의 온도로 건조시켜 키랄 HPLC 측정결과 99.9%의 키랄 순도를 갖는 순수한 (-)-시벤졸린 숙신산염 3.2g을 수득하였다(도 4).
1H-NMR (400 MHz, CD3OD): 7.38(m, 6H); 7.29(m, 3H); 7.21(m, 1H); 3.71(m, 2H); 3.53(m, 2H); 2.82(m, 1H); 2.50(s, 4H); 2.36(t, 1H); 1.91(m, 1H) ppm.
13C-NMR (100 MHz, CD3OD): 179.20, 170.55, 141.73, 139.83, 130.70, 129.78, 129.69, 128.84, 128.76, 128.16, 45.41, 42.41, 32.96, 23.00, 21.01 ppm.
IR spectrum: 1674.96cm-1 (Acid C=O stretching vibration), 2954.43 cm-1(Sp3 stretching vibration).
MW(g/mol): 380.44
m/z of (-)-Cibenzoline: 263.35(theoretical), 263(observed)
UV absorption: 1.155 absorption at 202.5nm
Specific Optical Rotation: [α]D -124.47; Rotation -VE.
<실시예>
실시예 1. (-)-시벤졸린 숙신산염의 무정형의 제조
제조예 1에 따라 제조된 상기 (-)-시벤졸린 숙신산염 2,083.4mg을 t-BuOH / 증류수 (50/50 v/v%) 용매 30,000μL에 녹인 후 하루 동안 동결 건조(-73℃, 16시간)하여, (-)-시벤졸린 숙신산염의 무정형 물질을 제조하였다.
상기 수득한 무정형에 대하여 고성능 XRD 분석을 통해, 도 1과 같이 무정형임을 확인하였다.
실시예 2. (-)-시벤졸린 숙신산염의 결정형 1의 제조
실시예 1에 따라 제조된 상기 (-)-시벤졸린 숙신산염의 무정형 33mg을 증류수 350μL에 녹여 현탁액을 제조한 뒤, 실온 조건에서 2주 동안 보관하여 평형화시킨다. 이후 원심분리기로 액체상을 제거 뒤 상압건조하여 (-)-시벤졸린 숙신산염의 결정형 1을 제조하였다.
상기 수득한 결정형 1에 대하여 고성능 XRD 분석(HT-XRD)을 통해, 도 2와 같이 신규한 결정형임을 확인하였다. 상기 표 1과 같이 고분해능 XRD 분석(HR-XRD)을 통해 회절 피크를 확인하였다. 열중량질량 분석(TGMS)을 통해 수화물임을 확인하였으며, 칼-피셔 적정법 분석 (Karl Fischer titration n)을 통해 10.5%의 수분이 포함된 것을 확인하였다. 시차주사열량기(DSC) 분석 결과는 DSC 용융 흡열 전이 피크는 1차로 약 47.20℃에서 시작하여 약 47.94℃ 최대에 도달하여, 49.75℃에서 끝났으며, 이어서 약 58.81°C에 최대에 도달하여, 약 68.57℃에서 끝났으며, 이는 수화물에 대한 피크로 판단된다. 2차로, 약 189.71℃에서 시작하여 약 190.75℃ 최대에 도달하여, 192.28℃에서 끝났다.
실시예 3. (-)-시벤졸린 숙신산염의 결정형 2의 제조
실시예 1에 따라 제조된 상기 (-)-시벤졸린 숙신산염의 무정형 20mg을 모르폴린 (Morpholine) 200μL에 녹여 현탁액을 제조한 뒤, 하기와 같은 3차의 온도 변화를 가한 뒤 실온에서 3일간 보관한다.
1차: 실온에서 50℃까지 승온 속도 10℃/시간으로 승온한 뒤, 50℃에서 5℃까지 감온 속도 20℃/시간 감온한다.
2차: 5℃에서 50℃까지 승온 속도 10℃/시간으로 승온한 뒤, 50℃에서 5℃까지 감온 속도 10℃/시간 감온한다.
3차: 5℃에서 50℃까지 승온 속도 10℃/시간으로 승온 한뒤, 50℃에서 5℃까지 감온 속도 5℃/시간 감온한 뒤 5℃에서 실온까지 승온 속도 10℃/시간으로 승온한다.
이후 원심분리기로 액체상을 제거 뒤 진공건조 (5mbar)하여 (-)-시벤졸린 숙신산염의 결정형 2를 제조하였다.
상기 수득한 결정형 2에 대하여 고성능 XRD 분석(HT-XRD)을 통해, 도 2와 같이 신규한 결정형임을 확인하였으며, 상기 표 2와 같이 고분해능 XRD 분석(HR-XRD)을 통해 회절 피크를 확인하였다. 열중량질량 분석(TGMS)을 통해 수화물이고, 모르폴린(Morpholine) 용매가 있음을 확인하였다. 시차주사열량기(DSC) 분석 결과는 DSC 용융 흡열 전이 피크는 1차로 약 74.09℃에서 시작하여 약 109.76℃ 최대에 도달하여, 116.45℃에서 끝났으며, 2차로 약 120.42℃에서 시작하여 약 134.98℃ 최대에 도달하여, 145.93℃에서 끝났으며, 3차로, 약 184.90℃에서 시작하여 약 204.69℃ 최대에 도달하여, 265.85℃에서 끝났다.
실시예 4-1. (-)-시벤졸린 숙신산염의 결정형 3의 제조
제조예 1에 따라 제조된 상기 (-)-시벤졸린 숙신산염 25.2mg을 메탄올 400μL에 50℃ 환경에서 녹여 현탁액을 제조한 뒤, 반용매인 시클로헥산(cyclohexane) 20mL 첨가하여 약 1시간 교반하여 결정화를 진행한다. 침전물이 발생하면 원심분리기(Rotanta 46 RSC Centrifuge, Andreas Hettich GmbH & Co. KG, Germany)로 3,000RPM 약 5분간 액체상을 제거하고 상압건조 또는 고진공 건조(5 mbar, 18시간)를 진행하여 (-)-시벤졸린 숙신산염의 결정형 3을 제조하였다.
상기 수득한 결정형 3에 대하여 고성능 XRD 분석(HT-XRD)을 통해, 도 2와 같이 신규한 결정형임을 확인하였다. 상기 표 3 및 도 3과 같이 고분해능 XRD 분석 (HR-XRD)을 통해 회절 피크를 확인하였다. 열중량질량 분석(TGMS)을 통해 무수물이며, 잔류 용매가 없음을 확인하였다. 시차주사열량기(DSC) 분석 결과는 DSC 용융 흡열 전이 피크는 약 190.26℃에서 시작하여 약 190.86℃에서 최대에 도달하여, 192.70℃에서 끝났다.
결정형 3은 편광 현미경 분석 결과, 도 4와 같이 단결정이 확인되었으며, 단결정 XRD (Single crystal X-ray diffraction) 분석을 통해, 도 4와 같이 삼사정계(Triclinic) 결정이고, 결정형 공간 군(Space group) P1임을 확인하였다. 결정 자료 및 구조의 미세 파라미터는 하기 표 5와 같다.
| 결정 자료 및 구조의 미세 파라미터 | |
| 결정 치수 | 0.50 X 0.40 X 0.16(mm3) |
| 결정 시스템 | 삼사정계(Triclinic) |
| 공간 군 | P1 공간 군 |
| 격자 상수 | a = 7.8748(6)Åb = 7.9994(9)Å c = 9.3644(12)Å α = 96.714(5)° β = 95.469(7)° γ = 118.505(6)° V = 507.06(10)Å3 Z = 1(1) Dc(밀도-계산치) = 1.246(g/cm3) |
실시예 4-2. (-)-시벤졸린 숙신산염의 결정형 3의 제조(scale-up)
또한 제조예 1에 따라 제조된 상기 (-)-시벤졸린 숙신산염 2247.8mg을 메탄올 10mL에 녹여 현탁액을 제조한 뒤, 현탁액을 2mL씩 분획하였다. 분획된 현탁액에 반용매인 시클로헥산(cyclohexane) 20mL를 첨가한 뒤, 1시간 교반하여 결정화를 진행하여, 1g의 결정형 3 물질을 수득하였다.
실시예 5: 1-프로판올 용매와 노멀 헵탄 반용매를 이용한 결정형 3의 제조
제조예 1에 따라 제조된 상기 (-)-시벤졸린 숙신산염 21.8mg을 1-프로판올 2,500μL에 녹여 과포화 용액을 제조한 뒤 이를 1.8mL 용기에 담아 반용매인 노멀 헵탄(n-heptan) 2mL가 담긴 40mL 용기에 넣고 밀봉하여 2주 동안 실온에서 보관한다. 침전물이 발생하면 원심분리기로 액체상을 제거 뒤 상압건조하여 (-)-시벤졸린 숙신산염의 결정형을 제조하였다.
상기 수득한 결정형에 대하여 고성능 XRD 분석(HT-XRD)을 통해, 실시예 4의 결정형 3임을 확인하였다.
<실험예>
실험예 1. 가속조건 보관 안정성 시험
실시예 1 내지 4 따라 제조된 상기 (-)-시벤졸린 숙신산염의 결정형 및 무정형에 대하여 가속조건(AAC Accelerated ageing conditions (40℃/75% RH)) 48시간 보관 안정성 시험을 수행하였다. 실험 결과는 하기 표 6과 같다.
| 구분 | 가속 조건 보관 안정성 | |
| 무정형 | 실시예 1 | 불안정 - 다른 결정형 확인 |
| 결정형 1 | 실시예 2 | 불안정 - 다른 결정형 확인 |
| 결정형 2 | 실시예 3 | 불안정 - 다른 결정형 확인 |
| 결정형 3 | 실시예 4 | 안정 - 결정형 3만 존재 |
실시예 1 내지 4로 제조한 무정형 및 결정형 중 (-)-시벤졸린 숙신산염의 안정한 결정형은 실시예 4의 결정형 3임을 확인하였다.
실험예 2. 장기 저장 안정성(Long-Term Stability)
실시예 4에 따라 제조된 상기 (-)-시벤졸린 숙신산염의 결정형 3을 60℃ 조건에서 4주간 보관한 뒤, HT-XRPD, DSC, TGMS, UPLC로 분석하여 장기 보관 안정성을 확인하였다. 실험 결과는 표 7과 같다.
| 기본 참조 값 | 1주차 | 4주차 | |||
| 결정형 3 | 실시예 4 | DSC (℃) | 193.2 | 191.2 | 191.1 |
| TGA 질량손실율(%) | 0.6 | 0.2 | 0.6 | ||
| 화학적 순도(%) | 100 | 100 | 100 |
실시예 4에 따라 제조된 결정형 3은 장기 보관하였을 때도, 결정형 변이 및 화학적 순도의 변화가 없이 안정한 것을 확인하였다.
실험예 3. 입자 크기 분석
실시예 4에 따라 제조된 상기 (-)-시벤졸린 숙신산염의 결정형 3을 레이저 회절 입자 분석기로 측정하였다. 실험 결과는 표 8와 같다.
| D10(μm) | D50(μm) | D90(μm) | ||
| 결정형 3 | 실시예 4 | 8.80 | 30.44 | 60.72 |
| 참고예 | 제조예 1-4 | 17.10 | 127.82 | 307.56 |
실시예 4에 따라 제조된 결정형 3은 D50이 30.44로 USP 매우 미세 입자 기준인 125 (참조, 2019 USP 42 NF 37 Volume 4 physical tests <811> powder fineness)보다 작으므로, 입자 크기가 매우 미세함을 확인하였다. 더욱이 제조예 1-4에서 제조된 물질의 입자보다 현저히 작아 약물의 유효 표면적이 증가하여 약물 용해 속도가 빨라져 약물 흡수율 및 생체 이용률이 증가할 것임을 확인하였다.
실험예 4. 동적 증기 수착/탈착 분석
동적 증기 수착/탈착 데이터(수분 흡수 등온선, Water sorption isotherms)는 증기 수착 분석기로 측정하였다. 실험 결과는 도 5와 같다
도 5에서 나타난 바와 같이, 흡착 주기에서 수분 흡수율 0.3%까지 수분을 흡수하였으며, 80% 상대습도에서 0.2%의 수분 흡수율을 나타냈다. 탈착 주기에서 흡수된 0.3%의 수분을 모두 방출하였으며, 흡착 2에서는 수분 흡수량이 거의 없었다. DVS 이후 수득된 시료가 Form D로 유지되었음을 HT-XRPD 분석을 통해 확인하였다.
실시예 4에 따라 제조된 결정형 3은 실험 가역적인 수분 흡착 환경에서도 결정형 3을 유지하는 것을 확인하여, 수분 환경에도 안정하고, 80% 상대 습도에서 0.2%의 수분 흡수율을 보여 비흡수성(유럽 약전 비흡성 분류 참조, European Pharmacopeia 5.0, 5.11. CHARACTERS SECTION IN MONOGRAPHS, Hygroscopicity classification)으로 확인하였다.
Claims (14)
- 하기의 분말 X-선 회절분광도 패턴(XRPD)으로 이루어진 군으로부터 선택되는 어느 하나의 (-)-시벤졸린 숙신산염의 결정형:
i) 분말 X선 회절 스펙트럼에 있어서, 9.7°, 14.9°, 21.5°, 23.4° 및 24.1°(2θ±0.2°) 회절 피크 포함하는 결정형(이하, 「결정형 1」이라고 함);
ii) 분말 X선 회절 스펙트럼에 있어서, 20.6°, 21.1°, 22.9 °, 25.2° 및 37.4° (2θ±0.2°) 회절 피크 포함하는 결정형(이하, 「결정형 2」이라고 함); 및
iii) 분말 X선 회절 스펙트럼에 있어서, 13.0°, 14.8°, 23.3°, 25.5° 및 26.1° (2θ±0.2°) 회절 피크 포함하는 결정형(이하, 「결정형 3」이라고 함). - 제1항에 있어서,
13.0°, 14.8°, 23.3°, 25.5° 및 26.1° (2θ±0.2°)에서의 회절 피크를 포함하는 XRPD 패턴을 가지는 무수물의 (-)-시벤졸린 숙신산염의 결정형. - 제2항에 있어서,
9.7°, 12.8°, 14.6°, 16.1°, 16.3°, 17.5°, 19.4°, 22.4°, 22.7°, 23.5° 및 25.4° (2θ±0.2°)로 이루어진 군에서 선택되는 1개 이상의 회절 피크를 추가로 포함하는 XRPD 패턴을 가지는 무수물의 (-)-시벤졸린 숙신산염의 결정형. - 제1항에 있어서,
승온속도가 10℃/min인 경우 190 내지 193℃ 온도에서 시차주사열량(DSC) 흡열 피크를 갖는 (-)-시벤졸린 숙신산염의 결정형. - 제1항에 있어서,
입자의 50%[D50]가 10 ㎛ 내지 50 ㎛ 의 입자 크기를 갖는 것을 특징으로 하는 결정형. - 제1항에 있어서,
하기의 동적 증기 수착/탈착(DVS) 패턴을 특징으로 하는 결정형:
i) 흡착 주기에서 0.3%의 수분을 흡착;
ii) 80% 상대 습도에서 0.2% 수분을 흡착; 및
iii) 탈착 주기에서 흡수된 0.3%의 수분을 모두 방출. - 삼사정계(Triclinic) 결정이고, 결정형 공간 군(Space group)이 P1인 (-)-시벤졸린 숙신산염의 결정형.
- 제7항에 있어서,
상기 삼사정계(Triclinic) 결정은 하기 격자상수 파라미터를 가지는 것인 (-)-시벤졸린 숙신산염의 결정형.
a = 7.87(6)Å
b = 8.00(9)Å
c = 9.36(12)Å
α = 96.71(5)°
β = 95.47(7)°
γ = 118.51(6)°
V = 507.06(10)Å3
Z = 1(1) - 제9항에 있어서,
단계 a) 의 극성 용매(polar solvent)는 물, 알코올계 용매, 알데하이드계 용매, 에스테르계 용매, 아미드계 용매 및 이의 혼합물인 (-)-시벤졸린 숙신산염 결정형 3의 제조 공정. - 제10항에 있어서,
상기 알코올계 용매는 메탄올, 에탄올, 직쇄 또는 분지쇄의 프로판올, 직쇄 또는 분지쇄의 부탄올, 직쇄 또는 분지쇄의 펜탄올, 또는 이들의 혼합물인 (-)-시벤졸린 숙신산염 결정형 3의 제조 공정. - 제9항에 있어서,
단계 b)의 탄소수 6 이상의 탄화수소용매는 시클로헥산, 시클로헥탄, n-헥산, n-헵탄 또는 이들의 혼합물인 (-)-시벤졸린 숙신산염 결정형 3의 제조 공정. - 제1항 내지 제8항의 어느 한 항의 (-)-시벤졸린 숙신산염의 결정형 및 약학적으로 허용 가능한 담체, 희석제 또는 부형제를 포함하는 약학적 조성물.
- 제13항에 있어서,
상기 조성물은 경구 투여용 캡슐 또는 정제의 형태인 약학적 조성물.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR20200037527 | 2020-03-27 | ||
| KR1020200037527 | 2020-03-27 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20210122140A true KR20210122140A (ko) | 2021-10-08 |
Family
ID=77892078
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020210039212A KR20210122140A (ko) | 2020-03-27 | 2021-03-26 | (-)-시벤졸린 숙신산염의 결정다형 |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US20230088511A1 (ko) |
| KR (1) | KR20210122140A (ko) |
| CN (1) | CN115003657A (ko) |
| WO (1) | WO2021194291A1 (ko) |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010132561A (ja) * | 2008-12-02 | 2010-06-17 | Dnp Fine Chemicals Fukushima Co Ltd | コハク酸シベンゾリンの新規a型結晶及びその製造方法 |
| CN102617383A (zh) * | 2012-03-20 | 2012-08-01 | 横店集团家园化工有限公司 | 索法地尔晶型、制备方法及包含索法地尔晶体的无菌粉末 |
| US20170204067A1 (en) * | 2016-01-14 | 2017-07-20 | Scinopharm Taiwan, Ltd. | Crystalline forms of olaparib and manufacturing processes therefor |
-
2021
- 2021-03-26 WO PCT/KR2021/003747 patent/WO2021194291A1/ko active Application Filing
- 2021-03-26 CN CN202180010840.4A patent/CN115003657A/zh active Pending
- 2021-03-26 KR KR1020210039212A patent/KR20210122140A/ko unknown
- 2021-03-26 US US17/798,406 patent/US20230088511A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| US20230088511A1 (en) | 2023-03-23 |
| CN115003657A (zh) | 2022-09-02 |
| WO2021194291A1 (ko) | 2021-09-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10654854B2 (en) | Salts and crystals of ITI-007 | |
| US11014925B2 (en) | Co-crystals of 1-(4-fluoro-phenyl)-4-((6bR,1OaS)-3-methyl-2,3,6b,9,10,10a-hexahydro-1H,7H- pyrido[3′,4′:4,51_pyrrolo [1,2,3-delqcuinoxalin-8-yl)-butan-1-one with nicotinamide or isonicotinamide | |
| US20180155291A1 (en) | New crystal form of lenvatinib methanesulfonate salt and preparation method thereof | |
| AU2020382214B2 (en) | Novel salt of terphenyl compound | |
| AU2014286047B2 (en) | Crystalline forms of ponatinib hydrochloride | |
| BR112013013179B1 (pt) | Polimorfo quimicamente puro de nor-udca, seu uso e seu método de preparação, e composição farmacêutica | |
| JP2020500912A (ja) | ブロモドメインタンパク質阻害薬の結晶形及びその製造方法並びに用途 | |
| KR20200036755A (ko) | (-)-시벤졸린 숙신산염의 신규한 제조 공정 | |
| WO2013150544A2 (en) | Ivabradine hydrochloride solid dispersion | |
| KR20210122140A (ko) | (-)-시벤졸린 숙신산염의 결정다형 | |
| EP4132909B1 (en) | Organic acid addition salts of s-pindolol | |
| EP3473623B1 (en) | Crystal forms of nbi-98854, preparation method therefor and use thereof | |
| EP2751094B1 (en) | Novel crystal form | |
| CN108137626B (zh) | Fosnetupitant的晶型 | |
| US11440911B2 (en) | Salts and crystals | |
| CN114380833B (zh) | 一种酮咯酸与4-吡啶甲酰胺共晶及其制备方法 | |
| CN113929630B (zh) | 一种吉非替尼药物共晶体 | |
| EP3368506B1 (en) | Process for the preparation of enclomiphene citrate having needle shaped crystal habit. | |
| CN113461662A (zh) | 羟哌吡酮可药用盐的新晶型及其制备方法 | |
| CN114040908A (zh) | 一种凝血因子XIa抑制剂的晶型及其制备方法 |