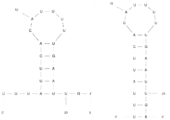
KR20200068647A - 트랜스페린 수용체 (TfR)에 대한 RNA 앱타머 - Google Patents
트랜스페린 수용체 (TfR)에 대한 RNA 앱타머 Download PDFInfo
- Publication number
- KR20200068647A KR20200068647A KR1020207006810A KR20207006810A KR20200068647A KR 20200068647 A KR20200068647 A KR 20200068647A KR 1020207006810 A KR1020207006810 A KR 1020207006810A KR 20207006810 A KR20207006810 A KR 20207006810A KR 20200068647 A KR20200068647 A KR 20200068647A
- Authority
- KR
- South Korea
- Prior art keywords
- nucleotides
- acid compound
- ribonucleic acid
- moiety
- cell
- Prior art date
Links
- 108010033576 Transferrin Receptors Proteins 0.000 title claims description 170
- 102000007238 Transferrin Receptors Human genes 0.000 title claims description 12
- 108091008103 RNA aptamers Proteins 0.000 title description 5
- 239000002773 nucleotide Substances 0.000 claims abstract description 359
- 125000003729 nucleotide group Chemical group 0.000 claims abstract description 357
- 150000001875 compounds Chemical class 0.000 claims abstract description 243
- 108091028043 Nucleic acid sequence Proteins 0.000 claims abstract description 203
- 229920002477 rna polymer Polymers 0.000 claims abstract description 106
- 210000004027 cell Anatomy 0.000 claims description 262
- 150000007523 nucleic acids Chemical group 0.000 claims description 145
- 238000000034 method Methods 0.000 claims description 114
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 95
- 230000001225 therapeutic effect Effects 0.000 claims description 84
- 239000000203 mixture Substances 0.000 claims description 76
- 206010028980 Neoplasm Diseases 0.000 claims description 70
- 201000010099 disease Diseases 0.000 claims description 66
- 201000011510 cancer Diseases 0.000 claims description 39
- 238000003384 imaging method Methods 0.000 claims description 39
- 238000011282 treatment Methods 0.000 claims description 37
- 230000000692 anti-sense effect Effects 0.000 claims description 32
- 208000035475 disorder Diseases 0.000 claims description 29
- 239000003814 drug Substances 0.000 claims description 29
- 239000002246 antineoplastic agent Substances 0.000 claims description 25
- 108010041191 Sirtuin 1 Proteins 0.000 claims description 24
- 108020004999 messenger RNA Proteins 0.000 claims description 24
- 239000012216 imaging agent Substances 0.000 claims description 23
- 239000008194 pharmaceutical composition Substances 0.000 claims description 23
- 108020004459 Small interfering RNA Proteins 0.000 claims description 22
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 20
- 230000008499 blood brain barrier function Effects 0.000 claims description 18
- 210000001218 blood-brain barrier Anatomy 0.000 claims description 18
- 108091070501 miRNA Proteins 0.000 claims description 18
- 239000002679 microRNA Substances 0.000 claims description 18
- 230000002265 prevention Effects 0.000 claims description 15
- 208000030159 metabolic disease Diseases 0.000 claims description 13
- 229940124597 therapeutic agent Drugs 0.000 claims description 12
- 239000002105 nanoparticle Substances 0.000 claims description 10
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 9
- 208000012902 Nervous system disease Diseases 0.000 claims description 8
- 229910052751 metal Inorganic materials 0.000 claims description 8
- 102100034808 CCAAT/enhancer-binding protein alpha Human genes 0.000 claims description 7
- 238000012546 transfer Methods 0.000 claims description 6
- 238000004519 manufacturing process Methods 0.000 claims description 5
- 229940126586 small molecule drug Drugs 0.000 claims description 5
- 239000002923 metal particle Substances 0.000 claims description 3
- 102000000344 Sirtuin 1 Human genes 0.000 claims description 2
- 108091029810 SaRNA Proteins 0.000 claims 4
- 229940078677 sarna Drugs 0.000 claims 4
- 101710168309 CCAAT/enhancer-binding protein alpha Proteins 0.000 claims 1
- 239000012581 transferrin Substances 0.000 abstract description 6
- 102000004338 Transferrin Human genes 0.000 abstract description 5
- 108090000901 Transferrin Proteins 0.000 abstract description 5
- 102000039446 nucleic acids Human genes 0.000 description 242
- 108020004707 nucleic acids Proteins 0.000 description 242
- -1 nucleic acid compounds Chemical class 0.000 description 172
- 102100026144 Transferrin receptor protein 1 Human genes 0.000 description 158
- 108090000623 proteins and genes Proteins 0.000 description 121
- 235000018102 proteins Nutrition 0.000 description 80
- 102000004169 proteins and genes Human genes 0.000 description 80
- 201000009030 Carcinoma Diseases 0.000 description 71
- 108091023037 Aptamer Proteins 0.000 description 50
- 241000700159 Rattus Species 0.000 description 46
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 39
- 235000001014 amino acid Nutrition 0.000 description 39
- 229940024606 amino acid Drugs 0.000 description 39
- 150000001413 amino acids Chemical class 0.000 description 39
- 230000000694 effects Effects 0.000 description 38
- 208000032839 leukemia Diseases 0.000 description 35
- 108020004414 DNA Proteins 0.000 description 28
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 28
- 239000000126 substance Substances 0.000 description 28
- 230000014509 gene expression Effects 0.000 description 27
- 206010039491 Sarcoma Diseases 0.000 description 26
- 239000000523 sample Substances 0.000 description 24
- 208000024891 symptom Diseases 0.000 description 22
- 102100031455 NAD-dependent protein deacetylase sirtuin-1 Human genes 0.000 description 21
- 201000001441 melanoma Diseases 0.000 description 21
- 102000053602 DNA Human genes 0.000 description 18
- 239000003112 inhibitor Substances 0.000 description 18
- 210000004185 liver Anatomy 0.000 description 18
- 210000004556 brain Anatomy 0.000 description 17
- 230000004048 modification Effects 0.000 description 17
- 238000012986 modification Methods 0.000 description 17
- 210000004369 blood Anatomy 0.000 description 16
- 239000008280 blood Substances 0.000 description 16
- 206010060862 Prostate cancer Diseases 0.000 description 15
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 15
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 14
- 241001465754 Metazoa Species 0.000 description 14
- 230000000295 complement effect Effects 0.000 description 14
- 241000699670 Mus sp. Species 0.000 description 13
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 13
- 230000004913 activation Effects 0.000 description 13
- 235000012000 cholesterol Nutrition 0.000 description 13
- 208000008443 pancreatic carcinoma Diseases 0.000 description 13
- 102000004196 processed proteins & peptides Human genes 0.000 description 13
- 230000002829 reductive effect Effects 0.000 description 13
- 238000012360 testing method Methods 0.000 description 13
- 108010007622 LDL Lipoproteins Proteins 0.000 description 12
- 102000007330 LDL Lipoproteins Human genes 0.000 description 12
- 108050002485 Sirtuin Proteins 0.000 description 12
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 12
- 238000002347 injection Methods 0.000 description 12
- 239000007924 injection Substances 0.000 description 12
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 12
- 201000002528 pancreatic cancer Diseases 0.000 description 12
- 230000009467 reduction Effects 0.000 description 12
- 206010025323 Lymphomas Diseases 0.000 description 11
- 125000003275 alpha amino acid group Chemical group 0.000 description 11
- 108010010234 HDL Lipoproteins Proteins 0.000 description 10
- 102000015779 HDL Lipoproteins Human genes 0.000 description 10
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 10
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 10
- 201000007270 liver cancer Diseases 0.000 description 10
- 208000014018 liver neoplasm Diseases 0.000 description 10
- 208000037819 metastatic cancer Diseases 0.000 description 10
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 10
- 210000001519 tissue Anatomy 0.000 description 10
- 206010006187 Breast cancer Diseases 0.000 description 9
- WBNQDOYYEUMPFS-UHFFFAOYSA-N N-nitrosodiethylamine Chemical compound CCN(CC)N=O WBNQDOYYEUMPFS-UHFFFAOYSA-N 0.000 description 9
- 206010035226 Plasma cell myeloma Diseases 0.000 description 9
- 238000004422 calculation algorithm Methods 0.000 description 9
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 8
- 208000026310 Breast neoplasm Diseases 0.000 description 8
- 206010009944 Colon cancer Diseases 0.000 description 8
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 8
- 206010027476 Metastases Diseases 0.000 description 8
- 208000034578 Multiple myelomas Diseases 0.000 description 8
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 8
- 208000009956 adenocarcinoma Diseases 0.000 description 8
- 238000011161 development Methods 0.000 description 8
- 230000018109 developmental process Effects 0.000 description 8
- 210000003238 esophagus Anatomy 0.000 description 8
- 239000012634 fragment Substances 0.000 description 8
- 230000006870 function Effects 0.000 description 8
- 208000005017 glioblastoma Diseases 0.000 description 8
- 210000003128 head Anatomy 0.000 description 8
- ZSIAUFGUXNUGDI-UHFFFAOYSA-N hexan-1-ol Chemical group CCCCCCO ZSIAUFGUXNUGDI-UHFFFAOYSA-N 0.000 description 8
- 201000005202 lung cancer Diseases 0.000 description 8
- 208000020816 lung neoplasm Diseases 0.000 description 8
- 230000009401 metastasis Effects 0.000 description 8
- 210000003739 neck Anatomy 0.000 description 8
- 229920001184 polypeptide Polymers 0.000 description 8
- 230000000069 prophylactic effect Effects 0.000 description 8
- 210000002966 serum Anatomy 0.000 description 8
- 206010041823 squamous cell carcinoma Diseases 0.000 description 8
- 208000003950 B-cell lymphoma Diseases 0.000 description 7
- 108020004705 Codon Proteins 0.000 description 7
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 7
- 102000004190 Enzymes Human genes 0.000 description 7
- 108090000790 Enzymes Proteins 0.000 description 7
- 241000282412 Homo Species 0.000 description 7
- 208000008839 Kidney Neoplasms Diseases 0.000 description 7
- 241000124008 Mammalia Species 0.000 description 7
- 206010033128 Ovarian cancer Diseases 0.000 description 7
- 206010061535 Ovarian neoplasm Diseases 0.000 description 7
- 206010038389 Renal cancer Diseases 0.000 description 7
- 230000002159 abnormal effect Effects 0.000 description 7
- 238000007792 addition Methods 0.000 description 7
- 239000005557 antagonist Substances 0.000 description 7
- 230000008901 benefit Effects 0.000 description 7
- 210000000481 breast Anatomy 0.000 description 7
- 239000003795 chemical substances by application Substances 0.000 description 7
- GYOZYWVXFNDGLU-XLPZGREQSA-N dTMP Chemical group O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)C1 GYOZYWVXFNDGLU-XLPZGREQSA-N 0.000 description 7
- 229940079593 drug Drugs 0.000 description 7
- 229940088598 enzyme Drugs 0.000 description 7
- 239000012530 fluid Substances 0.000 description 7
- 238000009472 formulation Methods 0.000 description 7
- 238000001727 in vivo Methods 0.000 description 7
- 201000010982 kidney cancer Diseases 0.000 description 7
- 230000003211 malignant effect Effects 0.000 description 7
- 230000007246 mechanism Effects 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- 125000002652 ribonucleotide group Chemical group 0.000 description 7
- 239000000243 solution Substances 0.000 description 7
- 125000006850 spacer group Chemical group 0.000 description 7
- 238000007920 subcutaneous administration Methods 0.000 description 7
- 238000006467 substitution reaction Methods 0.000 description 7
- 230000014616 translation Effects 0.000 description 7
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 6
- BPYKTIZUTYGOLE-IFADSCNNSA-N Bilirubin Chemical compound N1C(=O)C(C)=C(C=C)\C1=C\C1=C(C)C(CCC(O)=O)=C(CC2=C(C(C)=C(\C=C/3C(=C(C=C)C(=O)N\3)C)N2)CCC(O)=O)N1 BPYKTIZUTYGOLE-IFADSCNNSA-N 0.000 description 6
- 101000945515 Homo sapiens CCAAT/enhancer-binding protein alpha Proteins 0.000 description 6
- 101001045740 Homo sapiens Hepatocyte nuclear factor 4-alpha Proteins 0.000 description 6
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 6
- 208000003721 Triple Negative Breast Neoplasms Diseases 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- 230000009286 beneficial effect Effects 0.000 description 6
- 238000006243 chemical reaction Methods 0.000 description 6
- 229960004679 doxorubicin Drugs 0.000 description 6
- 125000000524 functional group Chemical group 0.000 description 6
- 238000000338 in vitro Methods 0.000 description 6
- 230000001965 increasing effect Effects 0.000 description 6
- 238000001990 intravenous administration Methods 0.000 description 6
- 206010061289 metastatic neoplasm Diseases 0.000 description 6
- 229920000642 polymer Polymers 0.000 description 6
- 208000011581 secondary neoplasm Diseases 0.000 description 6
- 238000013519 translation Methods 0.000 description 6
- 208000022679 triple-negative breast carcinoma Diseases 0.000 description 6
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 6
- DJJCXFVJDGTHFX-XVFCMESISA-N uridine 5'-monophosphate Chemical compound O[C@@H]1[C@H](O)[C@@H](COP(O)(O)=O)O[C@H]1N1C(=O)NC(=O)C=C1 DJJCXFVJDGTHFX-XVFCMESISA-N 0.000 description 6
- KHWCHTKSEGGWEX-RRKCRQDMSA-N 2'-deoxyadenosine 5'-monophosphate Chemical group C1=NC=2C(N)=NC=NC=2N1[C@H]1C[C@H](O)[C@@H](COP(O)(O)=O)O1 KHWCHTKSEGGWEX-RRKCRQDMSA-N 0.000 description 5
- NCMVOABPESMRCP-SHYZEUOFSA-N 2'-deoxycytosine 5'-monophosphate Chemical group O=C1N=C(N)C=CN1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)C1 NCMVOABPESMRCP-SHYZEUOFSA-N 0.000 description 5
- LTFMZDNNPPEQNG-KVQBGUIXSA-N 2'-deoxyguanosine 5'-monophosphate Chemical group C1=2NC(N)=NC(=O)C=2N=CN1[C@H]1C[C@H](O)[C@@H](COP(O)(O)=O)O1 LTFMZDNNPPEQNG-KVQBGUIXSA-N 0.000 description 5
- 208000003174 Brain Neoplasms Diseases 0.000 description 5
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 5
- 101150068639 Hnf4a gene Proteins 0.000 description 5
- 101150022826 Hnf4g gene Proteins 0.000 description 5
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 5
- 101710163270 Nuclease Proteins 0.000 description 5
- 108091034117 Oligonucleotide Proteins 0.000 description 5
- 102000011990 Sirtuin Human genes 0.000 description 5
- 210000000593 adipose tissue white Anatomy 0.000 description 5
- 150000001412 amines Chemical class 0.000 description 5
- 238000010171 animal model Methods 0.000 description 5
- 238000001514 detection method Methods 0.000 description 5
- 206010012601 diabetes mellitus Diseases 0.000 description 5
- 239000002552 dosage form Substances 0.000 description 5
- 238000005516 engineering process Methods 0.000 description 5
- 238000002474 experimental method Methods 0.000 description 5
- 239000008103 glucose Substances 0.000 description 5
- 108091008634 hepatocyte nuclear factors 4 Proteins 0.000 description 5
- 238000009396 hybridization Methods 0.000 description 5
- 230000002401 inhibitory effect Effects 0.000 description 5
- 230000003993 interaction Effects 0.000 description 5
- 210000003734 kidney Anatomy 0.000 description 5
- 239000003446 ligand Substances 0.000 description 5
- 239000002502 liposome Substances 0.000 description 5
- 208000003747 lymphoid leukemia Diseases 0.000 description 5
- 239000002184 metal Substances 0.000 description 5
- 230000001394 metastastic effect Effects 0.000 description 5
- 201000010879 mucinous adenocarcinoma Diseases 0.000 description 5
- 208000025113 myeloid leukemia Diseases 0.000 description 5
- ZJAOAACCNHFJAH-UHFFFAOYSA-N phosphonoformic acid Chemical compound OC(=O)P(O)(O)=O ZJAOAACCNHFJAH-UHFFFAOYSA-N 0.000 description 5
- 102000040430 polynucleotide Human genes 0.000 description 5
- 108091033319 polynucleotide Proteins 0.000 description 5
- 239000002157 polynucleotide Substances 0.000 description 5
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 5
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 4
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 4
- 102000006752 Hepatocyte Nuclear Factor 4 Human genes 0.000 description 4
- 101001045749 Homo sapiens Hepatocyte nuclear factor 4-gamma Proteins 0.000 description 4
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 4
- 108010000817 Leuprolide Proteins 0.000 description 4
- 208000028018 Lymphocytic leukaemia Diseases 0.000 description 4
- 229940124647 MEK inhibitor Drugs 0.000 description 4
- 108091005461 Nucleic proteins Proteins 0.000 description 4
- 239000002202 Polyethylene glycol Substances 0.000 description 4
- 108010029485 Protein Isoforms Proteins 0.000 description 4
- 102000001708 Protein Isoforms Human genes 0.000 description 4
- 101150051587 SIRT7 gene Proteins 0.000 description 4
- 108010041216 Sirtuin 2 Proteins 0.000 description 4
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 4
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 4
- 210000001185 bone marrow Anatomy 0.000 description 4
- 239000002775 capsule Substances 0.000 description 4
- 210000000170 cell membrane Anatomy 0.000 description 4
- 230000001413 cellular effect Effects 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 229940127089 cytotoxic agent Drugs 0.000 description 4
- 238000012217 deletion Methods 0.000 description 4
- 230000037430 deletion Effects 0.000 description 4
- 230000008030 elimination Effects 0.000 description 4
- 238000003379 elimination reaction Methods 0.000 description 4
- 208000037828 epithelial carcinoma Diseases 0.000 description 4
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 4
- 239000000499 gel Substances 0.000 description 4
- 230000003308 immunostimulating effect Effects 0.000 description 4
- 238000001802 infusion Methods 0.000 description 4
- 239000000543 intermediate Substances 0.000 description 4
- 230000003834 intracellular effect Effects 0.000 description 4
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 description 4
- 229960004338 leuprorelin Drugs 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- 229930182817 methionine Natural products 0.000 description 4
- 230000001537 neural effect Effects 0.000 description 4
- 210000000056 organ Anatomy 0.000 description 4
- 150000004713 phosphodiesters Chemical class 0.000 description 4
- 150000008300 phosphoramidites Chemical class 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- 229920001223 polyethylene glycol Polymers 0.000 description 4
- 238000003752 polymerase chain reaction Methods 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 230000035755 proliferation Effects 0.000 description 4
- 230000001681 protective effect Effects 0.000 description 4
- 230000001105 regulatory effect Effects 0.000 description 4
- 150000003839 salts Chemical class 0.000 description 4
- 235000000346 sugar Nutrition 0.000 description 4
- 238000013518 transcription Methods 0.000 description 4
- 230000035897 transcription Effects 0.000 description 4
- 230000004614 tumor growth Effects 0.000 description 4
- 210000003462 vein Anatomy 0.000 description 4
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 4
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 4
- 229960004528 vincristine Drugs 0.000 description 4
- VKLOPQHLJNFYKK-UHFFFAOYSA-N 3-dodecylsulfanylpropanoic acid Chemical compound CCCCCCCCCCCCSCCC(O)=O VKLOPQHLJNFYKK-UHFFFAOYSA-N 0.000 description 3
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 3
- 208000003170 Bronchiolo-Alveolar Adenocarcinoma Diseases 0.000 description 3
- 208000006332 Choriocarcinoma Diseases 0.000 description 3
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 3
- 102100022054 Hepatocyte nuclear factor 4-alpha Human genes 0.000 description 3
- 101000709248 Homo sapiens NAD-dependent protein deacetylase sirtuin-7 Proteins 0.000 description 3
- 102000006992 Interferon-alpha Human genes 0.000 description 3
- 108010047761 Interferon-alpha Proteins 0.000 description 3
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 3
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 3
- 208000000265 Lobular Carcinoma Diseases 0.000 description 3
- 108060001084 Luciferase Proteins 0.000 description 3
- 239000005089 Luciferase Substances 0.000 description 3
- 241001467552 Mycobacterium bovis BCG Species 0.000 description 3
- YBAFDPFAUTYYRW-UHFFFAOYSA-N N-L-alpha-glutamyl-L-leucine Natural products CC(C)CC(C(O)=O)NC(=O)C(N)CCC(O)=O YBAFDPFAUTYYRW-UHFFFAOYSA-N 0.000 description 3
- 102100034376 NAD-dependent protein deacetylase sirtuin-7 Human genes 0.000 description 3
- 108091028664 Ribonucleotide Proteins 0.000 description 3
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 208000024770 Thyroid neoplasm Diseases 0.000 description 3
- 239000004480 active ingredient Substances 0.000 description 3
- 239000013543 active substance Substances 0.000 description 3
- 208000002517 adenoid cystic carcinoma Diseases 0.000 description 3
- 239000000556 agonist Substances 0.000 description 3
- 235000004279 alanine Nutrition 0.000 description 3
- 210000003719 b-lymphocyte Anatomy 0.000 description 3
- 229960000190 bacillus calmette–guérin vaccine Drugs 0.000 description 3
- 230000033228 biological regulation Effects 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 201000003714 breast lobular carcinoma Diseases 0.000 description 3
- 238000002512 chemotherapy Methods 0.000 description 3
- 238000011260 co-administration Methods 0.000 description 3
- 230000001054 cortical effect Effects 0.000 description 3
- 229960004397 cyclophosphamide Drugs 0.000 description 3
- 125000003192 dTMP group Chemical group 0.000 description 3
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 3
- 229960000975 daunorubicin Drugs 0.000 description 3
- 239000005547 deoxyribonucleotide Substances 0.000 description 3
- 208000016097 disease of metabolism Diseases 0.000 description 3
- 239000003651 drinking water Substances 0.000 description 3
- 235000020188 drinking water Nutrition 0.000 description 3
- 239000003623 enhancer Substances 0.000 description 3
- 229940011871 estrogen Drugs 0.000 description 3
- 239000000262 estrogen Substances 0.000 description 3
- 239000000328 estrogen antagonist Substances 0.000 description 3
- 229960005420 etoposide Drugs 0.000 description 3
- 239000007850 fluorescent dye Substances 0.000 description 3
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 3
- 229960005277 gemcitabine Drugs 0.000 description 3
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 3
- 229910052737 gold Inorganic materials 0.000 description 3
- 239000010931 gold Substances 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 230000036541 health Effects 0.000 description 3
- 235000009200 high fat diet Nutrition 0.000 description 3
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 3
- 229960001438 immunostimulant agent Drugs 0.000 description 3
- 239000003022 immunostimulating agent Substances 0.000 description 3
- 230000001939 inductive effect Effects 0.000 description 3
- 208000015181 infectious disease Diseases 0.000 description 3
- 238000011081 inoculation Methods 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 238000007912 intraperitoneal administration Methods 0.000 description 3
- 238000007913 intrathecal administration Methods 0.000 description 3
- 206010073096 invasive lobular breast carcinoma Diseases 0.000 description 3
- 229910052742 iron Inorganic materials 0.000 description 3
- 210000000265 leukocyte Anatomy 0.000 description 3
- 150000002632 lipids Chemical class 0.000 description 3
- 239000007937 lozenge Substances 0.000 description 3
- 210000004072 lung Anatomy 0.000 description 3
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical compound ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 3
- YACKEPLHDIMKIO-UHFFFAOYSA-N methylphosphonic acid Chemical compound CP(O)(O)=O YACKEPLHDIMKIO-UHFFFAOYSA-N 0.000 description 3
- 230000035772 mutation Effects 0.000 description 3
- 210000000944 nerve tissue Anatomy 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 239000002243 precursor Substances 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 239000002336 ribonucleotide Substances 0.000 description 3
- CYOHGALHFOKKQC-UHFFFAOYSA-N selumetinib Chemical compound OCCONC(=O)C=1C=C2N(C)C=NC2=C(F)C=1NC1=CC=C(Br)C=C1Cl CYOHGALHFOKKQC-UHFFFAOYSA-N 0.000 description 3
- 210000003491 skin Anatomy 0.000 description 3
- 239000004055 small Interfering RNA Substances 0.000 description 3
- 150000003384 small molecules Chemical class 0.000 description 3
- 241000894007 species Species 0.000 description 3
- 238000010186 staining Methods 0.000 description 3
- 239000003826 tablet Substances 0.000 description 3
- 230000008685 targeting Effects 0.000 description 3
- 201000002510 thyroid cancer Diseases 0.000 description 3
- 210000001685 thyroid gland Anatomy 0.000 description 3
- 230000000699 topical effect Effects 0.000 description 3
- 239000003053 toxin Substances 0.000 description 3
- 231100000765 toxin Toxicity 0.000 description 3
- 108700012359 toxins Proteins 0.000 description 3
- 230000003442 weekly effect Effects 0.000 description 3
- LLXVXPPXELIDGQ-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-(2,5-dioxopyrrol-1-yl)benzoate Chemical compound C=1C=CC(N2C(C=CC2=O)=O)=CC=1C(=O)ON1C(=O)CCC1=O LLXVXPPXELIDGQ-UHFFFAOYSA-N 0.000 description 2
- IAKHMKGGTNLKSZ-INIZCTEOSA-N (S)-colchicine Chemical compound C1([C@@H](NC(C)=O)CC2)=CC(=O)C(OC)=CC=C1C1=C2C=C(OC)C(OC)=C1OC IAKHMKGGTNLKSZ-INIZCTEOSA-N 0.000 description 2
- GFMMXOIFOQCCGU-UHFFFAOYSA-N 2-(2-chloro-4-iodoanilino)-N-(cyclopropylmethoxy)-3,4-difluorobenzamide Chemical compound C=1C=C(I)C=C(Cl)C=1NC1=C(F)C(F)=CC=C1C(=O)NOCC1CC1 GFMMXOIFOQCCGU-UHFFFAOYSA-N 0.000 description 2
- KOQIAZNBAWFSQM-UHFFFAOYSA-N 2-[4-(3-ethynylanilino)-7-(2-methoxyethoxy)quinazolin-6-yl]oxyethanol Chemical compound C=12C=C(OCCO)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 KOQIAZNBAWFSQM-UHFFFAOYSA-N 0.000 description 2
- OTLLEIBWKHEHGU-UHFFFAOYSA-N 2-[5-[[5-(6-aminopurin-9-yl)-3,4-dihydroxyoxolan-2-yl]methoxy]-3,4-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-3,5-dihydroxy-4-phosphonooxyhexanedioic acid Chemical compound C1=NC=2C(N)=NC=NC=2N1C(C(C1O)O)OC1COC1C(CO)OC(OC(C(O)C(OP(O)(O)=O)C(O)C(O)=O)C(O)=O)C(O)C1O OTLLEIBWKHEHGU-UHFFFAOYSA-N 0.000 description 2
- PFNHSEQQEPMLNI-UHFFFAOYSA-N 2-methyl-1-pentanol Chemical compound CCCC(C)CO PFNHSEQQEPMLNI-UHFFFAOYSA-N 0.000 description 2
- WFRBDWRZVBPBDO-UHFFFAOYSA-N 2-methyl-2-pentanol Chemical compound CCCC(C)(C)O WFRBDWRZVBPBDO-UHFFFAOYSA-N 0.000 description 2
- NDMPLJNOPCLANR-UHFFFAOYSA-N 3,4-dihydroxy-15-(4-hydroxy-18-methoxycarbonyl-5,18-seco-ibogamin-18-yl)-16-methoxy-1-methyl-6,7-didehydro-aspidospermidine-3-carboxylic acid methyl ester Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 NDMPLJNOPCLANR-UHFFFAOYSA-N 0.000 description 2
- FRDAATYAJDYRNW-UHFFFAOYSA-N 3-methyl-3-pentanol Chemical compound CCC(C)(O)CC FRDAATYAJDYRNW-UHFFFAOYSA-N 0.000 description 2
- IWTBVKIGCDZRPL-UHFFFAOYSA-N 3-methylpentanol Chemical compound CCC(C)CCO IWTBVKIGCDZRPL-UHFFFAOYSA-N 0.000 description 2
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 2
- 208000036762 Acute promyelocytic leukaemia Diseases 0.000 description 2
- YLTKNGYYPIWKHZ-ACZMJKKPSA-N Ala-Ala-Glu Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCC(O)=O YLTKNGYYPIWKHZ-ACZMJKKPSA-N 0.000 description 2
- QRIYOHQJRDHFKF-UWJYBYFXSA-N Ala-Tyr-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)C)CC1=CC=C(O)C=C1 QRIYOHQJRDHFKF-UWJYBYFXSA-N 0.000 description 2
- 239000004475 Arginine Substances 0.000 description 2
- BFYIZQONLCFLEV-DAELLWKTSA-N Aromasine Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC(=C)C2=C1 BFYIZQONLCFLEV-DAELLWKTSA-N 0.000 description 2
- LEFKSBYHUGUWLP-ACZMJKKPSA-N Asn-Ala-Glu Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(O)=O LEFKSBYHUGUWLP-ACZMJKKPSA-N 0.000 description 2
- MLDQJTXFUGDVEO-UHFFFAOYSA-N BAY-43-9006 Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 MLDQJTXFUGDVEO-UHFFFAOYSA-N 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 108010006654 Bleomycin Proteins 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 206010058354 Bronchioloalveolar carcinoma Diseases 0.000 description 2
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 2
- 229940124292 CD20 monoclonal antibody Drugs 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 208000009458 Carcinoma in Situ Diseases 0.000 description 2
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 2
- 108010090461 DFG peptide Proteins 0.000 description 2
- 108010092160 Dactinomycin Proteins 0.000 description 2
- 238000005698 Diels-Alder reaction Methods 0.000 description 2
- 102100031480 Dual specificity mitogen-activated protein kinase kinase 1 Human genes 0.000 description 2
- 101710146526 Dual specificity mitogen-activated protein kinase kinase 1 Proteins 0.000 description 2
- 102100023266 Dual specificity mitogen-activated protein kinase kinase 2 Human genes 0.000 description 2
- 101710146529 Dual specificity mitogen-activated protein kinase kinase 2 Proteins 0.000 description 2
- 208000006402 Ductal Carcinoma Diseases 0.000 description 2
- 102000001301 EGF receptor Human genes 0.000 description 2
- 108060006698 EGF receptor Proteins 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 2
- 208000008999 Giant Cell Carcinoma Diseases 0.000 description 2
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 2
- 102000005720 Glutathione transferase Human genes 0.000 description 2
- 108010070675 Glutathione transferase Proteins 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 241001326189 Gyrodactylus prostae Species 0.000 description 2
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 2
- 101000616738 Homo sapiens NAD-dependent protein deacetylase sirtuin-6 Proteins 0.000 description 2
- 101000616727 Homo sapiens NAD-dependent protein deacylase sirtuin-5, mitochondrial Proteins 0.000 description 2
- 101000863629 Homo sapiens NAD-dependent protein lipoamidase sirtuin-4, mitochondrial Proteins 0.000 description 2
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- 206010022489 Insulin Resistance Diseases 0.000 description 2
- 102000014150 Interferons Human genes 0.000 description 2
- 108010050904 Interferons Proteins 0.000 description 2
- 102000000588 Interleukin-2 Human genes 0.000 description 2
- 108010002350 Interleukin-2 Proteins 0.000 description 2
- 108091092195 Intron Proteins 0.000 description 2
- UQSXHKLRYXJYBZ-UHFFFAOYSA-N Iron oxide Chemical compound [Fe]=O UQSXHKLRYXJYBZ-UHFFFAOYSA-N 0.000 description 2
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 2
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- 239000005411 L01XE02 - Gefitinib Substances 0.000 description 2
- 239000005551 L01XE03 - Erlotinib Substances 0.000 description 2
- HLFSDGLLUJUHTE-SNVBAGLBSA-N Levamisole Chemical compound C1([C@H]2CN3CCSC3=N2)=CC=CC=C1 HLFSDGLLUJUHTE-SNVBAGLBSA-N 0.000 description 2
- 206010050017 Lung cancer metastatic Diseases 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 2
- 101710175625 Maltose/maltodextrin-binding periplasmic protein Proteins 0.000 description 2
- XUMBMVFBXHLACL-UHFFFAOYSA-N Melanin Chemical compound O=C1C(=O)C(C2=CNC3=C(C(C(=O)C4=C32)=O)C)=C2C4=CNC2=C1C XUMBMVFBXHLACL-UHFFFAOYSA-N 0.000 description 2
- 102000018697 Membrane Proteins Human genes 0.000 description 2
- 108010052285 Membrane Proteins Proteins 0.000 description 2
- 229930192392 Mitomycin Natural products 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- 208000005927 Myosarcoma Diseases 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- XMBSYZWANAQXEV-UHFFFAOYSA-N N-alpha-L-glutamyl-L-phenylalanine Natural products OC(=O)CCC(N)C(=O)NC(C(O)=O)CC1=CC=CC=C1 XMBSYZWANAQXEV-UHFFFAOYSA-N 0.000 description 2
- BAWFJGJZGIEFAR-NNYOXOHSSA-N NAD zwitterion Chemical compound NC(=O)C1=CC=C[N+]([C@H]2[C@@H]([C@H](O)[C@@H](COP([O-])(=O)OP(O)(=O)OC[C@@H]3[C@H]([C@@H](O)[C@@H](O3)N3C4=NC=NC(N)=C4N=C3)O)O2)O)=C1 BAWFJGJZGIEFAR-NNYOXOHSSA-N 0.000 description 2
- 102100022913 NAD-dependent protein deacetylase sirtuin-2 Human genes 0.000 description 2
- 102100030710 NAD-dependent protein deacetylase sirtuin-3, mitochondrial Human genes 0.000 description 2
- 102100021840 NAD-dependent protein deacetylase sirtuin-6 Human genes 0.000 description 2
- 102100021839 NAD-dependent protein deacylase sirtuin-5, mitochondrial Human genes 0.000 description 2
- 102100030709 NAD-dependent protein lipoamidase sirtuin-4, mitochondrial Human genes 0.000 description 2
- MWUXSHHQAYIFBG-UHFFFAOYSA-N Nitric oxide Chemical compound O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 229930012538 Paclitaxel Natural products 0.000 description 2
- 206010033701 Papillary thyroid cancer Diseases 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 2
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 2
- 229940123924 Protein kinase C inhibitor Drugs 0.000 description 2
- 101000762949 Pseudomonas aeruginosa (strain ATCC 15692 / DSM 22644 / CIP 104116 / JCM 14847 / LMG 12228 / 1C / PRS 101 / PAO1) Exotoxin A Proteins 0.000 description 2
- 108091030071 RNAI Proteins 0.000 description 2
- 241000700157 Rattus norvegicus Species 0.000 description 2
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 2
- 108091005770 SIRT3 Proteins 0.000 description 2
- QVOGDCQNGLBNCR-FXQIFTODSA-N Ser-Arg-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(O)=O QVOGDCQNGLBNCR-FXQIFTODSA-N 0.000 description 2
- 108020004682 Single-Stranded DNA Proteins 0.000 description 2
- 101150074067 Sirt4 gene Proteins 0.000 description 2
- 101150109526 Sirt6 gene Proteins 0.000 description 2
- 102000000477 Sirtuin 2 Human genes 0.000 description 2
- 102000000478 Sirtuin 3 Human genes 0.000 description 2
- 108010041218 Sirtuin 3 Proteins 0.000 description 2
- 108091027967 Small hairpin RNA Proteins 0.000 description 2
- 101000857870 Squalus acanthias Gonadoliberin Proteins 0.000 description 2
- 108010090804 Streptavidin Proteins 0.000 description 2
- RYYWUUFWQRZTIU-UHFFFAOYSA-N Thiophosphoric acid Chemical class OP(O)(S)=O RYYWUUFWQRZTIU-UHFFFAOYSA-N 0.000 description 2
- FOCVUCIESVLUNU-UHFFFAOYSA-N Thiotepa Chemical compound C1CN1P(N1CC1)(=S)N1CC1 FOCVUCIESVLUNU-UHFFFAOYSA-N 0.000 description 2
- 230000010632 Transcription Factor Activity Effects 0.000 description 2
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 2
- DJJCXFVJDGTHFX-UHFFFAOYSA-N Uridinemonophosphate Natural products OC1C(O)C(COP(O)(O)=O)OC1N1C(=O)NC(=O)C=C1 DJJCXFVJDGTHFX-UHFFFAOYSA-N 0.000 description 2
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 2
- 208000027418 Wounds and injury Diseases 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- 208000036676 acute undifferentiated leukemia Diseases 0.000 description 2
- 150000001266 acyl halides Chemical class 0.000 description 2
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 2
- UDMBCSSLTHHNCD-KQYNXXCUSA-N adenosine 5'-monophosphate Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@H]1O UDMBCSSLTHHNCD-KQYNXXCUSA-N 0.000 description 2
- 210000003486 adipose tissue brown Anatomy 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- 230000001919 adrenal effect Effects 0.000 description 2
- 229960001686 afatinib Drugs 0.000 description 2
- ULXXDDBFHOBEHA-CWDCEQMOSA-N afatinib Chemical compound N1=CN=C2C=C(O[C@@H]3COCC3)C(NC(=O)/C=C/CN(C)C)=CC2=C1NC1=CC=C(F)C(Cl)=C1 ULXXDDBFHOBEHA-CWDCEQMOSA-N 0.000 description 2
- 150000001298 alcohols Chemical class 0.000 description 2
- 150000001299 aldehydes Chemical class 0.000 description 2
- 125000000539 amino acid group Chemical group 0.000 description 2
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 230000002280 anti-androgenic effect Effects 0.000 description 2
- 229940046836 anti-estrogen Drugs 0.000 description 2
- 230000001833 anti-estrogenic effect Effects 0.000 description 2
- 230000000118 anti-neoplastic effect Effects 0.000 description 2
- 239000000051 antiandrogen Substances 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- 239000000427 antigen Substances 0.000 description 2
- 108091007433 antigens Proteins 0.000 description 2
- 102000036639 antigens Human genes 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 2
- 125000003118 aryl group Chemical group 0.000 description 2
- 210000001130 astrocyte Anatomy 0.000 description 2
- 230000004900 autophagic degradation Effects 0.000 description 2
- 239000012148 binding buffer Substances 0.000 description 2
- 239000011616 biotin Substances 0.000 description 2
- 229960002685 biotin Drugs 0.000 description 2
- 235000020958 biotin Nutrition 0.000 description 2
- 229960001561 bleomycin Drugs 0.000 description 2
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 2
- 238000004820 blood count Methods 0.000 description 2
- 210000005013 brain tissue Anatomy 0.000 description 2
- 229960002092 busulfan Drugs 0.000 description 2
- 229950002826 canertinib Drugs 0.000 description 2
- OMZCMEYTWSXEPZ-UHFFFAOYSA-N canertinib Chemical compound C1=C(Cl)C(F)=CC=C1NC1=NC=NC2=CC(OCCCN3CCOCC3)=C(NC(=O)C=C)C=C12 OMZCMEYTWSXEPZ-UHFFFAOYSA-N 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 235000014633 carbohydrates Nutrition 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- 208000002458 carcinoid tumor Diseases 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 102000021178 chitin binding proteins Human genes 0.000 description 2
- 108091011157 chitin binding proteins Proteins 0.000 description 2
- 229960004630 chlorambucil Drugs 0.000 description 2
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 2
- 210000000349 chromosome Anatomy 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 229960002271 cobimetinib Drugs 0.000 description 2
- BSMCAPRUBJMWDF-KRWDZBQOSA-N cobimetinib Chemical compound C1C(O)([C@H]2NCCCC2)CN1C(=O)C1=CC=C(F)C(F)=C1NC1=CC=C(I)C=C1F BSMCAPRUBJMWDF-KRWDZBQOSA-N 0.000 description 2
- 239000003086 colorant Substances 0.000 description 2
- 239000002872 contrast media Substances 0.000 description 2
- 208000029078 coronary artery disease Diseases 0.000 description 2
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 2
- 229960000684 cytarabine Drugs 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 229960003957 dexamethasone Drugs 0.000 description 2
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 2
- AFOSIXZFDONLBT-UHFFFAOYSA-N divinyl sulfone Chemical class C=CS(=O)(=O)C=C AFOSIXZFDONLBT-UHFFFAOYSA-N 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 238000012377 drug delivery Methods 0.000 description 2
- 239000000975 dye Substances 0.000 description 2
- 229960001904 epirubicin Drugs 0.000 description 2
- 210000002919 epithelial cell Anatomy 0.000 description 2
- 229960001433 erlotinib Drugs 0.000 description 2
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- LIQODXNTTZAGID-OCBXBXKTSA-N etoposide phosphate Chemical compound COC1=C(OP(O)(O)=O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 LIQODXNTTZAGID-OCBXBXKTSA-N 0.000 description 2
- 229960000752 etoposide phosphate Drugs 0.000 description 2
- 210000003527 eukaryotic cell Anatomy 0.000 description 2
- 229960000255 exemestane Drugs 0.000 description 2
- 231100000776 exotoxin Toxicity 0.000 description 2
- 239000002095 exotoxin Substances 0.000 description 2
- 229960004039 finasteride Drugs 0.000 description 2
- DBEPLOCGEIEOCV-WSBQPABSSA-N finasteride Chemical compound N([C@@H]1CC2)C(=O)C=C[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H](C(=O)NC(C)(C)C)[C@@]2(C)CC1 DBEPLOCGEIEOCV-WSBQPABSSA-N 0.000 description 2
- 229960000390 fludarabine Drugs 0.000 description 2
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 2
- 229960005102 foscarnet Drugs 0.000 description 2
- CHPZKNULDCNCBW-UHFFFAOYSA-N gallium nitrate Chemical compound [Ga+3].[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O CHPZKNULDCNCBW-UHFFFAOYSA-N 0.000 description 2
- 229960002584 gefitinib Drugs 0.000 description 2
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 description 2
- 230000009368 gene silencing by RNA Effects 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 210000004602 germ cell Anatomy 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- VPZXBVLAVMBEQI-UHFFFAOYSA-N glycyl-DL-alpha-alanine Natural products OC(=O)C(C)NC(=O)CN VPZXBVLAVMBEQI-UHFFFAOYSA-N 0.000 description 2
- 108010050848 glycylleucine Proteins 0.000 description 2
- 210000003714 granulocyte Anatomy 0.000 description 2
- RQFCJASXJCIDSX-UUOKFMHZSA-N guanosine 5'-monophosphate Chemical compound C1=2NC(N)=NC(=O)C=2N=CN1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@H]1O RQFCJASXJCIDSX-UUOKFMHZSA-N 0.000 description 2
- 150000004820 halides Chemical class 0.000 description 2
- QNVRIHYSUZMSGM-UHFFFAOYSA-N hexan-2-ol Chemical compound CCCCC(C)O QNVRIHYSUZMSGM-UHFFFAOYSA-N 0.000 description 2
- ZOCHHNOQQHDWHG-UHFFFAOYSA-N hexan-3-ol Chemical compound CCCC(O)CC ZOCHHNOQQHDWHG-UHFFFAOYSA-N 0.000 description 2
- 102000053363 human HNF4A Human genes 0.000 description 2
- 102000053351 human HNF4G Human genes 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 239000001257 hydrogen Substances 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 229960002411 imatinib Drugs 0.000 description 2
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 2
- 210000002865 immune cell Anatomy 0.000 description 2
- 230000005847 immunogenicity Effects 0.000 description 2
- 230000002637 immunotoxin Effects 0.000 description 2
- 239000002596 immunotoxin Substances 0.000 description 2
- 231100000608 immunotoxin Toxicity 0.000 description 2
- 229940051026 immunotoxin Drugs 0.000 description 2
- 208000014674 injury Diseases 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 229940079322 interferon Drugs 0.000 description 2
- 238000001361 intraarterial administration Methods 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 229960004768 irinotecan Drugs 0.000 description 2
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 2
- 230000001788 irregular Effects 0.000 description 2
- 229960002725 isoflurane Drugs 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 108010034529 leucyl-lysine Proteins 0.000 description 2
- 229960001614 levamisole Drugs 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- 201000000014 lung giant cell carcinoma Diseases 0.000 description 2
- 108010017391 lysylvaline Proteins 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 229960004961 mechlorethamine Drugs 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 150000002739 metals Chemical group 0.000 description 2
- 230000003278 mimic effect Effects 0.000 description 2
- 229960004857 mitomycin Drugs 0.000 description 2
- 229960001156 mitoxantrone Drugs 0.000 description 2
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 2
- 238000010369 molecular cloning Methods 0.000 description 2
- 201000002077 muscle cancer Diseases 0.000 description 2
- 229950006238 nadide Drugs 0.000 description 2
- 239000002086 nanomaterial Substances 0.000 description 2
- 229950008835 neratinib Drugs 0.000 description 2
- JWNPDZNEKVCWMY-VQHVLOKHSA-N neratinib Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1OCC1=CC=CC=N1 JWNPDZNEKVCWMY-VQHVLOKHSA-N 0.000 description 2
- 229930027945 nicotinamide-adenine dinucleotide Natural products 0.000 description 2
- OSTGTTZJOCZWJG-UHFFFAOYSA-N nitrosourea Chemical compound NC(=O)N=NO OSTGTTZJOCZWJG-UHFFFAOYSA-N 0.000 description 2
- 208000008338 non-alcoholic fatty liver disease Diseases 0.000 description 2
- 230000000683 nonmetastatic effect Effects 0.000 description 2
- 238000012758 nuclear staining Methods 0.000 description 2
- 230000000269 nucleophilic effect Effects 0.000 description 2
- 230000005257 nucleotidylation Effects 0.000 description 2
- 229960001592 paclitaxel Drugs 0.000 description 2
- 230000007170 pathology Effects 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- 239000012071 phase Substances 0.000 description 2
- XUYJLQHKOGNDPB-UHFFFAOYSA-N phosphonoacetic acid Chemical compound OC(=O)CP(O)(O)=O XUYJLQHKOGNDPB-UHFFFAOYSA-N 0.000 description 2
- 210000002381 plasma Anatomy 0.000 description 2
- 208000031223 plasma cell leukemia Diseases 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 229960004618 prednisone Drugs 0.000 description 2
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 2
- 230000003449 preventive effect Effects 0.000 description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 2
- 210000001236 prokaryotic cell Anatomy 0.000 description 2
- 210000002307 prostate Anatomy 0.000 description 2
- 239000003881 protein kinase C inhibitor Substances 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 238000011363 radioimmunotherapy Methods 0.000 description 2
- 102000005962 receptors Human genes 0.000 description 2
- 108020003175 receptors Proteins 0.000 description 2
- 201000007416 salivary gland adenoid cystic carcinoma Diseases 0.000 description 2
- 108010026333 seryl-proline Proteins 0.000 description 2
- 230000019491 signal transduction Effects 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 229910052709 silver Inorganic materials 0.000 description 2
- 239000004332 silver Substances 0.000 description 2
- 101150045247 sirt5 gene Proteins 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 229960003787 sorafenib Drugs 0.000 description 2
- 238000001228 spectrum Methods 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 229960001603 tamoxifen Drugs 0.000 description 2
- 229950007866 tanespimycin Drugs 0.000 description 2
- AYUNIORJHRXIBJ-TXHRRWQRSA-N tanespimycin Chemical compound N1C(=O)\C(C)=C\C=C/[C@H](OC)[C@@H](OC(N)=O)\C(C)=C\[C@H](C)[C@@H](O)[C@@H](OC)C[C@H](C)CC2=C(NCC=C)C(=O)C=C1C2=O AYUNIORJHRXIBJ-TXHRRWQRSA-N 0.000 description 2
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 2
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 2
- 229960001278 teniposide Drugs 0.000 description 2
- 125000003396 thiol group Chemical group [H]S* 0.000 description 2
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 2
- 229960001196 thiotepa Drugs 0.000 description 2
- 208000030045 thyroid gland papillary carcinoma Diseases 0.000 description 2
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 2
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 2
- 229960000303 topotecan Drugs 0.000 description 2
- 229960004066 trametinib Drugs 0.000 description 2
- LIRYPHYGHXZJBZ-UHFFFAOYSA-N trametinib Chemical compound CC(=O)NC1=CC=CC(N2C(N(C3CC3)C(=O)C3=C(NC=4C(=CC(I)=CC=4)F)N(C)C(=O)C(C)=C32)=O)=C1 LIRYPHYGHXZJBZ-UHFFFAOYSA-N 0.000 description 2
- 230000002103 transcriptional effect Effects 0.000 description 2
- 229960003048 vinblastine Drugs 0.000 description 2
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 2
- UGGWPQSBPIFKDZ-KOTLKJBCSA-N vindesine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(N)=O)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 UGGWPQSBPIFKDZ-KOTLKJBCSA-N 0.000 description 2
- 229960004355 vindesine Drugs 0.000 description 2
- 230000003612 virological effect Effects 0.000 description 2
- 238000011179 visual inspection Methods 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- OZFAFGSSMRRTDW-UHFFFAOYSA-N (2,4-dichlorophenyl) benzenesulfonate Chemical compound ClC1=CC(Cl)=CC=C1OS(=O)(=O)C1=CC=CC=C1 OZFAFGSSMRRTDW-UHFFFAOYSA-N 0.000 description 1
- AXFMEGAFCUULFV-BLFANLJRSA-N (2s)-2-[[(2s)-1-[(2s,3r)-2-amino-3-methylpentanoyl]pyrrolidine-2-carbonyl]amino]pentanedioic acid Chemical compound CC[C@@H](C)[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(O)=O AXFMEGAFCUULFV-BLFANLJRSA-N 0.000 description 1
- 239000001618 (3R)-3-methylpentan-1-ol Substances 0.000 description 1
- QGKMIGUHVLGJBR-UHFFFAOYSA-M (4z)-1-(3-methylbutyl)-4-[[1-(3-methylbutyl)quinolin-1-ium-4-yl]methylidene]quinoline;iodide Chemical compound [I-].C12=CC=CC=C2N(CCC(C)C)C=CC1=CC1=CC=[N+](CCC(C)C)C2=CC=CC=C12 QGKMIGUHVLGJBR-UHFFFAOYSA-M 0.000 description 1
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 1
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 1
- LKJPYSCBVHEWIU-KRWDZBQOSA-N (R)-bicalutamide Chemical compound C([C@@](O)(C)C(=O)NC=1C=C(C(C#N)=CC=1)C(F)(F)F)S(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-KRWDZBQOSA-N 0.000 description 1
- UKAUYVFTDYCKQA-UHFFFAOYSA-N -2-Amino-4-hydroxybutanoic acid Natural products OC(=O)C(N)CCO UKAUYVFTDYCKQA-UHFFFAOYSA-N 0.000 description 1
- 102100025573 1-alkyl-2-acetylglycerophosphocholine esterase Human genes 0.000 description 1
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 1
- XRMVWAKMXZNZIL-UHFFFAOYSA-N 2,2-dimethyl-1-butanol Chemical compound CCC(C)(C)CO XRMVWAKMXZNZIL-UHFFFAOYSA-N 0.000 description 1
- VOQBEOLROSLCOG-UHFFFAOYSA-N 2,3-dihydroxy-2H-anthracen-1-one Chemical compound C1=CC=C2C=C(C(C(O)C(O)=C3)=O)C3=CC2=C1 VOQBEOLROSLCOG-UHFFFAOYSA-N 0.000 description 1
- SXSWMAUXEHKFGX-UHFFFAOYSA-N 2,3-dimethylbutan-1-ol Chemical compound CC(C)C(C)CO SXSWMAUXEHKFGX-UHFFFAOYSA-N 0.000 description 1
- IKECULIHBUCAKR-UHFFFAOYSA-N 2,3-dimethylbutan-2-ol Chemical compound CC(C)C(C)(C)O IKECULIHBUCAKR-UHFFFAOYSA-N 0.000 description 1
- RWEVIPRMPFNTLO-UHFFFAOYSA-N 2-(2-fluoro-4-iodoanilino)-N-(2-hydroxyethoxy)-1,5-dimethyl-6-oxo-3-pyridinecarboxamide Chemical compound CN1C(=O)C(C)=CC(C(=O)NOCCO)=C1NC1=CC=C(I)C=C1F RWEVIPRMPFNTLO-UHFFFAOYSA-N 0.000 description 1
- QNVRIHYSUZMSGM-LURJTMIESA-N 2-Hexanol Natural products CCCC[C@H](C)O QNVRIHYSUZMSGM-LURJTMIESA-N 0.000 description 1
- VHVPQPYKVGDNFY-DFMJLFEVSA-N 2-[(2r)-butan-2-yl]-4-[4-[4-[4-[[(2r,4s)-2-(2,4-dichlorophenyl)-2-(1,2,4-triazol-1-ylmethyl)-1,3-dioxolan-4-yl]methoxy]phenyl]piperazin-1-yl]phenyl]-1,2,4-triazol-3-one Chemical compound O=C1N([C@H](C)CC)N=CN1C1=CC=C(N2CCN(CC2)C=2C=CC(OC[C@@H]3O[C@](CN4N=CN=C4)(OC3)C=3C(=CC(Cl)=CC=3)Cl)=CC=2)C=C1 VHVPQPYKVGDNFY-DFMJLFEVSA-N 0.000 description 1
- MHXVDXXARZCVRK-WCWDXBQESA-N 2-[2-[4-[(e)-3,3,3-trifluoro-1,2-diphenylprop-1-enyl]phenoxy]ethylamino]ethanol Chemical compound C1=CC(OCCNCCO)=CC=C1C(\C=1C=CC=CC=1)=C(C(F)(F)F)/C1=CC=CC=C1 MHXVDXXARZCVRK-WCWDXBQESA-N 0.000 description 1
- PXJJOGITBQXZEQ-JTHROIFXSA-M 2-[4-[(z)-1,2-diphenylbut-1-enyl]phenoxy]ethyl-trimethylazanium;iodide Chemical compound [I-].C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCC[N+](C)(C)C)=CC=1)/C1=CC=CC=C1 PXJJOGITBQXZEQ-JTHROIFXSA-M 0.000 description 1
- TZYRSLHNPKPEFV-UHFFFAOYSA-N 2-ethyl-1-butanol Chemical compound CCC(CC)CO TZYRSLHNPKPEFV-UHFFFAOYSA-N 0.000 description 1
- ISTJMQSHILQAEC-UHFFFAOYSA-N 2-methyl-3-pentanol Chemical compound CCC(O)C(C)C ISTJMQSHILQAEC-UHFFFAOYSA-N 0.000 description 1
- CTRPRMNBTVRDFH-UHFFFAOYSA-N 2-n-methyl-1,3,5-triazine-2,4,6-triamine Chemical compound CNC1=NC(N)=NC(N)=N1 CTRPRMNBTVRDFH-UHFFFAOYSA-N 0.000 description 1
- DUXCSEISVMREAX-UHFFFAOYSA-N 3,3-dimethylbutan-1-ol Chemical compound CC(C)(C)CCO DUXCSEISVMREAX-UHFFFAOYSA-N 0.000 description 1
- MNIQECRMTVGZBM-UHFFFAOYSA-N 3-(1-methylpyrrolidin-2-yl)pyridine;7h-purin-6-amine Chemical compound NC1=NC=NC2=C1NC=N2.CN1CCCC1C1=CC=CN=C1 MNIQECRMTVGZBM-UHFFFAOYSA-N 0.000 description 1
- GOLORTLGFDVFDW-UHFFFAOYSA-N 3-(1h-benzimidazol-2-yl)-7-(diethylamino)chromen-2-one Chemical compound C1=CC=C2NC(C3=CC4=CC=C(C=C4OC3=O)N(CC)CC)=NC2=C1 GOLORTLGFDVFDW-UHFFFAOYSA-N 0.000 description 1
- RCLQNICOARASSR-SECBINFHSA-N 3-[(2r)-2,3-dihydroxypropyl]-6-fluoro-5-(2-fluoro-4-iodoanilino)-8-methylpyrido[2,3-d]pyrimidine-4,7-dione Chemical compound FC=1C(=O)N(C)C=2N=CN(C[C@@H](O)CO)C(=O)C=2C=1NC1=CC=C(I)C=C1F RCLQNICOARASSR-SECBINFHSA-N 0.000 description 1
- ZXNBBWHRUSXUFZ-UHFFFAOYSA-N 3-methyl-2-pentanol Chemical compound CCC(C)C(C)O ZXNBBWHRUSXUFZ-UHFFFAOYSA-N 0.000 description 1
- CLPFFLWZZBQMAO-UHFFFAOYSA-N 4-(5,6,7,8-tetrahydroimidazo[1,5-a]pyridin-5-yl)benzonitrile Chemical compound C1=CC(C#N)=CC=C1C1N2C=NC=C2CCC1 CLPFFLWZZBQMAO-UHFFFAOYSA-N 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- WVYWICLMDOOCFB-UHFFFAOYSA-N 4-methyl-2-pentanol Chemical compound CC(C)CC(C)O WVYWICLMDOOCFB-UHFFFAOYSA-N 0.000 description 1
- PCWGTDULNUVNBN-UHFFFAOYSA-N 4-methylpentan-1-ol Chemical compound CC(C)CCCO PCWGTDULNUVNBN-UHFFFAOYSA-N 0.000 description 1
- UWXSAYUXVSFDBQ-CYBMUJFWSA-N 4-n-[3-chloro-4-(1,3-thiazol-2-ylmethoxy)phenyl]-6-n-[(4r)-4-methyl-4,5-dihydro-1,3-oxazol-2-yl]quinazoline-4,6-diamine Chemical compound C[C@@H]1COC(NC=2C=C3C(NC=4C=C(Cl)C(OCC=5SC=CN=5)=CC=4)=NC=NC3=CC=2)=N1 UWXSAYUXVSFDBQ-CYBMUJFWSA-N 0.000 description 1
- YBJHBAHKTGYVGT-ZXFLCMHBSA-N 5-[(3ar,4r,6as)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoic acid Chemical compound N1C(=O)N[C@H]2[C@@H](CCCCC(=O)O)SC[C@H]21 YBJHBAHKTGYVGT-ZXFLCMHBSA-N 0.000 description 1
- IDPUKCWIGUEADI-UHFFFAOYSA-N 5-[bis(2-chloroethyl)amino]uracil Chemical compound ClCCN(CCCl)C1=CNC(=O)NC1=O IDPUKCWIGUEADI-UHFFFAOYSA-N 0.000 description 1
- XAUDJQYHKZQPEU-KVQBGUIXSA-N 5-aza-2'-deoxycytidine Chemical compound O=C1N=C(N)N=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 XAUDJQYHKZQPEU-KVQBGUIXSA-N 0.000 description 1
- STRZQWQNZQMHQR-UAKXSSHOSA-N 5-fluorocytidine Chemical compound C1=C(F)C(N)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 STRZQWQNZQMHQR-UAKXSSHOSA-N 0.000 description 1
- YHSMSRREJYOGQJ-UHFFFAOYSA-N 5-nonyloxytryptamine Chemical compound CCCCCCCCCOC1=CC=C2NC=C(CCN)C2=C1 YHSMSRREJYOGQJ-UHFFFAOYSA-N 0.000 description 1
- SDEAXTCZPQIFQM-UHFFFAOYSA-N 6-n-(4,4-dimethyl-5h-1,3-oxazol-2-yl)-4-n-[3-methyl-4-([1,2,4]triazolo[1,5-a]pyridin-7-yloxy)phenyl]quinazoline-4,6-diamine Chemical compound C=1C=C(OC2=CC3=NC=NN3C=C2)C(C)=CC=1NC(C1=C2)=NC=NC1=CC=C2NC1=NC(C)(C)CO1 SDEAXTCZPQIFQM-UHFFFAOYSA-N 0.000 description 1
- VVIAGPKUTFNRDU-UHFFFAOYSA-N 6S-folinic acid Natural products C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-UHFFFAOYSA-N 0.000 description 1
- PLIVFNIUGLLCEK-UHFFFAOYSA-N 7-[4-(3-ethynylanilino)-7-methoxyquinazolin-6-yl]oxy-n-hydroxyheptanamide Chemical compound C=12C=C(OCCCCCCC(=O)NO)C(OC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 PLIVFNIUGLLCEK-UHFFFAOYSA-N 0.000 description 1
- GOJJWDOZNKBUSR-UHFFFAOYSA-N 7-sulfamoyloxyheptyl sulfamate Chemical compound NS(=O)(=O)OCCCCCCCOS(N)(=O)=O GOJJWDOZNKBUSR-UHFFFAOYSA-N 0.000 description 1
- 102000009062 ADP Ribose Transferases Human genes 0.000 description 1
- 108010049290 ADP Ribose Transferases Proteins 0.000 description 1
- OONFNUWBHFSNBT-HXUWFJFHSA-N AEE788 Chemical compound C1CN(CC)CCN1CC1=CC=C(C=2NC3=NC=NC(N[C@H](C)C=4C=CC=CC=4)=C3C=2)C=C1 OONFNUWBHFSNBT-HXUWFJFHSA-N 0.000 description 1
- 108010066676 Abrin Proteins 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 208000009746 Adult T-Cell Leukemia-Lymphoma Diseases 0.000 description 1
- 208000016683 Adult T-cell leukemia/lymphoma Diseases 0.000 description 1
- JBVSSSZFNTXJDX-YTLHQDLWSA-N Ala-Ala-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](C)N JBVSSSZFNTXJDX-YTLHQDLWSA-N 0.000 description 1
- SDMAQFGBPOJFOM-GUBZILKMSA-N Ala-Arg-Arg Chemical compound NC(=N)NCCC[C@H](NC(=O)[C@@H](N)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O SDMAQFGBPOJFOM-GUBZILKMSA-N 0.000 description 1
- QDRGPQWIVZNJQD-CIUDSAMLSA-N Ala-Arg-Gln Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(O)=O QDRGPQWIVZNJQD-CIUDSAMLSA-N 0.000 description 1
- YAXNATKKPOWVCP-ZLUOBGJFSA-N Ala-Asn-Ala Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(O)=O YAXNATKKPOWVCP-ZLUOBGJFSA-N 0.000 description 1
- CXQODNIBUNQWAS-CIUDSAMLSA-N Ala-Gln-Arg Chemical compound C[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(O)=O)CCCN=C(N)N CXQODNIBUNQWAS-CIUDSAMLSA-N 0.000 description 1
- CSAHOYQKNHGDHX-ACZMJKKPSA-N Ala-Gln-Asn Chemical compound C[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O CSAHOYQKNHGDHX-ACZMJKKPSA-N 0.000 description 1
- HMRWQTHUDVXMGH-GUBZILKMSA-N Ala-Glu-Lys Chemical compound C[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@H](C(O)=O)CCCCN HMRWQTHUDVXMGH-GUBZILKMSA-N 0.000 description 1
- NBTGEURICRTMGL-WHFBIAKZSA-N Ala-Gly-Ser Chemical compound C[C@H](N)C(=O)NCC(=O)N[C@@H](CO)C(O)=O NBTGEURICRTMGL-WHFBIAKZSA-N 0.000 description 1
- KMGOBAQSCKTBGD-DLOVCJGASA-N Ala-His-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@H](C)N)CC1=CN=CN1 KMGOBAQSCKTBGD-DLOVCJGASA-N 0.000 description 1
- DVJSJDDYCYSMFR-ZKWXMUAHSA-N Ala-Ile-Gly Chemical compound [H]N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(O)=O DVJSJDDYCYSMFR-ZKWXMUAHSA-N 0.000 description 1
- NINQYGGNRIBFSC-CIUDSAMLSA-N Ala-Lys-Ser Chemical compound NCCCC[C@H](NC(=O)[C@@H](N)C)C(=O)N[C@@H](CO)C(O)=O NINQYGGNRIBFSC-CIUDSAMLSA-N 0.000 description 1
- OSRZOHXQCUFIQG-FPMFFAJLSA-N Ala-Phe-Pro Chemical compound C([C@H](NC(=O)[C@@H]([NH3+])C)C(=O)N1[C@H](CCC1)C([O-])=O)C1=CC=CC=C1 OSRZOHXQCUFIQG-FPMFFAJLSA-N 0.000 description 1
- MMLHRUJLOUSRJX-CIUDSAMLSA-N Ala-Ser-Lys Chemical compound C[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CCCCN MMLHRUJLOUSRJX-CIUDSAMLSA-N 0.000 description 1
- 108010011170 Ala-Trp-Arg-His-Pro-Gln-Phe-Gly-Gly Proteins 0.000 description 1
- LYILPUNCKACNGF-NAKRPEOUSA-N Ala-Val-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](C)N LYILPUNCKACNGF-NAKRPEOUSA-N 0.000 description 1
- REWSWYIDQIELBE-FXQIFTODSA-N Ala-Val-Ser Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(O)=O REWSWYIDQIELBE-FXQIFTODSA-N 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 239000012099 Alexa Fluor family Substances 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- 229920000856 Amylose Polymers 0.000 description 1
- 201000003076 Angiosarcoma Diseases 0.000 description 1
- 108020000948 Antisense Oligonucleotides Proteins 0.000 description 1
- MCYJBCKCAPERSE-FXQIFTODSA-N Arg-Ala-Asp Chemical compound OC(=O)C[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCCN=C(N)N MCYJBCKCAPERSE-FXQIFTODSA-N 0.000 description 1
- KWKQGHSSNHPGOW-BQBZGAKWSA-N Arg-Ala-Gly Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)NCC(O)=O KWKQGHSSNHPGOW-BQBZGAKWSA-N 0.000 description 1
- OTOXOKCIIQLMFH-KZVJFYERSA-N Arg-Ala-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCCN=C(N)N OTOXOKCIIQLMFH-KZVJFYERSA-N 0.000 description 1
- DXQIQUIQYAGRCC-CIUDSAMLSA-N Arg-Asp-Gln Chemical compound C(C[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N)CN=C(N)N DXQIQUIQYAGRCC-CIUDSAMLSA-N 0.000 description 1
- JVMKBJNSRZWDBO-FXQIFTODSA-N Arg-Cys-Ser Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CO)C(O)=O JVMKBJNSRZWDBO-FXQIFTODSA-N 0.000 description 1
- DGFXIWKPTDKBLF-AVGNSLFASA-N Arg-His-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CC1=CN=CN1)NC(=O)[C@H](CCCN=C(N)N)N DGFXIWKPTDKBLF-AVGNSLFASA-N 0.000 description 1
- CLICCYPMVFGUOF-IHRRRGAJSA-N Arg-Lys-Leu Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(O)=O CLICCYPMVFGUOF-IHRRRGAJSA-N 0.000 description 1
- WPOLSNAQGVHROR-GUBZILKMSA-N Asn-Gln-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CC(=O)N)N WPOLSNAQGVHROR-GUBZILKMSA-N 0.000 description 1
- XVAPVJNJGLWGCS-ACZMJKKPSA-N Asn-Glu-Asn Chemical compound C(CC(=O)O)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H](CC(=O)N)N XVAPVJNJGLWGCS-ACZMJKKPSA-N 0.000 description 1
- GFFRWIJAFFMQGM-NUMRIWBASA-N Asn-Glu-Thr Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O GFFRWIJAFFMQGM-NUMRIWBASA-N 0.000 description 1
- SUEIIIFUBHDCCS-PBCZWWQYSA-N Asn-His-Thr Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H]([C@@H](C)O)C(O)=O SUEIIIFUBHDCCS-PBCZWWQYSA-N 0.000 description 1
- XLZCLJRGGMBKLR-PCBIJLKTSA-N Asn-Ile-Phe Chemical compound NC(=O)C[C@H](N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 XLZCLJRGGMBKLR-PCBIJLKTSA-N 0.000 description 1
- PNHQRQTVBRDIEF-CIUDSAMLSA-N Asn-Leu-Ala Chemical compound C[C@@H](C(=O)O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(=O)N)N PNHQRQTVBRDIEF-CIUDSAMLSA-N 0.000 description 1
- YVXRYLVELQYAEQ-SRVKXCTJSA-N Asn-Leu-Lys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CC(=O)N)N YVXRYLVELQYAEQ-SRVKXCTJSA-N 0.000 description 1
- GKKUBLFXKRDMFC-BQBZGAKWSA-N Asn-Pro-Gly Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O GKKUBLFXKRDMFC-BQBZGAKWSA-N 0.000 description 1
- JWQWPRCDYWNVNM-ACZMJKKPSA-N Asn-Ser-Gln Chemical compound C(CC(=O)N)[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(=O)N)N JWQWPRCDYWNVNM-ACZMJKKPSA-N 0.000 description 1
- DOURAOODTFJRIC-CIUDSAMLSA-N Asn-Ser-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(=O)N)N DOURAOODTFJRIC-CIUDSAMLSA-N 0.000 description 1
- LMIWYCWRJVMAIQ-NHCYSSNCSA-N Asn-Val-Lys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CC(=O)N)N LMIWYCWRJVMAIQ-NHCYSSNCSA-N 0.000 description 1
- XOQYDFCQPWAMSA-KKHAAJSZSA-N Asn-Val-Thr Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O XOQYDFCQPWAMSA-KKHAAJSZSA-N 0.000 description 1
- ZVTDYGWRRPMFCL-WFBYXXMGSA-N Asp-Ala-Trp Chemical compound C[C@@H](C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)O)NC(=O)[C@H](CC(=O)O)N ZVTDYGWRRPMFCL-WFBYXXMGSA-N 0.000 description 1
- XYBJLTKSGFBLCS-QXEWZRGKSA-N Asp-Arg-Val Chemical compound NC(N)=NCCC[C@@H](C(=O)N[C@@H](C(C)C)C(O)=O)NC(=O)[C@@H](N)CC(O)=O XYBJLTKSGFBLCS-QXEWZRGKSA-N 0.000 description 1
- YNQIDCRRTWGHJD-ZLUOBGJFSA-N Asp-Asn-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](N)CC(O)=O YNQIDCRRTWGHJD-ZLUOBGJFSA-N 0.000 description 1
- UQBGYPFHWFZMCD-ZLUOBGJFSA-N Asp-Asn-Asn Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O UQBGYPFHWFZMCD-ZLUOBGJFSA-N 0.000 description 1
- SBHUBSDEZQFJHJ-CIUDSAMLSA-N Asp-Asp-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](N)CC(O)=O SBHUBSDEZQFJHJ-CIUDSAMLSA-N 0.000 description 1
- UCHSVZYJKJLPHF-BZSNNMDCSA-N Asp-Phe-Phe Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O UCHSVZYJKJLPHF-BZSNNMDCSA-N 0.000 description 1
- XXAMCEGRCZQGEM-ZLUOBGJFSA-N Asp-Ser-Asn Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(O)=O XXAMCEGRCZQGEM-ZLUOBGJFSA-N 0.000 description 1
- FIRWLDUOFOULCA-XIRDDKMYSA-N Asp-Trp-Lys Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CC(=O)O)N FIRWLDUOFOULCA-XIRDDKMYSA-N 0.000 description 1
- 108010024976 Asparaginase Proteins 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 201000001320 Atherosclerosis Diseases 0.000 description 1
- 108090001008 Avidin Proteins 0.000 description 1
- NOWKCMXCCJGMRR-UHFFFAOYSA-N Aziridine Chemical compound C1CN1 NOWKCMXCCJGMRR-UHFFFAOYSA-N 0.000 description 1
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 1
- 210000002237 B-cell of pancreatic islet Anatomy 0.000 description 1
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 1
- 241000193830 Bacillus <bacterium> Species 0.000 description 1
- 108091032955 Bacterial small RNA Proteins 0.000 description 1
- 206010004146 Basal cell carcinoma Diseases 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 206010005949 Bone cancer Diseases 0.000 description 1
- 208000018084 Bone neoplasm Diseases 0.000 description 1
- 208000014644 Brain disease Diseases 0.000 description 1
- 206010006417 Bronchial carcinoma Diseases 0.000 description 1
- SEEYHODCBSFJEE-UHFFFAOYSA-N C1(C(C=CC2=CC3=CC=CC=C3C=C12)=O)=O.C1(C(C=CC2=CC3=CC=CC=C3C=C12)=O)=O Chemical compound C1(C(C=CC2=CC3=CC=CC=C3C=C12)=O)=O.C1(C(C=CC2=CC3=CC=CC=C3C=C12)=O)=O SEEYHODCBSFJEE-UHFFFAOYSA-N 0.000 description 1
- IERHLVCPSMICTF-XVFCMESISA-N CMP group Chemical group P(=O)(O)(O)OC[C@@H]1[C@H]([C@H]([C@@H](O1)N1C(=O)N=C(N)C=C1)O)O IERHLVCPSMICTF-XVFCMESISA-N 0.000 description 1
- LLVZBTWPGQVVLW-SNAWJCMRSA-N CP-724714 Chemical compound C12=CC(/C=C/CNC(=O)COC)=CC=C2N=CN=C1NC(C=C1C)=CC=C1OC1=CC=C(C)N=C1 LLVZBTWPGQVVLW-SNAWJCMRSA-N 0.000 description 1
- 108091033409 CRISPR Proteins 0.000 description 1
- FVLVBPDQNARYJU-XAHDHGMMSA-N C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O Chemical compound C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O FVLVBPDQNARYJU-XAHDHGMMSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 239000005461 Canertinib Substances 0.000 description 1
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 208000024172 Cardiovascular disease Diseases 0.000 description 1
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 206010039499 Cartilage sarcomas Diseases 0.000 description 1
- 102000005403 Casein Kinases Human genes 0.000 description 1
- 108010031425 Casein Kinases Proteins 0.000 description 1
- 102000053642 Catalytic RNA Human genes 0.000 description 1
- 108090000994 Catalytic RNA Proteins 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 241000282994 Cervidae Species 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- JWBOIMRXGHLCPP-UHFFFAOYSA-N Chloditan Chemical compound C=1C=CC=C(Cl)C=1C(C(Cl)Cl)C1=CC=C(Cl)C=C1 JWBOIMRXGHLCPP-UHFFFAOYSA-N 0.000 description 1
- 206010008583 Chloroma Diseases 0.000 description 1
- 208000005243 Chondrosarcoma Diseases 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- 102000005853 Clathrin Human genes 0.000 description 1
- 108010019874 Clathrin Proteins 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 108020004635 Complementary DNA Proteins 0.000 description 1
- 229920000742 Cotton Polymers 0.000 description 1
- 241000195493 Cryptophyta Species 0.000 description 1
- VBPGTULCFGKGTF-ACZMJKKPSA-N Cys-Glu-Asp Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O VBPGTULCFGKGTF-ACZMJKKPSA-N 0.000 description 1
- SWJYSDXMTPMBHO-FXQIFTODSA-N Cys-Pro-Ser Chemical compound [H]N[C@@H](CS)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O SWJYSDXMTPMBHO-FXQIFTODSA-N 0.000 description 1
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 1
- 238000000018 DNA microarray Methods 0.000 description 1
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 1
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 1
- ZBNZXTGUTAYRHI-UHFFFAOYSA-N Dasatinib Chemical compound C=1C(N2CCN(CCO)CC2)=NC(C)=NC=1NC(S1)=NC=C1C(=O)NC1=C(C)C=CC=C1Cl ZBNZXTGUTAYRHI-UHFFFAOYSA-N 0.000 description 1
- SHIBSTMRCDJXLN-UHFFFAOYSA-N Digoxigenin Natural products C1CC(C2C(C3(C)CCC(O)CC3CC2)CC2O)(O)C2(C)C1C1=CC(=O)OC1 SHIBSTMRCDJXLN-UHFFFAOYSA-N 0.000 description 1
- 102000016607 Diphtheria Toxin Human genes 0.000 description 1
- 108010053187 Diphtheria Toxin Proteins 0.000 description 1
- 239000012591 Dulbecco’s Phosphate Buffered Saline Substances 0.000 description 1
- 208000032928 Dyslipidaemia Diseases 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 206010014733 Endometrial cancer Diseases 0.000 description 1
- 206010014759 Endometrial neoplasm Diseases 0.000 description 1
- 206010057649 Endometrial sarcoma Diseases 0.000 description 1
- 206010014958 Eosinophilic leukaemia Diseases 0.000 description 1
- 241000701533 Escherichia virus T4 Species 0.000 description 1
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 1
- 208000006168 Ewing Sarcoma Diseases 0.000 description 1
- 108700024394 Exon Proteins 0.000 description 1
- 208000001382 Experimental Melanoma Diseases 0.000 description 1
- 208000009331 Experimental Sarcoma Diseases 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 102100024785 Fibroblast growth factor 2 Human genes 0.000 description 1
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 1
- 201000008808 Fibrosarcoma Diseases 0.000 description 1
- 108090000331 Firefly luciferases Proteins 0.000 description 1
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 1
- 229910052688 Gadolinium Inorganic materials 0.000 description 1
- GYHNNYVSQQEPJS-YPZZEJLDSA-N Gallium-68 Chemical compound [68Ga] GYHNNYVSQQEPJS-YPZZEJLDSA-N 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- JRZJKWGQFNTSRN-UHFFFAOYSA-N Geldanamycin Natural products C1C(C)CC(OC)C(O)C(C)C=C(C)C(OC(N)=O)C(OC)CCC=C(C)C(=O)NC2=CC(=O)C(OC)=C1C2=O JRZJKWGQFNTSRN-UHFFFAOYSA-N 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 201000010915 Glioblastoma multiforme Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- INKFLNZBTSNFON-CIUDSAMLSA-N Gln-Ala-Arg Chemical compound NC(=O)CC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O INKFLNZBTSNFON-CIUDSAMLSA-N 0.000 description 1
- SOBBAYVQSNXYPQ-ACZMJKKPSA-N Gln-Asn-Asn Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O SOBBAYVQSNXYPQ-ACZMJKKPSA-N 0.000 description 1
- VSXBYIJUAXPAAL-WDSKDSINSA-N Gln-Gly-Ala Chemical compound OC(=O)[C@H](C)NC(=O)CNC(=O)[C@@H](N)CCC(N)=O VSXBYIJUAXPAAL-WDSKDSINSA-N 0.000 description 1
- QFXNFFZTMFHPST-DZKIICNBSA-N Gln-Phe-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=CC=C1)NC(=O)[C@H](CCC(=O)N)N QFXNFFZTMFHPST-DZKIICNBSA-N 0.000 description 1
- OUBUHIODTNUUTC-WDCWCFNPSA-N Gln-Thr-Lys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CCC(=O)N)N)O OUBUHIODTNUUTC-WDCWCFNPSA-N 0.000 description 1
- GCYFUZJHAXJKKE-KKUMJFAQSA-N Glu-Arg-Tyr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O GCYFUZJHAXJKKE-KKUMJFAQSA-N 0.000 description 1
- MLCPTRRNICEKIS-FXQIFTODSA-N Glu-Asn-Gln Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O MLCPTRRNICEKIS-FXQIFTODSA-N 0.000 description 1
- JVSBYEDSSRZQGV-GUBZILKMSA-N Glu-Asp-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](N)CCC(O)=O JVSBYEDSSRZQGV-GUBZILKMSA-N 0.000 description 1
- PKYAVRMYTBBRLS-FXQIFTODSA-N Glu-Cys-Glu Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(O)=O)C(O)=O PKYAVRMYTBBRLS-FXQIFTODSA-N 0.000 description 1
- QQLBPVKLJBAXBS-FXQIFTODSA-N Glu-Glu-Asn Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O QQLBPVKLJBAXBS-FXQIFTODSA-N 0.000 description 1
- KUTPGXNAAOQSPD-LPEHRKFASA-N Glu-Glu-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCC(=O)O)NC(=O)[C@H](CCC(=O)O)N)C(=O)O KUTPGXNAAOQSPD-LPEHRKFASA-N 0.000 description 1
- MTAOBYXRYJZRGQ-WDSKDSINSA-N Glu-Gly-Asp Chemical compound OC(=O)CC[C@H](N)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(O)=O MTAOBYXRYJZRGQ-WDSKDSINSA-N 0.000 description 1
- XMPAXPSENRSOSV-RYUDHWBXSA-N Glu-Gly-Tyr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)NCC(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O XMPAXPSENRSOSV-RYUDHWBXSA-N 0.000 description 1
- BFEZQZKEPRKKHV-SRVKXCTJSA-N Glu-Pro-Lys Chemical compound C1C[C@H](N(C1)C(=O)[C@H](CCC(=O)O)N)C(=O)N[C@@H](CCCCN)C(=O)O BFEZQZKEPRKKHV-SRVKXCTJSA-N 0.000 description 1
- QOXDAWODGSIDDI-GUBZILKMSA-N Glu-Ser-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(=O)O)N QOXDAWODGSIDDI-GUBZILKMSA-N 0.000 description 1
- HGJREIGJLUQBTJ-SZMVWBNQSA-N Glu-Trp-Leu Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H](CC(C)C)C(O)=O HGJREIGJLUQBTJ-SZMVWBNQSA-N 0.000 description 1
- XOEKMEAOMXMURD-JYJNAYRXSA-N Glu-Tyr-His Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CC2=CN=CN2)C(=O)O)NC(=O)[C@H](CCC(=O)O)N)O XOEKMEAOMXMURD-JYJNAYRXSA-N 0.000 description 1
- 208000002705 Glucose Intolerance Diseases 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- MZZSCEANQDPJER-ONGXEEELSA-N Gly-Ala-Phe Chemical compound NCC(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 MZZSCEANQDPJER-ONGXEEELSA-N 0.000 description 1
- QSDKBRMVXSWAQE-BFHQHQDPSA-N Gly-Ala-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)CN QSDKBRMVXSWAQE-BFHQHQDPSA-N 0.000 description 1
- FMVLWTYYODVFRG-BQBZGAKWSA-N Gly-Asn-Met Chemical compound CSCC[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)CN FMVLWTYYODVFRG-BQBZGAKWSA-N 0.000 description 1
- RPLLQZBOVIVGMX-QWRGUYRKSA-N Gly-Asp-Phe Chemical compound [H]NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O RPLLQZBOVIVGMX-QWRGUYRKSA-N 0.000 description 1
- JUGQPPOVWXSPKJ-RYUDHWBXSA-N Gly-Gln-Phe Chemical compound [H]NCC(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O JUGQPPOVWXSPKJ-RYUDHWBXSA-N 0.000 description 1
- FIQQRCFQXGLOSZ-WDSKDSINSA-N Gly-Glu-Asp Chemical compound [H]NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O FIQQRCFQXGLOSZ-WDSKDSINSA-N 0.000 description 1
- BHPQOIPBLYJNAW-NGZCFLSTSA-N Gly-Ile-Pro Chemical compound CC[C@H](C)[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)CN BHPQOIPBLYJNAW-NGZCFLSTSA-N 0.000 description 1
- NSVOVKWEKGEOQB-LURJTMIESA-N Gly-Pro-Gly Chemical compound NCC(=O)N1CCC[C@H]1C(=O)NCC(O)=O NSVOVKWEKGEOQB-LURJTMIESA-N 0.000 description 1
- MKIAPEZXQDILRR-YUMQZZPRSA-N Gly-Ser-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)CN MKIAPEZXQDILRR-YUMQZZPRSA-N 0.000 description 1
- ZLCLYFGMKFCDCN-XPUUQOCRSA-N Gly-Ser-Val Chemical compound CC(C)[C@H](NC(=O)[C@H](CO)NC(=O)CN)C(O)=O ZLCLYFGMKFCDCN-XPUUQOCRSA-N 0.000 description 1
- TVTZEOHWHUVYCG-KYNKHSRBSA-N Gly-Thr-Thr Chemical compound [H]NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O TVTZEOHWHUVYCG-KYNKHSRBSA-N 0.000 description 1
- WRFOZIJRODPLIA-QWRGUYRKSA-N Gly-Tyr-Cys Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)CN)O WRFOZIJRODPLIA-QWRGUYRKSA-N 0.000 description 1
- RIYIFUFFFBIOEU-KBPBESRZSA-N Gly-Tyr-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)CN)CC1=CC=C(O)C=C1 RIYIFUFFFBIOEU-KBPBESRZSA-N 0.000 description 1
- DUAWRXXTOQOECJ-JSGCOSHPSA-N Gly-Tyr-Val Chemical compound [H]NCC(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](C(C)C)C(O)=O DUAWRXXTOQOECJ-JSGCOSHPSA-N 0.000 description 1
- RYAOJUMWLWUGNW-QMMMGPOBSA-N Gly-Val-Gly Chemical compound NCC(=O)N[C@@H](C(C)C)C(=O)NCC(O)=O RYAOJUMWLWUGNW-QMMMGPOBSA-N 0.000 description 1
- ZVXMEWXHFBYJPI-LSJOCFKGSA-N Gly-Val-Ile Chemical compound [H]NCC(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O ZVXMEWXHFBYJPI-LSJOCFKGSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 229920002683 Glycosaminoglycan Polymers 0.000 description 1
- 239000000579 Gonadotropin-Releasing Hormone Substances 0.000 description 1
- BLCLNMBMMGCOAS-URPVMXJPSA-N Goserelin Chemical compound C([C@@H](C(=O)N[C@H](COC(C)(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1[C@@H](CCC1)C(=O)NNC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 BLCLNMBMMGCOAS-URPVMXJPSA-N 0.000 description 1
- 108010069236 Goserelin Proteins 0.000 description 1
- 206010018691 Granuloma Diseases 0.000 description 1
- JBCLFWXMTIKCCB-UHFFFAOYSA-N H-Gly-Phe-OH Natural products NCC(=O)NC(C(O)=O)CC1=CC=CC=C1 JBCLFWXMTIKCCB-UHFFFAOYSA-N 0.000 description 1
- 208000001258 Hemangiosarcoma Diseases 0.000 description 1
- 102000008088 Hepatocyte Nuclear Factors Human genes 0.000 description 1
- 108010049606 Hepatocyte Nuclear Factors Proteins 0.000 description 1
- 102100022047 Hepatocyte nuclear factor 4-gamma Human genes 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- MJNWEIMBXKKCSF-XVYDVKMFSA-N His-Ala-Asn Chemical compound C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H](CC1=CN=CN1)N MJNWEIMBXKKCSF-XVYDVKMFSA-N 0.000 description 1
- VDHOMPFVSABJKU-ULQDDVLXSA-N His-Phe-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=CC=C1)NC(=O)[C@H](CC2=CN=CN2)N VDHOMPFVSABJKU-ULQDDVLXSA-N 0.000 description 1
- BCSGDNGNHKBRRJ-ULQDDVLXSA-N His-Tyr-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)NC(=O)[C@H](CC2=CN=CN2)N BCSGDNGNHKBRRJ-ULQDDVLXSA-N 0.000 description 1
- 208000017604 Hodgkin disease Diseases 0.000 description 1
- 208000017662 Hodgkin disease lymphocyte depletion type stage unspecified Diseases 0.000 description 1
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 1
- 101100178250 Homo sapiens HNF4A gene Proteins 0.000 description 1
- 101000979342 Homo sapiens Nuclear factor NF-kappa-B p105 subunit Proteins 0.000 description 1
- 101000835093 Homo sapiens Transferrin receptor protein 1 Proteins 0.000 description 1
- 208000023105 Huntington disease Diseases 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- DOMWKUIIPQCAJU-LJHIYBGHSA-N Hydroxyprogesterone caproate Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)CCCCC)[C@@]1(C)CC2 DOMWKUIIPQCAJU-LJHIYBGHSA-N 0.000 description 1
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 1
- VSNHCAURESNICA-UHFFFAOYSA-N Hydroxyurea Chemical compound NC(=O)NO VSNHCAURESNICA-UHFFFAOYSA-N 0.000 description 1
- 208000037147 Hypercalcaemia Diseases 0.000 description 1
- 206010048643 Hypereosinophilic syndrome Diseases 0.000 description 1
- NBJAAWYRLGCJOF-UGYAYLCHSA-N Ile-Asp-Asn Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CC(=O)N)C(=O)O)N NBJAAWYRLGCJOF-UGYAYLCHSA-N 0.000 description 1
- JDAWAWXGAUZPNJ-ZPFDUUQYSA-N Ile-Glu-Arg Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)N JDAWAWXGAUZPNJ-ZPFDUUQYSA-N 0.000 description 1
- DFJJAVZIHDFOGQ-MNXVOIDGSA-N Ile-Glu-Lys Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](CCCCN)C(=O)O)N DFJJAVZIHDFOGQ-MNXVOIDGSA-N 0.000 description 1
- ADDYYRVQQZFIMW-MNXVOIDGSA-N Ile-Lys-Glu Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(=O)O)C(=O)O)N ADDYYRVQQZFIMW-MNXVOIDGSA-N 0.000 description 1
- YSGBJIQXTIVBHZ-AJNGGQMLSA-N Ile-Lys-Leu Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(O)=O YSGBJIQXTIVBHZ-AJNGGQMLSA-N 0.000 description 1
- JHNJNTMTZHEDLJ-NAKRPEOUSA-N Ile-Ser-Arg Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O JHNJNTMTZHEDLJ-NAKRPEOUSA-N 0.000 description 1
- BCISUQVFDGYZBO-QSFUFRPTSA-N Ile-Val-Asp Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CC(O)=O BCISUQVFDGYZBO-QSFUFRPTSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 102100039688 Insulin-like growth factor 1 receptor Human genes 0.000 description 1
- 101710184277 Insulin-like growth factor 1 receptor Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- 208000007766 Kaposi sarcoma Diseases 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- UKAUYVFTDYCKQA-VKHMYHEASA-N L-homoserine Chemical compound OC(=O)[C@@H](N)CCO UKAUYVFTDYCKQA-VKHMYHEASA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- QEFRNWWLZKMPFJ-ZXPFJRLXSA-N L-methionine (R)-S-oxide Chemical compound C[S@@](=O)CC[C@H]([NH3+])C([O-])=O QEFRNWWLZKMPFJ-ZXPFJRLXSA-N 0.000 description 1
- QEFRNWWLZKMPFJ-UHFFFAOYSA-N L-methionine sulphoxide Natural products CS(=O)CCC(N)C(O)=O QEFRNWWLZKMPFJ-UHFFFAOYSA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-L L-tartrate(2-) Chemical compound [O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O FEWJPZIEWOKRBE-JCYAYHJZSA-L 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 1
- 239000005511 L01XE05 - Sorafenib Substances 0.000 description 1
- 239000002067 L01XE06 - Dasatinib Substances 0.000 description 1
- 239000002136 L01XE07 - Lapatinib Substances 0.000 description 1
- 239000002118 L01XE12 - Vandetanib Substances 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 241000270322 Lepidosauria Species 0.000 description 1
- MJOZZTKJZQFKDK-GUBZILKMSA-N Leu-Ala-Gln Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCC(N)=O MJOZZTKJZQFKDK-GUBZILKMSA-N 0.000 description 1
- WNGVUZWBXZKQES-YUMQZZPRSA-N Leu-Ala-Gly Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C)C(=O)NCC(O)=O WNGVUZWBXZKQES-YUMQZZPRSA-N 0.000 description 1
- XBBKIIGCUMBKCO-JXUBOQSCSA-N Leu-Ala-Thr Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O XBBKIIGCUMBKCO-JXUBOQSCSA-N 0.000 description 1
- YOZCKMXHBYKOMQ-IHRRRGAJSA-N Leu-Arg-Lys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CCCCN)C(=O)O)N YOZCKMXHBYKOMQ-IHRRRGAJSA-N 0.000 description 1
- RFUBXQQFJFGJFV-GUBZILKMSA-N Leu-Asn-Gln Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O RFUBXQQFJFGJFV-GUBZILKMSA-N 0.000 description 1
- POJPZSMTTMLSTG-SRVKXCTJSA-N Leu-Asn-Lys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CCCCN)C(=O)O)N POJPZSMTTMLSTG-SRVKXCTJSA-N 0.000 description 1
- MYGQXVYRZMKRDB-SRVKXCTJSA-N Leu-Asp-Lys Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CCCCN MYGQXVYRZMKRDB-SRVKXCTJSA-N 0.000 description 1
- PVMPDMIKUVNOBD-CIUDSAMLSA-N Leu-Asp-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(O)=O PVMPDMIKUVNOBD-CIUDSAMLSA-N 0.000 description 1
- QLQHWWCSCLZUMA-KKUMJFAQSA-N Leu-Asp-Tyr Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 QLQHWWCSCLZUMA-KKUMJFAQSA-N 0.000 description 1
- CSFVADKICPDRRF-KKUMJFAQSA-N Leu-His-Leu Chemical compound CC(C)C[C@H]([NH3+])C(=O)N[C@H](C(=O)N[C@@H](CC(C)C)C([O-])=O)CC1=CN=CN1 CSFVADKICPDRRF-KKUMJFAQSA-N 0.000 description 1
- QJXHMYMRGDOHRU-NHCYSSNCSA-N Leu-Ile-Gly Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(O)=O QJXHMYMRGDOHRU-NHCYSSNCSA-N 0.000 description 1
- QNBVTHNJGCOVFA-AVGNSLFASA-N Leu-Leu-Glu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CCC(O)=O QNBVTHNJGCOVFA-AVGNSLFASA-N 0.000 description 1
- LXKNSJLSGPNHSK-KKUMJFAQSA-N Leu-Leu-Lys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)O)N LXKNSJLSGPNHSK-KKUMJFAQSA-N 0.000 description 1
- RXGLHDWAZQECBI-SRVKXCTJSA-N Leu-Leu-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O RXGLHDWAZQECBI-SRVKXCTJSA-N 0.000 description 1
- HVHRPWQEQHIQJF-AVGNSLFASA-N Leu-Lys-Glu Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(O)=O HVHRPWQEQHIQJF-AVGNSLFASA-N 0.000 description 1
- GCXGCIYIHXSKAY-ULQDDVLXSA-N Leu-Phe-Arg Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O GCXGCIYIHXSKAY-ULQDDVLXSA-N 0.000 description 1
- RGUXWMDNCPMQFB-YUMQZZPRSA-N Leu-Ser-Gly Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CO)C(=O)NCC(O)=O RGUXWMDNCPMQFB-YUMQZZPRSA-N 0.000 description 1
- IWMJFLJQHIDZQW-KKUMJFAQSA-N Leu-Ser-Phe Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 IWMJFLJQHIDZQW-KKUMJFAQSA-N 0.000 description 1
- SBANPBVRHYIMRR-UHFFFAOYSA-N Leu-Ser-Pro Natural products CC(C)CC(N)C(=O)NC(CO)C(=O)N1CCCC1C(O)=O SBANPBVRHYIMRR-UHFFFAOYSA-N 0.000 description 1
- BRTVHXHCUSXYRI-CIUDSAMLSA-N Leu-Ser-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O BRTVHXHCUSXYRI-CIUDSAMLSA-N 0.000 description 1
- QWWPYKKLXWOITQ-VOAKCMCISA-N Leu-Thr-Leu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CC(C)C QWWPYKKLXWOITQ-VOAKCMCISA-N 0.000 description 1
- AIQWYVFNBNNOLU-RHYQMDGZSA-N Leu-Thr-Val Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O AIQWYVFNBNNOLU-RHYQMDGZSA-N 0.000 description 1
- VHTIZYYHIUHMCA-JYJNAYRXSA-N Leu-Tyr-Gln Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCC(N)=O)C(O)=O VHTIZYYHIUHMCA-JYJNAYRXSA-N 0.000 description 1
- SEOXPEFQEOYURL-PMVMPFDFSA-N Leu-Tyr-Trp Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(O)=O SEOXPEFQEOYURL-PMVMPFDFSA-N 0.000 description 1
- VQHUBNVKFFLWRP-ULQDDVLXSA-N Leu-Tyr-Val Chemical compound CC(C)C[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](C(C)C)C(O)=O)CC1=CC=C(O)C=C1 VQHUBNVKFFLWRP-ULQDDVLXSA-N 0.000 description 1
- AIMGJYMCTAABEN-GVXVVHGQSA-N Leu-Val-Glu Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O AIMGJYMCTAABEN-GVXVVHGQSA-N 0.000 description 1
- MSFITIBEMPWCBD-ULQDDVLXSA-N Leu-Val-Tyr Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 MSFITIBEMPWCBD-ULQDDVLXSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 102000004058 Leukemia inhibitory factor Human genes 0.000 description 1
- 108090000581 Leukemia inhibitory factor Proteins 0.000 description 1
- 208000017170 Lipid metabolism disease Diseases 0.000 description 1
- 206010024612 Lipoma Diseases 0.000 description 1
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 1
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 1
- YIBOAHAOAWACDK-QEJZJMRPSA-N Lys-Ala-Phe Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 YIBOAHAOAWACDK-QEJZJMRPSA-N 0.000 description 1
- HQVDJTYKCMIWJP-YUMQZZPRSA-N Lys-Asn-Gly Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(O)=O HQVDJTYKCMIWJP-YUMQZZPRSA-N 0.000 description 1
- OVIVOCSURJYCTM-GUBZILKMSA-N Lys-Asp-Glu Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CCC(O)=O OVIVOCSURJYCTM-GUBZILKMSA-N 0.000 description 1
- AAORVPFVUIHEAB-YUMQZZPRSA-N Lys-Asp-Gly Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)NCC(O)=O AAORVPFVUIHEAB-YUMQZZPRSA-N 0.000 description 1
- QIJVAFLRMVBHMU-KKUMJFAQSA-N Lys-Asp-Phe Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O QIJVAFLRMVBHMU-KKUMJFAQSA-N 0.000 description 1
- NRQRKMYZONPCTM-CIUDSAMLSA-N Lys-Asp-Ser Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(O)=O NRQRKMYZONPCTM-CIUDSAMLSA-N 0.000 description 1
- PBLLTSKBTAHDNA-KBPBESRZSA-N Lys-Gly-Phe Chemical compound [H]N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O PBLLTSKBTAHDNA-KBPBESRZSA-N 0.000 description 1
- HAUUXTXKJNVIFY-ONGXEEELSA-N Lys-Gly-Val Chemical compound [H]N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](C(C)C)C(O)=O HAUUXTXKJNVIFY-ONGXEEELSA-N 0.000 description 1
- OJDFAABAHBPVTH-MNXVOIDGSA-N Lys-Ile-Gln Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCC(N)=O)C(O)=O OJDFAABAHBPVTH-MNXVOIDGSA-N 0.000 description 1
- ZXFRGTAIIZHNHG-AJNGGQMLSA-N Lys-Ile-Leu Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(C)C)C(=O)O)NC(=O)[C@H](CCCCN)N ZXFRGTAIIZHNHG-AJNGGQMLSA-N 0.000 description 1
- NCZIQZYZPUPMKY-PPCPHDFISA-N Lys-Ile-Thr Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(O)=O NCZIQZYZPUPMKY-PPCPHDFISA-N 0.000 description 1
- MYZMQWHPDAYKIE-SRVKXCTJSA-N Lys-Leu-Ala Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(O)=O MYZMQWHPDAYKIE-SRVKXCTJSA-N 0.000 description 1
- NJNRBRKHOWSGMN-SRVKXCTJSA-N Lys-Leu-Asn Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(O)=O NJNRBRKHOWSGMN-SRVKXCTJSA-N 0.000 description 1
- AIRZWUMAHCDDHR-KKUMJFAQSA-N Lys-Leu-Leu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O AIRZWUMAHCDDHR-KKUMJFAQSA-N 0.000 description 1
- XIZQPFCRXLUNMK-BZSNNMDCSA-N Lys-Leu-Phe Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)NC(=O)[C@H](CCCCN)N XIZQPFCRXLUNMK-BZSNNMDCSA-N 0.000 description 1
- WRODMZBHNNPRLN-SRVKXCTJSA-N Lys-Leu-Ser Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O WRODMZBHNNPRLN-SRVKXCTJSA-N 0.000 description 1
- LJADEBULDNKJNK-IHRRRGAJSA-N Lys-Leu-Val Chemical compound CC(C)C[C@H](NC(=O)[C@@H](N)CCCCN)C(=O)N[C@@H](C(C)C)C(O)=O LJADEBULDNKJNK-IHRRRGAJSA-N 0.000 description 1
- LUTDBHBIHHREDC-IHRRRGAJSA-N Lys-Pro-Lys Chemical compound NCCCC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCCCN)C(O)=O LUTDBHBIHHREDC-IHRRRGAJSA-N 0.000 description 1
- VWPJQIHBBOJWDN-DCAQKATOSA-N Lys-Val-Ala Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C)C(O)=O VWPJQIHBBOJWDN-DCAQKATOSA-N 0.000 description 1
- XBAJINCXDBTJRH-WDSOQIARSA-N Lys-Val-Trp Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)O)NC(=O)[C@H](CCCCN)N XBAJINCXDBTJRH-WDSOQIARSA-N 0.000 description 1
- 102000043136 MAP kinase family Human genes 0.000 description 1
- 108091054455 MAP kinase family Proteins 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- PWHULOQIROXLJO-UHFFFAOYSA-N Manganese Chemical compound [Mn] PWHULOQIROXLJO-UHFFFAOYSA-N 0.000 description 1
- 102000004318 Matrilysin Human genes 0.000 description 1
- 108090000855 Matrilysin Proteins 0.000 description 1
- 102000000422 Matrix Metalloproteinase 3 Human genes 0.000 description 1
- 208000007054 Medullary Carcinoma Diseases 0.000 description 1
- 208000000172 Medulloblastoma Diseases 0.000 description 1
- 108010090054 Membrane Glycoproteins Proteins 0.000 description 1
- 102000012750 Membrane Glycoproteins Human genes 0.000 description 1
- 206010027406 Mesothelioma Diseases 0.000 description 1
- MDXAULHWGWETHF-SRVKXCTJSA-N Met-Arg-Val Chemical compound CSCC[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](C(C)C)C(O)=O)CCCNC(N)=N MDXAULHWGWETHF-SRVKXCTJSA-N 0.000 description 1
- MCNGIXXCMJAURZ-VEVYYDQMSA-N Met-Asp-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](CCSC)N)O MCNGIXXCMJAURZ-VEVYYDQMSA-N 0.000 description 1
- MYAPQOBHGWJZOM-UWVGGRQHSA-N Met-Gly-Leu Chemical compound CSCC[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CC(C)C MYAPQOBHGWJZOM-UWVGGRQHSA-N 0.000 description 1
- JKXVPNCSAMWUEJ-GUBZILKMSA-N Met-Met-Asp Chemical compound [H]N[C@@H](CCSC)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(O)=O)C(O)=O JKXVPNCSAMWUEJ-GUBZILKMSA-N 0.000 description 1
- QAVZUKIPOMBLMC-AVGNSLFASA-N Met-Val-Leu Chemical compound CSCC[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CC(C)C QAVZUKIPOMBLMC-AVGNSLFASA-N 0.000 description 1
- IIHMNTBFPMRJCN-RCWTZXSCSA-N Met-Val-Thr Chemical compound CSCC[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O IIHMNTBFPMRJCN-RCWTZXSCSA-N 0.000 description 1
- 208000001145 Metabolic Syndrome Diseases 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- 238000006845 Michael addition reaction Methods 0.000 description 1
- 238000006957 Michael reaction Methods 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 206010028289 Muscle atrophy Diseases 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- 201000002481 Myositis Diseases 0.000 description 1
- AUEJLPRZGVVDNU-UHFFFAOYSA-N N-L-tyrosyl-L-leucine Natural products CC(C)CC(C(O)=O)NC(=O)C(N)CC1=CC=C(O)C=C1 AUEJLPRZGVVDNU-UHFFFAOYSA-N 0.000 description 1
- MVZGYPSXNDCANY-UHFFFAOYSA-N N-[4-[3-chloro-4-[(3-fluorophenyl)methoxy]anilino]-6-quinazolinyl]-2-propenamide Chemical compound FC1=CC=CC(COC=2C(=CC(NC=3C4=CC(NC(=O)C=C)=CC=C4N=CN=3)=CC=2)Cl)=C1 MVZGYPSXNDCANY-UHFFFAOYSA-N 0.000 description 1
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 1
- 108010079364 N-glycylalanine Proteins 0.000 description 1
- 108010057466 NF-kappa B Proteins 0.000 description 1
- 102000003945 NF-kappa B Human genes 0.000 description 1
- 108010047562 NGR peptide Proteins 0.000 description 1
- 208000002454 Nasopharyngeal Carcinoma Diseases 0.000 description 1
- 206010061306 Nasopharyngeal cancer Diseases 0.000 description 1
- 229930193140 Neomycin Natural products 0.000 description 1
- 206010061309 Neoplasm progression Diseases 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- 206010029488 Nodular melanoma Diseases 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 238000000636 Northern blotting Methods 0.000 description 1
- 102100023050 Nuclear factor NF-kappa-B p105 subunit Human genes 0.000 description 1
- 108020005497 Nuclear hormone receptor Proteins 0.000 description 1
- 108020004711 Nucleic Acid Probes Proteins 0.000 description 1
- HBPQPBSTHOHSFP-UHFFFAOYSA-N OC(=O)C([Pt])=O Chemical compound OC(=O)C([Pt])=O HBPQPBSTHOHSFP-UHFFFAOYSA-N 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 1
- LYNKVJADAPZJIK-UHFFFAOYSA-H P([O-])([O-])=O.[B+3].P([O-])([O-])=O.P([O-])([O-])=O.[B+3] Chemical compound P([O-])([O-])=O.[B+3].P([O-])([O-])=O.P([O-])([O-])=O.[B+3] LYNKVJADAPZJIK-UHFFFAOYSA-H 0.000 description 1
- 208000025618 Paget disease of nipple Diseases 0.000 description 1
- 208000024024 Paget disease of the nipple Diseases 0.000 description 1
- 241000282579 Pan Species 0.000 description 1
- 229930040373 Paraformaldehyde Natural products 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- 108091093037 Peptide nucleic acid Proteins 0.000 description 1
- 206010057249 Phagocytosis Diseases 0.000 description 1
- CYZBFPYMSJGBRL-DRZSPHRISA-N Phe-Ala-Glu Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(O)=O CYZBFPYMSJGBRL-DRZSPHRISA-N 0.000 description 1
- UHRNIXJAGGLKHP-DLOVCJGASA-N Phe-Ala-Ser Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(O)=O UHRNIXJAGGLKHP-DLOVCJGASA-N 0.000 description 1
- MPGJIHFJCXTVEX-KKUMJFAQSA-N Phe-Arg-Glu Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(O)=O MPGJIHFJCXTVEX-KKUMJFAQSA-N 0.000 description 1
- HPECNYCQLSVCHH-BZSNNMDCSA-N Phe-Cys-Phe Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC2=CC=CC=C2)C(=O)O)N HPECNYCQLSVCHH-BZSNNMDCSA-N 0.000 description 1
- IDUCUXTUHHIQIP-SOUVJXGZSA-N Phe-Gln-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CC2=CC=CC=C2)N)C(=O)O IDUCUXTUHHIQIP-SOUVJXGZSA-N 0.000 description 1
- WPTYDQPGBMDUBI-QWRGUYRKSA-N Phe-Gly-Asn Chemical compound N[C@@H](Cc1ccccc1)C(=O)NCC(=O)N[C@@H](CC(N)=O)C(O)=O WPTYDQPGBMDUBI-QWRGUYRKSA-N 0.000 description 1
- NAXPHWZXEXNDIW-JTQLQIEISA-N Phe-Gly-Gly Chemical compound OC(=O)CNC(=O)CNC(=O)[C@@H](N)CC1=CC=CC=C1 NAXPHWZXEXNDIW-JTQLQIEISA-N 0.000 description 1
- XEXSSIBQYNKFBX-KBPBESRZSA-N Phe-Gly-His Chemical compound C([C@H](N)C(=O)NCC(=O)N[C@@H](CC=1N=CNC=1)C(O)=O)C1=CC=CC=C1 XEXSSIBQYNKFBX-KBPBESRZSA-N 0.000 description 1
- QPVFUAUFEBPIPT-CDMKHQONSA-N Phe-Gly-Thr Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(O)=O QPVFUAUFEBPIPT-CDMKHQONSA-N 0.000 description 1
- YCCUXNNKXDGMAM-KKUMJFAQSA-N Phe-Leu-Ser Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O YCCUXNNKXDGMAM-KKUMJFAQSA-N 0.000 description 1
- GPSMLZQVIIYLDK-ULQDDVLXSA-N Phe-Lys-Val Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(O)=O GPSMLZQVIIYLDK-ULQDDVLXSA-N 0.000 description 1
- QRUOLOPKCOEZKU-HJWJTTGWSA-N Phe-Met-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CCSC)NC(=O)[C@H](CC1=CC=CC=C1)N QRUOLOPKCOEZKU-HJWJTTGWSA-N 0.000 description 1
- JLLJTMHNXQTMCK-UBHSHLNASA-N Phe-Pro-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)CC1=CC=CC=C1 JLLJTMHNXQTMCK-UBHSHLNASA-N 0.000 description 1
- ZJPGOXWRFNKIQL-JYJNAYRXSA-N Phe-Pro-Pro Chemical compound C([C@H](N)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(O)=O)C1=CC=CC=C1 ZJPGOXWRFNKIQL-JYJNAYRXSA-N 0.000 description 1
- XDMMOISUAHXXFD-SRVKXCTJSA-N Phe-Ser-Asp Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(O)=O XDMMOISUAHXXFD-SRVKXCTJSA-N 0.000 description 1
- UNBFGVQVQGXXCK-KKUMJFAQSA-N Phe-Ser-Leu Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O UNBFGVQVQGXXCK-KKUMJFAQSA-N 0.000 description 1
- ZVJGAXNBBKPYOE-HKUYNNGSSA-N Phe-Trp-Gly Chemical compound C([C@H](N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)NCC(O)=O)C1=CC=CC=C1 ZVJGAXNBBKPYOE-HKUYNNGSSA-N 0.000 description 1
- GLUYKHMBGKQBHE-JYJNAYRXSA-N Phe-Val-Arg Chemical compound NC(=N)NCCC[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](N)CC1=CC=CC=C1 GLUYKHMBGKQBHE-JYJNAYRXSA-N 0.000 description 1
- GNZCMRRSXOBHLC-JYJNAYRXSA-N Phe-Val-Met Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCSC)C(=O)O)NC(=O)[C@H](CC1=CC=CC=C1)N GNZCMRRSXOBHLC-JYJNAYRXSA-N 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 102000010752 Plasminogen Inactivators Human genes 0.000 description 1
- 108010077971 Plasminogen Inactivators Proteins 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- IHCXPSYCHXFXKT-DCAQKATOSA-N Pro-Arg-Glu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(O)=O IHCXPSYCHXFXKT-DCAQKATOSA-N 0.000 description 1
- XWYXZPHPYKRYPA-GMOBBJLQSA-N Pro-Asn-Ile Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O XWYXZPHPYKRYPA-GMOBBJLQSA-N 0.000 description 1
- XQSREVQDGCPFRJ-STQMWFEESA-N Pro-Gly-Phe Chemical compound [H]N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O XQSREVQDGCPFRJ-STQMWFEESA-N 0.000 description 1
- AUQGUYPHJSMAKI-CYDGBPFRSA-N Pro-Ile-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@@H]1CCCN1 AUQGUYPHJSMAKI-CYDGBPFRSA-N 0.000 description 1
- XYSXOCIWCPFOCG-IHRRRGAJSA-N Pro-Leu-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O XYSXOCIWCPFOCG-IHRRRGAJSA-N 0.000 description 1
- FKYKZHOKDOPHSA-DCAQKATOSA-N Pro-Leu-Ser Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O FKYKZHOKDOPHSA-DCAQKATOSA-N 0.000 description 1
- XQPHBAKJJJZOBX-SRVKXCTJSA-N Pro-Lys-Glu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(O)=O XQPHBAKJJJZOBX-SRVKXCTJSA-N 0.000 description 1
- QKDIHFHGHBYTKB-IHRRRGAJSA-N Pro-Ser-Phe Chemical compound N([C@@H](CO)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C(=O)[C@@H]1CCCN1 QKDIHFHGHBYTKB-IHRRRGAJSA-N 0.000 description 1
- YHUBAXGAAYULJY-ULQDDVLXSA-N Pro-Tyr-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(C)C)C(O)=O YHUBAXGAAYULJY-ULQDDVLXSA-N 0.000 description 1
- QKWYXRPICJEQAJ-KJEVXHAQSA-N Pro-Tyr-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)NC(=O)[C@@H]2CCCN2)O QKWYXRPICJEQAJ-KJEVXHAQSA-N 0.000 description 1
- WWXNZNWZNZPDIF-SRVKXCTJSA-N Pro-Val-Arg Chemical compound NC(N)=NCCC[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H]1CCCN1 WWXNZNWZNZPDIF-SRVKXCTJSA-N 0.000 description 1
- JXVXYRZQIUPYSA-NHCYSSNCSA-N Pro-Val-Gln Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O JXVXYRZQIUPYSA-NHCYSSNCSA-N 0.000 description 1
- YDTUEBLEAVANFH-RCWTZXSCSA-N Pro-Val-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H]1CCCN1 YDTUEBLEAVANFH-RCWTZXSCSA-N 0.000 description 1
- 206010036790 Productive cough Diseases 0.000 description 1
- 208000033826 Promyelocytic Acute Leukemia Diseases 0.000 description 1
- 229940079156 Proteasome inhibitor Drugs 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 201000001263 Psoriatic Arthritis Diseases 0.000 description 1
- 208000036824 Psoriatic arthropathy Diseases 0.000 description 1
- 102000003901 Ras GTPase-activating proteins Human genes 0.000 description 1
- 108090000231 Ras GTPase-activating proteins Proteins 0.000 description 1
- 229940078123 Ras inhibitor Drugs 0.000 description 1
- 230000010799 Receptor Interactions Effects 0.000 description 1
- 208000006265 Renal cell carcinoma Diseases 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- ZQUSFAUAYSEREK-WKILWMFISA-N SB-239063 Chemical compound COC1=NC=CC(C=2N(C=NC=2C=2C=CC(F)=CC=2)[C@@H]2CC[C@@H](O)CC2)=N1 ZQUSFAUAYSEREK-WKILWMFISA-N 0.000 description 1
- 201000001542 Schneiderian carcinoma Diseases 0.000 description 1
- 108091081021 Sense strand Proteins 0.000 description 1
- FIXILCYTSAUERA-FXQIFTODSA-N Ser-Ala-Arg Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O FIXILCYTSAUERA-FXQIFTODSA-N 0.000 description 1
- IDQFQFVEWMWRQQ-DLOVCJGASA-N Ser-Ala-Phe Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O IDQFQFVEWMWRQQ-DLOVCJGASA-N 0.000 description 1
- YQHZVYJAGWMHES-ZLUOBGJFSA-N Ser-Ala-Ser Chemical compound OC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(O)=O YQHZVYJAGWMHES-ZLUOBGJFSA-N 0.000 description 1
- WDXYVIIVDIDOSX-DCAQKATOSA-N Ser-Arg-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CO)CCCN=C(N)N WDXYVIIVDIDOSX-DCAQKATOSA-N 0.000 description 1
- FIDMVVBUOCMMJG-CIUDSAMLSA-N Ser-Asn-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](N)CO FIDMVVBUOCMMJG-CIUDSAMLSA-N 0.000 description 1
- TYYBJUYSTWJHGO-ZKWXMUAHSA-N Ser-Asn-Val Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(O)=O TYYBJUYSTWJHGO-ZKWXMUAHSA-N 0.000 description 1
- QKQDTEYDEIJPNK-GUBZILKMSA-N Ser-Glu-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CO QKQDTEYDEIJPNK-GUBZILKMSA-N 0.000 description 1
- GZFAWAQTEYDKII-YUMQZZPRSA-N Ser-Gly-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CO GZFAWAQTEYDKII-YUMQZZPRSA-N 0.000 description 1
- DLPXTCTVNDTYGJ-JBDRJPRFSA-N Ser-Ile-Cys Chemical compound OC[C@H](N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CS)C(O)=O DLPXTCTVNDTYGJ-JBDRJPRFSA-N 0.000 description 1
- DOSZISJPMCYEHT-NAKRPEOUSA-N Ser-Ile-Val Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C(C)C)C(O)=O DOSZISJPMCYEHT-NAKRPEOUSA-N 0.000 description 1
- KCNSGAMPBPYUAI-CIUDSAMLSA-N Ser-Leu-Asn Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(O)=O KCNSGAMPBPYUAI-CIUDSAMLSA-N 0.000 description 1
- GJFYFGOEWLDQGW-GUBZILKMSA-N Ser-Leu-Gln Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](CO)N GJFYFGOEWLDQGW-GUBZILKMSA-N 0.000 description 1
- QUGRFWPMPVIAPW-IHRRRGAJSA-N Ser-Pro-Phe Chemical compound OC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 QUGRFWPMPVIAPW-IHRRRGAJSA-N 0.000 description 1
- HAYADTTXNZFUDM-IHRRRGAJSA-N Ser-Tyr-Val Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](C(C)C)C(O)=O HAYADTTXNZFUDM-IHRRRGAJSA-N 0.000 description 1
- MFQMZDPAZRZAPV-NAKRPEOUSA-N Ser-Val-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CO)N MFQMZDPAZRZAPV-NAKRPEOUSA-N 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 102000039471 Small Nuclear RNA Human genes 0.000 description 1
- 108020003224 Small Nucleolar RNA Proteins 0.000 description 1
- 102000042773 Small Nucleolar RNA Human genes 0.000 description 1
- 238000002105 Southern blotting Methods 0.000 description 1
- 241000256248 Spodoptera Species 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 208000005718 Stomach Neoplasms Diseases 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 206010057644 Testis cancer Diseases 0.000 description 1
- PDMMFKSKQVNJMI-BLQWBTBKSA-N Testosterone propionate Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](OC(=O)CC)[C@@]1(C)CC2 PDMMFKSKQVNJMI-BLQWBTBKSA-N 0.000 description 1
- BSNZTJXVDOINSR-JXUBOQSCSA-N Thr-Ala-Leu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(O)=O BSNZTJXVDOINSR-JXUBOQSCSA-N 0.000 description 1
- VXMHQKHDKCATDV-VEVYYDQMSA-N Thr-Asp-Arg Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O VXMHQKHDKCATDV-VEVYYDQMSA-N 0.000 description 1
- KRPKYGOFYUNIGM-XVSYOHENSA-N Thr-Asp-Phe Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)N)O KRPKYGOFYUNIGM-XVSYOHENSA-N 0.000 description 1
- OHAJHDJOCKKJLV-LKXGYXEUSA-N Thr-Asp-Ser Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(O)=O OHAJHDJOCKKJLV-LKXGYXEUSA-N 0.000 description 1
- DCLBXIWHLVEPMQ-JRQIVUDYSA-N Thr-Asp-Tyr Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 DCLBXIWHLVEPMQ-JRQIVUDYSA-N 0.000 description 1
- NRUPKQSXTJNQGD-XGEHTFHBSA-N Thr-Cys-Arg Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O NRUPKQSXTJNQGD-XGEHTFHBSA-N 0.000 description 1
- ONNSECRQFSTMCC-XKBZYTNZSA-N Thr-Glu-Ser Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(O)=O ONNSECRQFSTMCC-XKBZYTNZSA-N 0.000 description 1
- NIEWSKWFURSECR-FOHZUACHSA-N Thr-Gly-Asp Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(O)=O NIEWSKWFURSECR-FOHZUACHSA-N 0.000 description 1
- KBBRNEDOYWMIJP-KYNKHSRBSA-N Thr-Gly-Thr Chemical compound C[C@H]([C@@H](C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)O)N)O KBBRNEDOYWMIJP-KYNKHSRBSA-N 0.000 description 1
- IGGFFPOIFHZYKC-PBCZWWQYSA-N Thr-His-Asp Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)N[C@@H](CC(=O)O)C(=O)O)N)O IGGFFPOIFHZYKC-PBCZWWQYSA-N 0.000 description 1
- NCXVJIQMWSGRHY-KXNHARMFSA-N Thr-Leu-Pro Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N1CCC[C@@H]1C(=O)O)N)O NCXVJIQMWSGRHY-KXNHARMFSA-N 0.000 description 1
- KRDSCBLRHORMRK-JXUBOQSCSA-N Thr-Lys-Ala Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(O)=O KRDSCBLRHORMRK-JXUBOQSCSA-N 0.000 description 1
- PUEWAXRPXOEQOW-HJGDQZAQSA-N Thr-Met-Gln Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(N)=O)C(O)=O PUEWAXRPXOEQOW-HJGDQZAQSA-N 0.000 description 1
- STUAPCLEDMKXKL-LKXGYXEUSA-N Thr-Ser-Asn Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(O)=O STUAPCLEDMKXKL-LKXGYXEUSA-N 0.000 description 1
- YRJOLUDFVAUXLI-GSSVUCPTSA-N Thr-Thr-Asp Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CC(O)=O YRJOLUDFVAUXLI-GSSVUCPTSA-N 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 208000033781 Thyroid carcinoma Diseases 0.000 description 1
- 102000011923 Thyrotropin Human genes 0.000 description 1
- 108010061174 Thyrotropin Proteins 0.000 description 1
- IVTVGDXNLFLDRM-HNNXBMFYSA-N Tomudex Chemical compound C=1C=C2NC(C)=NC(=O)C2=CC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)S1 IVTVGDXNLFLDRM-HNNXBMFYSA-N 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- MEZCXKYMMQJRDE-PMVMPFDFSA-N Trp-Leu-Tyr Chemical compound C([C@H](NC(=O)[C@@H](NC(=O)[C@@H](N)CC=1C2=CC=CC=C2NC=1)CC(C)C)C(O)=O)C1=CC=C(O)C=C1 MEZCXKYMMQJRDE-PMVMPFDFSA-N 0.000 description 1
- SUEGAFMNTXXNLR-WFBYXXMGSA-N Trp-Ser-Ala Chemical compound [H]N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(O)=O SUEGAFMNTXXNLR-WFBYXXMGSA-N 0.000 description 1
- WBZOZLNLXVBCNW-LTHWPDAASA-N Trp-Thr-Ile Chemical compound C1=CC=C2C(C[C@H](N)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(O)=O)[C@@H](C)O)=CNC2=C1 WBZOZLNLXVBCNW-LTHWPDAASA-N 0.000 description 1
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 1
- QAYSODICXVZUIA-WLTAIBSBSA-N Tyr-Gly-Thr Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(O)=O QAYSODICXVZUIA-WLTAIBSBSA-N 0.000 description 1
- NXRGXTBPMOGFID-CFMVVWHZSA-N Tyr-Ile-Asn Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(O)=O NXRGXTBPMOGFID-CFMVVWHZSA-N 0.000 description 1
- JLKVWTICWVWGSK-JYJNAYRXSA-N Tyr-Lys-Glu Chemical compound OC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 JLKVWTICWVWGSK-JYJNAYRXSA-N 0.000 description 1
- YSGAPESOXHFTQY-IHRRRGAJSA-N Tyr-Met-Asp Chemical compound CSCC[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)N YSGAPESOXHFTQY-IHRRRGAJSA-N 0.000 description 1
- ITDWWLTTWRRLCC-KJEVXHAQSA-N Tyr-Thr-Arg Chemical compound NC(N)=NCCC[C@@H](C(O)=O)NC(=O)[C@H]([C@H](O)C)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 ITDWWLTTWRRLCC-KJEVXHAQSA-N 0.000 description 1
- PWKMJDQXKCENMF-MEYUZBJRSA-N Tyr-Thr-Leu Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O PWKMJDQXKCENMF-MEYUZBJRSA-N 0.000 description 1
- AOIZTZRWMSPPAY-KAOXEZKKSA-N Tyr-Thr-Pro Chemical compound C[C@H]([C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CC2=CC=C(C=C2)O)N)O AOIZTZRWMSPPAY-KAOXEZKKSA-N 0.000 description 1
- RVGVIWNHABGIFH-IHRRRGAJSA-N Tyr-Val-Ser Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(O)=O RVGVIWNHABGIFH-IHRRRGAJSA-N 0.000 description 1
- 208000025865 Ulcer Diseases 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- DDRBQONWVBDQOY-GUBZILKMSA-N Val-Ala-Arg Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O DDRBQONWVBDQOY-GUBZILKMSA-N 0.000 description 1
- ASQFIHTXXMFENG-XPUUQOCRSA-N Val-Ala-Gly Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C)C(=O)NCC(O)=O ASQFIHTXXMFENG-XPUUQOCRSA-N 0.000 description 1
- UDNYEPLJTRDMEJ-RCOVLWMOSA-N Val-Asn-Gly Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)NCC(=O)O)N UDNYEPLJTRDMEJ-RCOVLWMOSA-N 0.000 description 1
- VLOYGOZDPGYWFO-LAEOZQHASA-N Val-Asp-Glu Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O VLOYGOZDPGYWFO-LAEOZQHASA-N 0.000 description 1
- QHDXUYOYTPWCSK-RCOVLWMOSA-N Val-Asp-Gly Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)NCC(=O)O)N QHDXUYOYTPWCSK-RCOVLWMOSA-N 0.000 description 1
- ROLGIBMFNMZANA-GVXVVHGQSA-N Val-Glu-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](C(C)C)N ROLGIBMFNMZANA-GVXVVHGQSA-N 0.000 description 1
- ZXAGTABZUOMUDO-GVXVVHGQSA-N Val-Glu-Lys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](CCCCN)C(=O)O)N ZXAGTABZUOMUDO-GVXVVHGQSA-N 0.000 description 1
- MHAHQDBEIDPFQS-NHCYSSNCSA-N Val-Glu-Met Chemical compound CSCC[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)C(C)C MHAHQDBEIDPFQS-NHCYSSNCSA-N 0.000 description 1
- WDIGUPHXPBMODF-UMNHJUIQSA-N Val-Glu-Pro Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N1CCC[C@@H]1C(=O)O)N WDIGUPHXPBMODF-UMNHJUIQSA-N 0.000 description 1
- UMPVMAYCLYMYGA-ONGXEEELSA-N Val-Leu-Gly Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O UMPVMAYCLYMYGA-ONGXEEELSA-N 0.000 description 1
- DAVNYIUELQBTAP-XUXIUFHCSA-N Val-Leu-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C(C)C)N DAVNYIUELQBTAP-XUXIUFHCSA-N 0.000 description 1
- MLADEWAIYAPAAU-IHRRRGAJSA-N Val-Lys-His Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N MLADEWAIYAPAAU-IHRRRGAJSA-N 0.000 description 1
- BCBFMJYTNKDALA-UFYCRDLUSA-N Val-Phe-Phe Chemical compound N[C@@H](C(C)C)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O BCBFMJYTNKDALA-UFYCRDLUSA-N 0.000 description 1
- GBIUHAYJGWVNLN-UHFFFAOYSA-N Val-Ser-Pro Natural products CC(C)C(N)C(=O)NC(CO)C(=O)N1CCCC1C(O)=O GBIUHAYJGWVNLN-UHFFFAOYSA-N 0.000 description 1
- YQYFYUSYEDNLSD-YEPSODPASA-N Val-Thr-Gly Chemical compound CC(C)[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(O)=O YQYFYUSYEDNLSD-YEPSODPASA-N 0.000 description 1
- SUGRIIAOLCDLBD-ZOBUZTSGSA-N Val-Trp-Asp Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)N[C@@H](CC(=O)O)C(=O)O)N SUGRIIAOLCDLBD-ZOBUZTSGSA-N 0.000 description 1
- AEFJNECXZCODJM-UWVGGRQHSA-N Val-Val-Gly Chemical compound CC(C)[C@H]([NH3+])C(=O)N[C@@H](C(C)C)C(=O)NCC([O-])=O AEFJNECXZCODJM-UWVGGRQHSA-N 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 235000009754 Vitis X bourquina Nutrition 0.000 description 1
- 235000012333 Vitis X labruscana Nutrition 0.000 description 1
- 240000006365 Vitis vinifera Species 0.000 description 1
- 235000014787 Vitis vinifera Nutrition 0.000 description 1
- 208000033559 Waldenström macroglobulinemia Diseases 0.000 description 1
- 208000000260 Warts Diseases 0.000 description 1
- 208000008383 Wilms tumor Diseases 0.000 description 1
- 108010017070 Zinc Finger Nucleases Proteins 0.000 description 1
- LUJZZYWHBDHDQX-QFIPXVFZSA-N [(3s)-morpholin-3-yl]methyl n-[4-[[1-[(3-fluorophenyl)methyl]indazol-5-yl]amino]-5-methylpyrrolo[2,1-f][1,2,4]triazin-6-yl]carbamate Chemical compound C=1N2N=CN=C(NC=3C=C4C=NN(CC=5C=C(F)C=CC=5)C4=CC=3)C2=C(C)C=1NC(=O)OC[C@@H]1COCCN1 LUJZZYWHBDHDQX-QFIPXVFZSA-N 0.000 description 1
- 201000000690 abdominal obesity-metabolic syndrome Diseases 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 108010081404 acein-2 Proteins 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 229930183665 actinomycin Natural products 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000007825 activation reagent Substances 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 238000011374 additional therapy Methods 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 210000001789 adipocyte Anatomy 0.000 description 1
- 201000005179 adrenal carcinoma Diseases 0.000 description 1
- 208000020990 adrenal cortex carcinoma Diseases 0.000 description 1
- 201000005188 adrenal gland cancer Diseases 0.000 description 1
- 208000007128 adrenocortical carcinoma Diseases 0.000 description 1
- 229940009456 adriamycin Drugs 0.000 description 1
- 201000006966 adult T-cell leukemia Diseases 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 230000032683 aging Effects 0.000 description 1
- 108010047495 alanylglycine Proteins 0.000 description 1
- PPQRONHOSHZGFQ-LMVFSUKVSA-N aldehydo-D-ribose 5-phosphate Chemical group OP(=O)(O)OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PPQRONHOSHZGFQ-LMVFSUKVSA-N 0.000 description 1
- 229930013930 alkaloid Natural products 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 125000003342 alkenyl group Chemical group 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 150000008052 alkyl sulfonates Chemical class 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- KOSRFJWDECSPRO-UHFFFAOYSA-N alpha-L-glutamyl-L-glutamic acid Natural products OC(=O)CCC(N)C(=O)NC(CCC(O)=O)C(O)=O KOSRFJWDECSPRO-UHFFFAOYSA-N 0.000 description 1
- 229960003437 aminoglutethimide Drugs 0.000 description 1
- ROBVIMPUHSLWNV-UHFFFAOYSA-N aminoglutethimide Chemical compound C=1C=C(N)C=CC=1C1(CC)CCC(=O)NC1=O ROBVIMPUHSLWNV-UHFFFAOYSA-N 0.000 description 1
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 1
- 229960000723 ampicillin Drugs 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- XCPGHVQEEXUHNC-UHFFFAOYSA-N amsacrine Chemical compound COC1=CC(NS(C)(=O)=O)=CC=C1NC1=C(C=CC=C2)C2=NC2=CC=CC=C12 XCPGHVQEEXUHNC-UHFFFAOYSA-N 0.000 description 1
- 229960001220 amsacrine Drugs 0.000 description 1
- 229960002932 anastrozole Drugs 0.000 description 1
- YBBLVLTVTVSKRW-UHFFFAOYSA-N anastrozole Chemical compound N#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1 YBBLVLTVTVSKRW-UHFFFAOYSA-N 0.000 description 1
- 239000003098 androgen Substances 0.000 description 1
- 229940030486 androgens Drugs 0.000 description 1
- 239000004037 angiogenesis inhibitor Substances 0.000 description 1
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 1
- ACPOUJIDANTYHO-UHFFFAOYSA-N anthra[1,9-cd]pyrazol-6(2H)-one Chemical compound C1=CC(C(=O)C=2C3=CC=CC=2)=C2C3=NNC2=C1 ACPOUJIDANTYHO-UHFFFAOYSA-N 0.000 description 1
- 230000000340 anti-metabolite Effects 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 229940030495 antiandrogen sex hormone and modulator of the genital system Drugs 0.000 description 1
- 102000025171 antigen binding proteins Human genes 0.000 description 1
- 108091000831 antigen binding proteins Proteins 0.000 description 1
- 229940100197 antimetabolite Drugs 0.000 description 1
- 239000002256 antimetabolite Substances 0.000 description 1
- 229940045687 antimetabolites folic acid analogs Drugs 0.000 description 1
- 229940045985 antineoplastic platinum compound Drugs 0.000 description 1
- 239000000074 antisense oligonucleotide Substances 0.000 description 1
- 238000012230 antisense oligonucleotides Methods 0.000 description 1
- 229940076005 apoptosis modulator Drugs 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 108010080488 arginyl-arginyl-leucine Proteins 0.000 description 1
- 108010052670 arginyl-glutamyl-glutamic acid Proteins 0.000 description 1
- 108010057412 arginyl-glycyl-aspartyl-phenylalanine Proteins 0.000 description 1
- 239000003886 aromatase inhibitor Substances 0.000 description 1
- 229940046844 aromatase inhibitors Drugs 0.000 description 1
- 238000003491 array Methods 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 108010069205 aspartyl-phenylalanine Proteins 0.000 description 1
- 108010093581 aspartyl-proline Proteins 0.000 description 1
- 108010092854 aspartyllysine Proteins 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 238000011888 autopsy Methods 0.000 description 1
- 229960002170 azathioprine Drugs 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 208000016894 basaloid carcinoma Diseases 0.000 description 1
- 201000000450 basaloid squamous cell carcinoma Diseases 0.000 description 1
- 208000003373 basosquamous carcinoma Diseases 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 229960000997 bicalutamide Drugs 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- ACWZRVQXLIRSDF-UHFFFAOYSA-N binimetinib Chemical compound OCCONC(=O)C=1C=C2N(C)C=NC2=C(F)C=1NC1=CC=C(Br)C=C1F ACWZRVQXLIRSDF-UHFFFAOYSA-N 0.000 description 1
- 238000012742 biochemical analysis Methods 0.000 description 1
- 239000013060 biological fluid Substances 0.000 description 1
- 230000029918 bioluminescence Effects 0.000 description 1
- 238000005415 bioluminescence Methods 0.000 description 1
- 239000000090 biomarker Substances 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 229910052797 bismuth Inorganic materials 0.000 description 1
- 210000001772 blood platelet Anatomy 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 229960001467 bortezomib Drugs 0.000 description 1
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 1
- 210000004781 brain capillary Anatomy 0.000 description 1
- 210000004958 brain cell Anatomy 0.000 description 1
- 210000000133 brain stem Anatomy 0.000 description 1
- 210000003123 bronchiole Anatomy 0.000 description 1
- 208000003362 bronchogenic carcinoma Diseases 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- HXCHCVDVKSCDHU-LULTVBGHSA-N calicheamicin Chemical compound C1[C@H](OC)[C@@H](NCC)CO[C@H]1O[C@H]1[C@H](O[C@@H]2C\3=C(NC(=O)OC)C(=O)C[C@](C/3=C/CSSSC)(O)C#C\C=C/C#C2)O[C@H](C)[C@@H](NO[C@@H]2O[C@H](C)[C@@H](SC(=O)C=3C(=C(OC)C(O[C@H]4[C@@H]([C@H](OC)[C@@H](O)[C@H](C)O4)O)=C(I)C=3C)OC)[C@@H](O)C2)[C@@H]1O HXCHCVDVKSCDHU-LULTVBGHSA-N 0.000 description 1
- 229930195731 calicheamicin Natural products 0.000 description 1
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical class C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 description 1
- 208000035269 cancer or benign tumor Diseases 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- 210000000234 capsid Anatomy 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- CREMABGTGYGIQB-UHFFFAOYSA-N carbon carbon Chemical compound C.C CREMABGTGYGIQB-UHFFFAOYSA-N 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 229960004562 carboplatin Drugs 0.000 description 1
- YAYRGNWWLMLWJE-UHFFFAOYSA-L carboplatin Chemical compound O=C1O[Pt](N)(N)OC(=O)C11CCC1 YAYRGNWWLMLWJE-UHFFFAOYSA-L 0.000 description 1
- UHBYWPGGCSDKFX-UHFFFAOYSA-N carboxyglutamic acid Chemical compound OC(=O)C(N)CC(C(O)=O)C(O)=O UHBYWPGGCSDKFX-UHFFFAOYSA-N 0.000 description 1
- 229960005243 carmustine Drugs 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 210000002421 cell wall Anatomy 0.000 description 1
- 230000007248 cellular mechanism Effects 0.000 description 1
- 230000004700 cellular uptake Effects 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 208000019065 cervical carcinoma Diseases 0.000 description 1
- 210000003679 cervix uteri Anatomy 0.000 description 1
- 229960005395 cetuximab Drugs 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 238000009614 chemical analysis method Methods 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 229940044683 chemotherapy drug Drugs 0.000 description 1
- 208000006990 cholangiocarcinoma Diseases 0.000 description 1
- 230000002759 chromosomal effect Effects 0.000 description 1
- 208000021668 chronic eosinophilic leukemia Diseases 0.000 description 1
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- 229930193282 clathrin Natural products 0.000 description 1
- GKIRPKYJQBWNGO-OCEACIFDSA-N clomifene Chemical class C1=CC(OCCN(CC)CC)=CC=C1C(\C=1C=CC=CC=1)=C(\Cl)C1=CC=CC=C1 GKIRPKYJQBWNGO-OCEACIFDSA-N 0.000 description 1
- 238000013377 clone selection method Methods 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 239000005515 coenzyme Substances 0.000 description 1
- 229960001338 colchicine Drugs 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 210000002777 columnar cell Anatomy 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 238000010226 confocal imaging Methods 0.000 description 1
- 238000004624 confocal microscopy Methods 0.000 description 1
- 210000002808 connective tissue Anatomy 0.000 description 1
- RYGMFSIKBFXOCR-IGMARMGPSA-N copper-64 Chemical compound [64Cu] RYGMFSIKBFXOCR-IGMARMGPSA-N 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 239000003431 cross linking reagent Substances 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 239000002254 cytotoxic agent Substances 0.000 description 1
- 231100000599 cytotoxic agent Toxicity 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- 229960002448 dasatinib Drugs 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000002716 delivery method Methods 0.000 description 1
- 239000000412 dendrimer Substances 0.000 description 1
- 229920000736 dendritic polymer Polymers 0.000 description 1
- 210000003298 dental enamel Anatomy 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000001212 derivatisation Methods 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- ANCLJVISBRWUTR-UHFFFAOYSA-N diaminophosphinic acid Chemical compound NP(N)(O)=O ANCLJVISBRWUTR-UHFFFAOYSA-N 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- RGLYKWWBQGJZGM-ISLYRVAYSA-N diethylstilbestrol Chemical compound C=1C=C(O)C=CC=1C(/CC)=C(\CC)C1=CC=C(O)C=C1 RGLYKWWBQGJZGM-ISLYRVAYSA-N 0.000 description 1
- 229960000452 diethylstilbestrol Drugs 0.000 description 1
- QONQRTHLHBTMGP-UHFFFAOYSA-N digitoxigenin Natural products CC12CCC(C3(CCC(O)CC3CC3)C)C3C11OC1CC2C1=CC(=O)OC1 QONQRTHLHBTMGP-UHFFFAOYSA-N 0.000 description 1
- SHIBSTMRCDJXLN-KCZCNTNESA-N digoxigenin Chemical compound C1([C@@H]2[C@@]3([C@@](CC2)(O)[C@H]2[C@@H]([C@@]4(C)CC[C@H](O)C[C@H]4CC2)C[C@H]3O)C)=CC(=O)OC1 SHIBSTMRCDJXLN-KCZCNTNESA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- NAGJZTKCGNOGPW-UHFFFAOYSA-K dioxido-sulfanylidene-sulfido-$l^{5}-phosphane Chemical compound [O-]P([O-])([S-])=S NAGJZTKCGNOGPW-UHFFFAOYSA-K 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 150000002019 disulfides Chemical class 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- 229960003668 docetaxel Drugs 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 235000006694 eating habits Nutrition 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 229940121647 egfr inhibitor Drugs 0.000 description 1
- 238000007336 electrophilic substitution reaction Methods 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 150000002081 enamines Chemical class 0.000 description 1
- 230000002124 endocrine Effects 0.000 description 1
- 210000000750 endocrine system Anatomy 0.000 description 1
- 210000004696 endometrium Anatomy 0.000 description 1
- 210000001163 endosome Anatomy 0.000 description 1
- 230000003511 endothelial effect Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- YJGVMLPVUAXIQN-UHFFFAOYSA-N epipodophyllotoxin Natural products COC1=C(OC)C(OC)=CC(C2C3=CC=4OCOC=4C=C3C(O)C3C2C(OC3)=O)=C1 YJGVMLPVUAXIQN-UHFFFAOYSA-N 0.000 description 1
- 150000002118 epoxides Chemical class 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 201000004101 esophageal cancer Diseases 0.000 description 1
- 229960005309 estradiol Drugs 0.000 description 1
- 229930182833 estradiol Natural products 0.000 description 1
- WCDWBPCFGJXFJZ-UHFFFAOYSA-N etanidazole Chemical compound OCCNC(=O)CN1C=CN=C1[N+]([O-])=O WCDWBPCFGJXFJZ-UHFFFAOYSA-N 0.000 description 1
- 235000019441 ethanol Nutrition 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- ZMMJGEGLRURXTF-UHFFFAOYSA-N ethidium bromide Chemical compound [Br-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 ZMMJGEGLRURXTF-UHFFFAOYSA-N 0.000 description 1
- 229960005542 ethidium bromide Drugs 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 208000021045 exocrine pancreatic carcinoma Diseases 0.000 description 1
- 210000003722 extracellular fluid Anatomy 0.000 description 1
- 229950011548 fadrozole Drugs 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 208000010706 fatty liver disease Diseases 0.000 description 1
- 210000003608 fece Anatomy 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- YCKRFDGAMUMZLT-BJUDXGSMSA-N fluorine-18 atom Chemical compound [18F] YCKRFDGAMUMZLT-BJUDXGSMSA-N 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- 229960001751 fluoxymesterone Drugs 0.000 description 1
- YLRFCQOZQXIBAB-RBZZARIASA-N fluoxymesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1CC[C@](C)(O)[C@@]1(C)C[C@@H]2O YLRFCQOZQXIBAB-RBZZARIASA-N 0.000 description 1
- 229960002074 flutamide Drugs 0.000 description 1
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 1
- 150000002224 folic acids Chemical class 0.000 description 1
- 235000008191 folinic acid Nutrition 0.000 description 1
- 239000011672 folinic acid Substances 0.000 description 1
- VVIAGPKUTFNRDU-ABLWVSNPSA-N folinic acid Chemical compound C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-ABLWVSNPSA-N 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 239000005350 fused silica glass Substances 0.000 description 1
- UIWYJDYFSGRHKR-UHFFFAOYSA-N gadolinium atom Chemical compound [Gd] UIWYJDYFSGRHKR-UHFFFAOYSA-N 0.000 description 1
- 229940044658 gallium nitrate Drugs 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 239000002406 gelatinase inhibitor Substances 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- QTQAWLPCGQOSGP-GBTDJJJQSA-N geldanamycin Chemical compound N1C(=O)\C(C)=C/C=C\[C@@H](OC)[C@H](OC(N)=O)\C(C)=C/[C@@H](C)[C@@H](O)[C@H](OC)C[C@@H](C)CC2=C(OC)C(=O)C=C1C2=O QTQAWLPCGQOSGP-GBTDJJJQSA-N 0.000 description 1
- 230000007274 generation of a signal involved in cell-cell signaling Effects 0.000 description 1
- 229940080856 gleevec Drugs 0.000 description 1
- 239000003862 glucocorticoid Substances 0.000 description 1
- 230000014101 glucose homeostasis Effects 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 108010049041 glutamylalanine Proteins 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- 108010075431 glycyl-alanyl-phenylalanine Proteins 0.000 description 1
- 108010010096 glycyl-glycyl-tyrosine Proteins 0.000 description 1
- 108010089804 glycyl-threonine Proteins 0.000 description 1
- 108010037850 glycylvaline Proteins 0.000 description 1
- XLXSAKCOAKORKW-AQJXLSMYSA-N gonadorelin Chemical compound C([C@@H](C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 XLXSAKCOAKORKW-AQJXLSMYSA-N 0.000 description 1
- 229940035638 gonadotropin-releasing hormone Drugs 0.000 description 1
- 229960002913 goserelin Drugs 0.000 description 1
- 208000017750 granulocytic sarcoma Diseases 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 210000002768 hair cell Anatomy 0.000 description 1
- 125000001188 haloalkyl group Chemical group 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 210000005003 heart tissue Anatomy 0.000 description 1
- 230000002489 hematologic effect Effects 0.000 description 1
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 1
- 230000002008 hemorrhagic effect Effects 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 229940022353 herceptin Drugs 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 108010040030 histidinoalanine Proteins 0.000 description 1
- 108010092114 histidylphenylalanine Proteins 0.000 description 1
- 108010085325 histidylproline Proteins 0.000 description 1
- HYFHYPWGAURHIV-UHFFFAOYSA-N homoharringtonine Natural products C1=C2CCN3CCCC43C=C(OC)C(OC(=O)C(O)(CCCC(C)(C)O)CC(=O)OC)C4C2=CC2=C1OCO2 HYFHYPWGAURHIV-UHFFFAOYSA-N 0.000 description 1
- 238000001794 hormone therapy Methods 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 150000007857 hydrazones Chemical class 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 229960001330 hydroxycarbamide Drugs 0.000 description 1
- 229920003063 hydroxymethyl cellulose Polymers 0.000 description 1
- 229940031574 hydroxymethyl cellulose Drugs 0.000 description 1
- 229950000801 hydroxyprogesterone caproate Drugs 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 230000000148 hypercalcaemia Effects 0.000 description 1
- 208000030915 hypercalcemia disease Diseases 0.000 description 1
- 208000006575 hypertriglyceridemia Diseases 0.000 description 1
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 1
- 229960001101 ifosfamide Drugs 0.000 description 1
- 150000002466 imines Chemical class 0.000 description 1
- 238000007654 immersion Methods 0.000 description 1
- 230000000984 immunochemical effect Effects 0.000 description 1
- 238000011532 immunohistochemical staining Methods 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 201000004933 in situ carcinoma Diseases 0.000 description 1
- 238000011503 in vivo imaging Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 206010022498 insulinoma Diseases 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 230000002601 intratumoral effect Effects 0.000 description 1
- 238000007914 intraventricular administration Methods 0.000 description 1
- PWBYYTXZCUZPRD-UHFFFAOYSA-N iron platinum Chemical compound [Fe][Pt][Pt] PWBYYTXZCUZPRD-UHFFFAOYSA-N 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 229960004130 itraconazole Drugs 0.000 description 1
- 235000015110 jellies Nutrition 0.000 description 1
- 125000000468 ketone group Chemical group 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 229940043355 kinase inhibitor Drugs 0.000 description 1
- 210000001865 kupffer cell Anatomy 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 229960004891 lapatinib Drugs 0.000 description 1
- BCFGMOOMADDAQU-UHFFFAOYSA-N lapatinib Chemical compound O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 BCFGMOOMADDAQU-UHFFFAOYSA-N 0.000 description 1
- 239000010699 lard oil Substances 0.000 description 1
- 208000003849 large cell carcinoma Diseases 0.000 description 1
- 229960003881 letrozole Drugs 0.000 description 1
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 description 1
- 229960001691 leucovorin Drugs 0.000 description 1
- 206010024378 leukocytosis Diseases 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 108010022197 lipoprotein cholesterol Proteins 0.000 description 1
- 206010024627 liposarcoma Diseases 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 208000019423 liver disease Diseases 0.000 description 1
- 230000005976 liver dysfunction Effects 0.000 description 1
- 230000003908 liver function Effects 0.000 description 1
- 210000005228 liver tissue Anatomy 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 229960002247 lomustine Drugs 0.000 description 1
- 210000005265 lung cell Anatomy 0.000 description 1
- 201000009546 lung large cell carcinoma Diseases 0.000 description 1
- 201000005243 lung squamous cell carcinoma Diseases 0.000 description 1
- 208000037841 lung tumor Diseases 0.000 description 1
- 210000002751 lymph Anatomy 0.000 description 1
- 230000001926 lymphatic effect Effects 0.000 description 1
- 230000002912 lymphogenic effect Effects 0.000 description 1
- 229960003646 lysine Drugs 0.000 description 1
- 108010038320 lysylphenylalanine Proteins 0.000 description 1
- 229940124302 mTOR inhibitor Drugs 0.000 description 1
- 201000000564 macroglobulinemia Diseases 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 229910001629 magnesium chloride Inorganic materials 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 1
- 208000027202 mammary Paget disease Diseases 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- 239000011572 manganese Substances 0.000 description 1
- 208000000516 mast-cell leukemia Diseases 0.000 description 1
- 230000008774 maternal effect Effects 0.000 description 1
- 239000003771 matrix metalloproteinase inhibitor Substances 0.000 description 1
- 229940121386 matrix metalloproteinase inhibitor Drugs 0.000 description 1
- 229960002985 medroxyprogesterone acetate Drugs 0.000 description 1
- PSGAAPLEWMOORI-PEINSRQWSA-N medroxyprogesterone acetate Chemical compound C([C@@]12C)CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2CC[C@]2(C)[C@@](OC(C)=O)(C(C)=O)CC[C@H]21 PSGAAPLEWMOORI-PEINSRQWSA-N 0.000 description 1
- 208000023356 medullary thyroid gland carcinoma Diseases 0.000 description 1
- 229960004296 megestrol acetate Drugs 0.000 description 1
- RQZAXGRLVPAYTJ-GQFGMJRRSA-N megestrol acetate Chemical compound C1=C(C)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 RQZAXGRLVPAYTJ-GQFGMJRRSA-N 0.000 description 1
- 210000002752 melanocyte Anatomy 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000008384 membrane barrier Effects 0.000 description 1
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 108010056582 methionylglutamic acid Proteins 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- LSDPWZHWYPCBBB-UHFFFAOYSA-O methylsulfide anion Chemical compound [SH2+]C LSDPWZHWYPCBBB-UHFFFAOYSA-O 0.000 description 1
- VKHAHZOOUSRJNA-GCNJZUOMSA-N mifepristone Chemical compound C1([C@@H]2C3=C4CCC(=O)C=C4CC[C@H]3[C@@H]3CC[C@@]([C@]3(C2)C)(O)C#CC)=CC=C(N(C)C)C=C1 VKHAHZOOUSRJNA-GCNJZUOMSA-N 0.000 description 1
- 229960003248 mifepristone Drugs 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- 230000000116 mitigating effect Effects 0.000 description 1
- 229960000350 mitotane Drugs 0.000 description 1
- 108091005601 modified peptides Proteins 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 201000006894 monocytic leukemia Diseases 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- HDZGCSFEDULWCS-UHFFFAOYSA-N monomethylhydrazine Chemical class CNN HDZGCSFEDULWCS-UHFFFAOYSA-N 0.000 description 1
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 description 1
- AARXZCZYLAFQQU-UHFFFAOYSA-N motexafin gadolinium Chemical compound [Gd].CC(O)=O.CC(O)=O.C1=C([N-]2)C(CC)=C(CC)C2=CC(C(=C2C)CCCO)=NC2=CN=C2C=C(OCCOCCOCCOC)C(OCCOCCOCCOC)=CC2=NC=C2C(C)=C(CCCO)C1=N2 AARXZCZYLAFQQU-UHFFFAOYSA-N 0.000 description 1
- 210000000214 mouth Anatomy 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 230000020763 muscle atrophy Effects 0.000 description 1
- 201000000585 muscular atrophy Diseases 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 201000005987 myeloid sarcoma Diseases 0.000 description 1
- 208000009091 myxoma Diseases 0.000 description 1
- ZYQXEVJIFYIBHZ-UHFFFAOYSA-N n-[2-[4-[3-chloro-4-[3-(trifluoromethyl)phenoxy]anilino]pyrrolo[3,2-d]pyrimidin-5-yl]ethyl]-3-hydroxy-3-methylbutanamide Chemical compound C=12N(CCNC(=O)CC(C)(O)C)C=CC2=NC=NC=1NC(C=C1Cl)=CC=C1OC1=CC=CC(C(F)(F)F)=C1 ZYQXEVJIFYIBHZ-UHFFFAOYSA-N 0.000 description 1
- RDSACQWTXKSHJT-NSHDSACASA-N n-[3,4-difluoro-2-(2-fluoro-4-iodoanilino)-6-methoxyphenyl]-1-[(2s)-2,3-dihydroxypropyl]cyclopropane-1-sulfonamide Chemical compound C1CC1(C[C@H](O)CO)S(=O)(=O)NC=1C(OC)=CC(F)=C(F)C=1NC1=CC=C(I)C=C1F RDSACQWTXKSHJT-NSHDSACASA-N 0.000 description 1
- QQZOPKMRPOGIEB-UHFFFAOYSA-N n-butyl methyl ketone Natural products CCCCC(C)=O QQZOPKMRPOGIEB-UHFFFAOYSA-N 0.000 description 1
- 201000011216 nasopharynx carcinoma Diseases 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 230000004770 neurodegeneration Effects 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- 201000000032 nodular malignant melanoma Diseases 0.000 description 1
- 108091027963 non-coding RNA Proteins 0.000 description 1
- 102000042567 non-coding RNA Human genes 0.000 description 1
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 1
- 102000006255 nuclear receptors Human genes 0.000 description 1
- 108020004017 nuclear receptors Proteins 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 238000003499 nucleic acid array Methods 0.000 description 1
- 239000002853 nucleic acid probe Substances 0.000 description 1
- 238000001668 nucleic acid synthesis Methods 0.000 description 1
- 238000010534 nucleophilic substitution reaction Methods 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 229960002230 omacetaxine mepesuccinate Drugs 0.000 description 1
- HYFHYPWGAURHIV-JFIAXGOJSA-N omacetaxine mepesuccinate Chemical compound C1=C2CCN3CCC[C@]43C=C(OC)[C@@H](OC(=O)[C@@](O)(CCCC(C)(C)O)CC(=O)OC)[C@H]4C2=CC2=C1OCO2 HYFHYPWGAURHIV-JFIAXGOJSA-N 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 239000012074 organic phase Substances 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 229960001756 oxaliplatin Drugs 0.000 description 1
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 1
- 150000002923 oximes Chemical class 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 239000003973 paint Substances 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 208000021255 pancreatic insulinoma Diseases 0.000 description 1
- 210000004923 pancreatic tissue Anatomy 0.000 description 1
- 229960001972 panitumumab Drugs 0.000 description 1
- 229950003440 panomifene Drugs 0.000 description 1
- 208000003154 papilloma Diseases 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 229920002866 paraformaldehyde Polymers 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 235000015927 pasta Nutrition 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 230000006320 pegylation Effects 0.000 description 1
- WVUNYSQLFKLYNI-AATRIKPKSA-N pelitinib Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OCC)=CC2=NC=C(C#N)C=1NC1=CC=C(F)C(Cl)=C1 WVUNYSQLFKLYNI-AATRIKPKSA-N 0.000 description 1
- 229960005079 pemetrexed Drugs 0.000 description 1
- QOFFJEBXNKRSPX-ZDUSSCGKSA-N pemetrexed Chemical compound C1=N[C]2NC(N)=NC(=O)C2=C1CCC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 QOFFJEBXNKRSPX-ZDUSSCGKSA-N 0.000 description 1
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 1
- 229960002340 pentostatin Drugs 0.000 description 1
- 208000030613 peripheral artery disease Diseases 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 230000008782 phagocytosis Effects 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 229940127557 pharmaceutical product Drugs 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 108010070409 phenylalanyl-glycyl-glycine Proteins 0.000 description 1
- 108010084525 phenylalanyl-phenylalanyl-glycine Proteins 0.000 description 1
- 108010018625 phenylalanylarginine Proteins 0.000 description 1
- 108010012581 phenylalanylglutamate Proteins 0.000 description 1
- 108010073101 phenylalanylleucine Proteins 0.000 description 1
- 108010051242 phenylalanylserine Proteins 0.000 description 1
- NMHMNPHRMNGLLB-UHFFFAOYSA-N phloretic acid Chemical compound OC(=O)CCC1=CC=C(O)C=C1 NMHMNPHRMNGLLB-UHFFFAOYSA-N 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 1
- PTMHPRAIXMAOOB-UHFFFAOYSA-L phosphoramidate Chemical compound NP([O-])([O-])=O PTMHPRAIXMAOOB-UHFFFAOYSA-L 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 125000002743 phosphorus functional group Chemical group 0.000 description 1
- 229910000073 phosphorus hydride Inorganic materials 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- BZQFBWGGLXLEPQ-REOHCLBHSA-N phosphoserine Chemical compound OC(=O)[C@@H](N)COP(O)(O)=O BZQFBWGGLXLEPQ-REOHCLBHSA-N 0.000 description 1
- 125000005642 phosphothioate group Chemical group 0.000 description 1
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- DFOXKPDFWGNLJU-UHFFFAOYSA-N pinacolyl alcohol Chemical compound CC(O)C(C)(C)C DFOXKPDFWGNLJU-UHFFFAOYSA-N 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 239000002797 plasminogen activator inhibitor Substances 0.000 description 1
- 150000003058 platinum compounds Chemical class 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- YJGVMLPVUAXIQN-XVVDYKMHSA-N podophyllotoxin Chemical compound COC1=C(OC)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@H](O)[C@@H]3[C@@H]2C(OC3)=O)=C1 YJGVMLPVUAXIQN-XVVDYKMHSA-N 0.000 description 1
- 229960001237 podophyllotoxin Drugs 0.000 description 1
- YVCVYCSAAZQOJI-UHFFFAOYSA-N podophyllotoxin Natural products COC1=C(O)C(OC)=CC(C2C3=CC=4OCOC=4C=C3C(O)C3C2C(OC3)=O)=C1 YVCVYCSAAZQOJI-UHFFFAOYSA-N 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 1
- 229920006316 polyvinylpyrrolidine Polymers 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 201000009104 prediabetes syndrome Diseases 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 1
- 229960000624 procarbazine Drugs 0.000 description 1
- 239000000651 prodrug Substances 0.000 description 1
- 229940002612 prodrug Drugs 0.000 description 1
- 229960003387 progesterone Drugs 0.000 description 1
- 239000000186 progesterone Substances 0.000 description 1
- 239000000583 progesterone congener Substances 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 108010031719 prolyl-serine Proteins 0.000 description 1
- 108010053725 prolylvaline Proteins 0.000 description 1
- 239000003207 proteasome inhibitor Substances 0.000 description 1
- 125000006239 protecting group Chemical group 0.000 description 1
- 239000003528 protein farnesyltransferase inhibitor Substances 0.000 description 1
- 239000003806 protein tyrosine phosphatase inhibitor Substances 0.000 description 1
- 208000029817 pulmonary adenocarcinoma in situ Diseases 0.000 description 1
- 239000000784 purine nucleoside phosphorylase inhibitor Substances 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 239000002096 quantum dot Substances 0.000 description 1
- 239000010453 quartz Substances 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 229960004432 raltitrexed Drugs 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 239000002464 receptor antagonist Substances 0.000 description 1
- 229940044551 receptor antagonist Drugs 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000003938 response to stress Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 1
- 150000003290 ribose derivatives Chemical group 0.000 description 1
- 108091092562 ribozyme Proteins 0.000 description 1
- 229960004641 rituximab Drugs 0.000 description 1
- 239000012266 salt solution Substances 0.000 description 1
- DFJSJLGUIXFDJP-UHFFFAOYSA-N sapitinib Chemical compound C1CN(CC(=O)NC)CCC1OC(C(=CC1=NC=N2)OC)=CC1=C2NC1=CC=CC(Cl)=C1F DFJSJLGUIXFDJP-UHFFFAOYSA-N 0.000 description 1
- 208000014212 sarcomatoid carcinoma Diseases 0.000 description 1
- 201000008157 scrotal carcinoma Diseases 0.000 description 1
- 229950010746 selumetinib Drugs 0.000 description 1
- 150000007659 semicarbazones Chemical class 0.000 description 1
- 229960003440 semustine Drugs 0.000 description 1
- 238000002864 sequence alignment Methods 0.000 description 1
- VGKDLMBJGBXTGI-SJCJKPOMSA-N sertraline Chemical compound C1([C@@H]2CC[C@@H](C3=CC=CC=C32)NC)=CC=C(Cl)C(Cl)=C1 VGKDLMBJGBXTGI-SJCJKPOMSA-N 0.000 description 1
- 229960002073 sertraline Drugs 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 230000003584 silencer Effects 0.000 description 1
- 229910052814 silicon oxide Inorganic materials 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 201000008261 skin carcinoma Diseases 0.000 description 1
- 206010040882 skin lesion Diseases 0.000 description 1
- 231100000444 skin lesion Toxicity 0.000 description 1
- 201000010153 skin papilloma Diseases 0.000 description 1
- 208000000649 small cell carcinoma Diseases 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 108091029842 small nuclear ribonucleic acid Proteins 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000007909 solid dosage form Substances 0.000 description 1
- 210000003802 sputum Anatomy 0.000 description 1
- 208000024794 sputum Diseases 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 230000024642 stem cell division Effects 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 201000011549 stomach cancer Diseases 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 208000023516 stroke disease Diseases 0.000 description 1
- 210000002536 stromal cell Anatomy 0.000 description 1
- 108091007196 stromelysin Proteins 0.000 description 1
- 201000010033 subleukemic leukemia Diseases 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 150000003456 sulfonamides Chemical class 0.000 description 1
- 150000003457 sulfones Chemical class 0.000 description 1
- 125000002128 sulfonyl halide group Chemical group 0.000 description 1
- 229960001796 sunitinib Drugs 0.000 description 1
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 206010042863 synovial sarcoma Diseases 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 230000009897 systematic effect Effects 0.000 description 1
- 229940037128 systemic glucocorticoids Drugs 0.000 description 1
- 238000002626 targeted therapy Methods 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 239000003277 telomerase inhibitor Substances 0.000 description 1
- 230000002381 testicular Effects 0.000 description 1
- 201000003120 testicular cancer Diseases 0.000 description 1
- 229960001712 testosterone propionate Drugs 0.000 description 1
- 125000005207 tetraalkylammonium group Chemical group 0.000 description 1
- 238000011285 therapeutic regimen Methods 0.000 description 1
- 150000007970 thio esters Chemical class 0.000 description 1
- CNHYKKNIIGEXAY-UHFFFAOYSA-N thiolan-2-imine Chemical compound N=C1CCCS1 CNHYKKNIIGEXAY-UHFFFAOYSA-N 0.000 description 1
- 210000000115 thoracic cavity Anatomy 0.000 description 1
- 108010033670 threonyl-aspartyl-tyrosine Proteins 0.000 description 1
- 108010061238 threonyl-glycine Proteins 0.000 description 1
- 108010071097 threonyl-lysyl-proline Proteins 0.000 description 1
- 206010043554 thrombocytopenia Diseases 0.000 description 1
- 229940104230 thymidine Drugs 0.000 description 1
- XXYIANZGUOSQHY-XLPZGREQSA-N thymidine 3'-monophosphate Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](OP(O)(O)=O)C1 XXYIANZGUOSQHY-XLPZGREQSA-N 0.000 description 1
- 208000013077 thyroid gland carcinoma Diseases 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000440 toxicity profile Toxicity 0.000 description 1
- FGMPLJWBKKVCDB-UHFFFAOYSA-N trans-L-hydroxy-proline Natural products ON1CCCC1C(O)=O FGMPLJWBKKVCDB-UHFFFAOYSA-N 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- 206010044412 transitional cell carcinoma Diseases 0.000 description 1
- 102000035160 transmembrane proteins Human genes 0.000 description 1
- 108091005703 transmembrane proteins Proteins 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 229960000575 trastuzumab Drugs 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- AYNNSCRYTDRFCP-UHFFFAOYSA-N triazene Chemical compound NN=N AYNNSCRYTDRFCP-UHFFFAOYSA-N 0.000 description 1
- 150000003852 triazoles Chemical class 0.000 description 1
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 1
- 108010038745 tryptophylglycine Proteins 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 230000005751 tumor progression Effects 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 1
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 1
- GFNNBHLJANVSQV-UHFFFAOYSA-N tyrphostin AG 1478 Chemical compound C=12C=C(OC)C(OC)=CC2=NC=NC=1NC1=CC=CC(Cl)=C1 GFNNBHLJANVSQV-UHFFFAOYSA-N 0.000 description 1
- 231100000397 ulcer Toxicity 0.000 description 1
- 229960001055 uracil mustard Drugs 0.000 description 1
- 150000003672 ureas Chemical class 0.000 description 1
- 210000003932 urinary bladder Anatomy 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 108010073969 valyllysine Proteins 0.000 description 1
- 229960000241 vandetanib Drugs 0.000 description 1
- UHTHHESEBZOYNR-UHFFFAOYSA-N vandetanib Chemical compound COC1=CC(C(/N=CN2)=N/C=3C(=CC(Br)=CC=3)F)=C2C=C1OCC1CCN(C)CC1 UHTHHESEBZOYNR-UHFFFAOYSA-N 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 208000019553 vascular disease Diseases 0.000 description 1
- 230000000304 vasodilatating effect Effects 0.000 description 1
- GPXBXXGIAQBQNI-UHFFFAOYSA-N vemurafenib Chemical compound CCCS(=O)(=O)NC1=CC=C(F)C(C(=O)C=2C3=CC(=CN=C3NC=2)C=2C=CC(Cl)=CC=2)=C1F GPXBXXGIAQBQNI-UHFFFAOYSA-N 0.000 description 1
- 229960003862 vemurafenib Drugs 0.000 description 1
- GBABOYUKABKIAF-GHYRFKGUSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-GHYRFKGUSA-N 0.000 description 1
- 229960002066 vinorelbine Drugs 0.000 description 1
- 230000029812 viral genome replication Effects 0.000 description 1
- 230000009278 visceral effect Effects 0.000 description 1
- 230000004584 weight gain Effects 0.000 description 1
- 235000019786 weight gain Nutrition 0.000 description 1
- 230000004580 weight loss Effects 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- QDLHCMPXEPAAMD-QAIWCSMKSA-N wortmannin Chemical compound C1([C@]2(C)C3=C(C4=O)OC=C3C(=O)O[C@@H]2COC)=C4[C@@H]2CCC(=O)[C@@]2(C)C[C@H]1OC(C)=O QDLHCMPXEPAAMD-QAIWCSMKSA-N 0.000 description 1
- QDLHCMPXEPAAMD-UHFFFAOYSA-N wortmannin Natural products COCC1OC(=O)C2=COC(C3=O)=C2C1(C)C1=C3C2CCC(=O)C2(C)CC1OC(C)=O QDLHCMPXEPAAMD-UHFFFAOYSA-N 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
- 150000003952 β-lactams Chemical class 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/115—Aptamers, i.e. nucleic acids binding a target molecule specifically and with high affinity without hybridising therewith ; Nucleic acids binding to non-nucleic acids, e.g. aptamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7105—Natural ribonucleic acids, i.e. containing only riboses attached to adenine, guanine, cytosine or uracil and having 3'-5' phosphodiester links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/549—Sugars, nucleosides, nucleotides or nucleic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/001—Preparation for luminescence or biological staining
- A61K49/0013—Luminescence
- A61K49/0017—Fluorescence in vivo
- A61K49/005—Fluorescence in vivo characterised by the carrier molecule carrying the fluorescent agent
- A61K49/0052—Small organic molecules
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/16—Aptamers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
- C12N2310/351—Conjugate
- C12N2310/3519—Fusion with another nucleic acid
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/32—Special delivery means, e.g. tissue-specific
Abstract
리보핵산 화합물이 개시되며, 리보핵산 화합물은 서열번호 1에 대해 적어도 90% 서열 동일성을 갖는 RNA 서열을 포함하거나, 이로 이루어지고, 상기 RNA 서열은 길이가 29개 이하의 뉴클레오타이드이고, RNA 서열은 트랜스페린 수용체 (TfR)에 결합할 수 있다.
Description
관련 출원에 대한 상호 참조
본 출원은 2017년 8월 11일에 출원된 미국 가출원 제 62/544,220호 및 2018년 5월 15일에 출원된 미국 가출원 제 62/671,604호에 우선권을 주장하며, 상기 문헌은 그 전문이 모든 목적을 위해 본 명세서에 참조로 포함된다.
ASCII 파일로서 제출된 "서열목록", 표 또는 컴퓨터 프로그램 목록 첨부에 대한 참조
2018년 8월 9일에 생성된 기계 형식 IBM-PC, MS-윈도우 운영 체제로서 8,935 바이트의 "EFSLIVE-17561747-v1-RICLP350028_ST25.txt" 파일에 기록된 서열목록은 참조로 포함한다.
본 발명의 분야
본 발명은 트랜스페린 수용체와 결합할 수 있는 핵산 화합물, 특히 리보핵산 화합물 및 조성물 및 이를 사용하는 방법에 관한 것이다.
트랜스페린 수용체 (TfR)는 혈장 당단백질 트랜스페린으로부터 철의 세포 흡수를 매개하는 세포 표면 상에 발현된 막 당단백질이다. 트랜스페린은 철에 결합하여, 트랜스페린-철 복합체를 생성한다 (문헌[Crichton & Charloteaux-Wauters, Eur J Biochem 1987; 164(3):485-506]). 이들 복합체는 TfR에 결합하고, 결합된 트랜스페린은 수용체-매개 세포내 섭취을 통해 세포로 내재화된다 (문헌[Qian ZM et al., Pharmacol Rev. 2002, 54(4):561-587]). 트랜스페린 및 철은 이후 엔도솜으로 방출된다.
TfR은 통상적으로 다양한 정상 세포에서 낮은 수준으로 발현되고, 활성화된 면역 세포 (문헌[Bayer AL et al., J Leukoc Biol 1998 64: 19-24; Holland JP et al., Nat Med 2012 18: 1586-1591]) 및 암세포 (문헌[Daniels TR et al., Clin Immunol 2006 121:144-158; Daniels TR et al., Clin Immunol 2006 121:159-176])를 포함하여 높은 증식 속도를 가진 세포에서 고도로 발현된다. 따라서, TfR-발현 세포의 표면에서 TfR에 결합하여, 세포 내에 내재화될 수 있는 화합물은 이러한 화합물의 표적화된 전달에 유용할 것이다.
때때로 화학 항체로 기재되는 앱타머는 형태 인식을 통해 그의 표적에 결합하는 작은 단일 가닥 RNA 또는 DNA 분자이다 (문자[Stottenburg R et al., Biomol Eng. 2007 Oct;24(4):381-403]). 앱타머는 동종 표적의 특이적 분자 인식이 가능한 고유한 3차원 구조를 포함하며, 그 크기, 생성 과정, 증가된 안정성 및 면역원성의 부재를 포함하여 항체에 비해 다수의 이점을 나타낸다. TfR에 결합할 수 있는 앱타머는 WO 2016/061386에 기재되어 있으며, 상기 문헌은 그 전문이 본 명세서에 참조로 포함된다.
TfR에 결합하는 앱타머는 전신을 통해 세포에의 치료 함유물의 표적화된 전달을 제공하는데 사용될 수 있다. 그러나, 뇌 장애의 치료는 대부분의 소분자가 뇌로 진입하는 것을 제한하는 혈뇌 장벽(BBB; blood-brain barrier)의 존재에 의해 크게 방해된다. 문헌[ACS Chem. Neurosci. 2017, 8, 777-784]은 TfR에 결합하고 BBB를 통과하는 능력을 갖는 이중 기능성 앱타머를 기재하고 있다.
표적화된 치료 전달을 위한 추가의 메커니즘이 필요하다.
본 발명은 트랜스페린 수용체 (TfR)에 결합할 수 있는 RNA/DNA 서열을 포함하는 핵산 화합물, 바람직하게는 리보핵산 화합물 또는 데옥시리보핵산 화합물을 제공한다. 핵산 화합물은 길이가 29개 이하의 뉴클레오타이드이다.
본 발명의 일 양상에서, 서열번호 1에 대해 적어도 90% 서열 동일성을 갖는 RNA 서열을 포함하거나, 이로 이루어진 리보핵산 화합물이 제공되며, 상기 RNA 서열은 길이가 29개 이하의 뉴클레오타이드이다. RNA 서열은 바람직하게는 트랜스페린 수용체 (TfR)에 결합할 수 있다.
일부 실시형태에서, RNA 서열은 길이가 22개 이하의 뉴클레오타이드이다. 일부 실시형태에서, RNA 서열은 길이가 22개의 뉴클레오타이드이다. 일부 실시형태에서, RNA 서열은 서열번호 1에 대해 100% 서열 동일성을 갖는다.
다른 양상에서, 본 발명은 서열번호 5에 대해 적어도 90% 서열 동일성을 갖는 RNA 서열을 포함하거나, 이로 이루어진 리보핵산 화합물을 제공하고, 상기 RNA 서열은 길이가 29개 이하의 뉴클레오타이드이고, RNA 서열은 트랜스페린 수용체 (TfR)에 결합할 수 있다.
일부 실시형태에서, RNA 서열은 길이가 16개의 뉴클레오타이드이다. 일부 실시형태에서, RNA 서열은 서열번호 5에 대해 100% 서열 동일성을 갖는다.
다른 양상에서, 상기 화합물은 서열번호 1 또는 서열번호 5를 포함하는 DNA 서열을 포함하거나, 이로 이루어진 데옥시리보핵산 화합물이고, 서열번호 1 또는 서열번호 5의 리보뉴클레오타이드 중 하나 또는 일부 또는 전부는 그의 균등한 데옥시리보뉴클레오타이드 잔기 dAMP, dGMP, dTMP 또는 dCMP로 치환되고, 상기 DNA 서열은 길이가 29개 이하의 뉴클레오타이드이고, 선택적으로 DNA 서열은 트랜스페린 수용체 (TfR)에 결합할 수 있다.
일부 실시형태에서, 리보핵산 화합물 또는 데옥시리보핵산 화합물은 세포 표면 상의 TfR에 결합할 수 있다. 일부 실시형태에서, 리보핵산 화합물 또는 데옥시리보핵산 화합물은 세포 내에 내재화될 수 있다. 일부 실시형태에서, 리보핵산 화합물 또는 데옥시리보핵산 화합물은 혈뇌 장벽을 통과할 수 있다.
일부 실시형태에서, 본 명세서에서 제공되는 핵산 화합물은 RNA/DNA 서열에 부착된 화합물 모이어티(moiety)를 추가로 포함한다. 일부 실시형태에서, 화합물 모이어티는 치료 모이어티 또는 영상화 모이어티이다. 일부 실시형태에서, 화합물 모이어티는 RNA/DNA 서열에 공유결합에 의해 부착된다.
일부 실시형태에서, 치료 모이어티는 핵산 모이어티, 펩타이드 모이어티 또는 소분자 약물 모이어티이다. 일부 실시형태에서, 치료 모이어티는 활성화 핵산 모이어티 또는 안티센스 핵산 모이어티이다. 일부 실시형태에서, 치료 모이어티는 miRNA, mRNA, saRNA 또는 siRNA 모이어티이다. 일부 실시형태에서, 치료 모이어티는 항암 치료 모이어티이다. 일부 실시형태에서, 치료 모이어티는 C/EBP알파 saRNA 모이어티, SIRT1 saRNA 모이어티, 또는 HNF saRNA 모이어티이다.
일부 실시형태에서, 영상화 모이어티는 생물발광 분자, 광활성 분자, 금속 또는 나노입자이다.
또한 본 발명에 따른 핵산 화합물을 포함하는 약제학적 조성물이 제공된다. 상기 조성물은 선택적으로 약제학적으로 허용 가능한 부형제를 포함할 수 있다. 일부 실시형태에서, 상기 조성물은 치료제, 선택적으로 항암제를 추가로 포함한다.
본 발명은 또한 화합물 모이어티를 세포 내에 전달하는 방법으로서, 상기 방법은 (i) 세포를 본 발명에 따른 핵산 화합물과 접촉시키는 단계; 및 (ii) 상기 핵산 화합물이 상기 세포 상의 트랜스페린 수용체에 결합하여 상기 세포 내로 통과되도록 함으로써, 상기 화합물 모이어티를 상기 세포 내에 전달하는 단계를 포함하는 방법을 제공한다.
또한 화합물을 세포 내에 전달하는 방법으로서, 상기 방법은 (i) 세포를 본 발명에 따른 핵산 화합물 및 화합물과 접촉시키는 단계; 및 (ii) 상기 리보핵산 화합물이 상기 세포 상의 트랜스페린 수용체에 결합하여 상기 세포 내로 통과되도록 함으로써, 상기 화합물 모이어티를 상기 세포 내에 전달하는 단계를 포함하는 방법이 제공된다. 일부 실시형태에서, 상기 화합물은 치료제 또는 영상화제이다.
다른 양상에서 본 발명은 의학적 치료 또는 예방 방법에 사용하기 위한 본 발명에 따른 핵산 화합물을 제공한다.
또한 질병 또는 장애의 치료 또는 예방을 위한 약제의 제조에서의 본 발명에 따른 핵산 화합물의 용도가 제공된다.
또한 질병 또는 장애의 치료 또는 예방 방법이 제공되며, 상기 방법은 이를 필요로 하는 대상체에 본 발명에 따른 핵산 화합물의 유효량을 투여하는 단계를 포함한다.
일부 실시형태에서, 질병 또는 장애는 암이다. 일부 실시형태에서, 상기 방법은 항암제를 투여하는 단계를 포함한다. 일부 실시형태에서, 질병 또는 장애는 대사 장애 또는 신경계 장애이다.
또한 세포의 검출 방법으로서, 상기 방법은 (i) 세포를 본 발명에 따른 핵산 화합물과 접촉시키는 단계로서, 핵산 화합물은 영상화 모이어티를 포함하는 단계; (ii) 핵산 화합물이 상기 세포 상의 트랜스페린 수용체에 결합하여 상기 세포 내로 통과되도록 하는 단계; 및 (iii) 상기 영상화 모이어티를 검출함으로써, 상기 세포를 검출하는 단계를 포함하는 방법이 제공된다.
또한 세포의 검출 방법으로서, 상기 방법은(i) 세포를 영상화제 및 본 발명에 따른 핵산 화합물과 접촉시키는 단계; (ii) 핵산 화합물이 상기 세포 상의 트랜스페린 수용체와 결합할 수 있도록 하고, 상기 영상화제가 상기 세포 내로 통과할 수 있도록 하는 단계; 및 (iii) 상기 영상화제를 검출함으로써, 상기 세포를 검출하는 단계를 포함하는 방법이 제공된다.
본 발명은 기재된 양상 및 바람직한 특징의 조합을 포함하며, 단, 이러한 조합이 명백히 허용되지 않거나 명백히 회피되는 경우는 제외된다.
발명의 상세한 설명
정의
본 발명의 다양한 실시형태 및 양상이 본 명세서에 도시되고 기재되었지만, 이러한 실시형태 및 양상은 단지 예로서 제공된다는 것이 당업자에게 자명할 것이다. 이제, 본 발명을 벗어나지 않으면서, 다수의 변경, 변화 및 치환이 당업자에게 인식될 것이다. 본 명세서에 기재된 본 발명의 실시형태에 대한 다양한 대안이 본 발명의 실시에 사용될 수 있음을 이해해야 한다.
본 명세서에 사용된 섹션 제목은 단지 체계화를 위한 것이며, 기재 대상을 제한하는 것으로 해석되어서는 안된다. 제한 없이 특허, 특허 출원, 기사, 서적, 매뉴얼 및 논문을 포함하는 본 출원에 인용된 모든 문헌 또는 문헌의 일부는 임의의 목적을 위해 그 전문이 본 명세서에 참조로 명백하게 포함된다.
본 명세서에 사용된 약어는 화학 및 생물학적 분야에서의 그의 통상적인 의미를 갖는다. 본 명세서에 제시된 화학 구조 및 화학식은 화학 분야에 공지된 표준 화학 원자가 규칙에 따라 작제된다.
달리 정의되지 않는 한, 본 명세서에 사용된 기술 및 과학 용어는 당업자에게 일반적으로 이해되는 것과 동일한 의미를 갖는다. 예를 들어, 문헌[Singleton et al., DICTIONARY OF MICROBIOLOGY 및 MOLECULAR BIOLOGY 2nd ed., J. Wiley & 20 Sons (New York, NY 1994); Sambrook et al., MOLECULAR CLONING, A LABORATORY MANUAL, Cold Springs Harbor Press (Cold Springs Harbor, NY 1989)]을 참조한다. 본 명세서에 기재된 것과 유사하거나 균등한 임의의 방법, 장치 및 재료가 본 발명의 실시에 사용될 수 있다. 하기의 정의는 본 명세서에 빈번하게 사용되는 특정 용어의 이해를 돕기 위해 제공되며, 본 개시내용의 범위를 제한하는 의미는 아니다.
"핵산"은 단일-, 이중- 또는 다중-가닥 형태의 데옥시리보뉴클레오타이드 또는 리보뉴클레오타이드 및 그의 중합체 또는 그의 상보체를 지칭한다. 용어 "폴리뉴클레오타이드"는 뉴클레오타이드의 선형 서열을 지칭한다. 용어 "뉴클레오타이드"는 통상적으로 폴리뉴클레오타이드의 단일 단위, 즉 단량체를 지칭한다. 뉴클레오타이드는 리보뉴클레오타이드, 데옥시리보뉴클레오타이드 또는 그의 변형된 버전일 수 있다. 본 명세서에서 고려되는 폴리뉴클레오타이드의 예는 단일 및 이중 가닥 DNA, 단일 및 이중 가닥 RNA (siRNA 포함), 및 단일 및 이중 가닥 DNA 및 RNA의 혼합물을 갖는 혼성체 분자를 포함한다. 핵산은 선형 또는 분지형일 수 있다. 예를 들어, 핵산은 뉴클레오타이드의 선형 사슬일 수 있거나, 핵산이 분지형일 수 있어서, 예를 들어, 핵산이 뉴클레오타이드의 하나 이상의 아암 (arm) 또는 분지를 포함할 수 있다. 선택적으로, 분지형 핵산은 반복적으로 분지되어, 덴드리머 (dendrimer) 등과 같은 고차 구조를 형성한다.
포스포티오에이트 골격을 갖는 핵산을 포함하는 핵산은 하나 이상의 반응성 모이어티를 포함할 수 있다. 본 명세서에 사용되는 바와 같이, 용어 반응성 모이어티는 공유, 비공유 또는 다른 상호작용을 통해 다른 분자, 예를 들어, 핵산 또는 폴리펩타이드와 반응할 수 있는 임의의 기를 포함한다. 예로서, 핵산은 공유, 비공유 또는 다른 상호작용을 통해 단백질 또는 폴리펩타이드 상의 아미노산과 반응하는 아미노산 반응성 모이어티를 포함할 수 있다.
상기 용어는 또한 합성, 자연 발생 및 비 자연 발생의 공지된 뉴클레오타이드 유사체 또는 변형된 골격 잔기 또는 연결을 포함하는 핵산을 포함하고, 이는 기준 핵산과 유사한 결합 특성을 가지며, 기준 뉴클레오타이드와 유사한 방식으로 대사된다. 이러한 유사체의 예는 제한 없이, 포스포아미데이트, 포스포로디아미데이트, 포스포로티오에이트 (포스포티오에이트라고도 함), 포스포로디티오에이트, 포스포노카복실산, 포스포노카복실레이트, 포스포노아세트산, 포스포노포름산, 메틸 포스포네이트, 붕소 포스포네이트 또는 O-메틸포스포로아미다이트 연결 (문헌[Eckstein, Oligonucleotides and Analogues: A Practical Approach, Oxford University Press] 참조); 및 펩타이드 핵산 골격 및 연결을 포함하는 포스포디에스테르 유도체를 포함한다. 다른 유사체 핵산은 미국 특허 제 5,235,033호 및 제 5,034,506호, 및 문헌[Chapters 6 and 7, ASC Symposium Series 580, Carbohydrate Modifications in Antisense Research, Sanghui & Cook, eds]에 기재된 것을 포함하여, 양의 골격; 비이온성 골격, 변형된 당 및 비리보스 골격 (예를 들어, 포스포로디아미데이트 모르폴리노 올리고 또는 잠금 핵산 (LNA))을 갖는 것들을 포함한다. 하나 이상의 카보사이클릭 당을 포함하는 핵산이 또한 하나의 핵산 정의 내에 포함된다. 리보스-포스페이트 골격의 변형은 다양한 이유로, 예를 들어 생리학적 환경에서 또는 바이오칩상의 프로브 (probe)로서 이러한 분자의 안정성 및 반감기를 증가시키기 위해 수행될 수 있다. 자연 발생 핵산 및 유사체의 혼합물을 제조할 수 있으며; 대안적으로, 상이한 핵산 유사체의 혼합물, 및 자연 발생 핵산 및 유사체의 혼합물을 제조할 수 있다. 실시형태에서, DNA의 뉴클레오타이드 간 연결은 포스포디에스테르, 포스포디에스테르 유도체, 또는 이 둘 모두의 조합이다.
단어 "상보적" 또는 "상보성"은 폴리뉴클레오타이드의 핵산이 제2 폴리뉴클레오타이드의 다른 핵산과 염기쌍을 형성하는 능력을 지칭한다. 예를 들어, 서열 A-G-T는 서열 T-C-A에 상보적이다. 상보성은 일부 핵산만이 염기쌍에 따라 매칭되는 경우 부분적일 수 있으며, 모든 핵산이 염기쌍에 따라 매칭되는 경우 완전할 수 있다.
본 명세서에 사용되는 바와 같이, 용어 "프로브" 또는 "프라이머 (primer)"는 샘플에 대한 특이적 혼성화가 검출될 수 있는 하나 이상의 핵산 단편으로 규정된다. 프로브 또는 프라이머는 사용될 특정 기법에 따라 임의의 길이일 수 있다. 예를 들어, PCR 프라이머는 일반적으로 길이가 10 내지 40개의 뉴클레오타이드이고, 예를 들어 서던 블롯에 대한 핵산 프로브는 길이가 100개 초과의 뉴클레오타이드일 수 있다. 프로브는 표지되지 않거나, 표적 또는 샘플에 대한 그 결합이 검출될 수 있도록 하기에 기재되는 바와 같이 표지될 수 있다. 프로브는 염색체, 예를 들어, 하나 이상의 클론, 단리된 전체 염색체 또는 염색체 단편, 또는 중합효소 연쇄 반응 (PCR) 증폭 산물의 수집의 하나 이상의 특정 (사전 선택된) 부분으로부터의 핵산 공급원으로부터 생성될 수 있다. 표적 요소 상에 고정된 핵산의 길이 및 복잡성은 본 발명에서 중요하지 않다. 당업자는 소정의 혼성화 절차에 대한 최적의 혼성화 및 신호 생성을 제공하고, 상이한 유전자 또는 게놈 위치 사이에 필요한 분석을 제공하도록 이들 인자를 조정할 수 있다.
프로브는 또한 어레이 (array)에서와 같이 고체 표면 (예를 들어, 니트로셀룰로스, 유리, 석영, 용융 실리카 슬라이드) 상에 고정된 단리 핵산일 수 있다. 일부 실시형태에서, 프로브는 예를 들어 WO 96/17958에 기재된 바와 같은 핵산 어레이의 구성원일 수 있다. 고밀도 어레이를 생성할 수 있는 기법이 또한 이 목적을 위해 사용될 수 있다 (예를 들어, 문헌[Fodor (1991) Science 767-773; Johnston (1998) Curr. Biol. 8: R171-R174; Schummer (1997) Biotechniques 23: 1087-1092; Kern (1997) Biotechniques 23: 120-124; 미국 특허 제 5, 143,854호] 참조).
용어 "유전자"는 단백질 생성에 관여하는 DNA 절편을 의미하고; 여기에는 코딩 영역의 전 및 후의 영역 (리더 (leader) 및 트레일러 (trailer))뿐만 아니라, 개별 코딩 절편 (엑손) 사이의 중간 서열 (인트론)이 포함된다. 인트론뿐만 아니라, 리더, 트레일러는 유전자의 전사 및 번역 동안 필요한 조절 요소를 포함한다. 또한, "단백질 유전자 산물"은 특정 유전자로부터 발현되는 단백질이다.
유전자와 관련하여 본 명세서에 사용되는 바와 같은 단어 "발현" 또는 "발현된"은 그 유전자의 전사 및/또는 번역 산물을 의미한다. 세포에서 DNA 분자의 발현 수준은 세포 내에 존재하는 해당 mRNA의 양 또는 세포에 의해 생성된 DNA에 의해 인코딩된 단백질의 양을 기반으로 하여 결정될 수 있다. 비코딩 핵산 분자 (예를 들어, siRNA)의 발현 수준은 당 업계에 널리 공지된 표준 PCR 또는 노던 블롯 방법에 의해 검출될 수 있다. 문헌[Sambrook et al., 1989 Molecular Cloning: A Laboratory Manual, 18.1-18.88]을 참조한다.
본 명세서에서 제공되는 바와 같이, 용어 "앱타머"는 (예를 들어, 높은 친화도 및 특이성으로) 단백질, 펩타이드 및 소분자에 결합하는 올리고뉴클레오타이드 (예를 들어, 짧은 올리고뉴클레오타이드 또는 데옥시리보뉴클레오타이드)를 지칭한다. 앱타머는 통상적으로 상보적 염기쌍을 형성하는 경향으로 인해 2차 또는 3차 구조를 규정하였으며, 따라서 종종 다양하고 복잡한 분자 구조로 접힐 수 있다. 3차원 구조는 앱타머 결합 친화도 및 특이성에 필수적이며, 특정 3차원 상호작용은 앱타머-표적 복합체의 형성을 유도한다. 앱타머는 기하급수적인 다량화에 의한 리간드의 전체 발전(evolution) 과정 (문헌[Ellington AD, Szostak JW (1990) In vitro selection of RNA molecules that bind specific ligands. Nature 346:818-822; Tuerk C, Gold L (1990) Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase. Science 249:505-510]에 기재된 바와 같은 SELEX)에 의하거나, SOMAmers (저속 오프-레이트 변형 앱타머 (slow off-rate modified aptamer)) (문헌[Gold L et al. (2010) Aptamer-based multiplexed proteomic technology for biomarker discovery. PLoS ONE 5(12):e15004])를 진행함으로써 시험관내에서 매우 큰 무작위 서열 라이브러리로부터 선택될 수 있다. SELEX 및 SOMAmer 기술의 적용은, 예를 들어 앱타머의 화학적 다양성을 확대하기 위해 아미노산 측쇄를 모방하는 작용기를 첨가하는 단계를 포함한다. 결과적으로 거의 모든 단백질 표적에 대한 높은 친화도의 앱타머를 다량화하고 확인한다. 앱타머는 선택 및 합성의 용이성 , 높은 결합 친화도 및 특이성, 가요성 구조, 낮은 면역원성 및 다양한 합성 접근성과 같은 표적화된 약물 전달을 위한 많은 바람직한 특성을 나타낸다. 현재까지, 다양한 항암제 (예를 들어, 화학요법 약물, 독소 및 siRNA)가 앱타머를 사용하여 시험관내에서 암 세포에 성공적으로 전달되었다.
본 명세서에 지칭되는 바와 같이, "안티센스 핵산"은 특정 표적 핵산 (예를 들어, 단백질로 번역 가능한 mRNA)의 적어도 일부에 상보적이고, 표적 핵산의 전사 (예를 들어, DNA로부터의 mRNA)를 감소시키거나, 표적 핵산 (예를 들어, mRNA)의 번역을 감소시키거나, 전사체 스플라이싱 (splicing) (예를 들어, 단일 가닥 모르폴리노 올리고)을 변이시킬 수 있는 핵산 (예를 들어, DNA 또는 RNA 분자)이다. 예를 들어, 문헌[Weintraub, Scientific American, 262:40 (1990)]을 참조한다. 통상적으로, 합성 안티센스 핵산 (예를 들어, 올리고뉴클레오타이드)은 일반적으로 길이가 15 내지 25개 염기이다. 따라서, 안티센스 핵산은 표적 핵산 (예를 들어, 표적 mRNA)에 혼성화 (예를 들어, 선택적으로 혼성화)할 수 있다. 실시형태에서, 안티센스 핵산은 엄격한 혼성화 조건 하에서 표적 핵산 서열 (예를 들어, mRNA)에 혼성화된다. 실시형태에서, 안티센스 핵산은 중간 정도의 엄격한 혼성화 조건 하에서 표적 핵산 (예를 들어, mRNA)에 혼성화된다. 안티센스 핵산은 자연 발생 뉴클레오타이드 또는 변형 뉴클레오타이드, 예를 들어 포스포로티오에이트, 메틸포스포네이트 및 -아노머 당-포스페이트, 골격 변형 뉴클레오타이드를 포함할 수 있다.
세포에서, 안티센스 핵산은 해당 mRNA에 혼성화하여 이중 가닥 분자를 형성한다. 안티센스 핵산은 세포가 이중 가닥인 mRNA를 번역하지 않을 것이기 때문에 mRNA의 번역을 간섭한다. 유전자의 시험관내 번역을 억제하기 위한 안티센스 방법의 사용은 당 업계에 널리 공지되어 있다 (문헌[Marcus-Sakura, Anal. Biochem., 172:289 (1988)]). 또한, DNA에 직접 결합하는 안티센스 분자가 사용될 수 있다. 안티센스 핵산은 단일 또는 이중 가닥 핵산일 수 있다. 안티센스 핵산의 비 제한적 예는 siRNA (그의 유도체 또는 전구체, 예컨대 뉴클레오타이드 유사체 포함), 짧은 헤어핀 RNA (shRNA), 마이크로 RNA (miRNA), saRNA (작은 활성화 RNA) 및 작은 핵 RNA (snoRNA) 또는 이들의 유도체 또는 전구체 중 일부를 포함한다.
본 명세서에서 제공되는 바와 같이, "siRNA", "작은 간섭 RNA", "작은 RNA" 또는 "RNAi"는 이중 가닥 RNA를 형성하는 핵산을 지칭하며, 이중 가닥 RNA는 유전자 또는 표적 유전자와 동일한 세포에서 발현되는 경우, 유전자 또는 표적 유전자의 발현을 감소 또는 억제하는 능력을 갖는다. 이중 가닥 분자를 형성하기 위해 혼성화하는 핵산의 상보적인 부분은 통상적으로 실질적이거나 완전한 동일성을 갖는다. 일 실시형태에서, siRNA 또는 RNAi는 표적 유전자와 실질적이거나 완전한 동일성을 갖고, 이중 가닥 siRNA를 형성하는 핵산이다. 실시형태에서, siRNA는 상보적 세포 mRNA와 상호작용함으로써 상보적 mRNA의 발현을 간섭함으로써 유전자 발현을 억제한다. 통상적으로, 핵산은 길이가 적어도 약 15 내지 50개의 뉴클레오타이드이다 (예를 들어, 이중 가닥 siRNA의 각각의 상보적 서열은 길이가 15 내지 50개의 뉴클레오타이드이고, 이중 가닥 siRNA는 길이가 약 15 내지 50개의 염기쌍임). 다른 실시형태에서, 길이가 20 내지 30개의 염기 뉴클레오타이드, 바람직하게는 길이가 약 20 내지 25 또는 약 24 내지 30개의 뉴클레오타이드 , 예를 들어 길이가 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 또는 30개의 뉴클레오타이드이다.
본 명세서에서 제공되는 바와 같이, "saRNA" 또는 "작은 활성화 RNA"는 이중 가닥 RNA를 형성하는 핵산을 지칭하며, 이중 가닥 RNA는 유전자 또는 표적 유전자와 동일한 세포에서 발현되는 경우, 유전자 또는 표적 유전자의 발현을 증가 또는 활성화하는 능력을 갖는다. 이중 가닥 분자를 형성하기 위해 혼성화하는 핵산의 상보적인 부분은 통상적으로 실질적이거나 완전한 동일성을 갖는다. 일 실시형태에서, saRNA는 표적 유전자와 실질적이거나 완전한 동일성을 갖고, 이중 가닥 saRNA를 형성하는 핵산이다. 통상적으로, 핵산은 길이가 적어도 약 15 내지 50개의 뉴클레오타이드이다 (예를 들어, 이중 가닥 saRNA의 각각의 상보적 서열은 길이가 15 내지 50개의 뉴클레오타이드이고, 이중 가닥 saRNA는 길이가 약 15 내지 50개의 염기쌍임). 다른 실시형태에서, 길이가 20 내지 30개의 염기 뉴클레오타이드, 바람직하게는 길이가 약 20 내지 25 또는 약 24 내지 29개의 뉴클레오타이드, 예를 들어 길이가 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 또는 30개의 뉴클레오타이드이다.
핵산 또는 단백질에 적용될 때 용어 "단리된"은 핵산 또는 단백질이 자연 상태에서 관련된 다른 세포 성분이 필수적으로 부재함을 의미한다. 이는 예를 들어, 균질한 상태일 수 있고, 비수용액 또는 수용액일 수 있다. 순도 및 균질성은 통상적으로 폴리아크릴아미드 겔 전기영동 또는 고성능 액체 크로마토그래피와 같은 분석 화학 기법을 사용하여 결정된다. 제조물에 존재하는 주 종류의 단백질을 실질적으로 정제한다.
용어 "정제된"은 전기영동 겔에서 핵산 또는 단백질이 필수적으로 하나의 밴드를 생성함을 나타낸다. 일부 실시형태에서, 핵산 또는 단백질은 적어도 50% 순수, 선택적으로 적어도 65% 순수, 선택적으로 적어도 75% 순수, 선택적으로 적어도 85% 순수, 선택적으로 적어도 95% 순수, 및 선택적으로 적어도 99% 순수하다.
용어 "단리된"은 또한 세포 또는 샘플 세포를 지칭할 수 있다. 단리된 세포 또는 샘플 세포는 세포가 그의 천연 상태에 있을 때 또는 세포가 그의 천연 상태로부터 처음 분리되었을 때, 세포에 일반적으로 수반되는 많은 성분이 실질적으로 부재하는 단일 세포 유형이다. 특정 실시형태에서, 단리된 세포 샘플은 세포를 적절한 상태로 유지하는데 필요한 자연 상태로부터의 이들 성분을 유지한다. 일부 실시형태에서, 단리된 (예를 들어, 정제된, 분리된) 세포 또는 단리된 세포는 샘플에서 실질적으로 유일한 세포 유형인 세포이다. 정제된 세포 샘플은 적어도 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 또는 100%의 하나의 유형의 세포를 포함할 수 있다. 단리된 세포 샘플은 세포 마커 또는 세포 마커의 조합을 사용하여 획득될 수 있으며, 상기 세포 마커 중 하나는 정제되지 않은 세포 샘플 내의 하나의 세포 유형에 고유하다. 일부 실시형태에서, 세포는 세포 분류기를 사용하여 단리된다. 일부 실시형태에서, 세포를 단리하기 위해 세포 단백질에 대한 항체가 사용된다.
본 명세서에 사용되는 바와 같이, 용어 "접합체"는 원자 또는 분자 사이의 결합을 지칭한다. 결합은 직접적이거나 간접적일 수 있다. 예를 들어, 본 명세서에 제공된 바와 같은 핵산 (예를 들어, 리보핵산)과 화합물 모이어티 사이의 접합체는, 예를 들어 공유결합에 의해 직접이루어지거나, 예를 들어 비공유 결합에 의해 간접적으로 이루어질 수 있다. 선택적으로, 접합체는 다음에 제한되는 것은 아니나, 친핵성 치환 (예를 들어, 아민 및 알코올과 아실 할라이드, 활성 에스테르의 반응), 친전자성 치환 (예를 들어, 엔아민 반응) 및 탄소-탄소 및 탄소-헤테로원자 다중 결합에의 첨가 (예를 들어, Michael 반응, Diels-Alder 첨가)를 포함하는 접합 화학을 사용하여 형성된다. 이들 및 다른 유용한 반응은 예를 들어 문헌[March, ADVANCED ORGANIC CHEMISTRY, 3rd Ed., John Wiley & Sons, New York, 1985; Hermanson, BIOCONJUGATE TECHNIQUES, Academic Press, San Diego, 1996; and Feeney et al., MODIFICATION OF PROTEINS; Advances in Chemistry Series, Vol. 198, American Chemical Society, Washington, D.C., 1982]에 논의되어 있다. 따라서, 핵산은 그의 골격을 통해 화합물 모이어티에 부착될 수 있다. 선택적으로, 리보핵산은 리보핵산과 화합물 모이어티의 상호작용을 용이하게 하는 하나 이상의 반응성 모이어티, 예를 들어 아미노산 반응성 모이어티를 포함한다.
본 명세서의 접합체 화학에 사용되는 유용한 반응성 모이어티 또는 작용기는 예를 들어 다음을 포함한다:
(a) 다음에 제한되는 것은 아니나, N-하이드록시숙신이미드 에스테르, N-하이드록시벤즈트리아졸 에스테르, 산 할라이드, 아실 이미다졸, 티오에스테르, p-니트로페닐 에스테르, 알킬, 알케닐, 알키닐 및 방향족 에스테르를 포함하는 카복실기 및 그의 다양한 유도체;
(b) 에스테르, 에테르, 알데하이드 등으로 전환될 수 있는 하이드록실기;
(c) 할라이드가 친핵성 기, 예를 들어 아민, 카복실레이트 음이온, 티올 음이온, 카바니온 또는 알콕사이드 이온과 같은 친핵성 기로 이후에 대체됨으로써, 이에 의해 할로겐 원자의 부위에 새로운 기가 공유결합에 의해 부착된 할로알킬 기;
(d) 예를 들어 말레이미도 기와 같은 Diels-Alder 반응에 관여할 수 있는 친다이엔체 기;
(e) 예를 들어 이민, 히드라존, 세미카바존 또는 옥심과 같은 카보닐 유도체의 형성, 또는 Grignard 첨가 또는 알킬리튬 첨가와 같은 메커니즘을 통해 후속 유도체화가 가능한 알데하이드 또는 케톤 기;
(f) 예를 들어 술폰 아미드를 형성하기 위한 아민과의 후속 반응을 위한 술포닐 할라이드 기;
(g) 디술파이드로 전환되거나, 아실 할라이드와 반응하거나, 금과 같은 금속에 결합될 수 있는 티올 기;
(h) 예를 들어 아실화, 알킬화 또는 산화될 수 있는 아민 또는 술피드릴 기;
(i) 예를 들어, 고리 첨가, 아실화, Michael 첨가 등에 관여할 수 있는 알켄;
(j) 예를 들어 아민 및 하이드록실 화합물과 반응할 수 있는 에폭사이드;
(k) 핵산 합성에 유용한 포스포르아미다이 트 및 다른 표준 작용기;
(I) 금속 규소 산화물 결합;
(m) 예를 들어 포스페이트 디에스테르 결합을 형성하기 위한 반응성 인 기 (예를 들어, 포스핀)에의 금속 결합; 및
(n) 술폰, 예를 들어 비닐 술폰.
반응성 작용기는 본 명세서에 기재된 단백질의 화학적 안정성에 관여하거나 간섭하지 않도록 선택될 수 있다. 예로서, 핵산은 비닐 술폰 또는 다른 반응성 모이어티을 포함할 수 있다. 선택적으로, 핵산은 화학식 S-S-R을 갖는 반응성 모이어티를 포함할 수 있다. R은 예를 들어 보호기일 수 있다. 선택적으로, R은 헥산올이다. 본 명세서에 사용되는 바와 같이, 용어 헥산올은 화학식 C6H13OH의 화합물을 포함하고, 1-헥산올, 2-헥산올, 3-헥산올, 2-메틸-1-펜탄올, 3-메틸-1-펜탄올, 4-메틸-1-펜탄올, 2-메틸-2-펜탄올, 3-메틸-2-펜탄올, 4-메틸-2-펜탄올, 2-메틸-3-펜탄올, 3-메틸-3-펜탄올, 2,2-디메틸-1-부탄올, 2,3-디메틸-1-부탄올, 3,3-디메틸-1-부탄올, 2,3-디메틸-2-부탄올, 3,3-디메틸-2-부탄올 및 2-에틸-1-부탄올을 포함한다. 선택적으로, R은 1-헥산올이다.
본 명세서에 사용되는 바와 같이, 용어 "약"은 특정 값을 포함하는 값의 범위를 의미하며, 당업자는 특정 값과 상당히 유사한 것으로 고려할 것이다. 실시형태에서, 용어 "약"은 당 업계에서 일반적으로 인정되는 측정을 사용한 표준 편차 내를 의미한다. 실시형태들에서, 약은 특정 값의 +/- 10%까지 확장되는 범위를 의미한다. 일부 실시형태에서, 약은 특정 값을 의미한다.
용어 "단백질", "펩타이드" 및 "폴리펩타이드"는 아미노산 중합체 또는 2개 이상의 상호작용 또는 결합 아미노산 중합체의 세트를 나타내는 것으로 상호 혼용된다. 상기 용어는 자연 발생 아미노산 중합체 및 비 자연 발생 아미노산 중합체뿐만 아니라, 하나 초과의 아미노산 잔기가 해당 자연 발생 아미노산의 인공 화학 모방체인 아미노산 중합체에 적용된다.
용어 "아미노산"은 자연 발생 및 합성 아미노산뿐만 아니라, 자연 발생 아미노산과 유사한 방식으로 기능하는 아미노산 유사체 및 아미노산 모방체를 지칭한다. 자연 발생 아미노산은 유전자 코드에 의해 인코딩되는 것뿐만 아니라, 이후에 변형된 아미노산, 예를 들어 하이드록시프롤린, γ-카복시글루타메이트 및 O-포스포세린이다. 아미노산 유사체는 자연 발생 아미노산, 즉 수소, 카복실기, 아미노기 및 R기에 결합된 탄소와 동일한 기본 화학 구조를 갖는 화합물, 예를 들어 호모세린, 노르류신, 메티오닌 술폭사이드, 메티오닌 메틸 술포늄을 지칭한다. 이러한 유사체는 변형된 R 기 (예를 들어, 노르류신) 또는 변형된 펩타이드 골격을 갖지만, 자연 발생 아미노산과 동일한 기본 화학 구조를 유지한다. 아미노산 모방체는 아미노산의 일반적인 화학 구조와는 상이한 구조를 가지나, 자연 발생 아미노산과 유사한 방식으로 기능하는 화학적 화합물을 지칭한다. 용어 "비 자연 발생 아미노산" 및 "비 천연 아미노산"은 자연에 존재하지 않는 아미노산 유사체, 합성 아미노산 및 아미노산 모방체를 지칭한다.
아미노산은 일반적으로 공지된 3개의 문자 기호 또는 lUPAC-IUB 생화학적 명명법 위원회에 의해 권장되는 1 문자 기호에 의해 본 명세서에서 지칭될 수 있다. 마찬가지로, 뉴클레오타이드는 통상적으로 인정되는 단일 문자 코드로 지칭될 수 있다.
"보존적으로 변형된 변이체"는 아미노산 및 핵산 서열 둘 모두에 적용된다. 특정 핵산 서열과 관련하여, 보존적으로 변형된 변이체는 동일하거나 필수적으로 동일한 아미노산 서열을 인코딩하는 핵산, 또는 핵산이 아미노산 서열을 인코딩하지 않는 경우 필수적으로 동일한 서열을 지칭한다. 유전자 코드의 축퇴성으로 인해, 기능적으로 동일한 다수의 핵산이 임의의 소정의 단백질을 인코딩한다. 예를 들어, 코돈 GCA, GCC, GCG 및 GCU는 모두 아미노산 알라닌을 인코딩한다. 따라서, 알라닌이 코돈에 의해 특정되는 모든 위치에서, 상기 코돈은 인코딩된 폴리펩타이드를 변이시키지 않으면서, 기재된 임의의 해당 코돈으로 변이될 수 있다. 이러한 핵산 변이는 "침묵 변이"이며, 이는 보존적으로 변형된 변이의 한 종류이다. 본 명세서에서 폴리펩타이드를 인코딩하는 모든 핵산 서열은 또한 핵산의 모든 가능한 침묵 변이를 기재한다. 당업자는 핵산 내의 각 코돈 (일반적으로 메티오닌에 대한 유일한 코돈인 AUG 및 일반적으로 트립토판에 대한 유일한 코돈인 TGG 제외)이 기능적으로 동일한 분자를 생성하도록 변형될 수 있음을 인식할 것이다. 따라서, 폴리펩타이드를 인코딩하는 핵산의 각각의 침묵 변이는 발현 산물과 관련하여 기재된 각각의 서열에 내재되어 있지만, 실제 프로브 서열과 관련하여서는 그러하지 않다.
아미노산 서열에 관해, 당업자는 변이에 의해 아미노산이 화학적으로 유사한 아미노산으로 치환되는 경우, 인코딩되는 서열에서 단일 아미노산 또는 작은 백분율의 아미노산을 변이, 첨가 또는 결실시키는 핵산, 펩타이드, 폴리펩타이드 또는 단백질 서열에 대한 개별 치환, 결실 또는 첨가가 "보존적으로 변형된 변이체"임을 인식할 것이다. 기능적으로 유사한 아미노산을 제공하는 보존적 치환 표는 당 업계에 널리 공지되어 있다. 이러한 보존적으로 변형된 변이체는 본 발명의 다형성 변이체, 종간 상동체 및 대립유전자에 추가되며, 이를 배제하지 않는다.
하기 8개의 그룹은 각각 서로에 대한 보존적 치환인 아미노산을 포함한다: 1) 알라닌 (A), 글리신 (G); 2) 아스파르트산 (D), 글루탐산 (E); 3)
아스파라긴 (N), 글루타민 (Q); 4) 아르기닌 (R), 리신 (K); 5) 이소류신 (I); 류신 (L),
메티오닌 (M), 발린 (V); 6) 페닐알라닌 (F), 티로신 (Y), 트립토판 (W); 7) 세린 (S), 트레오닌 (T); 및 8) 시스테인 (C), 메티오닌 (M) (예를 들어, 문헌[Creighton, Proteins (1984)] 참조).
본 명세서에 기재된 특정 단백질 (예를 들어, TfR)에서, 용어 단백질은 단백질의 자연 발생 형태, 단백질 전사 인자 활성 (예를 들어, 천연 단백질과 비교하여 적어도 50%, 80%, 90%, 95%, 96%, 97%, 98%, 99% 또는 100% 활성 이내)을 유지하는 변이체 또는 상동체 중 어느 하나를 포함한다. 일부 실시형태에서, 변이체 또는 상동체는 자연 발생 형태와 비교하여, 전체 서열 또는 서열의 일부 (예를 들어, 50, 100, 150 또는 200개의 인접 아미노산 부분)에 걸쳐 적어도 90%, 95%, 96%, 97%, 98%, 99% 또는 100% 아미노산 서열 동일성을 갖는다. 다른 실시형태에서, 단백질은 그의 NCBI 서열 참조번호에 의해 확인되는 바와 같은 단백질이다. 다른 실시형태에서, 단백질은 그의 NCBI 서열 참조번호에 의해 확인되는 바와 같은 단백질, 상동체 또는 그의 기능성 단편이다.
본 명세서에서 제공되는 바와 같이, 용어 "TfR"은 트랜스페린 수용체 (TfR) 단백질 자연 발생 형태, TfR의 활성 (예를 들어, 천연 단백질과 비교하여 적어도 50%, 80%, 90%, 95%, 96%, 97%, 98%, 99% 또는 100% 활성 이내)을 유지하는 변이체 또는 상동체 중 어느 하나를 포함한다. 일부 실시형태에서, 변이체 또는 상동체는 자연 발생 형태와 비교하여, 전체 서열 또는 서열의 일부 (예를 들어, 50, 100, 150 또는 200개의 인접 아미노산 부분)에 걸쳐 적어도 90%, 95%, 96%, 97%, 98%, 99% 또는 100% 아미노산 서열 동일성을 갖는다. 실시형태에서, TfR 단백질은 NCBI 서열 참조번호 Gl: 189458817 (NCBI 참조번호 서열: NP_003225.2; 서열번호 6)에 의해 확인되는 바와 같은 단백질이다. 실시형태에서, TfR 단백질은 NCBI 서열 참조번호 Gl: 189458816 (NCBI 참조번호 서열: NM_003234.3)에 의해 확인되는 뉴클레오타이드 서열에 의해 인코딩되는 바와 같은 단백질이다. 실시형태에서, TfR 단백질은 NCBI 서열 참조번호 Gl: 189458818 (NCBI 참조번호 서열: NM_001128148.2)에 의해 확인되는 뉴클레오타이드 서열에 의해 인코딩되는 바와 같은 단백질이다. 실시형태에서, TfR 단백질은 NCBI 서열 참조번호 Gl: 189458817 (NCBI 참조번호 서열: NP_003225.2; 서열번호 6)에 의해 확인되는 바와 같은 단백질, 상동체 또는 그의 기능성 단편이다. 실시형태에서, TfR 단백질은 NCBI 서열 참조번호 Gl: 189458816 (NCBI 참조번호 서열: NM_003234.3)에 의해 확인되는 뉴클레오타이드 서열에 의해 인코딩되는 바와 같은 단백질, 상동체 또는 그의 기능성 단편이다. 실시형태에서, TfR 단백질은 NCBI 서열 참조번호 Gl: 189458818 (NCBI 참조번호 서열: NM_001128148.2)에 의해 확인되는 뉴클레오타이드 서열에 의해 인코딩되는 바와 같은 단백질, 상동체 또는 그의 기능성 단편이다. 실시형태에서, TfR 단백질은 NCBI 유전자 ID: 7037에 해당 핵산 서열에 의해 인코딩된다.
본 명세서에서 제공되는 바와 같이, 용어 "C/EBPa" 또는 "C/EBP알파"는 CCAAT (시토신-시토신-아데노신-아데노신-티미딘/인핸서 (enhancer)-결합 단백질 알파 (C/EBPa) 자연 발생 형태, C/EBP알파의 전사 인자 활성 (예를 들어, 천연 단백질과 비교하여 적어도 50%, 80%, 90%, 95%, 96%, 97%, 98%, 99% 또는 100% 활성 이내)을 유지하는 변이체 또는 상동체 중 어느 하나를 포함한다. 일부 실시형태에서, 변이체 또는 상동체는 자연 발생 형태와 비교하여, 전체 서열 또는 서열의 일부 (예를 들어, 50, 100, 150 또는 200개의 인접 아미노산 부분)에 걸쳐 적어도 90%, 95%, 96%, 97%, 98%, 99% 또는 100% 아미노산 서열 동일성을 갖는다. 실시형태에서, C/EBP알파 단백질은 NCBI 서열 참조번호 Gl:28872794 (NP_004355.2), Gl: 551894998 (NP_001272758.1), Gl: 566559992 (NP_001274353.1), 또는 GI: 566559994 (NP_001274364.1)에 의해 확인되는 바와 같은 단백질, 또는 상동체 또는 그의 기능성 단편이다. 실시형태에서, C/EBP알파 단백질은 유전자 ID: 1050에 해당 핵산 서열에 의해 인코딩된다.
용어 "시르투인(sirtuin)"은 모노-ADP-리보실트랜스퍼라제 또는 데아세틸라제 활성 (데아세틸라제, 데숙신닐라제, 데말로닐라제, 데미리토실라제 및 데팔미토일라제 활성 포함)을 보유하는 시르투인 부류의 단백질 중 하나 이상을 지칭한다. 이는 니코틴 아데닌 디뉴클레오타이드 (NAD)에 따르고, 노화 메커니즘, 스트레스에 대한 반응, 및 암 및 당뇨병과 같은 장애의 조절과 관련되었다 (예를 들어, 문헌[North and Verdin, Genome Biol. 2004, 5(5): 224; Preyat and Leo, J. Leukoc. Biol. 2013, 93(5): 669-680; and Satoh A et al., J Neurosci. 2010, 30(30): 10220-10232], 상기 문헌 모두는 그 전문이 본 명세서에 참조로 포함됨). 인간 게놈은 7개의 시르투인 유전자 SIRT1 내지 SIRT7을 인코딩한다. "SIRT1", "SIRT2", "SIRT3", "SIRT4", "SIRT5", "SIRT6" 및 "SIRT7"은 각각 Sirtl 내지 Sirt7 단백질을 인코딩하는 인간 시르투인 유전자를 지칭하며, 이는 Sirtl 내지 Sirt7 중 하나 이상의 데아세틸라제 활성 (예를 들어, 천연 단백질과 비교하여 적어도 50%, 80%, 90%, 95%, 96%, 97%, 98%, 99% 또는 100% 활성 이내)을 유지하는 단백질 산물을 생성하는 이들의 상동체 및 변이체를 포함한다. 본 명세서에서 제공되는 바와 같이, 용어 "Sirtl", "Sirt2", "Sirt3", "Sirt4", "Sirt5", "Sirt6", 및 "Sirt7"은 임의의 자연 발생 형태, 상기 시르투인 단백질의 데아세틸라제 활성 (예를 들어, 천연 단백질과 비교하여 적어도 50%, 80%, 90%, 95%, 96%, 97%, 98%, 99% 또는 100% 활성 이내)을 유지하는 변이체 또는 상동체를 포함한다. 일부 실시형태에서, 변이체 또는 상동체는 자연 발생 형태와 비교하여, 전체 서열 또는 서열의 일부 (예를 들어, 50, 100, 150 또는 200개의 인접 아미노산 부분)에 걸쳐 적어도 90%, 95%, 96%, 97%, 98%, 99% 또는 100% 아미노산 서열 동일성을 갖는다. 일부 실시형태에서, 인간 Sirtl 단백질은 NCBI 참조번호 서열: NP_036370.2에 의해 확인되는 바와 같은 단백질이다. 일부 실시형태에서, Sirtl 단백질은 유전자 ID: 23411에 해당 핵산 서열에 의해 인코딩된다. 인간 Sirt2는 GenBank 참조번호 AAK51133.1에 의해 확인되는 바와 같은 단백질일 수 있고, 유전자 ID: 22933에 해당 핵산 서열에 의해 인코딩될 수 있다. 인간 Sirt3은 GenBank 참조번호 AAD40851.1에 의해 확인되는 바와 같은 단백질일 수 있고, 유전자 ID: 23410에 해당 핵산 서열에 의해 인코딩될 수 있다. 인간 Sirt4는 NCBI 참조번호 NP_036372.1에 의해 확인되는 바와 같은 단백질일 수 있고, 유전자 ID: 23409에 해당 핵산 서열에 의해 인코딩될 수 있다. 인간 Sirt5는 GenBank 참조번호 AAD40853.1에 의해 확인되는 바와 같은 단백질일 수 있고, 유전자 ID: 23408에 해당 핵산 서열에 의해 인코딩될 수 있다. 인간 Sirt6은 GenBank 참조번호 CAG33481.1에 의해 확인되는 바와 같은 단백질일 수 있고, 유전자 ID: 51548에 해당 핵산 서열에 의해 인코딩될 수 있다. 인간 Sirt7은 NCBI 참조번호 NP_057622.1에 의해 확인되는 바와 같은 단백질일 수 있고, 유전자 ID: 51547에 해당 핵산 서열에 의해 인코딩될 수 있다.
용어 "HNF"는 하나 이상의 간세포 핵 인자를 지칭한다. 간세포 핵 인자는 유전자 발현을 조절하는 것으로, 간에서 주로 발현되는 전사 인자의 그룹이다. HNF는 간, 내장, 신장 및 췌장 베타 세포에서 주로 발현되는 핵 수용체 단백질인 간세포 핵 인자 4 (HNF4)를 지칭할 수 있다. HNF4A 및 HNF4G 유전자에 의해 각각 발현되는 인간 HNF4의 2개의 이소형 HNF4α 및 HNF4γ가 존재한다. 인간 HNF4α 및/또는 HNF4A는 Uniprot P41235에 의해 확인된 바와 같은 단백질/유전자일 수 있으며, 이는 또한 대안적 프로모터 사용 및 대안적 스플라이싱에 의해 생성되는 HNF4α의 적어도 7개의 이소형을 기재한다. 인간 HNF4γ 및/또는 HNF4G는 Uniprot Q14541에 의해 확인된 바와 같은 단백질/유전자일 수 있으며, 이는 대안적 스플라이싱에 의해 생성된 HNF4γ의 2개의 이소형을 기재한다. HNF4A 유전자의 돌연변이 또는 변이는 소아 1의 성숙기-발병 당뇨병 (MODY1; 예를 들어, 문헌[Bulman MP et al., Diabetologia. 1997, 40(7): 859-62] 참조), 비-인슐린 의존성 진성 당뇨병 (NIDDM; 예를 들어, 문헌[Hani EH et al., J Clin Invest. 1998, 101 (3):521-6] 참조), 및 소아의 성숙기 발병 당뇨병을 갖는 판코니 관상동맥 증후군 4 (FRTS4; 예를 들어, 문헌[Hamilton AJ et al., J Med Genet. 2014, 51 (3): 165-9] 참조)을 포함하는 대사 장애와 관련된다. 용어 "HNF4α" 및 "HNF4γ"는 임의의 자연 발생 형태, HNF4α 또는 HNF4γ의 활성 (예를 들어, 천연 단백질과 비교하여 적어도 50%, 80%, 90%, 95%, 96%, 97%, 98%, 99% 또는 100% 활성 이내)을 유지하는 변이체 또는 상동체를 포함한다. 일부 실시형태에서, 변이체 또는 상동체는 자연 발생 형태와 비교하여, 전체 서열 또는 서열의 일부 (예를 들어, 50, 100, 150 또는 200개의 인접 아미노산 부분)에 걸쳐 적어도 90%, 95%, 96%, 97%, 98%, 99% 또는 100% 아미노산 서열 동일성을 갖는다. 용어 "HNF4A" 및 "HNF4G"는 HNF4α 및/또는 HNF4γ 중 하나 이상의 활성 (예를 들어, 천연 단백질과 비교하여 적어도 50%, 80%, 90%, 95%, 96%, 97%, 98%, 99% 또는 100% 활성 이내)을 유지하는 단백질 산물을 생성하는 그의 상동체 및 변이체뿐만 아니라, 유전자를 포함한다.
본 명세서에 사용되는 바와 같이 "세포"는 그의 게놈 DNA를 보존 또는 복제하기에 충분한 대사 또는 다른 기능을 수행하는 세포를 지칭한다. 세포는, 예를 들어 온전한 막의 존재, 특정 염료에 의한 염색, 자손 생성 능력, 또는 생식체의 경우에 제2 생식체와 조합하여, 생존 가능한 자손을 생성하는 능력을 포함하여 당 업계에 널리 공지된 방법에 의해 확인될 수 있다. 세포는 원핵 및 진핵 세포를 포함할 수 있다. 원핵 세포는 박테리아를 포함하지만 이에 제한되지는 않는다. 진핵 세포는 다음에 제한되는 것은 아니나, 효모 세포 및 식물 및 동물, 예를 들어 포유류, 곤충 (예를 들어, 스포돕테라(spodoptera))으로부터 유래된 세포 및 인간 세포를 포함한다.
용어 "혈뇌 장벽"은 순환 혈액을 뇌 및 중추신경계의 세포 외액으로부터 분리시키는 고도의 선택적 반투과성 막 장벽을 지칭한다. 장벽은 혈액과 뇌 사이의 이온, 분자 및 세포의 이동에 대한 엄격한 조절을 제공하며, 예를 들어, 문헌[Daneman and Prat, Cold Spring Harb Perspect Biol. 2015;7(1):a020412]을 참조한다. 많은 치료 분자는 일반적으로 뇌 모세혈관 내피 벽을 통한 극히 작은 투과성으로 인해 혈액으로부터 뇌로의 수송에서 제외된다.
"항암제"는 그의 통상의 일반적인 의미에 따라 사용되며, 항신생물 특성 또는 세포의 성장 또는 증식을 억제하는 능력을 갖는 조성물 (예를 들어, 화합물, 약물, 길항제, 억제제, 조절제)을 지칭한다. 실시형태에서, 항암제는 화학요법제이다. 실시형태에서, 항암제는 암 치료 방법에 유용한 것으로 본 명세서에서 확인된 제제이다. 실시형태에서, 항암제는 암 치료를 위해 FDA 또는 미국 이외의 국가의 유사한 규제 기관에 의해 승인된 제제이다. 항암제의 예는 다음에 제한되는 것은 아니나, MEK (예를 들어, MEK1, MEK2, 또는 MEK1 및 MEK2) 억제제 (예를 들어, XL518, CI-1040, PD035901, 셀루메티닙 (selumetinib)/AZD6244, GSK1120212/트라메티닙 (trametinib), GDC-0973, ARRY-162, ARRY-300, AZD8330, PD0325901, U0126, PD98059, TAK-733, PD318088, AS703026, BAY 869766), 알킬화제 (예를 들어, 사이클로포스파미드 (cyclophosphamide), 이포스파미드 (ifosfamide), 클로람부실 (chlorambucil), 부술판(busulfan), 멜팔란 (melphalan), 메클로레타민 (mechlorethamine), 우라무스틴 (uramustine), 티오테파 (thiotepa), 니트로소우레아(nitrosourea), 질소 머스타드 (nitrogen mustard) (예를 들어, 메클로로에타민 (mechloroethamine), 사이클로포스파미드 (cyclophosphamide), 클로람부실 (chlorambucil), meiphalan), 에틸렌이민 (ethylenimine) 및 메틸멜라민 (methylmelamine) (예를 들어, 헥사메틸멜라민 (hexamethlymelamine), 티오테파 (thiotepa)), 알킬 술포네이트 (alkyl sulfonate) (예를 들어, 부술판 (busulfan)), 니트로소우레아 (nitrosourea) (예를 들어, 카르무스틴 (carmustine), 로무스틴 (lomustine), 세무스틴 (semustine), 스트렙토조신 (streptozocin)), 트리아젠 (triazene) (데카바진 (decarbazine))), 항대사제 (예를 들어, 5-아자티오프린 (5-azathioprine), 류코보린 (leucovorin), 카페시타빈 (capecitabine), 플루다라빈 (fludarabine), 젬시타빈 (gemcitabine), 페메트렉세드 (pemetrexed), 랄티트렉세드 (raltitrexed), 엽산 유사체 (예를 들어, 메토트렉세이트 (methotrexate)), 또는 피리미딘 유사체 (예를 들어, 플루오로우라실 (fluorouracil), 플록소우리딘 (floxouridin), 시타라빈 (Cytarabine)), 퓨린 유사체 (예를 들어, 머캅토퓨린 (mercaptopurine), 티오구아닌 (thioguanine), 펜토스타틴 (pentostatin)) 등), 식물 알칼로이드 (예를 들어, 빈크리스틴 (vincristine), 빈블라스틴 (vinblastine), 비노렐빈 (vinorelbine), 빈데신 (vindesine), 포도필로톡신 (podophyllotoxin), 파클리탁셀 (paclitaxel), 도세탁셀 (docetaxel) 등), 토포이소머라제 억제제 (예를 들어, 이리노테칸 (irinotecan), 토포테칸 (topotecan), 암사크린 (amsacrine), 에토보시드 (etoposide) (VP 16), 에토포시드 포스페이트, 테니포시드 (teniposide) 등), 항종양 항생제 (예를 들어, 독소루비신 (doxorubicin), 아드리아마이신 (adriamycin), 다우노루비신 (daunorubicin), 에피루비신 (epirubicin), 악티노마이신 (actinomycin), 블레오마이신 (bleomycin), 미토마이신 (mitomycin), 미톡산트론 (mitoxantrone), 플리카마이신 (plicamycin) 등), 백금계 화합물 (예를 들어, 시스플라틴 (cisplatin), 옥살로플라틴 (oxaloplatin), 카보플라틴 (carboplatin)), 안트라세네디온 (anthracenedione) (예를 들어, 미톡산트론 (mitoxantrone)), 치환된 우레아 (예를 들어, 하이드록시우레아), 메틸 히드라진 유도체 (예를 들어, 프로카바진 (procarbazine)), 또는 부신피질 저해제 (예를 들어, 미토탄 (mitotane), 아미노글루테티미드 (aminoglutethimide)), 에피포도필로톡신 (epipodophyllotoxins) (예를 들어, 에토포시드)을 포함한다.
항암제의 추가의 예는, 다음에 제한되는 것은 아니나, 항생제 (예를 들어, 다우노루비신 (daunorubicin), 독소루비신 (doxorubicin), 블레오마이신 (bleomycin)), 효소 (예를 들어, L-아스파라기나제), 미토겐 (mitogen)-활성화된 단백질 키나제 신호전달의 억제제 (예를 들어, U0126, PD98059, PD184352, PD0325901, ARRY-142886, SB239063, SP600125, BAY 43-9006, 와르트만닌 (wortmannin), 또는 LY294002), mTOR 억제제, 항체 (예를 들어, 리툭산 (rituxan)), 5-아자-2'-데옥시시티딘, 독소루비신, 빈크리스틴, 에토포시드, 겜시타빈 (gemcitabine), 이마티닙 (imatinib) (Gleevec.RTM.), 겔다나마이신 (geldanamycin), 17-N-알릴아미노-17-데메트록시겔다나마이신 (17-AAG), 보르테조밉 (bortezomib), 트라스투주맙 (trastuzumab), 아나스트로졸 (anastrozole); 혈관형성 억제제; 항안드로겐, 항에스트로겐; 안티센스 올리고뉴클레오타이드; 아폽토시스 유전자 조절제 (apoptosis gene modulator); 아폽토시스 조절제; 아르기닌 데아미나제; BCR/ABL 길항제; 베타 락탐 유도체; bFGF 억제제; 비칼루타미드; 캄프토테신 유도체; 카제인 키나제 억제제 (ICOS); 클로미펜 유사체; 시타라빈 다클리시맙; 덱사메타손; 에스트로겐 작용제; 에스트로겐 길항제; 에타니다졸; 에토포시드 포스페이트; 엑세메스탄 (exemestane); 페이드라졸 (fadrozole); 피나스테리드 (finasteride); 플루다라빈; 플루오로다우노루니신 하이드로클로라이드; 가돌리늄 텍사피린 (gadolinium texaphyrin); 질산갈륨; 젤라티나제 억제제; 젬시타빈; 글루타티온 억제제; 헵술팜 (hepsulfam); 면역자극제 펩타이드; 인슐린 유사 성장 인자-1 수용체 억제제; 인터페론 작용제; 인터페론; 인터루킨; 레트로졸; 백혈병 억제 인자; 백혈구 알파 인터페론; 류프로라이드 (leuprolide) + 에스트로겐 + 프로게스테론; 류프로렐린 (leuprorelin); 마트리리신 (matrilysin) 억제제; 매트릭스 메탈로프로테이나제 억제제; MIF 억제제; 미페프리스톤 (mifepristone); 미스매칭된 이중 가닥 RNA; 단일클론 항체; 마이코박테리아 세포벽 추출물; 산화 질소 조절제; 옥살리플라틴 (oxaliplatin); 파노미펜 (panomifene); 펜트로졸 (pentrozole); 포스파타제 억제제; 플라스미노겐 활성화제 억제제; 백금 착물; 백금 화합물; 프레드니손; 프로테아좀 억제제; 단백질 A-기반 면역 조절제; 단백질 키나제 C 억제제; 단백질 키나제 C 억제제, 단백질 티로신 포스파타제 억제제; 퓨린 뉴클레오사이드 포스포릴라제 억제제; 라스 파네실 단백질 트랜스퍼라제 억제제; ras 억제제; ras-GAP 억제제; 리보자임; 신호 변환 억제제; 신호 변환 조절제; 단일 사슬 항원-결합 단백질; 줄기세포 억제제; 줄기세포 분열 억제제; 스트로멜리신 (stromelysin) 억제제; 합성 글리코사미노글리칸; 타목시펜 메티오디드 (tamoxifen methiodide); 텔로머라제 (telomerase) 억제제; 갑상선 자극 호르몬; 번역 억제제; 티로신 키나제 억제제; 유로키나제 수용체 길항제; 스테로이드 (예를 들어, 덱사메타손), 피나스테리드, 아로마타제 억제제, 고나도트로핀 방출 호르몬 작용제 (gonadotropin-releasing hormone agonist) (GnRH), 예를 들어 고세렐린 (goserelin) 또는 류프롤리드 (leuprolide), 아드레노코르티코스테로이드 (예를 들어, 프레드니손), 프로게스틴 (progestin) (예를 들어, 하이드록시프로게스테론 카프로에이트, 메게스트롤 아세테이트, 메드록시프로게스테론 아세테이트), 에스트로겐 (예를 들어, 디에틸스틸베스트롤, 에티닐 에스트라디올), 항에스트로겐 (예를 들어, 타목시펜 (tamoxifen)), 안드로겐 (예를 들어, 테스토스테론 프로피오네이트, 플루옥시메스테론), 항안드로겐 (예를 들어, 플루타미드), 면역자극제 (예를 들어, 바실러스 칼멧-구에린 (Bacillus Calmette-Guerin) (BCG)), 레바미솔 (levamisole), 인터루킨-2, 알파-인터페론 등), 단일클론 항체 (예를 들어, 항-CD20, 항-HER2, 항-CD52, 항-HLA-DR 및 항-VEGF 단일클론 항체), 면역독소 (예를 들어, 항-CD33 단일클론 항체-칼리케아미신 접합체, 항-CD22 단일클론 항체-슈도모나스 외독소 접합체 등), 방사선면역요법 (예를 들어, 111In, 90Y 또는 131I에 접합된 항-CD20 단일클론 항체 등), 트립톨리드 (triptolide), 호모하링토닌 (homoharringtonine), 독티노마이신, 독소루비신, 에피루비신, 토포테칸, 이트라코나졸, 빈데신, 세리바스타틴, 빈크리스틴, 데옥시아데노신, 세르트랄린, 피타바스타틴, 이리노테칸, 클로파지민, 5-노닐옥시트립타민, 베무라페닙, 다브라페닙, 에를로티닙, 게피티닙, EGFR 억제제, 표피 성장 인자 수용체 (EGFR)-표적 요법 또는 치료 (예를 들어, 게피티닙 (Iressa™), 에를로티닙 (Tarceva™), 세툭시맙 (Erbitux™), 라파티닙 (Tykerb™), 파니투무맙 (Vectibix™), 반데타닙 (Caprelsa™), 아파티닙/BIBW2992, CI-1033/카네르티닙, 네라티닙//HKI-272, CP-724714, TAK-285, AST-1306, ARRY334543, ARRY-380, AG-1478, 도코미티닙/PF299804, OSI-420/데스메틸 에를로티닙, AZD8931, AEE788, 펠리티닙/EKB-569, CUDC-101, WZ8040, WZ4002, WZ3146, AG-490, XL647, PD153035, BMS-599626), 소라페닙 (sorafenib), 이마티닙 (imatinib), 수니티닙 (sunitinib), 다사티닙 (dasatinib) 등을 포함한다.
"화학요법" 또는 "화학요법제"는 그의 통상의 일반적인 의미에 따라 사용되며, 항신생물 특성 또는 세포의 성장 또는 증식을 억제하는 능력을 갖는 화학 조성물 또는 화합물을 지칭한다.
추가로, 본 명세서에 기재된 리보핵산 화합물은 다음에 제한되는 것은 아니나, 면역자극제 (예를 들어, 바실러스 칼멧-구에린 (BCG), 레바미솔, 인터루킨-2, 알파 인터페론 등), 단일클론 항체 (예를 들어, 항-CD20, 항-HER2, 항-CD52, 항-HLA-DR, 항-PD-1 및 항-VEGF 단일클론 항체), 면역독소 (예를 들어, 항-CD33 단일클론 항체-칼리케아미신 접합체, 항-CD22 단일클론 항체-슈도모나스 외독소 접합체 등) 및 방사선면역요법 (예를 들어, 111In, 90Y 또는 131I에 접합된 항-CD20 단일클론 항체 등)을 포함하여, 종래의 면역치료제와 함께 공동 투여되거나 공유결합에 의해 부착될 수 있다.
추가의 실시형태에서, 본 명세서에 기재된 리보핵산 화합물은 다음에 제한되는 것은 아니나, 선택적으로 종양 항원에 대해 유도된 항체에 접합된 47Sc, 64Cu, 67Cu, 89Sr, 86Y, 87Y, 90Y, 105Rh, 111Ag, 111In, 117Sn, 149Pm, 153Sm, 166Ho, 177Lu, 186Re, 188Re, 211At, 및 212Bi와 같은 방사성 핵종을 포함하는 통상적인 방사선요법제와 공동 투여될 수 있다.
용어 "샘플"은 용어는 조직학적 목적을 위해 채취된 조직의 절편, 예를 들어 생검 및 부검 샘플, 및 동결 절편을 포함한다. 이러한 샘플에는 혈액 및 혈액 분획 또는 산물 (예를 들어, 골수, 혈청, 혈장, 혈소판, 적혈구 등), 가래, 조직, 배양 세포 (예를 들어, 1차 배양, 외식편 및 형질전환 세포), 분변, 소변, 다른 생물학적 유체 (예를 들어, 전립선 유체, 위액, 장액, 신장액, 폐액, 뇌척수액 등) 등이 포함된다. 샘플은 통상적으로 진핵 생물, 가장 바람직하게는 영장류, 예를 들어 침팬지 또는 인간; 소; 개; 고양이; 설치류, 예를 들어 기니피그, 랫트, 마우스; 토끼와 같은 포유류; 또는 조류; 파충류; 또는 어류와 같은 "대상체"로부터 획득된다. 일부 실시형태에서, 샘플은 인간으로부터 획득된다.
"대조군" 샘플 또는 값은 시험 샘플과 비교하기 위한 기준, 일반적으로 공지 기준으로서 역할을 하는 샘플을 지칭한다. 예를 들어, 시험 샘플은, 예를 들어 시험 화합물의 존재하에 시험 조건으로부터 채취될 수 있으며, 예를 들어 시험 화합물의 부재 (음성 대조군) 또는 공지 화합물의 존재 (양성 대조군) 하에 공지 조건으로부터의 샘플과 비교될 수 있다. 대조군은 또한 다수의 시험 또는 결과에서 수집된 평균 값을 나타낼 수 있다. 당업자는 대조군이 임의의 수의 파라미터의 평가를 위해 설계될 수 있음을 인식할 것이다. 예를 들어, 약리학적 데이터 (예를 들어, 반감기) 또는 치료 측정치 (예를 들어, 부작용의 비교)를 기반으로 하여 치료적 이점을 비교하기 위해 대조군을 설계할 수 있다. 당업자는 소정의 상황에서 어떤 대조군이 유용한지 이해하고, 대조군 값과의 비교를 기반으로 하여 데이터를 분석할 수 있다. 대조군은 또한 데이터의 유의도를 결정하는데 유용하다. 예를 들어, 소정의 파라미터의 값이 대조군에서 광범위하게 변이된다면, 시험 샘플의 변이는 유의하지 않은 것으로 간주될 것이다.
"질병" 또는 "병태"는 본 명세서에 제공된 화합물, 약제학적 조성물 또는 방법으로 치료될 수 있는 환자 또는 대상체의 상태 또는 건강 상태를 지칭한다. 실시형태에서, 질병은 암 (예를 들어, 간암, 췌장암, 췌장 간 전이, 뇌암, 전립선암, 신장암, 전이성 암, 흑색종, 거세 저항성 전립선암, 유방암, 삼중 음성 유방암, 교아세포종, 난소암, 폐암, 편평 세포 암종 (예를 들어, 두부, 경부 또는 식도), 결장직장암, 백혈병, 급성 골수성 백혈병, 림프종, B 세포 림프종 또는 다발성 골수종), 전염병 (예를 들어, HN 감염), 염증성 질병 (예를 들어, 류머티스 관절염) 또는 대사성 질병 (예를 들어, 당뇨병)이다. 실시형태에서, 질병은 TfR의 비정상 활성, TfR 인산화 또는 TfR 경로 활성, 또는 TfR에 의해 활성화된 경로와 관련된 (예를 들어, 이에 의해 유발된) 질병이다. 일부 실시형태에서, 질병은 암 (예를 들어, 전립선암, 신장암, 전이성 암, 흑색종, 거세 저항성 전립선암, 유방암, 삼중 음성 유방암, 교아세포종, 난소암, 폐암, 편평 세포 암종 (예를 들어, 두부, 경부 또는 식도), 결장직장암, 백혈병, 급성 골수성 백혈병, 림프종, B 세포 림프종 또는 다발성 골수종)이다.
본 명세서에 사용되는 바와 같이, 용어 "암"은 백혈병, 림프종, 암종 및 육종을 포함하여, 포유류에서 발견되는 모든 유형의 암, 신생물 또는 악성 종양을 지칭한다.
본 명세서에 제공된 화합물, 약제학적 조성물 또는 방법으로 치료될 수 있는 예시적인 암은 췌장암, 간암 (예를 들어, 간세포 암종), 췌장 간 전이, 림프종, 육종, 방광암, 골암, 뇌암 (예를 들어, 뇌종양, 수아세포종, 교아세포종, 다형성 교아세포종), 자궁경부암, 결장암, 식도암, 위암, 두경부암, 신장암, 골수종, 갑상선암, 백혈병, 전립선암, 유방암 (예를 들어, 삼중 음성, ER 양성, ER 음성, 화학요법 내성, 허셉틴 내성 (herceptin resistant), HER2 양성, 독소루비신 내성, 타목시펜 내성, 유관 암종, 소엽 암종, 원발성, 전이성), 난소암, 폐암 (예를 들어, 비소세포 폐암종, 편평 세포 폐암종, 선암종, 대세포 폐암종, 소세포 폐암종, 카르시노이드 (carcinoid), 육종), 신경교종, 신경아세포종, 흑색종, 거세 저항성 전립선암, 편평 세포 암종 (예를 들어, 두부, 경부 또는 식도), 결장직장암, 급성 골수성 백혈병, B 세포 림프종, 다발성 골수종, 호지킨병 (Hodgkin's disease), 비호지킨 림프종, 횡문근육종, 중피종, 자궁내막암, 혈소판증가증, 발텐스트롬 마크로글로불린혈증 (Waldenstrom macroglobulinemia) (WM), 인슐린종, 악성 카르시노이드, 전악성 피부 병변, 고환암, 악성 고칼슘혈증, 부신피질암, 내분비 또는 외분비 췌장의 신생물, 골수 갑상선암, 골수 갑상선 암종, 유두 갑상선암, 유두의 파젯병 (Paget's Disease of the Nipple), 엽상 종양, 소엽 암종, 유관 암종, 췌장 성상 세포의 암 또는 간 성상 세포의 암을 포함한다. 추가의 예는 내분비계, 뇌, 유방, 뼈, 자궁경부, 결장, 두경부, 식도, 간, 신장, 폐, 비소세포 폐, 난소, 위, 구강, 피부, 자궁, 자궁내막, 췌장, 갑상선, 방광, 전립선, 고환 또는 비뇨생식관의 암을 포함한다.
용어 "백혈병"은 광범위하게 혈액-형성 기관의 진행성 악성 질병을 지칭하며, 일반적으로 혈액 및 골수에서 백혈구 및 그의 전구체의 변형된 증식 및 발생을 특징으로 한다. 백혈병은 일반적으로 (1) 질병의 지속기간 및 특성-급성 또는 만성; (2) 관련된 세포의 유형; 골수성 (골수형성), 림프성 (림프형성) 또는 단핵구; 및 (3) 혈액에서 비정상 세포의 수의 증가 또는 비증가-백혈병 또는 비백혈병 (이상백혈병)을 기반으로 하여 임상적으로 분류된다. 본 명세서에 제공된 화합물, 약제학적 조성물 또는 방법으로 치료될 수 있는 예시적인 백혈병은 예를 들어 급성 비림프구성 백혈병, 만성 림프구성 백혈병, 급성 과립구 백혈병, 만성 과립구 백혈병, 급성 전골수성 백혈병, 성인 T-세포 백혈병, 비백혈성 백혈병, 백혈구성 백혈병, 호염기성 백혈병, 아세포 백혈병, 소백혈병, 만성 골수세포 백혈병, 피부 백혈병, 배아성 백혈병, 호산구성 백혈병, 그로스 백혈병 (Gross's leukemia), 모발세포 백혈병, 조혈 세포 백혈병, 혈구 모세포 백혈병, 조직구성 백혈병, 줄기세포 백혈병, 급성 단핵구성 백혈병, 백혈구감소 백혈병, 림프성 백혈병, 림프아구성 백혈병, 림프구성 백혈병, 림프형성 백혈병, 림프 백혈병, 림프육종 세포 백혈병, 비만 세포 백혈병, 거핵구 백혈병, 소골수아구성 백혈병, 단핵구성 백혈병, 골수아세포 백혈병, 골수구성 백혈병, 골수 과립구성 백혈병, 골수단핵구 백혈병, 나에겔리 백혈병 (Naegeli leukemia), 혈장 세포 백혈병, 다발성 골수종, 형질세포 백혈병, 전골수성 백혈병, 리더 세포 백혈병 (Rieder cell leukemia), 쉴링 백혈병 (Schilling's leukemia), 줄기세포 백혈병, 아백혈성 백혈병 또는 미분화 세포 백혈병을 포함한다.
용어 "육종"은 일반적으로 배아 결합 조직과 같은 물질로 구성되고, 섬유상 또는 균질 물질에 매립된 밀집 세포로 구성된 종양을 지칭한다. 본 명세서에 제공된 화합물, 약제학적 조성물 또는 방법으로 치료될 수 있는 육종은 연골육종, 섬유육종, 림프육종, 멜라노육종, 근육육종, 골육종, 아베메시 육종 (Abemethy's sarcoma), 지방세포육종, 지방육종, 폐포 연골 육종, 법랑아육종, 포도상육종, 녹색종육종, 융모막상피암종, 배아육종, 윌름스 종양 육종 (Wilms' tumor sarcoma), 자궁내막육종, 간질육종, 유잉육종 (Ewing's sarcoma), 근막육종, 섬유아세포 육종, 거대 세포 육종, 과립구성 육종, 호지킨 육종, 특발성 다발성 색소성 출혈성 육종, B 세포의 면역아세포 육종, 림프종, T 세포의 면역아세포 육종, 옌센 육종 (Jensen's sarcoma), 카포시 육종, 쿠퍼 세포 육종 (Kupffer cell sarcoma), 혈관육종, 백혈구 육종, 악성 중간엽 육종, 뼈주위육종, 망상구육종, 라우스육종 (Rous sarcoma), 장액낭성육종 (serocystic sarcoma), 활액 육종 또는 모세관확장 육종을 포함한다.
용어 "흑색종"은 피부 및 다른 기관의 멜라닌 세포계에서 발생하는 종양을 의미하는 것으로 여겨진다. 본 명세서에 제공된 화합물, 약제학적 조성물 또는 방법으로 치료될 수 있는 흑색종은 예를 들어, 선단 흑자성 흑색종, 무멜라닌 흑색종, 양성 소아 흑색종, 클로우드만 흑색종 (Cloudman's melanoma), S91 흑색종, 하딩-파시 흑색종 (Harding-Passey melanoma), 소아 흑색종, 악성 흑색점 흑색종, 악성 흑색종, 결절성 흑색종, 조갑하 흑색종 또는 표재성 분포형 흑색종을 포함한다.
용어 "암종"은 주변 조직에 침윤하여 전이를 유발하는 성향을 나타내는 상피 세포로 구성된 악성 신생 성장을 지칭한다. 본 명세서에 제공된 화합물, 약제학적 조성물 또는 방법으로 치료될 수 있는 예시적인 암종은 예를 들어, 갑상선 수질 암종, 가족성 갑상선 수질 암종, 선암종, 입상 암종, 선낭성암종 (adenocystic carcinoma), 선양 낭성 암종 (adenoid cystic carcinoma), 암종 선암종, 부신피질 암종, 폐포암종, 폐포 세포 암종, 기저 세포 암종 (basal cell carcinoma), 바닥세포암종 (carcinoma basocellulare), 기저암종 (basaloid carcinoma), 기저편평세포암종, 세기관지폐포암종 (bronchioalveolar carcinoma), 세기관지암종 (bronchiolar carcinoma), 기관지암종, 대뇌모양 암종, 담관세포암종, 융모막암종, 콜로이드암종 (colloid carcinoma), 면포암종, 자궁체부암종, 소공질암종 (cribriform carcinoma), 흉부 갑옷 암종, 피부암종, 원주암종, 원주세포암종, 관암종, 유관암종, 굳은 암종 (carcinoma durum), 배아성 암종, 뇌질모양 암종, 표피모양 암종, 상피선양 암종, 외성암종, 궤양 암종, 섬유성 암종, 젤라틴모양 암종 (gelatiniform carcinoma), 젤라틴성 암종 (gelatinous carcinoma), 거대 세포 암종 (giant cell carcinoma), 거대세포성 암종 (carcinoma gigantocellulare), 선암종, 과립세포암종, 모상암종, 혈액성 암종, 간세포암종, 허슬세포암종 (Hurthle cell carcinoma), 유리질 암종, 유부신암종, 태생성암종, 상피내암, 표피내암종, 상피내암종, 크롬페셔암종 (Krompecher's carcinoma), 컬치키세포암종 (Kulchitzky-cell carcinoma), 대세포암종, 수정체암종 (lenticular carcinoma), 수정체성 암종 (carcinoma lenticulare), 지방종 암종, 소엽 암종, 림프 상피 암종, 수질암종 (carcinoma medullare), 수질성 암종 (medullary carcinoma), 흑색증 암종, 무른 암종 (carcinoma molle), 점액암종 (mucinous carcinoma), 점액분비성 암종 (carcinoma muciparum), 점액세포 암종 (carcinoma mucocellulare), 점막표피모양 암종, 점액질 암종, 점액종, 비인두암종, 연맥세포암종, 근염암종, 유골암종, 유두암종, 문맥주위암종, 전암성 암종 (preinvasive carcinoma), 가시세포암종, 수상암종, 신장의 신세포암종, 예비세포암종, 육종성 암종, 슈나이더막 암종 (schneiderian carcinoma), 경성 암종, 음낭암종, 인환세포암종, 단순암종, 소세포암종, 선륜암종, 회전타원체세포암종, 방추세포암종, 해면상 암종 (carcinoma spongiosum), 편평암종, 편평세포암종, 스트링 암종 (string carcinoma), 혈관확장성암종, 모세혈관확장성암종, 이행세포암종, 결절암종, 관상암종, 결절상암종, 사마귀모양암종 또는 융모상암종 (carcinoma villosum)을 포함한다.
본 명세서에 사용되는 바와 같이, 용어 "전이", "전이성" 및 "전이성 암"은 상호 혼용될 수 있고, 하나의 기관 또는 다른 비인접 기관 또는 신체 부위로부터 증식성 질병 또는 장애, 예를 들어 암의 확산을 지칭한다. 암은 최초 발생 부위, 예를 들어 유방에서 발생하며, 이 부위는 원발성 종양, 예를 들어 원발성 유방암으로 지칭된다. 원발성 종양 또는 최초 발생 부위의 일부 암 세포는 국소 영역에서 주변 정상 조직을 침투 및 침윤하는 능력 및/또는 계를 통해 체내의 다른 부위 및 조직으로 순환하는 림프계 또는 혈관계의 벽을 침투하는 능력을 획득한다. 원발성 종양의 암 세포로부터 형성된 제2의 임상적으로 검출 가능한 종양은 전이성 또는 2차 종양으로 지칭된다. 암 세포가 전이될 때, 전이성 종양 및 그의 세포는 원래 종양의 세포와 유사한 것으로 추정된다. 따라서 폐암이 유방으로 전이되면, 유방 부위의 2차 종양은 비정상적인 유방 세포가 아닌 비정상적인 폐 세포로 구성된다. 유방의 2차 종양은 전이성 폐암을 지칭한다. 따라서, 전이성 암이라는 어구는 대상체가 원발성 종양을 가지고 있거나 가졌고, 하나 이상의 2차 종양을 갖는 질병을 지칭한다. 비-전이성 암 또는 전이성이 아닌 암을 갖는 대상체라는 어구는 대상체가 원발성 종양을 갖지만 하나 이상의 2차 종양을 갖지 않는 질병을 지칭한다. 예를 들어, 전이성 폐암은 원발성 폐 종양의 병력이 있거나, 예를 들어 유방의 2차 위치 또는 다수의 위치에 하나 이상의 2차 종양을 갖는 대상체의 질병을 지칭한다.
질병 (예를 들어, 당뇨병, 암 (예를 들어, 전립선암, 신장암, 전이성 암, 흑색종, 거세-저항성 전립선암, 유방암, 삼중 음성 유방암, 교아세포종, 난소암, 폐암, 편평 세포 암종 (예를 들어, 두부, 경부 또는 식도), 결장직장암, 백혈병, 급성 골수성 백혈병, 림프종, B 세포 림프종 또는 다발성 골수종))과 관련된 물질 또는 물질 활성 또는 기능과 관련하여 용어 "관련된" 또는 "~와 관련된"은 질병 (예를 들어, 당뇨병, 암 (예를 들어, 전립선암, 신장암, 전이성 암, 흑색종, 거세-저항성 전립선암, 유방암, 삼중 음성 유방암, 교아세포종, 난소암, 폐암, 편평 세포 암종 (예를 들어, 두부, 경부 또는 식도), 결장직장암, 백혈병, 급성 골수성 백혈병, 림프종, B 세포 림프종 또는 다발성 골수종) 또는 바이러스성 질병 (예를 들어, HN 감염 관련 질병))이 물질 또는 물질 활성 또는 기능에 의해 (전체 또는 부분적으로) 야기되거나, 상기 질병의 증상이 그에 의해 (전체 또는 부분적으로) 야기됨을 의미한다.
본 명세서에 사용되는 바와 같이, 용어 "비정상"은 정상과 상이하다. 효소 활성을 기재하는데 사용되는 경우, 비정상은 정상 대조군 또는 정상 비 질병 대조군 샘플의 평균보다 크거나 작은 활성을 지칭한다. 비정상 활성은 (예를 들어, 본 명세서에 기재된 바와 같은 방법을 사용하여) 비정상 활성을 정상 또는 비 질병 관련 양으로 복귀시키는 경우, 질병 또는 하나 이상의 질병 증상의 감소가 야기되는 질병 유발 활성의 양을 지칭할 수 있다.
"접촉"은 그 일반적인 통상의 의미에 따라 사용되며, 적어도 2개의 별개의 종류 (예를 들어, 생체 분자 또는 세포를 포함하는 화학 화합물)가 반응하거나, 상호작용하거나, 물리적으로 접촉하기에 충분히 근접해지도록 하는 과정을 지칭한다. 그러나, 생성된 반응 산물은 첨가된 시약 사이의 반응으로부터 또는 반응 혼합물 중 생성될 수 있는 하나 이상의 첨가 시약으로부터의 중간체로부터 직접 생성될 수 있음을 이해해야 한다. 접촉은 2개의 종류가 반응하거나, 상호작용하거나, 물리적으로 접촉하도록 하는 단계를 포함할 수 있으며, 2개의 종류는 본 명세서에 기재된 바와 같은 핵산 화합물 및 세포 (예를 들어, 암세포)일 수 있다.
리보핵산 화합물
본 발명은 특히 트랜스페린 수용체 (TfR)에 결합할 수 있는 핵산 화합물을 제공한다. 바람직한 실시형태에서, TfR은 세포 상에 존재하며, 일부 경우에는 핵산 화합물이 세포 내에 내재화된다.
TfR은 정상 세포에서 낮은 수준으로 발현된다. 활성화된 면역 세포 및 암과 같은 높은 증식 속도를 갖는 세포는 TfR의 상향조절된 발현을 나타낸다. 본 발명의 핵산 화합물은 따라서 TfR 결합을 통해 광범위한 세포를 표적화하는 메커니즘을 제공한다.
다양한 실시형태에서, 본 명세서에 제공된 핵산 화합물은 치료 또는 진단 분자와 같은 함유물을 포함하여, TfR-발현 세포로의 함유물의 표적화된 전달을 용이하게 한다. 핵산 화합물 및 함유물은 TfR-발현 세포 내에 내재화되어, 표적화된 세포 내 전달을 위한 효율적인 메커니즘을 제공할 수 있다.
WO 2016/061386은 TfR과 결합할 수 있는 리보핵산 화합물을 기재하고 있다. WO 2016/061386의 리보핵산 화합물은 적어도 30개의 뉴클레오타이드를 갖는 RNA 서열을 포함하고, 길이가 87 또는 43개의 뉴클레오타이드인 RNA 서열을 포함하는 화합물에 의해 증폭된다.
앱타머와 같은 핵산 화합물의 3차원 구조는 결합 친화도 및 특이성을 결정하는데 필수적이다. 따라서, 절단된 핵산 화합물이 동일한 표적에 결합하는 능력을 유지할 것이 절대적으로 예상되도록 핵산 화합물을 절단할 수 없다. 절단된 기능성 앱타머 서열을 예측하는 것은 간단한 경우가 아니다. 그럼에도 불구하고, 본 발명자들은 본 명세서에 제공된 바와 같이 29개 이하의 뉴클레오타이드의 더 짧은 특정 핵산 서열이 예기치않게 TfR에 결합하는 능력을 보유하고, TfR-발현 세포 내로 함유물와 함께 내재화될 수 있음을 발견하였다.
또한, 그의 작은 크기로 인해, 본 명세서에 기재된 핵산 화합물은 혈뇌 장벽 (BBB)을 통과하여, 뇌의 TfR-발현 세포 표적에 치료 또는 진단 함유물을 전달할 수 있다.
따라서, 본 발명의 핵산 화합물은 본 명세서에 나타낸 바와 같이 다수의 동물 종류에서 다양한 세포 유형으로 함유물을 표적화하여 전달하기 위한 고도로 특이적이고 효율적인 수단을 제공한다. 본 발명은 또한 거의 불침투성이고, 고도로 선택적이며, 적절하게 조정된 BBB를 극복하고, 치료제 및 영상화제를 뇌로 전달하는 유용한 메커니즘을 제공한다.
일부 양상에서, 본 발명은 서열번호 1에 대해 적어도 80% 서열 동일성을 갖는 RNA 서열을 포함하거나, 이로 이루어진 핵산 화합물을 제공하며, RNA 서열은 길이가 29개 이하의 뉴클레오타이드이다. 본 명세서에 제공되는 임의의 실시형태에서, 핵산 화합물은 리보핵산 화합물일 수 있다.
일부 실시형태에서 RNA 서열은 서열번호 1에 대해 적어도 85%, 적어도 87%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98% 또는 적어도 99% 서열 동일성을 갖는다. 일부 실시형태에서, RNA 서열은 서열번호 1에 대해 적어도 90% 서열 동일성을 갖는다. 일부 실시형태에서 RNA 서열은 서열번호 1에 대해 80%, 85%, 87%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100% 서열 동일성을 갖는다. 일부 실시형태에서, RNA 서열은 서열번호 1에 대해 100% 서열 동일성을 갖는다. 일부 실시형태에서, RNA 서열은 서열번호 1로 이루어진다. 일부 실시형태에서, RNA 서열은 트랜스페린 수용체 (TfR)에 결합할 수 있다. 일부 실시형태에서, RNA 서열은 트랜스페린 수용체 (TfR)에 결합한다. 일부 실시형태에서, TfR은 세포 표면 상에 존재한다. 일부 실시형태에서, 핵산 화합물은 세포 내에 내재화될 수 있다. 일부 경우, 세포는 TfR-발현 세포이다.
일부 경우 RNA 서열은 서열번호 1과 혼성화되는 핵산에 대해 적어도 80% 서열 동일성을 갖는다. 일부 경우 RNA 서열은 서열번호 1에 혼성화되는 핵산에 대해 적어도 85%, 적어도 87%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 또는 적어도 100% 서열 동일성을 갖는다.
일부 양상에서, 본 발명은 서열번호 5에 대해 적어도 80% 서열 동일성을 갖는 RNA 서열을 포함하거나, 이로 이루어진 핵산 화합물, 예를 들어, 리보핵산 화합물을 제공하며, RNA 서열은 길이가 29개 이하의 뉴클레오타이드이다. 일부 실시형태에서 RNA 서열은 서열번호 5에 대해 적어도 85%, 적어도 87%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98% 또는 적어도 99% 서열 동일성을 갖는다. 일부 실시형태에서, RNA 서열은 서열번호 5에 대해 적어도 90% 서열 동일성을 갖는다. 일부 실시형태에서 RNA 서열은 서열번호 5에 대해 80%, 85%, 87%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100% 서열 동일성을 갖는다. 일부 실시형태에서, RNA 서열은 서열번호 5에 대해 100% 서열 동일성을 갖는다. 일부 실시형태에서, RNA 서열은 서열번호 5로 이루어진다. 일부 실시형태에서, RNA 서열은 트랜스페린 수용체 (TfR)에 결합할 수 있다. 일부 실시형태에서, RNA 서열은 트랜스페린 수용체 (TfR)에 결합한다. 일부 실시형태에서, TfR은 세포 표면 상에 존재한다. 일부 실시형태에서, 핵산 화합물은 세포 내에 내재화될 수 있다. 일부 경우, 세포는 TfR-발현 세포이다.
일부 경우 RNA 서열은 서열번호 5에 혼성화되는 핵산에 대해 적어도 80% 서열 동일성을 갖는다. 일부 경우 RNA 서열은 서열번호 5에 혼성화되는 핵산에 대해 적어도 85%, 적어도 87%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 또는 적어도 100% 서열 동일성을 갖는다.
일부 실시형태에서 본 명세서에서 제공되는 RNA 서열은 길이가 29개 이하의 뉴클레오타이드, 28개 이하의 뉴클레오타이드, 27개 이하의 뉴클레오타이드, 26개 이하의 뉴클레오타이드, 25개 이하의 뉴클레오타이드, 24개 이하의 뉴클레오타이드, 23개 이하의 뉴클레오타이드, 22개 이하의 뉴클레오타이드, 21개 이하의 뉴클레오타이드, 20개 이하의 뉴클레오타이드, 19개 이하의 뉴클레오타이드, 18개 이하의 뉴클레오타이드, 17개 이하의 뉴클레오타이드, 또는 16개 이하의 뉴클레오타이드이다. 일부 경우 RNA 서열은 길이가 22개 이하의 뉴클레오타이드이다. 일부 실시형태에서 RNA 서열은 길이가 16 내지 29개의 뉴클레오타이드이다. 일부 실시형태에서 RNA 서열은 길이가 16 내지 22개의 뉴클레오타이드이다.
일부 실시형태에서 RNA 서열은 길이가 16개의 뉴클레오타이드이다. 일부 실시형태에서 RNA 서열은 길이가 17개의 뉴클레오타이드이다. 일부 실시형태에서 RNA 서열은 길이가 18개의 뉴클레오타이드이다. 일부 실시형태에서 RNA 서열은 길이가 19개의 뉴클레오타이드이다. 일부 실시형태에서 RNA 서열은 길이가 20개의 뉴클레오타이드이다. 일부 실시형태에서 RNA 서열은 길이가 21개의 뉴클레오타이드이다. 일부 실시형태에서 RNA 서열은 길이가 22개의 뉴클레오타이드이다. 일부 실시형태에서 RNA 서열은 길이가 23개의 뉴클레오타이드이다. 일부 실시형태에서 RNA 서열은 길이가 24개의 뉴클레오타이드이다. 일부 실시형태에서 RNA 서열은 길이가 25개의 뉴클레오타이드이다. 일부 실시형태에서 RNA 서열은 길이가 26개의 뉴클레오타이드이다. 일부 실시형태에서 RNA 서열은 길이가 27개의 뉴클레오타이드이다. 일부 실시형태에서 RNA 서열은 길이가 28개의 뉴클레오타이드이다. 일부 실시형태에서 RNA 서열은 길이가 29개의 뉴클레오타이드이다.
일부 경우, RNA 서열은 서열번호 1 또는 서열번호 5에 대해 적어도 80% 서열 동일성을 갖고, 길이가 29개 이하의 뉴클레오타이드, 28개 이하의 뉴클레오타이드, 27개 이하의 뉴클레오타이드, 26개 이하의 뉴클레오타이드, 25개 이하의 뉴클레오타이드, 24개 이하의 뉴클레오타이드, 23개 이하의 뉴클레오타이드, 22개 이하의 뉴클레오타이드, 21개 이하의 뉴클레오타이드, 20개 이하의 뉴클레오타이드, 19개 이하의 뉴클레오타이드, 18개 이하의 뉴클레오타이드, 17개 이하의 뉴클레오타이드, 또는 16개 이하의 뉴클레오타이드이다.
일부 경우, RNA 서열은 서열번호 1 또는 서열번호 5에 대해 적어도 85% 서열 동일성을 갖고, 길이가 29개 이하의 뉴클레오타이드, 28개 이하의 뉴클레오타이드, 27개 이하의 뉴클레오타이드, 26개 이하의 뉴클레오타이드, 25개 이하의 뉴클레오타이드, 24개 이하의 뉴클레오타이드, 23개 이하의 뉴클레오타이드, 22개 이하의 뉴클레오타이드, 21개 이하의 뉴클레오타이드, 20개 이하의 뉴클레오타이드, 19개 이하의 뉴클레오타이드, 18개 이하의 뉴클레오타이드, 17개 이하의 뉴클레오타이드, 또는 16개 이하의 뉴클레오타이드이다.
일부 경우, RNA 서열은 서열번호 1 또는 서열번호 5에 대해 적어도 87% 서열 동일성을 갖고, 길이가 29개 이하의 뉴클레오타이드, 28개 이하의 뉴클레오타이드, 27개 이하의 뉴클레오타이드, 26개 이하의 뉴클레오타이드, 25개 이하의 뉴클레오타이드, 24개 이하의 뉴클레오타이드, 23개 이하의 뉴클레오타이드, 22개 이하의 뉴클레오타이드, 21개 이하의 뉴클레오타이드, 20개 이하의 뉴클레오타이드, 19개 이하의 뉴클레오타이드, 18개 이하의 뉴클레오타이드, 17개 이하의 뉴클레오타이드, 또는 16개 이하의 뉴클레오타이드이다.
일부 경우, RNA 서열은 서열번호 1 또는 서열번호 5에 대해 적어도 90% 서열 동일성을 갖고, 길이가 29개 이하의 뉴클레오타이드, 28개 이하의 뉴클레오타이드, 27개 이하의 뉴클레오타이드, 26개 이하의 뉴클레오타이드, 25개 이하의 뉴클레오타이드, 24개 이하의 뉴클레오타이드, 23개 이하의 뉴클레오타이드, 22개 이하의 뉴클레오타이드, 21개 이하의 뉴클레오타이드, 20개 이하의 뉴클레오타이드, 19개 이하의 뉴클레오타이드, 18개 이하의 뉴클레오타이드, 17개 이하의 뉴클레오타이드, 또는 16개 이하의 뉴클레오타이드이다.
일부 경우, RNA 서열은 서열번호 1 또는 서열번호 5에 대해 적어도 91% 서열 동일성을 갖고, 길이가 29개 이하의 뉴클레오타이드, 28개 이하의 뉴클레오타이드, 27개 이하의 뉴클레오타이드, 26개 이하의 뉴클레오타이드, 25개 이하의 뉴클레오타이드, 24개 이하의 뉴클레오타이드, 23개 이하의 뉴클레오타이드, 22개 이하의 뉴클레오타이드, 21개 이하의 뉴클레오타이드, 20개 이하의 뉴클레오타이드, 19개 이하의 뉴클레오타이드, 18개 이하의 뉴클레오타이드, 17개 이하의 뉴클레오타이드, 또는 16개 이하의 뉴클레오타이드이다.
일부 경우, RNA 서열은 서열번호 1 또는 서열번호 5에 대해 적어도 92% 서열 동일성을 갖고, 길이가 29개 이하의 뉴클레오타이드, 28개 이하의 뉴클레오타이드, 27개 이하의 뉴클레오타이드, 26개 이하의 뉴클레오타이드, 25개 이하의 뉴클레오타이드, 24개 이하의 뉴클레오타이드, 23개 이하의 뉴클레오타이드, 22개 이하의 뉴클레오타이드, 21개 이하의 뉴클레오타이드, 20개 이하의 뉴클레오타이드, 19개 이하의 뉴클레오타이드, 18개 이하의 뉴클레오타이드, 17개 이하의 뉴클레오타이드, 또는 16개 이하의 뉴클레오타이드이다.
일부 경우, RNA 서열은 서열번호 1 또는 서열번호 5에 대해 적어도 93% 서열 동일성을 갖고, 길이가 29개 이하의 뉴클레오타이드, 28개 이하의 뉴클레오타이드, 27개 이하의 뉴클레오타이드, 26개 이하의 뉴클레오타이드, 25개 이하의 뉴클레오타이드, 24개 이하의 뉴클레오타이드, 23개 이하의 뉴클레오타이드, 22개 이하의 뉴클레오타이드, 21개 이하의 뉴클레오타이드, 20개 이하의 뉴클레오타이드, 19개 이하의 뉴클레오타이드, 18개 이하의 뉴클레오타이드, 17개 이하의 뉴클레오타이드, 또는 16개 이하의 뉴클레오타이드이다.
일부 경우, RNA 서열은 서열번호 1 또는 서열번호 5에 대해 적어도 94% 서열 동일성을 갖고, 길이가 29개 이하의 뉴클레오타이드, 28개 이하의 뉴클레오타이드, 27개 이하의 뉴클레오타이드, 26개 이하의 뉴클레오타이드, 25개 이하의 뉴클레오타이드, 24개 이하의 뉴클레오타이드, 23개 이하의 뉴클레오타이드, 22개 이하의 뉴클레오타이드, 21개 이하의 뉴클레오타이드, 20개 이하의 뉴클레오타이드, 19개 이하의 뉴클레오타이드, 18개 이하의 뉴클레오타이드, 17개 이하의 뉴클레오타이드, 또는 16개 이하의 뉴클레오타이드이다.
일부 경우, RNA 서열은 서열번호 1 또는 서열번호 5에 대해 적어도 95% 서열 동일성을 갖고, 길이가 29개 이하의 뉴클레오타이드, 28개 이하의 뉴클레오타이드, 27개 이하의 뉴클레오타이드, 26개 이하의 뉴클레오타이드, 25개 이하의 뉴클레오타이드, 24개 이하의 뉴클레오타이드, 23개 이하의 뉴클레오타이드, 22개 이하의 뉴클레오타이드, 21개 이하의 뉴클레오타이드, 20개 이하의 뉴클레오타이드, 19개 이하의 뉴클레오타이드, 18개 이하의 뉴클레오타이드, 17개 이하의 뉴클레오타이드, 또는 16개 이하의 뉴클레오타이드이다.
일부 경우, RNA 서열은 서열번호 1 또는 서열번호 5에 대해 적어도 96% 서열 동일성을 갖고, 길이가 29개 이하의 뉴클레오타이드, 28개 이하의 뉴클레오타이드, 27개 이하의 뉴클레오타이드, 26개 이하의 뉴클레오타이드, 25개 이하의 뉴클레오타이드, 24개 이하의 뉴클레오타이드, 23개 이하의 뉴클레오타이드, 22개 이하의 뉴클레오타이드, 21개 이하의 뉴클레오타이드, 20개 이하의 뉴클레오타이드, 19개 이하의 뉴클레오타이드, 18개 이하의 뉴클레오타이드, 17개 이하의 뉴클레오타이드, 또는 16개 이하의 뉴클레오타이드이다.
일부 경우, RNA 서열은 서열번호 1 또는 서열번호 5에 대해 적어도 97% 서열 동일성을 갖고, 길이가 29개 이하의 뉴클레오타이드, 28개 이하의 뉴클레오타이드, 27개 이하의 뉴클레오타이드, 26개 이하의 뉴클레오타이드, 25개 이하의 뉴클레오타이드, 24개 이하의 뉴클레오타이드, 23개 이하의 뉴클레오타이드, 22개 이하의 뉴클레오타이드, 21개 이하의 뉴클레오타이드, 20개 이하의 뉴클레오타이드, 19개 이하의 뉴클레오타이드, 18개 이하의 뉴클레오타이드, 17개 이하의 뉴클레오타이드, 또는 16개 이하의 뉴클레오타이드이다.
일부 경우, RNA 서열은 서열번호 1 또는 서열번호 5에 대해 적어도 98% 서열 동일성을 갖고, 길이가 29개 이하의 뉴클레오타이드, 28개 이하의 뉴클레오타이드, 27개 이하의 뉴클레오타이드, 26개 이하의 뉴클레오타이드, 25개 이하의 뉴클레오타이드, 24개 이하의 뉴클레오타이드, 23개 이하의 뉴클레오타이드, 22개 이하의 뉴클레오타이드, 21개 이하의 뉴클레오타이드, 20개 이하의 뉴클레오타이드, 19개 이하의 뉴클레오타이드, 18개 이하의 뉴클레오타이드, 17개 이하의 뉴클레오타이드, 또는 16개 이하의 뉴클레오타이드이다.
일부 경우, RNA 서열은 서열번호 1 또는 서열번호 5에 대해 적어도 99% 서열 동일성을 갖고, 길이가 29개 이하의 뉴클레오타이드, 28개 이하의 뉴클레오타이드, 27개 이하의 뉴클레오타이드, 26개 이하의 뉴클레오타이드, 25개 이하의 뉴클레오타이드, 24개 이하의 뉴클레오타이드, 23개 이하의 뉴클레오타이드, 22개 이하의 뉴클레오타이드, 21개 이하의 뉴클레오타이드, 20개 이하의 뉴클레오타이드, 19개 이하의 뉴클레오타이드, 18개 이하의 뉴클레오타이드, 17개 이하의 뉴클레오타이드, 또는 16개 이하의 뉴클레오타이드이다.
일부 경우, RNA 서열은 서열번호 1 또는 서열번호 5에 대해 적어도 100% 서열 동일성을 갖고, 길이가 29개 이하의 뉴클레오타이드, 28개 이하의 뉴클레오타이드, 27개 이하의 뉴클레오타이드, 26개 이하의 뉴클레오타이드, 25개 이하의 뉴클레오타이드, 24개 이하의 뉴클레오타이드, 23개 이하의 뉴클레오타이드, 22개 이하의 뉴클레오타이드, 21개 이하의 뉴클레오타이드, 20개 이하의 뉴클레오타이드, 19개 이하의 뉴클레오타이드, 18개 이하의 뉴클레오타이드, 17개 이하의 뉴클레오타이드, 또는 16개 이하의 뉴클레오타이드이다.
일부 실시형태에서, 본 명세서에서 제공되는 RNA 서열은 서열번호 1을 포함하거나 이로 이루어지고, 서열번호 1에 대해 1, 2, 3, 4개 이상의 뉴클레오타이드 변형을 추가로 포함한다. 이러한 변형은 뉴클레오타이드 첨가, 치환 및/또는 결실일 수 있다.
일부 경우, 본 명세서에서 제공되는 RNA 서열은 서열번호 1과 비교하여, 1, 2, 3, 또는 4개의 뉴클레오타이드가 상이하다.
일부 실시형태에서, RNA 서열은 위치 1, 2, 3, 20, 21 및/또는 22 중 하나 이상이 대안적 핵산 잔기, 예를 들어 AMP, GMP, UMP, CMP, dAMP, dGMP, dTMP, 및/또는 dCMP로 치환된 서열번호 1을 포함한다. 즉, 일부 실시형태에서, RNA 서열은 서열번호 5 및 각각의 5' 말단 및 3' 말단에 3개의 추가의 뉴클레오타이드를 포함한다.
일부 실시형태에서, RNA 서열은 서열번호 5를 포함하거나 이로 이루어지고, 서열번호 5에 대해 1, 2, 3, 4개 이상의 뉴클레오타이드 변형을 추가로 포함한다. 이러한 변형은 뉴클레오타이드 첨가, 치환 및/또는 결실일 수 있다.
일부 경우, 본 명세서에서 제공되는 RNA 서열은 서열번호 5와 비교하여, 1, 2, 3, 또는 4개의 뉴클레오타이드가 상이하다.
서열번호 1의 뉴클레오타이드 위치 4 내지 8은 뉴클레오타이드 위치 15 내지 19와 염기쌍을 형성할 것으로 예측된다. 서열번호 5의 뉴클레오타이드 위치 1 내지 5는 뉴클레오타이드 위치 12 내지 16과 염기쌍을 형성할 것으로 예측된다. 일부 실시형태에서, RNA 서열은 위치 4 내지 8 및/또는 15 내지 19 중 어느 하나 즉, 하나 이상의 뉴클레오타이드가 비정규 염기쌍을 유발하는 뉴클레오타이드 잔기에 의해 치환된 서열번호 1을 포함한다. 일부 실시형태에서, RNA 서열은 임의의 위치, 즉 위치 1 내지 5 및/또는 12 내지 16에서 하나 이상의 뉴클레오타이드가 비정규 염기쌍을 유발하는 뉴클레오타이드 잔기에 의해 치환된 서열번호 5를 포함한다. 예를 들어, A 또는 U/T는 C 또는 G로 대체될 수 있으며, 그 반대의 경우도 마찬가지이다. 일부 경우, U-A 쌍은 U-G로 대체될 수 있다.
본 명세서에 기재된 바와 같은 임의의 RNA 서열은 추가의 뉴클레오타이드를 추가로 포함할 수 있다. 추가의 뉴클레오타이드는 RNA 서열의 5' 말단, 3' 말단 또는 5' 말단 및 3' 말단 둘 모두에 첨가될 수 있다. 일부 실시형태에서, 본 명세서에 기재된 바와 같은 서열번호 1 또는 서열번호 5를 포함하는 RNA 서열은 총 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13개 이상의 추가의 뉴클레오타이드를 포함한다. RNA 서열이 서열번호 1을 포함하는 경우, RNA 서열은 총 7개 이하의 추가의 뉴클레오타이드를 포함할 수 있다. RNA 서열이 서열번호 5를 포함하는 경우, RNA 서열은 총 13개 이하의 추가의 뉴클레오타이드를 포함할 수 있다. 일부 실시형태에서, RNA 서열은 트랜스페린 수용체 (TfR)에 결합할 수 있다. 일부 실시형태에서, RNA 서열은 트랜스페린 수용체 (TfR)에 결합한다. 일부 실시형태에서, TfR은 세포 표면 상에 존재한다. 일부 실시형태에서, 핵산 화합물은 세포 내에 내재화될 수 있다. 일부 경우, 세포는 TfR-발현 세포이다.
일부 실시형태에서, RNA 서열은 서열번호 1 또는 서열번호 5를 포함하거나 이로 이루어지고, 본 명세서에 기재된 바와 같은 뉴클레오타이드 변형 및/또는 추가의 뉴클레오타이드를 추가로 포함하고, 길이가 29개 이하의 뉴클레오타이드, 28개 이하의 뉴클레오타이드, 27개 이하의 뉴클레오타이드, 26개 이하의 뉴클레오타이드, 25개 이하의 뉴클레오타이드, 24개 이하의 뉴클레오타이드, 23개 이하의 뉴클레오타이드, 22개 이하의 뉴클레오타이드, 21개 이하의 뉴클레오타이드, 20개 이하의 뉴클레오타이드, 19개 이하의 뉴클레오타이드, 18개 이하의 뉴클레오타이드, 17개 이하의 뉴클레오타이드, 또는 16개 이하의 뉴클레오타이드이다. 일부 실시형태에서, RNA 서열은 트랜스페린 수용체 (TfR)에 결합할 수 있다. 일부 실시형태에서, RNA 서열은 트랜스페린 수용체 (TfR)에 결합한다. 일부 실시형태에서, TfR은 세포 표면 상에 존재한다. 일부 실시형태에서, 핵산 화합물은 세포 내에 내재화될 수 있다. 일부 경우, 세포는 TfR-발현 세포이다.
A 본 명세서에서 제공되는 핵산 화합물은 서열번호 4를 포함할 수 있다. 일부 실시형태에서, 본 명세서에서 제공되는 RNA 서열은 서열번호 4를 포함한다.
일부 양상에서, 본 발명은 RNA 서열을 포함하는 핵산 화합물을 제공하고, RNA 서열은 서열번호 4를 포함하고, RNA 서열은 길이가 29개 이하의 뉴클레오타이드, 28개 이하의 뉴클레오타이드, 27개 이하의 뉴클레오타이드, 26개 이하의 뉴클레오타이드, 25개 이하의 뉴클레오타이드, 24개 이하의 뉴클레오타이드, 23개 이하의 뉴클레오타이드, 22개 이하의 뉴클레오타이드, 21개 이하의 뉴클레오타이드, 20개 이하의 뉴클레오타이드, 19개 이하의 뉴클레오타이드, 18개 이하의 뉴클레오타이드, 17개 이하의 뉴클레오타이드, 또는 16개 이하의 뉴클레오타이드이다. 일부 실시형태에서, RNA 서열은 트랜스페린 수용체 (TfR)에 결합할 수 있다. 일부 실시형태에서, RNA 서열은 트랜스페린 수용체 (TfR)에 결합한다. 일부 실시형태에서, TfR은 세포 표면 상에 존재한다. 일부 실시형태에서, 핵산 화합물은 세포 내에 내재화될 수 있다. 일부 경우, 세포는 TfR-발현 세포이다.
일부 경우, 본 명세서에 제공되는 핵산은 서열번호 4를 포함하는 RNA 서열을 포함한다. 일부 경우, 상기 RNA 서열은 길이가 10 내지 29개의 뉴클레오타이드이다. 일부 실시형태에서, 핵산은 RNA 서열을 포함하고, 상기 RNA 서열은 서열번호 4를 포함하고, 길이가 10 내지 29개의 뉴클레오타이드이고, 상기 핵산은 트랜스페린 수용체 (TfR)에 결합한다. 바람직하게는, RNA 서열은 본 명세서의 상기에 기재된 바와 같이, 길이가 16 내지 29개의 뉴클레오타이드이다.
일부 경우에, RNA 서열은 루프 구조 (loop structure)를 포함한다. 일부 경우에, RNA 서열은 줄기-루프 구조를 포함한다. 일부 경우에, RNA 서열은 분자 내 염기쌍을 포함한다. 일부 실시형태에서, 루프는 서열번호 4를 포함한다. 일부 경우에, 루프는 서열번호 4로 구성된다.
본 명세서에 기재된 임의의 실시형태에서, RNA 서열은 앱타머일 수 있다. 본 명세서에 기재된 임의의 실시형태에서, 핵산은 트랜스페린 수용체 (TfR)에 결합할 수 있다. 본 명세서에 기재된 임의의 실시형태에서, RNA 서열은 트랜스페린 수용체 (TfR)에 결합할 수 있다. 따라서, 본 명세서에서 제공되는 RNA 서열은 서열번호 1 또는 서열번호 5에 대해 적어도 80% (적어도 85% 등, 본 명세서의 상기에 기재된 바와 같음) 서열 동일성을 가질 수 있고, 16 내지 29개의 뉴클레오타이드 (본 명세서의 상기에 기재된 바와 같음)일 수 있고, RNA 서열은 트랜스페린 수용체 (TfR)에 결합할 수 있다. 임의의 실시형태에서, 핵산 화합물 TfR에 결합한다. 임의의 실시형태에서, RNA 서열 TfR에 결합한다. 임의의 실시형태에서, TfR은 세포 표면 상에 존재한다. 임의의 실시형태에서, 핵산 화합물은 세포 내에 내재화될 수 있다. 임의의 실시형태에서, 세포는 TfR-발현 세포이다.
본 명세서에 사용되는 바와 같이, 용어 "세포 표면 상"은 세포 표면 상의 분자, 예를 들어 트랜스페린 수용체 단백질의 위치를 지칭한다. 분자는 일정한 방식으로 세포막과 결합될 수 있다. 예를 들어, 분자는, 세포막에 걸쳐 있고, 세포질 도메인 및 세포외 도메인을 포함하는 내재성 또는 막관통 단백질일 수 있거나, 분자는 지질 고정될 수 있으며, 즉 세포막 내의 단일 또는 다중 지질 분자에 공유결합될 수 있거나, 분자는 내재성 막 단백질에 부착될 수 있다.
본 명세서에 사용되는 바와 같이, 용어 "세포 내에 내재화될 수 있는"은 본 발명의 핵산 분자가 세포 외부로부터 세포 내로 수송될 수 있는 능력을 지칭한다. 이는 세포내 섭취 또는 식균 작용과 같은 세포 메커니즘에 의해 수행될 수 있다. 일부 경우에는, 핵산이 TfR에 결합한 후, 예를 들어 TfR-핵산 복합체의 클라트린 (clathrin)-매개 세포내 섭취에 의해 내재화된다 (예를 들어, 문헌[Qian ZM et al., Pharmacol Rev. 2002, 54(4):561-587] 참조).
"TfR-발현 세포"는, TfR을 생성하고, 예를 들어 막 단백질로서 세포 표면에 TfR을 디스플레이하는 세포이다.
본 명세서에 제공되는 임의의 실시형태에서, RNA 서열은 리보뉴클레오타이드 잔기를 포함한다. 일부 실시형태에서, RNA 서열은 하나 이상의 데옥시리보뉴클레오타이드 잔기를 포함할 수 있다. 즉, 일부 경우, RNA 서열은 데옥시아데노신 모노포스페이트 (dAMP), 데옥시구아노신 모노포스페이트 (dGMP), 티미딘 모노포스페이트/데옥시티미딘 모노포스페이트 (TMP/dTMP) 및 데옥시시티딘 모노포스페이트 (dCMP)로부터 선택되는 하나 이상의 잔기를 포함한다. 일부 경우, RNA 서열의 하나 이상의 우리딘 모노포스페이트 (UMP) 잔기는 데옥시티미딘 모노포스페이트 (TMP/dTMP) 잔기로 치환된다. 일부 실시형태에서, 서열번호 1에 대해 적어도 80% 서열 동일성을 갖는 RNA 서열은 서열번호 1의 위치 1, 2, 3, 5, 6, 11, 12, 13, 14, 15, 19, 및/또는 20 중 하나 이상 또는 모두에 TMP/dTMP 잔기를 포함한다. 일부 실시형태에서, 서열번호 5에 대해 적어도 80% 서열 동일성을 갖는 RNA 서열은 서열번호 5의 위치 2, 3, 8, 9, 10, 11, 12, 및/또는 16 중 하나 이상 또는 모두에 dTMP 잔기를 포함한다. 본 명세서에 기재된 RNA 서열이 서열번호 4를 포함하는 경우, 상기 서열은 서열번호 4의 위치 4, 5, 6, 7, 및/또는 8 중 하나 이상 또는 모두에 dTMP 잔기를 포함할 수 있다. 본 명세서에 기재된 임의의 RNA 서열에서, AMP, GMP, 또는 CMP 잔기 중 하나 이상은 균등한 데옥시리보뉴클레오타이드 잔기 (즉 dAMP, dGMP, 또는 dCMP)로 치환될 수 있다. 일부 실시형태에서, RNA 서열의 모든 리보뉴클레오타이드 잔기는 균등한 데옥시리보뉴클레오타이드 잔기로 치환된다.
RNA 서열 중 일부, 대부분 또는 모두가 데옥시리보뉴클레오타이드 잔기로 구성된 경우, 서열은 DNA 서열로 기재될 수 있다. 따라서, 서열번호 1 또는 서열번호 5에 대해 적어도 80% 서열 동일성을 갖는 DNA 서열을 포함하는 핵산 화합물이 제공되고, 서열번호 1/서열번호 5의 UMP 잔기는 TMP/dTMP 잔기로 대체되고, DNA 서열은 길이가 29개 이하의 뉴클레오타이드이다. 일부 실시형태에서, DNA 서열은 TfR에 결합할 수 있고/거나, 세포, 바람직하게는 TfR-발현 세포 내에 내재화될 수 있다. 일부 실시형태에서 DNA 서열은 서열번호 1에 대해 적어도 85%, 적어도 87%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98% 또는 적어도 99% 서열 동일성을 갖고, 서열번호 1의 UMP 잔기는 dTMP 잔기로 대체된다. 일부 실시형태에서, 서열번호 1/서열번호 5의 모든 리보뉴클레오타이드 잔기는 균등한 데옥시리보뉴클레오타이드 잔기로 치환된다.
본 명세서에 기재된 모든 실시형태는 서열번호 1 또는 서열번호 5에 대해 적어도 80% 서열 동일성을 갖는 DNA 서열을 포함하는 핵산 화합물에 적용 가능하고, 서열번호 1/서열번호 5의 UMP 잔기는 dTMP 잔기로 대체되거나, 서열번호 1/서열번호 5의 모든 리보뉴클레오타이드 잔기는 균등한 데옥시리보뉴클레오타이드 잔기로 치환된다. 이러한 경우, 화합물은 데옥시리보핵산 화합물로서 기재될 수 있다.
일부 실시형태에서, 본 명세서에서 제공되는 핵산 화합물은 하나 이상의 데옥시리보뉴클레오타이드 잔기를 포함할 수 있다. 즉, 핵산 화합물은 본 명세서의 상기에 기재된 바와 같은 RNA/DNA 서열, 및 추가로 하나 이상의 데옥시리보뉴클레오타이드 잔기를 포함할 수 있다. 이러한 경우, 화합물은 데옥시리보핵산 화합물로 기재될 수 있다.
본 명세서에 개시된 임의의 핵산/리보핵산/데옥시리보핵산 화합물은 단리 및/또는 실질적으로 정제될 수 있다.
서열 동일성
2개 이상의 핵산 또는 폴리펩타이드 서열과 관련하여 용어 "동일한" 또는 "동일성" 백분율은 동일한 아미노산 잔기 또는 뉴클레오타이드의 특정 백분율 (즉, 비교 창 또는 지정 영역에 대한 최대 대응을 위해 비교 및 정렬되는 경우, 특정 영역에 걸쳐 약 60% 동일성, 바람직하게는 65%, 70%, 75%, 80%, 85%, 87%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 이상의 동일성)을 갖거나 동일한 2개 이상의 서열 또는 하위 서열을 지칭하며, 이는 예를 들어, 하기에 기재되는 디폴트의 파라미터를 갖는 BLAST 또는 BLAST 2.0 서열 비교 알고리즘을 사용하거나, 수동 정렬 및 육안 검사에 의해 측정되는 바와 같다 (예를 들어, NCBI 웹 사이트 http://www.ncbi.nlm.nih.gov/BLAST/ 등 참조). 그 후, 이러한 서열은 "실질적으로 동일한" 것으로 언급된다. 이러한 규정은 또한 시험 서열의 상보성을 지칭하거나, 그에 적용될 수 있다. 이러한 규정은 또한 결실 및/또는 첨가를 갖는 서열뿐만 아니라, 치환을 갖는 서열을 포함한다. 하기에 기재되는 바와 같이, 바람직한 알고리즘은 갭 등을 설명할 수 있다.
서열 비교에서, 통상적으로 하나의 서열이 시험 서열이 비교되는 기준 서열로서의 역할을 한다. 서열 비교 알고리즘을 사용할 때, 시험 및 참조 서열을 컴퓨터에 입력하고, 필요한 경우 하위 서열 좌표를 지정하며, 서열 알고리즘 프로그램 파라미터를 지정한다. 바람직하게는, 디폴트 프로그램 파라미터를 사용할 수 있거나, 대안적인 파라미터를 지정할 수 있다. 그 후, 서열 비교 알고리즘은 프로그램 파라미터를 기반으로 하여, 기준 서열에 대한 시험 서열의 서열 동일성 백분율을 계산한다.
본 명세서에 사용되는 바와 같이 "비교 윈도우"는 약 10 내지 600, 일반적으로 약 50 내지 약 200, 더욱 일반적으로 약 100 내지 약 150으로 이루어진 군으로부터 선택된 다수의 인접 위치 중 어느 하나의 절편에 대한 기준을 포함하며, 2개의 서열이 최적으로 정렬된 후 동일한 수의 인접 위치의 기준 서열과 서열이 비교될 수 있다.
비교를 위한 서열 정렬 방법은 당 업계에 널리 공지되어 있다. 비교를 위한 서열의 최적 정렬은 당업자에게 공지된 다양한 방식으로, 예를 들어 문헌[Smith & Waterman, Adv. Appl. Math. 2:482 (1981)]의 국소 상동성 알고리즘, 문헌[Needleman & Wunsch, J. Mol. Biol. 48:443 (1970)]의 상동성 정렬 알고리즘, 문헌[Pearson & Lipman, Proc. Nat'l. Acad. Sci. USA 85:2444 (1988)]의 유사성 검색 방법, 이들 알고리즘의 컴퓨터 구현예 (Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, Wl의 GAP, BESTFIT, PASTA, 및 FASTA), 또는 수동 정렬 및 육안 조사 (예를 들어, 문헌[Current Protocols in Molecular Biology (Ausubel et al., eds. 1995 supplement)] 참조)에 의해 수행될 수 있다. ClustalOmega (문헌[Soding, J. 2005, Bioinformatics 21, 951-960]), T-coffee (문헌[Notredame et al. 2000, J. Mol. Biol. (2000) 302, 205-217]), Kalign (문헌[Lassmann and Sonnhammer 2005, BMC Bioinformatics, 6(298)]) 및 MAFFT (문헌[Katoh and Standley 2013, Molecular Biology and Evolution, 30(4) 772-780]) 소프트웨어와 같은 공개적으로 이용 가능한 컴퓨터 소프트웨어가 사용될 수 있다. 이러한 소프트웨어를 사용할 때, 디폴트 파라미터, 예를 들어, 갭 페널티 및 확장 페널티가 바람직하게 사용된다.
서열 동일성 및 서열 유사성 백분율을 결정하는데 적합한 알고리즘의 바람직한 예는 BLAST 및 BLAST 2.0 알고리즘으로서, 각각 문헌[Altschul et al., Nuc. Acids Res. 25:3389-3402 (1977) 및 Altschul et al, J. Mol. Biol. 215:403-410 (1990)]에 기재되어 있다.
서열
화합물 모이어티 및 화합물
본 명세서에 제공된 핵산 화합물, 예를 들어, 리보/데옥시리보핵산 화합물은 치료 또는 진단 분자를 포함할 수 있다.
치료 또는 진단 분자는 본 명세서에 제공된 핵산 화합물의 일부를 형성할 수 있으며, 따라서 "화합물 모이어티", 예를 들어, 치료 모이어티 또는 영상화 모이어티로 지칭된다. 대안적으로, 치료 또는 진단 분자는 그의 실시형태를 포함하여 본 명세서에 제공된 핵산 화합물의 일부를 형성할 수 없지만, 본 명세서에 제공된 핵산 화합물과 상기 세포상의 TfR의 결합시 TfR-발현 세포에 의해 독립적으로 내재화될 수 있다. 이러한 상황에서, 치료 또는 진단 분자는 "화합물"로 지칭된다.
따라서, 본 명세서에서 제공되는 핵산 화합물 (그의 실시형태 포함)은 화합물 모이어티를 포함할 수 있다. 핵산 화합물이 화합물 모이어티를 포함하는 경우, 화합물 모이어티는 공유결합에 의해 (예를 들어, 직접 또는 공유결합된 중간체를 통해) 핵산 화합물 또는 RNA/DNA 서열에 부착될 수 있다 (예를 들어, 상기에 제시된 접합체 화학에 사용되는 유용한 반응성 모이어티 또는 작용기 참조). 따라서, 일부 실시형태에서, 핵산 화합물은 핵산 화합물 또는 RNA/DNA 서열에 공유결합에 의해 부착된 화합물 모이어티를 추가로 포함한다. 실시형태에서, 화합물 모이어티 및 핵산 화합물 또는 RNA/DNA 서열은 접합체를 형성한다. 일부 실시형태에서, 화합물 모이어티는, 예를 들어 이온 결합 (들), 반데르발스의 결합 (들)/상호작용, 수소 결합 (들), 극성 결합 (들), "접착성 가교" (예를 들어, 문헌[Zhou J et al. Nucleic Acids Res. 2009; 37 (9) 참조)):3094-3109]) 또는 이들의 조합 또는 혼합을 통해 핵산 화합물 또는 RNA/DNA 서열에 비공유결합에 의해 부착된다. 화합물 모이어티는 모듈형 스트렙타비딘 연결인자와 같은 중간체를 통해 핵산 화합물 또는 RNA/DNA 서열에 부착될 수 있다 (예를 들어, 문헌[Chu TC et al., Nucleic Acids Res 2006, 34:e73 참조). 화합물 모이어티가 본 명세서의 하기에 기재된 바와 같이 예를 들어 나노 입자 또는 리포좀에 캡슐화되는 경우, 캡슐화 모이어티 자체는 핵산 화합물 또는 RNA/DNA 서열에 공유결합에 의하거나, 비공유결합에 의해 부착될 수 있다.
일부 실시형태에서, 화합물 모이어티는 핵산 화합물 또는 RNA/DNA 서열에 공유결합에 의해 부착된 치료 모이어티 또는 영상화 모이어티이다.
본 명세서에서 제공되는 바와 같이, 용어 "치료 모이어티"는 그 일반적인 통상의 의미에 따라 사용되며, 이를 필요로 하는 대상체에 제공되는 경우, 치료 이점 (치료되는 기저 장애의 예방, 제거, 완화)을 갖는 1가 화합물을 지칭한다. 본 명세서에 제공된 바와 같은 치료 모이어티에는 제한 없이 펩타이드, 단백질, 핵산, 핵산 유사체, 소분자, 항체, 효소, 전구약물, 나노구조, 바이러스 캡시드, 다음에 제한되는 것은 아니나, 리신, 독소루비신, 다우노루비신, 탁솔, 에티디움 브로마이드, 미토마이신, 에토포시드, 테니포시드, 빈크리스틴, 빈블라스틴, 콜히친, 디하이드록시안트라세네온, 악티노마이신 D, 디프테리아 독소, 슈도모나스 엑소톡신 (PE) A, PE40, 아브린 및 글루코코르티코이드를 포함하는 세포독성제 (예를 들어, 독소)를 포함할 수 있다. 실시형태에서, 치료 모이어티는 본 명세서에 기재된 바와 같은 항암제 또는 화학요법제이다. 실시형태에서, 치료 모이어티는 핵산 모이어티, 펩타이드 모이어티 또는 소분자 약물 모이어티이다. 실시형태에서, 치료 모이어티는 핵산 모이어티이다. 실시형태에서, 치료 모이어티는 펩타이드 모이어티이다. 실시형태에서, 치료 모이어티는 소분자 약물 모이어티이다. 실시형태에서, 치료 모이어티는 뉴클레아제이다. 실시형태에서, 치료 모이어티는 면역자극제이다. 실시형태에서, 치료 모이어티는 독소이다. 실시형태에서, 치료 모이어티는 뉴클레아제이다. 실시형태에서, 치료 모이어티는 아연 핑거 뉴클레아제이다. 실시형태에서, 치료 모이어티는 전사 활성인자-유사 효과기 뉴클레아제이다. 실시형태에서, 치료 모이어티는 Cas9이다. 치료 모이어티는 나노입자 또는 리포좀에 캡슐화될 수 있으며, 나노입자 또는 리포좀은 핵산 화합물 또는 RNA/DNA 서열에 부착된다.
일부 실시형태에서, 치료 모이어티는 활성화 핵산 모이어티 (활성화 핵산을 포함하는 1가 화합물) 또는 안티센스 핵산 모이어티 (안티센스 핵산을 포함하는 1가 화합물)이다. 활성화 핵산은 소정의 유전자 또는 단백질의 발현 또는 활성을 검출 가능하게 증가시킬 수 있는 핵산을 지칭한다. 활성화 핵산은 활성화 핵산의 부재하의 대조군과 비교하여 발현 또는 활성을 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 이상 증가시킬 수 있다. 특정 예에서, 발현 또는 활성은 활성화 핵산의 부재 하의 발현 또는 활성보다 1.5배, 2배, 3배, 4배, 5배, 10배 이상 더 크다. 안티센스 핵산은, 특이적 표적 핵산의 적어도 일부에 상보적이고, 표적 핵산의 전사를 감소시키거나, 표적 핵산의 번역을 감소시키거나, 전사체 스플라이싱을 변경할 수 있는 핵산을 지칭한다. 안티센스 핵산은 소정의 유전자 또는 단백질의 발현 또는 활성을 검출 가능하게 감소시킬 수 있다. 안티센스 핵산은 안티센스 핵산의 부재 하의 대조군과 비교하여 발현 또는 활성을 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 이상 감소시킬 수 있다.
일부 실시형태에서, 치료 모이어티는 miRNA 모이어티 (miRNA를 포함하는 1가 화합물), mRNA 모이어티 (mRNA를 포함하는 1가 화합물), siRNA 모이어티 (siRNA를 포함하는 1가 화합물) 또는 saRNA 모이어티 (saRNA를 포함하는 1가 화합물)이다. 일부 실시형태에서, 치료 모이어티는 miRNA 모이어티이다. 용어 "miRNA"는 그의 일반적인 통상의 의미에 따라 사용되며, 전사 후에 유전자 발현을 조절할 수 있는 작은 비코딩 RNA 분자를 지칭한다. 일 실시형태에서, miRNA는 표적 유전자에 실질적이거나 완전한 동일성을 갖는 핵산이다. 일부 실시형태에서, miRNA는 상보적인 세포 mRNA와 상호작용함으로써, 상보적 mRNA의 발현을 간섭하여, 유전자 발현을 억제한다. 통상적으로, miRNA는 길이가 적어도 약 15 내지 50개의 뉴클레오타이드이다 (예를 들어, miRNA의 각각의 상보적 서열은 길이가 15 내지 50개의 뉴클레오타이드, miRNA는 길이가 약 15 내지 50개의 염기쌍임). 다른 실시형태에서, 길이가 20 내지 30개의 염기 뉴클레오타이드, 바람직하게는 약 20 내지 25 또는 약 24 내지 29개의 뉴클레오타이드, 예를 들어, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 또는 30개의 뉴클레오타이드이다. 일부 실시형태에서, 치료 모이어티는 본 명세서에 기재된 바와 같은 siRNA 모이어티이다. 일부 실시형태에서, 치료 모이어티는 본 명세서에 기재된 바와 같은 saRNA 모이어티이다. 실시형태에서, 치료 모이어티는 항암제 모이어티이다. 일부 실시형태에서, 치료 모이어티는 mRNA 모이어티이다. 실시형태에서, 치료 모이어티는 cDNA 모이어티이다.
일부 경우, 본 명세서에 제공되는 핵산 화합물 또는 RNA/DNA 서열은 뉴클레오타이드 화합물 모이어티 예를 들어, mRNA, miRNA, siRNA 또는 saRNA의 센스 가닥에 부착된다. 일부 경우 핵산 화합물 또는 RNA/DNA 서열은 뉴클레오타이드 화합물 모이어티의 안티센스 가닥에 부착된다. 일부 경우, 핵산 화합물 또는 RNA/DNA 서열은 뉴클레오타이드 화합물 모이어티의 가이드 가닥에 부착된다. 일부 경우, 핵산 화합물 또는 RNA/DNA 서열은 뉴클레오타이드 화합물 모이어티의 패신저 가닥 (passenger strand)에 부착된다.
일부 실시형태에서, 치료 모이어티는 C/EBP알파 saRNA 모이어티이다. 본 명세서에서 제공되는 바와 같이, "C/EBP알파 saRNA"는 C/EBP알파 유전자 및/또는 C/EBP알파 단백질의 발현을 활성화시키고/거나, 증가시킬 수 있는 saRNA이다. 일부 경우, 예를 들어, saRNA 서열은 서열번호 9 및/또는 서열번호 10을 포함한다.
일부 실시형태에서, 치료 모이어티는 시르투인 saRNA 모이어티이다. 본 명세서에서 제공되는 바와 같이, "시르투인 saRNA"는 시르투인 유전자, 예를 들어, SIRT1, SIRT2, SIRT3, SIRT4, SIRT5, SIRT6 또는 SIRT7의 발현을 활성화시키고/거나, 증가시킬 수 있는 saRNA이다. 일부 실시형태에서, 치료 모이어티는 SIRT1 saRNA 모이어티이다. 본 명세서에서 제공되는 바와 같이, "SIRT1 saRNA"는 SIRT1 유전자 및/또는 Sirt1 단백질의 발현을 활성화시키고/거나, 증가시킬 수 있는 saRNA이다. 일부 경우, 예를 들어, saRNA 서열은 서열번호 7 및/또는 서열번호 8을 포함한다.
일부 실시형태에서, 치료 모이어티는 HNF saRNA 모이어티이다. 본 명세서에서 제공되는 바와 같이, "HNF saRNA"는 HNF 유전자 및/또는 단백질, 예를 들어 HNF4 (그의 이소형 및 변이체 포함)의 발현을 활성화시키고/거나, 증가시킬 수 있는 saRNA이다. HNF saRNA는 HNF4 saRNA일 수 있다. 즉, HNF saRNA는 HNF4 유전자 및/또는 단백질의 발현을 조절하고, 예를 들어 발현을 활성화시키고/거나, 증가시키는 것일 수 있다.
일부 경우, 치료 모이어티는 NFκB (활성화된 B 세포의 핵 인자 카파-경쇄-인핸서) mRNA, miRNA, siRNA 또는 saRNA일 수 있다.
일부 경우, 치료 모이어티는 조효소 예컨대 NAD+/NADH (니코틴아미드 아데닌 디뉴클레오타이드)일 수 있으며, 예를 들어 문헌[Ying W, Front Biosci. 2007 Jan 1; 12: 1863-88]을 참조한다.
본 명세서에서 제공되는 화합물 모이어티는 영상화 모이어티일 수 있다. 본 명세서에서 제공되는 바와 같이, "영상화 모이어티"는 분광, 광화학, 생화학, 면역화학, 화학 또는 다른 물리적 수단에 의해 검출 가능한 1가 화합물이다. 일부 실시형태에서, 영상화 모이어티는 핵산 화합물 또는 RNA/DNA 서열에 공유결합에 의해 부착된다. 예시적인 영상화 모이어티는 제한 없이 32P, 방사성핵종, 양전자 방출 동위원소, 형광 염료, 형광단, 항체, 생물발광 분자, 화학발광 분자, 광활성 분자, 금속, 전자-밀도 시약, 효소 (예를 들어, ELISA에서 일반적으로 사용됨), 자기 조영제, 양자점, 나노입자, 예를 들어 금 나노입자, 비오틴 (biotin), 디곡시제닌 (digoxigenin), 합텐 및 단백질 또는 예를 들어, 표적 펩타이드에 특이적으로 반응성인 펩타이드 또는 항체에 방사성 표지를 혼입함으로써 검출될 수 있는 기타 물질이다. 항체를 모이어티에 접합시키기 위해 당 업계에 공지된 임의의 방법이 사용될 수 있으며, 예를 들어 문헌[Hermanson, Bioconjugate Techniques 1996, Academic Press, Inc., San Diego]에 기재된 방법을 사용한다. 예시적인 형광단에는 플루오레세인 (fluorescein), 로다민 (rhodamine), GFP, 쿠마린 (coumarin), FITC, Alexa fluor®, Cy3, Cy5, BODIPY 및 시아닌 염료 (cyanine dye)가 포함된다. 예시적인 방사성핵종은 플루오르-18, 갈륨-68 및 구리-64를 포함한다. 예시적인 자기 조영제는 가돌리늄, 철 산화물 및 철 백금 및 망간을 포함한다. 일부 실시형태에서, 영상화 모이어티는 생물발광 분자이다. 일부 실시형태에서, 영상화 모이어티는 광활성 분자이다. 일부 실시형태에서, 영상화 모이어티는 금속이다. 일부 실시형태에서, 영상화 모이어티는 나노입자이다.
본 명세서에 사용되는 바와 같이, 용어 "영상화제"는 이들이 본 명세서에 기재된 핵산 화합물에 부착되지 않은 경우 영상화 모이어티를 기재한다.
일부 경우, 본 명세에 기재되는 핵산 화합물은 (i) 본 명세서에 기재된 바와 같은 RNA/DNA 서열 및 (ii) 추가의 앱타머 분자를 포함한다. 상기 RNA/DNA 서열은 앱타머인 경우, 이러한 분자는 이중특이적 앱타머로 기재될 수 있다. 바람직하게는, 추가의 앱타머 분자는 TfR을 표적화하지 않거나, 이에 결합하지 않는다. 일부 경우에, 본 명세서에 기재된 핵산 화합물은 다가이다. 일부 경우에, 본 명세서에 기재된 핵산의 말단은 각각의 모이어티에 부착된 상보적 뉴클레오타이드 링커 서열을 사용하여 추가의 앱타머 분자의 말단에 어닐링될 수 있다 (예를 들어, 문헌[McNamara, J.O. et al. J. Clin. Invest. 2008 118:376-386] 참조, 상기 문헌은 그 전문이 본 명세서에 참조로 포함됨).
본 명세서에 기재된 화합물 모이어티 또는 화합물은 본 명세서에 기재되거나 당 업계에 공지된 임의의 적합한 방법에 의해 본 발명의 핵산 화합물에 접합될 수 있고, 예를 들어, 문헌[Zhu G et al., Bioconjug Chem. 2015 26(11): 2186-2197]을 참조하며, 상기 문헌은 그 전문이 본 명세서에 참조로 포함된다. 화학물질-기반 링커는 m-말레이미도벤조일 N-하이드록시숙신이미드 에스테르 (MBS), 2-이미노티올란 (Traut 시약), N-숙신이미딜-3-2-피리딜디티오 프로피오네이트 (SPDP)와 같은 활성화 시약을 사용할 수 있거나, 예를 들어, 페길화 또는 아비딘/비오틴 기법 (예를 들어, 문헌[Pardridge WM, Adv Drug Delivery Rev. 1999, 36:299-321 ; Qian ZM et al., supra], 상기 문헌은 그 전문이 본 명세서에 참조로 포함됨)을 사용할 수 있다.
변형
본 명세에 기재되는 핵산 화합물은, 예를 들어 뉴클레아제 내성 또는 결합 친화도와 같은 기능적 특성을 향상시키기 위해 본 명세서에 규정된 바와 같은 화학적 변형을 포함할 수 있다. 변형은 핵산 화합물, RNA/DNA 서열 및/또는 뉴클레오타이드-기반 화합물 모이어티 또는 화합물, 예를 들어, saRNA, siRNA, miRNA, mRNA에 존재할 수 있다.
일부 경우에, 하나 이상의 뉴클레오타이드의 염기, 당 고리 또는 포스페이트기에 변형이 이루어질 수 있다.
일부 경우, 본 명세에 기재되는 핵산 화합물은 하나 이상의 변형된 핵염기를 포함한다. 예를 들어, 핵산 화합물은 플루오로 (F), 아미노 (NH2) 또는 O-메틸 (OCH3) 기에 의해 변형된 하나 이상의 리보/데옥시리보핵염기를 포함할 수 있다. 일부 경우, 핵염기는 2' 위치, 3' 위치, 5' 위치 또는 6' 위치에서 변형된다. 일부 경우, 핵산 화합물은 하나 이상의 2'-아미노피리딘, 2'-플루오로피리딘, 2'-0-메틸 뉴클레오타이드 및/또는 '잠금' 뉴클레오타이드 (LNA)을 포함할 수 있다 (예를 들어, 문헌[Lin, Y et al., Nucleic Acids Res. 1994 22, 5229-5234 (1994); Ruckman, J. et al. J. Biol. Chem. 1998 273, 20556-20567; Burmeister, PE et al., Chem. Biol. 2005 12, 25-33; Kuwahara, M. & Obika, S. Artif. DNA PNA XNA 2013 4, 39-48; Veedu, R. N. & Wengel, J. Mol. Biosyst. 2009 5,787-792] 참조). 일부 경우, 핵산 화합물은 하나 이상의 L-형 핵산을 포함한다 (예를 들어, 문헌[Maasch, C et al., Nucleic Acids Symp. Ser. (Oxf.) 2008 52, 61-62] 참조). 다른 적합한 핵산 변형이 당업자에 자명할 것이다 (예를 들어, 문헌[Ni S et al., Int. J. Mol. Sci 2017 18, 1683] 참조, 상기 문헌은 그 전문이 본 명세서에 참조로 포함됨).
일부 경우에, 뉴클레오타이드 화합물 모이어티, 예를 들어 mRNA, miRNA, siRNA 또는 saRNA의 센스 및/또는 안티센스 가닥은 뉴클레오타이드 오버행 (overhang)을 포함할 수 있다. 예를 들어, 상기 오버행은 2-뉴클레오타이드 (UU) 오버행일 수 있다. 상기 오버행은 하나 또는 양쪽 가닥의 3' 말단에 존재할 수 있다. 오버행은 뉴클레오타이드 화합물 모이어티의 Dicer 인식에 유리할 수 있다.
일부 경우에, 본 명세서에 기재된 핵산 화합물은 3' 말단에 역위 티미딘 캡 (inverted thymidine cap)을 포함하거나, 3'-비오틴을 포함한다. 일부 경우에, 핵산 화합물의 포스포디에스테르 연결은 메틸포스포네이트 또는 포스포로티오에이트 유사체, 또는 트리아졸 연결로 대체된다 (문헌[Ni S et al., supra] 참조).
일부 경우에, 본 명세서에 기재된 핵산 화합물은 C3 스페이서 포스포라마이트 (spacer phosphoramite)의 하나 이상의 카피를 포함한다. 스페이서는, 예를 들어 RNA/DNA 서열 및 화합물 모이어티 사이 내부에, 또는 뉴클레오타이드 서열의 5' 또는 3' 말단에 혼입되어, 예를 들어, 영상화 모이어티에 부착될 수 있다.
일부 경우에, 본 명세서에 기재된 핵산 화합물은 반감기를 증가시키고/거나, 신장에 의한 제거에 저항성이 되도록 하는 변형을 포함한다. 예를 들어, 화합물은 콜레스테롤, 디알킬 지질, 단백질, 리포좀, 유기 또는 무기 나노물질, 나노입자, 불활성 항체 또는 폴리에틸렌 글리콜 (PEG), 예를 들어, 20kDa PEG, 40 kDa PEG를 포함하도록 변형될 수 있다. 이러한 변형은 화합물의 5' 말단에 존재할 수 있다. 일부 경우에, 변형은 신장 사구체에 대한 컷오프 임계값 초과의 질량 (약 30 내지 50 kDa)을 갖는 분자를 포함한다. 일부 경우에, 핵산 화합물은 플루로닉 겔 (pluronic gel)로 제형화될 수 있다. 적합한 변형 및 제형화의 예를 위해, 예를 들어 문헌[Ni et al, supra, and Zhou and Rossi, Nat Rev Drug Disc 2017, 16 181-202]을 참조하며, 상기 문헌은 둘 모두 그 전문이 본 명세서에 참조로 포함된다.
본 명세에 기재되는 핵산 화합물은 알부민 태그와 같은 태그를 포함할 수 있다. 다른 태그는 폴리(His) 태그, 키틴 (chitin) 결합 단백질 (CBP), 말토스 결합 단백질 (MBP), Strep-태그 및 글루타티온-S-트랜스퍼라제 (GST)를 포함할 수 있다. 화합물은 예를 들어 그 전문이 본 명세서에 참조로 포함되는 문헌[Srisawat C and Engelke DR, Methods. 2002 26(2): 156-161 and Walker et al., Methods Mol Biol. 2008; 488: 23-40]에 기재된 바와 같은 RNA/DNA 친화도 태그를 포함할 수 있다. 다른 적합한 태그는 당업자에게 쉽게 명백할 것이다.
본 명세서에 기재된 핵산 화합물은 핵산 부분과 화합물 모이어티 및/또는 태그 사이에 스페이서 또는 링커 서열을 포함할 수 있다. 적합한 스페이서 또는 링커 서열은 당업자에게 쉽게 명백할 것이다.
기능적 특성
본 명세서에 기재된 핵산 화합물은 특정 기능적 특성을 참조하여 특성화될 수 있다.
일부 실시형태에서, 본 명세서에 기재된 임의의 핵산/리보핵산/데옥시리보핵산 화합물은 하기 특성 중 하나 이상을 보유할 수 있다:
트랜스페린 수용체 (TfR)에 결합함;
TfR에 결합할 수 있음;
TfR에 특이적으로 결합함;
TfR에 특이적으로 결합할 수 있음;
세포 표면의 TfR에 결합함;
세포 표면의 TfR에 결합할 수 있음;
세포에 의해 내재화될 수 있음;
함유물, 예를 들어, 화합물 모이어티 또는 화합물을 세포 내에 전달할 수 있음;
혈뇌 장벽을 통과할 수 있음;
뇌로 수송될 수 있음;
함유물, 예를 들어, 화합물 모이어티 또는 화합물을 뇌로 전달할 수 있음.
트랜스페린 수용체와 핵산 화합물의 결합은 예를 들어 본 명세서에 예시되어 있고, 문헌[Drescher et al., Methods Mol Biol. 2009; 493: 323-343]에 기재된 바와 같이, 표면 플라즈몬 공명 기술에 의해 결정될 수 있다.
핵산 화합물이 세포에 의해 내재화되는 능력 또는 BBB를 통과하는 능력은 형광 염료와 같은 핵산 화합물에 접합된 영상화 모이어티를 사용하여, 상기 영상화 모이어티를 적절한 수단에 의해 검출함으로써, 결정될 수 있다. 적합한 영상화 방법은 본 명세서에 기재되어 있거나 당 업계에 널리 공지되어 있다. 다른 방법은 예를 들어 항체를 사용하여, 뇌 조직에서 치료 모이어티를 검출하는 단계를 포함한다.
함유물을 세포 내로 전달하는 핵산 화합물의 능력은, 예를 들어 영상화 모이어티의 검출에 의해 또는 그외에는 당 업계에 공지되는 바와 같이 함유물 자체를 검출하거나, 예를 들어, 본 명세서에 기재된 바와 같이, 상기 함유물의 성공적인 전달 효과를 검출함으로써, 결정될 수 있다.
본 명세서에서 제공되는 바와 같이, 용어 "내재화된", "내재화하는" 또는 "내재화"는 (예를 들어, 세포막에 의해 포획된 후) 세포의 세포질 내로 유도되는 조성물 (예를 들어, 화합물, 핵산 화합물, 치료제, 영상화제)을 지칭한다.
약제학적 제형
본 발명은 본 명세에 기재되는 핵산 화합물을 포함하는 약제학적 조성물을 제공한다.
본 명세에 기재되는 핵산 화합물은 임상용 약제학적 조성물 또는 약제로 제형화될 수 있고, 약제학적으로 허용 가능한 담체, 희석제, 부형제 또는 애주번트 (adjuvant)를 포함할 수 있다. 조성물은 국소, 비경구, 전신, 강내 (intracavitary), 정맥내, 동맥내, 근육내, 척수내, 안내, 결막내, 종양내, 피하, 피내, 척수내, 경구 또는 경피 투여 경로를 위해 제형화될 수 있으며, 이는 주사 또는 주입을 포함할 수 있다. 적합한 제형은 멸균 또는 등장성 매질 중 항원-결합 분자를 포함할 수 있다. 약제 및 약제학적 조성물은 겔 형태를 포함하여 유체로 제형화될 수 있다. 유체 제형은 인간 또는 동물 신체의 선택 영역에 주사 또는 주입 (예를 들어, 카테터를 통한 경우)에 의해 투여되도록 제형화될 수 있다.
일부 경우에, 본 발명에 따른 핵산 화합물은, 예를 들어 혈관 또는 종양으로의 주사 또는 주입용으로 제형화된다.
본 명세서에 제공된 핵산 화합물의 약제학적 조성물은 치료적 또는 예방 유효량, 즉 의도된 목적을 달성하기 위한 유효량으로 포함된 치료 모이어티를 갖는 조성물을 포함할 수 있다. 본 명세서에 제공된 핵산 화합물의 약제학적 조성물은 유효량, 즉 의도된 목적을 달성하기 위한 유효량으로 포함된 영상화 모이어티를 갖는 조성물을 포함할 수 있다. 특정 적용을 위해 유효한 실제 양은 특히 치료, 시험, 검출 또는 진단되는 병태에 따라 달라질 것이다. 질병을 치료하는 방법으로 투여되는 경우, 이러한 조성물은 적절한 결과, 예를 들어 표적 분자의 활성의 조절 및/또는 질병 증상의 진행의 감소, 제거 또는 지연을 달성하기 위해 유효한 활성 성분의 양을 포함할 것이다. 본 명세서에 제공된 치료 모이어티의 치료적 또는 예방 유효량의 결정은 특히 본 명세서의 상세한 개시내용에 비추어 당업자의 적정한 능력 내에 있다. 질병을 진단 또는 검출하는 방법으로 투여되는 경우, 이러한 조성물은 적절한 결과, 예를 들어 대상체에서 표적 분자, 세포 또는 종양의 존재 또는 부재의 검출을 달성하기 위해 유효한 본 명세서에 기재된 영상화 모이어티의 양을 포함할 것이다. 본 명세서에 제공된 영상화 모이어티의 검출 가능한 양의 결정은 특히 본 명세서의 상세한 개시내용에 비추어 당업자의 적정한 능력 내에 있다.
포유류에 투여되는 투여량 및 횟수 (단일 또는 다회 투여량)는 다양한 인자, 예를 들어 포유류가 다른 질병을 앓고 있는지; 투여 경로; 수용체의 크기, 연령, 성별, 건강, 체중, 체질량 지수 및 식습관; 치료되는 질병의 증상의 성질 및 정도, 동시 치료의 종류, 치료되는 질병의 합병증 또는 기타 건강 관련 문제에 따라 달라질 수 있다. 다른 치료 용법 또는 제제는 그의 실시형태를 포함하여 본 명세서에 기재된 방법 및 조성물과 함께 사용될 수 있다. 확립된 투여량 (예를 들어, 횟수 및 지속기간)의 조정 및 조작은 당업자의 적정한 능력 내에 있다.
본 명세서에 기재된 임의의 조성물 (예를 들어, 제공된 핵산 화합물뿐만 아니라, 항암제 및 제공된 핵산 화합물의 조합)에 대해, 치료 유효량은 세포 배양 분석으로부터 초기에 결정될 수 있다. 표적 농도는 본 명세서에 기재되거나 당 업계에 공지된 방법을 사용하여 측정된 바와 같이 본 명세서에 기재된 방법을 달성할 수 있는 활성 화합물 (들)의 농도일 것이다. 당 업계에 널리 공지된 바와 같이, 인간에서 사용하기 위한 유효량은 또한 동물 모델로부터 결정될 수 있다. 예를 들어, 인간을 위한 투여량은 동물에서 유효한 것으로 나타난 농도가 획득되도록 제형화될 수 있다. 상기에 기재된 바와 같이, 효과를 모니터링하고, 투여량을 상향 또는 하향 조정함으로써, 인간에서의 투여량을 조정할 수 있다. 상기 기재된 방법 및 다른 방법을 기반으로 하여, 인간에서 최대 효능을 달성하도록 하기 위한 투여량의 조절은 당업자의 적정한 능력 내에 있다.
일 양상에서, 그의 실시형태를 포함하여 본 명세서에 기재된 바와 같은 핵산 화합물, 및 약제학적으로 허용 가능한 부형제를 포함하는 약제학적 조성물이 본 명세서에 제공된다. 일부 실시형태에서, 핵산은 핵산 화합물 또는 RNA/DNA 서열에 공유결합에 의해 부착된 화합물 모이어티를 포함한다. 상기에 기재된 바와 같이, 화합물 모이어티는 핵산 화합물 또는 RNA/DNA 서열에 공유결합에 의해 부착된 치료 모이어티 또는 영상화 모이어티일 수 있다.
일부 양상에서, 약제학적 조성물은 그의 실시형태를 포함하여 본 명세서에서 제공되는 바와 같이, 핵산 화합물, 및 치료제를 포함한다. 일부 실시형태에서, 핵산 화합물은 화합물 모이어티를 포함한다. 일부 실시형태에서, 핵산 화합물 및 치료제는 에 공유결합에 의해 부착되지 않는다. 본 명세서에서 제공되는 바와 같이, 치료제는 치료 효과를 갖는 조성물 (예를 들어, 화합물, 약물, 길항제, 억제제, 조절제)을 지칭한다. 일부 실시형태에서, 치료제는 항암제이다. 일부 실시형태에서, 약제학적 조성물은 약제학적으로 허용 가능한 부형제를 포함한다.
일부 양상에서, 그의 실시형태를 포함하여 본 명세서에서 제공되는 바와 같은 핵산 화합물, 및 본 명세서에 기재된 바와 같은 화합물을 포함하는 약제학적 조성물이 제공된다. 즉, 조성물은 핵산 화합물 및 핵산 화합물 자체의 일부를 형성하지 않는 화합물, 예를 들어, 치료 또는 진단 분자를 포함한다. 일부 경우, 핵산 화합물은 화합물 모이어티를 포함한다. 일부 경우, 약제학적 조성물은 치료제를 추가로 포함한다.
"약제학적으로 허용 가능한 부형제" 및 "약제학적으로 허용 가능한 담체"는 활성 제제의 대상체에의 투여 및 대상체에 의한 흡수를 돕는 물질을 지칭하며, 환자에 심각한 유해 독성 효과를 유발하지 않으면서 본 발명의 조성물에 포함될 수 있다. 약제학적으로 허용 가능한 부형제의 비 제한적 예는 물, NaCl, 통상의 식염수 용액, 링거 젖산 용액, 통상의 수크로스, 통상의 글루코스, 결합제, 충전제, 붕해제, 윤활제, 코팅제, 감미제, 향료, 염 용액 (예를 들어, 링거액), 알코올, 오일, 젤라틴, 탄수화물, 예컨대 락토스, 아밀로스 또는 전분, 지방산 에스테르, 하이드록시메틸셀룰로스, 폴리비닐 피롤리딘 및 착색제 등을 포함한다. 이러한 제조물은 멸균될 수 있고, 적절한 경우, 본 발명의 화합물과 유해한 반응을 일으키지 않는 보조제, 예컨대 윤활제, 보존제, 안정화제, 습윤제, 유화제, 삼투압에 영향을 미치는 염, 완충액, 착색제 및/또는 방향성 물질 등과 혼합될 수 있다. 당업자는 다른 약제학적 부형제가 본 발명에 유용하다는 것을 인식할 것이다.
용어 "약제학적으로 허용 가능한 염"은 당 업계에 널리 공지된 다양한 유기 및 무기 반대 이온으로부터 유래된 염을 지칭하며, 단지 예로서 나트륨, 칼륨, 칼슘, 마그네슘, 암모늄, 테트라알킬암모늄 및 등; 분자가 염기성 작용기를 포함하는 경우, 하이드로클로라이드, 하이드로브로마이드, 타르트레이트, 메실레이트, 아세테이트, 말레에이트, 옥살레이트 등과 같은 유기 또는 무기 산의 염을 포함한다.
용어 "조성물"은 다른 담체의 존재 또는 부재 하에 활성 성분이 담체에 의해 둘러싸임으로써, 그와 결합된 상태가 되도록 하는 캡슐을 제공하는 담체로서 캡슐화 물질에 의한 활성 화합물의 제형을 포함하는 것으로 의도된다. 이와 유사하게, 카세제 (cachet) 및 로젠지 (lozenge)도 포함된다. 정제, 분말, 캡슐, 환제, 카세제 및 로젠지는 경구 투여에 적합한 고체 투여 형태로서 사용될 수 있다.
약제학적 조성물은 선택적으로 단위 투여 형태이다. 이러한 형태에서, 제조물은 적절한 양의 활성 성분을 포함하는 단위 투여량으로 세분된다. 단위 투여 형태는 포장된 조성물일 수 있고, 패키지는 바이알 (vial) 또는 앰풀 (ampoule) 내에 포장된 정제, 캡슐 및 분말과 같은 개별 정량의 조성물을 포함한다. 또한, 단위 투여 형태는 캡슐, 정제, 카세제 또는 로젠지 자체일 수 있거나, 패키지 형태 내의 적절한 수의 임의의 것일 수 있다. 단위 투여 형태는 동결 분산액일 수 있다.
전달 방법
상기에 기재된 바와 같이, 그의 실시형태를 포함하는 본 명세서에서 제공되는 핵산 화합물, 예를 들어, 리보/데옥시리보핵산 화합물은 화합물 모이어티 또는 화합물 (예를 들어, 치료제 또는 영상화제)을 세포 내에 전달하는데 사용될 수 있다. 화합물 모이어티 (예를 들어, 치료 모이어티 또는 영상화 모이어티)가 세포 내에 전달되는 경우, 화합물 모이어티는 그의 실시형태를 포함하는 본 명세서에서 제공되는 핵산 화합물에 공유결합에 의해 부착될 수 있다. 세포 상 TfR과 핵산 화합물의 결합시, 화합물 모이어티는 핵산 화합물에 공유결합에 의해 부착되어 세포에 의해 내재화될 수 있다. 따라서, 일 양상에서, 화합물 모이어티를 세포 내에 전달하는 방법이 제공된다. 상기 방법은 (i) 세포를 그의 실시형태를 포함하여 본 명세서에서 제공되는 바와 같은 핵산 화합물, 또는 조성물과 접촉시키는 단계 및 (ii) 핵산 화합물이 세포 상의 TfR에 결합하여, 세포 내로 통과되도록 함으로써, 화합물 모이어티를 세포 내로 전달하는 단계를 포함한다.
대안적으로, 화합물이 세포 내에 전달되는 경우, 화합물 (예를 들어, 치료제 또는 영상화제)은 핵산 화합물에 공유결합에 의해 부착되지 않을 수 있다. 그의 실시형태를 포함하여 본 명세서에서 제공되는 핵산 화합물과 세포 상의 TfR의 결합시, 제공 핵산 화합물 및 화합물은 서로 공유결합에 의해 부착되지 않은 상태에서 세포에 의해 내재화될 수 있다. 따라서, 다른 양상에서, 화합물을 세포 내에 전달하는 방법이 제공된다. 상기 방법은 (i) 세포를 그의 실시형태를 포함하여 본 명세서에서 제공되는 바와 같은 화합물 및 핵산 화합물, 또는 조성물과 접촉시키는 단계 및 (ii) 핵산 화합물이 세포 상의 TfR과 결합하여, 상기 화합물이 세포 내로 통과되도록 함으로써, 상기 화합물을 세포 내로 전달하는 단계를 포함한다. 실시형태에서, 화합물은 치료제 또는 영상화제이다. 실시형태에서, 화합물은 핵산 화합물에 비공유결합에 의해 부착된다.
상기 방법은 시험관내, 생체외 또는 생체내에서 수행될 수 있다. 일부 경우, 상기 방법은 화합물 모이어티 또는 화합물을 혈뇌 장벽을 통해 뇌로 전달하는 단계를 포함한다.
치료 및 예방적 적용
본 명세서에 제공되는 핵산 화합물, 예를 들어, 리보/데옥시리보핵산 화합물, 및 조성물은 치료 및 예방 방법에 사용된다.
본 발명은 의학적 치료 또는 예방 방법에 사용하기 위한 것으로 본 명세서에 기재된 핵산 화합물 및 조성물을 제공한다. 본 발명은 또한 질병 또는 장애를 치료 또는 예방하기 위한 약제의 제조에서 본 명세서에 기재된 핵산 화합물 및 조성물의 용도를 제공한다. 본 명세서에 기재된 본 발명은 또한 질병 또는 장애를 치료 또는 예방하는 방법을 제공하며, 이는 본 명세서에 기재된 핵산 화합물 또는 조성물의 치료 또는 예방 유효량을 이를 필요로 하는 대상체에 투여하는 단계를 포함한다.
본 명세서에 사용되는 바와 같이, "치료" 또는 "치료하는" 또는 "경감" 또는 "완화"는 본 명세서에서 상호 혼용된다. 이러한 용어는 다음에 제한되는 것은 아니나, 치료적 이익 및/또는 예방적 이익을 포함하는 유익하거나 바람직한 결과를 획득하기 위한 접근법을 지칭한다. 치료적 이점은 치료되는 기저 장애의 제거 또는 완화를 의미한다. 또한, 기저 장애와 관련된 하나 이상의 생리학적 증상의 제거 또는 완화에 의해 치료적 이점이 달성되므로, 환자는 여전히 기저 장애를 앓을 수 있으나, 환자에서 개선이 관찰된다. 예방적 이점을 위해, 조성물은 특정 질병이 발병할 위험이 있는 환자 또는 이 질병의 진단이 이루어지지 않았을지라도, 질병의 하나 이상의 생리학적 증상을 보고하는 환자에 투여될 수 있다. 치료는 질병을 예방하는 것, 즉 질병의 유도 전에 보호 조성물의 투여에 의해 질병의 임상 증상이 발생하지 않도록 하는 것; 질병을 억제하는 것, 즉, 유도성 사례 이후에, 그러나 질병의 임상적 발생 또는 재발 전에 보호 조성물의 투여에 의해 질병의 임상 증상이 발생하지 않도록 하는 것; 질병을 억제하는 것, 즉 초기 발생 후 보호 조성물의 투여에 의해 임상 증상의 발생을 저지하는 것; 질병의 재발을 방지하고/거나, 질병을 호전시키는 것, 즉 초기 발생 후 보호 조성물의 투여에 의해 임상 증상의 퇴행을 유발하는 것을 포함한다.
본 명세서에 기재된 핵산 화합물은 TfR을 발현하는 세포에 상기 화합물, 및/또는 관련된 치료 또는 영상화 모이어티의 전달이 유익한 임의의 질병/장애의 치료 또는 예방에 사용된다. 핵산 화합물은 또한 상기 화합물 및/또는 관련 모이어티의 뇌로의 전달이 유익한 임의의 질병/장애의 치료 또는 예방에 사용된다.
본 발명의 치료 및 예방적 유용성은 TfR을 발현하는 세포 또는 뇌로의 화합물 모이어티 또는 화합물의 전달이 유익한 임의의 대상체의 치료로 확장된다는 것이 이해될 것이다.
일부 실시형태에서, 질병/장애는 시르투인 유전자/단백질 예를 들어, SIRT1의 활성화, C/EBP알파 유전자/단백질의 활성화 및/또는 HNF 유전자/단백질의 활성화가 유익한 것이다. 일부 실시형태에서, 본 명세서에 기재된 핵산 및 조성물은 암, 대사 장애 또는 신경계 장애를 치료 또는 예방하는데 사용된다.
예를 들어, 일부 실시형태에서, 본 명세서에 기재된 특정 방법은 암 (예를 들어, 간암 (예를 들어, 간세포 암종), 췌장암, 췌장 간 전이, 전립선암, 신장암, 전이성 암, 흑색종, 거세 저항성 전립선암, 유방암, 삼중 음성 유방암, 교아세포종, 난소암, 폐암, 편평 세포 암종 (예를 들어, 두부, 경부 또는 식도), 결장직장암, 백혈병, 급성 골수성 백혈병, 림프종, B 세포 림프종 또는 다발성 골수종)을 치료한다. 예를 들어, 본 명세서의 특정 방법은 암의 발생, 성장, 전이 또는 진행을 저하시키거나 감소시키거나 방지함으로써 암을 치료하거나; 암의 증상을 저하시킴으로써 암을 치료한다. 암 (예를 들어, 간암 (예를 들어, 간세포 암종), 췌장암, 췌장 간 전이, 전립선암, 신장암, 전이성 암, 흑색종, 거세 저항성 전립선 암, 유방암, 삼중 음성 유방암, 교아세포종, 난소암, 폐암, 편평 세포 암종 (예를 들어, 두부, 경부 또는 식도), 결장직장암, 백혈병, 급성 골수성 백혈병, 림프종, B 세포 림프종 또는 다발성 골수종)의 증상은 당업자에 의해 인식되거나 결정될 수 있다.
일부 실시형태에서, 암은 본 명세서에 기재된 바와 같은 암이다. 일부 실시형태에서, 암은 간암, 예를 들어 간세포 암종, 췌장암, 췌장 간 전이, 전이성 암 또는 뇌암이다.
일부 경우, 암은 시르투인 유전자/단백질 예를 들어, SIRT1의 활성화, C/EBP알파 유전자/단백질의 활성화, 및/또는 HNF 유전자/단백질의 활성화가 치료 또는 예방 효과를 갖는 장애이다.
일부 실시형태에서, 본 명세서에 기재된 치료 방법은 본 명세서에 기재된 바와 같은 핵산 화합물 또는 조성물의 치료 또는 예방 유효량을 이를 필요로 하는 대상체에 투여하는 단계를 포함하고, 핵산 화합물은 항암 치료 모이어티를 포함한다. 일부 실시형태에서, 치료 방법은 항암제의 유효량을 이를 필요로 하는 대상체에 투여하는 단계를 추가로 포함한다.
일부 경우에, 본 명세서에 기재된 치료 방법은 예를 들어 Beclinl의 활성화 또는 억제를 통해 자가 포식을 유도 또는 억제하는 단계를 포함하고, 예를 들어 문헌[Jin and White, Autophagy 2007; 3(1):28-31 ; Rosenfeldt and Ryan, Expert Rev Mol Med. 2009; 11 :e36; and Mah and Ryan, Cold Spring Harb Perspect Biol. 2012; 4(1): a008821]을 참조하며, 상기 모든 문헌은 그 전문이 본 명세서에 참조로 포함된다. 일부 경우에, 본 명세서에 기재된 치료 방법은 활성화된 B 세포의 핵 인자 카파-경쇄-인핸서 (NF-κB)의 활성을 유도 또는 억제하는 단계를 포함한다.
일부 실시형태에서, 질병/장애는 대사 장애이다. 예를 들어, 대사 장애는 대사 증후군, 제1형 진성 당뇨병, 제2형 진성 당뇨병, 이상지질혈증, 공복 혈당 장애, 내당능장애 (impaired glucose tolerance), 비만, 심혈관 질병, 인슐린 저항성, 고중성지방혈증, 건선, 건선성 관절염, 관상동맥 혈관 질병, 관상동맥 심장 질병, 관상동맥 질병, 뇌졸중 및 말초 동맥 질병, 죽상동맥경화증, 지방간 질병, 비 알코올성 지방간 질병 (NAFLD), 지방간염 및/또는 지질 영양 장애일 수 있다.
일부 경우, 대사 장애는 시르투인 유전자/단백질의 활성화, C/EBP알파 유전자/단백질의 활성화, 및/또는 HNF 유전자/단백질의 활성화가 치료 또는 예방 효과를 갖는 장애이다.
일부 경우에, 본 발명의 핵산 및 조성물은 체중 감소, 체중 획득 감소, 혈청 글루코스 감소, 글루코스 항상성 조절, 인슐린 저항성 감소, 백색 지방 조직의 감소, 콜레스테롤 감소, 저밀도 지단백질 (LDL) 감소, 고밀도 지단백질 (HDL) 증가, 고밀도 지단백질/저밀도 지단백질 (HDL/LDL) 비율 증가, 혈청 트리글리세리드 감소에 사용된다.
일부 경우에, 본 발명의 핵산 및 조성물은 췌장, 뇌, 심장, 백색 및 갈색 지방 조직, 근육 및/또는 간에서 TfR-발현 세포를 표적화하는데 사용된다.
일부 실시형태에서, 질병/장애는 신경계 장애이다. 예를 들어, 신경계 장애는 알츠하이머병 (Alzheimer's disease), 근위축성 측삭 경화증 (ALS), 운동 신경계 질병, 파킨슨병 (Parkinson's disease), 헌팅턴병 (Huntington's disease), 척추 및 구근 근육 위축 (SBMA)일 수 있다.
일부 경우, 신경계 장애는 시르투인 유전자/단백질의 활성화, C/EBP알파 유전자/단백질의 활성화, 및/또는 HNF 유전자/단백질의 활성화가 치료 또는 예방 효과를 갖는 장애이다.
일부 경우에, 본 발명의 핵산 및 조성물은 신경변성의 치료 또는 예방, 즉 감소 또는 보호에 사용된다.
조합 치료가 고려되는 경우, 본 명세서에 기재된 제제 (즉, 핵산 화합물)는 조합의 특정 성질에 의해 제한되는 것으로 의도되지 않는다. 예를 들어, 본 명세서에 기재된 제제는 단순 혼합물뿐만 아니라, 화학적 혼성체로서 조합 투여될 수 있다. 후자의 예는 제제가 표적화 담체 또는 활성 약제에 공유결합에 의해 연결된 것이다. 공유결합은 다음에 제한되는 것은 아니나, 시중에서 입수 가능한 교차연결제의 사용과 같은 다양한 방식으로 달성될 수 있다.
"유효량"은 언급된 목적 (예를 들어, 이를 투여하여 획득하고자 하는 효과의 달성, 질병의 치료, 효소 활성의 감소, 질병 또는 병태의 하나 이상의 증상의 감소, 세포 내 바이러스 복제의 감소)을 달성하기에 충분한 양이다. "유효량"의 예는 질병의 증상 또는 증상들의 치료, 예방 또는 감소에 기여하기에 충분한 양이며, "치료 유효량"으로도 지칭될 수 있다. 증상 또는 증상들 (및 이 어구의 문법적 동의어)의 "감소"는 증상 (들)의 중증도 또는 횟수의 감소 또는 증상 (들)의 제거를 의미한다. 약물의 "예방 유효량"은 대상체에 투여되는 경우, 의도된 예방 효과, 예를 들어, 손상, 질병, 병리 또는 병태의 발병 (또는 재발)의 예방 또는 지연 또는 손상, 질병, 병리 또는 병태 또는 이들의 증상의 발병 (또는 재발)의 가능성의 감소를 유발하는 약물의 양이다. 완전한 예방 효과가 반드시 1회 투여량의 투여에 의해 발생하는 것은 아니며, 일련의 투여량의 투여 후에만 발생할 수 있다. 따라서, 예방 유효량은 1회 이상의 투여로 투여될 수 있다. 본 명세서에 사용되는 바와 같이, "활성 감소량"은 길항제의 부재에 비해 효소 또는 단백질의 활성을 감소시키는데 필요한 길항제의 양을 지칭한다. 본 명세서에 사용되는 바와 같이, "기능 파괴량"은 길항제의 부재에 비해 효소 또는 단백질의 기능을 파괴하는데 필요한 길항제의 양을 지칭한다. 소정의 부류의 의약품의 적절한 투여량에 대한 지침은 문헌에서 찾을 수 있다. 예를 들어, 소정의 파라미터에 대해 유효량은 적어도 5%, 10%, 15%, 20%, 25%, 40%, 50%, 60%, 75%, 80%, 90%, 또는 적어도 100%의 증가 또는 감소를 나타낸다. 효능은 또한 "배수" 증가 또는 감소로 표현될 수 있다. 예를 들어, 치료 유효량은 대조군에 대해 적어도 1.2배, 1.5배, 2배, 5배 이상의 효과를 유발할 수 있다. 정확한 양은 치료의 목적에 따라 다를 것이고, 공지된 기법을 사용하여 당업자에 의해 확인될 수 있을 것이다 (예를 들어, 문헌[Lieberman, Pharmaceutical Dosage Forms (vols. 1-3, 1992); Lloyd, The Art, Science and Technology of Pharmaceutical Compounding (1999); Pickar, Dosage Calculations (1999); and Remington: The Science and Practice of Pharmacy, 20th Edition, 2003, Gennaro, Ed., Lippincott, Williams & Wilkins] 참조).
"환자", "대상체" 또는 "이를 필요로 하는 대상체"는 본 명세서에 제공된 방법을 사용하여 치료될 수 있는 질병 또는 병태를 앓고 있거나 앓기 쉬운 살아있는 유기체를 지칭한다. 이 용어는 반드시 대상체가 특정 질병으로 진단된 경우만을 나타내는 것은 아니지만, 일반적으로 의료 감독하에 있는 개체를 지칭한다. 비 제한적인 예에는 인간, 다른 포유류, 소과동물, 랫트, 마우스, 개, 원숭이, 염소, 양, 소, 사슴 및 다른 비 포유류 동물이 포함된다. 일부 실시형태에서, 환자는 인간이다.
본 명세서에 사용되는 바와 같이, 용어 "투여"는 대상체에의 경구 투여, 좌약, 국소 접촉, 정맥내, 복강내, 근육내, 병변내, 척수내, 비강내 또는 피하 투여, 또는 서방형 장치, 예를 들어 미니 삼투 펌프의 이식으로서의 투여를 의미한다. 투여는 비경구 및 경점막 (예를 들어, 구강, 설하, 구개, 잇몸, 비강, 질, 직장 또는 경피)을 포함한 임의의 경로에 의해 이루어진다. 비경구 투여는 예를 들어 정맥내, 근육내, 동맥내, 피내, 피하, 복강내, 심실내 및 두개내를 포함한다. 다른 전달 방식은 다음에 제한되는 것은 아니나, 리포좀 제형, 정맥내 주입, 경피 패치 등의 사용을 포함한다. "공동 투여"는 본 명세서에 기재된 조성물이 하나 이상의 추가 요법, 예를 들어 화학요법, 호르몬 요법, 방사선요법 또는 면역요법과 같은 암 요법의 투여와 동시에, 그 직전에 또는 그 직후에 투여됨을 의미한다. 본 발명의 화합물은 환자에 단독 투여되거나 공동 투여될 수 있다. 공동 투여는 화합물을 개별적으로 또는 조합하여 (하나 초과의 화합물) 동시 또는 순차적으로 투여하는 것을 포함한다. 따라서, 제조물은 또한 필요시 (예를 들어, 대사 분해를 감소시키기 위해) 다른 활성 물질과 조합될 수 있다. 본 발명의 조성물은 면봉, 용액, 현탁액, 유제, 겔, 크림, 연고, 페이스트, 젤리, 페인트, 분말 및 에어로졸로 제형화되어, 국소 경로에 의해 경피로 전달될 수 있다.
본 명세서에 제공된 교시를 이용하여, 실질적인 독성을 유발하지는 않지만, 특정 환자에 의해 나타난 임상 증상을 치료하는데 유효한 효과적인 예방 또는 치료적 치료 용법이 계획될 수 있다. 이 계획에는 화합물 효능, 상대 생체이용률, 환자 체중, 부작용의 존재 및 중증도, 바람직한 투여 방식 및 선택된 제제의 독성 프로파일과 같은 인자를 고려함으로써 활성 화합물의 신중한 선택이 포함되어야 한다.
세포 검출 방법
본 명세서에 제공되는 핵산 조성물, 예를 들어, 리보/데옥시리보핵산 화합물은 또한 TfR를 발현하는 세포 내로의 화합물 및 화합물 모이어티의 전달을 위해 사용될 수 있다. 상기에 기재된 바와 같이, 전달되는 화합물 및 화합물 모이어티는 세포 검출에 유용한 영상화제일 수 있다. 따라서, 일 양상에서, 세포 검출 방법이 제공된다. 상기 방법은 (i) 세포를 그의 실시형태를 포함하여 본 명세서에서 제공되는 바와 같은 핵산 화합물, 또는 조성물과 접촉시키는 단계로서, 핵산 화합물은 영상화 모이어티를 추가로 포함하는 단계, (ii) 핵산 화합물, 또는 조성물이 세포 상의 트랜스페린 수용체에 결합하여, 세포 내로 통과되도록 하는 단계, (iii) 영상화 모이어티를 검출함으로써, 세포를 검출하는 단계를 포함한다.
다른 양상에서, 세포 검출 방법이 제공된다. 상기 방법은 (i) 세포를 그의 실시형태를 포함하여 본 명세서에서 제공되는 바와 같은 영상화제 및 핵산 화합물, 또는 조성물과 접촉시키는 단계, (ii) 핵산 화합물, 또는 조성물이 세포 상의 트랜스페린 수용체에 결합하여, 영상화제가 세포 내로 통과되도록 하는 단계, (iii) 영상화제를 검출함으로써, 세포를 검출하는 단계를 포함한다.
일부 경우, 세포는 악성 세포이다. 일부 경우, 세포는 유방 암 세포이다. 일부 경우, 세포는 전립선 암 세포이다. 일부 경우, 세포는 간 암 세포이다. 일부 경우, 세포는 췌장 암 세포이다. 일부 경우, 세포는 뇌 암 세포이다. 일부 경우, 세포는 비악성 세포이다. 일부 경우, 세포는 뇌 세포이다. 일부 경우, 세포는 유기체의 일부를 형성한다. 일부 경우, 유기체는 포유류이다. 일부 경우, 세포는 세포 배양물의 일부를 형성한다.
상기 방법은 시험관내, 생체외 또는 생체내에서 수행될 수 있다. 일부 경우에, 상기 방법은 화합물 모이어티 또는 화합물을 혈뇌 장벽을 통해 뇌로 전달하는 단계를 포함한다.
***
특정 형태로 또는 개시된 기능을 수행하기 위한 수단, 또는 개시된 결과를 획득하기 위한 방법 또는 과정과 관련하여 표현된 전술한 설명, 하기의 청구범위 또는 첨부 도면에 개시된 특징은 적절한 경우, 개별적으로 또는 이러한 특징들의 임의의 조합으로, 본 발명을 다양한 형태로 실현하기 위해 이용될 수 있다.
본 발명은 상기에 기재된 예시적인 실시형태와 관련하여 기재되었지만, 본 개시내용이 제공되는 경우 당업자에게는 많은 균등한 변형 및 변경이 명백할 것이다. 따라서, 상기에 제시된 본 발명의 예시적인 실시형태는 예시적인 것으로서, 제한되지 않는 것으로 간주된다. 기재된 실시형태에 대한 다양한 변화가 본 발명의 사상 및 범위를 벗어나지 않고 이루어질 수 있다.
의심의 여지를 없애기 위해, 본 명세서에 제공된 임의의 이론적 설명은 독자의 이해를 향상시키기 위한 목적으로 제공된다. 본 발명자들은 이러한 이론적 설명에 구속되기를 원하지 않는다.
다음의 청구범위를 포함한 본 명세서 전체에서, 문맥상 달리 요구되지 않는 한, 단어 "포함하다" 및 "포괄하다" 및 "~들을 포함하다", "포함하는" 및 "포괄하는"과 같은 변용예는 언급된 정수 또는 단계 또는 정수 또는 단계의 그룹을 포함하지만, 임의의 다른 정수 또는 단계 또는 정수 또는 단계의 그룹을 배제하는 것은 아님을 함축하는 것으로 이해될 것이다.
본 명세서 및 첨부된 청구범위에 사용된 바와 같이, 단수 형태 ("a", "an" 및 "the")는 문맥상 명백하게 다르게 지시되지 않는 한 복수의 지시대상을 포함한다는 점에 유의해야 한다. 범위는 본 명세서에서 "약" 하나의 특정 값 및/또는 "약" 다른 특정 값으로 표현될 수 있다. 이러한 범위가 표현될 때, 다른 실시형태는 하나의 특정 값 및/또는 다른 특정 값을 포함한다. 유사하게, 선행어 "약"의 사용에 의해 값이 근사치로 표현되는 경우, 특정 값은 다른 실시형태를 형성한다는 것을 이해할 것이다. 수치와 관련하여 용어 "약"은 선택적인 것으로, 예를 들어 +/- 10%를 의미한다.
지금부터 본 발명의 양상 및 실시형태가 첨부 도면을 참조하여 논의될 것이다. 추가의 양상 및 실시형태가 당업자에게 명백할 것이다.
본 발명의 원리를 설명하는 실시형태 및 실험이 지금부터 첨부 도면을 참조하여 논의될 것이다.
도 1. 앱타머 TR14 S1-3 (TfR; 서열번호 1)의 예측된 Mfold 구조.
도 2. 트랜스페린 수용체에 결합하는 앱타머 TR14 S1-3의 동역학.
도 3. 인간 간암 세포 (HepG2), 인간 췌장암 세포 (PANIC-1) 및 마우스 췌장암 세포 (LTPA)로의 앱타머 TR14 S1-3의 내재화.
도 4a 및 도 4b. TR14 S1-3 (TfR)이 혈뇌 장벽을 통과하는 능력을 나타내는 랫트 뇌로부터의 신경 조직의 면역조직화학적 염색. SIRT1 발현을 SIRT1 단일클론 항체를 사용하여 검출하였다. (도 4a) 대조군 랫트로부터의 신경 조직은 청색 음성 염색으로 나타난다. (도 4b) TfR-SIRT1 saRNA를 주사한 랫트로부터의 신경 조직은 SIRT1에 갈색 핵 염색으로 나타난다.
도 5a 및 도 5b. 수컷 Wistar 랫트에서 디에틸니트로사민 (DEN)-유도 간세포 암종 (HCC) 모델에서 PBS 및 TfR 단독 대조군과 비교하여 TfR-CEBPA 및 TfR-HNF 처리의 효과를 보여주는 그래프. TfR-CEBPA 및 TfR-HNF saRNA 처리는 종양 부피를 감소시켰으며 (도 5a), 혈액에서 빌리루빈 수치를 감소시킨다 (도 5b).
도 6. TfR-CEBPA saRNA의 정맥내 (IV) 또는 피하 (SC) 투여 후 수컷 F344 랫트에서 간세포 암종 모델에서의 종양 크기 변화 백분율을 보여주는 그래프.
도 7a 및 도 7b. 앱타머 대조군과 비교하여 마우스에서 전이성 췌장암 모델에서 TfR-CEBPA 및 P19-CEBPA 처리의 효과를 보여주는 그래프. (도 7a) TfR-CEBPA 또는 P19-CEBPA로 처리된 마우스는 감소된 종양 성장을 나타낸다 (감소된 광자 증가에 의해 결정됨). (도 7b) TfR-CEBPA 또는 P19-CEBPA로 처리된 마우스는 감소된 종양 부피를 나타낸다.
도 8a 내지 도 8f. 고지방식이가 제공된 F344 랫트에서 대사성 질병과 관련된 증상을 개선하는 TfR-SIRT 치료의 능력을 보여주는 그래프. (도 8a) TfR-SIRT로 처리된 랫트는 체중이 증가하지 않았다. (도 8b) TfR-SIRT로 처리된 랫트는 감소된 백색 지방 조직을 나타내었다. (도 8c) TfR-SIRT로 처리된 랫트는 감소된 총 콜레스테롤을 나타냈다. (도 8d) TfR-SIRT로 처리된 랫트는 감소된 저밀도 지단백질 (LDL) 콜레스테롤 수준을 나타냈다. (도 8e) TfR-SIRT로 처리된 랫트는 증가된 고밀도 지단백질 (HDL)/LDL 비를 나타냈다. (도 8f) TfR-SIRT로 처리된 랫트는 감소된 공복 혈당 수준을 나타냈다.
도 1. 앱타머 TR14 S1-3 (TfR; 서열번호 1)의 예측된 Mfold 구조.
도 2. 트랜스페린 수용체에 결합하는 앱타머 TR14 S1-3의 동역학.
도 3. 인간 간암 세포 (HepG2), 인간 췌장암 세포 (PANIC-1) 및 마우스 췌장암 세포 (LTPA)로의 앱타머 TR14 S1-3의 내재화.
도 4a 및 도 4b. TR14 S1-3 (TfR)이 혈뇌 장벽을 통과하는 능력을 나타내는 랫트 뇌로부터의 신경 조직의 면역조직화학적 염색. SIRT1 발현을 SIRT1 단일클론 항체를 사용하여 검출하였다. (도 4a) 대조군 랫트로부터의 신경 조직은 청색 음성 염색으로 나타난다. (도 4b) TfR-SIRT1 saRNA를 주사한 랫트로부터의 신경 조직은 SIRT1에 갈색 핵 염색으로 나타난다.
도 5a 및 도 5b. 수컷 Wistar 랫트에서 디에틸니트로사민 (DEN)-유도 간세포 암종 (HCC) 모델에서 PBS 및 TfR 단독 대조군과 비교하여 TfR-CEBPA 및 TfR-HNF 처리의 효과를 보여주는 그래프. TfR-CEBPA 및 TfR-HNF saRNA 처리는 종양 부피를 감소시켰으며 (도 5a), 혈액에서 빌리루빈 수치를 감소시킨다 (도 5b).
도 6. TfR-CEBPA saRNA의 정맥내 (IV) 또는 피하 (SC) 투여 후 수컷 F344 랫트에서 간세포 암종 모델에서의 종양 크기 변화 백분율을 보여주는 그래프.
도 7a 및 도 7b. 앱타머 대조군과 비교하여 마우스에서 전이성 췌장암 모델에서 TfR-CEBPA 및 P19-CEBPA 처리의 효과를 보여주는 그래프. (도 7a) TfR-CEBPA 또는 P19-CEBPA로 처리된 마우스는 감소된 종양 성장을 나타낸다 (감소된 광자 증가에 의해 결정됨). (도 7b) TfR-CEBPA 또는 P19-CEBPA로 처리된 마우스는 감소된 종양 부피를 나타낸다.
도 8a 내지 도 8f. 고지방식이가 제공된 F344 랫트에서 대사성 질병과 관련된 증상을 개선하는 TfR-SIRT 치료의 능력을 보여주는 그래프. (도 8a) TfR-SIRT로 처리된 랫트는 체중이 증가하지 않았다. (도 8b) TfR-SIRT로 처리된 랫트는 감소된 백색 지방 조직을 나타내었다. (도 8c) TfR-SIRT로 처리된 랫트는 감소된 총 콜레스테롤을 나타냈다. (도 8d) TfR-SIRT로 처리된 랫트는 감소된 저밀도 지단백질 (LDL) 콜레스테롤 수준을 나타냈다. (도 8e) TfR-SIRT로 처리된 랫트는 증가된 고밀도 지단백질 (HDL)/LDL 비를 나타냈다. (도 8f) TfR-SIRT로 처리된 랫트는 감소된 공복 혈당 수준을 나타냈다.
실시형태
실시형태는 다음에 제한되는 것은 아니나, 하기의 실시형태 P1 내지 P32를 포함한다:
실시형태 P1. 서열번호 1에 대해 적어도 90% 서열 동일성을 갖는 RNA 서열을 포함하거나, 이로 이루어진 리보핵산 화합물로서, 상기 RNA 서열은 길이가 29개 이하의 뉴클레오타이드이고, RNA 서열은 트랜스페린 수용체 (TfR)에 결합할 수 있는 리보핵산 화합물.
실시형태 P2. 실시형태 P1에 있어서, 상기 RNA 서열은 길이가 22개 이하의 뉴클레오타이드인, 리보핵산 화합물.
실시형태 P3. 실시형태 P1 또는 실시형태 P2에 있어서, 상기 RNA 서열은 길이가 22개의 뉴클레오타이드인, 리보핵산 화합물.
실시형태 P4. 실시형태 P1 내지 실시형태 P3 중 어느 한 실시형태에 있어서, RNA 서열은 서열번호 1에 대해 100% 서열 동일성을 갖는, 리보핵산 화합물.
실시형태 P5. 서열번호 5에 대해 적어도 90% 서열 동일성을 갖는 RNA 서열을 포함하거나, 이로 이루어진 리보핵산 화합물로서, 상기 RNA 서열은 길이가 29개 이하의 뉴클레오타이드이고, RNA 서열은 트랜스페린 수용체 (TfR)에 결합할 수 있는 리보핵산 화합물.
실시형태 P6. 실시형태 P5에 있어서, 상기 RNA 서열은 길이가 16개의 뉴클레오타이드인, 리보핵산 화합물.
실시형태 P7. 실시형태 P5 또는 실시형태 P6에 있어서, RNA 서열은 서열번호 5에 대해 100% 서열 동일성을 갖는, 리보핵산 화합물.
실시형태 P8. 실시형태 P1 내지 실시형태 P7 중 어느 한 실시형태에 있어서, RNA 서열은 세포 표면 상의 TfR에 결합할 수 있는, 리보핵산 화합물.
실시형태 P9. 실시형태 P1 내지 실시형태 P8 중 어느 한 실시형태에 있어서, 세포 내에 내재화될 수 있는, 리보핵산 화합물.
실시형태 P10. 실시형태 P1 내지 실시형태 P9 중 어느 한 실시형태에 있어서, 혈뇌 장벽을 통과할 수 있는, 리보핵산 화합물.
실시형태 P11. 실시형태 P1 내지 실시형태 P10 중 어느 한 실시형태에 있어서, 상기 RNA 서열에 부착된 화합물 모이어티를 추가로 포함하는, 리보핵산 화합물.
실시형태 P12. 실시형태 P11에 있어서, 화합물 모이어티는 치료 모이어티 또는 영상화 모이어티인, 리보핵산 화합물.
실시형태 P13. 실시형태 P11 또는 실시형태 P12에 있어서, 상기 화합물 모이어티는 상기 RNA 서열에 공유결합에 의해 부착된, 리보핵산 화합물.
실시형태 P14. 실시형태 P12 또는 실시형태 P13에 있어서, 상기 치료 모이어티는 핵산 모이어티, 펩타이드 모이어티 또는 소분자 약물 모이어티인, 리보핵산 화합물.
실시형태 P15. 실시형태 P14에 있어서, 상기 치료 모이어티는 활성화 핵산 모이어티 또는 안티센스 핵산 모이어티인, 리보핵산 화합물.
실시형태 P16. 실시형태 P14 또는 실시형태 P15에 있어서, 상기 치료 모이어티는 miRNA, mRNA, saRNA 또는 siRNA 모이어티인, 리보핵산 화합물.
실시형태 P17. 실시형태 P12 내지 실시형태 P16 중 어느 한 실시형태에 있어서, 상기 치료 모이어티는 항암 치료 모이어티인, 리보핵산 화합물.
실시형태 P18. 실시형태 P12 내지 실시형태 P17 중 어느 한 실시형태에 있어서, 상기 치료 모이어티는 C/EBP알파 saRNA 모이어티, SIRT1 saRNA 모이어티, 또는 HNF saRNA 모이어티인, 리보핵산 화합물.
실시형태 P19. 실시형태 P11 내지 실시형태 P13 중 어느 한 실시형태에 있어서, 영상화 모이어티는 생물발광 분자, 광활성 분자, 금속 또는 나노입자인, 리보핵산 화합물.
실시형태 P20. 실시형태 P1 내지 실시형태 P19 중 어느 한 실시형태에 따른 리보핵산 화합물을 포함하는 약제학적 조성물로서, 선택적으로 약제학적으로 허용 가능한 부형제를 포함하는 약제학적 조성물.
실시형태 P21. 실시형태 P20에 있어서, 치료제, 선택적으로 항암제를 추가로 포함하는, 약제학적 조성물.
실시형태 P22. 화합물 모이어티를 세포 내에 전달하는 방법으로서, 상기 방법은
(i) 세포를 실시형태 P11 내지 실시형태 P19 중 어느 한 실시형태에 따른 리보핵산 화합물 또는 실시형태 P20 또는 실시형태 P21에 따른 조성물과 접촉시키는 단계; 및
(ii) 상기 리보핵산 화합물이 상기 세포 상의 트랜스페린 수용체에 결합하여 상기 세포 내로 통과되도록 함으로써, 상기 화합물 모이어티를 상기 세포 내에 전달하는 단계
를 포함하는 방법.
실시형태 P23. 화합물을 세포 내에 전달하는 방법으로서, 상기 방법은
(i) 세포를 화합물 및 실시형태 P1 내지 실시형태 P10 중 어느 한 실시형태에 따른 리보핵산 화합물과 접촉시키는 단계; 및
(ii) 상기 리보핵산 화합물이 상기 세포 상의 트랜스페린 수용체에 결합하여 상기 세포 내로 통과되도록 함으로써, 상기 화합물 모이어티를 상기 세포 내에 전달하는 단계
를 포함하는 방법.
실시형태 P24. 실시형태 P23에 있어서, 상기 화합물은 치료제 또는 영상화제인, 방법.
실시형태 P25. 의학적 치료 또는 예방 방법에 사용하기 위한, 실시형태 P1 내지 실시형태 P19 중 어느 한 실시형태에 따른 리보핵산 화합물, 또는 실시형태 P20 또는 실시형태 P21에 따른 조성물.
실시형태 P26. 질병 또는 장애의 치료 또는 예방을 위한 약제의 제조에서의, 실시형태 P1 내지 실시형태 P19 중 어느 한 실시형태에 따른 리보핵산 화합물, 또는 실시형태 P20 또는 실시형태 P21에 따른 조성물의 용도.
실시형태 P27. 질병 또는 장애의 치료 또는 예방 방법으로서, 상기 방법은 실시형태 P1 내지 실시형태 P19 중 어느 한 실시형태에 따른 리보핵산 화합물, 또는 실시형태 P20 또는 실시형태 P21에 따른 조성물의 유효량을 이를 필요로 하는 대상체에 투여하는 단계를 포함하는 방법.
실시형태 P28. 질병 또는 장애는 암인 사용하기 위한 실시형태 P25에 따라 사용하기 위한 리보핵산 화합물 또는 조성물, 실시형태 P26에 따른 리보핵산 화합물 또는 조성물의 용도, 또는 실시형태 P27에 따른 방법.
실시형태 P29. P28에 있어서, 상기 방법은 항암제를 투여하는 단계를 추가로 포함하는, 사용하기 위한 리보핵산 화합물 또는 조성물, 리보핵산 화합물 또는 조성물의 용도, 또는 방법.
실시형태 P30. 질병 또는 장애는 대사 장애 또는 신경계 장애인 실시형태 P25에 따라 사용하기 위한 리보핵산 화합물 또는 조성물, 실시형태 P26에 따른 리보핵산 화합물 또는 조성물의 용도, 또는 실시형태 P27에 따른 방법.
실시형태 P31. 세포의 검출 방법으로서, 상기 방법은
(i) 세포를 실시형태 P1 내지 실시형태 P13, 또는 실시형태 P19 중 어느 한 실시형태에 따른 리보핵산 화합물, 또는 실시형태 P20에 따른 조성물과 접촉시키는 단계로서, 리보핵산 화합물은 영상화 모이어티를 포함하는 단계;
(ii) 상기 리보핵산 화합물이 상기 세포 상의 트랜스페린 수용체에 결합하여 상기 세포 내로 통과되도록 하는 단계; 및
(iii) 상기 영상화 모이어티를 검출함으로써, 상기 세포를 검출하는 단계
를 포함하는 방법.
실시형태 P32. 세포의 검출 방법으로서, 상기 방법은
(i) 세포를 실시형태 P1 내지 실시형태 P10 중 어느 한 실시형태에 따른 리보핵산 화합물 및 영상화제와 접촉시키는 단계;
(ii) 상기 리보핵산 화합물이 상기 세포 상의 트랜스페린 수용체에 결합하여 상기 영상화제가 상기 세포 내로 통과되도록 하는 단계; 및
(iii) 상기 영상화제를 검출함으로써, 상기 세포를 검출하는 단계
를 포함하는 방법.
실시예
실시예 1
TfR 앱타머의 선택 및 특성화
TfR의 세포외 도메인에 결합할 수 있는 앱타머는 기본적으로 문헌[Tuerk and Gold (Tuerk, C, Methods Mol Biol., 67, 219-230 (1997)]에 의해 기재되고, WO 2006/061386의 실시예에 기재된 바와 같이 단백질 SELEX (급격한 다량화에 의한 리간드의 전신 발생)에 의해 확인되었다.
2'F RNA의 라이브러리를 사용하여 뉴클레아제 저항성을 증가시키고 앱타머 접힘을 향상시켰다. 온전한 세포에 결합하는 2'F RNA 앱타머를 단리하기 위해, 규정된 서열에 측접된 40개의 뉴클레오타이드 길이의 랜덤 서열을 포함하는 대략 440개의 상이한 2'F RNA 분자의 라이브러리를 SELEX에 의해 스크리닝하였다. 12 사이클의 선택 후, 고도로 다량화된 앱타머 풀을 클로닝하였다.
WO 2006/061386에 기재된 바와 같이 87개의 뉴클레오타이드 TfR RNA 앱타머 (TR14; 서열번호 2) 및 43개의 뉴클레오타이드 TfR RNA 앱타머 (TR14S2; 서열번호 3)를 확인하고 특성화하였다. TfR에 대한 TR14 및 TR14S2 앱타머의 결합 친화도를 표면 플라즈몬 공명 (SPR) 기술을 사용하여 측정하였다. 결과를 표 1에 복사하였다. TR14 및 TR14S2는 인간 간암 세포 (HepG2; ATCC® HB-8065™) 내로 내재화될 수 있는 것으로 나타났다.
실시예 2
22개의 뉴클레오타이드 TfR 앱타머
TR14 앱타머의 더 작은 절단된 버전을 합성하였다 (서열번호 1). 이 22개의 뉴클레오타이드 TfR 앱타머를 "TR14 S1-3"으로 지정하였다. TR14 S1-3의 구조를 Mfold 소프트웨어 (문헌[Zuker M, Nucleic Acids Res. 2003 Jul 1 ;31 (13):3406-15])를 사용하여 예측하였으며, http://unafold.rna. albany.edu/?q=mfold에 제공되어 있다. TR14 S1-3의 Mfold 예측 구조는 도 1에 제시되어 있다.
TR14 S1-3의 동역학을 표면 플라즈몬 공명 (SPR) 기술에 의해 분석하였다. Biacore T100 (GE Healthcare, Uppsala, Sweden)을 사용하여 표지 부재하의 앱타머-트랜스페린 수용체 상호작용을 실시간으로 모니터링하였다. 결합 완충액 중 25 μg/mL (30 mM Tris-HCI, pH 7.5, 150 mM NaCI, 5 mM MgCl2)의 농도로 10 uL/분으로 주사하여, 비오티닐화된 앱타머를 스트렙타비딘 코팅된 Biocore 칩 (SensorChip SA, BR-1003-98, General Electric Company)에 결합시켰다. 65℃로 가열한 다음, 37℃로 냉각시킨 후, 고정시켜, RNA가 다시 접히도록 하였다. 결합 동역학을 측정하기 위해, 5가지 농도의 정제된 트랜스페린 수용체 단백질을 분당 10 uL의 유속으로 주사하였다. 결합 후, 20초 동안 분당 15 μL의 유속으로 50 mM NaOH를 주사함으로써 표면을 재생시켰다. 대조군 표면으로부터의 데이터를 제외하였다. 분석에 BIAevaluation 소프트웨어 (GE Healthcare)를 사용하였다. 동역학 파라미터를 계산하기 위해 결합 데이터를 질량 전달 모델에 의한 1:1 결합으로 조정하였다.
결과는 도 2에 도시되어 있다. 22개의 뉴클레오타이드 TR14 S1-3 앱타머는 TR14와 유사한 범위의 Ka, Kd 및 KD 값에서 트랜스페린 수용체 단백질에 결합한다.
실시예 3
TR14 S1-3과 TfR의 결합 및 세포 내로의 내재화
22개의 뉴클레오타이드 앱타머 TR14 S1-3이 트랜스페린 수용체에 결합하고, 세포 내에 내재화되는 능력을 평가하였다.
3개의 암 세포주를 시험하였다:
인간 간 암 세포 (HepG2, ATCC® HB-8065™)
인간 췌장 암 세포 (PANC-1, ATCC® CRL-1469)
마우스 췌장 암 세포 (LTPA, ATCC® CRL-2389).
1 x 105 세포를 35 mm 유리 바닥 디쉬 (MatTek, Ashland, MA)에 시딩하고, 24시간 동안 적절한 배지에서 성장시켰다. 앱타머 RNA를 Cy3 Silencer siRNA 표지 키트 (Thermo Fisher Scientific, Waltham, MA)를 사용하여 Cy3 형광 염료로 표지하였다. 결합 완충액 (30 mM Tris-HCI, pH 7.5, 150 mM NaCI, 5 mM MgCl2) 중 Cy3-표지된 앱타머를 200 nM에서 세포에 첨가하고, 2시간 동안 인큐베이션하였다. 영상화하기 전에, 세포를 DPBS로 2회 세척하였다. 생존 세포 공초점 영상화를 C-Apo 40x/1.2NA 수침 대물 렌즈 및 AIM 4.2 소프트웨어 (Carl Zeiss, Jena, Germany)를 사용하여 Zeiss LSM 510 Meta 역상 2 광자 공초점 현미경 시스템으로 수행하였다.
결과는 도 3에 도시되어 있다. 3개의 모든 암 세포주 (인간 HepG2, 인간 PANC-1 및 쥣과동물 LTPA)는 TfR-결합된 TR14 S1-3 앱타머를 내재화하였으며, 이는 TR14 S1-3이 종류 간 교차 반응성임을 나타낸다.
TR14 S1-3 앱타머는 혈뇌 장벽을 통과할 수 있다.
생체내에서 22개의 뉴클레오타이드 앱타머 TR14 S1-3이 혈뇌 장벽을 통과하는 능력에 대해 평가하였다.
TR14 S1-3 (TfR; 서열번호 1), 5개의 C3 (포스포라미다이트) 스페이서 및 SIRT1 saRNA를 포함하는 리보핵산을 합성하였다. SIRT1 saRNA의 센스 및 안티센스 가닥은 각각 서열번호 7 및 서열번호 8에 제시되어 있다. 센스 및 안티센스 서열은 각각 3' 말단에 2개의 뉴클레오타이드 (UU) 오버행를 포함한다.
랫트를 꼬리 주사를 통해 TfR-SIRT1 saRNA 또는 대조군으로 처리하였다. 순환 TfR이 SIRT1 saRNA 함유물을 뇌에 전달할 수 있는지를 검출하기 위해, 두 그룹 모두로부터의 신경 조직을 단리하고, SIRT1 단일클론 항체와 접촉시켰다.
결과는 도 4a 및 도 4b에 도시되어 있다. 대조군 랫트로부터의 신경 조직 (4a)은 청색 음성 염색을 나타내고, TfR-SIRT1 saRNA 리보핵산 화합물을 주사한 랫트로부터의 신경 조직 (4b)은 SIRT1에 갈색 핵 염색을 나타낸다.
이는 앱타머가 혈뇌 장벽을 통과하여, 신경 조직에서 핵으로 진입했음을 시사한다. 이는 TR14 S1-3이 뇌로 치료 및 영상화 함유물을 전달하기 위한 메커니즘을 제공할 수 있음을 나타낸다.
실시예 4
TR14 S1-3 앱타머는 생체내에서 함유물을 암 세포에 전달한다.
생체내에서 치료 함유물을 전달하는 TR14 S1-3 앱타머의 능력을 평가하였다.
TR14 S1-3 (TfR; 서열번호 1), 5개의 C3 (포스포라미다이트) 스페이서 및 CEBPA 또는 HNF saRNA를 포함하는 리보핵산을 합성하였다. CEBPA saRNA의 센스 및 안티센스 서열은 각각 서열번호 9 및 서열번호 10에 제시되어 있다. 센스 및 안티센스 서열은 각각 3' 말단에 2개의 뉴클레오타이드 (UU) 오버행를 포함한다.
랫트에서의 디에틸니트로사민 (DEN)-유도 간세포 암종 (HCC) 모델
생후 7주령의 수컷 Wistar 랫트 (약 200 g)를 BioLASCO Taiwan Co., Ltd.로부터 입수하였다. 랫트를 표준 조건에 수용하고, 모든 실험은 국립 대만 대학교의 기관 동물 관리 및 사용위원회가 준비한 "실험실 동물의 관리 및 사용 지침"에 따라 수행하였다. 모든 랫트에 9주 동안 음용수의 유일한 공급원으로서 100 ppm (vol/vol) DEN 용액 (Sigma, St Louis, MO)을 9주 동안 매일 제공한 후, 3주 동안 규칙적으로 물을 제공하였다. 동물의 평균 체중을 5마리의 랫트의 그룹당 1주에 1회 측정하고, 음용수 중 DEN의 농도를 첫째주 체중에 대비한 매주 체중에 비례하여 조정하였다. 예를 들어, DEN 투여 1주 및 5주째에서의 평균 체중 값이 각각 200 및 300 g (1.5배)인 경우, 음용수 중 DEN 농도를 각각 100 및 150 ppm으로 설정하였다.
생체내 처리를 위해, 9주 동안 DEN 용액에 노출된 동물을 사용하였다. 랫트를 PBS 그룹, TfR 그룹, TfR-CEBPA 그룹 및 TfR-HNF 그룹의 4개의 그룹으로 무작위로 분류하였다 (각 그룹당 n > 5). PBS, TfR, TfR-CEBPA 및 TfR-HNF를 꼬리 정맥을 통해 3주 동안 3회/주 주사하였다. 마지막 주사 후 2일째에 CO2에 의해 랫트를 희생시키고, 간을 제거한 후, 다음 분석을 위해 보관하였다. 혈액 샘플을 심장으로부터 수집하고, 3000 rpm에서 15분 동안 실온에서 원심분리하고, 분석시까지 혈청을 -80℃에 보존하였다.
희생 후, 모든 간엽을 즉시 제거하고, 중량을 측정하고, 간 표면 및 5 mm 슬라이스 절편에서 거시적으로 관찰되는 모든 결절의 직경을 측정하였다. 직경이 3 mm 초과인 모든 종양 결절의 총 부피와 관련하여 종양 부하량을 결정하였다.
혈액 분석기 Sysmex HST-N402XE (Sysmex, Japan)에 의해 완전 혈구 수 (CBC) 시험을 수행하였다. 빌리루빈의 혈청 수준 (더 높은 수준은 간 기능 장애를 나타냄)을 VITROS 5, 1 FS 화학 시스템 (Ortho Clinical Diagnostics, USA)으로 측정하였다.
결과는 도 5a 및 도 5b에 도시되어 있다. TfR-CEBPA 또는 TfR-HNF에 의한 처리가 제공된 랫트는 PBS 또는 TfR이 단독 제공된 랫트와 비교하여, 종양 부하량 (종양 부피)이 유의하게 감소한 것으로 나타났다 (도 5a). TfR-CEBPA 또는 TfR-HNF로 처리된 랫트는 또한 혈중 빌리루빈 수치가 유의하게 낮은 것으로 나타났으며, 이는 대조군 처리와 비교하여 간 기능이 개선되었음을 나타낸다 (도 5b).
랫트에서의 간 상피 세포 종양 모델
7주령의 수컷 F344 랫트 (약 200 g)를 BioLASCO Taiwan Co., Ltd로부터 입수하였다. 랫트를 표준 조건에 수용하고, 모든 실험은 국립 대만 대학교의 기관 동물 관리 및 사용위원회가 준비한 "실험실 동물의 관리 및 사용 지침"에 따라 수행하였다.
F344 랫트를 2% 이소플루란 혼합 산소로 마취시켰다. 0.05 ml PBS 중의 약 1x 106 GP7TB 랫트 간 상피 종양 세포를 간 중엽의 영역에 주사하고, 0.05 ml PBS 중의 2 x 106 GP7TB 세포를 랫트의 등 피하에 주사하였다. 접종 후 4주 동안 종양을 진행시킨 후, 랫트를 무작위로 그룹으로 분류하였다. 상이한 그룹의 랫트에 3주 동안 꼬리 정맥 또는 피하 경로를 통해 PBS 대조군, TfR 대조군 (3 nmol) 또는 TfR-CEBPA (3 nmol)를 3회/주 주사하였다. 주사 처리 동안 매주 등의 종양 크기를 기록하였다. 마지막 주사 후 2일째에 CO2에 의해 랫트를 희생시켰다. 등 및 간에서의 종양을 랫트로부터 제거하였다. 종양의 중량을 측정하고, 종양 크기를 눈금자에 의해 측정한 후, 다음 분석을 위해 -80℃에 보관하였다. 혈액 샘플을 심장으로부터 수집하고, 3000 rpm에서 15분 동안 실온에서 원심분리하고, 분석시까지 혈청을 -80℃에 보존하였다.
결과는 도 6에 도시되어 있다. CEBPA saRNA를 보유하는 TfR은 TfR이 정맥내 또는 피하 투여되었는지에 상관없이 대조군 처리와 비교하여 종양 성장을 감소시킬 수 있었다.
마우스에서의 전이성 췌장암 모델
박테리아에서 선택을 위한 암피실린 내성 유전자 및 포유류 세포에서 선택을 위한 네오마이신 유전자를 인코딩하는 pcDNA-3.1(+) 골격에 반딧불이 루시퍼라제 단편을 삽입하였다. 안정한 세포주에 대한 재조합 작제물을 플라스미드 미디 키트 (QIAGEN, USA)를 사용하여 정제하였다. Panc-1 (인간 췌장 암종) 세포를 24시간 동안 재조합 작제물로 형질감염시켰다. 다음날, 안정한 클론 선택을 위해 배양 배지를 표준 배지를 포함하는 1.2 mg/ml G418 (Merck, Germany)로 교체했다. 선택 2주 후, 하나의 안정한 세포주를 발췌하여, 1.2 mg/mL G418을 포함하는 배지에 유지시켰다. 루시퍼라제 발현 시스템을 사용하여 루시퍼라제 발현을 평가하였다.
추적성 종양 동물 모델을 확립하기 위해, 루시퍼라제 발현 (Panc-1-Luc) 세포를 갖는 1x106 Panc-1을 포함하는 PBS 중 단일세포 현탁액 30 ul를 6주령 암컷 NOD/SCI D 마우스 (BioLasco Co., Taiwan)의 간 중엽 영역에 주사함으로써 피하 이식을 수행하였다. 접종 후 1주 동안 종양을 진행시킨 후, 마우스를 5개의 그룹으로 무작위로 분류하고, PBS, TfR-CEBPA (1 nmol), 대조군 TfR-CEBPA (1 nmol), P19-CEBPA (1 nmol) 또는 대조군 P19-CEBPA (1 nmol)을 꼬리 정맥을 통해 3주 동안 3회/주 주사하였다. P19 앱타머는 WO 2013/154735에 기재되어 있다. 마지막 주사 후 2일째에 CO2에 의해 마우스를 희생시켰다. 마우스로부터 종양을 제거하고, 종양 크기를 눈금자에 의해 측정하였다. 첫 번째 주사 전 및 마지막 주사 후 1일째에 IVIS 200의 스펙트럼을 사용하여 생물 발광을 평가함으로써 종양 성장을 모니터링하였다.
생체내 영상화 전에, 이소플루란을 사용하여 마우스를 마취시켰다. 이어서 150 μg/kg D-루시페린 (Biosynth, USA)의 용액을 복강내 경로로 주사하였다. 마우스를 IVIS 200의 스펙트럼에서 영상화하고, Living Image 소프트웨어 (Caliper Life Sciences, Alameda, CA)를 사용하여 생물 발광 신호를 분석하였다.
결과는 도 7a 및 도 7b에 도시되어 있다. TfR-CEBPA로 처리된 마우스는 대조군과 비교하여 유의하게 감소된 종양 성장 (7a; 감소된 광자 증가에 의해 결정됨) 및 유의하게 감소된 종양 부피 (7b)를 나타냈다.
실시예 5
TR14 S1-3 앱타머는 생체내에서 대사성 질병과 관련된 세포에 함유물을 전달한다.
대사 장애를 개선시키는 TR14 S1-3 앱타머 및 SIRT1 saRNA의 능력은 다음과 같았다:
TR14 S1-3 (TfR; 서열번호 1), 5개의 C3 (포스포라미다이트) 스페이서 및 SIRT1 saRNA를 포함하는 리보핵산을 합성하였다. CEBPA saRNA의 센스 및 안티센스 서열은 각각 서열번호 7 및 서열번호 8에 제시되어 있다. 센스 및 안티센스 서열은 각각 3' 말단에 2개의 뉴클레오타이드 (UU) 오버행를 포함한다.
10주령의 수컷 F344 랫트 20마리를 BioLASCO Taiwan Co., Ltd로부터 입수하였다. 랫트를 표준 조건에 수용하고, 모든 실험은 국립 대만 대학교의 기관 동물 관리 및 사용위원회가 준비한 "실험실 동물의 관리 및 사용 지침"에 따라 수행하였다.
순응 1주 후, 랫트에 고지방식이: 88% 표준 실험실 식이, 10% 라드 오일 (Merck KGaA, Darmstadt, Germany) 및 2% 콜레스테롤 Ⅰ(Merck KGaA, Darmstadt, Germany)를 26주 동안 제공하였다. 고지방 사료 공급 14주 후, 랫트를 그룹으로 분류하였다 (각 그룹당 5마리의 랫트). 4개의 그룹의 랫트에 꼬리 정맥을 통해 12주 동안 PBS, FLUC 및 TfR-SIRT1을 각각 1회/주 주사하였다. 실험 종료시, 동물을 밤새 금식시킨 다음, CO2에 의해 희생시켰다. 랫트로부터 수확된 간, 뇌, 갈색 지방 및 백색 지방의 중량을 측정한 후, -80℃에서 보관하였다. 원심분리 튜브에 수집된 혈액 샘플을 3000 rpm에서 15분 동안 원심분리하였다. 생화학적 분석에 사용시까지 혈청을 -80℃에서 보관하였다.
주사 처리 동안 매주 체중을 기록하였다. 혈액 분석기 Sysmex HST-N402XE (Sysmex, Japan)에 의해 전체 혈액 계수 (CBC) 시험을 수행한다. 글루코스, 총 콜레스테롤, 고밀도 지단백질 (HDL) 콜레스테롤 및 저밀도 지단백질 (LDL) 콜레스테롤의 혈청 수준을 VITROS 5, 1 FS 화학 시스템 (Ortho Clinical Diagnostics, USA)으로 측정하였다.
랫트를 희생시킨 후, 간 및 뇌를 즉시 제거하고, 4% (w/v) 파라포름알데하이드에서 고정시켰다. 이어서, 간 및 뇌를 파라핀에 포매하고, (4 μm 두께의) 절편을 슬라이싱한 후, H&E로 염색하였다.
콜레스테롤을 측정하기 위해, 미세 균질화기에서 200 μl의 클로로포름:이소프로판올:NP-40 (7:11:0.1)으로 10 mg 간 조직을 추출하였다. 추출물을 15,000 g에서 5 내지 10분 동안 원심분리하였다. 액체 (유기상)를 새로운 튜브로 옮기고, 50℃에서 공기 건조시켜 클로로포름을 제거하였다. 미량 유기 용매를 제거하기 위해 샘플을 진공하에 30분 동안 방치하였다. 제조사의 지시에 따라 콜레스테롤/콜레스테릴 에스테르 정량 키트 (K603-100; Biovision)를 사용하여 간으로부터 추출된 콜레스테롤을 효소에 의해 정량화하였다.
결과는 도 8a 내지 도 8f에 도시되어 있다. 고지방식이 하에 TfR-SIRT1로 처리된 랫트는 체중이 증가하지 않았다 (8a). 동일한 랫트는 또한 백색 지방 조직 (8b), 총 콜레스테롤 (8c), LDL (8d) 및 공복 혈당 (8f)의 수준이 감소한 것으로 나타났다. 또한, 랫트는 증가된 HDL/LDL 비 (8e)를 나타내었고, 따라서 이는 LDL ("나쁜" 콜레스테롤)과 비교하여 더 높은 수준의 HDL ("좋은" 콜레스테롤)을 나타낸다. 모든 결과는 TfR-SIRT1에 의한 처리가 대사 장애를 완화할 수 있고, 정맥내 투여된 TfR이 필요한 조직에 함유물을 전달할 수 있음을 나타낸다.
SEQUENCE LISTING
<110> Apterna Limited
City of Hope
<120> RNA aptamers against Transferrin Receptor (TfR)
<130> IPA200219-GB
<150> US 62/544,220
<151> 2017-08-11
<150> US 62/671,604
<151> 2018-05-15
<160> 11
<170> PatentIn version 3.5
<210> 1
<211> 22
<212> RNA
<213> Artificial Sequence
<220>
<223> TR14 S1-3 (22mer)
<400> 1
uuuauucaca uuuuugaauu ga 22
<210> 2
<211> 87
<212> RNA
<213> Artificial Sequence
<220>
<223> TR14 (87mer)
<400> 2
gggagacaag aauaaacgcu caaugcguuc acguuuauuc acauuuuuga auugagcaug 60
agcuucgaca ggaggcucac aacaggc 87
<210> 3
<211> 43
<212> RNA
<213> Artificial Sequence
<220>
<223> TR14 S2 (43mer)
<400> 3
ggggcucaau gcguucacgu uuauucacau uuuugaauug agc 43
<210> 4
<211> 8
<212> RNA
<213> Artificial Sequence
<220>
<223> 8mer loop region
<400> 4
acauuuuu 8
<210> 5
<211> 16
<212> RNA
<213> Artificial Sequence
<220>
<223> 16mer truncation
<400> 5
auucacauuu uugaau 16
<210> 6
<211> 760
<212> PRT
<213> Artificial Sequence
<220>
<223> Human transferrin receptor protein 1 isoform 1
<400> 6
Met Met Asp Gln Ala Arg Ser Ala Phe Ser Asn Leu Phe Gly Gly Glu
1 5 10 15
Pro Leu Ser Tyr Thr Arg Phe Ser Leu Ala Arg Gln Val Asp Gly Asp
20 25 30
Asn Ser His Val Glu Met Lys Leu Ala Val Asp Glu Glu Glu Asn Ala
35 40 45
Asp Asn Asn Thr Lys Ala Asn Val Thr Lys Pro Lys Arg Cys Ser Gly
50 55 60
Ser Ile Cys Tyr Gly Thr Ile Ala Val Ile Val Phe Phe Leu Ile Gly
65 70 75 80
Phe Met Ile Gly Tyr Leu Gly Tyr Cys Lys Gly Val Glu Pro Lys Thr
85 90 95
Glu Cys Glu Arg Leu Ala Gly Thr Glu Ser Pro Val Arg Glu Glu Pro
100 105 110
Gly Glu Asp Phe Pro Ala Ala Arg Arg Leu Tyr Trp Asp Asp Leu Lys
115 120 125
Arg Lys Leu Ser Glu Lys Leu Asp Ser Thr Asp Phe Thr Gly Thr Ile
130 135 140
Lys Leu Leu Asn Glu Asn Ser Tyr Val Pro Arg Glu Ala Gly Ser Gln
145 150 155 160
Lys Asp Glu Asn Leu Ala Leu Tyr Val Glu Asn Gln Phe Arg Glu Phe
165 170 175
Lys Leu Ser Lys Val Trp Arg Asp Gln His Phe Val Lys Ile Gln Val
180 185 190
Lys Asp Ser Ala Gln Asn Ser Val Ile Ile Val Asp Lys Asn Gly Arg
195 200 205
Leu Val Tyr Leu Val Glu Asn Pro Gly Gly Tyr Val Ala Tyr Ser Lys
210 215 220
Ala Ala Thr Val Thr Gly Lys Leu Val His Ala Asn Phe Gly Thr Lys
225 230 235 240
Lys Asp Phe Glu Asp Leu Tyr Thr Pro Val Asn Gly Ser Ile Val Ile
245 250 255
Val Arg Ala Gly Lys Ile Thr Phe Ala Glu Lys Val Ala Asn Ala Glu
260 265 270
Ser Leu Asn Ala Ile Gly Val Leu Ile Tyr Met Asp Gln Thr Lys Phe
275 280 285
Pro Ile Val Asn Ala Glu Leu Ser Phe Phe Gly His Ala His Leu Gly
290 295 300
Thr Gly Asp Pro Tyr Thr Pro Gly Phe Pro Ser Phe Asn His Thr Gln
305 310 315 320
Phe Pro Pro Ser Arg Ser Ser Gly Leu Pro Asn Ile Pro Val Gln Thr
325 330 335
Ile Ser Arg Ala Ala Ala Glu Lys Leu Phe Gly Asn Met Glu Gly Asp
340 345 350
Cys Pro Ser Asp Trp Lys Thr Asp Ser Thr Cys Arg Met Val Thr Ser
355 360 365
Glu Ser Lys Asn Val Lys Leu Thr Val Ser Asn Val Leu Lys Glu Ile
370 375 380
Lys Ile Leu Asn Ile Phe Gly Val Ile Lys Gly Phe Val Glu Pro Asp
385 390 395 400
His Tyr Val Val Val Gly Ala Gln Arg Asp Ala Trp Gly Pro Gly Ala
405 410 415
Ala Lys Ser Gly Val Gly Thr Ala Leu Leu Leu Lys Leu Ala Gln Met
420 425 430
Phe Ser Asp Met Val Leu Lys Asp Gly Phe Gln Pro Ser Arg Ser Ile
435 440 445
Ile Phe Ala Ser Trp Ser Ala Gly Asp Phe Gly Ser Val Gly Ala Thr
450 455 460
Glu Trp Leu Glu Gly Tyr Leu Ser Ser Leu His Leu Lys Ala Phe Thr
465 470 475 480
Tyr Ile Asn Leu Asp Lys Ala Val Leu Gly Thr Ser Asn Phe Lys Val
485 490 495
Ser Ala Ser Pro Leu Leu Tyr Thr Leu Ile Glu Lys Thr Met Gln Asn
500 505 510
Val Lys His Pro Val Thr Gly Gln Phe Leu Tyr Gln Asp Ser Asn Trp
515 520 525
Ala Ser Lys Val Glu Lys Leu Thr Leu Asp Asn Ala Ala Phe Pro Phe
530 535 540
Leu Ala Tyr Ser Gly Ile Pro Ala Val Ser Phe Cys Phe Cys Glu Asp
545 550 555 560
Thr Asp Tyr Pro Tyr Leu Gly Thr Thr Met Asp Thr Tyr Lys Glu Leu
565 570 575
Ile Glu Arg Ile Pro Glu Leu Asn Lys Val Ala Arg Ala Ala Ala Glu
580 585 590
Val Ala Gly Gln Phe Val Ile Lys Leu Thr His Asp Val Glu Leu Asn
595 600 605
Leu Asp Tyr Glu Arg Tyr Asn Ser Gln Leu Leu Ser Phe Val Arg Asp
610 615 620
Leu Asn Gln Tyr Arg Ala Asp Ile Lys Glu Met Gly Leu Ser Leu Gln
625 630 635 640
Trp Leu Tyr Ser Ala Arg Gly Asp Phe Phe Arg Ala Thr Ser Arg Leu
645 650 655
Thr Thr Asp Phe Gly Asn Ala Glu Lys Thr Asp Arg Phe Val Met Lys
660 665 670
Lys Leu Asn Asp Arg Val Met Arg Val Glu Tyr His Phe Leu Ser Pro
675 680 685
Tyr Val Ser Pro Lys Glu Ser Pro Phe Arg His Val Phe Trp Gly Ser
690 695 700
Gly Ser His Thr Leu Pro Ala Leu Leu Glu Asn Leu Lys Leu Arg Lys
705 710 715 720
Gln Asn Asn Gly Ala Phe Asn Glu Thr Leu Phe Arg Asn Gln Leu Ala
725 730 735
Leu Ala Thr Trp Thr Ile Gln Gly Ala Ala Asn Ala Leu Ser Gly Asp
740 745 750
Val Trp Asp Ile Asp Asn Glu Phe
755 760
<210> 7
<211> 21
<212> RNA
<213> Artificial Sequence
<220>
<223> SIRT1 saRNA sense
<400> 7
auauguccuc cugggaagau u 21
<210> 8
<211> 21
<212> RNA
<213> Artificial Sequence
<220>
<223> SIRT1 saRNA antisense
<400> 8
ucuucccagg aggacauauu u 21
<210> 9
<211> 21
<212> RNA
<213> Artificial Sequence
<220>
<223> CEBPA saRNA sense
<400> 9
gcggucauug ucacuggucu u 21
<210> 10
<211> 21
<212> RNA
<213> Artificial Sequence
<220>
<223> CEBPA saRNA antisense
<400> 10
gaccagugac aaugaccgcu u 21
<210> 11
<211> 87
<212> RNA
<213> Artificial Sequence
<220>
<223> P19
<400> 11
gggagacaag aauaaacgcu caauggcgaa ugcccgccua auagggcguu augacuuguu 60
gaguucgaca ggaggcucac aacaggc 87
Claims (32)
- 서열번호 1에 대해 적어도 90% 서열 동일성을 갖는 RNA 서열을 포함하거나, 이로 이루어진 리보핵산 화합물로서, 상기 RNA 서열은 길이가 29개 이하의 뉴클레오타이드이고, RNA 서열은 트랜스페린 수용체 (TfR)에 결합할 수 있는, 리보핵산 화합물.
- 제1항에 있어서, 상기 RNA 서열은 길이가 22개 이하의 뉴클레오타이드인, 리보핵산 화합물.
- 제1항에 있어서, 상기 RNA 서열은 길이가 22개의 뉴클레오타이드인, 리보핵산 화합물.
- 제1항에 있어서, RNA 서열은 서열번호 1에 대해 100% 서열 동일성을 갖는, 리보핵산 화합물.
- 서열번호 5에 대해 적어도 90% 서열 동일성을 갖는 RNA 서열을 포함하거나, 이로 이루어진 리보핵산 화합물로서, 상기 RNA 서열은 길이가 29개 이하의 뉴클레오타이드이고, RNA 서열은 트랜스페린 수용체 (TfR)에 결합할 수 있는, 리보핵산 화합물.
- 제5항에 있어서, 상기 RNA 서열은 길이가 16개 뉴클레오타이드인, 리보핵산 화합물.
- 제5항에 있어서, RNA 서열은 서열번호 5에 대해 100% 서열 동일성을 갖는, 리보핵산 화합물.
- 제1항에 있어서, RNA 서열은 세포 표면 상의 TfR에 결합할 수 있는, 리보핵산 화합물.
- 제1항에 있어서, 세포 내에 내재화될 수 있는, 리보핵산 화합물.
- 제1항에 있어서, 혈뇌 장벽(blood-brain barrier)을 통과할 수 있는, 리보핵산 화합물.
- 제1항에 있어서, 상기 RNA 서열에 부착된 화합물 모이어티(moiety)를 추가로 포함하는, 리보핵산 화합물.
- 제11항에 있어서, 화합물 모이어티는 치료 모이어티 또는 영상화 모이어티인, 리보핵산 화합물.
- 제11항에 있어서, 상기 화합물 모이어티는 상기 RNA 서열에 공유결합에 의해 부착된, 리보핵산 화합물.
- 제12항에 있어서, 상기 치료 모이어티는 핵산 모이어티, 펩타이드 모이어티 또는 소분자 약물 모이어티인, 리보핵산 화합물.
- 제12항에 있어서, 상기 치료 모이어티는 활성화 핵산 모이어티 또는 안티센스 핵산 모이어티인, 리보핵산 화합물.
- 제12항에 있어서, 상기 치료 모이어티는 miRNA, mRNA, saRNA 또는 siRNA 모이어티인, 리보핵산 화합물.
- 제12항에 있어서, 상기 치료 모이어티는 항암 치료 모이어티인, 리보핵산 화합물.
- 제12항에 있어서, 상기 치료 모이어티는 C/EBP알파 saRNA 모이어티, SIRT1 saRNA 모이어티, 또는 HNF saRNA 모이어티인, 리보핵산 화합물.
- 제12항에 있어서, 영상화 모이어티는 생물발광 분자, 광활성 분자, 금속 또는 나노입자인, 리보핵산 화합물.
- 제1항에 따른 리보핵산 화합물을 포함하는 약제학적 조성물로서, 선택적으로 약제학적으로 허용 가능한 부형제를 포함하는 약제학적 조성물.
- 제20항에 있어서, 치료제, 선택적으로 항암제를 추가로 포함하는, 약제학적 조성물.
- 화합물 모이어티를 세포 내에 전달하는 방법으로서, 상기 방법은
(i) 세포를 제11항 내지 제19항 중 어느 한 항에 따른 리보핵산 화합물 또는 제20항 또는 제21항에 따른 조성물과 접촉시키는 단계; 및
(ii) 상기 리보핵산 화합물이 상기 세포 상의 트랜스페린 수용체에 결합하여 상기 세포 내로 통과되도록 함으로써, 상기 화합물 모이어티를 상기 세포 내에 전달하는 단계, 방법. - 화합물을 세포 내에 전달하는 방법으로서, 상기 방법은
(i) 세포를 화합물 및 제1항에 따른 리보핵산 화합물과 접촉시키는 단계; 및
(ii) 상기 리보핵산 화합물이 상기 세포 상의 트랜스페린 수용체에 결합하여 상기 세포 내로 통과되도록 함으로써, 상기 화합물 모이어티를 상기 세포 내에 전달하는 단계
를 포함하는 방법. - 제23항에 있어서, 상기 화합물은 치료제 또는 영상화제인, 방법.
- 의학적 치료 또는 예방 방법에 사용하기 위한, 제1항 내지 제19항 중 어느 한 항에 따른 리보핵산 화합물, 또는 제20항 또는 제21항에 따른 조성물.
- 질병 또는 장애의 치료 또는 예방을 위한 약제의 제조에서의, 제1항 내지 제19항 중 어느 한 항에 따른 리보핵산 화합물, 또는 제20항 또는 제21항에 따른 조성물의 용도.
- 질병 또는 장애의 치료 또는 예방 방법으로서, 상기 방법은 제1항 내지 제19항 중 어느 한 항에 따른 리보핵산 화합물 또는 제20항 또는 제21항에 따른 조성물의 유효량을 이를 필요로 하는 대상체에 투여하는 단계를 포함하는 방법.
- 제25항에 있어서; 제26항에 있어서; 또는 제27항에 있어서, 질병 또는 장애가 암인, 사용하기 위한 리보핵산 화합물 또는 조성물; 리보핵산 화합물 또는 조성물의 용도; 또는 방법.
- 제28항에 있어서, 상기 방법은 항암제를 투여하는 단계를 추가로 포함하는, 사용하기 위한 리보핵산 화합물 또는 조성물; 리보핵산 화합물 또는 조성물의 용도; 또는 방법.
- 제25항에 있어서; 제26항에 있어서; 또는 제27항에 있어서, 질병 또는 장애가 대사 장애 또는 신경계 장애인, 사용하기 위한 리보핵산 화합물 또는 조성물; 리보핵산 화합물 또는 조성물의 용도; 또는 방법.
- 세포의 검출 방법으로서, 상기 방법은
(i) 세포를 제1항 내지 제13항 또는 제19항 중 어느 한 항에 따른 리보핵산 화합물, 또는 제20항에 따른 조성물과 접촉시키는 단계로서, 리보핵산 화합물은 영상화 모이어티를 포함하는 단계;
(ii) 상기 리보핵산 화합물이 상기 세포 상의 트랜스페린 수용체에 결합하여 상기 세포 내로 통과되도록 하는 단계; 및
(iii) 상기 영상화 모이어티를 검출함으로써, 상기 세포를 검출하는 단계
를 포함하는, 방법. - 세포의 검출 방법으로서, 상기 방법은
(i) 세포를 제1항에 따른 리보핵산 화합물 및 영상화제와 접촉시키는 단계;
(ii) 상기 리보핵산 화합물이 상기 세포 상의 트랜스페린 수용체에 결합하여 상기 영상화제가 상기 세포 내로 통과되도록 하는 단계; 및
(iii) 상기 영상화제를 검출함으로써, 상기 세포를 검출하는 단계
를 포함하는, 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762544220P | 2017-08-11 | 2017-08-11 | |
| US62/544,220 | 2017-08-11 | ||
| US201862671604P | 2018-05-15 | 2018-05-15 | |
| US62/671,604 | 2018-05-15 | ||
| PCT/US2018/046343 WO2019033051A1 (en) | 2017-08-11 | 2018-08-10 | RNA APTAMERS AGAINST THE TRANSFERRIN RECEPTOR (TFR) |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20200068647A true KR20200068647A (ko) | 2020-06-15 |
Family
ID=65271776
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020207006810A KR20200068647A (ko) | 2017-08-11 | 2018-08-10 | 트랜스페린 수용체 (TfR)에 대한 RNA 앱타머 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US11427826B2 (ko) |
| EP (1) | EP3664814A4 (ko) |
| JP (1) | JP7382919B2 (ko) |
| KR (1) | KR20200068647A (ko) |
| CN (1) | CN111542326A (ko) |
| AU (1) | AU2018314236A1 (ko) |
| CA (1) | CA3072575A1 (ko) |
| WO (1) | WO2019033051A1 (ko) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3953473A1 (en) * | 2019-04-12 | 2022-02-16 | MiNA Therapeutics Limited | Sirt1-sarna compositions and methods of use |
| EP3980541A1 (en) | 2019-06-04 | 2022-04-13 | Apterna Limited | Aptamers against transferrin receptor (tfr) |
| GB202019692D0 (en) | 2020-12-14 | 2021-01-27 | Apterna Ltd | Aptamer-sirna fusions |
Family Cites Families (30)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5034506A (en) | 1985-03-15 | 1991-07-23 | Anti-Gene Development Group | Uncharged morpholino-based polymers having achiral intersubunit linkages |
| US5235033A (en) | 1985-03-15 | 1993-08-10 | Anti-Gene Development Group | Alpha-morpholino ribonucleoside derivatives and polymers thereof |
| US5143854A (en) | 1989-06-07 | 1992-09-01 | Affymax Technologies N.V. | Large scale photolithographic solid phase synthesis of polypeptides and receptor binding screening thereof |
| US6344321B1 (en) * | 1990-06-11 | 2002-02-05 | Gilead Sciences, Inc. | Nucleic acid ligands which bind to hepatocyte growth factor/scatter factor (HGF/SF) or its receptor c-met |
| US5830645A (en) | 1994-12-09 | 1998-11-03 | The Regents Of The University Of California | Comparative fluorescence hybridization to nucleic acid arrays |
| US20020142000A1 (en) | 1999-01-15 | 2002-10-03 | Digan Mary Ellen | Anti-CD3 immunotoxins and therapeutic uses therefor |
| US7635472B2 (en) | 2003-05-31 | 2009-12-22 | Micromet Ag | Pharmaceutical compositions comprising bispecific anti-cd3, anti-cd19 antibody constructs for the treatment of b-cell related disorders |
| JP2006089471A (ja) | 2004-08-26 | 2006-04-06 | National Institute Of Advanced Industrial & Technology | 癌の治療における抗モータリン2抗体と機能性核酸の使用 |
| WO2007033230A2 (en) | 2005-09-12 | 2007-03-22 | Novimmune S.A. | Anti-cd3 antibody formulations |
| MX2009010611A (es) | 2007-04-03 | 2010-03-26 | Micromet Ag | Enlazadores biespecificos, especificos para especies. |
| LT2520590T (lt) | 2007-04-03 | 2018-09-10 | Amgen Research (Munich) Gmbh | Susijusioms rūšims specifinis rišantis domenas |
| CN109456410B (zh) | 2007-04-03 | 2022-01-28 | 安进研发(慕尼黑)股份有限公司 | 跨物种特异性CD3-ε结合结构域 |
| JP5142265B2 (ja) | 2007-05-28 | 2013-02-13 | 独立行政法人産業技術総合研究所 | 抗モータリン抗体のパラトープ及びエピトープ |
| JP5641486B2 (ja) | 2009-12-10 | 2014-12-17 | 独立行政法人産業技術総合研究所 | 抗癌性抗モータリンペプチド抗体 |
| EP2625272B1 (en) * | 2010-10-08 | 2015-09-16 | Mina Therapeutics Limited | Methods of inducing insulin production |
| CA2870288A1 (en) | 2012-04-10 | 2013-10-17 | John J. Rossi | Rna aptamers for therapeutic and diagnostic delivery to pancreatic cancer cells |
| JP6636803B2 (ja) | 2013-02-05 | 2020-01-29 | エンクマフ エスアーエールエル | Bcmaに対する抗体の選択のための方法 |
| WO2014147559A1 (en) | 2013-03-18 | 2014-09-25 | University Of The Witwatersrand, Johannesburg | Cd7 receptor aptamers |
| EP2789630A1 (en) | 2013-04-09 | 2014-10-15 | EngMab AG | Bispecific antibodies against CD3e and ROR1 |
| SG11201508231UA (en) | 2013-04-19 | 2015-11-27 | Covagen Ag | Novel bispecific binding molecules with antitumoral activity |
| US20160326249A1 (en) | 2014-01-15 | 2016-11-10 | Zymeworks Inc. | Bi-specific cd3 and cd19 antigen-binding constructs |
| US9605266B2 (en) | 2014-07-16 | 2017-03-28 | City Of Hope | Cell-specific internalizing RNA aptamers against human CCR5 and uses therefore |
| CA2956718A1 (en) | 2014-07-31 | 2016-02-04 | Academia Sinica | An antagonistic pd-1 aptamer and its applications in cancer therapy related applications |
| WO2016061386A1 (en) * | 2014-10-15 | 2016-04-21 | City Of Hope | Rna aptamers against transferrin receptor (tfr) |
| US11180761B2 (en) | 2014-10-15 | 2021-11-23 | City Of Hope | PDGFR RNA aptamers |
| EP3250930A1 (en) | 2015-01-27 | 2017-12-06 | Klinikum rechts der Isar der Technischen Universität München | Quantitative assay for heat shock protein 70 (hsp70) protein in body fluids |
| EP3256593B1 (en) * | 2015-02-11 | 2020-03-25 | Deakin University | Epcam aptamers and conjugates thereof |
| WO2016161165A1 (en) * | 2015-03-31 | 2016-10-06 | City Of Hope | Anti-cancer rna aptamers |
| CN109312347A (zh) | 2016-02-19 | 2019-02-05 | 希望之城 | 双特异性适配子 |
| US20200181264A1 (en) | 2017-08-11 | 2020-06-11 | City Of Hope | Bispecific antigen-binding molecule |
-
2018
- 2018-08-10 AU AU2018314236A patent/AU2018314236A1/en active Pending
- 2018-08-10 EP EP18844104.2A patent/EP3664814A4/en active Pending
- 2018-08-10 WO PCT/US2018/046343 patent/WO2019033051A1/en unknown
- 2018-08-10 CN CN201880066428.2A patent/CN111542326A/zh active Pending
- 2018-08-10 US US16/637,679 patent/US11427826B2/en active Active
- 2018-08-10 KR KR1020207006810A patent/KR20200068647A/ko not_active Application Discontinuation
- 2018-08-10 JP JP2020507679A patent/JP7382919B2/ja active Active
- 2018-08-10 CA CA3072575A patent/CA3072575A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| JP2020532958A (ja) | 2020-11-19 |
| US11427826B2 (en) | 2022-08-30 |
| EP3664814A1 (en) | 2020-06-17 |
| CA3072575A1 (en) | 2019-02-14 |
| EP3664814A4 (en) | 2021-05-05 |
| US20200172905A1 (en) | 2020-06-04 |
| JP7382919B2 (ja) | 2023-11-17 |
| CN111542326A (zh) | 2020-08-14 |
| AU2018314236A1 (en) | 2020-03-19 |
| WO2019033051A1 (en) | 2019-02-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6661645B2 (ja) | トランスフェリン受容体(tfr)に対するrnaアプタマー | |
| MX2012012214A (es) | Composiciones y metodos para la distribucion selectiva de moleculas de oligonucleotidos para tipos especificos de neuronas. | |
| JP7382919B2 (ja) | トランスフェリン受容体(TfR)に対するRNAアプタマー | |
| CN106794216B (zh) | 阻断异粘蛋白-snd1相互作用的肽作为癌症治疗的用途 | |
| TW201718024A (zh) | 治療性細胞內化結合物 | |
| EP2961853B1 (en) | Methods for classifying a cancer as susceptible to tmepai-directed therapies and treating such cancers | |
| JP6262707B2 (ja) | がん幹細胞を含むまたはそれに由来するがんの治療、予防および診断のための方法および組成物 | |
| WO2018191153A1 (en) | Cancer treatment by malat1 inhibition | |
| JP2022532303A (ja) | Fmrp及び癌治療 | |
| US20220396794A1 (en) | APTAMERS AGAINST TRANSFERRIN RECEPTOR (TfR) | |
| CN107106697B (zh) | Pdgfr rna适体 | |
| KR101913693B1 (ko) | SS18-SSX 융합 유전자 특이적 siRNA 및 이를 포함하는 암 예방 또는 치료용 약학적 조성물 | |
| US20220243208A1 (en) | Aptamers against glioblastoma | |
| EP4361271A2 (en) | Aptamer-sirna fusions | |
| JP2023526328A (ja) | siRNAを使用してPRDM2/RIZタンパク質の発現を調節するがん治療 | |
| KR20200090678A (ko) | Banf1, plod3 또는 sf3b4의 억제제를 유효성분으로 포함하는 간암의 예방 및 치료용 조성물 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |