KR20190103226A - Ny-eso-1에 결합하는 t 세포 수용체 및 이의 사용 방법 - Google Patents
Ny-eso-1에 결합하는 t 세포 수용체 및 이의 사용 방법 Download PDFInfo
- Publication number
- KR20190103226A KR20190103226A KR1020197021319A KR20197021319A KR20190103226A KR 20190103226 A KR20190103226 A KR 20190103226A KR 1020197021319 A KR1020197021319 A KR 1020197021319A KR 20197021319 A KR20197021319 A KR 20197021319A KR 20190103226 A KR20190103226 A KR 20190103226A
- Authority
- KR
- South Korea
- Prior art keywords
- seq
- amino acid
- acid sequence
- tcr
- chain
- Prior art date
Links
- 108091008874 T cell receptors Proteins 0.000 title claims abstract description 922
- 238000000034 method Methods 0.000 title claims abstract description 143
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 title claims description 912
- 102100025570 Cancer/testis antigen 1 Human genes 0.000 title abstract description 138
- 101000856237 Homo sapiens Cancer/testis antigen 1 Proteins 0.000 title abstract description 138
- 150000007523 nucleic acids Chemical class 0.000 claims abstract description 106
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 39
- 102000039446 nucleic acids Human genes 0.000 claims abstract description 29
- 108020004707 nucleic acids Proteins 0.000 claims abstract description 29
- 210000004027 cell Anatomy 0.000 claims description 537
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 457
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 445
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 196
- 229920001184 polypeptide Polymers 0.000 claims description 152
- 108091033319 polynucleotide Proteins 0.000 claims description 131
- 239000002157 polynucleotide Substances 0.000 claims description 131
- 102000040430 polynucleotide Human genes 0.000 claims description 131
- 239000013598 vector Substances 0.000 claims description 120
- 210000001744 T-lymphocyte Anatomy 0.000 claims description 112
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 claims description 106
- 238000003776 cleavage reaction Methods 0.000 claims description 101
- 230000007017 scission Effects 0.000 claims description 101
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 91
- 206010028980 Neoplasm Diseases 0.000 claims description 88
- 230000014509 gene expression Effects 0.000 claims description 78
- 230000027455 binding Effects 0.000 claims description 61
- 201000011510 cancer Diseases 0.000 claims description 58
- 239000000427 antigen Substances 0.000 claims description 56
- 108091007433 antigens Proteins 0.000 claims description 55
- 102000036639 antigens Human genes 0.000 claims description 55
- 108010075704 HLA-A Antigens Proteins 0.000 claims description 41
- 230000004913 activation Effects 0.000 claims description 36
- 108010047041 Complementarity Determining Regions Proteins 0.000 claims description 33
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 claims description 29
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 claims description 29
- 102100026878 Interleukin-2 receptor subunit alpha Human genes 0.000 claims description 29
- 108010004889 Heat-Shock Proteins Proteins 0.000 claims description 25
- 102000002812 Heat-Shock Proteins Human genes 0.000 claims description 25
- 239000005557 antagonist Substances 0.000 claims description 24
- 239000012636 effector Substances 0.000 claims description 22
- 239000003814 drug Substances 0.000 claims description 21
- 230000001965 increasing effect Effects 0.000 claims description 21
- 239000003112 inhibitor Substances 0.000 claims description 19
- 230000001939 inductive effect Effects 0.000 claims description 17
- 238000004519 manufacturing process Methods 0.000 claims description 16
- 210000004698 lymphocyte Anatomy 0.000 claims description 15
- 229960005486 vaccine Drugs 0.000 claims description 15
- 230000006337 proteolytic cleavage Effects 0.000 claims description 14
- 229940124597 therapeutic agent Drugs 0.000 claims description 14
- 239000000556 agonist Substances 0.000 claims description 13
- 239000003795 chemical substances by application Substances 0.000 claims description 13
- 150000001875 compounds Chemical class 0.000 claims description 13
- 102000006639 indoleamine 2,3-dioxygenase Human genes 0.000 claims description 12
- 108020004201 indoleamine 2,3-dioxygenase Proteins 0.000 claims description 12
- 101001023379 Homo sapiens Lysosome-associated membrane glycoprotein 1 Proteins 0.000 claims description 11
- 102100035133 Lysosome-associated membrane glycoprotein 1 Human genes 0.000 claims description 11
- 239000000203 mixture Substances 0.000 claims description 11
- 230000008685 targeting Effects 0.000 claims description 11
- 239000013603 viral vector Substances 0.000 claims description 10
- 230000028993 immune response Effects 0.000 claims description 9
- 210000000581 natural killer T-cell Anatomy 0.000 claims description 8
- 241000701161 unidentified adenovirus Species 0.000 claims description 8
- 230000000890 antigenic effect Effects 0.000 claims description 7
- 229940127089 cytotoxic agent Drugs 0.000 claims description 7
- 230000034994 death Effects 0.000 claims description 7
- 231100000517 death Toxicity 0.000 claims description 7
- 230000001177 retroviral effect Effects 0.000 claims description 7
- 230000028327 secretion Effects 0.000 claims description 7
- 102100025137 Early activation antigen CD69 Human genes 0.000 claims description 6
- BCCRXDTUTZHDEU-VKHMYHEASA-N Gly-Ser Chemical compound NCC(=O)N[C@@H](CO)C(O)=O BCCRXDTUTZHDEU-VKHMYHEASA-N 0.000 claims description 6
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 claims description 6
- YGACXVRLDHEXKY-WXRXAMBDSA-N O[C@H](C[C@H]1c2c(cccc2F)-c2cncn12)[C@H]1CC[C@H](O)CC1 Chemical compound O[C@H](C[C@H]1c2c(cccc2F)-c2cncn12)[C@H]1CC[C@H](O)CC1 YGACXVRLDHEXKY-WXRXAMBDSA-N 0.000 claims description 6
- KRTIYQIPSAGSBP-KLAILNCOSA-N linrodostat Chemical compound C1(CCC(CC1)C1=C2C=C(F)C=CC2=NC=C1)[C@@H](C)C(=O)NC1=CC=C(Cl)C=C1 KRTIYQIPSAGSBP-KLAILNCOSA-N 0.000 claims description 6
- 101100451497 Dictyostelium discoideum hspB gene Proteins 0.000 claims description 5
- 101150022862 HSC70 gene Proteins 0.000 claims description 5
- 239000002246 antineoplastic agent Substances 0.000 claims description 5
- 229960003301 nivolumab Drugs 0.000 claims description 5
- 241000701447 unidentified baculovirus Species 0.000 claims description 5
- ZADWXFSZEAPBJS-SNVBAGLBSA-N (2r)-2-amino-3-(1-methylindol-3-yl)propanoic acid Chemical compound C1=CC=C2N(C)C=C(C[C@@H](N)C(O)=O)C2=C1 ZADWXFSZEAPBJS-SNVBAGLBSA-N 0.000 claims description 4
- 229940045513 CTLA4 antagonist Drugs 0.000 claims description 4
- 229940126547 T-cell immunoglobulin mucin-3 Drugs 0.000 claims description 4
- 229950009034 indoximod Drugs 0.000 claims description 4
- 229960002621 pembrolizumab Drugs 0.000 claims description 4
- 238000001959 radiotherapy Methods 0.000 claims description 4
- 238000012258 culturing Methods 0.000 claims description 3
- 230000006907 apoptotic process Effects 0.000 claims description 2
- 239000000824 cytostatic agent Substances 0.000 claims description 2
- 239000002254 cytotoxic agent Substances 0.000 claims description 2
- 231100000599 cytotoxic agent Toxicity 0.000 claims description 2
- 239000003937 drug carrier Substances 0.000 claims description 2
- 239000003053 toxin Substances 0.000 claims description 2
- 231100000765 toxin Toxicity 0.000 claims description 2
- 108700012359 toxins Proteins 0.000 claims description 2
- 102000011786 HLA-A Antigens Human genes 0.000 claims 4
- 239000013604 expression vector Substances 0.000 abstract description 30
- 230000009258 tissue cross reactivity Effects 0.000 abstract 6
- 108090000623 proteins and genes Proteins 0.000 description 49
- 102100028972 HLA class I histocompatibility antigen, A alpha chain Human genes 0.000 description 37
- 239000013638 trimer Substances 0.000 description 33
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 30
- 108020004414 DNA Proteins 0.000 description 28
- 235000001014 amino acid Nutrition 0.000 description 27
- 150000001413 amino acids Chemical class 0.000 description 25
- 238000011282 treatment Methods 0.000 description 25
- 238000000684 flow cytometry Methods 0.000 description 24
- 239000013642 negative control Substances 0.000 description 24
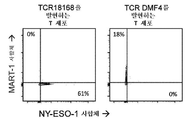
- 101000578784 Homo sapiens Melanoma antigen recognized by T-cells 1 Proteins 0.000 description 21
- 108700018351 Major Histocompatibility Complex Proteins 0.000 description 21
- 102100028389 Melanoma antigen recognized by T-cells 1 Human genes 0.000 description 21
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 description 21
- 210000001519 tissue Anatomy 0.000 description 21
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 20
- 210000004962 mammalian cell Anatomy 0.000 description 20
- 235000018102 proteins Nutrition 0.000 description 19
- 102000004169 proteins and genes Human genes 0.000 description 19
- 230000001086 cytosolic effect Effects 0.000 description 18
- 239000003446 ligand Substances 0.000 description 17
- 239000002773 nucleotide Substances 0.000 description 17
- 125000003729 nucleotide group Chemical group 0.000 description 17
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 16
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 15
- 210000004602 germ cell Anatomy 0.000 description 15
- 108020004999 messenger RNA Proteins 0.000 description 15
- 108091026890 Coding region Proteins 0.000 description 14
- 239000002671 adjuvant Substances 0.000 description 13
- 238000003556 assay Methods 0.000 description 13
- 238000003501 co-culture Methods 0.000 description 13
- 238000001727 in vivo Methods 0.000 description 13
- 239000000126 substance Substances 0.000 description 13
- 108700019146 Transgenes Proteins 0.000 description 12
- 230000030833 cell death Effects 0.000 description 12
- 239000000047 product Substances 0.000 description 12
- 241001529936 Murinae Species 0.000 description 11
- 238000010367 cloning Methods 0.000 description 11
- 230000000694 effects Effects 0.000 description 11
- 108010048367 enhanced green fluorescent protein Proteins 0.000 description 11
- 238000009396 hybridization Methods 0.000 description 11
- 230000003993 interaction Effects 0.000 description 11
- 238000010186 staining Methods 0.000 description 11
- 108091054438 MHC class II family Proteins 0.000 description 10
- 230000006044 T cell activation Effects 0.000 description 10
- 230000001413 cellular effect Effects 0.000 description 10
- 201000010099 disease Diseases 0.000 description 10
- 239000003550 marker Substances 0.000 description 10
- 239000002609 medium Substances 0.000 description 10
- 210000004986 primary T-cell Anatomy 0.000 description 10
- 238000013456 study Methods 0.000 description 10
- 230000002103 transcriptional effect Effects 0.000 description 10
- 101000794417 Homo sapiens T cell receptor alpha variable 3 Proteins 0.000 description 9
- 206010035226 Plasma cell myeloma Diseases 0.000 description 9
- 102100030199 T cell receptor alpha variable 3 Human genes 0.000 description 9
- 239000012472 biological sample Substances 0.000 description 9
- 238000004520 electroporation Methods 0.000 description 9
- 239000012634 fragment Substances 0.000 description 9
- 210000000987 immune system Anatomy 0.000 description 9
- 238000002360 preparation method Methods 0.000 description 9
- 238000003259 recombinant expression Methods 0.000 description 9
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 8
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 8
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 8
- 101000658404 Homo sapiens T cell receptor beta variable 29-1 Proteins 0.000 description 8
- 102000043131 MHC class II family Human genes 0.000 description 8
- 241000699666 Mus <mouse, genus> Species 0.000 description 8
- 102100027913 Peptidyl-prolyl cis-trans isomerase FKBP1A Human genes 0.000 description 8
- 102100034879 T cell receptor beta variable 29-1 Human genes 0.000 description 8
- 108010006877 Tacrolimus Binding Protein 1A Proteins 0.000 description 8
- 241000700605 Viruses Species 0.000 description 8
- 239000002299 complementary DNA Substances 0.000 description 8
- 239000000539 dimer Substances 0.000 description 8
- 239000003623 enhancer Substances 0.000 description 8
- 230000006698 induction Effects 0.000 description 8
- 239000000463 material Substances 0.000 description 8
- 201000001441 melanoma Diseases 0.000 description 8
- 230000003612 virological effect Effects 0.000 description 8
- PHEDXBVPIONUQT-UHFFFAOYSA-N Cocarcinogen A1 Natural products CCCCCCCCCCCCCC(=O)OC1C(C)C2(O)C3C=C(C)C(=O)C3(O)CC(CO)=CC2C2C1(OC(C)=O)C2(C)C PHEDXBVPIONUQT-UHFFFAOYSA-N 0.000 description 7
- 108020004705 Codon Proteins 0.000 description 7
- 102000004190 Enzymes Human genes 0.000 description 7
- 108090000790 Enzymes Proteins 0.000 description 7
- 241000588724 Escherichia coli Species 0.000 description 7
- 241001465754 Metazoa Species 0.000 description 7
- 108091034117 Oligonucleotide Proteins 0.000 description 7
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 7
- 239000012131 assay buffer Substances 0.000 description 7
- 239000011324 bead Substances 0.000 description 7
- 210000001185 bone marrow Anatomy 0.000 description 7
- 230000020411 cell activation Effects 0.000 description 7
- 239000000975 dye Substances 0.000 description 7
- 229940088598 enzyme Drugs 0.000 description 7
- 230000004927 fusion Effects 0.000 description 7
- 238000000338 in vitro Methods 0.000 description 7
- 239000002245 particle Substances 0.000 description 7
- PHEDXBVPIONUQT-RGYGYFBISA-N phorbol 13-acetate 12-myristate Chemical compound C([C@]1(O)C(=O)C(C)=C[C@H]1[C@@]1(O)[C@H](C)[C@H]2OC(=O)CCCCCCCCCCCCC)C(CO)=C[C@H]1[C@H]1[C@]2(OC(C)=O)C1(C)C PHEDXBVPIONUQT-RGYGYFBISA-N 0.000 description 7
- 230000035755 proliferation Effects 0.000 description 7
- 210000000130 stem cell Anatomy 0.000 description 7
- 230000000638 stimulation Effects 0.000 description 7
- 238000012916 structural analysis Methods 0.000 description 7
- 206010042863 synovial sarcoma Diseases 0.000 description 7
- 238000003786 synthesis reaction Methods 0.000 description 7
- 238000013518 transcription Methods 0.000 description 7
- 230000035897 transcription Effects 0.000 description 7
- 239000003981 vehicle Substances 0.000 description 7
- POVNCJSPYFCWJR-USZUGGBUSA-N (4s)-4-[[(2s)-2-[[(2s)-2-amino-3-(4-hydroxyphenyl)propanoyl]amino]-4-methylpentanoyl]amino]-5-[(2s)-2-[[2-[(2s)-2-[[(2s)-1-[[(2s,3r)-1-[[(1s)-1-carboxy-2-methylpropyl]amino]-3-hydroxy-1-oxobutan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]carbamoyl]pyrrolidin-1- Chemical compound C([C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N1[C@@H](CCC1)C(=O)NCC(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O)C1=CC=C(O)C=C1 POVNCJSPYFCWJR-USZUGGBUSA-N 0.000 description 6
- 101100426759 Hydrogenovibrio crunogenus (strain DSM 25203 / XCL-2) tsaC gene Proteins 0.000 description 6
- 108010002350 Interleukin-2 Proteins 0.000 description 6
- 102000000588 Interleukin-2 Human genes 0.000 description 6
- 239000005089 Luciferase Substances 0.000 description 6
- 102000043129 MHC class I family Human genes 0.000 description 6
- 108091054437 MHC class I family Proteins 0.000 description 6
- 241000124008 Mammalia Species 0.000 description 6
- 206010033128 Ovarian cancer Diseases 0.000 description 6
- 206010061535 Ovarian neoplasm Diseases 0.000 description 6
- 108020004511 Recombinant DNA Proteins 0.000 description 6
- 208000006265 Renal cell carcinoma Diseases 0.000 description 6
- 125000000539 amino acid group Chemical group 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 210000004369 blood Anatomy 0.000 description 6
- 239000008280 blood Substances 0.000 description 6
- 210000001124 body fluid Anatomy 0.000 description 6
- 239000012707 chemical precursor Substances 0.000 description 6
- 238000002474 experimental method Methods 0.000 description 6
- 108020001507 fusion proteins Proteins 0.000 description 6
- 102000037865 fusion proteins Human genes 0.000 description 6
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 6
- 230000003834 intracellular effect Effects 0.000 description 6
- 230000002147 killing effect Effects 0.000 description 6
- 210000001165 lymph node Anatomy 0.000 description 6
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 6
- 238000000746 purification Methods 0.000 description 6
- 102000005962 receptors Human genes 0.000 description 6
- 108020003175 receptors Proteins 0.000 description 6
- 239000000523 sample Substances 0.000 description 6
- 238000012216 screening Methods 0.000 description 6
- 238000001890 transfection Methods 0.000 description 6
- 238000013519 translation Methods 0.000 description 6
- VDABVNMGKGUPEY-UHFFFAOYSA-N 6-carboxyfluorescein succinimidyl ester Chemical compound C=1C(O)=CC=C2C=1OC1=CC(O)=CC=C1C2(C1=C2)OC(=O)C1=CC=C2C(=O)ON1C(=O)CCC1=O VDABVNMGKGUPEY-UHFFFAOYSA-N 0.000 description 5
- 206010006187 Breast cancer Diseases 0.000 description 5
- 208000026310 Breast neoplasm Diseases 0.000 description 5
- 102000004039 Caspase-9 Human genes 0.000 description 5
- 108090000566 Caspase-9 Proteins 0.000 description 5
- 238000002965 ELISA Methods 0.000 description 5
- 102000025850 HLA-A2 Antigen Human genes 0.000 description 5
- 108010074032 HLA-A2 Antigen Proteins 0.000 description 5
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 5
- 208000034578 Multiple myelomas Diseases 0.000 description 5
- 238000012408 PCR amplification Methods 0.000 description 5
- 206010060862 Prostate cancer Diseases 0.000 description 5
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 5
- 238000004422 calculation algorithm Methods 0.000 description 5
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 5
- 230000000139 costimulatory effect Effects 0.000 description 5
- 238000006471 dimerization reaction Methods 0.000 description 5
- 208000035475 disorder Diseases 0.000 description 5
- 238000005516 engineering process Methods 0.000 description 5
- 108020001756 ligand binding domains Proteins 0.000 description 5
- 201000005202 lung cancer Diseases 0.000 description 5
- 208000020816 lung neoplasm Diseases 0.000 description 5
- 230000035800 maturation Effects 0.000 description 5
- 230000004048 modification Effects 0.000 description 5
- 238000012986 modification Methods 0.000 description 5
- 238000002703 mutagenesis Methods 0.000 description 5
- 231100000350 mutagenesis Toxicity 0.000 description 5
- 239000013612 plasmid Substances 0.000 description 5
- 239000002243 precursor Substances 0.000 description 5
- 230000001225 therapeutic effect Effects 0.000 description 5
- 210000001541 thymus gland Anatomy 0.000 description 5
- 210000004881 tumor cell Anatomy 0.000 description 5
- 206010008342 Cervix carcinoma Diseases 0.000 description 4
- 108091035707 Consensus sequence Proteins 0.000 description 4
- 102000004127 Cytokines Human genes 0.000 description 4
- 108090000695 Cytokines Proteins 0.000 description 4
- 108010091938 HLA-B7 Antigen Proteins 0.000 description 4
- 101000983523 Homo sapiens Caspase-9 Proteins 0.000 description 4
- 108020004684 Internal Ribosome Entry Sites Proteins 0.000 description 4
- 208000008839 Kidney Neoplasms Diseases 0.000 description 4
- 206010023825 Laryngeal cancer Diseases 0.000 description 4
- 241000713666 Lentivirus Species 0.000 description 4
- 108060001084 Luciferase Proteins 0.000 description 4
- 241000699660 Mus musculus Species 0.000 description 4
- 208000009565 Pharyngeal Neoplasms Diseases 0.000 description 4
- 206010034811 Pharyngeal cancer Diseases 0.000 description 4
- 206010038389 Renal cancer Diseases 0.000 description 4
- 208000005718 Stomach Neoplasms Diseases 0.000 description 4
- 229940126530 T cell activator Drugs 0.000 description 4
- 208000024770 Thyroid neoplasm Diseases 0.000 description 4
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 4
- 210000000612 antigen-presenting cell Anatomy 0.000 description 4
- 210000004899 c-terminal region Anatomy 0.000 description 4
- 201000010881 cervical cancer Diseases 0.000 description 4
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 4
- 231100000135 cytotoxicity Toxicity 0.000 description 4
- 230000003013 cytotoxicity Effects 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 210000001671 embryonic stem cell Anatomy 0.000 description 4
- 206010017758 gastric cancer Diseases 0.000 description 4
- 239000001963 growth medium Substances 0.000 description 4
- 208000014829 head and neck neoplasm Diseases 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 238000003780 insertion Methods 0.000 description 4
- 230000037431 insertion Effects 0.000 description 4
- PGHMRUGBZOYCAA-UHFFFAOYSA-N ionomycin Natural products O1C(CC(O)C(C)C(O)C(C)C=CCC(C)CC(C)C(O)=CC(=O)C(C)CC(C)CC(CCC(O)=O)C)CCC1(C)C1OC(C)(C(C)O)CC1 PGHMRUGBZOYCAA-UHFFFAOYSA-N 0.000 description 4
- PGHMRUGBZOYCAA-ADZNBVRBSA-N ionomycin Chemical compound O1[C@H](C[C@H](O)[C@H](C)[C@H](O)[C@H](C)/C=C/C[C@@H](C)C[C@@H](C)C(/O)=C/C(=O)[C@@H](C)C[C@@H](C)C[C@@H](CCC(O)=O)C)CC[C@@]1(C)[C@@H]1O[C@](C)([C@@H](C)O)CC1 PGHMRUGBZOYCAA-ADZNBVRBSA-N 0.000 description 4
- 201000010982 kidney cancer Diseases 0.000 description 4
- 206010023841 laryngeal neoplasm Diseases 0.000 description 4
- 239000012528 membrane Substances 0.000 description 4
- 210000004379 membrane Anatomy 0.000 description 4
- 238000010369 molecular cloning Methods 0.000 description 4
- 230000035772 mutation Effects 0.000 description 4
- 201000000050 myeloid neoplasm Diseases 0.000 description 4
- 238000002823 phage display Methods 0.000 description 4
- 238000012545 processing Methods 0.000 description 4
- 230000000644 propagated effect Effects 0.000 description 4
- 230000000069 prophylactic effect Effects 0.000 description 4
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 230000009870 specific binding Effects 0.000 description 4
- 230000004936 stimulating effect Effects 0.000 description 4
- 201000011549 stomach cancer Diseases 0.000 description 4
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- 201000002510 thyroid cancer Diseases 0.000 description 4
- 238000011830 transgenic mouse model Methods 0.000 description 4
- 230000001052 transient effect Effects 0.000 description 4
- 230000003827 upregulation Effects 0.000 description 4
- DRHZYJAUECRAJM-DWSYSWFDSA-N (2s,3s,4s,5r,6r)-6-[[(3s,4s,4ar,6ar,6bs,8r,8ar,12as,14ar,14br)-8a-[(2s,3r,4s,5r,6r)-3-[(2s,3r,4s,5r,6s)-5-[(2s,3r,4s,5r)-4-[(2s,3r,4r)-3,4-dihydroxy-4-(hydroxymethyl)oxolan-2-yl]oxy-3,5-dihydroxyoxan-2-yl]oxy-3,4-dihydroxy-6-methyloxan-2-yl]oxy-5-[(3s,5s, Chemical compound O([C@H]1[C@H](O)[C@H](O[C@H]([C@@H]1O[C@H]1[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O1)O)O[C@H]1CC[C@]2(C)[C@H]3CC=C4[C@@H]5CC(C)(C)CC[C@@]5([C@@H](C[C@@]4(C)[C@]3(C)CC[C@H]2[C@@]1(C=O)C)O)C(=O)O[C@@H]1O[C@H](C)[C@@H]([C@@H]([C@H]1O[C@H]1[C@@H]([C@H](O)[C@@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@](O)(CO)CO3)O)[C@H](O)CO2)O)[C@H](C)O1)O)O)OC(=O)C[C@@H](O)C[C@H](OC(=O)C[C@@H](O)C[C@@H]([C@@H](C)CC)O[C@H]1[C@@H]([C@@H](O)[C@H](CO)O1)O)[C@@H](C)CC)C(O)=O)[C@@H]1OC[C@@H](O)[C@H](O)[C@H]1O DRHZYJAUECRAJM-DWSYSWFDSA-N 0.000 description 3
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 3
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 3
- 101100125027 Dictyostelium discoideum mhsp70 gene Proteins 0.000 description 3
- 101710089384 Extracellular protease Proteins 0.000 description 3
- 108010024636 Glutathione Proteins 0.000 description 3
- 102100028976 HLA class I histocompatibility antigen, B alpha chain Human genes 0.000 description 3
- 102000015789 HLA-DP Antigens Human genes 0.000 description 3
- 108010010378 HLA-DP Antigens Proteins 0.000 description 3
- 108010062347 HLA-DQ Antigens Proteins 0.000 description 3
- 102000006354 HLA-DR Antigens Human genes 0.000 description 3
- 108010058597 HLA-DR Antigens Proteins 0.000 description 3
- 101150031823 HSP70 gene Proteins 0.000 description 3
- 241000238631 Hexapoda Species 0.000 description 3
- 101000986086 Homo sapiens HLA class I histocompatibility antigen, A alpha chain Proteins 0.000 description 3
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 3
- 108060003951 Immunoglobulin Proteins 0.000 description 3
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 3
- 108010047620 Phytohemagglutinins Proteins 0.000 description 3
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 3
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 3
- -1 TCR18168 Proteins 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 230000000692 anti-sense effect Effects 0.000 description 3
- 239000012298 atmosphere Substances 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 239000010839 body fluid Substances 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 238000012217 deletion Methods 0.000 description 3
- 230000037430 deletion Effects 0.000 description 3
- 238000010586 diagram Methods 0.000 description 3
- 101150052825 dnaK gene Proteins 0.000 description 3
- 210000004700 fetal blood Anatomy 0.000 description 3
- 230000002068 genetic effect Effects 0.000 description 3
- 229960003180 glutathione Drugs 0.000 description 3
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 3
- 238000002744 homologous recombination Methods 0.000 description 3
- 230000006801 homologous recombination Effects 0.000 description 3
- 210000005260 human cell Anatomy 0.000 description 3
- 230000036039 immunity Effects 0.000 description 3
- 102000018358 immunoglobulin Human genes 0.000 description 3
- 230000001976 improved effect Effects 0.000 description 3
- 230000010354 integration Effects 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 206010024627 liposarcoma Diseases 0.000 description 3
- 238000013507 mapping Methods 0.000 description 3
- 238000004949 mass spectrometry Methods 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 230000001338 necrotic effect Effects 0.000 description 3
- 238000006384 oligomerization reaction Methods 0.000 description 3
- 230000001885 phytohemagglutinin Effects 0.000 description 3
- 238000007747 plating Methods 0.000 description 3
- 239000013641 positive control Substances 0.000 description 3
- 238000011084 recovery Methods 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 230000011664 signaling Effects 0.000 description 3
- 241000894007 species Species 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 238000010361 transduction Methods 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- NSBGUMKAXUXKGI-BPNHAYRBSA-N AP20187 Chemical compound C([C@@H](OC(=O)[C@@H]1CCCCN1C(=O)[C@@H](CC)C=1C=C(OC)C(OC)=C(OC)C=1)C=1C=C(OCC(=O)NCC(CNC(=O)COC=2C=C(C=CC=2)[C@@H](CCC=2C=C(OC)C(OC)=CC=2)OC(=O)[C@H]2N(CCCC2)C(=O)[C@@H](CC)C=2C=C(OC)C(OC)=C(OC)C=2)CN(C)C)C=CC=1)CC1=CC=C(OC)C(OC)=C1 NSBGUMKAXUXKGI-BPNHAYRBSA-N 0.000 description 2
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 2
- 235000014469 Bacillus subtilis Nutrition 0.000 description 2
- 102100027314 Beta-2-microglobulin Human genes 0.000 description 2
- 206010005949 Bone cancer Diseases 0.000 description 2
- 208000018084 Bone neoplasm Diseases 0.000 description 2
- 208000003174 Brain Neoplasms Diseases 0.000 description 2
- 102100025248 C-X-C motif chemokine 10 Human genes 0.000 description 2
- 101100124795 Caenorhabditis elegans hsp-110 gene Proteins 0.000 description 2
- 101100348617 Candida albicans (strain SC5314 / ATCC MYA-2876) NIK1 gene Proteins 0.000 description 2
- 108090000565 Capsid Proteins Proteins 0.000 description 2
- 102000005367 Carboxypeptidases Human genes 0.000 description 2
- 108010006303 Carboxypeptidases Proteins 0.000 description 2
- 201000009030 Carcinoma Diseases 0.000 description 2
- 102100023321 Ceruloplasmin Human genes 0.000 description 2
- 102000019034 Chemokines Human genes 0.000 description 2
- 108010012236 Chemokines Proteins 0.000 description 2
- 206010009944 Colon cancer Diseases 0.000 description 2
- 241000699802 Cricetulus griseus Species 0.000 description 2
- 101100016370 Danio rerio hsp90a.1 gene Proteins 0.000 description 2
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical group [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 2
- 101100285708 Dictyostelium discoideum hspD gene Proteins 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- 241000713730 Equine infectious anemia virus Species 0.000 description 2
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 2
- 201000003741 Gastrointestinal carcinoma Diseases 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 2
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 2
- 108060005986 Granzyme Proteins 0.000 description 2
- 102000001398 Granzyme Human genes 0.000 description 2
- 108010058607 HLA-B Antigens Proteins 0.000 description 2
- 102000018713 Histocompatibility Antigens Class II Human genes 0.000 description 2
- 208000017604 Hodgkin disease Diseases 0.000 description 2
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 2
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 2
- 101001033280 Homo sapiens Cytokine receptor common subunit beta Proteins 0.000 description 2
- 101000831007 Homo sapiens T-cell immunoreceptor with Ig and ITIM domains Proteins 0.000 description 2
- 101000830594 Homo sapiens Tumor necrosis factor ligand superfamily member 14 Proteins 0.000 description 2
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 2
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 2
- 206010024291 Leukaemias acute myeloid Diseases 0.000 description 2
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 2
- 101100096028 Mus musculus Smok1 gene Proteins 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 2
- 206010073137 Myxoid liposarcoma Diseases 0.000 description 2
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 2
- 101710153660 Nuclear receptor corepressor 2 Proteins 0.000 description 2
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 2
- 108020005187 Oligonucleotide Probes Proteins 0.000 description 2
- 101710160107 Outer membrane protein A Proteins 0.000 description 2
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 2
- 229930182555 Penicillin Natural products 0.000 description 2
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 2
- 102000035195 Peptidases Human genes 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- 108091036407 Polyadenylation Proteins 0.000 description 2
- 101710182846 Polyhedrin Proteins 0.000 description 2
- 241000283080 Proboscidea <mammal> Species 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 208000015634 Rectal Neoplasms Diseases 0.000 description 2
- 206010073139 Round cell liposarcoma Diseases 0.000 description 2
- 101100007329 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) COS1 gene Proteins 0.000 description 2
- 206010039491 Sarcoma Diseases 0.000 description 2
- 101100071627 Schizosaccharomyces pombe (strain 972 / ATCC 24843) swo1 gene Proteins 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 208000032383 Soft tissue cancer Diseases 0.000 description 2
- 108091081024 Start codon Proteins 0.000 description 2
- 108700027479 Syntex adjuvant formulation Proteins 0.000 description 2
- 102100037272 T cell receptor beta constant 1 Human genes 0.000 description 2
- 102100022590 T cell receptor gamma constant 1 Human genes 0.000 description 2
- 102100024834 T-cell immunoreceptor with Ig and ITIM domains Human genes 0.000 description 2
- 101150053558 TRBC1 gene Proteins 0.000 description 2
- 101150117561 TRBC2 gene Proteins 0.000 description 2
- 101150077364 TRDC gene Proteins 0.000 description 2
- 108010027179 Tacrolimus Binding Proteins Proteins 0.000 description 2
- 102000018679 Tacrolimus Binding Proteins Human genes 0.000 description 2
- 208000024313 Testicular Neoplasms Diseases 0.000 description 2
- 206010057644 Testis cancer Diseases 0.000 description 2
- 239000004098 Tetracycline Substances 0.000 description 2
- 210000000447 Th1 cell Anatomy 0.000 description 2
- 210000004241 Th2 cell Anatomy 0.000 description 2
- 241000723873 Tobacco mosaic virus Species 0.000 description 2
- 241000703392 Tribec virus Species 0.000 description 2
- 101710136122 Tryptophan 2,3-dioxygenase Proteins 0.000 description 2
- 102000057288 Tryptophan 2,3-dioxygenases Human genes 0.000 description 2
- 102100024586 Tumor necrosis factor ligand superfamily member 14 Human genes 0.000 description 2
- 208000002495 Uterine Neoplasms Diseases 0.000 description 2
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 2
- 208000004354 Vulvar Neoplasms Diseases 0.000 description 2
- 238000002441 X-ray diffraction Methods 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- 208000009956 adenocarcinoma Diseases 0.000 description 2
- 238000012867 alanine scanning Methods 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 230000003321 amplification Effects 0.000 description 2
- 210000002255 anal canal Anatomy 0.000 description 2
- 210000000436 anus Anatomy 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 108010081355 beta 2-Microglobulin Proteins 0.000 description 2
- 210000000013 bile duct Anatomy 0.000 description 2
- 239000000090 biomarker Substances 0.000 description 2
- 238000001574 biopsy Methods 0.000 description 2
- 230000024245 cell differentiation Effects 0.000 description 2
- 210000000170 cell membrane Anatomy 0.000 description 2
- 230000003833 cell viability Effects 0.000 description 2
- 201000010882 cellular myxoid liposarcoma Diseases 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 2
- 238000012411 cloning technique Methods 0.000 description 2
- 208000029742 colonic neoplasm Diseases 0.000 description 2
- 230000003750 conditioning effect Effects 0.000 description 2
- 239000000562 conjugate Substances 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 238000005138 cryopreservation Methods 0.000 description 2
- 210000000805 cytoplasm Anatomy 0.000 description 2
- 210000004443 dendritic cell Anatomy 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 229910052805 deuterium Inorganic materials 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 208000018554 digestive system carcinoma Diseases 0.000 description 2
- 238000010494 dissociation reaction Methods 0.000 description 2
- 230000005593 dissociations Effects 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 210000000959 ear middle Anatomy 0.000 description 2
- 201000004101 esophageal cancer Diseases 0.000 description 2
- 208000024519 eye neoplasm Diseases 0.000 description 2
- 239000012091 fetal bovine serum Substances 0.000 description 2
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 210000000232 gallbladder Anatomy 0.000 description 2
- 230000013595 glycosylation Effects 0.000 description 2
- 238000006206 glycosylation reaction Methods 0.000 description 2
- 201000010536 head and neck cancer Diseases 0.000 description 2
- 210000002443 helper t lymphocyte Anatomy 0.000 description 2
- 230000002440 hepatic effect Effects 0.000 description 2
- 102000055647 human CSF2RB Human genes 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 239000001257 hydrogen Substances 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 238000003018 immunoassay Methods 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 210000004263 induced pluripotent stem cell Anatomy 0.000 description 2
- 230000000977 initiatory effect Effects 0.000 description 2
- 238000011835 investigation Methods 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- 230000003902 lesion Effects 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 201000007270 liver cancer Diseases 0.000 description 2
- 208000014018 liver neoplasm Diseases 0.000 description 2
- 230000000527 lymphocytic effect Effects 0.000 description 2
- 208000006178 malignant mesothelioma Diseases 0.000 description 2
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 2
- 208000026037 malignant tumor of neck Diseases 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 102000006240 membrane receptors Human genes 0.000 description 2
- 210000003071 memory t lymphocyte Anatomy 0.000 description 2
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- 210000003097 mucus Anatomy 0.000 description 2
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 2
- 238000003199 nucleic acid amplification method Methods 0.000 description 2
- 201000008106 ocular cancer Diseases 0.000 description 2
- 239000002751 oligonucleotide probe Substances 0.000 description 2
- 238000002515 oligonucleotide synthesis Methods 0.000 description 2
- 238000005457 optimization Methods 0.000 description 2
- 210000001672 ovary Anatomy 0.000 description 2
- 201000002528 pancreatic cancer Diseases 0.000 description 2
- 208000008443 pancreatic carcinoma Diseases 0.000 description 2
- 108010089193 pattern recognition receptors Proteins 0.000 description 2
- 102000007863 pattern recognition receptors Human genes 0.000 description 2
- 229940049954 penicillin Drugs 0.000 description 2
- 108010091748 peptide A Proteins 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 210000004224 pleura Anatomy 0.000 description 2
- 201000003437 pleural cancer Diseases 0.000 description 2
- 210000001778 pluripotent stem cell Anatomy 0.000 description 2
- 230000004481 post-translational protein modification Effects 0.000 description 2
- 230000001323 posttranslational effect Effects 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 230000006798 recombination Effects 0.000 description 2
- 206010038038 rectal cancer Diseases 0.000 description 2
- 210000000664 rectum Anatomy 0.000 description 2
- 201000001275 rectum cancer Diseases 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 230000010076 replication Effects 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 210000003705 ribosome Anatomy 0.000 description 2
- 201000002314 small intestine cancer Diseases 0.000 description 2
- 239000011550 stock solution Substances 0.000 description 2
- 229960005322 streptomycin Drugs 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 201000003120 testicular cancer Diseases 0.000 description 2
- 235000019364 tetracycline Nutrition 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 230000002992 thymic effect Effects 0.000 description 2
- 208000008732 thymoma Diseases 0.000 description 2
- 230000009261 transgenic effect Effects 0.000 description 2
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 2
- 210000003171 tumor-infiltrating lymphocyte Anatomy 0.000 description 2
- 241001430294 unidentified retrovirus Species 0.000 description 2
- 206010046766 uterine cancer Diseases 0.000 description 2
- 239000004474 valine Substances 0.000 description 2
- 230000035899 viability Effects 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- DIGQNXIGRZPYDK-WKSCXVIASA-N (2R)-6-amino-2-[[2-[[(2S)-2-[[2-[[(2R)-2-[[(2S)-2-[[(2R,3S)-2-[[2-[[(2S)-2-[[2-[[(2S)-2-[[(2S)-2-[[(2R)-2-[[(2S,3S)-2-[[(2R)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[2-[[(2S)-2-[[(2R)-2-[[2-[[2-[[2-[(2-amino-1-hydroxyethylidene)amino]-3-carboxy-1-hydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1,5-dihydroxy-5-iminopentylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]hexanoic acid Chemical compound C[C@@H]([C@@H](C(=N[C@@H](CS)C(=N[C@@H](C)C(=N[C@@H](CO)C(=NCC(=N[C@@H](CCC(=N)O)C(=NC(CS)C(=N[C@H]([C@H](C)O)C(=N[C@H](CS)C(=N[C@H](CO)C(=NCC(=N[C@H](CS)C(=NCC(=N[C@H](CCCCN)C(=O)O)O)O)O)O)O)O)O)O)O)O)O)O)O)N=C([C@H](CS)N=C([C@H](CO)N=C([C@H](CO)N=C([C@H](C)N=C(CN=C([C@H](CO)N=C([C@H](CS)N=C(CN=C(C(CS)N=C(C(CC(=O)O)N=C(CN)O)O)O)O)O)O)O)O)O)O)O)O DIGQNXIGRZPYDK-WKSCXVIASA-N 0.000 description 1
- VEVMUSLHHIEHRV-IMWIMMFESA-N (2r)-2-[[(4s)-4-[(2-aminoacetyl)amino]-4-carboxybutanoyl]amino]-3-hydroxy-3-(hydroxymethyl)-4-(4-nitrophenoxy)-2-(sulfanylmethyl)butanoic acid Chemical compound NCC(=O)N[C@H](C(O)=O)CCC(=O)N[C@@](CS)(C(O)=O)C(O)(CO)COC1=CC=C([N+]([O-])=O)C=C1 VEVMUSLHHIEHRV-IMWIMMFESA-N 0.000 description 1
- YPBKTZBXSBLTDK-PKNBQFBNSA-N (3e)-3-[(3-bromo-4-fluoroanilino)-nitrosomethylidene]-4-[2-(sulfamoylamino)ethylamino]-1,2,5-oxadiazole Chemical compound NS(=O)(=O)NCCNC1=NON\C1=C(N=O)/NC1=CC=C(F)C(Br)=C1 YPBKTZBXSBLTDK-PKNBQFBNSA-N 0.000 description 1
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 1
- 108010093960 2-((1-(3,5-dichlorobenzenesulfonyl)pyrrolidine-2-carbonyl)amino)-4-(4-methyl-2-(methyl-(2-(4-(3-o-tolylureido)phenyl)acetyl)amino)pentanoylamino)butyric acid Proteins 0.000 description 1
- ZBMRKNMTMPPMMK-UHFFFAOYSA-N 2-amino-4-[hydroxy(methyl)phosphoryl]butanoic acid;azane Chemical compound [NH4+].CP(O)(=O)CCC(N)C([O-])=O ZBMRKNMTMPPMMK-UHFFFAOYSA-N 0.000 description 1
- QWZHDKGQKYEBKK-UHFFFAOYSA-N 3-aminochromen-2-one Chemical class C1=CC=C2OC(=O)C(N)=CC2=C1 QWZHDKGQKYEBKK-UHFFFAOYSA-N 0.000 description 1
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 1
- 102100023990 60S ribosomal protein L17 Human genes 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 229930024421 Adenine Natural products 0.000 description 1
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 1
- 102100034540 Adenomatous polyposis coli protein Human genes 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 239000012099 Alexa Fluor family Substances 0.000 description 1
- 101001084702 Arabidopsis thaliana Histone H2B.10 Proteins 0.000 description 1
- 241001203868 Autographa californica Species 0.000 description 1
- 238000012935 Averaging Methods 0.000 description 1
- 102100029822 B- and T-lymphocyte attenuator Human genes 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 101710098275 C-X-C motif chemokine 10 Proteins 0.000 description 1
- 102000002164 CARD domains Human genes 0.000 description 1
- 108050009503 CARD domains Proteins 0.000 description 1
- 108010062802 CD66 antigens Proteins 0.000 description 1
- 108091058556 CTAG1B Proteins 0.000 description 1
- 101150090257 CTAG1B gene Proteins 0.000 description 1
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 1
- 101100507655 Canis lupus familiaris HSPA1 gene Proteins 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 102100024533 Carcinoembryonic antigen-related cell adhesion molecule 1 Human genes 0.000 description 1
- 102000047934 Caspase-3/7 Human genes 0.000 description 1
- 108700037887 Caspase-3/7 Proteins 0.000 description 1
- 108010076667 Caspases Proteins 0.000 description 1
- 102000011727 Caspases Human genes 0.000 description 1
- 241000701489 Cauliflower mosaic virus Species 0.000 description 1
- 101150015280 Cel gene Proteins 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 206010057248 Cell death Diseases 0.000 description 1
- 102000006303 Chaperonin 60 Human genes 0.000 description 1
- 108010058432 Chaperonin 60 Proteins 0.000 description 1
- 241000195597 Chlamydomonas reinhardtii Species 0.000 description 1
- 241000195628 Chlorophyta Species 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- 229930105110 Cyclosporin A Natural products 0.000 description 1
- PMATZTZNYRCHOR-CGLBZJNRSA-N Cyclosporin A Chemical compound CC[C@@H]1NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)N(C)C(=O)CN(C)C1=O PMATZTZNYRCHOR-CGLBZJNRSA-N 0.000 description 1
- 108010036949 Cyclosporine Proteins 0.000 description 1
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 1
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 description 1
- 101150074155 DHFR gene Proteins 0.000 description 1
- 108010041986 DNA Vaccines Proteins 0.000 description 1
- 230000004544 DNA amplification Effects 0.000 description 1
- 229940021995 DNA vaccine Drugs 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 238000012286 ELISA Assay Methods 0.000 description 1
- YQYJSBFKSSDGFO-UHFFFAOYSA-N Epihygromycin Natural products OC1C(O)C(C(=O)C)OC1OC(C(=C1)O)=CC=C1C=C(C)C(=O)NC1C(O)C(O)C2OCOC2C1O YQYJSBFKSSDGFO-UHFFFAOYSA-N 0.000 description 1
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 1
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 1
- 102000003676 Glucocorticoid Receptors Human genes 0.000 description 1
- 108090000079 Glucocorticoid Receptors Proteins 0.000 description 1
- 108010015776 Glucose oxidase Proteins 0.000 description 1
- 239000004366 Glucose oxidase Substances 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 1
- 102100039619 Granulocyte colony-stimulating factor Human genes 0.000 description 1
- 102100028971 HLA class I histocompatibility antigen, C alpha chain Human genes 0.000 description 1
- 108010052199 HLA-C Antigens Proteins 0.000 description 1
- 229920001499 Heparinoid Polymers 0.000 description 1
- 102100034458 Hepatitis A virus cellular receptor 2 Human genes 0.000 description 1
- 101710083479 Hepatitis A virus cellular receptor 2 homolog Proteins 0.000 description 1
- 108010088652 Histocompatibility Antigens Class I Proteins 0.000 description 1
- 241001272567 Hominoidea Species 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000924577 Homo sapiens Adenomatous polyposis coli protein Proteins 0.000 description 1
- 101000864344 Homo sapiens B- and T-lymphocyte attenuator Proteins 0.000 description 1
- 101000858088 Homo sapiens C-X-C motif chemokine 10 Proteins 0.000 description 1
- 101000986087 Homo sapiens HLA class I histocompatibility antigen, B alpha chain Proteins 0.000 description 1
- 101000599940 Homo sapiens Interferon gamma Proteins 0.000 description 1
- 101001043564 Homo sapiens Prolow-density lipoprotein receptor-related protein 1 Proteins 0.000 description 1
- 101000679306 Homo sapiens T cell receptor gamma constant 1 Proteins 0.000 description 1
- 101000679307 Homo sapiens T cell receptor gamma constant 2 Proteins 0.000 description 1
- 101000946860 Homo sapiens T-cell surface glycoprotein CD3 epsilon chain Proteins 0.000 description 1
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 description 1
- 101000666896 Homo sapiens V-type immunoglobulin domain-containing suppressor of T-cell activation Proteins 0.000 description 1
- 241000701024 Human betaherpesvirus 5 Species 0.000 description 1
- 101100321817 Human parvovirus B19 (strain HV) 7.5K gene Proteins 0.000 description 1
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 1
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 1
- 102000012745 Immunoglobulin Subunits Human genes 0.000 description 1
- 108010079585 Immunoglobulin Subunits Proteins 0.000 description 1
- 108020005350 Initiator Codon Proteins 0.000 description 1
- 108010008212 Integrin alpha4beta1 Proteins 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 108090000467 Interferon-beta Proteins 0.000 description 1
- 102000003996 Interferon-beta Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 102000003816 Interleukin-13 Human genes 0.000 description 1
- 108090000176 Interleukin-13 Proteins 0.000 description 1
- 108050003558 Interleukin-17 Proteins 0.000 description 1
- 102000013691 Interleukin-17 Human genes 0.000 description 1
- 108010002386 Interleukin-3 Proteins 0.000 description 1
- 102000000646 Interleukin-3 Human genes 0.000 description 1
- 108090000978 Interleukin-4 Proteins 0.000 description 1
- 102000004388 Interleukin-4 Human genes 0.000 description 1
- 108010002586 Interleukin-7 Proteins 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- 229930182816 L-glutamine Natural products 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 102000017578 LAG3 Human genes 0.000 description 1
- 101150030213 Lag3 gene Proteins 0.000 description 1
- 108090001090 Lectins Proteins 0.000 description 1
- 102000004856 Lectins Human genes 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 108700020482 Maltose-Binding protein Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 102000003792 Metallothionein Human genes 0.000 description 1
- 108090000157 Metallothionein Proteins 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 108010006519 Molecular Chaperones Proteins 0.000 description 1
- 208000003445 Mouth Neoplasms Diseases 0.000 description 1
- 238000005481 NMR spectroscopy Methods 0.000 description 1
- 229930193140 Neomycin Natural products 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- 208000010505 Nose Neoplasms Diseases 0.000 description 1
- 102000010292 Peptide Elongation Factor 1 Human genes 0.000 description 1
- 108010077524 Peptide Elongation Factor 1 Proteins 0.000 description 1
- KHGNFPUMBJSZSM-UHFFFAOYSA-N Perforine Natural products COC1=C2CCC(O)C(CCC(C)(C)O)(OC)C2=NC2=C1C=CO2 KHGNFPUMBJSZSM-UHFFFAOYSA-N 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 241000235648 Pichia Species 0.000 description 1
- 101710089372 Programmed cell death protein 1 Proteins 0.000 description 1
- 102100021923 Prolow-density lipoprotein receptor-related protein 1 Human genes 0.000 description 1
- 108010076504 Protein Sorting Signals Proteins 0.000 description 1
- 108091034057 RNA (poly(A)) Proteins 0.000 description 1
- 229940022005 RNA vaccine Drugs 0.000 description 1
- 239000012979 RPMI medium Substances 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 108091027981 Response element Proteins 0.000 description 1
- 101100109192 Rhizobium galegae apt gene Proteins 0.000 description 1
- 229940044665 STING agonist Drugs 0.000 description 1
- 241000235070 Saccharomyces Species 0.000 description 1
- 241000277284 Salvelinus fontinalis Species 0.000 description 1
- 208000034189 Sclerosis Diseases 0.000 description 1
- 241000700584 Simplexvirus Species 0.000 description 1
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 1
- 102220497176 Small vasohibin-binding protein_T47D_mutation Human genes 0.000 description 1
- 241000256251 Spodoptera frugiperda Species 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 230000024932 T cell mediated immunity Effects 0.000 description 1
- 102100022571 T cell receptor gamma constant 2 Human genes 0.000 description 1
- 102100035794 T-cell surface glycoprotein CD3 epsilon chain Human genes 0.000 description 1
- 101150025482 TRGC1 gene Proteins 0.000 description 1
- 101150080446 TRGC2 gene Proteins 0.000 description 1
- 102100036407 Thioredoxin Human genes 0.000 description 1
- 108090000190 Thrombin Proteins 0.000 description 1
- 102000006601 Thymidine Kinase Human genes 0.000 description 1
- 108020004440 Thymidine kinase Proteins 0.000 description 1
- 102000008235 Toll-Like Receptor 9 Human genes 0.000 description 1
- 108010060818 Toll-Like Receptor 9 Proteins 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 102100038282 V-type immunoglobulin domain-containing suppressor of T-cell activation Human genes 0.000 description 1
- 241000700618 Vaccinia virus Species 0.000 description 1
- 229930003316 Vitamin D Natural products 0.000 description 1
- QYSXJUFSXHHAJI-XFEUOLMDSA-N Vitamin D3 Natural products C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)CCCC(C)C)=C/C=C1\C[C@@H](O)CCC1=C QYSXJUFSXHHAJI-XFEUOLMDSA-N 0.000 description 1
- 206010047741 Vulval cancer Diseases 0.000 description 1
- UZQJVUCHXGYFLQ-AYDHOLPZSA-N [(2s,3r,4s,5r,6r)-4-[(2s,3r,4s,5r,6r)-4-[(2r,3r,4s,5r,6r)-4-[(2s,3r,4s,5r,6r)-3,5-dihydroxy-6-(hydroxymethyl)-4-[(2s,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoxan-2-yl]oxy-3,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-3,5-dihydroxy-6-(hy Chemical compound O([C@H]1[C@H](O)[C@@H](CO)O[C@H]([C@@H]1O)O[C@H]1[C@H](O)[C@@H](CO)O[C@H]([C@@H]1O)O[C@H]1CC[C@]2(C)[C@H]3CC=C4[C@@]([C@@]3(CC[C@H]2[C@@]1(C=O)C)C)(C)CC(O)[C@]1(CCC(CC14)(C)C)C(=O)O[C@H]1[C@@H]([C@@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O[C@H]4[C@@H]([C@@H](O[C@H]5[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O5)O)[C@H](O)[C@@H](CO)O4)O)[C@H](O)[C@@H](CO)O3)O)[C@H](O)[C@@H](CO)O2)O)[C@H](O)[C@@H](CO)O1)O)[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O UZQJVUCHXGYFLQ-AYDHOLPZSA-N 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000033289 adaptive immune response Effects 0.000 description 1
- 229960000643 adenine Drugs 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 description 1
- 230000000735 allogeneic effect Effects 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 229940037003 alum Drugs 0.000 description 1
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- ILRRQNADMUWWFW-UHFFFAOYSA-K aluminium phosphate Chemical compound O1[Al]2OP1(=O)O2 ILRRQNADMUWWFW-UHFFFAOYSA-K 0.000 description 1
- 229940126575 aminoglycoside Drugs 0.000 description 1
- 238000004873 anchoring Methods 0.000 description 1
- 238000000137 annealing Methods 0.000 description 1
- 230000003466 anti-cipated effect Effects 0.000 description 1
- 230000003302 anti-idiotype Effects 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 239000000611 antibody drug conjugate Substances 0.000 description 1
- 229940049595 antibody-drug conjugate Drugs 0.000 description 1
- 230000030741 antigen processing and presentation Effects 0.000 description 1
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 1
- 238000003149 assay kit Methods 0.000 description 1
- 229960003852 atezolizumab Drugs 0.000 description 1
- 229950002916 avelumab Drugs 0.000 description 1
- 229960002756 azacitidine Drugs 0.000 description 1
- 102000005936 beta-Galactosidase Human genes 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 238000001815 biotherapy Methods 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 210000002459 blastocyst Anatomy 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- RFCBNSCSPXMEBK-INFSMZHSSA-N c-GMP-AMP Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]3[C@@H](O)[C@H](N4C5=NC=NC(N)=C5N=C4)O[C@@H]3COP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=C(NC2=O)N)=C2N=C1 RFCBNSCSPXMEBK-INFSMZHSSA-N 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 238000002619 cancer immunotherapy Methods 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000022534 cell killing Effects 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 238000002659 cell therapy Methods 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 230000014564 chemokine production Effects 0.000 description 1
- 239000002576 chemokine receptor CXCR4 antagonist Substances 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 229960001265 ciclosporin Drugs 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- 239000013599 cloning vector Substances 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 230000008602 contraction Effects 0.000 description 1
- 239000013068 control sample Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 229940121384 cxc chemokine receptor type 4 (cxcr4) antagonist Drugs 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 229960000684 cytarabine Drugs 0.000 description 1
- 230000016396 cytokine production Effects 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 230000001461 cytolytic effect Effects 0.000 description 1
- 238000002784 cytotoxicity assay Methods 0.000 description 1
- 231100000263 cytotoxicity test Toxicity 0.000 description 1
- 238000007405 data analysis Methods 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000002050 diffraction method Methods 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 229950009791 durvalumab Drugs 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 229950006370 epacadostat Drugs 0.000 description 1
- 229940011871 estrogen Drugs 0.000 description 1
- 239000000262 estrogen Substances 0.000 description 1
- 102000015694 estrogen receptors Human genes 0.000 description 1
- 108010038795 estrogen receptors Proteins 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 231100000573 exposure to toxins Toxicity 0.000 description 1
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- IJJVMEJXYNJXOJ-UHFFFAOYSA-N fluquinconazole Chemical compound C=1C=C(Cl)C=C(Cl)C=1N1C(=O)C2=CC(F)=CC=C2N=C1N1C=NC=N1 IJJVMEJXYNJXOJ-UHFFFAOYSA-N 0.000 description 1
- 239000000446 fuel Substances 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 238000002825 functional assay Methods 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 230000005021 gait Effects 0.000 description 1
- 238000012252 genetic analysis Methods 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 239000003862 glucocorticoid Substances 0.000 description 1
- 230000007946 glucose deprivation Effects 0.000 description 1
- 229940116332 glucose oxidase Drugs 0.000 description 1
- 235000019420 glucose oxidase Nutrition 0.000 description 1
- 108010008714 glucose-regulated protein 170 Proteins 0.000 description 1
- 125000003630 glycyl group Chemical group [H]N([H])C([H])([H])C(*)=O 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 239000002554 heparinoid Substances 0.000 description 1
- 229940025770 heparinoids Drugs 0.000 description 1
- 238000013537 high throughput screening Methods 0.000 description 1
- 102000046158 human CTAG1B Human genes 0.000 description 1
- 102000048974 human HLA-B Human genes 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 229940075628 hypomethylating agent Drugs 0.000 description 1
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 1
- 229960001101 ifosfamide Drugs 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 210000001822 immobilized cell Anatomy 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000003053 immunization Effects 0.000 description 1
- 238000002649 immunization Methods 0.000 description 1
- 230000000984 immunochemical effect Effects 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 238000012151 immunohistochemical method Methods 0.000 description 1
- 238000003364 immunohistochemistry Methods 0.000 description 1
- 238000001114 immunoprecipitation Methods 0.000 description 1
- 230000003308 immunostimulating effect Effects 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 1
- CGIGDMFJXJATDK-UHFFFAOYSA-N indomethacin Chemical compound CC1=C(CC(O)=O)C2=CC(OC)=CC=C2N1C(=O)C1=CC=C(Cl)C=C1 CGIGDMFJXJATDK-UHFFFAOYSA-N 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000015788 innate immune response Effects 0.000 description 1
- 229960003130 interferon gamma Drugs 0.000 description 1
- 229960001388 interferon-beta Drugs 0.000 description 1
- 230000004068 intracellular signaling Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 230000002601 intratumoral effect Effects 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 238000005342 ion exchange Methods 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 238000012004 kinetic exclusion assay Methods 0.000 description 1
- 239000002523 lectin Substances 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 238000003670 luciferase enzyme activity assay Methods 0.000 description 1
- HWYHZTIRURJOHG-UHFFFAOYSA-N luminol Chemical compound O=C1NNC(=O)C2=C1C(N)=CC=C2 HWYHZTIRURJOHG-UHFFFAOYSA-N 0.000 description 1
- 108700021021 mRNA Vaccine Proteins 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 108020004084 membrane receptors Proteins 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- HPNSFSBZBAHARI-UHFFFAOYSA-N micophenolic acid Natural products OC1=C(CC=C(C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-UHFFFAOYSA-N 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 238000000386 microscopy Methods 0.000 description 1
- 239000003226 mitogen Substances 0.000 description 1
- 238000012900 molecular simulation Methods 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 229940035032 monophosphoryl lipid a Drugs 0.000 description 1
- 210000000214 mouth Anatomy 0.000 description 1
- 229960000951 mycophenolic acid Drugs 0.000 description 1
- HPNSFSBZBAHARI-RUDMXATFSA-N mycophenolic acid Chemical compound OC1=C(C\C=C(/C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-RUDMXATFSA-N 0.000 description 1
- 210000004897 n-terminal region Anatomy 0.000 description 1
- 210000000822 natural killer cell Anatomy 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 210000001331 nose Anatomy 0.000 description 1
- 238000007899 nucleic acid hybridization Methods 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 230000036542 oxidative stress Effects 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 229940023041 peptide vaccine Drugs 0.000 description 1
- 229930192851 perforin Natural products 0.000 description 1
- 210000005259 peripheral blood Anatomy 0.000 description 1
- 239000011886 peripheral blood Substances 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 229950010773 pidilizumab Drugs 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000037452 priming Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 125000001500 prolyl group Chemical group [H]N1C([H])(C(=O)[*])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 108020001580 protein domains Proteins 0.000 description 1
- 230000009145 protein modification Effects 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 238000004064 recycling Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 210000003289 regulatory T cell Anatomy 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 1
- 229930182490 saponin Natural products 0.000 description 1
- 150000007949 saponins Chemical class 0.000 description 1
- 235000017709 saponins Nutrition 0.000 description 1
- 238000007423 screening assay Methods 0.000 description 1
- 239000006152 selective media Substances 0.000 description 1
- 238000012764 semi-quantitative analysis Methods 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 230000035939 shock Effects 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 238000002741 site-directed mutagenesis Methods 0.000 description 1
- 238000004513 sizing Methods 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- 239000007909 solid dosage form Substances 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 230000000392 somatic effect Effects 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 229950007213 spartalizumab Drugs 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 239000012192 staining solution Substances 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 230000035882 stress Effects 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 229940037128 systemic glucocorticoids Drugs 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 229910052713 technetium Inorganic materials 0.000 description 1
- GKLVYJBZJHMRIY-UHFFFAOYSA-N technetium atom Chemical compound [Tc] GKLVYJBZJHMRIY-UHFFFAOYSA-N 0.000 description 1
- 210000001550 testis Anatomy 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 229940040944 tetracyclines Drugs 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- MPLHNVLQVRSVEE-UHFFFAOYSA-N texas red Chemical compound [O-]S(=O)(=O)C1=CC(S(Cl)(=O)=O)=CC=C1C(C1=CC=2CCCN3CCCC(C=23)=C1O1)=C2C1=C(CCC1)C3=[N+]1CCCC3=C2 MPLHNVLQVRSVEE-UHFFFAOYSA-N 0.000 description 1
- 238000010257 thawing Methods 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- 108060008226 thioredoxin Proteins 0.000 description 1
- 229940094937 thioredoxin Drugs 0.000 description 1
- 229960004072 thrombin Drugs 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 230000026683 transduction Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 102000035160 transmembrane proteins Human genes 0.000 description 1
- 108091005703 transmembrane proteins Proteins 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 241001515965 unidentified phage Species 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 125000002987 valine group Chemical group [H]N([H])C([H])(C(*)=O)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 235000019166 vitamin D Nutrition 0.000 description 1
- 239000011710 vitamin D Substances 0.000 description 1
- 150000003710 vitamin D derivatives Chemical class 0.000 description 1
- 102000009310 vitamin D receptors Human genes 0.000 description 1
- 108050000156 vitamin D receptors Proteins 0.000 description 1
- 229940046008 vitamin d Drugs 0.000 description 1
- 201000005102 vulva cancer Diseases 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 238000002424 x-ray crystallography Methods 0.000 description 1
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/6425—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent the peptide or protein in the drug conjugate being a receptor, e.g. CD4, a cell surface antigen, i.e. not a peptide ligand targeting the antigen, or a cell surface determinant, i.e. a part of the surface of a cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/461—Cellular immunotherapy characterised by the cell type used
- A61K39/4611—T-cells, e.g. tumor infiltrating lymphocytes [TIL], lymphokine-activated killer cells [LAK] or regulatory T cells [Treg]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/463—Cellular immunotherapy characterised by recombinant expression
- A61K39/4632—T-cell receptors [TCR]; antibody T-cell receptor constructs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464484—Cancer testis antigens, e.g. SSX, BAGE, GAGE or SAGE
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464484—Cancer testis antigens, e.g. SSX, BAGE, GAGE or SAGE
- A61K39/464488—NY-ESO
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/46449—Melanoma antigens
- A61K39/464491—Melan-A/MART
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/65—Peptidic linkers, binders or spacers, e.g. peptidic enzyme-labile linkers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
- C07K14/08—RNA viruses
- C07K14/085—Picornaviridae, e.g. coxsackie virus, echovirus, enterovirus
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70539—MHC-molecules, e.g. HLA-molecules
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3069—Reproductive system, e.g. ovaria, uterus, testes, prostate
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5156—Animal cells expressing foreign proteins
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/32—Immunoglobulins specific features characterized by aspects of specificity or valency specific for a neo-epitope on a complex, e.g. antibody-antigen or ligand-receptor
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/02—Fusion polypeptide containing a localisation/targetting motif containing a signal sequence
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Genetics & Genomics (AREA)
- Cell Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Molecular Biology (AREA)
- Engineering & Computer Science (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
- Microbiology (AREA)
- Zoology (AREA)
- Mycology (AREA)
- Gastroenterology & Hepatology (AREA)
- Toxicology (AREA)
- Oncology (AREA)
- Virology (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Biomedical Technology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
- Pregnancy & Childbirth (AREA)
- Reproductive Health (AREA)
- Gynecology & Obstetrics (AREA)
- Peptides Or Proteins (AREA)
Abstract
TCR(예를 들어, NY-ESO-1에 결합하는 TCR), 이 TCR을 포함하는 세포 및 약제학적 조성물, 이 TCR을 암호화하는 핵산, 이 TCR을 제조하기 위한 발현 벡터 및 숙주 세포, 및 이 TCR을 사용하여 대상체를 치료하는 방법이 제공된다.
Description
관련 출원
본 출원은 2017년 1월 13일자로 출원된 미국 가출원 제62/446,084호(본 명세서에 그 전문이 참고로 포함됨)의 이익을 주장한다.
분야
본 개시내용은 NY-ESO-1 펩타이드에 결합하는 T 세포 수용체(TCR) 및 이를 사용하는 방법에 관한 것이다.
NY-ESO-1은 암/고환 항원 1A 또는 1B(CTAG1A 또는 CTAG1B) 유전자에 의해 암호화된 종양 연관된 항원이다. 이것은 글라이신 농후 N 말단 영역 및 소수성 C 말단 영역을 갖는 세포질 단백질이다. NY-ESO-1은 정상 체세포 조직이 아니라 생식 세포에서 발현된다. NY-ESO-1의 비정상 발현은 많은 유형의 종양, 예컨대 흑색종, 전립선암, 다발성 골수종, 유방암 및 폐암에서 확인되었다. 이의 종양 특이적 발현 프로필의 검토 시, NY-ESO-1은 암 치료에 대한 표적으로서 대단한 장래성을 보유한다.
따라서, NY-ESO-1을 발현하는 암 세포를 인식하고 이 세포에 대해 면역 반응을 지향시킬 수 있는 신규한 조성물에 대한 수요가 당해 분야에 있다.
본 개시내용은 TCR(예를 들어, NY-ESO-1에 결합하는 TCR), 이 TCR을 포함하는 세포 및 약제학적 조성물, 이 TCR을 암호화하는 핵산, 이 TCR을 제조하기 위한 발현 벡터 및 숙주 세포, 및 이 TCR을 사용하여 대상체를 치료하는 방법을 제공한다. 본 명세서에 개시된 TCR은 NY-ESO-1을 발현하는 암 세포에 대한 면역 반응을 지시하고, 대상체에서 NY-ESO-1 발현 암을 치료하는 데 특히 유용하다.
따라서, 일 양태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 단리된 T 세포 수용체(T cell receptor: TCR)를 제공하고, TCR은 상보성 결정 영역 CDR3α를 포함하는 α 사슬 가변 영역(Vα)을 포함하고, 여기서 CDR3α는 서열 번호 61, 62, 63, 64 또는 65에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, CDR3α는 서열 번호 64 또는 65에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, CDR3α는 서열 번호 7 및 39 내지 60으로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, CDR3α는 서열 번호 7, 39, 40, 43, 45, 47, 49 및 54로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다.
소정의 실시형태에서, Vα는 각각 서열 번호 5 및 6에 제시된 아미노산 서열을 포함하는 CDR1α 및 CDR2α를 포함한다. 소정의 실시형태에서, Vα는 각각 서열 번호 5, 6 및 7; 5, 6 및 39; 5, 6 및 40; 5, 6 및 41; 5, 6 및 42; 5, 6 및 43; 5, 6 및 44; 5, 6 및 45; 5, 6 및 46; 5, 6 및 47; 5, 6 및 48; 5, 6 및 49; 5, 6 및 50; 5, 6 및 51; 5, 6 및 52; 5, 6 및 53; 5, 6 및 54; 5, 6 및 55; 5, 6 및 56; 5, 6 및 57; 5, 6 및 58; 5, 6 및 59; 또는 5, 6 및 60에 제시된 아미노산 서열을 포함하는 CDR1α, CDR2α 및 CDR3α를 포함한다. 소정의 실시형태에서, Vα는 서열 번호 87 내지 91로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, Vα는 서열 번호 3 및 66 내지 86으로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, Vα는 서열 번호 3, 66, 69, 71, 73, 75 및 80으로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, 단리된 TCR은 서열 번호 13, 93 내지 96, 105 내지 118, 120 내지 123, 125 내지 128 및 408 내지 415로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 α 사슬을 포함한다. 소정의 실시형태에서, 단리된 TCR은 서열 번호 13, 105, 110, 115, 120, 125, 408 및 412로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 α 사슬을 포함한다.
소정의 실시형태에서, TCR은 CDR3β를 포함하는 β 사슬 가변 영역(Vβ)을 포함하고, 여기서 CDR3β는 서열 번호 10에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, Vβ는 각각 서열 번호 8 및 9에 제시된 아미노산 서열을 포함하는 CDR1β 및 CDR2β를 포함한다. 소정의 실시형태에서, Vβ는 서열 번호 4에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, 단리된 TCR은 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 β 사슬을 포함한다.
또 다른 양태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 단리된 T 세포 수용체(TCR)를 제공하고, TCR은 상보성 결정 영역 CDR3β를 포함하는 β 사슬 가변 영역(Vβ)을 포함하고, 여기서 CDR3β는 서열 번호 10에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, Vβ는 각각 서열 번호 8 및 9에 제시된 아미노산 서열을 포함하는 CDR1β 및 CDR2β를 포함한다. 소정의 실시형태에서, Vβ는 서열 번호 4에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, 단리된 TCR은 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 β 사슬을 포함한다.
또 다른 양태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 단리된 T 세포 수용체(TCR)를 제공하고, TCR은 서열 번호 18에 제시된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95%, 99% 또는 100% 동일한 아미노산 서열을 포함하는 α 사슬 가변 영역(Vα)을 포함한다. 소정의 실시형태에서, Vα는 서열 번호 18에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, TCR은 서열 번호 19에 제시된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95%, 99% 또는 100% 동일한 아미노산 서열을 포함하는 β 사슬 가변 영역(Vβ)을 포함한다. 소정의 실시형태에서, Vβ는 서열 번호 19에 제시된 아미노산 서열을 포함한다.
또 다른 양태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 단리된 T 세포 수용체(TCR)를 제공하고, TCR은 서열 번호 19에 제시된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95%, 99% 또는 100% 동일한 아미노산 서열을 포함하는 β 사슬 가변 영역(Vβ)을 포함한다. 소정의 실시형태에서, Vβ는 서열 번호 19에 제시된 아미노산 서열을 포함한다.
본 명세서에 개시된 TCR의 임의의 양태의 소정의 실시형태에서, TCR은 CDR1α, CDR2α 및 CDR3α를 포함하는 α 사슬 가변 영역(Vα), 및 CDR1β, CDR2β 및 CDR3β를 포함하는 β 사슬 가변 영역(Vβ)을 포함하고, 여기서 CDR1α, CDR2α, CDR3α, CDR1β, CDR2β 및 CDR3β는 각각 서열 번호 5, 6, 7, 8, 9 및 10; 5, 6, 39, 8, 9 및 10; 5, 6, 40, 8, 9 및 10; 5, 6, 41, 8, 9 및 10; 5, 6, 42, 8, 9 및 10; 5, 6, 43, 8, 9 및 10; 5, 6, 44, 8, 9 및 10; 5, 6, 45, 8, 9 및 10; 5, 6, 46, 8, 9 및 10; 5, 6, 47, 8, 9 및 10; 5, 6, 48, 8, 9 및 10; 5, 6, 49, 8, 9 및 10; 5, 6, 50, 8, 9 및 10; 5, 6, 51, 8, 9 및 10; 5, 6, 52, 8, 9 및 10; 5, 6, 53, 8, 9 및 10; 5, 6, 54, 8, 9 및 10; 5, 6, 55, 8, 9 및 10; 5, 6, 56, 8, 9 및 10; 5, 6, 57, 8, 9 및 10; 5, 6, 58, 8, 9 및 10; 5, 6, 59, 8, 9 및 10; 또는 5, 6, 60, 8, 9 및 10에 제시된 아미노산 서열을 포함한다.
또 다른 양태에서, 본 개시내용은 상보성 결정 영역 CDR1α, CDR2α 및 CDR3α를 포함하는 α 사슬 가변 영역(Vα), 및 CDR1β, CDR2β 및 CDR3β를 포함하는 β 사슬 가변 영역(Vβ)을 포함하는 단리된 TCR을 제공하고, 여기서 CDR1α, CDR2α, CDR3α, CDR1β, CDR2β 및 CDR3β는 각각 서열 번호 5, 6, 7, 8, 9 및 10; 5, 6, 39, 8, 9 및 10; 5, 6, 40, 8, 9 및 10; 5, 6, 41, 8, 9 및 10; 5, 6, 42, 8, 9 및 10; 5, 6, 43, 8, 9 및 10; 5, 6, 44, 8, 9 및 10; 5, 6, 45, 8, 9 및 10; 5, 6, 46, 8, 9 및 10; 5, 6, 47, 8, 9 및 10; 5, 6, 48, 8, 9 및 10; 5, 6, 49, 8, 9 및 10; 5, 6, 50, 8, 9 및 10; 5, 6, 51, 8, 9 및 10; 5, 6, 52, 8, 9 및 10; 5, 6, 53, 8, 9 및 10; 5, 6, 54, 8, 9 및 10; 5, 6, 55, 8, 9 및 10; 5, 6, 56, 8, 9 및 10; 5, 6, 57, 8, 9 및 10; 5, 6, 58, 8, 9 및 10; 5, 6, 59, 8, 9 및 10; 또는 5, 6, 60, 8, 9 및 10에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, Vα 및 Vβ는 각각 서열 번호 3 및 4, 66 및 4, 67 및 4, 68 및 4, 69 및 4, 70 및 4, 71 및 4, 72 및 4, 73 및 4, 74 및 4, 75 및 4, 76 및 4, 77 및 4, 78 및 4, 79 및 4, 80 및 4, 81 및 4, 82 및 4, 83 및 4, 84 및 4, 85 및 4, 또는 86 및 4에 제시된 아미노산 서열을 포함한다.
소정의 실시형태에서, TCR은 서열 번호 15, 26 또는 92에 제시된 아미노산 서열을 포함하는 α 사슬 불변 영역을 포함하는 α 사슬을 포함한다. 소정의 실시형태에서, α 사슬 불변 영역은 서열 번호 26에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, TCR은 서열 번호 16 또는 17에 제시된 아미노산 서열을 포함하는 β 사슬 불변 영역을 포함하는 β 사슬을 포함한다. 소정의 실시형태에서, β 사슬 불변 영역은 서열 번호 16에 제시된 아미노산 서열을 포함한다.
또 다른 양태에서, 본 개시내용은 α 사슬 및 β 사슬을 포함하는 단리된 TCR을 제공하고, 여기서 α 사슬은 서열 번호 13, 93 내지 96, 105 내지 118, 120 내지 123, 125 내지 128 및 408 내지 415로 이루어진 군으로부터 선택된 아미노산 서열을 포함하고, β 사슬은 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬은 서열 번호 13, 105, 110, 115, 120, 125, 408 및 412로 이루어진 군으로부터 선택된 아미노산 서열을 포함하고, β 사슬은 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다.
본 명세서에 개시된 TCR의 임의의 양태의 소정의 실시형태에서, α 사슬 및 β 사슬은 각각 서열 번호 13 및 14; 13 및 25; 13 및 97; 13 및 98; 13 및 99; 13 및 100; 13 및 101; 13 및 102; 13 및 103; 13 및 104; 93 및 14; 93 및 25; 93 및 97; 93 및 98; 93 및 99; 93 및 100; 93 및 101; 93 및 102; 93 및 103; 93 및 104; 94 및 14; 94 및 25; 94 및 97; 94 및 98; 94 및 99; 94 및 100; 94 및 101; 94 및 102; 94 및 103; 94 및 104; 95 및 14; 95 및 25; 95 및 97; 95 및 98; 95 및 99; 95 및 100; 95 및 101; 95 및 102; 95 및 103; 95 및 104; 96 및 14; 96 및 25; 96 및 97; 96 및 98; 96 및 99; 96 및 100; 96 및 101; 96 및 102; 96 및 103; 96 및 104; 105 및 14; 105 및 25; 105 및 97; 105 및 98; 105 및 99; 105 및 100; 105 및 101; 105 및 102; 105 및 103; 105 및 104; 106 및 14; 106 및 25; 106 및 97; 106 및 98; 106 및 99; 106 및 100; 106 및 101; 106 및 102; 106 및 103; 106 및 104; 107 및 14; 107 및 25; 107 및 97; 107 및 98; 107 및 99; 107 및 100; 107 및 101; 107 및 102; 107 및 103; 107 및 104; 108 및 14; 108 및 25; 108 및 97; 108 및 98; 108 및 99; 108 및 100; 108 및 101; 108 및 102; 108 및 103; 108 및 104; 109 및 14; 109 및 25; 109 및 97; 109 및 98; 109 및 99; 109 및 100; 109 및 101; 109 및 102; 109 및 103; 109 및 104; 110 및 14; 110 및 25; 110 및 97; 110 및 98; 110 및 99; 110 및 100; 110 및 101; 110 및 102; 110 및 103; 110 및 104; 111 및 14; 111 및 25; 111 및 97; 111 및 98; 111 및 99; 111 및 100; 111 및 101; 111 및 102; 111 및 103; 111 및 104; 112 및 14; 112 및 25; 112 및 97; 112 및 98; 112 및 99; 112 및 100; 112 및 101; 112 및 102; 112 및 103; 112 및 104; 113 및 14; 113 및 25; 113 및 97; 113 및 98; 113 및 99; 113 및 100; 113 및 101; 113 및 102; 113 및 103; 113 및 104; 114 및 14; 114 및 25; 114 및 97; 114 및 98; 114 및 99; 114 및 100; 114 및 101; 114 및 102; 114 및 103; 114 및 104; 115 및 14; 115 및 25; 115 및 97; 115 및 98; 115 및 99; 115 및 100; 115 및 101; 115 및 102; 115 및 103; 115 및 104; 116 및 14; 116 및 25; 116 및 97; 116 및 98; 116 및 99; 116 및 100; 116 및 101; 116 및 102; 116 및 103; 116 및 104; 117 및 14; 117 및 25; 117 및 97; 117 및 98; 117 및 99; 117 및 100; 117 및 101; 117 및 102; 117 및 103; 117 및 104; 118 및 14; 118 및 25; 118 및 97; 118 및 98; 118 및 99; 118 및 100; 118 및 101; 118 및 102; 118 및 103; 118 및 104; 120 및 14; 120 및 25; 120 및 97; 120 및 98; 120 및 99; 120 및 100; 120 및 101; 120 및 102; 120 및 103; 120 및 104; 121 및 14; 121 및 25; 121 및 97; 121 및 98; 121 및 99; 121 및 100; 121 및 101; 121 및 102; 121 및 103; 121 및 104; 122 및 14; 122 및 25; 122 및 97; 122 및 98; 122 및 99; 122 및 100; 122 및 101; 122 및 102; 122 및 103; 122 및 104; 123 및 14; 123 및 25; 123 및 97; 123 및 98; 123 및 99; 123 및 100; 123 및 101; 123 및 102; 123 및 103; 123 및 104; 125 및 14; 125 및 25; 125 및 97; 125 및 98; 125 및 99; 125 및 100; 125 및 101; 125 및 102; 125 및 103; 125 및 104; 126 및 14; 126 및 25; 126 및 97; 126 및 98; 126 및 99; 126 및 100; 126 및 101; 126 및 102; 126 및 103; 126 및 104; 127 및 14; 127 및 25; 127 및 97; 127 및 98; 127 및 99; 127 및 100; 127 및 101; 127 및 102; 127 및 103; 127 및 104; 128 및 14; 128 및 25; 128 및 97; 128 및 98; 128 및 99; 128 및 100; 128 및 101; 128 및 102; 128 및 103; 128 및 104; 408 및 14; 408 및 25; 408 및 97; 408 및 98; 408 및 99; 408 및 100; 408 및 101; 408 및 102; 408 및 103; 408 및 104; 409 및 14; 409 및 25; 409 및 97; 409 및 98; 409 및 99; 409 및 100; 409 및 101; 409 및 102; 409 및 103; 409 및 104; 410 및 14; 410 및 25; 410 및 97; 410 및 98; 410 및 99; 410 및 100; 410 및 101; 410 및 102; 410 및 103; 410 및 104; 411 및 14; 411 및 25; 411 및 97; 411 및 98; 411 및 99; 411 및 100; 411 및 101; 411 및 102; 411 및 103; 411 및 104; 412 및 14; 412 및 25; 412 및 97; 412 및 98; 412 및 99; 412 및 100; 412 및 101; 412 및 102; 412 및 103; 412 및 104; 413 및 14; 413 및 25; 413 및 97; 413 및 98; 413 및 99; 413 및 100; 413 및 101; 413 및 102; 413 및 103; 413 및 104; 414 및 14; 414 및 25; 414 및 97; 414 및 98; 414 및 99; 414 및 100; 414 및 101; 414 및 102; 414 및 103; 414 및 104; 415 및 14; 415 및 25; 415 및 97; 415 및 98; 415 및 99; 415 및 100; 415 및 101; 415 및 102; 415 및 103; 또는 415 및 104에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬 및 β 사슬은 각각 서열 번호 13 및 14; 13 및 25; 105 및 14; 105 및 25; 110 및 14; 110 및 25; 115 및 14; 115 및 25; 120 및 14; 120 및 25; 125 및 14; 125 및 25; 408 및 14; 408 및 25; 412 및 14; 또는 412 및 25에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬 및 β 사슬은 각각 서열 번호 13 및 14; 105 및 14; 110 및 14; 115 및 14; 120 및 14; 125 및 14; 408 및 14; 또는 412 및 14에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, TCR은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합한다.
또 다른 양태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 T 세포 수용체(TCR)의 α 사슬 가변 영역(Vα) 및 β 사슬 가변 영역(Vβ)을 포함하는 폴리펩타이드를 제공하고, 여기서 Vα는 상보성 결정 영역 CDR3α를 포함하고, CDR3α는 서열 번호 61, 62, 63, 64 또는 65에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, CDR3α는 서열 번호 64 또는 65에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, CDR3α는 서열 번호 7 및 39 내지 60으로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, CDR3α는 서열 번호 7, 39, 40, 43, 45, 47, 49 및 54로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다.
소정의 실시형태에서, Vα는 각각 서열 번호 5 및 6에 제시된 아미노산 서열을 포함하는 CDR1α 및 CDR2α를 포함한다. 소정의 실시형태에서, Vα는 각각 서열 번호 5, 6 및 7; 5, 6 및 39; 5, 6 및 40; 5, 6 및 41; 5, 6 및 42; 5, 6 및 43; 5, 6 및 44; 5, 6 및 45; 5, 6 및 46; 5, 6 및 47; 5, 6 및 48; 5, 6 및 49; 5, 6 및 50; 5, 6 및 51; 5, 6 및 52; 5, 6 및 53; 5, 6 및 54; 5, 6 및 55; 5, 6 및 56; 5, 6 및 57; 5, 6 및 58; 5, 6 및 59; 또는 5, 6 및 60에 제시된 아미노산 서열을 포함하는 CDR1α, CDR2α 및 CDR3α를 포함한다. 소정의 실시형태에서, Vα는 서열 번호 87 내지 91로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, Vα는 서열 번호 3 및 66 내지 86으로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, Vα는 서열 번호 3, 66, 69, 71, 73, 75 및 80으로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, 폴리펩타이드는 서열 번호 13, 93 내지 96, 105 내지 118, 120 내지 123, 125 내지 128 및 408 내지 415로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 α 사슬을 포함한다. 소정의 실시형태에서, 폴리펩타이드는 서열 번호 13, 105, 110, 115, 120, 125, 408 및 412로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 α 사슬을 포함한다.
소정의 실시형태에서, Vβ는 CDR3β를 포함하고, 여기서 CDR3β는 서열 번호 10에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, Vβ는 각각 서열 번호 8 및 9에 제시된 아미노산 서열을 포함하는 CDR1β 및 CDR2β를 포함한다. 소정의 실시형태에서, Vβ는 서열 번호 4에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, 폴리펩타이드는 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 β 사슬을 포함한다.
또 다른 양태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR의 Vα 및 Vβ를 포함하는 폴리펩타이드를 제공하고, 여기서 Vβ는 상보성 결정 영역 CDR3β를 포함하고, CDR3β는 서열 번호 10에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, Vβ는 각각 서열 번호 8 및 9에 제시된 아미노산 서열을 포함하는 CDR1β 및 CDR2β를 포함한다. 소정의 실시형태에서, Vβ는 서열 번호 4에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, 폴리펩타이드는 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 β 사슬을 포함한다.
또 다른 양태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR의 Vα 및 Vβ를 포함하는 폴리펩타이드를 제공하고, 여기서 Vα는 서열 번호 18에 제시된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95%, 99% 또는 100% 동일한 아미노산 서열을 포함한다. 소정의 실시형태에서, Vα는 서열 번호 18에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, Vβ는 서열 번호 19에 제시된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95%, 99% 또는 100% 동일한 아미노산 서열을 포함한다. 소정의 실시형태에서, Vβ는 서열 번호 19에 제시된 아미노산 서열을 포함한다.
또 다른 양태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR의 Vα 및 Vβ를 포함하는 폴리펩타이드를 제공하고, 여기서 Vβ는 서열 번호 19에 제시된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95%, 99% 또는 100% 동일한 아미노산 서열을 포함한다. 소정의 실시형태에서, Vβ는 서열 번호 19에 제시된 아미노산 서열을 포함한다.
본 명세서에 개시된 폴리펩타이드의 임의의 양태의 소정의 실시형태에서, Vα는 CDR1α, CDR2α 및 CDR3α를 포함하고, Vβ는 CDR1β, CDR2β 및 CDR3β를 포함하고, 여기서 CDR1α, CDR2α, CDR3α, CDR1β, CDR2β 및 CDR3β는 각각 서열 번호 5, 6, 7, 8, 9 및 10; 5, 6, 39, 8, 9 및 10; 5, 6, 40, 8, 9 및 10; 5, 6, 41, 8, 9 및 10; 5, 6, 42, 8, 9 및 10; 5, 6, 43, 8, 9 및 10; 5, 6, 44, 8, 9 및 10; 5, 6, 45, 8, 9 및 10; 5, 6, 46, 8, 9 및 10; 5, 6, 47, 8, 9 및 10; 5, 6, 48, 8, 9 및 10; 5, 6, 49, 8, 9 및 10; 5, 6, 50, 8, 9 및 10; 5, 6, 51, 8, 9 및 10; 5, 6, 52, 8, 9 및 10; 5, 6, 53, 8, 9 및 10; 5, 6, 54, 8, 9 및 10; 5, 6, 55, 8, 9 및 10; 5, 6, 56, 8, 9 및 10; 5, 6, 57, 8, 9 및 10; 5, 6, 58, 8, 9 및 10; 5, 6, 59, 8, 9 및 10; 또는 5, 6, 60, 8, 9 및 10에 제시된 아미노산 서열을 포함한다.
또 다른 양태에서, 본 개시내용은 TCR의 Vα 및 Vβ를 포함하는 폴리펩타이드를 제공하고, 여기서 Vα는 상보성 결정 영역 CDR1α, CDR2α 및 CDR3α를 포함하고, Vβ는 CDR1β, CDR2β 및 CDR3β를 포함하고, CDR1α, CDR2α, CDR3α, CDR1β, CDR2β 및 CDR3β는 각각 서열 번호 5, 6, 7, 8, 9 및 10; 5, 6, 39, 8, 9 및 10; 5, 6, 40, 8, 9 및 10; 5, 6, 41, 8, 9 및 10; 5, 6, 42, 8, 9 및 10; 5, 6, 43, 8, 9 및 10; 5, 6, 44, 8, 9 및 10; 5, 6, 45, 8, 9 및 10; 5, 6, 46, 8, 9 및 10; 5, 6, 47, 8, 9 및 10; 5, 6, 48, 8, 9 및 10; 5, 6, 49, 8, 9 및 10; 5, 6, 50, 8, 9 및 10; 5, 6, 51, 8, 9 및 10; 5, 6, 52, 8, 9 및 10; 5, 6, 53, 8, 9 및 10; 5, 6, 54, 8, 9 및 10; 5, 6, 55, 8, 9 및 10; 5, 6, 56, 8, 9 및 10; 5, 6, 57, 8, 9 및 10; 5, 6, 58, 8, 9 및 10; 5, 6, 59, 8, 9 및 10; 또는 5, 6, 60, 8, 9 및 10에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, Vα 및 Vβ는 각각 서열 번호 3 및 4, 66 및 4, 67 및 4, 68 및 4, 69 및 4, 70 및 4, 71 및 4, 72 및 4, 73 및 4, 74 및 4, 75 및 4, 76 및 4, 77 및 4, 78 및 4, 79 및 4, 80 및 4, 81 및 4, 82 및 4, 83 및 4, 84 및 4, 85 및 4, 또는 86 및 4에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬 불변 영역을 포함하는 α 사슬은 서열 번호 15, 26 또는 92에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬 불변 영역은 서열 번호 26에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, 폴리펩타이드는 서열 번호 16 또는 17에 제시된 아미노산 서열을 포함하는 β 사슬 불변 영역을 포함하는 β 사슬을 포함한다. 소정의 실시형태에서, β 사슬 불변 영역은 서열 번호 16에 제시된 아미노산 서열을 포함한다.
상기 양태의 소정의 실시형태에서, α 사슬은 서열 번호 13, 93 내지 96, 105 내지 118, 120 내지 123, 125 내지 128 및 408 내지 415로 이루어진 군으로부터 선택된 아미노산 서열을 포함하고, β 사슬은 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬은 서열 번호 13, 105, 110, 115, 120, 125, 408 및 412로 이루어진 군으로부터 선택된 아미노산 서열을 포함하고, β 사슬은 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬은 서열 번호 13, 105, 110, 115, 120, 125, 408 및 412로 이루어진 군으로부터 선택된 아미노산 서열을 포함하고, β 사슬은 서열 번호 14, 97, 99, 101 및 103으로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다.
또 다른 양태에서, 본 개시내용은 TCR의 α 사슬 및 β 사슬을 포함하는 폴리펩타이드를 제공하고, 여기서 α 사슬은 서열 번호 13, 93 내지 96, 105 내지 118, 120 내지 123, 125 내지 128 및 408 내지 415로 이루어진 군으로부터 선택된 아미노산 서열을 포함하고, β 사슬은 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬은 서열 번호 13, 105, 110, 115, 120, 125, 408 및 412로 이루어진 군으로부터 선택된 아미노산 서열을 포함하고, β 사슬은 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬은 서열 번호 13, 105, 110, 115, 120, 125, 408 및 412로 이루어진 군으로부터 선택된 아미노산 서열을 포함하고, β 사슬은 서열 번호 14, 97, 99, 101 및 103으로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다.
본 명세서에 개시된 폴리펩타이드의 임의의 양태의 소정의 실시형태에서, α 사슬 및 β 사슬은 각각 서열 번호 13 및 14; 13 및 25; 13 및 97; 13 및 98; 13 및 99; 13 및 100; 13 및 101; 13 및 102; 13 및 103; 13 및 104; 93 및 14; 93 및 25; 93 및 97; 93 및 98; 93 및 99; 93 및 100; 93 및 101; 93 및 102; 93 및 103; 93 및 104; 94 및 14; 94 및 25; 94 및 97; 94 및 98; 94 및 99; 94 및 100; 94 및 101; 94 및 102; 94 및 103; 94 및 104; 95 및 14; 95 및 25; 95 및 97; 95 및 98; 95 및 99; 95 및 100; 95 및 101; 95 및 102; 95 및 103; 95 및 104; 96 및 14; 96 및 25; 96 및 97; 96 및 98; 96 및 99; 96 및 100; 96 및 101; 96 및 102; 96 및 103; 96 및 104; 105 및 14; 105 및 25; 105 및 97; 105 및 98; 105 및 99; 105 및 100; 105 및 101; 105 및 102; 105 및 103; 105 및 104; 106 및 14; 106 및 25; 106 및 97; 106 및 98; 106 및 99; 106 및 100; 106 및 101; 106 및 102; 106 및 103; 106 및 104; 107 및 14; 107 및 25; 107 및 97; 107 및 98; 107 및 99; 107 및 100; 107 및 101; 107 및 102; 107 및 103; 107 및 104; 108 및 14; 108 및 25; 108 및 97; 108 및 98; 108 및 99; 108 및 100; 108 및 101; 108 및 102; 108 및 103; 108 및 104; 109 및 14; 109 및 25; 109 및 97; 109 및 98; 109 및 99; 109 및 100; 109 및 101; 109 및 102; 109 및 103; 109 및 104; 110 및 14; 110 및 25; 110 및 97; 110 및 98; 110 및 99; 110 및 100; 110 및 101; 110 및 102; 110 및 103; 110 및 104; 111 및 14; 111 및 25; 111 및 97; 111 및 98; 111 및 99; 111 및 100; 111 및 101; 111 및 102; 111 및 103; 111 및 104; 112 및 14; 112 및 25; 112 및 97; 112 및 98; 112 및 99; 112 및 100; 112 및 101; 112 및 102; 112 및 103; 112 및 104; 113 및 14; 113 및 25; 113 및 97; 113 및 98; 113 및 99; 113 및 100; 113 및 101; 113 및 102; 113 및 103; 113 및 104; 114 및 14; 114 및 25; 114 및 97; 114 및 98; 114 및 99; 114 및 100; 114 및 101; 114 및 102; 114 및 103; 114 및 104; 115 및 14; 115 및 25; 115 및 97; 115 및 98; 115 및 99; 115 및 100; 115 및 101; 115 및 102; 115 및 103; 115 및 104; 116 및 14; 116 및 25; 116 및 97; 116 및 98; 116 및 99; 116 및 100; 116 및 101; 116 및 102; 116 및 103; 116 및 104; 117 및 14; 117 및 25; 117 및 97; 117 및 98; 117 및 99; 117 및 100; 117 및 101; 117 및 102; 117 및 103; 117 및 104; 118 및 14; 118 및 25; 118 및 97; 118 및 98; 118 및 99; 118 및 100; 118 및 101; 118 및 102; 118 및 103; 118 및 104; 120 및 14; 120 및 25; 120 및 97; 120 및 98; 120 및 99; 120 및 100; 120 및 101; 120 및 102; 120 및 103; 120 및 104; 121 및 14; 121 및 25; 121 및 97; 121 및 98; 121 및 99; 121 및 100; 121 및 101; 121 및 102; 121 및 103; 121 및 104; 122 및 14; 122 및 25; 122 및 97; 122 및 98; 122 및 99; 122 및 100; 122 및 101; 122 및 102; 122 및 103; 122 및 104; 123 및 14; 123 및 25; 123 및 97; 123 및 98; 123 및 99; 123 및 100; 123 및 101; 123 및 102; 123 및 103; 123 및 104; 125 및 14; 125 및 25; 125 및 97; 125 및 98; 125 및 99; 125 및 100; 125 및 101; 125 및 102; 125 및 103; 125 및 104; 126 및 14; 126 및 25; 126 및 97; 126 및 98; 126 및 99; 126 및 100; 126 및 101; 126 및 102; 126 및 103; 126 및 104; 127 및 14; 127 및 25; 127 및 97; 127 및 98; 127 및 99; 127 및 100; 127 및 101; 127 및 102; 127 및 103; 127 및 104; 128 및 14; 128 및 25; 128 및 97; 128 및 98; 128 및 99; 128 및 100; 128 및 101; 128 및 102; 128 및 103; 128 및 104; 408 및 14; 408 및 25; 408 및 97; 408 및 98; 408 및 99; 408 및 100; 408 및 101; 408 및 102; 408 및 103; 408 및 104; 409 및 14; 409 및 25; 409 및 97; 409 및 98; 409 및 99; 409 및 100; 409 및 101; 409 및 102; 409 및 103; 409 및 104; 410 및 14; 410 및 25; 410 및 97; 410 및 98; 410 및 99; 410 및 100; 410 및 101; 410 및 102; 410 및 103; 410 및 104; 411 및 14; 411 및 25; 411 및 97; 411 및 98; 411 및 99; 411 및 100; 411 및 101; 411 및 102; 411 및 103; 411 및 104; 412 및 14; 412 및 25; 412 및 97; 412 및 98; 412 및 99; 412 및 100; 412 및 101; 412 및 102; 412 및 103; 412 및 104; 413 및 14; 413 및 25; 413 및 97; 413 및 98; 413 및 99; 413 및 100; 413 및 101; 413 및 102; 413 및 103; 413 및 104; 414 및 14; 414 및 25; 414 및 97; 414 및 98; 414 및 99; 414 및 100; 414 및 101; 414 및 102; 414 및 103; 414 및 104; 415 및 14; 415 및 25; 415 및 97; 415 및 98; 415 및 99; 415 및 100; 415 및 101; 415 및 102; 415 및 103; 또는 415 및 104에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬 및 β 사슬은 각각 서열 번호 13 및 14; 13 및 25; 105 및 14; 105 및 25; 110 및 14; 110 및 25; 115 및 14; 115 및 25; 120 및 14; 120 및 25; 125 및 14; 125 및 25; 408 및 14; 408 및 25; 412 및 14; 또는 412 및 25에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬 및 β 사슬은 각각 서열 번호 13 및 14; 105 및 14; 110 및 14; 115 및 14; 120 및 14; 125 및 14; 408 및 14; 또는 412 및 14에 제시된 아미노산 서열을 포함한다.
본 명세서에 개시된 임의의 폴리펩타이드의 소정의 실시형태에서, TCR은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합한다.
본 명세서에 개시된 임의의 폴리펩타이드의 소정의 실시형태에서, 폴리펩타이드는 오직 하나의 α 사슬 및 하나의 β 사슬을 포함한다. 소정의 실시형태에서, α 사슬은 β 사슬에 N 말단이다. 소정의 실시형태에서, α 사슬은 β 사슬에 C 말단이다. 소정의 실시형태에서, 폴리펩타이드는 α 사슬과 β 사슬 사이에 펩타이드 링커를 추가로 포함한다. 소정의 실시형태에서, 링커는 단백질분해 절단 부위를 포함한다. 소정의 실시형태에서, 단백질분해 절단 부위는 퓨린 절단 부위 및/또는 2A 절단 부위를 포함한다. 소정의 실시형태에서, 퓨린 절단 부위는 서열 번호 29 내지 31 및 131 내지 133으로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, 퓨린 절단 부위는 서열 번호 132에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, 2A 절단 부위는 서열 번호 32 내지 38, 130 및 134 내지 140으로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, 2A 절단 부위는 돼지 테스코바이러스-1 2A(P2A) 절단 부위를 포함한다. 소정의 실시형태에서, P2A 절단 부위는 서열 번호 33 또는 134에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, 단백질분해 절단 부위는 퓨린 절단 부위 및 2A 절단 부위를 포함한다. 소정의 실시형태에서, 퓨린 절단 부위는 서열 번호 132에 제시된 아미노산 서열을 포함하고, 2A 절단 부위는 서열 번호 33 또는 134에 제시된 아미노산 서열을 포함한다.
상기 양태의 소정의 실시형태에서, 폴리펩타이드는 폴리펩타이드의 C 말단에서 Gly-Ser을 추가로 포함한다. 본 개시내용의 범위를 제한하려는 의도 없이, 단리된 TCR 또는 폴리펩타이드에 대한 이러한 Gly-Ser 연장은 이전의 클로닝 단계로부터의 클로닝 흔적으로부터 생길 수 있다.
소정의 실시형태에서, 폴리펩타이드는 서열 번호 28, 141 내지 143, 158 내지 161, 176 내지 179, 194, 196, 212, 214, 230, 232, 248, 250, 416 및 417로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, 폴리펩타이드는,
(ⅰ) 서열 번호 28, 158, 176, 194, 212, 230, 248 및 416;
(ⅱ) 서열 번호 141, 159 및 177; 또는
(ⅲ) 서열 번호 142, 160, 178, 196, 214, 232, 250 및 417
로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다.
소정의 실시형태에서, 폴리펩타이드는 서열 번호 146 내지 149, 152 내지 155, 164 내지 167, 170 내지 173, 182 내지 185, 188 내지 191, 200, 202, 206, 208, 218, 220, 224, 226, 236, 238, 242, 244, 254, 256, 260, 262 및 418 내지 421로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, 폴리펩타이드는,
(ⅰ) 서열 번호 146, 164, 182, 200, 218, 236, 254 및 418;
(ⅱ) 서열 번호 147, 165 및 183;
(ⅲ) 서열 번호 148, 166, 184, 202, 220, 238, 256 및 419;
(ⅳ) 서열 번호 149, 167 및 185;
(ⅴ) 서열 번호 152, 170, 188, 206, 224, 242, 260 및 420;
(ⅵ) 서열 번호 153, 171 및 189;
(ⅶ) 서열 번호 154, 172, 190, 208, 226, 244, 262 및 421; 또는
(ⅷ) 서열 번호 155, 173 및 191
로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다.
본 명세서에 개시된 TCR 또는 폴리펩타이드의 임의의 양태의 소정의 실시형태에서, TCR은 인간 TCR(예를 들어, 전장 인간 TCR)이다. 소정의 실시형태에서, TCR은 전장 TCR, 가용성 TCR 또는 단일 사슬 TCR이다.
소정의 실시형태에서, 펩타이드는 HLA-A*0201의 맥락에서 제공된다. 소정의 실시형태에서, TCR이 T 세포의 표면에서 발현될 때, T 세포는 HLA-A*0201의 맥락에서 제공된 펩타이드를 디스플레이하는 제2 세포와 공배양(co-culture)될 때 활성화된다. 소정의 실시형태에서, T 세포는, HLA-A*0201의 맥락에서 제공된 펩타이드를 디스플레이하는 제2 세포와 공배양될 때 (a) CD69 표면 발현의 증가, (b) CD25 표면 발현의 증가, (c) CD107a 표면 발현의 증가, (d) IFNγ 분비의 증가, 또는 (e) 활성화된 T 세포의 핵 인자(NFAT) 활성화의 증가를 나타낸다. 소정의 실시형태에서, T 세포는 HLA-A*0201의 맥락에서 제공된 펩타이드를 디스플레이하는 제2 세포의 세포자멸사 또는 사멸을 유도한다.
소정의 실시형태에서, TCR 또는 폴리펩타이드는 효과기 모이어티에 접합된다. 소정의 실시형태에서, 효과기 모이어티는 세포독성제, 세포증식억제제, 독소, 방사성핵종, 검출 가능한 표지 또는 결합 모이어티이다. 소정의 실시형태에서, 결합 모이어티는 항체이다. 소정의 실시형태에서, 결합 모이어티는 항체 Fc 영역이다.
또 다른 양태에서, 본 개시내용은, 본 명세서에 개시된 TCR의,
(a) Vα를 암호화하는 제1 핵산 서열 및/또는 Vβ를 암호화하는 제2 핵산 서열; 또는
(b) α 사슬을 암호화하는 제1 핵산 서열 및/또는 β 사슬을 암호화하는 제2 핵산 서열
을 포함하는 단리된 폴리뉴클레오타이드를 제공한다. 소정의 실시형태에서, 제1 핵산 서열 및 제2 핵산 서열은 프레임내(in frame)에 있다.
소정의 실시형태에서, 제1 핵산 서열은 제2 핵산 서열에 5'이다. 소정의 실시형태에서, 제1 핵산 서열은 제2 핵산 서열에 3'이다. 소정의 실시형태에서, 폴리뉴클레오타이드는 제1 핵산 서열과 제2 핵산 서열 사이에 펩타이드 링커를 암호화하는 제3 핵산 서열을 추가로 포함하고, 제1 핵산 서열, 제2 핵산 서열 및 제3 핵산 서열은 프레임내에 있다. 소정의 실시형태에서, 링커는 단백질분해 절단 부위를 포함한다. 소정의 실시형태에서, 단백질분해 절단 부위는 퓨린 절단 부위 및/또는 2A 절단 부위를 포함한다. 소정의 실시형태에서, 퓨린 절단 부위는 서열 번호 29 내지 31 및 131 내지 133으로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, 퓨린 절단 부위는 서열 번호 132에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, 2A 절단 부위는 서열 번호 32 내지 38, 130 및 134 내지 140으로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, 2A 절단 부위는 돼지 테스코바이러스-1 2A(P2A) 절단 부위를 포함한다. 소정의 실시형태에서, P2A 절단 부위는 서열 번호 33 또는 134에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, 단백질분해 절단 부위는 퓨린 절단 부위 및 2A 절단 부위를 포함한다. 소정의 실시형태에서, 퓨린 절단 부위는 서열 번호 132에 제시된 아미노산 서열을 포함하고, 2A 절단 부위는 서열 번호 33 또는 134에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, 폴리뉴클레오타이드는 제1 핵산 서열 및 제2 핵산 서열에 3'인 Gly-Ser을 암호화하는 핵산 서열을 추가로 포함한다.
소정의 실시형태에서, 폴리뉴클레오타이드는 서열 번호 28, 141 내지 143, 158 내지 161, 176 내지 179, 194, 196, 212, 214, 230, 232, 248, 250, 416 및 417로 이루어진 군으로부터 선택된 아미노산 서열을 암호화한다. 소정의 실시형태에서, 폴리뉴클레오타이드는
(ⅰ) 서열 번호 28, 158, 176, 194, 212, 230, 248 및 416;
(ⅱ) 서열 번호 141, 159, 및 177; 또는
(ⅲ) 서열 번호 142, 160, 178, 196, 214, 232, 250 및 417
로 이루어진 군으로부터 선택된 아미노산 서열을 암호화한다.
소정의 실시형태에서, 폴리뉴클레오타이드는 서열 번호 146 내지 149, 152 내지 155, 164 내지 167, 170 내지 173, 182 내지 185, 188 내지 191, 200, 202, 206, 208, 218, 220, 224, 226, 236, 238, 242, 244, 254, 256, 260, 262 및 418 내지 421로 이루어진 군으로부터 선택된 아미노산 서열을 암호화한다. 소정의 실시형태에서, 폴리뉴클레오타이드는
(ⅰ) 서열 번호 146, 164, 182, 200, 218, 236, 254 및 418;
(ⅱ) 서열 번호 147, 165 및 183;
(ⅲ) 서열 번호 148, 166, 184, 202, 220, 238, 256 및 419;
(ⅳ) 서열 번호 149, 167 및 185;
(ⅴ) 서열 번호 152, 170, 188, 206, 224, 242, 260 및 420;
(ⅵ) 서열 번호 153, 171, 및 189;
(ⅶ) 서열 번호 154, 172, 190, 208, 226, 244, 262 및 421; 또는
(ⅷ) 서열 번호 155, 173 및 191
로 이루어진 군으로부터 선택된 아미노산 서열을 암호화한다.
또 다른 양태에서, 본 개시내용은 본 명세서에 개시된 폴리펩타이드의 폴리펩타이드를 암호화하는 단리된 폴리뉴클레오타이드를 제공한다.
또 다른 양태에서, 본 개시내용은 본 명세서에 개시된 폴리뉴클레오타이드를 포함하는 단리된 벡터를 제공한다. 소정의 실시형태에서, 벡터는 렌티바이러스 벡터, 레트로바이러스 벡터, 아데노바이러스 벡터, 아데노 연관된 바이러스 벡터 및 바큘로바이러스 벡터로 이루어진 군으로부터 선택된 바이러스 벡터이다.
또 다른 양태에서, 본 개시내용은 본 명세서에 개시된 폴리뉴클레오타이드 또는 벡터를 포함하는 조작된 세포를 제공한다. 또 다른 양태에서, 본 개시내용은 본 명세서에 개시된 TCR을 세포 표면에 제시하는 조작된 세포를 제공한다. 소정의 실시형태에서, 세포는 TCR을 발현한다. 소정의 실시형태에서, 세포는 인간 림프구이다. 소정의 실시형태에서, 세포는 T 세포, CD8+ T 세포, CD4+ T 세포, 자연 살해 T(NKT) 세포, 불변 자연 살해 T(iNKT) 세포, 점막 연관된 불변 T(MAiT) 세포 및 자연 살해(NK) 세포로 이루어진 군으로부터 선택된다.
또 다른 양태에서, 본 개시내용은 본 명세서에 개시된 단리된 TCR, 폴리펩타이드, 폴리뉴클레오타이드, 벡터 또는 조작된 세포, 및 약제학적으로 허용 가능한 담체를 포함하는 약제학적 조성물을 제공한다.
또 다른 양태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR을 제조하는 방법을 제공하고, 상기 방법은 본 명세서에 개시된 조작된 세포를 배양하는 단계를 포함하고, 이에 의해 폴리뉴클레오타이드가 발현되고 TCR이 제조된다. 또 다른 양태에서, 본 개시내용은 이러한 방법에 의해 제조된 단리된 TCR을 제공한다.
또 다른 양태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR을 발현하는 조작된 세포를 제조하는 방법을 제공하고, 상기 방법은 세포를 세포로의 벡터의 도입을 허용하는 조건 하에 본 명세서에 개시된 폴리뉴클레오타이드(예를 들어, 본 명세서에 개시된 α 사슬 가변 영역 및/또는 β 사슬 가변 영역을 암호화하는 폴리뉴클레오타이드, 본 명세서에 개시된 TCR의 α 사슬 및/또는 β 사슬을 암호화하는 폴리뉴클레오타이드 또는 이러한 폴리뉴클레오타이드(들)를 포함하는 벡터)와 접촉시키는 단계를 포함한다. 소정의 실시형태에서, 세포는 인간 림프구이다. 소정의 실시형태에서, 세포는 T 세포, CD8+ T 세포, CD4+ T 세포, 자연 살해 T(NKT) 세포, 불변 자연 살해 T(iNKT) 세포, 점막 연관된 불변 T(MAiT) 세포 및 자연 살해(NK) 세포로 이루어진 군으로부터 선택된다.
또 다른 양태에서, 본 개시내용은 대상체에서 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드를 디스플레이하는 세포에 대한 면역 반응을 유도하는 방법을 제공하고, 상기 방법은 유효량의 본 명세서에 개시된 단리된 TCR, 폴리펩타이드, 폴리뉴클레오타이드, 벡터, 조작된 세포, 또는 약제학적 조성물을 대상체에게 투여하는 단계를 포함한다.
또 다른 양태에서, 본 개시내용은 대상체에서 암을 치료하는 방법을 제공하고, 상기 방법은 유효량의 본 명세서에 개시된 단리된 TCR, 폴리펩타이드, 폴리뉴클레오타이드, 벡터, 조작된 세포, 또는 약제학적 조성물을 대상체에게 투여하는 단계를 포함한다.
본 명세서에 개시된 면역 반응을 유도하는 방법 또는 암을 치료하는 방법의 소정의 실시형태에서, TCR, 폴리뉴클레오타이드, 벡터, 조작된 세포 또는 약제학적 조성물은 정맥내 투여된다. 소정의 실시형태에서, 상기 방법은 대상체에게 추가적인 치료제를 투여하는 단계를 추가로 포함한다. 소정의 실시형태에서, 추가적인 치료제는 화학치료제, 방사선치료제 또는 관문 표적화제이다. 소정의 실시형태에서, 관문 표적화제는 길항제 항-PD-1 항체, 길항제 항-PD-L1 항체, 길항제 항-PD-L2 항체, 길항제 항-CTLA-4 항체, 길항제 항-TIM-3 항체, 길항제 항-LAG-3 항체, 길항제 항-CEACAM1 항체, 길항제 항-TIGIT 항체, 효능제 항-CD137 항체, 효능제 항-GITR 항체 및 효능제 항-OX40 항체로 이루어진 군으로부터 선택된다. 소정의 실시형태에서, 추가적인 치료제는 항-PD-1 항체이고, 선택적으로 항-PD-1 항체는 펨브롤리주맙 또는 니볼루맙이다. 소정의 실시형태에서, 추가적인 치료제는 인돌아민-2,3-다이옥시게나제(IDO)의 저해제이다. 소정의 실시형태에서, 저해제는 에파카도스타트, F001287, 인독시모드 및 NLG919로 이루어진 군으로부터 선택된다. 소정의 실시형태에서, 저해제는 에파카도스타트이다. 소정의 실시형태에서, 추가적인 치료제는 백신이다. 소정의 실시형태에서, 백신은 항원 펩타이드와 복합체화된 열 쇼크 단백질을 포함하는 열 쇼크 단백질 펩타이드 복합체(HSPPC)를 포함한다. 소정의 실시형태에서, 열 쇼크 단백질은 hsc70이고, 종양 연관된 항원 펩타이드와 복합체화된다. 소정의 실시형태에서, 열 쇼크 단백질은 gp96이고, 종양 연관된 항원 펩타이드와 복합체화되고, HSPPC는 대상체로부터 얻은 종양으로부터 유래된다.
소정의 실시형태에서, 암은 급성 림프구성 암, 급성 골수성 백혈병, 포상 횡문근육종, 골암, 뇌암, 유방암, 항문, 항문관 또는 항문직장의 암, 눈의 암, 간내 담관의 암, 관절의 암, 목, 담낭 또는 흉막의 암, 코, 비강 또는 중이의 암, 구강의 암, 음문의 암, 만성 림프구성 백혈병, 만성 골수성 백혈병, 골수종(예를 들어, 만성 골수성 암), 결장암, 식도암, 자궁경부암, 위장 유암종, 호지킨 림프종, 후두인두암, 신장암, 후두암, 간암, 폐암(예를 들어, 비소세포 폐암), 악성 중피종, 흑색종, 다발성 골수종, 인두암, 비호지킨 림프종, 난소암, 췌장암, 배막, 장막 및 장간막 암, 후두암, 전립선암, 직장암, 신장암(예를 들어, 신장 세포 암종(renal cell carcinoma: RCC)), 위암, 소장암, 연조직암, 위암, 암종, 육종(예를 들어, 활막 육종, 횡문근육종), 고환암, 갑상선암, 두경부암, 자궁암 및 방광암이다. 소정의 실시형태에서, 암은 흑색종, 유방암, 폐암, 전립선암, 갑상선암, 난소암 또는 활막 육종이다. 일 실시형태에서, 암은 활막 육종 또는 지방육종(예를 들어, 점액모양/원형 세포 지방육종)이다. 일 실시형태에서, 암은 다발성 골수종이다. 일 실시형태에서, 암은 신장 세포 암종이다. 일 실시형태에서, 암은 자궁경부암이다. 일 실시형태에서, 암은 난소암이다.
도 1은 APC 표지된 항-마우스 TCR β 사슬 항체 및 야생형 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1), MHC 앵커 최적화된 NY-ESO-1 펩타이드 SLLMWITQV(서열 번호 2), 또는 음성 대조군 펩타이드가 로딩된 PE 표지된 HLA-A*0201 삼합체를 사용한 AK-D10R3 세포 또는 TCR18168c를 발현하는 AK-D10R3 세포의 염색을 보여주는 일련의 유세포분석법 선도이다. 삼합체+ TCR+ 세포의 백분율은 각각의 선도에 표시된다.
도 2는 50㎍/㎖의 야생형 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1), 앵커 최적화된 NY-ESO-1 펩타이드 SLLMWITQV(서열 번호 2), 또는 음성 대조군 펩타이드에 의해 펄스화된 T2 세포와의 공배양 후 TCR18168c를 발현하는 AK-D10R3 세포의 활성화를 시험하는 검정으로부터의 결과를 보여주는 일련의 유세포분석법 선도이다. 유세포분석법 선도에서, y축은 표면 TCR 염색을 보여주고, x축은 IL-2-(NFAT)3-EGFP 리포터 작제물의 활성화로부터 생긴 Enhanced Green Fluorescent Protein(EGFP) 발현 또는 CD69 활성화 마커 발현을 보여준다. TCR 발현이 없는 AK-D10R3 세포는 음성 대조군으로서 사용되었다. TCR+EGFP+ 세포 및 TCR+CD69+ 세포의 백분율은 각각의 선도의 상부 오른쪽 패널에 표시된다.
도 3a, 도 3b, 도 3c, 도 3d 및 도 3e는 완전 인간 NY-ESO-1 TCR, TCR18168, 또는 MART-1 TCR DMF4를 발현하도록 형질주입된 건강한 도너로부터의 1차 인간 T 세포를 분석하는 연구로부터의 결과를 보여주는 그래프이다. 형질주입된 T 세포는 16시간 동안 HLA-A2 또는 HLA-B7을 발현하는 펩타이드 펄스화된 K562 세포와 공배양되었다. 효과기 세포 활성화(CD25 발현 및 IFNγ 분비) 및 표적 세포 사멸(카스파제-3/7 활성)은 이후 측정되었다. 도 3a는 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1) 또는 MART-1 펩타이드 ELAGIGILTV(서열 번호 22)가 로딩된 HLA-A*0201 삼합체를 사용한 TCR18168 발현 또는 DMF4 발현 T 세포의 염색을 보여주는 한 쌍의 유세포분석법 선도이다. NY-ESO-1 삼합체 양성/MART-1 삼합체 음성 세포의 백분율은 각각의 선도의 하부 오른쪽 패널에 표시된다. NY-ESO-1 삼합체 음성/MART-1 삼합체 양성 세포의 백분율은 각각의 선도의 상부 왼쪽 패널에 표시된다. 도 3b 및 도 3c는, K562 표적 세포와의 공배양 이후에, 유세포분석법에 의해 측정된, CD25+ T 세포의 백분율을 보여주는 막대 그래프이다. 도면에 표시된 바대로, HLA-A2 발현("K562-HLA-A2") 또는 HLA-B7 발현("K562-HLA-B7") K562 표적 세포는 DMSO 비히클, 0.01, 0.1 또는 1μM의 NY-ESO-1 펩타이드, 또는 1μM의 MART-1 펩타이드에 의해 펄스화되었다. K562 표적 세포의 부재 하에 임의의 자극이 없는(기저 활성화 수준) 또는 항-CD3/항-CD28 항체(최대 활성화 수준)에 의해 자극된 CD25+ T 세포의 백분율이 또한 도시되어 있다. 도 3d 및 도 3e는 검정의 완료 시, 공배양으로부터 취한 배지 중의, ELISA에 의해 측정된 바와 같은, IFNγ의 농도를 보여주는 막대 그래프이다.
도 4a, 도 4b 및 도 4c는 도 3a 내지 도 3e에 도시된 연구와 유사한 공배양 연구로부터의 결과를 보여주는 그래프이다. 상이한 건강한 도너로부터의 1차 T 세포는 TCR18168 또는 MART-1 TCR DMF4를 발현하도록 형질주입되었다. 형질주입된 T 세포는 16시간 동안 CellTrace(상표명) 바이올렛 염료 표지된 펩타이드 펄스화된 T2 세포와 공배양되었다. 표면 CD25 발현에 의해 측정된 바와 같은 T 세포 활성화 및 표적 세포의 소실에 의해 측정된 바와 같은 표적 세포 사멸은 조사되었다. 도 4a 및 도 4b는, DMSO 비히클, 1μM의 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1), 또는 1μM의 MART-1 펩타이드 ELAGIGILTV(서열 번호 22)에 의해 펄스화된 T2 표적 세포에 의한 공배양 이후에, 유세포분석법에 의해 측정된, CD25+ T 세포의 백분율을 보여주는 막대 그래프이다. T2 표적 세포의 부재 하에 임의의 자극이 없는(기저 활성화 수준) 또는 항-CD3/항-CD28 항체(최대 활성화 수준)에 의해 자극된 CD25+ T 세포의 백분율이 또한 도시되어 있다. 도 4c는 T 세포의 부재 하에 또는 TCR18168 또는 DMF4를 발현하는 T 세포의 존재 하에 생 T2 세포의 전체 수를 보여주는 막대 그래프이다. 도면에 표시된 바대로, T2 세포는 공배양 연구 전에 DMSO, NY-ESO-1 펩타이드 또는 MART-1 펩타이드에 의해 펄스화되었다.
도 5a 및 도 5b는 연구로부터의 결과를 보여주는 그래프이고, 이 연구에서 TCR18168을 발현하도록 렌티바이러스로 형질도입된 TCRβ 음성 주르카트(Jurkat)-NFAT-루시퍼라제 리포터 세포주는 분석 전에 16시간 동안 AAD 발현 펩타이드 펄스화된 B16 세포와 공배양되었다. AAD는 HLA-A*0201 분자의 α1 및 α2 도메인, 마우스 H-2Db 분자의 α3 도메인 및 인간 β2 마이크로글로불린을 포함하는 키메라 분자이다. 도 5a는, DMSO, 음성 대조군 MART-1 펩타이드 또는 NY-ESO-1 펩타이드(표적 펩타이드)에 의해 펄스화된, 포르볼 12-미리스테이트 13-아세테이트(PMA) 및 이오노마이신에 의해 자극된 TCR18168 발현 주르카트 리포터 세포(최대 NFAT-루시퍼라제 발현을 나타냄) 또는 AAD 발현 B16 세포에 의해 생성된 상대 광 단위를 보여주는 막대 그래프이다. 도 5b는, PMA 및 이오노마이신 대조군에 의해 생성된 평균 상대 광 단위로 정규화된, 다양한 농도의 NY-ESO-1 표적 펩타이드에 의해 펄스화된 AAD 발현 B16 세포와 공배양된 TCR18168 발현 주르카트 리포터 세포에 의해 생성된 상대 광 단위를 보여주는 선 그래프이다. x축은 AAD 발현 B16 세포를 펄스화하도록 사용된 펩타이드의 농도를 보여준다.
도 6은 APC 표지된 항-마우스 TCR β 사슬 항체 및 야생형 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)가 로딩된 PE 표지된 HLA-A*0201 삼합체를 사용한 키메라 TCR TCR18168c, TCR0001, TCR0009, TCR0011, TCR0013, TCR0015, TCR0017, TCR0019, TCR0021, TCR0023, TCR0027, TCR0029, TCR0031, TCR0033, TCR0035, TCR0037, TCR0049, TCR0059, TCR0061, TCR0065, TCR0067, TCR0069, SSX-2에 결합하는 기준 TCR을 발현하는 AK-D10R3 세포, 또는 TCR 음성 AK-D10R3 세포의 염색을 보여주는 일련의 유세포분석법 선도이다. 삼합체+ TCR+ 세포의 백분율은 각각의 선도에 표시된다.
도 7은 50㎍/㎖의 야생형 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)에 의해 펄스화된 T2 세포와의 공배양 후 키메라 TCR TCR18168c, TCR0001, TCR0009, TCR0011, TCR0013, TCR0015, TCR0017, TCR0019, TCR0021, TCR0023, TCR0027, TCR0029, TCR0031, TCR0033, TCR0035, TCR0037, TCR0049, TCR0059, TCR0061, TCR0065, TCR0067 또는 TCR0069를 발현하는 AK-D10R3 세포의 활성화를 시험하는 검정으로부터의 결과를 보여주는 일련의 유세포분석법 선도이다. 대조군 SXX-2 펩타이드에 의해 펄스화되거나 펩타이드가 없는 T2 세포와 공배양된 TCR18168c를 발현하는 AK-D10R3 세포는 대조군으로서 사용되었다. 유세포분석법 선도에서, y축은 표면 TCR 염색을 보여주고, x축은 AK-D10R3 세포에서의 IL-2-(NFAT)3-EGFP 리포터 작제물의 활성화로부터 생긴 EGFP 발현을 보여준다. TCR+EGFP+ 세포의 백분율은 각각의 선도의 상부 오른쪽 패널에 표시된다.
도 8a 및 도 8b는 APC 표지된 항-인간 TCR 항체, 야생형 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)가 로딩된 PE 표지된 HLA-A*0201 삼합체, 또는 대조군 SSX-2 펩타이드 KASEKIFYV(서열 번호 274)가 로딩된 PE 표지된 HLA-A*0201 삼합체를 사용한 완전 인간 TCR TCR18168, TCR0002, TCR0010, TCR0012, TCR0014, TCR0016, TCR0018, TCR0020, TCR0022, TCR0024, TCR0028, TCR0032, TCR0038, TCR0050, TCR0060, TCR0062, TCR0066, TCR0068 또는 TCR0070을 발현하는 주르카트 세포, 또는 TCR 음성 주르카트 세포의 염색을 보여주는 일련의 유세포분석법 선도이다. TCR+ 또는 삼합체+ 세포의 백분율은 각각의 선도에 표시된다.
도 9a 내지 도 9h는 TCR 형질주입된 T 세포와 다양한 농도의 NY-ESO-1 표적 펩타이드에 의해 펄스화된 T2 세포의 동시 배양 이후에 활성화의 마커인 CD25 발현의 백분율을 보여주는 일련의 그래프이다. 실험은 플레이팅 후 16시간에 판독으로 1:1 효과기:표적 비율에서 설정되었다. 각각의 표시된 TCR 후보(도 9a: 기준 TCR; 도 9b: TCR0002; 도 9c: TCR0014; 도 9d: TCR0018; 도 9e: TCR0022; 도 9f: TCR0028; 도 9g: TCR0038; 및 도 9h: TCR0070)에 대한 활성화 퍼센트 값은 다양한 펩타이드 용량에서 작도되었다.
도 10a 내지 도 10h는 TCR 형질주입된 T 세포와 다양한 농도의 NY-ESO-1 표적 펩타이드에 의해 펄스화된 T2 세포의 동시 배양 이후에 세포용해 가능성 및 탈과립화의 마커인 CD107a 발현의 백분율을 보여주는 일련의 그래프이다. 실험은 플레이팅 후 16시간에 판독으로 1:1 효과기:표적 비율에서 설정되었다. 각각의 표시된 TCR 후보(도 10a: 기준 TCR; 도 10b: TCR0002; 도 10c: TCR0014; 도 10d: TCR0018; 도 10e: TCR0022; 도 10f: TCR0028; 도 10g: TCR0038; 및 도 10h: TCR0070)에 대한 활성화 퍼센트 값은 다양한 펩타이드 용량에서 작도되었다.
도 11a 내지 도 11h는 TCR 형질주입된 T 세포에 의한 펩타이드 펄스화된 T2 세포의 사멸 퍼센트를 보여주는 일련의 그래프이다. 실험은 플레이팅 후 16시간에 판독으로 1:1 효과기:표적 비율에서 설정되었다. 값은, (100을 곱한) 대조군 표적 세포의 수로 나눈, 샘플 웰에서의 대조군 표적 세포의 수와 특정한 표적 세포의 수 사이의 차이로서 계산되었다. 각각의 표시된 TCR 후보(도 11a: 기준 TCR; 도 11b: TCR0002; 도 11c: TCR0014; 도 11d: TCR0018; 도 11e: TCR0022; 도 11f: TCR0028; 도 11g: TCR0038; 및 도 11h: TCR0070)에 대한 사멸 퍼센트 값은 다양한 펩타이드 용량에서 작도되었다.
도 12a 내지 도 12h는 표시된 비율에서 배양된 HLA-A*0201 및 NY-ESO-1 형질도입된 K562 표적 세포의 고정된 수에 의한 자극의 16시간 이후에 형질주입된 T 세포에 의한 활성화의 마커인 CD25 발현의 백분율을 보여주는 일련의 그래프이다. 각각의 표시된 TCR 후보(도 12a: 기준 TCR; 도 12b: TCR0002; 도 12c: TCR0014; 도 12d: TCR0018; 도 12e: TCR0022; 도 12f: TCR0028; 도 12g: TCR0038; 및 도 12h: TCR0070)에 대한 활성화 퍼센트 값은 표적 세포의 일정한 수를 유지시키면서 형질주입된 T 세포의 수가 변하여 다양한 효과기-대-표적 비율에서 작도되었다.
도 13a 내지 도 13h는 표시된 비율에서 HLA-A*0201 및 NY-ESO-1 형질도입된 K562 표적 세포의 고정된 수에 의한 TCR 형질주입된 T 세포의 공배양 이후에 세포용해 가능성 및 탈과립화의 마커인 CD107a 발현의 백분율을 보여주는 일련의 그래프이다. 각각의 표시된 TCR 후보(도 13a: 기준 TCR; 도 13b: TCR0002; 도 13c: TCR0014; 도 13d: TCR0018; 도 13e: TCR0022; 도 13f: TCR0028; 도 13g: TCR0038; 및 도 13h: TCR0070)에 대한 활성화 퍼센트 값은 표적 세포의 일정한 수를 유지시키면서 형질주입된 T 세포의 수가 변하여 다양한 효과기-대-표적 비율에서 작도되었다.
도 14a 내지 도 14h는 표시된 비율에서 HLA-A*0201 및 NY-ESO-1을 발현하도록 형질도입된 K562 세포의 사멸 퍼센트를 보여주는 일련의 그래프이다. 사멸 퍼센트는, (100을 곱한) 대조군 표적 세포의 수로 나눈, 샘플 웰에서의 대조군 표적 세포의 수와 특정한 표적 세포의 수 사이의 차이로서 계산되었다. 각각의 표시된 TCR 후보(도 14a: 기준 TCR; 도 14b: TCR0002; 도 14c: TCR0014; 도 14d: TCR0018; 도 14e: TCR0022; 도 14f: TCR0028; 도 14g: TCR0038; 및 도 14h: TCR0070)에 대한 사멸 퍼센트 값은 표적 세포의 일정한 수를 유지시키면서 형질주입된 T 세포의 수가 변하여 다양한 효과기-대-표적 비율에서 작도되었다.
도 15는 5:1 효과기:표적 비율에서 TCR 형질주입된 T 세포와의 공배양 이후에 HLA-B*0702 형질도입된 K562 세포에 대한 HLA-A*0201 및 NY-ESO-1 형질도입된 K562 세포의 우선적 사멸 퍼센트를 보여주는 그래프이다.
도 16a 내지 도 16f는 다양한 비율에서 HLA-A*0201 및 NY-ESO-1의 내인성 수준을 발현하는 SLM2-mel 흑색종 세포와의 TCR 형질주입된 T 세포의 공배양 이후에 활성화의 마커인 CD25 발현의 백분율을 보여주는 일련의 그래프이다. 각각의 표시된 TCR 후보(도 16a: 기준 TCR; 도 16b: TCR0002; 도 16c: TCR0014; 도 16d: TCR0018; 도 16e: TCR0022; 및 도 16f: TCR0028)에 대한 활성화 퍼센트 값은 표적 세포의 일정한 수를 유지시키면서 형질주입된 T 세포의 수가 변하여 다양한 효과기-대-표적 비율에서 작도되었다.
도 17a 내지 도 17f는 형질주입된 T 세포가 표시된 비율에서 SLM2-mel 세포와 공배양될 때 세포용해 가능성 및 탈과립화의 마커인 CD107a 발현의 백분율을 보여주는 일련의 그래프이다. 각각의 표시된 TCR 후보(도 17a: 기준 TCR; 도 17b: TCR0002; 도 17c: TCR0014; 도 17d: TCR0018; 도 17e: TCR0022; 및 도 17f: TCR0028)에 대한 활성화 퍼센트 값은 표적 세포의 일정한 수를 유지시키면서 형질주입된 T 세포의 수가 변하여 다양한 효과기-대-표적 비율에서 작도되었다.
도 18a 내지 도 18f는 HLA-A*0201 및 NY-ESO-1 펩타이드의 내인성 수준을 발현하는 SLM2-mel 흑색종 세포의 사멸 퍼센트를 보여주는 일련의 그래프이다. 각각의 표시된 TCR 후보(도 18a: 기준 TCR; 도 18b: TCR0002; 도 18c: TCR0014; 도 18d: TCR0018; 도 18e: TCR0022; 및 도 18f: TCR0028)에 대한 세포독성 값은 표적 세포의 일정한 수를 유지시키면서 형질주입된 T 세포의 수가 변하여 다양한 효과기-대-표적 비율에서 작도되었다.
도 19a 내지 도 19e는 앵커 최적화된 NY-ESO-1 펩타이드 SLLMWITQV(서열 번호 2)의 단일 점 돌연변이인 구합체 펩타이드의 그룹과 표시된 TCR(도 19a: 기준 TCR; 도 19b: TCR0001; 도 19c: TCR0017; 도 19d: TCR0021; 도 19e: TCR0037)의 특이성을 비교하는 일련의 열 지도이다. 구합체 펩타이드의 (P2 및 P9를 제외한) 각각의 위치는 19개의 상이한 아미노산 잔기 중 하나에 의해 치환되었다. 각각의 생성된 펩타이드는 T2 표적 세포를 펄스화하도록 사용되었고, 이것은 TCR 발현 효과기 세포(NY-ESO AK-D10R3 세포)와 공배양되었다. 생성된 돌연변이체 펩타이드에 대한 TCR의 결합 시, 효과기 세포는 EGFP 리포터를 발현하도록 활성화되었고, 이는 FACS에 의해 검출되었다. 결과는 열 지도로서 도시되어 있고, 여기서 수직 축에 표시된 잔기 대신에 수평 축에서 앵커 최적화된 NY-ESO-1 펩타이드 SLLMWITQV(서열 번호 2)에서의 네이티브 잔기의 아미노산 잔기 치환을 나타내는 각각의 블록은 (최소 0.0 및 최대 1.0으로 잘라진 정규화 값에 의해) 정규화된 평균 활성화로 스케일에서 음영이 되어 있다. "X"는 비시험된 돌연변이체를 나타낸다. (펩타이드 로딩이 없는) 배경 활성화는 모든 펩타이드 로딩된 샘플(변경된 및 네이티브 서열)로부터 공제되었다.
도 20a 내지 도 20e는 도 19a 내지 도 19e에 대해 기재된 바와 같은 각각의 돌연변이체 NY-ESO-1 펩타이드(검정 마름모꼴, "변경된"), 및 동족 앵커 최적화된 NY-ESO-1 펩타이드 SLLMWITQV(서열 번호 2)(개방 정사각형, "에피토프")에 대한 정규화된 평균 활성화 값을 보여주는, 표시된 TCR(도 20a: 기준 TCR; 도 20b: TCR0001; 도 20c: TCR0017; 도 20d: TCR0021; 도 20e: TCR0037)의 특이성 프로필을 비교하는 일련의 막대 그래프이다. 서열 번호 275-407의 펩타이드에 상응하는 (최대 1.0으로 잘린) 정규화된 평균 활성화 값은, 왼쪽에서 오른쪽으로, 각각의 도면의 가장 오른쪽에 도시된 앵커 최적화된 NY-ESO-1 펩타이드 SLLMWITQV(서열 번호 2)에 상응하는 "에피토프" 펩타이드 값을 제외하고, 서열 번호의 순차적인 증가 순서로 표시되어 있다. 오차 막대(검정)는 표준 평균 오차(SEM)를 나타낸다.
도 2는 50㎍/㎖의 야생형 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1), 앵커 최적화된 NY-ESO-1 펩타이드 SLLMWITQV(서열 번호 2), 또는 음성 대조군 펩타이드에 의해 펄스화된 T2 세포와의 공배양 후 TCR18168c를 발현하는 AK-D10R3 세포의 활성화를 시험하는 검정으로부터의 결과를 보여주는 일련의 유세포분석법 선도이다. 유세포분석법 선도에서, y축은 표면 TCR 염색을 보여주고, x축은 IL-2-(NFAT)3-EGFP 리포터 작제물의 활성화로부터 생긴 Enhanced Green Fluorescent Protein(EGFP) 발현 또는 CD69 활성화 마커 발현을 보여준다. TCR 발현이 없는 AK-D10R3 세포는 음성 대조군으로서 사용되었다. TCR+EGFP+ 세포 및 TCR+CD69+ 세포의 백분율은 각각의 선도의 상부 오른쪽 패널에 표시된다.
도 3a, 도 3b, 도 3c, 도 3d 및 도 3e는 완전 인간 NY-ESO-1 TCR, TCR18168, 또는 MART-1 TCR DMF4를 발현하도록 형질주입된 건강한 도너로부터의 1차 인간 T 세포를 분석하는 연구로부터의 결과를 보여주는 그래프이다. 형질주입된 T 세포는 16시간 동안 HLA-A2 또는 HLA-B7을 발현하는 펩타이드 펄스화된 K562 세포와 공배양되었다. 효과기 세포 활성화(CD25 발현 및 IFNγ 분비) 및 표적 세포 사멸(카스파제-3/7 활성)은 이후 측정되었다. 도 3a는 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1) 또는 MART-1 펩타이드 ELAGIGILTV(서열 번호 22)가 로딩된 HLA-A*0201 삼합체를 사용한 TCR18168 발현 또는 DMF4 발현 T 세포의 염색을 보여주는 한 쌍의 유세포분석법 선도이다. NY-ESO-1 삼합체 양성/MART-1 삼합체 음성 세포의 백분율은 각각의 선도의 하부 오른쪽 패널에 표시된다. NY-ESO-1 삼합체 음성/MART-1 삼합체 양성 세포의 백분율은 각각의 선도의 상부 왼쪽 패널에 표시된다. 도 3b 및 도 3c는, K562 표적 세포와의 공배양 이후에, 유세포분석법에 의해 측정된, CD25+ T 세포의 백분율을 보여주는 막대 그래프이다. 도면에 표시된 바대로, HLA-A2 발현("K562-HLA-A2") 또는 HLA-B7 발현("K562-HLA-B7") K562 표적 세포는 DMSO 비히클, 0.01, 0.1 또는 1μM의 NY-ESO-1 펩타이드, 또는 1μM의 MART-1 펩타이드에 의해 펄스화되었다. K562 표적 세포의 부재 하에 임의의 자극이 없는(기저 활성화 수준) 또는 항-CD3/항-CD28 항체(최대 활성화 수준)에 의해 자극된 CD25+ T 세포의 백분율이 또한 도시되어 있다. 도 3d 및 도 3e는 검정의 완료 시, 공배양으로부터 취한 배지 중의, ELISA에 의해 측정된 바와 같은, IFNγ의 농도를 보여주는 막대 그래프이다.
도 4a, 도 4b 및 도 4c는 도 3a 내지 도 3e에 도시된 연구와 유사한 공배양 연구로부터의 결과를 보여주는 그래프이다. 상이한 건강한 도너로부터의 1차 T 세포는 TCR18168 또는 MART-1 TCR DMF4를 발현하도록 형질주입되었다. 형질주입된 T 세포는 16시간 동안 CellTrace(상표명) 바이올렛 염료 표지된 펩타이드 펄스화된 T2 세포와 공배양되었다. 표면 CD25 발현에 의해 측정된 바와 같은 T 세포 활성화 및 표적 세포의 소실에 의해 측정된 바와 같은 표적 세포 사멸은 조사되었다. 도 4a 및 도 4b는, DMSO 비히클, 1μM의 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1), 또는 1μM의 MART-1 펩타이드 ELAGIGILTV(서열 번호 22)에 의해 펄스화된 T2 표적 세포에 의한 공배양 이후에, 유세포분석법에 의해 측정된, CD25+ T 세포의 백분율을 보여주는 막대 그래프이다. T2 표적 세포의 부재 하에 임의의 자극이 없는(기저 활성화 수준) 또는 항-CD3/항-CD28 항체(최대 활성화 수준)에 의해 자극된 CD25+ T 세포의 백분율이 또한 도시되어 있다. 도 4c는 T 세포의 부재 하에 또는 TCR18168 또는 DMF4를 발현하는 T 세포의 존재 하에 생 T2 세포의 전체 수를 보여주는 막대 그래프이다. 도면에 표시된 바대로, T2 세포는 공배양 연구 전에 DMSO, NY-ESO-1 펩타이드 또는 MART-1 펩타이드에 의해 펄스화되었다.
도 5a 및 도 5b는 연구로부터의 결과를 보여주는 그래프이고, 이 연구에서 TCR18168을 발현하도록 렌티바이러스로 형질도입된 TCRβ 음성 주르카트(Jurkat)-NFAT-루시퍼라제 리포터 세포주는 분석 전에 16시간 동안 AAD 발현 펩타이드 펄스화된 B16 세포와 공배양되었다. AAD는 HLA-A*0201 분자의 α1 및 α2 도메인, 마우스 H-2Db 분자의 α3 도메인 및 인간 β2 마이크로글로불린을 포함하는 키메라 분자이다. 도 5a는, DMSO, 음성 대조군 MART-1 펩타이드 또는 NY-ESO-1 펩타이드(표적 펩타이드)에 의해 펄스화된, 포르볼 12-미리스테이트 13-아세테이트(PMA) 및 이오노마이신에 의해 자극된 TCR18168 발현 주르카트 리포터 세포(최대 NFAT-루시퍼라제 발현을 나타냄) 또는 AAD 발현 B16 세포에 의해 생성된 상대 광 단위를 보여주는 막대 그래프이다. 도 5b는, PMA 및 이오노마이신 대조군에 의해 생성된 평균 상대 광 단위로 정규화된, 다양한 농도의 NY-ESO-1 표적 펩타이드에 의해 펄스화된 AAD 발현 B16 세포와 공배양된 TCR18168 발현 주르카트 리포터 세포에 의해 생성된 상대 광 단위를 보여주는 선 그래프이다. x축은 AAD 발현 B16 세포를 펄스화하도록 사용된 펩타이드의 농도를 보여준다.
도 6은 APC 표지된 항-마우스 TCR β 사슬 항체 및 야생형 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)가 로딩된 PE 표지된 HLA-A*0201 삼합체를 사용한 키메라 TCR TCR18168c, TCR0001, TCR0009, TCR0011, TCR0013, TCR0015, TCR0017, TCR0019, TCR0021, TCR0023, TCR0027, TCR0029, TCR0031, TCR0033, TCR0035, TCR0037, TCR0049, TCR0059, TCR0061, TCR0065, TCR0067, TCR0069, SSX-2에 결합하는 기준 TCR을 발현하는 AK-D10R3 세포, 또는 TCR 음성 AK-D10R3 세포의 염색을 보여주는 일련의 유세포분석법 선도이다. 삼합체+ TCR+ 세포의 백분율은 각각의 선도에 표시된다.
도 7은 50㎍/㎖의 야생형 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)에 의해 펄스화된 T2 세포와의 공배양 후 키메라 TCR TCR18168c, TCR0001, TCR0009, TCR0011, TCR0013, TCR0015, TCR0017, TCR0019, TCR0021, TCR0023, TCR0027, TCR0029, TCR0031, TCR0033, TCR0035, TCR0037, TCR0049, TCR0059, TCR0061, TCR0065, TCR0067 또는 TCR0069를 발현하는 AK-D10R3 세포의 활성화를 시험하는 검정으로부터의 결과를 보여주는 일련의 유세포분석법 선도이다. 대조군 SXX-2 펩타이드에 의해 펄스화되거나 펩타이드가 없는 T2 세포와 공배양된 TCR18168c를 발현하는 AK-D10R3 세포는 대조군으로서 사용되었다. 유세포분석법 선도에서, y축은 표면 TCR 염색을 보여주고, x축은 AK-D10R3 세포에서의 IL-2-(NFAT)3-EGFP 리포터 작제물의 활성화로부터 생긴 EGFP 발현을 보여준다. TCR+EGFP+ 세포의 백분율은 각각의 선도의 상부 오른쪽 패널에 표시된다.
도 8a 및 도 8b는 APC 표지된 항-인간 TCR 항체, 야생형 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)가 로딩된 PE 표지된 HLA-A*0201 삼합체, 또는 대조군 SSX-2 펩타이드 KASEKIFYV(서열 번호 274)가 로딩된 PE 표지된 HLA-A*0201 삼합체를 사용한 완전 인간 TCR TCR18168, TCR0002, TCR0010, TCR0012, TCR0014, TCR0016, TCR0018, TCR0020, TCR0022, TCR0024, TCR0028, TCR0032, TCR0038, TCR0050, TCR0060, TCR0062, TCR0066, TCR0068 또는 TCR0070을 발현하는 주르카트 세포, 또는 TCR 음성 주르카트 세포의 염색을 보여주는 일련의 유세포분석법 선도이다. TCR+ 또는 삼합체+ 세포의 백분율은 각각의 선도에 표시된다.
도 9a 내지 도 9h는 TCR 형질주입된 T 세포와 다양한 농도의 NY-ESO-1 표적 펩타이드에 의해 펄스화된 T2 세포의 동시 배양 이후에 활성화의 마커인 CD25 발현의 백분율을 보여주는 일련의 그래프이다. 실험은 플레이팅 후 16시간에 판독으로 1:1 효과기:표적 비율에서 설정되었다. 각각의 표시된 TCR 후보(도 9a: 기준 TCR; 도 9b: TCR0002; 도 9c: TCR0014; 도 9d: TCR0018; 도 9e: TCR0022; 도 9f: TCR0028; 도 9g: TCR0038; 및 도 9h: TCR0070)에 대한 활성화 퍼센트 값은 다양한 펩타이드 용량에서 작도되었다.
도 10a 내지 도 10h는 TCR 형질주입된 T 세포와 다양한 농도의 NY-ESO-1 표적 펩타이드에 의해 펄스화된 T2 세포의 동시 배양 이후에 세포용해 가능성 및 탈과립화의 마커인 CD107a 발현의 백분율을 보여주는 일련의 그래프이다. 실험은 플레이팅 후 16시간에 판독으로 1:1 효과기:표적 비율에서 설정되었다. 각각의 표시된 TCR 후보(도 10a: 기준 TCR; 도 10b: TCR0002; 도 10c: TCR0014; 도 10d: TCR0018; 도 10e: TCR0022; 도 10f: TCR0028; 도 10g: TCR0038; 및 도 10h: TCR0070)에 대한 활성화 퍼센트 값은 다양한 펩타이드 용량에서 작도되었다.
도 11a 내지 도 11h는 TCR 형질주입된 T 세포에 의한 펩타이드 펄스화된 T2 세포의 사멸 퍼센트를 보여주는 일련의 그래프이다. 실험은 플레이팅 후 16시간에 판독으로 1:1 효과기:표적 비율에서 설정되었다. 값은, (100을 곱한) 대조군 표적 세포의 수로 나눈, 샘플 웰에서의 대조군 표적 세포의 수와 특정한 표적 세포의 수 사이의 차이로서 계산되었다. 각각의 표시된 TCR 후보(도 11a: 기준 TCR; 도 11b: TCR0002; 도 11c: TCR0014; 도 11d: TCR0018; 도 11e: TCR0022; 도 11f: TCR0028; 도 11g: TCR0038; 및 도 11h: TCR0070)에 대한 사멸 퍼센트 값은 다양한 펩타이드 용량에서 작도되었다.
도 12a 내지 도 12h는 표시된 비율에서 배양된 HLA-A*0201 및 NY-ESO-1 형질도입된 K562 표적 세포의 고정된 수에 의한 자극의 16시간 이후에 형질주입된 T 세포에 의한 활성화의 마커인 CD25 발현의 백분율을 보여주는 일련의 그래프이다. 각각의 표시된 TCR 후보(도 12a: 기준 TCR; 도 12b: TCR0002; 도 12c: TCR0014; 도 12d: TCR0018; 도 12e: TCR0022; 도 12f: TCR0028; 도 12g: TCR0038; 및 도 12h: TCR0070)에 대한 활성화 퍼센트 값은 표적 세포의 일정한 수를 유지시키면서 형질주입된 T 세포의 수가 변하여 다양한 효과기-대-표적 비율에서 작도되었다.
도 13a 내지 도 13h는 표시된 비율에서 HLA-A*0201 및 NY-ESO-1 형질도입된 K562 표적 세포의 고정된 수에 의한 TCR 형질주입된 T 세포의 공배양 이후에 세포용해 가능성 및 탈과립화의 마커인 CD107a 발현의 백분율을 보여주는 일련의 그래프이다. 각각의 표시된 TCR 후보(도 13a: 기준 TCR; 도 13b: TCR0002; 도 13c: TCR0014; 도 13d: TCR0018; 도 13e: TCR0022; 도 13f: TCR0028; 도 13g: TCR0038; 및 도 13h: TCR0070)에 대한 활성화 퍼센트 값은 표적 세포의 일정한 수를 유지시키면서 형질주입된 T 세포의 수가 변하여 다양한 효과기-대-표적 비율에서 작도되었다.
도 14a 내지 도 14h는 표시된 비율에서 HLA-A*0201 및 NY-ESO-1을 발현하도록 형질도입된 K562 세포의 사멸 퍼센트를 보여주는 일련의 그래프이다. 사멸 퍼센트는, (100을 곱한) 대조군 표적 세포의 수로 나눈, 샘플 웰에서의 대조군 표적 세포의 수와 특정한 표적 세포의 수 사이의 차이로서 계산되었다. 각각의 표시된 TCR 후보(도 14a: 기준 TCR; 도 14b: TCR0002; 도 14c: TCR0014; 도 14d: TCR0018; 도 14e: TCR0022; 도 14f: TCR0028; 도 14g: TCR0038; 및 도 14h: TCR0070)에 대한 사멸 퍼센트 값은 표적 세포의 일정한 수를 유지시키면서 형질주입된 T 세포의 수가 변하여 다양한 효과기-대-표적 비율에서 작도되었다.
도 15는 5:1 효과기:표적 비율에서 TCR 형질주입된 T 세포와의 공배양 이후에 HLA-B*0702 형질도입된 K562 세포에 대한 HLA-A*0201 및 NY-ESO-1 형질도입된 K562 세포의 우선적 사멸 퍼센트를 보여주는 그래프이다.
도 16a 내지 도 16f는 다양한 비율에서 HLA-A*0201 및 NY-ESO-1의 내인성 수준을 발현하는 SLM2-mel 흑색종 세포와의 TCR 형질주입된 T 세포의 공배양 이후에 활성화의 마커인 CD25 발현의 백분율을 보여주는 일련의 그래프이다. 각각의 표시된 TCR 후보(도 16a: 기준 TCR; 도 16b: TCR0002; 도 16c: TCR0014; 도 16d: TCR0018; 도 16e: TCR0022; 및 도 16f: TCR0028)에 대한 활성화 퍼센트 값은 표적 세포의 일정한 수를 유지시키면서 형질주입된 T 세포의 수가 변하여 다양한 효과기-대-표적 비율에서 작도되었다.
도 17a 내지 도 17f는 형질주입된 T 세포가 표시된 비율에서 SLM2-mel 세포와 공배양될 때 세포용해 가능성 및 탈과립화의 마커인 CD107a 발현의 백분율을 보여주는 일련의 그래프이다. 각각의 표시된 TCR 후보(도 17a: 기준 TCR; 도 17b: TCR0002; 도 17c: TCR0014; 도 17d: TCR0018; 도 17e: TCR0022; 및 도 17f: TCR0028)에 대한 활성화 퍼센트 값은 표적 세포의 일정한 수를 유지시키면서 형질주입된 T 세포의 수가 변하여 다양한 효과기-대-표적 비율에서 작도되었다.
도 18a 내지 도 18f는 HLA-A*0201 및 NY-ESO-1 펩타이드의 내인성 수준을 발현하는 SLM2-mel 흑색종 세포의 사멸 퍼센트를 보여주는 일련의 그래프이다. 각각의 표시된 TCR 후보(도 18a: 기준 TCR; 도 18b: TCR0002; 도 18c: TCR0014; 도 18d: TCR0018; 도 18e: TCR0022; 및 도 18f: TCR0028)에 대한 세포독성 값은 표적 세포의 일정한 수를 유지시키면서 형질주입된 T 세포의 수가 변하여 다양한 효과기-대-표적 비율에서 작도되었다.
도 19a 내지 도 19e는 앵커 최적화된 NY-ESO-1 펩타이드 SLLMWITQV(서열 번호 2)의 단일 점 돌연변이인 구합체 펩타이드의 그룹과 표시된 TCR(도 19a: 기준 TCR; 도 19b: TCR0001; 도 19c: TCR0017; 도 19d: TCR0021; 도 19e: TCR0037)의 특이성을 비교하는 일련의 열 지도이다. 구합체 펩타이드의 (P2 및 P9를 제외한) 각각의 위치는 19개의 상이한 아미노산 잔기 중 하나에 의해 치환되었다. 각각의 생성된 펩타이드는 T2 표적 세포를 펄스화하도록 사용되었고, 이것은 TCR 발현 효과기 세포(NY-ESO AK-D10R3 세포)와 공배양되었다. 생성된 돌연변이체 펩타이드에 대한 TCR의 결합 시, 효과기 세포는 EGFP 리포터를 발현하도록 활성화되었고, 이는 FACS에 의해 검출되었다. 결과는 열 지도로서 도시되어 있고, 여기서 수직 축에 표시된 잔기 대신에 수평 축에서 앵커 최적화된 NY-ESO-1 펩타이드 SLLMWITQV(서열 번호 2)에서의 네이티브 잔기의 아미노산 잔기 치환을 나타내는 각각의 블록은 (최소 0.0 및 최대 1.0으로 잘라진 정규화 값에 의해) 정규화된 평균 활성화로 스케일에서 음영이 되어 있다. "X"는 비시험된 돌연변이체를 나타낸다. (펩타이드 로딩이 없는) 배경 활성화는 모든 펩타이드 로딩된 샘플(변경된 및 네이티브 서열)로부터 공제되었다.
도 20a 내지 도 20e는 도 19a 내지 도 19e에 대해 기재된 바와 같은 각각의 돌연변이체 NY-ESO-1 펩타이드(검정 마름모꼴, "변경된"), 및 동족 앵커 최적화된 NY-ESO-1 펩타이드 SLLMWITQV(서열 번호 2)(개방 정사각형, "에피토프")에 대한 정규화된 평균 활성화 값을 보여주는, 표시된 TCR(도 20a: 기준 TCR; 도 20b: TCR0001; 도 20c: TCR0017; 도 20d: TCR0021; 도 20e: TCR0037)의 특이성 프로필을 비교하는 일련의 막대 그래프이다. 서열 번호 275-407의 펩타이드에 상응하는 (최대 1.0으로 잘린) 정규화된 평균 활성화 값은, 왼쪽에서 오른쪽으로, 각각의 도면의 가장 오른쪽에 도시된 앵커 최적화된 NY-ESO-1 펩타이드 SLLMWITQV(서열 번호 2)에 상응하는 "에피토프" 펩타이드 값을 제외하고, 서열 번호의 순차적인 증가 순서로 표시되어 있다. 오차 막대(검정)는 표준 평균 오차(SEM)를 나타낸다.
TCR(예를 들어, NY-ESO-1에 결합하는 TCR), 이 TCR을 포함하는 세포 및 약제학적 조성물, 이 TCR을 암호화하는 핵산, 이 TCR을 제조하기 위한 발현 벡터 및 숙주 세포 및 이 TCR을 사용하여 대상체를 치료하는 방법이 제공된다. 본 명세서에 개시된 TCR은 NY-ESO-1을 발현하는 암 세포에 대해 면역 반응을 지향시키고, 이에 따라 대상체에서 NY-ESO-1 발현 암을 치료하는 데 특히 유용하다.
5.1 정의
본 명세서에 사용된 바와 같이, 용어 "약" 및 "대략"은, 숫자 값 또는 숫자 범위를 수식하기 위해 사용될 때, 값 또는 범위의 5% 내지 10% 초과(예를 들어, 5% 이상 내지 10% 초과) 및 5% 내지 10% 미만(예를 들어, 5% 이상 내지 10% 미만)의 편차가 언급된 값 또는 범위의 의도된 의미 내에 있다는 것을 나타낸다.
본 명세서에 사용된 바와 같이, 용어 "NY-ESO-1"은 CTAG1A 또는 CTAG1B 유전자에 의해 암호화된 인간 암/고환 항원을 의미한다.
본 명세서에 사용된 바와 같이, 용어 "T 세포 수용체" 및 "TCR"은 상호교환되어 사용되고, αβ 또는 γδ T 세포 수용체로부터의 CDR 또는 가변 영역을 포함하는 분자를 의미한다. TCR의 예는 전장 TCR, TCR의 항원 결합 단편, 막관통 및 세포질 영역이 결여된 가용성 TCR, 가요성 링커에 의해 부착된 TCR의 가변 영역을 함유하는 단일 사슬 TCR, 조작된 다이설파이드 결합에 의해 연결된 TCR 사슬, 단일 TCR 가변 도메인, 단일 펩타이드-MHC-특이적 TCR, 다중특이적 TCR(이중특이적 TCR 포함), TCR 융합, 동시자극 영역을 포함하는 TCR, 인간 TCR, 인간화된 TCR, 키메라 TCR, 재조합으로 제조된 TCR 및 합성 TCR을 포함하지만, 이들로 제한되지는 않는다. 소정의 실시형태에서, TCR은 전장 α 사슬 및 전장 β 사슬을 포함하는 전장 TCR이다. 소정의 실시형태에서, TCR은 막관통 및/또는 세포질 영역(들)이 결여된 가용성 TCR이다. 소정의 실시형태에서, TCR은 펩타이드 링커에 의해 연결된 Vα 및 Vβ를 포함하는 단일 사슬 TCR(scTCR), 예컨대 PCT 공보 WO 제2003/020763호, WO 제2004/033685호 또는 WO 제2011/044186호(이들은 각각 본 명세서에 그 전문이 참고로 포함됨)에 기재된 바와 같은 구조를 갖는 scTCR이다. 소정의 실시형태에서, TCR은 막관통 영역을 포함한다. 소정의 실시형태에서, TCR은 동시자극 신호전달 영역을 포함한다.
본 명세서에 사용된 바와 같이, 용어 "전장 TCR"은 TCR 가변 영역 및 TCR 막관통 영역 및 TCR 세포질 영역을 포함하는 TCR 불변 영역을 각각 포함하는 제1 폴리펩타이드 사슬 및 제2 폴리펩타이드 사슬의 이합체를 포함하는 TCR을 의미한다. 소정의 실시형태에서, 전장 TCR은 1개 또는 2개의 비변형된 TCR 사슬, 예를 들어 비변형된 α, β, γ 또는 δ TCR 사슬을 포함한다. 소정의 실시형태에서, 전장 TCR은 1개 또는 2개의 변경된 TCR 사슬, 예컨대 키메라 TCR 사슬 및/또는 비변형된 TCR 사슬에 비해 하나 이상의 아미노산 치환, 삽입 또는 결실을 포함하는 TCR 사슬을 포함한다. 소정의 실시형태에서, 전장 TCR은 성숙, 전장 TCR α 사슬 및 성숙, 전장 TCR β 사슬을 포함한다. 소정의 실시형태에서, 전장 TCR은 성숙, 전장 TCR γ 사슬 및 성숙, 전장 TCR δ 사슬을 포함한다.
본 명세서에 사용된 바와 같이, 용어 "TCR 가변 영역"은 TCR α 사슬에 대한 TRAC 유전자, TCR β 사슬에 대한 TRBC1 또는 TRBC2 유전자, TCR δ 사슬에 대한 TRDC 유전자, 또는 TCR γ 사슬에 대한 TRGC1 또는 TRGC2 유전자에 의해 암호화되지 않은 성숙 TCR 폴리펩타이드 사슬(예를 들어, TCR α 사슬 또는 β 사슬)의 일부를 의미한다. 몇몇 실시형태에서, TCR α 사슬의 TCR 가변 영역은 TRAV 및/또는 TRAJ 유전자에 의해 암호화된 성숙 TCR α 사슬 폴리펩타이드의 모든 아미노산을 포함하고, TCR β 사슬의 TCR 가변 영역은 TRBV, TRBD, 및/또는 TRBJ 유전자에 의해 암호화된 성숙 TCR β 사슬 폴리펩타이드의 모든 아미노산을 포함한다(예를 들어, 문헌[T cell receptor Factsbook, (2001) LeFranc and LeFranc, Academic Press, ISBN 0-12-441352-8](본 명세서에 그 전문이 참고로 포함됨) 참조). TCR 가변 영역은 일반적으로 프레임워크 영역(FR) 1, 2, 3 및 4 및 상보성 결정 영역(CDR) 1, 2 및 3을 포함한다.
본 명세서에 사용된 바와 같이, 용어 "α 사슬 가변 영역" 및 "Vα"는 상호교환되어 사용되고, TCR α 사슬의 가변 영역을 의미한다.
본 명세서에 사용된 바와 같이, 용어 "β 사슬 가변 영역" 및 "Vβ"는 상호교환되어 사용되고, TCR β 사슬의 가변 영역을 의미한다.
TCR의 맥락에서 본 명세서에 사용된 바와 같이, 용어 "CDR" 또는 "상보성 결정 영역"은 TCR 사슬의 가변 영역(예를 들어, α 사슬 또는 β 사슬) 내에 발견되는 비인접한 항원 조합 부위를 의미한다. 이 영역은 문헌[Lefranc, (1999) The Immunologist 7: 132-136, Lefranc et al., (1999) Nucleic Acids Res 27: 209-212, LeFranc (2001) T cell receptor Factsbook, Academic Press, ISBN 0-12-441352-8, Lefranc et al., (2003) Dev Comp Immunol. 27(1):55-77, 및 Kabat et al., (1991) Sequences of protein of immunological interest](이들은 각각 본 명세서에서 그 전문이 참고로 포함됨)에 기재되어 있다. 소정의 실시형태에서, CDR은 상기 Lefranc (1999) 문헌에 기재된 IMGT 넘버링 시스템에 따라 결정된다. 소정의 실시형태에서, CDR은 상기 Kabat 문헌에 기재된 Kabat 넘버링 시스템에 따라 결정된다. 소정의 실시형태에서, CDR은 경험적으로, 예를 들어 TCR과 동족 항원(예를 들어, 펩타이드 또는 펩타이드-MHC 복합체)의 상호작용의 구조 분석에 기초하여 정의된다. 소정의 실시형태에서, TCR의 α 사슬 및 β 사슬 CDR은 상이한 관례에 따라(예를 들어, Kabat 또는 IMGT 넘버링 시스템에 따라, 또는 경험적으로 구조 분석에 기초하여) 정의된다.
본 명세서에 사용된 바와 같이, 용어 "프레임워크 아미노산 잔기"는 TCR 사슬(예를 들어, α 사슬 또는 β 사슬)의 프레임워크 영역에서의 아미노산을 의미한다. 본 명세서에 사용된 바와 같이, 용어 "프레임워크 영역" 또는 "FR"은 TCR 가변 영역의 일부이지만 CDR의 일부가 아닌 아미노산 잔기를 포함한다.
본 명세서에 사용된 바와 같이, TCR과 관련하여 용어 "불변 영역"은, 선택적으로 막관통 영역의 전부 또는 일부 및/또는 세포질 영역의 전부 또는 일부가 결여된, (TCR α 사슬에 대해) TRAC 유전자, (TCR β 사슬에 대해) TRBC1 또는 TRBC2 유전자, (TCR δ 사슬에 대해) TRDC 유전자, 또는 (TCR γ 사슬에 대해) TRGC1 또는 TRGC2 유전자에 의해 암호화된 TCR의 부분을 의미한다. 소정의 실시형태에서, TCR 불변 영역은 막관통 영역 및 세포질 영역이 결여된다. TCR 불변 영역은 TRAV, TRAJ, TRBV, TRBD, TRBJ, TRDV, TRDD, TRDJ, TRGV 또는 TRGJ 유전자에 의해 암호화된 아미노산을 포함하지 않는다(예를 들어, 문헌[T cell receptor Factsbook, (2001) LeFranc and LeFranc, Academic Press, ISBN 0-12-441352-8](본 명세서에 그 전문이 참고로 포함됨) 참조).
본 명세서에 사용된 바와 같이, 용어 "주요 조직적합성 복합체" 및 "MHC"는 상호교환되어 사용되고, MHC 클래스 I 분자 및/또는 MHC 클래스 II 분자를 의미한다.
본 명세서에 사용된 바와 같이, 용어 "MHC 클래스 I"는 MHC 클래스 I α 사슬 및 β2 마이크로글로불린 사슬의 이합체를 의미하고, 용어 "MHC 클래스 II"는 MHC 클래스 II α 사슬 및 MHC 클래스 II β 사슬의 이합체를 의미한다.
본 명세서에 사용된 바와 같이, 용어 "펩타이드-MHC 복합체"는, 펩타이드가 MHC의 분야 인식된 펩타이드 결합 포켓에서 결합된, MHC 분자(MHC 클래스 I 또는 MHC 클래스 II)를 의미한다. 몇몇 실시형태에서, MHC 분자는 세포 표면에서 발현된 막 결합된 단백질이다. 몇몇 실시형태에서, MHC 분자는 막관통 또는 세포질 영역이 결여된 가용성 단백질이다.
본 명세서에 사용된 바와 같이, TCR과 관련하여 용어 "세포외"는 세포의 바깥에 위치한 재조합 막관통 단백질의 일부 또는 일부들을 의미한다.
본 명세서에 사용된 바와 같이, TCR 사슬과 관련하여 용어 "막관통"은 세포의 혈장 막에 임베딩된 TCR 사슬의 일부 또는 일부들을 의미한다.
본 명세서에 사용된 바와 같이, TCR 사슬과 관련하여 용어 "세포질"은 세포의 세포질에 위치한 TCR 사슬의 일부 또는 일부들을 의미한다.
본 명세서에 사용된 바와 같이, 용어 "동시자극 신호전달 영역"은 세포내 신호전달 사건을 매개하는 것을 책임지는 동시자극 분자의 세포내 부분을 의미한다.
"결합 친화도"는 일반적으로 분자의 단일 결합 자리(예를 들어, TCR)와 이의 결합 파트너(예를 들어, 펩타이드-MHC 복합체) 사이의 비공유 상호작용의 전체 합의 강도를 의미한다. 달리 표시되지 않는 한, 본 명세서에 사용된 바와 같이, "결합 친화도"는 결합 쌍의 구성원(예를 들어, TCR 및 펩타이드-MHC 복합체) 사이의 1:1 상호작용을 반영하는 고유한 결합 친화도를 의미한다. 이의 파트너 Y에 대한 분자 X의 친화도는 일반적으로 해리 상수(KD)로 표시될 수 있다. 친화도는 평형 해리 상수(KD) 및 평형 결합 상수(KA)를 포함하는 당해 분야에 공지된 다수의 방식으로 측정되고/되거나 표시될 수 있다. KD는 koff/kon의 몫으로부터 계산되는 한편, KA는 kon/koff의 몫으로부터 계산된다. kon은 예를 들어 펩타이드-MHC 복합체에 대한 TCR의 결합 상수를 의미하고, koff는 예를 들어 펩타이드-MHC 복합체에 대한 TCR의 결합 상수를 의미한다. kon 및 koff는 당업자에게 공지된 기법, 예컨대 BIAcore(등록상표) 또는 KinExA의 사용에 의해 결정될 수 있다. 본 명세서에 사용된 바와 같이, "더 낮은 친화도"는 더 높은 KD를 의미한다.
본 명세서에 사용된 바와 같이, 용어 "특이적으로 결합한다"는 특정한 항원(예를 들어, 특이적 펩타이드 또는 특이적 펩타이드-MHC 복합체 조합)에 우선적으로 결합하는 TCR의 능력을 의미하고, 그래서 이러한 결합은 당업자에 의해 이해된다. 예를 들어, 항원에 특이적으로 결합하는 TCR은 예를 들어 BIAcore(등록상표) 또는 당해 분야에 공지된 다른 면역검정에 의해 결정되는 바대로 일반적으로 더 낮은 친화도로 다른 항원에 결합할 수 있다(예를 들어, 문헌[Savage et al., Immunity. 1999, 10(4):485-92](본 명세서에 그 전문이 참고로 포함됨) 참조). 구체적인 실시형태에서, 항원에 특이적으로 결합하는 TCR은 TCR이 또 다른 항원에 결합할 때의 Ka의 적어도 2배, 5배, 10배, 50배, 100배, 500배, 1,000배, 5,000배 또는 10,000배 초과인 결합 상수(Ka)로 항원에 결합한다. 소정의 실시형태에서, 본 명세서에 개시된 TCR은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 특이적으로 결합한다.
본 명세서에 사용된 바와 같이, "에피토프"는 당해 분야에서의 용어이고, TCR이 결합할 수 있는 항원의 국소화된 영역(예를 들어, 펩타이드 또는 펩타이드-MHC 복합체)을 의미한다. 소정의 실시형태에서, TCR이 결합하는 에피토프는 예를 들어 NMR 분광법, X선 회절 결정학 연구, ELISA 검정, 질량 분광법(예를 들어, 액체 크로마토그래피 전기분무 질량 분광법)과 커플링된 수소/중수소 교환, 유세포분석법 분석, 돌연변이유발 맵핑(예를 들어, 부위 지정 돌연변이유발 맵핑), 및/또는 구조 모델링에 의해 결정될 수 있다. X선 결정학에 대해, 결정화는 당해 분야에서 임의의 공지된 방법을 이용하여 달성될 수 있다(예를 들어, 문헌[Giege R et al., (1994) Acta Crystallogr D Biol Crystallogr 50(Pt 4): 339-350; McPherson A (1990) Eur J Biochem 189: 1-23; Chayen NE (1997) Structure 5: 1269-1274; McPherson A (1976) J Biol Chem 251: 6300-6303](이들은 각각 본 명세서에서 그 전문이 참고로 포함됨)). TCR:항원 결정은 널리 공지된 X선 회절 기법을 이용하여 연구될 수 있고, 컴퓨터 소프트웨어, 예컨대 X-PLOR(Yale University, 1992, Molecular Simulations, Inc.가 배포; 예를 들어, 문헌[Meth Enzymol (1985) volumes 114 & 115, eds Wyckoff HW et al.,; 미국 제2004/0014194호), 및 BUSTER (Bricogne G (1993) Acta Crystallogr D Biol Crystallogr 49(Pt 1): 37-60; Bricogne G (1997) Meth Enzymol 276A: 361-423, ed Carter CW; Roversi P et al., (2000) Acta Crystallogr D Biol Crystallogr 56(Pt 10): 1316-1323(이들은 각각 본 명세서에서 그 전문이 참고로 포함됨))을 이용하여 정제될 수 있다. 돌연변이유발 맵핑 연구는 당업자에게 공지된 임의의 방법을 이용하여 달성될 수 있다. 알라닌 스캐닝 돌연변이유발 기법을 포함하는 돌연변이유발 기법의 설명을 위해, 예를 들어 문헌[Champe M et al., (1995) J Biol Chem 270: 1388-1394 및 Cunningham BC & Wells JA (1989) Science 244: 1081-1085](이들은 각각 본 명세서에서 그 전문이 참고로 포함됨)을 참조한다. 구체적인 실시형태에서, 항원의 에피토프는 알라닌 스캐닝 돌연변이유발 연구를 이용하여 결정된다. 구체적인 실시형태에서, 항원의 에피토프는 질량 분광법과 커플링된 수소/중수소 교환을 이용하여 결정된다. 소정의 실시형태에서, 항원은 펩타이드-MHC 복합체이다. 소정의 실시형태에서, 항원은 MHC 분자에 의해 제공된 펩타이드이다.
본 명세서에 사용된 바와 같이, 용어 "치료한다", "치료하는" 및 "치료"는 본 명세서에 기재된 치료학적 또는 예방적 조치를 의미한다. 몇몇 실시형태에서, "치료"의 방법은, 질환 또는 장애 또는 재발성 질환 또는 장애의 하나 이상의 증상을 예방, 치유, 지연, 이의 중증도를 감소, 또는 경감시키기 위한, 또는 이러한 치료의 부재에서 예상되는 것을 넘어 대상체의 생존을 연장하기 위한, 질환 또는 장애를 갖거나, 이러한 질환 또는 장애를 가질 소인이 있는 대상체에게 TCR 또는 TCR을 발현하는 세포의 투여를 이용한다.
본 명세서에 사용된 바와 같이, 대상체에 대한 치료의 투여의 맥락에서 용어 "유효량"은 원하는 예방학적 또는 치료학적 효과를 달성하는 치료의 양을 의미한다.
본 명세서에 사용된 바와 같이, 용어 "대상체"는 임의의 인간 또는 비인간 동물을 포함한다. 일 실시형태에서, 대상체는 인간 또는 비인간 포유류이다. 일 실시형태에서, 대상체는 인간이다.
2개의 서열(예를 들어, 아미노산 서열 또는 핵산 서열) 사이의 "동일성 퍼센트"의 결정은 수학 알고리즘을 이용하여 달성될 수 있다. 2개의 서열의 비교를 위해 사용된 수학 알고리즘의 구체적인 비제한적인 예는 문헌[Karlin S & Altschul SF (1993) PNAS 90: 5873-5877]에서처럼 변형된 바와 같은 문헌[Karlin S & Altschul SF (1990) PNAS 87: 2264-2268](이들은 각각 본 명세서에서 그 전문이 참고로 포함됨)의 알고리즘이다. 이러한 알고리즘은 문헌[Altschul SF et al., (1990) J Mol Biol 215: 403](본 명세서에서 그 전문이 참고로 포함됨)의 NBLAST 및 XBLAST 프로그램으로 도입된다. BLAST 뉴클레오타이드 조사는 본 명세서에 기재된 핵산 분자에 상동성인 뉴클레오타이드 서열을 얻기 위해 예를 들어 스코어=100, 워드길이=12에서 NBLAST 뉴클레오타이드 프로그램 매개변수 세트에 의해 수행될 수 있다. BLAST 단백질 조사는 본 명세서에 기재된 단백질 분자에 상동성인 아미노산 서열을 얻기 위해 예를 들어 스코어=50, 워드길이=3에서 XBLAST 프로그램 매개변수 세트에 의해 수행될 수 있다. 비교 목적을 위해 갭이 있는 정렬을 얻기 위해, Gapped BLAST는 문헌[Altschul SF et al., (1997) Nuc Acids Res 25: 3389-3402](본 명세서에서 참고로 그 전문이 포함됨)에 기재된 바대로 이용될 수 있다. 대안적으로, PSI BLAST는 분자 사이의 먼 관계를 검출하는 반복된 조사를 수행하도록 이용될 수 있다. Id. BLAST, Gapped BLAST 및 PSI Blast 프로그램을 이용할 때, 각각의 프로그램(예를 들어, XBLAST 및 NBLAST)의 디폴트 매개변수를 이용할 수 있다(예를 들어, 월드와이드웹, ncbi.nlm.nih.gov에서 National Center for Biotechnology Information(NCBI) 참조). 서열의 비교를 위해 이용된 수학 알고리즘의 또 다른 구체적인 비제한적인 예는 문헌[Myers and Miller, 1988, CABIOS 4:11-17](본 명세서에서 그 전문이 참고로 포함됨]의 알고리즘이다. 이러한 알고리즘은 GCG 서열 정렬 소프트웨어 패키지의 일부인 ALIGN 프로그램(버전 2.0)에서 도입된다. PAM120 중량 가중 테이블인 아미노산 서열을 비교하기 위한 ALIGN 프로그램을 이용할 때, 12의 갭 길이 패널티 및 4의 갭 패널티를 이용할 수 있다.
2개의 서열 사이의 동일성 퍼센트는 갭을 허용하거나 허용하지 않으면서 상기에 기재된 것과 유사한 기법을 이용하여 결정될 수 있다. 동일성 퍼센트의 계산에서, 통상적으로 오직 정확한 일치가 계수된다.
본 명세서에 사용된 바와 같이, 용어 "효과기 모이어티"는 분자의 천연 활성을 증가시키거나 감소시키거나, 분자에 신규한 활성을 부여하는 분자의 작용기 또는 성분을 의미한다. 소정의 실시형태에서, 효과기 모이어티는 결합 모이어티이다. 실시형태에서, 결합 모이어티는 세포 표면 단백질에 결합한다. 소정의 실시형태에서, 결합 모이어티는 항체이다.
본 명세서에 사용된 바와 같이, 용어 "항체" 및 "항체들"은 전장 항체, 전장 항체의 항원 결합 단편, 및 항체 CDR, VH 영역 또는 VL 영역을 포함하는 분자를 포함한다. 항체의 예는 단일클론 항체, 재조합으로 제조된 항체, 단일특이적 항체, 다중특이적 항체(이중특이적 항체 포함), 인간 항체, 인간화된 항체, 키메라 항체, 면역글로불린, 합성 항체, 2개의 중쇄 및 2개의 경쇄 분자를 포함하는 삼합체 항체, 항체 경쇄 단량체, 항체 중쇄 단량체, 항체 경쇄 이합체, 항체 중쇄 이합체, 항체 경쇄-항체 중쇄 쌍, 인트라바디, 헤테로접합체 항체, 항체-약물 접합체, 단일 도메인 항체, 1가 항체, 단일 사슬 항체 또는 단일 사슬 Fv(scFv), 낙타화된 항체, 아피바디, Fab 단편, F(ab')2 단편, 다이설파이드 연결된 Fv(sdFv), 항-이디오타입(항-Id) 항체(예를 들어, 항-항-Id 항체 포함), 및 임의의 상기의 항원 결합 단편을 포함한다. 소정의 실시형태에서, 본 명세서에 기재된 항체는 다중클론 항체 집단을 의미한다. 항체는 면역글로불린 분자의 임의의 유형(예를 들어, IgG, IgE, IgM, IgD, IgA 또는 IgY), 임의의 클래스(예를 들어, IgG1, IgG2, IgG3, IgG4, IgA1 또는 IgA2), 또는 임의의 하위클래스(예를 들어, IgG2a 또는 IgG2b)일 수 있다. 소정의 실시형태에서, 본 명세서에 기재된 항체는 IgG 항체, 또는 이의 클래스(예를 들어, 인간 IgG1 또는 IgG4) 또는 하위클래스이다. 구체적인 실시형태에서, 항체는 인간화된 단일클론 항체이다. 또 다른 구체적인 실시형태에서, 항체는 인간 단일클론 항체이다.
5.2 T 세포 수용체
일 양태에서, 본 개시내용은 SLLMWITQC(서열 번호 1) 또는 이의 앵커 최적화된 변이체 SLLMWITQV(서열 번호 2)의 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR을 제공한다. 소정의 실시형태에서, TCR은 SLLMWITQC(서열 번호 1) 또는 이의 앵커 최적화된 변이체 SLLMWITQV(서열 번호 2)의 아미노산 서열로 이루어진 펩타이드에 특이적으로 결합한다. 소정의 실시형태에서, TCR은 SLLMWITQC(서열 번호 1) 또는 이의 앵커 최적화된 변이체 SLLMWITQV(서열 번호 2)의 아미노산 서열로 이루어진 펩타이드를 포함하는 펩타이드-MHC 복합체에 결합한다. 소정의 실시형태에서, TCR은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드를 포함하는 펩타이드-MHC 복합체에 특이적으로 결합한다. 일 양태에서, 본 개시내용은 주요 조직적합성 복합체(major histocompatibility complex: MHC) 분자에 의해 제공된 SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)에 결합하는 TCR을 제공한다. 일 양태에서, 본 개시내용은 SLLMWITQC(서열 번호 1)-HLA-A*0201 복합체 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR을 제공한다. 예시적인 TCR의 아미노산 서열은 본 명세서에서 표 1에 기재되어 있다.
일 양태에서, 본 개시내용은 아미노산으로 이루어진 펩타이드에 결합하는 TCR을 제공한다. 본 명세서에 개시된 TCR의 CDR은 임의의 분야 인정된 넘버링 관례를 이용하여 정의될 수 있다. 추가적으로 또는 대안적으로, CDR은 경험적으로, 예를 들어 TCR과 동족 항원(예를 들어, 펩타이드 또는 펩타이드-MHC 복합체)의 상호작용의 구조 분석에 기초하여 정의될 수 있다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 본 명세서에서 표 1에 개시된 Vα 또는 Vβ의 CDR 중 1개, 2개 또는 모두를 포함하고, CDR은 예를 들어 상기 Lefranc M-P (1999) 문헌 및 상기 Lefranc M-P et al., (1999) 문헌에 기재된 바와 같은 IMGT 넘버링 시스템에 따라 정의된다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 본 명세서에서 표 1에 개시된 Vα 또는 Vβ의 CDR 중 1개, 2개 또는 모두를 포함하고, CDR은 상기 Kabat에 기재된 Kabat 넘버링 시스템에 따라 정의된다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 본 명세서에서 표 1에 개시된 Vα 또는 Vβ의 CDR 중 1개, 2개 또는 모두를 포함하고, CDR은 경험적으로, 예를 들어 TCR과 동족 항원(예를 들어, 펩타이드-MHC 복합체)의 상호작용의 구조 분석에 기초하여 결정된다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 본 명세서에서 표 1에 개시된 Vα 또는 Vβ의 CDR 중 1개, 2개 또는 모두를 포함하고, 각각의 CDR은 IMGT 또는 Kabat 넘버링 시스템에 따라 정의되거나, 경험적으로, 예를 들어 TCR과 동족 항원(예를 들어, 펩타이드 또는 펩타이드-MHC 복합체)의 상호작용의 구조 분석에 기초하여 결정된다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 CDR1α, CDR2α 및 CDR3α를 포함하는 Vα 및 CDR1β, CDR2β 및 CDR3β를 포함하는 Vβ를 포함하고, CDR1α, CDR2α 및 CDR3α는 서열 번호 각각 5, 6, 및 61; 5, 6 및 62; 5, 6 및 63; 5, 6 및 64; 또는 5, 6 및 65, 바람직하게는 각각 5, 6 및 7; 5, 6 및 39; 5, 6 및 40; 5, 6 및 41; 5, 6 및 42; 5, 6 및 43; 5, 6 및 44; 5, 6 및 45; 5, 6 및 46; 5, 6 및 47; 5, 6 및 48; 5, 6 및 49; 5, 6 및 50; 5, 6 및 51; 5, 6 및 52; 5, 6 및 53; 5, 6 및 54; 5, 6 및 55; 5, 6 및 56; 5, 6 및 57; 5, 6 및 58; 5, 6 및 59; 또는 5, 6 및 60에 제시된 CDR1α, CDR2α 및 CDR3α 아미노산 서열을 포함하고, CDR1β, CDR2β 및 CDR3β는 각각 서열 번호 8, 9 및 10에 기재된 CDR1β, CDR2β 및 CDR3β 아미노산 서열을 포함한다. 일 실시형태에서, 각각의 CDR은 IMGT 넘버링 시스템에 따라 정의된다. 일 실시형태에서, 각각의 CDR은 Kabat 넘버링 시스템에 따라 정의된다. 일 실시형태에서, 각각의 CDR은 경험적으로, 예를 들어 TCR과 동족 항원(예를 들어, 펩타이드 또는 펩타이드-MHC 복합체)의 상호작용의 구조 분석에 기초하여 결정된다. 일 실시형태에서, 각각의 CDR은 독립적으로 IMGT 또는 Kabat 넘버링 시스템에 따라 정의되거나, 경험적으로, 예를 들어 TCR과 동족 항원(예를 들어, 펩타이드-MHC 복합체)의 상호작용의 구조 분석에 기초하여 결정된다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은,
(a) 서열 번호 5의 아미노산 서열을 포함하는 CDR1α, 및/또는
(b) 서열 번호 6의 아미노산 서열을 포함하는 CDR2α, 및/또는
(c) 서열 번호 61의 아미노산 서열을 포함하는 CDR3α, 및/또는
(d) 서열 번호 8의 아미노산 서열을 포함하는 CDR1β, 및/또는
(e) 서열 번호 9의 아미노산 서열을 포함하는 CDR2β, 및/또는
(f) 서열 번호 10의 아미노산 서열을 포함하는 CDR3β를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은,
(a) 서열 번호 5의 아미노산 서열을 포함하는 CDR1α, 및/또는
(b) 서열 번호 6의 아미노산 서열을 포함하는 CDR2α, 및/또는
(c) 서열 번호 62의 아미노산 서열을 포함하는 CDR3α, 및/또는
(d) 서열 번호 8의 아미노산 서열을 포함하는 CDR1β, 및/또는
(e) 서열 번호 9의 아미노산 서열을 포함하는 CDR2β, 및/또는
(f) 서열 번호 10의 아미노산 서열을 포함하는 CDR3β를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은,
(a) 서열 번호 5의 아미노산 서열을 포함하는 CDR1α, 및/또는
(b) 서열 번호 6의 아미노산 서열을 포함하는 CDR2α, 및/또는
(c) 서열 번호 63의 아미노산 서열을 포함하는 CDR3α, 및/또는
(d) 서열 번호 8의 아미노산 서열을 포함하는 CDR1β, 및/또는
(e) 서열 번호 9의 아미노산 서열을 포함하는 CDR2β, 및/또는
(f) 서열 번호 10의 아미노산 서열을 포함하는 CDR3β를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은,
(a) 서열 번호 5의 아미노산 서열을 포함하는 CDR1α, 및/또는
(b) 서열 번호 6의 아미노산 서열을 포함하는 CDR2α, 및/또는
(c) 서열 번호 65의 아미노산 서열을 포함하는 CDR3α, 및/또는
(d) 서열 번호 8의 아미노산 서열을 포함하는 CDR1β, 및/또는
(e) 서열 번호 9의 아미노산 서열을 포함하는 CDR2β, 및/또는
(f) 서열 번호 10의 아미노산 서열을 포함하는 CDR3β를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은,
(a) 서열 번호 5의 아미노산 서열을 포함하는 CDR1α, 및/또는
(b) 서열 번호 6의 아미노산 서열을 포함하는 CDR2α, 및/또는
(c) 서열 번호 65의 아미노산 서열을 포함하는 CDR3α, 및/또는
(d) 서열 번호 8의 아미노산 서열을 포함하는 CDR1β, 및/또는
(e) 서열 번호 9의 아미노산 서열을 포함하는 CDR2β, 및/또는
(f) 서열 번호 10의 아미노산 서열을 포함하는 CDR3β를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 서열 번호 7, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 및 60으로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 CDR3α를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 서열 번호 10의 아미노산 서열을 포함하는 CDR3β를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 각각 서열 번호 5, 6 및 7; 5, 6 및 39; 5, 6 및 40; 5, 6 및 41; 5, 6 및 42; 5, 6 및 43; 5, 6 및 44; 5, 6 및 45; 5, 6 및 46; 5, 6 및 47; 5, 6 및 48; 5, 6 및 49; 5, 6 및 50; 5, 6 및 51; 5, 6 및 52; 5, 6 및 53; 5, 6 및 54; 5, 6 및 55; 5, 6 및 56; 5, 6 및 57; 5, 6 및 58; 5, 6 및 59; 또는 5, 6 및 60에 제시된 CDR1α, CDR2α 및 CDR3α 아미노산 서열을 갖는 Vα를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 각각 서열 번호 8, 9 및 10에 기재된 CDR1β, CDR2β 및 CDR3β 아미노산 서열을 갖는 Vβ를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 CDR1α, CDR2α 및 CDR3α를 갖는 Vα, 및 CDR1β, CDR2β 및 CDR3β를 갖는 Vβ를 포함하고, CDR1α, CDR2α, CDR3α, CDR1β, CDR2β 및 CDR3β는 각각 서열 번호 5, 6, 7, 8, 9 및 10; 5, 6, 39, 8, 9 및 10; 5, 6, 40, 8, 9 및 10; 5, 6, 41, 8, 9 및 10; 5, 6, 42, 8, 9 및 10; 5, 6, 43, 8, 9 및 10; 5, 6, 44, 8, 9 및 10; 5, 6, 45, 8, 9 및 10; 5, 6, 46, 8, 9 및 10; 5, 6, 47, 8, 9 및 10; 5, 6, 48, 8, 9 및 10; 5, 6, 49, 8, 9 및 10; 5, 6, 50, 8, 9 및 10; 5, 6, 51, 8, 9 및 10; 5, 6, 52, 8, 9 및 10; 5, 6, 53, 8, 9 및 10; 5, 6, 54, 8, 9 및 10; 5, 6, 55, 8, 9 및 10; 5, 6, 56, 8, 9 및 10; 5, 6, 57, 8, 9 및 10; 5, 6, 58, 8, 9 및 10; 5, 6, 59, 8, 9 및 10; 또는 5, 6, 60, 8, 9 및 10에 제시된 아미노산 서열을 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 서열 번호 3, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85 또는 86에 제시된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95% 또는 100%(예를 들어, 적어도 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99%) 동일한 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 3, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85 또는 86에 제시된 아미노산 서열을 갖는 Vα를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 서열 번호 4에 제시된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95% 또는 100%(예를 들어, 적어도 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99%) 동일한 아미노산 서열을 갖는 Vβ를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 4에 제시된 아미노산 서열을 갖는 Vβ를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 서열 번호 3, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85 또는 86에 제시된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95% 또는 100%(예를 들어, 적어도 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99%) 동일한 아미노산 서열을 갖는 Vα, 및 서열 번호 4에 제시된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95% 또는 100%(예를 들어, 적어도 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99%) 동일한 아미노산 서열을 갖는 Vβ를 포함한다. 소정의 실시형태에서, TCR은 각각 서열 번호 3 및 4, 66 및 4, 67 및 4, 68 및 4, 69 및 4, 70 및 4, 71 및 4, 72 및 4, 73 및 4, 74 및 4, 75 및 4, 76 및 4, 77 및 4, 78 및 4, 79 및 4, 80 및 4, 81 및 4, 82 및 4, 83 및 4, 84 및 4, 85 및 4, 또는 86 및 4에 제시된 아미노산 서열을 포함하는 Vα 및 Vβ를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은,
(a) 서열 번호 5의 아미노산 서열을 포함하는 CDR1α, 및/또는
(b) 서열 번호 6의 아미노산 서열을 포함하는 CDR2α, 및/또는
(c) 서열 번호 7 및 39 내지 60으로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 CDR3α, 및/또는
(d) 서열 번호 8의 아미노산 서열을 포함하는 CDR1β, 및/또는
(e) 서열 번호 9의 아미노산 서열을 포함하는 CDR2β, 및/또는
(f) 서열 번호 10의 아미노산 서열을 포함하는 CDR3β를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 서열 번호 7 및 39 내지 60으로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 CDR3α를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 서열 번호 10의 아미노산 서열을 포함하는 CDR3β를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 서열 번호 7의 아미노산 서열을 포함하는 CDR3α, 및 서열 번호 10의 아미노산 서열을 포함하는 CDR3β를 포함한다. 소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 각각 서열 번호 39 및 10; 40 및 10; 41 및 10; 42 및 10; 43 및 10; 44 및 10; 45 및 10; 46 및 10; 47 및 10; 48 및 10; 49 및 10; 50 및 10; 51 및 10; 52 및 10; 53 및 10; 54 및 10; 55 및 10; 56 및 10; 57 및 10; 48 및 10; 59 및 10; 또는 60 및 10에 제시된 아미노산 서열을 포함하는 CDR3α 및 CDR3β를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 각각 서열 번호 5, 6 및 7; 5, 6 및 39; 5, 6 및 40; 5, 6 및 41; 5, 6 및 42; 5, 6 및 43; 5, 6 및 44; 5, 6 및 45; 5, 6 및 46; 5, 6 및 47; 5, 6 및 48; 5, 6 및 49; 5, 6 및 50; 5, 6 및 51; 5, 6 및 52; 5, 6 및 53; 5, 6 및 54; 5, 6 및 55; 5, 6 및 56; 5, 6 및 57; 5, 6 및 58; 5, 6 및 59; 또는 5, 6 및 60에 제시된 CDR1α, CDR2α 및 CDR3α 아미노산 서열을 갖는 Vα를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 각각 서열 번호 8, 9 및 10에 기재된 CDR1β, CDR2β 및 CDR3β 아미노산 서열을 갖는 Vβ를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 CDR1α, CDR2α 및 CDR3α를 갖는 Vα, 및 CDR1β, CDR2β 및 CDR3β를 갖는 Vβ를 포함하고, CDR1α, CDR2α, CDR3α, CDR1β, CDR2β 및 CDR3β는 각각 서열 번호 5, 6, 7, 8, 9 및 10; 5, 6, 39, 8, 9 및 10; 5, 6, 40, 8, 9 및 10; 5, 6, 41, 8, 9 및 10; 5, 6, 42, 8, 9 및 10; 5, 6, 43, 8, 9 및 10; 5, 6, 44, 8, 9 및 10; 5, 6, 45, 8, 9 및 10; 5, 6, 46, 8, 9 및 10; 5, 6, 47, 8, 9 및 10; 5, 6, 48, 8, 9 및 10; 5, 6, 49, 8, 9 및 10; 5, 6, 50, 8, 9 및 10; 5, 6, 51, 8, 9 및 10; 5, 6, 52, 8, 9 및 10; 5, 6, 53, 8, 9 및 10; 5, 6, 54, 8, 9 및 10; 5, 6, 55, 8, 9 및 10; 5, 6, 56, 8, 9 및 10; 5, 6, 57, 8, 9 및 10; 5, 6, 58, 8, 9 및 10; 5, 6, 59, 8, 9 및 10; 또는 5, 6, 60, 8, 9 및 10에 제시된 아미노산 서열을 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 서열 번호 3 및 66 내지 86으로 이루어진 군으로부터 선택된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95% 또는 100%(예를 들어, 적어도 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99%) 동일한 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 3에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 66에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 67에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 68에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 69에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 70에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 71에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 72에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 73에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 74에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 75에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 76에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 77에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 78에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 79에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 80에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 81에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 82에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 83에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 84에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 85에 제시된 아미노산 서열을 갖는 Vα를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 86에 제시된 아미노산 서열을 갖는 Vα를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 서열 번호 4에 제시된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95% 또는 100%(예를 들어, 적어도 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99%) 동일한 아미노산 서열을 갖는 Vβ를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 4에 제시된 아미노산 서열을 갖는 Vβ를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 서열 번호 3 및 66 내지 86으로 이루어진 군으로부터 선택된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95% 또는 100%(예를 들어, 적어도 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99%) 동일한 아미노산 서열을 갖는 Vα, 및 서열 번호 4에 제시된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95% 또는 100%(예를 들어, 적어도 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99%) 동일한 아미노산 서열을 갖는 Vβ를 포함한다. 소정의 실시형태에서, TCR은 서열 번호 3, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85 또는 86에 제시된 아미노산 서열을 갖는 Vα, 및 서열 번호 4에 제시된 아미노산 서열을 갖는 Vβ를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 인간 TRAV3 생식선 서열로부터 유래된 아미노산 서열을 갖는 Vα(예를 들어, 서열 번호 18의 아미노산 서열을 포함하는 예를 들어 TRAV3*01)를 포함한다. 소정의 실시형태에서, TRAV3*01 생식선 서열은 C 말단에서 N 말단 알라닌 잔기 및/또는 아미노산 서열 RD를 추가로 포함한다. 프레임워크 1, 프레임워크 2, 프레임워크 3, CDR1α 및 CDR2α로부터 선택된 하나 이상의 영역(예를 들어, 이 영역의 2개, 3개, 4개 또는 5개)은 인간 TRAV3 생식선 서열로부터 유래될 수 있다(예를 들어, 서열 번호 18의 아미노산 서열을 포함하는 예를 들어 TRAV3*01). 소정의 실시형태에서, 프레임워크 1, 프레임워크 2, 프레임워크 3, CDR1α 및 CDR2α는 모두 인간 TRAV3 생식선 서열로부터 유래된다(예를 들어, 서열 번호 18의 아미노산 서열을 포함하는 예를 들어 TRAV3*01). 소정의 실시형태에서, TCR은 인간 TRAV3 생식선 서열로부터 유래된 아미노산 서열을 갖는 Vα(예를 들어, 서열 번호 18의 아미노산 서열을 포함하는 예를 들어 TRAV3*01) 및 서열 번호 7, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 또는 60에 제시된 아미노산 서열을 갖는 CDR3α를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 인간 TRBV29-1 생식선 서열로부터 유래된 아미노산 서열을 갖는 Vβ(예를 들어, 서열 번호 19의 아미노산 서열을 포함하는 예를 들어 TRBV29-1*01)를 포함한다. 소정의 실시형태에서, TRBV29-1*01 생식선 서열은 N 말단에서 아미노산 서열 SAVIS(서열 번호 27) 및/또는 C 말단에서 아미노산 서열 SVE를 추가로 포함한다. 프레임워크 1, 프레임워크 2, 프레임워크 3, CDR1β 및 CDR2β로부터 선택된 하나 이상의 영역(예를 들어, 이 영역의 2개, 3개, 4개 또는 5개)은 인간 TRBV29-1 생식선 서열로부터 유래될 수 있다(예를 들어, 서열 번호 19의 아미노산 서열을 포함하는 예를 들어 TRBV29-1*01). 소정의 실시형태에서, 프레임워크 1, 프레임워크 2, 프레임워크 3, CDR1β 및 CDR2β는 모두 인간 TRBV29-1 생식선 서열로부터 유래된다(예를 들어, 서열 번호 19의 아미노산 서열을 포함하는 예를 들어 TRBV29-1*01). 소정의 실시형태에서, TCR은 인간 TRBV29-1 생식선 서열로부터 유래된 아미노산 서열을 갖는 Vβ(예를 들어, 서열 번호 19의 아미노산 서열을 포함하는 예를 들어 TRBV29-1*01) 및 서열 번호 10에 제시된 아미노산 서열을 갖는 CDR3β를 포함한다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 서열 번호 11, 13, 93 내지 96, 105 내지 118, 120 내지 123, 125 내지 128 및 408 내지 415로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 α 사슬을 포함한다. 본 명세서에 개시된 α 사슬(예를 들어, 표 1에 개시된 서열을 갖는 α 사슬) 중 임의의 하나는 이의 C 말단에서 (예를 들어, 클로닝 흔적으로서) GS의 아미노산 서열; 절단 부위에 N 말단인 퓨린 인식 서열의 일부; 및/또는 절단 부위에 N 말단인 2A 인식 서열의 일부를 포함할 수 있다. 소정의 실시형태에서, α 사슬은 절단 부위에 N 말단인 퓨린 인식 서열의 일부를 추가로 포함하고, 여기서 퓨린 인식 서열의 일부는 α 사슬의 C 말단에 있다. 소정의 실시형태에서, 퓨린 인식 서열의 일부는 RAKR(서열 번호 30) 또는 RAKRS(서열 번호 132)의 아미노산 서열을 포함한다. 소정의 실시형태에서, 퓨린 인식 서열의 일부는 RA의 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬은 (예를 들어, C 말단에서 클로닝으로부터의 흔적 잔기로서) GS의 아미노산 서열을 추가로 포함한다. 소정의 실시형태에서, α 사슬은 절단 부위에 N 말단인 2A 인식 서열의 일부를 추가로 포함하고, 여기서 2A 인식 서열의 일부는 α 사슬의 C 말단에 있다. 소정의 실시형태에서, 2A 인식 서열은 표 7에서의 서열로 이루어진 군으로부터 선택되고, 선택적으로 여기서 절단 부위는 C 말단에서 Pro에 인접하게 N 말단인 펩타이드 결합이다. 소정의 실시형태에서, 2A 인식 서열은 P2A(GSGATNFSLLKQAGDVEENPGP(서열 번호 134)) 유래이고, 선택적으로 여기서 절단 부위는 C 말단에서 Pro에 인접하게 N 말단인 펩타이드 결합이다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 서열 번호 12, 14, 25 또는 97 내지 104에 제시된 아미노산 서열을 포함하는 β 사슬을 포함한다. 본 명세서에 개시된 α 사슬(예를 들어, 표 1에 개시된 서열을 갖는 β 사슬) 중 임의의 하나는 β 사슬의 C 말단에서 (예를 들어, 클로닝 흔적으로서) GS의 아미노산 서열; 절단 부위에 N 말단인 퓨린 인식 서열의 일부 또는 절단 부위에 N 말단인 2A 인식 서열의 일부를 포함할 수 있다. 소정의 실시형태에서, β 사슬은 절단 부위에 N 말단인 퓨린 인식 서열의 일부를 추가로 포함하고, 여기서 퓨린 인식 서열의 일부는 β 사슬의 C 말단에 있다. 소정의 실시형태에서, 퓨린 인식 서열의 일부는 RAKR(서열 번호 30) 또는 RAKRS(서열 번호 132)의 아미노산 서열을 포함한다. 소정의 실시형태에서, 퓨린 인식 서열의 일부는 RA의 아미노산 서열을 포함한다. 소정의 실시형태에서, β 사슬은 (예를 들어, C 말단에서 클로닝으로부터의 흔적 잔기로서) GS의 아미노산 서열을 추가로 포함한다. 소정의 실시형태에서, β 사슬은 절단 부위에 N 말단인 2A 인식 서열의 일부를 추가로 포함하고, 여기서 2A 인식 서열의 일부는 α 사슬의 C 말단에 있다. 소정의 실시형태에서, 2A 인식 서열은 표 7에서의 서열로 이루어진 군으로부터 선택되고, 선택적으로 여기서 절단 부위는 C 말단에서 Pro에 인접하게 N 말단인 펩타이드 결합이다. 소정의 실시형태에서, 2A 인식 서열은 P2A(GSGATNFSLLKQAGDVEENPGP(서열 번호 134)) 유래이고, 선택적으로 여기서 절단 부위는 C 말단에서 Pro에 인접하게 N 말단인 펩타이드 결합이다.
소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 각각 서열 번호 13 및 14에 제시된 아미노산 서열을 포함하는 α 사슬 및 β 사슬을 포함한다. 소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 각각 서열 번호 13 및 25에 제시된 아미노산 서열을 포함하는 α 사슬 및 β 사슬을 포함한다. 소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR(예를 들어, 단리된 TCR)(예를 들어, SLLMWITQC(서열 번호 1) 또는 SLLMWITQV(서열 번호 2)-HLA-A*0201 복합체에 결합하는 TCR)을 제공하되, TCR은 각각 서열 번호 11 및 12에 제시된 아미노산 서열을 포함하는 α 사슬 및 β 사슬을 포함한다. 소정의 실시형태에서, α 사슬은 C 말단에서 RA, RAKR(서열 번호 30), 또는 RAKRS(서열 번호 132)의 아미노산 서열을 추가로 포함하거나, β 사슬은 C 말단에서 RA, RAKR(서열 번호 30), 또는 RAKRS(서열 번호 132)의 아미노산 서열을 추가로 포함한다.
소정의 실시형태에서, 본 개시내용은 α 사슬 및 β 사슬을 포함하는 단리된 TCR을 제공하고, 여기서 α 사슬은 서열 번호 13, 93 내지 96, 105 내지 118, 120 내지 123, 125 내지 128 및 408 내지 415로 이루어진 군으로부터 선택된 아미노산 서열을 포함하고, β 사슬은 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. α 사슬 및/또는 β 사슬의 성숙 서열 이외에, 추가적인 아미노산 잔기는 적어도 하나의 사슬의 C 말단에 부가될 수 있다. 예를 들어, Gly-Ser은 클로닝 흔적으로부터 부가될 수 있다. (표 7에 기재된 바와 같은) 퓨린 절단 또는 2A 절단으로부터의 잔기는 사슬이 융합 단백질로부터 절단될 때 부가될 수 있다.
임의의 종으로부터의 임의의 TCR 불변 영역은 본 명세서에 개시된 TCR에서 사용될 수 있다. 소정의 실시형태에서, TCR은 인간 α, β, γ 또는 δ TCR 불변 영역을 포함한다. 소정의 실시형태에서, TCR은 야생형 불변 영역을 포함한다. 소정의 실시형태에서, TCR은 변경된 불변 영역, 예컨대 키메라 불변 영역 또는 야생형 불변 영역에 비해 하나 이상의 아미노산 치환, 삽입 또는 결실을 갖는 불변 영역을 포함한다. 몇몇 실시형태에서, TCR은 서열 번호 15의 α 사슬 불변 영역을 포함하는 α 사슬을 포함한다. 몇몇 실시형태에서, TCR은 서열 번호 26의 α 사슬 불변 영역을 포함하는 α 사슬을 포함한다. 몇몇 실시형태에서, TCR은 서열 번호 92의 α 사슬 불변 영역을 포함하는 α 사슬을 포함한다. 몇몇 실시형태에서, TCR은 서열 번호 16 또는 17의 β 사슬 불변 영역을 포함하는 β 사슬을 포함한다.
소정의 실시형태에서, 본 개시내용은 α 사슬 및 β 사슬을 포함하는 단리된 TCR을 제공하고, 여기서 α 사슬은 서열 번호 13, 93 내지 96, 105 내지 118, 120 내지 123, 125 내지 128 및 408 내지 415로 이루어진 군으로부터 선택된 아미노산 서열을 포함하고/하거나, β 사슬은 서열 번호 14, 25, 97, 98, 99, 100, 101, 102, 103 및 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, 본 개시내용은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 단리된 TCR을 제공하되, TCR은 α 사슬 및 β 사슬을 포함하고, 여기서 α 사슬은 서열 번호 13, 93 내지 96, 105 내지 118, 120 내지 123, 125 내지 128 및 408 내지 415로 이루어진 군으로부터 선택된 아미노산 서열을 포함하고/하거나, β 사슬은 서열 번호 14, 25, 97, 98, 99, 100, 101, 102, 103 및 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬은 서열 번호 13, 105, 110, 115, 120, 125, 408, 또는 412로 이루어진 군으로부터 선택된 아미노산 서열을 포함하고, β 사슬은 서열 번호 14, 25, 97, 98, 99, 100, 101, 102, 103 및 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬 및 β 사슬은 각각 서열 번호 13 및 14; 13 및 25; 13 및 97; 13 및 98; 13 및 99; 13 및 100; 13 및 101; 13 및 102; 13 및 103; 13 및 104; 93 및 14; 93 및 25; 93 및 97; 93 및 98; 93 및 99; 93 및 100; 93 및 101; 93 및 102; 93 및 103; 93 및 104; 94 및 14; 94 및 25; 94 및 97; 94 및 98; 94 및 99; 94 및 100; 94 및 101; 94 및 102; 94 및 103; 94 및 104; 95 및 14; 95 및 25; 95 및 97; 95 및 98; 95 및 99; 95 및 100; 95 및 101; 95 및 102; 95 및 103; 95 및 104; 96 및 14; 96 및 25; 96 및 97; 96 및 98; 96 및 99; 96 및 100; 96 및 101; 96 및 102; 96 및 103; 96 및 104; 105 및 14; 105 및 25; 105 및 97; 105 및 98; 105 및 99; 105 및 100; 105 및 101; 105 및 102; 105 및 103; 105 및 104; 106 및 14; 106 및 25; 106 및 97; 106 및 98; 106 및 99; 106 및 100; 106 및 101; 106 및 102; 106 및 103; 106 및 104; 107 및 14; 107 및 25; 107 및 97; 107 및 98; 107 및 99; 107 및 100; 107 및 101; 107 및 102; 107 및 103; 107 및 104; 108 및 14; 108 및 25; 108 및 97; 108 및 98; 108 및 99; 108 및 100; 108 및 101; 108 및 102; 108 및 103; 108 및 104; 109 및 14; 109 및 25; 109 및 97; 109 및 98; 109 및 99; 109 및 100; 109 및 101; 109 및 102; 109 및 103; 109 및 104; 110 및 14; 110 및 25; 110 및 97; 110 및 98; 110 및 99; 110 및 100; 110 및 101; 110 및 102; 110 및 103; 110 및 104; 111 및 14; 111 및 25; 111 및 97; 111 및 98; 111 및 99; 111 및 100; 111 및 101; 111 및 102; 111 및 103; 111 및 104; 112 및 14; 112 및 25; 112 및 97; 112 및 98; 112 및 99; 112 및 100; 112 및 101; 112 및 102; 112 및 103; 112 및 104; 113 및 14; 113 및 25; 113 및 97; 113 및 98; 113 및 99; 113 및 100; 113 및 101; 113 및 102; 113 및 103; 113 및 104; 114 및 14; 114 및 25; 114 및 97; 114 및 98; 114 및 99; 114 및 100; 114 및 101; 114 및 102; 114 및 103; 114 및 104; 115 및 14; 115 및 25; 115 및 97; 115 및 98; 115 및 99; 115 및 100; 115 및 101; 115 및 102; 115 및 103; 115 및 104; 116 및 14; 116 및 25; 116 및 97; 116 및 98; 116 및 99; 116 및 100; 116 및 101; 116 및 102; 116 및 103; 116 및 104; 117 및 14; 117 및 25; 117 및 97; 117 및 98; 117 및 99; 117 및 100; 117 및 101; 117 및 102; 117 및 103; 117 및 104; 118 및 14; 118 및 25; 118 및 97; 118 및 98; 118 및 99; 118 및 100; 118 및 101; 118 및 102; 118 및 103; 118 및 104; 120 및 14; 120 및 25; 120 및 97; 120 및 98; 120 및 99; 120 및 100; 120 및 101; 120 및 102; 120 및 103; 120 및 104; 121 및 14; 121 및 25; 121 및 97; 121 및 98; 121 및 99; 121 및 100; 121 및 101; 121 및 102; 121 및 103; 121 및 104; 122 및 14; 122 및 25; 122 및 97; 122 및 98; 122 및 99; 122 및 100; 122 및 101; 122 및 102; 122 및 103; 122 및 104; 123 및 14; 123 및 25; 123 및 97; 123 및 98; 123 및 99; 123 및 100; 123 및 101; 123 및 102; 123 및 103; 123 및 104; 125 및 14; 125 및 25; 125 및 97; 125 및 98; 125 및 99; 125 및 100; 125 및 101; 125 및 102; 125 및 103; 125 및 104; 126 및 14; 126 및 25; 126 및 97; 126 및 98; 126 및 99; 126 및 100; 126 및 101; 126 및 102; 126 및 103; 126 및 104; 127 및 14; 127 및 25; 127 및 97; 127 및 98; 127 및 99; 127 및 100; 127 및 101; 127 및 102; 127 및 103; 127 및 104; 128 및 14; 128 및 25; 128 및 97; 128 및 98; 128 및 99; 128 및 100; 128 및 101; 128 및 102; 128 및 103; 128 및 104; 408 및 14; 408 및 25; 408 및 97; 408 및 98; 408 및 99; 408 및 100; 408 및 101; 408 및 102; 408 및 103; 408 및 104; 409 및 14; 409 및 25; 409 및 97; 409 및 98; 409 및 99; 409 및 100; 409 및 101; 409 및 102; 409 및 103; 409 및 104; 410 및 14; 410 및 25; 410 및 97; 410 및 98; 410 및 99; 410 및 100; 410 및 101; 410 및 102; 410 및 103; 410 및 104; 411 및 14; 411 및 25; 411 및 97; 411 및 98; 411 및 99; 411 및 100; 411 및 101; 411 및 102; 411 및 103; 411 및 104; 412 및 14; 412 및 25; 412 및 97; 412 및 98; 412 및 99; 412 및 100; 412 및 101; 412 및 102; 412 및 103; 412 및 104; 413 및 14; 413 및 25; 413 및 97; 413 및 98; 413 및 99; 413 및 100; 413 및 101; 413 및 102; 413 및 103; 413 및 104; 414 및 14; 414 및 25; 414 및 97; 414 및 98; 414 및 99; 414 및 100; 414 및 101; 414 및 102; 414 및 103; 414 및 104; 415 및 14; 415 및 25; 415 및 97; 415 및 98; 415 및 99; 415 및 100; 415 및 101; 415 및 102; 415 및 103; 또는 415 및 104에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬 및 β 사슬은 각각 서열 번호 13 및 14; 13 및 25; 105 및 14; 105 및 25; 110 및 14; 110 및 25; 115 및 14; 115 및 25; 120 및 14; 120 및 25; 125 및 14; 125 및 25; 408 및 14; 408 및 25; 412 및 14; 또는 412 및 25에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬 및 β 사슬은 각각 서열 번호 13 및 14; 105 및 14; 110 및 14; 115 및 14; 120 및 14; 125 및 14; 408 및 14; 또는 412 및 14에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬 및 β 사슬은 각각 서열 번호 13 및 14에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬 및 β 사슬은 각각 서열 번호 105 및 14에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬 및 β 사슬은 각각 서열 번호 110 및 14에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬 및 β 사슬은 각각 서열 번호 115 및 14에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬 및 β 사슬은 각각 서열 번호 120 및 14에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬 및 β 사슬은 각각 서열 번호 125 및 14에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬 및 β 사슬은 각각 서열 번호 408 및 14에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, α 사슬 및 β 사슬은 각각 서열 번호 412 및 14에 제시된 아미노산 서열을 포함한다.
본 명세서에 개시된 TCR은 임의의 TCR 구조 포맷에서 사용될 수 있다. 예를 들어, 소정의 실시형태에서, TCR은 전장 α 사슬 및 전장 β 사슬을 포함하는 전장 TCR이다. 막관통 영역(및 선택적으로 또한 세포질 영역)은 가용성 TCR을 제조하도록 전장 TCR로부터 제거될 수 있다. 따라서, 소정의 실시형태에서, TCR은 막관통 및/또는 세포질 영역(들)이 결여된 가용성 TCR이다. 가용성 TCR을 제조하는 방법은 당해 분야에 널리 공지되어 있다. 몇몇 실시형태에서, 가용성 TCR은 이합체화를 촉진하는 조작된 다이설파이드 결합을 포함하고, 예를 들어, 미국 특허 제7,329,731호(본 명세서에 그 전문이 참고로 포함됨)를 참조한다. 몇몇 실시형태에서, 가용성 TCR은 다른 단백질 도메인, 예를 들어, 말토스 결합 단백질, 티오레독신, 인간 불변 카파 도메인 또는 류신 지퍼에 본 명세서에 기재된 TCR의 세포외 도메인을 융합함으로써 생성되고, 예를 들어, 문헌[Loset et al., Front Oncol. 2014; 4: 378](본 명세서에 그 전문이 참고로 포함됨)을 참조한다. 펩타이드 링커에 의해 연결된 Vα 및 Vβ를 포함하는 단일 사슬 TCR(scTCR)은 또한 생성될 수 있다. 이러한 scTCR을 각각 TCR 불변 영역에 연결된 Vα 및 Vβ를 포함할 수 있다. 대안적으로, scTCR은 Vα 및 Vβ를 포함할 수 있고, 여기서 Vα, Vβ 중 어느 하나, 또는 Vα 및 Vβ 둘 다는 TCR 불변 영역에 연결되지 않는다. 예시적인 scTCR은 PCT 공보 WO 제2003/020763호, WO 제2004/033685호 및 WO 제2011/044186호(이들은 각각 본 명세서에 그 전문이 참고로 포함됨)에 기재되어 있다. 더욱이, 본 명세서에 개시된 TCR은 2개의 폴리펩타이드 사슬(예를 들어, α 사슬 및 β 사슬)을 포함할 수 있고, 여기서 사슬은 사슬간 다이설파이드 결합을 형성할 수 있는 시스테인 잔기를 각각 갖도록 조작된다. 따라서, 소정의 실시형태에서, 본 명세서에 개시된 TCR은 조작된 다이설파이드 결합에 의해 연결된 2개의 폴리펩타이드 사슬을 포함한다. 조작된 다이설파이드 결합을 갖는 예시적인 TCR은 미국 특허 제8,361,794호 및 제8,906,383호(이들은 각각 본 명세서에 그 전문이 참고로 포함됨)에 기재되어 있다.
소정의 실시형태에서, 본 명세서에 개시된 TCR은 막관통 영역을 갖는 하나 이상의 사슬(예를 들어, α 사슬 및/또는 β 사슬)을 포함한다. 소정의 실시형태에서, 본 명세서에 개시된 TCR은 막관통 영역을 갖는 2개의 사슬(예를 들어, α 사슬 및 β 사슬)을 포함한다. 막관통 영역은 그 TCR 사슬의 내인성 막관통 영역, 내인성 막관통 영역의 변이체 또는 비상동성 막관통 영역일 수 있다. 소정의 실시형태에서, 본 명세서에 개시된 TCR은 내인성 막관통 영역을 갖는 α 사슬 및 β 사슬을 포함한다.
소정의 실시형태에서, 본 명세서에 개시된 TCR은 세포질 영역을 갖는 하나 이상의 사슬(예를 들어, α 사슬 및/또는 β 사슬)을 포함한다. 소정의 실시형태에서, 본 명세서에 개시된 TCR은 각각 세포질 영역을 갖는 2개의 사슬(예를 들어, α 사슬 및 β 사슬)을 포함한다. 세포질 영역은 그 TCR 사슬의 내인성 세포질 영역, 내인성 세포질 영역의 변이체 또는 비상동성 세포질 영역일 수 있다. 소정의 실시형태에서, 본 명세서에 개시된 TCR은 2개의 사슬(예를 들어, α 사슬 및 β 사슬)을 포함하고, 여기서 사슬 둘 다는 막관통 영역을 갖지만, 하나의 사슬은 세포질 영역이 결여된다. 소정의 실시형태에서, 본 명세서에 개시된 TCR은 2개의 사슬(예를 들어, α 사슬 및 β 사슬)을 포함하고, 여기서 사슬 둘 다는 내인성 막관통 영역을 갖지만, 내인성 세포질 영역이 결여된다. 소정의 실시형태에서, 본 명세서에 개시된 TCR은 α 사슬 및 β 사슬을 포함하고, 여기서 사슬 둘 다는 내인성 막관통 영역을 갖지만, 내인성 세포질 영역이 결여된다. 소정의 실시형태에서, 본 명세서에 개시된 TCR은 동시자극 분자로부터의 동시자극 신호전달 영역을 포함하고; 예를 들어, PCT 공보 WO 제1996/018105호, WO 제1999/057268호 및 WO 제2000/031239호, 및 미국 특허 제7,052,906호(이들은 모두 본 명세서에 그 전문이 참고로 포함됨)를 참조한다.
소정의 실시형태에서, 본 명세서에 기재된 TCR은 서열 번호 1 또는 2에 제시된 아미노산 서열을 갖는 펩타이드를 포함하는 펩타이드-MHC 복합체에 결합하고, 여기서 MHC는 임의의 MHC일 수 있다. 소정의 실시형태에서, MHC는 인간 MHC이다. 소정의 실시형태에서, MHC는 MHC 클래스 I 중쇄(예를 들어, HLA-A, HLA-B 또는 HLA-C, 예를 들어 임의의 다형 형태의 임의의 아형) 및 β2-마이크로글로불린 경쇄를 포함하는 MHC 클래스 I 분자이다. 소정의 실시형태에서, MHC는 HLA-A*0201이다. 소정의 실시형태에서, 펩타이드-MHC 복합체는 SLLMWITQC(서열 번호 1)-HLA-A*0201이다. 소정의 실시형태에서, MHC는 MHC 클래스 II α 사슬(예를 들어, HLA-DR, HLA-DQ 또는 HLA-DP의 α 사슬, 예를 들어 임의의 다형 형태의 임의의 아형) 및 MHC 클래스 II β 사슬(예를 들어, HLA-DR, HLA-DQ 또는 HLA-DP의 β 사슬, 예를 들어 임의의 다형 형태의 임의의 아형)을 포함하는 MHC 클래스 II 분자이다. 소정의 실시형태에서, MHC 클래스 II α 사슬 및 MHC 클래스 II β 사슬은 동일한 유형(예를 들어, HLA-DR, HLA-DQ 또는 HLA-DP)으로부터 유래된다.
소정의 실시형태에서, 본 개시내용은 함께 융합된 TCR의 α 사슬 가변 영역(Vα) 및 β 사슬 가변 영역(Vβ)을 포함하는 폴리펩타이드를 제공한다. 예를 들어, 이러한 폴리펩타이드는 선택적으로 2개의 사슬 사이의 링커(예를 들어, 펩타이드 링커)에 의해 Vβ에 N 말단 또는 C 말단인 Vα를 포함할 수 있다. 예를 들어, (표 7에서의 서열 중 임의의 하나로부터 선택된) 퓨린 및/또는 2A 절단 부위, 또는 이들의 조합은 Vα/Vβ 융합 폴리펩타이드에 대한 링커에서 사용될 수 있다.
소정의 실시형태에서, 본 개시내용은 함께 융합된 TCR의 α 사슬 및 β 사슬을 포함하는 폴리펩타이드를 제공한다. 예를 들어, 이러한 폴리펩타이드는 선택적으로 2개의 사슬 사이의 링커(예를 들어, 펩타이드 링커)에 의해 β 사슬에 N 말단 또는 C 말단인 α 사슬을 포함할 수 있다. 예를 들어, (표 7에서의 서열 중 임의의 하나로부터 선택된) 퓨린 및/또는 2A 절단 부위, 또는 이들의 조합은 α/β 융합 폴리펩타이드에 대한 링커에서 사용될 수 있다. 예를 들어, 융합 폴리펩타이드는, N 말단으로부터 C 말단으로, TCR의 α 사슬, 퓨린 절단 부위, 2A 절단 부위 및 TCR의 β 사슬을 포함할 수 있다. 소정의 실시형태에서, 폴리펩타이드는, N 말단으로부터 C 말단으로, TCR의 β 사슬, 퓨린 절단 부위, 2A 요소 및 TCR의 α 사슬을 포함한다. 소정의 실시형태에서, 폴리펩타이드는, N 말단으로부터 C 말단으로, TCR의 α 사슬, 2A 절단 부위 및 TCR의 β 사슬을 포함한다. 소정의 실시형태에서, 폴리펩타이드는, N 말단으로부터 C 말단으로, TCR의 β 사슬, 2A 요소 및 TCR의 α 사슬을 포함한다. 소정의 실시형태에서, 폴리펩타이드는, N 말단으로부터 C 말단으로, TCR의 α 사슬, 퓨린 절단 부위 및 TCR의 β 사슬을 포함한다. 소정의 실시형태에서, 폴리펩타이드는, N 말단으로부터 C 말단으로, TCR의 β 사슬, 퓨린 요소 및 TCR의 α 사슬을 포함한다. 예시적인 융합 TCR 서열은 표 8에 주어진다.
또 다른 양태에서, 상기에 기재된 TCR 또는 폴리펩타이드와 서열 번호 1 또는 2에 제시된 아미노산 서열을 포함하는 펩타이드의 동일한 에피토프(예를 들어, 동일한 아미노산 잔기)에 결합하는 TCR은 본 명세서에 제공된다. 소정의 실시형태에서, 펩타이드는 상기에 기재된 바대로 MHC와 복합체(예를 들어, HLA-A*0201)로 있다. 소정의 실시형태에서, TCR은 생체내 동물 또는 포유류(예를 들어, 인간)의 TCR 생식선 레퍼토리 내에 자연히 존재하지 않는 서열을 포함한다.
5.3 T 세포 수용체를 제시하는 세포
또 다른 양태에서, 본 개시내용은 포유류 세포(예를 들어, 조작된 포유류 세포) 또는 세포 표면에 본 명세서에 개시된 TCR을 제시하는 이의 집단을 제공한다. 임의의 포유류 세포는 본 명세서에 개시된 TCR을 제시하도록 사용될 수 있다. 소정의 실시형태에서, 포유류 세포는 CD3(예를 들어, CD3γ 사슬, CD3δ 사슬 및 2개의 CD3ε 사슬)을 발현한다. 소정의 실시형태에서, 포유류 세포는 인간 세포이다. 세포 표면 TCR이 이 효과기 세포를 NY-ESO-1 폴리펩타이드를 발현하는 종양 세포에 표적하고, 이로써 종양 세포의 사멸을 촉진할 수 있으므로, 세포 면역계의 효과기 세포는 본 명세서에 개시된 TCR을 제시하는 데 특히 유용하다. 따라서, 소정의 실시형태에서, 포유류 세포는 림프구(예를 들어, 인간 림프구), 예컨대 T 세포 또는 자연 살해(NK) 세포이다. 소정의 실시형태에서, 림프구는 T 세포이다. 임의의 발생 단계에서의 임의의 T 세포는 본 명세서에 개시된 TCR을 제시하도록 사용될 수 있다. 예를 들어, 소정의 실시형태에서, T 세포는 CD8+ 세포독성 T 세포, CD4+ 세포독성 T 세포, CD4+ 헬퍼 T 세포(예를 들어, Th1 또는 Th2 세포), CD4/CD8 이중 양성 T 세포, 종양 침윤 T 세포, 흉선세포, 기억 T 세포, 미경험 T 세포 및 자연 살해 T 세포, 예를 들어 불변 자연 살해 T 세포로 이루어진 군으로부터 선택된다. 이 세포가 효과기 세포로 분화하거나 발생하거나 성숙할 수 있으므로, 세포 면역계의 전구체 세포(예를 들어, T 림프구의 전구체)는 본 명세서에 개시된 TCR을 제시하는 데 또한 유용하다. 따라서, 소정의 실시형태에서, 포유류 세포는 다능성 줄기 세포(예를 들어, 배아 줄기 세포, 유도 다능성 줄기 세포), 조혈 줄기 세포, 또는 림프구 선조 세포이다. 소정의 실시형태에서, 조혈 줄기 세포 또는 림프구 선조 세포는 예를 들어 골수, 제대혈 또는 말초 혈액으로부터 단리되고/되거나 농후화된다.
세포는 많은 소스, 예를 들어 종양, 혈액, 골수, 림프절, 흉선 또는 또 다른 조직 또는 체액, 또는 성분채집술 생성물(이들로 제한되지는 않음)로부터 얻어질 수 있다. 소정의 실시형태에서, 세포는 대상체에 기능적 T 세포가 남는 치료 이후에 직접적으로 환자로부터 수득된다. 이와 관련하여, 소정의 암 치료 이후에, 면역계를 손상시키는 약물에 의한 특정한 치료에서, 치료 직후에 환자가 치료로부터 보통 회수할 때의 기간 동안, 수득된 T 세포의 품질은 생체외 증식하는 이의 능력에 대해 최적이거나 개선될 수 있다고 관찰된다. 마찬가지로, 본 명세서에 기재된 방법을 이용한 생체외 조작 이후에, 이 세포는 증대된 생착 및 생체내 증식을 위해 바람직한 상태에 있을 수 있다. 따라서, 소정의 실시형태에서, 세포는 이 회수 단계 동안 혈액, 골수, 림프절, 흉선 또는 또 다른 조직 또는 체액, 또는 성분채집술 생성물로부터 수집된다.
소정의 실시형태에서, 포유류 세포는 세포 표면에 본 명세서에 개시된 TCR을 제시하는 세포의 집단이다. 세포의 집단은 불균일 또는 균일할 수 있다. 소정의 실시형태에서, 집단의 적어도 50%(예를 들어, 적어도 60%, 70%, 80%, 90%, 95%, 99%, 99.5% 또는 99.9%)는 본 명세서에 기재된 바와 같은 세포이다. 소정의 실시형태에서, 집단은 실질적으로 순수하고, 여기서 집단의 적어도 50%(예를 들어, 적어도 60%, 70%, 80%, 90%, 95%, 99%, 99.5% 또는 99.9%)는 균일하다. 소정의 실시형태에서, 집단은 불균일하고, 세포의 혼합된 집단을 포함한다(예를 들어, 세포는 상이한 세포 유형, 발생 단계, 기원을 갖고, 상이한 방법에 의해 단리되거나, 정제되거나, 농후화되고, 상이한 물질에 의해 자극되고/되거나, 상이한 방법에 의해 조작됨). 소정의 실시형태에서, 세포는 말초 혈액 단핵 세포(PBMC)(예를 들어, 인간 PBMC)의 집단이다.
세포의 집단은 필요한 바대로 농후화되거나 정제될 수 있다. 소정의 실시형태에서, 조절 T 세포(예를 들어, CD25+ T 세포)는 예를 들어 표면, 예컨대 비드, 입자 또는 세포에 접합된 항-CD25 항체를 사용함으로써 집단으로부터 고갈된다. 소정의 실시형태에서, 항-CD25 항체는 (예를 들어, 형광 활성화 세포 분류에서 사용하기 위해) 형광성 염료에 접합된다. 소정의 실시형태에서, 관문 수용체(예를 들어, CTLA-4, PD-1, TIM-3, LAG-3, TIGIT, VISTA, BTLA, TIGIT, CD137 또는 CEACAM1)를 발현하는 세포는 예를 들어 표면, 예컨대 비드, 입자 또는 세포에 접합된 관문 수용체에 특이적으로 결합하는 항체를 사용함으로써 집단으로부터 고갈된다. 소정의 실시형태에서, T 세포 집단은 IFNγ, TNFα, IL-17A, IL-2, IL-3, IL-4, GM-CSF, IL-13, 그랜자임(예를 들어, 그랜자임 B) 및 페르포린, 또는 다른 적절한 분자, 예를 들어 다른 사이토카인 중 하나 이상을 발현하도록 선택될 수 있다. 이러한 발현을 결정하는 방법은 예를 들어 PCT 공보 WO 제2013/126712호(본 명세서에 그 전문이 참고로 포함됨)에 기재되어 있다.
세포는 생존능력, 증식, 및/또는 활성을 증가시키도록 생체외 자극될 수 있다. 몇몇 실시형태에서, 유도는 임의의 한정된 항원을 포함하지 않아서, 항원 반응성과 관련하여 다중클론인 세포 집단을 제공한다. 소정의 실시형태에서, 세포는 TCR/CD3 복합체 연관된 신호를 유도하거나 활성화하는 제1 물질(예를 들어, 항-CD3 항체)과 접촉한다. 소정의 실시형태에서, 세포는 T 세포 표면에서 보조 분자를 자극하는 제2 물질(예를 들어, CD28 또는 항-CD28 항체의 리간드)과 접촉한다. 소정의 실시형태에서, 세포는 CD3 및 CD28 둘 다와 상호작용하는 분자 또는 복합체와 접촉하고, 여기서 분자 또는 복합체는 표면(예를 들어, 비드, 입자 또는 세포)에 존재할 수 있다. 소정의 실시형태에서, 세포는 항-CD3 항체 및 항-CD28 항체를 제시하는 표면(예를 들어, 비드, 입자 또는 세포)과 접촉한다. 소정의 실시형태에서, 세포는 T 세포 생존능력, 증식, 및/또는 활성을 증가시키도록 세포 표면 수용체에 결합하는 하나 이상의 물질(예를 들어, IL-2 또는 IL-7)과 접촉한다. 소정의 실시형태에서, 세포는 피토헤마글루티닌과 접촉한다. 소정의 실시형태에서, 세포는 하나 이상의 세포내 신호, 예컨대 Ca2 + 방출을 자극하는 물질(예를 들어, 포르볼 12-미리스테이트 13-아세테이트 및/또는 이오노마이신)과 접촉한다. 대안적으로, 유도는 세포 표면에 제시된 TCR에 결합하는 펩타이드(예를 들어, NY-ESO-1 펩타이드)를 포함하는 항원을 포함할 수 있고, 이로써 항원 반응성과 관련하여 농후화된 세포 집단(예를 들어, 단일클론)을 제공한다. 항원은 펩타이드와의 복합체에서 MHC 분자(예를 들어, HLA 분자)를 추가로 포함할 수 있다. 항원은 막에 결합되거나 표면에 제시된 가용성 형태로서 존재할 수 있다. 상기에 기재된 바와 같은 물질은 임의의 조합으로 사용될 수 있고, 동시에 또는 순차적으로 효과기 세포 또는 이의 전구체와 접촉할 수 있다. 접촉은 종결될 수 있는 한편, 세포는 증가된 생존능력, 증식, 및/또는 활성의 상태에 있을 수 있다. 연장된 시간 기간에 걸친 T 세포의 지속된 증식은 원래의 T 세포 집단에 비해 세포의 수의 다중 배수 증가를 생성할 수 있다. 몇몇 실시형태에서, 활성화는 최적 생물학적 활성 및 생존을 위해 T 세포의 컨디셔닝을 허용하는 생물에너지 연료 소스의 제공을 통해 대사 적합성을 촉진하도록 수행될 수 있다.
소정의 실시형태에서, 포유류 세포(예를 들어, 림프구)는 세포로 도입된 전이유전자로부터 본 명세서에 개시된 TCR을 발현하고, 세포 표면에 TCR을 제시한다. TCR은 세포 표면에 구성적으로 디스플레이될 수 있다. 대안적으로, 세포는 TCR의 조건적 발현 및/또는 디스플레이를 할 수 있다. 예를 들어, TCR의 발현 또는 디스플레이는 외인성 자극 또는 세포 분화에 의해 유도될 수 있다. 소정의 실시형태에서, 전이유전자는 TCR α 사슬 및/또는 β 사슬, 또는 이의 단편(예를 들어, Vα, Vβ, CDR3α 및/또는 CDR3β)을 암호화한다. 소정의 실시형태에서, 전이유전자는 외인성 전사 및/또는 번역 제어 서열(예를 들어, 촉진자, 인핸서, 및/또는 Kozak 서열)에 작동 가능하게 연결된다. 소정의 실시형태에서, 전이유전자는, (예를 들어, 벡터에 의해 도입된) 네이티브 게놈 유전좌위에서가 아닌, 내인성 전사 및/또는 번역 제어 서열(예를 들어, 촉진자, 인핸서, 및/또는 Kozak 서열)에 작동 가능하게 연결된다. 소정의 실시형태에서, 전이유전자는, (예를 들어, 네이티브 게놈 유전좌위로 전이유전자를 삽입함으로써) 네이티브 게놈 유전좌위에서, 내인성 전사 및/또는 번역 제어 서열(예를 들어, 촉진자, 인핸서, 및/또는 Kozak 서열)에 작동 가능하게 연결된다.
소정의 실시형태에서, 전이유전자는 숙주 세포 게놈으로 통합된 DNA이고, 여기서 통합은 부위 특이적 통합(예를 들어, 상동성 재조합) 또는 DNA의 랜덤 삽입을 통해 발생한다. 소정의 실시형태에서, 전이유전자는 (예를 들어, 비통합 바이러스 게놈으로서 또는 에피솜 DNA로서 유지된) 숙주 세포 게놈으로 통합되지 않은 DNA이다. 소정의 실시형태에서, 전이유전자는 본 명세서에 개시된 TCR을 발현하도록 전사 및/또는 번역될 수 있는 폴리뉴클레오타이드(DNA, RNA, 변형된 DNA 및 변형된 RNA(이들로 제한되지는 않음)를 포함)이다. 소정의 실시형태에서, 전이유전자는 5' 말단에서 캡 및/또는 3' 말단에서 poly(A) 꼬리를 갖는 RNA이고, 여기서 캡 및 poly(A) 꼬리는 세포에서 리보솜 결합, 번역의 개시 및 RNA의 안정성을 조정할 수 있다.
소정의 실시형태에서, 전이유전자는 제1 서열 및 제2 서열을 포함하고, 제1 서열은 TCR α 사슬 또는 이의 단편(예를 들어, Vα 또는 CDR3α)을 포함하는 폴리펩타이드를 암호화하고, 제2 서열은 TCR β 사슬 또는 이의 단편(예를 들어, Vβ 또는 CDR3β)을 포함하는 폴리펩타이드를 암호화한다. 소정의 실시형태에서, 제1 서열 및 제2 서열은 각각 전사 및/또는 번역 제어 서열(예를 들어, 촉진자, 인핸서, 및/또는 Kozak 서열)에 작동 가능하게 연결된다. 소정의 실시형태에서, 제1 서열 및 제2 서열은 상이한 폴리뉴클레오타이드(예를 들어, DNA, RNA, 변형된 DNA 또는 변형된 RNA) 분자에 있다. 소정의 실시형태에서, 전이유전자의 제1 서열 및 제2 서열은 동일한 폴리뉴클레오타이드(예를 들어, DNA, RNA, 변형된 DNA 또는 변형된 RNA) 분자에 있다. 소정의 실시형태에서, 제1 서열 및 제2 서열은 2개의 별개의 폴리펩타이드(예를 들어, 내부 리보솜 진입 부위(internal ribosome entry site: IRES), 자가 절단 펩타이드(예를 들어, 2A 펩타이드), 또는 세포내 또는 세포외 프로테아제에 의해 인식된 펩타이드 서열)의 제조를 촉진하는 링커 서열에 의해 작동 가능하게 연결된다. 소정의 실시형태에서, 제1 서열 및 제2 서열은 독립적으로 전사 및/또는 번역될 수 있다. 소정의 실시형태에서, 제1 서열 및 제2 서열은 각각 숙주 세포 게놈으로 통합된다. 소정의 실시형태에서, 제1 서열 및 제2 서열은 각각 숙주 세포 게놈의 상이한 영역으로 통합된다.
대안적으로, 소정의 실시형태에서, 세포는 TCR을 발현하지 않지만, 대신에 TCR은 화학 수단에 의해 또는 세포 표면 항원에 대한 TCR의 결합에 의해 세포의 표면 밖에서 부착된다. 따라서, 소정의 실시형태에서, TCR은 세포 표면 항원에 결합하는 결합 모이어티에 연결된다. 결합 모이어티의 임의의 유형은 본 명세서에 개시된 TCR에 (공유로 또는 비공유로) 연결될 수 있다. 소정의 실시형태에서, TCR은 세포(예를 들어, 림프구)의 세포 표면 항원에 특이적으로 결합하는 항체 또는 이의 항원 결합 단편에 (화학적으로 또는 유전적으로) 융합된다.
소정의 실시형태에서, 세포는 세포사를 유도할 수 있는 폴리펩타이드를 암호화하는 폴리뉴클레오타이드를 추가로 포함한다. 소정의 실시형태에서, 폴리펩타이드는 다합체화(예를 들어, 이합체화 또는 올리고머화) 영역 및 세포사 유도 영역을 포함하는 키메라 폴리펩타이드이고, 여기서 세포사 유도 영역은 다합체화에 의해 활성화된다. 소정의 실시형태에서, 세포사 유도 영역은 프로테아제 활성을 갖는 카스파제(예를 들어, 카스파제-9)의 서열을 포함한다. 소정의 실시형태에서, 세포사 유도 영역은 전장 인간 카스파제-9 폴리펩타이드를 포함한다. 소정의 실시형태에서, 세포사 유도 영역은 절두된 인간 카스파제-9 폴리펩타이드(예를 들어, 여기서, 카스파제-9의 CARD 도메인은 결실됨)를 포함한다.
소정의 실시형태에서, 세포는 T 세포 활성화를 유도할 수 있는 폴리펩타이드를 암호화하는 폴리뉴클레오타이드를 추가로 포함한다. 소정의 실시형태에서, 폴리펩타이드는 예를 들어 PCT 공보 WO 제2015/123527호(본 명세서에 그 전문이 참고로 포함됨)에 기재된 바대로 유도성 키메라 자극 분자이다. 소정의 실시형태에서, 폴리펩타이드는 다합체화(예를 들어, 이합체화 또는 올리고머화) 영역을 포함하고, 여기서 폴리펩타이드는 다합체화 시 T 세포 활성화를 유도한다.
예를 들어, 세포사를 유도할 수 있는 폴리펩타이드 또는 T 세포 활성화를 유도할 수 있는 폴리펩타이드에 존재하는 다합체화 영역은 리간드(예를 들어, 합성 리간드)에 결합 시 다합체화하는 리간드 결합 도메인을 포함할 수 있다. 리간드는 2개 이상의 결합 자리를 가질 수 있고, 각각의 결합 자리는 키메라 폴리펩타이드의 리간드 결합 도메인에 결합할 수 있다. 소정의 실시형태에서, 리간드는 2개의 결합 자리를 갖고, 키메라 폴리펩타이드의 이합체화를 유도할 수 있다. 다양한 합성 리간드 및 상응하는 리간드 결합 도메인을 사용할 수 있다. 예를 들어, 다합체(예를 들어, 이합체) FK506은 FK506 결합 단백질(FKBP; 예를 들어, FKBP12 또는 이의 변이체)을 다합체화하도록 사용될 수 있고; 다합체(예를 들어, 이합체) 사이클로스포린 A는 사이클로필린 수용체를 다합체화하도록 사용될 수 있고; 다합체(예를 들어, 이합체) 에스트로겐은 에스트로겐 수용체를 다합체화하도록 사용될 수 있고; 다합체(예를 들어, 이합체) 글루코코르티코이드는 글루코코르티코이드 수용체를 다합체화하도록 사용될 수 있고; 다합체(예를 들어, 이합체) 테트라사이클린은 테트라사이클린 수용체를 다합체화하도록 사용될 수 있고; 다합체(예를 들어, 이합체) 비타민 D는 비타민 D 수용체를 다합체화하도록 사용될 수 있다. 리간드 결합 도메인은 작제물의 성질 및 리간드의 선택에 따라 세포막에 내부 또는 외부일 수 있다. 리간드 및 상응하는 리간드 결합 도메인의 비제한적인 예는 미국 특허 제9,089,520호; 문헌[Kopytek, S. J., et al., Chemistry & Biology 7:313-321 (2000); Gestwicki, J. E., et al., Combinatorial Chem. & High Throughput Screening 10:667-675 (2007); Clackson T Chem Biol Drug Des 67:440-2 (2006); 및 Schreiber, et al., Chemical Biology From Small Molecules 내지 Systems Biology and Drug Design (Wiley, 2007)](이의 내용은 본 명세서에서 그 전문이 참고로 포함됨)에 기재되어 있다.
소정의 실시형태에서, 세포사를 유도할 수 있는 폴리펩타이드는 FKBP12 폴리펩타이드 및 전장 또는 절두된 카스파제-9(예를 들어, 인간 카스파제-9)를 포함하는 키메라 폴리펩타이드이다. 소정의 실시형태에서, FKBP12 폴리펩타이드는 36번 위치에서 발린을 포함한다. 소정의 실시형태에서, FKBP12 폴리펩타이드는 서열 번호 23에 제시된 아미노산 서열을 포함한다. 소정의 실시형태에서, FKBP12 다합체화를 유도할 수 있는 리간드는 AP1903(CAS 등록 번호: 195514-63-7; 분자 화학식: C78H98N4O20; 분자량: 1411.65)이다. 소정의 실시형태에서, 리간드는 AP20187 또는 AP20187 유사체(예를 들어, AP1510)이다. 소정의 실시형태에서, 카스파제-9 폴리펩타이드는 서열 번호 24에 제시된 아미노산 서열을 포함한다.
소정의 실시형태에서, 세포사를 유도할 수 있는 폴리펩타이드를 암호화하는 폴리뉴클레오타이드는 전사 및/또는 번역 제어 서열(예를 들어, 촉진자, 인핸서, 및/또는 Kozak 서열)에 작동 가능하게 연결된다. 폴리뉴클레오타이드는 숙주 세포 게놈으로 통합될 수 있다. 대안적으로, 폴리뉴클레오타이드는 비통합 바이러스 게놈으로서 또는 에피솜 DNA로서 유지될 수 있다. 소정의 실시형태에서, 폴리뉴클레오타이드는 2개의 별개의 폴리펩타이드(예를 들어, 내부 리보솜 진입 부위(IRES), 자가 절단 펩타이드(예를 들어, 2A 펩타이드), 또는 세포내 또는 세포외 프로테아제에 의해 인식된 펩타이드 서열)의 제조를 수월하게 하는 링커 서열에 의해 TCR을 암호화하는 제1 서열 및/또는 제2 서열에 작동 가능하게 연결된다. 소정의 실시형태에서, 폴리뉴클레오타이드는 제1 서열 및/또는 제2 서열과 독립적으로 전사 및/또는 번역된다.
소정의 실시형태에서, 세포는 용액에 제공된다. 소정의 실시형태에서, 세포는 약 -80℃ 이하에서(예를 들어, 액체 질소 저장 탱크에서) 저온보존된다. 저온보존의 방법은 예를 들어 미국 특허 제5,580,714호 및 제6,740,484호(본 명세서에서 그 전문이 참고로 포함됨)에 기재된 바대로 당해 분야에 널리 공지되어 있다. 저온보존된 세포는 해동에 의해 회수될 수 있고, 상기에 기재된 바와 같은 TCR의 임의의 단리, 정제, 농후화, 자극 및 디스플레이는 저온보존 전에 또는 회수 후에 수행될 수 있다.
5.4 사용 방법
또 다른 양태에서, 본 개시내용은 본 명세서에 개시된 TCR, 폴리뉴클레오타이드, 벡터, 조작된 세포(예를 들어, 비상동성 및/또는 재조합 핵산을 포함하는 세포), 또는 약제학적 조성물을 사용하여 대상체를 치료하는 방법을 제공한다. NY-ESO-1 펩타이드에 대한 TCR의 표적화로부터 이익을 얻을 대상체에서의 임의의 질환 또는 장애는 본 명세서에 개시된 TCR을 사용하여 치료될 수 있다. 본 명세서에 개시된 TCR, 폴리뉴클레오타이드, 벡터, 조작된 세포 및 약제학적 조성물은 NY-ESO-1 펩타이드(예를 들어, NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체)를 디스플레이하는 종양에 면역력을 유도하는 데 특히 유용하고, 따라서 NY-ESO-1 양성 암을 갖는 대상체에 대한 면역치료로서 사용될 수 있다. 예를 들어, 소정의 실시형태에서, 본 개시내용은 대상체에서 NY-ESO-1 펩타이드에 반응하여 세포 매개된 면역력을 유도하는 방법을 제공하고, 상기 방법은 유효량의 본 명세서에 기재된 바와 같은 TCR, 폴리뉴클레오타이드, 벡터, 조작된 세포 또는 약제학적 조성물을 대상체에게 투여하는 단계를 포함한다. 소정의 실시형태에서, 본 개시내용은 유효량의 본 명세서에 개시된 바와 같은 TCR, 폴리뉴클레오타이드, 벡터, 조작된 세포 또는 약제학적 조성물을 대상체에게 투여하는 단계를 포함하는 대상체에서 암을 치료하는 방법을 제공한다.
소정의 실시형태에서, 상기 방법은 유효량의 본 명세서에 개시된 바와 같은 세포 또는 이의 집단을 대상체에게 투여하는 단계를 포함한다. 소정의 실시형태에서, 세포는 세포 표면에 본 명세서에 개시된 바와 같은 TCR을 구성적으로 디스플레이하도록 조작된다. 소정의 실시형태에서, 세포는 유도 사건에 반응하여 세포 표면에 본 명세서에 개시된 바와 같은 TCR을 조건적으로 디스플레이하도록 조작된다. 이 유도 사건은 세포의 투여 전에, 이것과 동시에 또는 이것 후에 투여되는 외인성 물질에 의한 자극일 수 있다. 추가적으로 또는 대안적으로, 유도 사건은 대상체에서 세포, 조직 또는 병변에 의한 자극일 수 있다.
소정의 실시형태에서, 세포는 리간드 결합 다합체화(예를 들어, 이합체화 또는 올리고머화) 영역 및 세포사 유도 영역을 포함하는 키메라 폴리펩타이드를 암호화하는 폴리뉴클레오타이드를 추가로 포함하고, 상기 방법은 다합체화 영역의 리간드를 투여하는 단계를 추가로 포함한다. 소정의 실시형태에서, 키메라 폴리펩타이드는 FKBP12 폴리펩타이드 및 카스파제-9(예를 들어, 인간 카스파제-9) 폴리펩타이드를 포함하고, 상기 방법은 FKBP12 리간드(예를 들어, AP1903)를 투여하는 단계를 추가로 포함한다. 소정의 실시형태에서, FKBP12 리간드는 질환의 개선의 표시(예를 들어, 암의 수축, 암 마커의 감소, 및/또는 암 증상의 개선)를 관찰한 후 또는 견디기 힘든 부작용(예를 들어, 높은 수준의 염증성 사이토카인, 및/또는 숙주에 의한 투여된 세포의 거부)을 확인한 후 투여된다.
상기에 개시된 바대로, 대상체에게 투여되는 세포는 자가유래 또는 동종이계일 수 있다. 소정의 실시형태에서, 자가유래 세포는 암 치료 이후에 직접적으로 환자로부터 수득된다. 이와 관련하여, 소정의 암 치료 이후에, 면역계를 손상시키는 약물에 의한 특정한 치료에서, 치료 직후에 환자가 치료로부터 보통 회수할 때의 기간 동안, 수득된 T 세포의 품질은 생체외 증식하는 이의 능력에 대해 최적이거나 개선될 수 있다고 관찰된다. 마찬가지로, 본 명세서에 기재된 방법을 이용한 생체외 조작 이후에, 이 세포는 증대된 생착 및 생체내 증식을 위해 바람직한 상태에 있을 수 있다. 따라서, 소정의 실시형태에서, 세포는 이 회수 단계 동안 혈액, 골수, 림프절, 흉선, 또는 또 다른 조직 또는 체액 또는 성분채집술 생성물로부터 수집된다. 추가로, 소정의 양태에서, 동원 및 컨디셔닝 섭생은 대상체에서 컨디션을 생성하도록 이용될 수 있고, 여기서 특정한 세포 유형의 재증식, 재순환, 재생 및/또는 증식은 특히 치료 이후에 한정된 시간 윈도우 동안 선호된다. 동원 물질은 CXCL12-상호작용 헤파리노이드, GM-CSF, G-CSF(예를 들어, 비변형된, 글라이코실화된 또는 PEG화된), IL-2(예를 들어, 비변형된, 글라이코실화된 또는 PEG화된), CXCR4 길항제(예를 들어, 플레릭사포르), 인테그린 α4β1 길항제(예를 들어, BIO5192), 사이클로포스파마이드, 5-플루오로유라실, 시스플라틴, 에토포사이드, 이포스파마이드, 사이타라빈, 및 이들의 조합으로 이루어진 군으로부터 선택될 수 있다.
사용된 세포의 수는 세포의 수명, 사용되는 프로토콜(예를 들어, 투여의 수), 증식하는 세포의 능력, 재조합 작제물의 안정성 등을 포함하는 다수의 상황에 따라 달라질 것이다. 소정의 실시형태에서, 세포는 관심 대상의 부위에 또는 그 근처에 일반적으로 주사되는 분산액으로서 적용된다. 세포는 임의의 생리학적으로 허용 가능한 매질 중에 투여될 수 있다.
본 명세서에 개시된 TCR, 폴리뉴클레오타이드, 벡터, 조작된 세포 또는 약제학적 조성물에 의해 치료될 수 있는 암은 NY-ESO-1을 발현하는 임의의 종양일 수 있다. NY-ESO-1을 발현하는 종양의 예는 예를 들어 상기 Jager 등의 문헌에 개시되어 있다. 또한, 상기 Chen 등의 문헌, 문헌[Stockert, et al., J. Exp. Med. 187:1349 (1998); Wang, et al, J. Immunol 161:3598-3606 (1998); Jungbluth, et al. Int. J. Cancer 92:856-860(2001); Jungbluth, et al, hit. J. Cancer 94:252-256(2001); Gnjatic, S. et al (2004) Ado Cancer Res 95: 1-30]; WO 제2004078776호; WO 제2013177247호; WO 제2014160030호; 및 WO 제2010106431호(이들은 각각 본 명세서에 그 전문이 참고로 포함됨)를 참조한다.
소정의 실시형태에서, 암은 급성 림프구성 암, 급성 골수성 백혈병, 포상 횡문근육종, 골암, 뇌암, 유방암, 항문, 항문관 또는 항문직장의 암, 눈의 암, 간내 담관의 암, 관절의 암, 목, 담낭 또는 흉막의 암, 코, 비강 또는 중이의 암, 구가의 암, 음문의 암, 만성 림프구성 백혈병, 만성 골수성 백혈병, 골수종(예를 들어, 만성 골수성 암), 결장암, 식도암, 자궁경부암, 위장 유암종, 호지킨 림프종, 후두인두암, 신장암, 후두암, 간암, 폐암(예를 들어, 비소세포 폐암), 악성 중피종, 흑색종, 다발성 골수종, 인두암, 비호지킨 림프종, 난소암, 췌장암, 배막, 장막 및 장간막 암, 후두암, 전립선암, 직장암, 신장암(예를 들어, 신장 세포 암종(RCC)), 위암, 소장암, 연조직암, 위암, 암종, 육종(예를 들어, 활막 육종, 횡문근육종), 고환암, 갑상선암, 두경부암, 자궁암 및 방광암이다. 소정의 실시형태에서, 암은 흑색종, 유방암, 폐암, 전립선암, 갑상선암, 난소암 또는 활막 육종이다. 일 실시형태에서, 암은 활막 육종 또는 지방육종(예를 들어, 점액모양/원형 세포 지방육종)이다. 소정의 실시형태에서, 암은 다발성 골수종, 활막 육종, 지방육종, 신장 세포 암종, 자궁경부암 및 난소암으로 이루어진 군으로부터 선택된다.
소정의 실시형태에서, 이 방법은 추가적인 치료제를 대상체에게 투여하는 단계를 추가로 포함한다. 소정의 실시형태에서, 추가적인 치료제는 화학치료제, 방사선치료제 또는 관문 표적화제이다. 소정의 실시형태에서, 화학치료제는 저메틸화제(예를 들어, 아자시티딘)이다. 소정의 실시형태에서, 관문 표적화제는 길항제 항-CTLA-4 항체, 길항제 항-PD-L1 항체, 길항제 항-PD-L2 항체, 길항제 항-PD-1 항체, 길항제 항-TIM-3 항체, 길항제 항-LAG-3 항체, 길항제 항-CEACAM1 항체, 효능제 항-GITR 항체 및 효능제 항-OX40 항체로 이루어진 군으로부터 선택된다.
소정의 실시형태에서, 항-PD-1 항체는 본 명세서에 개시된 방법에서 사용된다. 소정의 실시형태에서, 항-PD-1 항체는 Bristol-Myers Squibb에 의해 개발된 BMS-936558 또는 MDX1106으로도 공지된 니볼루맙이다. 소정의 실시형태에서, 항-PD-1 항체는 Merck & Co에 의해 개발된 람브롤리주맙 또는 MK-3475로도 공지된 펨브롤리주맙이다. 소정의 실시형태에서, 항-PD-1 항체는 CureTech에 의해 개발된 CT-011로도 공지된 피딜리주맙이다. 소정의 실시형태에서, 항-PD-1 항체는 Medimmune에 의해 개발된 AMP-514로도 공지된 MEDI0680이다. 소정의 실시형태에서, 항-PD-1 항체는 Novartis Pharmaceuticals에 의해 개발된 PDR001이다. 소정의 실시형태에서, 항-PD-1 항체는 Regeneron Pharmaceuticals에 의해 개발된 REGN2810이다. 소정의 실시형태에서, 항-PD-1 항체는 Pfizer에 의해 개발된 PF-06801591이다. 소정의 실시형태에서, 항-PD-1 항체는 BeiGene에 의해 개발된 PF-06801591이다. 소정의 실시형태에서, 항-PD-1 항체는 AnaptysBio 및 Tesaro에 의해 개발된 TSR-042이다. 소정의 실시형태에서, 항-PD-1 항체는 Hengrui에 의해 개발된 SHR-1210이다.
본 명세서에 개시된 치료 방법에서 사용될 수 있는 항-PD-1 항체의 추가의 비제한적인 예는 하기 특허 및 특허 출원(모든 목적을 위해 본 명세서에 그 전문이 참고로 포함됨)에 개시된다: 미국 특허 제6,808,710호; 미국 특허 제7,332,582호; 미국 특허 제7,488,802호; 미국 특허 제8,008,449호; 미국 특허 제8,114,845호; 미국 특허 제8,168,757호; 미국 특허 제8,354,509호; 미국 특허 제8,686,119호; 미국 특허 제8,735,553호; 미국 특허 제8,747,847호; 미국 특허 제8,779,105호; 미국 특허 제8,927,697호; 미국 특허 제8,993,731호; 미국 특허 제9,102,727호; 미국 특허 제9,205,148호; 미국 공보 US 제2013/0202623호 A1; 미국 공보 US 제2013/0291136호 A1; 미국 공보 US 제2014/0044738호 A1; 미국 공보 US 제2014/0356363호 A1; 미국 공보 US 제2016/0075783호 A1; 및 PCT 공보 WO 제2013/033091호 A1; PCT 공보 WO 제2015/036394호 A1; PCT 공보 WO 제2014/179664호 A2; PCT 공보 WO 제2014/209804호 A1; PCT 공보 WO 제2014/206107호 A1; PCT 공보 WO 제2015/058573호 A1; PCT 공보 WO 제2015/085847호 A1; PCT 공보 WO 제2015/200119호 A1; PCT 공보 WO 제2016/015685호 A1; 및 PCT 공보 WO 제2016/020856호 A1.
소정의 실시형태에서, 항-PD-L1 항체는 본 명세서에 개시된 방법에서 사용된다. 소정의 실시형태에서, 항-PD-L1 항체는 Genentech에 의해 개발된 아테졸리주맙이다. 소정의 실시형태에서, 항-PD-L1 항체는 AstraZeneca, Celgene 및 Medimmune에 의해 개발된 두르발루맙이다. 소정의 실시형태에서, 항-PD-L1 항체는 Merck Serono 및 Pfizer에 의해 개발된 MSB0010718C로도 공지된 아벨루맙이다. 소정의 실시형태에서, 항-PD-L1 항체는 Bristol-Myers Squibb에 의해 개발된 MDX-1105이다. 소정의 실시형태에서, 항-PD-L1 항체는 Amplimmune 및 GSK에 의해 개발된 AMP-224이다.
본 명세서에 개시된 치료 방법에서 사용될 수 있는 항-PD-L1 항체의 비제한적인 예는 하기 특허 및 특허 출원(모든 목적을 위해 본 명세서에 그 전문이 참고로 포함됨)에 개시되어 있다: 미국 특허 제7,943,743호; 미국 특허 제8,168,179호; 미국 특허 제8,217,149호; 미국 특허 제8,552,154호; 미국 특허 제8,779,108호; 미국 특허 제8,981,063호; 미국 특허 제9,175,082호; 미국 공보 US 제2010/0203056호 A1; 미국 공보 US 제2003/0232323호 A1; 미국 공보 US 제2013/0323249호 A1; 미국 공보 US 제2014/0341917호 A1; 미국 공보 US 제2014/0044738호 A1; 미국 공보 US 제2015/0203580호 A1; 미국 공보 US 제2015/0225483호 A1; 미국 공보 US 제2015/0346208호 A1; 미국 공보 US 제2015/0355184호 A1; 및 PCT 공보 WO 제2014/100079호 A1; PCT 공보 WO 제2014/022758호 A1; PCT 공보 WO 제2014/055897호 A2; PCT 공보 WO 제2015/061668호 A1; PCT 공보 WO 제2015/109124호 A1; PCT 공보 WO 제2015/195163호 A1; PCT 공보 WO 제2016/000619호 A1; 및 PCT 공보 WO 제2016/030350호 A1.
소정의 실시형태에서, 본 명세서에 개시된 TCR, 세포 또는 약제학적 조성물은 면역조절 효소(들), 예컨대 IDO(인돌아민-(2,3)-다이옥시게나제) 및/또는 TDO(트립토판 2,3-다이옥시게나제)를 표적화하는 화합물과 조합되어 대상체에게 투여된다. 소정의 실시형태에서, 이러한 화합물은 에파카도스타트(Incyte Corp; 예를 들어 PCT 공보 WO 제2010/005958호(본 명세서에 그 전문이 참고로 포함됨) 참조), F001287(Flexus Biosciences/Bristol-Myers Squibb), 인독시모드(NewLink Genetics) 및 NLG919(NewLink Genetics)로 이루어진 군으로부터 선택된다. 일 실시형태에서, 화합물은 에파카도스타트이다. 또 다른 실시형태에서, 화합물은 F001287이다. 또 다른 실시형태에서, 화합물은 인독시모드이다. 또 다른 실시형태에서, 화합물은 NLG919이다. 구체적인 실시형태에서, 본 명세서에 개시된 TCR, 세포 또는 약제학적 조성물은 암을 치료하기 위한 IDO 저해제와 조합되어 대상체에게 투여된다. 암을 치료하는 데 사용하기 위한 본 명세서에 기재된 바와 같은 IDO 저해제는 약제학적 조성물의 고체 투여형, 예컨대 정제, 환제 또는 캡슐에 존재하고, 여기서 약제학적 조성물은 IDO 저해제 및 약제학적으로 허용 가능한 부형제를 포함한다. 그러므로, 본 명세서에 기재된 바와 같은 TCR, 세포 또는 약제학적 조성물 및 본 명세서에 기재된 바와 같은 IDO 저해제는 별개의 투여형으로서 별개로, 순차적으로 또는 동시에 투여될 수 있다. 일 실시형태에서, 세포 또는 약제학적 조성물은 비경구로 투여되고, IDO 저해제는 경구로 투여된다. 특정한 실시형태에서, 저해제는 에파카도스타트(Incyte Corporation), F001287(Flexus Biosciences/Bristol-Myers Squibb), 인독시모드(NewLink Genetics) 및 NLG919(NewLink Genetics)로 이루어진 군으로부터 선택된다. 에파카도스타트는 PCT 공보 WO 제2010/005958호(모든 목적을 위해 본 명세서에 그 전문이 참고로 포함됨)에 기재되어 있다. 일 실시형태에서, 저해제는 에파카도스타트이다. 또 다른 실시형태에서, 저해제는 F001287이다. 또 다른 실시형태에서, 저해제는 인독시모드이다. 또 다른 실시형태에서, 저해제는 NLG919이다.
소정의 실시형태에서, 본 명세서에 개시된 TCR, 세포 또는 약제학적 조성물은 백신과 조합되어 대상체에게 투여된다. 백신은 예를 들어 펩타이드 백신, DNA 백신 또는 RNA 백신일 수 있다. 소정의 실시형태에서, 백신은 열 쇼크 단백질 기반 종양 백신 또는 열 쇼크 단백질 기반 병원균 백신이다. 구체적인 실시형태에서, 본 명세서에 개시된 TCR, 세포 또는 약제학적 조성물은 열 쇼크 단백질 기반 종양-백신과 조합되어 대상체에게 투여된다. 열 쇼크 단백질(HSP)은 모든 종에 걸쳐 편재하여 발견되는 고도로 보존된 단백질의 패밀리이다. 이의 발현은 열 쇼크 또는 독소에 대한 노출, 산화 스트레스 또는 글루코스 박탈을 포함하는 다른 스트레스 형태의 결과로서 훨씬 더 높은 수준으로 강력하게 유도될 수 있다. 5개의 패밀리가 분자량에 따라 분류된다: HSP-110, -90, -70, -60 및 -28. HSP는 항원 제시 세포(antigen presenting cell: APC), 예컨대 대식세포 및 수지상 세포(dendritic cell: DC)에서의 교차 제시 경로를 통해 면역원성 펩타이드를 전달하여서, T 세포 활성화를 발생시킨다. HSP는 종양 특이적 면역력을 유도할 수 있는 복합체를 형성하는 종양 연관된 항원 펩타이드의 샤페론 운반체로서 작용한다. 죽어가는 종양 세포로부터 방출 시, HSP-항원 복합체는 항원 제시 세포(APC)에 의해 흡수되고, 여기서 항원은 MHC 클래스 I 및 클래스 II 분자에 결합하는 펩타이드로 처리되어서, 항-종양 CD8+ 및 CD4+ T 세포를 활성화시킨다. 종양 조제로부터 유래된 HSP 복합체에 의해 유발된 면역력은 각각의 대상체의 암에 의해 발현된 고유한 항원 펩타이드 레퍼토리에 특이적으로 지향된다.
열 쇼크 단백질 펩타이드 복합체(HSPPC)는 항원 펩타이드와 비공유로 복합체화된 열 쇼크 단백질로 이루어진 단백질 펩타이드 복합체이다. HSPPC는 선천성 및 적응성 면역 반응 둘 다를 유발한다. 구체적인 실시형태에서, 항원 펩타이드(들)는 치료되는 암에 대한 항원성을 디스플레이한다. HSPPC는 막 수용체(주로 CD91)를 통한 APC에 의해 또는 톨형 수용체에 대한 결합에 의해 효율적으로 붙잡힌다. HSPPC 내재화는 APC의 기능적 성숙을 발생시키고, 케모카인 및 사이토카인 생성은 자연 살해 세포(NK), 단핵구, 및 Th1 및 Th-2 매개된 면역 반응을 활성화시킨다. 소정의 실시형태에서, 본 명세서에 개시된 방법에서 사용된 HSPPC는 항원 펩타이드와 복합체화된 스트레스 단백질의 hsp60, hsp70 또는 hsp90 패밀리로부터 하나 이상의 열 쇼크 단백질을 포함한다. 소정의 실시형태에서, HSPPC는 hsc70, hsp70, hsp90, hsp110, grp170, gp96, 칼레티쿨린, 또는 이들의 2개 이상의 조합을 포함한다.
구체적인 실시형태에서, 열 쇼크 단백질 펩타이드 복합체(HSPPC)는 재조합 항원 펩타이드와 복합체화된 재조합 열 쇼크 단백질(예를 들어, hsp70 또는 hsc70) 또는 이의 펩타이드 결합 도메인을 포함한다. 재조합 열 쇼크 단백질은 문헌[Dworniczak and Mirault, Nucleic Acids Res. 15:5181-5197 (1987)] 및 GenBank 수탁 번호 P11142 및/또는 Y00371(이들은 각각 본 명세서에 그 전문이 참고로 포함됨)에 기재된 바대로 예를 들어 인간 hsc70 서열을 사용하여 재조합 DNA 기법에 의해 제조될 수 있다. 소정의 실시형태에서, Hsp70 서열은 문헌[Hunt and Morimoto Proc. Natl. Acad. Sci. U.S.A. 82 (19), 6455-6459 (1985)] 및 GenBank 수탁 번호 P0DMV8 및/또는 M11717(이들은 각각 본 명세서에 그 전문이 참고로 포함됨)에 기재되어 있다. 항원 펩타이드는 당해 분야에 공지된 재조합 DNA 방법에 의해 또한 제조될 수 있다.
소정의 실시형태에서, 항원 펩타이드는 변형된 아미노산을 포함한다. 소정의 실시형태에서, 변형된 아미노산은 번역 후 변형을 포함한다. 소정의 실시형태에서, 변형된 아미노산은 번역 후 변형의 모방체를 포함한다. 소정의 실시형태에서, 변형된 아미노산은 측쇄 하이드록실 또는 아민에서 인산화된 Tyr, Ser, Thr, Arg, Lys 또는 His이다. 소정의 실시형태에서, 변형된 아미노산은 측쇄 하이드록실 또는 아민에서 인산화된 Tyr, Ser, Thr, Arg, Lys 또는 His 아미노산의 모방체이다.
구체적인 실시형태에서, 본 명세서에 개시된 TCR, 세포 또는 약제학적 조성물은 암을 치료하기 위해 열 쇼크 단백질 펩타이드 복합체(HSPPC), 예를 들어 열 쇼크 단백질 펩타이드 복합체-96(HSPPC-96)과 조합되어 대상체에게 투여된다. HSPPC-96은 항원 펩타이드와 복합체화된 gp96인 96kDa 열 쇼크 단백질(Hsp)을 포함한다. HSPPC-96은 대상체의 종양으로부터 제조된 암 면역치료이고, 암의 항원 "지문"을 함유한다. 소정의 실시형태에서, 이 지문은, 오직 특정한 대상체의 특정한 암 세포 및 백신의 주사가 특정한 암 지문을 갖는 임의의 세포를 인식하고 공격하도록 대상체의 면역계를 자극하도록 의도된다는 점에서, 존재하는 고유한 항원을 함유한다.
소정의 실시형태에서, HSPPC, 예를 들어 HSPPC-96은 대상체의 종양 조직으로부터 제조된다. 구체적인 실시형태에서, HSPPC(예를 들어, HSPPC-96)는 치료되는 암의 유형의 종양 또는 이의 전이로부터 제조된다. 또 다른 구체적인 실시형태에서, HSPPC(예를 들어, HSPPC-96)는 치료되는 대상체에 자가유래이다. 소정의 실시형태에서, 종양 조직은 비괴사성 종양 조직이다. 소정의 실시형태에서, 적어도 1그램(예를 들어, 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9 또는 적어도 10그램)의 비괴사성 종양 조직은 백신 섭생을 제조하도록 사용된다. 소정의 실시형태에서, 수술 절제 후, 비괴사성 종양 조직은 백신 조제에서 사용하기 전에 동결된다. 몇몇 실시형태에서, HSPPC, 예를 들어 HSPPC-96는 정제 기법에 의해 종양 조직으로부터 단리되고, 여과되고, 주사용 백신을 위해 준비된다. 소정의 실시형태에서, 대상체는 HSPPC, 예를 들어 HSPCC-96의 6 내지 12 용량이 투여된다. 이러한 실시형태에서, HSPPC, 예를 들어 HSPPC-96, 용량은 처음의 4 용량에 대해 주마다 및 이후 2 내지 8 추가적인 용량에 대해 2주마다 투여될 수 있다.
본 명세서에 기재된 방법에 따라 사용될 수 있는 HSPPC의 추가의 예는 하기 특허 및 특허 출원(본 명세서에서 그 전문이 본 명세서에 참고로 포함됨)에 개시되어 있다, 미국 특허 제6,391,306호, 제6,383,492호, 제6,403,095호, 제6,410,026호, 제6,436,404호, 제6,447,780호, 제6,447,781호 및 제6,610,659호.
소정의 실시형태에서, 본 명세서에 개시된 TCR, 세포 또는 약제학적 조성물은 애쥬번트와 조합되어 대상체에게 투여된다. 다양한 애쥬번트는 치료 맥락에 따라 사용될 수 있다. 적절한 애쥬번트의 비제한적인 예는 완전 프로인트 애쥬번트(CFA), 불완전 프로인트 애쥬번트(IFA), 몬타나이드 ISA(불완전 Seppic 애쥬번트), Ribi 애쥬번트 시스템(RAS), Titer Max, 무라밀 펩타이드, Syntex Adjuvant Formulation(SAF), 명반(알루미늄 하이드록사이드 및/또는 알루미늄 포스페이트), 알루미늄 염 애쥬번트, Gerbu(등록상표) 애쥬번트, 나이트로셀룰로스 흡수된 항원, 캡슐화된 또는 포획된 항원, 3 데-O-아크릴화 모노포스포릴 지질 A(3 D-MPL), 면역자극 올리고뉴클레오타이드, 톨형 수용체(TLR) 리간드, 만난 결합 렉틴(MBL) 리간드, STING 효능제, 면역 자극 복합체, 예컨대 사포닌, Quil A, QS-21, QS-7, ISCO매트릭스 및 기타를 포함하지만, 이들로 제한되지는 않는다. 다른 애쥬번트는 CpG 올리고뉴클레오타이드 및 이중 가닥 RNA 분자, 예컨대 poly(A) 및 poly(U)를 포함한다. 상기 애쥬번트의 조합은 또한 사용될 수 있다. 예를 들어, 미국 특허 제6,645,495호; 제7,029,678호; 및 제7,858,589호(이들은 모두 본 명세서에 그 전문이 참고로 포함됨)를 참조한다. 일 실시형태에서, 본 명세서에서 사용된 애쥬번트는 QS-21 STIMULON이다.
소정의 실시형태에서, 본 명세서에 개시된 TCR, 폴리뉴클레오타이드, 벡터, 조작된 세포 또는 약제학적 조성물은 종양 미소환경(TME)-컨디셔닝제와 조합되어 대상체에게 투여된다. 소정의 실시형태에서, TME-컨디셔닝제는 사이토카인(예를 들어, 인터류킨-2, 인터페론-α, 인터페론-β, 인터페론-γ, 종양 괴사 인자 슈퍼패밀리 구성원14(TNFSF14))이다. 소정의 실시형태에서, 사이토카인은 케모카인(예를 들어, (C-C 모티프) 리간드 21(CCL21) 및 C-X-C 모티프 케모카인 10(CXCL10))이다. 소정의 실시형태에서, TME-컨디셔닝제는 패턴 인식 수용체(PRR)의 효능제이다. 소정의 실시형태에서, 효능제는 TLR9의 합성 효능제(예를 들어, CpG)이다. 소정의 실시형태에서, 효능제는 STING의 합성 효능제(예를 들어, cGAMP)이다.
TCR, 폴리뉴클레오타이드, 벡터, 조작된 세포 또는 약제학적 조성물 및 추가적인 치료제(예를 들어, 화학치료제, 방사선치료제, 관문 표적화제, IDO 저해제, 백신, 애쥬번트, 및/또는 TME-컨디셔닝제)는 별개의 투여형으로서 별개로, 순차적으로 또는 동시에 투여될 수 있다. 일 실시형태에서, TCR, 폴리뉴클레오타이드, 벡터, 조작된 세포 또는 약제학적 조성물은 비경구로 투여되고, IDO 저해제는 경구로 투여된다.
본 명세서에 기재된 TCR, 폴리뉴클레오타이드, 벡터, 조작된 세포 또는 약제학적 조성물은 다양한 경로에 의해 대상체에게 전달될 수 있다. 이것은 비경구, 비강내, 기관내, 경구, 피내, 국소, 근육내, 복강내, 피부경유, 정맥내, 종양내, 결막, 척추강내 및 피하 경로를 포함하지만, 이들로 제한되지는 않는다. 폐 투여는 예를 들어 흡입기 또는 분무기의 사용, 및 스프레이로서 사용하기 위한 에어로졸제에 의한 제제화에 의해 또한 이용될 수 있다. 소정의 실시형태에서, 본 명세서에 기재된 TCR, 폴리뉴클레오타이드, 벡터, 조작된 세포 또는 약제학적 조성물은 정맥내로 전달된다. 소정의 실시형태에서, 본 명세서에 기재된 TCR, 폴리뉴클레오타이드, 벡터, 조작된 세포 또는 약제학적 조성물은 피하로 전달된다. 소정의 실시형태에서, 본 명세서에 기재된 TCR, 폴리뉴클레오타이드, 벡터, 조작된 세포 또는 약제학적 조성물은 종양내로 전달된다. 소정의 실시형태에서, 본 명세서에 기재된 TCR, 폴리뉴클레오타이드, 벡터, 조작된 세포 또는 약제학적 조성물은 종양 배수 림프절로 전달된다.
병태의 치료 및/또는 예방에서 효과적인 TCR, 폴리뉴클레오타이드, 벡터, 조작된 세포 또는 약제학적 조성물의 양은 질환의 성질에 따라 달라질 것이고, 표준 임상 기법에 의해 결정될 수 있다.
조성물에서 사용되는 정확한 용량은 투여 경로 및 감염 또는 이것에 의해 생긴 질환의 중증도에 따라 또한 달라질 것이고, 의사의 판단 및 각각의 대상체의 상황에 따라 결정되어야 한다. 예를 들어, 유효 용량은 투여의 수단, 표적 부위, 환자의 생리학적 상태(연령, 체중 및 건강 포함), 환자가 인간 또는 동물인지, 투여되는 다른 약제 또는 치료가 예방학적 또는 치료학적인지에 따라 또한 변할 수 있다. 보통, 환자는 인간이지만, 형질전환 포유류를 포함하는 비인간 포유류는 또한 치료될 수 있다. 치료 투약량은 안전성 및 효율을 최적화하도록 최적으로 적정된다.
본 명세서에 기재된 TCR은 면역검정, 예컨대 효소 연결 면역흡착 검정(ELISA), 면역침전 또는 웨스턴 블로팅을 포함하는 당업자에게 공지된 고전적인 면역조직학적 방법을 이용하여 생물학적 샘플에서 NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체의 수준 및/또는 NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체를 디스플레이하는 세포의 수를 평가하도록 또한 사용될 수 있다. 적합한 TCR 검정 표지는 당해 분야에 공지되어 있고, 효소 표지, 예컨대, 글루코스 산화효소; 방사성 동위원소, 예컨대 요오드(125I, 121I), 탄소(14C), 황(35S), 삼중수소(3H), 인듐(121In) 및 테크네튬(99Tc); 발광성 표지, 예컨대 루미놀; 및 형광성 표지, 예컨대 플루오레세인 및 로다민 및 비오틴을 포함한다. 이러한 표지는 본 명세서에 기재된 TCR을 표지하도록 사용될 수 있다. 대안적으로, 본 명세서에 기재된 TCR을 인식하는 분자는 생물학적 샘플에서 NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체 및/또는 NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체를 디스플레이하는 세포의 수를 검출하도록 표지되고 본 명세서에 기재된 TCR과 조합되어 사용될 수 있다.
NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체의 수준에 대한 평가는 제1 생물학적 샘플에서 직접적으로(예를 들어, 절대 단백질 수준을 결정하거나 예측함으로써) 또는 상대적으로(예를 들어, 제2 생물학적 샘플에서 질환 연관된 단백질 수준과 비교함으로써) NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체의 수준을 정성적으로 또는 정량적으로 측정하거나 예측하는 것을 포함하도록 의도된다. 제1 생물학적 샘플에서 NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체의 수준은 측정되거나 예측되고, 표준 수준과 비교될 수 있고, 표준은 질환을 갖지 않는 개체로부터 얻은 제2 생물학적 샘플로부터 취해지거나, 질환을 갖지 않는 개체의 집단으로부터의 수준을 평균함으로써 결정된다. 당해 분야에서 이해되는 것처럼, "표준" 수준이 알려지면, 이것은 비교를 위해 표준으로서 반복해서 사용될 수 있다.
본 명세서에 사용된 바와 같이, 용어 "생물학적 샘플"은 NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체를 잠재적으로 디스플레이하는 대상체, 세포주, 조직 또는 세포의 다른 소스로부터 얻은 임의의 생물학적 샘플을 의미한다. 동물(예를 들어, 인간)로부터 조직 생검 및 체액을 얻는 방법은 당해 분야에 널리 공지되어 있다. 생물학적 샘플은 말초 단핵 혈액 세포를 포함한다.
본 명세서에 기재된 TCR은 당업자에 대한 널리 공지된 시험관내 및 생체내 분야 및 표준을 포함하는 예후적, 진단학적, 모니터링 및 스크리닝 분야에 대해 그리고 본 설명에 기초하여 사용될 수 있다. 시험관내 평가 및 면역계 상태 및/또는 면역 반응의 평가를 위한 예후적, 진단학적, 모니터링 및 스크리닝 검정 및 키트는 NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체를 디스플레이하는 세포와 연관된 장애(예를 들어, NY-ESO-1 양성 암)를 갖거나 갖는 것으로 의심되는 것으로 알려진 것을 포함하여 환자 샘플을 평가하도록 예측, 진단 및 모니터링되도록 사용될 수 있다. 생체내 분야는 지시된 세포 치료 및 면역계 조정 및 NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체를 디스플레이하는 세포, 조직 또는 기관(예를 들어, NY-ESO-1 양성 암)의 방사성 영상화를 포함한다.
일 실시형태에서, 본 명세서에 기재된 TCR은 생검 샘플의 면역조직화학에서 NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체 및/또는 NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체를 디스플레이하는 세포의 수를 검출하기 위해 사용될 수 있다. 본 명세서에 기재된 TCR은 검출 가능한 또는 기능적 표지를 보유할 수 있다. 형광 표지를 사용할 때, 당해 분야에 공지된 현재 구입 가능한 현미경검사 및 형광 활성화 세포 분류기 분석(FACS) 또는 방법 둘 다의 조합은 특이적 결합 구성원을 확인하고 정량화하도록 이용될 수 있다. 본 명세서에 기재된 TCR은 형광 표지를 보유할 수 있다. 예시적인 형광 표지는 예를 들어 반응성 및 접합된 프로브, 예를 들어 아미노쿠마린, 플루오레세인 및 Texas red, Alexa Fluor 염료, Cy 염료 및 DyLight 염료를 포함한다. 본 명세서에 기재된 TCR은 방사성 표지, 예컨대 동위원소 3H, 14C, 32P, 35S, 36Cl, 51Cr, 57Co, 58Co, 59Fe, 67Cu, 90Y, 99Tc, 111In, 117Lu, 121I, 124I, 125I, 131I, 198Au, 211At, 213Bi, 225Ac 및 186Re를 보유할 수 있다. 방사성 표지가 사용될 때, 당해 분야에 공지된 현재 구입 가능한 계수 절차는 NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체에 대한 TCR의 특이적 결합을 확인하고 정량화하도록 이용될 수 있다. 표지가 효소인 경우에, 검출은 당해 분야에 공지된 바와 같은 임의의 현재 이용되는 비색, 분광광도, 형광분광광도, 전류적정 또는 가스분석 기법에 의해 달성될 수 있다. 이것은 TCR과 NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체 사이에 복합체의 형성을 허용하는 조건 하에 샘플 또는 대조군 샘플을 본 명세서에 기재된 TCR과 접촉시킴으로써 달성될 수 있다. TCR과 펩타이드-MHC 복합체 사이에 형성된 임의의 복합체는 검출되고 샘플 및 대조군에서 비교된다. NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체에 대한 본 명세서에 기재된 TCR의 특이적 결합의 견지에서, TCR은 NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체를 디스플레이하는 세포를 검출하도록 사용될 수 있다. 본 명세서에 기재된 TCR은 면역친화도 정제를 통해 이러한 복합체 또는 세포를 정제하도록 또한 사용될 수 있다. 예를 들어 NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체 또는 펩타이드-MHC 복합체를 포함하는 복합체의 존재의 정도의 반정량적 또는 정량적 분석을 위해 시험 키트의 형태로 제조될 수 있는 검정 시스템이 본 명세서에 또한 포함된다. 시스템 또는 시험 키트는 표지된 성분, 예를 들어 표지된 TCR, 및 하나 이상의 추가적인 면역화학 시약을 포함할 수 있다.
5.5
폴리뉴클레오타이드
, 벡터 및
TCR을
제조하는 방법
또 다른 양태에서, 숙주 세포(예를 들어, 이 콜라이 및 포유류 세포)에서 재조합 발현을 위한, NY-ESO-1 펩타이드에 결합하는 본 명세서에 기재된 TCR(예를 들어, α 사슬, β 사슬, Vα 도메인, 및/또는 Vβ 도메인)을 암호화하는 뉴클레오타이드 서열을 포함하는 폴리뉴클레오타이드, 및 벡터, 예를 들어 이러한 폴리뉴클레오타이드를 포함하는 벡터가 본 명세서에 제공된다. 숙주 세포, 예를 들어 포유류 세포에서의 효율적인 발현을 위해, 본 명세서에 제공된 임의의 TCR의 α 사슬 및/또는 β 사슬을 암호화하는 뉴클레오타이드 서열을 포함하는 폴리뉴클레오타이드, 및 이러한 폴리뉴클레오타이드 서열을 포함하는 벡터, 예를 들어 발현 벡터가 본 명세서에 제공된다.
본 명세서에 사용된 바와 같이, "단리된" 폴리뉴클레오타이드 또는 핵산 분자는 핵산 분자의 천연 소스(예를 들어, 마우스 또는 인간)에 존재하는 다른 핵산 분자로부터 분리된 것이다. 더구나, "단리된" 핵산 분자, 예컨대 cDNA 분자는 재조합 기법에 의해 제조될 때 다른 세포 재료 또는 배양 배지가 실질적으로 없거나, 화학적으로 합성될 때 화학 전구체 또는 다른 화학물질이 실질적으로 없을 수 있다. 예를 들어, 언어 "실질적으로 없다"는 다른 재료, 예를 들어 세포 재료, 배양 배지, 다른 핵산 분자, 화학 전구체, 및/또는 다른 화학물질의 약 15% 미만, 10%, 5%, 2%, 1%, 0.5% 또는 0.1%(특히 약 10% 미만)를 갖는 폴리뉴클레오타이드 또는 핵산 분자의 조제를 포함한다. 구체적인 실시형태에서, 본 명세서에 기재된 TCR을 암호화하는 핵산 분자(들)는 단리되거나 정제된다.
특정한 양태에서, 상기에 기재된 TCR과 서열 번호 1에 제시된 아미노산 서열을 포함하는 펩타이드의 동일한 에피토프에 결합하는 TCR을 암호화하는 뉴클레오타이드 서열을 포함하는 폴리뉴클레오타이드가 본 명세서에 제공된다. 소정의 실시형태에서, 펩타이드는 상기에 기재된 바와 같이 MHC와 복합체로 있다(예를 들어, HLA-A*0201). 소정의 실시형태에서, TCR은 생체내 동물 또는 포유류(예를 들어, 인간)의 TCR 생식선 레퍼토리 내에 자연에서 존재하지 않은 서열을 포함한다. 소정의 실시형태에서, 폴리뉴클레오타이드는 생체내 동물 또는 포유류(예를 들어, 인간)의 TCR 암호화 DNA 생식선 레퍼토리 내에 자연에서 존재하지 않은 서열을 포함한다.
소정의 양태에서, 본 명세서에 기재된 TCR의 α 사슬 및/또는 β 사슬을 암호화하는 뉴클레오타이드 서열을 포함하는 폴리뉴클레오타이드가 본 명세서에 제공된다. 폴리뉴클레오타이드는 본 명세서에 기재된 TCR의 α 사슬 FR 및 CDR을 포함하는 α 사슬을 암호화하는 뉴클레오타이드 서열(예를 들어, 표 1 참조) 또는 본 명세서에 기재된 TCR의 β 사슬 FR 및 CDR를 포함하는 β 사슬을 암호화하는 뉴클레오타이드 서열(예를 들어, 표 1 참조)을 포함할 수 있다.
소정의 실시형태에서, 폴리뉴클레오타이드는 본 명세서에 기재된 TCR의 α 사슬을 암호화하는 제1 핵산 서열 및 β 사슬을 암호화하는 제2 핵산 서열을 포함한다. 소정의 실시형태에서, 폴리뉴클레오타이드는 본 명세서에 기재된 TCR의 Vα를 암호화하는 제1 핵산 서열 및 Vβ를 암호화하는 제2 핵산 서열을 포함한다. 소정의 실시형태에서, 제1 핵산 서열 및 제2 핵산 서열은 프레임내에 있다. 제1 핵산 서열은 제2 핵산 서열에 5' 또는 3'일 수 있다. 소정의 실시형태에서, 폴리뉴클레오타이드는 제1 핵산 서열과 제2 핵산 서열 사이에 펩타이드 링커를 암호화하는 제3 핵산 서열을 추가로 포함하고, 여기서 제1 핵산 서열, 제2 핵산 서열 및 제3 핵산 서열은 프레임내에 있다. 링커는 임의의 단백질분해 절단 부위를 포함할 수 있다. 예시적인 단백질분해 절단 부위는 제한 없이 퓨린 절단 부위, (표 7에서의 서열 중 임의의 하나로부터 선택된) 2A 절단 부위, 또는 이들의 조합을 포함한다. 소정의 실시형태에서, 링커는 퓨린 절단 부위(예를 들어, 서열 번호 132에 제시된 아미노산 서열을 포함) 및 2A 절단 부위(예를 들어, 서열 번호 33 또는 134에 제시된 아미노산 서열을 포함)를 포함한다.
소정의 실시형태에서, 폴리뉴클레오타이드는 5'로부터 3'로 제1 핵산 서열, 제3 핵산 사열 및 제2 핵산 서열을 포함하고, 여기서 제3 핵산 서열은 N 말단으로부터 C 말단으로 퓨린 절단 부위 및 2A 절단 부위를 암호화한다. 소정의 실시형태에서, 폴리뉴클레오타이드는 5'로부터 3'로 제2 핵산 사열, 제3 핵산 서열 및 제1 핵산 서열을 포함하고, 여기서 제3 핵산 서열은 N 말단으로부터 C 말단으로 퓨린 절단 부위 및 2A 요소를 암호화한다. 소정의 실시형태에서, 폴리뉴클레오타이드는 5'로부터 3'로 제1 핵산 서열, 제3 핵산 사열 및 제2 핵산 서열을 포함하고, 여기서 제3 핵산 서열은 2A 절단 부위를 암호화한다. 소정의 실시형태에서, 폴리뉴클레오타이드는 5'로부터 3'로 제2 핵산 사열, 제3 핵산 서열 및 제1 핵산 서열을 포함하고, 여기서 제3 핵산 서열은 2A 요소를 암호화한다. 소정의 실시형태에서, 폴리뉴클레오타이드는 5'로부터 3'로 제1 핵산 서열, 제3 핵산 사열 및 제2 핵산 서열을 포함하고, 여기서 제3 핵산 서열은 퓨린 절단 부위를 암호화한다. 소정의 실시형태에서, 폴리뉴클레오타이드는 5'로부터 3'로 제2 핵산 사열, 제3 핵산 서열 및 제1 핵산 서열을 포함하고, 여기서 제3 핵산 서열은 퓨린 절단 부위를 암호화한다. 소정의 실시형태에서, 폴리뉴클레오타이드는 표 8에 제공된 아미노산 서열 중 임의의 하나를 암호화한다. 퓨린 절단 부위는 일반적으로 RX1X2R의 공통 서열(식 중, X1은 임의의 아미노산일 수 있고, X2는 K 또는 R임)(서열 번호 29)을 갖는다. 소정의 실시형태에서, X1은 K 또는 R이다. 소정의 실시형태에서, 퓨린 절단 부위는 RAKR의 서열(서열 번호 30)을 갖는다. 소정의 실시형태에서, 퓨린 절단 부위는 RX1X2RS의 공통 서열(식 중, X1은 임의의 아미노산일 수 있고, X2는 K 또는 R임)(서열 번호 131)을 갖는다. 소정의 실시형태에서, 퓨린 절단 부위는 RAKRS의 서열(서열 번호 132)을 갖는다. 소정의 실시형태에서, 퓨린 절단 부위는 RX1X2RS의 공통 서열(식 중, X1은 K 또는 R이고, X2는 K 또는 R임)(서열 번호 133)을 갖는다. 소정의 실시형태에서, 퓨린 절단 부위는 제2 아르기닌 잔기 후 절단된다. 2A 절단 부위는 일반적으로 X1X2EX3NPGP의 공통 서열(식 중, X1은 D 또는 G이고, X2는 V 또는 I이고, X3은 임의의 아미노산임)(서열 번호 32)을 갖는다. 소정의 실시형태에서, 2A 절단 부위는 C 말단 프롤린 잔기와 이전의 글라이신 잔기 사이에 절단된다. 소정의 실시형태에서, 2A 절단 부위는 서열 번호 33 내지 38, 130 및 134 내지 140으로부터 선택된 아미노산 서열을 포함한다(표 7). 소정의 실시형태에서, 2A 절단 부위는 서열 번호 33에 제시된 아미노산 서열을 갖는 돼지 테스코바이러스-1 2A(P2A) 절단 부위이다. 소정의 실시형태에서, 2A 절단 부위는 서열 번호 134에 제시된 아미노산 서열을 갖는 돼지 테스코바이러스-1 2A(P2A) 절단 부위이다. 소정의 실시형태에서, 폴리뉴클레오타이드는 서열 번호 28을 암호화하는 핵산 서열을 포함한다.
예를 들어, 코돈/RNA 최적화, 비상동성 신호 서열에 의한 대체 및 mRNA 불안정성 요소의 제거에 의해 최적화된 본 명세서에 기재된 TCR을 암호화하는 폴리뉴클레오타이드가 본 명세서에 또한 제공된다. 코돈 변화를 도입하고/하거나 mRNA에서의 저해 영역을 제거함으로써 재조합 발현을 위한 TCR(예를 들어, α 사슬, β 사슬, Vα 도메인, 및/또는 Vβ 도메인)을 암호화하는 최적화된 핵산을 생성하는 방법은 따라서 예를 들어 미국 특허 제5,965,726호; 제6,174,666호; 제6,291,664호; 제6,414,132호; 및 제6,794,498호에 기재된 최적화 방법을 채택함으로써 수행될 수 있다. 예를 들어, RNA 내의 잠재적인 스플라이스 부위 및 불안정성 요소(예를 들어, A/T 또는 A/U 농후 요소)는 재조합 발현에 대한 RNA의 안정성을 증가시키기 위해 핵산 서열에 의해 암호화된 아미노산을 변경하지 않으면서 돌연변이될 수 있다. 변경은 예를 들어 동일한 아미노산에 대해 대안적인 코돈을 이용하여 유전자 코드의 축퇴성을 이용한다. 몇몇 실시형태에서, 보존적 돌연변이, 예를 들어 원래의 아미노산과 유사한 화학 구조 및 특성 및/또는 기능을 갖는 유사한 아미노산을 암호화하도록 하나 이상의 코돈을 변경하는 것이 바람직할 수 있다. 이러한 방법은 최적화되지 않은 폴리뉴클레오타이드에 의해 암호화된 TCR의 발현에 대해 적어도 1배, 2배, 3배, 4배, 5배, 10배, 20배, 30배, 40배, 50배, 60배, 70배, 80배, 90배, 또는 100배 또는 이것 초과로 TCR의 발현을 증가시킬 수 있다.
소정의 실시형태에서, 본 명세서에 기재된 TCR(예를 들어, α 사슬, β 사슬, Vα 도메인 및/또는 Vβ 도메인)을 암호화하는 최적화된 폴리뉴클레오타이드 서열은 본 명세서에 기재된 TCR(예를 들어, α 사슬, β 사슬, Vα 도메인, 및/또는 Vβ 도메인)을 암호화하는 비최적화된 폴리뉴클레오타이드 서열의 안티센스(예를 들어, 상보성) 폴리뉴클레오타이드에 혼성화될 수 있다. 구체적인 실시형태에서, 본 명세서에 기재된 TCR을 암호화하는 최적화된 뉴클레오타이드 서열은 본 명세서에 기재된 TCR을 암호화하는 비최적화된 폴리뉴클레오타이드 서열의 안티센스 폴리뉴클레오타이드에 높은 엄격성 조건 하에 혼성화한다. 구체적인 실시형태에서, 본 명세서에 기재된 TCR을 암호화하는 최적화된 뉴클레오타이드 서열은 본 명세서에 기재된 TCR을 암호화하는 비최적화된 뉴클레오타이드 서열의 안티센스 폴리뉴클레오타이드에 높은 엄격성, 중간 또는 더 낮은 엄격성 혼성화 조건 하에 혼성화한다. 혼성화 조건에 관한 정보는 기재되어 있고, 예를 들어 미국 특허 출원 공보 US 제2005/0048549호(예를 들어, 문단 72 내지 73)(본 명세서에 참고로 포함됨)를 참조한다.
폴리뉴클레오타이드는 얻어질 수 있고, 폴리뉴클레오타이드의 뉴클레오타이드 서열은 당해 분야에 공지된 임의의 방법에 의해 결정된다. 본 명세서에 기재된 TCR, 예를 들어 표 1 내지 표 4에 기재된 TCR, 및 이 TCR의 변형된 버전을 암호화하는 뉴클레오타이드 서열은 널리 당해 분야에 공지된 방법을 이용하여 결정될 수 있고, 즉 특정한 아미노산을 암호화하는 것으로 공지된 뉴클레오타이드 코돈은 TCR을 암호화하는 핵산을 생성하는 방식으로 어셈블링된다. TCR을 암호화하는 이러한 폴리뉴클레오타이드는 (예를 들어, 문헌[Kutmeier G et al., (1994), BioTechniques 17: 242-6]에 기재된 바대로) 화학적으로 합성된 올리고뉴클레오타이드로부터 어셈블링될 수 있고, 이는 간단히 TCR을 암호화하는 서열의 일부를 함유하는 중첩하는 올리고뉴클레오타이드의 합성, 이 올리고뉴클레오타이드의 어닐링 및 결찰, 및 이후 PCR에 의한 결찰된 올리고뉴클레오타이드의 증폭을 수반한다.
대안적으로, 본 명세서에 기재된 TCR을 암호화하는 폴리뉴클레오타이드는 당해 분야에 널리 공지된 방법(예를 들어, PCR 및 다른 분자 클로닝 방법)을 이용하여 적합한 소스(예를 들어, T 림프구)로부터 핵산으로부터 생성될 수 있다. 예를 들어, 공지된 서열의 3' 및 5' 말단에 혼성화 가능한 합성 프라이머를 사용한 PCR 증폭은 관심 대상의 TCR을 발현하는 T 세포로부터 수득된 게놈 DNA를 사용하여 수행될 수 있다. 이러한 PCR 증폭 방법은 TCR의 α 사슬 및/또는 β 사슬을 암호화하는 서열을 포함하는 핵산을 수득하도록 사용될 수 있다. 이러한 PCR 증폭 방법은 TCR의 Vα 도메인 및/또는 Vβ 도메인을 암호화하는 서열을 포함하는 핵산을 수득하도록 사용될 수 있다. 증폭된 핵산은 예를 들어 키메라 및 인간화된 TCR을 생성하기 위해 숙주 세포에서의 발현 및 추가의 클로닝을 위해 벡터로 클로닝될 수 있다.
특정한 TCR을 암호화하는 핵산을 함유하는 클론이 구입 가능하지 않지만, TCR 분자의 서열이 공지된 경우, TCR을 암호화하는 핵산은, 서열의 3' 및 5' 말단에 혼성화 가능한 합성 프라이머를 사용한 PCR 증폭에 의해 또는 예를 들어 TCR을 암호화하는 cDNA 라이브러리로부터의 cDNA 클론을 확인하기 위해 특정한 유전자 서열에 특이적인 올리고뉴클레오타이드 프로브를 사용하여 클로닝함으로써, 적합한 소스(예를 들어, TCR cDNA 라이브러리, 또는 TCR을 발현하는 임의의 조직 또는 세포, 예컨대 본 명세서에 기재된 TCR을 발현하도록 선택된 T 림프구로부터 생성된 cDNA 라이브러리, 또는 이로부터 단리된 핵산, 예를 들어 poly A+ RNA)로부터 수득되거나 화학적으로 합성될 수 있다. 이후, PCR에 의해 생성된 증폭된 핵산은 당해 분야에 널리 공지된 임의의 방법을 이용하여 복제 가능한 클로닝 벡터로 클로닝될 수 있다.
본 명세서에 기재된 TCR을 암호화하는 DNA는 예를 들어 TCR의 α 사슬 및/또는 β 사슬을 암호화하는 유전자에 특이적으로 결합할 수 있는 올리고뉴클레오타이드 프로브를 사용함으로써 종래의 절차를 이용하여 용이하게 단리되고 서열분석될 수 있다. T 림프구는 이러한 DNA의 소스로 작용할 수 있다. 단리되면, DNA는 발현 벡터에 배치될 수 있고, 이것은 이후 재조합 숙주 세포에서 TCR의 합성을 얻기 위해 숙주 세포, 예컨대 이, 콜라이 세포, 유인원 COS 세포, 중국 햄스터 난소(CHO) 세포(예를 들어, CHO GS System(상표명)(Lonza)로부터의 CHO 세포), 또는 달리 TCR 단백질을 생성하는 골수종 세포로 형질주입된다.
전체 TCR을 생성하기 위해, Vα 또는 Vβ 뉴클레오타이드 서열, 제한 부위 및 제한 부위를 보호하기 위한 플랭킹 서열을 포함하는 PCR 프라이머는 예를 들어 개별 Vα 또는 Vβ 뉴클레오타이드 서열의 클론, 또는 가요성 링커에 의해 부착된 TCR의 가변 영역을 함유하는 단일 사슬 TCR의 클론과 같은 클론으로 Vα 또는 Vβ 서열을 증폭시키도록 사용될 수 있다. 당업자에게 공지된 클로닝 기법을 이용하여, PCR 증폭된 Vα 도메인은 α 사슬 불변 영역을 발현하는 벡터로 클로닝될 수 있고, PCR 증폭된 Vβ 도메인은 β 사슬 불변 영역을 발현하는 벡터로 클로닝될 수 있다. 소정의 실시형태에서, Vα 또는 Vβ 도메인을 발현시키기 위한 벡터는 EF-1α 촉진자, 분비 신호, 가변 영역에 대한 클로닝 부위, 불변 도메인 및 선택 마커, 예컨대 네오마이신을 포함한다. 이후, α 사슬 및 β 사슬 벡터는 당업자에게 공지된 기법을 이용하여 전체 TCR을 발현하는 안정한 또는 일시적인 세포주를 생성하도록 동시에 또는 순차적으로 세포주로 동시형질주입된다. Vα 또는 Vβ 도메인은 또한 필요한 불변 영역을 발현하는 벡터로 클로닝될 수 있다. 이후, 벡터는 당업자에게 공지된 기법을 이용하여 전체 TCR을 발현하는 안정한 또는 일시적인 세포주를 생성하도록 세포주로 형질주입된다.
DNA는 또한 예를 들어 쥣과 서열 대신에 인간 α 사슬 및 β 사슬 불변 도메인에 대한 암호화 서열을 치환함으로써 또는 TCR 암호화 서열에 비-TCR 폴리펩타이드에 대한 암호화 서열의 모두 또는 일부를 공유로 연결함으로써 변형될 수 있다.
본 명세서에 기재된 TCR을 암호화하는 폴리뉴클레오타이드에 높은, 중간 또는 낮은 엄격성 혼성화 조건 하에 혼성화하는 폴리뉴클레오타이드가 또한 제공된다. 구체적인 실시형태에서, 본 명세서에 기재된 폴리뉴클레오타이드는 본 명세서에 제공된 Vα 도메인 및/또는 Vβ 도메인을 암호화하는 폴리뉴클레오타이드에 높은, 중간 또는 낮은 엄격성 혼성화 조건 하에 혼성화한다.
혼성화 조건은 당해 분야에 기재되어 있고, 당업자에게 공지되어 있다. 예를 들어, 엄격한 조건 하의 혼성화는 약 45℃에서의 6x 염화나트륨/시트르산나트륨(SSC) 중의 필터 결합된 DNA에 대한 혼성화, 이어서 약 50 내지 65℃에서의 0.2x SSC/0.1% SDS 중의 하나 이상의 세척을 수반할 수 있고; 고도로 엄격한 조건 하의 혼성화는 약 45℃에서의 6x SSC 중의 필터 결합된 핵산에 대한 혼성화, 이어서 약 68℃에서의 0.1x SSC/0.2% SDS 중의 하나 이상의 세척을 수반할 수 있다. 다른 엄격한 혼성화 조건 하의 혼성화는 당업자에게 공지되어 있고, 예를 들어 문헌[Ausubel FM et al., eds., (1989) Current Protocols in Molecular Biology, Vol. I, Green Publishing Associates, Inc. 및 John Wiley & Sons, Inc., New York, 페이지 6.3.1 내지 6.3.6 및 2.10.3]에 기재되어 있다
소정의 양태에서, NY-ESO-1 펩타이드, 및 관련된 폴리뉴클레오타이드에 결합하는 본 명세서에 기재된 TCR을 (예를 들어, 재조합으로) 발현하는 세포(예를 들어, 숙주 세포) 및 발현 벡터가 본 명세서에 제공된다. 숙주 세포, 예를 들어 포유류 세포에서 재조합 발현을 위해 이러한 TCR을 암호화하는 뉴클레오타이드 서열을 포함하는 폴리뉴클레오타이드를 포함하는 벡터(예를 들어, 발현 벡터)가 본 명세서에 제공된다. 본 명세서에 기재된 TCR(예를 들어, 인간 또는 인간화된 TCR)을 재조합으로 발현하기 위한 이러한 벡터를 포함하는 숙주 세포가 본 명세서에 또한 제공된다. 특정한 양태에서, 숙주 세포로부터 이러한 TCR을 발현하는 것을 포함하는, 본 명세서에 기재된 TCR을 제조하는 방법이 본 명세서에 제공된다.
또 다른 양태에서, 본 명세서에 기재된 바대로 조작된 세포(예를 들어, 비상동성 및/또는 재조합 핵산을 포함하는 세포)를 제조하는 방법이 본 명세서에 제공된다. 소정의 실시형태에서, 상기 방법은 세포로의 벡터의 도입을 허용하는 조건 하에 본 명세서에 기재된 바대로 세포를 벡터와 접촉시키는 것을 포함한다. 소정의 실시형태에서, 조건은 (예를 들어, 리포솜 또는 전기천공에 의한) 벡터에 의한 세포의 형질주입을 허용한다. 일 실시형태에서, 조건은 전기천공에 의한 mRNA 벡터에 의한 세포의 형질주입을 허용한다. 소정의 실시형태에서, 벡터는 바이러스 벡터이고, 조건은 바이러스 벡터에 의한 세포의 형질도입을 허용한다. 소정의 실시형태에서, 벡터는 시험관내 또는 생체외 세포로 도입된다. 소정의 실시형태에서, 벡터는 생체내 세포로 도입된다.
NY-ESO-1 펩타이드에 결합하는 본 명세서에 기재된 TCR(예를 들어, 본 명세서에 기재된 전장 TCR, TCR의 α 사슬 및/또는 β 사슬 또는 단일 사슬 TCR)의 재조합 발현은 TCR을 암호화하는 폴리뉴클레오타이드를 함유하는 발현 벡터의 작제를 수반한다. 본 명세서에 기재된 TCR을 암호화하는 폴리뉴클레오타이드가 수득되면, TCR 분자의 제조를 위한 벡터는 당해 분야에 널리 공지된 기법을 이용하여 재조합 DNA 기술에 의해 제조될 수 있다. 따라서, 뉴클레오타이드 서열을 암호화하는 TCR을 함유하는 폴리뉴클레오타이드를 발현시킴으로써 단백질을 제조하는 방법은 본 명세서에 기재되어 있다. 당업자에게 널리 공지된 방법은 TCR 암호화 서열 및 적절한 전사 및 번역 제어 신호를 함유하는 발현 벡터를 작제하도록 사용될 수 있다. 이들 방법은 예를 들어 시험관내 재조합 DNA 기법, 합성 기법 및 생체내 유전자 재조합을 포함한다. 촉진자에 작동 가능하게 연결된 본 명세서에 기재된 TCR 분자(예를 들어, 전장 TCR, TCR의 α 사슬 또는 β 사슬, TCR의 Vα 또는 Vβ, 또는 α 또는 β 사슬 CDR)를 암호화하는 뉴클레오타이드 서열을 포함하는 복제 가능한 벡터가 또한 제공된다.
벡터는 부분적으로 천연 소스로부터 단일 가닥화 또는 이중 가닥화, 합성되거나 수득되고, 천연, 비천연 또는 변경된 뉴클레오타이드를 함유할 수 있는 임의의 유형의 뉴클레오타이드(DNA 및 RNA를 포함하지만, 이들로 제한되지는 않음)를 포함할 수 있다. 재조합 발현 벡터는 천연 발생 또는 비천연 발생 뉴클레오타이드간 연결 또는 연결의 유형 둘 다를 포함할 수 있다. 일 실시형태에서, 비천연 발생 또는 변경된 뉴클레오타이드 또는 뉴클레오타이드간 연결은 벡터의 전사 또는 복제를 방해하지 않는다. 발현 벡터는 바이러스 벡터(예를 들어, 레트로바이러스 벡터, 아데노바이러스 벡터, 아데노 연관된 바이러스 벡터 또는 바큘로바이러스 벡터)일 수 있다. 소정의 실시형태에서, 레트로바이러스 벡터는 렌티바이러스 벡터(예를 들어, HIV-1 게놈의 유전자 요소를 포함하는 벡터) 또는 말 전염성 빈혈 바이러스 벡터이다. 소정의 실시형태에서, 벡터는 바이러스 입자를 제공하도록 하나 이상의 바이러스 캡시드 단백질과 패키징된다.
발현 벡터는 종래의 기법에 의해 세포(예를 들어, 숙주 세포)로 이동될 수 있고, 생성된 세포는 이후 본 명세서에 기재된 TCR을 제조하도록 종래의 기법에 의해 배양될 수 있다. 따라서, 숙주 세포에서의 이러한 서열의 발현을 위해 촉진자에 작동 가능하게 연결된 본 명세서에 기재된 TCR 분자(예를 들어, 전장 TCR, TCR의 α 사슬 또는 β 사슬, TCR의 Vα 또는 Vβ, 또는 α 또는 β 사슬 CDR)를 암호화하는 폴리뉴클레오타이드를 함유하는 숙주 세포가 본 명세서에 제공된다. 소정의 실시형태에서, 이중 가닥 TCR의 발현을 위해, α 사슬 및 β 사슬 둘 다를 암호화하는 벡터는 개별적으로 하기에 기재된 바대로 전체 TCR 분자의 발현을 위해 숙주 세포에서 동시발현될 수 있다. 소정의 실시형태에서, 숙주 세포는 본 명세서에 기재된 TCR의 α 사슬 및 β 사슬 둘 다를 암호화하는 폴리뉴클레오타이드를 포함하는 벡터를 함유한다. 구체적인 실시형태에서, 숙주 세포는 2개의 상이한 벡터를 함유하고, 제1 벡터는 본 명세서에 기재된 TCR의 α 사슬 또는 α 사슬 가변 영역을 암호화하는 폴리뉴클레오타이드를 포함하고, 제2 벡터는 본 명세서에 기재된 TCR의 β 사슬 또는 β 사슬 가변 영역을 암호화하는 폴리뉴클레오타이드를 포함한다. 다른 실시형태에서, 제1 숙주 세포는 본 명세서에 기재된 TCR의 α 사슬 또는 α 사슬 가변 영역을 암호화하는 폴리뉴클레오타이드를 포함하는 제1 벡터를 포함하고, 제2 숙주 세포는 본 명세서에 기재된 TCR의 β 사슬 또는 β 사슬 가변 영역을 암호화하는 폴리뉴클레오타이드를 포함하는 제2 벡터를 포함한다. 구체적인 실시형태에서, 제2 세포에 의해 발현된 β 사슬 또는 β 사슬 가변 영역과 연관된 제1 세포에 의해 발현된 α 사슬 또는 α 사슬 가변 영역은 본 명세서에 기재된 TCR을 형성한다. 소정의 실시형태에서, 이러한 제1 숙주 세포 및 이러한 제2 숙주 세포를 포함하는 숙주 세포의 집단이 본 명세서에 제공된다.
특정한 실시형태에서, 본 명세서에 기재된 TCR의 α 사슬 또는 α 사슬 가변 영역을 암호화하는 폴리뉴클레오타이드를 포함하는 제1 벡터 및 본 명세서에 기재된 TCR의 β 사슬 또는 β 사슬 가변 영역을 암호화하는 폴리뉴클레오타이드를 포함하는 제2 벡터를 포함하는 벡터의 집단이 본 명세서에 제공된다.
다양한 숙주-발현 벡터 시스템은 본 명세서에 기재된 TCR 분자를 발현하도록 이용될 수 있다(예를 들어, 미국 특허 제5,807,715호 참조). 이러한 숙주-발현 시스템은 관심 대상의 암호화 서열이 제조되고 후속하여 정제될 수 있는 비히클을 나타내지만, 적절한 뉴클레오타이드 암호화 서열에 의해 형질전환 또는 형질주입될 때, 본 명세서에 기재된 TCR 분자를 인시츄로 발현할 수 있는 세포를 또한 나타낸다. 이것은 미생물, 예컨대 재조합 TCR 암호화 서열을 함유하는 박테리오파지 DNA, 플라스미드 DNA 또는 코스미드 DNA 발현 벡터에 의해 형질전환된 박테리아(예를 들어, 이. 콜라이(E. coli) 및 비. 서브틸리스(B. subtilis)); TCR 암호화 서열을 함유하는 재조합 효모 발현 벡터에 의해 형질전환된 효모(예를 들어, 사카로마이세스 피치아(Saccharomyces Pichia)); TCR 암호화 서열을 함유하는 재조합 바이러스 발현 벡터(예를 들어, 바큘로바이러스)에 의해 감염된 곤충 세포 시스템; 재조합 바이러스 발현 벡터(예를 들어, 꽃양배추 모자이크 바이러스, CaMV; 담배 모자이크 바이러스, TMV)에 의해 감염되거나 TCR 암호화 서열을 함유하는 재조합 플라스미드 발현 벡터(예를 들어, Ti 플라스미드)에 의해 형질전환된 식물 세포 시스템(예를 들어, 녹조류, 예컨대 클라미도모나스 레인하티(Chlamydomonas reinhardtii)); 또는 포유류 세포의 게놈(예를 들어, 메탈로티오네인 촉진자) 또는 포유류 바이러스(예를 들어, 아데노바이러스 후기 촉진자; 백시니아 바이러스 7.5K 촉진자)로부터 유래된 촉진자를 함유하는 재조합 발현 작제물을 보유하는 포유류 세포 시스템(예를 들어, COS(예를 들어, COS1 또는 COS), CHO, BHK, MDCK, HEK 293, NS0, PER.C6, VERO, CRL7O3O, HsS78Bst, HeLa, 및 NIH 3T3, HEK-293T, HepG2, SP210, R1.1, B-W, L-M, BSC1, BSC40, YB/20 및 BMT10 세포)를 포함하지만, 이들로 제한되지는 않는다. 구체적인 실시형태에서, 본 명세서에 기재된 TCR을 발현하기 위한 세포는 CHO 세포, 예를 들어 CHO GS System(상표명)(Lonza)로부터의 CHO 세포이다. 특정한 실시형태에서, 본 명세서에 기재된 TCR을 발현하기 위한 세포는 인간 세포, 예를 들어 인간 세포주이다. 구체적인 실시형태에서, 포유류 발현 벡터는 pOptiVEC(상표명) 또는 pcDNA3.3이다. 특정한 실시형태에서, 박테리아 세포, 예컨대 에스체리치아 콜라이 또는 진핵생물 세포(예를 들어, 포유류 세포)는 특히 전체 재조합 TCR 분자의 발현을 위해 재조합 TCR 분자의 발현에 사용된다. 인간 사이토메갈로바이러스로부터 주요 중간 초기 유전자 촉진자 요소와 같은 벡터와 함께 예를 들어, 포유류 세포, 예컨대 중국 햄스터 난소(CHO) 세포는 TCR에 대한 효과적인 발현 시스템이다(Foecking MK & Hofstetter H (1986) Gene 45: 101-5; 및 Cockett MI et al., (1990) Biotechnology 8(7): 662-7)). 소정의 실시형태에서, 본 명세서에 기재된 TCR은 CHO 세포 또는 NS0 세포에 의해 제조된다. 구체적인 실시형태에서, 본 명세서에 기재된 TCR을 암호화하는 뉴클레오타이드 서열의 발현은 구성적 촉진자, 유도성 촉진자 또는 조직 특이적 촉진자에 의해 조절된다.
소정의 실시형태에서, 포유류 숙주 세포는 림프구(예를 들어, 인간 림프구), 예컨대 T 세포 또는 자연 살해(NK) 세포이다. 소정의 실시형태에서, 림프구는 T 세포이다. 임의의 발생 단계에서의 임의의 T 세포는 본 명세서에 개시된 TCR을 발현하도록 사용될 수 있다. 예를 들어, 소정의 실시형태에서, T 세포는 CD8+ 세포독성 T 세포, CD4+ 세포독성 T 세포, CD4+ 헬퍼 T 세포(예를 들어, Th1 또는 Th2 세포), CD4/CD8 이중 양성 T 세포, 종양 침윤 T 세포, 흉선세포, 기억 T 세포, 미경험 T 세포 및 자연 살해 T 세포(예를 들어, 불변 자연 살해 T 세포)로 이루어진 군으로부터 선택된다. 세포 면역계의 전구체 세포(예를 들어, T 림프구의 전구체)는 이 세포가 효과기 세포로 분화하거나 발생하거나 성숙하므로 본 명세서에 개시된 TCR을 제시하는 데 또한 유용하다. 따라서, 소정의 실시형태에서, 포유류 숙주 세포는 다능성 줄기 세포(예를 들어, 배아 줄기 세포, 유도 다능성 줄기 세포), 림프구 선조 세포, 또는 조혈 줄기 세포(예를 들어, 골수, 제대혈 또는 말초 혈액으로부터 단리 및/또는 농후화됨)이다.
세포는 종양, 혈액, 골수, 림프절, 흉선 또는 또 다른 조직 또는 체액, 또는 성분채집술 생성물(이들로 제한되지는 않음)을 포함하는 많은 소스로부터 얻어질 수 있다. 소정의 실시형태에서, 세포는 대상체에 기능적 T 세포가 남는 치료 이후에 직접적으로 환자로부터 수득된다. 이와 관련하여, 소정의 암 치료 이후에, 면역계를 손상시키는 약물에 의한 특정한 치료에서, 치료 직후에 환자가 치료로부터 보통 회수할 때의 기간 동안, 수득된 T 세포의 품질은 생체외 증식하는 이의 능력에 대해 최적이거나 개선될 수 있다고 관찰된다. 마찬가지로, 본 명세서에 기재된 방법을 이용한 생체외 조작 이후에, 이 세포는 증대된 생착 및 생체내 증식을 위해 바람직한 상태에 있을 수 있다. 따라서, 소정의 실시형태에서, 세포는 이 회수 단계 동안 혈액, 골수, 림프절, 흉선 또는 또 다른 조직 또는 체액, 또는 성분채집술 생성물로부터 수집된다.
소정의 실시형태에서, 포유류 숙주 세포는 세포 표면에 본 명세서에 개시된 TCR을 제시하는 세포의 집단이다. 세포의 집단은 불균일 또는 균일할 수 있다. 소정의 실시형태에서, 집단의 적어도 50%(예를 들어, 적어도 60%, 70%, 80%, 90%, 95%, 99%, 99.5% 또는 99.9%)는 본 명세서에 기재된 바와 같은 세포이다. 소정의 실시형태에서, 집단은 실질적으로 순수하고, 여기서 집단의 적어도 50%(예를 들어, 적어도 60%, 70%, 80%, 90%, 95%, 99%, 99.5% 또는 99.9%)는 균일하다. 소정의 실시형태에서, 집단은 불균일하고, 세포의 혼합된 집단을 포함한다(예를 들어, 세포는 상이한 세포 유형, 발생 단계, 기원을 갖고, 상이한 방법에 의해 단리되거나, 정제되거나, 농후화되고, 상이한 물질에 의해 자극되고/되거나, 상이한 방법에 의해 조작됨). 소정의 실시형태에서, 세포는 말초 혈액 단핵 세포(PBMC)(예를 들어, 인간 PBMC)의 집단이다.
박테리아 시스템에서, 다수의 발현 벡터는 유리하게는 발현되는 TCR 분자에 대해 의도된 용도에 따라 선택될 수 있다. 예를 들어, 많은 분량의 이러한 TCR이 제조되어야 할 때, TCR 분자의 약제학적 조성물의 생성을 위해, 용이하게 정제된 융합 단백질 생성물의 높은 수준의 발현을 지시하는 벡터가 바람직할 수 있다. 이러한 벡터는 TCR 암호화 서열이 lac Z 암호화 영역과 프레임내 벡터로 개별적으로 결찰될 수 있어서 융합 단백질이 제조되는 이. 콜라이 발현 벡터 pUR278(Ruether U & Mueller-Hill B (1983) EMBO J 2: 1791-1794); pIN 벡터(Inouye S & Inouye M (1985) Nuc Acids Res 13: 3101-3109; Van Heeke G & Schuster SM (1989) J Biol Chem 24: 5503-5509) 등을 포함하지만, 이들로 제한되지는 않는다. 예를 들어, pGEX 벡터는 글루타티온 5-전환효소(GST)와의 융합 단백질로서 외래 폴리펩타이드를 발현하도록 또한 사용될 수 있다. 일반적으로, 이러한 융합 단백질은 가용성이고, 매트릭스 글루타티온 아가로스 비드에 대한 흡착 및 결합, 이어서 유리 글루타티온의 존재 하의 용리에 의해 용해된 세포로부터 용이하게 정제될 수 있다. pGEX 벡터는 트롬빈 또는 Xa 인자 프로테아제 절단 부위를 포함하도록 설계되어서, 클로닝된 표적 유전자 생성물은 GST 모이어티로부터 방출될 수 있다.
곤충 시스템에서, 아우토그라파 칼리포르니카(Autographa californica) 핵 다면체형성 바이러스(AcNPV)는 예를 들어 외래 유전자로부터 발현하도록 벡터로서 사용될 수 있다. 바이러스는 스포돕테라 프루지페르다(Spodoptera frugiperda) 세포에서 성장한다. TCR 암호화 서열은 바이러스의 비필수 영역(예를 들어, 폴리헤드린 유전자)으로 개별적으로 클로닝되고, AcNPV 촉진자(예를 들어, 폴리헤드린 촉진자)의 제어 하에 배치될 수 있다.
포유류 숙주 세포에서, 다수의 바이러스 기반 발현 시스템이 이용될 수 있다. 아데노바이러스가 발현 벡터로서 사용되는 경우에, 관심 대상의 서열을 암호화하는 TCR은 아데노바이러스 전사/번역 제어 복합체, 예를 들어 후기 촉진자 및 삼심열 리더 서열에 결찰될 수 있다. 이 키메라 유전자는 이후 시험관내 또는 생체내 재조합에 의해 아데노바이러스 게놈에서 삽입될 수 있다. 바이러스 게놈의 비필수 영역(예를 들어, 영역 El 또는 E3)에서의 삽입은 생존가능하고 감염된 숙주에서 TCR 분자를 발현할 수 있는 재조합 바이러스를 생성시킬 것이다(예를 들어, 문헌[Logan J & Shenk T (1984) PNAS 81(12): 3655-9] 참조). 특정한 개시 신호는 삽입된 TCR 암호화 서열의 효율적인 번역에 또한 필요할 수 있다. 이 신호는 ATG 개시 코돈 및 인접한 서열을 포함한다. 더욱이, 개시 코돈은 전체 삽입체의 번역을 보장하도록 원하는 암호화 서열의 리딩 프레임과 동상(in phase)으로 있어야 한다. 이 외인성 번역 제어 신호 및 개시 코돈은 천연 및 합성 둘 다의 다양한 기원일 수 있다. 발현의 효율은 적절한 전사 인핸서 요소, 전사 종결자 등의 포함에 의해 증대될 수 있다. (예를 들어, 문헌[Bitter G et al., (1987) Methods Enzymol. 153: 516-544] 참조).
또한, 삽입된 서열의 발현을 조정하거나, 원하는 특정한 방식으로 유전자 생성물을 변형시키고 처리하는, 숙주 세포 균주가 선택될 수 있다. 단백질 생성물의 이러한 변형(예를 들어, 글라이코실화) 및 처리(예를 들어, 절단)는 단백질의 융합에 중요할 수 있다. 상이한 숙주 세포는 단백질 및 유전자 생성물의 번역 후 처리 및 변형에 대한 특징 및 특정한 기전을 갖는다. 적절한 세포주 또는 숙주 시스템은 발현되는 외래 단백질의 정확한 변형 및 처리를 보장하도록 선택될 수 있다. 이를 위해, 1차 전사체의 적절한 처리, 유전자 생성물의 글라이코실화 및 포스포릴화에 대한 세포 기계를 보유하는 진핵생물 숙주 세포를 사용할 수 있다. 이러한 포유류 숙주 세포는 CHO, VERO, BHK, Hela, MDCK, HEK 293, NIH 3T3, W138, BT483, Hs578T, HTB2, BT2O 및 T47D, NS0(임의의 면역글로불린 사슬을 내인성으로 제조하지 않는 쥣과 골수종 세포주), CRL7O3O, COS(예를 들어, COS1 또는 COS), PER.C6, VERO, HsS78Bst, HEK-293T, HepG2, SP210, R1.1, B-W, L-M, BSC1, BSC40, YB/20, BMT10 및 HsS78Bst 세포를 포함하지만, 이들로 제한되지는 않는다. 소정의 실시형태에서, 본 명세서에 기재된 TCR 분자는 포유류 세포, 예컨대 CHO 세포에서 제조된다.
재조합 TCR의 장기간 발현을 위해, 안정한 발현 세포가 생성될 수 있다. 예를 들어, 본 명세서에 기재된 TCR을 안정하게 발현하는 세포주가 조작될 수 있다. 구체적인 실시형태에서, 본 명세서에 제공된 세포는 본 명세서에 기재된 TCR을 형성하도록 회합하는 α 사슬 또는 α 사슬 가변 영역 및 β 사슬 또는 β 사슬 가변 영역을 안정하게 발현한다.
소정의 양태에서, 숙주 세포는 적절한 발현 제어 요소(예를 들어, 촉진자, 인핸서, 서열, 전사 종결자, 폴리아데닐화 부위 등) 및 선택 가능한 마커에 의해 제어되는 DNA에 의해 형질전환될 수 있다. 외래 DNA/폴리뉴클레오타이드의 도입 이후에, 조작된 세포는 농후화 배지에서 1일 내지 2일 동안 성장하도록 허용될 수 있고, 이후 선택적 배지로 전환된다. 재조합 플라스미드에서의 선택 가능한 마커는 선택에 내성을 부여하고, 세포가 염색체로 플라스미드를 안정하게 통합하고 병소를 형성하도록 성장하게 하여서, 이는 결국 클로닝되고 세포주로 증식될 수 있다. 이 방법은 유리하게는 본 명세서에 기재된 TCR을 발현하는 세포주를 조작하도록 사용될 수 있다. 이러한 조작된 세포주는 특히 TCR 분자와 직접적으로 또는 간접적으로 상호작용하는 조성물의 스크리닝 및 평가에서 유용할 수 있다.
각각 tk, hgprt 또는 aprT 세포에서 단순 포진 바이러스 타이미딘 키나제(Wigler M et al., (1977) Cell 11(1): 223-32), 하이폭산틴구아닌 포스포리보실전환효소(Szybalska EH & Szybalski W (1962) PNAS 48(12): 2026-2034) 및 아데닌 포스포리보실전환효소(Lowy I et al., (1980) Cell 22(3): 817-23)(이들은 각각 본 명세서에 그 전문이 참고로 포함됨) 유전자(이들로 제한되지는 않음)를 포함하는 다수의 선택 시스템을 이용할 수 있다. 또한, 대사길항물질 내성은 하기 유전자에 대한 선택의 기초로서 사용될 수 있다: 메토트렉세이트에 내성을 부여하는 dhfr(Wigler M et al., (1980) PNAS 77(6): 3567-70; O'Hare K et al., (1981) PNAS 78: 1527-31); 마이코페놀산에 내성을 부여하는 gpt(Mulligan RC & Berg P (1981) PNAS 78(4): 2072-6); 아미노글라이코사이드 G-418에 내성을 부여하는 neo(Wu GY & Wu CH (1991) Biotherapy 3: 87-95; Tolstoshev P (1993) Ann Rev Pharmacol Toxicol 32: 573-596; Mulligan RC (1993) Science 260: 926-932; 및 Morgan RA & Anderson WF (1993) Ann Rev Biochem 62: 191-217; Nabel GJ & Felgner PL (1993) Trends Biotechnol 11(5): 211-5); 및 하이그로마이신에 내성을 부여하는 hygro(Santerre RF et al., (1984) Gene 30(1-3): 147-56)(이들은 각각 본 명세서에 그 전문이 참고로 포함됨). 재조합 DNA 기술의 분야에 흔히 공지된 방법은 원하는 재조합 클론을 선택하도록 일상적으로 적용될 수 있고, 이러한 방법은 예를 들어 문헌[Ausubel FM et al., (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, NY (1993); Kriegler M, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY (1990); 및 Chapters 12 and 13, Dracopoli NC et al., (eds.), Current Protocols in Human Genetics, John Wiley & Sons, NY (1994); Colbere-Garapin F et al., (1981) J Mol Biol 150: 1-14](본 명세서에서 그 전문이 참고로 포함됨)에 기재되어 있다.
TCR 분자의 발현 수준은 벡터 증폭에 의해 증가될 수 있다(검토를 위해, 문헌[Bebbington CR & Hentschel CCG, The use of vectors based on gene amplification for the expression of cloned genes in mammalian cells in DNA cloning, Vol. 3(Academic Press, New York, 1987)](본 명세서에 그 전문이 참고로 포함됨)을 참조한다). TCR을 발현하는 벡터 시스템에서의 마커가 증폭 가능할 때, 숙주 세포의 배양에 존재하는 저해제의 수준의 증가는 마커 유전자의 카피의 증가된 수를 갖는 숙주 세포의 선택을 발생시킬 것이다. 이러한 증폭된 영역은 TCR 유전자와 연관되고, TCR의 제조는 또한 증가할 것이다(Crouse GF et al., (1983) Mol Cell Biol 3: 257-66(본 명세서에 그 전문이 참고로 포함됨)).
다른 양태에서, 숙주 세포는 본 명세서에 기재된 바대로 TCR을 암호화하는 서열을 포함하는 바이러스 벡터(예를 들어, 레트로바이러스 벡터, 아데노바이러스 벡터, 아데노 연관된 바이러스 벡터 또는 바큘로바이러스 벡터)에 의해 형질도입될 수 있다. 소정의 실시형태에서, 레트로바이러스 벡터는 렌티바이러스 벡터(예를 들어, HIV-1 게놈의 유전 요소를 포함하는 벡터) 또는 말 감염성 빈혈 바이러스 벡터이다. 소정의 실시형태에서, 벡터는 바이러스 입자를 제공하도록 하나 이상의 바이러스 캡시드 단백질과 패키징된다.
소정의 실시형태에서, 벡터는 본 명세서에 기재된 바대로 TCR을 암호화하는 서열에 작동 가능하게 연결된 전사 및/또는 번역 제어 서열(예를 들어, 촉진자, 인핸서, 및/또는 Kozak 서열)을 추가로 포함한다. 대안적으로, TCR을 암호화하는 서열은 전사 및/또는 번역 제어 서열(예를 들어, 촉진자, 인핸서, 및/또는 Kozak 서열)에 작동 가능하게 연결되지 않을 수 있지만, 숙주 세포 게놈의 유전좌위를 플랭킹하는 서열에 상동성인 서열에 의해 플랭킹되고, 여기서 TCR 암호화 서열의 통합은 게놈 유전좌위에서의 또는 그 근처에서의 전사 및/또는 번역 제어 서열로부터의 암호화된 TCR의 발현을 허용한다.
숙주 세포는 본 명세서에 기재된 2개 이상의 발현 벡터와 동시전달(예를 들어, 동시형질주입 또는 동시형질도입)될 수 있고, 제1 벡터는 α 사슬 유래 폴리펩타이드를 암호화하고, 제2 벡터는 β 사슬 유래 폴리펩타이드를 암호화한다. 2개의 벡터는 α 사슬 및 β 사슬 폴리펩타이드의 동일한 발현이 가능하게 하는 동일한 선택 가능한 마커를 함유할 수 있다. 숙주 세포는 상이한 양의 2개 이상의 발현 벡터에 의해 동시전달될 수 있다. 예를 들어, 숙주 세포는 제1 발현 벡터 및 제2 발현 벡터의 하기 비율 중 임의의 하나에 의해 동시전달될 수 있다: 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, 1:12, 1:15, 1:20, 1:25, 1:30, 1:35, 1:40, 1:45 또는 1:50. 몇몇 실시형태에서, α 사슬 및 β 사슬에 대한 암호화 서열은 DNA이다. 몇몇 실시형태에서, α 사슬 및 β 사슬에 대한 암호화 서열은 RNA이다.
대안적으로, α 사슬 및 β 사슬 폴리펩타이드 둘 다를 암호화하고 발현할 수 있는 단일 벡터를 사용할 수 있다. α 사슬 및 β 사슬에 대한 암호화 서열은 cDNA 또는 게놈 DNA를 포함할 수 있다. 발현 벡터는 모노시스트론성 또는 다중시스트론성일 수 있다. 다중시스트론성 핵산 작제물은 2개, 3개, 4개, 5개, 6개, 7개, 8개, 9개, 10개 또는 이것 초과, 또는 2개 내지 5개, 5개 내지 10개 또는 10개 내지 20개의 범위의 유전자/뉴클레오타이드 서열을 암호화할 수 있다. 예를 들어, 이중시스트론성 핵산 작제물은 하기 순서로 촉진자, 제1 유전자(예를 들어, 본 명세서에 기재된 TCR의 β 사슬), 및 제2 유전자(예를 들어, 본 명세서에 기재된 TCR의 α 사슬)를 포함할 수 있다. 이러한 발현 벡터에서, 유전자 둘 다의 전사는 촉진자에 의해 추진될 수 있는 한편, 제1 유전자로부터의 mRNA의 번역은 캡 의존적 스캐닝 기전에 의해 개시될 수 있고, 제2 유전자로부터의 mRNA의 번역은 캡 독립적 기전에 의해, 예를 들어 IRES에 의해 개시될 수 있다. 대안적으로, 2개의 유전자는 자가 절단 펩타이드(예를 들어, 2A 펩타이드) 또는 세포내 또는 세포외 프로테아제에 의해 인식된 펩타이드 서열에 의해 작동 가능하게 연결될 수 있다.
본 명세서에 기재된 TCR 분자가 재조합 발현에 의해 제조되면, 이것은 면역글로불린 분자의 정제를 위한 당해 분야에 공지된 임의의 방법에 의해, 예를 들어 크로마토그래피(예를 들어, 이온 교환, 친화도 및 사이징 칼럼 크로마토그래피), 원심분리, 차등 용해도에 의해 또는 단백질의 정제를 위한 임의의 다른 표준 기법에 의해 정제될 수 있다. 추가로, 본 명세서에 기재된 TCR은 정제를 수월하게 하도록 본 명세서에 기재된 또는 달리 당해 분야에 공지된 비상동성 폴리펩타이드 서열에 융합될 수 있다.
구체적인 실시형태에서, 본 명세서에 기재된 TCR은 단리되거나 정제된다. 일반적으로, 단리된 TCR은 단리된 TCR보다 상이한 항원 특이성으로 다른 TCR이 실질적으로 없는 것이다. 예를 들어, 특정한 실시형태에서, 본 명세서에 기재된 TCR의 조제는 세포 재료 및/또는 화학 전구체가 실질적으로 없다. 언어 "세포 재료가 실질적으로 없다"는, TCR이 이것이 단리되거나 재조합으로 제조된 세포의 세포 성분으로부터 분리된, TCR의 조제를 포함한다. 따라서, 세포 재료가 실질적으로 없는 TCR은 비상동성 단백질(본 명세서에서 "오염 단백질"이라고도 칭함)의 약 30% 미만, 20%, 10%, 5%, 2%, 1%, 0.5% 또는 0.1%(건조 중량 기준)를 갖는 TCR 및/또는 TCR의 변이체, 예를 들어 TCR의 상이한 번역 후 변형된 형태 또는 TCR의 다른 상이한 버전(예를 들어, 이의 단편)의 조제를 포함한다. TCR이 재조합으로 제조될 때, 이것은 또한 일반적으로 배양 배지가 실질적으로 없고, 즉 배양 배지는 단백질 조제의 용적의 약 20% 미만, 10%, 2%, 1%, 0.5% 또는 0.1%를 나타낸다. TCR이 화학 합성에 의해 제조될 때, 이것은 일반적으로 화학 전구체 또는 다른 화학물질이 실질적으로 없고, 즉 이것은 TCR의 합성에 관여된 화학 전구체 또는 다른 화학물질로부터 분리된다. 따라서, TCR의 이러한 조제는 관심 대상의 TCR 이외의 화학 전구체 또는 화합물의 약 30% 미만, 20%, 10% 또는 5%(건조 중량 기준)를 갖는다. 구체적인 실시형태에서, 본 명세서에 기재된 TCR은 단리되거나 정제된다.
NY-ESO-1 펩타이드에 결합하는 TCR은 TCR의 합성에 대해 당해 분야에 공지된 임의의 방법에 의해, 예를 들어 화학 합성에 의해 또는 재조합 발현 기법에 의해 제조될 수 있다. 본 명세서에 기재된 방법은, 달리 표시되지 않는 한, 당해 분야의 기술 내의 분자 생물학, 미생물학, 유전자 분석, 재조합 DNA, 유기 화학, 생화학, PCR, 올리고뉴클레오타이드 합성 및 변형, 핵산 혼성화 및 관련 분야에서의 종래의 기법을 이용한다. 이 기법은 예를 들어 본 명세서에 인용된 문헌에 기재되어 있고, 문헌에 완전히 설명된다. 예를 들어, 문헌[Maniatis T et al., (1982) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press; Sambrook J et al., (1989), Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press; Sambrook J et al., (2001) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; Ausubel FM et al., Current Protocols in Molecular Biology, John Wiley & Sons (1987 및 연간 업데이트); Current Protocols in Immunology, John Wiley & Sons (1987 및 연간 업데이트) Gait (ed.) (1984) Oligonucleotide Synthesis: A Practical Approach, IRL Press; Eckstein (ed.) (1991) Oligonucleotides and Analogues: A Practical Approach, IRL Press; Birren B et al., (eds.) (1999) Genome Analysis: A Laboratory Manual, Cold Spring Harbor Laboratory Press](이들은 각각 본 명세서에 그 전문이 참고로 포함됨)을 참조한다.
구체적인 실시형태에서, 본 명세서에 기재된 TCR은 예를 들어 DNA 서열의 합성, 유전자 조작을 통한 생성을 수반하는 임의의 수단에 의해 제조, 발현, 생성 또는 단리된 TCR(예를 들어, 재조합 TCR)이다. 소정의 실시형태에서, 이러한 TCR은 생체내 동물 또는 포유류(예를 들어, 인간)의 TCR 생식선 레퍼토리 내에 자연에서 존재하지 않는, 서열(예를 들어, DNA 서열, RNA 서열 또는 아미노산 서열)을 포함한다.
일 양태에서, NY-ESO-1 펩타이드에 결합하는 TCR을 제조하는 방법이 본 명세서에 제공되고, 상기 방법은 본 명세서에 기재된 세포 또는 숙주 세포를 배양하는 단계를 포함한다. 소정의 양태에서, NY-ESO-1 펩타이드에 결합하는 TCR을 제조하는 방법이 본 명세서에 제공되고, 상기 방법은 본 명세서에 기재된 세포 또는 숙주 세포(예를 들어, 본 명세서에 기재된 TCR을 암호화하는 폴리뉴클레오타이드를 포함하는 세포 또는 숙주 세포)를 사용하여 TCR을 발현시키는(예를 들어, 재조합으로 발현시키는) 단계를 포함한다. 특정한 실시형태에서, 세포는 단리된 세포이다. 특정한 실시형태에서, 외인성 폴리뉴클레오타이드는 세포로 도입된다. 특정한 실시형태에서, 상기 방법은 세포 또는 숙주 세포로부터 얻은 TCR을 정제하는 단계를 추가로 포함한다.
본 명세서에 기재된 TCR은 당해 분야에 공지된 다양한 파지 디스플레이 방법을 이용하여 생성될 수 있다. 파지 디스플레이 방법에서, 기능적 TCR 도메인은 이를 암호화하는 폴리뉴클레오타이드 서열을 보유하는 파지 입자의 표면에 디스플레이된다. 특히, Vα 및 Vβ 도메인을 암호화하는 DNA 서열은 동물 cDNA 라이브러리(예를 들어, 이환된 조직의 인간 또는 쥣과 cDNA 라이브러리)로부터 증폭된다. Vα 및 Vβ 도메인을 암호화하는 DNA는 PCR에 의해 펩타이드 링커와 연결되고 파지미드 벡터로 클로닝된다. 벡터는 이. 콜라이에서 전기천공되고, 이. 콜라이는 헬퍼 파지에 의해 감염된다. 이 방법에서 사용된 파지는 통상적으로 fd 및 M13을 포함하는 섬질 파지이고, Vα 및 Vβ 도메인은 보통 파지 유전자 III 또는 유전자 VIII에 재조합으로 융합된다. 특정한 항원에 결합하는 항원 결합 도메인을 발현하는 파지는 예를 들어 세포의 표면에 디스플레이되거나 고체 표면 또는 비드에 포획된 이러한 복합체를 사용하여 펩타이드 또는 펩타이드-MHC 복합체에 의해 선택되거나 확인될 수 있다. 본 명세서에 기재된 TCR을 제조하기 위해 사용될 수 있는 파지 디스플레이 방법의 예는 문헌[Zhao Y et al., (2007) J Immunol 179: 5845-54](본 명세서에 그 전문이 참고로 포함됨)에 개시된 것을 포함한다.
상기 참고문헌에 기재된 바대로, 파지 선택 후, 파지로부터의 영역을 암호화하는 TCR은 인간 TCR을 포함하는 전체 TCR을 생성하도록 단리되고 사용되고, 예를 들어 하기에 기재된 바대로 포유류 세포, 곤충 세포, 식물 세포, 효모 및 박테리아를 포함하는 임의의 원하는 숙주에서 발현될 수 있다.
소정의 실시형태에서, 전체 TCR을 생성하기 위해, Vα 또는 Vβ 뉴클레오타이드 서열, 제한 부위 및 제한 부위를 보호하기 위한 플랭킹 서열을 포함하는 PCR 프라이머는 주형, 예를 들어 펩타이드 링커에 의해 연결된 TCR의 가변 영역을 함유하는 단일 사슬 TCR의 클론으로부터 Vα 또는 Vβ 서열을 증폭시키도록 사용될 수 있다. 당업자에게 공지된 클로닝 기법을 이용하여, PCR 증폭된 Vα 도메인은 Vα 불변 영역을 발현하는 벡터로 클로닝될 수 있고, PCR 증폭된 Vβ 도메인은 Vβ 불변 영역을 발현하는 벡터로 클로닝될 수 있다. 이후, α 사슬 및 β 사슬 벡터는 당업자에게 공지된 기법을 이용하여 전체 TCR을 발현하는 안정한 또는 일시적인 세포주를 생성하도록 동시에 또는 순차적으로 세포주로 동시형질주입된다. Vα 또는 Vβ 도메인은 필요한 불변 영역을 발현하는 하나의 벡터로 또한 클로닝될 수 있다. 이후, 벡터는 당업자에게 공지된 기법을 이용하여 전체 TCR을 발현하는 안정한 또는 일시적인 세포주를 생성하도록 세포주로 형질주입된다.
소정의 실시형태에서, 본 명세서에 기재된 바대로 TCR의 α 사슬 및 β 사슬을 암호화하는 폴리뉴클레오타이드로부터 또는 이를 포함하는 벡터로부터 전체 TCR을 생성하기 위해, TCR의 α 사슬 및 β 사슬을 포함하는 폴리펩타이드는 폴리뉴클레오타이드 또는 벡터로부터 발현된다. 폴리펩타이드는 선택적으로 단리되고/되거나, 정제된다. 폴리펩타이드는 퓨린 효소와 접촉한다. 소정의 실시형태에서, 퓨린 절단 부위가 RX1X2R(식 중, X1은 K 또는 R이고, X2는 K 또는 R임)의 아미노산 서열(서열 번호 31)을 갖는 경우에, 폴리펩타이드는 동시에 또는 후속하여 카복시펩티다제와 추가로 접촉하고, 여기서 카복시펩티다제는 폴리펩타이드의 C 말단으로부터 K 또는 R인 염기성 아미노산을 제거한다.
키메라 TCR은 TCR의 상이한 부분이 상이한 TCR 분자, 예를 들어 상이한 종으로부터의 TCR로부터 유래되는 분자이다.
특정한 실시형태에서, 본 명세서에 기재된 TCR로서 서열 번호 1 또는 2에 제시된 아미노산 서열을 포함하는 펩타이드의 동일한 에피토프에 결합하는, 본 명세서에 기재된 TCR은 인간 TCR이다. 인간 TCR은 당해 분야에 공지된 임의의 방법을 이용하여 제조될 수 있다. 예를 들어, 기능적 내인성 TCR을 발현할 수 없지만, 인간 TCR 유전자를 발현할 수 있는, 형질전환 마우스를 사용할 수 있다. 특히, 인간 α 사슬 및 β 사슬 TCR 유전자는 무작위로 또는 상동성 재조합에 의해 마우스 배아 줄기 세포로 도입될 수 있다. 마우스 α 사슬 및 β 사슬 TCR 유전자는 상동성 재조합에 의해 인간 TCR 유전좌위의 도입에 의해 별개로 또는 동시에 비기능적이 될 수 있다. 특히, JH 영역의 동형접합성 결실은 내인성 TCR 생성을 막는다. 변형된 배아 줄기 세포는 증식되고 배반포로 미량주사되어 키메라 마우스를 생산한다. 이후, 키메라 마우스는 사육되어 인간 TCR을 발현하는 동형접합성 자손을 생산한다. 형질전환 마우스는 선택된 항원, 예를 들어 항원(예를 들어, NY-ESO-1 펩타이드)의 전부 또는 일부와 일반 방식으로 면역화된다. 항원에 지향된 TCR을 포함하는 T 림프구는 면역화된 형질전환 마우스로부터 얻어질 수 있다. 형질전환 마우스가 보유한 인간 TCR 전이유전자는 T 세포 분화 동안 재배열한다. 따라서, 이러한 기법을 이용하여, 생체내 면역화로부터 생긴 치료학적으로 유용한 TCR을 제조할 수 있다.
NY-ESO-1 펩타이드에 결합하는 인간 TCR은 인간 TCR 서열로부터 유래된 TCR 라이브러리를 사용하여 파지 디스플레이 방법 또는 포유류 디스플레이를 포함하는 당해 분야에 공지된 다양한 방법에 의해 제조될 수 있다.
5.6
키트
본 명세서에 기재된 하나 이상의 TCR, 약제학적 조성물 또는 이의 접합체, 본 명세서에 기재된 하나 이상의 TCR을 암호화하는 폴리뉴클레오타이드(예를 들어, 발현 벡터) 또는 본 명세서에 기재된 하나 이상의 TCR을 발현하는 세포를 포함하는 키트가 또한 제공된다. 구체적인 실시형태에서, 본 명세서에 기재된 약제학적 조성물의 하나 이상의 성분, 예컨대 본 명세서에 제공된 하나 이상의 TCR, 폴리뉴클레오타이드 또는 세포에 의해 충전된 하나 이상의 용기를 포함하는 약제학적 팩 또는 키트가 본 명세서에 제공된다. 몇몇 실시형태에서, 키트는 본 명세서에 기재된 약제학적 조성물 및 임의의 예방제 또는 치료제, 예컨대 본 명세서에 기재된 것을 함유한다. 소정의 실시형태에서, 키트는 T 세포 미토겐, 예를 들어 피토헤마글루티닌(PHA) 및/또는 포르볼 12-미리스테이트 13-아세테이트(PMA), 또는 TCR 복합체 자극 항체, 예컨대 항-CD3 항체 및 항-CD28 항체 등을 함유할 수 있다. 의약품 또는 생물학적 제품의 제조, 사용 또는 판매를 규제하는 정부 기관이 규정한 형태의 통지가 이러한 용기(들)와 선택적으로 연관되고, 통지는 인간 투여에 대한 제조, 사용 또는 판매의 기관에 의한 승인을 반영한다.
상기 방법에서 사용될 수 있는 키트가 또한 제공된다. 일 실시형태에서, 키트는 하나 이상의 용기에서 본 명세서에 기재된 TCR, 예를 들어 정제된 TCR을 포함한다. 구체적인 실시형태에서, 본 명세서에 기재된 키트는 대조군 항원으로서 NY-ESO-1 펩타이드를 포함하는 실질적으로 단리된 펩타이드-MHC 복합체를 함유한다. 또 다른 구체적인 실시형태에서, 본 명세서에 기재된 키트는 NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체와 반응하지 않는 대조군 TCR을 추가로 포함한다. 또 다른 구체적인 실시형태에서, 본 명세서에 기재된 키트는 NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체에 대한 TCR의 결합을 검출하기 위한 하나 이상의 요소를 함유한다(예를 들어, TCR은 검출 가능한 기질, 예컨대 형광성 화합물, 효소 기질, 방사성 화합물 또는 발광성 화합물에 접합될 수 있거나, TCR을 인식하는 결합 분자는 검출 가능한 기질에 접합될 수 있다). 구체적인 실시형태에서, 본 명세서에 제공된 키트는 NY-ESO-1 펩타이드를 포함하는 재조합으로 제조된 또는 화학적으로 합성된 펩타이드-MHC 복합체를 포함할 수 있다. 키트에 제공된 NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체는 고체 지지체(예를 들어, 고체 표면 또는 비드)에 부착되거나, 지질 막(예를 들어, 리포솜 또는 고정된 세포)으로 통합될 수 있다. 더 구체적인 실시형태에서, 상기에 기재된 키트의 검출 수단은 NY-ESO-1 펩타이드를 포함하는 펩타이드-MHC 복합체가 부착되는 고체 지지체를 포함한다. 이러한 키트는 TCR을 인식하는 비부착된 리포터 표지된 결합 분자를 또한 포함할 수 있다. 이 실시형태에서, 펩타이드-MHC 복합체에 대한 TCR의 결합은 상기 리포터 표지된 결합 분자의 결합에 의해 검출될 수 있다.
6.
실시예
이 부문(즉, 6 부문)에서의 실시예는 제한이 아니라 예시의 방식으로 제공된다.
6.1
실시예
1: 쥣과 세포에서의
TCR18168c인
신규한
NY-
ESO
-1
TCR의
규명
SLLMWITQC(서열 번호 1)-HLA-A*0201에 결합하는 신규한 TCR은 독점적 포유류 세포 TCR 디스플레이 플랫폼을 이용하여 개발되었다. 본 명세서에서 TCR18168c라 칭하는 TCR은 각각 서열 번호 3 및 4에 제시된 아미노산 서열을 포함하는 α 사슬 가변 영역(Vα) 및 β 사슬 가변 영역(Vβ)을 포함한다. TCR18168c는 쥣과 세포주 AK-D10R3의 표면에서, 쥣과 불변 영역에 융합된 인간 가변 영역을 갖는, 키메라 단백질로서 발현되었다. 쥣과 불변 영역은 쥣과 CD3과의 적절한 앵커링 및 상호작용 및 쥣과 신호전달 경로의 적절한 촉발을 보장한다. AK-D10R3은 키메라 CD8을 발현하는 쥣과 흉선종 유래 마우스 TCR 음성, 마우스 CD8 음성 세포주(상응하는 마우스 CD8 α 및 β 막관통에 융합된 인간 CD8 α 및 β 세포외 영역 및 세포내 영역) 및 EGFP에 작동 가능하게 연결된 3개의 NFAT 결합 부위를 포함하는 최소 IL-2 촉진자를 포함하는 T 세포 활성화 리포터 작제물이다. TCR18168c는 각각 서열 번호 11 및 12에 제시된 아미노산 서열을 포함하는 α 사슬 및 β 사슬을 포함한다.
6.1.1
펩타이드
-
MHC
삼합체에
대한
TCR18168c를
발현하는 세포의 결합
처음에, TCR18168c를 발현하는 AK-D10R3 세포는 유세포분석법을 이용하여 동족 펩타이드-MHC 삼합체 또는 음성 대조군 펩타이드-MHC 삼합체에 대한 결합에 대해 시험되었다. 간단히, TCR18168c를 발현하는 AK-D10R3 세포는 96웰 검정 플레이트에서 플레이팅되고, APC 표지된 항-마우스 TCR β 사슬 항체(BD Biosciences, 카탈로그 553174호, 클론 H57-597) 및 야생형 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)(MBL, 카탈로그 T01064호), 앵커 최적화된 NY-ESO-1 펩타이드 SLLMWITQV(서열 번호 2)(MBL, 카탈로그 TS-M105-1호) 또는 음성 대조군 펩타이드가 로딩된 PE 표지된 HLA-A*0201 삼합체와 항온처리되었다. TCR 음성 AK-D10R3 세포는 대조군으로서 또한 시험되었다. 실온에서 30분 항온처리 이후에, 세포는 2회 세척되고, BD FACSCanto II 유세포분석기를 사용하여 유세포분석법에 분석되었다. 세포는 TCR 발현 (APC+) 및 펩타이드-MHC 결합 (PE+)에 대해 분석되었다.
도 1에 도시된 바대로, TCR18168c는, 세포 표면에서 발현될 때, 음성 대조군 삼합체가 아니라 야생형 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1) 또는 앵커 최적화된 펩타이드 SLLMWITQV(서열 번호 2)가 로딩된 HLA-A*0201 삼합체에 결합하였다.
6.1.2
펩타이드
펄스화된
T2 세포를 사용한
TCR
발현 AK-
D10R3
세포의 활성화
다음에, TCR18168c를 발현하는 AK-D10R3 세포는 동족 NY-ESO-1 펩타이드 또는 음성 대조군 펩타이드에 의해 펄스화된 T2 세포에 의해 활성화되는 이의 능력에 대해 시험되었다. 간단히, T2 세포(문헌[Salter, EMBO J. 1986; 5(5):943-9](본 명세서에서 그 전문이 참고로 포함됨)에 기재된 바와 같은 인간 림프아구 세포)는 37℃에서 3시간 동안 50㎍/㎖의 야생형 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)(P&E, 특별 주문), 앵커 최적화된 NY-ESO-1 펩타이드 SLLMWITQV(서열 번호 2)(IBA, 카탈로그 6-7013-901호) 또는 음성 대조군 펩타이드에 의해 펄스화되었다. 이후, 전체 5.0 x 104개의 TCR18168c를 발현하는 AK-D10R3 세포는 37℃ 및 10% CO2에서 18시간 동안 96웰 검정 플레이트에서 5.0 x 104개의 펩타이드 펄스화된 T2 세포와 항온처리되었다. TCR 음성 AK-D10R3 세포는 음성 대조군으로서 사용되었다. 이후, 세포는 실온에서 30분 동안 APC 표지된 항-마우스 TCR β 사슬 항체(BD Biosciences, 카탈로그 553174호, 클론 H57-597) 및 BV412 표지된 항-마우스 CD69 항체(Biolegend, 카탈로그 104528호, 클론 H1.2F)에 의해 염색되었다. 후속하여, 세포는 2회 세척되고, BD FACSCanto II 유세포분석기를 사용하여 유세포분석법에 의해 분석되었다. 세포는 TCR 발현 (APC+) 및 T 세포 활성화 (EGFP+ 또는 BV412+)에 대해 분석되었다.
야생형 또는 앵커 최적화된 NY-ESO-1 펩타이드에 의해 펄스화된 T2 세포와의 상호작용 시, TCR18168c를 발현하는 AK-D10R3 세포는 IL-2-NFAT 리포터 작제물의 활성화 및 T 세포 활성화 마커 CD69의 상향조절을 보여주었다(도 2). AK-D10R3 세포의 활성화는 NY-ESO-1 TCR과 이의 동족 펩타이드-MHC 복합체 사이의 상호작용에 의존하는데, 왜냐하면 TCR 음성 AK-D10R3 세포가 시험될 때 또는 TCR18168c를 발현하는 AK-D10R3 세포가 음성 대조군 펩타이드에 의해 펄스화된 T2 세포와 항온처리될 때 이러한 활성화가 관찰되지 않거나, 오직 최소 정도로 관찰되기 때문이다(도 2).
6.2
실시예
2: 인간 T 세포에서의
TCR18168인
신규한
NY-
ESO
-1
TCR의
규명
이 실시예에서, TCR18168 명칭의 TCR18168c의 완전 인간 버전은 1차 인간 T 세포 또는 인간 T 세포 리포터 세포주에서 발현되고, 하기에 기재된 바대로 다수의 기능적 검정에서 규명되었다. TCR18168은 인간 불변 영역에 융합된 TCR18168c의 Vα 및 Vβ를 포함한다. 구체적으로, TCR18168은 각각 서열 번호 13 및 14에 제시된 아미노산 서열을 포함하는 α 사슬 및 β 사슬을 포함한다. HLA-A*0201의 맥락에서 MART-1 펩타이드와 반응성인 TCR DMF4는 대조군으로서 사용되었다. DMF4는 미국 특허 제7,915,036호(본 명세서에서 그 전문이 참고로 포함됨)에 기재되어 있다. 전장 TCR DMF4는 각각 서열 번호 20 및 21에 제시된 아미노산 서열을 포함하는 α 사슬 및 β 사슬을 포함한다.
6.2.1
펩타이드
펄스화된
HLA
발현 K562 표적 세포와 공배양
된
TCR18168을
발현하는 1차 인간 T 세포의 규명
전장 인간 TCR TCR18168 및 DMF4에 대한 메신저 RNA(mRNA)는 mMESSAGE mMACHINE T7 Ultra 키트(Ambion, 카탈로그 AMB13455호)를 사용하여 시험관내 전사를 통해 생성되었다. TCR18168 mRNA는 순서대로 TCR18168 α 사슬, 퓨린 절단 부위, P2A 절단 부위 및 TCR18168 β 사슬을 암호화하는 벡터로부터 발현되었다. 생성된 TCR18168 mRNA는 서열 번호 28의 아미노산 서열을 암호화하는 폴리뉴클레오타이드 서열을 포함한다. DMF4 mRNA는 DMF4 β 사슬, P2A 절단 부위 및 DMF4 α 사슬을 암호화하는 벡터로부터 발현되었다. 건강한 도너로부터 단리되고 ImmunoCult(상표명) 인간 CD3/28 T cell Activator(Stemcell Technologies)에 의해 이전에 증식된 1차 인간 T 세포는 7.5㎍의 TCR mRNA와 혼합되고, MaxCyte GT(MaxCyte) 전기천공장치를 사용하여 전기천공되었다. 전기천공 후 대략 20시간에, 표적 TCR 발현은 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)(MBL, 카탈로그 T01064B호) 또는 MART-1 펩타이드 ELAGIGILTV(서열 번호 22)(MBL, 카탈로그 T01022호)를 함유하는 HLA-A*0201 삼합체에 의해 T 세포를 염색함으로써 평가되었고, BD LSR Fortessa를 사용하여 유세포분석법을 통해 분석되었다. 동시에, HLA-A2 또는 HLA-B7을 발현하도록 렌티바이러스로 형질도입된 K562 세포(ATCC, 카탈로그 CCL-243호)는 0.01, 0.1 또는 1μM의 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)(Genscript, 특별 주문), 1μM의 MART-1 펩타이드 ELAGIGILTV(서열 번호 22)(Genscript, 특별 주문), 또는 DMSO 단독(비히클 대조군)(Fisher Scientific, 카탈로그 BP231-100호)에 의해 펄스화되었다. TCR18168 발현 또는 DMF4 발현 T 세포는 16시간 동안 K562 표적 세포와 공배양되고, 항-인간 CD25 항체(eBioscience, 카탈로그 17-0259-42호)를 사용하여 유세포분석법에 의해 활성화 마커 CD25의 발현에 대해 분석되고, 인간 IFN 감마 ELISA Ready-Set-Go Kit(eBioscience, 카탈로그 88-7316-88)호를 사용하여 ELISA에 의해 IFNγ의 분비에 대해 분석되었다. 양성 대조군으로서, TCR18168 발현 또는 DMF4 발현 T 세포는 표적 세포의 부재 하에 16시간 동안 ImmunoCult(상표명) 인간 CD3/28 T cell Activator(Stemcell Technologies)를 사용하여 또한 활성화되고, 이후 유세포분석법을 이용하여 표면 CD25 발현에 대해 조사되었다.
TCR18168을 발현하는 인간 T 세포의 삼합체 염색은 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)를 함유하는 HLA-A*0201 삼합체에 대한 특이적 결합 및 음성 대조군 MART-1 펩타이드를 함유하는 HLA-A*0201 삼합체에 대한 최소 결합을 보여주었다(도 3a). 반대로, TCR DMF4를 발현하는 T 세포는 MART-1 펩타이드를 함유하는 HLA-A*0201 삼합체에 오직 결합하였다(도 3a).
NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)에 의해 펄스화된 HLA-A2 발현 K562 세포와의 공배양의 16시간 이후에, TCR18168을 발현하는 T 세포는 CD25 표면 발현(도 3b) 및 IFNγ 분비(도 3d)의 용량 의존적 상향조절을 나타냈다. NY-ESO-1 펩타이드의 부재 하에 NY-ESO-1 펩타이드가 로딩된 HLA-B7 발현 K562 세포 또는 HLA 발현 K562 세포와 공배양될 때, TCR18168 발현 T 세포는 CD25(도 3b) 또는 IFNγ(도 3d)의 상향조절을 나타내지 않았다. 비교하면, 특이성 대조군으로서, TCR DMF4를 발현하는 T 세포는 동족 MART-1 펩타이드에 의해 펄스화된 HLA-A2 발현 K562 세포와 공배양된 후에만 CD25 발현(도 3c) 및 IFNγ 분비(도 3e)의 증가를 나타냈다.
6.2.2
펩타이드
펄스화된
T2 표적 세포와 공배양
된
TCR18168을
발현하는 1차 인간 T 세포의 규명
다음에, (6.2.1 부문에 사용된 도너 세포와 다른) 건강한 도너로부터 단리되고 ImmunoCult(상표명) 인간 CD3/28 T cell Activator(Stemcell Technologies)에 의해 이전에 증식된 1차 인간 T 세포는 상기에 기재된 바대로 전기천공을 이용하여 인간 TCR18168 또는 DMF4를 발현하도록 형질주입되고, 내인성으로 HLA-A*0201을 발현하는 표적 세포로서 T2 세포를 사용하여 유사한 공배양 연구에서 분석되었다. 간단히, T2 세포(ATCC, 카탈로그 174xCEM.T2호)는 CellTrace(상표명) 바이올렛 염료(Thermo Fisher, 카탈로그 C34557호)에 의해 표지되고, 1μM의 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)(Genscript, 특별 주문), 1μM의 MART-1 펩타이드 ELAGIGILTV(서열 번호 22)(Genscript, 특별 주문), 또는 DMSO 단독(비히클 대조군)(Fisher Scientific, 카탈로그 BP231-100호)에 의해 펄스화되었다. TCR18168 발현 또는 DMF4 발현 T 세포는 16시간 동안 T2 표적 세포와 공배양되고, 이후 항-인간 CD25 항체(eBioscience, 카탈로그 17-0259-42호)를 사용하여 유세포분석법에 의해 CD25 표면 발현에 대해 분석되었다. 양성 대조군으로서, TCR18168 발현 또는 DMF4 발현 T 세포는 표적 세포의 부재 하에 16시간 동안 ImmunoCult(상표명) 인간 CD3/28 T cell Activator(Stemcell Technologies)를 사용하여 또한 활성화되고, 이후 유세포분석법을 이용하여 표면 CD25 발현에 대해 조사되었다. T2 표적 세포 사멸은 Zombie NIR 생/사 염료(Biolegend, 카탈로그 423105호)를 사용하여 생 T2 세포의 소실(즉, CellTrace(상표명) 바이올렛 염료 양성 세포의 소실)을 분석함으로써 측정되었다.
TCR18168을 발현하는 인간 T 세포는 동족 NY-ESO-1 펩타이드에 의해 펄스화된 T2 세포와의 공배양 후 또는 항-CD3/CD28 항체에 의한 자극 후CD25 표면 발현의 상향조절을 오직 나타냈다(도 4a). 또한, TCR18168 발현 T 세포는, CellTrace(상표명) 바이올렛 염료 양성 세포의 소실에 의해 측정된 바대로, DMSO 비히클 또는 MART-1 펩타이드에 의해 펄스화된 T2 세포가 아니라 동족 NY-ESO-1 펩타이드에 의해 펄스화된 T2 세포를 오직 사멸하였다(도 4c). 비교하면, TCR DMF4를 발현하는 T 세포는 동족 MART-1 펩타이드가 로딩된 T2 세포에 의해 오직 활성화되고(도 4b), 동족 MART-1 펩타이드가 로딩된 T2 세포를 오직 사멸하였다(도 4c).
6.2.3
NFAT
-
루시퍼라제
리포터 T 세포주를 사용한
TCR18168의
규명
TCRβ 음성 주르카트 세포(ATCC, 카탈로그 TIB-153호)는 NFAT 반응 요소 및 짧은 CMV 최소 촉진자의 제어 하에 (i) 루시퍼라제 리포터에 의해 렌티바이러스로 형질도입되고, (ii) TCR18168. B16-F10 세포(ATCC, 카탈로그 CRL-6475호)는 HLA-A*0201 분자의 α1 및 α2 도메인, 마우스 H-2Db 분자의 α3 도메인 및 인간 β2 마이크로글로불린을 포함하는 AAD를 발현하도록 렌티바이러스로 형질도입되고, 1nM 내지 1μM의 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)(Genscript, 특별 주문), 1μM의 MART-1 펩타이드 ELAGIGILTV(서열 번호 22)(Genscript, 특별 주문), 또는 DMSO(비히클 대조군)(Fisher Scientific, 카탈로그 BP231-100호)에 의해 펄스화되었다. TCR 발현 주르카트 리포터 세포는 16시간 동안 펩타이드 펄스화된 AAD 발현 B16 세포와 공배양되었다. 최대 NFAT 리포터 활성에 대한 양성 대조군으로서, TCR 발현 주르카트 리포터 세포는 또한 16시간 동안 PMA 및 이오노마이신(eBioscience, 카탈로그 00-4970호)을 함유하는 Cell Stimulation Cocktail에 의해 자극되었다. 루시퍼라제 리포터 활성은 Nano-Glo 루시퍼라제 검정 키트(Promega, 카탈로그 N1120호) 및 EnVision Multimode Plate Reader(Perkin Elmer)을 사용하여 측정되었다.
TCR18168을 발현하는 주르카트 리포터 세포는 DMSO 또는 MART-1 펩타이드에 의해 펄스화된 AAD 발현 B16 세포의 존재 하에 최소 루시퍼라제 리포터 활성을 나타냈다(도 5a). 그러나, 동족 NY-ESO-1 펩타이드에 의해 펄스화된 AAD 발현 B16 세포와 공배양될 때, TCR18168을 발현하는 주르카트 리포터 세포는 펩타이드 특이적(도 5a) 및 용량 의존적(도 5b) 활성화 반응을 나타냈다.
6.3
실시예
3:
TCR18168
돌연변이체의 제조 및 규명
이 실시예에서, TCR18168의 돌연변이체는 결합 및 T 세포 활성화에 대해 생성되고 규명되었다. 이 돌연변이체는 쥣과 불변 영역에 융합된 인간 가변 영역을 포함하는 키메라 TCR로서 또는 전체 인간 TCR로서 시험되었다.
6.3.1
TCR
β 사슬 지도된 선택 및/또는
NNK
CDR3
그래프팅을
이용한
TCR
스크리닝
간단히, 지도된 선택 스크리닝에서, TCR18168c의 β 사슬은 미경험 제대혈 유래된 α 사슬 라이브러리 또는 CDR3α에서 무작위화된 돌연변이를 갖는 TCR18168c의 α 사슬을 포함하는 2개의 α 사슬 라이브러리(하기에 기재된 α-NNK1 및 α-NNK2 라이브러리)에 대해 스크리닝하기 위한 가이드로서 사용되었다. TCR18168c β 사슬 및 α 사슬 라이브러리에 대한 발현 작제물은 T2/pMHC+ 세포의 존재 하에 pMHC 삼합체 결합 및 AK-D10R3 T 세포 활성화를 평가하도록 AK-D10R3 세포로 레트로바이러스로 형질도입되었다.
TCR18168c α 사슬 및 β 사슬의 CDR3 영역은 NNK CDR3 그래프팅에 의해 무작위화되었다. NNK 삼중항 코돈은 N: A/C/G/T 및 K: G/T 뉴클레오타이드로 이루어지고, 32개의 코돈을 갖는 모든 20개의 정규 아미노산의 커버링을 허용한다.
단일 가닥 NNK 올리고머의 2개 세트는 α 사슬 CDR3 및 β 사슬 CDR3 그래프팅에 사용되었다. 올리고머 라이브러리 α-NNK1 및 α-NNK2(Microsynth, 특별 주문)는 TCR18168c α 사슬 CDR3의 각각 잔기 RELYS(서열 번호 266) 및 GAGSY(서열 번호 267)를 무작위화하도록 사용되었다. 올리고머 라이브러리 β-NNK1 및 β-NNK2(Microsynth, 특별 주문)는 TCR18168c β 사슬 CDR3의 각각 잔기 GAGVT(서열 번호 268) 및 AGVTD(서열 번호 269)를 무작위화하도록 사용되었다. 표 9는 CDR3α 및 CDR3β 서열을 무작위화하도록 사용된 CDR3 NNK 뉴클레오타이드 올리고머의 서열을 제공한다. 단일 가닥 NNK CDR3 라이브러리 올리고머는 역가닥을 합성하고 이중 가닥 올리고머를 생성하도록 역 프라이밍 PCR 증폭으로 처리되었다.
스터퍼 서열에 의해 치환되는 α 및 β CDR3 영역을 제외하고, 전장 α 사슬 및 β 사슬 서열을 함유하는 레트로바이러스 발현 벡터는 스터퍼 서열을 절제하도록 분해되고, 후속하여 겔 정제되었다. 이후, 이중 가닥 CDR3α 및 CDR3β 라이브러리 올리고머는 분해되고 정제된 선형화된 벡터의 프레임워크 3과 프레임워크 4 사이에 결찰되어서 전장 TCR α 사슬 및 β 사슬 서열을 생성하였다.
재구성된 CDR3 무작위화된 TCR18168c 발현 작제물은 T2/pMHC+ 세포의 존재 하에 pMHC 삼합체 결합 및 세포 활성화를 평가하도록 AK-D10R3 세포로 레트로바이러스로 형질도입되었다.
전체 21개의 TCR18168c 돌연변이체는 지도된 선택 및/또는 NNK 돌연변이유발을 이용하여 확인되었다: TCR0001, TCR0009, TCR0011, TCR0013, TCR0015, TCR0017, TCR0019, TCR0021, TCR0023, TCR0027, TCR0029, TCR0031, TCR0033, TCR0035, TCR0037, TCR0049, TCR0059, TCR0061, TCR0065, TCR0067 및 TCR0069. 표 4는 이 키메라 TCR의 가변 영역 및 이의 인간 대응물의 서열 정보를 제공한다.
6.3.2
TCR
발현 AK-
D10R3
세포에 대한 NY-
ESO
-1
pMHC
삼합체의
결합
NY-ESO-1-표적화 키메라 TCR TCR18168c, TCR0001, TCR0009, TCR0011, TCR0013, TCR0015, TCR0017, TCR0019, TCR0021, TCR0023, TCR0027, TCR0029, TCR0031, TCR0033, TCR0035, TCR0037, TCR0049, TCR0059, TCR0061, TCR0065, TCR0067 또는 TCR0069를 발현하는 AK-D10R3 세포는 SF-IMDM 배지(BioConcept 카탈로그 1-28S07-1호)를 사용하여 10% CO2 분위기 중에 37℃에서 3일 동안 증식되었다. SSX-2에 결합하는 기준 TCR을 발현하는 AK-D10R3 세포 또는 TCR 음성 AK-D10R3 세포는 대조군으로서 사용되었다. 1.0 x 105개의 세포는 96웰 검정 플레이트의 각각의 웰에서 플레이팅되고, 5분 동안 300 x g 및 4℃에서 원심분리되고, 200㎕의 검정 완충제(2% FCS가 보충된 1x PBS)를 사용하여 2회 세척되고, 1.0 x 105개의 세포/100㎕의 농도로 검정 완충제 중에 재현탁되었다. 염색을 위해, 20㎕의 항-마우스 TCR β-사슬-APC 항체의 스톡 용액(BD, 카탈로그 553174호, 클론 H57-597)(1:500) 및 야생형 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1, 인하우스로 제조)(1:250)가 로딩된 PE 표지된 HLA-A*0201 삼합체를 각각의 웰에서 첨가하였다. 실온에서 30분 항온처리 이후에, 세포는 상기에 기재된 바대로 2회 세척되고, BD FACSCanto II 유세포분석기를 사용하여 유세포분석법에 의해 분석되었다. 세포는 pMHC 결합 (PE+)에 대해 TCR 발현 (APC+)에 대해 게이팅되었다. FlowJo 소프트웨어 점도표가 생성되고, TCR+ pMHC+ 세포의 백분율(%)은 결정되었다.
도 6에 도시된 바대로, 시험된 TCR18168c 및 각각의 TCR18168c 돌연변이체는 야생형 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)에 의해 로딩된 HLA-A*0201 삼합체에 결합하였다.
6.3.3 NY-
ESO
-1+ T2 세포에 의한
TCR
발현 AK-
D10R3
세포의 활성화
IL-2-(NFAT)3-EGFP 리포터 작제물 및 NY-ESO-1 표적화 키메라 TCR TCR18168c, TCR0001, TCR0009, TCR0011, TCR0013, TCR0015, TCR0017, TCR0019, TCR0021, TCR0023, TCR0027, TCR0029, TCR0031, TCR0033, TCR0035, TCR0037, TCR0049, TCR0059, TCR0061, TCR0065, TCR0067 또는 TCR0069를 발현하는 AK-D10R3 세포는 상기에 기재된 바대로 SF-IMDM 배지 중에 배양되었다. 동시에, T2 표적 세포(문헌[Salter RD, EMBO J, 1986 May 5 (5):943-9 PMID 3522223]에 의해 기재된 바와 같은 인간 림프아구 세포)는 NY-ESO-1 항원 펩타이드에 의해 펄스화되었다. T2 세포는 5분 동안 300 x g 및 4℃에서 원심분리되고, 1x PBS를 사용하여 세척되고, 1.0 x 106개의 세포/250㎕의 최종 농도로 50㎍/㎖의 NY-ESO-1 야생형 항원 SLLMWITQC(서열 번호 1, 인하우스로 제조)가 보충된 1x PBS 중에 재현탁되었다. SXX-2 펩타이드 KASEKIFYV(서열 번호 274)(Peptides & Elephants, 로트 EP07005/3009P04)에 의해 펄스화되거나 펩타이드가 없는 T2 세포는 대조군으로서 작용하였다. 펩타이드 적정을 위해, T2 세포는 1.0 x 106개의 세포마다 24, 2.4, 0.24, 2.4 x 10-2, 2.4 x 10-3, 2.4 x 10-4, 2.4 x 10-5, 2.4 x 10-6, 2.4 x 10-7, 2.4 x 10-8, 2.4 x 10-9, 2.4 x 10-10, 2.4 x 10-11, 2.4 x 10-12 또는 2.4 x 10-13㎍ 펩타이드를 사용하여 NY-ESO-1 항원의 용량 범위에 의해 펄스화되었다. 세포는 37℃에서 3시간 동안 항온처리되고, 상기에 기재된 바대로 1x PBS를 사용하여 2회 세척되고, SF-IMDM 배지를 사용하여 5.0 x 106개의 세포/20㎖의 최종 농도로 재현탁되었다.
200㎕의 TCR 발현 AK-D10R3 세포(5.0 x 104개의 세포)를 96웰 검정 플레이트의 각각의 웰에서 첨가하고, 5분 동안 300 x g에서 원심분리하고, 상청액을 버렸다. 다음에, 200㎕의 T2 표적 세포(5.0 x 104개의 세포) 현탁액을 각각의 웰에서 첨가하였다. AK-D10R3 세포는 조심스럽게 재현탁되고, 10% CO2 분위기에서 37℃에서 18시간 동안 T2 세포와 동시항온처리되었다. 동시염색을 위해, 세포 현탁액은 10분 동안 300 x g에서 침전되고, 검정 완충제를 사용하여 2회 세척되고, 20㎕/웰의 염색 용액(1:500 APC 표지된 항-마우스 TCR β-사슬 항체가 보충된 1x PBS)을 사용하여 재현탁되고, 실온에서 30분 동안 항온처리되었다. 후속하여, 세포는 상기에 기재된 바대로 검정 완충제를 사용하여 2회 세척되고, 80㎕의 검정 완충제 중에 재현탁되고, BD FACSCanto II 유세포분석기를 사용하여 유세포분석법에 의해 분석되었다. 세포는 T 세포 활성화 (EGFP+)에 대해 TCR 발현 (APC+)에 대해 게이팅되었다. FlowJo 소프트웨어를 사용하여 점도표가 생성되고, APC+ EGFP+ 세포의 백분율(%)은 결정되었다. 각각의 검정은 3회 수행되었다.
도 7에 도시된 바대로, 시험된 TCR18168c 및 각각의 TCR18168c 돌연변이체는 야생형 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)에 의해 펄스화된 T2 세포의 존재 하에 AK-D10R3 세포에서 IL-2-NFAT 리포터 작제물의 활성화를 매개할 수 있었다(도 7).
6.3.4
TCR
발현 주르카트 세포에 대한 NY-
ESO
-1
pMHC
삼합체의
결합
NY-ESO-1 표적화 키메라 TCR TCR18168c, TCR0001, TCR0009, TCR0011, TCR0013, TCR0015, TCR0017, TCR0019, TCR0021, TCR0023, TCR0027, TCR0031, TCR0037, TCR0049, TCR0059, TCR0061, TCR0065, TCR0067 또는 TCR0069는 전체 인간 TCR로 전환되고, 인간 주르카트 세포에서 발현되었다. 각각의 키메라 TCR에 상응하는 전체 인간 TCR의 명칭은 표 4에 기재되어 있다. 발현 작제물에서, 각각의 TCR의 α 사슬 및 β 사슬은 P2A-퓨린 부위를 통해 연결되었다.
TCR 발현 주르카트 세포는 L-글루타민이 보충된 RPMI 배지(BioConcept 카탈로그 1-41F03-I호, 로트 LA03485P)를 사용하여 10% CO2 분위기에서 37℃에서 3일 동안 증식되었다. TCR 음성 주르카트 세포는 대조군으로서 사용되었다. 1.0 x 105개의 세포는 96웰 검정 플레이트의 각각의 웰에서 플레이팅되고, 5분 동안 300 x g 및 4℃에서 원심분리되고, 200㎕의 검정 완충제(2% FCS가 보충된 1x PBS)를 사용하여 2회 세척되고, 1.0 x 105개의 세포/100㎕의 농도에서 검정 완충제 중에 재현탁되었다. 세포는 TCR 발현 및 pMHC 결합에 대해 독립적으로 염색되었다. 염색을 위해, 20㎕의 항-인간 TCR-APC 항체(eBioscience, 카탈로그 17-9985-42호, 클론 IP26)(1:200)의 스톡 용액 또는 야생형 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)(MBL, 카탈로그 T01064호, 로트 T1606011)(1:250)가 로딩된 PE 표지된 HLA-A*0201 삼합체는 각각의 웰에서 첨가되었다. 실온에서 30분 항온처리 이후에, 세포는 상기에 기재된 바대로 2회 세척되고, BD FACSCanto II 유세포분석기를 사용하여 유세포분석법에 의해 분석되었다. 대조군에서, 세포는 대조군 SXX-2 항원 펩타이드 KASEKIFYV(서열 번호 274)(MBL, 카탈로그 TSM079-1호, 로트 001)(1:250)가 로딩된 PE 표지된 HLA-A*0201 삼합체에 의해 염색되었다. 세포는 FSC에 대한 TCR 발현 (APC+) 또는 FSC에 대한 pMHC 결합 (PE+)에 대해 게이팅되었다. FlowJo 소프트웨어를 사용하여 점도표가 생성되고, TCR+ 또는 pMHC+ 세포의 백분율(%)은 결정되었다.
도 8a 및 도 8b에 도시된 바대로, 시험된 TCR18168 및 각각의 TCR18168 돌연변이체는 완전 인간 TCR로서 주르카트 세포의 표면에서 발현될 때 야생형 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)가 로딩된 HLA-A*0201 삼합체에 결합하였다.
6.3.5
펩타이드
펄스화된
T2 표적 세포와 공배양
된
TCR18168
돌연변이체를 발현하는 1차 인간 T 세포의 규명
TCR0002, TCR0014, TCR0018, TCR0022, TCR0028, TCR0038, TCR0070 또는 HLA-A*0201 삼합체 결합된 NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)에 특이적인 기준 TCR의 α 사슬 및 β 사슬의 융합 작제물을 암호화하는 mRNA 분자는 mMESSAGE mMACHINE T7 Ultra 키트(Ambion, 카탈로그 AMB13455호)를 사용하여 시험관내 전사를 통해 생성되었다. 각각의 mRNA는 5'→3' 순서로 TCR β 사슬, 퓨린 절단 부위, P2A 절단 부위 및 TCR α 사슬을 암호화하는 벡터로부터 발현되었다. 이후, 인간 1차 T 세포는 MaxCyte GT 전기천공장치를 사용하여 전기천공에 의해 이들 mRNA의 각각에 의해 형질주입되었다. 형질주입 효율은 APC SLLMWITQC(서열 번호 1) 삼합체 HLA-A*0201(MBL 카탈로그 T10605호)을 사용하여 전기천공 후 16시간에 평가되었다. 96웰 환저 플레이트를 사용하여, Cell Trace Violet(CTV)에 의해 표지된 형질주입된 1차 T 세포를, 5x 연속 희석에 의해 1000nM의 높은 용량으로부터 12.8pM의 낮은 농도로 다양한 농도의 SLLMWITQC(서열 번호 1) 펩타이드에 의해 펄스화된, 카복시플루오레세인 숙신이미딜 에스터(CFSE)에 의해 표지된 T2 표적 세포와 1:1 효과기-대-표적 비율에서 공배양하였다. 37℃ 및 5% CO2 하에 공배양의 16시간 후, 샘플 웰을 BD LSRFortessa(상표명) 세포 분석기에 의해 분석하여 세포 활성화(CD25, 도 9a 내지 도 9h), 탈과립화(CD107a, 도 10a 내지 도 10h) 및 생존가능 세포(도 11a 내지 도 11h)의 바이오마커를 평가하였다. 분석은 FlowJo(등록상표), Microsoft(등록상표) Excel(등록상표) 및 GraphPad Prism을 사용하여 수행되었다.
도 9a 내지 도 9h에 도시된 바대로, 시험된 모든 NY-ESO-1 특이적 TCR(TCR0002, TCR0014, TCR0018, TCR0022, TCR0028, TCR0038 및 TCR0070, 및 기준 TCR)은 세포 표면 CD25 발현에 의해 나타난 것처럼 세포 활성화를 유도하였다. CD25 발현의 백분율은 펄싱에 NY-ESO-1 펩타이드의 더 높은 수준이 사용될 때 증가하였다. 유사하게, 이 TCR은 모두 음성 대조군에 비해 세포 표면에서 CD107a 발현에 의해 도 10a 내지 도 10h에 도시된 바대로) 증가된 세포용해 가능성 및 세포 탈과립화를 나타냈다. 도 9a 내지 도 9h 및 도 10a 내지 도 10h에 도시된 실험에 대한 음성 대조군은 Mart-1 펩타이드 표적화 TCR, DMF4에 의해 형질주입되고, 1μM의 NY-ESO-1에 의해 펄스화된 T2 세포와 공배양된 인간 1차 T 세포이었다. 또한, 시험된 NY-ESO-1 특이적 TCR의 각각의 하나를 발현하는 1차 T 세포는 음성 대조군에 비해 증가된 세포독성을 나타냈다(생존가능 표적 T2 세포의 수의 감소에 의해 도 11a 내지 도 11h에 도시됨). 1μM의 Mart-1 펩타이드는 T2 세포를 펄스화하기 위한 음성 대조군으로서 사용되었다.
6.3.6
펩타이드
발현 종양 세포주에서 공배양
된
TCR18168
돌연변이체를 발현하는 1차 인간 T 세포의 규명
6.3.5 부문에 기재된 바와 같은 mRNA 분자를 제조하고, 6.3.5 부문에서와 동일한 방법을 이용하여 전기천공에 의해 1차 T 세포로 형질주입하였다. 이후, TCR 발현 T 세포는 내인성 NY-ESO-1을 발현하는 만성 골수성 백혈병 세포주 K562와 다양한 효과기-대-표적 비율에서 공배양되었다. 구체적으로, K562 세포는 CFSE에 의해 표지되고, (단백질을 과발현하도록) 인간 HLA-A*0201 및 NY-ESO-1에 의해 형질도입되었다. 고정된 수의 표적 K562 세포를 96웰 환저 조직 배양 플레이트에서 플레이팅하고, 다양한 분량의 형질주입된 T 세포와 3중 공배양하였다. 공배양물은 16시간 동안 37℃, 5% CO2에서 항온처리되고, 6.3.5 부문에 기재된 바대로 활성화(CD25), 탈과립화(CD107a) 및 표적 세포 생존능력의 바이오마커에 대해 측정되었다.
도 12a 내지 도 12h에 도시된 바대로, 시험된 모든 NY-ESO-1 특이적 TCR(TCR0002, TCR0014, TCR0018, TCR0022, TCR0028, TCR0038 및 TCR0070, 및 기준 TCR)은 다양한 효과기-대-표적 비율 하에 세포 표면 CD25 발현에 의해 표시된 바대로 세포 활성화를 유도하였다. 유사하게, 이 TCR은 모두 (세포 표면 상의 CD107a 발현에 의해 도 13a 내지 도 13h에 도시된) 증가된 세포용해 가능성 및 세포 탈과립화를 나타냈다. CD25 및 CD107a 발현 둘 다를 검출하기 위해, DMF4에 의해 형질주입된 인간 1차 T 세포는 음성 대조군으로서 사용되었다. 또한, 시험된 NY-ESO-1 특이적 TCR 중 임의의 하나를 발현하는 1차 T 세포는 (감소한 수의 생존가능 표적 K562 세포에 의해 도 14a 내지 도 14h에 도시된 바대로) 5:1 및 10:1의 효과기:표적 비율에서 음성 대조군에 비해 증가된 세포독성을 나타냈다. 세포독성 검정을 위해, DMF4에 의해 형질주입된 T 세포는 표적 세포와 공배양되고, 음성 대조군으로서 시험되었다.
또 다른 실험에서, 상기에 기재된 기준 TCR, TCR0002, TCR0014, TCR0018, TCR0022, TCR0028, TCR0038, TCR0070, 또는 음성 대조군 TCR DMF4를 암호화하는 mRNA에 의해 형질주입된 T 세포는 각각 K562 표적 세포의 2개의 그룹의 동일한 수의 혼합물과 5:1 효과기-표적 비율에서 공배양되었다. K562 세포의 제1 그룹(그룹 1)은 시험 TCR에 의해 인식된 동족 HLA-펩타이드 복합체를 디스플레이하도록 인간 HLA-A*0201 및 NY-ESO-1 단백질에 의해 형질도입되고, 4μM의 CFSE에 의해 표지되었다. K562 세포의 제2 그룹(그룹 2)은 인간 HLA-B*0702에 의해 형질도입되고, 0.20μM의 CFSE에 의해 표지되었다. 동시에, K562 세포의 동일한 혼합물은 제조되었지만, T 세포와 공배양되지 않았다. 각각의 경우에, 남아 있는 생존가능 K562 표적 세포의 각각의 세트의 수는 유세포분석법에 의해 결정되고, "사멸 퍼센트" 값은 T 세포 공배양 혼합물에서 남아 있는 생존가능 그룹 1 세포 대 남아 있는 생존가능 그룹 2 세포의 비율을 결정하는 것; 비-T 세포 공배양된 혼합물에서 남아 있는 생존가능 그룹 1 세포 대 남아 있는 생존가능 그룹 2 세포의 비율을 결정하는 것; 이 2개의 비율의 비율을 계산하는 것; 1로부터 공제하는 것; 및 100%를 곱하는 것에 의해 시험된 각각의 TCR에 대해 결정되었다. 양수 값은 그룹 2 세포와 비교된 그룹 1 세포의 우선적 사멸을 나타낸다. 도 15에 도시된 바대로, 음성 대조군 이외에 시험된 모든 TCR은 인간 HLA-A*0201 및 NY-ESO-1 단백질에 의해 형질도입된 K562 세포의 실질적인 우선적 사멸을 발생시켰다. 음성 대조군 샘플은 검출 가능한 우선적 사멸을 나타내지 않았다.
또 다른 실험에서, 표적 종양 세포는 NY-ESO-1 또는 HLA-A*0201의 과발현 없이 TCR 발현 1차 T 세포와 공배양되었다. 구체적으로, 내인성 NY-ESO-1 및 HLA-A*0201을 발현하는 SLM2-mel인 흑색종 세포는 표적 세포로서 사용되고, CTV에 의해 표지되었다. 고정된 수의 표적 세포를 96웰 환저 조직 배양 플레이트에서 TCR을 발현하는 다양한 수의 형질주입된 1차 T 세포와 3중 공배양하였다. 공배양 플레이트를 16시간 동안 37℃, 5% CO2에서 항온처리하고, 생존가능 세포의 수는 이 부문 및 이전의 부문에 기재된 바대로 동일한 유세포분석법을 이용하여 평가하였다. 시험된 모든 NY-ESO-1 특이적 TCR2는 음성 대조군에 비해 표면 CD25(도 16a 내지 도 16f) 및 CD107a(도 17a 내지 도 17f) 백분율 발현을 증가시켰다. 도 18a 내지 도 18f에 도시된 바대로, 시험된 모든 NY-ESO-1 특이적 TCR은 음성 대조군에 비해 증가된 세포독성을 나타냈다. 도 16a 내지 도 16f, 도 17a 내지 도 17f, 및 도 18a 내지 도 18f에 대한 음성 대조군으로서, PBS에 의해 형질주입된 T 세포는 상응하는 효과기-대-표적 비율에서 표적 세포와 공배양되었다.
6.3.7 NY-
ESO
-1
TCR
특이성 프로필의 규명
이 실시예는 본 명세서에 기재된 몇몇 NY-ESO-1 특이적 TCR의 표적 특이성을 평가하기 위한 스크리닝 방법의 사용을 예시한다.
간단히, SLLMWITQC(서열 번호 1)의 NY-ESO-1 펩타이드 서열과 높은 유사성을 갖는 짧은 폴리펩타이드의 그룹을 제조하였다. C 말단에서 발린을 갖는 앵커 최적화된 변이체(SLLMWITQV, 서열 번호 2)는 돌연변이유발에 대한 모 서열로서 사용되었다. 서열 번호 2의 앵커 위치 P2(L) 및 P9(V)를 제외한 각각의 위치는 모든 19개의 다른 가능한 자연 발생 아미노산에 의해 개별적으로 치환되어서, 133개의 변경된 펩타이드의 전체 세트(표 10에 기재된 바와 같은 서열 번호 275 내지 407)를 발생시켰다. 각각의 TCR의 특이성 프로필은 133개 중 1개의 펩타이드 또는 모 서열 번호 2가 로딩된 T2 표적 세포와 공배양 후 TCR 발현 효과기 세포의 활성화를 측정함으로써 평가되었다.
효과기 세포(NY-ESO AK-D10R3 세포)는 6.1 부문에 기재된 바대로 마우스 TCR 음성 흉선종 세포로부터 생성되고, NY-ESO-1 펩타이드 SLLMWITQC(서열 번호 1)에 특이적인 키메라 TCR TCR0001, TCR0017, TCR0021, TCR0037, 또는 기준 TCR; 키메라 마우스/인간 CD8; 및 3개의 NFAT 결합 부위(3xNFAT)를 포함하는 최소 IL-2 촉진자에 연결된 EGFP- 리포터 작제물에 의해 안정하게 형질도입되었다. 세포를 37℃ 및 10% CO2에서 3% 태아 소 혈청(FCS; Amimed), 1% 페니실린/스트렙토마이신(SIGMA-ALDRICH(미주리주 세인트 루이스)) 및 50μM의 β-머캅토에탄올(Gibco, Fisher Scientific(영국))이 보충된 SF-IMDM(Amimed(영국)) 중에 배양하였다. ATCC로부터 항원 제시 Tap 결핍 T2(174 x CEM.T2) 세포는 37℃ 및 5% CO2에서 10% FCS 및 1% 페니실린/스트렙토마이신이 보충된 RPMI 1640(SIGMA-ALDRICH) 중에 유지되었다.
(Peptides and Elephants(독일)로부터 구입되거나 인하우스로 제조된) 펩타이드를 DMSO 중에 현탁시키고, 농도를 4㎎/㎖로 조정하였다. 간단히, T2 세포를 PBS(Gibco) 중에 세척하고, 37℃ 및 5% CO2에서 2시간 동안 1 x 106개의 세포마다 80㎍의 펩타이드와 항온처리하였다. 항온처리 후, T2 세포를 PBS/2% FCS 중에 세척하고, 이후 SF-IMDM 배지 중에 재현탁시켰다. 관심 대상의 TCR을 발현하는 효과기 세포를 37℃ 및 10% CO2에서 SF-IMDM 배지 중에 16시간 동안 2:1 비율(96웰 플레이트의 웰마다 전체 150,000개의 세포)에서 펩타이드 펄스화된 T2 세포와 공배양하였다. 세포를 2% FBS/PBS 중에 2회 세척하고, 실온에서 30분 동안 항-마우스 TCR-β 사슬 클론 H57-597(BD Pharmingen(캘리포니아주 산 호세), 1:500)에 의해 염색하였다. 세포를 2회 세척한 후, BD FACS Canto II를 사용하여 FACS 분석하였다.
FlowJo V10 소프트웨어를 이용하여 데이터 분석을 수행하였다. 활성화는 NY-ESO AK-D10R3 집단에서 EGFP 발현 세포의 비율로서 계산되었다(AK-D10R3 세포는 TCR 발현에 기초하여 확인되었다). (펩타이드가 로딩되지 않은) 배경 활성화는 모든 펩타이드 로딩된 샘플(변경된 및 네이티브 서열)로부터 공제되었다. 배경 공제된 값의 평균 및 표준 평균 오차(SEM)는 모든 반복실험(각각의 TCR에 대한 적어도 3회 반복실험)으로부터 계산되고, 값은 네이티브 서열 펩타이드의 것에 정규화되고, 정규화된 값은 디스플레이 목적을 위해 최소 0.0(오직 열 지도) 및 최대 1.0(열 지도 및 막대 차트 둘 다)으로 잘렸다. 정규화된 값은 도 19a(기준 TCR), 도 19b(TCR0001), 도 19c(TCR0017), 도 19d(TCR 0021) 및 도 19e(TCR0037)에서 열 지도 포맷으로 기재되고, 도 20a(기준 TCR), 도 20b(TCR0001), 도 20c(TCR0017), 도 20d(TCR 0021) 및 도 20e(TCR0037)에서 막대 차트 포맷으로 기재된다.
열 지도 및 막대 차트는 시험된 각각의 TCR의 명확한 특이성 프로필을 밝혀냈다. 일반적으로, 백색(낮은 정규화된 값)의 더 높은 백분율은 NY-ESO-1 동족 펩타이드에서의 돌연변이에 대한 더 낮은 관용성을 나타내어서, 상기에 기재된 검정의 맥락에서 NY-ESO-1 동족 펩타이드에 대한 더 높은 정도의 특이성을 나타낸다. 도 19a 내지 도 19e에 도시된 바대로, TCR0001, TCR0017, TCR0021 및 TCR0037은 모두 평가된 돌연변이체 펩타이드에 대해 기준 TCR보다 NY-ESO-1 동족 펩타이드에 대해 실질적으로 더 높은 정도의 특이성을 나타냈다. 마찬가지로, 도 20a 내지 도 20e에서의 막대 차트는 기준 TCR과 비교하여 각각의 TCR0001, TCR0017, TCR0021 및 TCR0037에 대한 돌연변이체 펩타이드에 대한 낮은 정규화된 활성화 값의 더 높은 백분율을 밝혀냈다.
본 발명은 본 명세서에 기재된 구체적인 실시형태에 의해 범위에서 제한되지 않을 것이다. 실제로, 기재된 것 이외의 본 발명의 다양한 변형은 상기 설명 및 첨부된 도면으로부터 당업자에게 명확할 것이다. 이러한 변형은 첨부된 청구항의 범위 내에 해당하도록 의도된다.
본 명세서에 인용된 모든 참고문헌(예를 들어, 공보 또는 특허 또는 특허 출원)은, 각각의 개별 참고문헌(예를 들어, 공보 또는 특허 또는 특허 출원)이 모든 목적을 위해 그 전문이 참고로 포함되도록 구체적으로 및 개별적으로 표시된 것과 동일한 정도로, 모든 목적을 위해 본 명세서에 그 전문이 참고로 포함된다.
다른 실시형태는 하기 청구항 내에 있다.
Claims (147)
- 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 단리된 T 세포 수용체(T cell receptor: TCR)로서, 상기 TCR은 상보성 결정 영역 CDR3α를 포함하는 α 사슬 가변 영역(Vα)을 포함하고, 상기 CDR3α는 서열 번호 61, 62, 63, 64 또는 65에 제시된 아미노산 서열을 포함하는, 단리된 TCR.
- 제1항에 있어서, 상기 CDR3α는 서열 번호 64 또는 65에 제시된 아미노산 서열을 포함하는, 단리된 TCR.
- 제1항 또는 제2항에 있어서, 상기 CDR3α는 서열 번호 7 및 39 내지 60으로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 단리된 TCR.
- 제1항 내지 제3항 어느 한 항에 있어서, 상기 CDR3α는 서열 번호 7, 39, 40, 43, 45, 47, 49 및 54로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 단리된 TCR.
- 제1항 내지 제4항 어느 한 항에 있어서, 상기 Vα는 각각 서열 번호 5 및 6에 제시된 아미노산 서열을 포함하는 CDR1α 및 CDR2α를 포함하는, 단리된 TCR.
- 제1항 내지 제5항 어느 한 항에 있어서, 상기 Vα는 각각 서열 번호 5, 6 및 7; 5, 6 및 39; 5, 6 및 40; 5, 6 및 41; 5, 6 및 42; 5, 6 및 43; 5, 6 및 44; 5, 6 및 45; 5, 6 및 46; 5, 6 및 47; 5, 6 및 48; 5, 6 및 49; 5, 6 및 50; 5, 6 및 51; 5, 6 및 52; 5, 6 및 53; 5, 6 및 54; 5, 6 및 55; 5, 6 및 56; 5, 6 및 57; 5, 6 및 58; 5, 6 및 59; 또는 5, 6 및 60에 제시된 아미노산 서열을 포함하는 CDR1α, CDR2α 및 CDR3α를 포함하는, 단리된 TCR.
- 제1항 내지 제6항 어느 한 항에 있어서, 상기 Vα는 서열 번호 87 내지 91로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 단리된 TCR.
- 제1항 내지 제7항 어느 한 항에 있어서, 상기 Vα는 서열 번호 3 및 66 내지 86으로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 단리된 TCR.
- 제1항 내지 제8항 어느 한 항에 있어서, 상기 Vα는 서열 번호 3, 66, 69, 71, 73, 75 및 80으로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 단리된 TCR.
- 제1항 내지 제9항 어느 한 항에 있어서, 서열 번호 13, 93 내지 96, 105 내지 118, 120 내지 123, 125 내지 128 및 408 내지 415로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 α 사슬을 포함하는, 단리된 TCR.
- 제1항 내지 제10항 어느 한 항에 있어서, 서열 번호 13, 105, 110, 115, 120, 125, 408 및 412로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 α 사슬을 포함하는, 단리된 TCR.
- 제1항 내지 제11항 어느 한 항에 있어서, 상기 TCR은 CDR3β를 포함하는 β 사슬 가변 영역(Vβ)을 포함하고, 상기 CDR3β는 서열 번호 10에 제시된 아미노산 서열을 포함하는, 단리된 TCR.
- 제12항에 있어서, 상기 Vβ는 각각 서열 번호 8 및 9에 제시된 아미노산 서열을 포함하는 CDR1β 및 CDR2β를 포함하는, 단리된 TCR.
- 제12항 또는 제13항에 있어서, 상기 Vβ는 서열 번호 4에 제시된 아미노산 서열을 포함하는, 단리된 TCR.
- 제12항 내지 제14항 어느 한 항에 있어서, 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 β 사슬을 포함하는, 단리된 TCR.
- 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 단리된 T 세포 수용체(TCR)로서, 상기 TCR은 상보성 결정 영역 CDR3β를 포함하는 β 사슬 가변 영역(Vβ)을 포함하고, 상기 CDR3β는 서열 번호 10에 제시된 아미노산 서열을 포함하는, 단리된 TCR.
- 제16항에 있어서, 상기 Vβ는 각각 서열 번호 8 및 9에 제시된 아미노산 서열을 포함하는 CDR1β 및 CDR2β를 포함하는, 단리된 TCR.
- 제16항 또는 제17항에 있어서, 상기 Vβ는 서열 번호 4에 제시된 아미노산 서열을 포함하는, 단리된 TCR.
- 제16항 내지 제18항 어느 한 항에 있어서, 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 β 사슬을 포함하는, 단리된 TCR.
- 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 단리된 T 세포 수용체(TCR)로서, 상기 TCR은 서열 번호 18에 제시된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95%, 99% 또는 100% 동일한 아미노산 서열을 포함하는 α 사슬 가변 영역(Vα)을 포함하는, 단리된 TCR.
- 제20항에 있어서, 상기 Vα는 서열 번호 18에 제시된 아미노산 서열을 포함하는, 단리된 TCR.
- 제20항 또는 제21항에 있어서, 상기 TCR은 서열 번호 19에 제시된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95%, 99% 또는 100% 동일한 아미노산 서열을 포함하는 β 사슬 가변 영역(Vβ)을 포함하는, 단리된 TCR.
- 제22항에 있어서, 상기 Vβ는 서열 번호 19에 제시된 아미노산 서열을 포함하는, 단리된 TCR.
- 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 단리된 T 세포 수용체(TCR)로서, 상기 TCR은 서열 번호 19에 제시된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95%, 99% 또는 100% 동일한 아미노산 서열을 포함하는 β 사슬 가변 영역(Vβ)을 포함하는, 단리된 TCR.
- 제24 있어서, 상기 Vβ는 서열 번호 19에 제시된 아미노산 서열을 포함하는, 단리된 TCR.
- 제1항 내지 제25항 어느 한 항에 있어서, 상기 TCR은 CDR1α, CDR2α 및 CDR3α를 포함하는 α 사슬 가변 영역(Vα), 및 CDR1β, CDR2β 및 CDR3β를 포함하는 β 사슬 가변 영역(Vβ)을 포함하고, 상기 CDR1α, CDR2α, CDR3α, CDR1β, CDR2β 및 CDR3β는 각각 서열 번호 5, 6, 7, 8, 9 및 10; 5, 6, 39, 8, 9 및 10; 5, 6, 40, 8, 9 및 10; 5, 6, 41, 8, 9 및 10; 5, 6, 42, 8, 9 및 10; 5, 6, 43, 8, 9 및 10; 5, 6, 44, 8, 9 및 10; 5, 6, 45, 8, 9 및 10; 5, 6, 46, 8, 9 및 10; 5, 6, 47, 8, 9 및 10; 5, 6, 48, 8, 9 및 10; 5, 6, 49, 8, 9 및 10; 5, 6, 50, 8, 9 및 10; 5, 6, 51, 8, 9 및 10; 5, 6, 52, 8, 9 및 10; 5, 6, 53, 8, 9 및 10; 5, 6, 54, 8, 9 및 10; 5, 6, 55, 8, 9 및 10; 5, 6, 56, 8, 9 및 10; 5, 6, 57, 8, 9 및 10; 5, 6, 58, 8, 9 및 10; 5, 6, 59, 8, 9 및 10; 또는 5, 6, 60, 8, 9 및 10에 제시된 아미노산 서열을 포함하는, 단리된 TCR.
- 상보성 결정 영역 CDR1α, CDR2α 및 CDR3α를 포함하는 α 사슬 가변 영역(Vα), 및 CDR1β, CDR2β 및 CDR3β를 포함하는 β 사슬 가변 영역(Vβ)을 포함하는 단리된 TCR로서, 상기 CDR1α, CDR2α, CDR3α, CDR1β, CDR2β 및 CDR3β는 각각 서열 번호 5, 6, 7, 8, 9 및 10; 5, 6, 39, 8, 9 및 10; 5, 6, 40, 8, 9 및 10; 5, 6, 41, 8, 9 및 10; 5, 6, 42, 8, 9 및 10; 5, 6, 43, 8, 9 및 10; 5, 6, 44, 8, 9 및 10; 5, 6, 45, 8, 9 및 10; 5, 6, 46, 8, 9 및 10; 5, 6, 47, 8, 9 및 10; 5, 6, 48, 8, 9 및 10; 5, 6, 49, 8, 9 및 10; 5, 6, 50, 8, 9 및 10; 5, 6, 51, 8, 9 및 10; 5, 6, 52, 8, 9 및 10; 5, 6, 53, 8, 9 및 10; 5, 6, 54, 8, 9 및 10; 5, 6, 55, 8, 9 및 10; 5, 6, 56, 8, 9 및 10; 5, 6, 57, 8, 9 및 10; 5, 6, 58, 8, 9 및 10; 5, 6, 59, 8, 9 및 10; 또는 5, 6, 60, 8, 9 및 10에 제시된 아미노산 서열을 포함하는, 단리된 TCR.
- 제27항에 있어서, 상기 Vα 및 Vβ는 각각 서열 번호 3 및 4, 66 및 4, 67 및 4, 68 및 4, 69 및 4, 70 및 4, 71 및 4, 72 및 4, 73 및 4, 74 및 4, 75 및 4, 76 및 4, 77 및 4, 78 및 4, 79 및 4, 80 및 4, 81 및 4, 82 및 4, 83 및 4, 84 및 4, 85 및 4, 또는 86 및 4에 제시된 아미노산 서열을 포함하는, 단리된 TCR.
- 제1항 내지 제9항 및 제12항 내지 제28항 중 어느 한 항에 있어서, 상기 TCR은 서열 번호 15, 26 또는 92에 제시된 아미노산 서열을 포함하는 α 사슬 불변 영역을 포함하는 α 사슬을 포함하는, 단리된 TCR.
- 제1항 내지 제14항, 제16항 내지 제18항 및 제20항 내지 제29항 중 어느 한 항에 있어서, 상기 TCR은 서열 번호 16 또는 17에 제시된 아미노산 서열을 포함하는 β 사슬 불변 영역을 포함하는 β 사슬을 포함하는, 단리된 TCR.
- α 사슬 및 β 사슬을 포함하는 단리된 TCR로서, 상기 α 사슬은 서열 번호 13, 93 내지 96, 105 내지 118, 120 내지 123, 125 내지 128 및 408 내지 415로 이루어진 군으로부터 선택된 아미노산 서열을 포함하고, 상기 β 사슬은 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 단리된 TCR.
- 제31항에 있어서, 상기 α 사슬은 서열 번호 13, 105, 110, 115, 120, 125, 408 및 412로 이루어진 군으로부터 선택된 아미노산 서열을 포함하고, 상기 β 사슬은 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 단리된 TCR.
- 제31항 또는 제32항에 있어서, 상기 α 사슬 및 상기 β 사슬은 각각 서열 번호 13 및 14; 13 및 25; 13 및 97; 13 및 98; 13 및 99; 13 및 100; 13 및 101; 13 및 102; 13 및 103; 13 및 104; 93 및 14; 93 및 25; 93 및 97; 93 및 98; 93 및 99; 93 및 100; 93 및 101; 93 및 102; 93 및 103; 93 및 104; 94 및 14; 94 및 25; 94 및 97; 94 및 98; 94 및 99; 94 및 100; 94 및 101; 94 및 102; 94 및 103; 94 및 104; 95 및 14; 95 및 25; 95 및 97; 95 및 98; 95 및 99; 95 및 100; 95 및 101; 95 및 102; 95 및 103; 95 및 104; 96 및 14; 96 및 25; 96 및 97; 96 및 98; 96 및 99; 96 및 100; 96 및 101; 96 및 102; 96 및 103; 96 및 104; 105 및 14; 105 및 25; 105 및 97; 105 및 98; 105 및 99; 105 및 100; 105 및 101; 105 및 102; 105 및 103; 105 및 104; 106 및 14; 106 및 25; 106 및 97; 106 및 98; 106 및 99; 106 및 100; 106 및 101; 106 및 102; 106 및 103; 106 및 104; 107 및 14; 107 및 25; 107 및 97; 107 및 98; 107 및 99; 107 및 100; 107 및 101; 107 및 102; 107 및 103; 107 및 104; 108 및 14; 108 및 25; 108 및 97; 108 및 98; 108 및 99; 108 및 100; 108 및 101; 108 및 102; 108 및 103; 108 및 104; 109 및 14; 109 및 25; 109 및 97; 109 및 98; 109 및 99; 109 및 100; 109 및 101; 109 및 102; 109 및 103; 109 및 104; 110 및 14; 110 및 25; 110 및 97; 110 및 98; 110 및 99; 110 및 100; 110 및 101; 110 및 102; 110 및 103; 110 및 104; 111 및 14; 111 및 25; 111 및 97; 111 및 98; 111 및 99; 111 및 100; 111 및 101; 111 및 102; 111 및 103; 111 및 104; 112 및 14; 112 및 25; 112 및 97; 112 및 98; 112 및 99; 112 및 100; 112 및 101; 112 및 102; 112 및 103; 112 및 104; 113 및 14; 113 및 25; 113 및 97; 113 및 98; 113 및 99; 113 및 100; 113 및 101; 113 및 102; 113 및 103; 113 및 104; 114 및 14; 114 및 25; 114 및 97; 114 및 98; 114 및 99; 114 및 100; 114 및 101; 114 및 102; 114 및 103; 114 및 104; 115 및 14; 115 및 25; 115 및 97; 115 및 98; 115 및 99; 115 및 100; 115 및 101; 115 및 102; 115 및 103; 115 및 104; 116 및 14; 116 및 25; 116 및 97; 116 및 98; 116 및 99; 116 및 100; 116 및 101; 116 및 102; 116 및 103; 116 및 104; 117 및 14; 117 및 25; 117 및 97; 117 및 98; 117 및 99; 117 및 100; 117 및 101; 117 및 102; 117 및 103; 117 및 104; 118 및 14; 118 및 25; 118 및 97; 118 및 98; 118 및 99; 118 및 100; 118 및 101; 118 및 102; 118 및 103; 118 및 104; 120 및 14; 120 및 25; 120 및 97; 120 및 98; 120 및 99; 120 및 100; 120 및 101; 120 및 102; 120 및 103; 120 및 104; 121 및 14; 121 및 25; 121 및 97; 121 및 98; 121 및 99; 121 및 100; 121 및 101; 121 및 102; 121 및 103; 121 및 104; 122 및 14; 122 및 25; 122 및 97; 122 및 98; 122 및 99; 122 및 100; 122 및 101; 122 및 102; 122 및 103; 122 및 104; 123 및 14; 123 및 25; 123 및 97; 123 및 98; 123 및 99; 123 및 100; 123 및 101; 123 및 102; 123 및 103; 123 및 104; 125 및 14; 125 및 25; 125 및 97; 125 및 98; 125 및 99; 125 및 100; 125 및 101; 125 및 102; 125 및 103; 125 및 104; 126 및 14; 126 및 25; 126 및 97; 126 및 98; 126 및 99; 126 및 100; 126 및 101; 126 및 102; 126 및 103; 126 및 104; 127 및 14; 127 및 25; 127 및 97; 127 및 98; 127 및 99; 127 및 100; 127 및 101; 127 및 102; 127 및 103; 127 및 104; 128 및 14; 128 및 25; 128 및 97; 128 및 98; 128 및 99; 128 및 100; 128 및 101; 128 및 102; 128 및 103; 128 및 104; 408 및 14; 408 및 25; 408 및 97; 408 및 98; 408 및 99; 408 및 100; 408 및 101; 408 및 102; 408 및 103; 408 및 104; 409 및 14; 409 및 25; 409 및 97; 409 및 98; 409 및 99; 409 및 100; 409 및 101; 409 및 102; 409 및 103; 409 및 104; 410 및 14; 410 및 25; 410 및 97; 410 및 98; 410 및 99; 410 및 100; 410 및 101; 410 및 102; 410 및 103; 410 및 104; 411 및 14; 411 및 25; 411 및 97; 411 및 98; 411 및 99; 411 및 100; 411 및 101; 411 및 102; 411 및 103; 411 및 104; 412 및 14; 412 및 25; 412 및 97; 412 및 98; 412 및 99; 412 및 100; 412 및 101; 412 및 102; 412 및 103; 412 및 104; 413 및 14; 413 및 25; 413 및 97; 413 및 98; 413 및 99; 413 및 100; 413 및 101; 413 및 102; 413 및 103; 413 및 104; 414 및 14; 414 및 25; 414 및 97; 414 및 98; 414 및 99; 414 및 100; 414 및 101; 414 및 102; 414 및 103; 414 및 104; 415 및 14; 415 및 25; 415 및 97; 415 및 98; 415 및 99; 415 및 100; 415 및 101; 415 및 102; 415 및 103; 또는 415 및 104에 제시된 아미노산 서열을 포함하는, 단리된 TCR.
- 제33항에 있어서, 상기 α 사슬 및 상기 β 사슬은 각각 서열 번호 13 및 14; 13 및 25; 105 및 14; 105 및 25; 110 및 14; 110 및 25; 115 및 14; 115 및 25; 120 및 14; 120 및 25; 125 및 14; 125 및 25; 408 및 14; 408 및 25; 412 및 14; 또는 412 및 25에 제시된 아미노산 서열을 포함하는, 단리된 TCR.
- 제33항에 있어서, 상기 α 사슬 및 상기 β 사슬은 각각 서열 번호 13 및 14; 105 및 14; 110 및 14; 115 및 14; 120 및 14; 125 및 14; 408 및 14; 또는 412 및 14에 제시된 아미노산 서열을 포함하는, 단리된 TCR.
- 제31항 내지 제35항 어느 한 항에 있어서, 상기 TCR은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는, 단리된 TCR.
- 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 T 세포 수용체(TCR)의 α 사슬 가변 영역(Vα) 및 β 사슬 가변 영역(Vβ)을 포함하는 폴리펩타이드로서, 상기 Vα는 상보성 결정 영역 CDR3α를 포함하고, 상기 CDR3α는 서열 번호 61, 62, 63, 64 또는 65에 제시된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제37항에 있어서, 상기 CDR3α는 서열 번호 64 또는 65에 제시된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제37항 또는 제38항에 있어서, 상기 CDR3α는 서열 번호 7 및 39 내지 60으로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제37항 내지 제39항 중 어느 한 항에 있어서, 상기 CDR3α는 서열 번호 7, 39, 40, 43, 45, 47, 49 및 54로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제37항 내지 제40항 중 어느 한 항에 있어서, 상기 Vα는 각각 서열 번호 5 및 6에 제시된 아미노산 서열을 포함하는 CDR1α 및 CDR2α를 포함하는, 폴리펩타이드.
- 제37항 내지 제41항 중 어느 한 항에 있어서, 상기 Vα는 각각 서열 번호 5, 6 및 7; 5, 6 및 39; 5, 6 및 40; 5, 6 및 41; 5, 6 및 42; 5, 6 및 43; 5, 6 및 44; 5, 6 및 45; 5, 6 및 46; 5, 6 및 47; 5, 6 및 48; 5, 6 및 49; 5, 6 및 50; 5, 6 및 51; 5, 6 및 52; 5, 6 및 53; 5, 6 및 54; 5, 6 및 55; 5, 6 및 56; 5, 6 및 57; 5, 6 및 58; 5, 6 및 59; 또는 5, 6 및 60에 제시된 아미노산 서열을 포함하는 CDR1α, CDR2α 및 CDR3α를 포함하는, 폴리펩타이드.
- 제37항 내지 제42항 중 어느 한 항에 있어서, 상기 Vα는 서열 번호 87 내지 91로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제37항 내지 제43항 중 어느 한 항에 있어서, 상기 Vα는 서열 번호 3 및 66 내지 86으로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제44항에 있어서, 상기 Vα는 서열 번호 3, 66, 69, 71, 73, 75 및 80으로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제37항 내지 제45항 중 어느 한 항에 있어서, 서열 번호 13, 93 내지 96, 105 내지 118, 120 내지 123, 125 내지 128 및 408 내지 415로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 α 사슬을 포함하는, 폴리펩타이드.
- 제46항에 있어서, 서열 번호 13, 105, 110, 115, 120, 125, 408 및 412로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 α 사슬을 포함하는, 폴리펩타이드.
- 제37항 내지 제47항 중 어느 한 항에 있어서, 상기 Vβ는 CDR3β를 포함하고, 상기 CDR3β는 서열 번호 10에 제시된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제48항에 있어서, 상기 Vβ는 각각 서열 번호 8 및 9에 제시된 아미노산 서열을 포함하는 CDR1β 및 CDR2β를 포함하는, 폴리펩타이드.
- 제48항 또는 제49항에 있어서, 상기 Vβ는 서열 번호 4에 제시된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제48항 내지 제50항 중 어느 한 항에 있어서, 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 β 사슬을 포함하는, 폴리펩타이드.
- 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR의 Vα 및 Vβ를 포함하는 폴리펩타이드로서, 상기 Vβ는 상보성 결정 영역 CDR3β를 포함하고, 상기 CDR3β는 서열 번호 10에 제시된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제52항에 있어서, 상기 Vβ는 각각 서열 번호 8 및 9에 제시된 아미노산 서열을 포함하는 CDR1β 및 CDR2β를 포함하는, 폴리펩타이드.
- 제52항 또는 제53항에 있어서, 상기 Vβ는 서열 번호 4에 제시된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제52항 내지 제54항 중 어느 한 항에 있어서, 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 β 사슬을 포함하는, 폴리펩타이드.
- 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR의 Vα 및 Vβ를 포함하는 폴리펩타이드로서, 상기 Vα는 서열 번호 18에 제시된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95%, 99% 또는 100% 동일한 아미노산 서열을 포함하는, 폴리펩타이드.
- 제56항에 있어서, 상기 Vα는 서열 번호 18에 제시된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제56항 또는 제57항에 있어서, 상기 Vβ는 서열 번호 19에 제시된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95%, 99% 또는 100% 동일한 아미노산 서열을 포함하는, 폴리펩타이드.
- 제58항에 있어서, 상기 Vβ는 서열 번호 19에 제시된 아미노산 서열을 포함하는, 폴리펩타이드.
- 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR의 Vα 및 Vβ를 포함하는 폴리펩타이드로서, 상기 Vβ는 서열 번호 19에 제시된 아미노산 서열과 적어도 75%, 80%, 85%, 90%, 95%, 99% 또는 100% 동일한 아미노산 서열을 포함하는, 폴리펩타이드.
- 제60항에 있어서, 상기 Vβ는 서열 번호 19에 제시된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제37항 내지 제61항 중 어느 한 항에 있어서, 상기 Vα는 CDR1α, CDR2α 및 CDR3α를 포함하고, 상기 Vβ는 CDR1β, CDR2β 및 CDR3β를 포함하고, 상기 CDR1α, CDR2α, CDR3α, CDR1β, CDR2β 및 CDR3β는 각각 서열 번호 5, 6, 7, 8, 9 및 10; 5, 6, 39, 8, 9 및 10; 5, 6, 40, 8, 9 및 10; 5, 6, 41, 8, 9 및 10; 5, 6, 42, 8, 9 및 10; 5, 6, 43, 8, 9 및 10; 5, 6, 44, 8, 9 및 10; 5, 6, 45, 8, 9 및 10; 5, 6, 46, 8, 9 및 10; 5, 6, 47, 8, 9 및 10; 5, 6, 48, 8, 9 및 10; 5, 6, 49, 8, 9 및 10; 5, 6, 50, 8, 9 및 10; 5, 6, 51, 8, 9 및 10; 5, 6, 52, 8, 9 및 10; 5, 6, 53, 8, 9 및 10; 5, 6, 54, 8, 9 및 10; 5, 6, 55, 8, 9 및 10; 5, 6, 56, 8, 9 및 10; 5, 6, 57, 8, 9 및 10; 5, 6, 58, 8, 9 및 10; 5, 6, 59, 8, 9 및 10; 또는 5, 6, 60, 8, 9 및 10에 제시된 아미노산 서열을 포함하는, 폴리펩타이드.
- TCR의 Vα 및 Vβ를 포함하는 폴리펩타이드로서, 상기 Vα는 상보성 결정 영역 CDR1α, CDR2α 및 CDR3α를 포함하고, 상기 Vβ는 CDR1β, CDR2β 및 CDR3β를 포함하고, 상기 CDR1α, CDR2α, CDR3α, CDR1β, CDR2β 및 CDR3β는 각각 서열 번호 5, 6, 7, 8, 9 및 10; 5, 6, 39, 8, 9 및 10; 5, 6, 40, 8, 9 및 10; 5, 6, 41, 8, 9 및 10; 5, 6, 42, 8, 9 및 10; 5, 6, 43, 8, 9 및 10; 5, 6, 44, 8, 9 및 10; 5, 6, 45, 8, 9 및 10; 5, 6, 46, 8, 9 및 10; 5, 6, 47, 8, 9 및 10; 5, 6, 48, 8, 9 및 10; 5, 6, 49, 8, 9 및 10; 5, 6, 50, 8, 9 및 10; 5, 6, 51, 8, 9 및 10; 5, 6, 52, 8, 9 및 10; 5, 6, 53, 8, 9 및 10; 5, 6, 54, 8, 9 및 10; 5, 6, 55, 8, 9 및 10; 5, 6, 56, 8, 9 및 10; 5, 6, 57, 8, 9 및 10; 5, 6, 58, 8, 9 및 10; 5, 6, 59, 8, 9 및 10; 또는 5, 6, 60, 8, 9 및 10에 제시된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제63항에 있어서, 상기 Vα 및 Vβ는 각각 서열 번호 3 및 4, 66 및 4, 67 및 4, 68 및 4, 69 및 4, 70 및 4, 71 및 4, 72 및 4, 73 및 4, 74 및 4, 75 및 4, 76 및 4, 77 및 4, 78 및 4, 79 및 4, 80 및 4, 81 및 4, 82 및 4, 83 및 4, 84 및 4, 85 및 4, 또는 86 및 4에 제시된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제37항 내지 제45항 및 제48항 내지 제62항 중 어느 한 항에 있어서, 서열 번호 15, 26 또는 92에 제시된 아미노산 서열을 포함하는 α 사슬 불변 영역을 포함하는 α 사슬을 포함하는, 폴리펩타이드.
- 제37항 내지 제50항, 제52항 내지 제54항 및 제56항 내지 제64항 중 어느 한 항에 있어서, 서열 번호 16 또는 17에 제시된 아미노산 서열을 포함하는 β 사슬 불변 영역을 포함하는 β 사슬을 포함하는, 폴리펩타이드.
- TCR의 α 사슬 및 β 사슬을 포함하는 폴리펩타이드로서, 상기 α 사슬은 서열 번호 13, 93 내지 96, 105 내지 118, 120 내지 123, 125 내지 128 및 408 내지 415로 이루어진 군으로부터 선택된 아미노산 서열을 포함하고, 상기 β 사슬은 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제67항에 있어서, 상기 α 사슬은 서열 번호 13, 105, 110, 115, 120, 125, 408 및 412로 이루어진 군으로부터 선택된 아미노산 서열을 포함하고, 상기 β 사슬은 서열 번호 14, 25 및 97 내지 104로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제67항 또는 제68항에 있어서, 상기 α 사슬은 서열 번호 13, 105, 110, 115, 120, 125, 408 및 412로 이루어진 군으로부터 선택된 아미노산 서열을 포함하고, 상기 β 사슬은 서열 번호 14, 97, 99, 101 및 103으로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제37항 내지 제69항 중 어느 한 항에 있어서, 상기 α 사슬 및 상기 β 사슬은 각각 서열 번호 13 및 14; 13 및 25; 13 및 97; 13 및 98; 13 및 99; 13 및 100; 13 및 101; 13 및 102; 13 및 103; 13 및 104; 93 및 14; 93 및 25; 93 및 97; 93 및 98; 93 및 99; 93 및 100; 93 및 101; 93 및 102; 93 및 103; 93 및 104; 94 및 14; 94 및 25; 94 및 97; 94 및 98; 94 및 99; 94 및 100; 94 및 101; 94 및 102; 94 및 103; 94 및 104; 95 및 14; 95 및 25; 95 및 97; 95 및 98; 95 및 99; 95 및 100; 95 및 101; 95 및 102; 95 및 103; 95 및 104; 96 및 14; 96 및 25; 96 및 97; 96 및 98; 96 및 99; 96 및 100; 96 및 101; 96 및 102; 96 및 103; 96 및 104; 105 및 14; 105 및 25; 105 및 97; 105 및 98; 105 및 99; 105 및 100; 105 및 101; 105 및 102; 105 및 103; 105 및 104; 106 및 14; 106 및 25; 106 및 97; 106 및 98; 106 및 99; 106 및 100; 106 및 101; 106 및 102; 106 및 103; 106 및 104; 107 및 14; 107 및 25; 107 및 97; 107 및 98; 107 및 99; 107 및 100; 107 및 101; 107 및 102; 107 및 103; 107 및 104; 108 및 14; 108 및 25; 108 및 97; 108 및 98; 108 및 99; 108 및 100; 108 및 101; 108 및 102; 108 및 103; 108 및 104; 109 및 14; 109 및 25; 109 및 97; 109 및 98; 109 및 99; 109 및 100; 109 및 101; 109 및 102; 109 및 103; 109 및 104; 110 및 14; 110 및 25; 110 및 97; 110 및 98; 110 및 99; 110 및 100; 110 및 101; 110 및 102; 110 및 103; 110 및 104; 111 및 14; 111 및 25; 111 및 97; 111 및 98; 111 및 99; 111 및 100; 111 및 101; 111 및 102; 111 및 103; 111 및 104; 112 및 14; 112 및 25; 112 및 97; 112 및 98; 112 및 99; 112 및 100; 112 및 101; 112 및 102; 112 및 103; 112 및 104; 113 및 14; 113 및 25; 113 및 97; 113 및 98; 113 및 99; 113 및 100; 113 및 101; 113 및 102; 113 및 103; 113 및 104; 114 및 14; 114 및 25; 114 및 97; 114 및 98; 114 및 99; 114 및 100; 114 및 101; 114 및 102; 114 및 103; 114 및 104; 115 및 14; 115 및 25; 115 및 97; 115 및 98; 115 및 99; 115 및 100; 115 및 101; 115 및 102; 115 및 103; 115 및 104; 116 및 14; 116 및 25; 116 및 97; 116 및 98; 116 및 99; 116 및 100; 116 및 101; 116 및 102; 116 및 103; 116 및 104; 117 및 14; 117 및 25; 117 및 97; 117 및 98; 117 및 99; 117 및 100; 117 및 101; 117 및 102; 117 및 103; 117 및 104; 118 및 14; 118 및 25; 118 및 97; 118 및 98; 118 및 99; 118 및 100; 118 및 101; 118 및 102; 118 및 103; 118 및 104; 120 및 14; 120 및 25; 120 및 97; 120 및 98; 120 및 99; 120 및 100; 120 및 101; 120 및 102; 120 및 103; 120 및 104; 121 및 14; 121 및 25; 121 및 97; 121 및 98; 121 및 99; 121 및 100; 121 및 101; 121 및 102; 121 및 103; 121 및 104; 122 및 14; 122 및 25; 122 및 97; 122 및 98; 122 및 99; 122 및 100; 122 및 101; 122 및 102; 122 및 103; 122 및 104; 123 및 14; 123 및 25; 123 및 97; 123 및 98; 123 및 99; 123 및 100; 123 및 101; 123 및 102; 123 및 103; 123 및 104; 125 및 14; 125 및 25; 125 및 97; 125 및 98; 125 및 99; 125 및 100; 125 및 101; 125 및 102; 125 및 103; 125 및 104; 126 및 14; 126 및 25; 126 및 97; 126 및 98; 126 및 99; 126 및 100; 126 및 101; 126 및 102; 126 및 103; 126 및 104; 127 및 14; 127 및 25; 127 및 97; 127 및 98; 127 및 99; 127 및 100; 127 및 101; 127 및 102; 127 및 103; 127 및 104; 128 및 14; 128 및 25; 128 및 97; 128 및 98; 128 및 99; 128 및 100; 128 및 101; 128 및 102; 128 및 103; 128 및 104; 408 및 14; 408 및 25; 408 및 97; 408 및 98; 408 및 99; 408 및 100; 408 및 101; 408 및 102; 408 및 103; 408 및 104; 409 및 14; 409 및 25; 409 및 97; 409 및 98; 409 및 99; 409 및 100; 409 및 101; 409 및 102; 409 및 103; 409 및 104; 410 및 14; 410 및 25; 410 및 97; 410 및 98; 410 및 99; 410 및 100; 410 및 101; 410 및 102; 410 및 103; 410 및 104; 411 및 14; 411 및 25; 411 및 97; 411 및 98; 411 및 99; 411 및 100; 411 및 101; 411 및 102; 411 및 103; 411 및 104; 412 및 14; 412 및 25; 412 및 97; 412 및 98; 412 및 99; 412 및 100; 412 및 101; 412 및 102; 412 및 103; 412 및 104; 413 및 14; 413 및 25; 413 및 97; 413 및 98; 413 및 99; 413 및 100; 413 및 101; 413 및 102; 413 및 103; 413 및 104; 414 및 14; 414 및 25; 414 및 97; 414 및 98; 414 및 99; 414 및 100; 414 및 101; 414 및 102; 414 및 103; 414 및 104; 415 및 14; 415 및 25; 415 및 97; 415 및 98; 415 및 99; 415 및 100; 415 및 101; 415 및 102; 415 및 103; 또는 415 및 104에 제시된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제70항에 있어서, 상기 α 사슬 및 상기 β 사슬은 각각 서열 번호 13 및 14; 13 및 25; 105 및 14; 105 및 25; 110 및 14; 110 및 25; 115 및 14; 115 및 25; 120 및 14; 120 및 25; 125 및 14; 125 및 25; 408 및 14; 408 및 25; 412 및 14; 또는 412 및 25에 제시된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제37항 내지 제71항 중 어느 한 항에 있어서, 상기 α 사슬 및 상기 β 사슬은 각각 서열 번호 13 및 14; 105 및 14; 110 및 14; 115 및 14; 120 및 14; 125 및 14; 408 및 14; 또는 412 및 14에 제시된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제61항 내지 제72항 중 어느 한 항에 있어서, 상기 TCR은 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는, 폴리펩타이드.
- 제37항 내지 제73항 중 어느 한 항에 있어서, 오직 하나의 α 사슬 및 하나의 β 사슬을 포함하는, 폴리펩타이드.
- 제74항에 있어서, 상기 α 사슬은 β 사슬에 N 말단인, 폴리펩타이드.
- 제74항에 있어서, 상기 α 사슬은 β 사슬에 C 말단인, 폴리펩타이드.
- 제37항 내지 제76항 중 어느 한 항에 있어서, α 사슬과 β 사슬 사이에 펩타이드 링커를 추가로 포함하는, 폴리펩타이드.
- 제77항에 있어서, 상기 링커는 단백질분해 절단 부위를 포함하는, 폴리펩타이드.
- 제78항에 있어서, 상기 단백질분해 절단 부위는 퓨린 절단 부위 및/또는 2A 절단 부위를 포함하는, 폴리펩타이드.
- 제79항에 있어서, 상기 퓨린 절단 부위는 서열 번호 29 내지 31 및 131 내지 133으로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제80항에 있어서, 상기 퓨린 절단 부위는 서열 번호 132에 제시된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제79항에 있어서, 상기 2A 절단 부위는 서열 번호 32 내지 38, 130 및 134 내지 140으로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제79항에 있어서, 상기 2A 절단 부위는 돼지 테스코바이러스-1 2A(P2A) 절단 부위를 포함하는, 폴리펩타이드.
- 제83항에 있어서, 상기 P2A 절단 부위는 서열 번호 33 또는 134에 제시된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제78항 내지 제84항 중 어느 한 항에 있어서, 상기 단백질분해 절단 부위는 퓨린 절단 부위 및 2A 절단 부위를 포함하는, 폴리펩타이드.
- 제85항에 있어서, 상기 퓨린 절단 부위는 서열 번호 132에 제시된 아미노산 서열을 포함하고, 상기 2A 절단 부위는 서열 번호 33 또는 134에 제시된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제37항 내지 제86항 중 어느 한 항에 있어서, 상기 폴리펩타이드의 C 말단에서 Gly-Ser을 추가로 포함하는, 폴리펩타이드.
- 제37항 내지 제75항 및 제77항 내지 제87항 중 어느 한 항에 있어서, 서열 번호 28, 141 내지 143, 158 내지 161, 176 내지 179, 194, 196, 212, 214, 230, 232, 248, 250, 416 및 417로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제88항에 있어서,
i) 서열 번호 28, 158, 176, 194, 212, 230, 248 및 416;
ii) 서열 번호 141, 159 및 177; 또는
iii) 서열 번호 142, 160, 178, 196, 214, 232, 250 및 417
로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 폴리펩타이드. - 제37항 내지 제76항 및 제78항 내지 제87항 중 어느 한 항에 있어서, 서열 번호 146 내지 149, 152 내지 155, 164 내지 167, 170 내지 173, 182 내지 185, 188 내지 191, 200, 202, 206, 208, 218, 220, 224, 226, 236, 238, 242, 244, 254, 256, 260, 262 및 418 내지 421로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 폴리펩타이드.
- 제90항에 있어서,
i) 서열 번호 146, 164, 182, 200, 218, 236, 254 및 418;
ii) 서열 번호 147, 165 및 183;
iii) 서열 번호 148, 166, 184, 202, 220, 238, 256 및 419;
iv) 서열 번호 149, 167 및 185;
v) 서열 번호 152, 170, 188, 206, 224, 242, 260 및 420;
vi) 서열 번호 153, 171 및 189;
vii) 서열 번호 154, 172, 190, 208, 226, 244, 262 및 421; 또는
viii) 서열 번호 155, 173 및 191
로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 폴리펩타이드. - 제1항 내지 제91항 중 어느 한 항에 있어서, 상기 TCR은 인간 TCR인, 단리된 TCR 또는 폴리펩타이드.
- 제1항 내지 제92항 중 어느 한 항에 있어서, 상기 TCR은 전장 TCR, 가용성 TCR 또는 단일 사슬 TCR인, 단리된 TCR 또는 폴리펩타이드.
- 제1항 내지 제93항 중 어느 한 항에 있어서, 상기 펩타이드는 HLA-A*0201의 맥락에서 제공되는, 단리된 TCR 또는 폴리펩타이드.
- 제1항 내지 제94항 중 어느 한 항에 있어서, 상기 TCR이 T 세포의 표면에서 발현될 때, 상기 T 세포는 HLA-A*0201의 맥락에서 제공되는 펩타이드를 디스플레이하는 제2 세포와 공배양(co-culture)될 때 활성화되는, 단리된 TCR 또는 폴리펩타이드.
- 제95항에 있어서, 상기 T 세포는 HLA-A*0201의 맥락에서 제공되는 펩타이드를 디스플레이하는 제2 세포와 공배양될 때 (a) CD69 표면 발현의 증가, (b) CD25 표면 발현의 증가, (c) CD107a 표면 발현의 증가, (d) IFNγ 분비의 증가, 또는 (e) 활성화된 T 세포의 핵 인자(nuclear factor of activated T-cell: NFAT) 활성화의 증가를 나타내는, 단리된 TCR 또는 폴리펩타이드.
- 제95항 또는 제96항에 있어서, 상기 T 세포는 HLA-A*0201의 맥락에서 제공되는 펩타이드를 디스플레이하는 제2 세포의 세포자멸사 또는 사멸을 유도하는, 단리된 TCR 또는 폴리펩타이드.
- 제1항 내지 제97항 중 어느 한 항에 있어서, 상기 TCR 또는 상기 폴리펩타이드는 효과기 모이어티에 접합된, 단리된 TCR 또는 폴리펩타이드.
- 제98항에 있어서, 상기 효과기 모이어티는 세포독성제, 세포증식억제제, 독소, 방사성핵종, 검출 가능한 표지 또는 결합 모이어티인, 단리된 TCR 또는 폴리펩타이드.
- 제99항에 있어서, 상기 결합 모이어티는 항체인, 단리된 TCR 또는 폴리펩타이드.
- 제99항에 있어서, 상기 결합 모이어티는 항체 Fc 영역인, 단리된 TCR 또는 폴리펩타이드.
- 단리된 폴리뉴클레오타이드로서, 제1항 내지 제36항 및 제92항 내지 제101항 중 어느 하나의 TCR의,
(a) Vα를 암호화하는 제1 핵산 서열 및/또는 Vβ를 암호화하는 제2 핵산 서열; 또는
(b) α 사슬을 암호화하는 제1 핵산 서열 및/또는 β 사슬을 암호화하는 제2 핵산 서열
을 포함하되, 선택적으로 상기 제1 핵산 서열 및 상기 제2 핵산 서열은 프레임내(in frame)에 있는, 단리된 폴리뉴클레오타이드. - 제102항에 있어서, 상기 제1 핵산 서열은 상기 제2 핵산 서열에 5'인, 폴리뉴클레오타이드.
- 제102항에 있어서, 상기 제1 핵산 서열은 상기 제2 핵산 서열에 3'인, 폴리뉴클레오타이드.
- 제102항 내지 제104항 중 어느 한 항에 있어서, 상기 제1 핵산 서열과 제2 핵산 서열 사이에 펩타이드 링커를 암호화하는 제3 핵산 서열을 추가로 포함하고, 상기 제1 핵산 서열, 제2 핵산 서열 및 제3 핵산 서열은 프레임내에 있는, 폴리뉴클레오타이드.
- 제105항에 있어서, 상기 링커는 단백질분해 절단 부위를 포함하는, 폴리뉴클레오타이드.
- 제106항에 있어서, 상기 단백질분해 절단 부위는 퓨린 절단 부위 및/또는 2A 절단 부위를 포함하는, 폴리뉴클레오타이드.
- 제107항에 있어서, 상기 퓨린 절단 부위는 서열 번호 29 내지 31 및 131 내지 133으로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 폴리뉴클레오타이드.
- 제108항에 있어서, 상기 퓨린 절단 부위는 서열 번호 132에 제시된 아미노산 서열을 포함하는, 폴리뉴클레오타이드.
- 제107항에 있어서, 상기 2A 절단 부위는 서열 번호 32 내지 38, 130 및 134 내지 140으로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는, 폴리뉴클레오타이드.
- 제110항에 있어서, 상기 2A 절단 부위는 돼지 테스코바이러스-1 2A(P2A) 절단 부위를 포함하는, 폴리뉴클레오타이드.
- 제111항에 있어서, 상기 P2A 절단 부위는 서열 번호 33 또는 134에 제시된 아미노산 서열을 포함하는, 폴리뉴클레오타이드.
- 제107항 내지 제112항 중 어느 한 항에 있어서, 상기 단백질분해 절단 부위는 퓨린 절단 부위 및 2A 절단 부위를 포함하는, 폴리뉴클레오타이드.
- 제113항에 있어서, 상기 퓨린 절단 부위는 서열 번호 132에 제시된 아미노산 서열을 포함하고, 상기 2A 절단 부위는 서열 번호 33 또는 134에 제시된 아미노산 서열을 포함하는, 폴리뉴클레오타이드.
- 제102항 내지 제114항 중 어느 한 항에 있어서, 제1 핵산 서열 및 제2 핵산 서열에 3'인 Gly-Ser을 암호화하는 핵산 서열을 추가로 포함하는, 폴리뉴클레오타이드.
- 제102항, 제103항 및 제105항 내지 제115항 중 어느 한 항에 있어서, 서열 번호 28, 141 내지 143, 158 내지 161, 176 내지 179, 194, 196, 212, 214, 230, 232, 248, 250, 416 및 417로 이루어진 군으로부터 선택된 아미노산 서열을 암호화하는, 폴리뉴클레오타이드.
- 제116항에 있어서,
i) 서열 번호 28, 158, 176, 194, 212, 230, 248 및 416;
ii) 서열 번호 141, 159 및 177; 또는
iii) 서열 번호 142, 160, 178, 196, 214, 232, 250 및 417
로 이루어진 군으로부터 선택된 아미노산 서열을 암호화하는, 폴리뉴클레오타이드. - 제102항 및 제104항 내지 제115항 중 어느 한 항에 있어서, 서열 번호 146 내지 149, 152 내지 155, 164 내지 167, 170 내지 173, 182 내지 185, 188 내지 191, 200, 202, 206, 208, 218, 220, 224, 226, 236, 238, 242, 244, 254, 256, 260, 262 및 418 내지 421로 이루어진 군으로부터 선택된 아미노산 서열을 암호화하는, 폴리뉴클레오타이드.
- 제118항에 있어서,
i) 서열 번호 146, 164, 182, 200, 218, 236, 254 및 418;
ii) 서열 번호 147, 165 및 183
iii) 서열 번호 148, 166, 184, 202, 220, 238, 256 및 419;
iv) 서열 번호 149, 167 및 185;
v) 서열 번호 152, 170, 188, 206, 224, 242, 260 및 420;
vi) 서열 번호 153, 171 및 189;
vii) 서열 번호 154, 172, 190, 208, 226, 244, 262 및 421; 또는
viii) 서열 번호 155, 173 및 191
로 이루어진 군으로부터 선택된 아미노산 서열을 암호화하는, 폴리뉴클레오타이드. - 제37항 내지 제101항 중 어느 한 항의 폴리펩타이드를 암호화하는 단리된 폴리뉴클레오타이드.
- 제102항 내지 제120항 중 어느 한 항의 폴리뉴클레오타이드를 포함하는 단리된 벡터.
- 제121항에 있어서, 상기 벡터는 렌티바이러스 벡터, 레트로바이러스 벡터, 아데노바이러스 벡터, 아데노 연관된 바이러스 벡터 및 바큘로바이러스 벡터로 이루어진 군으로부터 선택된 바이러스 벡터인, 단리된 벡터.
- 제102항 내지 제120항 중 어느 한 항의 폴리뉴클레오타이드 또는 제121항 또는 제122항의 벡터를 포함하는 조작된 세포.
- 제1항 내지 제36항 및 제92항 내지 제101항 중 어느 한 항의 TCR을 세포 표면에 제시하는 조작된 세포.
- 제124항에 있어서, 상기 세포는 상기 TCR을 발현하는, 조작된 세포.
- 제123항 내지 제125항 중 어느 한 항에 있어서, 상기 세포는 인간 림프구인, 조작된 세포.
- 제123항 내지 제126항 중 어느 한 항에 있어서, 상기 세포는 T 세포, CD8+ T 세포, CD4+ T 세포, 자연 살해 T(natural killer T: NKT) 세포, 불변 자연 살해 T(invariant natural killer T: iNKT) 세포, 점막 연관된 불변 T(mucosal-associated invariant T: MAiT) 세포 및 자연 살해(NK) 세포로 이루어진 군으로부터 선택되는, 조작된 세포.
- 제1항 내지 제36항 및 제92항 내지 제101항 중 어느 한 항의 단리된 TCR, 제37항 내지 제101항 중 어느 한 항의 폴리펩타이드, 제102항 내지 제120항 중 어느 한 항의 폴리뉴클레오타이드, 제121항 또는 제122항의 벡터, 또는 제123항 내지 제127항 중 어느 한 항의 조작된 세포, 및 약제학적으로 허용 가능한 담체를 포함하는, 약제학적 조성물.
- 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR을 제조하는 방법으로서, 제123항 내지 제127항 중 어느 한 항의 조작된 세포를 배양하여서 상기 폴리뉴클레오타이드가 발현되고 상기 TCR이 제조되는 단계를 포함하는, TCR을 제조하는 방법.
- 제129항의 방법에 의해 제조된 단리된 TCR.
- 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드에 결합하는 TCR을 발현하는 조작된 세포를 제조하는 방법으로서, 세포를 상기 세포로의 상기 벡터의 도입을 허용하는 조건 하에 제121항 또는 제122항의 벡터와 접촉시키는 단계를 포함하는, TCR을 발현하는 조작된 세포를 제조하는 방법.
- 제131항에 있어서, 상기 세포는 인간 림프구인, TCR을 발현하는 조작된 세포를 제조하는 방법.
- 제131항 또는 제132항에 있어서, 상기 세포는 T 세포, CD8+ T 세포, CD4+ T 세포, 자연 살해 T(NKT) 세포, 불변 자연 살해 T(iNKT) 세포, 점막 연관된 불변 T(MAiT) 세포 및 자연 살해(NK) 세포로 이루어진 군으로부터 선택되는, TCR을 발현하는 조작된 세포를 제조하는 방법.
- 대상체에서 서열 번호 1 또는 2에 제시된 아미노산 서열로 이루어진 펩타이드를 디스플레이하는 세포에 대한 면역 반응을 유도하는 방법으로서, 유효량의 제1항 내지 제36항 및 제92항 내지 제101항 중 어느 한 항의 단리된 TCR, 제37항 내지 제101항 중 어느 한 항의 폴리펩타이드, 제102항 내지 제120항 중 어느 한 항의 폴리뉴클레오타이드, 제121항 또는 제122항의 벡터, 또는 제123항 내지 제127항 중 어느 한 항의 조작된 세포, 또는 제128항의 약제학적 조성물을 상기 대상체에게 투여하는 단계를 포함하는, 세포에 대한 면역 반응을 유도하는 방법.
- 대상체에서 암을 치료하는 방법으로서, 유효량의 제1항 내지 제36항 및 제92항 내지 제101항 중 어느 한 항의 단리된 TCR, 제37항 내지 제101항 중 어느 한 항의 폴리펩타이드, 제102항 내지 제120항 중 어느 한 항의 폴리뉴클레오타이드, 제121항 또는 제122항의 벡터, 또는 제123항 내지 제127항 중 어느 한 항의 조작된 세포, 또는 제128항의 약제학적 조성물을 상기 대상체에게 투여하는 단계를 포함하는, 암을 치료하는 방법.
- 제134항 또는 제135항에 있어서, 상기 TCR, 폴리뉴클레오타이드, 벡터, 조작된 세포, 또는 약제학적 조성물은 정맥내 투여되는, 방법.
- 제134항 내지 제136항 중 어느 한 항에 있어서, 상기 대상체에게 추가적인 치료제를 투여하는 단계를 추가로 포함하는, 방법.
- 제137항에 있어서, 상기 추가적인 치료제는 화학치료제, 방사선치료제 또는 관문 표적화제인, 방법.
- 제138항에 있어서, 상기 관문 표적화제는 길항제 항-PD-1 항체, 길항제 항-PD-L1 항체, 길항제 항-PD-L2 항체, 길항제 항-CTLA-4 항체, 길항제 항-TIM-3 항체, 길항제 항-LAG-3 항체, 길항제 항-CEACAM1 항체, 길항제 항-TIGIT 항체, 효능제 항-CD137 항체, 효능제 항-GITR 항체 및 효능제 항-OX40 항체로 이루어진 군으로부터 선택되는, 방법.
- 제137항에 있어서, 상기 추가적인 치료제는 항-PD-1 항체이고, 선택적으로 상기 항-PD-1 항체는 펨브롤리주맙 또는 니볼루맙인, 방법.
- 제137항에 있어서, 상기 추가적인 치료제는 인돌아민-2,3-다이옥시게나제(indoleamine-2,3-dioxygenase: IDO)의 저해제인, 방법.
- 제141항에 있어서, 상기 저해제는 에파카도스타트, F001287, 인독시모드 및 NLG919로 이루어진 군으로부터 선택되는, 방법.
- 제142항에 있어서, 상기 저해제는 에파카도스타트인, 방법.
- 제137항에 있어서, 상기 추가적인 치료제는 백신인, 방법.
- 제144항에 있어서, 상기 백신은 항원 펩타이드와 복합체화된 열 쇼크 단백질을 포함하는 열 쇼크 단백질 펩타이드 복합체(heat shock protein peptide complex: HSPPC)를 포함하는, 방법.
- 제145항에 있어서, 상기 열 쇼크 단백질은 hsc70이고, 종양 연관된 항원 펩타이드와 복합체화되는, 방법.
- 제146항에 있어서, 상기 열 쇼크 단백질은 gp96이고, 종양 연관된 항원 펩타이드와 복합체화되고, 상기 HSPPC는 대상체로부터 얻은 종양으로부터 유래되는, 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762446084P | 2017-01-13 | 2017-01-13 | |
| US62/446,084 | 2017-01-13 | ||
| PCT/US2018/013624 WO2018132739A2 (en) | 2017-01-13 | 2018-01-12 | T cell receptors that bind to ny-eso-1 and methods of use thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20190103226A true KR20190103226A (ko) | 2019-09-04 |
Family
ID=61656335
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197021319A KR20190103226A (ko) | 2017-01-13 | 2018-01-12 | Ny-eso-1에 결합하는 t 세포 수용체 및 이의 사용 방법 |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US11613764B2 (ko) |
| EP (1) | EP3568412A2 (ko) |
| JP (2) | JP2020503883A (ko) |
| KR (1) | KR20190103226A (ko) |
| CN (1) | CN110198954A (ko) |
| AU (1) | AU2018207172B2 (ko) |
| BR (1) | BR112019014510A2 (ko) |
| CA (1) | CA3049016A1 (ko) |
| EA (1) | EA201991696A1 (ko) |
| IL (1) | IL267878A (ko) |
| MA (1) | MA47265A (ko) |
| MX (1) | MX2019008346A (ko) |
| WO (1) | WO2018132739A2 (ko) |
Families Citing this family (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3837373B1 (en) | 2018-08-13 | 2024-06-12 | Rootpath Genomics, Inc. | High throughput cloning of paired bipartite immunoreceptor polynucleotides and applications thereof |
| WO2020086158A2 (en) * | 2018-09-05 | 2020-04-30 | The Regents Of The University Of California | Composition of ny-eso-1-specific t cell receptors restricted on multiple major histocompatibility complex molecules |
| EP3947436A4 (en) | 2019-04-05 | 2022-12-28 | Rootpath Genomics, Inc. | COMPOSITIONS AND METHODS FOR T-CELL RECEPTOR GENE ASSEMBLY |
| AU2020301161B2 (en) | 2019-06-25 | 2023-10-26 | Gilead Sciences, Inc. | FLT3L-Fc fusion proteins and methods of use |
| WO2021003357A1 (en) * | 2019-07-03 | 2021-01-07 | Regeneron Pharmaceuticals, Inc. | Anti-new york esophageal squamous cell carcinoma 1 (ny-eso-1) antigen-binding proteins and methods of use thereof |
| CN114616467A (zh) * | 2019-10-03 | 2022-06-10 | 瑞泽恩制药公司 | 筛选原代人类细胞中的同源t细胞和表位反应性的高通量方法 |
| US11692038B2 (en) | 2020-02-14 | 2023-07-04 | Gilead Sciences, Inc. | Antibodies that bind chemokine (C-C motif) receptor 8 (CCR8) |
| TWI815194B (zh) | 2020-10-22 | 2023-09-11 | 美商基利科學股份有限公司 | 介白素2-Fc融合蛋白及使用方法 |
| US20220389394A1 (en) | 2021-05-18 | 2022-12-08 | Gilead Sciences, Inc. | METHODS OF USING FLT3L-Fc FUSION PROTEINS |
| WO2023077028A1 (en) * | 2021-10-28 | 2023-05-04 | Lyell Immunopharma, Inc. | Enhanced t cell therapy targeting ny-eso-1 |
| CN118139858A (zh) | 2021-10-28 | 2024-06-04 | 吉利德科学公司 | 吡地嗪-3(2h)-酮衍生物 |
| AU2022376954A1 (en) | 2021-10-29 | 2024-05-02 | Gilead Sciences, Inc. | Cd73 compounds |
| US20240124412A1 (en) | 2021-12-22 | 2024-04-18 | Gilead Sciences, Inc. | Ikaros zinc finger family degraders and uses thereof |
| AU2022417491A1 (en) | 2021-12-22 | 2024-05-23 | Gilead Sciences, Inc. | Ikaros zinc finger family degraders and uses thereof |
| TW202340168A (zh) | 2022-01-28 | 2023-10-16 | 美商基利科學股份有限公司 | Parp7抑制劑 |
| AU2023233730A1 (en) | 2022-03-17 | 2024-09-26 | Gilead Sciences, Inc. | Ikaros zinc finger family degraders and uses thereof |
| US20230374036A1 (en) | 2022-04-21 | 2023-11-23 | Gilead Sciences, Inc. | Kras g12d modulating compounds |
| WO2024006929A1 (en) | 2022-07-01 | 2024-01-04 | Gilead Sciences, Inc. | Cd73 compounds |
| US20240254118A1 (en) | 2022-12-22 | 2024-08-01 | Gilead Sciences, Inc. | Prmt5 inhibitors and uses thereof |
| WO2024215754A1 (en) | 2023-04-11 | 2024-10-17 | Gilead Sciences, Inc. | Kras modulating compounds |
| WO2024220917A1 (en) | 2023-04-21 | 2024-10-24 | Gilead Sciences, Inc. | Prmt5 inhibitors and uses thereof |
Family Cites Families (80)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5807715A (en) | 1984-08-27 | 1998-09-15 | The Board Of Trustees Of The Leland Stanford Junior University | Methods and transformed mammalian lymphocyte cells for producing functional antigen-binding protein including chimeric immunoglobulin |
| US6174666B1 (en) | 1992-03-27 | 2001-01-16 | The United States Of America As Represented By The Department Of Health And Human Services | Method of eliminating inhibitory/instability regions from mRNA |
| GB9326253D0 (en) | 1993-12-23 | 1994-02-23 | Smithkline Beecham Biolog | Vaccines |
| US5997873A (en) | 1994-01-13 | 1999-12-07 | Mount Sinai School Of Medicine Of The City University Of New York | Method of preparation of heat shock protein 70-peptide complexes |
| WO1996018105A1 (en) | 1994-12-06 | 1996-06-13 | The President And Fellows Of Harvard College | Single chain t-cell receptor |
| US5580714A (en) | 1995-03-08 | 1996-12-03 | Celox Laboratories, Inc. | Cryopreservation solution |
| US5935576A (en) | 1995-09-13 | 1999-08-10 | Fordham University | Compositions and methods for the treatment and prevention of neoplastic diseases using heat shock proteins complexed with exogenous antigens |
| US6017540A (en) | 1997-02-07 | 2000-01-25 | Fordham University | Prevention and treatment of primary and metastatic neoplastic diseases and infectious diseases with heat shock/stress protein-peptide complexes |
| CA2654522C (en) | 1997-08-29 | 2014-01-28 | Antigenics Inc. | Compositions comprising the adjuvant qs-21 and polysorbate or cyclodextrin as exipient |
| US5948646A (en) | 1997-12-11 | 1999-09-07 | Fordham University | Methods for preparation of vaccines against cancer comprising heat shock protein-peptide complexes |
| GB9809658D0 (en) | 1998-05-06 | 1998-07-01 | Celltech Therapeutics Ltd | Biological products |
| US7049302B1 (en) | 1998-08-10 | 2006-05-23 | Antigenics Inc. | Compositions of CPG and saponin adjuvants and uses thereof |
| IL127142A0 (en) | 1998-11-19 | 1999-09-22 | Yeda Res & Dev | Immune cells having predefined biological specificity |
| US6194137B1 (en) | 1999-04-13 | 2001-02-27 | Organ Recovery Systems, Inc. | Method of cryopreservation of blood vessels by vitrification |
| JP2002541845A (ja) | 1999-04-16 | 2002-12-10 | セルテック セラピューティックス リミテッド | 合成膜貫通成分 |
| AU7072700A (en) | 1999-08-23 | 2001-03-19 | Dana-Farber Cancer Institute, Inc. | Pd-1, a receptor for b7-4, and uses therefor |
| WO2001039722A2 (en) | 1999-11-30 | 2001-06-07 | Mayo Foundation For Medical Education And Research | B7-h1, a novel immunoregulatory molecule |
| JP4317940B2 (ja) | 2001-08-31 | 2009-08-19 | イミュノコア・リミテッド | 物質 |
| EP1456652A4 (en) | 2001-11-13 | 2005-11-02 | Dana Farber Cancer Inst Inc | IMMUNOCELL ACTIVATION MODULATING SUBSTANCES AND USE METHOD THEREFOR |
| US20040014194A1 (en) | 2002-03-27 | 2004-01-22 | Schering Corporation | Beta-secretase crystals and methods for preparing and using the same |
| IL149820A0 (en) | 2002-05-23 | 2002-11-10 | Curetech Ltd | Humanized immunomodulatory monoclonal antibodies for the treatment of neoplastic disease or immunodeficiency |
| FI2206517T3 (fi) | 2002-07-03 | 2023-10-19 | Ono Pharmaceutical Co | Immuunopotentioivia koostumuksia käsittäen anti-PD-L1 -vasta-aineita |
| EP1549748B1 (en) | 2002-10-09 | 2014-10-01 | Immunocore Ltd. | Single chain recombinant t cell receptors |
| ATE514713T1 (de) | 2002-12-23 | 2011-07-15 | Wyeth Llc | Antikörper gegen pd-1 und ihre verwendung |
| US9068234B2 (en) | 2003-01-21 | 2015-06-30 | Ptc Therapeutics, Inc. | Methods and agents for screening for compounds capable of modulating gene expression |
| WO2004078776A2 (en) | 2003-03-04 | 2004-09-16 | Ludwig Institute For Cancer Research | Ny-eso-1 peptides which bind to class ii molecules and uses thereof |
| CA2566363C (en) * | 2004-05-19 | 2014-12-16 | Avidex Ltd | High affinity ny-eso t cell receptor |
| DK1791865T3 (da) | 2004-06-29 | 2010-11-01 | Immunocore Ltd | Celler der udtrykker en modificeret T-cellerecptor |
| US7915036B2 (en) | 2004-09-13 | 2011-03-29 | The United States Of America As Represented By The Secretary, Department Of Health And Human Services | Compositions comprising T cell receptors and methods of use thereof |
| EP2439273B1 (en) | 2005-05-09 | 2019-02-27 | Ono Pharmaceutical Co., Ltd. | Human monoclonal antibodies to programmed death 1(PD-1) and methods for treating cancer using anti-PD-1 antibodies alone or in combination with other immunotherapeutics |
| ES2546333T3 (es) | 2005-07-01 | 2015-09-22 | E. R. Squibb & Sons, L.L.C. | Anticuerpos monoclonales humanos para ligandos 1 (PD-L1) de muerte programada |
| BRPI0812913B8 (pt) | 2007-06-18 | 2021-05-25 | Merck Sharp & Dohme | anticorpos monoclonais ou fragmento de anticorpo para o receptor de morte programada humano pd-1, polinucleotideo, método para produzir os referidos anticorpos ou fragmentos de anticorpos, composição que os compreende e uso dos mesmos |
| GB0712670D0 (en) | 2007-06-29 | 2007-08-08 | King S College London | Isolated peptides and uses thereof |
| MX2010008786A (es) | 2008-02-11 | 2010-12-01 | Curetech Ltd | Anticuerpos monoclonales para tratamiento de tumores. |
| EP2262837A4 (en) | 2008-03-12 | 2011-04-06 | Merck Sharp & Dohme | PD-1 BINDING PROTEINS |
| RS53688B9 (sr) | 2008-07-08 | 2020-01-31 | Incyte Holdings Corp | 1,2,5-oksadiazoli kao inhibitori indoleamin 2,3-dioksigenaze |
| PL2350129T3 (pl) | 2008-08-25 | 2015-12-31 | Amplimmune Inc | Kompozycje antagonistów PD-1 i sposoby stosowania |
| WO2010029435A1 (en) | 2008-09-12 | 2010-03-18 | Isis Innovation Limited | Pd-1 specific antibodies and uses thereof |
| KR102197527B1 (ko) | 2008-09-26 | 2020-12-31 | 다나-파버 캔서 인스티튜트 인크. | 인간 항-pd-1, pd-l1, 및 pd-l2 항체 및 그의 용도 |
| KR20190069615A (ko) | 2008-12-09 | 2019-06-19 | 제넨테크, 인크. | 항-pd-l1 항체 및 t 세포 기능을 향상시키기 위한 그의 용도 |
| WO2010106431A2 (en) | 2009-03-20 | 2010-09-23 | Ludwig Institute For Cancer Research Ltd | High affinity t-cell receptor-like ny-eso-1 peptide antibodies, methods, and uses thereof |
| EP2486049A1 (en) | 2009-10-06 | 2012-08-15 | The Board Of Trustees Of The UniversityOf Illinois | Human single-chain t cell receptors |
| WO2011066389A1 (en) | 2009-11-24 | 2011-06-03 | Medimmmune, Limited | Targeted binding agents against b7-h1 |
| US20130202623A1 (en) | 2010-02-16 | 2013-08-08 | Nicolas Chomont | Pd-1 modulation and uses thereof for modulating hiv replication |
| EP2545078A1 (en) | 2010-03-11 | 2013-01-16 | UCB Pharma, S.A. | Pd-1 antibody |
| US9089520B2 (en) | 2010-05-21 | 2015-07-28 | Baylor College Of Medicine | Methods for inducing selective apoptosis |
| CN117756916A (zh) * | 2010-09-20 | 2024-03-26 | 生物技术细胞和基因治疗公司 | 抗原特异性t细胞受体和t细胞表位 |
| PL2699264T3 (pl) | 2011-04-20 | 2018-08-31 | Medimmune, Llc | Przeciwciała i inne cząsteczki wiążące B7-H1 i PD-1 |
| US8686119B2 (en) | 2011-07-24 | 2014-04-01 | Curetech Ltd. | Variants of humanized immunomodulatory monoclonal antibodies |
| US8920075B2 (en) | 2011-09-01 | 2014-12-30 | Halo Maritime Defense Systems, Inc. | Marine barrier and gate |
| JP6138813B2 (ja) | 2011-11-28 | 2017-05-31 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツングMerck Patent Gesellschaft mit beschraenkter Haftung | 抗pd−l1抗体及びその使用 |
| EP2817318A4 (en) | 2012-02-22 | 2016-04-27 | Univ Pennsylvania | COMPOSITIONS AND METHOD FOR GENERATING A PERSISTENT POPULATION OF T CELLS FOR CANCER TREATMENT |
| EP3828197B1 (en) | 2012-05-22 | 2024-10-02 | The United States of America, as represented by the Secretary, Department of Health and Human Services | Pharmaceutical composition comprising host cells encoding anti-ny-eso-1 t cell receptors |
| WO2013181634A2 (en) | 2012-05-31 | 2013-12-05 | Sorrento Therapeutics Inc. | Antigen binding proteins that bind pd-l1 |
| KR102250696B1 (ko) * | 2012-07-27 | 2021-05-12 | 더 보오드 오브 트러스티스 오브 더 유니버시티 오브 일리노이즈 | T 세포 수용체 조작 |
| JP6403166B2 (ja) | 2012-08-03 | 2018-10-10 | ダナ−ファーバー キャンサー インスティテュート, インコーポレイテッド | 単一抗原抗pd−l1およびpd−l2二重結合抗体およびその使用方法 |
| CN114507282A (zh) | 2012-10-04 | 2022-05-17 | 达纳-法伯癌症研究所公司 | 人单克隆抗-pd-l1抗体和使用方法 |
| AR093984A1 (es) | 2012-12-21 | 2015-07-01 | Merck Sharp & Dohme | Anticuerpos que se unen a ligando 1 de muerte programada (pd-l1) humano |
| CA2906587C (en) * | 2013-03-13 | 2023-02-14 | Health Research, Inc. | Compositions and methods for use of recombinant t cell receptors for direct recognition of tumor antigen |
| CA2910278C (en) | 2013-05-02 | 2021-09-28 | Anaptysbio, Inc. | Antibodies directed against programmed death-1 (pd-1) |
| CN105683217B (zh) | 2013-05-31 | 2019-12-10 | 索伦托治疗有限公司 | 与pd-1结合的抗原结合蛋白 |
| US20160145355A1 (en) | 2013-06-24 | 2016-05-26 | Biomed Valley Discoveries, Inc. | Bispecific antibodies |
| CN104250302B (zh) | 2013-06-26 | 2017-11-14 | 上海君实生物医药科技股份有限公司 | 抗pd‑1抗体及其应用 |
| US10077305B2 (en) | 2013-09-10 | 2018-09-18 | Medimmune Limited | Antibodies against PD-1 and uses thereof |
| CA3080200A1 (en) | 2013-09-13 | 2015-03-19 | Beigene Switzerland Gmbh | Anti-pd1 antibodies and their use as therapeutics and diagnostics |
| EP3060581A4 (en) | 2013-10-25 | 2017-06-07 | Dana-Farber Cancer Institute, Inc. | Anti-pd-l1 monoclonal antibodies and fragments thereof |
| CN104558177B (zh) | 2013-10-25 | 2020-02-18 | 苏州思坦维生物技术股份有限公司 | 拮抗抑制程序性死亡受体pd-1与其配体结合的单克隆抗体及其编码序列与用途 |
| US10344090B2 (en) | 2013-12-12 | 2019-07-09 | Shanghai Hangrui Pharmaceutical Co., Ltd. | PD-1 antibody, antigen-binding fragment thereof, and medical application thereof |
| RS62989B9 (sr) | 2014-01-15 | 2022-07-29 | Kadmon Corporation Llc | Imunomodulatorni agensi |
| TWI680138B (zh) | 2014-01-23 | 2019-12-21 | 美商再生元醫藥公司 | 抗pd-l1之人類抗體 |
| RU2021114500A (ru) | 2014-02-10 | 2021-06-07 | Мерк Патент Гмбх | НАПРАВЛЕННОЕ ИНГИБИРОВАНИЕ TGFβ |
| CA2937750A1 (en) | 2014-02-14 | 2015-08-20 | Bellicum Pharmaceuticals, Inc. | Methods for activating t cells using an inducible chimeric polypeptide |
| ES2753360T3 (es) | 2014-05-29 | 2020-04-08 | Spring Bioscience Corp | Anticuerpos contra PD-L1 y usos de los mismos |
| WO2015195163A1 (en) | 2014-06-20 | 2015-12-23 | R-Pharm Overseas, Inc. | Pd-l1 antagonist fully human antibody |
| TWI693232B (zh) | 2014-06-26 | 2020-05-11 | 美商宏觀基因股份有限公司 | 與pd-1和lag-3具有免疫反應性的共價結合的雙抗體和其使用方法 |
| TWI687438B (zh) | 2014-07-03 | 2020-03-11 | 英屬開曼群島商百濟神州生物科技有限公司 | 抗pd-l1抗體及其作為治療及診斷之用途 |
| CN105330740B (zh) | 2014-07-30 | 2018-08-17 | 珠海市丽珠单抗生物技术有限公司 | 抗pd-1抗体及其应用 |
| PL3177644T3 (pl) | 2014-08-05 | 2021-06-14 | MabQuest SA | Immunologiczne reagenty wiążące do PD-1 |
| PT3186283T (pt) | 2014-08-29 | 2020-02-21 | Hoffmann La Roche | Terapêutica combinada de imunocitocinas de variante de il-2 dirigidas ao tumor e anticorpos contra pd-l1 humano |
| GB201522592D0 (en) * | 2015-12-22 | 2016-02-03 | Immunocore Ltd | T cell receptors |
-
2018
- 2018-01-12 EP EP18711429.3A patent/EP3568412A2/en active Pending
- 2018-01-12 BR BR112019014510-9A patent/BR112019014510A2/pt unknown
- 2018-01-12 JP JP2019538347A patent/JP2020503883A/ja active Pending
- 2018-01-12 AU AU2018207172A patent/AU2018207172B2/en active Active
- 2018-01-12 EA EA201991696A patent/EA201991696A1/ru unknown
- 2018-01-12 WO PCT/US2018/013624 patent/WO2018132739A2/en unknown
- 2018-01-12 MA MA047265A patent/MA47265A/fr unknown
- 2018-01-12 MX MX2019008346A patent/MX2019008346A/es unknown
- 2018-01-12 KR KR1020197021319A patent/KR20190103226A/ko not_active Application Discontinuation
- 2018-01-12 CA CA3049016A patent/CA3049016A1/en active Pending
- 2018-01-12 CN CN201880006628.9A patent/CN110198954A/zh active Pending
-
2019
- 2019-07-07 IL IL267878A patent/IL267878A/en unknown
- 2019-07-15 US US16/512,031 patent/US11613764B2/en active Active
-
2023
- 2023-01-05 JP JP2023000639A patent/JP2023029503A/ja active Pending
- 2023-03-27 US US18/190,954 patent/US20240102044A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| AU2018207172B2 (en) | 2023-10-12 |
| WO2018132739A3 (en) | 2018-09-20 |
| BR112019014510A2 (pt) | 2020-02-18 |
| WO2018132739A2 (en) | 2018-07-19 |
| EA201991696A1 (ru) | 2020-02-05 |
| EP3568412A2 (en) | 2019-11-20 |
| JP2023029503A (ja) | 2023-03-03 |
| CA3049016A1 (en) | 2018-07-19 |
| CN110198954A (zh) | 2019-09-03 |
| MX2019008346A (es) | 2019-09-09 |
| JP2020503883A (ja) | 2020-02-06 |
| US20240102044A1 (en) | 2024-03-28 |
| MA47265A (fr) | 2019-11-20 |
| US20200040358A1 (en) | 2020-02-06 |
| IL267878A (en) | 2019-09-26 |
| US11613764B2 (en) | 2023-03-28 |
| AU2018207172A1 (en) | 2019-07-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11613764B2 (en) | T cell receptors that bind to NY-ESO-1 and methods of use thereof | |
| US11932689B2 (en) | Engineered T cell receptors and immune therapy using the same | |
| EP3177314B1 (en) | T cell immunotherapy specific for wt-1 | |
| JP2019536437A (ja) | Hpv特異的結合分子 | |
| KR20180118783A (ko) | 암에 대한 면역요법에서의 사용을 위하여 형질주입된 t 세포 및 t 세포 수용체 | |
| US20240301025A1 (en) | T cell receptors that bind to mixed lineage leukemia (mll)-specific phosphopeptides and methods of use thereof | |
| KR20210049816A (ko) | 표적 특이적 융합 단백질을 사용하는 tcr 리프로그래밍을 위한 조성물 및 방법 | |
| US20170267737A1 (en) | Glypican-3-specific T-cell receptors and their uses for immunotherapy of hepatocellular carcinoma | |
| ES2959953T3 (es) | Métodos para producir composiciones celulares genéticamente modificadas y composiciones relacionadas | |
| NZ746387A (en) | Transfected t-cells and t-cell receptors for use in immunotherapy against cancers | |
| KR20230159851A (ko) | 치료 세포 조성물의 효력을 결정하는 방법 | |
| Ou et al. | Development of an affinity-enhanced clinical candidate TCR targeting NY-ESO-1 with optimal potency and high specificity | |
| NL2031118B1 (en) | T cell receptors directed against transcription factor wt1 and uses thereof | |
| US20240131155A1 (en) | T cells for use in therapy | |
| US20230192886A1 (en) | Adoptive cell therapy combination treatment and compositions thereof | |
| CA3233480A1 (en) | Modified binding proteins and therapeutic uses thereof | |
| EP3707159A1 (en) | Novel engineered t cell receptors and immune therapy using the same |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |