KR20190053905A - 리포솜 안티센스 올리고뉴클레오타이드와의 병용 요법 - Google Patents
리포솜 안티센스 올리고뉴클레오타이드와의 병용 요법 Download PDFInfo
- Publication number
- KR20190053905A KR20190053905A KR1020197010647A KR20197010647A KR20190053905A KR 20190053905 A KR20190053905 A KR 20190053905A KR 1020197010647 A KR1020197010647 A KR 1020197010647A KR 20197010647 A KR20197010647 A KR 20197010647A KR 20190053905 A KR20190053905 A KR 20190053905A
- Authority
- KR
- South Korea
- Prior art keywords
- cancer
- cml
- administered
- pharmaceutical
- bcr
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1138—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against receptors or cell surface proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
- A61K31/7064—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines
- A61K31/7068—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines having oxo groups directly attached to the pyrimidine ring, e.g. cytidine, cytidylic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/711—Natural deoxyribonucleic acids, i.e. containing only 2'-deoxyriboses attached to adenine, guanine, cytosine or thymine and having 3'-5' phosphodiester links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/127—Liposomes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/31—Chemical structure of the backbone
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/31—Combination therapy
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/32—Special delivery means, e.g. tissue-specific
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/35—Special therapeutic applications based on a specific dosage / administration regimen
Abstract
본 명세서에는 환자에서 암을 치료하는 방법이 제공되며, 이 방법은 상기 환자에서 유효량의 Grb2 핵산의 번역 개시 부위에 혼성화한 뉴클레아제-내성 폴리뉴클레오타이드 및 Bcr-Abl 타이로신 카이나제 저해제(예를 들어, 다사티닙) 또는 사이티딘 유사체(예를 들어, 데시타빈 또는 시타라빈)를 투여하는 단계를 포함한다. 암은 Ph+ 및/또는 Bcr-Abl 양성 만성 골수성 백혈병 또는 급성 골수성 백혈병 또는 골수이형성 증후군일 수 있다.
Description
본 출원은 2017년 4월 19일자로 출원된 미국 가출원 제62/487,277호 및 2016년 9월 16일자로 출원된 제62/395,680호의 우선권 이익을 주장하며, 이들 각각의 전문은 본 명세서에 참고로 포함된다.
기술분야
본 발명은 일반적으로 의학 분야에 관한 것이다. 보다 특별하게는, 본 발명은 Grb2에 지향되는 안티센스 올리고뉴클레오타이드를 포함하는 병용 요법으로 암을 치료하는 것에 관한 것이다.
미국 암 협회(American Cancer Society)는 2015년에, 미국에서 만성 골수성 백혈병(CML)으로 새로 진단된 환자가 약 6,600명이고, CML로부터 약 1,140명이 사망하였다고 추정한다. CML 진단의 평균 연령은 대략 64세이다. 이 경우의 거의 절반은 65세 이상의 사람에서 진단된다. 이러한 유형의 백혈병은 주로 성인에 영향을 미치고, 어린이에서는 희귀하게 인지된다. CML은 만성, 가속기(accelerated), 및 급성 전환기(blast phase)로 구별된다. 대부분의 CML 환자는 그 질환의 만성기에서 진단된다. 만성기의 CML 환자는 치료되지 않으면, 이들은 그 질환의 가속기 및 급성 전환기로 신속하게 진행될 수 있다.
필라델피아 염색체(Ph)는 CML을 갖는 환자의 90% 내지 95%에서 존재한다. 그것은 염색체 9 및 22의 전좌로부터 초래하는데, 이것은 abl 유전자를 bcr 유전자의 3' 단부 상에 배치한다. 이러한 유전자 재배열은 모든 환자, 심지어는 표준 핵형이 Ph 염색체를 검출하지 않는 환자에서도 존재한다. 이러한 염색체 전좌는 키메라 유전자를 생산하는데, 이것은 Ph+ CML 세포에서 p210Bcr-Abl 융합 단백질로서 발현된다. Bcr-Abl 융합 단백질은 하향조절된 타이로신 카이나제 활성도를 가져서, RAS 및 포스파티딜이노시톨-3 카이나제(PI3K) 신호 변환 경로의 활성화를 초래하는데, 이것은 Ph+ 세포의 악성 형질전환, 증식 및 생존으로 이어진다.
Bcr-Abl 융합 단백질을 표적으로 하는 타이로신 카이나제 저해제라고 공지된 약물이 CML 환자를 위한 표준 치료법이다. 그 이유는, Bcr-Abl의 타이로신 카이나제 활성도를 억제하는 것이 Ph+ 세포 증식 및 생존을 감소시키기 때문이다. 제1 세대 타이로신 카이나제 저해제인 이마티닙(Imatinib)(Gleevec(등록상표))은 만성기 및 가속기에서 CML 환자를 위한 표준 치료법이다. 그러나, 급성 전환기에서의 CML 환자는 이마티닙에 반응하지 않는다. 또한, 이마티닙 내성이 일부 CML 만성기 또는 가속기 환자에서 관찰되었다. 제2 세대 타이로신 카이나제 저해제(예를 들어, 다사티닙(dasatinib: Das))은 통상적으로 이마티닙을 허용할 수 없거나 이마티닙에 내성인 CML 환자에게 제공된다. 그러나 CML 환자는, Bcr-Abl 융합 단백질이 T315I 유전자 돌연변이를 채택하면, 이마티닙 또는 제2 세대 타이로신 카이나제 저해제에 반응하지 않을 것이다. 가속기 또는 급성 전환기이거나 또는 타이로신 카이나제 저해제에 내성인 CML 환자를 위한 보다 효과적인 요법의 개발 필요성이 존재한다.
일 실시형태에서, 본 명세서에는 암의 치료를 필요로 하는 환자에서 암을 치료하는 방법이 제공되며, 이 방법은 환자에게, 환자 내의 Grb2 핵산에 혼성화한 뉴클레아제-내성 폴리뉴클레오타이드를 포함하는 유효량의 제1 약제학적 요법 및 Bcr-Abl 타이로신 카이나제 저해제를 포함하는 제2 약제학적 요법을 투여하는 단계를 포함한다. 일부 양상에서, 본 명세서에는 암의 치료를 필요로 하는 환자에서 암을 치료하는 데 사용하기 위한 조성물이 제공되며, 상기 조성물은 환자 내의 Grb2 핵산에 혼성화한 뉴클레아제-내성 폴리뉴클레오타이드를 포함하는 제1 약제학적 요법 및 Bcr-Abl 타이로신 카이나제 저해제를 포함하는 제2 약제학적 요법을 포함한다.
일부 양상에서, 폴리뉴클레오타이드는 Grb2 핵산의 번역 개시 부위에 혼성화한다. 일부 양상에서, 폴리뉴클레오타이드는 8 내지 50개 염기의 길이를 갖는 올리고뉴클레오타이드이다. 일부 양상에서, 폴리뉴클레오타이드는 서열번호 1에 따른 서열을 갖는다. 일부 양상에서, 폴리뉴클레오타이드는 P-에톡시 골격 링키지를 포함한다.
일부 양상에서, 폴리뉴클레오타이드는 리포솜 중에 캡슐화된다. 일부 양상에서, 제1 약제학적 요법은 중성 지질을 추가로 포함한다. 일부 양상에서, 제1 약제학적 요법은 BP1001이다. 일부 양상에서, 제1 약제학적 요법은 전신으로 투여된다. 일부 양상에서, 제1 약제학적 요법은 동맥내 또는 정맥내 투여를 위해 제형화된다. 일부 양상에서, 제1 약제학적 요법은 약 60㎎/㎡ 내지 약 90㎎/㎡의 투여량으로 투여된다. 일부 양상에서, 제1 약제학적 요법은 주당 2회 내지 4회 투여된다.
일부 양상에서, Bcr-Abl 타이로신 카이나제 저해제는 다사티닙, 이마티닙, 닐로티닙(nilotinib), 보수티닙(bosutinib), 포나티닙(ponatinib) 또는 베이프티닙(bafetinib)이다. 일 양상에서, Bcr-Abl 타이로신 카이나제 저해제는 다사티닙이다. 일부 양상에서, 다사티닙은 약 140㎎의 용량으로 투여된다. 일부 양상에서, 다사티닙은 1일 1회 투여된다.
일부 양상에서, 제2 약제학적 요법은 전신으로 투여된다. 일부 양상에서, 제2 약제학적 요법은, 경구, 동맥내 또는 정맥내로 투여된다. 일부 양상에서, 제1 약제학적 요법은 제2 약제학적 요법의 투여 이전에 투여된다.
일부 양상에서, 제1 약제학적 요법 및 제2 약제학적 요법은 동시에 투여된다. 일부 양상에서, 제1 약제학적 요법 및 제2 약제학적 요법은 별개의 경로에 의해서 투여된다.
일부 양상에서, 환자는 인간이다. 일부 양상에서, 환자는 이마티닙으로의 치료에 이전에 실패하였다.
일부 양상에서, 암은 결장직장암, 신경모세포종, 유방암, 췌장암, 뇌암, 폐암, 위암, 혈액암, 피부암, 고환암, 전립선암, 난소암, 간암 또는 식도암, 자궁경부암, 두경부암, 비흑색종 피부암 또는 교모세포종이다. 일부 양상에서, 암은 혈액암이다. 일부 양상에서, 혈액암은 만성 골수성 백혈병(CML), 급성 골수성 백혈병(AML) 또는 골수이형성 증후군(MDS)이다. 일부 양상에서, CML은 가속기 CML 또는 급성 전환기 CML이다. 일부 양상에서, CML 또는 AML은 Bcr-Abl 양성 CML 또는 Bcr-Abl 양성 AML이다. 일부 양상에서, Bcr-Abl 양성 CML 또는 Bcr-Abl 양성 AML은 T315I Bcr-Abl 돌연변이에 대해서 양성이다. 일부 양상에서, CML또는 AML은 필라델피아 염색체-양성 CML 또는 필라델피아 염색체-양성 AML이다.
일 실시형태에서, 본 명세서에는 암 또는 골수이형성 증후군(MDS)의 치료를 필요로 하는 환자에서 암 또는 골수이형성 증후군(MDS)을 치료하는 방법이 제공되며, 이 방법, 환자에게, Grb2 핵산에 혼성화한 뉴클레아제-내성 폴리뉴클레오타이드를 포함하는 유효량의 제1 약제학적 요법 및 사이티딘 유사체를 포함하는 제2 약제학적 요법을 투여하는 단계를 포함한다. 일부 양상에서, 암 또는 골수이형성 증후군(MDS)의 치료를 필요로 하는 환자에서 암 또는 골수이형성 증후군(MDS)을 치료하는 데 사용하기 위한 조성물이 본 명세서에 제공되며, 상기 조성물은 Grb2 핵산에 혼성화한 뉴클레아제-내성 폴리뉴클레오타이드를 포함하는 유효량의 제1 약제학적 요법 및 사이티딘 유사체를 포함하는 제2 약제학적 요법을 포함한다.
일부 양상에서, 폴리뉴클레오타이드는 Grb2 핵산의 번역 개시 부위에 혼성화한다. 일부 양상에서, 폴리뉴클레오타이드는 8 내지 50개 염기의 길이를 갖는 올리고뉴클레오타이드이다. 일부 양상에서, 폴리뉴클레오타이드는 서열번호 1에 따른 서열을 갖는다. 일부 양상에서, 폴리뉴클레오타이드는 P-에톡시 골격 링키지를 포함한다.
일부 양상에서, 폴리뉴클레오타이드는 리포솜 중에 캡슐화된다. 일부 양상에서, 제1 약제학적 요법은 중성 지질을 추가로 포함한다. 일부 양상에서, 제1 약제학적 요법은 BP1001이다. 일부 양상에서, 제1 약제학적 요법은 전신으로 투여된다. 일부 양상에서, 제1 약제학적 요법은 동맥내 또는 정맥내 투여를 위해 제형화된다. 일부 양상에서, 제1 약제학적 요법은 약 60㎎/㎡ 내지 약 90㎎/㎡의 투여량으로 투여된다. 일부 양상에서, 제1 약제학적 요법은 주당 2회 내지 4회 투여된다.
일부 양상에서, 사이티딘 유사체는 데시타빈, 시타라빈 또는 아자시티딘이다. 일 양상에서, 사이티딘 유사체는 데시타빈이다. 일 양상에서, 사이티딘 유사체는 시타라빈이다. 일부 양상에서, 시타라빈은 약 20㎎의 투여량으로 투여된다. 일부 양상에서, 시타라빈은 1일 2회 투여된다. 일부 양상에서, 시타라빈은 피하로 투여된다.
일부 양상에서, 제1 약제학적 요법은 제2 약제학적 요법의 투여 이전에 투여된다. 일부 양상에서, 제1 약제학적 요법 및 제2 약제학적 요법은 동시에 투여된다. 일부 양상에서, 제2 약제학적 요법은 제1 약제학적 요법의 투여 이전에 투여된다. 일부 양상에서, 제1 약제학적 요법 및 제2 약제학적 요법은 별개의 경로에 의해서 투여된다.
일부 양상에서, 환자는 인간이다.
일부 양상에서, 암은 결장직장암, 신경모세포종, 유방암, 췌장암, 뇌암, 폐암, 위암, 혈액암, 피부암, 고환암, 전립선암, 난소암, 간암 또는 식도암, 자궁경부암, 두경부암, 비흑색종 피부암 또는 교모세포종이다. 일부 양상에서, 암은 혈액암이다. 일부 양상에서, 혈액암은 만성 골수성 백혈병(CML), 급성 골수성 백혈병(AML) 또는 골수이형성 증후군(MDS)이다. 일부 양상에서, CML은 가속기 CML 또는 급성 전환기 CML이다. 일부 양상에서, CML 또는 AML은 Bcr-Abl 양성 CML 또는 Bcr-Abl 양성 AML이다. 일부 양상에서, Bcr-Abl 양성 CML 또는 Bcr-Abl 양성 AML은 T315I Bcr-Abl 돌연변이에 대해서 양성이다. 일부 양상에서, CML또는 AML은 필라델피아 염색체-양성 CML 또는 필라델피아 염색체-양성 AML이다.
일 실시형태에서, GRB2 폴리뉴클레오타이드 유전자 산물에 혼성화한 올리고뉴클레오타이드의 집단을 포함하는 조성물이 제공된다. 일부 양상에서, 집단의 올리고뉴클레오타이드는 포스페이트 골격 링키지를 통해서 함께 연결된 뉴클레오사이드 분자로 구성되며, 여기서 각각의 올리고뉴클레오타이드 내의 포스페이트 골격 링키지 중 적어도 하나는 P-에톡시 골격 링키지이고, 여기서 각각의 올리고뉴클레오타이드 내의 포스페이트 골격 링키지 중 80% 이하는 P-에톡시 골격 링키지이다. 일부 양상에서, 각각의 올리고뉴클레오타이드 내의 포스페이트 골격 링키지 중 적어도 하나는 포스포다이에스터 골격 링키지이다. 일부 양상에서, 집단의 올리고뉴클레오타이드는 서열번호 1에 따른 서열을 포함한다. 다양한 양상에서, 집단의 올리고뉴클레오타이드는 Grb2 단백질의 발현을 저해한다. 일부 양상에서, 조성물은 동결건조된다.
일부 양상에서, 포스페이트 골격 링키지 중 10% 내지 80%는 P-에톡시 골격 링키지이거나; 포스페이트 골격 링키지 중 20% 내지 80%는 P-에톡시 골격 링키지이거나; 포스페이트 골격 링키지 중 30% 내지 80%는 P-에톡시 골격 링키지이거나; 포스페이트 골격 링키지 중 40% 내지 80%는 P-에톡시 골격 링키지이거나; 포스페이트 골격 링키지 중 50% 내지 80%는 P-에톡시 골격 링키지이거나; 또는 포스페이트 골격 링키지 중 60% 내지 70% 또는 그들 내의 도출될 수 있는 임의의 범위는 P-에톡시 골격 링키지이다. 일부 양상에서, 포스페이트 골격 링키지 중 20% 내지 90%는 포스포다이에스터 골격 링키지이거나; 포스페이트 골격 링키지 중 20% 내지 80%는 포스포다이에스터 골격 링키지이거나; 포스페이트 골격 링키지 중 20% 내지 70%는 포스포다이에스터 골격 링키지이거나; 포스페이트 골격 링키지 중 20% 내지 60%는 포스포다이에스터 골격 링키지이거나; 포스페이트 골격 링키지 중 20% 내지 50%는 포스포다이에스터 골격 링키지이거나; 또는 포스페이트 골격 링키지 중 30% 내지 40% 또는 그들 내의 도출될 수 있는 임의의 범위는 포스포다이에스터 골격 링키지이다. 다양한 양상에서, 포스페이트 골격 링키지 중 적어도 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 60%, 65%, 70%, 75%, 80%, 85%, 90% 또는 95% 또는 그들 내의 임의의 값은 P-에톡시 골격 링키지이다. 다양한 양상에서, 포스페이트 골격 링키지 중 최대 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% 또는 95% 또는 그들 내의 임의의 값은 포스포다이에스터 골격 링키지이다. 특정 양상에서, 포스포다이에스터 골격 링키지는 올리고뉴클레오타이드 전체에 분포된다. 이와 같이, 올리고뉴클레오타이드는 키메라 분자가 아니다. 일부 양상에서, 올리고뉴클레오타이드는 포스포로티오에이트 골격 링키지를 포함하지 않는다.
일부 양상에서, 집단의 올리고뉴클레오타이드는 7 내지 30개 뉴클레오타이드 범위의 크기를 갖는다. 특정 양상에서, 집단의 올리고뉴클레오타이드는 12 내지 25개 뉴클레오타이드 범위의 크기를 갖는다. 다양한 양상에서, 집단의 올리고뉴클레오타이드는 적어도 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 또는 30개 뉴클레오타이드의 크기를 갖는다. 크기 범위는 그 집단 내의 올리고뉴클레오타이드의 평균 크기일 수 있다.
일부 양상에서, 집단의 올리고뉴클레오타이드는 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 또는 30개 뉴클레오타이드의 평균 크기를 갖고, 여기서 각각, 각각의 올리고뉴클레오타이드에서 포스페이트 골격 링키지 중 5, 6, 7, 8, 8, 9, 10, 11, 11, 12, 13, 14, 15, 15, 16, 17, 18, 19, 20, 20, 21, 22, 23 또는 24개 이하는 P-에톡시 골격 링키지이다. 일부 양상에서, 집단의 올리고뉴클레오타이드는 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 또는 30개 뉴클레오타이드의 평균 크기를 갖고, 각각, 각각의 올리고뉴클레오타이드에서 포스페이트 골격 링키지 중 적어도 2, 2, 2, 2, 3, 3, 3, 3, 4, 4, 4, 4, 4, 5, 5, 5, 5, 5, 5, 6, 6, 6, 6 또는 6개는 포스포다이에스터 골격 링키지이다.
일부 양상에서, 올리고뉴클레오타이드의 집단은 단일 종의 올리고뉴클레오타이드를 포함한다. 다른 양상에서, 올리고뉴클레오타이드의 집단은 적어도 2종의 올리고뉴클레오타이드를 포함한다. 단일 종의 올리고뉴클레오타이드는, 분자 내의 상이한 위치에 P-에톡시 링키지를 갖거나 갖지 않는 것을 제외하고는 동일한 뉴클레오타이드 서열을 가질 수 있다. 이와 같이, 집단은 집단의 올리고뉴클레오타이드 중에서 뉴클레오타이드 서열과 관련하여 균질할 수 있거나 포스포다이에스터 골격 링키지의 분포와 관련하여 불균질할 수 있다. 또한, 집단은 집단의 올리고뉴클레오타이드 중에서 P-에톡시 골격 링키지 및 포스포다이에스터 골격 링키지의 수와 관련하여 불균질할 수 있다. 비제한적인 예로서, 집단의 올리고뉴클레오타이드의 제1 부분은 70%의 P-에톡시 링키지 및 30%의 포스포다이에스터 링키지를 가질 수 있는 반면, 집단의 올리고뉴클레오타이드의 제2 부분은 60%의 P-에톡시 링키지 및 40%의 포스포다이에스터 링키지를 가질 수 있다. 일부 양상에서, 올리고뉴클레오타이드의 집단은 안티센스 올리고뉴클레오타이드, 소간섭 RNA(siRNA), 마이크로RNA(miRNA) 또는 piwiRNA(piRNA)를 포함한다.
다양한 양상에서, 조성물은 인지질을 추가로 포함한다. 일부 양상에서, 인지질 및 올리고뉴클레오타이드는 약 5:1 내지 약 100:1의 몰비로 존재한다. 일부 양상에서, 올리고뉴클레오타이드 및 인지질은 올리고뉴클레오타이드-지질 복합체, 예를 들어, 리포솜 복합체 등을 형성한다. 일부 양상에서, 리포솜 중 적어도 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99%는 직경이 5마이크론 미만이다. 일부 양상에서, 올리고뉴클레오타이드의 집단은 리포솜의 집단에 혼입된다.
일부 양상에서, 인지질은 비하전되거나 또는 생리 pH에서 중성 전하를 갖는다. 일부 양상에서, 인지질은 중성 인지질이다. 특정 양상에서, 중성 인지질은 포스파티딜콜린이다. 특정 양상에서, 중성 인지질은 다이올레일포스파티딜 콜린이다. 일부 양상에서, 인지질은 콜레스테롤이 본질적으로 존재하지 않는다.
일 실시형태에서, 본 실시형태의 올리고뉴클레오타이드 및 인지질 및 약제학적으로 허용 가능한 담체의 조성물을 포함하는 약제학적 조성물이 제공된다. 일부 양상에서, 조성물은 화학치료제를 추가로 포함한다.
일 실시형태에서, 세포를 본 실시형태의 올리고뉴클레오타이드 조성물과 접촉시키는 단계를 포함하는, 세포에서 Grb2 단백질의 발현 수준을 감소시키는 방법이 제공된다. 일부 양상에서, 세포는 포유동물 세포이다. 일부 양상에서, 세포는 암 세포이다.
일 실시형태에서, 세포를 본 실시형태의 약제학적 조성물과 접촉시키는 단계를 포함하는, 치료적 유효량의 올리고뉴클레오타이드를 세포에 전달하는 방법이 제공된다. 일부 양상에서, 방법은 이상증식(hyperplasia), 암, 자가면역 질환 또는 전염성 질환의 치료 방법이다.
일 실시형태에서, 대상체에게 치료적 유효량의 본 실시형태의 약제학적 조성물을 투여하는 단계를 포함하는, 암, 자가면역 질환 또는 전염성 질환을 갖는 대상체를 치료하는 방법이 제공된다. 일부 양상에서, 대상체는 인간이다. 일부 양상에서, 암은 방광암, 혈액암, 림프종암, 췌장암, 골암, 골수암, 뇌암, 유방암, 결장암, 식도암, 위암, 두경부암, 신장암, 간암, 폐암, 전립선암, 피부암, 고환암, 설암, 난소암 또는 자궁암이다. 본 발명의 방법으로 치료될 수 있는 종양은 흑색종, 전립선암, 난소암, 유방암, 유선암, 두경부 편평 세포암, 신장 유두 세포 암종, 담낭암, 직장암, 췌장암, 폐암, 결장암, 신경교종, 성상세포종, 전형적 호지킨 림프종, 및 민무늬근 종양, 뿐만 아니라 교모세포종으로부터의 세포, 골수 줄기세포, 조혈 세포, 골아세포, 상피 세포, 섬유모세포, 뿐만 아니라 아폽토시스(apoptosis)를 겪고, 종양 세포에 대한 내성 또는 이의 퇴행을 유도하는 임의의 다른 종양 세포를 포함하지만 이들로 제한되지 않는다. 일부 양상에서, 자가면역 질환은 홍반성 루푸스, 척추관절증, 쇼그렌병, 크론병, 진성 당뇨병, 다발성 경화증 또는 류마티스성 관절염이다. 일부 양상에서, 전염성 질환은 박테리아 감염, 진균 감염, 바이러스 감염 또는 기생충 감염이다. 일부 양상에서, 조성물은 피하, 정맥내 또는 복강내로 투여된다. 일부 양상에서, 방법은 적어도 제2 항암 요법을 대상체에게 투여하는 단계를 추가로 포함한다. 일부 양상에서, 제2 항암 요법은 수술 요법, 화학요법, 방사선 요법, 한랭요법, 호르몬 요법, 면역요법 또는 사이토카인 요법이다. 일부 양상에서, 조성물의 투여는 환자에서 Grb2 단백질의 발현을 감소시킨다.
"포획하다(entrap)", "캡슐화하다(encapsulate)", 및 "혼입하다"는 관심대상 작용제와의 회합 또는 그 주변에서의 회합에 의해서 용액 중으로의 자유 확산에 대한 장애를 형성하는 지질 또는 리포솜을 지칭하며, 예를 들어, 리포솜은 지질 층 내부에 또는 지질 층 내부 또는 사이의 수성 구획 내에 작용제를 캡슐화할 수 있다. 특정 실시형태에서, 조성물은 약제학적으로 허용 가능한 담체에 포함된다. 약제학적으로 허용 가능한 담체는 인간 대상체 또는 환자에 대한 투여를 위해서 제형화될 수 있다.
특정 실시형태에서, 지질 성분은 본질적으로 중성 전하를 갖는데, 그 이유는 그것이 중성 인지질 또는 순 중성 전하를 포함하기 때문이다. 특정 양상에서 중성 인지질은 포스파티딜콜린, 예컨대, DOPC, 난(egg) 포스파티딜콜린("EPC"), 다이라우로일포스파티딜콜린("DLPC"), 다이미리스토일포스파티딜콜린("DMPC"), 다이팔미토일포스파티딜콜린("DPPC"), 다이스테아로일포스파티딜콜린("DSPC"), 다이리놀레일포스파티딜콜린, 1,2-다이아라키도일-sn-글리세로-3-포스포콜린("DAPC"), 1,2-다이에이코센오일-sn-글리세로-3-포스포콜린("DEPC"), 1-미리스토일-2-팔미토일 포스파티딜콜린("MPPC"), 1-팔미토일-2-미리스토일 포스파티딜콜린("PMPC"), 1-팔미토일-2-스테아로일 포스파티딜콜린("PSPC"), 1-스테아로일-2-팔미토일 포스파티딜콜린("SPPC"), 1-팔미토일-2-올레일 포스파티딜콜린("POPC"), 1-올레일-2-팔미토일 포스파티딜콜린("OPPC") 또는 라이소포스파티딜콜린일 수 있다. 다른 양상에서 중성 인지질은 포스파티딜에탄올아민, 예컨대, 다이올레일포스파티딜에탄올아민("DOPE"), 다이스테아로일포스파티딜에탄올아민("DSPE"), 다이미리스토일 포스파티딜에탄올아민("DMPE"), 다이팔미토일 포스파티딜에탄올아민("DPPE"), 팔미토일올레일 포스파티딜에탄올아민("POPE") 또는 라이소포스파티딜에탄올아민일 수 있다. 특정 실시형태에서, 인지질 성분은 1, 2, 3, 4, 5, 6, 7, 8 또는 그 초과의 부류 또는 유형의 중성 인지질을 포함할 수 있다. 다른 실시형태에서, 인지질 성분은 2, 3, 4, 5, 6 또는 그 초과의 부류 또는 유형의 중성 인지질 포함할 수 있다.
특정 실시형태에서, 지질 성분은 본질적으로 중성 전하를 가질 수 있는데, 그 이유는 그것이 양으로 하전된 지질 및 음으로 하전된 지질을 포함한다. 지질 성분은 중성으로 하전된 지질(들) 또는 인지질(들)을 추가로 포함할 수 있다. 양으로 하전된 지질은 양으로 하전된 인지질일 수 있다. 음으로 하전된 지질은 음으로 하전된 인지질일 수 있다. 음으로 하전된 인지질은 포스파티딜세린, 예컨대, 다이미리스토일 포스파티딜세린("DMPS"), 다이팔미토일 포스파티딜세린("DPPS") 또는 뇌 포스파티딜세린("BPS")일 수 있다. 음으로 하전된 인지질은 포스파티딜글리세롤, 예컨대, 다이라우로일포스파티딜글리세롤("DLPG"), 다이미리스토일포스파티딜글리세롤("DMPG"), 다이팔미토일포스파티딜글리세롤("DPPG"), 다이스테아로일포스파티딜글리세롤("DSPG") 또는 다이올레일포스파티딜글리세롤("DOPG")일 수 있다. 특정 실시형태에서, 조성물은 콜레스테롤 또는 폴리에틸렌글리콜 (PEG)을 추가로 포함한다. 다른 실시형태에서, 조성물은 콜레스테롤이 본질적으로 존재하지 않는다. 특정 실시형태에서, 인지질은 자연 발생 인지질이다. 다른 실시형태에서, 인지질은 합성 인지질이다.
리포솜은 1종 이상의 인지질로 제조될 수 있되, 단 지질 재료는 실질적으로 비하전되어야 한다. 조성물은 음이온성 및 양이온성 인지질 및 콜레스테롤이 실질적으로 존재하지 않는 것이 중요하다. 적합한 인지질은 포스파티딜콜린 및 관련 기술 분야의 통상의 기술자에게 널리 공지된 다른 것을 포함한다.
본 명세서에서 사용되는 바와 같이, 명시된 성분과 관련하여, "본질적으로 함유하지 않는"은 명시된 성분 중 어느 것도 조성물 중에서 의도적으로 제형화되지 않고/않거나 오염물로서 또는 미량으로만 존재한다는 것을 의미하도록 본 명세서에서 사용된다. 조성물의 임의의 의도되지 않은 오염물로부터 초래된 명시된 성분의 총량은 따라서 양호하게는 0.05% 미만, 바람직하게는 0.01% 미만이다. 표준 분석 방법을 사용하여 명시된 성분의 어느 양도 검출되지 않을 수 있는 조성물이 가장 바람직하다.
본 명세서에서 사용되는 바와 같이, 단수 표현은 하나 이상을 의미할 수 있다. 본 명세서에서 청구범위(들)에 사용되는 바와 같이, 단어 "포함하는"과 관련하여 사용되는 경우, 단수 표현은 하나 또는 하나 초과를 의미할 수 있다.
청구범위에서 용어 "또는"의 사용은 단지 대안을 명확하게 제시하지 않거나 또는 그 대안이 서로 배타적이지 않는 한 "및/또는"을 의미하는 데 사용되지만, 본 개시내용은 단지 대안 및 "및/또는"을 지칭하는 정의를 뒷받침한다. 본 명세서에서 사용되는 바와 같이 "또 다른"은 적어도 제2 또는 그 초과를 의미할 수 있다.
본 출원 전체에서, 용어 "약"은 값이 장치에 대한 고유한 오차 변동, 그 값을 결정하기 위해서 사용되는 방법 또는 연구 대상체 사이에 존재하는 변동을 포함한다는 것을 나타내는 데 사용된다.
본 발명의 다른 목적, 특징부 및 이점은 하기 상세한 설명으로부터 자명할 것이다. 그러나 상세한 설명 및 구체적인 예는, 본 발명의 바람직한 실시형태를 제시하면서, 단지 예시의 방식에 의해서 제공되는데, 그 이유는 본 발명의 사상 및 범주 내의 다양한 변화 및 변형이 이러한 상세한 설명으로부터 관련 기술 분야의 통상의 기술자에게 자명할 것이기 때문이다.
하기 도면은 본 명세서의 일부를 형성하고, 본 발명의 특정 양상을 추가로 설명하기 위해서 포함된다. 본 발명은 본 명세서에 제시된 구체적인 실시형태의 상세한 설명과 조합하여 이러한 도면 중 하나 이상을 참고로 보다 양호하게 이해될 수 있다.
도 1는 환자의 혈장에서의 Grb2 안티센스 올리고의 농도를 나타낸 도면. 혈장에서 BP1001 수준은 이중 지수적으로(bi-exponentially) 감소되었다. 실선은 60㎎/㎡이 투여된 것이고; 점선은 90㎎/㎡이 투여된 것이었다.
도 2는 난치성/재발성 AML 환자에서 BP1001 + 저용량 Ara-C가 골수 블라스트를 감소시켰다는 것을 나타낸 도면.
도 3은 연구 설계의 개략도.
도 4는 타이로신 카이나제 신호를 전달하는 데 있어서의 GRB2의 중요한 역할을 도시한 다이어그램.
도 5A 내지 도 5B는 Grb2 단백질의 생산의 선택적 저해를 나타낸 도면. BV173(도 5A) 및 ALL-1(도 5B) 세포를 4 내지 8μM의 L-Grb2 안티센스 올리고 및 L-대조군 올리고와 함께 인큐베이션시켰다. 배양 3일 후, 단백질-함유 층을 준비하고, SDS-PAGE에 적용하고, 나이트로셀룰로스 막에 전달하였다. 블롯을 절편으로 절단하고, Grb2(표적) 또는 Crk1(대조군) 단백질에 대해서 특이적인 항체와 함께 인큐베이션시켰다.
도 6A 내지 도 6B는 백혈병의 마우스 모델에서의 BP1001의 활성도를 나타낸 도면. 도 6A는 32Dp210 BCR-ABL 양성 백혈병 이종이식편을 보유한 마우스를 15㎎/㎏/용량의 BP1001로 처리한 것을 나타낸 도면. 도 6B는 32Dp210 BCR-ABL 양성 백혈병 세포를 보유한 마우스를 5, 10, 또는 15㎎/㎏/용량의 BP1001로 처리한 것을 나타낸 도면.
도 7A 내지 도 7C은 BP1001 및 다사티닙 투여의 시기 및 순서의 효과를 나타낸 도면. 도 7A는 다사티닙을 투여하기 전에 BP1001로의 1시간 사전치료를 나타낸다. 도 7B는 BP1001을 투여하기 전에 다사티닙으로의 1일 사전치료를 나타낸다. 도 7C는 다사티닙을 투여하기 전에 BP1001로의 1일 사전치료를 나타낸다.
도 8A 내지 도 8D는 BP1001이 다사티닙 세포사 유도를 향상시킨다는 것을 나타내는 도면. 도 8A는 서브-G1기(sub-G1 phase)의 세포의 백분율을 나타낸 도면. 도 8B는 G1기의 세포의 백분율을 나타낸 도면. 도 8C는 S기의 세포의 백분율을 나타낸 도면. 도 8D는 G2/M기의 세포의 백분율을 나타낸 도면.
도 9A 내지 도 9B는 BP1001 사전치료가 다사티닙 및 닐로티닙 세포사 유도를 향상시킨다는 것을 나타내는 도면. 도 9A는 BP1001로의 사전치료 후에 서브-G1기의 세포의 백분율을 나타낸 도면. 도 9B는 타이로신 카이나제 저해제로의 사전치료 후에 서브-G1기의 세포의 백분율을 나타낸 도면.
도 1는 환자의 혈장에서의 Grb2 안티센스 올리고의 농도를 나타낸 도면. 혈장에서 BP1001 수준은 이중 지수적으로(bi-exponentially) 감소되었다. 실선은 60㎎/㎡이 투여된 것이고; 점선은 90㎎/㎡이 투여된 것이었다.
도 2는 난치성/재발성 AML 환자에서 BP1001 + 저용량 Ara-C가 골수 블라스트를 감소시켰다는 것을 나타낸 도면.
도 3은 연구 설계의 개략도.
도 4는 타이로신 카이나제 신호를 전달하는 데 있어서의 GRB2의 중요한 역할을 도시한 다이어그램.
도 5A 내지 도 5B는 Grb2 단백질의 생산의 선택적 저해를 나타낸 도면. BV173(도 5A) 및 ALL-1(도 5B) 세포를 4 내지 8μM의 L-Grb2 안티센스 올리고 및 L-대조군 올리고와 함께 인큐베이션시켰다. 배양 3일 후, 단백질-함유 층을 준비하고, SDS-PAGE에 적용하고, 나이트로셀룰로스 막에 전달하였다. 블롯을 절편으로 절단하고, Grb2(표적) 또는 Crk1(대조군) 단백질에 대해서 특이적인 항체와 함께 인큐베이션시켰다.
도 6A 내지 도 6B는 백혈병의 마우스 모델에서의 BP1001의 활성도를 나타낸 도면. 도 6A는 32Dp210 BCR-ABL 양성 백혈병 이종이식편을 보유한 마우스를 15㎎/㎏/용량의 BP1001로 처리한 것을 나타낸 도면. 도 6B는 32Dp210 BCR-ABL 양성 백혈병 세포를 보유한 마우스를 5, 10, 또는 15㎎/㎏/용량의 BP1001로 처리한 것을 나타낸 도면.
도 7A 내지 도 7C은 BP1001 및 다사티닙 투여의 시기 및 순서의 효과를 나타낸 도면. 도 7A는 다사티닙을 투여하기 전에 BP1001로의 1시간 사전치료를 나타낸다. 도 7B는 BP1001을 투여하기 전에 다사티닙으로의 1일 사전치료를 나타낸다. 도 7C는 다사티닙을 투여하기 전에 BP1001로의 1일 사전치료를 나타낸다.
도 8A 내지 도 8D는 BP1001이 다사티닙 세포사 유도를 향상시킨다는 것을 나타내는 도면. 도 8A는 서브-G1기(sub-G1 phase)의 세포의 백분율을 나타낸 도면. 도 8B는 G1기의 세포의 백분율을 나타낸 도면. 도 8C는 S기의 세포의 백분율을 나타낸 도면. 도 8D는 G2/M기의 세포의 백분율을 나타낸 도면.
도 9A 내지 도 9B는 BP1001 사전치료가 다사티닙 및 닐로티닙 세포사 유도를 향상시킨다는 것을 나타내는 도면. 도 9A는 BP1001로의 사전치료 후에 서브-G1기의 세포의 백분율을 나타낸 도면. 도 9B는 타이로신 카이나제 저해제로의 사전치료 후에 서브-G1기의 세포의 백분율을 나타낸 도면.
I.
성장 인자 수용체-결합 단백질 2(Grb2)
grb2 유전자는 백혈병에서 복제되는 영역인 인간 염색체 영역 17q22-qter에 매핑되어 있는데, 이것은 grb2 유전자 산물의 증가된 카피 수를 초래할 수 있다. Grb2는 뮤린 조혈 세포의 형질전환 및 높은 수준의 종양발생 타이로신 카이나제를 발현하는 인간 백혈병 세포의 증식에 중요하기 때문에, Grb2의 저해는 백혈병의 자연 이력에 중요한 영향을 가질 수 있다.
Grb2는 종양발생 타이로신 카이나제를 이의 하류 신호전달 분자, 예컨대, ERK 및 AKT(이것은 세포 증식 및 생존의 중요한 조절인자임)와 연결한다. Grb2 어댑터 단백질은 2개의 Src 상동성 3(Src homology 3: SH3) 도메인에 의해서 플랭킹된 Src 상동성 2(SH2) 도메인을 함유한다. Grb2는 이의 SH2 도메인을 사용하여 활성화된 타이로신 카이나제, 예컨대, Bcr-Abl, c-Cbl, 및 표피 성장 인자 수용체(EGFR)에서 발견되는 포스포타이로신 잔기에 결합하는 반면, 이것은 이의 SH3 도메인을 사용하여 프롤린-풍부 모티프, 예컨대, 구아닌 뉴클레오타이드 교환 인자, SOS(Son of Sevenless)에서 발견되는 것에 결합한다. GTPase 단백질인, RAS는 GTP에 결합되는 경우 활성화되고, GDP에 결합되는 경우 불활성화된다. 구아닌 뉴클레오타이드 교환 인자, 예컨대, SOS는 RAS 상에서 GTP에 대한 GDP의 교환을 증가시킨다. 성장 인자 자극 시, Grb2-SOS 복합체는 혈장막에 모집되고, 여기서 그것은 그의 SH2 도메인을 사용하여 성장 인자-자극된 타이로신 카이나제 수용체에 결합한다. 이러한 결합은 SOS가 혈장막에 국지화된 RAS에 인접하게 한다. 따라서 그것은 RAS 활성을 자극할 수 있다. 이어서 RAS 활성화는 결국 다양한 세포 과정의 조절에 중요한 다수의 하류 신호전달 경로를 활성화시킨다(Tari, 2001a).
가장 널리 공지된 RAS 신호전달 경로는 미토겐 활성화 단백질(MAP) 카이나제 캐스케이드이다. 이러한 캐스케이드에서, RAS는 GTP-의존적 방식으로 RAF에 결합한다. 이러한 결합은 RAF 활성화로 이어진다. 활성화된 RAF는 (미토겐 활성화 단백질 카이나제) MEK를 인산화시키고, 이것은 결국 ERK1,2를 인산화 및 활성화시킨다(세포외 조절된 카이나제 1,2). 이어서, 활성화된 ERK1,2는 핵으로 전좌되고, 인산화 전사 인자(예를 들어, ELK-1 및 MYC)에 의해서 전사를 활성화시킨다. 도 4는 Grb2 신호전달 경로를 도시한다. Bcr-Abl 종양유전자와 마찬가지로, c-Cbl 원종양형성유전자(proto-oncogene)는 CML 세포에서 구성적으로 인산화된 타이로신이다. Grb2는 CML 세포에서 c-CBL-지시된 경로를 매개할 수 있는데, 그 이유는 Grb2가 c-Cbl과 안정적인 복합체를 형성하는 것으로 나타났기 때문이다. 이러한 상호작용은 골수 전구세포 세포의 악성 형질전환을 초래할 수 있다.
Grb2를 저해함으로써, Grb2-SOS 복합체는 더 이상 RAS 상에서 GTP에 대해서 GDP를 교환할 수 없다. 따라서 MAP 카이나제 캐스케이드 및 이의 결과적인 전사의 하향조절이 일어난다(Tari 2001a).
II.
Grb2 유전자 발현의 저해
Grb2의 기능을 저해하기 위한 다수의 전략을 조사하였다. 하나의 전략은 Grb2의 대안적으로 스플라이싱된 형태를 클로닝하는 것을 포함하는데, 이것은 결실된 비기능성 SH2 도메인을 갖는다(Fath, 1994). 암호화된 Grb3-3 단백질은 인산화된 EGFR에 결합하지 않을 것인데, 그 이유는 결실된 잔기가 포스포타이로신 잔기에 대한 Grb2의 결합에 통합되기 때문이며; 그러나 Grb3-3은 기능성 SH3 도메인을 보유한다. 따라서, Grb3-3은 구아닌 뉴클레오타이드 교환 인자의 결합에서 Grb2와 경쟁할 수 있다. 문헌[Fath et al. (1994)]에 의한 연구에서, Swiss 3T3 섬유모세포 내로의 Grb3-3의 미세주사(microinjection)는 그것이 아폽토시스를 겪도록 유도하였다. 이러한 클론은 구아닌 뉴클레오타이드 교환 인자의 결합에서 Grb2와 경쟁하도록 설계된다.
두 번째 전략은 소분자 저해제를 사용하여 Grb2 SH2 도메인에 대한 성장 인자 수용체의 결합을 예방하는 것이다(Gay, 1999). 이러한 소분자 Grb2 SH2 저해제는 Tyr-X-Asn-X 모티프를 함유하는 포스포펩타이드 리간드와 복합체화된, Grb2의 X선 구조를 기초로 하는 분자 모델을 사용하여 설계된다. 이러한 저해제는 Grb2 SH2 도메인을 인식하고, 선택적으로 결합할 수 있는 요소를 함유한다. 이러한 저해제의 목적은 종양발생 형질전환을 반전시키고, 성장 인자-유도된 세포 운동성을 예방하는 것이다(Gay, 1999).
세 번째 전략은 Grb2-결합 포스포펩타이드를 사용하는 것을 포함한다(Williams, 1997). 세포를 세포-투과성 Grb2 결합 포스포펩타이드로 처리하는 것은, 이것과 Grb2를 회합시켜, Grb2에 대한 성장 인자 수용체 결합을 저해시킨다(Williams, 1997). 이것은 성장 인자-자극된 체세포분열유도(mitogenesis)를 방해할 수 있다.
네 번째로, Grb2 발현의 저해는 Grb2 mRNA의 특이적 영역에 상보성인 안티센스 올리고뉴클레오타이드를 사용하여 달성될 수 있다. 안티센스 올리고뉴클레오타이드가 표적 mRNA에 결합하는 경우, DNA-RNA 혼성체가 형성된다. 혼성체 형성은 mRNA의 번역, 따라서 암호화된 단백질의 발현을 저해한다. Grb2 단백질이 세포의 증식에 필수적인 경우, 이의 저해는 성장 억제로 이어질 수 있다. Grb2 발현의 저해는 또한 약물 내성을 극복할 수 있고, 암 세포에서 화학요법-유도된 아폽토시스를 촉진시킬 수 있다.
III.
Grb2에 대한 P-에톡시 올리고뉴클레오타이드 안티센스 요법 및 CML 및 AML에 대한 이의 저해성 활성도
성장 인자 수용체 결합 단백질-2(Grb2)는 종양발생 타이로신 카이나제, 예컨대, Bcr-Abl에 의해서 활용되어, Ras 경로를 활성화시킨다. Grb2는 마우스에서 섬유모세포를 형질전환시키고, 백혈병-유사 질환을 유도하도록 Bcr-Abl에 의해서 요구된다. grb2 mRNA에 특이적인 리포솜-혼입된 안티센스 올리고데옥시뉴클레오타이드(올리고)인 BP1001이 Grb2 발현을 차단하도록 개발되었다. Grb2의 인접한 cDNA 서열은 서열번호 2에 의해서 제공되고, Grb2의 단백질 서열은 서열번호 3에 제공된다.
Grb2를 저해하기 위해서 이러한 시도에서 사용되는 전략은 Grb2 mRNA에 대해서 특이적인 리포솜-혼입된, 뉴클레아제-내성 안티센스 올리고뉴클레오타이드를 사용한다. BP1001에서 안티센스 올리고뉴클레오타이드 약물 물질은 P-에톡시 골격을 함유하는 뉴클레아제-내성 포스포다이에스터 유사체이다. 이러한 구조는 포스포로티오에이트 골격을 갖는 것에서 선택되었는데, 그 이유는 그것이 황 모이어티를 갖지 않기 때문이다. 포스포로티오에이트 골격의 황 모이어티는 출혈 경향(bleeding diathesis)과 연관되었다.
사용되는 올리고뉴클레오타이드 서열은 5'-ATATTTGGCGATGGCTTC-3'(서열번호 1)이고, 인간 Grb2 mRNA의 번역 개시 부위에 대해서 특이적이고, 따라서 Grb2 단백질 생산을 손상시킨다. 이러한 안티센스는 Bcr-Abl-양성 백혈병 세포, 뿐만 아니라 높은 수준의 HER2/neu 또는 EGFR을 발현하는 유방암 세포에서 Grb2 발현 및 세포 성장을 저해하는 것으로 밝혀져 있다(도 5A 및 도 5B).
BP1001은 Grb2 mRNA에 대해서 표적화된 뉴클레아제-내성, 소수성 P-에톡시 안티센스 올리고가 혼입된 중성 리포솜이다. 전임상 연구에서, BP1001은 성장 저해를 유도하고, 이마티닙-감응성 및 이마티닙-내성 CML 세포주에서 ERK1,2 및 Akt 인산화를 감소시키는 데 효과적이었다. 또한, BP1001은 ph+ 백혈병 세포주 BV173 및 ALL-1에서 Grb2 단백질 생산을 선택적으로 저해하는 것으로 밝혀져 있고, Bcr-Abl+ 백혈병 세포주(ALL-1, BV173, 및 K562 세포)의 증식을 저해하는 것으로 발견되었다(표 16).
Grb2 단백질 발현의 저해는 Ph+ 백혈병 환자로부터 유래된 Bcr-Abl+ 세포주에서 세포 성장 저해로 이어졌는데, 이는 Grb2가 Bcr-Abl 유도된 세포 증식에 기능적 역할을 하고, 따라서 Ph+ 백혈병의 종양형성 가능성의 유지에 필수적인 역할을 한다는 것을 입증하였다. 이러한 결과는, Grb2 단백질의 하향조절이 Bcr-Abl 타이로신 카이나제에 의해서 조절되는 바와 같은 세포 성장의 저해로 이어질 수 있다는 것을 나타낸다.
BP1001은 Bcr-Abl-양성 백혈병 이종이식편을 보유하는 NOD/SCID 마우스의 생존을 증가시키는 데 효과적이었다(Tari, 2007). 연구는 32Dp210 Bcr-Abl 양성 백혈병 세포를 주사하고, 그 다음 BP1001로 처리된 마우스에서 이러한 작용제에 대한 항종양 반응을 나타내었다.
한 연구에서, 32Dp210 Bcr-Abl 양성 백혈병 세포가 주사된 마우스를 BP1001(15㎎/㎏/용량) 또는 대조군(빈(empty) DOPC 리포솜)으로, 종양 세포 주사 후 1일에 시작해서, 최대 6주 동안 주 2회 정맥내로 처리하였다. 마우스를 매일 빈사율(moribundity)/이병률(morbidity)에 대해서 관찰하였다. 모든 살아있는 마우스를 40일에 안락사시켰다. 32Dp210 Bcr-Abl 양성 백혈병 세포가 주사된 마우스에서, BP1001로 처리된 60%가 40일(연구 마지막)에 생존하였고, 이에 비해서 빈 리포솜이 제공된 마우스는 17%가 생존하였다. 이러한 처리된 동물에서 평균 생존 기간은 31.6 ± 13.1일이었고, 이에 비해서 빈 리포솜 군에서는 23.7 ± 8.3일이었다(도 6A).
32Dp210 Bcr-Abl 양성 백혈병 세포가 주사된 마우스에서의 제2 연구에서, 처리군에게 5, 10 또는 15㎎/㎏/용량의 BP1001를 종양 세포의 주사 후 1일에 시작해서, 최대 7주 동안 주 2회 정맥내로 투여하였다. 대조군에게 무작위 서열의 올리고뉴클레오타이드를 함유하는 DOPC 리포솜(15㎎/㎏/용량)을 동일한 스케줄로 제공하였다. 마우스를 매일 빈사율/이병률에 대해서 관찰하였다. 대조군에서 살아있는 마우스를 41일에 안락사시키고, 처리군은 48일에 안락사시켰다. 15㎎/㎏/용량의 용량 수준에서, BP1001로 처리된 마우스 중 80%는 48일(연구 마지막)에 생존하였고, 이에 비해서 15㎎/㎏/용량의 리포솜 대조군 올리고뉴클레오타이드이 제공된 마우스는 0%가 생존하였다(도 6B). 평균 생존 기간은 이들 군에서 각각 44.2 ± 8.5일 대 20.4 ± 7.9일이었다. 5 또는 10㎎/㎏/용량 BP1001로 처리된 마우스에서의 평균 생존 기간은 각각 20.8 ± 4.7일 및 22.2 ± 8.7일이었다. 결과는, 15㎎/㎏/용량의 용량 수준에서의 1주 2회 BP1001 처리가 대조군 올리고뉴클레오타이드 처리와 비교할 때 32Dp210 Bcr-Abl 양성 CML로 유도된 마우스에서의 생존을 증가시켰다는 것을 나타내었다.
또한, 4회의 BP1001 주입이 제공된 후 I상 시험에서 CML 환자에서 중추 블라스트에서의 상당한 감소가 관찰되었다(81%에서 내지 5%로). 환자는 T315I 돌연변이를 특징으로 하는, CML 블라스트 악화를 가졌다. 이러한 데이터는, Grb2가 CML 진행에서 중요한 역할을 한다는 것을 시사한다. 추가로, 전임상 연구는, BP1001 사전치료가 급성 골수성 백혈병(AML) 세포에서 시타라빈 세포독성을 향상시킨다는 것을 나타낸다.
IV.
BP1001 약리학 및 독성학
A.
래트에서의 약동학 연구
BP1001의 약동학 연구를 정맥내(i.v.) 투여 후에 래트에서 수행하였다(Tari, 2007). 루이스 래트(Lewis rat)(n = 5,400gm)에게 우측 대퇴부 동맥 및 좌측 대퇴부 정맥의 관삽입술 진행하였고, 체중 ㎏당 10㎎의 올리고뉴클레오타이드의 용량으로 방사선 표지된(32P) BP1001을 i.v.로 주사하였다. 혈액(0.3㎖)을 우측 대퇴부 동맥을 통해서 주사 후 5, 10, 20, 30, 60, 90, 120, 180 및 240분에 수집하였다. 각각의 채혈 후, 카테터를 나트륨 헤파린 1:1000(단위/㎖)으로 플러싱하였다. 전체 혈액 샘플을 추출하고, 이미 기술된 바와 같이 액체 신틸레이션(liquid scintillation)에 의해서 32P 방사능에 대해서 검정하였다(Tari, 1998; Gutierrez-Puente, 1999). 약동학 파라미터를 비선형 회귀 분석에 의해서 결정하였다(Rstrip; 마이크로 매쓰, 인크.(Micro Math, Inc.), 미국 유타주 솔트 레이크 시티 소재). 전체 혈액 약물 농도 데이터는 2-부분 모델에 가장 양호하게 정합되었다. 혈액으로부터의 BP1001의 클리어런스는 2-부분 수학 모델에 유사하게 정합된 것을 발견하였다(상관관계 r2 > 0.98). 초기 분포 상은 주사 후 첫 번째 6분에 걸쳐서 발생하였다(t1/2α = 5.16 ± 0.3분). 최종 상 반감기(t1/2β)는 225.6 ± 13.2분이었다. 분포의 즉시 겉보기 부피(36.42 ± 1.88㎖)는 이러한 크기의 래트에 대한 총 혈액 부피보다 더 컸다. 농도 곡선 하 면적(AUC)은 5.4 ± 0.9㎎/㎖ x 분인 반면, 체류 시간은 309.6 ± 21.5분이었다. 본 연구에서 관찰된 BP1001의 약동학 분포 및 높은 분포 부피는 이미 조사된 다른 리포솜-혼입된 P-에톡시 올리고뉴클레오타이드에 대해서 관찰된 것과 유사하였다(Tari, 1998; Gutierrez-Puente, 1999).
B.
마우스에서의 BP1001 조직 분포 연구
BP1001의 조직 분포 연구를 i.v. 투여 후에 마우스에서 수행하였다. 20마리의 마우스(5/군)를 3개의 시험군 및 하나의 대조군으로 나누었다. 시험군에게 체중 ㎏당 20㎎의 올리고뉴클레오타이드의 용량으로 방사선 표지된(32P) BP1001을 i.v.로 주사하였다. 주사된 마우스를 기관 수거를 위해서 주사 4, 24, 및 48시간 후에 CO2 흡입에 의해서 안락사시켰다. 대조군 동물은 주사되지 않은 동물이었다. 비장, 간, 신장, 심장, 위, 폐 및 골수 조직을 모든 동물로부터 수집하고, 각각의 기관으로부터의 조직 샘플(50 내지 100㎎)을 칭량하고, 가공하였다. 32P 방사능을 신틸레이션 카운터에 의해서 계수하였다. 결과를 평균 ㎍ BP1001/g 조직으로서 표현하였다. 예상된 바와 같이, 대조군 동물에서 어떠한 방사능도 검출되지 않았다. BP1001의 조직 분포는 이미 조사된 다른 리포솜-혼입된 P-에톡시 올리고뉴클레오타이드에 대해서 보고된 것과 유사하였다. BP1001은 조사된 모든 조직에 축적되었고, 비장, 간 및 신장 조직에 최고로 축적되었다. 주사 후 4시간에서, 조직 g당 평균 BP1001 조직 농도는 다음과 같았다: 64㎍(비장), 50㎍(간), 34㎍(신장), 다른 조직에서는 12 내지 34㎍ 범위. 조직 반감기는 비장, 간, 신장, 심장 및 위에서는 대략 24시간이었고, 폐에서는 48시간이었다. 최소량의 BP1001(두 대퇴골에서 약 0.4㎍)이 골수에서 검출되었는데, 여기서 이 농도는 72시간 동안 비교적 일정하게 유지되었다.
C.
BP1001 독성학
1.
마우스에서의 단일 용량 독성 연구
BP1001의 단일 용량 독성 연구에서, 15마리의 수컷 ICR 마우스(5/군)를 비주사된 대조군(군 I)에 배정하고, 2개의 처리군(군 II 및 III)에게 단일 주사로서 꼬리 정맥을 통해서 정맥내로 15 및 30㎎ 올리고/㎏을 제공하였다. 15마리의 암컷 ICR 마우스(5/군)를 비주사된 대조군(군 IV)에 배정하고, 2개의 처리군(군 V 및 VI)에게 각각 단일 주사로서 꼬리 정맥을 통해서 정맥내로 20 및 40㎎ 올리고/㎏를 제공하였다. 동물을 매일 관찰하였고, 혈액학 및 임상 화학 평가를 위해서 주사 후 2주 및 6주에 혈액을 수집하였다. 주사 후 6주에 혈액 수집 이후에 동물을 희생시키고, 기관 독성의 전체 및 현미경 평가를 위해서 조직을 수집하였다. 이병률 또는 사망률의 어떠한 징후도 관찰되지 않았다. 15 내지 40㎎/㎏ BP1001의 단일 정맥내 주사는 조사된 기관에서 어떠한 약물-관련 병변도 생성하지 않았다. 30 및 40㎎ 올리고/㎏의 주사 후 2주에 WBC 수치의 감소가 관찰되었다. 30㎎ 올리고/㎏의 주사 후 6주에 WBC 수치의 회복이 관찰되었다. 군 평균 WBC 수치는 40㎎ 올리고/㎏이 제공된 동물에서 6주에 완전히 회복되지 않았지만, 대조군과 통계학적으로 상이하지 않았다(Tari, 2007).
2.
마우스에서의 다회 용량 독성 연구
마우스에서의 BP1001의 다회 용량 독성 연구에서, 24마리의 ICR 마우스(암연구협회(Institute for Cancer Research)로부터의 마우스의 이계교배(outbred) 유형; 5마리 암컷/군, 3마리 수컷/군)를 비주사된 대조군(군 I)에 배정하고, 2개의 처리군(군 II 및 III)에게 15 및 25㎎ 올리고/㎏을 정맥내로 꼬리 정맥을 통해서 매일 연속 5일 동안 제공하였다. 동물을 매일 관찰하였고, 혈액학 및 임상 화학 평가를 위해서 주사 후 2주 및 6주에 혈액을 수집하였다. 주사 후 6주에 혈액 수집 이후에 동물을 희생시키고, 기관 독성의 전체 및 현미경 평가를 위해서 조직을 수집하였다. 이병률 또는 사망률의 어떠한 징후도 관찰되지 않았다. 15 내지 25㎎/㎏ BP1001의 다회 정맥내 주사는 조사된 기관에서 어떠한 약물-관련 병변도 생성하지 않았다. 처리된 군에서 주사 후 2주에 WBC 수치의 감소가 관찰되었는데, 이는 주사 후 6주에 지속되었다. 감별(differential) WBC 수치는, 처리된 동물에서 WBC의 특정 집단이 대조군과 상이하지 않았음을 나타내었다(Tari, 2007).
3.
토끼에서의 다회 용량 독성 연구
더치 벨티드 토끼(Dutch Belted rabbit)에서 1주 2회 정맥내(느린 볼러스(slow bolus)) 투여된 BP1001의 잠재적 독성을 수행하였다. BP1001을 28일 기간에 걸쳐서 투여하고, 그 후 2주 회복기를 가졌다. 연구 설계를 표 2에 나타낸다.
[표 2]
용량을 연구일 1, 3, 8, 10, 15, 17, 22 및 24일에 투여하였다. 연구에서 제1 투여일을 연구일 1로서 지정하였다. 용량을 각각의 일에 대략 동일한 시간에 제공하였다. 개별 용량 부피를 각각의 동물에 대해서 가장 최근에 기록된 체중을 기초로 계산하였다. 연구일 1 용량 수준을 연구전 체중에 대해서 계산하였다. 이러한 연구 설계를 기초로, 임상 관찰, 체중, 골수 세포학, 임상 병리학, 기관 중량 또는 현미경 조사에서 명백한 독성학적 변화가 없었다. 부검에서 3회의 전체 관찰을 기록하였다. 군 1, 연구일 4 수컷(#8939) 및 군 2, 연구일 42 암컷(#8968)은 작은 담낭의 전체 관찰을 가졌다. 군 1, 연구일 29 암컷(#8944)은 모든 폐엽에 관련된 어두운 초점의 전체 관찰을 가졌다. 이러한 비-용량-의존적 발견은 BP1001의 투여와 명백하게 관련이 없었다. 이러한 연구 설계를 기초로, 임상 관찰, 체중, 골수 세포학, 임상 병리학, 기관 중량 또는 현미경 조사에서 3.75, 5.00 또는 7.50㎎/㎏ BP1001의 1주 2회 정맥내(느린 볼러스) 투여는 어떠한 명백한 독성도 존재하지 않았다. 또한, 결과는, BP1001을 토끼에 투여하는 경우, 응고 파라미터에 대해서 어떠한 효과도 관찰되지 않았다는 것을 나타내었다.
D.
에임스 돌연변이유발력(Ames Mutagenicity) 연구
BP1001을 에임스 돌연변이유발력 연구에서 시험하였다. 염화나트륨(0.9%)을 5㎎의 Grb2 올리고뉴클레오타이드를 함유하는 BP1001의 바이알에 첨가하였다. 샘플을 S-9 효소 활성화 시스템의 존재 및 부재 하에서 다양한 농도에서 살모넬라의 5종의 균주에 대해서 시험하였다. 샘플은 시험된 균주에 대해서 돌연변이성이 아니었다.
E.
시험관내
포유동물 염색체 일탈 시험(CHO 세포)
BP1001을 아로클로(Aroclor)-유도된 S9 활성화 시스템의 존재 및 부재 둘 모두 하에서 CHO 세포를 사용하여 염색체 일탈 검정에서 시험하였다. 예비 독성 시험을 수행하여 염색체 일탈 검정에 대한 용량 범위를 확립하였다. 염색체 일탈 검정을 사용하여 BP1001의 염색체이상유발성(clastogenic) 가능성을 평가하였다. 본 연구의 발견을 기초로, BP1001은 비활성화 및 S9-활성화 시험 시스템 둘 모두에서 CHO 세포 내의 구조적 및 수치적 염색체 일탈의 유도에 대해서 음성인 것으로 결론지어졌다.
V.
인간에서 BP1001의 임상 시험
BP1001 I상 연구를 2 부분으로 수행하였다: (A) BP1001 용량 증가 및 (B) BP1001과 병행 저용량 시타라빈(LDAC) 용량 확장. 용량 증가(부분 A)의 경우, 표준 "3+3" 설계를 사용하였고, 여기서 혈액 악성종양을 갖는 3명 이상의 환자의 연속적인 코호트를 최대 내약 용량(maximum tolerated dose: MTD)이 확인될 때까지 5에서 135㎎/㎡로 증가하는 용량의 BP1001로 치료하였다. 연구의 용량 확장 부분(부분 B)의 경우, AML을 갖는 환자의 2개의 연속적인 하위세트를 고정 용량의 LDAC와 조합하여 MTD(또는 최대 시험 용량 [HTD]) 및 MTD(또는 HTD) 미만의 하나의 수준의 BP1001로 치료하여 안전성 및 생물학적 효과를 추가로 특징규명하고, 제안된 2상 용량을 확인하였다. 본 연구의 부분 둘 모두는 공개 표지, 순차적 용량-증가 설계(open-label, sequential, dose-escalation design)를 사용하여 안전성, 내약성 및 독성, 약동학(PK), 종양 반응 및 항백혈병 활성도를 평가하였다. 총 39명의 환자를 본 연구에서 치료하였다: AML(n = 30), CML-BP(n = 5), 및 MDS(n = 4). 39명의 환자 중에서, 27명이 평가 가치가 있었고; 12명은 질환 진행으로 인해서 전체 주기의 완결에 실패하여, 프로토콜에 따라서 대체하였다. 증식성 CML-BP의 경우 고용량 하이드록시유레아를 사용하면서, 5㎎/㎡에 대해서 1명의 환자 만이 용량-제한 독성(DLT), 등급 3 점막염 및 손발 증후군(hand-foot syndrome)을 경험하였다. 본 연구 의약은 기여 인자로서 제외될 수 없기 때문에, 이러한 사건은 DLT로 보고되었다. 6명의 환자로의 확장 시, 어떠한 다른 환자도 DLT를 발생시키지 않았다. 치료된 환자 중 누구도 다른 약물 관련 독성이 관찰되지 않았다. MTD는 확인되지 않았다. BP1001에 대한 HTD는 90㎎/㎡였다.
27명의 평가 가치가 있는 환자 중에서, 하나의 주기의 중간값을 투여하였다(1-5): 4명은 2주기가 제공되었고, 3명은 3주기가 제공되었고, 4명은 5주기가 제공되었고, 나머지 모두는 1주기가 제공되었다. 단일 작용제 코호트(부분 A)에 대해서 21명의 평가 가치가 있는 환자 중에서, 10명은 말초 또는 골수 블라스트의 50% 이상의 감소를 경험하였고; 2명은 피부 백혈병이 개선되었고; 6명은 블라스트가 일시적으로 감소하였다. BP1001 + LDAC 병용 요법(부분 B)에 대해서 6명의 평가 가치가 있는 환자 중에서, 3명은 완전 완화(CR)를 달성하였고, 2명은 부분 완화(PR)를 달성하였다.
A.
Grb2 바이오마커 연구
유세포 분석법을 사용하여 BP1001 단일 작용제 요법 중인 환자의 순환계 백혈병 세포에서 Grb2 및 pErk 단백질의 수준을 결정하고, 중간 형광 강도(median fluorescent intensity: MFI)로서 기록하였다. 치료 동안 Grb2 및 pErk의 MFI를 기준선에서의 것과 비교하였다. 마지막에 측정된 샘플(치료 마지막 또는 1주기, 22일)의 경우, BP1001은 12개의 샘플 중 10개에서 Grb2 수준을 25% 이상 감소시켰고, 12개의 샘플 중 7개에서 pErk 수준을 25% 이상 감소시켰다. Grb2 수준의 평균 감소는 49%(범위: 28% 내지 91%)였고, pErk 수준의 평균 감소는 52%(범위: 27% 내지 91%)였다.
B.
약동학 연구
BP1001(60㎎/㎡) + LDAC가 제공되거나 또는 BP1001(90㎎/㎡) + LDAC가 제공된 AML으로 진단된 난치성/재발성 환자로부터 수집된 혈장 샘플 상에서 약동학(PK) 분석을 수행하였다. 두 코호트 모두에서, Tmax는 투여 후 1시간이었다. 두 용량 모두의 Cmax는 82ng/㎖였다. 그러나, BP1001의 혈장 반감기는 90㎎/㎡ 용량보다 60㎎/㎡ 용량(29.6 ± 8.1시간 대 11.8 ± 5.4시간)의 경우 더 길었다. BP1001의 클리어런스 속도는 90㎎/㎡ 용량보다 60㎎/㎡ 용량(133 ± 24L/h 대 205 ± 70L/h)의 경우 더 낮았다. 이러한 결과는, 60㎎/㎡ BP1001 용량이 90㎎/㎡ 용량보다 더 선호될 수 있다는 것을 시사한다.
VI.
지질 및 리포솜
"리포솜"은 지질 이중층을 갖는 지질 함유 소포뿐만 아니라 안티센스 올리고뉴클레오타이드를 포획하거나 혼입할 수 있는 다른 지질 담체 입자를 의미하기 위해 본 명세서에서 사용된다. 이와 같이, 리포솜은 둘러싸인 지질 이중층 또는 응집체의 생성에 의해 형성된 다양한 단일라멜라, 다중라멜라, 및 다중소포성 지질 비히클을 포괄하는 일반 용어이다. 또한, 리포솜은 정의되지 않은 라멜라 구조를 가질 수 있다. 리포솜은 인지질 이중층 막 및 내부 수성 매질을 갖는 소포성 구조를 갖는 것을 특징으로 할 수 있다. 다중라멜라 리포솜은 수성 매질에 의해 분리된 다수의 지질 층을 갖는다. 이들은 인지질이 과량의 수용액 중에 현탁될 때 자발적으로 형성된다. 지질 성분은 둘러싸인 구조가 형성되기 전에 자가 재배열을 겪고 지질 이중층 사이에 물과 용해된 용질을 포획한다(Ghosh and Bachhawat, 1991). 그러나, 본 발명은 또한 일반적인 소포성 구조보다 용액 중에서 상이한 구조를 갖는 조성물을 포함한다. 예를 들어, 지질은 마이셀 구조를 취하거나 단지 지질 분자의 불균일한 응집체로서 존재할 수 있다.
리포솜은 다양한 약물을 병든 조직 내로 전달하기 위한 담체인 나노입자의 형태이다. 최적의 리포솜 크기는 표적 조직에 좌우된다. 종양 조직에서, 혈관구조는 불연속적이며, 기공 크기는 100 내지 780nm로 다양하다(Siwak et al., 2002). 그에 비해, 정상 혈관 내피 내의 기공 크기는 대부분의 조직에서 2nm 미만이고, 모세관후 세정맥에서 6nm이다. 음으로 하전된 리포솜은 중성 또는 양으로 하전된 리포솜보다 순환계로부터 더 신속하게 제거될 것으로 생각되지만; 최근 연구는 음으로 하전된 지질의 유형이 세망내피계(RES)에 의한 리포솜 흡수율에 영향을 미친다는 것을 나타내었다. 예를 들어, 입체적으로 차폐되지 않은 음으로 하전된 지질(포스파티딜세린, 포스파티드산, 및 포스파티딜글리세롤)을 함유하는 리포솜은 중성 리포솜보다 더 빠르게 제거된다. 흥미롭게도, 양이온성 리포솜(1,2-다이올레오일-3-트라이메틸암모늄-프로판[DOTAP]) 및 양이온성-리포솜-DNA 복합체는 음이온성, 중성, 또는 입체적으로 안정화된 중성 리포솜보다 세포내이입을 통해 혈관신생 혈관의 내피 세포에 더 잘 결합하고 내재화된다(Thurston et al., 1998; Krasnici et al., 2003). 양이온성 리포솜은 종양 세포와의 표면 상호작용이 정전기적으로 유도된 결합 부위 장벽 효과를 생성하여 전달 시스템과 종양 타원체와의 추가의 결합을 저해하기 때문에 종양 세포를 위한 이상적인 전달 비히클이 아닐 수 있다(Kostarelos et al., 2004). 그러나, 중성 리포솜은 더 양호한 종양내 침투를 갖는 것으로 보인다. 특정 리포솜 제제에 대한 독성이 또한 우려되어 왔다. 양이온성 리포솜은 반응성 산소 중간체의 방출을 촉진하여 용량 의존적 독성 및 폐 염증을 유발하며, 이 효과는 DOTAP와 같은 1가 양이온성 리포솜보다 다가 양이온성 리포솜에서 더 두드러진다(Dokka et al., 2000). 중성 및 음성 리포솜은 폐 독성을 나타내지 않는 것으로 보인다(Guitierrez-Puente et al., 1999). 양이온성 리포솜은 핵산을 효율적으로 흡수하면서 생체내 유전자 하향조절에 대한 제한된 성공을 이뤘는데, 아마도 이들의 안정적인 세포내 성질 및 그 결과 핵산 내용물의 방출 실패 때문일 것이다. 중성 전하를 갖는 지질 또는 중성화된 전하를 갖는 지질 조성물, 예를 들어, 1,2-다이올레일-sn-글리세로-3-포스포콜린(DOPC)은 중성 특성 및 생체내에서 안티센스 올리고뉴클레오타이드 전달의 성공으로 인해서 본 명세서에서 사용된다.
본 발명은 올리고뉴클레오타이드, 예컨대, 안티센스 올리고뉴클레오타이드를 지질 및/또는 리포솜과 회합시키는 방법 및 조성물을 제공한다. 올리고뉴클레오타이드는 리포솜의 수성 내부에 혼입되거나, 리포솜의 지질 이중층 내에 산재되거나, 리포솜 및 올리고뉴클레오타이드 둘 모두와 회합된 연결 분자를 통해 리포솜에 부착되거나, 리포솜에 포획되거나, 리포솜과 복합체화되거나, 지질을 함유하는 용액 중에 분산되거나, 지질과 혼합되거나, 지질과 조합되거나, 지질 중의 현탁액으로 함유되거나, 마이셀과 함께 함유되거나 복합체화되거나, 또는 지질과 달리 회합될 수 있다. 본 명세서에 제공된 리포솜 또는 리포솜/올리고뉴클레오타이드-회합된 조성물은 용액에서 임의의 특정 구조에 제한되지 않는다. 예를 들어, 이들은 이중층 구조로, 마이셀로서, 또는 "붕괴된" 구조로 존재할 수 있다. 이들은 또한 단순히 용액에서 산재되어, 가능하게는 크기 또는 형상이 균일하지 않은 응집체를 형성한다.
A.
지질
지질은 자연 발생 또는 합성일 수 있는 지방 물질이다. 예를 들어, 지질은 세포질에서 자연 발생하는 지방 소적뿐만 아니라 장쇄 지방족 탄화수소 및 이들의 유도체, 예컨대, 지방산, 알코올, 아민, 아미노 알코올, 및 알데하이드를 함유하는 관련 기술 분야의 통상의 기술자에게 널리 공지된 화합물의 부류를 포함한다. 예는 지질 1,2-다이올레일-sn-글리세로-3-포스포콜린(DOPC)이다.
본 발명의 지질 조성물은 인지질을 포함할 수 있다. 특정 실시형태에서, 단일 종류 또는 유형의 인지질이 지질 조성물, 예컨대, 리포솜의 생성에 사용될 수 있다. 다른 실시형태에서, 하나를 초과하는 종류 또는 유형의 인지질이 사용될 수 있다.
인지질은 글리세로인지질 및 특정 스핑고지질을 포함한다. 인지질은 다이올레일포스파티딜y콜린("DOPC"), 난(egg) 포스파티딜콜린("EPC"), 다이라우릴로일포스파티딜콜린("DLPC"), 다이미리스토일포스파티딜콜린("DMPC"), 다이팔미토일포스파티딜콜린("DPPC"), 다이스테아로일포스파티딜콜린("DSPC"), 다이리놀레일포스파티딜콜린, 1,2-다이아라키도일-sn-글리세로-3-포스포콜린("DAPC"), 1,2-다이에이코센오일-sn-글리세로-3-포스포콜린("DEPC"), 1-미리스토일-2-팔미토일 포스파티딜콜린("MPPC"), 1-팔미토일-2-미리스토일 포스파티딜콜린("PMPC"), 1-팔미토일-2-스테아로일 포스파티딜콜린("PSPC"), 1-스테아로일-2-팔미토일 포스파티딜콜린("SPPC"), 팔미토일오에오릴 포스파티딜콜린("POPC"), 1-올레일-2-팔미토일 포스파티딜콜린("OPPC"), 다이라우릴로일포스파티딜글리세롤("DLPG"), 다이미리스토일포스파티딜글리세롤("DMPG"), 다이팔미토일포스파티딜글리세롤("DPPG"), 다이스테아로일포스파티딜글리세롤("DSPG"), 다이올레일포스파티딜글리세롤("DOPG"), 다이미리스토일 포스파티드산("DMPA"), 다이팔미토일 포스파티드산("DPPA"), 다이스테아로일 포스파티드산("DSPA"), 다이올레일 포스파티드산("DOPA"), 다이미리스토일 포스파티딜에탄올아민("DMPE"), 다이팔미토일 포스파티딜에탄올아민("DPPE"), 다이스테아로일포스파티딜에탄올아민("DSPE"), 다이올레일포스파티딜에탄올아민("DOPE"), 팔미토일오에오릴 포스파티딜에틀리안올아민("POPE"), 다이미리스토일 포스파티딜세린("DMPS"), 다이팔미토일 포스파티딜세린("DPPS"), 뇌 포스파티딜세린("BPS"), 다이스테아로일 스핑고미엘린("DSSP"), 뇌 스핑고미엘린("BSP"), 다이팔미토일 스핑고미엘린("DPSP"), 라이소포스파티딜콜린, 및 라이소포스파티딜에탄올아민을 포함하지만 이들로 제한되지 않는다.
인지질은 예를 들어, 포스파티딜콜린, 포스파티딜글리세롤, 및 포스파티딜에탄올아민을 포함하고; 포스파티딜에탄올아민 및 포스파티딜콜린은 생리 조건(즉, 약 pH 7)에서 비하전되어 있기 때문에, 이러한 화합물은 중성 리포솜을 생성시키는 데 특히 유용할 수 있다. 특정 실시형태에서, 인지질 DOPC는 비하전된 리포솜 또는 지질 조성물을 생산하는데 사용된다. 특정 실시형태에서, 인지질이 아닌 지질(예컨대, 콜레스테롤)이 또한 사용될 수 있다.
인지질은 자연 또는 합성 공급원으로부터 유래될 수 있다. 그러나, 자연 공급원으로부터의 인지질, 예컨대, 난 또는 대두 포스파티딜콜린, 뇌 포스파티드산, 뇌 또는 식물 포스파티딜이노시톨, 심장 카디오리핀, 및 식물 또는 박테리아 포스파티딜에탄올아민은 특정 실시형태에서 주요 포스파티드(즉, 총 포스파티드 조성물의 50% 이상을 구성함)로서 사용되지 않는데, 그 이유는 이것이 생성된 리포솜의 불안정성 및 누출을 초래할 수 있기 때문이다.
B.
중성 리포솜
본 명세서에 사용된 바와 같이, "중성 리포솜 또는 지질 조성물" 또는 "비하전된 리포솜 또는 지질 조성물"은 본질적으로-중성 순전하(실질적으로 비하전됨)를 생성하는 하나 이상의 지질을 갖는 리포솜 또는 지질 조성물로서 정의된다. 특정 실시형태에서, 중성 리포솜 또는 지질 조성물은 그 자체로 중성인 지질 및/또는 인지질을 주로 포함할 수 있다. 특정 실시형태에서, 양친매성 지질은 중성 리포솜 또는 지질 조성물 중에 혼입될 수 있거나 이를 생성하는데 사용될 수 있다. 예를 들어, 중성 리포솜은 양으로 하전된 지질 및 음으로 하전된 지질을 조합함으로써 생성되어, 이들 전하가 실질적으로 서로를 상쇄함으로써, 본질적으로-중성인 순전하를 생성할 수 있다. "본질적으로 중성" 또는 "본질적으로 비하전된"는 주어진 집단(예컨대, 리포솜의 집단) 내의 소수의 지질(존재한다면)이 또 다른 성분의 반대 전하에 의해 상쇄되지 않는 전하를 포함한다(예를 들어, 성분의 10% 미만, 보다 바람직하게는 5% 미만, 가장 바람직하게는 1% 미만은 상쇄되지 않은 전하를 포함한다). 본 발명의 특정 실시형태에서, 조성물의 지질 성분이 본질적으로 중성이지만 리포솜의 형태가 아닌 조성물이 제조될 수 있다.
리포솜의 크기는 합성 방법에 따라 달라진다. 수성 용액 중에 현탁된 리포솜은 일반적으로 구형 소포 형상이고, 지질 이중층 분자의 하나 이상의 동심 층을 가질 수 있다. 각각의 층은 식 XY로 표현되는 분자의 평행 배열로 이루어지며, 상기 식에서 X는 친수성 모이어티이고, Y는 소수성 모이어티이다. 수성 현탁액에서, 동심 층은 친수성 모이어티가 수성 상과 접촉된 상태를 유지하는 경향이 있고, 소수성 영역이 자가-화합하는 경향이 있도록 배열된다. 예를 들어, 수성 상이 리포솜 내부에 존재할 때, 지질 분자는 배열 XY-YX의 라멜라로 공지된 이중층을 형성할 수 있다. 하나를 초과하는 지질 분자의 친수성 및 소수성 부분이 서로 회합될 때 지질의 응집체가 형성될 수 있다. 이러한 응집체의 크기 및 형상은 많은 상이한 변수, 예컨대, 용매의 본성 및 용액 중에 다른 화합물의 존재에 따라 달라질 것이다.
본 발명의 범주 내의 리포솜은 공지된 실험실 기술, 예를 들어, 문헌[Bangham et al. (1965)]의 방법(내용이 본 명세서에 참고로 포함됨); 문헌[Gregoriadis (1979)]의 방법(내용이 본 명세서에 참고로 포함됨); 문헌[Deamer and Uster (1983)]의 방법(내용이 참고로 포함됨); 및 문헌[Szoka and Papahadjopoulos (1978)]에 의해 기술된 역상 증발 방법 등에 따라서 제조될 수 있다. 전술한 방법은 수성 물질을 포획하는 이들 각각의 능력 및 이들 각각의 수성 공간-대-지질 비율이 상이하다.
특정 실시형태에서, 중성 리포솜은 올리고뉴클레오타이드, 예컨대 안티센스 올리고뉴클레오타이드를 전달하는데 사용될 수 있다. 중성 리포솜은 단일 유전자의 번역의 억제로 안내되는 단일 종의 올리고뉴클레오타이드를 함유할 수 있거나, 또는 중성 리포솜은 다수의 유전자의 번역의 억제로 안내되는 다수의 종의 올리고뉴클레오타이드를 함유할 수 있다. 또한, 중성 리포솜은 또한 올리고뉴클레오타이드에 더하여 화학치료제를 함유할 수 있고; 따라서, 특정 실시형태에서, 화학치료제 및 올리고뉴클레오타이드가 동일한 또는 별개의 조성물로 세포(예컨대, 인간 대상체 내의 암성 세포)에 전달될 수 있다.
건조된 지질 또는 동결건조된 리포솜은 탈수되고, 적합한 용매(예를 들어, DPBS 또는 Hepes 완충액)로 적절한 농도로 재구성될 수 있다. 이어서, 혼합물은 보텍스 혼합기에서 격렬하게 진탕될 수 있다. 리포솜은 적절한 총 인지질 농도(예를 들어, 약 10 내지 200mM)로 재현탁될 수 있다. 캡슐화되지 않은 올리고뉴클레오타이드는 29,000g에서의 원심분리에 의해 제거될 수 있고, 리포솜 펠릿은 세척된다. 대안적으로, 캡슐화되지 않은 올리고뉴클레오타이드는 과량의 용매에 대해 투석함으로써 제거될 수 있다. 캡슐화된 올리고뉴클레오타이드의 양은 표준 방법에 따라 결정될 수 있다.
VII.
유전자 발현의 저해
저해성 올리고뉴클레오타이드는 세포에서 유전자의 전사 또는 번역을 저해할 수 있다. 올리고뉴클레오타이드는 5 내지 50개 또는 그 초과의 뉴클레오타이드 길이, 특정 실시형태에서는 7 내지 30개 뉴클레오타이드 길이일 수 있다. 특정 실시형태에서, 올리고뉴클레오타이드는 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 또는 30개 뉴클레오타이드 길이일 수 있다. 올리고뉴클레오타이드는 핵산 및/또는 핵산 유사체를 포함할 수 있다. 저해성 올리고뉴클레오타이드는 세포 내에서 단일 유전자의 번역을 저해할 것이나; 특정 실시형태에서, 저해성 올리고뉴클레오타이드는 세포 내에서 하나를 초과하는 유전자의 번역을 저해할 수 있다.
올리고뉴클레오타이드 내에서, 올리고뉴클레오타이드의 성분은 동일한 유형이거나 전체적으로 균일할 필요는 없다(예를 들어, 올리고뉴클레오타이드는 뉴클레오타이드 및 핵산 또는 뉴클레오타이드 유사체를 포함할 수 있음). 본 발명의 특정 실시형태에서, 올리고뉴클레오타이드는 단일 핵산 또는 핵산 유사체 만을 포함할 수 있다. 저해성 올리고뉴클레오타이드는 상보성 핵산과 혼성화하여 이중 가닥의 구조를 형성하는, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30개 또는 그 초과의 인접한 핵염기(이들 사이의 모든 범위 포함)를 포함할 수 있다.
VIII.
핵산
본 발명은 중성 리포솜을 통해 올리고뉴클레오타이드를 전달하기 위한 방법 및 조성물을 제공한다. 올리고뉴클레오타이드는 핵산으로 구성되기 때문에, 핵산에 관한 방법(예를 들어, 핵산의 생산, 핵산의 변형 등)이 올리고뉴클레오타이드에 대해서도 사용될 수 있다.
용어 "핵산"은 관련 기술 분야에서 널리 공지되어 있다. 본 명세서에 사용되는 바와 같이, "핵산"은 일반적으로 핵염기를 포함하는, DNA, RNA, 또는 이의 유도체 또는 유사체의 분자(즉, 가닥)를 지칭한다. 이러한 정의는 단일 가닥 핵산 또는 이중 가닥 핵산을 지칭한다. 이중 가닥의 핵산은 완전히 상보적인 결합에 의해 형성될 수 있으나; 일부 실시형태에서, 이중 가닥의 핵산은 부분적인 또는 실질적인 상보적인 결합에 의해 형성될 수 있다. 본 명세서에 사용되는 바와 같이, 단일 가닥 핵산은 접두사 "ss"로 표시될 수 있고 이중 가닥의 핵산은 접두사 "ds"로 표시될 수 있다.
A.
핵염기
본 명세서에 사용되는 바와 같이 "핵염기"는 헤테로사이클릭 염기, 예를 들어, 적어도 하나의 자연 발생 핵산(즉, DNA 및 RNA)에서 발견되는 자연 발생 핵염기(즉, A, T, G, C 또는 U), 및 상기 핵염기의 자연 발생 또는 비-자연발생 유도체(들) 및 유사체 등을 지칭한다. 핵염기는 일반적으로 자연 발생 핵염기 쌍형성(예컨대, A와 T, G와 C, 및 A와 U 사이의 수소 결합)을 대체할 수 있는 방식으로 적어도 하나의 자연 발생 핵염기와 하나 이상의 수소 결합을 형성할 수 있다(즉, "어닐링" 또는 "혼성화") 핵염기는 본 명세서에 기술되거나 관련 기술 분야의 통상의 기술자에게 공지된 임의의 화학적 또는 자연 합성 방법을 사용하여, 뉴클레오사이드 또는 뉴클레오타이드에 포함될 수 있다.
"퓨린" 및/또는 "피리미딘" 핵염기(들)는 자연 발생 퓨린 및/또는 피리미딘 핵염기 및 또한 이의 유도체(들) 및 유사체(들)를 포괄하며, 이는 비제한적으로 알킬, 카복시알킬, 아미노, 하이드록실, 할로겐(즉, 플루오로, 클로로, 브로모, 또는 아이오도), 티올, 또는 알킬티올 모이어티 중 하나 이상에 의해 치환된 퓨린 또는 피리미딘을 포함한다. 바람직한 알킬(예를 들어, 알킬, 카복시알킬, 등) 모이어티는 약 1개, 약 2개, 약 3개, 약 4개, 약 5개, 내지 약 6개의 탄소 원자를 포함한다. 퓨린 또는 피리미딘의 다른 비제한적인 예는 데아자퓨린, 2,6-디이아미노퓨린, 5-플루오로우라실, 잔틴, 하이포잔틴, 8-브로모구아닌, 8-클로로구아닌, 브로모타일린, 8-아미노구아닌, 8-하이드록시구아닌, 8-메틸구아닌, 8-티오구아닌, 아자구아닌, 2-아미노퓨린, 5-에틸사이토신, 5-메틸사이오신, 5-브로모우라실, 5-에틸우라실, 5-아이오도우라실, 5-클로로우라실, 5-프로필우라실, 티오우라실, 2-메틸아데닌, 메틸티오아데닌, N,N-디에메틸아데닌, 아자아데닌, 8-브로모아데닌, 8-하이드록시아데닌, 6-하이드록시아미노퓨린, 6-티오퓨린, 4-(6-아미노헥실/사이토신) 등을 포함한다. 퓨린 및 피리미딘 유도체 또는 유사체는 (약어/변형된 염기 설명) ac4c/4-아세틸사이티딘, Mam5s2u/5-메톡시아미노메틸-2-티오우리딘, Chm5u/5-(카복시하이드록실메틸) 우리딘, Man q/베타, D-만노실퀘오신, Cm/2'-O-메틸사이티딘, Mcm5s2u/5-메톡시카보닐메틸-2-티오우리딘, Cmnm5s2u/5-카복시메틸아미노-메틸-2-티오리딘, Mcm5u/5-메톡시카보닐메틸우리딘, Cmnm5u/5-카복시메틸아미노메틸우리딘, Mo5u/5-메톡시우리딘, D/다이하이드로우리딘, Ms2i6a, 2-메틸티오-N6-아이소펜텐일아데노신, Fm/2'-O-메틸슈도우리딘, Ms2t6a/N-((9-베타-D-리보퓨라노실-2-메틸티오퓨린-6-yl)카바모일)트레오닌, Gal q/베타, D-갈락토실퀘오신, Mt6a/N-((9-베타-D-리보퓨라노실퓨린-6-yl)N-메틸-카바모일)트레오닌, Gm/2'-O-메틸구아노신, Mv/우리딘-5-옥시아세트산 메틸에스터, I/이노신, o5u/우리딘-5-옥시아세트산 (v), I6a/N6-아이소펜텐일아데노신, Osyw/와이부톡소신, m1a/1-메틸아데노신, P/슈도우리딘, m1f/1-메틸슈도우리딘, Q/퀘오신, m1g/1-메틸구아노신, s2c/2-티오사이티딘, m1I/1-메틸이노신, s2t/5-메틸-2-티오우리딘, m22g/2,2-다이메틸구아노신, s2u/2-티오우리딘, m2a/2-메틸아데노신, s4u/4-티오우리딘, m2g/2-메틸구아노신, T/5-메틸우리딘, m3c/3-메틸사이티딘, t6a/N-((9-베타-D-리보퓨라노실퓨린-6-yl)카바모일)트레오닌, m5c/5-메틸사이티딘, Tm/2'-O-메틸-5-메틸우리딘, m6a/N6-메틸아데노신, Um/2'-O-메틸우리딘, m7g/7-메틸구아노신, Yw/와이부토신, Mam5u/5-메틸아미노메틸우리딘 또는 X/3-(3-아미노-3-카복시프로필)우리딘, (acp3)u를 포함하지만 이들로 제한되지 않는다.
B.
뉴클레오사이드
본 명세서에서 사용되는 바와 같이, "뉴클레오사이드"는 핵염기 링커 모이어티에 공유 부착된 핵염기를 포함하는 개별적인 화학 단위를 지칭한다. "핵염기 링커 모이어티"의 비제한적인 예는 5개의 탄소 원자를 포함하는 당(즉, "5탄당")이며, 이는 비제한적으로 데옥시리보스, 리보스, 아라비노스, 또는 5탄당의 유도체 또는 유사체를 포함한다. 5탄당의 유도체 또는 유사체의 비제한적인 예는 2'-플루오로-2'-데옥시리보스 또는 당 고리에서 탄소가 산소 원자로 치환된 탄소환식 당을 포함한다. 본 명세서에 사용되는 바와 같이, "모이어티"는 일반적으로 더 큰 화학적 또는 분자적 구조의 더 작은 화학적 또는 분자적 성분을 지칭한다.
핵염기와 핵염기 링커 모이어티와의 상이한 유형의 공유 결합(들)이 관련 기술 분야에 공지되어 있다. 비제한적인 예로서, 퓨린(즉, A 또는 G) 또는 7-데아자퓨린 핵염기를 포함하는 뉴클레오사이드는 전형적으로 퓨린 또는 7-데아자퓨린의 9 위치와 5탄당의 1'-위치와의 공유 부착을 포함한다. 또 다른 비제한적인 예에서, 피리미딘 핵염기(즉, C, T, 또는 U)를 포함하는 뉴클레오사이드는 전형적으로 피리미딘의 1 위치와 5탄 당의 1'-위치와의 공유 부착을 포함한다(Kornberg and Baker, 1992).
C.
뉴클레오타이드
본 명세서에서 사용되는 바와 같이, "뉴클레오타이드"는 "골격 링키지"를 추가로 포함하는 뉴클레오사이드를 지칭한다. 골격 링키지는 일반적으로 뉴클레오타이드를 포함하는 또 다른 분자에 공유 부착시키거나, 또는 또 다른 뉴클레오타이드에 공유 부착시켜 핵산을 형성한다. 자연 발생 뉴클레오타이드 내의 "골격 연결"은 전형적으로 5탄당에 공유 부착된 포스페이트 모이어티(예를 들어, 포스포다이에터 골격 링키지)를 포함한다. 골격 모이어티의 부착은 전형적으로 5탄당의 3'- 또는 5'-위치에서 일어난다. 그러나, 특히 뉴클레오타이드가 자연 발생 5탄당 또는 포스페이트 모이어티의 유도체 또는 유사체를 포함하는 경우, 다른 유형의 부착이 관련 기술 분야에 공지되어 있다.
D.
핵산 유사체
핵산은 자연 발생 핵산 내에 존재할 수 있는 핵염기, 핵염기 링커 모이어티, 및/또는 골격 링키지를 포함하거나 전적으로 이들로 구성될 수 있다. 본 명세서에 사용되는 바와 같이 "유도체"는 자연 발생 분자의 화학적으로 변형되거나 변경된 형태를 지칭하는 반면, 용어 "모방체" 또는 "유사체"는 자연 발생 분자 또는 모이어티와 구조적으로 유사하거나 유사하지 않을 수 있지만, 유사한 기능을 보유하는 분자를 지칭한다. 핵염기, 뉴클레오사이드, 및 뉴클레오타이드 유사체 또는 유도체는 관련 기술 분야에 널리 공지되어 있다.
5탄당 및/또는 골격 링키지 유도체 또는 유사체를 포함하는 뉴클레오사이드, 뉴클레오타이드, 또는 핵산의 비제한적인 예는 dsDNA와 삼중 나선을 형성하고/하거나 dsDNA의 발현을 방지하는 퓨린 유도체를 포함하는 올리고뉴클레오타이드를 기술하는 미국 특허 제5,681,947호; DNA 또는 RNA, 특히 형광 핵산 프로브로서 사용하기 위한, DNA 또는 RNA에서 발견된 뉴클레오사이드의 형광 유사체를 포함하는 핵산을 기술하는 미국 특허 제5,652,099호 및 제5,763,167호; 향상된 뉴클레아제 안정성을 갖는 피리미딘 고리 상에 치환을 갖는 올리고뉴클레오타이드 유사체를 기술하는 미국 특허 제5,614,617호; 핵산 검출에서 사용된 변형된 5탄당(즉, 변형된 2'-데옥시퓨라노실 모이어티)을 갖는 올리고뉴클레오타이드 유사체를 기술하는 미국 특허 제5,670,663호, 제5,872,232호 및 제5,859,221호; 혼성화 검정에서 사용될 수 있는 수소 이외의 치환기로 4' 위치에서 치환된 적어도 하나의 5탄당 모이어티를 포함하는 올리고뉴클레오타이드를 기술하는 미국 특허 제5,446,137호; 3'-5' 골격 링키지를 갖는 데옥시리보뉴클레오타이드 및 2'-5' 골격 링키지를 갖는 리보뉴클레오타이드를 갖는 올리고뉴클레오타이드를 기술하는 미국 특허 제5,886,165호; 골격 링키지의 3'-위치 산소가 핵산의 뉴클레아제 내성을 향상시키기 위해 탄소로 대체된 변형된 골격 링키지를 기술하는 미국 특허 제5,714,606호; 뉴클레아제 내성을 향상시키는 하나 이상의 5' 메틸렌 포스포네이트 골격 링키지를 함유하는 올리고뉴클레오타이드를 기술함하는 미국 특허 제5,672,697호; 향상된 뉴클레아제 안정성 및 약물 또는 검출 모이어티를 전달하는 능력을 제공하기 위해 올리고뉴클레오타이드의 2' 탄소에 약물 또는 레이블을 포함할 수 있는 치환기 모이어티의 링키지를 기술하는 미국 특허 제5,466,786호 및 제5,792,847호; 세포 흡수, 뉴클레아제에 대한 내성, 및 표적 RNA에 대한 혼성화를 향상시키기 위해 인접한 5탄당 모이어티의 4' 위치 및 3' 위치를 부착시키는 2 또는 3 탄소 골격 링키지를 갖는 올리고뉴클레오타이드 유사체를 기술하는 미국 특허 제5,223,618호; 핵산 혼성화 프로브로서 유용한 적어도 하나의 설파메이트 또는 설파미드 골격 링키지를 포함하는 올리고뉴클레오타이드를 기술하는 미국 특허 제5,470,967호; 개선된 뉴클레아제 내성, 세포 흡수, 및 RNA 발현의 조절에 사용된 포스포다이에스터 골격 링키지를 대체하는 3개 또는 4개 원자 골격 링키지 모이어티를 갖는 올리고뉴클레오타이드를 기술하는 미국 특허 제5,378,825호, 제5,777,092호, 제5,623,070호, 제5,610,289호, 및 제5,602,240호; 막 투과성 및 안정성을 향상시키기 위해 올리고뉴클레오타이드의 2'-O 위치에 부착된 소수성 담체 작용제를 기술하는 미국 특허 제5,858,988호; DNA 또는 RNA에 대한 향상된 혼성화; 뉴클레아제에 대한 향상된 안정성을 갖는 5' 말단에서 안트라퀴논에 접합된 올리고뉴클레오타이드를 기술하는 미국 특허 제5,214,136호; DNA가 향상된 뉴클레아제 내성, 결합 친화성, 및 RNase H를 활성화시키는 능력을 위해 2'-데옥시-에리트로-펜토파라노실 뉴클레오타이드를 포함하는 PNA-DNA-PNA 키메라를 기술하는 미국 특허 제5,700,922호; DNA에 연결되어 DNA-RNA 혼성체를 형성하는 RNA를 기술하는 미국 특허 제5,708,154호; 하나 이상의 핵염기가 폴리에터 골격 내의 카이랄 탄소 원자에 연결된 폴리에터 핵산을 기술하는 미국 특허 제5,908,845호; 5탄당이 아닌 핵염기 모이어티, 핵염기 링커 모이어티(예를 들어, 아자 질소 원자, 아미도 및/또는 우레이도 테더(tether)), 및/또는 포스페이트 골격 링키지가 아닌 골격 링키지(예를 들어, 아미노에틸글리신, 폴리아마이드, 폴리에틸, 폴리티오아마이드, 폴리설핀아마이드, 또는 폴리설폰아마이드 골격 링키지)를 포함하는 1종 이상의 뉴클레오타이드 또는 뉴클레오사이드를 일반적으로 포함하는 펩타이드 핵산(PNA 또는 펩타이드 기반 핵산 유사체; 또는 PENAM)을 기술하는 미국 특허 제5,786,461호, 제5,891,625호, 제5,786,461호, 제5,773,571호, 제5,766,855호, 제5,736,336호, 제5,719,262호, 제5,714,331호, 제5,539,082호 및 국제 특허 제WO 92/20702호; 및 소수성, 뉴클레아제 내성 p-에톡시 골격 링키지를 기술하는 미국 특허 제5,855,911호에서의 것을 포함한다.
핵산 유사체의 다른 변형 및 용도는 관련 기술 분야에 공지되어 있으며, 핵산 유사체의 이러한 기술 및 유형이 본 발명에 사용될 수 있음이 예상된다.
E.
핵산의 제조
핵산은 화학적 합성, 효소적 생산 또는 생물학적 생산과 같은 관련 기술 분야에 공지된 임의의 기술에 의해 제조될 수 있다. 합성 핵산(예컨대, 합성 올리고뉴클레오타이드)의 비제한적인 예는 본 명세서에 참고로 포함된 유럽 특허 제EP 266,032호에 기술된 바와 같은 포스포트라이에스터, 포스파이트, 또는 포스포아미다이트 화학 및 고체상 기술을 사용한 시험관내 화학적 합성에 의해, 또는 각각 본 명세서에 참고로 포함된 문헌[Froehler et al. (1986)] 및 미국 특허 제5,705,629호에 기술된 바와 같은 데옥시뉴클레오사이드 H-포스포네이트 중간체에 의해 제조된 핵산을 포함한다. 본 발명의 방법에서, 1종 이상의 종의 올리고뉴클레오타이드가 사용될 수 있다. 다양한 올리고뉴클레오타이드 합성 기전은 예를 들어, 각각 본 명세서에 참고로 포함된 미국 특허 제4,659,774호, 제4,816,571호, 제5,141,813호, 제5,264,566호, 제4,959,463호, 제5,428,148호, 제5,554,744호, 제5,574,146호, 제5,602,244호에 개시되어 있다.
F.
핵산의 정제
핵산은 폴리아크릴아마이드 젤, 염화세슘 원심분리 구배, 또는 관련 기술 분야의 통상의 기술자에게 공지된 임의의 다른 수단에 의해 정제될 수 있다(예를 들어, 본 명세서에 참고로 포함된 문헌[Sambrook et al. (2001)] 참고).
특정 실시형태에서, 본 발명은 단리된 핵산인 핵산에 관한 것이다. 본 명세서에 사용되는 바와 같이, 용어 "단리된 핵산"은 하나 이상의 세포의 총 게놈 및 전사된 핵산의 대부분이 존재하지 않도록 단리된, 또는 달리 존재하지 않는 핵산 분자(예컨대, RNA 또는 DNA 분자)를 지칭한다. 특정 실시형태에서, 단리된 핵산"은 세포 성분 또는 시험관내 반응 성분, 예를 들어, 거대분자, 예컨대, 지질 또는 단백질, 작은 생물학적 분자 등의 대부분이 존재하지 않도록 단리된, 또는 달리 존재하지 않는 핵산을 지칭한다.
G.
혼성화
본 명세서에 사용되는 바와 같이, "혼성화", "혼성화하다" 또는 "혼성화할 수 있는"은 이중 또는 삼중 가닥의 분자 또는 부분적인 이중 또는 삼중 가닥 성질을 갖는 분자의 형성을 의미하는 것으로 이해된다. 본 명세서에 사용되는 바와 같이 용어 "어닐링"은 "혼성화하다"와 동의어이다.
본 명세서에 사용되는 바와 같이 "엄격한 조건(들)" 또는 "높은 엄격성"은 상보성 서열(들)을 함유하는 하나 이상의 핵산 가닥(들) 사이에 또는 내부에서 혼성화를 허용하지만 무작위 서열의 혼성화를 제외하는 조건이다. 엄격한 조건은 핵산 및 표적 가닥 사이의 미스매치(존재하는 경우)를 거의 허용하지 않는다. 이러한 조건은 관련 기술 분야의 통상의 기술자에게 널리 공지되어 있으며, 높은 선택성이 요구되는 적용에 바람직하다.
엄격한 조건은 약 50℃ 내지 약 70℃의 온도에서 약 0.02M 내지 약 0.15M NaCl에 의해 제공되는 것과 같은, 낮은 염 및/또는 높은 온도 조건을 포함할 수 있다. 원하는 엄격성의 온도 및 이온 강도는 특정 핵산(들)의 길이, 표적 서열(들)의 길이 및 핵염기 함량, 핵산(들)의 전하 조성, 및 혼성화 혼합물 내의 폼아마이드, 테트라메틸암모늄 클로라이드, 또는 다른 용매(들)의 존재 또는 농도에 의해 부분적으로 결정되는 것으로 이해된다.
또한 혼성화를 위한 이러한 범위, 조성 및 조건은 단지 비제한적인 예로서 언급되고, 특정 혼성화 반응에 대한 원하는 엄격성은 종종 하나 이상의 양성 또는 음성 대조군과 비교하여 경험적으로 결정되는 것으로 이해된다. 구상된 적용에 따라, 표적 서열에 대한 핵산의 다양한 선택성 정도를 달성하기 위해 다양한 조건의 혼성화를 이용하는 것이 바람직하다. 비제한적인 예에서, 엄격한 조건 하에서 핵산에 혼성화하지 않는 관련된 표적 핵산의 확인 또는 단리는 저온 및/또는 높은 이온 강도에서의 혼성화에 의해 달성될 수 있다. 이러한 조건은 "낮은 엄격성" 또는 "낮은 엄격성 조건"으로 불리며, 낮은 엄격성의 비제한적인 예는 약 20℃ 내지 약 50℃의 온도 범위에서 약 0.15 M 내지 약 0.9 M NaCl에서 수행된 혼성화를 포함한다. 물론, 낮은 또는 높은 엄격성 조건을 특정 용도에 맞게 추가로 변형하는 것은 관련 기술 분야의 통상의 기술자의 기술에 속한다.
IX.
리포솜 P-에톡시 안티센스 약물 제품의 제조 방법
표적 mRNA의 특이적 영역에 상보성인 안티센스 올리고뉴클레오타이드(올리고)가 내인성 유전자의 발현을 저해하는 데 사용되어 왔다. 안티센스 올리고뉴클레오타이드가 표적 mRNA에 결합하는 경우, DNA-RNA 혼성체가 형성된다. 이러한 혼성체 형성은 mRNA의 번역, 따라서 암호화된 단백질의 발현을 저해한다. 단백질이 세포의 생존에 필수적인 경우, 이의 발현의 저해는 세포사로 이어질 수 있다. 따라서, 안티센스 올리고뉴클레오타이드는 항암 및 항바이러스 요법에 유용한 툴일 수 있다.
유전자 발현을 저해하기 위해서 안티센스 올리고뉴클레오타이드를 사용하는 데 있어서의 주요 장애는 세포 불안정성, 낮은 세포 흡수 및 불량한 세포내 전달이다. 자연 포스포다이에스터는 뉴클레아제 가수분해에 내성이 아니고; 따라서 높은 농도의 안티센스 올리고뉴클레오타이드가 요구된 후에 임의의 저해성 효과가 관찰된다. 변형된 포스포다이에스터 유사체, 예컨대, P-에톡시는 이러한 뉴클레아제 가수분해 문제를 극복하기 위해서 제조되었지만, 이것은 그 문제에 대한 만족스러운 해결책을 제공하지 않았다.
안티센스 올리고뉴클레오타이드의 세포 흡수는 낮다. 이러한 문제를 해결하기 위해서, 물리학적 기술, 예컨대, 칼슘-포스페이트 침전, DEAE-덱스트란 중재 또는 전기천공이 올리고뉴클레오타이드의 세포 흡수를 증가시키기 위해서 사용되어 왔다. 이러한 기술은 재현이 어렵고, 생체내에서 적용 가능하지 않다. 양이온성 지질, 예컨대, 리포펙틴이 또한 올리고뉴클레오타이드를 전달하기 위해서 사용되어 왔다. 양이온성 지질 및 음으로 하전된 올리고뉴클레오타이드 사이에 정전기적 상호작용이 형성되고, 이것은 복합체를 생성하고, 그 다음 표적 세포에 의해서 흡수된다. 이러한 양이온성 지질은 뉴클레아제 소화로부터 올리고뉴클레오타이드를 보호하지 않고, 세포막에 유해하기 때문에, 이것은 뉴클레아제-내성 포스포로티오에이트뿐만 아니라 뉴클레아제-절단성 포스포다이에스터를 전달하는 데 유용하다.
제조된 또 다른 변형된 포스포다이에스터 유사체는 P-에톡시이다. P-에톡시 안티센스 골격은 출혈 보체 활성화에 부정적인 효과를 갖지 않는데, 이것은 다른 안티센스 유사체에 대해서 보고된 독성 중 일부이다. P-에톡시 올리고뉴클레오타이드의 변형은 포스페이트 골격에서 일어나서 그 변형은 표적 mRNA에 대한 이러한 올리고뉴클레오타이드의 결합을 방해할 것이다. P-에톡시 올리고뉴클레오타이드는 포스페이트 골격의 비브릿징 산소 원자에 에틸기를 첨가함으로써, 이러한 올리고뉴클레오타이드가 비하전된 화합물이 되게 한다. 뉴클레아제에 대한 이러한 내성에도 불구하고, P-에톡시 올리고뉴클레오타이드의 세포 흡수 및 세포내 전달이 불량한데, 그 이유는 내재화 시, 이러한 올리고뉴클레오타이드는 엔도솜/리소솜 액포 내부에 격리되어, 표적 mRNA에 대한 이의 접근을 지연시킨다.
A.
P-에톡시 안티센스 약물 제품
리포솜 p-에톡시 안티센스 약물 제품은 2개의 cGMP 제품으로 구성되며, 이들 둘 모두는 FDA 승인된 출시 기준으로 FDA가 요구하는 분석 증명서를 갖는다. 원료, 용매, 및 최종 의약품이 본 명세서에 기재되어 있다. 제조 시, 약물 제품은 하기 물질을 포함하는 호박색 또는 백색의 동결건조된 결정 또는 분말이다: 올리고뉴클레오타이드(예를 들어, p-에톡시 안티센스 약물 물질), 중성 지질(예를 들어, DOPC), 및 계면활성제(예를 들어, 폴리솔베이트 20). 환자에게 투여하기 위한 제제에서, 생리 식염수가 바이알에 첨가되며, 여기서 내부에 혼입된 p-에톡시 안티센스를 갖는 리포솜이 형성된다.
B.
P-에톡시 안티센스 약물 물질
완제품의 특정 물성(예를 들어, 용해도 및 소수성, 이는 이후에 식염수 중의 약물 제품의 용해도, 리포솜 내로의 올리고의 혼입, 및 리포솜 입자 크기에 영향을 미침)은 p-에톡시 안티센스 약물 물질의 생산 동안 미리 결정된 p-에톡시 및 포스포다이에스터 아미다이트 원료 혼합물을 사용하여 정의될 수 있다. P-에톡시 골격 기의 손실은 올리고뉴클레오타이드 제조 동안 무작위로 일어나서 이러한 링키지에서 포스포다이에스터 결합을 생성하지만, 이러한 손실은 올리고뉴클레오타이드 내에서 P-에톡시:포스포다이에스터 골격 링키지의 바람직한 비를 생성할 수 없다. 이러한 경우, P-에톡시와 포스포다이에스터 아미다이트 원료의 혼합물은 예상된 값의 P-에톡시 골격 결실을 보충함으로써, 목적하는 비를 갖는 올리고뉴클레오타이드를 생성한다. 올리고뉴클레오타이드의 골격에서 p-에톡시 분자의 수를 증가시키는 것은 분자를 더 소수성(이는 더 큰 리포솜 입자를 생성함; 표 1), 덜 극성, 및 덜 가용성으로 만든다(표 2). 전자-중성, 소수성 P-에톡시 약물 물질을 시험하는 방법은 올리고뉴클레오타이드 길이의 분포를 결정하기 위한 질량 분석법 및 약물 물질의 용해도를 결정하기 위한 검정을 포함하고, 이것은 용해도를 위한 실시 목적을 위해서 식염수 중에 재구성된 약물 제품을 육안으로 관찰한다. 올리고뉴클레오타이드가 더 많은 수의 P-에톡시 골격 링키지로 인해서 덜 가용성이 되기 때문에, 재구성된 용액은 소수성이 너무 높아질 때 미립자가 형성될 때까지 더 백색이 된다.
C.
리포솜 P-에톡시 안티센스 약물 제품의 제형화, 여과 및 동결건조
1그램(1g)의 pE 올리고를 1㎖의 DMSO당 10㎎ 올리고뉴클레오타이드의 비로 DMSO 중에 용해시킨다. 다음으로, DOPC를 1719㎖의 tert-부틸 알코올당 1g의 DOPC의 비로 tert-부틸 알코올을 첨가한다. 올리고 및 DOPC를 합치고, 2.67g의 DOPC당 1g의 올리고뉴클레오타이드의 비로 혼합한다. 이어서, 20㎖의 0.835%(v/v) 용액의 폴리솔베이트 20을 혼합물에 첨가하여 0.039㎎/㎖의 최종 농도를 생성한다. 용액을 멸균 필터에 통과시킨 후 동결건조용 유리 바이알에 분배한다.
계면활성제의 양을 적정함으로써 리포솜 입자 크기에 대한 계면활성제의 효과를 결정하였다(표 3). 폴리솔베이트 20의 부재 하에서, 입자 중 단지 2.8%가 300nm 이하의 직경을 가졌다. 1x 폴리솔베이트 20의 존재 하에서, 입자 중 12.5%가 300nm 이하의 직경을 가졌다. 3x 내지 10x 폴리솔베이트 20를 첨가하면, 입자 중 대략 20%가 300nm 이하의 직경을 가졌다. 따라서 1x에서 3x로의 계면활성제의 증가는 입자 크기의 감소를 초래한다.
D.
투여를 위한 리포솜 P-에톡시 안티센스 약물 제품의 제조
동결건조된 제제를 10 내지 5000μM의 최종 올리고 농도에서 생리 식염수(0.9%/10mM NaCl)로 수화시켰다. 리포솜-P-에톡시 올리고를 수동 진탕에 의해서 혼합하였다.
E.
리포솜 P-에톡시 안티센스 약물 제품의 시험 방법
제조된 약물 제품의 육안 검사: 제조 후, 약물 제품을 함유하는 샘플 바이알을 선택하고 육안으로 검사한다. 액체의 부재는 필수적이며, 이어서 바이알의 바닥에 있는 호박색 결정이 허용 가능하고, 백색의 응집된 분말 또는 외관의 허용성이 증가하면, 최상의 결과이다. 백색 외관은 높은 표면적 대 질량비를 갖는 보다 양호한 건조 공정을 나타내며, 이는 사용을 위한 재구성에 매우 도움이 된다.
환자 IV를 위한 준비가 된 재구성된 약물의 육안 검사: 생리 식염수를 제조된 리포솜 P-에톡시 안티센스 약물 제품을 함유하는 바이알에 첨가하고, 진탕하여 약물 결정 또는 분말이 완전히 용해된 용액으로 재구성한다. 3가지 주요 관찰이 이루어진다: 1) 결정 또는 분말이 완전히 용해된 것, 2) 비용해 물질의 백색 덩어리가 없는 것, 및 3) 외관이 유백색 또는 탈지 우유 외관인 것. 재구성된 액체의 외관이 더 청색일수록 더 양호한데, 이러한 신호는 청색 스펙트럼에서 광을 반사하는 더 작은 리포솜 입자 크기를 표시하기 때문이다.
질량 분석법: 질량 분석법(mass spec)은 샘플 내의 다양한 질량의 프로파일을 표시하는데 사용된다. P-에톡시 안티센스 물질이 생산될 때, 질량 분석이 샘플 상에서 진행된다. 결과는 "x" 축 상에서 오른쪽으로 증가하는 질량을 갖는 그리드 상에 존재하는 물질의 피크, 및 위로 증가하는 "y" 축 상의 상대적 질량 존재비를 나타낸다. 샘플로부터의 프로파일을 분석하여 p-에톡시 샘플 내의 p-에톡시 골격의 상대적 양을 결정하며, 피크의 프로파일은 (가장 먼 곳에서 시작하여 우측으로) p-에톡시 링키지로 구성된 모든 골격을 갖는 전장 물질을 나타내며, 좌측으로 이동하는 다음 피크는 p-에톡시 결실을 갖는 하나의 골격을 갖는 전장을 나타내고(따라서, 에틸은 넉 오프되고, 결과는 정상 포스포다이에스터 골격 링키지), 계속된다는 것을 인식한다. 우측으로 이동된 질량 분석 패턴은 더 많은 p-에톡시 골격을 가지며, 따라서 더 소수성이고 덜 가용성인 특성을 갖는 p-에톡시 샘플을 나타내고; 마찬가지로 좌측으로 이동된 질량 분석 패턴은 반대 효과를 갖는 p-에톡시 샘플을 나타낸다. 샘플의 질량 분석 차트의 검사는 또한 제조 동안의 여과가 여과된 약물 제품에 존재하는 올리고뉴클레오타이드 조성물에 어떠한 부정적인 효과를 생성하는지의 여부를 결정하는데 사용될 수 있다.
UV 시험: 자외선 시험은 샘플에 존재하는 올리고뉴클레오타이드의 질량을 결정하는데 사용된다. 올리고뉴클레오타이드는 260나노미터 범위의 광을 흡수한다. 그 결과, 완성된 재구성된 약물 제품의 UV 시험은 약물 제품의 바이알 내의 올리고뉴클레오타이드 약물 물질의 양을 결정하는 방법으로서 사용되게 되었다. 제조 개발 및 혁신 면에서, UV 시험은 용액 중에 더 적은 올리고뉴클레오타이드 및 이에 따라 더 낮은 UV 판독을 초래하는, 제조 시 여과 동안 경험하는 문제 또는 p-에톡시 안티센스 약물 물질의 불량한 용해도가 있는지 결정하는데 사용되었다. 이러한 방법은 검증될 것이고, 최종 제품 출시 시험의 일부가 될 가능성이 높다.
리포솜 입자 크기: 최종 약물 제품의 바이알을 재구성하고 리포솜 입자 크기에 대해 시험한다. 결과는 종종 중심점, 꼬리 및 평균값을 갖는 대략 정규 분포 또는 대부분의 입자의 대략 정규 분포 및 2차 입자 형성 효과로부터 비롯되는 더 작은 리포솜 입자의 더 작은 2차 피크이다. 리포솜 입자는 너무 크지 않는 것이 중요한데, 그 이유는 이들이 환자에서 부작용을 야기할 수 있기 때문이다(예를 들어, 폐 내의 더 작은 혈관에서 혈류 문제를 일으킴). 그 결과, 약물 제품 출시 기준은 입자 크기 시험이 리포솜의 90%가 약 5 마이크론 이하의 크기인 것을 나타내는 것을 포함한다. 또한, 더 작은 리포솜이 바람직한데, 그 이유는 이것이 세포 내로 더 잘 흡수될 수 있고, 두 번째로, 더 작은 리포솜이 혈관 기공을 침투함으로써 리포솜을 종양 내부로 침투시켜 리포솜 P-에톡시 안티센스 약물 제품의 치료 효과를 증가시킬 수 있기 때문이다.
X.
치료 방법
본 발명의 특정 양상은 암 환자를 Grb2를 표적으로 하는 뉴클레아제-내성 저해성 올리고를 함유하는 올리고뉴클레오타이드-지질 복합체(예를 들어, 중성 리포솜 내에 혼입된 올리고뉴클레오타이드)로 치료하는 방법을 제공한다. 특히, 올리고뉴클레오타이드는 Grb2의 번역 개시 부위에서 인간 뉴클레오타이드 서열과 염기 쌍을 이룰 수 있는 서열을 가질 수 있으므로, Grb2의 발현을 저해할 수 있다. 일부 양상에서, 방법은 환자에 대한 1차 치료제, 예를 들어, 타이로신 카이나제 저해제(예를 들어, 이마니팁(imanitib), 다사니팁(dasanitib), 닐로티닙, 보수티닙, 포나티닙 또는 베이프티닙) 또는 사이티딘 유사체(예를 들어, 데시타빈, 아자시티딘 또는 시타라빈)을 투여하는 단계를 추가로 포함한다.
"치료" 및 "치료하는"은 질환 또는 건강 관련 병태의 치료적 이익을 얻기 위한 목적으로 대상체에게 치료제를 투여 또는 적용하거나 절차 또는 양식을 수행하는 것을 지칭한다. 예를 들어, 치료는 올리고뉴클레오타이드-지질 복합체의 약제학적 유효량의 투여를 포함할 수 있다.
"대상체" 및 "환자"는 인간 또는 비-인간, 예컨대 영장류, 포유동물, 및 척추동물을 지칭한다. 특정 실시형태에서, 대상체는 인간이다.
본 명세서 전반에 사용된 바와 같은 용어 "치료적 이익" 또는 "치료적으로 효과적인"은 이 병태의 의학적 치료와 관련하여 대상의 웰빙을 촉진하거나 향상시키는 어느 것을 지칭한다. 이것은 질환의 징후 또는 증상의 빈도 또는 중증도의 감소를 포함하지만 이들로 제한되지 않는다. 예를 들어, 암의 치료는 예를 들어, 종양 크기의 감소, 종양 침윤성의 감소, 암 성장률의 감소, 또는 전이의 예방을 포함할 수 있다. 암 치료는 또한 암을 가진 대상체의 생존을 연장시키는 것을 지칭할 수 있다.
본 발명의 치료 방법이 유용한 종양은 고형 종양, 혈액 종양, 전이성 암, 또는 비-전이성 암에서 발견되는 것과 같은 임의의 악성 세포 유형을 포함한다. 예시적인 고형 종양은 췌장, 결장, 맹장, 식도, 위장관, 잇몸, 간, 피부, 위, 고환, 혀, 자궁, 위, 뇌, 머리, 목, 난소, 신장, 후두, 육종, 골, 폐, 방광, 흑색종, 전립선, 및 유방으로 이루어진 군으로부터 선택되는 기관의 종양을 포함하지만 이들로 제한되지 않는다. 예시적인 혈액 종양은 골수의 종양, T 또는 B 세포 악성 종양, 백혈병, 림프종, 모세포종, 골수종 등을 포함한다. 본 명세서에 제공된 방법을 사용하여 치료될 수 있는 암의 추가의 예는, 암종, 림프종, 모세포종, 육종, 백혈병, 편평 세포암, 폐암(소-세포 폐암, 비-소 세포 폐암, 폐의 선암종, 및 폐의 편평 암종 포함), 복막의 암, 간세포암, 위암(위장암 및 위장 간질암 포함), 췌장암, 교모세포종, 자궁경부암, 난소암, 간암, 방광암, 유방암, 결장암, 결장직장암, 자궁내막 또는 자궁 암종, 타액샘 암종, 신장암, 전립선암, 외음부암, 갑상선암, 다양한 유형의 두경부 암, 흑색종, 표재 확산성 흑색종, 악성 흑자 흑색종, 선단 흑자성 흑색종, 결절성 흑색종뿐만 아니라 B-세포 림프종(저등급/소포성 비호지킨 림프종 (NHL); 소 림프구성(SL) NHL; 중간 등급/소포성 NHL; 중간 등급 미만성 NHL; 고등급 면역모세포성 NHL; 고등급 림프모구성 NHL; 고등급 소 비-절단 세포 NHL; 큰 종양(bulky disease) NHL; 맨틀 세포 림프종; AIDS-관련 림프종; 및 발덴스트롬 마크로글로불린혈증 포함), 만성 림프구성 백혈병(CLL), 급성 림프모구성 백혈병(ALL), 모세포 백혈병, 다발성 골수종, 급성 골수성 백혈병(AML) 및 만성 골수성 백혈병을 포함하지만 이들로 제한되지 않는다.
암은 구체적으로 하기 조직학적 유형일 수 있으나, 이들로 제한되지 않는다: 신생물, 악성; 암종; 암종, 미분화; 거대 및 방추 세포 암종; 소 세포 암종; 유두 암종; 편평 세포 암종; 림프상피 암종; 기저 세포 암종; 모기질 암종; 이행 세포 암종; 유두 이행 세포 암종; 선암종; 가스트린종, 악성; 담관암종; 간세포 암종; 조합된 간세포 암종 및 담관암종; 육주상의 선암종; 선양 낭성 암종; 선종성 용종에서의 선암종; 선암종, 가족성 대상 용종증; 고형 암종; 유암종, 악성; 세기관지 폐포 선암종; 유두 선암종; 협색소성 암종; 호산성 암종; 호산세포성선암종; 호염기성 암종; 투명 세포 선암종; 과립 세포 암종; 여포성 선암종; 유두 및 여포성 선암종; 비피낭 경화성 암종; 부신 피질 암종; 자궁내막 암종; 피부 부속기 암종; 아포크린 선암종; 피지선 선암종; 이구선 선암종; 점액표피양 암종; 낭선암종; 유두 낭선암종; 유두 장액 낭선암종; 점액성 낭선암종; 점액 선암종; 인환세포 암종; 침윤성 유관 암종; 수질성 암종; 소엽성 암종; 염증성 암종; 파제트병, 유선; 선방 세포 암종; 선편평 암종; 편평 상피화생을 동반한 선암종; 흉선종, 악성; 난소 기질 종양, 악성; 협막세포종, 악성; 과립막 세포 종양, 악성; 남성모세포종, 악성; 세르톨리 세포 암종; 라이디히 세포 종양, 악성; 지질 세포 종양, 악성; 부신경절종, 악성; 유선외 부신경절종, 악성; 갈색세포종; 사구맥관육종; 악성 흑색종; 무색소성 흑색종; 표재확산성 흑색종; 거대 색소모반중 악성 흑색종; 상피 세포 흑색종; 청색 모반, 악성; 육종; 섬유육종; 섬유조직구종, 악성; 점액육종; 지방육종; 평활근육종; 횡문근육종; 배아 횡문근육육종; 포상 횡문근육육종; 기질 육종; 혼합 종양, 악성; 뮐러 혼합 종양; 신모세포종; 간모세포종; 암육종; 간엽세포종, 악성; 브레너 종양, 악성; 엽상 종양, 악성; 활막 육종; 중피종, 악성; 난소고환종; 배아성 암종; 기형종, 악성; 난소갑상선종, 악성; 융 모암종; 중신종, 악성; 혈관육종; 혈관내피종, 악성; 카포시 육종; 혈관주위세포종, 악성; 림프관육종; 골육종; 피질주위 골육종; 연골육종; 연골모세포종, 악성; 중간엽 연골육종; 뼈의 거대 세포 종양; 유잉 육종; 치성 종양, 악성; 법랑아세포 치성육종; 법랑아세포종, 악성; 법랑아세포성 섬유육종; 송과체종, 악성; 척색종; 신경교종, 악성; 뇌실막종; 성상세포종; 원형질성 성상세포종; 원섬유성 성장세포종; 성상모세포종; 교모세포종; 핍지교종; 핍지모세포종; 원시 신경외배엽성 육종; 신경절신경모세포종; 신경모포종; 망막세포종; 후각 신경원성 종양; 수막종, 악성; 신경섬유육종; 신경초종, 악성; 과립 세포 종양, 악성; 악성 림프종; 호지킨병; 호지킨병; 부육아종; 악성 림프종, 소 림프구성; 악성 림프종, 거대 세포, 확산성; 악성 림프종, 여포성; 균상식육종; 다른 특이성 비호지킨 림프종; 악성 조직구증; 다발성 골수종; 비만 세포 육종; 면역증식성 소장 질환; 백혈병; 림프구성 백혈병; 혈장 세포 백혈병; 적백혈병; 림프육종 세포 백혈병; 골수성 백혈병; 호염기성 백혈병; 호산성 백혈병; 단핵구성 백혈병; 비만 세포 백혈병; 거대핵모세포성 백혈병; 골수성 육종; 및 모세포 백혈병.
특정 실시형태에서, 본 발명은 질환을 저해하거나 반전시키기에 충분한 시간 기간 동안 생체내에서 병에 걸린 세포의 집단을 올리고뉴클레오타이드-지질 복합체의 치료적 유효량과 접촉시키는 단계를 포함하는, 올리고뉴클레오타이드-지질 복합체의 사용 방법을 고려한다. 일 실시형태에서, 생체내 접촉은 본 발명의 올리고뉴클레오타이드-지질 복합체를 포함하는 생리학적으로 허용 가능한 조성물의 치료적 유효량을 정맥내, 복강내, 피하내, 또는 종양내 주사에 의해 환자에게 투여함으로써 달성된다. 올리고뉴클레오타이드-지질 복합체는 주사에 의해 또는 시간에 걸친 점진적인 주입에 의해 비경구로 투여될 수 있다.
올리고뉴클레오타이드-지질 복합체를 포함하는 치료 조성물은 통상적으로, 예를 들어, 단위 용량의 주사에 의해서와 같이, 정맥내로 또는 피하내로 투여된다. 치료 조성물에 관하여 사용될 때 용어 "단위 용량"은 대상체를 위한 단위 투여량으로서 적합한 물리적으로 분리된 단위를 지칭하며, 각각의 단위는 필요한 희석제, 즉, 담체 또는 비히클과 회합되어 원하는 치료 효과를 생성하도록 계산된 활성 물질의 미리 결정된 양을 함유한다.
조성물은 투여 제형과 상용성인 방식으로, 그리고 치료적 유효량으로 투여된다. 투여될 양은 치료될 대상체, 활성 성분을 이용하는 대상체의 시스템의 능력, 및 원하는 치료 효과의 정도에 좌우된다. 투여될 필요가 있는 활성 성분의 정확한 양은 의사의 판단에 좌우되며 각 개인에 따라 다르다. 그러나, 전신 적용을 위한 적합한 투여량 범위가 본 명세서에 개시되어 있으며, 이는 투여 경로에 좌우된다. 초기 및 부스터 투여를 위한 적합한 요법이 또한 고려되며, 이는 초기 투여 후 후속 주사 또는 다른 투여에 의한 1시간 이상의 시간 간격의 반복된 용량에 의해 전형화된다. 예시적인 다회 투여가 본 명세서에 기재되어 있으며, 이는 폴리펩타이드의 높은 혈청 및 조직 수준을 계속 유지하는데 특히 바람직하다. 대안적으로, 혈중 농도를 생체내 요법을 위해 명시된 범위로 유지시키는데 충분한 연속적인 정맥내 주입이 고려된다.
본 발명의 방법은 질환을 치료하기 위해, 예컨대 종양 세포 성장을 저해하기 위해 또는 국소로 진전된 암 또는 전이성 암을 가진 암 환자에서 암 세포를 사멸하기 위해, 올리고뉴클레오타이드 조성물을 전신으로 또는 국소로 투여할 것을 요구할 수 있다는 것이 고려된다. 이것은 정맥내로, 척추강내로, 피하내로, 및/또는 복강내로 투여될 수 있다. 이것은 단독으로 또는 항-증식성 약물과 조합하여 투여될 수 있다. 일 실시형태에서, 이것은 수술 또는 다른 절차 이전에 환자에서 암 부하를 감소시키기 위해 투여된다. 대안적으로, 이것은 임의의 나머지 암(예를 들어, 수술이 제거하지 못한 암)이 생존하지 않도록 수술 후에 투여될 수 있다.
올리고뉴클레오타이드의 치료적 유효량은 원하는 효과를 달성하기 위해, 즉, 표적 단백질의 발현을 저해하기 위해 계산된 미리 결정된 양이다. 따라서, 본 발명의 올리고뉴클레오타이드의 투여를 위한 투여량 범위는 원하는 효과를 생성하기에 충분히 큰 투여량 범위이다. 투여량은 부정적인 부작용, 예컨대 과다점성 증후군, 폐 부종, 울혈성 심부전, 신경학상 효과 등을 일으킬 정도로 크지 않아야 한다. 일반적으로, 투여량은 환자의 연령, 환자의 병태, 환자의 성별, 및 환자에서 질환의 정도에 따라 달라질 것이며, 이는 관련 기술 분야의 통상의 기술자에 의해 결정될 수 있다. 투여량은 임의의 합병증이 있는 경우 개별 의사에 의해 조정될 수 있다.
본 발명의 조성물은 바람직하게는 환자에게 비경구로, 예를 들어 정맥내, 동맥내, 근육내, 림프관내, 복강내, 피하내, 흉막내, 또는 척추강내 주사에 의해 투여되거나, 또는 생체외에서 사용될 수 있다. 바람직한 투여량은 5 내지 90㎎/㎡이다. 투여는 바람직하게는 암이 사라지거나 퇴행될 때까지 예정된 스케줄로 반복되며, 다른 형태의 요법과 함께 투여될 수 있다.
XI.
약제학적 제제
리포솜을 포함하는 약제학적 조성물은 통상적으로 멸균된 약제학적으로 허용 가능한 담체 또는 희석제, 예컨대, 물 또는 식염수 용액을 포함할 것이다.
올리고뉴클레오타이드를 함유하는 중성 지질 성분(예를 들어, 리포솜 형태)의 임상 적용이 수행되는 경우, 일반적으로 지질 복합체를 의도된 적용에 적절한 약제학적 조성물로 제조하는 것이 이로울 것이다. 이것은 전형적으로 발열원, 뿐만 아니라 인간 또는 동물에게 해로울 수 있는 임의의 다른 불순물이 본질적으로 존재하지 않는 약제학적 조성물을 제조하는 것을 수반할 것이다. 복합체를 안정화시키고 표적 세포에 의한 흡수를 허용하기 위해 적절한 완충액을 사용할 수 있다.
구 "약제학적 또는 약리학적으로 허용 가능한"은 동물, 예컨대 인간에게 적절하게 투여될 때 불리한, 알레르기성 또는 다른 뜻밖의 반응을 일으키지 않는 분자 실체 및 조성물을 지칭한다. 올리고뉴클레오타이드 또는 추가적인 활성 성분을 포함하는 적어도 하나의 비하전된 지질 성분을 함유하는 약제학적 조성물의 제조는 본 명세서에 참고로 포함된 문헌[Remington: The Science and Practice of Pharmacy, 21st, 2005]에 의해 예시된 바와 같이 본 개시내용에 비추어 관련 기술 분야의 통상의 기술자에게 공지되어 있을 것이다. 더욱이, 동물(예를 들어, 인간) 투여의 경우, 생물학적 표준의 FDA에 의해 요구되는 바와 같은 안정성, 무균성, 발열원성, 일반 안정성 및 순도 표준을 만족해야 함이 이해될 것이다.
본 명세서에서 사용되는 바와 같이, "약제학적으로 허용 가능한 담체"는 관련 기술 분야의 통상의 기술자에게 공지된 바와 같은, 임의의 및 모든 용매, 분산 매질, 코팅, 계면활성제, 항산화제, 보존제(예를 들어, 항박테리아제, 항진균제), 등장성제, 흡수 지연제, 염, 보존제, 약물, 약물 안정화제, 젤, 결합제, 부형제, 붕해제, 윤활제, 감미제, 향료, 염료, 이러한 유사 물질 및 이의 조합물을 포함한다. 약제학적으로 허용 가능한 담체는 바람직하게는 인간에게 투여하기 위해 제형화되지만, 특정 실시형태에서 비-인간 동물에게 투여하기 위해 제형화되지만 인간에게 투여하는 데 허용되지 않을 (예를 들어, 정부 규제로 인해서) 약제학적으로 허용 가능한 담체를 사용하는 것이 바람직할 수 있다. 임의의 종래의 담체가 활성 성분과 비상용성인 경우를 제외하고, 치료적 또는 약제학적 조성물에서의 그의 용도가 고려된다.
환자 또는 대상체에게 투여된 본 발명의 조성물의 실제 투여량은 신체적 및 생리학적 인자, 예컨대 환자의 체중, 병태의 중증도, 치료되는 질환의 유형, 이전 또는 동시 치료 개입, 특발성 질환 및 투여 경로에 의해 결정될 수 있다. 투여를 담당하는 의사는, 어떤 경우에도, 조성물 내의 활성 성분(들)의 농도 및 개별 대상체를 위한 적절한 용량(들)을 결정할 것이다.
특정 실시형태에서, 약제학적 조성물은, 예를 들어, 적어도 약 0.1%의 활성 화합물을 포함할 수 있다. 다른 실시형태에서, 활성 화합물은 단위 중량의 약 2% 내지 약 75%, 또는 예를 들어 약 25% 내지 약 60%, 및 그들 내의 도출될 수 있는 임의의 범위를 차지할 수 있다. 다른 비제한적인 예에서, 용량은 투여당 약 1마이크로그램/㎏/체중, 약 5마이크로그램/㎏/체중, 약 10마이크로그램/㎏/체중, 약 50마이크로그램/㎏/체중, 약 100마이크로그램/㎏/체중, 약 200마이크로그램/㎏/체중, 약 350마이크로그램/㎏/체중, 약 500마이크로그램/㎏/체중, 약 1밀리그램/㎏/체중, 약 5밀리그램/㎏/체중, 약 10밀리그램/㎏/체중, 약 50밀리그램/㎏/체중, 약 100밀리그램/㎏/체중, 약 200밀리그램/㎏/체중, 약 350밀리그램/㎏/체중, 약 500밀리그램/㎏/체중, 내지 약 1000㎎/㎏/체중 또는 그 초과, 및 그들 내의 도출될 수 있는 임의의 범위를 포함할 수 있다. 본 명세서에 열거된 수로부터 도출될 수 있는 범위의 비제한적인 예에서, 약 5㎍/㎏/체중 내지 약 100㎎/㎏/체중, 약 5마이크로그램/㎏/체중 내지 약 500밀리그램/㎏/체중 등의 범위가 투여될 수 있다.
본 실시형태의 올리고뉴클레오타이드는 용량당 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 40, 50, 60, 70, 80, 90, 100 또는 그 초과의 ㎍의 핵산의 용량으로 투여될 수 있다. 각각의 용량은 1, 10, 50, 100, 200, 500, 1000 또는 그 초과의 ㎕ 또는 ㎖의 부피일 수 있다.
치료 조성물의 용액은 계면활성제, 예컨대, 하이드록시프로필셀룰로스와 적합하게 혼합된 물에서 제조될 수 있다. 분산액은 또한 글리세롤, 액체 폴리에틸렌 글리콜, 이의 혼합물 및 오일에서 제조될 수 있다. 일반적인 저장 및 사용 조건 하에서, 이러한 제제는 미생물의 성장을 방지하는 보존제를 함유한다.
본 발명의 치료 조성물은 액체 용액 또는 현탁액으로 주사 가능한 조성물의 형태로 투여될 수 있고; 주사 전 액체 중의 용액, 또는 액체 중의 현탁액에 적합한 고체 형태가 또한 제조될 수 있다. 이러한 제제는 또한 유화될 수 있다. 이러한 목적을 위한 전형적인 조성물은 약제학적으로 허용 가능한 담체를 포함한다. 예를 들어, 조성물은 인산염 완충 식염수의 밀리리터당 10㎎, 25㎎, 50㎎ 또는 최대 약100 ㎎의 인간 혈청 알부민을 함유할 수 있다. 다른 약제학적으로 허용 가능한 담체는 수용액, 비독성 부형제, 예컨대 염, 보존제, 완충제 등을 포함한다.
비-수성 용매의 예는 프로필렌 글리콜, 폴리에틸렌 글리콜, 식물성 오일 및 주사 가능한 유기 에스터, 예컨대, 에틸올레에이트를 포함한다. 수성 담체는 물, 알코올성/수성 용액, 식염수 용액, 비경구 비히클, 예컨대 염화나트륨, 링거 덱스트로스 등을 포함한다. 정맥내 비히클은 유체 및 영양 보충제를 포함한다. 보존제는 항미생물제, 항산화제, 킬레이팅제 및 불활성 기체를 포함한다. 약제학적 조성물의 다양한 성분의 pH 및 정확한 농도는 잘 공지된 파라미터에 따라 조정된다.
본 발명의 치료 조성물은 고전적인 약제학적 제제를 포함할 수 있다. 본 발명에 따른 치료 조성물의 투여는, 표적 조직이 상기 경로를 통해 이용 가능한 한, 임의의 일반적인 경로를 통해서 이루어질 것이다. 이것은 경구, 비내, 협측, 직장, 질 또는 국소를 포함한다. 국소 투여는 피부암, 화학요법 유도 탈모증 또는 다른 피부 과증식성 장애를 치료하는 피부암의 치료에 특히 유리할 수 있다. 대안적으로, 투여는 정위(orthotopic), 피내, 피하, 근육내, 복강내 또는 정맥내 주사에 의해 수행될 수 있다. 이러한 조성물은 일반적으로 생리학적으로 허용 가능한 담체, 완충제 또는 다른 부형제를 포함하는 약제학적으로 허용 가능한 조성물로서 투여될 것이다. 폐의 병태의 치료를 위해, 에어로졸 전달이 사용될 수 있다. 에어로졸의 부피는 약 0.01㎖ 및 0.5㎖이다.
치료 조성물의 유효량은 의도된 목표를 기반으로 결정된다. 용어 "단위 용량" 또는 "투여량"은 대상체에서 사용하는데 적합한 물리적으로 분리된 단위를 지칭하며, 각각의 단위는 그의 투여, 즉, 적절한 경로 및 치료 요법과 관련하여 상기에 논의된 원하는 반응을 생성하도록 계산된 치료 조성물의 미리 결정된 양을 함유한다. 치료 횟수 및 단위 용량에 따라 투여되는 양은 원하는 예방 또는 효과에 좌우된다.
치료 조성물의 정확한 양은 또한 의사의 판단에 좌우되며, 각각의 개인마다 다르다. 용량에 영향을 주는 인자는 환자의 신체 및 임상적 상태, 투여 경로, 의도된 치료 목표(예를 들어, 증상의 경감 대 치유) 및 특정 치료 물질의 효력, 안정성 및 독성을 포함한다.
XII.
병용 치료
특정 실시형태에서, 본 발명의 방법은 제2 또는 추가적인 요법과 조합하여, 유전자 발현의 저해제를 발현할 수 있는 저해성 올리고뉴클레오타이드, 또는 올리고뉴클레오타이드의 투여를 포함한다. 병용 요법을 포함하는 방법 및 조성물은 치료 또는 예방 효과를 향상시키고/시키거나 또 다른 항암 또는 항-과증식성 요법의 치료 효과를 증가시킨다. 치료 및 예방 방법 및 조성물은 원하는 효과, 예컨대, 암 세포의 사멸 및/또는 세포 과증식의 저해를 달성하는 효과적인 조합된 양으로 제공될 수 있다. 이 과정은 세포를 유전자 발현의 저해제 및 제2 요법, 예컨대, 타이로신 카이나제 저해제(예를 들어, 이마티닙, 닐로티닙, 다사티닙, 보수티닙, 포나티닙 또는 베이프티닙) 또는 사이티딘 유사체(예를 들어, 데시타빈, 시타라빈 또는 아자시티딘) 둘 모두와 접촉시키는 것을 포함할 수 있다. 조직, 종양, 또는 세포는 작용제(즉, 유전자 발현의 저해제 또는 항암제) 중 1종 이상을 포함하는 1종 이상의 조성물 또는 약리학적 제형(들)과 접촉될 수 있거나, 또는 조직, 종양, 및/또는 세포를 2종 이상의 별개의 조성물 또는 제형과 접촉시킴으로써 접촉될 수 있고, 여기서 하나의 조성물은 1) 저해성 올리고뉴클레오타이드; 2) 항암제, 또는 3) 저해성 올리고뉴클레오타이드 및 항암제 둘 모두를 제공한다. 또한, 이러한 병용 요법은 화학요법, 방사선요법, 수술 요법, 또는 면역요법과 함께 사용될 수 있음이 고려된다.
저해성 올리고뉴클레오타이드는 항암 치료에 대해 그 이전, 그 동안, 그 이후, 또는 다양한 조합으로 투여될 수 있다. 투여는 동시부터 수 분 내지 수 일 내지 수 주의 범위의 간격일 수 있다. 저해성 올리고뉴클레오타이드가 항암제와 별도로 환자에게 제공되는 실시형태에서, 두 화합물이 환자에게 유리하게 조합된 효과를 여전히 발휘할 수 있도록 일반적으로 각각의 전달 시간 사이에 상당한 시간 간격이 만료되지 않도록 보장될 것이다. 이러한 경우, 저해성 올리고뉴클레오타이드 요법 및 항암 요법을 서로 약 12 내지 24 또는 72시간 내에, 보다 바람직하게는 서로 약 6 내지 12시간 내에 환자에게 제공할 수 있음이 고려된다. 일부 경우, 각각의 투여 사이에 수 일(2, 3, 4, 5, 6 또는 7일) 내지 수 주(1, 2, 3, 4, 5, 6, 7 또는 8주)가 경과하는 경우, 치료 시간 기간을 유의하게 연장하는 것이 바람직할 수 있다.
특정 실시형태에서, 치료 과정은 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90일 또는 그 초과로 지속될 것이다. 하나의 작용제가 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 및/또는 90, 이의 임의의 조합에 제공될 수 있고, 또 다른 작용제가 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 및/또는 90 또는 이의 임의의 조합에 제공되는 것이 고려된다. 1일(24시간) 이내에, 환자는 작용제(들)의 하나 또는 복수 투여를 제공받을 수 있다. 더욱이, 치료 과정 후, 항암 치료가 투여되지 않는 시간 기간이 존재함이 고려된다. 이러한 시간 기간은, 환자의 상태, 예컨대, 이들의 예후, 체력, 건강 등에 따라, 1, 2, 3, 4, 5, 6, 7일, 및/또는 1, 2, 3, 4, 5주, 및/또는 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12개월 또는 그 초과로 지속될 수 있다.
다양한 조합이 사용될 수 있다. 하기 예의 경우, 저해성 올리고뉴클레오타이드 요법은 "A"이고 항암 요법은 "B"이다:
본 발명의 임의의 화합물 또는 요법의 투여는 작용제의 독성(존재한다면)을 고려하여, 이러한 화합물의 투여를 위한 일반 프로토콜을 따를 것이다. 따라서, 일부 실시형태에서, 병용 요법에 기인하는 독성을 모니터링하는 단계가 있다. 치료 주기는 필요에 따라 반복될 것임이 예상된다. 또한 다양한 표준 요법, 뿐만 아니라 수술 개입이 기술된 요법과 조합하여 적용될 수 있음이 고려된다.
특정 양상에서, 표준 요법은 화학요법, 방사선요법, 면역요법, 수술 요법 또는 유전자 요법을 포함할 것이고, 본 명세서에 기술된 바와 같은, 유전자 발현의 저해제 요법, 항암 요법, 또는 유전자 발현의 저해제 요법 및 항암 요법 둘 모두와 조합하여 사용될 수 있음이 고려된다.
A.
화학요법
다양한 화학치료제가 본 실시형태에 따라 사용될 수 있다. 용어 "화학요법"은 암을 치료하기 위한 약물의 사용을 지칭한다. "화학치료제"는 암의 치료에서 투여되는 화합물 또는 조성물을 내포하기 위해 사용된다. 이러한 작용제 또는 약물은 세포 내에서 이들의 활성 방식, 예를 들어, 이들의 세포 주기에 영향을 미치는지와 이들이 어떤 단계에서 세포 주기에 영향을 미치는지에 의해 분류된다. 대안적으로, 작용은 DNA를 직접 가교결합시키는 그의 능력, DNA로 삽입되는 그의 능력, 또는 핵산 합성에 영향을 미침으로써 염색체 및 유사분열 이상을 유도하는 그의 능력에 기초하여 규명될 수 있다.
화학치료제의 예는 알킬화제, 예컨대 티오테파 및 사이클로포스파마이드; 알킬 설포네이트, 예컨대 부설판, 임프로설판, 및 피포설판; 아지리딘, 예컨대 벤조도파, 카르보퀀, 메투레도파, 및 우레도파; 에틸렌이민 및 메틸아멜라민, 예컨대 알트레타민, 트라이에틸렌멜라민, 트라이에틸렌포스포아마이드, 트라이에틸렌티오포스포아마이드, 및 트라이메틸올로멜라민; 아세토게닌(예를 들어, 불라타신 및 불라타시논); 캄포테신(합성 유사체 토포테칸 포함); 브리오스타틴; 칼리스타틴; CC-1065(그의 아도젤레신, 카르젤레신 및 비젤레신 합성 유사체 포함); 크립토피신(특히 크립토피신 1 및 크립토피신 8); 돌라스타틴; 두오카르마이신(합성 유사체, KW-2189 및 CB1-TM1 포함); 엘레우테로빈; 판크라티스타틴; 사르코딕티인; 스폰기스타틴; 질소 머스타드, 예컨대 클로람부실, 클로르나파진, 콜로포스파마이드, 에스트라무스틴, 이포스파미드, 메클로에타민, 메클로에타민 옥사이드 하이드로클로라이드, 멜팔란, 노벰비친, 페네스테린, 프레드니무스틴, 트로포스파마이드, 및 우라실 머스타드; 니트로소우레아, 예컨대 카르무스틴, 클로로조토신, 포테무스틴, 로무스틴, 니무스틴, 및 라님누스틴; 항생제, 예컨대 에데다이인 항생제(예를 들어, 칼리케아미신, 특히 칼리케아미신 감마lI 및 칼리케아미신 오메가I1); 다이네미신, 예컨대 다이네미신 A; 비스포스포네이트, 예컨대 클로드로네이트; 에스페라미신; 뿐만 아니라 네오카르지노스타틴 발색단 및 관련 발색단백질 에네다이인 항생제 발색단, 아클라시노마이신, 악티노마이신, 아우트라마이신, 아자세린, 블레오마이신, 칵티노마이신, 카라비신, 카르미노마이신, 카르지노필린, 크로모마이시니스, 닥티노마이신, 다우노루비신, 데토루비신, 6-다이아조-5-옥소-L-노르류신, 독소루비신(모르폴리노-독소루비신, 시아노모르폴리노-독소루비신, 2-피롤리노-독소루비신 및 데옥시독소루비신 포함), 에피루비신, 에소루비신, 이다루비신, 마르셀로마이신, 미토마이신, 예컨대, 미토마이신 C, 미코페놀산, 노갈라마이신, 올리보마이신, 페플로마이신, 포트피로마이신, 푸로마이신, 쿠엘라마이신, 로도루비신, 스트렙토니그린, 스트렙토조신, 투베르시딘, 우베니멕스, 지노스타틴, 및 조루비신; 항-대사산물, 예컨대 메토트렉세이트 및 5-플루오로우라실(5-FU); 엽산 유사체, 예컨대 데놉테린, 프테롭테린, 및 트라이메트렉세이트; 퓨린 유사체, 예컨대 플루다라빈, 6-머캅토퓨린, 티아미프린, 및 티오구아닌; 피리미딘 유사체, 예컨대 안시타빈, 아자시티딘, 6-아자우리딘, 카르모푸르, 시타라빈, 데시타빈, 다이데옥시우리딘, 독시플루리딘, 에노시타빈, 및 플록스우리딘; 안드로겐, 예컨대 칼루스테론, 드로모스타놀론 프로피오네이트, 에피티오스타놀, 메피티오스탄, 및 테스토락톤; 항-아드레날, 예컨대 미토탄 및 트릴로스탄; 엽산 보충제, 예컨대 프롤린산; 아세글라톤; 알도포스파마이드 글리코시드; 아미노레불린산; 에닐우라실; 암사크린; 베스트라부실; 비산트렌; 에다트렉세이트; 데포파민; 데메콜신; 다이아지퀀; 엘포르미틴; 엘립티늄 아세테이트; 에포틸론; 에토글루시드; 갈륨 니트레이트; 하이드록시유레아; 렌티난; 로니다이닌; 메이탄시노이드, 예컨대, 메이탄신 및 안사미토신; 미토구아존; 미톡산트론; 모피단몰; 니트라에린; 펜토스타틴; 페바메트; 피라루비신; 로속산트론; 포도필린산; 2-에틸하이드라자이드; 프로카바진; PSK다당류 복합체; 라족산; 리족신; 시 조피란; 스피로게르마늄; 테누아존산; 트라이아지쿠온; 2,2',2"-트라이클로로트라이에틸아민; 트리코테센(특히 T-2 독소, 베라쿠린 A, 로리딘 A 및 안구이딘); 우레탄; 빈데신; 다카바진; 만노무스틴; 미토브로니톨; 미토락톨; 피포브로만; 가시토신; 아라비노시드("Ara-C"); 사이클로포스파마이드; 탁소이드, 예컨대, 파클리탁셀 및 도세탁셀 젬시타빈; 6-티오구아닌; 머캅토퓨린; 백금 배위 착물, 예컨대 시스플라틴, 옥살리플라틴, 및 카르보플라틴; 빈블라스틴; 백금; 에토포시드(VP-16); 이포스파마이드; 미톡산트론; 빈크리스틴; 비노렌빈; 노반트론; 테니포시드; 에다트렉세이트; 다우노마이신; 아미놉테린; 젤로다; 이반드로네이트; 이리노테칸(예를 들어, CPT-11); 토포아이소머라아제 저해제 RFS 2000; 다이플루오로메틸오르니틴(DMFO); 타이로신 카이나제 저해제, 예컨대, 이마티닙, 닐로티닙, 다사티닙, 보수티닙, 포나티닙, 및 베이프티닙; 레티노이드, 예컨대 레티노산; 카페시타빈; 카보플라틴, 프로카바진, 플리코마이신, 젬시타빈, 나벨빈, 파르네실-단백질 전달효소 억제제, 트랜스플라티눔, 및 상기 중 어느 것의 약제학적으로 허용 가능한 염, 산, 또는 유도체를 포함한다.
B.
방사선요법
DNA 손상을 일으키고, 광범위하게 사용되어 왔던 다른 인자는 일반적으로 γ선, X선, 및/또는 종양 세포에 방사성 동위원소의 유도된 전달로서 공지된 것을 포함한다. DNA 손상 인자의 다른 형태, 예컨대, 마이크로파, 양성자 빔 조사(미국 특허 제5,760,395호 및 제4,870,287호) 및 UV-조사가 또한 고려된다. 이러한 인자 모두는 DNA, DNA의 전구체, DNA의 복제 및 수선, 및 염색체의 조립 및 유지의 광범위한 손상에 영향을 미칠 가능성이 매우 높다. X선의 투여량 범위는 연장된 시간(3 내지 4주) 동안 50 내지 200 뢴트겐의 1일 용량부터 2000 내지 6000 뢴트겐의 단일 용량까지의 범위이다. 방사성 동위원소에 대한 투여량 범위는 광범위하게 달라지며, 동위원소의 반감기, 방출된 방사선의 강도 및 유형, 및 신생물 세포의 흡수에 좌우된다.
세포에 적용될 때 용어 "접촉된" 및 "노출된"은 치료 구조물 및 화학치료제 또는 방사성 치료제가 표적 세포에 전달되거나 표적 세포와 직접 병치되어 놓이는 과정을 기술하기 위해 본 명세서에 사용된다. 세포 사멸을 달성하기 위해, 예를 들어, 두 작용제 모두는 세포를 사멸시키거나 세포가 분열하는 것을 예방하는 데 효과적인 조합된 양으로 세포에 전달된다.
C.
면역요법
암 치료와 관련하여, 면역치료제는, 일반적으로, 암 세포를 표적화하고 파괴하는 면역 효과기 세포 및 분자의 사용에 좌우된다. 트라스투주맙(Trastuzumab)(허셉틴(Herceptin(상표명))이 그러한 예이다. 면역 효과기는, 예를 들어, 종양 세포의 표면 상의 일부 마커에 특이적인 항체일 수 있다. 항체 단독은 요법의 효과기로서 작용할 수 있거나 또는 그것은 세포사멸에 실제로 영향을 미치는 다른 세포를 동원할 수 있다. 항체는 또한 약물 또는 독소(화학치료제, 방사성핵종, 리신 A 사슬, 콜레라 독소, 백일해 독소 등)에 접합될 수 있고, 단지 표적화제로서 작용할 수 있다. 대안적으로, 효과기는 종양 세포 표적과 직접 또는 간접적으로 상호작용하는 표면 분자를 보유하는 림프구일 수 있다. 다양한 효과기 세포는 세포독성 T 세포 및 NK 세포를 포함한다. 치료 양상의 조합, 즉, 직접적인 세포독성 활성도 및 ErbB2의 저해 또는 감소는 ErbB2를 과발현하는 암의 치료에서 치료 이익을 제공할 것이다.
다른 면역요법이 또한 본 명세서에 논의된 유전자 침묵 요법과 조합된 요법의 일부로서 사용될 수 있다. 면역요법의 일 양상에서, 종양 세포는 표적화할 수 있는, 즉, 대부분의 다른 세포에 존재하지 않는 일부 마커를 가져야 한다. 많은 종양 마커가 존재하고, 이들 중 임의의 것은 본 발명의 문맥에서 표적화에 적합할 수 있다. 일반적인 종양 마커는 암배아 항원, 전립선 특이적 항원, 소변 종양 관련 항원, 태아 항원, 타이로시나아제(p97), gp68, TAG-72, HMFG, 시알릴 루이스 항원, MucA, MucB, PLAP, 에스트로겐 수용체, 라미닌 수용체, erb B 및 p155를 포함한다. 면역요법의 대안적인 양상은 항암 효과와 면역 자극 효과를 조합하는 것이다. 사이토카인, 예컨대, IL-2, IL-4, IL-12, GM-CSF, 감마-IFN, 케모카인, 예컨대, MIP-1, MCP-1, IL-8 및 성장 인자, 예컨대, FLT3 리간드를 비롯한, 면역 자극 분자가 또한 존재한다. 단백질로서 또는 종양 억제제와 조합하여 유전자 전달을 사용하여 면역 자극 분자를 조합하는 것은 항종양 효과를 향상시키는 것으로 나타났다. 더욱이, 이러한 화합물 중 임의의 것에 대한 항체는 본 명세서에 논의된 항암제를 표적화하는데 사용될 수 있다.
현재 조사 중이거나 사용 중인 면역요법의 예는 예를 들어, 면역 아주반트, 예컨대, 마이코박테리움 보비스, 플라스모디움 팔시파룸, 다이나이트로클로로벤젠 및 방향족 화합물(미국 특허 제5,801,005호 및 제5,739,169호; 문헌[Hui and Hashimoto, 1998; Christodoulides et al., 1998]), 사이토카인 요법, 예를 들어, 인터페론 α, β 및 γ; IL-1, GM-CSF 및 TNF(문헌[(Bukowski et al., 1998; Davidson et al., 1998; Hellstrand et al., 1998]) 유전자 요법, 예컨대, TNF, IL-1, IL-2, p53(문헌[Qin et al., 1998; Austin-Ward and Villaseca, 1998]; 미국 특허 제5,830,880호 및 제5,846,945호) 및 단클론성 항체, 예를 들어, 항-강글리오시드 GM2, 항-HER-2, 항-p185(문헌[Pietras et al., 1998; Hanibuchi et al., 1998]; 미국 특허 제5,824,311호)이다. 1종 이상의 항암 요법이 본 명세서에 논의된 유전자 침묵 요법과 함께 사용될 수 있음이 고려된다.
활성 면역요법에서, 항원성 펩타이드, 폴리펩타이드 또는 단백질, 또는 자가 또는 동종의 종양 세포 조성물 또는 "백신"은 일반적으로 별개의 박테리아 아주반트와 함께 투여된다(Ravindranath and Morton, 1991; Morton et al., 1992; Mitchell et al., 1990; Mitchell et al., 1993).
입양 면역요법에서, 환자의 순환성 림프구, 또는 종양 침윤된 림프구는 시험관내에서 단리되고, 림포카인, 예컨대, IL-2에 의해 활성화되거나 또는 종양 괴사를 위한 유전자가 형질도입되고, 재투여된다(Rosenberg et al., 1988; 1989).
D.
수술
암을 갖는 환자의 대략 60%는 예방, 진단 또는 병기결정, 치유, 및 완화 수술을 포함하는 일부 유형의 수술을 받을 것이다. 치유적 수술은 본 발명의 치료, 화학요법, 방사선요법, 호르몬 요법, 유전자 요법, 면역요법 및/또는 대안적인 요법과 같은 다른 요법과 함께 사용될 수 있는 암 치료이다.
치유적 수술은 암성 조직의 전부 또는 일부를 물리적으로 제거, 절개 및/또는 파괴하는 절제술을 포함한다. 종양 절제술은 종양의 적어도 일부를 물리적으로 제거하는 것을 지칭한다. 종양 절제술에 더하여, 수술에 의한 치료는 레이저 수술, 냉동수술, 전기수술, 및 현미경으로 제어되는 수술(모스 수술(Mohs' surgery))을 포함한다. 본 발명이 표재암, 전암, 또는 부수적인 양의 정상 조직의 제거와 함께 사용될 수 있다는 것이 추가로 고려된다.
암성 세포, 조직, 또는 종양의 부분 또는 전부의 절개 시, 신체에 공동(cavity)이 형성될 수 있다. 치료는 관류, 직접 주사 또는 추가적인 항암 요법을 이용한 영역의 국소 적용에 의해 달성될 수 있다. 이러한 치료는, 예를 들어, 1, 2, 3, 4, 5, 6, 또는 7일마다, 또는 1, 2, 3, 4, 및 5주마다 또는 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 또는 12개월마다 반복될 수 있다. 이러한 치료는 또한 달라지는 투여량일 수 있다.
E.
다른 작용제
다른 작용제가 치료의 치료 효능을 개선시키기 위해 본 실시형태의 특정 양상과 조합되어 사용될 수 있음이 고려된다. 이러한 추가적인 작용제는 세포 표면 수용체 및 GAP 접합부의 상향조절에 영향을 미치는 작용제, 세포 정지제 및 분화제, 세포 접착의 저해제, 세포자멸 유도제에 대한 과증식성 세포의 민감성을 증가시키는 작용제, 또는 다른 생물학적 작용제를 포함한다. GAP 접합부의 수를 증가시킴으로써 세포간 신호전달을 증가시키는 것은 주변의 과증식성 세포 집단에 대한 항-과증식성 효과를 증가시킬 것이다. 다른 실시형태에서, 세포정지제 또는 분화제는 치료의 항과증식성 효능을 증가시키기 위해 본 실시형태의 특정 양상과 조합하여 사용될 수 있다. 세포 접착의 저해제가 본 실시형태의 효능을 개선시키기 위해 고려된다. 세포 접착 저해제의 예는 국소 부착 카이나제(FAK) 저해제 및 로바스타틴이다. 아폽토시스에 대한 과증식성 세포의 민감성을 증가시키는 다른 작용제, 예컨대 항체 c225가 치료 효능을 개선시키기 위해 본 실시형태의 특정 양상과 조합하여 사용될 수 있음이 추가로 고려된다.
XIII.
실시예
하기 실시예는 본 발명의 바람직한 실시형태를 입증하기 위해 포함된다. 하기 실시예에 개시된 기술은 본 발명의 실시에서 잘 기능하기 위해 본 발명자에 의해 발견된 기술을 나타내고, 따라서 그 실시를 위한 바람직한 모드를 구성하는 것으로 간주될 수 있음이 관련 기술 분야의 통상의 기술자에게 인식되어야 한다. 그러나, 관련 기술 분야의 통상의 기술자는 본 개시내용에 비추어 본 발명의 사상 및 범위를 벗어나지 않고 개시된 특정 실시형태에서 많은 변화가 일어날 수 있고 유사한 결과를 얻을 수 있음을 이해해야 한다.
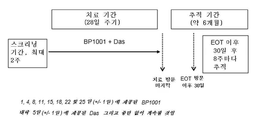
실시예 1 - 혈액 악성종양을 갖는 환자에서의 BP1001(리포솜 Grb2 안티센스)의 I상 연구
암 세포 신호전달에 본질적인, 성장 인자 수용체 결합 단백질-2(Grb2)는 종양발생 타이로신 카이나제에 의해서 활용되어 Ras 및 ERK를 활성화시킨다. BP1001은 Grb2 발현을 저해하는 리포솜-혼입된 안티센스이다. 본 연구는, 혈액 악성종양에서 BP1001의 안전성, 최대 내약 용량(MTD), 약동학, 및 항백혈병 활성도를 정의하는 것을 목적으로 하였다.
BP1001 약물 물질 및 투여. Grb2 안티센스 올리고의 서열은 다음과 같고: 5'-ATA TTT GGC GAT GGC TTC-3'(서열번호 1), 이것은 인간 grb2 mRNA의 코돈 2 내지 7을 표적으로 한다. P-에톡시 올리고 변형으로 구성된, Grb2 안티센스 올리고는 닛토 덴쿄 아베시카, 인크.(Nitto Denko Avecia, Inc.)(미국 오하이오주 45215 신티내티 리딩 로드 8560 소재)에 의해서 제조되었다. Grb2 안티센스 올리고를 동결건조 프로토콜을 통해서 1,2-다이올레일-3-포스파티딜콜린 지질(아밴티 폴리 리피즈(Avanti Polar Lipids), 미국 알라바마주 알라바스터 소재)에 혼입하였다. BP1001을 5-㎎ 약물 분말로서 제조하고, 4℃에서 저장하였다. 약물 주입일에, 2㎖의 0.9% 생리 식염수를 첨가하여 2.5㎎/㎖의 최종 BP1001 농도를 달성하였다. 참가자에게 28일 동안 BP1001을 2 내지 3-h 정맥내(IV) 주입으로 1주 2회(3 또는 4일마다) 투여하였다. 참가자가 치료로부터의 이익이 계속되면, 참가자에게 최대 6회 치료 주기를 제공할 수 있다.
환자 및 연구 설계. 난치성/재발성 필라델피아 염색체 양성 CML 또는 ALL, AML 또는 MDS로 진단된 성인 환자에서 BP1001의 안전성, 약동학 및 효능을 평가하기 위해서 표준 3+3 용량 증가 시험으로 연구를 설계하였다. 3명의 환자의 코호트를 각각의 용량 수준에 등록하였다. BP1001의 초기 용량은 5㎎/㎡(코호트 1)였다. 한 명의 환자가 등급 3 또는 그 초과의 독성이 발달하면, 3명 초과의 환자가 그 용량 수준에서 발생하였다. 2명 이상의 환자가 등급 3 또는 그 초과의 독성이 발달하면, 그 용량 수준은 독성인 것으로 여겨졌다. 2명 이상의 환자에서 용량-제한 독성을 생성하는 것보다 더 낮은 용량으로서 최대 내약 용량(MTD)을 정의하였다. 국립 암 연구소 이상 반응 표준 용어 기준(National Cancer Institute Common Terminology Criteria for Adverse Events: NCI CTCAE, 버전 3.0)을 사용하여 독성을 등급화하였다. 용량-제한 독성(DLT)이 관찰되지 않으면, 환자는 코호트 2(10㎎/㎡), 코호트 3(20㎎/㎡), 코호트 4(40㎎/㎡), 코호트 5(60㎎/㎡) 또는 코호트 6(90㎎/㎡)에 순차적으로 등록될 것이다.
BP1001 단일 작용제 I상 코호트 1 내지 6의 완결 시에, BP1001과 저용량 시타라빈의 조합물의 안정성 및 효능(Ib상)을 연구하였다. BP1001을 IV로 60㎎/㎡(코호트 7) 또는 90㎎/㎡(코호트 8)로서 투여하였다. 환자에게 BP1001의 3회 주사를 제공하였고, 그 후 20㎎의 저용량 시타라빈(LDAC)을 피하로 10일의 연속일 동안 1일 2회 투여하였다. 본 연구는 ClinicalTrials.gov, number NCT01159028로 등록되었다.
말초 혈액 및 골수 평가 말초 혈액 평가를 기준선(연구 시작 14일 이내), 1, 8, 15, 22일, 1주기의 완결 시에, 그리고 임상적으로 제시된 바와 같이 수행하였다. 골수 평가를 기준선(연구 시작 14일 이내), 1주기, 2주기의 완결 시에, 그리고 임상적으로 제시된 바와 같이 수행하였다. 기준선 세포유전학 데이터를 치료 전에 얻었다. 분자 분석을 수행하여 기준선 골수에 대한 체세포 돌연변이를 검출하였다.
유세포 분석법. 말초 혈액을 코호트 3, 4, 5 및 6 내의 환자로부터 수집한 후, 1주기의 1, 8, 15 및 22일, 및 2주기의 1일에 투여하였다. 백혈구를 소듐 헤파린을 함유하는 BD 진공채혈관(Vacutainer) CPT 세포 제조 튜브(비디 디킨슨(BD Dickinson))를 사용하여 말초 혈액으로부터 단리하고, 고정시키고, -80℃ 냉동기에서 저장하였다. 유세포 분석법을 활용하여, 검증 방법(플로우 컨트랙트 사이트 래보러토리(Flow Contract Site Laboratory), 미국 워싱턴주 보델 소재)을 사용하여 CD33-발현 세포에서 Grb2 및 인산화된 Erk1,2(pErk) 수준을 결정하였다.
약동학 샘플 수집 및 분석. Grb2 안티센스 올리고 농도의 측정을 위한 혈액 샘플을 코호트 7 및 8의 환자로부터, 투여전, 주입 시작(SOI) 후 1, 2, 4, 6, 8, 24, 72시간에 수집하였다. BP1001 농도의 측정을 위한 소변 샘플을 또한 코호트 7 및 8의 환자로부터, 투여 시작-4시간, 투여 후 4 내지 8시간 및 투여 후 8 내지 24시간에 수집하였다. PK 혈액 샘플을 혈장으로 가공하고, 최소 정량 한계(lower limit of quantitation: LLOQ; 0.5ng/㎖)를 사용한 검증 방법(찰스 리버 래버러토리즈(Charles River Laboratories), 캐나다 몬트리얼 소재)을 사용하여 분석하였다. 소변 샘플을 1.00ng/㎖의 LLOQ를 사용한 검증 방법(찰스 리버 래버러토리즈, 캐나다 몬트리얼 소재)을 사용하여 분석하였다.
PK 파라미터를 포에닉스 약동학 소프트웨어(서타라(Certara))를 사용하여 예측하였다. 2.5시간의 예측된 주입 시간을 사용하여, IV 주입 경로의 투여와 일치하는 비구획적 접근법을 파라미터 예측을 위해서 사용하였다. 실용적인 경우에는 언제나, 1주기의 1일로부터의 혈장 중의 Grb2 안티센스 올리고 개별 농도로부터 모든 파라미터를 생성하였다. 1주기, 1일 투여전 농도값은 LLOQ 미만이었고, 따라서 0시간 값은 0인 것으로 예측되었다. 주입 시작 시에 대한 공칭 샘플링 시간을 사용하여 파라미터를 예측하였다. 농도 대 시간 곡선 하 면적(AUC)을 선형 내삽법을 사용한 선형 사다리콜 방법을 사용하여 계산하였다. 최종 제거 단계의 기울기를 가중 농도 데이터 상에서 로그 선형 회귀를 사용하여 결정하였다. 최종 제가 단계의 결정에 관련된 파라미터는, 결정 계수(R2)가 0.800 미만이거나 또는 무한대까지의 AUC(%AUCextrap)의 외삽법이 총 면적의 20%를 초과하면, 보고되지 않았다.
혈장으로부터 예측된 파라미터는 다음과 같다: Tmax, 최대 관찰 농도가 관찰된 투여 후 시간; Cmax, 투여 후 측정된 최대 관찰 농도; T1/2, 겉보기 최종 제거 반감기; AUC(0-24), 투여에서 투여 후 24시간까지의 AUC; AUC(0-t), 투여에서, 마지막 정량 가능한 농도가 관찰된 투여 후 시간까지의 AUC; AUC(0-inf), 투여에서 무한대까지의 예측된 AUC; CL, Grb2 안티센스 올리고의 겉보기 클리어런스율; Vz, Grb2 안티센스 올리고의 분포의 겉보기 부피.
소변 파라미터 예측을 마이크로소프트 엑셀을 사용하여 수행하였다. 1주기의 1일로부터의 소변 중의 Grb2 안티센스 올리고 개별 농도로부터 모든 파라미터를 생성하였다. 보고된 파라미터는 다음과 같았다: 총 U, 전체 샘플링 기간에 걸쳐서 소변으로 배설된 Grb2 안티센스 올리고의 누적량; CLr, 혈장에 대한 신장 클리어런스; 회수 백분율, 투여된 총 약물에 비교된 소변으로 배설된 Grb2 안티센스 올리고의 상대적인 양.
통계학적 분석. PK 분석뿐만 아니라 표 및 그래프 생성은 포에닉스 버전 1.4에 의해서 생성하였다. 변수를 적절하게 그룹화 및 분류하기 위한 기술 통계학(N, 산술 평균, 표준 편차)을 포에닉스 버전 1.4, 및 마이크로소프트 엑셀 2007을 사용하여 생성하였다.
연구 목적. BP1001 I상 연구의 주요 목적은 단일 작용제 요법으로서 BP1001의 증가 용량의 독성 및 내약성을 결정하고; BP1001의 최대 내약 용량(MTD)을 결정하고; 저용량 시타라빈과 조합된 BP101의 독성 및 내약성(Ara-C; Ib상)을 결정하는 것이었다. BP1001 I상 연구의 2차 목적은 최적 생물학적 활성 용량(optimal biologically active dose: OBAD; 순환 백혈병 세포에서 Grb2 발현을 50% 감소시키는 것으로 정의됨)을 결정하고; BP1001의 생체내 약동학을 결정하고; 종양 반응을 평가하는 것이었다.
포함 또는 제외 기준. 본 연구의 부분 둘 모두는 공개 표지, 순차적 용량-증가 설계를 사용하여 안전성, 내약성 및 독성, PK, 종양 반응 및 항백혈병 활성도를 평가하였다. 포함 기준은 적어도 18세이고; 난치성 또는 재발성 AML, Ph+ CML, ALL 또는 MDS를 갖고; 연구 참여 전에 적어도 2주 동안 항암 요법이 중단되고(하이드록시유레아 또는 아나그렐리드(24시간), TKI(95일), 및 인터페론(2주) 예외); 적절한 간 및 신장 기능을 갖고(ALT <2x ULN, 혈청 크레아티닌 <2x ULN, 혈청 빌리룹 <2x ULN); 및 0 내지 2의 ECOG 수행 능력을 갖는 사람이었다. 제외 기준은 치료 프로그램을 수행하기 위한 환자의 능력을 방해할 심각한 병발성 의학적 질병을 갖는 것; 및 이전 제품의 14일 또는 5 반감보다 긴 또 다른 조사 제품이 제공된 사람이었다.
환자 특징. 총 39 환자를 본 연구에 등록시켰다: 13명의 환자(코호트 1), 6명의 환자(코호트 2), 3명의 환자(코호트 3), 3명의 환자(코호트 4), 3명의 환자(코호트 5), 4명의 환자(코호트 6), 4명의 환자(코호트 7) 및 3명의 환자(코호트 8). 5명의 환자는 CML 급성 전환기로 진단되었고, 30명의 환자는 AML로 진단되었고, 4명의 환자는 MDS로 진단되었다(표 3). 환자의 중간 연령은 66세였고, 32 내지 89세 범위였다. 27명은 남성 환자였고, 12명은 여성 환자였다. 등록 전에, 환자는 4종의 요법의 중간이 제공되었다. 이의 중간 수행 능력 상태는 1이었다. 중간 말초 혈액 블라스트 수치는 15%였고, 0 내지 96% 범위였다. 예측된 바와 같이, 이들 환자는 다양한 세포유전학을 가졌고, 이것은 하기를 포함하였다: t(9;22)(n = 7), 이배체(n = 12), 복합체(n = 10), 기타(n = 13). 2명의 환자는 t(9;22)-양성 CML 및 복합체 세포유전학을 가진 반면, 1명의 환자는 t(9;22)-양성 AML을 가졌다.
평가 가치가 있는 환자에서의 이상 반응. 39명의 환자 중에서, 27 환자가 평가 가치가 있었다. 12명의 환자는 질환 진행으로 인해서 전체 주기의 완결에 실패하여, 프로토콜에 따라서 대체하였다(표 4). 27명의 평가 가치가 있는 환자 중에서, 21명의 환자는 BP1001 단일 작용제 요법 중인 반면, 6명의 환자는 BP1001 + LDAC 병용 요법 중이었다. 표 8에 나타낸 바와 같이, 평가 가치가 있는 환자는 이의 백혈병에서 다양한 분자 이상을 가졌고, 이것은 ASXL1(n = 1), BCR-ABL(n = 2; 1명은 T315I를 포함함), CEBPA(n = 4), DNMT3A(n = 1), FLT-ITD(n = 2), IDH1/2(n = 3), JAK2(n = 2), NOTCH1(n = 1), NPM1(n = 2), NRAS(n = 2), TET2(n = 2), TP53(n = 2)을 포함하였다. 등록된 환자의 특징을 표 3에 제공한다.
증식성 CML-BP의 경우 고용량 하이드록시유레아를 사용하면서, 5㎎/㎡에 대해서 1명의 환자 만이 용량-제한 독성(DLT), 등급 3 점막염 및 손발 증후군을 경험하였다. 본 연구 의약은 기여 인자로서 제외될 수 없기 때문에, 이러한 사건은 DLT로 보고되었다. 6명의 환자로의 확장 시, 어떠한 다른 환자도 DLT를 발생시키지 않았다. 치료된 환자 중 누구도 다른 약물 관련 독성이 관찰되지 않았다. MTD는 확인되지 않았다. BP1001에 대한 HTD는 90㎎/㎡였다.
[표 3]
Grb2 안티센스 올리고의 약동학. 혈장 중의 Grb2 안티센스 올리고 농도의 최소 정량 한계(LLOQ)는 0.50ng/㎖이다. 연구전 시간 지점에서 정량 가능한 Grb2 안티센스 올리고 농도가 존재하지 않았다. 혈장 중의 Grb2 안티센스 올리고의의 수준은 이중 지수적으로 감소되었다(도 1). 혈장 중에서 Grb2 안티센스 올리고의 최대 농도는 주입 1시간 후에 관찰되었다(도 1). 주입 72시간 후, 혈장 중의 Grb2 안티센스 올리고의 수준은 LLOQ보다 낮거나 약간 높았다(도 1). 혈장 중의 Grb2 안티센스 올리고의 혈장 t1/2은 60㎎/㎡ 용량의 경우 22.2 내지 37.7시간 범위였고, 90㎎/㎡ 용량의 경우 4.64 내지 14.2시간 범위였다(표 5). Cmax, AUC(0-24), AUC(0-t) 및 AUC(0-inf)는, 60에서 90㎎/㎡로의 1.5배 용량 증가가 존재하였음에도 불구하고 두 용량 수준 모두에 대해서 유사하였다(표 5). 60에서 90㎎/㎡로의 용량 증가의 경우 Vz는 대략 1.5배 감소되었고, CL은 대략 1.5배 증가되었다(표 5).
투여된 총 용량과 비교된 소변에서 회수된 Grb2 안티센스 올리고의 양은 60㎎/㎡ 용량의 경우 0.04 내지 3.23%였고, 90㎎/㎡ 용량의 경우 0.36 내지 4.77% 범위였다. 평균 Grb2 안티센스 올리고 소변 농도는 60㎎/㎡ 코호트보다 90㎎/㎡ 코호트에서 더 높았다(표 6).
BP1001은 Grb2 및 인산화된 Erk1,2(pErk) 수준을 감소시켰다. 유세포 분석법을 사용하여 BP1001 단일 작용제 요법 중인 환자의 순환계 백혈병 세포에서 Grb2 및 pErk 단백질의 수준을 결정하고, 중간 형광 강도(MFI)로서 기록하였다. 치료 동안 Grb2 및 pErk의 MFI를 기준선에서의 것과 비교하였다(표 7). 마지막에 측정된 샘플(치료 마지막 또는 1주기, 22일)의 경우, BP1001은 12개의 샘플 중 10개에서 Grb2 수준을 25% 이상 감소시켰고, 12개의 샘플 중 7개에서 pErk 수준을 25% 이상 감소시켰다. Grb2 수준의 평균 감소는 49%(범위: 28% 내지 91%)였고, pErk 수준의 평균 감소는 52%(범위: 27% 내지 91%)였다.
BP1001의 항백혈병 활성도. 단일 작용제 요법으로서의 BP1001은 21명의 환자 중 9명에서 말초 혈액 블라스트를 50%를 초과하게 감소시켰고, 21명의 환자 중 3명에서 골수 블라스트를 50%를 초과하게 감소시켰다(표 8). 프로토콜에 따라서, 환자가 적합한 질환을 나타내거나(즉, 요법의 첫 번째 4주 요법에 걸쳐서 WBC의 50% 미만의 증가) 또는 질환이 개선되었으면 최대 6개월 동안 BP1001 치료를 제공할 수 있다. 4명의 환자는 2회 치료 주기가 완결되었고, 3명의 환자는 5회 치료 주기가 완결되었다(표 8). 이러한 7명의 환자는 다양한 세포유전학 및 분자 이상, 예컨대, JAK2 및 NRAS 돌연변이를 가졌다(표 8).
BP1001 + LDAC 병용 요법 중인 6명의 평가 가치가 있는 환자 중에서, 3명의 환자에게 3회 치료 주기를 제공하였고, 1명의 환자에게 5회 치료 주기를 제공하였다(표 8). 보다 중요하게는, 3명의 환자는 완전 완화(5% 이하의 골수 블라스트)가 달성되었고, 2명의 환자는 부분 완화(50% 이상의 골수 블라스트 감소)가 달성되었다(표 8; 도 2).
실시예 2 - Das와 조합된 BP1001의
시험관내
효능
BP1001의 임상 활성도를 가속기 또는 급성 전환기의 CML 환자에서 조사할 것이다. 이마티닙에 대한 가속기 환자 및 급성 전환기 환자의 반응은 불량하고, 단기적이다. 이러한 환자는 종종 다른 타이로신 카이나제 저해제, 예컨대, 다사티닙, 닐로티닙, 보수티닙, 및 포나티닙으로 치료된다. 여기서, BP1001이 CML 세포에서 다사티닙, 닐로티닙, 보수티닙, 및 포나티닙의 저해성을 향상시킬 수 있는지를 결정하였다.
세포 배양. BV173 및 K562 세포는 CML 환자로부터 유래된 Bcr-Abl-양성 세포주이다. 이들을 CLS 셀 라인즈 서비스 게엠베하(Cell Lines Service GmbH)(에펠하임(Eppelheim), 독일 소재)로부터 입수하였고, 10% 열 활성화 우태아 혈청이 보충된 RPMI 배지 중에서 배양하였다.
화학물질. Grb2 안티센스 올리고의 서열은 다음과 같다: 5'-ATATTTGGCGATGGCTTC-3'(서열번호 1). Grb2 안티센스 올리고는 아베시아(Avecia)(미국 오하이오주 신시내티 소재)에서 제조되었다. BP1001은 아벤티 폴라 리피즈(Avanti Polar Lipids)(미국 알리바마주 알라바스터 소재)에서 제조되었다. 간략하면, Grb2 안티센스 올리고를 다이올레일포스파티딜콜린 지질(아벤티 폴라 리피즈, 미국 알리바마주 알라바스터 소재)과 혼합하고, 동결시키고, 동결건조시켰다. 동결건조물을 4℃에서 저장하였다. 실험일에, BP1001을 배지로 수화시키고, 세포에 0 내지 120㎍/㎖의 최종 농도로 첨가하였다. 타이로신 카이나제 저해제, 예컨대, 다사티닙, 닐로티닙, 보수티닙 및 포나티닙은 셀렉 케미컬즈(Selleck Chemicals)(미국 텍사스주 휴스톤 소재)로부터 10mM DMSO 스톡 용액으로서 구매하였다.
세포 생존력 검정. BV173 및 K562 세포 각각을 배지 0.1㎖ 중에 96-웰 플레이트 내에 5 및 15 x 103개 세포/웰로 시딩하였다. 세포룰 BP1001 및/또는 타이로신 카이나제 저해제와 함께 4일 동안 인큐베이션시켰다. 비처리된 백혈병 세포 및 처리된 백혈병 세포의 생존력을 셀타이터-글로(CellTiter-Glo)(등록상표) 발광 세포 생존력 검정(프로메가, 미국 위스콘신주 매디슨 소재)에 의해서 측정하였다. 셀타이터-글로(등록상표) 발광 세포 생존력 검정은 대사 활성 세포의 지시자인, ATP의 존재를 정량함으로써 살아있는 세포의 수를 결정한다.
세포 주기 분석. BP1001 및/또는 타이로신 카이나제 저해제와 함께 4일 동안 인큐베이션시킨 후, BV173 세포를 수거하고, 인산염 완충 식염수(PBS)로 세척하였다. 이어서, 세포를 고정시키고, 1시간 동안 4℃에서 1X 고정화/투과화 완충액(Fixation/Permeabilization buffer)(이바이오사이언스(Ebioscience), 미국 캘리포니아주 샌디에고 소재)을 사용하여 투과시켰다. 투과화 후, 세포를 세척하고, 암실에서 4℃에서 약 30분 동안 7-아미노악티노마이신 D(7-AAD, 바이오레전드(Biolegend), 미국 캘리포니아주 샌디에고 소재)와 함께 인큐베이션시켰다. 유세포 분석 데이터 획득을 BD FACSDiva(상표명) 소프트웨어(비디 바이오사이언시스(BD Biosciences), 미국 캘리포니아주 샌디에고 소재)를 사용하여 획득하였다. 유세포 분석기를 20,000회 사례를 수집하도록 설정하였다. 상이한 세포 주기 단계(서브-G1, G1, S, G2/M)에서의 상대적인 백분율을 기록하였다.
BP1001 사전치료는 다사티닙 저해를 향상시켰다. 먼저 BP1001이 CML 세포주에서 다사티닙 저해를 향상시킬 수 있는지를 결정하였다. BP1001 첨가의 시기가 다사티닙 활성도에 영향을 미칠 수 있는지를 확인하기 위해서, BP1001 및 다사티닙 공동인큐베이션을 상이한 순서로 수행하였다: (1) (동일한 날 치료를 모방하기 위해서) 다사티닙을 첨가하기 1시간 전에 BP1001을 세포에 첨가하였음; (2) 세포를 다사티닙으로 처리하고 1시간 후에 BP1001을 세포에 첨가하였음; (3) 세포를 다사티닙으로 처리하기 1일 전에 BP1001을 첨가하였음.
공동인큐베이션 순서(1): 동일한 날에 첨가된 BP1001 및 다사티닙. K562 및 BV173 세포를 BP1001(0 내지 120㎍/㎖)과 함께 1시간 동안 인큐베이션시켰고, 그 후에 1nM 다사티닙으로 처리하였다. 4일 후에, 성장 저해성 효과를 결정하였다. 120㎍/㎖의 BP1001의 부재 및 존재 하에서, 다사티닙은 각각 K562 생존력을 25% 및 15% 감소시켰다(도 7A). 120㎍/㎖의 BP1001의 부재 및 존재 하에서, 다사티닙은 각각 BV173 생존력을 40 및 49% 감소시켰다(도 7A). 이러한 데이터는, CML 세포가 BP1001 및 다사티닙으로 동일한 날에 처리된 경우, BP1001이 다사티닙 저해에 최소한의 효과를 가졌음을 나타낸다.
공동인큐베이션 순서(2): BP1001 이전에 첨가된 다사티닙. CML 세포주를 다사티닙으로 1일 동안 처리하고, 그 다음 BP1001로 처리하였다. 세포 생존력을 3일 후에 결정하였다. 다사티닙은 K562 생존력을 12% 감소시켰다(도 7B). 190㎍/㎖ 농도의 BP1001의 첨가는 K562 생존력을 50%로 감소시켰다(도 7B). 그러나, 120㎍/㎖ 농도의 BP1001을 다사티닙에 첨가하는 경우, K562 생존력은 25% 감소되었다(도 7B). 다사티닙은 BV173 생존력을 6% 감소시켰다(도 7B). 120㎍/㎖의 BP1001의 첨가는 BV173 생존력을 34% 감소시켰다(도 7B). 다사티닙 처리 1일 후에 첨가된 BP1001은 BV173 생존력을 추가로 감소시켰다. 그러나 다사티닙 처리 1일 후에 첨가된 BP1001이 K562 생존력을 추가로 감소시킬 수 있는지는 명확하지 않다.
공동인큐베이션 순서(3): 다사티닙 이전에 첨가된 BP1001. CML 세포주를 BP1001과 함께 1일 동안 인큐베이션시키고, 그 다음 다사티닙으로 처리하였다. 다사티닙 단독을 K562 생존력을 25% 감소시켰다(도 7C). 120㎍/㎖의 BP1001을 다사티닙에 첨가하는 경우, K562 생존력은 44% 감소되었다(도 7C). 120㎍/㎖의 BP1001의 부재 및 존재 하에서, 다사티닙은 각각 BV173 생존력을 10% 및 68% 감소시켰다(도 7C). 이러한 데이터는 BP1001의 1일 사전치료가 두 CML 세포주 모두에서 다사티닙 저해를 향상시켰다는 것을 나타낸다.
BP1001은 다사티닙 세포사 유도를 향상시켰다. 다음으로, 본 발명자들은 BP1001이 다사티닙 저해를 향상시키는 기전을 결정하였다. BV173 세포를 BP1001과 함께 1일 동안 인큐베이션시키고, 그 다음 다사티닙으로 처리하였다. 3일 후, 세포를 수거하고, 유세포 분석법을 위해서 가공하였다. BP1001 + 다사티닙 조합물의 저해의 주요 기전은, 서브-G1기의 세포 백분율의 증가에 의해서 나타난 바와 같이 세포사 유도였다(도 8A 내지 도 8D). BP1001, 다사티닙 및 조합물로 처리될 때 서브-G1기의 세포의 백분율은 각각 3.1, 10.6 및 28.0이었다(도 8A 내지 도 8D).
BP1001 사전치료는 다사티닙 및 닐로티닙 세포사 유도를 선택적으로 향상시켰다. 유세포 분석법을 사용하여 닐로티닙, 보수티닙 및 포나티닙에 대한 BP1001 사전치료의 효과를 결정하였다. 도 3은 BP1001 사전치료가 다사티닙 및 닐로티닙 저해를 향상시켰음을 나타내었다. 서브-G1기의 세포의 백분율은 다사티닙의 경우 30.7에서 40.6으로, 닐로티닙의 경우 26.4에서 32으로 증가되었다(도 9A). 그러나, BP1001 사전치료는 보수티닙 또는 포나티닙 저해에 영향을 미치지 않았다(도 9A). 서브-G1기의, 보수티닙 및 BP1001 + 보수티닙 조합물로 처리된 세포의 백분율은 각각 34.3 및 36.4인 반면, 포나티닙 및 BP1001 + 포나티닙 조합물의 경우에는 각각 34.0% 및 36.0%이었다(도 9A). 이러한 데이터는, BP1001 사전치료가 다사티닙 및 닐로티닙 저해를 선택적으로 향상시켰음을 나타낸다.
흥미롭게도, 세포를 타이로신 카이나제 저해제 이후에 BP1001로 처리한 경우 감소된 세포사가 관찰되었다. 서브-G1기의 세포의 백분율은 다사티닙의 경우 64.1에서 51.8로 감소되었고, 닐로티닙의 경우 65.0에서 57.1로 감소되었고, 보수티닙의 경우 66.1에서 48.6으로 감소되었고, 포나티닙의 경우 71.1에서 51.7로 감소되었다(도 9B).
실시예 3 - 가속기 또는 급성 전환기의 Ph+ CML을 갖는 환자에서 다사티닙(Das)과 조합된 BP1001의 안전성, 약동학 및 효능을 평가하기 위한 Ib/IIa상 임상 시험
연구 이유. Ib상 연구는 가속기 또는 급성 전환기의 Ph+ CML을 갖는 참가자가 참여할 것이다. 참가자에게 BP1001 및 Das를 제공할 것이다. 이것은 공개 표지 단일 아암 임상 시험이다. Ib상 연구에서 치료제가 제공될 자격이 있는 참가자에게 BP1001(코호트 1의 경우 60㎎/㎡ 또는 코호트 2의 경우 90㎎/㎡) 및 동일 용량 수준의 Das(140㎎)를 제공할 것이다. 용량이 IIa상에 대해서 확인된 후, IIa상에서 치료제가 제공될 자격이 있는 모든 참가자에게 BP1001 및 Das 둘 모두에 대해서 동일한 용량 수준을 제공할 것이다. 본 연구의 경우 무작위화가 존재하지 않을 것이다.
각각의 치료 주기는 28일 것이다. BP1001은 각각의 치료 주기에서 총 8회 투여 동안 그 주기의 1일에 시작하여 2 내지 4일마다(+/- 1일의 허용 가능한 윈도우) 대략 1 내지 3시간에 걸쳐서 투여될 것이다. 그 주기의 5일 또는 대략 5일 및 BP1001의 제2 용량의 완결 24시간 이상 후에, 참가자에게 140㎎ Das의 1일 1회 경구 투여를 시작할 것이고, 중단 없이 그 후에 매일 계속할 것이다. 이러한 요법 이후의 반복 주기는 진행, 재발, 불내성까지 4주마다 예정될 것이고, 참가자는 6회 치료 주기가 완결되었거나 또는 참가자/조사자가 중단을 요청하였다. 참가자가 연구의 투여 부분을 완결한 경우, 그는 어느 것이 먼저이든, 대략 6개월 동안 또는 사망 또는 연구 중단까지 추적될 것이다.
연구 이유: 용량 선택. 예비 데이터는, Grb2 하향조절(및 가능한 항백혈병 이익)이 HTD(90㎎/㎡) 및 HTD 미만의 하나의 수준(60㎎/㎡)에서 BP1001을 사용하여 참가자에서 달성될 수 있고, 안정성/내약성은 이러한 두 용량 간에 실질적으로 차이가 없음을 나타낸다. 이를 기초로, 60 또는 90㎎/㎡ BP1001와 Das의 조합물의 안전성 및 내약성을 연구할 것이다.
Ib상 연구에서, BP1001을 정맥내로(IV) 1주 2회(2 내지 4일마다)(+/- 1일의 윈도우 허용 가능함), 28-일 주기에 걸쳐서 주어진 총 8회 용량 동안 대략 1 내지 3시간에 걸쳐서 투여할 것이다. 출발 용량은 60㎎/㎡일 것이고, BP1001의 제1 용량은 각각 28일 주기의 1일에 시작된다. BP1001의 제2 용량의 완결 24시간 이상 후에, 참가자에게 140㎎ Das의 매일 투여를 시작할 것이고, 중단 없이 그 후에 매일 계속할 것이다. BP1001의 제2 용량의 완결 24시간 이상 이후에 시작되는 한, 5일만큼 빠르게 Das의 투여를 시작할 수 있다. 3명의 환자에게 DLT의 부재 하에서 28일 동안 각각의 용량 수준으로 BP1001을 제공할 것이다. 이러한 연구 부분에서 용량 증가는 등급 3의 DLT가 검출될 때까지 계속될 것이다.
이전의 코호트의 3명의 환자가 DLT의 증거 없이 28일 치료가 완결되면 환자의 다음 코호트를 연구에 참여시킬 것이다. 그 후, 용량 증가를 90㎎/㎡까지 진행할 것이다. 한 환자가 DLT를 경험하면, 이러한 코호트는 3명의 추가적인 환자로 확장될 것이다. 치료된 3 내지 6명의 환자 중 2명 이상이 DLT를 경험한 임의의 코호트는 초과된 MTD를 갖는 것으로 간주될 것이고, 바로 더 낮은 용량의 코호트가 추가 연구를 위해서 선택될 것이다. 모든 환자를 NCI CTCAE 기준을 사용하여 치료 마지막(28일)에 독성에 대해서 평가할 것이다. 이러한 요법 이후의 반복 주기는 진행, 재발, 불내성까지 4주마다 예정될 것이고, 참가자는 6회 치료 주기가 완결되었거나 또는 참가자/조사자가 중단을 요청하였다.
IIa상 치료 스케줄은 Ib상 연구와 동일할 것이다. 그러나, 모든 참가자에게 (Ib상 연구에서 확인된) 동일한 용량의 BP1001 및 140㎎의 Das를 제공할 것이다.
연구 이유: 연구 설계. BP1001의 효능 및 안전성을 가속기 또는 급성 전환기인 Ph+ CML 환자의 치료에서 널리 확립된 치료 요법인 Das와 함께 평가할 것이다. 전임상 연구를 기초로, Das와 조합된 BP1001은 1차 치료제인 이마티닙에 전형적으로 반응하지 않는, 가속기 또는 급성 전환기의 CML 환자에게 이익을 제공하는 것으로 예측된다. 연구 설계를 도 3에 그래픽으로 나타낸다.
이러한 시험은 단일 아암 개방 표지 설계를 사용하여 Das와 조합된 BP1001의 안전성 프로파일, 약동학, 및 효능을 평가할 것이다. Ib상 연구는 공개 표지, 순차적 용량-증가 설계를 사용하여 안전성, 내약성 및 독성, 종양 반응 및 항백혈병 활성도를 평가한다.
표준 "3+3" 설계를 사용할 것인데, 여기서 CML을 갖는 환자의 연속적인 코호트를, 고정 용량의 Das와 조합하여, 최대 내약 용량(MTD)의 또는 MTD가 한정되지 않으면 HTD 및 MTD(또는 HTD)보다 1 낮은 수준의 BP1001로 치료하여 안전성 및 생물학적 효과를 특징규명하고, 제안된 IIa상 용량을 확인하였다.
3명의 환자에게 DLT의 부재 하에서 28일 동안 각각의 용량 수준으로 BP1001을 제공할 것이다. 이전의 코호트의 3명의 환자가 DLT의 증거 없이 28일 치료가 완결되면 환자의 다음 코호트를 연구에 참여시킬 것이다. 그 후, 용량 증가를 90㎎/㎡까지 진행할 것이다. 한 환자가 DLT를 경험하면, 이러한 코호트는 3명의 추가적인 환자로 확장될 것이다. 치료된 3 내지 6명의 환자 중 2명 이상이 DLT를 경험한 임의의 코호트는 초과된 MTD를 갖는 것으로 간주될 것이고, 바로 더 낮은 용량의 코호트가 추가 연구를 위해서 선택될 것이다. 모든 환자를 NCI CTCAE 기준을 사용하여 치료 마지막(28일)에 독성에 대해서 평가할 것이다.
환자에게 치료 연장을 제공할 수 있다. 이러한 요법 이후의 반복 주기는 진행, 재발, 불내성까지 4주마다 예정될 것이고, 참가자는 6회 치료 주기가 완결되었거나 또는 참가자/조사자가 중단을 요청하였다.
IIa상 연구는 공개 표지, 단일-용량 수준 연구이다. 연구 중인 치료가 제공될 자격이 있는 모든 참가자에게 Ib상 연구에 의해서 결정된 것과 동일한 용량 수준의 BP1001(HTD 또는 HTD보다 1 낮은 수준) 및 Das(140㎎) 둘 모두를 제공할 것이다. 본 연구의 경우 무작위화가 존재하지 않을 것이다.
IIa상 연구는 Das와 조합된 BP1001의 효능을 Das 단독에 대해서 보고된 역사적 반응률과 비교할 것이고, 단독으로 또는 Das와의 조합물로 제공되는 경우, BP1001의 약동학을 평가할 것이다.
대략 40명의 평가 가치가 있는 참가자가에게 하기와 같이 IIa상에서 BP1001과 Das의 조합물을 제공할 것이다. 스크리닝 기간 동안 적격성의 검정 이후에, 참가자에게 BP1001의 초기 용량을 제공할 것이다. 이러한 용량은 BP1001와 Das의 조합물의 안정성 및 내약성을 기초로 Ib상에서 확인될 것이다. BP1001을 C1D1에 대해서, 그리고 28일 주기에 걸쳐서 제공된 총 8회 용량에 대해서, 그 후에 2 내지 4일마다 제공할 것이다. 그 주기의 5일 또는 대략 5일 및 BP1001의 제2 용량의 완결 24시간 이상 후에, 참가자에게 140㎎ Das의 1일 1회 경구 용량을 시작할 것이고, 중단 없이 그 후에 매일 계속할 것이다.
적어도 3회의 치료 주기가 완결된 참가자를 이의 반응에 대해서 평가할 것이다. 목표 반응률은 35%이다. 톨, 시몬, 에스테이의 베이시안 접근법(Bayesian approach of Thall, Simon, Estey)이 무용성(futility) 모니터링에 대해서 구현될 것이다. 하기 무용성 중단 규칙이 5번 째 환자에서 시작하여, 5의 코호트 크기에 적용될 것이다: prob{p(RR)> 0.35) < 0.03, 식 중, p(RR)은 반응률을 나타냄. 즉, 연구 동안, 본 발명자들이 RR이 35%를 초과할 3% 미만의 가능성이 존재한다고 결정하면, 무용성으로 인해서 중단될 것이다.
베이시안 접근법은 또한 등록된 환자에 대한 독성 모니터링에 대해서 구현될 것인데, 여기서 독성은 치료에 적어도 관련 가능한 DLT인 것으로 결정된 임의의 비-혈액 독성으로서 정의된다. TOX로 표기되는 독성은 베타 이항 분포를 기초로 계산된 베이시안 중단 경계에 의해서 모니터링될 것이다. 본 발명자들은 선험적(priori), p(TOX) ~ 베타(0.6, 1.4)로서 예측한다. 본 연구는 Pr(p(TOX)> 0.30 | 데이터) >0.88이면, 독성을 위해서 중단될 것이다. 즉, 본 발명자들은, 연구 동안의 임의의 시간에, 본 발명자들이 독성이 30%를 초과할 88% 초과의 가능성이 존재한다고 결정하면, 새로운 환자 등록을 위한 시험을 중단할 것이다.
환자에게 치료 연장을 제공할 수 있다. 이러한 요법 이후의 반복 주기는 진행, 재발, 불내성까지 4주마다 예정될 것이고, 참가자는 6회 치료 주기가 완결되었거나 또는 참가자/조사자가 중단을 요청하였다.
연구 목적. Ib상 연구의 주요 목적은 Das와 조합된 BP1001의 용량 제한 독성(DLT) 및 최대 허용 용량(MTD)을 결정하는 것이다. IIa상 연구의 주요 목적은 BP1001과 Das의 조합물의 약동학(PK) 및 효능을 평가하는 것이다.
하기가 본 연구의 2차 목적이다: Das와 조합된 BP1001의 안전성을 평가하기 위함; BP1001와 Das의 조합물이 (역사적 비교에 의해서) Das 단독보다 더 높은 효능(혈액 반응, 세포유전학적 반응 또는 분자 반응)을 제공하는지를 결정하기 위함; 단독으로 그리고 Das와 조합하여 제공되는 경우 BP1001의 약동학(PK)을 평가하기 위함; 전체 생존, 반응에 대한 시간 및 반응 기간을 평가하기 위함.
본 연구의 탐색 목적은 abl 카이나제 도메인 돌연변이로의 치료 반응의 상관관계를 평가할 것이다.
연구 집단: 포함 기준. 스크리닝 시에, 참가자는 하기 기준 모두를 충족해야 본 연구에 참여할 자격이 있는 것으로 간주된다:
1. 18세 이상의 성인
2. 여성은 연구 동안 그리고 연구 약물 또는 Das의 마지막 투여 후 30일 동안 임신 가능성이 없어야 하고, 외과적으로 멸균되어야 하고, 폐경 후이거나 또는 적절한 실용적인 피임 방법을 수행해야 한다.
3. 남성은 연구 동안 그리고 연구 약물 또는 Das의 마지막 투여 후 적어도 30일 동안 적절한 피임 방법을 사용하는 것을 동의해야 한다.
4. 가속기 또는 급성 전환기에서 Ph+ CML의 조직학적으로 기록된 진단. 급성 전환기는 간 또는 비장을 제외하고, 말초 혈액 또는 골수에서 또는 골수외 질환의 존재에서 30% 이상의 블라스트로서 정의된다. 하기 파라미터 중 하나가 가속기 CML에 대한 기준을 충족시키는 데 필요하다:
a. 15% 이상의 말초 혈액 또는 골수에서의 블라스트
b. 30% 이상의 말초 혈액 또는 골수에서의 전골수구 및 블라스트
c. 20% 이상의 PB 또는 BM 호염구
d. 요법으로부터 초래되지 않은, 100 Х 103/㎖ 미만의 혈소판감소증
e. 세포유전학적 클론 진화
5. 하기에 의해서 정의된 바와 같은 적절한 간 및 신장 기능:
a. 정상 상한치(upper limit of normal: ULN)의 2.5배 이하의 아스파테이트 트랜스아미나제(AST) 및 알라닌 트랜스아미나제(ALT); 및
b. ULN의 1.5배 이하의 총 빌리루빈; 및
c. 적어도 50㎖/분의 예측 사구체 여과율(eGFR); 혈액 요소 질소(BUN) 및 크레아티닌 시험을 기준선에서 수행하는 경우 콕크로프트 골티(Cockcroft Gault) 식을 사용하여 eGFR을 결정함. eGFR 혈청 크레아티닌 및 BUN의 조합을 사용하여 안전성 보장을 위한 환자의 신장 기능을 평가할 것임.
(i) 콕크로프트 골티 식: 예측된 크레아티닌 청소율 = [(140 - 연령) Х 총 체중] / (혈청 크레아티닌 Х 72)
(ii) 여성의 경우 0.85를 곱함
6. 0, 1 또는 2의 문서화된 ECOG(Eastern Cooperative Oncology Group) 수행 능력 상태(표 9)
7. 임의의 이전 수술, 방사선요법 또는 항신생물제 치료(탈모 제외)의 효과로부터 회복됨
8. 서면 동의서를 제공할 의지 및 능력
연구 집단: 제외 기준. 스크리닝 시에, 하기 기중 중 임의의 것을 충족시킨 참가자는 본 연구의 참여에 제외될 것이다:
1. T315I 돌연변이를 갖는 환자는 제외될 것이지만, 이들의 반응은 별개로 분석될 것임.
2. 비흑색종 피부암 또는 자궁경부의 계내에서의 암종을 제외한 지난 2년 내에 CML이 아닌 또 다른 원발성 악성 종양.
3. 척추강내 요법이 필요한 공지된, 활성 연수막 백혈병. 주석: CNS 질환의 이력을 갖는 환자는 스크리닝 이전에 적어도 2회의 연속적인 문서화된 음성 척수액 평가를 기초로 참여가 허용될 수 있음
4. 백혈병에 대한 골수 기준을 또한 충족시키지 않는 단리된 골수외 백혈병
5. 하이드록시유레아 또는 아나그렐리드 또는 TKI(2일 이내)를 제외하고, BP1001 시작 14일 이내에 임의의 항암 요법의 수령
6. 비제어된 활성, 비치료 또는 점진적인 감염
7. BP1001 시작의 14일 이내 또는 5 반감기 이내에 임의의 시험 작용제의 수령
8. 스크리닝 기간 동안 임신 중이거나, 임신 진단에 양성이거나, 수유 중인 여성 또는 연구 과정 동안 또는 연구 약물의 마지막 용량 후 30일 이내에 임신 또는 수유가 의도되는 여성
9. BP1001에 대한 노출 전
10. Das에 대한 불내성의 이력을 갖는 환자 또는 Das가 적절하지 않을 수 있는 환자
11. 연구를 완결하는 참가자의 능력을 방해할 중증 병발성 의학적 또는 정신의학적 질병
12. 활성/만성 B형 간염 감염(양성 표면 항원 [HBsAg]을 기초로 함), C형 간염 감염(양성 항체 [HCV Ab]를 기초로 함) 또는 인간 면역결핍 바이러스(HIV-1 또는 HIV-2, 양성 항체를 기초로 함)
13. 연구 치료제를 용인하는 참가자의 능력을 손상시키거나 연구 수행의 임의의 양상 또는 결과의 해석을 방해할 수 있는 공존하는 병태의 존재. 이것은 불안정적이거나 비제어된 협심증, 뉴욕 심장 학회(New York Heart Association: NYHA) 클래스 III 또는 IV 울혈성 심부전, 비제어되고 지속적인 고혈압, 임상적으로 유의한 부정맥 또는 임상적으로 유의한 ECG 이상(예를 들어, 470msec 초과의 QTcF)을 포함하지만 이들로 제한되지 않음.
14. 지난 6개월 이내에, 하기 중 임의의 것을 가졌음: 흉수, 심근 경색, 불안정적인 협심증, 관상 동맥/말초 동맥 우회술, 뇌혈관 장애 또는 일과성 뇌허혈 발작.
15. 비제어된 발작 장애(즉, 지난 2개월 이내의 발작)
16. 조사자와의 의사소통하거나 협조할 수 없거나 협조할 의지가 없거나 어떠한 이유에서 프로토콜을 준수할 수 없거나 준수할 의지가 없음
연구 치료제: BP1001 용량 및 투여. BP1001은 IV 투여를 위한 재구성을 위해서 멸균, 무보존제, 백색 동결건조된 분말로 제공되며, 20㎖ 바이알 내에 공급된다. 각각의 단회 사용을 위해서, BP1001의 20-㎖ 바이알은 5㎎의 Grb2 올리고뉴클레오타이드 및 13.35㎎의 DOPC를 함유한다. 투여를 위한 계산은 Grb2 올리고뉴클레오타이드를 기초로 한다. BP1001의 각각의 바이알은 주사용 생리 식염수(0.9% 염화나트륨) 2㎖를 사용하여 재구성되어 5.0㎎/2.0㎖(2.5㎎/㎖)의 BP1001 농도를 산출해야 한다. 재구성된 BP1001은 재구성 후 대략 6시간 동안 안정적이고, 따라서, IV 주입은 재구성 후 대략 6시간 이내에 완결되어야 한다.
Ib상 연구에서, 사용될 BP1001의 용량은 60㎎/㎡(코호트 1) 또는 90㎎/㎡(코호트 2)이다. BP1001은 각각의 28일 주기의 1, 4, 8, 11, 15, 18, 22 및 25일(+/-1일 윈도우 허용 가능함)에 IV 주입으로서 투여될 것이다. 1회 치료 주기의 경우, 참가자에게 Das 투여를 진행하고 본 연구를 계속하기 위해 BP1001(1일 및 4일의 경우)의 두 용량 모두를 제공해야 한다. Das 투여를 시작하기 전에 두 용량 모두의 BP1001이 제공되지 않은 참가자는 본 연구의 투여 부분으로부터 중단되고, 본 연구의 추적 부분에 참여될 수 있다.
BP1001의 용량은 기준선(스크리닝 시) 체표면적(BSA)을 기초로 하지만; 용량은 기준선으로부터 10% 이상의 체중 변화를 경험한 참가자에 대해서 조정될 것이다. 100㎏ 초과의 체중을 갖는 참가자를 제외하고는 실제 체중을 사용하여 BSA를 계산할 것이고, 용량은 이들 개인의 경우 100㎏을 기준으로 계산될 것이다.
IV 주입은 대략 1 내지 3시간에 걸쳐서 투여될 것이고, IV 푸쉬(push) 또는 IV 볼러스(bolus)로 제공되지 않아야 한다. 주입은 전용 중추 또는 말초 IV 라인을 통해서 제공될 것이며, 다른 의약과 동시에 제공될 수 없다.
연구 치료제: 다사티닙 용량 및 투여. 다사티닙(Das)은 각각의 28일 주기의 대략 5일에 시작하여, 경구로, 1일 1회 투여될 것이다. BP1001의 제2 용량의 완결 24시간 이상 이후에 시작되는 한, 각각의 주기의 5일만큼 빠르게 Das의 투여를 시작할 수 있다. 시작되면, Das 치료는 중단 없이 계속될 것이다. 본 연구에 사용되는 Das의 용량은 140㎎(각각의 용량)이다.
공존하는 의약. 첫 번째 4주 요법 동안, 하이드록시유레아가 허용될 것이다. 아나그렐리드는 또한 500K 초과의 혈소판증가증을 관리하기 위해서 임의의 시기에 허용될 것이다. 하기 의약은 치료 기간 동안 허용되지 않는다: 연구 또는 다른 악성종양 하의 질환의 치료를 위한 임의의 항암제(Das, 하이드록시유레아 또는 아나그렐리드 제외).
스케줄 및 절차의 설명. 참가자는 표 10에 제시된 바와 같이 스크리닝 절차를 겪을 것이다.
초기 추적 방문은 치료 주기를 중단한 후 30일(+/- 7일) 이내에 진행되어야 한다. 초기 추적 방문은 하기를 포함할 것이다: 신체 검사; 블라스트 %를 비롯한 감별 및 혈소판이 포함된 CBC; 혈청 화학, 공존하는 의약 기록, 이상 반응 기록.
장기간 추적 방문은 요법 시작으로부터 12개월까지 또는 연구 중단까지 또는 또 다른 요법의 시작 또는 사망 시까지 30-일 추적 방문으로부터 8주(+/- 1주)마다 진행되어야 한다.
효능 종점. 하기 반응 기준 및 척도를 사용하여, 차도 및 객관적인 반응을 평가함으로써 예비 효능이 평가될 것이다. 추가적인 효능 종점은 반응 시기, 반응 기간 및 전체 생존을 포함할 것이다.
혈액 반응(HR) 기준을 표 11에 제공한다. 기준 모두는 이것이 먼저 충족되고 적어도 28일 후에 이행되는 경우, 확인된 HR이 수득된다.
세포유전학적 반응은 표 12에 제공된 바와 같은 세포유전학에 의해서 필라델피아 염색체(Ph)의 억제(또는 세포유전학적 분석이 유용하지 않거나, 예를 들어, 불충분한 중기인 경우, FISH)에 따라서 분류된다. 주요 세포유전학적 반응은 완전 반응과 부분 반응의 조합이다.
분자 반응은 표 13에 제공된 기준에 따라서 분류된다.
안전성 보고: 이상 반응(AE). 연구 약물이 제공된 각각의 참가자는 AE에 대해서 면밀히 모니터링될 것이다. AE는 고려된 약물의 관련 여부와 관계없이, 인간에서 약물의 사용과 연관된 부적절한 의학적 사건이다. 이상 반응은 연구 기간 동안 나타나거나 악화되는 임의의 징후, 증상, 질병 또는 진단을 포함한다. AE는 병발성 질병, 부상 또는 참가자의 건강의 임의의 공존하는 손상일 수 있다. 동의 시부터 치료 방문 마지막까지의 임의의 시기에 발생하는 모든 AE가 그 사건의 병인론과 관계없이 보고될 것이다. NCI의 CTCAE v4.03이 AE 등급화를 위해서 사용될 것이다. CTCAE는 evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf에서 월드 와이드 웹 상에서 찾아볼 수 있다.
이상 반응은 조절성 보고 목적을 위해서 "심각" 및 "비심각"으로 분류된다. "심각"의 정의는 그 사례의 중증도에 본질적으로 좌우되는 것은 아니다. 심각성의 기준을 충족하지 않는 모든 AE는 비심각으로서 간주된다.
연구 약물에 대한 관련과 관계없이, 임의의 용량(과용량 포함)에서 발생하는 임의의 AE는, (1) 그것이 사망을 초래하는 경우(즉, AE가 치사를 유발하거나 치사로 이어졌고, 참가자는 그 사례의 시기에 사망의 위험이 있고; 그것은 보다 중증인 경우 가설적으로 사망을 유발할 수 있는 사건을 지칭하지 않음); (2) 그것이 생명을 위협하는 경우(즉, AE가 개체를 즉각적인 사망 위험에 놓이게 하고, AE가 더 심각하면 가설적으로 그것이 사망으로 이어질 수 있는 경우는 아님); (3) 그것이 예상된 체류 기간을 초과하는 입원 또는 장기 입원을 요구하는 경우(즉, 예정된 치료 및 선택적 의료/수술 절차를 위한 입원은 이 기준에 의한 SAE가 아님); (4) 그것이 장애 상태를 유발하는 경우(즉, AE가 일상 생활 활동을 수행하는 참가자의 능력을 실질적으로 감소시킴); (5) 그것이 선천성 기형 또는 출생 결함을 유발하는 경우(즉, 수정 전 또는 임신 중에 연구 약물에 노출된 참가자의 자녀 또는 태아에서의 부작용 발견); 또는 (6) 그것이 의학적으로 중요한 상태인 경우(즉, AE가 상기의 심각한 기준 중 임의의 것을 충족시키지 않지만, 적절한 의학적 판단을 기초로, 참가자를 위태롭게 할 수 있거나 또는 이러한 기준에 열거된 결과 중 1개를 예방하기 위해서 의학적 또는 수술적 개입을 요구할 수 있음[즉, 응급실 또는 가정에서 알레르기성 기관지 경련에 대한 집중 치료; 입원을 초래하지 않는 혈액 순환 장애 또는 경련]) 심각한 이상 반응(SAE)으로서 분류될 것이다.
모든 AE에 대한 BP1001 IP 또는 Das와의 인과 관계 관련은 다음과 같이 평가될 것이다: (1) 명백하게 관련됨 - 연구 요법 투여에 명백하게 기인한 AE; (2) 관련 가능성 큼 - 연구 요법에 대한 인과 관계 연관의 타당한 가능성이 있는 AE; (3) 관련 가능성 있음 - 합병증, 의약 또는 다른 고려사항에 의한 혼동이 있지만 AE가 연구 요법에 의해서 유발되었을 수 있다는 것이 부당하지 않은 AE; 또는 (4) 관련 없음 - 연구 요법에 인과적으로 명백하게 관련이 없다고 간주되거나 명백한 대안적인 설명이 존재하는 AE.
예상되지 않은 AE는 BP1001 또는 Das 중 어느 하나의 공지된 결과로서 특징, 중증도 또는 빈도가 확인되지 않은 임의의 AE이다. "예상되지 않은"은 이러한 정의에서 사용되는 바와 같이 약제학적 제품의 약물학적 특성으로부터 예견되지 않은 이러한 경험의 관점보다 이전에 관찰된 적이 없는 AE를 지칭한다.
표 14는 문헌[Medical Dictionary for Regulatory Activities (MedDRA, Version 18.0)]에 명시된 바와 같은 치료군, 연구 등록 시의 질환 진단 및 신체 기관계 분류(system organ class: SOC)/우선순위 용어(preferred term: PT)에 의해서 제공된, 연구 2003-0578에서 BP1001을 사용한 단일요법에 대해서 가장 빈번하게 발생하는 AE뿐만 아니라 등급 3 이상의 강도(국립 암 연구소[NCI] 이상 반응 표준 용어 기준[CTCAE], 버전 4.0 기준)를 갖는 AE를 상술한다.
표 15는 SOC/PT, 발생률, 및 강도(NCI CTCAE 기초)에 의해서 제시된 연구 2003-0578에서 BP1001을 사용한 단일요법 이상 반응에 대한 모든 치료의 발생률에 대한 종합 목록을 상술한다.
가능한 위험 및 부작용. 다사티닙(Das) 및 BP1001 각각은 낮은 혈액 세포 수치(적혈구, 혈소판 백혈구)를 유발할 수 있다. 공지된 Das 부작용은 열, 피부 발진, 두통, 피로감, 설사, 구역, 숨가쁨, 근육통을 포함한다. 동물 및 인간에서의 연구를 기초로, BP1001은 손발 증후군, 구강 수포/상처 및 낮은 백혈구 수치를 초래할 수 있다.
* * *
본 명세서에 개시되고 청구된 모든 방법은 본 개시내용에 비추어 과도한 실험 없이 수행되고, 실행될 수 있다. 본 발명의 조성물 및 방법이 바람직한 실시형태와 관련하여 기술되었지만, 본 발명의 개념, 사상 및 범주를 벗어나지 않으면서 변형이 본 명세서에 기술된 방법 및 단계 또는 방법의 단계의 순서에 적용될 수 있음이 관련 기술 분야의 통상의 기술자에게 자명할 것이 다. 보다 구체적으로, 화학적으로 및 생리학적으로 관련된 특정 작용제가 동일하거나 유사한 결과가 달성되게 하면서 본 명세서에 기술된 작용제를 대체할 수 있음이 자명할 것이다. 관련 기술 분야의 통상의 기술자에게 자명한 그러한 모든 유사한 대체물 및 변형은 첨부된 청구범위에 의해 정의된 바와 같은 본 발명의 사상, 범위 및 개념에 속하는 것으로 간주된다.
참고문헌
하기 참고문헌은 본 명세서에 제시된 것을 보완하는 예시적인 절차 또는 다른 세부사항을 제공하는 정도로 본 명세서에 구체적으로 참고로 포함된다.
SEQUENCE LISTING
<110> BIO-PATH HOLDINGS, INC.
<120> COMBINATION THERAPY WITH LIPOSOMAL ANTISENSE OLIGONUCLEOTIDES
<130> WO/2018/053232
<140> PCT/US2017/051723
<141> 2017-09-15
<150> US 62/487,277
<151> 2017-04-19
<150> US 62/395,680
<151> 2016-09-16
<160> 3
<170> KoPatentIn 3.0
<210> 1
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic oligonucleotide
<400> 1
atatttggcg atggcttc 18
<210> 2
<211> 1109
<212> DNA
<213> Homo sapiens
<220>
<221> CDS
<222> (79)..(729)
<400> 2
gccagtgaat tcgggggctc agccctcctc cctcccttcc ccctgcttca ggctgctgag 60
cactgagcag cgctcaga atg gaa gcc atc gcc aaa tat gac ttc aaa gct 111
Met Glu Ala Ile Ala Lys Tyr Asp Phe Lys Ala
1 5 10
act gca gac gac gag ctg agc ttc aaa agg ggg gac atc ctc aag gtt 159
Thr Ala Asp Asp Glu Leu Ser Phe Lys Arg Gly Asp Ile Leu Lys Val
15 20 25
ttg aac gaa gaa tgt gat cag aac tgg tac aag gca gag ctt aat gga 207
Leu Asn Glu Glu Cys Asp Gln Asn Trp Tyr Lys Ala Glu Leu Asn Gly
30 35 40
aaa gac ggc ttc att ccc aag aac tac ata gaa atg aaa cca cat ccg 255
Lys Asp Gly Phe Ile Pro Lys Asn Tyr Ile Glu Met Lys Pro His Pro
45 50 55
tgg ttt ttt ggc aaa atc ccc aga gcc aag gca gaa gaa atg ctt agc 303
Trp Phe Phe Gly Lys Ile Pro Arg Ala Lys Ala Glu Glu Met Leu Ser
60 65 70 75
aaa cag cgg cac gat ggg gcc ttt ctt atc cga gag agt gag agc gct 351
Lys Gln Arg His Asp Gly Ala Phe Leu Ile Arg Glu Ser Glu Ser Ala
80 85 90
cct ggg gac ttc tcc ctc tct gtc aag ttt gga aac gat gtg cag cac 399
Pro Gly Asp Phe Ser Leu Ser Val Lys Phe Gly Asn Asp Val Gln His
95 100 105
ttc aag gtg ctc cga gat gga gcc ggg aag tac ttc ctc tgg gtg gtg 447
Phe Lys Val Leu Arg Asp Gly Ala Gly Lys Tyr Phe Leu Trp Val Val
110 115 120
aag ttc aat tct ttg aat gag ctg gtg gat tat cac aga tct aca tct 495
Lys Phe Asn Ser Leu Asn Glu Leu Val Asp Tyr His Arg Ser Thr Ser
125 130 135
gtc tcc aga aac cag cag ata ttc ctg cgg gac ata gaa cag gtg cca 543
Val Ser Arg Asn Gln Gln Ile Phe Leu Arg Asp Ile Glu Gln Val Pro
140 145 150 155
cag cag ccg aca tac gtc cag gcc ctc ttt gac ttt gat ccc cag gag 591
Gln Gln Pro Thr Tyr Val Gln Ala Leu Phe Asp Phe Asp Pro Gln Glu
160 165 170
gat gga gag ctg ggc ttc cgc cgg gga gat ttt atc cat gtc atg gat 639
Asp Gly Glu Leu Gly Phe Arg Arg Gly Asp Phe Ile His Val Met Asp
175 180 185
aac tca gac ccc aac tgg tgg aaa gga gct tgc cac ggg cag acc ggc 687
Asn Ser Asp Pro Asn Trp Trp Lys Gly Ala Cys His Gly Gln Thr Gly
190 195 200
atg ttt ccc cgc aat tat gtc acc ccc gtg aac cgg aac gtc 729
Met Phe Pro Arg Asn Tyr Val Thr Pro Val Asn Arg Asn Val
205 210 215
taagagtcaa gaagcaatta tttaaagaaa gtgaaaaatg taaaacacat acaaaagaat 789
taaacccaca agctgcctct gacagcagcc tgtgagggag tgcagaacac ctggccgggt 849
caccctgtga ccctctcact ttggttggaa ctttaggggg tgggaggggg cgttggattt 909
aaaaatgcca aaacttacct ataaattaag aagagttttt attacaaatt ttcactgctg 969
ctcctctttc ccctcctttg tctttttttt catccttttt tctcttctgt ccatcagtgc 1029
atgacgttta aggccacgta tagtcctagc tgacgccaat aataaaaaac aagaaaccaa 1089
aaaaaaaaaa cccgaattca 1109
<210> 3
<211> 217
<212> PRT
<213> Homo sapiens
<400> 3
Met Glu Ala Ile Ala Lys Tyr Asp Phe Lys Ala Thr Ala Asp Asp Glu
1 5 10 15
Leu Ser Phe Lys Arg Gly Asp Ile Leu Lys Val Leu Asn Glu Glu Cys
20 25 30
Asp Gln Asn Trp Tyr Lys Ala Glu Leu Asn Gly Lys Asp Gly Phe Ile
35 40 45
Pro Lys Asn Tyr Ile Glu Met Lys Pro His Pro Trp Phe Phe Gly Lys
50 55 60
Ile Pro Arg Ala Lys Ala Glu Glu Met Leu Ser Lys Gln Arg His Asp
65 70 75 80
Gly Ala Phe Leu Ile Arg Glu Ser Glu Ser Ala Pro Gly Asp Phe Ser
85 90 95
Leu Ser Val Lys Phe Gly Asn Asp Val Gln His Phe Lys Val Leu Arg
100 105 110
Asp Gly Ala Gly Lys Tyr Phe Leu Trp Val Val Lys Phe Asn Ser Leu
115 120 125
Asn Glu Leu Val Asp Tyr His Arg Ser Thr Ser Val Ser Arg Asn Gln
130 135 140
Gln Ile Phe Leu Arg Asp Ile Glu Gln Val Pro Gln Gln Pro Thr Tyr
145 150 155 160
Val Gln Ala Leu Phe Asp Phe Asp Pro Gln Glu Asp Gly Glu Leu Gly
165 170 175
Phe Arg Arg Gly Asp Phe Ile His Val Met Asp Asn Ser Asp Pro Asn
180 185 190
Trp Trp Lys Gly Ala Cys His Gly Gln Thr Gly Met Phe Pro Arg Asn
195 200 205
Tyr Val Thr Pro Val Asn Arg Asn Val
210 215
Claims (58)
- 암의 치료를 필요로 하는 환자에서 암을 치료하는 방법으로서, 상기 환자에게, 상기 환자 내 Grb2 핵산에 혼성화한 뉴클레아제-내성 폴리뉴클레오타이드를 포함하는 유효량의 제1 약제학적 요법 및 Bcr-Abl 타이로신 카이나제 저해제를 포함하는 제2 약제학적 요법을 투여하는 단계를 포함하는, 암을 치료하는 방법.
- 제1항에 있어서, 상기 폴리뉴클레오타이드는 Grb2 핵산의 번역 개시 부위에 혼성화한, 암을 치료하는 방법.
- 제1항 또는 제2항에 있어서, 상기 폴리뉴클레오타이드는 8 내지 50개 염기의 길이를 갖는 올리고뉴클레오타이드인, 암을 치료하는 방법.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 상기 폴리뉴클레오타이드는 서열번호 1에 따른 서열을 갖는, 암을 치료하는 방법.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 상기 폴리뉴클레오타이드는 P-에톡시 골격 링키지를 포함하는, 암을 치료하는 방법.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 상기 폴리뉴클레오타이드는 리포솜 중에 캡슐화된, 암을 치료하는 방법.
- 제1항에 있어서, 상기 제1 약제학적 요법은 중성 지질을 더 포함하는, 암을 치료하는 방법.
- 제1항에 있어서, 상기 제1 약제학적 요법은 전신으로 투여되는, 암을 치료하는 방법.
- 제1항에 있어서, 상기 제1 약제학적 요법은 동맥내 또는 정맥내 투여를 위해서 제형화된, 암을 치료하는 방법.
- 제7항에 있어서, 상기 제1 약제학적 요법은 약 60㎎/㎡ 내지 약 90㎎/㎡의 투여량으로 투여되는, 암을 치료하는 방법.
- 제7항에 있어서, 상기 제1 약제학적 요법은 주당 2회 내지 4회 투여되는, 암을 치료하는 방법.
- 제1항에 있어서, 상기 Bcr-Abl 타이로신 카이나제 저해제는 다사티닙(dasatinib), 이마티닙(imatinib), 닐로티닙(nilotinib), 보수티닙(bosutinib), 포나티닙(ponatinib) 또는 베이프티닙(bafetinib)인, 암을 치료하는 방법.
- 제1항에 있어서, 상기 Bcr-Abl 타이로신 카이나제 저해제는 다사티닙인, 암을 치료하는 방법.
- 제13항에 있어서, 상기 다사티닙은 약 140㎎의 투여량으로 투여되는, 암을 치료하는 방법.
- 제13항에 있어서, 상기 다사티닙은 1일 1회 투여되는, 암을 치료하는 방법.
- 제1항에 있어서, 상기 제2 약제학적 요법은 전신으로 투여되는, 암을 치료하는 방법.
- 제16항에 있어서, 상기 제2 약제학적 요법은 경구, 동맥내 또는 정맥내로 투여되는, 암을 치료하는 방법.
- 제1항에 있어서, 상기 제1 약제학적 요법은 상기 제2 약제학적 요법의 투여 이전에 투여되는, 암을 치료하는 방법.
- 제1항에 있어서, 상기 제1 약제학적 요법 및 상기 제2 약제학적 요법은 동시에 투여되는, 암을 치료하는 방법.
- 제1항에 있어서, 상기 제1 약제학적 요법 및 상기 제2 약제학적 요법은 별개의 경로에 의해서 투여되는, 암을 치료하는 방법.
- 제1항에 있어서, 상기 환자는 인간인, 암을 치료하는 방법.
- 제1항에 있어서, 상기 암은 결장직장암, 신경모세포종, 유방암, 췌장암, 뇌암, 폐암, 위암, 혈액암, 피부암, 고환암, 전립선암, 난소암, 간암 또는 식도암, 자궁경부암, 두경부암, 비흑색종 피부암 또는 교모세포종인, 암을 치료하는 방법.
- 제1항에 있어서, 상기 암은 혈액암인, 암을 치료하는 방법.
- 제23항에 있어서, 상기 혈액암은 만성 골수성 백혈병(CML), 급성 골수성 백혈병(AML) 또는 골수이형성 증후군(MDS)인, 암을 치료하는 방법.
- 제24항에 있어서, 상기 CML은 가속기(accelerated) CML 또는 급성 전환기(blast-phase) CML인, 암을 치료하는 방법.
- 제24항에 있어서, 상기 CML 또는 AML은 Bcr-Abl 양성 CML 또는 Bcr-Abl 양성 AML인, 암을 치료하는 방법.
- 제26항에 있어서, 상기 Bcr-Abl 양성 CML 또는 Bcr-Abl 양성 AML은 T315I Bcr-Abl 돌연변이에 대해서 양성인, 암을 치료하는 방법.
- 제24항에 있어서, 상기 CML 또는 AML은 필라델피아 염색체-양성 CML 또는 필라델피아 염색체-양성 AML인, 암을 치료하는 방법.
- 제1항에 있어서, 상기 환자는 이마티닙으로의 치료에 이전에 실패한, 암을 치료하는 방법.
- 암 또는 골수이형성 증후군(MDS)의 치료를 필요로 하는 환자에서 암 또는 골수이형성 증후군(MDS)을 치료하는 방법으로서, 상기 환자에게, Grb2 핵산에 혼성화한 뉴클레아제-내성 폴리뉴클레오타이드를 포함하는 유효량의 제1 약제학적 요법 및 사이티딘 유사체를 포함하는 제2 약제학적 요법을 투여하는 단계를 포함하는, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제30항에 있어서, 상기 폴리뉴클레오타이드는 Grb2 핵산의 번역 개시 부위에 혼성화한, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제30항 또는 제31항에 있어서, 상기 폴리뉴클레오타이드는 8 내지 50개 염기의 길이를 갖는 올리고뉴클레오타이드인, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제30항 내지 제32항 중 어느 한 항에 있어서, 상기 폴리뉴클레오타이드는 서열번호 1에 따른 서열을 갖는, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제30항 내지 제33항 중 어느 한 항에 있어서, 상기 폴리뉴클레오타이드는 P-에톡시 골격 링키지를 포함하는, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제30항 내지 제34항 중 어느 한 항에 있어서, 상기 폴리뉴클레오타이드는 리포솜 중에 캡슐화된, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제30항에 있어서, 상기 제1 약제학적 요법은 중성 지질을 더 포함하는, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제30항에 있어서, 상기 제1 약제학적 요법은 전신으로 투여되는, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제30항에 있어서, 상기 제1 약제학적 요법은 동맥내 또는 정맥내 투여를 위해서 제형화된, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제36항에 있어서, 상기 제1 약제학적 요법은 약 60㎎/㎡ 내지 약 90㎎/㎡의 투여량으로 투여되는, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제36항에 있어서, 상기 제1 약제학적 요법은 주당 2회 내지 4회 투여되는, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제1항에 있어서, 상기 사이티딘 유사체는 데시타빈(decitabine), 시타라빈(cytarabine) 또는 아자시티딘(azacitidine)인, 방법.
- 제41항에 있어서, 상기 사이티딘 유사체는 데시타빈인, 방법.
- 제41항에 있어서, 상기 사이티딘 유사체는 시타라빈인, 방법.
- 제43항에 있어서, 상기 시타라빈은 약 20㎎의 투여량으로 투여되는, 방법.
- 제43항에 있어서, 상기 시타라빈은 1일 2회 투여되는, 방법.
- 제43항에 있어서, 상기 시타라빈은 피하로 투여되는, 방법.
- 제30항에 있어서, 상기 제1 약제학적 요법은 상기 제2 약제학적 요법의 투여 이전에 투여되는, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제30항에 있어서, 상기 제1 약제학적 요법 및 상기 제2 약제학적 요법은 동시에 투여되는, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제30항에 있어서, 상기 제2 약제학적 요법은 상기 제1 약제학적 요법의 투여 이전에 투여되는, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제30항에 있어서, 상기 제1 약제학적 요법 및 상기 제2 약제학적 요법은 별개의 경로에 의해서 투여되는, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제30항에 있어서, 상기 환자는 인간인, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제30항에 있어서, 상기 암은 결장직장암, 신경모세포종, 유방암, 췌장암, 뇌암, 폐암, 위암, 혈액암, 피부암, 고환암, 전립선암, 난소암, 간암 또는 식도암, 자궁경부암, 두경부암, 비흑색종 피부암 또는 교모세포종인, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제52항에 있어서, 상기 암은 혈액암인, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제53항에 있어서, 상기 혈액암은 만성 골수성 백혈병(CML), 급성 골수성 백혈병(AML) 또는 골수이형성 증후군(MDS)인, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제54항에 있어서, 상기 CML은 가속기 CML 또는 급성 전환기 CML인, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제54항에 있어서, 상기 CML 또는 AML은 Bcr-Abl 양성 CML 또는 Bcr-Abl 양성 AML인, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제56항에 있어서, 상기 Bcr-Abl 양성 CML 또는 Bcr-Abl 양성 AML은 T315I Bcr-Abl 돌연변이에 대해서 양성인, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
- 제54항에 있어서, 상기 CML 또는 AML은 필라델피아 염색체-양성 CML 또는 필라델피아 염색체-양성 AML인, 암 또는 골수이형성 증후군(MDS)을 치료하는 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662395680P | 2016-09-16 | 2016-09-16 | |
| US62/395,680 | 2016-09-16 | ||
| US201762487277P | 2017-04-19 | 2017-04-19 | |
| US62/487,277 | 2017-04-19 | ||
| PCT/US2017/051723 WO2018053232A1 (en) | 2016-09-16 | 2017-09-15 | Combination therapy with liposomal antisense oligonucleotides |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20190053905A true KR20190053905A (ko) | 2019-05-20 |
Family
ID=61619722
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197010647A KR20190053905A (ko) | 2016-09-16 | 2017-09-15 | 리포솜 안티센스 올리고뉴클레오타이드와의 병용 요법 |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US10927379B2 (ko) |
| EP (1) | EP3512525B1 (ko) |
| JP (1) | JP7132911B2 (ko) |
| KR (1) | KR20190053905A (ko) |
| CN (1) | CN109963571A (ko) |
| AU (2) | AU2017325971A1 (ko) |
| BR (1) | BR112019005166A2 (ko) |
| CA (1) | CA3034637A1 (ko) |
| ES (1) | ES2928654T3 (ko) |
| MX (1) | MX2019003070A (ko) |
| SG (2) | SG11201901667TA (ko) |
| WO (1) | WO2018053232A1 (ko) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL269608B1 (en) | 2017-04-19 | 2024-02-01 | Bio Path Holdings Inc | Compounds Containing Phosphorus-Ethoxy-Based Nucleic Acids for STAT3 Inhibition for Use in the Treatment of Cancer and Autoimmune Diseases |
| EA201992490A1 (ru) * | 2017-04-19 | 2020-03-03 | Байо-Пат Холдингз, Инк. | Р-этокси нуклеиновые кислоты для ингибирования bcl2 |
| CN112891376B (zh) * | 2021-03-09 | 2023-02-03 | 阜阳天祥食品科技有限公司 | 羊油在制备治疗肺癌药品中的应用 |
Family Cites Families (69)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4959463A (en) | 1985-10-15 | 1990-09-25 | Genentech, Inc. | Intermediates |
| US4659774A (en) | 1985-11-01 | 1987-04-21 | American Hoechst Corporation | Support for solid-phase oligonucleotide synthesis |
| EP0266032A1 (en) | 1986-08-29 | 1988-05-04 | Beecham Group Plc | Modified fibrinolytic enzyme |
| US4816571A (en) | 1987-06-04 | 1989-03-28 | Applied Biosystems, Inc. | Chemical capping by phosphitylation during oligonucleotide synthesis |
| US5824311A (en) | 1987-11-30 | 1998-10-20 | Trustees Of The University Of Pennsylvania | Treatment of tumors with monoclonal antibodies against oncogene antigens |
| US4870287A (en) | 1988-03-03 | 1989-09-26 | Loma Linda University Medical Center | Multi-station proton beam therapy system |
| US5602244A (en) | 1988-05-26 | 1997-02-11 | Competitive Technologies, Inc. | Polynucleotide phosphorodithioate compounds |
| US5087617A (en) | 1989-02-15 | 1992-02-11 | Board Of Regents, The University Of Texas System | Methods and compositions for treatment of cancer using oligonucleotides |
| US5248671A (en) | 1989-02-15 | 1993-09-28 | Board Of Regents, The University Of Texas System | Methods and compositions for treatment of cancer using oligonucleotides |
| US5708154A (en) | 1989-02-24 | 1998-01-13 | City Of Hope | RNA-DNA hybrid molecules of nucleic acid |
| US5141813A (en) | 1989-08-28 | 1992-08-25 | Clontech Laboratories, Inc. | Multifunctional controlled pore glass reagent for solid phase oligonucleotide synthesis |
| EP0942000B1 (en) | 1989-10-24 | 2004-06-23 | Isis Pharmaceuticals, Inc. | 2'-Modified oligonucleotides |
| US5872232A (en) | 1990-01-11 | 1999-02-16 | Isis Pharmaceuticals Inc. | 2'-O-modified oligonucleotides |
| US5859221A (en) | 1990-01-11 | 1999-01-12 | Isis Pharmaceuticals, Inc. | 2'-modified oligonucleotides |
| US5214136A (en) | 1990-02-20 | 1993-05-25 | Gilead Sciences, Inc. | Anthraquinone-derivatives oligonucleotides |
| US5470967A (en) | 1990-04-10 | 1995-11-28 | The Dupont Merck Pharmaceutical Company | Oligonucleotide analogs with sulfamate linkages |
| US5602240A (en) | 1990-07-27 | 1997-02-11 | Ciba Geigy Ag. | Backbone modified oligonucleotide analogs |
| US5378825A (en) | 1990-07-27 | 1995-01-03 | Isis Pharmaceuticals, Inc. | Backbone modified oligonucleotide analogs |
| US5223618A (en) | 1990-08-13 | 1993-06-29 | Isis Pharmaceuticals, Inc. | 4'-desmethyl nucleoside analog compounds |
| BR9106702A (pt) | 1990-07-27 | 1993-06-08 | Isis Pharmaceuticals Inc | Analogo de oligonucleotideos e processos para modular a producao de uma proteina por um organismo e para tratar um organismo |
| US5610289A (en) | 1990-07-27 | 1997-03-11 | Isis Pharmaceuticals, Inc. | Backbone modified oligonucleotide analogues |
| US5623070A (en) | 1990-07-27 | 1997-04-22 | Isis Pharmaceuticals, Inc. | Heteroatomic oligonucleoside linkages |
| US6111094A (en) | 1990-08-14 | 2000-08-29 | Isis Pharmaceuticals Inc. | Enhanced antisense modulation of ICAM-1 |
| US5672697A (en) | 1991-02-08 | 1997-09-30 | Gilead Sciences, Inc. | Nucleoside 5'-methylene phosphonates |
| DK51092D0 (da) | 1991-05-24 | 1992-04-15 | Ole Buchardt | Oligonucleotid-analoge betegnet pna, monomere synthoner og fremgangsmaade til fremstilling deraf samt anvendelser deraf |
| US5766855A (en) | 1991-05-24 | 1998-06-16 | Buchardt, Deceased; Ole | Peptide nucleic acids having enhanced binding affinity and sequence specificity |
| US5539082A (en) | 1993-04-26 | 1996-07-23 | Nielsen; Peter E. | Peptide nucleic acids |
| US5719262A (en) | 1993-11-22 | 1998-02-17 | Buchardt, Deceased; Ole | Peptide nucleic acids having amino acid side chains |
| US5714331A (en) | 1991-05-24 | 1998-02-03 | Buchardt, Deceased; Ole | Peptide nucleic acids having enhanced binding affinity, sequence specificity and solubility |
| US5700922A (en) | 1991-12-24 | 1997-12-23 | Isis Pharmaceuticals, Inc. | PNA-DNA-PNA chimeric macromolecules |
| US5652099A (en) | 1992-02-12 | 1997-07-29 | Conrad; Michael J. | Probes comprising fluorescent nucleosides and uses thereof |
| WO1993016094A2 (en) | 1992-02-12 | 1993-08-19 | Chromagen, Inc. | Applications of fluorescent n-nucleosides and fluorescent structural analogs of n-nucleosides |
| US5428148A (en) | 1992-04-24 | 1995-06-27 | Beckman Instruments, Inc. | N4 - acylated cytidinyl compounds useful in oligonucleotide synthesis |
| GB9211979D0 (en) | 1992-06-05 | 1992-07-15 | Buchard Ole | Uses of nucleic acid analogues |
| US5438131A (en) | 1992-09-16 | 1995-08-01 | Bergstrom; Donald E. | 3-nitropyrrole nucleoside |
| US5846945A (en) | 1993-02-16 | 1998-12-08 | Onyx Pharmaceuticals, Inc. | Cytopathic viruses for therapy and prophylaxis of neoplasia |
| US5858988A (en) | 1993-02-24 | 1999-01-12 | Wang; Jui H. | Poly-substituted-phenyl-oligoribo nucleotides having enhanced stability and membrane permeability and methods of use |
| US5801005A (en) | 1993-03-17 | 1998-09-01 | University Of Washington | Immune reactivity to HER-2/neu protein for diagnosis of malignancies in which the HER-2/neu oncogene is associated |
| US6015886A (en) * | 1993-05-24 | 2000-01-18 | Chemgenes Corporation | Oligonucleotide phosphate esters |
| ES2115343T3 (es) | 1993-11-05 | 1998-06-16 | Amgen Inc | Metodo de preparacion de liposomas y encapsulacion de material. |
| US5446137B1 (en) | 1993-12-09 | 1998-10-06 | Behringwerke Ag | Oligonucleotides containing 4'-substituted nucleotides |
| US5519134A (en) | 1994-01-11 | 1996-05-21 | Isis Pharmaceuticals, Inc. | Pyrrolidine-containing monomers and oligomers |
| GB9506466D0 (en) | 1994-08-26 | 1995-05-17 | Prolifix Ltd | Cell cycle regulated repressor and dna element |
| US5574146A (en) | 1994-08-30 | 1996-11-12 | Beckman Instruments, Inc. | Oligonucleotide synthesis with substituted aryl carboxylic acids as activators |
| US5554744A (en) | 1994-09-23 | 1996-09-10 | Hybridon, Inc. | Method for loading solid supports for nucleic acid synthesis |
| US5855911A (en) | 1995-08-29 | 1999-01-05 | Board Of Regents, The University Of Texas System | Liposomal phosphodiester, phosphorothioate, and P-ethoxy oligonucleotides |
| US5705629A (en) | 1995-10-20 | 1998-01-06 | Hybridon, Inc. | Methods for H-phosphonate synthesis of mono- and oligonucleotides |
| US5670663A (en) | 1996-02-14 | 1997-09-23 | Regents Of The University Of California | Recovery of taxanes from conifers |
| US5760395A (en) | 1996-04-18 | 1998-06-02 | Universities Research Assoc., Inc. | Method and apparatus for laser-controlled proton beam radiology |
| US5739169A (en) | 1996-05-31 | 1998-04-14 | Procept, Incorporated | Aromatic compounds for inhibiting immune response |
| US7309692B1 (en) | 1996-07-08 | 2007-12-18 | Board Of Regents, The University Of Texas System | Inhibition of chronic myelogenous leukemic cell growth by liposomal-antisense oligodeoxy-nucleotides targeting to GRB2 or CRK1 |
| US5886165A (en) | 1996-09-24 | 1999-03-23 | Hybridon, Inc. | Mixed backbone antisense oligonucleotides containing 2'-5'-ribonucleotide- and 3'-5'-deoxyribonucleotides segments |
| US6977244B2 (en) | 1996-10-04 | 2005-12-20 | Board Of Regents, The University Of Texas Systems | Inhibition of Bcl-2 protein expression by liposomal antisense oligodeoxynucleotides |
| US5908845A (en) | 1996-10-30 | 1999-06-01 | Segev; David | Polyether nucleic acids |
| US7704962B1 (en) | 1997-10-03 | 2010-04-27 | Board Of Regents, The University Of Texas System | Small oligonucleotides with anti-tumor activity |
| US7285288B1 (en) | 1997-10-03 | 2007-10-23 | Board Of Regents, The University Of Texas System | Inhibition of Bcl-2 protein expression by liposomal antisense oligodeoxynucleotides |
| US20050186264A1 (en) | 2000-10-12 | 2005-08-25 | Kiani Mohammad F. | Targeting drug/gene carriers to irradiated tissue |
| AU2002241952A1 (en) | 2001-01-22 | 2002-07-30 | Genta Incorporated | Cell-proliferative disorder treatments using cre decoy oligomers, bcl-2 antisense and hybrid oligomers |
| US7425545B2 (en) | 2001-07-25 | 2008-09-16 | Isis Pharmaceuticals, Inc. | Modulation of C-reactive protein expression |
| JP4491240B2 (ja) | 2002-01-17 | 2010-06-30 | ザ ユニバーシティ オブ ブリティッシュ コロンビア | Igfbp−2およびigfbp−5を阻害する二重特異性アンチセンスオリゴヌクレオチド、並びにこれらの使用方法 |
| US20030147813A1 (en) | 2002-02-07 | 2003-08-07 | John Lyons | Method for treating chronic myelogenous leukemia |
| ATE494372T1 (de) | 2005-08-29 | 2011-01-15 | Regulus Therapeutics Inc | Verfahren für mir-122a-modulation |
| US20080171718A1 (en) | 2006-11-08 | 2008-07-17 | Brown Bob D | Methods and Compositions for Treating Cancer Using BCL-2 Antisense Oligomers, Tyrosine Kinase Inhibitors, and Chemotherapeutic Agents |
| EP2212438A1 (en) * | 2007-11-15 | 2010-08-04 | Bristol-Myers Squibb | Methods of identifying and treating individuals exhibiting nup214- abli positive t- cell malignancies with protein tyrosine kinase inhibitors and combinations thereof |
| ES2592902T3 (es) * | 2008-10-02 | 2016-12-02 | Vib Vzw | Inhibición del PlGF para el tratamiento de la leucemia positiva para el cromosoma Filadelfia |
| EP2670396A1 (en) * | 2011-01-31 | 2013-12-11 | Celgene Corporation | Pharmaceutical compositions of cytidine analogs and methods of use thereof |
| WO2012122447A1 (en) | 2011-03-09 | 2012-09-13 | The Brigham And Women's Hospital, Inc. | Methods of using microrna-26a to promote angiogenesis |
| EP2638911A1 (en) * | 2012-03-14 | 2013-09-18 | Sanofi | Novel combinations for treating acute myeloid leukaemia or chronic myeloid leukaemia |
| US9744187B2 (en) | 2015-10-14 | 2017-08-29 | Bio-Path Holdings, Inc. | p-Ethoxy nucleic acids for liposomal formulation |
-
2017
- 2017-09-15 MX MX2019003070A patent/MX2019003070A/es unknown
- 2017-09-15 BR BR112019005166A patent/BR112019005166A2/pt unknown
- 2017-09-15 AU AU2017325971A patent/AU2017325971A1/en not_active Abandoned
- 2017-09-15 CA CA3034637A patent/CA3034637A1/en active Pending
- 2017-09-15 JP JP2019514777A patent/JP7132911B2/ja active Active
- 2017-09-15 WO PCT/US2017/051723 patent/WO2018053232A1/en unknown
- 2017-09-15 KR KR1020197010647A patent/KR20190053905A/ko not_active IP Right Cessation
- 2017-09-15 EP EP17851584.7A patent/EP3512525B1/en active Active
- 2017-09-15 CN CN201780063395.1A patent/CN109963571A/zh active Pending
- 2017-09-15 ES ES17851584T patent/ES2928654T3/es active Active
- 2017-09-15 US US16/333,221 patent/US10927379B2/en active Active
- 2017-09-15 SG SG11201901667TA patent/SG11201901667TA/en unknown
- 2017-09-15 SG SG10202008771WA patent/SG10202008771WA/en unknown
-
2021
- 2021-01-15 US US17/150,151 patent/US20210261972A1/en active Pending
-
2023
- 2023-08-14 AU AU2023214401A patent/AU2023214401A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| JP7132911B2 (ja) | 2022-09-07 |
| EP3512525A4 (en) | 2020-04-15 |
| AU2017325971A1 (en) | 2019-04-11 |
| CN109963571A (zh) | 2019-07-02 |
| WO2018053232A1 (en) | 2018-03-22 |
| EP3512525A1 (en) | 2019-07-24 |
| EP3512525B1 (en) | 2022-07-27 |
| US20210261972A1 (en) | 2021-08-26 |
| SG10202008771WA (en) | 2020-10-29 |
| BR112019005166A2 (pt) | 2019-07-02 |
| ES2928654T3 (es) | 2022-11-21 |
| US20200032271A1 (en) | 2020-01-30 |
| US10927379B2 (en) | 2021-02-23 |
| AU2023214401A1 (en) | 2023-09-07 |
| SG11201901667TA (en) | 2019-03-28 |
| MX2019003070A (es) | 2019-10-14 |
| CA3034637A1 (en) | 2018-03-22 |
| JP2019529420A (ja) | 2019-10-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20210261972A1 (en) | Combination therapy with liposomal antisense oligonucleotides | |
| JP2022027993A (ja) | リポソーム製剤のためのp-エトキシ核酸 | |
| KR102657218B1 (ko) | Igf-1r 억제용 p-에톡시 핵산 | |
| US20220127608A1 (en) | P-ethoxy nucleic acids for stat3 inhibition | |
| KR20200021453A (ko) | Igf-1r 억제용 p-에톡시 핵산 | |
| AU2018254468B2 (en) | P-ethoxy nucleic acids for BCL2 inhibition | |
| EA041953B1 (ru) | Комбинированная терапия липосомальными антисмысловыми олигонуклеотидами | |
| EA042663B1 (ru) | Р-этокси нуклеиновые кислоты для ингибирования stat3 | |
| EA044637B1 (ru) | Р-этокси нуклеиновые кислоты для ингибирования bcl2 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| AMND | Amendment | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| AMND | Amendment | ||
| X601 | Decision of rejection after re-examination |