KR20180048586A - 형광 조직-단층촬영(fht) 시스템 및 방법 - Google Patents
형광 조직-단층촬영(fht) 시스템 및 방법 Download PDFInfo
- Publication number
- KR20180048586A KR20180048586A KR1020187002483A KR20187002483A KR20180048586A KR 20180048586 A KR20180048586 A KR 20180048586A KR 1020187002483 A KR1020187002483 A KR 1020187002483A KR 20187002483 A KR20187002483 A KR 20187002483A KR 20180048586 A KR20180048586 A KR 20180048586A
- Authority
- KR
- South Korea
- Prior art keywords
- tissue
- fluorescence
- fht
- white light
- image
- Prior art date
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/645—Specially adapted constructive features of fluorimeters
- G01N21/6456—Spatial resolved fluorescence measurements; Imaging
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N1/00—Sampling; Preparing specimens for investigation
- G01N1/02—Devices for withdrawing samples
- G01N1/04—Devices for withdrawing samples in the solid state, e.g. by cutting
- G01N1/06—Devices for withdrawing samples in the solid state, e.g. by cutting providing a thin slice, e.g. microtome
Abstract
일 실시 예에 있어서, 형광조직-단층 촬영(FHT) 시스템이 개시된다. FHT 시스템은 하우징, 하우징 내에 위치한 형광 카메라, 하우징 내에 위치한 백색광 카메라, 및 하우징 내에 위치한 형광 광원을 포함한다. FHT 시스템은 카메라 및 형광 광원이 챔버 내에 보유되는 조직 시편의 블록면을 향해 조준되도록 슬라이싱 장치의 챔버 내에서 하우징을 지지하도록 구성된 서포트 마운트를 더 포함한다.
Description
관련 출원
본 출원은 "CRYOFLUORESCENCE TOMOGRPAHY (FHT) SYSTEMS AND METHODS"라는 발명의 명칭으로 Hoppin 등에 의해 2015년 8월 31일자로 출원된 미합중국 임시 특허출원 제62/211,930호, 및 "MULTI-SPECTRAL THREE DIMENSIONAL IMAGING SYSTEM AND METHOD"라는 발명의 명칭으로 2016년 5월 19일자로 출원된 미합중국 정규 특허출원 제62/164,800호에 대하여 우선권을 주장하는 "MULTI-SPECTRAL THREE DIMENSIONAL IMAGING SYSTEM AND METHOD"라는 발명의 명칭으로 2015년 5월 21일자로 출원된 미합중국 임시 특허출원 제15/158,928호의 우선권을 주장하며, 이의 내용들은 그 전체가 여기에 참고문헌으로서 포함된다.
기술 분야
본 발명은 일반적으로 영상에 관한 것으로, 더욱 상세하게는 형광 조직-단층촬영 (FHT) 시스템 및 방법에 관한 것이다.
다중스펙트럼 형광 조직 절편 영상은 독립형 또는 개조된 절편 촬상기에서 생체내 약물 분포를 측정하는데 사용될 수 있다. 단일 촬상 시스템에서 이러한 특수성은 스캔당 높은 비용을 초래할 수 있다. 높은 처리량과 낮은 비용을 위해, 슬라이싱 장비와 협력하여 작동할 수 있는 해당 소프트웨어 패키지로 형광 조직학적 (histo-) 촬상기를 만드는 것이 중요하다. 이를 위해, 여기에 요약된 방법은 기존의 조직 슬라이싱 장비에 다용도의 운반가능한 기능을 추가하기 위한 형광 촬상 기법의 작업 흐름을 보여준다.
하기에보다 상세히 기술되는 본 발명의 하나 이상의 실시 예들에 따르면, 형광 조직-단층촬영(FHT) 시스템이 개시된다.
FHT 시스템은 하우징, 하우징 내에 위치한 형광 카메라, 하우징 내에 위치한 백색광 카메라, 및 하우징 내에 위치한 형광 광원을 포함한다. FHT 시스템은 카메라 및 형광 광원이 챔버 내에 보유되는 조직 시편의 블록면을 향해 조준되도록 슬라이싱 장치의 챔버 내에서 하우징을 지지하게 구성된 서포트 마운트를 더 포함한다.
다른 실시 예에서, FHT를 수행하기 위한 방법이 개시된다. 상기 방법은 슬라이싱 장치의 챔버 내에 장착된 촬상장치에 의해 챔버 내에 보유된 조직 시편의 블록면의 백색광 이미지를 캡쳐하는 단계를 포함한다. 이 방법은 또한 백색광 및 형광 조명 하에서 블록면의 형광 이미지를 촬상장치에 의해 캡쳐하는 단계를 포함한다. 이 방법은 결합된 이미지를 형성하기 위해서 백색광 및 형광 이미지를 촬상장치에 의해서 공동 등록하는 단계를 더 포함한다. 상기 방법은 또한 상기 촬상장치에 의해 상기 결합된 이미지를 전자 디스플레이에 제공하는 단계를 추가로 포함한다.
추가 실시 예들에 있어서, FHT 시스템이 개시된다. FHT 시스템은 슬라이싱 장치의 챔버 내에 보유되는 조직 시편의 블록면을 촬상하기 위한 수단을 포함한다. FHT 시스템은 또한 슬라이싱 장치의 챔버 내에 촬상 수단을 지지하기 위한 수단을 또한 포함한다.
특허 또는 특허출원 파일은 컬러로 구현된 도면이 적어도 하나의 도면을 포함한다. 컬러 도면이 있는 이 특허 또는 특허출원 공보의 사본은 필요한 수수료의 지불과 함께 요청에 따라 특허청에 의해 제공될 것이다.
본 명세서에 개시된 실시 예의 상기 및 다른 목적, 특징, 양태 및 이점은 하기의 첨부된 도면을 참조하여 다음의 상세한 설명으로부터 더욱 명백해질 것이다.
도 1A∼1B는 다양한 실시 예들에 따른 예시적인 냉동조직절편기/동결조직절편기(cryostat/cryomicrotome)를 나타낸 도면.
도 2∼4는 다양한 실시 예들에 따른 현미경절편도(microtome) 또는 동결조직절편기에서 사용하기 위한 예시적인 형광 조직-단층촬영 (FHT) 촬상장치를 나타낸 도면.
도 5는 다양한 실시 예에 따른 FHT 시스템의 예시적인 컴퓨팅 장치를 나타낸 도면.
도 6은 다양한 실시 예에 따른 FHT 영상을 위한 조직 시편을 준비하기 위한 예시적인 단순화된 절차를 나타낸 도면.
도 7은 다양한 실시 예에 따른 FHT 영상을 사용하여 조직 시편의 블록면을 촬상하기 위한 예시적인 단순화된 절차를 나타낸 도면.
도 8은 다양한 실시 예에 따른 FHT 시스템에 의해 캡쳐된 이미지에 대한 예시적인 등록 방안을 나타낸 도면.
도 9A∼9I는 다양한 실시 예에 따른 형광체가 주입된 실 조각의 FHT 영상의 테스트 결과를 나타낸 도면.
도 10A∼10B는 다양한 실시 예에 따른 뇌조직의 FHT 영상의 테스트 결과를 나타낸 도면.
도 11A∼11F는 다양한 실시 예에 따른 뇌조직의 FHT 영상의 추가 테스트 결과를 나타낸 도면.
도 12A∼12I는 다양한 실시 예에 따른 뇌조직의 FHT 영상의 추가적인 예들을 나타낸 도면.
도 13A∼13E는 다양한 실시 예에 따른 경막내 투여된 안티센스 올리고핵산의 영상의 예를 나타낸 도면.
도 14A∼14C는 FHT 시스템으로부터 붙어있는 조직 박편을 제거하기 위한 기구의 예를 나타낸 도면.
도 15A∼15B는 조직 블록에 기준 마커를 정확히 위치시키기 위한 샘플 장치를 나타낸 도면.
도 16은 다색의 기준 마커의 예를 나타낸 도면.
상기 참조 도면들은 본 발명의 기본 원리를 예시하는 다양한 바람직한 특징들의 다소 간략화된 표현을 나타내는 것으로서 반드시 축척대로만 도시된 것은 아니다. 예를 들어, 특정 치수, 방향, 위치 및 형상을 포함하는 본 발명의 특정 설계 특징들은 특정한 의도된 응용 및 사용 환경에 의해 부분적으로 결정될 수있다.
본 명세서에 개시된 실시 예의 상기 및 다른 목적, 특징, 양태 및 이점은 하기의 첨부된 도면을 참조하여 다음의 상세한 설명으로부터 더욱 명백해질 것이다.
도 1A∼1B는 다양한 실시 예들에 따른 예시적인 냉동조직절편기/동결조직절편기(cryostat/cryomicrotome)를 나타낸 도면.
도 2∼4는 다양한 실시 예들에 따른 현미경절편도(microtome) 또는 동결조직절편기에서 사용하기 위한 예시적인 형광 조직-단층촬영 (FHT) 촬상장치를 나타낸 도면.
도 5는 다양한 실시 예에 따른 FHT 시스템의 예시적인 컴퓨팅 장치를 나타낸 도면.
도 6은 다양한 실시 예에 따른 FHT 영상을 위한 조직 시편을 준비하기 위한 예시적인 단순화된 절차를 나타낸 도면.
도 7은 다양한 실시 예에 따른 FHT 영상을 사용하여 조직 시편의 블록면을 촬상하기 위한 예시적인 단순화된 절차를 나타낸 도면.
도 8은 다양한 실시 예에 따른 FHT 시스템에 의해 캡쳐된 이미지에 대한 예시적인 등록 방안을 나타낸 도면.
도 9A∼9I는 다양한 실시 예에 따른 형광체가 주입된 실 조각의 FHT 영상의 테스트 결과를 나타낸 도면.
도 10A∼10B는 다양한 실시 예에 따른 뇌조직의 FHT 영상의 테스트 결과를 나타낸 도면.
도 11A∼11F는 다양한 실시 예에 따른 뇌조직의 FHT 영상의 추가 테스트 결과를 나타낸 도면.
도 12A∼12I는 다양한 실시 예에 따른 뇌조직의 FHT 영상의 추가적인 예들을 나타낸 도면.
도 13A∼13E는 다양한 실시 예에 따른 경막내 투여된 안티센스 올리고핵산의 영상의 예를 나타낸 도면.
도 14A∼14C는 FHT 시스템으로부터 붙어있는 조직 박편을 제거하기 위한 기구의 예를 나타낸 도면.
도 15A∼15B는 조직 블록에 기준 마커를 정확히 위치시키기 위한 샘플 장치를 나타낸 도면.
도 16은 다색의 기준 마커의 예를 나타낸 도면.
상기 참조 도면들은 본 발명의 기본 원리를 예시하는 다양한 바람직한 특징들의 다소 간략화된 표현을 나타내는 것으로서 반드시 축척대로만 도시된 것은 아니다. 예를 들어, 특정 치수, 방향, 위치 및 형상을 포함하는 본 발명의 특정 설계 특징들은 특정한 의도된 응용 및 사용 환경에 의해 부분적으로 결정될 수있다.
신체 내의 보이지 않는 작은 물체를 발견하기 위해서 여러 가지 도전들이 지속되고 있다. 이러한 물질을 형광 물질로 라벨링하는 것은 콘트라스트를 도입할 수 있는 기술이지만, 가시적인 형광물질은 여기 광 및 방출 광 모두가 흡수되고 분산되기 때문에 문제가 된다. 근적외선(NIR) 형광등은 정상적인 신체 조직 및 체액의 맥락에서 높은 콘트라스트를 제공할 수 있다.
이전의 살아있는 조직으로부터의 절편의 조직학적 분석은 각 절편이 (예를 들어, 현미경을 사용하여) 장착, 처리 및 주사되어야 하기 때문에 시간 소모적이며 고된 작업이다. 블록면 영상은 조직 절편이 버려지고 단지 조직 시편의 노출된 블록면만이 촬상되기 때문에 종래의 분석과 반대이다. 블록면을 촬영하기 위해서 NIR 형광등을 사용하는 경우, 비록 NIR이 볼 수 있는 "여분의 깊이"를 보완하기 위한 시도를 해야 하지만, 극단적으로 높은 신호 대 잡음비가 달성된다. 일부 구현 예에서, 조직 내의 광 전파에 관한 가정뿐만 아니라 비디오 정보 (예를 들어, 컬러, 그레이 스케일 등)는 적어도 실제 형광의 근사를 생성하는데 사용될 수 있다.
일부 양태들에 있어서, 본원에 기술된 기술들은 조직 블록 및 원래 살아있는 조직에 존재하는 실제 NIR 형광의 근사치를 초고해상도로 재구성하기 위해 이들 데이터 세트에 적용된 데이터 세트 및 수학적 방법을 획득하기 위해 컬러/근적외선(NIR) 습득을 이용한다. NIR은 가시적인 형광 영상을 배제할 수 있는 내인성 발색단으로부터 높은 감도와 적은 간섭을 또한 제공한다.
도 1A를 참조하면, 다양한 실시 예에 따른 냉동조직절편기/동결조직절편기 (100)가 도시된다. 일반적으로, 현미경절편도는 현미경 검사에 사용하기 위해 조직 블록의 조직학적 표본을 준비하는데 일반적으로 사용되는 장치이다. 예를 들어, 현미경 절편도는 현미경을 사용하여 관찰을 위해 슬라이드에 장착할 수 있는 조직 블록으로부터 조직 시편의 얇은 층을 깎을 수 있다. 동결조직절편기는 슬라이싱(slicing) 동안에 감소된 온도에서 조직 시편을 유지하도록 작동할 수 있는 특수한 형태의 현미경절편도이다. 여기에 개시된 FHT 시스템은 동결조직절편기와 관련하여 설명되었지만, 본 명세서의 교시는 이에 한정되지 않는다. 특히, FHT 시스템은 임의의 수의 상이한 슬라이싱 장치들(예를 들어, 다른 현미경절편도, 조직학적 샘플 준비장치, 현미경절편도 등)을 사용하여 구현될 수 있다.
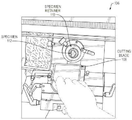
도시된 바와 같이, 동결조직절편기(100)는 절단 작업이 수행되는 밀봉된 챔버(106)를 둘러싸는 하우징(102)을 포함할 수 있다. 동결조직절편기(100)는 챔버 (106)에 대하여 동결조직절편기(100)의 사용자의 접근을 허용할 수 있는 도어(104) 또는 다른 접근기구(예를 들어, 뚜껑 등)를 또한 포함할 수 있다. 사용시에, 동결조직절편기(100)는, 얇게 잘라질 냉동 조직시편이 실온으로 해동되는 것을 방지하기 위해 챔버(106)의 내부 온도를 조절할 수 있다.
도 1B는 동결조직절편기(100)의 예시적인 챔버(106)를 보다 상세하게 도시한다. 도시된 바와 같이, 동결조직절편기(100)는 동결된 시편(112)을 제위치에 고정시키는 시편 리테이너(110)를 포함할 수 있다. 또한, 동결조직절편기(100)는 시동 될 때 시편(112)의 박층을 제거하도록 시편(112)의 블록면을 가로질러서 이동하는 하나 이상의 절단 블레이드(108)를 또한 포함할 수 있다. 많은 경우에 있어서, 시편(112)은 피험자로부터 추출한 생물학적 물질의 형태일 수 있고, 동결조직절편기(100)에 배치하기 전에 최적의 절삭 온도(OCT) 물질로 동결될 수 있다.
절단 블레이드(108)와 동결조직절편기(100)의 정렬은 결과적인 조직 절편의 두께를 조정하고 및/또는 절단 블레이드(108)와 조직 시편(112)의 적절한 접촉을 보장하도록 일부 동결조직절편기들에서 이루어질 수 있다. 예를 들면, 동결조직절편기(100)의 사용자는 조직 시편(112)의 슬라이싱을 개시하기 전에 먼저 조직 시편 (112)의 올바른 위치를 보장할 수 있다. 일부 실시 예에서, 절단 블레이드(108)의 작동은 사용자에 의해 수동으로 수행될 수 있다. 다른 실시 예에서, 절단 블레이드(108)의 작동 및/또는 시편 리테이너(110)의 이동은 컴퓨터 제어하에 동결조직절편기(100)에 의해 자동으로 수행될 수 있다.
본 발명의 기술을 구현하는데 사용될 수 있는 예시적인 동결조직절편기는 Leica Camera AG, Wetzlar, Germany로부터 시판중인 Leica 3050 동결조직절편기이다. 그러나, 이해되는 바와 같이, 본원의 기술은 임의의 수의 상이한 동종조직절편기에 적용될 수 있으며, 동결조직절편기의 특정 제조사, 모델 또는 유형으로 제한되지 않는다.
위에서 언급한 바와 같이, NIR 형광 촬영은 최근 몇년 사이에 출현하였고, 형광체가 주입된 조직과 정규 조직 사이에서 높은 콘트라스트의 이미지를 생성할 수 있는 능력을 나타낸다.
하기 표 1은 예시적인 형광 물질의 리스트를 그들의 피크 여기 파장(Ex) 및 피크 방출 파장(Em)과 함께 제공한다.
많은 경우에 있어서, 형광 영상의 목적으로 사용될 수 있는 형광체는 약 200 nm 내지 1000 nm 범위의 방출 스펙트럼을 나타낼 수 있다. 또한, 사용된 형광체의 각각이 상이한 방출 스펙트럼을 갖는다면, 다수의 형광체들이 단일 시편에 사용될 수 있다. 표 1에 열거되지 않은 다른 형광체들도 본 발명의 교시를 벗어남이 없이 사용될 수 있다.
다양한 실시 예들에 따르면, NIR 형광 촬상은 조직 시편의 형광 조직∼단층 촬영(FHT)을 수행하기 위해 동결조직절편기와 함께 레버리지될 수 있다. 언급된 바와 같이, 동결조직절편기들은 추가 분석을 위해 (예를 들어, 현미경 슬라이드 등에 절편를 장착함으로써) 조직 절편을 준비하는데 통상적으로 사용된다. 이와는 대조적으로, 본원의 FHT 기술은, 사용자가 원하는대로 폐기되거나 보유될 수 있는 결과적인 조직 절편들을 고려하지 않고 동결조직절편기에 있는 동안에 조직 시편 자체의 노출된 블록면을 영상함으로써 정확한 반대를 제시한다.
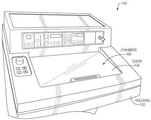
이제 도 2 내지 도 4를 참조하면, 다양한 실시 예들에서, 형광 조직-단층촬영(FHT) 시스템이 도시되어있다. 도 2에 도시된 바와 같이, FHT 시스템은 동결조직절편기(100)의 챔버(106) 내의 조직 시편(112)의 노출된 블록면을 영상화할 수 있는 촬상장치/시스템(200)을 포함할 수 있다. 알 수 있는 바와 같이, 촬상 시스템(200)은 임의의 수의 상이한 유형의 동결조직절편기와 함께 촬상 시스템(200)을 사용할 수 있게 운반될 수 있다. 바람직하게는, 동결조직절편기에 대해 상당한 변형을 일으키지 않고 FHT를 수행하도록 사용자로 하여금 동결조직절편기를 채택할 수 있게 한다.
촬상 시스템(200)은 촬상 시스템(200)의 다양한 영상 부품들을 에워싸는 하우징(202)을 포함할 수 있다. 일부 실시 예들에서, 하우징(202)은 사용자가 하우징(202)을 동결조직절편기(100)의 챔버(106) 내에 위치시킬 수 있게 하고 및/또는 거기로부터 촬상 시스템(200)을 제거할 수 있게하는 핸들(204)을 포함할 수 있다. 하우징(202)은 (예를 들어, 추운 온도 등에 카메라가 노출되는 것을 방지하도록) 플라스틱, 세라믹 또는 시트 금속과 같은 임의의 적합한 재료로 형성될 수 있으며, 동결조직절편기(100)의 챔버(106)의 내부 기후로부터 촬상 시스템(200)의 영상 부품들을 보호할 수 있다. 또한, 하우징(202)은 백색 및 NIR 스펙트럼의 광이 하우징(202)을 통과할 수 있도록 적어도 반투명일 수 있다. 또한, 하우징(202)은 주로 원통형상으로 도시되어 있지만, 하우징(202)의 다른 구현이 다른 형태의 기하학적 형태, 예를 들면, 동결조직절편기의 특정 유형이나 모델의 챔버 내에 맞추어 지도록 이루어질 수 있다.
다양한 실시 예들에 있어서, FHT 시스템은 조직 시편(112)에 대해 동결조직절편기(100)의 챔버(106) 내에서 적당한 거리로 하우징(202) 내에 영상 부품들을 위치시키기 위해 하나 이상의 지지 브래킷 또는 다른 보유 부재를 포함할 수 있다. 예를 들면, 도시된 바와 같이, 지지 장착/브래킷(210)은 챔버(106)의 플로어와 접촉하여 그로부터 거리를 두고 하우징(202)을 지지할 수 있다. 하우징(202)은 조직 시편(112)의 블록면으로부터 임의의 원하는 거리에 위치될 수 있지만, 도 3에 더욱 상세하게 나타낸 바와 같이, 시험은 약 10인치의 거리가, 절단 블레이드(108)의 운동을 방해하지 않으면서 샘플의 적절한 FHT 영상 결과를 산출하는 것으로 나타났다.
일부 실시 예들에 있어서, 브래킷(210)은 (예를 들어, 하나 이상의 나사, 볼트 등을 통해) 챔버(106)의 플로어에 결합되거나 고정될 수 있다. 다른 실시 예들에 있어서, 브래킷(210)은 (예를 들어, 절단 블레이드(108) 등과 연관된 구조하에서 활주하도록) 동결조직절편기(100)의 하나 이상의 부품에 결합하도록 형상화될 수 있다. 또한, 브래킷(210)은 다양한 실시 예에 따라 하우징(202)(예를 들어, 하우징(202)이 브래킷(210)에 놓여 있음)과 별개의 구성 요소일 수 있고, 거기에 고정되거나 결합될 수 있거나 또는 하우징(202)의 일부로서 직접적으로 형성될 수 있다.
촬상 시스템(200)의 촬상 구성 요소는 하나 이상의 전하 결합 장치(CCD) 카메라(206) 및 하나 이상의 조명 광원/광섬유(208)와 같은 하나 이상의 카메라를 포함 할 수 있다. 예를 들어, 카메라(206)는 가시 스펙트럼 내에서 이미지를 캡쳐하도록 구성된 백색광 카메라 및/또는 NIR 또는 IR 스펙트럼에서 이미지를 캡쳐하도록 구성된 형광 카메라를 포함할 수 있다. 유사하게, 조명 광원/섬유(208)는 영상 동안 조직 시편(112)의 블록면상에 형광 및/또는 백색광을 비추기 위해 하나 이상의 섬유를 포함할 수 있다. 하우징(202)의 후방으로 연장하는 것은 도 4에 도시 된 바와 같이 카메라(206) 및 조명 소스/섬유(208)를 컴퓨팅 장치(300)에 연결시키는 케이블(212)일 수 있다.
일부 경우에 있어서, 실내 조명에 의한 주변 조명은 촬상 시스템(200)이 전용 백색광 조명 소스를 요구하지 않도록 충분히 확산될 수 있다. 그러나, 다른 실시 예에서, 촬상 시스템(200)은 조명 섬유(208)의 일부 또는 하우징(202)의 단부 또는 하우징(202)의 외부에 위치한 조명들(예를 들어, 수술용 램프, 카메라 플래시 등)과 같이 촬상 시스템(200)의 일부로서 하나 이상의 백색 광원을 더 포함할 수 있다.
카메라(206)는 백색광 및 NIR 스펙트럼의 이미지를 캡쳐하도록 작동할 수 있는 임의의 적절한 유형일 수 있다. 예를 들어, 비록 다른 적합한 백색광 카메라가 다른 구현 예에서 사용될 수 있지만, FHT 시스템의 한 프로토 타입은 Melville, NY 소재의 Canon에 의해 시판중인고해상도 Canon EOS 700 백색광 카메라를 사용한다. 형광 영상을 위해, 적당한 시스템은 Marlboro, MA 소재의 Curadel LLC에 의해 시판중인 K∼FLARE®, and Lab∼FLARE® models Rl™, Rlv™, RP1™, RP2™, RC2™, FLARE® (FLuorescence∼Assisted Resection and Exploration) 촬상 시스템을 포함한다. 여기의 가르침을 벗어남이 없이 다른 적당한 시스템 부품들이 필요에 따라 사용될 수 있다.
정반사를 감소시키기 위해, 촬상 시스템(200)은 카메라(들)(206) 및/또는 조명 소스들(예를 들어, 조명 섬유들(208))을 갖는 편광판들을 포함할 수 있다. 예를 들어, 촬상 시스템(200)은 조명된 조직 시편(112)으로부터의 거울 반사를 감소시킬 90도 각도로 회전된 여기 및 방출을 갖는 동심성 선형 편광판을 사용할 수있다.
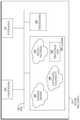
도 5는 다양한 실시 예들에 따른 컴퓨팅 장치(300)의 예시적인 개략적인 블록도를 도시한다. 도시된 바와 같이, 컴퓨팅 장치(300)는 하나 이상의 인터페이스 (310)(예를 들어, 유선, 무선 등), 적어도 하나의 프로세서(320), 및 시스템 버스 (350)에 의해 상호 접속되고 전원(360)에 의해 동력을 받는 메모리(340)를 포함할 수 있다.
인터페이스(들)(310)은 FHT 시스템의 다른 컴퓨팅 장치와 데이터를 통신하기위한 기계적, 전기적 및 신호 회로를 포함한다. 예를 들어, 인터페이스(310)는 케이블(212)을 통해 직접적으로 또는 임의의 수의 중간 구성 요소를 통해 간접적으로 촬상 시스템(200)의 카메라(206) 및 조명 섬유(208)에 통신 가능하게 결합될 수있다. 예를 들어, 인터페이스(들)(310)은 광원들이 활성화 될 때(예를 들어, 조직 시편(112)상의 형광등을 비추는) 제어를 제공하기 위해 조명 섬유(208)에 대한 하나 이상의 광원과 통신할 수 있다. 또한, 인터페이스(들)(310)은 추가 이미지 프로세싱을 위해 촬상 시스템(200)의 백색광 및 형광 카메라로부터 캡쳐된 이미지 데이터를 수신 할 수 있다.
어떤 경우들에 있어서, 인터페이스(들)(310)은 또한 하나 이상의 사용자 인터페이스 장치들과 통신할 수 있다. 일반적으로, 사용자 인터페이스 장치들은 사용자에게 감각 정보를 제공하고 및/또는 하나 이상의 센서를 통해 사용자로부터 입력을 수신한다. 예를 들어, 사용자 인터페이스 장치는, 하기의 예로서 제한되는 것은 아니지만, (예를 들어, 조직 블록면의 결과적인 이미지를 사용자에게 디스플레이하도록) 전자 디스플레이, 포인팅 장치(예를 들어, 트랙 패드, 터치 스크린 등), 오디오 장비(예를 들어, 스피커, 마이크 등) 등을 포함할 수 있다. 또한, 인터페이스(들)은 (예를 들어, 다른 장치로 이미지 데이터를 전달하거나, 다른 장치로부터 명령을 수신하기 위해) 유선 또는 무선 네트워크를 통해 컴퓨팅 장치(300)를 다른 컴퓨팅 장치에 통신 가능하게 연결시킬 수 있다.
메모리(340)는 여기에 기술된 실시 예와 관련된 소프트웨어 프로그램 및 데이터 구조를 저장하기 위한 프로세서(320) 및 인터페이스(들)(310)에 의해 접근 가능한 복수의 저장 위치를 포함한다. 프로세서(320)는 소프트웨어 프로그램을 실행하고 수신된 센서 데이터(예를 들어, 캡쳐된 이미지 데이터 등), 동작 매개변수 또는 설정 등을 포함할 수 있는 데이터 구조(345)를 조작하도록 구성된 하드웨어 요소 또는 하드웨어 로직을 포함할 수 있다. 통상적으로 메모리(340)에 상주하고 프로세서(320)에 의해 실행되는 운영 체제(342)는 그중에서도 장치(300)상에서 실행되는 소프트웨어 프로세스 및/또는 서비스를 지원하는 동작을 호출함으로써 장치(300)를 기능적으로 구성한다. 이러한 소프트웨어 프로세스 및/또는 서비스들은 여기에 설명된 바와 같이, 다양한 실시 예들에서, 조명 컨트롤러 프로세스(347) 및/또는 영상 프로세스(248)를 포함할 수 있다.
다양한 컴퓨터-판독가능 매체를 포함하는 다른 프로세서 및 메모리 유형이 여기에 기술된 기술에 관한 프로그램 명령을 저장하고 실행하는데 사용될 수 있음은 당업자에게 명백할 것이다. 또한, 이 설명이 다양한 프로세스를 설명하지만, 다양한 프로세스가 본 명세서의 기술에 따라 (예를 들어, 유사한 프로세스의 기능에 따라) 동작하도록 구성된 모듈로서 구현될 수 있음이 명백하게 고려된다. 또한, 프로세스가 개별적으로 도시되었지만, 당업자는 프로세스가 다른 프로세스 내의 루틴 또는 모듈일 수 있다는 것을 이해할 것이다.
일반적으로, 조명 제어기(347)는 형광 광원 및 가능하게는 백색 광원이 작동 될 때 제어하도록 구성될 수 있다. 인식할 수 있는 바와 같이, 발광 다이오드 (LED), 레이저 등과 같은 광원 자체는 컴퓨팅 장치(300)와 통신할 수 있고, 대응하는 광을 조직 시편(112)의 블록면위로 방출하도록 조명 광섬유(208)에 광학적으로 결합될 수 있다. 예를 들어, 조명 제어기(347)는 조직 내에 존재하는 형광 물질(들)로부터 여기 응답을 유발하기 위해, 촬상 시스템(200)이 NIR 또는 IR 파장으로 조직 시편(112)을 조사할 때 제어할 수 있다.
영상 프로세스(248)는 촬상 시스템(200)에 의해서 캡쳐된 이미지들을 획득 및/또는 처리하도록 작동될 수 있다. 에를 들면, 영상 프로세스(248)는 조직 시편(112)의 블록면의 백색광 및/또는 형광 이미지를 캡쳐하도록 카메라(206)에 신호들을 송신할 수 있다. 다음에, 영상 프로세스(248)는 후술하는 바와 같이 전자 디스플레이에 출력하기 위한 최종화된 이미지를 생성하기 위해 카메라(206)로부터 캡쳐된 이미지 데이터를 수신하여 이미지 프로세싱을 수행할 수 있다. 일부 실시 예에서, 영상 프로세스(348)는 절단 블레이드(108)의 자동화된 작동과 같이, 시편 리테이너(110)의 이동 등과 같은 동결조직절편기(100)의 하나 이상의 자동화된 기능을 제어하도록 추가 구성될 수 있다.
도 6을 참조하면, 다양한 실시 예에 따라, FHT 이미지 획득을 목적으로 조직 시편을 준비하기 위한 예시적인 간략화된 절차(600)가 도시되어 있다. 도시된 바와 같이, 절차(600)는 단계(605)에서 시작하여 대상 샘플/시편이 준비되는 단계(610)로 계속될 수 있다. 다양한 실시 예들에 있어서, 이 단계는 조직 시편에 적합한 형광 물질을 선택하고 선택된 형광 물질을 시편에 주입하는 것을 수반할 수 있다. 예를 들어, 표 1에서 이전에 나타낸 바와 같이, 상이한 형광체들은 상이한 스펙트럼 특성 및 적용을 가질 수 있다. 형광체 주입 후 적합한 축적 시간 후, 분석을 위한 연조직을 절제할 수 있다.
단계(615)에서, FHT 영상을 수행하기 위한 대상 시편의 준비 후, 대상 시편은 OCT 화합물의 블록 내에 삽입될 수 있다. 임의의 적합한 OCT 화합물이 이 단계를 위해 선택될 수 있다. OCT에 싸인 피험자 조직 블록은 (예를 들어, 도 1b에 도시 된 바와 같이) 동결조직절편기 내의 위치에 설치될 수 있다.
절차(600)는 또한 전술한 FHT 촬상 시스템 구성요소가 대상 블록의 블록면에 위치되고 지정되는 단계(620)를 또한 포함할 수 있다. 예를 들어, 촬상 시스템(200)은 전술한 바와 같이, 블록면의 영상을 위해 동결조직절편기(100)의 챔버(106) 내의 조직 시편(112)의 시편 블록면의 전방에 위치할 수 있다. 주목할 것은, 형광 성분은 가능한 많은 대상 표본이 카메라에 초점을 맞추고 대상이 가림없이 가장 큰 가능한 시야를 차지하도록 배치될 수 있다는 것이다.
절차(600)는 형광 채널이 촬상 시스템에 대해 선택되는 단계(625)를 또한 포함할 수 있다. 주목할 것은, 단계(610)에서 조직 시편에 사용된 형광체에 기초하여 상이한 NIR 채널이 선택될 수 있다. 만약 다수의 형광체가 시편에 사용되는 경우, 대응하는 NIR 채널은 형광체의 스펙트럼 특성을 중첩하도록 선택될 수 있다.
단계(620)와 유사하게, 절차(600)는 고해상도 백색광 카메라가 조직 시편에 위치하는 단계(630)를 포함할 수 있다. 만약, 예를 들어, 백색광 카메라 및 형광 카메라가 모두 동일한 하우징 (예를 들어, 하우징(202)) 내에 위치하면, 단계(620) 및 (630)은 하우징을 조직 시편에 대하여 동결조직절편기의 챔버 내에 위치시킴으로써 동시에 수행될 수 있다.
절차(600)의 단계(635)에서, 사용자는 필요에 따라 형광 및 백색광 카메라의 위치를 조정할 수 있다. 예를 들어, 카메라에 의해 획득된 테스트 이미지에 기초하여, 카메라의 위치는 조직의 블록면의 원하는 영역이 포착되거나 카메라가 포커싱되도록 보장하기 위해서 또는 다른 이유로 인해 더욱 조정될 수 있다.
절차(600)의 단계(640)에서, 백색광 및 형광 촬상 시스템이 OCT 블록의 블록면에 대하여 바람직한 위치에 위치되면, 구성 요소는 제 위치로 고정될 수 있다. 예를 들어, 만약 영상 요소들이 단일 하우징 내에 위치하면, 동결조직절편기의 챔버 내에서 하우징의 위치는 일단 원하는 위치가 달성되면 고정화될 수 있다.
절차(600)의 단계(645)에서, 조직 시편/샘플을 준비하고 장착한 후에, 조직이 거의 노출될 때까지 동결조직절편기의 블레이드(들)이 OCT 블록을 깍도록 작동될 수 있다. 다시 말하면, 단계(645)의 완료시, 노출된 블록면은 영상을 위해 캡슐화된 조직 앞에 매우 미세한 OCT 화합물 층만을 포함할 수 있다. 이어서, 절차(600)은 단계(650)에서 종료한다.
도 7을 참조하면, 다양한 실시 예에 따라 조직 시편에 FHT를 수행하기 위한 예시적인 단순화된 절차(700)가 도시되어 있다. 일부 실시 예에서, 절차(700)는 촬상 시스템 (예를 들어, 촬상 시스템 (200))과 통신하는 컴퓨팅 장치(예를 들어, 장치 (300))를 갖는 FHT 시스템을 동작시킴으로써 전체적으로 또는 부분적으로 수행 될 수 있다. 절차(700)는 단계(705)에서 시작하여 단계(710)로 계속될 수 있고, 여기서 위에서 상세히 기술된 바와 같이, 실내 조명은 FHT 시스템이 위치한 룸에서 활성화될 수 있다. 촬상 시스템의 성능에 따라 실내 조명의 주변 광은 영상의 목적을 위해 충분한 백색광을 제공할 수 있다.
절차(700)의 단계(715)에서, FHT 시스템은 백색광 카메라를 사용하여 조직 시편의 블록면을 획득할 수 있다. 특히, FHT 시스템의 컴퓨팅 장치는 동결조직절편기의 챔버 내에서 조직 시편의 블록면의 고화질 백색광 이미지를 포착할 수 있도록 백색광 카메라에 신호를 전송할 수 있다.
절차(700)의 단계(720)에서, FHT 시스템은 단계(715)와 동시에 또는 그 전후의 짧은 시간 내에 그것의 형광 영상 성분을 사용하여 하나 이상의 이미지를 캡쳐할 수도 있다. 일부 실시 예들에 있어서, 형광 영상 성분은 조직 시편의 블록면의 백색광 및 형광/NIR 이미지를 포착할 수 있다. 예를 들어, 형광 카메라는 실내 조명이 활성화되고 형광 조명을 사용하거나 사용하지 않은 상태에서 블록면의 이미지를 캡쳐할 수 있다.
절차(700)의 단계(725)에서, 실내 조명은 조직 시편으로부터 백색 광원을 제거하기 위해 불능화될 수 있다. 대안적으로, 만약 전용 백색 광원이 사용되면, 단계(710) 및 (725)는 필요에 따라 백색 광원을 켜고 끄는 것을 수반할 수 있다.
절차(700)의 단계(730)에서, FHT 시스템은 실내 조명이 비활성화된 상태에서 형광등 조명하에서 블록면의 이미지를 포착할 수 있다. 따라서, 단계(715),(720) 및 (730)의 결과로서, FHT 시스템은 다음과 같은 블록면의 뚜렷한 이미지 중 하나 또는 모두를 가질 수 있다; 1). 블록면이 백색광으로 조명되는 (예를 들어, 실내 조명이 켜진 상태) 동안에 백색광 카메라에 의해 캡쳐된 백색광 이미지, 2). 블록면이 백색광으로 단독으로 조명되는 동안에 형광 이미지 시스템에 의해 캡쳐된 형광 이미지, 3). 실내 조명과 형광 광원 모두 켜져 있는 동안에 형광 촬상 시스템에 의해 캡쳐된 형광 이미지, 4). 모든 광원이 꺼져있는 동안에 형광 촬상 시스템에 의해 캡쳐된 형광 이미지, 및 5). 백색 광원은 꺼져 있고 형광 광원은 켜져 있는 동안에 형광 촬상 시스템에 의해 캡쳐된 형광 이미지.
단계(735)에서, 실내 조명은 블록면의 영상을 완료한 후에 재활성화 될 수 있다. 이어서, 단계(740)에서, OCT 블록을 절단하도록 동결조직절편기의 블레이드(들)이 활성화되고, 이에 의해 영상을 위해 샘플의 다른 부분이 노출된다. 이때 또는 그 근방에서, 상기 단계들에 의해 한정된 프로토콜의 임의의 중단들이 단계(745)에서 나타날 수 있다. 예를 들어, 만약 과잉 이미지가 취해진다면, 나타난 것은 노출된 블록면의 캡쳐된 이미지들중 어느 것과 연관될 수 있고, 따라서 이들 이미지가 폐기되거나 무시될 수 있게 한다.
절차(700)의 단계(750)에서, OCT 블록으로부터 제거된 조직 층이 관심의 마지막 층인지 여부에 관한 결정이 이루어질 수 있다. 그렇지 않다면, 절차(700)는 단계(715)로 되돌아 가서, 새롭게 노출된 층에 대해 단계(715∼745)를 반복한다. 그러나, 조직의 최종 층이 영상된 경우, 절차(700)는 절차(700)가 종료되는 단계(755)로 계속 진행할 수 있다.
절차(600∼700) 내의 특정 단계들은 상술한 바와 같이 선택적일 수 있지만, 도 6 내지 도 7에 도시된 단계들은 단지 설명을 위한 예시이며, 소정의 다른 단계들이 필요에 따라 포함되거나 배제될 수 있다. 또한, 단계들의 특정 순서가 도시되어 있지만, 이러한 순서는 단지 예시적인 것이며, 본 명세서의 실시 예들의 범위를 벗어남이 없이 임의의 적절한 단계들의 배열이 이용될 수 있다. 또한, 절차(600∼700)는 개별적으로 기술되지만, 각 절차로부터의 특정 단계는 서로의 절차에 통합될 수 있으며, 절차는 상호 배타적인 것을 의미하지 않는다.
도 8을 참조하면, 다양한 실시 예에 따른, FHT 시스템 내의 이미지의 등록에 대한 설명(800)이 도시되어 있다. 특히, 최종 이미지(들)을 생성하기 위해 FHT 컴퓨팅 장치(예를 들어, 영상 프로세스(248)를 실행하는 장치(300))는 다양한 캡쳐 이미지(예를 들어,도 7에 도시된 절차(700)를 통해 캡쳐된 이미지)를 공동 등록할 수 있다. 최종화된 이미지는 인간 사용자에 의한 검토를 위해 전자 디스플레이 또는 다른 사용자 인터페이스 장치에 제공될 수 있다.
설명의 편의를 위해 다음 레이블들이 해당 이미지에 지정되어 있다고 가정한다:
WL FLARE ON: 백색광으로 조명된 블록면의 형광 촬상 시스템의 백색광 채널에서 캡쳐된 이미지(805).
WL FLARE OFF: 모든 조명들이 꺼져 있지만 형광 여기 광은 켜져있는 상태에서 블록면의 형광 촬상 시스템의 백색광 채널에서 캡쳐된 이미지.
FL FLARE ON: 형광 여기광 및 백색광으로 조명된 블록면에 대해 형광 촬상 시스템의 형광 채널에서 캡쳐된 이미지(815).
FL FLARE OFF: 형광 여기광 단독으로 조명된 블록면에 대해 형광 촬상 시스템의 형광 채널에서 캡쳐된 이미지(820).
WL HIGH ON: 백색광으로 조명된 블록면에 대해 고해상도 백색광 카메라에 의해 캡쳐된 이미지(들)(810).
다양한 실시 예들에 있어서, 상기 컴퓨팅 장치는 도 8에 도시된 바와 같이 다음 중 어느 하나 또는 모두를 수행함으로써 이미지 프로세싱을 수행할 수 있다:
1. WL_HIGH_ON 이미지를 자체 공동 등록하여 정렬된 이미지 스택을 만듦.
2. WL_FLARE_ON를 WL_HIGH_ON에 공동 등록함.
a. FL_FLARE_ON은 WL_FLARE_ON에 기본적으로 공동 등록됨.
3. WL_FLARE_OFF를 FL_FLARE_OFF에 공동 등록함.
4. 정렬된 FL_FLARE_OFF에서 다음의 이미지 형광 처리를 수행함.
특히, 컴퓨팅 장치는 WL_HIGH_ON 이미지를 제외하고 이미지 단위로 공동 등록을 수행할 수 있다.
알 수 있는 바와 같이, 상기 절차는 단지 예시적인 것이며 본 명세서의 교시를 제한하도록 의되된 것은 아니다. 특히, 상기 절차는 형광 광원의 출력이 백색 광원(예를 들어, 빗나가게하는 실내조명 등)에 비교할만한 경우에 특히 유용할 수있다. 그러나, 형광 신호가 충분히 높으면, 단일 절편 백색광 및 형광 이미지가 실내 조명과 동시에 캡쳐되고 서로 기본적으로 공동 등록되도록 상기 기술을 변형할 수 있다. 특히, 광학 필터가 이러한 경우에 형광 이미지 상에 사용될 수 있고, 이에 의해 상이한 조명 조건 하에서 이미지 캡쳐를 단순화한다. 일부 실시 예들에 있에서, 영상 부품들은 Curadel, LLC에 의해 시판중인 LAB∼FLARE® 촬상 시스템 또는 유사한 시스템을 대신에 포함할 수 있다. 이러한 시스템은 상이한 이미지 (예를 들어, 컬러 및 NIR 등)의 동시 획득을 가능하게 하여, 백색 광원(예를 들어, 실내 조명)을 스위치 온-오프할 필요성을 제거한다.
예-실
촬상
(Twine Imaging)
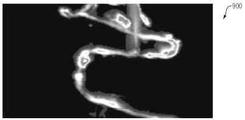
또한, 도 9A∼9I는 다양한 실시 예들에 따라, 실(twine)의 형광단∼주입부의 FHT 촬상의 시험 결과를 나타낸다. 특히, 다수의 개별적인 스트랜드를 포함하는 실의 촬상은 본 명세서의 기술을 사용하는 프로토타입 FHT 시스템을 사용하여 개념 입증으로서 수행되었다. 테스트하는 동안 다음 단계가 수행되었다:
· 키친 실을 형광 물질(AlexaFluor 647, 100nM 농도)에 10분간 담갔다.
· 키친 트와인은 건조되었고 OCT 베개 주위를 감쌌다.
· 감싸여진 베게는 큰 OCT 블록에 삽입되어 FHT 시스템에 의한 슬라이싱을 위해 동결되었다.
·이미지 데이터가 OCT 블록을 통해 50um 두께 영역에서 수집되었다.
·카메라 서브 시스템은 블록 위 약 15cm에 위치하여 ~5 x 5cm의 시야(FOV)와 ~0.085mm의 횡단 픽셀 크기를 갖는다.
또한, 도 9A∼9B는 FHT 시스템을 사용하여 실의 최초 캡쳐된 이미지(900∼910)를 나타낸다. 도시된 바와 같이, 이미지(900∼910)는 고농도의 형광 물질을 갖는 실의 부분과 그렇지 않은 실의 부분 사이의 콘트라스트를 나타낸다.
다양한 실시 예들에 따라, FHT 시스템은 디스플레이를 위한 이미지를 생성하기 위해 차감-기반 디블러링(deblurring)을 더 이용할 수 있다. 또한, 도 9C∼9D는 차감-기반 디블러링을 수행한 후의 이미지들(900∼910)을 각각 나타낸다. 일부 실시 예들에 따르면, 차감-기반 디블러링은 몬테카를로 시뮬레이션을 실행하거나, 포인트 스프레드 함수 방법을 사용하거나, 또는 디컨볼루션 방법을 수행하는 단계를 포함할 수 있다. 디컨볼루션 방법은 측정된 포인트 스프레드 함수 커널, 시뮬레이트된 포인트 스프레드 함수 커널, 리차드슨-루시(Richardson-Lucy) 방법, 웨이너 필터 디컨볼루션, 밴 시터(Van Cittert) 디콘볼루션, 블라인드 디콘볼루션 또는 정규화된 디컨볼루션 방법 중 하나를 포함할 수 있다.
또한, 도 9E∼9F는 각각 원래의 윤곽 및 흐림없는 윤곽 모두에서의 실의 추가 이미지를(930∼940)을 나타낸다. 또한, 도 9G∼9I는 상이한 이미지 프로세싱 기술을 이미지에 적용하는 것을 예시하기 위해 이미지(940)의 영역(942)의 이미지 (950∼970)를 나타낸다. 특히, 이미지(950)는 형광 촬상 시스템으로부터의 원래 형태의 영역(942)을 나타낸다. 도 9H의 이미지(960)는 차감-기반 디블러링을 수행한 후에 이미지(950)를 나타낸다. 최종적으로, 일부 실시 예에서, FHT 시스템은 이미지(960)에 에지-보존 평활화를 추가로 적용하여, 도 9에 도시된 이미지(970)가 얻어진다.
예-뇌조직
촬상
면역조직화학(immunohistochemistry), 형광 촬상 및 방사능 사진촬영술(autoradiography)와 같은 생체내 촬상 방법론들이 전신 또는 절제 기관에서 해부학, 생리학 및 약물 또는 추적자 분포를 연구하는데 사용되었다. 이러한 방법론들은 생체내 영상 연구를 따르거나 수반할 수 있으며, 독립형 연구로서의 역할을 할 수 있다. 생체외 프로세싱은 비교적 비싸고 시간이 많이 걸리기 때문에, 전체 시편에 걸쳐서 큰 간격(0.1∼1mm)으로 단면 및/또는 이미지를 찍는 경우가 있다. 영역들이 수집되거나 이미지화되지 않는 이러한 갭에서는 정보가 손실된다. 또한, 시편의 3차원 모델이 필요한 경우, 크게 이격된 영역의 보간이 필요하고 모델이 어려워질 수 있다.
위에서 설명한 것처럼 이러한 잠재적인 단점을 해결하기 위해, 수술중에 형광 촬상 시스템을 사용하여 마이크로 또는 현미경절편도가 매번 통과한 후에 고해상도의 백색 및 다중 스펙트럼 (700 내지 800 nm) 형광 이미지를 블록에서 캡쳐할 수 있고, 따라서 시편 전체에서 캡쳐된 정보의 양을 크게 개선할 수 있고 총 획득 시간이 단축된다. 일반적으로, 형광 및 고해상도 백색 광 데이터 수집 및 후속 공동∼등록 및/또는 3차원 재구성의 프로세스는 본 명세서에서 초저온형광e 단층활영 또는 FHT로 지칭된다.
본원에서 FHT 기술을 사용하여, 장기 또는 소형 동물 전체를 절개할 수 있고 (예, 25 미크론 등), 모든 이미지들을 2시간 이내에 포착하여 획득할 수 있어서 다양한 생체외 기술의 단점을 개선할 수 있고 고해상도의 3D 모델을 생성할 수 있다.
FHT를 통해 뇌의 생리학을 연구하는 능력을 조사하기 위해, 형광 포도당 대사 추적자인 XenoLight RediJect 2-Deoxy-D-glucose (2-DG, PerkinElmer, 750 nm excitation)를 쥐의 척수 강내 공간 내로 주입하였다. 1.5 시간의 분포 후, 동물을 희생시키고 뇌 조직을 절제하였고, 샘플을 OCT에서 초저온보전하였다. 현미경절편도(25 미크론 간격)가 통과할 때마다 고해상도의 백색광과 형광 이미지가 얻어졌다.
또한, 뇌실 및 지주막 공간의 해부학을 연구하기 위해, 형광 쌍성 이온성 이온 화합물 ZW800-1 (Curadel, LLC)을 쥐의 뇌척수 내 공간에 주입하였다. 이 화합물은 화학적 성질로 인해 뇌 유조직에 들어가지 않을 것으로 예상된다. 도시된 바와 같이, ZW800∼1 신호는 뇌실 및 지주막 공간에 구속되지만, 뇌 유조직에서는 두드러지게 빠져 있다. 뇌실 및 지주막 공간의 고해상도 3차원 지도를 작성하기 시작할 수 있다.
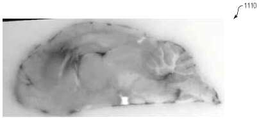
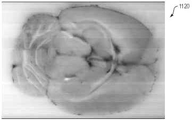
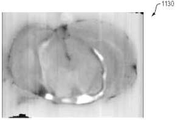
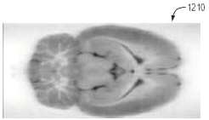
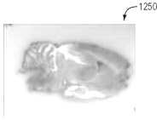
테스트 동안 캡쳐된 다양한 이미지가 도 10A 내지 도 12I에 도시되어 있다. 특히, 도 10A 및 도 10B는 회색으로 착색된 백색광 및 오렌지색/보라색으로 착색된 형광 이미지를 갖는 뇌 조직의 이미지(1000 및 1010)를 도시한다. 도 11A는 최대강도투사(MIP)을 사용하는 FHT 이미지(1100)를 나타낸다. 도 11B∼11D는 각각 시상, 관상 및 횡단 이중 카메라 정적 이미지(1110∼1130)를 나타낸다(예를 들어, 이미지(1110∼1130)은 백색광과 형광 캡쳐의 결합된 이미지들이다). 도 11E∼11F는 각각 듀얼 카메라, MIP 이미지(1140∼1150)를 도시한다.
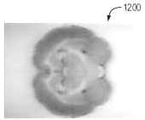
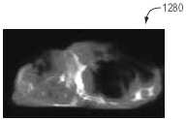
또한, 도 12A 내지 도 12C는 각각 관상면, 축상 및 사선면의 백색광 이미지 (1200~1220)를 도시한다. 또한, 도 12D 내지 12F는 관상, 축상, 및 시상 평면들을 따라 뇌 유조직에 흡수된 2-DG의 형광 이미지(1230~1250)를 도시한다. 마지막으로, 이미지(1260 ~ 1280)은 뇌실 및 지주막 공간에 구속된 형광체 ZW800-1을 나타낸다.
따라서, 이해할 수 있는 바와 같이, FHT는 해부학, 생리학 및 약물/추적자 분포를 생체 내 연구와 함께 또는 독립적인 연구로서 연구하기 위한 다중 스펙트럼, 고해상도 및 시간 효율적인 생체외 도구로서 기능한다.
예 -
수막공간내
투여된
안티센스
올리고핵산의
약동학적 및
약력학적
촬상
안티센스 올리고뉴클레오티드(ASOs)는 이들의 특정 표적화 및 연장된 약리학 적 효과에 기인하여 중추 신경계(CNS) 장애를 치료하기 위한 유망한 약제이다. 중추 신경계 질환 치료제의 개발은 대부분의 약물 분자가 혈액 뇌 장벽(BBB)을 넘어 목표물에 도달할 수 없기 때문에 방해 받고 있다. 척수강 내 (IT) 투여 경로는 BBB를 우회하여 약물을 CNS에 직접 전달하는 솔루션을 제공한다. 그러나, 약동학(PK) 및 약력학(PD)을 결정하는 것은 IT 공간의 해부학적 및 기능적 특성과 전체 조직학적 분자 기술에 의존하는 고유한 과제를 제시한다.
몇몇 양태에서, 영상 접근법은 라디오 및 형광단-분류 ASOs 추적 PK를 사용하는 것이 여기에 개시된다. 본원의 기술의 다른 측면은 수용체-표적화 방사선 추적자를 사용하여 PD의 추적을 가능하게 하기 위해 ASO를 타겟팅하는 신경 수용기를 채용한다. 시험 기간 동안, 이러한 PK/PD 원리는 MALAT1 하우스키핑 유전자와 GABA A 수용체 서브 유닛 GABRA1을 표적으로 하는 2개의 ASO를 사용하여 평가되었다. 125I-MALAT1 ASO를 이용한 동적 SPECT/CT 영상은 요추 IT 주사 후 신경 피질 조직의 광범위한 시간과 선량 의존성 노출을 보였으며 대뇌 피질 구조와 기저핵의 노출이 증가했다. 표지되지 않은 GABRA1 또는 MALAT1 ASO (코호트당 n=4)를 사용하는 투약 연구는 GABRA1 ASO에 특이적인 18F-플루마제닐 섭취의 점진적인 감소를 나타내었고, 그 효과는 기저핵과 비교하여 피질 구조에서 훨씬 더 크게 나타났다. 우리는 18F-플루마제닐 섭취의 감소가 ASO에 의해 생성된 GABRA1 mRNA 및 단백질 감소에 상응한다는 것을 확인했다.
다양한 실시 예들에 따라, 3D-FHT 영상 기술은 18F-플루마제닐에서 입증된 국소 수용체 녹다운과 함께 Cy7-분류된 GABRA1 AS0으로 투여된 IT의 분포 사이의 상관 관계를 입증하기 위해 개발되었다. 이 3D 극조온형광체 촬상 기술은 ASO 치료를 위한 PK/PD 관계의 3D 시각화를 가능하게 하는 생체 내 분자 영상과 생체외 조직학 사이의 가교 역할을 한다.
구체적으로, 테스트 동안, 4 마리의 쥐의 2개 그룹을 MALAT1 또는 GABRA A를 표적으로하는 단일 투여량의 안티센스 올리고핵산(ASO)으로 처리하였다. 상기 쥐들은 베이스 라인(ASO 치료 전날)에서 1시간 동적 18F-플루마제닐 PET 스캔을 받았고, 치료 후 1, 2, 3, 4 주가 경과하였다. 치료의 약동학은 18F-플루마제닐 PET, Cy7-표지 GABRA1 ASO에 의해 입증된 약력학 및 분포가 뒤따른다.
도 13A의 이미지(1300)는 4주 단일 투여 처리 후 4주째의 MALAT1 및 GABRA A ASO 처리군에 대한 곡선(AUC) 이미지의 평균 MIP, 시상면, 관상면 및 횡단면 18F-플루마제닐 PET 면적을 나타낸다. 이미지들은 감퇴-보정된 uCi-min의 유닛들에 대한 공통의 아틀라스 공간에 등록되고 감퇴-보정된 uCi-min의 단위로 스케일된다. 감소된 18F-플루마제닐 섭취는 GABRA A 대 MALAT1 ASO 처리 후에 나타난다.
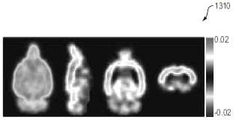
도 13B은 그룹당 N=4 쥐들에 대한 단일 투여량 처리 투여 후 4주째의 MALAT1 및 GABRA A ASO 처리된 그룹 사이의 MIP, 시상, 관상 및 횡단 18F-플루마제닐 PET (AUC) 차이 이미지를 나타내는 이미지(1310)를 도시한다. 대부분의 복셀은 그룹간에 긍정적이거나 변화가 없음을 유의해야 한다.
도 13C는 단일 투여 ASO 처리(시간축 1322)후 베이스 라인 및 1, 2, 3 및 4 주에서의 대뇌 피질에 대한 관심 부피에 대한 18F~플루마제닐 PET (AUC 축 1324)의 그래프(1320)를 도시한다. 피질 섭취는 GABRA A 대 MALAT1 표적 처치를 2, 3, 4 주 동안 유의하게 감소시켰다.
도 13D는 투여 후 1시간에 IT 투여된 Cy7-분류 GABRA1 ASO의 MIP 시상, 관상 및 횡단 3D-FHT 이미지의 이미지(1330)를 도시한다.
도 13E는 투여 후 4일째에 Cy7-분류 GABRA1 ASO를 투여한 IT의 MIP 시상, 관상 및 횡단 3D-FHT 이미지의 영상(1340)을 도시한다.
조직 절편의
클리어링
본원 기술의 실행동안에 주목된 바와 같이, 절단된 조직 절편는 슬라이싱 후, 정전기, 소수성 또는 절편와 블록 사이의 다른 상호 작용으로 인해 나머지 조직 블록에 "달라붙을"수 있다. 따라서, 일부 실시 예들에 있어서, FHT 시스템은 블록에 달라붙을 수 있고 이미지를 흐리게 만들 수 있는 어느 조직을 제거하기 위해서 슬라이싱 사이클의 마지막에 공기와 같은 가스 퍼프 또는 질소와 같은 비-습기 함유가스를 블록면 위로 송풍하는 기구를 더 포함 할 수 있다.
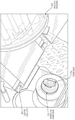
도 14A 내지 도 14C를 참조하면, 다양한 실시 예에 따라, FHT 시스템으로부터 부착된 조직을 제거하는 기구의 예가 도시되어있다. 도시된 바와 같이, 상기 기구는 일반적으로 공기, 질소 또는 아르곤과 같은 가스를 저장하는 가스 실린더 (1402)를 포함할 수 있다. 이해될 수 있는 바와 같이, 임의의 형태의 기체가 조직 시편의 유형, 환경 조건 등에 따라 원하는대로 선택될 수 있다. 예를 들어, 극저온 적용(예 : 동결조직절편기)의 경우, 수증기가 동결되어 가스의 흐름을 막을 수 있으므로 가스가 수증기(즉, 습도)를 가지지 않는 것이 중요하다. 따라서, 이러한 극저온 적용에 있어서, 질소 및 아르곤과 같은 가스가 바람직할 수 있다.
일반적으로, 도 14A에 도시된 바와 같이, 가스 실린더(1402)는 배관 시스템(1404) 및 제어 메커니즘 (1406)을 통해 FHT 시스템에 공압식으로 연결될 수 있다. 특히, 제어기구(1406)는 가스 실린더(1402)로부터 배관 시스템(1404)을 통해 조직 블록의 표면상으로 가스의 흐름을 조절하여 달라 붙은 조직 절편들을 제거하도록 구성될 수 있다. 다시 말해서, 제어기구는 가스 퍼프의 힘을 조절하여 가스가 조직 절편를 블록으로부터 완전히 분리시킬 수 있도록 한다. 마찬가지로, 배관 시스템(1404)은 가스 실린더(1402)로부터 가스를 제어기구(1406)를 통해 조직 블록면으로 운반할 수 있다.
도 14B에 도시 된 바와 같이, 제어 메커니즘(1406)은 다양한 실시 예에서 압력 조절기(1408), 솔레노이드 밸브(1410) 및 제어 전자 장치(1412)를 포함할 수 있다. 일반적으로, 압력 조절기(1408)는 배관 시스템(1404)의 가스 압력의 양을 제어하여, 사용자가 임의의 달라붙은 조직 절편이 배관 시스템(1404)의 노즐을 빠져 나가는 가스에 의해 제거되도록 압력을 조절할 수 있게 한다. 솔레노이드 밸브 (1410)는 배관 시스템(1404)에 연결될 수 있고 배관 시스템(1404)을 통한 가스의 유동을 제어할 수 있다. 예를 들어, 작동 될 때, 조직 시편의 블록면 위로 가스의 퍼프(puff)를 제공하기 위해서, 솔레노이드 밸브(1410)는 튜브 시스템(1404)을 통한 가스 유동을 차단 또는 차단 해제할 수 있다. 일부 실시 예들에 있어서, 도시 된 바와 같이, 제어 전자 장치(1412)는 시스템이 가스 퍼프 및/또는 공급된 가스의 압력을 공급할 때 제어하기 위해 솔레노이드 밸브(1410) 및/또는 압력 조절기 (1408)를 통해 전자 또는 컴퓨터 제어를 제공할 수 있다. 그러한 전자 장치(1412)는 시스템의 작동을 완전히 자동화하거나 사용자가 가스 퍼프를 수동으로 트리거 할 수 있게 한다.
도 14C는 다양한 실시 예에 따른 튜브 시스템(1404)을 보다 상세하게 도시한다. 도시된 바와 같이, 튜브 시스템(1404)은 제어 기구(1406)을 통해 노즐(1416)을 가스 실린더(1402)에 연결시키는 배관(1414)을 포함할 수 있다. 일반적으로, 노즐 (1416)은 조직 시편의 블록면으로부터 적당한 거리에 위치될 수 있으며, 몇몇 실시 예들에 있어서, 가스의 각 퍼프 후에 노즐(1416)이 조직 시편을 계속 향하도록 보장하기 위해서 절개장치(예를 들어, 현미경 절편도 등)에 결합될 수 있다. 예를 들어, 동결조직절편기의 경우에 있어서, 배관(1414) 및 노즐(1416)은 냉동 조직절편기의 온도 제어된 챔버 내에 위치될 수 있으며, 그에 의해 동결된 얼음 블록의 온도로 가스를 냉각시킨다. 이는 가스가 실온에 있을 때 발생하는 조직 블록의 용융을 방지한다.
기준마커
배치
조직 블록에 있는 기준 마커의 정확한 위치조정은 어렵고 시간 소모적인 절차일 수 있다. 기준 마커는 원본 블록과 관련하여 각 절편의 배향을 허용하고 슬라이싱 및 영상 도중에 기하학적 및 색수차 보정을 허용하기 때문에 FHT 애플리케이션에 대하여 중요하다. 일부 실시 예들에 있어서, 그들은 또한 흡수 및 산란에 기인한 광의 감쇠를 교정하고, 따라서 적절한 형광 이미지의 재구성을 위해 필요한 포인트-스플레이 함수의 계산을 허용한다.
도 15A 및 도 15B를 참조하면, 다양한 실시 예에 따라, 조직 블록에 기준 마커를 정확하게 위치시키기 위한 예시적인 장치(1500)가 도시되어 있다. 도시된 바와 같이, 장치(1500)는 조직 시편이 보유되는 조직 챔버(1504)와 결합하도록 구성 될 수 있다. 장치(1500)를 통해 확장하는 것은 기준점(1502)이 배치될 수 있는 임의의 개수의 틈새들일 수 있으며, 이에 의해 기준점(1502)을 조직 시편에 삽입할 수 있다. 장치(1500)는 ABS 플라스틱 등과 같은 임의의 적합한 재료로 형성될 수 있다.
절단 블레이드에 대한 손상 방지
조직학적 슬라이싱 기구의 절단 블레이드에 대한 손상은 FHT 시스템, 특히 자동화 및 반자동 시스템에서 문제가 될 수 있다. 이것은 전형적으로 금속으로 제조된 시편 리테이너(110)가 커팅 블레이드의 경로 내로 움직일 때 발생한다.
도 16을 참조하면, 다색 기준 마커(1502)의 예가 도시된다. 슬라이싱 기구의 절단 블레이드에 대한 손상을 방지하기 위해서, 드라이 엔젤 헤어 파스타(dry Angel hair pasta)의 조각과 같은 기준 마커(1502)는 한쪽 끝을 원래의 색과 다른 색으로 표시하기 위해 화학 용액 또는 페인트 용액에 침지될 수 있다. 예를 들어, 기준마커(1502a)가 회색인 경우, 말단 1∼2 mm가 검은색으로 표시될 수 있다. 또는, 기준마커(1502b)가 검은색인 경우, 오징어 잉크-주입된 파스타와 같은 경우, 말단 1~2mm는 회색 또는 흰색으로 페인트되거나 표백될 수 있다. 그 다음, 기준마커(1502)는 블록 지지체에 가장 가까운 단부가 특정 길이( "안전하지 않은 영역")의 대체 색상을 갖도록 표본 보유기(110) 상에 위치된다.
조직 블록을 슬라이서에 넣은 후에 슬라이싱이 시작되면, 사용자 정의 영상 소프트웨어가 기준마커(1502)의 위치와 색상을 지속적으로 식별할 수 있다. 색상이 기본 색상에서 대체 색상으로 바뀌면 소프트웨어가 모든 슬라이싱을 중지하고, 따라서 블레이드 손상을 방지하게 된다. 부가적인 실시 예들에 있어서, 기준마커의 수직 높이 전체의 컬러는 각 슬라이스의 정확한 깊이가 추정될 수 있도록 선택될 수 있다. 예를 들어, 빨간색에서 주황색, 파란색, 녹색, 노란색으로 매 mm마다 5mm 기준마커 색이 변할 경우, 절단 깊이는 한 색상에서 다른 색상으로 전환을 영상하고 알려진 조직을 기준으로 보간하여 절단 깊이를 추정할 수 있다.
따라서, 본원의 기술은, 챔버 내에서 조직 시편의 블록면상에서 FHT 촬상을 수행하기 위해, 동결조직절편기의 챔버 내에 FHT 촬상 시스템을 장착하는 것을 제공한다. 일부 양태들에 있어서, 시스템의 촬상 요소는 이동 가능한 하우징 내에 위치하여, 챔버 내의 조건들로부터 구성 요소들을 보호하고, 사용자가 원하는대로 동결조직절편기로부터 촬상 구성 요소들을 설치, 위치설정 및 제거할 수 있게 한다. 따라서, 본원의 FHT 시스템은 상당한 수정없이 임의의 수의 기존의 동결조직절편기와 함께 사용하기 위해 쉽게 적합화될 수 있다.
본 발명의 개념에 따른 방법은 비 일시적 컴퓨터 프로그램 제품으로 구현될 수 있다. 하나 이상의 컴퓨터 판독 가능 저장장치(들) 또는 컴퓨터 판독 가능 매체의 임의의 조합이 이용될 수 있다. 컴퓨터 판독 가능 매체는 컴퓨터 판독 가능 저장 매체일 수 있다. 컴퓨터 판독 가능 저장 장치는, 하기의 예로서 제한되는 것은 아니지만, 예를 들어, 전자, 자기, 광학, 전자기 또는 반도체 시스템, 장치, 또는 전술한 것의 임의의 적합한 조합일 수 있다. 컴퓨터 판독가능한 저장 장치의 보다 구체적인 예(비 포괄적 리스트)는 휴대용 컴퓨터 디스켓, 하드 디스크, RAM, 판독전용 메모리(ROM), 소거가능 프로그래밍 가능 판독전용 메모리(EPROM 또는 플래시 메모리), 광섬유, 휴대용 컴팩트 디스크 판독전용 메모리(CD-ROM), 광학 저장 장치, 자기 저장 장치, 또는 전술한 것의 임의의 적절한 조합을 포함할 수 있다. 이 문서의 문맥에서, 컴퓨터 판독가능 저장 장치는 명령 실행 시스템, 또는 장치에 의해 또는 그와 관련하여 사용하기 위한 프로그램을 저장할 수 있는 임의의 유형의 장치 또는 매체일 수 있다. 용어 "컴퓨터 판독 가능 저장 장치" 또는 그 변형은 구리 케이블, 광섬유 또는 무선 전송 매체와 같은 신호 전파 매체를 포함하지 않는다.
컴퓨터 판독 가능 저장 장치 또는 컴퓨터 판독 가능 매체상에 구현된 프로그램 코드는 무선, 유선, 광섬유 케이블, RF 등 또는 이들의 임의의 적절한 조합을 포함하는 임의의 적절한 매체를 사용하여 전송될 수 있다.
본 발명의 양태들에 대한 동작들을 수행하기 위한 컴퓨터 프로그램 코드는 자바, 스몰토크(Smalltalk), C++ 등과 같은 객체 지향 프로그래밍 언어 및 "C"프로그래밍 언어 또는 이와 유사한 프로그래밍 언어와 같은 종래의 절차형 프로그래밍 언어들을 포함하는 하나 이상의 프로그래밍 언어들의 임의의 조합으로 기록될 수 있다. 프로그램 코드는 전체적으로 사용자 컴퓨터에, 부분적으로 사용자의 컴퓨터에, 독립 실행형 소프트웨어 패키지로서, 부분적으로는 사용자 컴퓨터에, 부분적으로는 원격 컴퓨터에 또는 전체적으로 원격 컴퓨터 또는 서버상에서 실행될 수 있다. 후자의 시나리오에서, 원격 컴퓨터는 근거리 통신망(LAN) 또는 광역 네트워크(WAN)를 포함하는 임의의 유형의 네트워크를 통해 사용자의 컴퓨터에 연결될 수 있거나, 외부 컴퓨터 (예를 들어, 인터넷 서비스 제공자를 사용하는 인터넷을 통해)에 연결될 수 있다.
본 발명의 양태들은 본 발명의 실시 예에 따른 방법, 장치 (시스템) 및 컴퓨터 프로그램 제품의 흐름도 및/또는 블록도를 참조하여 여기에서 설명된다. 흐름도 및/또는 블록도에서 각각의 블록, 및 블록도 및/또는 블록도에서 블록들의 조합은, 컴퓨터 프로그램 명령에 의해 구션될 수 있음을 이해할 것이다. 이들 컴퓨터 프로그램 명령어는 흐름도 및/또는 블록도 블록이나 블록들에서 특정된 기능/동작을 구현하기 위한 수단을 생성하기 위해서 컴퓨터 또는 다른 프로그래밍 가능한 데이터 처리 장치들의 하나 이상의 프로세서를 통해서 그러한 명령들을 실행하는 기계장치를 제조하기 위해 하나 이상의 범용 컴퓨터, 특수 목적 컴퓨터 또는 다른 프로그램 가능한 데이터 처리 장치의 하나 이상의 프로세서에 제공될 수 있다.
이러한 컴퓨터 프로그램 명령은 하나 이상의 컴퓨터, 하나 이상의 프로그래밍 가능한 데이터 처리장치들, 또는 하나 이상의 다른 장치들이 특정한 방식으로 기능할 수 있게 하나 이상의 컴퓨터 판독가능한 저장장치들 또는 컴퓨터 판독가능한 매체에 또한 저장될 수 있고, 그리하여 하나 이상의 컴퓨터 판독가능 저장장치 또는 컴퓨터 판독가능 매체에 저장된 그 명령들은 흐름도 및/또는 블록도 블록이나 블록들에서 특정된 기능/동작을 구현하기 위한 명령을 포함하는 제조 물품을 생산하게 된다.
또한, 하나 이상의 컴퓨터들, 하나 이상의 다른 프로그래밍 가능한 데이터 처리 장치, 또는 하나 이상의 다른 장치에서 실행되는 명령들이 플로우 차트 및/또는 블록 다이어그램 블록 또는 블록들에서 특정된 기능/작용을 실행하기 위한 프로세스들을 제공하도록 컴퓨터 프로그램 명령은 하나 이상의 컴퓨터, 하나 이상의 다른 프로그램 가능한 데이터 처리 장치 또는 일련의 동작 단계들이 하나 이상의 컴퓨터에서 수행되게 하는 하나 이상의 다른 장치, 하나 이상의 다른 프로그래밍 가능한 데이터 처리 장치 또는 컴퓨터 실행 프로세스를 생성하기 위한 하나 이상의 다른 장치들 상에 또한 로딩될 수 있다.
본 명세서에서 사용된 용어는 단지 특정 실시 양태를 설명하기 위한 것이며, 본 발명을 제한하려는 것은 아니다. 본원에서 사용되는 바와 같이, 단수 형태 "a", "an" 및 "the"는 문맥상 다르게 지시하지 않는 한 복수 형태를 포함하도록 의도된 것이다. 본 명세서에서 사용되는 경우, 용어 "compries" 및/또는 "comprising"은 명시된 특징, 정수, 단계, 동작, 요소 및/또는 부품의 존재를 나타내지만, 하나 이상의 다른 특징, 정수, 단계, 동작, 요소, 부품 및/또는 이들의 그룹의 존재 또는 추가를 배제하지 않는다는 것이 더 이해될 것이다.
아래의 청구범위에서 모든 수단 또는 단계와 기능 요소의 상응하는 구조, 재료, 작용 및 균등물은 구체적으로 청구되는 다른 청구된 요소와 조합하여 기능을 수행하기 위한 임의의 구조, 재료 또는 작용을 포함한다. 본 발명의 설명은 예시 및 설명의 목적으로 제시되었지만, 개시된 형태로 본 발명을 포괄하거나 또는 제한하고자 의도한 것은 아니다. 본 발명의 범위 및 사상을 벗어남이 없이 많은 수정 및 변형이 이루어질 수 있음은 당업자에게 명백할 것이다. 실시 예들은 본 발명의 원리 및 실제 응용을 가장 잘 설명하고 해당 기술분야의 숙련된 당업자가 고려된 특정 용도에 적합한 다양한 변형 예를 갖는 다양한 실시 예에 대하여 본 발명을 이해할 수 있도록 선택되고 기술되었다.
Claims (20)
- 형광 조직-단층촬영 (FHT) 시스템으로서,
하우징;
상기 하우징 내에 위치한 형광 카메라;
상기 하우징 내에 위치한 백색광 카메라;
상기 하우징 내에 위치한 형광 광원; 및
상기 카메라들 및 상기 형광 광원이 상기 챔버 내에 보유된 조직 시편의 블록면쪽을 향하도록 슬라이싱 장치의 챔버 내에서 상기 하우징을 지지하도록 구성된 서포트 마운트(support mount);
를 포함하는 형광 조직-단층촬영 (FHT) 시스템. - 제 1 항에 있어서, 상기 서포트 마운트는 상기 챔버의 플로어 상에서 제거 가능하게 위치할 수 있는 형광 조직-단층촬영 (FHT) 시스템.
- 제 1 항에 있어서, 프로세스를 실행하도록 구성된 프로세서 및 상기 프로세서에 의해서 실행되는 상기 프로세스를 저장하기 위한 메모리를 포함하는 프로세싱 회로를 더 포함하며, 상기 프로세스는 실행되는 경우에,
상기 챔버 내에 보유된 조직 시편의 블록면의 백색광 이미지를 캡쳐하도록 상기 백색광 카메라를 제어하고;
백색광 및 형광 조명하에서 상기 블록면의 형광 이미지를 캡쳐하도록 상기 형광 카메라를 제어하고;
결합된 이미지를 형성하도록 상기 백색광과 상기 형광 이미지들을 공동-등록하고; 그리고
상기 결합된 이미지를 전자 디스플레이로 제공하도록 작동할 수 있는 형광 조직-단층촬영 (FHT) 시스템. - 제 3 항에 있어서, 상기 프로세스는 실행되는 경우에, 상기 블록면의 백색광과 형광 이미지들을 동시에 캡쳐하고 상기 백색광 및 상기 형광 카메라를 제어하는 형광 조직-단층촬영 (FHT) 시스템.
- 제 1 항에 있어서,
가압된 가스를 저장하는 가스 실린더;
배관을 통해 상기 가스 실린더에 결합되고 상기 조직 시편쪽으로 상기 노즐을 향하게 하기 위해 상기 슬라이싱 장치의 챔버 내에 위치할 수 있는 노즐; 및
상기 노즐을 통해 상기 챔버 내의 조직 시편을 향한 상기 가압된 가스의 흐름을 제어하는 상기 배관에 연결된 제어 기구;
를 더 포함하는 형광 조직-단층촬영 (FHT) 시스템. - 제 1 항에 있어서, 상기 시편 내로의 삽입을 위한 하나 이상의 다색 기준마커를 더 포함하는 형광 조직-단층촬영 (FHT) 시스템.
- 제 1 항에 있어서, 상기 하우징은 휴대 가능하며, 상기 하우징은 사용자가 상기 동결조절절편기 챔버 내에 상기 하우징을 제거 가능하게 위치시킬 수 있게 하는 핸들을 더 포함하는 형광 조직-단층촬영 (FHT) 시스템.
- 제 1 항에 있어서, 상기 슬라이싱 장치는 동결조절절편기(cryomicrotome)를 포함하는 형광 조직-단층촬영 (FHT) 시스템.
- 제 1 항에 있어서,
상기 조직 시편을 보유하도록 구성된 조직 챔버; 및
상기 조직 챔버와 결합하도록 구성된 기준 위치선정 장치 - 상기 기준 위치선정 장치는 상기 조직 챔버 내에 보유된 상기 조직 시편 내로 기준 마커가 삽입될 수 있는 다수의 틈새들을 형성함-;를
더 포함하는 형광 조직-단층촬영 (FHT) 시스템. - 제 1 항에 있어서, 상기 형광 카메라는 상기 조직 표본의 상기 블록면이 형광 광원으로 조사될 때 약 200 nm 내지 1000 nm 범위의 파장에서 상기 조직 시편 내의 형광단의 존재를 검출하도록 구성된 형광 조직-단층촬영 (FHT) 시스템.
- 형광 조직-단층촬영(FHT)을 수행하기 위한 방법으로서,
슬라이싱 장치의 챔버 내에 장착된 촬상 장치에 의해 챔버내에 보유된 조직 시편의 블록면의 백색광 이미지를 캡쳐하는 단계;
상기 촬상 장치에 의해, 백색광 및 형광 조명하에서의 상기 블록면의 형광 이미지를 포착하는 단계;
결합된 이미지를 형성하기 위해 상기 촬상 장치에 의해 상기 백색광 및 형광 이미지를 공동 등록하는 단계; 그리고
상기 결합된 이미지를 상기 촬상 장치에 의해서 전자 디스플레이에 제공하는 단계;
를 포함하는 형광 조직-단층촬영(FHT)을 수행하기 위한 방법. - 제 11 항에 있어서, 상기 백색광 및 형광 이미지들은 상기 촬상 장치에 의해서 동시에 획득되는 형광 조직-단층촬영(FHT)을 수행하기 위한 방법.
- 제 11 항에 있어서, 상기 촬상 장치는 상기 챔버의 플로어와 접촉하는 서포트 마운트를 사용하여 상기 챔버 내에 장착되는 형광 조직-단층촬영(FHT)을 수행하기 위한 방법.
- 제 11 항에 있어서, 상기 백색광 이미지는 상기 촬상 장치의 백색광 카메라를 통해서 캡쳐되고, 상기 형광 이미지는 상기 촬상 장치의 형광 카메라를 통해서 캡쳐되는 형광 조직-단층촬영(FHT)을 수행하기 위한 방법.
- 제 11 항에 있어서, 상기 백색광 조명은 주변 광을 포함하는 형광 조직-단층촬영(FHT)을 수행하기 위한 방법.
- 제 11 항에 있어서,
상기 조직 시편의 제2 블록면을 노출시키기 위해 상기 슬라이싱 장치를 수동으로 작동시키는 단계; 그리고
상기 노출된 제2 블록면의 결합된 백색광 및 형광 이미지를 상기 촬상 장치에 의해서 발생시키는 단계;
를 더 포함하는 형광 조직-단층촬영(FHT)을 수행하기 위한 방법. - 제 11 항에 있어서,
백색광하에서 상기 블록면의 고해상도 이미지를 캡쳐하는 단계; 및
상기 고해상도 이미지를 상기 백색광에 등록하는 단계;
를 포함하는 형광 조직-단층촬영(FHT)을 수행하기 위한 방법. - 제 11 항에 있어서,
상기 촬상 장치에 의해, 낮은 주위 광 조건 하에서 상기 블록면의 제2 형광 이미지를 캡쳐하는 단계; 및
상기 제2 형광 이미지를 상기 백색 조명 및 형광 조명하에 캡쳐된 형광 이미지로 상기 촬상 장치에 의해 등록하는 단계를 포함하는 형광 조직-단층촬영(FHT)을 수행하기 위한 방법. - 형광 조직-단층촬영 (FHT) 시스템으로서,
슬라이싱 장치의 챔버 내에 보유된 조직 시편의 블록면을 영상하는 수단; 및
동결조직절편기의 챔버 내에서 상기 촬상 수단을 지지하기 위한 수단을 포함을 포함하는 형광 조직-단층촬영(FHT) 시스템. - 제 19 항에 있어서, 상기 조직 시편의 상기 블록면으로 가압된 가스의 퍼프(puff)를 제공하기 위한 수단을 포함하는 형광 조직-단층촬영(FHT) 시스템.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562211930P | 2015-08-31 | 2015-08-31 | |
| US62/211,930 | 2015-08-31 | ||
| US15/158,928 US9799113B2 (en) | 2015-05-21 | 2016-05-19 | Multi-spectral three dimensional imaging system and method |
| US15/158,928 | 2016-05-19 | ||
| PCT/US2016/049708 WO2017040671A1 (en) | 2015-08-31 | 2016-08-31 | Fluorescence histo-tomography (fht) systems and methods |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180048586A true KR20180048586A (ko) | 2018-05-10 |
Family
ID=58188254
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187002483A KR20180048586A (ko) | 2015-08-31 | 2016-08-31 | 형광 조직-단층촬영(fht) 시스템 및 방법 |
Country Status (6)
| Country | Link |
|---|---|
| EP (1) | EP3298383A4 (ko) |
| JP (2) | JP6719123B2 (ko) |
| KR (1) | KR20180048586A (ko) |
| AU (1) | AU2016315795C1 (ko) |
| CA (1) | CA2987919A1 (ko) |
| WO (1) | WO2017040671A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20210065695A (ko) * | 2019-11-27 | 2021-06-04 | 울산과학기술원 | 연속 블록면 광간섭 현미경 장치 |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10580130B2 (en) * | 2017-03-24 | 2020-03-03 | Curadel, LLC | Tissue identification by an imaging system using color information |
| US10694117B2 (en) * | 2018-06-07 | 2020-06-23 | Curadel, LLC | Masking approach for imaging multi-peak fluorophores by an imaging system |
| WO2021186803A1 (ja) * | 2020-03-19 | 2021-09-23 | ソニー・オリンパスメディカルソリューションズ株式会社 | 医療用観察システム、制御装置および制御方法 |
| US20220020481A1 (en) | 2020-07-20 | 2022-01-20 | Abbott Laboratories | Digital pass verification systems and methods |
| EP3964817B1 (en) | 2020-09-03 | 2023-01-04 | Inpeco SA | Device and method for the automatic insertion of a reference material during the processing of a biological sample |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH10123054A (ja) * | 1996-10-23 | 1998-05-15 | Kagaku Gijutsu Shinko Jigyodan | 試料観察方法及びその装置 |
| WO2003016878A2 (de) * | 2001-08-09 | 2003-02-27 | Biocam Gmbh | System für die fluoreszenzdiagnostik |
| JP2006010620A (ja) * | 2004-06-29 | 2006-01-12 | Canon Inc | 顕微鏡観察用断面試料の作成方法、およびウルトラミクロトーム |
| US7507575B2 (en) * | 2005-04-01 | 2009-03-24 | 3M Innovative Properties Company | Multiplex fluorescence detection device having removable optical modules |
| DE102005045961B4 (de) * | 2005-09-26 | 2018-11-15 | Siemens Healthcare Gmbh | Verfahren und Vorrichtung zur Darstellung eines einen Fluoreszenzfarbstoff enthaltenden Gewebes |
| US7831075B2 (en) * | 2005-10-20 | 2010-11-09 | Case Western Reserve University | Imaging system |
| KR100853655B1 (ko) * | 2006-12-15 | 2008-08-25 | 한국전기연구원 | 피부 질환의 광학 진단 및 치료를 위한 장치, 광원 시스템 및 장치의 이용방법 |
| US20090236541A1 (en) * | 2008-03-24 | 2009-09-24 | General Electric Company | System and Methods for Optical Imaging |
| WO2010042217A1 (en) * | 2008-10-09 | 2010-04-15 | Sti Medical Systems, Llc | Process for preserving three dimensional orientation to allow registering histopathological diagnoses of tissue |
| US8747331B2 (en) * | 2009-06-23 | 2014-06-10 | Hologic, Inc. | Variable angle guide holder for a biopsy guide plug |
| JP5564654B2 (ja) * | 2010-05-31 | 2014-07-30 | 岩崎電気株式会社 | Led照射装置 |
| US20140135601A1 (en) * | 2012-11-09 | 2014-05-15 | Kestrel Labs, Inc. | User replaceable optical subsystem for laser-based photoplethysmography |
| BR112015020782A2 (pt) * | 2013-03-15 | 2017-10-10 | Univ Cornell | nanopartículas à base de sílica multimodal |
| WO2014176375A2 (en) * | 2013-04-23 | 2014-10-30 | Cedars-Sinai Medical Center | Systems and methods for recording simultaneously visible light image and infrared light image from fluorophores |
-
2016
- 2016-08-31 AU AU2016315795A patent/AU2016315795C1/en active Active
- 2016-08-31 KR KR1020187002483A patent/KR20180048586A/ko not_active Application Discontinuation
- 2016-08-31 EP EP16842910.8A patent/EP3298383A4/en active Pending
- 2016-08-31 WO PCT/US2016/049708 patent/WO2017040671A1/en unknown
- 2016-08-31 CA CA2987919A patent/CA2987919A1/en active Pending
- 2016-08-31 JP JP2018530666A patent/JP6719123B2/ja active Active
-
2020
- 2020-06-08 JP JP2020099152A patent/JP7093086B2/ja active Active
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20210065695A (ko) * | 2019-11-27 | 2021-06-04 | 울산과학기술원 | 연속 블록면 광간섭 현미경 장치 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3298383A4 (en) | 2019-01-16 |
| JP7093086B2 (ja) | 2022-06-29 |
| CA2987919A1 (en) | 2017-03-09 |
| AU2016315795C1 (en) | 2022-03-10 |
| AU2016315795A1 (en) | 2017-12-14 |
| JP2020169999A (ja) | 2020-10-15 |
| AU2016315795B2 (en) | 2021-09-09 |
| EP3298383A1 (en) | 2018-03-28 |
| WO2017040671A1 (en) | 2017-03-09 |
| JP6719123B2 (ja) | 2020-07-08 |
| JP2018534584A (ja) | 2018-11-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20180048586A (ko) | 형광 조직-단층촬영(fht) 시스템 및 방법 | |
| US11385222B2 (en) | Fluorescence histo-tomography (FHT) systems and methods | |
| US9964489B2 (en) | System and method for controlling depth of imaging in tissues using fluorescence microscopy under ultraviolet excitation following staining with fluorescing agents | |
| EP3194937B1 (en) | Method for controlling depth of imaging in tissues using fluorescence microscopy under ultraviolet excitation following staining with fluorescing agents | |
| ES2772073T3 (es) | Microscopía confocal rápida para apoyar procedimientos quirúrgicos | |
| US8867803B2 (en) | Optical projection tomography microscopy (OPTM) for large specimen sizes | |
| WO2010056945A2 (en) | Methods and systems for tissue processing and imaging | |
| WO2018175565A1 (en) | System and method for controlling depth of imaging in tissues using fluorescence microscopy under ultraviolet excitation following staining with fluorescing agents | |
| US20210149174A1 (en) | Histology-grade three-dimensional imaging of tissue using microscopy with ultraviolet surface excitation | |
| US20130324846A1 (en) | Devices and methods for optical pathology | |
| Anderson et al. | 3-D imaging mass spectrometry of protein distributions in mouse Neurofibromatosis 1 (NF1)-associated optic glioma | |
| Jiang et al. | Label-free imaging of brain and brain tumor specimens with combined two-photon excited fluorescence and second harmonic generation microscopy | |
| CN111095074A (zh) | 3轴侧视共聚焦荧光显微内镜 | |
| Kilin et al. | Health state dependent multiphoton induced autofluorescence in human 3D in vitro lung cancer model | |
| Xu et al. | Nanofluorophore assisted fluorescence image-guided cancer surgery | |
| Miao et al. | Multimodal 3D imaging of cells and tissue, bridging the gap between clinical and research microscopy | |
| Chen | Optimizing Optical-sectioning Microscopy Techniques for Diverse Biomedical Applications | |
| Darrell et al. | Maximum likelihood reconstruction for fluorescence optical projection tomography | |
| Matsuda et al. | Microscopic resolution imaging and proteomics correlation at histogeographically identical location: point by point correlation between ex vivo tissue imaging with high field MRI and multiplex tissue immunoblotting for proteomics profiling | |
| Sarantopoulos et al. | Imaging the bio-distribution of molecular probes using multispectral cryoslicing imaging |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |