KR20170093178A - 전구 세포를 사용한 안구 질환의 치료 - Google Patents
전구 세포를 사용한 안구 질환의 치료 Download PDFInfo
- Publication number
- KR20170093178A KR20170093178A KR1020177018057A KR20177018057A KR20170093178A KR 20170093178 A KR20170093178 A KR 20170093178A KR 1020177018057 A KR1020177018057 A KR 1020177018057A KR 20177018057 A KR20177018057 A KR 20177018057A KR 20170093178 A KR20170093178 A KR 20170093178A
- Authority
- KR
- South Korea
- Prior art keywords
- cells
- cell
- derived
- population
- tsp
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/48—Reproductive organs
- A61K35/51—Umbilical cord; Umbilical cord blood; Umbilical stem cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
- A61K9/0024—Solid, semi-solid or solidifying implants, which are implanted or injected in body tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
- A61K9/0051—Ocular inserts, ocular implants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0603—Embryonic cells ; Embryoid bodies
- C12N5/0605—Cells from extra-embryonic tissues, e.g. placenta, amnion, yolk sac, Wharton's jelly
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0618—Cells of the nervous system
- C12N5/062—Sensory transducers, e.g. photoreceptors; Sensory neurons, e.g. for hearing, taste, smell, pH, touch, temperature, pain
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2502/00—Coculture with; Conditioned medium produced by
- C12N2502/02—Coculture with; Conditioned medium produced by embryonic cells
- C12N2502/025—Coculture with; Conditioned medium produced by embryonic cells extra-embryonic cells, e.g. amniotic epithelium, placental cells, Wharton's jelly
-
- Y10S514/912—
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Biotechnology (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Developmental Biology & Embryology (AREA)
- Cell Biology (AREA)
- Genetics & Genomics (AREA)
- Wood Science & Technology (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Reproductive Health (AREA)
- Biochemistry (AREA)
- Gynecology & Obstetrics (AREA)
- Microbiology (AREA)
- Ophthalmology & Optometry (AREA)
- Neurology (AREA)
- General Engineering & Computer Science (AREA)
- Neurosurgery (AREA)
- Virology (AREA)
- Immunology (AREA)
- Hematology (AREA)
- Pregnancy & Childbirth (AREA)
- Physics & Mathematics (AREA)
- Acoustics & Sound (AREA)
- Analytical Chemistry (AREA)
- Dermatology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
산후 유래 세포와 같은 전구 세포 및 이러한 세포로부터의 컨디셔닝된 배지를 사용하여 안과 질병을 치료하고, 기능성 뉴런 시냅스의 발생을 촉진하고, 뉴런 증생을 개선시키는 방법 및 조성물이 개시된다. 또한, 시냅스 형성 및 뉴런 성장을 촉진하는, 세포에 의해 분비된 영양 인자 및 다른 작용제가 개시된다.
Description
관련 출원의 상호 참조
본 출원은 2014년 12월 5일자로 출원된 미국 가출원 제62/088,429호, 2015년 2월 27일자로 출원된 미국 가출원 제62/126,370호 및 2015년 9월 18일자로 출원된 미국 가출원 제62/220,873호의 이익을 주장하고, 이들 각각의 전체 내용은 전체적으로 본 명세서에 참고로 포함된다.
기술분야
본 발명은 안과 질병 및 장애, 특히 안구 질환, 예를 들어 망막 변성 질환에 대한 세포 기반 요법 또는 재생 요법의 분야에 관한 것이다. 본 발명은 전구 세포, 예를 들어 제대 조직 유래 세포, 태반 조직 유래 세포 및 이러한 세포로부터 제조된 컨디셔닝된 배지(conditioned medium)를 사용하는 안구 세포 및 조직의 재생 또는 수복을 위한 방법 및 조성물을 제공한다.
신체의 복잡하고 민감한 기관으로서, 눈은 정상적으로 기능하는 이의 능력에 영향을 주는 많은 질병 및 다른 유해한 질환을 경험할 수 있다. 이들 질환 중 대부분은 특정 안구 세포 및 이러한 세포로 이루어진 조직의 손상 또는 변성과 관련된다. 일례로서, 시신경 및 망막의 질병과 변성 질환은 전 세계적으로 실명의 주된 원인이다. 각막, 수정체 및 관련 안구 조직의 손상 또는 변성은 전 세계적으로 시력 상실의 다른 유의한 원인을 나타낸다.
망막은 세포와 돌기가 번갈아 존재하는 7개의 층을 함유하여 광 신호를 신경 신호로 변환시킨다. 망막 광수용체와 인접 망막 색소 상피 (RPE)는, 많은 장애에서 유전자 돌연변이 또는 환경 조건 (연령을 포함함)으로 인해 불균형을 이루게 되는, 기능적 단위를 형성한다. 이것은 아폽토시스(apoptosis) 또는 2차 변성을 통해 광수용체의 손실을 초래하며, 이는 시력의 점진적인 악화로 그리고 일부의 경우 실명으로 이어진다 (개관에 대해서는, 예를 들어 문헌[Lund, R. D. et al., Progress in Retinal and Eye Research, 2001; 20:415-449] 참조). 이러한 패턴에 속하는 두 부류의 안구 장애는 연령 관련 황반 변성 (AMD)과 망막색소변성 (RP)이다.
AMD는 미국에서 연령이 50세 이상인 사람들의 시력 상실의 가장 통상적인 원인이며, 이의 유병률은 연령이 높아짐에 따라 증가한다. AMD의 주요 장애는 RPE 기능장애와 부르크막(Bruch's membrane)의 변화로 인한 것으로 보이며, 다른 것들 중에서 지질 침착, 단백질 가교결합 및 영양소에 대한 감소된 투과성을 특징으로 한다 (상기 문헌[Lund et al., 2001] 참조). 유전자 구성, 연령, 영양, 흡연 및 일광 노출을 포함하는 다양한 요소가 황변 변성에 기여할 수 있다. 비삼출성 또는 "건성" 형태의 AMD가 AMD 사례의 90%를 차지하고; 나머지 10%는 삼출성-신생혈관성 형태 ("습성" AMD)이다. 건성 AMD 환자의 경우, 망막 색소 상피 (RPE)가 점차 소실되어, 국한된 위축 부위를 초래한다. RPE의 소실에 이어 광수용체 손실이 뒤따르므로, 영향받은 망막 부위는 시각 기능이 거의 없거나 전혀 없다.
AMD에 대한 현재의 요법은, 예를 들어 레이저 요법 및 약리학적 개입과 같은 절차를 포함한다. 열 에너지를 전달함으로써, 레이저 빔은 황반 아래의 누수 혈관을 파괴하여 시력 상실 속도를 둔화시킨다. 레이저 요법의 단점은 빔에 의해 전달되는 높은 열 에너지가 또한 근처의 건강한 조직을 파괴시킨다는 것이다. 문헌[Neuroscience 4th edition, (Purves, D, et al. 2008)]은 "현재 건성 AMD에 대한 치료법은 없다"고 언급한다.
RPE 이식은 인간의 경우 성공적이지 못하였다. 예를 들어, 문헌[Zarbin, M, 2003]은 하기와 같이 언급한다: "정상적인 노화에 따라, 인간 브루크막은 특히 황반하 영역에서 많은 변화 (예를 들어, 두께 증가, ECM과 지질의 침착, 단백질의 가교결합, 후기 당화 최종 생성물(advanced glycation end product)의 비효소적 형성)를 겪는다. AMD로 인한 이러한 변화 및 추가 변화는 ECM 리간드 (예를 들어, 라미닌, 피브로넥틴 및 콜라겐 IV)의 생체이용률을 감소시키고 AMD에 걸린 눈에서 RPE 세포의 극히 불량한 생존율을 야기할 수 있다. 따라서, 인간 RPE 세포는 이러한 ECM 분자에 부착하는 데 필요한 인테그린을 발현하지만, 노화된 황반하 인간 브루크막에서 RPE 세포 생존율은 손상된다." (문헌[Zarbin, MA, Trans Am Ophthalmol Soc, 2003; 101:493-514]).
망막색소변성은 주로 유전병으로 간주되며, 100개가 넘는 돌연변이가 광수용체 손실과 관련된다 (상기 문헌[Lund et al., 2001] 참조). 대부분의 돌연변이가 광수용체를 표적으로 하지만, 일부는 RPE 세포에 직접 영향을 미친다. 이들 돌연변이는 함께, 광수용체와 RPE 세포 사이의 분자 트래피킹(molecular trafficking) 및 광신호전달과 같은 과정에 영향을 미친다.
다른 덜 통상적인, 그러나 그럼에도 불구하고 쇠약성 망막병증(debilitating retinopathy)이 또한 시력 상실 및 실명으로 이어지는 진행성 세포 변성을 포함할 수 있다. 이것은, 예를 들어 당뇨 망막병증 및 맥락막 신생혈관막 (CNVM)을 포함한다.
세포와 조직 수복 및 재생을 위한 줄기 세포 기반 요법의 출현은 다수의 전술한 세포 변성 병증 및 다른 망막 질환에 대한 유망한 치료법을 제공한다. 줄기 세포는 다양한 성숙 세포 계통을 생성하기 위해 자가 재생(self-renewal) 및 분화가 가능하다. 이러한 세포의 이식은 표적 조직을 재구성하는 임상 도구로 이용됨으로써 생리학적 및 해부학적 기능성을 수복할 수 있다. 줄기 세포 기술의 적용은 광범위하며, 조직 공학(tissue engineering), 유전자 요법 전달, 및 세포 치료법, 즉, 생물치료제를 생성 또는 함유하는 외인적으로 공급되는 생세포 또는 세포 성분을 통한 표적 위치로의 이러한 생물치료제의 전달을 포함한다. (개관에 대해서는, 예를 들어 문헌[Tresco, P. A. et al., Advanced Drug Delivery Reviews, 2000, 42: 2-37]을 참조).
세포 요법은 신경학적 장애의 치료에 큰 가능성을 나타낸다. 이식된 세포는 손상된 세포를 대체하거나 신경 건강과 재생을 향상시키는 영양 인자(trophic factor)를 제공함으로써 회복 및 신경보호를 촉진하는 것으로 여겨진다. (문헌[Doeppner TR, Hermann DM, Frontiers in Cellular Neuroscience,. 2014; 8:357]; 문헌[Atala A, Lancet, 2014/2015; 385 (9967):487-488]; 문헌[ Popovich PG, Cell, 2012;150:1105-1106]; 문헌[Lindvall O, et al., Journal of Clinical Investigation, 2010;120:29-40]; 문헌[Rao MS, Mechanisms of Aging Development, 2001; 122:713-734]). 뉴런 돌기의 위축은 많은 신경학적 장애에서 보편적인 사건이며; 따라서, 신경돌기 증생(outgrowth)을 촉발할 수 있는 인자를 제공하는 것은 이러한 질병에서 치료 효과를 제공할 수 있다. 구체적으로는, 인간 제대 조직 유래 세포 (hUTC)는 뉴런 손실에 대한 유망한 치료법일 수 있다. 인간 제대는 윤리적인 우려 없이 산후 제대로부터 수집될 수 있고, 시험관내(in vitro) 배양 동안 핵형 안정성을 갖는 것으로 나타나며, 증식될 수 있다 (문헌[Lund et al., Stem Cells, 2007; 25 (3):602-61]). hUTC 투여의 치료 가능성은 다양한 동물 질병 모델에서 입증되었다. 예를 들어, 뇌졸중 (문헌[Moore et al., Somatosensory and Motor Research, 2013; 30:185-196]; 문헌[Zhang L, et al., Brain Research, 2012; 1489:104-112]; 문헌[Zhang L, et al., Cell transplantation, 2013;22:1569-1576]; 문헌[Jiang Q, et al., PloS One, 2012; 7 (8):e42845]; 문헌[Zhang L, et al., Stroke; 2011; 42:1437-1444]); 및 망막 변성 (상기 문헌[Lund et al., Stem Cells, 2007])의 동물 모델로의 hUTC의 전달은 이러한 세포가 기능 회복을 향상시키고 진행성 변성과 세포 사멸로부터 뉴런을 보호한다는 것을 나타내었다.
최근, 산후 유래 세포는 망막 변성을 완화(amelioration)시키는 것으로 밝혀졌다 (미국 특허 출원 공개 제2010/0272803호). RCS (Royal College of Surgeons) 래트는 티로신 수용체 키나제 (Mertk) 결함을 나타내며, 이는 외분절(outer segment) 식세포작용에 영향을 미쳐서 광수용체 세포 사멸을 초래한다. (문헌[Feng W. et al., J Biol Chem., 2002, 10: 277 (19): 17016-17022]). RCS 래트의 망막하 공간으로의 망막 색소 상피 (RPE) 세포의 이식은 광수용체 손실의 진행을 제한하고 시각 기능을 보존하는 것으로 나타났다. 또한, 산후 유래 세포는 광수용체 구조(rescue)를 촉진하고 이에 따라 RCS 모델에서 광수용체를 보존하는 데 사용될 수 있는 것으로 나타났다. (미국 특허 출원 공개 제2010/0272803호). RCS 래트의 눈으로의 인간 제대 조직 유래 세포 (hUTC)의 망막하 주입은 시력을 개선시키고 망막 변성을 완화시켰다. 더욱이, hUTC로부터 유래된 컨디셔닝된 배지 (CM)로의 처리는 시험관내에서 이영양성 RPE 세포에서 ROS의 식세포작용을 회복시켰다. (미국 특허 출원 공개 제2010/0272803호). 시력을 향상시키는 hUTC의 메커니즘은 본 명세서에서 추가로 조사된다.
본 발명은 안과 질병 및 장애에 대한 세포 기반 요법 또는 재생 요법에 적용가능한 조성물 및 방법을 제공한다. 특히, 본 발명은 산후 유래 세포와 같은 전구 세포 및 이러한 세포로부터 생성된 컨디셔닝된 배지를 사용하여, 안구 세포 및 조직의 재생 또는 수복을 포함하는 안과 질병 및 질환을 치료하는 방법, 및 약제학적 조성물을 포함하는 조성물을 특징으로 한다. 산후 유래 세포는 제대 조직 유래 세포 또는 태반 조직 유래 세포일 수 있다.
본 발명의 일 태양은 전구 세포 집단 또는 전구 세포 집단으로부터 제조된 컨디셔닝된 배지를 투여하는 단계를 포함하는 뉴런 세포에서 시냅스생성을 유도하여 안과 질병을 치료하는 방법이다. 본 발명의 실시 형태에서, 뉴런 세포 또는 뉴런은 망막 뉴런, 예를 들어 망막 신경절 세포, 광수용체 (간체 및 추체), 망막 무축삭 세포(retina amacrine cell), 수평 세포 또는 양극 세포이다. 본 발명의 특정 실시 형태에서, 전구 세포는 산후 유래 세포이다. 본 발명의 실시 형태에서, 산후 유래 세포는 혈액이 실질적으로 없는 인간 제대 조직 또는 태반 조직으로부터 단리된다. 추가의 실시 형태에서, 전구 세포는 영양 인자를 분비한다. 실시 형태에서, 컨디셔닝된 배지는 전구 세포 집단에 의해 분비된 영양 인자를 함유한다. 실시 형태에서, 산후 유래 세포와 같은 전구 세포에 의해 분비된 영양 인자는 시냅스생성을 유도한다. 실시 형태에서, 영양 인자는 트롬보스폰딘-1, 트롬보스폰딘-2 및 트롬보스폰딘-4로부터 선택된다.
본 발명의 태양에서, 뉴런 세포에서 신경돌기 증생을 유도하여 안과 질병을 치료하는 방법은 전구 세포 집단 또는 전구 세포 집단으로부터 제조된 컨디셔닝된 배지를 투여하는 단계를 포함한다. 본 발명의 실시 형태에서, 뉴런 세포 또는 뉴런은 망막 뉴런, 예를 들어 망막 신경절 세포, 광수용체 (간체 및 추체), 망막 무축삭 세포, 수평 세포 또는 양극 세포이다. 본 발명의 특정 실시 형태에서, 전구 세포는 산후 유래 세포이다. 본 발명의 실시 형태에서, 산후 유래 세포는 혈액이 실질적으로 없는 인간 제대 조직 또는 태반 조직으로부터 단리된다. 추가의 실시 형태에서, 전구 세포는 영양 인자를 분비한다. 실시 형태에서, 컨디셔닝된 배지는 전구 세포 집단에 의해 분비된 영양 인자를 함유한다. 실시 형태에서, 산후 유래 세포와 같은 전구 세포에 의해 분비된 영양 인자는 시냅스생성을 유도한다. 실시 형태에서, 영양 인자는 트롬보스폰딘-1, 트롬보스폰딘-2 및 트롬보스폰딘-4로부터 선택된다.
본 발명의 추가의 태양은 전구 세포 집단 또는 전구 세포 집단으로부터 제조된 컨디셔닝된 배지를 투여하는 단계를 포함하는 신경돌기 증생을 유도하는 방법이다. 본 발명의 실시 형태에서, 뉴런 세포 (뉴런)는 망막 뉴런, 예를 들어 망막 신경절 세포, 광수용체 (간체 및 추체), 망막 무축삭 세포, 수평 세포 또는 양극 세포이다. 본 발명의 실시 형태에서, 전구 세포는 산후 유래 세포이다. 실시 형태에서, 산후 유래 세포는 혈액이 실질적으로 없는 인간 제대 조직 또는 태반 조직으로부터 단리된다. 추가의 실시 형태에서, 전구 세포는 영양 인자를 분비한다. 실시 형태에서, 컨디셔닝된 배지는 전구 세포 집단에 의해 분비된 영양 인자를 함유한다. 실시 형태에서, 산후 유래 세포와 같은 전구 세포에 의해 분비된 영양 인자는 신경돌기 증생을 유도한다. 추가의 실시 형태에서, 전구 세포에 의해 분비된 영양 인자는 트롬보스폰딘-1, 트롬보스폰딘-2 및 트롬보스폰딘-4로부터 선택된다.
본 발명의 다른 실시 형태는 전구 세포 집단 또는 전구 세포 집단으로부터 제조된 컨디셔닝된 배지를 투여하는 단계를 포함하는 망막 뉴런에서 기능성 시냅스를 발생시키는 방법이다. 본 발명의 실시 형태에서, 망막 뉴런은 망막 신경절 세포, 광수용체 (간체 및 추체), 망막 무축삭 세포, 수평 세포 또는 양극 세포이고, 전구 세포는 산후 유래 세포이다. 실시 형태에서, 산후 유래 세포는 혈액이 실질적으로 없는 인간 제대 조직 또는 태반 조직으로부터 단리된다. 추가의 실시 형태에서, 전구 세포는 영양 인자를 분비한다. 실시 형태에서, 컨디셔닝된 배지는 전구 세포 집단에 의해 분비된 영양 인자를 함유한다. 실시 형태에서, 산후 유래 세포와 같은 전구 세포에 의해 분비된 영양 인자는 신경돌기 증생을 유도한다. 추가의 실시 형태에서, 전구 세포에 의해 분비된 영양 인자는 트롬보스폰딘-1, 트롬보스폰딘-2 및 트롬보스폰딘-4로부터 선택된다.
본 명세서에서의 본 발명의 실시 형태에서, 전구 세포, 예를 들어 산후 유래 세포의 세포 집단으로부터 제조된 컨디셔닝된 배지는 세포 집단에 의해 분비된 영양 인자를 함유한다. 세포에 의해 분비된 이러한 영양 인자는 트롬보스폰딘-1, 트롬보스폰딘-2 및 트롬보스폰딘-4로부터 선택된다. 산후 유래 세포는 제대 조직 유래 세포 (UTC) 또는 태반 조직 유래 세포 (PDC)이다.
일 실시 형태에서, 전구 세포는 망막 뉴런에서 기능성 시냅스의 발생을 촉진한다. 다른 실시 형태에서, 전구 세포에 의해 분비된 영양 인자는 뉴런에서 기능성 시냅스의 발생을 촉진한다. 특정 실시 형태에서, 영양 인자는 트롬보스폰딘-1, 트롬보스폰딘-2 및 트롬보스폰딘-4로부터 선택된다. 또 다른 실시 형태에서, 전구 세포 집단은 뉴런 세포의 성장을 지원한다.
추가의 실시 형태에서, 전구 세포 집단으로부터 제조된 컨디셔닝된 배지는 뉴런 세포의 성장을 지원한다. 본 발명의 실시 형태에서, 상기 기술된 전구 세포 집단으로부터 제조된 컨디셔닝된 배지는 그 세포 집단에 의해 분비된 영양 인자를 함유한다. 특정 실시 형태에서, 영양 인자는 트롬보스폰딘-1, 트롬보스폰딘-2 및 트롬보스폰딘-4로부터 선택된다.
본 발명의 다른 태양은 피검자에게 시냅스 발생을 촉진하기에 효과적인 양의 컨디셔닝된 배지를 투여하는 단계를 포함하는 망막 변성에서 시냅스의 발생을 촉진하는 방법을 특징으로 한다. 본 발명의 실시 형태에서, 컨디셔닝된 배지는 산후 유래 세포 집단으로부터 제조된다. 특정 실시 형태에서, 산후 유래 세포는 혈액이 실질적으로 없는 인간 제대 조직 또는 태반 조직으로부터 단리된다. 다른 실시 형태에서와 같이, 컨디셔닝된 배지는 세포 집단에 의해 분비된 영양 인자를 함유한다. 세포에 의해 분비된 이러한 영양 인자는 트롬보스폰딘-1, 트롬보스폰딘-2 및 트롬보스폰딘-4로부터 선택된다.
본 발명의 실시 형태에서, 산후 유래 세포는 혈액이 실질적으로 없는 인간 제대 조직 또는 태반 조직으로부터 유래된다. 실시 형태에서, 세포는 배양 중 증식가능하고, 신경 표현형의 세포로 분화될 가능성을 가지며; 세포는 성장을 위해 L-발린을 필요로 하고, 적어도 약 5% 산소에서 성장 가능하다. 세포는 하기의 특징 중 하나 이상을 추가로 포함한다: (a) 배양 중 적어도 약 40회의 배가(doubling) 가능성; (b) 젤라틴, 라미닌, 콜라겐, 폴리오미틴, 비트로넥틴 또는 피브로넥틴의 코팅을 포함하는 코팅된 조직 배양 용기 또는 코팅되지 않은 조직 배양 용기에서의 부착 및 증식; (c) 조직 인자, 비멘틴(vimentin) 및 알파-평활근 액틴 중 적어도 하나의 생성; (d) CD10, CD13, CD44, CD73, CD90, PDGFr-알파, PD-L2 및 HLA-A,B,C 중 적어도 하나의 생성; (e) 유세포 분석법에 의해 검출 시, CD31, CD34, CD45, CD80, CD86, CD117, CD141, CD178, B7-H2, HLA-G 및 HLA-DR,DP,DQ 중 적어도 하나의 생성의 결여; (f) 섬유아세포, 중간엽 줄기 세포 또는 장골능(iliac crest) 골수 세포인 인간 세포에 비해, 하기의 것을 인코딩하는 유전자 중 적어도 하나에 대해 증가된 유전자의 발현: 인터류킨 8; 레티큘론 1; 케모카인 (C--X--C 모티프) 리간드 1 (흑색종 성장 자극 활성, 알파); 케모카인 (C--X--C 모티프) 리간드 6 (과립구 주화성 단백질 2); 케모카인 (C--X--C 모티프) 리간드 3; 종양 괴사 인자, 알파 유도 단백질 3; C형 렉틴 수퍼패밀리 구성원 2; 빌름스 종양(Wilms tumor) 1; 알데하이드 데하이드로게나제 1 패밀리 구성원 A2; 레닌; 산화 저밀도 지질단백질 수용체 1; 호모 사피엔스(Homo sapiens) 클론 IMAGE:4179671; 단백질 키나제 C 제타; 가상 단백질 DKFZp564F013; 난소암 하향조절(downregulated in ovarian cancer) 1; 및 클론 DKFZp547k1113으로부터의 호모 사피엔스 유전자; (g) 섬유아세포, 중간엽 줄기 세포 또는 장골능 골수 세포인 인간 세포에 비해, 하기의 것을 인코딩하는 유전자 중 적어도 하나에 대해 감소된 유전자의 발현: 쇼트 스태처 호메오박스(short stature homeobox) 2; 열충격 27 kDa 단백질 2; 케모카인 (C--X--C 모티프) 리간드 12 (간질 세포 유래 인자 1) 엘라스틴 (판상부대동맥협착증, 윌리암스-보이렌 증후군(Williams-Beuren syndrome)); 호모 사피엔스 mRNA; cDNA DKFZp586M2022 (클론 DKFZp586M2022 유래); 중간엽 호메오박스 2 (성장 정지 특이적 호메오박스); 사인 오쿨리스 호메오박스 호모로그 1 (초파리(Drosophila)); 크리스탈린(crystallin), 알파 B; DAAM 2 (형태발생의 Dsh 관련 활성인자(dishevelled associated activator of morphogenesis) 2); DKFZP586B2420 단백질; 시밀러 투 뉴랄린(similar to neuralin) 1; 테트라넥틴 (플라스미노겐 결합 단백질); src 호몰로지 3 (src homology three, SH3) 및 시스테인 풍부 도메인; 콜레스테롤 25-하이드록실라제; runt-관련 전사 인자 3; 인터류킨 11 수용체, 알파; 프로콜라겐 C-엔도펩티다제 인핸서 (enhancer); 프리즐드 호모로그(frizzled homolog) 7 (초파리); 가상 유전자 BC008967; 콜라겐, 제VIII형, 알파 1; 테나신 C (헥사브라키온); 이로쿼이(iroquois) 호메오박스 단백질 5; 헤파에스틴; 인테그린, 베타 8; 시냅스 소포 당단백질 2; 신경아세포종, 종양 형성 억제 1; 인슐린 유사 성장 인자 결합 단백질 2, 36 kDa; 호모 사피엔스 cDNA FLJ12280 fis, 클론 MAMMA1001744; 사이토카인 수용체 유사 인자 1; 칼륨 중간체/작은 전도도의 칼슘 활성화 채널, 서브패밀리 N, 구성원 4; 인테그린, 베타 7; PDZ 결합 모티프를 갖는 전사 보조 활성화 인자 (T AZ); 사인 오쿨리스 호메오박스 호모로그 2 (초파리); KIAA1034 단백질; 소포 관련 막 단백질 5 (미오브레빈); EGF 함유 피불린 유사 세포외 매트릭스 단백질 1; 초기 성장 반응 3; 디스탈-레스 호메오박스(distal-less homeo box) 5; 가상 단백질 FLJ20373; 알도-케토 리덕타제 패밀리 1, 구성원 C3 (3-알파 하이드록시스테로이드 데하이드로게나제, 제II형); 바이글리칸; PDZ 결합 모티프를 갖는 전사 보조 활성화 인자 (TAZ); 피브로넥틴 1; 프로엔케팔린; 인테그린, 베타 유사 1 (EGF 유사 반복 도메인을 포함함); 호모 사피엔스 mRNA 전장 인서트 cDNA 클론 EUROIMAGE 1968422; EphA3; KIAA0367 단백질; 나트륨이뇨 펩티드 수용체 C/구아닐레이트 사이클라제 C (심방 나트륨이뇨 펩티드 수용체 C); 가상 단백질 FLJ14054; 호모 사피엔스 mRNA; cDNA DKFZp564B222 (클론 DKFZp564B222 유래); BCL2/아데노바이러스 E1B 19 kDa 상호작용 단백질 3 유사; AE 결합 단백질 1; 사이토크롬 c 옥시다제 서브유닛 VIIa 폴리펩티드 1 (근육); 시밀러 투 뉴랄린 1; B 세포 전좌 유전자 1; 가상 단백질 FLJ23191; 및 DKFZp586L151; 및 (h) hTERT 또는 텔로머라제의 발현의 결여. 일 실시 형태에서, 제대 조직 유래 세포는 하기와 같은 특징을 추가로 갖는다: (i) MCP-l, IL-6, IL-8, GCP-2, HGF, KGF, FGF, HB-EGF, BDNF, TPO, MIPlb, I309, MDC, RANTES 및 TIMP1 중 적어도 하나의 분비; (j) ELISA에 의해 검출 시 TGF-베타2, MIP1a, ANG2, PDGFbb 및 VEGF 중 적어도 하나의 분비의 결여. 다른 실시 형태에서, 태반 조직 유래 세포는 하기와 같은 특징을 추가로 갖는다: (i) MCP-l, IL-6, IL-8, GCP-2, HGF, KGF, HB-EGF, BDNF, TPO, MIP1a, RANTES 및 TIMP1 중 적어도 하나의 분비; (j) ELISA에 의해 검출 시 TGF-베타2, ANG2, PDGFbb, FGF 및 VEGF 중 적어도 하나의 분비의 결여.
특정 실시 형태에서, 산후 유래 세포는 하기와 같은 세포 유형의 모든 식별 특징을 갖는다: 세포 유형 UMB 022803 (P7) (ATCC 수탁 번호 PTA-6067); 세포 유형 UMB 022803 (P17) (ATCC 수탁 번호 PTA-6068), 세포 유형 PLA 071003 (P8) (ATCC 수탁 번호 PTA-6074); 세포 유형 PLA 071003 (P11) (ATCC 수탁 번호 PTA-6075); 또는 세포 유형 PLA 071003 (P16) (ATCC 수탁 번호 PTA-6079). 실시 형태에서, 제대 조직으로부터 유래되는 산후 유래 세포는 세포 유형 UMB 022803 (P7) (ATCC 수탁 번호 PTA-6067) 또는 세포 유형 UMB 022803 (P17) (ATCC 수탁 번호 PTA-6068)의 모든 식별 특징을 갖는다. 다른 실시 형태에서, 태반 조직으로부터 유래되는 산후 유래 세포는 하기와 같은 세포 유형의 모든 식별 특징을 갖는다: 세포 유형 PLA 071003 (P8) (ATCC 수탁 번호 PTA-6074); 세포 유형 PLA 071003 (P11) (ATCC 수탁 번호 PTA-6075); 또는 세포 유형 PLA 071003 (P16) (ATCC 수탁 번호 PTA-6079).
특정 실시 형태에서, 산후 유래 세포는 메탈로프로테아제 활성, 점액분해 활성 및 중성 프로테아제 활성을 포함하는 하나 이상의 효소 활성의 존재 하에 단리된다. 바람직하게는, 세포는 정상 핵형을 가지며, 이는 세포가 계대배양됨에 따라 유지된다. 바람직한 실시 형태에서, 산후 유래 세포는 CD10, CD13, CD44, CD73, CD90 각각을 포함한다. 일부 실시 형태에서, 산후 유래 세포는 CD10, CD13, CD44, CD73, CD90, PDGFr-알파 및 HLA-A,B,C 각각을 포함한다. 바람직한 실시 형태에서, 산후 유래 세포는 CD31, CD34, CD45, CD117 중 어느 것도 포함하지 않는다. 일부 실시 형태에서, 산후 유래 세포는 유세포 분석법에 의해 검출 시 CD31, CD34, CD45, CD117, CD141 또는 HLA-DR,DP,DQ 중 어느 것도 포함하지 않는다. 실시 형태에서, 세포는 hTERT 또는 텔로머라제의 발현이 결여되어 있다.
본 발명의 실시 형태에서, 세포 집단은 실질적으로 균질한 산후 유래 세포 집단이다. 특정 실시 형태에서, 집단은 균질한 산후 유래 세포 집단이다. 본 발명의 실시 형태에서, 산후 유래 세포는 혈액이 실질적으로 없는 인간 제대 조직 또는 태반 조직으로부터 유래된다.
특정 실시 형태에서, 산후 유래 세포 집단 또는 상기 기술된 바와 같은 산후 유래 세포 집단으로부터 생성된 컨디셔닝된 배지는 적어도 하나의 다른 세포 유형, 예를 들어 성상세포, 희소돌기아교세포, 뉴런, 신경 전구체(progenitor), 신경 줄기 세포, 망막 상피 줄기 세포, 각막 상피 줄기 세포, 또는 다른 다능성(multipotent) 또는 만능성(pluripotent) 줄기 세포와 함께 투여된다. 이러한 실시 형태에서, 다른 세포 유형은 세포 집단 또는 컨디셔닝된 배지와 동시에, 또는 그 전에, 또는 그 후에 투여될 수 있다.
마찬가지로, 이러한 실시 형태 및 다른 실시 형태에서, 산후 유래 세포 집단 또는 상기 기술된 바와 같은 세포 집단으로부터 제조된 컨디셔닝된 배지는 적어도 하나의 다른 작용제(agent), 예를 들어 안구 요법용 약물, 또는 다른 유익한 보조 작용제, 예를 들어 항염증제, 항아폽토시스제, 항산화제 또는 성장 인자와 함께 투여된다. 이러한 실시 형태에서, 다른 작용제는 세포 집단 또는 컨디셔닝된 배지와 동시에, 그 전에 또는 그 후에 투여될 수 있다.
다양한 실시 형태에서, 산후 유래 세포 집단 또는 산후 유래 세포 (제대 또는 태반)로부터 생성된 컨디셔닝된 배지는 눈의 표면에 투여되거나 눈의 내부 또는 눈 부근의 위치에 (예를 들어, 눈 뒤에) 투여된다. 산후 유래 세포 집단 또는 컨디셔닝된 배지는 캐뉼러를 통해 또는 눈 내부 또는 눈 부근에서 환자의 신체에 이식된 장치로부터 투여될 수 있거나, 산후 유래 세포 집단 또는 컨디셔닝된 배지를 갖는 매트릭스 또는 스캐폴드(scaffold)의 이식에 의해 투여될 수 있다.
본 발명의 다른 태양은, 기능성 시냅스의 발생을 촉진하기에 효과적인 양의 산후 유래 세포 집단 또는 세포 집단으로부터 제조된 컨디셔닝된 배지를 포함하는, 망막 변성 질환에서 기능성 시냅스의 발생을 촉진하는 조성물을 특징으로 한다. 바람직하게는, 컨디셔닝된 배지는 상기 기술된 바와 같은 산후 유래 세포로부터 제조된다. 더 바람직하게는, 산후 유래 세포는 혈액이 실질적으로 없는 산후 제대 또는 태반으로부터 단리된다. 변성 질환은 급성, 만성 또는 진행성 질환일 수 있다.
특정 실시 형태에서, 조성물은 적어도 하나의 다른 세포 유형, 예를 들어 성상세포, 희소돌기아교세포, 뉴런, 신경 전구체, 신경 줄기 세포, 망막 상피 줄기 세포, 각막 상피 줄기 세포, 또는 다른 다능성 또는 만능성 줄기 세포를 포함한다. 이들 또는 다른 실시 형태에서, 조성물은 적어도 하나의 다른 작용제, 예를 들어 안구 변성 장애를 치료하기 위한 약물 또는 다른 유익한 보조 작용제, 예를 들어 항염증제, 항아폽토시스제, 항산화제 또는 성장 인자를 포함한다.
일부 실시 형태에서, 조성물은 약제학적으로 허용가능한 담체를 추가로 포함하는 약제학적 조성물이다.
특정 실시 형태에서, 약제학적 조성물은 눈의 표면에 투여하기 위해 제형화된다. 대안적으로, 이것은 눈의 내부에 또는 눈 부근에 (예를 들어, 눈 뒤에) 투여하기 위해 제형화될 수 있다. 또한, 조성물은 산후 유래 세포 또는 컨디셔닝된 배지를 함유하는 매트릭스 또는 스캐폴드로 제형화될 수 있다.
본 발명의 또 다른 태양에 따르면, 안구 변성 질환에 걸린 환자를 치료하기 위한 키트가 제공된다. 키트는 약제학적으로 허용가능한 담체, 산후 유래 세포 - 바람직하게는, 상기 기술된 산후 유래 세포 - 집단, 또는 산후 유래 세포 집단으로부터 생성된 컨디셔닝된 배지, 및 환자를 치료하는 방법에서 키트를 사용하기 위한 설명서를 포함한다. 또한, 키트는 하나 이상의 추가 성분, 예를 들어 컨디셔닝된 배지를 생성하기 위한 시약 및 설명서, 또는 적어도 하나의 다른 세포 유형의 집단, 또는 안구 변성 질환의 치료에 유용한 하나 이상의 작용제를 함유할 수 있다.
일 실시 형태에서, 본 발명은 피검자에게 시냅스 형성을 유도하기에 효과적인 양의 산후 유래 세포 집단 또는 산후 유래 세포 집단으로부터 제조된 컨디셔닝된 배지를 투여하는 단계를 포함하는 망막 변성에서 시냅스 형성을 유도하는 방법이고, 여기서 산후 유래 세포는 혈액이 실질적으로 없는 인간 제대 조직 또는 태반 조직으로부터 유래되고, 세포 집단은 배양 중 증식가능하고, 적어도 신경 표현형의 세포로 분화될 가능성을 가지고, 계대 시 정상 핵형을 유지하고, 하기와 같은 특징을 가지며:
a) 배양 중 40회의 집단 배가 가능성;
b) CD10, CD13, CD44, CD73 및 CD90의 생성; 및
c) CD31, CD34, CD45, CD117 및 CD141의 생성의 결여,
산후 유래 세포 집단은 영양 인자를 분비하거나, 산후 유래 세포 집단으로부터 제조된 컨디셔닝된 배지는 세포 집단에 의해 분비된 영양 인자를 함유한다. 실시 형태에서, 세포 집단에 의해 분비된 영양 인자는 트롬보스폰딘-1, 트롬보스폰딘-2 및 트롬보스폰딘-4로부터 선택된다. 일부 실시 형태에서, 세포 집단은 실질적으로 균질한 집단이다. 특정 실시 형태에서, 세포 집단은 균질하다. 산후 유래 세포는 제대 조직 유래 세포 또는 태반 조직 유래 세포이다. 실시 형태에서, 제대 조직 유래 세포 집단은 MCP-l, IL-6, IL-8, GCP-2, HGF, KGF, FGF, HB-EGF, BDNF, TPO, MIPlb, I309, MDC, RANTES 및 TIMP1을 분비한다. 또한, 제대 조직 유래 세포 집단은 ELISA에 의해 검출 시 TGF-베타2, MIP1a, ANG2, PDGFbb 및 VEGF의 분비가 결여되어 있다. 다른 실시 형태에서, 태반 조직 유래 세포 집단은 MCP-l, IL-6, IL-8, GCP-2, HGF, KGF, HB-EGF, BDNF, TPO, MIP1a, RANTES 및 TIMP1을 분비한다. 실시 형태에서, 태반 조직 유래 세포 집단은 ELISA에 의해 검출 시 TGF-베타2, ANG2, PDGFbb, FGF 및 VEGF의 분비가 결여되어 있다. 또한, 세포 집단은 hTERT 또는 텔로머라제의 발현이 결여되어 있다. 실시 형태에서, 제대 조직 유래 세포 집단은 섬유아세포, 중간엽 줄기 세포 또는 장골능 골수 세포인 인간 세포에 비하여 인터류킨 8 및 레티큘론 1을 인코딩하는 유전자의 증가된 발현을 갖는다. 실시 형태에서, 세포 집단은 비멘틴 및 알파-평활근 액틴을 생성한다.
다른 실시 형태에서, 본 발명은 피검자에게 시냅스 형성을 유도하기에 효과적인 양의 제대 조직 유래 세포 집단 또는 인간 제대 조직 유래 세포 집단으로부터 제조된 컨디셔닝된 배지를 투여하는 단계를 포함하는 망막 변성에서 시냅스 형성을 유도하는 방법이고, 여기서 세포는 혈액이 실질적으로 없는 인간 제대 조직으로부터 유래되고, 세포 집단은 배양 중 증식가능하고, 적어도 신경 표현형의 세포로 분화될 가능성을 가지고, 계대 시 정상 핵형을 유지하고, 하기와 같은 특징을 가지며:
a) 배양 중 40회의 집단 배가 가능성;
b) CD10, CD13, CD44, CD73 및 CD90의 생성; 및
c) CD31, CD34, CD45, CD117 및 CD141의 생성의 결여,
제대 조직 유래 세포 집단은 영양 인자를 분비하거나, 인간 제대 조직 유래 세포 집단으로부터 제조된 컨디셔닝된 배지는 세포 집단에 의해 분비된 영양 인자를 함유한다. 실시 형태에서, 세포 집단에 의해 분비된 영양 인자는 트롬보스폰딘-1, 트롬보스폰딘-2 및 트롬보스폰딘-4로부터 선택된다. 실시 형태에서, 세포 집단은 MCP-l, IL-6, IL-8, GCP-2, HGF, KGF, FGF, HB-EGF, BDNF, TPO, MIPlb, I309, MDC, RANTES 및 TIMP1을 분비한다. 실시 형태에서, 세포 집단은 ELISA에 의해 검출 시 TGF-베타2, MIP1a, ANG2, PDGFbb 및 VEGF의 분비가 결여되어 있다. 일부 실시 형태에서, 세포 집단은 실질적으로 균질한 집단이다. 특정 실시 형태에서, 세포 집단은 균질하다. 또한, 세포 집단은 hTERT 또는 텔로머라제의 발현이 결여되어 있다. 실시 형태에서, 세포 집단은 섬유아세포, 중간엽 줄기 세포 또는 장골능 골수 세포인 인간 세포에 비하여 인터류킨 8 및 레티큘론 1을 인코딩하는 유전자의 증가된 발현을 갖는다. 실시 형태에서, 세포 집단은 비멘틴 및 알파-평활근 액틴을 생성한다.
상기 기술된 실시 형태에서, 제대 유래 세포 또는 태반 유래 세포는 하기와 같은 특징 중 하나 이상을 갖는다: HLA-A,B,C에 대해 양성임; CD10, CD13, CD44, CD73, CD90에 대해 양성임; HLA-DR,DP,DQ에 대해 음성임; CD31, CD34, CD45, CD117 및 CD141의 생성이 결여되어 있거나 이에 대해 음성임. 실시 형태에서, 세포는 비멘틴 및 알파-평활근 액틴을 생성한다.
상기 기술된 추가의 실시 형태에서, 제대 유래 세포는 섬유아세포, 중간엽 줄기 세포 또는 장골능 골수 세포인 인간 세포에 비하여 인터류킨 8 및 레티큘론 1을 인코딩하는 유전자의 증가된 발현을 갖는다. 실시 형태에서, 제대 유래 세포는 hTERT 또는 텔로머라제의 발현이 결여되어 있다.
상기 기술된 본 발명의 실시 형태에서, 망막 변성, 망막병증 또는 망막/황반 장애는 연령 관련 황반 변성이다. 대안적인 실시 형태에서, 망막 변성, 망막병증 또는 망막/황반 장애는 건성 연령 관련 황반 변성이다.
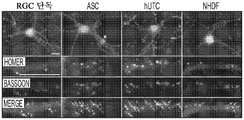
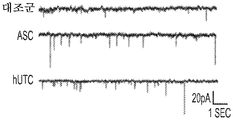
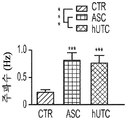
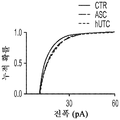
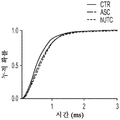
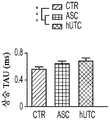
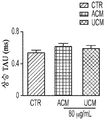
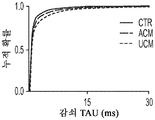
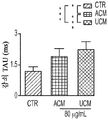
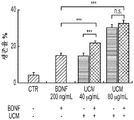
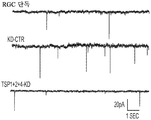
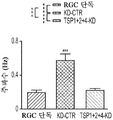
도 1a 내지 도 1m. hUTC는 배양된 RGC들 사이에 기능성 시냅스 형성을 유도한다. (도 1a) 실험 설계의 개략도. 정제된 RGC를 단독으로 배양하거나 트랜스웰 인서트(transwell insert)에서 hUTC, NHDF 또는 래트 ASC와 6일 동안 공동 배양하였다. 시냅스의 수 및 기능을 각각 면역세포화학 기반 검정 및 전기생리학 기반 검정에 의해 결정하였다. (도 1b) 시냅스전 (Bassoon, 적색) 및 시냅스후 (Homer, 녹색) 단백질에 특이적인 항체로 염색된 RGC의 대표적인 이미지. 하단: 입구 (흰색 박스)가 더 높은 배율로 나타나 있고, 공동 국재화(co-localization)된 시냅스 펑크텀(synaptic punctum) (merge, 황색)은 흰색 화살표로 표시되어 있다. 스케일 바(Scale bar): 20 μm. 공동 국재화된 시냅스 펑크텀의 수의 배수 증가 (n=59개 내지 161개의 세포/조건) (도 1c) 및 시냅스 밀도 (단위 수상돌기 길이당 시냅스의 수, n=30개의 세포/조건) (도 1d)의 정량화는 ASC와 마찬가지로 hUTC가 배양된 RGC들 사이에 흥분성 시냅스 형성을 유도함을 밝혀낸다. (배수 증가는 세포당 시냅스의 수를 RGC 단독 조건에서의 세포당 시냅스의 수로 정규화함으로써 계산하였다). 도 1e 내지 도 1i는 유도된 시냅스가 전기생리학적으로 기능성임을 도시한다. (도 1e) mEPSC를 나타내는 전 세포 패치 클램프 기록(whole-cell patch clamp recording)의 예시적인 트레이스. 사건간 간격의 누적 확률 플롯 (도 1f)및 mEPSC의 평균 주파수의 정량화 (도 1g)는 hUTC 또는 ASC와의 공동 배양이 시냅스 사건 수의 증가를 유도하였음을 밝혀내었다. (도 1h) mEPSC 진폭의 누적 확률 플롯은 단독으로 배양된 RGC와 비교할 때 hUTC 또는 ASC와 공동 배양된 RGC에서 큰 진폭 사건의 증가를 나타내었다. (도 1i) mEPSC 진폭의 평균값은 조건들 사이에 차이가 없었다. (전기생리학 실험의 경우, n=15개의 세포/조건. 모든 데이터를 평균±SEM으로 표현하였고, 유의성은 *** p<0.0001, ** p<0.001, 및 * p<0.05, n.s. 유의하지 않음으로 나타내었음.). 도 1j 내지 도 1m은 hUTC 및 ASC 공동 배양의 전기생리학적 파형 특성이 시냅스를 유도하였음을 도시한다. CTR (RGC 단독)과 비교하여 ASC 또는 hUTC와 공동 배양된 RGC로부터 기록된 mEPSC는 상승 tau (도 1j, 도 1k) 및 감쇠 tau (도 1l, 도 1m) 둘 모두에서 증가를 나타내었다. n=15개의 세포/조건. 모든 데이터를 평균±SEM으로 표현하였고, 유의성은 *** p<0.0001, ** p<0.001 및 * p<0.05로 나타내었다.
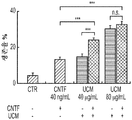
도 2a 내지 도 2n. hUTC 컨디셔닝된 배지 (UCM)는 배양된 RGC들 사이에 기능성 시냅스 형성을 유도한다. (도 2a) 실험 설계의 개략도. 정제된 RGC를 6일 동안 UCM (다양한 농도로) 또는 ACM으로 처리하였다. 시냅스의 수 및 기능을 각각 면역세포화학 기반 검정 및 전기생리학 기반 검정에 의해 결정하였다. (도 2b) 시냅스전 (Bassoon, 적색) 및 시냅스후 (Homer, 녹색) 단백질에 특이적인 항체로 염색된 RGC의 대표적인 이미지. 하단: 입구 (흰색 박스)가 더 높은 배율로 나타나 있고, 공동 국재화된 시냅스 펑크텀 (merge, 황색)은 흰색 화살표로 표시되어 있다. 스케일 바: 20 μm. 시냅스 수의 배수 증가 (n=65개 내지 157개의 세포/조건) (도 2c) 및 시냅스 밀도 (단위 수상돌기 길이당 시냅스의 수, n=30개의 세포/조건) (도 2d)의 정량화는 ACM과 마찬가지로 UCM이 배양된 RGC들 사이에 흥분성 시냅스 형성을 유도하였음을 나타내었다. (시냅스 수의 배수 증가는 세포당 공동 국재화된 시냅스 펑크텀의 수를 RGC 단독 조건에서의 시냅스의 수로 정규화함으로써 계산하였다). (도 2e) 단독으로 배양되거나 ACM (80 ㎍/mL) 또는 UCM (80 ㎍/mL)으로 처리된 RGC로부터의 mEPSC를 나타내는 전 세포 패치 클램프 기록의 예시적인 트레이스. 사건간 간격의 누적 확률 플롯 (도 2f)및 mEPSC의 평균 주파수의 정량화 (도 2g)는 UCM 또는 ACM으로의 처리가 시냅스 사건 수의 증가를 유도하였음을 밝혀내었다. (도 2h) mEPSC 진폭의 누적 확률 플롯은 단독으로 배양된 RGC와 비교하여 RGC가 UCM 또는 ACM으로 처리되었을 때 큰 진폭 사건의 증가를 나타내었다. (도 2i) mEPSC 진폭의 평균값은 조건들 사이에 유의한 차이가 없었다. (전기생리학 실험의 경우, n=15개의 세포/조건. 모든 데이터를 평균±SEM으로 표현하였고, 유의성은 *** *** p<0.0001, ** p<0.001 및 * p<0.05로 나타내었음). 도 2j 내지 2n. 시냅스 수 및 전기생리학적 특성의 UCM 유도 변화. (도 2j) 다양한 농도의 ACM과 UCM으로 처리된 RGC에서의 시냅스 수의 정량화. 결과는 시냅스 수의 배수 증가로 나타나 있다 (RGC 단독 조건에서의 공동 국재화된 시냅스 펑크텀의 수에 대해 정규화됨, n=29개 내지 157개의 세포/조건). ACM 또는 UCM으로 처리된 RGC로부터 기록된 mEPSC는 단독으로 배양된 RGC와 비교하여 상승 tau (도 2k, 도 2l) 및 감쇠 tau (도 2m, 도 2n) 둘 모두에서 증가를 나타내었고, n=15개의 세포/조건이었다. 모든 데이터를 평균±SEM으로 표현하였고, 유의성은 *** p<0.0001, ** p<0.001 및 * p<0.05로 나타내었다.
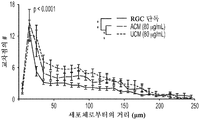
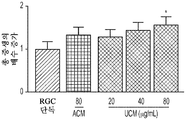
도 3a 내지 도 3j. hUTC 분비 인자는 RGC 생존 및 신경돌기 증생을 촉진한다. (도 3a) 생존 검정 시약으로 처리된 RGC의 대표적인 이미지 (생세포의 경우 칼세인(Calcein)-AM (녹색) 및 사멸된 세포의 경우 에티듐 호모다이머(Ethidium Homodimer)-1 (적색)). 스케일 바: 100 μm. (도 3b) 최소 배지 중에서 배양된 RGC (CTR)와 비교하여 다양한 농도의 ACM 및 UCM의 존재 하의 RGC 생존의 정량화 (n=9개 또는 10개의 현미경 필드(microscopic field)/조건). (도 3c) UCM 매개 생존 효과는 시험된 UCM의 모든 농도에서 포르스콜린(forskolin) 의존성이다 (n=9개 내지 18개의 현미경 필드/조건). UCM (40 ㎍/mL)의 생존 효과는 BDNF (도 3d) 및 CNTF (도 3e)의 생존 효과에 상가적이다 (n=18개 내지 20개의 현미경 필드/조건). (도 3f) 단독으로 배양되거나 ACM 또는 UCM으로 처리된 RGC의 대표적인 골격화 흔적(skeletonized trace). 스케일 바: 100 μm. (도 3g) 신경돌기 복잡성의 숄(Sholl) 분석은 컨디셔닝된 배지로 처리된 RGC가 단독으로 배양된 RGC와 비교하여 증가된 정교화를 가짐을 나타내었다 (n=20개 내지 24개의 세포/조건). 총 신경돌기 증생 (도 3h), 돌기의 수 (도 3i) 및 가지의 수 (도 3j)의 정량화는 단독으로 배양된 RGC와 비교하여 RGC가 UCM 또는 ACM으로 처리되었을 때 증가를 나타내었다 (n=25개 내지 36개의 세포/조건). 그래프는 RGC 단독 조건의 값에 대해 정규화된 배수 증가로 나타나 있다. 모든 데이터를 평균±SEM으로 표현하였고, 유의성은 *** p<0.0001, ** p<0.001 및 * p<0.05, n.s. 유의하지 않음으로 나타내었다.
도 4a 내지 도 4e. UCM에서의 시냅스생성 인자의 특징규명. (도 4a) 실험 설계의 개략도. 정제된 RGC를 6일 동안 UCM으로 처리하고, 이를 다양한 분자량 컷오프로 원심분리 농축기를 사용하여 분획화하였다. 이어서, 시냅스 수를 앞서 기술된 바와 같이 정량화하였다. (도 4b) 공동 국재화된 시냅스 펑크텀을 나타내는 대표적인 RGC 이미지 (시냅스전: Bassoon (적색), 시냅스후: Homer (녹색)). 하단: 흰색 박스가 더 높은 배율로 나타나 있다. 흰색 화살표는 공동 국재화된 시냅스 펑크텀을 나타낸다. 스케일 바: 20 μm. (도 4c) 시냅스 수의 배수 증가의 정량화. 배수 증가는 공동 국재화된 시냅스 펑크텀/세포의 수를 RGC 단독 조건에서 얻은 값에 대해 정규화함으로써 계산하였다 (n=30개 내지 44개의 세포/조건). (도 4d) 가바펜틴(gabapentin) (GBP, 32 μM)의 존재 또는 부재 하에 UCM으로 처리된 RGC에서의 공동 국재화된 시냅스 펑크텀을 나타내는 대표적인 RGC 이미지 (흰색 화살표, 시냅스전: Bassoon (적색) 및 시냅스후: Homer (녹색)). 스케일 바: 20 μm. (도 4e) RGC 단독 조건에 대해 정규화된 시냅스 수의 배수 증가의 정량화 (n=24개 또는 25개의 세포/조건). UCM 유도 시냅스생성은 GBP에 의해 저해되었다. 모든 데이터를 평균±SEM으로 표현하였고, 유의성은 *** p<0.0001, ** p<0.001 및 * p<0.05로 나타내었다.
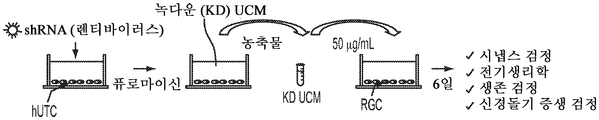
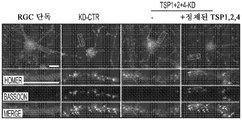
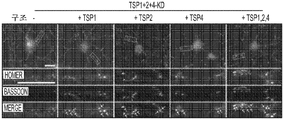
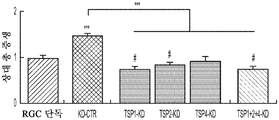
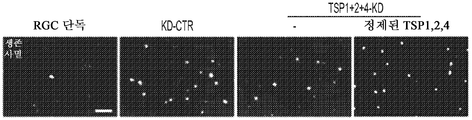
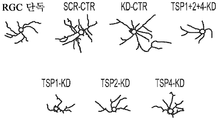
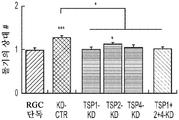
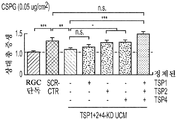
도 5a 내지 도 5k. TSP1, TSP2 및 TSP4는 hUTC 유도 시냅스생성에 필요하다. (도 5a) TSP-녹다운(knockdown) 실험 (도 5 내지 도 7)을 위한 실험 설계의 개략도. TSP1, TSP2 및 TSP4 발현을 hUTC의 렌티바이러스 shRNA 형질도입에 의해 침묵시키고, 녹다운 (KD) UCM을 수집하였다. RGC를 6일 동안 KD UCM으로 처리하였다. 시냅스 형성 (시냅스 검정), 시냅스 기능 (전기생리학), 뉴런 생존 (생존 검정) 및 신경돌기 증생 (증생 검정)에 대한 UCM의 효과를 결정하였다. (도 5b) 렌티바이러스 shRNA 형질도입을 사용한 TSP1, TS2P 및 TSP4 녹다운의 웨스턴 블롯 확인. 헤빈(HEVIN)이라 일컬어지는 무관한 hUTC 분비 단백질을 로딩 대조군(loading control)으로 사용하였다. (도 5c) RGC 단독 조건에 대해 정규화된, RGC 처리 스크램블 대조군(scrambled control) UCM (SCR-CTR) 및 TSP-KD UCM에서의 시냅스 수의 배수 증가 (n=30개의 세포/조건). (도 5d) RGC 단독 조건에 대해 정규화된, 다양한 TSP-KD UCM으로 처리된 RGC에서의 시냅스 수의 배수 증가 (n=76개 내지 81개의 세포/조건). (도 5e) RGC 단독 조건에 대해 정규화된, 정제된 TSP의 존재 하에 TSP1+2+4-KD UCM으로 처리된 RGC에 대한 시냅스 수의 배수 증가 (n=30개의 세포/조건). 모든 3개의 TSP (TSP1, TSP2 및 TSP4)의 첨가는 TSP1+2+4-KD UCM의 시냅스생성 효과를 구조하였다. 다양한 처리 각각으로부터의 RGC의 대표적인 이미지를 도 5h 내지 도 5j에서 찾아볼 수 있다. 도 5f 및 5g는 렌티바이러스 감염 hUTC의 퓨로마이신(Puromycin) 선택을 도시한다. (도 5f) 3일째 및 5일째의 다양한 퓨로마이신 농도의 존재 하에 렌티바이러스 형질도입이 없을 시의 hUTC의 치사 곡선 (n=3개의 현미경 필드/조건). (도 5g) 3일째 및 5일째의 퓨로마이신 (0.9 ㎍/mL)의 존재 하에 렌티바이러스 감염이 있을 시 및 없을 시의 hUTC의 대표적인 이미지. 스케일 바: 50 μm. 도 5h 내지 도 5l은 hUTC 분비 TSP가 RGC들 사이에 시냅스 형성을 유도함을 도시한다. (도 5h 내지 도 5j) 공동 국재화된 시냅스 펑크텀을 나타내는 RGC의 대표적인 이미지 (시냅스전: Bassoon (적색), 시냅스후: Homer (녹색))는 TSP1+2+4-KD UCM이 사용되었을 때 UCM의 시냅스생성 활성이 상실되었음을 나타내었다. 이러한 상실은 정제된 TSP1 또는 TSP2 또는 TSP4 (150 ng/ml)를 KD UCM에 첨가함으로써 부분적으로 구조될 수 있었다. 모든 3개의 TSP의 첨가는 UCM의 완전한 시냅스생성 효과를 구조하였다. 하단: 흰색 박스가 더 높은 배율로 나타나 있다. 흰색 화살표는 공동 국재화된 시냅스 펑크텀을 나타낸다. 스케일 바: 20 μm. (도 5k) 다양한 TSP-KD UCM을 사용한 처리 후 시냅스 밀도 (공동 국재화된 시냅스 펑크텀의 수/신경돌기 길이)의 변화의 정량화. (도 5l) 단독으로 배양된 RGC들 (음성 대조군) 또는 정제된 TSP의 존재 하에 KD CTR UCM으로 처리된 RGC들 사이에 형성된 시냅스의 정량화 (n=30개의 세포/조건). KD CTR UCM에 대한 정제된 TSP의 첨가는 시냅스 수의 추가의 증가를 가져오지 않았다. 모든 데이터를 평균±SEM으로 표현하였고, 유의성은 *** p<0.0001, ** p<0.001 및 * p<0.05, n.s. 유의하지 않음으로 나타내었다.
도 6a 내지 도 6i. TSP1, TSP2 및 TSP4는 시냅스 기능의 hUTC 유도 증가에 필요하다. (도 6a) AMC (양성 대조군), SCR-CTR, TSP1+2+4-KD UCM으로 처리된 RGC 또는 단독으로 배양된 RGC (음성 대조군)로부터의 mEPSC를 나타내는 전 세포 패치 클램프 기록의 예시적인 트레이스. UCM (TSP1+2+4-KD)에서의 TSP의 침묵은 SCR-CTR에 의해 달성된 주파수 (도 6b, 도 6c) 및 진폭 (도 6d, 도 6e) 증가 둘 모두를 제거하였다. 정량화된 데이터는 누적 확률 플롯 (도 6b, 도 6d) 및 평균값의 막대 그래프 (도 6c, 도 6e)로 나타나 있다. n=15개의 세포/조건. (도 6f) ACM (양성 대조군), SCR-CTR 또는 TSP1+2+4-KD UCM으로 처리된 RGC 또는 단독으로 배양된 RGC (음성 대조군)로부터의 mEPSC를 나타내는 전 세포 패치 클램프 기록의 예시적인 트레이스. UCM (TSP1+2+4-KD)에서의 TSP의 침묵은 SCR-CTR에 의해 달성된 주파수 (도 6g, 도 6h) 및 진폭 (도 6i, 도 6j) 증가 둘 모두를 제거하였다. 정량화된 데이터는 누적 확률 플롯 (도 6g, 도 6i) 및 평균값의 막대 그래프 (도 6h, 도 6j)로 나타나 있다. n=15개의 세포/조건. 도 6k 내지 도 6n은 UCM 처리 RGC의 파형 특성에 대한 TSP 녹다운의 효과를 도시한다. KD-CTR 처리 RGC 기록과 TSP1+2+4-KD UCM 처리 RGC 기록 사이의 유사한 값에 의해 나타난 바와 같이, 상승 tau (도 6k, 도 6l) 또는 감쇠 tau (도 6m, 도 6n)는 hUTC에서의 TSP 발현의 침묵에 의해 유의한 영향을 받지 않았다 (n=15개의 세포/조건). 모든 데이터를 평균±SEM으로 표현하였고, 유의성은 *** p<0.0001, ** p<0.001 및 * p<0.05로 나타내었다.
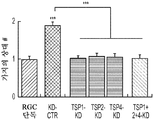
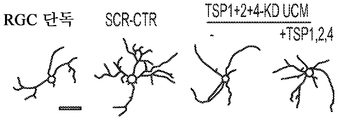
도 7a 내지 도 7o. TSP는 UCM 유도 신경돌기 증생에 필요하지만 세포 생존에는 필요하지 않다. (도 7a) RGC 단독 (음성 대조군)과 비교하여 SCR-CTR, KD-CTR 또는 TSP1+2+4-KD UCM으로 처리된 RGC의 대표적인 골격화 흔적. 스케일 바: 100 μm. TSP 침묵 hUTC UCM (TSP1+2+4-KD UCM)은 두 대조군인 SCR-CTR과 KD-CTR 모두와 비교하여 총 신경돌기 증생의 길이 (도 7b), 돌기의 수 (도 7c) 및 가지의 수 (도 7d)를 감소시켰다 (n=40개 내지 48개의 세포/조건). hUTC에서의 TSP의 침묵으로 인해, UCM은 총 신경돌기 증생의 길이 (n=120개 내지 169개의 세포/조건) (도 7e) 및 숄 분석에 의해 나타난 복잡성 (n=25개의 세포/조건) (도 7f)을 감소시키게 되었다. #는 RGC 단독 조건과 비교하여 총 증생의 유의한 감소를 나타낸다 (p<0.05). (도 7g) 정제된 TSP의 존재 하에 KD-CTR 또는 TSP1+2+4-KD UCM으로 처리된 RGC의 대표적인 골격화 흔적. 스케일 바: 100 μm. TSP1+2+4-KD UCM으로의 정제된 TSP의 첨가는 UCM의 기능을 회복시켜 총 신경돌기 성장 (n=29개 내지 33개의 세포/조건) (도 7h) 및 복잡성 (n=30개의 세포/조건) (도 7i)을 향상시켰다. #는 RGC 단독 조건과 비교하여 총 증생의 유의한 감소를 나타낸다 (p<0.05). (도 7j) 생존 검정 시약으로 처리된 RGC의 대표적인 이미지 (생세포의 경우 칼세인-AM (녹색) 및 사멸된 세포의 경우 에티듐 호모다이머-1 (적색)). 스케일 바: 100 μm. (도 7k) 다양한 TSP-KD UCM 조건으로 처리된 RGC에서의 생존 백분율의 정량화 (n=30개의 현미경 필드/조건). TSP2 또는 TSP4 또는 모든 3개의 TSP의 침묵은 UCM의 생존 촉진 효과를 감소시켰다. (도 7l) TSP1+2+4-KD UCM으로의 순수한 TSP의 첨가는 KD-UCM의 완전한 생존 효과를 회복시키지 않았다 (n=20개의 현미경 필드/조건). 도 7m 내지 도 7o는 RGC에서의 UCM 유도 신경돌기 증생의 TSP 관여를 도시한다. (도 7m) RGC 단독 (음성 대조군)과 비교하여 SCR-CTR, KD-CTR 및 TSP-KD UCM으로 처리된 RGC의 대표적인 골격화 흔적. 스케일 바: 100 μm. hUTC에서의 TSP의 녹다운은 돌기 (도 7n) 및 가지 (도 7o)의 수를 감소시켰다 (n=120개 내지 169개의 세포/조건). 돌기 수 및 가지 수의 배수 변화를 RGC 단독 대조군에 대해 정규화하였다. 도 7p 내지 도 7r은 정제된 TSP의 첨가가 TSP1+2+4-KD UCM의 신경돌기 증생 기능을 구조하였음을 도시한다. (도 7p) 정제된 TSP의 존재 하에 KD-CTR 또는 TSP1+2+4-KD UCM으로 처리된 RGC의 대표적인 골격화 흔적. 스케일 바: 100 μm. 정제된 TSP를 TSP1+2+4-KD UCM으로 다시 첨가하는 것 (도 7q)은 돌기 수에 대하여 미미한 효과를 가졌지만 가지 수의 배수 변화를 회복시켰다 (도 7r) (n=29개 내지 33개의 세포/조건). 모든 데이터를 RGC 단독에 대해 정규화하여, 평균±SEM으로 표현하였고, 유의성은 *** p<0.0001, ** p<0.001 및 * p<0.05로 나타내었다.
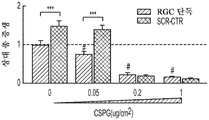
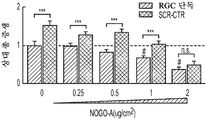
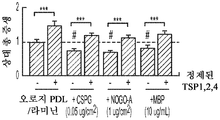
도 8a 내지 도 8j. hUTC 분비TSP는 CSPG, Nogo-A 또는 MBP의 존재 하에 신경돌기 증생을 유도한다. 증가하는 농도의 CSPG (n=45개 내지 79개의 세포/조건) (도 8a) 또는 Nogo-A (n=30개 내지 37개의 세포/조건) (도 8b)로 코팅된 커버슬립에서의 총 신경돌기 증생의 정량화. 그래프는 CSPG 또는 Nogo-A를 함유하지 않는 커버슬립에 플레이팅된 RGC의 증생 값에 대해 정규화된 배수 증가로 나타나 있다. CSPG (0.05 ug/㎠) (도 8c) 또는 Nogo-A (1 ug/㎠) (도 8d) 코팅 커버슬립에 플레이팅된 SCR-CTR, TSP KD UCM 및 정제된 TSP로 처리된 RGC의 대표적인 골격화 흔적. 스케일 바: 100 μm. 도 8e 및 도 8f. CSPG (0.05 ug/㎠, n=62개 내지 103개의 세포/조건) (도 8e) 또는 Nogo-A (1 ug/㎠, n=25개 내지 29개의 세포/조건) (도 8f) 코팅 커버슬립에 플레이팅된 RGC의 총 신경돌기 증생의 정량화. 그래프는 각각의 배양 조건 하에서 성장 배지만으로 배양된 RGC (RGC 단독)의 값에 대해 정규화된 배수 증가로 나타나 있다 도 8g. SCR-CTR 또는 TSP1+2+4-KD UCM 단독 또는 MBP (10 ug/mL)의 존재 하에 정제된 TSP가 보충된 TSP1+2+4-KD UCM으로 처리된 RGC의 대표적인 골격화 흔적. 스케일 바: 100 μm. 도 8h. 성장 저해 물질의 존재 하에 정제된 TSP로 처리된 RGC의 대표적인 골격화 흔적. 스케일 바: 100 μm. 도 8i. 총 신경돌기 증생의 정량화는 MBP의 존재 하에 UCM 분비 TSP2의 신경돌기 증생 활성의 향상을 나타내었다 (n=40개 내지 54개의 세포/조건). 그래프는 RGC 단독 조건의 값에 정규화된 배수 증가로 나타나 있다. 도 8j. 정제된 TSP를 사용한 RGC의 처리는 CSPG, Nogo-A 또는 MBP의 존재 하에 유의한 증생을 유도할 수 있다 (n=41개 내지 54개의 세포/조건). 모든 데이터를 평균±SEM으로 표현하였고, 유의성은 *** p<0.0001, ** p<0.001 및 * p<0.05, n.s. 유의하지 않음으로 나타내었다. #는 RGC 단독 조건과 비교하여 총 증생의 유의한 감소를 나타낸다 (p<0.05).
본 발명의 다른 특징 및 이점은 하기의 발명을 실시하기 위한 구체적인 내용 및 실시예로부터 명백해질 것이다.
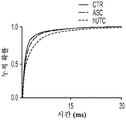
도 2a 내지 도 2n. hUTC 컨디셔닝된 배지 (UCM)는 배양된 RGC들 사이에 기능성 시냅스 형성을 유도한다. (도 2a) 실험 설계의 개략도. 정제된 RGC를 6일 동안 UCM (다양한 농도로) 또는 ACM으로 처리하였다. 시냅스의 수 및 기능을 각각 면역세포화학 기반 검정 및 전기생리학 기반 검정에 의해 결정하였다. (도 2b) 시냅스전 (Bassoon, 적색) 및 시냅스후 (Homer, 녹색) 단백질에 특이적인 항체로 염색된 RGC의 대표적인 이미지. 하단: 입구 (흰색 박스)가 더 높은 배율로 나타나 있고, 공동 국재화된 시냅스 펑크텀 (merge, 황색)은 흰색 화살표로 표시되어 있다. 스케일 바: 20 μm. 시냅스 수의 배수 증가 (n=65개 내지 157개의 세포/조건) (도 2c) 및 시냅스 밀도 (단위 수상돌기 길이당 시냅스의 수, n=30개의 세포/조건) (도 2d)의 정량화는 ACM과 마찬가지로 UCM이 배양된 RGC들 사이에 흥분성 시냅스 형성을 유도하였음을 나타내었다. (시냅스 수의 배수 증가는 세포당 공동 국재화된 시냅스 펑크텀의 수를 RGC 단독 조건에서의 시냅스의 수로 정규화함으로써 계산하였다). (도 2e) 단독으로 배양되거나 ACM (80 ㎍/mL) 또는 UCM (80 ㎍/mL)으로 처리된 RGC로부터의 mEPSC를 나타내는 전 세포 패치 클램프 기록의 예시적인 트레이스. 사건간 간격의 누적 확률 플롯 (도 2f)및 mEPSC의 평균 주파수의 정량화 (도 2g)는 UCM 또는 ACM으로의 처리가 시냅스 사건 수의 증가를 유도하였음을 밝혀내었다. (도 2h) mEPSC 진폭의 누적 확률 플롯은 단독으로 배양된 RGC와 비교하여 RGC가 UCM 또는 ACM으로 처리되었을 때 큰 진폭 사건의 증가를 나타내었다. (도 2i) mEPSC 진폭의 평균값은 조건들 사이에 유의한 차이가 없었다. (전기생리학 실험의 경우, n=15개의 세포/조건. 모든 데이터를 평균±SEM으로 표현하였고, 유의성은 *** *** p<0.0001, ** p<0.001 및 * p<0.05로 나타내었음). 도 2j 내지 2n. 시냅스 수 및 전기생리학적 특성의 UCM 유도 변화. (도 2j) 다양한 농도의 ACM과 UCM으로 처리된 RGC에서의 시냅스 수의 정량화. 결과는 시냅스 수의 배수 증가로 나타나 있다 (RGC 단독 조건에서의 공동 국재화된 시냅스 펑크텀의 수에 대해 정규화됨, n=29개 내지 157개의 세포/조건). ACM 또는 UCM으로 처리된 RGC로부터 기록된 mEPSC는 단독으로 배양된 RGC와 비교하여 상승 tau (도 2k, 도 2l) 및 감쇠 tau (도 2m, 도 2n) 둘 모두에서 증가를 나타내었고, n=15개의 세포/조건이었다. 모든 데이터를 평균±SEM으로 표현하였고, 유의성은 *** p<0.0001, ** p<0.001 및 * p<0.05로 나타내었다.
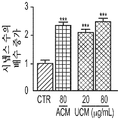
도 3a 내지 도 3j. hUTC 분비 인자는 RGC 생존 및 신경돌기 증생을 촉진한다. (도 3a) 생존 검정 시약으로 처리된 RGC의 대표적인 이미지 (생세포의 경우 칼세인(Calcein)-AM (녹색) 및 사멸된 세포의 경우 에티듐 호모다이머(Ethidium Homodimer)-1 (적색)). 스케일 바: 100 μm. (도 3b) 최소 배지 중에서 배양된 RGC (CTR)와 비교하여 다양한 농도의 ACM 및 UCM의 존재 하의 RGC 생존의 정량화 (n=9개 또는 10개의 현미경 필드(microscopic field)/조건). (도 3c) UCM 매개 생존 효과는 시험된 UCM의 모든 농도에서 포르스콜린(forskolin) 의존성이다 (n=9개 내지 18개의 현미경 필드/조건). UCM (40 ㎍/mL)의 생존 효과는 BDNF (도 3d) 및 CNTF (도 3e)의 생존 효과에 상가적이다 (n=18개 내지 20개의 현미경 필드/조건). (도 3f) 단독으로 배양되거나 ACM 또는 UCM으로 처리된 RGC의 대표적인 골격화 흔적(skeletonized trace). 스케일 바: 100 μm. (도 3g) 신경돌기 복잡성의 숄(Sholl) 분석은 컨디셔닝된 배지로 처리된 RGC가 단독으로 배양된 RGC와 비교하여 증가된 정교화를 가짐을 나타내었다 (n=20개 내지 24개의 세포/조건). 총 신경돌기 증생 (도 3h), 돌기의 수 (도 3i) 및 가지의 수 (도 3j)의 정량화는 단독으로 배양된 RGC와 비교하여 RGC가 UCM 또는 ACM으로 처리되었을 때 증가를 나타내었다 (n=25개 내지 36개의 세포/조건). 그래프는 RGC 단독 조건의 값에 대해 정규화된 배수 증가로 나타나 있다. 모든 데이터를 평균±SEM으로 표현하였고, 유의성은 *** p<0.0001, ** p<0.001 및 * p<0.05, n.s. 유의하지 않음으로 나타내었다.
도 4a 내지 도 4e. UCM에서의 시냅스생성 인자의 특징규명. (도 4a) 실험 설계의 개략도. 정제된 RGC를 6일 동안 UCM으로 처리하고, 이를 다양한 분자량 컷오프로 원심분리 농축기를 사용하여 분획화하였다. 이어서, 시냅스 수를 앞서 기술된 바와 같이 정량화하였다. (도 4b) 공동 국재화된 시냅스 펑크텀을 나타내는 대표적인 RGC 이미지 (시냅스전: Bassoon (적색), 시냅스후: Homer (녹색)). 하단: 흰색 박스가 더 높은 배율로 나타나 있다. 흰색 화살표는 공동 국재화된 시냅스 펑크텀을 나타낸다. 스케일 바: 20 μm. (도 4c) 시냅스 수의 배수 증가의 정량화. 배수 증가는 공동 국재화된 시냅스 펑크텀/세포의 수를 RGC 단독 조건에서 얻은 값에 대해 정규화함으로써 계산하였다 (n=30개 내지 44개의 세포/조건). (도 4d) 가바펜틴(gabapentin) (GBP, 32 μM)의 존재 또는 부재 하에 UCM으로 처리된 RGC에서의 공동 국재화된 시냅스 펑크텀을 나타내는 대표적인 RGC 이미지 (흰색 화살표, 시냅스전: Bassoon (적색) 및 시냅스후: Homer (녹색)). 스케일 바: 20 μm. (도 4e) RGC 단독 조건에 대해 정규화된 시냅스 수의 배수 증가의 정량화 (n=24개 또는 25개의 세포/조건). UCM 유도 시냅스생성은 GBP에 의해 저해되었다. 모든 데이터를 평균±SEM으로 표현하였고, 유의성은 *** p<0.0001, ** p<0.001 및 * p<0.05로 나타내었다.
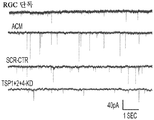
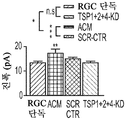
도 5a 내지 도 5k. TSP1, TSP2 및 TSP4는 hUTC 유도 시냅스생성에 필요하다. (도 5a) TSP-녹다운(knockdown) 실험 (도 5 내지 도 7)을 위한 실험 설계의 개략도. TSP1, TSP2 및 TSP4 발현을 hUTC의 렌티바이러스 shRNA 형질도입에 의해 침묵시키고, 녹다운 (KD) UCM을 수집하였다. RGC를 6일 동안 KD UCM으로 처리하였다. 시냅스 형성 (시냅스 검정), 시냅스 기능 (전기생리학), 뉴런 생존 (생존 검정) 및 신경돌기 증생 (증생 검정)에 대한 UCM의 효과를 결정하였다. (도 5b) 렌티바이러스 shRNA 형질도입을 사용한 TSP1, TS2P 및 TSP4 녹다운의 웨스턴 블롯 확인. 헤빈(HEVIN)이라 일컬어지는 무관한 hUTC 분비 단백질을 로딩 대조군(loading control)으로 사용하였다. (도 5c) RGC 단독 조건에 대해 정규화된, RGC 처리 스크램블 대조군(scrambled control) UCM (SCR-CTR) 및 TSP-KD UCM에서의 시냅스 수의 배수 증가 (n=30개의 세포/조건). (도 5d) RGC 단독 조건에 대해 정규화된, 다양한 TSP-KD UCM으로 처리된 RGC에서의 시냅스 수의 배수 증가 (n=76개 내지 81개의 세포/조건). (도 5e) RGC 단독 조건에 대해 정규화된, 정제된 TSP의 존재 하에 TSP1+2+4-KD UCM으로 처리된 RGC에 대한 시냅스 수의 배수 증가 (n=30개의 세포/조건). 모든 3개의 TSP (TSP1, TSP2 및 TSP4)의 첨가는 TSP1+2+4-KD UCM의 시냅스생성 효과를 구조하였다. 다양한 처리 각각으로부터의 RGC의 대표적인 이미지를 도 5h 내지 도 5j에서 찾아볼 수 있다. 도 5f 및 5g는 렌티바이러스 감염 hUTC의 퓨로마이신(Puromycin) 선택을 도시한다. (도 5f) 3일째 및 5일째의 다양한 퓨로마이신 농도의 존재 하에 렌티바이러스 형질도입이 없을 시의 hUTC의 치사 곡선 (n=3개의 현미경 필드/조건). (도 5g) 3일째 및 5일째의 퓨로마이신 (0.9 ㎍/mL)의 존재 하에 렌티바이러스 감염이 있을 시 및 없을 시의 hUTC의 대표적인 이미지. 스케일 바: 50 μm. 도 5h 내지 도 5l은 hUTC 분비 TSP가 RGC들 사이에 시냅스 형성을 유도함을 도시한다. (도 5h 내지 도 5j) 공동 국재화된 시냅스 펑크텀을 나타내는 RGC의 대표적인 이미지 (시냅스전: Bassoon (적색), 시냅스후: Homer (녹색))는 TSP1+2+4-KD UCM이 사용되었을 때 UCM의 시냅스생성 활성이 상실되었음을 나타내었다. 이러한 상실은 정제된 TSP1 또는 TSP2 또는 TSP4 (150 ng/ml)를 KD UCM에 첨가함으로써 부분적으로 구조될 수 있었다. 모든 3개의 TSP의 첨가는 UCM의 완전한 시냅스생성 효과를 구조하였다. 하단: 흰색 박스가 더 높은 배율로 나타나 있다. 흰색 화살표는 공동 국재화된 시냅스 펑크텀을 나타낸다. 스케일 바: 20 μm. (도 5k) 다양한 TSP-KD UCM을 사용한 처리 후 시냅스 밀도 (공동 국재화된 시냅스 펑크텀의 수/신경돌기 길이)의 변화의 정량화. (도 5l) 단독으로 배양된 RGC들 (음성 대조군) 또는 정제된 TSP의 존재 하에 KD CTR UCM으로 처리된 RGC들 사이에 형성된 시냅스의 정량화 (n=30개의 세포/조건). KD CTR UCM에 대한 정제된 TSP의 첨가는 시냅스 수의 추가의 증가를 가져오지 않았다. 모든 데이터를 평균±SEM으로 표현하였고, 유의성은 *** p<0.0001, ** p<0.001 및 * p<0.05, n.s. 유의하지 않음으로 나타내었다.
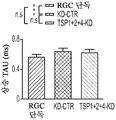
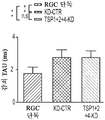
도 6a 내지 도 6i. TSP1, TSP2 및 TSP4는 시냅스 기능의 hUTC 유도 증가에 필요하다. (도 6a) AMC (양성 대조군), SCR-CTR, TSP1+2+4-KD UCM으로 처리된 RGC 또는 단독으로 배양된 RGC (음성 대조군)로부터의 mEPSC를 나타내는 전 세포 패치 클램프 기록의 예시적인 트레이스. UCM (TSP1+2+4-KD)에서의 TSP의 침묵은 SCR-CTR에 의해 달성된 주파수 (도 6b, 도 6c) 및 진폭 (도 6d, 도 6e) 증가 둘 모두를 제거하였다. 정량화된 데이터는 누적 확률 플롯 (도 6b, 도 6d) 및 평균값의 막대 그래프 (도 6c, 도 6e)로 나타나 있다. n=15개의 세포/조건. (도 6f) ACM (양성 대조군), SCR-CTR 또는 TSP1+2+4-KD UCM으로 처리된 RGC 또는 단독으로 배양된 RGC (음성 대조군)로부터의 mEPSC를 나타내는 전 세포 패치 클램프 기록의 예시적인 트레이스. UCM (TSP1+2+4-KD)에서의 TSP의 침묵은 SCR-CTR에 의해 달성된 주파수 (도 6g, 도 6h) 및 진폭 (도 6i, 도 6j) 증가 둘 모두를 제거하였다. 정량화된 데이터는 누적 확률 플롯 (도 6g, 도 6i) 및 평균값의 막대 그래프 (도 6h, 도 6j)로 나타나 있다. n=15개의 세포/조건. 도 6k 내지 도 6n은 UCM 처리 RGC의 파형 특성에 대한 TSP 녹다운의 효과를 도시한다. KD-CTR 처리 RGC 기록과 TSP1+2+4-KD UCM 처리 RGC 기록 사이의 유사한 값에 의해 나타난 바와 같이, 상승 tau (도 6k, 도 6l) 또는 감쇠 tau (도 6m, 도 6n)는 hUTC에서의 TSP 발현의 침묵에 의해 유의한 영향을 받지 않았다 (n=15개의 세포/조건). 모든 데이터를 평균±SEM으로 표현하였고, 유의성은 *** p<0.0001, ** p<0.001 및 * p<0.05로 나타내었다.
도 7a 내지 도 7o. TSP는 UCM 유도 신경돌기 증생에 필요하지만 세포 생존에는 필요하지 않다. (도 7a) RGC 단독 (음성 대조군)과 비교하여 SCR-CTR, KD-CTR 또는 TSP1+2+4-KD UCM으로 처리된 RGC의 대표적인 골격화 흔적. 스케일 바: 100 μm. TSP 침묵 hUTC UCM (TSP1+2+4-KD UCM)은 두 대조군인 SCR-CTR과 KD-CTR 모두와 비교하여 총 신경돌기 증생의 길이 (도 7b), 돌기의 수 (도 7c) 및 가지의 수 (도 7d)를 감소시켰다 (n=40개 내지 48개의 세포/조건). hUTC에서의 TSP의 침묵으로 인해, UCM은 총 신경돌기 증생의 길이 (n=120개 내지 169개의 세포/조건) (도 7e) 및 숄 분석에 의해 나타난 복잡성 (n=25개의 세포/조건) (도 7f)을 감소시키게 되었다. #는 RGC 단독 조건과 비교하여 총 증생의 유의한 감소를 나타낸다 (p<0.05). (도 7g) 정제된 TSP의 존재 하에 KD-CTR 또는 TSP1+2+4-KD UCM으로 처리된 RGC의 대표적인 골격화 흔적. 스케일 바: 100 μm. TSP1+2+4-KD UCM으로의 정제된 TSP의 첨가는 UCM의 기능을 회복시켜 총 신경돌기 성장 (n=29개 내지 33개의 세포/조건) (도 7h) 및 복잡성 (n=30개의 세포/조건) (도 7i)을 향상시켰다. #는 RGC 단독 조건과 비교하여 총 증생의 유의한 감소를 나타낸다 (p<0.05). (도 7j) 생존 검정 시약으로 처리된 RGC의 대표적인 이미지 (생세포의 경우 칼세인-AM (녹색) 및 사멸된 세포의 경우 에티듐 호모다이머-1 (적색)). 스케일 바: 100 μm. (도 7k) 다양한 TSP-KD UCM 조건으로 처리된 RGC에서의 생존 백분율의 정량화 (n=30개의 현미경 필드/조건). TSP2 또는 TSP4 또는 모든 3개의 TSP의 침묵은 UCM의 생존 촉진 효과를 감소시켰다. (도 7l) TSP1+2+4-KD UCM으로의 순수한 TSP의 첨가는 KD-UCM의 완전한 생존 효과를 회복시키지 않았다 (n=20개의 현미경 필드/조건). 도 7m 내지 도 7o는 RGC에서의 UCM 유도 신경돌기 증생의 TSP 관여를 도시한다. (도 7m) RGC 단독 (음성 대조군)과 비교하여 SCR-CTR, KD-CTR 및 TSP-KD UCM으로 처리된 RGC의 대표적인 골격화 흔적. 스케일 바: 100 μm. hUTC에서의 TSP의 녹다운은 돌기 (도 7n) 및 가지 (도 7o)의 수를 감소시켰다 (n=120개 내지 169개의 세포/조건). 돌기 수 및 가지 수의 배수 변화를 RGC 단독 대조군에 대해 정규화하였다. 도 7p 내지 도 7r은 정제된 TSP의 첨가가 TSP1+2+4-KD UCM의 신경돌기 증생 기능을 구조하였음을 도시한다. (도 7p) 정제된 TSP의 존재 하에 KD-CTR 또는 TSP1+2+4-KD UCM으로 처리된 RGC의 대표적인 골격화 흔적. 스케일 바: 100 μm. 정제된 TSP를 TSP1+2+4-KD UCM으로 다시 첨가하는 것 (도 7q)은 돌기 수에 대하여 미미한 효과를 가졌지만 가지 수의 배수 변화를 회복시켰다 (도 7r) (n=29개 내지 33개의 세포/조건). 모든 데이터를 RGC 단독에 대해 정규화하여, 평균±SEM으로 표현하였고, 유의성은 *** p<0.0001, ** p<0.001 및 * p<0.05로 나타내었다.
도 8a 내지 도 8j. hUTC 분비TSP는 CSPG, Nogo-A 또는 MBP의 존재 하에 신경돌기 증생을 유도한다. 증가하는 농도의 CSPG (n=45개 내지 79개의 세포/조건) (도 8a) 또는 Nogo-A (n=30개 내지 37개의 세포/조건) (도 8b)로 코팅된 커버슬립에서의 총 신경돌기 증생의 정량화. 그래프는 CSPG 또는 Nogo-A를 함유하지 않는 커버슬립에 플레이팅된 RGC의 증생 값에 대해 정규화된 배수 증가로 나타나 있다. CSPG (0.05 ug/㎠) (도 8c) 또는 Nogo-A (1 ug/㎠) (도 8d) 코팅 커버슬립에 플레이팅된 SCR-CTR, TSP KD UCM 및 정제된 TSP로 처리된 RGC의 대표적인 골격화 흔적. 스케일 바: 100 μm. 도 8e 및 도 8f. CSPG (0.05 ug/㎠, n=62개 내지 103개의 세포/조건) (도 8e) 또는 Nogo-A (1 ug/㎠, n=25개 내지 29개의 세포/조건) (도 8f) 코팅 커버슬립에 플레이팅된 RGC의 총 신경돌기 증생의 정량화. 그래프는 각각의 배양 조건 하에서 성장 배지만으로 배양된 RGC (RGC 단독)의 값에 대해 정규화된 배수 증가로 나타나 있다 도 8g. SCR-CTR 또는 TSP1+2+4-KD UCM 단독 또는 MBP (10 ug/mL)의 존재 하에 정제된 TSP가 보충된 TSP1+2+4-KD UCM으로 처리된 RGC의 대표적인 골격화 흔적. 스케일 바: 100 μm. 도 8h. 성장 저해 물질의 존재 하에 정제된 TSP로 처리된 RGC의 대표적인 골격화 흔적. 스케일 바: 100 μm. 도 8i. 총 신경돌기 증생의 정량화는 MBP의 존재 하에 UCM 분비 TSP2의 신경돌기 증생 활성의 향상을 나타내었다 (n=40개 내지 54개의 세포/조건). 그래프는 RGC 단독 조건의 값에 정규화된 배수 증가로 나타나 있다. 도 8j. 정제된 TSP를 사용한 RGC의 처리는 CSPG, Nogo-A 또는 MBP의 존재 하에 유의한 증생을 유도할 수 있다 (n=41개 내지 54개의 세포/조건). 모든 데이터를 평균±SEM으로 표현하였고, 유의성은 *** p<0.0001, ** p<0.001 및 * p<0.05, n.s. 유의하지 않음으로 나타내었다. #는 RGC 단독 조건과 비교하여 총 증생의 유의한 감소를 나타낸다 (p<0.05).
본 발명의 다른 특징 및 이점은 하기의 발명을 실시하기 위한 구체적인 내용 및 실시예로부터 명백해질 것이다.
다양한 특허 및 다른 간행물이 명세서 전반에 걸쳐 언급되어 있다. 이러한 간행물 각각은 본 명세서에 전체적으로 참고로 포함된다. 하기 예시적인 실시 형태의 상세한 설명에서, 이의 부분을 형성하는 첨부 도면에 관하여 언급하고자 한다. 이들 실시 형태는 당업자가 본 발명을 실시할 수 있도록 충분히 상세하게 기술되어 있으며, 다른 실시 형태가 이용될 수 있고, 타당한 구조적, 기계적, 전기적 및 화학적 변화가 본 발명의 사상 또는 범주를 벗어나지 않고서 이루어질 수 있음이 이해된다. 당업자가 본 명세서에 기재된 실시 형태를 실시가능하게 하는 데 필요가 없는 세부 사항을 피하기 위해, 당업자에게 공지된 특정 정보에 대한 설명을 생략할 수 있다. 따라서, 하기 상세한 설명은 제한적인 의미로 받아들여지지 않아야 하고, 예시적인 실시 형태의 범주는 첨부된 청구범위에 의해 한정된다.
정의
본 명세서 및 청구범위에 걸쳐 사용된 다양한 용어는 하기 제시된 바와 같이 정의되며, 본 발명을 명확히 하기 위한 것이다.
줄기 세포는 자가 재생할 뿐만 아니라, 분화되어, 자가 재생 전구체, 비재생 전구체, 및 최종 분화된 세포를 비롯한 자손 세포(progeny cell)를 생성하는 단일 세포의 능력에 의해 정의되는 미분화 세포이다. 줄기 세포는 또한 다수의 배엽층 (내배엽, 중배엽 및 외배엽)으로부터 다양한 세포 계통의 기능성 세포로 시험관내에서 분화되는 이의 능력뿐만 아니라 이식 후 다수의 배엽층의 조직을 생성시키며 배반포 내로의 주입 후 전부는 아니라 하더라도 대부분의 조직에 실질적으로 기여하는 이의 능력을 특징으로 한다.
줄기 세포는 그의 발생능(developmental potential)에 따라 하기와 같이 분류된다: (1) 전능성(totipotent); (2) 만능성; (3) 다능성; (4) 소기능성(oligopotent); 및 (5) 단일기능성(unipotent). 전능성 세포는 모든 배아 및 배외 세포 유형을 생성시킬 수 있다. 만능성 세포는 모든 배아 세포 유형을 생성시킬 수 있다. 다능성 세포는, 세포 계통의 하위세트(subset)이지만 모두 특정 조직, 기관 또는 생리학적 시스템 내에 있는 하위세트를 생성시킬 수 있는 세포 (예를 들어, 조혈 줄기 세포(hematopoietic stem cell, HSC)는 HSC (자가 재생), 혈구 세포 제한 소기능성 전구체 및 혈액의 정상 성분인 모든 세포 유형 및 요소 (예를 들어, 혈소판)를 포함하는 자손을 생성할 수 있음)를 포함한다. 소기능성인 세포는 다능성 줄기 세포보다 더 제한된 세포 계통의 하위세트를 생성시킬 수 있고; 단일기능성인 세포는 단일 세포 계통 (예를 들어, 정자형성 줄기 세포)을 생성시킬 수 있다.
줄기 세포는 또한 이것이 얻어질 수 있는 공급원에 기초하여 분류된다. 성체 줄기 세포는 대체로 다수의 분화된 세포 유형을 포함하는 조직에서 발견되는 다능성 미분화 세포이다. 성체 줄기 세포는 스스로 재생할 수 있다. 정상 환경 하에서, 이는 또한 분화되어, 그의 기원이 되는 조직의 특수화된 세포 유형, 및 가능하게는 다른 조직 유형을 제공할 수 있다. 유도 만능성 줄기 세포 (iPS 세포)는 만능성 줄기 세포로 변환되는 성체 세포이다. (문헌[Takahashi et al., Cell, 2006; 126 (4):663-676]; 문헌[Takahashi et al., Cell, 2007; 131:1-12]). 배아 줄기 세포는 배반포기 배아의 내세포집단 유래의 만능성 세포이다. 태아 줄기 세포는 태아 조직 또는 막으로부터 기원된 것이다. 산후 줄기 세포는 출산 후에 입수할 수 있는 배외 조직, 즉 태반 및 제대로부터 실질적으로 기원된 다능성 또는 만능성 세포이다. 이들 세포는 급속 증식 및 많은 세포 계통으로의 분화능을 포함하는 만능성 줄기 세포에 특유한 특징을 보유하는 것으로 밝혀졌다. 산후 줄기 세포는 혈액 유래 (예를 들어, 제대혈로부터 얻어지는 것과 같음)이거나 비혈액(non-blood) 유래(예를 들어, 제대 및 태반의 비혈액 조직으로부터 얻어진 바와 같음)일 수 있다.
배아 조직은 전형적으로 배아 (인간의 경우 수정에서 발생 약 6주까지의 기간을 지칭함)로부터 기원되는 조직으로 정의된다. 태아 조직은, 인간의 경우 발생 약 6주에서 분만까지의 기간을 지칭하는, 태아로부터 기원되는 조직을 지칭한다. 배외 조직은 배아 또는 태아와 관련되지만 이로부터 기원되지 않는 조직이다. 배외 조직은 배외 막 (융모막, 양막, 난황낭 및 요막), 제대 및 태반 (그 자체가 융모막 및 모체 기저탈락막으로부터 형성됨)을 포함한다.
분화는 특수화되지 않은 ("미수임된(uncommitted)") 또는 덜 특수화된 세포가, 예를 들어 신경 세포 또는 근육 세포와 같은 특수화된 세포의 특징을 획득하는 과정이다. 분화된 세포는 세포의 계통 내에서 보다 특수화된 ("수임된(committed)") 위치를 차지한 것이다. 분화 과정에 적용될 때, 수임된이란 용어는 분화 경로에서, 정상적인 환경 하에서 특정 세포 유형 또는 세포 유형의 하위세트로 계속 분화될 것이며, 정상적인 환경 하에서 다른 세포 유형으로 분화될 수 없거나 덜 분화된 세포 유형으로 되돌아갈 수 없는 시점까지 진행한 세포를 지칭한다. 탈분화(de-differentiation)는 세포가 세포의 계통 내의 덜 특수화된 (또는 수임된) 위치로 되돌아가는 과정을 지칭한다. 본 명세서에 사용된 바와 같이, 세포의 계통은 세포의 유전, 즉, 어느 세포로부터 왔는지 그리고 어떤 세포를 생성시킬 수 있는지를 규정한다. 세포의 계통은 세포를 발생과 분화의 유전적 체계 내에 둔다.
넓은 의미에서, 전구 세포는 그 자신보다 더 분화되지만 전구체의 풀(pool)을 보충하는 능력을 유지하는 자손을 생성하는 능력을 갖는 세포이다. 이 정의에 의하면, 줄기 세포 그 자체는 또한, 최종 분화된 세포에 대한 더 가까운 선구체(precursor)가 그러하듯이, 전구 세포이다. 본 발명의 세포를 지칭하는 경우, 하기에 더욱 상세히 기술된 바와 같이, 이러한 넓은 정의의 전구 세포가 사용될 수 있다. 좁은 의미에서, 전구 세포는 종종 분화 경로에서의 중간체인 세포로 정의되며, 다시 말하면, 이는 줄기 세포로부터 발생하고, 성숙 세포 유형 또는 세포 유형의 하위세트의 생성에서의 중간체이다. 이러한 유형의 전구 세포는 대체로 자가 재생할 수 없다. 따라서, 이러한 유형의 세포가 본 명세서에 지칭되는 경우, 이는 비재생 전구 세포 또는 중간 전구 세포 또는 중간 선구 세포로 지칭될 것이다.
본 명세서에 사용된 바와 같이, 문구 "안구 계통 또는 표현형으로 분화된다"는, 제한 없이 망막 및 각막 줄기 세포, 망막 및 홍채의 색소 상피 세포, 광수용체, 망막 신경절 및 다른 시신경 계통 (예를 들어, 망막 아교세포, 미세아교세포(microglia), 성상세포, 뮐러 세포(Mueller cell)), 수정체를 형성하는 세포, 및 공막, 각막, 윤부 및 결막의 상피 세포를 포함하는 특정 안구 표현형으로 부분적으로 또는 완전히 수임되는 세포를 지칭한다. 문구 "신경 계통 또는 표현형으로 분화된다"는 CNS 또는 PNS의 특정 신경 표현형, 즉, 뉴런 또는 아교 세포로 부분적으로 또는 완전히 수임되는 세포를 지칭하며, 후자의 범주는 제한 없이 성상세포, 희소돌기아교세포, 슈반 세포(Schwann cell) 및 미세아교세포를 포함한다.
본 명세서에 예시되고 본 발명에서 사용하기에 바람직한 세포는 대체로 산후 유래 세포 (또는 PPDC)로 지칭된다. 또한, 이것은 때때로 더 구체적으로는 제대 유래 세포 또는 태반 유래 세포 (UDC 또는 PDC)로 지칭될 수 있다. 또한, 세포는 줄기 또는 전구 세포인 것으로 기술될 수 있으며, 후자의 용어는 넓은 의미로 사용된다. 유래라는 용어는 세포를 이의 생물학적 공급원으로부터 얻고 성장시키거나, 시험관내에서 다른 방식으로 조작한 (예를 들어, 성장 배지 중에서 배양하여, 집단을 증식시키고/시키거나 세포주를 생성한) 것을 나타내기 위하여 사용된다. 제대 줄기 세포 및 태반 줄기 세포의 시험관내 조작 및 본 발명의 제대 유래 세포와 태반 유래 세포의 독특한 특징은 하기에 상세히 기재된다. 다른 수단에 의해 산후 태반 및 제대로부터 단리된 세포가 또한 본 발명에 사용하기에 적합한 것으로 간주된다. 이러한 다른 세포는 본 명세서에서 (산후 유래 세포라기보다는) 산후 세포로 지칭된다.
다양한 용어를 사용하여 배양 중인 세포를 기재한다. 세포 배양물은 대체로 살아있는 유기체로부터 취해지고, 조절된 조건 하에서 성장된 ("배양 중" 또는 "배양된") 세포를 지칭한다. 1차 세포 배양물은 첫 번째 계대배양(subculture) 전에 유기체(들)로부터 직접 취한 세포, 조직 또는 기관의 배양물이다. 세포는 세포 성장 및/또는 분열을 촉진하는 조건 하에 세포를 성장 배지 내에 넣을 때 배양 중 증식되어서 더욱 큰 세포 집단을 생성한다. 세포가 배양 중 증식될 때, 세포 증식 속도는 때때로 세포수의 배가에 필요한 시간의 양으로 측정된다. 이는 배가 시간(doubling time)으로 지칭된다.
세포주는 1차 세포 배양물의 1회 이상의 계대배양에 의해 형성되는 세포 집단이다. 계대배양의 각각의 라운드(round)는 계대로 지칭된다. 세포가 계대배양될 때, 세포는 계대된 것으로 지칭된다. 세포의 특정 집단, 또는 세포주는 때로는 그가 계대된 횟수로 지칭되거나 그러한 횟수에 의해 특징규명된다. 예를 들어, 10회 계대된 배양 세포 집단은 P10 배양물로서 지칭될 수 있다. 1차 배양, 즉 조직으로부터 세포를 단리한 후 첫 번째 배양을 P0으로 명명한다. 첫 번째 계대배양 후에, 세포는 2차 배양물로 기술된다(P1 또는 계대 1). 두 번째의 계대배양 후, 세포는 3차 배양물(P2 또는 계대 2) 등이 된다. 당업자라면 계대 기간 동안 많은 집단의 배가가 있을 수 있으며, 따라서 배양물의 집단 배가 수는 계대 수보다 크다는 것을 이해할 것이다. 계대 사이의 기간 동안 세포의 증식(즉, 집단 배가 수)은 시딩 밀도(seeding density), 기재(substrate), 배지, 성장 조건 및 계대 간 시간을 포함하지만 이에 한정되지 않는 많은 인자에 좌우된다.
성장 배지란 용어는 대체로 PPDC를 배양하기에 충분한 배지를 지칭한다. 특히, 본 발명의 세포를 배양하기 위한 현재 바람직한 하나의 배지는 둘베코 변형 필수 배지(Dulbecco's Modified Essential Media) (본 명세서에서 DMEM이라고도 약칭함)를 포함한다. DMEM-저농도 글루코스(DMEM-low glucose) (또한 본 명세서에서 DMEM-LG임) (미국 캘리포니아주 칼스배드 소재의 Invitrogen)가 특히 바람직하다. DMEM-저농도 글루코스에 바람직하게는 15% (v/v) 소 태아 혈청 (예를 들어, 규명된 소 태아 혈청, 미국 유타주 로건 소재의 Hyclone), 항생제/항진균제(antimycotic) (바람직하게는 50 내지 100 단위/밀리리터의 페니실린, 50 내지 100 마이크로그램/밀리리터의 스트렙토마이신 및 0 내지 0.25 마이크로그램/밀리리터의 암포테리신 B; 미국 캘리포니아주 칼스배드 소재의 Invitrogen), 및 0.001% (v/v)의 2-메르캅토에탄올 (미국 미주리주 세인트루이스 소재의 Sigma)이 보충된다. 하기 실시예에 사용된 바와 같이, 성장 배지는 15% 소 태아 혈청 및 항생제/항진균제 (페니실린/스트렙토마이신이 포함되는 경우, 이것은 바람직하게는 각각 50 U/ml 및 50 마이크로그램/ml이고; 페니실린/스트렙토마이신/암포테리신이 사용되는 경우, 이것은 바람직하게는 각각 100 U/ml, 100 마이크로그램/ml 및 0.25 마이크로그램/ml임)를 함유한 DMEM-저농도 글루코스를 지칭한다. 일부 경우에, 상이한 성장 배지가 사용되거나, 상이한 보충물이 제공되며, 이들은 보통 성장 배지에 대한 보충물로서 텍스트에 설명되어 있다.
컨디셔닝된 배지는 특정 세포 또는 세포 집단이 배양되고 이어서 제거된 배지이다. 세포가 배지 중에서 배양될 때, 이러한 세포는 다른 세포에 영양 지원 (trophic support)을 제공할 수 있는 세포 인자를 분비할 수 있다. 이러한 영양 인자는 호르몬, 사이토카인, 세포외 매트릭스(ECM), 단백질, 소포, 항체 및 과립을 포함하지만 이에 한정되지 않는다. 세포 인자를 함유하는 배지는 컨디셔닝된 배지이다.
대체로, 영양 인자는 세포의 생존, 성장, 증식 및/또는 성숙을 촉진하거나 세포의 활성 증가를 자극하는 물질로 정의된다. 영양 인자를 통한 세포 간의 상호작용은 다양한 유형의 세포 간에 발생할 수 있다. 영양 인자에 의한 세포 상호작용은 본질적으로 모든 세포 유형에서 발견되며, 신경 세포 유형 간에 특히 유의한 소통 수단이다. 또한, 영양 인자는 자가분비 방식으로 기능할 수 있는데, 즉, 세포는 그 자체의 생존, 성장, 분화, 증식 및/또는 성숙에 영향을 미치는 영양 인자를 생성할 수 있다.
배양된 척추동물 세포를 지칭할 때, 노화 (복제 노화 또는 세포 노화라고도 함)라는 용어는 유한한 세포 배양에 기인하는 특성, 즉, 유한한 수의 집단 배가 (때때로 헤이플릭 한계(Hayflick's limit)로 지칭됨)를 넘어서 성장하지 못하는 이의 능력을 지칭한다. 세포 노화는 섬유아세포 유사 세포를 사용하여 최초로 설명되었지만, 배양 중 성공적으로 성장할 수 있는 대부분의 정상 인간 세포 유형은 세포 노화를 겪는다. 다양한 세포 유형의 시험관내 수명은 다양하지만, 최대 수명은 전형적으로 100회 미만의 집단 배가이다 (이것은 배양물 중의 모든 세포가 노화됨에 따라 배양물이 분열할 수 없게 하는 배가 횟수임). 노화는 발생순서적 시간에 좌우되는 것이 아니라 배양물이 겪은 세포 분열 또는 집단 배가의 횟수에 의해 측정된다.
안구, 안과 및 시각이라는 용어는 "눈의, 또는 눈에 관한, 또는 눈과 관련된"을 규정하기 위해 본 명세서에서 상호교환적으로 사용된다.
안구 변성 질환 (또는 장애)이라는 용어는 세포 손상, 변성 또는 손실을 수반하는 눈과 뇌 사이의 신경 연결을 포함한 눈의 급성 및 만성 질환, 장애 또는 질병을 포함하는 포괄적인 용어이다. 안구 변성 질환은 연령 관련될 수 있거나 상해 또는 외상에 기인할 수 있거나 특정 질병 또는 장애와 관련될 수 있다. 급성 안구 변성 질환은, 뇌혈관 기능부전, 국소 또는 미만성 뇌 외상, 미만성 뇌 손상, 눈의 감염 또는 염증 질환, 망막 파열 또는 박리, 안구내 병변 (타박상 침투, 압박, 열상) 또는 다른 물리적 상해 (예를 들어, 물리적 또는 화학적 화상)로부터 발생하는 질환을 포함하는, 눈에 영향을 미치는 세포 사멸 또는 약화(compromise)와 관련된 질환을 포함하지만 이에 한정되지 않는다. 만성 안구 변성 질환 (진행성 질환을 포함함)은 하기와 같은 것을 포함하지만 이에 한정되지 않는다: 망막병증 및 다른 망막/황반 장애, 예를 들어 망막색소변성 (RP), 연령 관련 황반 변성 (AMD), 맥락막 신생혈관막 (CNVM); 망막병증, 예를 들어 당뇨 망막병증, 폐쇄성 망막병증, 겸상 세포 망막병증 및 고혈압 망막병증, 중심 망막 정맥 폐쇄, 경동맥 협착증, 시신경병증, 예를 들어 녹내장 및 관련 증후군; 수정체 및 외안(outer eye)의 장애, 예를 들어 화학적 또는 열적 상해로 발생하는 바와 같은 윤부 상피 세포 결핍 (LECD)으로도 지칭되는 윤부 줄기 세포 결핍 (LSCD), 스티븐-존슨 증후군(Steven-Johnson syndrome), 콘택트 렌즈 유도 각막병증, 안반흔성유천포창(ocular cicatricial pemphigoid), 선천성 무홍채증 또는 외배엽 이형성증 질병, 및 다중 내분비 결핍 관련 각막염.
'안구 변성 질환을 치료하는' (또는 안구 변성 질환의 치료)이라는 용어는 본 명세서에 정의된 바와 같은 안구 변성 질환의 효과를 완화시키거나, 그의 진행을 지연, 중지 또는 역전시키거나, 그의 발병을 지연 또는 예방하는 것을 지칭한다.
유효량이라는 용어는 본 명세서에 기술된 바와 같이 시험관내 또는 생체내(in vivo) 세포 성장 및/또는 분화 또는 안구 변성 질환의 치료를 포함하는 의도된 결과를 생성시키기에 효과적인, 시약 또는 약제학적 조성물, 예를 들어 성장 인자, 분화제, 영양 인자, 세포 집단 또는 다른 작용제의 농도 또는 양을 지칭한다. 성장 인자와 관련하여, 유효량은 약 1 나노그램/밀리리터 내지 약 1 마이크로그램/밀리리터의 범위일 수 있다. 생체내에서 환자에게 투여될 때의 PPDC와 관련하여, 유효량은 수백개 이하만큼 적은 양부터 수백만개 이상만큼 많은 양까지의 범위일 수 있다. 특정 실시 형태에서, 유효량은 103 내지 1111개, 더 구체적으로는 적어도 약 104개의 세포의 범위일 수 있다. 투여될 세포수는 의학 생물학자에게 익숙한 다른 인자들 중에서 치료될 크기 또는 총 체적/표면적뿐만 아니라 치료될 영역의 위치에 대한 투여 부위의 근접성을 포함하지만 이에 한정되지 않는 치료될 장애의 세부 사항에 따라 달라질 것임이 인식될 것이다.
유효 기간 (또는 시간) 및 유효 조건이라는 용어는 작용제 또는 약제학적 조성물이 그의 의도된 결과를 달성하는 데 필요하거나 바람직한 일정한 기간 또는 다른 제어가능한 조건 (예를 들어, 시험관내 방법을 위한 온도, 습도)을 지칭한다.
환자 또는 피검자라는 용어는 약제학적 조성물로 치료되거나 본 명세서에 기술된 방법에 따라 치료되는 포유류를 포함하는 동물, 바람직하게는 인간을 지칭한다.
생물학적으로 양립가능한 담체 또는 매체라는 용어와 상호교환적으로 사용될 수 있는 약제학적으로 허용가능한 담체 (또는 매체)라는 용어는 치료적으로 투여할 세포 및 다른 작용제와 양립가능할 뿐만 아니라, 건전한 의학적 판단의 범위 내에서 타당한 유익성/위험성 비(benefit/risk ratio)에 상응하는 과도한 독성, 자극, 알러지 반응 또는 다른 합병증 없이, 인간 및 동물의 조직과의 접촉 시 사용하기에 적합한 시약, 세포, 화합물, 물질, 조성물 및/또는 투여형을 지칭한다.
몇몇 용어가 세포 대체 요법과 관련하여 본 명세서에서 사용된다. 자가 전달(autologous transfer), 자가 이식, 자가이식편 등의 용어는 세포 공여체가 세포 대체 요법의 수령체이기도 한 처리를 지칭한다. 동종이계 전달(allogeneic transfer), 동종이계 이식, 동종이식편(allograft) 등의 용어는 세포 공여체가 세포 대체 요법의 수령체와 동일한 종이지만 동일한 개체는 아닌 처리를 지칭한다. 공여체의 세포가 수령체와 조직학적으로 매칭된 세포 전달은 때때로 동계 전달(syngeneic transfer)로 지칭된다. 이종 전달(xenogeneic transfer), 이종 이식, 이종이식편 등의 용어는 세포 공여체가 세포 대체 요법의 수령체와 상이한 종인 처리를 지칭한다. 본 명세서에 사용된 바와 같은 이식은 수령체로의 자가 또는 동종이계 공여체 세포 대체 요법의 도입을 지칭한다.
본 명세서에 사용된 바와 같이, 측정가능한 값, 예를 들어 양, 시간적 길이 등을 지칭할 때 용어 "약"은 특정된 값으로부터 ± 20% 내지 ± 0.1%, 바람직하게는 ± 20% 또는 ± 10%, 더 바람직하게는 ± 5%, 더욱 더 바람직하게는 ± 1%, 그리고 훨씬 더 바람직하게는 ± 0.1%의 변화를 포함함을 의미하며, 이러한 변화는 개시된 발명을 수행하기에 적절한 바와 같다.
상세한 설명
다양한 원인을 갖는 급성, 만성 및 진행성 장애 및 질병을 포함하는 안구 변성 질환은 특정한 또는 취약한 안구 세포 그룹의 기능장애 또는 손실을 공통적 특징으로 갖는다. 이러한 공통점은 취약한, 손상된 또는 손실된 안구 조직 또는 세포의 수복 또는 재생을 위한 유사한 치료법의 개발을 가능하게 하며, 그 중 하나가 세포 기반 요법이다. 안구 변성 질환을 위한 세포 요법의 개발은 안구 유래 줄기 세포 그 자체 (예를 들어, 망막 및 각막 줄기 세포), 배아 줄기 세포 및 몇몇 유형의 성체 줄기 또는 전구 세포 (예를 들어, 신경, 점막 상피 및 골수 줄기 세포)를 포함하는 비교적 적은 유형의 줄기 또는 전구 세포로 제한되어 왔다. 산후 제대 및 태반으로부터 단리된 세포는 이러한 목적을 위한 전구 세포의 유의한 신규 공급원으로 확인되었다. (미국 특허 출원 공개 제2005-0037491호 및 미국 특허 출원 공개 제2010-0272803호). 더욱이, 산후 태반 및 제대 조직으로부터 단리된 세포로부터 생성된 컨디셔닝된 배지는 안구 변성 질환을 치료하기 위한 다른 신규 공급원을 제공한다. 따라서, 본 명세서에 기술된 다양한 실시 형태에서, 본 발명은 산후 제대 또는 태반으로부터 단리된 세포와 같은 전구 세포로부터의 컨디셔닝된 배지를 사용하는 (안구 조직의 수복 및 재생을 위한) 방법 및 약제학적 조성물을 특징으로 한다. 본 발명은 안구 변성 질환에 적용가능하지만, 치료 또는 치유가 어렵거나 이용불가능한 다수의 안구 장애에 대하여 특히 적합할 것으로 기대된다. 이것은 제한 없이 연령 관련 황반 변성, 망막색소변성, 당뇨 망막병증 및 다른 망막병증을 포함한다.
당업계에 공지된 임의의 방법에 따라 산후 제대 또는 태반으로부터 단리된 세포와 같은 전구 세포로부터 유래된 컨디셔닝된 배지가 본 발명에 사용하기에 적합할 것으로 기대된다. 그러나, 일 실시 형태에서, 본 발명은 상기 정의된 바와 같은 제대 조직 유래 세포 (hUTC) 또는 태반 조직 유래 세포 (PDC)로부터 유래된 컨디셔닝된 배지를 사용하며, 이들 세포는 바람직하게는 아래에 설명된 방법에 따라 혈액이 실질적으로 없게 만들어진 제대 조직 또는 태반으로부터 유래된다. hUTC 또는 PDC는 배양 중 증식가능하고, 다른 표현형의 세포로 분화될 가능성을 갖는다. 특정 실시 형태는 이러한 전구 세포로부터 제조된 컨디셔닝된 배지, 컨디셔닝된 배지를 포함하는 약제학적 조성물, 및 급성 또는 만성 안구 변성 질환에 걸린 환자의 치료를 위해 약제학적 조성물을 사용하는 방법을 특징으로 한다. 본 발명의 산후 유래 세포는 배양 중 이의 성장 특성, 이의 세포 표면 마커, 이의 유전자 발현, 특정한 생화학적 영양 인자를 생성하는 이의 능력, 및 이의 면역학적 특성에 의해 특징규명되었다. 산후 유래 세포로부터 유래된 컨디셔닝된 배지는 그 세포에 의해 분비된 영양 인자에 의해 특징규명되었다.
세포의 제조
본 발명의 조성물 및 방법에 사용되는 세포, 세포 용해물을 포함하는 세포 집단 및 조제물, 컨디셔닝된 배지 등은 본 명세서에 그리고 상세하게는, 각각 본 명세서에 참고로 포함된, 미국 특허 제7,524,489호 및 제7,510,873호, 및 미국 특허 출원 공개 제2005/0058634호에 기술되어 있다. 산후 세포를 사용하는 방법에 따르면, 포유류 제대 및 태반은 만삭(full-term) 임신 또는 만삭전(pre-term) 임신의 종료 시 또는 종료 직후에, 예를 들어 출산 후 만출(expulsion) 후에 회수된다. 산후 조직은 출산 장소에서 멸균 용기, 예를 들어 플라스크, 비커, 배양 접시 또는 백(bag)에 넣어져 실험실로 수송될 수 있다. 용기는 염 용액, 예를 들어 둘베코 변형 이글 배지(Dulbecco's Modified Eagle's Medium, DMEM) 또는 인산염 완충 식염수 (PBS) 또는 이식용으로 사용되는 기관의 수송에 사용되는 임의의 용액, 예를 들어 위스콘신 대학 용액(University of Wisconsin solution) 또는 퍼플루오로화학물질 용액 (perfluorochemical solution)을 포함하지만 이에 한정되지 않는 용액 또는 배지를 가질 수 있다. 하나 이상의 항생제 및/또는 항진균제, 예를 들어, 비제한적으로, 페니실린, 스트렙토마이신, 암포테리신 B, 젠타마이신 및 니스타틴이 배지 또는 완충액에 첨가될 수 있다. 산후 조직은 항응고(anticoagulant) 용액, 예를 들어 헤파린 함유 용액으로 헹굴 수 있다. PPDC의 추출 전에 약 4 내지 10℃에서 조직을 유지하는 것이 바람직하다. PPDC의 추출 전에 조직을 동결시키지 않는 것이 더욱 더 바람직하다.
PPDC의 단리는 바람직하게는 무균 환경에서 일어난다. 제대는 당업계에 공지되어 있는 수단에 의해 태반으로부터 분리될 수 있다. 대안적으로, 제대 및 태반은 분리 없이 사용된다. 혈액 및 잔사(debris)가 바람직하게는 PPDC의 단리 이전에 산후 조직으로부터 제거된다. 예를 들어, 산후 조직은 인산염 완충 식염수와 같은, 그러나 이에 한정되지 않는 완충 용액으로 세척될 수 있다. 또한, 세척 완충액은 페니실린, 스트렙토마이신, 암포테리신 B, 젠타마이신 및 니스타틴과 같은, 그러나 이에 한정되지 않는 하나 이상의 항진균제 및/또는 항생제를 포함할 수 있다.
전체 태반 또는 제대, 또는 이의 단편 또는 절편을 포함하는 산후 조직은 기계적인 힘 (민싱 포스(mincing force) 또는 전단력)에 의해 해체된다. 현재 바람직한 실시 형태에서, 단리 절차는 또한 효소 분해 과정을 이용한다. 복합 조직 매트릭스로부터 개별 세포를 단리하여 배양 중 성장을 촉진하기에 유용한 많은 효소가 당업계에 알려져 있다. 약한 분해력 (예를 들어, 데옥시리보뉴클레아제 및 중성 프로테아제, 디스파제(dispase))으로부터 강한 분해력 (예를 들어, 파파인 및 트립신)의 범위에 걸쳐, 이러한 효소는 구매가능하다. 본 발명과 양립가능한 효소의 망라되지 않은 목록은 점액용해(mucolytic) 효소 활성, 메탈로프로테아제(metalloprotease), 중성 프로테아제, 세린 프로테아제 (예를 들어, 트립신, 키모트립신 또는 엘라스타제) 및 데옥시리보뉴클레아제를 포함한다. 메탈로프로테아제, 중성 프로테아제 및 점액용해 활성으로부터 선택되는 효소 활성이 현재 바람직하다. 예를 들어, 콜라게나제는 조직으로부터 다양한 세포를 단리하는 데 유용한 것으로 공지되어 있다. 데옥시리보뉴클레아제는 단일 가닥 DNA를 분해시킬 수 있으며, 단리 동안 세포 클럼핑(clumping)을 최소화시킬 수 있다. 바람직한 방법은, 예를 들어 콜라게나제 및 디스파제, 또는 콜라게나제, 디스파제, 및 하이알루로니다제를 사용한 효소적 처리를 포함하며, 이러한 방법은, 특정한 바람직한 실시 형태에서 콜라게나제와 중성 프로테아제인 디스파제의 혼합물이 해리 단계에서 사용되는 경우 제공된다. 클로스트리디움 히스톨리티쿰(Clostridium histolyticum) 유래의 적어도 하나의 콜라게나제와, 프로테아제 활성, 디스파제 및 서모 라이신(thermo lysin) 중 어느 하나의 존재 하에서의 분해를 사용하는 방법이 더 바람직하다. 콜라게나제와 디스파제 효소 활성 둘 모두를 사용한 분해를 사용하는 방법이 더욱 더 바람직하다. 콜라게나제 및 디스파제 활성에 더하여 하이알루로니다제 활성을 사용한 분해를 포함하는 방법이 또한 바람직하다. 당업자라면, 많은 이러한 효소 처리가 다양한 조직 공급원으로부터 세포를 단리하기 위한 것으로 당업계에 공지되어 있음을 인식할 것이다. 예를 들어, LIBERASE™ 블렌드자임(Blendzyme) 3 (Roche) 시리즈의 효소 조합이 본 발명의 방법에서 사용하기에 적합하다. 효소의 다른 공급원이 공지되어 있으며, 당업자라면 또한 이러한 효소를 그의 천연 공급원으로부터 직접적으로 얻을 수 있다. 또한, 당업자라면 새로운, 또는 추가의 효소 또는 효소 조합을 본 발명의 세포의 단리에 있어서의 그의 유용성에 대해 평가하는 데 준비가 잘 되어 있다. 바람직한 효소 처리는 0.5, 1, 1.5, 또는 2시간 또는 그 이상의 시간이 걸린다. 다른 바람직한 실시 형태에서, 조직은 해리 단계의 효소 처리 동안 37℃에서 인큐베이션된다.
본 발명의 일부 실시 형태에서, 산후 조직은 조직의 다양한 양상, 예를 들어 태반의 신생아, 신생아/모체, 및 모체 양상을 포함하는 절편으로 분리된다. 이어서, 분리된 절편은 본 명세서에 기술된 방법에 따라 기계적 및/또는 효소적 해리에 의해 해리된다. 신생아 또는 모체 계통의 세포는 당업계에 공지되어 있는 임의의 수단에 의해, 예를 들어 Y 염색체에 대한 원위치(in situ) 혼성화 또는 핵형 분석에 의해 확인될 수 있다.
단리된 세포 또는 산후 조직 - 이로부터 PPDC가 성장함 - 은 세포 배양을 개시 또는 시딩하는 데 사용될 수 있다. 단리된 세포를 세포외 매트릭스 또는 리간드, 예를 들어 라미닌, 콜라겐 (천연, 변성 또는 가교결합), 젤라틴, 피브로넥틴, 및 다른 세포외 매트릭스 단백질로 코팅되거나 코팅되지 않은 멸균 조직 배양 용기로 옮긴다. PPDC는, DMEM (고농도 또는 저농도 글루코스), 고등(advanced) DMEM, DMEM/MCDB 201, 이글 기본 배지(Eagle's basal medium), 햄 F10 배지(Ham's F10 medium, F10), 햄 F-12 배지(F12), 이스코브 변형 둘베코 배지(Iscove's modified Dulbecco's medium), 중간엽 줄기 세포 성장 배지(MSCGM), DMEM/F12, RPMI 1640, 및 cellgro FREE™와 같은, 그러나 이에 한정되지 않는, 세포의 성장을 지속시킬 수 있는 임의의 배양 배지 중에서 배양된다. 배양 배지에는, 예를 들어 하기와 같은 것을 포함하는 하나 이상의 성분이 보충될 수 있다: 소 태아 혈청 (FBS), 바람직하게는 약 2 내지 15% (v/v); 말 혈청 (ES); 인간 혈청 (HS); 베타-메르캅토에탄올 (BME 또는 2-ME), 바람직하게는 약 0.001% (v/v); 하나 이상의 성장 인자, 예를 들어 혈소판 유래 성장 인자(platelet-derived growth factor, PDGF), 상피 성장 인자(epidermal growth factor, EGF), 섬유아세포 성장 인자(fibroblast growth factor, FGF), 혈관 내피 성장 인자(vascular endothelial growth factor, VEGF), 인슐린 유사 성장 인자-1(insulin-like growth factor-1, IGF-1), 백혈구 저해 인자(leukocyte inhibitory factor, LIF) 및 에리트로포이에틴; L-발린을 포함하는 아미노산; 및 예를 들어 단독의 또는 조합된, 페니실린 G, 스트렙토마이신 설페이트, 암포테리신 B, 젠타마이신 및 니스타틴과 같은 미생물 오염 제어를 위한 하나 이상의 항생제 및/또는 항진균제. 배양 배지는 바람직하게는 성장 배지 (DMEM-저농도 글루코스, 혈청, BME 및 항생제)를 포함한다.
세포는 세포 성장을 가능하게 하는 밀도로 배양 용기에 시딩된다. 바람직한 실시 형태에서, 세포는 공기 중 약 0 내지 약 5 부피%의 CO2에서 배양된다. 일부 바람직한 실시 형태에서, 세포는 공기 중 약 2 내지 약 25%의 O2, 바람직하게는 공기 중 약 5 내지 약 20%의 O2에서 배양된다. 세포는 바람직하게는 약 25 내지 약 40℃에서 배양되며, 더 바람직하게는 37℃에서 배양된다. 세포는 바람직하게는 인큐베이터에서 배양된다. 배양 용기의 배지는 정지 상태이거나, 예를 들어 생물반응기(bioreactor)를 사용하여 교반될 수 있다. PPDC는 바람직하게는 (예를 들어, 글루타티온, 비타민 C, 카탈라제, 비타민 E, N-아세틸시스테인의 첨가에 의해) 낮은 산화 스트레스 하에 성장된다. 본 명세서에 사용된 바와 같이, "낮은 산화 스트레스"는 배양 세포에 대한 자유 라디칼 손상이 전혀 없거나 또는 최소인 조건을 지칭한다.
가장 적절한 배양 배지, 배지 제조 및 세포 배양 기법의 선택 방법은 당업계에 널리 공지되어 있고, 문헌[Doyle et al., (eds.), 1995, CELL & TISSUE CULTURE: LABORATORY PROCEDURES, John Wiley & Sons, Chichester] 및 문헌[Ho and Wang (eds.), 1991, ANIMAL CELL BIOREACTORS, Butterworth-Heinemann, Boston]을 포함한 다양한 출처에 기술되어 있으며, 이들 문헌은 본 명세서에 참고로 포함된다.
단리된 세포 또는 조직 단편을 충분한 기간 동안 배양한 후, PPDC는 산후 조직으로부터의 이주 또는 세포 분열 중 어느 하나 또는 이들 둘 모두의 결과로서 성장하였을 것이다. 본 발명의 일부 실시 형태에서, PPDC는 처음에 사용된 것과 동일하거나 상이한 유형의 신선한 배지를 함유하는 별도의 배양 용기로 옮겨지거나 계대되며, 여기서는 세포 집단이 유사 분열로 증식될 수 있다. 본 발명의 세포는 계대 0 내지 노화의 임의의 시점에서 사용될 수 있다. 세포는 바람직하게는 약 3 내지 약 25회 계대되며, 더 바람직하게는 약 4 내지 약 12회 계대되며, 바람직하게는 10 또는 11회 계대된다. 클로닝 및/또는 서브클로닝을 수행하여 세포의 클론 집단이 단리되었음을 확인할 수 있다.
본 발명의 일부 태양에서, 산후 조직에 존재하는 다양한 세포 유형은 PPDC가 단리될 수 있는 아집단(subpopulation)으로 분획화된다. 이것은 산후 조직을 그의 성분 세포로 해리시키기 위한 효소적 처리를 포함하지만 이에 한정되지 않는 세포 분리를 위한 표준 기법에 이어서, 예를 들어 하기와 같지만 이에 한정되지 않는 특정 세포 유형의 클로닝 및 선택을 사용하여 달성될 수 있다: 형태적 및/또는 생화학적 마커에 기반한 선택; 요망되는 세포의 선택적 성장 (양성 선택), 원하지 않는 세포의 선택적 파괴 (음성 선택); 예를 들어 대두 응집소를 사용하는 것과 같이, 혼합된 집단에서 차별적 세포 응집성을 기반으로 한 분리; 동결-해동 절차; 혼합된 집단에서의 세포의 차별적 부착 특성; 여과; 종래의 띠 원심분리(conventional and zonal centrifugation); 원심 세정 (역류 원심분리(counter-streaming centrifugation)); 단위 중력 분리(unit gravity separation); 역류 분배; 전기영동; 및 형광 활성화 세포 분류 (FACS). 클론 선택 및 세포 분리 기법의 개관에 대해서는, 본 명세서에 참고로 포함된 문헌[Freshney, 1994, CULTURE OF ANIMAL CELLS: A MANUAL OF BASIC TECHNIQUES, 3rd Ed., Wiley-Liss, Inc., New York]이 참조된다.
예를 들어, 배양 배지는 필요에 따라, 예컨대 피펫을 사용하여 접시로부터 배지를 조심스럽게 흡인시키고, 신선한 배지를 보충함으로써 변경된다. 인큐베이션은 충분한 개수 또는 밀도의 세포가 접시에 축적될 때까지 계속된다. 원래의 외식된 조직 절편이 제거될 수 있으며, 나머지 세포는 표준 기법을 사용하거나 셀 스크레이퍼(cell scraper)를 사용하여 트립신 처리된다(trypsinize). 트립신 처리 후에, 세포를 수집하고, 신선한 배지로 옮기고, 상기와 같이 인큐베이션한다. 일부 실시 형태에서, 배지는 트립신 처리 후 대략 24시간째에 적어도 1회 교체하여, 임의의 부유 세포를 제거한다. 배양물 중에 잔존하는 세포는 PPDC인 것으로 여겨진다.
PPDC는 동결보존될 수 있다. 따라서, 하기에 더욱 상세히 기술된 바람직한 실시 형태에서, 자가 전달 (산모 또는 아이 중 어느 하나)을 위한 PPDC를 아이의 출산 후에 적절한 산후 조직으로부터 얻은 다음에, 동결보존시켜 이들이 이후에 이식을 위해 필요한 경우에 이용가능하게 될 수 있다.
세포의 특징
PPDC와 같은 본 발명의 전구 세포는, 예컨대 하기와 같은 것에 의해 특징규명될 수 있다: 성장 특징 (예를 들어, 집단 배가 능력, 배가 시간, 노화까지의 계대), 핵형 분석 (예를 들어, 정상 핵형; 모체 또는 신생아 계통), 유세포 분석법 (예를 들어, FACS 분석), 면역조직화학 및/또는 면역세포화학 (예를 들어, 에피토프 검출을 위한 것), 유전자 발현 프로파일링 (예를 들어, 유전자 칩 어레이; 폴리머라제 연쇄 반응 (예를 들어, 역전사효소 PCR, 실시간 PCR 및 종래의 PCR)), 단백질 어레이, 단백질 분비 (예를 들어, 혈장 응고 검정 또는 PDC-컨디셔닝된 배지의 분석에 의해, 예를 들어 효소 결합 면역흡착 검정(Enzyme Linked ImmunoSorbent Assay, ELISA)에 의해), 혼합 림프구 반응 (예를 들어, PBMC의 자극의 척도로서), 및/또는 당업계에 공지된 다른 방법.
제대 조직으로부터 유래된 PPDC의 예는 2004년 6월 10일에 ATCC(American Type Culture Collection, 미국 버지니아주 20110 매너서스 유니버시티 블러바드 10801 소재)에 기탁되었고, 하기와 같이 ATCC 수탁번호가 지정되었다: (1) 세포주 명칭 UMB 022803 (P7)은 수탁 번호 PTA-6067로 지정되었고; (2) 세포주 명칭 UMB 022803 (P17)은 수탁번호 PTA-6068로 지정되었다. 태반 조직으로부터 유래된 PPDC의 예는 ATCC (미국 버지니아주 매너서스 소재)에 기탁되었고, 하기와 같이 ATCC 수탁 번호가 지정되었다: (1) 세포주 명칭 PLA 071003 (P8)은 2004년 6월 15일에 기탁되었으며, 수탁 번호 PTA-6074로 지정되었고; (2) 세포주 명칭 PLA 071003 (P11)은 2004년 6월 15일에 기탁되었으며, 수탁 번호 PTA-6075로 지정되었고; (3) 세포주 명칭 PLA 071003 (P16)은 2004년 6월 16일에 기탁되었으며, 수탁 번호 PTA-6079로 지정되었다.
다양한 실시 형태에서, PPDC는 하기와 같은 성장 특징 중 하나 이상을 보유한다: (1) 이것은 배양 중 성장을 위해 L-발린을 필요로 함; (2) 이것은 약 5% 내지 적어도 약 20%의 산소를 함유하는 분위기에서 성장 가능함; (3) 이것은 노화에 도달하기 전에 배양 중 적어도 약 40회의 배가 가능성을 가짐; 및 (4) 이것은 코팅되거나 코팅되지 않은 조직 배양 용기에 부착되어 증식함 - 코팅된 조직 배양 용기는 젤라틴, 라미닌, 콜라겐, 폴리오미틴, 비트로넥틴 또는 피브로넥틴의 코팅을 포함함.
특정 실시 형태에서, PPDC는 정상 핵형을 보유하며, 이는 세포가 계대됨에 따라 유지된다. 핵형 분석(karyotyping)은 태반으로부터 유래된 모체 세포로부터 신생아 세포를 확인하고 구별하는 데 특히 유용하다. 핵형 분석 방법은 당업자가 이용가능하며, 당업자에게 공지되어 있다.
다른 실시 형태에서, PPDC는 하기와 같은 것을 포함하는 특정 단백질의 생성에 의해 특징규명될 수 있다: (1) 비멘틴 및 알파-평활근 액틴 중 적어도 하나의 생성; 및 (2) 유세포 분석법에 의해 검출 시 CD10, CD13, CD44, CD73, CD90, PDGFr-알파, PD-L2 및 HLA-A,B,C 세포 표면 마커 중 적어도 하나의 생성. 다른 실시 형태에서, PPDC는 유세포 분석법에 의해 검출 시, CD31, CD34, CD45, CD80, CD86, CD117, CD141, CD178, B7-H2, HLA-G 및 HLA-DR,DP,DQ 세포 표면 마커 중 적어도 하나의 생성의 결여에 의해 특징규명될 수 있다. 비멘틴 및 알파-평활근 액틴을 생성하는 세포가 특히 바람직하다.
다른 실시 형태에서, PPDC는 섬유아세포, 중간엽 줄기 세포, 또는 장골능 골수 세포인 인간 세포에 비하여 하기 중 적어도 하나를 인코딩하는 유전자에 대해 증가된 유전자 발현에 의해 특징규명될 수 있다: 인터류킨 8; 레티큘론 1; 케모카인 (C--X--C 모티프) 리간드 1 (흑색종 성장 자극 활성, 알파); 케모카인 (C--X--C 모티프) 리간드 6 (과립구 주화성 단백질 2); 케모카인 (C--X--C 모티프) 리간드 3; 종양 괴사 인자, 알파 유도 단백질 3; C형 렉틴 수퍼패밀리 구성원 2; 빌름스 종양 1; 알데하이드 데하이드로게나제 1 패밀리 구성원 A2; 레닌; 산화 저밀도 지질단백질 수용체 1; 호모 사피엔스 클론 IMAGE:4179671; 단백질 키나제 C 제타; 가상 단백질 DKFZp564F013; 난소암 하향조절 1; 및 클론 DKFZp547k1113으로부터의 호모 사피엔스 유전자. 실시 형태에서, 제대 조직으로부터 유래된 PPDC는 섬유아세포, 중간엽 줄기 세포, 또는 장골능 골수 세포인 인간 세포에 비하여 하기 중 적어도 하나를 인코딩하는 유전자에 대해 증가된 유전자 발현에 의해 특징규명될 수 있다: 인터류킨 8; 레티큘론 1; 또는 케모카인 (C--X--C 모티프) 리간드 3. 다른 실시 형태에서, 태반 조직으로부터 유래된 PPDC는 섬유아세포, 중간엽 줄기 세포, 또는 장골능 골수 세포인 인간 세포에 비하여 레닌 또는 산화 저밀도 지질단백질 수용체 1 중 적어도 하나를 인코딩하는 유전자에 대해 증가된 유전자 발현에 의해 특징규명될 수 있다.
또 다른 실시 형태에서, PPDC는 섬유아세포, 중간엽 줄기 세포, 또는 장골능 골수 세포인 인간 세포에 비하여 하기 중 적어도 하나를 인코딩하는 유전자에 대해 감소된 유전자 발현에 의해 특징규명될 수 있다: 쇼트 스태처 호메오박스 2; 열충격 27 kDa 단백질 2; 케모카인 (C--X--C 모티프) 리간드 12 (간질 세포 유래 인자 1) 엘라스틴 (판상부대동맥협착증, 윌리암스-보이렌 증후군); 호모 사피엔스 mRNA; cDNA DKFZp586M2022 (클론 DKFZp586M2022 유래); 중간엽 호메오박스 2 (성장 정지 특이적 호메오박스); 사인 오쿨리스 호메오박스 상동체 1 (초파리); 크리스탈린, 알파 B; DAAM 2 (형태발생의 Dsh 관련 활성인자 2); DKFZP586B2420 단백질; 시밀러 투 뉴랄린 1; 테트라넥틴 (플라스미노겐 결합 단백질); src 호몰로지 3 (SH3) 및 시스테인 풍부 도메인; 콜레스테롤 25-하이드록실라제; runt-관련 전사 인자 3; 인터류킨 11 수용체, 알파; 프로콜라겐 C-엔도펩티다제 인핸서; 프리즐드 상동체 7 (초파리); 가상 유전자 BC008967; 콜라겐, 제VIII형, 알파 1; 테나신 C (헥사브라키온); 이로쿼이 호메오박스 단백질 5; 헤파에스틴; 인테그린, 베타 8; 시냅스 소포 당단백질 2; 신경아세포종, 종양 형성 억제 1; 인슐린 유사 성장 인자 결합 단백질 2, 36 kDa; 호모 사피엔스 cDNA FLJ12280 fis, 클론 MAMMA1001744; 사이토카인 수용체 유사 인자 1; 칼륨 중간체/작은 전도도의 칼슘 활성화 채널, 서브패밀리 N, 구성원 4; 인테그린, 베타 7; PDZ 결합 모티프를 갖는 전사 보조 활성화 인자 (TAZ); 사인 오쿨리스 호메오박스 상동체 2 (초파리); KIAAI034 단백질; 소포 관련 막 단백질 5 (미오브레빈); EGF 함유 피불린 유사 세포외 매트릭스 단백질 1; 초기 성장 반응 3; 디스탈-레스 호메오박스 5; 가상 단백질 FLJ20373; 알도-케토 리덕타제 패밀리 1, 구성원 C3 (3-알파 하이드록시스테로이드 데하이드로게나제, 제II형); 바이글리칸; PDZ 결합 모티프를 갖는 전사 보조 활성화 인자 (TAZ); 피브로넥틴 1; 프로엔케팔린; 인테그린, 베타 유사 1 (EGF 유사 반복 도메인을 포함함); 호모 사피엔스 mRNA 전장 인서트 cDNA 클론 EUROIMAGE 1968422; EphA3; KIAA0367 단백질; 나트륨이뇨 펩티드 수용체 C/구아닐레이트 사이클라제 C (심방 나트륨이뇨 펩티드 수용체 C); 가상 단백질 FLJ14054; 호모 사피엔스 mRNA; cDNA DKFZp564B222 (클론 DKFZp564B222 유래); BCL2/아데노바이러스 E1B 19 kDa 상호작용 단백질 3 유사; AE 결합 단백질 1; 및 사이토크롬 c 옥시다제 서브유닛 VIIa 폴리펩티드 1 (근육).
다른 실시 형태에서, 제대 조직으로부터 유래된 PPDC는 트롬보스폰딘-1, 트롬보스폰딘-2 및 트롬보스폰딘-4로부터 선택된 영양 인자의 분비에 의해 특징규명될 수 있다. 실시 형태에서, PPDC는 MCP-1, IL-6, IL-8, GCP-2, HGF, KGF, FGF, HB-EGF, BDNF, TPO, MIP1b, I309, RANTES, MDC 및 TIMP1 중 적어도 하나의 분비에 의해 특징규명될 수 있다. 일부 실시 형태에서, 제대 조직으로부터 유래된 PPDC는 ELISA에 의한 검출 시, TGF-베타2, ANG2, PDGFbb, MIP1a 및 VEGF 중 적어도 하나의 분비의 결여에 의해 특징규명될 수 있다. 대안적인 실시 형태에서, 태반 조직으로부터 유래된 PPDC는, ELISA에 의한 검출 시, MCP-l, IL-6, IL-8, GCP-2, HGF, KGF, HB-EGF, BDNF, TPO, MIP1a, RANTES 및 TIMP1 중 적어도 하나의 분비, 및 TGF-베타2, ANG2, PDGFbb, FGF 및 VEGF 중 적어도 하나의 분비의 결여에 의해 특징규명될 수 있다. 추가의 실시 형태에서, PPDC는 hTERT 또는 텔로머라제의 발현이 결여되어 있다.
바람직한 실시 형태에서, 세포는 상기 열거된 성장, 단백질/표면 마커 생성, 유전자 발현 또는 물질 분비 특징 중 2가지 이상을 포함한다. 상기 특징들 중 3가지, 4가지, 또는 5가지 또는 그 이상을 포함하는 세포가 더 바람직하다. 상기 특징들 중 6가지, 7가지, 또는 8가지 또는 그 이상을 포함하는 PPDC가 더욱 더 바람직하다. 상기 특징들 전부를 포함하는 세포가 현재 더욱 더 바람직하다.
특히 바람직한 실시 형태에서, 배양 중 증식가능한, 혈액이 실질적으로 없는 인간 제대 조직으로부터 단리된 세포는 CD117 또는 CD45의 생성이 결여되어 있고, hTERT 또는 텔로머라제를 발현하지 않는다. 일 실시 형태에서, 세포는 CD117 및 CD45의 생성이 결여되어 있고, 선택적으로 hTERT 및 텔로머라제도 발현하지 않는다. 다른 실시 형태에서, 세포는 hTERT 및 텔로머라제를 발현하지 않는다. 또 다른 실시 형태에서, 세포는 혈액이 실질적으로 없는 인간 제대 조직으로부터 단리되고, 배양 중 증식가능하고, CD117 또는 CD45의 생성이 결여되어 있고, hTERT 또는 텔로머라제를 발현하지 않으며, 하기 특징들 중 하나 이상을 갖는다: CD10, CD13, CD44, CD73 및 CD90을 발현함; CD31 또는 CD34를 발현하지 않음; 인간 섬유아세포, 중간엽 줄기 세포 또는 장골능 골수 세포에 비하여, 증가된 수준의 인터류킨 8 또는 레티큘론 1을 발현함; 및 분화 가능성을 가짐.
본 발명의 몇몇 태양에서 본 발명에 사용하기에 현재 바람직한 세포들 중에는 상기에 기재된 특징을 갖는 산후 세포가 있으며, 더욱 특히는, 정상 핵형을 가지며 계대에 따라 정상 핵형을 유지하는 세포, 및 추가로 마커 CD10, CD13, CD44, CD73, CD90, PDGFr-알파, 및 HLA-A,B,C 각각을 발현하는 세포가 있으며, 여기서 이들 세포는 열거된 마커에 상응하는 면역학적으로 검출가능한 단백질을 생성한다. 또한 전술한 것에 더하여, 유세포 분석법에 의한 검출 시, 마커 CD31, CD34, CD45, CD117, CD141 또는 HLA-DR,DP,DQ 중 임의의 것에 상응하는 단백질을 생성하지 않는 세포가 더욱 더 바람직하다. 추가의 바람직한 실시 형태에서, 세포는 hTERT 또는 텔로머라제의 발현이 결여되어 있다.
다양한 표현형에 이르게 하는 선(line)을 따라 분화될 가능성을 갖는 특정 세포는 불안정하며, 따라서 자발적으로 분화될 수 있다. 예를 들어 신경선(neural line)을 따라, 자발적으로 분화되지 않는 세포가 현재 본 발명에 사용하기에 바람직하다. 바람직한 세포는, 성장 배지에서 성장될 때, 예를 들어 Affymetrix의 GENECHIP을 사용하여 결정되는 바와 같이, 이의 표면 상에서 생성되는 세포 마커와 관련하여 그리고 다양한 유전자의 발현 패턴과 관련하여 실질적으로 안정하다. 세포는 다수의 집단 배가를 통해, 예를 들어 계대에 걸쳐 그의 표면 마커 특징이, 실질적으로 일정하게 유지된다.
그러나, PPDC의 한 가지 특징은, 이를 분화 유도 세포 배양 조건에 적용함으로써 이것이 다양한 계통 표현형으로 분화되도록 의도적으로 유도될 수 있다는 것이다. 특정 안구 변성 질환의 치료에 사용 시, PPDC는 당업계에 공지된 하나 이상의 방법을 사용하여 신경 표현형으로 분화되도록 유도될 수 있다. 예를 들어, 본 명세서에 예시된 바와 같이, PPDC는 라미닌으로 코팅된 플라스크에 B27 (B27 보충제, Invitrogen), L-글루타민 및 페니실린/스트렙토마이신을 함유하는 Neurobasal-A 배지 (미국 캘리포니아주 칼스배드 소재의 Invitrogen) - 이러한 배지의 조합은 본 명세서에서 신경 전구체 증식(Neural Progenitor Expansion, NPE) 배지로 지칭됨 - 중에서 플레이팅될 수 있다. NPE 배지에는 추가로 bFGF 및/또는 EGF가 보충될 수 있다. 대안적으로, (1) PPDC를 신경 전구 세포와 공동 배양하거나; (2) PPDC를 신경 전구 세포 컨디셔닝된 배지에서 성장시킴으로써 PPDC는 시험관내에서 분화되도록 유도될 수 있다.
신경 표현형으로의 PPDC의 분화는 확장된 돌기를 갖는 양극 세포 형태에 의해 입증될 수 있다. 유도된 세포 집단은 네스틴(nestin)의 존재에 대해 양성으로 염색될 수 있다. 분화된 PPDC는 네스틴, TuJ1 (BIII 튜불린), GFAP, 티로신 하이드록실라제, GABA, 04 및/또는 MBP의 검출에 의해 평가될 수 있다. 일부 실시 형태에서, PPDC는 신경구의 뉴런 줄기 세포 형성에 특유한 3차원체(three-dimensional body)를 형성하는 능력을 나타내었다.
세포 집단
본 발명의 다른 태양은 전구 세포, 예컨대 산후 유래 세포, 또는 다른 전구 세포의 세포 집단을 특징으로 한다. 산후 유래 세포는 태반 또는 제대 조직으로부터 단리될 수 있다. 바람직한 실시 형태에서, 세포 집단은 상기 기술된 PPDC를 포함하고, 이러한 세포 집단은 아래의 단락에 기술되어 있다.
일부 실시 형태에서, 세포 집단은 불균질하다. 본 발명의 불균질한 세포 집단은 적어도 약 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 95%의 세포를 포함할 수 있다. 본 발명의 불균질한 세포 집단은 전구 세포 (산후 유래 세포), 또는 다른 전구 세포, 예를 들어 상피 또는 신경 전구 세포를 추가로 포함할 수 있거나, 완전 분화된 세포를 추가로 포함할 수 있다.
일부 실시 형태에서, 집단은 실질적으로 균질하며, 즉, 실질적으로 PPDC만을 (바람직하게는 적어도 약 96%, 97%, 98%, 99% 또는 그 이상의 세포를) 포함한다. 일부 실시 형태에서, 세포 집단은 균질하다. 실시 형태에서, 본 발명의 균질한 세포 집단은 제대 또는 태반 유래 세포를 포함할 수 있다. 제대 유래 세포의 균질한 집단에는 바람직하게는 모체 계통의 세포가 없다. 태반 유래 세포의 균질한 집단은 신생아 또는 모체 계통을 가질 수 있다. 세포 집단의 균질성은 당업계에 알려져 있는 임의의 방법에 의해, 예를 들어 세포 분류(cell sorting) (예를 들어, 유세포 분석법)에 의해, 또는 공지되어 있는 방법에 따른 클론 증식에 의해 달성될 수 있다. 따라서, 바람직한 균질한 PPDC 집단은 산후 유래 세포의 클론 세포주를 포함할 수 있다. 이러한 집단은 매우 바람직한 기능성을 지닌 세포 클론이 단리되는 경우에 특히 유용하다.
또한, 요망되는 경로 (예를 들어, 신경, 상피)를 따라 줄기 세포 분화를 자극하는, 하나 이상의 인자의 존재 하에, 또는 조건 하에서 인큐베이션된 세포 집단이 본 명세서에 제공된다. 이러한 인자는 당업계에 알려져 있으며, 당업자는 분화에 적합한 조건의 결정이 통상의 실험으로 달성될 수 있음을 인식할 것이다. 이러한 조건의 최적화는 통계적 실험 설계 및 분석에 의해 달성될 수 있으며, 예를 들어 반응 표면 방법(response surface methodology)이, 예컨대 생물학적 배양에서, 다수의 변수의 동시 최적화를 가능하게 한다. 현재 바람직한 인자는, 성장 또는 영양 인자, 탈메틸화제, 신경 또는 상피 계통 세포와의 공동 배양, 또는 신경 또는 상피 계통 세포 컨디셔닝된 배지 중의 배양뿐만 아니라 이러한 경로를 따라 줄기 세포 분화를 자극하는 것으로 당업계에 공지된 다른 조건과 같은 인자를 포함하지만 이에 한정되지 않는다 (신경 분화에 유용한 인자에 관해서는, 예를 들어 문헌[Lang, K. J. D. et al., 2004, J. Neurosci. Res. 76: 184-192]; 문헌[Johe, K. K. et al., 1996, Genes Devel. 10: 3129-3140]; 문헌[Gottleib, D., 2002, Ann. Rev. Neurosci. 25: 381-407] 참조).
본 발명의 실시 형태에서, RGC와 공동 배양된 hUTC는 RGC에서의 시냅스 형성, 및 뉴런 생존과 증생에 긍정적인 영향을 미쳤다. hUTC와 RGC의 공동 배양은 시냅스 펑크텀의 수의 증가를 나타내었고, 성상세포 (양성 대조군)의 결과에 필적하였다. (도 1b 내지 도 1d).
미니어처 흥분성 시냅스후 전류(miniature excitatory postsynaptic current, mEPSC)의 측정은 hUTC가 시냅스 형성에 영향을 미침을 나타낸다. RGC를 단독으로 또는 hUTC 또는 ASC의 존재 하에 배양하였다 (도 1a). 성상세포와 유사하게, RGC와 hUTC의 공동 배양은 시냅스 사건 빈도의 증가를 가져왔고 (도 1e 내지 도 1g, 도 1f, 크루스칼-왈리스(Kruskal-Wallis) 검정, p<.0001, 도 1g, 일원(One-way) ANOVA, p<.0001), 이는 관찰된 시냅스 수의 증가와 일치한다 (도 1b 내지 도 1d). 또한, hUTC는 시냅스후 전류의 진폭을 증가시켰다. 성상세포와 마찬가지로, hUTC는 시냅스 활성을 강화시킨다 (도 1h, 도 1i). mEPSC 피크의 파형은 상승 및 감쇠 tau 둘 모두가 hUTC 처리에 따라 증가됨을 밝혀내었다 (도 1j 내지 도 1m). hUTC는 흥분성 시냅스 형성을 유도하고, 배양된 RGC에서 시냅스 기능을 향상시킨다.
컨디셔닝된 배지
일 태양에서, 본 발명은 아래에 기술된 바와 같이 시험관내 및 생체내에서 사용하기 위한, 배양된 전구 세포, 예컨대 산후 유래 세포, 또는 다른 전구 세포로부터의 컨디셔닝된 배지를 제공한다. 이러한 컨디셔닝된 배지의 사용은, 거부반응 또는 다른 불리한 면역학적 반응을 촉발할 수 있는 무손상 세포를 도입함이 없이, 세포에 의해 분비된 유익한 영양 인자가 환자에서 동종이계적으로 사용될 수 있게 한다. 컨디셔닝된 배지는 세포 (예를 들어, 세포 집단)를 배양 배지 중에서 배양하고, 이어서 배지로부터 세포를 제거함으로써 제조된다. 특정한 실시 형태에서, 산후 세포는 UTC 또는 PDC, 더 바람직하게는 hUTC이다.
상기 기술된 바와 같은 세포 집단으로부터 제조된 컨디셔닝된 배지는 그대로 사용되거나, 예를 들어 한외여과 또는 동결건조에 의해 추가로 농축되거나, 심지어 건조되거나, 부분 정제되거나, 당업계에 알려져 있는 바와 같은 약제학적으로 허용가능한 담체 또는 희석제와 배합되거나, 다른 화합물, 예를 들어 생물학적 제제, 예컨대 약제학적으로 유용한 단백질 조성물과 배합될 수 있다. 컨디셔닝된 배지는 시험관내에서 또는 생체내에서, 단독으로, 또는, 예를 들어 자가 또는 동계 생세포와 함께 사용될 수 있다. 생체내에 도입되는 경우, 컨디셔닝된 배지는, 예를 들어 필요한 세포 성장 또는 영양 인자를 환자에 제공하기 위해, 치료 부위에 국부적으로 또는 떨어진 곳에서 도입될 수 있다.
이전에, 인간 제대 조직 유래 세포가 시각 기능을 개선시키고 망막 변성을 완화시킨 것이 입증되었다 (미국 특허 출원 공개 제2010/0272803호). 또한, 산후 유래 세포는 광수용체 구조를 촉진하고 이에 따라 RCS 모델에서 광수용체를 보존하는 데 사용될 수 있는 것으로 나타났다. (미국 특허 출원 공개 제2010/0272803호). RCS 래트의 눈으로의 hUTC의 망막하 주입은 시력을 개선시키고 망막 변성을 완화시켰다. 더욱이, hUTC로부터 유래된 컨디셔닝된 배지 (CM)로의 처리는 시험관내에서 이영양성 RPE 세포에서 ROS의 식세포작용을 회복시켰다. (미국 특허 출원 공개 제2010/0272803호). 여기에서, 본 발명의 실시 형태는, 특히, 망막 신경절 세포, 광수용체 (간체 및 추체), 망막 무축삭 세포, 수평 세포 및 양극 세포를 포함하는 망막 뉴런에서, 신경돌기 증생 및 시냅스생성을 촉진하는 이전에 알려지지 않은 hUTC의 긍정적인 효과를 개시한다.
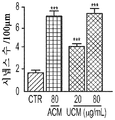
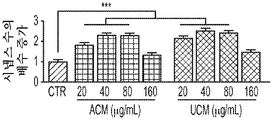
본 명세서에 제공된 바와 같이, hUTC 컨디셔닝된 배지 (UCM)를 제조하고, 망막 신경절 세포에 대한 시냅스 형성, 뉴런 생존 및 신경돌기 증생에 대한 효과를 평가하였다. 다양한 농도의 hUCM을 사용하여 RGC를 배양하였다. 시냅스 분석은 hUCM이, 성상세포 컨디셔닝된 배지 (ACM)와 유사하게, 농도 의존성 방식으로 RGC의 시냅스 형성을 유도하였음을 나타내었다. (도 2b). UCM은 Homer 및 Bassoon 펑크텀 수 둘 모두에 대해 긍정적인 영향을 미쳤다. (도 2b 내지 도 2d, 도 2J).
성상세포는 시냅스 형성을 조절하는 것으로 밝혀졌다. 시냅스 형성의 유도는 분비된 시냅스생성 분자, 예를 들어 트롬보스폰딘, 헤빈(hevin), 산성이고 시스테인이 풍부한 분비된 단백질 (secreted protein acidic and rich in cysteine, SPARC), 글리피칸(glypican), BDNF, TGF 베타-1, 콜레스테롤 및 에프린(ephrin)을 통해 이루어지는 것으로 여겨진다. (문헌[Clarke, Nature Reviews Neuroscience, 2013; 14:311-321]; 문헌[Bolton and Eroglu, Current Opinion in Neurobiology, 2009; 19:491-497]). 본 발명의 hUCM을 특징규명함에 있어서, 성상세포 및 성상세포로부터 제조된 컨디셔닝된 배지를 때때로 양성 대조군으로 사용하였다.
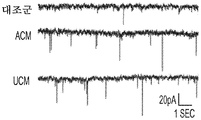
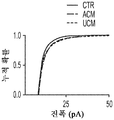
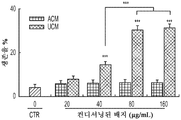
또한, hUCM은 mEPSC의 진폭과 주파수의 증가에 의해 나타난 바와 같이 기능성 시냅스를 강화시켰다. (도 2e 내지 도 2n). hUTC 이식 후 관찰된 기능 회복 이외에, 동물 질병 모델에서의 이전의 연구는 이러한 세포가 신경 구조의 보존에 영향을 미침을 밝혀내었다 (상기 문헌[Lund et al., 2007]; 문헌[Moore et al., Somatosensory and motor research, 2013; 30:185-196]; 문헌[Zhang L, et al., Brain Research, 2012; 1489:104-112]; 문헌[Jiang Q, et al. PloS One, 2012; 7:e42845]; 문헌[Zhang L, et al., Stroke; 2011; 42:1437-1444]). RGC 배양 시스템을 사용하는 경우, 시냅스생성 및 신경돌기 증생에 대한 UCM의 효과가 나타난다. 시냅스 형성에 대한 효과 외에, hUCM은 임의의 다른 성장 인자, 예를 들어 BDNF 및 CTNF의 부재 하에 RGC 생존을 촉진하였다. (도 3a 내지 도 3e).
또한, hUCM은 총 돌기 길이, 돌기 수 및 가지 수의 증가에 의해 입증된 바와 같이 RGC 신경돌기 증생을 향상시켰다. (도 3f 내지 도 3j).
본 발명의 실시 형태에서, hUTC는 시험관내에서 정제된 RGC들 사이에 기능성 시냅스의 발생을 촉진하는 인자를 분비한다. 더욱이, hUTC는 뉴런 성장 및 기능도 지원한다.
세포 변형, 성분 및 생성물
전구 세포, 예를 들어 산후 세포, 바람직하게는 PPDC는 또한 유전자 변형되어 치료적으로 유용한 유전자 생성물을 생성시키거나 종양의 치료를 위한 항신생물제를 생성시킬 수 있다. 유전자 변형은 임의의 다양한 벡터를 사용하여 달성될 수 있으며, 이러한 벡터는 통합 바이러스 벡터, 예를 들어 레트로바이러스 벡터 또는 아데노 관련 바이러스 벡터; 비통합 복제 벡터, 예를 들어 파필로마 바이러스 벡터, SV40 벡터, 아데노바이러스 벡터; 또는 복제-결함 바이러스 벡터를 포함하지만 이에 한정되지 않는다. DNA를 세포 내로 도입하는 다른 방법은 리포좀, 전기천공, 입자 총(particle gun)의 사용 또는 직접적 DNA 주입에 의한 것을 포함한다.
숙주 세포는 바람직하게는, 선택가능 마커, 및 특히 프로모터 또는 인핸서 서열, 전사 터미네이터, 폴리아데닐화 부위와 같은 하나 이상의 적절한 발현 조절 요소에 의해 조절되는, 또는 이러한 발현 조절 요소와 작동적으로 결합하여 DNA로 형질전환되거나 또는 형질감염된다. 삽입된 유전자가 발현되게 하기 위하여 임의의 프로모터가 사용될 수 있다. 예를 들어, 바이러스 프로모터는 CMV 프로모터/인핸서, SV40, 파필로마바이러스, 엡스타인-바(Epstein-Barr) 바이러스 또는 엘라스틴 유전자 프로모터를 포함하지만 이에 한정되지 않는다. 일부 실시 형태에서, 관심 유전자의 발현을 조절하는 데 사용되는 조절 요소는, 생성물이 생체내에서 필요할 때에만 합성되도록 유전자의 조절된 발현을 가능하게 할 수 있다. 일시적 발현이 요망될 경우, 바람직하게는 항시적(constitutive) 프로모터가 비통합 및/또는 복제 결손 벡터에서 사용된다. 대안적으로, 필요할 경우, 삽입된 유전자가 발현되게 하기 위하여 유도성 프로모터가 사용될 수 있다. 유도성 프로모터는 메탈로티오네인 및 열충격 단백질과 관련된 것을 포함하지만 이에 한정되지 않는다.
외래 DNA의 도입 이후, 조작된 세포를 강화 배지(enriched media)에서 성장시키고, 이어서 선택 배지로 교환할 수 있다. 외래 DNA 내의 선택가능 마커는 선택에 대한 내성을 부여하며, 세포가, 예를 들어 플라스미드 상에서와 같이 외래 DNA를 그의 염색체 내에 안정하게 통합시키고 성장시켜 증식소(foci)를 형성하게 하는데, 이는 결국 클로닝되고 세포주로 증식될 수 있다. 이러한 방법은 유전자 생성물을 발현하는 세포주를 조작하기 위하여 유리하게 사용될 수 있다.
세포는 이식 부위에서 염증 또는 거부반응을 촉진하는 인자의 발현을 "녹아웃(knock out)" 또는 "녹다운"시키도록 유전자 조작될 수 있다. 표적 유전자 발현 수준 또는 표적 유전자 생성물 활성 수준을 감소시키는 음성 조정 기법이 하기에 논의되어 있다. 본 명세서에 사용되는 바와 같이, "음성 조정"은 조정적 처리의 부재 하에서의 표적 유전자 생성물의 수준 및/또는 활성에 비하여 표적 유전자 생성물의 수준 및/또는 활성의 감소를 지칭한다. 뉴런 또는 아교 세포에 고유한 유전자의 발현은, 예를 들어 상동성 재조합 기법을 사용한 유전자의 불활성화에 의한 발현의 저해를 포함하는, 다수의 기법을 사용하여 감소되거나 녹아웃될 수 있다. 전형적으로, 중요한 단백질 영역을 인코딩하는 엑손(exon) (또는 그 영역의 5' 쪽 엑손)에는 양성 선택가능 마커, 예를 들어 neo가 개재되며, 이는 표적 유전자로부터의 정상 mRNA의 생성을 방지하여 이 유전자를 불활성화시킨다. 또한 유전자는 유전자의 일부에서의 결실의 생성에 의해 또는 전체 유전자의 결실에 의해 불활성화될 수 있다. 게놈 내에서 멀리 떨어져 있는, 표적 유전자에 대하여 상동성인 두 영역을 지닌 작제물을 사용함으로써, 이들 두 영역에 개재된 서열이 결실될 수 있다 (문헌 [Mombaerts et al., 1991, Proc. Nat. Acad. Sci. U.S.A. 88:3084-3087]). 또한, 안티센스, DNAzyme, 리보자임, 작은 간섭 RNA (siRNA) 및 표적 유전자의 발현을 저해하는 기타 이러한 분자를 사용하여, 표적 유전자 활성의 수준을 감소시킬 수 있다. 예를 들어, 주요 조직적합성 유전자 복합체(histocompatibility gene complex, HLA)의 발현을 저해하는 안티센스 RNA 분자는 면역 반응과 관련하여 가장 다재다능한 것으로 밝혀졌다. 또한 추가로, 삼중 나선 분자가 표적 유전자 활성 수준을 감소시키는데 사용될 수 있다. 이러한 기법은 문헌[L. G. Davis et al. (eds), 1994, BASIC METHODS IN MOLECULAR BIOLOGY, 2nd ed., Appleton & Lange, Norwalk, CT]에 상세히 기술되어 있다.
다른 태양에서, 본 발명은 산후 줄기 세포, 바람직하게는 PPDC, 또는 PPDC를 포함하는 불균질한 또는 균질한 세포 집단뿐만 아니라, 신경생성 경로를 따라 분화되도록 유전자 변형되거나 자극된 PPDC 또는 이의 집단으로부터 제조된 세포 용해물 및 세포 가용성 분획을 제공한다. 이러한 용해물 및 이의 분획은 다수의 유용성을 갖는다. 예를 들어, 생체내에서 세포 용해물 가용성 분획 (즉, 실질적으로 막이 없음)의 사용은, 거부반응 또는 다른 불리한 면역학적 반응을 촉발할 가능성이 높은 상당한 양의 세포 표면 단백질을 도입함이 없이, 유익한 세포내 환경이 환자에서 동종이계적으로 사용될 수 있게 한다. 세포의 용해 방법은 당업계에 널리 공지되어 있으며, 기계적 파괴, 효소적 파괴 또는 화학적 파괴 또는 이들의 조합의 다양한 수단을 포함한다. 이러한 세포 용해물은 이의 성장 배지에서 직접적으로 세포로부터 제조됨에 따라 분비된 성장 인자 등을 함유하거나, 예를 들어 PBS 또는 다른 용액 중에서, 배지가 없게 세척된 세포로부터 제조될 수 있다. 세척된 세포는 바람직한 경우 본래의 집단 밀도보다 더 높은 농도로 재현탁될 수 있다.
일 실시 형태에서, 전 세포(whole cell) 용해물은, 예를 들어 이후의 세포 분획의 분리 없이 세포를 파괴시킴으로써 제조된다. 다른 실시 형태에서, 세포막 분획은 당업계에 알려져 있는 통상적인 방법, 예를 들어 원심분리, 여과 또는 유사 방법에 의해 세포의 가용성 분획으로부터 분리된다.
산후 유래 세포와 같은 전구 세포의 세포 집단으로부터 제조된 세포 용해물 또는 세포 가용성 분획은 그대로 사용되거나, 예를 들어 한외여과 또는 동결건조에 의해 추가로 농축되거나, 심지어 건조되거나, 부분 정제되거나, 당업계에 알려져 있는 바와 같은 약제학적으로 허용가능한 담체 또는 희석제와 배합되거나, 다른 화합물, 예를 들어 생물학적 제제, 예컨대 약제학적으로 유용한 단백질 조성물과 배합될 수 있다. 세포 용해물 또는 이의 분획은 시험관내에서 또는 생체내에서, 단독으로, 또는, 예를 들어 자가 또는 동계 생세포와 함께 사용될 수 있다. 생체내에 도입되는 경우, 용해물은, 예를 들어 필요한 세포 성장 인자를 환자에 제공하기 위해, 치료 부위에 국부적으로 또는 멀리서 도입될 수 있다.
추가의 실시 형태에서, 산후 세포, 바람직하게는 PPDC는 생물학적 생성물을 고수율로 생성시키도록 시험관내에서 배양될 수 있다. 예를 들어, 관심의 특정 생물학적 생성물 (예컨대, 영양 인자)을 자연적으로 생성하거나 생물학적 생성물을 생성하도록 유전자 조작된 이러한 세포는 본 명세서에 기술된 배양 기법을 사용하여 클론 증식될 수 있다. 대안적으로, 세포는 요망되는 계통으로 분화를 유도하는 배지에서 증식될 수 있다. 어느 경우이든, 세포에 의해 생성되어 배지로 분비된 생물학적 생성물은 표준 분리 기법, 예컨대 몇 가지 예를 들자면 차별적 단백질 침전, 이온 교환 크로마토그래피, 겔 여과 크로마토그래피, 전기영동 및 HPLC를 사용하여, 컨디셔닝된 배지로부터 용이하게 단리될 수 있다. "생물반응기"는, 예를 들어 시험관내에서 3차원 배양물에 영양을 공급하기 위한 유동 방법을 이용하는 데 사용될 수 있다. 본질적으로, 신선한 배지가 3차원 배양물을 통과함에 따라, 생물학적 생성물이 배양물로부터 씻겨지고, 이어서 상기와 같이 유출물로부터 단리될 수 있다.
대안적으로, 관심 생물학적 생성물이 세포 내에 남아 있을 수 있고, 이에 따라 이의 수집은 상기 기술된 바와 같이 세포가 용해될 것을 필요로 할 수 있다. 이어서, 생물학적 생성물은 상기 열거된 기법 중 어느 하나 또는 그 이상을 사용하여 정제될 수 있다.
다른 실시 형태에서, 액체, 고체 또는 반고체 기재에서 산후 세포 (바람직하게는 PPDC)를 배양함으로써 생성된 세포외 매트릭스(ECM)가 제조되고 수집되어, 조직 수복 또는 대체가 필요한 피검자에 생세포를 이식하는 것의 대안으로 이용된다. 요망되는 양의 ECM이 3차원 프레임워크 상으로 분비되도록 하는 조건 하에서 세포가 본 명세서의 다른 부분에 기술된 바와 같이 그러한 프레임워크에서 시험관내 배양된다. 세포 및 프레임워크가 제거되고, ECM은 추가 용도, 예를 들어 주사용 제제로서의 용도를 위해 처리된다. 이를 달성하기 위해, 프레임워크 상의 세포가 치사되고, 임의의 세포 잔사가 프레임워크로부터 제거된다. 이러한 과정은 다수의 다양한 방식으로 수행될 수 있다. 예를 들어, 살아있는 조직이 동결보존제 없이 액체 질소에서 급속 동결(flash-freezing)될 수 있거나 세포가 삼투압에 반응하여 파열되도록 조직이 멸균 증류수에 침지될 수 있다.
일단 세포가 치사되면, 세포막이 파괴되고, 순한 표면활성 린스(mild detergent rinse), 예를 들어 EDTA, CHAPS 또는 쯔비터이온성 표면활성제로 처리하여 세포 잔사가 제거될 수 있다. 대안적으로, 조직은 효소적으로 분해되고/되거나 세포막을 파괴하여 세포 함유물의 제거를 가능하게 하는 시약으로 추출될 수 있다. 이러한 효소의 예는 하이알루로니다제, 디스파제, 프로테아제 및 뉴클레아제를 포함하지만 이에 한정되지 않는다. 표면활성제의 예는 비이온성 표면활성제, 예를 들어 알킬아릴 폴리에테르 알코올 (TRITON X-100), 옥틸페녹시 폴리에톡시-에탄올 (미국 펜실베이니아주 필라델피아 소재의 Rohm and Haas), BRIJ-35, 폴리에톡시에탄올라우릴 에테르 (미국 캘리포니아주 샌디에이고 소재의 Atlas Chemical Co.), 폴리소르베이트 20 (TWEEN 20), 폴리에톡시에탄올 소르비탄 모노 라우레이트 (Rohm and Haas), 폴리에틸렌 라우릴 에테르 (Rohm and Haas); 및 이온성 표면활성제, 예를 들어 소듐 도데실 설페이트, 분지형 또는 비분지형 사슬에 7개 내지 22개의 탄소 원자를 함유하는, 설페이트화 고급 지방족 알코올, 설폰화 알칸 및 설폰화 알킬아렌을 포함한다.
ECM의 수집은, 예를 들어 새로운 조직이 생분해성 또는 비생분해성인 3차원 프레임워크 상에 형성되었는지의 여부에 따라 다양한 방식으로 달성될 수 있다. 예를 들어, 프레임워크가 비생분해성인 경우, 프레임워크에 초음파처리, 고압 물 분사(high-pressure water jet), 기계적 스크레이핑(mechanical scraping) 또는 표면활성제 또는 효소를 사용한 가벼운 처리, 또는 상기한 것의 임의의 조합을 적용하여 ECM이 분리될 수 있다.
프레임워크가 생분해성인 경우, 예를 들어 프레임워크가 용액에서 분해 또는 용해될 수 있게 함으로써 ECM이 수집될 수 있다. 대안적으로, 생분해성 프레임워크가 ECM과 함께 그 자체로 주입될 수 있는 물질로 이루어진 경우, 프레임워크 및 ECM은 후속 주입을 위해 전체로서(in toto) 처리될 수 있다. 대안적으로, ECM은 비생분해성 프레임워크로부터의 ECM의 수집을 위해 상기 기술된 방법들 중 임의의 것에 의해 생분해성 프레임워크로부터 분리될 수 있다. 모든 수집 과정은 바람직하게는 ECM을 변성시키지 않도록 설계된다.
수집된 후, ECM은 추가로 처리될 수 있다. 예를 들어, ECM은 외과용 바늘을 통과할 수 있도록, 초음파처리와 같은 당업계에 널리 공지된 기법을 사용하여 미세 입자로 균질화될 수 있다 ECM의 성분들은 요망되는 경우 감마 조사(gamma irradiation)에 의해 가교결합될 수 있다. 바람직하게는, ECM은 0.25 내지 2 메가 라드(mega rad)로 조사되어 ECM을 멸균 및 가교결합시킬 수 있다. 글루타르알데하이드와 같은 독성인 작용제를 사용한 화학적 가교결합이 가능하지만, 대체로 바람직하지 않다.
ECM에 존재하는 다양한 유형의 콜라겐과 같은 단백질들의 양 및/또는 비는 본 발명의 세포에 의해 생성된 ECM을 하나 이상의 다른 세포 유형의 ECM과 혼합함으로써 조정될 수 있다. 또한, 생물학적 활성 물질, 예를 들어 단백질, 성장 인자 및/또는 약물이 ECM에 혼입될 수 있다. 예시적인 생물학적 활성 물질은 주입 부위에서 치유 및 조직 수복을 촉진하는 TGF-베타와 같은 조직 성장 인자 등을 포함한다. 이러한 추가 작용제는, 예를 들어 전 세포 용해물, 가용성 세포 분획, 또는 세포에 의해 생성된 추가 정제된 성분과 생성물을 사용하는, 상기 기술된 본 명세서의 실시 형태들 중 어느 것에서 이용될 수 있다.
약제학적 조성물
다른 태양에서, 본 발명은 안구 변성 질환의 치료를 위한 다양한 방법에서 비배아 줄기 세포, 예를 들어 산후 세포 (바람직하게는, PPDC), 이의 세포 집단, 이러한 세포에 의해 생성된 컨디셔닝된 배지, 및 이러한 세포에 의해 생성된 세포 성분과 생성물을 사용하는 약제학적 조성물을 제공한다. 특정 실시 형태는 생세포 (예를 들어, 단독의 또는 다른 세포 유형과 혼합된 PPDC)를 포함하는 약제학적 조성물을 포함한다. 다른 실시 형태는 PPDC 컨디셔닝된 배지를 포함하는 약제학적 조성물을 포함한다. 추가의 실시 형태는 PPDC의 세포 성분 (예를 들어, 세포 용해물, 가용성 세포 분획, ECM 또는 상기한 것 중 임의의 것의 성분) 또는 생성물 (예를 들어, 세포에 의해 자연적으로 생성되거나 유전자 변형을 통해 생성된 영양 인자 및 다른 생물학적 인자, 세포 배양으로부터의 컨디셔닝된 배지)을 사용할 수 있다. 어느 경우이든, 약제학적 조성물은 다른 활성 작용제, 예를 들어 당업계에 공지된 바와 같은 항염증제, 항아폽토시스제, 항산화제, 성장 인자, 신경영양 인자(neurotrophic factor), 또는 신경재생, 신경보호 또는 안과용 약물을 추가로 포함할 수 있다.
약제학적 조성물에 첨가될 수 있는 다른 성분의 예는 몇 가지 예를 들자면 하기와 같은 것을 포함하지만 이에 한정되지 않는다: (1) 다른 신경보호 또는 신경유익(neurobeneficial) 약물; (2) 선택된 세포외 매트릭스 성분, 예를 들어 당업계에 공지된 하나 이상의 유형의 콜라겐, 및/또는 성장 인자, 혈소판 풍부 혈장, 및 약물 (대안적으로, 성장 인자를 발현하고 생성하도록 PPDC가 유전자 조작될 수 있음); (3) 항아폽토시스제 (예를 들어, 에리트로포이에틴 (EPO), EPO 항체모방체(mimetibody), 트롬보포이에틴, 인슐린 유사 성장 인자 (IGF)-I, IGF-II, 간세포 성장 인자, 카스파제 저해제); (4) 항염증 화합물 (예를 들어, p38 MAP 키나제 저해제, TGF-베타 저해제, 스타틴, IL-6 및 IL-1 저해제, 페미롤라스트(PEMIROLAST), 트라닐라스트(TRANILAST), 레미케이드(REMICADE), 시롤리무스(SIROLIMUS), 및 비스테로이드성 항염증 약물 (NSAID) (예를 들어, 테폭살린(TEPOXALIN), 톨메틴(TOLMETIN), 및 서프로펜(SUPROFEN)); (5) 면역억제제 또는 면역조절제, 예를 들어 칼시뉴린(calcineurin) 저해제, mTOR 저해제, 항증식제, 코르티코스테로이드 및 다양한 항체; (6) 항산화제, 예를 들어 프로부콜(probucol), 비타민 C와 비타민 E, 코엔자임 Q-10, 글루타티온, L-시스테인 및 N-아세틸시스테인; 및 (6) 국부 마취제.
본 발명의 약제학적 조성물은, 약제학적으로 허용가능한 담체 또는 매체와 함께 제형화된, 전구 세포, 예를 들어 산후 세포 (바람직하게는, PPDC), 이러한 세포로부터 생성된 컨디셔닝된 배지, 또는 이의 성분 또는 생성물을 포함한다. 적합한 약제학적으로 허용가능한 담체는 물, 염 용액 (예를 들어, 링거액), 알코올, 오일, 젤라틴, 및 탄수화물, 예를 들어 락토스, 아밀로스, 또는 전분, 지방산 에스테르, 하이드록시메틸셀룰로스, 및 폴리비닐 피롤리딘을 포함한다. 이러한 제제는 멸균될 수 있고, 요망되는 경우, 보조제, 예를 들어 윤활제, 방부제, 안정제, 습윤제, 유화제, 삼투압에 영향을 미치는 염, 완충제, 및 착색제와 혼합될 수 있다. 전형적으로 그리고 배타적이지 않게, 세포 성분 또는 생성물을 포함하지만 생세포는 포함하지 않는 약제학적 조성물은 액체로서 제형화된다. PPDC 생세포를 포함하는 약제학적 조성물은 전형적으로, 액체, 반고체 (예를 들어, 겔) 또는 고체 (예를 들어, 안과용 조직 공학에 적절한 바와 같은 매트릭스, 스캐폴드 등)로 제형화된다.
약제학적 조성물은 의약 화학자 또는 생물학자에게 익숙한 바와 같은 보조 성분을 포함할 수 있다. 예를 들어, 이것은 사용되는 항산화제의 종류에 따라 달라지는 범위로 항산화제를 함유할 수 있다. 통상 사용되는 항산화제에 대한 합리적인 범위는 약 0.01% 내지 약 0.15% 중량/부피의 EDTA, 약 0.01% 내지 약 2.0% 중량/부피의 아황산나트륨, 및 약 0.01% 내지 약 2.0% 중량/부피의 메타중아황산나트륨이다. 당업자는 상기한 것 각각에 대해 약 0.1% 중량/부피의 농도를 사용할 수 있다. 다른 대표적인 화합물은 메르캅토프로피오닐 글리신, N-아세틸 시스테인, 베타-메르캅토에틸아민, 글루타티온 및 유사 종을 포함하지만, 또한 안구 투여에 적합한 다른 항산화제, 예를 들어 아스코르브산 및 이의 염 또는 아황산염 또는 메타중아황산나트륨이 사용될 수 있다.
눈의 자극을 최소화하기 위해, 완충제를 사용하여 점안 제형(eye drop formulation)의 pH를 약 4.0 내지 약 8.0의 범위로 유지할 수 있다. 직접적인 유리체강내 또는 안내 주사의 경우, 제형의 pH는 7.2 내지 7.5, 바람직하게는 7.3 내지 7.4이어야 한다. 안과용 조성물은 또한 눈에 투여하기에 적합한 장성 조절제(tonicity agent)를 포함할 수 있다. 이들 중, 0.9% 식염수 용액을 사용하여 제형을 대략 등장성으로 만드는 염화나트륨이 적합하다.
특정 실시 형태에서, 약제학적 조성물은 점도 향상제와 함께 제형화된다. 예시적인 작용제는 하이드록시에틸셀룰로스, 하이드록시프로필셀룰로스, 메틸셀룰로스, 및 폴리비닐피롤리돈이다. 약제학적 조성물에는 필요한 경우 보조 용매(cosolvent)가 첨가될 수 있다. 적합한 보조 용매는 글리세린, 폴리에틸렌 글리콜 (PEG), 폴리소르베이트, 프로필렌 글리콜 및 폴리비닐 알코올을 포함할 수 있다. 또한, 방부제, 예를 들어 벤잘코늄 클로라이드, 벤제토늄 클로라이드, 클로로부탄올, 페닐제2수은 아세테이트 또는 니트레이트, 티메로살, 또는 메틸 또는 프로필파라벤이 포함될 수 있다.
주사용 제형은 바람직하게는 일회용 투여를 위해 설계되고, 방부제를 함유하지 않는다. 주사가능한 용액은 0.9% 염화나트륨 용액 (290 내지 300 밀리오스몰의 오스몰랄 농도(osmolality))과 동등한 등장성을 가져야 한다. 이는 염화나트륨 또는 상기 열거된 바와 같은 다른 보조 용매, 또는 부형제, 예를 들어 상기 열거된 바와 같은 완충제 및 항산화제를 첨가하여 달성될 수 있다.
눈의 전방(anterior chamber) 조직은 방수(aqueous humor)에 침수(bathing)되어 있지만, 망막은 유리체에 지속적으로 노출된다. 이러한 유체/겔은 고도의 환원성 산화환원 상태로 존재하는데, 이는 이것이 항산화 화합물 및 효소를 함유하기 때문이다. 따라서, 안과용 조성물에 환원제를 포함시키는 것이 유리할 수 있다. 적합한 환원제는 N-아세틸시스테인, 아스코르브산 또는 염 형태, 및 아황산나트륨 또는 메타중아황산나트륨을 포함하며, 아스코르브산 및/또는 N-아세틸시스테인 또는 글루타티온이 주사가능한 용액에 특히 적합하다.
세포 또는 컨디셔닝된 배지, 또는 세포 성분 또는 세포 생성물을 포함하는 약제학적 조성물은 당업계에 공지된 여러 전달 방식 중 하나 이상으로 환자의 눈에 전달될 수 있다. 일부 경우에 사용하기에 적합할 수 있는 일 실시 형태에서, 조성물은 점안액 또는 세척액으로 눈에 국소적으로 전달된다. 다른 실시 형태에서, 조성물은 주기적인 안내 주사를 통해 또는 BSS 또는 BSS PLUS (미국 텍사스주 포트워스 소재의 Alcon USA)와 같은 관류 용액(irrigating solution) 중의 주입에 의해 눈 내부의 다양한 위치에 전달될 수 있다. 대안적으로, 조성물은, 예를 들어 Herrero-Vanrell의 미국 특허 제5,718,922호에 개시된 바와 같이, 사전 형성(pre-formed) 겔 또는 원위치 형성 겔 또는 리포좀과 같은 당업자에게 공지된 다른 안과용 투여형으로 적용될 수 있다. 다른 실시 형태에서, 조성물은 콘택트 렌즈 (예를 들어, Lidofilcon B, Bausch & Lomb CW79 또는 DELTACON (Deltafilcon A)) 또는 눈의 표면에 일시적으로 체류하는 다른 물체를 통해 치료가 필요한 눈의 수정체에 또는 그 수정체를 통해 전달될 수 있다. 다른 실시 형태에서, 콜라겐 각막 차폐물 (예를 들어, BIO-COR 용해가능한 각막 차폐물, 미국 매사추세츠주 워터타운 소재의 Summit Technology)과 같은 지지체가 사용될 수 있다. 조성물은 또한 삼투압 펌프 (ALZET, 미국 캘리포니아주 팔로알토 소재의 Alza Corp.)로부터 캐뉼러를 통해 또는 시한 방출 캡슐 (OCCUSENT) 또는 생분해성 디스크 (OCULEX, OCUSERT)의 이식에 의해 안구에 주입하여 투여될 수 있다. 이러한 투여 경로는 눈에 대한 약제학적 조성물의 연속적인 공급을 제공하는 이점을 갖는다. 이는 각막에 대한 국부적인 전달의 경우 이점일 수 있다.
전형적으로, 반고체 또는 고체 담체 중에 생세포를 포함하는 약제학적 조성물은 안구 손상 또는 고통 부위에서의 외과적 이식을 위해 제형화된다. 액체 조성물이 또한 외과적인 절차, 예를 들어 컨디셔닝된 배지에 의해 투여될 수 있음이 인식될 것이다. 특정 실시 형태에서, 반고체 또는 고체 약제학적 조성물은 반투과성 겔, 격자 (lattice), 세포 스캐폴드 등을 포함할 수 있으며, 이는 비생분해성이거나 생분해성일 수 있다. 예를 들어, 특정 실시 형태에서, 외인성 세포를 이의 주변 환경으로부터 격리시키지만, 세포가 생물학적 분자를 분비하고 주변 세포로 전달할 수 있게 하는 것이 바람직하거나 적절할 수 있다. 이러한 실시 형태에서, 이식된 세포를 숙주 조직으로부터 물리적으로 분리시키는, 비분해성이며 선택적으로 투과성인 장벽(barrier)에 의해 둘러싸인 PPDC를 포함하는 세포 집단 또는 생 PPDC를 포함하는 자가 이식물로 세포가 제형화될 수 있다. 이러한 이식물은 때때로 "면역보호물"로 지칭되는데, 이는 이것이 약리학적으로 유도된 면역억제의 부재 하에 면역 세포 및 거대분자가 이식된 세포를 치사하는 것을 방지하는 능력을 갖기 때문이다 (이러한 장치 및 방법의 개관에 대해서는, 예를 들어 문헌[P. A. Tresco et al., 2000, Adv. Drug Delivery Rev. 42: 3-27] 참조).
다른 실시 형태에서, 다양한 종류의 생분해성 겔 및 네트워크가 본 발명의 약제학적 조성물에 이용된다. 예를 들어, 지속 방출 제형에 특히 적합한 분해성 물질은 생체적합성(biocompatible) 중합체, 예를 들어 폴리(락트산), 폴리(락트산-코-글리콜산), 메틸셀룰로스, 하이알루론산, 콜라겐 등을 포함한다. 약물 전달 비히클에서의 생분해성 중합체의 구조, 선택 및 사용은 문헌[A. Domb et al., 1992, Polymers for Advanced Technologies 3:279-291]을 포함하는 여러 간행물에서 검토되었다. Wong 등의 미국 특허 제5,869,079호는 생분해성 지속 방출 안구 이식물에서의 친수성 엔티티(entity)와 소수성 엔티티의 조합을 개시한다. 또한, Guo 등의 미국 특허 제6,375,972호, Chen 등의 미국 특허 제5,902,598호, Wong 등의 미국 특허 제6,331,313호, Ogura 등의 미국 특허 제5,707,643호, Weiner 등의 미국 특허 제5,466,233호 및 Avery 등의 미국 특허 제6,251,090호는 각각 약제학적 조성물을 전달하는 데 사용될 수 있는 안내 이식 장치 및 시스템을 기술하고 있다.
예를 들어 손상된 또는 절단된 시신경과 같은 신경 병변의 수복을 위한 다른 실시 형태에서, 생분해성, 바람직하게는 생재흡수성 또는 생흡수성 스캐폴드 또는 매트릭스 상에 또는 그 내에 세포를 전달하는 것이 바람직하거나 적절할 수 있다. 이러한 전형적으로 3차원인 생체물질은 스캐폴드에 부착되거나, 스캐폴드 내에 분산되거나, 스캐폴드 내에 포획된(entrapped) 세포외 매트릭스 내에 혼입된 생세포를 함유한다. 일단 신체의 표적 영역으로 이식되면, 이들 이식물은 숙주 조직에 통합되고, 여기서 이식된 세포가 점차 정착하게 된다 (예를 들어, 상기 문헌 [P. A. Tresco et al., 2000] 참조; 또한 문헌[D. W. Hutmacher, 2001, J. Biomater. Sci. Polymer Edn. 12: 107-174] 참조).
본 발명에서 사용될 수 있는 스캐폴드 또는 매트릭스 (때때로 집합적으로 "프레임워크"로 지칭됨) 물질의 예는 부직포 매트(nonwoven mat), 다공성 폼(porous foam) 또는 자기 조립 펩티드(self-assembling peptide)를 포함한다. 부직포 매트는, 예를 들어, 상표명 VICRYL (미국 뉴저지주 섬머빌 소재의 Ethicon, Inc.)로 시판되는 글리콜산과 락트산 (PGA/PLA)의 합성 흡수성 공중합체로 이루어진 섬유를 사용하여 형성될 수 있다. 미국 특허 제6,355,699호에 논의된 바와 같이, 예를 들어 냉동 건조 또는 동결건조와 같은 과정에 의해 형성된 폴리(엡실론-카프로락톤)/폴리(글리콜산) (PCL/PGA) 공중합체로 이루어진 폼도 사용될 수 있다. 하이드로겔, 예를 들어 자기 조립 펩티드 (예를 들어, RAD16)도 사용될 수 있다. 원위치 형성 분해성 네트워크도 본 발명에 사용하기에 적합하다 (예를 들어, 문헌 [Anseth, K. S. et al., 2002, J. Controlled Release 78: 199-209]; 문헌[Wang, D. et al., 2003, Biomaterials 24: 3969-3980]; He 등의 미국 특허 출원 공개 제2002/0022676호 참조). 이들 물질은 주사에 적합한 유체로서 제형화되며, 이어서 다양한 수단 (예를 들어, pH, 온도 변화, 광에 대한 노출)에 의해 원위치에서 또는 생체내에서 분해가능한 하이드로겔 네트워크를 형성하도록 유도될 수 있다.
다른 실시 형태에서, 프레임워크는 생흡수성 물질, 예를 들어 PGA, PLA, PCL 공중합체 또는 블렌드, 또는 하이알루론산으로 만들어진 멀티필라멘트 얀(multifilament yarn)으로 이루어질 수 있는 펠트(felt)이다. 이 얀은 권축, 절단, 카딩(carding) 및 니들링(needling)으로 이루어진 표준 텍스타일 가공 기법을 사용하여 펠트로 만들어진다. 다른 실시 형태에서, 세포는 복합 구조일 수 있는 폼 스캐폴드 상에 시딩된다.
전술한 많은 실시 형태에서, 프레임워크는 유용한 형상으로 성형될 수 있다. 또한, PPDC가 사전 형성된 비분해성 외과용 또는 이식가능한 장치 상에, 예를 들어 섬유아세포 함유 GDC 혈관내 코일의 제조에 사용되는 것에 상응하는 방식으로 배양될 수 있다는 것이 인식될 것이다 (문헌 [Marx, W. F. et al., 2001, Am. J. Neuroradiol. 22: 323-333]).
매트릭스, 스캐폴드 또는 장치는 세포 부착을 향상시키기 위해 세포의 접종 전에 처리될 수 있다. 예를 들어, 접종 전에, 나일론 매트릭스는 0.1 몰의 아세트산으로 처리되고, 폴리라이신, PBS, 및/또는 콜라겐 중에서 인큐베이션되어 나일론을 코팅할 수 있다. 폴리스티렌을 황산을 사용하여 유사하게 처리할 수 있다. 또한, 프레임워크의 외부 표면은 프레임워크의 플라즈마 코팅 또는 하나 이상의 단백질 (예를 들어, 콜라겐, 탄성 섬유, 세망 섬유), 당단백질, 글리코사미노글리칸 (예를 들어, 헤파린 설페이트, 콘드로이틴-4-설페이트, 콘드로이틴-6-설페이트, 더마탄 설페이트, 케라틴 설페이트), 세포 매트릭스 및/또는 특히 젤라틴, 알기네이트, 한천, 아가로스, 및 식물성 검과 같은, 그러나 이에 한정되지 않는 다른 물질의 첨가에 의한 것과 같이, 세포의 부착 또는 성장 및 조직의 분화를 개선시키도록 변형될 수 있다.
생세포를 함유하는 프레임워크는 당업계에 공지된 방법에 따라 제조된다. 예를 들어, 세포를 배양 용기에서 자유롭게 서브-컨플루언시(sub-confluency) 또는 컨플루언시까지 성장시키고, 배양물로부터 들어 올려져, 프레임워크로 접종시킬 수 있다. 성장 인자는 세포의 접종 전에, 그 동안 또는 그 후에 배양 배지에 첨가되어, 요망되는 경우, 분화 및 조직 형성을 촉발시킬 수 있다. 대안적으로, 프레임워크 그 자체는 그 위에서의 세포의 성장이 향상되거나, 이식물의 거부반응의 위험이 감소되도록 변형될 수 있다. 따라서, 항염증제, 면역억제제 또는 성장 인자를 포함하지만 이에 한정되지 않는 하나 이상의 생물학적 활성 화합물을 국부적인 방출을 위하여 프레임워크에 첨가할 수 있다.
사용 방법
전구 세포, 예를 들어 산후 세포 (바람직하게는, hUTC 또는 PDC), 또는 이의 세포 집단, 또는 이러한 세포에 의해 생성된 컨디셔닝된 배지 또는 다른 성분 또는 생성물은 안구 세포 및 조직의 수복 및 재생을 지원하고 촉진하기 위해 다양한 방식으로 사용될 수 있다. 이러한 유용성은 시험관내, 생체외(ex vivo) 및 생체내 방법을 포함한다. 아래에 제시된 방법은 PPDC에 관한 것이지만, 다른 전구 세포도 이러한 방법에 사용하기에 적합할 수 있다.
시험관내
및
생체외
방법
일 실시 형태에서, 전구 세포, 예를 들어 산후 세포 (바람직하게는, hUTC 또는 PDC), 및 이로부터 생성된 컨디셔닝된 배지를 시험관내에서 사용하여 약제학적 작용제, 성장 인자, 조절 인자 등의 유효성 및 세포독성에 대해 매우 다양한 화합물을 스크리닝할 수 있다. 예를 들어, 이러한 스크리닝을 실질적으로 균질한 PPDC 집단에서 수행하여 안구 질환의 치료를 위해 PPDC와 함께 제형화되거나 이와 공동 투여될 후보 화합물의 효능 또는 독성을 평가할 수 있다. 대안적으로, 새로운 약제학적 약물 후보의 효능을 평가할 목적으로 눈에서 발견되는 세포 유형 또는 이의 전구체로 분화되도록 자극된 PPDC에서 이러한 스크리닝을 수행할 수 있다. 이러한 실시 형태에서, PPDC를 시험관내에서 유지하고, 시험될 화합물에 노출한다. 잠재적으로 세포독성인 화합물의 활성은 배양 중 세포를 손상시키거나 치사하는 이의 능력에 의해 측정할 수 있다. 이것은 생체 염색(vital staining) 기법에 의해 용이하게 평가될 수 있다.
상기 논의된 바와 같이, PPDC는 시험관내에서 배양되어, 세포에 의해 자연적으로 생성되거나, 다른 계통으로 분화되도록 유도될 때 세포에 의해 생성되거나, 유전자 변형을 통해 세포에 의해 생성되는 생물학적 생성물을 생성할 수 있다. 예를 들어, TIMP1, TPO, KGF, HGF, FGF, HBEGF, BDNF, MIP1b, MCP1, RANTES, I309, TARC, MDC 및 IL-8은 성장 배지에서 성장된 제대 유래 세포로부터 분비되는 것으로 밝혀졌다. 제대 유래 세포는 또한 트롬보스폰딘-1, 트롬보스폰딘-2 및 트롬보스폰딘-4를 분비한다. TIMP1, TPO, KGF, HGF, FGF, HBEGF, BDNF, MIP1a, MCP-1, RANTES, TARC, 에오탁신(Eotaxin) 및 IL-8은 성장 배지 중에서 배양된 태반 유래 PPDC로부터 분비되는 것으로 밝혀졌다 (실시예 참조).
이와 관련하여, 본 발명의 실시 형태는 컨디셔닝된 배지의 생성을 위한 PPDC의 사용을 특징으로 한다. PPDC로부터의 컨디셔닝된 배지의 생성은 미분화 PPDC로부터 또는 분화를 자극하는 조건 하에서 인큐베이션된 PPDC로부터 이루어질 수 있다. 이러한 컨디셔닝된 배지는, 예를 들어 상피 선구 세포 또는 신경 선구 세포의 시험관내 또는 생체외 배양에서의 사용, 또는 균질한 PPDC 집단 또는 PPDC와 다른 전구체를 포함하는 불균질한 집단을 포함하는 이식된 세포를 지원하기 위한 생체내에서의 사용이 고려된다.
PPDC로부터의 세포 용해물, 가용성 세포 분획 또는 성분, 또는 ECM 또는 이의 성분은 다양한 목적으로 사용될 수 있다. 상기 언급된 바와 같이, 이들 성분 중 일부는 약제학적 조성물에 사용될 수 있다. 다른 실시 형태에서, 세포 용해물 또는 ECM은 외과적으로, 또는 이식을 위해, 또는 생체외 목적으로 사용될 물질 또는 장치를 코팅 또는 다른 방식으로 처리하기 위해 사용되어, 이러한 처리 과정에서 접촉된 세포 또는 조직의 치유 또는 생존을 촉진한다.
실시예 12 및 실시예 14에 기술된 바와 같이, PPDC는 성체 신경 전구 세포와의 공동 배양으로 성장시킬 때 그 성체 신경 전구 세포의 생존, 성장 및 분화를 지원하는 능력을 나타내었다. 마찬가지로, 이전의 연구는 PPDC가 영양 메커니즘(trophic mechanism)을 통해 망막의 세포를 지원하는 기능을 할 수 있음을 나타낸다. (미국 특허 출원 공개 제2010-0272803호). 따라서, PPDC를 유리하게는 시험관내 공동 배양에서 사용하여, 다른 세포, 특히 신경 세포 및 신경 전구체와 안구 전구체 (예를 들어, 신경 줄기 세포 및 망막 또는 각막 상피 줄기 세포)에 영양 지원을 제공한다. 공동 배양의 경우, PPDC 및 요망되는 다른 세포를 두 세포 유형이 접촉하는 조건 하에서 공동 배양하는 것이 바람직할 수 있다. 이는, 예를 들어 적합한 배양 기재 상에 또는 배양 배지 내에 불균질한 세포 집단으로서 세포를 시딩함으로써 달성될 수 있다. 대안적으로, PPDC를 먼저 컨플루언스(confluence)까지 성장시킬 수 있고, 이어서 이는 배양 중인 제2의 요망되는 세포 유형에 대한 기재로서 작용할 것이다. 이러한 후자의 실시 형태에서, 세포는, 예를 들어 막 또는 유사한 장치에 의해 추가로 물리적으로 분리될 수 있어서, 공동 배양 기간 후에 다른 세포 유형이 분리되어 별도로 사용될 수 있도록 한다. 신경 또는 안구 세포 유형의 증식 및 분화를 촉진하기 위한 공동 배양에서의 PPDC의 사용은 연구 및 임상/치료 영역에서 적용가능성을 발견할 수 있다. 예를 들어, PPDC 공동 배양을 이용하여, 예컨대 기초 연구 목적 또는 약물 스크리닝 검정에서의 사용을 위해 배양 중 이러한 세포의 성장 및 분화를 촉진할 수 있다. PPDC 공동 배양은 또한 치료 목적을 위한 추후 투여를 위해 신경 또는 안구 전구체의 생체외 증식에 이용될 수 있다. 예를 들어, 신경 또는 안구 전구 세포가 개체로부터 수집되고, PPDC와의 공동 배양 중 생체외에서 증식되고, 이어서 그 개체로 (자가 전달) 또는 다른 개체로 (동계 또는 동종이계 전달) 복귀될 수 있다. 이러한 실시 형태에서, 생체외 증식 후, PPDC 및 전구체를 포함하는 혼합 세포 집단이 치료가 필요한 환자에게 투여될 수 있음이 인식될 것이다. 대안적으로, 자가 전달이 적절하거나 바람직한 상황에서, 공동 배양되는 세포 집단은 배양 중 물리적으로 분리될 수 있어서, 환자에 대한 투여를 위해 자가 전구체의 분리를 가능하게 한다.
생체내
방법
실시예에 설명된 바와 같이, 전구 세포 (PPDC), 또는 이러한 세포로부터 생성된 컨디셔닝된 배지는 안구 변성 질환을 치료하는 데 효과적으로 사용될 수 있다. 일단 눈의 표적 위치로 이식되면, PPDC와 같은 전구 세포, 또는 전구 세포로부터의 컨디셔닝된 배지는 원위치에서 뉴런 세포를 포함하는 안구 세포에 대한 영양 지원을 제공한다.
전구 세포 (PPDC), 전구 세포로부터의 컨디셔닝된 배지는 다른 유익한 약물, 생물학적 분자, 예를 들어 성장 인자, 영양 인자, (전구 세포 또는 분화된 세포 배양물로부터의) 컨디셔닝된 배지, 또는 다른 활성 작용제, 예를 들어 당업계에 공지된 바와 같은 항염증제, 항아폽토시스제, 항산화제, 성장 인자, 신경영양 인자 또는 신경재생 또는 신경보호 약물과 함께 투여될 수 있다. 컨디셔닝된 배지가 다른 작용제와 함께 투여되는 경우, 이것은 단일 약제학적 조성물로 함께, 또는 개별 약제학적 조성물로 다른 작용제와 동시에 또는 이와 순차적으로 (다른 작용제의 투여 전 또는 후에) 투여될 수 있다.
PPDC와 같은 전구 세포, 및 컨디셔닝된 배지 생성물과 함께 투여될 수 있는 다른 성분의 예는 몇 가지 예를 들자면 하기와 같은 것을 포함하지만 이에 한정되지 않는다: (1) 다른 신경보호 또는 신경유익 약물; (2) 선택된 세포외 매트릭스 성분, 예를 들어 당업계에 공지된 하나 이상의 유형의 콜라겐, 및/또는 성장 인자, 혈소판 풍부 혈장, 및 약물 (대안적으로, 세포는 성장 인자를 발현하고 생성하도록 유전자 조작될 수 있음); (3) 항아폽토시스제 (예를 들어, 에리트로포이에틴 (EPO), EPO 항체모방체, 트롬보포이에틴, 인슐린 유사 성장 인자 (IGF)-I, IGF-II, 간세포 성장 인자, 카스파제 저해제); (4) 항염증 화합물 (예를 들어, p38 MAP 키나제 저해제, TGF-베타 저해제, 스타틴, IL-6 및 IL-1 저해제, 페미롤라스트, 트라닐라스트, 레미케이드, 시롤리무스, 및 비스테로이드성 항염증 약물 (NSAID) (예를 들어, 테폭살린, 톨메틴, 및 서프로펜); (5) 면역억제제 또는 면역조절제, 예를 들어 칼시뉴린 저해제, mTOR 저해제, 항증식제, 코르티코스테로이드 및 다양한 항체; (6) 항산화제, 예를 들어 프로부콜, 비타민 C와 비타민 E, 코엔자임 Q-10, 글루타티온, L-시스테인 및 N-아세틸시스테인; 및 (6) 국부 마취제.
액체 또는 유체 약제학적 조성물은 눈의 더 전반적인 위치에 (예를 들어, 국소적으로 또는 안구내로) 투여될 수 있다.
다른 실시 형태는 PPDC와 같은 전구 세포로부터의 컨디셔닝된 배지, 또는 이러한 세포에 의해 자연적으로 생성되거나 그 세포의 유전자 변형을 통해 생성된 영양 인자 및 다른 생물학적 인자를 포함하는 약제학적 조성물을 투여함으로써 안구 변성 질환을 치료하는 방법을 포함한다. 역시, 이러한 방법은 다른 활성 작용제, 예를 들어 당업계에 공지된 바와 같은 성장 인자, 신경영양 인자 또는 신경재생 또는 신경보호 약물을 투여하는 단계를 추가로 포함할 수 있다.
PPDC와 같은 전구 세포로부터의 컨디셔닝된 배지 또는 본 명세서에 기술된 다른 약제학적 조성물 중 임의의 것을 투여하기 위한 투여형 및 계획(regimen)은 개별 환자의 상태, 예를 들어 안구 변성 질환의 특성 및 정도, 연령, 성별, 체중 및 전반적인 의학적 상태, 및 의사에게 알려져 있는 다른 인자를 고려하여 모범 의료행위 지침(good medical practice)에 따라 개발된다. 따라서, 환자에게 투여될 약제학적 조성물의 유효량은 당업계에 알려져 있는 바와 같은 이들 고려사항에 의해 결정된다.
세포 요법을 개시하기 전에 환자를 약리학적으로 면역억제시키는 것이 바람직하거나 적절할 수 있다. 상술한 바와 같이, 이는 전신 또는 국부 면역억제제의 사용을 통하여 달성되거나, 이는 캡슐화된 장치에서 세포를 전달함으로써 달성될 수 있다. 이식된 세포에 대한 면역 반응을 감소시키거나 제거하기 위한 이들 및 다른 수단은 당업계에 알려져 있다. 대안으로서, 컨디셔닝된 배지는 상기 언급된 바와 같이 면역원성을 감소시키도록 유전자 변형된 PPDC로부터 제조될 수 있다.
살아있는 환자에서의 이식된 세포의 생존은 다양한 스캐닝 기법, 예를 들어 컴퓨터 단층 촬영 (CAT 또는 CT) 스캔, 자기 공명 이미지화 (MRI) 또는 양전자 방출 단층촬영술 (PET) 스캔의 사용을 통해 결정될 수 있다. 이식물 생존의 결정은 또한 조직을 적출하고, 이를 가시적으로 또는 현미경을 통해 조사함으로써 사후에 행해질 수 있다. 대안적으로, 세포는 신경 또는 안구 세포 또는 이의 생성물, 예를 들어 신경전달물질에 특이적인 염색제로 처리될 수 있다. 또한, 이식된 세포는 추적 염료, 예를 들어 로다민 또는 플루오레세인 표지 미소구체, 패스트 블루(fast blue), 제2철(ferric) 미립자, 비스벤즈아미드 또는 유전자 도입된 리포터 유전자 생성물, 예를 들어 베타-갈락토시다제 또는 베타-글루쿠로니다제의 사전 혼입에 의해 확인될 수 있다.
이식된 세포 또는 컨디셔닝된 배지의 피검자의 안구 조직으로의 기능적 통합은 손상되거나 이환된 안구 기능의 회복을 검사함으로써 평가될 수 있다. 예를 들어, 황반 변성 또는 다른 망막병증의 치료의 유효성은 시력의 개선, 및 입체 컬러 안저 사진(stereoscopic color fundus photograph)의 비정상 및 등급에 대한 평가에 의해 결정될 수 있다. (문헌[Age-Related Eye Disease Study Research Group, NEI, NIH, AREDS Report No.8, 2001, Arch. Ophthalmol. 119: 1417-1436]).
키트 및 뱅크(Bank)
다른 태양에서, 본 발명은 상기 기술된 바와 같은 안구 재생 및 수복을 위한 다양한 방법에서 PPDC와 같은 전구 세포, 및 세포 집단, 세포, 바람직하게는 PPDC로부터 제조된 컨디셔닝된 배지, 및 이의 성분 및 생성물을 이용하는 키트를 제공한다. 안구 변성 질환의 치료 또는 다른 예정된 치료에 사용되는 경우, 키트는 적어도 산후 세포 또는 산후 세포로부터 유래된 컨디셔닝된 배지를 포함하는 하나 이상의 세포 집단 또는 컨디셔닝된 배지, 및 약제학적으로 허용가능한 담체 (액체, 반고체 또는 고체)를 포함할 수 있다. 키트는 또한 선택적으로, 예를 들어 주사에 의해, 세포 및 컨디셔닝된 배지를 투여하는 수단을 포함할 수 있다. 키트는 추가로 세포 및 컨디셔닝된 배지의 사용에 대한 설명서를 포함할 수 있다. 야전 병원용, 예를 들어 군용으로 제조된 키트는 조직 스캐폴드, 수술 봉합사 등을 비롯한 완전-절차(full-procedure) 공급물을 포함할 수 있으며, 이 경우 세포 또는 컨디셔닝된 배지는 급성 상해의 수복과 관련하여 사용될 것이다. 본 명세서에 기술된 바와 같은 검정 및 시험관내 방법을 위한 키트는, 예를 들어 하기 중 하나 이상을 함유할 수 있다: (1) PPDC 또는 이의 성분, 또는 PPDC의 컨디셔닝된 배지 또는 다른 생성물; (2) 시험관내 방법을 실시하기 위한 시약; (3) 적절한 경우, 다른 세포 또는 세포 집단; 및 (4) 시험관내 방법을 수행하기 위한 설명서.
또 다른 태양에서, 본 발명은 또한 본 발명의 조직, 세포, 세포 집단, 컨디셔닝된 배지, 및 세포 성분의 뱅킹을 제공한다. 상기 논의된 바와 같이, 세포 및 컨디셔닝된 배지는 용이하게 동결보존된다. 따라서, 본 발명은 세포를 뱅크에 동결보존하는 방법을 제공하며, 여기서 세포는 동결 보관되고, 세포의 면역학적, 생화학적 및 유전적 특성에 기반한 세포의 완전한 특징규명과 관련된다. 동결된 세포는 해동되어, 절차의 요건 및 환자의 필요에 따라 증식되거나 자가, 동계 또는 동종이계 요법에 직접 사용될 수 있다. 바람직하게는, 각각의 동결보존된 샘플에 대한 정보는 컴퓨터에 저장되고, 이는 외과의, 절차 및 환자의 요건에 기반하여 검색가능하며, 이때 적합한 매치(match)는 세포 또는 집단의 특징규명에 기반하여 이루어진다. 바람직하게는, 본 발명의 세포를 성장시켜 요망되는 세포량까지 증식시키고, 치료용 세포 조성물을 매트릭스 또는 지지체의 존재 또는 부재 하에 개별적으로 또는 공동 배양물로 제조한다. 일부 응용의 경우, 새로 준비된 세포를 사용하는 것이 바람직할 수 있지만, 세포를 동결시키고 컴퓨터에 정보를 입력하여 컴퓨터 입력을 샘플과 관련시킴으로써, 나머지를 동결보존 및 뱅킹할 수 있다. 공급원 또는 공여체를 그러한 세포의 수령체와 매칭시킬 필요가 없는 경우에도, 면역학적 목적을 위해, 뱅크 시스템은, 예를 들어 뱅킹된 세포의 바람직한 생화학적 또는 유전적 특성을 치료적 필요성에 쉽게 매칭시키게 한다. 요망되는 특성이 뱅킹된 샘플과 매칭되면, 샘플을 회수하여 치료적 사용을 위해 준비한다. 본 명세서에 기술된 바와 같이 제조된 세포 용해물, ECM 또는 세포 성분은 또한 동결보존되거나 다른 방식으로 (예를 들어, 동결건조에 의해) 보존되고 본 발명에 따라 뱅킹될 수 있다.
하기 실시예는 본 발명을 더욱 상세하게 설명하기 위하여 제공된다. 실시예는 본 발명을 예시하고자 하는 것으로서, 본 발명을 한정하고자 하는 것은 아니다.
하기의 약어가 본 명세서의 실시예 및 다른 부분 그리고 청구범위에 나타날 수 있다: ANG2 (또는 Ang2)는 안지오포이에틴(angiopoietin) 2이고; APC는 항원 제시 세포이고; BDNF는 뇌 유래 신경영양 인자이고; bFGF는 염기성 섬유아세포 성장 인자이고; bid (BID)는 "하루 두 번" (일일 2회)이고; CK18은 사이토케라틴 18이고; CNS는 중추 신경계이고; CNTF는 섬모 신경영양 인자이고; CXC 리간드 3은 케모카인 수용체 리간드 3이고; DMEM은 둘베코 최소 필수 배지이고; DMEM:lg (또는 DMEM:Lg, DMEM:LG)는 저농도 글루코스를 함유한 DMEM이고; EDTA는 에틸렌 다이아민 테트라아세트산이고; EGF (또는 E)는 표피 성장 인자이고; FACS는 형광 활성화 세포 분류이고; FBS는 소 태아 혈청이고; FGF (또는 F)는 섬유아세포 성장 인자이고; GBP는 가바펜틴(gabapentin)이고; GCP-2는 과립구 주화성 단백질-2이고; GDNF는 아교 세포 유래 신경영양 인자이고; GFAP는 아교세포 섬유 산성 단백질이고; HB-EGF는 헤파린 결합 표피 성장 인자이고; HCAEC는 인간 관상 동맥 내피 세포이고; HGF는 간세포 성장 인자이고; hMSC는 인간 중간엽 줄기 세포이고; HNF-1알파는 간세포 특이적 전사 인자이고; HVVEC는 인간 제대 정맥 내피 세포이고; I309는 케모카인이면서 CCR8 수용체에 대한 리간드이고; IGF-l은 인슐린 유사 성장 인자 1이고; IL-6은 인터류킨-6이고; IL-8은 인터류킨 8이고;K19는 케라틴 19이고; K8은 케라틴 8이고; KGF는 각질세포 성장 인자이고; LIF는 백혈병 저해 인자이고; MBP는 미엘린 염기성 단백질이고; MCP-l은 단핵구 주화성 단백질 1이고; MDC는 대식세포 유래 케모카인이고; MIP1알파는 대식세포 염증 단백질 1 알파이고; MIP1베타는 대식세포 염증 단백질 1 베타이고; MMP는 매트릭스 메탈로프로테아제 (MMP)이고; MSC는 중간엽 줄기 세포이고; NHDF는 정상 인간 피부 섬유아세포이고; NPE는 신경 전구체 증식 배지이고; NT3은 뉴로트로핀 3이고; 04는 희소돌기아교세포 또는 아교세포 분화 마커 04이고; PBMC는 말초 혈액 단핵 세포이고; PBS는 인산염 완충 식염수이고; PDGF-CC는 혈소판 유래 성장 인자 C이고; PDGF-DD는 혈소판 유래 성장 인자 D이고; PDGFbb는 혈소판 유래 성장 인자 bb이고; PO는 "경구로" (입에 의해)이고; PNS는 말초 신경계이고; Rantes (또는 RANTES)는 활성화 시 정상 T 세포 발현 및 분비 조절(regulated on activation, normal T cell expressed and secreted)이고; rhGDF-5는 재조합 인간 성장 및 분화 인자 5이고; SC는 피하이고; SDF-1알파는 간질 유래 인자 1 알파이고; SHH는 소닉 헤지호그(sonic hedgehog)이고; SOP는 표준 작업 절차(standard operating procedure)이고; TARC는 흉선 및 활성화 조절 케모카인이고; TCP는 조직 배양 플라스틱이고; TCPS는 조직 배양 폴리스티렌이고; TGF베타1은 형질전환 성장 인자 베타1이고; TGF베타2는 형질전환 성장 인자 베타2이고; TGF 베타-3은 형질전환 성장 인자 베타-3이고; TIMP1은 매트릭스 메탈로프로테이나제 1의 조직 저해제이고; TPO는 트롬보포이에틴이고; TSP는 트롬보스폰딘이고; TUJ1은 BIII 튜불린이고; VEGF는 혈관 내피 성장 인자이고; vWF는 폰 빌레브란트(von Willebrand) 인자이고; 알파FP는 알파-페토프로테인이다.
본 발명은 하기 실시예에 의해 추가로 설명되지만, 이에 의해 제한되지는 않는다.
실시예 1
신경돌기 증생 및 시냅스생성에 대한 전구 세포의 효과
시냅스생성은 뉴런들 사이, 특히 시냅스전 뉴런 (Bassoon)과 시냅스후 뉴런 (Homer) 사이의 시냅스의 형성이다. 이러한 시냅스 형성 과정은, 시냅스 형성을 촉진하는 것과 함께, 또한 뉴런 생존 및 성장에 대한 지원을 제공하는 성상세포 - 망막 신경절 세포를 포함함 - 에 의해 조절된다. 망막 변성 모델에 대한 생체외 인간 제대 조직 유래 세포 (hUTC)의 망막하 투여가 광수용체 및 시각 기능을 보존한 것으로 밝혀졌다. (미국 특허 출원 공개 제2010/0272803호). 여기에서, hUTC의 치료적 양상이 조사되고, 기능성 시냅스 형성 (시냅스생성), 뉴런 생존 및 증생에 대한 유래 hUTC의 효과가 특징규명된다.
재료 및 방법
인간 제대 조직 유래 세포 (hUTC)는 하기 실시예 4 내지 실시예 16에 기술되고, 모두 본 명세서에 참고로 포함된, 미국 특허 제7,524,489호 및 미국 특허 제7,510,873호, 및 미국 특허 출원 공개 제2005/0058634호에 상세히 기술된 방법으로부터 얻었다. 간략하게 말하면, 생존 출산 후 공여체 동의 하에 인간 제대를 얻었다. 조직을 민싱(mincing)하고, 효소적으로 분해시켰다. 0.5 U/mL의 콜라게나제 (독일 하이델베르크 소재의 Serva Electrophoresis), 5 U/mL의 중성 프로테아제 (독일 하이델베르크 소재의 Serva Elecrtrophoresis) 및 2 U/mL의 하이알루로니다제 (Cumulase; 덴마크 마알로브 소재의 Origio a/s)의 혼합물을 함유하는 둘베코 변형 이글 배지 (DMEM)-저농도 글루코스 (Lg) (미국 캔자스주 르넥사 소재의 SAFC Biosciences)를 사용하여 거의 완전히 분해시킨 후, 세포 현탁액을 70 μm 필터를 통해 여과시키고, 상청액을 250 x g로 원심분리하였다. 단리된 세포를 DMEM-Lg에서 수회 세척하고, 15% (vol/vol) 소 태아 혈청 (FBS; SAFC Biosciences) (5% (vol/vol) 이산화탄소, 37℃)을 함유하는 DMEM-Lg에 5,000개의 세포/㎠의 밀도로 플레이팅하였다. 세포가 대략 70% 컨플루언스에 도달하였을 때 (약 3 내지 4일), 이것을 TrypLE (미국 뉴욕주 그랜드아일랜드 소재의 Gibco)를 사용하여 계대하였다. 세포를 수회 증식시키고, 뱅킹하였다. 동결보존된 hUTC (16 내지 20회의 집단 배가)를 사용하였다.
망막 신경절 세포: 망막 신경절 세포 (RGC)를 이전에 기술된 바와 같이 (문헌[Winzeler A, Wang JT., Cold Spring Harbor Protocols, 2013; 643-652]) 암수 각각의 P7 (생후 7일째) 스프래그-돌리(Sprague-Dawley) 래트의 망막 (미국 매세추세츠주 윌밍턴 소재의 Charles River)으로부터 순차 면역 패닝(sequential immuno-panning)에 의해 정제하였다. 간략하게 말하면, 망막을 절개하고, 파파인 (6 U/mL, 미국 캘리포니아주 벌링게임 소재의 Worthington)으로 해리시켰다. 해리된 세포를 먼저 반데이라이아 심플리시폴리아(Bandeiraea Simplicifolia) 렉틴 I (BSL, 미국 캘리포니아주 벌링엄 소재의 Vector laboratories) 코팅 페트리 접시로 패닝하여 면역 세포, 세포 잔사 및 섬유아세포를 제거하였다. 결합되지 않은 세포를, RGC의 특이적 단리를 위해 항-Thy1 (클론 T11D7) 항체로 코팅된 페트리 접시로 옮겼다. 정제된 RGC를 부드럽게 트립신 처리하고, 24웰 플레이트에서 폴리-D-라이신 (PDL) 및 라미닌 코팅 유리 커버슬립에 리플레이팅(re-plating)하였다 (35,000개의 세포/커버슬립). B27 (미국 뉴욕주 그랜드아일랜드 소재의 Invitrogen), 뇌 유래 신경영양 인자 (BDNF), 섬모 신경영양 인자 (CNTF), 인슐린 및 포르스콜린을 함유하는 무혈청 성장 배지 (배지의 전체 레시피(recipe)는 상기 문헌[Winzeler and Wang, Cold Spring Harbor Protocols]에서 찾아볼 수 있음)에서 RGC를 배양하였다.
피질 성상세포 (ASC)를 문헌[McCarthy KD, de Vellis J., J. Cell Biology, 1980; 85:890-902]에 기술된 바와 같이 표준 방법을 사용하여 암수 각각의 P1 스프래그-돌리 새끼 래트로부터 단리하였다. 성상세포 공동 배양을 위해, 트랜스웰 인서트 (미국 뉴저지주 프랭클린 레이크스 소재의 BD Biosciences)를, 성상세포 성장 배지 (AGM, 문헌[McCarthy KD, de Vellis J., J. Cell Biology, 1980; 85:890-902]에 기재되어 있음) 중에 인서트당 125,000개의 피질 성상세포를 시딩함으로써 준비하였다. 다음 날 AGM을 RGC 성장 배지로 교체하고, 커버슬립에 4 DIV (시험관내 일수) RGC를 함유하는 24웰 플레이트로 트랜스웰 인서트를 옮겼다.
정상 인간 피부 섬유아세포 (NHDF)를 Lonza (미국 메릴랜드주 워커스빌 소재)로부터 입수하였다. 제조사의 프로토콜에 따라 세포를 증식시키고 계대 4에서 동결보존하였다.
RGC를 6일 동안 hUTC, 양성 대조군으로서의 ASC 또는 음성 대조군으로서의 NHDF 세포주와 공동 배양하였다. DIV3의 hUTC, 및 NHDF를 10K, 20K, 30K, 100K 및 200K로 시딩하였다. 성상세포를 130K로 시딩하였다. 25K, 50K 및 100K의 hUTC, 130K의 성상세포, 및 100K, 150K 및 200K의 NHDF를 사용하여 시냅스 형성에 대한 효과를 계산하였다.
공동 배양 실험을 위해, RGC와의 공동 배양 전날에 25,000개의 hUTC를 트랜스웰 인서트에 hUTC 성장 배지 중에 시딩하였다. 공동 배양 당일에 hUTC 성장 배지를 RGC 성장 배지로 교체하고, 유리 커버슬립에서 성장된 4 DIV RGC를 함유한 24웰 플레이트로 트랜스웰 인서트를 옮겼다.
제조사의 권장사항을 사용하여 NHDF를 섬유아세포 기저 배지 (FBM, Lonza) 중에서 배양하였다. RGC와의 공동 배양을 위해, RGC와의 공동 배양 전날에 150,000개의 NHDF를 트랜스웰 인서트에 FBM 배지 중에 시딩하였다. 다음 날 FBM을 RGC 성장 배지로 교체하고, 커버슬립에 4 DIV RGC를 함유하는 24웰 플레이트로 트랜스웰 인서트를 옮겼다.
면역세포화학에 의한 시냅스 수의 정량화 (시냅스 검정): 시냅스전 (Bassoon) 및 시냅스후 (Homer) 마커의 공동 국재화의 면역세포학적 분석 및 전기생리학에 의해 시냅스 형성을 평가하였다. 35,000개의 RGC를 4 DIV 동안 유리 커버슬립에서 단독으로 배양하고, 트랜스웰 인서트 또는 컨디셔닝된 배지를 4 DIV째에 첨가하였다. TSP 유도 시냅스 형성을 차단하기 위해, 32 μM 가바펜틴 (GBP)을 문헌[Eroglu C, et al., Cell, 2009; 139:380-392]에 기술된 바와 같이 컨디셔닝된 배지와 함께 첨가하였다. 공동 배양된 세포에 7 DIV째에 신선한 성장 배지를 공급하였다. 컨디셔닝된 배지를 사용한 경우, 컨디셔닝된 배지가 보충된 성장 배지를 7 DIV째에 제공하였다. 10 DIV째에, RGC를 4% PFA (w/v)로 고정시키고, 시냅스전 마커 bassoon (마우스 항-bassoon, 1:1000, RRID: AB_2038857, 미국 뉴욕주 파밍데일 소재의 Enzo) 및 시냅스후 마커 homer-1 (토끼 항-homer, 1:500, RRID: AB_1966438, 독일 괴팅겐 소재의 Synaptic Systems)에 대해 염색하였다. Alexa 접합 2차 항체 (Invitrogen, 염소 항 토끼 AF-488 (1:1000, RRID: AB_10563748) 및 염소 항 마우스 AF-594 (1:500, RRID: AB_10561507))를 검출에 사용하였다. 유리 슬라이드 (미국 펜실베이니아주 래드너 소재의 VWR Scientific) 상의 DAPI를 함유한 Vectashield 마운팅 배지 (Vector Laboratories) 중에 커버슬립을 마운팅하였다. RGC를 63X 대물렌즈를 사용하여 Zeiss Axioimager M1 형광 현미경 (미국 뉴욕주 톤우드 소재의 Carl Zeiss)에서 이미지화하였다. 가장 가까운 이웃세포(neighbor)와 적어도 2 세포 직경 떨어져 있는 형태적으로 건강한 단일 세포를 DAPI 형광에 의해 무작위로 확인하였다. 조건당 적어도 15개 내지 20개의 세포를 이미지화하여 실험마다 분석하였으며, 제시된 결과는 2회 또는 3회의 독립적인 실험의 평균이다. 캡처된 이미지를 NIH 이미지 처리 패키지인 ImageJ에 대한 커스텀 플러그-인(custom plug-in) (Barry Wark에 의해 작성됨, 요청 시 듀크 대학(Duke University)의 Cagla Eroglu로부터 입수가능함)을 사용하여 공동 국재화된 시냅스 펑크텀에 대하여 분석하였다. 염색 프로토콜 및 정량화 방법의 세부 사항은 문헌[Ippolito DM, Eroglu C., J Vis Exp,. 2010; 16(45):2270]에 상세히 기술되어 있다. 시냅스 밀도 (신경돌기 길이당 시냅스의 수)는 100 μm 수상돌기당 공동 국재화된 시냅스 펑크텀의 수를 계수함으로써 결정하였다. 이러한 분석을 위해, 세포당 하나의 근위 수상돌기를 이미지마다 무작위로 선택하였다. 제시된 시냅스 밀도 결과는 조건당 30개의 세포를 사용한 하나의 실험으로부터 얻은 것이다.
RGC로부터의 전기생리학적 기록: 미니어처 흥분성 시냅스후 전류 (mEPSC)를 -70 ㎷의 유지 전위에서 전 세포 패치 클램프에 의해 기록하였다. 세포를 0.2 mL/min의 유량으로 23 내지 24℃에서 세포외 용액의 연속 관류 하에서 유지하였다. 세포외 용액은 하기를 함유하였다: 124 mM NaCl, 2.5 mM KCl, 2 mM CaCl2, 1 mM MgCl2, 26 mM NaHCO3, 1.2 mM NaH2PO4, 10 mM D-글루코스 (pH 7.4). 테트로도톡신 (TTX, Abcam, 1 μM, 미국 매사추세츠주 케임브리지 소재의 Abcam)을 기록 중에 세포외 용액에 첨가하였다. 패치 피펫 (2.5 내지 5 MΩ) 중의 내부 용액은 120 mM 세슘 메탄 설포네이트, 5 mM NaCl, 10 mM 테트라에틸암모늄 클로라이드, 10 mM HEPES, 4 mM 리도카인 N-에틸 브로마이드, 1.1 mM EGTA, 4 mM 마그네슘 ATP, 및 0.3 mM 소듐 GTP를 함유하였고, pH는 CsOH를 사용하여 7.2로 조정하였고, 오스몰랄 농도는 수크로스를 사용하여 300 mOsm으로 설정하였다. 신호를 멀티클램프(MultiClamp) 700B 증폭기 (미국 캘리포니아주 서니베일 소재의 Molecular Devices)에 의해 기록하고, 10 ㎑에서 필터링하고, Digidata 1440A 디지타이저(digitizer) (Molecular Devices)를 사용하여 20 ㎑에서 디지털화하였다. 전 세포 구성(whole-cell configuration)에서, 기록은 직렬 저항이 20 MΩ 미만일 때에만 허용되었다. 모든 데이터는 pCLAMP10 (Molecular Devices)의 피크 검출 소프트웨어를 사용하여 분석하였다. 제시된 데이터는 3회의 독립적인 실험에 걸쳐 기록된 조건당 15개의 세포로부터 획득된 것이다.
신경돌기 증생 검정: RGC를 24시간 동안 폴리-D-라이신 (PDL) 및 마우스 라미닌 (20 ng/ml) 코팅 유리 커버슬립에 저밀도 (1,500개의 세포/커버슬립)로 시딩하고, 이어서 4% PFA (w/v)로 고정시키고, 토끼 항-β 튜불린 항체 (LI-COR, RRID: AB_1850029, 미국 네브라스카주 링컨 소재)에 이어서, 염소 항-토끼 AF-488로 면역염색하여 신경돌기를 가시화하였다. 24시간 후, CellTracker Red CMPTX 염료 (Inivtirogen)와 함께 15분 동안 인큐베이션한 후, 4% PFA (w/v)로 고정함으로써 신경돌기를 가시화하였다. Zeiss Axioimager M1 에피 형광 현미경(Epifluorescence Microscope) (Carl Zeiss)에서 20X 대물렌즈를 사용하여 신경돌기가 있는 단일 RGC의 이미지를 캡처하였다. 조건당 적어도 30개의 세포를 이미지화하여 실험마다 분석하였으며, 제시된 결과는 2회 또는 3회의 독립적인 실험의 평균이다. Metamorph 소프트웨어 (Molecular Devices)의 신경돌기 증생 적용 모듈을 사용하여 뉴런 형태를 분석하였다. 문헌[Ferreira TA, et al., Nature Methods, 2014; 11:982-984]에 기술된 바와 같이 Fiji용 플러그-인을 사용하여 숄 분석을 수행하였다.
정량화된 데이터의 통계 분석은 일원 분산 분석 (ANOVA)에 이어진, 각 쌍, 스튜던트 t (피셔 LSD) 사후 검정(Each Pair, Student's t (Fisher's LSD) post-test)을 사용하여 수행하였다. 신경돌기 증생 검정의 숄 분석의 경우, 공분산 분석 (ANCOVA)을 수행하였다. mEPSC의 누적 확률 분석의 경우, 크루스칼-왈리스 검정에 이어진, 던 다중 비교 사후 검정(Dunn's multiple comparison post-hoc test)을 사용하였다. SAS 9.2 소프트웨어 (SAS)가 내장된 JMP Genomics 5를 데이터의 모든 통계 분석에 사용하였다. 모든 데이터를 평균±SEM으로 표현하였고, 유의성은 *** p<0.0001, ** p<0.001 및 * p<0.05로 나타내었다.
결과
트랜스웰 인서트에서 hUTC와 공동 배양되었을 때, 정제된 RGC들 사이에 이루어진 시냅스의 수와 기능의 변화가 발견되었다. 1차 래트 성상세포 배양물 (ASC)과 공동 배양된 RGC는 양성 대조군을 제공하였는데, 이는 성상세포가 시냅스 수를 강하게 증가시키고 시냅스 활성을 향상시키는 것으로 나타나기 때문이다 (문헌[Pfrieger FW, Barres BA, Science, 1997; 277:1684-1687]; 문헌[Ullian EM, et al., Science, 2001; 291:657-661]). NHDF로 처리된 RGC는 음성 대조군을 제공하였는데, 이는 이것이 망막 변성 모델에서 유의한 기능적 또는 구조적 회복을 유도하지 않았기 때문이다 (상기 문헌[Lund et al., 2007]). hUTC와 RGC의 공동 배양은 시냅스 펑크텀의 수의 증가를 나타내었고, 성상세포 (양성 대조군)의 결과에 필적하였다. (도 1b 내지 도 1d). 4 DIV 후, RGC를 추가 6일 동안 hUTC, ASC 또는 NHDF와 공동 배양하였고, 각각 bassoon 및 homer인 한 쌍의 시냅스전 및 시냅스후 단백질로 면역염색함으로써 시냅스 수를 평가하였다 (도 1a). 시냅스는 이전에 기술된 방법 (상기 문헌[Ippolito DM, Eroglu C., J Vis Exp,. 2010])을 사용하여 시냅스전 및 시냅스후 마커의 공동 국재화로서 결정하였다 (도 1b, 화살표). hUTC는 단독으로 배양된 RGC와 비교할 때 RGC들 사이에 흥분성 시냅스의 형성을 유도하였다 (도 1b, 도 1c). 반면에, NHDF와의 공동 배양은 시냅스 수의 유의한 증가를 유도하지 않았다 (도 1b, 도 1c, 도 1d). 단위 신경돌기 길이당 시냅스 수의 정량화는 hUTC가 주로 시냅스 밀도를 증가시킴으로써 시냅스 수를 향상시킴을 밝혀내었다 (도 1d, 일원 ANOVA, p<.0001).
전 세포 패치 클램프 기록은 미니어처 흥분성 시냅스후 전류 (mEPSC)를 측정하였다. RGC를 단독으로 또는 hUTC 또는 ASC의 존재 하에 배양하였다 (도 1a). 성상세포와 유사하게, RGC와 hUTC의 공동 배양은 시냅스 사건 빈도의 증가를 가져왔고 (도 1e 내지 도 1g, 도 1f, 크루스칼-왈리스 검정, p<.0001, 도 1g, 일원 ANOVA, p<.0001), 이는 관찰된 시냅스 수의 강력한 증가와 일치한다 (도 1b 내지 도 1d). 또한, hUTC는 시냅스후 전류의 진폭을 증가시켰다. 성상세포와 마찬가지로, hUTC는 시냅스 활성을 강화시킨다 (도 1h, 도 1i 크루스칼-왈리스 검정, p<.0001). mEPSC 피크의 파형은 상승 및 감쇠 tau 둘 모두가 hUTC 처리에 따라 증가됨을 밝혀내었다 (도 1j 내지 도 1m). hUTC는 ASC와 유사하게, 흥분성 시냅스 형성을 유도하고, 배양된 RGC에서 시냅스 기능을 향상시킨다.
실시예
2
신경돌기
증생
및 시냅스생성에 대한
컨디셔닝된
배지의 효과
hUTC 컨디셔닝된 배지를 RGC와의 배양에서의 효과에 대해 평가하였다.
hUTC, RGC 및 성상세포를 상기 실시예 1에 기술된 바와 같이 얻었다.
컨디셔닝된 배지의 제조: 순수한 성상세포 배양물 또는 hUTC를 이것이 70% 컨플루언트(confluent)될 때까지 10-cm 조직 배양 접시 (미국 뉴욕주 코닝 소재의 Corning)에서 그 자체의 성장 배지에서 성장시켰다. 이어서, 세포를 따듯한 DPBS (Gibco)로 2회 세척하고, L-글루타민 (2 mM, Gibco), 소듐 피루베이트 (1 mM, Gibco), 페니실린 (100 U/mL) 및 스트렙토마이신 (100 ㎍/mL, Gibco)이 보충된 Neurobasal? (Gibco)로 이루어진 10 mL의 컨디셔닝 배지를 각각의 접시에 첨가하였다. 배지를 5일 동안 세포에 의해 컨디셔닝시켰다. 무세포의 컨디셔닝된 배지를 수집하고, 5 kDa 분자량 컷오프 Vivaspin 20 원심분리 농축기 (미국 뉴욕주 보헤미아 소재의 Sartorius)를 사용하여 10배 농축시켰다. 각각의 컨디셔닝된 배지의 단백질 농도를 제조사의 권장사항에 따라 브래포드(Bradford) 검정 (미국 뉴욕주 그랜드아일랜드 소재의 Thermo Scientific)에 의해 측정하였다. 저단백 결합 튜브(low protein-binding tube) (독일 함부르크 소재의 Eppendorf) 중의 성상세포-컨디셔닝된-배지 (ACM) 및 hUTC 컨디셔닝된 배지 (UCM)의 분취량을 액체 질소에서 급속 동결시키고, 사용 시까지 -80℃에서 보관하였다. 다양한 분자량 컷오프를 사용하여 UCM을 분획화하기 위해, 30 kDa 및 100 kDa Vivaspin 20 원심분리 농축기를 사용하였다. 5 내지 100 kDa의 UCM 분획을 수집하기 위해, 100 kDa Vivaspin 20의 통과액(flow-through)을 5 kDa Vivaspin 20 농축기로 농축하였다. 5 내지 100 kDa의 UCM 분획을 수집하기 위해, 100 kDa Vivaspin 20의 통과액을 5 kDa Vivaspan 농축기로 농축하였다. 처리를 위해, 동결된 분취량을 얼음에서 서서히 융해시키고, 컨디셔닝된 배지를 요망되는 농도로 빙랭 RGC 성장 배지 (시냅스 및 증생 검정) 또는 최소 배지 (생존 검정)에 첨가하였다.
컨디셔닝된 배지의 웨스턴 블롯 분석: 5% β-메르캅토에탄올 (v/v)을 함유하는 5x Laemmli 로딩 완충액 (Thermo Scientific)에서의 폴리-아크릴-아미드 겔 전기영동 (PAGE)을 위해 10 내지 20 ㎍의 컨디셔닝된 배지를 준비하였다. 단백질을 95℃에서 15분 동안 변성시켰다. 단백질을 10% SDS-PAGE 겔 (미국 캘리포니아주 허큘리스 소재의 BioRad)에서 분리하고, 이어서 PVDF 막 (Millipore)으로 옮겼다. TSP를 검출하기 위해; 염소 항-인간 TSP1 (1:250, RRID: AB_2201958), TSP2 (1:250, RRID: AB_220268), TSP4 (1:200, RRID: AB_2202087) (R&D Systems)를 사용하였다. 로딩 대조군을 위해, 헤빈/SPARCL1이라 일컬어지는 다른 hUTC 분비 단백질을 염소 항-헤빈 항체 (1:250, RRID: AB_2195103, R&D Systems)를 사용하여 검출하였다. 양고추냉이 퍼옥시다제 (HRP) 접합 항-염소 항체 (R&D, 1:5000)를 2차 항체로 사용하였다. 제조사의 권장사항에 따라 Amersham™ ECL 웨스턴 블롯팅 분석 시스템 키트 (미국 노스캐롤라이나주 윈터빌 소재의 GE Healthcare) 또는 SuperSignal? 웨스트 펨토 최대 감수성 기재 (West Femto Maximum Sensitivity Substrate) (Thermo Scientific)를 사용하여 검출을 수행하였다.
시냅스 검정, 전기생리학적 기록 및 신경돌기 증생 검정은 실시예 1에 기술되어 있다.
세포 생존 검정: RGC를 24웰 조직 배양 플레이트에 직접 플레이팅하였다 (7,500개의 세포/웰). 웰을 PDL 및 라미닌으로 코팅하였다. Neurobasal? (Invitrogen), SATO 보충제 (100 ㎍/ml의 트랜스페린, 100 ㎍/ml의 소 혈청 알부민, 60 ng/ml의 프로게스테론, 16 ㎍/ml의 푸트레신, 40 ng/ml의 셀렌산나트륨), N-아세틸 시스테인 (5 ㎍/ml), 트라이요오도-티로닌 (4 ㎍/ml), L-글루타민 (2 mM), 페니실린 (100 U/mL), 스트렙토마이신 (100 ㎍/mL), 소듐 피루베이트 (1 mM) 및 포르스콜린 (5 μM)을 함유하는 최소 배지에서 세포를 배양하였다. 생존에 대한 UCM 및 ACM의 효과를 시험하기 위해, 최소 배지에 포르스콜린, BDNF (200 ng/mL) 또는 CNTF (40 ng/mL)의 부재/존재 하에 다양한 농도의 컨디셔닝된 배지를 보충하였다. 세포 생존력은 제조사의 설명서에 따라 포유류 세포용 LIVE/DEAD? 생존력 키트 (Invitrogen)를 사용하여 3 DIV째에 평가하였다. 생존력 카운트(count)를 키트 작용제(kit agent)를 적용하고 나서 15분 후에 수행하였고, 대표적인 이미지를 20X 대물렌즈를 사용하여 Zeiss Axio Observer A1 에피 형광 현미경 (Carl Zeiss)으로 캡처하였다. 처리당 적어도 10개의 필드(field)를 각각의 실험에서 계수하였으며, 제시된 결과는 2회 또는 3회 실험의 평균이다. 생존 백분율은 생존 세포수를 사멸 세포 및 생존 세포의 총수로 나누고 100을 곱한 값으로 계산하였다.
정량화된 데이터의 통계 분석을 실시예 1에 기술된 바와 같이 수행하였다.
결과
RGC에 다양한 농도의 hUTC 컨디셔닝된 배지 (hUCM)를 공급하였다. hUTC를 단독으로 배양하고, hUTC 컨디셔닝된 배지 (UCM)를 수집하였다 (도 2a). RGC를 UCM으로 처리하고, 실시예 1에서와 동일한 검정을 사용하여 시냅스 수 및 기능에 대한 컨디셔닝된 배지의 효과에 대해 평가하였다. 시냅스 분석은 hUCM이, 성상세포 컨디셔닝된 배지 (ACM)와 유사하게, 농도 의존성 방식으로 트랜스웰 인서트에서 hUTC와 유사하게 RGC의 시냅스 형성을 유도하고 시냅스 기능을 향상시키기에 충분하였음을 나타내었다 (도 2b 내지 도 2n). (도 2b 내지 도 2d 및 도 2j). UCM은 배양 배지 mL당 20 내지 80 ㎍의 총 단백질의 농도에서 완전한 시냅스생성 활성을 나타내었다. hUTC 공동 배양 대신 UCM을 사용할 수 있다. 또한, hUCM은 mEPSC의 진폭과 주파수의 증가에 의해 나타난 바와 같이 기능성 시냅스를 강화시켰다. (도 2e 내지 도 2i).
이러한 결과는 hUTC가 시냅스 형성을 유도하였고 시냅스 기능을 향상시킴을 나타낸다. hUTC의 시냅스생성 효과는 동물 질병 모델에 대한 이러한 세포의 전달에 의해 발생하는 기능 회복에 기여한다.
시냅스 형성에 대한 효과 외에, hUCM은 임의의 다른 성장 인자, 예를 들어 BDNF 및 CTNF의 부재 하에 RGC 생존을 촉진하였다. (도 3a, 도 3d 및 도 3e). 배지 보충제 B27 및 성장 인자 BDNF, CNTF 및 인슐린은 결여되어 있지만 포르스콜린을 함유한 최소 배지 (최소 배지 대조 조건의 경우 CTR로 지칭됨)에서 3 DIV 동안 RGC를 배양하였다. 이러한 최소 배지 조건 하에서 5% 미만의 RGC가 3 DIV의 종료 시에 생존한다 (도 3a, 좌측 패널 및 도 3b). BDNF 또는 CNTF와 같은 성장 인자의 첨가는 포르스콜린의 존재 하에서만 RGC 생존을 증가시켰다 (문헌[Meyer-Franke A, et al., Neuron,. 1995; 15:805-819]). 배양 배지 중의 포르스콜린은 진행 중인 뉴런 활성을 모방하는 뉴런에서 cAMP 수준을 증가시키는데, 이는 CNS 뉴런의 생존에 중요하다 (문헌[Meyer-Franke et al., 1995]). 최소 배지로의 UCM의 첨가는 농도 의존성 방식으로 RGC 생존을 자극하였으며 (도 3a, 우측 패널 및 도 3b); 한편 ACM은 동일한 농도에서 RGC 생존을 촉진하지 않았다 (도 3b).
UCM의 생존 촉진 활성은 최소 배지에서 포르스콜린의 존재 하에 기능적이었다 (도 3c). 이러한 결과는 UCM이 RGC 생존을 자극하였음을 입증한다. 더 낮은 농도 (40 ㎍/ml)에서, UCM의 생존 효과는 BDNF 또는 CNTF의 효과에 상가적인 것으로 나타난다 (도 3d, 도 3e).
또한, UCM은 총 돌기 길이, 돌기 수 및 가지 수의 증가에 의해 입증된 바와 같이 RGC 신경돌기 증생을 향상시켰다. (도 3f 내지 도 3j). 플레이팅 시 UCM을 함유하는 RGC 성장 배지는 UCM이 신경돌기 증생 및 정교화를 촉진하는 인자를 함유함을 나타내었다 (도 3f 내지 도 3j). 또한, ACM은 신경돌기 증생을 촉진하였고 (도 3f 내지 도 3j); UCM은 대체로 전체적인 정교화 및 가지형성을 유도하는 데 더 효율적이었다 (도 3f 및 도 3j). 숄 분석은 단독으로 배양된 RGC와 비교할 때 UCM이 뉴런 복잡성을 증가시킴을 나타내었다. (도 3g).
요약하면, hUTC는 시험관내에서 정제된 RGC들 사이의 기능성 시냅스의 발생을 촉진하는 인자를 분비한다. 더욱이, hUTC는 또한 뉴런 생존 및 성장을 지원한다.
실시예 3
전구 세포에 의한 시냅스생성 인자의 분비
hUTC의 분비체(secretome)는 기능성 시냅스의 발생, 및 뉴런 생존 및 증생에 긍정적으로 영향을 미치는 것으로 밝혀졌다. 본 실시예에서는, hUTC에 의해 분비된 시냅스생성 인자를 확인한다.
면역세포화학 검정: hUTC 및 RGC는 상기 실시예 1에 기술된 바와 같이 얻었다. hUTC 컨디셔닝된 배지 (UCM)는 실시예 2에서와 같이 제조하였다.
UCM 중의 단백질을 약 5 kDa 내지 약 100 kDa 이내의 분자량 컷오프 (MWCO)에 의해 분리하였다. RGC를 배양하기 위해 80 ug/mL의 UCM을 사용하였고, 이를 면역세포화학 시냅스 검정에 의해 분석하였다. 5 kDa 초과, 30 kDA 초과 및 100 kDa 초과의 단리된 단백질을 RGC 단독 및 UCM 5 내지 100 kDa와 비교하였다. (도 4a).
hUTC에 의해 분비된 시냅스생성 인자의 추가 확인을 위해 시냅스생성 차단제인 가바펜틴 (GBP)을 사용하였다.
신경돌기 증생 검정: 병리학적 (즉, 성장 저해) 배양 조건 하에서 신경돌기 증생을 시험하기 위해, 다양한 농도의 콘드로이틴 설페이트 프로테오글리칸 (CSPG, 미국 매사추세츠주 빌레리카 소재의 EMD Millipore), Nogo-A (미국 매사추세츠주 미니애폴리스 소재의 R&D Systems)로 코팅된 커버슬립에 또는 가용성 미엘린 염기성 단백질 (MBP, 10 ug/mL, 미국 미주리주 세인트루이스 소재의 Sigma-Aldrich)의 존재 하에 있는 커버슬립에 RGC (1,500개의 세포/커버슬립)를 시딩하였다. 24시간 후, CellTracker Red CMPTX 염료 (Inivtirogen)와 함께 15분 동안 인큐베이션한 후, 4% PFA (w/v)로 고정함으로써 신경돌기를 가시화하였다. Zeiss Axioimager M1 에피 형광 현미경 (Carl Zeiss)에서 20X 대물렌즈를 사용하여 신경돌기가 있는 단일 RGC의 이미지를 캡처하였다. 조건당 적어도 30개의 세포를 이미지화하여 실험마다 분석하였으며, 제시된 결과는 2회 또는 3회의 독립적인 실험의 평균이다. Metamorph 소프트웨어 (Molecular Devices)의 신경돌기 증생 적용 모듈을 사용하여 뉴런 형태를 분석하였다. 문헌[Ferreira TA, et al., Nature Methods, 2014; 11:982-984]에 기술된 바와 같이 Fiji용 플러그-인을 사용하여 숄 분석을 수행하였다.
녹다운 검정: hUTC를 렌티바이러스 shRNA와 함께 배양하여 녹다운 (KD) UCM을 제조하였다. 이어서, RGC를 KD UCM에서 배양하고, 시냅스 형성, 전기생리학, 및 뉴런 생존 및 증생에 대해 검정하였다. (도 5a). 인간 THBS1, THBS2 또는 THBS4 mRNA (이들은 각각 TSP1, TSP2 및 TSP4로 번역됨)를 표적화하는 pLKO.1-puro 벡터에 클로닝된 shRNA 작제물 풀을 Thermo Scientific으로부터 구입하였다. 비어있는 pLKO.1 puro 벡터를 Addgene (플라스미드 8453, 미국 매사추세츠주 케임브리지 소재)으로부터 구입하고, 녹다운 대조군으로 사용하였다. 개별 작제물의 녹다운 효율을 hUTC로의 형질감염에 의해 결정하였다. 가장 효과적인 녹다운을 나타낸 각각의 TSP에 대한 shRNA 작제물을 후속 렌티바이러스 생성을 위해 선택하였다.
렌티바이러스를 제조하기 위해, 293T 렌티바이러스 패키징 세포를 형질감염 전날에 T75 플라스크당 8×106개의 세포로 시딩하였다. 다음 날, Thbs1 (클론 번호 TRCN00224호), Thbs2 (클론 번호 TRCN53972호), Thbs4 (클론 번호 TRCN54048호) 또는 녹다운 대조군 (Addgene 플라스미드 8453)에 대한 shRNA를 함유하는 pLKO.1-puro 렌티바이러스 플라스미드를 293T 세포에 형질감염시켰다. 스크램블 shRNA 대조군의 경우, Thbs1 (5'- ATAACTCCGATCGTTCAATAT-3'), Thbs2 (5'-GTTACATCTCGATACGATACA-3') 및 Thbs4 (5'-ATATAAGACGCTAGATCCACA-3') shRNA에 대하여 동일한 센스 및 안티센스 스크램블 서열을 함유하는 올리고(oligo)를 사용하였다. 스크램블 shRNA 올리고를 어닐링(annealing)하고, pLKO.1-puro에 클로닝하고, 이를 사용하여 렌티바이러스를 생성시켰다. 제조사의 권장사항에 따라 X-tremeGENE 형질감염 시약 (스위스 바젤 소재의 Roche)을 사용하여 패키징 플라스미드인 델타 R8.2 및 VSV-G를 공동 형질감염시켰다. 렌티바이러스 상청액을 형질감염 후 48시간 및 72시간째에 2회 수집하고, 0.45 μm 필터 (Millipore)를 통해 여과시켰다. Lenti-X™ GoStix™ (미국 캘리포니아주 마운틴뷰 소재의 Clontech)를 사용하여 바이러스 입자를 검출하였다. 여과된 상청액을 사용하여, 폴리브렌(polybrene) (2 ㎍/ml, Sigma)을 보충한 후 hUTC를 감염시켰다. RGC 실험을 위해 배지를 컨디셔닝시키기 전에 5일 동안 hUTC 배지에 퓨로마이신 (900 ng/mL)을 첨가함으로써 형질도입된 hUTC를 추가로 선택하였다.
재조합 TSP의 생성 및 정제: 정제된 재조합 인간 TSP1을 R&D Systems로부터 구입하였다. TSP2 정제의 경우, CHO 세포주 발현 마우스 TSP2를 사용하여 컨디셔닝된 배지를 생성하였다. 분비된 재조합 TSP2를 HiTRAP 헤파린 HP (GE Healthcare)를 사용하는 친화성 크로마토그래피 절차를 사용하여 이전에 기술된 바와 같이 (문헌[Oganesian A, et al., Molecular Biology of Cell, 2008; 19:563-571]) 배양 배지로부터 정제하였다. TSP4의 경우, 6-히스티딘 태깅(tagging)된 래트 TSP4 작제물 (pcDNA3-TSP4, 문헌[Kim DS, et al., J Neurosci, 2012; 32:8977-8987]에 기술된 바와 같음)을 제조사의 설명서에 따라 Lipofectamine 2000 (Invitrogen)을 사용하여 HEK293 세포에 형질감염시켰다. 분비된 재조합 TSP4를 제조사의 설명서에 따라 Ni-NTA 수지 (네덜란드 벤로 소재의 Qiagen)를 사용하는 Ni-킬레이팅 크로마토그래피에 의해 배양 배지로부터 정제하였다. 정제된 재조합 TSP를 30 kDa 컷오프 Vivaspin 20 (Sartorius)을 사용하여 1 mg/mL까지 농축시키고, 분취량을 액체 질소에서 급속 동결시키고, 사용 시까지 -80℃에서 보관하였다.
시냅스 검정, 전기생리학적 기록 및 신경돌기 증생 검정은 실시예 1에 기술되어 있다. 정량화된 데이터의 통계 분석을 실시예 1에 기술된 바와 같이 수행하였다. 컨디셔닝된 배지의 웨스턴 블롯 분석은 실시예 2에 기술되어 있다.
결과
다양한 분자량 컷오프 크기 배제 컬럼 (도 4a)을 사용하여 hUTC 분획화 UCM에 의해 분비된 시냅스생성 인자는 UCM의 시냅스생성 효과가 100 kDa보다 큰 분획 내에 집중된다는 것을 제공한다 (도 4b, 도 4c). RGC와의 UCM 배양의 면역세포화학은, 5 내지 100 kDa 범위의 시냅스생성 인자가 최소이며, 100 kDa보다 큰 인자로부터 최대 효과가 얻어짐을 나타내었다. (도 4b, 도 4c). UCM 유도 시냅스 형성에서의 TSP의 역할과 일치하게, GBP의 첨가는 시냅스생성 인자를 차단하였다. (도 4d, 도 4e). 가바펜틴은 시냅스생성 트롬보스폰딘 패밀리의 알려진 차단제이며, 이는 TSP 패밀리 단백질이 hUTC에 의해 분비된 주요 시냅스생성 인자임을 나타낸다.
동종형(Isoform) 특이적 shRNA를 사용하여, 렌티바이러스 매개 접근법을 사용하여 개별적으로 또는 조합하여 TSP1, 2 및 4를 녹다운시켰으며 (도 5a), 이는 TSP를 hUTC CM에서의 시냅스생성 인자로 확인해 주었다. 상응하는 shRNA에 의한 각각의 TSP의 특이적 녹다운을 웨스턴 블롯팅에 의해 확인하였다 (도 5b). shRNA가 없는 (KD-CTR) 또는 스크램블 TSP1, 2 및 4 shRNA를 함유하는 렌티바이러스로 3중 감염된 (SCR-CTR) 동일한 모(parent) 플라스미드 벡터의 렌티바이러스 형질도입으로부터 생성된 UCM을 대조군으로서 사용하였다. UCM을 렌티바이러스 감염 hUTC로부터 생성하고, 이를 RGC에 적용하여 TSP 녹다운의 효과를 확인하였다 (도 5a). hUTC에 전달된 TSP-1, TSP-2 및 TSP-4에 대한 shRNA 작제물은 각각의 TSP에 대한 발현의 녹다운을 초래하였다. (도 5b 및 도 5d). RGC에서의 시냅스 수 및 시냅스 밀도의 정량화는 모든 3개의 TSP (TSP1, TSP2 및 TSP4)가 UCM의 시냅스생성 기능에 기여하였음을 밝혀내었다 (도 5c, 도 5d, 도 5h 내지 도 5j). TSP의 개별적인 녹다운은 KD-CTR UCM과 비교하여 시냅스 수를 감소시켰다 (도 5c, 도 5d, 도 5h 내지 도 5j). 모든 3개의 TSP (TSP1+2+4-KD)의 녹다운은 UCM의 시냅스생성 효과를 제거하였다 (도 5c, 도 5d, 도 5j).
TSP1+2+4-KD UCM에 순수한 TSP1, TSP2 및 TSP4 (각각 150 ng/ml)를 보충함으로써 TSP1+2+4-KD UCM의 시냅스생성 효과를 회복시켰다 (도 5c, 도 5e, 도 5i). 순수한 TSP를 KD-CTR UCM에 첨가하는 것은 시냅스 수를 추가로 증가시키지 않았다 (도 5k).
mEPSC 전기생리학 기록은 TSP의 발현을 침묵시키는 것이 hUTC의 시냅스생성 효과를 감소시키며, mEPSC의 진폭과 주파수를 감소시켰음을 나타낸다. ACM (양성 대조군), SCR-CTR 또는 TSP1+2+4-KD UCM으로 처리된 RGC는 TSP 발현의 침묵이 시냅스 사건 빈도의 UCM 유도 증가를 감소시켰음을 나타내었다 (도 6f, 도 6g, 도 6h). 이는 UCM이 시냅스생성을 유도하는 데 TSP 1, 2 및 4가 필수적이라는 발견과 일치한다 (도 5). TSP 녹다운은 mEPSC 피크 특성, 예를 들어 진폭 (도 6i, 도 6j) 및 상승 tau (도 6k, 6l)에 대해 더 약한 영향을 미쳤다. 더욱이, TSP 녹다운은 감쇠 tau를 증가시키는 UCM의 능력에 영향을 미치지 않았다 (도 6m, 도 6n). hUTC에서의 TSP 1, 2 및 4의 침묵은 시냅스 수의 증가를 유도하는 이러한 세포의 능력을 제거한다. TSP의 손실은 시냅스 전류의 진폭 및 mEPSC 피크의 파형에 대한 UCM의 효과를 완전히 감소시키기 않는다.
또한, TSP 발현을 침묵시키는 것은 UCM의 신경돌기 증생 효과를 제거하였다 (도 7a, 도 7b, 도 7c, 도 7d, 도 7e). TSP1, 2 또는 4의 단일 녹다운은 돌기 수 및 가지 수에 대한 효과 (도 7n 및 도 7o)를 포함하는 UCM의 신경돌기 증생 촉진 효과 (도 7e)를 제거하였다. TSP1 단독이 아닌, TSP2 또는 TSP4 또는 모든 3개의 TSP의 녹다운은 UCM의 생존 촉진 활성을 감소시켰다 (도 7k). TSP1+2+4-KD UCM에 순수한 TSP들을 개별적으로 또는 모두 함께 보충하는 것은 UCM의 생존 촉진 기능을 구조하지 못하였다 (도 7l). TSP1+2+4-KD UCM에 순수한 TSP들 (TSP1, TSP2 및 TSP4) (각각 150 ng/ml)을 보충하는 것은 UCM의 신경돌기 증생 자극 기능을 회복시켰다 (도 7h, 도 7i, 도 7q, 도 7r).
CNS 상해 시, 반응성 아교세포에 의해 생성된 콘드로이틴 설페이트 프로테오글리칸 (CSPG) 및 미엘린 단백질, 예를 들어 Nogo A가 변성 뉴런으로부터 방출된다. 이러한 단백질은 축삭 재생을 저해하여 (문헌[Niederost et al., 2002]; 문헌[Silver and Miller, 2004]; 문헌[Usher et al., 2010]; 문헌[Walker et al., 2012]), 뉴런 수복 및 상해를 방해한다. 변형된 RGC 신경돌기 증생 검정은 hUTC가 성장을 저해하는 조건 하에서 신경돌기 증생을 촉진함을 나타낸다. CSPG 또는 Nogo-A를 사용하는 변형된 RGC 신경돌기 증생 검정에서 (도 8a 및 도 8b), CSPG는 0.05 ㎍/㎠에서 출발하여 신경돌기 증생을 방해하였고, 0.2 ㎍/㎠ 또는 그 이상의 농도에서 성장을 완전히 차단하였다 (도 8a). Nogo-A는 1 ㎍/㎠에서 출발하여 RGC에서 신경돌기 증생을 차단하였고, 2 ㎍/㎠에서 신경돌기 성장을 50% 넘게 저해하였다 (도 8b). 스크램블 shRNA를 인코딩하는 렌티바이러스로 형질도입된 UCM (SCR-CTR UCM)은 0.05 ㎍/㎠의 CSPG 또는 1 ㎍/㎠의 Nogo-A를 함유한 커버슬립에 플레이팅된 RGC에서 신경돌기 증생을 유도하였다 (도 8a 및 도 8b). hUCM은 성장 저해 조건 하에서도 신경돌기 증생을 유도하였다. SCR-CTR UCM은 높은 CSPG (> 0.2 ㎍/㎠) 및 Nogo-A (2 ㎍/㎠) 농도에서 신경돌기 증생을 촉발할 수 없었다 (도 8a 및 도 8b).
SCR-CTR UCM과 달리, TSP1+2+4-KD UCM은 0.05 ㎍/㎠의 CSPG (도 8c 및 도 8e) 또는 1 ㎍/㎠의 Nogo-A (도 8d 및 도 8f)가 존재하였을 때 신경돌기 증생을 촉발하지 못하였는데, 이는 TSP가 성장 저해 조건 하에서 hUCM의 신경돌기 증생 촉진 효과에 중요함을 나타낸다. 정제된 TSP2 또는 TSP4 단독의 첨가 또는 모든 3개의 TSP의 동시 첨가는 CSPG 또는 Nogo-A의 존재 하에 신경돌기 증생을 유도하는 TSP1+2+4-KD UCM의 능력을 구조하였다 (도 8c 내지 도 8f). 이러한 결과는 TSP, 특히 TSP2 및 TSP 4가 CSPG 또는 Nogo-A의 존재 하에 hUCM의 성장 자극 효과를 담당함을 나타낸다.
CNS 상해에 의해 생성된 미엘린 잔사는 또한 고수준의 미엘린 단백질 MBP를 방출한다 (문헌[Liu et al., 2006]; 문헌[Stapulionis et al., 2008]). 10 ㎍/ml의 가용성 MBP의 존재 하의 RGC 증생 검정은 MBP가 CNS 뉴런에 대하여 신경돌기 증생 저해 효과를 가졌음을 나타내었다. 이전의 연구는 MBP가 10 ㎍/ml보다 높은 농도에서 신경독성을 유도함을 나타내었다 (문헌[Zhang et al., 2014]). 여기에서, 10 ㎍/ml의 MBP는 RGC에서 신경돌기 증생의 손실을 초래한다 (도 8j, 정상 성장 배지 조건 하에서의 RGC 배양과 비교하여 증생의 14±0.07% 감소). SCR-CTR UCM은 MBP의 존재 하에 신경돌기 증생을 유도하였고, UCM의 이러한 효과는 TSP가 침묵되었을 때 상실되었다 (즉, TSP1+2+4-KD UCM, 도 8g 및 도 8i). 순수한 TSP2를 TSP1+2+4-KD UCM에 다시 첨가하는 것만으로 증생 촉진 효과를 구조하였다. 이러한 결과는 MBP의 존재 하에 TSP2가 신경돌기 증생을 매개할 수 있고, 성장 저해 조건 하에서 hUTC 분비 TSP인 TSP2 및 TSP4가 신경돌기 증생을 매개함을 나타낸다. 성장 배지에 대한 순수한 TSP의 첨가는 또한 CSPG, Nogo-A 또는 MBP의 존재 하에 RGC 신경돌기 증생을 유도하였다 (도 8h 및 도 8j).
실시예 4
산후 조직으로부터의 세포의 유래
본 실시예는 태반 및 제대 조직으로부터의 산후 유래 세포의 준비를 기술한다. 산후 제대 및 태반을 만삭 임신 또는 만삭전 임신의 분만 시에 얻었다. 세포를 5가지의 별개의 제대 및 태반 조직 공여체로부터 수집하였다. 다양한 세포 단리 방법을 하기의 특성을 갖는 세포를 생성하는 이의 능력에 대하여 시험하였다: 1) 줄기 세포에 공통적인 특징인 다양한 표현형을 갖는 세포로 분화될 가능성; 또는 2) 다른 세포 및 조직에 유용한 영양 인자를 제공할 가능성.
방법 및 재료
제대 세포 단리: 제대를 NDRI (National Disease Research Interchange, 미국 펜실베이니아주 필라델피아 소재)로부터 입수하였다. 조직을 정상 분만 후 얻었다. 세포 단리 프로토콜을 층류 후드에서 무균적으로 수행하였다. 혈액 및 잔사를 제거하기 위하여, 제대를 항진균제 및 항생제 (100 단위/밀리리터의 페니실린, 100 마이크로그램/밀리리터의 스트렙토마이신, 0.25 마이크로그램/밀리리터의 암포테리신 B)의 존재 하에 인산염 완충 식염수 (PBS; 미국 캘리포니아주 칼스배드 소재의 Invitrogen)에서 세척하였다. 이어서, 조직이 미세 펄프로 민싱될 때까지, 50 밀리리터의 배지 (DMEM-저농도 글루코스 또는 DMEM-고농도 글루코스; Invitrogen)의 존재 하에 150 ㎠의 조직 배양 플레이트에서 기계적으로 해리시켰다. 초핑된(chopped) 조직을 50 밀리리터 원추형 튜브 (튜브당 대략 5 그램의 조직)로 옮겼다.
이어서, 조직을 DMEM-저농도 글루코스 배지 또는 DMEM-고농도 글루코스 배지에서 분해시켰는데, 각각의 배지는 상기에 기재된 바와 같이 항진균제 및 항생제를 함유하였다. 일부 실험의 경우, 콜라게나제와 디스파제의 효소 혼합물을 사용하였다 ("C:D") (DMEM-저농도 글루코스 배지 중 콜라게나제 (미국 미주리주 세인트루이스 소재의 Sigma), 500 단위/밀리리터 및 디스파제 (Invitrogen), 50 단위/밀리리터). 다른 실험의 경우, 콜라게나제, 디스파제 및 하이알루로니다제의 혼합물 ("C:D:H")을 사용하였다 (DMEM-저농도 글루코스 중 콜라게나제, 500 단위/밀리리터; 디스파제, 50 단위/밀리리터 및 하이알루로니다제 (Sigma), 5 단위/밀리리터). 조직, 배지 및 분해 효소를 함유하는 원추형 튜브를 회전식 진탕기(orbital shaker) (미국 뉴욕주 브루클린 소재의 Environ)에서 225 rpm으로 2시간 동안 37℃에서 인큐베이션하였다.
분해 후, 조직을 5분 동안 150 x g로 원심분리하고, 상청액을 흡인하였다. 펠릿을 20 밀리리터의 성장 배지 (DMEM-저농도 글루코스 (Invitrogen), 15% (v/v) 소 태아 혈청 (FBS; 규정된 소 혈청; 로트 번호 AND18475; 미국 유타주 로건 소재의 Hyclone), 상기 기술된 바와 같은 0.001% (v/v) 2-메르캅토에탄올 (Sigma), 100 밀리리터의 항생제/항진균제당 1 밀리리터)에 재현탁시켰다. 세포 현탁액을 70 마이크로미터의 나일론 세포 스트레이너(strainer) (BD Biosciences)를 통해 여과시켰다. 성장 배지를 포함하는 추가 5 밀리리터 린스를 스트레이너에 통과시켰다. 이어서, 세포 현탁액을 40 마이크로미터의 나일론 세포 스트레이너 (BD Biosciences)에 통과시키고, 이어서 추가 5 밀리리터의 성장 배지로 헹구었다.
여과액을 성장 배지 (총 부피 50 밀리리터)에 재현탁시키고, 150 x g로 5분 동안 원심분리하였다. 상청액을 흡인하고, 세포를 50 밀리리터의 신선한 성장 배지에 재현탁시켰다. 이 과정을 2회 더 반복하였다.
최종 원심분리 시, 상청액을 흡인하고 세포 펠릿을 5 밀리리터의 신선한 성장 배지에 재현탁시켰다. 생존가능한 세포(viable cell)의 수를 트립판 블루(Trypan Blue) 염색을 사용하여 결정하였다. 이어서, 세포를 표준 조건 하에 배양하였다.
제대로부터 단리된 세포를 상기 기술된 바와 같이 젤라틴 코팅 T-75 ㎠의 플라스크 (미국 뉴욕주 코닝 소재의 Corning Inc.)에 항생제/항진균제를 함유하는 성장 배지 중에 5,000개의 세포/㎠로 시딩하였다. 2일 후 (다양한 실험에서, 세포를 2 내지 4일 동안 인큐베이션함), 사용된 배지를 플라스크로부터 흡인하였다. 세포를 PBS로 3회 세척하여 잔사 및 혈액 유래 세포를 제거하였다. 이어서, 세포에 성장 배지를 보충하고, 그 세포를 계대 1까지 컨플루언스 (계대 0으로부터 약 10일)에 이르도록 성장시켰다. 후속 계대 시 (계대 1에서 계대 2까지 등), 세포는 4 내지 5일 후에 서브컨플루언스(sub-confluence) (75 내지 85%의 컨플루언스)에 도달하였다. 이의 후속 계대를 위해, 세포를 5000개의 세포/㎠로 시딩하였다. 세포를 5%의 이산화탄소 및 대기중 산소를 포함하는 가습 인큐베이터에서 37℃에서 성장시켰다.
태반 세포 단리: 태반 조직을 NDRI (미국 펜실베이니아주 필라델피아 소재)로부터 입수하였다. 조직은 임신으로부터 유래된 것이고, 정상적인 수술 분만 시에 얻었다. 태반 세포는 제대 세포 단리에 대하여 기술된 바와 같이 단리하였다.
하기 예는 태반 조직으로부터의 개별적인 모체 유래 세포 집단과 신생아 유래 세포 집단의 단리에 적용된다.
세포 단리 프로토콜을 층류 후드에서 무균적으로 수행하였다. 태반 조직을 항진균제 및 항생제 (상기 기술된 바와 같음)의 존재 하에 인산염 완충 식염수 (PBS; 미국 캘리포니아주 칼스배드 소재의 Invitrogen.)에서 세척하여 혈액 및 잔사를 제거하였다. 이어서, 태반 조직을 3개의 절편으로 절개하였다: 상단선(top-line) (신생아 측면 또는 양상), 중단선(mid-line) (신생아 및 모체의 혼합형 세포 단리) 및 하단선 (모체 측면 또는 양상).
분리된 절편을 항생제/항진균제를 함유한 PBS에서 개별적으로 수회 세척하여 혈액 및 잔사를 추가로 제거하였다. 이어서, 각각의 절편을 50 밀리리터의 DMEM-저농도 글루코스의 존재 하에 150 ㎠의 조직 배양 플레이트에서 미세 펄프가 될 때까지 기계적으로 해리시켰다. 펄프를 50 밀리리터의 원추형 튜브로 옮겼다. 각각의 튜브는 대략 5 그램의 조직을 함유하였다. 항진균제 및 항생제 (100 U/밀리리터의 페니실린, 100 마이크로그램/밀리리터의 스트렙토마이신, 0.25 마이크로그램/밀리리터의 암포테리신 B) 및 분해 효소를 함유하는 DEME-저농도 글루코스 또는 DMEM-고농도 글루코스 배지에서 조직을 분해시켰다. 일부 실험의 경우, DMEM-저농도 글루코스 배지 중 500 단위/밀리리터의 콜라게나제 (미국 미주리주 세인트루이스 소재의 Sigma), 및 50 단위/밀리리터의 디스파제 (Invitrogen)를 함유하는 콜라게나제와 디스파제의 효소 혼합물 ("C:D")을 사용하였다. 다른 실험의 경우, 콜라게나제, 디스파제 및 하이알루로니다제의 혼합물 (C:D:H)을 사용하였다 (DMEM-저농도 글루코스 중 콜라게나제, 500 단위/밀리리터; 디스파제, 50 단위/밀리리터 및 하이알루로니다제 (Sigma), 5 단위/밀리리터). 조직, 배지 및 분해 효소를 함유하는 원추형 튜브를 회전식 진탕기 (미국 뉴욕주 브루클린 소재의 Environ)에서 225 rpm으로 2시간 동안 37℃에서 인큐베이션하였다.
분해 후, 조직을 5분 동안 150 x g 로 원심분리하고, 생성된 상청액을 흡인하였다. 페니실린/스트렙토마이신/암포테리신 B를 함유하는 20 밀리리터의 성장 배지에 펠릿을 재현탁시켰다. 세포 현탁액을 70 마이크로미터의 나일론 세포 스트레이너 (BD Biosciences)를 통해 여과시키고, 이어서 추가 5 밀리리터의 성장 배지로 헹구었다. 총 세포 현택액을 40 마이크로미터의 나일론 세포 스트레이너 (BD Biosciences)에 통과시킨 후, 린스로서 추가 5 밀리리터의 성장 배지를 사용하였다.
여과액을 성장 배지 (총 부피 50 밀리리터)에 재현탁시키고, 150 x g로 5분 동안 원심분리하였다. 상청액을 흡인하고, 세포 펠릿을 50 밀리리터의 신선한 성장 배지에 재현탁시켰다. 이 과정을 2회 더 반복하였다. 최종 원심분리 후, 상청액을 흡인하고 세포 펠릿을 5 밀리리터의 신선한 성장 배지에 재현탁시켰다. 트립판 블루 배제(Trypan Blue Exclusion) 시험을 사용하여 세포 카운트를 결정하였다. 이어서, 세포를 표준 조건에서 배양하였다.
LIBERASE 세포 단리: LIBERASE (미국 인디애나주 인디애나폴리스 소재의 Boehringer Mannheim Corp.) (밀리리터당 2.5 밀리그램, 블렌드자임 3; 미국 인디애나주 인디애나폴리스 소재의 Roche Applied Sciences) 및 하이알루로니다제 (5 단위/밀리리터, Sigma)를 함유하는 DMEM-저농도 글루코스 배지에서 제대 조직으로부터 세포를 단리하였다. 조직의 분해 및 세포의 단리는 상기 다른 프로테아제 분해에 대하여 기술된 바와 같았지만, C:D 또는 C:D:H 효소 혼합물 대신에 LIBERASE/하이알루로니다제 혼합물을 사용하였다. LIBERASE를 사용한 조직 분해는 쉽게 증식되는 산후 조직으로부터의 세포 집단의 단리를 가져왔다.
다른 효소 조합을 사용한 세포 단리: 다양한 효소 조합들을 사용한 제대로부터의 세포의 단리에 대하여 절차들을 비교하였다. 분해에 대하여 비교된 효소들은 하기를 포함하였다: i) 콜라게나제; ii) 디스파제; iii) 하이알루로니다제; iv) 콜라게나제:디스파제 혼합물 (C:D); v) 콜라게나제:하이알루로니다제 혼합물 (C:H); vi) 디스파제:하이알루로니다제 혼합물 (D:H); 및 vii) 콜라게나제:디스파제:하이알루로니다제 혼합물 (C:D:H). 이들 상이한 효소 분해 조건을 이용한 세포 단리에 있어서 차이가 관찰되었다 (표 4-1).
제대의 잔류 혈액으로부터의 세포의 단리: 다양한 접근법에 의해 제대로부터 세포의 풀을 단리하려는 다른 시도를 하였다. 일례에서, 제대를 슬라이싱(slicing)하고, 성장 배지로 세척하여 혈병(blood clot) 및 젤라틴 물질을 분리하였다. 혈액, 젤라틴 물질 및 성장 배지의 혼합물을 수집하고, 150 x g로 원심분리하였다. 펠릿을 성장 배지에 재현탁시켜 젤라틴 코팅 플라스크에 시딩하였다. 이들 실험으로부터, 세포 집단을 단리하였으며, 이는 용이하게 증식되었다.
제대혈로부터의 세포의 단리: 세포를 또한 NDRI로부터 입수된 제대혈 샘플로부터 단리하였다. 여기서 사용된 단리 프로토콜은 Ho 등의 국제특허 공개 WO 2003/025149호 (Ho, T. W. 등, "Cell Populations Which Co-Express CD49C and CD90", 국제특허 출원 PCT/US02/29971호)의 프로토콜이었다. 제대혈 (미국 펜실베이니아주 필라델피아 소재의 NDRI)의 샘플들 (각각 50 밀리리터 및 10.5 밀리리터)을 용해 완충액 (필터 멸균된 155 mM 염화암모늄, 10 밀리몰 중탄산칼륨, 0.1 밀리몰 EDTA (pH 7.2로 완충됨) (모든 성분들은 미국 미주리주 세인트루이스 소재의 Sigma로부터 입수함))과 혼합하였다. 세포를 1:20의 제대혈 대 용해 완충액의 비로 용해시켰다. 얻어진 세포 현탁액을 5초 동안 와동시키고, 주위 온도에서 2분 동안 인큐베이션하였다. 용해물을 원심분리하였다 (200 x g로 10분간). 세포 펠릿을 10% 소 태아 혈청 (미국 유타주 로건 소재의 Hyclone), 4 밀리몰 글루타민 (미국 버지니아주 헤른던 소재의 Mediatech), 100 밀리리터당 100 단위의 페니실린 및 100 밀리리터당 100 마이크로그램의 스트렙토마이신 (미국 캘리포니아주 칼스배드 소재의 Gibco)을 함유하는 완전 최소 필수 배지 (미국 캘리포니아주 칼스배드 소재의 Gibco)에 재현탁시켰다. 재현탁된 세포를 원심분리하여 (200 x g로 10분간), 상청액을 흡인하고, 세포 펠릿을 완전 배지로 세척하였다. 세포를 T75 플라스크 (미국 뉴욕주 소재의 Corning), T75 라미닌 코팅 플라스크, 또는 T175 피브로넥틴 코팅 플라스크 (미국 매사추세츠주 베드포드 소재의 Becton Dickinson) 중 어느 하나에 직접 시딩하였다.
다양한 효소 조합 및 성장 조건을 사용한 세포의 단리: 세포 집단을 다양한 조건들 하에서 단리하고 단리 직후 다양한 조건들 하에서 증식시킬 수 있는지를 결정하기 위하여, 상기에 제공된 절차에 따라, C:D:H의 효소 조합을 사용하여, 0.001% (v/v) 2-메르캅토에탄올 (미국 미주리주 세인트루이스 소재의 Sigma)을 함유하거나 함유하지 않는 성장 배지에서 세포를 분해시켰다. 이렇게 단리된 태반 유래 세포를 다양한 조건 하에서 시딩하였다. 모든 세포를 페니실린/스트렙토마이신의 존재 하에 성장시켰다. (표 4-2).
다양한 효소 조합 및 성장 조건을 사용한 세포의 단리: 모든 조건에서, 세포는 계대 0과 계대 1 사이에서 잘 부착되어 증식하였다 (표 4-2). 조건 5 내지 조건 8 및 조건 13 내지 조건 16에서의 세포는 시딩 후 4회의 계대까지 잘 증식하는 것으로 나타났으며, 이 시점에서 세포를 동결보존하고 뱅킹하였다.
결과
다양한 효소 조합을 사용한 세포 단리: C:D:H의 조합은 단리 후 최상의 세포 수율을 제공하였고, 다른 조건들보다 배양 중 더 많은 세대 동안 증식하는 세포를 생성시켰다 (표 4-1). 콜라게나제 또는 하이알루로니다제를 단독으로 사용해서는 증식가능한 세포 집단이 획득되지 않았다. 이 결과가 시험된 콜라겐에 특이적인 것인지를 결정하려는 시도는 하지 않았다.
[표 4-1]
다양한 효소 조합 및 성장 조건을 사용한 세포의 단리: 세포는 효소 분해 및 성장에 대하여 시험한 모든 조건 하에서 계대 0과 계대 1 사이에서 잘 부착되어 증식하였다 (표 4-2). 실험 조건 5 내지 실험 조건 8 및 실험 조건 13 내지 실험 조건 16에서의 세포는 시딩 후 4회의 계대까지 잘 증식하였으며, 이 시점에서 세포를 동결보존하였다. 모든 세포를 추가의 조사를 위하여 동결보존하였다.
[표 4-2]
제대에서 잔류 혈액으로부터의 세포의 단리: 유핵 세포가 부착되어 신속히 성장하였다. 이러한 세포를 유세포 분석법에 의해 분석하였으며, 이는 효소 분해에 의해 얻어진 세포와 유사하였다.
제대혈로부터의 세포의 단리: 조제물은 적혈구와 혈소판을 함유하였다. 처음 3주 동안에는 유핵 세포가 부착하여 분열하지 않았다. 배지를 시딩한지 3주 후에 교환하였으며, 어느 세포도 부착 및 성장하는 것으로 관찰되지 않았다.
요약: 세포 집단은 콜라게나제 (매트릭스 메탈로프로테아제), 디스파제 (중성 프로테아제) 및 하이알루로니다제 (하이알루론산을 분해하는 점액분해 효소)의 효소 조합을 사용하여 효율적으로 제대 및 태반 조직으로부터 유래될 수 있다. 또한, 블렌드자임인 LIBERASE를 사용할 수 있다. 구체적으로는, 또한 콜라게나제 (4 분쉬(Wunsch) 단위/g)와 서모라이신(thermolysin) (1714 카세인 단위/g)인 블렌드자임 3을 하이알루로니다제와 함께 사용하여 세포를 단리하였다. 이러한 세포는 젤라틴 코팅 플라스틱에서 성장 배지 중에서 배양될 때 많은 계대에 걸쳐 용이하게 증식되었다.
또한 세포를 제대혈이 아닌 제대 중 잔류 혈액으로부터 단리하였다. 사용한 조건들 하에서 부착하여 성장하는, 조직으로부터 세척된 혈병 내의 세포의 존재는 절개 과정 동안 방출된 세포로 인한 것일 수 있다.
실시예 5
산후 유래 세포의 핵형 분석
세포 요법에서 사용되는 세포주는 균질하고 임의의 오염 세포 유형이 없는 것이 바람직하다. 세포 요법에서 사용되는 세포는 정상적인 염색체 수 (46개) 및 구조를 가져야 한다. 균질하고 비산후 조직 기원의 세포가 없는 태반 및 제대 유래 세포주를 확인하기 위하여, 세포 샘플의 핵형을 분석하였다.
방법 및 재료
신생아 남아의 산후 조직 유래의 PPDC를 페니실린/스트렙토마이신을 함유하는 성장 배지 중에서 배양하였다. 신생아 남아 (X,Y)로부터의 산후 조직을 선택하여 신생아 유래 세포와 모체 유래 세포 (X,X)를 구별하였다. 세포를 T25 플라스크 (미국 뉴욕주 코닝 소재의 Corning Inc.)에서 성장 배지 중에 제곱센티미터당 5,000개의 세포로 시딩하고, 80% 컨플루언스로 증식시켰다. 세포를 함유하는 T25 플라스크를 성장 배지로 목부(neck)까지 충전시켰다. 샘플들을 택배로 임상 세포유전학 실험실로 배달하였다 (추정된 실험실 간 수송 시간은 1시간임). 염색체가 최상으로 가시화되는 시기인 중기 동안 세포를 분석하였다. 계수한 중기의 20개의 세포 중 5개를 정상 균질 핵형 수(2)에 대하여 분석하였다. 두 핵형이 관찰되면 세포 샘플을 균질한 것으로 특징규명하였다. 두 가지가 넘는 핵형이 관찰되면 세포 샘플을 불균질한 것으로 특징규명하였다. 불균질한 핵형 수(4)가 확인되는 시기에 추가의 중기 세포를 계수하고 분석하였다.
결과
염색체 분석을 위하여 보내진 모든 세포 샘플은 정상 외관을 나타내는 것으로 해석되었다. 분석된 16가지의 세포주 중 3가지는 불균질한 표현형 (XX 및 XY)을 나타내었는데, 이는 신생아 및 모체 기원 둘 모두로부터 유래된 세포의 존재를 나타낸다 (표 5-1). 조직 태반-N으로부터 유래된 세포는 태반의 신생아 양상으로부터 단리되었다. 계대 0에서, 이러한 세포주는 균질한 XY로 나타났다. 그러나, 계대 9에서, 세포주는 불균질 (XX/XY)하였는데, 이는 이전에 검출되지 않은 모체 기원 세포의 존재를 나타낸다.
[표 5-1]
요약: 염색체 분석은 임상 세포유전학 실험실에 의해 해석된 바와 같이 핵형이 정상으로 나타난 태반 및 제대 유래 세포를 확인해 주었다. 균질한 핵형에 의해 결정된 바와 같이, 핵형 분석은 또한 모체 세포가 없는 세포주를 확인해 주었다.
실시예 6
유세포 분석법에 의한 인간 산후 유래 세포 표면 마커의 평가
유세포 분석법에 의한 세포 표면 단백질 또는 "마커"의 특징규명을 사용하여 세포주의 정체(identity)를 결정할 수 있다. 발현의 컨시스턴시(consistency)는 다수의 공여체로부터, 그리고 다양한 처리 및 배양 조건에 노출된 세포에서 결정될 수 있다. 태반 및 제대로부터 단리된 산후 유래 세포(PPDC)주를 (유세포 분석법에 의해) 특징규명하였는데, 이는 이러한 세포주의 확인을 위한 프로파일을 제공한다.
방법 및 재료
배지 및 배양 용기: 세포를 페니실린/스트렙토마이신을 함유하는 성장 배지 (미국 캘리포니아주 칼스배드 소재의 Gibco) 중에서 배양하였다. 세포를 혈장 처리 T75, T150, 및 T225 조직 배양 플라스크 (미국 뉴욕주 코닝 소재의 Corning Inc.)에서 컨플루언트될 때까지 배양하였다. 플라스크의 성장 표면을 실온에서 20분 동안 2% (w/v) 젤라틴 (미국 미주리주 세인트루이스 소재의 Sigma)의 인큐베이션에 의해 젤라틴으로 코팅하였다.
항체 염색 및 유세포 분석법: 플라스크 내의 부착성 세포를 PBS에서 세척하고, 트립신/EDTA로 탈착하였다. 세포를 수집하여, 원심분리하고, 1 밀리리터당 1x107개의 세포 농도로 PBS 중 3% (v/v) FBS에 재현탁시켰다. 제조사의 설명서에 따라, 관심의 세포 표면 마커에 대한 항체 (하기 참조)를 100 마이크로리터의 세포 현탁액에 첨가하고, 혼합물을 암실에서 4℃에서 30분 동안 인큐베이션하였다. 인큐베이션 후, 세포를 PBS로 세척하고, 원심분리하여, 결합되지 않은 항체를 제거하였다. 세포를 500 마이크로리터의 PBS에 재현탁시키고, 유세포 분석법으로 분석하였다. 유세포 분석법에 의한 분석을 FACScalibur™ 기기 (미국 캘리포니아주 새너제이 소재의 Becton Dickinson)를 사용하여 수행하였다. 표 6-1은 사용된 세포 표면 마커에 대한 항체를 열거한다.
[표 6-1]
태반과 제대 비교: 태반 유래 세포를 계대 8에서 제대 유래 세포와 비교하였다.
계대별 비교: 태반 유래 세포와 제대 유래 세포를 계대 8, 계대 15 및 계대 20에서 분석하였다.
공여체별 비교: 공여체 간의 차이를 비교하기 위해, 다양한 공여체로부터의 태반 유래 세포를 서로 비교하고, 다양한 공여체로부터의 제대 유래 세포를 서로 비교하였다.
표면 코팅 비교: 젤라틴 코팅 플라스크에서 배양된 태반 유래 세포를 코팅되지 않은 플라스크에서 배양된 태반 유래 세포와 비교하였다. 젤라틴 코팅 플라스크에서 배양된 제대 유래 세포를 코팅되지 않은 플라스크에서 배양된 제대 유래 세포와 비교하였다.
분해 효소 비교: 세포의 단리 및 준비에 사용한 네 가지의 처리를 비교하였다. 1) 콜라게나제; 2) 콜라게나제/디스파제; 3) 콜라게나제/하이알루로니다제; 및 4) 콜라게나제/하이알루로니다제/디스파제를 사용한 처리에 의해, 태반으로부터 단리된 세포를 비교하였다.
태반층 비교: 태반 조직의 모체 양상으로부터 유래된 세포를 태반 조직의 섬모 영역으로부터 유래된 세포 및 태반의 신생 태아 양상으로부터 유래된 세포와 비교하였다.
결과
태반 대 제대 비교: 유세포 분석법에 의해 분석된 태반 및 제대 유래 세포는 CD10, CD13, CD44, CD73, CD90, PDGFr-알파 및 HLA-A, B, C의 양성 발현을 나타내었는데, 이는 IgG 대조군에 비하여 증가된 형광 값으로 나타나 있다. 이들 세포는 CD31, CD34, CD45, CD117, CD141, 및 HLA-DR, DP, DQ의 검출가능한 발현에 대해 음성이었는데, 이는 IgG 대조군에 필적하는 형광 값으로 나타나 있다. 양의 곡선의 형광 값의 변동이 설명되었다. 양의 곡선들의 평균 (즉, CD13) 및 범위 (즉, CD90)는 약간의 변동을 나타내었지만, 이들 곡선은 정상적인 것으로 나타났으며, 이는 균질한 집단임을 확인해 주었다. 두 곡선은 모두 개별적으로 IgG 대조군보다 더 큰 값을 나타내었다.
계대별 비교 -- 태반 유래 세포: 유세포 분석법에 의해 분석된 계대 8, 계대 15 및 계대 20의 태반 유래 세포는 CD10, CD13, CD44, CD73, CD90, PDGFr-알파 및 HLA-A, B, C의 발현에 대해 모두 양성이었는데, 이는 IgG 대조군에 비하여 증가된 형광 값에 반영된 바와 같다. 세포는 CD31, CD34, CD45, CD117, CD141, 및 HLA-DR, DP, DQ의 발현에 대해서는 음성이었으며, IgG 대조군과 일치하는 형광 값을 가졌다.
계대별 비교 -- 제대 유래 세포: 유세포 분석법에 의해 분석된 계대 8, 계대 15 및 계대 20의 제대 유래 세포는 모두 CD10, CD13, CD44, CD73, CD90, PDGFr-알파 및 HLA-A, B, C를 발현하였는데, 이는 IgG 대조군에 비하여 증가된 형광 값으로 나타나 있다. 이들 세포는 CD31, CD34, CD45, CD117, CD141, 및 HLA-DR, DP, DQ에 대해 음성이었는데, 이는 IgG 대조군과 일치하는 형광값으로 나타났다.
공여체별 비교 -- 태반 유래 세포: 유세포 분석법에 의해 분석된 개별적인 공여체로부터 단리된 태반 유래 세포는 각각, IgG 대조군에 비하여 증가된 형광 값을 가지면서, CD10, CD13, CD44, CD73, CD90, PDGFr-알파 및 HLA-A, B, C를 발현하였다. 세포는 CD31, CD34, CD45, CD117, CD141, 및 HLA-DR, DP, DQ의 발현에 대해서는 음성이었는데, 이는 IgG 대조군과 일치하는 형광 값으로 나타나 있는 바와 같다.
공여체별 비교 -- 제대 유래 세포: 유세포 분석법에 의해 분석된 개별적인 공여체로부터 단리된 제대 유래 세포는 각각 CD10, CD13, CD44, CD73, CD90, PDGFr-알파 및 HLA-A, B, C의 양성 발현을 나타내었는데, 이는 IgG 대조군에 비하여 증가된 형광 값에 반영되어 있다. 이들 세포는, IgG 대조군과 일치하는 형광 값을 가지면서, CD31, CD34, CD45, CD117, CD141, 및 HLA-DR, DP, DQ의 발현에 대해 음성이었다.
태반 유래 세포에 대한 젤라틴에 의한 표면 코팅의 효과: 유세포 분석법에 의해 분석된 젤라틴 코팅되거나 코팅되지 않은 플라스크에서 증식시킨 태반 유래 세포는 모두 CD10, CD13, CD44, CD73, CD90, PDGFr-알파 및 HLA-A, B, C를 발현하였으며, 이는 IgG 대조군에 비하여 증가된 형광 값에 반영되어 있다. 이들 세포는 CD31, CD34, CD45, CD117, CD141, 및 HLA-DR, DP, DQ의 발현에 대해서는 음성이었는데, 이는 IgG 대조군과 일치하는 형광 값으로 나타나 있다.
제대 유래 세포에 대한 젤라틴에 의한 표면 코팅의 효과: 유세포 분석법에 의해 분석된 젤라틴 및 코팅되지 않은 플라스크에서 증식시킨 제대 유래 세포는 모두, IgG 대조군에 비하여 증가된 형광 값을 가지면서, CD10, CD13, CD44, CD73, CD90, PDGFr-알파 및 HLA-A, B, C의 발현에 대해 양성이었다. 이들 세포는, IgG 대조군과 일치하는 형광 값을 가지면서, CD31, CD34, CD45, CD117, CD141, 및 HLA-DR, DP, DQ의 발현에 대해 음성이었다.
세포 표면 마커 프로파일에 대한 세포의 준비에 사용된 효소 분해 절차의 효과: 유세포 분석법에 의해 분석된 다양한 분해 효소를 사용하여 단리된 태반 유래 세포는 모두 CD10, CD13, CD44, CD73, CD90, PDGFr-알파 및 HLA-A, B, C를 발현하였는데, 이는 IgG 대조군에 비하여 증가된 형광 값으로 나타나 있는 바와 같다. 이들 세포는 CD31, CD34, CD45, CD117, CD141, 및 HLA-DR, DP, DQ의 발현에 대해서는 음성이었는데, 이는 IgG 대조군과 일치하는 형광 값으로 나타나 있는 바와 같다.
태반층 비교: 각각 유세포 분석법에 의해 분석된 태반의 모체, 섬모 및 신생아 층으로부터 단리된 세포는 CD10, CD13, CD44, CD73, CD90, PDGFr-알파 및 HLA-A, B, C의 양성 발현을 나타내었는데, 이는 IgG 대조군에 비하여 증가된 형광 값으로 나타나 있는 바와 같다. 이들 세포는 CD31, CD34, CD45, CD117, CD141, 및 HLA-DR, DP, DQ의 발현에 대해서는 음성이었는데, 이는 IgG 대조군과 일치하는 형광 값으로 나타나 있는 바와 같다.
요약: 유세포 분석법에 의한 태반 및 제대 유래 세포의 분석은 이들 세포주의 정체를 확립해 주었다. 태반 및 제대 유래 세포는 CD10, CD13, CD44, CD73, CD90, PDGFr-알파, HLA-A,B,C에 대해 양성이며, CD31, CD34, CD45, CD117, CD141 및 HLA-DR, DP, DQ에 대해 음성이다. 이러한 정체는 공여체, 계대, 배양 용기 표면 코팅, 분해 효소 및 태반층을 비롯한 변수의 변동들 사이에서 일치하였다. 개별적인 형광 값 히스토그램 곡선 평균 및 범위에 있어서의 일부 변동이 관찰되었지만, 시험한 모든 조건 하에서의 모든 양의 곡선은 정상적이었으며, IgG 대조군보다 더 큰 형광 값을 나타내었고, 이에 따라 세포가 마커의 양성 발현을 갖는 균질한 집단을 포함함을 확인해 주었다.
실시예 7
산후 조직 표현형의 면역조직화학적 특징규명
인간 산후 조직, 즉, 제대 및 태반 내에서 발견되는 세포의 표현형을 면역조직화학에 의해 분석하였다.
방법 및 재료
조직 준비: 인간 제대 및 태반 조직을 수집하고, 4℃에서 하룻밤 4% (w/v) 파라포름알데하이드에서 침지 고정시켰다. 하기 에피토프에 대해 유도된 항체를 사용하여 면역조직화학을 수행하였다: 비멘틴 (1:500; 미국 미주리주 세인트루이스 소재의 Sigma), 데스민 (1:150, 토끼에 대해 생성됨; Sigma; 또는 1:300, 마우스에 대해 생성됨; 미국 캘리포니아주 테메쿨라 소재의 Chemicon), 알파-평활근 액틴 (SMA; 1:400; Sigma), 사이토케라틴 18 (CK18; 1:400; Sigma), 폰 빌레브란트 인자 (vWF; 1:200; Sigma), 및 CD34 (인간 CD34 클래스 III; 1:100; 미국 캘리포니아주 카핀테리아 소재의 DAKOCytomation). 또한, 하기 마커를 시험하였다: 항-인간 GRO알파--PE (1:100; 미국 뉴저지주 프랭클린 레이크스 소재의 Becton Dickinson), 항인간 GCP-2 (1:100; 미국 캘리포니아주 샌타크루즈 소재의 Santa Cruz Biotech), 항인간 산화 LDL 수용체 1 (ox-LDL R1; 1:100; Santa Cruz Biotech), 및 항인간 NOGO-A (1:100; Santa Cruz Biotech). 고정된 표본을 메스(scalpel)로 트리밍(trimming)하여, 에탄올을 함유하는 드라이아이스조 상의 OCT 포매 화합물(embedding compound) (Tissue-Tek OCT); 미국 캘리포니아주 토런스 사쿠라 소재) 내에 두었다. 이어서, 동결된 블록을 표준 저온유지장치(cryostat) (Leica Microsystems)를 사용하여 절편화하고 (10 μm의 두께), 염색을 위하여 유리 슬라이드 상에 마운팅하였다.
면역조직화학: 면역조직화학을 이전의 연구와 유사하게 수행하였다 (예를 들어, 문헌[Messina, et al., 2003, Exper. Neurol. 184: 816-829]). 조직 절편을 인산염 완충 식염수 (PBS)로 세척하고, PBS, 4% (v/v) 염소 혈청 (미국 캘리포니아주 테메쿨라 소재의 Chemicon) 및 0.3% (v/v) Triton (Triton X-100; Sigma)을 함유하는 단백질 차단 용액에 1시간 동안 노출시켜 세포내 항원에 접근하였다. 관심 에피토프가 세포 표면 상에 위치하는 경우 (CD34, ox-LDL R1), Triton을 이 절차의 모든 단계에서 제외시켜 에피토프 손실을 방지하였다. 또한, 1차 항체를 염소에 대해 생성시킨 경우에는 (GCP-2, ox-LDL R1, NOGO-A), 3% (v/v) 당나귀 혈청을 이 절차 전체에 걸쳐 염소 혈청 대신에 사용하였다. 이어서, 차단 용액 중에 희석된 1차 항체를 실온에서 4시간 동안 절편에 적용하였다. 1차 항체 용액을 제거하고, 배양물을 PBS로 세척한 후, 차단액을 염소 항-마우스 IgG -- Texas Red (1:250; 미국 오리건주 유진 소재의 Molecular Probes) 및/또는 염소 항-토끼 IgG -- Alexa 488 (1:250; Molecular Probes) 또는 당나귀 항-염소 IgG -- FITC (1:150; Santa Cruz Biotech)와 함께 함유하는 2차 항체 용액을 적용하였다 (실온에서 1시간). 배양물을 세척하고, 10 마이크로몰의 DAPI (Molecular Probes)를 10분 동안 적용하여 세포핵을 가시화하였다.
면역염색 후, Olympus 도립 에피 형광 현미경 (미국 뉴욕주 멜빌 소재의 Olympus)에서 적절한 형광 필터를 사용하여 형광을 가시화하였다. 양성 염색은 대조군 염색보다 높은 형광 신호로 나타났다. 대표적인 이미지를 디지털 컬러 비디오 카메라 및 ImagePro 소프트웨어 (미국 캘리포니아주 칼스배드 소재의 Media Cybernetics)를 사용하여 캡처하였다. 삼중 염색된 샘플의 경우, 각각의 이미지를 한 번에 단지 하나의 방사 필터를 사용하여 촬영하였다. 이어서, Adobe Photoshop 소프트웨어 (미국 캘리포니아주 새너제이 소재의 Adobe)를 사용하여 층상 몽타주(layered montage)를 작성하였다.
결과
제대 특징규명: 비멘틴, 데스민, SMA, CK18, vWF 및 CD34 마커가 제대 내에서 발견되는 세포의 하위세트에서 발현되었다. 특히, vWF 및 CD34 발현은 제대 내에 함유된 혈관에 제한되었다. CD34+ 세포는 최내 층 (세포내강측)에 있었다. 비멘틴 발현은 제대의 혈관 및 매트릭스 전체에 걸쳐 발견되었다. SMA는 매트릭스 및 동맥과 정맥의 외벽에 한정되었지만, 혈관 그 자체에는 함유되어 있지 않았다. CK18 및 데스민은 단지 혈관 내에서 관찰되었으며, 데스민은 중간층 및 외층에 국한되었다.
태반 특징규명: 비멘틴, 데스민, SMA, CKI8, vWF 및 CD34는 모두 태반 내에서 관찰되었고, 영역 특이적이었다.
GRO알파, GCP-2, ox-LDL RI 및 NOGO-A 조직 발현: 이들 마커 중 어느 것도 제대 또는 태반 조직 내에서 관찰되지 않았다.
요약: 비멘틴, 데스민, 알파-평활근 액틴, 사이토케라틴 18, 폰 빌레브란트 인자 및 CD34는 인간 제대 및 태반 내의 세포에서 발현된다.
실시예 8
올리고뉴클레오티드 어레이를 사용한 산후 조직 유래 세포의 분석
Affymetrix GENECHIP 어레이를 사용하여 제대 및 태반 유래 세포의 유전자 발현 프로파일을 섬유아세포, 인간 중간엽 줄기 세포 및 인간 골수로부터 유래된 다른 세포주와 비교하였다. 이 분석은 산후 유래 세포의 특징규명을 제공하며, 이러한 세포에 대한 독특한 분자 마커를 확인해 주었다.
방법 및 재료
세포의 단리 및 배양: 인간 제대 및 태반을 환자의 동의 하에 정상 만삭 분만으로부터, NDRI (미국 펜실베이니아주 필라델피아 소재)에서 얻었다. 조직을 수령하고, 세포를 실시예 6에 기술된 바와 같이 단리하였다. 세포를 젤라틴-코팅된 조직 배양 플라스틱 플라스크에서 성장 배지 (DMEM-LG를 사용함) 중에서 배양하였다. 배양물을 5% CO2 하에 37℃에서 인큐베이션하였다.
인간 피부 섬유아세포를 Cambrex Incorporated (미국 메릴랜드주 워커스빌 소재; 로트 번호 9F0844) 및 ATCC CRL-1501 (CCD39SK)로부터 구입하였다. 두 세포주를 모두 10% (v/v) 소 태아 혈청 (Hyclone) 및 페니실린/스트렙토마이신 (Invitrogen)을 함유하는 DMEM/F12 배지 (미국 캘리포니아주 칼스배드 소재의 Invitrogen) 중에서 배양하였다. 세포를 표준 조직 처리 플라스틱에서 성장시켰다.
인간 중간엽 줄기 세포(hMSC)를 Cambrex Incorporated (미국 메릴랜드주 워커스빌 소재; 로트 번호 2F1655, 2F1656 및 2F1657)로부터 구입하고, 제조사의 설명서에 따라 MSCGM 배지 (Cambrex) 중에서 배양하였다. 세포를 5% CO2 하에 37℃에서 표준 조직 배양 플라스틱에서 성장시켰다.
인간 장골능 골수를 환자의 동의 하에 NDRI로부터 수령하였다. 골수를 Ho 등이 설명한 방법에 따라 처리하였다 (국제특허 공개 W003/025149호). 골수를 골수 1부 대 용해 완충액 20부의 비로 용해 완충액 (155 mM NH4Cl, 10 mM KHCO3, 및 0.1 mM EDTA, pH 7.2)과 혼합하였다. 세포 현탁액을 와동시키고, 주위 온도에서 2분 동안 인큐베이션하고, 500 x g로 10분 동안 원심분리하였다. 상청액을 버리고, 세포 펠릿을 10% (v/v) 소 태아 혈청 및 4 mM 글루타민이 보충된 최소 필수 배지-알파 (Invitrogen)에 재현탁시켰다. 세포를 다시 원심분리하여, 세포 펠릿을 신선한 배지에 재현탁시켰다. 생존가능한 단핵 세포를 트립판-블루 배제 (미국 미주리주 세인트루이스 소재의 Sigma)를 사용하여 계수하였다. 단핵 세포를 조직 배양 플라스틱 플라스크에 5 × 104개의 세포/㎠로 시딩하였다. 표준 대기중 O2 또는 5% O2에서, 5% CO2 하에 37℃에서 세포를 인큐베이션하였다. 세포를 배지 교환 없이 5일 동안 배양하였다. 배지 및 비부착성 세포를 5일의 배양 후 제거하였다. 부착성 세포를 배양 상태로 유지하였다.
mRNA의 단리 및 GENECHIP 분석: 활발하게 성장 중인 세포 배양물을 차가운 PBS에서 세포 스크레이퍼를 사용하여 플라스크로부터 탈착하였다. 세포를 300 x g로 5분 동안 원심분리하였다. 상청액을 제거하고, 세포를 신선한 PBS에 재현탁시키고, 다시 원심분리하였다. 상청액을 제거하고, 세포 펠릿을 즉시 동결시키고, -80℃에서 보관하였다. 세포 mRNA를 추출하고, cDNA로 전사시키고, 이어서 이를 cRNA로 전사시키고, 바이오틴 표지하였다. 바이오틴 표지 cRNA를 HG-U133A GENECHIP 올리고뉴클레오티드 어레이 (미국 캘리포니아주 산타클라라 소재의 Affymetrix)와 혼성화하였다. 제조사의 설명서에 따라 혼성화 및 데이터 수집을 수행하였다. "마이크로어레이의 유의도 분석(Significance Analysis of Microarrays)" (SAM) 버전 1.21 컴퓨터 소프트웨어를 사용하여 분석을 수행하였다 (문헌[Stanford University; Tusher, V. G. et al., 2001, Proc. Natl. Acad. Sci. USA 98: 5116-5121]).
결과
14가지의 상이한 세포 집단을 분석하였다. 세포가 계대 정보, 배양 기재 및 배양 배지와 함께 표 8-1에 열거되어 있다.
[표 8-1]
세포에서 차별적으로 발현된 290가지의 유전자를 분석하여, 주성분 분석(Principle Component Analysis)에 의해 데이터를 평가하였다. 이 분석은 집단들 사이의 유사성에 대한 상대적인 비교를 가능하게 한다.
표 8-2는 세포쌍 비교용으로 계산된 유클리드 거리 (Euclidean distance)를 나타낸다. 유클리드 거리는 세포 유형들 사이에서 차별적으로 발현된 290가지의 유전자를 기반으로 한 세포의 비교를 기초로 하였다. 유클리드 거리는 290가지의 유전자의 발현 사이의 유사성에 반비례한다 (즉, 상기 거리가 커질수록 더 적은 유사성이 존재함).
[표 8-2]
표 8-3, 표 8-4, 및 표 8-5는 태반 유래 세포에서 증가된 (표 8-3), 제대 유래 세포에서 증가된 (표 8-4), 그리고 제대 및 태반 유래 세포에서 감소된 (표 8-5) 유전자들의 발현을 나타낸다. 표제가 "프로브 세트 ID"인 컬럼은, 특정한 수탁 번호 ("NCBI 수탁 번호" 컬럼)로 NCBI (GenBank) 데이터베이스에서 발견될 수 있는 서열을 포함하는, 명명된 유전자 ("유전자명" 컬럼)에 혼성화하는, 칩 상의 특정 부위 상에 위치된 몇몇 올리고뉴클레오티드 프로브의 세트에 대한 제조사의 식별 코드를 지칭한다.
[표 8-3]
[표 8-4]
[표 8-5]
표 8-6, 표 8-7 및 표 8-8은 인간 섬유아세포 (표 8-6), ICBM 세포 (표 8-7), 및 MSC (표 8-8)에서 유전자 발현이 증가되었음을 나타낸다.
[표 8-6]
[표 8-7]
[표 8-8]
요약: 본 조사는 제대 및 태반으로부터 유래된 산후 세포의 분자적 특징규명을 제공하기 위하여 수행하였다. 이러한 분석은 3가지의 상이한 제대 및 3가지의 상이한 태반으로부터 유래된 세포를 포함하였다. 본 조사는 또한 2가지의 상이한 피부 섬유아세포주, 3가지의 중간엽 줄기 세포주, 및 3가지의 장골능 골수 세포주를 포함하였다. 이들 세포에 의해 발현된 mRNA를 22,000가지의 유전자에 대한 프로브를 포함하는 올리고뉴클레오티드 어레이를 사용하여 분석하였다. 결과에 의하면, 290가지의 유전자가 이들 5가지의 상이한 세포 유형에서 차별적으로 발현되는 것으로 나타났다. 이들 유전자는 태반 유래 세포에서 특이적으로 증가하는 10가지의 유전자 및 제대 유래 세포에서 특이적으로 증가하는 7가지의 유전자를 포함한다. 54가지의 유전자는, 다른 세포 유형과 비교하여, 태반 및 제대에서 특이적으로 더 낮은 발현 수준을 갖는 것으로 밝혀졌다. 선택된 유전자의 발현을 PCR로 확인하였다 (하기 실시예 참조). 이들 결과는 산후 유래 세포가, 예를 들어 골수 유래 세포 및 섬유아세포와 비교하여, 특유의 유전자 발현 프로파일을 가짐을 입증한다.
실시예 9
산후 유래 세포에서의 세포 마커
앞선 실시예에서, 인간 태반 및 인간 제대로부터 유래된 세포의 유사성 및 차이점을 이의 유전자 발현 프로파일을 다른 공급원으로부터 유래된 세포의 유전자 발현 프로파일과 비교함으로써 평가하였다 (올리고뉴클레오티드 어레이를 사용함). 하기 6개의 "시그니처(signature)" 유전자를 확인하였다: 산화 LDL 수용체 1, 인터류킨-8, 레닌, 레티큘론, 케모카인 수용체 리간드 3 (CXC 리간드 3) 및 과립구 주화성 단백질 2 (GCP-2). 이들 "시그니처" 유전자는 산후 유래 세포에서 비교적 높은 수준으로 발현되었다.
이 실시예에서 설명한 절차를 수행하여 마이크로어레이 데이터를 검증하고, 유전자 및 단백질 발현 사이의 일치/불일치를 찾아내며, 이외에도, 태반 및 제대 유래 세포의 독특한 식별자의 검출을 위한 일련의 신뢰성 있는 검정을 확립하였다.
방법 및 재료
세포: 태반 유래 세포 (핵형 분석에 의해 확인된 바와 같은 주로 신생아인 1개의 분리주(isolate)를 비롯한 3개의 분리주), 제대 유래 세포 (4개의 분리주) 및 정상 인간 피부 섬유아세포 (NHDF; 신생아 및 성인)를 젤라틴 코팅 T75 플라스크에서 페니실린/스트렙토마이신을 함유하는 성장 배지에서 성장시켰다. 중간엽 줄기 세포 (MSC)를 중간엽 줄기 세포 성장 배지 불렛(Bullet) 키트 (MSCGM; 미국 메릴랜드주 워커스빌 소재의 Cambrex)에서 성장시켰다.
IL-8 프로토콜의 경우, 세포를 액체 질소로부터 해동시키고, 젤라틴 코팅 플라스크에 5,000개의 세포/㎠로 플레이팅하고, 성장 배지에서 48시간 동안 성장시키고, 이어서 10 밀리리터의 혈청 고갈 배지 [DMEM-저농도 글루코스 (미국 캘리포니아주 칼스배드 소재의 Gibco), 페니실린/스트렙토마이신 (미국 캘리포니아주 칼스배드 소재의 Gibco) 및 0.1% (w/v)의 소 혈청 알부민 (BSA; 미국 미주리주 세인트루이스 소재의 Sigma)]에서 추가 8시간 동안 성장시켰다. 이 처리 후, RNA를 추출하고, 상청액을 150 x g로 5분 동안 원심분리하여 세포 잔사를 제거하였다. 이어서, 상청액을 ELISA 분석을 위하여 -80℃에서 동결시켰다.
ELISA 검정을 위한 세포 배양: 태반 및 제대로부터 유래된 산후 세포뿐만 아니라 인간 신생아 포피로부터 유래된 인간 섬유아세포도 젤라틴 코팅 T75 플라스크에서 성장 배지 중에서 배양하였다. 세포를 액체 질소에서 계대 11에서 동결시켰다. 세포를 해동시키고, 15 밀리리터 원심분리 튜브로 옮겼다. 5분 동안 150 x g로 원심분리 후, 상청액을 폐기하였다. 세포를 4 밀리리터 배양 배지에 재현탁시키고, 계수하였다. 세포를 15 밀리리터의 성장 배지를 함유하는 75 ㎠ 플라스크에서 플라스크당 375,000개의 세포로 24시간 동안 성장시켰다. 배지를 8시간 동안 혈청 기아 배지로 교환하였다. 혈청 기아 배지를 인큐베이션 종료 시에 수집하여, 5분 동안 14,000 x g로 원심분리하였다 (그리고 -20℃에서 보관하였다).
각각의 플라스크에서의 세포의 수를 추산하기 위하여, 2 밀리리터의 트립신/EDTA (미국 캘리포니아주 칼스배드 소재의 Gibco)를 각각의 플라스크에 첨가하였다. 세포를 플라스크로부터 탈착시킨 후, 트립신 활성을 8 밀리리터의 성장 배지로 중화시켰다. 세포를 15 밀리리터 원심분리 튜브로 옮기고, 150 x g로 5분 동안 원심분리하였다. 상청액을 제거하고, 1 밀리리터의 성장 배지를 각각의 튜브에 첨가하여 세포를 재현탁시켰다. 세포수를 혈구계(hemocytometer)를 사용하여 추산하였다.
ELISA 검정: 세포에 의해 혈청 기아 배지로 분비되는 IL-8의 양을 ELISA 검정 (미국 미네소타주 미니애폴리스 소재의 R&D Systems)을 사용하여 분석하였다. 모든 검정을 제조사가 제공한 설명서에 따라 시험하였다.
총 RNA 단리: RNA를 컨플루언트 산후 유래 세포 및 섬유아세포로부터 추출하거나, IL-8 발현에 대해서는 상기 기술된 바와 같이 처리된 세포로부터 추출하였다. 세포를 제조사의 설명서 (RNeasy? 미니 키트(Mini Kit); 미국 캘리포니아주 발렌시아 소재의 Qiagen)에 따라 베타-메르캅토에탄올 (미국 미주리주 세인트루이스 소재의 Sigma)을 함유하는 350 마이크로리터의 완충액 RLT를 사용하여 용해시켰다. RNA를 제조사의 설명서 (RNeasy? 미니 키트; 미국 캘리포니아주 발렌시아 소재의 Qiagen)에 따라 추출하고, DNase 처리 (2.7 U/샘플) (미국 미주리주 세인트루이스 소재의 Sigma)를 가하였다. RNA를 50 마이크로리터의 DEPC 처리수로 용리시켜, -80℃에서 보관하였다.
역전사: 또한 RNA를 인간 태반 및 제대로부터 추출하였다. 조직 (30 밀리그램)을 2-메르캅토에탄올을 함유하는 완충액 RLT 700 마이크로리터에 현탁시켰다. 샘플을 기계적으로 균질화하여, 제조사의 설명서에 따라 RNA 추출을 진행하였다. RNA를 50 마이크로리터의 DEPC 처리수로 추출하고, -80℃에서 보관하였다. RNA를 TaqMan? 역전사 시약 (미국 캘리포니아주 포스터 시티 소재의 Applied Biosystems)을 이용하여 25℃, 10분; 37℃, 60분; 및 95℃, 10분으로 랜덤 헥사머를 사용하여 역전사시켰다. 샘플을 -20℃에서 보관하였다.
산후 세포에서 독특하게 조절되는 것으로 cDNA 마이크로어레이에 의해 확인된 유전자 (시그니처 유전자 -- 산화 LDL 수용체, 인터류킨-8, 레닌 및 레티큘론을 포함함)를 실시간 PCR 및 종래의 PCR을 사용하여 추가로 조사하였다.
실시간 PCR: Assays-on-Demand? 유전자 발현 생성물을 사용하여 cDNA 샘플에 대해 PCR을 수행하였다: 산화 LDL 수용체 (Hs00234028); 레닌 (Hs00166915); 레티큘론 (Hs003825 15); CXC 리간드 3 (Hs00171061); GCP-2 (Hs00605742); IL-8 (Hs00174103); 및 GAPDH (미국 캘리포니아주 포스터 시티 소재의 Applied Biosystems)를 제조사의 설명서 (미국 캘리포니아주 포스터 시티 소재의 Applied Biosystems)에 따라 cDNA 및 TaqMan? 범용 PCR 마스터 믹스(master mix)와 혼합하였는데, 이는 ABI Prism 7000 SDS 소프트웨어 (미국 캘리포니아주 포스터 시티 소재의 Applied Biosystems)를 갖춘 7000 서열 검출 시스템을 사용하였다. 열 사이클 조건은, 처음에 50℃, 2분 및 95℃, 10분에 이어서, 40회 사이클의 95℃, 15초 및 60℃, 1분이었다. PCR 데이터를 제조사의 설명서 (ABI Prism 7700 서열 검출 시스템에 대한 Applied Biosystems의 유저 불레틴(User Bulletin) #2)에 따라 분석하였다.
종래의 PCR: 종래의 PCR을 ABI PRISM 7700 (미국 매사추세츠주 보스턴 소재의 Perkin Elmer Applied Biosystems)을 사용하여 수행하여 실시간 PCR로부터의 결과를 확인해 주었다. 2 마이크로리터의 cDNA 용액, 1x AmpliTaq Gold 범용 믹스 PCR 반응 완충액 (미국 캘리포니아주 포스터 시티 소재의 Applied Biosystems) 및 94℃에서의 5분 동안의 초기 변성을 사용하여 PCR을 수행하였다. 증폭을 각각의 프라이머 세트에 대하여 최적화하였다. IL-8, CXC 리간드 3, 및 레티큘론의 경우 (30회 사이클에 대해 94℃, 15초; 55℃, 15초; 및 72℃, 30초); 레닌의 경우 (38회 사이클에 대해 94℃, 15초; 53℃, 15초; 및 72℃, 30초); 산화 LDL 수용체 및 GAPDH의 경우 (33회 사이클에 대해 94℃, 15초; 55℃, 15초; 및 72℃, 30초); 증폭에 사용된 프라이머가 표 9-1에 열거되어 있다. 최종 PCR 반응물 중 프라이머 농도는 0.5 마이크로몰인 GAPDH를 제외하고는 1 마이크로몰이었다. GAPDH 프라이머는, 제조사의 TaqMan? 프로브를 최종 PCR 반응물에 첨가하지 않은 것을 제외하고는 실시간 PCR과 동일하였다. 샘플을 2% (w/v) 아가로스 겔 상에서 이동시켰으며, 에티듐 브로마이드 (미국 미주리주 세인트루이스 소재의 Sigma)로 염색하였다. 초점 거리 폴라로이드(Polaroid) 카메라 (미국 뉴저지주 사우스 플레인필드 소재의 VWR International)를 사용하여 667 범용 Twinpack 필름 (미국 뉴저지주 사우스 플레인필드 소재의 VWR International)을 사용하여 이미지를 캡처하였다.
[표 9-1]
면역형광: PPDC를 차가운 4% (w/v) 파라포름알데하이드 (미국 미주리주 세인트루이스 소재의 Sigma-Aldrich)를 사용하여 실온에서 10분 동안 고정시켰다. 계대 0 (PO) (단리 직후) 및 계대 11 (P 11) (태반 유래 세포의 2개의 분리주, 제대 유래 세포의 2개의 분리주)의 제대 및 태반 유래 세포 각각 1개의 분리주와, 섬유아세포 (P 11)를 사용하였다. 하기 에피토프에 대해 유도된 항체를 사용하여 면역세포화학을 수행하였다: 비멘틴 (1:500, 미국 미주리주 세인트루이스 소재의 Sigma), 데스민 (1:150; Sigma -- 토끼에 대해 생성됨; 또는 1:300; 미국 캘리포니아주 테메쿨라 소재의 Chemicon -- 마우스에 대해 생성됨), 알파-평활근 액틴 (SMA; 1:400; Sigma), 사이토케라틴 18 (CK18; 1:400; Sigma), 폰 빌레브란트 인자 (vWF; 1:200; Sigma), 및 CD34 (인간 CD34 클래스 III; 1:100; 미국 캘리포니아주 카핀테리아 소재의 DAKOCytomation). 또한, 계대 11 산후 세포에서 하기 마커를 시험하였다: 항-인간 GRO알파--PE (1:100; 미국 뉴저지주 프랭클린 레이크스 소재의 Becton Dickinson), 항인간 GCP-2 (1:100; 미국 캘리포니아주 샌타크루즈 소재의 Santa Cruz Biotech), 항인간 산화 LDL 수용체 1 (ox-LDL R1; 1:100; Santa Cruz Biotech), 및 항인간 NOGA-A (1:100; Santa Cruz Biotech).
배양물을 인산염 완충 식염수 (PBS)로 세척하고, PBS, 4% (v/v) 염소 혈청 (미국 캘리포니아주 테메쿨라 소재의 Chemicon) 및 0.3% (v/v) Triton (Triton X-100; 미국 미주리주 세인트루이스 소재의 Sigma)을 함유하는 단백질 차단 용액에 30분 동안 노출시켜 세포내 항원에 접근하였다. 관심 에피토프가 세포 표면 상에 위치한 경우 (CD34, ox-LDL R1), Triton X-100을 이 절차의 모든 단계에서 제외시켜 에피토프 손실을 방지하였다. 또한, 1차 항체를 염소에 대해 생성시킨 경우에는 (GCP-2, ox-LDL R1, NOGO-A), 3% (v/v) 당나귀 혈청을 전체에 걸쳐 염소 혈청 대신에 사용하였다. 이어서, 차단 용액 중에 희석된 1차 항체를 실온에서 1시간 동안 배양물에 적용하였다. 1차 항체 용액을 제거하고, 배양물을 PBS로 세척한 후, 차단액을 염소 항-마우스 IgG -- Texas Red (1:250; 미국 오리건주 유진 소재의 Molecular Probes) 및/또는 염소 항-토끼 IgG -- Alexa 488 (1:250; Molecular Probes) 또는 당나귀 항-염소 IgG -- FITC (1:150; Santa Cruz Biotech)와 함께 함유하는 2차 항체 용액을 적용하였다 (실온에서 1시간). 이어서, 배양물을 세척하고, 10 마이크로몰의 DAPI (Molecular Probes)를 10분 동안 적용하여 세포핵을 가시화하였다.
면역염색 후, Olympus? 도립 에피 형광 현미경 (미국 뉴욕주 멜빌 소재의 Olympus)에서 적절한 형광 필터를 사용하여 형광을 가시화하였다. 모든 경우에, 양성 염색은 대조군 염색보다 높은 형광 신호를 나타내었으며, 여기서 1차 항체 용액의 적용을 제외하고는 상기에 설명된 전체 절차를 따랐다. 대표적인 이미지를 디지털 컬러 비디오 카메라 및 ImagePro? 소프트웨어 (미국 캘리포니아주 칼스배드 소재의 Media Cybernetics)를 사용하여 캡처하였다. 삼중 염색된 샘플의 경우, 각각의 이미지를 한 번에 단지 하나의 방사 필터를 사용하여 촬영하였다. 이어서, Adobe Photoshop? 소프트웨어 (미국 캘리포니아주 새너제이 소재의 Adobe)를 사용하여 층상 몽타주를 작성하였다.
FACS 분석을 위한 세포의 준비: 플라스크 내의 부착성 세포를 인산염 완충 식염수 (PBS) (미국 캘리포니아주 칼스배드 소재의 Gibco)로 세척하고, 트립신/EDTA (미국 캘리포니아주 칼스배드 소재의 Gibco)로 탈착시켰다. 세포를 수집하여, 원심분리하고, 1 밀리리터당 1 × 10 7개의 세포 농도로 PBS 중 3% (v/v) FBS에 재현탁시켰다. 100 마이크로리터의 분취물을 원추형 튜브에 전달하였다. 세포내 항원에 대해 염색된 세포를 투과/세척(Perm/Wash) 완충액 (미국 캘리포니아주 샌디에이고 소재의 BD Pharmingen)으로 투과처리하였다. 항체를 제조사의 설명서에 따라 분취량에 첨가하고, 세포를 암실에서 4℃에서 30분 동안 인큐베이션하였다. 인큐베이션 후, 세포를 PBS로 세척하고, 원심분리하여 과량의 항체를 제거하였다. 2차 항체를 필요로 하는 세포를 100 마이크로리터의 3% FBS에 재현탁시켰다. 2차 항체를 제조사의 설명서에 따라 첨가하고, 세포를 암실에서 4℃에서 30분 동안 인큐베이션하였다. 인큐베이션 후, 세포를 PBS로 세척하고, 원심분리하여 과량의 2차 항체를 제거하였다. 세척된 세포를 0.5 밀리리터의 PBS에 재현탁시키고, 유세포 분석법으로 분석하였다. 하기 항체를 사용하였다: 산화 LDL 수용체 1 (sc-5813; Santa Cruz Biotech), GROa (555042; 미국 매사추세츠주 베드포드 소재의 BD Pharmingen), 마우스 IgG1 카파 (P-4685 및 M-5284; Sigma), 염소 IgG에 대한 당나귀 (sc-3743; Santa Cruz Biotech). 유세포 분석법에 의한 분석을 FACScalibur™ (미국 캘리포니아주 새너제이 소재의 Becton Dickinson)를 사용하여 수행하였다.
결과
인간 태반, 성인 및 신생아 섬유아세포, 및 중간엽 줄기 세포 (MSC)로부터 유래된 세포의 cDNA에 대하여 수행된, 선택된 "시그니처" 유전자에 대한 실시간 PCR의 결과는 산화 LDL 수용체와 레닌 둘 모두가 다른 세포와 비교하여 태반 유래 세포에서 더 높은 수준으로 발현되었음을 나타낸다. 실시간 PCR로부터 획득된 데이터를 AACT법으로 분석하고, 로그 스케일로 나타내었다. 레티큘론 및 산화 LDL 수용체 발현의 수준은 다른 세포와 비교하여 제대 유래 세포에서 더 높았다. CXC 리간드 3 및 GCP-2의 발현 수준의 유의한 차이는 산후 유래 세포와 대조군 사이에서 발견되지 않았다. 실시간 PCR의 결과가 종래의 PCR에 의해 확인되었다. PCR 생성물의 서열분석은 이들 관찰을 추가로 검증해 주었다. CXC 리간드 3의 발현 수준의 유의한 차이는, 상기 표 9-1에 열거된 종래의 PCR CXC 리간드 3 프라이머들을 사용하는 경우, 산후 유래 세포와 대조군 사이에서 발견되지 않았다.
산후 세포에서의 사이토카인 IL-8의 생성은 성장 배지 배양 산후 유래 세포 및 혈청 기아 산후 유래 세포 둘 모두에서 상승하였다. 모든 실시간 PCR 데이터는 종래의 PCR을 이용하여 그리고 PCR 생성물의 서열분석에 의해 검증되었다.
무혈청 배지에서 성장된 세포의 상청액을 IL-8의 존재에 대해 조사하였을 때, 태반 세포의 일부 분리주 및 제대 세포로부터 유래된 배지에서 최고의 양이 검출되었다 (표 9-2). IL-8은 인간 피부 섬유아세포로부터 유래된 배지에서는 검출되지 않았다.
[표 9-2]
또한, 태반 유래 세포를 FACS 분석에 의해 산화 LDL 수용체, GCP-2 및 GRO알파의 생성에 대해 조사하였다. 세포는 GCP-2에 대해 양성으로 시험되었다. 산화 LDL 수용체 및 GRO는 이러한 방법에 의해 검출되지 않았다.
또한, 태반 유래 세포를 면역세포화학적 분석에 의해, 선택된 단백질의 생성에 대하여 시험하였다. 단리 직후 (계대 0), 인간 태반으로부터 유래된 세포를 4% 파라포름알데하이드로 고정시키고, 하기 6가지의 단백질에 대한 항체에 노출시켰다: 폰 빌레브란트 인자, CD34, 사이토케라틴 18, 데스민, 알파-평활근 액틴 및 비멘틴. 세포는 알파-평활근 액틴과 비멘틴 둘 모두에 대해 양성으로 염색되었다. 이러한 패턴은 계대 11까지 보존되었다. 계대 0에서는 수개의 세포 (<5%)만이 사이토케라틴 18에 대해 양성으로 염색되었다.
계대 0의, 인간 제대로부터 유래된 세포를 면역세포화학적 분석에 의해, 선택된 단백질의 생성에 대하여 프로빙하였다. 단리 직후 (계대 0), 세포를 4% 파라포름알데하이드로 고정시키고, 하기 6가지의 단백질에 대한 항체에 노출시켰다: 폰 빌레브란트 인자, CD34, 사이토케라틴 18, 데스민, 알파-평활근 액틴 및 비멘틴. 제대 유래 세포는 알파-평활근 액틴 및 비멘틴에 대해 양성이었으며, 이때 염색 패턴은 계대 11까지 일관되었다.
요약 : 마이크로어레이 및 PCR (실시간 PCR 및 종래의 PCR 둘 모두)에 의해 측정된 유전자 발현 수준들 사이의 일치가 하기 4가지의 유전자에 대하여 확립되었다: 산화 LDL 수용체 1, 레닌, 레티큘론 및 IL-8. 이들 유전자의 발현은 PPDC에서 mRNA 수준에서 차별적으로 조절되었으며, 이때 IL-8도 단백질 수준에서 차별적으로 조절되었다. 산화 LDL 수용체의 존재는 태반으로부터 유래된 세포의 경우 FACS 분석에 의해 단백질 수준에서 검출되지 않았다. GCP-2와 CXC 리간드 3의 차별적 발현은 mRNA 수준에서 확인되지 않았지만, GCP-2는 태반 유래 세포의 경우 FACS 분석에 의해 단백질 수준에서 검출되었다. 이러한 결과는 마이크로어레이 실험으로부터 최초로 획득된 데이터에는 반영되어 있지 않지만, 이것은 방법의 감도차로 인한 것일 수 있다.
단리 직후 (계대 0), 인간 태반으로부터 유래된 세포는 알파-평활근 액틴과 비멘틴 둘 모두에 대해 양성으로 염색되었다. 이러한 패턴은 또한 계대 11의 세포에서 관찰되었다. 비멘틴과 알파-평활근 액틴 발현은 성장 배지에서 그리고 이러한 절차에 이용된 조건 하에서 계대를 거쳐 세포에서 보존될 수 있다. 계대 0의, 인간 제대로부터 유래된 세포를 알파-평활근 액틴 및 비멘틴의 발현에 대해 프로빙하였으며, 이들 둘 모두에 대해 양성이었다. 염색 패턴은 계대 11까지 보존되었다.
실시예 10
산후 유래 세포의 시험관내 면역학적 평가
산후 유래 세포 (PPDC)는, 존재하는 경우, 이 세포가 생체내 이식 시에 유발하게 될 면역학적 반응을 예측하려는 노력의 일환으로 그의 면역학적 특징에 대하여 시험관내에서 평가하였다. PPDC를 HLA-DR, HLA-DP, HLA-DQ, CD80, CD86, 및 B7-H2의 존재에 대하여 유세포 분석법에 의해 검정하였다. 이들 단백질은 항원 제시 세포 (APe)에 의해 발현되며, 미감작() CD4+ T 세포의 직접적인 자극에 필요하다 (문헌 [Abbas & Lichtman, CELLULAR AND MOLECULAR IMMUNOLOGY, 5th Ed. (2003) Saunders, Philadelphia, p. 171]). 또한, 세포주를 HLA-G (상기 문헌[Abbas & Lichtman, 2003]), CD 178 (문헌[Coumans, et al., (1999) Journal of Immunological Methods 224, 185-196]) 및 PD-L2 (상기 문헌[Abbas & Lichtman, 2003]; 문헌[Brown, et. al. (2003) The Journal of Immunology, 170:1257-1266])의 발현에 대해 유세포 분석법에 의해 분석하였다. 태반 조직에 있는 세포에 의한 이들 단백질의 발현은 자궁내에서 태반 조직의 면역-특권(immuno-privileged) 상태를 매개하는 것으로 여겨진다. 태반 및 제대 유래 세포주가 생체내에서 면역 반응을 유발하는 정도를 예측하기 위하여, 이들 세포주를 일방향 혼합 림프구 반응 (MLR)에서 시험하였다.
방법 및 재료
세포 배양: 2% 젤라틴 (미국 미주리주 세인트루이스 소재의 Sigma)으로 코팅된 T75 플라스크 (미국 뉴욕주 코닝 소재의 Corning Inc.)에서 페니실린/스트렙토마이신을 함유하는 성장 배지 중에서 컨플루언스될 때까지 세포를 배양하였다.
항체 염색: 세포를 인산염 완충 식염수 (PBS) (미국 캘리포니아주 칼스배드 소재의 Gibco)로 세척하고, 트립신/EDTA (미국 미주리주 칼스배드 소재의 Gibco)로 탈착하였다. 세포를 수집하여, 원심분리하고, 1 밀리리터당 1 × 107개의 세포 농도로 PBS 중 3% (v/v) FBS에 재현탁시켰다. 항체 (표 10-1)를 제조사의 설명서에 따라 100 마이크로리터의 세포 현탁액에 첨가하고, 세포를 암실에서 4℃에서 30분 동안 인큐베이션하였다. 인큐베이션 후, 세포를 PBS로 세척하고, 원심분리하여 결합되지 않은 항체를 제거하였다. 세포를 500 마이크로리터의 PBS에 재현탁시키고, FACSCalibur™ 기기 (미국 캘리포니아주 새너제이 소재의 Becton Dickinson)를 사용하여 유세포 분석법으로 분석하였다.
[표 10-1]
혼합 림프구 반응: 세포주 A로 표지된 계대 10의 제대 유래 세포 및 세포주 B로 표지된 계대 11의 태반 유래 세포의 동결보존된 바이알을 드라이아이스 상에 놓아서 CTBR (캐나다 퀘벡주 센느빌 소재)로 보내서 CTBR SOP 번호 CAC-031을 사용하여 혼합 림프구 반응을 수행하였다. 말초 혈액 단핵 세포 (PBMC)를 다수의 남성 및 여성 자원자 공여체로부터 수집하였다. 자극 (공여체) 동종이계 PBMC, 자가 PBMC, 및 산후 세포주를 마이토마이신 C로 처리하였다. 자가 및 마이토마이신 C 처리 자극 세포를 반응 (수령체) PBMC에 첨가하여, 4일 동안 배양하였다. 인큐베이션 후, [3H]-티미딘을 각각의 샘플에 첨가하고 18시간 동안 배양하였다. 세포 수집 후, 방사성 표지된 DNA를 추출하고, [3H]-티미딘 혼입량을 섬광 계수기(scintillation counter)를 사용하여 측정하였다.
동종이계 공여체의 자극 지수(stimulation index for the allogeneic donor; SIAD)는 수령체 + 마이토마이신 C 처리 동종이계 공여체의 평균 증식률을 수령체의 기저선 증식률로 나눈 것으로 계산하였다. PPDC의 자극 지수는 수령체 + 마이토마이신 C 처리 산후 세포주의 평균 증식률을 수령체의 기저선 증식률로 나눈 것으로 계산하였다.
결과
혼합 림프구 반응 -- 태반 유래 세포: 7가지의 인간 자원자 혈액 공여체를 스크리닝하여, 다른 6가지의 혈액 공여체와의 혼합 림프구 반응에서 강한 증식 반응을 나타낼 하나의 동종이계 공여체를 확인하였다. 이 공여체를 동종이계 양성 대조 공여체로서 선택하였다. 나머지 6가지의 혈액 공여체를 수령체로서 선택하였다. 동종이계 양성 대조 공여체 및 태반 유래 세포주를 마이토마이신 C로 처리하고, 6가지의 개별 동종이계 수령체와의 혼합 림프구 반응에서 배양하였다. 반응은 플레이트당 3가지의 수령체를 포함하는 2개의 세포 배양 플레이트를 사용하여 삼중으로 수행하였다 (표 10-2). 평균 자극 지수는 1.3 (플레이트 2) 내지 3 (플레이트 1)의 범위였으며, 동종이계 공여체 양성 대조군은 46.25 (플레이트 2) 내지 279 (플레이트 1)의 범위였다 (표 10-3).
[표 10-2]
[표 10-3]
혼합 림프구 반응 -- 제대 유래 세포: 6가지의 인간 자원자 혈액 공여체를 스크리닝하여, 다른 5가지의 혈액 공여체와의 혼합 림프구 반응에서 강한 증식 반응을 나타낼 하나의 동종이계 공여체를 확인하였다. 이 공여체를 동종이계 양성 대조 공여체로서 선택하였다. 나머지 5가지의 혈액 공여체를 수령체로서 선택하였다. 동종이계 양성 대조 공여체 및 태반 세포주를 마이토마이신 C-처리하고, 5가지의 개별 동종이계 수령체와의 혼합 림프구 반응에서 배양하였다. 반응은 플레이트당 3가지의 수령체를 포함하는 2개의 세포 배양 플레이트를 사용하여 삼중으로 수행하였다 (표 10-4). 평균 자극 지수는 6.5 (플레이트 1) 내지 9 (플레이트 2)의 범위였으며, 동종이계 공여체 양성 대조군은 42.75 (플레이트 1) 내지 70 (플레이트 2)의 범위였다 (표 10-5).
[표 10-4]
[표 10-5]
항원 제시 세포 마커 -- 태반 유래 세포: 유세포 분석법에 의해 분석된 태반 유래 세포의 히스토그램은 IgG 대조군과 일치하는 형광 값으로 나타나는 바와 같이 HLA-DR, DP, DQ, CD80, CD86, 및 B7-H2의 음성 발현을 나타내며, 이는 태반 세포주에 CD4+ T 세포를 직접적으로 자극하는 데 필요한 세포 표면 분자가 결여되어 있음을 나타낸다.
면역조절 마커 -- 태반 유래 세포: 유세포 분석법에 의해 분석된 태반 유래 세포의 히스토그램은, IgG 대조군에 비하여 증가된 형광 값으로 나타나는 바와 같이 PD-L2의 양성 발현을, 그리고 IgG 대조군과 일치하는 형광 값으로 나타나는 바와 같이 CD178 및 HLA-G의 음성 발현을 나타낸다.
항원 제시 세포 마커 -- 제대 유래 세포: 유세포 분석법에 의해 분석된 제대 유래 세포의 히스토그램은 IgG 대조군과 일치하는 형광 값으로 나타나는 바와 같이 HLA-DR, DP, DQ, CD80, CD86, 및 B7-H2의 음성 발현을 나타내며, 이는 제대 세포주에 CD4+ T 세포를 직접적으로 자극하는 데 필요한 세포 표면 분자가 결여되어 있음을 나타낸다.
면역조절 마커 -- 제대 유래 세포: 유세포 분석법에 의해 분석된 제대 유래 세포의 히스토그램은, IgG 대조군에 비하여 증가된 형광 값으로 나타나는 바와 같이 PD-L2의 양성 발현을, 그리고 IgG 대조군과 일치하는 형광 값으로 나타나는 바와 같이 CD178 및 HLA-G의 음성 발현을 나타낸다.
요약: 태반 유래 세포주를 사용하여 수행된 혼합 림프구 반응에서, 평균 자극 지수는 1.3 내지 3의 범위였으며, 동종이계 양성 대조군의 평균 자극 지수는 46.25 내지 279의 범위였다. 제대 유래 세포주를 사용하여 수행된 혼합 림프구 반응에서, 평균 자극 지수는 6.5 내지 9의 범위였으며, 동종이계 양성 대조군의 평균 자극 지수는 42.75 내지 70의 범위였다. 유세포 분석법에 의해 측정된 바와 같이, 태반 및 제대 유래 세포주는 자극 단백질 HLA-DR, HLA-DP, HLA-DQ, CD80, CD86, 및 B7-H2의 발현에 대해 음성이었다. 유세포 분석법에 의해 측정된 바와 같이, 태반 및 제대 유래 세포주는 면역 조절 단백질 HLA-G 및 CD178의 발현에 대해 음성이었으며, PD-L2의 발현에 대해 양성이었다. 동종이계 공여체 PBMC는 HLA-DR, DQ, CD8, CD86 및 B7-H2를 발현하는 항원 제시 세포를 함유함으로써, 미감작 CD4+ T 세포의 자극을 가능하게 한다. 미감작 CD4+ T 세포의 직접적인 자극에 필요한, 태반 및 제대 유래 세포 상의 항원 제시 세포 표면 분자의 부재 및 면역조절 단백질인 PD-L2의 존재는 동종이계 대조군과 비교하여 MLR에서 이들 세포가 나타내는 낮은 자극 지수를 설명할 수 있다.
실시예 11
산후 유래 세포에 의한 영양 인자의 분비
태반 및 제대 유래 세포로부터의 선택된 영양 인자의 분비를 측정하였다. 검출을 위해 선택된 인자는 하기를 포함하였다: (1) 혈관생성 활성을 갖는 것으로 공지된 것, 예를 들어 간세포 성장 인자 (HGF) (문헌[Rosen et al. (1997) Ciba Found. Symp. 212:215-26]), 단핵구 주화성 단백질 1 (MCP-l) (문헌[Salcedo et al. (2000) Blood 96;34-40]), 인터류킨-8 (IL-8) (문헌[Li et al. (2003) J. Immunol. 170:3369-76]), 각질세포 성장 인자 (KGF), 염기성 섬유아세포 성장 인자 (bFGF), 혈관 내피 성장 인자 (VEGF) (문헌 [Hughes et al. (2004) Ann. Thorac. Surg. 77:812-8]), 매트릭스 메탈로프로테이나아제 1 (TIMP1), 안지오포이에틴 2 (ANG2), 혈소판 유래 성장 인자 (PDGF-bb), 트롬보포이에틴 (TPO), 헤파린 결합 표피 성장 인자 (HB-EGF), 간질 유래 인자 1알파 (SDF-1알파); (2) 신경영양/신경보호 활성을 갖는 것으로 공지된 것, 예를 들어 뇌 유래 신경영양 인자 (BDNF) (문헌[Cheng et al. (2003) Dev. Biol. 258;319-33]), 인터류킨-6 (IL-6), 과립구 주화성 단백질-2 (GCP-2), 형질전환 성장 인자 베타2 (TGF베타2); 및 (3) 케모카인 활성을 갖는 것으로 공지된 것, 예를 들어 대식세포 염증 단백질 1알파 (MIP1a), 대식세포 염증 단백질 1베타 (MIP1b), 단핵구 화학유인자-1(monocyte chemoattractant-1, MCP-1), Rantes (활성화 시 정상 T 세포 발현 및 분비 조절), I309, 흉선 및 활성화 조절 케모카인 (TARe), 에오탁신, 대식세포 유래 케모카인 (MDC), IL-8.
방법 및 재료
세포 배양: 태반 및 제대 유래의 PPDC뿐만 아니라 인간 신생아 포피로부터 유래된 인간 섬유아세포도 젤라틴 코팅 T75 플라스크에서 페니실린/스트렙토마이신을 함유하는 성장 배지 중에서 배양하였다. 세포를 계대 11에서 동결보존하여, 액체 질소에서 보관하였다. 세포의 해동 후, 성장 배지를 세포에 첨가하고, 이어서 15 밀리리터 원심분리 튜브로 옮기고, 세포를 150 x g로 5분 동안 원심분리하였다. 상청액을 폐기하였다. 세포 펠릿을 4 밀리리터 성장 배지에 재현탁시키고, 세포를 계수하였다. 세포를 15 밀리리터의 성장 배지를 함유하는 75 ㎠ 플라스크당 375,000개의 세포로 시딩하고, 24시간 동안 배양하였다. 배지를 무혈청 배지 (DMEM-저농도 글루코스 (Gibco), 0.1% (w/v) 소 혈청 알부민 (Sigma), 페니실린/스트렙토마이신 (Gibco))로 8시간 동안 교환하였다. 컨디셔닝된 무혈청 배지를 인큐베이션 종료 시에 5분 동안 14,000 x g로 원심분리하여 수집하고, -20℃에서 보관하였다.
각각의 플라스크에서의 세포의 수의 추산을 위하여, 세포를 PBS로 세척하고, 2 밀리리터의 트립신/EDTA를 사용하여 탈착시켰다. 트립신 활성을 8 밀리리터의 성장 배지의 첨가에 의해 저해하였다. 세포를 150 x g로 5분 동안 원심분리하였다. 상청액을 제거하고, 세포를 1 밀리리터의 성장 배지에 재현탁시켰다. 세포수를 혈구계를 사용하여 추산하였다.
ELISA 검정: 세포를 5% 이산화탄소 및 대기중 산소에서 37℃에서 성장시켰다. 또한, 태반 유래 세포 (배치(batch) 101503)를 5% 산소 또는 베타-메르캅토에탄올 (BME)에서 성장시켰다. 각각의 세포 샘플에 의해 생성된 MCP-1, IL-6, VEGF, SDF-I알파, GCP-2, IL-8, 및 TGF-베타 2의 양을 ELISA 검정에 의해 측정하였다 (미국 미네소타주 미니애폴리스 소재의 R&D Systems). 모든 검정을 제조사의 설명서에 따라 수행하였다.
SearchLight ™ 멀티플렉스(multiplexed) ELISA 검정: 케모카인 (MIP1a, MIP1b, MCP-1, Rantes, 1309, TARC, 에오탁신, MDC, IL8), BDNF, 및 혈관생성 인자 (HGF, KGF, bFGF, VEGF, TIMP1, ANG2, PDGF-bb, TPO, HBF-EGF)를 SearchLight™ 프로테옴 어레이(Proteome Array) (Pierce Biotechnology Inc.)를 사용하여 측정하였다. 프로테옴 어레이는 웰당 2 내지 16가지의 단백질의 정량적 측정을 위한 멀티플렉스 샌드위치 ELISA이다. 이 어레이는 96웰 플레이트의 각각의 웰 내에 4 내지 16가지의 다양한 캡처 항체의 2×2, 3×3, 또는 4×4 패턴을 스포팅(spotting)함으로써 생성된다. 샌드위치 ELISA 절차 이후에, 전체 플레이트를 플레이트의 각각의 웰 내에서 각각의 스폿(spot)에서 발생된 화학발광 신호를 캡처하도록 이미지화한다. 각각의 스폿에서 발생된 신호의 양은 원래의 표준물 또는 샘플 중 표적 단백질의 양에 비례한다.
결과
ELISA 검정: MCP-1 및 IL-6은 태반 및 제대 유래 세포 및 피부 섬유아세포에 의해 분비되었다 (표 11-1). SDF-1알파는 5% O2 중에서 배양된 태반 유래 세포에 의해 그리고 섬유아세포에 의해 분비되었다. GCP-2 및 IL-8은 제대 유래 세포에 의해 그리고 BME 또는 5% O2의 존재 하에 배양된 태반 유래 세포에 의해 분비되었다. GCP-2는 인간 섬유아세포에 의해서도 분비되었다. TGF-베타2는 ELISA 검정에 의해 검출 불가능하였다.
[표 11-1]
SearchLight ™ 멀티플렉스 ELISA 검정: TIMP1, TPO, KGF, HGF, FGF, HBEGF, BDNF, MIP1b, MCP1, RANTES, I309, TARC, MDC, 및 IL-8은 제대 유래 세포로부터 분비되었다 (표 11-2 및 표 11-3). TIMP1, TPO, KGF, HGF, HBEGF, BDNF, MIP1a, MCP-1, RANTES, TARC, 에오탁신 및 IL-8은 태반 유래 세포로부터 분비되었다 (표 11-2 및 표 11-3). Ang2, VEGF 또는 PDGF-bb는 검출되지 않았다.
[표 11-2]
[표 11-3]
실시예 12
산후 유래 세포의 단기적인 신경 분화
신경 계통 세포로 분화되는 태반 및 제대 유래 세포 (집합적으로 산후 유래 세포 또는 PPDC)의 능력을 조사하였다.
방법 및 재료
산후 세포의 단리 및 증식: 태반 및 제대 조직 유래의 PPDC를 단리하고, 실시예 4에 기술된 바와 같이 증식시켰다.
변형된 우드베리-블랙(Woodbury-Black) 프로토콜 (A): 본래 골수 간질 세포의 신경 유도 가능성을 시험하기 위해 수행된 검정으로부터 본 검정을 구성하였다 (1). 제대 유래 세포 (022803) P4 및 태반 유래 세포 (042203) P3를 해동시키고, 서브-컨플루언스 (75%)에 도달할 때까지 5,000개의 세포/㎠로 성장 배지 중에서 배양 증식시켰다. 이어서, 세포를 트립신 처리하고, Titretek II 유리 슬라이드 (미국 코네티컷주 브리스톨 소재의 VWR International)에 웰당 6,000개의 세포로 시딩하였다. 대조군으로서, 중간엽 줄기 세포 (P3; 1F2155; 미국 메릴랜드주 워커스빌 소재의 Cambrex); 골아세포 (P5; CC2538; Cambrex), 지방 유래 세포 (Artecel, 미국 특허 제6,555,374 B1호) (P6; 공여체 2) 및 신생아 인간 피부 섬유아세포 (P6; CC2509; Cambrex)를 또한 동일한 조건 하에서 시딩하였다.
먼저 모든 세포를 하기를 함유하는 DMEM/F12 배지 (미국 캘리포니아주 칼스배드 소재의 Invitrogen) 중에서 4일 동안 증식시켰다: 15% (v/v) 소 태아 혈청 (FBS; 미국 유타주 로건 소재의 Hyclone), 염기성 섬유아세포 성장 인자 (bFGF; 20 나노그램/밀리리터; 미국 뉴저지주 록키힐 소재의 Peprotech), 표피 성장 인자 (EGF; 20 나노그램/밀리리터; Peprotech) 및 페니실린/스트렙토마이신 (Invitrogen). 4일 후, 세포를 인산염 완충 식염수 (PBS; Invitrogen)에 헹구고, 후속하여 24시간 동안 DMEM/F12 배지+20% (v/v) FBS+페니실린/스트렙토마이신 중에서 배양하였다. 24시간 후, 세포를 PBS로 헹구었다. 이어서, 200 mM 부틸화 하이드록시아니솔, 10 μM 염화칼륨, 5 밀리그램/밀리리터의 인슐린, 10 μM 포르스콜린, 4 μM 발프로산 및 2 μM 하이드로코르티손 (모든 화학물질은 미국 미주리주 세인트루이스 소재의 Sigma로부터 입수됨)을 함유하는 DMEM/FI2 (무혈청)로 이루어진 유도 배지 중에서 세포를 1 내지 6 시간 동안 배양하였다. 이어서, 세포를 100% 빙랭 메탄올에서 고정시키고, 면역세포화학을 수행하여 (하기 방법 참조) 인간 네스틴 단백질 발현을 평가하였다.
변형된 우드베리-블랙 프로토콜 (B): PPDC (제대 (022803) P11; 태반 (042203) P11 및 성인 인간 피부 섬유아세포 (1F1853, P11)를 해동시키고, 서브-컨플루언스 (75%)에 도달할 때까지 5,000개의 세포/㎠로 성장 배지 중에서 배양 증식시켰다. 이어서, 세포를 트립신 처리하고, (A)에서와 유사한 밀도로 시딩하되, (1) 24웰 조직 배양 처리 플레이트 (TCP, Falcon 브랜드(brand), VWR International), (2) TCP 웰+실온에서 1시간 동안 흡착시킨 2% (w/v) 젤라틴 또는 (3) TCP 웰+20 ㎍/밀리리터의 흡착 마우스 라미닌 (37℃에서 최소 2시간 동안 흡착시킴; Invitrogen)에 시딩하였다.
정확하게 A)에서와 같이, 먼저 세포를 증식시키고, 전술된 시간대(timeframe)에 배지를 교환하였다. 한 세트의 배양물을 이전과 같이 5일 6시간째에 고정시켰는데, 이때 실온에서 10분 동안 빙랭 4% (w/v) 파라포름알데하이드 (Sigma)를 사용하였다. 제2 세트의 배양물의 경우, 배지를 제거하고, B27 (B27 보충제; Invitrogen), L-글루타민 (4 mM) 및 페니실린/스트렙토마이신 (Invitrogen)을 함유하는 Neurobasal-A 배지 (Invitrogen)로 이루어진 신경 전구체 증식 배지 (NPE)로 교환하였다. NPE 배지에 레티노산 (RA; 1 μM; Sigma)을 추가로 보충하였다. 이러한 배지를 4일 후에 제거하고, 배양물을 실온에서 10분 동안 빙랭 4% (w/v) 파라포름알데하이드 (Sigma)로 고정시키고, 네스틴, GFAP 및 TuJ1 단백질 발현에 대해 염색하였다 (표 12-1 참조).
[표 12-1]
2단계 분화 프로토콜: PPDC (제대 (042203) P11, 태반 (022803) P11), 성인 인간 피부 섬유아세포 (P11;1F1853; Cambrex)를 해동시키고, 서브-컨플루언스 (75%)에 도달할 때까지 5,000개의 세포/㎠로 성장 배지 중에서 배양 증식시켰다. 이어서, 세포를 트립신 처리하고, 2,000개의 세포/㎠로 시딩하되, bFGF (20 나노그램/밀리리터; 미국 뉴저지주 록키힐 소재의 Peprotech) 및 EGF (20 나노그램/밀리리터; Peprotech)가 보충된 NPE 배지 [전체 배지 조성은 NPE+F+E로도 지칭됨]의 존재 하에 라미닌 (미국 뉴저지주 플랭클린 레이크스 소재의 BD Biosciences)으로 코팅된 24웰 플레이트에 시딩하였다. 동시에, 또한 해마로부터 단리된 성체 래트 신경 전구체 (P4; (062603))를 24웰 라미닌 코팅 플레이트에 NPE+F+E 배지 중에서 플레이팅하였다. 모든 배양물을 이러한 조건에서 6일 동안 유지하였고 (세포는 그 동안 1회 영양분을 공급받음), 이 시점에서 배지를 추가 7일 동안 표 12-2에 열거된 분화 조건으로 교환하였다. 배양물을 실온에서 10분 동안 빙랭 4% (w/v) 파라포름알데하이드 (Sigma)로 고정시키고, 인간 또는 래트 네스틴, GFAP 및 TuJ1 단백질 발현에 대해 염색하였다.
[표 12-2]
다중 성장 인자 프로토콜: 제대 유래 세포 (P11; (042203))를 해동시키고, 서브-컨플루언스 (75%)에 도달할 때까지 5,000개의 세포/㎠로 성장 배지 중에서 배양 증식시켰다. 이어서, 세포를 트립신 처리하고, NPE+F (20 나노그램/밀리리터)+E (20 나노그램/밀리리터)의 존재 하에 24웰 라미닌 코팅 플레이트 (BD Biosciences)에 2,000개의 세포/㎠로 시딩하였다. 또한, 일부 웰은 NPE+F+E+2% FBS 또는 10% FBS를 함유하였다. 4일의 "분화전" 조건 후, 모든 배지를 제거하고, 샘플을, 소닉 헤지호그 (SHH; 200 나노그램/밀리리터; 미국 미주리주 세인트루이스 소재의 Sigma), FGF8 (100 나노그램/밀리리터; Peprotech), BDNF (40 나노그램/밀리리터; Sigma), GDNF (20 나노그램/밀리리터; Sigma) 및 레티노산 (1 μM; Sigma)이 보충된 NPE 배지로 교환하였다. 배지 교체 후 7일째에, 배양물을 실온에서 10분 동안 빙랭 4% (w/v) 파라포름알데하이드 (Sigma)로 고정시키고, 인간 네스틴, GFAP, TuJ1, 데스민 및 알파-평활근 액틴 발현에 대해 염색하였다.
신경 전구체 공동 배양 프로토콜: 성체 래트 해마 전구체 (062603)를 라미닌 코팅 24웰 접시 (BD Biosciences)에 신경구 또는 단일 세포 (10,000개의 세포/웰)로 NPE +F (20 나노그램/밀리리터) + E (20 나노그램/밀리리터) 중에서 플레이팅하였다.
별도로, 제대 유래 세포 (042203) P11 및 태반 유래 세포 (022803) P11을 해동시키고, 48시간 동안 5,000개의 세포/㎠로 NPE +F (20 나노그램/밀리리터) +E (20 나노그램/밀리리터) 중에서 배양 증식시켰다. 이어서, 세포를 트립신 처리하고, 기존의 신경 전구체 배양물에 2,500개의 세포/웰로 시딩하였다. 이때, 기존 배지를 신선한 배지로 교환하였다. 4일 후, 배양물을 실온에서 10분 동안 빙랭 4% (w/v) 파라포름알데하이드 (Sigma)로 고정시키고, 인간 핵 단백질 (hNuc; Chemicon) (상기 표 12-1)에 대해 염색하여 PPDC를 확인하였다.
면역세포화학: 표 12-1에 열거된 항체를 사용하여 면역세포화학을 수행하였다. 배양물을 인산염 완충 식염수 (PBS)로 세척하고, PBS, 4% (v/v) 염소 혈청 (미국 캘리포니아주 테메쿨라 소재의 Chemicon) 및 0.3% (v/v) Triton (Triton X-100; Sigma)을 함유하는 단백질 차단 용액에 30분 동안 노출시켜 세포내 항원에 접근하였다. 이어서, 차단 용액 중에 희석된 1차 항체를 실온에서 1시간 동안 배양물에 적용하였다. 다음으로, 1차 항체 용액을 제거하고, 배양물을 PBS로 세척한 후, 차단 용액을 염소 항-마우스 IgG -- Texas Red (1:250; 미국 오리건주 유진 소재의 Molecular Probes) 및 염소 항-토끼 IgG -- Alexa 488 (1:250; Molecular Probes)과 함께 함유하는 2차 항체 용액을 적용하였다 (실온에서 1시간). 이어서, 배양물을 세척하고, 10 마이크로몰의 DAPI (Molecular Probes)를 10분 동안 적용하여 세포핵을 가시화하였다.
면역염색 후, Olympus 도립 에피 형광 현미경 (미국 뉴욕주 멜빌 소재의 Olympus)에서 적절한 형광 필터를 사용하여 형광을 가시화하였다. 모든 경우에, 양성 염색은 대조군 염색보다 높은 형광 신호를 나타내었으며, 여기서 1차 항체 용액의 적용을 제외하고는 상기에 설명된 전체 절차를 따랐다. 대표적인 이미지를 디지털 컬러 비디오 카메라 및 ImagePro 소프트웨어 (미국 캘리포니아주 칼스배드 소재의 Media Cybernetics)를 사용하여 캡처하였다. 삼중 염색된 샘플의 경우, 각각의 이미지를 한 번에 단지 하나의 방사 필터를 사용하여 촬영하였다. 이어서, Adobe Photoshop 소프트웨어 (미국 캘리포니아주 새너제이 소재의 Adobe)를 사용하여 층상 몽타주를 작성하였다.
결과
변형된 우드베리-블랙 프로토콜 (A): 이러한 신경 유도 조성물 중에서 인큐베이션 시, 모든 세포 유형은 양극 형태 및 확장된 돌기를 갖는 세포로 형질전환되었다. 다른 더 큰 비양극 형태도 관찰되었다. 또한, 유도된 세포 집단은 다능성 신경 줄기 및 전구 세포의 마커인 네스틴에 대해 양성으로 염색되었다.
변형된 우드베리-블랙 프로토콜 (B): 조직 배양 플라스틱 (TCP) 접시에서 반복하였을 때, 라미닌을 배양 표면에 미리 흡착시키지 않는 한 네스틴 발현은 관찰되지 않았다. 이어서, 네스틴 발현 세포가 계속하여 성숙한 뉴런을 생성할 수 있는지를 추가로 평가하기 위해, 신경 줄기 및 전구 세포의 이러한 세포로의 분화를 유도하는 것으로 알려진 배지 조성물인 NPE+RA (1 μM)에 PPDC 및 섬유아세포를 노출시켰다 (2, 3, 4). 세포를 미성숙 및 성숙 뉴런에 대한 마커인 TuJ1, 성상세포의 마커인 GFAP 및 네스틴에 대해 염색하였다. 어떠한 조건 하에서도 TuJ1은 검출되지 않았고, 뉴런 형태를 갖는 세포도 관찰되지 않았다. 또한, 네스틴 및 GFAP는 면역세포화학에 의해 결정된 바와 같이 더 이상 PPDC에 의해 발현되지 않았다.
2단계 분화: 제대 및 태반 PPDC 분리주 (뿐만 아니라 각각 음성 대조 세포 유형 및 양성 대조 세포 유형으로서의 인간 섬유아세포 및 설치류 신경 전구체)를 라미닌 (신경 촉진) 코팅 접시에 플레이팅하고, 신경 전구체의 뉴런 및 성상세포로의 분화를 촉진하는 것으로 알려진 13가지의 다양한 성장 조건 (및 2가지의 대조 조건)에 노출시켰다. 또한, 2가지의 조건을 추가하여 PPDC 분화에 대한 GDF5 및 BMP7의 영향을 조사하였다. 대체로, 2단계 분화 접근법을 취하였는데, 먼저 세포를 6일 동안 신경 전구체 증식 조건에 둔 후, 7일 동안 완전 분화 조건에 두었다. 형태적으로, 제대 유래 세포와 태반 유래 세포 둘 모두는 이러한 절차의 시간경과 전반에 걸쳐 세포 형태의 근본적인 변화를 나타내었다. 그러나, 뉴런 또는 성상세포 형상의 세포는 대조 신경 전구체 플레이팅 조건의 경우를 제외하고는 관찰되지 않았다. 인간 네스틴, TuJ1 및 GFAP에 대해 음성인 면역세포화학은 형태적 관찰을 확인해 주었다.
다수의 성장 인자: 다양한 신경 분화제에 대한 1주일 노출 후, 세포를 신경 전구체 (인간 네스틴), 뉴런 (TuJ1) 및 성상세포 (GFAP)를 나타내는 마커에 대해 염색하였다. 제1 단계로 혈청 비함유 배지에서 성장된 세포는 혈청 함유 (2% 또는 10%) 배지 중의 세포와 상이한 형태를 가졌는데, 이는 잠재적인 신경 분화를 나타낸다. 구체적으로는, 제대 유래 세포를 EGF 및 bFGF에 이어서, SHH, FGF8, GDNF, BDNF 및 레티노산에 노출시키는 2단계 절차 후, 세포는 배양된 성상세포의 형태와 유사한 긴 확장된 돌기를 나타내었다. 2% FBS 또는 10% FBS를 분화의 제1 단계에 포함시켰을 때, 세포수가 증가하였고, 세포 형태는 고밀도에서 대조 배양물과 변함이 없었다. 잠재적인 신경 분화는 인간 네스틴, TuJ1 또는 GFAP에 대한 면역세포화학적 분석에 의해 입증되지 않았다.
신경 전구체 및 PPDC 공동 배양: 신경 증식 조건 (NPE+F+E)에서 2일 먼저 시딩된 래트 신경 전구체의 배양물에 PPDC를 플레이팅하였다. 플레이팅된 PPDC의 가시적 확인은 이러한 세포가 단일 세포로서 플레이팅되었음을 입증하였지만, 플레이팅 후 4일째의 (총 6일) 인간 특이적 핵 염색 (hNuc)은 이것이 무질서해져서 신경 전구체와의 접촉을 피하는 경향이 있음을 나타내었다. 또한, PPDC가 부착된 경우, 이러한 세포는 퍼져 나갔고, 래트 기원을 갖는 분화된 뉴런에 의해 신경이 분포된 것으로 나타났는데, 이는 PPDC가 근육 세포로 분화되었을 수 있음을 암시한다. 이러한 관찰은 위상차 현미경 검사에 따른 형태에 기반하였다. 다른 관찰은, 전형적으로 큰 세포체 (신경 전구체보다 큼)가 신경 전구체와 유사한 형태를 가졌으며, 가느다란 돌기는 여러 방향으로 이어져 있다는 것이었다. hNuc 염색 (세포 핵의 절반에서 발견됨)은 일부의 경우 이러한 인간 세포가 래트 전구체와 융합되어 그의 표현형을 취하였을 수 있음을 나타내었다. 신경 전구체만을 함유하는 대조 웰은 제대 또는 태반 PPDC를 함유하는 공동 배양 웰보다 적은 총 전구체 및 뚜렷한 분화된 세포를 가졌는데, 이는 제대 유래 세포와 태반 유래 세포 둘 모두가 케모카인과 사이토카인의 방출 또는 접촉 매개 효과에 의해 신경 전구체의 분화 및 거동에 영향을 미쳤음을 추가로 나타낸다.
요약: 다수의 프로토콜을 수행하여 신경 계통 세포로 분화되는 PPDC의 단기적인 가능성을 결정하였다. 이것은 각각 다능성 신경 줄기 및 전구 세포, 미성숙 및 성숙 뉴런, 및 성상세포와 관련된 단백질인 네스틴, TuJ1, 및 GFAP에 대하여 면역세포화학과 함께, 형태의 위상차 이미지화를 포함하였다.
실시예 13
산후 유래 세포의 장기적인 신경 분화
신경 계통 세포로의 장기적인 분화를 겪는 제대 및 태반 유래 세포 (집합적으로 산후 유래 세포 또는 PPDC)의 능력을 평가하였다.
방법 및 재료
PPDC의 단리 및 증식: PPDC를 앞서의 실시예에 기술된 바와 같이 단리하고 증식시켰다.
PPDC 세포 해동 및 플레이팅: 성장 배지 중에서 미리 성장시킨 PPDC (제대 (022803) P11; (042203) P11; (071003) P12; 태반 (101503) P7)의 동결 분취량을 해동시키고, B27 (B27 보충제, Invitrogen), L-글루타민 (4 mM) 및 페니실린/스트렙토마이신 (10 밀리리터)을 함유하는 Neurobasal-A 배지 (미국 캘리포니아주 칼스배드 소재의 Invitrogen) - 이러한 배지의 조합은 본 명세서에서 신경 전구체 증식 (NPE) 배지로 지칭됨 - 중에, 라미닌 (미국 뉴저지주 프랭클린 레이크스 소재의 BD)으로 코팅된 T-75 플라스크에 5,000개의 세포/㎠로 플레이팅하였다. NPE 배지에 bFGF (20 나노그램/밀리리터, 미국 뉴저지주 록키힐 소재의 Peprotech) 및 EGF (20 나노그램/밀리리터, 미국 뉴저지주 록키힐 소재의 Peprotech)를 추가로 보충하였으며, 이는 본 명세서에서 NPE+bFGF+EGF로 지칭된다.
대조 세포 플레이팅: 또한, 성인 인간 피부 섬유아세포 (P11, 미국 메릴랜드주 워커스빌 소재의 Cambrex) 및 중간엽 줄기 세포 (P5, Cambrex)를 해동시키고, NPE+bFGF+EGF 중에, 라미닌 코팅 T-75 플라스크에 동일한 세포 시딩 밀도로 플레이팅하였다. 추가의 대조군으로서, 섬유아세포, 제대 및 태반 PPDC를 모든 배양물에 대하여 명시된 기간 동안 성장 배지에서 성장시켰다.
세포 증식: 모든 배양물로부터의 배지를 주 1회 신선한 배지로 교체하고, 세포를 증식에 대하여 관찰하였다. 대체로, NPE+bFGF+EGF 중에서의 제한된 성장으로 인해 각각의 배양물을 1개월에 걸쳐 1회 계대하였다.
면역세포화학: 1개월 후, 모든 플라스크를 실온에서 10분 동안 차가운 4% (w/v) 파라포름알데하이드 (Sigma)로 고정시켰다. 면역세포화학을 하기에 대해 유도된 항체를 사용하여 수행하였다: TuJ1 (BIII 튜불린; 1:500; 미국 미주리주 세인트루이스 소재의 Sigma) 및 GFAP (아교세포 섬유 산성 단백질; 1:2000; 미국 캘리포니아주 카핀테리아 소재의 DakoCytomation). 간략하게 말하면, 배양물을 인산염 완충 식염수 (PBS)로 세척하고, PBS, 4% (v/v) 염소 혈청 (미국 캘리포니아주 테메쿨라 소재의 Chemicon) 및 0.3% (v/v) Triton (Triton X-100; Sigma)을 함유하는 단백질 차단 용액에 30분 동안 노출시켜 세포내 항원에 접근하였다. 이어서, 차단 용액 중에 희석된 1차 항체를 실온에서 1시간 동안 배양물에 적용하였다. 다음으로, 1차 항체 용액을 제거하고, 배양물을 PBS로 세척한 후, 차단액을 염소 항-마우스 IgG -- Texas Red (1:250; 미국 오리건주 유진 소재의 Molecular Probes) 및 염소 항-토끼 IgG -- Alexa 488 (1:250; Molecular Probes)과 함께 함유하는 2차 항체 용액을 적용하였다 (실온에서 1시간). 이어서, 배양물을 세척하고, 10 마이크로몰의 DAPI (Molecular Probes)를 10분 동안 적용하여 세포핵을 가시화하였다.
면역염색 후, Olympus 도립 에피 형광 현미경 (미국 뉴욕주 멜빌 소재의 Olympus)에서 적절한 형광 필터를 사용하여 형광을 가시화하였다. 모든 경우에, 양성 염색은 대조군 염색보다 높은 형광 신호를 나타내었으며, 여기서 1차 항체 용액의 적용을 제외하고는 상기에 설명된 전체 절차를 따랐다. 대표적인 이미지를 디지털 컬러 비디오 카메라 및 ImagePro 소프트웨어 (미국 캘리포니아주 칼스배드 소재의 Media Cybernetics)를 사용하여 캡처하였다. 삼중 염색된 샘플의 경우, 각각의 이미지를 한 번에 단지 하나의 방사 필터를 사용하여 촬영하였다. 이어서, Adobe Photoshop 소프트웨어 (미국 캘리포니아주 새너제이 소재의 Adobe)를 사용하여 층상 몽타주를 작성하였다.
[표 13-1]
결과
NPE+bFGF+EGF 배지는 PPDC의 증식을 둔화시키고 이의 형태를 변경시킨다. 플레이팅 직후, PPDC의 하위세트가 라미닌으로 코팅된 배양 플라스크에 부착되었다. 이것은 동결/해동 과정에 따른 세포 사멸로 인하거나 새로운 성장 조건 때문이었을 수 있다. 부착된 세포는 성장 배지에서 관찰된 형태와 상이한 형태를 취하였다.
제대 유래 세포의 클론은 뉴런 단백질을 발현한다: 배양물을 해동/플레이팅 후 1개월째에 고정시키고, 뉴런 단백질인 TuJ1 및 성상세포에서 발견된 중간 세사(intermediate filament)인 GFAP에 대해 염색하였다. 성장 배지에서 성장된 모든 대조 배양물 및 NPE+bFGF+EGF 배지에서 성장된 인간 섬유아세포 및 MSC는 TuJ1-/GFAP-인 것으로 밝혀졌지만, TuJ1은 제대 및 태반 PPDC에서 검출되었다. 뉴런 유사 형태를 갖는 세포 및 이러한 형태를 갖지 않는 세포에서 발현이 관찰되었다. GFAP의 발현은 어느 배양물에서도 관찰되지 않았다. 뉴런 유사 형태를 갖는 TuJ1을 발현하는 세포의 백분율은 총 집단의 1% 이하였다 (n=3의 시험된 제대 유래 세포 분리주). 정량화되지는 않았지만, 뉴런 형태를 갖지 않는 TuJ1 + 세포의 백분율은 태반 유래 세포 배양물보다 제대 유래 세포 배양물에서 더 높았다. 이러한 결과는 특이적인 것으로 나타났는데, 이는 성장 배지에서의 연령 매칭된 대조군이 TuJ1을 발현하지 않았기 때문이다.
요약: 제대 유래 세포로부터 분화된 뉴런 (TuJ1 발현 및 뉴런 형태에 기반함)을 생성시키는 방법을 개발하였다. TuJ1에 대한 발현은 시험관내에서 1개월 이전에 조사되지 않았지만, 적어도 작은 제대 유래 세포 집단이 내정 분화(default differentiation) 또는 L-글루타민, 염기성 FGF 및 EGF가 보충된 최소 배지에 대한 1개월 노출에 따른 장기적인 유도를 통해 뉴런을 생성시킬 수 있다는 것이 명백하다.
실시예 14
신경 전구체 지원을 위한 PPDC 영양 인자
비접촉 의존성 (영양) 메커니즘을 통해 성체 신경 줄기 및 전구 세포 생존 및 분화에 대한 제대 및 태반 유래 세포 (집합적으로 산후 유래 세포 또는 PPDC)의 영향을 조사하였다.
방법 및 재료
성체 신경 줄기 및 전구 세포 단리: 피셔(Fisher) 344 성체 래트를 CO2 질식 후 경추 탈구에 의해 희생시켰다. 골 론저(bone rongeur)를 사용하여 전체 뇌를 무손상 상태로 적출하고, 뇌의 운동 및 체성감각 영역 후방에서의 관상 절개에 기반하여 해마 조직을 해부하였다 (문헌[Paxinos, G. & Watson, C. 1997. The Rat Brain in Stereotaxic Coordinates]). 조직을 B27 (B27 보충제; Invitrogen), L-글루타민 (4 mM; Invitrogen) 및 페니실린/스트렙토마이신 (Invitrogen)을 함유하는 Neurobasal-A 배지 (미국 캘리포니아주 칼스배드 소재의 Invitrogen) - 이러한 배지의 조합은 본 명세서에서 신경 전구체 증식 (NPE) 배지로 지칭됨 - 에서 세척하였다. NPE 배지에 bFGF (20 나노그램/밀리리터, 미국 뉴저지주 록키힐 소재의 Peprotech) 및 EGF (20 나노그램/밀리리터, 미국 뉴저지주 록키힐 소재의 Peprotech)를 추가로 보충하였으며, 이는 본 명세서에서 NPE+bFGF+EGF로 지칭된다.
세척 후, 덮여 있는 수막을 제거하고, 조직을 메스로 민싱하였다. 민싱된 조직을 수거하고, 트립신/EDTA (Invitrogen)를 총 부피의 75%로 첨가하였다. DNase (총 부피 8 밀리리터당 100 마이크로리터, 미국 미주리주 세인트루이스 소재의 Sigma)도 첨가하였다. 다음으로, 조직/배지를 18 게이지 바늘, 20 게이지 바늘, 및 마지막으로 25 게이지 바늘에 각각 1회씩 순차적으로 통과시켰다 (모든 바늘은 미국 뉴저지주 프랭클린 레이크스 소재의 Becton Dickinson으로부터 입수됨). 혼합물을 250 g로 3분 동안 원심분리하였다. 상청액을 제거하고, 신선한 NPE+bFGF+EGF를 첨가하고, 펠릿을 재현탁시켰다. 생성된 세포 현탁액을 40 마이크로미터의 세포 스트레이너 (Becton Dickinson)에 통과시키고, 라미닌 코팅 T-75 플라스크 (Becton Dickinson) 또는 로우 클러스터(low cluster) 24웰 플레이트 (Becton Dickinson)에 플레이팅하고, 설명된 연구를 위해 충분한 세포수가 얻어질 때까지 NPE+bFGF+EGF 배지에서 성장시켰다.
PPDC 플레이팅: 성장 배지에서 미리 성장된 산후 유래 세포 (제대 (022803) P12, (042103) P12, (071003) P12; 태반 (042203) P12)를 5,000개의 세포/트랜스웰 인서트 (24웰 플레이트용 크기)로 플레이팅하고, 인서트에서 성장 배지에서 1주일 동안 성장시켜 컨플루언스를 달성하였다.
성체 신경 전구체 플레이팅: 신경구 또는 단일 세포로 성장된 신경 전구체를 하루 동안 NPE+bFGF+EGF 중에 2,000개의 세포/웰의 근사 밀도로 라미닌 코팅 24웰 플레이트에 시딩하여 세포 부착을 촉진하였다. 하루 후, 산후 세포를 함유하는 트랜스웰 인서트를 하기 계획에 따라 첨가하였다:
a.
트랜스웰 (성장 배지 중의 제대 유래 세포, 200 마이크로리터) + 신경 전구체 (NPE+bFGF+EGF, 1 밀리리터)
b.
트랜스웰 (성장 배지 중의 태반 유래 세포, 200 마이크로리터) + 신경 전구체 (NPE+bFGF+EGF, 1 밀리리터)
c.
트랜스웰 (성인 인간 피부 섬유아세포 [1 F 1853; 미국 메릴랜드주 워커스빌 소재의 Cambrex); 성장 배지 중의 P12, 200 마이크로리터) + 신경 전구체 (NPE+bFGF+EGF, 1 밀리리터)
d.
대조군: 신경 전구체 단독 (NPE+bFGF+EGF, 1 밀리리터)
e.
대조군: 신경 전구체 단독 (오로지 NPE, 1 밀리리터)
면역세포화학: 공동 배양 7일 후, 모든 조건을 실온에서 10분 동안 차가운 4% (w/v) 파라포름알데하이드 (Sigma)로 고정시켰다. 면역조직화학을 표 14-1에 열거된 에피토프들에 대해 유도된 항체들을 사용하여 수행하였다. 간략하게 말하면, 배양물을 인산염 완충 식염수 (PBS)로 세척하고, PBS, 4% (v/v) 염소 혈청 (미국 캘리포니아주 테메쿨라 소재의 Chemicon) 및 0.3% (v/v) Triton (Triton X-100; Sigma)을 함유하는 단백질 차단 용액에 30분 동안 노출시켜 세포내 항원에 접근하였다. 이어서, 차단 용액 중에 희석된 1차 항체를 실온에서 1시간 동안 배양물에 적용하였다. 다음으로, 1차 항체 용액을 제거하고, 배양물을 PBS로 세척한 후, 차단 용액을 염소 항-마우스 IgG -- Texas Red (1:250; 미국 오리건주 유진 소재의 Molecular Probes) 및 염소 항-토끼 IgG -- Alexa 488 (1:250; Molecular Probes)과 함께 함유하는 2차 항체 용액을 적용하였다 (실온에서 1시간). 이어서, 배양물을 세척하고, 10 마이크로몰의 DAPI (Molecular Probes)를 10분 동안 적용하여 세포핵을 가시화하였다.
면역염색 후, Olympus 도립 에피 형광 현미경 (미국 뉴욕주 멜빌 소재의 Olympus)에서 적절한 형광 필터를 사용하여 형광을 가시화하였다. 모든 경우에, 양성 염색은 대조군 염색보다 높은 형광 신호를 나타내었으며, 여기서 1차 항체 용액의 적용을 제외하고는 상기에 설명된 전체 절차를 따랐다. 대표적인 이미지를 디지털 컬러 비디오 카메라 및 ImagePro 소프트웨어 (미국 캘리포니아주 칼스배드 소재의 Media Cybernetics)를 사용하여 캡처하였다. 삼중 염색된 샘플의 경우, 각각의 이미지를 한 번에 단지 하나의 방사 필터를 사용하여 촬영하였다. 이어서, Adobe Photoshop 소프트웨어 (미국 캘리포니아주 새너제이 소재의 Adobe)를 사용하여 층상 몽타주를 작성하였다.
[표 14-1]
신경 전구체 분화의 정량 분석: 해마 신경 전구체 분화의 정량화를 조사하였다. 조건마다 최소 1000개의 세포를 계수하거나, 그보다 더 적은 경우에는 그 조건에서 관찰된 총 세포수를 계수하였다. 주어진 염색에 대해 양성인 세포의 백분율은 양성 세포의 수를 DAPI (핵) 염색에 의해 결정된 바와 같은 총 세포수로 나눈 것으로 평가하였다.
질량 분광 분석 및 2D 겔 전기영동: 공동 배양의 결과로서의 독특한 분비 인자를 확인하기 위해, 배양물 고정 전에 취한 컨디셔닝된 배지 샘플을 -80℃에서 하룻밤 동결시켰다. 이어서, 샘플을 한외여과 스핀 장치 (MW 컷오프 30 kD)에 적용하였다. 체류물(retentate)을 면역친화성 크로마토그래피 (항-Hu-알부민; IgY)에 적용하였다 (면역친화성은 샘플로부터 알부민을 제거하지 못하였음). 여과액을 MALDI에 의해 분석하였다. 통과물(pass through)을 시바크론 블루(Cibachron Blue) 친화성 크로마토그래피에 적용하였다. 샘플을 SDS-PAGE 및 2D 겔 전기영동에 의해 분석하였다.
결과
PPDC 공동 배양은 성체 신경 전구체 분화를 자극한다: 제대 또는 태반 유래 세포와의 배양 후, 성체 래트 해마로부터 유래된 공동 배양된 신경 전구 세포는 중추 신경계의 모든 3가지 주요 계통을 따른 유의한 분화를 나타내었다. 이러한 효과는 공동 배양 5일 후 분명하게 관찰되었으며, 많은 세포는 복잡한 돌기를 정교화하였고, 분열하는 전구 세포에 특유한 밝은 상(phase bright) 특징을 상실하였다. 반대로, bFGF 및 EGF의 부재 하에 단독으로 성장된 신경 전구체는 건강하지 못한 것으로 나타났고, 생존이 제한되었다.
절차의 완료 후, 배양물을 미분화 줄기 및 전구 세포 (네스틴), 미성숙 및 성숙 뉴런 (TuJ1), 성상세포 (GFAP) 및 성숙 희소돌기아교세포 (MBP)를 나타내는 마커에 대해 염색하였다. 모든 3가지의 계통에 따른 분화가 확인되었지만, 대조 조건은 대부분의 세포 사이의 네스틴 양성 염색의 보유에 의해 입증된 바와 같이 유의한 분화를 나타내지 않았다. 제대 및 태반 유래 세포 둘 모두가 세포 분화를 유도하였지만, 모든 3가지의 계통의 분화 정도는 제대 유래 세포와의 공동 배양의 경우보다 태반 유래 세포와의 공동 배양의 경우에 더 낮았다.
제대 유래 세포와의 공동 배양 후 분화된 신경 전구체의 백분율을 정량화하였다 (표 14-2). 제대 유래 세포는 성숙한 희소돌기아교세포 (MBP)의 수를 유의하게 향상시켰다 (두 대조 조건 모두에서 24.0% 대 0%). 또한, 공동 배양은 배양 중 GFAP + 성상세포 및 TuJ1 + 뉴런의 수를 향상시켰다 (각각 47.2% 및 8.7%). 이러한 결과는 네스틴 염색에 의해 확인되었는데, 이는 전구체 상태가 공동 배양 후 소실되었음을 나타낸다 (대조 조건 4에서 13.4% 대 71.4%).
분화가 성인 인간 섬유아세포에 의해 영향을 받는 것으로도 나타났지만, 이러한 세포는 성숙한 희소돌기아교세포의 분화를 촉진할 수 없었고 상당한 양의 뉴런을 생성할 수도 없었다. 정량화되진 않았지만, 섬유아세포는 신경 전구체의 생존을 향상시키는 것으로 나타났다.
[표 14-2]
독특한 화합물의 확인: 제대 및 태반 유래 공동 배양으로부터의 컨디셔닝된 배지를, 적절한 대조군 (NPE 배지±1.7% 혈청, 섬유아세포와의 공동 배양으로부터의 배지)과 함께, 차이점에 대해 조사하였다. 잠재적으로 독특한 화합물들을 확인하고, 이들 각각의 2D 겔로부터 절제하였다.
요약: 성체 신경 전구 세포와 제대 또는 태반 PPDC의 공동 배양은 이러한 세포의 분화를 가져온다. 본 실시예에 제시된 결과는 제대 유래 세포와의 공동 배양 후 성체 신경 전구 세포의 분화가 특히 현저함을 나타낸다. 구체적으로는, 유의한 백분율의 성숙한 희소돌기아교세포가 제대 유래 세포의 공동 배양에서 발생하였다.
실시예 15
산후 유래 세포의 이식
산후 제대 및 태반으로부터 유래된 세포는 재생 요법에 유용하다. 생분해성 물질을 사용하여 SCID 마우스로 이식된 산후 유래 세포 (PPDC)에 의해 생성된 조직을 평가하였다. 평가된 물질은 Vicryl 부직포, 35/65 PCL/PGA 폼 및 RAD 16 자기 조립 펩티드 하이드로겔이었다.
방법 및 재료
세포 배양: 태반 및 제대 유래 세포를 젤라틴 코팅 플라스크에서 성장 배지 (DMEM-저농도 글루코스 (미국 캘리포니아주 칼스배드 소재의 Gibco), 15% (v/v) 소 태아 혈청 (카탈로그 번호 SH30070.03; 미국 유타주 로건 소재의 Hyclone), 0.001% (v/v) 베타메르캅토에탄올 (미국 미주리주 세인트루이스 소재의 Sigma), 페니실린/스트렙토마이신 (Gibco))에서 성장시켰다.
샘플 준비: 100만 개의 생존가능한 세포를 직경이 5 mm이고 두께가 2.25 mm인 Vicryl 부직포 스캐폴드 (64.33 밀리그램/cc; 로트 번호 3547-47-1) 또는 직경이 5 mm인 35/65 PCL/PGA 폼 (로트 번호 3415-53)에 15 마이크로리터의 성장 배지 중에 시딩하였다. 세포를 2시간 동안 부착되게 한 후, 성장 배지를 더 첨가하여 스캐폴드를 덮었다. 세포를 스캐폴드에서 하룻밤 성장시켰다. 세포가 없는 스캐폴드도 배지 중에서 인큐베이션하였다.
RAD16 자기 조립 펩티드 (미국 매사추세츠주 케임브리지 소재의 3D Matrix)를 물 중 멸균 1% (w/v) 용액으로 얻었고, 이를 사용 직전에 둘베코 변형 배지 (DMEM; Gibco)에서 10% (w/v) 수크로스 (미국 미주리주 세인트루이스 소재의 Sigma), 10 mM HEPES 중의 1 × 106개의 세포와 1:1로 혼합하였다. RAD 16 하이드로겔 중의 세포의 최종 농도는 1 × 106개의 세포/100 마이크로리터였다.
시험 물질 (N=4/Rx)
a.
Vicryl 부직포 + 1 × 106개의 제대 유래 세포
b.
35/65 PCL/PGA 폼 + 1 × 106개의 제대 유래 세포
c.
RAD 16 자기 조립 펩티드 + 1 × 106개의 제대 유래 세포
d.
Vicryl 부직포 + 1 × 106개의 태반 유래 세포
e.
35/65 PCL/PGA 폼 + 1 × 106개의 태반 유래 세포
f.
RAD 16 자기 조립 펩티드 + 1 × 106개의 태반 유래 세포
g.
35/65 PCL/PGA 폼
h.
Vicryl 부직포
동물 준비: 동물을 동물복지법(Animal Welfare Act)의 현재 요건에 따라 취급하고 관리하였다. 상기 공법의 준수는 동물복지규정 (9 CFR)을 지키고 실험 동물의 관리와 사용에 관한 지침(Guide for the Care and Use of Laboratory Animals, 7판)에 공포된 현재의 표준을 따름으로써 달성되었다.
마우스 (무스 무스쿨루스(Mus Musculus))/폭스 체이스(Fox Chase) SCID/수컷 (미국 인디애나주 인디애나폴리스 소재의 Harlan Sprague Dawley , Inc.), 5 주령: SCID 마우스의 모든 취급은 후드 아래에서 행하였다. 마우스를 개별적으로 칭량하고, 60 밀리그램/㎏의 KETASET (케타민 하이드로클로라이드, 미국 아이오와주 포르다지 소재의 Aveco Co., Inc.) 및 10 밀리그램/㎏의 ROMPUN (자일라진, 미국 캔자스주 쇼니 소재의 Mobay Corp.) 및 식염수의 혼합물의 복강내 주사로 마취시켰다. 마취의 유도 후, 등쪽 경추부에서 등쪽 요추천골부에 이르는 동물의 등 전체를 전기 동물 가위를 사용하여 털이 없게 깎았다. 이어서, 이 부위를 클로르헥시딘 다이아세테이트로 스크러빙(scrubbing)하고, 알코올로 헹구고, 건조시키고, 1% 가용 요오드의 요오도포어(iodophor) 수용액을 도포하였다. 안과용 연고를 눈에 적용하여 마취 기간 동안 조직의 건조를 방지하였다.
피하 이식 기법: 각각 길이가 대략 1.0 cm인 4개의 피부 절개부를 마우스의 등에 만들었다. 2개의 두개 부위는 견갑골의 촉진된 아래쪽 경계의 약 5 mm 꼬리쪽인 등쪽 측흉부 영역에 걸쳐 가로로 위치하였으며, 하나는 척주의 좌측에 그리고 하나는 척주의 우측에 있었다. 다른 2개는 촉진된 장골능의 약 5 mm 꼬리쪽인 꼬리쪽 천골-요추 수준의 둔부근 영역에 걸쳐 가로로 위치하였으며, 정중선 양쪽에 하나씩 있었다. 이식물을 실험 설계에 따라 이들 부위에 무작위로 배치하였다. 피부를 아래에 놓인 결합 조직으로부터 분리하여 작은 포켓을 만들고, 이식물을 절개부의 약 1 cm 꼬리쪽에 배치하였다 (또는 RAD16의 경우는 주사하였다). 적절한 시험 물질을 피하 공간에 이식하였다. 피부 절개부를 금속 클립으로 닫았다.
동물 수용: 마우스를 64℉ 내지 79℉의 온도 범위 및 30% 내지 70%의 상대 습도 내에서 연구 과정 내내 마이크로 아이솔레이터 케이지(micro isolator cage)에 개별적으로 수용하고, 대략 12시간/12시간의 명암 주기로 유지하였다. 온도 및 상대 습도는 가능한 한 최대로 명시된 범위 내로 유지하였다. 식이는 조사된 피코 마우스 사료(Irradiated Pico Mouse Chow) 5058 (Purina Co.)과 물을 자유식으로 공급하는 것으로 이루어졌다.
마우스를 이산화탄소 흡입에 의해 지정된 간격으로 안락사시켰다. 피부가 덮여 있는 피하 이식 부위를 절제하고, 조직학 검사를 위해 동결시켰다.
조직학 검사: 이식물이 있는 절제된 피부를 10% 중성 완충 포르말린 (미국 미시간주 칼라마주 소재의 Richard-Allan)으로 고정시켰다. 덮여 있는 그리고 인접한 조직을 갖는 샘플을 중앙에서 2등분하고, 파라핀 처리하고, 통상적인 방법을 사용하여 절단 표면에 임베딩하였다. 5 마이크로미터의 조직 절편을 마이크로톰(microtome)에 의해 얻고, 통상적인 방법을 사용하여 헤마톡실린 및 에오신 (미국 뉴욕주 베이쇼어 소재의 Poly Scientific)으로 염색하였다.
결과
30일 후에 SCID 마우스에 피하 이식된 (세포가 없는) 폼으로의 조직의 최소 내증식(ingrowth)이 있었다. 대조적으로, 제대 유래 세포 또는 태반 유래 세포가 이식된 폼에는 조직이 광범위하게 채워져 있었다. 일부 조직 내증식이 Vicryl 부직포 스캐폴드에서 관찰되었다. 제대 또는 태반 유래 세포가 시딩된 부직포 스캐폴드는 매트릭스 침착과 성숙한 혈관의 증가를 나타내었다.
요약: 합성 흡수성 부직포/폼 디스크 (5.0 mm의 직경 × 1.0 mm의 두께) 또는 자기 조립 펩티드 하이드로겔에 인간 제대 또는 태반으로부터 유래된 세포를 시딩하고, SCID 마우스의 등쪽 척추 영역에 양측으로 피하 이식하였다. 결과는 산후 유래 세포가 생분해성 스캐폴드에서 양질의 조직 형성을 극적으로 증가시킬 수 있었음을 나타내었다.
실시예 16
제대 조직 유래 세포에서의 텔로머라제 발현
텔로머라제는 염색체의 완전성을 보호하고 세포의 복제 수명을 연장시키는 역할을 하는 텔로미어 반복체를 합성하는 기능을 한다 (문헌[Liu, K, et al., PNAS, 1999; 96:5147-5152]). 텔로머라제는 2개의 구성요소, 텔로머라제 RNA 주형 (hTER) 및 텔로머라제 역전사효소 (hTERT)로 이루어진다. 텔로머라제의 조절은 hTER이 아닌 hTERT의 전사에 의해 결정된다. 따라서, hTERT mRNA를 위한 실시간 폴리머라제 연쇄 반응(PCR)은 세포의 텔로머라제 활성을 결정하는 용인된 방법이다.
세포 단리. 실시간 PCR 실험을 수행하여, 인간 제대 조직 유래 세포의 텔로머라제 생성량을 측정하였다. 인간 제대 조직 유래 세포를 상기에 기술된 실시예에 따라 준비하였다. 대체로, 정상 분만 후 NDRI (미국 펜실베이니아주 필라델피아 소재)로부터 얻은 제대를 세척하여, 혈액 및 잔사를 제거하고, 기계적으로 해리시켰다. 이어서, 조직을 37℃에서 배양 배지 중에서 콜라게나제, 디스파제 및 하이알루로니다제를 포함하는 분해 효소와 함께 인큐베이션하였다. 인간 제대 조직 유래 세포를 상기 실시예에 설명된 방법에 따라 배양하였다. 중간엽 줄기 세포 및 정상 피부 섬유아세포 (cc-2509 로트 번호 9F0844)를 미국 메릴랜드주 워커스빌 소재의 Cambrex로부터 획득하였다. 만능성 인간 고환 태생성 암종 (기형종) 세포주 nTera-2 세포 (NTERA-2 cl.Dl), (문헌[Plaia et al., Stem Cells, 2006; 24(3):531-546] 참조)를 ATCC (미국 버지니아주 매너서스 소재)로부터 구입하였고, 상기 설명된 방법에 따라 배양하였다.
전체 RNA 단리. RNA를 RNeasy? 키트 (미국 캘리포니아주 발렌시아 소재의 Qiagen)를 사용하여 세포로부터 추출하였다. RNA를 50 마이크로리터의 DEPC 처리수로 용리시켜, -80℃에서 보관하였다. RNA를 TaqMan? 역전사 시약 (미국 캘리포니아주 포스터시티 소재의 Applied Biosystems)을 사용하여 25℃, 10분; 37℃, 60분; 및 95℃, 10분으로 랜덤 헥사머를 사용하여 역전사시켰다. 샘플들을 -20℃에서 보관하였다.
실시간 PCR. 제조사의 설명서 (Applied Biosystems)에 따라, Applied Biosystems Assays-on-Demand™ (TaqMan? 유전자 발현 검정(Gene Expression Assay)으로도 공지됨)를 사용하여 cDNA 샘플에 대해 PCR을 수행하였다. 이러한 시판용 키트는 인간 세포에서의 텔로머라제를 분석하는 데 널리 사용된다. 간략하게 말하면, hTert (인간 텔로머라제 유전자) (Hs00162669) 및 인간 GAPDH (내부 대조군)를 cDNA 및 TaqMan ? 범용 PCR 마스터 믹스와 혼합하였는데, 이는 ABI Prism 7000 SDS 소프트웨어 (Applied Biosystems)를 갖춘 7000 서열 검출 시스템을 이용하였다. 열사이클 조건은 처음에 50℃, 2분 및 95℃, 10분에 이어서, 40회 사이클의 95℃, 15초 및 60℃, 1분이었다. PCR 데이터를 제조사의 설명서에 따라 분석하였다.
인간 제대 조직 유래 세포 (ATCC 수탁 번호 PTA-6067), 섬유아세포, 및 중간엽 줄기 세포를 hTert 및 18S RNA에 대해 검정하였다. 표 16-1에 나타낸 바와 같이, hTert 및 이에 따라 텔로머라제는 인간 제대 조직 유래 세포에서 검출되지 않았다.
[표 16-1]
인간 제대 조직 유래 세포 (분리주 022803, ATCC 수탁 번호 PTA-6067) 및 nTera-2 세포를 검정하였고, 그 결과는 2개의 로트의 인간 제대 조직 유래 세포에서는 텔로머라제의 발현을 나타내지 않았지만, 기형종 세포주는 높은 수준의 발현을 나타내었다 (표 16-2).
[표 16-2]
그러므로, 본 발명의 인간 제대 조직 유래 세포는 텔로머라제를 발현하지 않는 것으로 결론지을 수 있다.
다양한 특허 및 다른 간행물이 명세서 전반에 걸쳐 언급되어 있다. 이러한 간행물 각각은 본 명세서에 전체적으로 참고로 포함된다.
본 발명의 다양한 태양은 실시예 및 바람직한 실시 형태를 참조로 하여 상기 예시되었지만, 본 발명의 범주는 전술한 설명에 의해서가 아니라 특허법의 원칙 하에 적절하게 해석되는 하기 청구범위에 의해 규정되는 것으로 인식될 것이다.
SEQUENCE LISTING
<110> HARRIS, IAN
<110> DEJNEKA, NADINE
<120> TREATMENT OF OCULAR CONDITIONS USING PROGENITOR CELLS
<130> JBI5060
<140>
<141> 2015-12-__
<150> 62/088,429
<151> 2014-12-05
<150> 62/126,370
<151> 2015-02-27
<150> 62/220,873
<151> 2015-09-18
<160> 10
<170> PatentIn version 3.5
<210> 1
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic primer
<400> 1
gagaaatcca aagagcaaat gg 22
<210> 2
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic primer
<400> 2
agaatggaaa actggaatag g 21
<210> 3
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic primer
<400> 3
tcttcgatgc ttcggattcc 20
<210> 4
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic primer
<400> 4
gaattctcgg aatctctgtt g 21
<210> 5
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic primer
<400> 5
ttacaagcag tgcagaaaac c 21
<210> 6
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic primer
<400> 6
agtaaacatt gaaaccacag cc 22
<210> 7
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic primer
<400> 7
tctgcagctc tgtgtgaagg 20
<210> 8
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic primer
<400> 8
cttcaaaaac ttctccacaa cc 22
<210> 9
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic primer
<400> 9
cccacgccac gctctcc 17
<210> 10
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic primer
<400> 10
tcctgtcagt tggtgctcc 19
Claims (10)
- 산후 유래 세포 집단을 망막 변성이 있는 피검자의 눈에 투여하는 방법으로서,
상기 세포 집단은 균질한 인간 제대 조직 유래 세포 집단이고, 상기 인간 제대 조직 유래 세포는 혈액이 실질적으로 없는 인간 제대 조직으로부터 단리되고, 상기 세포 집단은 적어도 하나의 시냅스생성 인자를 분비하고, 상기 시냅스생성 인자는 TSP-1, TSP-2 및 TSP-4로부터 선택되는, 산후 유래 세포 집단을 망막 변성이 있는 피검자의 눈에 투여하는 방법. - 균질한 인간 제대 조직 유래 세포 집단을 피검자의 눈에 투여하는 단계를 포함하는 망막 뉴런에서 시냅스생성 또는 신경돌기 증생(outgrowth)을 유도하는 방법으로서,
상기 세포 집단은 혈액이 실질적으로 없는 인간 제대 조직으로부터 단리되고, 상기 인간 제대 조직 유래 세포 집단은 적어도 하나의 시냅스생성 인자를 분비하고, 상기 시냅스생성 인자는 TSP-1, TSP-2 및 TSP-4로부터 선택되는, 망막 뉴런에서 시냅스생성 또는 신경돌기 증생을 유도하는 방법. - 균질한 인간 제대 조직 유래 세포 집단을 포함하는 조성물을 망막 변성이 있는 피검자의 눈에 투여하는 단계를 포함하는 상기 피검자의 망막 뉴런에서 기능성 시냅스를 발생시키는 방법으로서,
상기 세포 집단은 혈액이 실질적으로 없는 인간 제대 조직으로부터 단리되고, 상기 인간 제대 조직 유래 세포 집단은 적어도 하나의 시냅스생성 인자를 분비하고, 상기 시냅스생성 인자는 TSP-1, TSP-2 및 TSP-4로부터 선택되는, 망막 변성이 있는 피검자의 망막 뉴런에서 기능성 시냅스를 발생시키는 방법. - 인간 제대 조직 유래 세포 집단을 망막 변성이 있는 피검자의 눈에 투여하는 방법으로서,
상기 세포 집단은 혈액이 실질적으로 없는 인간 제대 조직으로부터 단리되고, 상기 인간 제대 조직 유래 세포 집단은 적어도 하나의 시냅스생성 인자를 분비하고, 상기 시냅스생성 인자는 TSP-1, TSP-2 및 TSP-4로부터 선택되는, 인간 제대 조직 유래 세포 집단을 망막 변성이 있는 피검자의 눈에 투여하는 방법. - 제1항 내지 제4항 중 어느 한 항에 있어서, 상기 혈액이 실질적으로 없는 인간 제대 조직으로부터 단리된 세포 집단은 배양 중 증식가능하고, 적어도 신경 표현형의 세포로 분화될 가능성을 갖고, 계대 시 정상 핵형을 유지하며, 하기 특징을 갖는, 방법:
a) 배양 중 40회의 집단 배가(doubling) 가능성;
b) CD10, CD13, CD44, CD73 및 CD90의 생성;
c) CD31, CD34, CD45, CD117 및 CD141의 생성의 결여; 및
d) 섬유아세포, 중간엽 줄기 세포 또는 장골능(iliac crest) 골수 세포인 인간 세포에 비하여 인터류킨 8 및 레티큘론 1을 인코딩하는 유전자의 증가된 발현. - 제5항에 있어서, 상기 세포 집단은 HLA-A,B,C에 대해 양성이고, HLA-DR,DP,DQ에 대해 음성인, 방법.
- 제1항 내지 제6항 중 어느 한 항에 있어서, 상기 망막 뉴런은 망막 신경절 세포, 광수용체 (간체 및 추체), 망막 무축삭 세포(retina amacrine cell), 수평 세포 또는 양극 세포로 이루어진 군으로부터 선택되는, 방법.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 상기 눈에 대한 투여는 눈 내부 투여 또는 눈 뒤 투여로부터 선택되는, 방법.
- 제3항에 있어서, 상기 조성물은 약제학적 조성물인, 방법.
- 제9항에 있어서, 상기 약제학적 조성물은 약제학적으로 허용가능한 담체를 포함하는, 방법.
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462088429P | 2014-12-05 | 2014-12-05 | |
| US62/088,429 | 2014-12-05 | ||
| US201562126370P | 2015-02-27 | 2015-02-27 | |
| US62/126,370 | 2015-02-27 | ||
| US201562220873P | 2015-09-18 | 2015-09-18 | |
| US62/220,873 | 2015-09-18 | ||
| PCT/US2015/063923 WO2016090215A2 (en) | 2014-12-05 | 2015-12-04 | Treatment of ocular conditions using progenitor cells |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170093178A true KR20170093178A (ko) | 2017-08-14 |
Family
ID=56092673
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177018057A KR20170093178A (ko) | 2014-12-05 | 2015-12-04 | 전구 세포를 사용한 안구 질환의 치료 |
Country Status (16)
| Country | Link |
|---|---|
| US (1) | US20160158293A1 (ko) |
| EP (1) | EP3258946A4 (ko) |
| JP (1) | JP2017537702A (ko) |
| KR (1) | KR20170093178A (ko) |
| CN (1) | CN107206028A (ko) |
| AU (1) | AU2015358330A1 (ko) |
| BR (1) | BR112017011513A2 (ko) |
| CA (1) | CA2969690A1 (ko) |
| HK (1) | HK1250329A1 (ko) |
| MX (1) | MX2017007207A (ko) |
| PH (1) | PH12017500998A1 (ko) |
| RU (1) | RU2017123184A (ko) |
| SG (1) | SG11201704268TA (ko) |
| TW (1) | TW201636032A (ko) |
| WO (1) | WO2016090215A2 (ko) |
| ZA (1) | ZA201704521B (ko) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8790637B2 (en) | 2003-06-27 | 2014-07-29 | DePuy Synthes Products, LLC | Repair and regeneration of ocular tissue using postpartum-derived cells |
| WO2018102174A1 (en) * | 2016-12-01 | 2018-06-07 | Janssen Biotech, Inc. | Treatment of retinal degeneration using progenitor cells |
| JP7348892B2 (ja) * | 2019-12-30 | 2023-09-21 | 佛教慈濟醫療財團法人 | 眼疾患を予防または治療する組成物及び方法 |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PL1641914T3 (pl) * | 2003-06-27 | 2017-01-31 | DePuy Synthes Products, Inc. | Komórki pochodzące z poporodowej tkanki łożyska oraz sposoby uzyskiwania i zastosowania tych komórek |
| US8790637B2 (en) * | 2003-06-27 | 2014-07-29 | DePuy Synthes Products, LLC | Repair and regeneration of ocular tissue using postpartum-derived cells |
| WO2010131917A2 (ko) * | 2009-05-13 | 2010-11-18 | 메디포스트(주) | 줄기세포의 세포 활성과 연관된 tsp-1, tsp-2, il-17br 및 hb-egf 및 이들의 용도 |
| US20140295554A1 (en) * | 2011-07-11 | 2014-10-02 | Cha Bio & Diostech Co., Ltd. | Method for manufacturing umbilical cord extract and usage of the same |
| US20130251670A1 (en) * | 2011-09-13 | 2013-09-26 | Aidan Products, Inc | Treatment of Macular Edema Utilizing Stem Cell and Conditioned Media Thereof |
-
2015
- 2015-12-04 CA CA2969690A patent/CA2969690A1/en not_active Abandoned
- 2015-12-04 WO PCT/US2015/063923 patent/WO2016090215A2/en active Application Filing
- 2015-12-04 TW TW104140661A patent/TW201636032A/zh unknown
- 2015-12-04 US US14/960,055 patent/US20160158293A1/en not_active Abandoned
- 2015-12-04 MX MX2017007207A patent/MX2017007207A/es unknown
- 2015-12-04 CN CN201580075547.0A patent/CN107206028A/zh active Pending
- 2015-12-04 RU RU2017123184A patent/RU2017123184A/ru not_active Application Discontinuation
- 2015-12-04 AU AU2015358330A patent/AU2015358330A1/en not_active Abandoned
- 2015-12-04 KR KR1020177018057A patent/KR20170093178A/ko unknown
- 2015-12-04 JP JP2017529751A patent/JP2017537702A/ja active Pending
- 2015-12-04 SG SG11201704268TA patent/SG11201704268TA/en unknown
- 2015-12-04 EP EP15865014.3A patent/EP3258946A4/en not_active Withdrawn
- 2015-12-04 BR BR112017011513A patent/BR112017011513A2/pt not_active Application Discontinuation
-
2017
- 2017-05-30 PH PH12017500998A patent/PH12017500998A1/en unknown
- 2017-07-04 ZA ZA2017/04521A patent/ZA201704521B/en unknown
-
2018
- 2018-06-26 HK HK18108224.1A patent/HK1250329A1/zh unknown
Also Published As
| Publication number | Publication date |
|---|---|
| CA2969690A1 (en) | 2016-06-09 |
| HK1250329A1 (zh) | 2018-12-14 |
| WO2016090215A2 (en) | 2016-06-09 |
| JP2017537702A (ja) | 2017-12-21 |
| PH12017500998A1 (en) | 2017-12-18 |
| US20160158293A1 (en) | 2016-06-09 |
| EP3258946A4 (en) | 2018-08-01 |
| CN107206028A (zh) | 2017-09-26 |
| AU2015358330A1 (en) | 2017-06-08 |
| EP3258946A2 (en) | 2017-12-27 |
| BR112017011513A2 (pt) | 2018-07-10 |
| MX2017007207A (es) | 2018-01-30 |
| RU2017123184A3 (ko) | 2019-07-17 |
| SG11201704268TA (en) | 2017-06-29 |
| ZA201704521B (en) | 2019-01-30 |
| TW201636032A (zh) | 2016-10-16 |
| RU2017123184A (ru) | 2019-01-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4950660B2 (ja) | 分娩後由来細胞を使用する眼組織の修復および再生 | |
| JP5425400B2 (ja) | 産褥由来細胞を用いた脳卒中および他の急性神経変性障害の治療 | |
| JP6000982B2 (ja) | 臍由来細胞を使用する筋萎縮性側索硬化症の治療 | |
| KR20170094368A (ko) | 전구 세포를 사용한 망막 변성의 치료 | |
| TW201908478A (zh) | 調節米勒神經膠質細胞之方法 | |
| KR20170093178A (ko) | 전구 세포를 사용한 안구 질환의 치료 | |
| KR20180088713A (ko) | 전구 세포를 사용한 망막 변성의 치료 | |
| WO2018102174A1 (en) | Treatment of retinal degeneration using progenitor cells | |
| KR20190026758A (ko) | 전구 세포를 사용한 망막 혈관 질병의 치료 |