KR20160036591A - 티에노트리아졸로디아제핀 화합물을 함유하는 약학적 제제 - Google Patents
티에노트리아졸로디아제핀 화합물을 함유하는 약학적 제제 Download PDFInfo
- Publication number
- KR20160036591A KR20160036591A KR1020167004843A KR20167004843A KR20160036591A KR 20160036591 A KR20160036591 A KR 20160036591A KR 1020167004843 A KR1020167004843 A KR 1020167004843A KR 20167004843 A KR20167004843 A KR 20167004843A KR 20160036591 A KR20160036591 A KR 20160036591A
- Authority
- KR
- South Korea
- Prior art keywords
- compound
- carbon atoms
- alkyl
- pharmaceutically acceptable
- formula
- Prior art date
Links
- 0 Cc1c(C)[s]c-2c1C(c(cc1)ccc1Cl)=*=C(CC(OC)=N)c1nnc(C)[n]-21 Chemical compound Cc1c(C)[s]c-2c1C(c(cc1)ccc1Cl)=*=C(CC(OC)=N)c1nnc(C)[n]-21 0.000 description 1
Images
Classifications
-
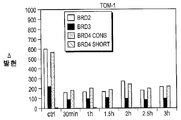
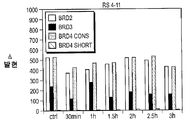
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
- A61K31/551—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole having two nitrogen atoms, e.g. dilazep
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
- A61K31/551—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole having two nitrogen atoms, e.g. dilazep
- A61K31/5513—1,4-Benzodiazepines, e.g. diazepam or clozapine
- A61K31/5517—1,4-Benzodiazepines, e.g. diazepam or clozapine condensed with five-membered rings having nitrogen as a ring hetero atom, e.g. imidazobenzodiazepines, triazolam
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1635—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1652—Polysaccharides, e.g. alginate, cellulose derivatives; Cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/167—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction with an outer layer or coating comprising drug; with chemically bound drugs or non-active substances on their surface
- A61K9/1676—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction with an outer layer or coating comprising drug; with chemically bound drugs or non-active substances on their surface having a drug-free core with discrete complete coating layer containing drug
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1682—Processes
- A61K9/1694—Processes resulting in granules or microspheres of the matrix type containing more than 5% of excipient
Abstract
본 발명은 환자에게 고형 분산물로서 하기 화학식 1에 의한 티에노트리아졸로디아제핀 화합물 또는 그의 약학적으로 허용가능한 염 또는 그의 수화물; 및 약학적으로 허용가능한 중합체를 포함하는 조성물의 약학적 허용량을 투여하는 단계를 포함하는, 림프모구 백혈병, 급성 골수성 백혈병, BCR-ABL 양성 급성 림프구성 백혈병 또는 CD34 양성 급성 골수성 백혈병의 치료 방법에 관한 것이다. 한 실시양태에서, 약학적으로 허용가능한 중합체는 HPMCAS이다.
<화학식 1>
상기 화학식에서, X는 할로겐이며, R1은 C1-C4 알킬이며, R2는 C1-C4 알킬이며, a는 1-4의 정수이며, R3은 C1-C4 알킬, C1-C4 하이드록시알킬, C1-C4 알콕시, 치환기(들)를 임의로 갖는 페닐 또는 치환기(들)를 임의로 갖는 헤테로아릴이다.
<화학식 1>
상기 화학식에서, X는 할로겐이며, R1은 C1-C4 알킬이며, R2는 C1-C4 알킬이며, a는 1-4의 정수이며, R3은 C1-C4 알킬, C1-C4 하이드록시알킬, C1-C4 알콕시, 치환기(들)를 임의로 갖는 페닐 또는 치환기(들)를 임의로 갖는 헤테로아릴이다.
Description
관련
출원에 대한 교차
-참조
본원은 2013년 8월 1일자로 출원된 미국 가출원 제61/861,291호 및 2013년 8월 7일자로 출원된 미국 가출원 제61/863,118호를 우선권주장으로 하며, 이들 출원 각각은 본원에 그 전문이 참조로 포함된다.
서열 목록
본원과 동시에 제출되며, 하기와 같이 확인된 컴퓨터-읽기 가능한 뉴클레오티드/아미노산 서열 목록은 본원에 참조로 그 전체를 인용한다: 2014년 7월 22일자로 생성된 "파일명.txt"라는 명칭의 1개의 xxx 바이트 ASCII (텍스트) 파일.
발명의 분야
일부 구체예에서, 본 발명은 백혈병을 치료하기 위한 약학적 조성물 및 그의 사용 방법에 관한 것이다. 보다 구체적으로, 본 발명은 개선된 용해도 및 생체이용률을 갖는 티에노트리아졸로디아제핀 화합물의 분산물을 포함하는 조성물 및 BCR-ABL 양성 급성 림프구성 백혈병 및/또는 CD34 양성 급성 골수성 백혈병의 치료 방법에 관한 것이다.
본원의 하기에 기재된 화학식 1의 화합물은 BRD2, BRD3 및 BRD4를 포함하는 BET(브로모도메인 및 엑스트라터미날) 단백질로서 공지된 전사 조절체의 탠덤 브로모도메인(BRD)-함유 패밀리에 아세틸화 히스톤 H4가 결합되는 것을 억제하는 것으로 나타났다. 본원에 그 전문이 참조로 포함된 미국 출원 공개 공보 번호 2010/0286127 A1을 참조한다. BET 단백질은 증식 및 분화의 주요한 후생적 조절체로서 나타났으며, 또한 본원에 그 전문이 참조로 포함된 문헌[Denis, G.V. "Bromodomain coactivators in cancer, obesity, type 2 diabetes, and inflammation," Discov Med 2010; 10:489-499]에 의하여 보고된 바와 같이 이상지질혈증으로의 경향 또는 지질생성의 부적절한 조절, 증가된 염증성 프로파일 및, 심혈관 질환 및 2형 당뇨병에 대한 위험성 및, 류마티스성 관절염 및 전신성 홍반성 루프스 등의 자가면역 질환에 대한 증가된 감수성과 관련되어 있다. 따라서, 화학식 II의 화합물은 각종 암, 심혈관 질환, 2형 당뇨병 및 자가면역 장애, 예컨대 류마티스 관절염 및 전신성 홍반성 루프스의 치료에 유용할 수 있다.
하기 본원에 기재된 화학식 1의 티에노트리아졸로디아제핀 화합물은 특히 약물 생체이용률 및 환자간 및 환자내 투여 반응에서의 변동성의 특정한 문제점을 비롯한 생약학 조성물의 일반적인 투여 및 제조와 관련된 매우 특정한 곤란점을 나타내며, 이는 티에노트리아졸로디아제핀의 사실상 수불용성 성질에 관한 비-통상적 투여 형태의 개발을 필요로 한다.
이전에, 본원에서 그 전문이 참조로 포함되는 미국 특허 출원 공개 공보 번호 20090012064 A1에서 보고된 바와 같이, 화학식 1의 티에노트리아졸로디아제핀 화합물은 담체인 에틸 아크릴레이트-메틸 메타크릴레이트-트리메틸암모니오에틸 메타크릴레이트 클로라이드 공중합체(유드라짓(Eudragit) RS, 롬(Rohm) 제조)로 제제화되어 궤양대장염 및 크론병 등의 염증성 장 질환의 치료를 위하여 하부 장에서 약학적 성분을 선택적으로 방출시키는 경구 제제를 제공하는 것으로 밝혀졌다. 동물 시험을 비롯한 다양한 실험에 의하여, 염증성 장 질환의 경우, 병변에서 화학식 1의 티에노트리아졸로디아제핀 화합물 방출 및 염증성 병변에서 그의 직접적인 작용이 위장관으로부터의 순환으로 화학식 1의 티에노트리아졸로디아제핀 화합물의 흡수보다 더 중요한 것으로 밝혀졌다. 그러나, 다수의 기타 질환 병태의 경우 위장관으로부터의 순환으로 화학식 1의 티에노트리아졸로디아제핀 화합물의 높은 흡수가 요구된다. 따라서, 위장관으로부터의 순환으로 화학식 1의 티에노트리아졸로디아제핀 화합물의 높은 흡수를 제공할 수 있는 화학식 1의 티에노트리아졸로디아제핀 화합물의 제제에 대한 수요가 존재한다.
한 실시양태에서, 본 발명은 환자에게 하기 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물 또는 그의 약학적으로 허용가능한 염 또는 그의 수화물 또는 용매화물을 포함하는 조성물의 약학적 허용량을 투여하는 단계를 포함하며, 티에노트리아졸로디아제핀 화합물은 비정질 티에노트리아졸로디아제핀 화합물 및 약학적으로 허용가능한 중합체를 포함하는 고형 분산물로서 형성되며, 고형 분산물은 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타내는 급성 림프구성 백혈병의 치료 방법을 제공한다:
<화학식 1>
상기 R1은 1-4의 탄소수를 갖는 알킬이고, 상기 R2는 수소 원자; 할로겐 원자; 또는 할로겐 원자 또는 하이드록실기에 의하여 임의로 치환된 1-4의 탄소수를 갖는 알킬이고, 상기 R3는 할로겐 원자; 할로겐 원자, 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시 또는 시아노에 의하여 임의로 치환된 페닐; -NR5-(CH2)m-R6, 상기 R5는 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, m은 0-4의 정수이며, 상기 R6은 할로겐 원자에 의하여 임의로 치환된 페닐 또는 피리딜임; 또는 -NR7-CO-(CH2)n-R8이고, 상기 R7은 수소 원자 또는 1-4의 탄소수를 갖는 알킬이며, n은 0-2의 정수이며, 상기 R8은 할로겐 원자에 의하여 임의로 치환된 페닐 또는 피리딜임, 상기 R4는 -(CH2)a-CO-NH-R9, a는 1-4의 정수이며, R9는 1-4의 탄소수를 갖는 알킬; 1-4의 탄소수를 갖는 하이드록시알킬; 1-4의 탄소수를 갖는 알콕시; 또는 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시, 아미노 또는 하이드록실기 에 의하여 임의로 치환된 페닐 또는 피리딜임, 또는 -(CH2)b-COOR10이고, b는 1-4의 정수이며, 상기 R10은 1-4의 탄소수를 갖는 알킬이다. 하나의 상기 실시양태에서, 약학적으로 허용가능한 중합체는 1:3 내지 1:1의 중량비의 티에노트리아졸로디아제핀 화합물 대 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트(HPMCAS)를 갖는 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트이다.
한 실시양태에서, 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물은 (i) (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 또는 그의 이수화물, (ii) 메틸 (S)-{4-(3'-시아노비페닐-4-일)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트, (iii) 메틸 (S)-{2,3,9-트리메틸-4-(4-페닐아미노페닐)-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트; 및 (iv) 메틸 (S)-{2,3,9-트리메틸-4-[4-(3-페닐프로피오닐아미노)페닐]-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트로 이루어진 군으로부터 독립적으로 선택된다.
또 다른 실시양태에서, 티에노트리아졸로디아제핀 화합물은 (S)-2-(4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일)-N-(4-하이드록시페닐)아세트아미드 이수화물이다.
또 다른 실시양태에서, 고형 분산물은 약 130℃ 내지 약 140℃ 범위의 단일 유리 전이 온도(Tg) 변곡점을 나타낸다.
본 개시내용은 환자에게 하기 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물 또는 그의 약학적으로 허용가능한 염 또는 그의 수화물 또는 용매화물을 포함하는 조성물의 약학적 허용량을 투여하는 단계를 포함하며, 티에노트리아졸로디아제핀 화합물은 비정질 티에노트리아졸로디아제핀 화합물 및 약학적으로 허용가능한 중합체를 포함하는 고형 분산물로서 형성되며, 고형 분산물은 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타내는 급성 골수성 백혈병의 치료 방법을 제공하는 실시양태를 추가로 제공한다:
<화학식 1>
상기 R1은 1-4의 탄소수를 갖는 알킬이고, 상기 R2는 수소 원자; 할로겐 원자; 또는 할로겐 원자 또는 하이드록실기에 의하여 임의로 치환된 1-4의 탄소수를 갖는 알킬이고, 상기 R3는 할로겐 원자; 할로겐 원자, 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시 또는 시아노에 의하여 임의로 치환된 페닐; -NR5-(CH2)m-R6, 상기 R5는 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, m은 0-4의 정수이며, 상기 R6은 할로겐 원자에 의하여 임의로 치환된 페닐 또는 피리딜임; 또는 -NR7-CO-(CH2)n-R8이고, 상기 R7은 수소 원자 또는 1-4의 탄소수를 갖는 알킬이며, n은 0-2의 정수이며, 상기 R8은 할로겐 원자에 의하여 임의로 치환된 페닐 또는 피리딜임, 상기 R4는 -(CH2)a-CO-NH-R9, a는 1-4의 정수이며, R9는 1-4의 탄소수를 갖는 알킬; 1-4의 탄소수를 갖는 하이드록시알킬; 1-4의 탄소수를 갖는 알콕시; 또는 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시, 아미노 또는 하이드록실기 에 의하여 임의로 치환된 페닐 또는 피리딜임, 또는 -(CH2)b-COOR10이고, b는 1-4의 정수이며, 상기 R10은 1-4의 탄소수를 갖는 알킬이다. 하나의 상기 실시양태에서, 약학적으로 허용가능한 중합체는 1:3 내지 1:1의 중량비의 티에노트리아졸로디아제핀 화합물 대 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트(HPMCAS)를 갖는 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트이다.
한 실시양태에서, 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물은 (i) (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 또는 그의 이수화물, (ii) 메틸 (S)-{4-(3'-시아노비페닐-4-일)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트, (iii) 메틸 (S)-{2,3,9-트리메틸-4-(4-페닐아미노페닐)-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트; 및 (iv) 메틸 (S)-{2,3,9-트리메틸-4-[4-(3-페닐프로피오닐아미노)페닐]-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트로 이루어진 군으로부터 독립적으로 선택된다.
또 다른 실시양태에서, 티에노트리아졸로디아제핀 화합물은 (S)-2-(4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일)-N-(4-하이드록시페닐)아세트아미드 이수화물이다.
한 실시양태에서, 고형 분산물은 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타낸다. 또 다른 실시양태에서, 고형 분산물은 약 130℃ 내지 약 140℃ 범위의 단일 유리 전이 온도(Tg) 변곡점을 나타낸다.
한 구체예에서, 본 발명은 환자에게 티에노트리아졸로디아제핀 화합물을 포함하는 조성물의 약학적 허용량을 투여하는 단계를 포함하는 BCR-ABL 양성 급성 림프구성 백혈병의 치료 방법을 제공한다. BCR-ABL 양성 급성 림프구성 백혈병의 치료 방법의 일부 바람직한 실시양태에서, 하기 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물 또는 그의 약학적으로 허용가능한 염 또는 그의 수화물 또는 용매화물은 하기와 같다:
<화학식 1>
상기 R1은 1-4의 탄소수를 갖는 알킬이고, 상기 R2는 수소 원자; 할로겐 원자; 또는 할로겐 원자 또는 하이드록실기에 의하여 임의로 치환된 1-4의 탄소수를 갖는 알킬이고, 상기 R3는 할로겐 원자; 할로겐 원자, 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시 또는 시아노에 의하여 임의로 치환된 페닐; -NR5-(CH2)m-R6, 상기 R5는 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, m은 0-4의 정수이며, 상기 R6은 할로겐 원자에 의하여 임의로 치환된 페닐 또는 피리딜임; 또는 -NR7-CO-(CH2)n-R8이고, 상기 R7은 수소 원자 또는 1-4의 탄소수를 갖는 알킬이며, n은 0-2의 정수이며, 상기 R8은 할로겐 원자에 의하여 임의로 치환된 페닐 또는 피리딜임, 상기 R4는 -(CH2)a-CO-NH-R9, a는 1-4의 정수이며, R9는 1-4의 탄소수를 갖는 알킬; 1-4의 탄소수를 갖는 하이드록시알킬; 1-4의 탄소수를 갖는 알콕시; 또는 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시, 아미노 또는 하이드록실기 에 의하여 임의로 치환된 페닐 또는 피리딜임, 또는 -(CH2)b-COOR10이고, b는 1-4의 정수이며, 상기 R10은 1-4의 탄소수를 갖는 알킬이다.
BCR-ABL 양성 급성 림프구성 백혈병의 치료 방법의 일부 바람직한 실시양태에서, 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물은
(i) (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 또는 그의 이수화물,
(ii) 메틸 (S)-{4-(3'-시아노비페닐-4-일)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트,
(iii) 메틸 (S)-{2,3,9-트리메틸-4-(4-페닐아미노페닐)-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트; 및
(iv) 메틸 (S)-{2,3,9-트리메틸-4-[4-(3-페닐프로피오닐아미노)페닐]-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트로 이루어진 군으로부터 독립적으로 선택된다.
BCR-ABL 양성 급성 림프구성 백혈병의 치료 방법의 일부 바람직한 실시양태에서, 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물은 (S)-2-(4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일)-N-(4-하이드록시페닐)아세트아미드 이수화물이다.
BCR-ABL 양성 급성 림프구성 백혈병의 치료 방법의 일부 바람직한 실시양태에서, 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물은 화학식 1의 비정질 티에노트리아졸로디아제핀 화합물 및 그의 약학적으로 허용가능한 염 또는 그의 수화물; 및 약학적으로 허용가능한 중합체를 포함하는 고형 분산물로서 형성된다.
BCR-ABL 양성 급성 림프구성 백혈병의 치료 방법의 일부 바람직한 실시양태에서, 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물은 화학식 1의 비정질 티에노트리아졸로디아제핀 화합물 및 그의 약학적으로 허용가능한 염 또는 그의 수화물; 및 약학적으로 허용가능한 중합체를 포함하는 고형 분산물로서 형성되며, 약학적으로 허용가능한 중합체는 1:3 내지 1:1의 중량비의 티에노트리아졸로디아제핀 화합물 대 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트(HPMCAS)를 갖는 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트이다.
BCR-ABL 양성 급성 림프구성 백혈병의 치료 방법의 일부 바람직한 실시양태에서, 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물을 포함하는 고형 분산물은 약 130℃ 내지 약 140℃ 범위의 단일 유리 전이 온도(Tg) 변곡점을 나타낸다. 한 실시양태에서, 고형 분산물은 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타낸다.
또 다른 구체예에서, 본 발명은 CD34 양성 급성 골수성 백혈병의 치료 방법을 제공한다. CD34 양성 급성 골수성 백혈병의 치료 방법의 일부 예시의 실시양태에서, 상기 방법은 환자에게 티에노트리아졸로디아제핀 화합물을 포함하는 조성물의 약학적 허용량을 투여하는 단계를 포함한다. CD34 양성 급성 골수성 백혈병의 치료 방법의 일부 바람직한 실시양태에서, 상기 방법은 환자에게 하기 화학식 1의 구조를 갖는 티에노트리아졸로디아제핀 화합물 또는 그의 약학적으로 허용가능한 염 또는 그의 수화물 또는 용매화물을 포함하는 조성물의 약학적 허용량을 투여하는 단계를 포함한다:
<화학식 1>
상기 R1은 1-4의 탄소수를 갖는 알킬이고, 상기 R2는 수소 원자; 할로겐 원자; 또는 할로겐 원자 또는 하이드록실기에 의하여 임의로 치환된 1-4의 탄소수를 갖는 알킬이고, 상기 R3는 할로겐 원자; 할로겐 원자, 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시 또는 시아노에 의하여 임의로 치환된 페닐; -NR5-(CH2)m-R6, 상기 R5는 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, m은 0-4의 정수이며, 상기 R6은 할로겐 원자에 의하여 임의로 치환된 페닐 또는 피리딜임; 또는 -NR7-CO-(CH2)n-R8이고, 상기 R7은 수소 원자 또는 1-4의 탄소수를 갖는 알킬이며, n은 0-2의 정수이며, 상기 R8은 할로겐 원자에 의하여 임의로 치환된 페닐 또는 피리딜임, 상기 R4는 -(CH2)a-CO-NH-R9, a는 1-4의 정수이며, R9는 1-4의 탄소수를 갖는 알킬; 1-4의 탄소수를 갖는 하이드록시알킬; 1-4의 탄소수를 갖는 알콕시; 또는 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시, 아미노 또는 하이드록실기 에 의하여 임의로 치환된 페닐 또는 피리딜임, 또는 -(CH2)b-COOR10이고, b는 1-4의 정수이며, 상기 R10은 1-4의 탄소수를 갖는 알킬이다.
CD34 양성 급성 골수성 백혈병의 치료 방법의 일부 바람직한 실시양태에서, 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물은
(i) (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로-[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 또는 그의 이수화물,
(ii) 메틸 (S)-{4-(3'-시아노비페닐-4-일)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트,
(iii) 메틸 (S)-{2,3,9-트리메틸-4-(4-페닐아미노페닐)-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트; 및
(iv) 메틸 (S)-{2,3,9-트리메틸-4-[4-(3-페닐프로피오닐아미노)페닐]-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트로 이루어진 군으로부터 독립적으로 선택된다.
CD34 양성 급성 골수성 백혈병의 치료 방법의 일부 바람직한 실시양태에서, 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물은 (S)-2-(4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일)-N-(4-하이드록시페닐)아세트아미드 이수화물이다.
CD34 양성 급성 골수성 백혈병의 치료 방법의 일부 바람직한 실시양태에서, 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물은 화학식 1의 비정질 티에노트리아졸로디아제핀 화합물 및 그의 약학적으로 허용가능한 염 또는 그의 수화물; 및 약학적으로 허용가능한 중합체를 포함하는 고형 분산물로서 형성된다. 한 실시양태에서, 고형 분산물은 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타낸다.
일부 바람직한 실시양태에서, CD34 양성 급성 골수성 백혈병의 치료 방법은 환자에게 화학식 1의 비정질 티에노트리아졸로디아제핀 화합물 및 그의 약학적으로 허용가능한 염 또는 그의 수화물의 약학적 허용량을 투여하는 단계를 포함하며, 화학식 1의 티에노트리아졸로디아제핀 화합물은 화학식 1의 비정질 티에노트리아졸로디아제핀 화합물 및 그의 약학적으로 허용가능한 염 또는 그의 수화물; 및 약학적으로 허용가능한 중합체를 포함하는 고형 분산물로서 형성되며, 약학적으로 허용가능한 중합체는 1:3 내지 1:1의 중량비의 티에노트리아졸로디아제핀 화합물 대 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트(HPMCAS)를 갖는 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트이다.
일부 바람직한 실시양태에서, CD34 양성 급성 골수성 백혈병의 치료 방법은 환자에게 약학적으로 허용가능한 중합체 중의 고형 분산물로서 형성된 화학식 1의 비정질 티에노트리아졸로디아제핀 화합물 및 그의 약학적으로 허용가능한 염 또는 그의 수화물의 약학적 허용량을 투여하는 단계를 포함하며, 고형 분산물은 약 130℃ 내지 약 140℃ 범위의 단일 유리 전이 온도(Tg) 변곡점을 나타낸다. 한 실시양태에서, 고형 분산물은 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타낸다.
본 발명의 티에노트리아졸로디아제핀 제제를 포함하는 약학적 조성물 및 방법의 실시양태의 상기 개요뿐 아니라, 하기 상세한 설명은 예시의 실시양태의 첨부된 도면과 함께 숙독시 더 잘 이해될 것이다. 그러나, 본 발명은 제시된 정확한 방식 및 수단으로 한정되지 않는 것으로 이해하여야 한다.
도면에서,
도 1A는 25% 화합물 (1-1) 및 유드라짓 L100-55를 포함하는 고형 분산물을 포함하는 비교 제제의 용해 프로파일을 도시한다.
도 1B는 50% 화합물 (1-1) 및 유드라짓 L100-55를 포함하는 고형 분산물을 포함하는 비교 제제의 용해 프로파일을 도시한다.
도 1C는 25% 화합물 (1-1) 및 폴리비닐피롤리돈(PVP)을 포함하는 고형 분산물을 포함하는 예시의 제제의 용해 프로파일을 도시한다.
도 1D는 50% 화합물 (1-1) 및 PVP를 포함하는 고형 분산물을 포함하는 예시의 제제의 용해 프로파일을 도시한다.
도 1E는 25% 화합물 (1-1) 및 PVP-비닐 아세테이트(PVP-VA)를 포함하는 고형 분산물을 포함하는 예시의 제제의 용해 프로파일을 도시한다.
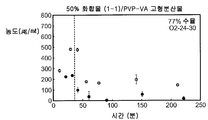
도 1F는 50% 화합물 (1-1) 및 PVP-VA를 포함하는 고형 분산물을 포함하는 예시의 제제의 용해 프로파일을 도시한다.
도 1G는 25% 화합물 (1-1) 및 히프로멜로스 아세테이트 숙시네이트(HPMCAS-M)를 포함하는 고형 분산물을 포함하는 예시의 제제의 용해 프로파일을 도시한다.
도 1H는 50% 화합물 (1-1) 및 HPMCAS-M을 포함하는 고형 분산물을 포함하는 예시의 제제의 용해 프로파일을 도시한다.
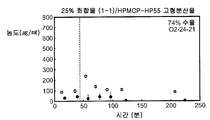
도 1I는 25% 화합물 (1-1) 및 히프로멜로스 프탈레이트(HPMCP-HP55)를 포함하는 고형 분산물을 포함하는 예시의 제제의 용해 프로파일을 도시한다.
도 1J는 50% 화합물 (1-1) 및 HMCP-HP55를 포함하는 고형 분산물을 포함하는 예시의 제제의 용해 프로파일을 도시한다.
도 2A는 25% 화합물 (1-1) 및 PVP의 고형 분산물을 포함하는 예시의 제제의 생체내 스크리닝의 결과를 도시한다.
도 2B는 25% 화합물 (1-1) 및 HPMCAS-M의 고형 분산물을 포함하는 예시의 제제의 생체내 스크리닝의 결과를 도시한다.
도 2C는 50% 화합물 (1-1) 및 HPMCAS-M의 고형 분산물을 포함하는 예시의 제제의 생체내 스크리닝의 결과를 도시한다.
도 3은 화합물 (1-1)의 고형 분산물의 분말 X선 회절 프로파일을 도시한다.
도 4A는 주위 조건 하에서 평형화된 25% 화합물 (1-1) 및 PVP의 고형 분산물에 대한 변형된 시차 주사 열량 측정 트레이스를 도시한다
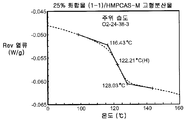
도 4B는 주위 조건 하에서 평형화된 25% 화합물 (1-1) 및 HPMCAS-M의 고형 분산물에 대한 변형된 시차 주사 열량 측정 트레이스를 도시한다.
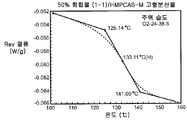
도 4C는 주위 조건 하에서 평형화된 50% 화합물 (1-1) 및 HPMCAS-M의 고형 분산물에 대한 변형된 시차 주사 열량 측정 트레이스를 도시한다.
도 5는 25% 화합물 (1-1) 및 PVP 또는 HMPCAS-M 및 50% 화합물 (1-1) 및 HPMCAS-MG의 고형 분산물에 대한 유리 전이 온도(Tg) 대 상대 습도(RH)의 플롯을 도시한다.
도 6은 75% 상대 습도 하에서 평형화된 25% 화합물 (1-1) 및 PVP의 고형 분산물에 대한 변형된 시차 주사 열량 측정 트레이스를 도시한다.
도 7A 및 7B는 25% 화합물 (1-1):PVP(흰색 원), 25% 화합물 (1-1):HPMCAS-MG(흰색 삼각형) 및 50% 화합물 (1-1):HPMCAS-MG(흰색 역삼각형)로서 1 ㎎/㎏ 정맥내 투여(검은색 사각형) 및 3 ㎎/㎏ 경구 투여 후 화합물 (1-1)에 대한 혈장 농도 대 시간 곡선을 도시한다. 삽도는 반로그 규모로 플롯한 동일한 데이타를 도시한다.
도 8A 및 8B는 25% 화합물 (1-1):PVP(흰색 원), 25% 화합물 (1-1):HPMCAS-MG(흰색 삼각형) 및 50% 화합물 (1-1):HPMCAS-MG(흰색 역삼각형)로서 3 ㎎/㎏ 경구 투여 후 화합물 (1-1)에 대한 혈장 농도 대 시간 곡선을 도시한다. 삽도는 반로그 규모로 플롯한 동일한 데이타를 도시한다.
도 9는 안정성 테스트의 시간 0에서 HPMCAS-MG 중의 화합물 (1-1)의 고형 분산물의 분말 X선 회절 프로파일을 도시한다.
도 10은 40℃ 및 75% 상대 습도에서 1 개월 후 HPMCAS-MG 중의 화합물 (1-1)의 고형 분산물의 분말 X선 회절 프로파일을 도시한다.
도 11은 40℃ 및 75% 상대 습도에서 2 개월 후 HPMCAS-MG 중의 화합물 (1-1)의 고형 분산물의 분말 X선 회절 프로파일을 도시한다.
도 12는 40℃ 및 75% 상대 습도에서 3 개월 후 HPMCAS-MG 중의 화합물 (1-1)의 고형 분산물의 분말 X선 회절 프로파일을 도시한다.
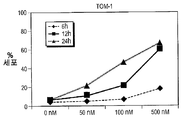
도 13A-13C는 처치 후 상이한 시점에서 수거한, 주르캇(Jurkat), RS 4-11 및 TOM-1 세포인 ALL 세포주에서 화합물 (1-1)에 의하여 유발된 아포프토시스의 역학을 도시한다. 아포프토시스 세포는 PI 흡수와 함께 또는 흡수 없이+아넥신 V로서 정의되었다. X축은 화합물 (1-1)의 투여량을 나타내며, Y축은 아포프토시스 세포의 비율을 나타낸다. 3개 중 1개의 대표적인 실험을 제시한다.
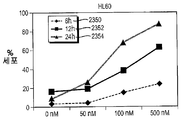
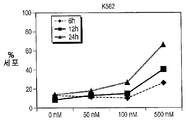
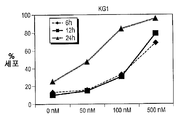
도 14A-14D는 처치 후 상이한 시점에서 수거한, HL60, K562, KGl 및 KGla 세포인 AML 세포주에서 화합물 (1-1)에 의하여 유도된 아포프토시스의 역학을 도시한다. 아포프토시스 세포는 PI 흡수와 함께 또는 흡수 없이+아넥신 V로서 정의되었다. X축은 화합물 (1-1)의 투여량을 나타내며, Y축은 아포프토시스 세포의 비율을 나타낸다. 2개 중 1개의 대표적 실험을 제시한다.
도 15A-15C는 ALL 및 AML 세포주에서 화합물 (1-1)에 의하여 야기된 세포 주기 변형을 도시한다. 무처치 HL60 및 100 nM의 화합물 (1-1)로 24 시간 동안 처치한 세포의 흐름 세포측정 프로파일의 대표적인 히스토그램(A). 세포 주기 분석 이전에 세포를 PI와 함께 배양하였다. ALL(도 15B) 및 AML(도 15C) 세포주에 대한 세포 주기 변형. X축은 세포주를 나타내며, Y축은 세포 주기 단계에서의 세포의 비율을 나타낸다.
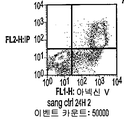
도 16은 화합물 (1-1)의 더 낮은 투여량에 의하여 야기된 아포프토시스를 도시한다. KGl 세포를 10 nM의 화합물 (1-1)과 함께 배양하였다. 아포프토시스 세포는 PI 흡수와 함께 또는 흡수 없이+아넥신 V로서 정의되었다 . 대표적인 도트 플롯을 제시한다(PI: FL2, 아넥신 V: FLl).
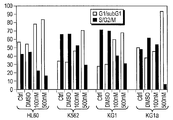
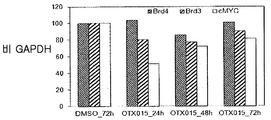
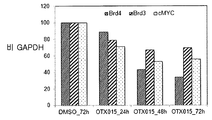
도 17A-17C는 백혈병 세포주 및 환자 샘플에서의 BRD 유전자 발현을 도시한다. 백혈병 세포주(도 17A) 및 ALL(도 17B) 및 AML(도 17C)로부터의 환자 샘플에서의 BRD2, BRD3 및 BRD4의 발현 레벨. X축은 세포주를 도시하며, Y축은 ABL에 대한 cDNA 양을 나타낸다. CD34+ 세포는 자기 비드를 사용한 양성 선택에 의하여 얻었다.
도 18A 및 18B는 화합물 (1-1) 처치시 BRD 단백질 및 c-MYC의 하향 조절을 도시한다. 세포 용해물 및 cDNA 추출은 상이한 ALL 및 AML 세포주로부터 얻었다. 단백질 및 cDNA 레벨은 면역블롯(도 18A) 및 QT-PCR(도 17B)에 의하여 연구하였다.
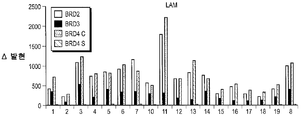
도 19A-19D는 화합물 (1-1)로 처리후 BRD2, BRD3, BRD4의 cDNA 역학을 도시한다. cDNA 추출은 상이한 ALL 및 AML 세포주로부터 얻었다. 발현 레벨은 QT-PCR에 의하여 연구하였다.
도 20은 1차 세포에 대한 화합물 (1-1) 효과를 도시한다. CD34+ 및 CD34- 제대 혈액 세포 및 AML 세포는 자기 항체-표지된 비드를 사용한 양성 선택에 의하여 얻었다. 세포를 상이한 투여량의 화합물 (1-1)로 처리하고, 24 시간 후 수거하였다. Y축은 PI 흡수와 함께 또는 흡수 없이 아넥신 V를 나타낸다.
도 21A-21T는 10 nM 및 100 nM의 농도에서 화합물 (1-1)에 단기간 노출시킨 후 96 시간에서 ALL 세포주(주르캇 및 RS 4-11) 및 AML 세포주(HL60 및 K562)에서의 아포프토시스의 흐름 세포측정 분석을 도시한다.
도 22A-22L은 0 nM, 1 nM 및 10 nM의 농도에서 화합물 (1-1)에 단기간 노출후 AML 세포주 HL60에서의 아포프토시스의 흐름 세포측정 분석을 도시한다.
도 23A, 23B 및 23C는 도 22A-22L의 HL60 세포주에 대한 아포프토시스를 도시한다.
도 24A 및 24B는 HL60 및 K562 세포주에 대한 아포프토시스를 도시한다.
도 25A 및 25B는 KG1 및 KG1a 세포주에 대한 아포프토시스를 도시한다.
도 26A 및 26B는 주르캇 및 RS4-11 세포주에 대한 아포프토시스를 도시한다.
도 27은 TOM1 세포주에 대한 아포프토시스를 도시한다.
도 28은 주르캇 세포주로부터 약물 약효세척 후의 아포프토시스의 플롯이다.
도 29A 및 29B는 HL60 및 K562 세포로부터 약물 약효세척 후의 아포프토시스의 플롯이다.
도 30A 및 30B는 주르캇 및 RS4-11 세포로부터 약물 약효세척 후의 아포프토시스의 플롯이다.
도 31A 및 31B는 3개의 ALL 세포주(주르캇, RS 4-11, TOM-1) 및 4개의 AML 세포주(HL60, K562, KG1 및 KG1a)에서의 MTT 검정을 도시한다.
도 32A-32C는 화합물 (1-1)을 사용한 처리 후 AML 환자에서의 아포프토시스 패턴을 도시한다.
도 33A-33G는 AML환자에서의 아포프토시스 패턴을 도시한다.
도 34A 및 34B는 AML환자에서의 아포프토시스 패턴을 도시한다.
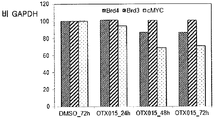
도 35는 화합물 (1-1)을 사용한 처리시 AML 및 ALL 세포주에서의 c-MYC 역학을 도시한다.
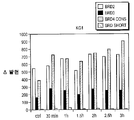
도 36은 화합물 (1-1)을 사용한 처리시 AML 및 ALL 세포주에서의 BRD4 역학을 도시한다.
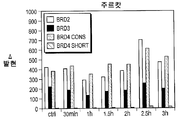
도 37은 화합물 (1-1)을 사용한 처리시 AML 및 ALL 세포주에서의 BRD2 역학을 도시한다.
도 38은 화합물 (1-1)을 사용한 처리시 AML 및 ALL 세포주에서의 BRD3 역학을 도시한다.
도 39A-39C는 AML 및 ALL 세포주에서 상이한 투여량의 화합물 (1-1)에 의하여 야기된 아포프토시스의 역학을 도시한다. 골수성 및 림프성 세포주는 증가되는 투여량의 화합물 (1-1)로 처리 후 72 시간에서 수거하였다. 아포프토시스 세포는 PI 흡수와 함께 또는 흡수 없이+아넥신 V로서 정의하였다. X축은 화합물 (1-1)의 투여량을 나타내며, Y축은 아포프토시스 세포의 비율을 나타낸다. 화합물 (1-1)을 사용한 처리시 AML 및 ALL 세포주에서의 3종의 독립적 실험 2회로부터의 평균±SD의 결과를 제시한다.
도 40A-40H는 백혈병 세포주에서 화합물 (1-1)(OTX015)을 사용하여 야기된 세포 주기 변형을 도시한다. 48 시간 동안 증가되는 투여량의 OTX015로 처리한 RS4-11 세포의 흐름 세포측정 프로파일의 대표적인 히스토그램을 도 40A-40F에 도시한다. 세포 주기 분석 전 세포를 PI와 함께 1 시간 배양하였다. 모든 AML 및 ALL 세포주에 대한 세포 주기 변형은 도 40G에서 48 시간에 분석하였다. X축은 세포주를 나타내며, Y축은 G1 및 S-단계에서의 세포의 비율을 나타낸다. 3종의 독립적 실험 2회로부터의 평균±SD의 결과를 제시한다.
도 41A 및 41B는 화합물 (1-1)(OTX015)에 의한 백혈병 세포주에서의 브로모도메인의 유전자 발현 및 조정을 도시한다. 최저 유전자 발현 레벨을 갖는 bcr-abl 유도된 세포주 BV-173 및 K562를 사용한 RQ-PCR에 의하여 검출시 불균질 레벨에서 상이한 세포주 발현된 BRD2, BRD3 및 BRD4(도 41A).
도 41C-41H는 각각 250 nM 및 500 nM에서 48 시간에서 OTX015 처리에 의한 cDNA 레벨에서의 BRD4, BRD2 및 BRD3의 조정을 도시한다. KG1, K562 및 주르캇에서 BRD3 및 BRD2의 상당한 상향조절 및 KG1 및 HL60에서 BRD2의 증가가 검출되었다. 기준선에서의 백혈병 세포주에서의 BRD4, BRD2 및 BRD3의 유전자 발현 레벨은 도 41A 및 41B에 제시한다. 250 nM 및 500 nM에서 OTX015: BRD4(도 41C 및 41D), BRD3(도 41E 및 41F) 및 BRD2(도 41G 및 41H)에 48 시간 노출 후 유전자 발현 레벨. X축은 세포주를 나타내며, Y축은 ABL에 대한 cDNA 양을 나타낸다. 2종의 독립적 실험 2회로부터의 평균±SD의 결과를 제시한다.
도 42A-42D는 모든 세포주에서 c-MYC의 하향조절을 야기하는 OTX015를 예시한다. 상이한 백혈병 세포주에서의 c-MYC의 기준 유전자 발현 레벨은 도 42A 및 42B에 도시한다. QT-PCR에 의하여 48 시간에서 검출된 250 nM 및 500 nM의 OTX015로 처리한 상이한 백혈병 세포주 및 c-MYC 하향조절은 도 42C 및 42D에 제시한다.
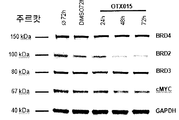
도 43A-43L은 BRD4, BRD2 및 BRD3뿐 아니라, c-MYC에 대한 단백질 레벨에서의 OTX015의 효과를 도시한다. 선택된 AML 세포주에서 HL60 BRD4 및 BRD3은 24 시간 처리 후 관찰된 c-MYC의 일시적 하향조절과 함께 500 nM에서 72 시간 OTX015 노출 후 영향을 받지 않은 채로 유지되는 한편(도 43A-43C), 거의 내성인 AML 세포주 K562는 24 시간 노출 후 출발하는 BRD4, BRD3 및 c-MYC의 하향조절을 나타낸다(도 43D-43F). 민감성 ALL 세포주의 경우, 주르캇은 48 시간 및 72 시간에서 c-MYC 하향조절을 나타내는 한편(도 43G-43I), BRD4, BRD3 및 c-MYC는 RS4-11에서 영향을 받지 않은 채 유지되었다(도 4JD-43L). AML 세포주 HL60, K562(도 43A-43C; 도 43D-43F) 및 ALL 세포주 주르캇 및 RS4-11(도 43G-43I; 도 4JD-43L)은 500 nM에서 OTX015로 처리하고, DMSO에 의하여 노출된 대조군과 비교하였다. 제시된 시점에서, 단백질을 추출하고, 겔 전기영동 후 BRD4, BRD3, BRD2 또는 c-MYC 항체를 사용하여 면역블로팅하였다. 블롯은 화학발광에 의하여 밝혀진 GAPDH 또는 BRD2에 관하여 단백질의 정확한 정량화를 가능케 하는 오디세이(ODYSSEY)(리코르(LiCor)) 기법을 사용하여 BRD4, BRD3, c-MYC 및 GAPDH에 대하여 밝혀냈다. 이러한 기법은 단백질 정량화를 가능케 하지는 않는다. 3종 중 하나의 대표적인 실험을 제시한다.
도 44A-44D는 1차 환자 세포에 대한 OTX015의 효과를 도시한다. AML 환자로부터의 5종의 샘플 및 1 ALL Ph+ 환자를 포함한 2종의 ALL을 OTX015를 사용하여 생체외 처리하였다. 환자 특징을 도 44D에 도시한다. OTX015는 35-85% 범위의 다양한 정도에서 1차 AML 환자 샘플에서의 아포프토시스를 야기하였다(도 6). Ph+ ALL 환자는 내성이 있는 것으로 보였다. OTX015는 AML 및 ALL 환자의 1차 세포에서의 아포프토시스를 야기하였다. 단핵 세포는 AML 및 ALL 환자로부터의 골수(BM) 또는 말초 혈액(PB)으로부터 얻었다. 세포를 250 및 500 nM의 OTX015로 72 시간 노출시키고, 아포프토시스를 아넥신 V 및 PI 염색에 의하여 평가하였다. 1종의 실험 2회로부터의 평균±SD의 결과를 제시한다.
도 45A-45E는 환자 샘플에서의 단백질 레벨에서의 c-MYC의 조정을 도시한다. 단백질 추출물은 각각 250 및 500 nM의 OTX015를 사용한 생체외 처치시 환자 5의 골수(BM) 세포(도 44D; 도 45A-45D)로부터 얻었다. BM 세포는 OTX015로의 72 시간 노출 후 c-MYC의 하향조절을 나타냈다. 환자 5로부터의 골수 세포를 OTX015로 250 nM 및 500 nM에서 처리하고, DMSO를 사용한 농도에 의하여 노출된 대조군과 비교하였다. 단백질을 72 시간에서 추출하고, 겔 전기영동 후 적절한 c-MYC 항체를 사용하여 면역블로팅시켰다. 블롯은 GAPDH에 관련된 단백질의 정확한 정량화를 가능케 하는 오디세이(리코르) 기법을 사용하여 밝혀냈다(도 45A). ABL에 대한 cMYC의 발현 레벨은 3종의 시점 24, 48 및 72 시간에서 RQ-PCR에 의하여 실현되었다(도 45B). 도 45B에서의 결과는 2회로부터의 평균±SD로 제시한다.
도 46은 OTX015의 생물학적 효과의 개요를 도시한다.
도 47A-47D는 RQ-PCR 분석에 의하여 평가시 환자 샘플에서의 BRD2, BRD3 및 BRD4의 기본 유전자 발현을 도시한다. ALL 환자 중에서, Ph+ ALL은 더 낮은 BRD 발현 레벨을 나타내는 한편(도 47A 및 47B; 도 47E에서 환자 3 내지 6), AML 환자 중에서 BRD 발현 레벨은 더욱 불균질하였다(도 47C 및 47D).
도 47E는 샘플을 평가하여 도 47A-47D에서의 결과를 산출하는 환자의 특징의 개요를 제공한다.
도면에서,
도 1A는 25% 화합물 (1-1) 및 유드라짓 L100-55를 포함하는 고형 분산물을 포함하는 비교 제제의 용해 프로파일을 도시한다.
도 1B는 50% 화합물 (1-1) 및 유드라짓 L100-55를 포함하는 고형 분산물을 포함하는 비교 제제의 용해 프로파일을 도시한다.
도 1C는 25% 화합물 (1-1) 및 폴리비닐피롤리돈(PVP)을 포함하는 고형 분산물을 포함하는 예시의 제제의 용해 프로파일을 도시한다.
도 1D는 50% 화합물 (1-1) 및 PVP를 포함하는 고형 분산물을 포함하는 예시의 제제의 용해 프로파일을 도시한다.
도 1E는 25% 화합물 (1-1) 및 PVP-비닐 아세테이트(PVP-VA)를 포함하는 고형 분산물을 포함하는 예시의 제제의 용해 프로파일을 도시한다.
도 1F는 50% 화합물 (1-1) 및 PVP-VA를 포함하는 고형 분산물을 포함하는 예시의 제제의 용해 프로파일을 도시한다.
도 1G는 25% 화합물 (1-1) 및 히프로멜로스 아세테이트 숙시네이트(HPMCAS-M)를 포함하는 고형 분산물을 포함하는 예시의 제제의 용해 프로파일을 도시한다.
도 1H는 50% 화합물 (1-1) 및 HPMCAS-M을 포함하는 고형 분산물을 포함하는 예시의 제제의 용해 프로파일을 도시한다.
도 1I는 25% 화합물 (1-1) 및 히프로멜로스 프탈레이트(HPMCP-HP55)를 포함하는 고형 분산물을 포함하는 예시의 제제의 용해 프로파일을 도시한다.
도 1J는 50% 화합물 (1-1) 및 HMCP-HP55를 포함하는 고형 분산물을 포함하는 예시의 제제의 용해 프로파일을 도시한다.
도 2A는 25% 화합물 (1-1) 및 PVP의 고형 분산물을 포함하는 예시의 제제의 생체내 스크리닝의 결과를 도시한다.
도 2B는 25% 화합물 (1-1) 및 HPMCAS-M의 고형 분산물을 포함하는 예시의 제제의 생체내 스크리닝의 결과를 도시한다.
도 2C는 50% 화합물 (1-1) 및 HPMCAS-M의 고형 분산물을 포함하는 예시의 제제의 생체내 스크리닝의 결과를 도시한다.
도 3은 화합물 (1-1)의 고형 분산물의 분말 X선 회절 프로파일을 도시한다.
도 4A는 주위 조건 하에서 평형화된 25% 화합물 (1-1) 및 PVP의 고형 분산물에 대한 변형된 시차 주사 열량 측정 트레이스를 도시한다
도 4B는 주위 조건 하에서 평형화된 25% 화합물 (1-1) 및 HPMCAS-M의 고형 분산물에 대한 변형된 시차 주사 열량 측정 트레이스를 도시한다.
도 4C는 주위 조건 하에서 평형화된 50% 화합물 (1-1) 및 HPMCAS-M의 고형 분산물에 대한 변형된 시차 주사 열량 측정 트레이스를 도시한다.
도 5는 25% 화합물 (1-1) 및 PVP 또는 HMPCAS-M 및 50% 화합물 (1-1) 및 HPMCAS-MG의 고형 분산물에 대한 유리 전이 온도(Tg) 대 상대 습도(RH)의 플롯을 도시한다.
도 6은 75% 상대 습도 하에서 평형화된 25% 화합물 (1-1) 및 PVP의 고형 분산물에 대한 변형된 시차 주사 열량 측정 트레이스를 도시한다.
도 7A 및 7B는 25% 화합물 (1-1):PVP(흰색 원), 25% 화합물 (1-1):HPMCAS-MG(흰색 삼각형) 및 50% 화합물 (1-1):HPMCAS-MG(흰색 역삼각형)로서 1 ㎎/㎏ 정맥내 투여(검은색 사각형) 및 3 ㎎/㎏ 경구 투여 후 화합물 (1-1)에 대한 혈장 농도 대 시간 곡선을 도시한다. 삽도는 반로그 규모로 플롯한 동일한 데이타를 도시한다.
도 8A 및 8B는 25% 화합물 (1-1):PVP(흰색 원), 25% 화합물 (1-1):HPMCAS-MG(흰색 삼각형) 및 50% 화합물 (1-1):HPMCAS-MG(흰색 역삼각형)로서 3 ㎎/㎏ 경구 투여 후 화합물 (1-1)에 대한 혈장 농도 대 시간 곡선을 도시한다. 삽도는 반로그 규모로 플롯한 동일한 데이타를 도시한다.
도 9는 안정성 테스트의 시간 0에서 HPMCAS-MG 중의 화합물 (1-1)의 고형 분산물의 분말 X선 회절 프로파일을 도시한다.
도 10은 40℃ 및 75% 상대 습도에서 1 개월 후 HPMCAS-MG 중의 화합물 (1-1)의 고형 분산물의 분말 X선 회절 프로파일을 도시한다.
도 11은 40℃ 및 75% 상대 습도에서 2 개월 후 HPMCAS-MG 중의 화합물 (1-1)의 고형 분산물의 분말 X선 회절 프로파일을 도시한다.
도 12는 40℃ 및 75% 상대 습도에서 3 개월 후 HPMCAS-MG 중의 화합물 (1-1)의 고형 분산물의 분말 X선 회절 프로파일을 도시한다.
도 13A-13C는 처치 후 상이한 시점에서 수거한, 주르캇(Jurkat), RS 4-11 및 TOM-1 세포인 ALL 세포주에서 화합물 (1-1)에 의하여 유발된 아포프토시스의 역학을 도시한다. 아포프토시스 세포는 PI 흡수와 함께 또는 흡수 없이+아넥신 V로서 정의되었다. X축은 화합물 (1-1)의 투여량을 나타내며, Y축은 아포프토시스 세포의 비율을 나타낸다. 3개 중 1개의 대표적인 실험을 제시한다.
도 14A-14D는 처치 후 상이한 시점에서 수거한, HL60, K562, KGl 및 KGla 세포인 AML 세포주에서 화합물 (1-1)에 의하여 유도된 아포프토시스의 역학을 도시한다. 아포프토시스 세포는 PI 흡수와 함께 또는 흡수 없이+아넥신 V로서 정의되었다. X축은 화합물 (1-1)의 투여량을 나타내며, Y축은 아포프토시스 세포의 비율을 나타낸다. 2개 중 1개의 대표적 실험을 제시한다.
도 15A-15C는 ALL 및 AML 세포주에서 화합물 (1-1)에 의하여 야기된 세포 주기 변형을 도시한다. 무처치 HL60 및 100 nM의 화합물 (1-1)로 24 시간 동안 처치한 세포의 흐름 세포측정 프로파일의 대표적인 히스토그램(A). 세포 주기 분석 이전에 세포를 PI와 함께 배양하였다. ALL(도 15B) 및 AML(도 15C) 세포주에 대한 세포 주기 변형. X축은 세포주를 나타내며, Y축은 세포 주기 단계에서의 세포의 비율을 나타낸다.
도 16은 화합물 (1-1)의 더 낮은 투여량에 의하여 야기된 아포프토시스를 도시한다. KGl 세포를 10 nM의 화합물 (1-1)과 함께 배양하였다. 아포프토시스 세포는 PI 흡수와 함께 또는 흡수 없이+아넥신 V로서 정의되었다 . 대표적인 도트 플롯을 제시한다(PI: FL2, 아넥신 V: FLl).
도 17A-17C는 백혈병 세포주 및 환자 샘플에서의 BRD 유전자 발현을 도시한다. 백혈병 세포주(도 17A) 및 ALL(도 17B) 및 AML(도 17C)로부터의 환자 샘플에서의 BRD2, BRD3 및 BRD4의 발현 레벨. X축은 세포주를 도시하며, Y축은 ABL에 대한 cDNA 양을 나타낸다. CD34+ 세포는 자기 비드를 사용한 양성 선택에 의하여 얻었다.
도 18A 및 18B는 화합물 (1-1) 처치시 BRD 단백질 및 c-MYC의 하향 조절을 도시한다. 세포 용해물 및 cDNA 추출은 상이한 ALL 및 AML 세포주로부터 얻었다. 단백질 및 cDNA 레벨은 면역블롯(도 18A) 및 QT-PCR(도 17B)에 의하여 연구하였다.
도 19A-19D는 화합물 (1-1)로 처리후 BRD2, BRD3, BRD4의 cDNA 역학을 도시한다. cDNA 추출은 상이한 ALL 및 AML 세포주로부터 얻었다. 발현 레벨은 QT-PCR에 의하여 연구하였다.
도 20은 1차 세포에 대한 화합물 (1-1) 효과를 도시한다. CD34+ 및 CD34- 제대 혈액 세포 및 AML 세포는 자기 항체-표지된 비드를 사용한 양성 선택에 의하여 얻었다. 세포를 상이한 투여량의 화합물 (1-1)로 처리하고, 24 시간 후 수거하였다. Y축은 PI 흡수와 함께 또는 흡수 없이 아넥신 V를 나타낸다.
도 21A-21T는 10 nM 및 100 nM의 농도에서 화합물 (1-1)에 단기간 노출시킨 후 96 시간에서 ALL 세포주(주르캇 및 RS 4-11) 및 AML 세포주(HL60 및 K562)에서의 아포프토시스의 흐름 세포측정 분석을 도시한다.
도 22A-22L은 0 nM, 1 nM 및 10 nM의 농도에서 화합물 (1-1)에 단기간 노출후 AML 세포주 HL60에서의 아포프토시스의 흐름 세포측정 분석을 도시한다.
도 23A, 23B 및 23C는 도 22A-22L의 HL60 세포주에 대한 아포프토시스를 도시한다.
도 24A 및 24B는 HL60 및 K562 세포주에 대한 아포프토시스를 도시한다.
도 25A 및 25B는 KG1 및 KG1a 세포주에 대한 아포프토시스를 도시한다.
도 26A 및 26B는 주르캇 및 RS4-11 세포주에 대한 아포프토시스를 도시한다.
도 27은 TOM1 세포주에 대한 아포프토시스를 도시한다.
도 28은 주르캇 세포주로부터 약물 약효세척 후의 아포프토시스의 플롯이다.
도 29A 및 29B는 HL60 및 K562 세포로부터 약물 약효세척 후의 아포프토시스의 플롯이다.
도 30A 및 30B는 주르캇 및 RS4-11 세포로부터 약물 약효세척 후의 아포프토시스의 플롯이다.
도 31A 및 31B는 3개의 ALL 세포주(주르캇, RS 4-11, TOM-1) 및 4개의 AML 세포주(HL60, K562, KG1 및 KG1a)에서의 MTT 검정을 도시한다.
도 32A-32C는 화합물 (1-1)을 사용한 처리 후 AML 환자에서의 아포프토시스 패턴을 도시한다.
도 33A-33G는 AML환자에서의 아포프토시스 패턴을 도시한다.
도 34A 및 34B는 AML환자에서의 아포프토시스 패턴을 도시한다.
도 35는 화합물 (1-1)을 사용한 처리시 AML 및 ALL 세포주에서의 c-MYC 역학을 도시한다.
도 36은 화합물 (1-1)을 사용한 처리시 AML 및 ALL 세포주에서의 BRD4 역학을 도시한다.
도 37은 화합물 (1-1)을 사용한 처리시 AML 및 ALL 세포주에서의 BRD2 역학을 도시한다.
도 38은 화합물 (1-1)을 사용한 처리시 AML 및 ALL 세포주에서의 BRD3 역학을 도시한다.
도 39A-39C는 AML 및 ALL 세포주에서 상이한 투여량의 화합물 (1-1)에 의하여 야기된 아포프토시스의 역학을 도시한다. 골수성 및 림프성 세포주는 증가되는 투여량의 화합물 (1-1)로 처리 후 72 시간에서 수거하였다. 아포프토시스 세포는 PI 흡수와 함께 또는 흡수 없이+아넥신 V로서 정의하였다. X축은 화합물 (1-1)의 투여량을 나타내며, Y축은 아포프토시스 세포의 비율을 나타낸다. 화합물 (1-1)을 사용한 처리시 AML 및 ALL 세포주에서의 3종의 독립적 실험 2회로부터의 평균±SD의 결과를 제시한다.
도 40A-40H는 백혈병 세포주에서 화합물 (1-1)(OTX015)을 사용하여 야기된 세포 주기 변형을 도시한다. 48 시간 동안 증가되는 투여량의 OTX015로 처리한 RS4-11 세포의 흐름 세포측정 프로파일의 대표적인 히스토그램을 도 40A-40F에 도시한다. 세포 주기 분석 전 세포를 PI와 함께 1 시간 배양하였다. 모든 AML 및 ALL 세포주에 대한 세포 주기 변형은 도 40G에서 48 시간에 분석하였다. X축은 세포주를 나타내며, Y축은 G1 및 S-단계에서의 세포의 비율을 나타낸다. 3종의 독립적 실험 2회로부터의 평균±SD의 결과를 제시한다.
도 41A 및 41B는 화합물 (1-1)(OTX015)에 의한 백혈병 세포주에서의 브로모도메인의 유전자 발현 및 조정을 도시한다. 최저 유전자 발현 레벨을 갖는 bcr-abl 유도된 세포주 BV-173 및 K562를 사용한 RQ-PCR에 의하여 검출시 불균질 레벨에서 상이한 세포주 발현된 BRD2, BRD3 및 BRD4(도 41A).
도 41C-41H는 각각 250 nM 및 500 nM에서 48 시간에서 OTX015 처리에 의한 cDNA 레벨에서의 BRD4, BRD2 및 BRD3의 조정을 도시한다. KG1, K562 및 주르캇에서 BRD3 및 BRD2의 상당한 상향조절 및 KG1 및 HL60에서 BRD2의 증가가 검출되었다. 기준선에서의 백혈병 세포주에서의 BRD4, BRD2 및 BRD3의 유전자 발현 레벨은 도 41A 및 41B에 제시한다. 250 nM 및 500 nM에서 OTX015: BRD4(도 41C 및 41D), BRD3(도 41E 및 41F) 및 BRD2(도 41G 및 41H)에 48 시간 노출 후 유전자 발현 레벨. X축은 세포주를 나타내며, Y축은 ABL에 대한 cDNA 양을 나타낸다. 2종의 독립적 실험 2회로부터의 평균±SD의 결과를 제시한다.
도 42A-42D는 모든 세포주에서 c-MYC의 하향조절을 야기하는 OTX015를 예시한다. 상이한 백혈병 세포주에서의 c-MYC의 기준 유전자 발현 레벨은 도 42A 및 42B에 도시한다. QT-PCR에 의하여 48 시간에서 검출된 250 nM 및 500 nM의 OTX015로 처리한 상이한 백혈병 세포주 및 c-MYC 하향조절은 도 42C 및 42D에 제시한다.
도 43A-43L은 BRD4, BRD2 및 BRD3뿐 아니라, c-MYC에 대한 단백질 레벨에서의 OTX015의 효과를 도시한다. 선택된 AML 세포주에서 HL60 BRD4 및 BRD3은 24 시간 처리 후 관찰된 c-MYC의 일시적 하향조절과 함께 500 nM에서 72 시간 OTX015 노출 후 영향을 받지 않은 채로 유지되는 한편(도 43A-43C), 거의 내성인 AML 세포주 K562는 24 시간 노출 후 출발하는 BRD4, BRD3 및 c-MYC의 하향조절을 나타낸다(도 43D-43F). 민감성 ALL 세포주의 경우, 주르캇은 48 시간 및 72 시간에서 c-MYC 하향조절을 나타내는 한편(도 43G-43I), BRD4, BRD3 및 c-MYC는 RS4-11에서 영향을 받지 않은 채 유지되었다(도 4JD-43L). AML 세포주 HL60, K562(도 43A-43C; 도 43D-43F) 및 ALL 세포주 주르캇 및 RS4-11(도 43G-43I; 도 4JD-43L)은 500 nM에서 OTX015로 처리하고, DMSO에 의하여 노출된 대조군과 비교하였다. 제시된 시점에서, 단백질을 추출하고, 겔 전기영동 후 BRD4, BRD3, BRD2 또는 c-MYC 항체를 사용하여 면역블로팅하였다. 블롯은 화학발광에 의하여 밝혀진 GAPDH 또는 BRD2에 관하여 단백질의 정확한 정량화를 가능케 하는 오디세이(ODYSSEY)(리코르(LiCor)) 기법을 사용하여 BRD4, BRD3, c-MYC 및 GAPDH에 대하여 밝혀냈다. 이러한 기법은 단백질 정량화를 가능케 하지는 않는다. 3종 중 하나의 대표적인 실험을 제시한다.
도 44A-44D는 1차 환자 세포에 대한 OTX015의 효과를 도시한다. AML 환자로부터의 5종의 샘플 및 1 ALL Ph+ 환자를 포함한 2종의 ALL을 OTX015를 사용하여 생체외 처리하였다. 환자 특징을 도 44D에 도시한다. OTX015는 35-85% 범위의 다양한 정도에서 1차 AML 환자 샘플에서의 아포프토시스를 야기하였다(도 6). Ph+ ALL 환자는 내성이 있는 것으로 보였다. OTX015는 AML 및 ALL 환자의 1차 세포에서의 아포프토시스를 야기하였다. 단핵 세포는 AML 및 ALL 환자로부터의 골수(BM) 또는 말초 혈액(PB)으로부터 얻었다. 세포를 250 및 500 nM의 OTX015로 72 시간 노출시키고, 아포프토시스를 아넥신 V 및 PI 염색에 의하여 평가하였다. 1종의 실험 2회로부터의 평균±SD의 결과를 제시한다.
도 45A-45E는 환자 샘플에서의 단백질 레벨에서의 c-MYC의 조정을 도시한다. 단백질 추출물은 각각 250 및 500 nM의 OTX015를 사용한 생체외 처치시 환자 5의 골수(BM) 세포(도 44D; 도 45A-45D)로부터 얻었다. BM 세포는 OTX015로의 72 시간 노출 후 c-MYC의 하향조절을 나타냈다. 환자 5로부터의 골수 세포를 OTX015로 250 nM 및 500 nM에서 처리하고, DMSO를 사용한 농도에 의하여 노출된 대조군과 비교하였다. 단백질을 72 시간에서 추출하고, 겔 전기영동 후 적절한 c-MYC 항체를 사용하여 면역블로팅시켰다. 블롯은 GAPDH에 관련된 단백질의 정확한 정량화를 가능케 하는 오디세이(리코르) 기법을 사용하여 밝혀냈다(도 45A). ABL에 대한 cMYC의 발현 레벨은 3종의 시점 24, 48 및 72 시간에서 RQ-PCR에 의하여 실현되었다(도 45B). 도 45B에서의 결과는 2회로부터의 평균±SD로 제시한다.
도 46은 OTX015의 생물학적 효과의 개요를 도시한다.
도 47A-47D는 RQ-PCR 분석에 의하여 평가시 환자 샘플에서의 BRD2, BRD3 및 BRD4의 기본 유전자 발현을 도시한다. ALL 환자 중에서, Ph+ ALL은 더 낮은 BRD 발현 레벨을 나타내는 한편(도 47A 및 47B; 도 47E에서 환자 3 내지 6), AML 환자 중에서 BRD 발현 레벨은 더욱 불균질하였다(도 47C 및 47D).
도 47E는 샘플을 평가하여 도 47A-47D에서의 결과를 산출하는 환자의 특징의 개요를 제공한다.
본 발명의 주제는 대표적인 실시양태를 제시하는 첨부한 도면 및 실시예를 참조하여 하기에서 보다 명확하게 기재될 것이다. 그러나, 본 발명의 주제는 상이한 형태로 구체화될 수 있으며, 본원에 명시된 실시양태로 한정되지 않는 것으로 간주하여야 한다. 그보다는, 이들 실시양태는 당업자가 기재 및 가능케 하기 위하여 제공한다. 다른 의미로 정의되지 않는다면, 본원에 사용된 모든 기술적 및 과학적 용어는 주제가 관련되어 있는 당업자에 의하여 통상적으로 이해되는 바와 동일한 의미를 갖는다. 본원에서 언급된 모든 공보, 특허 출원, 특허 및 기타 문헌은 본원에 그 전문이 참조로 포함된다.
본원에 기재된 본 발명은 급성 림프구성 백혈병, 급성 골수성 백혈병, BCR-ABL 양성 급성 림프구성 백혈병 및 CD34 양성 급성 골수성 백혈병의 치료 방법을 제공한다. 상세한 설명은 다양한 부문에서의 개시내용을 명시한다: I. 티에노트리아졸로디아제핀 화합물; II. 제제; III. 투여 형태; IV. 투여량; V. 제법; 및 VI. 실시예. 당업자는 치료 방법의 다양한 실시양태 각각이 본원에 기재된 티에노트리아졸로디아제핀 화합물, 제제, 투여 형태, 투여량 및 제법의 다양한 실시양태를 포함하는 것으로 이해할 것이다.
한 구체예에서, 본 발명은 환자에게 비정질 티에노트리아졸로디아제핀 화합물 및 그의 약학적으로 허용가능한 염 또는 그의 수화물; 및 약학적으로 허용가능한 중합체를 포함하는 고형 분산물로서 형성된, 본원에 기재된 바와 같은 티에노트리아졸로디아제핀 화합물을 포함하는 조성물의 약학적 허용량을 투여하는 단계를 포함하는, 급성 림프구성 백혈병의 치료 방법을 제공한다. 상기 고형 분산물의 다양한 실시양태가 본원에 기재되어 있으며, 그에 따라 사용될 수 있다.
한 구체예에서, 본 발명은 환자에게 비정질 티에노트리아졸로디아제핀 화합물 및 그의 약학적으로 허용가능한 염 또는 그의 수화물; 및 약학적으로 허용가능한 중합체를 포함하는 고형 분산물로서 형성된, 본원에 기재된 바와 같은 티에노트리아졸로디아제핀 화합물을 포함하는 조성물의 약학적 허용량을 투여하는 단계를 포함하는 급성 골수성 백혈병의 치료 방법을 제공한다. 상기 고형 분산물의 다양한 실시양태가 본원에 기재되어 있으며, 그에 따라 사용될 수 있다.
한 구체예에서, 본 발명은 환자에게 본원에 기재된 다양한 실시양태에 의한 티에노트리아졸로디아제핀 화합물을 포함하는 조성물의 약학적 허용량을 투여하는 단계를 포함하는, BCR-ABL 양성 급성 림프구성 백혈병의 치료 방법을 제공한다. BCR-ABL 양성 급성 림프구성 백혈병의 치료 방법의 일부 실시양태에서, 본원에 기재된 바와 같은 티에노트리아졸로디아제핀 화합물은 비정질 티에노트리아졸로디아제핀 화합물 및 그의 약학적으로 허용가능한 염 또는 그의 수화물; 및 약학적으로 허용가능한 중합체를 포함하는 고형 분산물로서 형성된다. 상기 고형 분산물의 다양한 실시양태가 본원에 기재되어 있으며, 그에 따라 사용될 수 있다.
한 구체예에서, 본 발명은 환자에게 본원에 기재된 다양한 실시양태에 의한 티에노트리아졸로디아제핀 화합물을 포함하는 조성물의 약학적 허용량을 투여하는 단계를 포함하는, CD34 양성 급성 골수성 백혈병의 치료 방법을 제공한다. CD34 양성 급성 골수성 백혈병의 치료 방법의 일부 실시양태에서, 본원에 기재된 바와 같은 티에노트리아졸로디아제핀 화합물은 비정질 티에노트리아졸로디아제핀 화합물 및 그의 약학적으로 허용가능한 염 또는 그의 수화물; 및 약학적으로 허용가능한 중합체를 포함하는 고형 분산물로서 형성된다. 상기 고형 분산물의 다양한 실시양태가 본원에 기재되어 있으며, 그에 따라 사용될 수 있다.
I. 티에노트리아졸로디아제핀 화합물:
한 실시양태에서, 본 발명의 제제에 사용되는 티에노트리아졸로디아제핀 화합물, 그의 임의의 염, 이성질체, 거울상이성질체, 라세메이트, 수화물, 용매화물, 대사물 및 다형태는 하기 화학식 1로 표시된다:
<화학식 1>
상기 R1은 1-4의 탄소수를 갖는 알킬이고, 상기 R2는 수소 원자; 할로겐 원자; 또는 할로겐 원자 또는 하이드록실기에 의하여 임의로 치환된 1-4의 탄소수를 갖는 알킬이고, 상기 R3는 할로겐 원자; 할로겐 원자, 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시 또는 시아노에 의하여 임의로 치환된 페닐; -NR5-(CH2)m-R6, 상기 R5는 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, m은 0-4의 정수이며, 상기 R6은 할로겐 원자에 의하여 임의로 치환된 페닐 또는 피리딜임; 또는 -NR7-CO-(CH2)n-R8이고, 상기 R7은 수소 원자 또는 1-4의 탄소수를 갖는 알킬이며, n은 0-2의 정수이며, 상기 R8은 할로겐 원자에 의하여 임의로 치환된 페닐 또는 피리딜임, 상기 R4는 -(CH2)a-CO-NH-R9, a는 1-4의 정수이며, R9는 1-4의 탄소수를 갖는 알킬; 1-4의 탄소수를 갖는 하이드록시알킬; 1-4의 탄소수를 갖는 알콕시; 또는 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시, 아미노 또는 하이드록실기 에 의하여 임의로 치환된 페닐 또는 피리딜임, 또는 -(CH2)b-COOR10이고, b는 1-4의 정수이며, 상기 R10은 1-4의 탄소수를 갖는 알킬이다.
한 실시양태에서, 적절한 알킬 기로는 1 개의 탄소 원자 내지 4개의 탄소 원자를 포함한 선형 또는 분지형 알킬 라디칼을 들 수 있다. 한 실시양태에서, 적절한 알킬 기로는 1개의 탄소 원자 내지 3개의 탄소 원자를 포함한 선형 또는 분지형 알킬 라디칼을 들 수 있다. 한 실시양태에서, 적절한 알킬 기로는 1개의 탄소 원자 내지 2개의 탄소 원자를 포함하는 선형 또는 분지형 알킬 라디칼을 들 수 있다. 한 실시양태에서, 예시의 알킬 라디칼로는 메틸, 에틸, 프로필, 이소프로필, n-부틸, 이소부틸, sec-부틸, tert-부틸을 들 수 있으나, 이에 한정되지 않는다. 한 실시양태에서, 예시의 알킬 기로는 메틸, 에틸, 프로필, 이소프로필, 2-메틸-1-프로필 및 2-메틸-2-프로필을 들 수 있으나, 이에 한정되지 않는다.
일부 실시양태에서, 본 발명은 본원에 기재된 티에노트리아졸로디아제핀 화합물의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물 및 동위원소-표지된 형태를 제공한다. 한 실시양태에서, 티에노트리아졸로디아제핀 화합물의 약학적으로 허용가능한 염으로는 무기 산으로 형성된 산 부가 염을 들 수 있다. 한 실시양태에서, 티에노트리아졸로디아제핀의 약학적으로 허용가능한 무기 산 부가 염으로는 염산, 브롬화수소산, 인산, 메타인산, 질산 및 황산의 염을 들 수 있다. 한 실시양태에서, 티에노트리아졸로디아제핀 화합물의 약학적으로 허용가능한 염으로는 유기 산으로 형성된 산 부가 염을 들 수 있다. 한 실시양태에서, 티에노트리아졸로디아제핀의 약학적으로 허용가능한 유기 산 부가 염으로는 타르타르산, 아세트산, 트리플루오로아세트산, 시트르산, 말산, 락트산, 푸마르산, 벤조산, 포름산, 프로피온산, 글리콜산, 글루콘산, 말레산, 숙신산, 캄포르황산, 이소티온산, 무스산, 겐티스산, 이소니코틴산, 사카르산, 글루쿠론산, 푸로산, 글루탐산, 아스코르브산, 안트라닐산, 살리실산, 페닐아세트산, 만델산, 엠본산(파모산), 메탄술폰산, 에탄술폰산, 판토텐산, 스테아르산, 술핀산, 알긴산, 갈락투론산 및 아릴술폰산, 예를 들면 벤젠술폰산 및 4-메틸 벤젠술폰산의 염을 들 수 있다.
화학식 1의 대표적인 티에노트리아졸로디아제핀 화합물로는 하기 표 A에 제시되어 있는 티에노트리아졸로디아제핀 화합물 (1-1) 내지 (1-18)을 들 수 있으나, 이에 한정되지 않는다:
하기 표 A의 화합물 (1-1)은 본원에서 OTX-015 또는 Y803으로서 지칭될 것이다.
<표 A>
본 발명의 예시의 화합물:
일부 실시양태에서, 화학식 1의 티에노트리아졸로디아제핀 화합물로는 (i) (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로-[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 또는 그의 이수화물, (ii) 메틸 (S)-{4-(3'-시아노비페닐-4-일)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트, (iii) 메틸 (S)-{2,3,9-트리메틸-4-(4-페닐아미노페닐)-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트; 및 (iv) 메틸 (S)-{2,3,9-트리메틸-4-[4-(3-페닐프로피오닐아미노)페닐]-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트를 들 수 있다.
일부 실시양태에서, 화학식 1의 티에노트리아졸로디아제핀 화합물로는 (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 이수화물을 들 수 있다.
일부 실시양태에서, 화학식 1의 티에노트리아졸로디아제핀 화합물로는 (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드를 들 수 있다.
II. 제제:
화학식 1의 화합물은 일반적으로 화합물의 사실상 수불용성 성질에 관하여 비-통상적인 투여 형태의 개발을 필요로 하는, 특히 약물 생체이용률 및 환자간 및 환자내 투여 반응에서의 변동성의 문제점을 비롯한 생약학 조성물의 투여 및 제조와 관련된 매우 특정한 곤란점을 나타낸다.
종래에는, 화학식 1의 화합물이 궤양대장염 및 크론병 등의 염증성 장 질환의 치료를 위하여 하부 장에서 약학적 성분을 선택적으로 방출하는 경구 제제를 제공하기 위하여 담체인 에틸 아크릴레이트-메틸 메타크릴레이트-트리메틸암모니오에틸 메타크릴레이트 클로라이드 공중합체(유드라짓 RS, 롬 제조)와의 고형 분산물로서 제제화될 수 있는 것으로 밝혀졌다(US 특허 출원 20090012064 A1, 2009년 1월 8일 공개). 동물 시험을 비롯한 다양한 실험에 의하여, 염증성 장 질환에서 병변에서의 염증성 병변에서의 약물 방출 및 그의 직접적인 작용은 위장관으로부터의 순환으로 약물의 흡수보다 더 중요한 것으로 밝혀졌다.
이제, 놀랍게도, 화학식 1에 의한 티에노트리아졸로디아제핀 화합물, 그의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체 이성질체 및 동위원소-표지된 형태가 약학적으로 허용가능한 중합체와의 고형 분산물로서 제제화되어 염증성 장 질환을 제외한 질환의 치료를 위하여 위장관으로부터 순환으로 약학적 성분의 높은 흡수를 제공하는 경구 제제를 제공한다는 것을 발견하였다. 개 및 사람 모두에서의 연구는 염증성 장 질환의 치료를 위하여 이전에 개발된 유드라짓 고형 분산물 제제와 비교한 이들 고형 분산물의 높은 경구 생체이용율을 갖는다.
고형 분산물은 불량한 수용성 약물의 경구 생체이용률을 개선시키고자 하는 전략을 갖는다.
본원에서 사용된 바와 같은 용어 "고형 분산물"은 2종 이상의 상이한 성분, 일반적으로 친수성 담체 및 소수성 약물인 화학식 1에 의한 티에노트리아졸로디아제핀 화합물을 포함하는 고체 생성물의 군을 지칭한다. 분산물 중의 약물의 분자 배열을 기준으로 하여 고형 분산물의 6종의 상이한 유형을 구분할 수 있다. 통상적으로, 고형 분산물은 단순 공융 혼합물, 고체 용액, 유리 용액 및 현탁액 및, 결정질 담체 중의 비정질 침전으로 분류된다. 게다가, 예를 들면 동일한 샘플 중에서 일부 분자는 클러스터 중에 존재할 수 있는 한편, 일부는 분자적으로 분산되는 특정 조합을 접할 수 있다.
한 실시양태에서, 화학식 1에 의한 티에노트리아졸로디아제핀 화합물은 비정질 입자(클러스터) 중에서 분자적으로 분산될 수 있다. 또 다른 실시양태에서, 화학식 1에 의한 티에노트리아졸로디아제핀 화합물은 결정질 입자로서 분산될 수 있다. 한 실시양태에서, 담체는 결정질일 수 있다. 또 다른 실시양태에서, 담체는 비정질일 수 있다.
한 실시양태에서, 본 발명은 화학식 1에 의한 티에노트리아졸로디아제핀 화합물 또는 그의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태; 및 약학적으로 허용가능한 중합체의 고형 분산물을 포함하는 약학적 조성물을 제공한다. 한 실시양태에서, 약학적으로 허용가능한 중합체는 히프로멜로스 아세테이트 숙시네이트(또한 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트 또는 HPMCAS로 지칭함)이다. 한 실시양태에서, 분산물은 1:3 내지 1:1의 중량비의 티에노트리아졸로디아제핀 화합물 대 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트(HPMCAS)를 갖는다. 한 실시양태에서, 티에노트리아졸로디아제핀 화합물 중 적어도 일부의 부분은 고형 분산물을 통하여 균질하게 분산된다. 또 다른 실시양태에서, 티에노트리아졸로디아제핀 화합물은 고형 분산물을 통하여 균질하게 분산된다. 일부 실시양태에서, 고형 분산물은 유리 전이 온도(Tg)에 대한 단일 변곡을 나타낸다. 일부 실시양태에서, 단일 Tg는 130℃ 내지 140℃ 사이에서 발생한다. 기타 상기 실시양태에서, 단일 Tg는 약 135℃에서 발생한다. 일부 상기 실시양태에서, 고형 분산물을 40℃에서 1개월 이상 동안 75%의 상대 습도에 노출시켰다. 일부 실시양태에서, 고형 분산물은 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타낸다. 본 출원의 경우 "실질적으로 없다"는 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21° 2θ에서 비정질 할로 위에서 회절선의 부재를 의미한다. 일부 실시양태에서, 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트(HPMCAS)는 9% 아세틸/11% 숙시노일을 갖는 M 등급(예, 5 ㎛의 평균 입자 크기(즉, HPMCAS-MF, 미세 분말 등급)를 갖거나 또는 1 ㎜의 평균 입자 크기(즉, HPMCAS-MG, 과립 등급)를 갖는 HPMCAS), 12% 아세틸/6% 숙시노일을 갖는 H 등급(예, 5 ㎛의 평균 입자 크기(즉, HPMCAS-HF, 미세 분말 등급)를 갖거나 또는 1 ㎜의 평균 입자 크기(즉, HPMCAS-HG, 과립 등급)를 갖는 HPMCAS) 및 8% 아세틸/15% 숙시노일을 갖는 L 등급(예, 5 ㎛의 평균 입자 크기(즉, HPMCAS-LF, 미세 분말 등급)를 갖거나 또는 1 ㎜의 평균 입자 크기(즉, HPMCAS-LG, 과립 등급)를 갖는 HPMCAS)를 포함할 수 있다.
한 실시양태에서, 본 발명은 약학적으로 허용가능한 중합체 중의 화학식 1의 티에노트리아졸로디아제핀 화합물 또는 그의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태의 고형 분산물을 포함하는 약학적 조성물을 제공한다. 한 실시양태에서, 약학적으로 허용가능한 중합체는 폴리비닐피롤리돈(또한 포비돈 또는 PVP로 지칭함)이다. 한 실시양태에서, 분산물은 1:3 내지 1:1의 중량비의 티에노트리아졸로디아제핀 화합물 대 PVP를 갖는다. 한 실시양태에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고형 분산물을 통하여 균질하게 분산된다. 또 다른 실시양태에서, 티에노트리아졸로디아제핀 화합물은 고형 분산물을 통하여 균질하게 분산된다. 일부 실시양태에서, 고형 분산물은 유리 전이 온도(Tg)에 대한 단일 변곡을 나타낸다. 일부 실시양태에서, 단일 Tg는 175℃ 내지 약 185℃ 사이에서 발생한다. 기타 상기 실시양태에서, 단일 Tg는 약 179℃에서 발생한다. 일부 상기 실시양태에서, 고형 분산물은 40℃에서 1개월 이상 동안 75%의 상대 습도에 노출시킨다. 일부 실시양태에서, 고형 분산물은 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타낸다. 본원의 경우 "실질적으로 없다"는 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21° 2θ에서 비정질 할로 위에서 회절선의 부재를 의미한다. 일부 실시양태에서, 폴리비닐 피롤리돈은 약 2,500(콜리돈(Kollidon)® 12 PF, 2,000 내지 3,000 사이의 중량-평균 분자량), 약 9,000(콜리돈® 17 PF, 7,000 내지 11,000 사이의 중량-평균 분자량), 약 25,000(콜리돈® 25, 28,000 내지 34,000 사이의 중량-평균 분자량), 약 50,000(콜리돈® 30, 44,000 내지 54,000 사이의 중량-평균 분자량) 및 약 1,250,000(콜리돈® 90 또는 콜리돈® 90F, 1,000,000 내지 1,500,000 사이의 중량-평균 분자량)의 분자량을 가질 수 있다.
한 실시양태에서, 본 발명의 약학적 조성물은 화학식 1의 티에노트리아졸로디아제핀 화합물의 비정질 형태 또는 그의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태 및 약학적으로 허용가능한 중합체의 고형 분산물을 포함한다. 한 실시양태에서, 약학적으로 허용가능한 중합체는 히프로멜로스 아세테이트 숙시네이트이다. 한 실시양태에서, 화학식 1의 티에노트리아졸로디아제핀 화합물 대 히프로멜로스 아세테이트 숙시네이트의 중량비는 1:3 내지 1:1이다. 한 실시양태에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고형 분산물을 통하여 균질하게 분산된다. 또 다른 실시양태에서, 티에노트리아졸로디아제핀 화합물은 고형 분산물을 통하여 균질하게 분산된다. 일부 실시양태에서, 고형 분산물은 유리 전이 온도(Tg)에 대한 단일 변곡을 나타낸다. 일부 실시양태에서, 단일 Tg는 130℃ 내지 140℃ 사이에서 발생한다. 기타 상기 실시양태에서, 단일 Tg는 135℃에서 발생한다. 일부 상기 실시양태에서, 고형 분산물을 40℃에서 1개월 이상 동안 75%의 상대 습도에 노출시켰다. 일부 실시양태에서, 고형 분산물은 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타낸다. 본원의 경우 "실질적으로 없다"는 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21° 2θ에서 비정질 할로 위에서 회절선의 부재를 의미한다.
한 실시양태에서, 본 발명의 약학적 조성물은 화학식 1의 티에노트리아졸로디아제핀 화합물의 비정질 형태 또는 그의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태 및 약학적으로 허용가능한 중합체의 고형 분산물을 포함한다. 한 실시양태에서, 약학적으로 허용가능한 중합체는 폴리비닐피롤리돈이다. 한 실시양태에서, 화학식 1의 티에노트리아졸로디아제핀 화합물 대 폴리비닐피롤리돈의 중량비는 1:3 내지 1:1 범위내이다. 한 실시양태에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고형 분산물을 통하여 균질하게 분산된다. 또 다른 실시양태에서, 티에노트리아졸로디아제핀 화합물은 고형 분산물을 통하여 균질하게 분산된다. 일부 실시양태에서, 고형 분산물은 유리 전이 온도(Tg)에 대한 단일 변곡을 나타낸다. 일부 실시양태에서, 단일 Tg는 175℃ 내지 약 185℃ 사이에서 발생한다. 기타 상기 실시양태에서, 단일 Tg는 약 179℃에서 발생한다. 일부 상기 실시양태에서, 고형 분산물을 40℃에서 1개월 이상 동안 75%의 상대 습도에 노출시켰다. 일부 실시양태에서, 고형 분산물은 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타낸다. 본원의 경우 "실질적으로 없다"는 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21° 2θ에서 비정질 할로 위에서 회절선의 부재를 의미한다.
한 실시양태에서, 본 발명의 약학적 조성물은 화학식 1의 티에노트리아졸로디아제핀 화합물의 결정질 형태 또는 그의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태 및 약학적으로 허용가능한 중합체의 고형 분산물을 포함한다. 한 실시양태에서, 약학적으로 허용가능한 중합체는 히프로멜로스 아세테이트 숙시네이트이다. 한 실시양태에서, 화학식 1의 티에노트리아졸로디아제핀 화합물 대 히프로멜로스 아세테이트 숙시네이트의 중량비는 1:3 내지 1:1 범위내이다.
한 실시양태에서, 본 발명의 약학적 조성물은 화학식 1의 티에노트리아졸로디아제핀 화합물의 결정질 형태 또는 그의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태 및 약학적으로 허용가능한 중합체의 고형 분산물을 포함한다. 한 실시양태에서, 약학적으로 허용가능한 중합체는 폴리비닐피롤리돈이다. 한 실시양태에서, 화학식 1의 티에노트리아졸로디아제핀 화합물 대 폴리비닐피롤리돈의 중량비는 1:3 내지 1:1 범위내이다.
일부 실시양태에서, 고형 분산물을 포함하는 약학적 조성물은 분무 건조에 의하여 생성된다.
한 실시양태에서, 본 발명의 약학적 조성물은 화학식 1의 티에노트리아졸로디아제핀 화합물 또는 그의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태 및 약학적으로 허용가능한 중합체의 분무 건조된 고형 분산물을 포함한다. 한 실시양태에서, 약학적으로 허용가능한 중합체는 히프로멜로스 아세테이트 숙시네이트이다. 한 실시양태에서, 화합물 (1) 대 히프로멜로스 아세테이트 숙시네이트의 중량비는 1:3 내지 1:1 범위내이다. 한 실시양태에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고형 분산물을 통하여 균질하게 분산된다. 또 다른 실시양태에서, 티에노트리아졸로디아제핀 화합물은 고형 분산물을 통하여 균질하게 분산된다. 일부 실시양태에서, 고형 분산물은 유리 전이 온도(Tg)에 대한 단일 변곡을 나타낸다. 일부 실시양태에서, 단일 Tg는 130℃ 내지 140℃ 사이에서 발생한다. 기타 상기 실시양태에서, 단일 Tg는 약 135℃에서 발생한다. 일부 상기 실시양태에서, 고형 분산물을 40℃에서 1개월 이상 동안 75%의 상대 습도에 노출시켰다. 일부 실시양태에서, 고형 분산물은 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타낸다. 본원의 경우 "실질적으로 없다"는 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21° 2θ에서 비정질 할로 위에서 회절선의 부재를 의미한다.
한 실시양태에서, 본 발명의 약학적 조성물은 화학식 1의 티에노트리아졸로디아제핀 화합물 또는 그의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태 및 약학적으로 허용가능한 중합체의 분무 건조된 고형 분산물을 포함한다. 한 실시양태에서, 약학적으로 허용가능한 중합체는 폴리비닐피롤리돈이다. 한 실시양태에서, 화합물 (1) 대 폴리비닐피롤리돈의 중량비는 1:3 내지 1:1 범위내이다. 한 실시양태에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고형 분산물을 통하여 균질하게 분산된다. 또 다른 실시양태에서, 티에노트리아졸로디아제핀 화합물은 고형 분산물을 통하여 균질하게 분산된다. 일부 실시양태에서, 고형 분산물은 유리 전이 온도(Tg)에 대한 단일 변곡을 나타낸다. 일부 실시양태에서, 단일 Tg는 175℃ 내지 185℃ 사이에서 발생한다. 기타 상기 실시양태에서, 단일 Tg는 약 179℃에서 발생한다. 일부 상기 실시양태에서, 고형 분산물을 40℃에서 1개월 이상 동안 75%의 상대 습도에 노출시켰다. 일부 실시양태에서, 고형 분산물은 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타낸다. 본원의 경우 "실질적으로 없다"는 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21° 2θ에서 비정질 할로 위에서 회절선의 부재를 의미한다.
한 실시양태에서, 본 발명의 약학적 조성물은 화학식 1의 티에노트리아졸로디아제핀 화합물의 비정질 형태 또는 그의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태 및 약학적으로 허용가능한 중합체의 분무 건조된 고형 분산물을 포함한다. 한 실시양태에서, 약학적으로 허용가능한 중합체는 히프로멜로스 아세테이트 숙시네이트이다. 한 실시양태에서, 화학식 1의 티에노트리아졸로디아제핀 화합물 대 히프로멜로스 아세테이트 숙시네이트의 중량비는 1:3 내지 1:1 범위내이다. 한 실시양태에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고형 분산물을 통하여 균질하게 분산된다. 또 다른 실시양태에서, 티에노트리아졸로디아제핀 화합물은 고형 분산물을 통하여 균질하게 분산된다. 일부 실시양태에서, 고형 분산물은 유리 전이 온도(Tg)에 대한 단일 변곡을 나타낸다. 일부 실시양태에서, 단일 Tg는 130℃ 내지 140℃ 사이에서 발생한다. 일부 상기 실시양태에서, 고형 분산물을 40℃에서 1개월 이상 동안 75%의 상대 습도에 노출시켰다. 기타 상기 실시양태에서, 단일 Tg는 약 135℃에서 발생한다. 일부 실시양태에서, 고형 분산물은 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타낸다. 본원의 경우 "실질적으로 없다"는 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21° 2θ에서 비정질 할로 위에서 회절선의 부재를 의미한다.
한 실시양태에서, 본 발명의 약학적 조성물은 화학식 1의 티에노트리아졸로디아제핀 화합물의 비정질 형태 또는 그의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태 및 약학적으로 허용가능한 중합체의 분무 건조된 고형 분산물을 포함한다. 한 실시양태에서, 약학적으로 허용가능한 중합체는 폴리비닐피롤리돈이다. 한 실시양태에서, 화학식 1의 티에노트리아졸로디아제핀 화합물 대 폴리비닐피롤리돈의 중량비는 1:3 내지 1:1 범위내이다. 한 실시양태에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고형 분산물을 통하여 균질하게 분산된다. 또 다른 실시양태에서, 티에노트리아졸로디아제핀 화합물은 고형 분산물을 통하여 균질하게 분산된다. 일부 실시양태에서, 고형 분산물은 유리 전이 온도(Tg)에 대한 단일 변곡을 나타낸다. 일부 실시양태에서, 단일 Tg는 175℃ 내지 185℃ 사이에서 발생한다. 일부 상기 실시양태에서, 고형 분산물을 40℃에서 1개월 이상 동안 75%의 상대 습도에 노출시켰다. 기타 상기 실시양태에서, 단일 Tg는 약 179℃에서 발생한다. 일부 실시양태에서, 고형 분산물은 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타낸다. 본원의 경우 "실질적으로 없다"는 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21° 2θ에서 비정질 할로 위에서 회절선의 부재를 의미한다.
한 실시양태에서, 본 발명의 약학적 조성물은 화학식 1의 티에노트리아졸로디아제핀 화합물의 결정질 형태 또는 그의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태 및 약학적으로 허용가능한 중합체의 분무 건조된 고형 분산물을 포함한다. 한 실시양태에서, 약학적으로 허용가능한 중합체는 히프로멜로스 아세테이트 숙시네이트이다. 한 실시양태에서, 화학식 1의 티에노트리아졸로디아제핀 화합물 대 히프로멜로스 아세테이트 숙시네이트의 중량비는 1:3 내지 1:1 범위내이다.
한 실시양태에서, 본 발명의 약학적 조성물은 화학식 1의 티에노트리아졸로디아제핀 화합물의 결정질 형태 또는 그의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태 및 약학적으로 허용가능한 중합체의 분무 건조된 고형 분산물을 포함한다. 한 실시양태에서, 약학적으로 허용가능한 중합체는 폴리비닐피롤리돈이다. 한 실시양태에서, 화학식 1의 티에노트리아졸로디아제핀 화합물 대 폴리비닐피롤리돈의 중량비는 1:3 내지 1:1 범위내이다.
한 바람직한 실시양태에서, 본 발명은 하기 2-[(6S)-4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노l[3,2-f]-[1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 이수화물, 화합물 (1-1) 또는 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태 및 약학적으로 허용가능한 중합체의 고형 분산물을 포함하는 약학적 조성물을 제공한다:
한 실시양태에서, 약학적으로 허용가능한 중합체는 HPMCAS이다. 한 실시양태에서, 분산물은 1:3 내지 1:1의 중량비로 화합물 (1-1) 및 HPMCAS를 갖는다. 한 실시양태에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고형 분산물을 통하여 균질하게 분산된다. 또 다른 실시양태에서, 티에노트리아졸로디아제핀 화합물은 고형 분산물을 통하여 균질하게 분산된다. 한 실시양태에서, 고형 분산물은 분무 건조된다. 일부 실시양태에서, 고형 분산물은 유리 전이 온도(Tg)에 대한 단일 변곡을 나타낸다. 일부 실시양태에서, 단일 Tg는 130℃ 내지 140℃ 사이에서 발생한다. 기타 상기 실시양태에서, 단일 Tg는 135℃에서 발생한다. 일부 상기 실시양태에서, 고형 분산물을 40℃에서 1개월 이상 동안 75%의 상대 습도에 노출시켰다. 일부 실시양태에서, 고형 분산물은 결정질 티에노트리아졸로디아제핀 화합물 (1-1)과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타낸다. 본원의 경우 "실질적으로 없다"는 결정질 티에노트리아졸로디아제핀 화합물 (1-1)과 관련된 약 21° 2θ에서 비정질 할로 위에서 회절선의 부재를 의미한다.
또 다른 실시양태에서, 약학적 조성물은 화합물 (1-1) 또는 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태; 및 약학적으로 허용가능한 중합체의 고형 분산물을 포함한다. 한 실시양태에서, 약학적으로 허용가능한 중합체는 PVP이다. 한 실시양태에서, 분산물은 1:3 내지 1:1의 중량비의 화합물 (1-1) 및 PVP를 갖는다. 한 실시양태에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고형 분산물을 통하여 균질하게 분산된다. 또 다른 실시양태에서, 티에노트리아졸로디아제핀 화합물은 고형 분산물을 통하여 균질하게 분산된다. 한 실시양태에서, 고형 분산물은 분무 건조된다. 일부 실시양태에서, 고형 분산물은 유리 전이 온도(Tg)에 대한 단일 변곡을 나타낸다. 일부 실시양태에서, 단일 Tg는 175℃ 내지 185℃ 사이에서 발생한다. 기타 상기 실시양태에서, 단일 Tg는 약 179℃에서 발생한다. 일부 상기 실시양태에서, 고형 분산물을 40℃에서 1개월 이상 동안 75%의 상대 습도에 노출시켰다. 일부 실시양태에서, 고형 분산물은 결정질 티에노트리아졸로디아제핀 화합물 (1-1)과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타낸다. 본원의 경우 "실질적으로 없다"는 결정질 티에노트리아졸로디아제핀 화합물 (1-1)과 관련된 약 21° 2θ에서 비정질 할로 위에서 회절선의 부재를 의미한다.
한 실시양태에서, 본 발명의 약학적 조성물은 티에노트리아졸로디아제핀 화합물 (1-1)의 비정질 형태 또는 그의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태; 및 약학적으로 허용가능한 중합체의 고형 분산물을 포함한다. 한 실시양태에서, 약학적으로 허용가능한 중합체는 HPMCAS이다. 한 실시양태에서, 분산물은 1:3 내지 1:1의 중량비로 화합물 (1-1) 및 HPMCAS를 갖는다. 한 실시양태에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고형 분산물을 통하여 균질하게 분산된다. 또 다른 실시양태에서, 티에노트리아졸로디아제핀 화합물은 고형 분산물을 통하여 균질하게 분산된다. 한 실시양태에서, 고형 분산물은 분무 건조된다. 일부 실시양태에서, 고형 분산물은 유리 전이 온도(Tg)에 대한 단일 변곡을 나타낸다. 일부 실시양태에서, 단일 Tg는 130℃ 내지 140℃ 사이에서 발생한다. 기타 상기 실시양태에서, 단일 Tg는 약 135℃에서 발생한다. 일부 상기 실시양태에서, 고형 분산물을 40℃에서 1개월 이상 동안 75%의 상대 습도에 노출시켰다. 일부 실시양태에서, 고형 분산물은 결정질 티에노트리아졸로디아제핀 화합물 (1-1)과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타낸다. 본원의 경우 "실질적으로 없다"는 결정질 티에노트리아졸로디아제핀 화합물 (1-1)과 관련된 약 21° 2θ에서 비정질 할로 위에서 회절선의 부재를 의미한다.
한 실시양태에서, 본 발명의 약학적 조성물은 티에노트리아졸로디아제핀 화합물 (1-1)의 비정질 형태 또는 그의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태; 및 약학적으로 허용가능한 중합체의 고형 분산물을 포함한다. 한 실시양태에서, 약학적으로 허용가능한 중합체는 PVP이다. 한 실시양태에서, 분산물은 1:3 내지 1:1의 중량비의 화합물 (1-1) 및 PVP를 갖는다. 한 실시양태에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고형 분산물을 통하여 균질하게 분산된다. 또 다른 실시양태에서, 티에노트리아졸로디아제핀 화합물은 고형 분산물을 통하여 균질하게 분산된다. 한 실시양태에서, 고형 분산물은 분무 건조된다. 일부 실시양태에서, 고형 분산물은 유리 전이 온도(Tg)에 대한 단일 변곡을 나타낸다. 일부 실시양태에서, 단일 Tg는 175℃ 내지 185℃ 사이에서 발생한다. 기타 상기 실시양태에서, 단일 Tg는 약 189℃에서 발생한다. 일부 상기 실시양태에서, 고형 분산물을 40℃에서 1개월 이상 동안 75%의 상대 습도에 노출시켰다. 일부 실시양태에서, 고형 분산물은 결정질 티에노트리아졸로디아제핀 화합물 (1-1)과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타낸다. 본원의 경우 "실질적으로 없다"는 결정질 티에노트리아졸로디아제핀 화합물 (1-1)과 관련된 약 21° 2θ에서 비정질 할로 위에서 회절선의 부재를 의미한다.
한 실시양태에서, 본 발명의 약학적 조성물은 티에노트리아졸로디아제핀 화합물 (1-1)의 결정질 형태 또는 그의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태 및 약학적으로 허용가능한 중합체의 고형 분산물을 포함한다. 한 실시양태에서, 약학적으로 허용가능한 중합체는 HPMCAS이다. 한 실시양태에서, 분산물은 1:3 내지 1:1의 중량비로 화합물 (1-1) 및 HPMCAS를 갖는다. 한 실시양태에서, 고형 분산물은 분무 건조된다.
한 실시양태에서, 본 발명의 약학적 조성물은 티에노트리아졸로디아제핀 화합물 (1-1)의 결정질 형태 또는 그의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태 및 약학적으로 허용가능한 중합체의 고형 분산물을 포함한다. 한 실시양태에서, 약학적으로 허용가능한 중합체는 PVP이다. 한 실시양태에서, 분산물은 1:3 내지 1:1의 중량비의 화합물 (1-1) 및 PVP를 갖는다. 한 실시양태에서, 고형 분산물은 분무 건조된다.
본원에 기재된 본 발명의 고형 분산물은 경구 투여시 특히 이로운 성질을 나타낸다. 고형 분산물의 이로운 성질의 예로는 동물 또는 사람에서의 표준 생체이용률 시험에서 투여시 일정하고 높은 레벨의 생체이용률을 들 수 있으나, 이에 한정되지 않는다. 본 발명의 고형 분산물은 화학식 1의 티에노트리아졸로디아제핀 화합물 및 중합체 및 첨가제를 포함하는 고형 분산물을 포함할 수 있다. 일부 실시양태에서, 화학식 1의 티에노트리아졸로디아제핀 화합물 약물은 물 및 대부분의 수성 매체 중에서의 용해도가 무시할 정도이어서, 고형 분산물은 화학식 1의 티에노트리아졸로디아제핀 화합물을 첨가제와 단순 혼합하여 얻을 수 없는 혈류로의 화학식 1의 티에노트리아졸로디아제핀 화합물의 흡수를 달성할 수 있다. 화학식 1의 티에노트리아졸로디아제핀 화합물 또는 티에노트리아졸로디아제핀 화합물 (1-1)의 생체이용률은 각종 시험관내 및/또는 생체내 연구를 사용하여 측정될 수 있다. 생체내 연구는 예를 들면 래트, 개 또는 사람을 사용하여 수행될 수 있다.
생체이용률은 가로축(X축)을 따른 시간에 대한 세로축(Y축)을 따른 화학식 1의 티에노트리아졸로디아제핀 화합물 또는 티에노트리아졸로디아제핀 화합물 (1-1)의 혈청 또는 혈장 농도를 플롯하여 얻은 곡선 아래 면적(AUC) 값에 의하여 측정될 수 있다. 그 후, 고형 분산물로부터 화학식 1의 티에노트리아졸로디아제핀 화합물 또는 티에노트리아졸로디아제핀 화합물 (1-1)의 AUC 값을 중합체가 없는 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물 또는 결정질 티에노트리아졸로디아제핀 화합물 (1-1)의 등가의 농도의 AUC 값과 비교한다. 일부 실시양태에서, 고형 분산물은 개에게 경구 투여시 적어도 0.4 배, 0.5 배, 0.6 배, 0.8 배, 1.0 배로부터 선택된 곡선 아래 면적(AUC) 값을 제공하며, 해당 AUC 값은 개에게 정맥내 투여한 등가량의 화학식 I의 결정질 티에노트리아졸로디아제핀 화합물을 포함하는 대조용 조성물에 의하여 제공된다.
생체이용률은 위 환경 및 장 환경의 pH값을 모사하는 시험관내 시험에 의하여 측정될 수 있다. 측정은 화학식 1의 티에노트리아졸로디아제핀 화합물 또는 티에노트리아졸로디아제핀 화합물 (1-1)의 고형 분산물을 1.0 내지 2.0의 pH를 갖는 수성 시험관내 테스트 매체 중에 현탁시켜 생성될 수 있으며, 그 후 대조용 시험관내 테스트 매체 중에서 5.0 내지 7.0의 pH로 조절된다. 화학식 1의 비정질 티에노트리아졸로디아제핀 화합물 또는 비정질 티에노트리아졸로디아제핀 화합물 (1-1)의 농도는 pH 조절 후 처음 2 시간 동안 임의의 시간에서 측정될 수 있다. 일부 실시양태에서, 고형 분산물은 중합체가 없는 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물 또는 결정질 티에노트리아졸로디아제핀 화합물 (1-1)의 농도에 비하여 적어도 5배 초과, 적어도 6배 초과, 적어도 7배 초과, 적어도 8배 초과, 적어도 9배 초과 또는 적어도 10배 초과로부터 선택된, 5.0 내지 7.0 사이의 pH에서 수성 시험관내 테스트 매체 중에서 화학식 1의 비정질 티에노트리아졸로디아제핀 화합물 또는 비정질 티에노트리아졸로디아제핀 화합물 (1-1)의 농도를 제공한다.
기타 실시양태에서, 1.0 내지 2.0의 pH를 갖는 수성 시험관내 테스트 매체 중에 배치된 고형 분산물로부터 화학식 1의 비정질 티에노트리아졸로디아제핀 화합물 또는 비정질 티에노트리아졸로디아제핀 화합물 (1-1)의 농도는 중합체가 없는 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물의 농도보다 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%; 적어도 80% 더 높다. 일부 상기 실시양태에서, 고형 분산물의 중합체는 HPMCAS이다. 일부 상기 실시양태에서, 고형 분산물의 중합체는 PVP이다.
기타 실시양태에서, 고형 분산물로부터 화학식 1의 비정질 티에노트리아졸로디아제핀 화합물 또는 비정질 티에노트리아졸로디아제핀 화합물 (1-1)의 농도는 1.0 내지 2.0의 pH를 갖는 수성 시험관내 테스트 매체 중에 배치된, 화학식 1의 티에노트리아졸로디아제핀 화합물 및, 히프로멜로스 프탈레이트 및 에틸 아크릴레이트-메틸 메타크릴레이트-트리메틸암모니오에틸 메타크릴레이트 클로라이드 공중합체로 이루어진 군으로부터 선택된 약학적으로 허용가능한 중합체의 고형 분산물로부터 화학식 1의 티에노트리아졸로디아제핀 화합물의 농도에 비하여 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%; 적어도 80% 더 높다. 일부 상기 실시양태에서, 고형 분산물의 중합체는 HPMCAS이다. 일부 상기 실시양태에서, 고형 분산물의 중합체는 PVP이다.
일부 실시양태에서, 본원에 기재된 고형 분산물은 시간 경과에 따른 습도 및 온도에 노출시 화학식 1의 티에노트리아졸로디아제핀 화합물 또는 티에노트리아졸로디아제핀 화합물 (1-1)의 재결정화에 대한 안정성을 나타낸다. 한 실시양태에서, 비정질 상태를 유지하는 화학식 1의 비정질 티에노트리아졸로디아제핀 화합물 또는 티에노트리아졸로디아제핀 화합물 (1-1)의 농도는 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98% 및 적어도 99%로부터 선택된다.
III. 투여 형태:
본 발명의 고형 분산물과 함께 사용될 수 있는 적절한 투여 형태로는 캡슐, 정제, 미니-정제, 비드, 비드렛, 펠릿, 과립, 과립화물 및 분말을 들 수 있으나, 이에 한정되지 않는다. 적절한 투여 형태는 예를 들면 장용피를 사용하여 코팅될 수 있다. 적절한 코팅은 셀룰로오스 아세테이트 프탈레이트, 하이드록시프로필메틸셀룰로오스(HPMC), 하이드록시프로필메틸셀룰로오스 프탈레이트, 폴리메틸아크릴산 공중합체 또는 하이드록실프로필메틸셀룰로오스 아세테이트 숙시네이트(HPMCAS)를 포함할 수 있으나, 이에 한정되지 않는다. 일부 실시양태에서, 예를 들면 동일한 샘플 중에서 본 발명의 티에노트리아졸로디아제핀의 일부 분자는 클러스터 내에 존재할 수 있으며, 일부는 담체와 함께 분자적으로 분산되는 특정 조합을 접할 수 있다.
일부 실시양태에서, 본 발명의 고형 분산물은 정제, 캐플릿 또는 캡슐로서 제제화될 수 있다. 하나의 일부 실시양태에서, 본 발명의 고형 분산물은 미니-정제 또는 입에 부어 먹는 과립 또는 구성(constitution)용 경구 분말로서 제제화될 수 있다. 일부 실시양태에서, 본 발명의 고형 분산물은 기타 부형제(예, 재결정화/침전 억제 중합체, 미각-차폐 성분 등)와 조합된 적절한 희석제 중에 분산되어 사용 준비가 된 제제를 산출한다. 일부 실시양태에서, 본 발명의 고형 분산물은 소아과 치료를 위하여 제제화될 수 있다.
한 실시양태에서, 본 발명의 약학적 조성물은 경구 투여용으로 제제화된다. 한 실시양태에서, 약학적 조성물은 본원에 기재된 각종 실시양태에 의하여 화학식 1의 티에노트리아졸로디아제핀 화합물 또는 그의 약학적으로 허용가능한 염, 수화물을 비롯한 용매화물, 라세메이트, 거울상이성질체, 이성질체 또는 동위원소-표지된 형태; 및 중합체 담체를 포함하는 고형 분산물을 포함한다. 한 실시양태에서, 약학적 조성물은 붕해제, 윤활제, 활택제, 결합제 및 충전제 등의 첨가제 1종 이상을 더 포함한다.
약학적 조성물과 함께 사용하기 위한 적절한 약학적으로 허용가능한 윤활제 및 약학적으로 허용가능한 활택제의 예로는 콜로이드성 실리카, 삼규산마그네슘, 전분, 탈크, 3염기성 인산칼슘, 스테아르산마그네슘, 스테아르산알루미늄, 스테아르산칼슘, 탄산마그네슘, 산화마그네슘, 폴리에틸렌 글리콜, 분말화 셀룰로오스, 글리세릴 베헤네이트, 스테아르산, 수소화 피마자유, 글리세릴 모노스테아레이트 및 나트륨 스테아릴 푸마레이트를 들 수 있으나, 이에 한정되지 않는다.
약학적 조성물과 함께 사용하기에 적절한 약학적으로 허용가능한 결합제의 예로는 전분; 셀룰로오스 및 그의 유도체, 예를 들면 미정질 셀룰로오스(예, 에프엠씨(FMC)로부터의 아비셀(AVICEL) PH), 하이드록시프로필 셀룰로오스, 하이드록시에틸 셀룰로오스 및 하이드록실프로필메틸셀룰로오스(HPMC, 예를 들면 다우 케미칼(Dow Chemical)로부터의 메토셀(METHOCEL); 수크로스, 덱스트로스, 옥수수 시럽; 다당류; 및 젤라틴을 들 수 있으나, 이에 한정되지 않는다.
약학적 조성물과 함께 사용하기에 적절한 약학적으로 허용가능한 충전제 및 약학적으로 허용가능한 희석제의 예로는 컨펙셔너스 슈가, 콤프레서블 슈가, 덱스트레이트, 덱스트린, 덱스트로스, 락토스, 만니톨, 미정질 셀룰로오스(MCC), 분말화 셀룰로오스, 소르비톨, 수크로스 및 탈크를 들 수 있으나, 이에 한정되지 않는다.
일부 실시양태에서, 부형제는 약학적 조성물에서 1 초과의 기능을 수행할 수 있다. 예를 들면, 충전제 또는 결합제도 또한 붕해제, 활택제, 부착방지제, 윤활제, 감미제 등일 수 있다.
일부 실시양태에서, 본 발명의 약학적 조성물은 첨가제 또는 성분, 예컨대 산화방지제(예, 아스코르빌 팔미테이트, 부틸화 하이드록실아니솔(BHA), 부틸화 하이드록시톨루엔(BHT), α-토코페롤, 프로필 갈레이트 및 푸마르산), 항균제, 효소 억제제, 안정화제(예, 말론산) 및/또는 보존제를 더 포함할 수 있다.
일반적으로, 본 발명의 약학적 조성물은 임의의 적절한 고체 투여 형태로 제제화될 수 있다. 일부 실시양태에서, 본 발명의 고형 분산물은 투여용 단위 투여 형태로, 예를 들면 캡슐 또는 정제 또는 다중-입자계, 예컨대 과립 또는 과립화물 또는 분말로서 배합된다.
한 실시양태에서, 약학적 조성물은 본원에 기재된 고형 분산물의 다양한 실시양태에 의한 화학식 1의 티에노트리아졸로디아제핀 화합물 및 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트(HPMCAS)의 고형 분산물을 포함하며, 티에노트리아졸로디아제핀 화합물은 고형 분산물 중에서 비정질이며, 1:3 내지 1:1의 중량비의 티에노트리아졸로디아제핀 화합물 대 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트(HPMCAS); 45-50 중량%의 락토스 일수화물; 35-40 중량%의 미정질 셀룰로오스; 4-6 중량%의 크로스카르멜로스 나트륨; 0.8-1.5 중량%의 콜로이드성 이산화규소; 및 0.8-1.5 중량%의 스테아르산마그네슘을 갖는다.
IV. 투여량:
한 실시양태에서, 본 발명은 임의의 적절한 고체 투여 형태로 제제화될 수 있는 약학적 조성물을 제공한다. 한 실시양태에서, 본 발명에 의한 약학적 조성물은 본원에 기재된 바와 같은 화학식 1의 티에노트리아졸로디아제핀의 다양한 실시양태 중 하나 이상을 약 10 ㎎ 내지 약 100 ㎎의 투여량으로 포함한다. 한 실시양태에서, 본 발명의 약학적 조성물은 본원에 기재된 바와 같은 화학식 1의 티에노트리아졸로디아제핀의 다양한 실시양태 중 하나 이상을 약 10 ㎎ 내지 약 100 ㎎, 약 10 ㎎ 내지 약 90 ㎎, 약 10 ㎎ 내지 약 80 ㎎, 약 10 ㎎ 내지 약 70 ㎎, 약 10 ㎎ 내지 약 60 ㎎, 약 10 ㎎ 내지 약 50 ㎎, 약 10 ㎎ 내지 약 40 ㎎, 약 10 ㎎ 내지 약 30 ㎎ 및 약 10 ㎎ 내지 약 20 ㎎으로 이루어진 군으로부터 선택된 투여량으로 포함한다. 한 실시양태에서, 본 발명의 약학적 조성물은 본원에 기재된 바와 같은 화학식 1의 티에노트리아졸로디아제핀의 다양한 실시양태 중 하나 이상을 약 10 ㎎, 약 50 ㎎, 약 75 ㎎, 약 100 ㎎으로 이루어진 군으로부터 선택된 투여량으로 포함한다.
일부 실시양태에서, 본 발명의 방법은 치료를 필요로 하는 환자에게 본원에 기재된 바와 같은 화학식 1의 티에노트리아졸로디아제핀의 다양한 실시양태 중 하나 이상을 약 1 ㎎, 약 2 ㎎, 약 2.5 ㎎, 약 3 ㎎, 약 4 ㎎, 약 5 ㎎, 약 7.5 ㎎, 약 10 ㎎, 약 15 ㎎, 약 20 ㎎, 약 25 ㎎, 약 30 ㎎, 약 35 ㎎, 약 40 ㎎, 약 45 ㎎, 약 50 ㎎, 약 55 ㎎, 약 60 ㎎, 약 65 ㎎, 약 70 ㎎, 약 75 ㎎, 약 80 ㎎, 약 85 ㎎, 약 90 ㎎, 약 95 ㎎, 약 100 ㎎, 약 110 ㎎, 약 120 ㎎, 약 130 ㎎, 약 140 ㎎ 및 약 150 ㎎으로 이루어진 군으로부터 선택된 투여량으로 주 1회, 닷새 걸러 1일 1회, 나흘 걸러 1일 1회, 사흘 걸러 1일 1회, 이틀 걸러 1일 1회, 하루 걸러 1일 1회, 1일 1회, 1일 2회, 1일 3회, 1일 4회 및 1일 5회로 이루어진 군으로부터 선택된 투여 형태로 투여되는 것을 포함한다. 또 다른 실시양태에서, 임의의 상기 투여량 또는 투여 형태는 주기적으로 감소될 수 있거나 또는 주기적으로 증가될 수 있다.
일부 실시양태에서, 본 발명의 방법은 치료를 필요로 하는 대상체에게 화합물 (1-1), (1-2), (1-3), (1-4), (1-5), (1-6), (1-7), (1-8), (1-9), (1-10), (1-11), (1-12), (1-13), (1-14), (1-15), (1-16), (1-17) 및 (1-18)로 이루어진 군으로부터 선택된 티에노트리아졸로디아제핀을 약 1 ㎎, 약 2 ㎎, 약 2.5 ㎎, 약 3 ㎎, 약 4 ㎎, 약 5 ㎎, 약 7.5 ㎎, 약 10 ㎎, 약 15 ㎎, 약 20 ㎎, 약 25 ㎎, 약 30 ㎎, 약 35 ㎎, 약 40 ㎎, 약 45 ㎎, 약 50 ㎎, 약 55 ㎎, 약 60 ㎎, 약 65 ㎎, 약 70 ㎎, 약 75 ㎎, 약 80 ㎎, 약 85 ㎎, 약 90 ㎎, 약 95 ㎎, 약 100 ㎎, 약 110 ㎎, 약 120 ㎎, 약 130 ㎎, 약 140 ㎎ 및 약 150 ㎎으로 이루어진 군으로부터 선택된 투여량으로 주 1회, 닷새 걸러 1일 1회, 나흘 걸러 1일 1회, 사흘 걸러 1일 1회, 이틀 걸러 1일 1회, 하루 걸러 1일 1회, 1일 1회, 1일 2회, 1일 3회, 1일 4회 및 1일 5회로 이루어진 군으로부터 선택된 투여 형태로 투여되는 것을 포함한다. 또 다른 실시양태에서, 임의의 상기 투여량 또는 투여 형태는 주기적으로 감소될 수 있거나 또는 주기적으로 증가될 수 있다.
상기 단위 투여 형태는 요법의 특정한 목적, 요법의 단계 등에 의존하여 1일 1 내지 5회 투여에 적절하다. 한 실시양태에서, 투여 형태는 치료를 필요로 하는 대상체에게 적어도 2일 연속 동안 1일 1회 이상으로 투여될 수 있다. 한 실시양태에서, 투여 형태는 치료를 필요로 하는 대상체에게 격일로 1일 1회 이상 투여될 수 있다. 한 실시양태에서, 투여 형태는 치료를 필요로 하는 대상체에게 적어도 1주당 동일하거나 및/또는 동일하지 않은 투여량으로 분할하여 투여될 수 있다. 한 실시양태에서, 투여 형태는 치료를 필요로 하는 대상체에게 주 1회, 1주당 격일로 3회 및/또는 6회 투여될 수 있다. 한 실시양태에서, 투여 형태는 치료를 필요로 하는 대상체에게 격일로, 이틀 걸러, 사흘 걸러, 나흘 걸러, 닷새 걸러 및/또는 매주 분할된 투여량으로 투여될 수 있다. 한 실시양태에서, 투여 형태는 치료를 필요로 하는 대상체에게 1개월당 2회 이상의 동일하게 또는 동일하지 않은 분할된 투여량으로 투여될 수 있다.
예를 들면 캡슐, 정제, 미니-정제, 비드, 비드렛, 펠릿, 과립, 과립화물 또는 분말에 사용된 투여 형태는 예를 들면 장용피를 사용하여 코팅될 수 있다. 적절한 코팅은 셀룰로오스 아세테이트 프탈레이트, 하이드록시프로필메틸셀룰로오스(HPMC), 하이드록시프로필메틸셀룰로오스 프탈레이트, 폴리메틸아크릴산 공중합체 또는 하이드록실프로필메틸셀룰로오스 아세테이트 숙시네이트(HPMCAS)를 포함할 수 있으나, 이에 한정되지 않는다.
V. 제법:
본원에 개시된 티에노트리아졸로디아제핀 화합물은 본원에 그 전문이 참조로 포함되는 미국 특허 출원 공개 번호 2010/0286127에 또는 본원에 기재된 절차에 의하여 유리 염기로서 또는 산 부가 염으로서 존재할 수 있다. 본 발명의 티에노트리아졸로디아제핀 화합물의 개개의 거울상이성질체 및 부분입체이성질체는 비대칭 또는 입체발생 중심을 함유하는 시판 중인 출발 물질로부터 또는 라세미 혼합물의 제조에 이어서 당업자에게 공지된 분해 방법에 의하여 합성적으로 생성될 수 있다.
일부 실시양태에서, 화학식 1에 의한 티에노트리아졸로디아제핀의 제제를 위한 다양한 실시양태 중 하나 이상은 용매 증발 방법에 의하여 생성된다. 한 실시양태에서, 용매 증발 방법은 화학식 1에 의한 티에노트리아졸로디아제핀 화합물의 가용화를 포함하며, 휘발성 용매 중의 담체는 차후에 증발된다. 한 실시양태에서, 휘발성 용매는 하나 이상의 부형제를 포함할 수 있다. 한 실시양태에서, 하나 이상의 부형제로는 점착방지제, 불활성 충전제, 계면활성제, 습윤화제, pH 변형제 및 첨가제를 들 수 있으나, 이에 한정되지 않는다. 한 실시양태에서, 부형제는 휘발성 용매 중에 용해되거나 또는 현탁 또는 팽윤된 상태로 존재할 수 있다.
한 실시양태에서, 본 발명에 의한 고형 분산물의 제조는 휘발성 용매 중에 현탁된 부형제 하나 이상을 건조시키는 것을 포함한다. 한 실시양태에서, 건조는 진공 건조, 저온에서의 휘발성 용매의 느린 증발, 회전 증발기의 사용, 분무-건조, 분무 과립화, 동결-건조 또는 초임계 유체의 사용을 들 수 있다.
한 실시양태에서, 조성물의 현탁액 또는 용액의 작은 액적으로의 분무화에 이어서 제제로부터 신속한 용매 제거를 포함하는 화학식 1에 의한 티에노트리아졸로디아제핀 조성물용 제제의 분무 건조 제조를 사용한다. 한 실시양태에서, 본 발명에 의한 제제의 제조는 용매 중의 조성물의 용액 또는 현탁액을 적절한 화학적 및/또는 물리적 불활성 충전제, 예컨대 락토스 또는 만니톨에 분무시키는 분무 과립화를 포함한다. 한 실시양태에서, 조성물의 용액 또는 현탁액의 분무 과립화는 2-방향 또는 3-방향 노즐에 의하여 달성된다.
본 발명은 하기의 비제한적인 실시예에서 예시된다.
VI. 실시예:
본 발명은 하기의 비제한적인 실시예에서 예시된다.
실시예
1: 화합물 (1-
1)의
고형 분산물의
시험관내
스크리닝
화합물 (1-1) 및, 히프로멜로스 아세테이트 숙시네이트(HPMCAS-M), 히프로멜로스 프탈레이트(HPMCP-HP55), 폴리비닐피롤리돈(PVP), PVP-비닐 아세테이트(PVP-VA) 및 유드라짓 L100-55를 비롯한 5종의 중합체 중 하나를 각각의 중합체에 대하여 25% 및 50%의 화합물 (1-1) 로딩 둘다에서 사용하여 10종의 고형 분산물을 생성하였다. 고형 분산물을 용매 증발 방법에 의하여 분무-건조를 사용한 후 저온 대류 오븐내에서의 2차 건조에 의하여 생성하였다. 각각의 고형 분산물의 성능은 시간 경과에 대하여 약물의 총량 및 용액 중에 존재하는 유리 약물의 양 둘다를 측정하는 비-싱크(sink) 용해 성능 테스트에 의하여 평가하였다. 비-싱크 용해는 저 가용성 화합물에 대한 생체내 상황을 가장 잘 나타내므로 선택하였다. 이 테스트는 생체내 조건을 모사하는 테스트 매체에 분산물을 투입한 후 약 30 내지 40 분에서 위 pH(0.1 N NaCl, pH 1.0)로부터 장 pH(FaFSSIF, pH 6.5)로 분산물의 "위 전달"을 포함하였다. [FaFSSIF는 3 mM 나트륨 타우로콜레이트, 0.75 mM 레시틴, 0.174 g NaOH 펠릿, 1.977 g NaH2PO4·H2O, 3.093 g NaCl 및 정제수 qs 500 ㎖로 이루어진 단식된 상태의 모사한 장 유체이다]. 용해된 약물의 양은 고-성능 액체 크로마토그래피(HPLC) 방법 및 아질런트(Agilent) 1100 시리즈 HPLC를 사용하여 정량화하였다. 제제의 용해 프로파일(도 1A-1J)은 동일한 매체 중의 제제화되지 않은 화합물에 대한 모든 분산 후보에서의 약물 용해도의 커다란 증가를 나타냈다. 고형 분산물 중에서 PVP 중의 25% 화합물 (1-1), HPMCAS-M 중의 25% 화합물 (1-1) 및 HPMCAS-M 중의 50% 화합물 (1-1) 분산물은 장 pH에서 방출된 더 높은 농도의 유리 약물의 발견에 기초하여 제제화되지 않은 화합물과 비교시 향상된 경구 흡수에 대한 가장 유망한 후보이었다.
실시예
2: 화합물 (1-
1)의
고형 분산물의
생체내
스크리닝
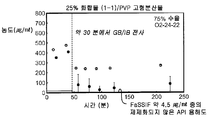
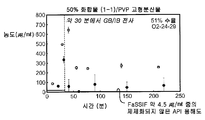
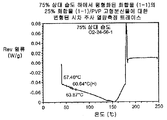
화합물 (1-1)의 가장 유망한 고형 분산물 3종, 즉 PVP 중의 25% 화합물 (1-1), HPMCAS-MG 중의 25% 화합물 (1-1) 및 HPMCAS-M 중의 50% 화합물 (1-1) 분산물은 생체내 연구를 위하여 더 큰 규모로 생성하였다. 각각의 제제는 실시예 1에 기재된 시험관내 용해 테스트로 평가하였다. 이들 분산물이 비정질 및 균질하다는 것을 확인하기 위하여, 각각의 분산물을 분말 X선 회절(PXRD) 및 변형된 시차 주사 열량측정(mDSC)에 의하여 평가하였다. 추가로, 각각의 분산물에 대한 유리 전이 온도(Tg)에 대한 물의 효과를 이해하기 위하여, 고정된 상대 습도(즉, 25%, 50% 및 75% RH)에서 18 시간 이상 동안 우선 평형화된 샘플에 대하여 mDSC를 수행하였다. [물은 고형 분산물에 대한 가소제로서 작용할 수 있으며, 활성 화합물 또는 중합체로 인하여 계의 흡습성은 이들 계에 의한 물 흡수의 양에 영향을 미칠 수 있다].
비-싱크 용해 결과(도 2A-2C)는 실시예 1에서의 분산물에 대한 실측치에 필적하였다. PXRD 결과(도 3)는 임의의 분산물에서의 결정질 화합물의 증거가 나타나지 않았으며, mDSC 결과(도 4A-4C)는 각각의 분산물에 대한 단일 유리 전이 온도(Tg)를 나타내는데, 이는 각각의 분산물이 균질하였다는 것을 나타낸다. X선 회절계는 브루커(Bruker) D-2 페이서(Phaser)이었다. 각각에 대하여 Tg 및 상대 습도 사이의 역관계가 관찰되었다(도 5). 특히, 75% RH에서 평형화된 PVP 고형 분산물 중의 25% 화합물 (1-1)의 경우, 2개의 Tg가 존재하는 것으로 나타났는데, 이는 상 분리가 발생하였다는 것을 나타내며, 이러한 분산물은 또한 75% RH에서의 용융 이벤트를 나타내는데, 이는 결정화가 RH 평형화 중에 발생하였다는 것을 시사하였다(도 6). 이러한 발견은 PVP 분산물 중의 25% 화합물 (1-1)이 HPMCAS-M 분산물보다 덜 안정할 수 있다는 것을 시사한다.
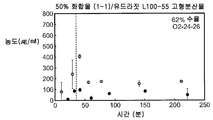
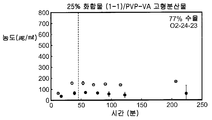
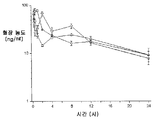
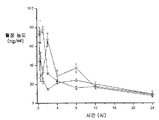
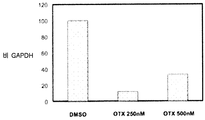
3종의 분산물의 생체이용률을 평가하기 위하여, 비글 개 수컷의 군(군당 3마리)에게 경구 급식에 의하여 투여된 화합물 (1-1)의 고형 분산물의 수성 현탁액 3 ㎎/㎏ 투여량 또는 물:에탄올:폴리에틸렌 글리콜(PEG) 400(60:20:20) 중에 용해된 화합물 (1-1) 1 ㎎/㎏ 투여량을 제공하고, 정맥내 볼루스로서 두부 정맥에 투여하였다. 혈액 샘플을 각 동물의 경정맥으로부터 정맥 투여 후 0(투여전), 5, 15 및 30 분 및 1, 2, 4, 8, 12 및 24 시간에서 및 경구 급식 투여 후 0(투여전), 15 및 30 분 및 1, 2, 4, 8, 12 및 24 시간에서 수집하였다. 각각의 샘플 중에 존재하는 화합물 (1-1)의 양은 0.5 ng/㎖의 정량화의 하한으로 정성적 LC-MS/MS 방법을 사용하여 검출하였다. 혈장 농도-시간 곡선 아래의 면적(AUC)은 말단 제거 단계의 무한으로의 외삽 없이 최종 측정 가능한 농도까지 선형 사다리꼴 법칙을 사용하여 측정하였다. 제거 반감기(t1/2)는 로그 농도-시간 곡선의 말단 선형 부분의 최소 자승 회귀 분석에 의하여 계산하였다. 최대 혈장 농도(Cmax) 및 Cmax까지의 시간(tmax)은 혈장 농도 데이타로부터 직접 유도되었다. 경구 생체이용률(F)은 경구 투여 후의 투여량 정규화된 AUC를 정맥내 투여 후의 투여량 정규화된 AUC로 나누어 계산하여 비율(%)로 보고하였다. 하기 표 1에 요약한 결과는 PVP 중의 25% 화합물 (1-1), HPMCAS-M 중의 25% 화합물 (1-1) 및 HPMCAS-M 중의 50% 화합물 (1-1) 고형 분산물의 58%, 49% 및 74% 각각의 평균 경구 생체이용률을 제공하였다.
<표 1>
실시예
3: 화합물 (1-
1)의
고형 분산물을 함유하는 캡슐의 제조 및 임상적 사용
10 ㎎ 강도의 젤라틴 캡슐은 혈액암 환자에서의 초기 임상 연구를 위하여 생성하였다. 실시예 1 및 2에 기재된 바와 같이, 화합물 (1-1)의 고형 분산물의 시험관내 및 생체내 테스트 결과에 기초하여, 캡슐 개발을 위하여 HPMCAS-M 고형 분산물 중의 50% 화합물 (1-1)을 선택하였다. 캡슐 개발은 크기 3 경질 젤라틴 캡슐 내에서 190 ㎎의 충전 중량을 목표로 하여 개시하였는데, 이러한 구성은 약학적 조성을 유지하면서 더 큰 크기 캡슐을 채워서 캡슐 강도를 잠재적으로 증가시키도록 한다. 경험에 기초하여, 4개의 캡슐 제제는 상이한 양의 붕해제를 사용하며, 습윤제를 사용한 그리고 사용하지 않고서 설계되었다. 4개 모두의 제제는 유사한 붕해 테스트 및 용해 테스트 결과를 나타냈으므로, 제조를 위하여 (습윤제 없이, 최소의 붕해제의) 가장 단순한 제제를 선택하였다. 고형 분산물에 대한 분무 건조 공정 및 후-건조 시간; 블렌딩 파라미터; 약 0.60 g/cc의 목표 벌크 밀도를 달성하기 위한 블렌드의 롤러 압착 및 제분; 및 캡슐 충전 조건을 확인하기 위하여 제조 공정 개발 및 규모 확대 연구를 수행하였다.
결정질 화합물 (1-1) 및 중합체 히프로멜로스 아세테이트 숙시네이트(HPMCAS-M)를 아세톤 중에 용해시키고, 분무-건조시켜 50% 화합물 (1-1) 로딩을 함유하는 고형 분산물 중간(SDI) 과립을 생성하였다. SDI는 PXRD 분석에 의하여 비정질인 것으로 나타났으며, mDSC 분석에 의하여 균질한(즉, 주위 조건 하에서 단일 Tg) 것으로 나타났다. HPMCAS-M 고형 분산물(1,000 g) 및, 미정질 셀룰로오스 충전제-결합제(4,428 g), 크로스카르멜로스 나트륨 붕해제(636 g), 콜로이드성 이산화규소 분산제/윤활제(156 g), 스테아르산마그네슘 분산제/윤활제(156 g) 및 락토스 일수화물 충전제(5,364 g)를 비롯한 부형제 중의 50% 화합물 (1-1)을 V-블렌더 내에서의 단계에서 블렌딩하였다. 그 후, 블렌드를 압착시키고, 과립화하여 약 0.6 g/㎖의 벌크 밀도를 얻었다. 자동 충전기를 사용하여 블렌드를 크기 3 경질 젤라틴 캡슐(목표 충전 중량: 190 ㎎)로 분배하고, 캡슐 연마기를 사용하여 마무리 처리된 캡슐을 연마하였다.
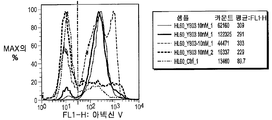
HPMCAS 고형 분산물 중의 50% 화합물 (1-1)을 함유하는 10 ㎎ 캡슐의 경구 투여 후 약물동력학 평가를 수행하고, 결과를 화합물 (1-1)의 유드라짓 고형 분산물을 함유하는 4×10 ㎎ 캡슐을 건강한 지원자에게 경구 투여 후 수행한 약물동력학 평가와 비교하였다.
2종의 약학적 조성물의 비교는 하기 표 2A 및 2B에 제공한다. 유드라짓 제제는 이미 2009년 1월 8일자에 공개된 미국 특허 출원 2009/0012064 A1의 실시예 5에 기재되어 있다. 상기 출원은 화학식 A의 티에노트리아졸로디아제핀 및, 암모니오 메타크릴레이트 공중합체 타입 B(유드라짓 RS), 메타크릴산 공중합체 타입 C(유드라짓 L100-55), 탈크 및 알루미노규산마그네슘을 비롯한 코팅 부형제를 물 및 에탄올의 혼합물 중에 용해 및/또는 분산시켜 유드라짓 고형 분산물 제제를 생성하였다는 점에 유의한다. 그 후, 원심분리 유동층 과립화기를 사용하여 상기 불균질한 혼합물을 미정질 셀룰로오스 구체(논파레일(Nonpareil) 101, 프로인트(Freund))에 적용하여 크기 2 하이드록시프로필 메틸셀룰로오스 캡슐로 분배된 과립을 생성하였다.
임상 연구 둘다에서, 화합물 (1-1)의 혈중 농도는 입증된 LC-MS/MS 방법을 사용하여 측정하고, 약물동력학 분석은 캡슐 투여 후 24 시간에 걸쳐 다양한 시점에서 측정한 화합물 (1-1)의 혈장 농도를 기준으로 하여 수행하였다. 하기 표 3에 요약한 결과는 HPMCAS-M 고형 분산물 제제가 AUC(924*4/1140, 투여된 투여량의 차이에 대하여 조절함)를 기준으로 하여 유드라짓 고형 분산물 제제보다 사람에서의 생체이용률이 3배 더 높았다는 것을 나타냈다. 추가로, 관찰된 tmax에 기초하여, HPMCAS 제제는 유드라짓 제제보다 더 신속하게 흡수되었다(1 h 대 4-6 h의 tmax). HPMCAS-M 고형 분산물 제제를 사용한 전신 노출에서의 뚜렷한 개선은 예상 밖이다.
<표 2A>
<표 2B>
<표 3>
실시예
4.
래트에서의
경구 노출
화합물 (1-1)의 고형 분산물의 3종의 제제의 경구 생체이용률을 래트에게서 측정하였다. 선택된 3종의 분산물은 PVP 중의 화합물 (1-1)의 25% 분산물, HPMCAS-MG 중의 화합물 (1-1)의 25% 분산물 및 HPMCAS-MG 중의 화합물 (1-1)의 50% 분산물이었다. 연구에 사용한 동물은 핀란드 투르쿠 대학의 중앙 동물 실험실로부터 입수한 특정 무병원체(SPF) Hsd:스프라그 돌리 래트이었다. 래트는 본래 네덜란드 할란으로부터 구입하였다. 래트는 암컷으로 10주령이었으며, 12마리의 래트를 연구에 사용하였다. 동물을 폴리카르보네이트 마크롤론(Makrolon) II 케이지(케이지당 3마리 동물)에 가두고, 동물 실내 온도는 21±3℃이었으며, 동물 실내 상대 습도는 55±15%이고, 동물 실내 조명은 인공 조명이며, 12 시간 명주기 및 암주기(18:00 및 06:00 시 사이의 암주기)에 대하여 순환시켰다. 사시나무 칩(에스토니아에 소재하는 타프베이 오위(Tapvei Oy))을 베딩에 사용하였으며, 베딩은 주 1회 이상 교체하였다. 투여 후 처음 2 시간 동안 음식과 물을 제거한 것을 제외하고, 동물에게 투여 전 음식과 물을 제공하였다.
PVP 중의 화합물 (1-1)의 25% 분산물, HPMCAS-MG 중의 화합물 (1-1)의 25% 분산물 및 HPMCAS-MG 중의 화합물 (1-1)의 50% 분산물을 함유하는 경구 투여 용액은 화합물 (1-1)의 0.75 ㎎/㎖의 농도를 얻기에 적절한 양을 사용하여 미리 계산된 양의 주사용 멸균수를 분산물을 보유하는 용기에 첨가하여 생성하였다. 각각의 투여전 20 초 동안 경구 투여 용액을 와류 혼합하였다. 정맥내 투여용 투여액은 0.25 ㎎/㎖의 화합물 (1-1)을 함유하였으며, 5 ㎎의 화합물 (1-1)을 400 Da(PEG400)의 평균 분자량을 갖는 4 ㎖의 폴리에틸렌 글리콜, 4 ㎖의 에탄올(96% 순도) 및 12 ㎖의 주사용 멸균수를 함유하는 혼합물 중에 용해시켜 생성하였다. 물 첨가 후 30 분 이내에 PVP 중의 화합물 (1-1)의 25% 분산물을 함유하는 투여액을 사용하였다. 물 첨가 후 60 분 이내에 HPMCAS-MG 중의 화합물 (1-1)의 25% 분산물 및 HPMCAS-MG 중의 화합물 (1-1)의 50% 분산물을 함유하는 투여액을 사용하였다. 정맥내 투여의 경우 1 ㎎/㎏ 및 경구 투여의 경우 3 ㎎/㎏의 화합물 (1-1)의 투여 레벨을 산출하도록 4 ㎖/㎏의 투여 부피를 사용하였다. 투여 방식은 하기 표 4에 제시한다.
<표 4>
혈액 샘플 약 50 ㎕를 투여 후 0.25, 0.5, 1, 2, 4, 8, 12 및 24 시간의 시점에서 5 ㎕의 에틸렌디아민테트라아세트산(EDTA) 용액을 함유하는 에펜도르프 시험관으로 수집하고, 각각의 샘플을 규정된 시점으로부터 5 분 이내에 수집하였다. 각각의 샘플로부터, 20 ㎕의 혈장을 얻고, 분석을 위하여 드라이 아이스 온도에서 보관하였다. 화합물 (1-1)의 농도에 대한 각각의 샘플의 분석은 0.5 ng/㎖의 정량화 하한으로 입증된 액체 크로마토그래피 탠덤 질량 분석법을 사용하여 수행하였다.
약물동력학 파라미터는 피닉스 윈논론(Phoenix WinNonlin) 소프트웨어 패키지(버젼 6.2.1, 미국 캘리포니아주에 소재하는 파사이트 코포레이션(Pharsight Corp.))으로 표준 비구획 방법으로 계산하였다. 제거 단계 반감기(t1/2)는 로그 농도-시간 곡선의 말단 선형 부분의 최소 자승 회귀 분석에 의하여 계산하였다. 혈장 농도-시간 곡선 아래의 면적(AUC)은 최종 측정 가능한 농도까지 선형 사다리꼴 법칙을 사용하고, 그후 말단 제거 단계의 무한으로의 외삽에 의하여 측정하였다. 화합물이 구획 또는 계내에 잔존하는 시간의 평균량을 나타내는 평균 체류 시간(MRT)은 약물 농도 프로파일을 무한으로 외삽하여 계산하였다. 최대 혈장 농도(Cmax) 및 Cmax까지의 시간(tmax)은 혈장 농도 데이타로부터 직접 유도하였다. 잠정적인 경구 생체이용률(F)은 경구 투여 후의 투여량 정규화된 AUC를 정맥내 투여 후의 투여량 정규화된 AUC로 나누어 계산하여, 즉 F=(AUC(경구)/투여량(경구))/(AUC(정맥내)/투여량(정맥내))], 비율(%)로 보고하였다.
약물동력학 파라미터는 하기 표 5에 제시하며, 혈장 농도 대 시간 플롯은 도 7 및 8에 제시한다.
<표 5>
실시예
5. 분무 건조된 분산물의 제조
화합물 (1-1)의 분무 건조된 분산물은 HPMCAS-MG(신 에츠 케미칼 컴파니, 리미티드(Shin Etsu Chemical Co., Ltd.)), HPMCP-HP55(신 에츠 케미칼 컴파니, 리미티드), PVP(ISP, 애쉬랜드, 인코포레이티드(Ashland, Inc.)의 분사), PVP-VA(바스프 코포레이션(BASF Corp.)) 및 유드라짓 L100-55(에보닉 인더스트리즈 아게(Evonik Industries AG))인 5종의 선택된 중합체를 사용하여 생성하였다. 모두 분무 건조시킨 용액을 각각의 중합체로 25 중량% 및 50 중량%로 생성하였다. 에탄올 중에서 생성한 PVP 용액을 제외하고, 모든 용액을 아세톤 중에서 생성하였다. 각각의 용액의 경우, 1.0 g의 고체(중합체 및 화합물 (1-1))를 10 g의 용매 중에서 생성하였다. 1.5 ㎜ 노즐이 있는 부치(Buechi) B-290, PE-024 분무 건조기 및 부치 B-295, P-002 응축기를 사용하여 용액을 분무 건조시켰다. 분무 건조기 노즐 압력은 80 psi로 설정하였으며, 목표 출구 온도는 40℃로 설정하였으며, 냉각기 온도는 -20℃로 설정하고, 펌프 속도는 100%로 설정하고, 흡인기 설정은 100%이었다. 분무 건조후, 고형 분산물을 수집하고, 밤새 저온 대류 오븐내에서 건조시켜 잔류 용매를 제거하였다.
실시예
6: 습도 및 온도와의 안정성
HPMCAS-MG 중의 화합물 (1-1)의 분무 건조된 분산물은 고온에서 수분으로의 노출에 의한 안정성에 대하여 평가하였다. 상대 습도에 대한 유리 전이 온도(Tg)는 1, 2 및 3 개월 동안 75% 상대 습도, 40℃에서 측정하였다. 분무 건조된 분산물을 HDPE 병 내부의 LDPE 백에 보관하여 벌크 제품 포장을 모사하였다. 데이타를 하기 표 6에 요약한다. 시간 0에서, Tg는 134℃이었으며, 1 개월에서 Tg는 134℃이었으며, 2 개월에서 Tg는 135℃이었으며, 3개월에서 Tg는 134℃이었으며, 각각의 측정에 대하여 유일한 단일 변곡점이 관찰되었다. X선 회절 패턴도 또한 각각의 샘플에 대하여 얻었다. 도 9는 안정성 테스트의 시점 0에서 HPMCAS-MG 중의 화합물 (1-1)의 고형 분산물의 분말 X선 회절 프로파일을 도시한다. 도 10, 11 및 12는 각각 40℃ 및 75% 상대 습도에서 노출 후 각각 1 개월, 2 개월 및 3 개월 후 HPMCAS-MG 중의 화합물 (1-1)의 고형 분산물의 분말 X선 회절 프로파일을 도시한다.
패턴은 화합물 (1-1)과 관련된 임의의 회절선을 나타내지 않았다.
실시예 7: 1차 세포의 세포주 및 선택
주르캇 세포(T-ALL), RS 4-11(MLL-AF4 B-전구체 ALL), TOM-1, BV173(Ph+ ALL 둘다)를 포함한 ALL 및, K562(모세포 발증에서의 Ph+ CML), HL-60(NRAS 유도된 AML2), NOMO1(MLL-AF9 유도된 AML), KG1(BMP-FGRF+ AML6) 및 그의 더 미성숙한 서브타입 KG1a를 포함한 AML에 대한 상이한 대표적인 세포주를 10% 또는 20% 열-불활성화된 소 태아 혈청 각각이 보충된 RPMI 1640(깁코 인비트로겐(Gibco Invitrogen), 스위스 바젤 소재), 2 mM L-글루타민, 100 IU/㎖ 페니실린 및 100 g/㎖ 스트렙토마이신 중에서 배양하였다.
골수(BM)로부터의 단핵 세포(MNC)를 피콜-파크(icoll-Paque) PLUS 밀도 구배(애머샴 바이오사이언시즈(Amersham Biosciences), 미국 써니베일 소재)에 의하여 분리하였다. 환자 세포는 10% 열-불활성화된 소 태아 혈청이 보충된 IMDM(깁코), 2 mM L-글루타민, 100 IU/㎖ 페니실린 및 성장 인자가 없는 100 g/㎖ 스트렙토마이신 중에서 유지하였다.
실시예 8: MTT -검정, 아포프토시스 평가 및 세포 주기 분석
MTT-검정: 세포를 24-웰 평판에 웰당 106의 밀도로 파종하여 더 작은 부피에서의 농도 변동을 피하고, DMSO 중의 1 mM 스톡 용액으로부터 바로 생성한 OTX015의 상이한 투여량으로 처리하였다. 세포를 MTT-검정을 위하여 96-웰 평판으로 옮겼다. 무처치 세포 및, OTX015의 희석에 사용된 DMSO(0.2-1%)의 동일량으로 처리한 세포를 대조군으로 사용하였다. 3-(4,5-디메틸티아졸-2-일)-2,5-디페닐테트라졸륨 브로마이드(MTT)(몰레큘라 프로브스(Molecular Probes), 미국 유진 소재)를 PBS 중의 5 ㎎/㎖의 스톡으로서 생성하였다. 그 후, 웰당 0.5 ㎎/㎖의 MTT 용액을 첨가하고, 암실에서 37℃에서 4 시간 동안 배양하였다. 그 후, 세포를 25% SDS 용해 완충액으로 용해시키고, 흡광도를 570 ㎚에서 읽었다. 2종의 독립 실험을 각각의 세포주에 대하여 실시하였다. GI50 값을 프리즘(Prism) v5 소프트웨어(그래프패드 인코포레이티드(GraphPad Inc.), 미국 라 호야 소재)로 계산하였다.
아포프토시스 평가: 환자 또는 세포주로부터 유래하는 총 1×106 세포를 1 ㎖ 배양 매체 중에서 재현탁시키고, DMSO 중의 1 mM 스톡 용액으로부터 바로 생성한 제시된 투여량의 OTX015와 함께 배양하였다. 대조용 세포를 해당 양의 디메틸 술폭시드(DMSO 0.2-1%)와 함께 배양하여 부형제의 독성을 배제시켰다. 아포프토시스 세포를 팩스캔(FACScan)(벡톤 디킨슨(Becton Dickinson), 미국 마운틴 뷰 소재)을 사용하는 혈구형광계 분석에 의하여 검출하였다. 제조업자의 지시사항에 따라 세포를 프로피듐 요오다이드(PI; 5 ㎍/㎖; 벡톤 디킨슨) 및 부수적으로 15 분 동안 실온에서 아넥신-V-FITC(벡톤 디킨슨)로 염색시켜 외막 포스파티딜 세린 노출을 측정하였다. 데이타를 플로우조(Flowjo)(트리 스타 인코포레이티드(Tree Star Inc.), 미국 애쉬랜드 소재) 흐름 세포측정 소프트웨어로 분석하였다.
세포 주기 분석: 통상의 세포-주기 분석의 경우, 1×106 세포를 수거하고, PBS 중에서 세정하고, 70% 빙냉 에탄올 중에서 고정시켰다. 세포를 100 ㎍/㎖ RNAse(시그마(Sigma), 프랑스 쌩-깡텡 팔라비예 소재)와 함께 배양시키고, PI(25 ㎍/㎖, 벡톤 디킨슨)로 염색한 후, 30 분 동안 37℃에서 배양하였다. 그 후, 세포-주기 분포를 혈구형광계 분석에 의하여 측정하였다. 데이타를 플로우조(트리 스타 인코포레이티드, 미국 애쉬랜드 소재) 흐름 세포측정 소프트웨어로 분석하였다.
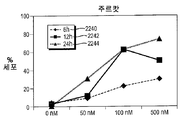
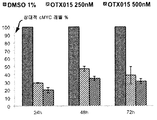
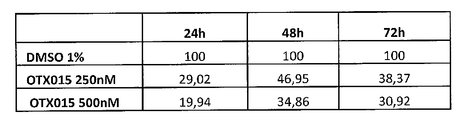
화합물 (1-1)은 상이한 시점에서 외막 포스파티딜세린 노출 및 프로피듐 요오다이드 혼입에 의하여 검출시 상이한 투여량의 약물로 처리한 3종의 ALL 세포주(주르캇, RS 4-11, TOM-1) 및 4종의 AML 세포주(HL60, K562, KG1 및 KG1a)에서의 아포프토시스를 야기하였다(도 13A-13C 및 도 14A-14D). 화합물 (1-1)은 K562 및 KGla 세포에서 더 적은 정도인 것을 제외하고, 테스트한 모든 세포주에서 아포프토시스를 야기하였다(도 14 B, D). 기타 모든 세포주에서, 세포의 50%는 100 nM의 화합물 (1-1)로 처리 후 12 내지 24 시간 이내에 아포프토시스 상태가 되었다.
게다가, 화합물 (1-1)은 모든 세포주에서 세포 주기 정지를 야기하였다(도 15A-15C). 아포프토시스 데이타는 K562, KG1a 및 TOM-1이 화합물 (1-1)로의 노출 후 세포 주기 분해에 덜 민감하였다는 것을 나타냈다. 더 낮은 투여량(10 nM)의 포뮬러 2는 연장된 배양, 즉 72 시간 후 아포프토시스를 야기하였다는 것이 중요하다(KG1 세포에서 테스트하고, 도 16에 도시한 바와 같음).
<표 7>
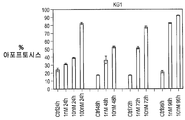
AML 및 ALL 세포주를 화합물 (1-1)의 증가하는 농도(0.1 nM-10 μM)에 노출시켰다. 증식중인 세포의 비율은 72 시간에서 MTT 검정에 의하여 측정하였으며, GI50 값을 5회 반복으로부터의 평균±SD로부터 프리즘 소프트웨어에 의하여 계산하였다. GI50 값을 3회의 독립 실험으로부터의 평균으로 나타냈다.
표 7에 제시한 바와 같이, 화합물 (1-1)은 도 39A-39C에 도시한 바와 같이 72 시간에서 외막 포스파티딜세린 노출 및 프로피듐 요오다이드 혼입에 의하여 검출된 바와 같이 이들 세포를 상이한 투여량의 화합물 (1-1)로 처리시 증가되는 투여량-의존성 방식으로 AML 세포주(KG1a 및 NOMO1 참조) 및 ALL 세포주(RS4-11, BV-173, 주르캇 및 TOM-1 참조)에서 아포프토시스를 야기하였다. AML 세포주 중에서, 2종(KG1 및 NOMO1)은 각각 198.3 및 229.1 nM의 GI50 값으로 민감성을 나타냈다. 2종의 세포주(HL60 및 KG1a)는 1.3 μM의 GI 값으로 덜 민감한 한편, K562는 11.3 μM의 GI50 값으로 내성이 있는 것으로 간주되었다. OTX015는 34.2-249.7 nM 사이의 GI50으로 모든 ALL 세포주에서의 세포 생육성의 투여량-의존성 감소를 야기하였다.
일반적으로, 화합물의 반 최고 억제 농도(IC-50 값)는 생물학적 또는 생화학적 기능을 억제하는데 있어서 화합물의 효과의 측정치이다. 그러므로, IC-50 값은 주어진 생물학적 과정을 절반(50%)까지 억제하는데 얼마나 많은 특정 약물 또는 임의의 화학적 물질이 요구되는지를 나타내는 정량적 측정값으로 간주할 수 있다. 그러나, 때때로 GI-50은 50% 성장 억제를 야기하는 농도에 대한 값을 상징화하는데 사용된다. GI-50의 사용은 시간 0에서의 세포 카운트에 대하여 보정한다는 것을 나타낸다. GI-50 값을 계산하기 위한 수학식의 일례는 테스트 화합물의 농도로서 GI-50을 정의하며, 100×(T-T0)/(C-T0)=50이며, 여기서 T는 테스트 약물에 48 시간 노출 후의 테스트 웰의 광학 밀도이며; T0은 시간 0에서의 테스트 웰의 광학 밀도이다.
게다가, 화합물 (1-1)은 거의 모든 세포주에서 S기 분획을 감소시켰다(도 40A-40H). 이러한 효과는 세포주에서의 G1에서의 축적과 함께 ALL 세포주 RS4-11 및 BV-173에서 뚜렷하였다.
실시예 9: 브로모도메인의 발현
브로모도메인의 발현은 정량적-실시간 폴리머라제 연쇄 반응(QT-PCR) 분석을 사용하여 상이한 세포주 및 환자 샘플 중에서 연구하였다. 페놀 및 구아니딘 이소티오시아네이트(상표명 트리졸(TRIzol)® 시약, 인비트로겐, 미국 뉴욕주 그랜드 아일랜드 소재)의 시약 용액을 사용한 추출후 얻은 총 RNA를 1 ㎍/㎕로 적정하고, -80℃에서 보관하였다. 상보성 DNA(cDNA)는 1 ㎍ RNA로부터 합성하였다. QT-PCR 반응은 써모사이클러 ABI 7900HT에서(100 ng의 RNA에 해당하는) cDNA의 10분의 1로부터 25 ㎕의 부피로 표준 모드(50℃에서 2 분-95℃에서 10 분의 1 주기에 이어서 95℃에서 15 초-6℃에서 1 분의 50 주기)로 수행하였다.
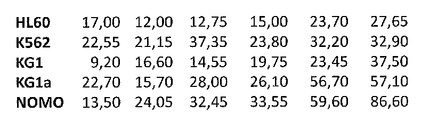
상이한 세포주는 QT-PCR에 의하여 검출시 상이한 레벨에서 발현된 BRD2, BRD3 및 BRD4를 발현시켰다(도 17A-17C). BRD4의 3종의 상이한 형태를 연구하였다: 공통 형태(BRD4c), 중간 형태 및 짧은 형태(BRD4s). 세포주에서 상이한 형태의 발현에 대한 차이는 존재하지 않았다. 아포프토시스 및 BRD 발현 사이에는 뚜렷한 상관관계가 없었다. AML 세포주 K562는 최저 발현 레벨을 가지며, 화합물 (1-1) 처리에 대하여 더 낮은 민감도를 가졌다. 유방암 세포주 MCF-7에 비하여 BRD 발현 레벨 사이에는 차이가 없었다. 매우 높은 레벨의 BRD가 제대 혈액으로부터의 선택된 CD34+ 세포에서 관찰되었다. BRD2, BRD3 및 BRD4의 발현은 환자 샘플에서 연구하였다. 환자 특징을 하기 표 8에 요약한다. ALL 환자 중에서, Ph+ ALL은 더 낮은 BRD 발현 레벨을 나타내는 반면, AML 환자에서의 BRD 발현 레벨은 더욱 불균질하였다(도 17A-17C).
<표 8>
BRD2, BRD3, BRD4 및 c-MYC의 하향조절을 야기하는지의 여부를 결정하기 위하여 화합물 (1-1)을 사용한 처치를 연구하였다. 종양유전자 c-MYC는 백혈병 유지에 대한 BRD4의 하류 파트너이다(Delmore, J. E, et al. Cell. 2011;146:904-917). 기타 작은 억제제, 예컨대 JQ1은 BRD4 하향조절 및 그 후 c-MYC 하향조절을 야기한다. 상이한 백혈병 세포주를 100 nM 포뮬러 2로 처치하고, 단백질 레벨에서 3 시간 이내에 c-MYC 하향조절과 관련된 BRD2, BRD3 및 BRD4의 신속한 하향조절이 관찰되었다(도 18A 및 18B). KG1 및 KGla에서 단백질 하향조절은 3 시간 이내에 TOM-1 세포(도 19A-19D)에 비하여 cDNA 감소(도 18A 및 18B)와 관련되지 않았다. 주르캇 및 RS 4-11 세포에서, BRD 2-4에 대한 cDNA는 초기에 하향조절되었으나, 3 시간 이전에 증가되었다(도 19A-19D). 결과는 포뮬러 2가 BRD2, BRD3, BRD4 및 c-MYC의 신속한 하향조절을 야기하였다는 것을 나타낸다.
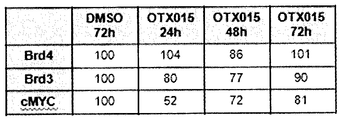
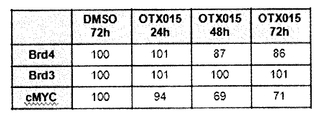
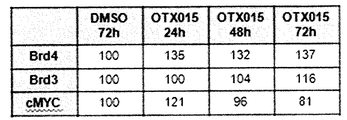
추가로 도 41A-41H에 도시한 바와 같이, 상이한 세포주는 최저 유전자 발현 레벨을 갖는 bcr-abl 유도된 세포주 BV-173 및 K562를 사용한 RQ-PCR에 의하여 검출된 바와 같이 불균질 레벨에서 BRD2, BRD3 및 BRD4를 발현시켰다(도 41A-41B). MTT, 아포프토시스 또는 세포 주기 정지를 비롯한 생물학적 효과 및 BRD 유전자 발현 사이에는 뚜렷한 상관관계가 없었다. 본 출원인은 48 시간에서 각각 250 nM 및 500 nM로 OTX015 처치에 의하여 cDNA 레벨에서 BRD4, BRD2 및 BRD3의 조정을 연구하였다. 본 출원인은 화합물 (1-1) 처리에 의하여 BRD4, BRD2 또는 BRD3(도 41C-41H)의 일정한 하향 조절을 검출할 수 없는 반면, KG1, K562 및 주르캇에서의 BRD3 및 BRD2의 상당한 상향조절 및, KG1 및 HL60에서의 BRD2의 증가가 검출되었다.
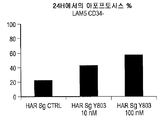
실시예 10: CD34+ 및 CD34- 세포에서 아포프토시스를 야기하는 화합물 (1-1)의 효능
1차 세포에서 아포프토시스를 야기하는 화합물 (1-1)의 효능을 연구하였다. CD34+ 및 CD34- 세포는 제대 혈액(건강한 대조군) 및 1명의 AML 환자로부터의 CD34+ 마이크로비드를 사용한 양성 선택에 의하여 얻었다. 통상의 면역표현형은 모세포 세포의 30%가 CD34+에 대하여 양성이었다는 것을 나타냈다. CD34+ 및 CD34- 제대 혈액 세포의 처리는 500 nM 투여량 레벨에서 미성숙 CD34+ 세포에 대한 독성을 입증하는 한편, 성숙한 구획은 영향을 받지 않은 채 유지되었다(도 20). CD34+ 및 CD34- AML 세포의 처리는 투여량 의존성 방식으로 아포프토시스의 시험관내 유도를 나타냈다.
화합물 (1-1)의 상이한 농도에서 24 시간에서 CD34-에 대한 아포프토시스 패턴은 도 32A-32C에 도시하였다.
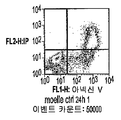
실시예 11: 화합물 (1-1)로의 짧은 노출 후의 아포프토시스
도 21A-21T는 화합물 (1-1)로의 짧은 노출 후 96 시간에서 아포프토시스를 나타냈다. HL60, KS62, 주르캇 및 RS4-11 세포는 화합물 (1-1)의 10 nM 및 100 nM로 각각 처리하였다. 세포를 6 시간(10 nM 및 100 nM) 및 24 시간(10 nM)에서 세정하고, 상청액을 버리고, 세포를 다시 새로운 배지에 파종하였다. 아포프토시스 세포를 96 시간에서(24 내지 72 시간은 도시하지 않음) FACS 분석에 의하여 평가하고, PI 흡수와 함께 또는 흡수 없이+아넥신 V로서 정의하였다. 2종의 실험 중 대표적인 실험 일례를 도 21A-21T에 도시한다.
실시예 12: 다양한 농도의 화합물 (1-1)에 노출 후 아포프토시스
도 22A-22L은 0 nM, 1 nM 및 및 10 nM의 화합물 (1-1)에 노출시 AML 세포주 HL60에서의 아포프토시스 데이타의 흐름 세포측정 분석을 도시한다. 도 23A, 23B 및 23C는 도 22A-22L의 HL60 세포주에 대한 아포프토시스를 도시한다.
화합물 (1-1)을 사용한 처리는 HL60 및 K562 세포에서 상당한 아포프토시스를 야기하였다(각각 도 24A 및 24B). 상당한 아포프토시스는 또한 KG1 및 KG1a 세포(도 25A 및 25B), 주르캇 및 RS4-11 세포(도 26A 및 26B) 및 TOM1 세포(도 27)에서 관찰되었다. K562는 화합물 (1-1)을 사용한 처리에 덜 민감하였으며, 20% 아포프토시스 세포는 24 시간에 관찰되었다. 1 및 10 nM 농도에서의 연장된 노출은 상이한 반응 패턴을 산출하였으며; 10 nM 단독에서의 96 시간의 노출후 HL60, KG1 및 주르캇 세포는 >90%, TOM-1은 70% 아포프토시스를 나타냈으며; 반대로, KG1a, MLL-융합 RS4-11 및 K562 세포는 더 낮은 아포프토시스(각각 45%, 30% 및 20%)를 나타낸 반면, 아포프토시스는 대조군에서 15% 내지 20%의 레벨에서 관찰되었다.
실시예 13: 약물 약효세척 후 아포프토시스
6 시간의 더 짧은 노출 후 약물 약효세척은 또한 민감성 HL60 및 주르캇 세포주에서 96 시간에서 상당히 지연된 아포프토시스와 관련되어 있으나(각각 도 28 및 29A, 29B), 덜 민감한 K562 및 RS4-11 세포주에서는 관련되어 있지 않다(도 30A 및 30B).
3종의 ALL 세포주에서의 MTT 검정 데이타는 도 31A 및 31B에 도시되어 있다.
실시예 14: 혈액 및 골수에서의 아포프토시스
도 33A-33G 및 34A-34B는 혈액 및 골수 세포의 다양한 농도의 화합물 (1-1)에 대한 아포프토시스를 도시한다.
실시예 15: c-MYC 역학
AML 및 ALL 세포주에서의 c-MYC 역학은 화합물 (1-1)을 사용한 처리시 측정하였으며, 도 35에 도시되어 있다. AML 및 ALL 세포주에서의 BRD4 역학은 또한 화합물 (1-1)을 사용한 처리시 측정하였으며, 도 36에 도시되어 있다. 도 37은 화합물 (1-1)을 사용한 처리시 AML 및 ALL 세포주에서의 BRD2 역학을 도시하였다. 도 38은 화합물 (1-1)을 사용한 처리시 AML 및 ALL 세포주에서의 BRD3 역학을 도시하였다.
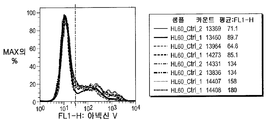
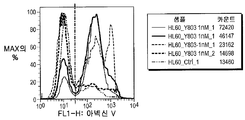
종양유전자 c-MYC는 BRD4에 의하여 활성화되므로 백혈병 유지에 중요한 것으로 생각된다. 기타 작은 BRD 억제제(즉 JQ1)는 상이한 설정에서 BRD4 하향조절에 이어서 c-MYC 하향조절을 야기하였다. 본 출원인은 상이한 백혈병 세포주에서 c-MYC의 기본 유전자 발현 레벨이 MTT, 아포프토시스 또는 세포 주기 효과에 대하여 화합물 (1-1)의 생물학적 효과에 대한 뚜렷한 상관관계 없이 불균질한 결과를 나타낸다는 것을 결정하였다(도 42A 및 42B). 이들 세포주를 250 nM 및 500 nM의 화합물 (1-1)로 처리하고, 48 시간에서 QT-PCR에 의하여 검출시 c-MYC 하향조절이 모든 세포주에서 관찰되었다(도 42C 및 42D).
BRDs 및 c-MYC 기본 유전자 발현의 뚜렷한 상관관계의 부재 및 RQ-PCR에 의하여 검출된 화합물 (1-1)에 의한 조정으로 인하여, 본 출원인은 BRD4, BRD2 및 BRD 3뿐 아니라 c-MYC에 대한 단백질 레벨에서 화합물 (1-1)의 잠재적 효과를 연구하였다.
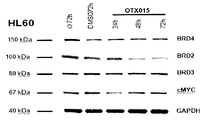
선택된 AML 세포주에서 HL60 BRD4 및 BRD3은 24 시간 처리 후 관찰된 c-MYC의 일시적 하향조절을 사용한 500 nM에서 72 시간 화합물 (1-1) 노출 후 영향을 받지 않은 채 유지된 반면(도 43A-43C), 거의 내성인 AML 세포주 K562는 24 시간 노출 후 출발한 BRD4, BRD3 및 c-MYC의 하향조절을 나타냈다(도 43D-43F). 민감성 ALL 세포주의 경우, 주르캇은 48 시간 및 72 시간에서 c-MYC 하향조절을 나타내는 한편(도 43G-43I), BRD4, BRD3 및 c-MYC는 RS4-11에서 영향을 받지 않은 채 유지되었다(도 43J-43L).
실시예 16: 면역블롯
단백질 추출물은 7×106 세포로부터 생성하였으며; 30 ㎍을 나트륨 도데실 술페이트(SDS)-폴리아크릴아미드 겔 위에서 4-15% 구배 겔(바이오-래드(Bio-Rad), 프랑스 마흔느-라-꼬께뜨 소재)을 사용하여 분리하고, 미니 트랜스-블롯(Mini Trans-Blot) 전기영동 전사 셀(바이오-래드)을 사용하여 니트로셀룰로오스 막으로 옮겼다. 막을 리코르 차단 완충액(리코르, 미국 네브래스카주 링컨 소재)으로 차단시키고, 각각의 1차 항체로 배양하였다: 항-BRD4(에피토믹스(Epitomics) 5716-1, 미국 벌링게임 소재), 항-BRD3(ab56342, 앱캠(AbCam), 영국 소재), 항-BRD2(ab37633, 앱캠, 영국 소재), 항 c-MYC(sc-764(N262), 미국 산타크루즈 소재) 및 항-GAPDH(인비트로겐 398600, 미국 그랜드 아일랜드 소재). 블롯을 염소 항-토끼 InfraRedDye 680RD 또는 염소 항-마우스 InfraRedDye 800CW 2차 항체(리코르)로 염색하였다. 리코르 오디세이 스캐너를 사용하여 막을 영상화하였다. 각각의 관심 밴드 주위에 박스를 수동으로 배치하고, 미가공 강도의 근적외선 형광 값으로 되돌리고, 레인내 배경은 오디세이 3.0 분석 소프트웨어(리코르)를 사용하여 뺐다.
BRD2에 대한 블롯은 염소(BRD2) 항-토끼 퍼옥시다제-표지된 또는 염소 항-마우스(GAPDH) 퍼옥시다제-표지된 2차 항체(바이오래드(Biorad), 미국 허큘레스 소재)로 염색시키고, 향상된 화학발광 검출계(ECL 및 ECL 플러스, 지이 헬쓰케어(GE Healthcare), 영국 버킹엄셔 소재)를 사용하여 판명하였다.
실시예 17: 정량적-실시간 폴리머라제 연쇄 반응( RQ - PCR )
트리졸(인비트로겐, 미국 그랜드 아일랜드 소재)을 사용한 추출 후 얻은 총 RNA를 1 ㎍/㎕로 적정하고, -80℃에서 보관하였다. 상보성 DNA(cDNA)는 1 ㎍ RNA로부터 합성하였다. RQ-PCR 반응(BRD2, BRD3, BRD4, c-MYC 및 ABL)은 써모사이클러 ABI7900HT에서 (100 ng의 RNA에 해당하는) cDNA의 10분의 1로부터 25 ㎕의 부피로 표준 모드(50℃에서 2 분-95℃에서 10 분의 1 주기에 이어서 95℃에서 15 초-60℃에서 1 분의 50 주기)로 수행하였다. 사용된 프라이머는 하기 표 9에 요약한다.
<표 9>
실시예 18: 1차 세포에서의 화합물 (1-1)의 효과
본 출원인은 1차 환자 세포에서의 화합물 (1-1)의 효과를 추가로 연구하였다. 본 출원인은 AML 환자로부터의 5종의 샘플 및 1 ALL Ph+ 환자를 포함한 2종의 ALL을 생체외 처리하였다. 환자 특징은 도 44D에 도시한다. 화합물 (1-1)은 1차 AML 환자 샘플에서 35-85% 범위의 다양한 정도에서 아포프토시스를 야기하였다(도 44A-44C). Ph+ ALL 환자는 내성이 있는 것으로 나타났다.
환자 샘플에서의 BRD2, BRD3 및 BRD4의 기본 유전자 발현은 RQ-PCR 분석에 의하여 평가하였다. 환자 특징을 하기 표 10에 요약한다. ALL 환자 중에서, Ph+ ALL은 더 낮은 BRD 발현 레벨을 나타내는 반면(도 47A 및 47B; 환자 3 내지 6), AML 환자에서의 BRD 발현 레벨은 더욱 불균질하였다(도 47C 및 47D).
<표 10>
단백질 추출물은 각각의 250 및 500 nM의 OTX015을 사용한 생체외 처리시 환자 5의 BM 세포로부터 얻을 수 있다(표 10; 도 44). 이들 세포는 OTX015에 72 시간 노출 후 c-MYC의 하향조절을 나타냈다(도 45A-45C).
당업자는 본 발명의 광의의 개념으로부터 벗어남이 없이 상기 제시 및 기재된 예시의 실시양태를 변경시킬 수 있다는 것을 숙지할 것이다. 그러므로, 본 발명은 제시 및 기재된 예시의 실시양태로 한정되지 않지만, 청구범위에 의하여 정의된 바와 같은 본 발명의 정신 및 범주내에서 변형을 포함시키고자 하는 것으로 이해한다. 예를 들면, 예시의 실시양태의 특정한 특징은 청구된 발명의 일부가 될 수 있거나 또는 일부가 될 수 없으며, 개시된 실시양태의 특징은 조합될 수 있다. 본원에서 구체적으로 명시하지 않는다면, 용어 "하나의" 및 "상기"("a", "an" 및 "the")는 하나의 요소로 한정되지 않으며, 그 대신 "하나 이상"으로서 읽어야만 한다.
본 발명의 도면 및 기재의 적어도 일부는 명확성을 위하여 당업자가 또한 본 발명의 일부를 포함할 수 있는 기타 요소를 제외하면서 본 발명의 명확한 이해를 위하여 관련되어 있는 요소에 집중하기 위하여 단순화된 것으로 이해하여야 한다. 그러나, 상기 요소는 당업계에 공지되어 있으며, 이들은 본 발명의 더 나은 이해를 반드시 돕지는 않으므로 상기 요소의 기재는 본원에 제공하지 않는다.
추가로, 방법이 본원에 명시된 단계의 특정한 순서에 의존하는 정도로, 단계의 특정한 순서를 청구범위를 한정하는 것으로 간주하여서는 안 된다. 본 발명의 방법에 관한 청구항은 기재된 순서로 그의 단계의 수행을 한정하지 않아야 하며, 당업자는 그러한 단계가 변경될 수 있으며, 여전히 본 발명의 정신 및 범주에 속한다는 것을 숙지할 수 있다.
Claims (24)
- 하기 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물 또는 그의 약학적으로 허용가능한 염 또는 그의 수화물 또는 용매화물을 포함하는 조성물의 약학적 허용량을 환자에게 투여하는 단계를 포함하는 급성 림프구성 백혈병의 치료 방법으로서, 티에노트리아졸로디아제핀 화합물이 비정질 티에노트리아졸로디아제핀 화합물 및 약학적으로 허용가능한 중합체를 포함하는 고형 분산물로서 형성되며, 고형 분산물이 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타내는, 급성 림프구성 백혈병의 치료 방법:
<화학식 1>
상기 R1은 1-4의 탄소수를 갖는 알킬이고, 상기 R2는 수소 원자; 할로겐 원자; 또는 할로겐 원자 또는 하이드록실기에 의하여 임의로 치환된 1-4의 탄소수를 갖는 알킬이고, 상기 R3는 할로겐 원자; 할로겐 원자, 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시 또는 시아노에 의하여 임의로 치환된 페닐; -NR5-(CH2)m-R6, 상기 R5는 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, m은 0-4의 정수이며, 상기 R6은 할로겐 원자에 의하여 임의로 치환된 페닐 또는 피리딜임; 또는 -NR7-CO-(CH2)n-R8이고, 상기 R7은 수소 원자 또는 1-4의 탄소수를 갖는 알킬이며, n은 0-2의 정수이며, 상기 R8은 할로겐 원자에 의하여 임의로 치환된 페닐 또는 피리딜임, 상기 R4는 -(CH2)a-CO-NH-R9, a는 1-4의 정수이며, R9는 1-4의 탄소수를 갖는 알킬; 1-4의 탄소수를 갖는 하이드록시알킬; 1-4의 탄소수를 갖는 알콕시; 또는 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시, 아미노 또는 하이드록실기 에 의하여 임의로 치환된 페닐 또는 피리딜임, 또는 -(CH2)b-COOR10이고, b는 1-4의 정수이며, 상기 R10은 1-4의 탄소수를 갖는 알킬이다. - 제1항에 있어서, 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물이 (i) (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로-[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 또는 그의 이수화물, (ii) 메틸 (S)-{4-(3'-시아노비페닐-4-일)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트, (iii) 메틸 (S)-{2,3,9-트리메틸-4-(4-페닐아미노페닐)-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트; 및 (iv) 메틸 (S)-{2,3,9-트리메틸-4-[4-(3-페닐프로피오닐아미노)페닐]-6H-티에노[3,2-f-][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트로 이루어진 군으로부터 독립적으로 선택되는 치료 방법.
- 제2항에 있어서, 티에노트리아졸로디아제핀 화합물이 (S)-2-(4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일)-N-(4-하이드록시페닐)아세트아미드 이수화물인 치료 방법.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 약학적으로 허용가능한 중합체가 1:3 내지 1:1의 중량비의 티에노트리아졸로디아제핀 화합물 대 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트(HPMCAS)를 갖는 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트인 치료 방법.
- 제4항에 있어서, 고형 분산물이 약 130℃ 내지 약 140℃ 범위의 단일 유리 전이 온도(Tg) 변곡점을 나타내는 치료 방법.
- 하기 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물 또는 그의 약학적으로 허용가능한 염 또는 그의 수화물 또는 용매화물을 포함하는 조성물의 약학적 허용량을 환자에게 투여하는 단계를 포함하는 급성 골수성 백혈병의 치료 방법으로서, 티에노트리아졸로디아제핀 화합물이 비정질 티에노트리아졸로디아제핀 화합물 및 약학적으로 허용가능한 중합체를 포함하는 고형 분산물로서 형성되며, 고형 분산물이 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타내는, 급성 골수성 백혈병의 치료 방법:
<화학식 1>
상기 R1은 1-4의 탄소수를 갖는 알킬이고, 상기 R2는 수소 원자; 할로겐 원자; 또는 할로겐 원자 또는 하이드록실기에 의하여 임의로 치환된 1-4의 탄소수를 갖는 알킬이고, 상기 R3는 할로겐 원자; 할로겐 원자, 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시 또는 시아노에 의하여 임의로 치환된 페닐; -NR5-(CH2)m-R6, 상기 R5는 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, m은 0-4의 정수이며, 상기 R6은 할로겐 원자에 의하여 임의로 치환된 페닐 또는 피리딜임; 또는 -NR7-CO-(CH2)n-R8이고, 상기 R7은 수소 원자 또는 1-4의 탄소수를 갖는 알킬이며, n은 0-2의 정수이며, 상기 R8은 할로겐 원자에 의하여 임의로 치환된 페닐 또는 피리딜임, 상기 R4는 -(CH2)a-CO-NH-R9, a는 1-4의 정수이며, R9는 1-4의 탄소수를 갖는 알킬; 1-4의 탄소수를 갖는 하이드록시알킬; 1-4의 탄소수를 갖는 알콕시; 또는 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시, 아미노 또는 하이드록실기 에 의하여 임의로 치환된 페닐 또는 피리딜임, 또는 -(CH2)b-COOR10이고, b는 1-4의 정수이며, 상기 R10은 1-4의 탄소수를 갖는 알킬이다. - 제6항에 있어서, 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물이 (i) (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 또는 그의 이수화물, (ii) 메틸 (S)-{4-(3'-시아노비페닐-4-일)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트, (iii) 메틸 (S)-{2,3,9-트리메틸-4-(4-페닐아미노페닐)-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트; 및 (iv) 메틸 (S)-{2,3,9-트리메틸-4-[4-(3-페닐프로피오닐아미노)페닐]-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트로 이루어진 군으로부터 독립적으로 선택되는 치료 방법.
- 제6항에 있어서, 티에노트리아졸로디아제핀 화합물이 (S)-2-(4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일)-N-(4-하이드록시페닐)아세트아미드 이수화물인 치료 방법.
- 제6항 내지 제8항 중 어느 한 항에 있어서, 약학적으로 허용가능한 중합체가 1:3 내지 1:1의 중량비의 티에노트리아졸로디아제핀 화합물 대 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트(HPMCAS)를 갖는 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트인 치료 방법.
- 제9항에 있어서, 고형 분산물이 약 130℃ 내지 약 140℃ 범위의 단일 유리 전이 온도(Tg) 변곡점을 나타내는 치료 방법.
- 하기 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물 또는 그의 약학적으로 허용가능한 염 또는 그의 수화물 또는 용매화물을 포함하는 조성물의 약학적 허용량을 환자에게 투여하는 단계를 포함하는 BCR-ABL 양성 급성 림프구성 백혈병의 치료 방법:
<화학식 1>
상기 R1은 1-4의 탄소수를 갖는 알킬이고, 상기 R2는 수소 원자; 할로겐 원자; 또는 할로겐 원자 또는 하이드록실기에 의하여 임의로 치환된 1-4의 탄소수를 갖는 알킬이고, 상기 R3는 할로겐 원자; 할로겐 원자, 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시 또는 시아노에 의하여 임의로 치환된 페닐; -NR5-(CH2)m-R6, 상기 R5는 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, m은 0-4의 정수이며, 상기 R6은 할로겐 원자에 의하여 임의로 치환된 페닐 또는 피리딜임; 또는 -NR7-CO-(CH2)n-R8이고, 상기 R7은 수소 원자 또는 1-4의 탄소수를 갖는 알킬이며, n은 0-2의 정수이며, 상기 R8은 할로겐 원자에 의하여 임의로 치환된 페닐 또는 피리딜임, 상기 R4는 -(CH2)a-CO-NH-R9, a는 1-4의 정수이며, R9는 1-4의 탄소수를 갖는 알킬; 1-4의 탄소수를 갖는 하이드록시알킬; 1-4의 탄소수를 갖는 알콕시; 또는 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시, 아미노 또는 하이드록실기 에 의하여 임의로 치환된 페닐 또는 피리딜임, 또는 -(CH2)b-COOR10이고, b는 1-4의 정수이며, 상기 R10은 1-4의 탄소수를 갖는 알킬이다. - 제11항에 있어서, 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물이 (i) (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로-[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 또는 그의 이수화물, (ii) 메틸 (S)-{4-(3'-시아노비페닐-4-일)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트, (iii) 메틸 (S)-{2,3,9-트리메틸-4-(4-페닐아미노페닐)-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트; 및 (iv) 메틸 (S)-{2,3,9-트리메틸-4-[4-(3-페닐프로피오닐아미노)페닐]-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트로 이루어진 군으로부터 독립적으로 선택되는 치료 방법.
- 제12항에 있어서, 티에노트리아졸로디아제핀 화합물이 (S)-2-(4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일)-N-(4-하이드록시페닐)아세트아미드 이수화물인 치료 방법.
- 제11항 내지 제13항 중 어느 한 항에 있어서, 티에노트리아졸로디아제핀 화합물이 화학식 1의 비정질 티에노트리아졸로디아제핀 화합물 및 그의 약학적으로 허용가능한 염 또는 그의 수화물; 및 약학적으로 허용가능한 중합체를 포함하는 고형 분산물로서 형성되는 치료 방법.
- 제14항에 있어서, 고형 분산물이 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타내는 치료 방법.
- 제15항에 있어서, 약학적으로 허용가능한 중합체가 1:3 내지 1:1의 중량비의 티에노트리아졸로디아제핀 화합물 대 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트(HPMCAS)를 갖는 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트인 치료 방법.
- 제16항에 있어서, 고형 분산물이 약 130℃ 내지 약 140℃ 범위의 단일 유리 전이 온도(Tg) 변곡점을 나타내는 치료 방법.
- 하기 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물 또는 그의 약학적으로 허용가능한 염 또는 그의 수화물 또는 용매화물을 포함하는 조성물의 약학적 허용량을 환자에게 투여하는 단계를 포함하는, CD34 양성 급성 골수성 백혈병의 치료 방법:
<화학식 1>
상기 R1은 1-4의 탄소수를 갖는 알킬이고, 상기 R2는 수소 원자; 할로겐 원자; 또는 할로겐 원자 또는 하이드록실기에 의하여 임의로 치환된 1-4의 탄소수를 갖는 알킬이고, 상기 R3는 할로겐 원자; 할로겐 원자, 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시 또는 시아노에 의하여 임의로 치환된 페닐; -NR5-(CH2)m-R6, 상기 R5는 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, m은 0-4의 정수이며, 상기 R6은 할로겐 원자에 의하여 임의로 치환된 페닐 또는 피리딜임; 또는 -NR7-CO-(CH2)n-R8이고, 상기 R7은 수소 원자 또는 1-4의 탄소수를 갖는 알킬이며, n은 0-2의 정수이며, 상기 R8은 할로겐 원자에 의하여 임의로 치환된 페닐 또는 피리딜임, 상기 R4는 -(CH2)a-CO-NH-R9, a는 1-4의 정수이며, R9는 1-4의 탄소수를 갖는 알킬; 1-4의 탄소수를 갖는 하이드록시알킬; 1-4의 탄소수를 갖는 알콕시; 또는 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시, 아미노 또는 하이드록실기 에 의하여 임의로 치환된 페닐 또는 피리딜임, 또는 -(CH2)b-COOR10이고, b는 1-4의 정수이며, 상기 R10은 1-4의 탄소수를 갖는 알킬이다. - 제18항에 있어서, 화학식 1로 표시되는 티에노트리아졸로디아제핀 화합물이 (i) (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 또는 그의 이수화물, (ii) 메틸 (S)-{4-(3'-시아노비페닐-4-일)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트, (iii) 메틸 (S)-{2,3,9-트리메틸-4-(4-페닐아미노페닐)-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트; 및 (iv) 메틸 (S)-{2,3,9-트리메틸-4-[4-(3-페닐프로피오닐아미노)페닐]-6H-티에노[3,2-f-][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트로 이루어진 군으로부터 독립적으로 선택되는 치료 방법.
- 제18항에 있어서, 티에노트리아졸로디아제핀 화합물이 (S)-2-(4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일)-N-(4-하이드록시페닐)아세트아미드 이수화물인 치료 방법.
- 제18항 내지 제20항 중 어느 한 항에 있어서, 티에노트리아졸로디아제핀 화합물이 화학식 1의 비정질 티에노트리아졸로디아제핀 화합물 및 그의 약학적으로 허용가능한 염 또는 그의 수화물; 및 약학적으로 허용가능한 중합체를 포함하는 고형 분산물로서 형성되는 치료 방법.
- 제21항에 있어서, 고형 분산물이 화학식 1의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X선 분말 회절 패턴을 나타내는 치료 방법.
- 제22항에 있어서, 약학적으로 허용가능한 중합체가 1:3 내지 1:1의 중량비의 티에노트리아졸로디아제핀 화합물 대 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트(HPMCAS)를 갖는 하이드록시프로필메틸셀룰로오스 아세테이트 숙시네이트인 치료 방법.
- 제23항에 있어서, 고형 분산물이 약 130℃ 내지 약 140℃ 범위의 단일 유리 전이 온도(Tg) 변곡점을 나타내는 치료 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361861291P | 2013-08-01 | 2013-08-01 | |
| US61/861,291 | 2013-08-01 | ||
| US201361863118P | 2013-08-07 | 2013-08-07 | |
| US61/863,118 | 2013-08-07 | ||
| PCT/EP2014/066629 WO2015014998A1 (en) | 2013-08-01 | 2014-08-01 | Pharmaceutical formulation containing thienotriazolodiazepine compounds |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20160036591A true KR20160036591A (ko) | 2016-04-04 |
Family
ID=51260882
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167004843A KR20160036591A (ko) | 2013-08-01 | 2014-08-01 | 티에노트리아졸로디아제핀 화합물을 함유하는 약학적 제제 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US9795612B2 (ko) |
| EP (1) | EP3027194A1 (ko) |
| JP (1) | JP6453877B2 (ko) |
| KR (1) | KR20160036591A (ko) |
| CN (1) | CN106029077A (ko) |
| WO (1) | WO2015014998A1 (ko) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015078929A1 (en) * | 2013-11-27 | 2015-06-04 | Oncoethix Sa | Method of treating leukemia using pharmaceutical formulation containing thienotriazolodiazepine compounds |
| US9956228B2 (en) * | 2014-05-02 | 2018-05-01 | Oncoethix Gmbh | Method of treating acute myeloid leukemia and/or acute lymphoblastic leukemia using thienotriazolodiazepine compounds |
| EP3185871A1 (en) * | 2014-08-28 | 2017-07-05 | Oncoethix GmbH | Methods of treating acute myeloid leukemia or acute lymphoid leukemia using pharmaceutical compositions containing thienotriazolodiazepine compounds |
| WO2016156905A1 (en) * | 2015-04-03 | 2016-10-06 | Oncoethix Gmbh | Pharmaceutical doses for a bromodomain and extraterminal protein (bet) inhibitor |
| US10683305B2 (en) | 2015-04-27 | 2020-06-16 | Concert Pharmaceuticals, Inc. | Deuterated OTX-015 |
| EP3658123A4 (en) * | 2017-07-24 | 2021-04-28 | Acryspharm LLC | PHARMACEUTICAL COMPOSITIONS WITH HIGH ACTIVE INGREDIENT LOAD |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DK0989131T3 (da) * | 1996-09-13 | 2003-03-03 | Mitsubishi Pharma Corp | Thienotriazolodiazepinforbindelser og deres medicinske anvendelse |
| KR100838686B1 (ko) * | 2000-06-16 | 2008-06-16 | 미쯔비시 웰 파마 가부시키가이샤 | 방출 pH 범위 및/또는 속도 제어 조성물 |
| CA2615455A1 (en) * | 2005-07-15 | 2007-01-25 | Bristol-Myers Squibb Company | Methods of identifying and treating individuals exhibiting mutant src kinase polypeptides |
| JP2010517510A (ja) * | 2007-01-09 | 2010-05-27 | ブリストル−マイヤーズ スクイブ カンパニー | 前立腺細胞中のタンパク質チロシンキナーゼおよび/またはタンパク質チロシンキナーゼ経路と相互作用しかつ/またはそれを調節する化合物の活性を予測するためのポリヌクレオチドの同定 |
| EP2239264A4 (en) * | 2007-12-28 | 2012-01-11 | Mitsubishi Tanabe Pharma Corp | ANTITUMOR AGENT |
| CA2746220A1 (en) * | 2008-12-08 | 2010-07-08 | Vm Pharma Llc | Compositions of protein receptor tyrosine kinase inhibitors |
| EP2569429A4 (en) * | 2010-05-14 | 2013-09-25 | Dana Farber Cancer Inst Inc | COMPOSITIONS AND METHOD OF METABOLIC MODULATION |
| WO2011143660A2 (en) | 2010-05-14 | 2011-11-17 | Dana-Farber Cancer Institute, Inc. | Compositions and methods for treating leukemia |
| WO2012075456A1 (en) * | 2010-12-02 | 2012-06-07 | Constellation Pharmaceuticals | Bromodomain inhibitors and uses thereof |
| AR084070A1 (es) * | 2010-12-02 | 2013-04-17 | Constellation Pharmaceuticals Inc | Inhibidores del bromodominio y usos de los mismos |
| CA2877434A1 (en) * | 2012-06-25 | 2014-01-03 | Oncoethix Sa | Method of treating lymphoma using thienotriazolodiazepine compounds |
| CN104968334B (zh) | 2012-09-28 | 2018-09-14 | 翁科埃斯克斯有限公司 | 包含噻吩并三唑并二氮杂卓化合物的药物制剂 |
| WO2015078929A1 (en) * | 2013-11-27 | 2015-06-04 | Oncoethix Sa | Method of treating leukemia using pharmaceutical formulation containing thienotriazolodiazepine compounds |
-
2014
- 2014-08-01 CN CN201480052842.XA patent/CN106029077A/zh active Pending
- 2014-08-01 EP EP14745163.7A patent/EP3027194A1/en not_active Withdrawn
- 2014-08-01 WO PCT/EP2014/066629 patent/WO2015014998A1/en active Application Filing
- 2014-08-01 US US14/908,626 patent/US9795612B2/en not_active Expired - Fee Related
- 2014-08-01 KR KR1020167004843A patent/KR20160036591A/ko not_active Application Discontinuation
- 2014-08-01 JP JP2016530548A patent/JP6453877B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2016525563A (ja) | 2016-08-25 |
| JP6453877B2 (ja) | 2019-01-16 |
| EP3027194A1 (en) | 2016-06-08 |
| US20160158245A1 (en) | 2016-06-09 |
| WO2015014998A1 (en) | 2015-02-05 |
| CN106029077A (zh) | 2016-10-12 |
| US9795612B2 (en) | 2017-10-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20160037201A (ko) | Bet-브로모도메인 억제제를 사용한 미만성 거대 b-세포 림프종 (dlbcl)의 치료 방법 | |
| JP6453877B2 (ja) | チエノトリアゾロジアゼピン化合物を含む医薬製剤 | |
| KR20150100613A (ko) | 티에노트리아졸로디아제핀 화합물을 함유하는 약제학적 제제 | |
| KR20160079823A (ko) | 티에노트리아졸로디아제핀 화합물을 함유하는 제약 제제를 사용하여 백혈병을 치료하는 방법 | |
| WO2015169953A1 (en) | Method of treating glioma using thienotriazolodiazepine compounds | |
| JP2017519727A (ja) | チエノトリアゾロジアゼピン化合物を用いる三種陰性乳癌の治療方法 | |
| JP2017514909A (ja) | チエノトリアゾロジアゼピン化合物を用いる急性骨髄性白血病及び/又は急性リンパ芽球性白血病の治療方法 | |
| WO2015018520A1 (en) | A bet-brd inhibitor represents a novel agent for alk positive anaplastic large cell lymphoma | |
| KR20170044172A (ko) | 티에노트리아졸로디아제핀 화합물을 함유하는 약학적 조성물을 사용하여 급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 방법 | |
| KR20170002550A (ko) | 티에노트리아졸로디아제핀 화합물을 사용한 내성 비호지킨 림프종, 수아세포종, 및/또는 alk+ 비소세포 폐암의 치료 방법 | |
| JP2017517579A (ja) | チエノトリアゾロジアゼピン化合物を用いる非小細胞肺癌及び/又は小細胞肺癌の治療方法 | |
| KR20160079822A (ko) | 티에노트리아졸로디아제핀 화합물을 함유하는 제약 제제를 사용하여 비소세포성 폐암을 치료하는 방법 | |
| KR20170037670A (ko) | 티에노트리아졸로디아제핀 화합물을 사용한 림프종의 치료 방법 | |
| WO2015168587A1 (en) | Method of treating resistant multiple myeloma and mantle cell lymphoma using thienotriazolodiazepine compounds |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Withdrawal due to no request for examination |