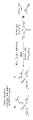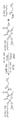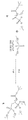KR20140064917A - H-포스포네이트-엔/-인 히드로포스포닐화 반응을 이용한 표적화된 나노입자의 원격 어셈블리 - Google Patents
H-포스포네이트-엔/-인 히드로포스포닐화 반응을 이용한 표적화된 나노입자의 원격 어셈블리 Download PDFInfo
- Publication number
- KR20140064917A KR20140064917A KR1020147007933A KR20147007933A KR20140064917A KR 20140064917 A KR20140064917 A KR 20140064917A KR 1020147007933 A KR1020147007933 A KR 1020147007933A KR 20147007933 A KR20147007933 A KR 20147007933A KR 20140064917 A KR20140064917 A KR 20140064917A
- Authority
- KR
- South Korea
- Prior art keywords
- agent
- group
- compound
- nanoparticles
- agents
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/56—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule
- A61K47/59—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyureas or polyurethanes
- A61K47/60—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyureas or polyurethanes the organic macromolecular compound being a polyoxyalkylene oligomer, polymer or dendrimer, e.g. PEG, PPG, PEO or polyglycerol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic System
- C07F9/02—Phosphorus compounds
- C07F9/28—Phosphorus compounds with one or more P—C bonds
- C07F9/38—Phosphonic acids RP(=O)(OH)2; Thiophosphonic acids, i.e. RP(=X)(XH)2 (X = S, Se)
- C07F9/40—Esters thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/548—Phosphates or phosphonates, e.g. bone-seeking
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6905—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a colloid or an emulsion
- A61K47/6911—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a colloid or an emulsion the form being a liposome
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/0004—Screening or testing of compounds for diagnosis of disorders, assessment of conditions, e.g. renal clearance, gastric emptying, testing for diabetes, allergy, rheuma, pancreas functions
- A61K49/0006—Skin tests, e.g. intradermal testing, test strips, delayed hypersensitivity
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic System
- C07F9/02—Phosphorus compounds
- C07F9/28—Phosphorus compounds with one or more P—C bonds
- C07F9/38—Phosphonic acids RP(=O)(OH)2; Thiophosphonic acids, i.e. RP(=X)(XH)2 (X = S, Se)
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Dispersion Chemistry (AREA)
- Dermatology (AREA)
- Toxicology (AREA)
- Immunology (AREA)
- Biomedical Technology (AREA)
- Diabetes (AREA)
- Endocrinology (AREA)
- Gastroenterology & Hepatology (AREA)
- Pathology (AREA)
- Rheumatology (AREA)
- Urology & Nephrology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
본 발명은, 예를 들어 표적화된 약물 전달 응용을 위한 나노입자의 개질 능력을 향상시키는 포스포네이트 화합물 및 포스포네이트 화합물의 제조 방법을 제공한다.
Description
관련 출원의 상호 참조
본원은, 전체 내용이 본원에 참조로 도입되는 2011년 8월 31일에 출원된 미국 가출원 번호 61/529,665에 대한 우선권의 이익을 청구한다.
정부 지원 연구 개발 하에 수행된 발명에 대한 권리에 관한 진술
해당 없음
컴팩트 디스크로 제출된 "서열 목록", 표 또는 컴퓨터 프로그램 목록 첨부물에 대한 참조
해당 없음
배경기술
현재, 치료제 및 진단제의 대부분은 환자에게 전신 투여된다. 불행하게도, 현행 전달 방법은, 치료제의 감소된 효능 뿐만 아니라 예를 들어 환자에서의 비-표적 부위에서의 약물 활성화로 인한 부작용을 비롯한 여러 단점을 가질 수 있다. 일부 이들 문제점을 해결하기 위한 노력에 있어, 진단제 및 치료제와 회합된 나노입자의 표적화 전달은 유망한 새로운 약물 전달 방식을 제공한다. 일부 약물 전달 방법의 경우, 리포솜과 같은 나노입자는 리포솜의 표면에 부착되는 표적화제를 사용하여 세포 표면 수용체를 표적화할 수 있다. 예를 들어, ανβ3 인테그린 수용체는 흔히 활성화된 내피 세포 상에서 상향 조절되고, 나노입자의 표면에 적합한 RGD 리간드를 도입함으로써 표적화될 수 있다 (문헌 [Dubey et al., "RGD-modified liposomes for tumor targeting" in Amiji, M.M., Ed. Nanotechnology for Cancer Therapy, CRC Press (2007), pp. 643-661)].
표적화된 약물 전달 방법을 개발하는 데 있어 최근에 일부 진보가 있었지만, 추가의 개선에 대한 필요성이 여전히 존재한다. 예를 들어, 표적화된 나노입자로의 나노입자의 변형 방법은 제한적이며, 일반적으로 나노입자 개질에 대해 불충분한 유연성을 제공한다. 또한, 나노입자의 개질에 사용될 수 있는 화합물에는, 예를 들어 나노입자 표면 특성 또는 진단 적합성을 변화시키는 것에 대한 충분한 범위의 기능이 허락되지 않는다. 본 발명은 이들 및 다른 필요성을 해결한다.
발명의 간단한 요약
본 발명은, 예를 들어 표적화된 약물 전달 응용을 위한 나노입자의 개질 능력을 향상시키는 포스포네이트 화합물 및 포스포네이트 화합물의 제조 방법을 제공한다.
본 발명의 하나의 측면에서, 본 발명의 화합물은 하기 화학식의 화합물을 포함할 수 있다.
상기 식에서, R1, R2, R3, R4, L1, L2, 및 L3은 각각 하기에서 보다 상세히 더 설명된다.
또 다른 측면에서, 본 발명은 하기 포스포네이트 화합물의 제조 방법을 포함하고, 본 방법은,
촉매의 존재 하에서, 화학식:
을 갖는 H-포스포네이트 화합물을, 화학식:
을 갖는 알킨 화합물과 조합하여, 화학식:
을 갖는 포스포네이트 화합물을 형성하는 것을 포함한다.
상기 식에서, 본 발명의 H-포스포네이트 화합물, 알킨 화합물, 및 포스포네이트 화합물은 하기에서 보다 상세히 설명된다.
또한 또 다른 측면에서, 본 발명의 화합물은 하기 화학식의 화합물을 포함할 수 있다.
상기 식에서, L1, L2, L4, R1 및 R2는 각각 하기에서 보다 상세히 더 설명된다.
또한 또 다른 측면에서, 본 발명은 연결 스캐폴드(linking scaffold)를 갖는 포스포네이트 화합물의 제조 방법을 포함하고, 상기 방법은,
촉매의 존재 하에서, 화학식:
을 갖는 H-포스포네이트 화합물을, 화학식:
을 갖는 알킨 화합물과 조합하여, 화학식:
을 갖는 포스포네이트 화합물을 형성하는 것을 포함한다.
상기 식에서, 본 발명의 H-포스포네이트 화합물, 알킨 화합물, 및 연결 스캐폴드를 갖는 포스포네이트 화합물은 하기에서 보다 상세히 설명된다.
본 발명의 포스포네이트 화합물 및 그의 제조 방법은, 약물 전달 및 진단 영상 분야에 대해 수많은 독특한 측면을 제공한다. 예를 들어, 본 발명은, 비-표적화된 나노입자의 표적화된 나노입자로의 변형을 용이하게 할 수 있는 화합물의 강력하고 간단한 제조 방법을 제공한다. 또한, 다양한 표적화제, 스텔스제(stealth agent), 및/또는 진단제의 다수의 조합이 각종 나노입자, 예컨대 리포솜 내로 도입될 수 있다. 개질된 나노입자의 제조에 있어 유연성은, 예를 들어 환자에게 투여된 후 긴 생체내 반감기를 가질 수도 있는 특정 치료 및/또는 진단 용도에 대해 맞춤화된(tailored) 나노입자를 가능하게 할 수 있다.
본 발명의 본질 및 이점에 대한 추가의 이해는, 명세서의 나머지 부분 및 도면을 참조함으로써 실현될 수 있다.
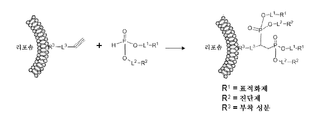
도 1은 본 발명의 예시적 실시양태에 따른, 알킨 화합물을 포함하는 나노입자와의 포스포네이트 화합물의 합성 제조 방법을 도시한다.
도 2는 본 발명의 예시적 실시양태에 따른, H-포스포네이트 화합물을 포함하는 나노입자와의 포스포네이트 화합물의 합성 제조 방법을 도시한다.
도 3은 본 발명의 예시적 실시양태에 따른 디옥타데실 옥트-1-엔-2-일포스포네이트의 제조에 대한 일반적 반응식을 나타낸다.
도 4는 본 발명의 예시적 실시양태에 따른 5-(비스(옥타데실옥시)포스포릴)헥스-5-엔산의 제조에 대한 일반적 반응식을 나타낸다.
도 5는 본 발명의 예시적 실시양태에 따른, 5-(비스(옥타데실옥시)포스포릴)헥스-5-엔산과 PEG1000-NH2의 커플링에 대한 일반적 반응식을 나타낸다.
도 6은 본 발명의 예시적 실시양태에 따른 tert-부틸 5-(비스(옥타데실옥시)포스포릴)헥스-5-에노에이트의 제조 방법을 나타낸다.
도 7은 본 발명의 예시적 실시양태에 따른 5,7-비스(비스(옥타데실옥시)포스포릴)헵탄산의 제조 방법을 나타낸다.
도 8은 본 발명의 예시적 실시양태에 따른, 5,7-비스(비스(옥타데실옥시)포스포릴)헵탄산과 PEG1000-NH2와의 일반적 반응을 제공한다.
도 9는 본 발명의 예시적 실시양태에 따른 테트라옥타데실 헵탄-1,3-디일디포스포노네이트의 제조를 나타낸다.
도 10은 본 발명의 예시적 실시양태에 따른 디옥타데실 2,5,8,11,14,17,20,23,26,29-데카옥사트리트리아콘트-31-엔-31-일포스포네이트의 제조에 대한 일반적 반응식을 나타낸다.
도 11은 본 발명의 예시적 실시양태에 따른 테트라옥타데실2,5,8,11,14,17,20,23,26,29-데카옥사트리트리아콘탄-32,33-디일디포스포네이트의 제조에 대한 일반적 반응식을 나타낸다.
도 12는 본 발명의 예시적 실시양태에 따른 테트라 옥타데실 1,1'-(1,3-페닐렌)비스(에텐-1,1-디일)디포스포네이트의 제조에 대한 일반적 반응식을 나타낸다.
도 13은 디옥타데실 1-시클로헥세닐비닐 포스포네이트 및 (E,Z)-디옥타데실 (2-(시클로헥스-1-엔-1-일)비닐)포스포네이트의 제조에 대한 반응식을 나타낸다.
도 2는 본 발명의 예시적 실시양태에 따른, H-포스포네이트 화합물을 포함하는 나노입자와의 포스포네이트 화합물의 합성 제조 방법을 도시한다.
도 3은 본 발명의 예시적 실시양태에 따른 디옥타데실 옥트-1-엔-2-일포스포네이트의 제조에 대한 일반적 반응식을 나타낸다.
도 4는 본 발명의 예시적 실시양태에 따른 5-(비스(옥타데실옥시)포스포릴)헥스-5-엔산의 제조에 대한 일반적 반응식을 나타낸다.
도 5는 본 발명의 예시적 실시양태에 따른, 5-(비스(옥타데실옥시)포스포릴)헥스-5-엔산과 PEG1000-NH2의 커플링에 대한 일반적 반응식을 나타낸다.
도 6은 본 발명의 예시적 실시양태에 따른 tert-부틸 5-(비스(옥타데실옥시)포스포릴)헥스-5-에노에이트의 제조 방법을 나타낸다.
도 7은 본 발명의 예시적 실시양태에 따른 5,7-비스(비스(옥타데실옥시)포스포릴)헵탄산의 제조 방법을 나타낸다.
도 8은 본 발명의 예시적 실시양태에 따른, 5,7-비스(비스(옥타데실옥시)포스포릴)헵탄산과 PEG1000-NH2와의 일반적 반응을 제공한다.
도 9는 본 발명의 예시적 실시양태에 따른 테트라옥타데실 헵탄-1,3-디일디포스포노네이트의 제조를 나타낸다.
도 10은 본 발명의 예시적 실시양태에 따른 디옥타데실 2,5,8,11,14,17,20,23,26,29-데카옥사트리트리아콘트-31-엔-31-일포스포네이트의 제조에 대한 일반적 반응식을 나타낸다.
도 11은 본 발명의 예시적 실시양태에 따른 테트라옥타데실2,5,8,11,14,17,20,23,26,29-데카옥사트리트리아콘탄-32,33-디일디포스포네이트의 제조에 대한 일반적 반응식을 나타낸다.
도 12는 본 발명의 예시적 실시양태에 따른 테트라 옥타데실 1,1'-(1,3-페닐렌)비스(에텐-1,1-디일)디포스포네이트의 제조에 대한 일반적 반응식을 나타낸다.
도 13은 디옥타데실 1-시클로헥세닐비닐 포스포네이트 및 (E,Z)-디옥타데실 (2-(시클로헥스-1-엔-1-일)비닐)포스포네이트의 제조에 대한 반응식을 나타낸다.
I. 정의
본원에서 사용되는 바와 같이, 용어 "알킬"은, 그 자체로 또는 또 다른 치환기의 일부로서, 달리 언급되지 않는 한, 지정된 탄소 원자수를 갖는 (즉, C10 -24는 10 내지 24개의 탄소를 의미함) 직쇄 또는 분지쇄 탄화수소 라디칼을 의미한다. 일부 실시양태에서, 알킬 기는 1 내지 36개의 탄소수 범위를 가질 수 있다. 특정 실시양태에서, 알킬 기는 10 내지 24개의 탄소수의 범위를 가질 수 있다. 일부 실시양태에서, 알킬 기는 포화 또는 불포화될 수 있고, 또한 치환 또는 비-치환될 수 있다.
본원에서 사용되는 바와 같이, 용어 "치환된"은 모(parent) 분자 또는 기에 결합된 기를 지칭한다. 예를 들어, 메틸 치환기를 갖는 알킬 기는 메틸-치환된 알킬 기이다. 적합한 치환기는 할로, 시아노, 알킬, 아미노, 히드록시, 알콕시, 및 아미도를 포함하나 이에 제한되지는 않는다.
본원에서 사용되는 바와 같이, 용어 "H-포스포네이트 화합물"은 H-P(O)(OL1-R1)(OL2-R2)의 화학식을 갖는 화합물을 지칭하며, 이는 본원에서 추가로 설명된다.
본원에서 사용되는 바와 같이, 용어 "알킨 화합물"은, 일반적으로 하나 이상의 탄소-대-탄소 삼중 결합을 갖는 화합물을 지칭한다. 특정 실시양태에서, 본 발명에서 사용된 알킨 화합물은 1급 알킨을 갖는다. 본 발명의 알킨 화합물은 본원에서 추가로 설명된다.
본원에서 사용되는 바와 같이, 용어 "표적화된 전달 조성물"은, 본 발명의 포스포네이트 화합물에 부착된 나노입자의 조성물을 지칭하며, 이들의 세부사항은 본원에서 추가로 설명된다. 본 발명의 조성물은, 치료 조성물로서, 진단 조성물로서, 또는 치료 및 진단 조성물 둘 다로서 사용될 수 있다. 특정 실시양태에서, 조성물은, 본원에서 추가로 설명되는 바와 같이, 대상체 또는 시험 샘플 내의 특정 표적에 대해 표적화될 수 있다.
본원에서 사용되는 바와 같이, 용어 "촉매"는 본 발명의 특정 포스포네이트 화합물의 합성을 용이하게 하도록 화학 반응에서 사용되는 시약을 지칭한다. 특정 실시양태에서, 촉매는, 본원에서 추가로 설명되는 바와 같이, 히드로포스포닐화 반응에서 사용될 수 있다. 적합한 촉매에는 시스-PdMe2(PPh2Me)2, 시스-PdMe2(PPh3)2, Pd(CH2=CH2)(PPh3)2, Pt(CH2=CH2)(PPh3)2, Pd(PPh3)4, Pt(PPh3)4, Pd(OAc)2가 포함될 수 있으나 이에 제한되지 않는다.
본원에서 사용되는 바와 같이, 용어 "나노입자"는 다양한 크기, 형상, 유형 및 용도를 갖는 입자를 지칭하며, 이는 본원에서 추가로 설명된다. 당업자가 인지하는 바와 같이, 나노입자의 특징, 예를 들어, 크기는, 나노입자의 유형 및/또는 용도 뿐만 아니라 당업계에 일반적으로 널리 공지되어 있는 다른 요인에 따라 달라질 수 있다. 일반적으로, 나노입자는 약 1 nm 내지 약 1000 nm의 크기 범위를 가질 수 있다. 다른 실시양태에서, 나노입자는 약 10 nm 내지 약 200 nm의 크기 범위를 가질 수 있다. 또한 다른 실시양태에서, 나노입자는 약 50 nm 내지 약 150 nm의 크기 범위를 가질 수 있다. 특정 실시양태에서, 나노입자는 신장 배설 한계 초과의 크기, 예를 들어 약 6 nm 초과의 직경을 갖는다. 다른 실시양태에서, 나노입자는 간에 의한 혈류로부터의 청소(clearance)를 피하기에 충분히 작고, 예를 들어, 1000 nm 미만의 직경을 갖는다. 나노입자는 구형, 원뿔형, 회전타원체형, 및 당업계에 일반적으로 공지되어 있는 다른 형상을 포함할 수 있다. 나노입자는 중공형 (예를 들어, 중공 내부 코어를 갖는 충실형 외부 코어)이거나 충실형이거나 또는 중공 및 충실 층 또는 다양한 충실 층을 갖는 다층형일 수 있다. 예를 들어, 나노입자는 충실 코어 영역 및 충실 외부 캡슐화 영역을 포함할 수 있고, 이들은 둘 다 가교될 수 있다. 나노입자는 지질, 중합체, 자성체 또는 금속 물질, 예컨대 실리카, 금, 산화철 등을 비롯한 각종 물질 중 하나의 물질, 또는 이들의 임의의 조합으로 구성될 수 있다. 지질은 지방, 왁스, 스테롤, 콜레스테롤, 지용성 비타민, 모노글리세리드, 디글리세리드, 인지질, 스핑고지질, 당지질, 양이온성 또는 음이온성 지질, 유도체화된 지질, 카디올리핀 등을 포함할 수 있다. 중합체는 블록 공중합체, 일반적으로 폴리(락트산), 폴리(락트-코-글리콜산), 폴리에틸렌 글리콜, 아크릴 중합체, 양이온성 중합체, 뿐만 아니라 나노입자 제조에 사용하기 위한 당업계에 공지된 다른 중합체를 포함할 수 있다. 일부 실시양태에서, 중합체는 생분해성 및/또는 생체적합성일 수 있다. 나노입자는 리포솜, 미셀, 지질단백질, 지질-코팅된 기포, 블록 공중합체 미셀, 폴리머솜, 니오솜, 양자점, 산화철 입자, 금 입자, 덴드리머, 또는 실리카 입자를 포함할 수 있다. 특정 실시양태에서, 지질 단층 또는 이중층은, 지질로 코팅될 수 있는 물질로 구성된 나노입자, 예를 들어 중합체 나노입자를 완전히 또는 부분적으로 코팅할 수 있다. 일부 실시양태에서, 리포솜은 다층 소포 (MLV), 대형 단층 소포 (LUV), 및 소형 단층 소포 (SUV)를 포함할 수 있다.
본원에서 사용되는 바와 같이, 용어 "치료제"는, 유효량으로 존재하는 경우, 치료 효과를 필요로 하는 대상체에 대해 요망되는 치료 효과를 생성하는 화합물 또는 분자를 지칭한다. 본 발명에서는, 본원에서 추가로 설명되는 바와 같이, 나노입자 및 포스포네이트 화합물과 함께 폭넓은 범위의 치료제 및 그의 용도가 고려된다.
본원에서 사용되는 바와 같이, 용어 "진단제"는 대상체 또는 시험 샘플에서 검출될 수 있는 성분을 지칭하며, 이는 본원에서 추가로 설명된다.
본원에서 사용되는 바와 같이, 용어 "연결기"는, 화합물의 부분들을 연결하는 포스포네이트 화합물의 부분을 지칭한다. 예를 들어, 연결기, L1은, R1 (예를 들어, 표적화제)을, 포스포네이트 화합물의 인에 결합된 산소에 연결시킬 수 있다. 제조되는 포스포네이트 화합물 및 화합물에 대해 요망되는 특성에 따라, 연결기는 표적화제와 예를 들어 나노입자에 부착될 수 있는 포스포네이트 화합물의 다른 부분의 적절한 분리를 달성하도록 용이하게 입수가능한 단량체 성분으로부터 어셈블링될 수 있다.
본원에서 사용되는 바와 같이, 용어 "표적화제"는 표적에 대해 특이적인 분자를 지칭한다. 특정 실시양태에서, 표적화제는 표적 리간드의 소분자 모방체 (예를 들어, 펩티드 모방 리간드), 표적 리간드 (예를 들어, RGD 펩티드 함유 펩티드 또는 폴레이트 아미드), 또는 특정 표적에 대해 특이적인 항체 또는 항체 단편을 포함할 수 있다. 표적화제는, 질병의 특정 발달기와 관련될 수 있는 기관, 조직, 세포, 세포외 매트릭스 성분, 및/또는 세포내 구획에서의 표적을 비롯한 폭넓게 다양한 표적에 결합할 수 있다. 일부 실시양태에서, 표적은 암 세포, 특히 암 줄기 세포를 포함할 수 있다. 표적은 세포 표면 상의 항원, 또는 암 세포에 존재하거나 정상 조직에 비해 암 세포에 더욱 널리 퍼져있는 항원인 종양 마커를 포함할 수 있다. 특정 실시양태에서, 표적화제는 폴산 유도체, B-12 유도체, 인테그린 RGD 펩티드, RGD 모방체, NGR 유도체, 소마토스타틴 유도체 또는 소마토스타틴 수용체에 결합하는 펩티드, 예를 들어, 옥트레오티드 및 옥트레오테이트 등을 추가로 포함할 수 있다. 일부 실시양태에서, 표적화제는 앱타머 (이는 핵산 (예를 들어, DNA 또는 RNA) 또는 펩티드로 구성되고, 특정 표적에 결합함)일 수 있다. 표적화제는 수용체 표적, 특히 종양과 관련되어 발현되는 수용체 표적에 특이적으로 또는 비-특이적으로 결합하도록 디자인될 수 있다. 수용체 표적의 예는, MUC-1, EGFR, 클라우딘(Claudin) 4, MUC-4, CXCR4, CCR7, FOL1R, 소마토스타틴 수용체 4, Erb-B2 (적혈모구 백혈병 종양유전자 동족체 2) 수용체, CD44 수용체, 및 VEGF 수용체-2 키나제를 포함하나 이에 제한되지는 않는다.
본원에서 사용되는 바와 같이, 용어 "스텔스제"는 나노입자의 표면 특성을 개질시킬 수 있는 분자를 지칭하며, 이는 본원에서 추가로 설명된다.
본원에서 사용되는 바와 같이, 용어 "~ 내에 내포된"은 나노입자의 표면 상에 또는 그 부근에서의 작용제의 위치를 지칭한다. 나노입자 내에 내포된 작용제는, 예를 들어, 리포솜의 이중층 멤브레인 내에 위치하거나 나노입자의 외부 중합체 쉘 내에 위치하여 그 쉘 내에 함유될 수 있다.
본원에서 사용되는 바와 같이, 용어 "캡슐화된"은, 나노입자 내부에 둘러싸이거나 완전히 함유된 작용제의 위치를 지칭한다. 리포솜의 경우, 예를 들어, 치료제 및/또는 진단제는 리포좀의 수성 내부 내에 존재하도록 캡슐화될 수 있다. 이어서, 리포솜을 불안정화시키도록 의도된 특정 조건 하에 이러한 캡슐화된 작용제의 방출이 촉발되거나 다른 방식으로 캡슐화된 작용제의 방출이 수행될 수 있다.
본원에서 사용되는 바와 같이, 용어 "~에 테더링된(tethered to)"은, 하나 이상의 성분이 공간에서 이동하는 자유를 갖도록 하나의 성분이 또 다른 성분에 부착된 것을 지칭한다. 특정 예시적 실시양태에서, 부착 성분은 나노입자를 둘러싼 용액 중에서 자유롭게 이동하도록 나노입자에 테더링될 수 있다. 일부 실시양태에서, 부착 성분은 표면으로부터 멀리 연장되면서 나노입자의 표면에 테더링될 수 있다.
본원에서 사용되는 바와 같이, 용어 "지질"은 지방, 왁스, 스테롤, 콜레스테롤, 콜레스테롤 유도체, 지용성 비타민, 모노글리세리드, C8-C36 알킬, 디글리세리드, 인지질, 스핑고지질, 당지질, 양이온성 또는 음이온성 지질, 유도체화된 지질 등을 포함할 수 있는 지질 분자를 지칭한다. 지질은 미셀, 단층, 및 이중층 멤브레인을 형성할 수 있다. 특정 실시양태에서, 지질은 리포솜으로 자체-어셈블링될 수 있다. 다른 실시양태에서, 지질은 단층 또는 이중층으로서 나노입자의 표면을 코팅할 수 있다.
본원에서 사용되는 바와 같이, 용어 "앱타머"는, 특정 표적에 특이적으로 결합하는 비-천연 올리고뉴클레오티드 (전형적으로 20 내지 200개의 뉴클레오티드)를 지칭한다. "비-천연"은 천연 뉴클레오티드 (A, T, C, G, U)의 비-천연 서열, 뿐만 아니라 비-천연 또는 변형 뉴클레오티드를 갖는 올리고뉴클레오티드를 포함한다. 예를 들어, "스피에겔머스(Spiegelmers)®"는 거울 상 핵산을 갖는 (즉, 천연 D 배열 대신에 L 키랄 배열) 앱타머이다. 앱타머는 분자내 상호작용에 의해 독특한 3차원 구조를 형성할 수 있고/거나, 예를 들어 1차 또는 2차 구조로부터 유도-적합 메커니즘에 의해 표적에 결합시 구조가 변할 수 있다. 표적에 대한 앱타머 결합은, 전형적인 상보적 핵산 하이브리드형성, 예를 들어 이중 또는 삼중 나선 형성에 의해 매개되지 않는다 (앱타머의 일부가 이러한 하이브리드형성에 참여할 수는 있지만). 예를 들어, 앱타머는 통상적으로 분자내 헤어핀 구조 및 다른 3차원 구조를 형성한다. 앱타머는 임의의 방법 또는 방법의 조합에 따라 선택될 수 있다. 기하급수적 농축에 의한 리간드의 계통 진화(Systematic Evolution of Ligands by Exponential Enrichment (셀렉스(SELEX)™), 또는 이들의 변형이 업계에서 통상적으로 사용된다. 기본적 셀렉스™ 공정은, 예를 들어 US 특허 번호 5,567,588에 기재되어 있다. 기본적 방법에 대한 다수의 변화가 또한 이용될 수 있다 (예를 들어, US 특허출원 번호 2010015041에 기재된 바와 같은 생체내 셀렉스™). 모노렉스(MONOLEX)™은, 예를 들어 문헌 [Nitsche et al. (2007) BMC Biotechnology 7:48] 및 WO02/29093에 기재된 또 다른 선택 공정이다. 종양 세포로 주입된 핵산 라이브러리를 사용한 생체내 선택 또한 가능하다 (예를 들어, 문헌 [Mi et al., (2010) Nat. Chem. Biol. 1:22] 참조). 본 발명에서 사용하기 위한 앱타머는, MUC-1, EGFR, 클라우딘 4, MUC-4, CXCR4, CCR7, FOL1R, 소마토스타틴 수용체 4, Erb-B2 (적혈모구 백혈병 종양유전자 동족체 2) 수용체, CD44 수용체, VEGF 수용체-2 키나제, 및 뉴클레올린을 포함하나 이에 제한되지는 않는 다양한 표적에 결합하도록 디자인될 수 있다.
본원에서 사용되는 바와 같이, 용어 "대상체"는 임의의 생명 단계의 임의의 포유동물, 특히 인간을 지칭한다.
본원에서 사용되는 바와 같이, 용어 "투여하다", "투여된", 또는 "투여하는"은 본 발명의 표적화된 전달 조성물의 투여 방법을 지칭한다. 본 발명의 표적화된 전달 조성물은 다양한 방식으로, 예컨대 국소, 비경구, 정맥내, 피부내, 근육내, 결장, 직장 또는 복강내 투여될 수 있다. 비경구 투여 및 정맥내 투여가 바람직한 투여 방법이다. 표적화된 전달 조성물은 또한 조성물 또는 제제의 일부로서 투여될 수 있다.
본원에서 사용되는 바와 같이, 질환, 질병, 장애, 또는 증후군을 "치료하는" 또는 이들의 "치료"라는 용어는, (i) 질병, 장애, 또는 증후군의 억제, 즉, 그의 발달 저지; 및 (ii) 질병, 장애, 또는 증후군의 경감, 즉 질병, 장애, 또는 증후군의 퇴행 유발을 포함한다. 당업계에 공지된 바와 같이, 전신 전달 대 국소 전달, 연령, 체중, 일반적 건강상태, 성별, 식습관, 투여 시간, 약물 상호작용 및 질환의 중증도에 대한 조정이 필수적일 수 있고, 이는 당업자에 의해 통상적인 실험에 의해 확인가능하다.
본원에서 사용되는 바와 같이, 용어 "제제"는 대상체로의 투여를 위한 성분들의 혼합물을 지칭한다. 예를 들어 관절내 (관절 내로), 정맥내, 근육내, 종양내, 피부내, 복강내, 및 피하 경로 투여와 같은 비경구 투여에 적합한 제제는, 산화방지제, 완충제, 정균제, 및 제제가 의도된 수용자의 혈액과 등장성이 되도록 하는 용질을 함유할 수 있는 수성 및 비-수성 등장성 멸균 주사액, 및 현탁화제, 가용화제, 증점제, 안정화제, 및 보존제를 포함할 수 있는 수성 및 비-수성 멸균 현탁액을 포함한다. 주사액 및 현탁액은 또한 멸균 분말, 과립 및 정제로부터 제조될 수 있다. 표적화된 전달 조성물의 제제는 단위-용량 또는 다중-용량 밀봉 용기, 예컨대 앰풀 및 바이알 중에 존재할 수 있다. 표적화된 전달 조성물은, 단독으로 또는 다른 적합한 성분과 조합되어, 구강 또는 비강을 통해 흡입에 의해 투여되는 에어로졸 제제를 형성할 수 있다 (즉, 이들은 "분무"될 수 있음). 에어로졸 제제는 가압 허용가능한 추진제, 예컨대 디클로로디플루오로메탄, 프로판, 질소 등 내에 배치될 수 있다. 직장 투여에 적합한 제제는, 예를 들어, 좌제 베이스와 함께 유효량의 표적화된 전달 조성물을 포함하는 좌제를 포함한다. 적합한 좌제 베이스는 천연 또는 합성 트리글리세리드 또는 파라핀 탄화수소를 포함한다. 또한, 예를 들어, 액체 트리글리세리드, 폴리에틸렌 글리콜, 및 파라핀 탄화수소를 포함한 베이스와 표적화된 전달 조성물의 조합을 함유하는 젤라틴 직장 캡슐을 사용할 수도 있다. 특정 실시양태에서, 제제는 국소 투여되거나 점안약 형태로 투여될 수 있다.
본 발명의 실시양태
II
. 일반적 설명
본 발명은 포스포네이트 화합물, 및 H-포스포네이트 화합물 및 알킨 화합물이 관여하는 히드로포스포닐화 반응을 이용한 포스포네이트 화합물의 제조 방법을 제공한다. 특정 실시양태에서, 본 발명의 포스포네이트 화합물을 사용하여 나노입자의 특징를 변형시킬 수 있다. 예를 들어, 포스포네이트 화합물은 비-표적화된 나노입자를 표적화된 나노입자로 변형시킬 수 있거나, 또는 스텔스제가 나노입자에 부착되어, 예를 들어 환자에게 투여된 후 나노입자의 생체내 반감기를 향상시킬 수 있다.
또한, 포스포네이트 화합물을 제조하기 위해 사용되는 히드로포스포닐화 화학은 다수의 독특한 측면을 제공한다. 예를 들어, H-포스포네이트 화합물을 나노입자에 부착하여, 나노입자가 나노입자의 표면 상에 H-포스포네이트 화합물의 반응성 부분을 나타내도록 할 수 있다. 후속 반응 단계에서는, 예를 들어 표적화제를 포함하고 H-포스포네이트 화합물과 반응하는 알킨 화합물을 제공하여 포스포네이트 화합물을 형성할 수 있으며, 이로써 비-표적화된 나노입자에서 관심있는 특정 표적과 결합할 수 있는 표적화제를 나타내는 표적화된 나노입자로 나노입자를 변형시킬 수 있다.
포스포네이트 화합물 및 그의 제조 방법은 환자에게 진단제 및/또는 치료제를 전달하기 위해 사용될 수 있는 나노입자 또는 기타 조성물의 제조를 위한 광범위한 옵션을 제공한다. 특정 실시양태에서, 나노입자는, 예를 들어 나노입자 표면에 대한 표적화제 및/또는 스텔스제의 부착에 더 적합한 시스템을 생성하도록 사용될 수 있는, 예를 들어 2개 또는 4개의 부착 성분을 갖는 포스포네이트 화합물의 앵커링 어셈블리(anchoring assembly)를 포함할 수 있다. 다르게는, 제시 어셈블리는 나노입자 표면 상에서 제조될 수 있고, 예를 들어 치료제 및/또는 진단제의 표적화 전달을 향상시킬 수 있는 2개 또는 4개의 표적화제를 제시할 수 있다.
III
.
포스포네이트
화합물
하나의 측면에서, 본 발명의 화합물은 하기 화학식의 화합물을 포함할 수 있다.
상기 식에서, 로 식별되는 결합은 단일 또는 이중 결합이고; L1, L2 및 L3은 각각 결합 또는 연결기이고; R1, R2 및 R3은 각각 독립적으로 나노입자, 부착 성분, 표적화제, 진단제 및 스텔스제로 이루어진 군으로부터 선택되고; R4는 H 및 -P(=O)(OL1-R1)(OL2-R2)로 이루어진 군으로부터 선택된 구성원이고, 상기 R4가 H 이외의 것일 때, 로 식별되는 결합은 단일 결합이다.
또 다른 측면에서, 본 발명의 화합물은 하기 화학식을 갖는 화합물을 포함할 수 있다.
상기 식에서, R1 및 R2는 각각 부착 성분이다. 특정 실시양태에서, 부착 성분은 포화 또는 불포화 C10 -24 알킬 기, 치환된 포화 또는 불포화 C10 -24 알킬 기, 및 콜레스테롤로부터 선택되고; L1 및 L2는 각각 결합이다. 일부 실시양태에서, 이들 화합물은, 포스포네이트 화합물이 나노입자와 회합될 수 있는 4개의 부착 성분 (2 x R1 및 2 x R2)을 포함하는, 나노입자 앵커링 어셈블리를 제공할 수 있다. 예를 들어, R3이 리포솜의 표면 상에 나타나고, 예를 들어 표적화제, 진단제, 또는 스텔스제를 제시할 수 있도록, 4개의 부착 성분이 리포솜의 지질 이중층의 표면과 상호작용할 수 있다.
또한 또 다른 측면에서, 본 발명의 화합물은 하기 화학식을 갖는 화합물을 포함할 수 있다.
상기 식에서, R3은 부착 성분이다. 특정 실시양태에서, 부착 성분은 포화 또는 불포화 C10 -24 알킬 기, 치환된 포화 또는 불포화 C10 -24 알킬 기, 및 콜레스테롤로부터 선택될 수 있다. 일부 실시양태에서, R1 및 R2는 각각 독립적으로 표적화제, 진단제, 및 스텔스제로 이루어진 군으로부터 선택될 수 있다. 이러한 실시양태에서, 상기 화합물은, R3이 예를 들어 지질 이중층과 상호작용할 수 있고 R1 및 R2가 예를 들어 표적화제, 진단제, 스텔스제, 또는 이들의 조합을 제시하도록 선택될 수 있는, 제시 어셈블리를 제공할 수 있다.
또한 또 다른 측면에서, 본 발명의 화합물은 하기 화학식을 갖는 화합물을 포함할 수 있다.
상기 식에서, L1 및 L2는 각각 결합 또는 연결기이고; R1 및 R2는 각각 독립적으로 나노입자, 부착 성분, 표적화제, 진단제 및 스텔스제로 이루어진 군으로부터 선택되고; L4는 아릴렌, 알킬렌 또는 이들의 조합으로 이루어진 군으로부터 선택된다.
당업자라면, 상기 기재된 앵커링 및 제시 어셈블리가, 로 식별되는 결합이 단일 결합이고 R1, R2 및 R3이 각각 상기 화합물 내에 존재하는 화합물에도 적용될 수 있음을 인지할 것이다. 이러한 실시양태에서, 2개의 부착 성분 (예를 들어, R1 및 R2)을 사용하여 화합물을 나노입자에 부착시킬 수 있거나, 또는 다르게는 R3을 나노입자에 부착시킬 수 있고, R1 및 R2는, 예를 들어 표적화제, 진단제, 스텔스제, 또는 이들의 조합으로서 제시할 수 있다. 또한, 본원에서 추가로 설명되는 바와 같이, L1, L2 및 L3은 본 발명의 포스포네이트 화합물의 요망되는 특성 또는 구조적 세부사항에 따라 결합 또는 연결기일 수 있다.
나노입자
폭넓게 다양한 나노입자가 본 발명에서 사용될 수 있다. 당업자가 인지하는 바와 같이, 나노입자의 특징, 예를 들어, 크기는, 나노입자의 유형 및/또는 용도 뿐만 아니라 당업계에 일반적으로 널리 공지되어 있는 다른 요인에 따라 달라질 수 있다. 적합한 입자는 구형, 회전타원체형, 평면형, 판-형상, 관형, 입방체형, 직육면체형, 계란형, 타원형, 원통형, 원뿔형, 또는 각뿔형일 수 있다. 적합한 나노입자는 약 1 nm 내지 약 1000 nm, 약 10 nm 내지 약 200 nm, 및 약 50 nm 내지 약 150 nm의 최대 치수 (예를 들어, 직경)의 크기 범위를 가질 수 있다.
적합한 나노입자는 당업계에 일반적으로 공지되어 있는 다양한 물질로 제조될 수 있다. 일부 실시양태에서, 나노입자는 지질, 중합체, 또는 금속 물질, 예컨대 실리카, 금, 산화철 등을 비롯한 각종 물질 중 하나의 물질, 또는 이들의 임의의 조합을 포함할 수 있다. 나노입자의 예는 리포솜, 미셀, 지질단백질, 지질-코팅된 기포, 블록 공중합체 미셀, 폴리머솜, 니오솜, 산화철 입자, 금 입자, 실리카 입자, 덴드리머, 또는 양자점을 포함할 수 있으나 이에 제한되지는 않는다.
일부 실시양태에서, 나노입자는 부분적으로 또는 전체적으로 포화 또는 불포화된 지질로 구성된 리포솜이다. 적합한 지질은 지방, 왁스, 스테롤, 콜레스테롤, 콜레스테롤 유도체, 지용성 비타민, 모노글리세리드, 디글리세리드, 인지질, 스핑고지질, 당지질, 유도체화된 지질 등을 포함할 수 있으나 이에 제한되지는 않는다. 일부 실시양태에서, 적합한 지질은 양친매성, 중성, 비-양이온성, 음이온성, 양이온성, 또는 소수성 지질을 포함할 수 있다. 특정 실시양태에서, 지질은 인지질 및/또는 스핑고지질과 같은, 전형적으로 세포 막 중에 존재하는 것들을 포함할 수 있다. 적합한 인지질은 포스파티딜콜린 (PC), 포스파티드산 (PA), 포스파티딜에탄올아민 (PE), 포스파티딜글리세롤 (PG), 포스파티딜세린 (PS), 및 포스파티딜이노시톨 (PI)을 포함하나 이에 제한되지는 않는다. 적합한 스핑고지질은 스핑고신, 세라미드, 스핑고미엘린, 세레브로시드, 술파티드, 강글리오시드, 및 피토스핑고신을 포함하나 이에 제한되지는 않는다. 다른 적합한 지질은 지질 추출물, 예컨대 에그 PC, 심장 추출물, 뇌 추출물, 간 추출물, 및 소이 PC를 포함할 수 있다. 일부 실시양태에서, 소이 PC는 히드로 소이(Hydro Soy) PC (HSPC)를 포함할 수 있다. 양이온성 지질은 N,N-디올레오일-N,N-디메틸암모늄 클로라이드 (DODAC), N,N-디스테아릴-N,N-디메틸암모늄 브로마이드 (DDAB), N-(1-(2,3-디올레오일옥시)프로필)-N,N,N-트리메틸암모늄 클로라이드 (DOTAP), N-(1-(2,3-디올레일옥시)프로필)-N,N,N-트리메틸암모늄 클로라이드 (DOTMA), 및 N,N-디메틸-2,3-디올레일옥시)프로필아민 (DODMA)을 포함하나 이에 제한되지는 않는다. 비-양이온성 지질은 디미리스토일 포스파티딜 콜린 (DMPC), 디스테아로일 포스파티딜 콜린 (DSPC), 디올레오일 포스파티딜 콜린 (DOPC), 디팔미토일 포스파티딜 콜린 (DPPC), 디미리스토일 포스파티딜 글리세롤 (DMPG), 디스테아로일 포스파티딜 글리세롤 (DSPG), 디올레오일 포스파티딜 글리세롤 (DOPG), 디팔미토일 포스파티딜 글리세롤 (DPPG), 디미리스토일 포스파티딜 세린 (DMPS), 디스테아로일 포스파티딜 세린 (DSPS), 디올레오일 포스파티딜 세린 (DOPS), 디팔미토일 포스파티딜 세린 (DPPS), 디올레오일 포스파티딜 에탄올아민 (DOPE), 팔미토일올레오일포스파티딜콜린 (POPC), 팔미토일올레오일-포스파티딜에탄올아민 (POPE) 및 디올레오일-포스파티딜에탄올아민 4-(N-말레이미도메틸)-시클로헥산-1-카르복실레이트 (DOPE-mal), 디팔미토일 포스파티딜 에탄올아민 (DPPE), 디미리스토일포스포에탄올아민 (DMPE), 디스테아로일-포스파티딜-에탄올아민 (DSPE), 16-O-모노메틸 PE, 16-O-디메틸 PE, 18-1-트랜스 PE, 1-스테아로일-2-올레오일-포스파티딜에탄올아민 (SOPE), 1,2-디엘라이도일-sn-글리세로-3-포스포에탄올아민 (트랜스DOPE), 및 카디올리핀을 포함하나 이에 제한되지는 않는다. 특정 실시양태에서, 지질은 유도체화된 지질, 예컨대 페길화된(PEGlyated) 지질을 포함할 수 있다. 유도체화된 지질은, 예를 들어, DSPE-PEG2000, 콜레스테롤-PEG2000, DSPE-폴리글리세롤, 또는 당업계에 일반적으로 널리 공지되어 있는 다른 유도체를 포함할 수 있다.
지질의 임의의 조합을 사용하여 나노입자, 예컨대 리포솜을 구성할 수 있다. 특정 실시양태에서, 리포솜의 지질 조성물은 누출률, 안정성, 입자 크기, 제타 전위, 단백질 결합, 생체내 순환, 및/또는 종양, 간, 비장 등과 같은 조직 내 축적과 같은 리포솜의 특징에 영향을 주도록 맞춤화될 수 있다. 예를 들어, DSPC 및/또는 콜레스테롤을 사용하여 리포솜으로부터의 누출을 감소시킬 수 있다. 리포솜의 표면 전하에 영향을 주도록 DSPG 및/또는 DOTAP와 같은 음의 또는 양의 지질이 포함될 수 있다. 일부 실시양태에서, 리포솜은 약 10개 이하의 유형의 지질, 또는 약 5개 이하의 유형의 지질, 또는 약 3개 이하의 유형의 지질을 포함할 수 있다. 일부 실시양태에서, 존재하는 특정 유형의 지질의 몰 퍼센트 (mol%)는 전형적으로, 나노입자, 예컨대 리포솜 중에 존재하는 총 지질의 약 0% 내지 약 10%, 약 10% 내지 약 30%, 약 30% 내지 약 50%, 약 50% 내지 약 70%, 약 70% 내지 약 90%, 약 90% 내지 100%를 이룬다. 본원에 기재된 지질은 리포솜 내에 포함될 수 있거나, 또는 지질은 본 발명의 나노입자, 예컨대 중합체 나노입자를 코팅하는 데 사용될 수 있다. 코팅은 부분적으로 또는 전체적으로 나노입자를 둘러쌀 수 있고 단층 및/또는 이중층을 포함할 수 있다.
다른 실시양태에서, 나노입자의 일부 또는 전부는 중합체, 예컨대 블록 공중합체 또는 나노입자 제조에 대해 당업계에 공지되어 있는 다른 중합체를 포함할 수 있다. 일부 실시양태에서, 중합체는 생분해성 및/또는 생체적합성일 수 있다. 적합한 중합체는 폴리에틸렌, 폴리카르보네이트, 폴리안히드라이드, 폴리히드록시산, 폴리프로필푸마레이트, 폴리카프로락톤, 폴리아미드, 폴리아세탈, 폴리에테르, 폴리에스테르, 폴리(오르토에스테르), 폴리시아노아크릴레이트, 폴리비닐 알콜, 폴리우레탄, 폴리포스파젠, 폴리아크릴레이트, 폴리메타크릴레이트, 폴리시아노아크릴레이트, 폴리우레아, 폴리스티렌, 폴리아민, 및 이들의 조합을 포함할 수 있으나 이에 제한되지는 않는다. 일부 실시양태에서, 입자의 예는 쉘 가교된 크네델(knedel)을 포함할 수 있으며, 이는 참고문헌: 미국 특허출원 번호 11/250830 (Becker et al.); [Thurmond, K.B. et al., J. Am. Chem. Soc., 119 (28) 6656- (1997)]; [Wooley, K.L., Chem. Eur. J., 3 (9): 1397-1399 (1997)]; [Wooley, K.L., J. Poly. Sci.: Part A: Polymer Chem., 38: 1397-1407 (2000)]에 추가로 설명되어 있다. 다른 실시양태에서, 적합한 입자는 폴리(락트 코-글리콜산) (PLGA)을 포함할 수 있다 (문헌 [Fu, K. et al., Pharm Res., 27:100-106 (2000)]).
또한 다른 실시양태에서, 나노입자는 부분적으로 또는 전체적으로 실리카, 금, 산화철 등의 금속 성질을 갖는 물질로 구성될 수 있다. 일부 실시양태에서, 실리카 입자는 중공형, 다공성, 및/또는 메조다공성일 수 있다 (문헌 [Slowing, I.I., et al., Adv. Drug Deliv. Rev., 60 (11):1278-1288 (2008)]). 금 입자는, 예시적 참고문헌: 문헌 [Bhattacharya, R. & Mukherjee, P., Adv. Drug Deliv. Rev., 60(11): 1289-1306 (2008)]에 제공된 바와 같이, 당업계에 일반적으로 공지되어 있다. 산화철 입자 또는 양자점이 또한 사용될 수 있고, 이들은 당업계에 널리 공지되어 있다 (문헌 [van Vlerken, L.E. & Amiji, M. M., Expert Opin. Drug Deliv., 3(2): 205-216 (2006)]). 나노입자는 또한 바이러스 입자 및 세라믹 입자를 포함하나 이에 제한되지는 않는다.
나노입자에 대한 부착
특정 실시양태에서, 부착 성분은, 부착 성분을 나노입자 상에 존재하는 반응성 기에 공유결합으로 부착시키는 데 사용될 수 있는 관능기를 포함할 수 있다. 관능기는, 부착 성분의 말단 위치와 같은, 부착 성분 상의 어디에도 위치할 수 있다. 폭넓게 다양한 관능기가 당업계에 일반적으로 공지되어 있고, 이들은 친핵성 치환 (예를 들어, 아민 및 알콜과 아실 할라이드 또는 활성 에스테르의 반응), 친전자성 치환 (예를 들어, 엔아민 반응) 및 탄소-탄소 및 탄소-헤테로원자 다중 결합에 대한 부가반응 (예를 들어, 마이클(Michael) 반응 또는 딜스-알더(Diels-Alder) 부가반응)과 같은 (이에 제한되지는 않음) 여러 부류의 반응 하에 반응할 수 있다. 이들 및 다른 유용한 반응은, 예를 들어, 문헌 [March, Advanced Organic Chemistry, 3rd Ed., John Wiley & Sons, New York, 1985]; 및 [Hermanson, Bioconjugate Techniques, Academic Press, San Diego, 1996]에서 논의되어 있다. 적합한 관능기는, 예를 들어: (a) 카르복실 기 및 그의 각종 유도체, 예컨대 N-히드록시숙신이미드 에스테르, N-히드록시벤즈트리아졸 에스테르, 산 할라이드, 아실 이미다졸, 티오에스테르, p-니트로페닐 에스테르, 알킬, 알케닐, 알키닐 및 방향족 에스테르 (이에 제한되지는 않음); (b) 에스테르, 에테르, 알데히드 등으로 전환될 수 있는 히드록실 기; (c) 할로알킬 기 (여기서, 할라이드는 이후에, 예를 들어 아민, 카르복실레이트 음이온, 티올 음이온, 탄소 음이온, 또는 알콕시드 이온 등의 친핵성 기로 치환될 수 있고, 이로써 할로겐 원자의 부위에 새로운 기의 공유결합 부착이 생김); (d) 예를 들어 말레이미도 기 등의 딜스-알더 반응에 참여할 수 있는 친디엔체 기; (e) 예를 들어 이민, 히드라존, 세미카르바존 또는 옥심 등의 카르보닐 유도체의 형성에 의해, 또는 그리냐르(Grignard) 부가반응 또는 알킬리튬 부가반응 등의 반응에 의해 후속 유도체화가 가능한 알데히드 또는 케톤 기; (f) 예를 들어 술폰아미드를 형성하는 아민과의 후속 반응을 위한 술포닐 할라이드 기; (g) 디술피드로 전환되거나 아실 할라이드와 반응할 수 있는 티올 기; (h) 예를 들어 아실화, 알킬화 또는 산화될 수 있는 아민 또는 술프히드릴 기; (i) 예를 들어 고리화부가반응, 아실화, 마이클 부가반응 등이 일어날 수 있는 알켄; 및 (j) 예를 들어 아민 및 히드록실 화합물과 반응할 수 있는 에폭시드를 포함할 수 있다. 일부 실시양태에서는, 클릭 화학에 기초한 플랫폼을 이용하여 부착 성분을 나노입자에 부착시킬 수 있다 (문헌 [Kolb, H.C. et al. M. G. Finn and K. B. Sharpless, Angew. Chem. Int'l. Ed. 40 (11): 2004 (2001)]). 일부 실시양태에서, 부착 성분은 하나의 관능기 또는 나노입자와의 다수의 공유 결합을 형성하는 다수의 관능기를 포함할 수 있다.
표 1은 본 발명에서 사용될 수 있는 관능기의 추가의 비-제한적 대표적 목록을 제공한다.
다른 실시양태에서, 부착 성분은, 친화성 상호작용, 금속 배위, 물리적 흡착, 소수성 상호작용, 반 데르 발스 상호작용, 수소 결합 상호작용, 자기 상호작용, 정전기 상호작용, 쌍극자-쌍극자 상호작용, 항체-결합 상호작용, 상보적 DNA 사이의 하이브리드형성 상호작용 등을 포함할 수 있으나 이에 제한되지는 않는 비-공유결합 상호작용에 의해 나노입자에 부착될 수 있다. 일부 실시양태에서, 부착 성분은 나노입자의 지질 이중층 부분에 존재할 수 있고, 여기서 특정 실시양태에서 나노입자는 리포솜이다. 예를 들어, 부착 성분은, 지질 이중층의 소수성 및/또는 친수성 영역과 부분적으로 또는 전체적으로 상호작용하는 지질 또는 인지질 (예를 들어, 포화 또는 불포화될 수 있는 C8-C36 알킬)일 수 있다. 일부 실시양태에서, 부착 성분은 나노입자와의 비-공유결합 상호작용을 가능하게 하는 하나의 기를 포함할 수 있지만, 다수의 기 또한 고려된다. 예를 들어, 다수의 이온 전하를 이용하여 부착 성분과 나노입자 사이의 충분한 비-공유결합 상호작용을 생성시킬 수 있다. 대안적 실시양태에서, 부착 성분은, 다수의 지질이 리포솜의 이중층 멤브레인 또는 나노입자 상에 코팅된 이중층 또는 단층과 상호작용하도록 다수의 지질을 포함할 수 있다. 특정 실시양태에서는, 주위 용액 조건을 변화시켜 비-공유결합 상호작용을 붕괴시킴으로써 나노입자로부터 부착 성분을 탈착시킬 수 있다.
본원에서 추가로 설명되는 바와 같이, 본 발명의 화합물의 일부는 R1, R2 및/또는 R3을 부착 성분으로서 포함할 수 있다. 일부 실시양태에서, 부착 성분은 포화 또는 불포화 C10-C24 알킬기, 치환된 포화 또는 불포화 C10-C24 알킬 기 또는 콜레스테롤을 포함할 수 있다. 특정 예시적 실시양태에서, 부착 성분은 부착 성분과 지질 이중층의 회합을 용이하게 하도록 선택될 수 있다. 예를 들어, 이중 결합의 길이, 부위 및 기하구조 및/또는 알킬 기의 치환은, 예를 들어 표적화제 및/또는 스텔스제와 같은 다른 성분의 제시에 의한 리포솜의 표면 특성 개질을 가능하게 하기 위해 지질 이중층에 요망되는 도입 수준을 제공하도록 선택될 수 있다.
다른 실시양태에서, 포스포네이트 화합물은 연결기, L1, L2 및/또는 L3에 의해 나노입자에 직접 부착될 수 있다. 이들 실시양태에서, R1, R2 및/또는 R3은 나노입자일 수 있다.
연결기
연결기는 본 발명의 포스포네이트 화합물의 또 다른 특징이다. 당업자는 다양한 연결기가 당업계에 공지되어 있고, 예를 들어 참고문헌 [Hermanson, G.T., Bioconjugate Techniques, 2nd Ed., Academic Press, Inc. (2008)]에서 찾아볼 수 있다는 것을 인지할 수 있다. 본 발명의 연결기를 이용하여, 화합물의 상이한 부분들 사이에 간격을 제공하는 등 화합물에 추가의 특성을 제공할 수 있다. 이러한 간격은, 예를 들어, 나노입자에 의해 발생되는 입체 장애 문제를 극복하기 위해 이용될 수 있다 (예를 들어, 나노입자로부터 일정 거리 떨어져 있는 표적화제가 표적에 결합될 수 있는 경우). 일부 실시양태에서, 연결기는 화합물의 물리적 특성을 변화시키는 데 사용될 수 있다.
일부 실시양태에서, 본 발명의 포스포네이트 화합물은 L1, L2 및 L3(이들은 각각 독립적으로 연결기 또는 결합일 수 있음)을 포함한다. 특정 실시양태에서, L1, L2 및 L3은 각각 독립적으로 친수성의 비-면역원성 수용성 연결기가 되도록 선택될 수 있다. 본 발명의 친수성의 비-면역원성 수용성 연결기는 폴리에틸렌 글리콜, 폴리프로필렌 글리콜, 폴리비닐 알콜, 폴리카르복실레이트, 폴리사카라이드, 및 덱스트란을 포함할 수 있으나 이에 제한되지는 않는다. 당업자는 연결기의 길이 및/또는 화학적 특성이 특정 용도를 위해, 예컨대 상기에서 논의된 바와 같은 간격을 고려하여 선택될 수 있음을 인지할 것이다.
다른 실시양태에서, 연결기는, 예를 들어, C1 -30 알킬렌 연결기 또는 유사한 헤테로알킬렌 연결기 (탄소 사슬에 O, N 및 S로부터 선택된 1 내지 10개의 헤테로원자가 개재된 알킬렌 연결기)일 수 있다. 다르게는, 일부 실시양태에서, 연결기는 아릴 모이어티, 예컨대 페닐렌 고리 또는 헤테로아릴 대응물을 포함할 수 있다. 특정 실시양태에서, 연결기는 부착 성분에 대해 상기 기재한 바와 같은 관능기를 포함할 수 있다. 관능기 (예를 들어, 카르복실 기)는 다른 작용제 (예를 들어, 스텔스제 또는 표적화제)를 포스포네이트 화합물에 부착시키기 위해 사용될 수 있다. 일반적으로 광범위하게 널리 공지되어 있는 연결 화학에 의해, 당업자라면 연결기를 사용하여 본원에 기재된 작용제 (예를 들어, 스텔스제)를 부착할 수 있는 무수히 많은 방법을 인지할 것이다.
특정 실시양태에서, 본 발명의 화합물은, 예를 들어 본원에서 추가로 설명된 포스포네이트 화합물에 연결될 수 있는 연결 스캐폴드를 더 포함할 수 있다. 본 발명의 연결 스캐폴드는 L4로 표시되고, 알킬렌, 아릴렌, 또는 이들의 조합을 포함할 수 있다. 연결 스캐폴드는 알킬렌 연결 스캐폴드 또는 유사한 헤테로알킬렌 연결 스캐폴드 (탄소 사슬에 O, N 및 S로부터 선택된 1 내지 10개의 헤테로원자가 개재된 알킬렌 연결기)를 포함할 수 있다. 또한, 연결 스캐폴드는 아릴렌 연결 스캐폴드 (예를 들어, 페닐렌) 또는 유사한 헤테로아릴렌 연결 스캐폴드 (방향족 고리 중 하나 이상의 탄소가 O, N 및 S로부터 선택된 헤테로원자에 의해 대체되는 아릴렌 연결 스캐폴드)를 포함할 수도 있다. 일부 실시양태에서, L4는 치환된 알킬렌, 치환된 아릴렌, 또는 이들의 조합을 임의로 포함할 수 있다. 예를 들어, 알킬렌 및/또는 아릴렌은 알킬, 아민, 니트릴 및 카르복실산으로 치환될 수 있다.
스텔스제
일부 실시양태에서, 포스포네이트 화합물은 하나 이상의 스텔스제를 포함할 수 있다. 예를 들어, 특정 실시양태에서, R1, R2 및 R3은 독립적으로 스텔스제가 되도록 선택될 수 있다. 스텔스제는 나노입자가 서로, 또한 혈액 세포 또는 관 벽에 점착되는 것을 막을 수 있다. 특정 실시양태에서, 스텔스 나노입자, 예를 들어, 스텔스 리포솜은, 나노입자가 대상체에 투여될 때 면역원성 및/또는 반응원성을 감소시킬 수 있다. 스텔스제는 또한 대상체 내에서의 나노입자의 혈액 순환 시간을 증가시킬 수 있다. 일부 실시양태에서, 나노입자는, 예를 들어, 나노입자가 부분적으로 또는 완전히 스텔스제로 구성되도록, 또는 나노입자가 스텔스제로 코팅되도록, 스텔스제를 포함할 수 있다. 본 발명에서 사용하기 위한 스텔스제는 당업계에 일반적으로 널리 공지되어 있는 것들을 포함할 수 있다. 적합한 스텔스제는 덴드리머, 폴리알킬렌 옥시드, 폴리에틸렌 글리콜, 폴리비닐 알콜, 폴리카르복실레이트, 폴리사카라이드, 및/또는 히드록시알킬 전분을 포함할 수 있으나 이에 제한되지는 않는다. 스텔스제는, 부착 성분과 관련하여 상기에 기재된 바와 같이, 공유결합 및/또는 비-공유결합 부착을 통해 본원에 기재된 포스포네이트 화합물에 부착될 수 있다. 예를 들어, 일부 실시양태에서, 본원에 기재된 포스포네이트 화합물에 대한 스텔스제의 부착은 스텔스제 상의 말단 관능기 (예를 들어, 아미노 기)와 관능기 (예를 들어, 카르복실 기)로 종결되는 연결기와의 반응을 포함할 수 있다.
특정 실시양태에서, 스텔스제는, 당업계에 널리 공지되어 있으며 일반적으로 에틸렌 옥시드의 올리고머 또는 중합체를 지칭하는 "폴리에틸렌 글리콜" 등의 폴리알킬렌 옥시드를 포함할 수 있다. 폴리에틸렌 글리콜 (PEG)은 선형 또는 분지형일 수 있고, 여기서 분지형 PEG 분자는 중심 코어로부터 유래된 추가의 PEG 분자를 가질 수 있고/거나 다수의 PEG 분자가 중합체 주쇄에 그래프팅될 수 있다. 당업계에서 이해되는 바와 같이, 폴리에틸렌 글리콜은, PEG의 유형을 식별하는 데 사용될 수 있는 분자량들의 분포로서 생성될 수 있다. 예를 들어, PEG500은, 당업계에 일반적으로 공지되어 있는 방법에 의해 측정시, ~500 g/mol의 평균 분자량을 갖는 PEG 분자의 분포로 식별된다. 다르게는, PEG는 하기 화학식으로 표시될 수 있다: H-[O-(CH2)2]n-OH (여기서, n은 중합체 내에 존재하는 단량체의 수임 (예를 들어, n은 1 내지 200의 범위일 수 있음)). 예를 들어, PEG100의 분포에 있어, 이는 n이 2인 PEG 중합체를 포함할 수 있다. 또 다른 예로, PEG1000은 n이 24인 PEG 분자를 포함할 수 있다. 다르게는, PEG5000은 n이 114인 PEG 분자를 포함할 수 있다. 일부 실시양태에서, PEG는 상기 나타낸 바와 같이, -OH 기 대신에 메틸기에 의해 종결될 수도 있다.
특정 실시양태에서, PEG는 저분자량 또는 고분자량 PEG, 예를 들어, PEG100, PEG500, PEG1000 , PEG2000, PEG3400, PEG5000, PEG10000, 또는 PEG20000을 포함할 수 있다. 일부 실시양태에서, PEG는 PEG100 내지 PEG10000, 또는 PEG1000 내지 PEG10000, 또는 PEG1000 내지 PEG5000의 범위일 수 있다. 특정 실시양태에서, 스텔스제는 PEG500, PEG1000, PEG2000, 또는 PEG5000일 수 있다. 특정 실시양태에서, PEG는 아민, 메틸 에테르, 알콜, 또는 카르복실산으로 종결될 수 있다. 특정 실시양태에서, 스텔스제는 각각 연결기와 함께 연결된 2개 이상의 PEG 분자를 포함할 수 있다. 연결기는 상기에 기재된 것들, 예를 들어 아미드 연결을 포함할 수 있다. 일부 실시양태에서는, 페길화-지질이, 나노입자를 "스텔스"로 만들기에 충분한 양으로 나노입자, 예를 들어 리포솜의 이중층 내에 존재하며, 여기서 스텔스 나노입자는 감소된 면역원성을 나타낸다.
치료제
일부 실시양태에서, 본 발명의 화합물은 치료제, 진단제, 또는 이들의 조합을 포함할 수 있다. 특정 실시양태에서, 치료제 및/또는 진단제는 본 발명의 포스포네이트 화합물과 직접 회합될 수 있다. 예를 들어, 치료제 및/또는 진단제는 포스포네이트 화합물에 공유결합 부착될 수 있다. 다른 실시양태에서, 치료제 및/또는 진단제는 본 발명의 포스포네이트 화합물과 회합된 나노입자 내에, 그 위에, 또는 그 주위에 어디에도 존재할 수 있다. 일부 실시양태에서, 치료제 및/또는 진단제는 나노입자 내에 내포되거나 캡슐화되거나, 또는 그에 테더링될 수 있다. 특정 실시양태에서, 나노입자는 리포솜이고, 진단 및/또는 치료제는 리포솜 내에 캡슐화된다.
본 발명에서 사용되는 치료제는 대상체에서의 질환을 치료하도록 지향되는 임의의 작용제를 포함할 수 있다. 일반적으로, 미국 약전 (U.S.P.), 문헌 [Goodman and Gilman's The Pharmacological Basis of Therapeutics, 10th Ed., McGraw Hill, 2001]; [Katzung, Ed., Basic and Clinical Pharmacology, McGraw-Hill/Appleton & Lange, 8th ed., September 21, 2000]; [Physician's Desk Reference (Thomson Publishing; and/or The Merck Manual of Diagnosis and Therapy, 18th ed., 2006, Beers and Berkow, Eds., Merck Publishing Group]; 또는 동물의 경우, 문헌 [The Merck Veterinary Manual, 9th ed., Kahn Ed., Merck Publishing Group, 2005] (이들 모두 본원에 참조로 도입됨)에 기재된 치료제를 포함하나 이에 제한되지는 않는 당업계에 공지된 임의의 치료제가 사용될 수 있다.
치료제는 치료가 요망되는 질병의 유형에 따라 선택될 수 있다. 예를 들어, 특정 유형의 암 또는 종양, 예컨대 암종, 육종, 백혈병, 림프종, 골수종, 및 중추 신경계 암 뿐만 아니라 충실성 종양 및 혼합 종양이 동일한 또는 가능하게는 상이한 치료제의 투여에 관여될 수 있다. 특정 실시양태에서, 치료제는 대상체에서의 암 질환을 치료하거나 그에 영향을 주기 위해 전달될 수 있고, 이는 화학치료제, 예컨대 알킬화제, 항대사물질, 안트라사이클린, 알칼로이드, 토포이소머라제 억제제, 및 다른 항암제를 포함할 수 있다. 일부 실시양태에서, 치료제는 안티센스제, 마이크로RNA, siRNA 및/또는 shRNA제를 포함할 수 있다.
일부 실시양태에서, 치료제는 아바스틴, 독소루비신, 시스플라틴, 옥살리플라틴, 카르보플라틴, 5-플루오로우라실, 겜시티빈 또는 탁산, 예컨대 파클리탁셀 및 도세탁셀을 포함하나 이에 제한되지는 않는 항암제 또는 세포독성제를 포함할 수 있다. 추가의 항암제는, 20-epi-1,25 디히드록시비타민 D3,4-이포메아놀, 5-에티닐우라실, 9-디히드로탁솔, 아비라테론, 아시비신, 아클라루비신, 아코다졸 히드로클로라이드, 아크로닌, 아실풀벤, 아데시페놀, 아도젤레신, 알데스류킨, all-tk 길항제, 알트레타민, 암바무스틴, 암보마이신, 아메탄트론 아세테이트, 아미독스, 아미포스틴, 아미노글루테티미드, 아미노레불린산, 암루비신, 암사크린, 아나그렐리드, 아나스트로졸, 안드로그라폴리드, 혈관형성 억제제, 길항제 D, 길항제 G, 안타렐릭스, 안트라마이신, 항배방화 형태형성 단백질(anti-dorsalizing morphogenetic protein)-1, 항에스트로겐, 항신생물약, 안티센스 올리고뉴클레오티드, 아피디콜린 글리시네이트, 아팝토시스 유전자 조정자, 아팝토시스 조절제, 아퓨린산, ARA-CDP-DL-PTBA, 아르기닌 데아미나제, 아스파라기나제, 아스페를린, 아술라크린, 아타메스탄, 아트리무스틴, 악시나스타틴 1, 악시나스타틴 2, 악시나스타틴 3, 아자시티딘, 아자세트론, 아자톡신, 아자티로신, 아제테파, 아조토마이신, 박카틴 III 유도체, 발라놀, 바티마스타트, 벤조클로린, 벤조데파, 벤조일스타우로스포린, 베타 락탐 유도체, 베타-알레틴, 베타클라마이신 B, 베툴린산, BFGF 억제제, 비칼루타미드, 비산트렌, 비산트렌 히드로클로라이드, 비사지리디닐스페르민, 비스나피드, 비스나피드 디메실레이트, 비스트라텐 A, 비젤레신, 블레오마이신, 블레오마이신 술페이트, BRC/ABL 길항제, 브레플레이트, 브레퀴나르 나트륨, 브로피리민, 부도티탄, 부술판, 부티오닌 술폭시민, 칵티노마이신, 칼시포트리올, 칼포스틴 C, 칼루스테론, 캄포테신 유도체, 카나리폭스 IL-2, 카페시타빈, 카라세미드, 카르베티머, 카르보플라틴, 카르복사미드-아미노-트리아졸, 카르복시아미도트리아졸, 카레스트 M3, 카르무스틴, 캄 700, 카르틸라제 유래 억제제, 카루비신 히드로클로라이드, 카르젤레신, 카세인 키나제 억제제, 카스타노스페르민, 세크로핀 B, 세데핑골, 세트로렐릭스, 클로람부실, 클로린, 클로로퀴녹살린 술폰아미드, 시카프로스트, 시롤레마이신, 시스플라틴, 시스-포르피린, 클라드리빈, 클로미펜 유사체, 클로트리마졸, 콜리스마이신 A, 콜리스마이신 B, 콤브레타스타틴 A4, 콤브레타스타틴 유사체, 코나게닌, 크람베시딘 816, 크리스나톨, 크리스타톨 메실레이트, 크립토파이신 8, 크립토파이신 A 유도체, 쿠라신 A, 시클로펜탄트라퀴논, 시클로포스파미드, 시클로플라탐, 시페마이신, 시타라빈, 시타라빈 옥포스페이트, 세포용해 인자, 시토스타틴, 다카르바진, 다클릭시맙, 닥티노마이신, 다우노루비신 히드로클로라이드, 데시타빈, 데히드로디뎀님 B, 데슬로렐린, 덱시포스파미드, 덱소르마플라틴, 덱스라족산, 덱스베라파밀, 데자구아닌, 데자구아닌 메실레이트, 디아지쿠온, 디뎀닌 B, 디독스, 디에틸노르스페르민, 디히드로-5-아자시티딘, 디옥사마이신, 디페닐 스피로무스틴, 도세탁셀, 도코사놀, 돌라세트론, 독시플루리딘, 독소루비신, 독소루비신 히드로클로라이드, 드롤록시펜, 드롤록시펜 시트레이트, 드로모스타놀론 프로피오네이트, 드로나비놀, 듀아조마이신, 듀오카르마이신 SA, 에브셀렌, 에코무스틴, 에다트렉세이트, 에델포신, 에드레콜로맙, 에플로미틴, 에플로미틴 히드로클로라이드, 엘레멘, 엘사미트루신, 에미테푸르, 엔로플라틴, 엔프로메이트, 에피프로피딘, 에피루비신, 에피루비신 히드로클로라이드, 에프리스테리드, 에르불로졸, 적혈구 유전자 치료 벡터 시스템, 에소루비신 히드로클로라이드, 에스트라무스틴, 에스트라무스틴 유사체, 에스트라무스틴 포스페이트 나트륨, 에스트로겐 작동제, 에스트로겐 길항제, 에타니다졸, 에토포시드, 에토포시드 포스페이트, 에토프린, 엑세메스탄, 파드로졸, 파드로졸 히드로클로라이드, 파자라빈, 펜레티니드, 필그라스팀, 피나스테리드, 플라보피리돌, 플레젤라스틴, 플록수리딘, 플루아스테론, 플루다라빈, 플루다라빈 포스페이트, 플루오로다우노루니신 히드로클로라이드, 플루오로우라실, 플루오로시타빈, 포르페니멕스, 포르메스탄, 포스퀴돈, 포스트리에신, 포스트리에신 나트륨, 포테무스틴, 가돌리늄 텍사피린, 질산갈륨, 갈로시타빈, 가니렐릭스, 겔라티나제 억제제, 겜시타빈, 겜시타빈 히드로클로라이드, 글루타티온 억제제, 헵술팜, 헤레굴린, 헥사메틸렌 비스아세트아미드, 히드록시우레아, 하이페리신, 이반드론산, 이다루비신, 이다루비신 히드로클로라이드, 이독시펜, 이드라만톤, 이포스파미드, 일모포신, 일로마스타트, 이미다조아크리돈, 이미퀴모드, 면역자극 펩티드, 인슐린-유사 성장 인자-1 수용체 억제제, 인터페론 작동제, 인터페론 알파-2A, 인터페론 알파-2B, 인터페론 알파-N1, 인터페론 알파-N3, 인터페론 베타-IA, 인터페론 감마-IB, 인터페론, 인터류킨, 이오벤구안, 아이오도독소루비신, 이프로플라틴, 이리노테칸, 이리노테칸 히드로클로라이드, 이로플락트, 이르소글라딘, 이소벵가졸, 이소호모할리콘드린 B, 이타세트론, 자스플라키놀리드, 카할랄리드 F, 라멜라린-N 트리아세테이트, 란레오티드, 란레오티드 아세테이트, 레이나마이신, 레노그라스팀, 렌티난 술페이트, 렙톨스타틴, 레트로졸, 백혈병 억제 인자, 백혈구 알파 인터페론, 류프롤리드 아세테이트, 류프롤리드/에스트로겐/프로게스테론, 류프로렐린, 레바미솔, 리아로졸, 리아로졸 히드로클로라이드, 선형 폴리아민 유사체, 친지질성 디사카라이드 펩티드, 친지질성 백금 화합물, 리소클리나미드 7, 로바플라틴, 롬브리신, 로메트렉솔, 로메트렉솔 나트륨, 로무스틴, 로니다민, 로속산트론, 로속산트론 히드로클로라이드, 로바스타틴, 록소리빈, 루르토테칸, 루테튬 텍사피린, 리소필린, 용균 펩티드, 마이탄신, 만노스타틴 A, 마리마스타트, 마소프로콜, 마스핀, 마트릴리신 억제제, 매트릭스 메탈로프로테이나제 억제제, 마이탄신, 메클로레타민 히드로클로라이드, 메게스트롤 아세테이트, 멜렝게스트롤 아세테이트, 멜팔란, 메노가릴, 메르바론, 메르캅토퓨린, 메테렐린, 메티오니나제, 메토트렉세이트, 메토트렉세이트 나트륨, 메토클로프라미드, 메토프린, 메투레데파, 마이크로알갈 단백질 키나제 C 억제제, MIF 억제제, 미페프리스톤, 밀테포신, 미리모스팀, 미스매치 이중 가닥 RNA, 미틴도미드, 미토카신, 미토크로민, 미토길린, 미토구아존, 미톨락톨, 미토말신, 미토마이신, 미토마이신 유사체, 미토나피드, 미토스페르, 미토탄, 미토톡신 섬유아세포 성장 인자-사포린, 미톡산트론, 미톡산트론 히드로클로라이드, 모파로텐, 몰그라모스팀, 모노클로날 항체, 인간 융모성 고나도트로핀, 모노포스포릴 지질 a/미코박테륨 세포 벽 SK, 모피다몰, 다중 약물 내성 유전자 억제제, 다중 종양 억제제 1-기재의 치료제, 머스타드 항암제, 미카퍼옥시드 B, 미코박테륨 세포 벽 추출물, 미코페놀산, 미리아포론, n-아세틸디날린, 나파렐린, 나그레스팁, 날록손/펜타조신, 나파빈, 나프테르핀, 나르토그라스팀, 네다플라틴, 네모루비신, 네리드론산, 중성 엔도펩티다제, 닐루타미드, 니사마이신, 질소 산화물 조정자, 니트록시드 산화방지제, 니트룰린, 노코다졸, 노갈라마이신, n-치환된 벤즈아미드, 06-벤질구아닌, 옥트레오티드, 오키세논, 올리고뉴클레오티드, 오나프리스톤, 온단세트론, 오라신, 경구 시토킨 유도제, 오르마플라틴, 오사테론, 옥살리플라틴, 옥사우노마이신, 옥시수란, 파클리탁셀, 파클리탁셀 유사체, 파클리탁셀 유도체, 팔라우아민, 팔미토일리족신, 파미드론산, 파낙시트리올, 파노미펜, 파라박틴, 파젤립틴, 페가스파르가제, 펠데신, 펠리오마이신, 펜타무스틴, 펜토산 폴리술페이트 나트륨, 펜토스타틴, 펜트로졸, 페플로마이신 술페이트, 페르플루브론, 페르포스파미드, 페릴릴 알콜, 페나지노마이신, 페닐아세테이트, 포스파타제 억제제, 피시바닐, 필로카르핀 히드로클로라이드, 피포브로만, 피포술판, 피라루비신, 피리트렉심, 피록산트론 히드로클로라이드, 플라세틴 A, 플라세틴 B, 플라스미노겐 활성화제 억제제, 백금 착물, 백금 화합물, 백금-트리아민 착물, 플리카마이신, 플로메스탄, 포르피메르 나트륨, 포르피로마이신, 프레드니무스틴, 프로카르바진 히드로클로라이드, 프로필 비스-아크리돈, 프로스타글란딘 J2, 전립선 암종 항안드로겐, 프로테아솜 억제제, 단백질 A-기재의 면역 조정자, 단백질 키나제 C 억제제, 단백질 티로신 포스파타제 억제제, 퓨린 뉴클레오시드 포스포릴라제 억제제, 퓨로이가신, 퓨로마이신 히드로클로라이드, 퓨르퓨린, 피라조푸린, 피라졸로아크리딘, 피리독실화 헤모글로빈 폴리옥시에틸렌 컨쥬게이트, RAF 길항제, 랄티트렉세드, 라모세트론, RAS 파르네실 단백질 트랜스퍼라제 억제제, RAS 억제제, RAS-GAP 억제제, 메틸제거 레텔립틴, 레늄 RE 186 에티드로네이트, 리족신, 리보프린, 리보자임, RII 레티나미드, RNAi, 로글레티미드, 로히투킨, 로무르티드, 로퀴니멕스, 루비기논 B1, 루복실, 사핑골, 사핑골 히드로클로라이드, 사인토핀, 사르크누, 사르코피톨 A, 사르그라모스팀, SDI 1 모방체, 세무스틴, 세네센세 유래 억제제 1, 센스 올리고뉴클레오티드, 신호 전달 억제제, 신호 전달 조정자, 심트라젠, 단일 사슬 항원 결합 단백질, 시조푸란, 소부족산, 나트륨 보로캅테이트, 나트륨 페닐아세테이트, 솔베롤, 소마토메딘 결합 단백질, 소네르민, 스파르포세이트 나트륨, 스파르포스산, 스파르소마이신, 스피카마이신 D, 스피로게르마늄 히드로클로라이드, 스피로무스틴, 스피로플라틴, 스플레노펜틴, 스퐁기스타틴 1, 스쿠알라민, 줄기 세포 억제제, 줄기-세포 분할 억제제, 스티피아미드, 스트렙토니그린, 스트렙토조신, 스트로멜리신 억제제, 술피노신, 술로페누르, 초활성 혈관활성 장 펩티드 길항제, 수라디스타, 수라민, 스와인소닌, 합성 글리코사미노글리칸, 탈리소마이신, 탈리무스틴, 타목시펜 메티오디드, 타우로무스틴, 타자로텐, 테코갈란 나트륨, 테가푸르, 텔루라피릴륨, 텔로머라제 억제제, 텔록산트론 히드로클로라이드, 테모포르핀, 테모졸로미드, 테니포시드, 테록시론, 테스톨락톤, 테트라클로로데카옥시드, 테트라조민, 탈리블라스틴, 탈리도미드, 티아미프린, 티오코랄린, 티오구아닌, 티오테파, 트롬보포이에틴, 트롬보포이에틴 모방체, 티말파신, 티모포이에틴 수용체 작동제, 티모트리난, 갑상선 자극 호르몬, 티아조푸린, 틴 에틸 에티오퓨르퓨린, 티라파자민, 티타노센 디클로라이드, 토포테칸 히드로클로라이드, 톱센틴, 토레미펜, 토레미펜 시트레이트, 전분화 줄기 세포 인자, 번역 억제제, 트레스톨론 아세테이트, 트레티노인, 트리아세틸루리딘, 트리시리빈, 트리시리빈 포스페이트, 트리메트렉세이트, 트리메트렉세이트 글루쿠로네이트, 트리프토렐린, 트로피세트론, 투불로졸 히드로클로라이드, 투로스테리드, 티로신 키나제 억제제, 티르포스틴, UBC 억제제, 우베니멕스, 우라실 머스타드, 우레데파, 비뇨생식동-유래 성장 억제 인자, 우로키나제 수용체 길항제, 바프레오티드, 바리올린 B, 벨라레솔, 베라민, 베르딘, 베르테포르핀, 빈블라스틴 술페이트, 빈크리스틴 술페이트, 빈데신, 빈데신 술페이트, 비네피딘 술페이트, 빙글리시네이트 술페이트, 빈류로신 술페이트, 비노렐빈, 비노렐빈 타르트레이트, 빈로시딘 술페이트, 빈크살틴, 빈졸리딘 술페이트, 비탁신, 보로졸, 자노테론, 제니플라틴, 질라스코르브, 지노스타틴, 지노스타틴 스티말라메르, 또는 조루비신 히드로클로라이드를 포함할 수 있으나 이에 제한되지는 않는다.
일부 실시양태에서, 치료제는 2종 이상의 치료제를 투여하는 것을 포함하는 작용제의 칵테일의 일부일 수 있다. 예를 들어, 시스플라틴 및 옥살리플라틴 둘 다를 갖는 리포솜이 투여될 수 있다. 또한, 치료제는 면역 자극 애주번트, 예컨대 알루미늄 겔 또는 염 애주번트 (예를 들어, 인산알루미늄 또는 수산화알루미늄), 인산칼슘, 엔도톡신, 톨(toll)-유사 수용체 애주번트 등 전에, 그 후에, 또는 그와 함께 전달될 수 있다.
본 발명의 치료제는 또한 치료 용도에 사용하기 위한 방사성핵종을 포함할 수 있다. 예를 들어, 오제(Auger) 전자의 방사체, 예컨대 111In이 킬레이트, 예컨대 디에틸렌트리아민펜타아세트산 (DTPA) 또는 1,4,7,10-테트라아자시클로도데칸-1,4,7,10-테트라아세트산 (DOTA)과 조합되어, 치료에 사용되도록 표적화된 전달 조성물, 예컨대 리포솜 중에 포함될 수 있다. 다른 적합한 방사성핵종 및/또는 방사성핵종-킬레이트 조합은 베타 방사성핵종 (177Lu, 153Sm, 88/90Y)과 DOTA, 64Cu-TETA, 188/186Re(CO)3-IDA; 188/186Re(CO)트리아민 (시클릭 또는 선형), 188/186Re(CO)3-Enpy2, 및 188/186Re(CO)3-DTPA를 포함할 수 있으나 이에 제한되지는 않는다.
상기에 기재된 바와 같이, 본 발명에서 사용되는 치료제는, 나노입자 내에 내포되거나 캡슐화되거나, 또는 그에 테더링되는 등의 다양한 방식으로 나노입자와 회합될 수 있다. 치료제의 로딩은, 예를 들어 참고문헌 [de Villiers, M. M. et al., Eds., Nanotechnology in Drug Delivery, Springer (2009)]; [Gregoriadis, G., Ed., Liposome Technology: Entrapment of drugs and other materials into liposomes, CRC Press (2006)]에 개시된 바와 같이, 당업계에 공지된 다양한 방식으로 수행될 수 있다. 하나의 실시양태 군에서는, 1종 이상의 치료제가 리포솜 내에 로딩될 수 있다. 리포솜의 로딩은, 예를 들어, 능동 또는 수동 방식으로 수행될 수 있다. 예를 들어, 치료제는, 치료제가 리포솜 내에 캡슐화되도록, 용액 중에서의 리포솜의 자체-어셈블리 과정 동안 포함될 수 있다. 특정 실시양태에서, 치료제는 또한 리포솜 이중층 내에 또는 다층 리포솜의 다층 내에 내포될 수 있다. 대안적 실시양태에서, 치료제는 리포솜 내에 능동 로딩될 수 있다. 예를 들어, 리포솜을 전기천공법과 같은 조건에 노출시킬 수 있고, 여기서는 이중층 멤브레인이 치료제를 함유하는 용액에 대해 투과성이 되어 치료제가 리포솜의 내부 부피로 도입될 수 있다.
진단제
본 발명에서 사용되는 진단제는, 예를 들어 참고문헌 [Armstrong et al., Diagnostic Imaging, 5th Ed., Blackwell Publishing (2004)]; [Torchilin, V. P., Ed., 표적화된 Delivery of Imaging Agents, CRC Press (1995)]; [Vallabhajosula, S., Molecular Imaging: Radiopharmaceuticals for PET and SPECT, Springer (2009)]에 제공된 바와 같은, 당업계에 공지된 임의의 진단제를 포함할 수 있다. 특정 실시양태에서, R1, R2 및 R3은 독립적으로 진단제가 되도록 선택될 수 있다. 진단제는, 감마-방출, 방사성, 에코발생, 광학, 형광, 흡수, 자기 또는 단층촬영 신호를 포함하나 이에 제한되지는 않는 검출가능한 신호를 제공하고/거나 향상시키는 작용제에서와 같이, 다양한 방식으로 검출될 수 있다. 진단제의 영상화 기술은 단일 광자 방출 컴퓨터 단층촬영 (SPECT), 자기 공명 영상 (MRI), 광학 영상, 양전자 방출 단층촬영 (PET), 컴퓨터 단층촬영 (CT), x-선 영상, 감마선 영상 등을 포함할 수 있으나 이에 제한되지는 않는다.
일부 실시양태에서, 진단제는, 예를 들어 금속 이온에 결합되어 다양한 진단 영상화 기술에 사용되는 킬레이터를 포함할 수 있다. 킬레이터의 예는, 에틸렌디아민테트라아세트산 (EDTA), [4-(1,4,8,11-테트라아자시클로테트라데스-1-일) 메틸]벤조산 (CPTA), 시클로헥산디아민테트라아세트산 (CDTA), 에틸렌비스(옥시에틸렌니트릴로)테트라아세트산 (EGTA), 디에틸렌트리아민펜타아세트산 (DTPA), 시트르산, 히드록시에틸 에틸렌디아민 트리아세트산 (HEDTA), 이미노디아세트산 (IDA), 트리에틸렌 테트라아민 헥사아세트산 (TTHA), 1,4,7,10-테트라아자시클로도데칸-1,4,7,10-테트라(메틸렌 포스폰산) (DOTP), 1,4,8,11-테트라아자시클로도데칸-1,4,8,11-테트라아세트산 (TETA), 1,4,7,10-테트라아자시클로도데칸-1,4,7,10-테트라아세트산 (DOTA), 및 이들의 유도체를 포함하나 이에 제한되지는 않는다.
본원에 기재된 진단제의 일부에는 방사성 동위원소가 도입될 수 있고, 이는 감마선, 양전자, 베타 및 알파 입자, 및 X-선을 방출하는 방사성핵종을 포함할 수 있다. 적합한 방사성핵종은 225Ac, 72As, 211At, 11B, 128Ba, 212Bi, 75Br, 77Br, 14C, 109Cd, 62Cu, 64Cu, 67Cu, 18F, 67Ga, 68Ga, 3H, 123I, 125I, 130I, 131I, 111In, 177Lu, 13N, 15O, 32P, 33P, 212Pb, 103Pd, 186Re, 188Re, 47Sc, 153Sm, 89Sr, 99 mTc, 88Y 및 90Y을 포함하나 이에 제한되지는 않는다. 특정 실시양태에서, 방사능 작용제는 111In-DTPA, 99mTc(CO)3-DTPA, 99 mTc(CO)3-ENPy2, 62/64/67Cu-TETA, 99 mTc(CO)3-IDA, 및 99 mTc(CO)3트리아민 (시클릭 또는 선형)을 포함할 수 있다. 다른 실시양태에서, 상기 작용제는 DOTA 및 111In, 177Lu, 153Sm, 88/90Y, 62/64/67Cu, 또는 67/68Ga를 갖는 그의 각종 유사체를 포함할 수 있다. 일부 실시양태에서, 리포솜은, 예를 들어, 참고문헌 [Phillips et al., Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology, 1(1): 69-83 (2008)]; [Torchilin, V.P. & Weissig, V., Eds. Liposomes 2nd Ed.: Oxford Univ. Press (2003)]; [Elbayoumi, T.A. & Torchilin, V.P., Eur. J. Nucl. Med. Mol. Imaging 33:1196- (2006)]; [Mougin-Degraef, M. et al., Int'l J. Pharmaceutics 344:110-117 (2007)]에 제공된 바와 같이, DTPA-지질과 같이, 킬레이트에 부착된 지질의 도입에 의해 방사성표지될 수 있다.
다른 실시양태에서, 진단제는 형광제, 인광제, 화학발광제 등과 같은 광학 작용제를 포함할 수 있다. 수많은 작용제 (예를 들어, 염료, 프로브, 표지 또는 지시제)가 당업계에 공지되어 있고, 본 발명에서 사용될 수 있다. (예를 들어, 문헌 [Invitrogen, The Handbook-A Guide to Fluorescent Probes and Labeling Technologies, Tenth Edition (2005)] 참조). 형광제는 각종 유기 및/또는 무기 소분자 또는 각종 형광 단백질 및 이들의 유도체를 포함할 수 있다. 예를 들어, 형광제는 시아닌, 프탈로시아닌, 포르피린, 인도시아닌, 로다민, 페녹사진, 페닐크산텐, 페노티아진, 페노셀레나진, 플루오레세인, 벤조포르피린, 스쿠아레인, 디피롤로 피리미돈, 테트라센, 퀴놀린, 피라진, 코린, 크로코늄, 아크리돈, 페난트리딘, 로다민, 아크리딘, 안트라퀴논, 칼코게노피릴륨 유사체, 클로린, 나프탈로시아닌, 메틴 염료, 인돌레늄 염료, 아조 화합물, 아줄렌, 아자아줄렌, 트리페닐 메탄 염료, 인돌, 벤조인돌, 인도카르보시아닌, 벤조인도카르보시아닌, 및 4,4-디플루오로-4-보라-3a,4a-디아자-s-인다센의 일반적 구조를 갖는 보디피(BODIPY)™ 유도체, 및/또는 임의의 이들의 컨쥬게이트 및/또는 유도체를 포함할 수 있으나 이에 제한되지는 않는다. 사용가능한 다른 작용제는, 예를 들어, 플루오레세인, 플루오레세인-폴리아스파르트산 컨쥬게이트, 플루오레세인-폴리글루탐산 컨쥬게이트, 플루오레세인-폴리아르기닌 컨쥬게이트, 인도시아닌 그린, 인도시아닌-도데카아스파르트산 컨쥬게이트, 인도시아닌-폴리아스파르트산 컨쥬게이트, 이소술판 블루, 인돌 디술포네이트, 벤조인돌 디술포네이트, 비스(에틸카르복시메틸)인도시아닌, 비스(펜틸카르복시메틸)인도시아닌, 폴리히드록시인돌 술포네이트, 폴리히드록시벤조인돌 술포네이트, 경질 헤테로원자 인돌 술포네이트, 인도시아닌비스프로판산, 인도시아닌비스헥산산, 3,6-디시아노-2,5-[(N,N,N',N'-테트라키스(카르복시메틸)아미노]피라진, 3,6-[(N,N,N',N'-테트라키스(2-히드록시에틸)아미노]피라진-2,5-디카르복실산, 3,6-비스(N-아자테디노)피라진-2,5-디카르복실산, 3,6-비스(N-모르폴리노)피라진-2,5-디카르복실산, 3,6-비스(N-피페라지노)피라진-2,5-디카르복실산, 3,6-비스(N-티오모르폴리노)피라진-2,5-디카르복실산, 3,6-비스(N-티오모르폴리노)피라진-2,5-디카르복실산 S-옥시드, 2,5-디시아노-3,6-비스(N-티오모르폴리노)피라진 S,S-디옥시드, 인도카르보시아닌테트라술포네이트, 클로로인도카르보시아닌, 및 3,6-디아미노피라진-2,5-디카르복실산을 포함하나 이에 제한되지는 않는다.
당업자는, 사용되는 특정 광학 작용제는 여기에 이용되는 파장, 피부 조직 하부 깊이, 및 당업계에 일반적으로 널리 공지되어 있는 다른 요인에 따라 달라질 수 있음을 인지할 것이다. 예를 들어, 광학 작용제의 최적 흡수 또는 여기 최대는 사용되는 작용제에 따라 달라질 수 있지만, 일반적으로, 본 발명의 광학 작용제는 전자기 스펙트럼의 자외선 (UV), 가시광선 또는 적외선 (IR) 범위의 빛을 흡수하거나 그에 의해 여기될 것이다. 영상화를 위해, 근-IR에서 흡수하고 방출하는 염료 (~700 내지 900 nm, 예를 들어, 인도시아닌)이 바람직하다. 내시경 방법을 이용한 국소 시각화에서는, 가시광선 영역에서 흡수하는 임의의 염료가 적합하다.
일부 실시양태에서, 본 발명의 방법에서 사용되는 비-이온화 방사선은 약 350 nm 내지 약 1200 nm의 파장 범위일 수 있다. 하나의 예시적 실시양태에서, 형광제는 전자기 스펙트럼의 가시광선 부분의 청색 범위 (약 430 nm 내지 약 500 nm)의 파장을 갖는 빛에 의해 여기될 수 있고, 전자기 스펙트럼의 가시광선 부분의 녹색 범위 (약 520 nm 내지 약 565 nm)의 파장에서 방출한다. 예를 들어, 플루오레세인 염료는 약 488 nm의 파장을 갖는 빛으로 여기될 수 있고, 이는 약 520 nm의 방출 파장을 가질 수 있다. 또 다른 예로, 3,6-디아미노피라진-2,5-디카르복실산은 약 470 nm의 파장을 갖는 빛으로 여기될 수 있고, 약 532 nm의 파장에서 형광을 낸다. 또 다른 실시양태에서, 광학 작용제의 여기 및 방출 파장은 전자기 스펙트럼의 근-적외선 범위 내에 포함될 수 있다. 예를 들어, 인도시아닌 염료, 예컨대 인도시아닌 그린은 약 780 nm의 파장을 갖는 빛으로 여기될 수 있고, 약 830 nm의 방출 파장을 가질 수 있다.
또한 다른 실시양태에서, 진단제는 당업계에 일반적으로 널리 공지되어 있는 자기 공명 (MR) 및 x-선 콘트라스트제, 예를 들어, 아이오딘-기재의 x-선 콘트라스트제, 초상자성 산화철 (SPIO), 가돌리늄 또는 망간의 착물 등을 포함할 수 있으나 이에 제한되지는 않는다. (예를 들어, 문헌 [Armstrong et al., Diagnostic Imaging, 5th Ed., Blackwell Publishing (2004)] 참조). 일부 실시양태에서, 진단제는 자기 공명 (MR) 영상화제를 포함할 수 있다. 자기 공명 작용제의 예는 상자성 작용제, 초상자성 작용제 등을 포함하나 이에 제한되지는 않는다. 상자성 작용제의 예는 가도펜테트산, 가도테르산, 가도디아미드, 가돌리늄, 가도테리돌, 망가포디피르, 가도베르세타미드, 시트르산제2철암모늄, 가도벤산, 가도부트롤, 또는 가독세트산을 포함할 수 있으나 이에 제한되지는 않는다. 초상자성 작용제는 초상자성 산화철 및 페리스텐을 포함할 수 있으나 이에 제한되지는 않는다. 특정 실시양태에서, 진단제는, 예를 들어 참고문헌 [H.S Thomsen, R.N. Muller and R.F. Mattrey, Eds., Trends in Contrast Media, (Berlin: Springer-Verlag, 1999)]; [P. Dawson, D. Cosgrove and R. Grainger, Eds., Textbook of Contrast Media (ISIS Medical Media 1999)]; [Torchilin, V.P., Curr. Pharm. Biotech. 1:183-215 (2000)]; [Bogdanov, A.A. et al., Adv. Drug Del. Rev. 37:279-293 (1999)]; [Sachse, A. et al., Investigative Radiology 32(1):44-50 (1997)]에 제공된 바와 같은, x-선 콘트라스트제를 포함할 수 있다. x-선 콘트라스트제의 예는, 이오파미돌, 이오메프롤, 이오헥솔, 이오펜톨, 이오프로미드, 이오시미드, 이오베르솔, 이오트롤란, 이오타술, 이오딕사놀, 이오데시몰, 이오글루카미드, 이오글루니드, 이오굴라미드, 이오사르콜, 이옥실란, 이오파미론, 메트리자미드, 이오비트리돌 및 이오시메놀을 포함하나 이에 제한되지는 않는다. 특정 실시양태에서, x-선 콘트라스트제는 이오파미돌, 이오메프롤, 이오프로미드, 이오헥솔, 이오펜톨, 이오베르솔, 이오비트리돌, 이오딕사놀, 이오트롤란 및 이오시메놀을 포함할 수 있다.
상기에 기재된 치료제와 유사하게, 진단제는, 예를 들어 나노입자 내에 내포되거나 캡슐화되거나, 또는 그에 테더링되는 것을 포함한 다양한 방식으로 나노입자와 회합될 수 있다. 유사하게, 진단제의 로딩은, 예를 들어 참고문헌 [de Villiers, M. M. et al., Eds., Nanotechnology in Drug Delivery, Springer (2009)]; [Gregoriadis, G., Ed., Liposome Technology: Entrapment of drugs and other materials into liposomes, CRC Press (2006)]에 개시된 바와 같이, 당업계에 공지된 다양한 방식으로 수행될 수 있다.
표적화제
일부 실시양태에서, 본 발명의 포스포네이트 화합물은 또한 1종 이상의 표적화제를 포함할 수 있다. 예를 들어, 특정 실시양태에서, R1, R2 및 R3은 독립적으로 표적화제가 되도록 선택될 수 있다. 일반적으로, 본 발명의 표적화제는, 기관, 조직, 세포, 세포외 매트릭스, 또는 세포내 영역과 회합된 표적과 같은 임의의 관심있는 표적과 회합될 수 있다. 특정 실시양태에서, 표적은 특정 질병 상태, 예컨대 암 질환과 관련될 수 있다. 다르게는, 표적화제는, 예를 들어 특정 질병 및/또는 세포, 조직, 및/또는 대상체의 특정 상태를 나타내는 표적을 가질 수 있는 하나 이상의 특정 유형의 세포를 표적화할 수 있다. 일부 실시양태에서, 표적화제는 단지 하나의 표적, 예컨대 수용체에 대해 특이적일 수 있다. 적합한 표적은 핵산, 예컨대 DNA, RNA, 또는 이들의 변형된 유도체를 포함할 수 있으나 이에 제한되지는 않는다. 적합한 표적은 또한 단백질, 예컨대 세포외 단백질, 수용체, 세포 표면 수용체, 종양-마커, 트랜스멤브레인 단백질, 효소, 또는 항체를 포함할 수 있으나 이에 제한되지는 않는다. 적합한 표적은, 예를 들어, 세포 표면 상에 존재할 수 있는, 탄수화물, 예컨대 모노사카라이드, 디사카라이드, 또는 폴리사카라이드를 포함할 수 있다. 특정 실시양태에서, 적합한 표적은 뮤신, 예컨대 MUC-1 및 MUC-4, 성장 인자 수용체, 예컨대 EGFR, 클라우딘 4, 핵소체 인단백질, 예컨대 뉴클레올린, 케모카인 수용체, 예컨대 CCR7, 수용체, 예컨대 소마토스타틴 수용체 4, Erb-B2 (적혈모구 백혈병 종양유전자 동족체 2) 수용체, CD44 수용체, 및 VEGF 수용체-2 키나제를 포함할 수 있다.
특정 실시양태에서, 표적화제는 표적 리간드의 소분자 모방체 (예를 들어, 펩티드 모방 리간드), 표적 리간드 (예를 들어, RGD 펩티드 함유 펩티드 또는 폴레이트 아미드), 또는 특정 표적에 대해 특이적인 항체 또는 항체 단편을 포함할 수 있다. 일부 실시양태에서, 표적화제는 폴산 유도체, B-12 유도체, 인테그린 RGD 펩티드, NGR 유도체, 소마토스타틴 유도체 또는 소마토스타틴 수용체에 결합하는 펩티드, 예를 들어, 옥트레오티드 및 옥트레오테이트 등을 추가로 포함할 수 있다.
본 발명의 표적화제는 또한 앱타머를 포함할 수 있다. 앱타머는 관심있는 표적과 회합되거나 그에 결합하도록 디자인될 수 있다. 앱타머는, 예를 들어, DNA, RNA, 및/또는 펩티드로 구성될 수 있고, 앱타머의 특정 측면은 당업계에 널리 공지되어 있다. (예를 들어, 문헌 [Klussman, S., Ed., The Aptamer Handbook, Wiley-VCH (2006)]; [Nissenbaum, E.T., Trends in Biotech. 26(8): 442-449 (2008)] 참조). 본 발명에서, 적합한 앱타머는 선형이거나 고리화될 수 있고, 약 150개 미만의 염기를 갖는 (즉, 약 150 mer 미만) 올리고뉴클레오티드를 포함할 수 있다. 앱타머는 길이가 약 100 내지 약 150개 염기 또는 약 80 내지 약 120개 염기의 범위일 수 있다. 특정 실시양태에서, 앱타머는 약 12 내지 약 40개 염기, 약 12 내지 약 25개 염기, 약 18 내지 약 30개 염기, 또는 약 15 내지 약 50개 염기의 범위일 수 있다. 앱타머는 질병 상태에서 존재하거나 발현되는 적합한 표적과 함께 사용하기 위해 개발될 수 있고, 이는 본원에 기재된 표적 부위를 포함하나 이에 제한되지는 않는다.
IV
.
포스포네이트
화합물 및 관련 성분의 제조 방법
포스포네이트 화합물은 다양한 방식으로 제조될 수 있다. 하나의 측면에서, 본 발명은 포스포네이트 화합물의 제조 방법을 포함하고, 본 방법은,
촉매의 존재 하에서, 화학식:
을 갖는 H-포스포네이트 화합물을, 화학식:
을 갖는 알킨 화합물과 조합하여, 화학식:
을 갖는 포스포네이트 화합물
(상기 식에서, 로 식별되는 결합은 단일 또는 이중 결합이고; L1, L2 및 L3은 각각 연결기이고; R1, R2 및 R3은 각각 독립적으로 부착 성분, 표적화제, 진단제 및 스텔스제로 이루어진 군으로부터 선택되고; R4는 H 및 -P(=O)(OL1-R1)(OL2-R2)로 이루어진 군으로부터 선택된 구성원이고, 상기 R4가 H 이외의 것일 때, 로 식별되는 결합은 단일 결합임)을 형성하는 것을 포함한다.
본원에서 제공된 바와 같이, H-포스포네이트 화합물 및 알킨 화합물이 관여되는 반응을 이용하여 부착 성분, 표적화제, 진단제, 치료제, 스텔스제, 또는 이들의 조합을 포함할 수 있는 매우 다양한 화합물을 제조할 수 있다. 또한, 이들 화합물의 제조 방법을 나노입자와 조합하여 화합물의 합성을 가능하게 하면서, 출발 물질 중 하나, 예를 들어 알킨 화합물을 나노입자에 부착시킬 수 있다.
당업자라면 본 발명의 포스포네이트 화합물의 제조를 위해 이용될 수 있는 다양한 합성 방법을 인지할 것이다. 예를 들어, 도 1에 도시된 바와 같이, 알킨 화합물을 각각 리포솜에 부착하고, H-포스포네이트 화합물과 조합하여 리포솜의 표면 상에 포스포네이트 화합물을 합성할 수 있고, 이로 인해, 예를 들어 표적화제 및/또는 스텔스제를 제시할 수 있다. 도 1에 나타낸 바와 같이, 알킨 화합물은 부착 성분인 R3에 의해 리포솜에 부착된다. 2개의 H-포스포네이트 화합물과의 후속 반응은 도 1에 나타낸 제시 어셈블리를 제조할 수 있고, 여기서 2개의 표적화제 (R1) 및 2개의 진단제 (R2)가 리포솜의 표면 상에 제시된다.
다르게는, 예시적 도 2에 도시된 바와 같이, H-포스포네이트 화합물을 나노입자에 부착하고, 이어서 알킨 화합물과 조합하여 나노입자의 표면 상의 본 발명의 포스포네이트 화합물을 생성시킬 수 있다. 예를 들어, 도 2에서 나타낸 바와 같이, R1 및 R2는 리포솜의 지질 이중층에 부착되는 부착 성분일 수 있다. 이어서, H-포스포네이트 화합물을 갖는 제조된 리포솜을 알킨 화합물과 조합할 수 있고, 상기 알킨 화합물은, 예를 들어 표적화제를 포함한다. 후속 히드로포스포닐화 반응 후에, 표적화제는 리포솜의 표면 상에 나타날 수 있고, 이로 인해 리포솜이 표적화된 리포솜으로 변형된다. 도 2의 앵커링 어셈블리는 2개 및 4개의 부착 성분 각각이 지질 이중층 내에 내포되도록 함으로써 안정성을 추가로 제공한다. 상기에서 보다 상세히 설명한 바와 같이, 연결기 L1, L2, 및 L3은, 요망되는 간격 또는 특정 용도를 위해 요망되는 다른 특징을 가능하게 하는 연결기 또는 결합으로서 독립적으로 선택될 수 있다.
히드로포스포닐화 반응이 나노입자 상의 본 발명의 포스포네이트 화합물의 제조에 대한 여러 이점을 제공하지만, 다른 방법을 이용하여 화합물을 제조할 수 있다. 예를 들어, H-포스포네이트 화합물 및 알킨 화합물을 함께 반응시켜 본 발명의 포스포네이트 화합물을 형성할 수 있다. 이어서, 포스포네이트 화합물을 나노입자에 부착시킬 수 있다. 일부 실시양태에서는, 먼저 표준 방법, 예를 들어, 압출을 이용하여 리포솜을 제조하고, 이어서 리포솜에 포스포네이트 화합물을 부착시킴으로써, 포스포네이트 화합물을 리포솜 내에 도입할 수 있다. 다른 실시양태에서는, 예를 들어, 포스포네이트 화합물 및 지질 성분을 함께 건조시키고, 이어서 혼합물을 수용액 중에 재현탁시켜 이중층과 회합된 포스포네이트 화합물을 갖는 리포솜을 형성함으로써, 리포솜의 형성 동안 포스포네이트 화합물을 리포솜 이중층 내에 도입할 수 있다.
다른 합성 순서를 이용하여 포스포네이트 화합물을 제조할 수 있다는 것 또한 고려된다. 예를 들어, 도 1에 나타낸 바와 같은 R3 및 L3을 포함하는 알킨 화합물을 R1 및 R2를 함유하지 않는 H-포스포네이트와 반응시킬 수 있다. 이러한 실시양태에서, L1은, 예를 들어, 표적화제, 스텔스제, 또는 진단제를 포함할 수 있는, R1 및/또는 R2에 대한 결합을 위한 관능기를 포함하는 연결기일 수 있다. 따라서, R1 및/또는 R2를 L1의 관능기와 반응시켜 최종 포스포네이트 화합물을 제조할 수 있다. 당업자는 본 발명의 포스포네이트 화합물을 제조하기 위한 여러 다른 가능한 합성 순서가 존재함을 인지할 것이다. 예를 들어, L3은 H-포스포네이트 화합물이 알킨 화합물과 반응한 후 추후에 R3과 반응할 수 있는 관능기를 가질 수 있다. 특정 실시양태에서, R1 및 R2는 동일할 수 있고, 따라서, 예를 들어, R1 및 R2가 표적화제인 경우, L1 및 L2는 각각 표적화제와 반응하여 본 발명의 포스포네이트 화합물을 제조할 수 있는 관능기를 함유할 수 있다.
본 발명은, 예를 들어 본원에서 추가로 설명되는, H-포스포네이트 화합물에 연결될 수 있는 연결 스캐폴드를 포함하는 화합물을 추가로 제공한다. 본원에서 추가로 설명된 연결 스캐폴드는 L4로 표시되고, 알킬렌, 아릴렌, 또는 이들의 조합을 포함할 수 있다.
하나의 측면에서, 본 발명은 포스포네이트 화합물의 제조 방법을 포함하고, 본 방법은,
촉매의 존재 하에서, 화학식:
을 갖는 H-포스포네이트 화합물을, 화학식:
을 갖는 알킨 화합물과 조합하여, 화학식:
을 갖는 포스포네이트 화합물
(상기 식에서, L1 및 L2는 각각 결합 또는 연결기이고; R1 및 R2는 각각 독립적으로 나노입자, 부착 성분, 표적화제, 진단제 및 스텔스제로 이루어진 군으로부터 선택되고; L4는 아릴렌, 알킬렌 또는 이들의 조합으로 이루어진 군으로부터 선택됨)을 형성하는 것을 포함한다. 특정 실시양태에서, H-포스포네이트 화합물 및 알킨 화합물은 각각 2:1의 몰비로 조합된다.
나노입자
본원에서 제공된 바와 같이, 본 발명은 당업계에 일반적으로 공지되어 있는 다양한 방식에 의해 제조될 수 있는 나노입자의 용도를 포함하고, 이러한 나노입자의 제조 방법은 요망되는 특정 나노입자에 따라 달라질 수 있다. 당업계에서 이용가능한 임의의 측정 기술을 이용하여 표적화된 전달 조성물 및 나노입자의 특성을 측정할 수 있다. 예를 들어, 동적 광 산란, x-선 광전자 현미경검사, 분말 x-선 회절, 주사 전자 현미경검사 (SEM), 투과 전자 현미경검사 (TEM), 및 원자간력 현미경검사 (AFM) 등의 기술을 이용하여 나노입자 및/또는 표적화된 전달 조성물의 평균 크기 및 분산성을 측정할 수 있다.
본 발명에서 사용되는 리포솜은 당업계에 일반적으로 널리 공지되어 있는 다양한 기술을 이용하여 제조될 수 있다. (예를 들어, 문헌 [Williams, A.P., Liposomes: A Practical Approach, 2nd Edition, Oxford Univ. Press (2003)]; [Lasic, D.D., Liposomes in Gene Delivery, CRC Press LLC (1997)] 참조). 예를 들어, 리포솜은 압출, 교반, 음파파쇄, 역상 증발, 수용액 중의 자체-어셈블리, 전극-기재의 형성 기술, 미세유체 유도 형성 기술 등의 기술 (이에 제한되지는 않음)에 의해 제조될 수 있다. 특정 실시양태에서는, 방법을 이용하여, 대형 단층 소포 (LUV) 및/또는 소형 단층 소포 (SUV)를 포함할 수 있는, 다층 및/또는 단층인 리포솜을 제조할 수 있다. 용액 중에서의 리포솜의 자체-어셈블리와 유사하게, 양친매성 분자가 미셀을 형성하기에 충분한 용액 조건에서 용해시 미셀을 형성하도록, 당업계에 일반적으로 널리 공지되어 있는 기술을 이용하여 미셀을 제조할 수 있다. 또한, 당업계에 공지된 방법을 이용하여 지질-코팅된 기포 및 지질단백질을 구성할 수 있다. (예를 들어, 문헌 [Farook, U., J. R. Soc. Interface, 6(32): 271-277 (2009)]; [Lacko et al., Lipoprotein Nanoparticles as Delivery Vehicles for Anti-Cancer Agents in Nanotechnology for Cancer Therapy, CRC Press (2007)] 참조).
본 발명에서 사용될 수 있는 중합체 나노입자의 제조 방법은 당업계에 일반적으로 널리 공지되어 있다 (예를 들어, 문헌 [Sigmund, W. et al., Eds., Particulate Systems in Nano- and Biotechnologies, CRC Press LLC (2009)]; [Karnik et al., Nano Lett., 8(9): 2906-2912 (2008)] 참조). 예를 들어, 블록 공중합체가 용액 중에서 자체-어셈블링되어 폴리머솜 및/또는 블록 공중합체 미셀을 형성할 수 있도록 당업계에 공지된 합성 방법을 이용하여 블록 공중합체를 제조할 수 있다. 니오솜은 당업계에 공지되어 있고, 이는 다양한 기술 및 조성물을 이용하여 제조될 수 있다 (문헌 [Baillie A.J. et al., J. Pharm. Pharmacol., 38:502-505 (1988)]). 공-침전, 열 분해, 및 마이크로에멀젼 등의 당업계에 공지된 임의의 방법을 이용하여 자기 및/또는 금속 입자를 구성할 수 있다. (또한 문헌 [Nagarajan, R. & Hatton, T.A., Eds., Nanoparticles Synthesis, Stabilization, Passivation, and Functionalization, Oxford Univ. Press (2008)] 참조). 투르케비치(Turkevich) 방법, 브루스트(Brust) 방법, 페라우트(Perraut) 방법 또는 초음파분해(sonolysis) 등의 당업계에 일반적으로 공지되어 있는 다양한 기술을 이용하여 금 입자 및 그의 유도체를 제조할 수 있다. (또한, 문헌 [Grzelczak et al., Chem. Soc. Rev., 37: 1783-1791 (2008)] 참조). 일부 실시양태에서는, 부착 성분을 황-금 테더링 화학을 통해 부착시킬 수 있다. 콜로이드 합성 기술 등의 당업계에 공지된 임의의 방법을 이용하여 양자점 또는 반도체 나노결정을 합성할 수 있다. 일반적으로, 양자점은 셀레늄화카드뮴, 황화카드뮴, 비화인듐, 인화인듐 등을 비롯한 반도체 물질 등의 다양한 물질로 구성될 수 있다.
다른 관련 성분
본원에 기재된 바와 같이, 본 발명의 포스포네이트 화합물은 표적화제, 스텔스제, 진단제, 치료제, 및 부착 성분 등의 성분을 포함할 수 있다. 당업자는 다양한 성분을 제조하기 위해 이용될 수 있는 일반적으로 널리 공지된 표준 기술을 인지할 것이다. 예를 들어, 표적화제, 스텔스제, 진단제, 치료제는, 부착 성분에 대해 상기에 기재된 바와 같이, 공유결합 및/또는 비-공유결합 부착을 통해 본 발명의 포스포네이트 화합물에 부착될 수 있다.
표적화제와 관련하여, 특정 실시양태에서 표적화제는 앱타머를 포함할 수 있다. 특정 표적에 대한 앱타머는, 시험관내 선택 방법, 예컨대 셀렉스™ (기하급수적 농축에 의한 리간드의 계통 진화), 또는 모노렉스™ 기술 (압타레스 아게(AptaRes AG)에서의 일회 앱타머 단리 절차), 생체내 선택 방법, 또는 이들의 조합 등 (이에 제한되지는 않음)의 당업계에 공지된 기술을 이용하여 식별될 수 있다. (예를 들어, 문헌 [Ellington, A.D. & Szostak, J.W., Nature 346(6287): 818-22]; [Bock et al., Nature 355(6360): 564-6 (1992)] 참조). 일부 실시양태에서는, 상기 언급된 방법을 이용하여, 본원에 개시된 바와 같은, 관심있는 특정 표적 부위에 결합하기 위해 사용될 수 있는 특정 DNA 또는 RNA 서열을 식별할 수 있다. 일련의 특정 앱타머가 식별되면, 앱타머를 포스포라미다이트 합성 등의 당업계에 공지된 다양한 방식으로 구성할 수 있다. 펩티드 앱타머의 경우, 다양한 식별 및 제조 기술이 이용될 수 있다 (예를 들어, 문헌 [Colas, P., J. Biol. 7:2 (2008)]; [Woodman, R. et al., J. Mol. Biol. 352(5): 1118-33 (2005)] 참조).
앱타머는 다양한 방식에 의해 H-포스포네이트 화합물 및 알킨 화합물에 부착될 수 있다. 예를 들어, H-포스포네이트 화합물 및 알킨 화합물 상의 연결기 L1, L2 또는 L3이 앱타머의 3' 또는 5' 말단과 반응할 수 있다. 대안적 실시양태에서, 앱타머는, 하나의 핵산을 H-포스포네이트 화합물 및 알킨 화합물 상의 연결기 L1, L2 또는 L3에 한번에 첨가함으로써 연속적으로 합성될 수 있다.
V.
표적화된
전달 조성물의 투여 방법
본 발명은 또한 포스포네이트 화합물을 포함하는 표적화된 전달 조성물을 포함한다. 하나의 측면에서, 본 발명은, R1 및 R2 중 적어도 하나는 표적화제이고, R3은 나노입자 또는 나노입자에 부착되는 부착 성분인, 본원에 기재된 포스포네이트 화합물을 포함하는 표적화된 전달 조성물을 포함한다. 상기에서 보다 상세히 설명된 바와 같이, 부착 성분은 여러 방식으로 나노입자에 부착될 수 있고, 예를 들어, 부착 성분은 리포솜의 이중층과 회합되는 지질일 수 있다.
본 발명의 표적화된 전달 조성물 및 방법은 대상체와 관련된 임의의 질병, 장애 및/또는 질환의 치료 및/또는 진단에 사용될 수 있다. 하나의 실시양태에서, 본 발명의 방법은, 암 질환을 치료하거나 진단하기에 충분한 치료제 또는 진단제를 또한 포함하며, 본 발명의 포스포네이트 화합물 및 나노 입자를 포함하는 표적화된 전달 조성물을 대상체에게 투여하는 것을 포함하는, 대상체에서의 암 질환의 치료 또는 진단 방법을 포함한다. 특정 실시양태에서, 암 질환은, 본 발명의 표적화된 전달 조성물의 표적화제에 의해 표적화되는 수용체를 충분히 발현하는 (예를 들어, 세포 표면 상에서 또는 혈관계 내에서) 암을 포함할 수 있다.
또 다른 실시양태에서, 본 발명의 방법은, 나노입자 및 본원에 기재된 포스포네이트 화합물을 포함하며, 여기서 포스포네이트 화합물 또는 나노입자는 진단제를 포함하는 표적화된 전달 조성물을 대상체에게 투여하고, 상기 대상체를 영상화하여 진단제를 검출하는 것을 포함하는, 표적화된 치료 처치에 대한 대상체의 적합성을 결정하는 방법을 포함한다.
투여
일부 실시양태에서, 본 발명은 표적화된 전달 조성물 및 생리학적으로 (즉, 제약상) 허용가능한 담체를 포함할 수 있다. 본원에서 사용되는 바와 같이, 용어 "담체"는 치료제 등의 약물에 대한 희석제 또는 비히클로서 사용되는 전형적으로 불활성인 물질을 지칭한다. 상기 용어는 또한, 조성물에 응집성을 부여하는 전형적으로 불활성인 물질을 포함한다. 전형적으로, 생리학적으로 허용가능한 담체는 액체 형태로 존재한다. 액체 담체의 예는 생리 식염수, 포스페이트 완충제, 완충 생리 식염수 (135 내지 150 mM NaCl), 물, 완충수, 0.4% 식염수, 0.3% 글리신, 향상된 안정성을 제공하기 위한 당단백질 (예를 들어, 알부민, 지질단백질, 글로불린 등) 등을 포함한다. 생리학적으로 허용가능한 담체는 부분적으로, 투여되는 특정 조성물에 의해, 또한 조성물 투여에 이용되는 특정 방법에 의해 결정되기 때문에, 본 발명의 제약 조성물의 폭넓게 다양한 적합한 제제가 존재한다 (예를 들어, 문헌 [Remington's Pharmaceutical Sciences, 17th ed., 1989] 참조).
본 발명의 조성물은 널리 공지된 통상의 멸균 기술에 의해 멸균될 수 있거나, 또는 멸균 조건 하에 제조될 수 있다. 수용액을 사용을 위해 패키징하거나 무균 조건 하에 여과하고 동결건조시킬 수 있고, 여기서는 동결건조된 제제를 멸균 수용액과 조합한 후 투여한다. 조성물은 생리학적 조건에 가깝게 되도록 필요에 따라 제약상 허용가능한 보조 성분, 예컨대 pH 조정제 및 완충제, 긴장성 조정제, 습윤제 등, 예를 들어, 아세트산나트륨, 락트산나트륨, 염화나트륨, 염화칼륨, 염화칼슘, 소르비탄 모노라우레이트, 및 트리에탄올아민 올레에이트를 함유할 수 있다. 동결건조된 표적화된 전달 조성물에 대한 안정화제와 같이, 조성물의 안정화를 위해 당이 포함될 수도 있다.
선택된 표적화된 전달 조성물은, 단독으로 또는 다른 적합한 성분과 조합되어, 흡입에 의해 투여되는 에어로졸 제제를 형성할 수 있다 (즉, 이들은 "분무"될 수 있음). 에어로졸 제제는 가압 허용가능한 추진제, 예컨대 디클로로디플루오로메탄, 프로판, 질소 등 내에 배치될 수 있다.
직장 투여에 적합한 제제는, 예를 들어, 좌제 베이스와 함께 유효량의 패키징된 표적화된 전달 조성물을 포함하는 좌제를 포함한다. 적합한 좌제 베이스는 천연 또는 합성 트리글리세리드 또는 파라핀 탄화수소를 포함한다. 또한, 예를 들어, 액체 트리글리세리드, 폴리에틸렌 글리콜, 및 파라핀 탄화수소를 비롯한 베이스와 선택된 표적화된 전달 조성물의 조합을 함유하는 젤라틴 직장 캡슐을 사용할 수도 있다.
예를 들어 관절내 (관절 내로), 정맥내, 근육내, 종양내, 피부내, 복강내, 및 피하 경로 투여와 같은 비경구 투여에 적합한 제제는, 산화방지제, 완충제, 정균제, 및 제제가 의도된 수용자의 혈액과 등장성이 되도록 하는 용질을 함유할 수 있는 수성 및 비-수성 등장성 멸균 주사액, 및 현탁화제, 가용화제, 증점제, 안정화제, 및 보존제를 포함할 수 있는 수성 및 비-수성 멸균 현탁액을 포함한다. 주사액 및 현탁액은 또한 멸균 분말, 과립 및 정제로부터 제조될 수 있다. 본 발명의 실행에서, 조성물은, 예를 들어, 정맥내 주입, 국소, 복강내, 방광내, 또는 경막내 투여될 수 있다. 비경구 투여 및 정맥내 투여가 바람직한 투여 방법이다. 표적화된 전달 조성물의 제제는 단위-용량 또는 다중-용량 밀봉 용기, 예컨대 앰풀 및 바이알 중에 존재할 수 있다.
제약 제제는 바람직하게는 단위 투여 형태로 존재한다. 이러한 형태에서, 제제는 적절한 양의 활성 성분, 예를 들어, 표적화된 전달 조성물을 함유하는 단위 용량으로 세분된다. 단위 투여 형태는 패키징된 제제일 수 있고, 여기서 패키지는 별개의 양의 제제를 함유한다. 조성물은, 요망되는 경우, 다른 상용성 치료제를 또한 함유할 수 있다.
암 치료를 위한 치료 용도에서, 본 발명의 제약 조성물에 사용된 치료제 및/또는 진단제를 포함하는 표적화된 전달 조성물은 매일 약 0.001 mg/kg 내지 약 1000 mg/kg의 초기 투여량으로 투여될 수 있다. 약 0.01 mg/kg 내지 약 500 mg/kg, 또는 약 0.1 mg/kg 내지 약 200 mg/kg, 또는 약 1 mg/kg 내지 약 100 mg/kg, 또는 약 10 mg/kg 내지 약 50 mg/kg의 1일 용량 범위를 이용할 수 있다. 그러나, 투여량은, 환자의 요구, 치료되는 질환의 중증도, 및 사용되는 표적화된 전달 조성물에 따라 달라질 수 있다. 예를 들어, 투여량은 특정 환자에서 진단되는 암의 유형 및 단계를 고려하여 경험적으로 결정될 수 있다. 본 발명의 맥락에서, 환자에게 투여되는 용량은, 시간에 따라 환자에서 유익한 치료 반응을 제공하기에 충분하여야 한다. 용량의 크기는 또한, 특정 환자에서의 특정 표적화된 전달 조성물의 투여에 수반되는 임의의 불리한 부작용의 존재, 성질 및 정도에 의해 결정될 것이다. 특정 상황에서의 적절한 투여량의 결정은 의사의 기술 범위 내에 있다. 일반적으로, 치료는 표적화된 전달 조성물의 최적 용량 미만인 보다 소량의 투여량으로 개시된다. 그 후, 투여량이 상황에 따라 최적 효과가 달성될 때까지 작은 증분으로 증가된다. 편의상, 요망되는 경우, 1일 총 투여량을 분할하여 낮 동안 여러 부분으로 나누어 투여할 수 있다.
일부 실시양태에서, 본 발명의 표적화된 전달 조성물은 질병, 장애, 및/또는 질환의 진단에 사용될 수 있다. 일부 실시양태에서는, 표적화된 전달 조성물을 이용하여 대상체에서의 암 질환, 예컨대 폐암, 유방암, 췌장암, 전립선암, 자궁암, 난소암, 결장암, 간암, 식도암 등을 진단할 수 있다. 일부 실시양태에서, 질병 상태의 진단 방법은 표적화된 전달 조성물을 사용하여 대상체의 체내 종양을 물리적으로 검출하고/거나 위치를 찾아내는 것을 포함할 수 있다. 예를 들어, 종양은 본 발명의 표적화된 전달 조성물의 표적화제에 의해 표적화되는 수용체를 충분히 발현하는 (예를 들어, 세포 표면 상에서 또는 혈관계 내에서) 암과 관련될 수 있다. 일부 실시양태에서는, 표적화된 전달 조성물을 이용하여 암 이외의 질환, 예컨대 증식성 질환, 심혈관 질환, 위장관 질환, 비뇨생식 질환, 신경계 질환, 근골격 질환, 혈액학적 질환, 염증성 질환, 자가면역 질환, 류마티스 관절염 등을 진단할 수도 있다.
본원에 개시된 바와 같이, 본 발명의 표적화된 전달 조성물은 본질적으로 검출가능한 특성을 갖는 진단제를 포함할 수 있다. 대상체에서 진단제 검출시, 표적화된 전달 조성물, 또는 표적화된 전달 조성물이 되는 부분을 갖는 입자의 집단을 대상체에게 투여할 수 있다. 이어서, 단일 광자 방출 컴퓨터 단층촬영 (SPECT), 자기 공명 영상 (MRI), 광학 영상, 양전자 방출 단층촬영 (PET), 컴퓨터 단층촬영 (CT), x-선 영상, 감마선 영상 등과 같은 진단제의 영상화 기술을 이용하여, 대상체를 영상화할 수 있다. 본원에 기재된 임의의 영상화 기술을 다른 영상화 기술과 조합하여 이용할 수 있다. 일부 실시양태에서, 입자 내의 영상화를 위한 방사성 동위원소의 도입은 대상체에서의 표적화된 전달 조성물의 생체내 추적을 가능하게 한다. 예를 들어, 표적화된 전달 조성물의 생물학적 분배 및/또는 제거를 측정하고, 임의로 이를 이용하여 환자의 치료를 변경할 수 있다. 예를 들어, 환자의 치료 및/또는 진단을 최적화하기 위해 보다 많거나 적은 표적화된 전달 조성물이 필요할 수 있다.
표적화된
전달
특정 실시양태에서, 본 발명의 표적화된 전달 조성물은 표적화된 방식으로 대상체에게 전달되어 치료제 또는 진단제를 방출할 수 있다. 예를 들어, 표적화된 전달 조성물은 대상체에서의 표적에 전달되고, 이어서 표적화된 전달 조성물, 예컨대 나노입자 내에 내포되거나 캡슐화되거나, 또는 그에 테더링된 치료제가 표적 부근에서의 용액 조건에 기초하여 전달될 수 있다. 용액 조건, 예컨대 pH, 염 농도 등은 표적 부근의 영역으로의 단기간 또는 장기간의 시간에 걸친 치료제의 방출을 촉발할 수 있다. 다르게는, 효소가 표적화된 전달 조성물로부터 치료제 또는 진단제를 절단하여 방출을 개시할 수 있다. 일부 실시양태에서, 표적화된 전달 조성물은 엔도시토시스에 의해 세포의 내부 영역으로 전달되고, 가능하게는 이후에 세포의 내부 구획, 예컨대 리소좀에서 분해될 수 있다. 당업자는 당업계에 일반적으로 공지되어 있는 다양한 방법을 이용하여 치료제 또는 진단제의 표적화된 전달을 수행할 수 있음을 인지할 것이다.
키트
본 발명은 또한 질병 상태의 치료 및/또는 진단을 위해 대상체에게 표적화된 전달 조성물을 투여하기 위한 키트를 제공한다. 이러한 키트는 전형적으로 질병 상태, 예컨대 암 질환의 치료 및/또는 진단을 위해 필수적인 둘 이상의 구성요소를 포함한다. 구성요소는 본 발명의 표적화된 전달 조성물, 시약, 용기 및/또는 장비를 포함할 수 있다. 일부 실시양태에서, 키트 내의 용기는 사용 전에 방사성표지된 방사성약물을 포함하는 표적화된 전달 조성물을 함유할 수 있다. 키트는 표적화된 전달 조성물의 투여를 위해 필수적인 임의의 반응 성분 또는 완충제를 추가로 포함할 수 있다. 또한, 표적화된 전달 조성물은 동결건조된 형태로 존재하고, 이어서 재구성된 후 투여될 수 있다.
특정 실시양태에서, 본 발명의 키트는 환자의 질병 상태의 치료 및/또는 진단을 위해 사용되는 하나 이상의 구성요소를 포함할 수 있는 패키징 어셈블리를 포함할 수 있다. 예를 들어, 패키징 어셈블리는 본원에 기재된 바와 같은 하나 이상의 표적화된 전달 조성물을 하우징하는 용기를 포함할 수 있다. 별도의 용기가 환자에게 투여되기 전에 표적화된 전달 조성물과 혼합될 수 있는 다른 부형제 또는 작용제를 포함할 수 있다. 일부 실시양태에서, 의사는 특정 환자에게 필요한 치료 또는 진단에 따라 특정 구성요소 및/또는 패키징 어셈블리를 선택하고 매칭할 수 있다.
본원에 기재된 실시양태는 단지 예시를 목적으로 한 것이고, 이를 고려하여 다양한 변형 또는 변화가 당업자에게 시사될 것이며 이것이 본원의 사상 및 범주, 또한 첨부된 특허청구범위의 범주 내에 포함되어야 한다는 것을 이해한다. 본원에서 인용된 모든 공개문헌, 특허, 및 특허 출원은 모든 목적상 그 전문이 참조로 도입된다.
VI
.
실시예
실시예
1
디옥타데실 옥트-1-엔-2-일포스포네이트의 제조
도 3은 디옥타데실 옥트-1-엔-2-일포스포네이트를 제조하기 위한 일반적 반응식을 나타낸다. 교반용 막대자석을 구비한 크림핑된 탑 마이크로파 바이알(crimped top microwave vial) 내의 테트라키스(트리페닐포스핀)팔라듐(0) (0.10 g, 0.09 mmol), 디옥타데실 포스포네이트 (1.56 g, 2.66 mmol), THF (6 mL) 및 1-옥틴 (0.30 g, 2.69 mmol)을 90분 동안 110℃에서 마이크로파 방사선 처리하였다 (바이오티지(Biotage) 개시제). 31P NMR (CDCl3)에 의해 연갈색 반응 혼합물을 검사하고, 반응의 완료를 결정하였다. 이를 증발시키고, 조 생성물을 헥산-에틸 아세테이트 구배 (15분에 걸쳐 0% 내지 10% 에틸 아세테이트, 48 mL/min 유량, ELSD 검출)를 이용하여 정상 상 플래쉬 크로마토그래피 (40 g 실리카 컬럼)에 의해 정제하여, 생성물인 디옥타데실 옥트-1-엔-2-일포스포네이트 (1.61 g, 86.7%, 90% 엑소-이성질체, A, 및 10% E-이성질체, B)를 수득하였다. 엑소-이성질체, A의 1H, 13C 및 31P NMR 스펙트럼은 목적한 구조와 일치하는 피크를 나타내었다. m/z 697.6571-697.6711의 추출된 이온 액체 크로마토그램 (엑소-이성질체 A의 [M+H]+ 이온 부근의 범위)은 11.80 및 11.90분 부근의 피크를 나타내었다. 엑소-이성질체, A의 질량 스펙트럼은, [M+H]+ 및 [2M+H]+ 이온의 피크가 각각 697.6627 m/z 및 1394.3190 m/z에 있음을 나타내었다. 그 외 NMR, 액체 크로마토그래피 및 질량 분광법 데이터는 목적한 구조와 일치하였다.
실시예
2
5-(비스(옥타데실옥시)포스포릴)헥스-5-엔산의 제조
도 4는 5-(비스(옥타데실옥시)포스포릴)헥스-5-엔산의 제조를 위한 일반적 반응식을 나타낸다. 교반용 막대자석을 구비한 크림핑된 탑 마이크로파 바이알 내의 테트라키스(트리페닐포스핀)팔라듐(0) (0.11 g, 0.09 mmol), 디옥타데실 히드로겐 포스포네이트 (1.55 g, 2.64 mmol), THF (6 mL) 및 5-헥신산 (0.30 g, 2.69 mmol)을 90분 동안 110℃에서 마이크로파 방사선 처리하였다 (바이오티지 개시제). 31P NMR (CDCl3)에 의해 황색 반응 혼합물을 검사하고, 반응의 완료를 결정하였다. 이를 증발시키고, 조 생성물을 헥산-에틸 아세테이트 구배 (10분에 걸쳐 0% 내지 100% 에틸 아세테이트, 48 mL/min 유량, ELSD 검출)를 이용하여 정상 상 플래쉬 크로마토그래피 (40 g 실리카 컬럼)에 의해 정제하여, 생성물인 5-(비스(옥타데실옥시)포스포릴)헥스-5-엔산 (0.98 g, 52.8%, 96% 엑소-이성질체, C 및 4% E-이성질체, D)을 수득하였다. 엑소-이성질체, C의 1H, 13C 및 31P NMR 스펙트럼은 목적한 구조와 일치하는 피크를 나타내었다. m/z 699.5980-699.6120의 추출된 이온 액체 크로마토그램 (엑소-이성질체 C의 [M+H]+ 이온 부근의 범위)은 11.14 및 11.20분 부근의 피크를 나타내었다. 엑소-이성질체, C의 질량 스펙트럼은 [M+H]+ 및 [2M+H]+ 이온의 피크가 각각 699.6050 m/z 및 1398.2035 m/z에 있음을 나타내었다. 그 외 NMR, 액체 크로마토그래피 및 질량 분광법 데이터는 목적한 구조와 일치하였다.
실시예
3
5-(비스(옥타데실옥시)포스포릴)헥스-5-엔산과 PEG1000-NH2 (m-dPEG® 24-아민)의 커플링
도 5는 5-(비스(옥타데실옥시)포스포릴)헥스-5-엔산과 PEG1000-NH2의 커플링에 대한 일반적 반응식을 나타낸다. 25 mL RBF 내에서 m-dPEG® 24-아민 (102.0 mg, 0.09 mmol), 5-(비스(옥타데실옥시)포스포릴)헥스-5-엔산 (64.4 mg, 0.09 mmol), 트리에틸아민 (13.3 mg, 0.13 mmol), DMF (2 mL) 및 CHCl3 (1 mL)를 아르곤 분위기 하에 30분 동안 실온에서 교반하였다. TBTU (35.7 mg, 0.11 mmol)를 반응 혼합물 용액에 첨가하고, 16시간 동안 실온에서 계속해서 교반하였다. 휘발성 물질을 회전 증발에 의해 제거하고, 조 생성물을 클로로포름-메탄올 구배 (10분에 걸쳐 0% 내지 10% 메탄올, 10 mL/min 유량, ELSD 검출)를 이용하여 정상 상 플래쉬 크로마토그래피 (4 g 실리카 컬럼)에 의해 정제하여, 생성물인 디옥타데실 (75-옥소-2,5,8,11,14,17,20,23,26,29,32,35,38,41,44,47,50,53,56,59,62,65,68,71-테트라코사옥사-74-아자옥타콘트-79-엔-79-일)포스포네이트 (58.1 mg, 35.0%)를 수득하였다. 고해상 질량 스펙트럼은 목적하는 반응 생성물과 일치하였다: (양이온 모드) C91H182NO28P의 경우 : 이론치 1769.2659, 검출치 1769.2690. 유사하게, 1H 및 31P NMR 스펙트럼은 목적한 구조와 일치하였다.: 31P NMR (202.3 MHz, CDCl3) δ(ppm): 19.3이고, 1H NMR (500 MHz, CDCl3) δ(ppm)은 다중 일치 피크를 나타내었다.
실시예
4
tert-부틸 5-(비스(옥타데실옥시)포스포릴)헥스-5-에노에이트, D의 제조
도 6에 나타낸 바와 같이, tert-부틸 5-(비스(옥타데실옥시)포스포릴)헥스-5-에노에이트 (MW 755.2), D는, 5-헥신산 대신에 tert-부틸 5-헥시노에이트를 사용하는 것을 제외하고는 실질적으로 실시예 2에 제공된 동일한 조건 및 절차 하에 제조될 수 있다.
실시예
5
tert-부틸 5,7-비스(비스(옥타데실옥시)포스포릴)헵타노에이트, E의 제조
실질적으로 문헌 [Phosphorus, Sulfur and Silicon and the Related Elements, 83 (1-4), 77-98:1993]에서 밝혀지고 도 6에서 기술된 조건을 이용하여, 디옥타데실 히드로겐 포스포네이트를 실시예 4에서 제조된 tert-부틸 5-(비스(옥타데실옥시)포스포릴)헥스-5-에노에이트, D와 반응시킬 수 있다. 따라서, THF (30 mL) 중에 용해된 디옥타데실 히드로겐 포스포네이트 (MW 586.95, 1.56 g, 2.66 mmol), 및 수소화나트륨 (95%, FW 24.0, 2.66 mmol, 0.064 g)을 불활성 분위기 하에 RT에서 교반하면서 반응시켰다. 이어서, THF 중의 tert-부틸 5-(비스(옥타데실옥시)포스포릴)헥스-5-에노에이트 (MW 1356.2, 3.65 g, 2.69 mmol)를 첨가하고, 반응이 완료될 때까지 불활성 분위기 하에서 반응시켰다. 반응 진행은 TLC, rphplc 또는 31P nmr로 추적할 수 있다. 반응이 완료되었을 때, 증발에 의해 용매를 제거할 수 있고, 조 생성물을 적합한 용매 시스템 (예를 들어, 헥산-에틸 아세테이트 구배 (ELSD 검출))을 이용하여 정상 상 플래쉬 크로마토그래피에 의해 정제하여, 실질적으로 순수한 생성물을 수득하였다. 또한, 조 생성물은 역상 상 HPLC (예를 들어, C4, 300 A, 및 적합한 용매 구배, 예를 들어 물;이소프로판올)를 이용하여 정제될 수도 있다. 목적한 생성물의 MS는 M+H + 1357.2, M+Na + 1379.2이다.
실시예
6
5,7-비스(비스(옥타데실옥시)포스포릴)헵탄산, G의 제조
tert-부틸 에스테르, E에서 산 G로의 전환이 도 7에 기술되어 있다. t-부틸 에스테르가 제거될 때까지 tert-부틸 5,7-비스(비스(옥타데실옥시)포스포릴)헵타노에이트를 트리플루오로아세트산 (TFA) 또는 디옥산 중의 염화수소로 처리하였다. 반응 진행은 tlc 또는 rphplc로 추적할 수 있다. 휘발성 물질을 진공 하에서 제거하고, 목적하는 산 생성물을 rphlpc (예를 들어, C4, 300A 컬럼, 적절한 용매 구배, 예를 들어 물:i-프로판올을 사용하고, ELSD 검출기를 이용함)에 의해 수득하였다. 목적하는 생성물의 질량은 1306.1이다.
실시예
7
5,7-비스(비스(옥타데실옥시)포스포릴)헵탄산과 PEG 1000-NH2, (m dPEG®24-아민)의 커플링.
도 8은 5,7-비스(비스(옥타데실옥시)포스포릴)헵탄산과 PEG1000-NH2의 일반적인 반응을 나타낸다. 반응을 실시예 3에 기재된 것과 유사한 비율 및 조건을 이용하여 수행하였다. 목적한 생성물의 질량은 2370.4이며, 결과적으로 M+H+는 2371.4, M+Na+는 2394.4이었다.
실시예
8
테트라옥타데실 헵탄-1,3-디일디포스포노네이트, J의 제조
실질적으로 문헌 [Phosphorus, Sulfur and Silicon and the Related Elements, 83 (1-4), 77-98:1993]에서 밝혀진 조건을 이용하여, 디옥타데실 히드로겐 포스포네이트를 디옥타데실 옥트-1-엔-2-일포스포네이트와 반응시켜 테트라-옥타데실 헵탄-1,3-디일디포스포네이트, J를 제조할 수 있다 (도 9 참조). 따라서, THF (6 mL) 중에 용해된 디옥타데실 히드로겐 포스포네이트 (MW 586.95, 1.56 g, 2.66 mmol), 및 수소화나트륨 (95%, FW 24.0, 2.66 mmol, 0.064 g)을 불활성 분위기 하에 RT에서 교반하면서 반응시켰다. 다르게는, 수소화나트륨은 등가 몰의 강염기, 예를 들어 리튬 디-이소프로필아미드 또는 나트륨 알콕사이드 등으로 대체될 수도 있다. 이어서, 디옥타데실 옥트-1-엔-2-일포스포네이트, A (MW 697.15, 1.88 g, 2.69 mmol)를 첨가하고, 반응이 완료될 때까지 불활성 분위기 하에서 반응시켰다. 반응 진행은 TLC, hplc 또는 31P nmr로 추적할 수 있다. 반응이 완료되었을 때, 증발에 의해 용매를 제거할 수 있고, 조 생성물을 적합한 용매 시스템 (예를 들어, 헥산-에틸 아세테이트 구배 (ELSD 검출))을 이용하여 정상 상 플래쉬 크로마토그래피에 의해 정제하여, 실질적으로 순수한 테트라옥타데실 헵탄-1,3-디일디포스포네이트를 수득하였다. 조 생성물은 또한 rphplc (C4, 300 A, 및 적합한 용매 구배)를 이용하여 정제될 수도 있다. 목적하는 생성물의 질량은 1270.1이다.
실시예
9
디옥타데실 2,5,8,11,14,17,20,23,26,29-데카옥사트리트리아콘트-31-엔-31-일포스포네이트, M의 제조
도 10은 디옥타데실 2,5,8,11,14,17,20,23,26,29-데카옥사트리트리아콘트-31-엔-31-일포스포네이트의 제조를 위한 일반적 반응식을 나타낸다.
단계 1. 2,5,8,11,14,17,20,23,26,29-데카옥살트리트리아콘트-32-인, L의 제조
문헌 [Shen, R., Shen, X., Zhang, Z., Li, Y., Liu, S., Liu, H., Journal of the American Chemical Society (2010), 132(25), 8627-8634]을 따라 2,5,8,11,14,17,20,23,26,29-데카옥살트리트리아콘트-31-인, L의 합성을 수행하였다. 둥근 바닥 플라스크를 무수 THF (50 mL) 중 모노메톡시-폴리에틸렌 글리콜 350 (3.50 g, 10 mmol)의 용액으로 충전시켰다. 자주 배기시키면서 상기 용액에 NaH (미네랄 오일 중의 70% w/w, 051 g, 11 mmol)를 0℃에서 첨가하였다. 30분 동안 교반한 후, 프로파르길 브로마이드 (톨루엔 중의 80%, 1.31 g, 11 mmol)를 천천히 첨가하고, 혼합물을 0℃에서 1시간 동안 교반하고, 이어서 밤새 환류시켰다. 현탁액을 여과하고, 이어서 여과액을 감압 하에 증발에 의해 건조시켜 휘발성 물질을 제거하였다. 조 생성물을 50 mL 물 중에 용해시키고, 디클로로메탄으로 추출하였다 (3x). 용액을 건조시키고, 휘발성 물질을 제거하여 목적한 생성물을 수득하였다. 양성자 NMR (300 MHz, CDCl3): 2.42 (s, 1H), 3.38 (s, 3H), 4.20 (s, 2H), 3.64 (t, 32H).
단계 2. 디옥타데실 2,5,8,11,14,17,20,23,26,29-데카옥사트리트리아콘트-31-엔-31-일포스포네이트, M의 제조
교반용 막대자석을 구비한 크림핑된 탑 마이크로파 바이알 내의 테트라키스(트리페닐포스핀)팔라듐(0) (0.11 g, 0.09 mmol), 디옥타데실 히드로겔 포스포네이트 (1.55 g, 2.64 mmol), THF (6 mL) 및 2,5,8,11,14,17,20,23,26,29-데카옥사트리트리아콘트-32-인 (MW 466.56, 1.26 g, 2.69 mmol)을 90분 동안 110℃에서 마이크로파 방사선 처리할 수 있다 (바이오티지 개시제). 반응은 31P NMR (CDCl3)로 추적할 수 있다. 반응이 완료되었을 때, 이를 냉각시키고, 증발에 의해 농축시켰다. 조 생성물을 정상 상 플래쉬 크로마토그래피 (적합한 용리 용매, 예를 들어 헥산-에틸 아세테이트 구배 (ELSD 검출)를 이용함)에 의해 또는 rphplc (C4, 300A, 적절한 용매 프로그램 및 ELSD 검출을 이용함)에 의해 정제하여, 목적한 생성물인 디옥타데실 2,5,8,11,14,17,20,23,26,29-데카옥사트리트리아콘트-31-엔-31-일포스포네이트를 수득하였다. 목적한 생성물의 질량 스펙트럼은 M+H+ 1054.5이다.
실시예
10
테트라옥타데실 2,5,8,11,14,17,20,23,26,29-데카옥사트리트리아콘탄-32,33-디일디포스포네이트의 제조
도 11은 테트라옥타데실 2,5,8,11,14,17,20,23,26,29-데카옥사트리트리아콘탄-32,33-디일디포스포네이트의 제조를 위한 일반적 반응식을 나타낸다. 먼저, 디옥타데실 2,5,8,11,14,17,20,23,26,29-데카옥사트리트리아콘트-31-엔-31-일포스포네이트, M을 제조하였다. 실질적으로 문헌 [Phosphorus, Sulfur and Silicon and the Related Elements, 83 (1-4), 77-98:1993]에서 밝혀진 조건을 이용하여, 디옥타데실 히드로겐 포스포네이트를 디옥타데실 2,5,8,11,14,17,20,23,26,29-데카옥사트리트리아콘트-31-엔-31-일포스포네이트와 반응시킬 수 있다. 따라서, THF (6 mL) 중에 용해된 디옥타데실 히드로겐 포스포네이트 (MW 586.95, 1.56 g, 2.66 mmol), 및 수소화나트륨 (95%, FW 24.0, 2.66 mmol, 0.064 g)을 불활성 분위기 하에서 RT에서 교반하면서 반응시켰다. 이어서, 디옥타데실 2,5,8,11,14,17,20,23,26,29-데카옥사트리트리아콘트-31-엔-31-일포스포네이트 (MW 1053.5, 2.83 g, 2.69 mmol)를 첨가하고, 반응이 완료될 때까지 불활성 분위기 하에서 반응시켰다. 반응 진행은 TLC, rphplc 또는 31P nmr로 추적할 수 있다. 반응이 완료되었을 때, 증발에 의해 용매를 제거할 수 있고, 조 생성물을 적합한 용매 시스템 (예를 들어, 헥산-에틸 아세테이트 구배 (ELSD 검출))을 이용하여 정상 상 플래쉬 크로마토그래피에 의해 정제하여, 실질적으로 순수한 생성물인 테트라옥타데실 2,5,8,11,14,17,20,23,26,29-데카옥사트리트리아콘탄-32,33-디일디포스포네이트를 수득하였다. 조생성물은 또한 rphplc (예를 들어, C4, 300 A, 및 적합한 용매 구배, 예를 들어 물;이소프로판올)를 이용하여 정제될 수도 있다. 목적한 생성물의 MS는 M+H + 1655.5, M+Na+ 1677.5이다.
실시예
11
도 12는 테트라옥타데실 1,1'-(1,3-페닐렌)비스(에텐-1,1-디일)디포스포네이트의 제조를 위한 일반적 반응식을 나타낸다.
교반용 막대자석을 구비한 크림핑된 탑 마이크로파 바이알 내의 테트라키스(트리페닐포스핀)팔라듐(0) (0.071 g, 0.06 mmol), 디옥타데실 포스포네이트 (1.06 g, 1.80 mmol), 1,3-디에티닐벤젠 (0.076 g, 0.60 mmol) 및 톨루엔 (1.5 mL)의 혼합물을 마이크로파 방사선 처리하였다 (바이오티지 개시제, 100℃, 1시간). 31P NMR (CDCl3)에 의해 황색 반응 혼합물을 검사하고, 반응의 완료를 결정하였다. 반응 혼합물 증발시키고, 조 생성물을 헥산-에틸 아세테이트 구배 (10분에 걸쳐 0% 내지 20% 에틸 아세테이트, 48 mL/min 유량, ELSD 검출)에 이어 등용매 (10분에 걸쳐 20% 에틸 아세테이트)를 이용하여 정상 상 플래쉬 크로마토그래피 (40 g 실리카 컬럼)에 의해 정제하여, 생성물인 테트라옥타데실 1,1'-(1,3-페닐렌)비스(에텐-1,1-디일)디포스포네이트 (0.22 g, 9.3%)를 수득하였다.
실시예
12
3,5-비스(1-(비스(옥타데실옥시)포스포릴)비닐)벤조산의 제조. 화학식: C83H156O8P2, 분자량: 1344.07
실질적으로 실시예 11의 절차를 이용하되, 1,3-디에티닐벤젠을 3,5-디에티닐벤조산으로 대체하고, 몰비를 유지하면서 표제 화합물을 제조할 수 있다. 목적한 생성물의 m/z는 M+H + 1345.0이다.
실시예
13
도 13은 디옥타데실 1-시클로헥세닐비닐 포스포네이트 및 (E,Z)-디옥타데실 (2-(시클로헥스-1-엔-1-일)비닐)포스포네이트의 제조를 위한 반응식을 나타낸다.
교반용 막대자석을 구비한 크림핑된 탑 마이크로파 바이알 내의 테트라키스(트리페닐포스핀)팔라듐(0) (0.10 g, 0.09 mmol), 디옥타데실 포스포네이트 (1.50 g, 2.66 mmol), THF (12 mL) 및 1-에티닐시클로헥스-1-엔 (0.27 g, 2.57 mmol)의 혼합물을 마이크로파 방사선 처리하였다 (바이오티지 개시제, 110℃, 1.5시간). 31P NMR (CDCl3)에 의해 연갈색 반응 혼합물을 검사하고, 반응의 완료를 결정하였다. 반응 혼합물을 증발시키고, 조 생성물을 헥산-에틸 아세테이트 구배 (20분에 걸쳐 0% 내지 20% 에틸 아세테이트, 48 mL/min 유량, ELSD 검출)를 이용하여 정상 상 플래쉬 크로마토그래피 (40 g 실리카 컬럼)에 의해 정제하여, 주로 1-시클로헥세닐비닐 생성물인, 디옥타데실 (1-(시클로헥스-1-엔-1-일)비닐)포스포네이트 (1.14 g, 64.4%), 및 E 및 Z - 2-시클로헥세닐비닐 생성물의 혼합물 (0.08 g)을 수득하였다. 디옥타데실 (1-(시클로헥스-1-엔-1-일)비닐)포스포네이트에 대한 NMR 데이터:
Claims (35)
- 제1항에 있어서, L1, L2, 및 L3 중 적어도 하나가 친수성의 비-면역원성 수용성 연결기인 화합물.
- 제2항에 있어서, 친수성의 비-면역원성 수용성 연결기가 폴리에틸렌 글리콜, 폴리프로필렌 글리콜, 폴리비닐 알콜, 폴리카르복실레이트, 폴리사카라이드 및 덱스트란으로 이루어진 군으로부터 선택되는, 화합물.
- 제1항에 있어서, 표적화제가 앱타머인 화합물.
- 제1항에 있어서, 진단제가 방사능 작용제, 형광제, 또는 콘트라스트제인 화합물.
- 제1항에 있어서, 스텔스제가 폴리에틸렌 글리콜, 덴드리머, 폴리비닐 알콜, 폴리카르복실레이트, 폴리사카라이드 및 히드록시알킬 전분으로 이루어진 군으로부터 선택되는, 화합물.
- 제1항에 있어서, R3이 지질 및 콜레스테롤로 이루어진 군으로부터 선택된 부착 성분인 화합물.
- 제1항에 있어서, L1 및 L2가 각각 결합이고, R1 및 R2가 각각 지질 및 콜레스테롤로 이루어진 군으로부터 선택된 부착 성분인 화합물.
- 제1항에 있어서, L1 및 L2가 각각 결합이고, R1 및 R2가 각각 독립적으로 포화 또는 불포화 C10 -24 알킬 기 및 치환된 포화 또는 불포화 C10 -24 알킬 기로 이루어진 군으로부터 선택된 부착 성분인 화합물.
- 제1항에 있어서, R1 및 R2가 각각 독립적으로 표적화제, 진단제 및 스텔스제로 이루어진 군으로부터 선택되고; R3이 나노입자 또는 나노입자에 부착되는 부착 성분이고; R4가 H인 화합물.
- 제1항에 있어서, L3이 연결기이고, R3이 스텔스제인 화합물.
- 제11항에 있어서, 스텔스제가 PEG500, PEG1000, PEG2000, 및 PEG5000으로 이루어진 군으로부터 선택되는, 화합물.
- 제13항에 있어서, R3이 PEG500, PEG1000, PEG2000, 및 PEG5000으로 이루어진 군으로부터 선택된 스텔스제인 화합물.
- 제13항에 있어서, R3이 표적화제이고, L3이 친수성의 비-면역원성 수용성 연결기인 화합물.
- 제13항에 있어서, R3이 진단제이고, L3이 친수성의 비-면역원성 수용성 연결기인 화합물.
- 제13항에 있어서, R3이 스텔스제이고, L3이 친수성의 비-면역원성 수용성 연결기인 화합물.
- 촉매의 존재 하에서, 화학식:
을 갖는 H-포스포네이트 화합물을, 화학식:
을 갖는 알킨 화합물과 조합하여, 화학식:
을 갖는 포스포네이트 화합물
(상기 식에서,
로 식별되는 결합은 단일 또는 이중 결합이고;
L1, L2 및 L3은 각각 연결기이고;
R1, R2 및 R3은 각각 독립적으로 부착 성분, 표적화제, 진단제 및 스텔스제로 이루어진 군으로부터 선택되고;
R4는 H 및 -P(=O)(OL1-R1)(OL2-R2)로 이루어진 군으로부터 선택된 구성원이고, 상기 R4가 H 이외의 것일 때, 로 식별되는 결합은 단일 결합임)을 형성하는 것을 포함하는, 포스포네이트 화합물의 제조 방법. - 제19항에 있어서, R3이 포화 또는 불포화 C10 -24 알킬 기, 치환된 포화 또는 불포화 C10 -24 알킬 기, 및 콜레스테롤로부터 선택된 부착 성분인 제조 방법.
- 제20항에 있어서, R3이 나노입자에 부착되는, 제조 방법.
- 제19항에 있어서, R1 및 R2가 각각 독립적으로 포화 또는 불포화 C10 -24 알킬 기, 치환된 포화 또는 불포화 C10 -24 알킬 기, 및 콜레스테롤로부터 선택된 부착 성분인 제조 방법.
- 제22항에 있어서, R1 및 R2가 나노입자에 부착되는, 제조 방법.
- 제24항에 있어서, R1 및 R2가 각각 포화 또는 불포화 C10 -24 알킬 기, 치환된 포화 또는 불포화 C10 -24 알킬 기, 및 콜레스테롤로부터 선택된 부착 성분인 화합물.
- 제26항에 있어서, H-포스포네이트 화합물 및 알킨 화합물을 각각 2:1의 몰비로 조합하는, 제조 방법.
- R1 및 R2 중 적어도 하나가 표적화제이고; R3이 나노입자 또는 나노입자에 부착되는 부착 성분인 제1항 및 제24항의 화합물을 포함하는 표적화된 전달 조성물.
- 제28항에 있어서, 나노입자가 리포솜이고, 부착 성분이 리포솜의 이중층과 회합되는 지질 또는 콜레스테롤인 표적화된 전달 조성물.
- R1 및 R2가 각각 나노입자에 부착되는 부착 성분이고 R3이 표적화제, 진단제 및 스텔스제로 이루어진 군으로부터 선택되는 제1항 및 제24항의 화합물을 포함하는 표적화된 전달 조성물.
- 제30항에 있어서, 나노입자가 리포솜이고, 부착 성분이 리포솜의 이중층과 회합되는 지질인 표적화된 전달 조성물.
- 암 질환을 치료하거나 진단하기에 충분한 치료제 또는 진단제를 포함하는 제28항 또는 제30항의 표적화된 전달 조성물을 대상체에게 투여하는 것을 포함하는, 대상체에서의 암 질환의 치료 또는 진단 방법.
- 제32항에 있어서, 나노입자가 리포솜이고, 치료제가 리포솜 내에 캡슐화되거나 내포되거나, 또는 그에 테더링되어(tethered) 있는, 방법.
- 제32항에 있어서, 치료제가 독소루비신, 시스플라틴, 옥살리플라틴, 카르보플라틴, 5-플루오로우라실, 겜시티빈 및 탁산으로 이루어진 군으로부터 선택된 항암제인 방법.
- R1, R2 또는 R3이 진단제이거나 나노입자가 진단제를 포함하는 제28항 또는 제30항의 표적화된 전달 조성물을 대상체에게 투여하고, 상기 대상체를 영상화하여 진단제를 검출하는 것을 포함하는, 표적화된 치료 처치에 대한 대상체의 적합성을 결정하는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161529665P | 2011-08-31 | 2011-08-31 | |
| US61/529,665 | 2011-08-31 | ||
| PCT/US2012/053211 WO2013033450A2 (en) | 2011-08-31 | 2012-08-30 | Remote assembly of targeted nanoparticles using h-phosphonate-ene/-yne hydrophosphonylation reactions |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140064917A true KR20140064917A (ko) | 2014-05-28 |
Family
ID=46832627
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147007933A KR20140064917A (ko) | 2011-08-31 | 2012-08-30 | H-포스포네이트-엔/-인 히드로포스포닐화 반응을 이용한 표적화된 나노입자의 원격 어셈블리 |
Country Status (9)
| Country | Link |
|---|---|
| US (2) | US9216225B2 (ko) |
| EP (1) | EP2750711A2 (ko) |
| JP (1) | JP2014525459A (ko) |
| KR (1) | KR20140064917A (ko) |
| CN (1) | CN103945869A (ko) |
| BR (1) | BR112014004716A2 (ko) |
| CA (1) | CA2845851A1 (ko) |
| IL (1) | IL231216A0 (ko) |
| WO (1) | WO2013033450A2 (ko) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9918190B2 (en) * | 2015-02-18 | 2018-03-13 | Cisco Technology, Inc. | Augmenting network device management |
| FR3046728B1 (fr) * | 2016-01-19 | 2020-04-03 | Centre National De La Recherche Scientifique | Nouvelles nanoparticules d'organosilice mesoporeuses, leur methode de preparation et leurs utilisations. |
| JPWO2019009434A1 (ja) * | 2017-07-06 | 2020-07-02 | 学校法人京都薬科大学 | 薬物送達用高分子ミセル |
Family Cites Families (36)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2940961A (en) * | 1957-08-09 | 1960-06-14 | Eastman Kodak Co | Alkyl 1-acetoxyalkenylphosphonates and polymers thereof |
| US3224973A (en) * | 1960-09-01 | 1965-12-21 | Ethyl Corp | Dialkyl hydroxybenzyl phosphonates as antioxidants |
| US3006945A (en) * | 1960-09-01 | 1961-10-31 | Ethyl Corp | Preparation of organic compounds |
| US3367870A (en) * | 1963-09-12 | 1968-02-06 | Geigy Chem Corp | Method of stabilization with carbonbonded phosphorus derivatives and compositions stabilized thereby |
| US3681481A (en) | 1969-11-12 | 1972-08-01 | Hooker Chemical Corp | Catalytic addition of compounds having a p-h bond to acetylene |
| DE3065878D1 (en) | 1979-07-09 | 1984-01-19 | Elf Aquitaine | Diphosphonic and triphosphonic acid esters, their preparation and applications |
| FR2460958A1 (fr) * | 1979-07-09 | 1981-01-30 | Elf Aquitaine | Nouveaux composes diphosphoniques, utiles a l'extraction des metaux lourds |
| US4820698A (en) * | 1985-11-04 | 1989-04-11 | The Procter & Gamble Company | Antimicrobial agents and process for their manufacture |
| US4798872A (en) * | 1986-04-28 | 1989-01-17 | Ashland Oil, Inc. | Alkylene phosphonate acid ester polyols |
| DE3643684A1 (de) * | 1986-12-20 | 1988-06-30 | Hoechst Ag | Verfahren zur herstellung von halogenierten phosphono-phosphorsaeureestern und ihre verwendung |
| DK637888A (da) * | 1987-11-24 | 1989-05-25 | Hoffmann La Roche | Carboxylsyreestere |
| US5567588A (en) | 1990-06-11 | 1996-10-22 | University Research Corporation | Systematic evolution of ligands by exponential enrichment: Solution SELEX |
| US5321153A (en) * | 1992-06-15 | 1994-06-14 | Monsanto Company | Process for making chiral alpha-amino phosphonates selected novel chiral alpha-amino phosphonates |
| JPH07140615A (ja) * | 1993-11-12 | 1995-06-02 | Fuji Photo Film Co Ltd | ハロゲン化銀カラー感光材料 |
| JPH07140606A (ja) * | 1993-11-19 | 1995-06-02 | Fuji Photo Film Co Ltd | ハロゲン化銀カラー写真感光材料 |
| DE4410601A1 (de) * | 1994-03-26 | 1995-09-28 | Boehringer Mannheim Gmbh | Neue 2.4-Diphosphonoglutarsäurederivate, Verfahren zu deren Herstellung und diese Verbindungen enthaltende Arzneimittel |
| WO1996024599A1 (en) * | 1995-02-10 | 1996-08-15 | Akzo Nobel N.V. | Synthesis of a hydrocarbylvinyl phosphonic acid hydrocarbyl ester |
| JP2775426B2 (ja) * | 1995-09-14 | 1998-07-16 | 工業技術院長 | 不飽和ホスホン酸エステルの製造方法 |
| GB9613722D0 (en) * | 1996-06-28 | 1996-08-28 | Univ Liverpool | Chemical compounds |
| JP3007984B1 (ja) * | 1999-03-08 | 2000-02-14 | 工業技術院長 | 不飽和ホスホン酸エステルの製造方法 |
| CA2747954C (en) * | 1999-12-03 | 2014-02-25 | The Regents Of The University Of California | Phosphonate compounds |
| JP3610371B2 (ja) * | 2000-03-13 | 2005-01-12 | 独立行政法人産業技術総合研究所 | (α−及び/又はβ−ホルミルエチル)ホスフィンオキシド化合物、(α−及び/又はβ−ホルミルエチル)ホスホン酸エステル化合物とその製造方法 |
| DE10049074A1 (de) | 2000-10-02 | 2002-04-18 | Andreas Kage | Verfahren zur Selektion hochaffin an ein Target bindender Nukleinsäuren |
| GB0025849D0 (en) * | 2000-10-23 | 2000-12-06 | Smithkline Beecham Plc | Novel compounds |
| DE10054218A1 (de) | 2000-11-02 | 2002-05-08 | Basf Ag | Verfahren zur Herstellung von Alkenylphosphonsäure-Derivaten |
| EP1506208A4 (en) * | 2002-05-11 | 2006-05-24 | Ilex Products Inc | USE OF 1,1 AND 1,2-DIPHOSPHONATES AS MODULATORS OF APOLIPOPROTEIN E |
| JP3836395B2 (ja) * | 2002-05-17 | 2006-10-25 | 独立行政法人科学技術振興機構 | アルケニルリン化合物の製造方法 |
| DE102004032781A1 (de) * | 2004-01-23 | 2005-08-11 | Mcs Micro Carrier Systems Gmbh | Bisphosphonsäurederivate |
| JP4314366B2 (ja) * | 2004-02-18 | 2009-08-12 | 独立行政法人産業技術総合研究所 | 含リンブタジエン化合物の製造方法 |
| US20100015041A1 (en) | 2005-01-18 | 2010-01-21 | Caltagirone Gaetano T | Class of Supramolecular Drug Molecules and Methods of Identification and Use Thereof |
| EP2019649A4 (en) * | 2006-04-27 | 2012-09-19 | Narmada R Shenoy | COMPOSITIONS AND METHODS FOR TREATING OR PREVENTING BODILUM DISORDER DISORDERS |
| CN1887890A (zh) * | 2006-07-17 | 2007-01-03 | 华中师范大学 | 具有除草活性的α-酰氧基烯基膦酸酯及制备 |
| CN1903862B (zh) * | 2006-07-20 | 2012-10-10 | 华中师范大学 | 具有除草活性的取代甲酰氧基烃基膦酸酯类光学活性异构体及制备 |
| FR2921838A1 (fr) * | 2007-10-05 | 2009-04-10 | Guerbet Sa | Nouveau procede de preparation de nanoparticules recouvertes d'une couche stabilisatrice gem-bisphosphonate couplee a des ligands de biodistribution hydrophile |
| EP2301911B1 (en) * | 2008-05-30 | 2015-08-19 | Sumitomo Chemical Company, Limited | Process for producing oseltamivir phosphate and intermediate compound |
| WO2011097563A1 (en) * | 2010-02-08 | 2011-08-11 | Board Of Regents Of The University Of Nebraska | Biomineral and metal binding liposomes, their synthesis, and methods of use thereof |
-
2012
- 2012-08-30 CN CN201280053586.7A patent/CN103945869A/zh active Pending
- 2012-08-30 CA CA2845851A patent/CA2845851A1/en not_active Abandoned
- 2012-08-30 BR BR112014004716A patent/BR112014004716A2/pt not_active IP Right Cessation
- 2012-08-30 US US13/599,777 patent/US9216225B2/en not_active Expired - Fee Related
- 2012-08-30 JP JP2014528613A patent/JP2014525459A/ja active Pending
- 2012-08-30 KR KR1020147007933A patent/KR20140064917A/ko not_active Application Discontinuation
- 2012-08-30 WO PCT/US2012/053211 patent/WO2013033450A2/en active Application Filing
- 2012-08-30 EP EP12758720.2A patent/EP2750711A2/en not_active Withdrawn
-
2014
- 2014-02-27 IL IL231216A patent/IL231216A0/en unknown
-
2015
- 2015-11-12 US US14/939,064 patent/US20160060280A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| US20130066098A1 (en) | 2013-03-14 |
| IL231216A0 (en) | 2014-04-30 |
| US9216225B2 (en) | 2015-12-22 |
| WO2013033450A3 (en) | 2013-09-06 |
| CA2845851A1 (en) | 2013-03-07 |
| US20160060280A1 (en) | 2016-03-03 |
| JP2014525459A (ja) | 2014-09-29 |
| BR112014004716A2 (pt) | 2017-03-28 |
| CN103945869A (zh) | 2014-07-23 |
| EP2750711A2 (en) | 2014-07-09 |
| WO2013033450A2 (en) | 2013-03-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20140067070A (ko) | H-포스포네이트에 의한 나노입자 peg 개질 | |
| JP5927194B2 (ja) | 治療ナノキャリアおよび/または診断ナノキャリアのターゲティングのためのアプタマーコンジュゲート | |
| Mitchell et al. | Incorporation of paramagnetic, fluorescent and PET/SPECT contrast agents into liposomes for multimodal imaging | |
| JP6294456B2 (ja) | 修飾されたドセタキセルリポソーム製剤 | |
| KR20140097215A (ko) | 암 치료를 위한 조합 리포좀 조성물 | |
| KR20140096080A (ko) | Mmp-표적 치료 및/또는 진단 나노담체 | |
| JP2014528411A (ja) | 相補的オリゴヌクレオチドリンカーを用いる標的化ナノ粒子の遠隔アセンブリ | |
| KR20140064917A (ko) | H-포스포네이트-엔/-인 히드로포스포닐화 반응을 이용한 표적화된 나노입자의 원격 어셈블리 | |
| US20170165382A1 (en) | Nanocarriers for cancer treatment | |
| US20160038597A9 (en) | Carrier that targets fucosylated molecule-producing cells |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |