KR20140044796A - 호르몬 무반응 유방암의 치료에서 egfr-패밀리 수용체의 저해제의 용도 - Google Patents
호르몬 무반응 유방암의 치료에서 egfr-패밀리 수용체의 저해제의 용도 Download PDFInfo
- Publication number
- KR20140044796A KR20140044796A KR1020137026392A KR20137026392A KR20140044796A KR 20140044796 A KR20140044796 A KR 20140044796A KR 1020137026392 A KR1020137026392 A KR 1020137026392A KR 20137026392 A KR20137026392 A KR 20137026392A KR 20140044796 A KR20140044796 A KR 20140044796A
- Authority
- KR
- South Korea
- Prior art keywords
- ser
- gly
- leu
- val
- erbb3
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4196—1,2,4-Triazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/565—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids not substituted in position 17 beta by a carbon atom, e.g. estrane, estradiol
- A61K31/568—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids not substituted in position 17 beta by a carbon atom, e.g. estrane, estradiol substituted in positions 10 and 13 by a chain having at least one carbon atom, e.g. androstanes, e.g. testosterone
- A61K31/5685—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids not substituted in position 17 beta by a carbon atom, e.g. estrane, estradiol substituted in positions 10 and 13 by a chain having at least one carbon atom, e.g. androstanes, e.g. testosterone having an oxo group in position 17, e.g. androsterone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/46—Hybrid immunoglobulins
- C07K16/468—Immunoglobulins having two or more different antigen binding sites, e.g. multifunctional antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
Abstract
종양 세포를 ErbB3 저해제, 바람직하게는 항-ErbB3 항체와 접촉시킴으로써, 호르몬 무반응 유방 종양의 성장을 억제하는 방법이 제시된다. 또한, ErbB3 또는 ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린 결합의 저해제를 환자에 투여함으로써 상기 환자에서 호르몬 무반응 유방암을 치료하기 위한 방법이 제시되고, 상기 저해제는 항-ErbB3 항체 또는 항-ErbB2 항체이다. 이들 치료 방법은 호르몬 무반응 유방암을 앓는 환자를 선별하고, 이후 저해제를 상기 환자에 투여하는 것을 더욱 포함할 수 있다. 이들 치료 방법은 또한, 에스트로겐 수용체 길항제, 또는 아로마타아제 저해제를 환자에 투여하는 것을 포함할 수 있고, 그리고 ErbB3 저해제와 공동으로 ErbB3 저해제, 에스트로겐 수용체 길항제, 또는 아로마타아제 저해제가 아닌 적어도 하나의 추가의 항암제를 환자에 투여하는 것을 더욱 포함할 수 있다.
Description
호르몬 무반응 유방암의 치료에서 EGFR-패밀리 수용체의 저해제의 용도.
배경
여성에서, 유방암은 가장 흔한 암 중의 한 가지이고 암 사망의 다섯 번째의 흔한 원인이다. 유방암의 이질성으로 인하여, 10-년 무진행 생존 (progression free survival)은 시기와 유형에 따라, 98%에서부터 10%까지 폭넓게 변할 수 있다. 상이한 형태의 유방암은 현저하게 상이한 생물학적 특징과 임상적 행태를 가질 수 있다. 따라서 환자의 유방암의 분류는 치료 섭생을 결정하기 위한 결정적인 구성요소가 되고 있다. 가령, 조직학적 유형과 등급의 분류와 함께, 유방암은 현재, 호르몬 수용체 (에스트로겐 수용체 (ER) 및 프로게스테론 수용체 (PR))의 발현 및 HER2 (ErbB2)의 발현에 대해 일과적으로 평가되는데, 그 이유는 호르몬 수용체 또는 HER2를 표적으로 하는 다수의 치료 양식이 현재 가용하기 때문이다. 다른 암, 예를 들면, 자궁암 또는 난소암은 유사하게 특성화될 수 있다. ER과 PR은 둘 모두 핵 수용체이고 (즉, 이들은 세포 표면보다는 세포 핵에 주로 위치한다), 그리고 ER 및/또는 PR을 직접적으로 또는 간접적으로 표적으로 하는 작은 분자 저해제가 개발되었다. HER2, 또는 인간 표피 성장 인자 수용체 유형 2는 세포 표면 상에 정상적으로 위치하는 수용체이고, 그리고 HER2를 표적으로 하는 항체가 치료제로서 개발되었다. HER2는 활성화 리간드에 자체적으로 결합할 수 없는, EGFR 패밀리 (여기에는 HER1 (EGFR), HER3 (ErbB3) 및 HER4 (ErbB4) 역시 포함된다)의 유일한 구성원이다. 따라서 HER2는 다른 EGFR 패밀리 구성원, 예를 들면, HER3과의 헤테로이합체성 수용체 복합체 내로 통합될 때, 수용체로서 유일하게 기능한다. 에스트로겐 수용체를 발현하는 것으로 분류된 암 (에스트로겐 수용체 양성, "ER+")은 ER 길항제, 예를 들면, 타목시펜으로 치료될 수 있다. 유사하게, 높은 수준의 HER2를 발현하는 것으로 분류된 암은 항-HER2 항체, 예를 들면, 트라스투주맙으로, 또는 HER2-활성 수용체 티로신 키나아제 저해제, 예를 들면, 라파티닙 (이것은 또한, EGFR 티로신 키나아제를 저해한다) 또는 AG879로 치료될 수 있다.
타목시펜은 수십 년 동안 ER+ 유방암에 대한 요법으로서 이용되었고, 현재 ER+ 유방암에 대한 일선 요법의 표준 구성요소를 대표한다. 타목시펜은 선별적 에스트로겐 수용체 조절자의 부류 (가령, 랄록시펜, 토레미펜 및 풀베스트란트)의 구성원이고, 이들 중에서 타목시펜, 토레미펜 및 풀베스트란트는 에스트로겐 수용체 길항제이고, 그리고 랄록시펜은 뼈에서 효현제 활성 및 유방암과 자궁암에서 길항제 활성을 갖는다. 이들 길항제 약물은 에스트로겐 수용체의 호르몬 활성화를 특이적으로 차단하고, 그리고 호르몬 무반응이 되지 않는 ER+ 유방암의 치료를 위한 효과적인 치료제이다. 타목시펜은 예로써, 최초 치료 시에 ER+ 유방암 환자의 절반 이상에서 관해를 유도한다. 호르몬 수용체 차단의 장기 유용성은 연장된 치료 이후에, 호르몬 무반응 종양 특징의 발생의 현상에 의해 제한된다. 대부분의 치료된 종양은 그들이 타목시펜 내성이 된다는 점에서 궁극적으로, 호르몬 무반응이 된다.
따라서 호르몬 길항제 및 에스트로겐 합성을 차단하는 기타 호르몬 조절 약물, 예를 들면, 아로마타아제 저해제 (가령, 엑세메스탄, 아나스트로졸, 레트로졸, 아나스트로졸, 보로졸, 포르메스탄 및 파드로졸)로 호르몬 차단은 ER+ 종양의 진행을 지연시킬 수 있지만, 이런 호르몬 조절 약물에 대한 내성의 빈번한 발생으로 인하여, 호르몬 무반응 ER+ 암에 대해 효과적인 항-암 치료제가 오랫동안 요구되었다. 본 발명은 이러한 요구를 해소하고 추가의 이익을 제공한다.
요약
본원에서는 에스트로겐 수용체 양성과 에스트로겐 수용체 음성 호르몬 무반응 유방암을 비롯한 호르몬 무반응 유방암 (가령, 종양)을 치료하기 위한 방법뿐만 아니라 이런 방법에 이용될 수 있는 제약학적 조성물이 제시된다. 이들 방법과 조성물은 적어도 부분적으로, ErbB3 저해가 호르몬 무반응 유방암 세포의 성장을 억제할 수 있다는 발견에 기초된다. 특히, 항-ErbB3 항체의 투여는 호르몬 무반응 유방암 세포의 성장을 억제하는 것으로 생각된다. 게다가, 현재, ErbB2/ErbB3 헤테로이합체의 헤레굴린 활성화는 차례로, 에스트로겐 수용체를 활성화시키는 (이의 인산화를 유발함으로써) 것으로 밝혀졌는데, 이러한 현상은 ER+ 종양에서 호르몬 조절 약물에 대한 내성의 발생에서 일정한 역할을 하는 것으로 생각된다. 따라서 본원에서는 ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린의 결합을 저해함으로써, 에스트로겐 수용체의 활성화를 저해하기 위한 방법과 조성물 역시 제시된다. 이런 방법은 본원에서 기술된 바와 같은 하나 또는 그 이상의 에스트로겐 수용체 조절 약물의 공동-투여와 함께, 유익하게 실시될 수 있다.
따라서 호르몬 무반응 유방암의 치료를 위한 ErbB3 저해제의 용도 (가령, 약제의 제조를 위한 이의 용도)가 제시된다. 다른 양상에서, 호르몬 무반응 유방암 종양 (선택적으로, 에스트로겐 수용체 양성 호르몬 무반응 유방암 종양)의 성장을 억제하는 방법이 개시되고, 상기 방법은 종양을 효과량의 ErbB3 저해제와 접촉시키는 단계를 포함한다. 다른 양상에서, 환자에서 호르몬 무반응 유방암 종양 (선택적으로, 에스트로겐 수용체 양성 호르몬 무반응 유방암 종양)의 성장을 억제하는 방법이 제시되고, 상기 방법은 효과량의 ErbB3 저해제를 환자에 투여하는 단계를 포함한다. 또 다른 양상에서, 호르몬 무반응 유방암 종양 (선택적으로, 에스트로겐 수용체 양성 호르몬 무반응 유방암 종양)에 대해 환자를 치료하는 방법이 제시되고, 상기 방법은 효과량의 ErbB3 저해제를 환자에 투여하는 단계를 포함한다. 또 다른 양상에서, 환자에서 유방암 종양을 치료하는 방법이 제시되고, 상기 방법은 호르몬 무반응 유방암 종양 (선택적으로, 에스트로겐 수용체 양성 호르몬 무반응 유방암 종양)을 갖는 환자를 선별하는 단계; 그리고 효과량의 ErbB3 저해제를 상기 환자에 투여하는 단계를 포함한다.
예시적인 구체예에서, ErbB3 저해제는 항-ErbB3 항체이다. 예시적인 항-ErbB3 항체는 각각, 서열 번호: 1과 2에서 제시된 아미노산 서열을 포함하는 VH 및/또는 VL 영역을 포함하는 Ab #6이다. 다른 예시적인 항-ErbB3 항체는 선택적으로 아미노 말단에서 카르복시 말단 순서로, 각각 서열 번호: 3-5에서 제시된 바와 같은 VH CDR1, 2와 3 서열, 그리고 선택적으로 아미노 말단에서 카르복시 말단 순서로, 각각 서열 번호: 6-8에서 제시된 바와 같은 VL CDR1, 2와 3 서열을 포함하는 항체이다. 다른 구체예에서, 항-ErbB3 항체는 각각, 서열 번호 42와 43에서 제시된 아미노산 서열을 포함하는 중쇄와 경쇄를 갖는다. 다른 구체예에서, 항-ErbB3 항체는 Ab #3 (각각, 서열 번호: 9와 10에서 제시된 바와 같은 VH와 VL 서열을 포함), Ab #14 (각각, 서열 번호: 17과 18에서 제시된 바와 같은 VH와 VL 서열을 포함), Ab #17 (각각, 서열 번호: 25와 26에서 제시된 바와 같은 VH와 VL 서열을 포함) 또는 Ab #19 (각각, 서열 번호: 33과 34에서 제시된 바와 같은 VH와 VL 서열을 포함)이다. 다른 구체예에서, 항-ErbB3 항체의 투여는 종양의 성장 또는 침입 또는 전이를 저해한다.
다른 양상에서, 본원에서 제시된 치료 방법은 ErbB3 저해제가 아닌 적어도 하나의 추가의 항암제를 환자에 공동-투여하는 단계를 더욱 포함한다. 한 구체예에서, 적어도 하나의 추가의 항암제는 적어도 하나의 화학치료 약물, 예를 들면, 백금-기초된 화학요법 약물, 탁산, 티로신 키나아제 저해제, 세린/트레오닌 단백질 키나아제 저해제, 항-EGFR 항체, 항-ErbB2 항체, 이중특이적 항-ErbB2/ErbB3 항체, 그리고 이들의 조합으로 구성된 군에서 선택되는 약물(들)을 포함한다.
다른 구체예에서, 적어도 하나의 추가의 항암제는 EGFR 저해제, 예를 들면, 항-EGFR 항체 또는 EGFR 신호전달의 작은 분자 저해제를 포함한다. 바람직한 항-EGFR 항체는 세툭시맙을 포함한다. 항-EGFR 항체의 다른 실례에는 MM-151, Sym004, 마투주맙, 파니투무맙, 니모투주맙 및 mAb 806이 포함된다. EGFR 신호전달의 예시적인 작은 분자 저해제는 제피티닙을 포함한다. EGFR 신호전달의 유용한 작은 분자 저해제의 다른 실례에는 아파티닙, 라파티닙, 카널티닙, 에를로티닙 HCL, 펠리티닙, PKI-166, PD-158780, 그리고 AG 1478가 포함되지만 이들에 국한되지 않는다.
또 다른 구체예에서, 적어도 하나의 추가의 항암제는 혈관 내피 성장 인자 (VEGF) 저해제를 포함한다. 예시적인 VEGF 저해제는 항-VEGF 항체, 예를 들면, 베바시주맙 항체를 포함한다. 또 다른 구체예에서, 적어도 하나의 추가의 항암제는 에스트로겐 수용체 길항제 및 아로마타아제 저해제 중에서 어느 한쪽 또는 둘 모두를 포함한다. 에스트로겐 수용체 길항제의 실례에는 랄록시펜, 타목시펜, 아피목시펜 (4-히드록시타목시펜), 아르족시펜, 라소폭손, 토레미펜 및 풀베스트란트가 포함된다. 아로마타아제 저해제의 실례에는 엑세메스탄, 아나스트로졸, 레트로졸, 아미노글루테티미드, 테스토락톤, 보로졸, 포르메스탄 및 파드로졸이 포함되지만 이들에 국한되지 않는다. 한 구체예에서, 아로마타아제 저해제는 레트로졸이다. 또 다른 구체예에서, 적어도 하나의 추가의 항암제는 세린/트레오닌 단백질 키나아제 저해제, 예를 들면, 라파마이신의 포유동물 표적 (mTOR) 저해제, 포스파티딜이노시톨-3-키나아제 (PI3K) 저해제, 또는 미토겐 활성화된 키나아제 키나아제 (MEK) 저해제를 포함한다. mTOR 저해제의 실례에는 템시롤리무스, 에베롤리무스, 시롤리무스, 또는 리다포롤리무스가 포함되지만 이들에 국한되지 않는다. PI3K 저해제의 실례에는 CAL101 및 PX-866이 포함되지만 이들에 국한되지 않고, 이들 둘 모두 현재, 임상 시험에서 조사 중에 있다. MEK 저해제의 실례에는 XL518, CI-1040, PD035901, 셀루메티닙, 그리고 GSK1120212가 포함되지만 이들에 국한되지 않는다. 한 구체예에서, 적어도 하나의 추가의 항암제는 mTOR 저해제 및 아로마타아제 저해제 중에서 어느 한쪽 또는 둘 모두를 포함한다. 한 구체예에서, 적어도 하나의 항암제는 에베롤리무스 및 엑세메스탄을 포함한다. 또 다른 구체예에서, 적어도 하나의 추가의 항암제는 IGF1R 저해제를 포함한다. IGF1R 저해제의 실례에는 달로투주맙, AMG-479, R1507, 피지투무맙, IMC-A12, XL228, BMS-754807 및 MM-141이 포함된다.
한 구체예에서, 호르몬 무반응 유방암은 ER+이다.
추가의 양상에서, 본원에서는 종양 세포에서 에스트로겐 수용체의 헤레굴린-매개된 활성화를 저해하기 위한 방법이 제시되고, 상기 방법은 하기 단계를 포함한다: 1) 항-에스트로겐 요법으로 악성 종양에 대해 치료되고 이런 요법에 대해 내성화된 인간 환자를 선별하는 단계, 상기 환자는 악성 종양을 갖고, 상기 종양은 환자가 내성화된 이후 환자로부터 채취된 종양 생검의 분석에 의해, 에스트로겐 수용체 양성이고 HER2를 과다발현하고, 그리고 상기 활성화는 에스트로겐 수용체의 인산화를 포함하고, 그리고 2) 이렇게 선별된 환자에 ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린 결합을 저해하는 항체를 투여하는 단계, 여기서 상기 항체는 시험관내에서 MCF7 세포에서 헤레굴린-유도된 에스트로겐 수용체 인산화를 적어도 20%, 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 또는 적어도 70% 저해하는데 충분한 농도인, 환자의 혈류 내에 상기 항체의 농도를 산출하는 용량으로 투여되고, 여기서 상기 용량에서 상기 투여는 종양을 치료하는데 효과적이다.
세포는 생검에 의해, ER+ 및 HER2++ 또는 HER2+++이거나, 또는 적어도 0.02 pg HRG/μg의 단백질 (가령, ELISA에 의해)을 내포하거나, 또는 HER2 FISH-양성인 종양 내에 있을 수 있다. 저해는 ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린 결합을 저해하는 항체를 세포외액 내로 도입함으로써 달성된다. 한 구체예에서, 종양은 악성 종양이다.
치료되는 종양 유형의 무제한적 실례에는 유방, 난소, 폐, 또는 피부 (가령, 흑색종)의 암이 포함된다.
종양은 환자 내에 있을 수 있고, 그리고 항체는 혈류 내에서 항체의 충분한 농도를 산출하는데 효과적인 양의 항체를 환자에 투여함으로써 혈류 내로 도입될 수 있다. 투여는 정맥내 주사 또는 주입에 의해 달성될 수 있다. 한 구체예에서, 항체는 항-HER3 (항-ErbB3) 항체, 예를 들면, 각각, 서열 번호: 1과 2에서 제시된 아미노산 서열을 포함하는 VH 및/또는 VL 영역을 갖는 항체일 수 있다. 다른 구체예에서, 항체는 각각, 서열 번호: 42와 43에서 제시된 아미노산 서열을 포함하는 VH 및/또는 VL 영역을 포함하는 항-ErbB3 항체일 수 있다. 항체는 항-HER2 (항-ErbB2) 항체, 예를 들면, C6.5, C6.5 디아바디, 또는 페르투주맙일 수 있다. 항체는 또한, 항-ErbB2/항-ErbB3 이중특이적 항체일 수 있다. scFv 인간 혈청 알부민 (HSA) 접합체인 다수의 이중특이적 항-ErbB2/항-ErbB3 항체는 US 특허 공개 20110059076, 그리고 PCT 공개 번호 WO2009/126920에서 기술되고, 이들 각각은 ALM, A5-HSA-ML3.9, A5-HSA-B1D2, B12-HSA-B1D2, A5-HSA-F5B6H2, H3-HSA-F5B6H2, F4-HSA-F5B6H2, 그리고 H3-HSA-B1D2를 비롯하여, scFv HSA 접합체이고 본원에서 제시된 방법과 조성물에 이용하기 적합한 B2B3-1 및 기타 이중특이적 항-ErbB2/항ErbB3 항체를 개시한다. 한 구체예에서, 이중특이적 항체는 서열 번호:44를 포함한다. 다른 적절한 이중특이적 항-ErbB2/항ErbB3 항체는 US 특허 번호 7,332,580과 7,332,585에서 개시되고 청구된다. 바람직하게는, 상기 항체의 투여는 종양의 성장 또는 침입 또는 전이를 저해한다.
따라서 헤레굴린 매개된 에스트로겐 수용체 활성화의 저해를 위해, 그리고 또한 또는 대안으로, 호르몬 무반응 유방암 (또는 다른 호르몬 무반응 암, 예를 들면, 난소암, 자궁암, 또는 자궁경부암) 또는 아로마타아제 내성 에스트로겐 수용체 양성 암, 예를 들면, 유방암, 난소암, 자궁암, 또는 자궁경부암의 치료를 위해 제공되는 ErbB3 저해제 (가령, 항-ErbB3 항체) 또는 항-ErbB2 항체 또는 이중특이적 항-ErbB2/ErbB3 항체 (가령, 약제의 제조를 위한 이의 용도)가 개시된다. 추가의 구체예에서, ErbB3 저해제, 예를 들면, 항-ErbB3 항체 또는 항-ErbB2 항체 또는 이중특이적 항-ErbB2/ErbB3 항체가 아로마타아제 저해제와의 복합 요법에서, 에스트로겐 수용체 양성 암 (가령, 유방암, 난소암, 자궁암, 또는 자궁경부암)의 치료에서 이용을 위해 제공된다 (가령, 약제의 제조를 위한 이의 용도). 이런 복합은 이런 복합으로 치료된 암에서 호르몬 내성의 발생을 지체시키거나 예방한다. 추가의 구체예에서, 상기 방법은 에스트로겐 수용체 길항제 및 아로마타아제 저해제 중에서 어느 한쪽 또는 둘 모두의 공동-투여를 더욱 포함한다. 추가의 양상에서, 본원에서는 에스트로겐 수용체의 헤레굴린-매개된 활성화의 저해를 위한 조성물이 제시되고, 상기 저해는 항-에스트로겐 요법으로 악성 종양에 대해 치료되고 이런 요법에 대해 내성화된 인간 환자의 선별을 뒤따르고, 상기 환자는 악성 종양을 갖고, 상기 종양은 환자가 내성화된 이후 환자로부터 채취된 종양 생검의 분석에 의해, 에스트로겐 수용체 양성이고 ErbB2를 과다발현하고, 그리고 상기 활성화는 에스트로겐 수용체의 인산화를 포함하고, 상기 조성물은 ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린 결합을 저해하는 항-ErbB3 항체; ErbB2에 결합하고 ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린 결합을 저해하는 항-ErbB2 항체 (가령, 페르투주맙); 또는 ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린 결합을 저해하는 항-ErbB2/항ErbB3 이중특이적 항체 (가령, 서열 번호:44 (U.S. 특허 공개 번호 20110059076에서 서열 번호:16으로 지칭됨)를 포함하는 항체)를 포함한다. 일부 구체예에서, 암은 호르몬 무반응 에스트로겐-수용체 양성 암이다.
한 구체예에서, 이들 각 조성물은 에스트로겐 수용체 길항제 및 아로마타아제 저해제 중에서 하나 또는 그 이상을 선택적으로 포함한다. 에스트로겐 수용체 길항제의 실례에는 랄록시펜, 타목시펜, 아피목시펜 (4-히드록시타목시펜), 아르족시펜, 라소폭손, 토레미펜 및 풀베스트란트가 포함된다. 아로마타아제 저해제의 실례에는 엑세메스탄, 아나스트로졸, 레트로졸, 아미노글루테티미드, 테스토락톤, 보로졸, 포르메스탄 및 파드로졸이 포함된다. 예시적인 구체예에서, 아로마타아제 저해제는 레트로졸이다.
다른 구체예에서, 이들 각 조성물은 mTOR 저해제 및 아로마타아제 저해제 중에서 하나 또는 그 이상을 선택적으로 포함한다. mTOR 저해제의 실례에는 템시롤리무스, 에베롤리무스, 시롤리무스, 또는 리다포롤리무스가 포함된다. 예시적인 구체예에서, mTOR 저해제는 에베롤리무스이다. 아로마타아제 저해제의 실례에는 엑세메스탄, 아나스트로졸, 레트로졸, 아미노글루테티미드, 테스토락톤, 보로졸, 포르메스탄 및 파드로졸이 포함된다. 예시적인 구체예에서, 아로마타아제 저해제는 엑세메스탄이다.
다른 구체예에서, 이들 각 조성물은 MEK 저해제, PI3K 저해제, 그리고 IGF-1R 저해제 중에서 하나 또는 그 이상을 선택적으로 포함한다.
도면의 간단한 설명
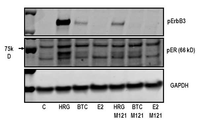
도 1은 처리되지 않은 대조 세포 ("C"), MM-121로 전처리 ("MM121")되거나 전처리되지 않고 헤레굴린 베타 1 ("HRG"), 베타세룰린 ("BTC"), 또는 에스트로겐 ("E2")으로 자극된 세포로부터 용해물의 겔의 웨스턴블롯의 이미지를 포함한다. 위쪽 패널은 인산화된 ErbB3 (pErbB3)에 특이적인 항체로 탐침된 블롯으로부터 결과를 보여주고, 중간 패널은 인산화된 (ser 167과 ser 118) 에스트로겐 수용체 알파 (pER)에 특이적인 항체로 탐침된 블롯을 보여주고, 그리고 아래쪽 패널은 부하 대조 (loading control)로서 글리세르알데히드-3-인산탈수소효소 (GAPDH)에 특이적인 항체로 탐침된 블롯을 보여준다.
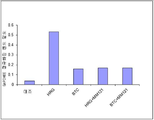
도 2는 도 1에서 대조 ("대조"), 헤레굴린 ("HRG"), 베타세룰린 ("BTC"), 헤레굴린 + MM-121 ("HRG+MM121") 및 베타세룰린 + MM-121 ("BTC+MM121") 레인 각각에서 관련된 (pER) 밴드로부터 밀도계측 결과를 보여주는 그래프이다. 밴드 밀도는 GAPDH 밀도에 정규화되고, 그리고 정규화된 밀도 (Y-축)는 X-축에 지시된 바와 같이 대조 및 자극된 세포 (MM-121 전처리된 세포 및 MM-121 전처리되지 않은 세포 둘 모두)에 대해 도시된다. HRG와 BTC 레인 사이에 화살촉 모양은 HRG 레인 내에 pER 밴드를 지시한다.
도 3은 레트로졸 내성 생쥐 이종이식편 모델에서 시간의 흐름 (주, x 축)에서 종양 체적 (y-축)을 보여주는 그래프이다. 데이터는 대조로서 PBS (사각형), MM-121 단독 ("MM", 삼각형), 레트로졸 다독 ("Let", 뒤집힌 삼각형), 그리고 MM-121과 레트로졸의 조합 (MM+Let, 다이아몬드)으로 치료된 생쥐에 대해 도시된다. 14주 마크 시점에서, 이들 레트로졸 생쥐는 3가지 군으로 분할되었다: 레트로졸 단독 ("Let", 뒤집힌 삼각형), MM-121 단독 ("Let→MM", 원) 및 MM-121과 레트로졸의 조합 ("Let→MM+Let", 별).
도 1은 처리되지 않은 대조 세포 ("C"), MM-121로 전처리 ("MM121")되거나 전처리되지 않고 헤레굴린 베타 1 ("HRG"), 베타세룰린 ("BTC"), 또는 에스트로겐 ("E2")으로 자극된 세포로부터 용해물의 겔의 웨스턴블롯의 이미지를 포함한다. 위쪽 패널은 인산화된 ErbB3 (pErbB3)에 특이적인 항체로 탐침된 블롯으로부터 결과를 보여주고, 중간 패널은 인산화된 (ser 167과 ser 118) 에스트로겐 수용체 알파 (pER)에 특이적인 항체로 탐침된 블롯을 보여주고, 그리고 아래쪽 패널은 부하 대조 (loading control)로서 글리세르알데히드-3-인산탈수소효소 (GAPDH)에 특이적인 항체로 탐침된 블롯을 보여준다.
도 2는 도 1에서 대조 ("대조"), 헤레굴린 ("HRG"), 베타세룰린 ("BTC"), 헤레굴린 + MM-121 ("HRG+MM121") 및 베타세룰린 + MM-121 ("BTC+MM121") 레인 각각에서 관련된 (pER) 밴드로부터 밀도계측 결과를 보여주는 그래프이다. 밴드 밀도는 GAPDH 밀도에 정규화되고, 그리고 정규화된 밀도 (Y-축)는 X-축에 지시된 바와 같이 대조 및 자극된 세포 (MM-121 전처리된 세포 및 MM-121 전처리되지 않은 세포 둘 모두)에 대해 도시된다. HRG와 BTC 레인 사이에 화살촉 모양은 HRG 레인 내에 pER 밴드를 지시한다.
도 3은 레트로졸 내성 생쥐 이종이식편 모델에서 시간의 흐름 (주, x 축)에서 종양 체적 (y-축)을 보여주는 그래프이다. 데이터는 대조로서 PBS (사각형), MM-121 단독 ("MM", 삼각형), 레트로졸 다독 ("Let", 뒤집힌 삼각형), 그리고 MM-121과 레트로졸의 조합 (MM+Let, 다이아몬드)으로 치료된 생쥐에 대해 도시된다. 14주 마크 시점에서, 이들 레트로졸 생쥐는 3가지 군으로 분할되었다: 레트로졸 단독 ("Let", 뒤집힌 삼각형), MM-121 단독 ("Let→MM", 원) 및 MM-121과 레트로졸의 조합 ("Let→MM+Let", 별).
상세한 설명
본원에서는 호르몬 무반응 유방암 및 기타 ER+ 암, 특히 HER2를 과다발현하는 암을 치료하기 위한 방법이 제시된다. 또한, 이런 치료를 위한 제약학적 조성물, 그리고 이런 치료에서 이들의 용도가 제시된다. 실시예에서 더욱 기술된 바와 같이, ErbB3 저해제, 예를 들면, 항-ErbB3 항체, 또는 ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린의 결합을 저해할 수 있는 다른 항체는 생체내에서 호르몬 무반응 유방암 세포의 성장, 침입과 전이 중에서 하나 또는 그 이상을 억제할 수 있는 것으로 생각된다. 따라서 호르몬 무반응 유방암 (가령, 에스트로겐 수용체 양성 호르몬 무반응 유방암)의 성장, 침입 또는 전이를 억제하기 위한 방법 및 조성물과 이들의 용도뿐만 아니라 환자에서 이런 유방암을 예로써, ErbB3 저해제로 치료하기 위한 방법과 조성물이 제시된다.
ER+ 암은 항-에스트로겐 작용제를 포함하는 요법 섭생에 대한 후보의 좋은 예이다. 이런 암에는 일정한 유방, 난소, 자궁, 자궁내막, 폐, 뼈, 뇌, 방광, 간과 비뇨생식기 암이 포함되지만 이들에 국한되지 않는다.
암은 ErbB2 유전자 증폭된 암 및/또는 ErbB2 발현 (HER2+) 또는 과다발현 (HER2++, HER2+++) 암일 수 있다. HER2 또는 Neu로 알려져 있는 ErbB2는 세포내 티로신 키나아제 활성을 통해, 세포내 신호 (가령, 리간드 활성화 시에)를 산출하는 세포 표면 막통과 수용체 단백질이다. 과잉에서, 이런 신호는 예로써, 세포 분열을 촉발함으로써 종양형성을 증진할 수 있다. ErbB2 유전자는 유방, 난소, 자궁내막, 췌장, 결장직장, 전립선, 타액선, 피부, 신장, 그리고 폐가 포함되지만 이들에 국한되지 않는 많은 유형의 인간 악성 종양에서 증폭되고 및/또는 과다발현된다. ErbB2 과다발현 암은 ErbB2 과다발현의 수준에 따라 HER2+++ 또는 HER2++로 명명되는데, HER2+++는 최고 수준의 HER2 발현을 지시한다. HER2+++ 및 HER2++ 상태는 전형적으로, 면역검정, 예를 들면, 면역조직화학 (IHC), 예를 들면, Herceptest®에 의해 결정된다. College of American Pathologists (CAP) 및 American Society of Clinical Oncology (ASCO)에 의해 제공된 가이드라인에 따르면, HER2 음성으로 명명된 종양은 IHC 검사가 염색 없음 또는 <30%의 종양 세포에서 막 염색을 보여주는 종양이다; 종양은 IHC 검사가 > 30%의 종양 세포에서 희미한 막 염색을 유발하면, "HER2"+로 명명되는데, 여기서 막의 일부만 염색된다; 종양은 IHC 검사가 >30%의 종양 세포에서 약한 또는 중간 (완전한) 막 염색을 유발하면, "HER2++"로 명명된다; 그리고 종양은 IHC 검사가 >30%의 종양 세포의 균일하고 강한 염색을 유발하면, "HER2+++"으로 명명된다. ErbB2 유전자 증폭은 예로써, FISH (형광 동소 혼성화, fluorescence in situ hybridization)에 의해 결정될 수 있는데, HER2-증폭된 암 세포는 HER2-증폭되는 2개 이상의 HER2 유전자 사본을 갖는 것들이고, 그리고 HER2-증폭된 암 세포를 포함하는 세포 및/또는 종양은 "FISH 양성"으로 지칭된다.
정의:
본원에서 이용된 바와 같이, 용어 "호르몬 무반응 유방암"은 항-호르몬 요법의 효과에 내성인 유방암을 지칭한다. 호르몬 무반응 유방암은 내분비 요법에 대한 데노보 내성이거나, 또는 치료 동안 내성을 획득하는 에스트로겐 수용체 양성 유방암이다. 호르몬-수용체-양성 유방암의 대략 25-50%는 내분비 요법에 대한 데노보 내성이고, 그리고 본질적으로 모든 전이성 유방암은 획득된 내성을 발달시킨다.
본원에서 이용된 바와 같이, 용어 "에스트로겐 수용체 양성" (ER+)은 종양 세포가 에스트로겐 수용체 (ER)에 대해 양성으로 채점되는 (즉, 전통적인 조직병리 방법을 이용하여) 종양 (가령, 암종), 전형적으로 유방 종양을 지칭한다. CAP와 ASCO에 의해 제공된 권고 사항에 따르면, 종양은 검사된 (가령, 면역조직화학에 의해) 종양 세포의 적어도 1%가 ER 양성으로 채점되면, ER+이다.
본원에서 교체가능하게 이용되는 용어 "ErbB3"과 "HER3"은 U.S. 특허 번호 5,480,968에서 기술된 바와 같은 인간 ErbB3 단백질을 지칭한다.
본원에서 교체가능하게 이용되는 용어 "ErbB2", "HER2"와 "HER2 수용체"는 ErbB2 종양유전자 또는 HER2 종양유전자로 지칭되는, 인간 neu 종양유전자의 단백질 산물을 지칭한다.
본원에서 이용된 바와 같이, 용어 "ErbB3 저해제"는 ErbB3의 활성을 저해하거나, 하향조정하거나, 억제하거나, 또는 하향조절하는 치료제를 포함하는 것으로 의도된다. 상기 용어는 화학적 화합물, 예를 들면, 작은 분자 저해제, 그리고 생물학적 작용제, 예를 들면, 항체, 간섭 RNA (shRNA, siRNA), 가용성 수용체 등을 포함하는 것으로 의도된다. 예시적인 ErbB3 저해제는 항-ErbB3 항체이다.
본원에서 이용된 바와 같이, "항체"는 면역글로불린 유전자 또는 면역글로불린 유전자의 단편에 의해 실질적으로 인코딩된 결합 도메인을 포함하는 하나 또는 그 이상의 폴리펩티드로 구성되는 단백질이고, 여기서 상기 단백질은 항원에 면역특이적으로 결합한다. 인정된 면역글로불린 유전자에는 카파, 람다, 알파, 감마, 델타, 엡실론과 뮤 불변 영역 유전자뿐만 아니라 무수한 면역글로불린 가변 영역 유전자가 포함된다. 경쇄는 카파 또는 람다로서 분류된다. 중쇄는 감마, 뮤, 알파, 델타, 또는 엡실론으로 분류되고, 이들은 차례로, 면역글로불린 부류, IgG, IgM, IgA, IgD와 IgE를 각각 정의한다. 전형적인 면역글로불린 구조 단위는 폴리펩티드 사슬의 2개의 동일한 쌍으로 구성되는 사합체를 포함하는데, 각 쌍은 하나의 "경쇄" (약 25 kD) 및 하나의 "중쇄" (약 50-70 kD)를 갖는다. "VL" 및 VH"는 이들 경쇄와 중쇄의 각 가변 영역을 지칭한다.
항체에는 본래의 면역글로불린뿐만 아니라 다양한 펩티다아제로 효소분해에 의해 생산되거나, 또는 화학적으로 또는 재조합 DNA 발현 기술을 이용하여 데노보 합성될 수 있는 이들의 항원-결합 단편이 포함된다. 이런 단편에는 예로써, F(ab)2 이합체 및 Fab 단위체가 포함된다. 유용한 항체에는 단일 사슬 항체 (단일 폴리펩티드 사슬로서 존재하는 항체), 예를 들면, VH와 VL 사슬이 함께 결합되어 (직접적으로 또는 펩티드 링커를 통해) 연속 폴리펩티드가 형성되는 단일 사슬 Fv 항체 (scFv)가 포함된다.
"면역특이적" 또는 "면역특이적으로"는 면역글로불린 유전자 또는 면역글로불린 유전자의 단편에 의해 실질적으로 인코딩된 도메인을 거쳐, 관심되는 단백질의 하나 또는 그 이상의 에피토프에 결합하지만, 항원성 분자의 혼성 집단을 내포하는 시료에서 다른 분자를 실질적으로 인식하고 결합하지 않는 항체를 지칭한다. 전형적으로, 항체는 표면 플라즈몬 공명 검정 또는 세포 결합 검정에 의해 측정될 때, 50 nM 이하의 값을 갖는 Kd로, 동계 항원에 면역특이적으로 결합한다. 이런 검정의 이용은 당분야에서 널리 알려져 있고, 그리고 하기 실시예 3에서 기술된다.
"항-ErbB3 항체"는 ErbB3의 엑토도메인에 면역특이적으로 결합하는 항체이고, 그리고 "항-ErbB2 항체"는 ErbB2의 엑토도메인에 면역특이적으로 결합하는 항체이다. 항체는 단리된 항체일 수 있다. ErbB3 또는 ErB2에 대한 이런 결합은 표면 플라즈몬 공명 검정 또는 세포 결합 검정에 의해 측정될 때, 50 nM 이하의 값을 갖는 Kd를 나타낸다. 예시적인 항-ErbB3 항체는 ErbB3의 EGF-유사 리간드 매개된 인산화를 저해한다, 예를 들면, 항-ErbB2 항체는 ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린의 결합을 저해한다. EGF-유사 리간드에는 EGF, TGFα, 베타세룰린, 헤파린-결합 표피 성장 인자, 비레굴린, 에피겐, 에피레굴린, 그리고 암피레굴린이 포함되고, 이들은 전형적으로 ErbB1에 결합하고 ErbB1과 ErbB3의 헤테로이합체화를 유도한다.
본원에서 이용된 바와 같이, 용어 "이중특이적 항체"는 2개의 항원-결합 부위를 포함하는 단백질을 지칭하는데, 첫 번째 결합 부위는 첫 번째 항원 또는 에피토프에 대한 면역특이적 결합을 나타내고, 그리고 두 번째 결합 부위는 첫 번째와 상이한 두 번째 항원 또는 에피토프에 대한 면역특이적 결합을 나타낸다. 항-ErbB3/항-ErbB2 이중특이적 항체는 2개의 결합 부위를 포함하는 항체인데, 한 결합 부위는 ErbB3의 엑토도메인에 면역특이적으로 결합하고, 그리고 다른 결합 부위는 ErbB2의 엑토도메인에 면역특이적으로 결합한다.
본원에서 이용된 바와 같이, 용어 "EGFR 저해제" 또는 "EGFR 신호전달의 저해제"는 EGFR 신호전달 활성을 저해하거나, 하향조정하거나, 억제하거나, 또는 하향조절하는 치료제를 포함하는 것으로 의도된다. 상기 용어는 화학적 화합물, 예를 들면, 작은 분자 저해제 (가령, 작은 분자 티로신 키나아제 저해제) 및 생물학적 작용제, 예를 들면, 항체, 간섭 RNA (shRNA, siRNA), 가용성 수용체 등을 포함하는 것으로 의도된다.
본원에서 이용된 바와 같이, 용어 "VEGF 저해제"는 VEGF 신호전달 활성을 저해하거나, 하항조정하거나, 억제하거나, 또는 하향조절하는 치료제를 포함하는 것으로 의도된다. 상기 용어는 화학적 화합물, 예를 들면, 작은 분자 저해제 (가령, 작은 분자 티로신 키나아제 저해제) 및 생물학적 작용제, 예를 들면, 항체, 간섭 RNA (shRNA, siRNA), 가용성 수용체 등을 포함하는 것으로 의도된다.
본원에서 이용된 바와 같이, 용어 "mTOR 저해제"는 라파마이신의 포유동물 표적 (mTOR)을 저해하거나, 하항조정하거나, 억제하거나, 또는 하향조절하는 치료제를 포함하는 것으로 의도된다. 상기 용어는 화학적 화합물, 예를 들면, 작은 분자 저해제 (가령, 작은 분자 세린/트레오닌 키나아제 저해제) 및 생물학적 작용제, 예를 들면, 항체, 간섭 RNA (shRNA, siRNA), 가용성 수용체 등을 포함하는 것으로 의도된다.
본원에서 이용된 바와 같이, 용어 "MEK 저해제"는 미토겐 활성화된 단백질 키나아제 키나아제 (MEK)를 저해하거나, 하항조정하거나, 억제하거나, 또는 하향조절하는 치료제를 포함하는 것으로 의도된다. 상기 용어는 화학적 화합물, 예를 들면, 작은 분자 저해제 (가령, 작은 분자 세린/트레오닌 키나아제 저해제) 및 생물학적 작용제, 예를 들면, 항체, 간섭 RNA (shRNA, siRNA), 가용성 수용체 등을 포함하는 것으로 의도된다.
본원에서 이용된 바와 같이, 용어 "PI3K 저해제"는 포스파티딜이노시톨-3-키나아제 (PI3K)를 저해하거나, 하항조정하거나, 억제하거나, 또는 하향조절하는 치료제를 포함하는 것으로 의도된다. 상기 용어는 화학적 화합물, 예를 들면, 작은 분자 저해제 (가령, 작은 분자 세린/트레오닌 키나아제 저해제) 및 생물학적 작용제, 예를 들면, 항체, 간섭 RNA (shRNA, siRNA), 가용성 수용체 등을 포함하는 것으로 의도된다.
본원에서 교체가능하게 이용되는 용어 "억제한다", "억제", "저해한다" 및 "저해"는 활성의 완전한 차단을 비롯하여, 생물학적 활성 (가령, 종양 세포 성장)에서 임의의 통계학적으로 유의한 감소를 지칭한다. 가령, "저해"는 생물학적 활성에서 약 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 또는 100%의 감소를 지칭할 수 있다.
용어 "환자"는 예방적 또는 치료적 처치를 받는 인간 또는 기타 포유류 동물을 포함한다.
본원에서 이용된 바와 같이, 용어 "치료한다", "치료하는" 및 "치료"는 본원에서 기술된 치료적 또는 예방적 조치를 지칭한다. "치료" 방법은 환자, 예를 들면, 호르몬 무반응 유방암 종양을 앓는 환자에, 상기 질환 또는 장애 또는 재발성 질환 또는 장애를 치료하거나, 지연시키거나, 이의 심각도를 감소시키거나, 또는 이의 하나 또는 그 이상의 증상을 완화시키기 위해, 또는 이런 치료의 부재에서 예상되는 것보다 초과하여 환자의 생존을 연장시키기 위해, 본원에서 기술된 것들과 같은 ErbB3 저해제의 투여를 이용한다.
본원에서 이용된 바와 같이, 용어 "효과량"은 환자에 투여될 때, 호르몬 무반응 유방암의 치료, 예측 또는 진단을 달성하는데 충분한, 작용제, 예를 들면, ErbB3 저해제, 예를 들면, 항-ErbB3 항체의 양을 지칭한다. 치료 효과량은 치료되는 환자와 질환 상태, 환자의 체중과 연령, 질환 상태의 심각도, 투여 방식 등에 따라 변할 것이고, 이것은 당업자에 의해 쉽게 결정될 수 있다. 투여 용량은 예로써, 약 1 ng 내지 약 10,000 mg, 약 5 ng 내지 약 9,500 mg, 약 10 ng 내지 약 9,000 mg, 약 20 ng 내지 약 8,500 mg, 약 30 ng 내지 약 7,500 mg, 약 40 ng 내지 약 7,000 mg, 약 50 ng 내지 약 6,500 mg, 약 100 ng 내지 약 6,000 mg, 약 200 ng 내지 약 5,500 mg, 약 300 ng 내지 약 5,000 mg, 약 400 ng 내지 약 4,500 mg, 약 500 ng 내지 약 4,000 mg, 약 1 μg 내지 약 3,500 mg, 약 5 μg 내지 약 3,000 mg, 약 10 μg 내지 약 2,600 mg, 약 20 μg 내지 약 2,575 mg, 약 30 μg 내지 약 2,550 mg, 약 40 μg 내지 약 2,500 mg, 약 50 μg 내지 약 2,475 mg, 약 100 μg 내지 약 2,450 mg, 약 200 μg 내지 약 2,425 mg, 약 300 μg 내지 약 2,000, 약 400 μg 내지 약 1,175 mg, 약 500 μg 내지 약 1,150 mg, 약 0.5 mg 내지 약 1,125 mg, 약 1 mg 내지 약 1,100 mg, 약 1.25 mg 내지 약 1,075 mg, 약 1.5 mg 내지 약 1,050 mg, 약 2.0 mg 내지 약 1,025 mg, 약 2.5 mg 내지 약 1,000 mg, 약 3.0 mg 내지 약 975 mg, 약 3.5 mg 내지 약 950 mg, 약 4.0 mg 내지 약 925 mg, 약 4.5 mg 내지 약 900 mg, 약 5 mg 내지 약 875 mg, 약 10 mg 내지 약 850 mg, 약 20 mg 내지 약 825 mg, 약 30 mg 내지 약 800 mg, 약 40 mg 내지 약 775 mg, 약 50 mg 내지 약 750 mg, 약 100 mg 내지 약 725 mg, 약 200 mg 내지 약 700 mg, 약 300 mg 내지 약 675 mg, 약 400 mg 내지 약 650 mg, 약 500 mg, 또는 약 525 mg 내지 약 625 mg 범위의 본원에서 제시된 바와 같은 항체 또는 이의 항원 결합 부분에서 변할 수 있다. 투약은 예로써, 매주, 10일마다, 2주마다, 18일마다, 3주마다, 4주마다, 5주마다 또는 6주마다일 수 있다. 용량 섭생은 최적 치료 반응을 제공하기 위해 조정될 수도 있다. 효과량은 또한, ErbB3 저해제의 임의의 독성 또는 유해한 효과 (부작용)가 최소화되고 및/또는 유익한 효과에 의해 압도되는 양이다. MM-121의 경우에, 투약은 정확하게 또는 대략 6 mg/kg 또는 12 mg/kg 매주, 또는 12 mg/kg 또는 24 mg/kg 격주에서 정맥내일 수 있다. MM-111의 경우에, 투약은 정확하게는 또는 대략 y mg/kg의 최초 부하 분량 (loading dose) 및 정확하게는 또는 대략 z mg/kg의 차후 유지 분량 (maintenance dose)으로 정확하게는 또는 대략 x일마다 정맥내일 수 있고, 여기서 x, y와 z는 7, 25와 20, 또는 10, 40과 30, 또는 14, 60과 44, 또는 18, 90과 75, 또는 21, 120과 105이다. 추가의 바람직한 투약 섭생은 하기에 기술된다.
용어 "항암제" 및 "항신생물제"는 악성 종양, 예를 들면, 암성 성장을 치료하는데 이용되는 약물을 지칭한다. 약물 요법은 단독으로, 또는 다른 치료, 예를 들면, 수술 또는 방사선 요법과 공동으로 이용될 수 있다.
"치료적 상승효과"는 치료제의 조합으로 환자의 치료가 최적 용량에서 이용된 조합의 각 개별 구성물에 의해 달성되는 결과보다 치료적으로 우월한 결과를 드러내는 현상을 지칭한다 (T. H. Corbett et al., 1982, Cancer Treatment Reports, 66, 1187). 이러한 문맥에서, 치료적으로 우월한 결과는 환자가 a) 조합의 개별 구성물이 조합에서와 동일한 용량에서 단일요법으로서 각각 투여되는 경우에 치료적 이익과 동등하거나 이보다 큰 치료적 이익을 얻으면서, 더욱 적은 빈도의 부작용을 나타내거나, 또는 b) 각 구성물이 개별 성분으로서 투여될 때와 동일한 용량에서 조합(들)으로 투여될 때 조합의 각 개별 구성물로 치료의 치료적 이익보다 큰 치료적 이익을 얻으면서, 용량-제한 독성 (dose-limiting toxicity)을 나타내지 않는 것이다. 이종이식편 모델에서, 각 구성물이 개별 최대 허용량 (maximum tolerated dose)을 일반적으로 초과하지 않는 용량에서 존재하는 최대 허용량으로 이용된 조합은 이러한 조합의 투여에 의해 달성된 종양 성장에서 감소가 구성물이 단독으로 투여될 때 최고 구성물의 종양 성장에서 감소의 값보다 클 때 치료적 상승효과를 드러낸다.
따라서 조합에서, 이런 조합의 성분은 항-ErbB3 항체로 단일요법, 또는 항체 요법의 부재에서 화학치료제(들)로 치료와 비교하여, 췌장 종양 성장의 억제에 대한 부가적 또는 초부가적 효과를 갖는다. "부가적"은 각 개별 성분으로 단일요법에 의해 달성된 최고의 개별 결과보다 크기에서 (가령, 종양 분열 지수 또는 종양 성장의 감소의 수준에서, 또는 종양 축소 또는 증상-없는 또는 증상-감소된 기간의 빈도 및/또는 지속 기간의 수준에서) 더욱 큰 결과를 의미하고, 반면 "초부가적"은 이런 별개의 결과의 합계를 크기에서 초과하는 결과를 지시하는데 이용된다. 한 구체예에서, 부가적 효과는 췌장 종양 성장을 늦추거나 중지시키는 것으로 측정된다. 부가적 효과는 또한, 예로써 췌장 종양의 크기에서 감소, 종양 분열 지수의 감소, 시간의 흐름에서 전이성 병소의 숫자에서 감소, 전체 반응 비율에서 증가, 또는 중간 또는 전체 생존에서 증가로서 측정될 수 있다.
치료적 처치의 유효성이 정량될 수 있는 적도 (measure)의 한 가지 무제한적 실례는 log10 세포 살해를 계산하는 것인데, 이것은 하기 방정식에 따라 결정된다:
log10 세포 살해 = T C (일수)/3.32 x Td
여기서 T C는 세포의 성장에서 지연을 나타내고, 이것은 치료 군 (T)의 종양 및 대조 군 (C)의 종양이 미리 결정된 값 (가령, 1 g, 또는 10 mL)에 도달하는 일수 (day)에서 평균 시간이고, 그리고 Td는 종양의 체적이 대조 동물에서 배증하는데 필요한 일수 (day)에서 시간을 나타낸다. 이러한 적도를 적용할 때, log10 세포 살해가 0.7과 동등하거나 이보다 크면, 산물은 활성인 것으로 간주되고, 그리고 log10 세포 살해가 2.8보다 크면, 산물은 매우 활성인 것으로 간주된다. 이러한 적도를 이용하면, 각 구성물이 일반적으로 최대 허용량과 동등하거나 이보다 적은 용량에서 존재하는 자체 최대 허용량으로 이용된 조합은 log10 세포 살해가 단독으로 투여될 때 최고 구성물의 log10 세포 살해의 값보다 클 때 치료적 상승효과를 나타낸다. 예시적인 사례에서, 조합의 log10 세포 살해는 상기 조합의 최고 구성물의 log10 세포 살해의 값을 적어도 0.1 log 세포 살해, 적어도 0.5 log 세포 살해, 또는 적어도 1.0 log 세포 살해에 의해 초과한다. 다양한 양상과 구체예는 하기 하위섹션에서 더욱 상세하게 기술된다.
I. ErbB3 저해제
본원에서 더욱 상세하게 기술된 바와 같이, 본원에서 제시된 방법과 조성물은 하나 또는 그 이상의 ErbB3 저해제의 이용을 수반한다.
한 구체예에서, ErbB3 저해제는 항-ErbB3 항체, 예를 들면, 단일클론 항체이다. 유용한 항-ErbB3 항체 (또는 이들로부터 유래된 VH/VL 도메인)는 당분야에서 널리 공지된 방법을 이용하여 만들어질 수 있다. 대안으로, 당분야에서 인정된 항-ErbB3 항체가 이용될 수 있다. 가령, U.S. 7,846,440에서 기술된 Ab#3, Ab #14, Ab #17, Ab # 19가 이용될 수 있다. ErbB3에 결합에 대해 임의의 이들 항체와 경쟁하는 항체 역시 이용될 수 있다. 이용될 수 있는 당분야에서 인정된 추가의 항-ErbB3 항체에는 US 7,285,649; US20200310557; US20100255010에서 개시된 것들뿐만 아니라 항체 IB4C3과 2D1D12 (U3 Pharma Ag), 이들 둘 모두 예로써, US20040197332에서 기술되고 하이브리도마 세포주 DSM ACC 2527 또는 DSM ACC 2517 (DSMZ에 기탁됨)에 의해 생산된다; U.S. 특허 번호 7,705,130에서 기술된 AMG888 (U3-1287 - U3 Pharma Ag 및 Amgen)로 지칭되는 항-ErbB3 항체; 그리고 US 5,968,511에서 기술된 단일클론 항체 8B8 (ATCC® HB-12070™), 그리고 US 특허 공개 번호 20110256154에서 기술된 AV-203 (Aveo Pharmaceuticals)으로 지칭되는 항-ErbB3 항체가 포함된다. 다른 유용한 항-ErbB3 항체는 당분야에서 이중특이적 항체의 배경에서 개시된다 (예로써, WO/2009126920에서 B2B3-1 또는 B2B3-2, 그리고 US 7,846,440, US 20090291085, US 20100056761 및 US 20100266584에서 기술된 것들을 참조한다). 예시적인 항-ErbB3 단일클론 항체는 현재 II기 임상 시험이 진행 중인 완전 인간 항-ErbB3 항체, MM-121을 포함한다. MM-121은 PCT 공개 번호 WO 2008/100624 및 U.S. 특허 번호 7,846,440에서 더욱 기술되고, 그리고 각각, 서열 번호: 1과 2에서 제시된 바와 같은 VH와 VL 서열을 포함한다. MM-121은 US 7,846,440에서 "Ab #6"으로 지칭된다. 대안으로, 항-ErbB3 단일클론 항체는 ErbB3에 결합에 대해 MM-121와 경쟁하는 항체이다. 다른 구체예에서, 항-ErbB3 항체는 서열 번호: 3-5 (VH CDR1, 2, 3) 및 6-8 (VL CDR1, 2, 3)에서 각각 제시된 MM-121의 VH와 VL CDR 서열을 포함하는 항체이다. 다른 구체예에서, 항-ErbB3 항체는 각각, 서열 번호 42와 43에서 제시된 아미노산 서열을 포함하는 중쇄와 경쇄를 갖는다. 항-ErbB3 항체의 다른 실례에는 WO 2008/100624에서 더욱 기술되고, 그리고 서열 번호: 9와 10, 17과 18, 25와 26, 그리고 33과 34에서 각각 제시된 VH와 VL 서열을 갖는 Ab #3, Ab #14, Ab #17 및 Ab #19가 포함된다. 다른 구체예에서, 항-ErbB3 항체는 Ab # 3의 VH와 VL CDR 서열 (각각, 서열 번호: 11-13 및 14-18에서 제시됨)을 포함하는 항체 또는 Ab # 14의 VH와 VL CDR 서열 (각각, 서열 번호: 19-21 및 22-24에서 제시됨)을 포함하는 항체 또는 Ab # 17의 VH와 VL CDR 서열 (각각, 서열 번호: 27-29 및 30-32에서 제시됨)을 포함하는 항체 또는 Ab # 19의 VH와 VL CDR 서열 (각각, 서열 번호: 35-37 및 38-40에서 제시됨)을 포함하는 항체이다.
대안으로, 항-ErbB3 항체는 서열 번호:41의 잔기 92-104를 포함하는 인간 ErbB3의 에피토프에 결합하고, 그리고 ErbB3을 발현하는 암 세포의 증식의 저해로 특징되는 단일클론 항체 또는 이의 항원 결합 부분이다. 암 세포는 MALME-3M 세포, AdrR 세포, 또는 ACHN 세포일 수 있고, 그리고 증식은 대조에 비하여 적어도 10% 감소될 수 있다. 추가의 구체예에서, 이러한 단리된 단일클론 항체 또는 이의 항원 결합 부분은 서열 번호:41의 잔기 92-104 및 129를 포함하는 에피토프에 결합한다.
또 다른 구체예에서, 항-ErbB3 항체는 2개 또는 그 이상의 항-ErbB3 항체의 혼합물 또는 칵테일을 포함할 수 있고, 이들 각각은 ErbB3 상에서 상이한 에피토프에 결합한다. 한 구체예에서, 이러한 혼합물 또는 칵테일은 3개의 항-ErbB3 항체를 포함하고, 이들 각각은 ErbB3 상에서 상이한 에피토프에 결합한다.
다른 구체예에서, ErbB3 저해제는 ErbB3의 발현 또는 활성을 저해하는 핵산 분자, 예를 들면, RNA 분자를 포함한다. ErbB3의 RNA 길항제는 당분야에서 기술된다 (예로써, U.S. 특허 출원 공개 번호 20080318894를 참조한다). 게다가, ErbB3에 특이적인 간섭 RNA, 예를 들면, ErbB3의 발현 및/또는 활성을 특이적으로 저해하는 shRNA 또는 siRNA가 당분야에서 기술되었다.
또 다른 구체예에서, ErbB3 저해제는 ErbB3 경로를 통해 신호전달을 저해하는 ErbB3의 가용성 형태를 포함한다. 이런 가용성 ErbB3 분자는 당분야에서 기술되었다 (예로써, U.S. 특허 번호 7,390,632, U.S. 특허 번호 7,638,303 및 U.S. 특허 번호 7,638,302 (이들 각각은 Maihle et al.), 그리고 U.S. 특허 번호 7,919,098 (Zhou)을 참조한다).
II. 항-ErbB2 항체
본원에서 제시된 방법과 조성물은 ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린의 결합을 저해할 수 있는 하나 또는 그 이상의 항-ErbB2 항체의 이용을 수반할 수 있다. 적절한 항-ErbB2 항체에는 U.S. 특허 번호 5,977,322에서 기술된 C6.5 (및 이들의 다수의 유도체)뿐만 아니라 U.S. 특허 번호 6,054,297에서 기술된 트라스투주맙, 또는 U.S. 특허 번호 6,949,245에서 기술된 페르투주맙이 포함된다.
III. 이중특이적 항체
본원에서 제시된 방법과 조성물은 하나 또는 그 이상의 이중특이적 항체, 바람직하게는 ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린의 결합을 저해할 수 있는 이중특이적 항체의 이용을 수반할 수 있다. 이런 이중특이적 항체에는 US 특허 7,332,580에서 기술된 바와 같은 ALM뿐만 아니라 U.S. 특허 출원 공개 번호 20110059076, 그리고 PCT 공개 번호 WO2009/126920에서 기술된 바와 같은 A5-HSA-ML3.9, A5-HSA-B1D2, B12-HSA-B1D2, A5-HSA-F5B6H2, H3-HSA-F5B6H2, F4-HSA-F5B6H2, 그리고 H3-HSA-B1D2가 포함되고, 이들 각각은 거기에 기술된 바와 같이, mHSA를 포함하는 것들과 같은 변이체 형태를 갖는다. 한 구체예에서, 이중특이적 항체는 서열 번호:44를 포함한다.
IV. 방법
한 양상에서, 호르몬 무반응 유방암의 치료를 위한 약제의 제조에서 ErbB3 저해제의 용도가 제시되고, 일정한 구체예에서 유방암은 에스트로겐 수용체 양성 호르몬 무반응 유방암이다.
다른 양상에서, 호르몬 무반응 유방암 세포 (선택적으로, ER+ 호르몬 무반응 유방암 세포)의 성장을 억제하는 방법이 제시되고, 상기 방법은 세포를 효과량의 ErbB3 저해제와 접촉시키는 단계를 포함한다.
다른 양상에서, 환자에서 호르몬 무반응 유방암 종양 (선택적으로, ER+ 호르몬 무반응 유방암 종양)의 성장을 억제하는 방법이 제시되고, 상기 방법은 효과량의 ErbB3 저해제를 환자에 투여하는 단계를 포함한다.
또 다른 양상에서, 환자에서 유방암 종양 (선택적으로, 에스트로겐 수용체 양성 호르몬 무반응 유방암 종양)을 치료하는 방법이 제시되고, 상기 방법은 하기 단계를 포함한다:
호르몬 무반응 유방암 종양을 앓는 환자를 선별하는 단계; 그리고
효과량의 ErbB3 저해제를 환자에 투여하는 단계.
다른 양상에서, 호르몬 무반응 유방암 종양을 앓는 환자는 계류 중인 국제 출원 PCT/US2009/054051에서 개시된 선별 방법의 이용에 의해 더욱 선별된 환자이다.
ErbB3 저해제로 치료되는 호르몬 무반응 유방암은 ErbB1 (EGFR), ErbB3, 그리고 헤레굴린 (HRG)을 공동-발현할지도 모른다. EGFR과 HRG의 발현은 항-EGFR 항체, 항-ErbB3 항체 또는 항-HRG 항체를 이용하여, RT-PCR에 의해 또는 표준 면역검정 기술, 예를 들면, ELISA 검정, 포르말린-고정되고 파라핀-포매된 조직 (가령, 조직학적 평가를 위해 일과적으로 가공 처리된 유방암 조직)의 면역조직화학적 염색에 의해 확인될 수 있다. 본 발명에 따른 치료를 위한 선호되는 종양의 추가의 특징은 계류 중인 U.S. 특허 공개 번호 20110027291에서 제시되고, 이것은 PCT 출원 번호 PCT/US2009/054051에 우선권을 주장한다.
한 구체예에서, 환자에 투여된 ErbB3 저해제는 항-ErbB3 항체이다. 예시적인 항-ErbB3 항체는 각각, 서열 번호: 1과 2에 제시된 VH와 VL 서열을 포함하는 MM-121, 또는 각각, 서열 번호: 3-5에 제시된 VH CDR1, 2와 3 서열, 그리고 각각, 서열 번호: 6-8에 제시된 VL CDR1, 2와 3 서열 (즉, MM-121의 VH와 VL CDR)을 포함하는 항체이다. 추가의 무제한적 예시적인 항-ErbB3 항체 및 다른 형태의 ErbB3 저해제는 상기 하위섹션 I에서 상세하게 기술된다.
ErbB3 저해제는 환자에 저해제의 효과적인 전달에 적합한 임의의 루트에 의해 환자에 투여될 수 있다. 가령, 많은 작은 분자 저해제는 경구 투여에 적합하다. 항체 및 기타 생물학적 작용제는 전형적으로, 비경구, 예를 들면, 정맥내, 복막내, 피하 또는 근육내 투여된다. 본원에서 제시된 방법에서 이용하기 적합한 다양한 투여 루트, 용량 및 제약학적 제제는 하기에 더욱 상세하게 기술된다.
추가의 양상에서, 본원에서 기술된 방법에는 에스트로겐 수용체의 헤레굴린-매개된 활성화 인산화의 저해 (가령, 적어도 부분적인 차단) 방법이 포함된다. 이들 방법은 ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린의 결합을 저해하여 이런 인산화를 저해할 수 있는 하나 또는 그 이상의 항체의 이용을 수반한다. 일정한 구체예에서, 이런 방법은 에스트로겐 수용체 길항제 및 아로마타아제 저해제를 비롯한 호르몬 조절 약물의 선택적 공동-투여를 더욱 포함한다.
V. 제약학적 조성물
다른 양상에서, 본원에서 개시된 방법에 이용될 수 있는 제약학적 조성물, 다시 말하면, 호르몬 무반응 유방암 종양을 치료하기 위한 제약학적 조성물이 제시된다.
한 구체예에서, 호르몬 무반응 유방암을 치료하기 위한 제약학적 조성물은 ErbB3 저해제 및 제약학적 담체를 포함한다. ErbB3 저해제는 제약학적 담체를 이용하여 제약학적 조성물로 조제될 수 있다. 추가적으로, 제약학적 조성물은 예로써, 호르몬 무반응 유방암 종양에 대해 환자의 치료를 위한 조성물의 이용에 관한 사용설명서를 포함할 수 있다.
한 구체예에서, 조성물 내에 ErbB3 저해제는 ErbB3의 면역특이적 결합을 제공하기 위한 항-ErbB3 항체, 예를 들면, MM-121, 또는 MM-121 내에 존재할 때와 동일한 상대적인 순서로 항체 내에 배치된 MM-121의 VH와 VL CDR을 포함하는 항체이다. 추가의 무제한적 예시적인 항-ErbB3 항체 및 다른 형태의 ErbB3 저해제는 상기 하위섹션 I에서 상세하게 기술된다.
본원에서 이용된 바와 같이, "제약학적으로 허용되는 담체"은 임의의 모든 용매, 분산 매체, 코팅, 항균제와 항진균제, 등장성제와 흡수 지연제, 완충제, 그리고 생리학적으로 융화성인 기타 부형제를 포함한다. 바람직하게는, 담체는 비경구, 경구, 또는 국소 투여에 적합하다. 투여 루트에 따라, 활성 화합물, 예를 들면, 작은 분자 또는 생물학적 작용제는 화합물을 비활성화시킬지도 모르는 산 및 기타 자연 조건의 작용으로부터 화합물을 보호하기 위한 물질에서 코팅될 수 있다.
제약학적으로 허용되는 담체에는 무균 수성 용액 또는 분산액 및 무균 주사가능 용액 또는 분산액의 즉석 제조를 위한 무균 분말뿐만 아니라 정제, 알약, 캡슐 등의 제조를 위한 전통적인 부형제가 포함된다. 제약학적 활성 물질의 조제를 위한 이런 매체와 작용제의 이용은 당분야에서 알려져 있다. 임의의 전통적인 매체 또는 작용제가 활성 화합물과 양립할 수 없는 경우를 제외하고, 본원에서 제시된 제약학적 조성물에서 이의 이용이 예기된다. 보충 활성 화합물 역시 조성물 내로 함입될 수 있다.
제약학적으로 허용되는 담체는 제약학적으로 허용되는 항산화제를 포함할 수 있다. 제약학적으로 허용되는 항산화제의 실례에는 (1) 물 용해성 항산화제, 예를 들면, 아스코르브산, 시스테인 염산염, 황산수소나트륨, 메타중아황산나트륨, 아황산나트륨 등; (2) 오일-용해성 항산화제, 예를 들면, 아스코빌 팔미테이트, 부틸화된 히드록시아니솔 (BHA), 부틸화된 히드록시톨루엔 (BHT), 레시틴, 프로필 갈레이트, 알파-토코페롤 등; 그리고 (3) 금속 킬레이트화제, 예를 들면, 구연산, 에틸렌디아민 테트라아세트산 (EDTA), 소르비톨, 주석산, 인산 등이 포함된다.
본원에서 제시된 제약학적 조성물에서 이용될 수 있는 적절한 수성과 비수성 담체의 실례에는 물, 에탄올, 폴리올 (가령, 글리세롤, 프로필렌 글리콜, 폴리에틸렌 글리콜 등), 그리고 이들의 적절한 혼합물, 그리고 주사가능 유기 에스테르, 예를 들면, 에틸 올레산염이 포함된다. 필요한 경우에, 적절한 유동성은 예로써, 코팅 물질, 예를 들면, 레시틴의 이용에 의해, 분산액의 경우에 필요한 입자 크기의 유지에 의해, 그리고 계면활성제의 이용에 의해 유지될 수 있다. 많은 경우에, 등장성제, 예를 들면, 당, 다가알코올, 예를 들면, 만니톨, 소르비톨, 또는 염화나트륨을 조성물 내에 포함시키는 것이 바람직할 것이다. 주사가능 조성물의 지속성 흡수는 흡수를 지연시키는 작용제, 예를 들면, 모노스테아레이트 염 및 젤라틴을 조성물 내에 포함시킴으로써 달성될 수 있다.
이들 조성물은 또한, 기능성 부형제, 예를 들면, 보존제, 습윤제, 유화제 및 분산제를 내포할 수도 있다.
치료 조성물은 전형적으로, 무균이고, 비-발열성이고, 그리고 제조와 보관의 조건 하에 안정적이어야 한다. 조성물은 용액, 마이크로에멀젼, 리포좀, 또는 높은 약물 농도에 적합한 다른 정연한 구조로서 조제될 수 있다.
무균 주사가능 용액은 활성 화합물을 필요한 양으로, 앞서 열거된 성분 중에서 한 가지 또는 이들의 조합과 함께 적절한 용매 내에 함입하고, 필요에 따라, 그 이후에 멸균, 예를 들면, 미세여과함으로써 제조될 수 있다. 일반적으로, 분산액은 활성 화합물을, 기본 분산 매체 및 앞서 열거된 것들로부터 필요한 기타 성분을 내포하는 무균 운반체 내로 함입함으로써 제조된다. 무균 주사가능 용액의 제조를 위한 무균 분말의 경우에, 바람직한 제조 방법은 미리 멸균-여과된 용액으로부터 활성 성분 + 임의의 추가의 원하는 성분의 분말을 산출하는 진공 건조 및 동결-건조 (lyophilization)이다. 활성 작용제(들)는 무균 조건 하에, 추가의 제약학적으로 허용되는 담체(들), 그리고 필요할 지도 모르는 임의의 보존제, 완충제, 또는 추진제와 혼합될 수도 있다.
미생물의 존재의 예방은 멸균 절차 (상기 참조)에 의해, 그리고 다양한 항균제와 항진균제, 예를 들면, 파라벤, 클로로부탄올, 페놀 소르브산 등의 포함에 의해 담보될 수 있다. 또한, 등장성제, 예를 들면, 당, 염화나트륨 등을 조성물 내로 포함시키는 것이 바람직할 수 있다. 이에 더하여, 주사가능 제약학적 형태의 지속성 흡수는 흡수를 지연시키는 작용제, 예를 들면, 알루미늄 모노스테아레이트 및 젤라틴의 포함에 의해 달성될 수 있다.
ErbB3 저해제를 포함하는 제약학적 조성물은 단독으로 또는 복합 요법으로 투여될 수 있다. 가령, 복합 요법은 ErbB3 저해제 및 적어도 하나 또는 그 이상의 추가 치료제, 예를 들면, 당분야에서 공지되고 하기 하위섹션 IV에서 더욱 상세하게 논의된 하나 또는 그 이상의 화학치료제를 포함하는 본원에서 제시된 조성물을 포함할 수 있다. 제약학적 조성물은 또한, 방사선 요법 및/또는 수술과 함께 투여될 수 있다.
용량 섭생은 최적의 원하는 반응 (가령, 치료 반응)을 제공하기 위해 조정된다. 가령, 단일 일시주사가 투여되거나, 몇몇 분할된 분량이 시간의 흐름에서 투여되거나, 또는 분량이 치료 상황의 긴급성에 따라 비례하여 감소되거나 증가될 수 있다.
항체의 투여를 위한 예시적인 용량 범위에는 10-1000 mg (항체)/kg (환자의 체중), 10-800 mg/kg, 10-600 mg/kg, 10-400 mg/kg, 10-200 mg/kg, 30-1000 mg/kg, 30-800 mg/kg, 30-600 mg/kg, 30-400 mg/kg, 30-200 mg/kg, 50-1000 mg/kg, 50-800 mg/kg, 50-600 mg/kg, 50-400 mg/kg, 50-200 mg/kg, 100-1000 mg/kg, 100-900 mg/kg, 100-800 mg/kg, 100-700 mg/kg, 100-600 mg/kg, 100-500 mg/kg, 100-400 mg/kg, 100-300 mg/kg 및 100-200 mg/kg이 포함된다. 예시적인 투약 일정에는 3일마다 1회, 5일마다 1회, 7일마다 1회 (즉, 주 1회), 10일마다 1회, 14일마다 1회 (즉, 2주마다 1회), 21일마다 1회 (즉, 3주마다 1회), 28일마다 1회 (즉, 4주마다 1회) 및 월 1회가 포함된다.
투여의 용이성 및 용량의 균일성을 위하여, 비경구 조성물을 단위 용량 형태로 조제하는 것이 유리할 수 있다. 본원에서 이용된 바와 같은 단위 용량 형태는 치료되는 환자에 대한 단위 용량으로서 적합한 물리적으로 별개의 단위를 지칭한다; 각 단위는 임의의 필요한 제약학적 담체와 함께, 원하는 치료 효과를 산출하기 위해 계산된 미리 결정된 양의 활성 작용제를 내포한다. 단위 용량 형태에 대한 명세는 (a) 활성 화합물의 독특한 특징 및 달성되는 특정 치료 효과, 그리고 (b) 개체에서 민감성의 치료를 위한 이런 활성 화합물을 배합하는 분야에서 내재된 한계에 의해 지시되고 이들에 직접적으로 의존한다.
본원에서 개시된 제약학적 조성물 내에서 활성 성분의 실제 용량 수준은 환자에 대한 독성 없이, 특정 환자, 조성물, 그리고 투여 방식에 대한 원하는 치료 반응을 달성하는데 효과적인 활성 성분의 양을 획득하기 위해 변할 수 있다. 본원에서 이용된 바와 같이, 투여의 배경에서 "비경구"는 경장과 국소 투여 이외의 투여 양식, 통상적으로 주사에 의한 투여 양식을 의미하고, 그리고 여기에는 제한 없이, 정맥내, 근육내, 동맥내, 척추강내, 관절낭내, 안와내, 심장내, 피내, 복막내, 경기관, 피하, 표피하, 관절내, 피막하, 지주막하, 척수내, 경막외 및 흉골내 주사와 주입이 포함된다.
본원에서 이용된 바와 같이, 구 "비경구 투여" 및 "비경구 투여된"은 경장 (즉, 소화관을 거쳐)과 국소 투여 이외의 투여 양식, 통상적으로 주사 또는 주입에 의한 투여 양식을 지칭하고, 그리고 여기에는 제한 없이, 정맥내, 근육내, 동맥내, 척추강내, 관절낭내, 안와내, 심장내, 피내, 복막내, 경기관, 피하, 표피하, 관절내, 피막하, 지주막하, 척수내, 경막외 및 흉골내 주사와 주입이 포함된다. 정맥내 주사와 주입이 종종 (하지만 배타적이지 않음), 항체 투여에 이용된다.
본원에서 제시된 작용제가 약제로서 인간 또는 동물에 투여될 때, 이들은 단독으로, 또는 제약학적으로 허용되는 담체와 공동으로 예로써, 0.001 내지 90% (더욱 바람직하게는, 0.005 내지 70%, 예를 들면, 0.01 내지 30%)의 활성 성분을 내포하는 제약학적 조성물로서 제공될 수 있다.
VI. 복합 요법
일정한 구체예에서, 호르몬 무반응 유방암 세포의 성장을 억제하기 위한, 또는 호르몬 무반응 유방 종양을 앓는 환자를 치료하기 위한 본원에서 제시된 방법과 용도는 ErbB3 저해제 및 ErbB3 저해제가 아닌 적어도 하나의 추가의 항암제의 투여를 포함할 수 있다.
한 구체예에서, 적어도 하나의 추가의 항암제는 적어도 하나의 화학치료 약물을 포함한다. 이런 화학치료 약물의 무제한적 실례에는 백금-기초된 화학요법 약물 (가령, 시스플라틴, 카르보플라틴), 탁산 (가령, 파클리탁셀 (Taxol®), 도세탁셀 (Taxotere®), EndoTAG-1™ (양으로 하전된 지질-기초된 복합체 내에 캡슐화된 파클리탁셀의 제제; MediGene®), Abraxane® (알부민에 결합된 파클리탁셀의 제제), 티로신 키나아제 저해제 (가령, 이마티닙/Gleevec®, 수니티닙/Sutent®, 다사티닙/Sprycel®), 그리고 이들의 조합이 포함된다.
다른 구체예에서, 적어도 하나의 추가의 항암제는 EGFR 저해제, 예를 들면, 항-EGFR 항체 또는 EGFR 신호전달의 작은 분자 저해제를 포함한다. 예시적인 항-EGFR 항체는 세툭시맙 (Erbitux®, ImClone Systems)이다. 항-EGFR 항체의 다른 실례에는 MM-151 (2011년 7월 5일자 제출된, Bukhalid et al., 공동 계류 중이고 일반 양도된 U.S. 특허 출원 일련 번호 61/504,633에서 더욱 기술됨), Sym004 (Symphogen, Pederson et al., Cancer Research January 15, 2010 70; 588, 또한 U.S. 특허 일련 번호 7,887,805를 참조한다), 마투주맙 (EMD72000), 파니투무맙 (Vectibix®; Amgen); 니모투주맙 (TheraCIM™) 및 mAb 806이 포함된다. EGFR 신호전달 경로의 예시적인 작은 분자 저해제는 제피티닙 (Iressa®)인데, 이것은 AstraZeneca 및 Teva로부터 상업적으로 구입가능하다. EGFR 신호전달의 작은 분자 저해제의 다른 실례에는 에를로티닙 HCL (OSI-774; Tarceva®; OSI Pharma), 라파티닙 (Tykerb®, GlaxoSmithKline), 카널티닙 (카널티닙 중염산염, Pfizer), 펠리티닙 (Pfizer); PKI-166 (Novartis); PD158780; 아파티닙 (Tomtovok®, Boehringer Ingleheim); 그리고 AG 1478 (4-(3-클로로아닐리노)-6,7-디메톡시퀴나졸린)이 포함된다.
또 다른 구체예에서, 적어도 하나의 추가의 항암제는 VEGF 저해제를 포함한다. 예시적인 VEGF 저해제는 항-VEGF 항체, 예를 들면, 베바시주맙 (Avastatin®; Genentech)을 포함한다.
다른 구체예에서, 적어도 하나의 추가의 항암제는 IGF1R 저해제, 예를 들면, 항-EGFR 항체 또는 EGFR 신호전달의 작은 분자 저해제를 포함한다. 항-IGF1R 저해제의 실례에는 달로투주맙 (Merck, 일명 MK-0646), AMG-479 (Amgen), R1507 (Roche), 피지투무맙 (Pfizer), IMC-A12 (Imclone/Lilly), 그리고 MM-141, 이중특이적 ErbB3/IGF1R 저해제 (2011년 10월 11일자 제출된, Lugovskoy et al., 공동 계류 중이고 일반 양도된 U.S. 특허 출원 일련 번호 61/558,192에서 더욱 기술됨)가 포함된다. 작은 분자 IGF1R 저해제의 실례에는 XL228 (Exelixis) 및 BMS-754807 (BMS)이 포함된다.
실시예
실시예 1:
ER+, 호르몬 무반응 유방 종양의 MM-121 치료
ER+ 호르몬 무반응 유방 종양-보유 생쥐의 MM-121 치료의 항-종양 효능과 내약성의 분석은 MCF7 인간 유방 암종 세포의 타목시펜-내성 변이체의 이종이식편을 이용하여 수행된다. 타목시펜-내성 인간 유방 암종 세포주 TAMR-1, TAMR-7, 그리고 TAMR-8 세포는 A. E. Lykkesfeldt의 실험실 (Department of Tumor Endocrinology, Division for Cancer Biology, Danish Cancer Society. Strandboulevarden 49, DK-2100 Copenhagen 0, Denmark)로부터 획득된다. 이들은 Charles River Laboratories International로부터 구입된 암컷 무흉선 nu+/nu+ 누드 생쥐에서 이종이식편으로서 성장된다. Arizona Cancer Center breeding colony, Tucson, AZ로부터 구입된 SCID 생쥐 (C.B.-17/IcrACCscid) 역시 적합하다. 이들 생쥐는 실내온도-제어된 공간 내에 설치된 Tecniplast® 개별적으로 환기된 폴리카보네이트 (Makrolon®) 우리 (IVC)에서 수용되고 사료와 산성화된 물에 자유롭게 접근한다. 생쥐는 전신 마취 하에 ~ (약) 107 TAMR-1, TAMR-7, 또는 TAMR-8 세포가 옆구리에서 피하로 또는 유방 지방체 내로 주입된다.
단일요법에서 항-종양 효능을 조사하기 위하여, MM-121 또는 운반체 대조 (100μL)가 3일마다 IP 주사에 의해, 생쥐당 600μg (PBS에서 6 mg/mL 용액으로서 MM-121)으로 종양-보유 생쥐 (즉, 세포의 주입 이후에 14일의 종양 성장 후)에 제공된다. 대조 생쥐는 PBS 운반체만 제공된다. 효능은 항체-치료된 생쥐와 운반체 대조 생쥐 사이에 종양 성장을 비교함으로써 결정되고, 그리고 중간 상대적 종양 체적의 실험 대 대조 비율 (T/C 값)로서 표시된다. 50% 미만의 최소 T/C 값은 치료를 효과적으로 등급매기기 위한 필수조건이다. 대조와 실험 군은 각각, 각각 1개의 종양을 보유하는 10마리 생쥐를 내포한다. 무작위화를 위한 유사한 크기의 종양을 보유하는 30마리 생쥐를 획득하기 위하여, 종양당 40마리 생쥐가 한쪽에만 국한적으로 이식된다.
생쥐는 무작위화되고, 그리고 요법은 충분한 숫자의 개별 종양이 대략 200 mm3의 체적까지 성장할 때 시작된다. 종양은 디지털 캘리퍼스 측정 (digital caliper measurement)에 의해 측정되고 (L x W), 그리고 종양 체적은 공식 π/6 (W2 x L)을 이용하여 계산된다. 일차 분량은 0일 (무작위화 당일)에 또는 하루 후에 투여된다.
최종 분량의 투여 후 대략 24시간 시점에, 모든 생쥐는 혈청을 준비하기 위해 방혈된다; 이에 더하여, 종양이 순간 냉동 및 파라핀 포매 (FFPE)를 위해 동일한 생쥐로부터 수집된다 (각각 1/2 종양).
동물 실험을 위한 규정에 따라서, 생쥐는 종양 체적이 1800 mm3 (생쥐당 1개의 종양)을 초과하면 희생된다. 생쥐는 그들의 종양이 상기 크기까지 성장하지만 60일보다 길지 않을 때까지 모니터링되고 투약된다. 그 후, 이들은 시료 수집을 위해 희생된다.
연구의 종결 시점에서, 최종 분량의 투여 후 대략 24시간 시점에, 연구 중인 모든 생쥐는 혈청의 준비를 위한 혈액의 최대량을 획득하기 위해 설하 방혈된다. 혈청은 각각 대략 250 μL씩 2개 튜브에 등분된다.
이에 더하여, 모든 생쥐로부터 종양은 액체 질소에서 순간 냉동 (1/2 종양, 시료의 보관을 위한 COVARIS 가방이 제공된다)을 위해, 그리고 10% 완충된 포르말린에서 <24시간 동안 고정, 차후 탈수 및 파라핀 포매 (1/2 종양)를 위해 지체 없이 절제된다.
동물 체중과 종양 직경 (W과 L)은 주 2회 측정되고, 그리고 종양 체적은 공식 π/6 (W2xL)을 이용하여 계산된다. 종양 성장 곡선은 플롯팅된다. 2와 4 배증 시간 동안 종양 저해 및 절대 성장 지연이 계산된다.
실질적으로 기술된 바와 같이 수행된 실험의 결과는 MM-121 치료가 종양 성장을 저해하거나 중지시키고, 그리고 일부 경우에, 종양 크기를 감소시킨다는 것을 증명할 것이다.
실시예 2:
시험관내에서
HRG
-유도된
ER
인산화의
MM
-121 저해
MCF7 세포는 처리되지 않거나, 또는 MM-121 (250nM)로 1시간 동안 전처리된다. 세포는 이후, 헤레굴린 베타1 (EGF 도메인, 10nM R&D systems), 베타세룰린 (20nM, R&D systems) 또는 에스트로겐 (베타 에스트라디올-100nM, Sigma)로 30분 동안 자극되거나, 또는 자극 없이 방치된다. 이들 세포의 용해물은 pER 및 pErbB3에 대해 탐침된 웨스턴블롯에 의해 분석된다.
에스트로겐 수용체의 헤레굴린-유도된 활성화를 감소시키는 MM-121의 능력을 증명하기 위하여, 치료는 앞서 기술된 방법 또는 이들의 소소한 변형을 이용하여 ER+, PR+, ErbB2+ 암 세포주 MCF7에서 조사되었다. 세포는 처리되지 않거나, 또는 MM-121로 전처리되었다. 처리되지 않은 세포 및 전처리된 세포는 헤레굴린, 베타세룰린, 또는 에스트로겐으로 자극되었다. 세포 용해물은 ErbB3과 에스트로겐 수용체의 인산화된 형태에 대해 웨스턴블롯에 의해 분석되었다.
도 1 (웨스턴블롯) 및 도 2 (도 1에서 데이터의 밀도계측)에서 도시된 바와 같이, 처리되지 않은 헤레굴린-자극된 세포, 그리고 정도가 덜하긴 하지만 (약 2/3 덜함), 처리되지 않은 베타세룰린-자극된 세포는 에스트로겐 수용체와 ErbB3 둘 모두의 인산화를 나타냈다. 대조적으로, MM-121로 전처리된 헤레굴린-자극된 세포는 pErbB3과 pER의 양에서 실질적인 (약 2/3) 감소를 보였다. 이들 결과는 에스트로겐 수용체의 헤레굴린-유도된 활성화가 ErbB3에 의해 매개되고, 그리고 MM-121가 에스트로겐 수용체 활성화의 이러한 양식을 저해할 수 있다는 것을 증명한다. 놀랍게도, 헤레굴린 자극은 에스트로겐이 그러한 것보다 극적으로 (적어도 4-배) 높은 수준의 ER 인산화를 유도하였다.
실시예 3: MM-121과의 공동-투여에 의한 민감성 복원 및/또는 아로마타아제 저해제에 대한 내성 예방
아로마타아제 저해제 (AI) 치료는 환자에 의해 충분히 관용되고, 그리고 상기 요법은 상대적으로 장기간 동안 효과적이다. 하지만, AI 치료에 초기에 반응하는 환자는 상기 약물에 내성화될 수 있다. AI 내성의 기전을 조사하기 위하여, ER + 폐경후 유방암에 상응하는 이종이식편 모델이 개발되었다. 이러한 종양내 아로마타아제 이종이식편 모델에 대한 종양은 난소절제된 무흉선 생쥐에서 에스트로겐 생산의 비-난소 공급원을 제공하기 위해 인간 태반 아로마타아제 유전자로 안정적으로 형질감염된 MCF7 인간 유방 선암종 세포로부터 성장된다 (MCF-7CA, 예로써 Brodie et al., Clinical Cancer Research 884s Vol. 11, 884s - 888s, January 15, 2005 (Suppl.)를 참조한다). 충분한 에스트로겐이 MCF7-CA 세포에 의해 생산되어 (주입된 안드로스테네디온의 방향족화로부터) 그들의 증식 및 종양 형성이 자극된다. 이것은 아로마타아제를 발현하고 성선자극호르몬 피드백 조절 (gonadotropin feedback regulation)이 없는 종양을 앓는 폐경후 유방암 환자의 모델이다.
MCF-7CA 종양: MCF-7CA 세포는 5% 소 태아 혈청 및 네오마이신을 내포하는 Eagle의 최소 필수 배지에서 배양되었다. 배양 배지는 주2회 교체되었다. 합류이하 MCF-7CA 세포는 Hank의 용액 내로 긁어 모아지고 4℃에서 2분 동안 1,000 rpm에서 원심분리되었다. 이들 세포는 이후, Matrigel™ (10mg/ml)에서 재현탁되어 2-5 x 107 세포/ml의 세포 현탁액이 만들어졌다. 4-6주령의 난소절제된 암컷 BALB/c 무흉선 생쥐 (20-22g 체중)는 발열원-없는 환경에서 빛과 습도의 통제된 조건 하에 수용되고 사료와 물이 무제한으로 공급되었다. 각 생쥐는 0.1 ml의 세포 현탁액이 피하 (s.c.) 접종되었다. 동물은 이후, 0.1 mg 안드로스테네디온/생쥐가 매일 s.c. 주입되었다. 성장 속도는 종양을 캘리퍼스로 매주 측정함으로써 결정되었다. 종양 체적은 구체에 대한 공식 (4/3 r12. r 2)에 따라 계산되었다. 종양이 측정가능 크기에 도달할 때, 생쥐는 동등한 종양 체적 (300mm3)을 갖는 10마리 동물의 군으로 분할되었다. 생쥐는 0.3% 히드록시프로필셀룰로오스 (HPC)에서 0.1 ml 화합물로 6주 동안 치료되었다.
레트로졸 내성 모델에서 레트로졸 대 레트로졸 + MM121
레트로졸-내성 이종이식편 모델에서 레트로졸과 공동으로 MM-121의 효능을 증명하기 위해, 종양 보유 생쥐는 앞서 기술된 바와 같이 준비되고 각각 10마리 생쥐의 3개 군 및 30마리 생쥐의 1개 군으로 무작위화되었는데, 이들 각각은 종양의 유사한 크기 분포를 갖는 생쥐를 내포하였다. 내성의 발생이 예상되는 기간 동안 최초 치료를 위하여, 1개 군은 대조로서 PBS로, Q3D, i.p. 치료되고; 1개 군은 MM-121 단독 (.2ml PBS에서 600μg MM121/생쥐, 3일마다 i.p.)으로 치료되고; 30마리-생쥐 군은 레트로졸 단독 (10μg/생쥐/일)으로 치료되고; 그리고 마지막 군은 레트로졸과 MM-121 둘 모두로 치료되었다. 종양은 매주 측정되고, 그리고 종양 체적이 계산되었다. 생쥐는 종양이 약 1400-1700 mm3 이상의 체적까지 지속적으로 성장하면, 희생되었다. 레트로졸 단독으로 치료된 생쥐의 군에서 종양이 내성화되고 체적에서 약 600 mm3을 초과할 때, 상기 군은 각각 10마리 생쥐의 3개 군으로 세분되었다. 이들 내성 종양에 대한 MM-121 복합 요법의 효과를 조사하기 위하여, 이들 3개 군의 치료는 하기와 같이 지속되었다: 1개 군은 레트로졸 단독 (10μg/생쥐/일)이 지속적으로 제공되고, 1개 군은 레트로졸의 일일 제공이 중단되고 MM-121 (600 μg Q3D, i.p.) 단독으로 치료되고, 그리고 1개 군은 레트로졸 (10μg/생쥐/일) 및 MM-121(600μg Q3D, i.p.)의 조합으로 치료되었다.
결과는 도 3에 도시된다. 거기에 지시된 바와 같이, MM-121-치료된 (삼각형) 생쥐 및 PBS 단독 대조 (사각형) 생쥐에서 종양은 5주의 경과에서 급속하게 성장하였는데, 이것은 이들 군에 대한 최종 측정이었다. 종양 성장은 레트로졸 치료만을 받은 3개 군 (뒤집힌 화살표) 및 MM-121과 레트로졸로 복합 치료를 받은 군 (다이아몬드)에서 더욱 느리게 진행되었다.
레트로졸 치료를 받은 생쥐의 군에서 레트로졸 내성은 종양 체적이 600mm3까지 증가하는 지점으로 정의되었다. 이러한 종양 체적은 레트로졸 단독이 제공된 군에서, 약 14주의 매일 레트로졸 치료 후 도달되었다. 레트로졸 단독 또는 MM-121 단독이 제공된 생쥐에서 종양은 시간의 흐름에서 체적이 지속적으로 증가하는 반면, MM-121와 레트로졸의 조합이 제공된 생쥐의 종양은 600mm3 내성 역치 미만으로 감소하고 연구의 나머지 기간 (19주) 내내 감소된 체적을 유지하였고, 따라서 이러한 복합 치료가 획득된 레트로졸 내성을 극복한다는 것을 증명하였다.
레트로졸 단독이 제공된 생쥐와 대조적으로, 치료의 시작부터 레트로졸과 MM-121 둘 모두가 제공된 군 (다이아몬드 형상)은 레트로졸 내성 종양이 발생하지 않았고 (즉, 종양이 600mm3의 체적에 결코 도달하지 않았다), 따라서 이러한 조합으로 치료가 레트로졸 내성의 발생을 예방한다는 것을 증명하였다.
실시예 4: mTOR 저해제 및 아로마타아제 저해제와 함께 MM-121의 공동-투여
MM-121 + 엑세메스탄 + 에베롤리무스의 삼중 조합이 ER+ 유방암의 치료에서 엑세메스탄 단독, 또는 에베롤리무스와 엑세메스탄의 조합보다 효과적인지를 증명하기 위하여, 환자는 MM-121 단독, 엑세메스탄 단독, 에베롤리무스 단독, 에베롤리무스와 엑세메스탄의 조합, 그리고 MM-121, 에베롤리무스, 그리고 엑세메스탄의 조합이 투약될 것이다. MM-121은 예로써, 1주차에 40mg/kg 부하 분량으로 투약되고, 그 이후에 20 mg/kg 매주 유지 분량이 주1회 정맥내 주입으로서 60분에 걸쳐 투여될 것이다; 엑세메스탄은 하루 1회 경구 투여된 25 mg으로 투약될 것이다; 에베롤리무스는 하루 1회 경구 투여된 10 mg으로 투약될 것이다. 환자는 그들의 질환의 방사선학적 또는 임상적 진행이 상세히 기록될 때까지 치료될 것이다. 이들 결과는 MM-121 + 엑세메스탄 + 에베롤리무스의 삼중 조합이 ER+ 유방암 환자의 치료에서 엑세메스탄 단독, 또는 에베롤리무스와 엑세메스탄의 조합보다 효과적이라는 것을 증명할 것이다.
등가물
당업자는 단지 일과적인 실험을 이용하여, 본원에서 기술된 특정한 구체예의 많은 등가물을 인지하거나, 또는 확인할 수 있을 것이다. 이런 등가물은 하기 청구항에 의해 포함되는 것으로 의도된다. 종속항에서 개시된 구체예의 임의의 조합은 본 발명의 범위 내에 있는 것으로 예기된다.
참고문헌으로서 편입
본원에서 인용된 각각의 모든 허여된 특허, 특허 출원 및 간행물은 본원에 전체로서 참고문헌으로 편입된다.
SEQUENCE LISTING
<110> MERRIMACK PHARMACEUTICALS, INC.
<120> USE OF INHIBITORS OF EGFR-FAMILY RECEPTORS IN THE
TREATMENT OF
HORMONE REFRACTORY BREAST CANCERS
<130> MMJ-027PC
<140> PCT/US2012/028792
<141> 2012-03-12
<150> 61/604,281
<151> 2012-02-28
<150> 61/451,848
<151> 2011-03-11
<160> 44
<170> PatentIn version 3.5
<210> 1
<211> 119
<212> PRT
<213> Homo sapiens
<400> 1
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
Val Met Ala Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Gly Gly Trp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Leu Lys Met Ala Thr Ile Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 2
<211> 111
<212> PRT
<213> Homo sapiens
<400> 2
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Ser Tyr
20 25 30
Asn Val Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Ile Ile Tyr Glu Val Ser Gln Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Thr Glu Asp Glu Ala Asp Tyr Tyr Cys Cys Ser Tyr Ala Gly Ser
85 90 95
Ser Ile Phe Val Ile Phe Gly Gly Gly Thr Lys Val Thr Val Leu
100 105 110
<210> 3
<211> 5
<212> PRT
<213> Homo sapiens
<400> 3
His Tyr Val Met Ala
1 5
<210> 4
<211> 17
<212> PRT
<213> Homo sapiens
<400> 4
Ser Ile Ser Ser Ser Gly Gly Trp Thr Leu Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 5
<211> 10
<212> PRT
<213> Homo sapiens
<400> 5
Gly Leu Lys Met Ala Thr Ile Phe Asp Tyr
1 5 10
<210> 6
<211> 14
<212> PRT
<213> Homo sapiens
<400> 6
Thr Gly Thr Ser Ser Asp Val Gly Ser Tyr Asn Val Val Ser
1 5 10
<210> 7
<211> 7
<212> PRT
<213> Homo sapiens
<400> 7
Glu Val Ser Gln Arg Pro Ser
1 5
<210> 8
<211> 11
<212> PRT
<213> Homo sapiens
<400> 8
Cys Ser Tyr Ala Gly Ser Ser Ile Phe Val Ile
1 5 10
<210> 9
<211> 118
<212> PRT
<213> Homo sapiens
<400> 9
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ala Tyr
20 25 30
Asn Met Arg Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Tyr Pro Ser Gly Gly Ala Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Tyr Tyr Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 10
<211> 110
<212> PRT
<213> Homo sapiens
<400> 10
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Asp Ser Asn Ile Gly Arg Asn
20 25 30
Tyr Ile Tyr Trp Tyr Gln Gln Phe Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Arg Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Ile Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Arg
65 70 75 80
Ser Glu Asp Glu Ala Glu Tyr His Cys Gly Thr Trp Asp Asp Ser Leu
85 90 95
Ser Gly Pro Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 11
<211> 5
<212> PRT
<213> Homo sapiens
<400> 11
Ala Tyr Asn Met Arg
1 5
<210> 12
<211> 17
<212> PRT
<213> Homo sapiens
<400> 12
Val Ile Tyr Pro Ser Gly Gly Ala Thr Arg Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 13
<211> 9
<212> PRT
<213> Homo sapiens
<400> 13
Gly Tyr Tyr Tyr Tyr Gly Met Asp Val
1 5
<210> 14
<211> 13
<212> PRT
<213> Homo sapiens
<400> 14
Ser Gly Ser Asp Ser Asn Ile Gly Arg Asn Tyr Ile Tyr
1 5 10
<210> 15
<211> 7
<212> PRT
<213> Homo sapiens
<400> 15
Arg Asn Asn Gln Arg Pro Ser
1 5
<210> 16
<211> 11
<212> PRT
<213> Homo sapiens
<400> 16
Gly Thr Trp Asp Asp Ser Leu Ser Gly Pro Val
1 5 10
<210> 17
<211> 122
<212> PRT
<213> Homo sapiens
<400> 17
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ala Tyr
20 25 30
Gly Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Pro Ser Gly Gly His Thr Lys Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Leu Glu Thr Gly Leu Leu Val Asp Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 18
<211> 106
<212> PRT
<213> Homo sapiens
<400> 18
Gln Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Tyr Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Gln Leu Gly Ser Lys Phe Val
20 25 30
Ser Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro Val Leu Val Met Tyr
35 40 45
Lys Asp Lys Arg Arg Pro Ser Glu Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Ile
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ala Trp Asp Ser Ser Thr Tyr Val
85 90 95
Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105
<210> 19
<211> 5
<212> PRT
<213> Homo sapiens
<400> 19
Ala Tyr Gly Met Gly
1 5
<210> 20
<211> 17
<212> PRT
<213> Homo sapiens
<400> 20
Tyr Ile Ser Pro Ser Gly Gly His Thr Lys Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 21
<211> 13
<212> PRT
<213> Homo sapiens
<400> 21
Val Leu Glu Thr Gly Leu Leu Val Asp Ala Phe Asp Ile
1 5 10
<210> 22
<211> 11
<212> PRT
<213> Homo sapiens
<400> 22
Ser Gly Asp Gln Leu Gly Ser Lys Phe Val Ser
1 5 10
<210> 23
<211> 8
<212> PRT
<213> Homo sapiens
<400> 23
Tyr Lys Asp Lys Arg Arg Pro Ser
1 5
<210> 24
<211> 9
<212> PRT
<213> Homo sapiens
<400> 24
Gln Ala Trp Asp Ser Ser Thr Tyr Val
1 5
<210> 25
<211> 118
<212> PRT
<213> Homo sapiens
<400> 25
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Trp Tyr
20 25 30
Gly Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Pro Ser Gly Gly Ile Thr Val Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Asn Tyr Tyr Tyr Gly Leu Asp Val Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 26
<211> 108
<212> PRT
<213> Homo sapiens
<400> 26
Gln Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val
1 5 10 15
Gly Asp Arg Ile Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Gly Asp
20 25 30
Ser Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Pro Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Phe Arg Ser Leu Gln
65 70 75 80
Pro Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Ser Ala Asn Ala Pro
85 90 95
Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 27
<211> 5
<212> PRT
<213> Homo sapiens
<400> 27
Trp Tyr Gly Met Gly
1 5
<210> 28
<211> 17
<212> PRT
<213> Homo sapiens
<400> 28
Tyr Ile Ser Pro Ser Gly Gly Ile Thr Val Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 29
<211> 9
<212> PRT
<213> Homo sapiens
<400> 29
Leu Asn Tyr Tyr Tyr Gly Leu Asp Val
1 5
<210> 30
<211> 11
<212> PRT
<213> Homo sapiens
<400> 30
Gln Ala Ser Gln Asp Ile Gly Asp Ser Leu Asn
1 5 10
<210> 31
<211> 7
<212> PRT
<213> Homo sapiens
<400> 31
Asp Ala Ser Asn Leu Glu Thr
1 5
<210> 32
<211> 9
<212> PRT
<213> Homo sapiens
<400> 32
Gln Gln Ser Ala Asn Ala Pro Phe Thr
1 5
<210> 33
<211> 119
<212> PRT
<213> Homo sapiens
<400> 33
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Gly Met Trp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Gly Ser Ser Gly Gly Pro Thr Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Gly Gly Arg Gly Thr Pro Tyr Tyr Phe Asp Ser Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 34
<211> 110
<212> PRT
<213> Homo sapiens
<400> 34
Gln Tyr Glu Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Ile Gly Arg Trp
20 25 30
Asn Ile Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Asp Val Ser Asn Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Thr Ser Ser
85 90 95
Ser Thr Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 35
<211> 5
<212> PRT
<213> Homo sapiens
<400> 35
Arg Tyr Gly Met Trp
1 5
<210> 36
<211> 17
<212> PRT
<213> Homo sapiens
<400> 36
Tyr Ile Gly Ser Ser Gly Gly Pro Thr Tyr Tyr Val Asp Ser Val Lys
1 5 10 15
Gly
<210> 37
<211> 10
<212> PRT
<213> Homo sapiens
<400> 37
Gly Arg Gly Thr Pro Tyr Tyr Phe Asp Ser
1 5 10
<210> 38
<211> 14
<212> PRT
<213> Homo sapiens
<400> 38
Thr Gly Thr Ser Ser Asp Ile Gly Arg Trp Asn Ile Val Ser
1 5 10
<210> 39
<211> 7
<212> PRT
<213> Homo sapiens
<400> 39
Asp Val Ser Asn Arg Pro Ser
1 5
<210> 40
<211> 10
<212> PRT
<213> Homo sapiens
<400> 40
Ser Ser Tyr Thr Ser Ser Ser Thr Trp Val
1 5 10
<210> 41
<211> 1323
<212> PRT
<213> Homo sapiens
<400> 41
Ser Glu Val Gly Asn Ser Gln Ala Val Cys Pro Gly Thr Leu Asn Gly
1 5 10 15
Leu Ser Val Thr Gly Asp Ala Glu Asn Gln Tyr Gln Thr Leu Tyr Lys
20 25 30
Leu Tyr Glu Arg Cys Glu Val Val Met Gly Asn Leu Glu Ile Val Leu
35 40 45
Thr Gly His Asn Ala Asp Leu Ser Phe Leu Gln Trp Ile Arg Glu Val
50 55 60
Thr Gly Tyr Val Leu Val Ala Met Asn Glu Phe Ser Thr Leu Pro Leu
65 70 75 80
Pro Asn Leu Arg Val Val Arg Gly Thr Gln Val Tyr Asp Gly Lys Phe
85 90 95
Ala Ile Phe Val Met Leu Asn Tyr Asn Thr Asn Ser Ser His Ala Leu
100 105 110
Arg Gln Leu Arg Leu Thr Gln Leu Thr Glu Ile Leu Ser Gly Gly Val
115 120 125
Tyr Ile Glu Lys Asn Asp Lys Leu Cys His Met Asp Thr Ile Asp Trp
130 135 140
Arg Asp Ile Val Arg Asp Arg Asp Ala Glu Ile Val Val Lys Asp Asn
145 150 155 160
Gly Arg Ser Cys Pro Pro Cys His Glu Val Cys Lys Gly Arg Cys Trp
165 170 175
Gly Pro Gly Ser Glu Asp Cys Gln Thr Leu Thr Lys Thr Ile Cys Ala
180 185 190
Pro Gln Cys Asn Gly His Cys Phe Gly Pro Asn Pro Asn Gln Cys Cys
195 200 205
His Asp Glu Cys Ala Gly Gly Cys Ser Gly Pro Gln Asp Thr Asp Cys
210 215 220
Phe Ala Cys Arg His Phe Asn Asp Ser Gly Ala Cys Val Pro Arg Cys
225 230 235 240
Pro Gln Pro Leu Val Tyr Asn Lys Leu Thr Phe Gln Leu Glu Pro Asn
245 250 255
Pro His Thr Lys Tyr Gln Tyr Gly Gly Val Cys Val Ala Ser Cys Pro
260 265 270
His Asn Phe Val Val Asp Gln Thr Ser Cys Val Arg Ala Cys Pro Pro
275 280 285
Asp Lys Met Glu Val Asp Lys Asn Gly Leu Lys Met Cys Glu Pro Cys
290 295 300
Gly Gly Leu Cys Pro Lys Ala Cys Glu Gly Thr Gly Ser Gly Ser Arg
305 310 315 320
Phe Gln Thr Val Asp Ser Ser Asn Ile Asp Gly Phe Val Asn Cys Thr
325 330 335
Lys Ile Leu Gly Asn Leu Asp Phe Leu Ile Thr Gly Leu Asn Gly Asp
340 345 350
Pro Trp His Lys Ile Pro Ala Leu Asp Pro Glu Lys Leu Asn Val Phe
355 360 365
Arg Thr Val Arg Glu Ile Thr Gly Tyr Leu Asn Ile Gln Ser Trp Pro
370 375 380
Pro His Met His Asn Phe Ser Val Phe Ser Asn Leu Thr Thr Ile Gly
385 390 395 400
Gly Arg Ser Leu Tyr Asn Arg Gly Phe Ser Leu Leu Ile Met Lys Asn
405 410 415
Leu Asn Val Thr Ser Leu Gly Phe Arg Ser Leu Lys Glu Ile Ser Ala
420 425 430
Gly Arg Ile Tyr Ile Ser Ala Asn Arg Gln Leu Cys Tyr His His Ser
435 440 445
Leu Asn Trp Thr Lys Val Leu Arg Gly Pro Thr Glu Glu Arg Leu Asp
450 455 460
Ile Lys His Asn Arg Pro Arg Arg Asp Cys Val Ala Glu Gly Lys Val
465 470 475 480
Cys Asp Pro Leu Cys Ser Ser Gly Gly Cys Trp Gly Pro Gly Pro Gly
485 490 495
Gln Cys Leu Ser Cys Arg Asn Tyr Ser Arg Gly Gly Val Cys Val Thr
500 505 510
His Cys Asn Phe Leu Asn Gly Glu Pro Arg Glu Phe Ala His Glu Ala
515 520 525
Glu Cys Phe Ser Cys His Pro Glu Cys Gln Pro Met Glu Gly Thr Ala
530 535 540
Thr Cys Asn Gly Ser Gly Ser Asp Thr Cys Ala Gln Cys Ala His Phe
545 550 555 560
Arg Asp Gly Pro His Cys Val Ser Ser Cys Pro His Gly Val Leu Gly
565 570 575
Ala Lys Gly Pro Ile Tyr Lys Tyr Pro Asp Val Gln Asn Glu Cys Arg
580 585 590
Pro Cys His Glu Asn Cys Thr Gln Gly Cys Lys Gly Pro Glu Leu Gln
595 600 605
Asp Cys Leu Gly Gln Thr Leu Val Leu Ile Gly Lys Thr His Leu Thr
610 615 620
Met Ala Leu Thr Val Ile Ala Gly Leu Val Val Ile Phe Met Met Leu
625 630 635 640
Gly Gly Thr Phe Leu Tyr Trp Arg Gly Arg Arg Ile Gln Asn Lys Arg
645 650 655
Ala Met Arg Arg Tyr Leu Glu Arg Gly Glu Ser Ile Glu Pro Leu Asp
660 665 670
Pro Ser Glu Lys Ala Asn Lys Val Leu Ala Arg Ile Phe Lys Glu Thr
675 680 685
Glu Leu Arg Lys Leu Lys Val Leu Gly Ser Gly Val Phe Gly Thr Val
690 695 700
His Lys Gly Val Trp Ile Pro Glu Gly Glu Ser Ile Lys Ile Pro Val
705 710 715 720
Cys Ile Lys Val Ile Glu Asp Lys Ser Gly Arg Gln Ser Phe Gln Ala
725 730 735
Val Thr Asp His Met Leu Ala Ile Gly Ser Leu Asp His Ala His Ile
740 745 750
Val Arg Leu Leu Gly Leu Cys Pro Gly Ser Ser Leu Gln Leu Val Thr
755 760 765
Gln Tyr Leu Pro Leu Gly Ser Leu Leu Asp His Val Arg Gln His Arg
770 775 780
Gly Ala Leu Gly Pro Gln Leu Leu Leu Asn Trp Gly Val Gln Ile Ala
785 790 795 800
Lys Gly Met Tyr Tyr Leu Glu Glu His Gly Met Val His Arg Asn Leu
805 810 815
Ala Ala Arg Asn Val Leu Leu Lys Ser Pro Ser Gln Val Gln Val Ala
820 825 830
Asp Phe Gly Val Ala Asp Leu Leu Pro Pro Asp Asp Lys Gln Leu Leu
835 840 845
Tyr Ser Glu Ala Lys Thr Pro Ile Lys Trp Met Ala Leu Glu Ser Ile
850 855 860
His Phe Gly Lys Tyr Thr His Gln Ser Asp Val Trp Ser Tyr Gly Val
865 870 875 880
Thr Val Trp Glu Leu Met Thr Phe Gly Ala Glu Pro Tyr Ala Gly Leu
885 890 895
Arg Leu Ala Glu Val Pro Asp Leu Leu Glu Lys Gly Glu Arg Leu Ala
900 905 910
Gln Pro Gln Ile Cys Thr Ile Asp Val Tyr Met Val Met Val Lys Cys
915 920 925
Trp Met Ile Asp Glu Asn Ile Arg Pro Thr Phe Lys Glu Leu Ala Asn
930 935 940
Glu Phe Thr Arg Met Ala Arg Asp Pro Pro Arg Tyr Leu Val Ile Lys
945 950 955 960
Arg Glu Ser Gly Pro Gly Ile Ala Pro Gly Pro Glu Pro His Gly Leu
965 970 975
Thr Asn Lys Lys Leu Glu Glu Val Glu Leu Glu Pro Glu Leu Asp Leu
980 985 990
Asp Leu Asp Leu Glu Ala Glu Glu Asp Asn Leu Ala Thr Thr Thr Leu
995 1000 1005
Gly Ser Ala Leu Ser Leu Pro Val Gly Thr Leu Asn Arg Pro Arg
1010 1015 1020
Gly Ser Gln Ser Leu Leu Ser Pro Ser Ser Gly Tyr Met Pro Met
1025 1030 1035
Asn Gln Gly Asn Leu Gly Glu Ser Cys Gln Glu Ser Ala Val Ser
1040 1045 1050
Gly Ser Ser Glu Arg Cys Pro Arg Pro Val Ser Leu His Pro Met
1055 1060 1065
Pro Arg Gly Cys Leu Ala Ser Glu Ser Ser Glu Gly His Val Thr
1070 1075 1080
Gly Ser Glu Ala Glu Leu Gln Glu Lys Val Ser Met Cys Arg Ser
1085 1090 1095
Arg Ser Arg Ser Arg Ser Pro Arg Pro Arg Gly Asp Ser Ala Tyr
1100 1105 1110
His Ser Gln Arg His Ser Leu Leu Thr Pro Val Thr Pro Leu Ser
1115 1120 1125
Pro Pro Gly Leu Glu Glu Glu Asp Val Asn Gly Tyr Val Met Pro
1130 1135 1140
Asp Thr His Leu Lys Gly Thr Pro Ser Ser Arg Glu Gly Thr Leu
1145 1150 1155
Ser Ser Val Gly Leu Ser Ser Val Leu Gly Thr Glu Glu Glu Asp
1160 1165 1170
Glu Asp Glu Glu Tyr Glu Tyr Met Asn Arg Arg Arg Arg His Ser
1175 1180 1185
Pro Pro His Pro Pro Arg Pro Ser Ser Leu Glu Glu Leu Gly Tyr
1190 1195 1200
Glu Tyr Met Asp Val Gly Ser Asp Leu Ser Ala Ser Leu Gly Ser
1205 1210 1215
Thr Gln Ser Cys Pro Leu His Pro Val Pro Ile Met Pro Thr Ala
1220 1225 1230
Gly Thr Thr Pro Asp Glu Asp Tyr Glu Tyr Met Asn Arg Gln Arg
1235 1240 1245
Asp Gly Gly Gly Pro Gly Gly Asp Tyr Ala Ala Met Gly Ala Cys
1250 1255 1260
Pro Ala Ser Glu Gln Gly Tyr Glu Glu Met Arg Ala Phe Gln Gly
1265 1270 1275
Pro Gly His Gln Ala Pro His Val His Tyr Ala Arg Leu Lys Thr
1280 1285 1290
Leu Arg Ser Leu Glu Ala Thr Asp Ser Ala Phe Asp Asn Pro Asp
1295 1300 1305
Tyr Trp His Ser Arg Leu Phe Pro Lys Ala Asn Ala Gln Arg Thr
1310 1315 1320
<210> 42
<211> 445
<212> PRT
<213> Homo sapiens
<400> 42
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
Val Met Ala Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Gly Gly Trp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Leu Lys Met Ala Thr Ile Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu
210 215 220
Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu
290 295 300
Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 43
<211> 217
<212> PRT
<213> Homo sapiens
<400> 43
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Ser Tyr
20 25 30
Asn Val Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Ile Ile Tyr Glu Val Ser Gln Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Thr Glu Asp Glu Ala Asp Tyr Tyr Cys Cys Ser Tyr Ala Gly Ser
85 90 95
Ser Ile Phe Val Ile Phe Gly Gly Gly Thr Lys Val Thr Val Leu Gly
100 105 110
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu
115 120 125
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Val Ser Asp Phe
130 135 140
Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro Val
145 150 155 160
Lys Val Gly Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn Lys
165 170 175
Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser
180 185 190
His Arg Ser Tyr Ser Cys Arg Val Thr His Glu Gly Ser Thr Val Glu
195 200 205
Lys Thr Val Ala Pro Ala Glu Cys Ser
210 215
<210> 44
<211> 1095
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 44
Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asn Ile Asn Arg Asp Gly Ser Ala Ser Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Gly Val Gly Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Gln Ser Ala Leu Thr Gln Pro Ala
130 135 140
Ser Val Ser Gly Ser Pro Gly Gln Ser Ile Thr Ile Ser Cys Thr Gly
145 150 155 160
Thr Ser Ser Asp Val Gly Gly Tyr Asn Phe Val Ser Trp Tyr Gln Gln
165 170 175
His Pro Gly Lys Ala Pro Lys Leu Met Ile Tyr Asp Val Ser Asp Arg
180 185 190
Pro Ser Gly Val Ser Asp Arg Phe Ser Gly Ser Lys Ser Gly Asn Thr
195 200 205
Ala Ser Leu Ile Ile Ser Gly Leu Gln Ala Asp Asp Glu Ala Asp Tyr
210 215 220
Tyr Cys Ser Ser Tyr Gly Ser Ser Ser Thr His Val Ile Phe Gly Gly
225 230 235 240
Gly Thr Lys Val Thr Val Leu Gly Ala Ala Ser Asp Ala His Lys Ser
245 250 255
Glu Val Ala His Arg Phe Lys Asp Leu Gly Glu Glu Asn Phe Lys Ala
260 265 270
Leu Val Leu Ile Ala Phe Ala Gln Tyr Leu Gln Gln Ser Pro Phe Glu
275 280 285
Asp His Val Lys Leu Val Asn Glu Val Thr Glu Phe Ala Lys Thr Cys
290 295 300
Val Ala Asp Glu Ser Ala Glu Asn Cys Asp Lys Ser Leu His Thr Leu
305 310 315 320
Phe Gly Asp Lys Leu Cys Thr Val Ala Thr Leu Arg Glu Thr Tyr Gly
325 330 335
Glu Met Ala Asp Cys Cys Ala Lys Gln Glu Pro Glu Arg Asn Glu Cys
340 345 350
Phe Leu Gln His Lys Asp Asp Asn Pro Asn Leu Pro Arg Leu Val Arg
355 360 365
Pro Glu Val Asp Val Met Cys Thr Ala Phe His Asp Asn Glu Glu Thr
370 375 380
Phe Leu Lys Lys Tyr Leu Tyr Glu Ile Ala Arg Arg His Pro Tyr Phe
385 390 395 400
Tyr Ala Pro Glu Leu Leu Phe Phe Ala Lys Arg Tyr Lys Ala Ala Phe
405 410 415
Thr Glu Cys Cys Gln Ala Ala Asp Lys Ala Ala Cys Leu Leu Pro Lys
420 425 430
Leu Asp Glu Leu Arg Asp Glu Gly Lys Ala Ser Ser Ala Lys Gln Arg
435 440 445
Leu Lys Cys Ala Ser Leu Gln Lys Phe Gly Glu Arg Ala Phe Lys Ala
450 455 460
Trp Ala Val Ala Arg Leu Ser Gln Arg Phe Pro Lys Ala Glu Phe Ala
465 470 475 480
Glu Val Ser Lys Leu Val Thr Asp Leu Thr Lys Val His Thr Glu Cys
485 490 495
Cys His Gly Asp Leu Leu Glu Cys Ala Asp Asp Arg Ala Asp Leu Ala
500 505 510
Lys Tyr Ile Cys Glu Asn Gln Asp Ser Ile Ser Ser Lys Leu Lys Glu
515 520 525
Cys Cys Glu Lys Pro Leu Leu Glu Lys Ser His Cys Ile Ala Glu Val
530 535 540
Glu Asn Asp Glu Met Pro Ala Asp Leu Pro Ser Leu Ala Ala Asp Phe
545 550 555 560
Val Glu Ser Lys Asp Val Cys Lys Asn Tyr Ala Glu Ala Lys Asp Val
565 570 575
Phe Leu Gly Met Phe Leu Tyr Glu Tyr Ala Arg Arg His Pro Asp Tyr
580 585 590
Ser Val Val Leu Leu Leu Arg Leu Ala Lys Thr Tyr Glu Thr Thr Leu
595 600 605
Glu Lys Cys Cys Ala Ala Ala Asp Pro His Glu Cys Tyr Ala Lys Val
610 615 620
Phe Asp Glu Phe Lys Pro Leu Val Glu Glu Pro Gln Asn Leu Ile Lys
625 630 635 640
Gln Asn Cys Glu Leu Phe Glu Gln Leu Gly Glu Tyr Lys Phe Gln Asn
645 650 655
Ala Leu Leu Val Arg Tyr Thr Lys Lys Val Pro Gln Val Ser Thr Pro
660 665 670
Thr Leu Val Glu Val Ser Arg Asn Leu Gly Lys Val Gly Ser Lys Cys
675 680 685
Cys Lys His Pro Glu Ala Lys Arg Met Pro Cys Ala Glu Asp Tyr Leu
690 695 700
Ser Val Val Leu Asn Gln Leu Cys Val Leu His Glu Lys Thr Pro Val
705 710 715 720
Ser Asp Arg Val Thr Lys Cys Cys Thr Glu Ser Leu Val Asn Arg Arg
725 730 735
Pro Cys Phe Ser Ala Leu Glu Val Asp Glu Thr Tyr Val Pro Lys Glu
740 745 750
Phe Gln Ala Glu Thr Phe Thr Phe His Ala Asp Ile Cys Thr Leu Ser
755 760 765
Glu Lys Glu Arg Gln Ile Lys Lys Gln Thr Ala Leu Val Glu Leu Val
770 775 780
Lys His Lys Pro Lys Ala Thr Lys Glu Gln Leu Lys Ala Val Met Asp
785 790 795 800
Asp Phe Ala Ala Phe Val Glu Lys Cys Cys Lys Ala Asp Asp Lys Glu
805 810 815
Thr Cys Phe Ala Glu Glu Gly Lys Lys Leu Val Ala Ala Ser Gln Ala
820 825 830
Ala Leu Gly Leu Ala Ala Ala Leu Gln Val Gln Leu Val Gln Ser Gly
835 840 845
Ala Glu Val Lys Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly
850 855 860
Ser Gly Tyr Ser Phe Thr Ser Tyr Trp Ile Ala Trp Val Arg Gln Met
865 870 875 880
Pro Gly Lys Gly Leu Glu Tyr Met Gly Leu Ile Tyr Pro Gly Asp Ser
885 890 895
Asp Thr Lys Tyr Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Val
900 905 910
Asp Lys Ser Val Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Pro
915 920 925
Ser Asp Ser Ala Val Tyr Phe Cys Ala Arg His Asp Val Gly Tyr Cys
930 935 940
Thr Asp Arg Thr Cys Ala Lys Trp Pro Glu Trp Leu Gly Val Trp Gly
945 950 955 960
Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Ser Gly
965 970 975
Gly Gly Ser Gly Gly Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro
980 985 990
Ser Val Ser Ala Ala Pro Gly Gln Lys Val Thr Ile Ser Cys Ser Gly
995 1000 1005
Ser Ser Ser Asn Ile Gly Asn Asn Tyr Val Ser Trp Tyr Gln Gln
1010 1015 1020
Leu Pro Gly Thr Ala Pro Lys Leu Leu Ile Tyr Asp His Thr Asn
1025 1030 1035
Arg Pro Ala Gly Val Pro Asp Arg Phe Ser Gly Ser Lys Ser Gly
1040 1045 1050
Thr Ser Ala Ser Leu Ala Ile Ser Gly Phe Arg Ser Glu Asp Glu
1055 1060 1065
Ala Asp Tyr Tyr Cys Ala Ser Trp Asp Tyr Thr Leu Ser Gly Trp
1070 1075 1080
Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
1085 1090 1095
Claims (60)
- 에스트로겐 수용체 양성 또는 음성 호르몬 무반응 유방암의 치료를 위한 ErbB3 저해제.
- 에스트로겐 수용체 양성 또는 음성 호르몬 무반응 유방암 세포의 성장을 억제하는 방법에 있어서, 상기 세포를 효과량의 ErbB3 저해제와 접촉시키는 단계를 포함하는 것을 특징으로 하는 방법.
- 환자에서 에스트로겐 수용체 양성 또는 음성 호르몬 무반응 유방암 종양의 성장을 억제하는 방법에 있어서, 효과량의 ErbB3 저해제를 상기 환자에 투여하는 단계를 포함하는 것을 특징으로 하는 방법.
- 환자에서 에스트로겐 수용체 양성 또는 음성 호르몬 무반응 유방암 종양을 치료하는 방법에 있어서, 효과량의 ErbB3 저해제를 상기 환자에 투여하는 단계를 포함하는 것을 특징으로 하는 방법.
- 환자에서 유방암 종양을 치료하는 방법에 있어서, 하기 단계를 포함하는 것을 특징으로 하는 방법:
에스트로겐 수용체 양성 또는 음성 호르몬 무반응 유방암 종양을 갖는 환자를 선별하는 단계; 그리고
효과량의 ErbB3 저해제를 상기 환자에 투여하는 단계. - 청구항 1 내지 5중 어느 한 항에 있어서, ErbB3 저해제는 항-ErbB3 항체인 것을 특징으로 하는 방법.
- 청구항 6에 있어서, 항-ErbB3 항체는 각각, 서열 번호: 1과 2에서 제시된 아미노산 서열을 포함하는 VH 및/또는 VL 영역을 포함하는 것을 특징으로 하는 방법.
- 청구항 6에 있어서, 항-ErbB3 항체는 각각, 서열 번호: 42와 43에서 제시된 아미노산 서열을 포함하는 VH 및/또는 VL 영역을 포함하는 것을 특징으로 하는 방법.
- 청구항 6에 있어서, 항-ErbB3 항체는 아미노 말단에서 카르복시 말단 순서로, 각각 서열 번호: 3-5에서 제시된 VH CDR1, 2와 3 서열, 그리고 아미노 말단에서 카르복시 말단 순서로, 각각 서열 번호: 6-8에서 제시된 VL CDR1, 2와 3 서열을 포함하는 것을 특징으로 하는 방법.
- 청구항 3 내지 5중 어느 한 항에 있어서, ErbB3 저해제가 아닌 효과량의 적어도 하나의 추가의 항암제를 환자에 공동-투여하는 단계를 더욱 포함하는 것을 특징으로 하는 방법.
- 청구항 10에 있어서, 적어도 하나의 추가의 항암제는 적어도 하나의 화학치료 약물을 포함하는 것을 특징으로 하는 방법.
- 청구항 10에 있어서, 적어도 하나의 추가의 항암제는 백금-기초된 화학요법 약물, 탁산, 티로신 키나아제 저해제, 세린/트레오닌 단백질 키나아제 저해제, 항-EGFR 항체, 항-ErbB2 항체, 그리고 이들의 조합으로 구성된 군에서 선택되는 것을 특징으로 하는 방법.
- 청구항 10에 있어서, 적어도 하나의 추가의 항암제는 EGFR 저해제를 포함하는 것을 특징으로 하는 방법.
- 청구항 10에 있어서, EGFR 저해제는 항-EGFR 항체를 포함하는 것을 특징으로 하는 방법.
- 청구항 14에 있어서, 항-EGFR 항체는 세툭시맙을 포함하는 것을 특징으로 하는 방법.
- 청구항 13에 있어서, EGFR 저해제는 EGFR 신호전달의 작은 분자 저해제인 것을 특징으로 하는 방법.
- 청구항 16에 있어서, EGFR 신호전달의 작은 분자 저해제는 아파티닙, 제피티닙, 라파티닙, 카널티닙, 펠리티닙, 에를로티닙, PKI-166, PD158780, 그리고 AG 1478로 구성된 군에서 선택되는 것을 특징으로 하는 방법.
- 청구항 10에 있어서, 적어도 하나의 추가의 항암제는 VEGF 저해제를 포함하는 것을 특징으로 하는 방법.
- 청구항 18에 있어서, VEGF 저해제는 항-VEGF 항체를 포함하는 것을 특징으로 하는 방법.
- 청구항 19에 있어서, 항-VEGF 항체는 베바시주맙인 것을 특징으로 하는 방법.
- 청구항 1 내지 20중 어느 한 항에 있어서, 호르몬 무반응 유방암은 에스트로겐 수용체 양성 (ER+)인 것을 특징으로 하는 방법.
- 청구항 21에 있어서, 에스트로겐 수용체 길항제 및 아로마타아제 저해제 중에서 어느 한쪽 또는 둘 모두의 공동-투여를 더욱 포함하는 것을 특징으로 하는 방법.
- 청구항 22에 있어서, 에스트로겐 수용체 길항제는 랄록시펜, 타목시펜, 아피목시펜 (4-히드록시타목시펜), 아르족시펜, 라소폭손, 토레미펜 및 풀베스트란트에서 선택되고; 그리고 아로마타아제 저해제는 엑세메스탄, 아나스트로졸, 레트로졸, 아미노글루테티미드, 테스토락톤, 보로졸, 포르메스탄 및 파드로졸에서 선택되는 것을 특징으로 하는 방법.
- 청구항 22에 있어서, 아로마타아제 저해제는 레트로졸인 것을 특징으로 하는 방법.
- 청구항 21에 있어서, mTOR 저해제 및 아로마타아제 저해제 중에서 어느 한쪽 또는 둘 모두의 공동-투여를 더욱 포함하는 것을 특징으로 하는 방법.
- 청구항 25에 있어서, mTOR 저해제는 템시롤리무스, 에베롤리무스, 시롤리무스, 그리고 리다포롤리무스에서 선택되고; 그리고 아로마타아제 저해제는 엑세메스탄, 아나스트로졸, 레트로졸, 아미노글루테티미드, 테스토락톤, 보로졸, 포르메스탄 및 파드로졸에서 선택되는 것을 특징으로 하는 방법.
- 청구항 26에 있어서, 아로마타아제 저해제는 엑세메스탄인 것을 특징으로 하는 방법.
- 청구항 26에 있어서, mTOR 저해제는 에베롤리무스인 것을 특징으로 하는 방법.
- 종양 세포에서 에스트로겐 수용체의 헤레굴린-매개된 활성화를 저해하는 방법에 있어서, 하기 단계를 포함하는 것을 특징으로 하는 방법: 1) 항-에스트로겐 요법으로 악성 종양에 대해 치료되고 이런 요법에 대해 내성화된 인간 환자를 선별하는 단계, 상기 환자는 악성 종양을 갖고, 상기 종양은 환자가 내성화된 이후 환자로부터 채취된 종양 생검의 분석에 의해, 에스트로겐 수용체 양성이고 HER2를 과다발현하고, 그리고 상기 활성화는 에스트로겐 수용체의 인산화를 포함하고, 그리고 2) 이렇게 선별된 환자에 ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린 결합을 저해하는 항체를 투여하는 단계, 여기서 상기 항체는 시험관내에서 MCF7 세포에서 헤레굴린-유도된 에스트로겐 수용체 인산화를 적어도 20%, 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 또는 적어도 70% 저해하는데 충분한 농도인, 환자의 혈류 내에 상기 항체의 농도를 산출하는 용량으로 투여되고, 여기서 상기 용량에서 상기 투여는 종양을 치료하는데 효과적인 것을 특징으로 하는 방법.
- 청구항 29에 있어서, 악성 종양은 유방, 난소, 폐, 또는 피부의 종양인 것을 특징으로 하는 방법.
- 청구항 29에 있어서, HER2의 과다발현은 종양 생검 검사 HER2++ 또는 HER2+++ 또는 HER2 FISH-양성에 의해 지시되는 것을 특징으로 하는 방법.
- 청구항 29 내지 31중 어느 한 항에 있어서, 항-에스트로겐 요법은 에스트로겐 수용체 차단제로 치료 및 아로마타아제 저해제로 치료 중에서 어느 한쪽 또는 둘 모두인 것을 특징으로 하는 방법.
- 청구항 32에 있어서, 투여는 정맥내 주사 또는 주입에 의한 것을 특징으로 하는 방법.
- 청구항 31 내지 33중 어느 한 항에 있어서, 항체는 항-ErbB2 항체인 것을 특징으로 하는 방법.
- 청구항 29 내지 33중 어느 한 항에 있어서, 항체는 항-ErbB3 항체인 것을 특징으로 하는 방법.
- 청구항 35에 있어서, 항체는 각각, 서열 번호: 1과 2에서 제시된 아미노산 서열을 포함하는 VH 및/또는 VL 영역을 포함하는 것을 특징으로 하는 방법.
- 청구항 35에 있어서, 항-ErbB3 항체는 각각, 서열 번호: 42와 43에서 제시된 아미노산 서열을 포함하는 VH 및/또는 VL 영역을 포함하는 것을 특징으로 하는 방법.
- 청구항 29 내지 33중 어느 한 항에 있어서, 항체는 항-ErbB2/항ErbB3 이중특이적 항체인 것을 특징으로 하는 방법.
- 청구항 38에 있어서, 이중특이적 항체는 ALM, A5-HSA-ML3.9, A5-HSA-B1D2, B12-HSA-B1D2, A5-HSA-F5B6H2, H3-HSA-F5B6H2, F4-HSA-F5B6H2 및 H3-HSA-B1D2로 구성된 군에서 선택되는 것을 특징으로 하는 방법.
- 청구항 29 내지 39중 어느 한 항에 있어서, 항체의 투여는 종양의 성장, 침입, 그리고 전이 중에서 하나 또는 그 이상을 저해하는 것을 특징으로 하는 방법.
- 청구항 29 내지 40중 어느 한 항에 있어서, 에스트로겐 수용체 길항제 및 아로마타아제 저해제 중에서 어느 한쪽 또는 둘 모두의 공동-투여를 더욱 포함하는 것을 특징으로 하는 방법.
- 청구항 41에 있어서, 에스트로겐 수용체 길항제는 랄록시펜, 타목시펜, 아피목시펜 (4-히드록시타목시펜), 아르족시펜, 라소폭손, 토레미펜 및 풀베스트란트에서 선택되고; 그리고 아로마타아제 저해제는 엑세메스탄, 아나스트로졸, 레트로졸, 아미노글루테티미드, 테스토락톤, 보로졸, 포르메스탄 및 파드로졸에서 선택되는 것을 특징으로 하는 방법.
- 청구항 42에 있어서, 아로마타아제 저해제는 레트로졸인 것을 특징으로 하는 방법.
- 에스트로겐 수용체의 헤레굴린-매개된 활성화의 저해를 위한 조성물에 있어서, 상기 저해는 항-에스트로겐 요법으로 악성 종양에 대해 치료되고 이런 요법에 대해 내성화된 인간 환자의 선별을 뒤따르고, 상기 환자는 악성 종양을 갖고, 상기 종양은 환자가 내성화된 이후 환자로부터 채취된 종양 생검의 분석에 의해, 에스트로겐 수용체 양성이고 ErbB2를 과다발현하고, 그리고 상기 활성화는 에스트로겐 수용체의 인산화를 포함하고, 상기 조성물은 ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린 결합을 저해하는 항-ErbB3 항체를 포함하는 것을 특징으로 하는 조성물.
- 에스트로겐 수용체의 헤레굴린-매개된 활성화의 저해를 위한 조성물에 있어서, 상기 저해는 항-에스트로겐 요법으로 악성 종양에 대해 치료되고 이런 요법에 대해 내성화된 인간 환자의 선별을 뒤따르고, 상기 환자는 악성 종양을 갖고, 상기 종양은 환자가 내성화된 이후 환자로부터 채취된 종양 생검의 분석에 의해, 에스트로겐 수용체 양성이고 ErbB2를 과다발현하고, 그리고 상기 활성화는 에스트로겐 수용체의 인산화를 포함하고, 상기 조성물은 ErbB2에 결합하고 ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린 결합을 저해하는 항-ErbB2 항체를 포함하는 것을 특징으로 하는 조성물.
- 청구항 45에 있어서, 항-ErbB2 항체는 페르투주맙인 것을 특징으로 하는 조성물.
- 에스트로겐 수용체의 헤레굴린-매개된 활성화의 저해를 위한 조성물에 있어서, 상기 저해는 항-에스트로겐 요법으로 악성 종양에 대해 치료되고 이런 요법에 대해 내성화된 인간 환자의 선별을 뒤따르고, 상기 환자는 악성 종양을 갖고, 상기 종양은 환자가 내성화된 이후 환자로부터 채취된 종양 생검의 분석에 의해, 에스트로겐 수용체 양성이고 ErbB2를 과다발현하고, 그리고 상기 활성화는 에스트로겐 수용체의 인산화를 포함하고, 상기 조성물은 ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린 결합을 저해하는 항-ErbB2/항ErbB3 이중특이적 항체를 포함하는 것을 특징으로 하는 조성물.
- 호르몬 무반응 에스트로겐-수용체 양성 암의 치료를 위한 조성물에 있어서, ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린 결합을 저해하는 항-ErbB3 항체를 포함하는 것을 특징으로 하는 조성물.
- 호르몬 무반응 에스트로겐-수용체 양성 암의 치료를 위한 조성물에 있어서, ErbB2에 결합하고 ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린 결합을 저해하는 항-ErbB2 항체를 포함하는 것을 특징으로 하는 조성물.
- 청구항 44 내지 49중 어느 한 항에 있어서, 에스트로겐 수용체 길항제 및 아로마타아제 저해제 중에서 어느 한쪽 또는 둘 모두와의 공동-투여에 이용되는 것을 특징으로 하는 조성물.
- 청구항 45에 있어서, 항-ErbB2 항체는 페르투주맙인 것을 특징으로 하는 조성물.
- 호르몬 무반응 에스트로겐-수용체 양성 암의 치료를 위한 조성물에 있어서, ErbB2/ErbB3 헤테로이합체에 대한 헤레굴린 결합을 저해하는 항-ErbB2/항ErbB3 이중특이적 항체를 포함하는 것을 특징으로 하는 조성물.
- 청구항 50에 있어서, 에스트로겐 수용체 길항제는 랄록시펜, 타목시펜, 아피목시펜 (4-히드록시타목시펜), 아르족시펜, 라소폭손, 토레미펜 및 풀베스트란트에서 선택되고; 그리고 아로마타아제 저해제는 엑세메스탄, 아나스트로졸, 레트로졸, 아미노글루테티미드, 테스토락톤, 보로졸, 포르메스탄 및 파드로졸에서 선택되는 것을 특징으로 하는 조성물.
- 청구항 53에 있어서, 아로마타아제 저해제는 레트로졸인 것을 특징으로 하는 조성물.
- 청구항 38에 있어서, 이중특이적 항체는 서열 번호:44를 포함하는 항체인 것을 특징으로 하는 방법.
- 청구항 47 또는 52에 있어서, 이중특이적 항체는 서열 번호:44를 포함하는 항체인 것을 특징으로 하는 조성물.
- 청구항 44 내지 59중 어느 한 항에 있어서, mTOR 저해제 및 아로마타아제 저해제 중에서 어느 한쪽 또는 둘 모두와의 공동-투여에 이용되는 것을 특징으로 하는 조성물.
- 청구항 57에 있어서, mTOR 저해제는 템시롤리무스, 에베롤리무스, 시롤리무스, 그리고 리다포롤리무스에서 선택되고; 그리고 아로마타아제 저해제는 엑세메스탄, 아나스트로졸, 레트로졸, 아미노글루테티미드, 테스토락톤, 보로졸, 포르메스탄 및 파드로졸에서 선택되는 것을 특징으로 하는 조성물.
- 청구항 58에 있어서, 아로마타아제 저해제는 엑세메스탄인 것을 특징으로 하는 방법.
- 청구항 58에 있어서, mTOR 저해제는 에베롤리무스인 것을 특징으로 하는 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161451848P | 2011-03-11 | 2011-03-11 | |
| US61/451,848 | 2011-03-11 | ||
| US201261604281P | 2012-02-28 | 2012-02-28 | |
| US61/604,281 | 2012-02-28 | ||
| PCT/US2012/028792 WO2012125573A2 (en) | 2011-03-11 | 2012-03-12 | Use of inhibitors of egfr-family receptors in the treatment of hormone refractory breast cancers |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140044796A true KR20140044796A (ko) | 2014-04-15 |
Family
ID=45894680
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137026392A KR20140044796A (ko) | 2011-03-11 | 2012-03-12 | 호르몬 무반응 유방암의 치료에서 egfr-패밀리 수용체의 저해제의 용도 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US20140134170A1 (ko) |
| EP (1) | EP2683741A2 (ko) |
| JP (1) | JP2014508782A (ko) |
| KR (1) | KR20140044796A (ko) |
| CN (1) | CN103562226A (ko) |
| AU (1) | AU2012229147B2 (ko) |
| BR (1) | BR112013022882A2 (ko) |
| CA (1) | CA2828075A1 (ko) |
| EA (1) | EA201300996A1 (ko) |
| MX (1) | MX2013010379A (ko) |
| SG (1) | SG192844A1 (ko) |
| WO (1) | WO2012125573A2 (ko) |
Families Citing this family (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PL2716301T3 (pl) * | 2007-02-16 | 2017-10-31 | Merrimack Pharmaceuticals Inc | Przeciwciała przeciw ERBB3 i ich zastosowania |
| DK2544680T3 (en) * | 2010-03-11 | 2015-04-27 | Merrimack Pharmaceuticals Inc | USE OF ErbB3 INHIBITORS IN TREATMENT OF TRIPLE-NEGATIVE BREAST CANCER |
| US9155802B2 (en) | 2010-11-01 | 2015-10-13 | Symphogen A/S | Pan-HER antibody composition |
| BR112014027291A2 (pt) | 2012-05-02 | 2017-08-08 | Symphogen As | composições de anticorpos pan-her humanizados |
| WO2015100459A2 (en) | 2013-12-27 | 2015-07-02 | Merrimack Pharmaceuticals, Inc. | Biomarker profiles for predicting outcomes of cancer therapy with erbb3 inhibitors and/or chemotherapies |
| NZ724013A (en) | 2014-02-28 | 2019-11-29 | Merus Nv | Antibodies that bind egfr and erbb3 |
| CN104208069A (zh) | 2014-05-08 | 2014-12-17 | 上海市计划生育科学研究所 | 双炔失碳酯组合物和疾病治疗方法 |
| KR20170137886A (ko) | 2015-04-17 | 2017-12-13 | 메리맥 파마슈티컬즈, 인크. | 세리반투맙에 의한 병용 치료 |
| US10184006B2 (en) | 2015-06-04 | 2019-01-22 | Merrimack Pharmaceuticals, Inc. | Biomarkers for predicting outcomes of cancer therapy with ErbB3 inhibitors |
| ITUB20160828A1 (it) * | 2016-02-18 | 2017-08-18 | Univ Degli Studi Genova | Utilizzo di una dieta che mima il digiuno per potenziare l'efficacia di antiestrogeni nella terapia del cancro |
| JP2019508428A (ja) | 2016-03-15 | 2019-03-28 | メリマック ファーマシューティカルズ インコーポレーティッド | 抗erbb3抗体を含む組み合わせ療法を用いて、er+、her2−、hrg+乳癌を治療するための方法 |
| ES2909576T3 (es) | 2016-10-11 | 2022-05-09 | Univ Duke | Tratamiento con lasofoxifeno del cáncer de mama ER+ |
| EP3568132A4 (en) * | 2017-01-10 | 2020-09-09 | Wang, Wei | MODULATION BY LASOFOXIFEN OF EESTROGENIC SIGNALS OF MEMBRANARY ORIGIN AND METHODS FOR THE TREATMENT OF TUMORS |
| EP3600413A1 (en) | 2017-03-31 | 2020-02-05 | Merus N.V. | Erbb-2 and erbb3 binding bispecific antibodies for use in the treatment f cells that have an nrg1 fusion gene |
| CN111148764A (zh) * | 2017-05-17 | 2020-05-12 | 美勒斯公司 | 用于乳腺癌的ErbB-2/ErbB-3双特异性抗体与内分泌治疗的组合 |
| MX2020001432A (es) | 2017-08-09 | 2020-03-20 | Merus Nv | Anticuerpos que se unen al receptor del factor de crecimiento epidermico (egfr) y tirosina-proteina cinasa met (cmet). |
| WO2019185164A1 (en) | 2018-03-29 | 2019-10-03 | Hummingbird Bioscience Holdings Pte. Ltd. | Her3 antigen-binding molecules |
| CN112261937B (zh) | 2018-04-10 | 2023-11-14 | 杜克大学 | 乳腺癌的拉索昔芬治疗 |
| TW202227504A (zh) * | 2020-10-15 | 2022-07-16 | 大陸商上海翰森生物醫藥科技有限公司 | 抗erbb3抗體或其抗原結合片段及其醫藥用途 |
Family Cites Families (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5183884A (en) | 1989-12-01 | 1993-02-02 | United States Of America | Dna segment encoding a gene for a receptor related to the epidermal growth factor receptor |
| WO1994004679A1 (en) | 1991-06-14 | 1994-03-03 | Genentech, Inc. | Method for making humanized antibodies |
| US5977322A (en) | 1995-06-14 | 1999-11-02 | The Regents Of The University Of California | High affinity human antibodies to tumor antigens |
| US5968511A (en) | 1996-03-27 | 1999-10-19 | Genentech, Inc. | ErbB3 antibodies |
| US6949245B1 (en) | 1999-06-25 | 2005-09-27 | Genentech, Inc. | Humanized anti-ErbB2 antibodies and treatment with anti-ErbB2 antibodies |
| US7390632B2 (en) | 1999-09-30 | 2008-06-24 | Tumor Biology Investment Group, Inc. | Soluble ErbB3 receptor isoforms |
| US7612042B2 (en) | 2001-05-31 | 2009-11-03 | Tumor Biology Investment Group, Inc. | Methods for inhibiting heregulin and treating cancer |
| EP1283053A1 (en) | 2001-08-09 | 2003-02-12 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | Inhibitors of HER3 activity |
| CN100424175C (zh) | 2002-03-26 | 2008-10-08 | 上海泽生科技开发有限公司 | ErbB-3 用于肿瘤治疗的方法和组合物 |
| US7332580B2 (en) | 2002-04-05 | 2008-02-19 | The Regents Of The University Of California | Bispecific single chain Fv antibody molecules and methods of use thereof |
| US7332585B2 (en) * | 2002-04-05 | 2008-02-19 | The Regents Of The California University | Bispecific single chain Fv antibody molecules and methods of use thereof |
| AR056857A1 (es) | 2005-12-30 | 2007-10-24 | U3 Pharma Ag | Anticuerpos dirigidos hacia her-3 (receptor del factor de crecimiento epidérmico humano-3) y sus usos |
| PL2716301T3 (pl) * | 2007-02-16 | 2017-10-31 | Merrimack Pharmaceuticals Inc | Przeciwciała przeciw ERBB3 i ich zastosowania |
| EP2132229B1 (en) | 2007-03-01 | 2016-05-11 | Symphogen A/S | Recombinant anti-epidermal growth factor receptor antibody compositions |
| CA2686908A1 (en) | 2007-05-11 | 2008-11-20 | Enzon Pharmaceuticals, Inc. | Rna antagonist compounds for the modulation of her3 |
| EP2288715B1 (en) * | 2008-04-11 | 2014-09-24 | Merrimack Pharmaceuticals, Inc. | Human serum albumin linkers and conjugates thereof |
| EA022884B1 (ru) | 2008-08-15 | 2016-03-31 | Мерримак Фармасьютикалз, Инк. | СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ С ИСПОЛЬЗОВАНИЕМ АНТИ-ErbB3 АНТИТЕЛА |
| WO2010059315A1 (en) * | 2008-11-18 | 2010-05-27 | Merrimack Pharmaceuticals, Inc. | Human serum albumin linkers and conjugates thereof |
| ES2572728T3 (es) | 2009-03-20 | 2016-06-02 | F. Hoffmann-La Roche Ag | Anticuerpos anti-HER biespecíficos |
| CA2759792A1 (en) | 2009-04-29 | 2010-11-04 | Trellis Bioscience, Inc. | Improved antibodies immunoreactive with heregulin-coupled her3 |
| EP2488199A1 (en) * | 2009-10-14 | 2012-08-22 | Merrimack Pharmaceuticals, Inc. | Bispecific binding agents targeting igf-1r and erbb3 signalling and uses thereof |
| DK2544680T3 (en) * | 2010-03-11 | 2015-04-27 | Merrimack Pharmaceuticals Inc | USE OF ErbB3 INHIBITORS IN TREATMENT OF TRIPLE-NEGATIVE BREAST CANCER |
| CA2795799C (en) | 2010-04-09 | 2018-09-25 | Aveo Pharmaceuticals, Inc. | Anti-erbb3 antibodies |
| EA201390085A1 (ru) * | 2010-07-09 | 2013-06-28 | Экселиксис, Инк. | Композиции ингибиторов киназ для лечения рака |
-
2012
- 2012-03-12 EA EA201300996A patent/EA201300996A1/ru unknown
- 2012-03-12 MX MX2013010379A patent/MX2013010379A/es unknown
- 2012-03-12 EP EP12711080.7A patent/EP2683741A2/en not_active Withdrawn
- 2012-03-12 JP JP2013557943A patent/JP2014508782A/ja active Pending
- 2012-03-12 CA CA2828075A patent/CA2828075A1/en not_active Abandoned
- 2012-03-12 WO PCT/US2012/028792 patent/WO2012125573A2/en active Application Filing
- 2012-03-12 KR KR1020137026392A patent/KR20140044796A/ko not_active Application Discontinuation
- 2012-03-12 BR BR112013022882A patent/BR112013022882A2/pt not_active IP Right Cessation
- 2012-03-12 AU AU2012229147A patent/AU2012229147B2/en not_active Ceased
- 2012-03-12 US US14/004,598 patent/US20140134170A1/en not_active Abandoned
- 2012-03-12 SG SG2013062856A patent/SG192844A1/en unknown
- 2012-03-12 CN CN201280012969.XA patent/CN103562226A/zh active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| EP2683741A2 (en) | 2014-01-15 |
| MX2013010379A (es) | 2014-03-27 |
| US20140134170A1 (en) | 2014-05-15 |
| CA2828075A1 (en) | 2012-09-20 |
| NZ614427A (en) | 2015-08-28 |
| JP2014508782A (ja) | 2014-04-10 |
| SG192844A1 (en) | 2013-09-30 |
| AU2012229147A1 (en) | 2013-03-14 |
| BR112013022882A2 (pt) | 2016-12-20 |
| EA201300996A1 (ru) | 2014-01-30 |
| AU2012229147B2 (en) | 2015-12-24 |
| WO2012125573A2 (en) | 2012-09-20 |
| WO2012125573A3 (en) | 2012-12-27 |
| CN103562226A (zh) | 2014-02-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2012229147B2 (en) | Use of inhibitors of EGFR-family receptors in the treatment of hormone refractory breast cancers | |
| JP6185102B2 (ja) | トリプルネガティブおよび基底様乳癌の治療におけるerbb3阻害剤の使用 | |
| US20120156130A1 (en) | Use of her3 binding agents in prostate treatment | |
| KR20140023921A (ko) | ErbB 경로 저해제들에 대한 저항성을 극복하는 방법 | |
| Gandullo-Sánchez et al. | HER3 in cancer: from the bench to the bedside | |
| NZ614427B2 (en) | Use of inhibitors of egfr-family receptors in the treatment of hormone refractory breast cancers | |
| US20220040498A1 (en) | Methods of increasing response to cancer radiation therapy | |
| WO2022226637A1 (en) | Method for allowing immune cells infiltration in tumors | |
| Shabaya et al. | Novel therapeutic strategies and combinations for HER2-overexpressing breast cancer | |
| Rowinsky et al. | Cixutumumab |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |