KR20140036164A - 신경보호 펩타이드 - Google Patents
신경보호 펩타이드 Download PDFInfo
- Publication number
- KR20140036164A KR20140036164A KR1020137027914A KR20137027914A KR20140036164A KR 20140036164 A KR20140036164 A KR 20140036164A KR 1020137027914 A KR1020137027914 A KR 1020137027914A KR 20137027914 A KR20137027914 A KR 20137027914A KR 20140036164 A KR20140036164 A KR 20140036164A
- Authority
- KR
- South Korea
- Prior art keywords
- amino acid
- peptide
- acid sequence
- amino acids
- isolated peptide
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70585—CD44
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Organic Chemistry (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Gastroenterology & Hepatology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Immunology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Zoology (AREA)
- Epidemiology (AREA)
- Cell Biology (AREA)
- Psychology (AREA)
- Molecular Biology (AREA)
- Toxicology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Cardiology (AREA)
- Psychiatry (AREA)
- Hospice & Palliative Care (AREA)
- Heart & Thoracic Surgery (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
Abstract
신경퇴행성 질환을 치료하는 방법이 개시된다. 이 방법은 CD44V10 아미노산 서열의 적어도 3개의 아미노산 및 CD44V10 아미노산 서열의 100개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드의 치료적 유효량을 대상에게 투여하는 단계를 포함한다.
Description
본 발명은 이의 일부 실시태양에서 신경보호 펩타이드 물질 및 이의 용도에 관한 것이다.
알츠하이머병(AD), 파킨슨병(PD), 근위축성측색경화증(ALS) 및 헌팅턴병(HD)와 같은 신경퇴행성 질환은 성인 때 개시되고, 만성적이고, 진행성이며 비가역적으로 심각하게 장애가 있는 질병이며 뉴런의 사망을 포함하는 뉴런의 구조 및 기능의 진행성 손실이 존재한다.
알츠하이머병(AD)은 인지 기능의 진행성 손실을 특징으로 하는 가장 유행하는 신경퇴행성 질환이다. AD 조직병변은 각각 아밀로이드-β(Aβ) 및 과인산화 타우(tau)의 퇴적으로부터 발생하는 단백질 이상 즉 플라크 및 신경원섬유성 덩어리로 정의된다. 이런 병변들은 뉴런과 백질의 손실, 콩고친화성 혈관증, 염증 및 산화성 손상을 동반한다[1]. AD에서 염증의 역할은 신경소교세포 형태의 변화 및 노인성 플라크를 둘러싸는 성상교세포증에 의해 증명된다[2]. Aβ 펩타이드는 최초 β-세크레타제 분열 및 뒤이은 γ-세크레타제에 의한 막내 소화를 통해, 촉매 코어에 프레세닐린1을 가진 단백질 착물인 β-아밀로이드 전구체 단백질(APP)로부터 생산된다. 결과로 얻은 펩타이드가 분배되고 AD-형성(AD-defining) 아밀로이드 플라크에 퇴적된다[1].
파킨슨병(PD)은 흑색질 치밀부(substantia nigra pars compacta)에 도파민 뉴런의 선택적 퇴화에 의해 유발된 만성 및 진행성 신경퇴행성 질환이다. 증상들은 떨림, 경직성, 느린 움직임 및 자세 불안정을 포함하는 운동신경 관련 증상을 포함한다. 비 운동신경 증상들은 자율신경 실조증 및 감각 및 수면 장애이다. 치매를 포함하는 인지 및 신경행동 문제는 진행된 단계의 질병에서 일반적이다. PD는 비록 젊을 때 개시되는 경우도 있지만, 주로 60세 근처에 나타난다. PD의 주요 병변 특징은 흑색질, 더욱 구체적으로 치밀부의 밑면 부분에서 세포 사망이며, 환자 사망시 세포의 70%까지 영향을 미친다[3].
CD44는 과도한 대체 스플라이싱(alternative splicing) 및 번역 후 변이로부터 발생하는 종류 I 막투과 단백질의 집단을 암호화한다. 변형들이 단백질의 세포외막-기부에 위치하며 변형체 엑손 V2(쥐에서 V1) 내지 V10에 의해 암호화된다[4]. CD44는 히알루론산(HA)에 대한 주요 세포 표면 수용체이나 콜라겐, 피브로넥틴, 피브리노겐, 라미닌 및 오스테오폰틴과 같은 단백질과 결합하는 것으로 나타났다[5]. CD44는 염증 부위에 림프구를 순환하는 점증에 필수적이다[6,7]. 어떠한 변형체 엑손도 포함하지 않는 CD44S는 가장 편재하는 형태이며 대부분의 세포 형태에 의해 발현된다[8]. 10개 변형체 엑손 중 하나 이상이 포함되는 CD44 변형체 단백질은 암[9] 및 류마티스 관절염[10]과 다발성 경화증[11]과 같은 자가면역 질병과 관련되어 대부분 보고된다. CD44 스플라이싱 변형체에 대해 제안된 독특한 작용들 중 하나는 신호 변환에서의 참여이다. 예로서 CD44V6는 c-Met[12] 및 VEGFR-2[13]과 같은 티로신 키나아제를 통한 신호전달에 필수적인 적으로 나타났다.
뇌에서 CD44는 백질의 성상에서 주로 발견된다[14-18]. 반대로 엑손 V4, V5 및 V10을 포함하는 CD44 변형체들은 뉴런에 집중되었다[17]. CD44 발현은 해마에서 활성화된 소교세포에서 발견되며 일과성 전뇌허혈이 뒤따른다[19]. CD44는 숫자가 AD 뇌에서 급격하게 증가하는 CD44 양성 성상의 특정 서브세트를 아키야마 등이 보고했을 때 AD와 관련하여 처음으로 언급되었다[14]. CNS 재생에서 CD44의 중요한 역할은 망막 신경절 세포의 축색돌기 성장에 필수적인 것으로 발견됨에 따라 보고되었다[20]. CD44는 CD44-결핍 생쥐가 야생형 생쥐의 경색 크기와 비교하여 감소된 경색 크기를 갖기 때문에 허혈성 뇌손상에 중요한 역할을 하는 것으로 나타났고 중뇌 동맥 폐색이 뒤따른다[21]. 람미치 등[22]은 CD44가 추정 핵 신호절단(putative nuclear signaling)을 위해 세포외 도메인뿐만 아니라 CD44 세포내 도메인을 유리시키는 프레세닐린-의존성 세크레타제[22]에 의해 이중 막간 분할을 겪는다는 것을 보고하였다.
WO2009007934는 스플라이스 변형체 CD44V3, CD44V6 및 CD44V10의 발현은 비-AD 개인과 비교하여 AD 환자의 해마에서 현저하게 증가된다는 것을 교시한다.
본 발명은 상기한 문제들을 해결하기 위한 것이다.
본 발명의 일부 실시태양들의 한 양태에 따라 CD44V10 아미노산 서열의 적어도 3개의 아미노산 및 CD44V10 아미노산 서열의 100개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드의 치료적 유효량을 대상에게 투여하는 단계를 포함하여, 신경퇴행성 질환을 치료하는 치료가 필요한 대상의 신경퇴행성 질환을 치료하는 방법이 제공된다.
본 발명의 일부 실시태양들의 한 양태에 따라 CD44V6 아미노산 서열의 적어도 3개의 아미노산 및 CD44V6 아미노산 서열의 100개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드의 치료적 유효량을 대상에게 투여하는 단계를 포함하여, 신경퇴행성 질환을 치료하는 치료가 필요한 대상의 신경퇴행성 질환을 치료하는 방법이 제공된다.
본 발명의 일부 실시태양들의 한 양태에 따라, 펩타이드가 SEQ ID NO: 49 또는 50으로 나타낸 아미노산 서열로 이루어지지 않는 것을 조건으로, CD44V10 아미노산 서열의 적어도 3개의 아미노산 및 CD44V10 아미노산 서열의 20개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드가 제공된다.
본 발명의 일부 실시태양들의 한 양태에 따라, 펩타이드가 SEQ ID NO: 1, 51 또는 52로 나타낸 아미노산 서열로 이루어지지 않는 것을 조건으로, CD44V6 아미노산 서열의 적어도 3개의 아미노산 및 CD44V6 아미노산 서열의 20개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드가 제공된다.
본 발명의 일부 실시태양들의 한 양태에 따라, 활성제로서 CD44V10 아미노산 서열의 적어도 3개의 아미노산 및 CD44V10 아미노산 서열의 100개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드 및 약학적으로 유효한 담체를 포함하는 약학적 조성물이 제공된다.
본 발명의 일부 실시태양들의 한 양태에 따라, 신경퇴행성 질환을 치료하는데 사용하기 위한, CD44V10 아미노산 서열의 적어도 3개의 아미노산 및 CD44V10 아미노산 서열의 100개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드가 제공된다.
본 발명의 일부 실시태양들에 따라, 펩타이드는 화학식 1의 아미노산을 포함한다:
X1-G-Y-T-S,
여기서 X1은 글루탐산 또는 글루타민 중 하나이다.
본 발명의 일부 실시태양들에 따라, 아미노산 서열은 펩타이드 모방체를 포함한다.
본 발명의 일부 실시태양들에 따라, 펩타이드 모방체는 레트로-인버소 모방체(retro-inverso mimetic)를 포함한다.
본 발명의 일부 실시태양들에 따라, 펩타이드는 SEQ ID NO: 26, 45 또는 46으로 나타내어진다.
본 발명의 일부 실시태양들에 따라, 펩타이드는 CD44V10 아미노산 서열로 이루어진다.
본 발명의 일부 실시태양들에 따라, CD44V10 아미노산 서열은 인간 CD44V10 아미노산 서열이다.
본 발명의 일부 실시태양들에 따라, CD44V6 아미노산 서열은 인간 CD44V6 아미노산 서열이다.
본 발명의 일부 실시태양들에 따라, 펩타이드는 코어 서열 X1-X2-S-H을 포함하며, X1 및 X2는 산성 아미노산이다.
본 발명의 일부 실시태양들에 따라, X1은 글루탐산을 포함한다.
본 발명의 일부 실시태양들에 따라, X2는 아스파르트산을 포함한다.
본 발명의 일부 실시태양들에 따라, 펩타이드는 CD44V6 아미노산 서열로 이루어진다.
본 발명의 일부 실시태양들에 따라, 펩타이드는 SEQ ID NO: 8-15, 18-45 또는 46으로 나타낸 아미노산 서열을 포함한다.
본 발명의 일부 실시태양들에 따라, 펩타이드는 SEQ ID NO: 49 또는 50으로 나타낸 아미노산 서열을 포함한다.
본 발명의 일부 실시태양들에 따라, 펩타이드는 SEQ ID NO: 2-7, 16 또는 17로 나타낸 아미노산 서열을 포함한다.
본 발명의 일부 실시태양들의 한 양태에 따라, 신경퇴행성 질환을 치료하는데 사용하기 위한, CD44V6 아미노산 서열의 적어도 3개의 아미노산 및 CD44V6 아미노산 서열의 100개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드가 제공된다.
본 발명의 일부 실시태양들에 따라, 신경퇴행성 질환은 파킨슨병, 다발성 경화증, ALS, 다계통위축증, 알츠하이머병, 뇌졸중, 외상성 뇌 손상, 진행성 핵성 마비, 염색체 17번과 관련된 파킨슨증을 가진 전두측두엽 치매 및 피크병으로 이루어진 그룹으로부터 선택된다.
본 발명의 일부 실시태양들에 따라, 신경퇴행성 질환은 파킨슨병이다.
본 발명의 일부 실시태양들에 따라, 신경퇴행성 질환은 알츠하이머병이다.
본 발명의 일부 실시태양들에 따라, 펩타이드는 SEQ ID NO: 12, 15, 17, 19, 24, 26, 31, 32, 34, 36-38, 43-46으로 이루어진 그룹으로부터 선택된 아미노산 서열을 포함한다.
본 발명의 일부 실시태양들에 따라, 펩타이드는 SEQ ID NO: 26 또는 45로 나타낸 아미노산 서열을 포함한다.
본 발명의 일부 실시태양들의 한 양태에 따라, 활성제로서 CD44V6 아미노산 서열의 적어도 3개의 아미노산 및 CD44V6 아미노산 서열의 100개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드 및 약학적으로 유효한 담체를 포함하는 약학적 조성물이 제공된다.
본 발명의 일부 실시태양들에 따라, 펩타이드는 세포 침투제에 부착된다.
본 발명의 일부 실시태양들에 따라, 아미노산의 적어도 하나는 천연 발생 아미노산이다.
본 발명의 일부 실시태양들에 따라, 아미노산의 적어도 하나는 합성 아미노산이다.
본 발명의 일부 실시태양들에 따라, 합성 아미노산은 D 이성질체를 포함한다.
본 발명의 일부 실시태양들에 따라, 분리된 펩타이드는 세포 침투제에 공유결합으로 부착된다.
본 발명의 일부 실시태양들에 따라, 세포 침투제는 펩타이트제이다.
본 발명의 일부 실시태양들에 따라, 펩타이드는 20개 아미노산보다 길지 않다.
본 발명의 일부 실시태양들에 따라, 펩타이드는 길이가 5-10개 아미노산이다.
본 발명의 일부 실시태양들의 한 양태에 따라, 신경퇴행성 질환을 치료하는데 유용한 물질을 선택하는 방법이 제공되며, 이 방법은:
(a) 신경 독소의 존재하에서 CD44v10/6 펩타이드를 신경 세포들과 접촉시키는 단계; 및
(b) 신경 세포들의 세포 사망을 관찰하는 단계를 포함하며, CD44v10/6 펩타이드의 부존재하에서 신경 세포들의 세포 사망의 양 또는 시간과 비교된 CD44v10/6 펩타이드의 존재하에서 신경 세포들의 세포 사망의 양 또는 시간의 감소는 신경퇴행성 질환을 치료하는데 유용한 물질임을 나타낸다.
본 발명의 일부 실시태양에 따라, 신경 독소는 아밀로이드 펩타이드, 글루타메이트, 6-OHDA, MPTP 및 MPP+로 이루어진 그룹으로부터 선택된다.
본 발명의 일부 실시태양에 따라, 투여는 피하 투여를 포함한다.
본 발명의 일부 실시태양에 따라, 투여는 비강내 투여를 포함한다.
달리 정의하지 않는 한, 본 발명에 사용된 모든 기술적 및/또는 과학적 용어들은 본 발명이 속하는 기술분야의 당업자가 일반적으로 이해한 것과 동일한 의미를 가진다. 비록 본 발명에 기술된 것들과 유사하거나 동일한 방법들과 재료들이 본 발명의 실시태양들의 실시 또는 테스트에 사용될 수 있지만, 예시적 방법들 및/또는 재료들이 이하에 기술된다. 불일치의 경우, 정의를 포함하는 특허 명세서가 확인할 것이다. 또한, 재료들, 방법들 및 실시예들은 단지 예시적이며 필수적으로 제한하려는 것이 아니다.
본 발명의 내용 중에 포함되어 있다.
본 발명의 일부 실시태양들은 첨부된 도면들을 참조하여 단지 예로서 본 발명에 기술된다. 이제 도면들을 상세하게 구체적으로 참조하여, 도시된 상세한 사항들은 예시적이며 본 발명의 실시태양들의 설명적 논의를 위한다는 것이 강조된다. 이와 관련하여, 도면들과 함께 설명은 어떻게 본 발명의 실시태양들이 실시될 수 있는지 당업자에게 명백하게 한다.
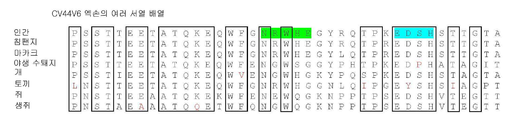
도 1a-b는 다양한 포유류 유기체의 단백질 서열들을 나타내는 CD44V6(도 1a) 및 CD44V10(도 1b)의 여러 단백질 서열 배열이다. 배열은 단백질 블라스트 알고리즘 온라인(NCBI)을 사용하여 이루어졌다. 종들의 임의의 것에서 최대 하나의 비-보존 치환이 있는 보존 잔기들은 박스로 표시된다. 보존 잔기들에서 비-보존 치환은 적색 글자로 표시된다.
도 2는 도 1에 표시된 보존 영역에 따라 합성이 유도된 V6(생쥐) 및 V10(인간)의 목록을 도시한다.
도 3은 48시간 동안 80μM Aβ(1-42)에 의한 처리 이후, SK-N-SH 인간 신경모세포종 세포들의 생존 능력에 대한 3배 농도의 V6 및 V10 펩타이드의 효과를 도시하는 막대 그래프이다. 세포 생존 능력은 XTT 비색계 분석법을 사용하여 측정하였다.
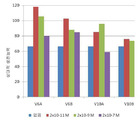
도 4a-b는 48시간 동안 25μM Aβ(25-35)에 의한 처리 이후, N2A 생쥐 신경모세포종 세포들의 생존 능력에 대한 1nM의 V6 및 V10 펩타이드의 효과를 도시하는 막대 그래프이다. (도 4a) XTT에 의해 측정된 상대 세포 생존능력 및 (도 4b) 상대 카스파제 3 활성 수준이 도시된다.
도 5a-b는 48시간 동안 200μM MPTP에 의한 처리 이후, N2A 생쥐 신경모세포종 세포들의 생존 능력에 대한 1μM의 V6 및 V10 펩타이드의 효과를 도시하는 막대 그래프이다. XTT에 의해 측정된 상대 세포 생존능력(도 5a) 및 상대 카스파제 3 활성 수준(도 5b)이 도시된다.
도 6a-c는 48시간 동안 30μM에 의한 처리 이후, 표 1과 도 2에 나열된 인간 V6 및 V10 펩타이드의 효과를 도시하는 그래프이다. 상대 생존 능력(도 6a) 및 카스파제 3 활성(도 6b)이 도시된다. (도 6c) N2A 세포들에서 30μM 6-OHDA에 대한 N-아세틸화 및 C-아미드화 V10A1_N+4 펩타이드의 보호 효과를 다양한 농도에서 테스트하였다. 알라마 블루 형광(alamar blue fluorescence)에 의해 측정된 상대 생존 능력이 도시된다.
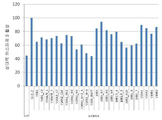
도 7a-b는 48시간 동안 25μM Aβ(25-35)에 의한 처리 이후, SK-N-SH 인간 신경모세포종 세포들의 생존 능력에 대한 1 pM에서 표 1 및 도 2에 나열된 인간 V6 및 V10 펩타이드의 효과를 도시하는 막대 그래프이다. 알라마 블루 형광에 의해 측정된 상대 생존 능력(도 7a) 및 카스파제 3 활성(도 7b)이 도시된다.
도 8a-b는 22시간 동안 30μM 6-OHDA(도 8a) 또는 40μM(도 8b)에 의한 처리 이후, N2A 생쥐 신경모세포종 세포들의 생존 능력에 대한 10 fM 및 1 pM에서 표 3에 나열된 인간 P26-유도 펩타이드의 효과를 도시하는 막대 그래프이다. 도 8b에서 세포들은 6-OHDA의 첨가 이전 2.3시간 동안 펩타이드에 의한 선 배양된 반면, 도 8a에서, 6-OHDA는 펩타이드와 함께 첨가되었다. 알라마 블루 형광에 의해 측정된 상대 생존 능력이 도시된다.
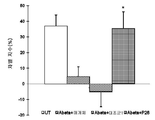
도 9는 새로운 물체 인식(NOR) 작업에서 기억 테스트 단계에 대한 차별 지수(discrimination index)에 대한 P26(SEQ ID NO: 26, 1, 10 및 100 ng/rat) 또는 P34(SEQ ID NO: 34, 10 및 100 ng/rat)의 반복 IH/ICV 투여의 효과를 도시하는 막대 그래프이다. **매개체(vehicle)에 의한 P<0.01 Aβ(1-42) 대 대조군(Aβ(1-42) 없음) ##P<0.01 대 매개체 대조군.
도 10a-b는 Aβ 미세주사 이후 모리스 수중 미로(MWM) 공간 기억 분석법에 대한 피하(SC) 투여 펩타이드의 효과를 도시하는 그래프이다. a., MWM에서 4개 트레이닝 세션을 거친 평균 잠복기. 펩타이드-처리 그룹 중에서, P26 그룹은 매개체 그룹과 비교된 더 낮은 수준의 평균 잠복기를 나타내었다(2, 3 및 4일에 # p<0.001). b. 테스트 세션에 대한 표적 사분면에서 소비한 시간을 도시한다. P26 그룹은 매개체 그룹과 비교된 표적 사분면에서 소비한 더 높은 수준의 시간을 도시하였다(# p<0.05). UT - 미처리된 그룹.
도 11은 Aβ 미세주사 이후 NOR 분석법에 대한 SC 투여된 펩타이드의 효과를 도시하는 막대 그래프이다. 기억 테스트 단계에 대한 차별 지수가 도시된다. * P<0.05 대 대조군 및 # p<0.05 대 Aβ 유일 그룹.
도 12는 수컷 쥐(Sprague Dawley rats)에서 1mg/kg의 복용량으로 펩타이드 용액의 피하 투여 이후 평가된 P26(SEQ ID NO: 26) 및 P26-RI(SEQ ID NO: 45)의 약물 생체 반응학을 도시하는 그래프이다. LC-MS/MS 방법이 혈장 샘플들에서 두 펩타이드의 정량화를 위해 사용되었다. 정량화의 하한(LLOQ)은 22.34ng/mL이었다.
도 13은 CD44의 게놈 구조의 개략적 설명이다.
도 1a-b는 다양한 포유류 유기체의 단백질 서열들을 나타내는 CD44V6(도 1a) 및 CD44V10(도 1b)의 여러 단백질 서열 배열이다. 배열은 단백질 블라스트 알고리즘 온라인(NCBI)을 사용하여 이루어졌다. 종들의 임의의 것에서 최대 하나의 비-보존 치환이 있는 보존 잔기들은 박스로 표시된다. 보존 잔기들에서 비-보존 치환은 적색 글자로 표시된다.
도 2는 도 1에 표시된 보존 영역에 따라 합성이 유도된 V6(생쥐) 및 V10(인간)의 목록을 도시한다.
도 3은 48시간 동안 80μM Aβ(1-42)에 의한 처리 이후, SK-N-SH 인간 신경모세포종 세포들의 생존 능력에 대한 3배 농도의 V6 및 V10 펩타이드의 효과를 도시하는 막대 그래프이다. 세포 생존 능력은 XTT 비색계 분석법을 사용하여 측정하였다.
도 4a-b는 48시간 동안 25μM Aβ(25-35)에 의한 처리 이후, N2A 생쥐 신경모세포종 세포들의 생존 능력에 대한 1nM의 V6 및 V10 펩타이드의 효과를 도시하는 막대 그래프이다. (도 4a) XTT에 의해 측정된 상대 세포 생존능력 및 (도 4b) 상대 카스파제 3 활성 수준이 도시된다.
도 5a-b는 48시간 동안 200μM MPTP에 의한 처리 이후, N2A 생쥐 신경모세포종 세포들의 생존 능력에 대한 1μM의 V6 및 V10 펩타이드의 효과를 도시하는 막대 그래프이다. XTT에 의해 측정된 상대 세포 생존능력(도 5a) 및 상대 카스파제 3 활성 수준(도 5b)이 도시된다.
도 6a-c는 48시간 동안 30μM에 의한 처리 이후, 표 1과 도 2에 나열된 인간 V6 및 V10 펩타이드의 효과를 도시하는 그래프이다. 상대 생존 능력(도 6a) 및 카스파제 3 활성(도 6b)이 도시된다. (도 6c) N2A 세포들에서 30μM 6-OHDA에 대한 N-아세틸화 및 C-아미드화 V10A1_N+4 펩타이드의 보호 효과를 다양한 농도에서 테스트하였다. 알라마 블루 형광(alamar blue fluorescence)에 의해 측정된 상대 생존 능력이 도시된다.
도 7a-b는 48시간 동안 25μM Aβ(25-35)에 의한 처리 이후, SK-N-SH 인간 신경모세포종 세포들의 생존 능력에 대한 1 pM에서 표 1 및 도 2에 나열된 인간 V6 및 V10 펩타이드의 효과를 도시하는 막대 그래프이다. 알라마 블루 형광에 의해 측정된 상대 생존 능력(도 7a) 및 카스파제 3 활성(도 7b)이 도시된다.
도 8a-b는 22시간 동안 30μM 6-OHDA(도 8a) 또는 40μM(도 8b)에 의한 처리 이후, N2A 생쥐 신경모세포종 세포들의 생존 능력에 대한 10 fM 및 1 pM에서 표 3에 나열된 인간 P26-유도 펩타이드의 효과를 도시하는 막대 그래프이다. 도 8b에서 세포들은 6-OHDA의 첨가 이전 2.3시간 동안 펩타이드에 의한 선 배양된 반면, 도 8a에서, 6-OHDA는 펩타이드와 함께 첨가되었다. 알라마 블루 형광에 의해 측정된 상대 생존 능력이 도시된다.
도 9는 새로운 물체 인식(NOR) 작업에서 기억 테스트 단계에 대한 차별 지수(discrimination index)에 대한 P26(SEQ ID NO: 26, 1, 10 및 100 ng/rat) 또는 P34(SEQ ID NO: 34, 10 및 100 ng/rat)의 반복 IH/ICV 투여의 효과를 도시하는 막대 그래프이다. **매개체(vehicle)에 의한 P<0.01 Aβ(1-42) 대 대조군(Aβ(1-42) 없음) ##P<0.01 대 매개체 대조군.
도 10a-b는 Aβ 미세주사 이후 모리스 수중 미로(MWM) 공간 기억 분석법에 대한 피하(SC) 투여 펩타이드의 효과를 도시하는 그래프이다. a., MWM에서 4개 트레이닝 세션을 거친 평균 잠복기. 펩타이드-처리 그룹 중에서, P26 그룹은 매개체 그룹과 비교된 더 낮은 수준의 평균 잠복기를 나타내었다(2, 3 및 4일에 # p<0.001). b. 테스트 세션에 대한 표적 사분면에서 소비한 시간을 도시한다. P26 그룹은 매개체 그룹과 비교된 표적 사분면에서 소비한 더 높은 수준의 시간을 도시하였다(# p<0.05). UT - 미처리된 그룹.
도 11은 Aβ 미세주사 이후 NOR 분석법에 대한 SC 투여된 펩타이드의 효과를 도시하는 막대 그래프이다. 기억 테스트 단계에 대한 차별 지수가 도시된다. * P<0.05 대 대조군 및 # p<0.05 대 Aβ 유일 그룹.
도 12는 수컷 쥐(Sprague Dawley rats)에서 1mg/kg의 복용량으로 펩타이드 용액의 피하 투여 이후 평가된 P26(SEQ ID NO: 26) 및 P26-RI(SEQ ID NO: 45)의 약물 생체 반응학을 도시하는 그래프이다. LC-MS/MS 방법이 혈장 샘플들에서 두 펩타이드의 정량화를 위해 사용되었다. 정량화의 하한(LLOQ)은 22.34ng/mL이었다.
도 13은 CD44의 게놈 구조의 개략적 설명이다.
본 발명의 일부 실시태양들에서, 본 발명은 신경보호 펩타이트 물질 및 이의 용도에 관한 것이다.
본 발명의 적어도 하나의 실시태양을 상세하게 설명하기 전에, 본 발명은 다음 설명에서 나타낸 또는 실시예들에 의해 예시된 세부내용에 본 발명의 응용분야를 필수적으로 제한되지 않는다는 것이 이해돼야 한다. 본 발명은 다른 실시태양들일 수 있거나 다양한 방식으로 실시되거나 실행될 수 있다.
스플라이스 변형체 CD44V3, CD44V6 및 CD44V10의 발현은 비-AD 개인과 비교된 AD 환자의 해마에서 현저하게 증가한 것으로 이미 발견되었다. CD44 변형체의 발현은 추가로 특징이 나타내어졌고 주로 뉴런성인 것으로 발견되었다[23].
본 발명자들은 CD44 V6 및 V10 엑손 서열로부터 유도된 여러 펩타이드의 기능의 특징을 나타내었고 이런 펩타이드들은 신경 세포들에게 베타 아밀로이드(Aβ), MPTP 및 6-OHDA와 같은 신경 독소로부터의 저항력을 부여한다는 것을 발견하였고, 이런 펩타이드 또는 유도체는 신경퇴행성 질환의 치료를 위한 약물로서 역할을 할 수 있다는 것을 나타낸다.
본 발명자들은 신경보호를 제공하는 최소 활성 도메인을 밝혀내기 위해 구조-기능성 분석들을 실행하였다. 결과들은 파킨슨병 및 알츠하이머병에 대한 동물 모델에서 추가로 입증되었다. 이런 발견들은 본 발명의 펩타이드들을 약물 개발을 위한 선두 화합물들로 위치시킨다.
따라서, 본 발명의 한 양태에 따라, CD44V10 아미노산 서열의 적어도 3개 아미노산 및 상기 CD44V10 아미노산 서열의 20개 이하 아미노산을 포함하는 분리된 펩타이드가 제공되며 펩타이드는 신경보호 활성을 포함한다.
본 발명의 추가 또는 대안적 양태에 따라, CD44V6 아미노산 서열의 적어도 3개 아미노산 및 상기 CD44V6 아미노산 서열의 20개 이하 아미노산을 포함하는 분리된 펩타이드가 제공되며 펩타이드는 신경보호 활성을 포함한다.
한 실시태양에 따라, CD44V10 아미노산 서열은 서열:
DSTDRIPATIRNDVTGGRR (SEQ ID NO: 49); 또는
NSNVNRSLSGDQDTFHPSG (SEQ ID NO: 50)로 이루어지지 않는다.
다른 실시태양에 따라, CD44V6 아미노산 서열은 서열:
DSTDRIPATIQATPSSTTE (SEQ ID NO: 51); 또는
DSHSTTGTAGDQDTFHPSG (SEQ ID NO: 52)로 이루어지지 않는다.
SEQ ID NO: 49-52로 나타낸 아미노산 서열을 포함하는 펩타이드들은 이하에서 추가로 설명된 것과 같이 신경퇴행성 질환의 치료에 사용하는 것이 고려된다.
본 발명에서 사용된 대로 "CD44"는 RefSeq 수탁번호: NM_000610.3으로 나타낸 대로 큰 수의 포유류 세포 형태로 발현되는 세포 표면 단백질을 의미한다. 한 구체적인 실시태양에 따라 CD44는 인간 CD44 유전자이다. 엑손 1-5 및 16-20을 포함하는 CD44로 지정된 표준 아이소형은 대부분의 세포 형태에서 발현된다. 유전자 구조는 도 13에 제공되며 스플라이스 변형체 CD44V6 및 CD44V10의 구조를 포함한다.
본 발명에 사용된 대로, 용어 "CD44V10"은 SEQ ID NO: 53, RefSeq 수탁번호: NP_000601.3(인간 CD44 항원 아이소형 1 전구체, NCBI 참조 서열)의 아미노산 좌표(coordinates) 537-604에 해당하며 SEQ ID NO: 2로 예시된다.
본 발명에 사용된 대로, 용어 "CD44V6"은 SEQ ID NO: 53, RefSeq 수탁번호: NP_000601.3(인간 CD44 항원 아이소형 1 전구체, NCBI 참조 서열)의 아미노산 좌표(coordinates) 386-427에 해당하며 SEQ ID NO: 8로 예시된다.
본 발명에 사용된 대로, 문구 "신경보호 활성"은 신경 세포 사망의 예방을 의미한다. 효과는 세포자멸사 또는 퇴화로부터 신경 세포, 즉 뉴런의 보호 형태를 취할 수 있다. 신경보호 활성을 정량화하는 분석법은 세포 생존 능력 분석법(예를 들어, XTT, MTT), 형태학적 분석법(예를 들어, 세포 염색) 또는 세포자멸사 생화학적 분석법(예를 들어, 카스파제 3 활성 등)을 포함한다.
한 구체적인 실시태양에 따라, CD44V6 아미노산 서열은 인간 CD44V6 아미노산 서열이다.
한 구체적인 실시태양에 따라, CD44V10 아미노산 서열은 인간 CD44V10 아미노산 서열이다.
다른 구체적인 실시태양에 따라, 펩타이드는 CD44V6 아미노산 서열(SEQ ID NO: 2)로 이루어진다.
본 발명이 실시되는 것을 추가로 감소시키면서, 본 발명자들은 신경보호를 제공하는 펩타이드 부분(아미노산 서열)은 코어 서열 X1-X2-S-H를 포함한다는 것을 밝혀내었고, X1 및 X2는 산성 아미노산이다.
본 발명에 사용된 대로, 문구 "산성 아미노산"은 생리학적 pH에서 극성이고 음으로 하전되는 천연 발생 또는 합성 아미노산을 의미한다.
한 구체적인 실시태양에 따라, X1은 글루탐산을 포함한다.
한 구체적인 실시태양에 따라, X2는 아스파르트산을 포함한다.
한 구체적인 실시태양에 따라, 펩타이드는 SEQ ID NO: 6 또는 7의 아미노산 서열을 포함한다.
한 다른 실시태양에서, CD44V6는 CD44V6 아미노산 서열(SEQ ID NO: 2)로 이루어진다.
한 다른 실시태양에서, 펩타이드는 SEQ ID NO: 2-7, 16 또는 17로 나타낸 아미노산 서열을 포함한다.
상기한 대로, CD44V10의 펩타이드는 또한 본 발명에서 고려된다. 따라서, 한 예시적 실시태양에 따라, 펩타이드는 SEQ ID NO: 8-15, 18-46 또는 구체적으로, SEQ ID NO: 8-15, 18-38, 39-42 또는 43-46로 나타낸 아미노산 서열을 포함한다.
본 발명이 실시되는 것을 추가로 감소시키면서, 본 발명자들은 신경보호를 제공하는데 유효한 CD44V10의 최소 부분을 확인할 수 있었다.
따라서, 한 예시적 실시태양에 따라, CD44V10 펩타이드는 화학식 1의 아미노산 서열을 포함한다:
X1-G-Y-T-S,
여기서 X1은 글루탐산 또는 글루타민 중 하나이다.
이하에서 더욱 상세하게 기술될 것과 같이, 펩타이드의 아미노산 서열은 레트로-인버소 모방체와 같은 펩타이드 모방체(예를 들어, SEQ ID NO: 45 또는 46)를 포함한다.
한 예시적 실시태양에 따라, 펩타이드는 SEQ ID NO: 26으로 나타내어진다.
한 예시적 실시태양에 따라, 펩타이드는 SEQ ID NO: 26, 45 또는 46으로 나타내어진다.
한 구체적인 실시태양에 따라, 펩타이드는 CD44V10 아미노산 서열(SEQ ID NO: 8)로 이루어진다.
본 발명에서 사용된 용어 "펩타이드"는 천연 펩타이드(분해 생성물, 합성적으로 합성된 폴리펩타이드 또는 재조합 폴리펩타이드) 및 펩타이드 모방체(예를 들어, 인버소, 레트로 또는 레트로-인버소, 일반적으로, 합성적으로 합성된 펩타이드)를 포함하는 천연 또는 합성 아미노산의 폴리머 뿐만 아니라 예를 들어 신체에 있는 동안 펩타이드를 더욱더 안정하게 하는 변이를 가질 수 있거나 세포들 속으로 더욱 침투할 수 있는 폴리펩타이드 유사체인 펩토이드 및 세미펩토이드를 의미한다.
이런 변이는 N 말단 변이, C 말단 변이, CH2-NH, CH2-S, CH2-S=O, O=C-NH, CH2-O, CH2-CH2, S=C-NH, CH=CH 또는 CF=CH를 포함하나 이에 제한되지 않는 폴리펩타이드 결합 변이, 주쇄 변이 및 잔기 변이를 포함하나 이에 제한되지 않는다. 펩타이드 모방체를 제조하는 방법들은 당업계에 주지되어 있고, 예를 들어, 본 발명에 완전히 설명된 것과 같이 참조로 포함된 Quantitative Drug Design, C.A. Ramsden Gd., Chapter 17.2, F. Choplin Pergamon Press (1992)에 명시된다. 이와 관련하여 추가 세부내용은 이하에 제공된다.
폴리펩타이드 내 폴리펩타이드 결합(-CO-NH-)은, 예를 들어, N-메틸화 결합(-N(CH3)-CO-), 에스터 결합(-C(R)H-C-O-O-C(R)-N-), 케토메틸렌 결합(-CO-CH2-), α-아자 결합(-NH-N(R)-CO-)에 의해 대체될 수 있으며, R은, 예를 들어, 메틸인 임의의 알킬, 카바 결합(-CH2-NH-), 하이드록시에틸렌 결합(-CH(OH)-CH2-), 티오아마이드 결합(-CS-NH-), 올레핀성 이중 결합(-CH=CH-), 레트로 아마이드 결합(-NH-CO-), 폴리펩타이드 유도체(-N(R)-CH2-CO-)이며, R은 탄소 원자 상에 천연적으로 제공된 "보통" 측쇄이다.
이런 변이는 폴리펩타이드 사슬을 따라 결합들 중 임의의 것에서 그리고 동시에 여러 곳(2-3)에서 일어날 수 있다.
천연 방향족 아미노산, Trp, Tyr 및 Phe는 페닐글리신, 나프틸엘라닌(Nol), Phe의 고리 메틸화 유도체, Phe 또는 o-메틸-Tyr의 할로겐화 유도체로 대체될 수 있다.
상기 이외에, 본 발명의 폴리펩타이드는 하나 이상의 변형 아미노산 또는 하나 이상의 비-아미노산 모노머(예를 들어, 지방산, 착물 탄수화물 등)를 포함할 수 있다.
본 명세서 및 아래 청구항 부분에서 사용된 용어 "아미노산" 또는 "아미노산들"은 20개의 천연 발생 아미노산을 포함하는 것으로 이해된다; 이런 아미노산들은 주로 번역 후 인비보로 변형되며, 예를 들어, 하이드록시프롤린, 포스포세린 및 포스포트레오닌을 포함하며; 다른 예외적인 아미노산은 2-아미노아디프산, 하이드록시리신, 아이소데스모신, 노르-발린, 노르-류신 및 오르니틴을 포함하나 이에 제한되지 않는다. 또한, 용어 "아미노산"은 D- 및 L-아미노산(입체이성질체)을 포함한다.
아래 표 A 및 B는 본 발명과 함께 사용될 수 있는 천연 발생 아미노산(표 A) 및 예외적 또는 변형 아미노산(표 B)을 나열한다.
표 A
표 B
표 B 내용
본 발명의 펩타이드들의 아미노산들은 보존성으로 또는 비 보존성으로 치환될 수 있다.
본 발명에 사용된 용어 "보존성 치환"은 유사한 입체 특성들을 가진 천연 또는 비 천연 발생 아미노 또는 펩타이드 모방체에 의한 펩타이드에서 천연 서열에 존재하는 아미노산의 대체를 의미한다. 대체될 천연 아미노산의 측쇄가 극성이거나 소수성인 경우, 보존성 치환은 천연 발생 아미노산 비 천연 발생 아미노산 또는 극성 또는 소수성인(또한 대체된 아미노산의 측쇄와 동일한 입체 특성들을 가지는) 펩타이드 모방체와 이루어져야 한다.
천연 발생 아미노산들은 일반적으로 이들의 특성에 따라 분류되기 때문에, 천연 발생 아미노산들에 의한 보존성 치환은 본 발명에 따라 입체적으로 유사한 비 하전 아미노산들에 의한 하전된 아미노산들의 치환이 보존성 치환으로 생각된다는 사실을 기억함으로써 쉽게 결정될 수 있다.
비 천연 발생 아미노산들에 의한 보존성 치환을 일으키기 위해서, 당업계에 주지된 아미노산 유사체(합성 아미노산)를 사용하는 것이 가능하다. 천연 발생 아미노산의 펩타이드 모방체는 당업자에게 주지된 문헌에서 잘 입증된다.
보존성 치환에 영향을 미칠 때, 치환하는 아미노산은 최초 아미노산과 동일하거나 유사한 작용기를 측쇄에 가져야 한다.
본 발명에 사용된 문구 "비 보존성 치환"은 다른 전기화학적 및/또는 입체 특성들을 가진 다른 천연 또는 비 천연 발생 아미노산에 의한 모 서열에 존재하는 아미노산의 대체를 의미한다. 따라서, 치환하는 아미노산의 측쇄는 치환되는 천연 아미노산의 측쇄보다 현저하게 클 수 있고(또는 작을 수 있다) 및/또는 치환되는 아미노산과 현저하게 상이한 전기 특성들을 가진 작용기를 가질 수 있다. 이런 형태의 비 보존성 치환의 예들은 알라닌에 대한 페닐알라닌 또는 사이클로헥실메틸 글리신의 치환, 글리신에 대한 아이소류신의 치환 또는 아스파르트산에 대한 -NH-CH[(-CH2)5-COOH]-CO- 의 치환을 포함한다. 본 발명의 범위에 해당되는 이런 비 보존성 치환들은 신경보호 특성들을 가진 펩타이드를 여전히 구성하는 치환들이다.
언급한 대로, 본 발명의 펩타이드들의 N 및 C 말단은 작용기들에 의해 보호될 수 있다. 적절한 작용기들은 Green and Wuts, "Protecting Groups in Organic Synthesis", John Wiley and Sons, Chapters 5 and 7, 1991에 기술되며, 이의 교시는 참조로 본 발명에 포함된다. 바람직한 보호기들은, 예를 들어, 화합물들의 친수성을 감소시키고 친유성을 증가시킴으로써 이에 부착된 화합물의 세포 속으로의 수송을 촉진하는 것들이다.
이런 모이어티들은 세포 내에서, 가수분해에 의해 또는 효소에 의해, 세포 내에서 인비보 분열될 수 있다. 하이드록시 보호기들은 에스터, 카보네이트 및 카바메이트 보호기를 포함한다. 아민 보호기는 상기한 대로 N-말단 보호기로서 상기한 대로, 알콕시 및 아릴옥시 카본일기를 포함한다. 카복실산 보호기는 C-말단 보호기로서 상기한 대로, 지방족, 벤질 및 아릴 에스터를 포함한다. 한 실시태양에서, 본 발명의 펩타이드에서 하나 이상의 글루탐산 또는 아스파르트산 잔기의 측쇄에 있는 카복실산 그룹은 바람직하게는 메틸, 에틸, 벤질 또는 치환된 벤질 에스터로 보호된다.
N-말단 보호기의 예들은 아실기(-CO-R1) 및 알콕시 카본일 또는 아릴옥시 카본일기(-CO-O-R1)를 포함하며, R1은 지방족, 치환된 지방족, 벤질, 치환된 벤질, 방향족 또는 치환된 방향족기를 포함한다. 아실기의 구체적인 예들은 아세틸, (에틸)-CO-, n-프로필-C0-, iso-프로필-CO-, n-부틸-CO-, sec-부틸-CO-, t-부틸-CO-, 헥실, 라우로일, 팔미톨일, 미리스토일, 스테아릴, 올레오일, 페닐-CO-, 치환된 페닐-CO-, 벤질-CO- 및 (치환된 벤질)-CO-를 포함한다. 알콕시 카본일 및 아릴옥시 카본일기의 예들은 CH3-O-CO-, (에틸)-O-CO-, n-프로필-O-CO-, iso-프로필-O-CO-, n-부틸-O-CO-, sec-부틸-O-CO-, t-부틸-O-CO-, 페닐-O-CO-, 치환된 페닐-O-CO- 및 벤질-O-CO-, (치환된 벤질)-O-CO-을 포함한다. 아다만탄, 나프탈렌, 미리스톨레일, 톨루엔, 바이페닐, 시나모일, 나이트로벤조일, 톨루오일, 퓨로일, 벤조일, 사이클로헥세인, 노르보넨, Z-카프로익. N-아실화를 촉진하기 위해서, 1개 내지 4개 글리신 잔기들이 분자의 N-말단에 존재할 수 있다.
화합물의 C-말단에서 카복실기는, 예를 들어, 아마이드(즉, C-말단에서 하이드록실기는 -NH2, -NHR2 및 -NR2R3로 대체된다) 또는 에스터(즉, C-말단에서 하이드록실기는 -OR2로 대체된다)에 의해 보호될 수 있다. R2 및 R3는 독립적으로 지방족, 치환된 지방족, 벤질, 치환된 벤질, 아릴 또는 치환된 아릴기이다. 또한, 질소 원자와 함께 고려하면, R2 및 R3는 질소, 산소 또는 황과 같은 약 0-2개 추가 이형원자에 의해 C4 내지 C8 헤테로사이클릭 고리를 형성할 수 있다. 적절한 헤테로사이클릭 고리의 예들은 피페리딘일, 피롤리딘일, 모르폴리노, 티오모르폴리노 또는 피페라진일을 포함한다. C-말단 보호기의 예들은 -NH2, -NHCH3, -N(CH3)2, -NH(에틸), -N(에틸)2, -N(메틸)(에틸), -NH(벤질), -N(C1-C4 알킬)(벤질), -NH(페닐), -N(C1-C4 알킬)(페닐), -OCH3, -O-(에틸), -O-(n-프로필), -O-(n-부틸), -O-(iso-프로필), -O-(sec-부틸), -O-(t-부틸), -O-벤질 및 -O-페닐을 포함한다.
중요한 것은, (상기한 대로, CD44V6, CD44V10로부터 유래된) 본 발명의 펩타이드는 일반적으로 본 발명의 CD44 펩타이드로 불린다.
본 발명의 CD44 펩타이드(즉, 신경보호 펩타이드 부분)는 길이가 3-100 또는 3-50 또는 3-40 또는 3-30개 아미노산이다. 다른 실시태양에 따라, 펩타이드는 길이가 3-20, 5-20, 5-20, 5-18, 5-15, 5-10, 7-10, 8-10개 아미노산이다.
본 발명의 CD44 펩타이드는 상기한 대로 신경보호 및 신경퇴행성 조건을 위한 인비트로 및 인비보 모델을 사용하여 이어지는 실시예에서 이들의 신경보호 활성에 적합할 수 있다.
본 교시들은 신경퇴행성 질환을 치료하는데 유용한 물질들의 확인에 추가로 사용될 수 있다.
따라서, 다음을 포함하는 방법이 제공된다:
(a) 신경 독소의 존재하에서 CD44v10/6 펩타이드를 신경 세포들과 접촉시키는 단계; 및
(b) 신경 세포들의 세포 사망을 관찰하는 단계를 포함하며, CD44v10/6 펩타이드의 부존재하에서 신경 세포들의 세포 사망의 양 또는 시간과 비교된 CD44v10/6 펩타이드의 존재하에서 신경 세포들의 세포 사망의 양 또는 시간의 감소는 신경퇴행성 질환을 치료하는데 유용한 물질임을 나타낸다.
신경 세포 사망을 관찰하는 방법들은 당업계에 주지되어 있고 (신경보호 하에서) 위에 추가로 기술되며 이어지는 실시예 부분에서 추가로 기술된다.
본 발명에 사용된 신경 독소는 일반적으로 뉴런들을 죽임으로써 신경계 및/또는 뇌를 손상시키는 분자를 의미한다.
한 구체적인 실시태양에 따라, 신경 독소는 아밀로이드, 글루타메이트, 6-OHDA, MPTP AND MPP+로 이루어진 그룹으로부터 선택된다.
CD44 펩타이드의 생체이용률을 개선하기 위해서, 펩타이드에 있는 단일, 부분 또는 심지어 모든 아미노산은 효소적 단백질분해 활성에 영향을 쉽게 받지 않는 D 아미노산일 수 있고 의약으로서 본 발명의 펩타이드의 사용을 전적으로 개선할 수 있다. 본 발명의 펩타이드는 침투제에 (공유결합적으로 또는 비 공유결합적으로) 부착될 수 있다.
본 발명에 사용된 대로 문구 "침투제"는 세포막을 가로질러 부착된 펩타이드의 임의의 것의 전위를 높이는 물질을 의미한다.
한 실시태양에 따라, 침투제는 펩타이드이며 펩타이드 결합을 통해 (공유결합적으로 또는 비 공유결합적으로) CD44 펩타이드에 부착된다.
통상적으로, 펩타이드 침투제는 리신 또는 아르기닌과 같은 높은 상대적으로 다량의 양으로 하전된 아미노산을 포함하는 아미노산 조성물을 갖거나 극성/하전 아미노산 및 비 극성, 소수성 아미노산의 교대하는 패턴을 포함하는 서열들을 가진다.
비 제한적인 실시예를 통해서, 세포 침투 펩타이드(CPP) 서열들이 세포내 침투를 높이기 위해 사용될 수 있다. CPP는 HIV TAT 단백질 [YGRKKRR (SEQ ID NO: 54), YGRKKRRQRRR (SEQ ID NO: 55), 또는 RRQRR (SEQ ID NO: 56)]의 단백질 형질전환 도메인(PTD)의 짧고 긴 버젼을 포함할 수 있다. 그러나, 설명은 그렇게 제한적이지 않으며, 당업자에 의해 공지된 대로, 임의의 적절한 침투제가 사용될 수 있다.
한 특정 실시태양에 따라, 본 발명의 펩타이드 컨쥬게이트들은 25, 30 또는 40개 아미노산보다 길지 않다(이것은 상기한 대로 세포 침투제와 같은 임의의 추가로 부착된 서열과 함께 CD44 펩타이드를 포함한다).
본 발명의 펩타이드는, 예를 들어, 펩타이드에 부착된 소수성 모이어티(다양한 직선형, 가지형, 고리형, 폴리사이클릭 또는 헤테로사이클릭 탄화수소 및 탄화수소 유도체)와 같은 비 아미노산 모이어티; 비 펩타이드 침투제; 특히 화합물이 직선형일 때, 분해를 감소시키도록 화합물의 말단에 부착된 다양한 보호기를 포함할 수 있다. 화합물에 존재하는 화학적(비 아미노산) 그룹들은 감소된 분해 또는 클리어런스(clearance); 다양한 세포 펌프에 의한 감소된 반발력, 향상된 유전면역 활성, 향상된 다양한 투여 방식(내장 등을 통한 다양한 장벽을 통한 투과를 허용하는 다양한 서열들의 부착); 증가된 특이성, 증가된 친화도, 감소된 독성 등과 같은 다양한 생리학적 특성을 개선하도록 포함될 수 있다.
본 발명의 펩타이드들의 아미노산 서열 성분을 다른 비 아미노산 물질들에 부착시키는 것은 공유 결합, 예를 들어, 분해 또는 절단되어 지속적으로 방출할 수 있는 화합물을 생산하는 소수성 폴리머에 대한 착화(complexion)와 같은 비 공유 착화; 리포솜 또는 미셀에 펩타이드의 아미노산 부분의 포획에 의할 수 있고 본 발명의 최종 펩타이드를 생산한다. 결합은 다른 성분(리포좀, 미셀) 내에 아미노산 서열의 포획 또는 폴리머 내에 아미노산 서열의 침지에 의할 수 있고 본 발명의 최종 펩타이드를 생산한다.
본 발명의 펩타이드들은 직선형 또는 고리형일 수 있다(고리화는 안정성을 향상시킬 수 있다). 고리화는 당업계에 공지된 임의의 수단에 의해 일어날 수 있다. 화합물이 주로 아미노산으로 구성되는 경우, 고리화는 N- 대 C-말단, N-말단 대 측쇄 및 N-말단 대 주쇄, C-말단 대 측쇄, C-말단 대 주쇄, 측쇄 대 주쇄 및 측쇄 대 측쇄뿐만 아니라 주쇄 대 주쇄 고리화를 통해 일어날 수 있다. 펩타이드의 고리화는 펩타이드에 포함된 비 아미노산 유기 모이어티를 통해 일어날 수 있다.
본 발명의 펩타이드는 표준 고체상 기술들을 사용함으로써 생화학적으로 합성될 수 있다. 이런 방법들은 배타적 고체상 합성, 부분 고체상 합성 방법, 단편 응축, 전통적인 용액 합성을 포함한다. 고체상 폴리펩타이드 합성 절차들은 당업계에 주지되어 있고 John Morrow Stewart and Janis Dillaha Young, Solid Phase Polypeptide Syntheses (2nd Ed., Pierce Chemical Company, 1984)에 추가로 기술된다.
대용량 펩타이드 합성은 Andersson Biopolymers 2000;55(3):227-50에 기술된다.
합성 펩타이드들은 분취용 고성능 액체 크로마토그래피[Creighton T. (1983) Proteins, structures and molecular principles. WH Freeman and Co. N.Y.]에 의해 정제될 수 있고 이의 조성물은 아미노산 서열화를 통해 확인될 수 있다.
재조합 기술들이 본 발명의 펩타이드들을 생성하는데 사용될 수 있다. 재조합 기술을 사용하여 본 발명의 펩타이드를 생산하기 위해서, 본 발명의 펩타이드를 암호화하는 폴리뉴클레오티드는 숙주 세포들에서 본 발명의 폴리펩타이드들의 구조성, 조직 특이적 또는 유도성 전사를 명령하는데 적합한 cis-조절 서열(예를 들어, 프로모터 서열)의 전사 제어하에서 폴리뉴클레오티드 서열을 포함하는 핵산 발현 벡터 속에 결찰된다.
숙주 세포들에서 합성될 수 있는 것 이외에, 본 발명의 폴리펩타이드들은 인비트로 발현 시스템을 사용하여 합성될 수 있다. 이런 방법들은 당업계에 주지되어 있고 시스템의 구성요소들은 상업적으로 구입할 수 있다.
언급한 대로, 신경보호 기능 때문에, 본 발명의 펩타이드들은 신경퇴행성 질환을 치료하는데 사용될 수 있다.
본 발명의 한 양태에 따라, CD44V10 아미노산 서열의 적어도 3개의 아미노산 및 CD44V10 아미노산 서열의 20개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드의 치료적 유효량을 대상에게 투여하는 단계를 포함하여, 신경퇴행성 질환을 치료하는 치료가 필요한 대상의 신경퇴행성 질환을 치료하는 방법이 제공된다.
본 발명의 다른 양태에 따라 CD44V6 아미노산 서열의 적어도 3개의 아미노산 및 CD44V6 아미노산 서열의 20개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드의 치료적 유효량을 대상에게 투여하는 단계를 포함하여, 신경퇴행성 질환을 치료하는 치료가 필요한 대상의 신경퇴행성 질환을 치료하는 방법이 제공된다.
본 발명에 사용된 대로, 문구 "치료가 필요한 대상" 또는 "대상"은 신경 손상을 겪고 있거나 신경 손상이 나타날 위험에 있는 임의의 나이에 있는 포유류, 바람직하게는 인간을 의미한다.
본 발명에 사용된 대로, 문구 "신경 손상"은 신경 세포들 및/또는 신경교 세포들의 급성 및/또는 진행성 손상 및/또는 손실을 특징으로 하는 임의의 질병, 질환 또는 이상을 의미한다.
본 발명의 일부 실시태양들에 따라, 신경 손상과 관련된 병변은 중추 신경계에서 신경 세포 및/또는 신경교 세포에 영향을 준다.
신경 세포들에 대한 급성 또는 돌연 손상에 의해 유발된 병변들의 비 제한적인 예들은 뇌 손상, 척추 손상, 머리 손상 및 뇌졸중[뇌혈관 사고(CVA)]을 포함한다.
본 발명의 일부 실시태양들에 따라, 신경 손상과 관련된 병변은 암이다. 신경 및 신경교 세포들에 영향을 미치는 암들의 비 제한적인 예들은 뇌의 교모세포종, 신경모세포종, 샘암종뿐만 아니라 유방암, 폐암 등과 같은 원격 암의 전이를 포함한다.
본 발명의 일부 실시태양들에 따라, 신경 손상과 관련된 병변은 만성적이다.
본 발명의 일부 실시태양들에 따라, 신경 손상과 관련된 병변은 신경퇴행성 질환이다.
예시적 신경퇴행성 질환 또는 이상은 다계통위축증, 뇌졸중, 진행성 핵성 마비, 염색체 17번과 관련된 파킨슨증을 가진 전두측두엽 치매, 외상성 뇌 손상(TBI), 피크병, 다발성 경화증, 피부황반성루푸스, 알츠하이머병, 파킨슨병, 노인성 치매, 근위축성측색경화증, 다운증후군, 네덜란드형 유전성 뇌출혈 아밀로이드증, 반응성 아밀로이드증, 가족성지중해열, 두드러기 및 청각장애를 동반한 가족성아밀로이드신경병증, 머클-웰스 증후군, 다발성 골수종, 거대글로불린혈증 관련 골수종, 가족성아밀로이드신경병증, 가족성심장근육병증, 단발성 심장 아밀로이드증, 전신 노인성 아밀로이드증, 성인 개시 당뇨병, 인슐린 종, 단발성 심방 아밀로이드증, 갑상선 수질암, 가족성아밀로이드증, 아밀로이드증을 동반한 유전성 뇌출혈, 가족성아말로이드다발신경병증, 스크래피, 크로이츠펠트-야콥병, 게르스트만-슈트로이슬러-샤인커병, 소해면상뇌병증, 프리온 매개 질병 및 헌팅턴병을 포함하나 이에 제한되지 않는다.
한 구체적인 실시태양에 따라, 신경퇴행성 질환은 알츠하이머병이다.
한 구체적인 실시태양에 따라, 신경퇴행성 질환은 파킨슨병이다.
본 발명의 펩타이드들은 자체로 제공될 수 있거나 적절한 담체 또는 부형제와 혼합되어 약학적 조성물의 일부로서 제공될 수 있다.
본 발명에 사용된 대로 "약학적 조성물"은 생리학적으로 적절한 담체 및 부형제와 같은 다른 화학적 구성요소들과 함께 본 발명에 기술된 하나 이상의 활성 성분의 제제를 의미한다. 약학적 조성물의 목적은 유기체 대한 화합물의 투여를 촉진하는 것이다.
본 발명에서 용어 "활성 성분"은 생물학적 효과에 책임이 있는 펩타이드를 의미한다.
이하에서, 서로 교환하여 사용될 수 있는 문구 "생리학적으로 허용가능한 담체" 및 "약학적으로 허용가능한 담체"는 유기체에 현저한 자극을 일으키지 않고 투여된 화합물의 생물학적 활성과 특성을 폐기하지 않는 담체 또는 희석제를 의미한다.
본 발명에서 용어 "부형제"는 활성 성분의 투여를 더 촉진하기 위해 약학적 조성물에 첨가된 불활성 물질을 의미한다. 제한 없는 부형제들의 예들은 탄산칼슘, 인산칼슘, 다양한 당 및 전분, 셀룰로오스 유도체, 젤라틴, 식물성 오일 및 폴리에틸렌 글리콜 형태를 포함한다.
약물의 제제화 및 투여에 대한 기술들은 참조로 본 발명에 포함된 "Remington's Pharmaceutical Sciences," Mack Publishing Co., Easton, PA, 최신판에서 발견할 수 있다.
적절한 투여 경로들은, 예를 들어, 경구, 직장, 점막투과, 특히 비강투과, 장내 또는 근육내, 피하 및 골수내 주사를 포함하는 비 경구 전달뿐만 아니라 경막내, 직접 뇌실내, 예를 들어, 우심방 또는 좌심방 속으로 심장내, 총 관상동맥 속으로, 정맥내, 복강내, 비강내 또는 안구내 주사를 포함할 수 있다.
이어지는 실시예들 부분에서 충분히 기술한 대로, 본 발명의 펩타이드들은 각각이 본 발명에서 고려되고, 필수적으로 국소 방식의 투여를 제공하는, 해마내(IH), 뇌실내(ICV), 두개내(IC) 또는 경막내 투여에 의해 뇌 속에 직접 투여될 때 알츠하이머병 및 파킨슨병에 대해 보호할 수 있었다.
중추신경계(CNS)에 대한 약물 전달에 대한 통상적인 방법들은 신경외과적 전략(예를 들어, 뇌내 주사 또는 뇌실내 주입); BBB의 내인성 수송 경로들 중 하나를 이용하려는 시도에서 물질의 분자 조작(예를 들어, BBB를 자체로 가로지를 수 있는 물질과 조합하여 내피 세포 표면 분자에 대한 친화력을 갖는 수송 펩타이드를 포함하는 키메릭 융합 단백질의 생산); 물질의 지질 용해도를 증가시키도록 설계된 약동학적 전략(예를 들어, 수용성 물질들의 지질 또는 콜레스테롤 담체에 대한 접합); 및 (경동맥 속으로 만니톨 용액의 주입 또는 안지오텐신 펩타이드와 같은 생물학적으로 활성인 물질의 사용으로부터 기인한) 과삼투압 파열에 의한 BBB의 무결성의 일시적 파열을 포함한다. 그러나, 이런 전략들의 각각은 침습성 수술 절차와 관련된 고유한 위험, 내인성 수송 시스템에 고유한 제한에 의해 부과된 크기 제한, CNS의 활성 외부일 수 있는 담체 모티프로 구성된 키메릭 분자의 전신 투여와 관련된 효과적으로 바람직하지 않은 생물학적 부작용, 및 BBB가 파열될 때 뇌의 영역들 내의 뇌 손상의 가능한 위험과 같은 제한을 가지며, 이것이 부최적 전달 방법이 되게 한다.
본 발명의 약학적 조성물들은, 예를 들어, 통상적인 혼합, 용해, 과립화, 드라제 제조, 균질 혼합물화, 에멀젼화, 캡슐화, 포획 또는 동결건조 방법과 같은 당업계에 주지된 방법들에 의해 제조될 수 있다.
따라서 본 발명에 따라 사용하기 위한 약학적 조성물들은 활성 성분들의 약학적으로 사용될 수 있는 제제로의 처리를 촉진하는 부형제 및 보조제를 포함하는 하나 이상의 생리학적으로 허용가능한 담체를 사용하는 통상적인 방식으로 제제화될 수 있다. 적절한 제제화는 선택된 투여 경로에 의존한다.
주사를 위해, 약학적 조성물의 활성 성분들은 수용액에서, 바람직하게는 행크 용액, 링거 용액 또는 생리학적 염 버퍼와 같은 생리학적으로 적합한 버퍼에서 제조될 수 있다. 점막투과 투여를 위해, 삼투될 장벽에 적합한 침투물들이 제제화에 사용된다. 이런 침투제들은 일반적으로 당업계에 공지되어 있다.
경구 투여를 위해, 약학적 조성물은 당업계에 주지된 약학적으로 허용가능한 담체들과 활성 화합물들을 조합함으로써 쉽게 제제화될 수 있다. 이런 담체들은 약학적 조성이 환자에 의한 경구 주사를 위한 정제, 알약, 드라제, 캡슐, 지질, 겔, 시럽, 슬러리, 현탁액 등으로 제제화되게 할 수 있다. 경구 사용을 위한 약리학적 제제들은 고체 부형제를 사용하여, 선택적으로 최종 혼합물을 분쇄하고, 원하는 경우 적절한 보조제를 첨가한 후, 과립들의 혼합물을 처리하여 정제 또는 드라제 코어를 얻는데 사용될 수 있다. 적절한 부형제들은, 특히, 락토오스, 수크로오스, 만니톨 또는 소르비톨을 포함하는 당; 옥수수 전분, 밀 전분, 쌀 전분, 감자 전분, 젤라틴, 트래거캔스 검, 메틸 셀룰로오스, 하이드록시프로필메틸-셀룰로오스, 소듐 카복시메틸셀룰로오스와 같은 셀룰로오스 제제; 및/또는 폴리바이닐피롤리돈(PVP)와 같은 생리학적으로 허용가능한 폴리머이다. 원하는 경우, 가교 폴리바이닐 피롤리돈, 아가 또는 알긴산 또는 알긴산 나트륨과 같은 이의 염과 같은 분해제들이 첨가될 수 있다.
드라제 코어들에 적절한 코팅이 제공된다. 이를 위해서, 선택적으로 아라비아 검, 활석, 폴리바이닐 피롤리돈, 카보폴 겔, 폴리에틸렌 글리콜, 이산화티타늄, 래커 용액 및 적절한 유기 용매 또는 용매 혼합물을 포함할 수 있는 농축된 당 용액이 사용될 수 있다. 염료 또는 안료는 확인을 위해 또는 활성 화합물 복용량의 상이한 조합을 특징을 나타내기 위해 정제 또는 드라제 코팅에 첨가될 수 있다.
경구적으로 사용될 수 있는 약학적 조성물들은 젤라틴으로 제조된 푸시-핏 캡슐뿐만 아니라 글리세롤 또는 소르비톨과 같은 젤라틴 및 가소제로 제조된 부드럽고, 밀봉된 캡슐을 포함한다. 푸시-핏 캡슐은 락토오스와 같은 충전제, 전분과 같은 접합제, 활석 또는 스테아르산마그네슘과 같은 윤활제 및 선택적으로 안정제와의 혼합물에 활성 성분들을 포함할 수 있다. 부드러운 캡슐에서, 활성 성분들은 지방 오일, 액체 파라핀 또는 액체 폴리에틸렌 글리콜과 같은 적절한 액체에 용해되거나 현탁될 수 있다. 또한, 안정제가 첨가될 수 있다. 경구 투여를 위한 모든 제제는 투여의 선택 경로에 적합한 복용량이어야 한다.
구강 투여의 경우, 조성물들은 통상적인 방식으로 제제화된 정제들 또는 박하 드롭스 형태를 가질 수 있다.
비강 흡입에 의한 투여의 경우, 본 발명에 따라 사용하기 위한 활성 성분들은 적절한 추진체, 예를 들어, 다이클로로다이플루오로메테인, 트라이클로로플루오로메테인, 다이클로로-테트라플루오로에테인 또는 이산화탄소의 사용과 함께 가압 팩 또는 분무기로부터의 에어로졸 스프레이 제공 형태로 편리하게 전달된다. 가압 에어로졸의 경우에, 복용 단위는 계량된 양을 전달하는 밸브를 제공함으로써 결정될 수 있다. 디스펜서에 사용하기 위한, 예를 들어, 젤라틴의 캡슐 및 카트리지는 화합물 및 락토오스 또는 전분과 같은 적절한 분말 베이스의 분말 혼합물을 포함하도록 제제화될 수 있다.
본 발명에 기술된 약학적 조성물은, 예를 들어, 급속 주사(bolus injection) 또는 연속 주입에 의한 비 경구 투여를 위해 제제화될 수 있다. 주사용 제제는 선택적으로 방부제가 첨가된, 예를 들어, 앰풀 또는 수회 복용 용기에 단위 제형으로 제공될 수 있다. 조성물들은 유성 또는 수성 매개체 속 현탁액, 용액 또는 에멀젼일 수 있고 현탁제, 안정제 및/또는 분산제와 같은 제제화 물질을 포함할 수 있다.
비 경구 투여용 약학적 조성물들은 수용성 형태의 활성 제제의 수용액을 포함한다. 또한, 활성 성분들의 현탁액은 적절한 유상 또는 수성 주사 현탁액으로 제조될 수 있다. 적절한 친유성 용매 또는 매개체는 참깨 오일과 같은 지방 오일 또는 에틸 올레이트, 트라이글리세라이드 또는 리포좀과 같은 합성 지방산 에스터를 포함한다. 수성 주사 현탁액은 소듐 카복시메틸 셀룰로오스, 소르비톨 또는 덱스트란과 같은 현탁액의 점도를 증가시키는 물질들을 포함할 수 있다. 선택적으로, 현탁액은 또한 활성 성분들의 용해도를 증가시켜 고 농축 용액의 제조를 허용하는 적절한 안정제들 도는 물질들을 포함할 수 있다.
선택적으로, 활성 성분은 사용 전에, 적절한 매개체, 예를 들어, 살균한, 발열원-제거 수성 용액에 의한 구성을 위한 분말 형태일 수 있다.
본 발명의 약학적 조성물은 코코아 버터 또는 다른 글리세라이드와 같은 통상적인 좌약 베이스를 사용하여, 좌약 또는 정체관장제와 같은 직장 조성물로 제제화될 수 있다.
본 발명의 내용에서 사용하는데 적합한 약학적 조성물들은 활성 성분들이 의도한 목적을 성취하는데 효과적인 양으로 포함되는 조성물을 포함한다. 더욱 구체적으로, 치료적 유효량은 질환(예를 들어, 파킨슨병, 알츠하이머병)의 증상들을 경감 또는 완화하거나 치료될 대상의 생존을 연장하는데 효과적인 활성 성분(CD44 펩타이드)의 양을 의미한다.
치료적 유효량의 측정은, 특히 본 발명에 제공된 상세한 설명의 관점에서, 완전히 당업자의 능력 내에 있다.
본 발명의 방법들에 사용된 임의의 제제의 경우, 치료적 유효량 또는 복용량은 인비트로 및 세포 배양 분석법으로부터 최초로 측정될 수 있다. 예를 들어, 복용량은 원하는 농도 또는 역가를 얻기 위해 동물 모델들에서 제제화될 수 있다. 이런 정보는 인간에서 유용한 복용량을 더욱 정확하게 측정하는데 사용될 수 있다.
본 발명에 기술된 활성 성분들의 독성과 치료 효과는 인비트로, 세포 배양 또는 실험 동물들에서 표준 약학적 절차들에 의해 측정될 수 있다. 이런 인비트로 및 세포 배양 분석법과 동물 연구들로부터 얻은 데이터는 인간에서 사용하기 위한 복용량의 범위를 명확히 나타내는데 사용될 수 있다. 복용량은 사용된 제형과 이용된 투여 경로에 따라 변할 수 있다. 정확한 제제, 투여 경로 및 복용량은 환자의 상태의 관점에서 개별 의사에 의해 선택될 수 있다(예를 들어, Fingl, et al., 1975, in "The Pharmacological Basis of Therapeutics", Ch. 1 p.1 참조).
복용량 및 간격은 개별적으로 뇌에 조절될 수 있고 또는 활성 서분의 혈액 수준은 생물학적 효과(최소 유효 농도, MEC)를 유도하거나 억제하는데 충분하다. MEC는 각 제제에 대해 변할 수 있으나, 인비트로 데이터로부터 측정될 수 있다. MEC를 성취하는데 필요한 복용량은 개인의 특징들 및 투여 경로에 의존할 것이다. 탐지 분석법은 혈장 농도를 측정하는데 사용될 수 있다.
치료될 이상의 심각성 및 반응성에 따라, 복용은 단일 또는 복수의 투여일 수 있으며, 치료 과정은 수일부터 수주 또는 치료가 일어나거나 질병 상태의 감소가 얻어질 때까지 지속된다.
투여될 조성물의 양은 물론, 치료될 대상, 고통의 심각성, 투여의 방식, 주치의 판단 등에 의존할 것이다.
본 발명의 조성물들은, 원하는 경우, 활성 성분을 포함하는 하나 이상의 단위 제형을 포함할 수 있는 팩 또는 FDA 승인 키트와 같은 디스펜서 장치에 제공될 수 있다. 팩은, 예를 들어, 블리스터 팩과 같은 금속 또는 플라스틱 호일을 포함할 수 있다. 팩 또는 디스펜서 장치는 투여 지시들이 수반될 수 있다. 팩 또는 디스펜서는 의약의 제조, 사용 또는 판매를 규율하는 정부기관에 의해 규정된 형태로 용기와 결합된 고시를 수용할 수 있으며, 이 고시는 조성물의 형태 또는 인간 또는 동물 투여의 기관에 의한 승인을 나타낸다. 예를 들어, 이런 고시는 처방약에 대한 미국 식품의약청에 의해 승인된 표시 또는 승인된 제품 삽입물일 수 있다. 추가로 상술한 대로, 적합한 약학적 담체에 제제화된 본 발명의 제제를 포함하는 조성물들이 제조되어, 적절한 용기에 놓이고 징후가 나타난 이상의 치료를 위해 표시될 수 있다.
본 발명에 사용된 대로 용어 "약"은 ±10%를 의미한다.
본 발명에 사용된 대로 용어 "방법"은 화학, 약학, 생물학, 생화학 및 의학 분야의 전문가에게 공지된 또는 이 전문가에 의해 공지된 방식, 수단, 기술 및 절차로부터 쉽게 개발된 방식, 수단, 기술 및 절차를 포함하나 이에 제한되지 않는 소정의 임무를 성취하기 위한 방식, 수단, 기술 및 절차를 의미한다.
본 발명에 사용된 대로, 용어 "치료하는"은 이상의 진행을 끝내는, 실질적으로 억제, 지연 또는 역전하는 것, 이상의 임상적 또는 심미적 증상들을 실질적으로 완화하거나 이상의 임상적 또는 심미적 증상들의 출현을 실질적으로 예방하는 것을 포함한다.
명쾌함을 위해, 개별 실시태양들의 내용에 기술된 본 발명의 특정 특징들이 단일 실시태양과 조합하여 제공될 수 있다고 생각된다. 반대로, 간결함을 위해, 단일 실시태양의 내용에 기술된 본 발명의 여러 특징이 개별적으로 또는 임의의 적절한 하부조합으로 또는 본 발명의 임의의 다른 기술된 실시태양에서 적절한 대로 제공될 수 있다. 다양한 실시태양의 내용에 기술된 특정 특징들은, 실시태양이 이런 요소들 없이 효력이 없는 것이 아닌 한, 이런 실시태양들의 필수 특징들로 고려되지 않는다.
상기한 대로 그리고 아래 청구항에서 청구한 대로 본 발명의 여러 실시태양 및 양태는 다음 실시예들에서 실험적 뒷받침을 발견한다.
실시예
이제 상기 설명들과 함께 비 제한적인 방식으로 본 발명의 일부 실시태양들을 설명하는 다음 실시예들을 참조한다.
일반적으로, 본 발명에 사용된 명명법 및 본 발명에 이용된 실험적 절차는 분자, 생화학, 분자생물학 및 재조합 DNA 기술을 포함한다. 이런 기술들은 문헌에서 완전히 설명된다. 예를 들어, 다음을 참조하며, "Molecular Cloning: A laboratory Manual" Sambrook et al., (1989); "Current Protocols in Molecular Biology" Volumes I-III Ausubel, R. M., ed. (1994); Ausubel et al., "Current Protocols in Molecular Biology", John Wiley and Sons, Baltimore, Maryland (1989); Perbal, "A Practical Guide to Molecular Cloning", John Wiley & Sons, New York (1988); Watson et al., "Recombinant DNA", Scientific American Books, New York; Birren et al. (eds) "Genome Analysis: A Laboratory Manual Series", Vols. 1-4, Cold Spring Harbor Laboratory Press, New York (1998); methodologies as set forth in U.S. Pat. Nos. 4,666,828; 4,683,202; 4,801,531; 5,192,659 and 5,272,057; "Cell Biology: A Laboratory Handbook", Volumes I-III Cellis, J. E., ed. (1994); "Culture of Animal Cells - A Manual of Basic Technique" by Freshney, Wiley-Liss, N. Y. (1994), Third Edition; "Current Protocols in Immunology" Volumes I-III Coligan J. E., ed. (1994); Stites et al. (eds), "Basic and Clinical Immunology" (8th Edition), Appleton & Lange, Norwalk, CT (1994); Mishell and Shiigi (eds), "Selected Methods in Cellular Immunology", W. H. Freeman and Co., New York (1980); available immunoassays are extensively described in the patent and scientific literature, see, for example, U.S. Pat. Nos. 3,791,932; 3,839,153; 3,850,752; 3,850,578; 3,853,987; 3,867,517; 3,879,262; 3,901,654; 3,935,074; 3,984,533; 3,996,345; 4,034,074; 4,098,876; 4,879,219; 5,011,771 and 5,281,521; "Oligonucleotide Synthesis" Gait, M. J., ed. (1984); "Nucleic Acid Hybridization" Hames, B. D., and Higgins S. J., eds. (1985); "Transcription and Translation" Hames, B. D., and Higgins S. J., eds. (1984); "Animal Cell Culture" Freshney, R. I., ed. (1986); "Immobilized Cells and Enzymes" IRL Press, (1986); "A Practical Guide to Molecular Cloning" Perbal, B., (1984) and "Methods in Enzymology" Vol. 1-317, Academic Press; "PCR Protocols: A Guide To Methods And Applications", Academic Press, San Diego, CA (1990); Marshak et al., "Strategies for Protein Purification and Characterization - A Laboratory Course Manual" CSHL Press (1996); 이의 전부는 본 발명에서 완전히 설명한 대로 참조로 포함된다. 다른 일반적인 참조문헌들은 이 문서 도처에 제공된다. 참조문헌 내의 절차들은 당업자에 주지된 것으로 생각되며 독자의 편의를 위해 제공된다. 참조문헌 내의 모든 정보는 참조로 본 발명에 포함된다.
실시예
1
CD44
의 엑손 6 및 10으로부터의 활성
펩타이드의
확인
재료 및 방법
모든 펩타이드들은 >95% 순도에서 라이프테인(South Pleinfield, NJ, USA)에 의해 합성되었다. N2A 생쥐 신경모세포종 및 SK-N-SH 인간 신경모세포종(ATCC)을 10% 태아 소 혈청, L-글루트(Glut) 및 1% 페니실린-스트렙토마이신(Beit Haemek, Israel)으로 보충된 듈베코 변형 이글스 배지에 유지하였다. 세포들을 5% CO2로 37℃에서 배양기에 유지하였다. 각 실험 전 5일 동안 SK-N-SH 세포들을 3μM RA(Sigma-Aldrich)로 처리하여 세포들을 신경 세포들에 대해 분화시켰다. 세포들을 24웰 플레이트에 성장시키고 48시간 동안 Aβ 펩타이드 또는 MPTP(Sigma-Aldrich, 24hrs)로 처리하였고 그 후에 세포들에 XTT 생존능력 분석법을 실행하였다. XTT 생존능력 분석법은 테트라졸륨 염 XTT를 포마잔의 오렌지색 화합물로 환원시키는 신진대사 활성 세포들의 능력을 기초로 한다. 수용성 염료의 강도는 신진대사 활성 세포들의 숫자와 비례한다. XTT(Beit Haemek, Israel)를 1:3 희석 후 성장 배지에 의한 처리 이후 세포들에 첨가하고 1-2시간 동안 배양하였다. 흡수도를 420nm에서 측정하였다. 제조사의 지시에 따라 생존능력 분석법 후 카파제 3 분석법(EnzChek Caspase3 Assay kit, Invitrogen, Carlsbad, Ca, USA)이 이어졌다.
결과
siRNA를 사용하는 기능 실험들의 인비트로 및 인비보 손실은, CD44V6 및 CD44V10이 AD, PD 및 ALS(미공개 데이터)와 같은 신경퇴행성 질환에 중요한 역할을 한다는 것을 나타낸다. CD44S 및 스플라이스 변형체 아이소폼은 신호 변환 경로에 포함되는 다중 단백질-단백질 상호작용에 참여하는 것으로 나타났다(폰타 등에 의해 검토[9]). 따라서 본 발명자들은 이런 상호작용들이 신경 세포 사망에서 CD44V6 및 CD44V10 기능을 매개할 수 있다는 것과 V6 또는 V10 엑손 서열들로부터 유래된 펩타이드들은 이런 상호작용들의 붕괴를 위한 물질로 작용할 수 있다는 것을 생각하였다. 또한 인간 V6 서열로부터 유래된 소형 펜타펩타이드(NRWHE-SEQ ID NO: 1)는 Met 티로신 키나아제 수용체를 통해 간세포 성장 인자(HGF)를 억제할 수 있다는 것이 나타났다[24].
이런 펩타이드들을 확인하는 것을 도울 수 있는 보존된 서열들을 확인하기 위해서, 본 발명자들은 V6 및 V10 서열들에 대한 여러 종들의 서열 배열을 만들었다(도 1). 보존된 서열들을 기초로, V6 및 V10에서 상이한 영역들을 덮는 합성된 여러 펩타이드들을 합성하였다(도 2). 펩타이드들을 신경모세포종 세포주 N2A(생쥐) 및 SK-N-SH(인간)의 세포 사망에 대한 효과에 대해 테스트하였다. 도 3에 도시된 예로서, 생쥐 V6 서열로부터 유래된 두 펩타이드 및 인간 V10 서열로부터 유래된 두 펩타이드의 효과를, Aβ 1-42 펩타이드에 의해 유도된 SK-N-SH 세포들의 세포 사망에 대해, 3배 농도로, 테스트하였다. 세포 생존능력을 XTT의 감소로 측정하였다. 상대적 생존능력 백분율은 처리되지 않은 세포들의 생존능력으로 정의된 100%로서 나타내어진다. 모든 4 펩타이드는 비 펩타이드 대조군과 비교하여 세포들에 대해 적어도 부분적 보호를 부여하는 것이 발견되었다(도 3). 놀랍게도, V6 펩타이드들에 부여된 보호는 20pM의 농도에서 최대였고 보호의 정도는 더 높은 정도에서 감소하였다. 생쥐 V6 및 인간 V10 서열들로부터 유래된 다른 펩타이드들을 추가로 합성하였고(6-21 아미노산, 도 2) N2A 세포들에서 Aβ 25-35 독성으로부터의 이들의 보호 활성을 비교하였다(도 4a-b). Aβ 25-35는 증가된 효력으로 전장 펩타이드의 독성 및 집합 특성들을 모방한다[25]. 1nM 농도에서, 대부분의 펩타이드들은, 생존능력 분석법(XTT, 도 4a) 및 (도 4b, 세포자멸사 유도에 대한 마커로서) 카파제 3 활성 모두에 의해 측정된 대로, 적어도 부분적으로 세포들을 보호하였다. 또한 이런 펩타이드들을 독성 양이온 1-메틸-4-페닐피리디늄(MPP+)으로 신진대사되는 PD 모델링 신경독소인 1-메틸-4-페닐-1,2,3,6-테트라하이드로피리딘(MPTP)에 의해 유도된 세포 사망으로부터의 보호에 대해 테스트하였다. 또한 펩타이드들의 일부는 (펩타이드 없는) 대조군 세포들과 비교된 1μM에서 MPTP에 대한 보호 효과를 갖는 것으로 발견되었다. 결과들은 도 5a-b에 제공된다.
실시예
2
CD44
펩타이드들의
구조/기능 분석
재료 및 방법
모든 방법은 상기 실시예 1과 동일하다. 펩타이드 및 6-하이드록시도파민을 시그마 알드리치(St. Lewis, USA)로부터 구입하였다.
결과
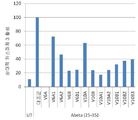
이런 발견은 본 발명자들이 펩타이드 스크린을 V6B, V10A 및 V10B 인간 서열에서 보존된 영역들로부터 유래된 더 작은 펩타이드로 확장하게 하였다(표 1).
| 이름 | 서열 | SEQ ID NO : |
| V6B1 | TPKEDSH | 16 |
| V6B1_C4 | EDSH | 17 |
| V10A/B_L | PVTSAKTGSFGVTAVTV | 18 |
| V10A/B_S | PVTSAKTGSFG | 19 |
| V10A2_C7 | PVTSAKT | 20 |
| V10A2_C10 | TFIPVTSAKT | 21 |
| V10A1_N12 | TTLLEGYTSHYP | 22 |
| V10A1_N8 | TTLLEGYT | 23 |
| V10A1_N6 | TTLLEG | 24 |
| V10A1_N+2_6 | LLEGYT | 25 |
| V10A1_N+4 (P26으로도 불림) |
EGYTSHYP | 26 |
| V10A1_EGYT | EGYT | 27 |
| V10B3_N7 | SLSGDQDT | 28 |
| V10B3_N6 | SLSGDQD | 29 |
| V10B3_N5 | SLSGD | 30 |
| V10B2.5_6 | NVNRSL | 31 |
| V10B2.5_9 | NVNRSLSGD | 32 |
| V10B2_N10 | DSNSNVNRSL | 33 |
| V10B1_8 (P34로도 불림) |
FGVTAVTV | 34 |
| V10B1_7 | FGVTAVT | 35 |
이런 펩타이드들을 1 pM 농도에서 6-하이드록시도파민(6-OHDA) 처리된 N2A 세포들에 대한 보호 효과에 대해 선별하였다. 6-OHDA는 파킨슨병을 인비트로 및 인비보로 모방하기 위해 모델 시스템에서 일반적으로 사용되는 도파민 유사체이다. 6-OHDA는 반응성 산소 종들(ROS)의 방출 및 미토콘드리아 호흡 사슬에 대한 가능한 직접적 효과에 의해 세포자멸사를 유도한다. 결과는 세포 생존능력에 대한 펩타이드들 및 6-OHDA 처리된 세포들에 대한 카파제 3 활성화의 다른 효과를 나타낸다(도 6a-b). 펩타이드들의 일부의 보호 효과를 다양한 복용량 범위에서 테스트하였다. 예를 들어, 8 mer 펩타이드 V10A1_N+4의 경우, 최적 보호 복용량은 fM 농도 근처인 것으로 발견되었다(도 6c). 펩타이드 패널을 pM 농도에서 SK-N-SH 인간 신경모세포종 세포들에서 Aβ(25-35) 유도 독성에 대한 이들의 효과에 대해 테스트하였다. Aβ 스트레스에 대해 유효한 펩타이드들의 프로파일은 6-OHDA-유효 펩타이드보다 현저하게 달랐다(도 7a-b).
실시예
3
인비보
파킨슨 모델에서 본 발명의 일부
펩타이드의
인비보
효과
재료 및 방법
C57BL 생쥐(모두 수컷, 8-12주령, Harlan Laboratories Israel로부터 얻음)에 1일 및 2일에 3시간 간격으로, 1일 2회 복강(IP) 주사에 의해 100㎕/생쥐의 복용량으로 18mg/kg MPTP(Sigam-Aldrich)로 투여하였다. 0일의 연구 및 연속 8일 동안 연구에서, 생쥐에 PBS(매개체) 또는 12μl/생쥐에서 1mg/kg으로 펩타이드들 중 하나를 비강으로 투여하였다. 인비보 연구들에 사용된 모든 펩타이드는 LifeTein에 의해 합성되었고 N 말단 아세틸화 및 C 말단 아마이드화에 의해 변형되었다. 비강내 설비를 위해서, 각 생쥐를 약하게 마취시킨(2.5% 아이소플루레인) 후 억제되었고 전체 12μl의 전체량을 콧구멍 속에 주입하면서 테이블에 평행하게 목을 유지시켰다. 6μl를 두 개의 3μl 방울로 왼쪽 콧구멍에 투여하고, 15초 멈추고, 6μl를 두 개의 3μl 방울로 오른쪽 콧구멍에 투여하고, 15초 멈췄다. 8일에 동물들을 경추골 탈구로 안락사시켰다. 안락사 직후, 뇌들을 제거하고 선조체를 절단(왼쪽 및 오른쪽 선조체를 풀하였다)하고, 계량하고 드라이 아이스에 동결시켰다. 선조체 샘플들을 0.1M 과염소산과 10ng/ml 3,4 다이하이드록시벤질아민(DHBA)을 포함하는 용액에서 80W로 5초 초음파로 균질화하였다. 각 조직 추출물의 상청액들을 컨디셔닝 세포 모델 5021 및 분석용 세포 모델 5011을 가진 전기화학 탐지기 Coulochem II ESA에 연결된 역상 컬럼(GL-Science, Inertsil ODS-2 5um 4.6x150mm 실온) 상의 HPLC 펌프(Jasco PU - 2080 Plus)에 직접 주사하였다. 작동 전위를 컨디셔닝 셀 상에서 0.35V 및 분석용 셀 상에서 0.1V 및 -0.35V로 설정하였다. 이동상은 0.05M 일염기 인산나트륨이었고, 80mg/L EDTA, 125mg/L 헵테인 설폰산, 55ml의 메탄올 및 50ml의 아세토나이트릴 pH=2.7를 포함하였다. 유속은 1.5ml/min이었다. 도파민, DOPAC 및 HVA 값을 용해물 단백질 농도(BCA kit, Pierce)로 정규화하였다.
결과
MPTP 및 6-OHDA에 대한 가장 효과적인 펩타이드들을 인비보 PD 모델 즉 MPTP 주사 생쥐에 대해 선택하였다. 이런 모델에서, MPTP의 반복된 복강 주사(이틀 연속으로 3h 간격으로 18mg/kg)가 흑색질에서 도파민 신경 사망 및 선조체의 도파민 결실을 초래한다. 펩타이드들(또는 매개체)을 MPTP에 노출하기 1일 전 시작하여 1mg/kg으로 비강내 설비에 의해 일일 2회 사용하였고 연구 종료시까지 지속하였다. MPTP의 주사 7일 후 생쥐들을 희생시키고 도파민(DA), 3,2-다이하이드록시페닐아세트산(DOPAC) 및 호모바닐산(HVA)의 선조체 수준을 HPLC로 평가하였다. 9개 펩타이드를 8개 그룹에서 테스트하였고 DA, DOPAC 및 HVA 수준의 결과들이 표 2에 나타난다.
구체적으로 표 2는 MPTP-처리된 생쥐에서 도파민 및 신진대사물의 선조체 수준에 대한 인간 V6 및 V10-유래 펩타이드(1mg/kg, 비강 투여)의 효과를 설명한다. 생쥐를 재료 및 방법에 기술된 프로토콜에 따라 처리하였다. DA, DOPAC 및 HVA의 선조체 수준은 HPLC에 의해 측정되고, 전체 단백질 함량 값으로 나누고 매개체 처리된 생쥐에서 얻은 수준에 대해 정규화되었다. 그룹 1 및 3을 정상 표시된 아날로그 및 레트로-인버소 아날로그(역전 서열에서 D 아미노산)의 1:1 혼합물로 처리하였다. 그룹 6을 10B2.5_6 및 10B2.5_9 펩타이드의 1:1 혼합물로 처리하였다.
| SEQ ID NO | 펩타이드의 이름 | DA | DOPAC | HVA | |
| 1 | 17 | hV6B1_C4 | 20.7 | 41.7 | 16.6 |
| 2 | 19 | V10A/B_S | 26.6 | 27.2 | 13.7 |
| 3 | 24 | V10A1_N6 | 17.7 | 24.3 | -0.7 |
| 4 | 26 | V10A1_N+4 | 58.0 * | 61.8 * | 28.5 |
| 5 | 15 | hV10B3 | 18.1 | 22.5 | 44.2 * |
| 6 | 31 및 32 | 10B2.5_6+10B2.5_9 | 13.6 | 35.1 | 53.0 * |
| 7 | 34 | 10B1_8 | 46.6 * | 75.9 ** | 83.3 ** |
| 8 | 12 | hV10A2 | 24.7 | 54.8 * | 73.4 ** |
* p value <0.05
** p value <0.01
2개 8-mer, V10-유래 펩타이드 즉 V10A1_N+4(SEQ ID NO: 26) 및 10B1_8(SEQ ID NO: 34)에 의한 처리는 부형제 대조군과 비교하여 선조체 DA 수준에 대한 현저하게 긍정적인 효과를 가졌다. 이런 펩타이드들 뿐만 아니라 3개의 다른 펩타이드(hV10B3 - SEQ ID NO: 15; V10A2 - SEQ ID NO:12; 10B2.5 _6 - SEQ ID NO: 31; 및 10B2.5_9 - SEQ ID NO: 32)는 2DA 신진대사물, DOPAC 및 HVA의 적어도 하나의 수준을 현저하게 증가시켰다(위 표 2). 이런 결과들은 CD44V10로부터 유래된 펩타이드들이 도파민성 뉴런들을 MPTP 인비보로부터 보호할 수 있다는 것을 나타내며 이런 펩타이드들은 파킨슨병에 대한 새로운 의약으로 개발돼야 한다는 것을 나타낸다.
실시예
4
본 발명의 일부 실시태양들의
펩타이드
내 활성 성분들의 확인
결과
V10A1_N+4(이하에서 "P26", SEQ ID NO: 26)를 추가 구조-기능 분석을 위해 선택하였다. 이런 펩타이드로부터 유래된 펩타이드들을 합성하였고 아래 표 3에 나타내었다.
| 이름 | SEQ ID NO: | 서열 |
| 26-1 | 36 | EGYTSHY |
| 26-2 | 37 | EGYTSH |
| 26-3 | 38 | EGYTS |
| 26-4 | 39 | GYTSHYP |
| 26-5 | 40 | YTSHYP |
| 26-6 | 41 | TSHYP |
| 26-7 | 42 | GYTSHY |
| 26-8 | 43 | QGYTSHYP |
| 26-9 | 44 | EGYTSAYP |
| 26-RI | 45 | *P*Y*H*S*T*Y*G*E |
| 26-R | 46 | PYHSTYGE |
* D 아미노산
표 3에 나타낸 펩타이드들을 6-OHDA로부터의 N2A를 보호하는데 이들의 효과에 대해 테스트하였다(도 8). 이런 데이터는 P26 서열에서 일부 변이들은 적얻 부분 활성을 유지하면서 용인될 수 있다는 것을 나타낸다. 이런 변이들은 C-말단 절단(26-1, 26-2 및 26-3), 글루타민에 의한 N-말단 글루탐산의 대체 및 알라닌에 의한 위치 7에서 히스티딘의 대체(각각 26-8 및 26-9)를 포함한다.
가장 흥미롭게도, 레트로-인버소(RI, 주요 서열이 역전되고 L-아미노산보다 D-아미노산이 사용된다) P26 유도체(26-RI, SEQ ID NO: 26)는 이의 신경보호 활성을 보유한다. 레트로-인버소 펩타이드는 연장된 구조에서 천연 L-서열의 측쇄 형태와 유사한 측쇄 형태를 가지며 단백질 가수분해에 완전히 저항력이 있으면서 모 분자의 생물학적 활성들을 가진다고 가정된다[Chorev, M. and M. Goodman, Recent developments in retro peptides and proteins -- an ongoing topochemical exploration. Trends Biotechnol, 1995. 13(10): p. 438-45]. 따라서, 신경보호를 매개하기 위한 최소 서열은 SEQ ID NO: 47 STYG-X(X는 E 또는 Q이다)로 나타나거나 각 아미노산이 D 또는 L일 수 있는 이의 레트로 배치인 것으로 생각된다.
실시예
5
V10A1
N+4(
P26
) 및
P34
펩타이드의
해마내
(
IH
)/
뇌실내
(
ICV
) 주사는 쥐들을 Aβ
(1-42)
손상으로부터 보호한다.
재료 및 방법
동물 - 중국, 후난, 헹양, 사우스 차이나 대학의 실험 동물 센터로부터 수컷 쥐(Sprague Dawley rats)를 얻었다. 도착 후, 쥐들을 온도- 및 습도-제어 환경에 개별적으로 수용하고 임의로 음식과 물과 접하게 하였다. 동물들을 12시간 밝음/어두움 스케줄로 유지하면서, 7 A.M에 불을 켰다. 수용된 후, 쥐들이 실험자에게 익숙해지도록 1주 동안 쥐들을 만졌다(하루당 쥐당 5-6분). 실험 동물의 보호와 사용을 위한 건강 가이드의 국제 기관에 따라 실험들을 실행하였고 실험 프로토콜들은 대학 동물 보호 및 사용 위원회에 승인을 받았다.
약물 - Aβ(1-42)를 Sigma-Aldrich(USA)로부터 구입하였다. 펩타이드들을 LifeTein(USA)로부터 얻었다.
알츠하이머병( AD ) 모델의 설정 - Aβ(1-42) (Sigma-Aldrich, USA)를 6㎍/μl의 농도에서 여과된 PBS를 용해하고 용액을 사용 전에 2시간 동안 37℃로 유지하였다. 용액의 1 마이크로리터를 정위고정 좌표(stereotaxic coordinate): 브레마로부터 AP = 3.6, ML = 2.0 및 두개골로부터 DV = 3.0에서 소듐 벤토바비탈(55mg/kg i.p.) 마취하에서 오른쪽 해마 속에 미세주사기로 주사하였다. 대조군 쥐들에 1μl의 PBS를 주사하였다. IH/ICV 연구에서, 1μl의 펩타이드 또는 PBS를 동일한 정위고정 좌표에서 오른쪽 해마 속에 주사하였다.
펩타이드 투여 - ICV 주사를 위해서, 미세주사 캐뉼라를 다음 정위고정 좌표: AP = 1, ML = 1.6, DV = 3.8에 따라 측뇌실 속에 심었다. Aβ 주사 24시간 후, 쥐들은 지정된 복용량으로 PBS 또는 펩타이드의 첫 번째 ICV 주사를 받았다. 피하(SC) 연구에서, PBS 또는 PBS 속 펩타이드 용액의 일일 SC 주사를 1ml/쥐에서 1mg/kg의 복용량으로 실행하였고 21일 동안 지속하였다.
새로운 물체 인식 작업 - NOR 작업을 Aβ 주사 21일 후 테스트하였다.
훈련 장치는 밝게 비추어지는 위치에 있는 소음-감소 캐비넷 및 분리된 방에 놓인 블랙 플렉시글라스 박스(50x50x40cm)이었다. 조명이 캐비넷의 천장에 장착된 15W 백색 집 광에 의해 제공되었고 65 dB 배경 소음은 캐비넷에 있는 환기 팬에 의해 공급되었다. 박스의 바닥은 톱밥으로 덮었다. 작업에 사용된 물체들은 모양과 색에 차이가 있는 유리 및 플라스틱과 같은 방수 재료로 제조되었다. 물체들의 크기는 약 6x6x8cm이었다. 두 물체를 항상 박스의 뒷 코너에 위치하였다. 위치와 물체들은 쥐들이 코너들 또는 물체들의 하나에 대해 가질 수 있는 임의의 선호에 대해 균형이 잡히도록 제어되었다. 행동 절차는 두 단계: 훈련 및 기억 테스트를 수반하였다. 훈련 시험 동안, 쥐를 박스에 놓았고 2개의 동일한 물체를 10분 동안 탐사하게 하였고 두 물체를 탐사하는데 사용된 총 시간을 기록하였다. 물체의 탐사는 <1cm의 거리에서 물체를 코로 지적 및/또는 물체를 코로 접촉하는 것으로 정의하였다. 톱밥을 뒤섞었고 테스트 사이에 박스 및 물체들을 40% 에탄올 용액으로 세척하였다. 훈련 시험(기억 테스트 시험) 24시간 후, 친숙한 물체와 새로운 물체의 한 복사물을 훈련 단계 동안 자극물로서 동일한 위치에 놓았다. 쥐를 3분 동안 박스에 놓았고 각 물체를 탐사하는데 걸린 시간 및 두 물체를 탐사하는데 사용된 총 시간을 기록하였다. 두 물체를 탐사하는데 사용된 총 시간의 비율로 표현된 기억력을 평가하는데 사용된 차별 지수를 새로운 물체와 친숙한 물체를 탐사하는데 시간 차이로서 계산하였다.
모리스 수미로 테스트 - 40cm의 깊이까지 물(25±1℃)로 채워진 원형 수조(200cm 지름, 60cm 높이)로 구성된다. 풀의 모서리 둘레에 4개의 동일하게 떨어진 위치를 출발점으로 사용하였고, 이것이 풀을 4개 사분면으로 나눴다. 탈출 플랫폼(10cm 지름)을 물의 표면 2cm 아래에 풀에 놓았다. 탈출 플랫폼을 풀의 무작위로 선택된 사분면 중 하나의 중간에 놓고 전체 실험 동안 동일 위치를 위치시켰다. 훈련을 시작하기 전에, 쥐들을 플랫폼 없이 120초 동안 풀 속에서 자유롭게 수영하게 하였다. 동물들은 4일 동안 세션(각 출발점으로부터 한 번)당 4회 시도로 구성된 훈련 세션을 받았고, 각 시험은 120s의 천장 시간과 대략 30s의 시험 간격을 가졌다. 숨겨진 플랫폼에 오른 후, 동물들을 다음 시험의 개시 전에 30초 동안 그곳에 남겨두었다. 만일 쥐가 120s의 최대 시간 내에 숨겨진 플랫폼을 찾는데 실패한 경우, 쥐를 플랫폼 위에 부드럽게 놓고 동일한 시간 간격 동안 그곳에 남겨두었다. 숨겨진 플랫폼을 찾는데 걸린 시간(잠재(초))을 측정하였다. 습득 단계 24시간 후, 플랫폼을 제거함으로써 프로브 테스트를 실행하였다. 쥐들을 120s 동안 풀에서 자유롭게 수영하게 하고 미리 숨겨진 플랫폼을 포함한 표적 사분면에서 보낸 시간을 기록하였다. 표적 사분면에서 보낸 시간은 학습 후 발생한 기억 강화의 정도를 나타내었다. 모리스 수미로 테스트를 Aβ 주사 24일 후 시작하였다.
통계 분석 - 원-웨이 ANOVA를 사용하여 통계 분석을 실행하였다. 사후검정(Post-hoc comparisions)을 피셔 LSD 테스트(SigmaStat 3.2)로 실행하였다. 모든 데이터는 평균±SEM으로 표현하였다. 유의 수준은 p<0.05로 설정하였다.
결과
효과를 테스트하기 위해서, 인비보 알츠하이머병(AD) 모델에서 P26 및 V10B1_8(이하에서 P34) 펩타이드들을 Aβ(1-42) 미세주사 쥐 모델에서 테스트하였다[Soto, C., et al., Beta - sheet breaker peptides inhibit fibrillogenesis in a rat brain model of amyloidosis: implications for Alzheimer's therapy . Nat Med, 1998. 4(7): p. 822-6]. 이 모델에서, 쥐들은 오른쪽 해마 속에 6㎍ Aβ(1-42)의 단일 미세주사를 받았다. 동시에, 1μl의 펩타이드 용액 또는 PBS(매개체)를 동일한 위치 속에 주사하였다. 이런 치료 후 동일한 복용량으로 펩타이드 또는 매개체(PBS)의 일일 ICV 주사가 뒤따랐다. Aβ 주사 21일 후 새로운 물체 인식 평가법에 대해 쥐들을 테스트하였다(NOR, 도 9). 결과는 100ng/쥐에서 P26 및 10 및 100ng/쥐에서 P34는 차별 지수를 현저하게 증가시켰다(p<0.01)는 것을 나타낸다. 데이터는 P26 및 P34 펩타이드들의 ICV/IH 투여는 인비보에서 Aβ의 독성 효과를 예방한다는 것을 나타낸다.
실시예
6
V10A1
N+4(
P26
)
펩타이드의
말초 주사는 쥐들을 Aβ
(1-42)
손상으로부터 보호한다.
재료 및 방법
실험 절차들 및 피하 주사(SC)는 위 실시예 5에 기술된다.
결과
피하(SC) 주사에 의한 펩타이드들의 비경구 투여는 Aβ 독성으로부터 쥐들을 보호하는 것에 대해 평가되었다. 따라서 Aβ(1-42) 미세주사 쥐 모델을 사용하였고 1mg/kg P26 펩타이드뿐만 아니라 대조군 펩타이드(cont1: AVAVEAAG SEQ ID NO: 48, n=10-11)의 일일 SC 주사가 뒤따랐다. 21일 주사 기간 후 모리스 수미로(MWM) 및 NOR 기억력 평가법이 뒤따랐다. 결과는 3개 SC-주사된 펩타이드 중 단지 P26가 두 평가법에서 행동을 현저하게 개선하였다(도 10 및 11). 이런 결과들은 P26 펩타이드의 신경보호 효과가 펩타이드가 비 경구 투여에 의해 주어질 때에도 나타나는 것을 입증하며, 펩타이드는 혈액-뇌 장벽을 가로지를 수 있으며 관련 뇌 영역에 충분한 농도에 이르는 것을 암시한다.
실시예
7
P26
및
P26
-
IR
의 약동학
재료 및 방법
펩타이드들의 약동학은 수컷 쥐(Sprague Dawley rats)에서 SC 펩타이드 투여 이후 평가하였다. 매개체로서 인산염 버퍼 식염수(pH 7.4)를 사용하여 펩타이드 용액을 제조하였고 2mL/kg의 복용 부피로 1mg/kg의 복용량을 피하를 통해 투여하였다.
투여 0(복용 전) 및 0.17, 0.5, 1, 2, 4, 8 및 24시간에 혈액 샘플들을 수집하였다. 각 시점에서, 대략 0.25mL의 혈액을 캐뉼라가 연결된 쥐의 경정맥을 통해 뽑아내어 200mM K2EDTA(혈액의 mL당 20μL)를 포함하는 미리 표지된 마이크로퓨즈 튜브에 옮겼다. 샘플링 이후 헤파린처리된 식염수의 동일한 부피를 카테터 속으로 밀어넣었다. 혈액 샘플들을 4±2℃에서 5분 동안 5000g에서 원심분리하였다. 모든 혈장 샘플들을 분석 때까지 -70℃이하로 저장하였다. 합목적(fit-for-purpose) LD-MS/MS 방법을 혈장 샘플들에서 펩타이드들의 정량화에 사용하였다. 정량화(LLOQ)의 하한은 22.34ng/mL이었다.
결과
P26 및 P26-IR의 약동학을 1mg/kg의 피하 주사에 의해 쥐들에서 테스트하였다(도 12). P26-IR은 P12에 대한 130ng/ml와 비교하여 1227 ng/ml의 겉보기 Cmax로 개선된 SC 약동학을 입증하였다. 인비트로 활성과 함께 P26-IR 유사체에 의한 이런 10배 개선은 P26-IR이 P26과 비교하여 더 적은 복용량으로 사용될 수 있다는 것을 암시한다.
비록 본 발명은 이의 구체적인 실시태양들과 함께 기술되었지만, 여러 대안, 변이 및 변형은 당업자에게 명백할 것이라는 것 분명하다. 따라서, 본 발명은 첨부된 청구항의 취지와 넓은 범위 내에 해당하는 이런 대안, 변이 및 변형 모두를 포함한다고 생각된다.
본 명세서에 인용된 모든 공개공보, 특허 및 특허출원은, 각 개별 공개공보, 특허 및 특허출원이 참조로 본 발명에 구체적이고 개별적으로 포함될 것으로 나타내어진 것과 같은 정도로, 전문이 참조로 명세서에 포함된다. 또한, 본 명세서에서 임의의 참조문헌의 인용 또는 확인은 이런 참조문헌이 본 발명에 대한 선행기술로 이용할 수 있다는 것으로 해석되지 않아야 한다. 섹션 제목으로 사용되는 정도로, 참조문헌은 필수적으로 제한적인 것으로 해석되지 않아야 한다.
참조문헌
(다른 참조문헌들은 본 출원에 인용된다)
1. Querfurth, H.W. and F.M. LaFerla, Alzheimer's disease . N Engl J Med, 2010. 362(4): p. 329-44.
2. Glass, C.K., et al., Mechanisms underlying inflammation in neurodegeneration . Cell, 2010. 140(6): p. 918-34.
3. Davie, C.A., A review of Parkinson's disease . Br Med Bull, 2008. 86: p. 109-27.
4. Naor, D., R.V. Sionov, and D. Ish-Shalom, CD44 : structure , function , and association with the malignant process . Adv Cancer Res, 1997. 71: p. 241-319.
5. Ilangumaran, S., B. Borisch, and D.C. Hoessli, Signal transduction via CD44 : role of plasma membrane microdomains . Leuk Lymphoma, 1999. 35(5-6): p. 455-69.
6. DeGrendele, H.C., et al., CD44 and its ligand hyaluronate mediate rolling under physiologic flow : a novel lymphocyte - endothelial cell primary adhesion pathway . J Exp Med, 1996. 183(3): p. 1119-30.
7. DeGrendele, H.C., P. Estess, and M.H. Siegelman, Requirement for CD44 in activated T cell extravasation into an inflammatory site . Science, 1997. 278(5338): p. 672-5.
8. Ponta, H., D. Wainwright, and P. Herrlich, The CD44 protein family . Int J Biochem Cell Biol, 1998. 30(3): p. 299-305.
9. Ponta, H., L. Sherman, and P.A. Herrlich, CD44 : from adhesion molecules to signalling regulators. Nat Rev Mol Cell Biol, 2003. 4(1): p. 33-45.
10. Golan, I., et al., Expression of extra trinucleotide in CD44 variant of rheumatoid arthritis patients allows generation of disease - specific monoclonal antibody . J Autoimmun, 2007. 28(2-3): p. 99-113.
11. Garin, T., et al., CD44 variant DNA vaccination with virtual lymph node ameliorates experimental autoimmune encephalomyelitis through the induction of apoptosis . J Neurol Sci, 2007. 258(1-2): p. 17-26.
12. Orian-Rousseau, V., et al., CD44 is required for two consecutive steps in HGF /c- Met signaling. Genes Dev, 2002. 16(23): p. 3074-86.
13. Tremmel, M., et al., A CD44v6 peptide reveals a role of CD44 in VEGFR -2 signaling and angiogenesis. Blood, 2009. 114(25): p. 5236-44.
14. Akiyama, H., et al., Morphological diversities of CD44 positive astrocytes in the cerebral cortex of normal subjects and patients with Alzheimer's disease . Brain Res, 1993. 632(1-2): p. 249-59.
15. Moretto, G., R.Y. Xu, and S.U. Kim, CD44 expression in human astrocytes and oligodendrocytes in culture . J Neuropathol Exp Neurol, 1993. 52(4): p. 419-23.
16. Bignami, A. and R. Asher, Some observations on the localization of hyaluronic acid in adult, newborn and embryonal rat brain . Int J Dev Neurosci, 1992. 10(1): p. 45-57.
17. Kaaijk, P., et al., Differential expression of CD44 splice variants in the normal human central nervous system . J Neuroimmunol, 1997. 73(1-2): p. 70-6.
18. Asher, R. and A. Bignami, Hyaluronate binding and CD44 expression in human glioblastoma cells and astrocytes . Exp Cell Res, 1992. 203(1): p. 80-90.
19. Kang, W.S., et al., Differential regulation of osteopontin receptors , CD44 and the alpha (v) and beta (3) integrin subunits , in the rat hippocampus following transient forebrain ischemia . Brain Res, 2008. 1228: p. 208-16.
20. Ries, A., J.L. Goldberg, and B. Grimpe, A novel biological function for CD44 in axon growth of retinal ganglion cells identified by a bioinformatics approach . J Neurochem, 2007. 103(4): p. 1491-505.
21. Wang, X., et al., CD44 deficiency in mice protects brain from cerebral ischemia injury . J Neurochem, 2002. 83(5): p. 1172-9.
22. Lammich, S., et al., Presenilin - dependent intramembrane proteolysis of CD44 leads to the liberation of its intracellular domain and the secretion of an Abeta - like peptide . J Biol Chem, 2002. 277(47): p. 44754-9.
23. Pinner, E., M. Laudon, and N. Zisapel, CD44 splice variants in neurodegenerative diseases. WO/2009/007934, 2009.
24. Matzke, A., et al., A five - amino - acid peptide blocks Met - and Ron - dependent cell migration. Cancer Res, 2005. 65(14): p. 6105-10.
25. Varadarajan, S., et al., Different mechanisms of oxidative stress and neurotoxicity for Alzheimer's A beta (1--42) and A beta (25--35). J Am Chem Soc, 2001. 123(24): p. 5625-31.
Claims (39)
- CD44V10 아미노산 서열의 적어도 3개의 아미노산 및 CD44V10 아미노산 서열의 100개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드의 치료적 유효량을 대상에게 투여하는 단계를 포함하여, 신경퇴행성 질환을 치료하는 치료가 필요한 대상의 신경퇴행성 질환을 치료하는 방법.
- CD44V6 아미노산 서열의 적어도 3개의 아미노산 및 CD44V6 아미노산 서열의 100개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드의 치료적 유효량을 대상에게 투여하는 단계를 포함하여, 신경퇴행성 질환을 치료하는 치료가 필요한 대상의 신경퇴행성 질환을 치료하는 방법.
- 펩타이드가 SEQ ID NO: 49 또는 50으로 나타낸 아미노산 서열로 이루어지지 않는 것을 조건으로, CD44V10 아미노산 서열의 적어도 3개의 아미노산 및 CD44V10 아미노산 서열의 20개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드.
- 펩타이드가 SEQ ID NO: 1, 51 또는 52로 나타낸 아미노산 서열로 이루어지지 않는 것을 조건으로, CD44V6 아미노산 서열의 적어도 3개의 아미노산 및 CD44V6 아미노산 서열의 20개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드.
- 활성제로서 CD44V10 아미노산 서열의 적어도 3개의 아미노산 및 CD44V10 아미노산 서열의 100개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드 및 약학적으로 유효한 담체를 포함하는 약학적 조성물.
- 신경퇴행성 질환을 치료하는데 사용하기 위한, CD44V10 아미노산 서열의 적어도 3개의 아미노산 및 CD44V10 아미노산 서열의 100개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드.
- 제 1 항, 제 3 항, 제 5 항 또는 제 6 항에 있어서,
상기 펩타이드는 화학식 1의 아미노산을 포함하는 방법 또는 분리된 펩타이드:
X1-G-Y-T-S,
여기서 X1은 글루탐산 또는 글루타민 중 하나이다. - 제 7 항에 있어서,
상기 아미노산 서열은 펩타이드 모방체를 포함하는 방법 또는 분리된 펩타이드. - 제 8 항에 있어서,
상기 펩타이드 모방체는 레트로-인버소 모방체(retro-inverso mimetic)를 포함하는 방법 또는 분리된 펩타이드. - 제 7 항 내지 제 9 항 중 어느 한 항에 있어서,
상기 펩타이드는 SEQ ID NO: 26, 45 또는 46으로 나타내어지는 방법 또는 분리된 펩타이드. - 제 1 항, 제 3 항, 제 5 항 또는 제 6 항에 있어서,
CD44V10 아미노산 서열로 이루어지는 방법 또는 분리된 펩타이드. - 제 1 항, 제 3 항, 제 5 항 또는 제 6 항에 있어서,
상기 CD44V10 아미노산 서열은 인간 CD44V10 아미노산 서열인 방법 또는 분리된 펩타이드. - 제 2 항 또는 제 4 항에 있어서,
상기 CD44V6 아미노산 서열은 인간 CD44V6 아미노산 서열인 방법 또는 분리된 펩타이드. - 제 2 항 또는 제 4 항에 있어서,
코어 서열 X1-X2-S-H을 포함하며, X1 및 X2는 산성 아미노산인 방법 또는 분리된 펩타이드. - 제 14 항에 있어서,
X1은 글루탐산을 포함하는 방법 또는 분리된 펩타이드. - 제 14 항에 있어서,
X2는 아스파르트산을 포함하는 방법 또는 분리된 펩타이드. - 제 2 항 또는 제 4 항에 있어서,
펩타이드는 CD44V6 아미노산 서열로 이루어지는 방법 또는 분리된 펩타이드. - 제 1 항, 제 3 항, 제 5 항 또는 제 6 항에 있어서,
펩타이드는 SEQ ID NO: 8-15, 18-45 또는 46으로 나타낸 아미노산 서열을 포함하는 방법 또는 분리된 펩타이드. - 제 1 항 또는 제 6 항에 있어서,
펩타이드는 SEQ ID NO: 49 또는 50으로 나타낸 아미노산 서열을 포함하는 방법 또는 분리된 펩타이드. - 제 2 항 또는 제 4 항에 있어서,
펩타이드는 SEQ ID NO: 2-7, 16 또는 17로 나타낸 아미노산 서열을 포함하는 방법 또는 분리된 펩타이드. - 신경퇴행성 질환을 치료하는데 사용하기 위한, CD44V6 아미노산 서열의 적어도 3개의 아미노산 및 CD44V6 아미노산 서열의 100개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드.
- 제 1 항, 제 2 항, 제 3 항, 제 4 항, 제 6 항 또는 제 21 항에 있어서,
신경퇴행성 질환은 파킨슨병, 다발성 경화증, ALS, 다계통위축증, 알츠하이머병, 뇌졸중, 외상성 뇌 손상, 진행성 핵성 마비, 염색체 17번과 관련된 파킨슨증을 가진 전두측두엽 치매 및 피크병으로 이루어진 그룹으로부터 선택되는 방법 또는 분리된 펩타이드. - 제 1 항, 제 2 항, 제 3 항, 제 4 항, 제 6 항 또는 제 21 항에 있어서,
상기 신경퇴행성 질환은 파킨슨병인 방법 또는 분리된 펩타이드. - 제 1 항, 제 2 항, 제 3 항, 제 4 항, 제 6 항 또는 제 21 항에 있어서,
상기 신경퇴행성 질환은 알츠하이머병인 방법 또는 분리된 펩타이드. - 제 23 항 또는 제 24 항에 있어서,
상기 펩타이드는 SEQ ID NO: 12, 15, 17, 19, 24, 26, 31, 32, 34, 36-38, 43-46으로 이루어진 그룹으로부터 선택된 아미노산을 포함하는 방법 또는 분리된 펩타이드. - 제 23 항에 있어서,
상기 펩타이드는 SEQ ID NO: 26 또는 45로 나타낸 아미노산 서열을 포함하는 방법 또는 분리된 펩타이드. - 활성제로서 CD44V6 아미노산 서열의 적어도 3개의 아미노산 및 CD44V6 아미노산 서열의 100개 이하 아미노산을 포함하며 신경보호 활성을 포함하는 분리된 펩타이드 및 약학적으로 유효한 담체를 포함하는 약학적 조성물.
- 제 1 항 내지 제 27 항 중 어느 한 항에 있어서,
펩타이드는 세포 침투제에 부착되는 방법, 분리된 펩타이드 또는 약학적 조성물. - 제 1 항 내지 제 27 항 중 어느 한 항에 있어서,
아미노산의 적어도 하나는 천연 발생 아미노산인 방법, 분리된 펩타이드 또는 약학적 조성물. - 제 1 항 내지 제 27 항 중 어느 한 항에 있어서,
아미노산의 적어도 하나는 합성 아미노산인 방법, 분리된 펩타이드 또는 약학적 조성물. - 제 30 항에 있어서,
합성 아미노산은 D 이성질체를 포함하는 방법, 분리된 펩타이드 또는 약학적 조성물. - 제 28 항에 있어서,
분리된 펩타이드는 세포 침투제에 공유결합으로 부착되는 방법, 분리된 펩타이드 또는 약학적 조성물. - 제 28 항에 있어서,
세포 침투제는 펩타이트제인 방법, 분리된 펩타이드 또는 약학적 조성물. - 제 1 항 내지 제 27 항 중 어느 한 항에 있어서,
펩타이드는 20개 아미노산보다 길지 않은 방법, 분리된 펩타이드 또는 약학적 조성물. - 제 1 항 내지 제 27 항 중 어느 한 항에 있어서,
펩타이드는 길이가 5-10개 아미노산인 방법, 분리된 펩타이드 또는 약학적 조성물. - 신경퇴행성 질환을 치료하는데 유용한 물질을 선택하는 방법으로서, 이 방법은:
(a) 신경 독소의 존재하에서 CD44v10/6 펩타이드를 신경 세포들과 접촉시키는 단계; 및
(b) 신경 세포들의 세포 사망을 관찰하는 단계를 포함하며, CD44v10/6 펩타이드의 부존재하에서 신경 세포들의 세포 사망의 양 또는 시간과 비교된 CD44v10/6 펩타이드의 존재하에서 신경 세포들의 세포 사망의 양 또는 시간의 감소는 신경퇴행성 질환을 치료하는데 유용한 물질임을 나타내는 방법. - 제 36 항에 있어서,
상기 신경 독소는 아밀로이드 펩타이드, 글루타메이트, 6-OHDA, MPTP 및 MPP+로 이루어진 그룹으로부터 선택되는 방법. - 제 1 항 또는 제 2 항에 있어서,
상기 투여는 피하 투여를 포함하는 방법. - 제 1 항 또는 제 2 항에 있어서,
상기 투여는 비강내 투여를 포함하는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161466966P | 2011-03-24 | 2011-03-24 | |
| US61/466,966 | 2011-03-24 | ||
| PCT/IL2012/050104 WO2012127475A1 (en) | 2011-03-24 | 2012-03-22 | Neuroprotective peptides |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140036164A true KR20140036164A (ko) | 2014-03-25 |
Family
ID=45999925
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137027914A KR20140036164A (ko) | 2011-03-24 | 2012-03-22 | 신경보호 펩타이드 |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20140045764A1 (ko) |
| EP (1) | EP2688582B1 (ko) |
| JP (1) | JP5960793B2 (ko) |
| KR (1) | KR20140036164A (ko) |
| CN (1) | CN103648517B (ko) |
| AU (1) | AU2012232642B2 (ko) |
| BR (1) | BR112013024323A2 (ko) |
| CA (1) | CA2830792A1 (ko) |
| EA (1) | EA201391387A1 (ko) |
| MX (1) | MX2013010910A (ko) |
| SG (1) | SG193418A1 (ko) |
| WO (1) | WO2012127475A1 (ko) |
| ZA (1) | ZA201307169B (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20170089784A (ko) * | 2016-01-27 | 2017-08-04 | 경상대학교산학협력단 | 아디포넥틴 수용체 활성화 신규 펩티드를 유효성분으로 포함하는 신경질환의 예방, 개선 또는 치료용 조성물 |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB201220899D0 (en) * | 2012-11-21 | 2013-01-02 | Kit Karlsrusher Inst Fuer Technologie Und Inst Fuer Toxikologie Und Genetik And Amcure Gmbh | CD44v6-derived pegylated peptides |
| US10981956B2 (en) | 2016-03-31 | 2021-04-20 | Senju Pharmaceutical Co., Ltd. | Neuroprotective peptide |
| JP6962908B2 (ja) * | 2016-03-31 | 2021-11-05 | 千寿製薬株式会社 | 神経保護ペプチド |
| EP3712164A4 (en) | 2017-11-14 | 2021-08-18 | Senju Pharmaceutical Co., Ltd. | PEPTIDE STABILIZED BY PACAP |
| JP7260930B2 (ja) | 2018-11-08 | 2023-04-19 | ニオバスク ティアラ インコーポレイテッド | 経カテーテル僧帽弁人工補綴物の心室展開 |
| EP3974027B1 (en) | 2019-05-14 | 2024-10-23 | Senju Pharmaceutical Co., Ltd. | Stabilized pacap peptide |
| US20220202905A1 (en) | 2019-05-14 | 2022-06-30 | Senju Pharmaceutical Co., Ltd. | Composition for preventing or treating neurotrophic keratitis which contains pacap peptide or stabilized pacap peptide |
| CN112569351B (zh) * | 2020-12-16 | 2021-10-15 | 南通大学 | Cd44抗体在制备治疗帕金森疾病的药物中的应用 |
Family Cites Families (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL154600B (nl) | 1971-02-10 | 1977-09-15 | Organon Nv | Werkwijze voor het aantonen en bepalen van specifiek bindende eiwitten en hun corresponderende bindbare stoffen. |
| NL154598B (nl) | 1970-11-10 | 1977-09-15 | Organon Nv | Werkwijze voor het aantonen en bepalen van laagmoleculire verbindingen en van eiwitten die deze verbindingen specifiek kunnen binden, alsmede testverpakking. |
| NL154599B (nl) | 1970-12-28 | 1977-09-15 | Organon Nv | Werkwijze voor het aantonen en bepalen van specifiek bindende eiwitten en hun corresponderende bindbare stoffen, alsmede testverpakking. |
| US3901654A (en) | 1971-06-21 | 1975-08-26 | Biological Developments | Receptor assays of biologically active compounds employing biologically specific receptors |
| US3853987A (en) | 1971-09-01 | 1974-12-10 | W Dreyer | Immunological reagent and radioimmuno assay |
| US3867517A (en) | 1971-12-21 | 1975-02-18 | Abbott Lab | Direct radioimmunoassay for antigens and their antibodies |
| NL171930C (nl) | 1972-05-11 | 1983-06-01 | Akzo Nv | Werkwijze voor het aantonen en bepalen van haptenen, alsmede testverpakkingen. |
| US3850578A (en) | 1973-03-12 | 1974-11-26 | H Mcconnell | Process for assaying for biologically active molecules |
| US3935074A (en) | 1973-12-17 | 1976-01-27 | Syva Company | Antibody steric hindrance immunoassay with two antibodies |
| US3996345A (en) | 1974-08-12 | 1976-12-07 | Syva Company | Fluorescence quenching with immunological pairs in immunoassays |
| US4034074A (en) | 1974-09-19 | 1977-07-05 | The Board Of Trustees Of Leland Stanford Junior University | Universal reagent 2-site immunoradiometric assay using labelled anti (IgG) |
| US3984533A (en) | 1975-11-13 | 1976-10-05 | General Electric Company | Electrophoretic method of detecting antigen-antibody reaction |
| US4098876A (en) | 1976-10-26 | 1978-07-04 | Corning Glass Works | Reverse sandwich immunoassay |
| US4879219A (en) | 1980-09-19 | 1989-11-07 | General Hospital Corporation | Immunoassay utilizing monoclonal high affinity IgM antibodies |
| US5011771A (en) | 1984-04-12 | 1991-04-30 | The General Hospital Corporation | Multiepitopic immunometric assay |
| US4666828A (en) | 1984-08-15 | 1987-05-19 | The General Hospital Corporation | Test for Huntington's disease |
| US4683202A (en) | 1985-03-28 | 1987-07-28 | Cetus Corporation | Process for amplifying nucleic acid sequences |
| US4801531A (en) | 1985-04-17 | 1989-01-31 | Biotechnology Research Partners, Ltd. | Apo AI/CIII genomic polymorphisms predictive of atherosclerosis |
| US5272057A (en) | 1988-10-14 | 1993-12-21 | Georgetown University | Method of detecting a predisposition to cancer by the use of restriction fragment length polymorphism of the gene for human poly (ADP-ribose) polymerase |
| US5192659A (en) | 1989-08-25 | 1993-03-09 | Genetype Ag | Intron sequence analysis method for detection of adjacent and remote locus alleles as haplotypes |
| US5281521A (en) | 1992-07-20 | 1994-01-25 | The Trustees Of The University Of Pennsylvania | Modified avidin-biotin technique |
| EP0703989B1 (en) * | 1993-06-18 | 1997-11-05 | Oy Biotie Therapies | COMPOSITIONS AND DIAGNOSTIC METHODS USING MONOCLONAL ANTIBODIES AGAINST CD44v6 |
| JPH09508265A (ja) * | 1994-01-18 | 1997-08-26 | プレジデント アンド フェロウズ オブ ハーバード カレッジ | 平滑筋細胞におけるcd44発現 |
| DE19653607A1 (de) * | 1996-12-20 | 1998-06-25 | Boehringer Ingelheim Int | Verfahren zur Diagnose und Therapie von Hodgkin-Lymphomen |
| AU3448899A (en) * | 1998-01-24 | 1999-08-09 | Bristol-Myers Squibb Company | Artificial proteoglycans |
| DK1647556T3 (da) * | 2004-10-14 | 2010-07-19 | Karlsruher Inst Technologie | Peptidforbindelser og derivater deraf til behandling af sygdomme hos mennesker ved inhibering af signaloverførsel via vækstfaktorer |
| AU2008273713B2 (en) * | 2007-07-10 | 2014-07-03 | Neurim Pharmaceuticals (1991) Ltd. | CD44 splice variants in neurodegenerative diseases |
| EP2266593A1 (en) * | 2009-06-24 | 2010-12-29 | Karlsruher Institut für Technologie | Use of CD44v6 in the treatment of ophthalmic diseases |
-
2012
- 2012-03-22 BR BR112013024323A patent/BR112013024323A2/pt not_active Application Discontinuation
- 2012-03-22 EP EP12716661.9A patent/EP2688582B1/en active Active
- 2012-03-22 US US14/007,010 patent/US20140045764A1/en not_active Abandoned
- 2012-03-22 WO PCT/IL2012/050104 patent/WO2012127475A1/en active Application Filing
- 2012-03-22 MX MX2013010910A patent/MX2013010910A/es not_active Application Discontinuation
- 2012-03-22 CA CA2830792A patent/CA2830792A1/en not_active Abandoned
- 2012-03-22 KR KR1020137027914A patent/KR20140036164A/ko not_active Application Discontinuation
- 2012-03-22 EA EA201391387A patent/EA201391387A1/ru unknown
- 2012-03-22 JP JP2014500540A patent/JP5960793B2/ja active Active
- 2012-03-22 SG SG2013068499A patent/SG193418A1/en unknown
- 2012-03-22 CN CN201280014793.1A patent/CN103648517B/zh active Active
- 2012-03-22 AU AU2012232642A patent/AU2012232642B2/en active Active
-
2013
- 2013-09-18 ZA ZA2013/07169A patent/ZA201307169B/en unknown
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20170089784A (ko) * | 2016-01-27 | 2017-08-04 | 경상대학교산학협력단 | 아디포넥틴 수용체 활성화 신규 펩티드를 유효성분으로 포함하는 신경질환의 예방, 개선 또는 치료용 조성물 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20140045764A1 (en) | 2014-02-13 |
| JP5960793B2 (ja) | 2016-08-02 |
| EP2688582B1 (en) | 2017-02-15 |
| EA201391387A1 (ru) | 2014-01-30 |
| CN103648517B (zh) | 2016-04-20 |
| JP2014510101A (ja) | 2014-04-24 |
| MX2013010910A (es) | 2014-03-27 |
| ZA201307169B (en) | 2014-05-28 |
| CN103648517A (zh) | 2014-03-19 |
| AU2012232642A1 (en) | 2013-10-17 |
| BR112013024323A2 (pt) | 2017-06-13 |
| WO2012127475A1 (en) | 2012-09-27 |
| AU2012232642B2 (en) | 2016-12-08 |
| EP2688582A1 (en) | 2014-01-29 |
| CA2830792A1 (en) | 2012-09-27 |
| SG193418A1 (en) | 2013-10-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20140036164A (ko) | 신경보호 펩타이드 | |
| ES2439950T3 (es) | Péptidos con permeabilidad celular inhibidores de la ruta de transducción de señales de la JNK | |
| CN109354605B (zh) | 一种Nogo-A受体结合肽及其衍生物与应用 | |
| ES2384385T3 (es) | Nuevo uso de la proteína factor antisecretor | |
| CA2773935C (en) | Peptides for the treatment of oxidative stress related disorders | |
| US20180170983A1 (en) | New Use of Cell-Permeable Peptide Inhibitors of the JNK Signal Transduction Pathway for the Treatment of Mild Cognitive Impairment | |
| EP3160489B1 (en) | Cell-permeable peptide inhibitors of the jnk signal transduction pathway for the treatment of cystitis | |
| KR20170104457A (ko) | 신경변성 장애 | |
| US20230174582A1 (en) | Vipr2 antagonist peptide | |
| KR102084341B1 (ko) | 짧은 합성 펩티드 및 그의 용도 | |
| US20230212225A1 (en) | Peptide compostions and methods for treating tauopathies | |
| US20210347821A1 (en) | Inhibitors of pick1 and uses thereof | |
| Zhang et al. | Davunetide improves spatial learning and memory in Alzheimer's disease-associated rats | |
| WO2014052766A1 (en) | Hepatocyte growth factor mimics as therapeutic agents | |
| US10400009B2 (en) | β-sheet breaker peptide used for preventing and/or treating alzheimer's disease | |
| EP3464325A1 (en) | Backbone cyclized inhibitory peptides of myeloid differentiation factor 88 (myd88) | |
| US20190233487A1 (en) | Neuroprotective beta amyloid core peptides and peptidomimetic derivatives | |
| US20240034752A1 (en) | Artificial short interfering peptide for the phosphorylation substrate of dapk1 and its pharmaceutical applications | |
| US20230095144A1 (en) | Amyloid inhibitory peptides | |
| JP2024512569A (ja) | 治療におけるadnfポリペプチドの使用 | |
| WO2013041238A1 (en) | Use of kibra peptides, hdac inhibitor or proteasome inhibitor for improving anxiety disorders | |
| Saad et al. | Salivary flow, sodium renal excretion, urinary volume and arterial blood pressure induced by pilocarpine: influence of nitric oxide | |
| WO2013041239A1 (en) | Pkm zeta bindin peptides, peptide derivatives and conjugates, and uses thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |