KR20130140358A - 살메테롤 지나포산염, 플루티카손 프로피오네이트 및 티오트로피움 브로마이드를 포함하는 흡입 제형용 건조 분말 및 이의 제조방법 - Google Patents
살메테롤 지나포산염, 플루티카손 프로피오네이트 및 티오트로피움 브로마이드를 포함하는 흡입 제형용 건조 분말 및 이의 제조방법 Download PDFInfo
- Publication number
- KR20130140358A KR20130140358A KR1020120063665A KR20120063665A KR20130140358A KR 20130140358 A KR20130140358 A KR 20130140358A KR 1020120063665 A KR1020120063665 A KR 1020120063665A KR 20120063665 A KR20120063665 A KR 20120063665A KR 20130140358 A KR20130140358 A KR 20130140358A
- Authority
- KR
- South Korea
- Prior art keywords
- carrier
- dry powder
- inhalation
- inhalation formulation
- particle size
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/136—Amines having aromatic rings, e.g. ketamine, nortriptyline having the amino group directly attached to the aromatic ring, e.g. benzeneamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/137—Arylalkylamines, e.g. amphetamine, epinephrine, salbutamol, ephedrine or methadone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/165—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide
- A61K31/166—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide having the carbon of a carboxamide group directly attached to the aromatic ring, e.g. procainamide, procarbazine, metoclopramide, labetalol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/439—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom the ring forming part of a bridged ring system, e.g. quinuclidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/46—8-Azabicyclo [3.2.1] octane; Derivatives thereof, e.g. atropine, cocaine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/565—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids not substituted in position 17 beta by a carbon atom, e.g. estrane, estradiol
- A61K31/568—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids not substituted in position 17 beta by a carbon atom, e.g. estrane, estradiol substituted in positions 10 and 13 by a chain having at least one carbon atom, e.g. androstanes, e.g. testosterone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
- A61K9/0075—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy for inhalation via a dry powder inhaler [DPI], e.g. comprising micronized drug mixed with lactose carrier particles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/141—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers
- A61K9/145—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers with organic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/08—Bronchodilators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Abstract
본 발명은 약리활성성분으로서 살메테롤 지나포산염, 플루티카손 프로피오네이트 및 티오트로피움 브로마이드, 및 담체를 포함하는 건조 분말; 및 이를 포함하는 흡입 제형으로서, 상기 건조 분말 흡입 제형은 흡입시 상기 세 가지 약리활성성분이 목표 부위로 충분히 도달하고, 함량균일성이 우수할 뿐 아니라 유속변화에 다른 동적입자분포의 변화가 적어, 호흡기 질환, 특히 천식 및 만성 폐쇄성 폐질환(COPD)의 예방 또는 치료에 유용하다.
Description
본 발명은 살메테롤 지나포산염, 플루티카손 프로피오네이트 및 티오트로피움 브로마이드를 포함하는 흡입 제형용 건조 분말 및 이의 제조방법에 관한 것이다.
호흡기 질환, 예를 들어 천식 및 만성 폐쇄성 폐질환(COPD)의 치료를 위해, 다양한 약물들이 흡입제 형태로 사용되고 있다. 흡입제는 소량의 약리활성성분으로 목적하는 치료효과를 달성할 수 있는 장점이 있는 반면, 투여되는 약리활성성분 중 일부만이 목표 부위에 도달하고, 약리활성성분이 치료를 필요로 하지 않는 다른 장기에 도달하여 부작용을 일으키는 단점이 있다. 따라서, 약리활성성분이 목표 부위에 재현성 있게 표적화되도록 하여 약효를 극대화하고, 약리활성성분이 치료를 필요로 하지 않는 장기에 도달하는 것을 방지하기 위한 연구가 계속 되고 있다.
흡입제의 효과적인 투여를 위해, 약물을 공기와 함께 흡입하여 기도에 투여하는 흡입 장치(inhaler)가 호흡기 질환 치료에 폭넓게 이용되고 있다. 대표적으로 정량 분무식 흡입기(Metered Dose Inhaler; MDI)가 1956년에 처음으로 승인된 이래 흡입기 시장의 80%를 선점할 정도로 널리 사용되어 왔으나, 오존층 파괴와 지구 온난화와 같은 환경적인 문제가 대두됨에 따라 최근에는 건조 분말 흡입기(Dry Powder Inhaler; DPI)에 대한 연구가 본격적으로 시작되었다. 현재는 DPI 제형이 MDI 제형의 단점을 보완하는 단계에 있다. MDI는 추진체로 쓰일 수 있는 용매와 약리활성성분이 압축되어 있어 안정성이 저하되며, 분무가 되어 나오는 속도가 빨라 약리활성성분이 인후부에 너무 빨리 도달을 하는 단점이 있는데 반해, DPI는 사용하기 쉽고, 고체 분말 입자들로만 이루어져 있어 안정성이 더 우수한 장점이 있다(Martin J Telko and Anthony J Hickey, Dry Powder Inhaler Formulation, Respiratory Care, September 2005, Vol 50, No. 9 참조).
한편, 호흡기 질환의 예방 및 치료를 위해 다양한 약물이 시험되고 있다. 예를 들어, 선택적 베타-2 아드레날린 수용체 효능제(베타-2 효능제)가 기관지 확장 효과를 제공하여 호흡곤란 증상을 경감시킬 목적으로 사용된다. 베타-2 효능제는 즉시 작용을 하는 속효성 베타-2 효능제와 작용시간이 긴 지속성 베타-2 효능제로 분류될 수 있다. 속효성 베타-2 효능제의 예로는 살부타몰(Salbutamol), 페노테롤(Fenoterol), 레발부테롤(Levalbuterol), 터부탈린(Terbutaline) 등이 있으며, 이들은 즉각적인 개선효과를 나타내지만 작용시간이 짧다는 단점이 있다. 지속성 베타-2 효능제의 예로는 포모테롤(Formoterol), 인다카테롤(Indacaterol), 살메테롤(Salmeterol), 툴로부테롤(Tulobuterol) 등이 있으며, 이들은 지속적으로 기관지 확장 효과를 나타내지만 일반적으로 12시간 이내의 작용시간을 가지기 때문에 1일 2회 이상의 투여가 필요한 단점이 있다.
상기 베타-2 효능제는 환자의 기관지 수축 증상을 경감시키지만, 천식의 또 다른 요소인 염증을 치료하기 위해 또 다른 약물, 예를 들어 스테로이드가 사용된다. 스테로이드 약물의 예로서, 흡입형 코르티코스테로이드(ICS, Inhaled corticosteroid)로서, 베클로메타손(beclomethasone), 부데소니드(budesonide), 플루니솔리드(flunisolide), 플루티카손 프로피오네이트(fluticasone propionate), 모메타손 푸로에이트(mometasone furoate), 트리암시놀로(triamcinolone) 등이 알려져 있다.
또 다른 계열의 치료제로 흡입형 항콜린성 약물(Inhaled anticholinergic)이 COPD의 치료를 위한 안정하고 효과적인 기관지 확장제로서 잘 확립되어져 왔다. 항콜린성 약물에 의한 치료는 FEV1(1초 동안의 강제 호기량, Forced Expiratory Volume in 1 second), 휴지시 또는 동적 폐 과팽창 증상 및 운동 능력을 개선시키고, COPD 격화(exacerbation)를 감소시킨다. 현재 적은 수의 흡입형 항콜린성 기관지확장제가 이용가능한데, 이의 예로는 속효성인 이프라트로피움 브로마이드(ipratropium Br), 옥시트로피움 브로마이드(oxitropium Br) 및 지속성인 티오트로피움 브로마이드(Tiotropium Br) 등을 들 수 있다.
세계천식기구(Global Initiative for Asthma(GINA)) 및 세계COPD기구(Global Initiative for Chronic Obstructive Lung Disease(GOLD))는 질병 상태의 악화에 맞추어 점증적 치료 방법을 권고하고 있는데, 이는 상이하거나 상보적인 작용 기전을 지닌 약물 부류들의 복합제를 사용하는 것을 포함한다. 예를 들어 지속성 베타-2 효능제는 천식 또는 COPD 환자에게 처방되는 치료제로서 FEV1이 80% 미만인 환자들에게 주로 사용되며, COPD 환자 중 호흡곤란의 증상이 있으면서 FEV1이 50% 미만이거나 잦은 급성 악화가 있는 경우 ICS가 추가로 사용된다.
전술한 바와 같은 약물들을 이용한 일부 복합제들이 이미 알려져 있다. 대표적인 예로는 살메테롤 지나포산염과 플루티카손 프로피오네이트와의 흡입용 복합제를 들 수 있다(세레타이드, GSK). 세레타이드는 MDI 제형인 에보할러와 DPI 제형인 디스커스가 시판되고 있다. 세레타이드는 지속성 베타-2 효능제인 살메테롤에 의한 기도 수축 치료 및 ICS인 플루티카손 프로피오네이트에 의한 염증 치료를 동시에 제공한다. 그러나 건조 흡입 분말 형태로 제공되는 세레타이드 디스커스의 경우 베타-2 효능제와 흡입형 코르티코스테로이드의 두 가지 약물이 동시에 흡입 가능한 제형이기는 하나 지속적인 기관지확장 작용이 없기 때문에 1일에 2회 투여해야 하는 단점이 있을 뿐 아니라, 흡입시 약물이 폐로 들어가는 것을 느낄 수 없을 정도로 부형제의 양이 부족하고, 흡입된 약물을 육안으로 확인이 불가능하기 때문에 종종 흡입이 되지 않거나 2번 이상을 흡입하게 되는 단점이 있다.
또한, 속효성 항콜린제인 이프라트로피움 브로마이드와 지속성 베타-2 효능제인 살메테롤을 이용한 조합요법이 국제공개 제WO01/76601호에 개시되어 있으며, 항콜린제 및 베타 작용제와 함께 스테로이드를 이용하는 추가적인 조합 요법이 미국특허 제6,423,298호 및 국제공개 제WO02/07672호에 기재되어 있다.
그러나 상기 복합제들은 베타-2 효능제에 의한 속효성 기관지 확장 작용과 코르티코스테로이드의 항염증 작용 및 항콜린제의 지속적인 기관지 확장 작용이 모두 가능한 삼중 복합제에 관한 것은 아니다.
최근 베타-2 효능제, 코르티코스테로이드 및 항콜린제의 삼중 복합제에 대한 기술이 대한민국 출원공개 제10-2010-0063116호 및 제10-2009-0121338에 언급되어 있으나, 이들은 구체적인 장치(device)나 그에 따른 유효량 확인, 제조 방법이나 포장형태, 담체로 사용되는 물질의 입자 크기 등에 대한 특성 등이 전혀 고려되지 않았고 그에 대한 평가 내용도 포함하고 있지 않다. 흡입제형, 특히 건조 분말 흡입 제형의 경우 사용하는 장치에 따라 압력강하 값이 다양하고 포장된 형태, 예를 들어 블리스터 포장되어 있는지 캡슐에 포장되어 있는지에 따라 흡입시 폐로 전달되는 유효성분의 양에 변화가 생길 수 있다. 또한 제형의 구성에 있어서 담체로 사용되는 부형제(유당 등)의 특성과 비율에 따라 약효에 많은 차이가 발생할 수 있다. 더욱이 같은 약물군이라 하더라도 약물 고유의 물리 화학적인 특성에 의해 균일성이 나빠지거나 보관 안정성이 떨어지는 등의 원치 않는 결과가 발생할 수 있다.
호흡기 질환의 예방 또는 치료를 위한 흡입 제형에 사용할 수 있는 약물들과 그들의 조합이 일부 알려져 있으나, 지속성 베타-2 효능제, 흡입용 코르티코스테로이드 및 항콜린제를 동시에 투여할 수 있는 제형의 조성과 제조 방법이 아직 구체적으로 개발되지 않았기 때문에 환자의 복약순응도 개선 및 휴대편의성을 위해서 세 가지 약효군에 따른 성분들을 정확하고 안정하게 투여할 수 있는 동시투여 형태의 복합제형에 대한 조성과 제조방법이 제공되어야 할 필요가 있다.
따라서, 본 발명의 목적은 흡입시 상기 세 가지 약리활성성분이 목표 부위로 충분히 도달하고, 함량 균일성이 우수할 뿐만 아니라 유속변화에 따른 동적입자분포의 변화가 적은 장점을 갖는, 살메테롤 지나포산염, 플루티카손 프로피오네이트 및 티오트로피움 브로마이드를 포함하는 흡입 제형용 건조 분말을 제공하는 것이다.
본 발명의 다른 목적은 상기 흡입 제형용 건조 분말을 포함하는 흡입 제형을 제공하는 것이다.
본 발명의 또 다른 목적은 상기 흡입 제형용 건조 분말을 제조하는 방법을 제공하는 것이다.
상기 목적에 따라, 본 발명은 살메테롤 지나포산염, 플루티카손 프로피오네이트, 티오트로피움 브로마이드 및 담체를 포함하며, 입자의 평균 입도가 30~120 μm인, 흡입 제형용 건조 분말을 제공한다.
상기 다른 목적에 따라, 본 발명은 상기 흡입 제형용 건조 분말을 포함하는 흡입 제형을 제공한다.
상기 또 다른 목적에 따라, 본 발명은 1) 전체 담체의 양을 기준으로 5~20 중량%의 담체를 혼합기의 기벽에 도포하는 단계; 2) 살메테롤 지나포산염, 플루티카손 프로피오네이트, 티오트로피움 브로마이드를 전체 담체의 양을 기준으로 5~20 중량%의 담체에 배산하는 단계; 및 3) 상기 배산된 성분들 및 잔량의 담체를 1)의 혼합기에 넣은 후, 입자 크기를 실질적으로 변화시키지 않는 힘으로 분쇄 및 혼합하는 단계를 포함하는, 본 발명에 따른 흡입 제형용 건조 분말을 제조하는 방법을 제공한다.
본 발명의 흡입 제형용 건조 분말은 혼합균일성이 우수하고, 유속변화에 따른 동적입자분포의 변화가 적으며, 세 가지 활성성분 모두 건조 분말 형태로 동시투여가 가능하기 때문에 휴대가 편하고, 환자의 복약순응도가 뛰어나 호흡기 질환, 특히 천식 및 만성 폐쇄성 폐질환(COPD)에 대한 치료 지속성이 우수하다.
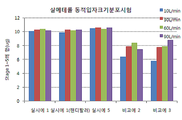
도 1은 시험예 2에 따라 시험한 살메테롤의 동적입자분포시험 결과이다.
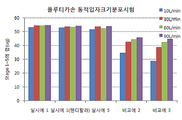
도 2는 시험예 2에 따라 시험한 플루티카손의 동적입자분포시험 결과이다.
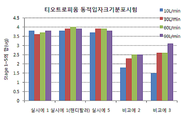
도 3은 시험예 2에 따라 시험한 티오트로피움의 동적입자분포시험 결과이다.
도 2는 시험예 2에 따라 시험한 플루티카손의 동적입자분포시험 결과이다.
도 3은 시험예 2에 따라 시험한 티오트로피움의 동적입자분포시험 결과이다.
본 발명의 흡입 제형용 건조 분말은 약리활성성분으로서 지속성 베타-2 효능제인 살메테롤 지나포산염(salmeterol xinafoate), 흡입형 코르티코스테로이드인 플루티카손 프로피오네이트(fluticasone propionate) 및 흡입형 항콜린제인 티오트로피움 브로마이드(tiotropium bromide), 및 추가적으로 담체(carrier)를 포함하며, 입자의 평균 입도가 30~120 μm인 것을 특징으로 한다.
본원에서는 각 활성성분의 특정 염 또는 용매화물을 사용하였으나, 당해 기술분야의 숙련자라면 상기 예시된 특정 염 또는 용매화물 대신에 동일하거나 유사한 활성을 갖는 등가물(equivalent)을 사용할 수 있을 것이다. 사용가능한 등가물의 예로는, 약제학적으로 허용가능한 염, 용매화물, 수화물, 거울상이성질체, 유도체, 다형제, 전구약물 등을 들 수 있지만, 이에 제한되는 것은 아니다.
상기 약리활성성분들이 폐에 효과적으로 이송되어 약리학적 활성을 나타내기 위해서는 각 활성성분의 입자가 미분화되어야 한다. 일반적으로 기관지계에 흡입되기 위한 최적 입자 크기는 0.1 μm 초과 내지 10 μm, 바람직하게는 0.1 μm 초과 내지 5 μm이다. 입자 크기가 0.1 μm 이하로 너무 작을 경우, 흡입시 기관지에 침착되지 못하고 오히려 몸 밖으로 다시 배출될 수 있다. 이에, USP 34 <601> 'Aerosol, Nasal spray, Metered-dose inhaler and Dry powder inhaler'에 따르면 MDI 및 DPI 제형에 대해 다양한 기구(Apparatus 1~6)를 사용하여 동적입자크기분포(Aerodynamic Size Distribution)를 측정하도록 제안하고 있다. 예를 들어, USP 34 <601>의 Apparatus 3(Anderson Cascade Impactor)을 사용하면 스테이지(Stage) 1~5에 모이는 주 성분이 대략적으로 0.1~5 μm의 동적입자크기분포를 가지는 것으로 판단할 수 있어 이 양을 정량한다면 흡입제의 사용시 폐에 들어가 약리학적 활성을 나타내는 유효량을 유추할 수 있다. 일반적으로 이 영역에 해당하는 입자분포율은 흡입되기 위해 계량되어진 활성성분 함량의 10% 내지 30%이면 바람직하다.
그러나, 작은 입자는 체적비에 대해 표면적이 크기 때문에 열역학적으로 불안정하며, 과다한 표면 에너지가 발생하여 입자가 괴상화 상태로 진행되기 쉽다. 이와 같이, 입자가 괴상화되면 캡슐 또는 흡입 장치의 내벽에 부착되어 흡입 시에 분말의 배출이 잘 이루어지지 않는 문제가 발생한다. 이러한 문제를 해결하기 위해, 약리활성성분을 적합한 부형제, 즉 담체 입자와 혼합하여 투여할 수 있다.
구체적으로, 미세한 크기의 약리활성성분을 담체 입자에 부착함으로써 열역학적으로 안정된 상태를 유지시키고 괴상화가 이루어지지 않게 하고 흡입 장치 바깥쪽, 즉 흡입시 몸안으로 입자의 이송이 원활하게 이루어지게 하는 것이 바람직하다. 또한, 흡입 후 기도에서 담체 입자 표면으로부터 약리활성성분이 쉽게 떨어져 나와 목표 부위에 도달할 수 있게 하여야 한다. 보통 담체는 입자 크기가 상당히 커서 목표 부위에 직접 도달하지 않기 때문에 담체로부터 약리활성성분이 쉽게 떨어져 나오지 않을 경우 목표 부위에 도달하는 약리활성성분의 양이 현저히 떨어질 수 있다. 또한 담체의 크기가 클수록 유동성이 좋기 때문에 흡입 장치 외부로 쉽게 이송될 수 있도록 충분한 크기를 가지는 담체를 포함하도록 해야 한다.
본 발명의 건조 분말 흡입 제형에 사용되는 담체는 충분한 유동성을 나타내는 입자 크기를 가지는 것이 바람직하다. 본 발명의 하나의 구현예에서, 상기 담체의 입자 크기는 30~120 μm일 수 있다. 또한 상기 담체 입자에 미세화된 담체를 혼합하여 사용할 수 있고, 이 경우 담체 입자에 대한 약리활성성분 입자의 부착을 균일하게 하고, 기도 내에서 담체 입자로부터 약리활성성분 입자의 방출을 용이하게 할 수 있는 장점이 있다. 이는 일반적으로 불규칙한 담체 입자 표면에 소량의 미세화된 담체 입자를 일차적으로 부착함으로써, 표면 에너지가 높은 부위에 상기 미세화된 담체 입자가 우선적으로 부착되어 표면 에너지를 낮추게 되고, 결국 담체의 전체적인 표면 에너지를 낮추고 아울러 균질한 표면 에너지를 가지게 하기 때문이다. 상기 미세화된 담체 입자의 평균 입자 크기는 35 μm 이하, 바람직하게는 30 μm 이하, 더욱 바람직하게는 25 μm 이하일 수 있다. 또한, 미세화된 담체 입자의 양은 흡입제 조성물의 흐름성에 영향을 주지 않을 정도로 사용될 수 있으며, 예를 들어, 전체 담체 입자 중량을 기준으로 0.1~20 중량%의 비율로 사용하는 것이 바람직하다. 하나의 구현예에서, 상기 미세화된 담체 입자는 1~15 중량%의 비율로 사용될 수 있고, 다른 구현예에서, 상기 미세화된 담체 입자는 3~12 중량%의 비율로 사용될 수 있다. 일반적으로 담체 입자에 미세화된 담체 입자를 섞어서 사용할 수 있지만 본 발명에서는 입자 크기가 고르게 분포되어 있는 시판중인 담체 입자도 사용가능하다.
또한, 약리활성성분이 흡입 장치에서 배출되거나 목표 부위로 도달하기 위해서는 담체 입자의 표면특성 또한 중요한 요인이 될 수 있다. 약리활성성분이 좋은 유동성을 가지고 흡입 장치로부터 쉽게 빠져나오기 위해서는 흡입 장치 내에서 담체 입자 표면에 충분한 부착력으로 지지되어야 하지만, 흡입 장치를 떠나 목표 부위에 도달하기 위해서는 기도 내에서 담체 표면으로부터 쉽게 이탈할 수 있어야 하기 때문에, 담체 표면과 약리활성성분 사이의 부착력은 적당한 값을 유지하여야 하는 어려움이 있다. 본 발명에서는 약리활성성분과 담체 간의 부드러운 분쇄 및 혼합 과정을 거쳐 약리활성성분이 담체의 표면에 적당한 부착력으로 부착되게 된다.
담체로 사용하는 부형제의 선정은 흡입 제형, 특히 2개 이상의 약리활성성분을 함유하는 복합제 형태의 흡입 제형의 조성에 있어서 중요한 요소이다. 본 발명의 조성에서 사용가능한 부형제는 글루코스, 아라비노스와 같은 단당류; 락토오스, 말토스, 수크로스와 같은 이당류; 전분, 덱스트린 또는 덱스트란과 같은 다당류; 및 소르비톨, 만니톨, 자일리톨과 같은 폴리알코올류, 및 이들의 수화물을 포함한다. 본 발명의 하나의 구현예에서 부형제로서 단당류 또는 이당류가 사용되며, 다른 구현예에서 락토오스가 사용되고, 또 다른 구현예에서 락토오스 일수화물이 사용된다.
담체의 적절한 사용량 선정도 중요한 문제이다. 담체의 양이 너무 많을 경우에는 흡입시 과도한 이물감이 느껴져 환자가 복약시 불편할 수 있을 뿐만 아니라, 외부물질인 담체로 인해 천식이 유발될 수도 있다. 더욱이, 너무 적은 양의 담체를 사용하면 담체와 약리활성성분 간에 균일성을 확보하기 힘들뿐 아니라 1회 흡입할 양을 캡슐이나 블리스터 포낭에 계량하기가 매우 어려워진다. 따라서, 본 발명에서 담체는 15 mg 내지 25 mg의 양으로 사용될 수 있다. 상기 담체 양은 일반적인 생산방식에 따라 캡슐이나 블리스터에 충전이 가능하기 때문에 흡입제 생산을 위한 특별한 기기의 설치가 필요하지 않고, 일반적인 제약 생산공장에서 제조가 가능한 장점이 있다.
다만, 흡입 제형의 경우 담체에 비해 약리활성성분의 양이 상대적으로 매우 적기 때문에 통상적인 단순한 혼합만으로는 함량 균일성을 확보하기 어려운 문제가 있으며, 이를 보완하기 위해 배산 등과 같은 방법으로 약물과 담체를 혼합할 수 있다. 배산이라 함은 약리활성성분과 부형제를 1:1 내지 1:4의 비율, 예를 들어 1:1, 1:2 또는 1:4의 비율로 혼합한 후, 상기 혼합물에 동등한 비율의 부형제를 가하여 혼합하는 과정을, 부형제를 전부 사용할 때까지 반복하여 수행하는 방식을 지칭한다. 하지만 약리활성성분이 아주 작은 입도를 가지고, 내용물의 총량에서 아주 낮은 비율을 차지할 경우 흡입제의 경우 배산을 통한 혼합 방법을 사용하더라도 함량 균일성에 문제가 발생할 수 있다.
따라서 스크리닝 장치를 이용한 층화혼합방법으로 흡입 제형의 함량 균일성을 해결하고자 하는 방법이 시도되기도 하였지만(국내특허 제0849837호), 층화방식의 경우 반드시 큰 입자와 작은 입자가 분리되어 사용되어야 하며, 10개 이상 바람직하게는 30개 이상의 개개 분획물이 스크리닝 장치를 통과하여야 하는 작업상의 불편함이 발생한다.
이에 본 발명자들은 약리활성성분과 담체입자와의 부드러운 분쇄 및 단순혼합 공정을 통하여 본 발명의 흡입 제형의 함량 균일성을 해결하였다. 본 발명에서 사용된 '부드러운 분쇄 및 혼합'이라 함은 볼 또는 쵸퍼가 존재하는 블렌더에 분말을 주입한 후 혼합하는 공정에서, 블렌더가 회전하는 동안 볼 또는 쵸퍼에 의해 분말에 입자의 크기를 실질적으로, 예를 들어 20% 이상 변화시키지 않는 정도의 물리적인 힘이 가해지는 것을 의미한다. 담체로써 사용되는 입자가 강한 물리적인 힘을 지속적으로 받을 경우 입자의 크기가 작아지는데, 입자의 크기가 너무 작게 변할 경우 분말의 유동성이 불량해져 흡입시 흡입 장치 또는 캡슐 내에 분말들이 잔존하게 되고 목표하는 만큼의 약리활성성분을 목표부위에 전달할 수 없게 된다. 하나의 바람직한 구체예에서, 본 발명의 흡입 제형용 건조 분말은 30~120 μm의 평균 입도를 가질 수 있다. 상기 평균 입도 범위에서, 약리활성성분의 함량 균일성이 우수하고, 유속 변화에 따른 입자크기분포의 차이가 거의 없다. 하지만, 평균 입도가 120 μm를 초과하면 활성성분의 함량 균일성이 불량하며, 흡입장치로 흡입시 캡슐 내에 약리활성성분이 많이 잔존하는 문제가 있다. 또한, 평균 입도가 30 μm 미만이면 약리활성성분이 유속에 따라 큰 유효량 변화를 나타내는 문제가 있다. 또 다른 바람직한 구체예에서, 본 발명의 흡입 제형용 건조 분말은 55~65 μm의 평균 입도를 가질 수 있다.
혼합 순서에 있어서는 먼저 소량의 담체를 쵸퍼와 블렌더 기벽에 도포하고 나서 일정양의 담체와 약리활성성분을 배산하여 체과한 뒤 부드러운 분쇄 및 혼합 공정을 거칠 수 있다. 상기 도포되는 담체의 양은 전체 담체의 양을 기준으로 5~20 중량%인 것이 바람직하며, 상기 약리활성성분과 배산시 사용되는 담체의 양 역시 전체 담체의 양을 기준으로 5~20 중량%인 것이 바람직하나, 상기 양에 제한되는 것은 아니다. 약리활성성분의 경우 입자 크기가 매우 작고 표면 에너지가 높아 입자의 물성이 상당히 끈적끈적하기 때문에 먼저 넣고 분쇄를 하게 되면 쵸퍼와 블렌더 기벽에 붙어서 손실이 발생할 확률이 매우 높다. 따라서, 흐름성이 좋은 적당량의 담체 입자를 분쇄 전에 투입하여 쵸퍼와 블렌더 기벽에 도포함으로써 이를 방지할 수 있다. 이후, 약리활성성분과 담체를 배산하여 체과한 뒤 부드러운 분쇄공정을 거치면 된다. 이때 혼합공정실의 상대습도는 40~60%로 유지하는 것이 바람직하다. 상대습도가 너무 낮으면 입자들의 정전기 현상이 심해 혼합을 진행하기가 어렵고 혼합하더라도 공정 중 손실이 매우 커지는 문제가 발생하며, 또한, 습도가 너무 높으면 입자들이 수분을 흡수하여 괴상화가 되기 쉽다. 특히 살메테롤 지나포산염은 흡습하는 성질이 있어 수분에 과다 노출이 되면 생산 후 장기 보관시 안정성을 확보할 수 없다.
상기 전술한 바와 같이, 본 발명은 1) 전체 담체의 양을 기준으로 5~20 중량%의 담체를 혼합기의 기벽에 도포하는 단계; 2) 살메테롤 지나포산염, 플루티카손 프로피오네이트, 티오트로피움 브로마이드를 전체 담체의 양을 기준으로 5~20 중량%의 담체에 배산하는 단계; 및 3) 상기 배산된 성분들 및 잔량의 담체를 1)의 혼합기에 넣은 후, 입자 크기를 변화시키지 않는 힘으로 분쇄 및 혼합하는 단계를 포함하는, 본 발명에 따른 흡입 제형용 건조 분말을 제조하는 방법을 제공한다.
한편, 본 발명은 흡입 장치에 사용되는 젤라틴 또는 히프로멜로오스와 같은 캡슐 및 카트리지, 또는 층상 알루미늄 박막과 같은 블리스터(blister)내에 본 발명의 흡입 제형용 건조 분말이 함유된 제형을 제공하며, 상기 제형은 바람직하게는 캡슐 형태일 수 있다. 본 발명에 사용될 수 있는 캡슐의 크기는 1호 내지 4호 캡슐을 들 수 있다. 본 발명의 하나의 구현예에서 3호 캡슐이 사용될 수 있다. 캡슐 형태로 제공될 때의 장점은 특별한 충전장치가 없어도 본 발명의 흡입 제형 제조가 가능하다는 데 있다. 또한 본 발명의 조성물이 충전되는 캡슐은 투명한 것이 바람직하다. 투명한 캡슐을 사용하게 되면 환자들이 본 발명의 흡입용 복합제를 흡입 후에 자신이 건조 분말 약리활성성분을 흡입하였는지의 여부를 직접 눈으로 확인이 가능한 장점이 있다. 또한, 건조된 분말들의 응집, 변색 등과 같은 안정성의 저하나 제품 불량을 환자들이 직접 흡입하기 전에 육안으로 확인이 가능하다는 장점이 있다.
건조흡입분말의 흡입에 사용되는 장치(device)는 계량된 캡슐 형태 내의 조성물을 환자의 폐로 운반하기 위해 캡슐을 파열시키거나, 캡슐에 구멍을 뚫거나, 기타 방식으로 캡슐을 개방시키는 수단을 포함한다. 또한, 공기의 흐름을 형성시키기 위하여 공기가 들어가는 흡입구, 환자가 입을 대고 흡입을 하여 약리활성성분이 배출되는 배출구, 및 이물질을 걸러주는 체를 추가로 포함할 수 있다. 이러한 장치의 예로는, 시판중인 GSK의 ROTAHALER®, 베링거 잉겔하임의 HANDIHALER® 및 PLASTIAPE의 AEROLIZER®를 들 수 있다. 본 발명의 흡입 제형은 캡슐형 조성물을 사용할 수 있는 장치면 어느 것이나 사용가능하지만 바람직하게는 AEROLIZER®가 사용될 수 있다. 상기 장치는 흡입 장치 캡에 캡슐이 들어가는 홈이 있으며 버튼을 누르면 홈 양쪽 끝에서 핀이 나오게 되어 캡슐에 구멍을 뚫는 방식으로 작동되며, 크기가 크지 않아 휴대가 편리한 장점이 있다.
상기와 같은 DPI 흡입 장치에서 약리활성성분을 캡슐에서 기도로 빨아 들이는 추진체는 환자의 흡입력이다. 모든 DPI 흡입장치는 환자가 흡입시에 공기의 이동으로 인하여 생기는 압력강하 값을 가지게 되는데 공기의 흐름에 의해 변하는 압력강하 값이 흡입 제형의 적절한 유효량 평가를 위한 동적입자크기분포 및 단위전달량 함량균일성 시험 등에 있어서 중요한 변수로 작용할 수 있다. 실제로 최대흡기유속(Peak Inspiratory Flow)은 장치에 따라 다를 뿐 아니라, 환자의 연령이나 질병 상태에 따라 10~100 L/분으로 다양하다. 이에 따라 미국약전에서는 흡입 유속을 분당 0 L부터 100 L까지 조절할 수 있으며, 압력강하 값이 4 kPa로 유지될 때의 유속(Qout)과 T(초)=240/Qout 식에서 얻어진 T의 값을 흡입 시간으로 하여 시험을 평가하도록 제시하고 있다. 따라서 환자마다 유사한 약리학적 활성효과를 나타내기 위하여는 유속의 변화에 따른 동적입자크기분포값의 변화가 적은 것이 바람직하다. 본 발명에 따른 건조 분말 흡입 제형은 세 가지 약리활성성분이 유속의 변화에 의한 동적입자크기분포값에 변화가 거의 없는 장점이 있다.
따라서 본 발명에 따른 건조 분말 흡입 제형은 흡입 장치 내에서 혼합물이 충분히 배출될 수 있으며, 기도 내에서 담체로부터 약리활성성분이 쉽게 이탈되어 목표 부위에 약리활성성분이 충분히 도달할 수 있으며, 미분쇄된 약리활성성분의 함량균일성이 우수하고 유속변화에 의한 동적입자크기분포의 변화가 적은 특징을 가진다.
본 발명에 따른 건조 분말 흡입 제형에서, 살메테롤 지나포산염은 단위투여량을 기준으로 25~100 μg의 양으로, 플루티카손 프로피오네이트는 단위투여량을 기준으로 25~500 μg의 양으로, 티오트로피움 브로마이드는 단위투여량을 기준으로 5~50 μg의 양으로 사용될 수 있으나, 이는 처방하고자 하는 대상 및 질병 상태 등 여러 가지 인자에 따라 달라질 수 있다.
살메테롤과 플루티카손 및 티오트로피움을 포함하는 본 발명의 건조 분말 흡입 제형은 기관지수축, 염증 및 기도의 점액성 분비물이 제어될 수 있어, 호흡기 질환, 특히 천식 및 만성 폐쇄성 폐질환(COPD)에 뛰어난 치료효과를 나타낼 수 있다.
이하, 본 발명을 실시예에 의거하여 상세하게 설명하고자 한다. 단, 하기 실시예는 본 발명을 예시하기 위한 것일 뿐 본 발명의 범위가 이에 한정되는 것은 아니다.
실시예 1 : 건조 분말 흡입 제형의 제조 Ⅰ
유당 2 mg 해당량을 혼합기에 넣어 혼합기를 도포한 다음, 하기 표 1의 조성의 비율에 따라 살메테롤 지나포산염, 플루티카손 프로피오네이트, 티오트로피움 브로마이드 및 유당 2 mg 해당량을 배산한 후 혼합기에 넣고, 나머지 유당을 혼합기에 볼과 함께 넣어 20분간 혼합하였다. 상기 혼합물을 12시간 이상 안정화시킨 다음 캡슐 충전기를 사용하여 투명한 3호 캡슐에 충전하였다. 캡슐 충전시 내용물의 질량 편차는 3.4%로 양호하였으며, 심파텍(Sympatec)사의 HELOS 입자 측정기를 통해 측정한 상기 조성물의 평균 입도는 60.19 μm였다.
| 성분 | (mg) |
| 살메테롤 지나포산염 | 0.0725 (살메테롤로서 0.05) |
| 플루티카손 프로피오네이트 | 0.2500 |
| 티오트로피움 브로마이드 | 0.0225 (티오트로피움으로서 0.018) |
| 유당 | 20.0000 |
| 합계 | 20.3450 |
실시예 2 : 건조 분말 흡입 제형의 제조 II
하기 표 2와 같이, 티오트로피움 브로마이드를 0.01125 mg으로 사용하는 것을 제외하고 실시예 1의 제조과정에 따라 건조 분말 흡입 제형을 제조하였다. 캡슐 충전시 내용물의 질량 편차는 3.1%로 양호하였으며, 조성물의 평균 입도는 58.34 μm였다.
| 성분 | (mg) |
| 살메테롤 지나포산염 | 0.0725 (살메테롤로서 0.05) |
| 플루티카손 프로피오네이트 | 0.2500 |
| 티오트로피움 브로마이드 | 0.01125 (티오트로피움으로서 0.009) |
| 유당 | 20.0000 |
| 합계 | 20.33375 |
실시예 3 : 건조 분말 흡입 제형의 제조 III
하기 표 3과 같이, 플루티카손 프로피오네이트를 0.5000 mg으로 사용하는 것을 제외하고 실시예 1의 제조과정에 따라 건조 분말 흡입 제형을 제조하였다. 캡슐 충전시 내용물의 질량편차는 4.5%로 양호하였으며, 조성물의 평균 입도는 56.91 μm였다.
| 성분 | (mg) |
| 살메테롤 지나포산염 | 0.0725 (살메테롤로서 0.05) |
| 플루티카손 프로피오네이트 | 0.5000 |
| 티오트로피움 브로마이드 | 0.0225 (티오트로피움으로서 0.018) |
| 유당 | 20.0000 |
| 합계 | 20.5950 |
실시예 4 : 건조 분말 흡입 제형의 제조 IV
하기 표 4와 같이, 플루티카손 프로피오네이트를 0.1000 mg으로 사용하고 티오트로피움 브로마이드를 0.01125 mg으로 사용하는 것을 제외하고, 실시예 1의 제조과정에 따라 건조 분말 흡입 제형을 제조하였다. 캡슐 충전시 내용물의 질량편차는 3.9%로 양호하였으며, 조성물의 평균 입도는 62.48 μm였다.
| 성분 | (mg) |
| 살메테롤 지나포산염 | 0.0725 (살메테롤로서 0.05) |
| 플루티카손 프로피오네이트 | 0.1000 |
| 티오트로피움 브로마이드 | 0.01125 (티오트로피움으로서 0.009) |
| 유당 | 20.0000 |
| 합계 | 20.18375 |
실시예 5 : 건조 분말 흡입 제형의 제조 V
하기 표 5와 같이, 유당을 총 15 mg으로 사용하는 것을 제외하고, 실시예 1의 제조과정에 따라 건조 분말 흡입 제형을 제조하였다. 캡슐 충전시 내용물의 질량편차는 4.8%로 양호하였으며, 조성물의 평균 입도는 63.57 μm였다.
| 성분 | (mg) |
| 살메테롤 지나포산염 | 0.0725 (살메테롤로서 0.05) |
| 플루티카손 프로피오네이트 | 0.2500 |
| 티오트로피움 브로마이드 | 0.0225 (티오트로피움으로서 0.018) |
| 유당 | 15.0000 |
| 합계 | 15.3450 |
실시예
6 : 건조 분말 흡입 제형의 제조
VI
하기 표 6과 같이, 유당을 총 25 mg으로 사용하는 것을 제외하고, 실시예 1의 제조과정에 따라 건조 분말 흡입 제형을 제조하였다. 캡슐 충전시 내용물의 질량편차는 3.2%로 양호하였으며, 조성물의 평균 입도는 58.72 μm였다.
| 성분 | (mg) |
| 살메테롤 지나포산염 | 0.0725 (살메테롤로서 0.05) |
| 플루티카손 프로피오네이트 | 0.2500 |
| 티오트로피움 브로마이드 | 0.0225 (티오트로피움으로서 0.018) |
| 유당 | 25.0000 |
| 합계 | 25.3450 |
비교예
1 : 건조 분말 흡입 제형의 제조
VII
하기 표 7과 같이, 살메테롤 지나포산염, 플루티카손 프로피오네이트, 티오트로피움 브로마이드 및 유당을 한꺼번에 혼합기에 넣고 60분간 혼합하였다. 상기 혼합물을 12시간 이상 안정화시킨 다음, 캡슐 충전기를 사용하여 투명한 3호 캡슐에 충전하였다. 캡슐 충전시 내용물의 질량편차는 4.9%로 양호하였으며, 조성물의 평균 입도는 145.39 μm였다.
| 성분 | (mg) |
| 살메테롤 지나포산염 | 0.0725 (살메테롤로서 0.05) |
| 플루티카손 프로피오네이트 | 0.2500 |
| 티오트로피움 브로마이드 | 0.0225 (티오트로피움으로서 0.018) |
| 유당 | 20.0000 |
| 합계 | 20.3450 |
비교예
2 : 건조 분말 흡입 제형의 제조
VIII
하기 표 8과 같이, 비교예 1에서 유당을 5 mg으로 사용하는 것을 제외하고 비교예 1의 제조과정에 따라 건조 분말 흡입 제형을 제조하였다. 상기 조성물의 평균 입도는 140.56 μm였다.
| 성분 | (mg) |
| 살메테롤 지나포산염 | 0.0725 (살메테롤로서 0.05) |
| 플루티카손 프로피오네이트 | 0.2500 |
| 티오트로피움 브로마이드 | 0.0225 (티오트로피움으로서 0.018) |
| 유당 | 5.0000 |
| 합계 | 5.3450 |
비교예
3 : 건조 분말 흡입 제형의 제조
IX
평균 입자 크기가 약 17 μm인 유당(Respitose® ML006, DMV사)을 사용하여 실시예 1의 제조방법에 따라 하기 표 9의 조성의 비율로 혼합물을 제조하였다. 상기 혼합물을 12시간 이상 안정화시킨 다음 캡슐 충전기를 사용하여 투명한 3호 캡슐에 충전하였다. 캡슐 충전시 내용물의 질량 편차는 7.4%로 불량하였으며, 심파텍(Sympatec)사의 HELOS 입자 측정기를 통해 측정한 상기 조성물의 평균 입도는 14.63 μm였다.
| 성분 | (mg) |
| 살메테롤 지나포산염 | 0.0725 (살메테롤로서 0.05) |
| 플루티카손 프로피오네이트 | 0.2500 |
| 티오트로피움 브로마이드 | 0.0225 (티오트로피움으로서 0.018) |
| 유당 | 20.0000 |
| 합계 | 20.3450 |
시험예
1 : 활성성분의 함량균일성 시험
실시예 1과 2 및 비교예 1의 캡슐제를 사용하여 살메테롤, 플루티카손 및 티오트로피움의 함량균일성 시험을 아래의 조건에서 수행하였다. 상기 시험 결과는 하기 표 10 내지 12에 나타내었다. 각 함량균일성 시험 결과에 따른 판정치의 계산은 대한약전 일반시험법중 제제균일성 항에 따라 계산하였다.
- 판정치 =
M = 기준값, X = 개개함량의 평균
k = 판정계수(n=10 일때 2.4), s= 표준편차
- 살메테롤 및 플루티카손의 분석조건 -
컬럼 : 안지름 약 4.6 mm 및 길이 15 cm인 스테인레스관에 입경 5 μm의 액체크로마토그래프용 옥타데실실릴화한 실리카겔을 충전한 컬럼
이동상 : 메탄올 : 아세토니트릴 : 물 (50 : 16 : 34, v/v/v)의 혼합액에 초산암모늄을 0.6%(w/v) 첨가한 용액
검출기 : 자외부 흡광 광도계 (측정파장 228 nm)
온도 : 40℃
유속 : 1.0 mL/분
주입량 : 100 μL
- 티오트로피움의 분석조건 -
컬럼 : 안지름 약 4.6 mm 및 길이 15 cm인 스테인레스관에 입경 5 μm의 액체크로마토그래프용 옥틸실릴화한 실리카겔을 충전한 컬럼
이동상 : 헵탄설폰산나트륨 일수화물 1.79 g을 물 1 L에 녹이고 인산으로 pH 3.2로 조정한 다음 상기 용액 700 mL와 아세토니트릴 300 mL을 혼합한 용액.
검출기 : 자외부 흡광 광도계 (측정파장 240 nm)
온도 : 30℃
유속 : 2.0 mL/분
주입량 : 10 μL
| 살메테롤 (%) | 플루티카손 (%) | 티오트로피움 (%) | |
| 1 | 96.2 | 102.6 | 96.2 |
| 2 | 94.6 | 96.7 | 96.8 |
| 3 | 94.9 | 103.7 | 99.3 |
| 4 | 103.2 | 94.6 | 101.0 |
| 5 | 96.8 | 92.6 | 99.0 |
| 6 | 104.6 | 98.5 | 101.7 |
| 7 | 99.0 | 103.1 | 99.0 |
| 8 | 106.2 | 96.6 | 97.4 |
| 9 | 102.6 | 103.6 | 99.9 |
| 10 | 102.5 | 103.9 | 100.9 |
| 평균 | 100.1 | 99.6 | 99.1 |
| 표준편차 | 4.3 | 4.3 | 1.9 |
| 판정치 | 10.2 | 10.3 | 4.4 |
| 살메테롤 (%) | 플루티카손 (%) | 티오트로피움 (%) | |
| 1 | 96.4 | 100.2 | 99.4 |
| 2 | 98.7 | 100.5 | 99.1 |
| 3 | 98.6 | 100.7 | 101.3 |
| 4 | 96.4 | 99.6 | 101.5 |
| 5 | 100.8 | 96.9 | 96.1 |
| 6 | 98.6 | 100.6 | 100.6 |
| 7 | 100.8 | 100.0 | 98.4 |
| 8 | 100.8 | 100.7 | 101.5 |
| 9 | 100.9 | 100.6 | 101.4 |
| 10 | 96.5 | 98.5 | 92.9 |
| 평균 | 98.9 | 99.8 | 99.2 |
| 표준편차 | 1.9 | 1.2 | 2.8 |
| 판정치 | 4.6 | 3.0 | 6.8 |
| 살메테롤 (%) | 플루티카손 (%) | 티오트로피움 (%) | |
| 1 | 92.3 | 88.6 | 101.6 |
| 2 | 88.5 | 110.7 | 112.2 |
| 3 | 120.6 | 112.6 | 88.7 |
| 4 | 95.6 | 98.7 | 89.4 |
| 5 | 98.6 | 87.6 | 105.7 |
| 6 | 92.4 | 92.4 | 110.7 |
| 7 | 85.6 | 120.4 | 92.7 |
| 8 | 110.8 | 88.7 | 86.9 |
| 9 | 106.7 | 92.4 | 93.4 |
| 10 | 98.6 | 98.6 | 105.5 |
| 평균 | 99.0 | 99.1 | 98.7 |
| 표준편차 | 10.8 | 11.6 | 9.5 |
| 판정치 | 26.0 | 27.8 | 22.9 |
상기 표 10 내지 12에서 보는 바와 같이, 실시예 1과 실시예 2의 건조 분말 흡입 제형의 경우, 세 가지 활성성분의 함량균일성의 판정치가 모두 15 이하로서 균일성이 양호한 것을 확인할 수 있었다. 그러나 비교예 1의 제형은 활성성분들의 함량균일성의 판정치가 모두 20 이상으로서 균일성이 불량한 것으로 나타났다.
시험예
2 : 활성성분의
동적입자크기분포
(
Aerodynamic
Size
Distribution
)
실시예 1, 실시예 5, 비교예 2 및 비교예 3의 건조 분말 흡입 제형을 대상으로, 흡입 장치로 에어로리저(AEROLIZER®) 및 시험기구로 Apparatus 3(Anderson Cascade Impactor)을 사용하여 동적입자크기분포(particle size distribution)를 시험한 후 스테이지(stage) 1에서부터 5까지의 약리활성성분의 함량을 측정하였다. 실시예 1의 제형의 경우, 흡입장치로 핸디할러(HANDIHALER®)를 사용하여 추가시험하였다. 유속은 10 L/분, 30 L/분, 60 L/분 및 90 L/분의 네 가지 조건으로 설정하였고, 분석법은 시험예 1의 분석법을 사용하였다. 또한, 실험실 상대습도를 45~60%로 유지시켜 흡입 도중 혼합물 입자에 영향을 미칠 수 있는 정전기가 최대한 발생하지 않게 하였다. 시험결과를 도 1 내지 3에 나타내었다.
도 1 내지 3에서 보는 바와 같이, 실시예 1과 실시예 5의 건조 분말 흡입제형은 10 L/분에서 90 L/분의 유속범위에서 유효량에 해당하는 스테이지 1 내지 5 범위의 함량 결과가 거의 유사하며 유속변화에 따른 입자크기분포가 거의 차이가 없는 것으로 나타났다. 이에 반해, 비교예 2과 비교예 3의 경우, 각 약리활성성분의 함량이 실시예 1 또는 실시예 5에 비해 낮았으며, 유속변화에 따른 입자크기분포의 변화가 매우 큰 것으로 나타났다. 비교예 2의 경우 담체인 유당의 양이 적고, 담체의 입자크기 및 혼합방법이 적절하지 못하여 흡입시 캡슐내에 활성성분이 많이 남으며, 유속변화에 따라 상이한 동적입자분포변화를 나타내는 것으로 보인다. 또한 비교예 3의 경우 조성물의 입자크기가 적절하지 않기 때문에 실시예에 비해 유속에 따른 유효량 변화가 큰 것으로 보인다.
Claims (10)
- 살메테롤 지나포산염, 플루티카손 프로피오네이트, 티오트로피움 브로마이드 및 담체를 포함하며, 입자의 평균 입도가 30~120 μm인, 흡입 제형용 건조 분말.
- 제1항에 있어서, 상기 건조 분말 입자의 평균 입도가 55~65 μm인 것을 특징으로 하는, 흡입 제형용 건조 분말.
- 제1항에 있어서, 상기 담체가 단당류, 이당류, 다당류, 및 폴리알콜올류, 및 이들의 수화물로 이루어진 군으로부터 선택되는 것을 특징으로 하는, 흡입 제형용 건조 분말.
- 제3항에 있어서, 상기 담체가 락토오스 일수화물인 것을 특징으로 하는, 흡입 제형용 건조 분말.
- 제1항에 있어서, 상기 흡입 제형용 건조 분말이 호흡기 질환의 예방 또는 치료에 사용되는 것을 특징으로 하는, 흡입 제형용 건조 분말.
- 살메테롤 지나포산염, 플루티카손 프로피오네이트, 티오트로피움 브로마이드 및 담체를 포함하며, 입자의 평균 입도가 30~120 μm인 제1항의 흡입 제형용 건조 분말을 포함하는 흡입 제형.
- 제6항에 있어서, 상기 담체가 단위투여량을 기준으로 15 mg 내지 25 mg의 양으로 포함되는 것을 특징으로 하는, 흡입 제형.
- 제6항에 있어서, 상기 살메테롤 지나포산염, 플루티카손 프로피오네이트 및 티오트로피움 브로마이드가 단위 투여량을 기준으로 각각 25~100 μg, 25~500 μg, 및 5~50 μg의 양으로 포함되는 것을 특징으로 하는, 흡입 제형.
- 1) 전체 담체의 양을 기준으로 5~20 중량%의 담체를 혼합기의 기벽에 도포하는 단계;
2) 살메테롤 지나포산염, 플루티카손 프로피오네이트, 티오트로피움 브로마이드를 전체 담체의 양을 기준으로 5~20 중량%의 담체에 배산하는 단계; 및
3) 상기 배산된 성분들 및 잔량의 담체를 1)의 혼합기에 넣은 후, 입자 크기를 실질적으로 변화시키지 않는 힘으로 분쇄 및 혼합하는 단계
를 포함하는, 제1항의 흡입 제형용 건조 분말을 제조하는 방법.
- 제9항에 있어서, 상기 약리활성성분과 담체가 각각 0.1 μm 초과 내지 10 μm 및 30~120 μm의 평균 입도를 갖는 것을 특징으로 하는, 제1항의 흡입 제형용 건조 분말을 제조하는 방법.
Priority Applications (20)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020120063665A KR20130140358A (ko) | 2012-06-14 | 2012-06-14 | 살메테롤 지나포산염, 플루티카손 프로피오네이트 및 티오트로피움 브로마이드를 포함하는 흡입 제형용 건조 분말 및 이의 제조방법 |
| SG11201408292YA SG11201408292YA (en) | 2012-06-14 | 2013-06-03 | Dry powder for inhalation formulation comprising salmeterol xinafoate, fluticasone propionate and tiotropium bromide, and method for preparing same |
| PCT/KR2013/004880 WO2013187626A1 (en) | 2012-06-14 | 2013-06-03 | Dry powder for inhalation formulation comprising salmeterol xinafoate, fluticasone propionate and tiotropium bromide, and method for preparing same |
| US14/402,548 US9283232B2 (en) | 2012-06-14 | 2013-06-03 | Dry powder for inhalation formulation comprising salmeterol xinafoate, fluticasone propionate and tiotropium bromide, and method for preparing same |
| JP2015517171A JP2015519394A (ja) | 2012-06-14 | 2013-06-03 | キシナホ酸サルメテロール、プロピオン酸フルチカゾンおよび臭化チオトロピウムを含む吸入製剤用ドライパウダー、ならびにその製造方法 |
| CN201380030898.0A CN104363895A (zh) | 2012-06-14 | 2013-06-03 | 用于吸入制剂的包含昔萘酸沙美特罗、丙酸氟替卡松和噻托溴铵的干粉及其制备方法 |
| AU2013275113A AU2013275113A1 (en) | 2012-06-14 | 2013-06-03 | Dry powder for inhalation formulation comprising salmeterol xinafoate, fluticasone propionate and tiotropium bromide, and method for preparing same |
| BR112014030910A BR112014030910A2 (pt) | 2012-06-14 | 2013-06-03 | pó seco para formulação de inalação compreendendo xinafoato de salmeterol, propionato de fluticasona e brometo de tiotrópio e método para preparar o mesmo |
| MX2014014755A MX2014014755A (es) | 2012-06-14 | 2013-06-03 | Polvo seco para formulacion para inhalacion que comprende xinafoato de salmeterol, propionato de fluticasona y bromuro de tiotropio, y metodo para su preparacion. |
| NZ703788A NZ703788A (en) | 2012-06-14 | 2013-06-03 | Dry powder for inhalation formulation comprising salmeterol xinafoate, fluticasone propionate and tiotropium bromide, and method for preparing same |
| EP13804439.1A EP2861219A4 (en) | 2012-06-14 | 2013-06-03 | DRY POWDER FOR INHALATION FORMULATION WITH SALMETEROLXINAFOAT, FLUTICASONPROPIONATE AND TIOTROPIUMBROMIDE, AND METHOD FOR THE PRODUCTION THEREOF |
| IN11257DEN2014 IN2014DN11257A (ko) | 2012-06-14 | 2013-06-03 | |
| RU2015100905A RU2015100905A (ru) | 2012-06-14 | 2013-06-03 | Сухой порошок для ингаляционного препарата, включающий сальметерола ксинафоат, флутиказона пропионат и тиотропия бромид, а также способ его изготовления |
| CA2876283A CA2876283A1 (en) | 2012-06-14 | 2013-06-03 | Dry powder for inhalation formulation comprising salmeterol xinafoate, fluticasone propionate and tiotropium bromide, and method for preparing same |
| TW102120909A TWI565481B (zh) | 2012-06-14 | 2013-06-13 | 包含沙美特羅羥萘甲酸鹽、弗提卡松丙酸鹽及托溴銨溴化物之吸入型調配物的乾粉末以及其製備方法 |
| PH12014502746A PH12014502746A1 (en) | 2012-06-14 | 2014-12-09 | Dry powder for inhalation formulation comprising salmeterol xinafoate, fluticasone propionate and tiotropium bromide, and method for preparing same |
| IL236198A IL236198A0 (en) | 2012-06-14 | 2014-12-11 | Dry powder for inhalation preparation containing salmatrol zinafoate, fluticasone propionate and tiotropium bromide, and its production method |
| ZA2015/00208A ZA201500208B (en) | 2012-06-14 | 2015-01-13 | Dry powder for inhalation formulation comprising salmeterol xinafoate, fluticasone propionate and tiotropium bromide, and method for preparing same |
| US14/746,225 US9549936B2 (en) | 2012-06-14 | 2015-06-22 | Method for preparing dry powder for inhalation formulation comprising salmeterol xinafoate, fluticasone propionate and tiotropium bromide |
| HK15107131.8A HK1206602A1 (en) | 2012-06-14 | 2015-07-27 | Dry powder for inhalation formulation comprising salmeterol xinafoate, fluticasone propionate and tiotropium bromide, and method for preparing same |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020120063665A KR20130140358A (ko) | 2012-06-14 | 2012-06-14 | 살메테롤 지나포산염, 플루티카손 프로피오네이트 및 티오트로피움 브로마이드를 포함하는 흡입 제형용 건조 분말 및 이의 제조방법 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20130140358A true KR20130140358A (ko) | 2013-12-24 |
Family
ID=49758405
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020120063665A KR20130140358A (ko) | 2012-06-14 | 2012-06-14 | 살메테롤 지나포산염, 플루티카손 프로피오네이트 및 티오트로피움 브로마이드를 포함하는 흡입 제형용 건조 분말 및 이의 제조방법 |
Country Status (19)
| Country | Link |
|---|---|
| US (2) | US9283232B2 (ko) |
| EP (1) | EP2861219A4 (ko) |
| JP (1) | JP2015519394A (ko) |
| KR (1) | KR20130140358A (ko) |
| CN (1) | CN104363895A (ko) |
| AU (1) | AU2013275113A1 (ko) |
| BR (1) | BR112014030910A2 (ko) |
| CA (1) | CA2876283A1 (ko) |
| HK (1) | HK1206602A1 (ko) |
| IL (1) | IL236198A0 (ko) |
| IN (1) | IN2014DN11257A (ko) |
| MX (1) | MX2014014755A (ko) |
| NZ (1) | NZ703788A (ko) |
| PH (1) | PH12014502746A1 (ko) |
| RU (1) | RU2015100905A (ko) |
| SG (1) | SG11201408292YA (ko) |
| TW (1) | TWI565481B (ko) |
| WO (1) | WO2013187626A1 (ko) |
| ZA (1) | ZA201500208B (ko) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016159542A1 (en) * | 2015-03-31 | 2016-10-06 | Hanmi Pharm. Co., Ltd. | Capsule for inhalation with improved stability of combined active ingredients |
| KR20210044336A (ko) * | 2019-10-14 | 2021-04-23 | 한미약품 주식회사 | 흡입 제형용 건조 분말 및 이의 제조방법 |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN106573082B (zh) | 2014-06-30 | 2020-01-17 | 普罗沃锐斯科学有限公司 | 用于确定药物的递送剂量的量和均匀性的采样装置及相关方法 |
| KR20160038767A (ko) * | 2014-09-30 | 2016-04-07 | 한미약품 주식회사 | 복합 활성성분의 안정성이 개선된 흡입 제형용 건조분말 |
| MA41378A (fr) * | 2015-01-20 | 2017-11-28 | Teva Branded Pharmaceutical Prod R & D Inc | Inhalateur de poudre sèche comprenant du propionate de fluticasone et du xinafoate de salmétérol |
| EP3288541B1 (en) * | 2015-05-01 | 2020-09-02 | Board of Regents, The University of Texas System | Multidrug brittle matrix compositions |
| WO2017156287A1 (en) * | 2016-03-09 | 2017-09-14 | Proveris Scientific Corporation | Methods for measuring dose content uniformity performance of inhaler and nasal devices |
| CN108066329B (zh) * | 2016-11-11 | 2021-11-16 | 江苏恒瑞医药股份有限公司 | 一种吸入用氟替卡松或其衍生物的微粒的制备方法 |
| WO2021260441A1 (en) * | 2020-06-26 | 2021-12-30 | Mylan Pharma Uk Limited | Formulations including 5-[3-(3-hydroxyphenoxy)azetidin-1-yl]-5-methyl-2,2-diphenylhexanamide |
| CN115266987B (zh) * | 2022-07-31 | 2023-06-30 | 浙江知一药业有限责任公司 | 治疗呼吸系统疾病的药物组合物 |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB9322014D0 (en) | 1993-10-26 | 1993-12-15 | Co Ordinated Drug Dev | Improvements in and relating to carrier particles for use in dry powder inhalers |
| GB0003935D0 (en) * | 2000-02-08 | 2000-04-12 | King S College London | Formulation for dry powder inhaler |
| DE10130371A1 (de) | 2001-06-23 | 2003-01-02 | Boehringer Ingelheim Pharma | Neue Arzneimittelkompositionen auf der Basis von Anticholinergika, Corticosteroiden und Betamimetika |
| GB0312148D0 (en) | 2003-05-28 | 2003-07-02 | Aventis Pharma Ltd | Stabilized pharmaceutical products |
| SE527190C2 (sv) | 2003-06-19 | 2006-01-17 | Microdrug Ag | Inhalatoranordning samt kombinerade doser av en beta2-agonist, ett antikolinergiskt medel och ett antiinflammatorisk steroid |
| GB0326632D0 (en) | 2003-11-14 | 2003-12-17 | Jagotec Ag | Dry powder formulations |
| EP2327403A3 (en) | 2007-02-19 | 2011-08-31 | Cipla Limited | Pharmaceutical combinations of at least two bronchodilators |
| EP2197444A1 (en) | 2007-09-12 | 2010-06-23 | Glaxo Group Limited | Novel combination of therapeutic agents |
| BRPI0915803A2 (pt) * | 2008-07-18 | 2015-11-10 | Prosonix Ltd | processo para aumentar a cristalinidade de pelo menos um material sólido, partícula, composição farmacêutica, e, inalador |
| JP5705112B2 (ja) * | 2008-07-30 | 2015-04-22 | エスティーシー.ユーエヌエム | ドライパウダー吸入エアロゾル用の大径キャリア粒子を含む製剤 |
| TR201000681A2 (tr) * | 2010-01-29 | 2011-08-22 | B�Lg�� Mahmut | İnhalasyon yoluyla alınan kuru toz formülasyonları. |
-
2012
- 2012-06-14 KR KR1020120063665A patent/KR20130140358A/ko not_active Application Discontinuation
-
2013
- 2013-06-03 IN IN11257DEN2014 patent/IN2014DN11257A/en unknown
- 2013-06-03 BR BR112014030910A patent/BR112014030910A2/pt not_active IP Right Cessation
- 2013-06-03 MX MX2014014755A patent/MX2014014755A/es unknown
- 2013-06-03 SG SG11201408292YA patent/SG11201408292YA/en unknown
- 2013-06-03 WO PCT/KR2013/004880 patent/WO2013187626A1/en active Application Filing
- 2013-06-03 US US14/402,548 patent/US9283232B2/en not_active Expired - Fee Related
- 2013-06-03 RU RU2015100905A patent/RU2015100905A/ru not_active Application Discontinuation
- 2013-06-03 EP EP13804439.1A patent/EP2861219A4/en not_active Withdrawn
- 2013-06-03 CN CN201380030898.0A patent/CN104363895A/zh active Pending
- 2013-06-03 CA CA2876283A patent/CA2876283A1/en not_active Abandoned
- 2013-06-03 NZ NZ703788A patent/NZ703788A/en not_active IP Right Cessation
- 2013-06-03 AU AU2013275113A patent/AU2013275113A1/en not_active Abandoned
- 2013-06-03 JP JP2015517171A patent/JP2015519394A/ja active Pending
- 2013-06-13 TW TW102120909A patent/TWI565481B/zh not_active IP Right Cessation
-
2014
- 2014-12-09 PH PH12014502746A patent/PH12014502746A1/en unknown
- 2014-12-11 IL IL236198A patent/IL236198A0/en unknown
-
2015
- 2015-01-13 ZA ZA2015/00208A patent/ZA201500208B/en unknown
- 2015-06-22 US US14/746,225 patent/US9549936B2/en not_active Expired - Fee Related
- 2015-07-27 HK HK15107131.8A patent/HK1206602A1/xx unknown
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016159542A1 (en) * | 2015-03-31 | 2016-10-06 | Hanmi Pharm. Co., Ltd. | Capsule for inhalation with improved stability of combined active ingredients |
| KR20160117069A (ko) | 2015-03-31 | 2016-10-10 | 한미약품 주식회사 | 복합 활성성분의 안정성이 개선된 흡입용 캡슐제 |
| KR20210044336A (ko) * | 2019-10-14 | 2021-04-23 | 한미약품 주식회사 | 흡입 제형용 건조 분말 및 이의 제조방법 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20150283151A1 (en) | 2015-10-08 |
| HK1206602A1 (en) | 2016-01-15 |
| MX2014014755A (es) | 2015-02-24 |
| IL236198A0 (en) | 2015-01-29 |
| TWI565481B (zh) | 2017-01-11 |
| US9549936B2 (en) | 2017-01-24 |
| CN104363895A (zh) | 2015-02-18 |
| AU2013275113A1 (en) | 2015-02-05 |
| ZA201500208B (en) | 2016-10-26 |
| PH12014502746B1 (en) | 2015-02-02 |
| US9283232B2 (en) | 2016-03-15 |
| JP2015519394A (ja) | 2015-07-09 |
| IN2014DN11257A (ko) | 2015-10-09 |
| EP2861219A1 (en) | 2015-04-22 |
| SG11201408292YA (en) | 2015-01-29 |
| PH12014502746A1 (en) | 2015-02-02 |
| NZ703788A (en) | 2016-10-28 |
| WO2013187626A1 (en) | 2013-12-19 |
| US20150157566A1 (en) | 2015-06-11 |
| CA2876283A1 (en) | 2013-12-19 |
| TW201402154A (zh) | 2014-01-16 |
| BR112014030910A2 (pt) | 2017-06-27 |
| RU2015100905A (ru) | 2016-08-10 |
| EP2861219A4 (en) | 2015-10-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US9549936B2 (en) | Method for preparing dry powder for inhalation formulation comprising salmeterol xinafoate, fluticasone propionate and tiotropium bromide | |
| CN105101955B (zh) | 至少包含两种通过喷雾干燥以增加制剂稳定性而得到的干粉的组合物 | |
| EP2806855B1 (en) | Dry powder formulation comprising a corticosteroid and a beta-adrenergic for administration by inhalation | |
| TW200407174A (en) | Composition | |
| CN107205936B (zh) | 包含至少一种通过喷雾干燥得到的增加制剂稳定性的干粉的组合物 | |
| JP5154732B2 (ja) | 薬剤 | |
| KR20180036459A (ko) | 복합 활성성분의 개선된 함량 균일성 및 높은 단위전달량을 갖는 흡입용 캡슐제 및 이의 제조방법 | |
| CN114514020A (zh) | 用于吸入用干粉制剂的新型载体颗粒 | |
| EP3203984B1 (en) | Pharmaceutical composition containing budesonide and formoterol. | |
| KR20160038767A (ko) | 복합 활성성분의 안정성이 개선된 흡입 제형용 건조분말 | |
| TW201605432A (zh) | 新穎劑量及調配物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |