KR20130109254A - 핑골리모드 hcl의 결정질 형태 - Google Patents
핑골리모드 hcl의 결정질 형태 Download PDFInfo
- Publication number
- KR20130109254A KR20130109254A KR1020137024001A KR20137024001A KR20130109254A KR 20130109254 A KR20130109254 A KR 20130109254A KR 1020137024001 A KR1020137024001 A KR 1020137024001A KR 20137024001 A KR20137024001 A KR 20137024001A KR 20130109254 A KR20130109254 A KR 20130109254A
- Authority
- KR
- South Korea
- Prior art keywords
- fty720
- salt
- crystalline
- hydrochloride
- composition
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C215/00—Compounds containing amino and hydroxy groups bound to the same carbon skeleton
- C07C215/02—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups and amino groups bound to acyclic carbon atoms of the same carbon skeleton
- C07C215/22—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups and amino groups bound to acyclic carbon atoms of the same carbon skeleton the carbon skeleton being unsaturated
- C07C215/28—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups and amino groups bound to acyclic carbon atoms of the same carbon skeleton the carbon skeleton being unsaturated and containing six-membered aromatic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/137—Arylalkylamines, e.g. amphetamine, epinephrine, salbutamol, ephedrine or methadone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/02—Local antiseptics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/13—Crystalline forms, e.g. polymorphs
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Epidemiology (AREA)
- Emergency Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Transplantation (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
본 발명은 2-아미노-2-[2-(4-C2 -20-알킬-페닐)에틸]프로판-1,3-디올의 결정질 형태 및 수화물, 및 특히 다양한 자가면역 병태의 치료 또는 예방에서의 이들의 용도에 관한 것이다.
Description
본 발명은 화합물 FTY720 히드로클로라이드의 결정질 형태 및 수화물, 및 이들의 용도에 관한 것이다.
2-아미노-2-[2-(4-C2 -20-알킬-페닐)에틸]프로판-1,3-디올 화합물은 EP-A-0627406에 개시되어 있으며, 이의 관련된 개시내용은 본원에 참고로 포함된다. 관측된 활성에 근거하여, 상기 화합물은 면역억제제로서 유용한 것으로 밝혀졌다. 따라서, 상기 화합물은 다발성 경화증을 비롯한 다양한 자가면역 병태의 치료 또는 예방에 유용할 수 있다. 이러한 부류의 특정 화합물은 FTY720 (2-아미노-2-[2-(4-옥틸페닐)에틸]프로판-1,3-디올; 핑골리모드 (fingolimod))이며, 이는 유리 염기 또는 히드로클로라이드 염 형태로 얻을 수 있다. FTY720의 구조를 아래에 나타낸다.
본 발명은 부분적으로 FTY720 히드로클로라이드가 다형성을 나타낸다는 발견을 기초로 한다. 본원에서 주어진 실시예가 예시하는 바와 같이, FTY720 히드로클로라이드는 실온에서 특정한 결정질 형태 (이후 형태 I)로 존재한다. 결정질 형태 I은 대략 40℃의 전이 온도 (transition temperature)에서 또 다른 결정질 형태 (형태 II)로의 변화를 겪는다. 또한, 결정질 형태 II는 대략 66℃의 온도에서 제3 결정질 형태 (형태 III)으로의 전이를 겪는다. 대략 107℃의 온도에서, FTY720 히드로클로라이드는 결정질 규칙성 (crystalline order)이 보다 낮은 상을 형성한다.
따라서, 본 발명은 FTY720 히드로클로라이드의 신규 결정질 형태 (그의 용매화물, 특히 수화물 포함)를 제공한다.
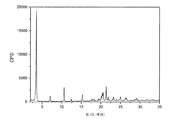
FTY720 히드로클로라이드의 결정질 형태 I은 하기 2-세타 값 중 적어도 2개, 바람직하게는 적어도 4개, 보다 바람직하게는 모두에서 피크를 갖는 X-선 분말 회절 패턴으로 특성화된다: 3.6, 7.1, 10.7, 12.5, 15.4 및 20.6도 2-세타. 상기 2-세타 값에서의 피크는 하기 상대 강도를 가질 수 있다: 3.6 (강), 7.1 (약), 10.7 (약), 12.5 (약), 15.4 (중) 및 20.6 (중). 한 실시양태에서, 상기 결정질 형태는 하기 2-세타 값 중 적어도 2개, 바람직하게는 적어도 4개, 보다 바람직하게는 모두에서 피크를 갖는 X-선 분말 회절 패턴으로 특성화된다: 3.55, 7.12, 10.71, 12.48, 15.42 및 20.59도 2-세타. 상기 2-세타 값에서의 피크는 하기 상대 강도를 가질 수 있다: 3.55 (강), 7.12 (약), 10.71 (약), 12.48 (약), 15.42 (중) 및 20.59 (중). 특정 실시양태에서, 상기 결정질 형태는 실질적으로 도 1에서 나타낸 것에 상응하는 X-선 분말 회절 패턴으로 특성화된다.
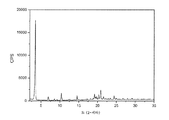
FTY720 히드로클로라이드의 결정질 (형태 II)은 하기 2-세타 값 중 적어도 2개, 바람직하게는 적어도 4개, 보다 바람직하게는 모두에서 피크를 갖는 X-선 분말 회절 패턴으로 특성화된다: 3.5, 6.9, 10.4, 14.6, 19.2, 20.3 및 20.9도 2-세타. 상기 2-세타 값에서의 피크는 하기 상대 강도를 가질 수 있다: 3.5 (강), 6.9 (약), 10.4 (약), 14.6 (약), 19.2 (약), 20.3 (약) 및 20.9 (약). 한 실시양태에서, 상기 결정질 형태는 하기 2-세타 값 중 적어도 2개, 바람직하게는 적어도 4개, 보다 바람직하게는 모두에서 피크를 갖는 X-선 분말 회절 패턴으로 특성화된다: 3.47, 6.92, 10.38, 14.58, 19.20, 20.34 및 20.86도 2-세타. 상기 2-세타 값에서의 피크는 하기 상대 강도를 가질 수 있다: 3.47 (강), 6.92 (약), 10.38 (약), 14.58 (약), 19.20 (약), 20.34 (약) 및 20.86 (약). 특정 실시양태에서, 상기 결정질 형태는 실질적으로 도 2에서 나타낸 것에 상응하는 X-선 분말 회절 패턴으로 특성화된다.
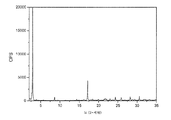
FTY720 히드로클로라이드의 결정질 형태 (형태 III)는 하기 2-세타 값 중 적어도 2개, 바람직하게는 적어도 4개, 보다 바람직하게는 모두에서 피크를 갖는 X-선 분말 회절 패턴으로 특성화된다: 3.5, 6.9, 10.3, 14.4, 18.9, 20.3, 20.7 및 24.2도 2-세타. 상기 2-세타 값에서의 피크는 하기 상대 강도를 가질 수 있다: 3.5 (강), 6.9 (약), 10.3 (약), 14.4 (약), 18.9 (약), 20.3 (약), 20.7 (약) 및 24.2 (약). 한 실시양태에서, 상기 결정질 형태는 하기 2-세타 값 중 적어도 2개, 바람직하게는 적어도 4개, 보다 바람직하게는 모두에서 피크를 갖는 X-선 분말 회절 패턴으로 특성화된다: 3.46, 6.88, 10.32, 14.41, 18.94, 20.26, 20.73 및 24.23도 2-세타. 상기 2-세타 값에서의 피크는 하기 상대 강도를 가질 수 있다: 3.46 (강), 6.88 (약), 10.32 (약), 14.41 (약), 18.94 (약), 20.26 (약), 20.73 (약) 및 24.23 (약). 특정 실시양태에서, 상기 결정질 형태는 실질적으로 도 3에서 나타낸 것에 상응하는 X-선 분말 회절 패턴으로 특성화된다.
추가적으로, 본 발명은 FTY720 히드로클로라이드의 결정질 형태 I의 제조 방법을 제공하며, 이는 FTY720 히드로클로라이드의 결정질 형태 II 또는 형태 III을 40℃ 미만의 온도로 냉각시키는 단계를 포함한다. 바람직하게는, 상기 방법은 결정질 형태 I로의 전환을 보장하기 위해, 30℃ 이하, 보다 바람직하게는 20℃ 이하, 보다 더 바람직하게는 10℃ 이하, 예를 들어 8℃ 이하, 예를 들어 2 내지 8℃의 온도로 냉각하는 단계를 포함한다.
또한, FTY720 히드로클로라이드가 실질적으로 수화물 형태로 존재할 수 있다는 것을 발견하였다. 소정 실시양태에서, 수화물은 약 2.9, 17.2, 30.6, 28.2, 24.4, 8.6 및 25.9도 2-세타 중 적어도 2개, 바람직하게는 적어도 4개, 보다 바람직하게는 모두에서 피크를 갖는 X-선 분말 회절 패턴으로 특성화된다. 상기 2-세타 값에서의 피크는 하기 상대 강도를 가질 수 있다: 2.9 (강), 17.2 (중), 30.6 (약), 28.2 (약), 24.4 (약), 8.6 (약) 및 25.9 (약). 특정 실시양태에서, 실질적으로 도 4에서 나타낸 것에 상응하는 X-선 분말 회절 패턴으로 특성화되는 FTY720 히드로클로라이드의 수화물을 제공한다.
도 1은 FTY720 히드로클로라이드 형태 I의 XRPD 다이아그램이다.
도 2는 FTY720 히드로클로라이드 형태 II의 XRPD 다이아그램이다.
도 3은 FTY720 히드로클로라이드 형태 III의 XRPD 다이아그램이다.
도 4는 FTY720 히드로클로라이드 염의 수화물의 XRPD 다이아그램이다.
도 2는 FTY720 히드로클로라이드 형태 II의 XRPD 다이아그램이다.
도 3은 FTY720 히드로클로라이드 형태 III의 XRPD 다이아그램이다.
도 4는 FTY720 히드로클로라이드 염의 수화물의 XRPD 다이아그램이다.
예로서 및 제한 없이, FTY720 히드로클로라이드의 다양한 결정질 형태 및 수화물은 본원 실시예에서 주어진 절차에 따라 얻을 수 있다. 특히, FTY720 히드로클로라이드의 다양한 다형적 형태 사이의 상호전환은 실시예에 기재된 절차에 따라 FTY720 히드로클로라이드를 가열 또는 냉각시켜 달성할 수 있다.
유리하게는, 본 발명의 다양한 결정질 염 형태는 FTY720의 유리 염기 형태와 비교하여 하나 이상의 바람직한 특성을 가질 수 있다. 예를 들어, 본 발명의 결정질 염은, 특히 저장 및 유통 동안에 유리 염기에 비해 보다 안정하며 품질이 보다 높을 수 있다. 추가적으로, 상기 염은 물에서 높은 해리도를 가질 수 있으며, 따라서 실질적으로 개선된 수용해도를 가질 수 있다. 또한, 상기 염은 이들이 측정가능한 수분 흡수 또는 손실을 나타내지 않는다는 점에서 유리할 수 있다.
결정질 형태는 본원 실시예에서 예시된 것과 같은 X-선 분말 회절 스펙트럼의 주요 피크로 특성화될 수 있다. 또한, 결정질 형태는 그의 열역학 안정성, 그의 물리적 파라미터, 예컨대 적외선 분광법 (IR)에서의 흡수 패턴 또는 시차 주사 열량측정 (DSC)에서의 상 전이 신호의 측면에서 다를 수 있다.
본 발명의 소정 실시양태에서, 본 발명의 다양한 결정질 염 형태는 실질적으로 순수한 결정질 형태이다. 본원에서 사용되는 용어 "실질적으로 순수한"은 예를 들어 X-선 분말 회절, 라만 분광법 또는 IR 분광법에 의해 측정시에 90%, 보다 바람직하게는 95%, 보다 바람직하게는 96%, 보다 바람직하게는 97%, 보다 바람직하게는 98%, 보다 바람직하게는 99% 초과의 다형적 순도의 결정질 형태에 대한 언급을 포함한다.
또한, 본 발명의 결정질 염을 포함하는 제약 제제를 제공한다. 본 발명의 제약 제제는 제제의 총 중량을 기준으로 바람직하게는 0.01 내지 20 중량%, 보다 바람직하게는 0.1 내지 10 중량%, 예를 들어 0.5 내지 5 중량%의 염을 함유한다.
제약 제제는 경구 투여에 적합한 형태, 예를 들어 정제 또는 캡슐 형태의 고체 제약 조성물일 수 있다. 조성물은 통상의 방식으로, 예를 들어 본 발명의 염을 제약상 허용되는 담체 또는 희석제와 혼합하여 제조할 수 있다.
특정 실시양태에서, 제제는 본 발명의 염 및 당 알콜을 포함하는 고체 제약 조성물이다. 이러한 유형의 조성물은 WO 2004/089341 (그 내용이 본원에 참조로 포함됨)에 개시되어 있다. 상기 공보에 개시되어 있는 고체 조성물이 본 발명의 염의 경구 투여에 특히 적합하다. 조성물은 화합물의 전신 투여의 편리한 수단을 제공하고, 주사용 또는 경구용 액체 제제의 단점이 없으며, 양호한 물리화학적 특성 및 저장 특성을 갖는다. 특히, 본 발명의 조성물은 조성물 전체에 걸친 화합물의 분포에서의 높은 수준의 균등성 뿐만 아니라 높은 안정성을 나타낼 수 있다. 따라서, 조성물은 고속 자동화 장비에서 제조될 수 있으며, 이에 따라 수동 캡슐화를 필요로 하지 않는다.
당 알콜은 희석제, 담체, 충전재 또는 벌크화제로서 작용할 수 있으며, 적합하게는 만니톨, 말티톨, 이노시톨, 크실리톨 또는 락티톨, 바람직하게는 실질적으로 비흡습성인 당 알콜, 예를 들어 만니톨 (D-만니톨)일 수 있다. 단일 당 알콜, 또는 2종 이상의 당 알콜의 혼합물, 예를 들어 만니톨과 크실리톨의 혼합물 (예를 들어, 1:1 내지 4.1의 비율)이 사용될 수 있다.
특히 바람직한 실시양태에서, 당 알콜은 높은 비표면적의 분무-건조된 조성물, 예를 들어 만니톨 조성물로부터 제조된다. 이러한 유형의 만니톨 조성물을 사용하여 조성물에서 만니톨 전체에 걸쳐 화합물의 균등 분포를 촉진하는 것을 보조할 수 있다. 더 작은 평균 크기 및/또는 각 입자 상의 보다 거친 표면을 갖는 입자로 구성된 당 알콜 (예를 들어, 만니톨) 제제를 제공함으로써 보다 높은 표면적을 달성할 수 있다. 분무-건조된 당 알콜, 예를 들어 만니톨 (예를 들어, 300 μm 이하의 평균 입자 크기를 가짐)의 사용은 또한 조성물로부터 형성되는 정제의 압축성 및 경도를 개선시키는 것으로 밝혀졌다.
바람직하게는, 당 알콜 (예를 들어, 만니톨) 제제의 단일점 표면적은 1 내지 7 m2/g, 예를 들어 2 내지 6 m2/g 또는 3 내지 5 m2/g이다. 만니톨 제제는 적합하게는 100 내지 300 μm, 예를 들어 150 내지 250 μm의 평균 입자 크기, 및 0.4 내지 0.6 g/mL, 예를 들어 0.45 내지 0.55 g/mL의 벌크 밀도를 가질 수 있다. 높은 표면적의 적합한 만니톨은 파르텍 (Parteck) M200 (이.머크 (E. Merck)로부터 상업적으로 입수가능함)이다.
조성물은 조성물의 총 중량을 기준으로 바람직하게는 75 내지 99.99 중량%, 보다 바람직하게는 85 내지 99.9 중량%, 예를 들어 90 내지 99.5 중량%의 당 알콜을 함유한다.
바람직하게는, 조성물은 윤활제를 추가로 포함한다. 적합한 윤활제에는 스테아르산, 스테아르산마그네슘, 스테아르산칼슘, 스테아르산아연, 글리세릴 팔미토스테아레이트, 나트륨 스테아릴 푸마레이트, 카놀라 오일, 수소화 식물성 오일, 예컨대 수소화 피마자 오일 (예를 들어, 쿠티나 (Cutina)® 또는 루브리왁스 (Lubriwax)® 101), 미네랄 오일, 나트륨 라우릴 술페이트, 산화마그네슘, 콜로이드성 이산화규소, 실리콘 유체, 폴리에틸렌 글리콜, 폴리비닐 알콜, 나트륨 벤조에이트, 탈크, 폴록사머, 또는 상기 중 임의의 것들의 혼합물이 포함된다. 바람직하게는, 윤활제는 스테아르산마그네슘, 수소화 피마자 오일 또는 미네랄 오일을 포함한다. 콜로이드성 이산화규소 및 폴리에틸렌 글리콜은 윤활제로서 덜 바람직하다.
조성물은 조성물의 총 중량을 기준으로 바람직하게는 0.01 내지 5 중량%, 보다 바람직하게는 1 내지 3 중량%, 예를 들어 약 2 중량%의 윤활제를 함유한다.
조성물은 1종 이상의 추가의 부형제, 예컨대 담체, 결합제 또는 희석제를 포함할 수 있다. 특히, 조성물은 미세결정질 셀룰로스 (예를 들어, 아비셀 (Avicel)®), 메틸셀룰로스, 히드록시프로필셀룰로스, 히드록시프로필메틸셀룰로스, 전분 (예를 들어, 옥수수 전분) 또는 인산이칼슘을, 조성물의 총 중량을 기준으로 바람직하게는 0.1 내지 90 중량%, 예를 들어 1 내지 30 중량%의 양으로 포함할 수 있다. 결합제, 예를 들어 미세결정질 셀룰로스, 메틸셀룰로스, 히드록시프로필 셀룰로스, 히드록시프로필메틸 셀룰로스가 사용되는 경우, 이는 조성물의 총 중량을 기준으로 바람직하게는 1 내지 8 중량%, 예를 들어 3 내지 6 중량%의 양으로 포함된다. 결합제의 사용은 제제의 과립 강도를 증가시키며, 이는 미세 과립화를 위해 특히 중요하다. 높은 정제 경도 및/또는 보다 긴 붕해 시간이 필요한 경우, 미세결정질 셀룰로스 및 메틸셀룰로스가 특히 바람직하다. 보다 빠른 붕해가 필요한 경우, 히드록시프로필 셀룰로스가 바람직하다. 적절한 경우, 크실리톨이 또한 추가의 결합제로서 (예를 들어, 미세결정질 셀룰로스에 더하여), 예를 들어 20 중량% 이하의 당 알콜, 예를 들어 크실리톨의 양으로 첨가될 수 있다.
한 실시양태에서, 조성물은 안정화제, 바람직하게는 글리신 HCl 또는 중탄산나트륨을 추가로 포함한다. 안정화제는 예를 들어 0.1 내지 30 중량%, 바람직하게는 1 내지 20 중량%의 양으로 존재할 수 있다.
조성물은 분말, 과립 또는 펠렛의 형태이거나, 또는 단위 투여 형태, 예를 들어 정제 또는 캡슐일 수 있다. 본 발명의 조성물은 경구 투여가능한 캡슐 쉘, 특히 경질 젤라틴 쉘로 캡슐화되기에 매우 적합하다.
별법으로, 조성물은 정제로 압축될 수 있다. 임의로, 정제는 예를 들어 탈크 또는 폴리사카라이드 (예를 들어, 셀룰로스), 또는 히드록시프로필메틸-셀룰로스 코팅제로 코팅될 수 있다.
제약 캡슐이 단위 투여 형태인 경우, 각각의 단위 투여량은, 예를 들어 약 0.5 내지 약 10 mg의 본 발명의 염을 함유할 수 있다.
본 발명의 조성물은 표준 안정성 시험에 의해 나타낸 바와 같은 양호한 안정성 특징을 나타낼 수 있으며, 예를 들어 1년, 2년 또는 3년까지, 및 심지어 더 긴 기간의 저장 수명 안정성을 가질 수 있다. 안정성 특징은, 예를 들어 특정 시간 동안 특정 온도, 예를 들어 20, 40 또는 60℃에서 저장한 후 HPLC 분석에 의해 분해 생성물을 측정함으로써 결정될 수 있다.
본 발명의 제약 조성물은 표준 방법, 예를 들어 통상적인 혼합, 과립화, 당-코팅, 용해 또는 동결건조 방법에 의해 제조될 수 있다. 이용할 수 있는 절차는 당업계에 알려져 있다 (예를 들어, 문헌 [L. Lachman et al. The Theory and Practice of Industrial Pharmacy, 3rd Ed, 1986], [H Sucker et al, Pharmazeutische Technologie, Thieme, 1991], [Hagers Handbuch der pharmazeutischen Praxis, 4th Ed. (Springer Veriag, 1971)] 및 [Remington's Pharmaceutical Sciences, 13th Ed., (Mack Publ., Co., 1970)] 또는 최신판에 기재된 것들).
소정 실시양태에서, 제약 조성물은
(a) 본 발명의 염을 당 알콜과 혼합하는 단계;
(b) (a)에서 얻은 혼합물을 밀링 및/또는 과립화하는 단계; 및
(c) (b)에서 얻은 밀링 및/또는 과립화된 혼합물을 윤활제와 혼합하는 단계
를 포함하는 방법에 의해 제조된다.
상기 방법을 이용하여, 양호한 수준의 함량 및 블렌드 균등성 (즉, 조성물 전체에 걸친 염의 실질적 균등 분포), 용해 시간, 및 안정성을 갖는 제제를 얻는다.
임의로, 염은 덩어리의 제거를 위해서 단계 (a) 이전에, 예를 들어 400 내지 500 μm 메쉬 스크린을 사용하여 예비스크리닝되고/거나 미분화될 수 있다. 혼합 단계 (a)는 적합하게는 염 및 당 알콜, 예를 들어 만니톨을 임의의 적절한 블렌더 또는 믹서 중에서, 예를 들어 100 내지 400 회전으로 블렌딩하는 것을 포함할 수 있다.
상기 방법은 성분을 건식 혼합함으로써 수행할 수 있다. 이 실시양태에서, 밀링 단계 (b)는 적합하게는 (a)에서 얻은 혼합물을 스크린 (바람직하게는, 400 내지 500 μm의 메쉬 크기를 가짐)을 통해 통과시키는 것을 포함할 수 있다. 방법 단계 (a)는 예비혼합물을 형성하기 위해 총량의 염을 우선 소량, 예를 들어 당 알콜의 총 중량의 5 내지 25 중량%의 당 알콜과 혼합하는 단계를 포함할 수 있다. 이어서, 잔여량의 당 알콜을 예비혼합물에 첨가한다. 단계 (a)는 또한 결합제 용액, 예를 들어 메틸셀룰로스 및/또는 크실리톨, 예를 들어 수용액을 혼합물에 첨가하는 단계를 포함할 수 있다. 별법으로, 결합제를 건조 혼합물에 첨가하고 과립화 단계에서 물을 첨가한다.
임의로, (b)에서 얻은 밀링된 혼합물은 윤활제와 혼합하기 전에 1회 더 블렌딩될 수 있다. 바람직하게는, 윤활제, 예를 들어 스테아르산마그네슘은 혼합 전에 예를 들어 800 내지 900 μm 스크린을 사용하여 예비스크리닝된다.
별법으로, 습식 과립화 방법이 이용된다. 이 실시양태에서, 염은 바람직하게는 먼저 바람직한 당 알콜, 예를 들어 만니톨과 건조-혼합되고, 이어서 수득된 당 알콜/염 혼합물은 결합제, 예컨대 히드록시프로필 셀룰로스 또는 히드록시프로필메틸 셀룰로스와 건조-혼합된다. 그 후, 물이 첨가되고, 혼합물은 예를 들어 자동화된 과립화기를 사용하여 과립화된다. 그 후, 과립은 건조되고 밀링된다.
바람직한 경우, 단계 (c)에서 추가량의 결합제가 (b)에서 수득된 혼합물에 첨가될 수 있다.
상기 방법은 (c)에서 수득된 혼합물을, 예를 들어 자동화된 캡슐화 장치를 사용하여 경질 젤라틴 캡슐로 캡슐화 또는 타정하는 추가 단계를 포함할 수 있다. 캡슐은 개별 외관을 부여하고 이를 즉시 인식가능하게 하도록 착색되거나 또는 표시될 수 있다. 염료의 사용은 외관의 향상 뿐만 아니라 캡슐의 확인을 위한 기능을 할 수 있다. 약학에서 사용하기에 적합한 염료에는 전형적으로 카로티노이드, 산화철 및 클로로필이 포함된다. 바람직하게는, 본 발명의 캡슐은 코드를 사용하여 표시된다.
본 발명의 염 및 다형체는 다음에서 유용할 수 있다.
a) 장기 또는 조직 이식 거부의 치료 및 예방, 예를 들어 심장, 폐, 심장-폐 조합, 간, 신장, 췌장, 피부 또는 각막 이식물 수용자에 대한 치료, 및 이식편대숙주 질환 (예컨대, 골수 이식 후 종종 발생하는 것)의 예방; 특히, 급성 또는 만성 동종- 및 이종이식편 거부의 치료, 또는 인슐린 생성 세포의 이식, 예를 들어 췌장 도세포의 이식에서; 및
b) 자가면역 질환 또는 염증성 병태, 예를 들어 류마티스성 관절염, 전신성 홍반성 루푸스, 하시모토 갑상선염, 다발성 경화증, 중증 근무력증, I형 또는 II형 당뇨병 및 그와 관련된 장애, 혈관염, 악성 빈혈, 쇼그렌 증후군, 포도막염, 건선, 그레이브스 안병증, 원형 탈모증 등, 알레르기성 질환, 예를 들어 알레르기성 천식, 아토피성 피부염, 알레르기성 비염/결막염, 알레르기성 접촉성 피부염, 염증성 질환 (임의로는 기저의 이상 반응이 있는 것), 예를 들어 염증성 장 질환, 크론병 또는 궤양성 대장염, 내인성 천식, 염증성 폐 손상, 염증성 간 손상, 염증성 사구체 손상, 아테롬성동맥경화증, 골관절염, 자극성 접촉성 피부염 및 나아가 습진성 피부염, 지루성 피부염, 면역학적으로 매개된 장애의 피부 소견, 염증성 안질환, 각결막염, 심근염 또는 간염의 치료 및 예방.
상기 용도에 있어서, 요구되는 투여량은 물론 투여 방식, 치료할 특정 병태 및 목적하는 효과에 따라 다를 것이다. 일반적으로, 체중 1 kg 당 약 0.1 내지 약 100 mg의 1일 투여량에 의해 만족스러운 결과가 달성되는 것으로 나타난다. 보다 대형인 포유동물, 예를 들어 인간에서 권고되는 1일 투여량은 약 0.5 mg 내지 2000 mg 범위로서, 이를 편리하게는 1일 4회까지의 분할 투여로 또는 지연 형태로 투여한다.
상기 염은 임의의 적절한 경로로, 예를 들어 경구적으로, 예를 들어 정제 또는 캡슐 형태로, 국소적으로 또는 비경구적으로, 예를 들어 정맥내로 투여될 수 있다. 본 발명의 염을 1종 이상의 제약상 허용되는 담체 또는 희석제와 함께 포함하는 제약 조성물은 제약상 허용되는 담체 또는 희석제와 혼합함으로써 통상의 방식으로 제조될 수 있다. 경구 투여를 위한 단위 투여 형태는, 예를 들어 약 0.1 mg 내지 약 500 mg의 활성 물질을 함유한다.
상기 염은 단독의 활성 성분으로서, 또는 면역조절 요법에서의 여타의 약물 또는 여타의 소염제와 함께, 예를 들어 동종이식편 급성 또는 만성 거부 또는 염증성 또는 자가면역 장애의 치료 또는 예방을 위해 투여될 수 있다. 예를 들어, 이들은 칼시뉴린 억제제, 예를 들어 시클로스포린 A, 시클로스포린 G, FK-506, ABT-281, ASM 981; mTOR 억제제, 예를 들어 라파마이신, 40-O-(2-히드록시)에틸-라파마이신, CCI779, ABT578 또는 AP23573 등; 코르티코스테로이드; 시클로포스파미드; 아자티오프렌; 메토트렉세이트; 또 다른 S1P 수용체 효능제, 예를 들어 FTY 720 또는 그의 유사체; 레플루노미드 또는 그의 유사체; 미조리빈; 마이코페놀산; 마이코페놀레이트 모페틸; 15-데옥시스페르구알린 또는 그의 유사체; 면역억제성 모노클로날 항체, 예를 들어 백혈구 수용체, 예를 들어 MHC, CD2, CD3, CD4, CD 11a/CD18, CD7, CD25, CD27, B7, CD40, CD45, CD58, CD137, ICOS, CD150 (SLAM), OX40, 4-1BB 또는 이들의 리간드, 예를 들어 CD154에 대한 모노클로날 항체; 또는 여타 면역조절성 화합물, 예를 들어 CTLA4 또는 그의 돌연변이체의 세포외 도메인의 적어도 일부분을 가진 재조합 결합 분자, 예를 들어 CTLA4 또는 그의 돌연변이체의 적어도 세포외 부분이 비(非)-CTLA4 단백질 서열에 연결되어 있는 재조합 결합 분자, 예를 들어 CTLA4Ig (예를 들어, ATCC 68629로 표기되는 것) 또는 그의 돌연변이체, 예를 들어 LEA29Y, 또는 여타의 부착 분자 억제제, 예를 들어 mAb 또는 저분자량 억제제 (LFA-1 길항제, 셀렉틴 길항제 및 VLA-4 길항제 포함)와 병용될 수 있다.
염이 또 다른 면역조절제 또는 소염제와 함께 투여되는 경우, 공동-투여되는 면역조절제 또는 소염제의 투여량은 물론 병용-약물의 유형, 치료할 병태 등에 따라 달라질 것이다.
따라서, 본 발명은 다음을 제공한다.
1. 치료 유효량의 본 발명의 결정질 염을 대상체에게 투여하는 것을 포함하는, 장기 또는 조직 이식 거부의 치료 또는 예방 방법.
2. 치료 유효량의 본 발명의 결정질 염을 대상체에게 투여하는 것을 포함하는, 자가면역 질환 또는 염증성 병태의 치료 또는 예방 방법.
3. 약제로서 사용하기 위한 본 발명의 결정질 염.
4. 본 발명의 결정질 염, 및 제약상 허용되는 희석제 또는 담체를 포함하는 제약 조성물.
5. 의약 제조, 예를 들어 상기 개시된 방법에서의 의약 제조를 위한 본 발명의 결정질 염의 용도.
6. (a) 본 발명의 결정질 염 및 (b) 상술한 병태의 예방 또는 치료에 적합한 제2의 약물 물질을 포함하는 제약 조합물.
7. (a) 본 발명의 결정질 염 및 (b) 상술한 병태의 예방 또는 치료에 적합한 제2의 약물 물질을, 예를 들어 동시에 또는 순차적으로 공동-투여하는 것을 포함하는, 상기 정의된 바와 같은 방법.
하기 실시예는 본 발명을 예시한다. 실시예 1 내지 13에서, 화합물 A, FTY720 또는 FTY720 히드로클로라이드 염에 대한 언급은 본 발명의 다양한 결정질 염 형태 중 임의의 것에 대한 언급을 포함하는 것으로 받아들여져야 한다.
실시예
1
미분화된 화합물 A, 예를 들어 2-아미노-2-[2-(4-옥틸페닐)에틸]프로판-1,3-디올 히드로클로라이드 염 (FTY720)을 스크리닝하고, 스크리닝된 화합물 116.7 g을 미세결정질 셀룰로스 작용제 9683.3 g과 혼합하였다. 이어서, 혼합물을 30 메쉬 스크린을 사용하여 프레위트 (Frewitt) MGI 장치 (키 인터내셔널 인코포레이티드 (Key International Inc.), 미국 소재)에서 밀링하였다. 스테아르산마그네슘을 20 메쉬 스크린을 사용하여 스크리닝하고, 스크리닝된 화합물 200 g을 상기 FTY720 혼합물과 블렌딩하여, 생성물 조성물을 제조하였다.
이어서, 생성물 조성물을 7 mm 다이를 사용하여 정제 프레스 상에서 압축하여, 각각 다음을 함유하는 120 mg 정제를 형성하였다.
화합물 A, 예를 들어 FTY720* 1.4 mg
미세결정질 셀룰로스, 예를 들어 아비셀 PH 102 116.2 mg
스테아르산마그네슘 2.4 mg
총 120 mg
*유리 형태의 화합물 A 1 mg은 FTY720 1.12 mg과 동등하다.
실시예
2
추가 실시예에서, 스테아르산마그네슘을 쿠티나® (수소화 피마자 오일)로 대체한 것을 제외하고는, 실시예 1의 방법을 반복하였다.
실시예
3
18 메쉬 스크린을 사용하여 화합물 A, 예를 들어 FTY720, 및 미세결정질 셀룰로스, 예를 들어 아비셀 PH 102를 각각 개별적으로 스크리닝하였다. 스크리닝된 FTY720 1.9 g을 스크리닝된 미세결정질 셀룰로스 작용제 40 g과 함께 블렌더에서 32 rpm으로 120회전 혼합하였다. 이어서, 상기 FTY720 혼합물을 35 메쉬 스크린을 통해 스크리닝하였다.
스크리닝된 FTY720 혼합물을 추가의 미세결정질 셀룰로스, 예를 들어 아비셀 PH 102 340.1 g 및 히드록시프로필셀룰로스 12 g과 함께 과립화기에 첨가하였다. 혼합물을 3분 동안 혼합하였다. 이어서, 물을 100 ml/분의 속도로 첨가하고, 혼합물을 2분 동안 과립화하였다. 과립을 트레이 건조기로 옮기고, 50℃에서 150분 동안 건조시켰다.
이어서, 혼합물을 35 메쉬 스크린을 사용하여 프레위트 MGI 장치에서 밀링하였다. 스테아르산마그네슘을 스크리닝하고, 스크리닝된 화합물 6 g을 FTY720 혼합물과 함께 32 rpm으로 90회전 블렌딩하여, 블렌드 중 미세결정질 셀룰로스, 예를 들어 아비셀 PH 102 전체에 걸친 S1P 수용체 효능제의 실질적 균등 분포를 나타내는 생성물 조성물을 제조하였다.
이어서, 생성물 조성물을 H & K 400 캡슐화 장치 상에서 크기 3 경질 젤라틴 쉘에 충전하였다. 생성물 조성물 120 mg을 각 캡슐에 첨가하였다. 이에 따라, 각 캡슐은 다음을 함유하였다.
FTY720* 0.56 mg
미세결정질 셀룰로스 114.04 mg
히드록시프로필셀룰로스 3.6 mg
스테아르산마그네슘 1.8 mg
총 120 mg
실시예
4
추가 실시예에서, 스테아르산마그네슘을 쿠티나® (수소화 피마자 오일)로 대체한 것을 제외하고는, 실시예 3의 방법을 반복하였다.
실시예
5
추가 실시예에서, 히드록시프로필 셀룰로스를 히드록시프로필메틸 셀룰로스로 대체한 것을 제외하고는, 실시예 3의 방법을 반복하였다.
실시예
6a
미분화된 화합물 A, 예를 들어 FTY720을 400 μm (40 메쉬) 스크린을 사용하여 스크리닝하였다. 스크리닝된 화합물 58.35 g을 25 L 볼레 빈 (Bohle bin) 블렌더에서 미세결정질 셀룰로스, 예를 들어 아비셀 PH 102 4841.65 g과 240회의 블렌딩 회전으로 혼합하였다. 이어서, 혼합물을 425 μm 메쉬 스크린을 사용하여 프레위트 MGI 장치에서 밀링하고, 밀링된 혼합물을 다시 한 번 블렌딩하였다. 스테아르산마그네슘을 스크리닝하고, 스크리닝된 화합물 100 g을 FTY720 혼합물과 블렌딩하여, 블렌드 전체에 걸친 S1P 수용체 효능제의 실질적 균등 분포를 나타내는 생성물 조성물을 제조하였다.
이어서, 생성물 조성물을 H & K 400 캡슐화 장치 상에서 크기 3 경질 젤라틴 쉘에 충전하였다. 생성물 조성물 120 mg을 각 캡슐에 첨가하였다. 이에 따라, 각 캡슐은 다음을 함유하였다.
FTY720* 1.4 mg
미세결정질 셀룰로스 116.2 mg
스테아르산마그네슘 2.4 mg
총 120 mg
실시예
6b
또 다른 실시양태에서, 실시예 6a에 기재된 성분 및 양을 이용하여 캡슐을 제조하였지만, FTY720을 (스크리닝하기 전에) 먼저 만니톨 14 mg과 혼합하였다. 이어서, 상기 혼합물을 상술한 바와 같이 스크리닝하였다. 이어서, 스크리닝된 혼합물을 나머지 만니톨과 블렌딩하고, 스테아르산마그네슘을 첨가한 후, 추가로 블렌딩하고, 캡슐에 충전하였다.
실시예
7 및 8
추가 실시예에서, 각각의 캡슐이 각 성분을 하기 양으로 함유한다는 점을 제외하고는, 실시예 6에 기재된 바와 같이 캡슐을 제조하였다.
실시예
7
실시예
8
FTY720* 2.8 mg 5.6 mg
미세결정질 셀룰로스 114.8 mg 112 mg
스테아르산마그네슘 2.4 mg 2.4 mg
총 120 mg 120 mg
실시예
9 내지 11
추가 실시예에서, 스테아르산마그네슘을 각각의 경우에 쿠티나® (수소화된 피마자 오일)로 대체한다는 점을 제외하고는, 실시예 6 내지 8에 기재된 바와 같이 캡슐을 제조하였다.
실시예
12 및 13
각 성분을 칭량하고, 막자사발에서 혼합한 후, 캡슐에 충전하여 하기 구성성분을 함유한 캡슐을 제조하였다.
실시예
12
실시예
13
FTY720 5 mg 1 mg
D-만니톨 83.7 mg 117 mg
옥수수 전분 24 mg -
아비셀® PH101 12 mg -
히드록시프로필셀룰로스 0.3 mg 7 mg
탈크 3 mg 3 mg
루브리왁스® 101 2 mg 2 mg
총 130 mg 130 mg
실시예
14:
FTY720
HCl
의
다형체
및 수화물
퍼킨엘머 (PerkinElmer) DSC-7 및 피리스 (Pyris) 1 시스템을 사용하여 시차 주사 열량측정 (DSC) 곡선을 기록하였다.
DSC 가열 곡선은 대략 40℃, 66℃ 및 107℃에서 3가지 특징적 전이를 나타내었다. 형태 I의 용융 및 이어서 형태 II로의 재결정화를 암시하는 40℃에서의 제1 흡열 피크에 이은 작은 발열 피크가 있었다. 형태 II 및 형태 III 사이의 제2 전이는 고체-고체 전이였다. 제3 전이는 107℃에서 관찰되었다. 107℃ 초과에서, X-선 분말 패턴은 거의 사라졌고, 2.9°에서 오직 하나의 강한 피크만이 잔류하였는데, 이는 상기 온도보다 높은 온도에서 결정질 규칙성이 보다 낮은 상의 형성을 제시한다. 열현미경 관찰 결과, 107℃ 초과에서 복굴절이 나타났으며, 이는 분해 개시 온도인 약 260℃보다 낮은 약 230℃에서만 사라졌다.
이어서, 온도-변수 XRPD를 수행하여 DSC에서 나타난 다양한 전이의 특성을 조사하였다. 가열 속도는 10 K/분이었고, 각 실험 당 단계 시간은 5분이었다. 신태그 (Scintag) X1 회절 시스템을 사용하여 Cu Kα 조사와 함께 X-선 분말 다이아그램을 2° 내지 35° (2 세타) 사이에서 기록하였다. 온도 및 습도 제어 장치가 구비된 신태그 XDS 2000 시스템을 사용하여 온도-변수 및 습도-변수 XRPD를 수행하였다.
온도-변수 XRPD에 따르면, FTY720 HCl은 적어도 4개의 상이한 결정질 형태로 존재할 수 있다. 107℃ 초과에서, 거의 모든 회절 피크가 사라졌고, 2.9°에서 오직 하나의 강한 피크만이 잔류하였다. 이러한 결과는 DSC 결과와도 일치한다. 그러나, 0℃에서 나타난 추가 결정질 형태 (형태 IV)는 XRPD에서만 관찰되었고, DSC에서는 나타나지 않았다. 형태 IV의 X-선 분말 패턴은 형태 I의 X-선 분말 패턴과 매우 유사하였고, DSC에서 열적 사건이 관찰되지 않았으므로, 형태 IV의 결정 특성은 형태 I과 매우 유사한 것으로 추정할 수 있다.
하기에 제시된 유의한 피크를 갖는 FTY720 히드로클로라이드 형태 I의 XRPD 다이아그램을 도 1에 나타내었다.
특정 실시양태에서, FTY720 히드로클로라이드 형태 I의 XRPD 다이아그램은 다음과 같았다.
하기에 제시된 유의한 피크를 갖는 FTY720 히드로클로라이드 형태 II의 XRPD 다이아그램을 도 2에 나타내었다.
특정 실시양태에서, FTY720 히드로클로라이드 형태 II의 XRPD 다이아그램은 다음과 같았다.
하기에 제시된 유의한 피크를 갖는 FTY720 히드로클로라이드 형태 III의 XRPD 다이아그램을 도 3에 나타내었다.
특정 실시양태에서, FTY720 히드로클로라이드 형태 III의 XRPD 다이아그램은 다음과 같았다.
대략 ±0.2도의 일부 오차가 각각의 2 θ 각도 할당에 존재할 수 있다.
다이나믹 베이퍼 시스템 (Dynamic Vapor System) (DVS-1)을 사용하여 수착/탈착 등온선을 측정하였다. 측정은 25℃ 및 40℃에서 수행되었다.
25℃에서 기록된 수분 탈착 등온선은 90% 내지 60%의 상대 습도 (r.h.), 즉 5.2 내지 5.9%의 거의 일정한 수분 함량을 나타내었다. 이는 수화물 (일수화물의 이론적 수분 함량은 4.98%임)의 형성을 제시하였다. 40℃에서 기록된 수분 수착 등온선은 이미 80% r.h.에서 제1의 유의한 수분 흡수를 나타낸 반면, 25℃에서 기록된 등온선은 90% r.h.에서 제1 흡수를 나타내었다. 60℃ 및 75% r.h.에서 1개월간 및 80℃ 및 75% r.h.에서 1개월간 저장된 형태 I의 샘플은 10.2 내지 10.6%의 수분 함량을 갖는 수화물 형태로 전환된 것으로 나타났고, 이는 2 mol의 수분에 대해 계산된 수분 함량 9.48%에 근접하였다.
하기에 제시된 유의한 피크를 갖는 수화물의 XRPD 다이아그램을 도 4에 나타내었다.
본 발명의 특정 실시양태에서, 수화물의 XRPD 다이아그램은 다음과 같았다.
하기는 본 발명의 추가 실시양태이다:
실시양태 1. 약 3.6, 7.1, 10.7, 12.5, 15.4 및 20.6도 2-세타에서 피크를 갖는 X-선 분말 회절 패턴으로 특성화되는 결정질 형태 (형태 I)인, 2-아미노-2-(2-(4-옥틸페닐)에틸)-프로판-1,3-디올 (FTY720)의 결정질 히드로클로라이드 염.
실시양태 2. 약 3.5, 6.9, 10.4, 14.6, 19.2, 20.3 및 20.9도 2-세타에서 피크를 갖는 X-선 분말 회절 패턴으로 특성화되는 결정질 형태 (형태 II)인, 2-아미노-2-(2-(4-옥틸페닐)에틸)-프로판-1,3-디올 (FTY720)의 결정질 히드로클로라이드 염.
실시양태 3. 약 3.5, 6.9, 10.3, 14.4, 18.9, 20.3, 20.7 및 24.2도 2-세타에서 피크를 갖는 X-선 분말 회절 패턴으로 특성화되는 결정질 형태 (형태 III)인, 2-아미노-2-(2-(4-옥틸페닐)에틸)-프로판-1,3-디올 (FTY720)의 결정질 히드로클로라이드 염.
실시양태 4. 실질적으로 수화물 형태인, 2-아미노-2-(2-(4-옥틸페닐)에틸)프로판-1,3-디올 (FTY720)의 결정질 히드로클로라이드 염.
실시양태 5. 제4 실시양태에 있어서, 약 2.9, 17.2, 30.6, 28.2, 24.4, 8.6 및 25.9도 2-세타에서 피크를 갖는 X-선 분말 회절 패턴으로 특성화되는 결정질 형태를 포함하는 염.
실시양태 6. 제1 실시양태 내지 제5 실시양태 중 어느 한 실시양태에 있어서, 실질적으로 순수한 결정질 형태인 염.
실시양태 7. 제1 실시양태 내지 제6 실시양태 중 어느 한 실시양태에 있어서, 요법에서 사용하기 위한 염.
실시양태 8. 제1 실시양태 내지 제6 실시양태 중 어느 한 실시양태에 있어서, 장기 또는 조직 이식 거부, 자가면역 질환 또는 염증성 병태의 치료 또는 예방에서 사용하기 위한 염.
실시양태 9. 제1 실시양태 내지 제6 실시양태 중 어느 한 실시양태의 염을 제약상 허용되는 담체 또는 부형제와 함께 포함하는 제약 조성물.
실시양태 10. 장기 또는 조직 이식 거부, 자가면역 질환 또는 염증성 병태의 치료 또는 예방용 의약의 제조를 위한, 제1 실시양태 내지 제6 실시양태 중 어느 한 실시양태의 염의 용도.
실시양태 11. 치료 유효량의 제1 실시양태 내지 제6 실시양태 중 어느 한 실시양태의 염을 투여하는 것을 포함하는, 환자에서 장기 또는 조직 이식 거부, 자가면역 질환 또는 염증성 병태의 치료 또는 예방을 위한 방법.
실시양태 12. 제2 실시양태 또는 제3 실시양태의 결정질 염을 40℃ 미만의 온도로 냉각시키는 단계를 포함하는, 제1항의 결정질 염의 제조 방법.
실시양태 13. 제12 실시양태에 있어서, 10℃ 미만, 예를 들어 8℃ 미만, 예를 들어 2 내지 8℃의 온도로 냉각시키는 단계를 포함하는 방법.
Claims (1)
- 장기 또는 조직 이식 거부의 치료를 위한, 2-아미노-2-(2-(4-옥틸페닐)에틸)프로판-1,3-디올 (FTY720)의 결정질 히드로클로라이드 염의 용도.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP08168865 | 2008-11-11 | ||
| EP08168865.7 | 2008-11-11 | ||
| PCT/EP2009/064891 WO2010055028A2 (en) | 2008-11-11 | 2009-11-10 | Organic compounds |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117010560A Division KR101393994B1 (ko) | 2008-11-11 | 2009-11-10 | 핑골리모드 hcl의 결정질 형태 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20130109254A true KR20130109254A (ko) | 2013-10-07 |
Family
ID=40521487
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117010560A KR101393994B1 (ko) | 2008-11-11 | 2009-11-10 | 핑골리모드 hcl의 결정질 형태 |
| KR1020137024001A KR20130109254A (ko) | 2008-11-11 | 2009-11-10 | 핑골리모드 hcl의 결정질 형태 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117010560A KR101393994B1 (ko) | 2008-11-11 | 2009-11-10 | 핑골리모드 hcl의 결정질 형태 |
Country Status (14)
| Country | Link |
|---|---|
| US (2) | US8530522B2 (ko) |
| EP (1) | EP2356090B1 (ko) |
| JP (4) | JP2012508216A (ko) |
| KR (2) | KR101393994B1 (ko) |
| CN (3) | CN107233336A (ko) |
| AU (1) | AU2009315736B2 (ko) |
| BR (1) | BRPI0921826A2 (ko) |
| CA (1) | CA2743232C (ko) |
| ES (1) | ES2643161T3 (ko) |
| MX (1) | MX2011004962A (ko) |
| PL (1) | PL2356090T3 (ko) |
| PT (1) | PT2356090T (ko) |
| RU (2) | RU2549899C2 (ko) |
| WO (1) | WO2010055028A2 (ko) |
Families Citing this family (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103228617A (zh) * | 2010-10-01 | 2013-07-31 | 斯索恩有限公司 | 制备盐酸芬戈莫德晶体的方法 |
| PL2632889T3 (pl) | 2010-10-28 | 2019-04-30 | Mapi Pharma Ltd | Związki pośrednie i sposób wytwarzania fingolimodu |
| WO2012071524A1 (en) | 2010-11-24 | 2012-05-31 | Ratiopharm Gmbh | Arylsulfonate salts of fingolimod and processes for preparation thereof |
| WO2012070059A1 (en) | 2010-11-25 | 2012-05-31 | Shilpa Medicare Limited | Fingolimod polymorphs and their processes |
| ES2746016T3 (es) | 2010-12-28 | 2020-03-04 | Synthon Bv | Procedimiento para la preparación de cristales de clorhidrato de fingolimod |
| WO2012097330A2 (en) * | 2011-01-14 | 2012-07-19 | University Of Washington | Compositions and methods for treating degenerative muscle conditions |
| EP2702034A4 (en) | 2011-04-29 | 2015-03-25 | Reddys Lab Ltd Dr | PREPARATION OF FINGOLIMOD AND ITS SALTS |
| EP2809318B1 (en) | 2011-05-26 | 2019-05-08 | GRI Bio, Inc. | Ammonium-containing sulfonic acid, phosphonic acid and carboxylic acid derivatives and their medical use |
| DK2809648T3 (da) | 2011-05-26 | 2019-06-17 | Gri Bio Inc | Oxygenberigede amino- eller ammonium-holdige sulfonsyrederivater og disses medicinske anvendelse |
| WO2012160188A1 (en) | 2011-05-26 | 2012-11-29 | Jado Technologies Gmbh | Hydroxy-substituted amino and ammonium derivatives and their medical use |
| US9186333B2 (en) | 2011-08-01 | 2015-11-17 | Teva Pharmaceutical Industries Ltd. | Process for preparing pharmaceutical compositions of fingolimod |
| WO2013091704A1 (en) * | 2011-12-22 | 2013-06-27 | Synthon Bv | Pharmaceutical composition comprising fingolimod |
| CN102887829B (zh) * | 2012-09-05 | 2014-07-02 | 中国科学院上海药物研究所 | 芬戈莫德粘酸盐及其晶体的制备方法和用途 |
| US9732030B2 (en) | 2013-01-17 | 2017-08-15 | Shilpa Medicare Limited | Process for the preparation of fingolimod and its salts |
| WO2014136047A2 (en) | 2013-03-05 | 2014-09-12 | Biocon Limited | A process for the preparation of 2-amino-1,3-propane diol compounds and salts thereof |
| US20160128951A1 (en) * | 2013-07-29 | 2016-05-12 | Aizant Drug Research Solutions Pvt Ltd | Pharmaceutical compositions of fingolimod |
| WO2016042493A1 (en) * | 2014-09-19 | 2016-03-24 | Aizant Drug Research Pvt. Ltd | Pharmaceutical compositions of fingolimod |
| US9925138B2 (en) | 2015-01-20 | 2018-03-27 | Handa Pharmaceuticals, Llc | Stable solid fingolimod dosage forms |
| RU2627691C1 (ru) * | 2016-07-06 | 2017-08-10 | Олег Ростиславович Михайлов | Кристаллическая η-модификация 2-амино-2-(2-(4-октилфенил)этил)пропан-1,3-диол гидрохлорида, способ её получения и фармацевтическая композиция на её основе |
| CN106860440A (zh) * | 2017-01-16 | 2017-06-20 | 南京医科大学第二附属医院 | 盐酸芬戈莫德在制备治疗系统性红斑狼疮脑病药物中的应用 |
| CN106667981B (zh) * | 2017-01-16 | 2019-05-14 | 南京医科大学第二附属医院 | 盐酸芬戈莫德在制备治疗药物性肝损伤药物中的应用 |
| GR1009654B (el) | 2018-08-31 | 2019-11-18 | Φαρματεν Α.Β.Ε.Ε. | Φαρμακευτικο σκευασμα που περιλαμβανει εναν ανοσοτροποποιητικο παραγοντα και μεθοδος για την παρασκευη αυτου |
| WO2020245775A1 (en) * | 2019-06-05 | 2020-12-10 | Biocon Limited | Crystalline forms of 2-amino-2-(2-(4-octylphenyl) ethyl) propane-1,3-diol |
| CN114599363A (zh) | 2019-10-31 | 2022-06-07 | 爱杜西亚药品有限公司 | Cxcr7拮抗剂与s1p1受体调节剂的组合 |
| WO2022253077A1 (zh) | 2021-05-31 | 2022-12-08 | 上海博志研新药物技术有限公司 | 芬戈莫德药用盐、制备方法、含其的药物组合物及应用 |
| EP4212156A1 (en) | 2022-01-13 | 2023-07-19 | Abivax | Combination of 8-chloro-n-(4-(trifluoromethoxy)phenyl)quinolin-2-amine and its derivatives with a s1p receptor modulator |
Family Cites Families (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DK0627406T3 (da) * | 1992-10-21 | 1999-07-12 | Taito Co | 2-Amino-1,3-propandiolforbindelser og immunundertrykkende midler |
| US6476004B1 (en) * | 1996-07-18 | 2002-11-05 | Mitsubishi Pharma Corporation | Pharmaceutical composition |
| JP4079505B2 (ja) * | 1998-04-28 | 2008-04-23 | 田辺三菱製薬株式会社 | 2−アミノ−2−[2−(4−オクチルフェニル)エチル]プロパン−1,3−ジオールの新規な製造法 |
| ATE288414T1 (de) * | 1998-11-11 | 2005-02-15 | Novartis Pharma Gmbh | Herstellung von 2-amino-2(2-(4- alkylphenyl)äthyl)propan-1,3-diolen |
| DK1031347T3 (da) * | 1999-01-27 | 2002-07-08 | Idea Ag | Transnasal transport/immunisering med meget tilpasselige bærere |
| CA2362381C (en) * | 1999-02-10 | 2009-12-22 | Welfide Corporation | Amide compounds and medicinal use thereof |
| CN1144779C (zh) * | 1999-03-11 | 2004-04-07 | 杭州中美华东制药有限公司 | 制备2-[2-(4-烷基苯基)-乙基]-2-氨基-丙二醇的方法以及其中制得的中间产物 |
| ES2322442T3 (es) * | 2001-06-08 | 2009-06-22 | Novartis Ag | Tratamiento o profilaxis del rechazo de injertos de celulas productoras de insulina. |
| US20030144712A1 (en) * | 2001-12-20 | 2003-07-31 | Jackson Streeter, M.D. | Methods for overcoming organ transplant rejection |
| EP1944026B1 (en) * | 2002-05-16 | 2013-06-26 | Novartis AG | Use of EDG receptor binding agents in cancer |
| GB0217152D0 (en) * | 2002-07-24 | 2002-09-04 | Novartis Ag | Organic compounds |
| PE20131352A1 (es) * | 2003-04-08 | 2013-11-14 | Novartis Ag | Composicion farmaceutica que contiene un agonista del receptor s1p y un alcohol de azucar |
| CN1212308C (zh) * | 2003-07-24 | 2005-07-27 | 漆又毛 | 2-氨基-2-(2-(4-辛基苯基)乙基)-1,3-丙二醇盐酸盐的制备方法 |
| CN1241903C (zh) * | 2003-10-14 | 2006-02-15 | 马启明 | 制备2-对辛基苯乙基-2-氨基丙二醇的方法 |
| TWI418350B (zh) * | 2005-06-24 | 2013-12-11 | Sankyo Co | 含有ppar調節劑之醫藥組成物的用途 |
| AU2006297130B2 (en) * | 2005-09-30 | 2009-12-24 | Novartis Ag | DPP IV inhibitor for use in the treatment of autoimmune diseases and graft rejection |
| SI1951674T1 (sl) * | 2005-10-26 | 2012-01-31 | Merck Serono Sa | Derivati sulfonamida in njihova uporaba za moduliranje metaloproteinaz |
| CN1310869C (zh) * | 2005-11-22 | 2007-04-18 | 江苏吴中苏药医药开发有限责任公司 | 2-氨基-2-[2-(4-烷基苯基)乙基]-1,3-丙二醇的制备方法 |
| CN100548968C (zh) * | 2006-03-01 | 2009-10-14 | 徐州师范大学 | 一种制备2-对辛基苯乙基-2-氨基丙二醇盐酸盐的方法 |
| US8318812B2 (en) * | 2006-06-02 | 2012-11-27 | The Ohio State University Research Foundation | Therapeutic agents for the treatment of lymphoid malignancies |
| MX2009002993A (es) * | 2006-09-26 | 2009-04-01 | Novartis Ag | Composiciones farmaceuticas que comprenden un modulador de s1p. |
| EP3545953A1 (en) * | 2008-06-20 | 2019-10-02 | Novartis AG | Paediatric compositions for treating1 multiple sclerosis |
| CN103228617A (zh) | 2010-10-01 | 2013-07-31 | 斯索恩有限公司 | 制备盐酸芬戈莫德晶体的方法 |
-
2009
- 2009-11-10 CN CN201710377640.8A patent/CN107233336A/zh active Pending
- 2009-11-10 PT PT97483507T patent/PT2356090T/pt unknown
- 2009-11-10 KR KR1020117010560A patent/KR101393994B1/ko active IP Right Grant
- 2009-11-10 MX MX2011004962A patent/MX2011004962A/es active IP Right Grant
- 2009-11-10 BR BRPI0921826A patent/BRPI0921826A2/pt not_active Application Discontinuation
- 2009-11-10 PL PL09748350T patent/PL2356090T3/pl unknown
- 2009-11-10 US US13/128,825 patent/US8530522B2/en active Active
- 2009-11-10 EP EP09748350.7A patent/EP2356090B1/en active Active
- 2009-11-10 CA CA2743232A patent/CA2743232C/en active Active
- 2009-11-10 CN CN200980144998XA patent/CN102209705A/zh active Pending
- 2009-11-10 RU RU2011123371/04A patent/RU2549899C2/ru active
- 2009-11-10 WO PCT/EP2009/064891 patent/WO2010055028A2/en active Application Filing
- 2009-11-10 AU AU2009315736A patent/AU2009315736B2/en not_active Ceased
- 2009-11-10 ES ES09748350.7T patent/ES2643161T3/es active Active
- 2009-11-10 KR KR1020137024001A patent/KR20130109254A/ko not_active Application Discontinuation
- 2009-11-10 JP JP2011535130A patent/JP2012508216A/ja not_active Withdrawn
- 2009-11-10 CN CN201510141353.8A patent/CN104788325A/zh active Pending
- 2009-11-10 RU RU2015111229/04A patent/RU2015111229A/ru not_active Application Discontinuation
-
2013
- 2013-08-12 US US13/964,817 patent/US20140051766A1/en not_active Abandoned
-
2014
- 2014-02-06 JP JP2014020950A patent/JP2014139179A/ja not_active Withdrawn
-
2015
- 2015-09-03 JP JP2015173474A patent/JP2016028056A/ja not_active Withdrawn
-
2017
- 2017-09-07 JP JP2017172276A patent/JP2018035160A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| US20140051766A1 (en) | 2014-02-20 |
| EP2356090A2 (en) | 2011-08-17 |
| PT2356090T (pt) | 2017-10-16 |
| CN104788325A (zh) | 2015-07-22 |
| AU2009315736B2 (en) | 2013-08-29 |
| MX2011004962A (es) | 2011-05-30 |
| WO2010055028A2 (en) | 2010-05-20 |
| RU2011123371A (ru) | 2012-12-20 |
| BRPI0921826A2 (pt) | 2016-01-12 |
| EP2356090B1 (en) | 2017-07-05 |
| RU2015111229A3 (ko) | 2018-11-08 |
| CA2743232C (en) | 2015-12-29 |
| RU2015111229A (ru) | 2015-11-20 |
| AU2009315736A1 (en) | 2010-05-20 |
| RU2549899C2 (ru) | 2015-05-10 |
| US8530522B2 (en) | 2013-09-10 |
| JP2016028056A (ja) | 2016-02-25 |
| KR101393994B1 (ko) | 2014-05-14 |
| CN107233336A (zh) | 2017-10-10 |
| WO2010055028A3 (en) | 2010-07-08 |
| JP2012508216A (ja) | 2012-04-05 |
| JP2018035160A (ja) | 2018-03-08 |
| KR20110069156A (ko) | 2011-06-22 |
| JP2014139179A (ja) | 2014-07-31 |
| US20110229501A1 (en) | 2011-09-22 |
| CN102209705A (zh) | 2011-10-05 |
| CA2743232A1 (en) | 2010-05-20 |
| PL2356090T3 (pl) | 2017-12-29 |
| ES2643161T3 (es) | 2017-11-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101393994B1 (ko) | 핑골리모드 hcl의 결정질 형태 | |
| RU2543621C2 (ru) | Соли финголимода | |
| WO2015104666A2 (en) | Pharmaceutical composition of fingolimod | |
| AU2013100532A4 (en) | Crystalline forms of fingolimod HCL | |
| AU2013203470A1 (en) | Salts of fingolimod |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |