KR20120102645A - N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드의 고체 형태 - Google Patents
N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드의 고체 형태 Download PDFInfo
- Publication number
- KR20120102645A KR20120102645A KR1020127013139A KR20127013139A KR20120102645A KR 20120102645 A KR20120102645 A KR 20120102645A KR 1020127013139 A KR1020127013139 A KR 1020127013139A KR 20127013139 A KR20127013139 A KR 20127013139A KR 20120102645 A KR20120102645 A KR 20120102645A
- Authority
- KR
- South Korea
- Prior art keywords
- peak
- hcl
- disease
- ppm
- ray powder
- Prior art date
Links
- 239000007787 solid Substances 0.000 title abstract description 77
- QYLPFQBPOBAQSP-UHFFFAOYSA-N n-[4-(7-azabicyclo[2.2.1]heptan-7-yl)-2-(trifluoromethyl)phenyl]-4-oxo-5-(trifluoromethyl)-1h-quinoline-3-carboxamide Chemical compound C1=CC(C(F)(F)F)=C2C(=O)C(C(=O)NC3=CC=C(C=C3C(F)(F)F)N3C4CCC3CC4)=CNC2=C1 QYLPFQBPOBAQSP-UHFFFAOYSA-N 0.000 title description 2
- 238000000034 method Methods 0.000 claims abstract description 101
- -1 4- (7-azabicyclo [2.2.1] heptan-7-yl) -2- (trifluoromethyl) phenyl Chemical group 0.000 claims abstract description 30
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 17
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims abstract description 8
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 118
- 239000000203 mixture Substances 0.000 claims description 118
- 201000010099 disease Diseases 0.000 claims description 100
- 150000001875 compounds Chemical class 0.000 claims description 95
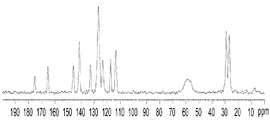
- 238000000634 powder X-ray diffraction Methods 0.000 claims description 75
- 230000000694 effects Effects 0.000 claims description 63
- 201000003883 Cystic fibrosis Diseases 0.000 claims description 45
- 230000035772 mutation Effects 0.000 claims description 45
- 208000011580 syndromic disease Diseases 0.000 claims description 32
- 239000003795 chemical substances by application Substances 0.000 claims description 31
- 208000025678 Ciliary Motility disease Diseases 0.000 claims description 29
- 238000001460 carbon-13 nuclear magnetic resonance spectrum Methods 0.000 claims description 29
- 201000009266 primary ciliary dyskinesia Diseases 0.000 claims description 29
- 102100026383 Vasopressin-neurophysin 2-copeptin Human genes 0.000 claims description 27
- 201000010064 diabetes insipidus Diseases 0.000 claims description 27
- 208000006673 asthma Diseases 0.000 claims description 25
- 239000013078 crystal Substances 0.000 claims description 25
- 230000007812 deficiency Effects 0.000 claims description 24
- 108090000623 proteins and genes Proteins 0.000 claims description 23
- 206010006451 bronchitis Diseases 0.000 claims description 21
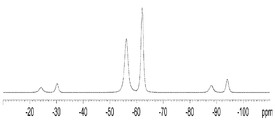
- 238000000806 fluorine-19 nuclear magnetic resonance spectrum Methods 0.000 claims description 21
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 claims description 20
- 206010033645 Pancreatitis Diseases 0.000 claims description 19
- 208000035475 disorder Diseases 0.000 claims description 17
- 230000007547 defect Effects 0.000 claims description 15
- 210000000988 bone and bone Anatomy 0.000 claims description 14
- 230000002132 lysosomal effect Effects 0.000 claims description 14
- 238000001228 spectrum Methods 0.000 claims description 14
- 206010006458 Bronchitis chronic Diseases 0.000 claims description 13
- 208000007451 chronic bronchitis Diseases 0.000 claims description 13
- 230000001052 transient effect Effects 0.000 claims description 13
- 206010014561 Emphysema Diseases 0.000 claims description 12
- 239000012472 biological sample Substances 0.000 claims description 12
- 239000012634 fragment Substances 0.000 claims description 12
- 230000009278 visceral effect Effects 0.000 claims description 12
- 206010010356 Congenital anomaly Diseases 0.000 claims description 11
- 208000003556 Dry Eye Syndromes Diseases 0.000 claims description 11
- 238000009825 accumulation Methods 0.000 claims description 11
- 208000019693 Lung disease Diseases 0.000 claims description 10
- 206010012601 diabetes mellitus Diseases 0.000 claims description 10
- 230000001965 increasing effect Effects 0.000 claims description 10
- 238000012545 processing Methods 0.000 claims description 10
- 206010010774 Constipation Diseases 0.000 claims description 9
- 208000029725 Metabolic bone disease Diseases 0.000 claims description 9
- 206010049088 Osteopenia Diseases 0.000 claims description 9
- 208000001132 Osteoporosis Diseases 0.000 claims description 9
- 208000035467 Pancreatic insufficiency Diseases 0.000 claims description 9
- 208000021386 Sjogren Syndrome Diseases 0.000 claims description 9
- 239000002671 adjuvant Substances 0.000 claims description 9
- 230000000172 allergic effect Effects 0.000 claims description 9
- 208000010668 atopic eczema Diseases 0.000 claims description 9
- 230000002146 bilateral effect Effects 0.000 claims description 9
- 230000001886 ciliary effect Effects 0.000 claims description 9
- 230000000391 smoking effect Effects 0.000 claims description 9
- 102000011045 Chloride Channels Human genes 0.000 claims description 8
- 108010062745 Chloride Channels Proteins 0.000 claims description 8
- 206010013774 Dry eye Diseases 0.000 claims description 8
- 150000002632 lipids Chemical class 0.000 claims description 8
- 230000000750 progressive effect Effects 0.000 claims description 8
- 208000024827 Alzheimer disease Diseases 0.000 claims description 7
- 208000009575 Angelman syndrome Diseases 0.000 claims description 7
- 206010002961 Aplasia Diseases 0.000 claims description 7
- 208000014644 Brain disease Diseases 0.000 claims description 7
- 206010008025 Cerebellar ataxia Diseases 0.000 claims description 7
- 208000020406 Creutzfeldt Jacob disease Diseases 0.000 claims description 7
- 208000003407 Creutzfeldt-Jakob Syndrome Diseases 0.000 claims description 7
- 208000010859 Creutzfeldt-Jakob disease Diseases 0.000 claims description 7
- 208000024940 Dent disease Diseases 0.000 claims description 7
- 206010013883 Dwarfism Diseases 0.000 claims description 7
- 208000032274 Encephalopathy Diseases 0.000 claims description 7
- 208000024720 Fabry Disease Diseases 0.000 claims description 7
- 229920002683 Glycosaminoglycan Polymers 0.000 claims description 7
- 206010019860 Hereditary angioedema Diseases 0.000 claims description 7
- 206010060378 Hyperinsulinaemia Diseases 0.000 claims description 7
- 208000000563 Hyperlipoproteinemia Type II Diseases 0.000 claims description 7
- 102100024640 Low-density lipoprotein receptor Human genes 0.000 claims description 7
- 206010028289 Muscle atrophy Diseases 0.000 claims description 7
- 206010068871 Myotonic dystrophy Diseases 0.000 claims description 7
- 206010033799 Paralysis Diseases 0.000 claims description 7
- 201000005660 Protein C Deficiency Diseases 0.000 claims description 7
- 206010045261 Type IIa hyperlipidaemia Diseases 0.000 claims description 7
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 claims description 7
- 230000007423 decrease Effects 0.000 claims description 7
- 206010015037 epilepsy Diseases 0.000 claims description 7
- 201000001386 familial hypercholesterolemia Diseases 0.000 claims description 7
- 239000003527 fibrinolytic agent Substances 0.000 claims description 7
- 208000013746 hereditary thrombophilia due to congenital protein C deficiency Diseases 0.000 claims description 7
- 230000003451 hyperinsulinaemic effect Effects 0.000 claims description 7
- 201000008980 hyperinsulinism Diseases 0.000 claims description 7
- 201000001441 melanoma Diseases 0.000 claims description 7
- 230000020763 muscle atrophy Effects 0.000 claims description 7
- 201000000585 muscular atrophy Diseases 0.000 claims description 7
- 230000004770 neurodegeneration Effects 0.000 claims description 7
- 208000015122 neurodegenerative disease Diseases 0.000 claims description 7
- 108010040003 polyglutamine Proteins 0.000 claims description 7
- 229920000155 polyglutamine Polymers 0.000 claims description 7
- 201000009890 sinusitis Diseases 0.000 claims description 7
- 210000000278 spinal cord Anatomy 0.000 claims description 7
- 210000001177 vas deferen Anatomy 0.000 claims description 7
- 102100034452 Alternative prion protein Human genes 0.000 claims description 6
- 208000029323 Congenital myotonia Diseases 0.000 claims description 6
- 208000033981 Hereditary haemochromatosis Diseases 0.000 claims description 6
- 208000023105 Huntington disease Diseases 0.000 claims description 6
- 208000022559 Inflammatory bowel disease Diseases 0.000 claims description 6
- 208000007466 Male Infertility Diseases 0.000 claims description 6
- 208000008955 Mucolipidoses Diseases 0.000 claims description 6
- 206010072928 Mucolipidosis type II Diseases 0.000 claims description 6
- 208000010316 Myotonia congenita Diseases 0.000 claims description 6
- 208000012902 Nervous system disease Diseases 0.000 claims description 6
- 208000018737 Parkinson disease Diseases 0.000 claims description 6
- 108091000054 Prion Proteins 0.000 claims description 6
- 238000002441 X-ray diffraction Methods 0.000 claims description 6
- 230000002124 endocrine Effects 0.000 claims description 6
- 238000000338 in vitro Methods 0.000 claims description 6
- 238000001727 in vivo Methods 0.000 claims description 6
- 208000019423 liver disease Diseases 0.000 claims description 6
- 208000020460 mucolipidosis II alpha/beta Diseases 0.000 claims description 6
- 208000000638 myeloperoxidase deficiency Diseases 0.000 claims description 6
- 230000020978 protein processing Effects 0.000 claims description 6
- 230000000306 recurrent effect Effects 0.000 claims description 6
- 201000002909 Aspergillosis Diseases 0.000 claims description 5
- 208000036641 Aspergillus infections Diseases 0.000 claims description 5
- 208000006386 Bone Resorption Diseases 0.000 claims description 5
- 206010062264 Congenital hyperthyroidism Diseases 0.000 claims description 5
- 230000010256 bone deposition Effects 0.000 claims description 5
- 230000024279 bone resorption Effects 0.000 claims description 5
- 230000007613 environmental effect Effects 0.000 claims description 5
- 230000035876 healing Effects 0.000 claims description 5
- 230000000926 neurological effect Effects 0.000 claims description 5
- 208000021090 palsy Diseases 0.000 claims description 5
- 230000008439 repair process Effects 0.000 claims description 5
- 208000000668 Chronic Pancreatitis Diseases 0.000 claims description 4
- 201000011240 Frontotemporal dementia Diseases 0.000 claims description 4
- 206010028980 Neoplasm Diseases 0.000 claims description 4
- 206010033649 Pancreatitis chronic Diseases 0.000 claims description 4
- 208000000609 Pick Disease of the Brain Diseases 0.000 claims description 4
- 206010036697 Primary hypothyroidism Diseases 0.000 claims description 4
- 201000001883 cholelithiasis Diseases 0.000 claims description 4
- 230000003247 decreasing effect Effects 0.000 claims description 4
- 208000001130 gallstones Diseases 0.000 claims description 4
- 208000021302 gastroesophageal reflux disease Diseases 0.000 claims description 4
- 208000003532 hypothyroidism Diseases 0.000 claims description 4
- 208000028782 Hereditary disease Diseases 0.000 claims description 3
- 206010033647 Pancreatitis acute Diseases 0.000 claims description 3
- 201000003229 acute pancreatitis Diseases 0.000 claims description 3
- 206010003246 arthritis Diseases 0.000 claims description 3
- 230000008468 bone growth Effects 0.000 claims description 3
- 230000010478 bone regeneration Effects 0.000 claims description 3
- 201000011510 cancer Diseases 0.000 claims description 3
- 230000002496 gastric effect Effects 0.000 claims description 3
- 230000036210 malignancy Effects 0.000 claims description 3
- 208000010693 Charcot-Marie-Tooth Disease Diseases 0.000 claims description 2
- 208000013558 Developmental Bone disease Diseases 0.000 claims description 2
- 206010072610 Skeletal dysplasia Diseases 0.000 claims description 2
- 208000003167 cholangitis Diseases 0.000 claims description 2
- 208000027157 chronic rhinosinusitis Diseases 0.000 claims description 2
- 230000002784 sclerotic effect Effects 0.000 claims description 2
- 230000002269 spontaneous effect Effects 0.000 claims description 2
- 102000027257 transmembrane receptors Human genes 0.000 claims 4
- 108091008578 transmembrane receptors Proteins 0.000 claims 4
- 208000007984 Female Infertility Diseases 0.000 claims 2
- 206010021928 Infertility female Diseases 0.000 claims 2
- 241000228212 Aspergillus Species 0.000 claims 1
- 208000012904 Bartter disease Diseases 0.000 claims 1
- 208000010062 Bartter syndrome Diseases 0.000 claims 1
- 208000020084 Bone disease Diseases 0.000 claims 1
- 206010016654 Fibrosis Diseases 0.000 claims 1
- 208000019683 Gorham-Stout disease Diseases 0.000 claims 1
- 208000018565 Hemochromatosis Diseases 0.000 claims 1
- 208000031226 Hyperlipidaemia Diseases 0.000 claims 1
- 208000030172 endocrine system disease Diseases 0.000 claims 1
- 230000004761 fibrosis Effects 0.000 claims 1
- 208000013403 hyperactivity Diseases 0.000 claims 1
- 230000011164 ossification Effects 0.000 claims 1
- 210000001685 thyroid gland Anatomy 0.000 claims 1
- 102000012605 Cystic Fibrosis Transmembrane Conductance Regulator Human genes 0.000 description 99
- 108010079245 Cystic Fibrosis Transmembrane Conductance Regulator Proteins 0.000 description 99
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 46
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 44
- 210000004027 cell Anatomy 0.000 description 41
- 239000000523 sample Substances 0.000 description 38
- 238000002360 preparation method Methods 0.000 description 34
- JWUJQDFVADABEY-UHFFFAOYSA-N 2-methyltetrahydrofuran Chemical compound CC1CCCO1 JWUJQDFVADABEY-UHFFFAOYSA-N 0.000 description 31
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 31
- 108091006146 Channels Proteins 0.000 description 30
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 30
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 30
- 239000000243 solution Substances 0.000 description 28
- 238000006243 chemical reaction Methods 0.000 description 27
- 239000011541 reaction mixture Substances 0.000 description 26
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 25
- 108020001823 ΔF508-CFTR Proteins 0.000 description 25
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 24
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 22
- 230000032258 transport Effects 0.000 description 22
- 210000004379 membrane Anatomy 0.000 description 21
- 239000012528 membrane Substances 0.000 description 21
- 238000003756 stirring Methods 0.000 description 21
- 230000006870 function Effects 0.000 description 20
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 19
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 18
- 101000907783 Homo sapiens Cystic fibrosis transmembrane conductance regulator Proteins 0.000 description 17
- 235000019439 ethyl acetate Nutrition 0.000 description 17
- 102000056427 human CFTR Human genes 0.000 description 17
- WAEYWIDTDWJDJA-UHFFFAOYSA-N 4-oxo-5-(trifluoromethyl)-1h-quinoline-3-carboxylic acid Chemical compound C1=CC(C(F)(F)F)=C2C(=O)C(C(=O)O)=CNC2=C1 WAEYWIDTDWJDJA-UHFFFAOYSA-N 0.000 description 16
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 15
- 239000000843 powder Substances 0.000 description 15
- 239000000725 suspension Substances 0.000 description 15
- JQHCKZLQJDVZPH-UHFFFAOYSA-N 7-azabicyclo[2.2.1]heptane;hydrochloride Chemical compound [Cl-].C1CC2CCC1[NH2+]2 JQHCKZLQJDVZPH-UHFFFAOYSA-N 0.000 description 14
- 239000003814 drug Substances 0.000 description 14
- 239000003623 enhancer Substances 0.000 description 14
- YDSLNLXECXVMMY-UHFFFAOYSA-N 7-[4-nitro-3-(trifluoromethyl)phenyl]-7-azabicyclo[2.2.1]heptane Chemical compound C1=C(C(F)(F)F)C([N+](=O)[O-])=CC=C1N1C2CCC1CC2 YDSLNLXECXVMMY-UHFFFAOYSA-N 0.000 description 13
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 12
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 12
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 12
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 12
- 238000000576 coating method Methods 0.000 description 12
- 210000000981 epithelium Anatomy 0.000 description 12
- 239000010410 layer Substances 0.000 description 12
- 239000012299 nitrogen atmosphere Substances 0.000 description 12
- 239000012044 organic layer Substances 0.000 description 12
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 12
- 235000018102 proteins Nutrition 0.000 description 12
- 102000004169 proteins and genes Human genes 0.000 description 12
- 239000002904 solvent Substances 0.000 description 12
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 11
- 150000001450 anions Chemical class 0.000 description 11
- 238000001914 filtration Methods 0.000 description 11
- 239000011734 sodium Substances 0.000 description 11
- ZRVMLMPILZRXTI-UHFFFAOYSA-N 8-chloro-4-oxo-5-(trifluoromethyl)-1h-quinoline-3-carboxylic acid Chemical compound C1=CC(C(F)(F)F)=C2C(=O)C(C(=O)O)=CNC2=C1Cl ZRVMLMPILZRXTI-UHFFFAOYSA-N 0.000 description 10
- 206010012735 Diarrhoea Diseases 0.000 description 10
- 238000001157 Fourier transform infrared spectrum Methods 0.000 description 10
- 238000003556 assay Methods 0.000 description 10
- 238000001816 cooling Methods 0.000 description 10
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 9
- 239000007995 HEPES buffer Substances 0.000 description 9
- 210000003097 mucus Anatomy 0.000 description 9
- 229910052757 nitrogen Inorganic materials 0.000 description 9
- 210000004940 nucleus Anatomy 0.000 description 9
- 230000003287 optical effect Effects 0.000 description 9
- 230000005855 radiation Effects 0.000 description 9
- 229940124597 therapeutic agent Drugs 0.000 description 9
- 108700028369 Alleles Proteins 0.000 description 8
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 8
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 8
- 210000000170 cell membrane Anatomy 0.000 description 8
- HZKKQOCNNKDBRA-UHFFFAOYSA-N ethyl 8-chloro-4-oxo-5-(trifluoromethyl)-1h-quinoline-3-carboxylate Chemical compound C1=CC(C(F)(F)F)=C2C(=O)C(C(=O)OCC)=CNC2=C1Cl HZKKQOCNNKDBRA-UHFFFAOYSA-N 0.000 description 8
- 239000012065 filter cake Substances 0.000 description 8
- 239000007788 liquid Substances 0.000 description 8
- 229920001223 polyethylene glycol Polymers 0.000 description 8
- 239000000047 product Substances 0.000 description 8
- 230000002829 reductive effect Effects 0.000 description 8
- ZKHQWZAMYRWXGA-KQYNXXCUSA-J ATP(4-) Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP([O-])(=O)OP([O-])(=O)OP([O-])([O-])=O)[C@@H](O)[C@H]1O ZKHQWZAMYRWXGA-KQYNXXCUSA-J 0.000 description 7
- ZKHQWZAMYRWXGA-UHFFFAOYSA-N Adenosine triphosphate Natural products C1=NC=2C(N)=NC=NC=2N1C1OC(COP(O)(=O)OP(O)(=O)OP(O)(O)=O)C(O)C1O ZKHQWZAMYRWXGA-UHFFFAOYSA-N 0.000 description 7
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 7
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 7
- 238000010521 absorption reaction Methods 0.000 description 7
- 239000000969 carrier Substances 0.000 description 7
- 230000002950 deficient Effects 0.000 description 7
- GCRDMRZCDJJIGQ-UHFFFAOYSA-N diethyl 2-[[2-chloro-5-(trifluoromethyl)anilino]methylidene]propanedioate Chemical compound CCOC(=O)C(C(=O)OCC)=CNC1=CC(C(F)(F)F)=CC=C1Cl GCRDMRZCDJJIGQ-UHFFFAOYSA-N 0.000 description 7
- 230000004064 dysfunction Effects 0.000 description 7
- 239000000706 filtrate Substances 0.000 description 7
- 239000008101 lactose Substances 0.000 description 7
- 230000028327 secretion Effects 0.000 description 7
- 239000002002 slurry Substances 0.000 description 7
- 239000007790 solid phase Substances 0.000 description 7
- 238000002411 thermogravimetry Methods 0.000 description 7
- TWCKZRPQNIFPKA-UHFFFAOYSA-N 1,4-dihydroquinoline-3-carboxamide Chemical compound C1=CC=C2CC(C(=O)N)=CNC2=C1 TWCKZRPQNIFPKA-UHFFFAOYSA-N 0.000 description 6
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 6
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 6
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 6
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- OHCQJHSOBUTRHG-KGGHGJDLSA-N FORSKOLIN Chemical compound O=C([C@@]12O)C[C@](C)(C=C)O[C@]1(C)[C@@H](OC(=O)C)[C@@H](O)[C@@H]1[C@]2(C)[C@@H](O)CCC1(C)C OHCQJHSOBUTRHG-KGGHGJDLSA-N 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 6
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 6
- 229910052799 carbon Inorganic materials 0.000 description 6
- 238000004113 cell culture Methods 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 239000011248 coating agent Substances 0.000 description 6
- 238000001938 differential scanning calorimetry curve Methods 0.000 description 6
- 239000002552 dosage form Substances 0.000 description 6
- 239000003937 drug carrier Substances 0.000 description 6
- MNVOYAYCMYYYTO-UHFFFAOYSA-N ethyl 4-oxo-5-(trifluoromethyl)-1h-quinoline-3-carboxylate Chemical compound C1=CC(C(F)(F)F)=C2C(=O)C(C(=O)OCC)=CNC2=C1 MNVOYAYCMYYYTO-UHFFFAOYSA-N 0.000 description 6
- 239000012530 fluid Substances 0.000 description 6
- 238000002866 fluorescence resonance energy transfer Methods 0.000 description 6
- 208000015181 infectious disease Diseases 0.000 description 6
- 150000002500 ions Chemical class 0.000 description 6
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- 230000007246 mechanism Effects 0.000 description 6
- 239000002609 medium Substances 0.000 description 6
- 239000000546 pharmaceutical excipient Substances 0.000 description 6
- 238000010992 reflux Methods 0.000 description 6
- 239000000126 substance Substances 0.000 description 6
- 208000024891 symptom Diseases 0.000 description 6
- DYHSDKLCOJIUFX-UHFFFAOYSA-N tert-butoxycarbonyl anhydride Chemical compound CC(C)(C)OC(=O)OC(=O)OC(C)(C)C DYHSDKLCOJIUFX-UHFFFAOYSA-N 0.000 description 6
- 239000003981 vehicle Substances 0.000 description 6
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 5
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 5
- YCKRFDGAMUMZLT-UHFFFAOYSA-N Fluorine atom Chemical compound [F] YCKRFDGAMUMZLT-UHFFFAOYSA-N 0.000 description 5
- 238000005033 Fourier transform infrared spectroscopy Methods 0.000 description 5
- 241000124008 Mammalia Species 0.000 description 5
- 108010067035 Pancrelipase Proteins 0.000 description 5
- 239000002202 Polyethylene glycol Substances 0.000 description 5
- 239000004480 active ingredient Substances 0.000 description 5
- 239000000872 buffer Substances 0.000 description 5
- 239000002775 capsule Substances 0.000 description 5
- 229940079593 drug Drugs 0.000 description 5
- 239000000975 dye Substances 0.000 description 5
- 235000019441 ethanol Nutrition 0.000 description 5
- 238000002474 experimental method Methods 0.000 description 5
- 229910052731 fluorine Inorganic materials 0.000 description 5
- 239000011737 fluorine Substances 0.000 description 5
- 238000009472 formulation Methods 0.000 description 5
- 238000010438 heat treatment Methods 0.000 description 5
- 239000003921 oil Substances 0.000 description 5
- 235000019198 oils Nutrition 0.000 description 5
- 239000006187 pill Substances 0.000 description 5
- 229920000642 polymer Polymers 0.000 description 5
- 229920006395 saturated elastomer Polymers 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 239000007909 solid dosage form Substances 0.000 description 5
- 239000003826 tablet Substances 0.000 description 5
- DQARDWKWPIRJEH-UHFFFAOYSA-N tert-butyl n-(4-hydroxycyclohexyl)carbamate Chemical compound CC(C)(C)OC(=O)NC1CCC(O)CC1 DQARDWKWPIRJEH-UHFFFAOYSA-N 0.000 description 5
- 238000002560 therapeutic procedure Methods 0.000 description 5
- 210000001519 tissue Anatomy 0.000 description 5
- 239000001993 wax Substances 0.000 description 5
- PUPZLCDOIYMWBV-UHFFFAOYSA-N (+/-)-1,3-Butanediol Chemical compound CC(O)CCO PUPZLCDOIYMWBV-UHFFFAOYSA-N 0.000 description 4
- GIFDDEUMMLLKIL-UHFFFAOYSA-N 4-(7-azabicyclo[2.2.1]heptan-7-yl)-2-(trifluoromethyl)aniline Chemical compound C1=C(C(F)(F)F)C(N)=CC=C1N1C2CCC1CC2 GIFDDEUMMLLKIL-UHFFFAOYSA-N 0.000 description 4
- IMLXLGZJLAOKJN-UHFFFAOYSA-N 4-aminocyclohexan-1-ol Chemical compound NC1CCC(O)CC1 IMLXLGZJLAOKJN-UHFFFAOYSA-N 0.000 description 4
- WMQOSURXFLBTPC-UHFFFAOYSA-N 4-fluoro-1-nitro-2-(trifluoromethyl)benzene Chemical compound [O-][N+](=O)C1=CC=C(F)C=C1C(F)(F)F WMQOSURXFLBTPC-UHFFFAOYSA-N 0.000 description 4
- 206010006474 Bronchopulmonary aspergillosis allergic Diseases 0.000 description 4
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 4
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 4
- 206010061218 Inflammation Diseases 0.000 description 4
- XSTRZZXVGQMKLM-LJGSYFOKSA-N N[C@H]1CC[C@H](CS(O)(=O)=O)CC1 Chemical compound N[C@H]1CC[C@H](CS(O)(=O)=O)CC1 XSTRZZXVGQMKLM-LJGSYFOKSA-N 0.000 description 4
- 229920002472 Starch Polymers 0.000 description 4
- 229930006000 Sucrose Natural products 0.000 description 4
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 4
- 238000013019 agitation Methods 0.000 description 4
- 208000006778 allergic bronchopulmonary aspergillosis Diseases 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 210000002469 basement membrane Anatomy 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 229940124630 bronchodilator Drugs 0.000 description 4
- 230000001684 chronic effect Effects 0.000 description 4
- 239000012043 crude product Substances 0.000 description 4
- 230000034994 death Effects 0.000 description 4
- 231100000517 death Toxicity 0.000 description 4
- 238000000113 differential scanning calorimetry Methods 0.000 description 4
- 229910001873 dinitrogen Inorganic materials 0.000 description 4
- 239000000796 flavoring agent Substances 0.000 description 4
- 235000013355 food flavoring agent Nutrition 0.000 description 4
- 239000008103 glucose Substances 0.000 description 4
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- 230000001976 improved effect Effects 0.000 description 4
- 239000003701 inert diluent Substances 0.000 description 4
- 230000004054 inflammatory process Effects 0.000 description 4
- 239000000314 lubricant Substances 0.000 description 4
- 210000004072 lung Anatomy 0.000 description 4
- 230000001404 mediated effect Effects 0.000 description 4
- SLFVYFOEHHLHDW-UHFFFAOYSA-N n-(trifluoromethyl)aniline Chemical compound FC(F)(F)NC1=CC=CC=C1 SLFVYFOEHHLHDW-UHFFFAOYSA-N 0.000 description 4
- 230000001613 neoplastic effect Effects 0.000 description 4
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 4
- 230000009467 reduction Effects 0.000 description 4
- 208000023504 respiratory system disease Diseases 0.000 description 4
- 230000003248 secreting effect Effects 0.000 description 4
- 235000019698 starch Nutrition 0.000 description 4
- 239000005720 sucrose Substances 0.000 description 4
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 4
- QCQCHGYLTSGIGX-GHXANHINSA-N 4-[[(3ar,5ar,5br,7ar,9s,11ar,11br,13as)-5a,5b,8,8,11a-pentamethyl-3a-[(5-methylpyridine-3-carbonyl)amino]-2-oxo-1-propan-2-yl-4,5,6,7,7a,9,10,11,11b,12,13,13a-dodecahydro-3h-cyclopenta[a]chrysen-9-yl]oxy]-2,2-dimethyl-4-oxobutanoic acid Chemical class N([C@@]12CC[C@@]3(C)[C@]4(C)CC[C@H]5C(C)(C)[C@@H](OC(=O)CC(C)(C)C(O)=O)CC[C@]5(C)[C@H]4CC[C@@H]3C1=C(C(C2)=O)C(C)C)C(=O)C1=CN=CC(C)=C1 QCQCHGYLTSGIGX-GHXANHINSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 3
- 101150029409 CFTR gene Proteins 0.000 description 3
- 206010010904 Convulsion Diseases 0.000 description 3
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 3
- SUZLHDUTVMZSEV-UHFFFAOYSA-N Deoxycoleonol Natural products C12C(=O)CC(C)(C=C)OC2(C)C(OC(=O)C)C(O)C2C1(C)C(O)CCC2(C)C SUZLHDUTVMZSEV-UHFFFAOYSA-N 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- 102100030826 Hemoglobin subunit epsilon Human genes 0.000 description 3
- 206010020751 Hypersensitivity Diseases 0.000 description 3
- 102000004310 Ion Channels Human genes 0.000 description 3
- 108090000862 Ion Channels Proteins 0.000 description 3
- 238000005004 MAS NMR spectroscopy Methods 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 3
- 238000005481 NMR spectroscopy Methods 0.000 description 3
- WQBMWKLDZHSZDS-UHFFFAOYSA-N O=C1C(=CNC2=CC=CC(=C12)C(F)(F)F)C(=O)N Chemical compound O=C1C(=CNC2=CC=CC(=C12)C(F)(F)F)C(=O)N WQBMWKLDZHSZDS-UHFFFAOYSA-N 0.000 description 3
- 208000037656 Respiratory Sounds Diseases 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- 206010047924 Wheezing Diseases 0.000 description 3
- 230000002159 abnormal effect Effects 0.000 description 3
- 230000001154 acute effect Effects 0.000 description 3
- 235000010443 alginic acid Nutrition 0.000 description 3
- 229920000615 alginic acid Polymers 0.000 description 3
- 125000000129 anionic group Chemical group 0.000 description 3
- 239000003242 anti bacterial agent Substances 0.000 description 3
- 239000008346 aqueous phase Substances 0.000 description 3
- 210000003050 axon Anatomy 0.000 description 3
- 230000000903 blocking effect Effects 0.000 description 3
- 210000001124 body fluid Anatomy 0.000 description 3
- 239000010839 body fluid Substances 0.000 description 3
- 229910002091 carbon monoxide Inorganic materials 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- OHCQJHSOBUTRHG-UHFFFAOYSA-N colforsin Natural products OC12C(=O)CC(C)(C=C)OC1(C)C(OC(=O)C)C(O)C1C2(C)C(O)CCC1(C)C OHCQJHSOBUTRHG-UHFFFAOYSA-N 0.000 description 3
- 229940125904 compound 1 Drugs 0.000 description 3
- 239000010949 copper Substances 0.000 description 3
- 108010040974 cystic fibrosis transmembrane conductance regulator delta F508 Proteins 0.000 description 3
- 238000012217 deletion Methods 0.000 description 3
- 230000037430 deletion Effects 0.000 description 3
- 229910003460 diamond Inorganic materials 0.000 description 3
- 239000010432 diamond Substances 0.000 description 3
- 235000014113 dietary fatty acids Nutrition 0.000 description 3
- 206010013781 dry mouth Diseases 0.000 description 3
- 239000003995 emulsifying agent Substances 0.000 description 3
- 230000002708 enhancing effect Effects 0.000 description 3
- 229940088598 enzyme Drugs 0.000 description 3
- 239000000284 extract Substances 0.000 description 3
- 239000000194 fatty acid Substances 0.000 description 3
- 229930195729 fatty acid Natural products 0.000 description 3
- 239000012091 fetal bovine serum Substances 0.000 description 3
- 210000002950 fibroblast Anatomy 0.000 description 3
- 239000000945 filler Substances 0.000 description 3
- 230000004907 flux Effects 0.000 description 3
- TZBJGXHYKVUXJN-UHFFFAOYSA-N genistein Natural products C1=CC(O)=CC=C1C1=COC2=CC(O)=CC(O)=C2C1=O TZBJGXHYKVUXJN-UHFFFAOYSA-N 0.000 description 3
- 239000011521 glass Substances 0.000 description 3
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 3
- 239000008187 granular material Substances 0.000 description 3
- 229910052739 hydrogen Inorganic materials 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- 210000000936 intestine Anatomy 0.000 description 3
- 235000019359 magnesium stearate Nutrition 0.000 description 3
- 229960001855 mannitol Drugs 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 238000012856 packing Methods 0.000 description 3
- 239000003755 preservative agent Substances 0.000 description 3
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 3
- 239000000376 reactant Substances 0.000 description 3
- 230000000241 respiratory effect Effects 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 238000010898 silica gel chromatography Methods 0.000 description 3
- 229910000029 sodium carbonate Inorganic materials 0.000 description 3
- 239000008247 solid mixture Substances 0.000 description 3
- 239000008107 starch Substances 0.000 description 3
- 239000000829 suppository Substances 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 238000001757 thermogravimetry curve Methods 0.000 description 3
- 229960000707 tobramycin Drugs 0.000 description 3
- NLVFBUXFDBBNBW-PBSUHMDJSA-N tobramycin Chemical compound N[C@@H]1C[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N NLVFBUXFDBBNBW-PBSUHMDJSA-N 0.000 description 3
- 239000000080 wetting agent Substances 0.000 description 3
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- VKTTYIXIDXWHKW-UHFFFAOYSA-N 2-chloro-5-(trifluoromethyl)aniline Chemical compound NC1=CC(C(F)(F)F)=CC=C1Cl VKTTYIXIDXWHKW-UHFFFAOYSA-N 0.000 description 2
- OOUGLTULBSNHNF-UHFFFAOYSA-N 3-[5-(2-fluorophenyl)-1,2,4-oxadiazol-3-yl]benzoic acid Chemical compound OC(=O)C1=CC=CC(C=2N=C(ON=2)C=2C(=CC=CC=2)F)=C1 OOUGLTULBSNHNF-UHFFFAOYSA-N 0.000 description 2
- OIFIAKRKSKMURW-UHFFFAOYSA-N 4-(7-azoniabicyclo[2.2.1]heptan-7-yl)-2-(trifluoromethyl)aniline;chloride Chemical compound Cl.C1=C(C(F)(F)F)C(N)=CC=C1N1C2CCC1CC2 OIFIAKRKSKMURW-UHFFFAOYSA-N 0.000 description 2
- OCKGFTQIICXDQW-ZEQRLZLVSA-N 5-[(1r)-1-hydroxy-2-[4-[(2r)-2-hydroxy-2-(4-methyl-1-oxo-3h-2-benzofuran-5-yl)ethyl]piperazin-1-yl]ethyl]-4-methyl-3h-2-benzofuran-1-one Chemical compound C1=C2C(=O)OCC2=C(C)C([C@@H](O)CN2CCN(CC2)C[C@H](O)C2=CC=C3C(=O)OCC3=C2C)=C1 OCKGFTQIICXDQW-ZEQRLZLVSA-N 0.000 description 2
- SDDSJMXGJNWMJY-BRHAQHMBSA-N 7-[(2r,4ar,5r,7ar)-2-[(3s)-1,1-difluoro-3-methylpentyl]-2-hydroxy-6-oxo-3,4,4a,5,7,7a-hexahydrocyclopenta[b]pyran-5-yl]heptanoic acid Chemical compound O1[C@](C(F)(F)C[C@@H](C)CC)(O)CC[C@@H]2[C@@H](CCCCCCC(O)=O)C(=O)C[C@H]21 SDDSJMXGJNWMJY-BRHAQHMBSA-N 0.000 description 2
- SNZSSCZJMVIOCR-UHFFFAOYSA-N 7-azabicyclo[2.2.1]heptane Chemical compound C1CC2CCC1N2 SNZSSCZJMVIOCR-UHFFFAOYSA-N 0.000 description 2
- 208000030507 AIDS Diseases 0.000 description 2
- 229920001817 Agar Polymers 0.000 description 2
- WZPBZJONDBGPKJ-UHFFFAOYSA-N Antibiotic SQ 26917 Natural products O=C1N(S(O)(=O)=O)C(C)C1NC(=O)C(=NOC(C)(C)C(O)=O)C1=CSC(N)=N1 WZPBZJONDBGPKJ-UHFFFAOYSA-N 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 2
- 102000008130 Cyclic AMP-Dependent Protein Kinases Human genes 0.000 description 2
- XRHVZWWRFMCBAZ-UHFFFAOYSA-L Endothal-disodium Chemical compound [Na+].[Na+].C1CC2C(C([O-])=O)C(C(=O)[O-])C1O2 XRHVZWWRFMCBAZ-UHFFFAOYSA-L 0.000 description 2
- 102000003837 Epithelial Sodium Channels Human genes 0.000 description 2
- 108090000140 Epithelial Sodium Channels Proteins 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 108010024636 Glutathione Proteins 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 239000004705 High-molecular-weight polyethylene Substances 0.000 description 2
- 206010021143 Hypoxia Diseases 0.000 description 2
- 208000026350 Inborn Genetic disease Diseases 0.000 description 2
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 2
- 108010021466 Mutant Proteins Proteins 0.000 description 2
- 102000008300 Mutant Proteins Human genes 0.000 description 2
- 235000019483 Peanut oil Nutrition 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- 208000024571 Pick disease Diseases 0.000 description 2
- 239000004696 Poly ether ether ketone Substances 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 2
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 2
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 2
- 102000003673 Symporters Human genes 0.000 description 2
- 108090000088 Symporters Proteins 0.000 description 2
- 239000007983 Tris buffer Substances 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 235000010419 agar Nutrition 0.000 description 2
- 239000000783 alginic acid Substances 0.000 description 2
- 229960001126 alginic acid Drugs 0.000 description 2
- 150000004781 alginic acids Chemical class 0.000 description 2
- MBMBGCFOFBJSGT-KUBAVDMBSA-N all-cis-docosa-4,7,10,13,16,19-hexaenoic acid Chemical compound CC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CCC(O)=O MBMBGCFOFBJSGT-KUBAVDMBSA-N 0.000 description 2
- 208000026935 allergic disease Diseases 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 239000002260 anti-inflammatory agent Substances 0.000 description 2
- 229940121363 anti-inflammatory agent Drugs 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- XYOVOXDWRFGKEX-UHFFFAOYSA-N azepine Chemical compound N1C=CC=CC=C1 XYOVOXDWRFGKEX-UHFFFAOYSA-N 0.000 description 2
- 229960003644 aztreonam Drugs 0.000 description 2
- WZPBZJONDBGPKJ-VEHQQRBSSA-N aztreonam Chemical compound O=C1N(S([O-])(=O)=O)[C@@H](C)[C@@H]1NC(=O)C(=N/OC(C)(C)C(O)=O)\C1=CSC([NH3+])=N1 WZPBZJONDBGPKJ-VEHQQRBSSA-N 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- JUPQTSLXMOCDHR-UHFFFAOYSA-N benzene-1,4-diol;bis(4-fluorophenyl)methanone Chemical compound OC1=CC=C(O)C=C1.C1=CC(F)=CC=C1C(=O)C1=CC=C(F)C=C1 JUPQTSLXMOCDHR-UHFFFAOYSA-N 0.000 description 2
- SESFRYSPDFLNCH-UHFFFAOYSA-N benzyl benzoate Chemical compound C=1C=CC=CC=1C(=O)OCC1=CC=CC=C1 SESFRYSPDFLNCH-UHFFFAOYSA-N 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 230000003115 biocidal effect Effects 0.000 description 2
- 229920002988 biodegradable polymer Polymers 0.000 description 2
- 239000004621 biodegradable polymer Substances 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 239000007844 bleaching agent Substances 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 239000000168 bronchodilator agent Substances 0.000 description 2
- 235000019437 butane-1,3-diol Nutrition 0.000 description 2
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 2
- 239000001768 carboxy methyl cellulose Substances 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- MYSWGUAQZAJSOK-UHFFFAOYSA-N ciprofloxacin Chemical compound C12=CC(N3CCNCC3)=C(F)C=C2C(=O)C(C(=O)O)=CN1C1CC1 MYSWGUAQZAJSOK-UHFFFAOYSA-N 0.000 description 2
- 229940110456 cocoa butter Drugs 0.000 description 2
- 235000019868 cocoa butter Nutrition 0.000 description 2
- 238000002648 combination therapy Methods 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 230000001276 controlling effect Effects 0.000 description 2
- 229910052802 copper Inorganic materials 0.000 description 2
- 235000005687 corn oil Nutrition 0.000 description 2
- 239000002285 corn oil Substances 0.000 description 2
- 235000012343 cottonseed oil Nutrition 0.000 description 2
- 239000002385 cottonseed oil Substances 0.000 description 2
- 238000005384 cross polarization magic-angle spinning Methods 0.000 description 2
- 239000012045 crude solution Substances 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 238000013480 data collection Methods 0.000 description 2
- 230000018044 dehydration Effects 0.000 description 2
- 238000006297 dehydration reaction Methods 0.000 description 2
- 230000003111 delayed effect Effects 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- LTMHNWPUDSTBKD-UHFFFAOYSA-N diethyl 2-(ethoxymethylidene)propanedioate Chemical compound CCOC=C(C(=O)OCC)C(=O)OCC LTMHNWPUDSTBKD-UHFFFAOYSA-N 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 238000004090 dissolution Methods 0.000 description 2
- 239000008298 dragée Substances 0.000 description 2
- 238000002651 drug therapy Methods 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 239000003792 electrolyte Substances 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 239000002702 enteric coating Substances 0.000 description 2
- 238000009505 enteric coating Methods 0.000 description 2
- 210000002919 epithelial cell Anatomy 0.000 description 2
- 239000002713 epithelial sodium channel blocking agent Substances 0.000 description 2
- MMXKVMNBHPAILY-UHFFFAOYSA-N ethyl laurate Chemical compound CCCCCCCCCCCC(=O)OCC MMXKVMNBHPAILY-UHFFFAOYSA-N 0.000 description 2
- DEFVIWRASFVYLL-UHFFFAOYSA-N ethylene glycol bis(2-aminoethyl)tetraacetic acid Chemical compound OC(=O)CN(CC(O)=O)CCOCCOCCN(CC(O)=O)CC(O)=O DEFVIWRASFVYLL-UHFFFAOYSA-N 0.000 description 2
- 230000005713 exacerbation Effects 0.000 description 2
- 230000001747 exhibiting effect Effects 0.000 description 2
- 239000003172 expectorant agent Substances 0.000 description 2
- 150000004665 fatty acids Chemical class 0.000 description 2
- 235000003599 food sweetener Nutrition 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 239000007903 gelatin capsule Substances 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 229940045109 genistein Drugs 0.000 description 2
- 235000006539 genistein Nutrition 0.000 description 2
- ZCOLJUOHXJRHDI-CMWLGVBASA-N genistein 7-O-beta-D-glucoside Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1OC1=CC(O)=C2C(=O)C(C=3C=CC(O)=CC=3)=COC2=C1 ZCOLJUOHXJRHDI-CMWLGVBASA-N 0.000 description 2
- 210000004907 gland Anatomy 0.000 description 2
- 229960003180 glutathione Drugs 0.000 description 2
- 230000001744 histochemical effect Effects 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 230000009610 hypersensitivity Effects 0.000 description 2
- 239000005457 ice water Substances 0.000 description 2
- 229960004592 isopropanol Drugs 0.000 description 2
- 206010023332 keratitis Diseases 0.000 description 2
- 201000010666 keratoconjunctivitis Diseases 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 239000008297 liquid dosage form Substances 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 201000005296 lung carcinoma Diseases 0.000 description 2
- 210000003712 lysosome Anatomy 0.000 description 2
- 230000001868 lysosomic effect Effects 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 2
- 239000004530 micro-emulsion Substances 0.000 description 2
- 229940066491 mucolytics Drugs 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 239000000346 nonvolatile oil Substances 0.000 description 2
- 235000015097 nutrients Nutrition 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 239000004006 olive oil Substances 0.000 description 2
- 235000008390 olive oil Nutrition 0.000 description 2
- 229910052763 palladium Inorganic materials 0.000 description 2
- 229940045258 pancrelipase Drugs 0.000 description 2
- 239000000312 peanut oil Substances 0.000 description 2
- 239000012071 phase Substances 0.000 description 2
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 2
- 150000003904 phospholipids Chemical class 0.000 description 2
- HYAFETHFCAUJAY-UHFFFAOYSA-N pioglitazone Chemical compound N1=CC(CC)=CC=C1CCOC(C=C1)=CC=C1CC1C(=O)NC(=O)S1 HYAFETHFCAUJAY-UHFFFAOYSA-N 0.000 description 2
- 229920000729 poly(L-lysine) polymer Polymers 0.000 description 2
- 229920002530 polyetherether ketone Polymers 0.000 description 2
- 229910000027 potassium carbonate Inorganic materials 0.000 description 2
- WFIZEGIEIOHZCP-UHFFFAOYSA-M potassium formate Chemical compound [K+].[O-]C=O WFIZEGIEIOHZCP-UHFFFAOYSA-M 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- 229960004063 propylene glycol Drugs 0.000 description 2
- 238000010926 purge Methods 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- 201000010727 rectal prolapse Diseases 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 210000001533 respiratory mucosa Anatomy 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 210000003296 saliva Anatomy 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 201000009881 secretory diarrhea Diseases 0.000 description 2
- 239000008159 sesame oil Substances 0.000 description 2
- 235000011803 sesame oil Nutrition 0.000 description 2
- BNRNXUUZRGQAQC-UHFFFAOYSA-N sildenafil Chemical compound CCCC1=NN(C)C(C(N2)=O)=C1N=C2C(C(=CC=1)OCC)=CC=1S(=O)(=O)N1CCN(C)CC1 BNRNXUUZRGQAQC-UHFFFAOYSA-N 0.000 description 2
- 229910052710 silicon Inorganic materials 0.000 description 2
- 239000010703 silicon Substances 0.000 description 2
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 2
- 238000004611 spectroscopical analysis Methods 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- 239000003765 sweetening agent Substances 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- 210000001138 tear Anatomy 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 238000001622 two pulse phase modulation pulse sequence Methods 0.000 description 2
- 210000001215 vagina Anatomy 0.000 description 2
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical compound OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- MHCVCKDNQYMGEX-UHFFFAOYSA-N 1,1'-biphenyl;phenoxybenzene Chemical compound C1=CC=CC=C1C1=CC=CC=C1.C=1C=CC=CC=1OC1=CC=CC=C1 MHCVCKDNQYMGEX-UHFFFAOYSA-N 0.000 description 1
- OQZQXOFJGSSYNX-UHFFFAOYSA-N 1,2-dihydroquinoline-3-carboxamide Chemical compound C1=CC=C2NCC(C(=O)N)=CC2=C1 OQZQXOFJGSSYNX-UHFFFAOYSA-N 0.000 description 1
- 229940058015 1,3-butylene glycol Drugs 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- AEQDJSLRWYMAQI-UHFFFAOYSA-N 2,3,9,10-tetramethoxy-6,8,13,13a-tetrahydro-5H-isoquinolino[2,1-b]isoquinoline Chemical compound C1CN2CC(C(=C(OC)C=C3)OC)=C3CC2C2=C1C=C(OC)C(OC)=C2 AEQDJSLRWYMAQI-UHFFFAOYSA-N 0.000 description 1
- CHHHXKFHOYLYRE-UHFFFAOYSA-M 2,4-Hexadienoic acid, potassium salt (1:1), (2E,4E)- Chemical compound [K+].CC=CC=CC([O-])=O CHHHXKFHOYLYRE-UHFFFAOYSA-M 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- WVVVSSSXKIIQAJ-UHFFFAOYSA-N 5-(trifluoromethyl)-1,4-dihydroquinoline-3-carboxamide Chemical compound FC(C1=C2CC(=CNC2=CC=C1)C(=O)N)(F)F WVVVSSSXKIIQAJ-UHFFFAOYSA-N 0.000 description 1
- HKIQLQJZKCSFRJ-UHFFFAOYSA-N 5-(trifluoromethyl)-1H-quinolin-4-one Chemical compound OC1=CC=NC2=CC=CC(=C12)C(F)(F)F HKIQLQJZKCSFRJ-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 208000010444 Acidosis Diseases 0.000 description 1
- 102100022524 Alpha-1-antichymotrypsin Human genes 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- APKFDSVGJQXUKY-KKGHZKTASA-N Amphotericin-B Natural products O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1C=CC=CC=CC=CC=CC=CC=C[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 APKFDSVGJQXUKY-KKGHZKTASA-N 0.000 description 1
- 108091006515 Anion channels Proteins 0.000 description 1
- 102000037829 Anion channels Human genes 0.000 description 1
- 102000010637 Aquaporins Human genes 0.000 description 1
- 108010063290 Aquaporins Proteins 0.000 description 1
- 206010003557 Asthma exercise induced Diseases 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 208000035143 Bacterial infection Diseases 0.000 description 1
- 102000004506 Blood Proteins Human genes 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- 206010006448 Bronchiolitis Diseases 0.000 description 1
- FHLPSULNGJGJGR-UHFFFAOYSA-N C[N]1(C2CCC1CC2)c(cc1C(F)(F)F)ccc1NC(C1=CNc2ccccc2C1=O)=O Chemical compound C[N]1(C2CCC1CC2)c(cc1C(F)(F)F)ccc1NC(C1=CNc2ccccc2C1=O)=O FHLPSULNGJGJGR-UHFFFAOYSA-N 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 108010078791 Carrier Proteins Proteins 0.000 description 1
- 208000009043 Chemical Burns Diseases 0.000 description 1
- 206010008631 Cholera Diseases 0.000 description 1
- 102000004266 Collagen Type IV Human genes 0.000 description 1
- 108010042086 Collagen Type IV Proteins 0.000 description 1
- 201000002200 Congenital disorder of glycosylation Diseases 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 108010049894 Cyclic AMP-Dependent Protein Kinases Proteins 0.000 description 1
- RGHNJXZEOKUKBD-SQOUGZDYSA-M D-gluconate Chemical class OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O RGHNJXZEOKUKBD-SQOUGZDYSA-M 0.000 description 1
- 208000005156 Dehydration Diseases 0.000 description 1
- 201000004624 Dermatitis Diseases 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- 235000019739 Dicalciumphosphate Nutrition 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 206010058314 Dysplasia Diseases 0.000 description 1
- 208000014094 Dystonic disease Diseases 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 206010015150 Erythema Diseases 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- 208000004657 Exercise-Induced Asthma Diseases 0.000 description 1
- GBNRNAVAZIWIPR-MEZFUOHNSA-N FC(C(=O)O)(F)F.N[C@@H]1CC[C@H](CC1)CS(=O)(=O)O Chemical compound FC(C(=O)O)(F)F.N[C@@H]1CC[C@H](CC1)CS(=O)(=O)O GBNRNAVAZIWIPR-MEZFUOHNSA-N 0.000 description 1
- 108010049003 Fibrinogen Proteins 0.000 description 1
- 102000008946 Fibrinogen Human genes 0.000 description 1
- 239000004606 Fillers/Extenders Substances 0.000 description 1
- 241000206672 Gelidium Species 0.000 description 1
- 206010064571 Gene mutation Diseases 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Polymers OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102100020948 Growth hormone receptor Human genes 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- 206010020772 Hypertension Diseases 0.000 description 1
- 206010020850 Hyperthyroidism Diseases 0.000 description 1
- 208000000038 Hypoparathyroidism Diseases 0.000 description 1
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000003746 Insulin Receptor Human genes 0.000 description 1
- 108010001127 Insulin Receptor Proteins 0.000 description 1
- 102100027612 Kallikrein-11 Human genes 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- 240000007472 Leucaena leucocephala Species 0.000 description 1
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 1
- GSDSWSVVBLHKDQ-JTQLQIEISA-N Levofloxacin Chemical compound C([C@@H](N1C2=C(C(C(C(O)=O)=C1)=O)C=C1F)C)OC2=C1N1CCN(C)CC1 GSDSWSVVBLHKDQ-JTQLQIEISA-N 0.000 description 1
- 208000026709 Liddle syndrome Diseases 0.000 description 1
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 1
- 208000002720 Malnutrition Diseases 0.000 description 1
- 240000003183 Manihot esculenta Species 0.000 description 1
- 235000016735 Manihot esculenta subsp esculenta Nutrition 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 208000024556 Mendelian disease Diseases 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 206010056886 Mucopolysaccharidosis I Diseases 0.000 description 1
- 102100021339 Multidrug resistance-associated protein 1 Human genes 0.000 description 1
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 244000061176 Nicotiana tabacum Species 0.000 description 1
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 102000004316 Oxidoreductases Human genes 0.000 description 1
- 108090000854 Oxidoreductases Proteins 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 102100035917 Peripheral myelin protein 22 Human genes 0.000 description 1
- 101710199257 Peripheral myelin protein 22 Proteins 0.000 description 1
- 102000045595 Phosphoprotein Phosphatases Human genes 0.000 description 1
- 108700019535 Phosphoprotein Phosphatases Proteins 0.000 description 1
- 206010035664 Pneumonia Diseases 0.000 description 1
- 229920002732 Polyanhydride Polymers 0.000 description 1
- 229920000954 Polyglycolide Polymers 0.000 description 1
- 229920001710 Polyorthoester Polymers 0.000 description 1
- 208000004880 Polyuria Diseases 0.000 description 1
- 108010050254 Presenilins Proteins 0.000 description 1
- 102000015499 Presenilins Human genes 0.000 description 1
- 102000007327 Protamines Human genes 0.000 description 1
- 108010007568 Protamines Proteins 0.000 description 1
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 description 1
- 108700005075 Regulator Genes Proteins 0.000 description 1
- 238000003991 Rietveld refinement Methods 0.000 description 1
- 235000019485 Safflower oil Nutrition 0.000 description 1
- 108010000303 Secretory Proteinase Inhibitory Proteins Proteins 0.000 description 1
- 102000002255 Secretory Proteinase Inhibitory Proteins Human genes 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- GIIZNNXWQWCKIB-UHFFFAOYSA-N Serevent Chemical compound C1=C(O)C(CO)=CC(C(O)CNCCCCCCOCCCCC=2C=CC=CC=2)=C1 GIIZNNXWQWCKIB-UHFFFAOYSA-N 0.000 description 1
- 102000012479 Serine Proteases Human genes 0.000 description 1
- 108010022999 Serine Proteases Proteins 0.000 description 1
- 201000001880 Sexual dysfunction Diseases 0.000 description 1
- 244000061456 Solanum tuberosum Species 0.000 description 1
- 235000002595 Solanum tuberosum Nutrition 0.000 description 1
- 108010068542 Somatotropin Receptors Proteins 0.000 description 1
- SSZBUIDZHHWXNJ-UHFFFAOYSA-N Stearinsaeure-hexadecylester Natural products CCCCCCCCCCCCCCCCCC(=O)OCCCCCCCCCCCCCCCC SSZBUIDZHHWXNJ-UHFFFAOYSA-N 0.000 description 1
- 201000009594 Systemic Scleroderma Diseases 0.000 description 1
- 206010042953 Systemic sclerosis Diseases 0.000 description 1
- 206010053615 Thermal burn Diseases 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 101710152431 Trypsin-like protease Proteins 0.000 description 1
- 102000003425 Tyrosinase Human genes 0.000 description 1
- 108060008724 Tyrosinase Proteins 0.000 description 1
- PGAVKCOVUIYSFO-XVFCMESISA-N UTP Chemical compound O[C@@H]1[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)O[C@H]1N1C(=O)NC(=O)C=C1 PGAVKCOVUIYSFO-XVFCMESISA-N 0.000 description 1
- GXBMIBRIOWHPDT-UHFFFAOYSA-N Vasopressin Natural products N1C(=O)C(CC=2C=C(O)C=CC=2)NC(=O)C(N)CSSCC(C(=O)N2C(CCC2)C(=O)NC(CCCN=C(N)N)C(=O)NCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(CCC(N)=O)NC(=O)C1CC1=CC=CC=C1 GXBMIBRIOWHPDT-UHFFFAOYSA-N 0.000 description 1
- 108010004977 Vasopressins Proteins 0.000 description 1
- 102000002852 Vasopressins Human genes 0.000 description 1
- SVJGGWZOTSJMCQ-RMTIMQEASA-N [(1s,2s,3r,4r,5s,6r)-2,3,4,5-tetrakis[bis(propanoyloxymethoxy)phosphoryloxy]-6-octoxycyclohexyl] butanoate Chemical compound CCCCCCCCO[C@@H]1[C@H](OC(=O)CCC)[C@H](OP(=O)(OCOC(=O)CC)OCOC(=O)CC)[C@@H](OP(=O)(OCOC(=O)CC)OCOC(=O)CC)[C@H](OP(=O)(OCOC(=O)CC)OCOC(=O)CC)[C@H]1OP(=O)(OCOC(=O)CC)OCOC(=O)CC SVJGGWZOTSJMCQ-RMTIMQEASA-N 0.000 description 1
- 239000001089 [(2R)-oxolan-2-yl]methanol Substances 0.000 description 1
- ZUSWDTWYONAOPH-UHFFFAOYSA-N [2-(trifluoromethyl)phenyl]hydrazine;hydrochloride Chemical group [Cl-].[NH3+]NC1=CC=CC=C1C(F)(F)F ZUSWDTWYONAOPH-UHFFFAOYSA-N 0.000 description 1
- 239000002250 absorbent Substances 0.000 description 1
- 230000002745 absorbent Effects 0.000 description 1
- 239000003655 absorption accelerator Substances 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 230000007950 acidosis Effects 0.000 description 1
- 208000026545 acidosis disease Diseases 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 230000009056 active transport Effects 0.000 description 1
- 208000024716 acute asthma Diseases 0.000 description 1
- 201000009840 acute diarrhea Diseases 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 210000001552 airway epithelial cell Anatomy 0.000 description 1
- NDAUXUAQIAJITI-UHFFFAOYSA-N albuterol Chemical compound CC(C)(C)NCC(O)C1=CC=C(O)C(CO)=C1 NDAUXUAQIAJITI-UHFFFAOYSA-N 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- 108010091628 alpha 1-Antichymotrypsin Proteins 0.000 description 1
- 108010050122 alpha 1-Antitrypsin Proteins 0.000 description 1
- 102000015395 alpha 1-Antitrypsin Human genes 0.000 description 1
- 229940024142 alpha 1-antitrypsin Drugs 0.000 description 1
- 102000005840 alpha-Galactosidase Human genes 0.000 description 1
- 108010030291 alpha-Galactosidase Proteins 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- CEGOLXSVJUTHNZ-UHFFFAOYSA-K aluminium tristearate Chemical compound [Al+3].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CEGOLXSVJUTHNZ-UHFFFAOYSA-K 0.000 description 1
- 229940063655 aluminum stearate Drugs 0.000 description 1
- 229960004821 amikacin Drugs 0.000 description 1
- LKCWBDHBTVXHDL-RMDFUYIESA-N amikacin Chemical compound O([C@@H]1[C@@H](N)C[C@H]([C@@H]([C@H]1O)O[C@@H]1[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O1)O)NC(=O)[C@@H](O)CCN)[C@H]1O[C@H](CN)[C@@H](O)[C@H](O)[C@H]1O LKCWBDHBTVXHDL-RMDFUYIESA-N 0.000 description 1
- 235000001014 amino acid Nutrition 0.000 description 1
- APKFDSVGJQXUKY-INPOYWNPSA-N amphotericin B Chemical compound O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1/C=C/C=C/C=C/C=C/C=C/C=C/C=C/[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 APKFDSVGJQXUKY-INPOYWNPSA-N 0.000 description 1
- 229960003942 amphotericin b Drugs 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 230000002924 anti-infective effect Effects 0.000 description 1
- 230000003110 anti-inflammatory effect Effects 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- KBZOIRJILGZLEJ-LGYYRGKSSA-N argipressin Chemical compound C([C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CSSC[C@@H](C(N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N1)=O)N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCN=C(N)N)C(=O)NCC(N)=O)C1=CC=CC=C1 KBZOIRJILGZLEJ-LGYYRGKSSA-N 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 238000002820 assay format Methods 0.000 description 1
- 229960003995 ataluren Drugs 0.000 description 1
- 238000005102 attenuated total reflection Methods 0.000 description 1
- 229960004099 azithromycin Drugs 0.000 description 1
- MQTOSJVFKKJCRP-BICOPXKESA-N azithromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)N(C)C[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 MQTOSJVFKKJCRP-BICOPXKESA-N 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 208000022362 bacterial infectious disease Diseases 0.000 description 1
- OGBUMNBNEWYMNJ-UHFFFAOYSA-N batilol Chemical class CCCCCCCCCCCCCCCCCCOCC(O)CO OGBUMNBNEWYMNJ-UHFFFAOYSA-N 0.000 description 1
- 239000000440 bentonite Substances 0.000 description 1
- 229910000278 bentonite Inorganic materials 0.000 description 1
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 1
- 229960002903 benzyl benzoate Drugs 0.000 description 1
- 102000007478 beta-N-Acetylhexosaminidases Human genes 0.000 description 1
- 108010085377 beta-N-Acetylhexosaminidases Proteins 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 229920000249 biocompatible polymer Polymers 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000002051 biphasic effect Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 230000036760 body temperature Effects 0.000 description 1
- 239000012267 brine Substances 0.000 description 1
- 230000003435 bronchoconstrictive effect Effects 0.000 description 1
- DQXBYHZEEUGOBF-UHFFFAOYSA-N but-3-enoic acid;ethene Chemical compound C=C.OC(=O)CC=C DQXBYHZEEUGOBF-UHFFFAOYSA-N 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 239000003518 caustics Substances 0.000 description 1
- 238000000423 cell based assay Methods 0.000 description 1
- 230000030570 cellular localization Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 229960000541 cetyl alcohol Drugs 0.000 description 1
- AQWKVJFRGORALM-UHFFFAOYSA-N chembl1941089 Chemical compound CC1=CC=C(O)C(C2=NNC(=C2)C=2C=CC=CC=2)=C1 AQWKVJFRGORALM-UHFFFAOYSA-N 0.000 description 1
- 229910052729 chemical element Inorganic materials 0.000 description 1
- 150000003841 chloride salts Chemical group 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 208000019902 chronic diarrheal disease Diseases 0.000 description 1
- 210000004081 cilia Anatomy 0.000 description 1
- 229960003405 ciprofloxacin Drugs 0.000 description 1
- 239000004927 clay Substances 0.000 description 1
- 229950005980 cobiprostone Drugs 0.000 description 1
- 239000008119 colloidal silica Substances 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 210000002777 columnar cell Anatomy 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 239000003636 conditioned culture medium Substances 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 239000012050 conventional carrier Substances 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 210000000399 corneal endothelial cell Anatomy 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 230000000875 corresponding effect Effects 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 229940092125 creon Drugs 0.000 description 1
- 238000005388 cross polarization Methods 0.000 description 1
- 239000002178 crystalline material Substances 0.000 description 1
- 238000002447 crystallographic data Methods 0.000 description 1
- 229940127089 cytotoxic agent Drugs 0.000 description 1
- 238000007405 data analysis Methods 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 239000003405 delayed action preparation Substances 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- 125000004431 deuterium atom Chemical group 0.000 description 1
- NEFBYIFKOOEVPA-UHFFFAOYSA-K dicalcium phosphate Chemical compound [Ca+2].[Ca+2].[O-]P([O-])([O-])=O NEFBYIFKOOEVPA-UHFFFAOYSA-K 0.000 description 1
- 229940038472 dicalcium phosphate Drugs 0.000 description 1
- 229910000390 dicalcium phosphate Inorganic materials 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 230000001079 digestive effect Effects 0.000 description 1
- GXGAKHNRMVGRPK-UHFFFAOYSA-N dimagnesium;dioxido-bis[[oxido(oxo)silyl]oxy]silane Chemical compound [Mg+2].[Mg+2].[O-][Si](=O)O[Si]([O-])([O-])O[Si]([O-])=O GXGAKHNRMVGRPK-UHFFFAOYSA-N 0.000 description 1
- ZPWVASYFFYYZEW-UHFFFAOYSA-L dipotassium hydrogen phosphate Chemical compound [K+].[K+].OP([O-])([O-])=O ZPWVASYFFYYZEW-UHFFFAOYSA-L 0.000 description 1
- 235000019797 dipotassium phosphate Nutrition 0.000 description 1
- 229910000396 dipotassium phosphate Inorganic materials 0.000 description 1
- 238000007598 dipping method Methods 0.000 description 1
- 230000008034 disappearance Effects 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- 230000035619 diuresis Effects 0.000 description 1
- 108010067396 dornase alfa Proteins 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 239000006196 drop Substances 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 208000001848 dysentery Diseases 0.000 description 1
- 208000010118 dystonia Diseases 0.000 description 1
- 239000003221 ear drop Substances 0.000 description 1
- 229940047652 ear drops Drugs 0.000 description 1
- 238000003372 electrophysiological method Methods 0.000 description 1
- 231100000321 erythema Toxicity 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- 229940093499 ethyl acetate Drugs 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 239000005038 ethylene vinyl acetate Substances 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 208000024695 exercise-induced bronchoconstriction Diseases 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 239000003925 fat Substances 0.000 description 1
- 235000019197 fats Nutrition 0.000 description 1
- 210000003608 fece Anatomy 0.000 description 1
- 231100000502 fertility decrease Toxicity 0.000 description 1
- 229940012952 fibrinogen Drugs 0.000 description 1
- 230000003480 fibrinolytic effect Effects 0.000 description 1
- 125000004216 fluoromethyl group Chemical group [H]C([H])(F)* 0.000 description 1
- 229960000308 fosfomycin Drugs 0.000 description 1
- YMDXZJFXQJVXBF-STHAYSLISA-N fosfomycin Chemical compound C[C@@H]1O[C@@H]1P(O)(O)=O YMDXZJFXQJVXBF-STHAYSLISA-N 0.000 description 1
- 238000004508 fractional distillation Methods 0.000 description 1
- 239000003517 fume Substances 0.000 description 1
- 210000000232 gallbladder Anatomy 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 208000016361 genetic disease Diseases 0.000 description 1
- 230000000762 glandular Effects 0.000 description 1
- 235000001727 glucose Nutrition 0.000 description 1
- 125000005456 glyceride group Chemical group 0.000 description 1
- YQEMORVAKMFKLG-UHFFFAOYSA-N glycerine monostearate Natural products CCCCCCCCCCCCCCCCCC(=O)OC(CO)CO YQEMORVAKMFKLG-UHFFFAOYSA-N 0.000 description 1
- SVUQHVRAGMNPLW-UHFFFAOYSA-N glycerol monostearate Natural products CCCCCCCCCCCCCCCCC(=O)OCC(O)CO SVUQHVRAGMNPLW-UHFFFAOYSA-N 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 229960002449 glycine Drugs 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 208000037824 growth disorder Diseases 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 1
- 239000008240 homogeneous mixture Substances 0.000 description 1
- 239000003906 humectant Substances 0.000 description 1
- 230000036571 hydration Effects 0.000 description 1
- 238000006703 hydration reaction Methods 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 1
- XXSMGPRMXLTPCZ-UHFFFAOYSA-N hydroxychloroquine Chemical compound ClC1=CC=C2C(NC(C)CCCN(CCO)CC)=CC=NC2=C1 XXSMGPRMXLTPCZ-UHFFFAOYSA-N 0.000 description 1
- 229960004171 hydroxychloroquine Drugs 0.000 description 1
- 230000001077 hypotensive effect Effects 0.000 description 1
- 210000003016 hypothalamus Anatomy 0.000 description 1
- 230000007954 hypoxia Effects 0.000 description 1
- 230000001146 hypoxic effect Effects 0.000 description 1
- 229960001680 ibuprofen Drugs 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 208000021267 infertility disease Diseases 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 208000030603 inherited susceptibility to asthma Diseases 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 208000003243 intestinal obstruction Diseases 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 201000010901 lateral sclerosis Diseases 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 239000003591 leukocyte elastase inhibitor Substances 0.000 description 1
- 229960003376 levofloxacin Drugs 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000006194 liquid suspension Substances 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- UFSKUSARDNFIRC-UHFFFAOYSA-N lumacaftor Chemical group N1=C(C=2C=C(C=CC=2)C(O)=O)C(C)=CC=C1NC(=O)C1(C=2C=C3OC(F)(F)OC3=CC=2)CC1 UFSKUSARDNFIRC-UHFFFAOYSA-N 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 239000000391 magnesium silicate Substances 0.000 description 1
- 229910000386 magnesium trisilicate Inorganic materials 0.000 description 1
- 235000019793 magnesium trisilicate Nutrition 0.000 description 1
- 229940099273 magnesium trisilicate Drugs 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 230000001071 malnutrition Effects 0.000 description 1
- 235000000824 malnutrition Nutrition 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 108010082117 matrigel Proteins 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 238000002779 membrane potential assay Methods 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 239000003094 microcapsule Substances 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 239000006082 mold release agent Substances 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- CQDGTJPVBWZJAZ-UHFFFAOYSA-N monoethyl carbonate Chemical compound CCOC(O)=O CQDGTJPVBWZJAZ-UHFFFAOYSA-N 0.000 description 1
- 208000005264 motor neuron disease Diseases 0.000 description 1
- 230000000420 mucociliary effect Effects 0.000 description 1
- 230000000510 mucolytic effect Effects 0.000 description 1
- 108010066052 multidrug resistance-associated protein 1 Proteins 0.000 description 1
- 229940097496 nasal spray Drugs 0.000 description 1
- 239000007922 nasal spray Substances 0.000 description 1
- LYGJENNIWJXYER-UHFFFAOYSA-N nitromethane Chemical compound C[N+]([O-])=O LYGJENNIWJXYER-UHFFFAOYSA-N 0.000 description 1
- 230000008518 non respiratory effect Effects 0.000 description 1
- 231100000344 non-irritating Toxicity 0.000 description 1
- 238000010899 nucleation Methods 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 208000015380 nutritional deficiency disease Diseases 0.000 description 1
- 208000007892 occupational asthma Diseases 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 229940041678 oral spray Drugs 0.000 description 1
- 239000000668 oral spray Substances 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 230000000849 parathyroid Effects 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 239000002831 pharmacologic agent Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N phenylalanine group Chemical group N[C@@H](CC1=CC=CC=C1)C(=O)O COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 229960005095 pioglitazone Drugs 0.000 description 1
- 238000007747 plating Methods 0.000 description 1
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920001610 polycaprolactone Polymers 0.000 description 1
- 239000002861 polymer material Substances 0.000 description 1
- 208000005987 polymyositis Diseases 0.000 description 1
- 229920001451 polypropylene glycol Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 150000004804 polysaccharides Chemical class 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 239000004302 potassium sorbate Substances 0.000 description 1
- 235000010241 potassium sorbate Nutrition 0.000 description 1
- 229940069338 potassium sorbate Drugs 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- 235000012015 potatoes Nutrition 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 229950008679 protamine sulfate Drugs 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 238000001799 protein solubilization Methods 0.000 description 1
- 230000007925 protein solubilization Effects 0.000 description 1
- 208000007153 proteostasis deficiencies Diseases 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 230000009325 pulmonary function Effects 0.000 description 1
- 229940107568 pulmozyme Drugs 0.000 description 1
- 150000003856 quaternary ammonium compounds Chemical class 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000011514 reflex Effects 0.000 description 1
- 230000029058 respiratory gaseous exchange Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 235000005713 safflower oil Nutrition 0.000 description 1
- 239000003813 safflower oil Substances 0.000 description 1
- 229960002052 salbutamol Drugs 0.000 description 1
- 229960004017 salmeterol Drugs 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 230000000580 secretagogue effect Effects 0.000 description 1
- 210000000582 semen Anatomy 0.000 description 1
- 231100000872 sexual dysfunction Toxicity 0.000 description 1
- 230000001568 sexual effect Effects 0.000 description 1
- 229960003310 sildenafil Drugs 0.000 description 1
- 150000004760 silicates Chemical class 0.000 description 1
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 1
- 235000012239 silicon dioxide Nutrition 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- 229910052665 sodalite Inorganic materials 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 239000000176 sodium gluconate Substances 0.000 description 1
- 235000012207 sodium gluconate Nutrition 0.000 description 1
- 229940005574 sodium gluconate Drugs 0.000 description 1
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 1
- 239000011343 solid material Substances 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000009987 spinning Methods 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 239000008174 sterile solution Substances 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 239000003206 sterilizing agent Substances 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 239000012258 stirred mixture Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 210000004243 sweat Anatomy 0.000 description 1
- 230000005469 synchrotron radiation Effects 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 230000004489 tear production Effects 0.000 description 1
- JRMUNVKIHCOMHV-UHFFFAOYSA-M tetrabutylammonium bromide Chemical compound [Br-].CCCC[N+](CCCC)(CCCC)CCCC JRMUNVKIHCOMHV-UHFFFAOYSA-M 0.000 description 1
- BSYVTEYKTMYBMK-UHFFFAOYSA-N tetrahydrofurfuryl alcohol Chemical compound OCC1CCCO1 BSYVTEYKTMYBMK-UHFFFAOYSA-N 0.000 description 1
- CZDYPVPMEAXLPK-UHFFFAOYSA-N tetramethylsilane Chemical compound C[Si](C)(C)C CZDYPVPMEAXLPK-UHFFFAOYSA-N 0.000 description 1
- PASYJVRFGUDDEW-WMUGRWSXSA-J tetrasodium;[[(2r,3s,5r)-5-(4-amino-2-oxopyrimidin-1-yl)-3-hydroxyoxolan-2-yl]methoxy-oxidophosphoryl] [[[(2r,3s,4r,5r)-5-(2,4-dioxopyrimidin-1-yl)-3,4-dihydroxyoxolan-2-yl]methoxy-oxidophosphoryl]oxy-oxidophosphoryl] phosphate Chemical compound [Na+].[Na+].[Na+].[Na+].O=C1N=C(N)C=CN1[C@@H]1O[C@H](COP([O-])(=O)OP([O-])(=O)OP([O-])(=O)OP([O-])(=O)OC[C@@H]2[C@H]([C@@H](O)[C@@H](O2)N2C(NC(=O)C=C2)=O)O)[C@@H](O)C1 PASYJVRFGUDDEW-WMUGRWSXSA-J 0.000 description 1
- WROMPOXWARCANT-UHFFFAOYSA-N tfa trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.OC(=O)C(F)(F)F WROMPOXWARCANT-UHFFFAOYSA-N 0.000 description 1
- 230000036575 thermal burns Effects 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- JOHWNGGYGAVMGU-UHFFFAOYSA-N trifluorochlorine Chemical class FCl(F)F JOHWNGGYGAVMGU-UHFFFAOYSA-N 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 239000002753 trypsin inhibitor Substances 0.000 description 1
- 229940054369 ultrase Drugs 0.000 description 1
- 230000003827 upregulation Effects 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 238000003828 vacuum filtration Methods 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 229960003726 vasopressin Drugs 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 210000002268 wool Anatomy 0.000 description 1
- 150000003751 zinc Chemical class 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4748—Quinolines; Isoquinolines forming part of bridged ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4709—Non-condensed quinolines and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/10—Laxatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/02—Nasal agents, e.g. decongestants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/02—Drugs for disorders of the urinary system of urine or of the urinary tract, e.g. urine acidifiers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/10—Drugs for genital or sexual disorders; Contraceptives for impotence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/04—Artificial tears; Irrigation solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/14—Drugs for disorders of the endocrine system of the thyroid hormones, e.g. T3, T4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/18—Drugs for disorders of the endocrine system of the parathyroid hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/10—Antioedematous agents; Diuretics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/08—Bridged systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/13—Crystalline forms, e.g. polymorphs
Abstract
본 발명은 N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드의 실질적으로 결정질인 형태 및 고체 상태인 형태 (형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들 형태의 임의의 조합), 그의 제약 조성물, 및 그를 사용하는 치료 방법에 관한 것이다.
Description
관련 출원에 대한 상호 참조
본 출원은 2009년 10월 23일에 출원된 미국 가출원 제61/254,614호를 우선권 주장한다.
발명의 기술 분야
본 발명은 낭성 섬유증 막횡단 전도도 조절자 ("CFTR")의 조정자인, N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드의 고체 상태 형태, 예를 들어 결정질 형태에 관한 것이다. 본 발명은 또한 N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드의 결정질 형태를 포함하는 제약 조성물, 및 그를 사용하는 방법에 관한 것이다.
ATP 카세트 운반체는 다양한 약리학적 작용제, 잠재적으로 독성인 약물 및 생체이물 뿐만 아니라, 음이온의 운반을 조절하는 막 운반체 단백질 그룹이다. ATP 카세트 운반체는 그의 특이적 활성을 위해 세포성 아데노신 트리포스페이트 (ATP)와 결합하고 이를 이용하는 상동성 막 단백질이다. 이들 운반체 중 일부는, 악성 암세포를 화학 치료제로부터 방어하는, 다중약물 내성 단백질 (다중약물 내성 단백질 MRP1 또는 MDR1-P 당단백질과 유사)로 밝혀졌다. 현재까지, 48개의 이러한 운반체가 확인되었으며, 이들은 서열 동일성 및 기능에 기초하여 7개의 그룹으로 분류되었다.
질환과 통상적으로 관련있는 ATP 카세트 운반체 그룹의 한 구성원은 cAMP/ATP 매개된 음이온 채널, CFTR이다. CFTR은 흡수성 및 분비성 상피 세포를 포함하는 각종 세포 유형에서 발현되고, 이는 막을 통과하는 음이온 플럭스 뿐만 아니라, 다른 이온 채널 및 단백질의 활성을 조절한다. 상피 세포에서, CFTR의 정상적인 기능은 호흡기 및 소화 조직을 비롯한, 체내 전체에서 전해질 운반의 유지에 있어서 중요하다. CFTR은, 각각 6개의 막횡단 나선체를 함유하는 직렬로 반복되는 막횡단 도메인 및 뉴클레오티드 결합 도메인으로 이루어진 단백질을 코딩하는 대략 1480개의 아미노산으로 구성된다. 2개의 막횡단 도메인은 채널 활성 및 세포 트래픽킹(trafficking)을 조절하는 다중 인산화 부위를 갖는 커다란 극성 조절 (R)-도메인에 의해 연결된다.
CFTR을 코딩하는 유전자가 확인되고 서열분석되었다 (문헌 [Gregory, R. J. et al., (1990) Nature 347:382-386], [Rich, D. P. et al., (1990) Nature 347:358-362], [Riordan, J. R. et al., (1989) Science 245:1066-1073] 참조). 이들 유전자에서의 결함은, 인간에게서 가장 흔한 치명적인 유전 질환인 낭성 섬유증 ("CF")을 초래하는 CFTR의 돌연변이를 야기한다. 미국에서는 유아 2,500명 당 대략 1명 꼴로 낭성 섬유증에 걸린다. 전체 미국 인구 중에서, 최대 1000만명의 사람들이 명백한 발병 징후를 나타내지 않으면서 단일 카피(copy)의 결함 유전자를 갖고 있다. 이와 달리, CF 관련 유전자의 카피 2개를 갖는 개체는 만성 폐 질환을 비롯하여, CF의 악화 및 치명적인 영향을 받는다.
낭성 섬유증 환자에서, 호흡기 상피에서 내인성 발현된 CFTR의 돌연변이는 첨단부 음이온 분비의 감소를 야기하여, 이온 및 체액 운반의 불균형을 초래한다. 이로 인한 음이온 운반의 감소는 폐에서의 점액 축적 및 이에 수반되는 미생물 감염의 증대에 기여하고, 이것은 결국 CF 환자의 사망을 초래한다. 호흡기 질환 이외에도, CF 환자는 통상적으로 위장 문제 및 췌장 기능부전으로 고통을 받고, 치료받지 않으면 사망에 이르게 된다. 또한, 낭성 섬유증에 걸린 남성의 대다수가 불임이고, 낭성 섬유증에 걸린 여성은 생식 능력이 감소한다. 2개 카피의 CF 관련 유전자의 심각한 영향과는 대조적으로, 단일 카피의 CF 관련 유전자를 갖는 개체는 콜레라 및 설사로 인한 탈수에 대한 내성 증가를 나타내는데, 이는 아마도 집단 내에서 CF 유전자의 빈도가 상대적으로 높은 것을 설명해준다.
CF 염색체의 CFTR 유전자의 서열 분석은 다양한 질환 유발 돌연변이를 밝혀냈다 (문헌 [Cutting, G. R. et al., (1990) Nature 346:366-369]; [Dean, M. et al., (1990) Cell 61:863:870]; 및 [Kerem, B-S. et al., (1989) Science 245:1073-1080]; [Kerem, B-S et al., (1990) Proc. Natl. Acad. Sci. USA 87:8447-8451]). 현재까지, CF 유전자에서의 1000가지가 넘는 질환 유발 돌연변이가 확인되었다 (http://www.genet.sickkids.on.ca/cftr/app). 가장 보편적인 돌연변이는 CFTR 아미노산 서열의 508 위치의 페닐알라닌의 결실이고, 통상적으로 ΔF508-CFTR이라 한다. 상기 돌연변이는 낭성 섬유증 사례의 대략 70%에서 발생하고, 중증 질환과 관련이 있다.
ΔF508-CFTR에서의 508 잔기의 결실은 신생 단백질이 올바르게 폴딩되는 것을 방해한다. 이것은 돌연변이 단백질이 ER을 빠져나가지 못하게 하고 원형질 막으로 트래픽킹되지 못하게 한다. 그 결과, 막에 존재하는 채널의 개수가 야생형 CFTR을 발현하는 세포에서 관찰되는 것보다 훨씬 더 적다. 트래픽킹 저하 이외에도, 상기 돌연변이는 결함이 있는 채널 게이팅(gating)을 야기한다. 막내의 채널 개수의 감소와 결함이 있는 게이팅은 함께 상피를 통과하는 음이온 운반의 감소를 초래하여, 결함이 있는 이온 및 체액 운반을 초래한다 (문헌 [Quinton, P. M. (1990), FASEB J. 4: 2709-2727]). 그러나, 막에서 감소된 개수의 ΔF508-CFTR은 야생형 CFTR보다 적긴 하지만 기능적임이 연구를 통해 확인되었다 (문헌 [Dolmans et al., (1991), Nature Lond. 354: 526-528]; [Denning et al., supra]; [Pasyk and Foskett (1995), J. Cell. Biochem. 270: 12347-50]). ΔF508-CFTR 이외에도, 트래픽킹, 합성 및/또는 채널 게이팅에서의 결함을 야기하는 CFTR의 다른 질환 유발 돌연변이 (R117H-CFTR 및 G551D-CFTR)가 상향 또는 하향 조절되어 음이온 분비를 변경시키고 질환 진행 및/또는 중증도를 변형시킬 수 있다.
CFTR이 음이온 뿐만 아니라 다양한 분자를 운반하지만, 이러한 역할 (음이온, 클로라이드 및 중탄산염 운반)이 상피를 통과하는 이온 및 물을 운반하는 중요한 메카니즘의 한 요소임은 명백하다. 다른 요소는 클로라이드의 세포로의 흡수에 관여하는, 상피 Na+ 채널, ENaC, Na+/2Cl-/K+ 공동운반체, Na+-K+-ATP아제 펌프 및 기저막 K+ 채널을 포함한다.
이들 요소는 함께 작동하여, 이들의 선택적 발현 및 세포내 국소화를 통해 상피를 횡단하는 방향성 운반을 달성한다. 클로라이드 흡수는 첨단막 상에 존재하는 ENaC 및 CFTR과 세포의 기저측부 표면 상에서 발현된 Na+-K+-ATP아제 펌프 및 Cl- 채널의 공동작용 활성에 의해 발생한다. 내강 측으로부터의 클로라이드의 2차 능동 운반은 세포내 클로라이드의 축적을 야기하고, 이것은 이후에 Cl- 이온 채널을 통해 세포에서 수동적으로 방출되어 벡터성 운반을 초래할 수 있다. 기저측부 표면에서의 Na+/2Cl-/K+ 공동운반체, Na+-K+-ATP아제 펌프 및 기저막 K+ 채널 및 내강 측에서의 CFTR의 배치는 내강 측의 CFTR을 통한 클로라이드 분비의 균형을 맞춘다. 물은 아마도 그 자체로서는 능동 운반되지 않기 때문에, 상피를 통과하는 이것의 유동은 나트륨 및 클로라이드의 대량 유동에 의해 발생되는 미소한 상피횡단 삼투 구배에 의존한다.
CFTR에서의 돌연변이로 인한 중탄산염 운반 결함은 특정한 분비 기능의 결함을 초래하는 것으로 가설화된다. 예를 들어, 문헌 ["Cystic fibrosis: impaired bicarbonate secretion and mucoviscidosis," Paul M. Quinton, Lancet 2008; 372: 415-417]을 참조로 한다.
중간 정도의 CFTR 기능이상과 관련있는 CFTR에서의 돌연변이는 또한 CF와 특정한 질환 징후는 공유하나 CF의 진단 기준에는 못 미치는 상태의 환자에서 분명하게 나타난다. 여기에는 선천성 양측 정관 결손증, 특발성 만성 췌장염, 만성 기관지염 및 만성 비부비동염이 포함된다. 돌연변이체 CFTR이 환경 인자 또는 변경 유전자와 함께 위험 인자라고 생각되는 다른 질환에는 원발성 경화성 담관염, 알레르기성 기관지폐 아스페르길루스증 및 천식이 포함된다.
담배 흡연, 저산소증 및 저산소 신호를 유도하는 환경 인자들 역시 CFTR 기능을 손상시키는 것으로 입증되었고 특정한 형태의 호흡기 질환, 예컨대 만성 기관지염의 원인이 될 수 있다. CFTR 기능 결함 때문일 수 있지만 CF의 진단 기준에는 못 미치는 질환은 CFTR 관련 질환으로서 특징화된다.
CFTR 활성의 조정은, 낭성 섬유증 이외에도, CFTR에서의 돌연변이에 의해 직접적으로 유발되지 않는 다른 질환, 예컨대 분비성 질환 및 CFTR에 의해 매개되는 다른 단백질 폴딩 질환에 대해 유익할 수 있다. CFTR은 수많은 세포의 상피를 통과하는 클로라이드 및 중탄산염 플럭스를 조절하여 체액 이동, 단백질 가용화, 점액 점도 및 효소 활성을 제어한다. CFTR에서의 결함은 기도, 또는 간 및 췌장을 비롯한 여러 기관의 관의 차단을 초래할 수 있다. 강화제는 세포막에 존재하는 CFTR의 게이팅 활성을 증대시키는 화합물이다. 점액의 증점화, 불완전한 체액 조절, 불완전한 점액 청소(clearance), 또는 염증 및 조직 파괴를 유도하는 차단된 관을 수반하는 임의의 질환이 강화제에 대한 후보자일 수 있다.
여기에는 만성 폐쇄성 폐 질환 (COPD), 천식, 흡연 유발 COPD, 만성 기관지염, 비부비동염, 변비, 안구건조증, 및 쇼그렌 증후군(Sjoegren's Syndrome), 위식도 역류 질환, 담석, 직장 탈출증 및 염증성 장 질환이 포함되나, 이들로 제한되지는 않는다. COPD는 진행성이고 완전히 가역적이지 않는 기류 장애로 특징화된다. 기류 장애는 점액 과다분비, 폐기종 및 세기관지염 때문이다. 돌연변이체 또는 야생형 CFTR의 활성인자가 COPD에서 공통적인 점액 과다분비 및 불완전한 점액섬모 청소에 대한 잠재적 치료법을 제공한다. 구체적으로, CFTR을 통과하는 음이온 분비의 증가는 점액을 수화시키고 주변섬모(periciliary) 체액 점도를 최적화시키도록 기도 표면 액체로의 체액 운반을 촉진할 수 있다. 이는 점액섬모 청소를 향상시키고 COPD와 관련된 증상을 감소시킬 것이다. 또한, 향상된 기도 청소로 인해 진행중인 감염 및 염증을 저해함으로써, CFTR 조정자는 폐기종을 특징화하는 기도의 실질 파괴를 저해하거나 지연시킬 수 있고 기도 질환에서의 점액 과다분비의 근간이 되는 점액 분비 세포 개수 및 크기의 증가를 감소시키거나 역전시킬 수 있다. 안구건조증은 눈물 생성의 감소 및 비정상적 눈물막 지질, 단백질 및 뮤신 프로파일을 특징으로 한다. 건성안의 원인은 다수 있는데, 그 중의 일부는 연령, 라식 안구 수술, 관절염, 약물치료, 화학적/열적 화상, 알레르기, 및 낭성 섬유증 및 쇼그렌 증후군과 같은 질환을 포함한다. CFTR을 통한 음이온 분비의 증가는 각막 내피 세포 및 눈 주위의 분비선으로부터의 체액 운반을 증대시켜 각막 수화를 증가시킬 것이다. 이는 안구건조증과 관련있는 증상을 완화시키는데 도움을 줄 것이다. 쇼그렌 증후군은 면역계가 눈, 입, 피부, 호흡기 조직, 간, 질 및 장을 비롯한, 신체 전체의 수분 생성 선(gland)을 공격하는 자가면역 질환이다. 그에 대한 증상은 건성안, 입 및 질 뿐만 아니라, 폐 질환을 포함한다. 상기 질환은 또한 류마티스성 관절염, 전신성 홍반, 전신성 경화증 및 다발성근염/피부근염과 관련있다. 결함이 있는 단백질 트래픽킹은 치료 옵션이 제한되는 질환을 유발하는 것으로 생각된다. CFTR 활성의 조정자가 상기 질환에 걸린 다양한 기관을 수화시킬 수 있고 관련된 증상을 완화시키는데 도움을 줄 수 있다. 낭성 섬유증에 걸린 개체는 장폐색이 반복해서 발병하고 직장 탈출증, 담석, 위식도 역류 질환, GI 악성종양 및 염증성 장 질환의 높은 발병률을 가지며, 이는 CFTR 기능이 상기 질환의 예방에서 중요한 역할을 할 수 있음을 시사한다.
상기 논의된 바와 같이, ΔF508-CFTR의 508 잔기의 결실은 신생 단백질이 올바르게 폴딩되는 것을 방해하여, 이러한 돌연변이 단백질이 ER을 빠져나가지 못하게 하고 원형질 막으로 트래픽킹되지 못하게 하는 것으로 생각된다. 그 결과, 성숙 단백질이 원형질 막에 불충분한 양으로 존재하고 상피 조직 내에서의 클로라이드 운반이 유의하게 감소된다. 사실, ER 기구에 의한 CFTR의 결함이 있는 ER 프로세싱의 이러한 세포 현상은, CF 질환만이 아니라 광범위한 다른 단독 및 유전성 질환의 근본적인 이유인 것으로 밝혀졌다. ER 기구가 기능부전 상태가 될 수 있는 2가지 경로는, 분해를 유도하는 단백질의 ER 방출에의 커플링 부재, 또는 결함이 있고/잘못 폴딩된 단백질의 ER 축적에 의한 것이다 (문헌 [Aridor M, et al., Nature Med., 5(7), pp 745-751 (1999)]; [Shastry, B. S., et al., Neurochem. International, 43, pp 1-7 (2003)]; [Rutishauser, J., et al., Swiss Med Wkly, 132, pp 211-222 (2002)]; [Morello, JP et al., TIPS, 21, pp. 466-469 (2000)]; [Bross P., et al., Human Mut., 14, pp. 186-198 (1999)]). 상기의 전자에 의한 ER 기능부전과 관련있는 질환은 낭성 섬유증 (상기 논의된 잘못 폴딩된 ΔF508-CFTR로 인한 것), 유전성 폐기종 (a1-안티트립신으로 인한 것; 비-Piz 변이체), 유전성 혈색소침착증, 응고-섬유소용해 결핍, 예컨대 단백질 C 결핍, 제1형 유전성 혈관부종, 지질 프로세싱 결핍, 예컨대 가족성 고콜레스테롤혈증, 제1형 킬로미크론혈증, 무베타지단백혈증, 리소솜 축적 질환, 예컨대 I-세포병/가성 후를러병(pseudo-Hurler), 점액다당류증 (리소솜 프로세싱 효소로 인한 것), 샌드호프/테이-삭스병(Sandhof/Tay-Sachs; β-헥소스아미니다제로 인한 것), 제II형 크리글러-나자르병(Crigler-Najjar type II; UDP-글루쿠로닐-시알릭-트랜스퍼라제로 인한 것), 다발성내분비병증/고인슐린혈증, 당뇨병 (인슐린 수용체로 인한 것), 라론 왜소증(Laron dwarfism; 성장 호르몬 수용체로 인한 것), 미엘로퍼옥시다제 결핍, 원발성 부갑상선기능저하증 (전구부갑상선(preproparathyroid) 호르몬으로 인한 것), 흑색종 (티로시나제로 인한 것)이다. 상기의 후자에 의한 ER 기능부전과 관련있는 질환은 제1형 글리카노시스 CDG, 유전성 폐기종 (α1-안티트립신 (PiZ 변이체)으로 인한 것), 선천성 갑상선기능항진증, 골형성 부전 (제I형, 제II형, 제IV형 프로콜라겐으로 인한 것), 유전성 저섬유소원혈증 (피브리노겐으로 인한 것), ACT 결핍 (α1-안티키모트립신으로 인한 것), 요붕증 (DI), 신경성 DI (바소프레신 호르몬/V2-수용체로 인한 것), 신성 DI (아쿠아포린 II로 인한 것), 샤르코-마리 투스 증후군(Charcot-Marie Tooth syndrome; 말초 미엘린 단백질 22로 인한 것), 펠리체우스-메르츠바허병(Perlizaeus-Merzbacher disease), 신경변성 질환, 예컨대 알츠하이머병(Alzheimer's disease; βAPP 및 프레세닐린으로 인한 것), 파킨슨병(Parkinson's disease), 근위축성 측삭 경화증, 진행성 핵상마비, 픽병(Pick's disease), 여러 폴리글루타민 신경계 장애, 예컨대 헌팅톤병(Huntington's), 제I형 척수소뇌성 운동실조, 척수 및 연수 근육 위축, 치상핵적핵 담창구시상하핵 질환 및 근긴장성 이영양증 뿐만 아니라, 해면상 뇌병증, 예컨대 유전성 크로이츠펠트-야콥병(Creutzfeldt-Jakob disease; 프리온 단백질 프로세싱 결함으로 인한 것), 파브리병(Fabry disease; 리소솜 α-갈락토시다제 A로 인한 것), 스트라우슬러-샤잉커 증후군(Straussler-Scheinker syndrome; Prp 프로세싱 결함으로 인한 것), 불임성 췌장염, 췌장 기능부전, 골다공증, 골감소증, 고램 증후군(Gorham's Syndrome), 클로라이드 채널병증, 선천성 근긴장증 (톰슨(Thomson) 및 베커(Becker) 형태), 제III형 바터 증후군(Bartter's syndrome), 덴트병(Dent's disease), 과도놀람증, 간질, 과도놀람증, 리소솜 축적 질환, 안젤만 증후군(Angelman syndrome), 원발성 섬모 운동이상증 (PCD), 내장역위증 동반 PCD (카르타게너 증후군(Kartagener syndrome)이라고도 알려짐), 내장역위증 비동반 PCD 및 섬모 무형성, 및 간 질환이다.
CFTR에서의 돌연변이가 원인이 되는 다른 질환에는 선천성 양측 정관 결손증 (CBAVD)에 의해 유발되는 남성 불임증, 경증 폐 질환, 특발성 췌장염 및 알레르기성 기관지폐 아스페르길루스증 (ABPA)이 포함된다. 문헌 ["CFTR-opathies: disease phenotypes associated with cystic fibrosis transmembrane regulator gene mutations," Peader G. Noone and Michael R. Knowles, Respir. Res. 2001, 2: 328-332] (본원에 참고로 포함됨)을 참조로 한다.
CFTR 활성의 상향 조절 이외에, CFTR 조정자에 의한 음이온 분비의 감소는, 상피 물 운반이 분비촉진제 활성화된 클로라이드 운반의 결과로서 현저히 증가한, 분비성 설사의 치료에 유익할 수 있다. 이러한 메카니즘은 cAMP의 상승 및 CFTR의 자극을 포함한다.
설사의 다양한 원인이 있지만, 과다한 클로라이드 운반으로부터 초래되는 설사 질환의 주요 결과는 모두 공통적이며 탈수, 산성증, 성장 장애 및 사망을 포함한다. 급성 및 만성 설사는 전세계의 많은 지역에서 주요한 의학적 문제를 나타낸다. 설사는 영양실조의 중요 인자이고 5세 미만 아동의 주요 사망 원인 (5,000,000명 사망/1년)이다.
또한, 분비성 설사는 후천성 면역결핍 증후군 (AIDS) 및 만성 염증성 장 질환 (IBD) 환자에서 위험한 상태이다. 매년 선진국으로부터 개발도상국으로의 여행자 16,000,000명에게 설사가 발병하며, 설사의 중증도 및 사례수는 여행 국가 및 지역에 따라 다양하다.
따라서, 인간 CFTR의 야생형 및 돌연변이체 형태의 효과적이고 선택적인 CFTR 강화제가 요구된다. 이러한 돌연변이체 CFTR 형태에는 ΔF508del, G551D, R117H, 2789+5G->A가 포함되나, 이들로 제한되지는 않는다.
또한, 포유동물의 세포막에서 CFTR의 활성을 조정하는데 사용될 수 있는 CFTR 활성 조정자 및 그의 조성물이 요구된다.
상기 CFTR 활성 조정자를 사용하여 CFTR에서의 돌연변이에 의해 유발되는 질환을 치료하는 방법이 요구된다.
포유동물의 생체외 세포막에서 CFTR 활성을 조정하는 방법이 요구된다.
또한, 치료제로서 사용하기에 적합한 제약 조성물에 용이하게 사용될 수 있는 상기 화합물의 안정한 고체 형태가 요구된다.
발명의 개요
본 발명은 하기 구조식을 갖는, N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드 (이하, "화합물 I"이라 함)의 고체 형태에 관한 것이다.
화합물 I 및 그의 제약상 허용되는 조성물은 낭성 섬유증, 천식, 흡연 유발 COPD, 만성 기관지염, 비부비동염, 변비, 췌장염, 췌장 기능부전, 선천성 양측 정관 결손증 (CBAVD)에 의해 유발되는 남성 불임증, 경증 폐 질환, 특발성 췌장염, 알레르기성 기관지폐 아스페르길루스증 (ABPA), 간 질환, 유전성 폐기종, 유전성 혈색소침착증, 응고-섬유소용해 결핍, 예컨대 단백질 C 결핍, 제1형 유전성 혈관부종, 지질 프로세싱 결핍, 예컨대 가족성 고콜레스테롤혈증, 제1형 킬로미크론혈증, 무베타지단백혈증, 리소솜 축적 질환, 예컨대 I 세포병/가성-후를러병, 점액다당류증, 샌드호프/테이-삭스병, 제II형 크리글러-나자르병, 다발성내분비병증/고인슐린혈증, 당뇨병, 라론 왜소증, 미엘로퍼옥시다제 결핍, 원발성 부갑상선기능저하증, 흑색종, 제1형 글리카노시스 CDG, 선천성 갑상선기능항진증, 골형성 부전, 유전성 저섬유소원혈증, ACT 결핍, 요붕증 (DI), 신경성 DI, 신성 DI, 샤르코-마리 투스 증후군, 펠리체우스-메르츠바허병, 신경변성 질환, 예컨대 알츠하이머병, 파킨슨병, 근위축성 측삭 경화증, 진행성 핵상 마비, 픽병, 여러 폴리글루타민 신경계 장애, 예컨대 헌팅톤병, 제I형 척수소뇌성 운동실조, 척수 및 연수 근육 위축, 치상핵적핵 담창구시상하핵 질환 및 근긴장성 이영양증 뿐만 아니라, 해면상 뇌병증, 예컨대 유전성 크로이츠펠트-야콥병 (프리온 단백질 프로세싱 결함으로 인한 것), 파브리병, 스트라우슬러-샤잉커 증후군, COPD, 안구건조증, 또는 쇼그렌병, 골다공증, 골감소증, 골 치유 및 골 성장 (예를 들어, 골 복구, 골 재생, 골 재흡수 감소 및 골 침착 증가), 고램 증후군, 클로라이드 채널병증, 예컨대 선천성 근긴장증 (톰슨 및 베커 형태), 제III형 바터 증후군, 덴트병, 과도놀람증, 간질, 과도놀람증, 리소솜 축적 질환, 안젤만 증후군, 및 원발성 섬모 운동이상증 (PCD) [내장역위증 동반 PCD (카르타게너 증후군이라고도 알려짐), 내장역위증 비동반 PCD 및 섬모 무형성을 비롯한, 섬모의 구조 및/또는 기능의 유전성 장애에 대한 용어]을 포함하나, 이들로 제한되지는 않는 다양한 질환, 장애 또는 상태를 치료하거나 또는 이들의 중증도를 감소시키는데 유용하다.
한 측면에서, 화합물 I은 본원에서 기재되고 특징화된 바와 같이, 형태 B, 형태 A-HCl 또는 형태 B-HCl이라고 언급되는 실질적으로 결정질인 형태이다.
또 다른 측면에서, 화합물 I은 본원에서 기재되고 특징화된 바와 같이, 형태 A-HCl 또는 형태 B-HCl이라고 언급되는 히드로클로라이드 염 형태이다.
또 다른 측면에서, 화합물 I은 본원에서 기재되고 특징화된 바와 같이, 형태 B-HCl이라고 언급되는 히드로클로라이드 염 형태이다.
본원에 기재된 방법을 사용하여 형태 B, 형태 A-HCl, 형태 B-HCl, 또는 이들 형태의 임의의 조합을 포함하는 본 발명의 조성물을 제조할 수 있다.
도 1은 형태 A-HCl의 예시 샘플의 X선 분말 회절 패턴이다.
도 2는 형태 A-HCl의 대표 샘플의 DSC 곡선이다.
도 3은 온도에 대한 함수로서 샘플 중량을 나타내는, 형태 A-HCl의 대표 샘플의 열중량 분석법에 의한 곡선이다.
도 4는 형태 A-HCl의 대표 샘플의 FTIR 스펙트럼이다.
도 5는 형태 A-HCl의 대표 샘플의 고체상 13C NMR 스펙트럼이다.
도 6은 형태 A-HCl의 대표 샘플의 고체상 19F NMR 스펙트럼이다.
도 7a는 기구 1에 의해 기록된, 형태 B의 대표 샘플의 X선 분말 회절 패턴이다.
도 7b는 기구 2에 의해 기록된, 형태 B의 대표 샘플의 X선 분말 회절 패턴이다.
도 8은 형태 B의 대표 샘플의 DSC 곡선이다.
도 9는 온도에 대한 함수로서 샘플 중량을 나타내는, 형태 B의 대표 샘플의 열중량 분석법에 의한 곡선이다.
도 10은 형태 B의 대표 샘플의 FTIR 스펙트럼이다.
도 11은 형태 B의 대표 샘플의 고체상 13C NMR 스펙트럼이다.
도 12는 형태 B의 대표 샘플의 고체상 19F NMR 스펙트럼이다.
도 13은 형태 B-HCl의 대표 샘플의 X선 분말 회절 패턴이다.
도 14는 형태 B-HCl의 대표 샘플의 DSC 곡선이다.
도 15는 온도에 대한 함수로서 샘플 중량을 나타내는, 형태 B-HCl의 대표 샘플의 열중량 분석법에 의한 곡선이다.
도 16은 형태 B-HCl의 대표 샘플의 FTIR 스펙트럼이다.
도 17은 형태 B-HCl의 대표 샘플의 고체상 13C NMR 스펙트럼이다.
도 18은 형태 B-HCl의 대표 샘플의 고체상 19F NMR 스펙트럼이다.
도 19는 단일 X선 분석법에 근거한 형태 B의 입체형태적 구조를 도시한 것이다.
도 20은 단일 X선 분석법에 근거한 형태 A-HCl의 입체형태적 구조를 도시한 것이다.
도 21은 단일 X선 분석법에 근거한 형태 A-HCl의 분자 팩킹 도면이다.
도 22는 단일 X선 분석법에 근거한 형태 B-HCl의 입체형태적 구조를 도시한 것이다.
도 23은 단일 X선 분석법에 근거한 형태 B-HCl의 분자 팩킹 도면이다.
도 2는 형태 A-HCl의 대표 샘플의 DSC 곡선이다.
도 3은 온도에 대한 함수로서 샘플 중량을 나타내는, 형태 A-HCl의 대표 샘플의 열중량 분석법에 의한 곡선이다.
도 4는 형태 A-HCl의 대표 샘플의 FTIR 스펙트럼이다.
도 5는 형태 A-HCl의 대표 샘플의 고체상 13C NMR 스펙트럼이다.
도 6은 형태 A-HCl의 대표 샘플의 고체상 19F NMR 스펙트럼이다.
도 7a는 기구 1에 의해 기록된, 형태 B의 대표 샘플의 X선 분말 회절 패턴이다.
도 7b는 기구 2에 의해 기록된, 형태 B의 대표 샘플의 X선 분말 회절 패턴이다.
도 8은 형태 B의 대표 샘플의 DSC 곡선이다.
도 9는 온도에 대한 함수로서 샘플 중량을 나타내는, 형태 B의 대표 샘플의 열중량 분석법에 의한 곡선이다.
도 10은 형태 B의 대표 샘플의 FTIR 스펙트럼이다.
도 11은 형태 B의 대표 샘플의 고체상 13C NMR 스펙트럼이다.
도 12는 형태 B의 대표 샘플의 고체상 19F NMR 스펙트럼이다.
도 13은 형태 B-HCl의 대표 샘플의 X선 분말 회절 패턴이다.
도 14는 형태 B-HCl의 대표 샘플의 DSC 곡선이다.
도 15는 온도에 대한 함수로서 샘플 중량을 나타내는, 형태 B-HCl의 대표 샘플의 열중량 분석법에 의한 곡선이다.
도 16은 형태 B-HCl의 대표 샘플의 FTIR 스펙트럼이다.
도 17은 형태 B-HCl의 대표 샘플의 고체상 13C NMR 스펙트럼이다.
도 18은 형태 B-HCl의 대표 샘플의 고체상 19F NMR 스펙트럼이다.
도 19는 단일 X선 분석법에 근거한 형태 B의 입체형태적 구조를 도시한 것이다.
도 20은 단일 X선 분석법에 근거한 형태 A-HCl의 입체형태적 구조를 도시한 것이다.
도 21은 단일 X선 분석법에 근거한 형태 A-HCl의 분자 팩킹 도면이다.
도 22는 단일 X선 분석법에 근거한 형태 B-HCl의 입체형태적 구조를 도시한 것이다.
도 23은 단일 X선 분석법에 근거한 형태 B-HCl의 분자 팩킹 도면이다.
발명의 상세한 설명
정의
본원에서 사용되는 바와 같이, 달리 나타내지 않는 한, 하기 정의들이 적용될 것이다.
본원에서 사용된 용어 "ABC-운반체"는 ABC-운반체 단백질 또는 적어도 하나의 결합 도메인을 포함하는 그의 단편을 의미하고, 여기서 상기 단백질 또는 그의 단편은 생체내 또는 시험관내 존재한다. 본원에서 사용된 용어 "결합 도메인"은 조정자에 결합할 수 있는 ABC-운반체의 도메인을 의미한다. 예를 들어, 문헌 [Hwang, T. C. et al., J. Gen. Physiol. (1998): 111(3), 477-90]을 참조로 한다.
본원에서 사용된 용어 "CFTR"은 낭성 섬유증 막횡단 전도도 조절자 또는 조절자 활성을 가질 수 있는 그의 돌연변이, 예를 들어 (이들로 제한되지는 않음) ΔF508 CFTR, R117H CFTR 및 G551D CFTR을 의미한다 (CFTR 돌연변이에 대해서는 예를 들어 http://www.genet.sickkids.on.ca/cftr/app 참조).
본원에서 사용된 용어 "조정"은 측정가능한 정도로의 증가 또는 감소를 의미한다.
본원에서 사용된 용어 "정상 CFTR" 또는 "정상적인 CFTR 기능"은 흡연, 오염 또는 폐에서 염증을 유발하는 임의의 것과 같은 환경 인자에 의한 손상이 일어나지 않은 야생형 유사 CFTR을 의미한다.
본원에서 사용된 용어 "감소된 CFTR" 또는 "감소된 CFTR 기능"은 정상 CFTR보다 적은 것 또는 정상적인 CFTR 기능보다 약화된 것을 의미한다. 용어 "결정질"은 구조 단위가 고정된 기하학적 패턴 또는 격자로 배열되어, 결정질 고체가 엄격한 장거리질서를 갖는 화합물 또는 조성물을 말한다. 결정 구조를 구성하는 구조 단위는 원자, 분자 또는 이온일 수 있다. 결정질 고체는 뚜렷한 융점을 나타낸다.
용어 "실질적으로 결정질"이란 엄격한 장거리질서를 갖는 고정된 기하학적 패턴 또는 격자로 대체적으로 배열된 고체 물질을 말한다. 예를 들어, 실질적으로 결정질인 물질은 약 85% 초과의 결정도 (예를 들면, 약 90% 초과의 결정도, 약 95% 초과의 결정도, 또는 약 99% 초과의 결정도)를 갖는다. 또한, "실질적으로 결정질"이란 용어는 상기 단락에서 정의된 기술어 "결정질"을 포함함을 알아야 한다.
본 발명의 목적을 위해, 화학 원소는 문헌 [Periodic Table of the Elements, CAS version, Handbook of Chemistry and Physics, 75th Ed.]에 따라 확인된다. 추가로, 유기 화학의 일반 원리는 문헌 ["Organic Chemistry", Thomas Sorrell, University Science Books, Sausalito: 1999] 및 ["March's Advanced Organic Chemistry", 5th Ed., Ed.: Smith, M.B. and March, J., John Wiley & Sons, New York: 2001]에 개시되어 있으며, 상기 문헌의 전문이 본원에 참고로 포함된다.
달리 명시하지 않는 한, 본 발명의 화합물의 모든 호변이성질체 형태는 본 발명의 범주내에 포함된다.
또한, 달리 명시하지 않는 한, 본원에서 나타낸 구조는 또한 1개 이상의 동위원소 풍부화된 원자의 존재 여부에서만 상이한 화합물도 포함하고자 한다. 예를 들어, 수소의 듀테륨 또는 트리튬에 의한 대체, 또는 탄소의 13C 또는 14C-풍부화된 탄소에 의한 대체를 제외하고는 본 발명의 구조를 갖는 화합물은 본 발명의 범주내에 포함된다. 이러한 화합물은, 예를 들어 생물학적 분석에서 분석학적 도구 또는 탐침으로서 유용하다. 이러한 화합물, 특히 듀테륨 원자를 함유하는 화합물은 변형된 대사 성질을 나타낼 수 있다.
형태 A-HCl
한 측면에서, 본 발명은 형태 A-HCl로서 특징화되는 N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드의 형태를 특징으로 한다.
일부 실시양태에서, 형태 A-HCl은 Cu K 알파 방사선을 사용하여 얻은 X선 분말 회절에서, 하기 피크 (°) 중 하나 이상의 X선 분말 회절 패턴을 특징으로 한다: 약 6.9 내지 약 7.3° (예를 들어, 약 7.1°) 피크; 약 8.0 내지 약 8.4° (예를 들어, 약 8.2°) 피크; 약 13.9 내지 약 14.2° (예를 들어, 약 14.1°) 피크; 및 약 21.0 내지 약 21.4° (예를 들어, 약 21.2°) 피크.
일부 실시양태에서, 형태 A-HCl은 Cu K 알파 방사선을 사용하여 얻은 X선 분말 회절에서, 하기 피크 (°) 중 하나 이상의 X선 분말 회절 패턴을 특징으로 한다: 약 6.9 내지 약 7.3° (예를 들어, 약 7.1°) 피크; 약 8.0 내지 약 8.4° (예를 들어, 약 8.2°) 피크; 약 11.9 내지 약 12.3° (예를 들어, 약 12.1°) 피크; 약 13.5 내지 약 13.9° (예를 들어, 약 13.7°) 피크; 약 16.2 내지 약 16.6° (예를 들어, 약 16.4°) 피크; 약 18.5 내지 약 18.9° (예를 들어, 약 18.7°) 피크; 및 약 21.0 내지 약 21.4° (예를 들어, 약 21.2°) 피크.
일부 실시양태에서, 형태 A-HCl은 Cu K 알파 방사선을 사용하여 얻은 X선 분말 회절에서, 하기 피크 (°) 중 하나 이상의 X선 분말 회절 패턴을 특징으로 한다: 약 6.9 내지 약 7.2° (예를 들어, 약 7.1°) 피크; 약 8.0 내지 약 8.4° (예를 들어, 약 8.2°) 피크; 약 13.9 내지 약 14.3° (예를 들어, 약 14.1°) 피크; 약 14.5 내지 약 14.9° (예를 들어, 약 14.7°) 피크; 약 16.2 내지 약 16.6° (예를 들어, 약 16.4°) 피크; 약 18.5 내지 약 18.9° (예를 들어, 약 18.7°) 피크; 약 21.0 내지 약 22.2°에서의 3개의 피크 (예를 들어, 약 21.2°, 약 21.7° 및 약 21.9° 피크); 약 22.6 내지 약 23.0° (예를 들어, 약 22.8°) 피크; 약 24 내지 약 25°에서의 2개의 피크 (예를 들어, 약 24.6°및 약 25.0°); 및 약 35.3 내지 약 36.0°에서의 2개의 피크 (예를 들어, 약 35.6°).
일부 실시양태에서, 형태 A-HCl은 도 1에 제공된 X선 분말 회절 패턴을 특징으로 한다.
일부 실시양태에서, 형태 A-HCl은 고체 상태 13C NMR 스펙트럼에서 하기 피크 (백만분율 (ppm)) 중 하나 이상을 특징으로 한다: 약 163.5 내지 약 163.9 ppm (예를 들어, 약 163.7 ppm) 피크, 약 137.0 내지 약 137.4 ppm (예를 들어, 약 137.2 ppm) 피크, 및 약 121.3 내지 약 121.7 ppm (예를 들어, 약 121.5 ppm) 피크.
일부 실시양태에서, 형태 A-HCl은 고체 상태 13C NMR 스펙트럼에서 하기 피크 (백만분율 (ppm)) 중 하나 이상을 특징으로 한다: 약 175.5 내지 약 175.9 ppm (예를 들어, 약 175.7 ppm) 피크, 약 163.5 내지 약 163.9 ppm (예를 들어, 약 163.7 ppm) 피크, 약 142.4 내지 약 142.8 ppm (예를 들어, 약 142.6 ppm) 피크, 약 140.6 내지 약 141.0 ppm (예를 들어, 약 140.8 ppm) 피크, 약 137.0 내지 약 137.4 ppm (예를 들어, 137.2 ppm) 피크, 약 131.3 내지 약 131.7 ppm (예를 들어, 약 131.5 ppm) 피크, 및 약 121.3 내지 약 121.7 ppm (예를 들어, 약 121.5 ppm) 피크.
일부 실시양태에서, 형태 A-HCl은 도 5에 도시된 고체 상태 13C NMR 스펙트럼을 특징으로 한다.
일부 실시양태에서, 형태 A-HCl은 고체 상태 19F NMR 스펙트럼에서 하기 피크 (백만분율 (ppm)) 중 하나 이상을 특징으로 한다: 약 -56.8 내지 약 -57.2 ppm (예를 들어, 약 -57.0 ppm) 피크, 및 약 -60.3 내지 약 -60.7 ppm (예를 들어, 약 -60.5 ppm) 피크.
일부 실시양태에서, 형태 A-HCl은 도 6에 도시된 고체 상태 19F NMR 스펙트럼을특징으로 한다.
또 다른 실시양태에서, 형태 A-HCl은 도 4에 제공된 FTIR 스펙트럼을 특징으로 한다.
형태 B
한 측면에서, 본 발명은 형태 B로서 특징화되는 N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드의 형태를 특징으로 한다.
일부 실시양태에서, 형태 B는 Cu K 알파 방사선을 사용하여 얻은 X선 분말 회절에서, 하기 피크 (°) 중 하나 이상의 X선 분말 회절 패턴을 특징으로 한다: 약 6.5 내지 약 6.9° (예를 들어, 약 6.7°) 피크; 약 9.8 내지 약 10.2° (예를 들어, 약 10.0°) 피크; 약 11.0 내지 약 11.4° (예를 들어, 약 11.2°) 피크; 약 13.2 내지 약 13.6° (예를 들어, 약 13.4°) 피크; 및 약 23.8 내지 약 24.2° (예를 들어, 약 24.2°) 피크.
일부 실시양태에서, 형태 B는 Cu K 알파 방사선을 사용하여 얻은 X선 분말 회절에서, 하기의 하나 이상의 피크를 특징으로 한다: 약 6.5 내지 약 6.9° (예를 들어, 약 6.7°) 피크, 약 9.2 내지 약 9.6° (예를 들어, 약 9.4°) 피크, 약 11.0 내지 약 11.4° (예를 들어, 약 11.2°) 피크, 약 13.2 내지 약 13.6° (예를 들어, 약 13.4°) 피크, 약 15.0 내지 약 15.4° (예를 들어, 약 15.2°) 피크, 약 17.0 내지 약 17.4° (예를 들어, 약 17.2°) 피크, 약 17.6 내지 약 18.0° (예를 들어, 약 17.8°) 피크, 약 17.9 내지 약 18.3° (예를 들어, 약 18.1°) 피크, 약 19.0 내지 약 19.4° (예를 들어, 약 19.2°) 피크, 약 19.9 내지 약 20.3° (예를 들어, 약 20.1°) 피크, 약 21.0 내지 약 21.5° (예를 들어, 약 21.2°) 피크, 약 21.8 내지 22.2° (예를 들어, 약 22.0°) 피크, 약 23.8 내지 약 24.2° (예를 들어, 약 24.0°) 피크, 약 26.0 내지 약 26.4° (예를 들어, 약 26.2°) 피크, 약 27.0 내지 약 27.4° (예를 들어, 약 27.2°) 피크, 약 27.5 내지 약 27.9° (예를 들어, 약 27.7°) 피크, 및 약 28.7 내지 약 29.1° (예를 들어, 약 28.9°) 피크.
일부 실시양태에서, 형태 B는 도 7에 제공된 X선 분말 회절 패턴을 특징으로 한다.
일부 실시양태에서, 형태 B는 고체 상태 13C NMR 스펙트럼에서 하기 피크 (백만분율 (ppm)) 중 하나 이상을 특징으로 한다: 약 165.1 내지 약 165.5 ppm (예를 들어, 약 165.3 ppm) 피크, 약 145.7 내지 약 146.1 ppm (약 145.9 ppm) 피크, 약 132.7 내지 약 133.1 ppm (예를 들어, 약 132.9 ppm) 피크, 및 약 113.2 내지 약 113.6 ppm (예를 들어, 약 113.4 ppm) 피크.
일부 실시양태에서, 형태 B는 고체 상태 13C NMR 스펙트럼에서 하기 피크 (백만분율 (ppm)) 중 하나 이상을 특징으로 한다: 약 175.1 내지 약 175.5 ppm (예를 들어, 약 175.3 ppm) 피크, 약 165.1 내지 약 165.5 ppm (예를 들어, 약 165.3 ppm) 피크, 약 141.2 내지 약 141.6 ppm (예를 들어, 약 141.4 ppm) 피크, 약 145.7 내지 약 146.1 ppm (예를 들어, 약 145.9 ppm) 피크, 약 132.7 내지 약 133.1 ppm (예를 들어, 약 132.9 ppm) 피크, 약 123.3 내지 약 123.7 ppm (예를 들어, 약 123.5 ppm) 피크, 약 126.6 내지 약 127.0 ppm (예를 들어, 약 126.8 ppm) 피크, 약 113.2 내지 약 113.6 ppm (예를 들어, 약 113.4 ppm) 피크, 약 117.2 내지 약 117.6 ppm (예를 들어, 약 117.4 ppm) 피크, 약 58.1 내지 약 58.5 ppm (예를 들어, 약 58.3 ppm) 피크, 약 26.7 내지 약 27.1 ppm (예를 들어, 약 26.9 ppm) 피크, 및 약 29.o0 내지 약 29.4 ppm (예를 들어, 약 29.2 ppm) 피크.
일부 실시양태에서, 형태 B는 도 11에 도시된 고체 상태 13C NMR 스펙트럼을 특징으로 한다.
일부 실시양태에서, 형태 B는 고체 상태 19F NMR 스펙트럼에서 하기 피크 (백만분율 (ppm)) 중 하나 이상을 특징으로 한다: 약 -55.9 내지 약 -56.3 ppm (예를 들어, 약 -56.1 ppm) 피크, 및 약 -61.9 내지 약 -62.3 ppm (예를 들어, 약 -62.1 ppm) 피크.
일부 실시양태에서, 형태 B는 도 12에 도시된 고체 상태 19F NMR 스펙트럼을 특징으로 한다.
또 다른 실시양태에서, 본 발명은 단사 결정계, P21/c 공간군, 및 하기 단위 셀 치수를 갖는, 형태 B의 N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드의 결정을 특징으로 한다: a = 13.5429(4) Å, b = 13.4557(4) Å, c = 12.0592(4) Å, α = 90°, β = 101.193° 및 γ = 90°.
한 실시양태에서, 본 발명은 단사 결정계, P21/c 공간군, 및 하기 단위 셀 치수를 갖는, 형태 B의 N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드의 결정을 제공한다: a = 13.5429(4) Å, b = 13.4557(4) Å, c = 12.0592(4) Å.
또 다른 실시양태에서, 형태 B는 도 10에 제공된 FTIR 스펙트럼을 특징으로 한다.
형태 B-HCl
한 측면에서, 본 발명은 형태 B-HCl로서 특징화되는 N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드의 형태를 특징으로 한다.
일부 실시양태에서, 형태 B-HCl은 Cu K 알파 방사선을 사용하여 얻은 X선 분말 회절에서, 하기 피크 (°) 중 하나 이상의 X선 분말 회절 패턴을 특징으로 한다: 약 8.1 내지 약 8.5° (예를 들어, 약 8.3°) 피크; 약 8.8 내지 약 9.2° (예를 들어, 약 9.0°) 피크; 약 12.8 내지 약 13.2° (예를 들어, 약 13.0°) 피크; 약 17.8 내지 약 18.2° (예를 들어, 약 18.0°) 피크; 및 약 22.8 내지 약 23.2° (예를 들어, 약 23.0°) 피크.
일부 실시양태에서, 형태 B-HCl은 Cu K 알파 방사선을 사용하여 얻은 X선 분말 회절에서, 하기 피크 (°) 중 하나 이상의 X선 분말 회절 패턴을 특징으로 한다: 약 8.1 내지 약 8.5° (예를 들어, 약 8.3°) 피크; 약 14.6 내지 약 15.1° (예를 들어, 약 14.8°) 피크; 약 16.5 내지 약 16.9° (예를 들어, 약 16.7°) 피크; 약 17.6 내지 약 18.4°에서의 3개의 피크 (예를 들어, 약 17.8°, 약 18.0° 및 약 18.2°); 약 21.4 내지 약 22.1°에서의 2개의 피크 (예를 들어, 약 21.7° 및 약 22.0°); 약 22.8 내지 약 23.8°에서의 2개의 피크 (예를 들어, 약 23.0° 및 약 23.6° 피크); 약 24.7 내지 약 25.4°에서의 2개의 피크 (예를 들어, 약 24.9° 및 약 25.2°); 약 26.9 내지 약 27.3° (예를 들어, 약 27.1°) 피크; 약 30.9 내지 약 31.3° (예를 들어, 약 31.1°) 피크; 및 약 38.2 내지 약 38.7° (예를 들어, 약 38.5°) 피크.
일부 실시양태에서, 형태 B-HCl은 Cu K 알파 방사선을 사용하여 얻은 X선 분말 회절에서, 하기 피크 (°) 중 하나 이상의 X선 분말 회절 패턴을 특징으로 한다: 약 8.1 내지 약 8.5° (예를 들어, 약 8.3°) 피크; 약 13.8 내지 약 14.3° (예를 들어, 약 14.1°) 피크; 약 14.6 내지 약 15.5°에서의 2개의 피크 (예를 들어, 약 14.8° 및 약 15.2°); 약 16.5 내지 약 16.9° (예를 들어, 약 16.7°) 피크; 약 17.6 내지 약 18.4°에서의 3개의 피크 (예를 들어, 약 17.8°, 약 18.0° 및 약 18.2°); 약 19.1 내지 약 19.7°에서의 2개의 피크 (예를 들어, 약 19.3° 및 약 19.5°); 약 21.4 내지 약 22.1°에서의 2개의 피크 (예를 들어, 약 21.7° 및 약 22.0°); 약 22.8 내지 약 23.8°에서의 2개의 피크 (예를 들어, 약 23.0° 및 약 23.6° 피크); 약 24.5 내지 약 25.9°에서의 4개의 피크 (예를 들어, 약 24.7°, 약 24.9°, 약 25.2° 및 약 25.7°); 약 26.9 내지 약 27.3° (예를 들어, 약 27.1°) 피크; 약 27.7 내지 약 28.3°에서의 2개의 피크 (예를 들어, 약 27.9° 및 약 28.1°); 약 29.5 내지 약 30.0°에서의 2개의 피크 (예를 들어, 약 29.7° 및 약 29.8°); 약 29.5 내지 약 30.0°에서의 2개의 피크 (예를 들어, 약 29.7° 및 약 29.8°); 약 30.9 내지 약 31.3° (예를 들어, 약 31.1°) 피크; 약 32.1 내지 약 32.5° (예를 들어, 약 32.3°) 피크; 약 33.2 내지 약 34.1°에서의 3개의 피크 (예를 들어, 약 33.4°, 약 33.8° 및 약 33.9°); 약 35.0 내지 약 35.4° (예를 들어, 약 35.2°) 피크; 약 36.0 내지 약 36.4° (예를 들어, 약 36.2°) 피크; 및 약 38.3 내지 약 40.1°에서의 3개의 피크 (예를 들어, 약 38.5°, 약 38.6° 및 약 39.9°).
일부 실시양태에서, 형태 B-HCl은 도 13에 제공된 X선 분말 회절 패턴을 특징으로 한다.
일부 실시양태에서, 형태 B-HCl은 고체 상태 13C NMR 스펙트럼에서 하기 피크 (백만분율 (ppm)) 중 하나 이상을 특징으로 한다: 약 168.0 내지 약 168.4 ppm (예를 들어, 약 168.2 ppm) 피크, 약 148.5 내지 약 148.9 ppm (예를 들어, 약 148.7 ppm) 피크, 약 138.6 내지 약 139.0 ppm (예를 들어, 약 138.8 ppm) 피크, 약 119.6 내지 약 120.0 ppm (예를 들어, 약 119.8 ppm) 피크, 및 약 23.7 내지 약 24.1 ppm (예를 들어, 약 23.9 ppm) 피크.
일부 실시양태에서, 형태 B-HCl은 고체 상태 13C NMR 스펙트럼에서 하기 피크 (백만분율 (ppm)) 중 하나 이상을 특징으로 한다: 약 176.1 내지 약 176.5 ppm (예를 들어, 약 176.3 ppm) 피크, 약 168.0 내지 약 168.4 ppm (예를 들어, 약 168.2 ppm) 피크, 약 148.5 내지 약 148.9 ppm (예를 들어, 약 148.7 ppm) 피크, 약 143.0 내지 약 143.4 ppm (예를 들어, 약 143.2 ppm) 피크, 약 138.6 내지 약 139.0 ppm (예를 들어, 약 138.8 ppm) 피크, 약 119 내지 약 134 ppm에서의 7개의 피크 (예를 들어, 약 131.6 ppm, 약 129.6 ppm, 약 129.1 ppm, 약 126.7 ppm, 약 125.8 ppm, 약 122.7 ppm 및 약 119.8 ppm), 약 112.1 내지 약 112.5 ppm (예를 들어, 약 112.3 ppm) 피크, 약 68.8 내지 약 69.2 ppm (예를 들어, 약 69.0 ppm) 피크, 약 66.7 내지 약 67.1 ppm (예를 들어, 약 66.9 ppm) 피크, 약 28.1 내지 약 28.5 ppm (예를 들어, 약 28.3 ppm) 피크, 및 약 23.7 내지 약 24.1 ppm (예를 들어, 약 23.9 ppm) 피크.
일부 실시양태에서, 형태 B-HCl은 도 17에 도시된 고체 상태 13C NMR 스펙트럼을 특징으로 한다.
일부 실시양태에서, 형태 B-HCl은 고체 상태 19F NMR 스펙트럼에서 하기 피크 (백만분율 (ppm)) 중 하나 이상을 특징으로 한다: 약 -55.4 내지 약 -55.8 ppm (예를 들어, 약 -55.6 ppm) 피크, 및 약 -61.8 내지 약 -62.2 ppm (예를 들어, 약 -62.0 ppm) 피크.
일부 실시양태에서, 형태 B-HCl은 도 18에 도시된 고체 상태 19F NMR 스펙트럼을 특징으로 한다.
또 다른 실시양태에서, 형태 B-HCl은 도 16에 제공된 FTIR 스펙트럼을 특징으로 한다.
한 측면에서, 본 발명은 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들의 임의의 조합, 및 제약상 허용되는 아주반트 또는 담체를 포함하는 제약 조성물을 특징으로 한다.
한 측면에서, 본 발명은 유효량의 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들의 임의의 조합을 인간에게 투여하는 것을 포함하는, 인간에서의 CFTR 매개 질환의 치료 방법을 특징으로 한다.
일부 실시양태에서, 상기 방법은 추가의 치료제를 투여하는 것을 포함한다.
일부 실시양태에서, 상기 질환은 낭성 섬유증, 췌장염, 부비동염, 유전성 폐기종, 유전성 혈색소침착증, 응고-섬유소용해 결핍, 예컨대 단백질 C 결핍, 제1형 유전성 혈관부종, 지질 프로세싱 결핍, 예컨대 가족성 고콜레스테롤혈증, 제1형 킬로미크론혈증, 무베타지단백혈증, 리소솜 축적 질환, 예컨대 I 세포병/가성-후를러병, 점액다당류증, 샌드호프/테이-삭스병, 제II형 크리글러-나자르병, 다발성내분비병증/고인슐린혈증, 당뇨병, 라론 왜소증, 미엘로퍼옥시다제 결핍, 원발성 부갑상선기능저하증, 흑색종, 제1형 글리카노시스 CDG, 유전성 폐기종, 선천성 갑상선기능항진증, 골형성 부전, 유전성 저섬유소원혈증, ACT 결핍, 요붕증 (DI), 신경성 DI, 신성 DI, 샤르코-마리 투스 증후군, 펠리체우스-메르츠바허병, 신경변성 질환, 예컨대 알츠하이머병, 파킨슨병, 근위축성 측삭 경화증, 진행성 핵상 마비, 픽병, 여러 폴리글루타민 신경계 장애, 예컨대 헌팅톤병, 제I형 척수소뇌성 운동실조, 척수 및 연수 근육 위축, 치상핵적핵 담창구시상하핵 질환 및 근긴장성 이영양증 뿐만 아니라, 해면상 뇌병증, 예컨대 유전성 크로이츠펠트-야콥병, 파브리병, 스트라우슬러-샤잉커 증후군, COPD, 안구건조증, 췌장 기능부전, 골다공증, 골감소증, 고램 증후군, 클로라이드 채널병증, 선천성 근긴장증 (톰슨 및 베커 형태), 제III형 바터 증후군, 덴트병, 과도놀람증, 간질, 과도놀람증, 리소솜 축적 질환, 안젤만 증후군, 원발성 섬모 운동이상증 (PCD), 내장역위증 동반 PCD (카르타게너 증후군이라고도 알려짐), 내장역위증 비동반 PCD 및 섬모 무형성, 및 쇼그렌병으로부터 선택된다.
한 실시양태에서, 본 발명은 유효량의 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들의 임의의 조합을 인간에게 투여하는 것을 포함하는, 상기 인간에서의 낭성 섬유증의 치료 방법을 제공한다.
한 측면에서, 본 발명은 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들 형태의 임의의 조합, 및 제약상 허용되는 담체를 포함하는 제약학적 팩 또는 키트를 특징으로 한다.
본 발명의 다른 측면
용도, 제제 및 투여
제약상 허용되는 조성물
본 발명의 한 측면에서, 제약상 허용되는 조성물이 제공되며, 상기 조성물은 본원에 기재된 형태 A-HCl, 형태 B 또는 형태 B-HCl을 포함하고, 임의로 제약상 허용되는 담체, 아주반트 또는 비히클을 포함한다. 특정 실시양태에서, 이들 조성물은 임의로 1종 이상의 추가의 치료제를 더 포함한다.
상기 기재된 바와 같이, 본 발명의 제약상 허용되는 조성물은 제약상 허용되는 담체, 아주반트 또는 비히클을 추가로 포함하며, 본원에서 사용되는 이들은 목적하는 특정한 투여 형태에 적합한, 임의의 및 모든 용매, 희석제, 또는 기타 액체 비히클, 분산 또는 현탁 보조제, 표면 활성제, 등장화제, 증점제 또는 유화제, 보존제, 고체 결합제, 윤활제 등을 포함한다. 문헌 [Remington's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980)]에 제약상 허용되는 조성물을 제제화하는데 사용되는 다양한 담체 및 그의 공지된 제조 기법이 개시되어 있다. 임의의 통상적인 담체 매질이, 예를 들어 임의의 바람직하지 않은 생물학적 효과를 일으키거나 또는 제약상 허용되는 조성물의 임의의 다른 성분(들)과 해로운 방식으로 상호작용함으로써, 본 발명의 화합물과 상용가능하지 않는 경우를 제외하면, 그의 사용은 본 발명의 범주내에 포함되는 것으로 고려된다. 제약상 허용되는 담체로서 사용될 수 있는 물질의 일부 예로는 이온 교환체, 알루미나, 알루미늄 스테아레이트, 레시틴, 혈청 단백질, 예컨대 인간 혈청 알부민, 완충 물질, 예컨대 인산염, 글리신, 소르브산 또는 칼륨 소르베이트, 포화 식물성 지방산의 부분 글리세리드 혼합물, 물, 염 또는 전해질, 예컨대 프로타민 술페이트, 인산수소이나트륨, 인산수소칼륨, 염화나트륨, 아연염, 콜로이드성 실리카, 마그네슘 트리실리케이트, 폴리비닐 피롤리돈, 폴리아크릴레이트, 왁스, 폴리에틸렌-폴리옥시프로필렌 블록 중합체, 양모 지방, 당, 예컨대 락토스, 글루코스 및 수크로스; 전분, 예컨대 옥수수 전분 및 감자 전분; 셀룰로스 및 그의 유도체, 예컨대 나트륨 카르복시메틸 셀룰로스, 에틸 셀룰로스 및 셀룰로스 아세테이트; 분말화 트라가칸트; 맥아; 젤라틴; 활석; 부형제, 예컨대 코코아 버터 및 좌제 왁스; 오일, 예컨대 낙화생유, 면실유, 홍화유, 참깨유, 올리브유, 옥수수유 및 대두유; 글리콜, 예컨대 프로필렌 글리콜 또는 폴리에틸렌 글리콜; 에스테르, 예컨대 에틸 올레에이트 및 에틸 라우레이트; 한천; 완충제, 예컨대 수산화마그네슘 및 수산화알루미늄; 알긴산; 발열원 무함유 물; 등장성 식염수; 링거액; 에틸 알콜 및 인산염 완충 용액 뿐만 아니라, 기타 비독성 상용성 윤활제, 예컨대 나트륨 라우릴 술페이트 및 마그네슘 스테아레이트가 포함되나, 이들로 제한되지는 않으며, 또한 착색제, 이형제, 코팅제, 감미제, 향미제 및 향료, 보존제 및 산화방지제도 제조자의 판단에 따라 조성물 중에 존재할 수 있다.
화합물 및 제약상 허용되는 조성물의 용도
또 다른 측면에서, 본 발명은 CFTR 돌연변이가 원인인 것으로 생각되는 상태, 질환 또는 장애를 치료하거나 또는 이들의 중증도를 감소시키는 방법을 제공한다. 특정 실시양태에서, 본 발명은 CFTR 활성의 결핍이 원인인 것으로 생각되는 상태, 질환 또는 장애의 치료를 필요로 하는 대상체, 바람직하게는 포유동물에 본원에 기재된 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들 형태의 임의의 조합을 포함하는 조성물을 투여하는 것을 포함하는, CFTR 활성의 결핍이 원인인 것으로 생각되는 상태, 질환 또는 장애의 치료 방법을 제공한다.
특정 실시양태에서, 본 발명은 CFTR을 코딩하는 유전자에서의 돌연변이 또는 환경 인자 (예를 들어, 흡연)로 인한 CFTR 기능 감소와 관련있는 질환의 치료 방법을 제공한다. 이들 질환에는 낭성 섬유증, 천식, 흡연 유발 COPD, 만성 기관지염, 비부비동염, 변비, 췌장염, 췌장 기능부전, 선천성 양측 정관 결손증 (CBAVD)에 의해 유발되는 남성 불임증, 경증 폐 질환, 특발성 췌장염, 알레르기성 기관지폐 아스페르길루스증 (ABPA), 간 질환, 유전성 폐기종, 유전성 혈색소침착증, 응고-섬유소용해 결핍, 예컨대 단백질 C 결핍, 제1형 유전성 혈관부종, 지질 프로세싱 결핍, 예컨대 가족성 고콜레스테롤혈증, 제1형 킬로미크론혈증, 무베타지단백혈증, 리소솜 축적 질환, 예컨대 I 세포병/가성-후를러병, 점액다당류증, 샌드호프/테이-삭스병, 제II형 크리글러-나자르병, 다발성내분비병증/고인슐린혈증, 당뇨병, 라론 왜소증, 미엘로퍼옥시다제 결핍, 원발성 부갑상선기능저하증, 흑색종, 제1형 글리카노시스 CDG, 선천성 갑상선기능항진증, 골형성 부전, 유전성 저섬유소원혈증, ACT 결핍, 요붕증 (DI), 신경성 DI, 신성 DI, 샤르코-마리 투스 증후군, 펠리체우스-메르츠바허병, 신경변성 질환, 예컨대 알츠하이머병, 파킨슨병, 근위축성 측삭 경화증, 진행성 핵상 마비, 픽병, 여러 폴리글루타민 신경계 장애, 예컨대 헌팅톤병, 제I형 척수소뇌성 운동실조, 척수 및 연수 근육 위축, 치상핵적핵 담창구시상하핵 질환 및 근긴장성 이영양증 뿐만 아니라, 해면상 뇌병증, 예컨대 유전성 크로이츠펠트-야콥병 (프리온 단백질 프로세싱 결함으로 인한 것), 파브리병, 스트라우슬러-샤잉커 증후군, COPD, 안구건조증, 또는 쇼그렌병, 골다공증, 골감소증, 골 치유 및 골 성장 (예를 들어, 골 복구, 골 재생, 골 재흡수 감소 및 골 침착 증가), 고램 증후군, 클로라이드 채널병증, 예컨대 선천성 근긴장증 (톰슨 및 베커 형태), 제III형 바터 증후군, 덴트병, 과도놀람증, 간질, 과도놀람증, 리소솜 축적 질환, 안젤만 증후군, 및 원발성 섬모 운동이상증 (PCD) [내장역위증 동반 PCD (카르타게너 증후군이라고도 알려짐), 내장역위증 비동반 PCD 및 섬모 무형성을 비롯한, 섬모의 구조 및/또는 기능의 유전성 장애에 대한 용어]이 포함된다.
일부 실시양태에서, 본 발명의 방법은 본원에서 한정된 조성물 중 하나를 환자에게 투여하는 것을 포함하는, 상기 환자에서의 낭성 섬유증을 치료하거나 또는 그의 중증도를 감소시키는 것을 포함한다. 특정 실시양태에서, 환자는 인간 CFTR의 돌연변이 형태를 갖는다. 다른 실시양태에서, 환자는 인간 CFTR의 다음 돌연변이 ΔF508, R117H 및 G551D 중 하나 이상을 갖는다. 한 실시양태에서, 본 발명의 방법은 인간 CFTR의 ΔF508 돌연변이를 갖는 환자에게 본원에서 한정된 조성물 중 하나를 투여하는 것을 포함하는, 상기 환자에서의 낭성 섬유증을 치료하거나 또는 그의 중증도를 감소시키는 것을 포함한다. 한 실시양태에서, 본 발명의 방법은 인간 CFTR의 G551D 돌연변이를 갖는 환자에게 본원에서 한정된 조성물 중 하나를 투여하는 것을 포함하는, 상기 환자에서의 낭성 섬유증을 치료하거나 또는 그의 중증도를 감소시키는 것을 포함한다. 한 실시양태에서, 본 발명의 방법은 적어도 하나의 대립유전자에서의 인간 CFTR의 ΔF508 돌연변이를 갖는 환자에게 본원에서 한정된 조성물 중 하나를 투여하는 것을 포함하는, 상기 환자에서의 낭성 섬유증을 치료하거나 또는 그의 중증도를 감소시키는 것을 포함한다. 한 실시양태에서, 본 발명의 방법은 두 대립유전자 모두에서의 인간 CFTR의 ΔF508 돌연변이를 갖는 환자에게 본원에서 한정된 조성물 중 하나를 투여하는 것을 포함하는, 상기 환자에서의 낭성 섬유증을 치료하거나 또는 그의 중증도를 감소시키는 것을 포함한다. 한 실시양태에서, 본 발명의 방법은 적어도 하나의 대립유전자에서의 인간 CFTR의 G551D 돌연변이를 갖는 환자에게 본원에서 한정된 조성물 중 하나를 투여하는 것을 포함하는, 상기 환자에서의 낭성 섬유증을 치료하거나 또는 그의 중증도를 감소시키는 것을 포함한다. 한 실시양태에서, 본 발명의 방법은 두 대립유전자 모두에서의 인간 CFTR의 G551D 돌연변이를 갖는 환자에게 본원에서 한정된 조성물 중 하나를 투여하는 것을 포함하는, 상기 환자에서의 낭성 섬유증을 치료하거나 또는 그의 중증도를 감소시키는 것을 포함한다.
일부 실시양태에서, 본 발명의 방법은 환자에게 본원에서 한정된 조성물 중 하나를 투여하는 것을 포함하는, 상기 환자에서의 낭성 섬유증의 중증도를 감소시키는 것을 포함한다. 특정 실시양태에서, 환자는 인간 CFTR의 돌연변이 형태를 갖는다. 다른 실시양태에서, 환자는 인간 CFTR의 다음 돌연변이 ΔF508, R117H 및 G551D 중 하나 이상을 갖는다. 한 실시양태에서, 본 발명의 방법은 인간 CFTR의 ΔF508 돌연변이를 갖는 환자에게 본원에서 한정된 조성물 중 하나를 투여하는 것을 포함하는, 상기 환자에서의 낭성 섬유증의 중증도를 감소시키는 것을 포함한다. 한 실시양태에서, 본 발명의 방법은 인간 CFTR의 G551D 돌연변이를 갖는 환자에게 본원에서 한정된 조성물 중 하나를 투여하는 것을 포함하는, 상기 환자에서의 낭성 섬유증의 중증도를 감소시키는 것을 포함한다. 한 실시양태에서, 본 발명의 방법은 적어도 하나의 대립유전자에서의 인간 CFTR의 ΔF508 돌연변이를 갖는 환자에게 본원에서 한정된 조성물 중 하나를 투여하는 것을 포함하는, 상기 환자에서의 낭성 섬유증의 중증도를 감소시키는 것을 포함한다. 한 실시양태에서, 본 발명의 방법은 두 대립유전자 모두에서의 인간 CFTR의 ΔF508 돌연변이를 갖는 환자에게 본원에서 한정된 조성물 중 하나를 투여하는 것을 포함하는, 상기 환자에서의 낭성 섬유증의 중증도를 감소시키는 것을 포함한다. 한 실시양태에서, 본 발명의 방법은 적어도 하나의 대립유전자에서의 인간 CFTR의 G551D 돌연변이를 갖는 환자에게 본원에서 한정된 조성물 중 하나를 투여하는 것을 포함하는, 상기 환자에서의 낭성 섬유증의 중증도를 감소시키는 것을 포함한다. 한 실시양태에서, 본 발명의 방법은 두 대립유전자 모두에서의 인간 CFTR의 G551D 돌연변이를 갖는 환자에게 본원에서 한정된 조성물 중 하나를 투여하는 것을 포함하는, 상기 환자에서의 낭성 섬유증의 중증도를 감소시키는 것을 포함한다.
일부 측면에서, 본 발명은 환자에게 본원에 기재된 화합물 I을 투여하는 것을 포함하는, 상기 환자에서의 골다공증을 치료하거나 또는 그의 중증도를 감소시키는 방법을 제공한다.
특정 실시양태에서, 환자에서 골다공증을 치료하거나 또는 그의 중증도를 감소시키는 방법은 상기 환자에게 본원에 기재된 제약 조성물을 투여하는 것을 포함한다.
일부 측면에서, 본 발명은 환자에게 본원에 기재된 화합물 I을 투여하는 것을 포함하는, 상기 환자에서의 골감소증을 치료하거나 또는 그의 중증도를 감소시키는 방법을 제공한다.
특정 실시양태에서, 환자에서 골감소증을 치료하거나 또는 그의 중증도를 감소시키는 방법은 상기 환자에게 본원에 기재된 제약 조성물을 투여하는 것을 포함한다.
일부 측면에서, 본 발명은 환자에게 본원에 기재된 화합물 I을 투여하는 것을 포함하는, 상기 환자에서의 골 치유 및/또는 골 복구 방법을 제공한다.
특정 실시양태에서, 환자에서의 골 치유 및/또는 골 복구 방법은 상기 환자에게 본원에 기재된 제약 조성물을 투여하는 것을 포함한다.
일부 측면에서, 본 발명은 환자에게 본원에 기재된 화합물 I을 투여하는 것을 포함하는, 상기 환자에서의 골 재흡수 감소 방법을 제공한다.
특정 실시양태에서, 환자에서의 골 재흡수 감소 방법은 상기 환자에게 본원에 기재된 제약 조성물을 투여하는 것을 포함한다.
일부 측면에서, 본 발명은 환자에게 본원에 기재된 화합물 I을 투여하는 것을 포함하는, 상기 환자에서의 골 침착 증가 방법을 제공한다.
특정 실시양태에서, 환자에서의 골 침착 증가 방법은 상기 환자에게 본원에 기재된 제약 조성물을 투여하는 것을 포함한다.
일부 측면에서, 본 발명은 환자에게 본원에 기재된 화합물 I을 투여하는 것을 포함하는, 상기 환자에서의 COPD를 치료하거나 또는 그의 중증도를 감소시키는 방법을 제공한다.
특정 실시양태에서, 환자에서의 COPD를 치료하거나 또는 그의 중증도를 감소시키는 방법은 상기 환자에게 본원에 기재된 제약 조성물을 투여하는 것을 포함한다.
일부 측면에서, 본 발명은 환자에게 본원에 기재된 화합물 I을 투여하는 것을 포함하는, 상기 환자에서의 흡연 유발 COPD를 치료하거나 또는 그의 중증도를 감소시키는 방법을 제공한다.
특정 실시양태에서, 환자에서의 흡연 유발 COPD를 치료하거나 또는 그의 중증도를 감소시키는 방법은 상기 환자에게 본원에 기재된 제약 조성물을 투여하는 것을 포함한다.
일부 측면에서, 본 발명은 환자에게 본원에 기재된 화합물 I을 투여하는 것을 포함하는, 상기 환자에서의 만성 기관지염을 치료하거나 또는 그의 중증도를 감소시키는 방법을 제공한다.
특정 실시양태에서, 환자에서의 만성 기관지염을 치료하거나 또는 그의 중증도를 감소시키는 방법은 상기 환자에게 본원에 기재된 제약 조성물을 투여하는 것을 포함한다.
특정 실시양태에서, 본 발명은 정상적인 CFTR 기능과 관련있는 질환의 치료 방법을 제공한다. 이들 질환에는 만성 폐쇄성 폐 질환 (COPD), 만성 기관지염, 재발성 기관지염, 급성 기관지염, 비부비동염, 변비, 췌장염, 예를 들어 만성 췌장염, 재발성 췌장염 및 급성 췌장염, 췌장 기능부전, 선천성 양측 정관 결손증 (CBAVD)에 의해 유발되는 남성 불임증, 경증 폐 질환, 특발성 췌장염, 간 질환, 유전성 폐기종, 담석, 위식도 역류 질환, 위장 악성종양, 염증성 장 질환, 변비, 당뇨병, 관절염, 골다공증 및 골감소증이 포함된다.
특정 실시양태에서, 본 발명은 본원에 기재된 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들 형태의 임의의 조합의 유효량을 포유동물에 투여하는 단계를 포함하는, 유전성 혈색소침착증, 응고-섬유소용해 결핍, 예컨대 단백질 C 결핍, 제1형 유전성 혈관부종, 지질 프로세싱 결핍, 예컨대 가족성 고콜레스테롤혈증, 제1형 킬로미크론혈증, 무베타지단백혈증, 리소솜 축적 질환, 예컨대 I 세포병/가성-후를러병, 점액다당류증, 샌드호프/테이-삭스병, 제II형 크리글러-나자르병, 다발성내분비병증/고인슐린혈증, 당뇨병, 라론 왜소증, 미엘로퍼옥시다제 결핍, 원발성 부갑상선기능저하증, 흑색종, 제1형 글리카노시스 CDG, 선천성 갑상선기능항진증, 골형성 부전, 유전성 저섬유소원혈증, ACT 결핍, 요붕증 (DI), 신경성 DI, 신성 DI, 샤르코-마리 투스 증후군, 펠리체우스-메르츠바허병, 신경변성 질환, 예컨대 알츠하이머병, 파킨슨병, 근위축성 측삭 경화증, 진행성 핵상 마비, 픽병, 여러 폴리글루타민 신경계 장애, 예컨대 헌팅톤병, 제I형 척수소뇌성 운동실조, 척수 및 연수 근육 위축, 치상핵적핵 담창구시상하핵 질환 및 근긴장성 이영양증 뿐만 아니라, 해면상 뇌병증, 예컨대 유전성 크로이츠펠트-야콥병 (프리온 단백질 프로세싱 결함으로 인한 것), 파브리병, 스트라우슬러-샤잉커 증후군, 고램 증후군, 클로라이드 채널병증, 선천성 근긴장증 (톰슨 및 베커 형태), 제III형 바터 증후군, 덴트병, 과도놀람증, 간질, 과도놀람증, 리소솜 축적 질환, 안젤만 증후군, 원발성 섬모 운동이상증 (PCD), 내장역위증 동반 PCD (카르타게너 증후군이라고도 알려짐), 내장역위증 비동반 PCD 및 섬모 무형성, 또는 쇼그렌병을 비롯한 정상적인 CFTR 기능과 관련있는 질환의 치료 방법을 제공한다.
대안의 바람직한 실시양태에 따라서, 본 발명은 본원에 기재된 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들 형태의 임의의 조합을 포함하는 조성물의 유효량을 포유동물에 투여하는 단계를 포함하는, 낭성 섬유증의 치료 방법을 제공한다.
본 발명에 따르면, 형태 A-HCl, 형태 B, 형태 B-HCl, 이들 형태의 임의의 조합, 또는 이들의 제약상 허용되는 조성물의 "유효량"은 상기 인용된 질환, 장애 또는 상태 중 하나 이상을 치료하거나 또는 이들의 중증도를 감소시키는데 효과적인 양이다.
형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들 형태의 임의의 조합, 또는 이들의 제약상 허용되는 조성물은 상기 인용된 질환, 장애 또는 상태 중 하나 이상을 치료하거나 또는 이들의 중증도를 감소시키는데 효과적인 임의의 양 및 임의의 투여 경로를 사용하여 투여할 수 있다.
특정 실시양태에서, 형태 A-HCl, 형태 B, 형태 B-HCl, 이들 형태의 임의의 조합, 또는 이들의 제약상 허용되는 조성물은 호흡기 및 비호흡기 상피의 첨단막(apical membrane)에서의 잔여 CFTR 활성을 나타내는 환자에서 낭성 섬유증을 치료하거나 또는 그의 중증도를 감소시키는데 유용하다. 상피 표면에 잔여 CFTR 활성의 존재는 당업계에 공지된 방법, 예를 들어 표준 전기생리학적, 생화학적 또는 조직화학적 기법을 사용하여 용이하게 검출할 수 있다. 이러한 방법은 생체내 또는 생체외 전기생리학적 기법, 땀 또는 타액의 Cl- 농도 측정, 또는 세포 표면 밀도를 모니터링하기 위한 생체외 생화학적 또는 조직화학적 기법을 사용하여 CFTR 활성을 확인한다. 이러한 방법을 사용하여, 잔여 CFTR 활성을 가장 일반적인 돌연변이인 ΔF508에 대하여 동형접합적 또는 이형접합적인 환자를 비롯하여, 여러 다양한 돌연변이에 대하여 이형접합적 또는 동형접합적인 환자에서 용이하게 검출할 수 있다.
또 다른 실시양태에서, 본원에 기재된 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들 형태의 임의의 조합, 또는 이들의 제약상 허용되는 조성물은 약리학적 방법 또는 유전자 요법을 사용하여 유도되거나 또는 증강된 잔여 CFTR 활성을 갖는 환자에서 낭성 섬유증을 치료하거나 또는 그의 중증도를 감소시키는데 유용하다. 이러한 방법은 세포 표면에 존재하는 CFTR의 양을 증가시킴으로써, 환자에게 이전에는 존재하지 않았던 CFTR 활성을 유도하거나 또는 환자에서의 잔여 CFTR 활성의 원래 수준을 증강시킨다.
한 실시양태에서, 본원에 기재된 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들 형태의 임의의 조합, 또는 이들의 제약상 허용되는 조성물은 잔여 CFTR 활성을 나타내는 특정한 유전자형, 예를 들어 제III 부류 돌연변이 (불완전한 조절 또는 게이팅), 제IV 부류 돌연변이 (전도도 변경) 또는 제V 부류 돌연변이 (합성 감소)를 갖는 환자에서 낭성 섬유증을 치료하거나 또는 그의 중증도를 감소시키는데 유용하다 (문헌 [Lee R. Choo-Kang, Pamela L., Zeitlin, Type I, II, III, IV, and V cystic fibrosis Transmembrane Conductance Regulator Defects and Opportunities of Therapy; Current Opinion in Pulmonary Medicine 6:521-529, 2000]). 잔여 CFTR 활성을 나타내는 다른 환자 유전자형은 상기 부류 중 하나에 대하여 동형접합적인 환자 또는 제I 부류 돌연변이, 제II 부류 돌연변이 또는 비분류 돌연변이를 비롯한, 임의의 다른 부류의 돌연변이를 갖는 이형접합적인 환자를 포함한다.
한 실시양태에서, 본원에 기재된 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들 형태의 임의의 조합, 또는 이들의 제약상 허용되는 조성물은, 통상적으로 상피의 첨단막에서의 잔여 CFTR 활성도와 상관관계가 있는 특정한 임상학적 표현형, 예를 들어 중등도 내지 경도의 임상학적 표현형을 갖는 환자에서 낭성 섬유증을 치료하거나 또는 그의 중증도를 감소시키는데 유용하다. 이러한 표현형은 췌장 기능부전 환자 또는 특발성 췌장염 및 선천성 양측 정관 결손증, 또는 경증 폐 질환을 진단받은 환자를 포함한다.
정확한 필요량은 대상체의 종, 연령 및 일반적 상태, 감염의 중증도, 특정 작용제, 그의 투여 방식 등에 따라 대상체마다 달라질 것이다. 본 발명의 화합물은 투여의 용이성 및 투여량의 균일성을 위해 투여 단위 형태로 제제화되는 것이 바람직하다. 본원에 사용된 표현 "투여 단위 형태"는 치료할 환자에게 적절한, 물리적으로 분리된 단위의 작용제를 말한다. 그러나, 본 발명의 화합물 및 조성물의 총 1일 사용량은 분별있는 의학적 판단의 범주 내에서 담당 의사가 결정할 일임을 알 것이다. 임의의 특정 환자 또는 유기체를 위한 구체적인 유효 용량 수준은 치료할 장애 및 상기 장애의 중증도; 사용되는 특정 화합물의 활성; 사용되는 특정 조성물; 환자의 연령, 체중, 일반적 건강상태, 성별 및 식단; 사용되는 특정 화합물의 투여 시간, 투여 경로 및 배출 속도; 치료 기간; 사용되는 특정 화합물과 조합되어 또는 동시에 사용되는 약물, 및 의료 업계에 널리 공지되어 있는 유사한 인자들을 비롯한 다양한 인자에 따라 달라질 것이다. 본원에 사용된 용어 "환자"는 동물, 바람직하게는 포유동물, 가장 바람직하게는 인간을 의미한다.
본 발명의 제약상 허용되는 조성물은 치료할 감염의 중증도에 따라, 경구로, 직장으로, 비경구로, 낭내로, 질내로, 복강내로, 국소적으로 (분말제, 연고, 점적제 또는 패치에 의해), 협측으로, 구강 또는 비강 분무 등으로 인간 및 다른 동물에 투여될 수 있다. 특정 실시양태에서, 본 발명의 화합물은 목적하는 치료 효과를 얻기 위해, 대상체의 체중에 대하여 1일 약 0.01 mg/kg 내지 약 50 mg/kg, 바람직하게는 약 0.5 mg/kg 내지 약 25 mg/kg의 투여량 수준으로 1일 1회 이상 경구 또는 비경구 투여될 수 있다.
경구 투여를 위한 액체 투여 형태에는 제약상 허용되는 에멀젼, 마이크로에멀젼, 용액, 현탁액, 시럽 및 엘릭시르가 포함되나, 이들로 제한되지는 않는다. 액체 투여 형태는, 활성 화합물 이외에도, 당업계에서 통상 사용되는 비활성 희석제, 예를 들어 물 또는 기타 용매, 가용화제 및 유화제, 예컨대 에틸 알콜, 이소프로필 알콜, 에틸 카르보네이트, 에틸 아세테이트, 벤질 알콜, 벤질 벤조에이트, 프로필렌 글리콜, 1,3-부틸렌 글리콜, 디메틸포름아미드, 오일 (특히, 면실유, 땅콩유, 옥수수유, 배아유, 올리브유, 피마자유 및 참깨유), 글리세롤, 테트라히드로푸르푸릴 알콜, 폴리에틸렌 글리콜 및 소르비탄의 지방산 에스테르, 및 이들의 혼합물을 함유할 수 있다. 경구 조성물은 비활성 희석제 이외에도 또한 아주반트, 예컨대 습윤제, 유화제 및 현탁화제, 감미제, 향미제 및 향료를 포함할 수 있다.
주사가능한 제제, 예를 들어 주사가능한 수성 또는 유성 멸균 현탁액은 적합한 분산제 또는 습윤제 및 현탁화제를 사용하여 공지된 기술에 따라 제제화될 수 있다. 주사가능한 멸균 제제는 또한, 예를 들어 1,3-부탄디올 중의 용액과 같이, 비독성의 비경구로 허용되는 희석제 또는 용매 중의 주사가능한 멸균 용액, 현탁액 또는 에멀젼일 수 있다. 사용가능한 허용되는 비히클 및 용매 중에는, 물, 링거액, U.S.P. 및 등장성 염화나트륨 용액이 있다. 또한, 멸균 고정유가 통상적으로 용매 또는 현탁 매질로서 사용된다. 상기 목적을 위해, 합성 모노글리세리드 또는 디글리세리드를 비롯한 임의의 순한 고정유가 사용될 수 있다. 추가로, 올레산과 같은 지방산이 주사제의 제조에 사용된다.
주사가능한 제제는, 예를 들어 박테리아-보유 필터를 통한 여과에 의해, 또는 사용 전에 멸균수 또는 다른 주사가능한 멸균 매질 중에 용해 또는 분산될 수 있는 멸균 고체 조성물 형태로 멸균제를 혼입시킴으로써 멸균될 수 있다.
본 발명의 화합물의 효과를 연장시키기 위해서, 피하 또는 근육내 주사된 화합물의 흡수를 저속화하는 것이 종종 바람직하다. 이것은 수용해도가 불량한 결정질 또는 무정형 물질의 액체 현탁액을 사용함으로써 달성될 수 있다. 이후, 화합물의 흡수 속도는 용해 속도에 따라 달라지고, 이것은 다시 결정 크기 및 결정질 형태에 따라 달라질 수 있다. 별법으로, 비경구 투여된 화합물 형태의 흡수 지연은 화합물을 오일 비히클 중에 용해 또는 현탁시킴으로써 달성된다. 주사가능한 데포 형태는 생분해성 중합체, 예컨대 폴리락티드-폴리글리콜리드 중에 화합물의 마이크로캡슐 매트릭스를 형성함으로써 제조된다. 화합물 대 중합체의 비율, 및 사용되는 특정 중합체의 특성에 따라, 화합물 방출 속도가 제어될 수 있다. 다른 생분해성 중합체의 예로는 폴리(오르토에스테르) 및 폴리(무수물)이 포함된다. 또한, 주사가능한 데포 제제는 화합물을 신체 조직과 상용성인 리포좀 또는 마이크로에멀젼 중에 포획시킴으로써 제조된다.
직장 또는 질 투여를 위한 조성물은 바람직하게는 본 발명의 화합물을 적합한 비자극성 부형제 또는 담체, 예컨대 코코아 버터, 폴리에틸렌 글리콜 또는 좌제 왁스와 혼합하여 제조할 수 있는 좌제이며, 이것은 주위 온도에서는 고체이지만 체온에서는 액체여서 직장강 또는 질강에서 용융되어 활성 화합물을 방출한다.
경구 투여를 위한 고체 투여 형태에는 캡슐, 정제, 환제, 분말제 및 과립제가 포함된다. 이러한 고체 투여 형태에서, 활성 화합물은 1종 이상의 비활성의 제약상 허용되는 부형제 또는 담체, 예컨대 시트르산나트륨 또는 인산이칼슘 및/또는 a) 충전제 또는 증량제, 예컨대 전분, 락토스, 수크로스, 글루코스, 만니톨 및 규산, b) 결합제, 예를 들어 카르복시메틸셀룰로스, 알기네이트, 젤라틴, 폴리비닐피롤리디논, 수크로스 및 아카시아, c) 보습제, 예컨대 글리세롤, d) 붕해제, 예컨대 한천-한천, 탄산칼슘, 감자 또는 타피오카 전분, 알긴산, 특정 실리케이트 및 탄산나트륨, e) 용해 지연제, 예컨대 파라핀, f) 흡수 촉진제, 예컨대 4급 암모늄 화합물, g) 습윤제, 예를 들어 세틸 알콜 및 글리세롤 모노스테아레이트, h) 흡수제, 예컨대 카올린 및 벤토나이트 점토, 및 i) 윤활제, 예컨대 활석, 칼슘 스테아레이트, 마그네슘 스테아레이트, 고체 폴리에틸렌 글리콜, 나트륨 라우릴 술페이트, 및 이들의 혼합물과 혼합된다. 캡슐, 정제 및 환제의 경우에, 투여 형태는 또한 완충제를 포함할 수 있다.
또한, 유사한 유형의 고체 조성물이 부형제, 예컨대 락토스 또는 유당 및 고분자량 폴리에틸렌 글리콜 등을 사용하여 연질 및 경질-충전 젤라틴 캡슐 중에서 충전제로서 사용될 수 있다. 정제, 당의정, 캡슐, 환제 및 과립제의 고체 투여 형태는 제약 제제화 업계에 널리 공지되어 있는 코팅물 및 쉘, 예컨대 장용 코팅물 및 다른 코팅물을 사용하여 제조될 수 있다. 이들은 임의로 유백화제를 함유할 수 있고, 또한 장관의 특정 부위에서, 임의로는 지연된 방식으로 활성 성분(들)만을 방출하거나 또는 활성 성분(들)을 우선적으로 방출하는 조성물일 수도 있다. 사용될 수 있는 포매 조성물의 예로는 중합체 물질 및 왁스가 포함된다. 또한, 유사한 유형의 고체 조성물이 부형제, 예컨대 락토스 또는 유당 및 고분자량 폴리에틸렌 글리콜 등을 사용하여 연질 및 경질-충전 젤라틴 캡슐 중에서 충전제로서 사용될 수 있다.
활성 화합물은 또한 상기한 바와 같은 1종 이상의 부형제와 함께 마이크로캡슐화된 형태일 수도 있다. 정제, 당의정, 캡슐, 환제 및 과립제의 고체 투여 형태는 제약 제제화 업계에 널리 공지되어 있는 코팅물 및 쉘, 예컨대 장용 코팅물, 방출 제어 코팅물 및 다른 코팅물을 사용하여 제조될 수 있다. 이러한 고체 투여 형태에서, 활성 화합물은 1종 이상의 비활성 희석제, 예컨대 수크로스, 락토스 또는 전분과 혼합될 수 있다. 이러한 투여 형태는 또한 통상의 관행에 따라 비활성 희석제 이외의 추가의 물질, 예를 들어 정제화 윤활제 및 기타 정제화 보조제, 예컨대 마그네슘 스테아레이트 및 미세결정질 셀룰로스를 포함할 수 있다. 캡슐, 정제 및 환제의 경우에, 투여 형태는 또한 완충제를 포함할 수 있다. 이들은 임의로 유백화제를 함유할 수 있고, 또한 장관의 특정 부위에서, 임의로는 지연된 방식으로 활성 성분(들)만을 방출하거나 또는 활성 성분(들)을 우선적으로 방출하는 조성물일 수도 있다. 사용될 수 있는 포매 조성물의 예로는 중합체 물질 및 왁스가 포함된다.
본 발명의 화합물의 국소 또는 경피 투여를 위한 투여 형태에는 연고, 페이스트, 크림, 로션, 겔, 분말제, 용액, 스프레이, 흡입제 또는 패치가 포함된다. 활성 성분은 멸균 조건하에 제약상 허용되는 담체, 및 필요에 따라 임의의 필요한 보존제 또는 완충제와 혼합된다. 안과용 제제, 점이제 및 점안제도 또한 본 발명의 범주내에 포함되는 것으로 고려된다. 추가로, 본 발명은 신체로의 화합물의 제어 전달을 제공하는 부가의 이점을 갖는 경피 패치의 사용을 고려한다. 이러한 투여 형태는 상기 화합물을 적절한 매질 중에 용해 또는 분산시킴으로써 제조된다. 피부를 통과하는 화합물의 플럭스를 증가시키기 위해 흡수 증진제를 사용할 수도 있다. 속도는 속도 제어 막을 제공하거나 또는 화합물을 중합체 매트릭스 또는 겔 중에 분산시킴으로써 제어할 수 있다.
또한, 본원에 기재된 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들의 임의의 조합, 또는 이들의 제약상 허용되는 조성물은 조합 요법에서 사용될 수 있는데, 즉 본원에 기재된 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들의 임의의 조합, 또는 이들의 제약상 허용되는 조성물은 하나 이상의 다른 목적하는 치료제 또는 의료 절차와 동시에, 그 이전에 또는 그 이후에 투여될 수 있음을 알 것이다. 조합 요법에 사용되는 요법 (치료제 또는 절차)의 특정한 조합은 목적하는 치료제 및/또는 절차의 상용가능성 및 달성할 목적하는 치료 효과를 고려할 것이다. 또한, 사용되는 요법은 동일한 장애에 대하여 목적하는 효과를 달성할 수 있거나 (예를 들어, 본 발명의 화합물은 동일한 장애의 치료에 사용되는 또 다른 작용제와 동시에 투여될 수 있음), 또는 상이한 효과 (예를 들어, 임의의 부작용의 통제)를 달성할 수 있음을 알 것이다. 본원에서 사용된 바와 같이, 특정 질환 또는 상태를 치료 또는 예방하기 위해 통상 투여되는 추가의 치료제는 "치료할 질환 또는 상태에 적절하다"고 공지되어 있다.
한 실시양태에서, 추가의 작용제는 점액용해제, 기관지확장제, 항생제, 항감염제, 항염증제, 본 발명의 화합물 이외의 CFTR 조정자 또는 영양제로부터 선택된다.
한 실시양태에서, 추가의 작용제는 항생제이다. 본원에서 유용한 예시적인 항생제에는 토브라마이신 (토브라마이신 흡입형 분말제 (TIP) 포함), 아지트로마이신, 아즈트레오남 (아즈트레오남의 에어로졸화 형태 포함), 아미카신 (그의 리포좀 제제 포함), 시프로플록사신 (흡입에 의한 투여에 적합한 그의 제제 포함), 레보플락사신 (그의 에어로졸화 제제 포함) 및 항생제 2종, 예를 들어 포스포마이신과 토브라마이신의 조합물이 포함된다.
또 다른 실시양태에서, 추가의 작용제는 점액용해제이다. 본원에서 유용한 예시적인 점액용해제에는 풀모자임(Pulmozyme)®이 포함된다.
또 다른 실시양태에서, 추가의 작용제는 기관지확장제이다. 예시적인 기관지확장제에는 알부테롤, 메타프로테네롤 술페이트, 피르부테롤 아세테이트, 살메테롤 또는 테트라불린 술페이트가 포함된다.
또 다른 실시양태에서, 추가의 작용제는 폐 기도 표면 액체를 복원시키는데 효과적이다. 이러한 작용제는 세포 내부에서의, 또한 세포 외부로의 염의 이동을 향상시켜, 폐 기도에서의 점액이 더욱 수화되어 보다 용이하게 청소되도록 한다. 예시적인 이러한 작용제에는 고장성 식염수, 데누포솔 테트라나트륨 ([[(3S,5R)-5-(4-아미노-2-옥소피리미딘-1-일)-3-히드록시옥솔란-2-일]메톡시-히드록시포스포릴][[[(2R,3S,4R,5R)-5-(2,4-디옥소피리미딘-1-일)-3,4-디히드록시옥솔란-2-일]메톡시-히드록시포스포릴]옥시-히드록시포스포릴]히드로겐 포스페이트) 또는 브론키톨 (만니톨의 흡입형 제제)이 포함된다.
또 다른 실시양태에서, 추가의 작용제는 항염증제, 즉 폐 염증을 감소시킬 수 있는 작용제이다. 본원에서 유용한 예시적인 이러한 작용제에는 이부프로펜, 도코사헥산산 (DHA), 실데나필, 흡입형 글루타티온, 피오글리타존, 히드록시클로로퀸 또는 시마바스타틴이 포함된다.
또 다른 실시양태에서, 추가의 작용제는 채널을 차단함으로써 직접적으로 또는 상피 나트륨 채널 차단제 (ENaC) 활성의 증가를 유도하는 프로테아제 (예를 들어, 세린 프로테아제, 채널 활성화 프로테아제)의 조정에 의해 간접적으로 ENaC의 활성을 감소시킨다. 이러한 작용제의 예로는 카모스타트 (트립신 유사 프로테아제 억제제), QAU145, 552-02, GS-9411, INO-4995, 에어로라이틱(Aerolytic) 및 아밀로라이드가 포함된다. 상피 나트륨 채널 차단제 (ENaC)의 활성을 감소시키는 추가의 작용제는, 예를 들어 PCT 공보 제WO2009/074575호에서 찾아볼 수 있으며, 상기 공보의 내용은 그 전문이 본원에 포함된다.
본원에 기재된 다른 질환들 중에서, CFTR 조정자, 예컨대 형태 B, 형태 B-HCl 및 형태 A-HCl과 ENaC의 활성을 감소시키는 작용제의 조합은 리들 증후군(Liddle's syndrome), 염증성 또는 알레르기성 상태, 예를 들어 낭성 섬유증, 원발성 섬모 운동이상증, 만성 기관지염, 만성 폐쇄성 폐 질환, 천식, 기도 감염증, 폐 암종, 구강건조증 및 건성 각결막염, 기도 감염증 (급성 및 만성; 바이러스성 및 박테리아성) 및 폐 암종을 치료하는데 유용하다.
또한, CFTR 조정자, 예컨대 형태 B, 형태 B-HCl 및 형태 A-HCl과 ENaC의 활성을 감소시키는 작용제의 조합은 그의 표면 상에서의 보호막 액체의 비정상적인 생리가 연관있어 보이는, 상피를 통과하는 비정상적인 체액 조절과 관련있는, 호흡기 질환 이외의 질환을 또한 포함하는 상피 나트륨 채널의 차단에 의해 매개되는 질환, 예를 들어 구강건조증 (건조 구강) 또는 건성 각결막염 (건성안)의 치료에 유용하다. 추가로, 신장에서의 상피 나트륨 채널의 차단은 이뇨를 촉진시킴으로써 혈압강하 효과를 유도하기 위해 사용될 수 있다.
천식은 내인성 (비알레르기성) 천식 및 외인성 (알레르기성) 천식, 경증 천식, 중등증 천식, 중증 천식, 기관지 천식, 운동 유도성 천식, 직업성 천식 및 박테리아 감염 이후에 유발된 천식을 포함한다. 천식의 치료는 또한 천명 증상을 보이고, 주요한 의학적 문제를 갖는 환자 카테고리로 확립되었고 현재 종종 초기 또는 초반 천식 환자로서 확인되는 "유아 천명"으로 진단받거나 또는 진단받을 가능성이 있는, 예를 들어 4세 또는 5세 미만의 대상체의 치료를 포괄하는 것으로 이해되어야 한다 (편의상 이러한 특정 천식 상태는 "유아 천명 증후군"이라 함). 천식의 치료에서 예방 효능은 증상성 발작, 예를 들어 급성 천식성 또는 기관지수축성 발작의 빈도 또는 중증도의 감소, 폐 기능의 향상 또는 기도 과민반응의 개선에 의해 입증될 것이다. 이는 또한 다른 대증 요법, 즉 증상성 발작이 발생하였을 때 이를 제한하거나 또는 중단시키기 위한 또는 그러한 효과를 목적으로 하는 요법, 예를 들어 항염증제 (예를 들어, 코르티코-스테로이드) 또는 기관지확장제를 덜 필요로 한다는 사실에 의해 입증될 수 있다. 천식에서의 예방학적 이점은, 특히 "아침에 악화되는(morning dipping)" 경향이 있는 대상체에서 분명히 드러날 수 있다. "아침에 악화되는 경향"은 천식 환자의 상당수에게 공통적이고, 예를 들어 대략 오전 4시-6시 사이, 즉 임의의 이전에 실시되었던 천식 대증 요법 이후에 보통은 상당한 시간이 지난 후의 천식 발작을 특징으로 하는, 인지된 천식 증상이다.
만성 폐쇄성 폐 질환은 만성 기관지염 또는 그와 관련있는 호흡장애, 폐기종 뿐만 아니라, 다른 약물 요법, 특히 다른 흡입형 약물 요법으로 인한 기도 과민반응의 악화를 포함한다. 일부 실시양태에서, CFTR 조정자, 예컨대 형태 B, 형태 B-HCl 및 형태 A-HCl과 ENaC의 활성을 감소시키는 작용제의 조합은, 예를 들어 급성, 아라키드성(arachidic), 카타르성(catarrhal), 크루프성(croupus), 만성 또는 프티노이드성(phthinoid) 기관지염을 비롯한 모든 유형 또는 기원의 기관지염의 치료에 유용하다.
또 다른 실시양태에서, 추가의 작용제는 형태 B, 형태 B-HCl 및 형태 A-HCl 이외의 CFTR 조정자, 즉 CFTR 활성을 조정하는 효과를 갖는 작용제이다. 예시적인 이러한 작용제에는 아탈루렌 ("PTC124®"; 3-[5-(2-플루오로페닐)-1,2,4-옥사디아졸-3-일]벤조산), 시나풀티드, 란코부티드, 데펠레스타트 (인간 재조합 호중구 엘라스타제 억제제), 코비프로스톤 (7-{(2R,4aR,5R,7aR)-2-[(3S)-1,1-디플루오로-3-메틸펜틸]-2-히드록시-6-옥소옥타히드로시클로펜타[b]피란-5-일}헵탄산), 또는 (3-(6-(1-(2,2-디플루오로벤조[d][1,3]디옥솔-5-일)시클로프로판카르복사미도)-3-메틸피리딘-2-일)벤조산이 포함된다. 또 다른 실시양태에서, 추가의 작용제는 3-(6-(1-(2,2-디플루오로벤조[d][1,3]디옥솔-5-일)시클로프로판카르복사미도)-3-메틸피리딘-2-일)벤조산이다.
또 다른 실시양태에서, 추가의 작용제는 영양제이다. 예시적인 이러한 작용제에는 판크레리파제 (췌장 효소 대체제), 예를 들어 판크레아제(Pancrease)®, 판크레아카르브(Pancreacarb)®, 울트라제(Ultrase)® 또는 크레온(Creon)®, 리프로토마제(Liprotomase)® (기존의 트리지텍(Trizytek)®), 아쿠아덱스(Aquadeks)® 또는 글루타티온 흡입제가 포함된다. 한 실시양태에서, 추가의 영양제는 판크레리파제이다.
한 실시양태에서, 추가의 작용제는 본 발명의 화합물 이외의 CFTR 조정자이다.
본 발명의 조성물에 존재하는 추가의 치료제의 양은 상기 치료제를 유일한 활성제로서 포함하는 조성물로 통상적으로 투여될 양보다 많지 않을 것이다. 바람직하게는, 본원에 개시된 조성물 중의 추가의 치료제의 양은 상기 작용제를 유일한 치료 활성제로서 포함하는 조성물에 통상적으로 존재하는 양의 약 50% 내지 100%의 범위일 것이다.
본원에 기재된 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들의 임의의 조합, 또는 이들의 제약상 허용되는 조성물은 또한 이식가능한 의료 장치, 예컨대 보철물, 인공 판막, 혈관 이식편, 스텐트 및 카테터를 코팅하기 위한 조성물에 혼입될 수도 있다. 따라서, 본 발명은 또 다른 측면에서 전반적으로 상기 기재된 바와 같고 본원에서의 부류 및 하위부류에 속하는 본 발명의 화합물, 및 이식가능한 장치의 코팅에 적합한 담체를 포함하는, 상기 이식가능한 장치를 코팅하기 위한 조성물을 포함한다. 또 다른 측면에서, 본 발명은 전반적으로 상기 기재된 바와 같고 본원에서의 부류 및 하위부류에 속하는 본 발명의 화합물, 및 이식가능한 장치의 코팅에 적합한 담체를 포함하는 조성물로 코팅된 이식가능한 장치를 포함한다. 적합한 코팅물 및 코팅된 이식가능한 장치의 일반적인 제작은 미국 특허 제6,099,562호, 제5,886,026호 및 제5,304,121호에 개시되어 있다. 코팅물은 통상적으로 생체적합성 중합체 물질, 예컨대 히드로겔 중합체, 폴리메틸디실록산, 폴리카프로락톤, 폴리에틸렌 글리콜, 폴리락트산, 에틸렌 비닐 아세테이트 및 이들의 혼합물이다. 코팅물은 임의로 플루오로실리콘, 다당류, 폴리에틸렌 글리콜, 인지질 또는 이들의 조합물의 적합한 탑코트로 추가로 피복되어 조성물에 제어 방출 특징을 부여할 수 있다.
본 발명의 또 다른 측면은 본원에 기재된 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들의 임의의 조합, 또는 이들의 제약상 허용되는 조성물을 환자에게 투여하거나 또는 생물학적 샘플과 접촉시키는 것을 포함하는, 상기 생물학적 샘플 또는 환자 (예를 들어, 시험관내 또는 생체내)에서 CFTR 활성을 조정하는 것에 관한 것이다. 본원에서 사용된 용어 "생물학적 샘플"은 비제한적으로 세포 배양물 또는 그의 추출물; 포유동물로부터 수득된 생검 물질 또는 그의 추출물; 및 혈액, 타액, 소변, 대변, 정액, 눈물, 또는 기타 체액 또는 이들의 추출물을 포함한다.
생물학적 샘플에서의 CFTR의 조정은 당업자에게 공지된 다양한 목적에 유용하다. 그러한 목적의 예로는, 생물학적 및 병리학적 현상에서의 CFTR의 연구 및 CFTR의 신규 조정자의 비교 평가가 포함되나, 이들로 제한되지는 않는다.
또 다른 실시양태에서, 음이온 채널을 본원에 기재된 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들의 임의의 조합, 또는 이들의 제약상 허용되는 조성물과 접촉시키는 단계를 포함하는, 시험관내 또는 생체내에서 상기 채널의 활성을 조정하는 방법이 제공된다. 바람직한 실시양태에서, 음이온 채널은 클로라이드 채널 또는 중탄산염 채널이다. 다른 바람직한 실시양태에서, 음이온 채널은 클로라이드 채널이다.
대안의 실시양태에 따라서, 본 발명은 세포를 본원에 기재된 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들의 임의의 조합, 또는 이들의 제약상 허용되는 조성물과 접촉시키는 단계를 포함하는, 상기 세포의 막에서 기능성 CFTR의 개수를 증가시키는 방법을 제공한다.
또 다른 바람직한 실시양태에 따라서, CFTR의 활성은 막횡단 전압 전위의 측정에 의해 측정된다. 생물학적 샘플에서 막을 교차하는 전압 전위를 측정하는 수단은 당업계에 공지된 임의의 방법, 예컨대 광학 막 전위 분석법 또는 다른 전기생리학적 방법을 이용할 수 있다.
광학 막 전위 분석법은 곤잘레즈(Gonzalez) 및 치엔(Tsien)에 의해 개시된 전압 감수성 FRET 센서 (문헌 [Gonzalez, J. E. and R. Y. Tsien (1995) "Voltage sensing by fluorescence resonance energy transfer in single cells." Biophys J 69(4): 1272-80] 및 [Gonzalez, J. E. and R. Y. Tsien (1997) "Improved indicators of cell membrane potential that use fluorescence resonance energy transfer" Chem Biol 4(4): 269-77] 참조)를 형광 변화 측정 기기, 예컨대 전압/이온 탐침 판독기 (VIPR) (문헌 [Gonzalez, J. E., K. Oades, et al., (1999) "Cell-based assays and instrumentation for screening ion-channel targets" Drug Discov Today 4(9): 431-439] 참조)와 함께 이용한다.
이러한 전압 감수성 분석법은 막 가용성의, 전압 감수성 염료인 DiSBAC2(3)과 형광성 인지질인 CC2-DMPE (원형질 막의 바깥쪽 소엽에 부착되어 있으며 FRET 공여체로서 작용함) 사이에서의 형광 공명 에너지 전이 (FRET)의 변화를 기반으로 한다. 막 전위 (Vm)의 변화는 음으로 하전된 DiSBAC2(3)이 원형질 막을 교차하여 재분포되도록 하고, 이에 따라 CC2-DMPE로부터의 에너지 전이량이 변화한다. 형광 방사의 변화는, 96웰 또는 384웰 마이크로타이터 플레이트에서 세포 기반의 스크리닝을 수행하도록 디자인된 통합된 액체 핸들러 및 형광 검출기인 VIPR™ II를 사용하여 모니터링할 수 있다.
또 다른 측면에서, 본 발명은 (i) 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들의 임의의 조합, 또는 상기 실시양태 중 어느 하나를 포함하는 조성물; 및 (ii) a) 상기 조성물을 생물학적 샘플과 접촉시키는 것 및 b) CFTR 또는 그의 단편의 활성을 측정하는 것에 대한 지침서를 포함하는, 시험관내 또는 생체내 생물학적 샘플에서 CFTR 또는 그의 단편의 활성을 측정하는데 사용하기 위한 키트를 제공한다. 한 실시양태에서, 키트는 a) 추가의 화합물을 생물학적 샘플과 접촉시키는 것; b) 상기 추가의 화합물의 존재하에서의 CFTR 또는 그의 단편의 활성을 측정하는 것; 및 c) 추가의 화합물의 존재하에서의 CFTR의 활성을 본원에 기재된 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들의 임의의 조합의 존재하에서의 CFTR의 활성과 비교하는 것에 대한 지침서를 추가로 포함한다. 한 실시양태에서, CFTR 또는 그의 단편의 활성을 비교하는 단계는 상기 CFTR 또는 그의 단편의 밀도의 척도를 제공한다. 바람직한 실시양태에서, 키트는 CFTR의 밀도를 측정하는데 사용된다.
한 측면에서, 본 발명은
트랜스-4-아미노시클로헥산올을 Boc 무수물과 접촉시켜 하기 화학식 A의 화합물을 생성하고;
화학식 A의 화합물을 메탄술폰산과 접촉시켜 하기 화학식 B의 화합물을 생성하고;
화학식 B의 화합물을 트리플루오로아세트산과 접촉시켜 하기 화학식 C의 화합물을 생성한 다음;
화학식 C의 화합물을 수산화물과 접촉시켜 하기 화학식 9a의 화합물을 생성하는 것을 포함하는, 화학식 9a의 화합물 또는 그의 제약상 허용되는 염의 제조 방법을 포함한다.
또 다른 실시양태에서, 상기 방법은 화학식 9a의 화합물을 염산과 접촉시켜 하기 화학식 9의 화합물을 제조하는 것을 추가로 포함한다.
본원에 기재된 발명이 보다 잘 이해될 수 있도록 하기 위해, 하기 실시예가 설명된다. 이들 실시예는 단지 설명을 위한 것으로서, 어떠한 방식으로도 본 발명을 제한하는 것으로 해석되지 않음을 알아야 한다.
실시예
방법 및 물질
XRPD (X선 분말 회절법)
기구 1
X선 분말 회절법 (XRPD) 데이터를 리가쿠/MSC 미니플렉스(MiniFlex) 데스크탑 분말 X선 회절계 (미국 텍스사주 더 우드랜즈 소재의 리가쿠(Rigaku))를 사용하여 실온에서 기록하였다. X선은 Kβ 억제 필터가 장착된 30 kV 및 15 mA에서 작동되는 Cu 튜브를 사용하여 발생시켰다. 발산 슬릿은 각각 4.2° 및 슬릿 0.3 mm로 설정된 산란 및 수광 슬릿에 따라 가변성이었다. 스캔 모드는 0.02°단계 폭 및 2.0초의 카운트 시간으로 고정 시간 (FT) 방식이었다. 분말 X선 회절계는 75% 소달라이트 (Na3Al4Si4O12Cl) 및 25% 규소 (리가쿠, Cat# 2100/ALS)의 표준 시료를 사용하여 보정하였다. 6개 샘플단을 제로 백그라운드 샘플 홀더 (SH-LBSI511-RNDB)와 함께 사용하였다. 분말 샘플을 요철부에 넣고 유리 슬라이드로 평탄화시켰다.
기구 2
별법으로, 분말 X선 회절 측정을 구리 방사선 (1.54060 A)과 함께 파날리티컬(PANalytical) 제조의 X-pert Pro 회절계를 사용하여 실온에서 수행하였다. 광학 입사 빔은 샘플 및 회절 빔 사이드 상에서의 일정한 조사 길이를 보장하도록 하는 가변성 발산 슬릿으로 이루어졌다. 스캐닝 모드에서 2.12° 2θ의 활성 길이가 측정되는 급속 선형 고체 상태 검출기를 사용하였다. 분말 샘플을 제로 백그라운드 규소 홀더의 요철부에 팩킹하고 스피닝을 수행하여 우수한 통계자료를 얻었다. 대칭 스캔은 0.017°의 단계 크기 및 15.5초의 스캔 단계 시간으로 4-40° 2θ에서 측정하였다.
기구 3
별법으로, 고분해능의 데이터를 빔라인 ID31 (프랑스 그르노블 소재의 유럽 싱크로트론 방사광 시설(European Synchrotron Radiation Facility))을 사용하여 실온에서 수집하였다. X선은 3개의 11 mm 간극의 엑스-바큠 언듈레이터(ex-vacuum undulator)에 의해 발생시켰다. 빔은 극저온 냉각된 쌍결정 단색화장치 (Si(111) 결정)에 의해 단색화시켰다. 물에 의해 냉각된 슬릿은 단색화장치 상의 입사 빔, 및 샘플로 전달된 단색 빔의 크기를 0.5 내지 2.5 mm (수평) x 0.1 내지 1.5 mm (수직) 범위로 한정하였다. 실험에 사용된 파장은 1.29984 (3) Å였다. 회절계는 2θ에 대한 함수로서 회절선 강도를 측정하기 위해 수직으로 스캐닝되는 9개의 검출기 층으로 이루어져 있다. 각각의 검출기 앞에 Si(111) 검광자 결정이 있으며, 검출기 채널은 대략 2° 떨어져 있다. 상기 회절계는 0.003° 만큼 좁은 피크폭으로 매우 정확한 고분해능의 회절 패턴을 제공할 수 있으며, 피크 위치의 정확성은 0.0001° 정도이다. 분말 회절법 데이터를 프로세싱하여 머티리얼즈 스튜디오(Materials Studio)를 사용하여 색인화하였다 (리플렉스(Reflex) 모듈). 구조는 머티리얼즈 스튜디오의 파우더솔브(PowderSolve) 모듈을 사용하여 규명하였다. 획득한 솔루션을 구조적 타당성에 대해서 평가한 후에 리트벨트(Rietveld) 정밀화 절차를 사용하여 정밀화하였다.
형태 B에 대하여 실시예에서 기재된 XRPD 스펙트럼은 상기 기재된 설정으로 기구 1 (도 7a) 또는 기구 2 (도 7b)를 사용하여 기록한 것이다. 형태 B-HCl 및 형태 A-HCl에 대하여 실시예에서 기재된 XRPD 스펙트럼은 상기 기재된 설정으로 기구 2를 사용하여 기록한 것이다. 형태 A-HCl 및 형태 B-HCl의 결정계, 공간군 및 단위 셀 치수는 기구 3을 사용하여 측정하였다.
시차 주사 열량측정법 (
DSC
)
시차 주사 열량측정법 (DSC)은 TA DSC Q2000 시차 주사 열량계 (미국 델라웨어주 뉴캐슬 소재의 TA 인스트루먼츠(TA Instruments))를 사용하여 수행하였다. 상기 기구는 인듐으로 보정하였다. 대략 2 내지 3 mg의 샘플을 1개의 구멍이 있는 뚜껑을 사용하여 크림핑(crimped)된 밀폐 팬으로 칭량하여 넣었다. DSC 샘플을 10℃/분의 가열 속도로 25℃ 내지 315℃에서 스캐닝하였다. 써말 어드밴티지 Q 씨리즈(Thermal Advantage Q Series)™ 소프트웨어를 사용하여 데이터를 수집하고, 유니버셜 어낼리시스(Universal Analysis) 소프트웨어 (미국 델라웨어주 뉴캐슬 소재의 TA 인스트루먼츠)를 사용하여 분석하였다.
열중량 분석법 (TGA)
열중량 분석법 (TGA) 데이터를 TA Q500 열중량 분석기 (미국 델라웨어주 뉴캐슬 소재의 TA 인스트루먼츠)에서 수집하였다. 대략 3 내지 5 mg의 중량을 갖는 샘플을 10℃/분의 가열 속도로 25℃ 내지 350℃에서 스캐닝하였다. 써말 어드밴티지 Q 씨리즈™ 소프트웨어를 사용하여 데이터를 수집하고, 유니버셜 어낼리시스 소프트웨어 (미국 델라웨어주 뉴캐슬 소재의 TA 인스트루먼츠)를 사용하여 분석하였다.
FTIR 분광분석법
FTIR 스펙트럼을 지능형 공전운동 샘플링 장착부 (다중반사 감쇠 전반사 부속품), 45°에서의 다이아몬드창을 갖는, 써모 사이언티픽(Thermo Scientific) 제조의 니콜렛(Nicolet) 6700 FT-IR 분광기로부터 수집하였다. 데이터 수집 및 분석에 사용된 소프트웨어는 옴닉(Omnic) 7.4였다. 수집 설정은 하기와 같다.
검출기: DTGS KBr;
빔스플릿터(beamsplitter): KBr 상의 Ge;
광원: 에버글로(EverGlo) IR;
스캔 범위: 4000 - 400 cm-1;
증폭도: 8.0;
광학 속도: 0.6329 cm/초;
애퍼쳐(Aperture): 100;
스캔 횟수: 32; 및
분해능: 4 cm-1
분말 샘플을 다이아몬드 결정 상에 직접 놓고 압력을 가하여 샘플의 표면을 다이아몬드 결정의 표면에 맞추었다. 백그라운드 스펙트럼을 수집한 후에 샘플 스펙트럼을 수집하였다.
고체 상태 핵 자기 분광분석법
고체 상태 핵 자기 분광분석법 (SSNMR) 스펙트럼을 브루커(Bruker) 400 MHz 양성자 주파수 광구경 분광기에서 얻었다. 양성자 검출된, 양성자 포화 회복 데이터를 지수 함수에 맞춤으로써 양성자 이완 종축 이완 시간 (1H T1)을 얻었다. 이들 값을 사용하여 탄소 교차 편광 매직 앵글 스피닝 실험 (13C CPMAS)의 최적의 재순환 지연을 설정하였고, 이는 통상적으로 1.2 x 1H T1 내지 1.5 x 1H T1로 설정되었다. 양성자 채널에 대한 선형 진폭 경사 (50% → 100%) 및 100 kHz TPPM 디커플링(decoupling)을 사용하여 2 ms의 접촉 시간으로 탄소 스펙트럼을 얻었다. 전형적인 매직 앵글 스피닝 (MAS) 속도는 15.0 kHz였다. 양성자 디커플링된, 비교차 편광 MAS 실험을 사용하여 플루오린 스펙트럼을 얻었다. 100 kHz TPPM 디커플링을 사용하였다. 재순환 지연은 ≥ 5 x 19F T1로 설정하였다. 플루오린 검출된, 양성자 디커플링된 포화 회복 데이터를 지수 함수에 맞춤으로써 플루오린 종축 이완 시간 (19F T1)을 얻었다. 탄소 및 플루오린 스펙트럼은 29.5 ppm으로 설정된, 고체상 애더만탄의 중첩 공명을 외부 참조하였다. 상기 절차를 사용하여, 탄소 스펙트럼은 0 ppm에서 테트라메틸 실란을 간접 참조하였고, 플루오린 스펙트럼은 0 ppm에서 니트로메탄을 간접 참조하였다.
제조
실시예
: 7-
아자비시클로[2.2.1]헵탄
히드로클로라이드
(9)
트랜스-4-(tert-부톡시카르보닐아미노)시클로헥산올 (A)의 제조, 방법 1.
탄산나트륨 (920.2 g, 8.682 mol, 2 eq.)을 반응 용기에 첨가한 후에, 물 (3.000 L, 6 vol)을 첨가하고 교반하였다. 디클로로메탄 (DCM, 4.000 L, 4 vol)을 첨가한 후에, 트랜스-4-아미노시클로헥산올 (500.0 g, 4.341 mol)을 첨가하여 2상의 반응 혼합물을 생성하고, 이를 실온에서 격렬하게 교반하였다. 이어서 DCM (2 vol) 중의 Boc2O (947.4 g, 997.3 mL, 4.341 mol, 1 eq.)의 용액을 용기에 신속히 적가하고, 생성된 반응 혼합물을 실온에서 밤새 교반하였다. 이어서 반응 혼합물을 여과하고 필터 케이크를 물 (2 x 8 vol)로 세척하였다. 생성물을 압축 케이크가 될 때까지 흡인 건조시켰다. 이어서 케이크를 35℃ 진공 오븐에서 24시간 동안 건조시켜, 트랜스-4-(tert-부톡시카르보닐아미노)시클로헥산올 (A) 830 g을 결정질 고형물로서 제공하였다.
트랜스-4-(tert-부톡시카르보닐아미노)시클로헥산올 (A)의 제조, 방법 2.
2개의 50 L 들이 3목 둥근 바닥 플라스크에 각각 기계식 교반기 및 열전대를 설치하였다. 플라스크를 냉각조에 넣은 후에, 각각의 플라스크에 물 (8.87 L) 및 트랜스-4-아미노시클로헥산올 (1479 g)을 충전하였다. 약 10 내지 30분 후에, 트랜스-4-아미노시클로헥산올이 용해되었고, 탄산칼륨 (1774.6 g)을 각각의 플라스크에 첨가하였다. 약 10 내지 20분 후에, 탄산칼륨이 용해되었고, DCM (2.96 L)을 각각의 플라스크에 충전하였다. 이어서 DCM (1479 mL) 중의 Boc 무수물 (3082.6 g)을 20 내지 30℃에서 온도를 유지하는 속도로 각각의 플라스크에 첨가하였다. 얼음/물 조를 사용하여 발열을 제어하고 대략 1 내지 2시간이 소요되는 첨가를 가속하였다. 첨가하는 동안에 현탁물이 형성되었고, Boc 무수물이 사라지는 것에 기초하여 반응이 완료될 때까지, 반응 혼합물을 실온으로 가온하고 밤새 교반하였다. 이어서 헵탄 (6 L)을 각각의 플라스크에 충전하고, 혼합물을 대략 0 내지 5℃로 냉각시켰다. 고형물을 동일한 필터를 사용하여 여과함으로써 각각의 플라스크로부터 수집하였다. 합친 고형물을 헵탄 (6 L), 이어서 물 (8 L)로 세척하였다. 고형물을 기계식 교반기가 설치된, 적절한 크기의 크록(crock)에 충전하였다. 물 (12 L) 및 헵탄 (6 L)을 첨가하고, 생성된 현탁물을 30 내지 60분 동안 기계식으로 교반하였다. 고형물을 여과에 의해 수집한 후에, 필터 상에서 물 (8 L) 및 헵탄 (8 L)으로 세척하고, 필터 상에서 3일 동안 공기 건조시킨 후에, 진공하에 30 내지 35℃에서 일정한 중량까지 건조시켜, 생성물을 백색 고형물로서 제공하였다.
트랜스-4-(tert-부톡시카르보닐아미노)시클로헥실메탄술포네이트 (B)의 제조, 방법 1.
12 L 들이 플라스크에 질소 유동장치 및 기계식 교반기를 설치하였다. 트랜스-4-(tert-부톡시카르보닐아미노)시클로헥산올 (750 g, 3.484 mol), 이어서 테트라히드로푸란 (THF, 6.000 L, 8 vol)을 혼입하고, 혼합물을 교반하였다. 트리에틸아민 (370.2 g, 509.9 mL, 3.658 mol, 1.05 eq.)을 첨가하고 혼합물을 0℃로 냉각시켰다. 메탄술포닐 클로라이드 (419.0 g, 283.1 mL, 3.658 mol, 1.05 eq.)를 주의하여 적가하고, 이때 혼합물의 온도를 5℃ 미만으로 유지하였다. 첨가한 후에, 혼합물을 0℃에서 3시간 동안 교반한 후에, 실온 (17℃)으로 서서히 가온하고 밤새 (약 15시간) 교반하였다. 혼합물을 물 (6 vol)로 켄칭시키고 15분 동안 교반하였다. 에틸 아세테이트 (EtOAc, 9.000 L, 12 vol)를 첨가하고 15분 동안 계속해서 교반하였다. 교반을 중단하고 혼합물을 10분 동안 정치하고, 수성상을 제거하였다. 1 N HCl (6 vol, 4.5 L)을 첨가하고 15분 동안 계속해서 교반하였다. 교반을 중단하고 수성상을 제거하였다. 10 w/v% NaHCO3 (4.5 L, 6 vol)를 첨가하고 혼합물을 10분 동안 교반하였다. 교반을 중단하고 수성상을 제거하였다. 물 (6 vol, 4.5 L)을 첨가하고 혼합물을 10분 동안 교반하였다. 수성층을 제거하고, 유기층을 연마 여과한 다음, 4 vol로 농축시켰다. 헵탄 (5.5 vol, 4 L)을 첨가하고 혼합물을 다시 농축 건조시켜, 트랜스-4-(tert-부톡시카르보닐아미노)시클로헥실메탄술포네이트 988 g을 생성하였다.
트랜스-4-(tert-부톡시카르보닐아미노)시클로헥실메탄술포네이트 (B)의 제조, 방법 2.
기계식 교반기, 첨가 깔때기, 질소 유입구, 열전대 및 건조 튜브를 갖춘 3목 둥근 바닥 플라스크를 냉각조에 넣었다. 트랜스-4-(tert-부톡시카르보닐아미노)시클로헥산올 (2599 g, 12.07 mol, 1.0 eq.), 테트라히드로푸란 (THF) (20.8 L) 및 트리에틸아민 (1466 g, 14.49 mol, 1.2 eq.)을 플라스크에 첨가하였다. 혼합물을 빙수조로 냉각시키고 교반하였다. 메탄술포닐 클로라이드 (1466 g, 12.80 mol, 1.06 eq.)를 첨가 깔때기에 의해 1시간에 걸쳐서 적가하였다. 첨가하는 것이 완료되면, 냉각조를 제거하고, 출발 물질이 소진되었음을 TLC에 의해 확인할 때까지 (약 30분) 반응 혼합물을 교반하였다. 이어서 반응 혼합물을 염산 수용액 (물 6.7 L 중의 HCl 223 mL) 및 EtOAc (10.4 L)로 켄칭시켰다. 혼합물을 주위 온도에서 대략 10 내지 20분 동안 교반한 후에, 분별 깔때기로 옮겼다. 층을 분리하고, 수성층을 버렸다. 유기층을 물 (2 x 4.5 L), 포화 중탄산나트륨 수용액 (1 x 4.5 L)으로 세척하고, 5 내지 10분 동안 교반하면서 무수 황산마그네슘 상에서 건조시켰다. 혼합물을 여과하고 필터 케이크를 EtOAc (2 x 600 mL)로 세척하였다. 합친 세척물 및 여과물을 감압하에 40℃에서 농축시켜, 백색 고형물을 남겼다. 고형물을 헵탄 (3 L)에 녹이고 얼음/메탄올 냉각조에서 냉각시켰다. 추가의 헵탄 (5 L)을 첨가하고, 혼합물을 0 내지 5℃에서 1시간 이상의 시간 동안 교반하였다. 이어서 고형물을 여과에 의해 수집하고, 냉각된 헵탄 (0 내지 5℃, 2 x 1.3 L)으로 세척한 다음, 진공하에 40℃에서 일정한 중량까지 건조시켜, 표제 화합물을 제공하였다.
주: 냉각조 및 얼음조와 함께 둥근 바닥 플라스크를 사용하는 대신에 재킷형 반응기를 사용할 수 있다.
트랜스-4-아미노시클로헥실메탄술포네이트 (C)의 제조, 방법 1.
트랜스-4-(tert-부톡시카르보닐아미노)시클로헥실메탄술포네이트 (985 g, 3.357 mol)를 질소 분위기하에 교반기 및 개방 통기구를 갖춘 12 L 들이 3목 플라스크에 혼입하였다. DCM (1.970 L, 2 vol)을 실온에서 첨가하고, 교반을 개시하였다. 트리플루오로아세트산 (TFA) (2.844 kg, 1.922 L, 24.94 mol, 2 vol)을 각각 1 L씩 2회분의 배치로 혼합물에 서서히 첨가하였다. 첫번째 첨가 후에, 혼합물을 30분 동안 교반한 다음, 두번째 첨가를 수행하였다. 혼합물을 밤새 (15시간) 실온에서 교반하여 투명 용액을 생성하였다. 이어서 2-메틸테트라히드로푸란 (4 vol)을 반응 혼합물에 첨가하고, 이것을 1시간 동안 교반하였다. 이어서 혼합물을 주의하여 퓸 후드에서 여과한 다음 흡인 건조시켜, 과량의 TFA가 함유된 트랜스-4-아미노시클로헥실메탄술포네이트의 TFA 염 1100 g을 생성하였다.
트랜스-4-아미노시클로헥실메탄술포네이트 (C)의 제조, 방법 2.
50 L 들이 3목 둥근 바닥 플라스크에 기계식 교반기, 첨가 깔때기 및 열전대를 설치하고 냉각조에 넣었다. 플라스크에 트랜스-4-(tert-부톡시카르보닐아미노)시클로헥실메탄술포네이트 (3474 g, 1.0 eq.) 및 DCM (5.9 L)을 첨가하였다. 생성된 현탁물을 5 내지 10분 동안 주위 온도에서 교반한 후에, 트리플루오로아세트산 (TFA, 5.9 L)을 첨가 깔때기를 통해 2.5시간에 걸쳐서 서서히 첨가하여 그에 의한 발열 및 기체 방출의 속도를 제어하였다. 반응 혼합물을 실온에서 밤새 교반한 후에, 빙수조를 사용하여 15℃ 내지 20℃로 냉각시켰다. 이어서 2-메틸 테트라히드로푸란 (2-MeTHF, 11.8 L)을 첨가 깔때기를 통해 25℃ 미만으로 내부 온도를 유지하는 속도로 (대략 1.5시간) 첨가하였다. 처음 4-5 L의 2-MeTHF의 첨가는 발열성이었다. 생성된 현탁물을 1시간 동안 교반하였다. 고형물을 여과에 의해 수집한 후에, 2-MeTHF (2 x 2.2 L)로 세척하고, 이어서 진공하에 주위 온도에서 일정한 중량까지 건조시켜, 표제 화합물을 백색 고형물로서 제공하였다.
7-아자비시클로[2.2.1]헵탄 히드로클로라이드 (9)의 제조, 방법 1.
트랜스-4-아미노시클로헥실메탄술포네이트의 TFA 염 (200 g, 650.9 mmol)을 3 L 들이 3목 플라스크에 혼입하고, 이어서 물 (2.200 L, 11 vol)을 첨가하였다. 반응 혼합물의 온도를 25℃ 미만으로 유지하면서, NaOH (78.11 g, 1.953 mol, 3 eq.)를 서서히 첨가하고, 혼합물을 밤새 교반하였다. 이어서 DCM (1.4 L, 7 vol)을 첨가하고 혼합물을 교반한 다음, 유기층을 분리하였다. 이어서 수성층을 DCM (1.4 L, 7 vol)으로 2회 추출하고, DCM층을 합쳤다. 이어서 HCl (108.5 mL, 12 M, 1.3020 mol, 2 eq.)을 첨가하고, 혼합물을 30분 동안 교반한 후에, 회전식 증발기에서 농축 건조시켰다. 아세토니트릴 (10 vol)을 첨가하고 혼합물을 농축시켰다. 미량의 물이 모두 공비 제거될 때까지 이를 3회 반복하여, 7-아자비시클로[2.2.1]헵탄 히드로클로라이드 (9)를 제공하였다. 조질 생성물을 아세토니트릴 (10 vol)로부터 재결정화하여, 7-아자비시클로[2.2.1]헵탄 히드로클로라이드 (9)를 무색 결정질 고형물로서 제공하였다.
참고로, 추출을 위해 DCM을 첨가하는 대신에, 조질 생성물을 또한 약 95℃ 내지 97℃에서 증류시킨 다음 추가로 재결정화할 수 있다.
7-아자비시클로[2.2.1]헵탄 히드로클로라이드 (9)의 제조, 방법 2.
50 L 들이 3목 둥근 바닥 플라스크에 기계식 교반기, 첨가 깔때기 및 열전대를 설치하고 가열 맨틀에 넣었다. 트랜스-4-아미노시클로헥실메탄술포네이트 트리플루오로아세테이트 (3000 g, 1 eq.) 및 물 (30 L)을 플라스크에 첨가하였다. 50% NaOH (2343 g, 29.29 mol, 3 eq.)를, 이의 첨가는 약간의 발열성이므로 온도를 25℃ 미만으로 유지하는 속도로 첨가 깔때기에 의해 첨가하면서, 혼합물을 교반하였다. NaOH 첨가를 완료하면, 반응 혼합물을 밤새 실온에서 교반하였다. 생성물을 환류 온도 (대략 100℃)에서 분별 증류함으로써 회수하며, 이때 헤드 온도는 95 내지 98℃였다. 각각의 분획의 pH는 HCl을 첨가함으로써 2로 조정하고, 감압하에 55℃에서 농축시켜, 점성 페이스트를 남겼다. 아세토니트릴 (ACN 1.5 L)을 첨가하고 생성된 현탁물을 30분 동안 교반한 후에, 1시간 동안 0 내지 5℃로 냉각시켰다. 고형물을 여과에 의해 수집하고, 냉각된 (0 내지 5℃) ACN (2 x 600 mL)으로 세척하고, 진공하에 50℃에서 일정한 중량까지 건조시켰다.
22 L 들이 3목 둥근 바닥 플라스크에 기계식 교반기, 열전대 및 응축기를 설치하고 가열 맨틀에 넣었다. 수집한 고형물 (2382 g), 메탄올 (4.7 L) 및 2-MeTHF (4.7 L)를 플라스크에 첨가하였다. 생성된 현탁물을 교반하고 환류 온도 (대략 65℃)로 가열하였다. 반응 플라스크를 냉각조로 옮기고, 혼합물을 교반하였다. 이어서 2-MeTHF (4.7 L)를 30분에 걸쳐서 첨가 깔때기를 통해 첨가하였다. 생성된 현탁물을 0 내지 5℃로 냉각시키고 이 온도에서 30분 동안 교반하였다. 고형물을 여과에 의해 수집하고, 냉각된 (0 내지 5℃) 2-MeTHF (2 x 600 mL)로 세척한 후에, 진공하에 55℃에서 일정한 중량까지 건조시켰다.
기계식 교반기, 열전대, 질소 유입구 및 응축기를 갖춘 12 L 들이 3목 둥근 바닥 플라스크를 가열 맨틀에 넣었다. 조질 생성물 (2079 g) 및 ACN (6.2 L)을 플라스크에 첨가하였다. 생성된 현탁물을 교반하고 30분 동안 환류 온도 (대략 82℃)로 가열하였다. 플라스크를 냉각조로 옮기고 현탁물을 0 내지 5℃로 서서히 냉각시키고, 이 온도에서 1시간 동안 유지하였다. 고형물을 여과에 의해 수집하고, 냉각된 (0 내지 5℃) ACN (3 x 600 mL)으로 세척하고, 진공하에 55℃에서 일정한 중량까지 건조시켜, 표제 생성물을 제공하였다.
실시예 1A: 4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실산 (7)의 제조
디에틸 2-((2-클로로-5-(트리플루오로메틸)페닐아미노)메틸렌) 말로네이트 (4)의 제조
2-클로로-5-(트리플루오로메틸)아닐린 (2) (200 g, 1.023 mol), 디에틸 2-(에톡시메틸렌)말로네이트 (3) (276 g, 1.3 mol) 및 톨루엔 (100 mL)을 딘-스타크(Dean-Stark) 응축기를 갖춘, 1 L 들이 3목 둥근 바닥 플라스크에서 질소 분위기하에 합쳤다. 용액을 교반하면서 140℃로 가열하고 이 온도를 4시간 (h) 동안 유지하였다. 반응 혼합물을 70℃로 냉각시키고 헥산 (600 mL)을 서서히 첨가하였다. 생성된 슬러리를 교반하고 실온으로 가온하였다. 고형물을 여과에 의해 수집하고, 헥산 중의 10% 에틸 아세테이트 (2 x 400 mL)로 세척한 후에, 진공하에 건조시켜, 생성물 디에틸 2-((2-클로로-5-(트리플루오로메틸)페닐아미노)메틸렌) 말로네이트 (4)를 백색 고형물로서 제공하였다.
에틸 8-클로로-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실레이트 (5A)의 제조, 방법 1.
1 L 들이 3목 플라스크에 다우섬(Dowtherm)® (200 mL, 8 mL/g)을 충전하고, 200℃에서 1시간 동안 탈기시켰다. 용매를 260℃로 가열하고, 디에틸 2-((2-클로로-5-(트리플루오로메틸)페닐아미노)메틸렌)말로네이트 (4) (25 g, 0.07 mol)를 10분 (min)에 걸쳐서 나누어 충전하였다. 생성된 혼합물을 260℃에서 6.5시간 동안 교반하고, 생성된 에탄올 부산물을 증류에 의해 제거하였다. 혼합물을 80℃로 서서히 냉각시켰다. 헥산 (150 mL)을 30분에 걸쳐서 서서히 첨가한 후에, 추가의 헥산 200 mL를 한 번에 첨가하였다. 실온에 도달할 때까지 슬러리를 교반하였다. 고형물을 여과하고, 헥산 (3 x 150 mL)으로 세척한 후에, 진공하에 건조시켜, 에틸 8-클로로-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실레이트 (5A)를 황갈색 고형물로서 제공하였다.
에틸 8-클로로-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실레이트 (5A)의 제조, 방법 2.
화합물 4 (2000 g, 5.468 mol)를 반응기에 혼입하였다. 다우섬 (4.000 L)을 반응기에 충전하고, 질소를 퍼징하면서 밤새 실온에서 탈기시켰다. 이어서 교반한 다음 260℃로 가온하였다. 생성된 EtOH를 증류 제거하였다. 반응을 모니터링하였고 5.5시간 후에 반응은 실질적으로 완료되었다. 열원을 제거하고 반응 혼합물을 80℃로 냉각시키고 헵탄 (2.000 L)을 충전하였다. 혼합물을 30분 동안 교반하였다. 헵탄 (6.000 L)을 교반 혼합물에 충전하고 밤새 계속해서 교반하였다. 고형물을 여과하고 헵탄 (4.000 L)으로 세척한 다음 진공 오븐에서 50℃에서 건조시켜 화합물 6A를 제공하였다.
에틸 4-옥소-5-(트리플루오로메틸)-1H-퀴놀린-3-카르복실레이트 (6)의 제조
5 L 들이 3목 플라스크에 에틸 8-클로로-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실레이트 (5A) (100 g, 0.3 mol), 에탄올 (1250 mL, 12.5 mL/g) 및 트리에틸아민 (220 mL, 1.6 mol)을 충전하였다. 이어서 용기에 5℃에서 10% Pd/C (50% 습윤화) 10 g을 충전하였다. 반응물을 수소 분위기하에 20시간 동안 5℃에서 격렬하게 교반하고, 그 후에 반응 혼합물을 대략 150 mL의 부피로 농축시켰다. Pd/C가 함유된 슬러리로서 생성물 에틸 4-옥소-5-(트리플루오로메틸)-1H-퀴놀린-3-카르복실레이트 (6)를 그대로 다음 단계에 적용하였다.
4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실산 (7)의 제조
에틸 4-옥소-5-(트리플루오로메틸)-1H-퀴놀린-3-카르복실레이트 (6) (58 g, 0.2 mol, Pd/C를 함유하는 조질 반응물 슬러리)를, 환류 응축기를 갖춘 1 L 들이 플라스크에서 NaOH (5 M, 814 mL, 4.1 mol) 중에 현탁시키고 80℃에서 18시간 동안 가열한 후에, 추가로 100℃에서 5시간 동안 가열하였다. 반응물을 팩킹 셀라이트(Celite)를 통해 가온 여과하여 Pd/C를 제거하고, 셀라이트를 1 N NaOH로 세정하였다. 여과물을 약 pH 1로 산성화시켜 점성의 백색 침전물을 수득하였다. 침전물을 여과한 후에 물 및 냉각된 아세토니트릴로 세정하였다. 이어서 고형물을 진공하에 건조시켜 4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실산 (7)을 백색 고형물로서 제공하였다.
실시예 1B: 4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실산 (7)의 별법의 제조
8-클로로-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실산 (5B)의 제조
에틸 8-클로로-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실레이트 (5A) (1200 g, 3.754 mol)를 반응 용기에 충전한 후에, 2-프로판올 (1.200 L) 및 물 (7.200 L)을 첨가하고 교반하였다. 수산화나트륨 (600.6 g, 7.508 mol)과 물 (1.200 L)을 혼합하고 실온으로 냉각시켰다. 생성된 혼합물을 반응 용기에 충전한 후에 3.5시간 동안 교반하면서 80℃로 가열하여 암색의 균일 혼합물을 생성하였다. 추가의 시간 후에, 아세트산 (9.599 L, 20 w/v%, 31.97 mol)을 적하 깔때기를 통해 45분에 걸쳐서 첨가하였다. 반응 혼합물을 교반하면서 6℃/시간의 속도로 22℃로 냉각시켰다. 생성된 고형물을 여과하고, 물 (3 L)로 세척하여, 습윤 케이크 (1436 g)를 생성하였다. 여과물을 진공 오븐에서 질소 흐름하에 드라이에어라이트(Drierite)® 상에서 건조시켜, 8-클로로-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실산 (5B)을 갈색 고형물 (1069 g)로서 생성하였다. 8-클로로-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실산 (5B)을, 메탄올 1.5 L 중에서 슬러리화하고 6시간 동안 교반함으로써 정제하였다. 이어서 이것을 여과하고 건조시켜, 정제된 8-클로로-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실산 (5B) 968.8 g을 제공하였다.
4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실산 (7)의 제조
8-클로로-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실산 (5B) (18.5 g, 1.00 eq., 제한 반응물)을 반응 용기에 충전하고 MeOH (118 mL, 6.4 vol)를 비활성 분위기하에 교반하면서 첨가하였다. 반응기에 나트륨 메톡시드 (3.53 g, 1.00 eq.)를 10분에 걸쳐서 나누어 첨가하였다. 모든 고형물이 용액이 될 때까지 (5 내지 10분) 혼합물을 교반하였다. 이어서 탄소 상의 팔라듐 (2.7 g, 0.03 eq.)을 반응 혼합물에 첨가하였다. MeOH (67 mL, 3.6 vol)에 용해된 칼륨 포르메이트 (10.78 g, 2 eq.)를 30분에 걸쳐서 반응 혼합물에 첨가하고 주위 온도에서 약 4.5시간 동안 교반하였다. 8-클로로-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실산이 4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실산 (7)에 대하여 1.0% 이하일 때 반응이 완료된 것으로 판단하였다. 반응이 완료되었을 때, 혼합물을 셀라이트 패드 (셀라이트의 질량은 출발시에 용기에 충전한 8-클로로-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실산 (5B) 질량의 대략 2배를 사용함)를 통해 여과하여 고형물을 제거하였다. 셀라이트 케이크를 MeOH (37 mL, 2 vol)로 세척하였다. 여과물을 깨끗한 반응 용기에 충전하고 교반하였다. 아세트산 (7.22 mL, 2 eq.)을 교반 용액에 적어도 45분에 걸쳐서 연속적으로 충전하고 생성된 슬러리를 5 내지 16시간 동안 교반하였다. 고형물을 여과하고 케이크를 MeOH (56 mL, 3 vol)로 세척하고, 흡인 건조시킨 후에, 진공 건조시켜, 생성물을 백색/회백색 고형물로서 제공하였다.
별법으로, 칼륨 포르메이트 반응물은 수소 기체로 대체할 수 있다.
실시예
2A: 4-(7-
아자비시클로[2.2.1]헵탄
-7-일)-2-(
트리플루오로메틸
)아닐린 (11A)의 제조
7-[4-니트로-3-(트리플루오로메틸)페닐]-7-아자비시클로[2.2.1]헵탄 (10A)의 제조, 방법 1.
7-아자비시클로[2.2.1]헵탄 히드로클로라이드 (9) (4.6 g, 34.43 mmol)를 함유하는 플라스크에 질소 분위기하에 아세토니트릴 (50 mL) 중의 4-플루오로-1-니트로-2-(트리플루오로메틸)벤젠 (8) (6.0 g, 28.69 mmol) 및 트리에틸아민 (8.7 g, 12.00 mL, 86.07 mmol)의 용액을 첨가하였다. 반응 플라스크를 질소 분위기하에 16시간 동안 80℃에서 가열하였다. 이어서 반응 혼합물을 냉각시키고, 물과 디클로로메탄 사이에 분배하였다. 유기층을 1 M HCl로 세척하고, Na2SO4 상에서 건조시키고, 여과한 다음, 농축 건조시켰다. 실리카겔 크로마토그래피 (헥산 중의 0-10% 에틸 아세테이트)에 의한 정제로 7-[4-니트로-3-(트리플루오로메틸)페닐]-7-아자비시클로[2.2.1]헵탄을 황색 고형물로서 수득하였다.
7-[4-니트로-3-(트리플루오로메틸)페닐]-7-아자비시클로[2.2.1]헵탄 (10A)의 제조, 방법 2.
4-플루오로-1-니트로-2-(트리플루오로메틸)벤젠 (8) (901 g, 4.309 mol)을 30 L 들이 재킷형 용기에 탄산나트륨 (959.1 g, 9.049 mol) 및 DMSO (5 L, 5.5 vol)와 함께 질소 분위기하에 교반하면서 혼입하였다. 이어서 7-아자비시클로[2.2.1]헵탄 히드로클로라이드 (9) (633.4 g, 4.740 mol)를 용기에 나누어 첨가하고, 온도를 서서히 55℃로 상승시켰다. 반응을 HPLC에 의해 모니터링하는데, 기질이 < 1% AUC일 때 반응이 완료된 것으로 간주하였다. 이어서 혼합물을 10 vol의 EtOAc로 희석시키고 물 (5.5 vol)로 3회 세척하였다. 이어서 유기층을 4 vol로 농축시키고, 시클로헥산을 첨가한 다음 4 vol로 농축시켰다. 시클로헥산을 첨가하고 생성 용액을 4 vol로 농축시키는 과정을 모든 EtOAc가 제거될 때까지 반복하였고, 플라스크 내의 총 부피는 시클로헥산을 함유하여 약 4 vol이었다. 반응 혼합물을 회전식 증발기에서 30분 동안 60℃로 가열하였다. 이어서 용액을 교반하거나 또는 회전시키면서 3시간 동안 실온으로 냉각시켰다. 모든 고형물이 결정화되었고, 이를 농축 건조시켜, 7-[4-니트로-3-(트리플루오로메틸)페닐]-7-아자비시클로[2.2.1]헵탄 (10A)을 제공하였다.
7-[4-니트로-3-(트리플루오로메틸)페닐]-7-아자비시클로[2.2.1]헵탄 (10A)의 제조, 방법 3.
3 vol의 DCM에 용해된 4-플루오로-1-니트로-2-(트리플루오로메틸)벤젠 (8)에 테트라부틸암모늄브로마이드 (0.05 eq.) 및 50 중량% KOH (3.6 eq.)를 첨가하였다. 이어서 7-아자비시클로[2.2.1]헵탄 히드로클로라이드 (9)를 0 내지 5℃에서 첨가하였다. 반응물을 주위 온도로 가온하였다. 반응을 HPLC에 의해 모니터링하는데, 기질이 < 1% AUC일 때 반응이 완료된 것으로 간주하였고, 층을 분리하였다. 유기층을 1 M HCl로 세척하고, 수성층을 버렸다. 이어서 유기층을 물로 1회, 염수로 1회 세척한 후에, 증발시켰다. 생성 물질을 환류 온도에서 시클로헥산으로부터 재결정화하였다. 고형물을 여과하고, 시클로헥산으로 세척한 다음, 진공 오븐에서 질소 분위기하에 45℃에서 건조시켜, 7-[4-니트로-3-(트리플루오로메틸)페닐]-7-아자비시클로[2.2.1]헵탄을 제공하였다.
4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)아닐린 (11A)의 제조
7-[4-니트로-3-(트리플루오로메틸)페닐]-7-아자비시클로[2.2.1]헵탄 (10A) (7.07 g, 24.70 mmol) 및 10% Pd/C (0.71 g, 6.64 mmol)를 충전한 플라스크를 배기시킨 후에 질소를 플러싱하였다. 에탄올 (22 mL)을 첨가하고 반응 플라스크에 수소 벌룬을 장착하였다. 12시간 동안 격렬하게 교반한 후에, 반응 혼합물에 질소를 퍼징하고 Pd/C를 여과에 의해 제거하였다. 여과물을 감압하에 암색의 오일로 농축시키고, 실리카겔 크로마토그래피 (헥산 중의 0-15% 에틸 아세테이트)로 정제하여, 4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)아닐린 (11A)을 보라색 고형물로서 제공하였다.
실시예
2B: 4-(7-
아자비시클로[2.2.1]헵탄
-7-일)-2-(
트리플루오로메틸
)아닐린 (11B)
히드로클로라이드의
제조
4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)아닐린 히드로클로라이드 (11B)의 제조, 방법 1.
탄소 상의 팔라듐 (150 g, 5 w/w%)을 뷔히 수소화장치 (Buechi Hydrogenator; 20 L 용량)에 질소 분위기하에 충전한 후에, 상기 실시예 2A (방법 2)에서 제조된 7-[4-니트로-3-(트리플루오로메틸)페닐]-7-아자비시클로[2.2.1]헵탄 (10A, 1500 g) 및 2-메틸테트라히드로푸란 (10.5 L, 7 vol)을 첨가하였다. 이어서 수소화장치에 수소 기체를 퍼징한 후에 대기압보다 0.5 bar 높은 압력에서 혼합물에 연속적으로 충전하였다. 이어서 혼합물을, 용기 재킷을 냉각시킴으로써 18℃ 내지 23℃의 온도에서 교반하였다. 수소 기체가 더 이상 사용되지 않고 발열이 더 이상 발생하지 않을 때 진공을 용기에 적용하였다. 이어서 질소 기체를 0.5 bar에서 용기에 충전하고 진공을 재적용한 후에, 질소 기체를 0.5 bar까지 2차 충전하였다. 여과된 분취물의 HPLC에 의해 7-[4-니트로-3-(트리플루오로메틸)페닐]-7-아자비시클로[2.2.1]헵탄 (10A)이 잔류하지 않음 (예를 들어, 0.5% 이하)이 확인되었을 때, 반응 혼합물을 질소 분위기하에 셀라이트 필터를 사용하는 필터 깔때기를 통해 시료받이 플라스크로 옮겼다. 셀라이트 필터 케이크를 2-메틸테트라히드로푸란 (3 L, 2 vol)으로 세척하였다. 세척물 및 여과물을, 교반하고 온도를 제어하면서 질소 분위기하에 용기에 충전하였다. 1,4-디옥산 (1 vol) 중의 4 M HCl을 용기에 20℃에서 1시간에 걸쳐서 연속적으로 첨가하였다. 혼합물을 추가로 10시간 이상 동안 교반하고, 여과한 다음, 2-메틸테트라히드로푸란 (2 vol)으로 세척하고, 건조시켜, 4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)아닐린의 히드로클로라이드 염 (11B) 1519 g을 백색 결정질 고형물로서 생성하였다.
본 실시예에서 대체 용매로 교체될 수도 있다. 예를 들면, MeOH 및/또는EtOH가 2-MeTHF 대신에 사용될 수 있다.
4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)아닐린 히드로클로라이드 (11B)의 제조, 방법 2.
뷔히 수소화장치 (20 L 용량)에서, 탄소 상의 팔라듐 (5 w/w%, 150 g)을 질소하에 혼입한 후에, 7-[4-니트로-3-(트리플루오로메틸)페닐]-7-아자비시클로[2.2.1]헵탄 (1500 g) 및 2-메틸테트라히드로푸란 (10.5 L, 7 vol)을 첨가하였다. 이어서 수소화장치에 수소 기체를 퍼징한 후에 대기압보다 0.5 bar 높은 압력에서 교반 혼합물에 연속적으로 충전하였다. 반응 혼합물의 온도를, 용기 재킷을 냉각시킴으로써 18℃ 내지 23℃에서 유지하였다. 수소 기체가 더 이상 사용되지 않고 발열이 더 이상 발생하지 않을 때 진공을 용기에 적용하였다. 이어서 질소 기체를 용기에 충전하고 진공을 재적용한 후에, 질소 기체를 0.5 bar에서 충전하였다. 여과된 분취물의 HPLC에 의해 7-[4-니트로-3-(트리플루오로메틸)페닐]-7-아자비시클로[2.2.1]헵탄이 검출되지 않음 (0.5% 이하)이 확인되었을 때, 반응이 완료된 것으로 간주하였다. 이어서 반응 혼합물을 셀라이트를 통해 여과하였다. 잔류 슬러리를 질소 기체하에 셀라이트 필터를 함유하는 필터 깔때기를 통해 시료받이 플라스크로 옮겼다. 셀라이트 케이크를 2-메틸테트라히드로푸란 (3 L, 2 vol)으로 세척하였다. 세척물 및 여과물을, 교반 메카니즘, 온도 제어 및 질소 분위기를 갖춘 용기로 옮겼다. 1,4-디옥산 (1 vol) 중의 4 M HCl을 용기에 20℃에서 1시간에 걸쳐서 연속적으로 첨가하였다. 생성 혼합물을 추가로 10시간 동안 교반하고, 여과한 다음, 2-메틸테트라히드로푸란 (2 vol)으로 세척하고, 건조시켜, 7-[4-아미노-3-(트리플루오로메틸)페닐]-7-아자비시클로[2.2.1]헵탄 히드로클로라이드 (11B) 1519 g을 백색 결정질 고형물로서 생성하였다.
본 실시예에서 대체 용매로 교체될 수도 있다. 예를 들면, MeOH 및/또는EtOH가 2-MeTHF 대신에 사용될 수 있다.
실시예 3A: N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드 (형태 A)의 제조
2-메틸테트라히드로푸란 (91.00 mL) 중의 4-옥소-5-(트리플루오로메틸)-1H-퀴놀린-3-카르복실산 (7) (9.1 g, 35.39 mmol) 및 4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)아닐린 (11A) (9.2 g, 35.74 mmol)의 용액에 프로필 포스폰산 시클릭 무수물 (T3P (에틸 아세테이트 중의 50% 용액), 52.68 mL, 88.48 mmol) 및 피리딘 (5.6 g, 5.73 mL, 70.78 mmol)을 실온에서 첨가하였다. 반응 플라스크를 10시간 동안 질소 분위기하에 65℃에서 가열하였다. 실온으로 냉각시킨 후에, 반응 혼합물을 에틸 아세테이트로 희석시키고 포화 Na2CO3 용액 (50 mL)으로 켄칭시켰다. 층을 분리하고, 수성층을 에틸 아세테이트로 2회 더 추출하였다. 합친 유기층을 물로 세척하고, Na2SO4 상에서 건조시키고, 여과한 다음, 황갈색 고형물로 농축시켰다. 조질 고형물을 에틸 아세테이트와 디에틸 에테르의 2:1 혼합물 중에서 슬러리화하고, 진공 여과에 의해 수집한 다음, 에틸 아세테이트/디에틸 에테르 혼합물로 2회 더 세척하여, 조질 생성물을 연황색 결정질 분말로서 제공하였다. 분말을 가온된 에틸 아세테이트에 용해시키고 셀라이트 상으로 흡수시켰다. 실리카겔 크로마토그래피 (디클로로메탄 중의 0-50% 에틸 아세테이트)에 의한 정제로 N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드 (화합물 I)를 고체 형태 A의 백색 결정질 고형물로서 제공하였다. LC/MS m/z 496.0 [M+H]+, 체류 시간 1.48분 (RP-C18, 3분에 걸쳐서 10-99% CH3CN/0.05% TFA).
실시예 3B: N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드 (형태 A-HCl)의 제조
2-메틸테트라히드로푸란 (0.57 L, 1.0 vol)을 30 L 들이 재킷형 반응 용기에 충전한 후에, 4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)아닐린의 히드로클로라이드 염 (11B) (791 g, 2.67 mol) 및 4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실산 (7) (573 g, 2.23 mol) 및 추가의 2-메틸테트라히드로푸란 5.2 L (9.0 vol)를 첨가하였다. 교반을 개시하고, 2-메틸테트라히드로푸란 중의 T3P (2.84 kg, 4.46 mol)를 15분에 걸쳐서 반응 혼합물에 첨가하였다. 이어서, 피리딘 (534.0 g, 546.0 mL, 6.68 mol)을 30분에 걸쳐서 첨가 깔때기를 통해 적가하였다. 혼합물을 약 30분에 걸쳐서 45℃로 가온하고 12 내지 15시간 동안 교반하였다. 이어서 혼합물을 실온으로 냉각시키고, 온도를 30℃ 미만으로 유지하면서, 2-메틸테트라히드로푸란 (4 vol, 2.29 L), 이어서 물 (6.9 vol, 4 L)을 첨가하였다. 수성층을 제거하고 유기층을 주의하여 NaHCO3 포화 수용액으로 2회 세척하였다. 이어서 유기층을 10 w/w% 시트르산 (5 vol), 또한 최종적으로 물 (7 vol)로 세척하였다. 혼합물을 연마 여과하고 또 다른 건조 용기로 옮겼다. N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드 히드로클로라이드 (형태 A-HCl)의 시드 결정 (3.281 g, 5.570 mmol)을 첨가하였다. HCl (g) (10 eq.)을 2시간에 걸쳐서 버블링하고 혼합물을 밤새 교반하였다. 생성된 현탁물을 여과하고, 2-메틸테트라히드로푸란 (4 vol)으로 세척하고, 흡인 건조시킨 다음, 60℃에서 오븐 건조시켜, 형태 A-HCl로서의 화합물 I을 제공하였다.
형태 A-HCl의 분말 회절도를 도 1에 나타냈다.
하기 표 1은 형태 A-HCl의 대표 XRPD 피크를 제공한다.
<표 1>
화합물 1 형태 A-HCl의 단결정은 단사 결정계, P21/c 공간군, 및 하기 단위 셀 치수를 갖는 것으로 결정되었다: a = 13.6175(4) Å, b = 21.614(3) Å, c = 8.3941(4) Å, α = 90°, β = 112.303° 및 γ = 90°.
형태 A-HCl의 대표 샘플을 또한 현미경을 사용하여 평가하였다.
형태 A-HCl의 대표 샘플의 DSC 곡선은 도 2에 제공되었다.
형태 A의 대표 샘플의 TGA 곡선은 도 3에 제공되었다.
형태 A-HCl의 대표 샘플은 도 4에 제공된 FTIR 스펙트럼을 제공하였다.
표 2는 형태 A-HCl의 특징적인 FTIR 흡수를 제공한다.
<표 2>
형태 A-HCl의 대표 샘플을 또한 고체 상태 (SS) 13C 및 19F NMR을 사용하여 분석하였다. 각각의 NMR 스펙트럼은 도 5 및 도 6에 제공되었다. 13C SSNMR 및 19F SSNMR 스펙트럼에서 확인되는 여러 개의 피크가 하기 표 3 및 표 4에 기재되어 있다.
<표 3>
<표 4>
실시예 4A: N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드 (형태 B)의 제조
2-메틸테트라히드로푸란 (1 vol)을 30 L 들이 재킷형 반응 용기에 충전한 후에, 4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)아닐린의 히드로클로라이드 염 (11B) (1.2 eq.) 및 4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복실산 (7) (573 g, 2.228 mol)을 첨가하였다. 추가의 2-메틸테트라히드로푸란 (9 vol)을 용기에 충전하고 교반을 개시하였다. 2-메틸테트라히드로푸란 (2 eq.) 중의 T3P를 15분의 기간에 걸쳐서 반응 혼합물에 첨가하였다. 피리딘 (3 eq.)을 첨가 깔때기를 사용하여 신속히 적가하였다. 이어서 교반하면서, 혼합물을 약 30분의 기간에 걸쳐서 45℃로 가열하고 이 온도를 약 5시간 동안 유지하였다. 혼합물을 실온으로 냉각시켰다. 2-메틸테트라히드로푸란 (4 vol)을 첨가한 후에, 물 (6.9 vol)을 서서히 첨가하고, 반응물의 온도를 30℃ 미만으로 유지하였다. 수성층을 제거하고 유기층을 NaHCO3 포화 수용액으로 2회 세척하였다. 이어서 유기층을 주의하여 10 w/w% 시트르산 (5 vol) 및 물 (7 vol)로 세척하고, 연마 여과한 후에, 또 다른 건조 용기로 옮겼다. 2-메틸테트라히드로푸란 (10 vol)을 첨가하고 교반을 개시하였다. 헵탄 (10 vol)을 교반하면서 신속히 적가하였다. 혼합물을 약 12시간의 기간 동안 교반한 후에, 진공 여과하였다. 고형 필터 케이크를 또 다른 용기에 혼입하였다. 물 (15 vol)을 용기에 충전하고 현탁물을 48시간 동안 격렬하게 교반한 후에, 여과하였다. 고형 케이크를 물 (5 vol)로 세척하고 일정한 중량까지 45℃에서 건조시켜, 화합물 I 형태 B를 제공하였다.
화합물 I 형태 B의 분말 회절도를 도 7a 및 도 7b에 나타냈다.
표 5는 형태 B의 대표 XRPD 피크이다.
<표 5>
형태 B의 대표 샘플의 DSC 곡선은 도 8에 제공되었다,
형태 B의 대표 샘플의 TGA 곡선은 도 9에 제공되었다.
형태 B의 대표 샘플은 도 10에 제공된 FTIR 스펙트럼을 제공하였다.
표 6은 형태 B의 특징적인 FTIR 흡수를 제공한다.
<표 6>
형태 B의 대표 샘플을 또한 고체 상태 13C 및 19F NMR을 사용하여 분석하였다. 각각의 NMR 스펙트럼은 도 11 및 도 12에 제공되었다. 13C SSNMR 및 19F SSNMR 스펙트럼에서 확인된 여러 개의 피크가 하기 표 7 및 표 8에 기재되어 있다.
<표 7>
<표 8>
화합물 1 형태 B의 단결정을 마이크로마운트(MicroMount) 루프 상에 고정시키고, 밀봉된 구리 X선 튜브 및 아펙스(Apex) II CCD 검출기가 설치된 브루커 아펙스 II 회절계에 맞추었다. 초기에, 40개 프레임으로 구성된 3개의 세트를 수집하여 예비 단위 셀을 결정하였다. 이 후에 15개의 스캔 및 6084개의 프레임으로 이루어진 완전한 데이터 세트를 입수하였다. 데이터 수집은 실온에서 수행하였다. 데이터를 브루커 AXS로부터의 아펙스 II 소프트웨어를 사용하여 통합하고 스케일링(scaled)하였다. 통합 및 스케일링은 6176개의 상을 생성하였고, 이들 중 2250개는 특이하였다. 구조는 SHELXTL 소프트웨어를 사용하여 공간군 P21/c에서의 직접적인 방법으로 규명하였다. 정밀화 역시 SHELXTL 소프트웨어를 사용하여 F2에 대한 풀 매트릭스(full matrix) 최소자승법으로 수행하였다. 모두 392개의 파라미터가 정밀화에 사용되어, 상 대 파라미터의 비율은 5.74였다. 최종 정밀화 인덱스는 wR2 = 0.0962이고 Rl = 0.0682였다 (I > 2 시그마(I)를 갖는 상의 경우에는 wR2 = 0.0850이고 Rl= 0.0412임).
형태 B의 N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드의 단결정은 단사 결정계, P21/c 공간군, 및 하기 단위 셀 치수를 갖는 것으로 결정되었다: a = 13.5429(4) Å, b = 13.4557(4) Å, c = 12.0592(4) Å, α = 90°, β = 101.193° 및 γ = 90°.
실시예 4B: N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드 (형태 B-HCl)의 제조
2-메틸테트라히드로푸란 100 mL를 교반기를 갖추고 있으며 질소 분위기를 갖는 3목 플라스크에 충전하였다. 화합물 I 형태 A-HCl (55 g, 0.103 mol), 이어서 2-메틸테트라히드로푸란 349 mL를 플라스크에 첨가하고, 교반을 개시하였다. 물 28 mL를 플라스크에 첨가하고 플라스크를 60℃의 내부 온도로 가온하고 48시간 동안 교반하였다. 플라스크를 실온으로 냉각시키고 1시간 동안 교반하였다. 필터 케이크가 건조될 때까지 반응 혼합물을 진공 여과하였다. 고형 필터 케이크를 2-메틸테트라히드로푸란 (4 vol)으로 2회 세척하였다. 고형 필터 케이크를 진공 흡인하에 약 30분의 기간 동안 둔 다음 건조 트레이로 옮겼다. 필터 케이크를 진공하에 60℃에서 건조시켜, 백색 결정질 고형물로서 형태 B-HCl을 제공하였다.
형태 B-HCl의 분말 회절도를 도 13에 나타냈다.
하기 표 9는 형태 B-HCl의 대표 XRPD 피크를 제공한다.
<표 9>
화합물 1 형태 B-HCl의 단결정은 단사 결정계, P21/a 공간군, 및 하기 단위 셀 치수를 갖는 것으로 결정되었다: a = 12.57334(5) Å, b = 19.68634(5) Å, c = 8.39399(5) Å, α = 90°, β = 90.0554° 및 γ = 90°.
형태 B-HCl의 대표 샘플을 또한 현미경을 사용하여 평가하였다.
형태 B-HCl의 대표 샘플의 DSC 곡선은 도 14에 제공되었다.
형태 B-HCl의 대표 샘플의 TGA 곡선은 도 15에 제공되었다.
형태 B-HCl의 대표 샘플은 도 16에 제공된 FTIR 스펙트럼을 제공하였다.
표 10은 형태 B-HCl의 특징적인 FTIR 흡수를 제공한다.
<표 10>
형태 B-HCl을 또한 고체 상태 13C 및 19F NMR을 사용하여 분석하였다. 각각의 NMR 스펙트럼은 도 17 및 도 18에 제공되었다. 13C SSNMR 및 19F SSNMR 스펙트럼에서 확인된 여러 개의 피크가 표 11 및 표 12에 나열되어 있다.
<표 11>
<표 12>
실시예 4C: N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드 (형태 B-HCl)의 별법의 제조
형태 A-HCl (14.638 g, 27.52 mmol)을 100 mL 들이 둥근 바닥 플라스크에 충전하였다. EtOH (248.9 mL) 및 물 (27.82 mL)을 첨가하였다. 백색 슬러리를 환류 온도로 가열하였다. 투명 용액이 77℃에서 수득되었다. 반응물을 45℃로 냉각시키고, 30분 동안 교반한 후에, 20℃로 냉각시켰다. 혼합물을 추가로 3시간 동안 20℃에서 교반하였다. 생성물을 여과하고 케이크를 EtOH로 세척하였다. 고형물을 진공 오븐에서 질소 흐름하에 45℃에서 건조시켜, 화합물 I 형태 B-HCl을 백색 고형물로서 제공하였다. XRPD 분석에 의해 고형물을 형태 B-HCl로서 확인하였다.
참고로, MeOH/H2O 및 IPA/H2O 등과 같은 기타 용매 조합을 본 실시예에서 기재된 EtOH/H2O 대신에 사용할 수 있다. 대체 용매 조합의 예가 표 13에 제공되었다.
<표 13>
또한, 실시예 3A, 3B 및 4A-4C에서, 용매로서 2-MeTHF 대신에 EtOAC를 사용할 수 있음을 주지한다.
화합물의 ΔF508-CFTR 강화 성질의 검출 및 측정을 위한 분석법
화합물의 ΔF508-CFTR 조정 성질을 분석하기 위한 막 전위 광학법
본 분석법은 형광성 전압 감수성 염료를 사용하여, 형광 플레이트 판독기 (예를 들어, 몰레큘라 디바이시즈, 인크.(Molecular Devices, Inc.) 제조의 FLIPR III)를 통해 NIH 3T3 세포에서의 기능적 ΔF508-CFTR의 증가에 대한 판독치로서 막 전위의 변화를 측정한다. 반응을 위한 구동력은 세포를 화합물로 미리 처리하고 나서 전압 감수성 염료를 로딩한 후에 단일 액체 첨가 단계에 의한 채널 활성화와 더불어 형성되는 클로라이드 이온 구배이다.
강화제 화합물의 확인
ΔF508-CFTR의 강화제를 확인하기 위해, 이중 첨가 HTS 분석 포맷을 개발하였다. 이 HTS 분석법은 형광성 전압 감수성 염료를 사용하여, FLIPR III을 통해 온도 보정된 ΔF508 CFTR NIH 3T3 세포에서의 ΔF508 CFTR의 게이팅 (전도도) 증가에 대한 척도로서 막 전위의 변화를 측정한다. 반응을 위한 구동력은 세포를 강화제 화합물 (또는 DMSO 비히클 대조군)로 미리 처리하고 나서 재분포 염료를 로딩한 후에 형광 플레이트 판독기, 예컨대 FLIPR III을 사용하는 단일 액체 첨가 단계에서의 포르스콜린에 의한 채널 활성화와 더불어 형성되는 Cl- 이온 구배이다.
용액
조(bath) 용액 #1: (mM) NaCl 160, KCl 4.5, CaCl2 2, MgCl2 1, HEPES 10, pH 7.4 (NaOH 사용).
조 용액 #1의 대체 용액은 클로라이드염이 글루코네이트염으로 교체된 조 용액을 포함한다.
세포 배양
ΔF508-CFTR을 안정적으로 발현하는 NIH3T3 마우스 섬유모세포를 막 전위의 광학 측정을 위해 사용하였다. 세포를 5% CO2 및 90% 습도에서 175 cm2 배양 플라스크 내의 2 mM 글루타민, 10% 태아 소 혈청, 1X NEAA, β-ME, 1X pen/strep 및 25 mM HEPES가 보충된 둘베코 변형 이글 배지(Dulbecco's modified Eagle's medium) 중에서 37℃에서 유지하였다. 모든 광학 분석법을 위해, 세포를 384웰 매트리겔 코팅된 플레이트에 약 20,000개/웰로 시딩하고 37℃에서 2시간 동안 배양한 후에, 강화제 분석을 위해 27℃에서 24시간 동안 배양하였다. 보정 분석법에서, 세포를 화합물의 존재 및 부재하에 16 내지 24시간 동안 27℃ 또는 37℃에서 배양하였다.
화합물의 ΔF508-CFTR 조정 성질을 분석하기 위한 전기생리학적 분석법
1. 유씽 챔버(Ussing Chamber) 분석법
유씽 챔버 실험을 ΔF508-CFTR을 발현하는 분극화 기도 상피 세포에서 수행하여 광학 분석법에서 확인된 ΔF508-CFTR 조정자를 추가로 특징화하였다. 비-CF 및 CF 기도 상피를 기관지 조직으로부터 단리하여 이미 개시된 바와 같이 배양하고 (문헌 [Galietta, L.J.V., Lantero, S., Gazzolo, A., Sacco, O., Romano, L., Rossi, G.A., & Zegarra-Moran, O. (1998) In Vitro Cell. Dev. Biol. 34, 478-481]), NIH3T3 컨디셔닝된 배지로 예비코팅된 코스타(Costar)® 스냅웰(Snapwell)™ 필터 상에 플레이팅하였다. 4일 후에 첨단 배지를 제거하고, 세포를 공기 액체 계면에서 >14일 동안 성장시킨 후에 사용하였다. 이로써, 기도 상피의 특징인 섬모를 갖는 완전 분화된 원주 세포의 단층이 생성되었다. 비-CF HBE를 임의의 알고 있는 폐 질환이 없는 비흡연자로부터 단리하였다. CF-HBE를 ΔF508-CFTR에 대하여 동형접합적인 환자로부터 단리하였다.
코스타® 스냅웰™ 세포 배양 삽입물 상에서 성장시킨 HBE를 유씽 챔버 (미국 캘리포니아주 샌디에고 소재의 피지올로직 인스트루먼츠, 인크.(Physiologic Instruments, Inc.))에 놓고, 기저측부에서 첨단부까지의 Cl- 구배 존재 하의 단락 전류 (ISC) 및 상피횡단 저항을 전압 클램프 시스템 (미국 아이오와주 소재의 아이오와 대학 생명공학부)을 사용하여 측정하였다. 간략하게 설명하면, HBE를 전압 클램프 기록 조건 (Vhold = 0 mV)하에 37℃에서 조사하였다. 기저측부 용액은 145 NaCl, 0.83 K2HPO4, 3.3 KH2PO4, 1.2 MgCl2, 1.2 CaCl2, 10 글루코스, 10 HEPES (NaOH를 사용하여 pH를 7.35로 조정함)를 함유하였고 (mM), 첨단부 용액은 145 Na글루코네이트, 1.2 MgCl2, 1.2 CaCl2, 10 글루코스, 10 HEPES (NaOH를 사용하여 pH를 7.35로 조정함)를 함유하였다 (mM).
강화제 화합물의 확인
전형적인 프로토콜은 기저막에서 첨단막까지의 Cl- 농도 구배를 이용하였다. 이러한 구배를 설정하기 위해, 기저막에는 통상의 링거를 사용하고 첨단부 NaCl은 동몰량의 나트륨 글루코네이트 (NaOH를 사용하여 pH 7.4로 적정함)로 대체하여, 상피를 교차하는 큰 Cl- 농도 구배를 제공하였다. 포르스콜린 (10 μM) 및 모든 시험 화합물을 세포 배양 삽입물의 첨단 쪽에 첨가하였다. 추정 ΔF508-CFTR 강화제의 효능을 공지된 강화제인 제니스테인의 효능과 비교하였다.
2. 패치 클램프 기록
ΔF508-NIH3T3 세포에서의 총 Cl- 전류를 이미 개시된 바와 같이 천공형 패치 기록 장치를 사용하여 모니터링하였다 (문헌 [Rae, J., Cooper, K., Gates, P., & Watsky, M. (1991) J. Neurosci. Methods 37, 15-26]). 전압 클램프 기록은 악소패치(Axopatch) 200B 패치 클램프 증폭기 (미국 캘리포니아주 포스터 시티 소재의 악손 인스트루먼츠 인크.(Axon Instruments Inc.))를 사용하여 22℃에서 수행하였다. 피펫 용액은 150 N-메틸-D-글루카민 (NMDG)-Cl, 2 MgCl2, 2 CaCl2, 10 EGTA, 10 HEPES 및 240 ㎍/mL 암포테리신-B (HCl을 사용하여 pH를 7.35로 조정함)를 함유하였다 (mM). 세포외 배지는 150 NMDG-Cl, 2 MgCl2, 2 CaCl2, 10 HEPES (HCl을 사용하여 pH를 7.35로 조정함)를 함유하였다 (mM). 펄스 발생, 데이터 입수 및 분석은 디지데이터(Digidata) 1320 A/D 인터페이스 및 클램펙스(Clampex) 8 (악손 인스트루먼츠 인크.)이 설치된 PC를 사용하여 수행하였다. ΔF508-CFTR을 활성화시키기 위해, 10 μM 포르스콜린 및 20 μM 제니스테인을 조에 첨가하고, 전류-전압 관계를 30초마다 모니터링하였다.
강화제 화합물의 확인
ΔF508-CFTR 강화제가 ΔF508-CFTR을 안정적으로 발현하는 NIH3T3 세포에서 거시적 ΔF508-CFTR Cl- 전류 (IΔF508)를 증가시키는 능력 또한 천공형 패치 기록 기법을 사용하여 조사하였다. 광학 분석법에서 확인된 강화제는 광학 분석법에서 관찰된 것과 유사한 효력 및 효능으로 IΔF508의 용량 의존성 증가를 야기하였다. 조사한 모든 세포에서, 강화제 적용 이전 및 적용 동안의 역전위는 약 -30 mV로, ECl 계산치 (-28 mV)에 해당하였다.
세포 배양
ΔF508-CFTR을 안정적으로 발현하는 NIH3T3 마우스 섬유모세포를 전세포 기록을 위해 사용하였다. 세포를 5% CO2 및 90% 습도에서 175 cm2 배양 플라스크 내의 2 mM 글루타민, 10% 태아 소 혈청, 1X NEAA, β-ME, 1X pen/strep 및 25 mM HEPES가 보충된 둘베코 변형 이글 배지 중에서 37℃에서 유지하였다. 전세포 기록을 위해, 2,500 내지 5,000개의 세포를 폴리-L-리신 코팅된 유리 커버슬립에 시딩하고 24 내지 48시간 동안 27℃에서 배양한 후에 이것을 사용하여 강화제의 활성을 시험하였고; 보정 화합물의 존재 또는 부재하에 37℃에서 인큐베이션하여 보정제의 활성을 측정하였다.
3. 단일-채널 기록
NIH3T3 세포에서 발현된 wt-CFTR 및 온도 보정된 ΔF508-CFTR의 게이팅 활성을 악소패치 200B 패치-클램프 증폭기 (악손 인스트루먼츠 인크.)를 사용하여 이미 개시된 바와 같이 절개된 내부-외부 막 패치 기록으로 관찰하였다 (문헌 [Dalemans, W., Barbry, P., Champigny, G., Jallat, S., Dott, K., Dreyer, D., Crystal, R.G., Pavirani, A., Lecocq, J-P., Lazdunski, M. (1991) Nature 354, 526-528]). 피펫은 150 NMDG, 150 아스파르트산, 5 CaCl2, 2 MgCl2 및 10 HEPES (트리스 염기를 사용하여 pH를 7.35로 조정함)를 함유하였다 (mM). 조는 150 NMDG-Cl, 2 MgCl2, 5 EGTA, 10 TES 및 14 트리스 염기 (HCl을 사용하여 pH를 7.35로 조정함)를 함유하였다 (mM). 절개 후에, wt- 및 ΔF508-CFTR은 둘다 1 mM Mg-ATP, 75 nM cAMP 의존성 단백질 키나제 (PKA; 미국 위스콘신주 매디슨 소재의 프로메가 코포레이션(Promega Corp.))의 촉매 서브유닛, 및 10 mM NaF 첨가에 의해 활성화되어 단백질 포스파타제를 억제하였고, 이것은 전류 감소를 저해하였다. 피펫 전위는 80 mV로 유지시켰다. 채널 활성은 2개 이하의 활성 채널을 함유하는 막 패치로부터 분석하였다. 동시에 개방된 최대 개수로 실험 동안의 활성 채널의 개수를 결정하였다. 단일 채널 전류 크기를 측정하기 위해서, 120초의 ΔF508-CFTR 활성으로부터 기록된 데이터를 100 Hz에서 "오프-라인(off-line)" 필터링한 후에 이것을 사용하여 바이오-패치(Bio-Patch) 분석 소프트웨어 (프랑스 소재의 바이오-로직 컴파니(Bio-Logic Comp.))를 사용하여 멀티가우시안(multigaussian) 함수로 맞춘 모든 지점 크기 히스토그램을 제작하였다. 총 미시적 전류 및 개방 확률(open probability; Po)을 120초의 채널 활성으로부터 측정하였다. Po는 바이오-패치 소프트웨어를 사용하여 결정하거나, 또는 관계식 Po = I/i(N) (여기서, I = 평균 전류, i = 단일 채널 전류 크기, 및 N = 패치내 활성 채널의 개수)으로부터 결정하였다.
세포 배양
ΔF508-CFTR을 안정적으로 발현하는 NIH3T3 마우스 섬유모세포를 절개된 막 패치-클램프 기록을 위해 사용하였다. 세포를 5% CO2 및 90% 습도에서 175 cm2 배양 플라스크 내의 2 mM 글루타민, 10% 태아 소 혈청, 1X NEAA, β-ME, 1X pen/strep 및 25 mM HEPES가 보충된 둘베코 변형 이글 배지 중에서 37℃에서 유지하였다. 단일 채널 기록을 위해, 2,500 내지 5,000개의 세포를 폴리-L-리신 코팅된 유리 커버슬립에 시딩하고 24 내지 48시간 동안 27℃에서 배양한 후에 사용하였다.
화합물 I 형태 A는 ATP 결합 카세트 운반체의 조정자로서 유용하다. 화합물 I 형태 A의 EC50 (㎛)은 2.0 μM 미만인 것으로 측정되었다. 화합물 I 형태 A의 효능은 100% 내지 25%인 것으로 계산되었다. 100% 효능은 4-메틸-2-(5-페닐-1H-피라졸-3-일)페놀에 의해 달성되는 최대 반응임을 알아야 한다.
Claims (99)
- 형태 A-HCl로서 특징화되는 N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드.
- 제1항에 있어서, X선 분말 회절 패턴에서 약 7.1°에서의 피크를 특징으로 하는 형태 A-HCl.
- 제1항 또는 제2항에 있어서, X선 분말 회절 패턴에서 약 21.2°에서의 피크를 특징으로 하는 형태 A-HCl.
- 제1항 내지 제3항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 6.9 내지 약 7.3°에서의 피크를 특징으로 하는 형태 A-HCl.
- 제1항 내지 제4항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 8.0 내지 약 8.4°에서의 피크를 특징으로 하는 형태 A-HCl.
- 제1항 내지 제5항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 13.9 내지 약 14.3°에서의 피크를 특징으로 하는 형태 A-HCl.
- 제1항 내지 제6항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 21.0 내지 약 21.4°에서의 피크를 특징으로 하는 형태 A-HCl.
- 제1항 내지 제7항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 14.5 내지 약 14.9°에서의 피크를 특징으로 하는 형태 A-HCl.
- 제1항 내지 제8항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 16.2 내지 약 16.6°에서의 피크를 특징으로 하는 형태 A-HCl.
- 제1항 내지 제9항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 18.5 내지 약 18.9°에서의 피크를 특징으로 하는 형태 A-HCl.
- 제1항 내지 제10항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 22.6 내지 약 23.0°에서의 피크를 특징으로 하는 형태 A-HCl.
- 제1항에 있어서, X선 분말 회절 패턴에서 약 6.9 내지 약 7.3°에서의 피크, 약 8.0 내지 약 8.4°에서의 피크, 약 13.9 내지 약 14.3°에서의 피크, 및 약 21.0 내지 약 21.4°에서의 피크를 특징으로 하는 형태 A-HCl.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 도 1의 회절 패턴을 특징으로 하는 형태 A-HCl.
- 제1항 내지 제13항 중 어느 한 항에 있어서, 13C NMR 스펙트럼에서 약 163.7 ppm에서의 피크를 특징으로 하는 형태 A-HCl.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 13C NMR 스펙트럼에서 약 137.2 ppm에서의 피크를 특징으로 하는 형태 A-HCl.
- 제1항 내지 제15항 중 어느 한 항에 있어서, 13C NMR 스펙트럼에서 약 121.5 ppm에서의 피크를 특징으로 하는 형태 A-HCl.
- 제1항 내지 제16항 중 어느 한 항에 있어서, 13C NMR 스펙트럼에서 약 163.7 ppm에서의 피크, 약 137.2 ppm에서의 피크, 및 약 121.5 ppm에서의 피크를 특징으로 하는 형태 A-HCl.
- 제1항 내지 제17항 중 어느 한 항에 있어서, 도 5의 13C NMR 스펙트럼을 특징으로 하는 형태 A-HCl.
- 제1항 내지 제18항 중 어느 한 항에 있어서, 19F NMR 스펙트럼에서 약 -57.0 ppm에서의 피크를 특징으로 하는 형태 A-HCl.
- 제1항 내지 제19항 중 어느 한 항에 있어서, 19F NMR 스펙트럼에서 약 -60.5 ppm에서의 피크를 특징으로 하는 형태 A-HCl.
- 제1항 내지 제20항 중 어느 한 항에 있어서, 19F NMR 스펙트럼에서 약 -57.0 ppm에서의 피크 및 약 -60.5 ppm에서의 피크를 특징으로 하는 형태 A-HCl.
- 제1항 내지 제21항 중 어느 한 항에 있어서, 도 6의 19F NMR 스펙트럼을 특징으로 하는 형태 A-HCl.
- 제1항 내지 제22항 중 어느 한 항에 있어서, 단사 결정계; P21/c 공간군; 및 하기 단위 셀 치수를 갖는 것으로 결정된 단결정임을 특징으로 하는 형태 A-HCl:
a = 13.6175(4) Å;
b = 21.614(3) Å;
c = 8.3941(4) Å;
α = 90°;
β = 112.303°; 및
γ = 90°. - 제1항 내지 제23항 중 어느 한 항의 형태 A-HCl, 및 제약상 허용되는 아주반트 또는 담체를 포함하는 제약 조성물.
- 형태 B로서 특징화되는 N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드.
- 제24항에 있어서, X선 분말 회절 패턴에서 약 6.5 내지 약 6.9°에서의 피크를 특징으로 하는 형태 B.
- 제25항 또는 제26항에 있어서, X선 분말 회절 패턴에서 약 9.2 내지 약 9.6°에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제27항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 11.0 내지 약 11.4°에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제28항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 13.2 내지 약 13.6°에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제29항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 15.0 내지 약 15.4°에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제30항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 17.0 내지 약 17.4°에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제31항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 17.6 내지 약 18.0°에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제32항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 17.9 내지 약 18.3°에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제33항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 19.1 내지 약 19.5°에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제34항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 19.9 내지 약 20.3°에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제35항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 21.0 내지 약 21.5°에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제36항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 21.8 내지 22.2°에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제37항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 23.8 내지 약 24.2°에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제38항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 26.0 내지 약 26.4°에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제39항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 27.1 내지 약 27.5°에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제40항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 27.5 내지 약 27.9°에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제41항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 28.7 내지 약 29.1°에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제42항 중 어느 한 항에 있어서, X선 분말 회절에서 약 6.5 내지 약 6.9° (예를 들어, 약 6.7°)에서의 피크; 약 9.8 내지 약 10.2° (예를 들어, 약 10.0°)에서의 피크; 약 11.0 내지 약 11.4° (예를 들어, 약 11.2°)에서의 피크; 약 13.2 내지 약 13.6° (예를 들어, 약 13.4°)에서의 피크; 및 약 23.8 내지 약 24.2° (예를 들어, 약 24.2°)에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제43항 중 어느 한 항에 있어서, X선 분말 회절에서 약 6.7°에서의 피크; 약 10.0°에서의 피크; 약 11.2°에서의 피크; 약 13.4°에서의 피크; 및 약 24.2°에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제44항 중 어느 한 항에 있어서, 도 7a 또는 7b의 회절 패턴을 특징으로 하는 형태 B.
- 제25항 내지 제45항 중 어느 한 항에 있어서, 13C NMR 스펙트럼에서 약 165.3 ppm에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제46항 중 어느 한 항에 있어서, 13C NMR 스펙트럼에서 약 145.9 ppm에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제47항 중 어느 한 항에 있어서, 13C NMR 스펙트럼에서 약 132.9 ppm에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제48항 중 어느 한 항에 있어서, 13C NMR 스펙트럼에서 약 113.4 ppm에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제49항 중 어느 한 항에 있어서, 13C NMR 스펙트럼에서 약 165.3 ppm에서의 피크, 약 145.9 ppm에서의 피크, 약 132.9 ppm에서의 피크, 및 약 113.4 ppm에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제50항 중 어느 한 항에 있어서, 도 11의 13C NMR 스펙트럼을 특징으로 하는 형태 B.
- 제25항 내지 제51항 중 어느 한 항에 있어서, 19F NMR 스펙트럼에서 약 -56.1 ppm에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제52항 중 어느 한 항에 있어서, 19F NMR 스펙트럼에서 약 -62.1 ppm에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제53항 중 어느 한 항에 있어서, 19F NMR 스펙트럼에서 약 -56.1 ppm에서의 피크 및 약 -62.1 ppm에서의 피크를 특징으로 하는 형태 B.
- 제25항 내지 제54항 중 어느 한 항에 있어서, 도 12의 19F NMR 스펙트럼을 특징으로 하는 형태 B.
- 제25항 내지 제55항 중 어느 한 항에 있어서, 단사 결정계, P21/c 공간군, 및 하기 단위 셀 치수를 갖는 것으로 결정된 단결정임을 특징으로 하는 형태 B:
a = 13.5429(4) Å;
b = 13.4557(4) Å;
c = 12.0592(4) Å;
α = 90°;
β = 101.193°; 및
γ = 90°. - 제25항 내지 제56항 중 어느 한 항의 형태 B, 및 제약상 허용되는 아주반트 또는 담체를 포함하는 제약 조성물.
- 형태 B-HCl로서 특징화되는 N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드.
- 제58항에 있어서, X선 분말 회절 패턴에서 약 8.1 내지 약 8.5°에서의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 또는 제59항에 있어서, X선 분말 회절 패턴에서 약 14.6 내지 약 15.1°에서의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제60항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 16.5 내지 약 16.9°에서의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제61항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 17.6 내지 약 18.4°에서의 3개의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제62항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 21.4 내지 약 22.1°에서의 2개의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제63항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 22.8 내지 약 23.8°에서의 2개의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제64항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 24.7 내지 약 25.4°에서의 2개의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제65항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 26.1 내지 약 27.3°에서의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제66항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 30.9 내지 약 31.3°에서의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제67항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 38.2 내지 약 38.7°에서의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제68항 중 어느 한 항에 있어서, 도 13의 X선 회절 패턴을 특징으로 하는 형태 B-HCl.
- 제58항 내지 제69항 중 어느 한 항에 있어서, X선 분말 회절 패턴에서 약 8.1 내지 약 8.5°에서의 피크, 약 14.6 내지 약 15.1°에서의 피크, 약 16.5 내지 약 16.9°에서의 피크, 약 17.6 내지 약 18.4°에서의 3개의 피크, 약 21.4 내지 약 22.1°에서의 2개의 피크, 약 22.8 내지 약 23.8°에서의 2개의 피크, 약 24.7 내지 약 25.4°에서의 2개의 피크, 약 26.1 내지 약 27.3°에서의 피크, 약 30.9 내지 약 31.3°에서의 피크, 및 약 38.2 내지 약 38.7°에서의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제70항 중 어느 한 항에 있어서, X선 분말 회절에서 약 8.1 내지 약 8.5°에서의 피크; 약 8.8 내지 약 9.2°에서의 피크; 약 12.8 내지 약 13.2°에서의 피크; 약 17.8 내지 약 18.2°에서의 피크; 및 약 22.8 내지 약 23.2°에서의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제71항 중 어느 한 항에 있어서, 13C NMR 스펙트럼에서 약 168.2 ppm에서의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제72항 중 어느 한 항에 있어서, 13C NMR 스펙트럼에서 약 148.7 ppm에서의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제73항 중 어느 한 항에 있어서, 13C NMR 스펙트럼에서 약 138.8 ppm에서의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제74항 중 어느 한 항에 있어서, 13C NMR 스펙트럼에서 약 119.8 ppm에서의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제75항 중 어느 한 항에 있어서, 13C NMR 스펙트럼에서 약 23.9 ppm에서의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제76항 중 어느 한 항에 있어서, 13C NMR 스펙트럼에서 약 168.2 ppm에서의 피크, 약 148.7 ppm에서의 피크, 약 138.8 ppm에서의 피크, 약 119.8 ppm에서의 피크, 및 약 23.9 ppm에서의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제77항 중 어느 한 항에 있어서, 도 17의 13C NMR 스펙트럼을 특징으로 하는 형태 B-HCl.
- 제58항 내지 제78항 중 어느 한 항에 있어서, 19F NMR 스펙트럼에서 약 -55.6 ppm에서의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제79항 중 어느 한 항에 있어서, 19F NMR 스펙트럼에서 약 -62.0 ppm에서의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제80항 중 어느 한 항에 있어서, 19F NMR 스펙트럼에서 약 -55.6 ppm에서의 피크 및 약 -62.0 ppm에서의 피크를 특징으로 하는 형태 B-HCl.
- 제58항 내지 제81항 중 어느 한 항에 있어서, 도 18의 19F NMR 스펙트럼을 특징으로 하는 형태 B-HCl.
- 제58항 내지 제82항 중 어느 한 항에 있어서, 단사 결정계, P21/a 공간군, 및 하기 단위 셀 치수를 갖는 것으로 결정된 단결정임을 특징으로 하는 형태 B-HCl:
a = 12.57334(5) Å;
b = 19.68634(5) Å;
c = 8.39399(5) Å;
α = 90°;
β = 90.0554°; 및
γ = 90°. - 제58항 내지 제83항 중 어느 한 항의 형태 B-HCl, 및 제약상 허용되는 아주반트 또는 담체를 포함하는 제약 조성물.
- 제1항 내지 제84항 중 어느 한 항에 따른 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들 형태의 임의의 조합의 유효량을 환자에게 투여하는 단계를 포함하는, 상기 환자에서의 낭성 섬유증, 천식, 흡연 유발 COPD, 만성 기관지염, 비부비동염, 변비, 췌장염, 췌장 기능부전, 선천성 양측 정관 결손증 (CBAVD)에 의해 유발되는 남성 불임증, 경증 폐 질환, 특발성 췌장염, 알레르기성 기관지폐 아스페르길루스증 (ABPA), 간 질환, 유전성 폐기종, 유전성 혈색소침착증, 응고-섬유소용해 결핍, 예컨대 단백질 C 결핍, 제1형 유전성 혈관부종, 지질 프로세싱 결핍, 예컨대 가족성 고콜레스테롤혈증, 제1형 킬로미크론혈증, 무베타지단백혈증, 리소솜 축적 질환, 예컨대 I 세포병/가성-후를러병(pseudo-Hurler), 점액다당류증, 샌드호프/테이-삭스병(Sandhof/Tay-Sachs), 제II형 크리글러-나자르병(Crigler-Najjar type II), 다발성내분비병증/고인슐린혈증, 당뇨병, 라론 왜소증(Laron dwarfism), 미엘로퍼옥시다제 결핍, 원발성 부갑상선기능저하증, 흑색종, 제1형 글리카노시스 CDG, 선천성 갑상선기능항진증, 골형성 부전, 유전성 저섬유소원혈증, ACT 결핍, 요붕증 (DI), 신경성 DI, 신성 DI, 샤르코-마리 투스 증후군(Charcot-Marie Tooth syndrome), 펠리체우스-메르츠바허병(Perlizaeus-Merzbacher disease), 신경변성 질환, 예컨대 알츠하이머병(Alzheimer's disease), 파킨슨병(Parkinson's disease), 근위축성 측삭 경화증, 진행성 핵상 마비, 픽병(Pick's disease), 여러 폴리글루타민 신경계 장애, 예컨대 헌팅톤병(Huntington's), 제I형 척수소뇌성 운동실조, 척수 및 연수 근육 위축, 치상핵적핵 담창구시상하핵 질환 및 근긴장성 이영양증 뿐만 아니라, 해면상 뇌병증, 예컨대 유전성 크로이츠펠트-야콥병(Creutzfeldt-Jakob disease; 프리온 단백질 프로세싱 결함으로 인한 것), 파브리병(Fabry disease), 스트라우슬러-샤잉커 증후군(Straussler-Scheinker syndrome), COPD, 안구건조증, 또는 쇼그렌병(Sjogren's disease), 골다공증, 골감소증, 골 치유 및 골 성장 (예를 들어, 골 복구, 골 재생, 골 재흡수 감소 및 골 침착 증가), 고램 증후군(Gorham's Syndrome), 클로라이드 채널병증, 예컨대 선천성 근긴장증 (톰슨(Thomson) 및 베커(Becker) 형태), 제III형 바터 증후군(Bartter's syndrome), 덴트병(Dent's disease), 과도놀람증, 간질, 과도놀람증, 리소솜 축적 질환, 안젤만 증후군(Angelman syndrome), 및 원발성 섬모 운동이상증 (PCD) [내장역위증 동반 PCD (카르타게너 증후군(Kartagener syndrome)이라고도 알려짐), 내장역위증 비동반 PCD 및 섬모 무형성을 비롯한, 섬모의 구조 및/또는 기능의 유전성 장애에 대한 용어]으로부터 선택되는 질환을 치료하거나 또는 그의 중증도를 감소시키는 방법.
- 제85항에 있어서, 상기 질환이 낭성 섬유증인 방법.
- 제1항 내지 제84항 중 어느 한 항에 따른 화합물의 유효량을 환자에게 투여하는 단계를 포함하는, 상기 환자에서의 CFTR을 코딩하는 유전자에서의 돌연변이 또는 환경 인자로 인한 CFTR 기능 감소와 관련있는 질환을 치료하거나 또는 그의 중증도를 감소시키는 방법.
- 제87항에 있어서, 질환이 낭성 섬유증, 만성 기관지염, 재발성 기관지염, 급성 기관지염, 선천성 양측 정관 결손증 (CBAVD)에 의해 유발되는 남성 불임증, 선천성 자궁 및 질 결손증 (CAUV)에 의해 유발되는 여성 불임증, 특발성 만성 췌장염 (ICP), 특발성 재발성 췌장염, 특발성 급성 췌장염, 만성 비부비동염, 원발성 경화성 담관염, 알레르기성 기관지폐 아스페르길루스증, 당뇨병, 건성안, 변비, 알레르기성 기관지폐 아스페르길루스증 (ABPA), 골 질환 및 천식인 방법.
- 제1항 내지 제84항 중 어느 한 항에 따른 화합물의 유효량을 환자에게 투여하는 단계를 포함하는, 상기 환자에서의 정상적인 CFTR 기능과 관련있는 질환을 치료하거나 또는 그의 중증도를 감소시키는 방법.
- 제89항에 있어서, 질환이 만성 폐쇄성 폐 질환 (COPD), 만성 기관지염, 재발성 기관지염, 급성 기관지염, 비부비동염, 변비, 만성 췌장염, 재발성 췌장염, 및 급성 췌장염, 췌장 기능부전, 선천성 양측 정관 결손증 (CBAVD)에 의해 유발되는 남성 불임증, 경증 폐 질환, 특발성 췌장염, 간 질환, 유전성 폐기종, 담석, 위식도 역류 질환, 위장 악성종양, 염증성 장 질환, 변비, 당뇨병, 관절염, 골다공증 및 골감소증인 방법.
- 제89항에 있어서, 질환이 유전성 혈색소침착증, 응고-섬유소용해 결핍, 예컨대 단백질 C 결핍, 제1형 유전성 혈관부종, 지질 프로세싱 결핍, 예컨대 가족성 고콜레스테롤혈증, 제1형 킬로미크론혈증, 무베타지단백혈증, 리소솜 축적 질환, 예컨대 I 세포병/가성-후를러병, 점액다당류증, 샌드호프/테이-삭스병, 제II형 크리글러-나자르병, 다발성내분비병증/고인슐린혈증, 당뇨병, 라론 왜소증, 미엘로퍼옥시다제 결핍, 원발성 부갑상선기능저하증, 흑색종, 제1형 글리카노시스 CDG, 선천성 갑상선기능항진증, 골형성 부전, 유전성 저섬유소원혈증, ACT 결핍, 요붕증 (DI), 신경성 DI, 신성 DI, 샤르코-마리 투스 증후군, 펠리체우스-메르츠바허병, 신경변성 질환, 예컨대 알츠하이머병, 파킨슨병, 근위축성 측삭 경화증, 진행성 핵상 마비, 픽병, 여러 폴리글루타민 신경계 장애, 예컨대 헌팅톤병, 제I형 척수소뇌성 운동실조, 척수 및 연수 근육 위축, 치상핵적핵 담창구시상하핵 질환 및 근긴장성 이영양증 뿐만 아니라, 해면상 뇌병증, 예컨대 유전성 크로이츠펠트-야콥병 (프리온 단백질 프로세싱 결함으로 인한 것), 파브리병, 스트라우슬러-샤잉커 증후군, 고램 증후군, 클로라이드 채널병증, 선천성 근긴장증 (톰슨 및 베커 형태), 제III형 바터 증후군, 덴트병, 과도놀람증, 간질, 과도놀람증, 리소솜 축적 질환, 안젤만 증후군, 원발성 섬모 운동이상증 (PCD), 내장역위증 동반 PCD (카르타게너 증후군이라고도 알려짐), 내장역위증 비동반 PCD 및 섬모 무형성, 또는 쇼그렌병인 방법.
- a. 제1항 내지 제84항 중 어느 한 항에 따른 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들 형태의 임의의 조합을 포함하는 조성물;
b. i. 조성물을 생물학적 샘플과 접촉시키는 것;
ii. CFTR 또는 그의 단편의 활성을 측정하는 것
에 대한 지침서
를 포함하는, 시험관내 또는 생체내 생물학적 샘플에서 CFTR 또는 그의 단편의 활성을 측정하는데 사용하기 위한 키트. - 제92항에 있어서,
i. 추가의 화합물을 생물학적 샘플과 접촉시키는 것;
ii. 상기 추가의 화합물의 존재하에서의 CFTR 또는 그의 단편의 활성을 측정하는 것; 및
iii. 추가의 화합물의 존재하에서의 CFTR의 활성을 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들 형태의 임의의 조합의 존재하에서의 CFTR의 활성과 비교하는 것
에 대한 지침서를 추가로 포함하는 키트. - 제93항에 있어서, 상기 CFTR 또는 그의 단편의 활성을 비교하는 단계가 상기 CFTR 또는 그의 단편의 밀도의 척도를 제공하는 것인 키트.
- CFTR을 제1항 내지 제84항 중 어느 한 항에 따른 형태 A-HCl, 형태 B, 형태 B-HCl, 또는 이들 형태의 임의의 조합과 접촉시키는 단계를 포함하는, 생물학적 샘플에서 CFTR 활성을 조정하는 방법.
- 제95항에 있어서, 환자가 동형접합적 ΔF508 돌연변이가 일어난 낭성 섬유증 막횡단 수용체 (CFTR)를 갖는 방법.
- 제95항에 있어서, 환자가 동형접합적 G551D 돌연변이가 일어난 낭성 섬유증 막횡단 수용체 (CFTR)를 갖는 방법.
- 제95항에 있어서, 환자가 이형접합적 ΔF508 돌연변이가 일어난 낭성 섬유증 막횡단 수용체 (CFTR)를 갖는 방법.
- 제95항에 있어서, 환자가 이형접합적 G551D 돌연변이가 일어난 낭성 섬유증 막횡단 수용체 (CFTR)를 갖는 방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US25461409P | 2009-10-23 | 2009-10-23 | |
| US61/254,614 | 2009-10-23 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120102645A true KR20120102645A (ko) | 2012-09-18 |
Family
ID=43334525
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127013139A KR20120102645A (ko) | 2009-10-23 | 2010-10-21 | N-(4-(7-아자비시클로[2.2.1]헵탄-7-일)-2-(트리플루오로메틸)페닐)-4-옥소-5-(트리플루오로메틸)-1,4-디히드로퀴놀린-3-카르복사미드의 고체 형태 |
Country Status (19)
| Country | Link |
|---|---|
| US (2) | US8389727B2 (ko) |
| EP (1) | EP2491042A1 (ko) |
| JP (1) | JP5877157B2 (ko) |
| KR (1) | KR20120102645A (ko) |
| CN (1) | CN102666546B (ko) |
| AR (1) | AR078766A1 (ko) |
| AU (1) | AU2010310617A1 (ko) |
| BR (1) | BR112012009584A2 (ko) |
| CA (1) | CA2778493A1 (ko) |
| CL (1) | CL2012001007A1 (ko) |
| HK (1) | HK1173151A1 (ko) |
| IL (1) | IL219327A0 (ko) |
| MX (1) | MX2012004791A (ko) |
| NZ (1) | NZ599703A (ko) |
| RU (1) | RU2568608C2 (ko) |
| TW (1) | TWI507409B (ko) |
| UA (1) | UA108087C2 (ko) |
| WO (1) | WO2011050220A1 (ko) |
| ZA (1) | ZA201202919B (ko) |
Families Citing this family (42)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20100074949A1 (en) | 2008-08-13 | 2010-03-25 | William Rowe | Pharmaceutical composition and administration thereof |
| EP1664006A2 (en) | 2003-09-06 | 2006-06-07 | Vertex Pharmaceuticals Incorporated | Modulators of atp-binding cassette transporters |
| US7977322B2 (en) | 2004-08-20 | 2011-07-12 | Vertex Pharmaceuticals Incorporated | Modulators of ATP-binding cassette transporters |
| HUE032540T2 (en) | 2004-06-24 | 2017-09-28 | Vertex Pharma | Modulators of ATP-binding cassette transporters |
| US7999113B2 (en) | 2005-08-11 | 2011-08-16 | Vertex Pharmaceuticals Incorporated | Modulators of cystic fibrosis transmembrane conductance regulator |
| KR20160067985A (ko) | 2005-11-08 | 2016-06-14 | 버텍스 파마슈티칼스 인코포레이티드 | Atp 결합 카세트 수송체의 헤테로사이클릭 조정제 |
| EP2016065B1 (en) | 2005-12-28 | 2012-09-19 | Vertex Pharmaceuticals Incorporated | 1-(benzo[d][1,3]dioxol-5-yl)-n-(phenyl)cyclopropane-carboxamide derivatives and related compounds as modulators of atp-binding cassette transporters for the treatment of cystic fibrosis |
| PL1993360T3 (pl) | 2005-12-28 | 2017-08-31 | Vertex Pharmaceuticals Incorporated | Stałe postacie n-[2,4-bis(1,1-dimetyloetylo)-5-hydroksyfenylo]-1,4- dihydro-4-oksochinolino-3-karboksyamidu |
| SI3091011T1 (en) * | 2006-04-07 | 2018-06-29 | Vertex Pharmaceuticals Incorporated | Modulators of ATP conveyor belt conveyors |
| US7645789B2 (en) * | 2006-04-07 | 2010-01-12 | Vertex Pharmaceuticals Incorporated | Indole derivatives as CFTR modulators |
| US10022352B2 (en) | 2006-04-07 | 2018-07-17 | Vertex Pharmaceuticals Incorporated | Modulators of ATP-binding cassette transporters |
| US8563573B2 (en) | 2007-11-02 | 2013-10-22 | Vertex Pharmaceuticals Incorporated | Azaindole derivatives as CFTR modulators |
| CN104447716A (zh) | 2007-05-09 | 2015-03-25 | 沃泰克斯药物股份有限公司 | Cftr调节剂 |
| CA2696298C (en) | 2007-08-24 | 2016-09-06 | Vertex Pharmaceuticals Incorporated | Modulators of cystic fibrosis transmembrane conductance regulator |
| SI2217572T1 (sl) | 2007-11-16 | 2014-05-30 | Vertex Pharmaceuticals Incorporated | Izokinolinski modulatorji prenaĺ alcev z atp-vezavno kaseto |
| EP2639224B1 (en) | 2007-12-07 | 2016-08-24 | Vertex Pharmaceuticals Incorporated | Process for producing cycloalkylcarboxiamido-pyridine benzoic acids |
| KR20100098545A (ko) * | 2007-12-07 | 2010-09-07 | 버텍스 파마슈티칼스 인코포레이티드 | 3(6(12,2디플루오로벤조〔d〕〔1,3〕디옥솔5일)사이클로프로판카복스아미도)3메틸피리딘2일)벤조산의 제형 |
| US20100036130A1 (en) * | 2007-12-07 | 2010-02-11 | Vertex Pharmaceuticals Incorporated | Processes for producing cycloalkylcarboxamido-pyridine benzoic acids |
| EP3683218A1 (en) | 2007-12-07 | 2020-07-22 | Vertex Pharmaceuticals Incorporated | Solid forms of 3-(6-(1-(2,2-difluorobenzo[d][1,3]dioxol-5-yl) cyclopropanecarboxamido)-3-methylpyridin-2-yl) benzoic acid |
| NZ602030A (en) | 2008-02-28 | 2014-02-28 | Vertex Pharma | Heteroaryl derivatives as cftr modulators |
| PL2615085T3 (pl) | 2008-03-31 | 2016-02-29 | Vertex Pharma | Pochodne pirydynowe jako modulatory CFTR |
| KR20110063578A (ko) * | 2008-09-29 | 2011-06-10 | 버텍스 파마슈티칼스 인코포레이티드 | 3-(6-(1-(2,2-디플루오로벤조[d][1,3]디옥솔-5-일)사이클로프로판카복스아미도)-3-메틸피리딘-2-일)벤조산의 투여 단위 |
| RU2518479C2 (ru) * | 2008-10-23 | 2014-06-10 | Вертекс Фармасьютикалз Инкорпорейтед | Твердые формы n-(7-азабицикло[2.2.1]гептан-7-ил-)-2-(трифторметил)фенил)-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоксамида |
| TWI465449B (zh) | 2008-10-23 | 2014-12-21 | Vertex Pharma | 囊腫性纖維化跨膜傳導調節因子之調控因子 |
| WO2010108162A1 (en) | 2009-03-20 | 2010-09-23 | Vertex Pharmaceuticals Incorporated | Process for making modulators of cystic fibrosis transmembrane conductance regulator |
| BR112012006031A2 (pt) * | 2009-09-17 | 2019-09-24 | Vertex Pharma | processo para preparação de compostos azabicíclicos. |
| CA2778492A1 (en) * | 2009-10-23 | 2011-04-28 | Vertex Pharmaceuticals Incorporated | Process for preparing modulators of cystic fibrosis transmembrane conductance regulator |
| CA2778493A1 (en) * | 2009-10-23 | 2011-04-28 | Vertex Pharmaceuticals Incorporated | Solid forms of n-(4-(7-azabicyclo[2.2.1]heptan-7-yl)-2-trifluoromethyl)phenyl)-4-oxo-5-(trifluoromethyl)-1,4-dihydroquinoline-3-carboxamide |
| US8802868B2 (en) | 2010-03-25 | 2014-08-12 | Vertex Pharmaceuticals Incorporated | Solid forms of (R)-1(2,2-difluorobenzo[D][1,3]dioxo1-5-yl)-N-(1-(2,3-dihydroxypropyl-6-fluoro-2-(1-hydroxy-2-methylpropan2-yl)-1H-Indol-5-yl)-Cyclopropanecarboxamide |
| NZ602795A (en) | 2010-04-07 | 2015-01-30 | Vertex Pharma | Solid forms of 3-(6-(1-(2,2-difluorobenzo[d][1,3]dioxol-5-yl) cyclopropanecarboxamido)-3-methylpyridin-2-yl)benzoic acid |
| CA2795804C (en) | 2010-04-07 | 2021-10-26 | Vertex Pharmaceuticals Incorporated | Pharmaceutical compositions of 3-(6-(1-(2,2-difluorobenzo[d][1,3]dioxol-5-yl) cyclopropanecarboxamido)-3-methylpyriodin-2-yl)benzoic acid and administration thereof |
| EP3381899B1 (en) | 2010-04-22 | 2021-01-06 | Vertex Pharmaceuticals Incorporated | Intermediate compound for process of producing cycloalkylcarboxamido-indole compounds |
| TW201202250A (en) * | 2010-05-20 | 2012-01-16 | Vertex Pharma | Processes for producing modulators of cystic fibrosis transmembrane conductance regulator |
| US8563593B2 (en) | 2010-06-08 | 2013-10-22 | Vertex Pharmaceuticals Incorporated | Formulations of (R)-1-(2,2-difluorobenzo[D] [1,3] dioxol-5-yl)-N-(1-(2,3-dihydroxypropyl)-6-fluoro-2-(1-hydroxy-2-methylpropan-2-yl)-1H-indol-5-yl)cyclopropanecarboxamide |
| ME02650B (me) | 2011-11-08 | 2017-06-20 | Vertex Pharma | Modulatori atp- vezujućih kasetnih transportera |
| US20130224293A1 (en) | 2012-02-27 | 2013-08-29 | Vertex Pharmaceuticals Incorporated | Pharmaceutical composition and administrations thereof |
| US8674108B2 (en) | 2012-04-20 | 2014-03-18 | Vertex Pharmaceuticals Incorporated | Solid forms of N-[2,4-bis(1,1-dimethylethy)-5-hydroxyphenyl]-1,4-dihydro-4-oxoquinoline-3-carboxamide |
| AR092857A1 (es) | 2012-07-16 | 2015-05-06 | Vertex Pharma | Composiciones farmaceuticas de (r)-1-(2,2-difluorobenzo[d][1,3]dioxol-5-il)-n-(1-(2,3-dihidroxipropil)-6-fluoro-2-(1-hidroxi-2-metilpropan-2-il)-1h-indol-5-il)ciclopropancarboxamida y administracion de las mismas |
| RU2016122882A (ru) | 2013-11-12 | 2017-12-19 | Вертекс Фармасьютикалз Инкорпорейтед | Способ получения фармацевтических композиций для лечения опосредованных cftr заболеваний |
| BR112016023422A8 (pt) | 2014-04-15 | 2021-07-20 | Vertex Pharma | dispersão seca por spray, composição farmacêutica e seus usos, kit e comprimido |
| JP6746569B2 (ja) | 2014-10-07 | 2020-08-26 | バーテックス ファーマシューティカルズ インコーポレイテッドVertex Pharmaceuticals Incorporated | 嚢胞性線維症膜貫通コンダクタンス制御因子のモジュレーターの共結晶 |
| CA2968130C (en) | 2014-11-18 | 2022-08-16 | Vertex Pharmaceuticals Incorporated | Process of conducting high throughput testing high performance liquid chromatography |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5304121A (en) | 1990-12-28 | 1994-04-19 | Boston Scientific Corporation | Drug delivery system making use of a hydrogel polymer coating |
| US5994341A (en) | 1993-07-19 | 1999-11-30 | Angiogenesis Technologies, Inc. | Anti-angiogenic Compositions and methods for the treatment of arthritis |
| ITMI941099A1 (it) * | 1994-05-27 | 1995-11-27 | Smithkline Beecham Farma | Derivati chinolinici |
| US6099562A (en) | 1996-06-13 | 2000-08-08 | Schneider (Usa) Inc. | Drug coating with topcoat |
| HUE032540T2 (en) | 2004-06-24 | 2017-09-28 | Vertex Pharma | Modulators of ATP-binding cassette transporters |
| PL1993360T3 (pl) * | 2005-12-28 | 2017-08-31 | Vertex Pharmaceuticals Incorporated | Stałe postacie n-[2,4-bis(1,1-dimetyloetylo)-5-hydroksyfenylo]-1,4- dihydro-4-oksochinolino-3-karboksyamidu |
| ES2602331T3 (es) | 2007-12-10 | 2017-02-20 | Novartis Ag | Pirazin-carboxamidas de tipo amilorida como bloqueantes de ENaC |
| TWI465449B (zh) * | 2008-10-23 | 2014-12-21 | Vertex Pharma | 囊腫性纖維化跨膜傳導調節因子之調控因子 |
| RU2518479C2 (ru) * | 2008-10-23 | 2014-06-10 | Вертекс Фармасьютикалз Инкорпорейтед | Твердые формы n-(7-азабицикло[2.2.1]гептан-7-ил-)-2-(трифторметил)фенил)-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоксамида |
| US20110257223A1 (en) * | 2008-10-23 | 2011-10-20 | Vertex Pharmaceuticals Incorporated | Modulators of Cystic Fibrosis Transmembrane Conductance Regulator |
| CA2778493A1 (en) * | 2009-10-23 | 2011-04-28 | Vertex Pharmaceuticals Incorporated | Solid forms of n-(4-(7-azabicyclo[2.2.1]heptan-7-yl)-2-trifluoromethyl)phenyl)-4-oxo-5-(trifluoromethyl)-1,4-dihydroquinoline-3-carboxamide |
| CA2778492A1 (en) * | 2009-10-23 | 2011-04-28 | Vertex Pharmaceuticals Incorporated | Process for preparing modulators of cystic fibrosis transmembrane conductance regulator |
-
2010
- 2010-10-21 CA CA2778493A patent/CA2778493A1/en not_active Abandoned
- 2010-10-21 AU AU2010310617A patent/AU2010310617A1/en not_active Abandoned
- 2010-10-21 CN CN201080053379.2A patent/CN102666546B/zh not_active Expired - Fee Related
- 2010-10-21 KR KR1020127013139A patent/KR20120102645A/ko not_active Application Discontinuation
- 2010-10-21 BR BR112012009584A patent/BR112012009584A2/pt not_active IP Right Cessation
- 2010-10-21 NZ NZ599703A patent/NZ599703A/en not_active IP Right Cessation
- 2010-10-21 RU RU2012121168/04A patent/RU2568608C2/ru not_active IP Right Cessation
- 2010-10-21 MX MX2012004791A patent/MX2012004791A/es active IP Right Grant
- 2010-10-21 JP JP2012535394A patent/JP5877157B2/ja not_active Expired - Fee Related
- 2010-10-21 US US12/909,789 patent/US8389727B2/en active Active
- 2010-10-21 WO PCT/US2010/053633 patent/WO2011050220A1/en active Application Filing
- 2010-10-21 UA UAA201206183A patent/UA108087C2/uk unknown
- 2010-10-21 EP EP10774360A patent/EP2491042A1/en not_active Withdrawn
- 2010-10-22 TW TW099136177A patent/TWI507409B/zh not_active IP Right Cessation
- 2010-10-25 AR ARP100103915A patent/AR078766A1/es unknown
-
2012
- 2012-04-20 CL CL2012001007A patent/CL2012001007A1/es unknown
- 2012-04-20 ZA ZA2012/02919A patent/ZA201202919B/en unknown
- 2012-04-22 IL IL219327A patent/IL219327A0/en unknown
-
2013
- 2013-01-11 HK HK13100461.5A patent/HK1173151A1/zh not_active IP Right Cessation
- 2013-01-28 US US13/751,656 patent/US8741922B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| BR112012009584A2 (pt) | 2019-09-24 |
| HK1173151A1 (zh) | 2013-07-05 |
| UA108087C2 (uk) | 2015-03-25 |
| JP2013508407A (ja) | 2013-03-07 |
| CA2778493A1 (en) | 2011-04-28 |
| RU2012121168A (ru) | 2013-11-27 |
| ZA201202919B (en) | 2013-06-26 |
| US20130137722A1 (en) | 2013-05-30 |
| RU2568608C2 (ru) | 2015-11-20 |
| CN102666546A (zh) | 2012-09-12 |
| MX2012004791A (es) | 2013-02-01 |
| US20110123449A1 (en) | 2011-05-26 |
| JP5877157B2 (ja) | 2016-03-02 |
| CL2012001007A1 (es) | 2012-09-07 |
| TWI507409B (zh) | 2015-11-11 |
| EP2491042A1 (en) | 2012-08-29 |
| IL219327A0 (en) | 2012-06-28 |
| WO2011050220A1 (en) | 2011-04-28 |
| NZ599703A (en) | 2014-06-27 |
| AU2010310617A1 (en) | 2012-05-24 |
| AR078766A1 (es) | 2011-11-30 |
| CN102666546B (zh) | 2015-09-09 |
| US8389727B2 (en) | 2013-03-05 |
| US8741922B2 (en) | 2014-06-03 |
| TW201121976A (en) | 2011-07-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8741922B2 (en) | Solid forms of N-(4-(7-azabicyclo[2.2,1]heptan-7-yl)-2-trifluoromethyl)phenyl)-4-oxo-5-(trifluoromethyl)-1,4-dihydroquinoline-3-carboxamide | |
| US8884018B2 (en) | Process for preparing modulators of cystic fibrosis transmembrane conductance regulator | |
| EP2358680B1 (en) | Solid forms of n-(4-(7-azabicyclo[2.2.1]heptan-7-yl)-2-(trifluoromethyl)phenyl)-4-oxo-5-(trifluoromethyl)-1,4-dihydroquinoline-3-carboxamide | |
| JP2012506866A (ja) | 嚢胞性線維症膜コンダクタンス制御因子の修飾因子 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| WITB | Written withdrawal of application |