KR20120052937A - 안정한 나노입자형 약물 현탁액 - Google Patents
안정한 나노입자형 약물 현탁액 Download PDFInfo
- Publication number
- KR20120052937A KR20120052937A KR1020127001358A KR20127001358A KR20120052937A KR 20120052937 A KR20120052937 A KR 20120052937A KR 1020127001358 A KR1020127001358 A KR 1020127001358A KR 20127001358 A KR20127001358 A KR 20127001358A KR 20120052937 A KR20120052937 A KR 20120052937A
- Authority
- KR
- South Korea
- Prior art keywords
- cancer
- abt
- composition
- compound
- particle size
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene or sparfloxacin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/02—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0087—Galenical forms not covered by A61K9/02 - A61K9/7023
- A61K9/0095—Drinks; Beverages; Syrups; Compositions for reconstitution thereof, e.g. powders or tablets to be dispersed in a glass of water; Veterinary drenches
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- Dispersion Chemistry (AREA)
- Hematology (AREA)
- Oncology (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Inorganic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Diabetes (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
액상 약제학적 조성물은 약 3㎛이하의 D90 입자 크기를 가진 ABT-263과 같은 고체 입자 Bcl-2 계열 단백질 억제 화합물이 현탁된 수성 매질을 포함하고; 이때상기 수성 매질은 하나 이상의 약제학적으로 허용되는 계면활성제 및 중탄산나트륨과 같은 하나 이상의 약제학적으로 허용되는 염기화제를 입자 크기의 증가를 함께 억제하기 위한 유효량으로 추가로 포함한다. 상기 조성물은 하나 이상의 항-아폽토시스 Bcl-2 계열 단백질의 과발현을 특징으로 하는 질환, 예를 들어 암을 치료하기 위해 이것을 필요로 하는 대상자에게 경구 또는 비경구 투여하기에 적합하다.
Description
본 출원은 2009년 6월 18일 일자로 출원된 미국 가출원 번호 제 61/218,281호에 대한 우선권을 주장하고, 이의 전문은 본원에 참조로서 인용된다
발명의 분야
본 발명은 저용해도의 입자형 약물 화합물을 포함하는 액상 현탁액 제형 및 상기 제형의 제조 방법에 관한 것이다. 본 발명은 특히 Bcl-2 계열 단백질들을 표적으로 하는 아폽토시스-촉진 화합물 계열에 적용할 수 있고 따라서, 본 발명은 추가로 상기 단백질들의 과발현을 특징으로 하는 질병 치료를 위한 액상 현탁액 제형의 사용 방법에 관한 것이다.
아폽토시스의 회피는 암의 한 특징이다[참조: Hanahan & Weinberg (2000) Cell 100:57-70]. 암 세포들은 DNA 손상, 발암 유전자 활성화, 비정상적 세포 주기 진행 및 정상 세포들이 아폽토시스 되도록 하는 혹독한 미세환경들과 같은 세포 스트레스들에 의한 계속적인 충격을 극복해야 한다. 암세포들이 아폽토시스를 회피하는 주요 수단 중 하나는 Bcl-2 계열의 항-아폽토시스 단백질을 상향조절하는 것이다.
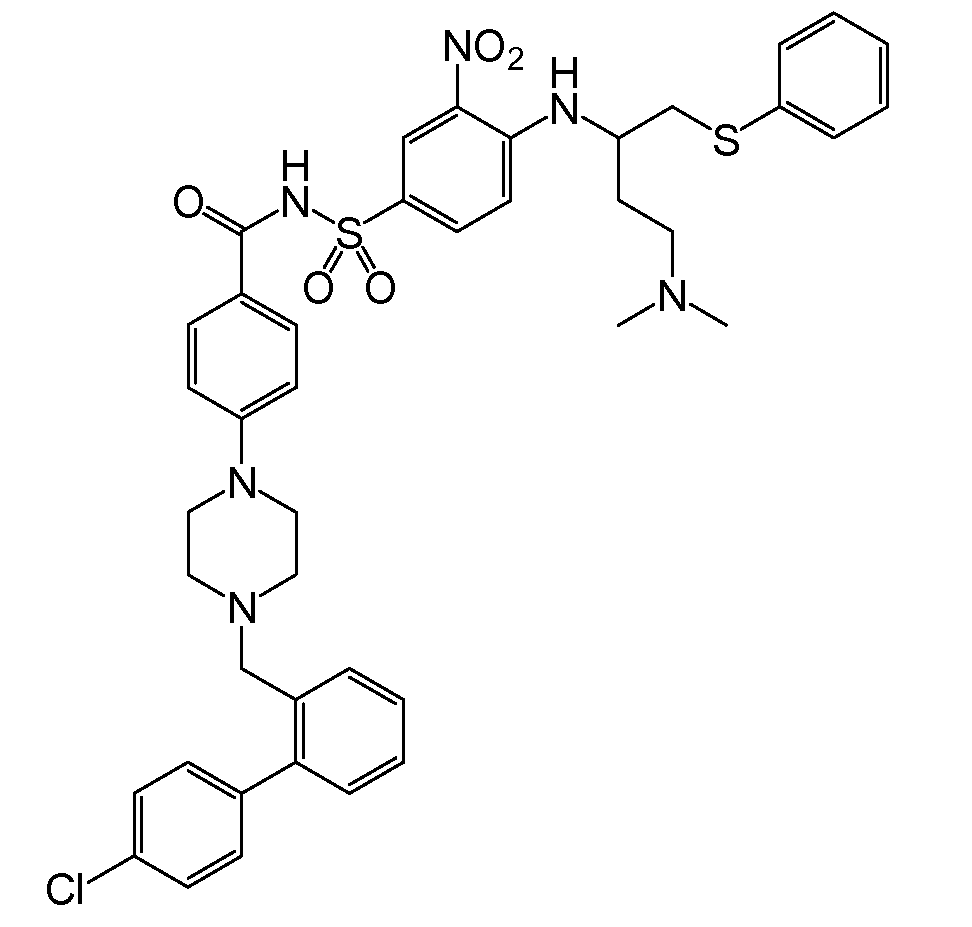
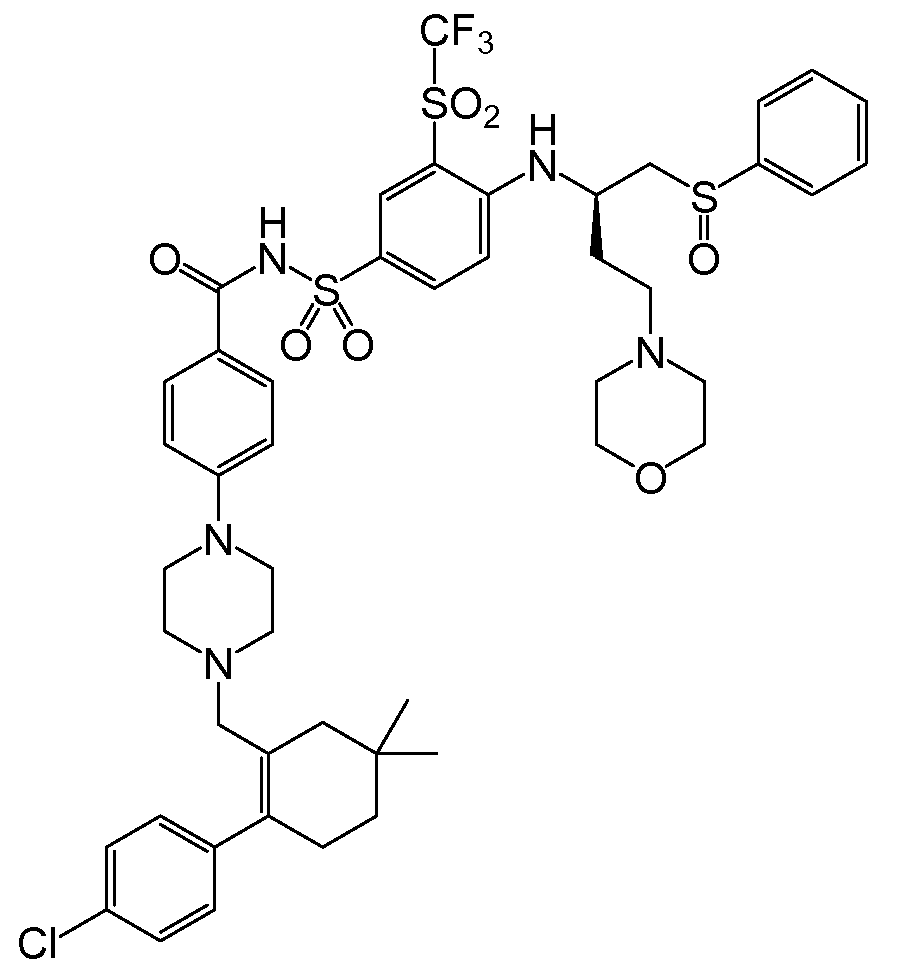
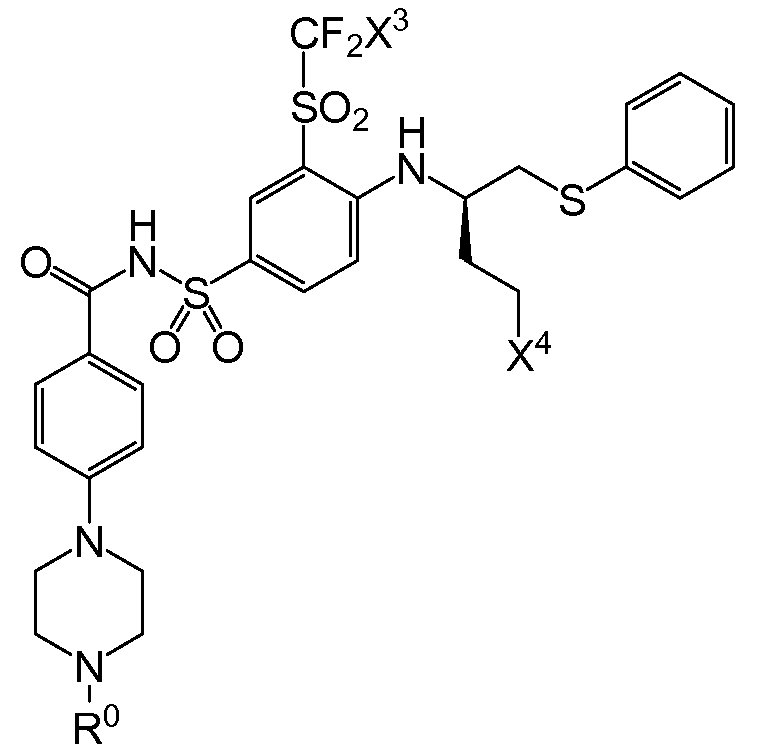
Bcl-2 단백질의 BH3 결합 홈(binding groove)을 점유하는 화합물들이, 예를 들면, 문헌[참조: Bruncko et al . (2007) J. Med . Chem . 50:641-662]에 기술되어 있다. 상기 화합물로는, ABT-737로도 공지되어 있는, 하기 화학식을 갖는 N-(4-(4-((4'-클로로-(1,1'-바이페닐)-2-일)메틸)피페라진-1-일)벤조일)-4-(((1R)-3-(디메틸아미노)-1-((페닐설파닐)메틸)프로필)아미노)-3-니트로벤젠-설폰아미드가 포함된다.
ABT-737은 Bcl-2 계열 단백질(상세하게는, Bcl-2, Bcl-X L 및 Bcl-w)에 높은 친화성(<1nM)으로 결합한다. 이는 소세포 폐암(SCLC)과 림프구성 악성 종양에 대항하는 단일-약제 활성을 나타내며, 기타 화학요법제들의 아폽토시스 촉진 효과를 강화시킨다. ABT-737 및 관련 화합물들 및 이러한 화합물들의 제조방법은 미국 특허 출원 공보 제2007/0072860호(Bruncko et al.)에 기재되어 있다.
더욱 최근에, Bcl-2 계열 단백질들에 대해 높은 결합 친화성을 갖는 일련의 화합물들이 추가로 확인되었다. 이들 화합물들 및 이들의 제조방법은 본원에 전문이 참조로서 인용된 미국 특허 출원 공보 제2007/0027135호(Bruncko et al.)(본원에서 "'135 공보")에 기재되어 있으며, 이들의 하기 화학식으로부터 ABT-737과 구조적으로 관련되어 있음을 알 수 있다.
'135 공보는 종래에 공지된 Bcl-2 계열 단백질의 억제제들이 강력한 세포 효능 또는 경구 투여후 높은 전신 노출량 중 어느 하나를 가질 수는 있지만 이들 특성을 둘 다 갖지는 않는다고 기술한다. 화합물의 세포 효능의 통상적 척도는 50% 세포 효과를 유발하는 농도(EC50)이다. 화합물의 경구 투여후 전신 노출량의 통상적 척도는 화합물의 혈장 농도를 경구 투여 후의 경과 시간으로 그래프화하여 수득한 곡선하 면적(AUC)이다. '135 공보에 언급된 종래에 공지된 화합물들은 낮은 AUC/EC50 비를 갖는데, 이는 이들이 경구적으로 효과적이지 않다는 것을 의미한다. 반면, 상기 화학식의 화합물은 종래에 공지된 화합물의 것보다 훨씬 더 높은 AUC/EC50 비를 가져, 세포 효능과 경구 투여후 전신 노출량에 관해 향상된 특성들을 갖는 것으로 입증된다고 기술되어 있다.
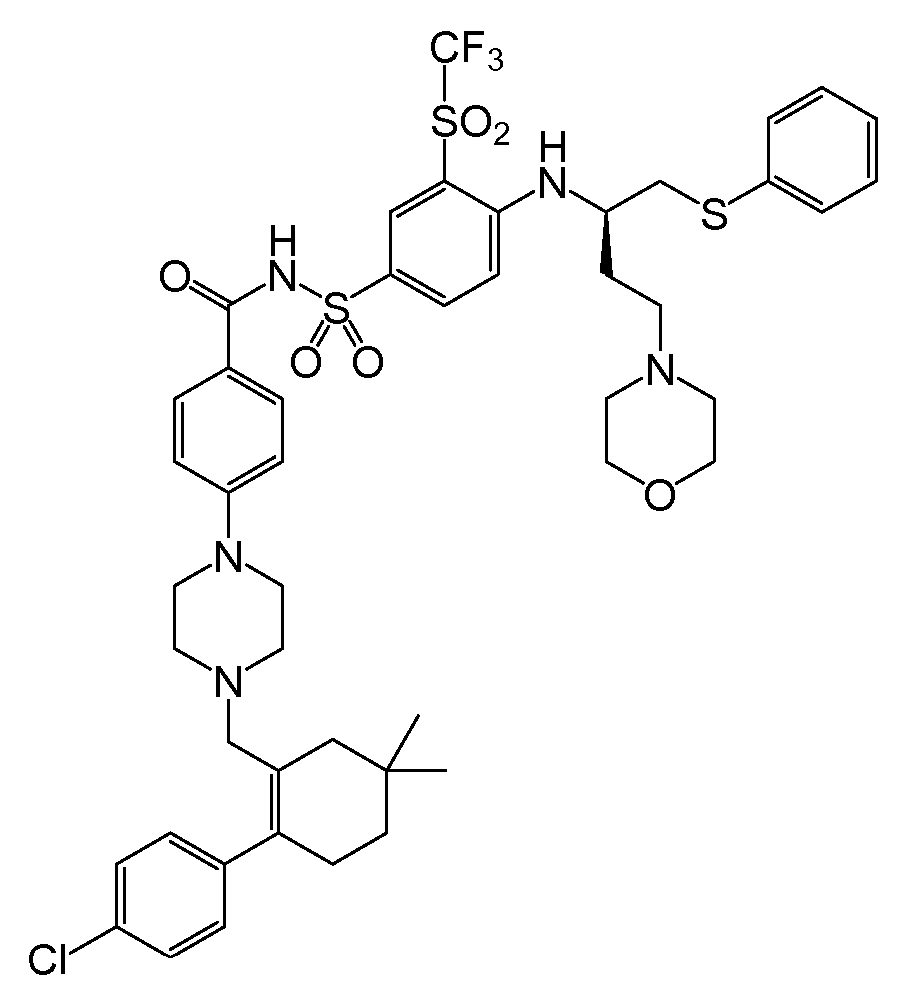
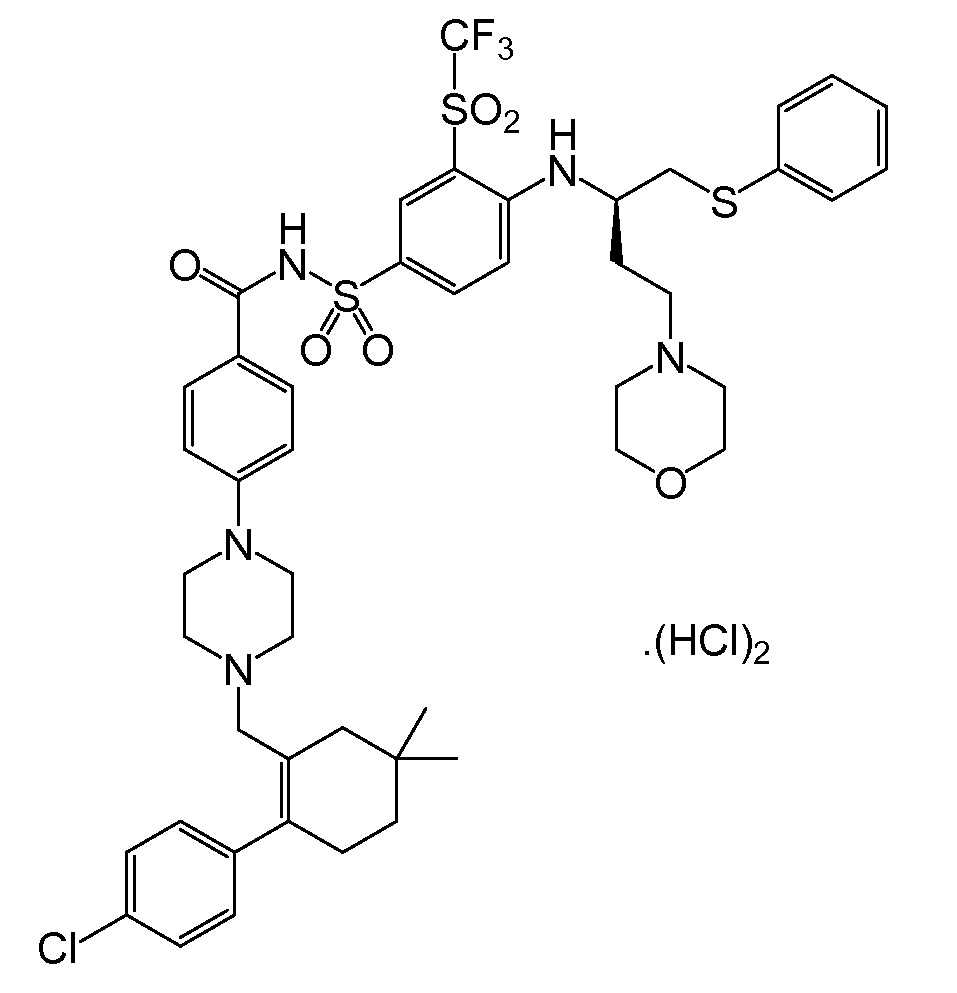
'135 공보의 "실시예 1"에서 확인된 하나의 화합물은, ABT-263으로도 공지되어 있는, N-(4-(4-((2-(4-클로로페닐)-5,5-디메틸-1-사이클로헥스-1-엔-1-일)메틸)피페라진-1-일)벤조일)-4-(((1R)-3-(모르폴린-4-일)-1-((페닐설파닐)메틸)프로필)아미노-3-((트리플루오로메틸)설포닐)벤젠설폰아미드이다. 이 화합물은 분자량이 974.6g/mol이고, 하기 화학식을 갖는다:
ABT-263은 Bcl-2 및 Bcl-XL에 높은 친화성(<1nM)으로 결합하고, Bcl-w에 대해서도 이와 유사하게 높은 친화성을 갖는 것으로 사료된다. 이의 AUC/EC50 비는 '135 공보에 56으로 보고되어 있으며, 이는 ABT-737에 대해 보고된 것(4.5)보다 한자리수 이상 더 크다. '135 공보에 따른 AUC의 측정을 위해, 각 화합물을 10% DMSO(디메틸 설폭사이드)/PEG-400(평균 분자량 약 400의 폴리에틸렌 글리콜)의 비히클 중 2㎎/㎖ 용액으로서 경구 위관 영양법에 의해 5㎎/kg 단일 용량으로 래트에 투여하였다.
경구 생체이용률(예를 들면, 경구 투여후 AUC를 정맥내 투여후 AUC의 백분율로서 나타냄)은 '135 공보에 보고되어 있지 않지만, 이로부터 ABT-263의 것이 ABT-737의 것보다 실질적으로 더 클 것으로 결론지을 수 있다.
최근에, 문헌[참조: Tse et al .(2008) Cancer Res . 68(9):3421-3428]에서도개에 투여하였을 때 PEG400/DMSO중의 ABT-263 용액의 경구 생체이용률이 22.4%이고, 60%의 PhosalTM PG(포스파티딜콜린+프로필렌 글리콜)과 30% PEG-400과 10%의 에탄올중에서의 ABT-263 용액의 경구 생체이용률은 47.6% 이었다는 보충자료가 있다.
산화 반응은 특히 용액에서 제형화 되는 경우 약제의 중요한 분해 경로를 나타낸다. 산화는 산소 분자에 의한 기질의 비촉매 자가 산화, 광분해 개시, 용혈성 열 분열 및 금속 촉매를 포함하는 다수의 경로에 의해 일어날 수 있다. 다양한 관능 그룹들은 산화에 대한 특정한 민감도를 나타낸다. 특히, 티오에테르는 황 원자의α-위치에서 수소 탈취 또는 α-퍼옥실 라디칼의 직접 부가에 의해 또는 단일 전자 전달 과정을 통해 분해될 수 있으며, 이는 설파이드를 설핀, 설폰 또는 설폭사이드로 변형시킨다. [참조: Hovorka & Schoneich(2001) J. Pharm . Sci . 90:253-269)
ABT-263을 포함해 '135공보에 기술된 화합물이 갖고 있는 (페닐설파닐)메틸 그룹은 티오에테르 연결기(linkage)를 갖는 것으로 나타나며, 이는 예를 들면 산소 또는 초산화물, 과산화수소 또는 하이드록실 라디칼과 같은 반응성 산소 종들의 존재하에 산화되기 쉬운 것으로 보인다. '135 공보는 게재된 화합물의 투여에 유용한 부형제들의 광범위한 목록 중에 산화방지제들을 포함한다.
그러나, 약제학적 조성물들은 활성성분의 산화에 덜 민감한 것이 유리할 것이다. 게다가 조성물들은 '135 공보 또는 문헌[Tse et al . (2008), supra]의 용액 조성물보다 더 높게 활성성분을 로딩(loading)할 수 있는 것이 유리할 것이다.
ABT-263을 포함하는 수성 용해도가 매우 낮은 '135 공보 화합물은 제형화기와 관련된 문제점을 발생시키고, 위장관의 수성 매질중의 용해도에 강하게 의존하는 허용가능한 경구 생체이용률을 유지할 필요가 있는 경우 특히 그러하다. 입자 크기 감소는 흔히 불량한 수용성 약물의 생체이용률을 증가시키기 위한 방법으로서 시도되고 있으나, 임의의 크기의 고체입자들을 사용하여 용액 형태의 약물로 수득될 수 있는 것에 상응하는 생체이용률을 달성하기란 흔히 어렵고, 이는 입자크기 감소에 있어서 궁극적인 과제인 것으로 고려될 수 있다.
액체 매질 중 불량한 수용성 약물 입자의 현탁액을 제공하는 제형화기에 대한 또 다른 문제점은 현탁된 입자, 특히 1 ㎛ 크기 이하의 매우 작은 입자는 시간이 지남에 따라, 예를 들어 입자 응집을 통해 입자 크기가 커지는 경향이 있다. 그러한 입자 크기의 증가는 현탁액을 불안정하게 할 수 있고/있거나 이의 생체이용률을 저하시킬 수 있다. 계면 활성제와 같은 표면 개질제들은 폭넓게 사용되고 있으나 항상 성공적인 것은 아니다. 미국 특허 제 7,459,283호(Wertz & Ryde)에는 조성물들이 표면 안정화제로서 리소자임을 가지고 있는 나노 입자형 활성제를 포함하는 것으로 되어 있다.
문헌 [참조:Moschwitzer et al. (2004) Eur . J. Pharmaceut . Biopharmaceut. 58:615-619]에는 8.4%의 중탄산나트륨과 1%의 폴록사머 188을 포함한 수성 매질에 약물의 분산에 의한 오메프라졸(omeprazole)의 나노현탁액(액체상에서 나노결정(<1000nm직경) 분산액으로써 정의되어 있다)의 제법이 기재되어 있다. 물리적 안정성 연구들은 0℃에서 3일이 지나면 중간 입자 크기로 증가한다고 밝혔다; 저자들은 그 크기는 증가한다고 결론지었다. "물론 이 나노현탁액들이 2년의 장기적 안정성을 지니는 것은 아니라고 지적한다". 오메프라졸의 화학적 안정성은 50 또는 100mg/ml의 나노현탁액 대 5mg/ml의 수용액으로 제형화 함으로써 크게 증가한다고 알려졌었다; 저자들은 나노입자들의 결정구조를 포함하는 것이 그러한 안정성을 위한 설명이 가능하다고 인용했다.
이 점에서, ABT-263은, '135 공보에 따라 제조되는 경우 이것은 무정형 고체; 즉, 오메프라졸과 같은 결정성이 결핍되어 있기 때문에 나노현탁액 제형을 위해 불량한 후보로 보인다.
개선된 요법을 필요로 하는 특정 유형의 질환은 비-호지킨 림프종(NHL)이다. NHL은 미국에서 여섯 번째로 유행하고 있는 신종 암이며, 주로 60대와 70대 환자들 사이에서 발생한다. NHL은 단일 질환이 아니라, 임상적 속성과 조직학을 포함한 수개의 특성들을 기반으로 분류되는 관련 질환들의 한 계열이다.
하나의 분류 방법은 상이한 조직학적 아형들을 고유 병력을 기준으로 2개의 주요 범주, 즉, 지연형(indolent)과 공격형(aggressive)으로 나누는 것이다. 일반적으로, 지연형 아형들은 서서히 진행하고 일반적으로 치유가 불가능한 반면, 공격형 아형들은 빠르게 진행하고 잠재적으로 치유가 가능하다. 가장 흔한 지연형 아형은 여포성 림프종이고, 미만성 거대세포 림프종은 가장 흔한 공격형 아형이다. 종양 단백질 Bcl-2는 비-호지킨 B-세포 림프종에서 최초로 기술되었다.
여포성 림프종의 치료는 통상적으로 생물학적-기반 또는 병용 화학요법으로 이루어진다. 리툭시맙, 사이클로포스파미드, 독소루비신, 빈크리스틴 및 프레드니손의 병용 요법(R-CHOP)은 리툭시맙, 사이클로포스파미드, 빈크리스틴 및 프레드니손의 병용 요법(RCVP)과 마찬가지로 통상적으로 사용된다. 리툭시맙(B-세포의 표면에서 균일하게 발현되는 인단백질인 CD20을 표적화함) 또는 플루다라빈의 단일-약제 요법도 사용된다. 화학요법제 용법에 리툭시맙을 추가하면 개선된 반응 속도 및 증가된 무진행 생존율을 제공할 수 있다.
난치성 또는 재발성 비-호지킨 림프종을 치료하는 데에는 방사선 면역 요법제, 고용량 화학요법 및 줄기세포 이식을 사용할 수 있다. 현재, 치유를 제공하는 승인된 치료 용법은 존재하지 않으며, 현재의 가이드라인들은, 심지어 제1선 현장(first-line setting)에서도, 환자들을 임상 시험의 맥락에서 치료할 것을 권장한다.
공격형 거대 B-세포 림프종 환자의 제1선 치료는 통상적으로 리툭시맙, 사이클로포스파미드, 독소루비신, 빈크리스틴 및 프레드니손(R-CHOP) 또는 용량-조절된 에토포사이드, 프레드니손, 빈크리스틴, 사이클로포스파미드, 독소루비신 및 리툭시맙(DA-EPOCH-R)으로 이루어진다.
대부분의 림프종은 초기에는 상기 요법들 중 어느 하나에 반응하지만, 종양은 보통 재발되고 결국 난치성이 된다. 환자가 받는 용법의 수가 증가할수록, 화학요법에 대한 질환의 내성은 커지게 된다. 제1선 치료에 대한 평균 반응은 대략 75%, 제2선 치료는 60%, 제3선 치료는 50%, 그리고 제4선 치료는 약 35 내지 40%이다. 다수의 재발된 현장에서 단일 약제로 20%에 도달한 반응율은 확실하고 보증된 향후 연구로서 간주된다.
현재의 화학요법제들은 다양한 기전들을 통해 아폽토시스를 유도함으로써 이들의 항종양 반응을 유발해낸다. 그러나, 다수의 종양들은 궁극적으로 이들 약제들에 내성을 갖게 된다. Bcl-2 및 Bcl-X L 은 시험관내(in vitro) 및 더욱 최근에는 생체내(in vivo) 단기 생존율 분석에서 화학요법 내성을 부여하는 것으로 나타났다. 이는, Bcl-2 및 Bcl-X L 의 기능 억제를 목표로 하는 개선된 치료법들이 개발될 수 있다면, 상기 화학요법-내성은 성공적으로 극복될 수 있을 것이다.
Bcl-2 및 Bcl-X L 과 같은 Bcl-2 계열 단백질들을 표적화하는 아폽토시스-촉진 약물들은 치료학적 유효 범위에서 농도를 유지하기 위해 혈장 농도의 보강을 지속적으로, 예를 들어 매일 제공하는 용법에 따라 최상으로 투여된다. 이는 일일 단위의 비경구, 예를 들면, 정맥내(i.v.) 또는 복강내(i.p.) 투여에 의해 달성될 수 있다. 그러나, 일일 단위의 비경구 투여는 특히 외래 환자의 경우 임상 현장에서 흔히 실용적이지 않다. 예컨대 암 환자에게 화학요법제로서의 아폽토시스-촉진제의 임상적 유용성을 증진시키기 위해서는, 허용되는 경구 생체이용률을 가진 투여 형태 또는 용액 제형보다 덜 제한적인 투여 형태가 매우 바람직할 것이다. 이러한 투여 형태 및 이의 경구 투여를 위한 용법은 비-호지킨 림프종을 포함하는 다수의 암 유형들의 치료에서 중대한 진보이고, 화학요법제와의 병용 치료를 더욱 용이하게 실현할 수 있을 것이다.
발명의 개요
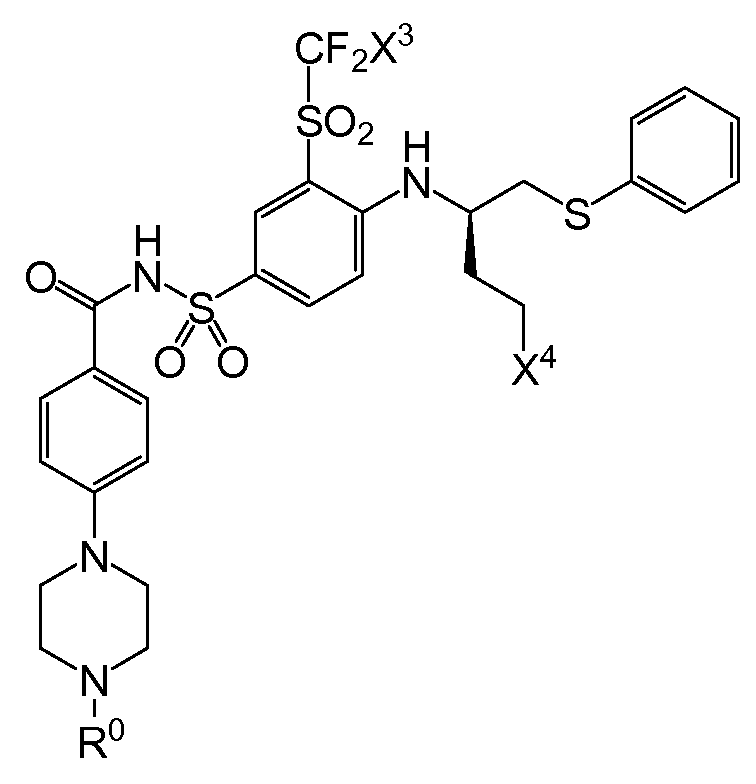
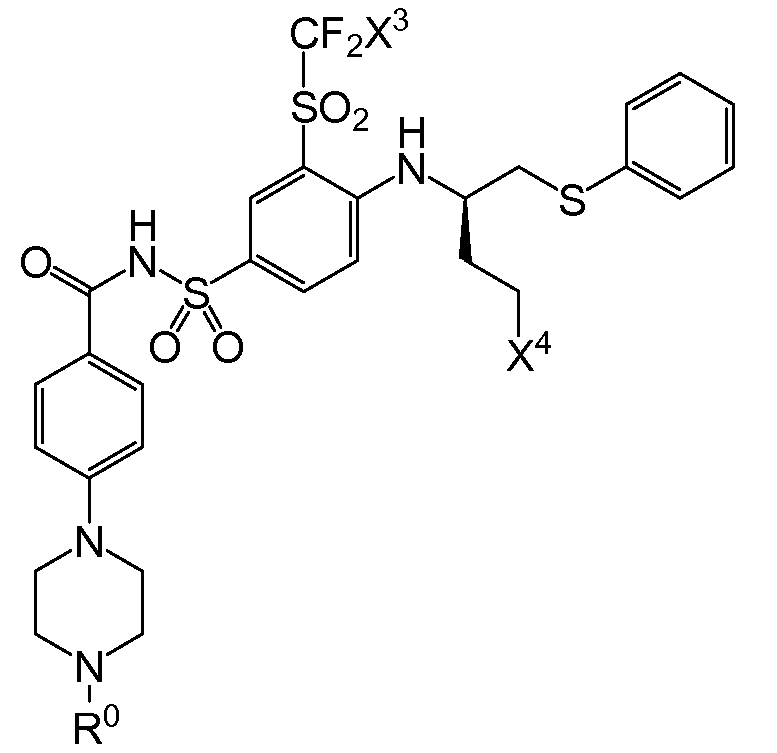
3㎛이하의 D90 입자 크기를 갖는 고체 입자 화합물이 현탁되어 있는 수성 매질을 포함하는 액상 약제학적 조성물이 제공되고, 이때 상기 화합물은 화학식 Ⅰ의 화합물, 이의 약제학적으로 허용되는 염, 프로드럭, 프로드럭의 염 또는 이의 대사물이고, 상기 수성 매질은 입자 크기 증가를 함께 억제하기 위한 유효량으로 하나 이상의 약제학적으로 허용되는 계면활성제 및 하나 이상의 약제학적으로 허용되는 염기화제를 포함한다.
화학식 Ⅰ
상기 화학식 I에서,
X3은 클로로 또는 플루오로이고,
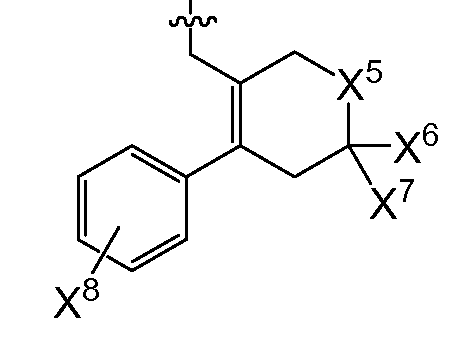
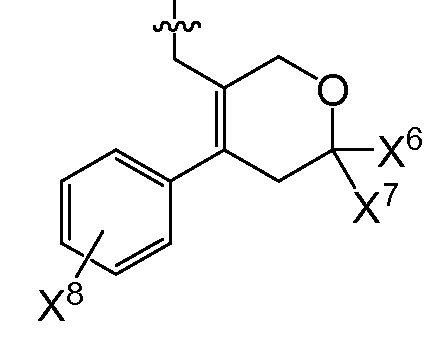
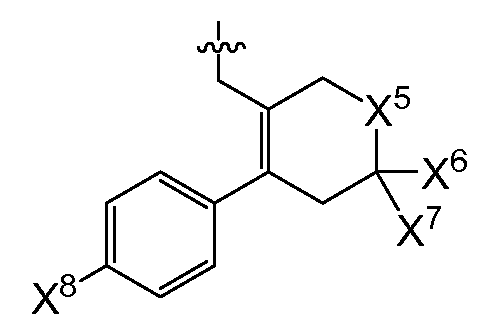
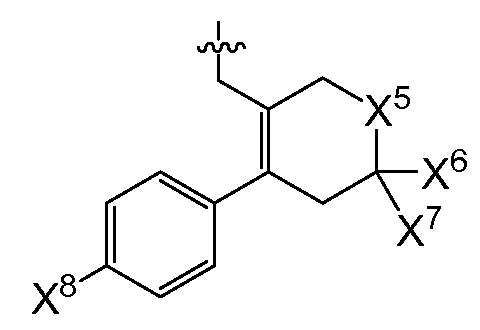
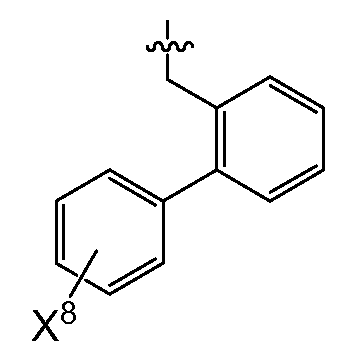
(1) X4는 아제판-1-일, 모르폴린-4-일, 1,4-옥사제판-4-일, 피롤리딘-1-일, -N(CH3)2, -N(CH3)(CH(CH3)2), 7-아자바이사이클로[2.2.1]헵탄-7-일 또는 2-옥사-5-아자바이사이클로[2.2.1]헵트-5-일이고, R0은
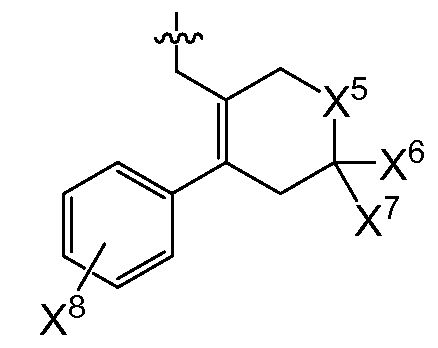
(여기서, X5는 -CH2 -, -C(CH3)2- 또는 -CH2CH2 -이고,
X6 및 X7은 둘 다 -H 이거나, 둘 다 메틸이고,
X8은 플루오로, 클로로, 브로모 또는 요오도이다)이거나;
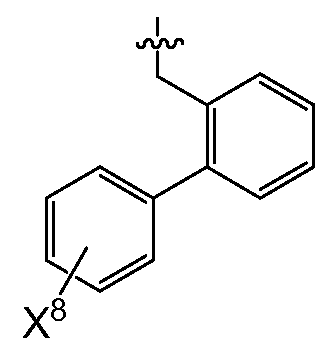
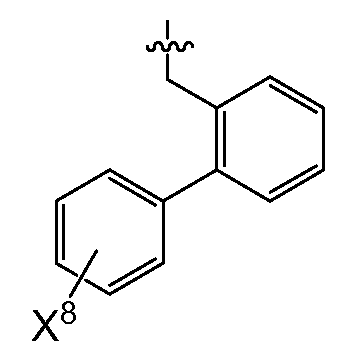
(2) X4는 아제판-1-일, 모르폴린-4-일, 피롤리딘-1-일,-N(CH3)(CH(CH3)2) 또는 7-아자바이사이클로[2.2.1]헵탄-7-일이고,R0은 (여기서, X6, X7 및 X8은 상기된 바와 같다)이거나;
비록 본 발명의 조성물은 기본적으로 경구 투여용으로 의도한 것이나, 일반적으로 또한 비경구 경로를 포함한 다른 경로용으로도 적합하다.
더 나아가 약 3㎛이하의 D90 입자 크기를 가지고 있는 입자형 형태로, 화학식 Ⅰ의 화합물 또는 약제학적으로 허용되는 염, 프로드럭, 프로드럭의 염 또는 이의 대사물; 및 (a)하나 이상의 계면활성제와 하나 이상의 염기화제 및 (b)하나 이상의 분산제와 증량제를 포함하는 약제학적으로 허용되는 부형제를 포함하는 고체 약제학적 조성물이 제공되고, 상기 조성물은 수성 매질에 분산시켜 현탁액을 수득할 수 있고 이때, 계면활성제 및 염기화제는 함께 입자 크기 증가를 억제하기 위한 유효량으로 존재한다.
여전히 더 나아가 화학식Ⅰ의 화합물 또는 약제학적으로 허용되는 염, 프로드럭, 프로드럭의 염 또는 이의 대사물을 포함하는 활성 약제학적 성분(API)을 제공하고, 하나 이상의 약제학적으로 하용되는 염기화제의 존재하에 상기 API를 약 3㎛이하의 D90 입자 크기로 습식 분쇄하여 분쇄된 약물을 수득하고, 하나 이상의 약제학적으로 허용되는 계면활성제를 가진 수성 매질 중에 분쇄된 약물 기질을 현탁시킴을 포함하는, 약제학적 조성물을 제조하기 위한 방법이 제공되며, 이때 하나 이상의 염기화제와 하나 이상의 계면활성제는 입자 크기 증가를 함께 억제하기 위한 유효량으로 수득한 현탁액에 존재한다.
임의의 상기 양태들에 따르면, 약물 화합물 또는 API는, 예를들면 ABT-263 또는 이의 결정성 염, 예를 들어, ABT-263 bis-염화수소(ABT-263 bis-HCl)염일 수 있다.
또한 추가로 아폽토시스 기능이상 및/또는 항-아폽토시스 Bcl-2 계열 단백질의 과발현을 특징으로 하는 질환의 치료 방법이 제공되고, 상기 방법은 아폽토시스 기능이상 및/또는 항-아폽토시스 Bcl-2 계열 단백질의 과발현을 특징으로 하는 질환을 갖는 대상자에게 상술된 바와 같은 조성물, 예를들어 ABT-263 유리 염기 또는 ABT-263 bis-HCl을 포함하는 조성물의 치료학적 유효량을 경구 투여함을 포함한다. 상기 질환의 예로는 암을 비롯한 다수의 신생물 질환들이 포함된다. 본 발명의 방법에 따라 치료될 수 있는 특정한 예시적 유형의 암은 비-호지킨 림프종(NHL)이다. 본 발명의 방법에 따라 치료될 수 있는 또 다른 특정한 예시적 유형의 암은 만성 림프구성 백혈병이다. 본 발명의 방법에 따라 치료될 수 있는 또 다른 특정한 예시적 유형의 암은 예를 들면, 소아 환자에서의 급성 림프구성 백혈병이다.
추가로, 사람 암 환자, 예를 들면 비-호지킨 림프종, 만성 림프구성 백혈병 또는 급성 림프구성 백혈병 환자의 혈류에서 치료학적 유효 혈장 농도의 ABT-263 및/또는 하나 이상의 이의 대사물을 유지시키는 방법도 제공되며, 상기 방법은 상기 ABT-263 유리 염기 또는 결정성 염을 포함하는 조성물을 1일 약 50 내지 약 500㎎의 ABT-263 유리 염기와 등량으로 약 3시간 내지 약 7일의 평균 투여 간격으로 대상자에게 투여함을 포함한다.
앞서 제공된 것들의 더 구체적인 측면들을 포함하는 본 발명의 추가의 양태들은 하기된 상세한 설명에서 발견되거나 이로부터 명백해질 것이다.
도 1은 본 발명의 조성물(제형 Ⅱ) 및 지질 매질(제형C) 중 ABT-263 bis-HCl의 비교 용액을 개(별도로 표시한 것 외에 공복이 아닌 상태)에 경구 투여함에 따른 24시간 동안의 ABT-263 혈장 농도를 그래프로 도시한 것이며, 실시예 3에 기술되어 있다.
본원에 따른 현탁액 조성물은 나노 크기의 고체 입자형 약물 화합물을 포함한다. 본원에 기술된 현탁액 중에 약물 나노입자는 눈에 띄게 응집하지 않지만, 안정적인 제형의 생산물을 수득함이 발견됐다.
본원에서 다른 언급이 없는 한, "나노입자(nanoparticle)" 용어는 약 3㎛(3,000nm)이하의 입자 크기(입자의 가장 긴 차원의 직경)를 말한다. 인용된 "나노입자들"은 1㎛미만의 입자(submicron)뿐 아니라 약 1 내지 약 3㎛의 입자(micron-sized)를 포함한다. 비슷하게 형용사 "나노 크기의"도 상기 나노입자와 같이 정의된다. 본문에서 다른 언급이 없는 한, "나노입자형(nanoparticulate)"은 현탁액 또는 다른 조성물로써, "나노현탁액(nanosuspension)"은 약 3 ㎛이하의 D90 입자 크기를 가진 것을 의미한다.
조성물의 D90 입자 크기는 매개 변수이며 그러한 것은 조성물 중 입자들의 90% 부피 백분율이 당업자에게 공지된 종래 입자크기 측정 기술에 의해 측정된 그 변수보다 그들의 가장 긴 차원이 작다는 것이다. 그러한 기술은, 예를 들어 침강장 흐름 분획법(sedimentation field flow fractionation), 광자 상관 분광 측정기(photon correlation spectroscopy), 광산란법(light scattering) 및 디스크 원심 분리법(disk centrifugation)을 포함한다. 본 발명의 다양한 양태에서, 현탁액들은 D90 입자 크기가 약 3,000nm, 약 2,000nm, 약 1,500nm, 약 1,000nm, 약 900nm, 약 800nm, 약 700nm, 약 600nm, 약 500nm 이하이다.
조성물의 D50 입자 크기는 매개 변수이며 그러한 것은 조성물 중 입자들의 50% 부피 백분율이 당업자에게 공지된 종래 입자 크기 측정 기술에 의해 측정된 그 변수보다 그들의 가장 긴 차원이 작다는 것이다. 그러므로 D50 입자 크기는 부피 중앙값의 입자 크기의 측정이나, 때때로 "평균(average 또는 mean)" 입자 크기를 언급한다. 본 발명의 다양한 양태에서, 현탁액들은 D50입자 크기가 약 1,000nm, 약 900nm, 약 800nm, 약 700nm, 약 600nm, 약 500nm, 약 400nm, 약 350nm, 약 300nm 이하이다.
특정 양태에서 본 발명의 현탁액은 D90 입자 크기가 약 1,000nm 이하이며 D50 입자 크기는 약 400nm이하이다. 또 다른 특정 양태에서는, 본 발명의 현탁액은 D90 입자 크기가 약 800nm 이하이며 D50 입자 크기는 약 350nm이하이다.
"저용해도(low solubility)" 및 "불량한 용해성(poorly soluble)"은 수용해도가 약 100 ㎍/ml 이하인 것이다. 본 발명은 약물로서 물에 본질적으로 용해되지 않는 것, 즉 약 10 ㎍/ml보다 낮은 용해도를 갖는 것이 특히 유리할 수 있다. 이론에 결부시키지 않고, 그러한 약물을 위한 나노입자형 현탁액의 장점은 잘 알려진 휘트니-노이 방정식에 따른 표면적에 비례하는 개선된 용해율뿐만 아니라, 켈빈 방정식에 따른 개선된 용해도를 부분적으로 유발한다. 잠재적으로 식효(food effect)를 감소시킬 뿐 아니라 생체이용률을 증진시킬 수 있다.
많은 화합물의 수용해도는 PH-의존적이라고 인식되며, 본원에서 관심있는 그러한 화합물의 용해도의 경우, 생리학적으로 관련된 pH, 예를 들면 약 1 내지 약 8의 pH의 것이라고 인식될 것이다. 따라서, 다양한 양태들에서, 약물은 약 1 내지 약 8의 pH 범위 내의 적어도 한 점에서, 약 100㎍/㎖ 미만, 예를 들면 약 30㎍/㎖ 미만 또는 약 10㎍/㎖ 미만의 수용해도를 갖는다. 예시적으로, ABT-263은 pH 2에서 4㎍/㎖ 미만의 수용해도를 갖는다.
본 발명의 조성물에서, 약물 화합물은 상기 명시된 화학식 Ⅰ의 화합물 또는 약제학적으로 허용되는 염, 프로드럭, 프로드럭의 염 또는 이의 대사물이다.
추가의 양태에서, 상기 화합물은 X3이 플루오로인 화학식 I을 갖는다.
또다른 추가의 양태에서, 상기 화합물은 X4가 모르폴린-4-일인 화학식 I을 갖는다.
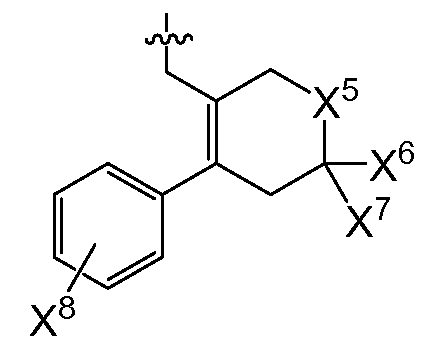
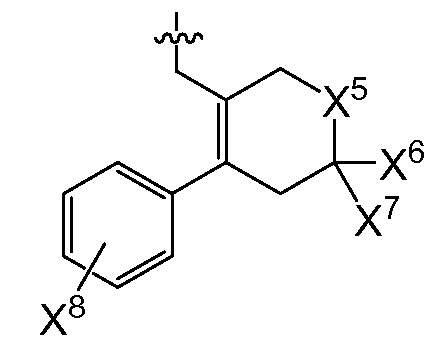
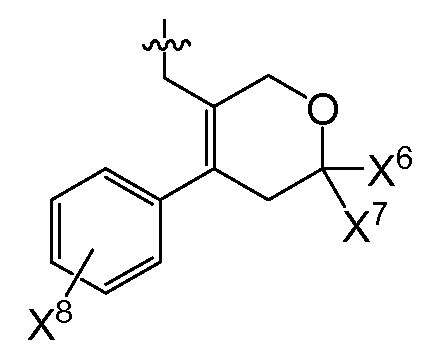
또다른 추가의 양태에서, 상기 화합물은 R0이 인 화학식 I을 갖는다(여기서, X5는 -O-, -CH2 -, -C(CH3)2- 또는 -CH2CH2- 이고, X6 및 X7은 둘 다 -H이거나 둘 다 메틸이고, X8은 플루오로, 클로로, 브로모 또는 요오도이다). 예시적으로, 당해 양태에 따르면, X5는 -C(CH3)2-일 수 있고/있거나 X6 및 X7은 각각 -H일 수 있고/있거나 X8은 클로로일 수 있다.
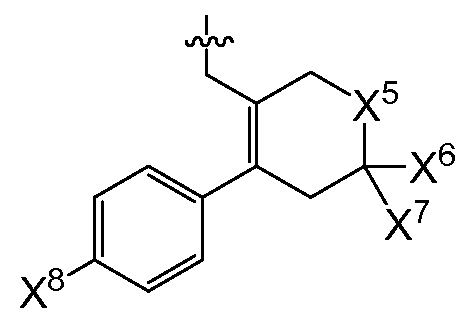
또 다른 추가의 양태에서, 상기 화합물은 R0이 인 화학식 I을 갖는다(여기서, X5는 -O-, -CH2 -, -C(CH3)2- 또는 -CH2CH2- 이고, X6 및 X7은 둘 다 -H이거나 둘 다 메틸이고, X8은 플루오로, 클로로, 브로모 또는 요오도이다). 예시적으로, 당해 양태에 따르면, X5는 -C(CH3)2-일 수 있고/있거나 X6 및 X7은 각각 -H일 수 있고/있거나 X8은 클로로일 수 있다.
또다른 추가의 양태에서, 상기 화합물은 X3이 플루오로이고 X4가 모르폴린-4-일인 화학식 I을 갖는다.
또다른 추가의 양태에서, 상기 화합물은 X3이 플루오로이고 R0이 인 화학식 I을 갖는다(여기서, X5는 -O-, -CH2-, -C(CH3)2 -또는 -CH2CH2-이고, X6 및 X7은 둘 다 -H이거나 둘 다 메틸이고, X8은 플루오로, 클로로, 브로모 또는 요오도이다). 예시적으로, 당해 양태에 따르면, X5는 -C(CH3)2-일 수 있고/있거나 X6 및 X7은 각각 -H일 수 있고/있거나 X8은 클로로일 수 있다.
또다른 추가의 양태에서, 상기 화합물은 X4가 모르폴린-4-일이고 R0이 인 화학식 I을 갖는다(여기서, X5는 -O-, -CH2-, -C(CH3)2- 또는 -CH2CH2-이고, X6 및 X7은 둘 다 -H이거나 둘 다 메틸이고, X8은 플루오로, 클로로, 브로모 또는 요오도이다). 예시적으로, 당해 양태에 따르면, X5는 -C(CH3)2-일수 있고/있거나 X6 및 X7은 각각 -H일 수 있고/있거나 X8은 클로로일 수 있다.
또다른 추가의 양태에서, 상기 화합물은 X3이 플루오로이고 X4가 모르폴린-4-일이며 R0이 인 화학식 I을 갖는다(여기서, X5는 -O-, -CH2-, -C(CH3)2 -또는 -CH2CH2-이고, X6 및 X7은 둘 다 -H이거나 둘 다 메틸이고, X8은 플루오로, 클로로, 브로모 또는 요오도이다). 예시적으로, 당해 양태에 따르면, X5는 -C(CH3)2-이거나/또는 X6 및 X7은 각각 -H일 수 있고/있거나 X8은 클로로일 수 있다.
화학식 I의 화합물들은 비대칭적으로 치환된 탄소 원자들을 R- 또는 S-배열로 함유할 수 있으며, 이러한 화합물들은 라세미체로서 존재할 수 있거나, 어느 하나의 배열이 다른 배열보다 과량으로, 예를 들면 적어도 약 85:15의 에난티오머 비율로 존재할 수 있다. 상기 화합물은 실질적으로 에난티오머적으로 순수할 수 있으며, 예를 들면, 적어도 약 95:5 또는 몇몇 경우 적어도 약 98:2 또는 적어도 약 99:1의 에난티오머 비율을 가질 수 있다.
화학식 I의 화합물들은 대안적으로 또는 추가로, 탄소-탄소 이중 결합 또는 탄소-질소 이중 결합을 Z- 또는 E-배열로 함유할 수 있으며, "Z"라는 용어는 큰 치환체들이 이중 결합의 동일 측면 상에 존재하는 배열을 의미하고, "E"라는 용어는 큰 치환체들이 이중 결합의 반대쪽 측면들 상에 존재하는 배열을 의미한다. 당해 화합물은 대안적으로 Z-이성질체와 E-이성질체의 혼합물로서 존재할 수 있다.
화학식 I의 화합물들은 대안적으로 또는 추가로, 양성자가 한 원자로부터 다른 원자로 이동하는 호변체들 또는 이의 평형 혼합물로서 존재할 수 있다. 호변체의 예로는 예시적으로, 케토-에놀, 페놀-케토, 옥심-니트로소, 니트로-아시, 이민-엔아민 및 이와 같은 것을 포함한다.
몇몇 양태에서, 화학식 I의 화합물은 이의 모 화합물 형태에서 단독으로 또는 염 또는 프로드럭 형태의 화합물과 함께, 나노입자형 현탁액 중에 존재한다.
화학식 I의 화합물들은 산 부가염, 염기 부가염 또는 양쪽성 이온을 형성할 수 있다. 화학식 I의 화합물의 염은 당해 화합물이 분리되는 동안 또는 정제된 후에 제조될 수 있다. 산 부가염은 화학식 I의 화합물과 산과의 반응으로부터 유도된 것들이다. 예를 들면, 화학식 I의 화합물의, 아세트산염, 아디프산염, 알긴산염, 중탄산염, 시트르산염, 아스파르트산염, 벤조산염, 벤젠설폰산염(베실산염), 중황산염, 부티르산염, 캄포르산염, 캄포르설폰산염, 디글루콘산염, 포름산염, 푸마르산염, 글리세로인산염, 글루탐산염, 헤미황산염, 헵탄산염, 헥산산염, 하이드로클로라이드, 하이드로브로마이드, 하이드로요오다이드, 락토비온산염, 락트산염, 말레산염, 메시틸렌설폰산염, 메탄설폰산염, 나프틸렌설폰산염, 니코틴산염, 옥살산염, 파모산염, 펙틴산염, 과황산염, 인산염, 피크르산염, 프로피온산염, 석신산염, 타르타르산염, 티오시안산염, 트리클로로아세트산염, 트리플루오로아세트산염, 파라-톨루엔설폰산염 및 운데칸산염을 포함하는 염이 본 발명의 조성물에 사용될 수 있다. 리튬, 나트륨, 칼륨, 칼슘 및 마그네슘과 같은 양이온들의 중탄산염, 탄산염, 수산화물 또는 인산염과 화합물과의 반응으로부터 유도된 것들을 포함하는 염기 부가염들도 마찬가지로 사용될 수 있다.
화학식 I의 화합물은 통상적으로 1개 초과의 양성자성 질소 원자를 갖고, 따라서 당해 화합물 1당량에 대해 1당량 초과, 예를 들면 약 1.2 내지 약 2당량, 약 1.5 내지 약 2당량 또는 약 1.8 내지 약 2당량의 산과 함께 산 부가염을 형성할 수 있다.
ABT-263은 마찬가지로 산 부가염, 염기 부가염 또는 양쪽성 이온을 형성할 수 있다. ABT-263의 염은 당해 화합물이 분리되는 동안 또는 정제된 후에 제조될 수 있다. ABT-263과 산과의 반응으로부터 유도되는 산 부가염으로는 앞서 열거된 것들이 포함된다. 앞서 열거된 것들을 포함하는 염기 부가염들도 마찬가지로 사용될 수 있다. ABT-263은 2개 이상의 양성자성 질소 원자를 갖고, 따라서 당해 화합물 1당량에 대해 1당량 초과, 예를 들면 약 1.2 내지 약 2당량, 약 1.5 내지 약 2당량 또는 약 1.8 내지 약 2당량의 산과 함께 산 부가염을 형성할 수 있다.
예시적으로, ABT-263의 경우, 예를 들면, 비스-하이드로클로라이드(bis-HCl) 및 비스-하이드로브로마이드(bis-HBr) 염을 포함하는 비스-염이 형성될 수 있다.
예를 들면, 분자량이 1047.5g/mol이고 하기 구조식으로 나타나는 ABT-263 bis-HCl은 다양한 방법들, 예를 들면, 아래와 같이 요약될 수 있는 방법에 의해 제조될 수 있다:
ABT-263 유리 염기는 예시적으로 앞서 언급한 '미국 특허 출원 공보 제 2007/0027135호의 실시예 1에 기술된 바와 같이 제조될 수 있으며, 상기 문헌의 전문은 본원에 참조로서 인용된다. 적합한 중량의 ABT-263 유리 염기를 에틸 아세테이트에 용해시킨다. 에탄올 중 염산 용액(예를 들면, 에탄올 80g 중 HCl 약 4.3㎏)을 ABT-263 1mol당 2mol 이상의 HCl 및 수득된 ABT-263 bis-HCl 염의 결정화를 위한 충분한 에탄올(약 20vol 이상)를 제공하는 양으로 ABT-263 용액에 첨가한다. 상기 용액을 교반하면서 약 45℃로 가열하고, 시드(sead)를 에탄올중의 슬러리로서 첨가한다. 약 6시간 후, 수득된 슬러리를 약 1시간에 걸쳐 약 20℃로 냉각시키고, 이 온도에서 약 36시간 동안 혼합한다. 상기 슬러리를 여과하여 ABT-263 bis-HCl의 에탄올 용매화물인 결정성 고체를 회수한다. 이 고체를 진공 및 질소에서 약 8일간 온화하게 교반하면서 건조시켜 백색의 탈용매화된 ABT-263 bis-HCl 결정들을 수득한다. 이 재료는 본 발명의 조성물을 제조하기 위한 API로서 적합하다.
상기 모 화합물은 엄밀히 말해 양쪽성 이온이며, 따라서 항상 진정한 염기로서 거동하는 것은 아닌 것으로 인식되지만, 본원에서는 상기 모 화합물을 지칭하는 데에 편의상 "유리 염기"라는 용어를 사용한다.
화학식 Ⅰ의 화합물 및 상기 화합물의 제조 방법은 미국 특허 출원 공보 제 2007/0027135호 및/또는 언급한 미국 특허 출원 공보 제 2007/0072860호에 게재되어 있으며, 상기 문헌들은 각각 그의 전문이 본원에 참조된다. 본원에서 사용되는 치환제들에 대한 용어들은 정확하게 상기 공보들에서와 같이 정의된다.
-NH, -C(O)OH, -OH 또는 -SH 잔기들을 갖는 화학식 Ⅰ의 화합물들에는, 생체내(in vivo) 대사 과정들에 의해 제거되어 유리 -NH, -C(O)OH, -OH 또는 -SH 잔기들을 갖는 모 화합물을 방출할 수 있는 프로드럭 - 형성 잔기들이 부착될 수 있다. 프로드럭의 염도 사용될 수 있다.
이론에 결부시키지 않고, 화학식 Ⅰ의 화합물들의 치료 효능은 적어도 부분적으로는 이들이, Bcl-2, BCI-XL 또는 Bcl-w 와 같은 Bcl-2 계열 단백질의 BH3 결합 홈을 점유함으로써, 상기 단백질의 항-아폽토시스 작용을 억제하는 방식으로 상기 단백질에 결합하는 능력에 기인하는 것으로 사료된다. 일반적으로, Bcl-2 계열 단백질에 대해 높은 결합 친화성, 예를 들면 약 5nM이하, 바람직하게는 1nM이하의 Ki를 갖는 화합물을 선택하는 것이 바람직한 것으로 밝혀질 것이다.
나노입자형 현탁액은 결정, 반결정 또는 무정형일 수 있는 개별 고체 상태상으로서 화학식 Ⅰ의 화합물 또는 염, 프로드럭, 프로드럭의 염 또는 이의 대사물을 포함한다. ABT-263의 경우에, '135공보에 따라 제조된 유리 염기형태는 무정형 또는 유리질이고, 이것은 일반적으로 약물의 결정성 염 형태 예를 들어, 나노 현탁액을 제조하는데 있어서 ABT-263 bis-HCl을 사용하는 것이 바람직하다. 그러나, 중탄산나트륨과 같은 염기화제의 존재하에 염을 현탁시키는 즉시 염이 유리 염기로 일부 변환할 수 있고, 고체상 중 수득물이 적어도 부분적으로 무정형이 된다. 따라서, 한 양태로 나노 현탁액이 ABT-263 유리 염기, ABT-263 bis-HCl 또는 이의 혼합물을 포함한다. ABT-263 나노현탁액 속 약물입자는 적어도 부분적으로 무정형이라는 가능성에도 불구하고, 그러한 나노현탁액에서 눈에 띄게 높은 정도의 물리적 안정성을 가지는 것으로 관찰되며, 이는 하기 실시예 2에서 설명된다.
본 발명자들은 본원에서 기술된 나노입자형 현탁액들은 물리적 안정성을 가진 허용할 수 있는 상품 수명의 장점뿐 아니라, 상품을 위해 바람직한 제조 방법의 견고성을 제공함을 밝혔다.
화학식 Ⅰ의 화합물 또는 염, 프로드럭, 프로드럭의 염 또는 이의 대사물은조성물을 적절한 용법에 따라 이의 필요 대상자에 투여할 때 치료학적 유효량으로 본 발명의 나노입자형 현탁액 속에 존재한다. 본원에서 투여 용량은 문맥이 달리 요구하지 않는 한 모 화합물 등량(유리 염기 등량)으로서 표현한다. 통상적으로, 적절한 빈도수, 예를 들면, 1일 2회 내지 주 1회로 투여될 수 있는 단위 용량(한번에 투여되는 양)은 해당 화합물에 따라 약 10 내지 약 1,000㎎이다. 투여 빈도수가 1일 1회(q.d.)인 경우, 단위 용량과 1일 용량은 동일하다. 예시적으로, 예를 들어 약물이 ABT-263인 경우, 단위 용량은 통상적으로 약 25 내지 약 1,000㎎, 더욱 통상적으로는 약 50 내지 약 500㎎, 예를 들면 약 50, 약 100, 약 150, 약 200, 약 250, 약 300, 약 350, 약 400, 약 450 또는 약 500㎎ , 유리 염기 등량이다. 제형이 현탁액 속에 나노입자형 조성물을 동봉하는 캡슐 쉘 또는 고체형태를 포함하거나 또는 고체형태 속에 나노입자형 조성물을 포함하는 정제는, 단위 용량이 단일 캡슐 또는 정제, 또는 다수의 캡슐 또는 정제, 가장 통상적으로는 1 내지 약 10개의 캡슐 또는 정제로 전달될 수 있다.
단위 용량이 높을수록, 용액 중에 비교적 높은 농도의 약물을 가진 현탁액을 선택하는 것이 더욱 바람직해진다. 통상적으로, 현탁액의 약물 농도는 약 10㎎/㎖ 이상, 예를 들면, 약 10 내지 약 500㎎/㎖이지만, 특정 경우 이보다 더 낮거나 더 높은 농도가 허용되거나 달성될 수 있다. 예시적으로, 예를 들어 약물이 ABT-263인 경우, 다양한 양태들에서 약물 농도는 유리 염기 등량 중량을 기준으로 약 10㎎/㎖ 이상, 예를 들면, 약 10 내지 약 400㎎/㎖, 또는 약 20㎎/㎖ 이상, 예를 들면, 약 20 내지 약 200㎎/㎖, 예를 들면 약 20, 약 25, 약 30, 약 40, 약 50, 약 75, 약 100, 약 125, 약 150 또는 약 200㎎/㎖이다.
본 발명의 조성물들은 좋은 저장 안정성을 가지고 있다. 특히, 그들은 물리적으로 안정하므로 적어도 그들은 시간이 지남에 따라 예를 들어 입자 응집을 통해, 입자 크기가 증가하는 허용할 수 없는 경향을 갖지 않는다. 입자 응집은 나노입자형 현탁액에서 흔한 문제이다. 계면활성제와 같은 표면 개질제들은 나노입자가 응집하려는 경향을 감소시켜 중요하며, 이론에 결부시키지 않고, 하나 이상의 계면활성제가 본 발명의 조성물에 존재한다면 그것을 돕는 것으로 사료된다.
본원의 임의의 "염기화제"는 현탁액 매질의 pH를 상승시키는 임의의 제제이다. 임의의 약제학적으로 허용되는 염기화제가 이용될 수 있고, 나트륨 및 칼륨과 같은 알칼리 금속의 수산화물 및 중탄산염이 제한없이 포함된다. 본원에서 특히 중탄산 나트륨을 참조로써 보여주나, 경우에 따라 중탄산나트륨을 다른 염기화제들로 치환할 수 있다.
본 발명의 조성물에 유용한 중탄산나트륨의 양은 근소한 임계를 가지지 않고 당업자는, 예를들어 통상적인 저장-안정성 테스트를 통해 특별한 조성물의 양을 용이하게 최적화할 수 있다. 일반적으로, 좋은 결과들은 약 20내지 약 200mg/ml 예를들어 약 40 내지 약 160mg/ml의 중탄산나트륨의 양을 얻을 수 있다.
계면활성제의 선택과 양은 근소한 임계를 가지지 않고, 제형화될 특정 약물 화합물 및 목적하는 약물 로딩(loading) 정도에 의존한다. 계면활성제의 비 제한적인 예들은 개별적으로 또는 조합적으로, 제4(급) 암모늄 화합물, 예를들어 벤즈알코늄 클로라이드, 벤젠토늄 클로라이드 및 세틸피리디늄 클로라이드; 디옥틸 나트륨 설포석시네이트; 폴리옥시에틸렌 알킬페닐 에테르, 예를틀어 노녹시놀 9, 노녹시놀 10 그리고 옥톡시놀 9; 폴록사머(폴리옥시에틸렌 및 폴리옥시프로필렌 블록 공중합체), 예를들어 폴록사머 188 및 폴록사머 237 ; 폴리옥시에틸렌 지방산 글리세리드 및 오일, 예를들어 폴리옥시에틸렌 (8) 카프릴릭/카프릭 모노- 및 디글리세리드, 폴리옥시에틸렌 (35) 피마자유 및 폴리옥시에틸렌 (40) 수소화된 피마자유; 폴리옥시에틸렌 알킬 에테르, 예를들어 세테스-10, 라우레스-4, 라우레스-23, 올레스-2, 올레스-10, 올레스-20, 스테아레스-2, 스테아레스-10, 스테아레스-20, 스테아레스-100 및 폴리옥시에틸렌 (20) 세토스테아릴 에테르; 폴리옥시에틸렌 지방산 에스테르, 예를들어 폴리옥시에틸렌 (20) 스테아레이트, 폴리옥시에틸렌 (40) 스테아레이트 및 폴리옥시에틸렌 (100) 스테아레이트; 소르비탄 에스테르, 예를들어 소르비탄 모노라우레이트, 소르비탄 모노올레에이트, 소르비탄 모노팔미테이트 및 소르비탄 모노스테아레이트; 폴리옥시에틸렌 소르비탄 에스테르, 예를들어 폴리소르베이트 20 및 폴리소르베이트 80; 프로필렌 글리콜 지방산 에스테르, 예를들어 프로필렌 글리콜 라우레이트; 나트륨 라우릴 설페이트; 지방산 및 이의 염, 예를들어 올레산, 올레산 나트륨 및 트리에탄올아민 올레에이트; 글리세릴 지방산 에스테르, 예를들어 글리세릴 모노올레에이트, 글리세릴 모노스테아레이트 및 글리세릴 팔미토스테아레이트; α-토코페릴 폴리에틸렌 글리콜 숙신산(TPGS); 티록사폴 등을 포함한다. 한 양태에서, 적어도 하나의 계면활성제는 폴록사머 또는 폴록사머의 혼합물이다. 폴록사머 188은 구체적인 예시이다. 하나 이상의 계면활성제들은 통상적으로 전체 약 10 내지 약 100mg/ml을 구성한다. 폴록사머 188의 경우에, 예시적으로 적합한 양은 약 10 내지 약 100mg/ml이며, 예를 들어 약 15 내지 약 60 mg/ml이다.
현탁액의 수성 매질은, 물, 식염수(예를들어 포스페이트-완충 식염수 또는 PBS)와 같은 주입가능한 유체 또는 과일 주스나 탄산음료와 같은 임바이버블 액체의 형태를 취할 수 있다. 나노 입자형 약물 화합물의 한 양태에서, 적어도 하나의 계면활성제 및 적어도 하나의 염기화제(및 임의로 추가적인 구성요소들)는 사용하기 직전에 발명의 현탁액 조성물을 형성하기 위해 적합한 수성 매질과 함께 재구성하기 위한 건조 분말 혼합물로서 제조된다. 그러한 재구성할 수 있는 분말은 추가적으로 상기 언급된 성분 뿐만 아니라, 적어도 하나의 약제학적으로 허용되는 분산제 또는 증량제, 일반적으로 당, 예를 들어 덱스트로오스, 만니톨(mannitol) 또는 덱스트란(dextran)과 같은 수용성 물질, 인산염 예를 들어, 인산 나트륨 또는 인산 칼륨; 유기산, 예를 들어, 구연산 또는 타르타르산, 또는 그 염 또는 상기 물질의 혼합물을 함유해야만 한다. 대안적으로 건조 분말 혼합물은 위장액 안의 나노입자들의 재현탁액을 위해 대상자에 투여할 수 있고, 상기 투여를 위해 그러한 분말 혼합물은 경우에 따라 정제로 만들거나 캡슐 안에 충전된 형태일 수 있다.
화학식 I의 화합물의 경우에, 물리적 안정성뿐 아니라 화학적 안정성인 제형을 제공하는 것이 바람직할 수 있다. 특히, 그러한 제형은 예를들어 (페닐설파닐)메틸 그룹의 티오에테르 연결점에서 화학식 I의 화합물의 산화성 분해를 허용할 수 없는 정도로 나타내지 말아야 한다.
이것과 관련해, ABT-263 유리 염기, ABT-263 bis-HCl 또는 이의 배합물과 같은 화학식 I의 화합물을 포함하는 본 발명의 조성물은 이전 '135 공보 또는 참조[Tse et al. (2008), supra]에 공개된 ABT-263의 용액 조성물들보다 상당한 잇점을 지닌다. 본원에 제시된 나노현탁액 중 존재하는 ABT-263의 고체상 형태(결정, 반결정 또는 무정형)는 용액 중 ABT-263보다 산화성 분해에 대해 상당히 내성인 것으로 사료된다.
그러나, 경우에 따라 산화성 분해 경향은 현탁액 조성물 속에 적합한 산화방지제를 포함함으로써 추가로 감소시킬 수 있다.
"산화방지제" 또는 "산화방지제" 성질을 가지는 화합물은 또 다른 화학물질 또는 그 자체의 산화를 억제, 방지, 감소 또는 지연시킬 수 있는 화학적 화합물이다. 산화방지제들은 본원에서 기술하는, 예를 들어 제형에서 화학식 Ⅰ의 화합물의 산화를 억제, 방지, 감소 또는 지연시킴에 의해 지질 제형의 안정성 및 저장수명을 개선시킬 수 있다.
안정성 또는 저장수명의 향상은, 예를 들어 제형 속 설폭사이드의 출현 또는 증가 비율을 관찰함으로써 평가될 수 있다. 전체에서 설폭사이드는 반복적인 샘플링 및 분석을 통해 관찰할 수 있고, 대안적으로 샘플들은 화학식 Ⅰ의 화합물, 즉 화학식
본원에서 언급한 설폭사이드 분해 생성물은 설폭사이드 그룹의 황원자 입체 중심에서 두 부분입체이성질체들(diastereomers)을 다 포함하는 것으로 이해될 것이다.
본원에서 산화방지제의 "산화방지제 유효량"은 상기 산화방지제를 함유하는 제형에서, 산화방지제를 함유하지 않는 달리 유사한 제형에 비해,
(a) 분해 생성물, 예를 들면 상기 설폭사이드 분해 생성물의 형성 또는 축적의 상당한 감소(예를 들면, 약 25% 이상, 약 50% 이상, 약 75% 이상, 약 80% 이상, 약 85% 이상 또는 약 90% 이상의 감소) 및/또는
(b) 분해 생성물이 임계값(threshold level)에 도달하는 데 걸리는 시간의 상당한 증가(예를 들어 적어도 약 30, 적어도 약 60, 적어도 약 90 또는 적어도 약 180일)
를 제공하는 양이다. 상기 제형에서 (a) 분해 생성물의 형성 또는 축적의 감소 또는 (b) 분해 생성물이 임계점에 도달하는 데 걸리는 시간 증가의 정도를 측정하기 위한 저장 안정성 연구는 어떤 적절한 온도 또는 온도의 범위에서 수행 될 수 있다. 예시적으로, 5℃에서의 연구는 냉장 조건 하에서 저장 안정성을 나타낼수 있고, 약 20 내지 25℃에서의 연구는 보통 주위 조건하에서 저장 안정성을 나타낼 수 있으며, 약 30℃ 또는 그 이상의 온도에서의 연구는 촉진 숙성(aging) 연구에 유용할 수 있다. 예를 들어 존재하는 화학식 Ⅰ의 화합물의 초기 양이 약 0.2% 내지 약 2%의 범위 내에서, 분해 생성물의 임의의 적절한 임계값을 종말점으로서 선택할 수 있다.
다양한 예시적인 양태들에서, 산화방지제는 자외선을 투과시키지 않는 밀봉된 용기 안에서 주위조건(예를 들어 약 20 내지 25℃ )하에 저장될 때, 제형 내에서 약물의 산화적 분해(언급된 저장 기간이 끝난 후, 예를 들면 존재하는 설폭사이드 분해 생성물의 양에 의해 측정됨)를,
(a) 약 3개월 이상 동안 약 1% 미만으로;
(b) 약 6개월 이상 동안 약 1% 미만으로;
(c) 약 1년 이상 동안 약 1% 미만으로;
(d) 약 3개월 이상 동안 약 0.5% 미만으로;
(e) 약 6개월 이상 동안 약 0.5% 미만으로; 또는
(f) 약 1년 이상 동안 약 0.5% 미만으로;
유지시키기에 효과적인 양으로 포함된다.
약제학적 조성물에 사용되는 산화방지제는 가장 통상적으로는 삼중항 또는 단일항 산소, 초산화물, 과산화물 및 유리 하이드록실 라디칼과 같은 산화 종들의 발생을 억제시키는 제제, 또는 이러한 산화 종들이 발생되었을 때 이들을 제거하는 제제이다. 통상적으로 사용되는 이들 계열의 산화방지제의 예로는 부틸화 하이드록시아니솔(BHA), 부틸화 하이드록시톨루엔(BHT), 레티닐 팔미테이트, 토코페롤, 프로필 갈레이트, 아스코르브산 및 아스코르빌 팔미테이트가 포함된다. 그러나 본원에서 유용한 산화방지제는, 이론에 결부시키지 않고, 주로 경쟁적 기질로서, 즉 산화 종들에 의해 우선적으로 공격되어 약물을 과도한 분해로부터 보호하는 "희생적" 산화방지제로서 기능하는 것으로 사료되는 중질-칼코겐 산화방지제이다.
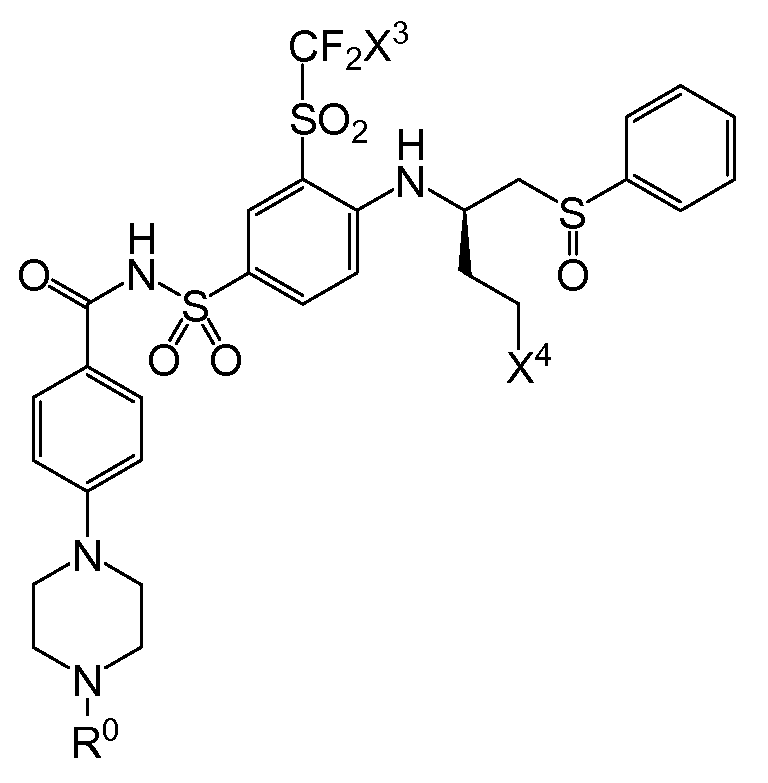
몇몇 양태에서, HCA는 하나 이상의 화학식 II의 산화방지제 화합물, 약제학적으로 허용되는 이의 염 또는 Y1이 S이고 R3이 H인 경우, 이의 -S-S- 이량체 또는 상기 이량체의 약제학적으로 허용되는 염을 포함한다.
화학식 II
상기 화학식 II에서,
n은 0, 1 또는 2이고,
Y1은 S 또는 Se이고,
Y2는 NHR1, OH 또는 H이고, 여기서, R1은 알킬 또는 알킬카보닐이고,
Y3은 COOR2 또는 CH2OH이고, 여기서, R2는 H 또는 알킬이고,
R3은 H 또는 알킬이고,
여기서, 알킬 그룹들은 임의로, 카복실, 알킬카보닐, 알콕시카보닐, 아미노 및 알킬카보닐아미노로 이루어진 그룹으로부터 독립적으로 선택되는 하나 이상의 치환체에 의해 독립적으로 치환된다.
다른 양태에서, HCA는 화학식 III의 산화방지제 화합물이다.
화학식 III
상기 화학식 III에서,
Y는 S, Se 또는 S-S이고,
R4 및 R5는 H, 알킬 및 (CH2)nR6으로부터 독립적으로 선택되고, 여기서, n은 0 내지 10이고, R6은 아릴카보닐, 알킬카보닐, 알콕시카보닐, 카복실 또는 CHR7R8-치환된 알킬이며, 여기서, R7 및 R8은 독립적으로 CO2R9, CH2OH, 수소 또는 NHR10이고, 여기서, R9는 H, 알킬, 치환된 알킬 또는 아릴알킬이고, R10은 수소, 알킬, 알킬카보닐 또는 알콕시카보닐이다.
"알킬" 치환체 또는 화학식 II 또는 화학식 III에 따른 치환체의 부분을 형성하는 "알킬" 또는 "알콕시" 그룹은 1 내지 약 18개의 탄소 원자를 갖고, 직쇄 또는 분지쇄로 이루어질 수 있다.
화학식 III에 따른 치환체의 부분을 형성하는 "아릴" 그룹은, 치환되지 않거나 하나 이상의 하이드록시, 알콕시 또는 알킬 그룹으로 치환된, 페닐 그룹이다.
몇몇 양태에서, 화학식 II에서의 R1은 C1 -4 알킬(예: 메틸 또는 에틸) 또는 (C1-4 알킬)카보닐(예: 아세틸)이다.
몇몇 양태에서, 화학식 II에서의 R2는 H 또는 C1 -18 알킬, 예를 들면 메틸, 에틸, 프로필(예: n-프로필 또는 이소프로필), 부틸(예: n-부틸, 이소부틸 또는 t-부틸), 옥틸(예: n-옥틸 또는 2-에틸헥실), 도데실(예: 라우릴), 트리데실, 테트라데실, 헥사데실 또는 옥타데실(예: 스테아릴)이다.
R3은 통상적으로 H 또는 C1 -4 알킬(예: 메틸 또는 에틸)이다.
HCA는, 예를 들면, 천연 또는 합성 아미노산 또는 이의 알킬 에스테르와 같은 유도체 또는 N-아실 유도체, 또는 상기 아미노산 또는 유도체의 염일 수 있다. 상기 아미노산 또는 이의 유도체가 천연 공급원으로부터 유도된 경우, 이는 통상 L-배열로 존재하지만, 필요에 따라 D-이성질체 및 D,L-이성질체 혼합물이 대체될 수 있는 것으로 이해된다.
본원에서 유용한 HCA의 비제한적 예로는 β-알킬머캅토케톤, 시스테인, 시스틴, 호모시스테인, 메티오닌, 티오디글리콜산, 티오디프로피온산, 티오글리세롤, 셀레노시스테인, 셀레노메티오닌 및 이들의 염, 에스테르, 아미드 및 티오에테르, 및 이들의 배합물이 포함된다. 더욱 구체적으로, 하나 이상의 HCA는 N-아세틸시스테인, N-아세틸시스테인 부틸 에스테르, N-아세틸시스테인 도데실 에스테르, N-아세틸-시스테인 에틸 에스테르, N-아세틸시스테인 메틸 에스테르, N-아세틸시스테인 옥틸 에스테르, N-아세틸-시스테인 프로필 에스테르, N-아세틸시스테인 스테아릴 에스테르, N-아세틸시스테인 테트라데실 에스테르, N-아세틸시스테인 트리데실 에스테르, N-아세틸메티오닌, N-아세틸메티오닌 부틸 에스테르, N-아세틸메티오닌 도데실 에스테르, N-아세틸메티오닌 에틸 에스테르, N-아세틸메티오닌 메틸 에스테르, N-아세틸메티오닌 옥틸 에스테르, N-아세틸메티오닌 프로필 에스테르, N-아세틸메티오닌 스테아릴 에스테르, N-아세틸메티오닌 테트라데실 에스테르, N-아세틸메티오닌 트리데실 에스테르, N-아세틸셀레노시스테인, N-아세틸셀레노시스테인 부틸 에스테르, N-아세틸셀레노시스테인 도데실 에스테르, N-아세틸셀레노시스테인 에틸 에스테르, N-아세틸셀레노시스테인 메틸 에스테르, N-아세틸셀레노시스테인 옥틸 에스테르, N-아세틸셀레노시스테인 프로필 에스테르, N-아세틸셀레노시스테인 스테아릴 에스테르, N-아세틸셀레노시스테인 테트라데실 에스테르, N-아세틸셀레노시스테인 트리데실 에스테르, N-아세틸셀레노메티오닌, N-아세틸셀레노메티오닌 부틸 에스테르, N-아세틸셀레노메티오닌 도데실 에스테르, N-아세틸셀레노메티오닌 에틸 에스테르, N-아세틸셀레노메티오닌 메틸 에스테르, N-아세틸셀레노메티오닌 옥틸 에스테르, N-아세틸셀레노메티오닌 프로필 에스테르, N-아세틸셀레노메티오닌 스테아릴 에스테르, N-아세틸셀레노메티오닌 테트라데실 에스테르, N-아세틸셀레노메티오닌 트리데실 에스테르, 시스테인, 시스테인 부틸 에스테르, 시스테인 도데실 에스테르, 시스테인 에틸 에스테르, 시스테인 메틸 에스테르, 시스테인 옥틸 에스테르, 시스테인 프로필 에스테르, 시스테인 스테아릴 에스테르, 시스테인 테트라데실 에스테르, 시스테인 트리데실 에스테르, 시스틴, 시스틴 디부틸 에스테르, 시스틴 디(도데실) 에스테르, 시스틴 디에틸 에스테르, 시스틴 디메틸 에스테르, 시스틴 디옥틸 에스테르, 시스틴 디프로필 에스테르, 시스틴 디스테아릴 에스테르, 시스틴 디(테트라데실) 에스테르, 시스틴 디(트리데실) 에스테르, N,N-디아세틸시스틴, N,N-디아세틸시스틴 디부틸 에스테르, N,N-디아세틸시스틴 디에틸 에스테르, N,N-디아세틸시스틴 디(도데실) 에스테르, N,N-디아세틸시스틴 디메틸 에스테르, N,N-디아세틸시스틴 디옥틸 에스테르, N,N-디아세틸시스틴 디프로필 에스테르, N,N-디아세틸시스틴 디스테아릴 에스테르, N,N-디아세틸시스틴 디(테트라데실) 에스테르, N,N-디아세틸시스틴 디(트리데실) 에스테르, 디부틸 티오디글리콜레이트, 디부틸 티오디프로피오네이트, 디(도데실) 티오디글리콜레이트, 디(도데실) 티오디프로피오네이트, 디에틸 티오디글리콜레이트, 디에틸 티오디프로피오네이트, 디메틸 티오디글리콜레이트, 디메틸 티오디프로피오네이트, 디옥틸 티오디글리콜레이트, 디옥틸 티오디프로피오네이트, 디프로필 티오디글리콜레이트, 디프로필 티오디프로피오네이트, 디스테아릴 티오디글리콜레이트, 디스테아릴 티오디프로피오네이트, 디(테트라데실) 티오디글리콜레이트, 디(테트라데실) 티오디프로피오네이트, 호모시스테인, 호모시스테인 부틸 에스테르, 호모시스테인 도데실 에스테르, 호모시스테인 에틸 에스테르, 호모시스테인 메틸 에스테르, 호모시스테인 옥틸 에스테르, 호모시스테인 프로필 에스테르, 호모시스테인 스테아릴 에스테르, 호모시스테인 테트라데실 에스테르, 호모시스테인 트리데실 에스테르, 메티오닌, 메티오닌 부틸 에스테르, 메티오닌 도데실 에스테르, 메티오닌 에틸 에스테르, 메티오닌 메틸 에스테르, 메티오닌 옥틸 에스테르, 메티오닌 프로필 에스테르, 메티오닌 스테아릴 에스테르, 메티오닌 테트라데실 에스테르, 메티오닌 트리데실 에스테르, S-메틸시스테인, S-메틸-시스테인 부틸 에스테르, S-메틸시스테인 도데실 에스테르, S-메틸시스테인 에틸 에스테르, S-메틸-시스테인 메틸 에스테르, S-메틸시스테인 옥틸 에스테르, S-메틸시스테인 프로필 에스테르, S-메틸-시스테인 스테아릴 에스테르, S-메틸시스테인 테트라데실 에스테르, S-메틸시스테인 트리데실 에스테르, 셀레노시스테인, 셀레노시스테인 부틸 에스테르, 셀레노시스테인 도데실 에스테르, 셀레노시스테인 에틸 에스테르, 셀레노시스테인 메틸 에스테르, 셀레노시스테인 옥틸 에스테르, 셀레노시스테인 프로필 에스테르, 셀레노시스테인 스테아릴 에스테르, 셀레노시스테인 테트라데실 에스테르, 셀레노시스테인 트리데실 에스테르, 셀레노메티오닌, 셀레노메티오닌 부틸 에스테르, 셀레노메티오닌 도데실 에스테르, 셀레노메티오닌 에틸 에스테르, 셀레노메티오닌 메틸 에스테르, 셀레노메티오닌 옥틸 에스테르, 셀레노메티오닌 프로필 에스테르, 셀레노메티오닌 스테아릴 에스테르, 셀레노메티오닌 테트라데실 에스테르, 셀레노메티오닌 트리데실 에스테르, 티오디글리콜산, 티오디프로피온산, 티오글리세롤, 이들의 이성질체 및 이성질체들의 혼합물, 및 이들의 염으로부터 선택될 수 있다.
HCA 화합물의 염은 아세트산염, 아디프산염, 알긴산염, 중탄산염, 시트르산염, 아스파르트산염, 벤조산염, 벤젠설폰산염(베실산염), 중황산염, 부티르산염, 캄포르산염, 캄포르설폰산염, 디글루콘산염, 포름산염, 푸마르산염, 글리세로인산염, 글루탐산염, 헤미황산염, 헵탄산염, 헥산산염, 하이드로클로라이드, 하이드로브로마이드, 하이드로요오다이드, 락토비온산염, 락트산염, 말레산염, 메시틸렌설폰산염, 메탄설폰산염, 나프틸렌설폰산염, 니코틴산염, 옥살산염, 파모산염, 펙틴산염, 과황산염, 인산염, 피크르산염, 프로피온산염, 석신산염, 타르타르산염, 티오시안산염, 트리클로로아세트산염, 트리플루오로아세트산염, 파라-톨루엔설폰산염 및 운데칸산염과 같은 산 부가염일 수 있다. 특정 양태에서, 앞서 개별적으로 언급한 화합물들 중 하나의 하이드로클로라이드 염은 조성물 중에 산화방지 유효량으로 존재한다.
이론에 결부시키지 않고, 일반적으로 앞서 예시된 것들과 같은 중질 칼코겐 산화방지제들은 이들 자체가 더 용이하게 산화될 수 있어서 약물 화합물보다 우선적으로 산화됨으로써 활성 화합물을 보호하는 것으로 사료된다. 일반적으로, 이러한 작용 방식으로 약물 화합물에 대한 허용가능한 정도의 보호를 제공하기 위해서는 산화방지제가 실질적인 양, 예를 들면 약물 화합물에 대해 약 1:10 이상의 몰비로 존재해야 한다. 몇몇 양태에서, 산화방지제 대 약물 화합물의 몰비는 약 1:10 내지 약 2:1, 예를 들면 약 1:5 내지 약 1.5:1이다. 상기 몰비가 대략 1:1, 즉, 약 8:10 내지 약 10:8인 경우 때때로 최상의 결과가 수득될 것이다.
황을 포함하는 산화방지제들의 또 다른 계열인 아황산염 무기산화방지제, 중아황산염, 메타중아황산염 및 티오황산염류들은 본발명의 조성물들로써 유용할 수 있다. 이러한 산화방지제들은 수성 용액 중에서 사용된다. 아황산염, 중아황산염, 메타중아황산염 및 티오황산염류의 나트륨 및 칼륨의 염들은 본 양태에 따라 유용한 산화방지제들이다; 더 특별히 나트륨 및 칼륨 메타중아황산염이 있다. 그러한 황을 포함하는 산화방지제들은 약물 화합물의 농도와 동등한 몰을 제공하는 것보다매우 낮은 농도에, 예를 들어 약물 화합물에 대한 몰비가 1대 20 만큼 낮거나 그 이하인 경우에, 효과적일 수 있다.
설폭사이드 형성을 최소화하기 위해, EDTA와 같은 킬레이트제 또는 이의 염(예를 들면, 디나트륨 EDTA 또는 칼슘 디나트륨 EDTA), 예를 들면 조성물의 약 0.002중량% 내지 약 0.02중량%의 양으로 선택적으로 첨가된다. 킬레이트제는 산화적 분해를 촉진시킬 수 있는 금속 이온들을 격리시킨다.
설폭사이드 형성은 낮은 과산화물 값을 갖는 제형 성분들을 선택함으로써 추가로 최소화될 수 있다. 과산화물 값은 약제학적 부형제들의 잘 정립된 특성이며, 이는 일반적으로 (본원에서와 같이) 부형제 1㎏당 과산화물 밀리당량에 상응하는 단위(meq/kg)로 표현된다. 몇몇 부형제들은 본질적으로 낮은 과산화물 값을 갖지만, 다른 것들, 예를 들면 올레일 잔기 및/또는 폴리옥시에틸렌 쇄와 같은 불포화 지방산을 갖는 것들은 과산화물의 공급원들일 수 있다.
또다른 현탁액 조성물의 선택적 성분들은 완충제, 착색제, 착향료, 보존제, 감미료, 토닉시파잉제(tonicifying agents) 및 이의 배합물을 포함한다.
본 발명의 한 양태에서, 화학식 Ⅰ의 화합물 또는 약제학적으로 허용할 수 있는 염, 프로드럭, 프로드럭의 염 또는 이의 대사물, 예를 들어 ABT-263 또는 이의 결정성 염을 포함하는 활성 약제학적 성분(API)을 제공하고, 적어도 하나의 염기화제(중탄산나트륨과 같은)의 존재하에 상기 API를 약 3㎛이하의 D90 입자 크기로 습식 분쇄하여 분쇄된 약물을 수득하고, 적어도 하나의 계면활성제를 가진 수성 매질 중에 분쇄된 약물 기질을 현탁시킴을 포함하는 약제학적 조성물을 제조하기 위한 방법이 제공되며, 이때 적어도 하나의 염기화제와 적어도 하나의 계면활성제는 입자 크기 증가를 함께 억제하기 위한 유효량으로 수득된 현탁액에 존재한다.
임의의 적합한 습식 분쇄 방법이 이용될 수 있다. 특히 유용하다고 발견된 습식 분쇄 방법은 실례로 하기 실시예 1에서 기술된 것처럼 고압 균질화 상태이다.
본 발명은 본원에서 기술된 임의의 방법에 의해 제조된 조성물로 제한되지 않는다. 그러나, 상기 방법에 의해 제조된 조성물은 본 발명의 특별한 양태이다.
한 양태에서, 방법은 더 나아가 현탁액에 적어도 하나의 약제학적으로 허용되는 분산제 또는 증량제를 첨가하고, 현탁액을 건조(예를 들어, 냉동 건조 또는 동결건조 또는 대안적으로 분무건조)시켜 재구성할 수 있는 건조 분말을 수득하고 임의로 분말을 정제(예를들어 성형 또는 압축)로 만들거나 분말을 캡슐안으로 충전시켜 단위 투여 형태를 제조함을 포함한다.
게다가 중탄산나트륨의 안정화의 잇점들은, 입자크기를 작게 하기 위한 습식 가공, 예를 들어 D90입자 크기를 약 700nm 이하로 하는 것이 중탄산나트륨의 존재하에 가능한 것으로 밝혀졌다. 예시적으로 본원에서 하기 실시예 2에서 보여진 바와 같이 중탄산나트륨 없이 동일한 변수처리를 했을 때, D90 입자 크기는 1,000nm 미만으로 감소할 수 없었다. 본 방법에서 습식 분쇄 방법을 사용하면 건조 분쇄와 비교했을 때, 고온에서 API의 노출 감소와 API의 열분해의 위험을 줄일 수 있는 장점이 있다. 한 양태에서, 예를 들어 약 5℃내지 약 30℃의 표적 온도의 약 1 내지 약 5℃ 범위에서 프로세싱 온도가 조절된다. 이것은 냉각기가 있는 물 욕조 안에 열교환기를 담금으로써 제형을 작동시키는 것 같은 종래 방식에 의해 얻어질 수 있다.
조성물은 최종 농도에서 습식 분쇄를 위해 제조될 수 있거나, 고농도 및 습식 분쇄 이후에 목적하는 농도로 희석하여 제조할 수 있다. 적어도 한 계면활성제 및 경우에 따라 임의의 추가적 성분을 습식 분쇄 전 또는 후에 첨가할 수 있다.
본 발명의 조성물은 통상적으로 "경구로 전달될 수 있는", 즉 경구투여가 적합하다; 그러나, 그러한 조성물은 다른 경로로 투여함으로써 필요한 대상자에 약물을 전달하기 위해 유용할 수 있으며, 비경구, 설하선, 협측, 비강, 폐, 국소, 경피, 피내, 안구, 귀의, 직장, 질, 위내, 두개내, 윤활내(intrasynovial) 및 내부 관절 경로를 제한 없이 포함한다. 특별한 양태에서 조성물은 경구 및/또는 비경구 투여용으로 사용된다.
"경구 투여" 및 "경구 투여되는" 용어는 본원에서 대상자에 입으로(p.o) 투여하는 것이며 즉, 조성물은 예를 들어 적절한 물의 용적 또는 다른 음료와 함께 즉각적으로 삼켜진다. 본원에서 "경구 투여"는 예를 들어 설하선 또는 협측 투여 또는 치주위 조직과 같은 구강 표피로 국소 투여하는 것과 같은 조성물을 직접 삼키는 것을 포함하지 않는 구강내 투여와는 구별된다.
예기치 않게 발견된 본 발명의 나노입자형 ABT-263 bis HCl 현탁액은 경구 투여될때 약물의 표준 용액, 예를 들어 '135 공보에 개시된 PEG-400안에 10% DMSO로 구성된 운반체 속의 용액과 비교하면 증진된 생체흡수력을 제공한다. 임상실험에서 (하기 실시예 3) ABT-263 bis-HCl의 지질 용액 제형(본원에서 "제형C")으로 얻은 것에 상응하는 생체흡수력인 것으로 밝혀졌다. 이러한 증진된 생체흡수률은, 예를 들면 하나 이상의 높은 Cmax를 가진 약동학적(PK) 프로파일 또는 AUC(예를 들어 AUC0 -24 또는 AUC0 -∞)에 의해 측정된 증가된 생체이용률로 확인될 수 있다. 예시적으로, 생체이용률은 경구 용량과 정맥내(i.v.) 용량의 임의의 차이를 고려하여, 예를들면 시험 화합물의 경구 전달에 대한 AUC를 적합한 용액 중의 약물의 정맥내 전달에 대한 AUC의 백분율로서 계산하는 매개 변수 F를 사용하여, 백분율로서 표현될 수 있다.
생체이용률은 사람 또는 임의의 적합한 모델 종들에서 PK 연구함으로써 결정될 수 있다. 이 목적을 위해, 하기 실시예 3에 예시적으로 기술된 바와 같이 일반적으로 개 모델이 적합하다. 다양한 예시적인 양태들에서, 약물이 ABT-263 bis-HCl과 같은 ABT-263의 결정성 염인 경우, 본 발명의 조성물들은 개 모델에서 공복 또는 공복이 아닌 동물들에게 약 2.5 내지 10mg/kg의 단일 용량으로 투여했을 때,적어도 약 15% 또는 적어도 약 20 % 또는 적어도 약 25 %, 최대 약 50 % 또는 이를 초과하는 경구 생체이용률을 나타낸다.
일반적으로 또는 본원에서 특별하게 기술된 조성물을 포함하여 본원에 포괄된 조성물들은, 대상자에 화학식 Ⅰ의 화합물 또는 약제학적으로 허용될 수 있는 염, 프로드럭, 염의 프로드럭 또는 이의 대사물인 약물의 경구전달에 유용하다. 따라서, 대상자에 그러한 약물 전달을 위한 본 발명의 방법은 상기 제시된 경구 투여 조성물을 포함한다.
그 대상자는 사람 또는 사람이 아닌 것(예를들어, 농장, 동물원, 직장 또는 반려 동물 또는 모델로 사용되는 실험용 동물)이 될 수 있지만 중요한 양태는, 예를 들어 아폽토시스 기능 이상 및/또는 항 아폽토시스 Bcl-2 계열 단백질의 과발현을 특징으로 하는 질병을 치료하기 위한 약물이 필요한 사람 환자이다. 사람 대상자는 남자 또는 여자 및 임의의 연령이 가능하나, 통상적으로 성인이 대상이다.
조성물은 보통 약물의 치료학적으로 유효한 1일 용량을 제공하는 양으로 투여된다. 본원에서 "1일 용량" 용어는 투여 빈도에 관계없이 하루에 투여되는 약물의 양을 의미한다. 예를 들어 만약 대상자가 하루에 두번 150mg의 단위 용량을 투여 받는다면, 1일 용량은 300mg이다. "1일 용량" 용어의 사용은 특정한 투여량이 반드시 하루에 한번 투여되야 하는 것을 의미하지 않는 것으로 이해될 것이다. 그러나, 특정한 양태에서 투여 빈도수는 1일 1회(q.b)이고, 단위 용량과 1일 용량은 동일하다.
치료학적 유효량을 구성하는 것은 특정 화합물, 대상자(종들 및 대상자의 몸무게를 포함), 치료를 위한 질병(예를 들어 특정한 타입의 암), 질병의 단계 및/또는 심각도, 화합물에 대한 개별적인 대상의 내성, 화합물이 단일 투여되는지, 하나 이상의 다른 약물과 병용하여 투여되는지, 예를 들어 암의 치료를 위한 다른 화학적 치료제 사용 여부 등 다른 요소에 의존한다. 그러므로 1일 용량은 넓은 폭 내에서 다양할 수 있으며, 예를 들어 약 10 내지 약 1,000mg이다. 크거나 적은 1일 용량은 특정 상황들에서 적절할 수 있다. 이것은 본원에서 인용한 '치료학적 유효" 양은 본원에서 약물이 오직 그러한 양을 단일 투여했을 때 약제학적으로 효과 있다는 것을 반드시 요구하는 것은 아니다; 통상적으로 치료학적 효능은 적절한 빈도 및 투여 기간을 포함하여 용법에 따라 반복적으로 투여된 조성물에 의존한다. 선택된 1일 용량은 암 치료의 면에서 잇점을 제공하기 충분해야 하는 반면, 이것은 받아들일 수 없거나 참기 힘든 정도의 부작용을 유발시키기에 충분하지 않는 것이 매우 바람직하다. 적합한 치료학적 유효량은 본원에서 공개 및 본원에서 인용된 것을 기초로 과도한 실험 없이 통상 기술을 가진 의사에 의해 선택될 수 있으며, 위에서 언급된 것처럼 요인들을 고려해야 한다. 예를 들어 의사는 부작용의 위험을 감소하기 위해, 비교적 적은 1일 용량을 가지고 암환자 치료 과정을 개시하여 수일 또는 수주 기간 이상 동안 용량을 증가시키면서 최적화할 것이다.
예시적으로, ABT-263의 적합한 용량은 일반적으로 약 25 내지 약 1,000mg/일, 더 통상적으로 약 50 내지 약 500 mg/일 또는 약 200 내지 약 400 mg/일, 예를 들어 약 50, 약 100, 약 150, 약 200, 약 250, 약 300, 약 350, 약 400, 약 450 또는 약 500mg/일이며, 평균 투여 간격은 약 3시간 내지 약 7일이며, 예를 들어 약 8시간 내지 약 3일 또는 약 12시간 내지 약 2일이다. 가증 흔한 경우는 1일 1회(q.d.)투여 용법이 적합하다.
본원에서 "평균 투여 간격"은 시간의 기간으로서 정의되며, 예를 들어 1일 또는 1주일, 시간의 기간 동안 투여되는 단위 용량의 수에 의해 나눠진다. 예를 들어, 약물을 1일에 3번 투여하면 오전 8시경, 정오 및 오후 6시로 평균 투여 기간은 8시간이다(24시간을 3으로 나눈 기간). 만약 약물이 정제 또는 캡슐과 같은 분리된 투약형태로써 정제되었을 때에는, 한번에 투여된 투약형태들의 수(예를 들어 2 내지 10)를 정의된 평균 투여 간격의 목적에 따라 단위 용량을 고려해야 한다.
예를 들어 약물 화합물이 ABT-263 bis-HCl형태의 ABT-263인 경우에, 몇몇 양태들에서 1일 투여양 및 투여 간격은 ABT-263 혈장 농도를 0.5 내지 10 ㎍/ml로 유지하도록 선택될 수 있다. 그러므로 그러한 양태들에 따라 ABT-263 치료 과정 동안, 정상 상태 최고 혈장농도(Cmax)는 일반적으로 약 10 ㎍/ml를 초과해서는 안 되고, 정상 상태 최저 혈장농도(Cmin)는 일반적으로 약 0.5 ㎍/ml 아래로 떨어지면 안 된다. 상기 주어진 범위 내에서, Cmax/Cmin 비가 약 5 이하, 예를 들어 정상 상태에서 약 3이하의 비를 제공하기에 효과적인 1일 투여량 및 평균 투여 간격을 선택하는 것이 바람직한 것으로 밝혀질 것이다. 투여 기간이 길수록 Cmax/Cmin 의 비율이 더 커지는 경향이 있음을 이해할 것이다. 예시적으로, 정상상태에서 ABT-263 Cmax가 약 3 내지 8㎍/ml이고 Cmin가 약 1 내지 약 5㎍/ml인 것이 본 방법에 의한 표적이 될 수 있다. Cmax 및 Cmin 의 정상상태 값들은, 미국식품의약국(FDA)과 같은 규제 기관에서 승인될 수 있는 것들을 제한 없이 포함하는 표준 프로토콜에 따라 수행되는 사람 PK 연구에서 확립될 수 있다.
본 양태에 따른 투여는 음식 여부와 상관없이, 즉 공복 상태 또는 공복이 아닌 상태에서 할 수 있다. 그러나 본 발명의 조성물은 긍정적인 식효를 나타낼 수 있기 때문에, 이것은 공복이 아닌 환자들에게 본 조성물들을 투여하는 것이 일반적으로 선호된다.
발명의 조성물들은 단일 또는 병용 치료, 예를 들어 다른 화학적 요법 또는 전리 방사선과 병용되는 것이 적합하다. 본 발명의 특별한 장점은 하루에 한번 경구 투여를 허용하며, 하루에 한번, 다른 경구 투여 약물과 함께 치료하에 있는 환자를 위해 편리한 용법이다. 경구 투여는 환자 그/그녀 자신 또는 환자의 집에 있는 간병인에 의해 쉽게 해낼 수 있다; 이것은 또한 병원 또는 거주 요양 시설에 있는 환자를 위한 투여에 있어 편리한 경로이다.
병용 요법은 예시적으로 본 발명의 조성물, 예를 들면 ABT-263을 포함하는 조성물, 보르테조미브, 카보플라틴, 시스플라틴, 사이클로포스파미드, 다카바진, 덱사메타손, 도세탁셀, 독소루비신, 에토포사이드, 플루다라빈, 이리노테칸, 파클리탁셀, 라파마이신, 리툭시맙, 빈크리스틴 및 이와 같은 것들 중의 하나 이상과 함께, 예를 들면 CHOP(사이클로포스파미드 + 독소루비신 + 빈크리스틴 + 프레드니손), RCVP(리툭시맙 + 사이클로포스파미드 + 빈크리스틴 + 프레드니손), R-CHOP(리툭시맙 + CHOP) 또는 DA-EPOCH-R(용량-조절된 에토포사이드, 프레드니손, 빈크리스틴, 사이클로포스파미드, 독소루비신 및 리툭시맙)과 같은 다중치료제와 함께 투여함을 포함한다.
예를 들어 ABT-263을 포함하는 본 발명의 조성물은, 이에 제한되는 것은 아니지만, 알킬화제, 혈관신생 억제제, 항체, 항대사성물질, 세포분열저지성 물질, 항증식성 물질, 항바이러스성 물질, 오로라 키나제 억제제, 기타 아폽토시스 촉진제(예를 들면, Bcl-xL, Bcl-w 및 Bfl-1 억제제), 사멸 수용체 경로의 활성화제, Bcr-Abl 키나제 억제제 , BiTE (이특이적 T-세포 엔게이져) 항체, 항체-약물 접합체, 생물학적 반응 개질제, 사이클린-의존 키나제(CDK)억제제, 세포주기 억제제, 사이클로옥시게나제-2(COX-2)억제제, 이중 가변 도메인 결합 단백질(DVD), 사람 상피 성장 인자 수용체 2(EbB2 또는 HER/2neu) 억제제, 성장 인자 억제제, 열쇼크 단백질(HSP)-90 억제제, 히스톤 데아세틸라제(HDAC) 억제제, 호르몬 요법제, 면역제제, 아폽토시스 단백질 억제제(IAP), 삽입성 항생제, 키나제 억제제, 키네신 억제제, JAK2억제제, 포유동물 표적의 라파마이신(mTOR)억제제, 마이크로RNA, 미토겐-활성화된 세포외 신호-조절 키나제 (MEK)억제제, 다가 결합 단백질, 비-스테로이드성 항염증 약물(NSAID), 폴리-ADP(아데노신 디포스페이트)-리보스 폴리머라제(PARP) 억제제, 백금 화학요법제, 폴로-유사 키나제(PLK) 억제제, 포스포이노시티드-3 키나제(PI3K) 억제제, 프로테아솜 억제제, 퓨린 동족체, 피리미딘 동족체, 수용체 티록신 키나제 억제제, 레티노이드, 델토이드, 식물 알칼로이드, 소형 억제성 리보핵산(siRNA), 토포아이소머라제 억제제, 유비퀴틴 리가제 억제제 등을 포함하는 하나 이상의 치료제와 함께 병용 요법으로 투여될 수 있다.
BiTE 항체들은 T-세포가 동시에 두 세포에 결합함으로써 암세포를 공격하도록 지시하는 이특이적 항체들이다. T-세포는 표적 암세포를 공격한다. BiTE 항체의 예는, 이에 제한되는 것은 아니지만, 아데카투무맙 (Micromet MT201), 블리나투모맙(Micromet MT103) 등을 포함한다. 이론에 결부시키지 않고, T-세포가 표적 암세포의 아폽토시스를 유발하는 메카니즘의 하나가 퍼포린 및 그랜자임 B를 포함하는 세포용해 과립 성분의 엑소사이토시스에 의한다. 이러한 점에서, Bcl-2는 퍼포린과 그랜자임 B 둘 다에 의한 아폽토시스의 유도를 감소시키는 것으로 나타난다. 이 자료에서 Bcl-2의 억제는 암세포를 표적화 할 때 T-세포에 의해 유도된 세포독성 효과를 증가시킬 수 있음을 시사한다.[참조:Sutton et al. (1997) J. Immunol. 158:5783-5790]
siRNA는 내인성 RNA 염기 또는 화학 개질된 뉴클레오티드를 갖는 분자이다. 상기 개질은 세포 활성을 파기하지 않고, 오히려 증가된 안정성 및/또는 증가된 세포 역가를 부여한다. 화학 개질물의 예로는 포스포로티오에이트 그룹, 2'-데옥시뉴클레오티드, 2'-OCH3-함유 리보뉴클레오티드, 2'-F-리보뉴클레오티드, 2'-메톡시에틸 리보뉴클레오티드, 이들의 병용물 등이 포함된다. siRNA는 다양한 길이(예: 10 내지 200bps)와 다양한 구조[예: 헤어핀, 단일/이중 가닥, 벌지(bulge), 닉/갭(nick/gap), 미스매치]를 가질 수 있고, 활성 유전자 침묵을 제공하도록 세포 내에서 처리된다. 이중-가닥 siRNA(dsRNA)는 각 가닥에 동일한 수의 뉴클레오티드를 가질 수 있거나[평활 말단(blunt ends)] 또는 비대칭 말단을 가질 수 있다[오버행(overhangs)]. 1 또는 2개의 뉴클레오티드 오버행이 센스 및/또는 안티센스 가닥 뿐만 아니라 주어진 가닥의 5'- 및/또는 3'-말단에 존재할 수 있다. 예컨대, Mcl-1을 표적화하는 siRNA는 다양한 암세포주에서 ABT-263 또는 ABT-737의 활성을 증진시키는 것으로 나타났다[참조: Tse et al . (2008) Cancer Res . 68:3421-3428 및 이의 참조문헌들].
다가 결합 단백질은 2개 이상의 항원 결합 부위를 포함하는 결합 단백질이다. 다가 결합 단백질은 3개 이상의 항원 결합 부위를 갖도록 조작되며, 일반적으로 천연 항체가 아니다. "다중 특이적 결합 단백질" 이란 용어는 둘 이상의 관련된 또는 관련되지 않은 표적에 결합할 수 있는 결합 단백질을 의미한다. 이중 가변 도메인(DVD) 결합 단백질은 2개 이상의 항원 결합 부위를 포함하는 단백질에 결합하는 4가 또는 다가 결합 단백질이다. 이러한 DVD는 단일 특이적일 수 있거나(즉, 하나의 항원에 결합할 수 있음) 다중 특이적일 수 있다(즉, 둘 이상의 항원에 결합할 수 있음). 2개의 중쇄 DVD 폴리펩티드와 2개의 경쇄 DVD 폴리펩티드를 포함하는 DVD 결합 단백질을 DVD Ig라고 부른다. DVD Ig의 각각의 절반은 중쇄 DVD 폴리펩티드, 경쇄 DVD 폴리펩티드 및 2개의 항원 결합 부위를 포함한다. 각각의 결합 부위는 항원 결합 부위 하나당 항원 결합에 관계된 총 6개의 CDR과 함께, 중쇄 가변 도메인 및 경쇄 가변 도메인을 포함한다.
알킬화제는 알트레타민, AMD-473, AP-5280, 아파지퀴온, 벤다무스틴, 브로스탈리신, 부설판, 카보퀴온, 카무스틴(BCNU), 클로람부실, Cloretazine™ (라로무스틴, VNP 40101M), 사이클로포스파미드, 다카바진, 에스트라무스틴, 포테무스틴, 글루포스파미드, 이포스파미드, KW-2170, 로무스틴(CCNU), 마포스파미드, 멜팔란, 미토브로니톨, 미토락톨, 니무스틴, 질소 머스타드 N-옥사이드, 라니무스틴, 테모졸로미드, 티오테파, 트레오설판, 트로포스파미드 등을 포함한다.
혈관신생 억제제로서는 상피 성장 인자 수용체(EGFR) 억제제 , 내피 특이적 수용체 티록신 키나제(Tie-2) 억제제, 인슐린 성장 인자-2 수용체(IGFR-2) 억제제, 매트릭스 메탈로프로테이나제-2(MMP-2) 억제제, 매트릭스 메탈로프로테이나제 9(MMP-9) 억제제, 혈소판 유래 성장 인자 수용체(PDGFR)억제제, 트롬보스폰딘 동족체, 혈관 내피 성장 인자 수용체 티로신 키나제(VEGFR) 억제제 등을 포함한다.
항대사성물질로서는 Alimta™ (퍼메트렉스 이나트륨, LY231514, MTA), 5-아자씨티딘, Xeloda™ (카페시타빈), 카모퍼, Leustat™ (클라드리빈), 클로파라빈,싸이타라빈, 싸이타라빈 옥포스페이트, 시토신 아라비노시드, 데시타빈, 데퍼록사민, 독시플루리딘, 에플로니틴, EICAR (5-에티닐-l-β-D-리보푸라노실리미다졸-4-카복사미드), 에노시타빈, 에테닐사이티딘, 플루다라빈, 5-플루오로우라실(5-FU) 단독 또는 레우코보린, Gemzar™ (겜시타빈), 하이드록시우레아, Alkeran™ (멜파란), 머캅토퓨린, 6-머캅토퓨린 리보사이드, 메토트렉세이트, 마이코페놀산, 네라라빈, 놀라트렉스드, 옥포스페이트, 페리트레솔, 펜토스타틴, 랄티트렉스드, 리바비린, S-1, 트리아핀, 트리메트렉세이트, TS-1, 티아조푸린, 테가푸, 비다라빈, UFT 등을 포함한다.
항바이러스성 물질로는 리토나비르, 하이드록시클로로퀸 등을 포함한다.
오로라 키나제 억제제는 ABT-348, AZD-1152, MLN-8054, VX-680, 오로라 A-특이적 키나제 억제제, 오로라 B-특이적 키나제 억제제, 판-오로라 키나제 억제제 등을 포함한다.
ABT-263 또는 본원의 화학식 Ⅰ의 화합물 이외의 Bcl-2 계열 단백질 억제제는, AT-101((-)고시폴), Genasense™ Bcl-2-표적화 안티센스 올리고뉴클레오티드(G3139 또는 옵리머전), IPI- 194, IPI-565, ABT-737, GX-070 (오바토클락스) 등을 포함한다.
Bcr-Abl 키나제 억제제는 다사티닙(BMS-354825) , Gleevec™ (이마티닙) 등을 포함한다.
CDK 억제제는 AZD-5438, BMI-1040, BMS-387032, CVT-2584, 플라보피리돌, GPC-286199, MCS-5A, PD0332991, PHA-690509, 셀리씨클립(CYC-202 또는 R-로스코비틴), ZK-304709 등을 포함한다.
COX-2 억제제는 ABT-963, Arcoxia™(에토리콕시브), Bextra™ (발데콕시브), BMS-347070, Celebrex™ (셀레콕시브), COX-189 (루미라콕시브), CT-3, Deramaxx™(데라콕시브), JTE-522, 4-메틸-2-(3,4-디메틸페닐)-l-(4-설파모일페닐)-lH-피롤, MK-663 (에토리콕시브), NS-398, 파레콕시브, RS-57067, SC-58125, SD-8381, SVT-2016, S-2474, T-614, Vioxx™ (로페콕시브) 등을 포함한다.
EGFR 억제제는 ABX-EGF, 항-EGFR 면역리포좀, EGF-백신, EMD-7200, Erbitux™ (세툭시맙), HR3, IgA 항체, Iressa™ (게피티닙), Tarceva™ (에를로티닙 또는 OSI-774), TP-38, EGFR 융합 단백질, Tykerb™ (라파티닙) 등을 포함한다.
ErbB2 수용체 억제제로는 CP-724714, CI-1033 (카네르티닙), Herceptin™ (트라스투주맙), Tykerb™ (라파티닙), Omnitarg™ (2C4, 페투주맙), TAK-165, GW-572016(이오나파밉), GW-282974, EKB-569, PI-166, dHER2 (HER2 백신), APC-8024 (HER2 백신), 항-HER/2neu 이중특이적 항체, B7.her2IgG3, AS HER2 3관능성 이중 특이적 항체, mAB AR-209, mAB 2B-1 등을 포함한다.
히스톤 데아세틸라제 억제제는 뎁시펩티드, LAQ-824, MS-275, 트라포신, 수베로일라닐리드 하이드록삼산(SAHA), TSA, 밸프로산 등을 포함한다.
HSP-90 억제제는 17AAG, CNF-101, CNF-1010, CNF-2024, 17-DMAG, 겔다나미신, IPI-504, KOS-953, Mycograb™ (HSP-90에 대한 사람 재조합 항체), nab-17AAG, NCS-683664, PU24FC1, PU-3, 라디시콜, SNX-2112, STA-9090, VER-49009 등을 포함한다.
아폽토시스 단백질 억제제는 HGS-1029, GDC-0145, GDC-0152, LCL-161, LBW-242 등을 포함한다.
항체-약물 접합체는 항-CD22-MC-MMAF, 항-CD22-MC-MMAE, 항-CD22-MCC-DMl, CR-Ol 1-vcMMAE, PSMA-ADC, MEDI-547, SGN-19A, SGN-35, SGN-75 등을 포함한다.
사멸 수용체 경로 활성화제는 TRAIL, 및 TRAIL 또는 사멸 수용체(예를들어 DR4 및 DR5)를 표적화하는 항체 또는 기타 제제들, 예를 들어, 아포맙, 코나투무맙, ETR2-ST01, GDC0145 (렉사투무맙), HGS-1029, LBY-135, PRO-1762, 트라스투주맙 등을 포함한다.
키네신 억제제는 AZD-4877 및 ARRY-520와 같은 Eg5 억제제, GSK-923295A와 같은 CENPE 억제제 등을 포함한다.
JAK2 억제제는 CEP-701 (레사우르티닙), XL019, INCB-018424 등을 포함한다.
MEK 억제제는 ARRY-142886, ARRY-438162, PD-325901, PD-98059 등을 포함한다.
mTOR 억제제는 AP-23573, CCI-779, 에베롤리무스, RAD-001, 라파마이신, 템시롤리무스, ATP-경쟁적 TORC1/TORC2 억제제 (PI-103, PP242, PP30 및 토린 1을 포함) 등을 포함한다.
비-스테로이드성 항염증 약물(NSAID)은 Amigesic™ (살살레이트), Dolobid™ (디플루니살), Motrin™ (이부프로펜), Orudis™ (케토프로펜), Relafen™ (나부메톤), Feldene™ (피록시캄), 이부프로펜 크림, Aleve™ 및 Naprosyn™ (나프록센), Voltaren™(디클로페낙), Indocin™ (인도메타신), Clinoril™ (설린닥), Tolectin™ (톨메틴), Lodine™ (에토돌락), Toradol™ (케토롤락), Daypro™ (옥사프로진) 등을 포함한다.
PDGFR 억제제는 CP-673451, CP-868596 등을 포함한다.
백금 화학요법제는 시스플라틴, Eloxatin™ (옥살리플라틴), 엡타플라틴, 로바플라틴, 네다플라틴, Paraplatin™ (카보플라틴), 피코플라틴, 사트라플라틴 등을 포함한다.
폴로- 유사 키나제 억제제는 BI-2536 등을 포함한다.
포스포 이노시티드-3 키나제(PI3K) 억제제는 워트만닌, LY-294002, XL-147, CAL-120, ONC-21, AEZS-127, ETP-45658, PX-866, GDC-0941, BGT226, BEZ235, XL765등을 포함한다.
트롬보스폰딘 동족체는 ABT-510, ABT-567, ABT-898, TSP-I 등을 포함한다.
VEGFR 억제제는 Avastin™ (베바시주맙), ABT-869, AEE-788, Angiozyme™ (혈관 신생을 억제하는 리보자임(리보자임 제약(볼더,CO) 및 시론(에메리빌레,CA)), 악시티닙(AG-13736), AZD-2171, CP-547632, IM-862, Macugen™ (페갑타닙), Nexavar™ (소라페닙, BAY43-9006), 파조파닙 (GW-786034), 바타라닙 (PTK-787 또는 ZK-222584), Sutent™ (수니티닙 또는 SU-11248), VEGF trap, Zactima™ (반데타닙 또는 ZD-6474) 등을 포함한다.
항생제는 아클라루비신, 악티노마이신 D, 암루비신, 안나마이신, Adriamycin™ (독소루비신), Blenoxane™ (블레오마이신), 다우노루비신, Caelyx™ 및 Myocet™ (리포좀성 독소루비신), 엘사미트루신, 에피루비신, 글라루비신, 이다루비신, 마이토마이신 C, 네모루비신, 네오카르지노스타틴, 페플로마이신, 피라루비신, 레베카마이신, 스티말라메르, 스트렙토조신, Valstar™ (발루비신), 지노스타틴과 같은 삽입성 항생제 등을 포함한다.
토포아이소머라제 억제제로는 아클라루비신, 9-아미노캄프토테신, 아모나피드, 암사크린, 베카테카린, 벨로테칸, BN-80915, Camptosar™ (이리노테칸 하이드로틀로라이드), 감프토테신, Cardioxane™ (덱스라족산), 디플로모테칸, 에도테카린, Ellence™ 및 Pharmorubicin™ (에피루비신), 에토포사이드, 엑사테칸, 10-하이드록실캄프토테신, 지마테칸, 루토테칸, 미토산트론, 오라테신, 피라부신, 피산트론, 루비테칸, 소부족산, SN-38, 타플루포시드, 토포테칸 등을 포함한다.
항체는 Avastin™ (베바시주맙), CD40-특이적 항체, chTNT-1/B, 데노수맙, Erbitux™ (세투시맙), Humax-CD4™ (자놀리무맙), IGFlR-특이적 항체, 린투주맙, Panorex™ (에드레콜로맙), Rencarex™ (WX G250), Rituxan™ (리툭시맙), 티실리무맙, 트라스투주맙, CD20 항체 타입 I 및 II 등을 포함한다.
호르몬 치료제는 Arimidex™ (아나스트로졸), Aromasin™ (엑세메스탄), 아르족시펜, Casodex™ (비칼루타미드), Cetrotide™ (세트로렉릭스), 데가렐릭스, 데슬로레린, Desopan™ (트릴로스탄), 덱사메타손, Drogenil™ (플로루타미드), Evista™ (랄록시펜), Afema™ (파드로졸), Fareston™ (토레미펜), Faslodex™ (풀베스트란트), Femara™ (레트로졸), 포메스탄, 글루코코르티코이드, Hectorol™ (도세칼시페롤), Renagel™ (세벨라메르 카보네이트), 라소포시펜, 류프롤리드 아세테이트, Megace™ (메게스트롤), Mifeprex™ (미페프리스톤), Nilandron™ (닐루타미드), Nolvadex™ (타목시펜 시트레이트)를 포함하는 타목시펜 , Plenaxis™ (아바렐릭스), 프레드니손, Propecia™ (피나스테라이드), 릴로스탄, Suprefact™ (부세렐린), Trelstar™ (트립토렐린)을 포함하는 황체 형성 호르몬(LHRH), Vantas™ (히스트렐린 임플란트)을 포함하는 히스트렐린, Modrastane™ (트릴로스탄), Zoladex™ (고세렐린) 등을 포함한다.
델토이드 및 레티노이드는 세오칼시톨 (EB1089 또는 CB1093), 렉사칼시톨(KH1060), 펜레티니드, Panretin™ (알리레티노인), Atragen™ (리포좀성 트레티노인)을 포한하는 트레티노인, Targretin™ (벡사로텐), LGD-1550 등을 포함한다.
PARP 억제제는 ABT-888, 올라파립, KU-59436, AZD-2281, AG-014699, BSI-201, BGP-15, INO-1001, ONO-2231 등을 포함한다.
식물 알칼로이드는 빈크리스틴, 빈블라스틴, 빈데신, 비노렐빈 등을 포함한다.
프로테아좀 억제제는 Velcade™ (보르테조밉), MG132, NPI-0052, PR-171 등을 포함한다.
면역제제의 예로는 인터페론 및 다른 면역 증강제를 포함한다. 인터페론으로는 인터페론 알파, 인터페론 알파-2a, 인터페론 알파-2b, 인터페론 베타, 인터페론 감마-1a, Actimmune™ (인터페론 감마-1b), 인터페론 감마-nl, 이의 조합체 등을 포함한다. 기타 약제로는 알파페론(IFN-α), BAM-002 (산화 글루타티온), Beromun™ (타소네민), Bexxar™ (토시투모맙), Campath™ (알렘투주맙), CTLA4 (세포독성 림프구 항원 4), 다카바진, 데닐류킨, 에프라투주맙, Granocyte™ (레노그라스팀), 렌티난, 류코사이테 알파 인터페론, 이미퀴모드, MDX-OlO (항-CTLA-4), 멜라노마 백신, 미투모맙, 몰그라모스팀, Mylotarg™ (겜투주맙 오조가마이신), Neupogen™ (필그라스팀), Onco VAC-CL, Ovarex™ (오레고보맙), 펨투모맙(Y-muHMFGl), Provenge™ (시풀류셀-T), 사가라모스팀, 사이조피란, 테세류킨, Theracys™ (BCG 또는 바실루스 칼메트-게린), 우베니멕스 , Virulizin™(면역 요법제, Lorus Pharmaceuticals), Z-100 (마루야마 특이 기질 또는 SSM), WF-10 (테트라클로로데카옥사이드 또는 TCDO), Proleukin™ (알데스류킨), Zadaxin™(티말파신), Zenapax™ (다클리주맙), Zevalin™ (90Y-이브리투맙 티욱세탄) 등을 포함한다.
생물학적 반응 개질제들은 유기체의 방어 기전 또는 조직 세포의 생존, 성장 또는 분화와 같은 생물학적 반응들이 항- 종양 활성을 갖도록 개질시키는 약제이며, 크레스틴, 렌티난, 시조푸란, 피시바닐, PF-3512676 (CpG-8954), 우베니멕스 등을 포함한다.
피리미딘 동족체는 시타라빈(시토신 아라비노시드, 아라 C 또는 아라비노시드 C), 독시플루리딘, Fludara™ (플루다라빈), 5-FU (5-플루오로라실), 플록스우리딘, Gemzar™ (겜시타빈), Tomudex™ (랄티트렉스드), 트리아세틸우리딘, Troxatyl™ (트록사시타빈) 등을 포함한다.
퓨린 동족체는 Lanvis™ (티오구아닌), Purinethol™ (머캅토퓨린) 등을 포함한다.
항유사분열제는 바타불린, 에포틸론 D (KOS-862), N-(2-((4-하이드록시-페닐)아미노)피리딘-3-일)-4-메톡시벤젠설폰아미드, 익사베필론(BMS-247550), 파클리탁셀, Taxotere™ (도세탁셀), 라로탁셀(PNU-100940, RPR-109881 또는 XRP-9881), 파투필론, 빈플루닌, ZK-EPO (합성 에포틸론) 등을 포함한다.
유비퀴틴 리가제 억제제는 누틀린과 같은 MDM2 억제제, MLN4924 와 같은 NEDD8 억제제 등을 포함한다.
본원 발명의 조성물은 방사선치료의 효율성을 증가시키는 방사선 감작제로써 이용될 수 있다. 방사선치료의 예는, 이에 제한 되는 것은 아니지만, 외부 방사선 요법(XBRT), 원격 치료, 근접 치료, 밀봉 선원 방사선 요법, 개봉 선원 방사선 요법 등을 포함한다.
추가적 또는 대안적으로, 본원 발명의 조성물은 하나 이상의 항종양제와 함께 병용해서 투여될 수 있거나, Abraxane™ (ABI-007), ABT-100 (파르네실 트랜스퍼라제 억제제), Advexin™ (Ad5CMV-p53 백신 또는 콘투수진 라데노벡), Altocor™ 또는 Mevacor™ (로바스타틴), Ampligen™ (폴리(I)-폴리(C12U), 합성 RNA), Aptosyn™ (엑시술린드), Aredia™ (파미드론산), 아그라빈, L-아스파라기나제, 아타메스탄 (l-메틸-3,17-디온-안드로스타-l,4-디엔), Avage™ (타자로텐), AVE-8062 (컴브레타스타틴 유도체), BEC2 (미투모맙), 카켁틴 또는 카켁신(종양 괴사 인자), Canvaxin™ (멜라노마 백신), CeaVac™ (암 백신), Celeuk™ (셀몰류킨), Ceplene™ (히스타민 디하이드로클로라이드)을 포함하는 히스타민, Cervarix™ (AS04 보조제 흡착된 사람 파필로마 바이러스(HPV) 백신), CHOP (Cytoxan™ (사이클로포스파미드) + Adriamycin™ (독소루비신) + Oncovin™ (빈크리스틴) + 프레드니손), 컴브레타스타틴 A4P, Cypat™ (시프로테론), DAB(389)EGF (사람 표피 성장 인자 His-Ala 링커를 통해 융합된 디프테리아 독소의 촉매 및 전좌 도메인), 다카바진, 닥티노마이신, Dimericine™ (T4N5 리포좀 로션), 5,6-디메틸산테논-4-아세트산(DMXAA), 디스코데몰리드, DX-8951f (엑사테칸 메실레이트), 에닐우라실(에티닐우라실), Evizon™ (스쿠알라민 락테이트)을 포함하는 스쿠알라민 , 엔자스타우린, EPO-906 (에포틸원 B), Gardasil™ (4가 사람 파필로마 바이러스(유형 6, 11, 16, 18) 재조합 백신), Gastrimmune™, Genasense™ (오블리메르센), GMK (강를리오시드 접합체 백신), GV AX™ (전립선 암 백신), 할로푸지논, 히스테렐린, 하이드록시카바미드, 이반드론산, IGN-101, IL-13-PE38, IL-13-PE38QQR (신트레데킨 베수도톡스), IL-13-슈도모나스 외독소, 인터페론-α, 인터페론-γ, Junovan™ 및 Mepact™ (미파머티드), 로나파닙, 5,10-메틸린테트라하이드로폴레이트, 밀테포신(헥사데실-포스포콜린), Neovastat™ (AE-941), Neutrexin™ (트리메트렉세이트 글루쿠론산염), Nipent™ (펜토스타틴), Onconase™ (란피르나제, 리보뉴글레아제 효소), Oncophage™ (비테스펜, 흑색종 백신 치료), OncoVAX™ (IL-2 백신), Orathecin™ (루비테칸), Osidem™ (항체-기반 세포 약물), Ovarex™ MAb (뮤린 모노클로날 항체), 파클리탁셀 알부민-안정화 나노입자, 파클리탁셀, Pandimex™ (20(s)-프로토파낙사디올(aPPD) 및 20(s)-프로토파낙사트리올(aPPT)를 포함하는 인삼 기원의 아글리콘 사포닌), 파니투무맙, Panvac™-VF(시험용 암백신), 페가스파가제, 페긴테르페로날파(PEG 인터페론 A), 페녹소디올, 프로카바진, 레비마스타트, Removab™ (카투마소맙), Revlimid™ (레나리도미드), RSR13 (에파프록시랄), Somatuline™ LA(란레오티드), Soriatane™ (아시트레틴), 스타우로스포린(스트렙토미세스 스타우로스포레스), 타라보스텟(PTlOO), Targretin™ (벡사로텐), Taxoprexin™ (도코사헥세노익산 (DHA) + 파클리탁셀), Telcyta™ (칸포스파미드, TLK-286), Temodar™ (테모졸로미드), 테스밀리펜, 테트란드린, 탈리도미드, Theratope™ (STn-KLH 백신), Thymitaq™ (노라트렉스 디하이드로클로라이드), TNFerade™ (아데노벡터: 종양 괴사 인자-α를 위한 유전자 포함 DNA 운반체), Tracleer™ 또는 Zavesca™ (보센탄), TransMID-107R™ (KSB-311, 디프테리아 독소), 트레티노인(레틴-A), Trisenox™ (아세닉 트리옥시드), Ukrain™ (큰 애기똥풀 식물로부터 얻은 알칼로이드 유도체), Virulizin™, Vitaxin™ (항-αvβ3 항체), Xcytrin™ (모텍사핀 가돌리늄), Xinlay™ (아트라센탄), Xyotax™ (파클리탁셀 폴리글루멕스), Yondelis™ (트라벡테딘), ZD-6126 (N-아세틸콜치놀-O-포스페이트), Zinecard™ (덱스라조산), 졸레드로닉산, 조로비신 등으로부터 선택되는 화학적 요법제와 병용해 투여할 수 있다.
한 양태에서, 본원 발명의 조성물, 예를 들어 ABT-263을 포함하는 조성물은 항아폽토시스 Bcl-2 단백질, 항아폽토시스 Bcl-XL 단백질 및 항아폽토시스 Bcl-w 단백질 중 하나 이상이 과발현되어 나타나는 질환을 치료하기 위해 이를 필요로 하는 환자들에게 치료학적 유효량으로 투여된다.
또 다른 양태에서, 본 발명의 조성물, 예를 들면 ABT-263을 포함하는 본 발명의 조성물은 비정상적인 세포 성장 및/또는 이상조절된 아폽토시스의 질환을 치료하기 위해 이를 필요로 하는 대상자에게 치료학적 유효량으로 투여된다.
상기 질환의 예로는, 이에 제한되는 것은 아니지만, 암, 중피종, 방광암, 췌장암, 피부암, 두경부암, 피부 또는 안구내 흑색종, 난소암, 유방암, 자궁암, 난관 암종, 자궁내막 암종, 자궁경부 암종, 질 암종, 외음부 암종, 골암, 대장암, 직장암, 항문 부위의 암, 위암, 위장(위, 결장 및/또는 십이지장)암, 만성 림프구성 백혈병, 급성 림프구성 백혈병, 식도암, 소장암, 내분비계 암, 갑상선암, 부갑상선암, 부신암, 연질 조직 육종, 요도암, 음경암, 고환암, 간세포(간 및/또는 담관)암, 1차 또는 2차 중추신경계 종양, 1차 또는 2차 뇌종양, 호지킨병, 만성 또는 급성 백혈병, 만성 골수성 백혈병, 림프구성 림프종, 림프아구성 백혈병, 여포성 림프종, T-세포 또는 B-세포 기원의 림프구 악성 종양, 흑색종, 다발성 골수종, 구강암, 비-소세포 폐암, 전립선암, 소세포 폐암, 신장암 및/또는 요관암, 신세포 암종, 신우 암종, 중추신경계의 신생물, 1차 중추신경계 림프종, 비-호지킨 림프종, 척수 축 종양, 뇌간 신경교종, 뇌하수체 선종, 부신피질암, 담낭암, 비장암, 담관암종, 섬유육종, 신경아세포종, 망막아종 또는 이들의 조합이 포함된다.
더욱 구체적인 양태에서, 본 발명의 조성물, 예를 들면 ABT-263을 포함하는 본 발명의 조성물은, 방광암, 뇌암, 유방암, 골수암, 자궁경부암, 만성 림프구성 백혈병, 급성 림프구성 백혈병, 직장암, 식도암, 간세포암, 림프아구성 백혈병, 여포성 림프종, T-세포 또는 B-세포 기원의 림프구 악성 종양, 흑색종, 골수성 백혈병, 골수종, 구강암, 난소암, 비-소세포 폐암, 전립선암, 소세포 폐암 또는 비장암을 치료하기 위해 이를 필요로 하는 대상자에게 치료학적 유효량으로 투여된다.
임의의 이들 양태들에 따르면, 상기 조성물은 단일 용법으로, 또는 하나 이상의 추가의 치료제와의 병용 용법으로 투여된다.
예를 들면, 중피종, 방광암, 췌장암, 피부암, 두경부암, 피부 또는 안구내 흑색종, 난소암, 유방암, 자궁암, 난관 암종, 자궁내막 암종, 자궁경부 암종, 질 암종, 외음부 암종, 골암, 대장암, 직장암, 항문 부위의 암, 위암, 위장(위, 결장 및/또는 십이지장)암, 만성 림프구성 백혈병, 급성 림프구성 백혈병, 식도암, 소장암, 내분비계 암, 갑상선암, 부갑상선암, 부신암, 연질 조직 육종, 요도암, 음경암, 고환암, 간세포(간 및/또는 담관)암, 1차 또는 2차 중추신경계 종양, 1차 또는 2차 뇌종양, 호지킨병, 만성 또는 급성 백혈병, 만성 골수성 백혈병, 림프구성 림프종, 림프아구성 백혈병, 여포성 림프종, T-세포 또는 B-세포 기원의 림프구 악성 종양, 흑색종, 다발성 골수종, 구강암, 비-소세포 폐암, 전립선암, 소세포 폐암, 신장암 및/또는 요관암, 신세포 암종, 신우 암종, 중추신경계의 신생물, 1차 중추신경계 림프종, 비-호지킨 림프종, 척수 축 종양, 뇌간 신경교종, 뇌하수체 선종, 부신피질암, 담낭암, 비장암, 담관암종, 섬유육종, 신경아세포종, 망막아종 또는 이들 조합의 치료 방법은, (a) 본 발명의 조성물, 예를 들면 ABT-263을 포함하는 본 발명의 조성물 및 (b) 하나 이상의 에토포사이드, 빈크리스틴, CHOP, 리툭시맙, 라파마이신, R-CHOP, RCVP, DA-EPOCH-R 또는 보르테조밉의 치료학적 유효량을 대상자에게 투여함을 포함한다.
구체적 양태에서, 본 발명의 조성물, 예를 들면 ABT-263을 포함하는 본 발명의 조성물은 B-세포 림프종 또는 비-호지킨 림프종과 같은 림프구성 악성 종양의 치료를 위해, 이를 필요로 하는 대상자에게 치료학적 유효량의 에토포사이드, 빈크리스틴, CHOP, 리툭시맙, 라파마이신, R-CHOP, RCVP, DA-EPOCH-R 또는 보르테조밉과 함께 치료학적 유효량으로 투여된다.
본원 발명은 사람 암 환자의 혈류에서 치료학적 유효 혈장 농도의 ABT-263 및/또는 하나 이상의 이의 대사물을 유지시키는 방법을 제공하는 것으로서, 상기 방법은 상기 대상자에 ABT-263 또는 약제학적으로 허용되는 염, 프로드럭, 프로드럭의 염 또는 이의 대사물, 특히 ABT-263의 결정성 염 , 예를 들어 ABT-263 bis-UCL을 포함하는 나노입자형 현탁액을 1일 약 50 내지 500mg의 ABT-263 과 동등한 용량으로 약 3시간 내지 7일의 평균 투여 간격으로 투여하는 것을 포함한다
치료학적 유효 혈장 농도를 구성하는 것은 특히, 환자가 가진 특정 암, 상기 암의 단계, 암의 중증도 및 공격성 및 추구하는 결과(예를 들면, 안정화, 종양 성장의 감소, 종양 수축, 전이 위험 감소 등)에 따라 달라진다. 상기 혈장 농도는 암 치료의 측면에서 이점을 제공하기에 충분하면서도, 허용될 수 없거나 참을 수 없는 정도의 불리한 부작용을 유발할 정도로 과도하지는 않아야 한다.
일반적인 암 및 특히 비-호지킨 림프종과 같은 림프구성 악성 종양의 치료를 위해, ABT-263의 혈장 농도는 대부분의 경우 약 0.5 내지 약 10㎍/㎖ 범위 내에서 유지되어야 한다. 따라서, ABT-263 치료 과정 동안, 정상 상태 Cmax는 일반적으로 약 10㎍/㎖를 초과하지 않아야 하며, 정상 상태 Cmin는 일반적으로 약 0.5㎍/㎖ 미만으로 떨어지지 않아야 한다. 또한, 상기 제공된 범위 내에서, 정상 상태에서 약 5 이하, 예를 들면 약 3 이하의 Cmax/Cmin 비율을 제공하기에 효과적인 1일 용량 및 평균 투여 간격을 선택하는 것이 바람직한 것으로 밝혀질 것이다. 투여 간격이 길어질수록 Cmax/Cmin 비율이 더 커지는 경향이 있음을 이해할 것이다. 예시적으로, 본 발명의 방법은 정상 상태에서 약 3 내지 약 8㎍/㎖의 ABT-263 Cmax 및 약 1 내지 약 5㎍/㎖의 Cmin을 목표로 할 수 있다.
당해 양태에 따르면, 치료학적 유효 ABT-263 혈장 수준을 유지하기에 효과적인 1일 용량은 약 50 내지 약 500㎎이다. 대부분의 경우, 적합한 1일 용량은 약 200 내지 약 400㎎이다. 예시적으로, 상기 1일 용량은 예를 들면 약 50, 약 100, 약 150, 약 200, 약 250, 약 300, 약 350, 약 400, 약 450 또는 약 500㎎일 수 있다.
당해 양태에 따르면, 치료학적 유효 ABT-263 혈장 수준을 유지하기에 효과적인 평균 투여 간격은 약 3시간 내지 약 7일이다. 대부분의 경우, 적합한 평균 투여 간격은 약 8시간 내지 약 3일, 또는 약 12시간 내지 약 2일이다. 1일 1회(q.d.) 투여 용법이 종종 적합하다.
당해 양태에 관해, ABT-263은 예시적으로 ABT-263 bis-HCl 또는 다른 결정ABT-263 염 형태로 약제학적 조성물 중에 존재한다. 앞서 더욱 충분히 정의된 바와 같은, 본 발명의 임의의 ABT-263 조성물이 사용될 수 있다.
다른 양태들에서와 마찬가지로, 당해 양태에 따른 투여는 음식물과 함께 또는 음식물 없이, 즉, 공복이 아닌 상태 또는 공복인 상태에서 이루어질 수 있다. 일반적으로, 본 발명의 조성물은 공복이 아닌 환자에게 투여되는 것이 바람직하다.
실시예
하기 실시예는 단지 예시적이며 어떤 방법으로 밝혀진 사실에 제한적이지 않다.
농도 및 용량을 포함한 모든 ABT-263 양들은, 주어진 실시예에서 다른 언급이 없는 한 유리 염기와 동등한 용량으로써 표현된다. ABT-263은 bis-HCl염으로써 사용되는 경우, 1.076 mg의 ABT-263 bis-HCl은 1 mg ABT-263 유리 염기 등량으로 제공한다.
실시예
1: 예시적인 나노입자형
현탁액의
제조
ABT-263 나노입자형 현탁액 제형들은 하기 제시된 고압 균질화에 의해 제조된다. 제형은 물 속에 하기 조성(모든 백분율은 중량/부피로 표현)을 갖는다.
제형 I (비교)
ABT-263 bis-HCl 5% ( 4.65% 유리 염기 등량)
폴록사머 188 3%
제형
II
(본 발명의 예시)
ABT-263 bis-HCl 5% ( 4.65% 유리 염기 등량)
폴록사머 188 3%
NaHCO3 8.4%
폴록사머 188(Pluronic™ F68)의 제시된 양 및 제형 Ⅱ의 경우에 중탄산나트륨의 제시된 양을 포함하는 수성 용액을 제조한다. 5% 중량/부피(50 mg/ml)현탁액을 제공하기 위해 충분한 양인 결정성 ABT-263 bis-HCl을 Sonifier™ 균질화기(Branson Ultrasonic, Danbury, CT)를 사용해 각각 수성 용액 속에 분산시켰다.이어서, 수득한 분산액을 Microfluidizer™ M-11OL 처리기(Microfluidics International Corp., Newton, MA)의 샘플 저장소에 첨가하고 12,000 psi (대략 82.5 MPa)에서 2시간 동안 처리하였다. 샘플 온도는 냉각장치에 연결된 물 욕조에 함침된 열교환기를 통해 분산시켜 20 ± 2°C 의 온도로 유지시켰다.
그렇게 얻어진 현탁액들(제형 I 및 II)은 제조 즉시 및 5℃에서 14일 동안 저장한 후에 입자 크기를 측정하였다(실시예 2 참조). 제형 II는 개에서 경구 약력동력학(PK)연구에 사용되었다(실시예 3 참조).
실시예
2:
나노현탁액의
입자 크기 안정성에 대한 중탄산나트륨의 효과
제형 I 및 II는 그들의 입자 크기 분포와 관련해서 비교한다(D90 및 D50). 입자 크기 측정은 현탁액의 제조 즉시 (t=0) 및 5℃에서 14일 동안 저장한 후에 수행하였다. 또한 입자 크기는 20ml 0.9% 염화나트륨 용액(NaCl)에서 각각의 현탁액 1ml를 희석시킨 후 현탄액에 대해 t=0에서 측정했다. 데이터는 표 1에 제시한다.
표 1 나노현탁액 제형 I 및 II의 D90 및 D50 입자 크기(μm)
실시예
3: 예시적인 나노
현탁액의
약력동력학
실시예 1의 제형 II의 단일-투여 약력동력학은 공복이 아닌 비글 개(n=4)에게 5mg/kg의 경구 투여 후 측정하였다. 제형은 두 가지 방법인 경구 위관영양법 및 캡슐로써 투여하였다. 제형 Ⅱ는 히스타민-전처리된 공복의 개(n=4)에게 단지 경구 위관영양법으로 투여하였다. 비교 목적을 위해 지질 매질( 제형 C, Phosal 53 MCT™ 및 에탄올을 90:10으로 혼합하고 25 mg/ml의 농도로 용해된 ABT-263 bis-HCl 분말로부터 제조된)안에 ABT-263 bis-HCl의 용액 제형을 공복이 아닌 개에 투여하였다. 제형 C는 임상 연구에서 ABT-263을 평가하기 위해 사용하였다. Phosal 53 MCT™ 은 포스포리피드 유한책임회사에 의해 제공된 독점 블렌드이고 53% 포스파티딜콜린 및 29%의 중간쇄 트리글리세리드를 함유한다.
연속 헤파린 처리된 혈액 샘플은 투여 직전 및 투여 한지 0.25, 0.5, 1, 1.5, 2, 3, 4, 6, 9, 12, 15 및 24 시간 후에 각각의 동물들의 경정맥으로부터 수득하였다. 혈장은 원심분리기(대략 4℃에서 10분 동안 2000rpm)에 의해 분리하고 ABT-263은 아세토니트릴을 사용한 단백질 침전을 사용하여 분리하였다.
ABT-263 및 내부 표준물은 서로로부터 및 0.7 ml/min의 유속에서 아세토니트릴/0.1%의 트리플루오로아세트산 이동상 (50/50의 부피비)을 가진 50 x 3 mm Keystone Betasil CN™ 5 ㎛ 칼럼상에 동시-추출된 오염물질로부터 분리하였다. 가열된 분무기 접지면을 가진 생체분자 질량 분석기 Sciex API3000™상에서 분석한다. ABT-263 및 내부표준물 피크 면적은 Sciex MacQuan™ 소프트웨어를 사용해 결정하였다. 각각 샘플의 혈장 약물 농도는 농도에 대한 스파이크 혈장 표준물의 피크 면적 비율(상위/ 내부 표준)의 최소 제곱 선형 회귀(비-가중)법에 의해 계산하였다. 혈장 농도 데이터는 WinNonlin 3(Pharsight)를 사용한 멀티-지수 곡선 피팅에 적용하였다.
투여 후 0 내지 t시간 까지(마지막 측정된 혈장 농도 시간, 본원에서 24시간)의 혈장 농도-시간 곡선 이하 면적은 혈장 농도-시간 프로필에 대한 선형 사다리꼴 규칙을 사용하여 계산하였다.
투여 이후 24시간에 걸친 평균 혈장 농도는 도 1에 나타낸다.
PK 변수의 계산된 평균값은 표 2에 요약한다.
표 2 개(만약 따로 언급하지 않는 한 공복이 아님)에서 PK 변수(평균 ± SEM)
Claims (32)
- 약 3㎛이하의 D90입자 크기를 갖는 고체 입자 화합물이 현탁되어 있는 수성 매질을 포함하는 액상 약제학적 조성물로서, 상기 화합물이 화학식Ⅰ의 화합물 또는 이의 약제학적으로 허용되는 염, 프로드럭, 프로드럭의 염 또는 대사물이고, 상기 수성 매질이 입자의 크기 증가를 함께 억제하기 위한 유효량으로 하나 이상의 약제학적으로 허용되는 계면활성제 및 하나 이상의 약제학적으로 허용되는 염기화제를 추가로 포함하는 것인, 액상 약제학적 조성물.
화학식 I
상기 화학식 I에서,
X3은 클로로 또는 플루오로이고,
(1) X4는 아제판-1-일, 모르폴린-4-일, 1,4-옥사제판-4-일, 피롤리딘-1-일, -N(CH3)2, -N(CH3)(CH(CH3)2), 7-아자바이사이클로[2.2.1]헵탄-7-일 또는 2-옥사-5-아자바이사이클로[2.2.1]헵트-5-일이고, R0은
(여기서, X5는 -CH2-, -C(CH3)2- 또는 -CH2CH2-이고,
X6 및 X7은 둘 다 -H 이거나, 둘 다 메틸이고,
X8은 플루오로, 클로로, 브로모 또는 요오도이다)이거나;
(2) X4는 아제판-1-일, 모르폴린-4-일, 피롤리딘-1-일, - N(CH3)(CH(CH3)2) 또는 7-아자바이사이클로[2.2.1]헵탄-7-일이고, R0은 (여기서, X6, X7 및 X8은 상기된 바와 같다)이거나;
(3) X4는 모르폴린-4-일 또는 -N(CH3)2이고, R0은 (여기서, X8은 상기된 바와 같다)이다. - 제1항에 있어서, 화합물이 약 800nm이하의 D90 입자 크기 및/또는 약 350nm이하의 D50 입자 크기를 갖는 것인 조성물.
- 제1항 또는 제2항에 있어서, 약물 화합물이 약 20 내지 약 200mg/ml의 양으로 존재하는 것인 조성물.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 하나 이상의 계면활성제가 벤즈알코늄 클로라이드, 벤젠토늄 클로라이드, 세틸피리디늄 클로라이드, 디옥틸 나트륨 설포석시네이트, 폴리옥시에틸렌 알킬페닐 에테르, 노녹시놀 9, 노녹시놀 10, 옥톡시놀 9, 폴록사머, 폴록사머 188, 폴록사머 237, 폴리옥시에틸렌 지방산 글리세리드, 폴리옥시에틸렌 지방산 오일, 폴리옥시에틸렌 (8) 카프릴릭/카프릭 모노- 및 디글리세리드, 폴리옥시에틸렌 (35) 피마자유, 폴리옥시에틸렌 (40) 수소화된 피마자유, 폴리옥시에틸렌 알킬 에테르, 세테스-10, 라우레스-4, 라우레스-23, 올레스-2, 올레스-10, 올레스-20, 스테아레스-2, 스테아레스-10, 스테아레스-20, 스테아레스-100, 폴리옥시에틸렌 (20) 세토스테아릴 에테르, 폴리옥시에틸렌 지방산 에스테르, 폴리옥시에틸렌 (20) 스테아레이트, 폴리옥시에틸렌 (40) 스테아레이트, 폴리옥시에틸렌 (100) 스테아레이트, 소르비탄 에스테르, 소르비탄 모노라우레이트, 소르비탄 모노올레에이트, 소르비탄 모노팔미테이트, 소르비탄 모노스테아레이트, 폴리옥시에틸렌 소르비탄 에스테르, 폴리소르베이트 20, 폴리소르베이트 80, 프로필렌 글리콜 지방산 에스테르, 프로필렌 글리콜 라우레이트, 나트륨 라우릴 설페이트, 올레산, 올레산 나트륨, 트리에탄올아민 올레에이트, 글리세릴 지방산 에스테르, 글리세릴 모노올레에이트, 글리세릴 모노스테아레이트, 글리세릴 팔미토스테아레이트, TPGS, 티록사폴 및 이의 배합물로 이루어진 그룹으로부터 선택된 것인 조성물.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 하나 이상의 계면활성제가 약 10 내지 약 100mg/ml의 총 계면활성제 양으로 존재하는 것인 조성물.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 하나 이상의 염기화제가 중탄산나트륨을 포함하는 것인 조성물.
- 제6항에 있어서, 중탄산나트륨이 약 20 내지 약 200mg/ml의 양으로 존재하는 것인 조성물.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 화합물이 ABT-263 또는 이의 결정성 염인 조성물.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 화합물이 ABT-263 유리 염기, ABT-263 bis-HCl 염 또는 이의 배합물인 조성물.
- 제9항에 있어서, 하나 이상의 계면활성제가 폴록사머를 포함하고 약 10 내지 약 100mg/ml의 총 계면활성제 양으로 존재하는 것인 조성물.
- 제9항에 있어서, 하나 이상의 계면활성제가 폴록사머 188를 포함하고 약 15내지 약 60mg/ml의 총 계면활성제 양으로 존재하는 것인 조성물.
- 제9항 내지 제11항 중 어느 한 항에 있어서, 하나 이상의 염기화제가 중탄산나트륨을 포함하고 약 40 내지 약 160mg/ml의 양으로 존재하는 것인 조성물.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 수성 매질이 식염수 매질인 조성물.
- 제1항 내지 제13항 중 어느 한 항에 있어서, 비경구 또는 경구 투여를 위한 조성물.
- 약 3㎛ 이하의 D90입자 크기를 갖는 입자 형태로 화학식 Ⅰ의 화합물 또는 이의 약제학적으로 허용되는 염, 프로드럭, 프로드럭의 염 또는 대사물; 및 (a) 하나이상의 계면활성제 및 하나 이상의 염기화제 및 (b) 하나 이상의 분산제 또는 증량제를 포함하는 약제학적으로 허용되는 부형제를 포함하는 고체 약제학적 조성물로서, 이때 상기 계면활성제 및 염기화제가 입자 크기 증가를 함께 억제하기 위한 유효량으로 존재하는 현탁액을 제공하기 위해 수성 매질에서 분산될 수 있는 고체 약제학적 조성물.
화학식 Ⅰ
상기 화학식 I에서,
X3은 클로로 또는 플루오로이고,
(1) X4는 아제판-1-일, 모르폴린-4-일, 1,4-옥사제판-4-일, 피롤리딘-1-일, -N(CH3)2, -N(CH3)(CH(CH3)2), 7-아자바이사이클로[2.2.1]헵탄-7-일 또는 2-옥사-5-아자바이사이클로[2.2.1]헵트-5-일이고, R0은
(여기서, X5는 -CH2-, -C(CH3)2- 또는 -CH2CH2-이고,
X6 및 X7은 둘 다 -H이거나, 둘 다 메틸이고,
X8은 플루오로, 클로로, 브로모 또는 요오도이다)이거나;
(2) X4는 아제판-1-일, 모르폴린-4-일, 피롤리딘-1-일, -N(CH3)(CH(CH3)2) 또는 7-아자바이사이클로[2.2.1]헵탄-7-일이고, R0은 (여기서, X6, X7 및 X8은 상기된 바와 같다)이거나;
(3) X4는 모르폴린-4-일 또는 -N(CH3)2이고, R0은 (여기서, X8은 상기된 바와 같다)이다. - 하나 이상의 약제학적으로 허용되는 염기화제의 존재하에 활성 약제학적 성분(API)을 약 3㎛이하의 D90 입자 크기로 습식 분쇄하여 분쇄된 약물 물질을 수득하고, 하나 이상의 약제학적으로 허용되는 계면활성제의 보조하에 수성 매질 중에 상기 분쇄된 약물 물질을 현탁시킴을 포함하는 약제학적 조성물을 제조하기 위한 방법으로서, 이때 하나 이상의 염기화제 및 하나 이상의 계면활성제가 수득된 현탁액중에 입자 크기 증가를 함께 억제하기 위한 유효량으로 존재하고, API가 화학식Ⅰ의 화합물 또는 이의 약제학적으로 허용되는 염, 프로드럭, 프로드럭의 염 또는 대사물을 포함하는 것인, 약제학적 조성물의 제조 방법.
화학식 Ⅰ
상기 화학식 I에서,
X3은 클로로 또는 플루오로이고,
(1) X4는 아제판-1-일, 모르폴린-4-일, 1,4-옥사제판-4-일, 피롤리딘-1-일, -N(CH3)2, -N(CH3)(CH(CH3)2), 7-아자바이사이클로[2.2.1]헵탄-7-일 또는 2-옥사-5-아자바이사이클로[2.2.1]헵트-5-일이고, R0은
(여기서, X5는 -CH2-, -C(CH3)2 -또는 -CH2CH2-이고,
X6 및 X7은 둘 다 -H이거나, 둘 다 메틸이고,
X8은 플루오로, 클로로, 브로모 또는 요오도이다)이거나;
(2) X4는 아제판-1-일, 모르폴린-4-일, 피롤리딘-1-일, -N(CH3)(CH(CH3)2) 또는 7-아자바이사이클로[2.2.1]헵탄-7-일이고, R0은 (여기서, X6, X7 및 X8은 상기된 바와 같다)이거나;
(3) X4는 모르폴린-4-일 또는 -N(CH3)2이고, R0은 (여기서, X8은 상기된 바와 같다)이다. - 제16항에 있어서, API가 ABT-263 bis-HCl을 포함하는 것인 방법.
- 제16항 또는 제17항에 있어서, API가 약 800nm이하의 D90 입자 크기 및/또는 약 350nm이하의 D50 입자 크기로 분쇄되는 것인 방법.
- 제16항 내지 제18항 중 어느 한 항에 있어서, 습식 분쇄가 고압 균질화를 포함하는 것인 방법.
- 제16항 내지 제19항 중 어느 한 항에 있어서, 하나 이상의 계면활성제가 습식 분쇄 전에 API 및 하나 이상의 염기화제에 첨가되는 것인 방법.
- 제16항 내지 제20항 중 어느 한 항에 있어서, 하나 이상의 염기화제가 중탄산나트륨을 포함하는 것인 방법.
- 제16항 내지 제21항 중 어느 한 항에 있어서, 현탁액에 분산제 또는 증량제를 첨가하고 상기 현탄액을 건조시켜 재구성될 수 있는 분말을 수득함을 추가로 포함하는 방법.
- 아폽토시스 기능이상 및/또는 항-아폽토시스 Bcl-2 계열 단백질의 과발현을 특징으로 하는 질환을 가진 대상자에게 치료학적 유효량의 제1항 내지 제15항 중 어느 한 항에 따른 조성물을 투여함으로써 아폽토시스 기능이상 및/또는 항-아폽토시스 Bcl-2 계열 단백질의 과발현을 특징으로 하는 질환을 치료하기 위한 제1항 내지 제15항 중 어느 한 항에 따른 조성물의 용도.
- 제23항에 있어서, 조성물이 비경구 또는 경구로 투여되는 것인 용도.
- 제23항 또는 제24항에 있어서, 질환이 신생물 질환인 것인 용도.
- 제25항에 있어서, 신생물 질환이 암, 중피종, 방광암, 췌장암, 피부암, 두경부암, 피부 또는 안구내 흑색종, 난소암, 유방암, 자궁암, 난관 암종, 자궁내막 암종, 자궁경부 암종, 질 암종, 외음부 암종, 골암, 대장암, 직장암, 항문 부위의 암, 위암, 위장(위, 결장 및/또는 십이지장)암, 만성 림프구성 백혈병, 급성 림프구성 백혈병, 식도암, 소장암, 내분비계 암, 갑상선암, 부갑상선암, 부신암, 연질 조직 육종, 요도암, 음경암, 고환암, 간세포(간 및/또는 담관)암, 1차 또는 2차 중추신경계 종양, 1차 또는 2차 뇌종양, 호지킨병, 만성 또는 급성 백혈병, 만성 골수성 백혈병, 림프구성 림프종, 림프아구성 백혈병, 여포성 림프종, T-세포 또는 B-세포 기원의 림프구 악성 종양, 흑색종, 다발성 골수종, 구강암, 비-소세포 폐암, 전립선암, 소세포 폐암, 신장암 및/또는 요관암, 신세포 암종, 신우 암종, 중추신경계의 신생물, 1차 중추신경계 림프종, 비-호지킨 림프종, 척수 축 종양, 뇌간 신경교종, 뇌하수체 선종, 부신피질암, 담낭암, 비장암, 담관암종, 섬유육종, 신경아세포종, 망막아종 및 이들의 조합으로 이루어진 그룹으로부터 선택된 것인 용도.
- 제25항에 있어서, 신생물 질환이 림프구성 악성 종양인 용도.
- 제27항에 있어서, 림프구성 악성 종양이 비-호지킨 림프종인 용도.
- 제25항에 있어서, 신생물 질환이 만성 또는 급성 림프구성 백혈병인 용도.
- 제23항 내지 제29항 중 어느 한 항에 있어서, 투여되는 조성물이 ABT-263 유리 염기, ABT-263 bis-HCl 및 이의 배합물을 포함하고 1일당 약 50 내지 약 500mg의 ABT-263 유리 염기 등량이, 약 3시간 내지 약 7일의 평균 치료 간격으로 경구 투여되는 것인 용도.
- 제30항에 있어서, 조성물이 1일당 약 200 내지 약 400mg의 ABT-263 유리 염기 등량으로 1일 1회 투여되는 것인 용도.
- 제8항에 따른 조성물을 환자에게 1일당 약 50 내지 약 500mg의 ABT-263 유리 염기 등량으로 약 3시간 내지 약 7일의 평균 투여 간격으로 투여함으로써, ABT-263 및/또는 이의 하나 이상의 대사물의 치료학적 유효 혈장 농도를 사람 암환자의 혈류에 유지시키기 위한 제8항에 따른 조성물의 용도.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US21828109P | 2009-06-18 | 2009-06-18 | |
| US61/218,281 | 2009-06-18 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120052937A true KR20120052937A (ko) | 2012-05-24 |
Family
ID=42797219
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127001358A Withdrawn KR20120052937A (ko) | 2009-06-18 | 2010-06-14 | 안정한 나노입자형 약물 현탁액 |
Country Status (15)
| Country | Link |
|---|---|
| US (1) | US20100323020A1 (ko) |
| EP (1) | EP2442789A1 (ko) |
| JP (1) | JP2012530704A (ko) |
| KR (1) | KR20120052937A (ko) |
| CN (1) | CN102802609A (ko) |
| AU (1) | AU2010260226A1 (ko) |
| BR (1) | BRPI1014027A2 (ko) |
| CA (1) | CA2764187A1 (ko) |
| IL (1) | IL216593A0 (ko) |
| MX (1) | MX2011013797A (ko) |
| RU (1) | RU2012101627A (ko) |
| SG (1) | SG176929A1 (ko) |
| TW (1) | TW201103573A (ko) |
| WO (1) | WO2010147899A1 (ko) |
| ZA (1) | ZA201109219B (ko) |
Families Citing this family (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20100280031A1 (en) * | 2009-04-30 | 2010-11-04 | Paul David | Lipid formulation of apoptosis promoter |
| US8728516B2 (en) * | 2009-04-30 | 2014-05-20 | Abbvie Inc. | Stabilized lipid formulation of apoptosis promoter |
| US8362013B2 (en) * | 2009-04-30 | 2013-01-29 | Abbvie Inc. | Salt of ABT-263 and solid-state forms thereof |
| TWI532484B (zh) * | 2009-06-08 | 2016-05-11 | 艾伯維有限公司 | 包含凋亡促進劑之固態分散劑 |
| TWI471321B (zh) * | 2009-06-08 | 2015-02-01 | 亞培公司 | Bcl-2族群抑制劑之口服醫藥劑型 |
| US8927009B2 (en) * | 2009-12-22 | 2015-01-06 | Abbvie Inc. | ABT-263 capsule |
| UA113500C2 (xx) | 2010-10-29 | 2017-02-10 | Одержані екструзією розплаву тверді дисперсії, що містять індукуючий апоптоз засіб | |
| US8716363B2 (en) | 2011-09-28 | 2014-05-06 | Globus Medical, Inc. | Biodegradable putty compositions and implant devices, methods, and kits relating to the same |
| EP2763668A4 (en) * | 2011-10-05 | 2015-04-15 | Douglas Pharmaceuticals Ltd | PHARMACEUTICAL PROCESSES AND TOPICAL COMPOSITIONS WITH ACITRETIN |
| AU2014226290B2 (en) * | 2013-03-04 | 2018-11-15 | Vtv Therapeutics Llc | Stable glucokinase activator compositions |
| WO2014164957A1 (en) * | 2013-03-12 | 2014-10-09 | Cephalon, Inc. | Nanoparticulate and macroparticulate formulations |
| US10556916B2 (en) | 2014-04-01 | 2020-02-11 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Zirconium-89 oxine complex as a cell labeling agent for positron emission tomography |
| US20150320774A1 (en) * | 2014-05-09 | 2015-11-12 | AuroMedics Pharma LLC | Formulations of cyclophosphamide liquid concentrate |
| KR20170110083A (ko) | 2014-12-23 | 2017-10-10 | 인털렉츄얼 프라퍼티 어쏘시에이츠, 엘엘씨 | 경피 투여를 위한 방법 및 제형 |
| IL285928B2 (en) | 2016-05-06 | 2025-06-01 | Eagle Pharmaceuticals Inc | Fulvestrant formulations and methods of their use |
| ES3014923T3 (en) | 2016-06-16 | 2025-04-28 | Azurity Pharmaceuticals Inc | Composition and method for proton pump inhibitor suspension |
| US20200031920A1 (en) * | 2017-04-04 | 2020-01-30 | The George Washington University | Combination Therapy for Treating Cancer |
| JP2020534285A (ja) * | 2017-09-15 | 2020-11-26 | アンパサンド バイオファーマシューティカルズ インコーポレイテッドAmpersand Biopharmaceuticals Inc. | 投与および処置の方法 |
| WO2019139902A1 (en) | 2018-01-10 | 2019-07-18 | Zeno Royalties & Milestones, LLC | Benzamide compounds |
| WO2020023549A1 (en) * | 2018-07-24 | 2020-01-30 | January Therapeutics, Inc. | Nanoparticle compositions |
| US10751333B1 (en) | 2019-07-16 | 2020-08-25 | Cutispharma, Inc. | Compositions and kits for omeprazole suspension |
| US11633478B2 (en) | 2019-07-16 | 2023-04-25 | Azurity Pharmaceuticals, Inc. | Compositions and kits for Omeprazole suspension |
| BR112022008683A2 (pt) | 2019-11-05 | 2022-07-19 | Abbvie Inc | Regimes de dosagem para uso no tratamento de mielofibrose e distúrbios relacionados a mpn com navitoclax |
| US20210169903A1 (en) * | 2019-12-09 | 2021-06-10 | Tyme, Inc. | Pharmaceutical compositions and methods |
| CN117599041B (zh) * | 2024-01-22 | 2024-05-03 | 中国人民解放军军事科学院军事医学研究院 | 去氢雌马酚及其衍生物作为新型辐射防护剂和细胞保护剂的医药用途 |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE60332212D1 (de) | 2002-02-04 | 2010-06-02 | Elan Pharma Int Ltd | Arzneistoffnanopartikel mit lysozym-oberflächenstabilisator |
| US7973161B2 (en) | 2003-11-13 | 2011-07-05 | Abbott Laboratories | Apoptosis promoters |
| CA2606147C (en) * | 2005-05-12 | 2011-07-05 | Abbott Laboratories | Apoptosis promoters |
| JP5277168B2 (ja) * | 2006-09-05 | 2013-08-28 | アボット・ラボラトリーズ | 血小板過剰を治療するbclインヒビター |
| CA2708223A1 (en) * | 2007-12-06 | 2009-06-11 | Andrew Krivoshik | Oral compositions of abt-263 for treating cancer |
-
2010
- 2010-06-14 KR KR1020127001358A patent/KR20120052937A/ko not_active Withdrawn
- 2010-06-14 CN CN2010800368047A patent/CN102802609A/zh active Pending
- 2010-06-14 BR BRPI1014027A patent/BRPI1014027A2/pt not_active IP Right Cessation
- 2010-06-14 EP EP10724981A patent/EP2442789A1/en not_active Withdrawn
- 2010-06-14 MX MX2011013797A patent/MX2011013797A/es not_active Application Discontinuation
- 2010-06-14 RU RU2012101627/15A patent/RU2012101627A/ru unknown
- 2010-06-14 AU AU2010260226A patent/AU2010260226A1/en not_active Abandoned
- 2010-06-14 CA CA2764187A patent/CA2764187A1/en not_active Abandoned
- 2010-06-14 WO PCT/US2010/038526 patent/WO2010147899A1/en not_active Ceased
- 2010-06-14 SG SG2011094406A patent/SG176929A1/en unknown
- 2010-06-14 JP JP2012516170A patent/JP2012530704A/ja not_active Withdrawn
- 2010-06-17 US US12/817,640 patent/US20100323020A1/en not_active Abandoned
- 2010-06-18 TW TW099119972A patent/TW201103573A/zh unknown
-
2011
- 2011-11-24 IL IL216593A patent/IL216593A0/en unknown
- 2011-12-14 ZA ZA2011/09219A patent/ZA201109219B/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| IL216593A0 (en) | 2012-02-29 |
| ZA201109219B (en) | 2013-05-29 |
| JP2012530704A (ja) | 2012-12-06 |
| MX2011013797A (es) | 2012-01-30 |
| TW201103573A (en) | 2011-02-01 |
| CA2764187A1 (en) | 2010-12-23 |
| BRPI1014027A2 (pt) | 2019-09-24 |
| WO2010147899A1 (en) | 2010-12-23 |
| SG176929A1 (en) | 2012-01-30 |
| US20100323020A1 (en) | 2010-12-23 |
| EP2442789A1 (en) | 2012-04-25 |
| CN102802609A (zh) | 2012-11-28 |
| RU2012101627A (ru) | 2013-07-27 |
| AU2010260226A1 (en) | 2012-02-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20120052937A (ko) | 안정한 나노입자형 약물 현탁액 | |
| ES2523999T3 (es) | Dispersiones sólidas que contienen inhibidores de cinasas | |
| US20220110951A1 (en) | Pharmaceutical dosage form for oral administration of a bcl 2 family inhibitor | |
| JP5705840B2 (ja) | アポトーシス促進剤を含有する固体分散体 | |
| JP2015500343A (ja) | キナーゼ阻害剤を含有する組成物 | |
| CN103038239A (zh) | 激酶抑制剂的晶体形式 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0105 | International application |
Patent event date: 20120117 Patent event code: PA01051R01D Comment text: International Patent Application |
|
| PG1501 | Laying open of application | ||
| N231 | Notification of change of applicant | ||
| PN2301 | Change of applicant |
Patent event date: 20130904 Comment text: Notification of Change of Applicant Patent event code: PN23011R01D |
|
| PC1203 | Withdrawal of no request for examination | ||
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |