KR20110015516A - 혈관신생억제 작용을 갖는 항종양 테르페노이드 약학적 조성물 ‘아비실린’ - Google Patents
혈관신생억제 작용을 갖는 항종양 테르페노이드 약학적 조성물 ‘아비실린’ Download PDFInfo
- Publication number
- KR20110015516A KR20110015516A KR1020107022802A KR20107022802A KR20110015516A KR 20110015516 A KR20110015516 A KR 20110015516A KR 1020107022802 A KR1020107022802 A KR 1020107022802A KR 20107022802 A KR20107022802 A KR 20107022802A KR 20110015516 A KR20110015516 A KR 20110015516A
- Authority
- KR
- South Korea
- Prior art keywords
- abicillin
- tumor
- activity
- medicament
- pharmaceutical composition
- Prior art date
Links
- 230000000259 anti-tumor effect Effects 0.000 title claims abstract description 37
- 150000003505 terpenes Chemical class 0.000 title claims abstract description 30
- 230000033115 angiogenesis Effects 0.000 title claims abstract description 14
- 239000008194 pharmaceutical composition Substances 0.000 title claims abstract description 14
- 230000002401 inhibitory effect Effects 0.000 title description 6
- 230000001747 exhibiting effect Effects 0.000 title 1
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 62
- 238000000034 method Methods 0.000 claims abstract description 27
- 230000005764 inhibitory process Effects 0.000 claims abstract description 18
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 16
- 239000000203 mixture Substances 0.000 claims abstract description 11
- 235000007586 terpenes Nutrition 0.000 claims abstract description 11
- 201000010099 disease Diseases 0.000 claims abstract description 10
- 239000002253 acid Substances 0.000 claims abstract description 9
- 230000002001 anti-metastasis Effects 0.000 claims abstract description 8
- 238000011282 treatment Methods 0.000 claims abstract description 8
- KGEKLUUHTZCSIP-HOSYDEDBSA-N [(1s,4s,6r)-1,7,7-trimethyl-6-bicyclo[2.2.1]heptanyl] acetate Chemical compound C1C[C@]2(C)[C@H](OC(=O)C)C[C@H]1C2(C)C KGEKLUUHTZCSIP-HOSYDEDBSA-N 0.000 claims abstract description 6
- 230000009471 action Effects 0.000 claims abstract description 5
- 150000004141 diterpene derivatives Chemical class 0.000 claims abstract description 5
- 229930003658 monoterpene Natural products 0.000 claims abstract description 5
- 230000007935 neutral effect Effects 0.000 claims abstract description 4
- 150000002989 phenols Chemical class 0.000 claims abstract description 4
- 235000003441 saturated fatty acids Nutrition 0.000 claims abstract description 4
- 150000004671 saturated fatty acids Chemical class 0.000 claims abstract description 4
- 235000021122 unsaturated fatty acids Nutrition 0.000 claims abstract description 4
- 150000004670 unsaturated fatty acids Chemical class 0.000 claims abstract description 4
- 241000218641 Pinaceae Species 0.000 claims abstract description 3
- 229940115397 bornyl acetate Drugs 0.000 claims abstract description 3
- 239000003814 drug Substances 0.000 claims description 38
- 239000000243 solution Substances 0.000 claims description 9
- 230000001939 inductive effect Effects 0.000 claims description 7
- 239000013543 active substance Substances 0.000 claims description 6
- 230000037396 body weight Effects 0.000 claims description 6
- 239000004480 active ingredient Substances 0.000 claims description 5
- 235000011613 Pinus brutia Nutrition 0.000 claims description 4
- 239000000824 cytostatic agent Substances 0.000 claims description 4
- 230000001085 cytostatic effect Effects 0.000 claims description 3
- 239000002552 dosage form Substances 0.000 claims description 3
- 239000004005 microsphere Substances 0.000 claims description 3
- 230000004913 activation Effects 0.000 claims description 2
- 238000013270 controlled release Methods 0.000 claims description 2
- 239000000839 emulsion Substances 0.000 claims description 2
- 230000009462 endogenous apoptosis Effects 0.000 claims description 2
- 239000007903 gelatin capsule Substances 0.000 claims description 2
- 239000008187 granular material Substances 0.000 claims description 2
- 239000002077 nanosphere Substances 0.000 claims description 2
- 239000006187 pill Substances 0.000 claims description 2
- 239000000843 powder Substances 0.000 claims description 2
- 239000000725 suspension Substances 0.000 claims description 2
- 239000006188 syrup Substances 0.000 claims description 2
- 235000020357 syrup Nutrition 0.000 claims description 2
- 239000003826 tablet Substances 0.000 claims description 2
- 241000124008 Mammalia Species 0.000 claims 2
- 239000003242 anti bacterial agent Substances 0.000 claims 1
- 229940088710 antibiotic agent Drugs 0.000 claims 1
- 239000003937 drug carrier Substances 0.000 claims 1
- 239000008177 pharmaceutical agent Substances 0.000 claims 1
- 239000000546 pharmaceutical excipient Substances 0.000 claims 1
- 230000002265 prevention Effects 0.000 claims 1
- 201000011510 cancer Diseases 0.000 abstract description 21
- 239000003795 chemical substances by application Substances 0.000 abstract description 17
- 230000006907 apoptotic process Effects 0.000 abstract description 11
- 239000000126 substance Substances 0.000 abstract description 10
- 230000002491 angiogenic effect Effects 0.000 abstract description 9
- 230000008569 process Effects 0.000 abstract description 9
- 230000001225 therapeutic effect Effects 0.000 abstract description 8
- 230000000844 anti-bacterial effect Effects 0.000 abstract description 7
- 230000003110 anti-inflammatory effect Effects 0.000 abstract description 7
- 230000002519 immonomodulatory effect Effects 0.000 abstract description 7
- 230000029663 wound healing Effects 0.000 abstract description 6
- 241000218631 Coniferophyta Species 0.000 abstract description 5
- 208000035475 disorder Diseases 0.000 abstract description 5
- 230000006698 induction Effects 0.000 abstract description 5
- 230000000771 oncological effect Effects 0.000 abstract description 3
- 239000008203 oral pharmaceutical composition Substances 0.000 abstract description 3
- -1 terpene compound Chemical class 0.000 abstract description 3
- 231100000252 nontoxic Toxicity 0.000 abstract description 2
- 206010067482 No adverse event Diseases 0.000 abstract 1
- 230000000202 analgesic effect Effects 0.000 abstract 1
- 238000013459 approach Methods 0.000 abstract 1
- 230000008482 dysregulation Effects 0.000 abstract 1
- 230000000694 effects Effects 0.000 description 50
- 241001465754 Metazoa Species 0.000 description 31
- 210000004027 cell Anatomy 0.000 description 28
- 229940079593 drug Drugs 0.000 description 23
- 238000002474 experimental method Methods 0.000 description 20
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 16
- XJMOSONTPMZWPB-UHFFFAOYSA-M propidium iodide Chemical compound [I-].[I-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CCC[N+](C)(CC)CC)=C1C1=CC=CC=C1 XJMOSONTPMZWPB-UHFFFAOYSA-M 0.000 description 16
- 210000004881 tumor cell Anatomy 0.000 description 16
- 241000699670 Mus sp. Species 0.000 description 15
- 239000002246 antineoplastic agent Substances 0.000 description 15
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 15
- 229960004316 cisplatin Drugs 0.000 description 15
- 206010027476 Metastases Diseases 0.000 description 14
- 230000001772 anti-angiogenic effect Effects 0.000 description 13
- 210000002889 endothelial cell Anatomy 0.000 description 13
- 230000009401 metastasis Effects 0.000 description 13
- 239000004037 angiogenesis inhibitor Substances 0.000 description 12
- 201000001441 melanoma Diseases 0.000 description 12
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 10
- 201000010897 colon adenocarcinoma Diseases 0.000 description 10
- 208000029742 colonic neoplasm Diseases 0.000 description 10
- 201000005202 lung cancer Diseases 0.000 description 10
- 208000020816 lung neoplasm Diseases 0.000 description 10
- 230000001988 toxicity Effects 0.000 description 10
- 231100000419 toxicity Toxicity 0.000 description 10
- 238000012360 testing method Methods 0.000 description 9
- 230000001472 cytotoxic effect Effects 0.000 description 8
- 238000010171 animal model Methods 0.000 description 7
- 230000015572 biosynthetic process Effects 0.000 description 7
- 230000034994 death Effects 0.000 description 7
- 230000001965 increasing effect Effects 0.000 description 7
- 241000700159 Rattus Species 0.000 description 6
- 229940041181 antineoplastic drug Drugs 0.000 description 6
- 230000008901 benefit Effects 0.000 description 6
- 235000019198 oils Nutrition 0.000 description 6
- 230000000306 recurrent effect Effects 0.000 description 6
- 238000002271 resection Methods 0.000 description 6
- 238000011287 therapeutic dose Methods 0.000 description 6
- 230000004614 tumor growth Effects 0.000 description 6
- 108090000672 Annexin A5 Proteins 0.000 description 5
- 102000004121 Annexin A5 Human genes 0.000 description 5
- 206010006187 Breast cancer Diseases 0.000 description 5
- 206010060862 Prostate cancer Diseases 0.000 description 5
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 5
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 5
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 5
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 5
- 229940120638 avastin Drugs 0.000 description 5
- 231100000433 cytotoxic Toxicity 0.000 description 5
- 230000012010 growth Effects 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 108010082117 matrigel Proteins 0.000 description 5
- 230000007246 mechanism Effects 0.000 description 5
- 230000005012 migration Effects 0.000 description 5
- 238000013508 migration Methods 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 238000001228 spectrum Methods 0.000 description 5
- 238000001356 surgical procedure Methods 0.000 description 5
- 238000002560 therapeutic procedure Methods 0.000 description 5
- 231100000331 toxic Toxicity 0.000 description 5
- 230000002588 toxic effect Effects 0.000 description 5
- 206010029113 Neovascularisation Diseases 0.000 description 4
- 206010039491 Sarcoma Diseases 0.000 description 4
- 201000008274 breast adenocarcinoma Diseases 0.000 description 4
- 238000002513 implantation Methods 0.000 description 4
- 238000003786 synthesis reaction Methods 0.000 description 4
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 4
- 102000009840 Angiopoietins Human genes 0.000 description 3
- 108010009906 Angiopoietins Proteins 0.000 description 3
- 206010052360 Colorectal adenocarcinoma Diseases 0.000 description 3
- 241000699666 Mus <mouse, genus> Species 0.000 description 3
- 229930012538 Paclitaxel Natural products 0.000 description 3
- 206010052428 Wound Diseases 0.000 description 3
- 208000027418 Wounds and injury Diseases 0.000 description 3
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 3
- 229940127089 cytotoxic agent Drugs 0.000 description 3
- 230000003013 cytotoxicity Effects 0.000 description 3
- 231100000135 cytotoxicity Toxicity 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 235000005911 diet Nutrition 0.000 description 3
- 238000011534 incubation Methods 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 230000014399 negative regulation of angiogenesis Effects 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 229960001592 paclitaxel Drugs 0.000 description 3
- 230000035755 proliferation Effects 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 238000009097 single-agent therapy Methods 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 235000020238 sunflower seed Nutrition 0.000 description 3
- VEEGZPWAAPPXRB-BJMVGYQFSA-N (3e)-3-(1h-imidazol-5-ylmethylidene)-1h-indol-2-one Chemical compound O=C1NC2=CC=CC=C2\C1=C/C1=CN=CN1 VEEGZPWAAPPXRB-BJMVGYQFSA-N 0.000 description 2
- 201000001320 Atherosclerosis Diseases 0.000 description 2
- 206010008342 Cervix carcinoma Diseases 0.000 description 2
- 102100024785 Fibroblast growth factor 2 Human genes 0.000 description 2
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 2
- 208000006552 Lewis Lung Carcinoma Diseases 0.000 description 2
- 235000008331 Pinus X rigitaeda Nutrition 0.000 description 2
- 241000018646 Pinus brutia Species 0.000 description 2
- 102000004278 Receptor Protein-Tyrosine Kinases Human genes 0.000 description 2
- 108090000873 Receptor Protein-Tyrosine Kinases Proteins 0.000 description 2
- 241000202349 Taxus brevifolia Species 0.000 description 2
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 2
- 238000009098 adjuvant therapy Methods 0.000 description 2
- RWZYAGGXGHYGMB-UHFFFAOYSA-N anthranilic acid Chemical compound NC1=CC=CC=C1C(O)=O RWZYAGGXGHYGMB-UHFFFAOYSA-N 0.000 description 2
- 230000004663 cell proliferation Effects 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 201000010881 cervical cancer Diseases 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 238000002648 combination therapy Methods 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 230000001186 cumulative effect Effects 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 230000007850 degeneration Effects 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 230000037213 diet Effects 0.000 description 2
- 230000007613 environmental effect Effects 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 230000002147 killing effect Effects 0.000 description 2
- 208000032839 leukemia Diseases 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- 230000003211 malignant effect Effects 0.000 description 2
- 230000001394 metastastic effect Effects 0.000 description 2
- 208000037819 metastatic cancer Diseases 0.000 description 2
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 2
- 206010061289 metastatic neoplasm Diseases 0.000 description 2
- VMGAPWLDMVPYIA-HIDZBRGKSA-N n'-amino-n-iminomethanimidamide Chemical compound N\N=C\N=N VMGAPWLDMVPYIA-HIDZBRGKSA-N 0.000 description 2
- 229930014626 natural product Natural products 0.000 description 2
- 210000001640 nerve ending Anatomy 0.000 description 2
- 208000004235 neutropenia Diseases 0.000 description 2
- 231100000065 noncytotoxic Toxicity 0.000 description 2
- 230000002020 noncytotoxic effect Effects 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 239000006186 oral dosage form Substances 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 230000002062 proliferating effect Effects 0.000 description 2
- 102000005962 receptors Human genes 0.000 description 2
- 108020003175 receptors Proteins 0.000 description 2
- BOLDJAUMGUJJKM-LSDHHAIUSA-N renifolin D Natural products CC(=C)[C@@H]1Cc2c(O)c(O)ccc2[C@H]1CC(=O)c3ccc(O)cc3O BOLDJAUMGUJJKM-LSDHHAIUSA-N 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- DAEPDZWVDSPTHF-UHFFFAOYSA-M sodium pyruvate Chemical compound [Na+].CC(=O)C([O-])=O DAEPDZWVDSPTHF-UHFFFAOYSA-M 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 230000002269 spontaneous effect Effects 0.000 description 2
- 239000011550 stock solution Substances 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 238000011200 topical administration Methods 0.000 description 2
- 231100000041 toxicology testing Toxicity 0.000 description 2
- 238000002054 transplantation Methods 0.000 description 2
- 230000005747 tumor angiogenesis Effects 0.000 description 2
- DSSYKIVIOFKYAU-XCBNKYQSSA-N (R)-camphor Chemical compound C1C[C@@]2(C)C(=O)C[C@@H]1C2(C)C DSSYKIVIOFKYAU-XCBNKYQSSA-N 0.000 description 1
- BJHCYTJNPVGSBZ-YXSASFKJSA-N 1-[4-[6-amino-5-[(Z)-methoxyiminomethyl]pyrimidin-4-yl]oxy-2-chlorophenyl]-3-ethylurea Chemical compound CCNC(=O)Nc1ccc(Oc2ncnc(N)c2\C=N/OC)cc1Cl BJHCYTJNPVGSBZ-YXSASFKJSA-N 0.000 description 1
- NHBKXEKEPDILRR-UHFFFAOYSA-N 2,3-bis(butanoylsulfanyl)propyl butanoate Chemical compound CCCC(=O)OCC(SC(=O)CCC)CSC(=O)CCC NHBKXEKEPDILRR-UHFFFAOYSA-N 0.000 description 1
- 241000218642 Abies Species 0.000 description 1
- 206010051113 Arterial restenosis Diseases 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 208000004736 B-Cell Leukemia Diseases 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 241000723346 Cinnamomum camphora Species 0.000 description 1
- 206010052358 Colorectal cancer metastatic Diseases 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 206010014513 Embolism arterial Diseases 0.000 description 1
- 201000009273 Endometriosis Diseases 0.000 description 1
- 108010040476 FITC-annexin A5 Proteins 0.000 description 1
- 206010018001 Gastrointestinal perforation Diseases 0.000 description 1
- CEAZRRDELHUEMR-URQXQFDESA-N Gentamicin Chemical compound O1[C@H](C(C)NC)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](NC)[C@@](C)(O)CO2)O)[C@H](N)C[C@@H]1N CEAZRRDELHUEMR-URQXQFDESA-N 0.000 description 1
- 229930182566 Gentamicin Natural products 0.000 description 1
- 206010018364 Glomerulonephritis Diseases 0.000 description 1
- 208000032843 Hemorrhage Diseases 0.000 description 1
- 101000946124 Homo sapiens Lipocalin-1 Proteins 0.000 description 1
- 241000218652 Larix Species 0.000 description 1
- 102100034724 Lipocalin-1 Human genes 0.000 description 1
- 231100000002 MTT assay Toxicity 0.000 description 1
- 238000000134 MTT assay Methods 0.000 description 1
- 102000002274 Matrix Metalloproteinases Human genes 0.000 description 1
- 108010000684 Matrix Metalloproteinases Proteins 0.000 description 1
- 206010061309 Neoplasm progression Diseases 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 208000037273 Pathologic Processes Diseases 0.000 description 1
- 235000005205 Pinus Nutrition 0.000 description 1
- 241000218602 Pinus <genus> Species 0.000 description 1
- 241000896103 Pinus sibirica Species 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 101000852966 Rattus norvegicus Interleukin-1 receptor-like 1 Proteins 0.000 description 1
- 208000017442 Retinal disease Diseases 0.000 description 1
- 206010038923 Retinopathy Diseases 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 108010006830 TIE receptors Proteins 0.000 description 1
- 102000005450 TIE receptors Human genes 0.000 description 1
- 102000012753 TIE-2 Receptor Human genes 0.000 description 1
- 108010090091 TIE-2 Receptor Proteins 0.000 description 1
- 229940123237 Taxane Drugs 0.000 description 1
- 241001116500 Taxus Species 0.000 description 1
- 108091008605 VEGF receptors Proteins 0.000 description 1
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 description 1
- 108010053100 Vascular Endothelial Growth Factor Receptor-3 Proteins 0.000 description 1
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 description 1
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 1
- 102100033179 Vascular endothelial growth factor receptor 3 Human genes 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 230000009102 absorption Effects 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000000061 acid fraction Substances 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 230000007059 acute toxicity Effects 0.000 description 1
- 231100000403 acute toxicity Toxicity 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 230000002152 alkylating effect Effects 0.000 description 1
- 229940024606 amino acid Drugs 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 230000001399 anti-metabolic effect Effects 0.000 description 1
- 230000001028 anti-proliverative effect Effects 0.000 description 1
- 230000001640 apoptogenic effect Effects 0.000 description 1
- 206010003549 asthenia Diseases 0.000 description 1
- 230000006399 behavior Effects 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 229960000397 bevacizumab Drugs 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 208000034158 bleeding Diseases 0.000 description 1
- 230000000740 bleeding effect Effects 0.000 description 1
- 239000002981 blocking agent Substances 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 229930008380 camphor Natural products 0.000 description 1
- 229960000846 camphor Drugs 0.000 description 1
- 125000000837 carbohydrate group Chemical group 0.000 description 1
- 230000020411 cell activation Effects 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 210000003710 cerebral cortex Anatomy 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 230000000973 chemotherapeutic effect Effects 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 1
- 208000023819 chronic asthma Diseases 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 238000004737 colorimetric analysis Methods 0.000 description 1
- 238000009096 combination chemotherapy Methods 0.000 description 1
- 238000011284 combination treatment Methods 0.000 description 1
- 230000001054 cortical effect Effects 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 239000002254 cytotoxic agent Substances 0.000 description 1
- 231100000599 cytotoxic agent Toxicity 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 230000000378 dietary effect Effects 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 229930004069 diterpene Natural products 0.000 description 1
- 230000002526 effect on cardiovascular system Effects 0.000 description 1
- 229940124642 endogenous agent Drugs 0.000 description 1
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000012894 fetal calf serum Substances 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 229960002518 gentamicin Drugs 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 230000002489 hematologic effect Effects 0.000 description 1
- 230000003054 hormonal effect Effects 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 208000017169 kidney disease Diseases 0.000 description 1
- 208000003747 lymphoid leukemia Diseases 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- ZDZOTLJHXYCWBA-BSEPLHNVSA-N molport-006-823-826 Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-BSEPLHNVSA-N 0.000 description 1
- 229940125645 monoclonal antibody drug Drugs 0.000 description 1
- 150000002773 monoterpene derivatives Chemical group 0.000 description 1
- 235000002577 monoterpenes Nutrition 0.000 description 1
- 230000004899 motility Effects 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- 230000001338 necrotic effect Effects 0.000 description 1
- 230000010046 negative regulation of endothelial cell proliferation Effects 0.000 description 1
- 210000000653 nervous system Anatomy 0.000 description 1
- 230000000926 neurological effect Effects 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 231100001083 no cytotoxicity Toxicity 0.000 description 1
- 231100000404 nontoxic agent Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 231100000956 nontoxicity Toxicity 0.000 description 1
- 229940126701 oral medication Drugs 0.000 description 1
- 230000001151 other effect Effects 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000009054 pathological process Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 210000005259 peripheral blood Anatomy 0.000 description 1
- 239000011886 peripheral blood Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 230000002980 postoperative effect Effects 0.000 description 1
- 230000002028 premature Effects 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 230000001023 pro-angiogenic effect Effects 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 238000001243 protein synthesis Methods 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 230000008844 regulatory mechanism Effects 0.000 description 1
- 230000003578 releasing effect Effects 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 229940054269 sodium pyruvate Drugs 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 208000003265 stomatitis Diseases 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 238000006257 total synthesis reaction Methods 0.000 description 1
- 238000011830 transgenic mouse model Methods 0.000 description 1
- 230000014616 translation Effects 0.000 description 1
- 210000005239 tubule Anatomy 0.000 description 1
- 230000010304 tumor cell viability Effects 0.000 description 1
- 230000005751 tumor progression Effects 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 230000008673 vomiting Effects 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
- 230000004584 weight gain Effects 0.000 description 1
- 235000019786 weight gain Nutrition 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/12—Ketones
- A61K31/122—Ketones having the oxygen directly attached to a ring, e.g. quinones, vitamin K1, anthralin
- A61K31/125—Camphor; Nuclear substituted derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K36/00—Medicinal preparations of undetermined constitution containing material from algae, lichens, fungi or plants, or derivatives thereof, e.g. traditional herbal medicines
- A61K36/13—Coniferophyta (gymnosperms)
- A61K36/15—Pinaceae (Pine family), e.g. pine or cedar
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/14—Vasoprotectives; Antihaemorrhoidals; Drugs for varicose therapy; Capillary stabilisers
Abstract
본 발명은 혈관신생 조절 장애에 의해 야기되는 질환을 치료하기 위한 의약 및 화학 및 제약 산업 및 작용제에 관한 것으로, 특히 직접적인 항종양, 항-재발 및 항-전이 작용에 보조적인 혈관신생 억제의 유도 및 관련된 아폽토시스 내인성 시스템의 활성화에 의해, 다양한 기원의 암 질환(oncological disease)을 치료하는 방법에 관한 것이다. 본 발명은 소나무과의 침엽수에서 유래한, 천연 테르펜 화합물(이소프레노이드)의 종류와 관련된 구성성분을 포함하는, 신규한 경구 의약 제형 '아비실린(Abisilin)'을 사용하며, 상기 의약 제형은 하기를 함유한다: 세스퀴테르페노이드 (3 내지 6 %); 중성 디테르페노이드 (11 내지 15 %); 디테르펜산 (22 내지 28 %), 트리테르펜산 (8 내지 16 %), 불포화 및 포화 지방산 (0.1 내지 0.3 %); 페놀성 화합물 (0.1 내지 0.2 %); 나머지는 모노테르페노이드로서, 상기에서 보르닐 아세테이트 함량은 총 테르펜 조성물에 대해 10.0% 이상이다. 상기 신규한 경구용 아비실린은, 면역조절 작용, 항세균 작용, 항염증 작용, 진통 작용, 상처-치유 작용 및 기타 약리학적으로 중요한 작용을 나타내는 것으로 알려진 물질로서, 그의 사용은 금기(contra-indication) 또는 독성 작용을 나타내지 않고, 다양한 작용제와 함께 사용될 수 있으며, 새로운 치료적 접근방법을 제공하고, 암 질환 및 혈관신생 과정 장애에 의해 야기되는 다수의 기타 질환들의 치료 효율을 향상시키는 것을 목적으로 한다.
Description
본 발명은 의약 및 화학 및 제약 산업에 관한 것이며, 특히, 혈관신생의 억제, 내인성 아폽토시스의 유도, 종양 세포 증식의 둔화, 및 항재발 및 항전이 효과의 활성화를 포함하는 항종양 과정을 유도하는 무독성 다중-활성 작용제, 이른바 침엽수에서 유래한 테르펜(이소프레노이드)에 기초한 경구용 약학적 의약 조성물 아비실린(Abisilin)을 사용하여, 상기 항종양 과정의 케스케이드(cascade)를 유도함으로써, 다양한 기원의 암질환을 치료하기 위한 항종양 약물의 개발에 관한 것이며, 상기 조성물은 하기의 구성성분을 포함한다:
모노테르페노이드, 세스퀴테르페노이드, 중성 디테르페노이드, 디테르펜산, 트리테르펜산, 페놀성 화합물 및 불포화 및 포화 지방산.
또한, 본 발명은 혈관신생 장애와 관련된 다수의 질환, 주로 안구 신생혈관생성(neovascularization)에 의해 야기되는 질환 (망막병증 또는 연령-의존성 황반 변성(age-related mascular degeneration))을 치료하고, 만성 및 급성 신장 질환(사구체신염)의 경우에서 혈관간세포(mesangial cell) 증식성 장애, 건선, 진행성 죽종, 동맥 재협착(arterial restenosis), 당뇨병, 류마티스성 관절염, 만성 천식, 자궁내막증, 자가면역 질환, 동맥성 또는 이식-후 죽상경화증 및 다른 많은 질환들을 치료하는데 유용하다.
화학치료제, 호르몬 약제 또는 생체반응 조절제로 분류되는 대부분의 항종양 약물 사용의 분석은 그들 중 대부분이 종양 결절(tumor node) 퇴화를 촉진하는 반면 전이에는 영향을 미치지 않는다는 것을 보여주었으나, 전이는 암 환자에서 가장 빈번한 사망 원인이다.
원발성 종양(primary tumor) 뿐만 아니라 그의 전이에 있어서 성장을 억제할 가능성이 신규한 종류의 항종양 약제, 1971년 Judas Folkman 박사에 의해 최초로 제안된 (Folkman, J., Tumor Angiogenesis Therapeutic Implication, N. Engl. J. Med. 1971; 285: 1182-6), 이른바 항-혈관신생 약제에서 발견되었다. 항-혈관신생 약제는 종래의 항종양 화학치료제에 비해 하기와 같은 많은 이점들을 갖는다: 선택적 작용, 부작용 위험의 감소, 약물 내성 및 독성 감소.
종양 혈관생성을 저해하는 항-혈관신생 약제는 종양 성장을 늦추거나 또는 중단시키고, 전이를 억제한다.
상기 과정을 수행하기 위한 다수의 방법들이 있으며, 이는 문제되는 경우가 특정한 조절 메커니즘을 갖는 세포의 직접적인 손상이 아니고; 오히려, 이것은 매우 많은 세포 표적을 갖는 일반적인 내피 세포의 활성을 억제하는 것이기 때문이다: 증식 및/또는 이동의 억제, 세포 분화의 차단, 혈관신생 성장 인자(angiogenic growth factor) (티로신 키나아제 수용체 CHER-1)의 중화, 혈관내피 성장인자(VEGF) 및 안지오포이에틴(angiopoietin)/TIF 수용체 시스템에 대한 작용, VEGFR-2 및 VEGFR-3 혈관신생 성장인자 및 이들의 특이적 수용체의 억제 및 매트릭스 메탈로프로테이나제(matrix metalloproteinase)의 억제.
내피 세포의 정상적인 기능적 반응성은, 그의 기능이 마찬가지로 신체의 다른 세포 시스템에 의해 결정되기 때문에, 역시 그 스스로를 취약하게 만든다.
이러한 표적의 복수성은 많은 잠재적인 항-혈관신생 억제제를 제시할 수 있게 하였다. 그러나, 선행기술의 항-혈관신생 약제는, 몇몇 필요한 이점들만이 알려져있다.
예를 들면, 아바스틴(Avastin)은 가장 유망한 항종양 약제로 알려져 있다; 아바스틴은 혈관 내피 성장 인자(VEGF)와의 선택적 결합에 의해, 혈관생성을 감소시키고 종양 성장을 억제시킬 수 있는 항-혈관신생 효과를 갖는 단일클론 항체(monoclonal antibody) 약물 군의 약물이다 (미국 특허 제60542297호; 미국 특허 제6639055호).
그러나, 아바스틴의 임상적 효능 (총 생존 기간을, 화학치료만으로 치료받은 환자의 경우 13.6 개월에서 17.7 개월로 증가시킨 것에 비해, 전이성 대장암을 앓는 환자에서 전체 생존 기간을 15.6 개월에서 20.3 개월로 증가시킴)은 보다 효과적인 약제에 대한 연구를 자극하였다. 위장관 천공, 출혈, 동맥 혈전색전증(thromboembolism) 및 다른 질환의 복합 요법에 사용된 아바스틴의 활성 물질, 베파시주맙(bevacizumab)에 대한 놀라운 금기(counter indication) 및 부작용 목록의 존재에 따라 이는 더욱 촉진되었다.
이론적으로, 신생혈관생성-촉진 화학적 신호를 차단하는 혈관신생 억제제는, 상기 과정이 통상적인 과정에 해당하므로, 모든 종류의 종양에 대해 효과적일 것으로 기대되었다.
아바스틴의 임상 시험 결과는 이러한 이론적 예상이 틀렸음을 입증하였다.
또한, 혈관생성의 억제를 증진시킬 수 있고 암을 치료하는 데 유용한, VEGP/VEGF 수용체 및 안지오포이에틴/TIE 수용체 시스템의 기능에 영향을 미치는 조합 및 조성물이 알려져 있다 (RU 2292221, C2, June 20, 2001). 이와 같은 다수의(multiple) 화합물은 항-혈관신생 작용의 다단계 메커니즘 중 개별적 측면에서만 효과를 나타내므로, 항종양제의 효능을 증가시키는데 미미한 영향만을 미친다. 안지오포이에틴/Tie2 수용체 시스템에 대한 효과를 연구한 결과, 유도된 종양의 성장 둔화만을 보였다 (Siemeister et al., Cancer Res. 59, 3185-3191, 1999).
안트라닐산(anthranilic acid) 및 티오안트라닐산 N-아릴아미드는 종양 질환(neoplasmic disease) 및 혈관신생과 관련된, VEGF 티로신 키나아제 수용체 Fit-1의 활성을 억제하는 것으로 알려졌다. 이들의 사용은 유의하지 않은 치료 효능을 나타낸다.
생물학적 활성 스펙트럼 및 기원(source)에 있어서 본 발명에 대한 가장 적절한 기술은 내피 세포 증식을 효율적으로 억제하는, 즉 혈관신생 억제제에 해당하는 항종양 약제인, 파클리탁셀(Paclitaxel) (탁솔(Taxol))이다 (Klauber, N., et al., Cancer Res., 57, 81-86, 1997).
탁솔은 복잡한 구조의 디테르페노이드, 즉 탁산(taxane)에 기초하여 최초로 개발되었으며, 탁산은 1971년 태평양 주목 나무(Pacific Yew Tree) (Taxus brevifolia Nutl)의 수피(bark) 물질로부터 분리되었다. 이제, 탁솔 및 그의 유사체를 전합성(complete synthesis)하기 위한 공지된 방법이 존재한다 (미국 A1. 제5488116호, Jan. 2006; RU 제2196581호, May 4, 2000). 도세탁셀(Docetaxel)(탁소티어(Taxotere)), 탁솔의 반합성 유사체는 유럽 주목 나무(Taxus baccata) 물질로부터 분리되었고, R-테트라올(R-tetraol)은 시베리아 잣나무(Pinus sibirica) 종 및/또는 쳄브라 소나무(Pinus chembra) 종 및/또는 전나무속(genus Abies), 및/또는 잎갈나무속(genus Larix)의 침엽수에서 유래한 갤리폿(gallipot)의 천연 테르페노이드 복합체를 이용하여, 천연 생성물로부터 활성 성분의 분리를 통해, 또는 캠퍼(camphor)와 혼합된 랩다노이드(labdanoid) 디테르펜 산 분획을 이용하여 그로부터 얻어진 혼합물을 감마-방사선에 노출시켜 R-테트라올 구조를 생성하는 반합성 경로(RU 2196581, C2, May 4, 2000)를 통해 제조되었다.
앞에서 상술된 방법에 의해 제조된, 전술된 화합물들은 하기의 문제점을 갖는다: 모든 약제에 내재적인 약간의 독성 (호중구 감소증, 원섬유성 호중구 감소증, 감염, 구토, 설사, 구내염, 무력증, 신경학적(운동성) 및 혈액학적 합병증 등), 및 낮은 효능, 이러한 문제점들은 종양학자들로 하여금 더욱 효과적인 치료를 제공하기 위해 이러한 혈관신생-억제제와 다른 활성제의 조합 설계를 추구하도록 만든다.
선행기술의 항-혈관신생 테르페노이드 약제의 문제점은 이들의 제조를 위해 제안되는 다단계 반응(multistep scheme)에 기인할 수 있으며, 이 반응들은 부분합성 또는 전합성에 기초하여 개별적인 활성 물질을 순수한 형태로 분리하는 것을 목적으로 하고, 상기의 합성은 다양한 종류의 독성의 출현을 야기하며 약제로부터 필요한 복합-활성(multi-activity)을 결여시킨다.
따라서, 혈관신생을 억제하기 위한 다수의 표적 및 많은 선행기술 약제의 존재에도 불구하고, 선행기술 약제에 내재된 모든 장점을 가지면서도 이들의 본질적인 결점을 갖지 않는, 항-혈관신생 약학적 조성물에 대한 요구가 있으며, 이들 조성물은 다음과 같을 것이 기대된다:
- 독성이 없고;
- 금기가 없으며;
- 그와 조합하여 사용할 경우, 항종양 세포독성제의 독성을 감소시키고 효능을 증가시키며;
- 직접적인 항종양 활성을 갖고;
- 항재발 및 항전이 효과를 유발하고;
- 내성, 특히, 아폽토시스에 대한 내성을 유발하지 않고;
- 종양에서 신생혈관생성-억제 선택성을 나타내고 신생혈관생성을 중단시키며; 및
- 선택적으로, 면역조절, 통증-완화, 항세균, 항-염증, 및 항-혈관신생 작용제의 복합-활성 스펙트럼에 있어서의 다른 종류의 활성을 포함하고;
- 세포 아폽토시스를 유도할 수 있다.
상기 열거된 항목은 선행기술의 방법 및 약제에 존재하는 많은 문제점들에 비추어, 필요한 결과에 도달하기 위해 요구되는 조건들을 모두 포함하는 것은 아니다.
종양 성장 과정에 이러한 복합-활성 효과를 동시에 유발할 수 있는 항-혈관신생 작용제들은 공지되어 있지 않고, 선행기술로부터 자명하지도 않다.
본 발명의 목적은 선행기술 약제에 현존하는 결점을 갖지 않는, 즉 장기 사용에서 아무런 독성 부작용을 야기하지 않고, 금기(counter-reaction)를 갖지 않으며, 내성 (특히, 아폽토시스에 대한 내성)을 유발하지 않고, 및 세포분열억제(cytostatic) 약제와 조합하여 사용될 경우 그의 효능을 증가시킬 뿐만 아니라 독성을 감소시키는, 항-혈관신생 항종양제를 사용한 신생혈관생성(neovascularization)의 선택적 억제 또는 완전한 중단을 위한 약제를 탐색하고 개발하는 것이다. 또한, 청구된 본 방법은 모든 선행기술의 혈관신생 저해제(angiogenesis blocking agent)에 비해 많은 장점을 갖고, 즉 직접적인 항종양 효과를 나타내며, 세포 아폽토시스를 유도할 수 있고, 항재발 및 항전이 활성을 가지며, 동시에 면역조절 활성, 항세균 활성, 상처-치유 활성, 항-염증 활성, 통증-완화 활성 및 기타 활성을 갖는다.
이론적으로, 천연 테르페노이드의 복합체는 복합성분으로 구성되고 복합-활성을 나타내어, 선행기술의 혈관신생 억제 방법에 내재된 결점들을 갖지 않으며, 전술된 필요한 이점들 중 일부를 가질 것으로 기대될 수 있다.
본 발명의 발명자들은 과학적 연구를 수행하는 과정에서, 면역조절, 항-염증, 상처-치유, 통증-완화, 및 항세균 활성을 가지며, 또한 신경매개인자(neuromediator) 합성 장애를 갖는 병적 상태 (특히, 암)(RU 제2244928호, February 19, 2003)에서 대뇌 피질 신경 말단의 특이적인 체액성 매개인자를 활성화할 수 있는 테르페노이드 물질 아비실(Abisil) (특허 RU 제2054945호, June 28, 1995; RU 제2198653호, March 29, 2002에서 개시됨)이, 놀랍게도 효과적인 혈관신생 억제제이며, 세포독성뿐만 아니라 아폽토시스-유도 활성, 항재발 활성, 항전이 활성 및 항종양 활성을 나타낸다는 것을 발견하였다.
아비실 테르페노이드 물질은 신규한 약제, 즉 복합-활성 테르페노이드 약학적 조성물 아비실린(Abisilin)의 기초로서의 역할을 하며, 상기 아비실린은 경구 투여 형태로서 20% 오일 용액이고, 새로운 약제학적 활성의 스펙트럼 및 혈관신생 장애, 특히 악성 종양 성장과 관련된 병적 과정(pathologic process)을 중단시키는 새로운 기회를 갖는다.
테르페노이드 약학적 조성물 아비실린의 복합-활성은, 소나무과의 대표식물에서 환경적 영향에 대한 생체보호(bioprotection)를 제공하는 생산- 및 합성-유발(yield- and synthesis-provoked) 물질을 함유하는 천연 화합물 테르펜 복합체의 사용에 의해 달성되며, 상기 물질은 동일한 모노테르펜 화합물을 풍부하게 함유한다. 가장 효과적인 개별적 작용제와 천연 테르펜 복합체의 강화(enrichment) (원료 물질로부터의 직접 추출 또는 자연적 활성화 유도를 통한 강화)는 최종 생성물의 사용에 있어서, 전술된 선행기술의 항-혈관신생 약제에 내재하는 독성 효과를 유발하지 않았다. 높은 치료 효과는 몇 가지 극대의(superlative) 효과에 기인할 뿐만 아니라 약학적 조성물 아비실린의 모든 활성 물질들의 상승작용(synergism)에 기인한 것이며, 아비실린은 소나무(Pinaceae)과의 침엽수에서 유래한 테르펜(이소프레노이드)으로, 하기를 포함한다:
- 세스퀴테르페노이드(3 내지 6 %);
- 중성 테르페노이드 (11 내지 15 %);
- 디테르펜산 (23 내지 28 %);
- 트리테르펜산 (8 내지 16 %);
- 불포화 및 포화 지방산 (0.1 내지 0.3 %);
- 페놀성 화합물 (0.1 내지 0.2 %);
- 나머지는 모노테르페노이드이며, 상기에서 보르닐 아세테이트(bornyl acetate) 함량은, 해바라기 씨 오일에 용해된 총 테르펜 조성물에 대해 10.0% 이상이다.
또한, 혈관신생-억제 효과를 갖는 항종양 테르페노이드 약학적 조성물 아비실린의 개발은 근본적으로 새로운 전략의 제안에 기초하며, 이 전략은 환경적 영향으로부터 보호하기 위해 내부에서 합성되는, 침엽수에서 유래한 내인성 테르페노이드 화합물을 사용하여, 뇌 구조에 의한, 사람 또는 동물 체내에서 정상적인 생리적 과정의 조절에 있어 불균형을 막을 수 있는 고유의 내인성 작용제(endogenous agent)의 생성을 유발하는 것이다.
혈관신생-억제 효과를 갖는 복합-활성 항종양 경구용 약제 아비실린의 일반 독성에 대해 연구하였다.
일반 독성 연구에서 진행된, 본 발명의 바람직한 변형에서, 아비실린은 체중 1 킬로그램 당 80 내지 100 mg의 투여량으로 경구적으로 투여된다 (실시예 1 참조).
본 발명의 또다른 바람직한 변형은 종양 세포에 선택적인 세포독성 효과를 유도하는 방법 및 아비실린을 1000 ㎍/mL의 투여량으로 사용하여 아폽토시스-유사 메커니즘에 의해 이들을 죽이는 방법이며, 이는 Jurkat 세포주에 있어서 상기 투여량에서 AnV+PI-, AnV+PI+, 및 AnV-PI+에 대해 양성인 세포의 총 비율이 86.6 %에 상당하여, 최대인 것으로 밝혀졌기 때문이다 (실시예 2 참조).
본 발명의 보다 바람직한 변형은, 이식가능한 고형암, 흑색종 B-16, Ca-755, LLC, CC-5 및 육종 M-1에 대해, 필요한 키트를 사용하여 규명된 바와 같이, 2 내지 11일 동안 체중 킬로그램 당 10 내지 100 mg 투여량으로 아비실린을 경구 투여하여 아비실린의 항종양 활성을 유도하는 방법이다 (실시예 3 참조).
다양한 기원의 종양 질환의 치료를 나타내는 본 발명의 바람직한 변형은, 용액, 정제, 젤라틴 캡슐, 알약, 시럽제, 현탁제, 산제, 에멀젼, 과립, 마이크로스피어(microsphere) 또는 나노스피어(nanosphere), 또는 약제의 활성 성분의 제어된 방출을 달성하기에 유용한 다른 투여형의 형태일 수 있는, 약학적 조성물 아비실린의 사용으로 구성된다.
이식가능한 종양 CAC, Ca-755 및 흑색종 B-16에 대해 연구된, 선행기술의 약제 시스플라틴(Cisplatin)을 동반한 아비실린 투여는 아비실린의 사용으로 인한 상승 효과의 달성뿐만 아니라 두 약제 모두의 치료적 유의성(therapeutic significane)의 증가를 입증하였다.
본 발명의 바람직한 구체예는 인 비트로(in vitro) 및 인 비보(in vivo) 실험에서 아비실린을 사용하여 혈관신생-유발(pro-angiogenic) 및 항-혈관신생 매개인자들 간의 자연적 균형을, 후자가 우세해지는 방향으로 이동시키는 방법이다 (실시예 4 참조).
또한, 본 발명의 더욱 바람직한 구체예는 체중 킬로그램당 80 내지 100 mg 투여량의 경구 투여에 의해 항재발 및 항전이 효과를 유도하기 위한 약제 아비실린의 사용이다 (실시예 5 참조).
본 발명의 바람직한 구체예를 예시하기 위해 실시예 1 내지 5가 하기에 제공되나, 이는 본 발명의 범위를 제한하지 않는다.
실시예
1
최대 허용 용량(maximal possible dose)인 10000 mg/kg에서, 급성 독성을 결정하는 데 있어 동물의 사망이 관찰되지 않았으므로, 본 약제는 러시아 국가 기준(Russian State Standard) (GOST) 12.1.007-76 하에서 물질 위험 카테고리(Substance Hazard Category) Ⅳ로 분류될 수 있다.
평균 체중이 각각 165 ± 3 g 및 163 ± 3 g인 비-가계(non-pedigree) 수컷 및 암컷 랫트에 대해 아만성(subchronic) 실험을 수행하였다. 연구된 약제를 14일동안, 1일 1회, 수컷 랫트에는 100, 50,0 또는 1000 mg/kg 의 투여량으로, 암컷 랫트에는 100 및 1000 mg/kg의 투여량으로 위내(intragastrically) 투여하였다.
실험 결과에 따르면, 연구된 투여량에서 아비실린은 실험 동물의 전체 지표(체중 증가, 행동 반응, 식이 및 음수 섭취); 말초 혈액의 세포 조성; 간의 배설, 흡수, 단백질-합성, 및 탄수화물 기능; 혈청 콜레스테롤 수준; 및 심혈관계, 배설계 및 신경계의 기능적 상태에 있어서 신뢰할만한 변화를 야기하지 않았다.
아비실린 1000 mg/kg, 즉 권장되는 치료적 용량을 10배 초과한 투여량의 사용은, 단지 실험 동물 중 일부에서 위장관 점막의 약한 국소 자극(irritation)을 야기했다.
따라서, 연구된 투여량에서의 아비실린 투여에 대한 일반 독성 연구는 이들의 사용이 신체 기관 또는 조직에 구조적 이상(structural disorder)을 유발하지 않는다는 것을 보여준다.
실시예
2
종양 세포에 대한
아비실린의
세포독성 및
아폽토시스
-유도 활성
하기의 종양 세포주(cell line)에 대해 인 비트로 연구를 수행하였다: Jurkat(T-세포 림프아구성 백혈병), Raji(B-세포 백혈병), K562(만성 골수성 백혈병(myelogenic leukemia)), U937(골수백혈병(myeloleukemia)), Mel P(흑색종), T 47 D(유방암), SKOV-3(난소암) 및 PC-3(전립선암).
상기 세포주들을 37℃ 및 CO2 대기 중에서, 10% 소 태아 혈청(fetal calf serum), 2 mM/mL 글루타민, 0.1 mg/mL 겐타미신(gentamicin), 비타민, 소듐 파이루베이트, 및 아미노산을 포함하는 완전 RPMI-1640 배지에서 증식시켰다.
본 연구에서, 아비실린은 하기의 농도로 사용하였다: 300 ㎍/mL, 500 ㎍/mL, 800 ㎍/mL, 및 1000 ㎍/mL. 1 % DMSO (디메틸 술폭시드)를 희석제로 사용하였다.
아비실린 세포독성 활성은 MTT 분석을 사용하여 비색법(colorimetric method)에 의해 결정하였다. 종양 세포를 5 x 104 세포/mL 농도로 Saasted 편평-바닥 96-웰 플레이트에 접종하고, 시험 농도의 아비실린 20 ㎕를 각각의 웰에 첨가하고, 플레이트를 72시간 동안 표준 온도 및 압력 하에서 인큐베이션하였다 (각각의 아비실린 농도를 3회씩 시험하였다). 사용된 대조군은 아비실린-불포함 웰 3개, 및 1% DMSO가 20 ㎕ 첨가된 웰 3개였다. 배양 종료 5시간 전에, MTT 용액(Sigma Chemical Co., 미국) 20 ㎕를 각각의 웰에 첨가하였다. 인큐베이션을 종료한 후, 플레이트를 100 rpm으로 2-3분 동안 원심분리시켜 세포들을 침전시켰다. 상등액(supernatant)을 조심스럽게 수집하고, 각각의 웰에 포르마잔(formazan) 결정의 용매인, DMSO(ICN Biomedicals, Inc.) 200 ㎕를 첨가하였다. 세포들을 재현탁시키고, 37 ℃에서 10분 동안 인큐베이션하고, 뒤이어 Uniplan AIFR-01 면역효소적 반응 판독기(immunoenzymatic reaction reader)(러시아)를 사용하여 540 mm의 파장에서, 상기 용액의 흡광도(optical density, OD)를 측정하였다. MTT는 살아있는 세포에 의해 수-불용성 포르마잔으로 대사되며, 이에 의해 생존 세포의 양에 비례하여 용액의 흡광도를 변화시킨다. 집단(pool) 내에서 죽은 세포의 양이 50 % 이상인 경우, 종양 세포들이 시험된 약제에 감수성을 갖는 것으로 간주하였다. 모든 실험들은 3회씩 실시되었다. 생존율은 (시험군에서의 평균 OD/대조군에서의 평균 OD) x 100 %로서 결정되었다.
사멸 세포(apoptotic cell)들은 프로피듐 요오다이드(propidium iodide, PI) 생체 염색(vital stain)과 조합된 FITC-결합 아넥신 Ⅴ(FITC-conjugated Annexin Ⅴ)를 사용하여, 이중 생체염색법(intravital staining)에 의해 검출하였다.
아넥신 Ⅴ-FITC 및 PI 염색 세포들을 다음의 기준에 따라 평가하였다:
아넥신 Ⅴ 음성/PI 음성 (AnV- PI-) 살아있는 세포, 아넥신 Ⅴ 양성/PI 음성 (AnV+ PI-) 조기 사멸 세포, 및 아넥신 Ⅴ 양성/PI 양성 (AnV+ PI+) 늦은 사멸 또는 괴사 세포. 대조군은 동일한 조건이나 아비실린이 부재한 상태에서 배양된 종양 세포 및 동일한 조건이나 아비실린 대신 1% DMSO 용액이 첨가된 상태에서 배양된 종양 세포로 이루어진다.
실험 데이터의 통계적 처리를 위해 Statistika 6.0 소프트웨어를 사용하였다. 평균값들을 비교하기 위해 스튜던트 검정이 사용하였다 (p<0.05인 경우 편차가 유의한 것으로 간주함).
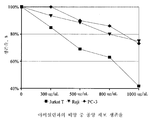
본 연구는 아비실린과 종양세포의 인큐베이션이 Jurkat, Raji, 및 PC-3 세포주에 대한 그의 세포독성 활성을 나타낸다는 것을 보여준다. 아비실린 존재 하에서 종양 세포 생존율 곡선이 도 1에 표시된다.
아비실린의 가장 현저한 세포독성은 Jurkat 세포주에 대한 것이었으며, 아비실린 농도 1000 ㎍/mL에 대해 41.8 %에 상당했다. 아비실린 농도가 증가함에 따라, 살아있는 종양 세포의 백분율 함량이 감소했고, 그 역도 마찬가지였다.
U937, K562, T 47 D, SKOV-3 및 Mel P 종양 세포에 대한 아비실린 활성 연구에서는 세포독성이 검출되지 않았다.
Jurkat, Raji, PC-3 및 U937계 세포에 대한 아넥신 Ⅴ/PI 이중 생체 염색법을 이용하여, 아비실린 농도 300 ㎍ 및 1000 ㎍에 있어서 아비실린-유도 아폽토시스를 측정하였다.
아비실린은 아폽토시스-유사 메커니즘에 의해 시험된 계열의 종양 세포 사멸을 유도하는 것으로 밝혀졌다(표 1).
| 시약 |
AnV+ PI-, AnV+ PI+, AnV- PI+에 양성인 종양세포의 전체 비율 | |||
| Jurkat | Raji | PC-3 | U937 | |
| 대조군(1% DMSO) | 26,0 | 23,1 | 33,1 | 1,7 |
| 아비실린, 300 ㎍/mL | 53,3* | 27,9 | 56,7* | 7,4 |
| 아비실린, 1000 ㎍/mL | 86,6* | 44,9* | 62,4* | 38,2* |
주: * p<0.05, 시험군 및 대조군 사이에 신뢰할 만한 편차를 의미함.
주목할만한 것은 아비실린 농도의 증가에 따른 사멸 세포의 수의 현저한 증가이다. AnV+ PI-, AnV+ PI+, 및 AnV- PI+에 대해 양성인 세포 전체의 가장 높은 비율은 Jurkat 세포주에 대해 검출되었고, 이는 아비실린 농도 1000 ㎍/mL에 대해86.6 %에 상당했다.
따라서, 상기 실험 데이터는 아비실린의 종양 세포에 대한 선택적 세포독성 활성 및 아폽토시스-유사 메커니즘에 의해 이들 세포의 사멸을 유도함으로써 항-혈관신생 작용제의 사용과 병행하는 항종양 요법의 기회를 현저하게 증가시키는 아비실린의 능력을 시사한다.
또한, 본 발명의 상기 양태는, 선행기술의 효과 스펙트럼 (항세균 효과, 면역 조절 효과, 항-염증 효과, 상처-치유 효과, 및 통증-완화 효과의 조합)에 몇 가지 놀라운 치료적으로 유의한 효과, 즉 아폽토시스-유사 메커니즘에 의한 일부 종양 세포주에 대한 세포독성 효과를 유발하는 능력이 보강되기 때문에, 국소 투여 및 적용에의 사용이 권고되는 공지된 복합-활성 테르페노이드 물질 아비실(Abisil) 및 그에 기반한 약학적 조성물의 적용 영역을 확장시킨다.
이는 선행기술의 조성물 아비실 및 본 발명에 따른 조성물 아비실린이 종양 질환의 외과적 치료 효율을 증가시킬 수 있는 작용제로서의 사용을 위해 권장될 수 있게 한다.
실시예
3
이식가능한(
transplantable
) 종양에 있어서 경구용 약학적 조성물
아비실린의
항종양 활성
신규한 항종양 물질을 선별하는데 사용되는 필수 동물 종양 모델 목록, 즉 흑색종 B-16, 상피종 루이스 폐암(epidermoid Lewis lung carcinoma),(LLC), 유방선암 Ca-755, 자궁 경부암 5기 CC-5, 대장 선암(colon adenocarcinoma, CAC), 및 다형성 세포 육종(polymorphic cell sarcoma) M-1에 포함된, 마우스에서의 이식가능한 종양에 대한 아비실린의 항종양 활성을 연구하였다.
실험 동물은 각각 20 내지 25 g인, BDF(C BI/6 X DBA/2) 및 F(C D1/6 및 CBA/2) 1-세대 잡종 마우스; CBA/2, BALB/c, 및 DBA/2 계 마우스 (수컷 및 암컷); 및 각각 200 내지 250 g인 비-계통(non-pedigree) 암컷 랫트였다. 마우스와 랫트는 러시아 의과학 연구소(Russian Academy of Medicinal Sciences), Blokhin Russian Oncologic Center의 실험 동물 분과(Experimental Animal Division)에서 구입하였고, 일반적인 식이량에 따라 섭식시켰다.
아비실린을 10, 100, 150, 500 및 2500 mg/kg의 투여량으로, 오일 용액의 형태로 경구 투여(per os)하였다. 해바라기씨 오일을 약제의 용매로서 사용하였다.
또한 테르페노이드 약제 아비실린이 넓은-스펙트럼의(wide-spectrum) 알킬화 화학요법제(alkylating chemotherapeutic agent)의 군에 속하는 항종양 작용제와의 조합 상태로 유용한지 여부를 연구하였다. Bristol-Myers Squibb로부터 구입한 시스플라틴을 본 실험에서 사용하였다.
아비실린을 10일 동안 매일 또는 다음 일정에 따라 동물에 경구로 투여하였다: 2일차와 6일차 또는 2일차와 11일차. 상기 치료는 고형암 (Ca-755, CAC, 흑색종 B-16, LLC, CC-5, 또는 M1)이 이식되고 48시간이 경과한 후에 시작되었다. 조합 치료에서, 아비실린을 10일 동안 매일, 종양 이식 48시간 후에 시작하여, 50 mg/kg의 투여량으로 마우스에 경구 투여하였다; 항종양 작용제 시스플라틴을 5 mg/kg의 투여량으로 1회 복강내(intraperitonially, ip) 투여하였다. 전술된 종양을 앓고 있는 동물들을 사망할 때까지 모니터링 하였다. 상기 약제의 항종양 효과를 대조군 동물 대비 시험 동물에서의 종양 성장 억제 백분율 (TGI, %)로서 판단하였다.
약제의 독성을 대조군 동물의 사망 대비 마우스의 조기 사망, 및 이들의 기관 (비장, 간 및 다른 기관) 상태 및 초기값 대비 체중의 변화에 의해 평가(score)하였다.
비처리 대조군 대비 항종양 효과의 통계적 유의성은 피셔-스튜던트 검정(Fisher-Student test)에 의해 결정하였다. 비교된 군들 간의 차이는 p≤0.05인 경우 통계적으로 신뢰성 있는 것으로 간주하였다.
아비실린 항종양 활성에 대한 연구 결과는 하기의 표 2에 제시된다.
| 투여량 (mg/kg) |
투여일자 |
TGI, %/종양 이식 후 일 (p<0.05) | |||||
| 흑색종 B-16 | Ca-755 | LLC | CC-5 | CAC | 육종 M-1 | ||
| 10 | 2-11 | 66/13 | 59/7 | N.D | ± | N.D | N.D |
| 100 | 2-11 | 63/7 | 62/7, 65/10 | 56/7 | 61/7 | ± | 54/7 |
| 150 | 2-11 | N.D | N.D | 57/7 | ± | N.D | N.D |
| 500 | 2-11 | ± | ± | ± | ± | 26/7 | ± |
| 2500 | 2 및 6 | 62/7 | ± | ± | ± | 26/28 | N.D |
| 2500 | 2 및 11 | ± | ± | 60/13 | ± | N.D | 68/7, 53/16 |
10. 주: "±"는 대조군 대비 p>0.05인 경우, TGI, %를 의미함;
"N.D"는 "결정되지 않음(not determined)"을 의미함.
본 연구는 아비실린이 10일 동안 투여된 경우, 10 및 100 mg/kg의 투여량에서만, 이식가능한 흑색종 B-16에 대해 단기적인 중등도의(moderate) 항종양 효과를 갖는다는 것을 보여주며: 각각 TGI = 66 % (실험 13일차) 및 63 % (7일차, p<0.05), 및 2500 mg/kg의 투여량으로 5일 간격을 두고 2회 투여된 경우, 실험 7일 차에 효과를 나타냈다 (TGI = 62 %). 그러나, 상기 약제는 500 mg/kg의 투여량으로 10일 동안 투여된 경우 또는 2500 mg/kg의 투여량으로 10일 간격으로 2회 투여된 경우 효과가 없었다.
유방 선암 Ca-755에서, 10 mg/kg (TGI는 실험 7일차에 59 %였다) 및 100 mg/kg (TGI = 7일차 62 % 및 10일차 65 %)의 투여량에서 통계적으로 유의한 효과가 검출되었다. 이후 일자에, 항종양 활성은 전반적으로 감소했다.
상피종 루이스 폐암 (LLC)에 대해서는, 본 발명의 항종양 효과는 종양 이식 7일 후, 경구 투여에 있어 100 mg/kg 및 150 mg/kg의 투여량에서 검출되었다: 각각 TGI = 56% 및 57% (p<0.05). 동일한 종양에 대해, 아비실린은 2500 mg/kg의 투여량으로 10일 간격을 두고 2회 투여된 경우, 중등도의 항종양 효과를 나타냈다: 실험 13일차 TGI = 60 %.
마우스에서 초기 자궁경부암(CC-5)에 대한 최대 종양 성장 억제 (TGI = 61 %)는 투여 7일차에 150 mg/kg의 투여량에서, 즉 상기 약제 5배의 경구 투여 후에 관찰되었다 (TGI = 61 %),
마우스 대장선암(CAC)에서, 아비실린은 10일 투여 계획(schedule)에서 50 mg/kg 및 100 mg/kg의 투여량에서 효과가 없었다. 그러나, 상기 약제는 500 mg/kg 투여량으로 10-일 투여시 치료 7일 차 (TGI = 26 %) 및, 5일 간격으로 2회 주입(infusion)하는 계획 하에서는 치료 28일 차에 2500 mg/kg의 투여량에서 (TGI = 26 %) 약한 항종양 효과를 나타냈다.
이식가능한 랫트 육종 M-1에서, 아비실린은 실험 7일차에 100 mg/kg의 투여량으로 5회 투여 후 즉시, 중등도의 항종양 효과를 나타냈다: TGI = 54 %(p<0.05). 상기 약제가 2500 mg/kg의 투여량으로 2회 투여된 경우 (종양 이식 후 2일차 및 11일차), 치료 시작으로부터 7일차 및 16일차에 역시 항종양 효과가 관찰되었다 (각각, TGI = 68% 및 53%).
아비실린을 처리받은, 이식가능한 종양을 갖는 실험 동물 중 어떤 동물도 연구된 투여량에서 뚜렷한 아비실린 독성을 보이지 않았다. 이식가능한 종양에 대한 항종양 활성 실험에서 밝혀진 아비실린의 치료적 용량은, 5일 동안 매일 경구 투여하는 경우 100 mg/kg이었다.
마우스에서 이식가능한 대장 선암 (CAC), 유방 선암 Ca-775, 및 흑색종 B-16에 대한 아비실린의 항종양 활성이 종래의(old) 항종양 약제 시스플라틴과의 조합으로 연구되었으며, 두 약제 모두 단독요법에서 사용되는 치료적 용량의 절반에 해당하는 투여량으로 투여되었다(표 3).
| 약제 |
투여량 mg/kg |
투여일자 |
투여경로 |
TGI, %/종양 이식 후 일 | ||
| CAC | Ca-755 | 흑색종 B-16 | ||||
| 아비실린+ 시스플라틴 |
50+5 | 2-11 | per os | 38*/7, 62*/12, 40*/21, 45*/28 |
91*/7, 83*/11, 66*/14, 54*/18, 49/22 |
75/7. 74/9, 63/11, 32/17 |
| 아비실린 | 50 | 2-11 | per os | 8/7, 9/12, 3/21, 6/28 |
13/7, 0/11, 7/14, 6/18, 6/22 |
19/7, 62/9, 23/11, 12/17 |
| 시스플라틴 | 5 | 2 | в/бp | 0/7, 22/12, 14/21, 35/22 |
86/7, 62/11, 52/14, 43/18, 39/22 | 80/7, 83/9, 65/11, 19/17 |
주: * p<0.05 vs. 시스플라틴.
표 3에 편집된 데이터는 대장 선암 (CAC)이 단독 요법에서는 아비실린 및 시스플라틴에 대해 감수성이 없다는 것을 분명히 보여준다. 이 약제들의 조합 투여에서, 치료적 효과가 21일 동안 관찰되었다(TGI = 38 내지 62 %).
이식가능한 유방 선암 Ca-755의 경우, 아비실린과 시스플라틴의 조합 사용은 15일 동안 누적적 항암 효과를 야기했다: TGI = 7일 후 86% 대비 91%, 11일 후 62% 대비 83%, 14일 후 52% 대비 66%, 18일 후 43% 대비 54%, 및 22일 후 39% 대비 49%. 또한, 두 약제의 조합 사용은 실험 동물의 수명을 20 %까지 증가시켰다.
마우스에서 이식가능한 흑색종 B-16에 대한 아비실린과 시스플라틴의 조합 투여는 시스플라틴 단독요법에 비해 이 종양에 대해 유리한 항종양 효과를 보이지 않았다.
연구된 6개 중 5개의 이식가능한 고형암에 대한 아비실린의 중등도의 항종양 효과 및 아비실린과 시스플라틴의 조합 투여에 대한 일부 종양(CAC, Ca-755)의 증가된 감수성은, 아비실린이 다른 항종양 작용제와 조합되어, 조합 화학요법으로 악성 종양을 치료하는데 유용하다는 것을 시사할 수 있는 근거를 제공한다.
따라서, 실험적 연구는 복합-활성 테르페노이드 약제 아비실린이 경구로 투여된 경우, 이식가능한 고형암 (Ca-755, 흑색종 B-16, LLC, CC-5 및 육종 M-1)에 대해 중등도의 항종양 활성을 갖는다는 것을 보여준다.
또한, 치료적 용량의 절반으로 아비실린 및 시스플라틴을 조합 투여하는 것이 이식가능한 종양을 갖는 동물에 대한 실험에서 항종양 효과를 증가시키는 것으로 밝혀졌다.
이식가능한 고형암을 갖는 동물에 매일 경구로 투여하는 경우, 아비실린의 치료적 용량은 100 mg/kg 이었다.
아비실린은 누적 투여량 5000 mg/kg에서, 상기 투여량이 10일 동안 500 mg/kg의 투여량으로 매일 투여되었는지 또는 4일 및 9일의 간격을 두고 2500 mg/kg의 투여량으로 2회 투여되었는지와 무관하게, 독성 증상(manifestation)을 유발하지 않았다.
실시예
4
아비실린의
인 비트로 및 인 비보 항-혈관신생 활성
아비실린의 항-혈관신생 활성을 SV40-바이러스-형질전환 마우스 SVEC-4-10 내피세포 군에서 연구하였다 [Walter-Yoohrling, J., et al., Clin. Cancer Res. 2004; 10:2179-2189].
10 mg/mL의 농도를 갖는 아비실린의 스톡(stock) 용액 (10% DMSO/PBS)은 실험 일자의 기간(span) 내에, 러시아 의과학 연구소, 러시아 암 센터(Russian Oncologic Center), 실험적 종양 진단 및 치료를 위한 기관(Institute for Experimental Tumor Diagnostics and Therapy)의 투여 제형 연구실(Dosage Forms Laboratory)에서 제조되었다. 스톡 용액을 1% PBS를 사용하여 실험에 필요한 농도까지 희석시켰다.
각각의 실험은 4회 이상 반복하였다.
아비실린의 항-혈관신생 활성은 하기 과정을 통해 인 비트로 및 인 비보에서 입증될 수 있다:
(1) 아비실린을 고밀도로 접종된 SVEC-4-10계 세포와 함께 24시간 동안 인큐베이션하여 내피세포에 대한 아비실린의 세포독성 효과를 유발시켰다.
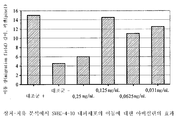
본 발명자들의 데이터에 의하면, 아비실린은 1 mg/mL 내지 0.125 mg/mL의 농도 범위에서 내피 세포를 사멸시킨다 (도 2). FD50은 0.21 mg/mL였다.
(2) 저밀도로 접종된 bFGF-활성화(bFGF-activated) SVEC-4-10 내피세포의 증식 활성에 대한 아비실린의 효과를 연구하여 아비실린의 항증식 효과를 평가하였다.
아비실린은 1 mg/mL 내지 0.125 mg/mL의 농도 범위에서 SVEC-4-10 내피세포의 증식을 억제하는 것으로 나타났다 (IC50 = 0.09 mg/mL).
두 개의 비세포독성(noncytotoxic) 농도 (0.0625 mg/mL 및 0.031 mg/mL)에 대해, 20 %의 내피 세포 증식 억제가 관찰되었다 (도 3).
(3) 0.25 mg/mL 내지 0.031 mg/mL의 아비실린 농도 범위에서, SVEC-4-10 마우스 내피 세포 군의 이동의 억제로서 (상처 면적 측정법(wound area measurements)을 이용함) 아비실린의 이동억제(antimigration) 효과를 평가하였다.
0.25 mg/mL의 아비실린 농도에서 내피 세포의 상처-내 이동(in-wound migration)의 89% 억제를 관찰하였다. 비세포독성 농도 (0.0625 mg/mL 및 0.031 mg/mL)에서, 아비실린은 내피세포의 상처-내 이동을 억제하지 않았다.
(4) 관상 구조(tubular structure)에 대한 아비실린의 효과
내피 세포에 의한 관상 구조의 형성을 억제하는 아비실린의 능력은 아비실린 투여량 0.125 mg/mL 내지 0.015 mg/mL의 범위에서 확인되었다.
연구결과는 아비실린이 0.125 mg/mL의 농도에서 부분적으로 세관 형성(tubular formation)을 억제한다는 것을 보여주었다. 관찰된 세관들은 짧고, 개구되었으며, 다른 세관들과의 접촉(contact)에 의해 묶여(confine)있지 않았다. 0.0625, 0.031 및 0.15 mg/mL의 아비실린 농도에서는, 세관 형성의 억제가 관찰되지 않았다 (도 6).
(5) 마트리겔 이식편(Matrigel implant)에서 혈관신생에 대한 아비실린의 효과
아비실린의 항-혈관신생 활성을, bFGF 혈관신생 프로모터에 의해 도핑된(doped) 마트리겔 이식편에서의 혈관신생 억제 능력으로서 인 비보에서 연구하였다. 아비실린은 2, 1 및 0.2 mg/mL의 농도로, 7일 동안 매일 경구로 투여되었다.
본 연구는 연구된 농도에서 아비실린이 투여량-의존적으로 마트리겔에서 혈관생성을 억제한다는 것을 보여주었다 (도 7). 최대 억제는 아비실린 농도 2 및 1 mg/mL에서 관찰되었다; 0.2 mg/mL의 경우, 마트리겔 이식편에서 신생혈관생성의 부분적 억제가 관찰되었다. 헤마톡실린-(hematoxylin-) 및 에오신-(eosin-)염색된 마트리겔 이식편의 조직 절편(histological section)은 아비실린을 섭취한 마우스에서 내피 세포의 양 및 기질 요소(stromal element)의 투여량-의존적인 감소를 보여주었다.
따라서, 아비실린은 인 비보 및 인 비트로에서 항-혈관신생 활성을 갖는 것으로 나타났다. 이 실험들에서 얻어진 데이터는 악성 종양에서 혈관신생을 억제할 수 있는 작용제로서, 청구된 방법에서의 사용을 위한 아비실린의 적합성을 나타내는 응용가능한 의의(applied significance)을 가지며, 이러한 항종양 효과 및 항-혈관신생 효과를 동시에 갖는 복합-활성 무독성 작용제를 제조하는 방법이 당해 기술분야에서 아직 알려지지 않았고 자명하지 않기 때문에 더욱 그러하다.
실시예
5
아비실린의
항재발
및 항전이 효과
악성 암(neoplasm)에서 전이 및 재발을 억제하는 방법의 실험적 개발 (development)은 C57BL6계 마우스 및 BDF1 1-세대 잡종을 사용하였고, 각각의 동물의 체중은 20 내지 25 g으로, 피하로 루이스 폐암(Lewis lung carcinoma)을 이식받았다. 마우스들은 러시아 의과학 연구소, 러시아 암 센터의 실험 동물 연구 분과로부터 구입하였고, 일반 식이량에 따라 섭식시켰다. 모든 실험 과정은 동물을 포함하는 연구를 위한 국제 시험관리 기준(international good practice)에 따라 수행하였다.
아비실린을 60 내지 400 mg/mL의 투여량 범위에서, 오일 용액의 형태로 경구 투여했다. 해바라기씨 오일이 상기 약제에 대한 용매로 사용되었다. 대조군 및 처리군(treated group) 각각은 7 내지 10 마리의 동물을 포함했다.
아비실린의 항종양, 항재발 및 항전이 활성은 2005년에 게재된, 신규한 약리학적 물질의 실험적(전임상) 연구를 위한 매뉴얼(the Manual for Experimental(Preclinical) Study of Novel Pharmacological Substances)에 기재된 권고(recommendation)에 따라 확인하였다.
데이터의 처리를 위해서 스튜던트 검정을 사용하였다.
마우스에서 절개된(cut through) 피부 상에 미리 생성된 스티치(stitch) 밑으로 1 x 105 루이스 폐암 세포의 이식에 의해 재발이 유도된 후, 유도된 종양의 출현 비율 및 시간, 및 종양의 진행 동태(progression dynamics)에 대한 아비실린의 효과를 연구하였다.
100 mg/mL 및 400 mg/mL의 투여량으로 10일 동안의 아비실린의 경구 투여는 뚜렷한(well defined) 항재발 효과를 유발했다. 예를 들면, 종양 세포가 이식된 후 400 mg/mL의 투여량으로 아비실린을 투여받은 동물 군에서는, 14일 후에 7 마리의 동물 중 2 마리에서 재발이 나타났으며, 100 mg/mL의 투여량으로 아비실린을 제공받은 동물 군에서는 실험 12일차가 될 때까지 7마리의 동물 중 단지 3 마리에서 재발이 나타났다. 또한, 다른 동물들에서는 90일이 넘는 관찰 기간 동안 유도된 재발이 관찰되지 않았다.
유도된 재발(induced recurrence)의 성장 및 전이에 대한 아비실린 경구 투여 (60, 120 및 360 mg/mL의 투여량으로, 10일 동안)의 효과에 대한 연구는 아비실린 투여가 유도된 루이스 폐암의 출현 및 성장의 동태를 억제했을 뿐만 아니라, 120 mg/mL의 투여량으로 투여된 경우 재발 종양의 전이를 46 %만큼 감소시켰다(표 4)는 것을 보여주었다. 33일차에 동물들을 희생시킨 후 모든 처리군 및 대조군 동물에서 전이가 밝혀졌음에도 불구하고, 대조군 동물에서의 449.7 ± 146.1에 비하여, 전이성 암을 갖는 폐의 평균 중량은 241.0 ± 36.0 mg이었다.
루이스 폐암의 자연(spontaneous) 재발 및 전이에 대한 아비실린(60, 100, 또는 120 mg/mL; 경구 투여; 5회; 원발성 종양 결절(primary tumor node)의 절제 전, 후, 또는 전과 후)의 효과는 그의 투여 계획에 따라 좌우되었다 (표 5).
약제가 60 mg/mL의 투여량으로 투여된 경우, 가장 뛰어난 효과는 절제 후 보조 요법(adjuvant therapy)에 의해 달성되었다. 실험 27일차에, 재발은 대조군에서의 6/7에 비교하여, 시험군의 마우스 3/7에서 나타났다. 수술-전(pre-surgery) 요법 및 조합 (수술-전 및 수술-후) 계획은 모두 덜 효과적이었다. 그러나, 120 mg/mL의 투여량으로 아비실린을 투여하는 것은 수술-전 투여 계획에서 가장 효과적이었다. 루이스 폐암의 전이에 대한 상기 요법의 효과를 평가하기 위한 실험에서 35일 차에 동물들을 희생시킨 후에, 아비실린이 60 mg/mL의 투여량으로 사용된 경우 수술-후(보조) 요법이 가장 효과적이라는 데이터를 얻었다. 이러한 계획에 따라 (경구, 60 mg/mL 투여량, 원발성 종양의 절제 5일 후) 아비실린을 투여받은 동물에서, 45 %의 전이 억제가 발견되었다 (전이성-암을 보유하는 폐의 평균 중량은, 대조군 동물에서의 709.4 ± 237.3 mg와 비교하여 처리군 동물에서 393.3 ± 160.0 mg이었다)).
[표 4]
C57B1/6 마우스에서 유도된 루이스 폐암 재발의 출현, 성장 및 전이의 동태에 대한 아비실린의 효과
16. 주: * 군 내의 전체 동물 수에 대한 재발한 동물 수의 비율
(+) 10 미만, (++) 10 내지 30, 및 (+++) 30을 초과한 전이 재발 동물 수
[표 5]
루이스 폐암의 자연 재발 및 전이에 대한, 원발성 종양의 외과적 절제(surgical resection)에 보조적인 아비실린의 효과
주: *군 내의 전체 동물 수에 대한 재발한 동물 수의 비율;
(+) 10 미만, (++) 10 내지 30, 및 (+++) 30을 초과한 전이 재발 동물 수
상기 실험 데이터로부터, 정해진 계획에 따른 복합-활성 테르페노이드 약제 아비실린 및 경구 투여형을 사용하는, 본 명세서에서 청구된 방법은 하기와 같은 필요한 결과에 도달한다는 결론에 이른다:
루이스 폐암의 유도된 재발을 억제하고, 재발 종양의 전이를 억제한다(다양한 실험에서 25 내지 46 %). 최상의 효과는 상기 약제를 100 내지 120 mg/kg의 투여량으로 다음의 7 내지 10일 동안 경구 투여함으로써 달성되었다. 원발성 종양의 수술에 의한 절제(surgical removal) 후 보조 요법에서의 아비실린 활성 연구는 루이스 폐암의 자연 재발의 출현 및 진행을 억제하는 아비실린의 능력을 보여주었다. 가장 효과적인 것은 원발성 종양의 절제 후 상기 약제를 60 mg/kg의 투여량으로 5일 동안 사용하는 것이었다. 120 mg/kg의 투여량에서, 상기 약제는 수술-전 투여에서 더욱 효과적이었다. 아비실린의 5회의 수술-후 투여는, 원발성 종양의 절제수술에 보조적으로, 루이스 폐암 전이의 45 % 억제를 제공했다.
따라서, 청구된, 정해진 계획 및 일정에 따른 복합-활성 테르페노이드 약제 아비실린의 경구 투여 방법은, 악성 암 진행에서 혈관신생 과정을 억제하며:
- 항재발 및 항전이 효과를 야기하며;
- 금기를 갖지 않고;
- 세포독성 및 아폽토시스-유도 효과를 유발하며;
- 마우스에서 이식가능한 종양의 필요한 세포주(strain)에서 항종양 활성을 나타내고;
- 조합하여 사용하는 경우, 세포독성 항종양제(시스플라틴)의 독성을 감소시키고 치료 효능을 증가시키며;
- 내성을 유발하지 않고;
- 신생혈관생성 억제에 있어 선택적이며;
- 치료적 용량을 10 배 초과하는 투여량으로 경구 투여하는 경우 독성 효과를 나타내지 않는, 놀라운 기회를 제공한다.
또한, 상기 약제는 종양 질환의 수술 치료(surgical treatment) 효과를 상승시킬 수 있는 작용제로서 국소 투여 및 적용이 권고되는, 종래의 복합-활성 테르페노이드 물질 아비실(Abisil) 및 그에 기반한 약학적 조성물의 사용 영역을 확대시킨다.
약제 아비릴린의 높은 치료적 효과의 또다른 원인은, 그의 아비실 물질의 이미 알려진 복합-활성, 즉 면역조절 활성, 항세균 활성, 상처-치유 활성, 항-염증 활성, 및 통증-완화 활성의 조합이며, 나아가 이 물질은 대뇌 피질에서 신경 말단의 특이적인 내인성 체액성 매개인자(endogenous humoral mediator)의 합성을 촉진할 수 있다.
악성 암의 근절를 위한 제안된 방법은, 의도된 목적을 달성하는 기회를 제공하며, 상기 목적은, 선행기술 약제의 결점을 가지지 않는, 즉 장기 사용에서 독성 부작용을 야기하지 않고, 내성을 야기하지 않으며 (특히, 아폽토시스에 대한 내성), 세포분열 억제제와의 복합 요법에서 사용되는 경우, 상기 세포분열 억제제의 효능을 증가시킬 뿐만 아니라 그의 독성을 감소시킬 수 있는, 항-혈관신생 항종양 약제 아비실린을 사용하여 신생혈관생성의 선택적 억제 또는 중단을 위한 약제를 규명하고, 개발하는 것이다. 또한, 상기 약제는 모든 선행 기술의 혈관신생-억제 작용제에 비해 몇 가지 이점을 가지며, 즉 직접적인 항종양 효과를 갖고, 세포 아폽토시스를 유도할 수 있고, 항-재발 및 항전이 효과를 야기하고, 동시에 면역조절, 항세균, 상처-치유, 항-염증, 통증-완화 및 기타 효과를 갖는다.
Claims (4)
- 복합-활성 약학적 조성물 아비실린(Abisilin)을 사용하여, 혈관신생 억제가 치료적으로 유효한 작용인, 종양 및 기타 질환을 치료 및 예방하기 위한 약제로서, 활성 성분으로, 소나무과(Pinaceae family)의 침엽수에서 유래한 테르펜(이소프레노이드)으로서, 상기 테르펜은 총 중량에 대한 백분율 기준으로 하기의 구성성분, 즉:
- 세스퀴테르페노이드 (3 내지 6 %);
- 중성 디테르페노이드 (11 내지 15 %);
- 디테르펜 산 (23 내지 28 %);
- 트리테르펜 산 (8 내지 16 %);
- 불포화 및 포화 지방산 (0.1 내지 0.3 %);
- 페놀성 화합물 (0.1 내지 0.2 %); 및
- 나머지는 보르닐 아세테이트(bornyl acetate) 함량이 특정한 비율로 취한 총 테르펜에 대해 10.0 % 이상인 모노테르페노이드를 포함하는 것인 테르펜, 및 약학적으로 허용가능한 담체 및/또는 부형제를 포함하고, 상기 조성물은 사람을 포함한 포유동물에, 유효량으로 경구 투여되는 것을 특징으로 하는 약제. - 제1항에 있어서, 상기 약제는 다양한 기원의 종양 질환(tumor disease)을 치료하기 위한 것이고, 상기 약제는 용액, 정제, 젤라틴 캡슐, 알약, 시럽제, 현탁제, 산제, 에멀젼, 과립, 마이크로스피어(microsphere), 또는 나노스피어(nanosphere) 또는 상기 약제의 활성 성분의 제어된 방출에 유용한 다른 투여형의 형태일 수 있는, 약학적 조성물 아비실린으로 대표되는 것인 약제.
- 제1항 또는 제2항에 있어서, 상기 약제는 혈관신생 시스템 억제를 유도하고 직접적인 항종양, 항재발, 및 항전이 효과 및 내인성 아폽토시스(apoptosis) 시스템의 관련된 활성화를 야기하기 위한 것이고, 상기 약학적 조성물은 종양 질환을 앓는, 사람을 포함한 포유동물에 매일 체중 킬로그램 당 80 내지 100 mg의 투여량으로 경구 투여되는 것인 약제.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 상기 약학적 조성물 아비실린이 다른 약학적 활성 물질(항생제(antibiotics), 세포분열억제제(cytostatics) 등)과 함게 사용되는 것인 약제.
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PCT/RU2008/000147 WO2009113902A1 (ru) | 2008-03-14 | 2008-03-14 | Пpoтивooпyxoлeвaя терпеноидная фармацевтическая композиция «aбиcилин» с ангиогенезингибирующим дeйcтвиeм |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20110015516A true KR20110015516A (ko) | 2011-02-16 |
Family
ID=41065440
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107022802A KR20110015516A (ko) | 2008-03-14 | 2008-03-14 | 혈관신생억제 작용을 갖는 항종양 테르페노이드 약학적 조성물 ‘아비실린’ |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US20110165271A1 (ko) |
| EP (1) | EP2275112A4 (ko) |
| JP (1) | JP2011514354A (ko) |
| KR (1) | KR20110015516A (ko) |
| CN (1) | CN102036672A (ko) |
| CA (1) | CA2727792C (ko) |
| EA (1) | EA017659B1 (ko) |
| IL (1) | IL208092A (ko) |
| WO (1) | WO2009113902A1 (ko) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102657660A (zh) * | 2012-04-28 | 2012-09-12 | 上海交通大学医学院 | 三萜类化合物在制备抑制血管生成药物中的应用 |
| WO2013176564A1 (ru) * | 2012-05-25 | 2013-11-28 | Общество С Ограниченной Ответственностью "Инитиум-Фарм" | Терпеноидное средство для профилактики и лечения атеросклероза и коррекции метаболического синдрома |
| RU2634253C1 (ru) * | 2016-12-22 | 2017-10-24 | Федеральное государственное бюджетное учреждение "Российский онкологический научный центр имени Н.Н. Блохина" Министерства здравоохранения Российской Федерации (ФГБУ "РОНЦ им. Н.Н. Блохина" Минздрава России) | Антиангиогенное лекарственное средство |
| RU2747147C1 (ru) * | 2020-06-22 | 2021-04-28 | Федеральное государственное бюджетное учреждение "Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина" Министерства здравоохранения Российской Федерации (ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России) | Фармацевтическая композиция, проявляющая цитотоксичность в отношении клеток карциномы толстой кишки человека |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2051900C1 (ru) | 1991-02-15 | 1996-01-10 | Санкио Компани Лимитед | 5-амино-1-гидроксиметилциклопентан-1,2,3,4-тетраол, 2-амино-4-гидроксиметил-3a,5,6,6a-тетрагидро-4н-циклопент-[d]-оксазол-4,5,6-триол, их фармацевтически приемлемые соли и способы их получения |
| LU91067I2 (fr) * | 1991-06-14 | 2004-04-02 | Genentech Inc | Trastuzumab et ses variantes et dérivés immuno chimiques y compris les immotoxines |
| WO1994004679A1 (en) | 1991-06-14 | 1994-03-03 | Genentech, Inc. | Method for making humanized antibodies |
| US5488116A (en) | 1992-03-30 | 1996-01-30 | Sloan-Kettering Institute For Cancer Research | Total synthesis of taxol and analogues thereof |
| RU2054945C1 (ru) * | 1995-06-28 | 1996-02-27 | Нина Максимовна Пинигина | Средство "абисил-1", обладающее противовоспалительной, антибактериальной и ранозаживляющей активностью |
| RU2196581C2 (ru) | 2000-05-04 | 2003-01-20 | Колесников Андрей Григорьевич | Способ получения r-тетраола, обладающего противоопухолевой активностью |
| KR20080068151A (ko) | 2000-06-23 | 2008-07-22 | 바이엘 쉐링 파마 악티엔게젤샤프트 | VEGF/VEGF 수용체 및 안지오포이에틴/Tie수용체의 기능을 방해하는 조합 제제 및 조성물과 이들의용도 (Ⅱ) |
| RU2198653C1 (ru) * | 2002-03-29 | 2003-02-20 | Пинигина Нина Максимовна | Полиактивные ректальные или вагинальные суппозитории на основе природных терпенов, обогащенных монотерпеноидами, для лечения и/или профилактики урологических, проктологических или гинекологических заболеваний |
| EP1539204A1 (en) * | 2002-08-30 | 2005-06-15 | Biopharmacopae Design International Inc. | Plant extracts for treatment of angiogenesis and metastasis |
| RU2244928C2 (ru) | 2003-02-19 | 2005-01-20 | Пинигина Нина Максимовна | Эндогенная фармацевтическая композиция, полученная на основе целенаправленной активации гуморальных медиаторов нервных окончаний коры головного мозга |
| RU2338547C1 (ru) * | 2007-02-16 | 2008-11-20 | Людмила Анатольевна Лацерус | Полиактивная терпеноидная субстанция абисил-2, фармацевтическая композиция на ее основе и способы ее применения |
-
2008
- 2008-03-14 WO PCT/RU2008/000147 patent/WO2009113902A1/ru active Application Filing
- 2008-03-14 CA CA2727792A patent/CA2727792C/en active Active
- 2008-03-14 EA EA201001289A patent/EA017659B1/ru not_active IP Right Cessation
- 2008-03-14 KR KR1020107022802A patent/KR20110015516A/ko not_active Application Discontinuation
- 2008-03-14 EP EP08873343A patent/EP2275112A4/en not_active Ceased
- 2008-03-14 US US12/922,338 patent/US20110165271A1/en not_active Abandoned
- 2008-03-14 CN CN2008801288610A patent/CN102036672A/zh active Pending
- 2008-03-14 JP JP2010550631A patent/JP2011514354A/ja active Pending
-
2010
- 2010-09-12 IL IL208092A patent/IL208092A/en active IP Right Grant
Also Published As
| Publication number | Publication date |
|---|---|
| CA2727792C (en) | 2017-07-25 |
| JP2011514354A (ja) | 2011-05-06 |
| WO2009113902A1 (ru) | 2009-09-17 |
| CN102036672A (zh) | 2011-04-27 |
| IL208092A (en) | 2015-07-30 |
| CA2727792A1 (en) | 2009-09-17 |
| EP2275112A4 (en) | 2011-10-12 |
| US20110165271A1 (en) | 2011-07-07 |
| EP2275112A1 (en) | 2011-01-19 |
| EA017659B1 (ru) | 2013-02-28 |
| EA201001289A1 (ru) | 2011-04-29 |
| IL208092A0 (en) | 2010-12-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Gao et al. | Opportunities and challenges for co-delivery nanomedicines based on combination of phytochemicals with chemotherapeutic drugs in cancer treatment | |
| Qu et al. | Transcription factor NRF2 as a promising therapeutic target for Alzheimer’s disease | |
| Cheng et al. | Phytomedicine—Modulating oxidative stress and the tumor microenvironment for cancer therapy | |
| US8691870B2 (en) | Use of isothiocyanates for treating cancer | |
| Lu et al. | Repurposing of artemisinin-type drugs for the treatment of acute leukemia | |
| US20050288378A1 (en) | Cancer chemotherapy | |
| Liang et al. | The synergism of natural compounds and conventional therapeutics against colorectal cancer progression and metastasis | |
| Kumar et al. | Moringa oleifera L. leaf extract induces cell cycle arrest and mitochondrial apoptosis in Dalton's Lymphoma: An in vitro and in vivo study | |
| KR20110015516A (ko) | 혈관신생억제 작용을 갖는 항종양 테르페노이드 약학적 조성물 ‘아비실린’ | |
| US20110021620A1 (en) | Use of tea polyphenols in preparing medicaments for prevention or treatment of tumors | |
| KR20220119335A (ko) | 천화분, 백선피 및 상백피를 포함하는 암 및 내성암에 대한 약학적 조성물 | |
| Isleem et al. | Synergistic anticancer effect of combining metformin with olive (Olea europaea L.) leaf crude extract on the human breast cancer cell line MCF-7 | |
| US20060110467A1 (en) | Cancer chemotherapy | |
| US20120201903A1 (en) | Cytoprotective or therapeutic plant composition | |
| US20220168319A1 (en) | COMBINED USE OF A-NOR-5alpha ANDROSTANE COMPOUND DRUG AND ANTICANCER DRUG | |
| JP2016530326A (ja) | ロクベンシモツケソウ抽出物及びその用途 | |
| WO2021006822A1 (en) | Pharmaceutical compositions having synergistic effects of natural extracts for cancer treatment undergoing chemotherapy | |
| JP2014224148A (ja) | 血管新生阻害作用を示す抗腫瘍テルペノイド医薬組成物アビシリン | |
| TWI728551B (zh) | 藥學組合物用於治療與半乳糖凝集素-1活化相關癌症之用途 | |
| Hassan et al. | Synergistic Effect of the Combination of Polyphenols with Gemcitabineon Pancreatic Cancer Cell line AsPC-1 | |
| RU2784809C2 (ru) | Комбинированный продукт, содержащий дициклоплатин, и способ его получения и применения | |
| Raup-Konsavage et al. | Medical use of cannabidiol and impact on cancer cell viability | |
| EP1549330B1 (en) | Pomolic acid for treating multidrug resistant tumours | |
| Osman et al. | Modulation of Doxorubicin Induced Expression of Multidrug Resistance Gene in Breast Cancer cells by Astaxanthin | |
| Nerkar et al. | Ethnopharmacological review of boswellia serrata for anticancer activity |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |