KR20080019720A - 치료 펩티드 및 백신 - Google Patents
치료 펩티드 및 백신 Download PDFInfo
- Publication number
- KR20080019720A KR20080019720A KR1020087001808A KR20087001808A KR20080019720A KR 20080019720 A KR20080019720 A KR 20080019720A KR 1020087001808 A KR1020087001808 A KR 1020087001808A KR 20087001808 A KR20087001808 A KR 20087001808A KR 20080019720 A KR20080019720 A KR 20080019720A
- Authority
- KR
- South Korea
- Prior art keywords
- peptide
- composition
- group
- hiv
- amino acid
- Prior art date
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims abstract description 76
- 229960005486 vaccine Drugs 0.000 title claims abstract description 33
- 230000001225 therapeutic effect Effects 0.000 title claims abstract description 28
- 102000004196 processed proteins & peptides Human genes 0.000 title abstract description 28
- 239000000203 mixture Substances 0.000 claims abstract description 42
- 238000000034 method Methods 0.000 claims abstract description 15
- 241000725303 Human immunodeficiency virus Species 0.000 claims description 37
- 230000002163 immunogen Effects 0.000 claims description 16
- 150000001413 amino acids Chemical class 0.000 claims description 14
- KVPFYRAFNZKJSD-CPXLMRBJSA-N (2s,3r)-2-[[(2s)-2-[[(2s)-4-amino-2-[[(2s,3r)-2-[[(2s,3r)-2-amino-3-hydroxybutanoyl]amino]-3-hydroxybutanoyl]amino]-4-oxobutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-3-hydroxybutanoic acid Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)O)C(O)=O)CC1=CC=C(O)C=C1 KVPFYRAFNZKJSD-CPXLMRBJSA-N 0.000 claims description 11
- 239000002671 adjuvant Substances 0.000 claims description 10
- 241000282412 Homo Species 0.000 claims description 7
- 125000006239 protecting group Chemical group 0.000 claims description 5
- 150000001408 amides Chemical class 0.000 claims description 3
- 210000004899 c-terminal region Anatomy 0.000 claims description 3
- 125000003275 alpha amino acid group Chemical group 0.000 claims 6
- 125000003368 amide group Chemical group 0.000 claims 2
- 125000000539 amino acid group Chemical group 0.000 claims 2
- 239000000470 constituent Substances 0.000 claims 2
- 125000005647 linker group Chemical group 0.000 claims 1
- 230000027455 binding Effects 0.000 abstract description 66
- 239000003814 drug Substances 0.000 abstract description 15
- 229940079593 drug Drugs 0.000 abstract description 9
- 201000010099 disease Diseases 0.000 abstract description 7
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 7
- 230000001939 inductive effect Effects 0.000 abstract description 6
- 102100035875 C-C chemokine receptor type 5 Human genes 0.000 abstract description 5
- 201000004681 Psoriasis Diseases 0.000 abstract description 3
- 208000024827 Alzheimer disease Diseases 0.000 abstract description 2
- 101710149870 C-C chemokine receptor type 5 Proteins 0.000 abstract description 2
- 241000714260 Human T-lymphotropic virus 1 Species 0.000 abstract description 2
- 201000006417 multiple sclerosis Diseases 0.000 abstract description 2
- 208000006961 tropical spastic paraparesis Diseases 0.000 abstract description 2
- 241001430294 unidentified retrovirus Species 0.000 abstract description 2
- 206010020460 Human T-cell lymphotropic virus type I infection Diseases 0.000 abstract 1
- 206010044696 Tropical spastic paresis Diseases 0.000 abstract 1
- 230000003960 inflammatory cascade Effects 0.000 abstract 1
- AKWRNBWMGFUAMF-ZESMOPTKSA-N (2s)-n-[(2s)-1-[[(2s,3r)-1-amino-3-hydroxy-1-oxobutan-2-yl]amino]-3-(4-hydroxyphenyl)-1-oxopropan-2-yl]-2-[[(2s,3r)-2-[[(2s,3r)-2-[[(2s,3r)-2-[[(2s)-2-[[(2r)-2-aminopropanoyl]amino]-3-hydroxypropanoyl]amino]-3-hydroxybutanoyl]amino]-3-hydroxybutanoyl]amin Chemical compound C[C@@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@H](C(=O)N[C@@H]([C@H](O)C)C(N)=O)CC1=CC=C(O)C=C1 AKWRNBWMGFUAMF-ZESMOPTKSA-N 0.000 description 64
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 33
- 208000031886 HIV Infections Diseases 0.000 description 32
- 210000004027 cell Anatomy 0.000 description 31
- 230000003472 neutralizing effect Effects 0.000 description 30
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 description 29
- 230000002788 anti-peptide Effects 0.000 description 28
- 108010071384 Peptide T Proteins 0.000 description 27
- 241000700605 Viruses Species 0.000 description 27
- 102000005962 receptors Human genes 0.000 description 25
- 108020003175 receptors Proteins 0.000 description 25
- 230000000694 effects Effects 0.000 description 19
- 210000002966 serum Anatomy 0.000 description 18
- 238000006386 neutralization reaction Methods 0.000 description 14
- 230000005764 inhibitory process Effects 0.000 description 12
- 102100031650 C-X-C chemokine receptor type 4 Human genes 0.000 description 11
- 108010017088 CCR5 Receptors Proteins 0.000 description 11
- 102000004274 CCR5 Receptors Human genes 0.000 description 11
- 101710151805 Mitochondrial intermediate peptidase 1 Proteins 0.000 description 11
- 210000004556 brain Anatomy 0.000 description 11
- 238000002474 experimental method Methods 0.000 description 11
- 101000922348 Homo sapiens C-X-C chemokine receptor type 4 Proteins 0.000 description 10
- 102100034349 Integrase Human genes 0.000 description 10
- 241000283973 Oryctolagus cuniculus Species 0.000 description 10
- 208000015181 infectious disease Diseases 0.000 description 10
- 238000003556 assay Methods 0.000 description 9
- 239000012528 membrane Substances 0.000 description 9
- 238000002965 ELISA Methods 0.000 description 8
- 238000004458 analytical method Methods 0.000 description 8
- 230000000840 anti-viral effect Effects 0.000 description 8
- 102000004169 proteins and genes Human genes 0.000 description 8
- 108090000623 proteins and genes Proteins 0.000 description 8
- 230000003612 virological effect Effects 0.000 description 8
- 108090000189 Neuropeptides Proteins 0.000 description 7
- 101800001690 Transmembrane protein gp41 Proteins 0.000 description 7
- 230000015572 biosynthetic process Effects 0.000 description 7
- 239000003446 ligand Substances 0.000 description 7
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 7
- 208000030507 AIDS Diseases 0.000 description 6
- 108091008927 CC chemokine receptors Proteins 0.000 description 6
- 101710091045 Envelope protein Proteins 0.000 description 6
- 101710188315 Protein X Proteins 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- 102000019034 Chemokines Human genes 0.000 description 5
- 108010012236 Chemokines Proteins 0.000 description 5
- 230000000903 blocking effect Effects 0.000 description 5
- 150000001875 compounds Chemical class 0.000 description 5
- 230000001419 dependent effect Effects 0.000 description 5
- 239000000835 fiber Substances 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 210000002540 macrophage Anatomy 0.000 description 5
- 238000000159 protein binding assay Methods 0.000 description 5
- 238000012216 screening Methods 0.000 description 5
- 229940125575 vaccine candidate Drugs 0.000 description 5
- 108010041397 CD4 Antigens Proteins 0.000 description 4
- 102000001327 Chemokine CCL5 Human genes 0.000 description 4
- 108010055166 Chemokine CCL5 Proteins 0.000 description 4
- 102000009410 Chemokine receptor Human genes 0.000 description 4
- 108050000299 Chemokine receptor Proteins 0.000 description 4
- 101710121417 Envelope glycoprotein Proteins 0.000 description 4
- 108010003205 Vasoactive Intestinal Peptide Proteins 0.000 description 4
- 230000009471 action Effects 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 238000010790 dilution Methods 0.000 description 4
- 239000012895 dilution Substances 0.000 description 4
- 238000009472 formulation Methods 0.000 description 4
- 230000010415 tropism Effects 0.000 description 4
- 102000005674 CCR Receptors Human genes 0.000 description 3
- 108090000288 Glycoproteins Proteins 0.000 description 3
- 102000003886 Glycoproteins Human genes 0.000 description 3
- 229940033330 HIV vaccine Drugs 0.000 description 3
- 101000946926 Homo sapiens C-C chemokine receptor type 5 Proteins 0.000 description 3
- 101900082162 Human immunodeficiency virus type 1 group M subtype B Surface protein gp120 Proteins 0.000 description 3
- 108060003951 Immunoglobulin Proteins 0.000 description 3
- 101710142969 Somatoliberin Proteins 0.000 description 3
- 210000001744 T-lymphocyte Anatomy 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 239000005557 antagonist Substances 0.000 description 3
- 230000036436 anti-hiv Effects 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 108010005774 beta-Galactosidase Proteins 0.000 description 3
- 238000012512 characterization method Methods 0.000 description 3
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 3
- 230000004927 fusion Effects 0.000 description 3
- 239000000499 gel Substances 0.000 description 3
- 230000013595 glycosylation Effects 0.000 description 3
- 238000006206 glycosylation reaction Methods 0.000 description 3
- 102000018358 immunoglobulin Human genes 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- VBUWHHLIZKOSMS-RIWXPGAOSA-N invicorp Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CCSC)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC=1NC=NC=1)C(C)C)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=C(O)C=C1 VBUWHHLIZKOSMS-RIWXPGAOSA-N 0.000 description 3
- 239000006166 lysate Substances 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- 210000000274 microglia Anatomy 0.000 description 3
- 238000010369 molecular cloning Methods 0.000 description 3
- 230000003389 potentiating effect Effects 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 239000012744 reinforcing agent Substances 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 238000001262 western blot Methods 0.000 description 3
- HZUXWTFTXZRVQJ-HHMSKVAWSA-N (3s)-4-[[(2s)-4-amino-1-[[(2s)-1-[[(1s,2r)-1-carboxy-2-hydroxypropyl]amino]-3-(4-hydroxyphenyl)-1-oxopropan-2-yl]amino]-1,4-dioxobutan-2-yl]amino]-3-[[(2s,3r)-2-amino-3-hydroxybutanoyl]amino]-4-oxobutanoic acid Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)O)C(O)=O)CC1=CC=C(O)C=C1 HZUXWTFTXZRVQJ-HHMSKVAWSA-N 0.000 description 2
- 102100024167 C-C chemokine receptor type 3 Human genes 0.000 description 2
- 108700012434 CCL3 Proteins 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 101710132601 Capsid protein Proteins 0.000 description 2
- 101710205625 Capsid protein p24 Proteins 0.000 description 2
- 102000000013 Chemokine CCL3 Human genes 0.000 description 2
- 102000001326 Chemokine CCL4 Human genes 0.000 description 2
- 108010055165 Chemokine CCL4 Proteins 0.000 description 2
- 241000283074 Equus asinus Species 0.000 description 2
- 238000005033 Fourier transform infrared spectroscopy Methods 0.000 description 2
- 230000004988 N-glycosylation Effects 0.000 description 2
- 102000003797 Neuropeptides Human genes 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- 239000012124 Opti-MEM Substances 0.000 description 2
- 101710177166 Phosphoprotein Proteins 0.000 description 2
- 102000002808 Pituitary adenylate cyclase-activating polypeptide Human genes 0.000 description 2
- 108010004684 Pituitary adenylate cyclase-activating polypeptide Proteins 0.000 description 2
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 2
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 2
- 101710149279 Small delta antigen Proteins 0.000 description 2
- 102100022831 Somatoliberin Human genes 0.000 description 2
- 102100022563 Tubulin polymerization-promoting protein Human genes 0.000 description 2
- 102000055135 Vasoactive Intestinal Peptide Human genes 0.000 description 2
- 102400000015 Vasoactive intestinal peptide Human genes 0.000 description 2
- 108010067390 Viral Proteins Proteins 0.000 description 2
- 208000036142 Viral infection Diseases 0.000 description 2
- 102000018265 Virus Receptors Human genes 0.000 description 2
- 108010066342 Virus Receptors Proteins 0.000 description 2
- 239000000427 antigen Substances 0.000 description 2
- 108091007433 antigens Proteins 0.000 description 2
- 102000036639 antigens Human genes 0.000 description 2
- 230000005540 biological transmission Effects 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 230000035605 chemotaxis Effects 0.000 description 2
- 230000007012 clinical effect Effects 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 239000012153 distilled water Substances 0.000 description 2
- 229940000406 drug candidate Drugs 0.000 description 2
- 230000036039 immunity Effects 0.000 description 2
- 230000001965 increasing effect Effects 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 230000002458 infectious effect Effects 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 210000001616 monocyte Anatomy 0.000 description 2
- 201000001119 neuropathy Diseases 0.000 description 2
- 230000007823 neuropathy Effects 0.000 description 2
- 230000009871 nonspecific binding Effects 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 239000004031 partial agonist Substances 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 208000033808 peripheral neuropathy Diseases 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 230000009870 specific binding Effects 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 230000002992 thymic effect Effects 0.000 description 2
- 238000000954 titration curve Methods 0.000 description 2
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 2
- 108010015141 vasoactive intestinal peptide (7-11) Proteins 0.000 description 2
- 230000009385 viral infection Effects 0.000 description 2
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- OPIFSICVWOWJMJ-AEOCFKNESA-N 5-bromo-4-chloro-3-indolyl beta-D-galactoside Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1OC1=CNC2=CC=C(Br)C(Cl)=C12 OPIFSICVWOWJMJ-AEOCFKNESA-N 0.000 description 1
- TVEXGJYMHHTVKP-UHFFFAOYSA-N 6-oxabicyclo[3.2.1]oct-3-en-7-one Chemical compound C1C2C(=O)OC1C=CC2 TVEXGJYMHHTVKP-UHFFFAOYSA-N 0.000 description 1
- 229940124718 AIDS vaccine Drugs 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 241000714195 Aids-associated retrovirus Species 0.000 description 1
- 102100026189 Beta-galactosidase Human genes 0.000 description 1
- 101710149862 C-C chemokine receptor type 3 Proteins 0.000 description 1
- 108700011778 CCR5 Proteins 0.000 description 1
- 101150017501 CCR5 gene Proteins 0.000 description 1
- 108010061299 CXCR4 Receptors Proteins 0.000 description 1
- 101100476210 Caenorhabditis elegans rnt-1 gene Proteins 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 101710094648 Coat protein Proteins 0.000 description 1
- 229930195709 D-tyrosine Natural products 0.000 description 1
- 125000002849 D-tyrosine group Chemical group [H]N([H])[C@@]([H])(C(=O)[*])C([H])([H])C1=C([H])C([H])=C(O[H])C([H])=C1[H] 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- 102000009123 Fibrin Human genes 0.000 description 1
- 108010073385 Fibrin Proteins 0.000 description 1
- BWGVNKXGVNDBDI-UHFFFAOYSA-N Fibrin monomer Chemical compound CNC(=O)CNC(=O)CN BWGVNKXGVNDBDI-UHFFFAOYSA-N 0.000 description 1
- 238000001157 Fourier transform infrared spectrum Methods 0.000 description 1
- 108091006027 G proteins Proteins 0.000 description 1
- 101150048348 GP41 gene Proteins 0.000 description 1
- 102000030782 GTP binding Human genes 0.000 description 1
- 108091000058 GTP-Binding Proteins 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- SXRSQZLOMIGNAQ-UHFFFAOYSA-N Glutaraldehyde Chemical compound O=CCCCC=O SXRSQZLOMIGNAQ-UHFFFAOYSA-N 0.000 description 1
- 102100021181 Golgi phosphoprotein 3 Human genes 0.000 description 1
- 239000007995 HEPES buffer Substances 0.000 description 1
- 108010039334 HIV Envelope Protein gp120 Proteins 0.000 description 1
- 229940126154 HIV entry inhibitor Drugs 0.000 description 1
- 208000037357 HIV infectious disease Diseases 0.000 description 1
- 229940033332 HIV-1 vaccine Drugs 0.000 description 1
- XLYOFNOQVPJJNP-ZSJDYOACSA-N Heavy water Chemical compound [2H]O[2H] XLYOFNOQVPJJNP-ZSJDYOACSA-N 0.000 description 1
- 101000980744 Homo sapiens C-C chemokine receptor type 3 Proteins 0.000 description 1
- 101000639987 Homo sapiens Stearoyl-CoA desaturase 5 Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 102100034353 Integrase Human genes 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- 229910025794 LaB6 Inorganic materials 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- 102000043136 MAP kinase family Human genes 0.000 description 1
- 108091054455 MAP kinase family Proteins 0.000 description 1
- 101000897431 Macaca mulatta C-C chemokine receptor type 5 Proteins 0.000 description 1
- 101710125418 Major capsid protein Proteins 0.000 description 1
- 101710141454 Nucleoprotein Proteins 0.000 description 1
- 239000002033 PVDF binder Substances 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 108010039918 Polylysine Proteins 0.000 description 1
- 101710083689 Probable capsid protein Proteins 0.000 description 1
- 230000010799 Receptor Interactions Effects 0.000 description 1
- 102000016983 Releasing hormones receptors Human genes 0.000 description 1
- 108070000025 Releasing hormones receptors Proteins 0.000 description 1
- 108700008625 Reporter Genes Proteins 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 241000713311 Simian immunodeficiency virus Species 0.000 description 1
- 101900350318 Simian immunodeficiency virus Surface protein gp120 Proteins 0.000 description 1
- 102100033930 Stearoyl-CoA desaturase 5 Human genes 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- COQLPRJCUIATTQ-UHFFFAOYSA-N Uranyl acetate Chemical compound O.O.O=[U]=O.CC(O)=O.CC(O)=O COQLPRJCUIATTQ-UHFFFAOYSA-N 0.000 description 1
- 102000012088 Vasoactive Intestinal Peptide Receptors Human genes 0.000 description 1
- 108010075974 Vasoactive Intestinal Peptide Receptors Proteins 0.000 description 1
- 206010058874 Viraemia Diseases 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 230000004931 aggregating effect Effects 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 239000012491 analyte Substances 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 230000003042 antagnostic effect Effects 0.000 description 1
- 238000002832 anti-viral assay Methods 0.000 description 1
- 230000005875 antibody response Effects 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 239000012148 binding buffer Substances 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 238000012754 cardiac puncture Methods 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 239000013592 cell lysate Substances 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 238000000978 circular dichroism spectroscopy Methods 0.000 description 1
- 238000001142 circular dichroism spectrum Methods 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 238000000749 co-immunoprecipitation Methods 0.000 description 1
- 230000015271 coagulation Effects 0.000 description 1
- 238000005345 coagulation Methods 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 230000009137 competitive binding Effects 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- IQFVPQOLBLOTPF-HKXUKFGYSA-L congo red Chemical compound [Na+].[Na+].C1=CC=CC2=C(N)C(/N=N/C3=CC=C(C=C3)C3=CC=C(C=C3)/N=N/C3=C(C4=CC=CC=C4C(=C3)S([O-])(=O)=O)N)=CC(S([O-])(=O)=O)=C21 IQFVPQOLBLOTPF-HKXUKFGYSA-L 0.000 description 1
- 230000001054 cortical effect Effects 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000000586 desensitisation Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 210000005069 ears Anatomy 0.000 description 1
- 238000001493 electron microscopy Methods 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 108010078428 env Gene Products Proteins 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 229950003499 fibrin Drugs 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 108091006047 fluorescent proteins Proteins 0.000 description 1
- 102000034287 fluorescent proteins Human genes 0.000 description 1
- 239000012737 fresh medium Substances 0.000 description 1
- 108091005996 glycated proteins Proteins 0.000 description 1
- 230000036252 glycation Effects 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 239000002835 hiv fusion inhibitor Substances 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 208000033519 human immunodeficiency virus infectious disease Diseases 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 230000037451 immune surveillance Effects 0.000 description 1
- 230000003053 immunization Effects 0.000 description 1
- 238000002649 immunization Methods 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 230000028802 immunoglobulin-mediated neutralization Effects 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 239000003547 immunosorbent Substances 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 239000002054 inoculum Substances 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 230000000873 masking effect Effects 0.000 description 1
- 210000004779 membrane envelope Anatomy 0.000 description 1
- WSFSSNUMVMOOMR-NJFSPNSNSA-N methanone Chemical compound O=[14CH2] WSFSSNUMVMOOMR-NJFSPNSNSA-N 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 230000028550 monocyte chemotaxis Effects 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 230000010807 negative regulation of binding Effects 0.000 description 1
- 229910052754 neon Inorganic materials 0.000 description 1
- GKAOGPIIYCISHV-UHFFFAOYSA-N neon atom Chemical compound [Ne] GKAOGPIIYCISHV-UHFFFAOYSA-N 0.000 description 1
- 230000002314 neuroinflammatory effect Effects 0.000 description 1
- 210000002569 neuron Anatomy 0.000 description 1
- 230000016273 neuron death Effects 0.000 description 1
- 230000007171 neuropathology Effects 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 230000005298 paramagnetic effect Effects 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 230000006919 peptide aggregation Effects 0.000 description 1
- 108010011903 peptide receptors Proteins 0.000 description 1
- 102000014187 peptide receptors Human genes 0.000 description 1
- 229940125667 peptide vaccine candidate Drugs 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 239000000902 placebo Substances 0.000 description 1
- 229940068196 placebo Drugs 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 229920000656 polylysine Polymers 0.000 description 1
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 1
- 239000000276 potassium ferrocyanide Substances 0.000 description 1
- 229910000160 potassium phosphate Inorganic materials 0.000 description 1
- 235000011009 potassium phosphates Nutrition 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 235000019833 protease Nutrition 0.000 description 1
- 108010030416 proteoliposomes Proteins 0.000 description 1
- 239000002096 quantum dot Substances 0.000 description 1
- 239000010453 quartz Substances 0.000 description 1
- 239000000700 radioactive tracer Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 108010043277 recombinant soluble CD4 Proteins 0.000 description 1
- 235000020095 red wine Nutrition 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 239000004332 silver Substances 0.000 description 1
- 238000002741 site-directed mutagenesis Methods 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 239000012192 staining solution Substances 0.000 description 1
- 239000011550 stock solution Substances 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 238000003239 susceptibility assay Methods 0.000 description 1
- XOGGUFAVLNCTRS-UHFFFAOYSA-N tetrapotassium;iron(2+);hexacyanide Chemical compound [K+].[K+].[K+].[K+].[Fe+2].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-] XOGGUFAVLNCTRS-UHFFFAOYSA-N 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 230000007502 viral entry Effects 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/21—Retroviridae, e.g. equine infectious anemia virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/162—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/08—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses
- C07K16/10—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses from RNA viruses
- C07K16/1036—Retroviridae, e.g. leukemia viruses
- C07K16/1045—Lentiviridae, e.g. HIV, FIV, SIV
- C07K16/1063—Lentiviridae, e.g. HIV, FIV, SIV env, e.g. gp41, gp110/120, gp160, V3, PND, CD4 binding site
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/15011—Lentivirus, not HIV, e.g. FIV, SIV
- C12N2740/15022—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/16011—Human Immunodeficiency Virus, HIV
- C12N2740/16111—Human Immunodeficiency Virus, HIV concerning HIV env
- C12N2740/16122—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/16011—Human Immunodeficiency Virus, HIV
- C12N2740/16111—Human Immunodeficiency Virus, HIV concerning HIV env
- C12N2740/16134—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Virology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Molecular Biology (AREA)
- Hematology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biophysics (AREA)
- Gastroenterology & Hepatology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Communicable Diseases (AREA)
- AIDS & HIV (AREA)
- Oncology (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Rheumatology (AREA)
- Neurosurgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Hospice & Palliative Care (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Pain & Pain Management (AREA)
- Tropical Medicine & Parasitology (AREA)
- Psychiatry (AREA)
Abstract
본 발명은 광범위한 HIV의 치료와 다양한 클래드(clade)의 HIV에 대한 항체를 유도하는 광의의 HIV 치료제 및 백신을 형성하는 조성물과, HIV gp-120에서 유래된 짧은 펩티드 서열 면역원 및 CCR5 결합 부위를 구성하는 것으로 동정된 펩티드로 제조된 다양한 치료 조성물을 동정하는 능력에 관한 것이다. 또한, 본 발명은 알츠하이머, 건선, 다발성 경화, 인간의 염증 케스케이드와 관련된 그외 질병과 같은 질병 뿐만 아니라 열대 연축성 하반신 마비의 원인인 HTLV-I와 같은 관련 레트로바이러스에 대해 효과적인 치료를 제공하는 약물의 후보물질일 수 있는 펩티드 서열을 선별하는 방법에 관한 것이다.
Description
본 출원은 2005년 6월 23일자 미국 가출원 제 60/693,087호, 2005년 6월 23일자 미국 가출원 제 60/698,088호와 2005년 6월 23일자 미국 가출원 제 60/693,089호를 기초로 한 우선권을 주장한다. 본 출원은 2006년 6월 23일 출원된 출원번호 제 11/474049호의 "알킬글리코시드 조성물의 안정화 및 그 방법"에 관한 것으로, 2006년 6월 23일자로 PCT/US06/24576으로 출원되었으며, 이들은 원용에 의해 본 명세서에 포함된다.
HIV-1 감염과 AIDS를 예방할 수 있는 백신은 그것의 지리학적 기원, 서브타입 또는 유전자형 특이성에 상관없이, 현재 백신 후보군이 도달하지 못한 목표인, 감염된 바이러스 최초 분리주에 대하여 강력한 중화 활성을 가진 항체를 높은 수준으로 유도할 수 있는 면역원이 필요한 것으로, 널리 인식되어 있다. 그래서 광범위한 중화를 매개하는 에피토프의 동정은 적절한 백신의 고안과 개발에 있어서 매우 중요하다. 특히, 우세한 북아메리카 클래드 B 서브타입과 비교하여, 개발도상국에서 나타나며, 전세계적으로 관련된 신흥 균주를 구성하는 클래드 C 서브타입에 대한 백신 후보 항체의 개발이 매우 중요하다.
HIV 감염된 개체에서, HIV의 외피는 중화 항체에 선호적인 타겟이다. 어떤 중화 에피토프 군집은 적어도 부분적으로는 최초 분리주 및/또는 모노사이토트로픽(monocytotrophic) 분리주의 gp120 env 단백질에 노출되는 것으로 보인다. 20여년간의 수많은 연구에도 불구하고, 백신의 광범위한 중화를 도출할 수 있는 면역원은 발견되지 않았다. 이것이, HIV 감염에 대한 백신 개발이 어려운 이유이다.
본 발명은 다양한 HIV 균주와 HIV-1에 대한 예방을 위한 면역 전략(strategy)에서 중요한 요소인 펩티드에 대해 강력한 중화 활성을 가진 항체를 유도할 수 있는 펩티드를 인지하는, 공동-수용체 CCR5에 부착하는 gp120의 짧은 서열 동정에 관한 것이다. 결합 부위 펩티드 면역원을 포함하여, 이들 부착 서열에 대해 형성된 항체는, 균주(strain)에 상관없이 HIV 바이러스에 대한 예방 작용에 참여하며, 또한 치료적인, 즉 이의 수동 투여는 바이러스 수준을 감소시키고 이미 HIV에 감염된 사람에게 임상적인 효과를 제공할 것으로 예상된다.
중화 항체는 HIV-1 감염에 반응한다. 항-인간 면역결핍성 바이러스 타입에 대한 중화 항체는 최초 감염 후 몇달간 바이러스 혈증으로 처음으로 나타난다. 초기에 나타나는 중화 항체는 매우 타입 특이적이다. 중화 항체 반응은 감염된 후(16)에 확장되지만, 통상 장기간 감염된 개체를 포함하여 대부분의 환자들에서는 약하고 단발적으로 발생된다.
중화 항체는 gp120 외부 측면과 gp41 트랜스멤브레인(transmemebrane) 당단백질로 구성된 HIV-1의 외피 당단백질을 인식한다. gp120 당단백질은 타겟 CD4 와 케모카인 수용체 CCR5 및 CXCR4에 결합한다. 아주 드물게도, 항체는 gp120가 CD4와 복합체를 형성한 후에만 발현되는 gp120 에피토프에 의해 생성된다. 실제 공동-수용체 결합 부위(binding site), 즉 바람직한 백신 타겟은 gp120이 CD4에 결합한 경우에만 형성되다고 생각된다. 이들 CD4 유도된(CD4i) 항체는 gp120-sCD4 복합체의 CCR5와 CXCR4 결합을 차단한다. HIV-1에 감염된 인간에서 분리된 CD4i 항체의 수는 매우 적다.
대부분 초기의 HIV-1 백신 작업은, 중화 항체를 발생시키는 백신을 개발하는 것을 목표로 하였다. 이들 중화 항체는 이들의 작용 범위가 좁고 동물 모델에 접종된 바이러스 균주에만 대개 특이적이다. 따라서, 이들 항체는 넓은 범위의 특이성을 갖고 있지 못하여, 좋은 백신 후보물이 되지 못한다.
대부분의 성공적인 백신은 바이러스가 그 수용체와 결합하는 것을 방해한다. HIV의 수용체는 공동-수용체인 CXCR4와 CCR5(1, 2)이다. 이에, 공동-수용체의 결합 부위를 동정하기 위해 지난 20년간 집중적으로 연구하였지만 아직까지 이루지 못하였음에도 불구하고, 백신 용도로 적합한 다양한 균주에 대한 바람직하고 광범위한 중화를 형성할 수 있는 면역원을 생산할 수 있을 것으로 기대하고 있다.
본 발명의 목적은, 부분적으로는 생물학적으로 활성인 공동-수용체의 결합 부위에 대한 항체를 제공하는 것이다. 상기 항체는 시험관내(in vitro) 연구에서 gp120-sCD4 복합체의 CCR5 수용체 결합을 강력하게 저해하였으며, 적절한 펩티드 구조에 대한 항체는 광범위한 중화 항체를 유도하여, HIV-1 감염에 대한 예방 면역을 제공할 것으로, 즉, 백신으로 기대된다.
10여년간, 대부분의 HIV-1 분리주에 대하여 광범위하고 강력한 중화를 매개하는 인간 MAb는 겨우 수종만 분리되었다. 이들 MAb 중 두 개는 gp120의 표면에 결합하고(MAbs b12와 2G12)(3, 4), 하나는 gp41의 막 스패닝 도메인(membrane spanning domain)에 아주 근접하게 위치된 에피토프에 결합한다. MAb b12는 gp120의 C3-V4 영역과 탄수화물을 포함한 불연속적인 에피토프의 복합체를 인지한다. MAb 2F5는 gp41의 외부 도메인(ectodomain)의 선형 에피토프에 결합하지만, 이 에피토프는 단순하지 않고 다양한 1차 분리주(primary isolates)에 대한 시험관내 중화 활성이 입증된 6개의 잔기로 이루어진 선형 서열인 MAb2 b12, 2G12 및2F5 보다 더욱 복잡할 것으로 보인다. 지금까지 임상 실험을 거친 모든 재조합 외피에 대한 백신 후보물질들은, 심지어 광범위한 중화를 매개하는 것으로 알려진 에피토프를 포함하는 경우에도, 1차 분리주에 대해 유의한 중화 항체를 유도하진 못하였다. 펩티드계 백신 후보물질 역시 적절한 면역반응을 유도하지 못하였다.
펩티드 DAPTA(Dala1-펩티드 T-아미드, (5))에 대한 상동 서열이 다수의 HIV-1 분리주의 V2 영역내에 존재하고 있다(4,078개의 서열을 조사함). 펩티드 DAPTA에 대한 다클론성의 정제된 IgG 항체를 이용한 실험 결과를 통해, 1차 균주와 실험실에서 순응시킨 균주에 대한 유의한 중화 활성이 입증되었으며, 연결(bridging) 시트 근처에서 V2 도메인의 카르복시 말단으로부터 8개의 서열이 새로운 중화 에피토프로 기대되었다.
다클론성
펩티드
DAPTA
항혈청의 제조
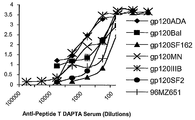
친화성으로 정제된 항체를 만들기 위해, 6마리의 토끼에, 1) 프로인트 완전 보강제(Freud complete ajduvant)에 현탁된 75㎍의 펩티드 DAPTA(1일), 2) 프로인트 불완전 보강제에 현탁된 75㎍의 펩티드 DAPTA(20일), 3) 보강제 무첨가된 150㎍ 의 DAPTA(35일)를, 연속 피하 주사하여 면역화하였다. 혈청전환을 테스트하기 위해, 1일째와 그 후 매주 토끼의 귀에서 정맥혈을 채취하였고, 정제된 펩티드 DAPTA가 코팅된 마이크로 적정 플레이트와 홀스래디시 퍼옥시다제가 접합된(conjugated) 염소 항-토끼 IgG를 이용하여, 효소-면역흡착 분석(ELISA)으로 혈청 테스트를 실시하였다. 혈청 양성반응을 보인 토끼에서 심장천공방법으로 채혈하였다. 항혈청내 존재하는 펩티드 DAPTA 항체는 정제된 펩티드 DAPTA가 커플링된 친화성 세파로스 컬럼을 이용하여 친화성 크로마토그래피로 정제하였다.
본 발명의 간단한 요약
이하, 바람직한 구현예를 요약한다. 그러나, 어떠한 방식으로도 본 발명을 제한하는 것으로 의도되지 않는다. 본 발명은 유효한 백신의 주요 성분인, 다양한 HIV 클래드에 대해 광범위한 중화 항체를 유도하는 조성물에 관한 것이다.
예로, 본 발명은 HIV gp-120에서 유래된 짧은 펩티드 서열 면역원을 동정하는 능력과 CCR5 결합 부분을 구성하는 동정된 펩티드로 제조된 다양한 치료 조성물에 관한 것이다. 펩티드는 다양한 HIV 균주의 펩티드 서열, 관련 바이러스 종의 서열, 다른 바이러스 외피의 서열, 선택된 신경 펩티드의 서열을 분석함으로써, 선택된다.
다른 예로, 본 발명은 HIV 치료제로 작용하거나 또는 인간에게 투여했을 때 활성인 항-HIV 백신 항체를 광범위하게 유도하는 면역원으로서 작용하는 조성물을 제공한다.
또다른 예로, 본 발명은 치료학적으로 유용한 제형으로 펩티드를 안정화시키고, 펩티드의 응집을 감소시키고, 펩티드의 면역성을 증강시키는 능력에 관한 것이다. 보다 상세하게는, 본 발명은 자가조합(self associating) 또는 자가응집성(self aggregating) 펩티드 또는 단백질 약물 하나 이상과, 하나 이상의 계면활성제를 포함하는 치료 조성물을 제공하며, 상기 계면활성제는 하나 이상의 알킬글리코시드 및/또는 사카라이드 알킬 에스테르를 더 포함한다.
또다른 예로, 본 발명은 알츠하이머병, 건선, 다발성 신경경화증, 사람의 염증반응 전달체계와 관련된 다른 질병 등의 질환 뿐만 아니라 열대 연축성 하반신 마비의 원인인 HTLV-1과 같은 레트로바이러스에 유효한 치료를 제공하는 약물 후보 물질일 수 있는, 펩티드 서열을 선별하는 신규한 방법에 관한 것이다.
발명의 상세한 설명
종래의 연구 결과 및 방법과는 대조적으로, 본 명세서에 개시된 결과 및 방법은 유용한 항 HIV 활성 및 다른 치료적 특성과 같은 예상하지 못한 특성을 보인다. 하기의 예에서, 전부가 아닌 일부 본 발명의 다양한 예를 예시한다.
본 발명은 공동-수용체의 결합을 차단하는 가변적이만 상동적인 서열을 가진 gp120의 V2 부분에 있는 생활성의 펜타펩티드(pentapeptide) 패밀리에 관한 것이다. 종래의 연구에서, V2 부분은 gp120의 수용체 결합 및 감염성에 주된 역할을 수행하지 않는 것으로 생각되었다. V2가 결여된 돌연변이는 감염성(6, 7)인 것으로 여겨졌다. V2 루프(loop)와는 반대로, V3 루프는 gp120의 수용체 결합성 에피토프를 포함하는 것으로 널리 제시되었다(7-9). 그러나, 여전히 그러한 상동 서열이 형성될 수 있는 부분은 gp160의 V2가 아닌 다른 부분일 수 있다.
본 발명은 CCR5에 수용체 활성을 가진 하나 이상의 펩티드를 포함하는 제형에 관한 것이다. 펩티드 T(SF-2분리주에서 유래된)와 상동한 서열은 많은 HIV-1 분리주의 V2 영역내 유사한 위치에 있다. 본 발명자들은, Entrez 데이타 베이스에서 이용가능한 4078개의 외피(gp120) V2 서열을 조사하였다. 이들 중 60%는 xTxYx 또는 xNxYx의 형태를 취하며, 23%는 xSxYx의 형태를 취하며, 나머지 17%는 서로 다른 마이너 모티프 10개에 분산되어 있으며, 발생율은 2-7%이다. 이들 다양한 외피 유래의 펜타펩티드 서열의 중요성은, 알려진 서열의 80% 이상을 차지하는 2개의 주된 모티프와 같이, 서열이 완성되기 위해 약간의 마이너 예가 있는, 수용체 활성 모티프를 특정화하는 것이다. 구조들의 집합으로부터, 치료제 또는 면역원으로서 다양한 HIV 종에 대해 광범위한 특이성을 가진 펩티드를 단독으로, 또는 혼합 형태로 제작할 수 있다.
본 발명자들이 연구한 V2 서열은 전부 그렇지는 않지만 HIV 분리주에서 많은 경우 거의 같은 위치(V2, stem 근처)에서 발견되며, T DAPTA 펩티드의 말단 5개의 아미노산과 다소 상동적이다. 펩티드는 VIP/PACAP/GHRH 펩티드 그룹과 상당한 상동성을 가지고 있다. 이들 바이러스로부터 유래된 많은 신경펩티드(표 1의 펩티드 포함)를 합성 및 테스트하였으며, 그 결고과 T DAPTA 옥타펩티드와 동등하거나, 더 강력한 생활성을 가지고 있는 것으로 입증되었다. 약리학적으로는, 펜타펩티드는 케모카인인 케모탁시스의 부분 길항제이다(10). DAPTA의 길항 효과는 gp120-sCD4의 CCR5(11) 결합성을 차단하는 능력으로 인한 것이거나, 또는 시험관내에서 gp120-유도성 신경세포의 사멸을 차단하는 능력(12)으로 인한 것이다.
도 1. DAPTA는 gp120-CD4 복합체와 CCR5 수용체의 공면역침강반응(co-immunoprecipitiation)을 방해한다.
도 2. GP120의 CCR5 결합 분석.
도 3A-B. 형광표지된 gp120(FITC-gp120)은 sCD4 존재하에 효율적으로 Cf2Th/synCCR5 세포에 결합한다.
도 4A-C. DAPTA는 gp120 외피 단백질이 CCR5에 결합하는 것을 저해한다.
도 5A-B. 항-펩티드 DAPTA의 단량성 gp120에 대한 결합성.
도 6. 항-펩티드 T DAPTA 혈청의 sp120 결합 친화성.
도 7. 항-펩티드 T DAPTA IgG의 gp120 단백질에 대한 수용성 CD4 의존적인 결합성.
도 8. 항-펩티드 T IgG 및 다클론성 혈청의 멤브레인에 고정된 바이러스 및 재조합 gp120 단백질에 대한 친화적 결합성.
GP120
유래
V2
관련 펜타펩티드의 치료제 및 백신 면역원 라이브러리의 동정
하기 표 1은 치료 펩티드와 백신 성분을 선택할 수 있는 유용한 19개의 펜타펩티드의 라이브러리를 나타낸다.
표 1
| 서열 | V2의 말단에서의 빈도 (4085 이용가능) |
| NTSYR | 1164 |
| SSEYR | 308 |
| NTSYM | 127 |
| YTSYR | 121 |
| NYSYT | 75 |
| NSEYR | 73 |
| TTSYR | 73 |
| TTSYT | 70 |
| NTSYS | 64 |
| STSYR | 63 |
| NSSYR | 50 |
| NNSYR | 41 |
| NTRYR | 38 |
| STEYR | 15 |
| TTNYT | 14 |
| NTEYR | 11 |
| NTNYR | 6 |
| NGSYR | 3 |
| NSSYT | 1 |
하기 표 2는 V2 펜타펩티드와 이의 해당 HIV 분리주를 나열한 것이다.
표 2
| SF-2 | ASTTTNYT * | BAL | NNRYR |
| SF-2 | TTNYT | ADA | NTSYR |
| IIIB | TTSYT | WMJ-1 | SSTYR |
| RFII | NTSYG | NY5 | NISYT |
| Z3 | SSTYR | Synthetic | TTNdY#T |
주: *는 펩티드 T의 서열, 말단 펜타펩티드는 굵은 글씨, #은 위치 4(12)에 D-티로신을 가지고 있는 비활성 유사체이다. V2 펩티드에 대한 HIV 분리주를 나타내며, 실제 펩티드 서열을 나타낸다. 펩티드는, 티로신(Y)가 동일 위치에 있으며, 세린(S)와 트레오닌(T)이 하나의 메틸기만 다른 구조적으로 관련있는 아미노산을 유사체로 인지하다. 약간의 변형이 알려져 있으며, 이들 세부적인 구조는 이미 논 의되었다(18, 57). 펩티드 T가 실험실에서 순응된 바이러스 SF-2(이전, ARV(13))에서 유래되었지만, CCR5에 대해 활성이 있다는 것은 흥미로운 일이다. 이는, 이들 펩티드 중 일부가 관련 CXCR4 엔트리 수용체와 일부 VIP 수용체(14, 15)에 활성을 가진다는 것을 의미한다. 약간의 변형은 생체 내에서 이루어지는 작용인 수용체의 이용성을 확장시키며, CXCR4 엔트리 수용체를 또한 이용하는 HIV 진행 과정에서 후기에 듀얼 트로픽(dual-tropic)이라고 불리우는 바이러스 분리주가 출현한다.
뇌 바이러스 분리주는 CD4와 CCR5를 낮은 수준 발현하는 뇌의 미세아교세포(microglia)와 대식세포에서의 증식을 위해 적응된, 별개의 외피 단백질 표현형을 이루는 것으로 보인다(16). 뇌 바이러스 분리주로부터 유래된 외피 단백질 펜타펩티드는, CD5 또는 공동-수용체를 적게 발현하도록 적응된, 뇌를 감염시키는 것과 같은, HIV 종을 차단하는데 있어, 특이적인 치료적 편이를 제공할 수 있다. CD4 및/또는 CCR5의 발혀 수준이 낮은 세포에 감염하는 능력은 T 세포와 대식세포 둘 다에 대한 폭넓은 감수성을 제공할 것이며, 따라서 뇌에 적응된 균주로부터 유래된 펜타펩티드를 사용하여, 뇌의 대식세포 또는 미세아교세포에한 국한되지 않고 다양한 조직 및 세포에서 적은 수의 수용체에 적응된 HIV 군주의 감염을 억제할 수 있으며, 또는 백신이나 치료 항체 제조를 위한 면역원을 만들 수 있다. 적은 수의 수용체에 적응된 바이러스 분리주의 억제는, HIV 치료제 개발에서 차기 프론티어일 것임에 틀림없으며, 높은 활성을 가지는 리간드가 가장 효과적일 것이다. 천연의 바이러스로부터 만들어진 서열을 스크리닝함으로써, 생물학적 적정성과 실질적인 유용성을 최적화할 것이다. 치료 펩티드 후보체들을 수용체 효능에 대해 쉽게 테 스트할 수 있으며, 대부분의 매우 활성이 높은 펜타펩티드를 안정성 및 생체이용성을 위해 추가적인 변형을 만듬으로써 약물 후보체로 만들 수 있다.
뇌에서
동정된
V2
수용체-활성 펩티드 치료제와 면역원, 및 선택된
신경펩티드에서
동정된 백신 펜타펩티드
예시적인 서열은 (16)에 기재된 5종의 뇌 분리주에서 동정되었으며, 이는 하기 표에 나타낸다.
표 3
| 뇌 V2 서열 |
| TSNYS |
| NSNYS |
| TTSYR |
| NTSYR |
| TISYR |
gp120의 V2 부분내 펜타펩티드 뿐만 아니라, 상기 펩티드 모티프가 gp120의 다른 부분, gp41(막 경계에 존재)와 VIP/PACAP/GHRH(17)과 관련된 신경 펩티드에도 존재하는 것으로 확인되었다.
표 4
| 신경펩티드 서열 | 신경펩티드 |
| TDNYT | VIP (7-11), 인간, 랫 |
| TDTYT | VIP(7-11), 닭 |
| TDSYR | GHRH (7-11), 인간 |
따라서, V2 관련 펩티드는 생물학적으로 활성인 것으로 입증되었고, 가장 간단한 설명은 이들이 특이적인 케모카인 수용체에서 약리학적으로 활성이라는 것이다.
HIV 외피 단백질
GP41
에서
동정된
V2
관련 펜타펩티드
하기 표는 치료제 또는 백신 면역원으로 사용될 수 있는 gp41 HIV 서열을 나타낸 것이다.
표 5
| 서열 | 빈도 | 비율 (702건 중에서) |
| IDNYT | 202 | 28.8% |
| ISNYT | 192 | 27.4% |
| INNYT | 155 | 22.1% |
| ISNYS | 27 | 3.8% |
| IENYT | 19 | 2.7% |
| VSNYT | 15 | 2.1% |
| ITNYT | 9 | 1.3% |
| IGNYT | 7 | 1% |
| VNNYT | 5 | 0.7% |
| IDKYT | 5 | 0.7% |
| IHNYT | 4 | 0.6% |
| IDSYT | 4 | 0.6% |
| ISKYT | 3 | 0.4% |
| ISTYT | 3 | 0.4% |
| SIIYE | 3 | 0.4% |
| IGKYT | 2 | 0.3% |
| ISNYK | 2 | 0.3% |
| VSNYS | 2 | 0.3% |
| IANYT | 2 | 0.3% |
| NQIYE | 2 | 0.3% |
| ISQYS | 1 | 0.1% |
| IDDYT | 1 | 0.1% |
| ISSYT | 1 | 0.1% |
| ISDYT | 1 | 0.1% |
| VIYYT | 1 | 0.1% |
| IYNYT | 1 | 0.1% |
| INNYS | 1 | 0.1% |
| IRQYT | 1 | 0.1% |
| VRNYT | 1 | 0.1% |
| INNYI | 1 | 0.1% |
| STIYR | 1 | 0.1% |
| EYIYT | 1 | 0.1% |
| DTIYR | 1 | 0.1% |
| ATIYD | 1 | 0.1% |
| GTIYQ | 1 | 0.1% |
| HTKYI | 1 | 0.1% |
본 발명자들은 Entrez 데이타베이스에서 702개의 gp41 서열을 조사하였다. 보고된 펜타펩티드 서열 모두, 이들 펩티드 유사체들의 공유된 결합 기능에 부합되는, gp41의 거의 126 위치와 동일한 위치에 위치한다. 본 발명은 농도가 높거나 낮은 하나 이상의 펩티드 또는 단백질을 포함하는 제형을 기술한다.
CCR5
에 결합하여
HIV
GP120
의
CCR5
결합성을 차단하는, 다양한
V2
관련 펜타펩티드의 동정
상기의 방법, 상세하게는 (11)의 방법을 이용하여, 경쟁적인 소형 gp120 펩티드를 첨가하거나 첨가하지 않은 상태에서 gp120/CD4 복합체의 ChfTh-CCR5 발현 세포에 대한 결합성에 대해, 본 발명자들은, V2 유래의 DAPTA에 대한 상동 펩티드 역시 CCR5에 대한 gp120 결합을 차단하는 강력한 능력을 가진다는 일반적인 사례를 보여준다. 특이성의 표지로 구조-기능 활성은, TTNYT 펩티드에서 아미노산 L 형이 D 형으로 교체됨으로써 효과가 급격히 감소하고, 펩티드 INNYT에서 N을 D로 교체하므로써 형성된 IDNYT은 활성이 약한 것으로, 나타났다. 놀랍게도, TTNYT 펩티드의 아미노산 모두가 D형인 형태가 실질적인 활성을 유지하고 있었으며, 이는, 이들 펜타펩티드의 아미노산이 모두 D형인 형태가 유용하며, 이들의 펩티다아제에 의한 분해에 대해 안정적일 것이라는 예상으로 인해 바람직할 수 있다.
표 6
| 펩티드 | GP120 / sCD4 의 CCR5 에 대한 결합 저해 EC 50 ( nM ) |
| TTNYT | .1nM |
| TTN(dY)T | >1000 nM |
| 모두l D, ttnyt | 2 nM |
| NTSYR | .1 |
| TTSYT | .05 |
| TSNYS | .2 |
| SSTYR | .1 |
| NNRYR | .2 |
| NSNYS | .5 |
| NSSYT | .2 |
| NSSYR | .04 |
| NSEYR | .08 |
| SSEYR | .3 |
| TTSYR | .1 |
| TISYR | .4 |
| YSSYR | .6 |
| INNYT | .06 |
| IDNYT | 1 |
펩티드 T
DAPTA
는
Gp120
-
SCD4
복합체의
CCR5
수용체에 대한 결합을 방지한다.
도 1에 나타낸 바와 같이, DAPTA는 gp120-CD4 복합체와 CCR5 수용체와의 공면역침강을 방지한다. 패널 A에서 설명된 연구에서는, hCCR5 수용체를 발현하는 Cf2Th/synR5 세포가 사용되었다. 가용화된 CCR5 수용체는 항-태그(anti-tag) 항체 ID4로 면역침강시켜, 단백질 A/G 아가로스상에 포획한 다음, DAPTA의 존재 또는 부재하에 gp120 Bal-sCD4 복합체와 함께 배양하였다. 면역침강된 gp120은 인간 HIVIg로 웨스턴 블롯팅함으로써 검출하였다. 동일 멤브레인을 취하여 CCR5(NT) 수용체(하단 패널 A)에 대한 토끼 다클론 항혈청으로 혼성화하였다. 패널 B는 Cf2Th 모 흉선 세포주의 세포 용해물이다. 면역침강된 gp120 단백질은 발견되지 않았다. 패널 C는 HOS CD4를 나타낸다. CCR5 세포는 gp120CM235 단백질과 배양하기 전에 DAPTA를 처리하였다. 약 2x1.107의 CCR5가 결합된 막을 CCR5에 대한 MAb와 함께 면역침강하였다. 공 면역침강된 gp120 단백질과 멤브레인에 부착된 CD4 수용체는 웨스턴 블롯팅으로 검출하였다.
DAPTA
는
GP120
의
CD4
의존적인
CCR5
결합을 차단한다.
도 2에 나타낸 바와 같이, 본 발명의 발명자들은 MIP1- 또는 CCR5 "차단성" 항체와 같은, 공지된 CCR5 리간드에 의한 저해에 민감한, CCR5 발현 세포에 대한 gp120/sCD4 복합체의 결합 분석을 수행하였다. 항-바이러스 분석은 원용에 의해 본 발명에 포함되는 종래 문헌(Ruff et al., 2001, Antiviral Res, 52, 63-75)에서 구체적으로 다루어졌으며, 본원에서 설명될 것이다.
본 발명자들은, 형광 단백질 표지 키트(Roche Diagnositics GmBh)를 이용하여 수용성 gp120 단백질(25ug/ml)로부터 새로운 FITC 표지된 추적자를 만들었다. 결합 분석은 50mM HEPES(Gibco), pH=7.4, 5mM MgCl2, 1mM CaCl2·6H2O(Sigma), 5% BSA(Sigma) 및 0.1% NaN3가 포함된 최종 부피 100ul의 결합 완충액 중에서 수행하였다. 결합은 여러가지 CCR5 발현 세포주를 이용하여 96웰 필터 플레이트(Millipore)에서 37℃에서 1시간 동안 수행하였다. 부착되지 않은 표지 단백질은 급속 진공 필터로 제거하고, 96웰 플레이트 매니폴드를 이용하여 세척하였다. 필터는 형광 플레이트 리더(Hewlett Packard)로 496/530nm에서 카운트하였다. 비특이적 결합은 sCD4가 없는 상태에서 결정하였고, 100nM sCD4 존재하에서 gp120-FITC 결합에서 제하였다(총 결합성).
형광
표지된
gp120
(
FITC
-
gp120
)은
sCD4
가 존재하는 경우에만 효과적으로 Cf2Th/synCCR5 세포에 결합한다.
결합은 분석에서 sCD4가 없을 때에는 거의 검출되지 않았다. FITC-gp120의 최대 결합성은 100nM sCD4의 존재하에 수득되었고, 그 후에도 사용하였다.
도 3에 나타낸 바와 같이, gp120(Bal과 CM235) 결합 특이성은 비표지된 HIV-1Bal, 또는 CCR5의 리간드로 알려진 MIP-1와의 경쟁에 의해 입증되었다(도 2, 상단). 표지된 FITC-gp120Bal(0.5nM)의 결합은 동일 몰수(0.5nM)가 존재할 경우에 80% 이상으로 저해되었으며, 또는 비-표지된 HIV-1Bal의 20배 과량(10nM)에서 백그라운드 수준으로 감소되었다. 이전에 설명한 것처럼(23-25), gp120 단백질 Bal과 CM235 둘다의 결합은 CCR5 특이적인 리간드인 (MIP-1 (10nM)로 저해되었다. gp120 결합을 차단(26)시키는 CCR5에 대한 2D7 항체와 함께 개의 흉선세포 배양에 의해, FITC-gp120CM235의 결합도 저해되었다(도 1). FITC-gp120 단백질은 100nM sCD4의 존재하에, CCR5 음성인 개의 흉선 Cf2Th 모세포에 감지가능한 수준으로 결합되지 않았다. 이 연구로, gp120-FITC의 CD4 의존적인 CCR5 수용체 결합이 확인된다(26-30).
CCR5 결합성 gp120 단백질 2개(Bal, CM235) 각각의 포화 결합 조건(도 3)을, Ch2Th/synR5 세포에 FITC-표지된 gp120 양을 증가시켜(0.25에서 2.5nM) 추가하여 연구하였다(도 2, 오른쪽). 비특이적 결합은 sCD4 부재하에 결정하였고, 100nM sCD4 존재하에서의 결합으로부터 제하였다. gp120Bal의 포화적인 고친화성 결합은 Kd 0.46 +.17nM(P<.05)이고, gp120CM235I의 Kd는 0.77 + .35nM(P<.05)이며, 이러한 결과는 다른 연구 결과와 일치된다(27, 31, 31, 32).
DAPTA
는
gp120
외피 단백질의
CCR5
결합을 저해한다.
gp120의 CCR5 수용체 결합에 대한 펩티드 저해제의 효능을 규명하기 위해, 고정된 농도의 sCD4/gp120 복합체를 이용하여 CCR5에 선택적이 케모카인 리간드 MIP-1 및와 DAPTA의 농도를 증가시키는 조건하에서, 수행하였다. 이러한 연구는 도 4에 나타내었다. 총 특이 결합은 sCD4(100nM)의 첨가 또는 무첨가 조건에서의 FITIC-gp120의 결합 차이로 정하였다.
gp120BaL/sCD4의 CCR5(Cf2Th/synR5) 세포 결합은 MIP-1( IC50 = 1.5 + .002nM, P<.05)와 DAPTA(IC50 = 55 + 0.08pM, P<.05)에 의해 완전하게 저해되었다(도 3A). DAPTA에 대한 힐 슬로프는 -1.07이었고, 이는 한 부위 경쟁적인 결합모델(one-site competitive binding model)과 일치된다. 이와 유사하게, 동일 세포에 대한 gp120CMCM235/sCD4의 결합 저해를 연구하였고, 그 결과 MIP-1 (IC50 = 1.8 + 0.006nM, P<.05)과 DAPTA(IC50 = 0.32 + .03nM, P<.05)에 의해 특이 결합이 실질적으로(>80%) 저해된 것으로 확인되었다(도 3B). 또한, 다른 세포, 즉 CD4-발현 세포주(GHOST CD4.CCR5)에 대한 gp120Cm235/sCD4의 결합 역시 MIP-1 (IC50 = .43 + 0.07nM, P<.05)와 DAPTA(IC50 = 51 + 0.09nM, P<.05)에 의해 저해되는 것으로 확인되었다(도 3C). 패널 A-C의 데이타는, 세번의 실험으로 결정된 수치의 평균 + SEM 값이다. 분석은 PRISM에 의해 수행하였다.
이들 임상 및 기초 연구 결과의 관련성은 gp120의 펩티드 T 부분이 케모카인 공동-수용체 CCR5(11)에 결합하는 에피토프로서의 동정을 입증한다는 것이다. 거 의 25년의 노력하였으나, CCR5의 임상적으로 유효한 짧은 펩티드 수용체 경쟁자를 밝혀내지 못하였다. 예를 들면, 전체 gp120 분자를 스패닝(spanning)하는 20 mer 두 세트를 준비하여, 항바이러스 활성을 테스트하였다(두번째 세트는 첫번째와 비교하여 10 개의 위치가 이동되었음). 이들 샘플들 모두 어떠한 항-바이러스 활성을 나타내지 않았다. 또한, 10년 동안, $30B 연방차원/개인 차원의 효과적인 HIV 백신을 동정하려는 노력의 완전한 실패는 NIH의 백신 연구센터의 임상적 연구 소장인 Barney Graham 박사의 "효과적인 HIV 백신이 가능한가"(Feb 15, 2006, Bethesda, MD)라는 제목의 발표에서, 광범위하게 중화 항-HIV 항체를 만들 수 있는 능력을 끌어내고자 하는 연구에 대한 비자명성(non-obviousness)을 표명하였다. 사실, 과거와 현재의 백신을 만들고자하는 모든 시도의 실패 근간이 되는 그러한 항체를 유도하는 것은 불가능하다.
CCR5 수용체에 결합하는 HIV 외피 gp120 펩티드는 수용체에 바이러스가 결합하는 것을 저해하는 면역원으로 사용될 수 있다. 거의 모든 성공적인 항체 백신은 바이러스의 수용체 결합 또는 부착(attachment)을 저해함으로써 작용한다.
최근 몇 년동안, 제형화된 펩티드의 특성과 상세한 구조 연구(MacPhee, 미공개)에 대한 분석을 통해, DAPTA가 수용액에서 매우 빠르게 용해되자마자 응고되어 생체이용성과 항-바이러스 활성을 잃게 되는 경향성이 매우 강한 것으로 밝혀졌다. 이러한 DAPTA의 특성은 가끔 차선의 임상 결과(33)와 위음성의 시험관내 결과를 유도한다. 예를 들면, 펩티드 T 용액이 걸죽해져서 "겔"이 되면, 점막, 예를 들면, 코 상피세포를 통해 이동되는 활성 및/또는 능력을 잠재적으로 잃어 버린다 는 것을 고려하여야하는 것으로 보고되었다. 제형에서 소듐 클로라이드를 제거하고, ml 당 5 mg까지 농도를 낮추며 문제가 해결되는 것으로 나타났다. 그러나, 심지어 1mg/mL에서, 실온에서의 분광 편광(spectropolarimetric) 분석으로, 더욱 희석된 0.1mg/ml에서 205.4nm에서 큰 피크가 나타나던 것이 237.2nm로 이동된 것을 나타났으며, 이것은 펩티드 T가 고농도에서 스스로 상호작용하여 응집과정을 거쳐 겔화 되어버린다는 것을 의미한다. 펩티드 T가 소섬유(fibril)를 형성하는 것을 전자현미경으로 확인하였고, 펩티드 T가 지금까지 알려진 어떤 다른 작은 펩티드보다 소섬유를 형성하기 쉽다.
소섬유
형성 결정
펩티드 T 또는 그 유사체의 소섬유 형성은 전자현미경을 이용하여 측정할 수 있다. 2 ul의 DAPTA 수용액을 폼바/탄소로 코팅된 니켈 EM 그리드에 가하였다. 그리드를 10 ul의 증류수로 3회 세척하였고, 2% 유라닐 아세테이트 10 ul로 염색하였다. 샘플은 LaB6 필라멘트(120kv)의 FEITEM Tecnai 현미경으로 관찰하였고, MEgaview IICCD 카메라로 이미지화하였다.
펩티드 T 또는 그 유사체의 소섬유 형성은 염료 결합으로 측정할 수도 있다. 콩고 레드를 PBS(5 mM 포타슘포스페이트, 150 mM NaCl, pH7.4)에 용해시켜, 7 ug/ml의 농도로 맞추었다. 이 용액을 4 ℃로 냉각시키고, DAPTA를 10 mg/ml 스탁 수용액으로 첨가하여, 염색 용액내 펩티드의 최종 농도를 0.48 mg/ml로 맞추었다. 분말을 용해시킨 직전의 펩티드 용액을, 응집되 펩티드가 함유된 만든 후 시간이 경과된 스탁 용액과 비교하였다. 스펙트럼은 4 ℃에서 400-700 nm에서 확인하였 다.
펩티드 T 또는 그 유사체의 소섬유소 형성은 원편광 이색성 분광 분석(CD spectroscopy)으로도 측정할 수 있다. 신선하게 준비한 펩티드 또는 소섬유 응집이 함유된 10 mg/ml의 수용액을 증류수에 최종 농도 50 ug/ml로 4 ℃에서 첨가하였다. CD 스펙트럼은 Jasco 모델 J-810 스펙트로미터로 0.1 cm 패스 길이의 석영 큐빗을 사용, 190-250 nm에서, 1분 간격, 2초의 반응시간으로 측정하였다.
펩티드 T 또는 그 유사체의 소섬유소 형성를 측정하는 또다른 방법은 Fourier 변환 적외선 스펙트로스코피(Transform Infrared(FTIR) spectroscopy)를 이용하여 수행된다. DAPTA를 10 mg/ml의 농도가 되게 중수소화된 물에 용해시키고, 섬유질 형성을 촉진시키는 온도 및 시간 조건하에서 배양하였다. 25 ul의 샘플을 6 um 간격으로 떨어져 있는 NaCl 윈도우가 있는 미리 냉각시킨 트랜스미션 셀에 위치시켰다. FTIR 스펙트럼을 DTGS 검출기를 이용하여 트랜스미션 모드에서 BioRad FTS-175C Frourier 변환 분광기에서 측정하였다. 2506 인터페로그램은 2 cm-1 분석능으로 기록하였다. 수증기를 제거하였고, 스펙트럼 베이스라인을 수정하였다.
면역원의 특성
항-펩티드
DAPTA
항체의
단량성
Gp120
결합
도 5는 항-펩티드 DAPTA 항체의 단량체 gp120에 대한 결합성을 나타낸 것이다. 패널 A에서, IIIB gp120(●); gp120 ADA( ) 및 gp120 Bal(▲)은 직접 마이크 로플레이트에 코팅(코팅된 ELISA)되었다. 25배 연속 희석한 항-펩티드 DAPTA를 웰에 첨가하였다. 결합된 항체는 항-토끼 IgG-HPR-당나귀(KP&L) 1:1000으로 검출하였고, 450 nm에서 광학 밀도를 측정하였다. 백그라운드는 정상적인 토끼 혈청 대조군으로 측정하였다. 테스트한 gp120 단백질 3가지 모두가 1/2 최대(half-maximal) 결합에 도달하는데 필요한 V2 항체의 농도는 8-25 ng/ml였다. 데이타는 대표적인 실험의 결과이며, 각 기준점(datum point)은 세번의 실험에서 나온 결과의 평균값이다. 패널 B는 sCD4가 있는 경우(■)와 없는 경우(◇)에 항-펩티드 DAPTA와의 gp120 IIIB 반응성을 나타낸다. 항체는 sCD4가 있는 경우에 높은 친화력으로 결합한다. 결과는 2번 반복한 실험으로부터 구하였다. 각 기준점은 세번 실험 결과의 평균값이다.
항-펩티드 T
DAPTA
항체의
가용화된
gp120
에 대한 결합성
항-펩티드 T DAPTA 항체 및 정제된 IgG 분자의 실험실에서 순응시킨 다양한 바이러스 균주로부터 유래된 gp120 재조합 단백질에 대한 친화성을, ELISA 분석으로 측정하였다. 다클론성 항-펩티드 T DAPTA혈청은 가용화된 gp120 단백질, gp120ADA 및 gp120IIIB에 고친화력으로 결합하며, SF162 gp120에는 가장 낮은 친화력으로 결합하였다. 이를 도 6에 나타낸다. 포착된 ELISA 결과는 우수한 중화 활성과의 관련성을 보이며, 본원에서 개발한 단순한 ELISA 테스트로 백신 후보 항체를 분별할 수 있음을 시사한다.
GP120(1 ug/ml)을 마이크로플레이트에서 다클론성 고트 항-HIV-1SF gp120 혈청에 의해 포착하였다(포착 ELISA). 연속 3번 희석한 항-펩티드T DAPTA 혈청을 열 로 불활성화시켜, 웰에 첨가하였다. 결합된 항체는 당나귀 항-토끼IgG-HRP로 검출하였고, 450 nm에서 광학 밀도를 측정하였다. 백그라운드를 결합된 펩티드 T DAPTA에 대한 면역전 토끼 혈청에 의해 측정하여, 제하였다. 데이타 라인들은 3세트로 수행한 두 실험의 결과이다.
항-펩티드 T
DAPTA
항체의
가용화된
gp120
에 대한 결합은
CD4
의존적이다.
수용성 Cd4(sCD4) 첨가 및 무첨가한 상태에서의 정제된 항-부착 부위 IgG의 gp120에 대한 친화적 결합력을, 친화성 ELISA에 사용된 펩티드 T로부터 정제된 전체 항-펩티드 T DAPTA 토끼 항혈청의 면역글로불린 분획을 이용하여 연구하였다.
이를 도 7에 나타낸다. 수용성 gp120 단백질을 항-HIV-1SF2 혈청이나 sCD4(1ug/ml)가 코팅된 마이크로플레이트 웰에 포착하였다. 3배수로 연속 희석한 항-펩티드 T DAPTA IgG를 각 희석 농도마다 3세트로 첨가하였다. 결합된 항-펩티드 T DAPTA IgG는, 2%의 정상 염소 혈청이 첨가된 차단 완충액중에서 HPR-당나귀 항 토끼 IgG로 검출하였다. 이 결과는 3세트로 수행한 2가지 실험의 평균값이다. 오차 막대(error bar)는 SD, p<0.05이다.
CD4에 결합되었을 때 주로 gp120을 인식하는 항체들이 특히 관심사이며, 백신으로 적당하다. CD4 유도성 항체 (CD4i)로 불리우는 항체는 CCR5와 CXCR4가 gp120-CD4 복합체(34-36)에 결합하는 것을 저해하며, gp120의 공동-수용체 결합을 허용하는 구조에 대해 인가된 것으로 파악되고 있다. 그러나, 인간으로부터 분리된 예시적인 CD4i 항체들은 제한적이며, 프로토타입(prototype)은 HIV-1 일차 분리주에 대해 약한 중화 활성만을 나타낸다. 이들 항체들 중 아주 드문 경우에는 CD4i 에피토프에 대한 상대적인 접근불능성이 원인이 된다(6, 37, 38).
gp120의 CD4 유도성(CD4i) 부위를 발견하는 항체의 수는 매우 제한적이다. gp120의 CD4로 촉발된 구조를 인식하는 Ab는 공동-수용체 결합 에피토프에 대한 것인 듯하다. 항-펩티드 T 항체는 우선적으로 CD4 유도성 에피토프를 인식하는 것으로 입증되어, 공동-수용체 결합부 또는 그 근처에 결합하는 것으로 추정된다.
항-부착 부위
Ab
는
GP120
/
sCD4
의
CCR5
엔트리 공동-수용체 결합을 차단한다.
항-펩티드 T DAPTA 항혈청과 정제된 항-펩티드 T DAPTA IgG의 gp120에 대한 친화력을 웨스턴 블롯으로 더욱 연구하였다. 2개의 HIV-1 바이러스 균주, JR-CSF와 SF162의 바이러스 입자를 농축시키고, NP40 존재하에 라이시스한 다음 바이러스 단백질을 4-12%의 폴리아크릴아미드 겔에서 전기영동으로 분리하였다. 슬롯 당 라이세이트 1, 2 및 3 ng에서 측정된 p24 항원에 따라, 3가지 농도를 사용하였다. 바이러스 단백질을 NEM PVDF 막에 옮기고, 정제된 항-펩티드 T DAPTA IgG(1:200)로 혼성화하였다. 항체는 농도 의존적으로 바이러스 gp120 단백질을 인지하였다.
이는 도 8에 예시되어 있다. 패널 A에서, 바이러스 입자를 농축하여, 4-12 SDS PAGE에서 분리하였다. ELISA로 측정한 1, 2, 3 ng의 p24 단백질이 첨가된 바이러스 라이세이트를 로딩하였다. 막을 펩티드 T DAPTA IgG(1:200)에 대한 친화성으로 정제한 항-펩티드 T DAPTA로 혼성화하고, HRP 당나귀 항 토끼 IgG(1:2000)으로 염색하였다. 필름을 ECL 용액(Amersham)으로 현상하였다. 실험은 두번 반복하였다. 패널 B에서, IIIB HIV-1 바이러스 균주의 전체 라이세이트와 2 ug/ml의 농도의 수용성 gp120 IIIB 재조합 단백질을 10% SDS PAGE에서 전기영동하여 분리한 다음, 이동시켰다. 막은, 펩티드 T DAPTA 10 uM 존재하에, 항-펩티드 T DAPTA 다클론성 혈청(#195), 프리-블리드(pre-bleed) 혈청 및 항-펩티드 T DAPTA 혈청과 함께 인큐베이션하였다. HIV-1 gp120 IIIB 외피 단백질에 대한 항-펩티드 T DAPTA 항체의 특이성이 입증되었다. 펩티드 T DAPTA는 항-펩티드 T DAPTA의 gp120 단백질 결합을 차단시킨다(도 8A).
V2
펩티드 베이스 항체 항-펩티드
DAPTA
의 중화 특성
HIV-1의 중화를 HELA CD4+ CXCR4/CCR5+ 세포(P7)의 합포체(syncytia) 카운트 분석으로 평가하였다. 블루 포커스 유닛(BFU/well)은 현미경하에서 카운트하였다. 하기 표 7에 요약된 데이타는 0.125 ug/well로 고정된 항체를 이용하여 수득하였다. 또한, 정제된 IgG의 중화 활성 역가를 적정(titration)하였다. IgG 단편의 적정 곡선은, 낮은 친화력의 펩티드 DAPTA에 대한 다클론성 항혈청과 유사한 적정 곡선을 보였다(데이타 미기재). 감염 저해율은 세번 실험하여 산출한 평균값이며, 식: "저해율%: 100 -[(Ab 첨가시의 BFU: Ab 무첨가시의 BFU) x 100]"으로 계산하였다.
표 7. 1차 균주와 실험실에서 순응시킨 HIV-1바이러스 균주에 대해 테스트한 항-펩티드 T DAPTA의 중화 활성
| 균주 | 서브타입 | 표현형 | 저해율%(0.125ug/ml Abs) |
| 92HT593 | B | X4/R5(SI) | 33.3 |
| 92US077 | B | X4/R5(SI) | 15.3 |
| 92US727 | B | R5(NSI) | 0 |
| 93BR019 | B/F | R5/X4 | 96.6 |
| 93IN101 | C | R5(NSI) | 95.9 |
| Bal | B | 5(NSI) | 84.6 |
| JR-FL | B | R5(NSI) | 44.7 |
| ADA | B | R5(NSI) | 51.3 |
| IIIB | B | X4(SI) | 35.7 |
| MN | X4(SI) | 69.3 | |
| RF | B | X4/R5(SI) | 11.8 |
| pNL4.3 | B | X4(SI) | 0.9 |
흔히 연구되는 클래드 B 분리주에서 펩티드 T/DAPTA에 대한 항체의 효과(50%의 저해율[IC50]을 달성하기 위해 필요한 농도)를 비교하기 위하여, 공동-수용체 특이성을 가진 것으로 밝혀진 세포주(HELA CD4-β갈락토시다아제와 HELA CD4.CCR5)를 이용한 포커스 형성 분석에서 바이러스 감염 1-라운드를 수행하였다(39)(표 1).
상기 실험에서, 감염 분석을 다음과 같이 수행하였다. CD4를 높은 수준으로 발현하며 잘려진 인간 면역결핍 바이러스 타입 1(HIV-1)의 긴 말단 반복부(LTR)의 통제하에 있는 베타 갈락토시다제 유전자의 삽입된(integrated) 1 카피를 포함하는, HeLa 세포주(MAGI)를 사용하였고, CCR5 유전자를 가지는 이 세포주(MAGI-CCR5){Pirounaki et al., 2000}는 NIAID AIDS 저장소에서 구하였다. 펩티드 T의 케모카인 수용체 서브타입 민감성을 결정하기 위하여, MAGI와 MAGI-CCR5를 하기와 같이 사용하여, 이전의 프로토콜을 사용하였다(40-43). 간단하게 설명하면, MAGI 또는 MAGI-CCR5 세포를 10,000 세포/웰로 96웰 플레이트에 접종하였다. 1일 후, 배지를 제거하고 펩티드 T나 MIP-1 용액을 20 ug/ml DEAE-덱스트린과 함께 Opti-MEM 배지(Gibco BRL, Life Technologies)에 첨가하였다. 플레이트는 37℃, 5% CO2에서 60분간 인큐베이션하고, 바이러스 희석물을 첨가하여, 1.5시간 더 인큐베이션하였다. 바이러스 접종원을 제거하고, 웰을 0.2 mL의 Opti-MEM 배지로 두번 세척하였고, 새로운 배지(150 ul/well DMEM)를 첨가하였다. 46시간 더 배양한 후, 세포들을 1%의 포름알데히드, 0.2%의 글루타르알데히드가 포함된 PBS에서 5분간 실온에서 고정하고, PBS로 두번 세척한 다음, 4 mM 포타슘 페로시아나이드, 2 mM MgCl, 0.4 mg/ml의 5-브로모-4-클로로-3-인돌로일l- -D-갈락토피라노시드(X-gal stain, Inalco Pharmaceuticals, St. Luis Obispo, CA)를 PBS에서 37℃ 및 5% CO2에서 50분간 염색하였고, PBS로 두 번 세척하였다. 블루 포커스는 현미경으로 카운팅하고, 감염 수준은 블루 포커스 유닛으로 기록하였다(BFU/well). BFU/well의 백그라운드는 모든 분석에서 < 3이었다.
비가공 항혈청과 면역전 대조군 혈청을 개시된 감염 분석으로 CCR5 균주인 SF162와 JR-CSF에 대한 감염성 저해에 대해 테스트하였다. 면역 혈청에서의 중화 역가(IC50) 범위는 1:20 - 1:40 희석 범위였지만, 면역전 혈청에서의 비특이적 중화는 미미하였다(미기재).
특이성 및 효능을 증가시키기 위해, 펩티드 T/DAPTA 컬럼을 이용한 추가적인 연구를 위해 친화성으로 정제한 혈청을 준비하였다. CCR5 균주인 SF162와 JR-CSF에 대한 친화성으로 정제된 항체의 중화 역가는, SF162 바이러스 균주는 0.25-125 ug/ml이고, JR-CSF 바이러스 균주는 0.125 - 0.66 ug/ml이었다(미기재). 정제된 IgG 분획의 중화 활성 역가에 대한 역가 곡선은, SF162 백신 균주에 대해 친화성이 낮은 gp120 공동-수용체 부착 부위에 대한 다클론성 항체와 유사하였다.
프리-블리드(pre-bleed) 혈청은 동일한 분석방법으로 테스트하였다. 1:20 희석된 항체 샘플에서 백그라운드 저해는 2-4%의 범위로 나타났다. gp120 공동-수용체 부착 부위 친화성으로 정제된 Ig의 활성은 여러가지 클래드에서 대표성과 다양성을 위해 선택된 HIV 분리주의 대규모 샘플에서 이후 평가하였다.
정상 토끼 혈청(Laboratory of Antiviral Drug Mechanisms, Science Applications International Corporation at Frederick National Cancer Institute-Frederick Cancer Research and Development Center)에서 수득된 컷 오프 값(cut off value)은 95% 신뢰수준에서 19%이며, 1:5로 희석하여 실험하였다. 표 X에서 나타낸 결과는 각각 바이러스 균주를 3세트로 실험한 2번의 독립된 실험 결과이다.
gp120 공동-수용체 부착 부위에 대한 친화성으로 정제된 면역글로불린은, 두개의 일차 분리주인 Clade B/F의 93BR019와 93IN101 Clade C 바이러스 균주에 대해 매우 높은 중화 활성을 보였으며, 이들 균주 이외의 균주들에 대해서는 유의한 중화 활성을 나타내었다. X4 바이러스 분리주에 대한 활성을 예상하지 못하였으며, 이는 이들 펩티드가 R5, X4 및 두가지 속성의 HIV 균주에 대한 면역원이나 치료제 제조에 유용할 수 있음을 의미한다.
친화성으로 정제한 순수 항-펩티드 T에 의한
HIV
의 중화
HIV-1 클래드 C 분리주에 대한 IC50 0.045 ug/ml의 항-부착 부위 IgG의 중화 활성을, 듀크대학의 AIDS 백신 연구소(David Montefiori, personal communication)에서 1-라운드 루시퍼라제 리포터 유전자 분석으로 확인하였다. 데이타는 표 8에서 나타낸다.
표 8
| 바이러스 | SF162 . LS | SS1196 .1 | 6101.10 | 6535.3 | Du123 .6 | Du156 .12 |
| 클래드 | B | B | B | B | C | C |
| (친화성 순수한 Ig) | >0.125 ug/ml | 0.08 ug/ml | 0.05 ug/ml | 0.06 ug/ml | 0.04 ug/ml | 0.05 ug/ml |
수치는, 상대적인 발광 단위(relative luminescence unit, RLU)가 TZM-bl 세포에서의 바이러스 대조군 웰(테스트 샘플 무첨가)에 비하여 50% 감소되었을때의 혈청 희석 값이다. 활성을 보인 샘플은 굵은 글씨로 나타내었다.
반복 서열
유용한 펜타펩티드 서열은 그의 반복된 모티프로 확인할 수도 있는데, 반복되는 모티프는 1 내지 수 백개의 아미노산에 의해 떨어져 있거나, 즉 V2 에서가 아닌 외피 단백질의 임의 다른 부위에, 또는 떨어져 있지 않은 선형 배열로 2-5번 발생된다. 이들 펩티드의 바람직하지 않은 응집성은 외피내 "스태플 같은(staple-like)" 유착 부위로서 제공되는 이들 펜타펩티드 서열을 이용하여 바이러스의 3차 외피 구조를 구축하는데 유용하다. 모든 경우에서, 임의 해당 바이러스내에서의 펜타펩티드 서열 반복은 정해진 것은 아니지만, 또다른 유용한 서열을 지시할 수 있다. 예를 들면, EYIYT 서열은 5번 반복된다. 이러한 반복은 컨센서 스(concensus)에 근접하여 하류에 있진 않다. 그러나, 반복되기 때문에 활성 화합물의 라이브러리에 추가된다.
CCR5
수용체 활성 존재
유용한 후보물질은 CCR5 수용체를 위한 친화성을 가지고 있을 것이다. 따라서, 다양한 펜타펩티드 조성물(예, 다양한 링커와 면역원이 부착된)의 활성 분석(결합 분석, 항바이러스 또는 다른 CCR5 수용체의 상대적인 바이오활성 분석)은 추가적인 유용한 스크리닝 방법이 될 것이다. CCR5 수용체에 대한 친화성이 높을 수록 최종 생산물의 치료 활성은 더 높을 것이다.
유용한 후보물질은 면역원으로 사용되기 전에 전형적으로 광범위한 항바이러스 활성을 보일 것이다. 그래서 이들 백신은 치료제로 기대된다.
본 발명의 특히 중요한 측면은, 이들 펩티드들의 혼성-길항제(mixed-antagonist)로서의 약리 활성에 관한 것이다. 혼성(부분) 작용제(agonist) 형태의 약물은 노벨상 수상자인 아르비드 카를슨(Medicine/Physiology, 2000)이 언급한 바와 같이 수용체 상호작용에 임상적으로 바람직한 타입이다. 혼성/부분 작용제 약물에서는, 완전 길항제의 탈감수성, 내성 및 부작용이 방지되며, 제약회사에서 이런 타입의 약물을 성공적으로 개발하였다. 부분 작용제 약물은 수용체 활성(See Redwine, 1999 DAPTA 작용의 혼성 작용제 측면을 보임)의 균형을 잡는 작용을 하므로, 바람직한 치료제이다. 본 발명자들은 본원에서 설명한 이들 펩티드들의 고유 생물 활성을 결정하기 위한 방법을 개발하였고, 인간에 투여한 후 6개월 이후에 수용체에 내성을 유도하지 않는 것으로 입증된, 표 6의 펩티드들과 같은 혼성-작용제 를 개발하였다.
HIV-1 gp120은 가장 광범위하게 당화된 단백질 중 하나이다. 23 또는 24 N-연결된 당화 부위를 포함하고 있으며, 이들 부위에 부착된 글리칸은 단백질 총 질량의 대략 1/2에 해당된다. 당화 및 당화효소 저해제를 이용한 수많은 연구를 통해, HIV-1 외피 당단백질의 구조를 결정하는데 있어 탄수화물 모이어티의 중요성이 확인되었다. 부위 특이적 돌연변이(Site-directed mutagenesis)에서, 대부분의 당화 부위 각각이 필수불가결한 것은 아닌 것으로 나타났다. gp120의 아미노-말단부의 절반에 위치되어 있는 24가지 부위에서, 단지 5(아미노산 88, 141, 197, 262, 276) 곳만 바이러스 감염에 작용한다. 197 부위는 V2 부근이나 본 발명자들이 규명한 결합 부위 펩티드 대부분의 위치에 있다. 예로, 당화 모티프 T/SxN은 본 발명의 펩티드에서 종종 나타남을 참조한다. 본원의 결과는, N-연결된 당화 부위가 명세서에 기재된 펩티드 근저, 펩티드에 또는 펩피트 내부에 있으며, 나아가 CCR5와 같은 공동-수용체에 대한 바이러스 결합 에피토프임을 시사한다. 당화는 존재한다면, 구조 특이성에 기여하거나, 중요한 에피토프의 면역 감시를 피하기 위한 수단으로서 천연 항체에 의한 중화를 은폐할 수 있다.
본 발명의 일 예는, 면역 특성을 가진 조성물이다. 이 조성물은 일반적으로 A-L-P-C 모이어티의 조합으로서 언급되며, 여기에서 A는 보강제이고, L은 임의연결 모이어티이고, P는 펩티드 모이어티이고, C는 보호기이다.
본 발명의 조성물에, 모든 보강제를 사용할 수 있다. 펩티드와 링커 영역은 보강제와 독립적으로 작용하는 것으로 생각되므로, 따라서 어떠한 방법으로도 보강 제의 선택을 제한하진 않는다. 일부 예에 불과한 유용 보강제의 예로는, 인간에게 허용가능한 보강제, 간염 코어 항원, 폴리라이신 등이 있다. 본 발명 이추 또는 이전에 개발된 보강제도 포함된다.
대안적으로, 보강제는 특정 상태로 분배될 수 있다. 예로, 펩티드가 응집된 경우이다.
본 발명의 또 다른 예는, 치료 특성을 지닌 조성물이다. 이 조성물은 일반적으로 L-P-C 모이어티의 조합으로 설명되며, L은 임의 모이어티이며, 바람직하기로는 짧은 펩티드 모이어티이고, P는 다른 펩티드 모이어티이고, C는 보호기이다.
L과 P를 조합한 영역의 길이는, 대략 7 내지 16개의 아미노산으로 이루어진 임의 특정 길이가 기능할 것이다. 바람직한 예로, 상기 조합한 영역의 길이는 7 내지 11이다. 보다 바람직하게는, 상기 조합한 영역의 길이는 7-9이다. 또다른 바람직한 예로, 상기 조합한 영역의 길이는 8이다. 대안적으로, 천연의 중성 펩티드는 28개의 아미노산으로 구성되므로, 본 발명의 조성물의 펩티드 영역의 길이는 대략 28개의 아미노산일 수 있다(표 4 참조).
본 발명의 다양한 조성물은 단독으로 작용하거나, 또는 칵테일로서 조합하여 작용하도록 고안된다. 상한 없이 다수의 여러가지 화합물을 사용할 수 있다. 가장 유용한 칵테일은 2-7개의 여러 화합물로 구성될 수 있다.
C 모이어티는 임의 보호기일 수 있다. 바람직한 예는 아미드이다.
또한, 본 발명은 다음과 같은 활성을 가진 화합물을 스크리닝하기 위한 방법 및 화합물에 관한 것이다: R5 또는 듀얼-트로픽(R5/X4) 균주에서의 HIV 억제, 모노 사이트-유래된 대식세포(MDMs), 미세아교세포(microglia) 또는 HIV 바이러스에 감염된 사람의 T세포에서의 HIV 억제. 다른 활성으로는, 비제한적으로 알츠하이머를 유발하는 신경염증, 다발성경화증, 건선 및 관절염 등의, CCR5 수용체의 모듈레이션(modulation)에 의해 치료가능한 모든 인간 질병을 포함한다. 이들 질병은 억제되거나 완치되며, 질병의 진행이 정지되거나 역위되며, 임상적인 효과가 있을 것이다.
마지막으로, 본 발명은 조성물의 안정성을 스크리닝하는 방법에 관한 것이다. 이는, 바이러스 감염성, 케모탁시스(chemotaxis), MAP 키나아제의 활성화, gp120 결합, CCR5 활성화 또는 저해, 또는 G-단백질 시그널링으로 이루어진 군으로부터 선택되는 생물학적인 특정화 방법에 의해 결정된다.
참조문헌
1. Berger, E.A., P.M. Murphy, and J.M. Farber. 1999. Chemokine receptors as HIV-1 coreceptors: roles in viral entry, tropism, and disease. Annu Rev Immunol. 17:657-700.
2. Raport, C.J., J. Gosling, V.L. Schweickart, P.W. Gray, and I.F. Charo. 1996. Molecular cloning and functional characterization of a novel human CC chemokine receptor (CCR5) for RANTES, MIP-1beta, and MIP-1alpha. J Biol Chem. 271:17161-17166.
3. Zwick, M.B., R. Kelleher, R. Jensen, A.F. Labrijn, M. Wang, G.V.J. Quinnan, P.W. Parren, and D.R. Burton. 2003. A novel human antibody against human immunodeficiency virus type 1 gp120 is V1, V2, and V3 loop dependent and helps delimit the epitope of the broadly neutralizing antibody immunoglobulin G1 b12. J Virol. 77:6965-6978.
4. Armbruster, C., G.M. Stiegler, B.A. Vcelar, W. Jager, U. Koller, R. Jilch, C.G. Ammann, M. Pruenster, H. Stoiber, and H.W. Katinger. 2004. Passive immunization with the anti-HIV-1 human monoclonal antibody (hMAb) 4E10 and the hMAb combination 4E10/2F5/2G12. J Antimicrob Chemother. 54:915-920.
5. Pert, C.B., J.M. Hill, M.R. Ruff, R.M. Berman, W.G. Robey, L.O. Arthur, F.W. Ruscetti, and W.L. Farrar. 1986. Octapeptides deduced from the neuropeptide receptor-like pattern of antigen T4 in brain potently inhibit human immunodeficiency virus receptor binding and T-cell infectivity. Proc Natl Acad Sci U S A. 83:9254-9258.
6. Cao, J., N. Sullivan, E. Desjardin, C. Parolin, J. Robinson, R. Wyatt, and J. Sodroski. 1997. Replication and neutralization of human immunodeficiency virus type 1 lacking the V1 and V2 variable loops of the gp120 envelope glycoprotein. J Virol. 71:9808-9812.
7. Kwong, P.D., R. Wyatt, J. Robinson, R.W. Sweet, J. Sodroski, and W.A. Hendrickson. 1998. Structure of an HIV gp120 envelope glycoprotein in complex with the CD4 receptor and a neutralizing human antibody. Nature. 393:648-659.
8. Ebenbichler, C., P. Westervelt, A. Carrillo, T. Henkel, D. Johnson, and L. Ratner. 1993. Structure-function relationships of the HIV-1 envelope V3 loop tropism determinant: evidence for two distinct conformations. AIDS. 7:639-646.
9. Ling, H., O. Usami, P. Xiao, H.X. Gu, and T. Hattori. 2004. The N-terminal of the V3 loop in HIV type 1 gp120 is responsible for its conformation-dependent interaction with cell surface molecules. AIDS Res Hum Retroviruses. 20:213-218.
10. Redwine, L.S., C.B. Pert, J.D. Rone, R. Nixon, M. Vance, B. Sandler, M.D. Lumpkin, D.J. Dieter, and M.R. Ruff. 1999. Peptide T blocks GP120/CCR5 chemokine receptor-mediated chemotaxis. Clin Immunol. 93:124-131.
11. Polianova, M.T., F.W. Ruscetti, C.B. Pert, and M.R. Ruff. 2005. Chemokine receptor-5 (CCR5) is a receptor for the HIV entry inhibitor peptide T (DAPTA). Antiviral Res. 67:83-92.
12. Brenneman, D.E., J.M. Buzy, M.R. Ruff, and C.B. Pert. 1988. Peptide T sequences prevent neuronal cell death produced by the envelope protein (gp120) of the human immunodeficiency virus. Drug Devel Res. 15:361-369.
13. Sanchez-Pescador, R., M.D. Power, P.J. Barr, K.S. Steimer, M.M. Stempien, S.L. Brown-Shimer, W.W. Gee, A. Renard, A. Randolph, J.A. Levy, and e. al. 1985. Nucleotide sequence and expression of an AIDS-associated retrovirus (ARV-2). Science. 227:484-492.
14. Sacerdote, P., M.R. Ruff, and C.B. Pert. 1987. Vasoactive intestinal peptide 1-12: a ligand for the CD4 (T4)/human immunodeficiency virus receptor. J Neurosci Res. 18:102-107.
15. Ruff, M.R., B.M. Martin, E.I. Ginns, W.L. Farrar, and C.B. Pert. 1987. CD4 receptor binding peptides that block HIV infectivity cause human monocyte chemotaxis. Relationship to vasoactive intestinal polypeptide. FEBS Lett. 211:17-22.
16. Peters, P.J., J. Bhattacharya, S. Hibbitts, M.T. Dittmar, G. Simmons, J. Bell, P. Simmonds, and P.R. Clapham. 2004. Biological analysis of human immunodeficiency virus type 1 R5 envelopes amplified from brain and lymph node tissues of AIDS patients with neuropathology reveals two distinct tropism phenotypes and identifies envelopes in the brain that confer an enhanced tropism and fusigenicity for macrophages. J Virol. 78:6915-6926.
17. Mulroney, S.E., K.J. McDonnell, C.B. Pert, M.R. Ruff, Z. Resch, W.K. Samson, and M.D. Lumpkin. 1998. HIV gp120 inhibits the somatotropic axis: a possible GH-releasing hormone receptor mechanism for the pathogenesis of AIDS wasting. Proc Natl Acad Sci U S A. 95:1927-1932.
18. Alkhatib, G., C. Combadiere, C.C. Broder, Y. Feng, P.E. Kennedy, P.M. Murphy, and E.A. Berger. 1996. CC CKR5: a RANTES, MIP-1alpha, MIP-1beta receptor as a fusion cofactor for macrophage-tropic HIV-1. Science. 272:1955-1958.
19. Choe, H., M. Farzan, Y. Sun, N. Sullivan, B. Rollins, P.D. Ponath, L. Wu, C.R. Mackay, G. LaRosa, W. Newman, N. Gerard, C. Gerard, and J. Sodroski. 1996. The beta-chemokine receptors CCR3 and CCR5 facilitate infection by primary HIV-1 isolates. Cell. 85:1135-1148.
20. Deng, H., R. Liu, W. Ellmeier, S. Choe, D. Unutmaz, M. Burkhart, P. Di Marzio, S. Marmon, R.E. Sutton, C.M. Hill, C.B. Davis, S.C. Peiper, T.J. Schall, D.R. Littman, and N.R. Landau. 1996. Identification of a major co-receptor for primary isolates of HIV-1. Nature. 381:661-666.
21. Doranz, B.J., J. Rucker, Y. Yi, R.J. Smyth, M. Samson, S.C. Peiper, M. Parmentier, R.G. Collman, and R.W. Doms. 1996. A dual-tropic primary HIV-1 isolate that uses fusin and the beta-chemokine receptors CKR-5, CKR-3, and CKR-2b as fusion cofactors. Cell. 85:1149-1158.
22. Dragic, T., V. Litwin, G.P. Allaway, S.R. Martin, Y. Huang, K.A. Nagashima, C. Cayanan, P.J. Maddon, R.A. Koup, J.P. Moore, and W.A. Paxton. 1996. HIV-1 entry into CD4+ cells is mediated by the chemokine receptor CC-CKR-5 [see comments]. Nature. 381:667-673.
23. Samson, M., O. Labbe, C. Mollereau, G. Vassart, and M. Parmentier. 1996. Molecular cloning and functional expression of a new human CC-chemokine receptor gene. Biochemistry. 35:3362-3367.
24. Combadiere, C., S.K. Ahuja, H.L. Tiffany, and P.M. Murphy. 1996. Cloning and functional expression of CC CKR5, a human monocyte CC chemokine receptor selective for MIP-1(alpha), MIP-1(beta), and RANTES. J Leukoc Biol. 60:147-152.
25. Raport, C.J., J. Gosling, V.L. Schweichart, P. Gray, and I.F. Charos. 1996. Molecular cloning and functional characterization of a novel human CC chemokine receptor (CCR%) for RANTES, MIP-1, and MIP-1 J. Biolog . Chem. 271:17161-17166.
26. Wu, L., W.A. Paxton, N. Kassam, N. Ruffing, J.B. Rottman, N. Sullivan, H. Choe, J. Sodroski, W. Newman, R.A. Koup, and C.R. Mackay. 1997. CCR5 levels and expression pattern correlate with infectability by macrophage-tropic HIV-1, in vitro. J Exp Med. 185:1681-1691.
27. Doranz, B.J., S.S. Baik, and R.W. Doms. 1999. Use of a gp120 binding assay to dissect the requirements and kinetics of human immunodeficiency virus fusion events. J Virol. 73:10346-10358.
28. Martin, K.A., R. Wyatt, M. Farzan, H. Choe, L. Marcon, E. Desjardins, J. Robinson, J. Sodroski, C. Gerard, and N.P. Gerard. 1997. CD4-independent binding of SIV gp120 to rhesus CCR5. Science. 278:1470-1473.
29. Trkola, A., J. Matthews, C. Gordon, T. Ketas, and J.P. Moore. 1999. A cell line-based neutralization assay for primary human immunodeficiency virus type 1 isolates that use either the CCR5 or the CXCR4 coreceptor. J Virol. 73:8966-8974.
30. Moore, J.P., and J. Sodroski. 1996. Antibody cross-competition analysis of the human immunodeficiency virus type 1 gp120 exterior envelope glycoprotein. J Virol. 70:1863-1872.
31. Doms, R.W. 2000. Beyond receptor expression: the influence of receptor conformation, density, and affinity in HIV-1 infection. Virology. 276:229-237.
32. Mondor, I., M. Moulard, S. Ugolini, P.J. Klasse, J. Hoxie, A. Amara, T. Delaunay, R. Wyatt, J. Sodroski, and Q.J. Sattentau. 1998. Interactions among HIV gp120, CD4, and CXCR4: dependence on CD4 expression level, gp120 viral origin, conservation of the gp120 COOH- and NH2-termini and V1/V2 and V3 loops, and sensitivity to neutralizing antibodies. Virology. 248:394-405.
33. Simpson, D.M., D. Dorfman, R.K. Olney, G. McKinley, J. Dobkin, Y. So, J. Berger, M.B. Ferdon, and B. Friedman. 1996. Peptide T in the treatment of painful distal neuropathy associated with AIDS: results of a placebo-controlled trial. The Peptide T Neuropathy Study Group. Neurology. 47:1254-1259.
34. Babcock, G.J., T. Mirzabekov, W. Wojtowicz, and J. Sodroski. 2001. Ligand binding characteristics of CXCR4 incorporated into paramagnetic proteoliposomes. J Biol Chem. 276:38433-38440.
35. Trkola, A., T. Dragic, J. Arthos, J.M. Binley, W.C. Olson, G.P. Allaway, C. Cheng-Mayer, J. Robinson, P.J. Maddon, and J.P. Moore. 1996. CD4 dependent, antibody-sensitive interactions between HIV-1 and its co-receptor CCR5. Nature. 384:184-187.
36. Wu, L., N.P. Gerard, R. Wyatt, H. Choe, C. Parolin, N. Ruffing, A. Borsetti, A.A. Cardoso, E. Desjardin, W. Newman, C. Gerard, and J. Sodroski. 1996. CD4-induced interaction of primary HIV-1 gp120 glycoproteins with the chemokine receptor CCR-5. Nature. 384:179-183.
37. Sullivan, N., Y. Sun, Q. Sattentau, M. Thali, D. Wu, G. Denisova, J. Gershoni, J. Robinson, J. Moore, and J. Sodroski. 1998. CD4-Induced conformational changes in the human immunodeficiency virus type 1 gp120 glycoprotein: consequences for virus entry and neutralization. J Virol. 72:4694-4703.
38. Kwong, P.D., M.L. Doyle, D.J. Casper, C. Cicala, S.A. Leavitt, S. Majeed, T.D. Steenbeke, M. Venturi, I. Chaiken, M. Fung, H. Katinger, P.W. Parren, J. Robinson, R.D. Van, L. Wang, D.R. Burton, E. Freire, R. Wyatt, J. Sodroski, W.A. Hendrickson, and J. Arthos. 2002. HIV-1 evades antibody-mediated neutralization through conformational masking of receptor-binding sites. Nature. 420:678-682.
39. Ruff, M.R., L.M. Melendez-Guerrero, Q.E. Yang, W.Z. Ho, J.W. Mikovits, C.B. Pert, and F.A. Ruscetti. 2001. Peptide T inhibits HIV-1 infection mediated by the chemokine receptor-5 (CCR5). Antiviral Res. 52:63-75.
40. Kimpton, J., and M. Emerman. 1992. Detection of replication-competent and pseudotyped human immunodeficiency virus with a sensitive cell line on the basis of activation of an integrated beta-galactosidase gene. J Virol. 66:2232-2239.
41. Harrington, R.D., and A.P. Geballe. 1993. Cofactor requirement for human immunodeficiency virus type 1 entry into a CD4-expressing human cell line. J Virol. 67:5939-5947.
42. Vodicka, M.A., W.C. Goh, L.I. Wu, M.E. Rogel, S.R. Bartz, V.L. Schweickart, C.J. Raport, and M. Emerman. 1997. Indicator cell lines for detection of primary strains of human and simian immunodeficiency viruses. Virology. 233:193-198.
43. Pirounaki, M., N.A. Heyden, M. Arens, and L. Ratner. 2000. Rapid phenotypic drug susceptibility assay for HIV-1 with a CCR5 expressing indicator cell line. J Virol Methods. 85:151-161.
Claims (20)
- 구조: A-L-P-C를 포함하는 인간 면역결핍 바이러스에 효과적인 치료 조성물 및 백신 면역원:A는 임의 보강제이고;L은 임의 연결 모이어티이고;P는 구조 R1R2R3R4R5 및 다른 임이 아미노산을 갖는 펩티드이고:R1은 N, S, T, D, R, K, A, 또는 E로 이루어진 군으로부터 선택되며,R2는 N, S, T, D, G, I, 또는 E로 이루어진 군으로부터 선택되며,R3은 N, S, T, D, G, R, K, I, Q, H, 또는 E로 이루어진 군으로부터 선택되며,R4는 Y이며,R5는 N, S, T, R, K, A, M, W 또는 G, 또는 그의 아미드로 이루어진 군으로 선택되며,C는 보호기이다.
- 제 1항에 있어서, L은 3개의 아미노산 모이어티로 구성되며, P는 5개의 아미노산 모이어티로 구성되는 것을 특징으로 하는 치료 조성물 및 백신 면역원.
- 제 1항에 있어서, L은 트리펩티드 모이어티 A-S-T인 것을 특징으로 하는 치료 조성물 및 백신 면역원.
- 제 1항에 있어서, R2는 T, S 및 N으로 이루어진 군으로부터 선택되는 것을 특징으로 하는 치료 조성물 및 백신 면역원.
- 제 1항에 있어서, P는 EYIYT, INNYT, ISNYS, ISNYT, ISYRL, NNRYR, NNSYR, NSNYS, NSSYR, NTIYT, NTSYG, NTSYM, NTSYR, NTSYS, SSEYR, SSRYR, SSTYR, STNYT, STSYR, TISYR, TSNYS, TTNFT, TTNYT, 모두 D형인 TTNYT, TTSYR, TTSYT 및 YTSYR로 이루어진 군으로부터 선택되는 것을 특징으로 하는 치료 조성물 및 백신 면역원.
- 제 1항에 있어서, A는 인간에게 허용가능한 모든 보강제인 것을 특징으로 하는 치료 조성물 및 백신 면역원.
- 제 1항에 있어서, C는 C-말단 아미드기인 것을 특징으로 하는 치료 조성물 및 백신 면역원.
- 제 1항에 있어서, 상기 조성물은 2-5개의 구성 성분으로 구성된 칵테일을 포함하며, 상기 구성 성분은 P 영역의 아미노산 모이어티 서열이 상이한 것을 특징으로 하는 치료 조성물 및 백신 면역원.
- 제 1항에 있어서, L-P 영역은 약 7 내지 약 16개의 아미노산 잔기를 가진 펩티드를 포함하는 것을 특징으로 하는 치료 조성물 및 백신 면역원.
- 제 1항에 있어서, 상기 아미노산은 D 입체이성체인 것을 특징으로 하는 치료 조성물 및 백신 면역원.
- 구조 L-P-C를 갖는 치료 조성물:L은 임의 트리펩티드(tri-peptide) 서열을 포함하며,P는 구조 R1R2R3R4R5 및 다른 임이 아미노산을 갖는 펩티드이고:R1은 N, S, T, D, R, K, A, 또는 E로 이루어진 군으로부터 선택되며,R2는 N, S, T, D, G, I, 또는 E로 이루어진 군으로부터 선택되며,R3은 N, S, T, D, G, R, K, I, Q, H, 또는 E로 이루어진 군으로부터 선택되며,R4는 Y이며,R5는 N, S, T, R, K, A, M, W 또는 G, 또는 그의 아미드로 이루어진 군으로 선택되며,C는 임의 보호기이다.
- 제 11항에 있어서, L은 3개의 아미노산 모이어티로 구성되며, P는 5개의 아미노산 모이어티로 구성되는 것을 특징으로 하는 조성물.
- 제 11항에 있어서, L은 트리펩티드 모이어티 A-S-T인 것을 특징으로 하는 조성물.
- 제 11항에 있어서, R2는 T, S 및 N으로 이루어진 군으로부터 선택되는 것을 특징으로 하는 조성물.
- 제 11항에 있어서, P는 EYIYT, INNYT, ISNYS, ISNYT, ISYRL, NNRYR, NNSYR, NSNYS, NSSYR, NTIYT, NTSYG, NTSYM, NTSYR, NTSYS, SSEYR, SSRYR, SSTYR, STNYT, STSYR, TISYR, TSNYS, TTNFT, TTNYT, 모두 D형인 TTNYT, TTSYR, TTSYT 및 YTSYR로 이루어진 군으로부터 선택되는 것을 특징으로 하는 조성물.
- 제 11항에 있어서, A는 인간에게 허용가능한 모든 보강제인 것을 특징으로 하는 조성물.
- 제 11항에 있어서, C는 C-말단 아미드기인 것을 특징으로 하는 조성물.
- 제 11항에 있어서, 상기 조성물은 2-5개의 구성 성분으로 구성된 칵테일을 포함하며, 상기 구성 성분은 P 영역의 아미노산 모이어티 서열이 상이한 것을 특징으로 하는 조성물.
- 제 11항에 있어서, L-P 영역은 약 7 내지 약 16개의 아미노산 잔기를 가진 펩티드를 포함하는 것을 특징으로 하는 조성물.
- 제 11항에 있어서, 상기 아미노산은 D 입체이성체인 것을 특징으로 하는 조성물.
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US69308905P | 2005-06-23 | 2005-06-23 | |
| US69308805P | 2005-06-23 | 2005-06-23 | |
| US69308705P | 2005-06-23 | 2005-06-23 | |
| US60/693,089 | 2005-06-23 | ||
| US60/693,087 | 2005-06-23 | ||
| US60/693,088 | 2005-06-23 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20080019720A true KR20080019720A (ko) | 2008-03-04 |
Family
ID=37571305
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020087001808A KR20080019720A (ko) | 2005-06-23 | 2006-06-23 | 치료 펩티드 및 백신 |
Country Status (9)
| Country | Link |
|---|---|
| US (3) | US7700115B2 (ko) |
| EP (1) | EP1893233A4 (ko) |
| JP (1) | JP2008546803A (ko) |
| KR (1) | KR20080019720A (ko) |
| AU (1) | AU2006261133B2 (ko) |
| BR (1) | BRPI0611927A2 (ko) |
| CA (1) | CA2624957A1 (ko) |
| MX (1) | MX2007016573A (ko) |
| WO (1) | WO2006138745A2 (ko) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2006261133B2 (en) | 2005-06-23 | 2012-04-05 | Rapid Pharmaceuticals Ag | Therapeutic peptides and vaccines |
| US8178497B2 (en) | 2007-11-14 | 2012-05-15 | Rapid Pharmaceuticals Ag | Method of treating HIV in drug resistant non plasma viral reservoirs with monomeric DAPTA |
| US10130674B2 (en) * | 2010-02-09 | 2018-11-20 | Creative Bio-Peptides | Modified peptide that reduces pain in peripheral neuropathy |
| US9040046B2 (en) | 2011-01-31 | 2015-05-26 | Kai Xu | Sodium pump antibody agonists and methods of treating heart disease using the same |
| US20140092376A1 (en) * | 2012-10-01 | 2014-04-03 | Momentive Performance Materials, Inc. | Container and method for in-line analysis of protein compositions |
| US20140322250A1 (en) | 2013-04-26 | 2014-10-30 | Michael Ruff | Peptides for the Treatment of Multiple Sclerosis and Related Diseases |
| US20180344798A1 (en) * | 2017-05-31 | 2018-12-06 | Creative Bio-Peptides Inc. | Topically active peptides for treating cosmetic and dermatological conditions |
| US11510961B2 (en) | 2019-12-19 | 2022-11-29 | Creative Bio-Peptides, Inc. | Methods and compositions for use of a chemokine receptor antagonist peptide to treat addiction, substance abuse disorders or symptoms thereof |
| US20210244788A1 (en) * | 2020-02-06 | 2021-08-12 | Creative Bio-Peptides Inc. | Oral peptide antagonists of multiple chemokine receptors for reversing loss of synapses and dendritic spines |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS63501716A (ja) * | 1985-10-24 | 1988-07-14 | サウスウエスト・ファウンデ−ション・フォア・バイオメディカル・リサ−チ | 合成ペプチドおよびaidsおよびarcの診断ならびにワクチン注射へのその使用 |
| US6242564B1 (en) | 1986-06-03 | 2001-06-05 | Candace B. Pert | Treatment of tropical spastic paresis with peptide T |
| US5276016A (en) * | 1986-06-03 | 1994-01-04 | The United States Of America As Represented By The Department Of Health And Human Services | Small peptides which inhibit binding to T-4 receptors and act as immunogens |
| AU7544987A (en) * | 1986-06-03 | 1988-01-11 | Pert, C.B. | Small peptides which inhibit binding to t-4 receptors |
| AU604719B2 (en) * | 1986-06-03 | 1991-01-03 | United States of America, as represented by the Secretary, U.S. Department of Commerce, The | Small peptides which inhibit binding to t-4 receptors and act as immunogens |
| US5063206A (en) | 1988-12-16 | 1991-11-05 | The United States Of Americas As Represented By The Department Of Health And Human Services | Compositions having use as treatment of neuropsychiatric deficits |
| US5739109A (en) | 1988-12-16 | 1998-04-14 | Advanced Immunit Inc. | Method of treating neuroinflammatory degenerative diseases |
| DK64592D0 (da) | 1992-05-14 | 1992-05-14 | Carlbiotech Ltd As | Peptider til terapeutisk behandling |
| US6011014A (en) | 1992-03-27 | 2000-01-04 | Advanced Immunit, Inc. | Peptide T and related peptides in the treatment of inflammation, including multiple sclerosis |
| US5534495A (en) | 1993-05-25 | 1996-07-09 | Advanced Peptides And Biotechnology Sciences | Treatment of non-HIV neuropathic pain syndromes |
| US5514670A (en) | 1993-08-13 | 1996-05-07 | Pharmos Corporation | Submicron emulsions for delivery of peptides |
| US20040126811A1 (en) * | 2002-02-21 | 2004-07-01 | Thomas Boren | Helicobacter pylori sialic acid binding adhesin, saba and saba-gene |
| WO2007002465A2 (en) | 2005-06-23 | 2007-01-04 | Rapid Pharmaceuticals, Llc | Stabilizing alkylglycoside compositions and methods thereof |
| AU2006261133B2 (en) | 2005-06-23 | 2012-04-05 | Rapid Pharmaceuticals Ag | Therapeutic peptides and vaccines |
-
2006
- 2006-06-23 AU AU2006261133A patent/AU2006261133B2/en not_active Ceased
- 2006-06-23 MX MX2007016573A patent/MX2007016573A/es active IP Right Grant
- 2006-06-23 JP JP2008518460A patent/JP2008546803A/ja active Pending
- 2006-06-23 WO PCT/US2006/024580 patent/WO2006138745A2/en active Application Filing
- 2006-06-23 EP EP06785485A patent/EP1893233A4/en not_active Withdrawn
- 2006-06-23 CA CA002624957A patent/CA2624957A1/en not_active Abandoned
- 2006-06-23 BR BRPI0611927-1A patent/BRPI0611927A2/pt not_active IP Right Cessation
- 2006-06-23 KR KR1020087001808A patent/KR20080019720A/ko not_active Application Discontinuation
- 2006-06-23 US US11/426,301 patent/US7700115B2/en active Active - Reinstated
-
2010
- 2010-01-16 US US12/688,862 patent/US10071153B2/en active Active
-
2018
- 2018-08-03 US US16/054,455 patent/US10973906B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| WO2006138745A3 (en) | 2007-11-29 |
| BRPI0611927A2 (pt) | 2011-08-16 |
| EP1893233A2 (en) | 2008-03-05 |
| CA2624957A1 (en) | 2006-12-28 |
| US10071153B2 (en) | 2018-09-11 |
| AU2006261133B2 (en) | 2012-04-05 |
| JP2008546803A (ja) | 2008-12-25 |
| MX2007016573A (es) | 2008-10-17 |
| US20060292167A1 (en) | 2006-12-28 |
| US20190000964A1 (en) | 2019-01-03 |
| US20100184705A1 (en) | 2010-07-22 |
| AU2006261133A1 (en) | 2006-12-28 |
| US10973906B2 (en) | 2021-04-13 |
| EP1893233A4 (en) | 2010-03-31 |
| WO2006138745A2 (en) | 2006-12-28 |
| US7700115B2 (en) | 2010-04-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10973906B2 (en) | Therapeutic peptides and vaccines | |
| Koch et al. | Structure-based, targeted deglycosylation of HIV-1 gp120 and effects on neutralization sensitivity and antibody recognition | |
| Root et al. | HIV-1 gp41 as a target for viral entry inhibition | |
| Yang et al. | Improved elicitation of neutralizing antibodies against primary human immunodeficiency viruses by soluble stabilized envelope glycoprotein trimers | |
| Kolchinsky et al. | Loss of a single N-linked glycan allows CD4-independent human immunodeficiency virus type 1 infection by altering the position of the gp120 V1/V2 variable loops | |
| Xiang et al. | A V3 loop-dependent gp120 element disrupted by CD4 binding stabilizes the human immunodeficiency virus envelope glycoprotein trimer | |
| Dowbenko et al. | Epitope mapping of the human immunodeficiency virus type 1 gp120 with monoclonal antibodies | |
| Xiang et al. | Epitope mapping and characterization of a novel CD4-induced human monoclonal antibody capable of neutralizing primary HIV-1 strains | |
| Lagenaur et al. | sCD4-17b bifunctional protein: extremely broad and potent neutralization of HIV-1 Env pseudotyped viruses from genetically diverse primary isolates | |
| Si et al. | Envelope glycoprotein determinants of neutralization resistance in a simian-human immunodeficiency virus (SHIV-HXBc2P 3.2) derived by passage in monkeys | |
| Srivastava et al. | Role of neutralizing antibodies in protective immunity against HIV | |
| Yuan et al. | CD4-induced T-20 binding to human immunodeficiency virus type 1 gp120 blocks interaction with the CXCR4 coreceptor | |
| EP1466924B1 (en) | Synthetic peptide vaccines for HIV: the CBD epitope as an effective immunogen to elicit broadly neutralizing antibodies against HIV | |
| Khurana et al. | Identification of a linear peptide recognized by monoclonal antibody 2D7 capable of generating CCR5-specific antibodies with human immunodeficiency virus-neutralizing activity | |
| WO1998000535A2 (en) | Method for inhibiting hiv-1 infection, drug screens, and methods of diagnosis and prognosis of susceptibility to hiv infection | |
| AU731975B2 (en) | GP120 polypeptides having conformational discontinuous chemokine receptor binding sites and methods of inhibiting HIV infection | |
| Albright et al. | Interactions between HIV-1 gp120, chemokines, and cultured adult microglial cells | |
| WO1998015569A9 (en) | Gp120 polypeptides having conformational discontinuous chemokine receptor binding sites and methods of inhibiting hiv infection | |
| CN101242854A (zh) | 治疗肽及疫苗 | |
| Jinno-Oue et al. | The synthetic peptide derived from the NH2-terminal extracellular region of an orphan G protein-coupled receptor, GPR1, preferentially inhibits infection of X4 HIV-1 | |
| Melikyan et al. | The role of the N-terminal segment of CCR5 in HIV-1 Env-mediated membrane fusion and the mechanism of virus adaptation to CCR5 lacking this segment | |
| Couto | Synthetic antibodies targeting HIV-1 infectivity | |
| Srivastava et al. | Challenges in Designing HIV Env Immunogens for Developing a Vaccine | |
| Mörner | Studies on HIV-2 antibody mediated neutralisation, coreceptor usage and in vivo tropism | |
| Guenaga | Epitope Scaffolds And The HIV-1 gp41 2F5 Neutralization Determinant |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| N231 | Notification of change of applicant | ||
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |