KR101225911B1 - 미생물의 검출 및 정량화 - Google Patents
미생물의 검출 및 정량화 Download PDFInfo
- Publication number
- KR101225911B1 KR101225911B1 KR1020077013575A KR20077013575A KR101225911B1 KR 101225911 B1 KR101225911 B1 KR 101225911B1 KR 1020077013575 A KR1020077013575 A KR 1020077013575A KR 20077013575 A KR20077013575 A KR 20077013575A KR 101225911 B1 KR101225911 B1 KR 101225911B1
- Authority
- KR
- South Korea
- Prior art keywords
- dye
- color
- dyes
- control
- test
- Prior art date
Links
- 0 N#*C(C(C1=O)=NNc(cc2)ccc2S(O)(=O)=O)=NN1c1ccccc1 Chemical compound N#*C(C(C1=O)=NNc(cc2)ccc2S(O)(=O)=O)=NN1c1ccccc1 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/02—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving viable microorganisms
- C12Q1/04—Determining presence or kind of microorganism; Use of selective media for testing antibiotics or bacteriocides; Compositions containing a chemical indicator therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/02—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving viable microorganisms
- C12Q1/04—Determining presence or kind of microorganism; Use of selective media for testing antibiotics or bacteriocides; Compositions containing a chemical indicator therefor
- C12Q1/06—Quantitative determination
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Analytical Chemistry (AREA)
- Toxicology (AREA)
- Immunology (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Biotechnology (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Abstract
샘플내 미생물 존재의 반-정량적 또는 정량적 검출 방법이 제공된다. 상기 방법은 1종 이상의 미생물 존재하에서 검출가능한 색 변화가 일어나는 시험 염료를 이용한다. 예를 들어, 한 실시양태에서는, 시험 염료는 미생물 성분 (예를 들면, 세포막, 세포질 등)과 세포 외부 환경 사이의 극성 차이에 반응하는 용매화발색 염료 (예를 들면, 레이차트 염료)이다. 별법으로, 다른 메카니즘이 염료와 미생물 사이의 상호작용, 예컨대 산-염기 반응, 산화환원 반응 등을 전적으로 또는 부분적으로 초래할 수도 있다. 어느 것이든 상관없이, 시험 염료의 색을 대조 염료의 색과 비교할 수 있으며, 상기 대조 염료의 색은 기지 미생물 농도에 대응한다.
미생물, 정량적 검출, 용매화발색 염료, 레이차트 염료, 메로시아닌 염료
Description
관련 출원
본 출원은 2003년 12월 16일자로 출원된 미국 특허 출원 10/737,574호의 우선권을 주장하는, 국제 출원 PCT/US2004/042461호 (2004년 12월 16일자로 출원됨)의 일부 계속 출원이다.
본 발명은 세균, 효모, 곰팡이 및 바이러스와 같은 미생물의 검출을 위한 방법 및 제품에 관한 것이다.
일상생활 속에서 우리는 질병의 원인이 될 수 있는, 미생물로 오염된 표면에 무의식적으로 노출되어 있다. 여러 연구들이 특정 세균으로 오염된 "위험지점"이 공중전화, 문 손잡이, 병원 대기실과 어린이 보육기관의 장난감, 열풍 손 건조기, 주방에서 사용되는 타월 및 스펀지, 일상적인 환자 간호 중에 있는 병원 직원의 손, 및 생고기와 야채를 섞는 음식 조리대 표면과 칼로부터의 교차 오염을 포함한다는 것을 보여주고 있다.
미국 내에서만도 여러 지역에서 최근 세균 오염의 발생이 아동 및 노인의 사망을 초래하였고 그 외의 사람들을 질병에 걸리게 하였다. 또한, 음식물의 미생물 오염도 전 세계적으로 주요 문제이다. 살모넬라(Salmonella), 대장균(E. coli) 및 기타 음식물 유래의 세균은 매년 셀 수 없을 정도의 질병을 야기하고 있다. 급성 증상은 메스꺼움, 구토, 비정상적인 복통, 설사, 고열 및 두통을 포함한다. 급성 증상의 발병 이후에는 만성적인 결과가 따를 수 있다. 표면의 교차 오염은 육류, 생선 및 가금류에서 유래한 세균을 야채와 같은 비조리 음식물로 전달할 수 있기 때문에, 음식 조리대 표면의 세균 존재 여부를 간단히 검출할 수 있으면 큰 도움이 될 수 있다.
마찬가지로, 식품 가공 산업에서 미생물의 유해 수준의 검출이 가족과 소비자의 건강을 같이 유지하는 데 있어서 매우 중요하다. 식품 가공 산업에서는 세균의 모니터링이 중요하다. 육류 포장에서 치즈 생산에 이르는 실질적으로 모든 식품의 가공은 식품 공급의 안전성을 보장하기 위해 미생물 수준을 모니터링하는 것을 포함한다.
미생물 오염으로 인한 폐해가 식품 산업에만 국한되는 것은 아니다. 최근 수십년간 병원 및 보건 공동체가 진원지인 것이 문제가 되는 "슈퍼버그(superbug)"의 급격한 증가가 나타나고 있다. 항생제의 남용 뿐만 아니라 병원의 불충분한 청결은 메티실린-내성 S. 아우레우스(S. aureus) (MRSA) 및 클로스트리디움 디피실(Clostridium difficile) 뿐만 아니라, 반코마이신-내성 장구균(enterococci) 및 다른 그람-음성 간균을 초래하였다 (Dancer, 2004). 최근 BBC의 보고에 따르면, MRSA로 인한 사망이 한해 5000명으로 추정된다고 한다. 상기 기사는 "청결은 환자의 주요 관심사이며 MRSA 문제는 점점 심각해지고 있다"고 밝혔다. 병원의 많은 환자들이 이미 면역-결핍 상태이며 따라서 감염의 위험이 더욱 크다는 것을 고려하면, 병원 환경에서 악성 세균으로 인한 위험은 보다 더욱 위협적이게 된다.
병원 청결 및 병원 감염의 예방에 관한 수많은 보고서와 연구가 있다.
유사하게, 맥각과 같은 곰팡이도 호밀과 같은 특정 곡물에서 성장하는 것으로 알려져 있으며, 리세르그산과 유사한 독성이 있는 알칼로이드의 생산에 의해 잠재적으로 유해할 수 있다. 아스퍼질러스 니게르(Aspergillus niger) 및 기타 곰팡이들은 천식과 같은 호흡기 증상을 악화시킬 뿐만 아니라, 알레르기 반응을 일으킬 수 있는 포자를 만드는 것으로 알려져 있다. 만일 A. 니게르가 습기찬 벽이나, 집 또는 상업용 건물의 에어 컨디셔닝 장치에서 성장하기 시작하면, 특히 문제가 될 수 있다.
칸디다 알비칸스(Candida albicans)와 같은 특정 효모는 문제가 되는 또다른 부류의 미생물일 수 있다. C. 알비칸스는 유아 기저귀 발진, 아동 및 면역-결핍 성인의 아구창, 및 효모에 의한 질내 감염 등과 관련있다. 효모는 또한 위장관과 신체의 인두 부위를 감염시킬 수도 있다.
현재의 세균 검출 방법은 비품의 표면에서 샘플을 채취하는 것을 포함한다. 식품 가공 환경에서는 이러한 비품이 육류 절단기일 수 있고, 식당이나 가정과 같은 음식물 조리 환경에서는 이러한 표면이 식탁, 도마, 냉장고 내부 또는 작업 표면일 수 있다. 그 후에, 샘플을 밤새 인큐베이션하여 배양물을 생육하였다. 밤새 성장 배지는 샘플이 적절한 온도와 습도하의 한천 평판 배지 상에서 성장하도록 하여, 육안으로도 볼 수 있을 만큼 충분히 큰 콜로니를 형성할 때까지 세균을 생육 및 증식시킨다. 정해진 시간 동안 인큐베이션하고 세균의 콜로니가 성장하도록 한 후에, 훈련된 전문가가 한천 평판 배지 샘플을 손으로 검사하고 콜로니 형성 수 (CFU)를 추정한다. 이러한 방법은 다소 고가이며 상당한 시간 지체를 수반한다; 지체된 시간 동안 오염된 제품이 옮겨지거나 존재하는 미생물에 사람들이 노출될 수 있다.
유해한 미생물을 신속하게 검출할 수 있는 방법 및 제품이 명백히 요구되고 있다.
발명의 요약
당업자들이 겪는 상기 어려움에 대한 반응으로서, 본 발명자들은 미생물의 존재하에서 시각적으로 검출가능한 변화가 일어나는 미생물 감수성 착색제 및 이동상을 포함하는 지시 조성물을 개발하였다. 이러한 조성물은 미생물의 존재를 나타내도록 표면에 도포될 수 있다. 이동상은 살균제일 수 있다. 착색제는 미생물의 존재하에서 육안으로 볼 수 있는 색 변화를 제공한다. 이동상은 액체이거나 겔일 수 있고 착색제는 염료일 수 있다. 몇몇 실시양태에서, 착색제는 미생물의 농도에 비례하는 속도로 색이 변화한다. 다른 실시양태에서는, 존재하는 미생물의 양은 변화가 일어나는 착색제의 양에 비례한다.
적합한 염료의 예로는 메로시아닌 염료, 4-[2-N-치환-1,4-히드로피리딘-4-일리딘)에틸리덴]시클로헥사-2,5-디엔-1-온, 적색 피라졸론 염료, 아조메틴 염료, 인도아닐린 염료, 디아자메로시아닌 염료, 레이차트(Reichardt's) 염료로 예시되는 양쪽성 이온 염료 등과 이들의 혼합물이 있다. 특별히 적합한 것은 양쪽성 이온이 염료의 색소원을 포함하는 연속된 π 전자계 안에 함유된 양쪽성 이온 염료이다. 미생물 지시제로서 특히 유용한 것으로 여겨지는 또다른 부류의 염료는 메로시아닌 염료이다.
염료는 또한 용매계 또는 수성계 용액으로서 표면에 도포되고 건조되어, 도포된 염료 용액의 건조 잔류물을 남긴다. 이러한 건조 잔류물은 미생물과 접촉시 색이 변화하므로, 미용 화장지 상자와 같은 포장재, 장갑과 같은 의료 용구, 및 재료가 사용되기 전에 염료와 함께 제조될 수 있고 차후에 미생물의 오염을 지시하는 기타 표면 상에 사용될 수 있다. 놀랍게도 본 발명자들은 이들 염료가 표면에 도포되고 건조되었을 때, 코팅물을 제조하는데 사용된 용매와 히드록시프로필-베타-시클로덱스트린과 같은 첨가제 및 계면활성제의 사용이, 코팅물의 미생물 검출 능력에 유의한 영향을 미친다는 것을 발견하였다.
히드록시프로필-베타-시클로덱스트린은 종이 타월이나 유사한 와이프 재료에 코팅된 후 착색제의 휘도를 증가시키는데 효과적인 것으로 밝혀졌다. 이론에 구애받기를 원하지 않지만, 본 발명자들은 시클로덱스트린 유도체의 첨가에 의해 염료의 결정화를 억제함으로써 염료의 색이 향상된다고 믿고 있다. 염료를 간섭하는 것으로 밝혀진 표백제의 존재로 인해 위 양성으로 판독되는 것을 막는데 도움이 되도록 다른 화합물을 와이프에 첨가할 수도 있다.
미생물 지시 착색제를 혼입한 측방 유동 장치 또한 본 발명의 범주에 포함된다. 이러한 장치는 검출 대역 및 대조 대역을 갖는 막이 있으며, 상기 검출 대역은 세균 존재에 반응하여 색이 변화하고 대조 대역은 분석이 적절하게 행해졌는지 를 나타내기 위해 본래의 염료 색을 유지하게 된다.
또한, 미생물 감수성 착색제를 함유하는 용액을 표면에 도포하고 미생물의 존재를 나타내는 시각적으로 검출가능한 변화를 관찰함으로써 표면 상의 미생물을 검출하는 방법이 본원에 기재되어 있다.
본 발명의 기타 특징 및 측면이 하기에 더욱 상세히 기재되어 있다.
본 발명의 최상의 양식을 비롯하여, 당업자들을 위한 본 발명의 충분하고 실시가능한 기재는 첨부된 도면을 참조로 하여 본 명세서의 나머지 부분에 더욱 구체적으로 상술되어 있다.
도 1은 5가지 기본적인 세균 세포 모양의 도면이다.
도 2는 세균 세포 배열의 도면이다.
도 3은 한 메로시아닌 염료의 구조이다.
도 4 및 도 5는 메로시아닌 염료의 합성 방법을 도해한다.
도 6 A-D는 오래된 닭을 사용한 미생물 오염의 지시에 관한 도해이다.
도 7 A-G는 단계적인 미생물 오염의 지시 및 세정에 관한 도해이다.
도 8 A-D는 서로 다른 농도의 세균을 이용한 미생물 오염의 지시에 관한 도해이다.
도 9 A-E는 세균을 이용한 미생물 오염의 지시 및 정량화, 및 지시 염료의 적정에 관한 도해이다.
도 10 A-C는 컴퓨터 키보드 상의 미생물 오염의 지시에 관한 도해이다.
도 11 A-D는 용액에 계면활성제를 첨가한 경우와 첨가하지 않았을 경우 미생물 오염의 지시에 관한 도해이다.
도 12 A-F는 용매에 따른 미생물 오염 지시 속도를 나타내는 도해이다.
도 13 A-C는 착색제가 기재 상에서 건조된, 미생물 오염의 지시에 관한 도해이다.
도 14는 델타 E를 S. 아우레우스의 기지 농도에 대해 플롯팅한 실시예 30에서 얻어진 결과의 그래프이다.
도 15는 델타 E를 P. 애루기노사(P. aeruginosa)의 기지 농도에 대해 플롯팅한 실시예 30에서 얻어진 결과의 그래프이다.
도 16은 델타 E를 대장균의 기지 농도에 대해 플롯팅한 실시예 30에서 얻어진 결과의 그래프이다.
도 17은 본 발명에서 사용될 수 있는 측방 유동 분석 장치의 한 실시양태의 상면도이다.
본 명세서 및 도면에서 참조 기호를 반복 사용하는 것은 본 발명의 동일하거나 유사한 특징 또는 요소를 나타내기 위함이다.
본 발명은 세균 및 기타 미생물의 검출을 포함하며 본원에서 "미생물"이란 용어의 사용은 세균, 효모 및 곰팡이와 같은 진균, 및 바이러스를 포함하는 것으로 이해되어야 한다.
수천개의 다양한 종류의 세균이 존재한다. 몇몇은 단지 미미하게 상이하여 고도로 훈련된 사람만이 그들을 확인할 수 있다. 또한, 성장 양태 및 외형상 큰 차이가 있어 매우 용이하게 확인할 수 있는 군도 있다. 사소한 차이점을 무시하면, 대부분의 세균은 도 1에 나타낸 5가지의 기본적인 세포 모양에 따라 분류될 수 있다. 도 1의 좌측에서부터 우측으로 구형 또는 구균, 막대형 또는 간균, 나선형 또는 나선균, 콤마형 또는 비브리오균 및 사상균의 형태이다.
그들의 서로 다른 모양 외에도, 그들의 세포 배열이 쌍구균, 연쇄상 구균 및 포도상 구균 (도 2에서 좌측에서부터 우측으로)으로 서로 다르다. 예를 들어, 몇몇 구균은 항상 쌍으로 모여있다 (쌍구균). 다른 것들은 사슬 모양으로 배열되어 있다 (연쇄상 구균). 또다른 것들은 다발지어 있다 (포도상 구균). 쌍구균은 폐렴을 일으키는 것으로 알려져 있다. 연쇄상 구균은 종종 "연쇄구균 인두염"과 관련있다. 포도상 구균은 "포도상구균 감염증"과 몇몇 종류의 식중독에서의 그들의 역할 때문에 많은 사람들에게 잘 알려져 있다.
또한 세균은 크기에 있어서도 어느 정도 차이가 있으나, 평균적으로 세균마다 약 1/25,000 인치 (2.54 cm)이다. 다른 말로 하면, 25,000개의 세균을 옆으로 늘어 놓았을 때 일직선으로 단지 1 인치밖에 안 된다. 9조 마리의 평균 크기의 세균을 담기 위해서 1 입방 인치면 충분하다 -- 지구상 모든 사람에게 약 3,000마리의 세균이 있다.
최신 분자 생물학 개념에 기초한 세균의 하위 분류의 이론적 원리에 관하여 많은 논의가 있으나, 실지 미생물학자가 하위 분류하는 신속한 수단은 그람 반응 (세균을 분류하기 위한 염색법) 및 형태학을 기초로 한다.
그람-양성 세균은 알콜 또는 아세톤 존재하에서 크리스탈 바이올렛 염색액을 유지한다. 이들은 중요한 속을 포함한다: 액티노마이세스(Actinomyces), 바실러스(Bacillus), 비피도박테리움(Bifidobacterium), 셀룰로모나스(Cellulomonas), 클로스트리디움(Clostridium), 코리네박테리움(Corynebacterium), 마이크로코쿠스(Micrococcus), 미코박테리움(Mycobacterium), 노카르디아(Nocardia), 스타필로코쿠스(Staphylococcus), 스트렙토코쿠스(Streptococcus) 및 스트렙토마이세스(Streptomyces). 몇몇 그람-양성 세균, 특히 코리네박테리움, 미코박테리움 및 노카르디아 속의 것들은 산 존재하에서도 염료를 유지한다. 이들은 항산성균으로 알려져 있다.
그람-음성 세균은 알콜 또는 아세톤 존재하에서 크리스탈 바이올렛 염색액을 유지하지 않는다. 이들은 중요한 속을 포함한다: 아세토박터(Acetobacter), 아그로박테리움(Agrobacterium), 알카리지너스(Alcaligenes), 보르데텔라(Bordetella), 브루셀라(Brucella), 캄피로박터(Campylobacter), 카울로박터(Caulobacter), 엔테로박터(Enterobacter), 에르위니아(Erwinia), 에스케리키아(Escherichia), 헬리코박테리움(Helicobacterium), 레지오넬라(Legionella), 네세리아(Nesseria), 니트로박트(Nitrobact), 파스퇴렐리아(Pasteurelia), 슈도모나스(Pseudomonas), 리조비움(Rhizobium), 리켓시아(Rickettsia), 살모넬라(Salmonella), 시겔라(Shigella), 티오바실러스(Thiobacilus), 베이엘로니엘라(Veiellonealla), 비브리오(Vibrio), 크산토모나스(Xanthomonas) 및 예르시니아(Yersinia).
세균의 막은 일반적으로 지질당의 지질 이중층으로 이루어져 있다. 그람-음성 세균과 그람-양성 세균의 세포막, 즉 세포벽 사이에는 차이점이 있다. 그람-음성 세균의 세포벽은 별개의 층으로 이루어진 얇은 구조로 되어 있다. 전형적인 3층 구조를 가지며 세포질 막과 유사한 조성을 갖는 외층이 있다.
그람-음성 세균의 세포벽의 주성분은 지질다당류이다. 또한 인지질, 단백질, 지단백질 및 소량의 펩티도글리칸이 존재한다. 지질다당류는 다당류 잔기의 반복 단위가 부착되어 있는 코어 부위로 이루어진다. 대부분의 그람-음성 세균의 세포벽을 이루는 성분은, 그람-음성 감염으로 인한 발열성 효과와 연관있는 내독소 활성과 관련있다. 이러한 유기체의 균체 항원 특이성을 위한 근거는 측쇄 위에 존재하고 있다. 상이한 당류의 배열뿐만 아니라 성분 측면에서 이러한 측쇄의 화학 조성이 균체 또는 O-항원 결정요소의 성질을 결정하고, 이는 수많은 그람-음성 종을 혈청학적으로 분류하는 중요한 수단이다. 많은 경우에, 상이한 종에 속하는 특정 유기체가 강력한 혈청학적 교차 반응성을 제공하는 이유는, 화학적으로 유사한 탄수화물 잔기를 지질다당류 측쇄의 일부로 갖기 때문이고, 이것은 일반적으로 약 30개의 반복 단위를 갖는다.
그람-양성 세균은 세포벽 구조의 일부로서 펩티도글리칸 및 다당류 및/또는 테이코산을 갖는 것을 특징으로 한다. 종종 무레인이라고도 불리는 펩티도글리칸은 짧은 펩티드를 통해 서로 가교된 글리칸 스트랜드의 헤테로폴리머이다.
무레인의 기본 골격은 베타-1,4-연결되며 교대하는 N-아세틸글루코사민과 N-아세틸 무람산 잔기의 사슬이다. 무람산은 세균의 세포벽과 회합된 특이한 물질이다. 이러한 사슬은 L- 및 D- 아미노산들로 이루어진 짧은 폴리펩티드 사슬에 의해 가교된다. 그람-음성 세균에서는 펩티도글리칸이 구조가 단순하고 대부분의 속에서 비교적 균일한 반면, 그람-양성 세균에서는 구조와 조성에 있어서 매우 큰 차이가 있다. 일반적으로 펩티도글리칸은 다층을 이루고 있다. 또한 몇몇 군에서는 조성에 있어 몇가지 미미한 차이가 기록되었다. 따라서, 미코박테리움 및 노카르디아는 무람산의 N-아세틸 잔기가 산화된 형태의 N-글리콜릴로 대체되어 있다. 폴리펩티드 줄기와 가교 양쪽의 아미노산 조성은 다른 군 사이에서는 광범위하게 다를 수 있다. 이러한 차이는 이들 유기체 분류의 기초를 이룬다.
곰팡이 및 효모는 진균계에 속하는 유기체이다. 비록 수많은 곰팡이와 진균이 인간에게 유익하나, 몇몇은 병원성이며 중독을 일으키거나 사망에 이르게 할 수 있는 유해한 진균독을 방출할 수 있다. 효모 또한 감염을 일으킬 수 있으며, 가장 널리 알려진 것은 효모균 질염일 것이다.
접합균류는 검은 빵곰팡이, 및 식물 및 동물과 공생 관계를 갖고 있는 다른 곰팡이들을 포함하는 진균 강이다. 이러한 곰팡이들은 융합하여 단단한 "접합포자"를 형성할 수 있다. 자낭균류는 진균의 한 강이며, 효모, 흰가루병균, 검은 곰팡이 및 청녹색 곰팡이, 및 느릅나무병(Dutch elm disease), 사과나무검은별무늬병(apple scab) 및 맥각병과 같은 질병을 일으킬 수 있는 몇몇 종을 포함한다. 이러한 진균의 생활사는 유성 생식과 무성 생식을 조합하고, 균사는 핵 및 세포질의 통과가 가능한 다공성의 벽으로 분할된다. 불완전균류는 또다른 강의 진균으로, 앞서 언급한 강이나 담자균류 강 (대부분의 버섯, 소공 진균(pore fungi) 및 말불버섯(puffball fungi)을 포함함)에 쉽게 일치하지 않는 여러 종의 진균 집합을 포함한다. 이러한 불완전균류는 치즈 및 페니실린을 생산하는 종을 포함하나, 또한 무좀 및 백선의 원인이 되는 것과 같은 병원성 종류도 포함한다.
최근 생물의학 분야에서 염료의 사용은 연구에서의 관심과 기술적 중요성 측면에서 괄목할만한 성장을 보여왔다. 염료는 예를 들면, 분석 생화학, 의학적 진단과 심지어는 질병의 치료 및 예방과 같은 수많은 분야에서 사용된다. 이러한 염료의 색은 특정 응용 분야 뿐만 아니라 분광학적 검출 (미국 특허 제5,036,000호) 및 체액 분석 대상물의 측정 (유럽 특허 제0 250 700호)을 위한 단순 유기 반응에서부터 종양의 검출을 위한 고 정밀 영상기술 (Motohashi, Med. Res. Rev., 11, 239, 1991)에 이르는 분야에서 필수적이다. 염료는 또한 질병 치료에 있어 임상적으로 이용될 수도 있다 (미국 특허 제5,468,469호). 피부, 머리, 목, 폐 및 식도의 악성 종양과 같은 특정 종류의 암의 치료에 있어, 광역학적 치료법이 성공적으로 사용되었다 (Sedlacek, "The change in research for the therapy of tumors", Chimia, 45, 52, 1991). 다른 치료적 응용은 염료의 항바이러스성 및 살균성과 연관있다. 염료는 또한 조직학, 형광 바이오라벨링(biolabeling) 및 형광 바이오프로브(bioprobe)의 중요 분야에서 핵심 성분이다. 이와 연관된 기술들은 매우 복잡하며 염색, 세척 및 교차 염색을 필요로 한다 (Blum, "Photodynamic action and disease caused by light", Reinhold, New York, 3, 1941).
본 발명자들은 특정 착색제를 사용함으로써 미생물-지시 스프레이와 신속한 미생물 정량법을 달성할 수 있음을 발견하였다. 본 기술의 잠재적 응용 범위는 주방용 조리대, 손, 의료 구역, 욕실, 침대의 가로널, 의료 용구, 수술대, 가정용품, 주방, 음식물, 음식 조리대 표면, 식품 가공 설비, 문 손잡이, 전화기 및 컴퓨터 키보드와 같은 고체 표면 상에서의 미생물의 검출을 포함하나 이에 한정되지는 않는다. 이러한 착색 염료의 코팅물, 스프레이 또는 용액은 세균 및 기타 미생물의 유해 수준에 대하여 감수성이며, 색 변화는 표면의 세정 및/또는 오염제거가 효과적이었는지를 증명하는 시각적 지시 기구로서 이용된다.
사용되는 염료는 그람-양성 세균과 그람-음성 세균 균주 둘다에 감수성이어야 하기 때문에 지시 기술을 위한 요건이 상당히 엄격하다. 염료는 미생물이나 미생물의 대사산물과 신속히 반응해야만 한다. 최대한의 다목적 용도를 위하여 염료는 효모 및 곰팡이와 같은 기타 미생물에도 감수성이어야 한다.
앞에서 언급하였듯이, 때때로 세포 및 세균의 확인을 위한 염색액으로서 염료가 이용되어 왔다. 염색액이 반응하거나 세포 또는 세균에 의해 선택적으로 계속 유지되어 이들과 백그라운드 또는 존재하는 기타 성분과의 대비를 향상시킴으로써 확인을 돕는다 (Johnson, 1995). 일반적으로 염색액을 표면에 도포하고, 그 후에 미생물의 존재가 드러나도록 진탕하거나 또는 씻어내어 초과분을 제거한다. 본 발명자들은 미생물에 노출되거나 미생물과 상호작용하였을 때 색이 변화하는 착색제에 관한 이전의 어떠한 보고도 아는 바 없다.
용매화발색현상이 관찰되는 색 변화의 원인이 될 수 있으나, 본 발명자들은 하나의 특정 이론에 구애받기를 바라지 않는다. 용매화발색 염료는 용매의 극성 및/또는 수소 결합의 성향과 같은 분자적 환경이 변화할 때 색 변화가 일어난다. 예를 들어, 물과 같은 극성 환경에서 어떤 염료는 청색을 띄고 있으나, 지질-풍부 용액과 같은 비극성 환경에서는 황색이나 적색을 나타낼 수 있다. 이와 같은 "적절한 염료"에 의한 색의 발현은, 하기에 더욱 상세히 기재된 염료의 바닥 상태와 들뜬 상태 간의 분자 극성 차이에 좌우된다. 레이차트 염료가 연구를 위한 모델 염료로 선택되었다.
본 발명자들은, 특정 용매화발색 염료가 특정 세포 성분들 (예컨대, 세포막, 세포질 등)과 세포 외부의 극성 간의 극성 차이에 반응함으로써 미생물을 검출하는데 유용할 수도 있을 것이라는 의문을 가졌다. 본 발명자들은, 미생물이 종이 타월과 같은 기재 위에 코팅된 특정 염료와 접촉하였을 때, 실제로 색 변화가 관찰되었다 - 색 변화가 있었을 뿐만 아니라, 대부분의 경우에 세균과 접촉한 영역에서는 염료가 탈색되었다는 것을 발견하였다. 발명자들에게 놀랍게도, 이후의 연구는 이러한 메카니즘이 전적으로 용매화발색현상에만 기인하는 것이 아닐 수 있다는 것을 시사하였다. 실제로, 본 발명자들은 본원에서 보고하듯이, 놀랍게도, 하기를 알아내었다:
i) 세균 또는 기타 미생물에 의해 탈색되는 염료의 양은 염료에 노출되는 미생물의 농도와 상관관계를 가질 수 있고, 이는 본 방법이 정성적인 것에 대비한 정량적임을 시사한다.
ii) 그람-양성 세균, 그람-음성 세균, 효모 및 곰팡이를 비롯한 일련의 미생물이 검출될 수 있다.
iii) 시험용 염료는 건조 막 코팅물로서 또는 세균 함유 액체에 첨가되는 용액으로서, 또는 스프레이-온(spray-on) 검출기 시스템으로서 사용될 수 있다.
iv) 예를 들어 종이 타월이나 에나멜 표면상에서 건조 코팅물로서 사용될 경우, 이러한 염료가 그로부터 도포되어지는 용매의 성질은 검출 염료의 성능 (탈색 시간, 탈색 영역과 비탈색 영역 간의 대비, 및 감도)에 유의하게 영향을 미친다.
v) 예를 들어 종이 타월상에서 건조 코팅물로서 사용될 경우, 염료와 함께 코팅물에 포함된 첨가제는 검출 염료의 성능 (탈색 시간, 탈색 영역과 비탈색 영역 간의 대비 및 감도)에 영향을 미칠 수 있다. 예를 들어 히드록시프로필-베타-시클로덱스트린은 검출 염료의 성능을 향상시킨다.
vi) 이들 염료의 세균 유도 탈색은 강염기를 사용하여 역전될 수 있다.
용매화발색현상이 관찰되는 색 변화에 기여할 수 있으나, 이러한 관찰 결과는 또한 다른 합당한 메카니즘과 양립할 수도 있다. 예를 들어, 이러한 관찰 결과는 또한 세균의 존재로 인한 염료의 색 변화에 기여할 수 있는 몇몇 유형의 산-염기 상호작용이나, 몇몇 유형의 양성자 공여 반응과 양립할 수도 있다. 본 발명자들은 또한, 특정 염료가 일련의 미생물들에 노출되었을 때, 산화환원 유형의 반응이 감지되는 색 변화에 기여할 수도 있다는 가능성을 완전히 배제하지 않았다. 다른 요인들 또한 미생물의 존재하에서 특정 염료로 관찰되는 색 변화에 기여할 수 있으며, 예를 들면 색 변화를 일으키는 특정 염료와 세포막의 일부의 상호작용이 있을 수 있다. 그러나 또다른 가능성은 세균의 세포벽에 있는 매우 조직화된 산 잔기가 특정 지시제 염료를 양성자화할 수 있으며, 그 결과 색이 소실된다는 것이다.
본 발명자들은 놀랍고도 아직까지 설명되지 않은 현상을 발견하였고, 이들을 사용하여 여러 미생물을 검출하고 정량화하는데 유용한 방법을 개발하였다.
일반적으로 색 변화의 시각적 검출과 관련하여, "색"이라는 것은 물체로부터 반사되거나 방사되는 가시 영역의 여러 파장의 광의 존재 또는 부재를 인간 눈의 기구가 감지할 때 발생하는 지각의 한 종류이다. 눈에 들어온 광은 가시 스펙트럼의 특정 영역에 대해 감수성인 망막의 3종류의 추상세포에 의해 분광학적으로 분석된다. 이러한 세포로부터의 자극은 차례로 망막 뉴런, 시신경 뉴런 및 시각령에 의해 처리되어 색의 지각이 일어난다. 색을 부여하는 몇몇 메카니즘 (예를 들면, 흡광, 방사, 형광, 인광, 굴절, 회절 등)이 있으나, 적절한 것은 흡광에 의한 색에 집중되어 있다. 다른 말로 하면, 본 발명은 광의 특정 파장을 흡수함으로써 그들의 색을 나타내는 염료에 관련되어 있다.
인간의 눈이 기능하는 방식 때문에, 감지되는 색은 일반적으로 물체에 의해 흡수되는 파장의 광과 보색 관계이다. 예를 들어, 백색광 아래에서 볼 때 적색으로 보이는 물체는, 실제로는 490 내지 500 nm 파장 범위의 청색광을 선택적으로 흡수하는 것이다. 이와 유사하게, 백색광 아래에서 볼 때 황색으로 보이는 물체는, 실제로는 435 내지 480 nm 범위의 청색광을 흡수하는 것이다.
분자에 의한 가시광선의 흡수는 분자 내의 전자 전이와 관련있으며 들뜬 상태를 초래한다. 분자의 바닥 상태와 관련된 들뜬 상태 간의 에너지차가 플랭크(Planck) 공식에 따라, 흡수된 광의 파장을 결정한다:
E=hν
식 중, E = 에너지, h = 플랭크 상수, ν = 흡수된 광의 광자의 진동수이며, 이는 파장 λ 및 광의 속도 c와 하기 식의 상관관계가 있다.
ν=c/λ
하기 상태도가 전자 전이를 그림으로 묘사하기 위해 사용될 수 있다:
명백히, 흡수된 광자의 에너지는 광자의 파장에 반비례한다. 따라서 청색 광 (435 내지 480 nm)의 광자는 황색광 (580 내지 595 nm)보다 큰 에너지를 갖고 있다. 따라서, 백색광 아래에서 봤을 때 용액이나 물체 상의 염료의 색은 염료 분자의 바닥 상태와 첫번째 허용된 들뜬 상태 간의 전이 에너지에 의해 결정된다.
염료의 광 흡수 부위는 일반적으로 그 염료의 색소원으로 알려져 있다. 색소원은 콘쥬게이션계와 연결된 발색단을 포함한다. 발색단은 근본적으로 염료를 발색시키는 작용기이며 그 예로, 아조 염료 경우에는 아조기, 카로틴의 경우에는 폴리엔기, 안트라퀴논 염료 경우에는 카르보닐기가 있다. 그외의 발색단이 다수 있다. 조색단은 콘쥬게이션된 색소원에 작용함으로써 염료의 색과 강도에 영향을 준다. 조색단은 색소원과 콘쥬게이션될 수도 있거나 그렇지 않을 수도 있다. 일례로 아미노기는 예를 들어, 벤젠 고리를 통하여 아조기 (발색단)와 콘쥬게이션되어 아미노아조 색소원을 형성할 것이다. 콘쥬게이션된 아미노 조색단은 아조기의 흡수대를 보다 긴 파장으로 변위시키고 흡수대의 강도를 증가시킨다. 그러나 아미노 아조 색소원에 술폰산기를 적절하게 배치시키면 콘쥬게이션되지는 않지만, 전자를 끌어당기는 효과로 흡수를 보다 긴 파장으로 변위시킨다.
바닥 상태가 들뜬 상태보다 더 극성인 염료의 예로는 하기 나타낸 메로시아닌 염료 1이 있다. 전하-분리된 좌측의 카노니칼 1은 바닥 상태의 주요 기여체인 반면, 우측의 카노니칼 1'은 첫번째 들뜬 상태의 주요 기여체이다.
하기 나타낸 인디고 2는 바닥 상태가 들뜬 상태보다 극성이 현저히 낮은 염료의 한 예이다. 좌측의 카노니칼 형태 2는 염료의 바닥 상태의 주요 기여체인 반면, 우측의 카노니칼 2'는 들뜬 상태의 주요 기여체이다.
본 발명의 실시에 적합한 염료는 상기 기재된 것들 뿐만 아니라 레이차트 염료, 메로시아닌 염료, 연속된 π 전자계 안에 형식 양전하와 음전하를 지닌 양쪽성 이온 염료, 4-[2-N-치환-1,4-히드로피리딘-4-일리딘)에틸리덴]시클로헥사-2,5-디엔-1-온, 적색 피라졸론 염료, 아조메틴 염료, 인도아닐린 염료, 디아자메로시아닌 염료 및 이들의 혼합물을 포함한다.
메로시아닌 염료는 문헌 ["Colour and Constitution of Organic Molecules", Academic Press (London) 1976]에 논의된 그리피트(Griffiths)의 공여체-단순 수용체 색소원 분류 내에 속하고, 여기에서 카르보닐기는 전자 수용체 잔기로서 작용한다. 전자 수용체는 예를 들어 히드록실기 또는 아미노기와 같이 전자를 공여할 수 있는 전자 공여기와 콘쥬게이션되어 있다. 메로시아닌 염료는 화학식 3과 같은 구조를 포함하는 비교적 광범위한 부류의 염료이며, 여기서 헤테로시클릭 시스템 안의 질소 원자는 공여체로서 작용한다. n은 0을 포함하는 어떠한 정수도 될 수 있다. 메로시아닌 염료는 전하가 분리 (양쪽성 이온)된 공명 형태를 갖는다.
비닐계 아미드를 비롯한 아시클릭 메로시아닌 염료 또한 알려져 있다.
메로시아닌 염료는 사진 필름에 사용될 때 특정 파장의 광에 대하여 할로겐화 은을 광감작화하는 그의 능력 때문에 연구되었다. 수많은 메로시아닌 염료의 구조가 알려져 있다. 화학식 4 내지 14는 메로시아닌 염료의 몇 가지 비-제한적인 예를 보여준다. 이들 염료 각각에 대하여, 전하 분리된 공명 구조를 유도할 수 있음을 주목한다. 참조문헌이 전하 분리된 (양쪽성 이온) 형태가 염료의 바닥 상태에 유의하게 기여하고 있음을 설명하고 있다.
식 중, R은 메틸, 알킬, 아릴, 페닐 등일 수 있다.
양쪽성 이온
색소원
특정 염료는 영구적으로 양쪽성 이온 형태로 제조될 수 있다. 다시 말해서, 이들 염료는 π-전자계와 회합된 영구 전하를 갖고 있으며, 색소원의 중성 공명 구조를 유도할 수 없다. 이러한 염료는 일반 화학식 16에 부합하는 레이차트 염료 15를 포함한다.
레이차트 염료 외에, 적합한 음성 용매화발색 피리디늄 N-페놀레이트 베타인 염료의 또다른 예는 하기 화학식 16 내지 21로 상술되어 있다.
식 중, R은 수소, -C(CH3)3, -CF3 또는 C6F13이다.
추가의 비-제한적인 화학식 24 내지 32는 일반 화학식 23에 부합하는 하기를 포함할 수 있다.
23
식 중, X는 산소, 탄소, 질소, 황일 수 있다.
염료의 양은 미생물과 접촉시 육안으로 그 변화를 검출할 수 있을 만큼의 색 변화가 일어날 수 있도록 충분해야 하며, 따라서 염료의 감도에 좌우될 것이다. 충분한 것으로 밝혀진 염료의 양은 일반적으로 건조 상태 기준으로 0.001 내지 20 중량%, 몇몇 실시양태에서는 0.01 내지 10 중량%, 몇몇 실시양태에서는 0.05 내지 5 중량%, 몇몇 실시양태에서는 0.1 내지 3 중량%이다. 색 변화는 미생물의 농도 및 유형에 의존되는 방식으로 매우 신속하게 일어난다.
조성물은 상기 기재된 바와 같이 미생물-감수성 착색제 및 이동상을 포함한다. "이동상"이라는 용어는 착색제를 위한 담체로서 사용될 수 있는 액체 및 기체를 포함한다. 아세토니트릴, 테트라히드라푸란; 크실렌; 포름알데히드 (예를 들면, 디메틸포름아미드), 및 알콜 (예를 들면, 메탄올, 에탄올, n-프로판올 및 이소프로판올)이 적합한 담체인 것으로 밝혀졌으나, 어떤 효과적인 담체라도 사용될 수 있다. 이동상은 추가로 소독제 또는 살균제의 조성물일 수도 있다.
착색제 염료는 미생물의 존재를 나타내도록 표면 상에 분무하거나 문질러 바를 수 있는 액체 형태일 수 있다. 염료를 함유하는 액체를 표면에 도포할 수 있고, 도포된 액체가 건조되어, 차후에 미생물에 의한 오염에 노출될 수 있는 염료의 건조 잔류물을 형성한다. 미생물에 노출 시에, 건조 잔류물은 색이 변화하게 되고, 이는 미생물의 존재를 나타낸다. 색 변화는 본 발명에 따라 신속하게 일어날 수 있다. 예를 들면, 색소원은 약 30분 미만 내에, 몇몇 실시양태에서는 약 5분 미만 내에, 몇몇 실시양태에서는 약 1분 미만 내에, 몇몇 실시양태에서는 약 30초 미만 내에, 몇몇 실시양태에서는 약 10초 미만 내에 색이 변화하기 시작할 수 있다.
용액 도포된 염료의 건조 잔류물을 이용하는 그러한 지시 방법은 고체 표면, 예를 들면 미용 화장지 상자와 같은 포장재, 스티커, 종이, 화장지, 의료 용구, 예컨대 수술용 장갑, 수술용 가운 및 드레이프, 안면 마스크, 부팡형 모자(bouffant cap), 수술용 모자 및 두건과 같은 머리 덮개, 검사용 및 수술용 장갑, 구두 싸개, 부츠 싸개 및 슬리퍼와 같은 신발류, 상처 드레싱, 붕대, 멸균 랩, 와이퍼, 실험복, 원피스형 전신 작업복, 에이프런 및 쟈켓과 같은 의복류, 환자용 침구류, 들것 및 유모차 시트, 음식 조리용 랩, 설거지용 스펀지, 클로쓰, 문 손잡이, 전화기, 컴퓨터 키보드, 컴퓨터 마우스, 펜, 연필, 메모장, 화장실 손잡이, 상처 드레싱, 붕대 및 장난감 (예를 들어, 병원 대기실, 탁아시설에 있는)에 사용하기에 유용할 수 있다.
따라서, 용매화발색 염료가 코팅될 수 있는 기재는 와이프 뿐만 아니라 상기 언급한 것과 같은 세균에 노출될 수 있는 기타 물품들을 포함할 수 있다. 또한 용매화발색 염료는 손의 미생물 오염을 파악하기 위해 사용되는 로션이나 크림에 혼입될 수도 있다. 염료는 오염을 경고하기 위해 스펀지나 설거지용 타월에 혼입될 수도 있다.
착색제로 코팅되어 와이프로 사용되기에 적합한 기재는 필름, 직물 및 부직포, 셀룰로스 기재, 예컨대 화장지, 종이 타월 및 코폼 재료, 에어레이드 재료, 본디드-카디드 웹 등을 비롯한 전통적으로 와이프를 위해 사용되는 것들을 포함한다. 기재의 비제한적인 예는 미국 특허 제4,775,582호, 미국 특허 제4,853,281호, 미국 특허 제4,833,003호 및 미국 특허 제4,511,488호에서 찾아 볼 수 있다 (이 모든 특허는 킴벌리-클라크 코포레이션(Kimberly-Clark Corporation)에 양도됨).
부직포는 스펀본딩, 멜트블로잉, 에어레잉, 본딩 및 카딩 등의 공정을 통해 제조될 수 있다. 부직포는 폴리에스테르, 나일론 및 폴리올레핀을 포함하나, 이들로 한정되지는 않는 열가소성 수지로부터 제조될 수 있다. 올레핀은 에틸렌, 프로필렌, 부틸렌, 이소프렌 등과 이들의 조합물을 포함한다.
"스펀본드 섬유"는 예를 들어 미국 특허 제4,340,563호 (Appel 등), 미국 특허 제3,692,618호 (Dorschner 등), 미국 특허 제3,802,817호 (Matsuki 등), 미국 특허 제3,338,992호 및 미국 특허 제3,341,394호 (Kinney), 미국 특허 제3,502,763호 (Hartman) 및 미국 특허 제3,542,615호 (Dobo 등)에서와 같이, 용융된 열가소성 물질을 다수의 미세하고 일반적으로 원형의 모세관인 방사구로부터 필라멘트 형태로 압출한 후에 압출된 필라멘트의 직경을 급속히 감소시키는 방법에 의해 형성된 작은 직경의 섬유이다. 스펀본드 섬유는 수집 표면에 침착되었을 때 일반적으로 끈적이지 않는다. 스펀본드 섬유는 일반적으로 연속적이며 (최소 10개의 샘플로부터) 평균 직경이 7 마이크로미터 이상, 보다 바람직하게는 약 10 내지 20 마이크로미터이다.
"멜트블로운 섬유"는, 용융된 열가소성 물질을 다수의 미세하고 일반적으로 원형인 다이 모세관을 통해 용융된 쓰레드 또는 필라멘트로서 수렴되는 고속의 통상 고온 기체 (예를 들면, 공기) 스트림으로 압출시킴으로써 형성되는 섬유를 의미하고, 상기 고온 기체는 용융된 열가소성 물질의 필라멘트를 가늘게 하여 극세사 직경일 수 있는 그들의 직경을 감소시킨다. 그 후에, 멜트블로운 섬유는 고속 기체 스트림에 의해 운반되고 수집 표면 상에 침착되어 랜덤하게 분산된 멜트블로운 섬유의 웹을 형성한다. 이러한 공정은 예를 들면 미국 특허 제3,849,241호 (Butin 등)에 개시되어 있다. 멜트블로운 섬유는 연속적이거나 불연속적일 수 있는 극세사이고, 이는 일반적으로 10 마이크로미터 미만의 평균 직경을 갖고, 일반적으로 수집 표면 상에 침착되었을 때 점착성이다.
본원에서 사용된 용어 "코폼"은, 제조하는 동안에 웹에 다른 물질을 첨가하는 통로인 활강로 근처에 적어도 하나의 멜트블로운 다이헤드가 배열되어 있는 공정을 의미한다. 이러한 다른 물질은 펄프, 초흡수성 입자, 천연 중합체 (예를 들면, 레이온 또는 면 섬유, 또는 다른 셀룰로스 물질) 및/또는 합성 중합체 (예를 들면, 폴리프로필렌 또는 폴리에스테르) 섬유일 수 있으며, 예를 들어 상기 섬유는 스테이플 길이일 수 있다. 코폼 공정은 일반 양도된 미국 특허 제4,818,464호 (Lau) 및 미국 특허 제4,100,324호 (Anderson 등)에 나타나 있다. 코폼 공정에 의해 제조된 웹은 일반적으로 코폼 재료라고 지칭된다.
본디드 카디드 웹은 코밍 또는 카딩 장치를 통해 보내지는 스테이플 섬유로부터 제조되고, 이것은 기계 방향으로 스테이플 섬유를 파괴하고 정렬시켜, 일반적으로 기계 방향-배향된 섬유상 부직 웹을 형성한다. 웹이 일단 형성되면, 이것을 몇가지 방법, 예컨대 분말 결합, 패턴 결합, 통풍 결합 및 초음파 결합 중 하나 이상에 의해 결합시킨다.
에어레잉 공정에서는, 약 3 내지 약 52 밀리미터 범위의 전형적인 길이를 갖는 소섬유 다발을 분리하고, 공기 공급물 내에 동반시킨 다음, 일반적으로 진공 공급장치의 보조를 받아 성형 스크린 상에 침착시킨다. 그 후에, 랜덤하게 침착된 섬유를 서로에 결합시킨다. 에어레이드 교시의 예는 미국 특허 제4,640,810호 (Laursen 등, 스캔 웹 오브 노쓰 아메리카 인크.(Scan Web of North America Inc.)에 양도됨)에 기재된 댄웹(DanWeb) 공정, 미국 특허 제4,494,278호 (Kroyer 등) 및 미국 특허 제5,527,171호 (Soerensen) (니로 세퍼레이션 a/s(Niro Separation a/s)에 양도됨)에 기재된 크로이어(Kroyer) 공정, 미국 특허 제4,375,448호 (Appel 등, 킴벌리-클라크 코포레이션에 양도됨)의 방법, 또는 기타 유사한 방법을 포함한다.
본 발명자들은, 예를 들어 하이포아염소산나트륨 용액, 염소 및 중아황산 나트륨과 같은 표면 세정에 사용되는 표백제가 용매화발색 염료에 부정적인 영향을 미칠 수 있고 세균이 존재하지 않는다 하더라도 색 변화를 일으킬 수 있음을 발견하였다. 따라서, 본 발명의 또다른 측면은 용매화발색 염료와 함께 와이프 내에 있는 표백 검출 착색제를 포함한다. 지시제는 예를 들면 2,2',5,5'-테트라메틸 벤지딘일 수 있고, 이것은 보통 무색이고 염소 또는 하이포아염소산나트륨에 노출되었을 때 적색으로 변한다. 지시제는 또한 전분 및 요오드의 조합일 수 있고 이것은 염소 또는 하이포아염소산염의 존재하에서 흑색으로 변한다. 또다른 지시제인 푹신(fuchsine)은 메타중아황산나트륨과 같은 아황산염의 검출에 유용할 수 있다. 푹신은 분홍색이고 아황산염에 노출되었을 때 무색으로 변한다. 이러한 방식으로, 와이프의 영역이 세균에 감수성인 것으로 표시될 수 있고, 다른 영역은 표백제 및 보존제에 감수성인 것으로 표시되며, 그 결과 활성 표백제를 함유하는 표면은 색 변화 조합을 제공하여 사용자가 세균 오염을 표백과 구별할 수 있게 된다. 표백제 지시제는 와이프 상에 숨겨진 단어 "BLEACH"를 스펠링대로의 패턴으로 찍어 나타낼 수 있어, 와이프가 표백제를 통과한다면 단어 BLEACH가 용매화발색 염료에 표백제가 일으킬 수도 있는 다른 색 변화와 함께 눈에 보이게 된다. 표백제 지시제의 양은 단지 육안에 의해 검출될 수 있는 색 변화를 일으키기에 충분한 양을 필요로 하고, 용매화발색 염료와 동일한 범위 내에 있다.
본 발명자들은 또한 예를 들면 a) 세균을 검출하는 용매화발색 염료, b) 테트라메틸 벤지딘과 같은 염소/하이포아염소산염 검출제 물질, c) 전분과 요오드화칼륨의 혼합물과 같은 산화제 검출제, d) 푹신과 같은 중아황산염 지시제, e) 아질산염 검출 시약의 소량의 견본을 지시 스트립 상에 포함시킬 수 있다고 믿고 있다. 이러한 방식으로, 다양한 성질의 지시제가 예를 들어 식품의 상태 또는 품질을 제공할 수 있다.
본 발명의 또다른 측면에서, 기재 상의 코팅물을 사용하여 검출 염료(들)가 결정화되는 것을 억제함으로써 미생물에 대해 더욱 높은 감도를 갖는 코팅물을 수득할 수 있다. 이상적으로는, 표면 상에 단일 염료 분자를 갖는 코팅물이 미생물에 대해 높은 감도를 갖는다. 각각의 염료 분자는 미생물 막과 자유롭게 상호작용한다. 반대로, 염료의 작은 결정은 우선 용해된 다음 막을 침투한다. 어떠한 이론에도 구애받기를 원하지 않지만, 본 발명자들은 히드록시프로필-베타-시클로덱스트린, 히드록시에틸-베타-시클로덱스트린, 감마-시클로덱스트린, 히드록시프로필-감마-시클로덱스트린, 히드록시에틸-감마-시클로덱스트린 (이하, 총괄적으로 "시클로덱스트린"이라 함) (이들 모두는 미국 인디애나주 해몬드 소재의 세레스타 인터내셔널(Cerestar International)로부터 입수가능함)이 염료의 결정화를 방해하여, 기재 상에서 더욱 선명한 염료 색이 나타나도록 한다고 믿고 있다. 효과적인 것으로 밝혀진 시클로덱스트린의 양은 0.001 내지 2 중량%, 바람직하게는 0.01 내지 1 중량%, 보다 바람직하게는 0.025 내지 0.5 중량%이다.
특정 계면활성제 또한 미생물을 검출하는데 있어서 염료를 보조하는 것으로 밝혀졌다. 특히 바람직한 계면활성제는 비이온성 계면활성제, 예컨대 에톡실화된 알킬페놀, 에톡실화된 및 프로폭실화된 지방 알콜, 에틸렌 옥시드-프로필렌 옥시드 블록 공중합체, (C8-C18) 지방산의 에톡실화된 에스테르, 에틸렌 옥시드와 장쇄 아민 또는 아미드의 축합 생성물, 에틸렌 옥시드와 알콜의 축합 생성물, 아세틸렌계 디올 및 이들의 혼합물이다. 적합한 비이온성 계면활성제의 여러 특정 예는 메틸 글루세트-10, PEG-20 메틸 글루코스 디스테아레이트, PEG-20 메틸 글루코스 세스퀴스테아레이트, C11 -15 파레트-20, 세테트-8, 세테트-12, 도독시놀-12, 라우레트-15, PEG-20 피마자유, 폴리소르베이트 20, 스테아레트-20, 폴리옥시에틸렌-10 세틸 에테르, 폴리옥시에틸렌-10 스테아릴 에테르, 폴리옥시에틸렌-20 세틸 에테르, 폴리옥시에틸렌-10 올레일 에테르, 폴리옥시에틸렌-20 올레일 에테르, 3 내지 20개의 에틸렌 옥시드 잔기를 포함하는, 에톡실화된 노닐페놀, 에톡실화된 옥틸페놀, 에톡실화된 도데실페놀 또는 에톡실화된 (C6-C22) 지방 알콜, 폴리옥시에틸렌-20 이소헥사데실 에테르, 폴리옥시에틸렌-23 글리세롤 라우레이트, 폴리옥시-에틸렌-20 글리세릴 스테아레이트, PPG-10 메틸 글루코스 에테르, PPG-20 메틸 글루코스 에테르, 폴리옥시에틸렌-20 소르비탄 모노에스테르, 폴리옥시에틸렌-80 피마자유, 폴리옥시에틸렌-15 트리데실 에테르, 폴리옥시-에틸렌-6 트리데실 에테르, 라우레트-2, 라우레트-3, 라우레트-4, PEG-3 피마자유, PEG 600 디올레에이트, PEG 400 디올레에이트 및 이들의 혼합물을 포함하나, 이들로 한정되지는 않는다. 시판되고 있는 비이온성 계면활성제는 미국 펜실바니아주 알렌타운 소재의 에어 프러덕츠 앤드 케미컬즈(Air Products and Chemicals)로부터 입수가능한 아세틸렌계 디올 계면활성제인 설피놀(SURFYNOL; 등록상표) 및 미국 펜실바니아주 피츠버그 소재의 피셔 사이언티픽(Fischer Scientific)으로부터 입수가능한 폴리옥시에틸렌 계면활성제인 트윈(TWEEN; 등록상표)을 포함할 수 있다.
또한 결합제를 사용하여 기재 상에서 착색제의 고정을 용이하게 할 수 있다. 예를 들면, 수용성 유기 중합체가 결합제로서 사용될 수 있다. 수용성 유기 중합체의 한 적합한 부류는 다당류 및 그의 유도체를 포함한다. 다당류는 양이온, 음이온, 비이온성 및/또는 양쪽성일 수 있는 탄수화물 반복 단위를 함유하는 중합체이다. 한 특정 실시양태에서, 다당류는 비이온성, 양이온, 음이온 및/또는 양쪽성 셀룰로스성 에테르이다. 적합한 비이온성 셀룰로스성 에테르는 알킬 셀룰로스 에테르, 예컨대 메틸 셀룰로스 및 에틸 셀룰로스; 히드록시알킬 셀룰로스 에테르, 예컨대 히드록시에틸 셀룰로스, 히드록시프로필 셀룰로스, 히드록시프로필 히드록시부틸 셀룰로스, 히드록시에틸 히드록시프로필 셀룰로스, 히드록시에틸 히드록시부틸 셀룰로스 및 히드록시에틸 히드록시프로필 히드록시부틸 셀룰로스; 알킬 히드록시알킬 셀룰로스 에테르, 예컨대 메틸 히드록시에틸 셀룰로스, 메틸 히드록시프로필 셀룰로스, 에틸 히드록시에틸 셀룰로스, 에틸 히드록시프로필 셀룰로스, 메틸 에틸 히드록시에틸 셀룰로스 및 메틸 에틸 히드록시프로필 셀룰로스 등을 포함할 수 있으나, 이들로 한정되지는 않는다.
본 발명의 또다른 측면에 따라서, 염료는 또한 그것이 노출된 미생물의 양에 관한 정보를 제공할 수 있다는 것이 밝혀졌다. 예를 들면, 레이차트 염료는 강력한 음성 용매화발색 현상을 나타낸다. 즉, 레이차트 염료는 1종 이상의 미생물 존재하에서 청색에서 무색으로 색 변화가 일어날 수 있다. 염료의 색 변화 정도를 시각적으로 또는 기구를 사용하여 측정하여 미생물 농도와의 반-정량적 및/또는 정량적 상관관계를 제공할 수 있다. 예를 들면, 반응시킨 시험 염료의 색을, 미생물에 대한 반응성 측면에서 시험 염료와 동일하거나 유사한 화합물로부터 형성된 대조 염료의 색과 비교할 수 있다 (예를 들면, 시각적으로 또는 기구의 도움으로). 미생물의 서로 다른 농도에 대응하여 복수 개의 대조 염료 또한 사용될 수 있다. 예를 들면, 각각 밀리리터당 103, 104, 105, 106 및 107 콜로니 형성 단위 ("CFU")의 미생물 농도와 반응하는 5가지 대조 염료가 사용될 수 있다. 비교시, 대조 염료 중에서 1종 이상을 시험 시료와 반응하는 시험 염료와 동일하거나 실질적으로 유사한 색을 갖도록 선택할 수 있다. 그 후에, 시료내 미생물의 농도 (또는 농도 범위)를 선택된 대조 염료(들) 및 대응하는 기지 미생물 농도(들)로부터 결정한다. 이에 따라 정량적 (즉, 특정 농도) 또는 반-정량적 (즉, 농도 범위) 결과가 상기 기술을 사용하여 얻어질 수 있다.
필요하다면, 시료에 존재하는 1종 이상의 미생물의 실제 양을 더욱 잘 측정하기 위해 염료의 색 강도를 측정할 수 있다. 한 실시양태에서, 색 강도는 광학식 판독기를 사용하여 측정된다. 광학식 판독기의 실제 구성 및 구조는 당업자에게 용이하게 이해되는 것처럼 일반적으로 다양할 수 있다. 전형적으로, 광학식 판독기는 전자기 방사선을 방사할 수 있는 광원 및 시그널 (예를 들면, 투과되거나 반사된 광)을 기록할 수 있는 검출기를 함유한다. 광원은 전자기 방사선, 예컨대 가시광선 또는 근-가시광선 영역 (예를 들면, 적외선 또는 자외선)의 광을 제공할 수 있는 당업계에 공지된 임의의 장치일 수 있다. 본 발명에서 사용될 수 있는 적합한 광원은 예를 들면, 발광 다이오드 (LED), 섬광등, 냉음극 형광 램프, 전기발광 램프 등을 포함하나, 이들로 한정되지는 않는다. 조명은 다중 방사되고/되거나 시준될 수 있다. 몇몇 경우에는, 조명을 펄스화하여 임의의 백그라운드 간섭을 감소시킬 수 있다. 또한, 조명은 연속적일 수 있거나 지속파 (CW)와 펄스화 조명을 조합할 수 있으며, 이때 복수 개의 조명 빔이 다중 방사되어 (예를 들면, 펄스화 빔은 CW 빔과 다중 방사됨) CW 기원에 의해 유도된 시그널과 펄스화된 기원에 의해 유도된 시그널 사이에 시그널 구별을 가능하게 한다. 예를 들면, 몇몇 실시양태에서는, LED (예를 들면, 알루미늄 갈륨 아르세나이드 적색 다이오드, 갈륨 포스파이드 녹색 다이오드, 갈륨 아르세나이드 포스파이드 녹색 다이오드, 또는 인듐 갈륨 니트라이드 보라색/청색/자외선(UV) 다이오드)가 펄스화 광원으로서 사용된다. 본 발명에서 사용하기에 적합한 UV LED 들뜸 다이오드의 한 시판용 예는 반치폭이 10도이고, 최고 파장이 370 내지 375 나노미터이며, 스펙트럼 반높이 너비가 12 나노미터인 빔으로 10 밀리암페어 (3.5 내지 3.9 볼트)의 순방향 전류에서 750 내지 1000 마이크로와트의 광출력을 내보내는 모델명 NSHU550E (니키아 코포레이션(Nichia Corporation))이다.
몇몇 경우에, 광원은 염료에 확산 조명을 제공할 수 있다. 예를 들면, 복수 개의 점광원의 어레이 (예를 들면, LED)는 상대적으로 확산 조명을 단순히 제공하는 데 사용될 수 있다. 비교적 저렴한 방식으로 확산 조명을 제공할 수 있는 또다른 특히 바람직한 광원은 전기발광 (EL) 장치이다. EL 장치는 일반적으로, 그 중 적어도 하나가 투명하여 광이 빠져나가는 전극들 사이에 개재된 발광 물질 (예를 들면, 인광체 입자)을 이용하는 콘덴서 구조이다. 전극에 전압을 인가하면 발광 물질 내에서 변화하는 전기장이 발생하여, 광을 방사하도록 한다.
검출기는 일반적으로 시그널을 감지할 수 있는 당업계에 공지된 임의의 장치일 수 있다. 예를 들면, 검출기는 공간의 식별을 위해 구성된 전자식 이미지화 검출기일 수 있다. 이러한 전자식 이미지화 센서의 몇몇 예는 고속 선형 전하-결합 소자 (CCD), 전하-주입 소자 (CID), 상보적-금속-산화막-반도체 (CMOS) 소자 등을 포함한다. 이러한 이미지 검출기는 예를 들면, 일반적으로 전자식 광 센서의 2차원 어레이이지만, 단일 라인의 검출기 픽셀 또는 광 센서, 예를 들면 이미지를 스캐닝하기 위한 것들을 포함하는 선형 이미지화 검출기 (예를 들면, 선형 CCD 검출기) 또한 사용될 수 있다. 어레이는 각각 "어드레스"라고 하는 이미 알고 있는 특정한 위치의 세트를 포함한다. 이미지 검출기에서 각각의 어드레스는 소정의 영역 (예를 들면, 전형적으로 박스형 또는 직사각형 모양의 영역)을 덮는 센서가 차지하고 있다. 상기 영역을 일반적으로 "픽셀" 또는 픽셀 영역이라고 한다. 검출기 픽셀은, 예를 들면 CCD, CID 또는 CMOS 센서, 또는 광을 검출하거나 측정하는 임의의 다른 소자 또는 센서일 수 있다. 검출기 픽셀의 크기는 매우 다양할 수 있고, 몇몇 경우에는 직경 또는 길이가 0.2 마이크로미터 정도로 작을 수 있다.
다른 실시양태에서, 검출기는 공간 식별 능력이 결여된 광 센서일 수 있다. 이러한 광 센서는 예를 들면 광전자증배관 장치, 포토다이오드, 예컨대 애벌랜치(avalanche) 포토다이오드 또는 실리콘 포토다이오드 등을 포함할 수 있다. 실리콘 포토다이오드는 이들이 저렴하며, 고감도이며, 고속으로 작업할 수 있으며 (짧은 라이즈타임/넓은 대역폭), 대부분의 다른 반도체 기술 및 모노리식 회로(monolithic circuitry)에 용이하게 통합된다는 점에서 때로는 유리하다. 또한, 실리콘 포토다이오드는 물리적으로 작아서, 이들을 다양한 유형의 검출 시스템에 용이하게 도입할 수 있다. 실리콘 포토다이오드가 사용된다면, 방출된 시그널의 파장 범위는 400 내지 1100 나노미터의 감도 범위 내에 있을 수 있다.
광학식 판독기는 일반적으로 예를 들면, 발광 (예를 들면, 형광, 인광 등), 흡광 (예를 들면, 형광성 또는 비-형광성), 회절 등을 비롯한 임의의 공지된 검출 기술을 이용할 수 있다. 본 발명의 한 특정 실시양태에서, 광학식 판독기는 흡광도의 함수로서 색 강도를 측정한다. 한 실시양태에서, 흡광도 판독값은 미국 버지니아주 소재의 다이넥스 테크놀러지즈 오브 챈틸리(Dynex Technologies of Chantilly)로부터의 마이크로플레이트 판독기 (모델명 MRX)를 사용하여 측정된다. 또다른 실시양태에서, 흡광도 판독값은 문헌 [Pocket Guide to Digital Printing, F. Cost, Delmar Publishers, Albany, NY, ISBN 0-8273-7592-1]의 제144면 및 제145면에서 논의된 "CIELAB"라고 알려진 통상의 시험법을 사용하여 측정된다. 상기 방법은 색 지각의 보색 이론을 기초로 감지된 색의 3가지 지표에 상응하는 세가지 변수 L*, a* 및 b*를 정의한다. 세 변수는 하기 의미를 갖는다:
L* = 0 내지 100 범위의 밝기 (또는 명도), 여기서 0 = 어두움 및 100 = 밝음;
a* = 대략 -100 내지 100 범위의 적색/녹색 축; 양의 값은 적색이고 음의 값은 녹색임;
b* = 대략 -100 내지 100 범위의 황색/청색 축; 양의 값은 황색이고 음의 값은 청색임.
CIELAB 색 공간이 다소 시각적으로 균일하기 때문에, 인간에 의해 감지된 두 색 사이의 차이를 나타내는 단수가 계산될 수 있다. 상기 차이를 ΔE로 하고 두 색 사이의 3가지 차이 (ΔL*, Δa*, 및 Δb*)의 제곱의 합을 제곱근하여 계산한다. CIELAB 색 공간에서, ΔE 단위는 각각 두 색 사이의 "최소 인지차 (just noticeable difference)"와 거의 동등하다. 따라서 CIELAB는 색 관리 및 색 변화의 표시를 목적으로 기준 색 공간으로서 사용될 수 있는 객관적인 장치-독립형 표색계를 위한 양호한 척도이다. 따라서 상기 시험법을 사용하여, 색 강도 (L*, a*, 및 b*)를 예를 들면, 일본 오사카 소재의 미놀타 컴퍼니 리미티드 (Minolta Co. Ltd.)의 소형 분광광도계 (모델명 CM2600d)를 사용하여 측정할 수 있다. 상기 기구는 CIE No. 15, ISO 7724/1, ASTME 1164 및 JIS Z8722-1982 (확산 조명/8도 관측 시스템)에 따라 D/8 기하학적 배열을 이용한다. 표면의 수직선에 대해 8도의 각으로 견본 표면에 의해 반사된 D65 광이 견본-측정 광학 시스템에 투입된다. 또다른 적합한 광학식 판독기는 그 전문이 본원에 참조로 포함되는, 미국 특허 출원 공개번호 2003/0119202호 (Kaylor 등)에 개시된 반사 분광광도계이다. 마찬가지로, 투과식 검출 시스템 또한 본 발명에서 사용될 수 있다.
색 강도 측정 방식과 상관없이, 몇몇 실시양태에서는 결과를 미리 결정된 검출 곡선과 비교할 수 있다. 검출 곡선은 여러 기지 미생물 농도에서 염료의 색 강도를 플롯팅함으로써 만들어진다. 이러한 방식으로, 반응시킨 시험 염료의 색을 측정할 수 있고, 검출 곡선을 사용하여 용이하게 미생물 농도와 상호 연관시켜 사용자에게 정량적 또는 반-정량적 결과를 제공할 수 있다. 검출 곡선을 광범위한 미생물에 대해 만들 수 있지만, 검출 곡선을 단일 종류의 미생물에 대해 만들 수 있다는 것 또한 고려된다. 따라서, 색 강도는 특정 적용에서 해당 미생물의 검출 곡선과 상관관계를 가질 수 있다. 예를 들면, 대장균에 대하여 특유의 반응성을 나타내는 염료가 선택될 수 있다. 이어서 색 변화가 일어나면, 색 강도를 대장균의 미리 결정된 검출 곡선과 상호 연관시킬 수 있다. 또한, 다수 개의 검출 곡선을 여러 종류의 미생물에 대하여 만들 수 있다.
상기 기재한 상호 연관시키는 방법은 자동으로 및/또는 수동으로 실시될 수 있다. 예를 들면, 마이크로프로세서를 임의적으로 이용하여 목적하는 상호 연관시키는 기술을 자동으로 선택하고 검출기로부터의 측정치를 정량적으로 또는 반정량적으로 미생물 농도를 나타내는 결과로 전환시킬 수 있다. 마이크로프로세서는 사용자가 최후 몇몇 결과를 상기하도록 기억 능력을 포함할 수 있다. 당업자라면 임의의 적합한 컴퓨터-판독형 기억 소자, 예컨대 RAM, ROM, EPROM, EEPROM, 플래쉬 메모리 카드, 디지털 비디오 디스크, 베르누이(Bernoulli) 카트리지 등을 사용할 수 있다는 것을 알 것이다. 필요하다면, 결과는 액정 (LCD) 또는 LED 디스플레이를 사용하여 사용자에게 전달될 수 있다.
상기 기재된 상호 연관시키는 기술은 본 발명에 따라 다양한 방법으로 실시될 수 있다. 예를 들면, 임의 갯수의 독립된 검출 영역 (예를 들면, 선, 점 등)을 제공하는 검출 대역을 함유하는 기재를 이용하여 사용자가 시료내 1종 이상의 미생물의 농도를 더욱 잘 측정할 수 있다. 각각의 영역은 동일한 시험 염료를 함유할 수 있거나 상이한 종류의 미생물과 반응하는 상이한 염료를 함유할 수 있다. 예를 들면, 몇몇 염료는 그람-양성 세균에 대해 더욱 고감도이고 몇몇 염료는 그람-음성 세균에 대해 더욱 고감도이다. 이러한 방식으로, 1종 초과의 미생물이 검출될 수 있다. 시험 염료 농도를 또한 선택적으로 조절하여 목적하는 수준의 검출 감도를 제공할 수 있다. 예를 들면, 보다 높은 농도는 낮은 미생물 수준이 추정될 때 높은 수준의 검출 감도를 제공할 수 있다. 필요하다면, 기재는 또한 시험 염료와 동일하거나 이와 유사한 대조 염료가 도포된 대조 대역을 함유할 수 있다. 대조 대역은 일반적으로 시험하는 동안에 색이 변화하지 않아 정량적 및/또는 반-정량적 비교를 위해 사용될 수 있다. 검출 대역과 마찬가지로, 대조 대역 또한 임의 갯수의 독립된 영역을 제공할 수 있다. 예를 들면, 대조 대역은 전술한 바와 같이 상이한 예정된 미생물 농도에 대응하는 영역을 함유할 수 있다. 또한, 상기 영역은 상이한 종류의 미생물에 대하여 상이한 감도 수준을 갖는 염료를 함유할 수 있다.
기재는 염료로 도포될 수 있는 다양한 물질로부터 형성될 수 있다. 예를 들면, 기재는 필름, 종이, 부직포, 편직물, 제직물, 발포체 등으로부터 형성될 수 있다. 한 특정 실시양태에서, 기재는 라벨의 제조에 통상 이용되는 원단(facestock) 물질, 예컨대 종이, 폴리에스테르, 폴리에틸렌, 폴리프로필렌, 폴리부틸렌, 폴리아미드 등이다. 접착제, 예컨대 감압 접착제, 열-활성화 접착제, 용융 접착제 등을 원단 물질의 한 표면 이상에 이용하여 원단 물질을 목적하는 물품에 부착시키는 것을 보조할 수 있다. 감압 접착제의 적합한 예는 예를 들면, 아크릴계 접착제 및 탄성 접착제를 포함한다. 한 실시양태에서, 감압 접착제는 아크릴산 에스테르 (예를 들면, 2-에틸 헥실 아크릴레이트)와 극성 공단량체 (예를 들면, 아크릴산)의 공중합체 기재이다. 접착제는 두께가 약 0.1 내지 약 2 밀 (2.5 내지 50 마이크로미터)의 범위일 수 있다. 사용하기 전에 접착제와 접촉하는 박리 라이너 또한 이용될 수 있다. 박리 라이너는 당업계에 공지된 다양한 물질, 예컨대 실리콘-코팅된 종이 또는 필름 기재를 함유할 수 있다. 사용하는 동안에, 처리된 기재 및 접착제는 박리 라이너로부터 박리된다. 그 후에, 접착제를 목적하는 위치에 인접하게 위치시켜 처리된 기재를 주위에 노출시킨다.
도 17에, 기재가 측방 유동 장치 (20)인 본 발명의 또다른 실시양태가 도해되어 있다. 보다 구체적으로, 장치 (20)는 유체 매질로서 작용하고 임의로는 경질 재료 (도시되지 않음)에 의해 지지되는 다공막 (23)을 함유한다. 일반적으로, 다공막 (23)은 시료가 통과할 수 있는 다양한 물질로부터 제조될 수 있다. 예를 들어, 다공막 (23)을 형성하기 위해 사용되는 물질은 합성 개질되는 천연, 합성 또는 자연 발생 물질, 예컨대 다당류 (예를 들면, 종이와 같은 셀룰로스 물질 및 셀룰로스 아세테이트 및 니트로셀룰로스와 같은 셀룰로스 유도체); 폴리에테르 술폰; 폴리에틸렌; 나일론; 폴리비닐리덴 플루오라이드 (PVDF); 폴리에스테르; 폴리프로필렌; 실리카; 무기 물질, 예컨대 탈활성화된 알루미나, 규조토, MgSO4, 또는 비닐 클로라이드, 비닐 클로라이드-프로필렌 공중합체 및 비닐 클로라이드-비닐 아세테이트 공중합체와 같은 중합체의 다공성 중합체 매트릭스에 균일하게 분산된 기타 무기 미분 물질; 자연 발생 (예를 들면, 면) 및 합성 (예를 들면, 나일론 또는 레이온) 클로쓰; 다공성 겔, 예컨대 실리카 겔, 아가로스, 덱스트란 및 젤라틴; 중합체 필름, 예컨대 폴리아크릴아미드 등을 포함할 수 있으나, 이들로 한정되지는 않는다. 한 특정 실시양태에서, 다공막 (23)은 니트로셀룰로스 및/또는 폴리에테르 술폰 물질로부터 형성된다. "니트로셀룰로스"라는 용어는 니트로셀룰로스 단독이거나 또는 질산 및 다른 산, 예컨대 탄소수 1 내지 7의 지방족 카르복실산의 혼합된 에스테르일 수 있는 셀룰로스의 질산 에스테르를 지칭하는 것으로 이해되어야 한다. 장치 (20)는 또한 흡수 패드 (28)를 함유할 수 있다. 흡수 패드 (28)는 일반적으로 전체 다공막 (23)을 통해 이동하는 유체를 수용한다. 당업계에 널리 공지된 것처럼, 흡수 패드 (28)는 막 (23)을 통한 모세관 작용 및 유체 유동을 용이하게 하는 것을 보조할 수 있다.
시료내 미생물의 검출을 개시하기 위해, 사용자는 시료를 이들이 차후에 이동하는 다공막 (23)의 일부에 직접 도포할 수 있다. 별법으로, 시료를 우선, 다공막 (23)과 유동 소통하는 샘플링 패드 (도시되지 않음) 및/또는 콘쥬게이트 패드 (도시되지 않음)에 도포할 수 있다. 샘플링 패드 및 콘쥬게이트 패드를 형성하기 위해 사용될 수 있는 몇몇 적합한 물질은 니트로셀룰로스, 셀룰로스, 다공성 폴리에틸렌 패드 및 유리 섬유 여과지를 포함하나, 이들로 한정되지는 않는다. 도포되는 곳과 상관없이, 시료는 미생물의 존재를 시그널링할 수 있는 다공막 (23)에 의해 한정된 검출 대역 (31)으로 이동한다. 특히, 도 17에 도시된 것처럼, 검출 대역 (31)은 1종 이상의 미생물과 접촉시 검출가능한 색 변화를 나타내는 시험 염료를 포함한다. 분석 장치 (20)는 또한 대조 염료로 도포되고 임의로는 검출 대역 (31)의 하류에 위치하는 대조 대역 (32)을 이용한다. 대조 대역 (20)은 시험하는 동안에 일반적으로 색이 변화하지 않아 반-정량적 및/또는 정량적 비교를 위해 사용될 수 있다.
시험 염료 및 대조 염료는 때때로 다공막 (23)의 매트릭스를 통해서는 실질적으로 확산되지 않는 방식으로 도포된다. 그에 따라 사용자가 목적하는 반응 시간 후에 염료의 색을 용이하게 검출할 수 있다. 예를 들면, 염료는 다공막 (23)의 표면에 존재하는 관능기와 이온 결합 및/또는 공유 결합을 형성하여 고정된 상태로 잔류한다. 한 실시양태에서, 양으로 하전된 염료는 몇몇 다공막 (예를 들면, 니트로셀룰로스)의 표면에 존재하는 음으로 하전된 카르복실기와 이온 결합을 형성할 수 있다. 별법으로, 염료가 다공막 (23)의 매트릭스로 확산되는 것을 실질적으로 억제하는 특정 성분을 염료 용액에 첨가할 수 있다. 기타 경우에는, 고정화가 필요하지 않을 수 있고, 대신 염료가 시료와의 반응을 위해 다공막 (23)의 매트릭스로 확산될 수 있다.
하기 실시예가 본 발명의 다양한 실시양태를 예시하는 것을 도와준다.
실시예
재료
별도의 언급이 없는 한 모든 시약과 용매는 알드리치 케미컬 컴퍼니 인크. (Aldrich Chemical Company Inc.; 미국 위스콘신주 밀워키)로부터 입수하였으며, 추가의 정제없이 사용하였다. 본 연구를 위하여 사용된 미생물은 하기와 같다:
1. 그람 음성 (생균)
- 에스케리키아 콜라이(ATCC #8739)
- 슈도모나스 애루기노사(ATCC #9027)
- 살모넬라 콜레라슈스(Salmonella choleraesuis)
- 가드네렐라 바기날리스(Gardnerella vaginalis)
2. 그람 양성 (생균)
- 스타필로코쿠스 아우레우스(ATCC #6538)
- S. 자일로시스(S. Xylosis)
- 락토바실러스 액시도필러스(Lactobacillus acidophilus)
3. 그람 양성 (사균)
- 스타필로코쿠스 아우레우스(ATCC #6538)
- S. 자일로시스
4. 효모 (생균)
- 칸디다 알비칸스
5. 곰팡이 (생균)
- 아스퍼질러스 니게르
6. 바이러스
- 폴리오 바이러스 제1형
- 헤르페스 심플렉스 바이러스 1 (HSV-1)
- 리노바이러스
- 미즐즈
- 백시니아
- 인플루엔자 A
모든 바이러스는 미국 뉴저지주 페어필드 소재의 지브랄타르 래보러토리즈, 인크.(Gibraltar Laboratories, Inc.)로부터 입수하였다. 레이차트 염료 (2,6-디페닐-4-(2,4,6-트리페닐피리디니오)-페놀레이트) 및 1-도코실-4-(4-히드록시스티릴)-피리디늄 브로마이드는 미국 위스콘신주 밀워키 소재의 알드리치 케미컬 컴퍼니로부터 구입하였다. 본 연구에서 사용된 다른 메로시아닌들은 직접 합성하였고 하기에 상세히 기재되어 있다.
메로시아닌
염료의 합성
1-데코실-4-(4-히드록시스티릴)-피리디늄 브로마이드는 알드리치 케미컬 컴퍼니 (미국 위스콘신주 밀워키)로부터 구입하여 직접 사용하였다.
메로시아닌 염료의 추가 예들은 2단계 반응을 통해 실험실에서 합성되었다.
합성 방법을 사용하여 제조된 합성 염료는 도 3에 나타내었다.
도 4에 도시된 것처럼, 메틸 요오다이드를 빙조에서 이소프로판올 50 ml 중 δ-피콜린의 교반 용액에 서서히 첨가하였다. 첨가를 완료한 후에, 반응물을 가열 환류시키고 2시간 동안 계속 환류하였다. 그 후에, 빙조에서 용액을 냉각한 뒤 부흐너(Buchner) 깔때기에서 침전물을 여과하고, 냉각된 알콜로 세척하였다. 이어서 2시간 동안 증기 후드에서 분말을 건조시켰다. 조 생성물의 수율은 18.6 그램이었다. 조 생성물을 더 이상 정제하지 않고 다음 단계에 직접 사용하였다.
도 5에 도시된 것처럼 N-메틸-δ-피콜론 (9.4 g, 0.04 몰) 및 바닐린 (6.1 g, 0.04 몰)을 모두 에탄올 50 ml 중에서 교반하면서 용해시켰다. 상기 용액에 피페리딘 (3.4 g, 0.04 몰)을 첨가하고, 혼합물을 16시간 동안 환류하였다. 그 후에, 반응 혼합물을 빙조에서 냉각하고 부흐너 깔때기를 사용하여 생성물을 여과하고 냉각된 에탄올로 세척하였다.
그 후에, 상기 화학식 13 (여기서, R=메틸)의 조 염료를 60분 동안 0.2몰 수산화칼륨 용액 250 ml 중에서 교반하여 양쪽성 이온을 형성한 뒤 부흐너 깔때기를 사용하여 여과하였다. 이어서 최소량의 1:1 물/메탄올 혼합물로부터 염료를 결정화하였다. 수율은 9.4 g (98%)이었다.
다른 염료도 각각의 알킬 요오다이드로부터 출발하여 유사한 방식으로 합성하였다. 하기 표 1은 3가지 다른 R기의 화합물 및 화학식 13의 염료의 수율을 나타내고 있다.
| 합성된 알킬 유도체 및 수율 | |
| 알킬기 | 수율(%) |
| R=메틸 | 98 |
| R=헥실 | 92 |
| R=도데실 | 87 |
실시예
1: 사전 오염된 표면에
아세토니트릴
용매 중의
레이차트
염료 도포
스프레이로서 이들 염료의 사용을 연구하기 위해, 레이차트 염료 용액 (아세토니트릴 10 ml 중 160 mg)을 제조하였다. 에어로졸 추진체를 갖는 스프레이병을 이용하여 스프레이 장치를 형성하였다.
생닭의 다리를 수일간 상온에 방치하여 높은 세균 수준을 보장하였다. 도 6에 도시된 것처럼, 닭 다리를 세라믹 플레이트 표면 상에 몇 초간 놓아둔 뒤 (6A), 제거하고, 그 후에 닭즙의 잔류물을 제거하기 위해 표면을 압지로 닦아냈다 (6B). 이어서, 스프레이병을 이용하여 표면에 레이차트 염료 용액을 분무하였다 (6C). 반복성을 보장하기 위해 추가의 닭 조각으로 시험을 반복하여 유사한 결과를 얻었다.
표면에 지시제 염료 용액을 분무한 후, 닭과 접촉하였던 전 영역이 탈색되었으며 (즉, 지시제 스프레이의 색이 청색에서 매우 옅어지거나 무색으로 변함), 닭의 윤곽을 나타내었다 (6D). 표면상에 닭이 놓여졌던 곳에 상응하는 정확한 지점에서 염료가 신속히 탈색되었다.
실시예
2: 오염된 표면에 이소프로판올 중의
레이차트
염료 도포
이소프로판올은 그 자체의 소독 능력으로 인해 추가의 이점을 가질 수 있는담체로서 연구되었다. 레이차트 염료를 이소프로판올에 용해시켰다 (이소프로판올 10 ml 중의 염료 160 mg). 세균 오염을 시험하기 위한 "실세계" 표면으로서 플라스틱 문 손잡이를 이용하였다. 오래된 닭에서 생긴 즙을 사용하여 손잡이 중 하나의 표면을 표시하였다. 나머지 문 손잡이는 대조군으로서 오염되지 않은 채로 남겨 두었다. 두 손잡이 모두를 닦아냈다. 염료의 이소프로판올 용액을 두 표면 모두에 분무하였다. 레이차트 염료의 청색에서 무색으로의 탈색에 의해 문 손잡이의 오염 영역을 용이하게 관찰하였다.
실시예
3: 오염된
표면 상에서
위 양성(False Positives) 판독을 위한 이소프로판올 중의
레이차트
염료 지시제의 분무 시험
레이차트 염료 지시제는 닭에서 유래한 미생물에 대하여 높은 감도를 보이는 것으로 나타났다. 지시제를 위 양성 판독인지를 시험하기 위해, 지질 및 단백질과 같은 닭즙의 다른 성분이 사용되었다. 비-세균성이면서 잠재적인 간섭의 가능성이 높은 닭 브로쓰가 사용되었다.
새로 개봉한 캔의 스완슨(Swanson; 등록상표) 닭 브로쓰 (미국 뉴저지주 소재의 캠프벨 수프 컴퍼니(Campbell Soup Co.), 소매 식료품점에서 구입 가능함)를 세라믹 표면 상에 피펫으로 떨어뜨리고, 스코트 (SCOTT; 등록상표) 종이 타월로 닦아 건조하였다. 또한 기지의 양성 대조군으로서, 오래된 닭에서 생긴 즙을 세라믹 표면 상의 다른 위치에 피펫으로 떨어뜨리고 닦아 건조하였다. 레이차트 염료 지시제 (이소프로판올 10 ml 중 160 mg)를 세라믹 표면 상에 분무하였더니 명확하게 오래된 닭즙 (따라서 세균)을 함유하는 면만이 탈색되었다. 본 실험을 통하여, 닭의 경우에 탈색 반응을 일으키는 것이 닭의 지방이나 단백질 같은 몇몇 이차 성분이 아니라, 실제로 세균인 것으로 결론내릴 수 있었다.
실시예
4: 오염된
표면 상에서
세정 보조제로서
레이차트
염료
지시제
스프레이
세정 보조제로서 이소프로판올 중 레이차트 염료 스프레이의 사용 또한 시험하였다. 도 7에 도시된 것처럼, 사각형 모양의 세라믹 표면을 절반으로 나누어 양쪽 모두에 오래된 닭즙을 세로로 발랐다 (7A). 하나의 절반 A면에, 스코트 (등록상표) 종이 타월로 표면을 철저하게 닦는 것 외의 다른 세정은 실시하지 않았다. 나머지 절반 B면에는, 킴벌리-클라크 프로페셔널 모이스춰라이징 인스턴트 손 소독제 (60% 에탄올 용액, 미국 조지아주 로즈웰)를 타월에 묻혀, 표면을 세정하는데 사용하였다 (7B). 그 후에, 세정에 차이가 있는지를 판단하기 위해 레이차트 염료 스프레이를 도포하였다 (7C). 세정제가 도움이 되기는 했으나, 몇몇 영역을 "놓친" 것을 알 수 있었다 (7D). 다음으로, K-C 프로페셔널 소독제로 다시 양쪽의 가늘고 긴 영역의 아래 절반을 철저하게 세정하고, 이때 가장 세정이 필요한 곳을 나타내기 위해 스프레이로부터 나타난 표시를 사용하였다 (7E). 상기 영역에 다시 분무를 하면 (7F), 탈색이 일어나지 않았고 이는 표면의 청결함을 증명하였다 (7G).
실시예
5:
레이차트
염료로 코팅된 종이 물질의 탈색
본 실험은 세균 오염에 대한 레이차트 염료의 표면 코팅물의 반응능을 시험하였다. 도 8에 도시된 것처럼, 종이 시트를 레이차트 염료 용액 (80 mg/10 ml 아세토니트릴)으로 브러쉬-코팅하였다 (8A). 상기 종이에 107, 106, 105 및 104 CFU/ml의 대장균 또는 S. 아우레우스 용액 100 ㎕ 분량을 첨가하였다 (8B). 물을 음성 대조군으로서 사용하였다. 두 종류 모두 세균으로 오염되었을 때 염료의 색이 신속히 사라졌으나 (8C), S. 아우레우스의 경우에 더욱 신속하였다 (8D). 두 세균 용액이 모두 실제로 107 CFU/ml 농도였으나, 대장균 용액이 1 X 107 CFU/ml인 것에 비해, S. 아우레우스 용액의 실제 농도는 7 X 107 CFU/ml라는 것이 후에 밝혀졌다. 세균 용액에 대해 신속한 탈색 (1분 미만)이 관찰된 반면, 물은 수분 후에 염료의 약간의 탈색을 일으켰다.
자가-접착 스티커 (에버리-데니슨(Avery-Dennison)) 종이 시트를 2가지 다른 농도의 레이차트 염료 용액 (160 mg/10 mL 아세토니트릴, 80 mg/10 mL 아세토니트릴)으로 브러쉬-코팅하였다. 스티커를 하기스(Huggies; 등록상표) 젖은 와이프 상자의 뚜껑 및 래치 장치에 부착하였다. 장갑 낀 손으로 스티커의 표면에 107 CFU/mL의 S. 아우레우스를 옮겼다. 두 농도 모두에서 신속히 탈색되었으나, 보다 낮은 농도의 염료를 도포한 표면에서 탈색이 보다 쉽게 보였으며, 이는 검출과 명확한 시각적 대비를 보이는 최적의 코팅 농도가 있을 수 있음을 나타낸다. 스티커는 다양한 용도에서 세균 오염을 쉽고 신속하게 검출하는 수단을 제공할 수 있다.
실시예
6:
레이차트
염료를 이용한 세균 농도의 정량화
기재에 고정된 염료를 액상 세균과 접촉 (실시예 5)시키는 것보다는 기재 상에서 세균을 액상 염료를 사용하여 시험함으로써 레이차트 염료-기반 세균 지시제의 신규한 잠재력을 파악할 수 있었다. 본 실험은 어떤 표면에 있는 기지 농도의 세균에 염료 용액이 어떻게 반응하는지를 밝혀내는데 주력하였다. 100 ㎕의 108 CFU/ml 그람-양성 세균을 스코트 (등록상표) 타월에 묻혔다 (도 9A). 이 지점에 아세토니트릴에 용해된 레이차트 염료 (10 ml 아세토니트릴 중의 160 mg) 한 방울을 떨어뜨렸다 (9B).
비교를 위해, 염료를 떨어뜨린 지점을 타월 위에서 건조시킨 후 동량의 세균을 첨가하였다. 일단 세균이 있는 지점에 첨가되면, 레이차트 염료는 즉시 탈색되었다. 이와 반대로 염료-함유 셀룰로스 타월 상에 있는 세균의 반응은, 탈색에 수분이 소요되었다. 세균이 있는 지점에 추가로 염료 방울을 적가하면 (9C), 네번째 방울까지 탈색 상태가 유지되었다가, 이 시점부터 보라색이 지속되었다 (9D). 피펫으로 아세토니트릴을 첨가하여 염료가 코팅된 스코트 (등록상표) 타월 위의 염료 색을 다시 복구하려는 시도는 실패하였다 (9E).
실시예
7:
레이차트
염료를 이용한 세균 지시제의 적정 시험
기재-고정 세균에 의한 염료 용액의 신속한 탈색과 그 반응이 종료점에 도달한다는 사실의 발견은, 세균의 CFU/ml에 관한 정량적 정보를 제공하는 염료의 능력에 관한 조사를 촉진시켰다. 본 실험은 기재-고정 세균의 여러 농도를 염료로 적정하여 색을 안정화시키는데 필요한 염료의 양이 세균의 CFU/ml에 따라 변하는지를 확인하는데 목적이 있다.
연속 희석된 S. 아우레우스 세균 현탁액 100 ㎕를 각각 스코트 (등록상표) 종이 타월에 묻혔다. 레이차트 염료의 아세토니트릴 용액 (40 mg/10 ml)의 방울 (10 ㎕)을 피펫을 이용하여 세균이 있는 각 지점에 떨어뜨렸다. 염료 용액은 처음에는 색을 띄나 거의 즉각적으로 (1초 미만) 탈색이 되며, 염료가 더 이상 탈색되지 않으며 보라색/청색이 흐려지지 않을 때까지 동일한 지점에 추가로 방울을 떨어뜨렸다. 이를 상이한 세균 농도를 묻힌 각각의 지점에서 반복하였다.
결과는 표면 또는 기재 상에서 세균 오염 수준과 충분한 상관관계가 있음을 보여 주었다.
실시예
8: 오래된 여성 소변 내의 세균 적정
본 신규 방법의 실제 사용 예를 예증하기 위해, 오래된 풀링 여성 소변 샘플 (100 ㎕)을 셀룰로스 타월에 묻혀 몇몇 지점에서 각각 100 ㎕ 부피의 소변을 제공하였다. 2종류의 염료 용액을 적정 연구를 위하여 사용하였다: 40 mg 염료/10 ml 아세토니트릴 및 160 mg 염료/10 ml 아세토니트릴. 이어서 염료 용액을 10 ㎕ 분량으로 소변 지점에 떨어뜨리고, 청색/보라색 염료 색이 유지될 때까지 계속하였다 (즉, 색이 일정해질 때까지 소변에 염료를 첨가함). 표 2는 염료 색이 계속 일정하게 유지되기 (즉, 더 이상 탈색되지 않기) 위해 필요한 각 염료 용액의 부피를 나타내고 있다. 오래된 여성 소변은 세균 오염 수준이 높은 것으로 알려져 있으며, 본 사전 연구는 상기 특정 샘플이 높은 수준으로 오염되었다는 것을 보여주었다.
| 풀링 여성 소변의 세균 정량화 | ||
| 샘플 | 4 mg/ml 염료 용액 | 16 mg/ml 염료 용액 |
| 소변 | 120 ㎕ | 30 ㎕ |
더욱 농축된 (4배 농축) 염료 용액보다 더욱 희석된 (4배 희석) 염료 용액이 4배로 필요하다는 것이 흥미롭다. 이것은 포화 상태를 위해 필요한 양을 최소화하기 위해 최고 농도의 염료를 사용함으로써 서로 다른 산업 분야 (식품 대 의료 등)에서 나타나는 다양한 CFU 수준에 지시제 시스템을 맞출 수 있도록 한다. 예를 들어, 닭 부위는 시간과 보관 상태에 따라 어느 지점이나 102 내지 109의 세균 농도를 초래할 수 있다. 그러나, 식품 생산자 및 취급자들은 질병에 대한 우려로 인하여 107이나 이보다 높은 수준에만 주의를 기울인다. 반면, 병원은 일반적으로 질환, 질병, 또는 수술 때문에 몇몇 방식으로 이미 면역 결핍된 환자들을 치료하고 있다. 따라서 병원 직원은 대부분의 다른 산업 분야보다 훨씬 낮은 수준의 세균에도 주의를 기울여야 하고 감염되기 쉬운 환자들의 감염 위험을 감소시키기 위하여 지시제 염료 농도를 그들의 특별한 요구에 맞춤으로써 잠재적으로 이득을 얻을 수 있다.
실시예
9: 세균, 곰팡이 및 효모를 비롯한 다양한 미생물에 대한 세균
지시제
시험
앞에서 기재한 것과 동일한 방식으로, 세균 및 기타 미생물을 피펫으로 떨어뜨리는 기재로서 셀룰로스 타월을 사용하였다. 107 CFU/ml의 S. 아우레우스, C. 알비칸스 (효모), G. 바기날리스, 대장균, P. 애루기노사 및 L. 액시도필러스를 타월에 피펫으로 떨어뜨렸다 (각각 100 ㎕). 추가로, 105의 A. 니게르 (흔한 곰팡이)를 타월에 피펫으로 떨어뜨렸다. 그 다음 레이차트 염료 용액 (10 ml 아세토니트릴 중의 160 mg)을 10 ㎕ 분량으로 각 지점에 첨가하고 지속적인 색을 얻는데 필요한 방울의 수를 계수하였다.
각 유기체에 대하여 지속적으로 보라색을 유지하는데 필요한 염료의 양을 표 3에 나타내었다. 가장 강력한 반응은 L. 액시도필러스에서 관찰되었고, 뒤이어 S. 아우레우스, G. 바기날리스, 대장균, P. 애루기노사, C. 알비칸스, 그리고 마지막은 A. 니게르였다. 그람-음성인 G. 바기날리스만큼 그람-양성인 S. 아우레우스도 강력한 반응을 보이는 것 같지만, 정상상태 반응에 도달하는 데 필요한 양은 다양한 종류의 세균 및 병원체에 따라 서로 상이하였다.
| 레이차트 염료를 이용한 다양한 미생물의 적정 | ||
| 화합물 | 종류 | 지속적인 색을 얻는데 필요한 염료의 양 (㎕) |
| 락토바실러스 | 그람(+) | 110 |
| S. 아우레우스 | 그람(+) | 90 |
| G. 바기날리스 | 그람(-) | 90 |
| 대장균 | 그람(-) | 80 |
| P. 애루기노사 | 그람(-) | 80 |
| C. 알비칸스 | 효모 | 70 |
| A. 니게르 | 곰팡이 | 50 |
실시예
10: 세균 세포벽 성분에 대한
레이차트
염료
지시제
시험
본 지시제 기술이 어떻게 작용하는지는 세균 세포벽에서 통상 발견되는 분자를 이용하여 파악할 수 있었다. 그람-양성 세균 및 그람-음성 세균의 표면을 차지하는 화합물에 몇몇 공통성이 있으나, 그들의 배열 및 화학적 조성은 서로 다르다. 그람-음성 세균은 지질다당류 (LPS)로 코팅된 외막을 지니고 있다. LPS는 그람-음성 세균의 표면에 순-음전하를 제공하고, 그것의 병원성에 기여한다. 그람-양성 세균은 두꺼운 펩티도글리칸 또는 무레인의 시트형 층으로 코팅되어 있다. 시트는 교대하는 N-아세틸글루코사민과 N-아세틸무람산 분자로부터 형성된다. 또한 테이코산도 그람-양성 세균에서 발견되며, N-아세틸무람산에 연결될 수 있다. 그람-음성 세균도 펩티도글리칸을 갖고 있으나, 그람-양성 세균의 층이 훨씬 두껍다. 게다가, 그람-음성 세균의 펩티도글리칸 층은 LPS 층의 아래에 위치하고 있어, 표면에서부터 접근하기가 어렵다.
스코트 (등록상표) 종이 타월에 대장균-유래 해독된 지질다당류 (지질 A 성분 제거됨), 스트렙토코쿠스 패칼리스(Streptococcus faecalis) 유래의 리포테이코산, 대장균-유래 지질다당류, 및 무람산의 용액을 묻혔다. 순수 LPS를 제외한 모든 용액은 5% (중량/중량), 1% (중량/중량) 및 0.2% (중량/중량) 농도로 제조하였다. 순수 LPS는 안전성 때문에 0.1% (중량/중량), 0.02% (중량/중량) 및 0.004% (중량/중량)로 제조하였다. 레이차트 염료 (10 ml 아세토니트릴 중의 160 mg)를 10 ㎕ 분량으로 각 지점에 첨가하고 지속적인 색을 얻는데 필요한 염료의 양을 기록하였다. 종이 타월의 염료 지점에 세포벽 화합물을 떨어뜨리는 반대의 실험 또한 실시하였다.
무람산은 가장 강력한 반응을 일으켜서, 양쪽 실험 설정에서 염료의 거의 즉각적인 탈색을 초래하였다. 다른 화합물도 결국 염료의 탈색을 일으키나, 무람산만큼 강력하게 반응하지는 않는 것으로 보인다. 무람산은 그람-양성 세균에서 보다 높은 농도로 발견되기 때문에, 이러한 결과는 상기 염료의 CFU/mL 데이터를 제공하는 능력 뿐만 아니라, 반응의 강도와 속도에 기초하여 그람-양성 세균 및 그람-음성 세균을 구별하는 능력을 보여주고 있다.
실시예
11: 닭 관련 성분의 시험
레이차트 염료 지시제는 상온에서 보관하였던 생 닭고기에서 성장하는 미생물에 대하여 높은 감수성을 갖는 것으로 나타났다. 그러나 위 양성 판독의 가능성을 고려할 때, 지질 및 단백질과 같은 닭즙의 다른 성분에 대한 지시제의 반응 시험이 필요하게 되었다. 자연 발생 물질로 인한 잠재적인 간섭을 감시하기 위하여, 캔에 든 닭 브로쓰를 지질, 단백질 등과 같은 닭 유래 산물을 함유하는 대조군으로서 이용하였다.
새로 개봉한 스완슨 (등록상표) 닭 브로쓰를 고온 플레이트 표면에 피펫으로 떨어뜨리고 스코트 (등록상표) 타월로 닦아 건조하였다. 양성 대조군으로서 며칠간 상온에서 보관한 생닭의 즙도 고온 플레이트에 피펫으로 떨어뜨리고 닦아 건조하였다. 레이차트 염료 지시제 (10 ml 이소프로판올 중의 160 mg)를 표면에 분무하였더니, 명백하게 오래된 닭즙 (따라서 세균)을 함유하는 면만이 탈색되었다. 본 실험으로부터, 닭의 경우에 있어서 탈색 반응을 일으키는 것은 닭의 지방이나 단백질 같은 몇몇 다른 성분들이 아니라 실제로 미생물의 존재라고 결론내릴 수 있었다.
실시예
12: 강염기가
레이차트
염료의 탈색에 미치는 영향
무람산과 같은 세포벽 성분과 레이차트 염료의 상호작용에 관한 예비 결과와 잠재적인 위 양성 판독을 확인하기 위한 작업은, 산과의 반응이 레이차트 염료의 탈색에 기여할 수 있다는 점을 암시하였다. 그에 따라, 산-염기 반응이 관찰되어지는 색 변화에서 소정의 역할을 할 수 있다고 추측하였다. 탈색된 레이차트 염료에 대한 강염기의 효과를 시험하기 위한 실험을 계획하였다.
레이차트 염료 (10 ml 아세토니트릴 중의 160 mg) 몇 방울을 피펫을 이용하여 스코트 (등록상표) 타월에 떨어뜨리고 건조하였다. 색 변화를 일으키는 것으로 알려진 두 화합물 (아세트산 및 알드리치 완충액 pH 2.0)을 각각 두 지점에 떨어뜨리면 염료의 신속한 탈색이 일어났다. 그 후 1 N NaOH 한 방울을 상기 각각의 지점들 중 한 지점에 떨어뜨렸더니, 신속한 색의 재발현을 유도하였다. 1 N NaOH를 첨가한 후 레이차트 염료의 청색/보라색이 돌아왔다.
이러한 결과를 보강하기 위해 지시제 스프레이를 이용한 2차 실험을 수행하였다. 오래된 생 닭즙을 용이하게 인식가능한 패턴으로 고온 플레이트 표면에 피펫으로 떨어뜨렸다. 표면을 압지로 건조한 후 레이차트 염료 지시제 스프레이 (10 ml 아세토니트릴 중의 160 mg)를 분무하였더니, 닭즙과 동일한 패턴으로 염료의 탈색이 일어났다. 그 후에 1 N NaOH 한 방울을 이미 탈색이 일어난 영역에 떨어뜨렸더니, 작은 점으로 색이 재발현되었다. 이러한 현상은 다른 영역에서도 반복되었다.
1 N NaOH가 단지 세균에만 작용하고 염료에는 작용하지 않을 가능성을 시험하기 위해, 오래된 닭즙과 1몰 NaOH를 동일한 비율로 혼합한 후 30초간 정치하였다. 그 후에 이 혼합물을 이용하여 또다른 동일한 (그러나 좀더 작은) 패턴을 형성하였다. 이 용액 역시 레이차트 염료의 신속한 탈색을 일으키나, 색은 1 N NaOH를 첨가하면 다시 돌아왔다.
실시예
13: 정상
질액
및 세균성 질염 (
BV
)에 감염된
질액에
대한
레이차트
염료-코팅 스티커 시험
세균 기원의 질 감염의 높은 이환률을 고려하여, 건강한 질액 (낮은 pH, 세균 감염 없음), pH 양성/세균성 질염 (BV) 음성 질액 (세균 감염은 없으나 pH가 정상보다 높음), 및 pH 양성/BV 양성 질액 (pH가 정상보다 높고 세균 감염이 확인됨) 샘플에 대한 레이차트 염료-코팅된 스티커의 반응을 파악하기 위한 실험을 행하였다. 2가지의 서로 다른 농도의 레이차트 염료 용액 (160 mg/10 mL 아세토니트릴, 80 mg/10 mL 아세토니트릴, 40 mg/10 mL 아세토니트릴, 20 mg/10 mL 아세토니트릴)을 스티커 시트에 브러쉬-코팅하였다. 각 농도의 스티커를 정상 질액, BV 양성/pH 양성 질액, 및 BV 음성/pH 양성 질액 샘플로 시험하였다.
정상 질액은, 아마도 락토바실러스와 낮은 pH의 조합으로 인해, 급격한 염료의 탈색을 가져왔다. BV 양성/pH 양성 샘플은, 아마도 다수의 BV 세균의 존재로 인해, 그 다음으로 급격한 탈색을 보였다. BV 음성/pH 양성 샘플은, 아마도 정상 샘플보다 적은 양의 락토바실러스로 인해, 단지 약하게 염료가 탈색되었다. 이 3가지 상태의 탈색은 용이하게 구별될 수 있었으며, 질 위생 분야에서 이 기술이 진단 능력이 있을 수 있음을 제시하였다.
실시예
14: 일반적인 표면에 대한
레이차트
염료
지시제
스프레이의 시험
건조된 표면에서 세균이 며칠 간은 아니지만, 몇 시간 동안은 생존할 수 있다는 것은 잘 알려져 있다. 일반적인 표면 상의 세균 및 기타 미생물을 확인하고 소비자나 작업자에게 오염을 경고하는 능력은 세정 및 소독에 도움을 주고 감염이 확산되는 것을 최소화하는데 도움이 된다.
도 10에 도시된 것처럼, 미생물 지시제 스프레이를 시험하기 위한 "실세계" 표면의 예로서 오래된 컴퓨터 키보드가 사용되었다 (10A). 이소프로판올에 레이차트 염료를 용해시키고 (10 ml 이소프로판올 중의 160 mg) 에어로졸-기반 분무 장치에 장착하였다. 이어서 지시제 용액을 키보드에 분무하였다 (10B).
레이차트 염료 지시제 용액을 키보드에 분무함으로써 특정 영역에서 염료의 탈색이 신속하게 일어났다 (10C). 단지 특정 키나 영역만이 오염을 나타낸다는 것이 흥미로웠는데, 이는 숫자 판처럼 많이 오염된 키를 특별히 확인할 수 있도록 하였다. 키보드는 매우 자주 사용되나, 거의 세정하지 않기 때문에, 이 표면을 통해 실세계 표면들의 미생물 수준을 짐작할 수 있다.
실시예
15: 세균 지시제의 감도를 향상시키기 위한 계면활성제의 사용
레이차트 염료 용액 (80 mg/10 mL 아세토니트릴)과 트윈 (등록상표) 80 (200 ㎕) 폴리옥시에틸렌 계면활성제 (미국 펜실바니아주 피츠버그 소재의 피셔 사이언티픽)를 제조하였다. 이어서 이 용액을 사용하여 세라믹 표면을 코팅하였고 (도 11) 통풍 건조하였다. 계면활성제가 없는 제2 레이차트 염료 용액 (80 mg/10 mL 아세토니트릴)을 표면에 묻히고 또한 통풍 건조하였다 (11A). 건조 후 높은 세균 수를 갖고 있는 것으로 알려진 오래된 닭즙 한 방울을 각각의 코팅 영역에 떨어뜨렸다 (11B). 트윈 (등록상표) 80 계면활성제를 함유하는 영역 (11C)은, 트윈 (등록상표) 계면활성제를 함유하지 않는 영역 (11D)과 비교하였을 때 훨씬 빠른 속도 (> 20 내지 30초)로 탈색되었다. 게다가, 트윈 (등록상표) 계면활성제를 첨가함으로써 표면에서 염료를 제거하기가 용이해졌다. 소량의 물을 첨가하여도 표면으로부터 완전히 제거할 수 있지만, 계면활성제를 함유하지 않는 지점에 물을 첨가하는 것은 표면으로부터 제거의 용이함을 향상시키지 않았다.
실시예
16: 용매 선택의 중요성
여러 다른 용매를 사용하여 제조된 레이차트 염료 코팅물의 거동을 평가하였다.
아세토니트릴, 이소프로판올 및 크실렌 중의 레이차트 염료 용액을 제조한 뒤 용액들을 사용하여 스코트 (등록상표) 주방용 롤 타월을 코팅한 후 통풍 건조하였다 (도 12A 및 12D). 처리된 타월에 100 ㎕ 분량의 S. 아우레우스를 묻힌 후 (12B, 12E), 코팅물의 색 변화를 관찰하였다. 세균 현탁액을 묻힌 곳에서, 아세토니트릴 용액-기재 코팅물 만이 신속한 탈색을 보였다 (12C). 레이차트 염료는 아세토니트릴에 용해되었을 때 일정한 색을 나타내는 것으로 관찰되었다. 나머지 두 용매의 코팅물에서는 가시적인 색 변화가 관찰되지 않았다 (12F).
본 발명자들은 염료의 용매로서 이소프로판올을 사용할 수 있도록 레이차트 염료의 농도를 조절할 수 있음을 발견하였다. 아세토니트릴에 비하여 염료의 색이 덜 강하지만, 미생물의 오염에 반응하는 탈색이 즉시 그리고 용이하게 관찰되었다.
실시예
17: 면직물에 코팅된 N-
도코실
-
메로시아닌
염료
폴리스티렌 접시에 신선한 닭 (슈퍼마켓으로부터 구입)의 절반을 투명 필름으로 덮은 상태로 상온에서 3주 동안 보관하였다. 폴리스티렌 접시에서 수집된 담황색 즙을 피펫을 이용하여 채취한 후 시험을 위해 사용하였다.
47 mg의 1-도코실-4-(4-히드록시스티릴)-피리디늄 브로마이드 (알드리치 케미컬)를 10 g의 디메틸포름아미드와 혼합하였다. 진탕하고 정치하면 소량의 고체가 남는다. 오렌지색 상층액을 평량 (29.2 cm x 20.3 cm = 6.888 g)의 면직물 위에 떨어뜨려 오렌지색-황색의 원을 형성하였다. 1 N의 수산화나트륨 용액 한 방울을 면직물 위의 오렌지색-황색 지점에 첨가하면 오렌지색-황색에서 분홍빛 오렌지색으로 색이 변화하였다.
오래된 닭즙을 면직물 상의 오렌지색-황색 지점에 떨어뜨리면, 매우 옅은 황색으로 색 변화가 일어났다. 면직물에서 색 변화는 신속하였다. 이와 유사하게, 오래된 닭즙을 면직물의 분홍빛 오렌지색 영역 (염료 + NaOH 용액)에 떨어뜨리면, 분홍빛 오렌지색에서 매우 옅은 황색으로 유사한 색 변화가 일어났다.
실시예
18: 주방용 종이 타월 상에 코팅된 N-
메틸메로시아닌
및 오래된 소변
여성의 소변을 수집한 후 상온의 유리 용기에서 8일간 보관하였다. 상기 기재된 바와 같이 하기 구조의 N-메틸 메로시아닌 염료를 합성하였다. 0.5 g을 20 ml 탈이온수에 용해시키고, 타월을 용액에 침지시키고, 과량을 방울방울 떨어뜨린 다음 코팅된 타월을 주변 조건에서 건조시킴으로써 스코트 (등록상표) 주방용 롤 종이 타월에 코팅하였다. 종이 타월은 염료에 의해 진한 오렌지색으로 염색되었다.
오래된 소변을 오렌지색으로 착색된 타월에 떨어뜨리면 진한 오렌지 색에서 담황색으로 즉각적인 색 변화가 일어났다. 대조군으로서, 오래된 소변을 0.2 마이크로미터 필터를 통해 여과하여 세균 및 기타 미생물을 제거하였다. 여과 후에, 오래된 소변은 타월 위에 떨어뜨렸을 때 색 변화를 일으키지 않았으며, 이는 미생물이 색 변화를 일으키는 원인이 되는 반면 오래된 소변 내의 다른 성분은 그렇지 않다는 것을 시사한다.
실시예
19: 주방용 타월 상에 코팅된 N-
메틸메로시아닌
및 오래된 소변
여성의 소변을 수집하고 37℃에서 24시간 동안 보관하였다. 풀링 여성 소변은 이러한 조건 하에서 보관한 후에 대략 1×105 CFU/ml의 세균 수를 갖는 것으로 예상될 수 있다. 하기 화학식 33의 N-메틸 메로시아닌 염료를 상기 기재된 바와 같이 합성하였다. 0.5 g을 20 ml 탈이온수에 용해시키고 타월을 용액에 침지시키고, 과량을 방울방울 떨어뜨린 다음 코팅된 타월을 주변 조건에서 건조시킴으로서 스코트 (등록상표) 주방용 롤 종이 타월에 코팅하였다. 종이 타월은 염료에 의해 진한 오렌지색으로 염색되었다.
오래된 소변을 오렌지색으로 착색된 타월 위에 떨어뜨리면 진한 오렌지색에서 담황색으로 즉각적인 색 변화가 일어났다. 대조군으로서, 오래된 소변을 0.2 마이크로미터 필터를 통해 여과하여 세균 및 기타 미생물을 제거하였다. 여과 후에, 오래된 소변은 타월 위에 떨어뜨렸을 때 색 변화를 일으키지 않았으며, 이는 미생물이 색 변화를 일으키는 원인이 되는 반면 오래된 소변 내의 다른 성분은 그렇지 않다는 것을 시사한다.
실시예
20: 주방용 종이 타월 상에 코팅된 N-
메틸
메로시아닌
염료 및 애완용 새의 장 운동
새장의 애완용 잉꼬로부터 잉꼬 배설물을 수집하고 약 10 ml의 아틀란타시 가정용 수돗물 중에서 진탕하였다. 상기 화학식 33의 N-메틸 메로시아닌 염료를 상기 기재된 바와 같이 합성하였다. 0.5 g을 20 ml 탈이온수에 용해시키고 타월을 용액에 침지시키고, 과량을 방울방울 떨어뜨린 다음 코팅된 타월을 주변 조건에서 건조시킴으로써 스코트 (등록상표) 주방용 롤 종이 타월 상에 코팅하였다. 종이 타월은 염료에 의해 진한 오렌지색으로 염색되었다 (도 13A).
수돗물 중의 잉꼬 배설물 현탁액의 방울을 코팅된 타월 위에 떨어뜨리면 (13B), 현탁액이 첨가된 곳에서 진한 오렌지색에서 담황색으로의 즉각적인 색 변화가 일어났다 (13C). 대조군으로서, 아틀란타시 가정용 수돗물을 타월의 다른 영역에 떨어뜨리면, 물에 의해 색이 다소 옅어졌으나 상기 영역은 여전히 오렌지색이었다.
실시예
21 (예측):
코팅물에
사용되는
지시제
염료
히드록시프로필 메틸 셀룰로스 1 g, 화학식 33의 N-메틸 메로시아닌 0.5 g을, 양호하게 교반하면서, 물 10 g과 이소프로필 알콜 10 g의 혼합물에 용해시킬 수 있다. 상기 용액을 폴리에스테르 필름에 코팅하고 실온에서 건조시켜, 미생물의 존재를 검출할 수 있는 코팅된 가요성 필름을 생산할 수 있다.
실시예
22 (예측):
코팅물
중의
지시제
염료
에틸셀룰로스 1 g, 화학식 33의 N-메틸 메로시아닌 0.25 g을 테트라히드로푸란 20 g에 용해시킬 수 있다. 상기 용액을 폴리에스테르 필름에 코팅하고, 실온에서 건조시켜 미생물의 존재를 검출할 수 있는 코팅된 가요성 필름을 생산할 수 있다.
실시예
23: 측방 유동 장치
밀리포어 니트로셀룰로스 HF75 막 (미국 메사츄세츠주 빌레리카 소재의 밀리포어 코포레이션(Millipore Corporation))을 약 30 cm의 길이를 갖는 플라스틱 지지 카드 (밀리포어 코포레이션) 위에 적층하였다. 검출 대역 및 대조 대역 양쪽에서, 이소프로판올 중의 5 중량% 레이차트 염료 용액을 손으로 가늘고 길게 묻혔다. 막을 37.5℃ 온도의 실험실 오븐에서 1시간 동안 건조시켰다. 막 카드를 오븐에서 꺼낸 후에, 셀룰로스 흡상 패드 (밀리포어 코포레이션으로부터 목록번호# CFSP203000)를 대조 대역에 근접한 막의 한쪽 말단에 부착하였다. 샘플 패드를 부착하기 위해 사용되는 카드의 나머지 말단을 잘라내었다. 이어서 카드를 4 mm 스트립으로 얇게 잘라서 반쪽 스틱을 형성하였다.
일단 반쪽 스틱이 제조되면, 세균 용액을 검출 막의 말단에 도포하였다. 모세관 작용은 용액 및 세균을 검출 대역 내로 끌어당기고, 검출 대역에서 색 변화가 관찰되었다. 대조 라인 색이 시험하는 동안 계속 동일하게 유지되었다.
실시예
24:
시클로덱스트린
증강
먼저, 스코트 (등록상표) 종이 타월을 침지에 의해 수용액 (20 ml 중의 1 g)으로서 히드록시프로필-베타-시클로덱스트린 (미국 인디애나주 해몬드 소재의 세레스타 인터내셔널)으로 코팅하고 주변 온도에서 통풍 건조시켰다. 건조될 때 코팅된 종이 타월을 이소프로판올 중의 레이차트 염료 용액 (1 중량%)으로 처리하고 통풍 건조시켰다. 건조된 타월은 보라색/청색이었다. 이때, 시클로덱스트린은 염료의 결정화를 방해하여, 종이 타월 상에서 염료가 더욱 강한 색이 되도록 한다. 이러한 코팅된 타월을 그람-음성 세균 (대장균)을 사용하는 시험에 사용하고, 10,000 CFU/ml를 함유하는 배지 100 마이크로리터 분량을 타월에 도포하면 5초 미만 내에 무색으로 변하는 것을 발견하였다. 이러한 탈색은 15초 정도로 오래 걸리긴 하지만 500 CFU/ml의 세균 농도까지는 발생하는 것으로 밝혀졌다. 따라서 염료가 결정화되는 것을 방해함으로써, 염료가 단일 분자로서 기재 상에 존재하는 것으로 생각되며, 그에 따라 세균 수준에 대한 염료의 감도가 증가하였다. 본 발명자들은, 타월에 코팅물 (예를 들면, 시클로덱스트린)을 조심스럽게 사용함으로써 염료의 단일-분자 코팅이 기재의 표면 상에서 일어나고 최고 감도가 얻어질 것이라고 믿고 있다.
실시예
25: 건조 샘플 시험
용액이 아니라 "건조" 세균 샘플을 사용하여, 레이차트 염료 코팅된 종이 타월의 시험을 수행하였다. 일련의 성장 배지를 함유하는 한천 페트리 디쉬에서 수거한 대장균 세균 콜로니의 건조 샘플을 사용하였다. 이러한 건조 샘플을 미리 보습된 염료 코팅 스코트 (등록상표) 종이 타월에 문질렀다. 콜로니가 위치하고 문질러진 영역은 1 내지 5초 내에 무색으로 변화하였다. 이것은 젖은 와이프 타월이 사용되는 방법과 유사하며 양호하게 수행되었다.
실시예
26: 표백제
지시제
시험
레이차트 염료와 3,3',5,5'-테트라메틸벤지딘 (TMB)의 혼합물을 스코트 (등록상표) 종이 타월에 코팅하고 통풍 건조시켰다. 묽은 표백제 용액을 종이 타월에 도포하면, 레이차트 염료 탈색 및 오렌지색/황색으로의 TMB 변화가 일어났다. 이것은 표백제 지시제가 세균 지시 와이퍼로 만들어질 수 있음을 보여준다.
최종 시험에서, 레이차트 염료 및 TMB 화합물의 코팅물을 갖는 스코트 (등록상표) 종이 타월을 대장균 세균의 현탁액에 적가 방식으로 노출시켰다. 세균과 접촉되어진 타월 영역은 10초 미만 내에 백색 점으로 탈색되었다. 오렌지색/황색이 나타나지 않는 것으로 관찰되었다.
실시예
27:
메로시아닌
및 양쪽성 이온 염료의 UV-가시광선 흡수 스펙트럼
추가의 정제 없이 레이차트 염료를 사용하였다. N-n-헥실 및 N-n-도데실 메로시아닌 염료를 기재된 바와 같이 합성하였다. 사용된 용매는 알드리치 케미컬로부터 입수하였으며 HPLC 등급이었다. 시마즈 UV-1601 UV-가시광선 분광광도계 (시마즈 코포레이션(Shimadzu Corporation))를 사용하여 400 내지 800 nm 범위에서 염료의 최장 파장 피크 흡수를 측정하였으며, 상기 염료는 석영 커벳에 함유된 3가지 서로 다른 용매에 용해되어 있다. 하기 표는 좌측의 용매 및 상단의 염료를 사용한 시험 결과를 포함한다.
| 헥실 메로시아닌 | 도데실 메로시아닌 | 레이차트 염료 | |
| 아세톤 | 617.5 nm (녹색) | 617 nm (녹색) | 674 nm (청색을 띤 녹색) |
| 메탄올 | 514 nm (오렌지색) | 522 nm (오렌지색) | 509 nm (적색) |
| 아세토니트릴 | 582 nm (녹색을 띤 청색) | 600 nm (청색) | 623 nm (청색) |
메로시아닌 염료는 더욱 긴 파장의 흡수 이외에도 400 nm 근처에서 흡수를 보였으며, 이는 감지되는 색을 변화시켰다.
명백하게, 분광학법 측정을 기초로 하여, 이들 염료는 상이한 용매에 용해되었을 때 미생물 검출 염료 간의 최장 파장 피크 흡수가 큰 변위 (10 nm 초과)를 나타냈다.
실시예
28: 바이러스 검출
본 발명에 따라 바이러스 존재를 검출하는 색소원의 능력이 설명되어 있다. 폴리오 바이러스 제1형, 헤르페스 심플렉스 바이러스 1 (HSV-1), 리노바이러스, 미즐즈, 백시니아 및 인플루엔자 A를 작제하고 증식된 MA-104 배아 원숭이 신장 세포에 접종하고, 둘베코 변형 이글 배지 (DMEM)를 공급하고 태아 송아지 혈청을 5%의 농도까지 보충하고 5% CO2의 존재하에 6일 동안 37±1℃에서 인큐베이션하였다. 감염된 세포 시트를 현미경 관찰함으로써 바이러스 증식을 세포 시트의 적어도 50%에서 관찰되는, 세포 붕괴 (세포변성 효과, CPE), 예컨대 원형화, 무딘톱날모양, 세포용해, 핵농축 등으로 검출하였다. 바이러스 없이 시약 단독에 의해 초래된 세포 붕괴의 정도로서 세포독성을 측정하였다. DMEM 중의 10-배 연속 희석액을 사용하여 바이러스를 적정하고, 희석액마다 MA 104 배양액을 4개 복제하고, 각각의 복제물에 0.1 ml의 바이러스 희석액을 접종하였다. 바이러스 복제 정도를 리드(Reed) 및 멘치(Muench)의 방법에 의해 결정되는 조직 배양액 감염 투여량-50% (TCID 50)으로서 계산하였다.
레이차트 염료-코팅된 스티커 (160 mg/10 mL 아세토니트릴, 80 mg/10 mL 아세토니트릴, 40 mg/10 mL 아세토니트릴 및 20 mg/10 mL 아세토니트릴)를 시험 표면으로서 사용하였다. 배지 중 50 ㎕의 희석되지 않은 바이러스 (TCID50 10-8 폴리오 바이러스/mL; TCID50 10-7 HSV-1/mL; TCID50 10-7 리노바이러스/mL; TCID50 10-6 미즐즈 바이러스/mL; TCID50 10-6 백시니아/mL; 및 TCID50 10-7 인플루엔자/mL)를 각각의 스티커에 떨어뜨리고, 3분 동안 둔 후에 면봉으로 방울을 제거하였다. 배지 및 염수로 희석된 리노바이러스 및 폴리오 바이러스에 있어서는, 배지 단독, 바이러스-무함유 세포 배양 배지 및 바이러스-무함유 세포 배양 염수의 분취물을 대조 샘플로서 사용하고 이들 또한 면봉으로 채집(swabbing)하기 전에 3분 동안 놓아두었다. 나머지 바이러스 (그들의 원래 배양 배지에서 희석되지 않은 상태로 사용됨)는 배지 대조군만이 사용되었다.
폴리오 바이러스에 있어서, 염수 대조군은 염료가 간섭받는 것으로 나타난 반면, 배지는 색 변화가 일어나지 않았다. 따라서, 나머지 실험을 위하여 배지 중의 폴리오 바이러스의 희석액을 사용하였다. 바이러스를 10-배 증분으로 배지에서 연속적으로 희석하고, 각각의 스티커에 50 ㎕ 분량을 도포하였다. 3분 동안 둔 후에, 방울을 스티커로부터 면봉으로 채집하였다. 리노바이러스에 있어서, 배지 대조군은 간섭이 나타난 반면, 염수 대조군은 염료의 색 변화를 유도하지 않았다. 따라서, 염수 중에서 희석된 바이러스의 10-배 연속 희석액을 50 ㎕ 분량으로 스티커에 도포하고 3분 후에 면봉으로 채집하였다. 폴리오 바이러스 및 리노바이러스에 있어서, 스티커는 10-6 (10-배 연속 희석액에서 여섯번째)까지는 색이 변하였으며, 이는 염료-코팅된 스티커가 이들 바이러스의 검출에 대한 감도를 가지고 있음을 나타낸다 (폴리오 바이러스의 경우에 약간 더 강하게 탈색됨). HSV-1, 인플루엔자 A, 미즐즈 및 백시니아는, 단지 (희석되지 않은) 바이러스의 50 ㎕ 방울을 스티커에 묻혔다. 관찰된 후속 탈색을 바이러스-무함유 대조 배지에서 관찰된 탈색 및 살모넬라 (108 CFU/mL) 양성 대조군과 비교하였다. 탈색이 살모넬라 세균에서 관찰된 것만큼 강하지는 않았지만, 희석되지 않은 HSV-1 바이러스에의 노출은 리노바이러스 및 폴리오 바이러스에서 관찰된 것보다 더욱 강한 스티커 탈색을 유도하였다. 인플루엔자 A, 백시니아 및 미즐즈 바이러스에 반응한 탈색은 다른 바이러스로 관찰된 것보다 덜 강하였다.
또한 레이차트 염료의 2가지 용액 (400 ㎕의 트윈 80 계면활성제를 함유하거나 함유하지 않은 80 mg/10 mL 아세토니트릴)을 제조하였다. 폴리오 바이러스 또는 리노바이러스 (양쪽 모두 배지에서 희석되지 않음)의 100 ㎕ 방울을 접힌 스코트 (등록상표) 종이 타월에 피펫으로 떨어뜨리고, 각각의 바이러스-함유 지점에 레이차트 염료 방울을 첨가하였다. 계면활성제-함유 및 계면활성제-무함유 용액 양쪽 모두에서 색이 신속히 탈색되었다. 색이 일정해질 때까지 염료를 첨가하였다 (대략 9 방울). 앞서 언급된 것과 동일한 배지 및 염수 대조군 또한 시험하였다. 배지가 염료 탈색능을 약간 나타내었으나, 염수는 앞서 물을 사용하여 관찰된 것과 동일한 적정 거동을 나타내었다.
실시예
29: 세균 오염의 반-정량화
세균 농도에 관한 반-정량적 정보를 제공하는 레이차트 염료의 능력이 설명되어 있다. 종이-기원 기재 (니나 본드(Neenah Bond); 상표명) (미국 조지아주 알파레타 소재의 니나 페이퍼, 인크.(Neenah Paper, Inc.)로부터 입수가능함)를, 종이를 코팅물에 침지하거나 종이에 브러쉬-코팅한 후에, 종이를 걸어 건조시킴으로써 레이차트 염료 용액 (80 mg/아세토니트릴 10 ml)으로 초기에 처리하였다. 기지 농도의 S. 아우레우스 (ml당 101, 102, 103, 104, 105, 106 및 107 CFU) 7 방울을 각 시트의 상단에 떨어뜨렸다. 대략 2분 후에, 방울을 제거하고 압지로 닦아내면, 105 CFU/mL 이상의 S. 아우레우스 농도에서 분명한 색 변화가 나타났다. 보다 낮은 농도에서는 색차가 덜 분명하고, 특히 브러쉬-코팅된 시트의 경우에 그렇다.
이어서 맹검 검사를 실시하였다. 시험 목적으로, 106 CFU/mL 농도로 100 ㎕를 함유하는 첫번째 방울을 레이차트 염료를 함유하는 침지-코팅된 시트의 일부에 떨어뜨렸다. 105 CFU/mL 농도로 100 ㎕를 함유하는 두번째 방울을 레이차트 염료를 함유하는 브러쉬-코팅된 시트의 일부에 떨어뜨렸다. 최종적으로, 104 CFU/mL 농도로 S. 아우레우스를 함유하는 세번째 방울을 레이차트 염료를 함유하는 침지-코팅된 시트의 일부에 떨어뜨렸다. 이들 세 방울의 농도를 실험 참가자 중 두명에게는 알려주지 않았다. 대략 2분 후에, 방울을 제거하고 압지로 닦아냈다. 대조 영역을 사용하여, 각 샘플의 농도를 이들 두 사람이 각각 시각적으로 추정하였다. 두 사람 모두 첫번째 샘플의 농도를 106 CFU/mL로 정확하게 추정하였다. 이들은 또한 두번째 샘플에 대해서도 105 CFU/mL의 농도로 정확하게 추측하였다. 그러나, 이들은 세번째 샘플을 103 CFU/mL로 잘못 추정하였다. 이러한 부정확성은 적어도 부분적으로, 105 CFU/mL 미만의 농도에서는 대조 영역의 색이 비교적 덜 차이나기 때문인 것으로 생각된다. 그러나, 본 발명자들은 색소원의 농도 및 코팅물의 균일성을 이러한 낮은 농도에서 정확한 결과를 얻을 수 있도록 용이하게 선택할 수 있을 것이라고 믿고 있다. 어떠한 경우에도, 대조 영역이 보다 높은 농도 (예를 들면, 105 CFU/mL 이상)에서 보다 뚜렷한 색차를 제공하기 때문에, 임상적으로 보다 관련있는 높은 농도에서는 정확한 결과가 달성된다고 생각된다.
실시예
30: 세균 오염의 정량화
세균 농도에 관한 정량적 정보를 제공하는 레이차트 염료의 능력이 설명되어 있다. 종이-기원 기재 (니나 본드; 상표명) (미국 조지아주 알파레타 소재의 니나 페이퍼 인크.로부터 입수가능함) 및 라벨 (애버리-데니슨으로부터 입수가능함)을 레이차트 염료 용액 (80 mg/아세토니트릴 10 ml)으로 초기에 코팅하고 걸어 건조하였다. 기지 농도의 S. 아우레우스, P. 애루기노사 및 대장균의 분취물 (100 마이크로리터)을 사용하여 각 종류의 세균에 대하여 대조 곡선을 그렸다. 보다 구체적으로, 레이차트 염료로 코팅된 지시제 스트립을 세균 분취량을 감소시키면서 노출시켰다. 각 분취물의 도포 후에 소형 분광광도계를 사용하여 각 CFU/mL 농도에 대해 "델타 E" 값 (L*, a* 및 b* 값을 사용하여 계산함)을 측정하였다. 결과를 하기 표 4 (종이) 및 표 5 (라벨)에 기재하였다.
| 종이 기재의 결과 | |||
| 로그 CFU/ml | 델타 E (S. 아우레우스) |
델타 E (대장균) |
델타 E (P. 애루기노사) |
| 8 | - | 9.3642 | - |
| 7 | 11.73368 | 4.3483 | 4.9569 |
| 6 | 3.876455 | 3.2574 | 1.3193 |
| 5 | 2.447325 | 2.3320 | 1.7151 |
| 4 | 2.074175 | 3.0123 | 2.2358 |
| 3 | 1.866789 | 3.8228 | 1.7900 |
| 라벨 기재의 결과 | |||
| 로그 CFU/ml | 델타 E (S. 아우레우스) |
델타 E (대장균) |
델타 E (P. 애루기노사) |
| 7 | 18.62321 | 7.778702 | 6.9567 |
| 6 | 6.908263 | 4.866590 | 4.2419 |
| 5 | 6.919863 | 4.643888 | 4.6519 |
| 4 | 4.791472 | 5.200596 | 4.9473 |
| 3 | 5.413890 | 5.130312 | 3.8787 |
상기로부터, S. 아우레우스, P. 애루기노사 및 대장균 각각에 대하여 표준 검출 곡선을 도 5 내지 7에 도시한 바와 같이 그렸다. 도시된 바와 같이, 각 종류의 세균은 염료 처리된 기재의 색을 약간 상이한 방식으로 변화시켜, 독특한 표준 곡선을 만들었다. 그 후에, 미지의 세균 농도의 방울을 스티커에 떨어뜨리고 분광광도계를 사용하여 나타난 색의 "델타 E"를 측정하였다. 각 미지 샘플로 얻어진 수치를 하기 표 6 및 표 7에 기재하였다.
| 종이 기재의 결과 | ||||||||
| S. 아우레우스 | 대장균 | P. 애루기노사 | ||||||
| 로그 CFU/ml (실측치) |
델타 E | 로그 CFU/ml (추정치) |
로그 CFU/ml (실측치) |
델타 E | 로그 CFU/ml (추정치) |
로그 CFU/ml (실측치) |
델타 E | 로그 CFU/ml (추정치) |
| 5 | 3.16136 | 5 | 3 | 1.3605 | 5 | 3 | 1.0267 | 5 |
| 라벨 기재의 결과 | ||||||||
| S. 아우레우스 | 대장균 | P. 애루기노사 | ||||||
| 로그 CFU/ml (실측치) |
델타 E | 로그 CFU/ml (추정치) |
로그 CFU/ml (실측치) |
델타 E | 로그 CFU/ml (추정치) |
로그 CFU/ml (실측치) |
델타 E | 로그 CFU/ml (추정치) |
| 6 | 6.869068 | 5 내지 6 | 7 | 7.1157 | 7 | 6 | 4.4954 | 5 내지 6 |
| 6 | 4.228215 | 3 | - | - | - | 6 | 4.1002 | 3 내지 6 |
수치 데이터로부터 알 수 있는 것처럼, 미지 농도의 델타 E 값이 어느 기지의 델타 E 값에 근사한지를 판단함으로써 미지 농도가 예상되었다. 몇몇 결과는 완전히 정확하지는 않았지만, 본 발명자들은 코팅물의 균일성을 개선하는 것이 검출 정확성을 더욱 향상시킨다고 믿고 있다.
비교예
(본 발명의
실시예가
아님)
비교예를 위해 세균 공급원으로서 오래된 닭을 사용하였다. 폴리스티렌 접시에 신선한 닭 (슈퍼마켓으로부터 구입)의 절반을 투명 필름으로 덮은 상태로 상온에서 3주 동안 보관하였다. 폴리스티렌 접시에서 수집한 담황색 즙을 피펫을 이용하여 채취하여, 시험에 사용하였다.
비교예
1
오래된 닭즙을 스코트 (등록상표) 종이 타월 위에 방울로 떨어뜨렸다. 하기 화학식 34의 Cl 산 그린 41 (알드리치 케미컬) 용액 (0.008 몰/l) (히드록시안트라퀴논 염료의 예)을 오래된 닭즙에 방울로 떨어뜨렸다. 색 변화가 관찰되지 않았다. 대조군으로서, 100 mg의 레이차트 염료를 10 ml 아세토니트릴에 현탁시켰다. 이 현탁액을 오래된 닭즙에 방울로 떨어뜨리면 즉시 탈색되었다.
비교예
2
오래된 닭즙을 스코트 (등록상표) 종이 타월 위에 방울로 떨어뜨렸다. 하기 화학식 35의 Cl 산 그린 25 용액 (0.008 몰/l) (안트라퀴논 염료의 예)을 오래된 닭즙에 방울로 떨어뜨렸다. 색 변화가 관찰되지 않았다. 대조군으로서, 100 mg의 레이차트 염료를 10 ml 아세토니트릴에 현탁시켰다. 이 현탁액을 오래된 닭즙에 방울로 떨어뜨리면 즉시 탈색되었다.
비교예
3
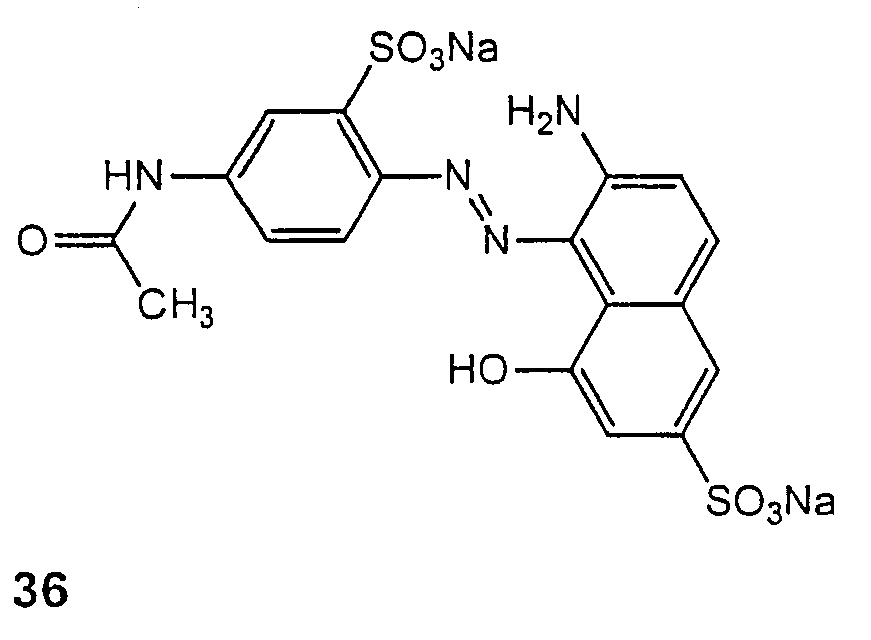
오래된 닭즙을 스코트 (등록상표) 종이 타월 위에 방울로 떨어뜨렸다. 하기 화학식 36의 Cl 산 레드 37 (알드리치 케미컬) 50 mg (아미노아조 염료의 예)을 10 ml 탈이온수에 용해시켰다. 이 염료 용액을 종이 타월 위의 오래된 닭즙에 방울로 떨어뜨렸다. 색 변화가 관찰되지 않았다. 대조군으로서, 100 mg의 레이차트 염료를 10 ml 아세토니트릴에 현탁시켰다. 이 현탁액을 오래된 닭즙에 방울로 떨어뜨리면 즉시 탈색되었다.
비교예
4
오래된 닭즙을 스코트 (등록상표) 종이 타월 위에 방울로 떨어뜨렸다. 하기 화학식 37의 Cl 산 옐로우 23 (식품 착색제 타르트라진으로도 공지됨) (알드리치 케미컬) 50 mg (페닐피라졸론 염료의 예)을 10 ml 탈이온수에 용해시켰다. 이 염료 용액을 종이 타월 위의 오래된 닭즙에 방울로 떨어뜨렸다. 색 변화가 관찰되지 않았다. 대조군으로서, 100 mg의 레이차트 염료를 10 ml 아세토니트릴에 현탁시켰다. 이 현탁액을 오래된 닭즙에 방울로 떨어뜨리면 즉시 탈색되었다.
비교예
5
오래된 닭즙을 스코트 (등록상표) 종이 타월 위에 방울로 떨어뜨렸다. 하기 화학식 38의 Cl 산 레드 52 (술포르호다민 B) (크산텐 염료의 예)의 수용액을 종이 타월 위의 오래된 닭즙에 방울로 떨어뜨렸다. 색 변화가 관찰되지 않았다. 대조군으로서, 100 mg의 레이차트 염료를 10 ml 아세토니트릴에 현탁시켰다. 이 현탁액을 오래된 닭즙에 방울로 떨어뜨리면 즉시 탈색되었다.
비교예
6
오래된 닭즙을 스코트 (등록상표) 종이 타월 위에 방울로 떨어뜨렸다. 하기 화학식 39의 Cl 산 블루 74 (인디고 카르민으로도 공지됨) (알드리치 케미컬) (인디고이드 염료의 예) 30 mg을 10 ml 탈이온수에 용해시켰다. 이 염료 용액을 종이 타월 위의 오래된 닭즙에 방울로 떨어뜨렸다. 색 변화가 관찰되지 않았다. 대조군으로서, 100 mg의 레이차트 염료를 10 ml 아세토니트릴에 현탁시켰다. 이 현탁액을 오래된 닭즙에 방울로 떨어뜨리면 즉시 탈색되었다.
당업자에 의해 이해될 수 있듯이, 본 발명에 대한 변화 및 변형은 당업자의 능력 범위 내에 있는 것으로 간주된다. 이러한 변화의 예는 상기 확인된 특허에 포함되고 상기 특허는 각각 본 명세서와 일치되는 정도까지 그 전체내용이 참고문헌으로 본원에 포함된다. 이러한 변화 및 변형은 발명자에 의해 본 발명의 범주 내에 있는 것으로 해석된다. 또한, 본 발명의 범주는 본원에 기재된 특정한 실시양태로만 제한되는 것으로 해석되어서는 안되고, 상기 개시내용을 고려하여 판단할 때 첨부된 청구의 범위에 따른다는 것을 이해하여야 한다.
Claims (22)
- 양쪽성 이온인 N-페놀레이트 베타인 시험 염료를 샘플과 접촉시켜 시험 염료의 검출가능한 색 변화를 일으키는 단계, 및그 후에 시험 염료의 색을 양쪽성 이온인 N-페놀레이트 베타인 대조 염료의 색과 비교하는 단계를 포함하며, 상기 대조 염료의 색은 기지 미생물 농도에 대응하는 것인, 샘플내 미생물 존재의 반-정량적 또는 정량적 검출 방법.
- 제1항에 있어서, 시험 염료, 대조 염료 또는 양자 모두가 용매화발색 염료인 방법.
- 삭제
- 삭제
- 삭제
- 삭제
- 제1항에 있어서, N-페놀레이트 베타인 염료가 레이차트(Reichardt's) 염료인 방법.
- 삭제
- 제1항에 있어서, 시험 염료의 색을 복수 개의 대조 염료의 색과 비교하며, 상기 대조 염료는 각각 서로 다른 기지 미생물 농도에 대응하는 색을 갖는 것인 방법.
- 양쪽성 이온인 N-페놀레이트 베타인 시험 염료를 샘플과 접촉시켜 시험 염료의 검출가능한 색 변화를 일으키는 단계, 및그 후에 시험 염료의 색을 복수 개의 양쪽성 이온인 N-페놀레이트 베타인 대조 염료의 색과 비교하는 단계를 포함하며, 상기 대조 염료는 각각 서로 다른 기지 미생물 농도에 대응하는 색을 갖는 것인, 샘플내 미생물 존재의 반-정량적 또는 정량적 검출 방법.
- 삭제
- 제10항에 있어서, 시험 염료 및 대조 염료가 레이차트 염료인 방법.
- 제1항, 제2항, 제7항, 제9항, 제10항 및 제12항 중 어느 한 항에 있어서, 시험 염료, 대조 염료 또는 대조 염료들, 또는 이들의 조합물의 색 강도를 측정하는 단계를 더 포함하는 방법.
- 제13항에 있어서, 시험 염료의 색 강도가 시료내 미생물의 농도에 비례하는 방법.
- 제13항에 있어서, 대조 염료 또는 대조 염료들의 색 강도를 복수 개의 기지 미생물 농도에 대하여 플롯팅함으로써 검출 곡선을 그리는 단계를 더 포함하는 방법.
- 제15항에 있어서, 검출 곡선에서 시험 염료의 색 강도를 미생물 농도와 상호 연관시키는 단계를 더 포함하는 방법.
- 제1항, 제2항, 제7항, 제9항, 제10항 및 제12항 중 어느 한 항에 있어서, 기재가 시험 염료를 함유하는 검출 대역 및 대조 염료 또는 대조 염료들을 함유하는 대조 대역을 형성하는 것인 방법.
- 제1항, 제2항, 제7항, 제9항, 제10항 및 제12항 중 어느 한 항에 있어서, 색 변화가 5분 이내에 일어나는 방법.
- 검출 대역 및 대조 대역을 형성하며, 이때 시험 염료는 미생물의 존재하에서 검출가능한 색 변화가 일어날 수 있는 검출 대역 내에 함유되고, 복수 개의 대조 염료는 대조 대역 내에 함유되며, 대조 염료 각각의 색은 서로 다른 기지 미생물 농도에 대응하는 것이고, 상기 시험 염료 및 대조 염료는 양쪽성 이온인 N-페놀레이트 베타인 염료인, 샘플내 미생물 존재의 반-정량적 또는 정량적 검출용 기재.
- 제1항, 제2항, 제7항, 제9항, 제10항 및 제12항 중 어느 한 항에 있어서, 색 변화가 1분 이내에 일어나는 방법.
- 삭제
- 제19항에 있어서, 시험 염료, 대조 염료 또는 이들의 조합물이 레이차트 염 료인 기재.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PCT/US2004/042461 WO2005059162A2 (en) | 2003-12-16 | 2004-12-16 | Microbial detection and quantification |
| USPCT/US2004/042461 | 2004-12-16 | ||
| US11/117,651 US7399608B2 (en) | 2003-12-16 | 2005-04-28 | Microbial detection and quantification |
| US11/117,651 | 2005-04-28 | ||
| PCT/US2005/038416 WO2006065350A2 (en) | 2004-12-16 | 2005-10-24 | Microbial detection and quantification |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20070086272A KR20070086272A (ko) | 2007-08-27 |
| KR101225911B1 true KR101225911B1 (ko) | 2013-01-24 |
Family
ID=36596413
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020077013575A KR101225911B1 (ko) | 2004-12-16 | 2005-10-24 | 미생물의 검출 및 정량화 |
Country Status (3)
| Country | Link |
|---|---|
| KR (1) | KR101225911B1 (ko) |
| CN (1) | CN102121056B (ko) |
| MX (1) | MX2007007122A (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR102353452B1 (ko) * | 2020-12-23 | 2022-01-21 | 한국과학기술원 | 에어로졸화된 비말 검출장치 |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8871232B2 (en) * | 2007-12-13 | 2014-10-28 | Kimberly-Clark Worldwide, Inc. | Self-indicating wipe for removing bacteria from a surface |
| CN107043803A (zh) * | 2017-05-24 | 2017-08-15 | 中检科(北京)实验室能力评价有限公司 | 药品中霉菌和酵母菌总数计数能力验证样品及其制备方法 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4556636A (en) | 1983-06-09 | 1985-12-03 | Eastman Kodak Company | Composition, analytical element and method for the detection of bacteria |
| JPH1183849A (ja) | 1997-09-12 | 1999-03-26 | Toa Medical Electronics Co Ltd | 尿中有形成分の分析方法及びその分析試薬 |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE1598092A1 (de) * | 1966-03-29 | 1970-04-23 | Boehringer Mannheim Gmbh | Verfahren und diagnostische Mittel zum Bakterien-Nachweis |
| US4859584A (en) * | 1986-10-31 | 1989-08-22 | Smithkline Beckman Corporation | Cell growth rate determination by measurement of changes in cyanine dye levels in plasma membranes |
-
2005
- 2005-10-24 MX MX2007007122A patent/MX2007007122A/es active IP Right Grant
- 2005-10-24 CN CN2010105288572A patent/CN102121056B/zh not_active Expired - Fee Related
- 2005-10-24 KR KR1020077013575A patent/KR101225911B1/ko active IP Right Grant
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4556636A (en) | 1983-06-09 | 1985-12-03 | Eastman Kodak Company | Composition, analytical element and method for the detection of bacteria |
| JPH1183849A (ja) | 1997-09-12 | 1999-03-26 | Toa Medical Electronics Co Ltd | 尿中有形成分の分析方法及びその分析試薬 |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR102353452B1 (ko) * | 2020-12-23 | 2022-01-21 | 한국과학기술원 | 에어로졸화된 비말 검출장치 |
Also Published As
| Publication number | Publication date |
|---|---|
| MX2007007122A (es) | 2009-02-18 |
| KR20070086272A (ko) | 2007-08-27 |
| CN102121056B (zh) | 2013-01-16 |
| CN102121056A (zh) | 2011-07-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US7399608B2 (en) | Microbial detection and quantification | |
| KR101431824B1 (ko) | 미생물의 검출 및 정량 | |
| EP2059805B1 (en) | Microbe-sensitive indicators and use of the same | |
| US7300770B2 (en) | Detection of microbe contamination on elastomeric articles | |
| KR101219829B1 (ko) | 탄성 용품 상의 미생물 오염 검출 | |
| US8361742B2 (en) | Method for detecting Candida on skin | |
| US7727513B2 (en) | Method for screening for bacterial conjunctivitis | |
| CN101080497B (zh) | 微生物检测与定量 | |
| KR101225911B1 (ko) | 미생물의 검출 및 정량화 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20160108 Year of fee payment: 4 |
|
| FPAY | Annual fee payment |
Payment date: 20170111 Year of fee payment: 5 |
|
| FPAY | Annual fee payment |
Payment date: 20180105 Year of fee payment: 6 |
|
| FPAY | Annual fee payment |
Payment date: 20190108 Year of fee payment: 7 |