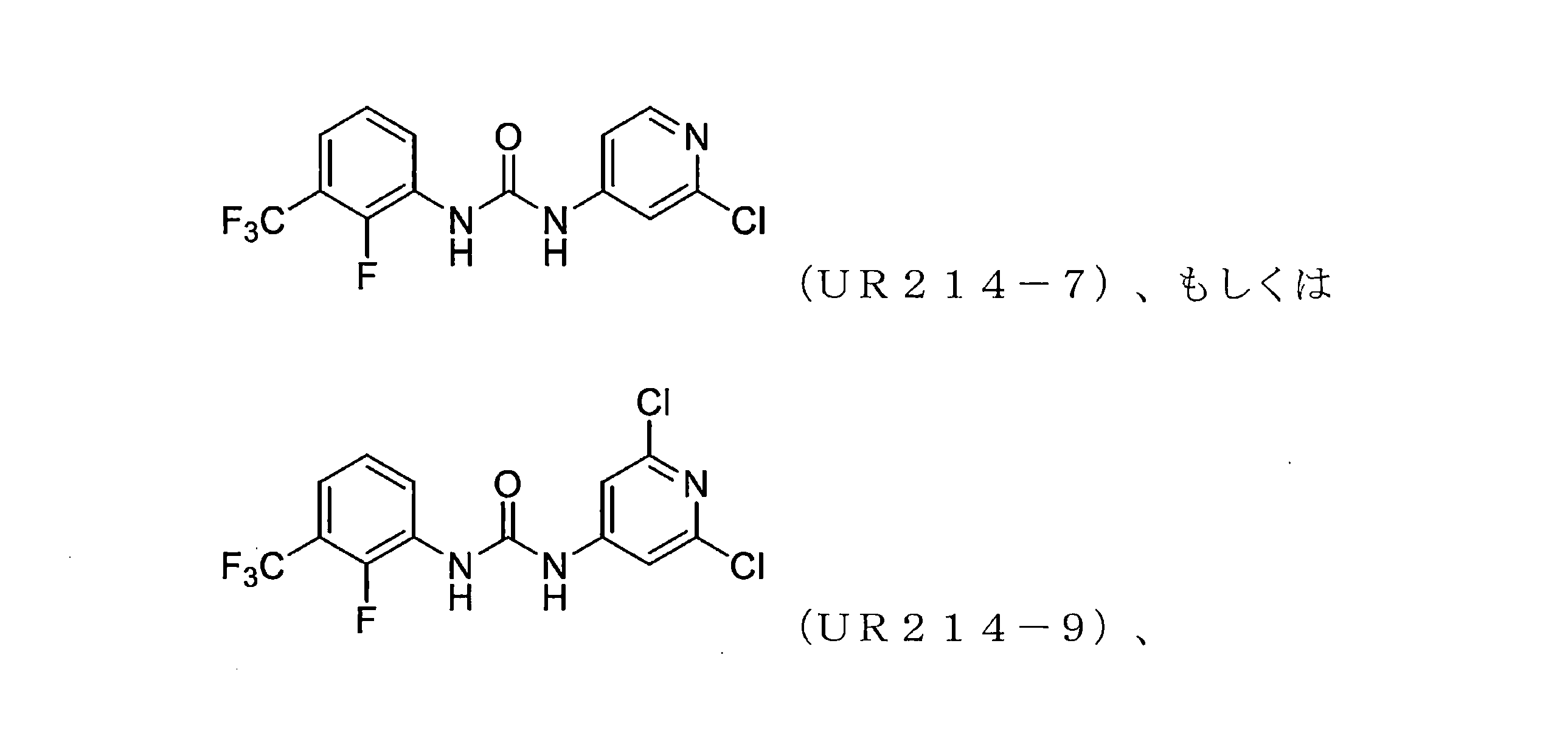
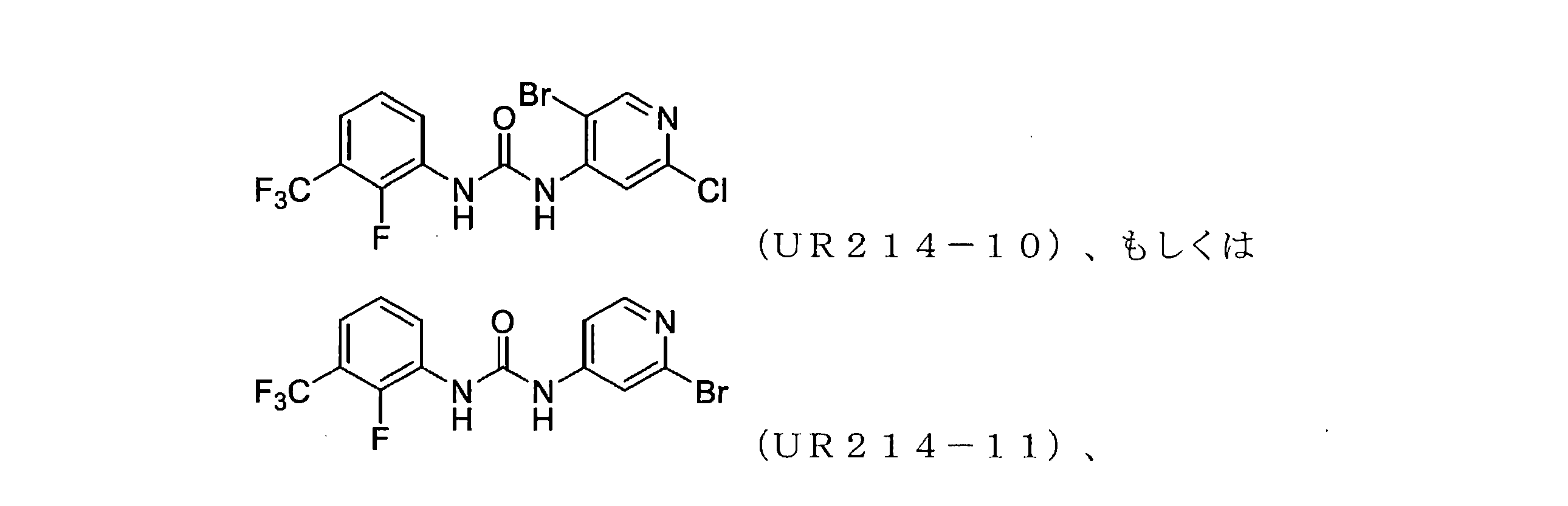
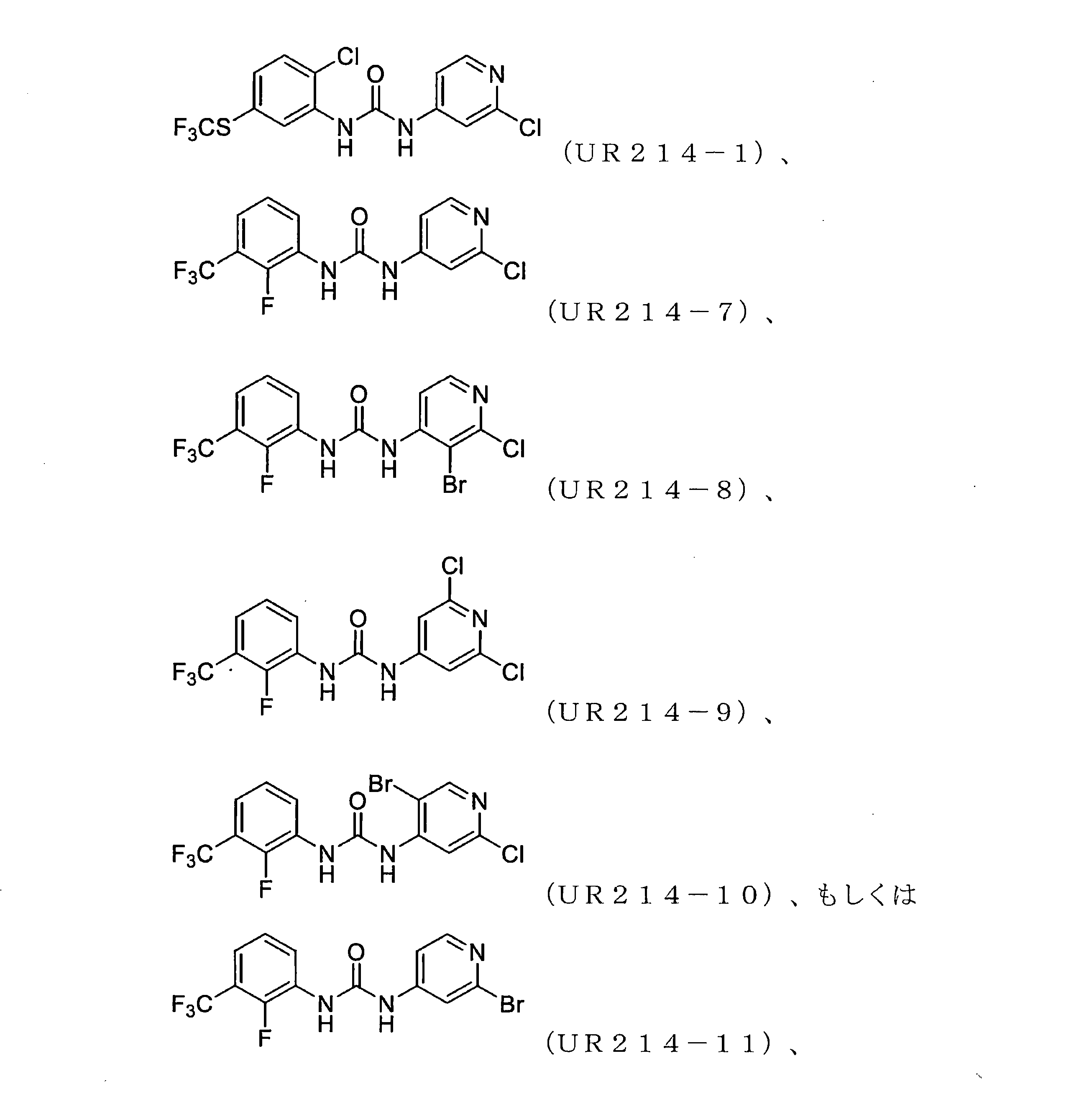
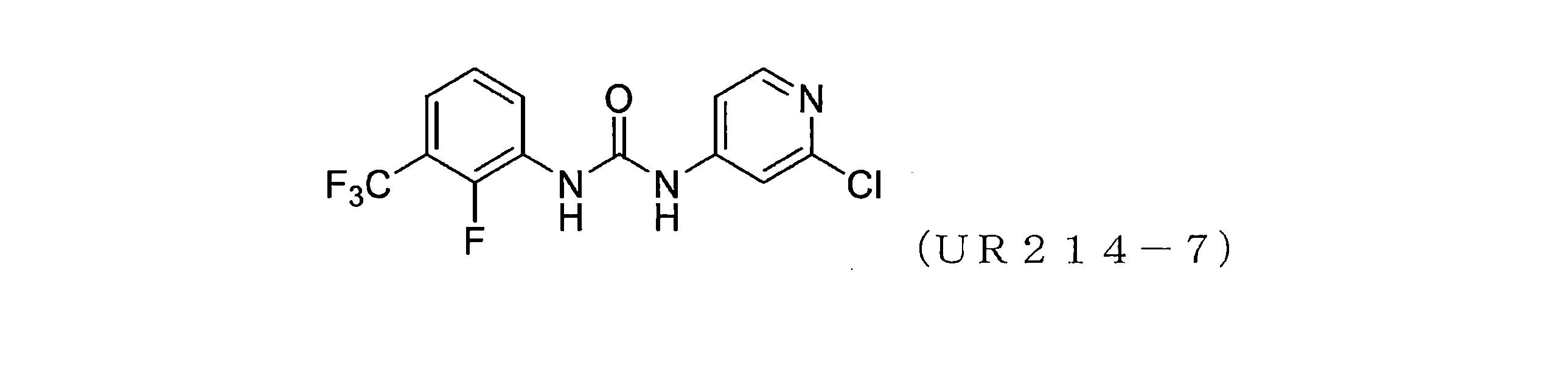
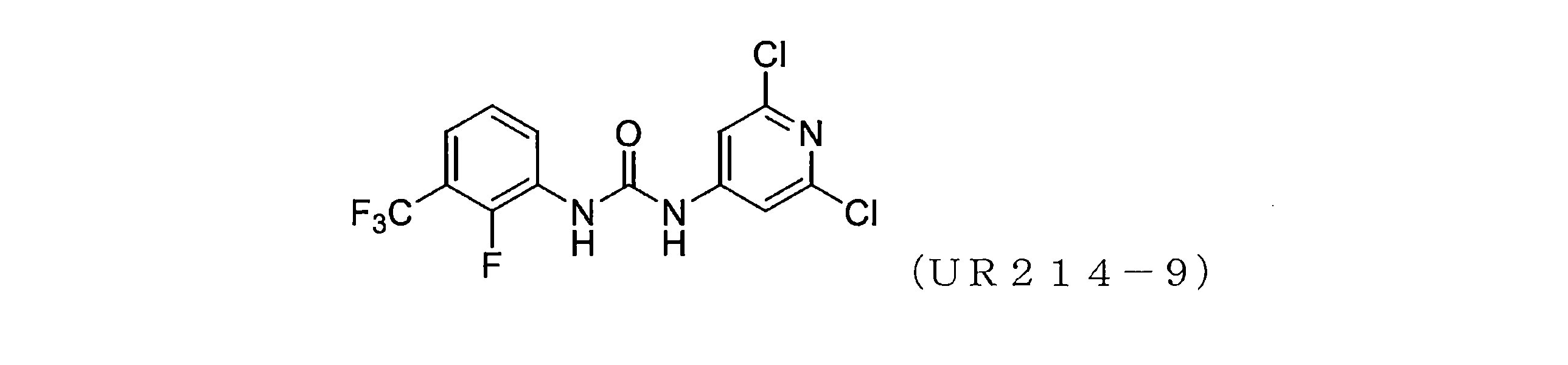
本開示は、セプチン-2などのセプチンタンパク質の発現または活性を調節するための化合物、組成物、および方法を提供する。様々な置換を有するピリジンを含む新規分子、例えば、アリール尿素の設計、合成およびスクリーニングが本明細書に開示されている。実施例に開示されているこれらの例示的な分子は、腫瘍細胞におけるセプチン-2の集合を強力に破壊し、マイクロナノモル範囲で細胞増殖を減少させる。本明細書に記載の化合物、例えば、ジアリール尿素はまた、膵臓腫瘍組織量および他の腫瘍モデルを低減することができた。
セプチン-2はフィラメント形成細胞骨格GTPaseであり、セプチン-7、セプチン-6、セプチン-9、セプチン-4、およびその他のセプチンとフィラメント状のオリゴマー構造を形成する。セプチン-2を介したフィラメント状構造は、減数分裂後の分化中の精子尾部の構造的完全性および運動性に不可欠である(Kuo et al(2015)J Cell Sci 128(5):923-934)。セプチン-2は、アクチン細胞骨格の正常な組織化に必要であり、ポリグルタミル化微小管を維持し、効率的な小胞輸送を促進し、MAP4のチューブリンへの結合を妨げることにより、分極した円柱状の上皮の生合成に役割を果たす。セプチン-2は有糸分裂の進行に必要である。セプチン-2は、動原体および染色体の集合での局在化を維持するために必要な有糸分裂紡錘体の中央平面で足場を形成する。分裂後期の間、セプチン-2は染色体分離および紡錘体伸長に関与する。セプチン-2は繊毛形成および細胞運動に役割を果たしている。繊毛では、セプチン-2はTMEM231タンパク質を局在化することによって構造様複合体(B9複合体)の集合を調節することによって作用する。繊毛は、繊毛と原形質膜との間の膜貫通タンパク質の拡散を防ぐ一次繊毛の基部にある拡散バリアの完全性に必要である。セプチン-2は、Listeria monocytogenesおよびShigella flexneriなどの2つの細胞内微生物病原体の内在化に役割を果たす。セプチン-2の過剰発現は漿液性および明細胞卵巣がんの腫瘍形成を促進する(Cantillo et al.(2017)Gynecologic Oncology 145:Supplement 1,pp.123-124)。
セプチンはヘテロマーオリゴマーに集合して、細胞内にフィラメント、バンドル、およびリングなどの高次の足場構造を生成する。それらは、アクチンフィラメント、微小管、および中間径フィラメントに似た細胞骨格成分である。セプチンは、拡散バリアの制御、タンパク質の局在化、細胞外膜融合、オートファゴソーム調節、リソソーム恒常性維持、ミトコンドリア分裂、ならびに膜性細胞小器官および多小胞体の生合成を含む、多様な必須細胞メカニズムに関与していることが知られている(Kartmann and Roth(2001)J Cell Sci 114(Pt 5):839-844、Caudron and Barral(2009)Dev Cell 16(4):493-506、Bridges and Gladfelter(2015)J Biol Chem 290(28):17173-17180、Pagliuso et al.(2016)EMBO Rep 17(6):858-873、Sirianni et al.(2016)EMBO Rep 17(7):1029-1043、Mostowy et al.(2010)Cell Host Microbe 8(5):433-444、Traikov et al.(2014)PLoS One 9(11):e109372、およびDolat and Spiliotis(2016)J Cell Biol 214(5):517-527)。セプチンはRASがん遺伝子と構造的に関連しており、それらの発現レベルは、腎臓、肺、結腸直腸、皮膚、脳、子宮内膜、卵巣、および乳房など、いくつかの種類のがんで変化することがわかっている(Cerveira et al.(2011)Biol Chem 392(8-9):713-724、Connolly et al.(2011)Biol Chem 392(8-9):725-738、およびAngelis and Spiliotis(2016)Front Cell Dev Biol 4:122)。さらに、異常なセプチンの発現は、神経変性/神経筋疾患、血液障害、不妊症、および発達障害に関連している(Dolat et al.(2014)Biol Chem 395(2):123-141、およびMarttinen et al.(2015)Mol Neurodegener 10:16)。
本開示は、セプチン-2などのセプチンタンパク質の発現または活性を調節するための化合物を提供する。いくつかの好ましい実施形態では、そのような化合物は、セプチン-2などのセプチンタンパク質の発現または活性を低減または阻害することができる。
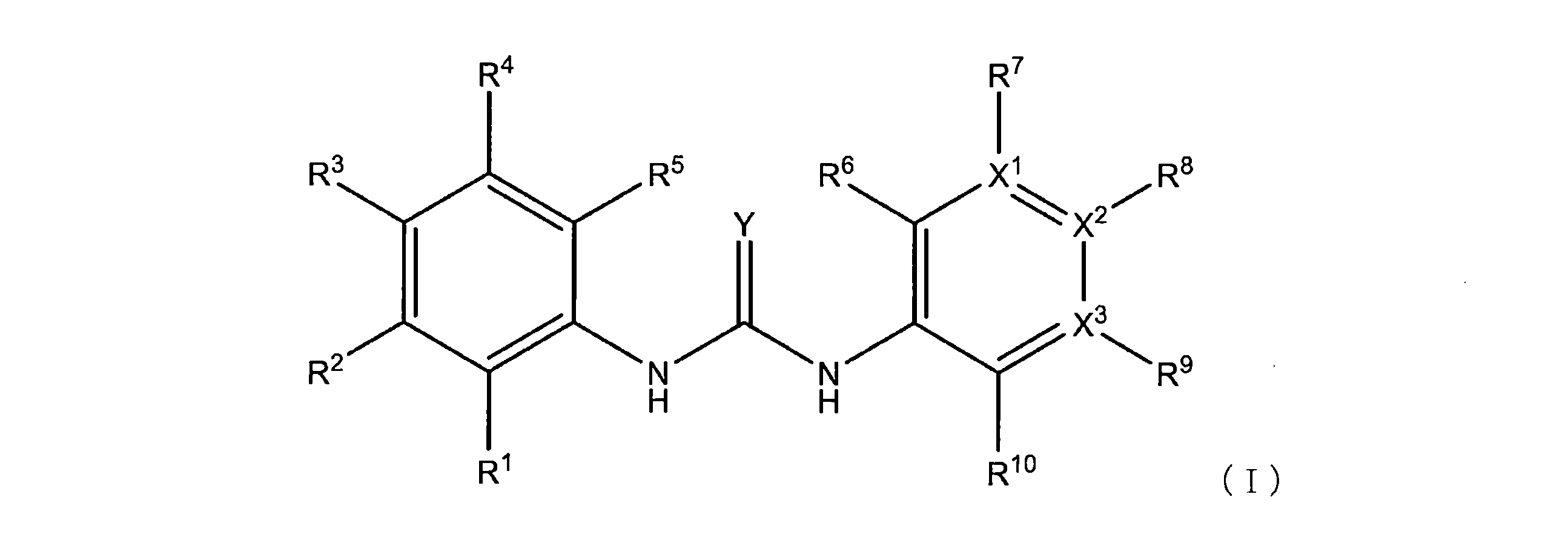
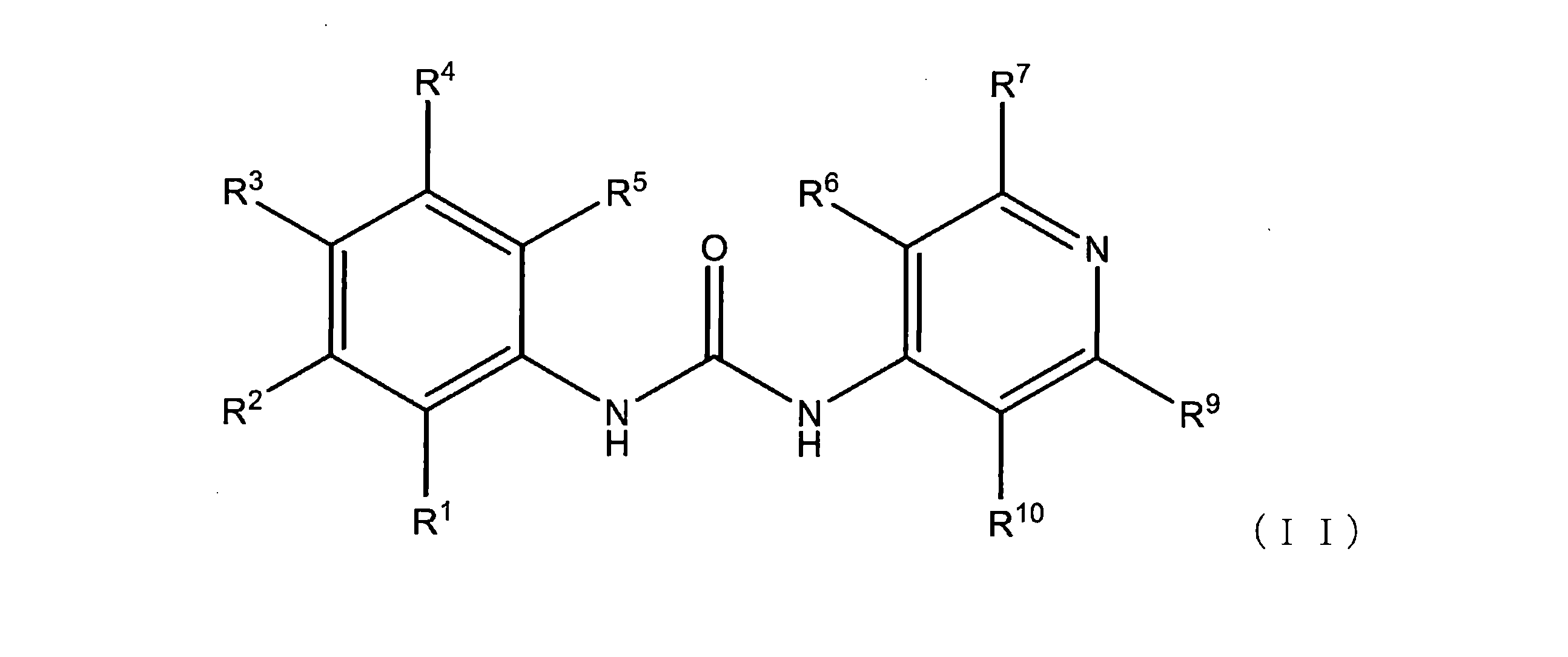
本明細書に開示されるのは、式(I)の例示的な化合物:
またはその薬学的に許容される塩であり、
式中、
X
1、X
2、およびX
3のそれぞれは、独立して、CまたはNであり、X
1、X
2、およびX
3のうちの少なくとも1つはNであり、
Yは、O、S、NH、N-OH、N-OR
11、またはNR
11であり、好ましくはYはOまたはSであり、
R
1、R
2、R
3、R
4、R
5、R
6、およびR
10のそれぞれは、独立して、アルキル、アルケン、アルケニル、フェニル、ピリジルまたはナフチルから選択され、ここで、クロロ、フルオロ、ブロモ、メチル、エチル、イソプロピル、-OCH
3、-OH、-NH
2/-CF
3、-OCF
3、-SCH
3、-OCH
3、-C(O)OH、-C(O)OCH
3、-CH
2NH
2、-N(CH
3)
2、-CH
2-ピロリジンおよび-CHOH。R
1、R
2、R
3、R
4、R
5、R
6、およびR
10のそれぞれは、フェニルもしくは5~6員の芳香族複素環系、または芳香族炭素環式環、芳香族複素環式環、または芳香族炭素環式環と芳香族複素環式環との組み合わせを含む8~10員の二環式環系でさらに置換することができ、これらのそれぞれは、独立して、ハロ、任意選択的にNR
2、OR、CO
2RもしくはCONR
2で置換されたC
1-C
3アルキル、任意選択的にNR
2、OR、CO
2RもしくはCONRで置換されたO-(C
1-C
3)-アルキル、NR
2、OCF
3、CF
3、NO
2、CO
2R、CONR、SR、S(O
2)N(R)
2、SCF
3、CN、N(R)C(O)R、N(R)C(O)OR、N(R)C(O)C(O)R、N(R)S(O
2)R、N(R)R、N(R)
2、OR、OC(O)R、OP(O)
3H
2、またはN=C-N(R)
2である。これらの置換におけるRは、アミン、-OH、-SH、ハロ、-O-、-S-;NR
2、OR、CO
2R、S(O
2)N(R)
2、N=C-N(R)
2、R、もしくはCONR
2で任意選択的に置換されたC1-C
3直鎖または分岐アルキル;O-(C
1-C
3)-アルキル;NR
2、OR、CO
2R、S(O
2)N(R)
2、N=C-N(R)
2、R、もしくはCONR
2で任意選択的に置換されたO-(C
1-C
3)-アルキル;NR
2、OCF
3、CF
3、NO
2、CO
2R、CONR、R、OR、NHR;NR2、SR;C(O)R、C(O)N(R)R、C(O)OR、SR、S(O
2)N(R)
2、SCF
3、N=C-N(R)
2、またはCNにより、さらにまたは任意選択的に置換されている。R基は、R。R
1およびR
2でさらに置換されていてもよく、あるいはN(R
2)SO
2-N(R
2)
2、N(R)SO
2-N(R
2)(R
3)、N(R
2)C(O)-OR
2、N(R
2)C(O)-N(R
2)
2、N(R
2)C(O)-N(R
2)(R
3)、N(R
2)C(O)-R
2、N(R
2)
2、C(O)-R
2、CH(OH)-R
2、C(O)-N(R
2)
2、C(O)-OR
2、J、またはN(R’)
2、OR’、CO
2R’、CON(R’)
2、R
3、SO
2N(R)
2、OC(O)R
2、OC(O)R’、OC(O)N(R
2)
2、-N(R
4)(R
5)、-C(O)N(R
5)(R
2)、-C(O)R
5、-N(R
2)C(O)N(R
2)(R
5)、-NC(O)OR
5、-OC(O)N(R
2)(R
5)、もしくは-Jで任意選択的に置換された(Cχ-C
4)直鎖もしくは分岐アルキル、N(R’)、OR’、CO
2R’、CON(R’)
2、もしくはSO
2N(R
2)
2で任意選択的に置換された5~6員の炭素環式もしくは複素環式環系、またはN(R’)
2、OR’、CO
2R’、CON(R’)
2、もしくはSO
2N(R
2)
2で任意選択的に置換された8~10員の炭素環式もしくは複素環式環系、から独立して選択されてもよい;
いくつかの実施形態では、R
1、R
2、R
3、R
4、R
5、R
6、およびR
10のそれぞれは、独立して、H、F、Cl、Br、I、NO
2、(C=O)-R
11、(C=O)-OR
11、(C=O)-NHR
11、(C=O)-N(R
11)
2、C
1-C
6アルキル、C
2-C
6アルケニル、C
2-C
6アルキニル、C
6-C
10アリールまたは5~10員ヘテロアリールであり、上記C
1-C
6アルキル、C
2-C
6アルケニル、C
2-C
6アルキニル、C
6-C
10アリールまたは5~10員ヘテロアリールは、任意選択的にF、Cl、Br、I、(C=O)-R
11、(C=O)-OR
11、(C=O)-NHR
11、(C=O)-N(R
11)
2、C
1-C
6アルキル、C
6-C
10アリールまたは5~10員ヘテロアリールによる1、2、3、またはそれ以上の置換を含み、
R
7、R
8、およびR
9のそれぞれは、存在する場合、独立して、H、F、Cl、Br、I、NO
2、(C=O)-R
11、(C=O)-OR
11、(C=O)-NHR
11、(C=O)-N(R
11)
2、C
1-C
6アルキル、C
2-C
6アルケニル、C
2-C
6アルキニル、C
6-C
10アリールまたは5~10員ヘテロアリールであり、上記C
1-C
6アルキル、C
2-C
6アルケニル、C
2-C
6アルキニル、C
6-C
10アリールまたは5~10員ヘテロアリールは、任意選択的にF、Cl、Br、I、(C=O)-R
11、(C=O)-OR
11、(C=O)-NHR
11、(C=O)-N(R
11)
2、C
1-C
6アルキル、C
6-C
10アリールまたは5~10員ヘテロアリールによる1、2、3、またはそれ以上の置換を含み、
それぞれのR
11は、独立して、C
1-C
6アルキル、C
2-C
6アルケニル、C
2-C
6アルキニル、C
6-C
10アリールまたは5~10員ヘテロアリールであり、上記C
1-C
6アルキル、C
2-C
6アルケニル、C
2-C
6アルキニル、C
6-C
10アリールまたは5~10員ヘテロアリールは、任意選択的にF、Cl、Br、I、(C=O)-(C
1-C
6アルキル)、(C=O)-O(C
1-C
6アルキル)、(C=O)-NH(C
1-C
6アルキル)、または(C=O)-N(C
1-C
6アルキル)
2による1、2、3、またはそれ以上の置換を含む。
いくつかの実施形態では、式(I)の化合物中のX2はNである。いくつかの実施形態では、X1およびX3の両方がCである。いくつかの実施形態では、式(I)の化合物中のX2はNであり、X1およびX3の両方がCである。
いくつかの実施形態では、式(I)の化合物中のR2は、フェノキシではない。いくつかの実施形態では、式(I)の化合物中のR3は、イミダゾリルまたはピリミジニルではない。いくつかの実施形態では、式(I)の化合物中のR2はフェノキシではなく、R3はイミダゾリルまたはピリミジニルではない。
いくつかの実施形態では、式(I)の化合物中のX2がNであり、X1およびX3の両方がCであり、R2はフェノキシではなく、R3はイミダゾリルまたはピリミジニルではない。
いくつかの実施形態では、式(I)の化合物は、フォルクロルフェヌロン(FCF)、またはその薬学的に許容される塩である。いくつかの実施形態では、式(I)の化合物は、フォルクロルフェヌロン(FCF)、またはその薬学的に許容される塩ではない。
いくつかの実施形態では、式(I)の化合物は、式(II)の構造:
またはその薬学的に許容される塩を有する。
式(I)および/または(II)の化合物のいくつかの実施形態では、R3、R4、およびR5のそれぞれは、独立して、H、F、Cl、Br、I、NO2、(C=O)-R11、(C=O)-OR11、(C=O)-NHR11、(C=O)-N(R11)2、またはC1-C6アルキルであり、上記C1-C6アルキルは、任意選択的にF、Cl、Br、I、またはフェニルによる1、2、3、またはそれ以上の置換を含む。
いくつかの実施形態では、式(II)の化合物中のR2は、フェノキシではない。いくつかの実施形態では、式(II)の化合物中のR3は、イミダゾリルまたはピリミジニルではない。いくつかの実施形態では、式(II)の化合物中のR2はフェノキシではなく、R3はイミダゾリルまたはピリミジニルではない。
いくつかの実施形態において、式(II)の化合物は、フォルクロルフェヌロン(FCF)、またはその薬学的に許容される塩である。いくつかの実施形態において、式(II)の化合物は、フォルクロルフェヌロン(FCF)、またはその薬学的に許容される塩ではない。
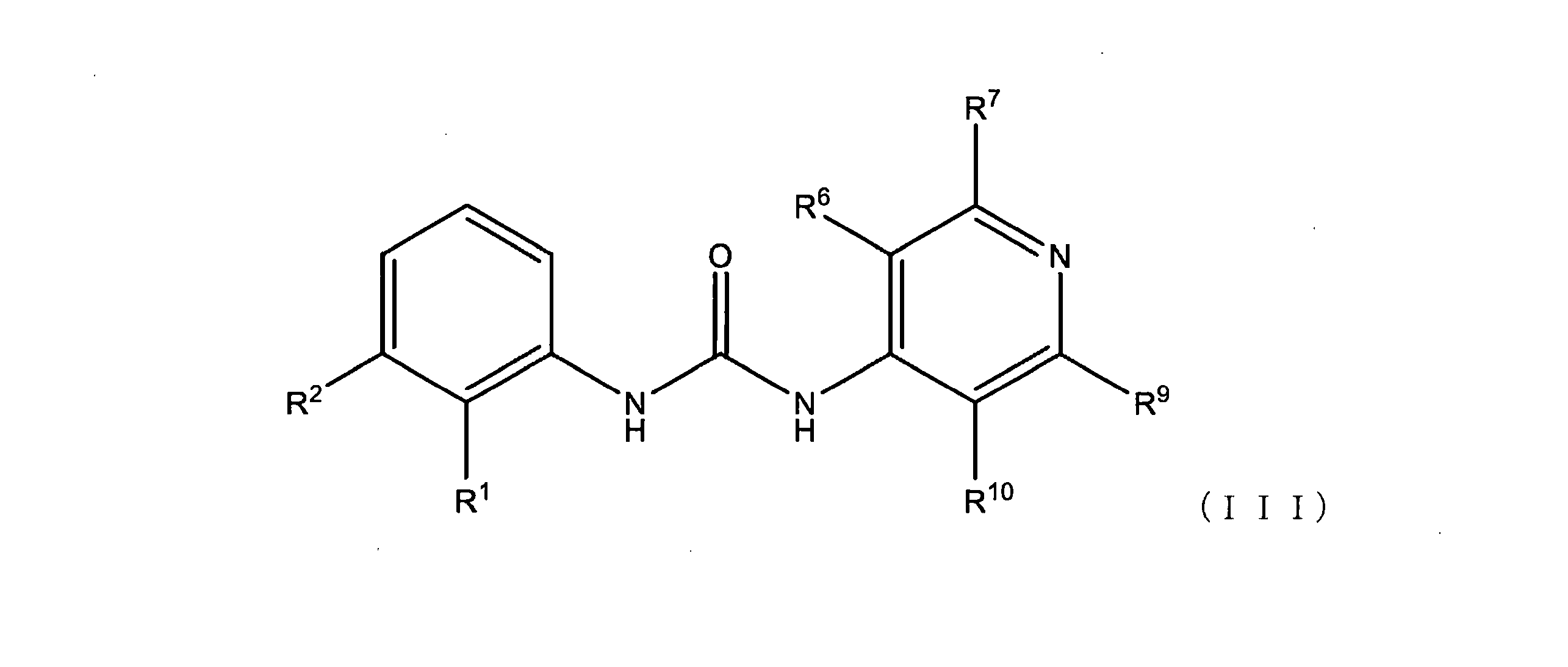
いくつかの実施形態では、式(I)の化合物は、式(III)の構造:
またはその薬学的に許容される塩を有する。
式(I)、(II)、および/または(III)の化合物のいくつかの実施形態では、R6、R7、R9およびR10のそれぞれは、独立して、H、F、Cl、Br、I、NO2、(C=O)-R11、(C=O)-OR11、(C=O)-NHR11、(C=O)-N(R11)2、またはC1-C6アルキルであり、上記C1-C6アルキルは、任意選択的にF、Cl、Br、I、またはフェニルによる1、2、3、またはそれ以上の置換を含む。
いくつかの実施形態では、式(III)の化合物中のR2は、フェノキシではない。
いくつかの実施形態において、式(III)の化合物は、フォルクロルフェヌロン(FCF)、またはその薬学的に許容される塩である。いくつかの実施形態において、式(III)の化合物は、フォルクロルフェヌロン(FCF)、またはその薬学的に許容される塩ではない。
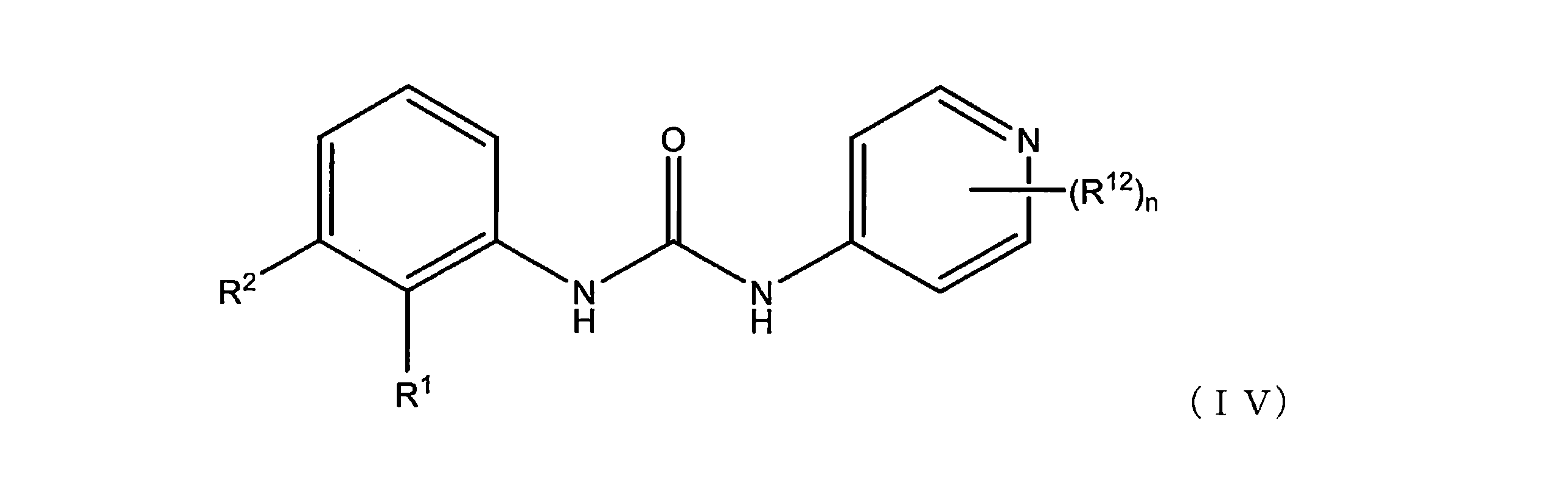
いくつかの実施形態では、式(I)の化合物は、式(IV)の構造:
またはその薬学的に許容される塩を有し、
式中
それぞれのR
12が、独立して、F、Cl、Br、I、NO
2、(C=O)-R
11、(C=O)-OR
11、(C=O)-NHR
11、(C=O)-N(R
11)
2、C
1-C
6アルキル、C
2-C
6アルケニル、C
2-C
6アルキニル、C
6-C
10アリールまたは5~10員ヘテロアリールであり、上記C
1-C
6アルキル、C
2-C
6アルケニル、C
2-C
6アルキニル、C
6-C
10アリールまたは5~10員ヘテロアリールは、任意選択的にF、Cl、Br、I、(C=O)-R
11、(C=O)-OR
11、(C=O)-NHR
11、(C=O)-N(R
11)
2、C
1-C
6アルキル、C
6-C
10アリールまたは5~10員ヘテロアリールによる1、2、3、またはそれ以上の置換を含み、
nが、1または2である。
いくつかの実施形態では、式(III)の化合物中のR2は、フェノキシではない。
式(I)、(II)、(III)、および/または(IV)の化合物のいくつかの実施形態では、R1が、F、Cl、Br、I、NO2、(C=O)-R11、(C=O)-OR11、(C=O)-NHR11、(C=O)-N(R11)2、またはC1-C6アルキルであり、上記C1-C6アルキルは、任意選択的にF、Cl、Br、I、またはフェニルによる1、2、3、またはそれ以上の置換を含む。いくつかの実施形態では、R1は、F、Cl、Br、またはIである。例えば、R1は、Fであり得る。
式(I)、(II)、(III)、および/または(IV)の化合物のいくつかの実施形態では、R2が、F、Cl、Br、I、NO2、(C=O)-R11、(C=O)-OR11、(C=O)-NHR11、(C=O)-N(R11)2、またはC1-C6アルキルであり、上記C1-C6アルキルは、任意選択的にF、Cl、Br、I、またはフェニルによる1、2、3、またはそれ以上の置換を含む。いくつかの実施形態では、R2は、任意選択的にF、Cl、Br、またはIによる1、2、3、またはそれ以上の置換を含む、C1-C6アルキルである。いくつかの実施形態では、R2は、任意選択的にFまたはClによる1、2または3置換を含む、C1-C3アルキルである。例えば、R2は、CF3であり得る。
式(I)、(II)、(III)、および/または(IV)の化合物のいくつかの実施形態では、R1およびR2のそれぞれが、独立して、F、Cl、Br、I、またはC1-C6アルキルであり、上記C1-C6アルキルは、任意選択的にF、Cl、Br、I、またはフェニルによる1、2、3、またはそれ以上の置換を含む。いくつかの実施形態では、R1は、F、Cl、Br、またはIであり、R2は、任意選択的にFまたはClによる1、2または3置換を含む、C1-C3アルキルである。
式(IV)の化合物のいくつかの実施形態では、各R12は、F、Cl、Br、I、またはC1-C6アルキルであり、上記C1-C6アルキルは、任意選択的に、F、Cl、Br、またはIによる1、2、3、またはそれ以上の置換を含む。いくつかの実施形態では、それぞれのR12は、F、ClまたはBrである。いくつかの実施形態では、それぞれのR12はClである。いくつかの実施形態では、R12が、オルト置換基である。
いくつかの実施形態では、式(IV)の化合物は、フォルクロルフェヌロン(FCF)、またはその薬学的に許容される塩である。いくつかの実施形態では、式(IV)の化合物は、フォルクロルフェヌロン(FCF)、またはその薬学的に許容される塩ではない。
いくつかの実施形態では、本明細書に記載の化合物は、フォルクロルフェヌロン(FCF)の類似体を含む。いくつかの実施形態では、本明細書に記載の化合物は、以下の構造:
またはその薬学的に許容される塩を含む。
いくつかの実施形態では、本明細書に記載の化合物は、以下の構造:
またはその薬学的に許容される塩を含む。
いくつかの実施形態では、本明細書に記載の化合物は、以下の構造:
またはその薬学的に許容される塩を含む。
いくつかの実施形態では、本明細書に記載の化合物は、以下の構造:
またはその薬学的に許容される塩を含む。
特定の実施形態では、本開示は、本開示の化合物(例えば、式(I)、(II)、(III)、および/または(IV)の化合物)、またはその薬学的に許容される塩、ならびに薬学的に許容される賦形剤を含む医薬組成物を提供する。
特定の実施形態では、医薬組成物は、1つ以上の追加の治療薬を含む。
本明細書に開示される化合物またはその薬学的に許容される塩を含む医薬組成物は、通常の慣行に従って選択され得る1つ以上の薬学的に許容される賦形剤とともに調製され得る。錠剤は、流動促進剤(glidant)、充填剤、結合剤などを含む賦形剤を含み得る。水性組成物は、無菌形態で調製することができ、経口投与以外による送達を意図する場合、一般に等張性であり得る。すべての組成物は、任意選択的に、Rowe et al,Handbook of Pharmaceutical Excipients,6th edition,American Pharmacists Association,2009に記載されているような賦形剤を含み得る。賦形剤には、アスコルビン酸および他の抗酸化剤、EDTAなどのキレート剤、デキストリン、ヒドロキシアルキルセルロース、ヒドロキシアルキルメチルセルロース、ステアリン酸などの炭水化物が含まれ得る。特定の実施形態では、組成物は、固体経口剤形を含む固体剤形として提供される。
組成物は、経口投与を含む様々な投与経路に適したものを含む。組成物は、単位剤形で提供されてもよく、薬学分野での周知方法のいずれかによって調製することができる。そのような方法は、有効成分(例えば、本開示の化合物またはその薬学的な塩)を1つ以上の薬学的に許容される賦形剤と会合させるステップを含む。組成物は、有効成分を液体賦形剤もしくは細分された固体賦形剤またはその両方と均一かつ密接に会合させ、次いで、必要に応じて生成物を成形することによって調製される。技術および製剤化は、一般的に、Remington:The Science and Practice of Pharmacy,21st Edition,Lippincott Williams and Wilkins,Philadelphia,Pa.,2006に記載されている。
経口投与に適した本明細書に記載の組成物は、それぞれが所定量の有効成分を含むカプセル、カシェ剤または錠剤を含むがこれらに限定されない別個の単位(単位剤形)として提示することができる。一実施形態では、医薬組成物は錠剤である。
本明細書に開示される医薬組成物は、本明細書に開示される1つ以上の化合物、またはその薬学的に許容される塩を、薬学的に許容される賦形剤および任意選択的に他の治療薬とともに含む。有効成分を含む医薬組成物は、意図される投与方法に適した任意の形態であり得る。例えば、経口使用に使用される場合、錠剤、トローチ、ロゼンジ、水性または油性懸濁液、分散性粉末または顆粒、乳濁液、硬質または軟質カプセル、シロップまたはエリキシル剤を調製することができる。経口使用を意図とした組成物は、医薬組成物の製造のための当技術分野で知られている任意の方法に従って調製することができ、そのような組成物は、口当たりの良い調製物を提供するために、甘味剤、香味剤、着色剤および保存剤を含む1つ以上の賦形剤を含み得る。錠剤の製造に適した、毒性のない薬学的に許容される賦形剤と混合した有効成分を含む錠剤が許容される。これらの賦形剤は、例えば、炭酸カルシウムまたは炭酸ナトリウム、ラクトース、ラクトース一水和物、クロスカルメロースナトリウム、ポビドン、リン酸カルシウムまたはナトリウムなどの不活性希釈剤、トウモロコシデンプンまたはアルギン酸などの造粒および崩壊剤、セルロース、微結晶性セルロース、デンプン、ゼラチンまたはアカシアなどの結合剤、ならびにステアリン酸マグネシウム、ステアリン酸、またはタルクなどの潤滑剤であり得る。錠剤は、コーティングされていないか、またはマイクロカプセル化を含む既知の技術によってコーティングされて、消化管での崩壊および吸着を遅らせ、それによって長期間にわたって持続的な作用を提供し得る。例えば、モノステアリン酸グリセリルまたはジステアリン酸グリセリルなどの時間遅延材料を単独でまたはワックスとともに使用することができる。
剤形を生成するために不活性成分と組み合わせることができる有効成分の量は、意図される治療対象および特定の投与様式に応じて変化し得る。例えば、いくつかの実施形態では、ヒトへの経口投与のための剤形は、適切かつ便利な量の薬学的に許容される賦形剤とともに製剤化された約1~1000mgの活性物質を含み得る。特定の実施形態では、薬学的に許容される賦形剤は、全組成物(重量:重量)の約5~約95%変化する。
特定の実施形態では、本開示の化合物またはその薬学的に許容される塩を1つの変形例で含む組成物は、有効成分が代謝される速度に影響を与える薬剤を含まない。したがって、一態様で本開示の化合物を含む組成物は、本開示の化合物または本開示の化合物と別々に、連続してまたは同時に投与される任意の他の有効成分の代謝に影響を与える(例えば、遅くする、妨げる、もしくは遅らせる)薬剤を含まないことが理解される。
したがって、一態様で本明細書に詳述される方法、キット、製造品などのいずれも、本開示の化合物または本開示の化合物と別々に、連続してまたは同時に投与される任意の他の有効成分の代謝に影響を与える(例えば、遅くする、妨げる、もしくは遅らせる)薬剤を含まないことが理解される。
本開示はさらに、当技術分野で知られている従来の方法によって、例えば、有効成分を薬学的に許容される治療的に不活性な有機および/もしくは無機担体または賦形剤に結合させることによって、あるいはそれらと混合することによって調製することができる、薬学的に許容される組成物の単一の有効成分として投与するための本開示の化合物を含む。
別の可能性は、既知の薬物における他の有効成分との相乗効果を有する第2のまたは他の有効成分としての本開示の化合物の使用、またはそのような薬物と一緒の本開示の化合物の投与である。
本開示の化合物はまた、インビボで有効成分を放出するプロドラッグまたは他の適切に改変された形態の形態で使用され得る。
本開示は、本開示の化合物またはその薬学的に許容される塩を使用する方法を提供する。
例えば、いくつかの実施形態では、セプチンタンパク質の活性を低減または阻害する方法は、セプチンタンパク質を本開示の化合物または組成物、あるいはその薬学的に許容される塩と接触させることを含む。セプチンタンパク質は、当技術分野で知られているセプチンタンパク質のうちのいずれか1つまたは組み合わせであり、例えば、セプチン-1、セプチン-2、セプチン-3、セプチン-4、セプチン-5、セプチン-6、セプチン-7、セプチン-8、セプチン-9、セプチン-10、セプチン-11、セプチン-12、および/またはセプチン-14であり得る。いくつかの実施形態では、セプチンタンパク質は、セプチン-2、セプチン-4、セプチン-9、および/またはセプチン-14である。いくつかの実施形態では、セプチンタンパク質は、セプチン-2およびセプチン-9である。いくつかの実施形態では、セプチンタンパク質は、セプチン-2である。
いくつかの実施形態では、本開示は、細胞を本開示の化合物もしくは組成物、またはその薬学的に許容される塩と接触させることを含む、細胞生存率および/または増殖を阻害する方法を提供する。
本明細書でさらに開示されるのは、疾患または障害の治療を必要とする対象に、治療有効量の本開示の化合物もしくは組成物、またはその薬学的に許容される塩を投与することを含む、疾患または障害を治療する方法である。いくつかの実施形態では、疾患または障害はがんである。
一般に、本開示の化合物またはその薬学的に許容される塩で治療することができるがんは、上記のようなセプチンタンパク質の異常な発現または活性を有するがんである。いくつかの実施形態では、がんは、肺がん、卵巣がん、腎がん、尿路上皮がん、子宮内膜がん、結腸直腸がん、皮膚がん、脳がん、乳がん、肝臓がん、膵臓がん、またはそれらの任意の組み合わせを含む。いくつかの実施形態では、がんは、肺がん、卵巣がん、腎がん、子宮内膜がん、肝臓がん、膵臓がん、またはそれらの任意の組み合わせを含む。いくつかの実施形態では、がんは、卵巣がん、子宮内膜がん、膵臓がん、またはそれらの任意の組み合わせを含む。いくつかの実施形態では、がんは、卵巣明細胞がんなどの卵巣がんを含む。
本開示は、本開示の化合物もしくは組成物、またはその薬学的に許容される塩を含むキットを提供する。任意選択的に、キットは、例えば、がんの治療に使用するための使用説明書をさらに含む。使用説明書は一般的に書面による説明書であるが、説明書を含む電子記憶媒体(例えば、磁気ディスケットまたは光ディスクなど)も使用することができる。
本開示はまた、本開示の化合物またはその薬学的に許容される塩を含む1つ以上の容器を含む医薬キットを提供する。任意選択的に、そのような容器に関連付けられるのは、医薬品の製造、使用、または販売を規制する政府機関によって規定された形態の通知であり、この通知は、人間の管理のための製造、使用、または販売に対する政府機関による承認を反映している。各成分(2つ以上の成分がある場合)は、別々の容器にパッケージ化するか、交差反応性および貯蔵寿命が許す限り、いくつかの成分を1つの容器に組み合わせることができる。キットは、単位剤形、バルクパッケージ(例えば、複数回投与パッケージ)、またはサブユニット投与であることができる。任意選択的に、キットには、複数の単位用量の化合物および使用説明書が含まれており、薬局(例えば、病院の薬局および調剤薬局など)での保管および使用に十分な量でパッケージ化されている。
本明細書に記載の方法で使用するのに適したパッケージングで、本開示の化合物またはその薬学的に許容される塩の単位用量を含む製造品も提供される。適切な包装は当技術分野で知られており、例えば、バイアル、容器、アンプル、ボトル、ジャー、可撓性パッケージングなどが含まれる。任意選択的に、製造品はさらに滅菌および/または密封される。
別途定義されない限り、本明細書で使用されるすべての技術用語および科学用語は、当業者に一般に理解されるのと同じ意味を有する。化学基の前部または端部のダッシュは、親部分への結合点を示すための便宜上の事項であり、化学基は、通常の意味を失うことなく、1つ以上のダッシュを伴ってまたは伴わずに表すことができる。「Cu-v」または「Cu-Cv」などの接頭辞は、後に続く基がu~v個の炭素原子を有することを示し、ここで、uおよびvは整数である。例えば、「C1-6アルキル」または「C1-C6アルキル」は、アルキル基が1~6個の炭素原子を有することを示す。
「アルキル」は、線状または分枝状の飽和一価炭化水素である。例えば、アルキル基は、1~10個の炭素原子(すなわち、C1-10アルキル)または1~8個の炭素原子(すなわち、C1-8アルキル)または1~6個の炭素原子(すなわち、C1-6アルキル)または1~4個の炭素原子(すなわち、C1-4アルキル)を有することができる。アルキル基の例としては、限定されるものではないが、メチル(Me、-CH3)、エチル(Et、-CH2CH3)、1-プロピル(n-Pr、n-プロピル、-CH2CH2CH3)、2-プロピル(i-Pr、i-プロピル、-CH(CH3)2)、1-ブチル(n-Bu、n-ブチル、-CH2CH2CH2CH3)、2-メチル-1-プロピル(i-Bu、i-ブチル、-CH2CH(CH3)2)、2-ブチル(s-Bu、s-ブチル、-CH(CH3)CH2CH3)、2-メチル-2-プロピル(t-Bu、t-ブチル、-C(CH3)3)、1-ペンチル(n-ペンチル、-CH2CH2CH2CH2CH3)、2-ペンチル(-CH(CH3)CH2CH2CH3)、3-ペンチル(-CH(CH2CH3)2)、2-メチル-2-ブチル(-C(CH3)2CH2CH3)、3-メチル-2-ブチル(-CH(CH3)CH(CH3)2)、3-メチル-1-ブチル(-CH2CH2CH(CH3)2)、2-メチル-1-ブチル(-CH2CH(CH3)CH2CH3)、1-ヘキシル(-CH2CH2CH2CH2CH2CH3)、2-ヘキシル(-CH(CH3)CH2CH2CH2CH3)、3-ヘキシル(-CH(CH2CH3)(CH2CH2CH3))、2-メチル-2-ペンチル(-C(CH3)2CH2CH2CH3)、3-メチル-2-ペンチル(-CH(CH3)CH(CH3)CH2CH3)、4-メチル-2-ペンチル(-CH(CH3)CH2CH(CH3)2)、3-メチル-3-ペンチル(-C(CH3)(CH2CH3)2)、2-メチル-3-ペンチル(-CH(CH2CH3)CH(CH3)2)、2,3-ジメチル-2-ブチル(-C(CH3)2CH(CH3)2)、3,3-ジメチル-2-ブチル(-CH(CH3)C(CH3)3、およびオクチル(-(CH2)7CH3)が含まれる。
「アルケニル」は、少なくとも1つの炭素-炭素二重結合を有する線状または分枝状の一価炭化水素ラジカルである。例えば、アルケニル基は、2~8個の炭素原子(すなわち、C2-8アルケニル)または2~6個の炭素原子(すなわち、C2-6アルケニル)または2~4個の炭素原子(すなわち、C2-4アルケニル)を有することができる。アルケニル基の例には、エテニル(-CH=CH2)、アリル(-CH2CH=CH2)、および-CH2-CH=CH-CH3が含まれるが、これらに限定されない。
「アルキニル」は、少なくとも1つの炭素-炭素三重結合を有する線状または分枝状の一価炭化水素ラジカルである。例えば、アルキニル基は、2~8個の炭素原子(すなわち、C2-8アルキニル)または2~6個の炭素原子(すなわち、C2-6アルキニル)または2~4個の炭素原子(すなわち、C2-4アルキニル)を有することができる。アルキニル基の例には、アセチレニル(-C≡CH)、プロパルギル(-CH2C≡CH)、および-CH2-C≡C-CH3が含まれるが、これらに限定されない。
本明細書で使用される「ハロ」または「ハロゲン」は、フルオロ(-F)、クロロ(-Cl)、ブロモ(-Br)およびヨード(-I)を指す。
本明細書で使用される「アリール」は、単一のすべてが炭素の芳香族環、または環のうちの少なくとも1つが芳香族である複数の縮合のすべて炭素の環系を指す。例えば、特定の実施形態では、アリール基は、6~20個の炭素原子、6~14個の炭素原子、または6~12個の炭素原子を有する。アリールにはフェニルラジカルが含まれる。アリールはまた、少なくとも1つの環が芳香族であり、他の環が芳香族または非芳香族(すなわち、炭素環)である約9~20個の炭素原子を有する多重縮合環系(例えば、2、3または4環を含む環系)を含む。そのような多重縮合環系は、任意選択的に、多重縮合環系の任意の炭素環部分上、1つ以上(例えば、1、2または3個)のオキソ基で置換されている。多重縮合環系の環は、原子価要件で可能な場合、縮合、スピロ、およびブリッジ結合を介して相互に接続することができる。特定の原子範囲(atom range)のメンバーのアリール(例えば、6~10員のアリール)を参照する場合、原子範囲は、アリールの全環原子に対するものであることも理解されたい。例えば、6員のアリールにはフェニルが含まれ、10員のアリールにはナフチルと1,2,3,4-テトラヒドロナフチルが含まれる。アリール基の非限定的な例には、フェニル、インデニル、ナフチル、1,2,3,4-テトラヒドロナフチル、アントラセニルなどが含まれるが、これらに限定されない。
本明細書で使用される「ヘテロアリール」は、環内に炭素以外の少なくとも1つの原子を有する単一芳香環を指し、原子は、酸素、窒素および硫黄からなる群から選択され、「ヘテロアリール」はまた、少なくとも1つのそのような芳香環を有する多重縮合環系を含み、この多重縮合環系を以下にさらに説明する。したがって、「ヘテロアリール」は、約1~6個の炭素原子、ならびに酸素、窒素、および硫黄からなる群から選択される約1~4個のヘテロ原子の単一芳香環を含む。任意選択的に、環が芳香族である場合、硫黄原子および窒素原子も酸化された形で存在する。例示的なヘテロアリール環系には、ピリジル、ピリミジニル、オキサゾリルまたはフリルが含まれるが、これらに限定されない。「ヘテロアリール」はまた、上記で定義されたヘテロアリール基が、ヘテロアリール(例えば、1,8-ナフチリジニルを形成するため)、複素環(例えば、1,2,3,4-テトラヒドロ-1,8-ナフチリジニルを形成するため)、炭素環(例えば、5,6,7,8-テトラヒドロキノリルを形成するため)およびアリール(例えば、インダゾリルを形成するため)から選択される1つ以上の環と縮合して多重縮合環系を形成する、多重縮合環系(例えば、2つの環を含む環系)を含む。したがって、ヘテロアリール(単一芳香環または多重縮合環系)は、ヘテロアリール環内に約1~9個の炭素原子および約1~6個のヘテロ原子を有する。そのような多重縮合環系は、任意選択的に縮合環の炭素環または複素環部分上の1つ以上(例えば、1、2、3または4)のオキソ基で置換されている。多重縮合環系の環は、原子価要件で可能な場合、縮合、スピロ、およびブリッジ結合を介して相互に接続できる。多重縮合環系の個々の環は、任意選択的に、互いに対して任意の順序で接続されることを理解されたい。ヘテロアリールまたはヘテロアリール多重縮合環系の結合点は、炭素原子およびヘテロ原子(例えば、窒素)を含むヘテロアリールまたはヘテロアリール多重縮合環系の任意の適切な原子であり得ることが理解されるべきである。特定の原子範囲のメンバーのヘテロアリール(例えば、5~10員のヘテロアリール)を参照する場合、原子範囲は、ヘテロアリールの全環原子に対するものであり、炭素原子およびヘテロ原子を含むことも理解されたい。例えば、5員のヘテロアリールにはチアゾリルが含まれ、10員のヘテロアリールにはキノリニルが含まれる。例示的なヘテロアリールには、ピリジル、ピロリル、ピラジニル、ピリミジニル、ピリダジニル、ピラゾリル、チエニル、インドリル、イミダゾリル、オキサゾリル、イソキサゾリル、チアゾリル、フリル、オキサジアゾリル、チアジアゾリル、キノリル、イソキノリル、ベンゾチアゾリル、ベンゾオキサゾリル、インダゾリル、キノキサリル、キナゾリル、5,6,7,8-テトラヒドロイソキノリニルベンゾフラニル、ベンズイミダゾリル、チアナフテニル、ピロロ[2,3-b]ピリジニル、キナゾリニル-4(3H)-オン、およびトリアゾリルが含まれるが、これらに限定されない。
「本開示の化合物」は、本明細書に開示される化合物を含み、例えば、本開示の化合物は、実施例の化合物を含む、式(I)、(II)、(III)および(IV)の化合物を含む。
本明細書で使用される「治療」または「治療する」または「治療すること」は、有益なまたは所望の結果を得るためのアプローチを指す。本開示の目的のために、有益なまたは所望の結果には、症状の緩和および/または症状の程度の縮減、および/または疾患もしくは状態に関連する症状の悪化の予防が含まれるが、これらに限定されない。一実施形態では、「治療」または「治療すること」は、以下のうちの1つ以上を含む:a)疾患または状態を阻害すること(例えば、疾患または状態に起因する1つ以上の症状を減少させること、および/または疾患もしくは状態の程度を縮減させること)、b)疾患または状態に関連する1つ以上の症状の発症を遅延させることまたは阻止すること(例えば、疾患または状態を安定させること、疾患または状態の悪化または進行を遅延させること)、ならびにc)疾患または状態を緩和すること、例えば、臨床症状の退行を引き起こすこと、病状を改善すること、疾患の進行を遅延させること、生活の質を高めること、および/または生存を延長すること。
本明細書で使用される疾患または状態の発症で参照される「遅延させること」は、疾患または状態の発症を延期、妨害、遅延、遅らせる、安定化および/または延期することを意味する。この遅延には、疾患の病歴および/または治療されている個人に応じて、様々な長さの時間になる可能性がある。当業者には明らかであるように、十分なまたは有意な遅延は、事実上、個体が疾患または状態を発症しないという点で、予防を包含することができる。
本明細書で使用される「予防する」または「予防」または「予防すること」は、疾患の臨床症状が発症しないように、疾患または障害の発症に対し保護するレジメンを指す。したがって、「予防」は、対象において疾患の徴候が検出可能になる前の対象への療法の施与(例えば、治療物質の投与)に関連する。対象は、疾患または障害の発症(development)または発症(onset)に関連することが知られている1つ以上のリスク因子を有する個体など、疾患または障害を発症するリスクのある個体であり得る。また、予防には100%の成功率は必要ないことも理解されている。
本明細書で使用されるタンパク質、例えば、セプチンタンパク質の活性の「調節」または「調節すること」は、活性が増加または減少するような活性の変化を指す。いくつかの実施形態では、調節は活性を減少させる。
本明細書で使用される「低減させる」または「低減」または「低減させること」は、特定のレベル(例えば、タンパク質および/またはmRNAの発現レベルおよび/または活性もしくは機能)を減少させる効果を指す。結果として低減したレベルは、以前のレベルの、約99%、98%、95%、90%、85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%、10%、5%、3%、1%以下、または100%よりも小さい上記に列挙されていない任意のパーセンテージである。具体的には、結果として生じる低減したレベルはゼロである可能性があり、これは実験的に検出できないことを意味する(例えば、発現レベルおよび/または活性もしくは機能に対して)。本明細書で使用される「低減させる」などの用語は、「阻害する」などの用語と交換可能である。
本明細書で使用される「対象」は、哺乳動物、例えば、脊索動物門内の動物を指し、これらに限定されないが、霊長類(ヒト、他の大型類人猿(ヒト科(hominid))、テナガザル(テナガザル科(hylobatid))、旧世界サル(オナガザル科(cercopithecid))、新世界サル(広鼻猿類、少なくともマーモセット科(Callitrichid)、オマキザル科(Cebid)、ヨザル科(Aotid)、サキ科(Pitheciid)、クモザル科(Atelid)を含む、広鼻猿類)、メガネザルおよび曲鼻亜目(Strepsirrhine)(少なくともキツネザルおよびノロマザルのような霊長類を含む))、グリレス大目(Glire)(ナキウサギ、ウサギ、ノウサギ、およびげっ歯類(少なくともマウスのようなげっ歯類、ウロコオリスのようなげっ歯類、ビーバーのようなげっ歯類、ヤマアラシのようなげっ歯類、およびリスのようなげっ歯類を含む))、ネコのような肉食動物(少なくともネコ、オビリンサン属(Asiatic linsang)、キノボリジャコウネコ科(African palm civet)、ジャコウネコ科(Viverroid)、ハイエナ、およびマングースを含むネコ亜目(feliform))、イヌのような肉食動物(少なくともイヌ、クマ、レッサーパンダ、スカンク、イタチ、ミンク、クズリ、アライグマ、セイウチ、アシカ、アザラシを含むイヌ亜目(caniform))、ハリネズミ、トガリネズミ、モグラ、ラクダ類(少なくともラクダとラマを含む)、ブタ(少なくともブタおよびペッカリー)、カバ、クジラ、イルカ、コウモリ、ウマ、有袋類などを含む。いくつかの実施形態では、本明細書に記載の対象は、ブタ、ウシ、ウマ、ラクダ類、イヌ、ネコ、ラット、マウスなどの家畜、カニクイザルまたはチンパンジーなどの非ヒト霊長類、またはヒトである。いくつかの実施形態では、対象は、ヒトである。いくつかの実施形態では、対象は、マウス、ラット、ハムスター、モルモット、サル、類人猿、ウサギ、ネコ、イヌ、ウマ、ブタ、ライオン、トラ、オオカミなどを含むがこれらに限定されない動物である。
本明細書で使用される「リスクのある個体」は、治療されるべき状態を発症するリスクのある個体を指す。「リスクのある」個体は、検出可能な疾患または状態を有していてもいなくてもよく、本明細書に記載の方法の治療前に検出可能な疾患を示していても示さなくてもよい。「リスクのある」とは、個体が1つ以上のいわゆるリスク因子を有することを意味し、これは、疾患または状態の発症と相関し、当技術分野で知られている測定可能なパラメータである。これらのリスク因子のうちの1つ以上を有している個体は、これらのリスク因子を有していない個体よりも疾患または状態を発症する可能性が高くなる。
本明細書で使用される「治療有効量」または「有効量」は、疾患を治療するために対象に投与されたときに、疾患のそのような治療を行うのに十分である化合物の量を含む、所望の生物学的または医学的応答を引き出すのに有効な量を指す。有効量は、化合物、疾患およびその重症度、ならびに、治療される対象の年齢、体重などに応じて変化する。有効量には、ある範囲の量を含めることができる。当技術分野で理解されているように、有効量は、1つ以上の用量であり得、すなわち、所望の治療エンドポイントを達成するために、単一の用量または複数の用量が必要とされ得る。有効量は、1つ以上の治療薬を投与する状況で考慮され得、単一の薬剤は、1つ以上の他の薬剤と組み合わせて、望ましいまたは有益な結果が可能であるまたは達成される場合、有効量で与えられるとみなされ得る。任意の同時投与される化合物の適切な用量は、化合物の組み合わせ作用(例えば、相加効果または相乗効果)のために、任意選択的に低下させることができる。
「薬学的に許容される賦形剤」には、限定することなく、任意の、アジュバント、担体、賦形剤、流動促進剤、甘味剤、希釈剤、防腐剤、染料/着色剤、風味増強剤、界面活性剤、湿潤剤、分散剤、懸濁剤、安定剤、等張剤、溶媒、またはヒトもしくは家畜での使用が許容されるものとして米国食品医薬品局によって承認された乳化剤が含まれる。
本明細書に記載の化合物の薬学的に許容される塩、水和物、溶媒和物、互変異性型、多形体、およびプロドラッグも提供される。「薬学的に許容される」または「生理学的に許容される」とは、獣医学的またはヒトの医薬用途に適した医薬組成物を調製するのに有用な化合物、塩、組成物、剤形および他の材料を指す。
本明細書に記載の化合物は、薬学的に許容される塩として、または適切な場合には遊離塩基として調製および/または製剤化することができる。薬学的に許容される塩は、遊離塩基の所望の薬理学的活性を有する化合物の遊離塩基形態の非毒性塩である。これらの塩は、無機もしくは有機の酸または塩基に由来し得る。例えば、塩基性窒素を含む化合物は、化合物を無機酸または有機酸と接触させることにより、薬学的に許容される塩として調製することができる。薬学的に許容される塩の非限定的な例には、硫酸塩、ピロ硫酸塩、重硫酸塩、亜硫酸塩、重亜硫酸塩、リン酸塩、リン酸一水素塩、リン酸二水素塩、メタリン酸塩、ピロリン酸塩、塩化物、臭化物、ヨウ化物、酢酸塩、プロピオン酸塩、デカン酸塩、カプリル酸塩、アクリル酸塩、ギ酸塩、イソ酪酸塩、カプロン酸塩、ヘプタン酸塩、プロピオン酸塩、シュウ酸塩、マロン酸塩、コハク酸塩、スベリン酸塩、セバシン酸塩、フマル酸塩、マレイン酸塩、ブチン-1,4-ジオエート、ヘキシン-1,6-ジオエート、安息香酸塩、クロロ安息香酸塩、メチル安息香酸塩、ジニトロ安息香酸塩、ヒドロキシ安息香酸塩、メトキシ安息香酸塩、フタル酸塩、スルホン酸塩、メチルスルホン酸塩、プロピルスルホン酸塩、ベシル酸塩、キシレンスルホン酸塩、ナフタレン-1-スルホン酸塩、ナフタレン-2-スルホン酸塩、フェニル酢酸塩、フェニルプロピオン酸塩、フェニル酪酸塩、クエン酸塩、乳酸塩、γ-ヒドロキシ酪酸塩、グリコール酸塩、酒石酸塩、およびマンデル酸塩が含まれる。他の適切な薬学的に許容される塩のリストは、Remington:The Science and Practice of Pharmacy,21st Edition,Lippincott Wiliams and Wilkins,Philadelphia,Pa.,2006に記載されている。
本明細書に開示される化合物の「薬学的に許容される塩」の例には、アルカリ金属(例えば、ナトリウム、カリウム)、アルカリ土類金属(例えば、マグネシウム)、アンモニウムおよびNX4
+(Xは、C1-C4アルキルである)などの適切な塩基に由来する塩も含まれる。ナトリウム塩またはカリウム塩などの塩基付加塩も含まれる。
本明細書で使用される「がん」という用語は、身体の臓器およびシステムの正常な機能を妨害する臓器の器官の制御されていない細胞の増殖を指す。元の場所から移動して重要な臓器に播種するがん細胞は、影響を受けた臓器の機能低下を通じて、最終的には対象の死につながる可能性がある。がん細胞は、異常に分裂して増殖する細胞である。場合によっては、発現された遺伝子およびタンパク質のプロファイル、ならびにそれらの発現のレベルに基づいて、がん細胞をそれらの正常な対応物から区別することが可能である。がん細胞で一般的に影響を受ける遺伝子には、がん遺伝子が含まれる。がん関連の変異は、それらの発現の減少または完全な欠失につながる。他では、変異は、発現の増加または正常な対応物の活性化されたバリアントの発現を引き起こす。
「腫瘍」という用語は通常、新生物(neoplasm)と同等であり、文字通り「新生物(new growth)」を意味し、「がん」と交換可能に使用される。「腫瘍性障害」は、細胞増殖、特に新生物に関連する任意の障害である。「新生物」は、その出現を開始した発がん性因子の除去後も持続および増殖する組織の異常な塊である。新生物には、良性および悪性の2種類がある。ほぼすべての良性腫瘍は被包性であり、非侵襲的であり、対照的に、悪性腫瘍はほとんど被包性でなく、浸潤性の破壊的な増殖によって隣接する組織に侵入する。この浸潤性増殖の後に、元の腫瘍とは不連続な部位に腫瘍細胞が移植される可能性がある。
転移は原発腫瘍から身体の他の部分へのがん細胞の播種に起因する原発腫瘍の位置とは異なるがん細胞の領域である。原発腫瘍塊の診断時に、対象は転移の存在についてモニターされ得る。転移は、特定の症状のモニタリングに加えて、磁気共鳴画像法(MRI)スキャン、コンピュータ断層撮影(CT)スキャン、血液および血小板数、肝機能検査、胸部X線、ならびに骨スキャンの単独または併用によって最も頻繁に検出される。
本発明の化合物および組成物は、対象のがんを治療するために使用することができる。いくつかの実施形態では、がんは、婦人科がん(卵巣がんなど)、膵臓がん、子宮内膜がん、肝臓がん、腎がん、血液がん、中枢神経系(CNS)がん、またはそれらの任意の組み合わせを含む。いくつかの重要なCNSがんの例には、神経芽腫、髄芽腫、末梢悪性神経鞘腫瘍、上衣腫、chraniopharyngioma、星状細胞腫、髄膜腫、胚細胞腫、神経膠腫、混合性神経膠腫、脈絡叢腫瘍、乏突起膠腫、末梢性神経外胚葉性腫瘍、原始神経外胚葉性腫瘍(PNET)、CNSリンパ腫、下垂体腺腫、およびシュワン腫、が含まれるが、これらに限定されない。いくつかの実施形態では、星状細胞腫は、グレードI、グレードII、グレードIII、またはグレードIVである。星状細胞腫は、低悪性度または高悪性度の場合がある。星状細胞腫は、若年性毛様細胞性星状細胞腫、上衣下巨細胞性星状細胞腫、多形性(pleimorphic)黄色星状膠細胞腫、退形成性星状細胞腫、または大脳神経膠腫症であり得る。いくつかの実施形態では、乏突起膠腫は、混合性神経膠腫(乏突起星細胞腫)または退形成性乏突起膠腫である。1つの好ましい実施形態では、がんは神経芽腫を含む。
本発明の化合物および組成物によって治療することができるがんには、基底細胞がん、胆道がん、膀胱がん、骨がん、脳およびCNSがん、乳がん、子宮頸がん、絨毛がん、結腸および直腸がん、結合組織がん、消化器系がん、子宮内膜がん、食道がん、眼がん、線維腫、頭頸部がん、胃がん、上皮内新生物、腎臓がん、喉頭がん、急性骨髄性白血病、急性リンパ性白血病、慢性骨髄性白血病、慢性リンパ性白血病を含む白血病、肝臓がん、肺がん(例えば、小細胞および非小細胞)、ホジキンおよび非ホジキンリンパ腫を含むリンパ腫、黒色腫、口腔がん(例えば、唇、舌、口、および咽頭)、前立腺がん、網膜芽細胞腫、横紋筋肉腫、直腸がん、呼吸器系がん、肉腫、皮膚がん、胃がん、精巣がん、甲状腺がん、子宮がん、泌尿器系がん、ならびに他のがん腫および肉腫も含まれるが、これらに限定されない。
本発明の化合物および組成物による治療を目的とする例示的ながん腫には、限定されないが、腺房がん、小葉がん、濾胞状腺がん(腺嚢がん種、腺筋上皮腫、篩状がんおよび円柱腫とも呼ばれる)、がん腺腫(carcinoma adenomatosum)、腺がん、副腎皮質がん、肺胞がん、肺胞上皮がん(細気管支がん、肺胞上皮腫および肺腺腫症とも呼ばれる)、基底細胞がん(basal cell carcinoma)、基底細胞がん(carcinoma basocellulare)(基底細胞がん(basaloma)または基礎細胞腫、および毛母がんとも呼ばれる)、類基底細胞がん、基底扁平細胞がん、乳がん、気管支肺胞上皮がん、細気管支がん、気管支原性がん、大脳様がん(cerebriform carcinoma)、胆管細胞がん(胆管腫および胆管がんとも呼ばれる)、絨毛がん(chorionic carcinoma)、粘液がん(colloid carcinoma)、面皰がん、体がん(corpus carcinoma)、篩状がん、よろい状がん、皮膚がん、円柱状がん(cylindrical carcinoma)、円柱細胞がん、腺管がん、硬性がん(carcinoma durum)、胎児性がん、髄様がん、眼球上がん、類表皮がん、上皮腺様がん(carcinoma epitheliale adenoide)、潰瘍がん、線維がん(carcinoma fibrosum)、ゼラチン状がん、膠様がん、巨細胞がん、巨大細胞、腺がん、顆粒膜細胞がん、毛母体がん、血球様がん、肝細胞がん(肝細胞腫、悪性肝がんおよび肝臓がんとも呼ばれる)、ヒュルトレ細胞がん、硝子質がん(hyaline carcinoma)、副腎様がん(hypernephroid carcinoma)、乳児胎児性がん(infantile embryonal carcinoma)、上皮内がん(carcinoma in situ)、表皮内がん、上皮内がん(intraepithelial carcinoma)、クロムペッカーがん(Krompecher’s carcinoma)、クルチスキー細胞がん(Kulchitzky-cell carcinoma)、レンズ状がん(lenticular carcinoma)、レンズ状がん(carcinoma lenticulare)、脂肪腫性がん、リンパ上皮がん、乳腺炎様がん(carcinoma mastitoides)、髄様がん(carcinoma medullare)、髄様がん(medullary carcinoma)、黒色がん(carcinoma melanodes)、黒色がん(melanotic carcinoma)、粘液性がん(mucinous carcinoma)、粘液性がん(carcinoma muciparum)、粘膜細胞がん(carcinoma mucocellulare)、粘液性類表皮がん、粘液がん(carcinoma mucosum)、粘膜がん(mucous carcinoma)、粘液腫様がん、鼻咽頭がん、黒色がん(carcinoma nigrum)、燕麦細胞がん、骨化性がん(carcinoma ossificans)、類骨がん(osteoid carcinoma)、卵巣がん、乳頭がん、門脈周囲がん(periportal carcinoma)、前浸潤がん、前立腺がん、腎臓の腎細胞がん(腎臓の腺がんおよび腎明細胞がん(hypernephoroid carcinoma)と呼ばれる)、予備細胞がん、肉腫様がん(carcinoma sarcomatodes)、シュナイダーがん腫(scheinderian carcinoma)、硬性がん(scirrhous carcinoma)、陰嚢がん、印環細胞がん、単純がん、小細胞がん、ソラノイドがん(solanoid carcinoma)、回転楕円面細胞がん腫、紡錘細胞がん、海綿様がん、扁平上皮がん、有棘細胞がん、ストリングがん(string carcinoma)、毛細血管拡張性がん(carcinoma telangiectaticum)、毛細血管拡張様がん(carcinoma telangiectodes)、移行上皮がん、結節がん(carcinoma tuberosum)、結節がん(tuberous carcinoma)、疣状がん、絨毛がん(carcinoma vilosum)が含まれる。
例示的な肉腫は、骨および軟部組織で発生するまれな間葉性新生物である。様々な種類の肉腫が認識されており、これらには以下が含まれる:例えば、脂肪肉腫(粘液性脂肪肉腫および多形性脂肪肉腫を含む)、平滑筋肉腫、横紋筋肉腫、悪性末梢神経鞘腫瘍(悪性シュワン腫、神経線維肉腫、または神経原性肉腫とも呼ばれる)、ユーイング腫瘍(骨のユーイング肉腫、骨外性(すなわち非骨性)ユーイング肉腫、および原始神経外胚葉性腫瘍[PNET])、滑膜肉腫、血管肉腫(angiosarcomas)、血管肉腫(hemangiosarcomas)、リンパ管肉腫、カポジ肉腫、血管内皮腫、線維肉腫、類腱腫(侵襲性線維腫症とも呼ばれる)、隆起性皮膚線維肉腫(DFSP)、悪性線維性組織球腫(MFH)、血管周囲細胞腫、悪性間葉腫、胞状軟部肉腫、類上皮肉腫、明細胞肉腫、線維形成性小細胞腫瘍、消化管間質腫瘍(GIST)(GI間質性肉腫としても知られる)、骨肉腫(osteosarcoma)(骨肉腫(osteogenic sarcoma)としても知られる)-骨格および骨格外、ならびに軟骨肉腫。
本発明の化合物および組成物はまた、難治性がんを治療するために使用することができる。難治性がんは、処方された通常の標準治療に耐性のあるがんである。したがって、難治性がんに対する本発明に従って治療される対象は、そのがんに対する別の治療にすでに曝露されている可能性がある。あるいは、がんが難治性である可能性が高い場合(例えば、がん細胞または対象の病歴の分析が得られている場合)、対象はまだ別の治療に曝露されていない可能性がある。難治性がんの例には、白血病、黒色腫、腎細胞がん、結腸がん、肝臓(肝)がん、膵臓がん、非ホジキンリンパ腫、および肺がんが含まれるが、これらに限定されない。
本発明の化合物および組成物はまた、免疫原性のあるがんを治療するために使用することができる。免疫原性のあるがんは、その表面または細胞死時に免疫原を発現する可能性があるがんである。これらの免疫原は、がん抗原のインビボ内在源であり、その放出は、がんを治療するために本発明の方法によって利用することができる。例示的な免疫原性のあるがんには、悪性黒色腫および腎細胞がん、マンテル細胞リンパ腫(Mantel Cell Lymphoma)、濾胞性リンパ腫、びまん性大細胞型B細胞リンパ腫、T細胞性急性リンパ芽球性白血病、バーキットリンパ腫、骨髄腫、免疫細胞腫、急性前骨髄球性白血病、慢性骨髄性/急性リンパ芽球性白血病、急性白血病、B細胞急性リンパ芽球性白血病、未分化大細胞白血病、骨髄異形成症候群/急性骨髄性白血病、非ホジキンリンパ腫、慢性リンパ性白血病(CLL)、急性リンパ芽球性白血病(ALL)、急性骨髄性白血病(AML)、一般的(common)(pre-B)急性リンパ性白血病、悪性黒色腫、T細胞リンパ腫、白血病、B細胞リンパ腫、上皮性悪性腫瘍、リンパ性悪性腫瘍、婦人科がん、胆管腺がん、および膵管腺がんが含まれる。
本発明の化合物および組成物はまた、血管新生を治療するために使用することができる。血管新生は、内皮細胞の異常な急速な増殖であり、異常な新しい血管の持続的かつ衰えることのない形成をもたらす。数か月または数年続く血管新生は、がんの増殖および進行をサポートする可能性があり、例えば、眼、皮膚、心臓、血管、肺、消化管、および尿生殖器管などの様々な臓器および組織に損傷を与える可能性がある。
本明細書で使用される場合、「血管新生を阻害する」という用語は、本発明に記載の化合物での治療時、またはセプチン-2もしくは他のセプチンファミリーのタンパク質を個別にまたは集合的に標的化することによる異常な微小血管の数または密度の低減を指す。臨床現場で最も広く使用されている方法は、生検(開腹または針)または検体における血管(微小血管)の組織化学的または免疫組織化学的染色に依存している。検査することができる血管新生の特徴には、例えば、血管密度ならびに/または血管周囲カフの形態および/もしくは厚さが含まれる。組織学的生検または検体における微小血管密度の領域が定量化される。微小血管密度の高い領域(「ホットスポット」)は、例えば、最も多くの腫瘍細胞を含み、かつ/または転移の可能性が最も高い可能性がある。微小血管密度を決定する1つの技術は、毛細血管間距離を測定することである。血管新生を評価する別の方法は、血管周囲のカフの厚さを測定することである。血管周囲カフの厚さの増加は、血管新生の進行に関連しており、疾患の悪化を示している可能性がある。
本発明の一態様である血管新生の阻害は、血管新生(angiogenesis)(血管新生(angiogenic))因子の血液、血清、血漿、もしくは組織レベル、または血管新生(angiogenesis)の代理マーカーとして機能する血管新生(angiogenic)因子のレベルを測定することによって評価することができる。血管新生の代理マーカーとして機能することができる例示的な血管新生因子には、アンギオゲニン、アンギオポイエチン-1、Del-1、線維芽細胞増殖因子:酸性(aFGF)および塩基性(bFGF)、フォリスタチン、顆粒球コロニー刺激因子(G-CSF)、肝細胞増殖因子(HGF)/散乱因子(SF)、インターロイキン-8(IL-8)、レプチン、ミッドカイン、胎盤増殖因子、血小板由来内皮細胞増殖因子(PD-ECGF)、血小板由来増殖因子-BB(PDGF-BB)、プレイオトロフィン(PTN)、プログラニュリン、プロリフェリン、トランスフォーミング増殖因子-アルファ(TGF-アルファ)、トランスフォーミング増殖因子-ベータ(TGF-ベータ)、腫瘍壊死因子-アルファ(TNF-アルファ)、および血管内皮増殖因子(VEGF)/血管透過性因子(VPF)、が含まれるが、これらに限定されない。画像処理技術は、血管新生の評価にも有用である。適切な画像処理技術またはデバイスには、CT、回転CT、マイクロCT、マルチプルエナジーコンピュータ断層撮影(MECT)、単一検出器CT(SDCT)、多検出器CT(MDCT)、体積測定CT(VCT)、MRI、マイクロMR、X線、回転X線、PET、近赤外線/光学などの非侵襲的デバイス、ならびに対象の体外で使用するか、または体腔に非侵襲的に挿入することができるその他の非侵襲的スキャン技術およびデバイスが含まれる。血管新生は、CT血管造影(CTA)、トモシンセシス、X線マイクロ血管造影、およびその他の技術によっても画像化できる。血管新生画像処理技術の1つとして、腫瘍微小血管灌流の灌流変化を検出する、超音波およびコントラスト特異的なイメージングモダリティと組み合わせたマイクロバブルベースの造影剤(SonoVue)の使用を含む。他の血管新生画像処理技術には、カラードップラーおよびマンモグラフィが含まれる。カラードップラー画像処理は、乳がんなどの腫瘍における血管新生を示すことができる。マンモグラフィにより、乳房腫瘍の血管新生した縁を明らかにすることができる。広範囲の画像または放射線学的徴候を、色素によって増強することができる。
血管新生はまた、身体の関心領域に少なくとも1つの造影剤を導入することを含むプロセスによって対象において評価することができる。例えば、血管を検出するための造影剤を血管に注射することができる。少量の造影剤を局所的に導入して、特定の身体の関心領域の血管の検出を増強することができる。あるいは、造影剤は、広い身体領域または対象の身体全体における血管の検出を増強するのに十分な量で提供され得る。構造データは、対象の身体について取得することができるか、または1つ以上の標的臓器、例えば、肺、心臓、乳房、結腸など、臓器の一部、もしくは対象の身体の別の標的体積について取得することができる。標的体積は、対象の身体の任意の部分、例えば、手足、腹部、胴体、首、頭、またはそれらの任意の部分にすることができる。本明細書に記載されていない血管新生を評価するための他の方法または技術を、本発明の目的のために使用することができる。血管新生を評価するための方法および技術は、当業者に知られている。
本発明に記載の化合物および組成物の使用は、放射線療法、外科手術、従来の化学療法などの他の療法と組み合わせることができるか、または1つ以上の追加の療法との組み合わせと組み合わせることができる。
本発明に記載の化合物および組成物は、医薬組成物として単独で投与されるか、または治療上有効かつ生理学的に許容される量の1つ以上の他の有効成分または薬剤と組み合わせて投与される。そのような他の有効成分には、グルタチオン拮抗薬、血管新生阻害剤、化学療法剤、および抗体(例えば、がん抗体)が含まれるが、これらに限定されない。本発明に記載の化合物および組成物ならびに他の有効成分または薬剤は、同時にまたは連続して投与される。本発明に記載の化合物および組成物を別の活性剤と同時に投与する場合、または別の有効成分と組み合わせて投与する場合、化合物および組成物および他の有効成分は、同じまたは別個の製剤で投与されるが、同時に投与される。他の活性剤およびセプチン標的化合物の投与が時間的に離れている場合、他の活性剤は、互いに、かつ本発明の化合物および組成物とともに順次投与される。投与間の時間の区切りは、数分、数時間、数日、またはそれ以上の時間である。
グルタチオン拮抗薬の例には、ブチオニンスルホキシミン、シクロホスファミド、イフォスファミド、アクチノマイシンD、およびN-(4-ヒドロキシフェニル)レチナミド(4-HPR)が含まれるが、これらに限定されない。
血管新生阻害剤の例には、これらに限定されないが、2-メトキシエストラジオール(2-ME)、AG3340、アンギオスタチン、アンチトロンビンIII、抗VEGF抗体、バチマスタット、ベバシズマブ(アバスタチン)、BMS-275291、CAI、カンスタチン、カプトプリル、軟骨由来阻害剤(CDI)、CC-5013、セレコキシブ(CELEBREX(登録商標))、COL-3、コンブレタスタチン、コンブレタスタチンA4リン酸、ダルテパリン(FRAGIN(登録商標))、EMD 121974(シレンジタイド)、エンドスタチン、エルロチニブ(TARCEVA(登録商標))、ゲフィチニブ(イレッサ)、ゲニステイン、臭化水素酸ハロフジノン(TEMPOSTATIN(商標))、Id1、Id3、IM862、メシル酸イマチニブ、誘導タンパク質10、インターフェロン-アルファ、インターロイキン12、ラベンダスチンA、LY317615またはAE-941(NEOVASTAT(商標))、マリマスタット、マスピン、メドロキシプロゲステロンアセテート(Medroxpregesterone)、Meth-1、Meth-2、ネオバスタット(Neovastat)、オステオポンチン切断産物、PEX、色素上皮増殖因子(PEGF)、血小板因子第4因子、プロラクチンフラグメント、プロリフェリン関連タンパク質(PRP)、PTK787/ZK 222584、組換えヒト血小板第4因子(rPF4)、レスチン(Restin)、スクアラミン、SU5416、SU6668、スラミン、タキソール、テコガラン(Tecogalan)、サリドマイド、トロンボスポンジン、TNP-470、トロポニンI、バソスタチン、VEG1、VEGF-Trap、およびZD6474が含まれる。いくつかの実施形態では、血管新生阻害剤は、VEGF拮抗薬である。VEGF拮抗薬は、VEGF結合分子であり得る。VEGF結合分子には、VEGF抗体またはその抗原結合フラグメントが含まれる。VEGF拮抗薬の一例はNeXstarである。
化学療法剤は、本発明の化合物および組成物に対する追加の有効成分として使用することができる。このような化学療法剤には、限定されないが、DNA損傷剤が含まれ、これらには、トポイソメラーゼ阻害剤(例えば、エトポシド、ランプトテシン、トポテカン、テニポシド、ミトキサントロン)、抗微小管剤(例えば、ビンクリスチン、ビンブラスチン)、抗代謝剤(例えば、シタラビン、メトトレキサート、ヒドロキシ尿素、5-フルオロウラシル、フロクスウリジン、6-チオグアニン、6-メルカプトプリン、フルダラビン、ペントスタチン、クロロデオキシアデノシン)、DNAアルキル化剤(例えば、シスプラチン、メクロレタミン、シクロホスファミド、イフォスファミド、メルファラン、クロラムブシル(chorambucil)、ブスルファン、チオテパ、カルムスチン、ロムスチン、カルボプラチン、ダカルバジン、プロカルバジン)、およびDNA鎖切断誘導剤(例えば、ブレオマイシン、ドキソルビシン、ダウノルビシン、イダルビシン、マイトマイシンC)が含まれる。化学療法剤には合成、半合成および天然由来の薬剤が含まれる。重要な化学療法剤には、限定されないが、以下が含まれる:アシビシン、アクラルビシン、塩酸アコダゾール(Acodazole)、アクロニン、アドゼレシン、アドリアマイシン、アルデスロイキン、アリトレチノイン、アロプリノールナトリウム、アルトレタミン、アンボマイシン(Ambomycin)、酢酸アメタントロン、アミノグルテチミド、アムサクリン、アナストロゾール、バンレイシ科(Annonaceous)アセトゲニン、アントラマイシン、アシミシン、アスパラギナーゼ、アスペルリン、アザシチジン、アゼテパ、アゾトマイシン、バチマスタット、ベンゾデパ、ベキサロテン、ビカルタミド、塩酸ビサントレン、ジメシル酸ビスナフィド、ビゼレシン、硫酸ブレオマイシン、ブレキナルナトリウム、カルボメチル、ブロピリミン、ブラタシン、ブスルファン、カベルゴリン、カクチノマイシン、カルステロン、カラセミド、カルベチマー、カルボプラチン、カルムスチン、塩酸カルビシン、カルゼルシン、セデフィンゴール、セレコキシブ、クロラムブシル、シロレマイシン(Cirolemycin)、シスプラチン、クラドリビン、メシル酸クリスナトール、シクロホスファミド、シタラビン、ダカルバジン、DACA(N-[2-(ジメチル-アミノ)エチル]アクリジン-4-カルボキサミド)、ダクチノマイシン、塩酸ダウノルビシン、ダウノマイシン、デシタビン、デニロイキンジフチトクス、デキソルマプラチン(Dexormaplatin)、デザグアニン、メシル酸デザグアニン、ジアジクオン、ドセタキセル、ドキソルビシン、塩酸ドキソルビシン、ドロロキシフェン、クエン酸ドロロキシフェン、プロピオン酸ドロモスタノロン、デュアゾマイシン(Duazomycin)、エダトレキサート、塩酸エフロニチン、エルサミトルシン、エンロプラチン(enloplatin)、エンプロマート、エピプロピジン、塩酸エピルビシン、エルブロゾール、塩酸エソルビシン、エストラムスチン、エストラムスチンリン酸エステルナトリウム、エタニダゾール、エチオダイドオイル(Ethiodized Oil)I 131、エトポシド、リン酸エトポシド、エトプリン、塩酸ファドロゾール、ファザラビン、フェンレチニド、フロクスウリジン、フルダラビンリン酸エステル、フルオロウラシル、5-FdUMP、フルオロシタビン(Fluorocitabine)、ホスキドン、ホストリエシンナトリウム、FK-317、FK-973、FR-66979、FR-900482、ゲムシタビン、塩酸ゲムシタビン、ゲムツズマブオゾガマイシン、ゴールドAu 198、酢酸ゴセレリン、グアナコン(guanacone)、ヒドロキシ尿素、塩酸イダルビシン、イフォスファミド、イルモフォシン、インターフェロンアルファ-2a、インターフェロンアルファ-2b、インターフェロンアルファ-n1、インターフェロンアルファ-n3、インターフェロンベータ-Ia、インターフェロンガンマ-Ib、イプロプラチン(Iproplatin)、塩酸イリノテカン、酢酸ランレオチド、レトロゾール、酢酸リュープロリド、塩酸リアロゾール、ロメトレキソール(Lometrexol)ナトリウム、ロムスチン、塩酸ロソキサントロン、マソプロコール、マイタンシン、塩酸メクロレタミン、酢酸メゲストロール、酢酸メレンゲストロール、メルファラン、メノガリル、メルカプトプリン、メトトレキサート、メトトレキサートナトリウム、メトキサレン、メトプリン、メツレデパ、ミチンドミド、ミトカルシン(Mitocarcin)、ミトクロミン(Mitocromin)、ミトギリン(Mitogillin)、ミトマルシン(Mitomalcin)、マイトマイシン、マイトマイシンC、ミトスパー(Mitosper)、ミトタン、塩酸ミトキサントロン、ミコフェノール酸、ノコダゾール、ノガラマイシン、オプレルベキン、オルマプラチン、オキシスラン、パクリタキセル、パミドロン酸二ナトリウム、ペグアスパラガーゼ、ペリオマイシン(Peliomycin)、ペンタムスチン、硫酸ペプロマイシン、ペルホスファミド、ピポブロマン、ピポスルファン、ピロキサントロン塩酸塩、プリカマイシン、プロメスタン、ポルフィマーナトリウム、ポルフィロマイシン、プレドニムスチン、塩酸プロカルバジン、ピューロマイシン、塩酸ピューロマイシン、ピラゾフリン、リボプリン、リツキシマブ、ログレチミド、ロリニアスタチン(Rolliniastatin)、サフィンゴール、塩酸サフィンゴール、サマリウム/レキシドロナム、セムスチン、シムトラゼン、スパルホサート(Sparfosate)ナトリウム、スパルソマイシン、スピロゲルマニウム塩酸塩、スピロムスチン、スピロプラチン、スクアモシン(Squamocin)、スクアモタシン(Squamotacin)、ストレプトニグリン、ストレプトゾシン、塩化ストロンチウムSr89、スロフェヌル、タリソマイシン、タキサン、タキソイド、テコガラン(Tecogalan)ナトリウム、テガフール、塩酸テロキサントロン、テモポルフィン、テニポシド、テロキシロン、テストラクトン、チアミプリン、チオグアニン、チオテパ、チミタク(Thymitaq)、チアゾフリン、チラパザミン、トムデックス、TOP-53、塩酸トポテカン、クエン酸トレミフェン、トラスツズマブ、酢酸トレストロン(Trestolone)、リン酸トリシリビン、トリメトレキサート、グルクロン酸トリメトレキサート、トリプトレリン、塩酸ツブロゾール、ウラシルマスタード、ウレデパ、バルルビシン、バプレオチド、ベルテポルフィン、ビンブラスチン、硫酸ビンブラスチン、ビンクリスチン、硫酸ビンクリスチン、ビンデシン、硫酸ビンデシン、硫酸ビネピジン、ビングリシナート(Vinglycinate)スルファート、硫酸ビンロイロシン(Vinleurosine)、酒石酸ビノレルビン、硫酸ビンロシジン(Vinrosidine)、硫酸ビンゾリジン(Vinzolidine)、ボロゾール、ゼニプラチン、ジノスタチン、塩酸ゾルビシン、2-クロロデオキシアデノシン、2’-デオキシホルマイシン、9-アミノカンプトテシン、ラルチトレキセド、N-プロパルギル-5,8-ジデアザ葉酸、2-クロロ-2’-アラビノ-フルオロ-2’-デオキシアデノシン、2-クロロ-2’-デオキシアデノシン、アニソマイシン、トリコスタチンA、hPRL-G129R、CEP-751、リノマイド(linomide)、硫黄マスタード、ナイトロジェンマスタード(メクロルエタミン)、シクロホスファミド、メルファラン、クロラムブシル、イフォスファミド、ブスルファン、N-メチル-N-ニトロソウレア(MNU)、N、N’-ビス(2-クロロエチル)-N-ニトロソウレア(BCNU)、N-(2-クロロエチル)-N’-シクロヘキシル-N-ニトロソウレア(CCNU)、N-(2-クロロエチル)-N’-(トランス-4-メチルシクロヘキシル-N-ニトロソウレア(MeCCNU)、N-(2-クロロエチル)-N’-(ジエチル)エチルホスホネート-N-ニトロソウレア(ホテムスチン)、ストレプトゾトシン、ジアカルバジン(diacarbazine)(DTIC)、ミトゾロミド、テモゾロミド、チオテパ、マイトマイシンC、AZQ、アドゼレシン、シスプラチン、カルボプラチン、オルマプラチン、オキサリプラチン、C1-973、DWA2114R、JM216、JM335、Bis(プラチナ)、トムデックス、アザシチジン、シタラビン、ゲムシタビン、6-メルカプトプリン、6-チオグアニン、ヒポキサンチン、テニポシド、9-アミノカンプトテシン、トポテカン、CPT-11、ドキソルビシン、ダウノマイシン、エピルビシン、ダルビシン、ミトキサントロン、ロソキサントロン、ダクチノマイシン(アクチノマイシンD)、アムサクリン、ピラゾロアクリジン、オールトランスレチノール、14-ヒドロキシレトロレチノール、オールトランスレチノイン酸、N-(4-ヒドロキシフェニル)レチナミド、13-シスレチノイン酸、3-メチルTTNEB、9-シスレチノイン酸、フルダラビン(2-F-ara-AMP)、および2-クロロデオキシアデノシン(2-Cda)。
本発明の化合物および組成物と組み合わせることが意図される他の化学療法剤には、これらに限定されないが、以下が含まれる:20-エピ-1,25ジヒドロキシビタミンD3、5-エチニルウラシル、アビラテロン、アクラルビシン、アシルフルベン、アデシペノール、アドゼレシン、アルデスロイキン、ALL-TK拮抗薬、アルトレタミン、アンバムスチン、アミドックス、アミフォスチン、アミノレブリン酸、アムルビシン、アムサクリン、アナグレリド、アナストロゾール、アンドログラホリド、血管新生阻害剤、アンタゴニストD、アンタゴニストG、アンタレリックス(antarelix)、抗背側形成タンパク質-1(anti-dorsalizing morphogenetic protein-1)、抗アンドロゲン、前立腺がん、抗エストロゲン、アンチネオプラストン、アンチセンスオリゴヌクレオチド、グリシン酸アフィジコリン、アポトーシス遺伝子モジュレーター、アポトーシスレギュレーター、アプリン酸、ara-CDP-DL-PTBA、アルギニンデアミナーゼ、アスラクリン(asulacrine)、アタメスタン、アトリムスチン(atrimustine)、アキシナスタチン1、アキシナスタチン2、アキシナスタチン3、アザセトロン、アザトキシン、アザチロシン(azatyrosine)、バッカチンIII誘導体、バラノール、バチマスタット、BCR/ABLアンタゴニスト、ベンゾクロリン(benzochlorin)、ベンゾイルスタウロスポリン、ベータラクタム誘導体、ベータ-アレチン(alethine)、ベータクラマイシンB(betaclamycin B)、ベツリン酸、bFGF阻害剤、ビカルタミド、ビスアントレン、ビスアジリジニルスペルミン(bisaziridinylspermine)、ビスナフィド(bisnafide)、ビストラテンA、ビゼレシン、ブレフラート(breflate)、ブレオマイシンA2、ブレオマイシンB2、ブロピリミン、ブドチタン(budotitane)、ブチオニンスルホキシミン、カルシポトリオール、カルホスチンC、カンプトテシン誘導体(例えば、10-ヒドロキシ-カンプトテシン)、カナリア痘IL-2;カペシタビン、カルボキサミド-アミノ-トリアゾール、カルボキシアミドトリアゾール、CaRest M3、CARN 700、軟骨由来阻害剤、カルゼレシン、カゼインキナーゼ阻害剤(ICOS)、カスタノスペルミン、セクロピンB、セトロレリックス、クロリン(chlorins)、クロロキノキサリンスルホンアミド、シカプロスト、シス-ポルフィリン、クラドリビン類似体、クロトリマゾール、コリスマイシン(collismycin)A、コリスマイシンB、コンブレタスタチンA4、コンブレタスタチン類似体、コナゲニン、クランベシジン(crambescidin)816、クリスナトール、クリプトフィシン8、クリプトフィシンA誘導体、クラシンA、シクロペンタントラキノン(cyclopentanthraquinone)、シクロプラタム(cycloplatam)、シペマイシン(cypemycin)、シタラビンオクホスファート、細胞溶解因子、サイトスタチン、ダクリキシマブ(dacliximab)、デシタビン、デヒドロジデムニン(dehydrodidemnin)B、2’デオキシコホルマイシン(DCF)、デスロレリン、デキシホスファミド(dexifosfamide)、デクスラゾキサン、デクスベラパミル、ジアジクオン、ジデムニンB、ジドックス(didox)、ジエチルノルスペルミン、ジヒドロ-5-アザシチジン、ジヒドロタキソール、ジオキサマイシン(dioxamycin)、ジフェニルスピロムスチン、ディスコデルモリド、ドコサノール、ドラセトロン、ドキシフルリジン、ドロロキシフェン、ドロナビノール、デュオカルマイシンSA、エブセレン、エコムスチン、エデルホシン、エドレコロマブ、エフロルニチン、エレメン、エミテフル、エピルビシン、エポチロン(A、R=H、B、R=Me)、エピチロン、エプリステリド、エストラムスチン類似体、エストロゲンアゴニスト、エストロゲンアンタゴニスト、エタニダゾール、エトポシド、エトポシド4’-リン酸(エトポフォス)、エキセメスタン、ファドロゾール、ファザラビン、フェンレチニド、フィルグラスチム、フィナステリド、フラボピリドール、フレゼラスチン、フルアステロン、フルダラビン、塩酸フルオロダウノルニシン(fluorodaunorunicin hydrochloride)、ホルフェニメクス、ホルメスタン、ホストリエシン、ホテムスチン、ガドリニウムテキサフィリン、硝酸ガリウム、ガロシタビン、ガニレリックス、ゲラチナーゼ阻害剤、ゲムシタビン、グルタチオン阻害剤、ヘプスルファム(hepsulfam)、ヘレグリン、ヘキサメチレンビスアセトアミド、ホモハリントンニン(HHT)、ハイペリシン、イバンドロン酸イダルビシン、イドキシフェン、イドラマントン、イルモフォシン、イロマスタット、イミダゾアクリドン(imidazoacridone)、イミキモド、免疫刺激ペプチド、インスリン様成長因子-1受容体阻害剤、インターフェロンアゴニスト、インターフェロン、インターロイキン、ヨーベングアン、ヨードドキソルビシン、イポメアノール、4-、イリノテカン、イロプラクト(iroplact)、イルソグラジン、イソベンガゾール(isobengazole)、イソホモハリコンドリン(isohomohalicondrin)B、イタセトロン、ジャスプラキノリド、カハラリド(kahalalide)F、ラメラリン-Nトリアセテート、ランレオチド、レイナマイシン、レノグラスチム、硫酸レンチナン、レプトルスタチン(leptolstatin)、レトロゾール、白血病抑制因子、白血球αインターフェロン、ロイプロリド+エストロゲン+プロゲステロン、ロイプロレリン、レバミソール、リアロゾール、線状ポリアミン類似体、親油性二糖ペプチド(lipophilic disaccharide peptide)、親油性白金化合物、リッソクリナミド(lissoclinamide)7、ロバプラチン、ロンブリシン、ロメトレキソール、ロニダミン、ロソキサントロン、ロバスタチン、ロキソリビン、ルルトテカン(lurtotecan)、ルテチウムテキサフィリン、リゾフィリン(lysofylline)、溶解ペプチド、マイタンシン、マンノプロテインA、マリマスタット、マソプロコール、マスピン、マトリリシン阻害剤、マトリックスメタロプロテイナーゼ阻害剤、メノガリル、メルバロン、メテレリン、メチオニナーゼ、メトクロプラミド、MIF阻害剤、ミフェプリストン、ミルテフォシン、ミリモスティム、ミスマッチ二本鎖RNA、ミトラシン、ミトグアゾン、ミトラクトール、マイトマイシン類似体、ミトナフィド、マイトトキシン線維芽細胞成長因子-サポリン、ミトキサントロン、モファロテン、モルグラモスチム、モノクローナル抗体、ヒト絨毛性ゴナドトロピン、モピダモール、多剤耐性遺伝子阻害剤、複数腫瘍抑制因子1(multiple tumor suppressor 1)ベースの治療、マスタード抗がん剤、ミカペルオキシド(mycaperoxide)B、マイコバクテリア細胞壁抽出物、ミリアポロン(myriaporone)、N-アセチルジナリン、N-置換ベンズアミド、ナファレリン、ナグレスチップ(nagrestip)、ナロキソン+ペンタゾシン、ナパビン(napavin)、ナフテルピン、ナルトグラスチム、ネダプラチン、ネモルビシン(nemorubicin)、ネリドロン酸、中性エンドペプチダーゼ、ニルタミド、ニサマイシン(nisamycin)、一酸化窒素モジュレーター、ニトロキシド抗酸化剤、ニトルリン(nitrullyn)、O6-ベンジルグアニン、オクトレオチド、オキセノン(okicenone)、オリゴヌクレオチド、オナプリストン、オンダンセトロン、オンダンセトロン、オラシン(oracin)、経口サイトカイン誘導物質、オルマプラチン、オサテロン、オキサリプラチン、オキサウノマイシン(oxaunomycin)、パクリタキセル類似体、パクリタキセル誘導体、パラウアミン(palauamine)、パルミトイルリゾキシン、パミドロン酸、パナキシトリオール、パノミフェン、パラバクチン、パゼリプチン、ペガスパルガーゼ、ペルデシン、ペントサンポリサルフェートナトリウム、ペントスタチン、ペントロゾール(pentrozole)、ペルフルブロン、ペルホスファミド、ペリリルアルコール、フェナジノマイシン、フェニルアセテート、ホスファターゼ阻害剤、ピシバニル、塩酸ピロカルピン、ピラルビシン、ピリトレキシム、プラセチン(placetin)A、プラセチンB、プラスミノーゲンアクチベーター阻害剤、プラチナ複合体、プラチナ化合物、プラチナ-トリアミン複合体、ポドフィロトキシン、ポルフィマーナトリウム、ポルフィロマイシン、プロピルビスアクリドン、プロスタグランジンJ2、プロテアソーム阻害剤、プロテインAベースの免疫モジュレーター、プロテインキナーゼC阻害剤、複数のプロテインキナーゼC阻害剤、微細藻類、タンパク質チロシンホスファターゼ阻害剤、プリンヌクレオシドホスホリラーゼ阻害剤、プルプリン、ピラゾロアクリジン、ピリドキシル化ヘモグロビンポリオキシエチレンコンジュゲート、rafアンタゴニスト、ラルチトレキセド、ラモセトロン、rasファルネシルタンパク質トランスフェラーゼ阻害剤、ras阻害剤、ras-GAP阻害剤、レテリプチン脱メチル化、レニウムRe186エチドロネート、リゾキシン、リボザイム、RIIレチナミド、ログレチミド(rogletimide)、ロヒツキン(rohitukine)、ロムルチド、ロキニメックス、ルビジノン(rubiginone)B1、ルボキシル(ruboxyl)、サフィンゴール、サイントピン(saintopin)、SarCNU、サルコフィトール(sarcophytol)A、サルグラモスチム、Sdi 1模倣薬、セムスチン、老化由来阻害剤1(senescence derived inhibitor 1)、センスオリゴヌクレオチド、シグナル伝達阻害剤、シグナル伝達モジュレーター、一本鎖抗原結合タンパク質、シゾフィラン、ソブゾキサン、ボロカプテイト(sodium borocaptate)、フェニル酢酸ナトリウム、ソルベロール(solverol)、ソマトメジン結合タンパク質、ソネルミン(sonermin)、スパルフォシン酸(sparfosic acid)、スピカマイシンD(spicamycin D)、スピロムスチン、スプレノペンチン(splenopentin)、スポンギスタチン1(spongistatin 1)、スクアラミン、幹細胞阻害剤、幹細胞分裂阻害剤、スチピアミド(stipiamide)、ストロメライシン阻害剤、スルフィノシン、超活性血管作用性腸管ペプチド拮抗薬、スラディスタ(suradista)、スラミン、スウェインソニン、合成グリコサミノグリカン、タリムスチン、タモキシフェンメチオジド、タウロムスチン(tauromustine)、タザロテン、テコガランナトリウム(tecogalan sodium)、テガフール、テルラピリリウム(tellurapyrylium)、テロメラーゼ阻害剤、テモポルフィン、テモゾロミド、テニポシド、テトラクロロデカオキシド、テトラゾミン(tetrazomine)、タリブラスチン(thaliblastine)、サリドマイド、チオコラリン(thiocoraline)、トロンボポエチン、トロンボポエチン模倣薬、チマルファシン(thymalfasin)、チモポイエチン受容体アゴニスト、チモトリナン(thymotrinan)、甲状腺刺激ホルモン、エチルエチオプルプリンすず、チラパザミン、二塩化チタノセン、トポテカン、トプセンチン(topsentin)、トレミフェン、全能性幹細胞因子、翻訳阻害剤、トレチノイン、トリアセチルウリジン、トリシリビン、トリメトレキサート、トリプトレリン、
トロピセトロン、ツロステリド(turosteride)、チロシンキナーゼ阻害剤、チルホスチン、UBC阻害剤、ウベニメクス、泌尿生殖洞由来成長阻害因子、ウロキナーゼ受容体拮抗薬、バプレオチド、バリオリンB(variolin B)、ベクター系、赤血球遺伝子療法、ベラレソール(velaresol)、ベラミン(veramine)、ベルジン(verdin)、ベルテポルフィン、ビノレルビン、ビンキサルチン(vinxaltine)、ビタキシン(vitaxin)、ボロゾール、ザノテロン(zanoterone)、ゼニプラチン(zeniplatin)、ジラスコルブ(zilascorb)、およびジノスタチンスチマラマー。
本発明の化合物および組成物と組み合わせることが意図される他の化学療法剤には、これらに限定されないが、抗増殖剤(例えば、ピリトレキシムイソチオネート(Piritrexim Isothionate))、抗前立腺肥大剤(例えば、シトグルシド)、良性前立腺肥大症療法剤(例えば、塩酸タムスロシン)、前立腺成長阻害剤(例、ペントモン(Pentomone))、および放射性物質:フィブリノーゲン1 125、フルデオキシグルコースF 18、フルオロドパF 18、インスリンI 125、インスリンI 131、ヨーベングアンI 123、ヨージパミドナトリウムI 131、ヨードアンチピリンI 131、ヨードコレステロールI 131、ヨードヒプル酸ナトリウムI 123、ヨードヒプル酸ナトリウムI 125、ヨードヒプル酸ナトリウムI 131、ヨードピラセットI 125、ヨードピラセットI 131、イオフェタミン塩酸塩I 123、イオメチン(Iomethin)I 125、イオメチンI 131、ヨータラム酸ナトリウムI 125、ヨータラム酸ナトリウムI 131、ヨーチロシンI 131、リオチロニンI 125、リオチロニンI 131、酢酸メリソプロール(Merisoprol Acetate)Hg 197、酢酸メリソプロールHg 203、メリソプロールHg 197、メチルヨードベンゾグアニン(Methyl Iodobenzo Guanine)(MIBG-I131またはMIBG-I123)、セレノメチオニンSe 75、テクネチウムTc 99m三硫化アンチモンコロイド、テクネチウムTc 99mビシセート、テクネチウムTc 99mジソフェニン、エチドロン酸Tc 99mテクネチウム、テクネチウムTc 99mエキサメタジン(Exametazine)、テクネチウムTc 99mフリホスミン、テクネチウムTc 99mグルセプタート、テクネチウムTC 99mリドフェニン、テクネチウムTc 99mメブロフェニン、メドロン酸Tc 99mテクネチウム、テクネチウムTc 99mメドロン酸二ナトリウム、テクネチウムTc 99mメリチアジド、テクネチウムTc 99mオキシドロネート、テクネチウムTc 99mペンテタート、テクネチウムTc 99mペンテト酸カルシウム三ナトリウム、テクネチウムTc 99mセスタミビ、テクネチウムTc 99mシボロキシム、テクネチウムTc 99mサクシマー、テクネチウムTc 99m硫黄コロイド、テクネチウムTc 99mテボロキシム、テクネチウムTc 99mテトロホスミン、テクネチウムTc 99mチアチド(Tiatide)、チロキシンI 125、チロキシンI 131、トルポビドン(Tolpovidone)I 131、トリオレインI 125、およびトリオレインI 131が含まれる。MIBG-I131およびMIBG-I123は、本発明の化合物および組成物との同時投与のための特に好ましい化学療法剤である。
本発明の化合物および組成物と組み合わせることが意図される化学療法剤の別のカテゴリーには、1つ以上の抗がん補助増強剤、例えば、三環系抗うつ薬(例えば、イミプラミン、デシプラミン、アミトリプチリン、クロミプラミン、トリミプラミン、ドキセピン、ノルトリプチリン、プロトリプチリン、アモキサピンおよびマプロチリン)、非三環系抗うつ薬(例えば、セルトラリン、トラゾドンおよびシタロプラム)、Ca++拮抗薬(例えば、ベラパミル、ニフェジピン、ニトレンジピンおよびカロベリン)、カルモジュリン阻害剤(例えば、プレニラミン、トリフルオロペラジンおよびクロミプラミン)、アンホテリシンB、トリパラノール類似体(例えば、タモキシフェン)、抗不整脈薬(例えば、キニジン)、抗高血圧薬(例えば、レセルピン)、チオール枯渇剤(Thiol depleter)(例えば、ブチオニンおよびスルホキシミン)および多剤耐性低減剤(Multiple Drug Resistance reducing agent)、例えばクレマフォール(Cremaphor)ELなどが含まれるが、これらに限定されない。本発明に記載されている薬剤と組み合わせることができる他の化学療法剤には、以下が含まれる:バンレイシ科(annonaceous)アセトゲニン、アシミシン、ロリニアスタチン(rolliniastatin)、グアナコン(guanacone)、スクアモシン(squamocin)、ブラタシン、スクアモタシン(squamotacin)、タキサン、パクリタキセル、ゲムシタビン、メトトレキサートFR-900482、FK-973、FR-66979、FK-317、5-FU、FUDR、FdUMP、ヒドロキシ尿素、ドセタキセル、ディスコデルモリド、エポチロン、ビンクリスチン、ビンブラスチン、ビノレルビン、メタパック(meta-pac)、イリノテカン、SN-38、10-OHカンプト、トポテカン、エトポシド、アドリアマイシン、フラボピリドール、シス-Pt、カルボ-Pt、ブレオマイシン、マイトマイシンC、ミトラマイシン、カペシタビン、シタラビン、2-Cl-2’デオキシアデノシン、フルダラビン-PO4、ミトキサントロン、ミトゾロミド、ペントスタチン、およびトムデックス。
本発明の化合物および組成物と組み合わせることが意図されている化学療法剤の1つの重要なクラスは、タキサン(例えば、パクリタキセルおよびドセタキセル)である。例えば、本発明の化合物および組成物と組み合わせたタモキシフェンまたはアロマターゼ阻害剤アリミデックス(すなわち、アナストロゾール)は、乳がんおよび婦人科がん(卵巣がんなど)に特に有用である。
本発明の重要な態様として、本発明の化合物および組成物は、抗体と組み合わせて投与される。本発明による他の有効成分として使用することができる抗体の例には、これらに限定されないが、抗CD20抗体(モノクローナル抗体、またはmAbを含む)、リツキシマブ、リツキサン(商標)、トシツモマブベクサール、抗HER2抗体、トラスツズマブ、ハーセプチン(商標)、MDX-210、抗CA125mAb、オレゴボマブ、B43.13、Ovarex(商標)、Breva-Rex、AR54、GivaRex、ProstaRex、抗EGF受容体mAb、IMC-C225、アービタックス(商標)、抗EGF受容体mAb、MDX-447、ゲムツズマブオゾガマイシン、マイロターグ、CMA-676、抗CD33(Wyeth Pharmaceuticals)、抗組織因子タンパク質(TF)、ior-c5、抗c5抗体、抗EGF受容体mAb、MDX-447、抗17-1A mAb、エドレコロマブ、パノレックス、抗CD20 mAb(Y-90標識)、イブリツモマブチウキセタン(IDEC-Y2B8)、ゼバリン、ガングリオシドGD3エピトープの抗イディオタイプmAb模倣物、BEC2、抗HLA-Dr10 mAb(131I LYM-1)、Oncolym(商標)、抗CD33ヒト化mAb(SMART M195)、Zamyl(商標)、抗CD52 humAb(LDP-03)、CAMPATH、抗CD1 mAb、抗t6抗体、抗CAR(補体活性化受容体)mAb、MDX-11、ヒト化二重特異性mAbコンジュゲート(補体カスケード活性化因子)、MDX-22、OV103(Y-90標識抗体)、セロゴバブ、OncoScint(商標)、抗17-1A mAb、3622W94、抗VEGF(RhumAb-VEGF)、ベバシズマブ、Avastin(商標)、抗TAC(IL-2受容体)ヒト化抗体(SMART)、ダクリズマブ、ゼナパックス、抗TAG-72部分ヒト化二重特異性抗体、MDX-220、高分子量プロテオグリカン(I-Mel-1)の抗イディオタイプmAb模倣物、MELIMMUNE-1、高分子量プロテオグリカン(I-Mel-2)の抗イディオタイプmAb模倣物、MELIMMUNE-2、抗CEA Ab(hMN14)、CEACide(商標)、Pretarget(商標)放射性標的薬剤、hmAbH11 scFvフラグメント(NovomAb-G2)、H11 scFv、抗DNAまたはDNA関連タンパク質(ヒストン)mAbおよびコンジュゲート、TNT(例:Cotara(商標))、Gliomab-H mAb、GNI-250 mAb、抗EGF受容体mAb、EMD-72000、抗CD22ヒト化Ab、LymphoCide、非ホジキンのカリケアマイシン(CMA 676)との抗CD33 mAbコンジュゲート、ゲムツズマブオゾガマイシン、マイロターグ(商標)、Monopharm-C、結腸、GD2ガングリオシドに対する抗イディオタイプヒトmAb、4B5、黒色腫、抗EGF受容体ヒト化Ab、ior egf/r3、抗ior c2糖タンパク質mAb、BABS(生合成抗体結合部位)タンパク質、抗FLK-2/FLT-3 mAb、mAb/小分子コンジュゲート、TAP(腫瘍活性化プロドラッグ)、抗GD-2二重特異性mAb、MDX-260、抗核自己抗体(モノクローナル抗体を結合)、ANA Ab、抗HLA-DR Ab(SMART 1D10 Ab)、Remitogen(商標)、SMART ABL 364 Ab、抗CEA I131標識mAb、およびImmuRAIT-CEA、が含まれる。
本発明の化合物および組成物との組み合わせのための他の抗体には、これらに限定されないが、関節リウマチおよびクローン病のためのインフリキシマブ(レミケード)およびエタネルセプト(エンブレル)などの抗TNFα抗体、パリビズマ(palivizuma)、小児対象のための抗RSV抗体、ベバシズマブ、アレムツズマブ、キャンパス-1H、BLyS-mAb、fSLE、抗VEGF2、抗Trail受容体、B3 mAb、m170 mAb、mAB BR96、およびAbx-Cbl mAb、が含まれる。本発明は、がん抗原(本明細書に記載される)、細胞表面分子、間質細胞分子、細胞外マトリックス分子、および腫瘍血管系関連分子に向けられた抗体を含むがこれらに限定されない、いくつかのクラスの抗体およびそのフラグメントを包含する。
細胞表面分子は、細胞の表面で発現する分子である。細胞外ドメインに加えて、それはさらに膜貫通ドメインおよび細胞質ドメインを含み得る。例には、HER2、CD20、CD33、EGF受容体、HLA-DR、CD52、CD1、CEA、CD22、GD2ガングリオシド、FLK2/FLT3、VEGF、VEGFRなどのHLAマーカーが含まれる。
間質細胞分子は、間質細胞によって発現される分子である。例には、FAPおよびCD26が含まれるが、これらに限定されない。
細胞外マトリックス分子は、細胞外マトリックスに見られる分子である。例には、コラーゲン、グリコサミノグリカン(GAG)、プロテオグリカン、エラスチン、フィブロネクチン、およびラミニンが含まれるが、これらに限定されない。
腫瘍血管系関連分子は、腫瘍の血管系によって発現される分子である(すなわち、白血病などの全身性がんではなく固形がん)。がん抗原と同様に、腫瘍血管系関連分子は正常な血管系によって発現され得るが、腫瘍の血管系上に存在することにより、それは抗がん療法の適切な標的となる。場合によっては、腫瘍血管系関連分子は、正常な血管系よりも腫瘍血管系においてより高いレベルで発現される。例には、これらに限定されないが、エンドグリン(米国特許第5,660,827号を参照されたい)、ELAM-1、VCAM-1、ICAM-1、LAM-1と反応するリガンド、MHCクラスII抗原、ホスファチジルセリンおよびホスファチジルエタノールアミンなどのアミノリン脂質(米国特許第6,312,694号に記載されるような)、VEGFR1(Flt-1)およびVEGFR2(KDR/Flk-1)、ならびに米国特許第5,776,427号に記載されているような他の腫瘍血管系関連分子、が含まれる。エンドグリンに対する抗体は、米国特許第5,660,827号に記載されており、TEC-4およびTEC-11、ならびにこれらの抗体と同一のエピトープを認識する抗体、が含まれる。アミノリン脂質に対する抗体は、米国特許第6,312,694号に記載されている。VEGFを阻害する抗体は、米国特許6,342,219号に記載され、かつ2C3(ATCC PTA1595)を含む。腫瘍血管系に特異的な他の抗体には、FGFとFGFRとの複合体またはTGFβとTGFβRとの複合体などの成長因子とその受容体との複合体に反応する抗体が含まれる。この後者のクラスの抗体は、米国特許第5,965,132号に記載され、かつGV39およびGV97を含む。
本発明に含まれる抗体には、本明細書に明示的に記載されている抗体、および本明細書に記載されているものと同じエピトープに結合する抗体も含まれることが理解されるべきである。
本発明に記載の化合物および組成物は、アポトーシス抗体と組み合わせて、優れた結果を達成することができる。例示的なアポトーシス抗体には、これらに限定されないが、抗BAX抗体(これは、ヒト、ネズミ、および/または異なる動物源由来のそれらのBAX抗原と拮抗する)、抗flax抗体、抗Fas/Fasリガンド抗体、抗グランザイム抗体、(例えば、抗グランザイムB抗体)、抗BCL抗体、抗シトクロムC抗体、TRADD、TRAIL、TRAFF、および/またはDR3と拮抗する(antagnizing)抗体、抗BIM抗体、抗PARP抗体、抗カスパーゼ抗体、抗CD29、PL18-5 PanVera、抗CD29、PL4-3 PanVera、抗CD41a、PT25-2 PanVera、抗CD42b、PL52-4 PanVera、抗CD42b、GUR20-5 PanVera、抗CD42b、WGA-3 PanVera、抗CD43、1D4 PanVera、抗CD46、MCP75-6 PanVera、抗CD61、PL11-7 PanVera、抗CD61、PL8-5 PanVera、抗CD62/P-slctn、PL7-6 PanVera、抗CD62/P-slctn、WGA-1 PanVera、抗CD154、5F3 PanVera、ならびに抗CD1、抗CD2、抗CD3、抗CD4、抗CD5、抗CD6、抗CD7、抗CD8、抗CD9、抗CD10、抗CD11、抗CD12、抗CD13、抗CD14、抗CD15、抗CD16、抗CD17、抗CD18、抗CD19、抗CD20、抗CD21、抗CD22、抗CD23、抗CD24、抗CD25、抗CD26、抗CD27、抗CD28、抗CD29、抗CD30、抗CD31、抗CD32、抗CD33、抗CD34、抗CD35、抗CD36、抗CD37、抗CD38、抗CD39、抗CD40 抗CD41、抗CD42、抗CD43、抗CD44、抗CD45、抗CD46、抗CD47、抗CD48、抗CD49、抗CD50、抗CD51、抗CD52、抗CD53、抗CD54、抗CD55、抗CD56、抗CD57、抗CD58、抗CD59、抗CD60、抗CD61、抗CD62、抗CD63、抗CD64、抗CD65、抗CD66、抗CD67、抗CD68、抗CD69、抗CD70、抗CD71、抗CD72、抗CD73、抗CD74、抗CD75、抗CD76、抗CD77、抗CD78、抗CD79、抗CD80、抗CD81、抗CD82、抗CD83、抗CD84、抗CD85、抗CD86、抗CD87、抗CD88、抗CD89、抗CD90、抗CD91、抗CD92、抗CD93、抗CD94、抗CD95、抗CD96、抗CD97、抗CD98、抗CD99、抗CD100、抗CD101、抗CD102、抗CD103、抗CD104、抗CD105、抗CD106、抗CD107、抗CD108、抗CD109、抗CD110、抗CD111、抗CD112、抗CD113、抗CD114、抗CD115、抗CD116、抗CD117、抗CD118、抗CD119、抗CD120、抗CD121、抗CD122、抗CD123、抗CD124、抗CD125、抗CD126、抗CD127、抗CD128、抗CD129、抗CD130、抗CD131、抗CD132、抗CD133、抗CD134、抗CD135、抗CD136、抗CD137、抗CD138、抗CD139、抗CD140、抗CD141、抗CD142、抗CD143、抗CD144、抗CD145、抗CD146、抗CD147、抗CD148、抗CD149、抗CD150、抗CD151、抗CD152、抗CD153、抗CD154、抗CD155、抗CD156、抗CD157、抗CD158、抗CD159、抗CD160、抗CD161、抗CD162、抗CD163、抗CD164、抗CD165、抗CD166、抗CD167、抗CD168、抗CD169、抗CD170、抗CD171、抗CD172、抗CD173、抗CD174、抗CD175、抗CD176、抗CD177、抗CD178、抗CD179、抗CD180、抗CD181、抗CD182、抗CD183、抗CD184、抗CD185、抗CD186、抗CD187、抗CD188、抗CD189、抗CD190、抗CD191、抗CD192、抗CD193、抗CD194、抗CD195、抗CD196、抗CD197、抗CD198、抗CD199、抗CD200、抗CD201、抗CD202、抗CD203、抗CD204、抗CD205、抗CD206、抗CD207、抗CD208、抗CD209、抗CD210、抗CD211、抗CD212、抗CD213、抗CD214、抗CD215、抗CD216、抗CD217、抗CD218、抗CD219、抗CD220、抗CD221、抗CD222、抗CD223、抗CD224、抗CD225、抗CD226、抗CD227、抗CD228、抗CD229、抗CD230、抗CD231、抗CD232、抗CD233、抗CD234、抗CD235、抗CD236、抗CD237、抗CD238、抗CD239、抗CD240 抗CD241、抗CD242、抗CD243、抗CD244、抗CD245、抗CD246、抗CD247、抗CD248、抗CD249、抗CD250、などの抗体が含まれる。
本発明に記載の化合物および組成物と組み合わせて投与される他の例示的なヒトケモカイン抗体には、ヒトCNTF抗体、ヒトエオタキシン抗体、ヒト上皮(Epitherlial)好中球活性化ペプチド-78、ヒトエクソダス抗体、ヒトGRO抗体、ヒトHCC-1抗体、ヒトI-309抗体、ヒトIP-10抗体、ヒトI-TAC抗体、ヒトLIF抗体、ヒト肝臓発現ケモカイン抗体、ヒトリンホトキシン抗体、ヒトMCP抗体、ヒトMIP抗体、IFN-ガンマ抗体による誘導ヒトモノカイン、ヒトNAP-2抗体、ヒトNP-1抗体、ヒト血小板第4因子抗体、ヒトRANTES抗体、ヒトSDF抗体、およびヒトTECK抗体が含まれるが、これらに限定されない。
本発明に記載の化合物および組成物と組み合わせて投与される他の例示的なケモカイン抗体には、ヒトB細胞誘引マウスケモカイン抗体、ケモカイン-1抗体、マウスエオタキシン抗体、マウスエクソダス抗体、マウスGCP-2抗体、マウスKC抗体、マウスMCP抗体、マウスMIP抗体、マウスRANTES抗体、ラットケモカイン抗体、ラットケモカイン抗体、ラットCNTF抗体、ラットGRO抗体、ラットMCP抗体、ラットMIP抗体、およびラットRANTES抗体が含まれるが、これらに限定されない。
本発明に記載の化合物および組成物と組み合わせて投与される例示的なサイトカイン/サイトカイン受容体抗体には、ヒトビオチン化サイトカイン/サイトカイン受容体抗体、ヒトIFN抗体、ヒトIL抗体、ヒトレプチン抗体、ヒトオンコスタチン抗体、ヒトTNF抗体、ヒトTNF受容体ファミリー抗体、マウスビオチン化サイトカイン/サイトカイン受容体抗体、マウスIFN抗体、マウスIL抗体、マウスTNF抗体、マウスTNF受容体抗体、マウス抗CCR4抗体、ラットビオチン化サイトカイン/サイトカイン受容体抗体、ラットIFN抗体、ラットIL抗体、およびラットTNF抗体が含まれるが、これらに限定されない。
本発明に記載の化合物および組成物と組み合わせて投与される例示的なECM抗体には、コラーゲン/プロコラーゲン、ラミニン、コラーゲン(ヒト)、ラミニン(ヒト)、プロコラーゲン(ヒト)、ビトロネクチン/ビトロネクチン受容体、ビトロネクチン(ヒト)、ビトロネクチン受容体(ヒト)、フィブロネクチン/フィブロネクチン受容体、フィブロネクチン(ヒト)、およびフィブロネクチン受容体(ヒト)が含まれるが、これらに限定されない。
本発明に記載の化合物および組成物と組み合わせて投与される例示的な増殖因子抗体には、ヒト増殖因子抗体、マウス増殖因子抗体、およびブタ増殖因子抗体が含まれるが、これらに限定されない。
本発明に記載の化合物および組成物と組み合わせて投与される他の例示的な増殖因子抗体には、バキュロウイルス抗体、カドヘリン抗体、補体抗体、Clq抗体、フォンヴィルブランド因子抗体、Cre抗体、HIV抗体、インフルエンザ抗体、ヒトレプチン。抗体、マウスレプチン抗体、マウスCTLA-4抗体、ヒトCTLA-4抗体、P450抗体、およびRNAポリメラーゼ抗体が含まれるが、これらに限定されない。
本発明に記載の化合物および組成物と組み合わせて投与される例示的な神経生物学的抗体には、アミロイド抗体、GFAP抗体、ヒトNGF抗体、ヒトNT-3抗体、およびヒトNT-4抗体が含まれるが、これらに限定されない。
本発明に記載の化合物および組成物と組み合わせて投与されるさらなる例示的な抗体には、一次抗体のMSRSカタログおよびリンスコットディレクトリなどの参考文献に記載されている抗体が含まれるが、これらに限定されない。
本発明のいくつかの好ましい実施形態では、本発明に記載される化合物および組成物と組み合わせて投与される抗体には、アバスチン(ベバシズマブ)、BEC2(ミツモマブ(mitumomab))、ベキサール(トシツモマブ)、キャンパス(アレムツズマブ)、CeaVac、ハーセプチン(トラスツズマブ)、IMC-C225(セツキシマブ)、LymphoCide(エプラツズマブ)、MDX-210、マイロターグ(ゲムツズマブオゾガマイシン)、Panorex(エドレコロマブ)、リツキサン(リツキシマブ)、セラギン(Theragyn)(ペンツモマブ(pemtumomab))、Zamyl、およびゼバリン(イブリツモマブチツキセタン)が含まれるが、これらに限定されない。本発明はまた、その抗体フラグメントを包含する。
いくつかの好ましい実施形態では、がん抗原は、VEGF、抗イディオタイプmAb(GD3ガングリオシド模倣物)、CD20、CD52;抗イディオタイプmAb(CEA模倣物)、ERBB2、EGFR、CD22、ERBB2 X CD65(fcγRI)、EpCam、PEMおよびCD33である。
本発明に記載の化合物および組成物と組み合わせて投与される抗体には、従来の方法論によって調製することができるモノクローナル抗体またはポリクローナル抗体が含まれるが、これらに限定されない。それらはさらに単離されるか、腹水に存在する可能性がある。そのような抗体は、以下でより詳細に議論されるように、キメラまたはヒト化抗体を作製するためにさらに操作することができる。
重要なことに、当技術分野でよく知られているように、抗体分子のごく一部であるパラトープのみが、そのエピトープへの抗体の結合に関与している(一般に、Clark,W.R.(1986)The Experimental Foundations of Modern Immunology Wiley & Sons,Inc.,New York、Roitt,I.(1991)Essential Immunology,7th Ed.,Blackwell Scientific Publications,Oxfordを参照されたい)。例えば、pFc’およびFc領域は補体カスケードのエフェクターであるが、抗原結合には関与していない。pFc’領域が酵素的に切断された抗体、またはpFc’領域なしで生成された抗体は、F(ab’)2フラグメントと呼ばれ、インタクトな抗体の抗原結合部位の両方を保持する。同様に、Fc領域が酵素的に切断された抗体、またはFc領域なしで生成された抗体は、Fabフラグメントと呼ばれ、インタクトな抗体分子の抗原結合部位の1つを保持する。さらに進むと、Fabフラグメントは、共有結合した抗体軽鎖と、Fdで示される抗体重鎖の一部とから構成される。Fdフラグメントは抗体特異性の主要な決定因子であり(単一のFdフラグメントは、抗体特異性を変えることなく最大10の異なる軽鎖に結合する可能性がある)、Fdフラグメントは単独でもエピトープ結合能を保持する。
本発明に含まれるのは、抗原のエピトープと直接相互作用する抗体の相補性決定領域(CDR)、およびパラトープの三次構造を維持するフレームワーク領域(FR)である(一般に、Clark,1986;Roitt,1991を参照されたい)。
哺乳動物抗体の非CDR領域も含まれ、元の抗体のエピトープ特異性を保持しながら、共特異的または異種特異的抗体の同様の領域で置き換えることができる。このような抗体は、抗原結合能を有するインタクトな抗体のフラグメントを含め、「キメラ」抗体と呼ばれる。
本発明はまた、F(ab’)2、Fab、FvおよびFdフラグメント;Fcおよび/またはFRおよび/またはCDR1および/またはCDR2および/または軽鎖CDR3領域が相同なヒトまたは非ヒト配列によって置き換えられているキメラ抗体;FRおよび/またはCDR1および/またはCDR2および/または軽鎖CDR3領域が相同なヒトまたは非ヒト配列によって置き換えられているキメラF(ab’)2フラグメント抗体;FRおよび/またはCDR1および/またはCDR2および/または軽鎖CDR3領域が相同なヒトまたは非ヒト配列によって置き換えられているキメラFabフラグメント抗体;ならびにFRおよび/またはCDR1および/またはCDR2領域が相同なヒトまたは非ヒト配列によって置き換えられているキメラFdフラグメント抗体を提供する。本発明はまた、いわゆる一本鎖抗体を含む。
本明細書に記載の化合物および組成物は、治療上有効かつ生理学的に許容可能な量で投与されるが、これは、所望の有益な生物学的効果、この場合はがんの治療または血管新生の阻害を実現するために必要または十分な、対象に対して生理学的に許容される量である。生物学的に有益な効果は、例えば、治療の投与後の治療の生理学的効果を決定することによって測定することができる。生物学的に有益な効果は、治療されている障害に起因する症状の改善および/もしくは絶対的な排除、または、例えば、画像化における微小血管(例えば、異常な微小血管)の数の低減によって証明されるように、治療されている障害における血管新生の阻害であり得る。
治療上有効かつ生理学的に許容される量は、特定の化合物もしくは化合物の組み合わせ、組成物もしくは組成物の組み合わせ、および/または使用される療法に応じて変化し得る。それはまた、治療されている状態(例えば、がん)、対象のサイズ、または疾患もしくは状態の重症度などの要因に応じて変化する可能性がある。当業者は、過度の実験を必要とせずに、特定のセプチン標的化合物の化合物または組み合わせの有効量を経験的に決定することができる。本明細書で提供される教示と組み合わせて、効力、相対的生物学的利用能、患者の体重、有害な副作用の重症度および好ましい投与様式などの様々な化合物および重み係数から選択することにより、効果的な予防的または治療的治療レジメンを計画することができ、これは実質的な毒性を引き起こさないが、それでも特定の対象を治療するのに完全に効果的である。
場合によっては、本明細書に記載の化合物もしくは組成物または第2の薬剤のいずれかの治療量以下の投与量、あるいは両方の治療量以下の投与量が、対象を治療するために使用される。例えば、本明細書に記載の化合物または組成物を抗がん剤と一緒に使用する場合、化合物または組成物および抗がん剤は、治療量以下の用量で投与され、それでも望ましい治療効果を生み出す。本明細書で使用される「治療量以下の用量」は、他の薬剤の非存在下で投与された場合に対象に治療結果をもたらすであろう用量よりも少ない投与量を指す。したがって、抗がん剤の治療量以下の用量は、本明細書に記載の化合物または組成物の投与がない場合、対象において同じまたは実質的に同様の治療結果をもたらさない用量である。抗がん剤の治療量は、医学の分野で知られている。これらの用量は、Remington’s Pharmaceutical Sciences,18th ed.,1990などの参考文献、およびがん治療のガイダンスとして医療専門家によって信頼されている他の多くの医学参考文献に広く記載されており、当技術分野でよく知られている。
本明細書に記載の化合物および組成物の場合、治療有効量は、細胞培養アッセイなどのインビトロアッセイから最初に決定される。治療有効量は、動物実験でも決定することができる。例えば、第2の薬剤を伴うまたは伴わない本明細書に記載の化合物または組成物の有効量は、例えば、腫瘍退縮および/または腫瘍形成の防止のインビボアッセイを使用して評価される。関連する動物モデルには、例えば、悪性細胞が動物対象に、通常は定義された部位に注射されるアッセイが含まれる。一般に、ある範囲のセプチン標的化合物用量が動物に投与される。悪性細胞の注射後の腫瘍の増殖の阻害は、がんを発症するリスクを低減する能力を示している。既存の腫瘍のさらなる増殖(またはサイズの縮小)の阻害は、がんを治療する能力を示している。
両方の薬剤の適用用量は、投与された化合物の相対的な生物学的利用能および効力に基づいて調整することができる。上記の方法および他の方法に基づいて最大の有効性を達成するように用量を調整することは、通常の当業者の能力の範囲内である。
本明細書に記載の化合物および組成物の好ましい対象用量は、典型的には約0.1μg~30,000mg、より典型的には約1μg/日~20,000mg、さらにより典型的には約10μg~15,000mg、最も典型的には約100μg~10,000μgの範囲である。対象の体重に関して述べると、典型的な投与量は、約0.1μg~200mg/kg/日、より典型的には約0.5~150mg/kg/日の範囲である。いくつかの重要な実施形態では、化合物は、約1~100mg/kg/日の量で投与される。いくつかの他の重要な実施形態では、化合物は、10~60mg/kg/日の量で投与される。
本明細書で使用される「ルーチンスケジュール」は、本発明に記載の化合物または組成物を送達するために選択される所定の指定された期間を指す。ルーチンスケジュールは、スケジュールが事前に決定されている限り、同一または長さが異なる期間を含む。ルーチンスケジュールは、例えば、1日あたり2、3、4、または6回の投与で、毎日の投与、2日ごと、3日ごと、4日ごと、5日ごと、6日ごと、毎週の投与、毎月の投与またはその間の任意の設定された日数または週数-その間で、2か月ごと、3か月ごと、4か月ごと、5か月ごと、6か月ごと、7か月ごと、8か月ごと、9か月ごと、10か月ごと、11か月ごと、12か月ごとなど、が含まれる。あるいは、所定のルーチンスケジュールは、最初の週は毎日、続いて数か月は毎月、その後は3か月ごとに投与することを含み得る。適切なスケジュールが特定の日の投与を含むことが事前に決まっている限り、任意の特定の組み合わせはルーチンスケジュールによってカバーされる。
本発明の化合物または組成物は、薬学的に許容される担体で、またはベクターもしくは送達システムの状況で投与される。本発明の化学的/物理的ベクターの例は、コロイド分散系である。コロイド分散系には、水中油型エマルジョン、ミセル、混合ミセル、およびリポソームを含む脂質ベースの系が含まれる。本発明の好ましいコロイド系はリポソームである。リポソームは、インビボまたはインビトロでの送達ベクターとして有用な人工膜容器である。サイズが0.2~4.0μmの大きな単層容器(LUV)は、大きな高分子をカプセル化できることが示されている。RNA、DNA、およびインタクトなビリオンは、水性内部にカプセル化され、生物学的に活性な形で細胞に送達される(Fraley,et al.,Trends Biochem.Sci.,(1981)6:77)。
リポソームを使用して、本発明を具体化する化合物を送達することができる。リポソームを糖、糖脂質、またはタンパク質などの特定のリガンドに結合させることにより、リポソームを特定の組織に標的化することができる。リポソームを細胞に標的化するのに有用であり得るリガンドには、細胞特異的受容体と相互作用する分子のインタクトなものまたはフラグメント、および細胞の細胞表面マーカーと相互作用する抗体などの分子が含まれるが、これらに限定されない。そのようなリガンドは、当業者によく知られている結合アッセイによって容易に同定することができる。さらに他の実施形態では、リポソームは、例えば、前述の免疫療法抗体のうちの1つにそれを結合することによって、がんを標的化することができる。さらに、ベクターは、ベクターを宿主細胞の核に向ける核標的化ペプチドに結合することができる。
本明細書に記載の化合物または組成物を送達するために使用されるリポソームは、例えば、N-[1-(2,3ジオレイルオキシ)-プロピル]-N,N,N-トリメチルアンモニウムクロリド(DOTMA)およびジメチルジオクタデシルアンモニウムブロミド(DDAB)などのカチオン性脂質から形成されるLIPOFECTIN(商標)およびLIPOFECTACE(商標)として、Gibco BRLから市販されている。リポソームを作製するための方法は当技術分野で周知であり、多くの刊行物に記載されている。リポソームは、Gregoriadis,G.in Trends in Biotechnology,(1985)3:235-241によっても概観されている。
他の実施形態では、本発明を具体化する化合物を送達するために使用される化学的/物理的ベクターは、経口または粘膜送達などの送達に適した生体適合性ミクロスフェアを含む。このようなミクロスフェアは、Chickering et al.,Biotech.And Bioeng.,(1996)52:96-101およびMathiowitz et al.,Nature,(1997)386:410-414ならびにPCT特許出願第WO97/03702号に開示されている。
本発明に記載の化合物または組成物を送達するために使用することができる非生分解性および生分解性ポリマーマトリックスは両方とも、生分解性マトリックスを含む。そのようなポリマーは、天然または合成ポリマーであり得る。ポリマーは、放出が望まれる期間に基づいて、一般に数時間から1年以上のオーダーで選択される。通常、数時間から3か月~12か月の範囲の期間にわたる放出が最も望ましい。ポリマーは、任意選択で、水中でその重量の最大約90%を吸収することができるヒドロゲルの形態であり、さらに、任意選択で、多価イオンまたは他のポリマーと架橋される。
本明細書に記載の薬剤の処方に使用されると考えられるポリマーマトリックスは、好ましくは、ミクロスフェア(薬剤が固体高分子マトリックス全体に分散している)またはマイクロカプセル(薬剤が高分子シェルのコアに格納される)などの微粒子の形態である。本発明を具体化する化合物を送達するために利用することができる薬剤を含むための他の形態のポリマーマトリックスには、フィルム、コーティング、ゲル、インプラント、およびステントが含まれる。ポリマーマトリックスデバイスのサイズおよび組成は、マトリックスが導入される組織において好ましい放出動態をもたらすように選択される。ポリマーマトリックスのサイズは、使用される送達方法、典型的には組織への注射、またはエアロゾルによる鼻および/または肺領域への懸濁液の投与に従ってさらに選択される。好ましくは、エアロゾル経路が使用される場合、ポリマーマトリックスおよびセプチン標的化合物の化合物は、界面活性剤ビヒクルに含まれる。ポリマーマトリックス組成物は、好ましい分解速度を有すること、および生体接着性である材料から形成されることの両方を有するように選択され得、マトリックスが損傷を受けた鼻および/または肺表面に投与されるときの移動の有効性をさらに高める。マトリックス組成物はまた、分解しないように選択することができ、むしろ、長期間にわたる拡散によって放出するように選択することができる。いくつかの好ましい実施形態では、本明細書に記載の化合物または組成物は、インプラントを介して対象に投与される。
特に興味深い生体接着性ポリマーには、生体内分解性ヒドロゲル(H.S.Sawhney,C.P.Pathak and J.A.Hubell in Macromolecules,(1993)26:581-587によって記述されたものなど)、ポリヒアルロン酸、カゼイン、ゼラチン、グルチン、ポリ酸無水物、ポリアクリル酸、アルギン酸塩、キトサン、ポリ(メチルメタクリレート)、ポリ(エチルメタクリレート)、ポリ(ブチルメタクリレート)、ポリ(イソブチルメタクリレート)、ポリ(ヘキシルメタクリレート)、ポリ(イソデシルメタクリレート))、ポリ(ローレル(laurel)メタクリレート)、ポリ(フェニルメタクリレート)、ポリ(メチルアクリレート)、ポリ(イソプロピルアクリレート)、ポリ(イソブチルアクリレート)、およびポリ(オクタデシルアクリレート)が含まれる。
本発明の組成物および方法は、既存の外科的処置または薬物療法を置き換えるのに有用であるが、場合によっては、本発明は、そのような状態を治療するための既存の療法の有効性を改善するのに有用である。したがって、併用療法は、がんの治療を受けている、または受ける予定の対象を治療するために使用することができる。例えば、薬剤は、別の抗増殖(例えば、抗がん)療法と組み合わせて対象に投与され得る。適切な抗がん療法には、腫瘍塊を除去するための外科的処置、化学療法、または局所放射線療法が含まれる。他の抗増殖療法は、本発明の薬剤による治療の前、同時、または後に投与することができる。異なる治療の投与の間に数時間、数日、場合によっては数週間の遅れがあってもよく、その結果、薬剤は他の治療の前または後に投与され得る。いくつかの実施形態では、本明細書に記載の化合物または組成物は、他の抗増殖治療と一緒にまたはそれなしで(例えば、手術、放射線または化学療法の前に)投与されるが、タイミングはそれほど限定されない。
本明細書に記載の化合物または組成物はまた、非外科的、抗増殖性(例えば、抗がん性)薬物療法と組み合わせて投与することができる。いくつかの実施形態では、薬剤は、細胞増殖抑制性化合物などの抗がん剤と組み合わせて投与され得る。細胞増殖抑制性化合物は、細胞の成長および/または増殖を抑制する化合物(例えば、核酸、タンパク質)である。いくつかの実施形態では、細胞増殖抑制性化合物は、腫瘍の悪性細胞に向けられる。さらに他の実施形態では、細胞増殖抑制性化合物は、血管平滑筋細胞または線維芽細胞の成長および/または増殖を阻害するものである。
本発明の方法によれば、本明細書に記載の化合物または組成物は、他の抗がん剤の前、同時、または後に投与される。投与スケジュールには、異なる薬剤を交互に投与することが含まれる。他の実施形態において、本発明の併用療法は、他の療法による治療の前および最中、または最中および後、または前および後に送達される。場合によっては、薬剤は他の抗増殖治療の投与の24時間以上前に投与される。他の実施形態では、2つ以上の抗増殖療法が対象に投与される。例えば、対象は、手術および少なくとも1つの他の抗増殖性化合物の両方と組み合わせて、本発明の薬剤を受け取る。あるいは、薬剤は、2つ以上の抗がん剤と組み合わせて投与される。
本明細書に記載の化合物または組成物は、免疫応答を増強するために、アジュバントなどの他の治療薬と組み合わせることができる。本明細書に記載の化合物または組成物および他の治療薬は、同時にまたは連続して投与することができる。他の治療薬が同時に投与される場合、それらは同じまたは別々の製剤で投与することができるが、同時に投与される。他の治療薬および本明細書に記載の化合物または組成物の投与はまた、時間的に離すことができ、これは、治療薬が、本明細書に記載の化合物または組成物の投与の前または後のいずれかの異なる時間に投与されることを意味する。これらの化合物と薬剤の投与の間の時間の分離は、数分またはそれ以上の時間であってもよい。他の治療薬には、核酸アジュバント、非核酸アジュバント、サイトカイン、非免疫療法抗体、抗原などが含まれるが、これらに限定されない。
核酸アジュバントは、核酸であるアジュバントである。例には、2001年2月27日に発行された米国特許第6,194,388号B1、2001年3月27日に発行された米国特許第6,207,646号B1、および2001年5月29日に発行された米国特許第6,239,116号B1に記載されているような、CpGジヌクレオチドを含むものなどの免疫刺激性核酸分子が含まれる。
「非核酸アジュバント」は、体液性および/または細胞性免疫応答を刺激することができる、本明細書に記載の免疫刺激性核酸を除く任意の分子または化合物である。非核酸アジュバントには、例えば、デポ効果(depo effect)を生み出すアジュバント、免疫刺激アジュバント、デポ効果を生み出し免疫系を刺激するアジュバント、および粘膜アジュバントが含まれる。
本明細書で使用される「デポ効果を生み出すアジュバント」は、がんワクチンに存在するがん抗原などの抗原を体内でゆっくりと放出させ、それにより免疫細胞の抗原への曝露を延長させるアジュバントである。このクラスのアジュバントには、ミョウバン(例えば、水酸化アルミニウム、リン酸アルミニウム)、またはミネラルオイル、非ミネラルオイル、油中水型もしくは油中水中油型(oil-in-water-in oil)エマルジョン、例えばSeppic ISAシリーズのMontanideアジュバント(例えば、Montanide ISA 720、AirLiquide、Paris,France)などの水中油型エマルジョン、MF-59(Span85およびTween80で安定化された水中スクアレンエマルジョン、Chiron Corporation、Emeryville,CA、およびPROVAX(安定化された洗剤とミセル形成剤を含む水中油型エマルジョン、DEC Pharmaceuticals Corporation、San Diego,Calif.)、を含むエマルジョンベースの製剤が含まれるが、これらに限定されない。
「免疫刺激アジュバント」は、免疫系の細胞の活性化を引き起こすアジュバントである。例えば、免疫細胞にサイトカインを産生および分泌させる可能性がある。このクラスのアジュバントには、QS21(HPLC分画で21番目のピークで溶出する糖脂質、Antigenics,Inc.、Waltham,Mass.)などのQ.saponariaの木の樹皮から精製されたサポニン、ポリ[ジ(カルボキシラトフェノキシ)ホスファゼン(PCPPポリマー、Virus Research Institute、USA)、モノホスホリルリピドA(MPL、Ribi ImmunoChem Research,Inc.、Hamilton,Mont.)、ムラミルジペプチド(MDP、Ribi)およびスレオニル-ムラミルジペプチド(t-MDP、Ribi)などのリポ多糖の誘導体、OM-174(リピドAに関連するグルコサミン二糖、OM Pharma SA、Meyrin,Switzerland)、およびLeishmania伸長因子(精製されたLeishmaniaタンパク質、Corixa Corporation、Seattle,Wash.)が含まれるが、これらに限定されない。
「デポ効果を生み出し、免疫系を刺激するアジュバント」は、上記の両方の機能を備えた化合物である。このクラスのアジュバントには、ISCOMS(混合サポニン、脂質を含み、抗原を保持できる細孔を持つウイルスサイズの粒子を形成する免疫刺激複合体、CSL、Melbourne,Australia)、SB-AS2(MPLおよびQS21を含む水中油型エマルジョンであるSmithKline Beechamアジュバントシステム#2:SmithKline Beecham Biologicals [SBB]、Rixensart、Belgium)、SB-AS4(ミョウバンおよびMPLを含むSmithKline Beechamアジュバントシステム#4、SBB、Belgium)、CRL 1005などのミセルを形成する非イオン性ブロックコポリマー(これらは、ポリオキシエチレンの鎖で挟んだ疎水性のポリオキシプロピレンの直鎖を含む、Vaxcel,Inc.、Norcross,Ga.)、およびSyntexアジュバント製剤(SAF、Tween80および非イオン性ブロックコポリマーを含む水中油型エマルジョン、Syntex Chemicals,Inc.、Boulder,Colo.)が含まれるが、これらに限定されない。
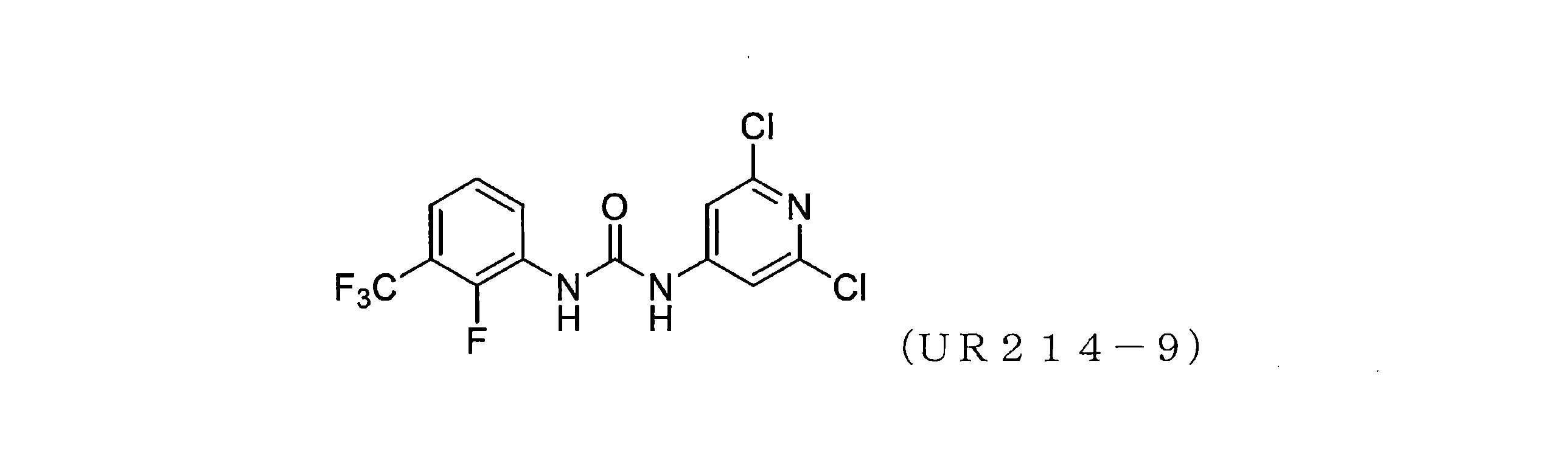
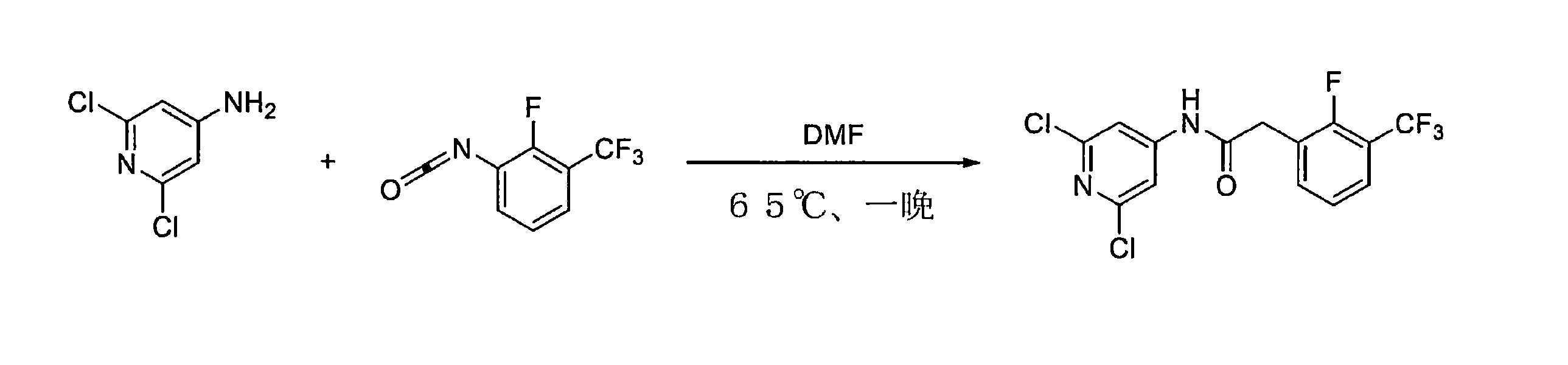
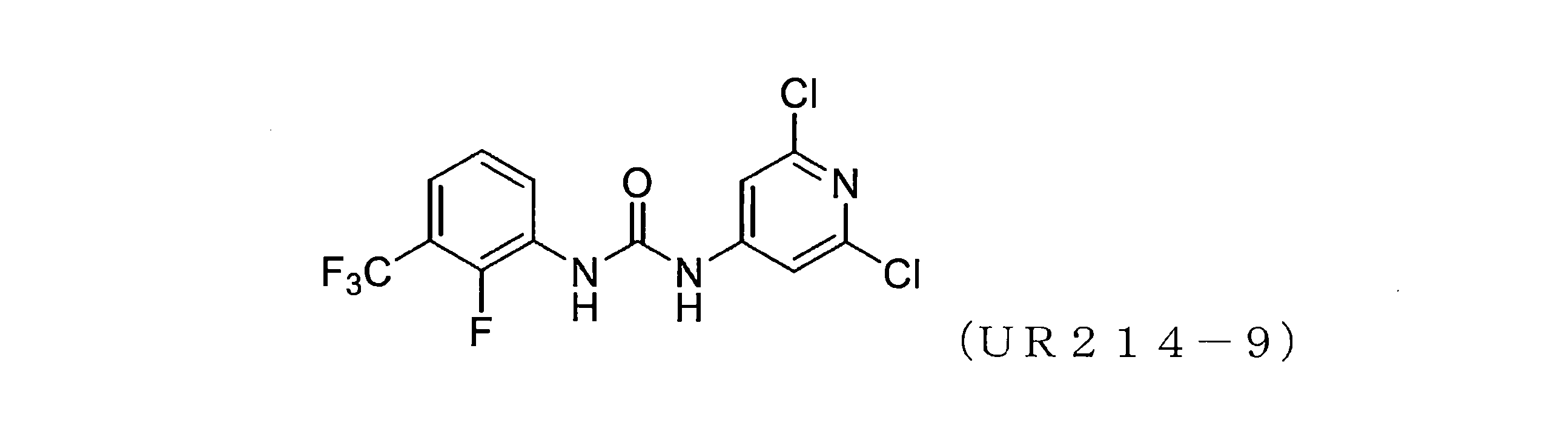
実施例1開示された化合物UR214-9の代表的な合成
化合物UR214-9は、以下の一般的な手順を使用して合成された。
乾燥DMF中のアミン(0.01~0.1mol)の溶液に、イソシアネート(0.01~0.1mol)の溶液を滴下して加え、続いて反応混合物を加熱し、65℃で一晩撹拌した。反応混合物を室温に冷却し、DMFを減圧下で除去した。得られた反応混合物の一部を、溶離液としてヘキサン:酢酸エチルまたはDCM:MeOHを使用する分取薄層クロマトグラフィーを使用して精製した。所望のバンドをこすり取り、MeOH:DCM(90:10)を使用して化合物をシリカゲルから剥がした。溶媒を減圧下で蒸発させ、所望の化合物を粉末として収集した。
本出願において開示または例示されるものなどの本出願の他の化合物(例えば、式(I)~(IV)の化合物)もまた、同じ合成経路に従って調製される。
このプロセスによって得られたUR214-9の代表的な質量スペクトルを図13に提示する。
実施例2強力なセプチン阻害剤の開発とがん細胞株におけるそれらの細胞毒性効果
導入
卵巣と子宮の悪性腫瘍は比較的一般的であり、残念ながら非常に致命的である。女性で4番目に多いがんである子宮がんは、米国で年間約60,000件の新規のがんの診断と10,000件のがんによる死亡を示している(Siegel,R.L.,Miller,K.D.& Jemal,A.Cancer Statistics,2017.CA Cancer J.Clin.67,7-30,2017を参照されたい)。あまり一般的ではないが、卵巣がんはさらに致命的であり、5年生存率は46.6%である(www.cdc.gov/cancer/dataviz、2019年6月)。これらの疾患の現在の治療は、外科的管理と医療的管理の組み合わせに依存している。進化する一方で、両者の第一選択医療の基盤は、プラチナベースの薬とタキサン薬の組み合わせであり、10年以上にわたってそうなっている。
ジアリール尿素誘導体は医薬品化学において非常に興味深い存在であり、抗炎症作用、抗血栓作用、抗菌作用など幅広い生物活性を有する低分子である(Garuti,L.,Roberti,M.,Bottegoni,G.& Ferraro,M.Diaryl Urea:A Privileged Structure in Anticancer Agents.Curr.Med.Chem.23,1528-1548,2016を参照されたい)。さらに、ソラフェニブやレゴラフェニブなどのジアリール尿素誘導体は、がん治療に臨床的に使用されている(Sadeghian-Rizi,S.et al.Synthesis and characterization of some novel diaryl urea derivatives bearing quinoxalindione moiety.Res.Pharm.Sci.13,82-92,2018を参照されたい)。フォルクロロフェヌロン(FCF、N-(2-クロロ-4-ピリジル)-N’-フェニル尿素)は、現在農業で利用されている小さな合成尿素誘導体である。FCFは強力なサイトカイニン活性を示し、果実のサイズを大きくする植物肥料として世界中で使用されている。興味深いことに、FCFは、がん細胞株の増殖、足場非依存性増殖、遊走および浸潤を阻害することが示されている(Blum,W.et al.The phytohormone forchlorfenuron decreases viability and proliferation of malignant mesothelioma cells in vitro and in vivo.Oncotarget 10,6944-6956,2019、Zhang,N.et al.The requirement of SEPT2 and SEPT7 for migration and invasion in human breast cancer via MEK/ERK activation.Oncotarget 7,61587-61600,2016、およびVardi-Oknin,D.,Golan,M.& Mabjeesh,N.J.Forchlorfenuron disrupts SEPT9_i1 filaments and inhibits HIF-1.Plos One 8,e73179,2013を参照されたい)。FCFの効果は、前立腺、中皮腫、肺、結腸、乳房、卵巣、子宮頸部など、様々な種類のがんで実証されている。FCFは、腫瘍の成長が抑制されたマウスモデルでも有効であることが見出されている。分子レベルでは、FCF治療は、HIF-1αとHER2の抑制を引き起こし、これらは両方とも、より悪性のがん表現型に関連していることが知られている(Marcus,E.A.et al.Septin oligomerization regulates persistent expression of ErbB2/HER2 in gastric cancer cells.Biochem.J.473,1703-1718,2016を参照されたい)。
本実施例では、婦人科がん細胞株のパネルに対する細胞毒性活性をテストできる強力なセプチン阻害剤を開発することを目的として、FCFの化学構造を最適化するために焦点を絞った構造活性相関研究が実施された。また、FCFまたは誘導された阻害剤が、卵巣がんの進行だけでなく、進行した疾患や生存率の低下などの患者の転帰不良にも関連しているヒト精巣上体タンパク質4(HE4)分泌に寄与するかどうかも調査された(James,N.E.,Chichester,C.& Ribeiro,J.R.Beyond the Biomarker:Understanding the Diverse Roles of Human Epididymis Protein 4 in the Pathogenesis of Epithelial Ovarian Cancer.Front.Oncol.8,124,2018を参照されたい)。がん細胞増殖因子受容体の発現に対する開示された阻害剤の役割も調査された。
方法
細胞株、培養、および試薬。細胞は、加湿インキュベーター内で5%CO2を含む37℃で10%ウシ胎児血清(またはOVCAR-3の場合は20%)、ペニシリン(100単位/mL)、およびストレプトマイシン(100μg/mL)を補充したDMEM(SKOV-3、KLE、OVCAR-3、OVCAR8-C5およびIGROV-1)またはRPMI-1640(ECC-1およびHCH-1)のいずれかで維持された。抗体は、Abcam(セプチン-2、ab179436)およびCell Signaling Technology、ERK(9102)、p-ERK(4370)、β-アクチン(3700)、α-チューブリン(2144)、EGFR(4267)およびHER2(4290)から購入した。FCFはアブカムから購入した。他のすべての化学物質はSigma Aldrichからのものであった。
誘導体の合成。FCFの誘導体は、様々に置換されたアリールイソシアネートを異なって置換された4-アミノピリジンと、65℃で一晩乾燥DMF中で(0.1:0.1)モル比でカップリングすることによって合成された。溶離液としてDCM-MeOHまたは純粋な酢酸エチルを用いる薄層クロマトグラフィープレートを使用して反応をモニターした。スポットはUVチャンバーでモニターした。反応終了後、反応混合物を湿った氷(wet ice)混合物に注ぎ、粉砕し、次いで分離した固体を真空で濾過した。生成物をヘキサン、続いてジエチルエーテルで洗浄し、真空下で乾燥させた。化合物は、分光光度法によって特徴づけられた。
定量的リアルタイムPCR。示された細胞株は、Lipofectamine 3000(Invitrogen)を使用して、セプチン-2を標的とするsiRNAまたは非標的化対照siRNA(Santa Cruz Biotechnology:sc-37007またはsc-40936)でトランスフェクトされた。Tri試薬とDirect-zolキット(Zymo Research)を使用して、全RNAを溶解および単離した。逆転写は、iScript cDNA合成キット(BioRad)を使用して、どちらもメーカーの推奨に従って実行された。定量的リアルタイムPCRは、QuantStudio 12 K FlexリアルタイムPCRシステム(ABI)と、次のようなFAM標識プローブ:SEPT2(Hs01565417_m1)、WFDC2(Hs00899484_m1)、TBP(Hs00427620_m1)またはB2M(Hs00187842_m1)(正規化の参照として使用された)で構成されているTaqman遺伝子発現アッセイ(ABI)を使用して実施した。
細胞生存率、増殖およびアポトーシスアッセイ。細胞生存率、増殖、および細胞アポトーシスは、MTS(Promega)、BrdU細胞増殖(Cell Signaling Technology)、およびカスパーゼ-Glo 3/7アポトーシス検出(Promega)アッセイを使用して、適切な変更を加えたそれぞれのメーカーの推奨に従って測定した。
酵素免疫測定法(ELISA)およびイムノブロッティング。上記の培地で細胞を一晩維持した。培地を除去し、示された条件でビヒクル(DMSO)またはFCF/開示された阻害剤のいずれかを含む新鮮な完全培地と交換した。処理後、細胞溶解物と上清を収集し、HE4アッセイ(Human HE4 Quantikine ELISA Kit、R&D Systems)に供した。上清中のHE4の量は、一致する細胞溶解物のタンパク質濃度に対して正規化された。HER2のレベルは、Human Total ErbB2/Her2 DuoSet IC ELISA(R&D systemsによって決定された。ウェスターブロット分析は、以前に公開されたプロトコルを使用して実施された(Kim,K.K.et al.Tetrathiomolybdate inhibits mitochondrial complex IV and mediates degradation of hypoxia-inducible factor-1alpha in cancer cells.Sci.Rep.5,14296,2015を参照されたい)。
データ取得および統計分析。顕微解剖された正常な卵巣間質(N=8)を、高悪性度漿液性卵巣がん患者からの腫瘍間質サンプル(N=31)と比較するセプチンの遺伝子発現プロファイリングは、’R2:Genomics Analysis and Visualization Platform (http://r2/am/nl)によるMixed Ovarian Cancer(CAF)-Wong-77-u133p2データセットから得られた。SDの平均値をプロットし、スチューデントのt検定を使用して比較した(両側、対応のない不均一分散t検定、p<0.01の場合の有意差)。様々ながんの中でのセプチン-2または子宮内膜がんのセプチンの予後評価は、Human Protein Atlas(http://www.proteinatlas.org)を通じて取得したTCGAデータを使用して実施された(Uhlen,M.et al.Towards a knowledge-based Human Protein Atlas.Nat.Biotechnol.28,1248-1250,2010を参照されたい)。セプチンの高集団と低集団の間の生存曲線とそれらの統計的有意性は、GraphPad Prismソフトウェア(Mantel-Cox test)を使用して分析された。
結果
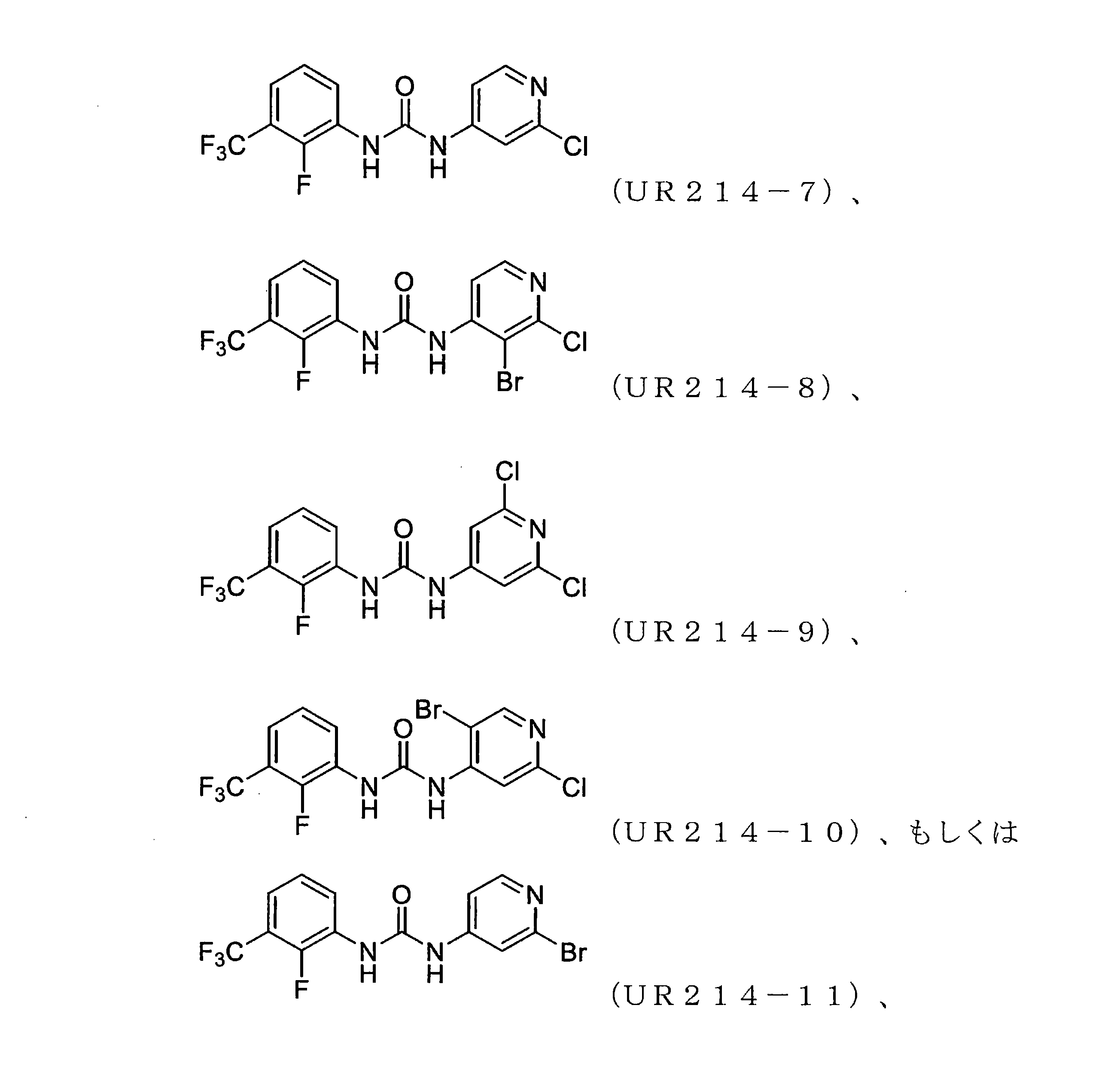
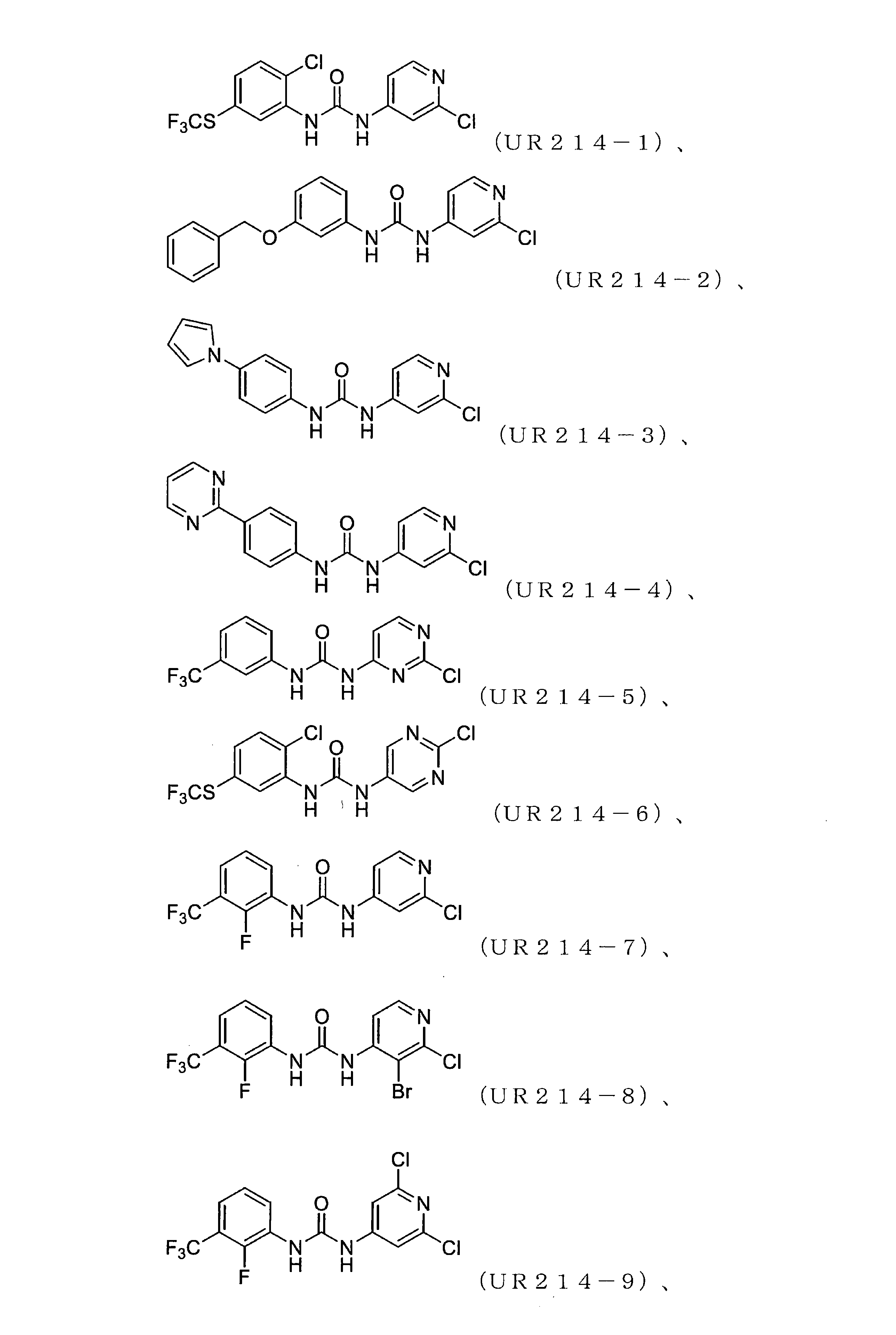
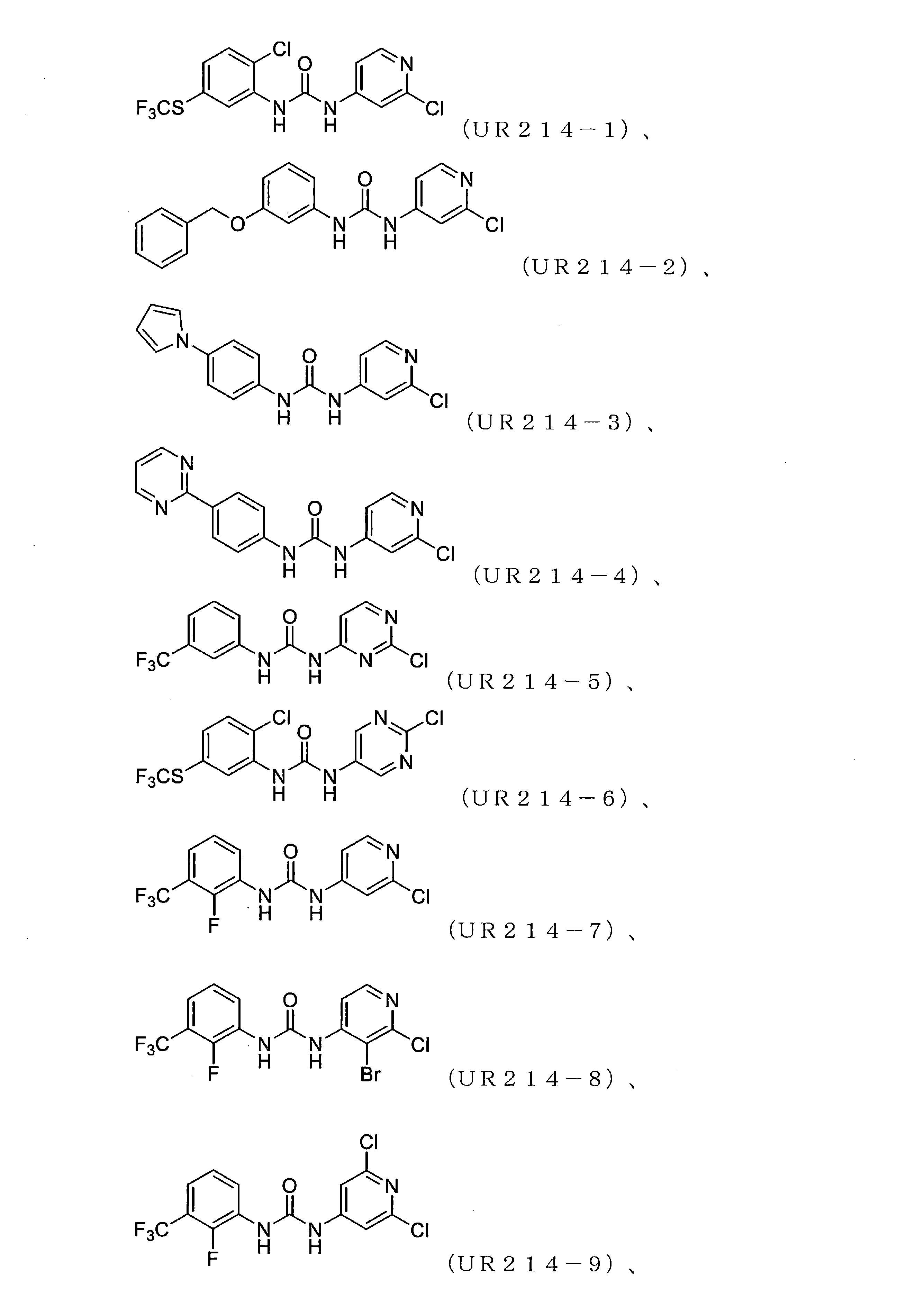
FCFの処理は、子宮内膜がんおよび卵巣がん細胞株の生存率を低減させた。細胞生存率に対するFCFの効果は、子宮内膜(ECC-1およびKLE)および卵巣(HCH-1、OVCAR-3、およびSKOV-3)のがん細胞株を使用する婦人科がん細胞株のパネルで最初に試験された。FCF処理は、これらの細胞の生存率を時間および用量依存的に低減させた(図1)。FCFは細胞株のパネルに対して顕著な細胞毒性活性を示したが、そのような阻害は比較的高濃度(100μM以上)でのみ達成された。
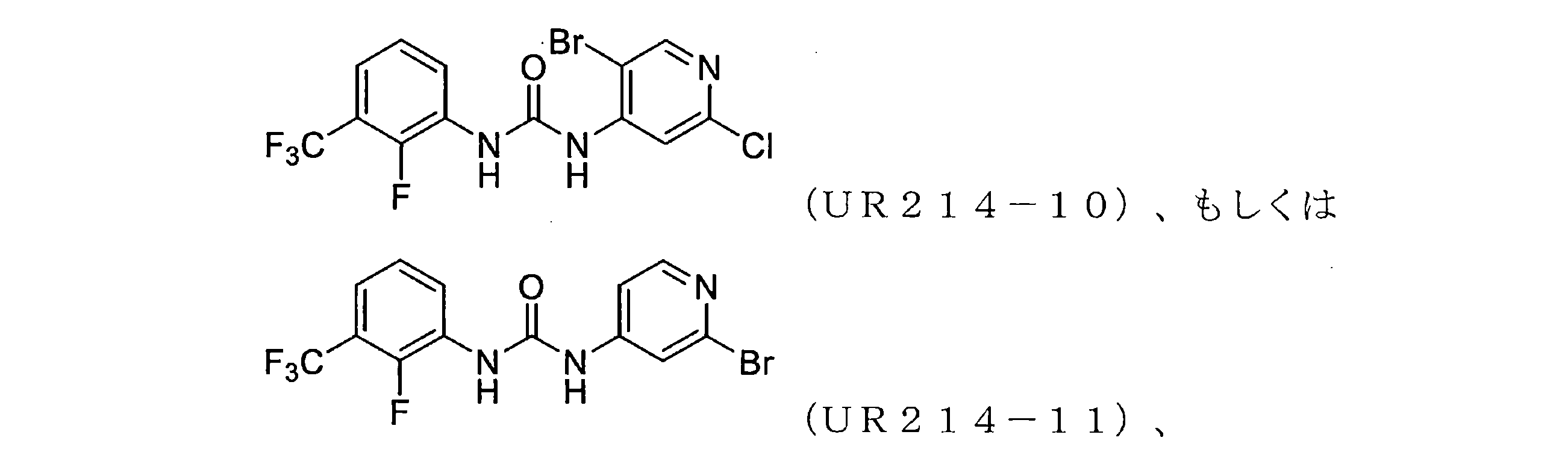
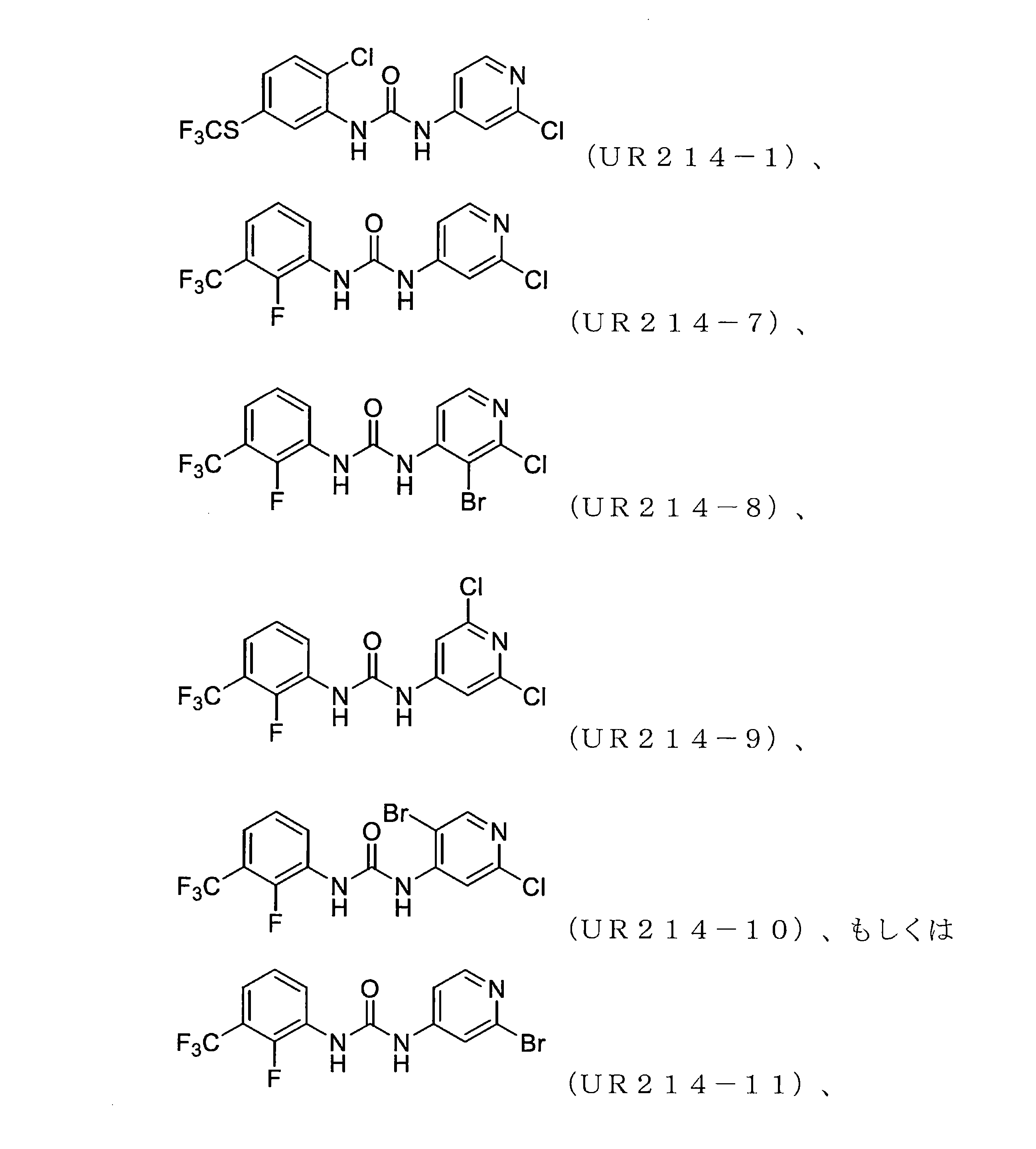
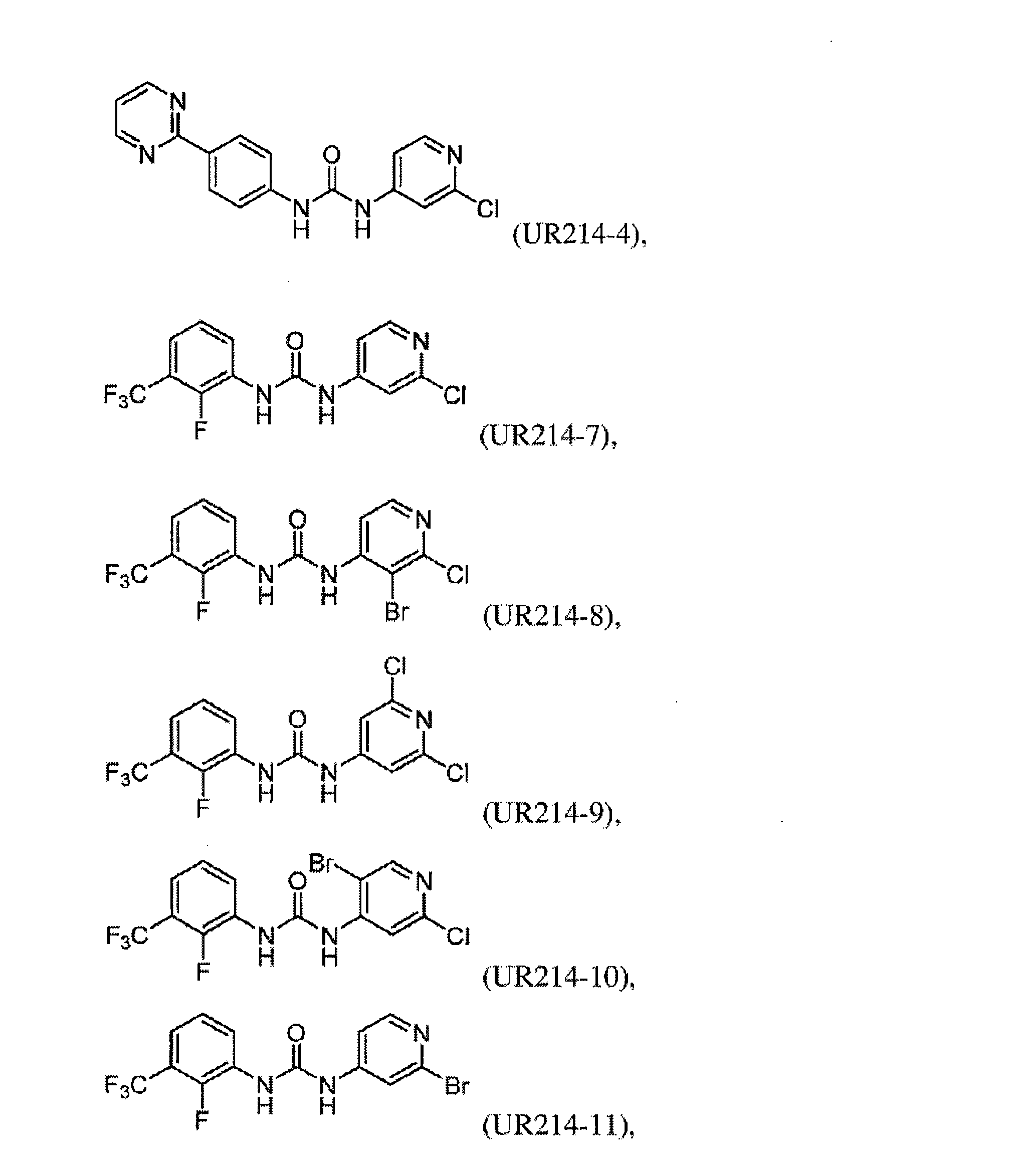
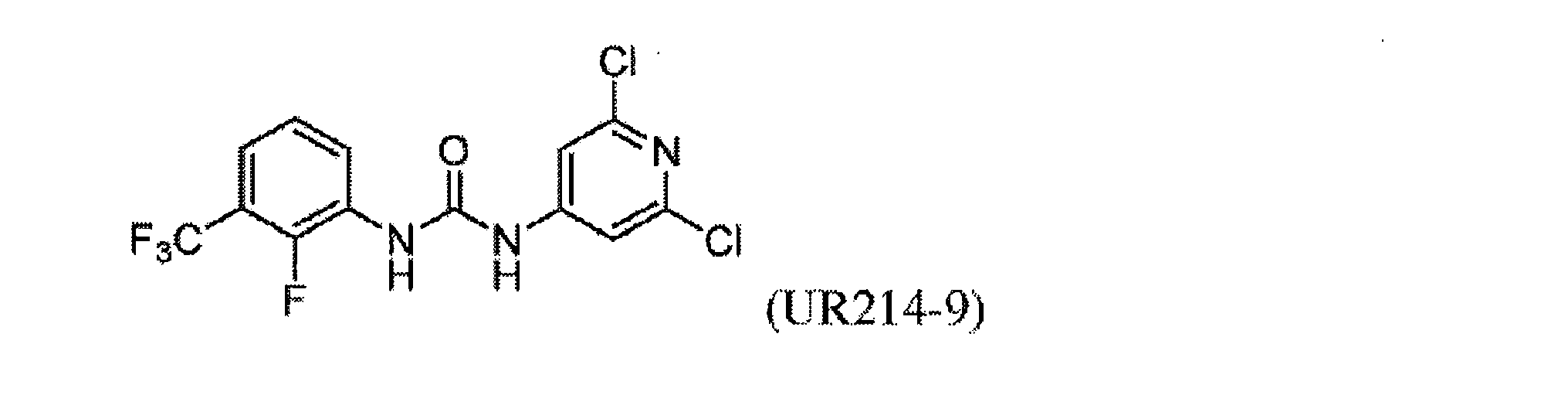
FCFの構造変更。非常に強力な誘導体を生成することを目的として、FCF足場の体系的な構造変更が行われた(表1)。フェニル部分の置換基は最初に変化させ、2-クロロピリジン(cholopyridine)を一定に保った(UR214-5およびUR214-6を除く)。分子の抗増殖活性に対する改変の効果を読み取るために、置換基を変化させた。図2Aに記載されているように、ベンジルオキシ(UR214-2)、ピリミジニル(UR214-4)およびピロリル(UR214-3)などの置換は許容されなかった。ただし、FCFのフェニル環のCF3S置換(UR214-1)は、非常に強力な細胞毒性活性を生成した。2-クロロピリジンの重要性は、CF3S-Ph部分(UR214-6)を残したまま、2-クロロピリジンを2-クロロピリミジンに置き換えることにより実証され、この変更により、活性が欠如した。UR214-1ががん細胞に対して最も強力な分子として出現し、次にUR214-7が続いた(図2A)。UR214-1はそれ以上変更されなかったが、有効性を高めるためにさらに最適化するためUR214-7が選択された。
合成された誘導体が細胞の生存率と増殖に及ぼす影響。UR214-7の構造をさらに精緻化して、分子UR214-8からUR214-11までの分子を開発した。これらの化合物(UR214-7~UR214-11)の腫瘍細胞の生存率に対する用量依存的な効果をMTSアッセイを用いて試験した(図2E)。化合物UR214-7~UR214-11による処理は、卵巣(SKOV-3、OVCAR-3、およびHCH-1)および子宮内膜(ECC-1およびKLE)のがん細胞に対して強力な抗生存率効果を発揮した。シリーズの中で最も活性の高い化合物(UR214-9)を製造するために、ピリジンの6番目の炭素に塩化物を設置した。UR214-9は、不明確な理由でUR214-7が優れた効力を有したHCH-1を除いて、ほとんどの細胞株にわたって強力な活性を示した(図2E)。ほとんどの場合、ピリジンのハロゲン化物置換基は十分に許容された。驚いたことに、2-クロロの2-ブロモへの置換は許容されたため、UR214-11は活性を失うことはなく、さらなる変更のための機会が開かれていた。次に、BrdUアッセイを使用して、低用量範囲でのECC-1細胞に対するUR214-7およびUR214-9の抗増殖活性を測定した。このアッセイでは、FCFを陽性対照として利用した。図2Bに示すように、48時間のUR214-9処理は、それぞれ約33μMおよび4μMの生存率と増殖とを抑制した。UR214-7は、11μM未満で腫瘍細胞の生存率を変化させなかったが、増殖を低減させた(図2B、右)。両方のアッセイで、FCFは活性が欠如していた。次に、ECC-1細胞のアポトーシスを誘導するUR214-7およびUR214-9の能力を分析した。図2Dに示すように、UR214-7およびUR214-9の両方での処理はアポトーシスを引き起こしたが、後者ははるかに効果的であった。UR214-7およびUR214-9処理の効果は、時間および用量に依存していた(図2C)。
誘導体はHER2発現を選択的に阻害する。FCFは、いくつかの種類のがんの侵襲性に関与している細胞膜に固定された増殖因子であるHER2を下方調節することが示されている。したがって、新しく生成された誘導体ががん細胞株におけるHER2発現に影響を与えるかどうかが調査された。UR214-7およびUR214-9による処理は、EGFR発現に影響を与えなかった。しかしながら、UR214-7およびUR214-9での処理は、有意に高い用量でのFCFがそうであったように、ECC-1およびHCH-1細胞の両方でHER2発現の阻害をもたらした(図3A)。以前の研究は、HER2に対するFCFの効果は、セプチンの破壊よって達成される可能性があり、セプチン-2のノックダウンがHER2発現を減少させることを示唆している。したがって、セプチン-2がノックダウンされ、HER2レベルに対するその影響が決定された。セプチン-2のノックダウンはHER2の下方調節をもたらした(図3B)。セプチン-2の阻害はまた、がん細胞株の生存率を減少させた(図3C)。
誘導体はHE4分泌を減少させる。HE4は、卵巣がんおよび子宮内膜がんの患者で高度に上方調節され(Moore,R.G.et al.The use of multiple novel tumor biomarkers for the detection of ovarian carcinoma in patients with a pelvic mass.Gynecol.Oncol.108,402-408,2008、およびMoore,R.G.et al.Serum HE4 levels are less frequently elevated than CA125 in women with benign gynecologic disorders.Am.J.Obstet.Gynecol.206,351 e351-358,2012を参照されたい)、がんの悪性表現型に関連する小さな分泌糖タンパク質である。したがって、FCFまたはその強力な類似体がHE4の分泌に影響を与える可能性があるかどうかを決定した。図4Aに示すように、FCF処理(300μMで7時間)は、HE4の細胞内レベルのわずかな増加とともに、HE4を安定して過剰発現するOVCAR8-C5によるHE4分泌の減少をもたらした。この効果は、ECC-1細胞とHCH-1細胞の両方で用量依存的であることが見出された(図4B)。FCFと比較して、HE4分泌の同様の阻害は、はるかに低い濃度でUR214-1およびUR214-7によって達成された(<10~27倍、図4C)。FCF処理は、HE4 mRNAをある程度抑制することが見出された(図4D)。低分子干渉RNAによるセプチン-2の破壊もまた、HE4発現の低減をもたらした(図4E)。
セプチンの過剰発現は、がんによる死亡率の増加と関連する。本研究では、セプチン2ノックダウンにより、HER2およびHE4の発現が低下し、がん細胞株の生存率が減少した。さらに、セプチンは悪性のがんの表現型に関連している(Dolat,L.et al.Septins promote stress fiber-mediated maturation of focal adhesions and renal epithelial motility.J.Cell Biol.207,225-235,2014、Mizutani,Y.et al.Possible role of a septin,SEPT1,in spreading in squamous cell carcinoma DJM-1 cells.Biol.Chem.394,281-290,2013、Jiang,H.et al.MicroRNA-127-3p promotes glioblastoma cell migration and invasion by targeting the tumor-suppressor gene SEPT7.Oncol.Rep.31,2261-2269,2014、Froidevaux-Klipfel,L.et al.Septin cooperation with tubulin polyglutamylation contributes to cancer cell adaptation to taxanes.Oncotarget 6,36063-36080,2015、およびGonzalez,M.E.,Makarova,O.,Peterson,E.A.,Privette,L.M.& Petty,E.M.Up-regulation of SEPT9_v1 stabilizes c-Jun-N-terminal kinase and contributes to its pro-proliferative activity in mammary epithelial cells.Cell Signal.21,477-487,2009を参照されたい)。したがって、セプチンの発現が子宮内膜がんおよび卵巣がんの患者の転帰と関連しているかどうかが調査された。カプラン・マイヤー生存分析は、セプチン-2、-3、および-7の発現によって層別化された子宮内膜がんに対して実施された。これらのセプチンは、FCFの結合研究に使用されたため、特に興味深いものである(Angelis,D.,Karasmanis,E.P.,Bai,X.& Spiliotis,E.T.In silico docking of forchlorfenuron(FCF)to septins suggests that FCF interferes with GTP binding.Plos One 9,e96390,2014を参照されたい)。Cancer Genome Atlas(TCGA)(図5A)の分析は、セプチン-2とセプチン-3の両方の過剰発現が子宮内膜がんの死亡率の増加と相関していることを示している。子宮内膜がんでは、セプチン-2の相対的発現が最も高く、次にセプチン-7が続いた。セプチン-3の発現は非常に低いことがわかった(図5B)。セプチン-2の発現と死亡率の増加との相関関係は、腎臓、肺、肝臓、膵臓のがんでも見られたが、卵巣がんでは見られなかった。がん関連線維芽細胞(CAF)は、がん細胞を取り囲み、支持する間質に見られる。セプチンネットワークは、腫瘍形成促進性の微小環境を作り出す際にCAFをサポートすることが知られている(Calvo,F.et al.Cdc42EP3/BORG2 and Septin Network Enables Mechano-transduction and the Emergence of Cancer-Associated Fibroblasts.Cell Rep.13,2699-2714,2015を参照されたい)。したがって、卵巣がん関連間質と正常な卵巣間質におけるセプチン発現をプロファイリングしたデータも分析された(Wong-77-MAS5.0-u133p2)。がん関連間質では、セプチン-2およびセプチン-9の発現は有意に上方調節されたが、セプチン-6およびセプチン-7は変化しなかった(図5C)。
考察
この実施例では、FCFによる処理により、卵巣がんおよび子宮内膜がんの細胞株の細胞生存率が100~300μMの範囲で低減することが判明したが、これは薬理学的に望ましない。FCFの構造を最適化するための取り組みを通じて、非常に強力な類似体であるUR214-1、UR214-7、およびUR214-9が生成された。これらの類似体による処理は、FCFよりもかなり低い用量で複数の子宮内膜および卵巣がん細胞の増殖を阻止した。UR214-9は、4~5μMの範囲でがん細胞の増殖を阻害することがわかった。さらなる構造最適化は、さらなる動物および潜在的にヒトの試験に適切であるナノモルディスラプターにつながる可能性がある。
セプチンは、がんの悪性表現型に関連する細胞骨格タンパク質の部類のものである。さらに、セプチンは、EGFR、HER2、HIF-1α/血管新生軸などのがん遺伝子発現にますます関連している(Diesenberg,K.,Beerbaum,M.,Fink,U.,Schmieder,P.& Krauss,M.SEPT9 negatively regulates ubiquitin-dependent downregulation of EGFR.J.Cell Sci.128,397-407,2015、Angelis,D.& Spiliotis,E.T.Septin Mutations in Human Cancers.Front.Cell Dev.Biol.4,122,2016、およびAmir,S.,Wang,R.,Simons,J.W.& Mabjeesh,N.J.SEPT9_v1 up-regulates hypoxia-inducible factor 1 by preventing its RACK1-mediated degradation.J.Biol.Chem.284,11142-11151,2009を参照されたい)。したがって、高セプチン-2レベルが子宮内膜がんを含むいくつかのがんの種類で患者の生存率の低下に関連していることは驚くべきことではない。さらに、卵巣腫瘍間質はセプチン-2および-9が高度に富んでいることがわかっており、卵巣がんにおけるこれら2つの構造タンパク質の役割についてさらに調査が求められている。
HE4は、WFDC2によってコードされる分泌糖タンパク質である。卵巣がんおよび子宮内膜がんでは上方調節されることが見出されており(Moore,R.G.et al.Utility of a novel serum tumor biomarker HE4 in patients with endometrioid adenocarcinoma of the uterus.Gynecol.Oncol.110,196-201,2008を参照されたい)、がん細胞の増殖、移動、浸潤、転移、および化学療法抵抗性を増加させることが示されている。本結果では、UR214-1およびUR214-7による処理がHE4分泌の低減をもたらすことを示す。したがって、これらのFCF類似体は、婦人科がんにおいて特に治療上の利益をもたらす可能性がある。
FCFは現在までに知られている唯一の小分子セプチン阻害剤である。セプチンは陸上植物には見られないため(Yamazaki,T.et al.Localization and evolution of septins in algae.Plant.J.74,605-614,2013を参照されたい)、植物の成長に大きな影響を与えるFCFが(Kopecny,D.et al.Phenyl-and benzylurea cytokinins as competitive inhibitors of cytokinin oxidase/dehydrogenase:a structural study.Biochim.92,1052-1062,2010を参照されたい)、セプチンを含まない細胞プロセスに関与していることは理にかなっているように思われる。実際、FCFの非セプチン効果が説明されている(Heasley,L.R.,Garcia,G.III & McMurray,M.A.Off-target effects of the septin drug forchlorfenuron on nonplant eukaryotes.Eukaryot.Cell 13,1411-1420,2014を参照されたい)。それにもかかわらず、FCFはセプチンのダイナミクスを阻害し、セプチンベースの構造の組み立てを妨害することも示されている(Hu,Q.,Nelson,W.J.& Spiliotis,E.T.Forchlorfenuron alters mammalian septin assembly,organization,and dynamics.J.Biol.Chem.283,29563-29571,2008を参照されたい)。インシリコ研究は、FCFがセプチンのヌクレオチド結合ポケットと相互作用する可能性があることを示唆している。本実施例では、FCF類似体での処理により、HER2とHE4の両方が下方調節され、セプチン-2ノックダウンの効果を模倣しているように見られた。
実施例3。セプチン破壊は腫瘍成長を制御し、トラスツズマブ(ハーセプチン(商標))の有効性を高める
セプチンは、細胞質分裂、細胞移動、染色体動態、およびタンパク質分泌に関与するGTP結合細胞骨格タンパク質のファミリーである。セプチンはヘテロオリゴマー化して、細胞内に足場フィラメント、バンドル、およびリングを生成する。さらに、セプチンはチューブリンおよびアクチンの機能を調節する重要な細胞骨格成分である。膵臓、腎臓、肺、結腸直腸、皮膚、脳、子宮内膜、卵巣、乳房および他の悪性腫瘍におけるセプチンタンパク質発現の変化が観察されている。異常なセプチンの発現は、神経変性/神経筋疾患、血液障害、不妊症、および発達障害にも関連している。個々のセプチンファミリーメンバーの異常な富化が腫瘍形成を増強するのに十分であるかどうか、または特定のヘテロオリゴマーアセンブリが関係している可能性があるかどうかは不明である。セプチンを標的とする薬剤は、主にセプチンのオリゴマー構造構成が治療法の設計において困難な課題をもたらすため、依然としてわかりにくいままである。
本実施例では、膵臓がん、乳がん、肺がん、腎臓がん、肝臓がん、または黒色腫の患者の生存に対する個々のセプチンの影響を調査した。セプチンが生存に及ぼす影響を調べるために、Human Protein Atlas(HPA)、およびR2:Genomics Analysis and Visualization Platform(https://hgserver1.amc.nl/cgi-bin/r2/main.cgi)で公開されている転写データおよびツールを使用した。強力なセプチンモジュレーターであるUR214-9が記載されており、セプチン-2とセプチン-9、およびβ-アクチンの構造組織を破壊し、がん細胞の増殖と腫瘍の成長を制御する。分子ドッキング技術を使用して、UR214-9およびその類似体がGDP結合ドメインおよび既知のFCF結合ポケットの要素とどのように相互作用するかを調査した。遺伝子発現がUR214-9によってどのように影響を受けるかを特定し、それによってそのオフターゲットの傾向を特徴づけるために、UR214-9で処理された乳がんおよび膵臓がん細胞のトランスクリプトーム解析を実施した。要約すると、この実施例は、強力なセプチンフィラメントモジュレーターとしてUR214-9を提示し、UR214-9による膵臓、卵巣、および乳がん細胞のセプチン構造の解体が効果的な治療戦略になり得ることを示している。
方法
細胞株、細胞培養、および試薬。PANC-1、BXPC-3およびCAPAN-1、SKOV-3、MCF7、MDA-MD-231細胞は、ATCCから入手し、10%ウシ胎児血清ペニシリン(100単位/mL)およびストレプトマイシン(100μg/mL)を補充した、DMEM、RPMI-1640、およびIMDMで、37℃の5%CO2を含む加湿インキュベーター内で維持した。JIMT-1細胞は、米国のAddexBio Incから購入し(カタログ番号:C0006005)、10%FBSおよび抗生物質を添加したDMEMで維持した。セプチン-2(カタログ番号:HPA018481)、セプチン-7(カタログ番号:HPA029524)、セプチン-9(カタログ番号:HPA029524)抗体はSigma Aldrich Inc.から購入した。DyLight 488(カタログ番号:DI-1488,ウサギ、Dylight594(カタログ番号:DI-2594,マウス)は、Vector Laboratories Inc.から購入した。ファイロジン-TRITCはECM Biosciencesから購入した(カタログ番号:PF7551)。HER2(Cell Signaling Technology、カタログ番号:4290)、pSTAT-3(カタログ番号:9145p)、STAT-3(カタログ番号:4904)およびGAPDH抗体(カタログ番号:2118s)はCell Signaling Technology Inc.USAから購入し、メーカー推奨の希釈で使用した。
誘導体の合成。UR214-9は、アルゴンフラッシュ雰囲気下、65℃で一晩、乾燥DMF中、(0.1:0.1)モル比でアリールイソシアネートと2,6-ジクロロ4-アミノピリジンをカップリングすることにより合成した。溶離液としてDCM-MeOHまたは純粋な酢酸エチルを用いる薄層クロマトグラフィープレートを使用して反応をモニターした。スポットはUVチャンバーでモニターした。反応終了後、反応混合物を湿った氷混合物に注ぎ、粉砕し、分離した固体を真空下で濾過した。生成物をヘキサン、続いてジエチルエーテルで洗浄し、真空下で乾燥させた。化合物は、質量分析によって特徴づけられた。
分子ドッキング。9と関連化合物の潜在的な結合モードを調査するためのドッキング実験は、MolsoftのICMソフトウェアパッケージ(v.3.8-7)を使用して実行した。分子はかなり小さく、やや対称的である(2つの親油性置換芳香環が両側にある中央の尿素基で構成されている)。化合物8、9、および10が最も活性の高いものであるため、同様の結合モードを共有している可能性があると想定した。したがって、化合物FCF、UR214-8、-9、および-10は、これまでに利用可能なセプチン-2二量体複合体の最高品質の構造であるPDB ID 2QNRのヌクレオチド結合部位にドッキングされた(Angelis,D.,et al.,In silico docking of forchlorfenuron(FCF)to septins suggests that FCF interferes with GTP binding.PLoS One.9,e96390,2014を参照されたい)。受容体の調製(鎖AのGDP結合部位に基づく)およびリガンドの構築は、標準設定を使用してICM内で実行された。各化合物およびそのポーズのICMスコアが計算され、FCFと比較された。化合物は、2.0のエフォートおよび化合物あたり20ポーズの設定で、「ドックテーブル」機能とドッキングされた。ドッキングポーズを目視で確認すると、2セットの低エネルギーポーズ(「セットA」および「セットB」)が際立っており、高活性化合物が同様のコンフォメーションをとることができる。
細胞生存率と細胞周期分析。UR214-9で処理されたPANC-1、BXPC-3、およびCAPAN-1膵臓がん細胞の細胞生存率は、先に公開された手順に従ってCell Titre96R Aqueous One Solution Cell Proliferation Assay(Promega Corp.、カタログ番号:G3580)を使用して測定された。Live/Dead色素キット(Invitrogen Coro.,カタログ番号:L34975)をUR214-9またはビヒクルで処理されたPANC-1およびBXPC-3膵臓がん細胞の生細胞および死細胞の数を推定するために使用した。簡単に説明すると、細胞をビヒクルまたはUR214-9(3μM)で72時間処理した。細胞をトリプシン処理によって回収し、固定-透過処理試薬(濃縮液を希釈液で1:3の比率で希釈して調製)(Biogem Inc.、希釈液:カタログ番号92160-00-160および濃縮液カタログ番号:2550-00-50)を使用して固定および透過処理し、Live/Dead色素で1時間染色した。細胞を1000rpmで5分間遠心分離し、ペレットを洗浄し、DPBSで3回スピンダウンした。細胞を305フローサイトメーターで分析し、ビヒクル群と対照群の両方に同数の細胞を入力することにより、相対的な生細胞と死細胞の集団を計算した。
細胞周期分析のために、BXPC-3およびPANC-1およびJIMT-1細胞(100,000/ウェル)を6ウェルディッシュに一晩播種し、一晩付着させた。培地をDMSOまたはUR214-9(100nMおよび3μM)を添加した新鮮な完全培地と交換し、細胞を72時間インキュベートした。薬物を含む培地を除去し、細胞をPBSで2回洗浄し、穏やかにトリプシン処理した。細胞を15mLチューブに収集し、完全なDMEM培地を加えてトリプシンをブロックし、細胞を遠心分離した。上清を除去し、細胞を70%冷EtOHで30分間穏やかに処理した。固定された細胞を遠心分離し、得られたペレットをフローサイトメトリーチューブに収集し、事前に処方されたPI/RNase溶液(Cell Signaling Technology、カタログ番号:4087s)で30分間染色した。PI含有量はフローサイトメーターを使用して分析した。Flowjoソフトウェアを使用してデータを処理した。
細胞周期タンパク質の発現。定性的/半定量的タンパク質発現プロファイリング用に設計された、ハイスループットELISAベースの抗体アレイである、Cell Cycle Antibody Array(FullMoon BioSystems Inc、カタログ番号:ACC:058)を使用して、薬物処理後のタンパク質の変化を調査した。PANC-1細胞は、プロテアーゼおよびホスファターゼ阻害剤(Cell Signaling、カタログ番号:9803S)を含む緩衝液で溶解した。総タンパク質含有量はブラッドフォードアッセイによって定量化され、製造元の指示に従って、60個のプローブのそれぞれに4~6個のスポットを含むアレイを使用して等量のタンパク質を2回分析した(ACC058、Cell Cycle Antibody Array、Full Moon Biosystems、Sunnyvale,CA)。バックグラウンド補正後、FullMoon Incのイメージングサービスを使用して平均シグナル強度を測定した。ナイーブおよび
328の処理グループの両方でのタンパク質発現は、GAPDHシグナルに対して正規化された。
セプチンの乱れ(Disarrangement)の共焦点解析。細胞内のセプチン-2構造に対するUR214-9処理の影響を決定するために、PANC-1またはJIMT-1細胞をスライドガラスに播種し、一晩付着させた。培地をDMSOまたはUR214-9(1μMおよび70nM)を添加した完全DMEM培地と交換し、細胞を48時間インキュベートした。培地を再び新しい完全培地と交換し、中性緩衝ホルマリンで40Cで15分間固定した。培地を除去し、細胞をPBST(5x5mL)で繰り返し洗浄した。細胞をPSB中のセプチン-2抗体(Sigma Aldrich、カタログ番号:HPA018481)で40℃で一晩染色した。培地を再度除去し、細胞を2x5mL PBSTで洗浄した。細胞を暗所で1時間蛍光結合二次抗体で染色した。スライドを暗所で7x5mL PBSTで繰り返し洗浄し、DAPI(Vector labs)を含む封入剤を塗布し、スライドガラスで覆った。スライドは分析まで40℃で暗所に保存された。共焦点画像は、基本的に以前に公開されたように取得および処理された(Moore,R.G.,Hill,E.K.,Horan,T.,Yano,N.,Kim,K.,MacLaughlan,S.,Lambert-Messerlian,G.,Tseng,Y.D.,Padbury,J.F.,Miller,M.C.,Lange,T.S.,Singh,R.K.Sci Rep.4,3574,2014を参照されたい)。膵臓腫瘍マイクロアレイ(US Biomax、カタログ番号T142a)を脱パラフィンし、処理し、セプチン-2抗体(Sigma Aldrich、カタログ番号:HPA018481)で一晩染色し、PBSTで洗浄し、ソースに一致する二次(FITC)で1時間インキュベートした。スライドをPBST(5x10mL)でそれぞれ5分間洗浄した。封入剤を含むDAPIを塗布し、スライドガラスで覆った。共焦点画像は、ダイオードレーザー402、488、および561を使用してNikon C1si共焦点顕微鏡(Nikon Inc.Mellville,NY.)で取得した。連続したオプティカルセクションはEZ-C1コンピュータソフトウェア(Nikon Inc.Mellville,NY)により得られた。Zシリーズセクションは、40x PlanApoレンズとスキャンズーム2で0.3μmで、または60x Plan Apo対物レンズおよびスキャンズーム2で、0.25μmごとに収集した。デコンボリューション測定は、Elements(Nikon Inc.Mellville,NY)コンピュータソフトウェアを使用して行った。フィールドあたり5つの細胞のアウトライン化および分析が行われた。
UR214-9の抗腫瘍反応を評価するための異種移植研究。NSGマウス356の左脇腹に、それぞれマトリゲル:培地(1:1)中の100万個のPANC-1(HER2+、n=12)、JIMT1(動物数=10)およびSKOV-3(動物数=10)細胞を移植した。マウスを無作為化し、耳パンチで識別し、腫瘍が触知可能であることが判明した時点で、ビヒクル群と処理群に細分した。JIMT1とSKOV-3の両方は1週間以内に侵襲性腫瘍を形成し、ビヒクルまたはUR214-9(25mg/kg、IP、週7日)で処理した。PANC-1は成長の遅い腫瘍を形成し、腫瘍の長さが5mmを超えた時点で、処理が開始された。SKOV-3細胞の群はまた、トラスツズマブまたはトラスツズマブ+UR214-9で処理された。ビヒクルの処方は:滅菌水中の40%ヒドロキシプロピル-ベータ-シクロデキストリン[Acros Organics]およびソルトールHS15(Sigma])であった。25mg/kg当量のUR214-9(DMSO中1uL=200ug)を600uLのPBS+400uLのビヒクルに溶解し、ボルテックスして透明な懸濁液を得た。腫瘍量と動物の体重は、毎週または隔週のルーチンでデジタルノギスによって手動で測定された。腫瘍体積は、式1/2(LxW^2)を使用して計算された(式中、Lは最も長い直径であり、Wは最も広い幅である。)。ビヒクル群と処理群の間の統計的差異は、一元配置分散分析を使用してGraphPrism-8ソフトウェアによって分析された。P<0.05が有意であるとみなされた。処理期間後のマウスを安楽死させ、腫瘍を切除し、秤量し、液体窒素で凍結させた。対照群と処理群の腫瘍の一部は、中性緩衝ホルムアルデヒドとパラフィン包埋で固定された。組織化学用に5μMの厚さの組織スライドを調製した。
mRNAシーケンシング。総RNA濃度は、NanopDrop 1000分光光度計(NanoDrop、Wilmington,DE)で測定し、RNA品質はAgilent Bioanalyzer(Agilent、Santa Clara,CA)で評価した(Bolger,A.M.,Lohse,M.,Usadel,B.Trimmomatic:a flexible trimmer for Illumina sequence data.Bioinformatics.30,2114-2120,2014を参照されたい)。TruSeq Stranded mRNA Sample Preparation Kit(Illumina、San Diego,CA)をメーカーのプロトコルに従って次世代シーケンシングライブラリーの構築に使用した。簡単に説明すると、mRNAをオリゴdT磁気ビーズを用いて200ngの全RNAから精製し、フラグメント化した。ランダムヘキサマープライミングで第1鎖cDNA合成を行い、続いて鎖マーキングのためにdUTP組み込みを使用して第2鎖cDNA合成を行った。次に、二本鎖cDNAに対して末端修復および3’アデニル化を行った。イルミナアダプターをcDNAの両端にライゲーションし、ゲル電気泳動で精製し、アダプター配列に特異的なPCRプライマーで増幅して、サイズが約200~500bpのcDNAアンプリコンを生成した。増幅されたライブラリーは、Illuminaシングルエンドフローセルにハイブリダイズし、cBot(Illumina,San Diego,CA)を使用して増幅された。IlluminaのNextSeq550を使用して、サンプルごとに75ntのシングルエンドリードが生成された(Dobin,A.,Davis,C.A.,Schlesinger,F.,Drenkow,J.,Zaleski,C.,Jha,S.,Batut,P.,Chaisson,M.,Gingeras,T.R.STAR:ultrafast universal RNA-seq aligner.Bioinformatics.29,15-21,2012を参照されたい)。
全トランスクリプトームデータ解析。NovaSeq6000シーケンサーから生成された生の読み取りは、bcl2fastqバージョン2.19.0を使用して逆多重化された。品質フィルタリングおよびアダプターの削除は、Trimmomatic-0.36と次のパラメータを使用して実行される:「TRAILING:13 LEADING:13 ILLUMINACLIP:adapters.fasta:2:30:10 SLIDINGWINDOW:4:20 MINLEN:35」次に、処理/クリーニングされた読み取りは、STAR-2.6.0cを使用して次のパラメータを指定して、Homo sapiensリファレンスシーケンス(GRCh38、hg38)にマッピングされた:「--twopassMode Basic--runMode alignReads--genomeDir ${GENOME}--readFilesIn ${SAMPLE}--outSAMtype BAM SortedByCoordinate--outSAMstrandField intronMotif-outFilterIntronMotifs RemoveNoncanonical」。subread-1.6.1パッケージ(featureCounts)を使用して、次のパラメータを指定して遺伝子カウントを導出した:「-s 2-t exon -g gene_name」。差次的発現解析およびデータ正規化は、R-3.4.1環境内で0.05の調整されたp値しきい値でDESeq2-1.16.1を使用して実行した。ヒートマップは、pheatmap Rパッケージを使用して作成された(R Core Team.R:A language and environment for statistical computing.R Foundation for Statistical Computing,Vienna,Austria.(2016).URL https://www.R-project.org/、Love,M.I.,Huber,W.,Anders,S.“Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2.”Genome Biology 15,550(2014)、および39.Liao,Y.,Smyth,GK.,Shi,W.featureCounts:an efficient general-purpose program for assigning sequence reads to genomic features.Bioinformatics 30,923-930,2014を参照されたい)
データ取得および統計分析。様々ながんのパネルにおけるセプチン-2、-7、および-9の予後評価は、Human Protein Atlasツールを使用して実施された。あるいは、R2 Genome.orgツールを使用して、セプチン富化が生存の見通しに与える影響を判断した。0.05未満のp値は有意であるとみなされた。ナイーブ群と処理群の相対的な腫瘍サイズは、一元配置分散分析(annova)設定を使用してGraphPrism8を使用して計算された。0.05未満のp値は有意であるとみなされた。
結果
セプチンの富化は、がん患者の生存率の低下と相関する。R2:Genomics Analysis and Visualization Platform(https://hgserver1.amc.nl/cgi-bin/r2/main.cgi)に寄託された膵臓がんおよび卵巣がん患者の公的にアクセス可能なマイクロアレイデータベースを解析した。セプチン-2mRNAは正常な膵臓と比較して悪性膵臓に富化していた(図6A、p=1.3e-4)。同様に、卵巣がん上皮は、正常な間質と比較して、セプチン-2を有意に富化して発現した(図6B、左、p=1.2e-7)。悪性卵巣間質の顕微解剖された間質はまた、正常な間質よりもセプチン-2 mRNAの発現の上昇を示した(図6B、右、p=1.21e-4)。同様に、正常な間質と比較して、悪性乳房の腫瘍上皮成分は、セプチン-2 mRNA富化の増加を示した(図6C、左、p=0.49e-3)。さらに、乳房腫瘍の浸潤領域の増加は、セプチン-2富化の増加につながった(図6C、右、p=8.9e-3)。セプチン-2発現の程度によってグループ分けされた膵臓がん患者のカプラン・マイヤー生存率(https://hgserver1.amc.nl/cgi-bin/r2/main.cgi20 and Human Protein Atlas21で入手可能なマイクロアレイデータより)は、セプチン-2 mRNA富化が死亡率の増加と有意に(p=0.0011)相関することを示す(図6D、左)。同様に、セプチン-7および-9の富化は、膵臓がん患者の死亡率の増加と相関している。セプチン-2の富化はまた、乳がん(図6D、中央、p=3.9e-3)および卵巣がん(図6D、右、p=0.011)の患者にとっても不利な要因である。他のセプチンに基づく生存の見通しの解析は、セプチン-7の富化が乳房の悪性腫瘍と診断された患者にとって不利であることが判明したことを示している(p=0.0079)。
UR214-9は細胞内でセプチン-2の壊滅を引き起こす。UR214-9の化学構造を図7Aに示す。UR214-9は、FCFの構造活性相関に基づく最適化によって取得された。フェニル環にフッ素原子の基を組み込み、ピリジン環のC-6に塩素原子を設置することで、UR214-9はセプチンのフィラメント構造の強力なディスラプターになった。高解像度(60x2)の共焦点顕微鏡を使用して、BXPC-3、CAPAN-1、Panc-1(膵臓)およびJIMT-1(乳房)およびSKOV-3卵巣がん細胞のパネルにおけるセプチン-2、6、7、および-9の構造配置に対するDMSO、FCF(陽性対照)およびUR214-9の影響を測定した。FCFはBXPC-3細胞のセプチン-2フィラメントを強化しているように見えるが(図7B、左下)、PANC-1のセプチン-2針状物(needle)は、UR214-9処理(1uM)後に細胞表面で乱れ、転位置した(図7C、左下)。同様に、薬物処理後のJIMT-1細胞のセプチン-2針状物は、構造的破壊と核周辺への再配置を示した(図7C、右下)。次に、共焦点顕微鏡を使用して、UR214-9で処理したときのPANC-1細胞における他のセプチンファミリーメンバーの応答を調査した。セプチン-7は発現の低減を示したが、セプチン-9はフィラメント構造の乱れを示した。セプチン-4、-6は明確なフィラメント構造を示さず、代わりに点状の染色を示し、これは、DMSOで処理した対照と比較して処理群で低減したか、薬物効果は決定的ではなかった(データは示さず)。同様に、UR214-9で処理されたJIMT-1乳がん細胞は、核の周辺にセプチン-2の強い構造的混乱と再配置を示した。JIMT-1細胞は明確なセプチン-7構造を示さなかったため、セプチン-7に対するUR214-9の効果はあいまいなままであった。しかし、UR214-9で処理したPANC-1およびJIMT-1細胞の共焦点顕微鏡では、セプチン-9のフィラメント構造に明らかな乱れを示した。UR214-9処理がセプチンファミリーのタンパク質の発現を変化させるかどうかを、PANC-1、MDA-MB-231、JIMT-1、およびMCF-7がん細胞の全細胞溶解物をイムノブロッティングすることによって調べた。免疫ブロットは、検証済みのセプチン-2、6、7、および-9抗体でプローブした。PANC-1細胞では、セプチン-9の発現は興味深いことに完全に阻害されたが、セプチン-2、-6、および-7の発現は影響を受けなかった(図7D)。同様に、MDA-MB-231、JIMT-1、およびMCF-7細胞のウエスタンブロット分析は、それらのフィラメント構造が圧倒的に破壊されているにもかかわらず、UR214-9がセプチン-2,6および-9ファミリーのタンパク質のタンパク質発現レベルを変化させないことを示した(図7E)。がん細胞におけるセプチン壊滅現象は、UR214-9での処理時(1μM、48時間)に、セプチン-2が薬物曝露後に細胞表面に再配置されたように見えるセプチン-2フィラメントの完全な破壊を示したSKOV-3卵巣がん細胞を使用してさらに検証された(図7F)。薬物処理されたSKOV-3細胞における125のセプチン-6、7および-9構造のさらなる検査は、セプチン-9の再編成を示した(図7G、下)。セプチン-6は非針状であり、UR214-9で処理すると減少することがわかった(図7G、上)。セプチン-7発現の変化は、UR214-9の非針状および拡散/点状の発現のために明確ではなかった(図7G、中央)。
UR214-9は、膵臓がんおよび乳がん細胞でアクチンフィラメントの破壊を引き起こす。セプチンは、アクチンの機能を制御することが以前に示されている(Schmidt,K.,Nichols,BJ.Functional interdependence between septin and actin cytoskeleton.BMC Cell Biol.12,43,2004を参照されたい)。UR214-9で処理されたPANC-1およびJIMT1細胞の共焦点顕微鏡は、1μMの用量で48時間処理された場合、アクチンフィラメントの破壊を示した(図8)。PANC-1細胞とJIMT1細胞の両方のアクチンフィラメント針の代表的な構造的混乱(図8)。関心領域は、白いボックスに示される中に示される。
インシリコドッキングでは、UR214-9とセプチン-2の主要な相互作用が示される。UR214-9および関連化合物(FCFを含む)の潜在的な結合モードを調査するためのドッキング実験を実施した。UR214-9とその類似体はサイズが小さく、構造と対称性が似ていおり、それらは、2つの親油性置換芳香環が両側にある中央の尿素基で構成されている。化合物UR214-8、9、および10は、本明細書に記載されている最も活性な化合物であり、これを考慮に入れて、それらは同様の結合モードを共有できると仮定した。したがって、化合物FCF、UR214-8、UR214-9、およびUR214-10は、利用可能なセプチン-2二量体複合体の最高品質の構造であるPDB ID 2QNRのヌクレオチド結合部位にドッキングされた。ドッキングポーズを目視検査したところ、すべての高活性化合物が同様のコンフォメーションをとることができる2セットの低エネルギーポーズ(「セットA、上下」および「セットB、上下」)が特定された。
2つのセットは、分子の3つの主要部分(中央の尿素部分、ピリジン、フェニル環)がほぼ同じ領域にあり、GDPでグアニンの代わりにピリジン環を有する点で互いに類似している(図9A-9D)。セットAでは、ピリジン窒素原子がグアニンカルボニル酸素原子の代わりに見られ、鎖AのG241の152骨格と水素結合を形成している。セットAのICMスコアは、化合物UR214-8:-8.85、化合物UR214-9:-8.59、化合物UR214-10:-10.4、およびFCF:-7.21であることがわかり、親FCFよりも合成された類似体の結合エネルギーが強いことを示している。セットBは、Autodockソフトウェアで取得した、同じ構造テンプレートで以前に報告されたFCFのドッキングポーズと同じように見える。図9Cおよび9Dにおいて、UR214-9またはその類似体の原子と相互作用するアミノ酸残基の同一性が示される。
UR214-9は、がん細胞の生存率を低下させ、細胞周期の進行を阻止する。UR214-9での処理は、72時間の処理の間、ヒト膵臓がん細胞(BXPC-3およびPANC-1)細胞(図9A)の生存率を低下させた。UR214-9で処理したPANC-1およびBXPC-3細胞は、処理72時間後のLive-Dead細胞キットによる染色およびフローサイトメトリーに基づいて、非生存細胞の大集団を示した。(図9Bおよび-9C)。細胞周期プロセスにおけるセプチンの役割を考慮して、100nMの非細胞毒性濃度でのPANC-1およびBXPC-3膵臓がん細胞の細胞周期進行に対するUR214-9の効果を分析した。100nM用量のUR214-9による処理は、PANC-1で軽度のS期停止を引き起こしたが、BXPC-3細胞は非毒性用量で細胞周期分布に変化を示さなかった。用量を3μM濃度のUR214-9に増やすと、BXPC-3細胞のG1期で圧倒的な停止を引き起こした(21%と比較して約95%)が、PANC-1細胞はサブG1/G0期で完全な停止を示した。同様に、UR214-9の用量を増やして(3μM)処理したJIMT-1細胞は、G1期の停止を示し、G0期での蓄積物が大幅に増加した。
細胞周期タンパク質発現の分析。スポット抗体アレイを使用して、薬物処理またはナイーブPANC-1細胞で発現する複数の細胞周期関連タンパク質を同時に研究した。相対光子数の測定により、Cullin-3、グリコーゲンシンターゼキナーゼ-3(GSK-3b)、p19ARF、14.3.3.Pan、APC11、APC2、ATM、C-able、CD14Aホスファターゼ、CDC25C、CDC34、CDC37、CDC47、CDC7、CDH1、CDK1およびCDK-3が、処理されたPANC-1とナイーブのPANC-1で>2.0の倍率変化が意味のあるものとみなされる、最も発現および影響を受けたタンパク質であることが示された。β-アクチンは最も顕著な発現を示したが、発現レベルは処理後も変化しなかった。一方、Cullin-3は、処理されたPANC-1細胞とナイーブなPANC-1細胞とで最も顕著な上方調節を示した。CullinベースのユビキチンリガーゼファミリーのメンバーであるCullin-3は、Hrt1およびBTBドメインを含むタンパク質と相互作用する。得られた複合体は、Cullin3ベースのE3リガーゼとして機能し、特定の基質をユビキチン化および分解させ(Pintard,L.,Willems,A.,Peter,M.Cullin-based ubiquitin ligases:Cul3-BTB complexes join the family.EMBO J.23,1681-7,2004を参照されたい)、これはCullin-3を介したユビキチン化およびその後の分解の抑制におけるセプチンの役割を示している。
UR214-9処理は、HER2+異種移植腫瘍の成長を遅らせる。セプチン-2は胃がん細胞におけるHER2発現を調節する(Kumar,V.,Abbas,A.,Aster,J.Robbins basic pathology.Philadelphia:Elsevier/Saunders.2013;p.697.ISBN 9781437717815を参照されたい)。HER2は様々な悪性腫瘍で過剰発現しており(Buza,N.,Roque,DM.,Santin,AD.“HER2/neu in Endometrial Cancer:A Promising Therapeutic Target With Diagnostic Challenges”.Archives of Pathology & Laboratory Medicine.138,343-50,2014、およびRuschoff,J.,Hanna,W.,Bilous,M.,Hofmann,M.,Osamura,R.Y.,Penault-Llorca,F.,van de Vijver,M,,Viale,G.“HER2 testing in gastric cancer:a practical approach”.Modern Pathology.25:637-50,2012を参照されたい)、腫瘍の発生、進行、転移、化学療法抵抗性を促進することが知られている(Ruiz-Saenz,A.,Dreyer,C.,Campbell,M.R.,Steri,V.,Gulizia,N.,Moasser,M.M.HER2 Amplification in Tumors Activates PI3K/Akt Signaling Independent of HER3.Cancer Res.78,3645-3658,2018を参照されたい)。セプチンは、腫瘍細胞の原形質膜でHER2受容体を保護および安定化して、HER2の組織化された腫瘍形成を永続させることが示されている(Marcus,E.A.,Tokhtaeva,E.,Turdikulova,S.,Capri,J.,Whitelegge,J.P.,Scott,D.R.,Sachs,G.,Berditchevski,F.,Vagin,O.Septin oligomerization regulates persistent expression of ErbB2/HER2 in gastric cancer cells.Biochem J.473,1703-18,2016を参照されたい)。セプチン-2を標的とすることが、HER2の組織化された腫瘍形成を制御するための新しいアプローチとして潜在的に現れ得ると仮定した。MTSアッセイは、UR214-9処理が、薬物曝露の48時間までに、用量依存的にBXPC-3およびPANC-1膵臓がんの増殖を低減させることを示した(図10A)。UR214-9[3μM]による処理では、BXPC-3細胞の全集団をLive-deadキット(Invitrogen Inc)で分析したところ、48時間の薬物曝露中に29.4%の死細胞が生成された。同様に、PANC-1細胞は、UR214-9[3μM]で処理すると、38%を超える死細胞の203集団を示した。次に、インビボでの膵臓がん異種移植片腫瘍成長に対するUR214-9処理の影響を決定した。HER2+PANC-1細胞を異種移植したマウスは、有意に遅延した増殖を示した(p<0.0001)(図10D)。UR214-9の抗腫瘍効果は、JIMT1(乳がん)細胞に由来するHER2陽性異種移植片に対してさらに評価された。インビトロでのUR214-9曝露によるJIMT-1細胞の細胞死の増加(図10E)に加えて、UR214-9で処理されたJIMT1異種移植腫瘍は、腫瘍の体積と重量の両方の測定に基づいて(図10G)、有意な増殖制御をもたらした(図10F)。
UR214-9はHER2の発現を阻害し、STAT-3のリン酸化を阻止する。膵臓がん細胞PANC-1(HER2+)の全細胞溶解物のイムノブロット分析で、UR214-9で72時間処理された細胞はPANC-1におけるHER2発現の用量依存的な減少を示した(図11A、上)。STAT3のリン酸化は、HER2活性化の下流の読み出しであり33、したがって、UR214-9処理は、PANC-1細胞のリン酸化されたSTAT-3も低減させた(図11A、下)。同様に、UR214-9処理は、MDA-MB-231、JIMT-1、およびMCF-7乳がん細胞のパネルでHER2発現を低減させ(図11B)各細胞株でSTAT-3のリン酸化を低減させた(図11C)。我々は最近、セプチン-2が卵巣がんで高度に過剰発現していることを示した(James,N.E.,Cantillo,E.,Yano,N.,Chichester,C.O.,DiSilvestro,.PA.,Hovanesian,V.,Rao,R.S.P.,Kim,K.K.,Moore,R.G.,Ahsan,N.,Ribeiro,J.R.Septin-2 is overexpressed in epithelial ovarian cancer and mediates proliferation via regulation of cellular metabolic proteins.Oncotarget.10,2959-2972,2019を参照されたい)。JIMT-1およびPANC-1細胞株と同様に、SKOV-3、プラチナ耐性の卵巣がん細胞株はHER2増幅を特徴としている(DeFazio-Eli,L.,Strommen,K.,Dao-Pick,T.,Parry,G.,Goodman,L.,Winslow,J.Quantitative assays for the measurement of HER1-HER2 heterodimerization and phosphorylation in cell lines and breast tumors:applications for diagnostics and targeted drug mechanism of action.Breast Cancer Res.13(2),R44,2011、およびEnglish,D.P.,Roque,D.M.,Santin,A.D.HER2 expression beyond breast cancer:therapeutic implications for gynecologic malignancies.Mol.Diagn.Ther.17,85-99,2013を参照されたい)。したがって、SKOV-3細胞株由来の異種移植片を使用して、HER2増幅異種移植片腫瘍に対するUR214-9の抗腫瘍効果を検証した。UR214-9とトラスツズマブの併用の結果をさらに確認するために、マウスをトラスツズマブ単独またはUR214-9との併用でさらに処理した。図11Dに示すように、UR214-9とトラスツズマブの両方が腫瘍の成長を制御した。この組み合わせは明らかに、両方の薬剤単独よりも腫瘍の成長を大幅に制御した。UR214-9とトラスツズマブの併用の真の利点は、処理を中止し、腫瘍を成長させたときに明らかになった。図11Dに示すように、UR214-9およびトラスツズマブ群の腫瘍サイズは、処理を中止したときに対照の平均サイズに達したが、組み合わせは腫瘍成長に対するより大きな制御を維持した(組み合わせp<0.0001****対、ビヒクル対UR214-9およびトラスツズマブに対するp=0.0004***および0.0001***)。抽出された腫瘍の重さを量ったとき、組み合わせ群はより小さな腫瘍の存在を示したが、UR214-9群とトラスツズマブ群の両方がビヒクル群で見られた平均サイズと一致する腫瘍を生成した(図11E)。
全トランスクリプトーム解析により、UR-214-9が選択的であることが明らかとなった。RNA-Seqは、JIMT-1およびPanc-1細胞株で、それぞれ4つの複製からなる3つの処理グループ(10nMアファチニブ、1μM UR214-9、およびDMSO)で実行された。試料は、平均深度5,800万回の読み取りでシーケンスされ、各試料の読み取りデータの90%以上が、アダプターと品質のトリミング後にヒト参照ゲノム(hg38)に一意にアラインメントされた。薬物処理を対照群と比較し、差次的に発現する遺伝子を決定した(調整されたp値<0.05)。アファチニブ処理と対照との間に1236個(713個のアップおよび523個のダウン)の調節不全遺伝子があった(図12Aおよび12C)。ENRICHR Webツールを使用して、上方調節された遺伝子(ALPP、TRIM29、CYP1A1)が細胞外マトリックスの組織化とカドヘリン結合に関連し、下方調節された遺伝子(EGR1、DUSP6、HMGA2など)がプリン代謝とリボソーム生合成に関連していることを確認した。逆に、11個(7個のアップおよび4個のダウン)の遺伝子のみが、UR214-9処理と対照の間で調節不全と呼ばれた(図12Bおよび12D)。PANC-1細胞株に関しては、対照群と比較してアファチニブ処理で有意に差次的に発現すると決定された遺伝子は2つ(COL13A1およびPRSS22)のみであり、UR214-9と対照の間で差次的に発現する遺伝子は呼ばれなかった。
考察
セプチンと悪性腫瘍との関連性が次々と明らかになり、がん細胞におけるセプチンの異常な機能を阻害するセプチン標的治療薬の特定が重要となっている。セプチン-240を本質的に強化するFCFを出発点として、細胞を殺したり細胞内のセプチンタンパク質レベルを変化させたりすることなく、がん細胞のセプチン-2および-9フィラメントアセンブリを分解する小分子であるUR214-9が開発された。UR214-9処理を介してオリゴマーのセプチンフィラメント構造を破壊することは、細胞質分裂に影響を与え、がん細胞の増殖を制御するための鍵となる可能性がある。UR214-9によるセプチンフィラメントの破壊は、インビトロでの膵臓がん細胞(および乳がん、卵巣子宮内膜がん、肺がん、および腎臓がん)の増殖を低減させただけでなく、UR214-9で処理された乳がん、卵巣、膵臓および肺の悪性腫瘍の異種移植腫瘍も腫瘍成長の低減を示した。興味深いことに、トラスツズマブとの併用により、HER2陽性SKOV-3異種移植片の成長をより強力に制御できるようになった(図11D)。
HER2陽性卵巣がん異種移植モデルにおけるUR214-9との併用処理によるトラスツズマブの抗腫瘍効果の増強は、おそらくセプチン-2とHER2の関連に起因している。セプチン-2はがん細胞でHER2シグナル伝達を維持することが示されている。セプチンは、腫瘍細胞の原形質膜にあるHER2受容体を保護および安定化して、HER2で組織化された発がん性シグナル伝達と腫瘍形成を永続させる。セプチンを標的とすることで、HER2陽性の乳房、膵臓、および卵巣や肺などの他の悪性腫瘍の生存率を改善できると予想される。HER2の過剰発現は、侵襲性の乳房悪性腫瘍と患者の生存率の低下につながる(Slamon,D.J.,Clark,G.M.,Wong,S.G.,Levin,W.J.,Ullrich,A.,McGuire,W.L.Human breast cancer:correlation of relapse and survival with amplification of the HER-2/neu oncogene.Science 235:177-182,1987を参照されたい)。HER2+悪性腫瘍の治療法の現在のレパートリーは不十分である。HER2+乳がん患者の60%より多くがトラスツズマブ治療に反応せず、治療に対する抵抗性は事実上すべての患者で急速に発症する(Pohlmann,P.R.,Mayer,I.A.,Mernaugh,R.Resistance to Trastuzumab in Breast Cancer.Clin Cancer Res.15:7479-7491,2009を参照されたい)。さらに、トラスツズマブが固形乳房腫瘍に浸透して、耐性および転移を促進する分泌型(短縮型)のHER2を遮断できないため、HER2で組織化された乳房腫瘍の成長を完全かつ持続的に制御する上での有用性が制限される(Hayes,D.F.,Yamauchi,H.,Broadwater,G.,Cirrincione,C.T.,Rodrigue,S.P.,Berry,D.A.,Younger,J.,Panasci,L.L.,Millard,F.,Duggan,D.B.,Norton,L.,Henderson,I.C.;Cancer and Leukemia Group B.Circulating HER-2/erbB-2/c-neu(HER-2)extracellular domain as a prognostic factor in patients with metastatic breast cancer:Cancer and Leukemia Group B Study 8662.Clin.Cancer Res.7,2703-11,2001を参照されたい)。同様に、HER2+乳がん患者の脳転移の治療または予防は、とりわけトラスツズマブ治療後の段階では困難である(Belkacemi,Y.,Hanna,N.E.,Besnard,C.,Majdoul,S.,Gligorov,J.Local and Regional Breast Cancer Recurrences:Salvage Therapy Options in the New Era of Molecular Subtypes.Front Oncol.8,112,2018)。患者の約3分の2は、トラスツズマブに対する頭蓋外疾患の制御または奏功にもかかわらず、脳転移を発症する(Clayton,A.J.,Danson,S.,Jolly,S.,Ryder,W.D.,Burt,P.A.,Stewart,A.L.,Wilkinson,P.M.,Welch,R.S.,Magee,B.,Wilson,G.,Howell,A.,Wardley,A.M.Incidence of cerebral metastases in patients treated with trastuzumab for metastatic breast cancer.Br J Cancer 91,639-643,2004を参照されたい)。トラスツズマブは中枢神経系に浸透しないため、脳は聖域として機能する可能性がある(Morris PG,McArthur HL,Hudis CA.Therapeutic options for metastatic breast cancer.Expert Opin Pharmacother.10,967-981,2009を参照されたい)。血液脳関門(BBB)浸透剤は、HER2+陽性がん患者の脳転移をより適切に制御するために必要である。UR214-9は、BBBを通過しやすくする小さな極性表面積の特徴の構造的属性を備えている(Ur214-9に対する計算=53.49に対し<90がBBBを通過するため必要とされる)。
したがって、UR214-9は、HER2+がんからの脳転移を有する患者の転帰を改善する可能性がある。
セプチンのシグナル伝達の関連性は完全には理解されていない。セプチンとUR214-9処理がもたらす摂動のシグナル伝達の関連性を決定するために、UR214-9および、比較対象として、HER2標的療法であるアファチニブで処理された乳がんおよび膵臓がん細胞のグローバルrna-seq解析を実施した。図12A~12Dに示されるように、アファチニブ処理は明らかにPANC-1細胞の転写プロファイルに最も大きな影響を及ぼしたが、DMSOおよびUR214-9による処理はトランスクリプトームにあまり影響を与えなかった。UR214-9処理と対照の間に差次的に発現する遺伝子がないことは、UR214-9の作用機序が非転写であり、UR214-9による処理が全体的な転写応答を誘発しないように思われることを示唆している。
まとめると、この例では、セプチンの異常な発現ががん患者の予後不良を示していることを示している。UR214-9は、これまでに説明されていない細胞の薬理学的および細胞骨格反応であるセプチン-2および-9フィラメントの壊滅を誘導し、がん細胞の増殖と腫瘍の成長を制御することができる小分子の最初のプロトタイプである。さらに、UR214-9の重要な薬理学的特徴は、限定されたオフターゲット関与の利点である。図12A~12Dに示すように、JIMT-1乳がん細胞における1200を超える遺伝子の遺伝子発現に影響を与えるEGFR標的療法であるアファチニブと比較して、100倍高い用量でもUR214-9処理は20未満の遺伝子にしか有意に影響を及ぼさなかった。UR214-9はFCFの密接な構造類似体であるが、UR214-9は薬理学的にFCFとは大きく異なる。FCFはセプチン2を強化することが示されているが、UR214-9はセプチン-2とセプチン-9のフィラメント状の集合体を解体する。分子ドッキングによって計算されたICMスコアは、FCFよりもセプチン-2:セプチン-2二量体複合体とのUR214-9の結合親和性が高いことを示した。弱い薬理学的効果、オフターゲット効果、およびセプチン-2フィラメントの強化に関連する機能のために臨床的に不適当であるFCFを除いて、UR214-9は、ナノモル濃度(70nM~1uM)でセプチンの構造配列を解体できる、これまでに説明されている唯一のセプチンモジュレーターである可能性がある。乳がん、膵臓がん、卵巣がん、および肺がんの異種移植モデルにおける予備的な抗腫瘍反応(データは示していない)と、HER2発現異種移植腫瘍におけるトラスツズマブの反応を有意に増強するその処理能力を考えると、セプチンを解体することは、腫瘍の成長を防ぐための効果的で臨床的に有望なアプローチであることは明らかであるが、投与量、送達処方、および投与頻度を最適化する必要があり、腫瘍の成長を超えてより完全な制御を達成するために相乗的または少なくとも相加的な組み合わせ剤を特定する必要がある。トラスツズマブとの併用による有望な結果に基づいて、UR214-9の臨床的有用性を高めるために、乳がんモデルにおけるUR214-9とパクリタキセルおよびトラスツズマブの併用の結果を現在評価している。
本発明は、その詳細な説明と併せて説明されてきたが、前述の説明は、添付の特許請求の範囲によって定義される本発明の範囲を説明することを意図しており、限定するものではない。その他の態様、利点、および変更は、以下の特許請求の範囲内にある。
本明細書で参照される特許および科学文献は、当業者が利用できる知識を確立している。本明細書に引用されているすべての米国特許および公開済みまたは未公開の米国特許出願は、参照により組み込まれる。本明細書で引用されたすべての公開された外国特許および特許出願は、参照により本明細書に組み込まれる。本明細書に引用されているアクセッション番号によって示されるGenbankおよびNCBIの提出物は、参照により本明細書に組み込まれる。本明細書で引用されている他のすべての公開された参考文献、文書、原稿、および科学文献は、参照により本明細書に組み込まれる。
本発明は、特にその好ましい実施形態を参照して示され、説明されてきたが、添付の請求項によって包含される本発明の範囲から逸脱することなく、その形態および詳細の種々の変更がなされ得ることが当業者によって理解されよう。
以下に、本願の当初の特許請求の範囲に記載された発明を付記する。
[1] 式(I)の構造:
を含む化合物、またはその薬学的に許容される塩であって、
式中、
X
1
、X
2
、およびX
3
のそれぞれは、独立して、CまたはNであり、X
1
、X
2
、およびX
3
のうちの少なくとも1つはNであり、
Yは、O、S、NH、N-OH、N-OR
11
、またはNR
11
であり、
R
1
、R
2
、R
3
、R
4
、R
5
、R
6
、およびR
10-
のそれぞれは、独立して、H、F、Cl、Br、I、NO
2
、(C=O)-R
11
、(C=O)-OR
11
、(C=O)-NHR
11
、(C=O)-N(R
11
)
2
、C
1
-C
6
アルキル、C
2
-C
6
アルケニル、C
2
-C
6
アルキニル、C
6
-C
10
アリールまたは5~10員ヘテロアリールであり、前記C
1
-C
6
アルキル、C
2
-C
6
アルケニル、C
2
-C
6
アルキニル、C
6
-C
10
アリールまたは5~10員ヘテロアリールは、任意選択的にF、Cl、Br、I、(C=O)-R
11
、(C=O)-OR
11
、(C=O)-NHR
11
、(C=O)-N(R
11
)
2
、C
1
-C
6
アルキル、C
6
-C
10
アリールまたは5~10員ヘテロアリールによる1、2、3、またはそれ以上の置換を含み、
R
7
、R
8
、およびR
9
のそれぞれは、存在する場合、独立して、H、F、Cl、Br、I、NO
2
、(C=O)-R
11
、(C=O)-OR
11
、(C=O)-NHR
11
、(C=O)-N(R
11
)
2
、C
1
-C
6
アルキル、C
2
-C
6
アルケニル、C
2
-C
6
アルキニル、C
6
-C
10
アリールまたは5~10員ヘテロアリールであり、前記C
1
-C
6
アルキル、C
2
-C
6
アルケニル、C
2
-C
6
アルキニル、C
6
-C
10
アリールまたは5~10員ヘテロアリールは、任意選択的にF、Cl、Br、I、(C=O)-R
11
、(C=O)-OR
11
、(C=O)-NHR
11
、(C=O)-N(R
11
)
2
、C
1
-C
6
アルキル、C
6
-C
10
アリールまたは5~10員ヘテロアリールによる1、2、3、またはそれ以上の置換を含み、
それぞれのR
11
は、独立して、C
1
-C
6
アルキル、C
2
-C
6
アルケニル、C
2
-C
6
アルキニル、C
6
-C
10
アリールまたは5~10員ヘテロアリールであり、前記C
1
-C
6
アルキル、C
2
-C
6
アルケニル、C
2
-C
6
アルキニル、C
6
-C
10
アリールまたは5~10員ヘテロアリールは、任意選択的にF、Cl、Br、I、(C=O)-(C
1
-C
6
アルキル)、(C=O)-O(C
1
-C
6
アルキル)、(C=O)-NH(C
1
-C
6
アルキル)、または(C=O)-N(C
1
-C
6
アルキル)
2
による1、2、3、またはそれ以上の置換を含む、化合物またはその薬学的に許容される塩。
[2] 構造:
またはその薬学的に許容される塩を含む、[1]に記載の化合物。
[3] X
2
が、Nである、[1]に記載の化合物。
[4] X
1
およびX
3
の両方が、Cである、[3]に記載の化合物。
[5] 式(II)の構造:
またはその薬学的に許容される塩を含む、[4]に記載の化合物。
[6] 式(III)の構造:
またはその薬学的に許容される塩を含む、[5]に記載の化合物。
[7] 式(IV)の構造:
またはその薬学的に許容される塩を含み、
式中、
それぞれのR
12
は、独立して、F、Cl、Br、I、NO
2
、(C=O)-R
11
、(C=O)-OR
11
、(C=O)-NHR
11
、(C=O)-N(R
11
)
2
、C
1
-C
6
アルキル、C
2
-C
6
アルケニル、C
2
-C
6
アルキニル、C
6
-C
10
アリールまたは5~10員ヘテロアリールであり、前記C
1
-C
6
アルキル、C
2
-C
6
アルケニル、C
2
-C
6
アルキニル、C
6
-C
10
アリールまたは5~10員ヘテロアリールは、任意選択的にF、Cl、Br、I、(C=O)-R
11
、(C=O)-OR
11
、(C=O)-NHR
11
、(C=O)-N(R
11
)
2
、C
1
-C
6
アルキル、C
6
-C
10
アリールまたは5~10員ヘテロアリールによる1、2、3、またはそれ以上の置換を含み、
nが、1または2である、[6]に記載の化合物。
[8] R
1
が、F、Cl、Br、I、NO
2
、(C=O)-R
11
、(C=O)-OR
11
、(C=O)-NHR
11
、(C=O)-N(R
11
)
2
、またはC
1
-C
6
アルキルであり、前記C
1
-C
6
アルキルが、任意選択的にF、Cl、Br、I、またはフェニルによる1、2、3、またはそれ以上の置換を含む、[1]および[3]~[7]のいずれかに記載の化合物。
[9] R
2
が、F、Cl、Br、I、NO
2
、(C=O)-R
11
、(C=O)-OR
11
、(C=O)-NHR
11
、(C=O)-N(R
11
)
2
、またはC
1
-C
6
アルキルであり、前記C
1
-C
6
アルキルが、任意選択的にF、Cl、Br、I、またはフェニルによる1、2、3、またはそれ以上の置換を含む、[1]および[3]~[8]のいずれかに記載の化合物。
[10] R
1
およびR
2
のそれぞれが、独立して、F、Cl、Br、I、またはC
1
-C
6
アルキルであり、前記C
1
-C
6
アルキルが、任意選択的にF、Cl、Br、I、またはフェニルによる1、2、3、またはそれ以上の置換を含む、[1]および[3]~[9]のいずれかに記載の化合物。
[11] R
12
が、オルト置換基である、[7]~[10]のいずれかに記載の化合物。
[12] それぞれのR
12
が、F、Cl、Br、I、またはC
1
-C
6
アルキルであり、前記C
1
-C
6
アルキルが、任意選択的にF、Cl、Br、またはIによる1、2、3、またはそれ以上の置換を含む、[7]~[11]のいずれかに記載の化合物。
[13] それぞれのR
11
が、独立して、C
1
-C
6
アルキル、C
2
-C
6
アルケニル、C
2
-C
6
アルキニル、C
6
-C
10
アリールまたは5~10員ヘテロアリールであり、前記C
1
-C
6
アルキル、C
2
-C
6
アルケニル、C
2
-C
6
アルキニル、C
6
-C
10
アリールまたは5~10員ヘテロアリールは、任意選択的にF、Cl、Br、I、(C=O)-(C
1
-C
6
アルキル)、(C=O)-O(C
1
-C
6
アルキル)、(C=O)-NH(C
1
-C
6
アルキル)、または(C=O)-N(C
1
-C
6
アルキル)
2
による1、2、3、またはそれ以上の置換を含む、[1]および[3]~[12]のいずれかに記載の化合物。
[14] i)R
2
が、フェノキシではないか、または
ii)R
3
が、イミダゾリルもしくはピリミジニルではない、[1]および[3]~[5]のいずれかに記載の化合物。
[15] 構造:
またはその薬学的に許容される塩を含む、[1]に記載の化合物。
[16] 構造:
またはその薬学的に許容される塩を含む、[1]および[3]~[14]のいずれかに記載の化合物。
[17] 構造:
またはその薬学的に許容される塩を含む、[1]~[16]のいずれかに記載の化合物。
[18] [1]~[17]のいずれかに記載の化合物、またはその薬学的に許容される塩、および薬学的に許容される賦形剤を含む、医薬組成物。
[19] 1つ以上の追加の治療薬をさらに含む、[18]に記載の医薬組成物。
[20] 前記追加の治療薬が化学療法剤、または抗体、または核酸分子、または治療細胞である、[19]に記載の医薬組成物。
[21] がんの治療を必要とする対象のがんを治療する方法であって、治療有効量の請求項1~17のいずれか一項に記載の化合物、もしくはその薬学的に許容される塩、または[18]に記載の医薬組成物を前記対象に投与することを含む、方法。
[22] 前記がんが、膵臓がん、乳がん、肺がん(例えば、小細胞および非小細胞肺がん)、腎臓(腎)がん、肝臓がん、卵巣がん、子宮内膜がん、基底細胞がん、胆道がん、膀胱がん、骨がん、脳および/またはCNSがん、子宮頸がん、絨毛がん、結腸および直腸がん、結合組織がん、消化器系がん、子宮内膜がん、食道がん、眼がん、線維腫、頭頸部がん、胃がん、上皮内新生物、喉頭がん、白血病(例えば、急性骨髄性白血病、急性リンパ性白血病、慢性骨髄性白血病、慢性リンパ性白血病など)、リンパ腫(例えば、ホジキンおよび非ホジキンリンパ腫)、黒色腫、口腔がん(例えば、唇、舌、口、および咽頭がん)、前立腺がん、網膜芽細胞腫、横紋筋肉腫、直腸がん、呼吸器系がん、肉腫、皮膚がん、胃がん、精巣がん、甲状腺がん、子宮がん、泌尿器系がん、またはそれらの任意の組み合わせ、を含む、[21]に記載の方法。
[23] 前記方法が、1つ以上の追加の治療薬を投与することをさらに含む、[21]または[22]に記載の方法。
[24] 前記1つ以上の追加の治療薬が、化学療法剤を含む、[23]に記載の方法。
[25] 前記化学療法剤が、タキサン、またはパクリタキセルを含む、[24]に記載の方法。
[26] 前記1つ以上の追加の治療薬が、抗体を含む、[23]に記載の方法。
[27] 前記抗体が、抗HER2抗体を含む、[26]に記載の方法。
[28] 前記抗HER2抗体が、トラスツズマブを含む、[27]に記載の方法。