JP7681069B2 - 抗ペリオスチン抗体及びその使用 - Google Patents
抗ペリオスチン抗体及びその使用 Download PDFInfo
- Publication number
- JP7681069B2 JP7681069B2 JP2023122675A JP2023122675A JP7681069B2 JP 7681069 B2 JP7681069 B2 JP 7681069B2 JP 2023122675 A JP2023122675 A JP 2023122675A JP 2023122675 A JP2023122675 A JP 2023122675A JP 7681069 B2 JP7681069 B2 JP 7681069B2
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- amino acid
- acid sequence
- seq
- cancer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/46—Hybrid immunoglobulins
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/10—Cells modified by introduction of foreign genetic material
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/71—Decreased effector function due to an Fc-modification
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Genetics & Genomics (AREA)
- Immunology (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Biophysics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- Zoology (AREA)
- Microbiology (AREA)
- Wood Science & Technology (AREA)
- Cell Biology (AREA)
- General Engineering & Computer Science (AREA)
- Mycology (AREA)
- Epidemiology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Description
本出願は、2018年12月14日に出願された米国仮出願番号第62/779,996号、及び2019年9月11日に出願された米国仮出願番号第62/899,075号の恩典を主張し、これらは全て、その全体が参照によりここに組み入れられる。
ペリオスチン(POSTN)は、上皮間葉転換(EMT)、細胞・マトリックス相互作用、及び炎症をはじめとする、多くの病理学的プロセスに関与する多細胞タンパク質である。POSTNは、炎症、線維症、及びがんを含む、いくつかの病的状況において過剰発現され、ここでそれは、悪い予後に相関する。がんにおいて、POSTNは典型的には、がん関連線維芽細胞(CAF)などの間質細胞によって発現されるが、POSTNの発現はまた、がん惹起細胞(CIC)及び骨髄由来免疫抑制細胞においても報告されている。POSTNは、フィブロネクチン及びコラーゲンなどの他のマトリクス細胞タンパク質に結合することによって細胞外基質再構築を調節し、インテグリン受容体リガンドとして作用して、細胞の生存、遊走/浸潤、上皮間葉転換、血管新生、及び免疫細胞の動員を促進する。POSTNは、免疫の排除を促進することによって、及び腫瘍浸潤骨髄球系細胞による免疫抑制を増加させることによって、抗腫瘍免疫を抑制することを含む、がんの生物学の複数の側面に対して作用することによって、腫瘍の増殖及び進行を駆動すると仮定されている。
本明細書には、インテグリンにより媒介される細胞接着などの、ペリオスチンの機能を阻害する抗体が記載されている。このような抗体は、がんの処置に有用である。本明細書に記載の抗ペリオスチン抗体は、腫瘍のコラーゲン含量を減少させ、マクロファージのM1表現型への極性化を増加させつつ、顆粒球細胞及び腫瘍関連マクロファージなどの抑制性骨髄系細胞集団の浸潤を減少させ、腫瘍浸潤T細胞の蓄積及び抗腫瘍特性を増加させる。
本明細書には、ペリオスチンに結合する組換え抗体又はその抗原結合断片が記載され、ここでの該抗体又はその抗原結合断片は、(a)配列番号1(GYTFTSYG)に示されるアミノ酸配列を含む免疫グロブリン重鎖CDR1(CDR-H1);(b)配列番号2(ISAYNGNT)、3(ISAYSGNT)、4(ISAYQGNT)、5(ISAYTGNT)、又は6(ISAYDGNT)のいずれか1つに示されるアミノ酸配列を含む免疫グロブリン重鎖CDR2(CDR-H2);(c)配列番号7(DILVVPFDY)、8(DVLVVPFDY)、又は9(DMLVVPFDY)のいずれか1つに示されるアミノ酸配列を含む免疫グロブリン重鎖CDR3(CDR-H3);(d)配列番号10(SSDIGSNR)に示されるアミノ酸配列を含む免疫グロブリン軽鎖CDR1(CDR-L1);(e)配列番号11(SND)に示されるアミノ酸配列を含む免疫グロブリン軽鎖CDR2(CDR-L2);及び(f)配列番号12(AAWDDSLSTYV)に示されるアミノ酸配列を含む免疫グロブリン軽鎖CDR3(CDR-L3)を含む。
本明細書には、ペリオスチン(POSTN)機能を阻害する抗体が記載されている。このような抗体は、がんの処置に有用である。本明細書に記載の抗体は、腫瘍のコラーゲン含量を減少させ、マクロファージのM1表現型への極性化を増加させつつ、顆粒球及び腫瘍関連マクロファージの浸潤を減少させ、そして腫瘍浸潤T細胞の蓄積及び抗腫瘍特性を増加させる。特定の実施態様では、抗ペリオスチン抗体は、全く処置しないもの又は対照の処置と比較して、腫瘍コラーゲン含量を少なくとも約5%、10%、15%。20%、25%、30%、35%、又は40%減少させる。特定の実施態様では、抗ペリオスチン抗体は、全く処置しないもの又は対照の処置と比較して、顆粒球及び腫瘍関連マクロファージの浸潤を少なくとも約20%、25%、30%、35%、40%、45%、又は50%減少させる。特定の実施態様では、抗ペリオスチン抗体は、全く処置しないもの又は対照の処置と比較して、CD11b陽性細胞の浸潤を少なくとも約20%、25%、30%、35%、40%、45%、又は50%減少させる。特定の実施態様では、抗ペリオスチン抗体は、全く処置しないもの又は対照の処置と比較して、腫瘍関連マクロファージのM1型(CD11b陽性、MHCクラスII陽性、CD206陰性)への極性化を少なくとも約20%、25%、30%、35%、40%、45%、又は50%増加させる。特定の実施態様では、抗ペリオスチン抗体は、全く処置しないもの又は対照の処置と比較して、腫瘍内のCD4陽性及び/又はCD8陽性T細胞の蓄積を、少なくとも約20%、25%、30%、35%、40%、45%、又は50%増加させる。特定の実施態様では、抗ペリオスチン抗体は、全く処置しないもの又は対照の処置と比較して、腫瘍浸潤CD8陽性T細胞のインターフェロンγの産生を、少なくとも約20%、25%、30%、35%、40%、45%、又は50%増加させる。
本明細書には、結合した場合に、ペリオスチンの生物学的活性(例えばインテグリンにより媒介される細胞接着)を阻害し、腫瘍の微小環境を変化させる(コラーゲン再構築及び免疫細胞の変化)、ヒトペリオスチンの特有のエピトープ又は領域が記載されている。この結合は、抗体のCDRアミノ酸残基と、ペリオスチン内のアミノ酸残基(例えば接触残基)との間の弱い(ファンデルワールス引力)、中程度の(水素結合)、及び強力な(塩橋)相互作用の組合せである。特定の実施態様では、接触残基は、抗ペリオスチン抗体上の残基と水素結合を形成するペリオスチン上の残基である。特定の実施態様では、接触残基は、抗ペリオスチン抗体上の残基と塩橋を形成するペリオスチン上の残基である。特定の実施態様では、接触残基は、抗ペリオスチン抗体上の残基とファンデルワールス引力を生じ、抗ペリオスチン抗体上の残基の少なくとも5Å、4Å、又は3Å以内である、ペリオスチン上の残基である。
本明細書に開示された抗体は、がん又は腫瘍の処置に有用な抗体である。処置は、処置される容態を改善又は寛解することを探究した方法を指す。がんに関する処置は、腫瘍体積の低減、腫瘍体積の成長の低減、無進行生存期間又は寿命の延長を含むがこれらに限定されない。特定の実施態様では、処置は、処置されるがんの緩解に影響を及ぼすだろう。特定の実施態様では、処置は、以前に処置されたがん又は腫瘍の再発若しくは進行を予防することを目的とした、予防用量又は維持用量としての使用を包含する。当業者によって、該抗体は、安全かつ有効であり得るが、全ての個体が、投与される処置に等しく応答するわけではなく、それにも関わらずこれらの個体は処置されると判断されることが理解される。
本明細書に記載の抗体は、ヒト個体への投与に十分なほど純粋な、単離され精製された形態で提供され得る。
以下の例示的な実施例は、本明細書に記載の組成物及び方法の実施態様の代表であり、いずれにしても限定することを意味するものではない。
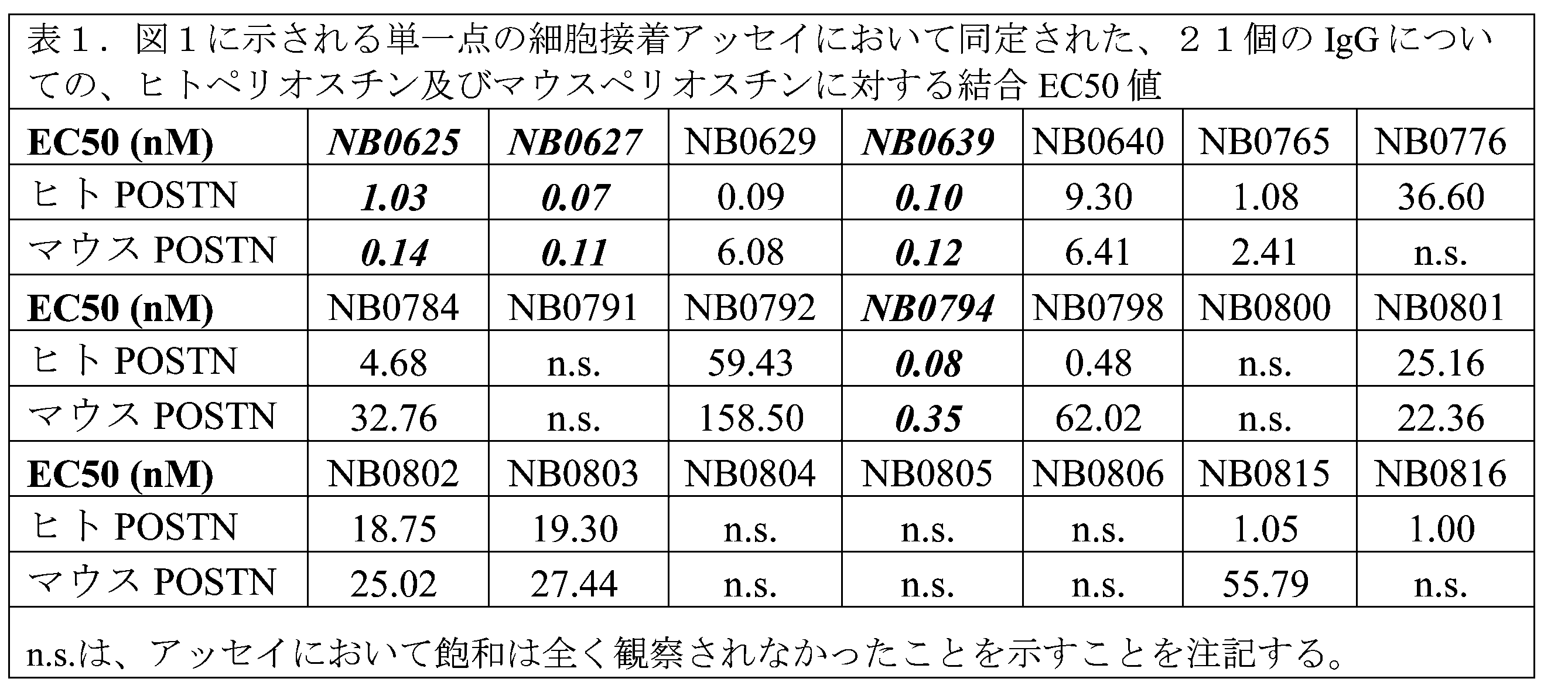
完全ヒトファージライブラリーを使用して、ファージディスプレイ抗体発見キャンペーンを実施し、ペリオスチンに対する結合物を単離した。簡潔に言えば、3回のパンニングを、組換えヒトペリオスチン、組換えマウスペリオスチン、又はその組合せのいずれかを使用して行ない、マウス交差反応性結合物の同定に重点が置かれた。このパンニング戦略から、マウスペリオスチンと交差反応する78個の配列の特有なScFvが同定され、細胞接着アッセイにおける機能スクリーニングのためにヒトIgG1フォーマットで生成された。図1を参照されたい。
4つの候補を、細胞接着アッセイにおいて用量反応で再試験し、IC50値を決定した。このスクリーニングから、NB0627は、特に適したIgGとして同定された(表2)。
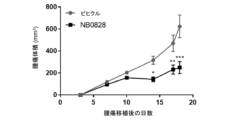
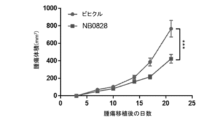
NB0828の有効性を、2つの別々の腫瘍モデルである膀胱MB49及び大腸CT26の腫瘍モデルにおいて試験した。簡潔に言えば、250,000個のMB49細胞を、雌C57BL/6マウスの脇腹に皮内注射したか、又は、50,000個のCT26細胞を、雌Balb/cマウスの脇腹に皮内注射した。腫瘍の移植から3日後、マウスを、NB0828(50mg/kg、週3回)又はビヒクル対照(PBS)のいずれかを用いて腹腔内に処置した。腫瘍体積を、カリパスによる測定により週2回評価し、(長さ×幅2)/2として計算した。マウスを、腫瘍のサイズがいずれかの単一の方向で15mmを超えた場合、又は人道的終点としての腫瘍の潰瘍化に因り安楽死させた。
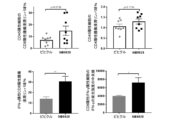
MB49又はCT26の担がんマウスを、NB0828又はビヒクル対照を用いて、記載のように3日目から開始して処置した。示されるデータについて、免疫表現型検査は、MB49及びCT26についてそれぞれ、腫瘍の移植後20日目及び18日目に実施された。腫瘍を切除し、皮膚を除去し、手術用のメスの刃を使用して機械的に破壊し、その後、ミルテニー社のマウス腫瘍解離酵素混液を使用して酵素消化した。消化された試料を、40μmのろ過器を通し、RPMIで洗浄し、その後、RPMI+10%のウシ胎児血清で2回目の洗浄を行なった。その後、細胞を、計数のために再懸濁し、1試料あたり最大で2×106個の白血球を蒔き、フローサイトメトリーによる分析のために染色した。CT26モデルにおけるCD8陽性腫瘍浸潤リンパ球の機能の評価のために、消化された腫瘍の単一細胞懸濁液を、抗CD28抗体及びブレフェルディンAの存在下で、AH1ペプチド[H2-Ld拘束性gp70(423~431)MuLVエピトープ、CT26細胞によって発現される免疫優性CD8陽性T細胞エピトープ]を用いて37℃で5時間刺激した。刺激後、標準的な表面/細胞内染色法によって、細胞を染色して、フローサイトメトリーを使用して、CD8陽性T細胞によるIFN-γの産生を検出した。示された細胞集団を評価するために使用されたフロー染色パネルは、以下の表4に含まれる。生存率判定染色(サーモフィッシャー社、Live/Dead Fixable Violet Stain)を使用して、生細胞イベントのみを調べることが可能となり、汎白血球マーカーCD45が、免疫コンパートメント内の集団の標準化を可能とするために含められた。関心対象の免疫集団は、以下のように表現型的に/機能的に定義された:全骨髄球系細胞(CD45陽性CD11b陽性)、顆粒球(CD45陽性CD11b陽性Gr-1 hi又はCD45陽性CD11b陽性Ly6G陽性Ly6C lo)、マクロファージ(CD45陽性CD11b陽性Ly6G陰性Ly6C lo/陰性F4/80陽性)、M1マクロファージ(MHC II陽性CD206陰性)、M2マクロファージ(MHC II陰性CD206陽性)、CD8陽性腫瘍浸潤リンパ球(CD45陽性CD11b陰性CD3陽性CD90.2陽性CD8陽性)、CD4陽性腫瘍浸潤リンパ球(CD45陽性CD11b陰性CD3陽性CD90.2陽性CD4陽性)、IFN-γ陽性CD8陽性腫瘍浸潤リンパ球(CD45陽性CD11b陰性CD3陽性CD8陽性IFN-γ陽性)。蛍光強度の中央値(MFI)を、IFN-γ陽性CD8陽性腫瘍浸潤リンパ球に由来するIFN-γ染色強度の決定のために使用した。
腫瘍のコラーゲン総含量を、クイックザイム社の総コラーゲンアッセイを使用したヒドロキシプロリンの定量によって評価した。試料の調製のために、MB49腫瘍を、腫瘍が終点に達した時に担がんマウスから切除し、液体窒素中で瞬間凍結させ、-80℃で保存し、その後、分析した。腫瘍材料を秤量し、6M HClに1mlのHClあたり200mgの腫瘍の割合で再懸濁し、ボルテックスにかけ、95℃で20時間インキュベートした。チューブを冷却し、13,000RPMで10分間遠心分離にかけ、上清を回収した。上清を、製造業者の推奨するプロトコールに従って、ミリQ水で希釈し、その後、4M HClで希釈し、供給された緩衝液及び検出試薬を使用してヒドロキシプロリンの検出のために蒔き、技術的反復実験を行なった。570nmにおける吸光度の数値を測定し、供給されたコラーゲンを使用して作成された標準曲線と比較して、各試料中のコラーゲンの量を計算した。各試料の計算された総コラーゲン量(μg)を、腫瘍投入量の総質量(mg)で割り、腫瘍試料間のデータを標準化した。
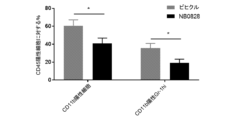
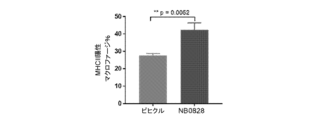
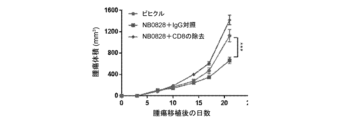
NB0828を、マウス大腸MC38腫瘍モデルにおける腫瘍増殖を低減させるその有効性について試験し、結果を図8に示した。簡潔に言えば、200,000個のMC38細胞を、雌C57BL/6マウスの脇腹に皮内注射した。腫瘍の移植から3日後、マウスを、NB0828(50mg/kg、週3回)又はビヒクル対照(PBS)のいずれかを用いて腹腔内に処置した。CD8陽性T細胞の除去のために、抗マウスCD8a抗体(クローン2.43)又はIgGアイソタイプ対照(クローンLTF-2)を、最初の6回の投薬(10mg/kg、週3回)についてはNB0828と共に送達した。血液中のT細胞の除去は、表5に列挙されたフロー染色パネルを使用したフローサイトメトリーによって確認された。腫瘍体積を、MB49及びCT26のモデルについて記載されているのと同じ方法を使用して測定した。NB0828は、MC38モデルにおいて腫瘍増殖を低減するのに効果的であった(図8)。NB0828はまた、図9A及び9Cに示されているように、腫瘍微小環境を変化させることにより、CD8陽性T細胞を増加させ、腫瘍関連マクロファージ(TAM)の出現頻度を減少させ、炎症誘発性マクロファージの比を増加させるのに効果的であった。NB0828のこのモデルにおける腫瘍増殖を低減させる効力は、CD8陽性T細胞に依存していた。なぜなら、NB0828による処置中のCD8陽性T細胞の除去は、図9Dに示されるように、NB0828の有益な効果を元に戻したからである。要するに、このデータは、NB0828が、効果的に腫瘍増殖を低減させ、腫瘍部位へのCD8陽性T細胞を増加させ、腫瘍関連マクロファージを減少させ、浸潤腫瘍における炎症誘発性M1マクロファージ表現型を増加させることを示す。
腫瘍を切除し、皮膚を除去し、手術用のメスを使用して機械的に破壊し、その後、ミルテニー社のマウス腫瘍解離酵素混液を使用して酵素消化した(37℃で振盪プラットフォーム上で45分間のインキュベーション)。消化された試料を、40μmのろ過器を通し、RPMIで洗浄し、その後、RPMI+10%のウシ胎児血清で2回目の洗浄を行なった。その後、細胞を、計数のために再懸濁し、1試料あたり最大で2×106個の白血球を蒔き、フローサイトメトリーによる分析のために染色した。MC38モデルにおけるCD8陽性腫瘍浸潤リンパ球(CD8陽性TIL)機能の評価のために、消化された腫瘍の単一細胞懸濁液(1試料あたり最大2×106個の白血球)を、抗CD28抗体及びブレフェルディンAの存在下で、p15Eペプチド[MC38腫瘍によって発現される、H2-Kb拘束性p15E(604~611)MuLVエピトープ]を用いて37℃で5時間刺激した。刺激後、細胞を染色して、eBioscience社の細胞内固定及び透過緩衝液セットを使用した標準的な表面/細胞内染色法によるフローサイトメトリーを使用して、CD8陽性T細胞によるIFN-γの産生を検出した。示された細胞集団を評価するために使用されたフロー染色パネルは、以下の表に含まれる。生存率判定染色(サーモフィッシャー社、生死判別のための固定可能なバイオレット染色(Live/Dead Fixable Violet Stain))を使用して、生細胞イベントのみを調べることが可能となり、汎白血球マーカーCD45が、免疫コンパートメント内の集団の標準化を可能とするために含められた。MC38における研究のために、関心対象の報告された免疫集団は、以下のように表現型的に/機能的に定義された:総骨髄球系細胞(CD45陽性CD11b陽性)、マクロファージ(CD45陽性CD11b陽性Ly6G陰性Ly6C lo/陰性F4/80陽性)、M1マクロファージ(MHC II陽性)、M2マクロファージ(MHC II陰性)、CD8陽性腫瘍浸潤リンパ球(CD45陽性CD11b陰性CD3陽性SSC lo CD8陽性)、IFN-γ陽性CD8陽性腫瘍浸潤リンパ球(CD45陽性CD11b陰性CD3陽性SSC loCD8陽性IFN-γ陽性)。
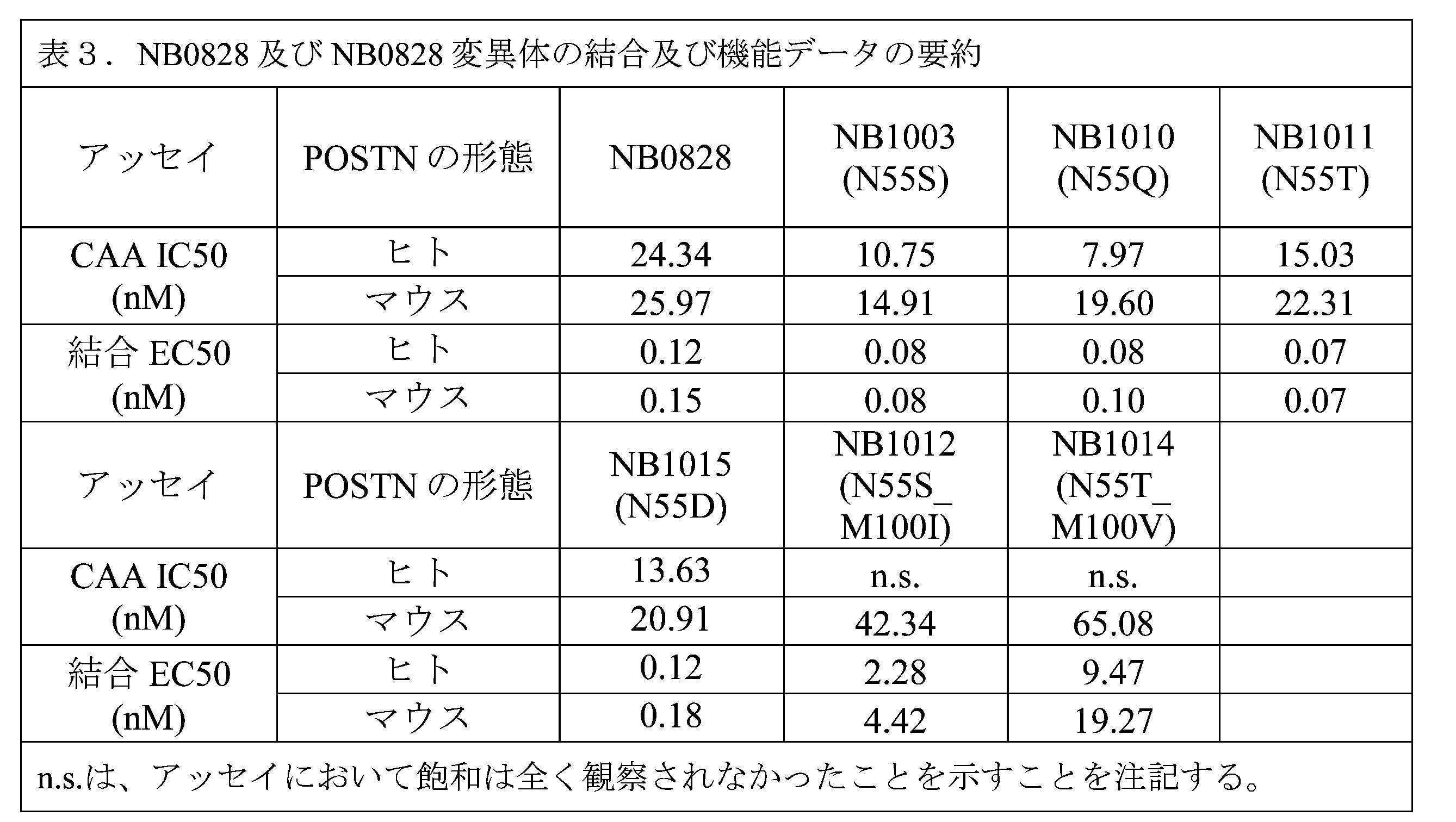
NB0828の結合領域を調べて、抗体をさらに特徴付けた。
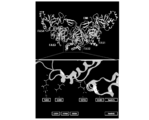
配列的にペリオスチンに最も近い相同タンパク質は、形質転換増殖因子β誘導タンパク質(BIGH3)であり、これは、該タンパク質のEMI-FAS4領域内に48%の配列相同率を有する。2つのタンパク質間の配列相同率は低いが、全体的なドメイン構造は非常に類似しており、1つのEMIドメインと4つの直列ファシクリン(FAS)ドメインを含んでいる。NB0828は、高い親和性で、ペリオスチンに結合するが、BIGH3には結合しない。NB0828の結合ドメインをさらに特徴付けるために、BIGH3/POSTNキメラタンパク質を作製し、ここで、ペリオスチンの各ドメインを、BIGH3の対応するドメインと置き換え、5つのBIGH/POSTNキメラを作製した(図10)。NB0828結合研究を、これらのタンパク質に対してELISAによって実施した。図11Aに示されているように、NB0828は、FAS2キメラを除いて、全てのBIGH3/POSTNキメラへの結合を保持している。POSTN FAS2ドメインをBIGH3 FAS2ドメインで置き換えた場合の、この観察可能な結合の減少は、NB0828がPOSTNのFAS2ドメインに結合することを示す。
ペリオスチンのFAS2ドメインは、132アミノ酸から構成される立体配座構造である。FAS2ドメイン間の様々な位置における単一のアミノ酸置換(アラニン)変異体を作製して、NB0828エピトープ又は結合領域をさらに規定し、重要な接触残基を同定した(表5)。公開されている結晶構造(Liu et al, 2018; PDB # 5YJG)を使用して、コンピューター分析ツールであるMOEにおける表面露出に基づいて、突然変異誘発のための残基を同定した。
ヒト、マウス、ラット、及びカニクイザルの種間のNB0828の結合親和性が決定された。NB0828の親和性は、octet redシステムを使用して決定された。簡潔に言えば、抗ヒトFc抗体(AHC)バイオセンサーを使用して、NB0828を捕捉し、その後、滴定量の組換えヒト、マウス、ラット、又はカニクイザルのペリオスチンと会合させた(100nM→0nM;1:2の希釈率)。組換えヒト、マウス、及びラットのペリオスチンは、R&Dシステム社から商業的に購入し、カニクイザルのペリオスチンは社内で作製された。結果は、4つの種間のペリオスチンに対するNB0828の親和性が、非常に類似し、0.1~0,5nMの範囲内であることを示す。このデータは、上記に詳述されたエピトープマッピング実験を強く支持する。なぜなら、記載のNB0828の結合ループにおける配列同一率が、4つの種間で100%であったからである。
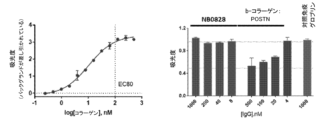
NB0828が、細胞外タンパク質であるテネイシンC及びI型コラーゲンに対するペリオスチンの結合を遮断するかどうかを決定するために、競合的ELISAアッセイを実施した。組換えヒトペリオスチン(2ng/mL)を、マキシソーププレート上に4℃で一晩かけてコーティングした。翌日、プレートをカゼインブロッキング緩衝液を用いて37℃で1時間かけてブロッキングした。組換えヒトテネイシンC及びヒトI型コラーゲンについての結合EC80を決定するために、タンパク質を、EZ-Link(商標)NHS-PEG4-ビオチン(フィッシャー社)を使用して10:1でビオチニル化し、各ビオチニル化タンパク質の滴定液をプレートに加え、室温で1時間インキュベートした。プレートをPBSTで4回洗浄し、その後、アビジン-HRP(セイヨウワサビペルオキシダーゼ)を使用して30分間かけて検出した。その後、プレートを、再度、4×PBSTで洗浄し、TMB基質及び1M HClを使用して展開した。各タンパク質のEC80は、グラフパッドプリズム7ソフトウェアを使用して決定された。競合的ELISAのために、NB0828の滴定液、対照IgG、又はPBSTをプレートに加え、室温で30分間振盪しながらインキュベートした。その後、プレートをPBSTで4回洗浄し、ビオチニル化テネイシンC(0.9nM、13A、左)、又はコラーゲン(100nM、13B、左)のいずれかのEC80結合濃度、又は予め混合された遮断対照をプレートに加えた。予め混合された遮断対照は、EC80濃度のビオチニル化タンパク質を、組換えヒトペリオスチンの滴定液と混合することによって調製され、室温で30分間振盪しながらインキュベートし、その後、プレートに加えた。その後、プレートを室温で1時間振盪しながらインキュベートし、洗浄し、検出し、上記のように展開した。
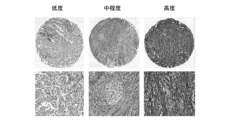
様々なヒトのがん間のペリオスチンの発現レベルを評価するために、免疫組織化学的検査(IHC)による有病率の研究を実施した。18個の腫瘍の徴候及び約750個の個々の試料を含んでいる、組織マイクロアレイ(TMA)を、ペリオスチンの発現について評価した。試料を、1:50に希釈された、抗ペリオスチン抗体のEPR20806(アブカム社の製造識別番号:ab215199、ロット識別番号:GR3192974-3)を用いて染色した。染色を、デジタル病理学法(HALO、Indica labs社)を使用して定量して、IHCスコアを計算した(IHCスコア=[低い強度の染色領域%*1]+[中程度の強度の染色領域%*2]+[高い強度の染色領域%*3])。低い/高いペリオスチンの染色についての切点は、全試料間のおよそのペリオスチンIHCスコア平均値に基づいて、ペリオスチンのIHCスコアは50であるとして計算された。有病率の研究は、試験された徴候間及び徴候内における、一連のペリオスチンの染色を示し、膵がん、乳がん、及び扁平細胞肺がんが最も高いレベルのペリオスチン染色を示した(図14A)。ペリオスチンの高い腫瘍は、全ての徴候において存在したが、出現頻度は異なっていた(図14A)。乳がんにおける代表的なペリオスチン発現の免疫組織化学的検査画像が、図14Bに示されている。要するに、これらのデータは、ペリオスチンが、複数の種類の腫瘍の間で広く発現されていることを実証する。
Claims (6)
- ペリオスチンに結合する組換え抗体又はその抗原結合断片であって、ここでの該抗体又はその抗原結合断片は、
a)配列番号1(GYTFTSYG)に示されるアミノ酸配列を含む免疫グロブリン重鎖CDR1(CDR-H1);
b)配列番号2(ISAYNGNT)に示されるアミノ酸配列を含む免疫グロブリン重鎖CDR2(CDR-H2);
c)配列番号9(DMLVVPFDY)に示されるアミノ酸配列を含む免疫グロブリン重鎖CDR3(CDR-H3);
d)配列番号10(SSDIGSNR)に示されるアミノ酸配列を含む免疫グロブリン軽鎖CDR1(CDR-L1);
e)配列番号11(SND)に示されるアミノ酸配列を含む免疫グロブリン軽鎖CDR2(CDR-L2);及び
f)配列番号12(AAWDDSLSTYV)に示されるアミノ酸配列を含む免疫グロブリン軽鎖CDR3(CDR-L3)
を含み、
組換え抗体又はその抗原結合断片が、Fab、F(ab)2 、又は一本鎖可変断片(scFv)であるか、又は含む、組換え抗体又はその抗原結合断片。 - 免疫グロブリン重鎖可変領域及び免疫グロブリン軽鎖可変領域:
a)ここでの免疫グロブリン重鎖可変領域は、配列番号13に示されるアミノ酸配列に対して少なくとも90%、95%、97%、99%同一であるか、又は100%同一である、アミノ酸配列を含み;そして
b)ここでの免疫グロブリン軽鎖可変領域は、配列番号14に示されるアミノ酸配列に対して少なくとも90%、95%、97%、99%同一であるか、又は100%同一である、アミノ酸配列を含み;
を含む、請求項1に記載の組換え抗体又はその抗原結合断片。 - 請求項1又は2に記載の組換え抗体又はその抗原結合断片をコードしている核酸。
- 請求項3に記載の核酸を含む、細胞株。
- 請求項1又は2に記載の組換え抗体又はその抗原結合断片と、薬学的に許容される賦形剤、担体、又は希釈剤とを含む、医薬組成物。
- がんの処置に使用するための、請求項1又は2に記載の組換え抗体若しくはその抗原結合断片、又は請求項5に記載の医薬組成物。
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201862779996P | 2018-12-14 | 2018-12-14 | |
| US62/779,996 | 2018-12-14 | ||
| US201962899075P | 2019-09-11 | 2019-09-11 | |
| US62/899,075 | 2019-09-11 | ||
| PCT/IB2019/001307 WO2020121059A1 (en) | 2018-12-14 | 2019-12-13 | Anti-periostin antibodies and uses thereof |
| JP2021534246A JP2022513228A (ja) | 2018-12-14 | 2019-12-13 | 抗ペリオスチン抗体及びその使用 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021534246A Division JP2022513228A (ja) | 2018-12-14 | 2019-12-13 | 抗ペリオスチン抗体及びその使用 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2023139243A JP2023139243A (ja) | 2023-10-03 |
| JP7681069B2 true JP7681069B2 (ja) | 2025-05-21 |
Family
ID=71075443
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021534246A Pending JP2022513228A (ja) | 2018-12-14 | 2019-12-13 | 抗ペリオスチン抗体及びその使用 |
| JP2023122675A Active JP7681069B2 (ja) | 2018-12-14 | 2023-07-27 | 抗ペリオスチン抗体及びその使用 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021534246A Pending JP2022513228A (ja) | 2018-12-14 | 2019-12-13 | 抗ペリオスチン抗体及びその使用 |
Country Status (22)
| Country | Link |
|---|---|
| US (1) | US20220010003A1 (ja) |
| EP (1) | EP3894439A4 (ja) |
| JP (2) | JP2022513228A (ja) |
| KR (1) | KR20210108972A (ja) |
| CN (1) | CN113631571B (ja) |
| AU (1) | AU2019395887A1 (ja) |
| BR (1) | BR112021010634A2 (ja) |
| CA (1) | CA3120059A1 (ja) |
| CL (1) | CL2021001297A1 (ja) |
| CO (1) | CO2021007444A2 (ja) |
| CR (1) | CR20210310A (ja) |
| DO (1) | DOP2021000113A (ja) |
| EC (1) | ECSP21043288A (ja) |
| IL (1) | IL283890B2 (ja) |
| JO (1) | JOP20210144A1 (ja) |
| MA (1) | MA54472A (ja) |
| MX (1) | MX2021007043A (ja) |
| PE (1) | PE20211962A1 (ja) |
| PH (1) | PH12021551352A1 (ja) |
| SA (1) | SA521422250B1 (ja) |
| SG (1) | SG11202103849TA (ja) |
| WO (1) | WO2020121059A1 (ja) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2021046634A1 (en) * | 2019-09-11 | 2021-03-18 | Boehringer Ingelheim Io Canada, Inc. | Methods of treating cancer by the use of pd-1 axis inhibitors and anti-periostin antibodies |
| WO2023036305A1 (zh) * | 2021-09-13 | 2023-03-16 | 沈阳眼产业技术研究院有限公司 | 抗periostin人源化单克隆抗体及其制备方法与应用 |
| KR20240038198A (ko) | 2022-09-15 | 2024-03-25 | 한남대학교 산학협력단 | 인슐린 분비 베타세포 분화 유도 항체 및 이를 유효성분으로 포함하는 대사성 질환 예방 또는 치료용 조성물 |
| WO2025149667A1 (en) | 2024-01-12 | 2025-07-17 | Pheon Therapeutics Ltd | Antibody drug conjugates and uses thereof |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009528820A (ja) | 2006-02-22 | 2009-08-13 | フィロジェン・エッセペア | 血管腫瘍マーカー |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL85035A0 (en) | 1987-01-08 | 1988-06-30 | Int Genetic Eng | Polynucleotide molecule,a chimeric antibody with specificity for human b cell surface antigen,a process for the preparation and methods utilizing the same |
| DE3883899T3 (de) | 1987-03-18 | 1999-04-22 | Sb2, Inc., Danville, Calif. | Geänderte antikörper. |
| AU675916B2 (en) | 1991-06-14 | 1997-02-27 | Genentech Inc. | Method for making humanized antibodies |
| EP0714409A1 (en) | 1993-06-16 | 1996-06-05 | Celltech Therapeutics Limited | Antibodies |
| AU3657899A (en) | 1998-04-20 | 1999-11-08 | James E. Bailey | Glycosylation engineering of antibodies for improving antibody-dependent cellular cytotoxicity |
| NZ539776A (en) | 1999-01-15 | 2006-12-22 | Genentech Inc | Polypeptide variants with altered effector function |
| US7361740B2 (en) | 2002-10-15 | 2008-04-22 | Pdl Biopharma, Inc. | Alteration of FcRn binding affinities or serum half-lives of antibodies by mutagenesis |
| US20080226635A1 (en) | 2006-12-22 | 2008-09-18 | Hans Koll | Antibodies against insulin-like growth factor I receptor and uses thereof |
| WO2013038696A1 (ja) * | 2011-09-15 | 2013-03-21 | 国立大学法人名古屋大学 | 胸膜中皮腫患者の早期発見のための分子マーカー及びその発現解析方法 |
| WO2014136910A1 (ja) * | 2013-03-08 | 2014-09-12 | 国立大学法人大阪大学 | ペリオスチンのExon-21部位によりコードされるペプチドに対する抗体及び該抗体を含む炎症関連疾患の予防又は治療用医薬組成物 |
| GB201419084D0 (en) * | 2014-10-27 | 2014-12-10 | Agency Science Tech & Res | Anti-PD-1 antibodies |
| CN108348589B (zh) * | 2015-09-18 | 2022-09-23 | 安驰肿瘤公司 | 治疗性cd47抗体 |
-
2019
- 2019-12-13 AU AU2019395887A patent/AU2019395887A1/en active Pending
- 2019-12-13 BR BR112021010634A patent/BR112021010634A2/pt unknown
- 2019-12-13 SG SG11202103849TA patent/SG11202103849TA/en unknown
- 2019-12-13 CN CN201980082813.0A patent/CN113631571B/zh active Active
- 2019-12-13 JP JP2021534246A patent/JP2022513228A/ja active Pending
- 2019-12-13 PE PE2021000873A patent/PE20211962A1/es unknown
- 2019-12-13 KR KR1020217022051A patent/KR20210108972A/ko active Pending
- 2019-12-13 MX MX2021007043A patent/MX2021007043A/es unknown
- 2019-12-13 MA MA054472A patent/MA54472A/fr unknown
- 2019-12-13 CA CA3120059A patent/CA3120059A1/en active Pending
- 2019-12-13 PH PH1/2021/551352A patent/PH12021551352A1/en unknown
- 2019-12-13 WO PCT/IB2019/001307 patent/WO2020121059A1/en not_active Ceased
- 2019-12-13 IL IL283890A patent/IL283890B2/en unknown
- 2019-12-13 EP EP19897138.4A patent/EP3894439A4/en active Pending
- 2019-12-13 CR CR20210310A patent/CR20210310A/es unknown
- 2019-12-13 JO JOP/2021/0144A patent/JOP20210144A1/ar unknown
- 2019-12-13 US US17/413,094 patent/US20220010003A1/en active Pending
-
2021
- 2021-05-18 CL CL2021001297A patent/CL2021001297A1/es unknown
- 2021-06-08 CO CONC2021/0007444A patent/CO2021007444A2/es unknown
- 2021-06-11 DO DO2021000113A patent/DOP2021000113A/es unknown
- 2021-06-13 SA SA521422250A patent/SA521422250B1/ar unknown
- 2021-06-14 EC ECSENADI202143288A patent/ECSP21043288A/es unknown
-
2023
- 2023-07-27 JP JP2023122675A patent/JP7681069B2/ja active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009528820A (ja) | 2006-02-22 | 2009-08-13 | フィロジェン・エッセペア | 血管腫瘍マーカー |
Non-Patent Citations (1)
| Title |
|---|
| Orecchia P, et al.,EUROPEAN JOURNAL OF CANCER,47,2011年,pp. 2221-2229 |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2019395887A1 (en) | 2021-05-20 |
| CA3120059A1 (en) | 2020-06-18 |
| US20220010003A1 (en) | 2022-01-13 |
| KR20210108972A (ko) | 2021-09-03 |
| JP2023139243A (ja) | 2023-10-03 |
| PH12021551352A1 (en) | 2022-05-11 |
| JOP20210144A1 (ar) | 2023-01-30 |
| EP3894439A1 (en) | 2021-10-20 |
| CL2021001297A1 (es) | 2022-01-07 |
| MX2021007043A (es) | 2021-08-11 |
| IL283890B2 (en) | 2025-11-01 |
| SA521422250B1 (ar) | 2023-12-21 |
| CR20210310A (es) | 2021-11-24 |
| CO2021007444A2 (es) | 2021-09-30 |
| DOP2021000113A (es) | 2021-09-30 |
| JP2022513228A (ja) | 2022-02-07 |
| MA54472A (fr) | 2022-03-23 |
| WO2020121059A1 (en) | 2020-06-18 |
| CN113631571A (zh) | 2021-11-09 |
| IL283890B1 (en) | 2025-07-01 |
| IL283890A (en) | 2021-07-29 |
| BR112021010634A2 (pt) | 2021-11-16 |
| PE20211962A1 (es) | 2021-10-04 |
| SG11202103849TA (en) | 2021-05-28 |
| ECSP21043288A (es) | 2021-09-30 |
| EP3894439A4 (en) | 2022-11-30 |
| CN113631571B (zh) | 2025-07-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TWI842707B (zh) | 最佳化抗-tl1a抗體 | |
| JP7681069B2 (ja) | 抗ペリオスチン抗体及びその使用 | |
| CN114502595B (zh) | 针对脊髓灰质炎病毒受体(pvr)的抗体及其用途 | |
| US20230030597A1 (en) | Methods of treating cancer by the use of pd-1 axis inhibitors and anti-periostin antibodies | |
| JP7642542B2 (ja) | Flt3アゴニスト抗体及びその使用 | |
| EA050347B1 (ru) | Антитела к периостину и их применение | |
| JP2024509369A (ja) | 抗pd-l1抗体及びその使用 | |
| CN114929741A (zh) | 针对lif的抗体及其用途 | |
| HK40073145A (en) | Antibodies against the poliovirus receptor (pvr) and uses thereof | |
| HK40073145B (zh) | 针对脊髓灰质炎病毒受体(pvr)的抗体及其用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230824 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20230824 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230906 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240716 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20241007 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20241204 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20250116 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20250415 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20250509 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7681069 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |