定義
特に定義されない限り、本明細書で使用されるすべての技術的および科学的用語は、当業者によって一般的に理解されるのと同じ意味を有する。すべての特許、出願、公開公報および他の刊行物は、出典明示によりその全体が本明細書に組み込まれる。本明細書にて、ある用語について複数の定義がある場合には、特記されない限り、このセクションの定義を優先する。
この中で、ならびに本明細書および添付した特許請求の範囲で使用される場合の、「a」および「an」なる不定冠詞および「the」なる定冠詞は、文脈が明らかにそうでないと示さない限り、複数ならびに単数の指示対象物を包含する。
本明細書で使用される場合の、「含む」および「包含する」なる語は、互換的に使用され得る。「含む」および「包含する」なる語は、言及されるように述べられた特徴または構成要素の存在を特定するものと解釈することもできるが、1または複数の特徴または構成要素あるいはその群の存在または付加を排除するものではない。加えて、「含む」および「包含する」なる語は、「からなる」なる語によって包含される例も含むものとする。その結果、「からなる」なる語は、「含む」および「包含する」なる語の代わりに使用され、本発明のさらに具体的な実施態様を提供することができる。
「からなる」なる語は、対象が、その構成する、記載された特徴または構成要素の少なくとも90%、95%、97%、98%または99%を有することを意味する。もう一つ別の実施態様において、「からなる」なる語は、達成されるべき技術的効果に不可欠でないものを除き、任意の後続する記載の範囲から他のいずれの特徴または構成要素も排除する。
本明細書で使用される場合の、「または」なる語は、任意の1つまたは任意の組み合わせを意味する、包括的な「または」として解釈されるべきである。従って、「A、BまたはC」は次のいずれか「A;B;C;AとB;AとC;BとC;A、BおよびC」を意味する。この定義の例外は、要素、機能、工程または行為の組み合わせが、ある意味で、本質的に相互に排他的である場合にのみ生じるであろう。
本明細書で使用される場合の、「医薬的に許容される塩」なる語は、無機酸および塩基、ならびに有機酸および塩基を含む、医薬的に許容される非毒性の酸または塩基より製造される塩をいう。本明細書で提供される化合物の適切な医薬的に許容される塩基付加塩には、アルミニウム、カルシウム、リチウム、マグネシウム、カリウム、ナトリウムおよび亜鉛より製造される金属塩、またはリジン、N,N’-ジベンジルエチレンジアミン、クロロプロカイン、コリン、ジエタノールアミン、エチレンジアミン、メグルミン(N-メチル-グルカミン)およびプロカインより製造される有機塩が含まれるが、これらに限定されない。適切な非毒性酸には、酢酸、アルギン酸、アントラニル酸、ベンゼンスルホン酸、安息香酸、カンファ-スルホン酸、クエン酸、エテンスルホン酸、ギ酸、フマル酸、フロ酸、ガラクツロン酸、グルコン酸、グルクロン酸、グルタミン酸、グリコール酸、臭化水素酸、塩酸、イセチオン酸、乳酸、マレイン酸、リンゴ酸、マンデル酸、メタンスルホン酸、ムチン酸、硝酸、パモ酸、パントテン酸、フェニル酢酸、リン酸、プロピオン酸、サリチル酸、ステアリン酸、コハク酸、サルファニル酸、硫酸、酒石酸、およびp-トルエンスルホン酸などの無機酸および有機酸が含まれるが、これらに限定されない。他も当該分野において周知であり、例えば、Remington’s Pharmaceutical Sciences, 18th eds., Mack Publishing, Easton PA(1990)またはRemington: The Science and Practice of Pharmacy, 19th eds., Mack Publishing, Easton PA(1995)を参照のこと。
本明細書で使用される場合で特に断らない限り、「立体異性体」または「立体異性的に(stereomerically)純粋な」なる語は、その化合物の他の立体異性体が実質的に含まれない、化合物の1つの立体異性体を意味する。例えば、1つのキラル中心を有する立体異性的に純粋な化合物は、該化合物の対極にあるエナンチオマーを実質的に含まないであろう。2つのキラル中心を有する立体異性的に純粋な化合物は、その化合物の他のジアステレオマーを実質的に含まないであろう。典型的な立体異性的に純粋な化合物は、約80重量%以上の該化合物の1の立体異性体と、約20重量%未満の該化合物の他の立体異性体とを、約90重量%以上の該化合物の1の立体異性体と、約10重量%未満の該化合物の他の立体異性体とを、約95重量%以上の該化合物の1の立体異性体と、約5重量%未満の該化合物の他の立体異性体とを、または約97重量%以上の該化合物の1の立体異性体と、約3重量%未満の該化合物の他の立体異性体とを含む。化合物はキラル中心を有することができ、ラセミ体、個々のエナンチオマーまたはジアステレオマー、およびその混合物として存在し得る。かかる異性体の形態はすべて、その混合物を含め、本明細書で提供される実施態様の中に含まれる。
かかる化合物の立体異性的に純粋な形態の使用、ならびにそれらの形態の混合物の使用は、本明細書で提供される実施態様に包含される。例えば、特定の化合物の等量または不等量のエナンチオマーを含む混合物は、本明細書で提供される方法および組成物に使用されてもよい。これらの異性体は、非対称的に合成されても、またはキラルカラムまたはキラル分割剤などの標準的な技術を用いて分割されてもよい。例えば、Jacques, J.ら、Enantiomers, Racemates and Resolutions(Wiley-Interscience, New York, 1981);Wilen, S. H.ら、Tetrahedron 33:2725(1977);Eliel, E. L.、Stereochemistry of Carbon Compounds(McGraw-Hill, NY, 1962);Wilen, S. H.、Tables of Resolving Agents and Optical Resolutions p. 268(E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN, 1972);Todd, M.、Separation Of Enantiomers:Synthetic Methods(Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany, 2014);Toda, F.、Enantiomer Separation: Fundamentals and Practical Methods(Springer Science & Business Media, 2007);Subramanian, G.、Chiral Separation Techniques: A Practical Approach(John Wiley & Sons, 2008);Ahuja, S.、Chiral Separation Methods for Pharmaceutical and Biotechnological Products(John Wiley & Sons, 2011)を参照のこと。
本明細書で提供される化合物はキラル中心を含有し得ると理解されるべきである。かかるキラル中心は(R)または(S)配置のいずれであってもよく、またはその混合物であってもよい。本明細書で提供される化合物のキラル中心はインビボにおいてエピマー化を受け得ると認識されるべきである。そのため、当業者であれば、化合物のその(R)形態での投与が、インビボにてエピマー化を受ける化合物については、その(S)形態の化合物の投与と均等であることを認識するであろう。
光学活性な(+)および(-)、(R)-および(S)-、または(D)-および(L)-異性体は、キラル合成物またはキラル試薬を用いて製造されてもよく、または、キラル固定相でのクロマトグラフィーなどの従来の技法を用いて分割されてもよい。
「互変異性体」は、相互に平衡状態にある化合物の異性体の形態をいう。異性体の形態の濃度は、例えば、化合物が固体であるか、有機溶液または水溶液中にあるかどうかで、化合物が存在する環境に依存するであろうし、それに応じて異なってもよい。例えば、水溶液では、ピラゾールは、以下の異性体の形態を示す可能性があり、それらは互いの互変異性体と称される。
当業者にとって容易に理解されるように、多種多様な官能基および他の構造は互変異性を示す可能性があり、化合物のすべての互変異性体は、本明細書で提供される化合物の範囲内にある。
本明細書で提供される化合物は、1または複数原子で、不自然な割合の原子同位体を含有し得ることにも留意すべきである。例えば、化合物は、例えば、トリチウム(3H)、ヨウ素-125(125I)、硫黄-35(35S)または炭素-14(14C)などの放射性同位体で放射性標識されてもよく、あるいは重水素(2H)、炭素-13(13C)または窒素-15(15N)などで同位体的に富むようにされてもよい。本明細書で使用される場合の、「アイソトポログ」は同位体に富む化合物である。「同位体に富む」なる語は、その原子の天然の同位体組成と異なる同位体組成を有する原子をいう。「同位体に富む」は、その原子の天然の同位体組成と異なる同位体組成を有する少なくとも1つの原子を含有する化合物をもいう。「同位体組成」なる語は、所定の原子について存在する各同位体の量をいう。放射性標識され、同位体に富む化合物は、治療剤、例えば、がん治療剤、研究用試剤、例えば、結合アッセイ試剤、および診断剤、例えば、インビボ画像診断剤として有用である。放射性であるか、そうでないかのいずれかの化合物のありとあらゆる同位体の変形も、本明細書にて提供される化合物の範囲内に含まれるものとする。いくつかの実施態様において、本明細書で提供されるのは、化合物のアイソトポログであり、例えば、アイソトポログは重水素、炭素-13(13C)および/または窒素-15(15N)に富む化合物である。本明細書で使用される場合の、「重水素化」は、少なくとも1個の水素(H)が重水素(Dまたは2Hで示される)で置換されている化合物を、すなわち、該化合物が少なくとも1つの位置で重水素に富むことを意味する。
立体異性体または同位体の組成とは独立して、本明細書で提供される化合物は、各々、本明細書で提供される医薬的に許容される塩のいずれかの形態にて提供され得ることが理解される。同様に、同位体の組成は、本明細書で提供される各化合物の立体異性体の組成とは独立して変化し得ることが理解される。さらには、同位体の組成は、個々の化合物またはその塩に存在するそれらの元素に限定される一方で、その組成はその個々の化合物の医薬的に許容される塩の選択とは独立して変化してもよい。
表示された構造と、その構造に付与された名称との間に矛盾がある場合、表示された構造がより重みがあることに留意すべきである。
本明細書で使用される場合で特に断らない限り、「治療する」なる語は、障害、疾患または症状の、または障害、疾患または症状に付随する1または複数の徴候の全体または一部を軽減すること、またはそれらの徴候のさらなる進行または悪化を遅らせるか、または停止させること、あるいは障害、疾患または症状自体の病因を軽減または根絶させることを意味する。
本明細書で使用される場合で特に断らない限り、「予防する」なる語は、障害、疾患または症状の全体または一部の発症、再発またはまん延を遅延および/または防止するか;対象が障害、疾患または症状を獲得することを妨げるか;あるいは対象が障害、疾患または症状を獲得するリスクを低減する方法を意味する。
本明細書で使用される場合で特に断らない限り、「管理する」なる語は、特定の疾患または障害に罹患したことがある患者においてその疾患または障害の再発を防止すること、該疾患または障害に罹患したことのある患者が、寛解状態を維持することを伸ばすこと、該患者の死亡率を下げること、および/または管理されている疾患または症状に付随する徴候の重篤度の低下または回避を維持することを包含する。
本明細書で使用される場合で特に断らない限り、化合物との関連で「効果的な量」なる語は、障害、疾患または症状、あるいはその徴候を治療、予防または管理することのできる量を意味する。
本明細書で使用される場合で特に断らない限り、「対象」または「患者」なる語は、動物を、ウシ、サル、ウマ、ヒツジ、ブタ、トリ、ターキー、ウズラ、ネコ、イヌ、マウス、ラット、ウサギまたはモルモットなどの動物を、1の実施態様にて哺乳動物を、もう一つ別の実施態様にてヒトを包含するが、これらに限定されない。
本明細書で使用される場合で特に断らない限り、「再発」なる語は、治療に応答し(例えば、完全奏功を達成し)、次に進行のあった、障害、疾患または症状をいう。治療は1または複数のラインの療法を含み得る。1の実施態様において、障害、疾患または症状は1または複数のラインの療法で以前に治療されたことがある。もう一つ別の実施態様において、障害、疾患または症状は、1、2、3または4ラインの療法で以前に治療されたことがある。1の実施態様において、障害、疾患または症状は、例えば、MZL(SMZLを含む)、BL、MM(PCLを含む)、MDS、AML(B細胞AMLを含む)、ALL、TCL(ALCLおよびセザリ症候群を含む)、またはHLなどの血液悪性腫瘍である。
本明細書で使用される場合で特に断らない限り、「難治性」なる語は、1または複数のラインの療法を含み得る先行の治療に応答しない、障害、疾患または症状をいう。1の実施態様において、障害、疾患または症状は、2またはそれ以上のラインの治療法で以前に治療されており、つい最近の全身性療法を含むレジメンに対して完全奏功(CR)であるとは言えない。1の実施態様において、障害、疾患または症状は、例えば、MZL(SMZLを含む)、BL、MM(PCLを含む)、MDS、AML(B細胞AMLを含む)、ALL、TCL(ALCLおよびセザリ症候群を含む)、またはHLなどの血液悪性腫瘍である。
がん、例えば、血液悪性腫瘍との関連で、阻害は、とりわけ、疾患進行の阻害、腫瘍成長の阻害、原発性腫瘍の減少、腫瘍関連の徴候の緩和、腫瘍分泌因子の阻害、原発性または二次性腫瘍の出現の遅延、原発性または二次性腫瘍の進行の遅れ、原発性または二次性腫瘍の発生の減少、疾患の二次効果の遅れまたはその重篤性の減少、腫瘍増殖の阻止および腫瘍の退縮、無憎悪期間(TTP)の増加、無憎悪生存期間(PFS)の増加、全生存期間(OS)の増加によって評価され得る。本明細書で使用されるOSは、治療の開始から何らかの原因で死亡するまでの時間を意味する。本明細書で使用される場合のTTPは、治療の開始から腫瘍の進行までの時間を意味し;TTPには死亡は含まれない。1の実施態様において、PFSは、治療の開始から腫瘍の進行または死亡までの時間を意味する。1の実施態様において、PFSは化合物の最初の投与から疾患の進行の第1の発生、または何らかの理由で死亡するまでの時間を意味する。1の実施態様において、PFSの割合は、カプラン-マイヤー推定法を用いて計算される。無事象生存期間(EFS)は治療の開始から、腫瘍の進行、何らかの理由での治療の中断、または死亡を含む、何らかの治療の失敗までの時間を意味する。1の実施態様において、全奏功率(ORR)は、応答を達成する患者の割合を意味する。1の実施態様において、ORRは、完全および部分応答を達成する患者の割合の合計を意味する。1の実施態様において、ORRは、最良応答>部分応答(PR)である患者の割合を意味する。1の実施態様において、奏功期間(DoR)は、応答を達成してから、再発または病勢進行までの時間である。1の実施態様において、DoRは、応答>部分応答(PR)を達成してから、再発または病勢進行までの時間である。1の実施態様において、DoRは、応答の第1の文書化から進行性疾患または死亡の第1の文書化までの時間である。1の実施態様において、DoRは、応答>部分応答(PR)の第1の文書化から、進行性疾患または死亡の第1の文書化までの時間である。1の実施態様において、応答までの時間(TTR)は、化合物の第1の投与から応答の第1の文書化までの時間を意味する。1の実施態様において、TTRは、化合物の第1の投与から、応答>部分応答(PR)の第1の文書化までの時間を意味する。極端に言えば、完全な阻害は、本明細書では、予防または化学予防と称される。この文脈で、「予防」なる語は、臨床的に明らかながんの発症を防止するか、または前臨床的に明らかな段階のがんの発症を防止することのいずれかを含む。また、この定義には、悪性細胞に形質転換することを防止するか、または前悪性細胞から悪性細胞への進行を阻止するか、逆行させることも包含されるものとする。これには、がんを発症するリスクのある人々に対する予防的処理が含まれる。
特定の実施態様において、安定した疾患またはその欠如は、患者の徴候の評価、身体検査、例えば、PDG-PET(フルオロデオキシグルコース-ポジトロン放出型断層撮影)、PET/CT(ポジトロン放出型断層撮影/コンピューター断層撮影)スキャン、脳および脊椎のMRI(磁気共鳴画像)を用いて画像化される腫瘍の可視化、CSF(脳脊髄液)、眼科検査、硝子体液サンプリング、網膜写真、骨髄評価および他の一般的に認知された評価様式などの当該分野において公知の方法により測定され得る。
本明細書で使用される場合で特に断らない限り、「共投与」および「併用」なる語は、1または複数の治療剤(例えば、本明細書にて提供される化合物、およびもう一つ別の抗がん剤または対処療法剤)を、具体的に時間を限定することなく、同時に、一緒に、または連続するかのいずれかで投与することを包含する。1の実施態様において、該治療剤は、同時に細胞内にまたは患者の体内に存在するか、あるいは同時にその生物学的または治療的効果を発揮する。1の実施態様において、該治療剤は同じ組成物または単位投与形の中にある。もう一つ別の実施態様において、該治療剤は別々の組成物または単位投与形の中にある。
「対処療法剤」なる語は、もう一つ別の治療剤による治療から由来する副作用を治療、防止または管理する、いずれの物質をもいう。
本明細書で使用される場合で特に断らない限り、「約」および「およそ」なる語は、組成物または剤形の成分の用量、量、または重量パーセントとの関連で使用される場合、その特定の用量、量、または重量パーセントから得られる薬理効果と等しい効果を提供すると、当業者によって理解される、用量、量、または重量パーセントを意味する。1の実施態様において、「約」および「およそ」なる語は、この文脈で使用される場合、その特定の用量、量、または重量パーセントの、30%内、20%内、15%内、10%内、または5%内の用量、量、または重量パーセントを意味する。
化合物
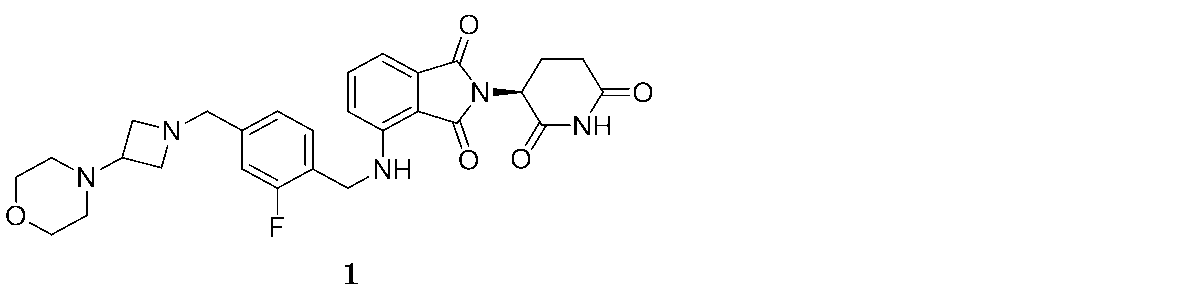
本明細書にて提供される方法にて用いるために提供されるのは、(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(「化合物1」と称される):
で示される化合物、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩である。本明細書で提供されるのは、本明細書で提供される治療方法にて用いるための化合物1である。
また、本明細書にて提供される方法にて用いるために提供されるのは、(R)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(「化合物2」と称される):
で示される化合物、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩である。本明細書で提供されるのは、本明細書で提供される治療方法にて用いるための化合物2である。
本明細書にて提供される方法にて用いるために提供されるのは、2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(「化合物3」と称される):
で示される化合物、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩である。本明細書で提供されるのは、本明細書で提供される治療方法にて用いるための化合物3である。
1の実施態様において、化合物1は本明細書で提供される方法にて使用される。1の実施態様において、化合物1の互変異性体は本明細書で提供される方法にて使用される。1の実施態様において、化合物1のアイソトポログは本明細書で提供される方法にて使用される。1の実施態様において、化合物1の医薬的に許容される塩は本明細書で提供される方法にて使用される。
1の実施態様において、化合物2は本明細書で提供される方法にて使用される。1の実施態様において、化合物2の互変異性体は本明細書で提供される方法にて使用される。1の実施態様において、化合物2のアイソトポログは本明細書で提供される方法にて使用される。1の実施態様において、化合物2の医薬的に許容される塩は本明細書で提供される方法にて使用される。
1の実施態様において、化合物3は本明細書で提供される方法にて使用される。1の実施態様において、化合物3のエナンチオマーは本明細書で提供される方法にて使用される。1の実施態様において、化合物3のエナンチオマーの混合物は本明細書で提供される方法にて使用される。1の実施態様において、化合物3の互変異性体は本明細書で提供される方法にて使用される。1の実施態様において、化合物3のアイソトポログは本明細書で提供される方法にて使用される。1の実施態様において、化合物3の医薬的に許容される塩は本明細書で提供される方法にて使用される。
治療および予防方法
I. 血液悪性腫瘍
1の実施態様において、本明細書で提供されるのは、血液悪性腫瘍を治療、予防または管理するために、2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を用いる方法である。
特定の実施態様において、血液悪性腫瘍は、白血病、リンパ腫、多発性骨髄腫、および骨髄異形成症候群(MDS)を含む、血液悪性腫瘍の形態である。
さらに具体的な実施態様において、血液悪性腫瘍は、辺縁帯リンパ腫(MZL)(脾臓辺縁帯リンパ腫(SMZL)を含む)、バーキットリンパ腫(BL)、多発性骨髄腫(MM)(形質細胞白血病(PCL)を含む)、骨髄異形成症候群(MDS)、急性骨髄性白血病(AML)(B細胞AMLを含む)、急性リンパ性白血病(ALL)、T細胞リンパ腫(TCL)(未分化大細胞リンパ腫(ALCL)およびセザリ症候群を含む)、またはホジキンリンパ腫(HL)である。
特定の実施態様において、血液悪性腫瘍は非ホジキンリンパ腫(NHL)以外である。1の実施態様において、血液悪性腫瘍は、びまん性大細胞型B細胞リンパ腫(DLBCL)、濾胞性リンパ腫(FL)、マントル細胞リンパ腫(MCL)、または原発性中枢神経系リンパ腫(PCNSL)以外である。
特定の実施態様において、血液悪性腫瘍は慢性リンパ性白血病/小リンパ球性リンパ腫(CLL/SLL)以外である。
1の実施態様において、血液悪性腫瘍はMZLである。1の実施態様において、MZLはSMZLである。
1の実施態様において、血液悪性腫瘍はBLである。
1の実施態様において、血液悪性腫瘍はMMである。1の実施態様において、MMはPCLである。
1の実施態様において、血液悪性腫瘍はMDSである。
1の実施態様において、血液悪性腫瘍はAMLである。1の実施態様において、AMLはB細胞AMLである。
1の実施態様において、血液悪性腫瘍はALLである。
1の実施態様において、血液悪性腫瘍はTCLである。1の実施態様において、TCLはALCLである。1の実施態様において、TCLはセザリー症候群である。
1の実施態様において、血液悪性腫瘍はHLである。
1の実施態様において、本明細書で提供されるのは、血液悪性腫瘍を治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含み、ここで該血液悪性腫瘍がMZL、BL、MM、MDS、AML、ALL、TCL、またはHLである、方法である。
1の実施態様において、本明細書で提供されるのは、血液悪性腫瘍を治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含み、ここで該血液悪性腫瘍がMZL、BL、MM、MDS、AML、ALL、TCL、またはHLである、方法である。
1の実施態様において、本明細書で提供されるのは、血液悪性腫瘍を治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含み、ここで該血液悪性腫瘍がMZL、BL、MM、MDS、AML、ALL、TCL、またはHLである、方法である。
1の実施態様において、本明細書で提供されるのは、血液悪性腫瘍を予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、血液悪性腫瘍を予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、血液悪性腫瘍を予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、血液悪性腫瘍を管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、血液悪性腫瘍を管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、血液悪性腫瘍を管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、対象は1または複数のラインの療法に失敗したことがある。1の実施態様において、該対象は少なくとも1つの先行療法に失敗したことがある。1の実施態様において、該対象は少なくとも2つの先行療法に失敗したことがある。
1の実施態様において、血液悪性腫瘍は新たに診断された血液悪性腫瘍である。1の実施態様において、該血液悪性腫瘍は再発性または難治性血液悪性腫瘍(R/R 血液悪性腫瘍)である。
1の実施態様において、本明細書で提供されるのは、新たに診断された血液悪性腫瘍を治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断された血液悪性腫瘍を治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断された血液悪性腫瘍を治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断される血液悪性腫瘍を予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、新たに診断された血液悪性腫瘍を管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性血液悪性腫瘍を治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性血液悪性腫瘍を治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性血液悪性腫瘍を治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性血液悪性腫瘍を予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、再発性または難治性血液悪性腫瘍を管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、完全奏功、部分奏功、または安定疾患を達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、血液悪性腫瘍の患者に投与することを含む、方法である。1の実施態様において、完全奏功(CR)を確認するために、骨髄評価を受ける対象にて、微小残存病変(MRD)検出が行われてもよい。1の実施態様において、本明細書で提供されるのは、患者での微小残存病変(MRD)陰性を達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、血液悪性腫瘍の患者に投与することを含む、方法である。1の実施態様において、MRD陰性は末梢血および/または骨髄で測定される。1の実施態様において、MRD陰性は最低3ヶ月続く。もう一つ別の実施態様において、本明細書で提供されるのは、患者での全生存期間、無増悪生存期間、無イベント生存期間、無増悪期間、または無病生存期間の増加を達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、血液悪性腫瘍の患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、患者での全生存期間の増加を達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、血液悪性腫瘍の患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、患者での無増悪生存期間の増加を達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、血液悪性腫瘍の患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、患者での無イベント生存期間の増加を達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、血液悪性腫瘍の患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、患者での無増悪期間の増加を達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、血液悪性腫瘍の患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、患者での無病生存期間の増加を達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、血液悪性腫瘍の患者に投与することを含む、方法である。
本明細書で提供される方法は、患者の年齢に関係なく、患者を治療することを包含する。いくつかの実施態様において、対象は18以上である。他の実施態様において、対象は18、25、35、40、45、50、55、60、65、または70歳以上である。他の実施態様において、対象は65歳未満である。他の実施態様において、対象は65歳以上である。
II. リンパ腫
1. 辺縁帯リンパ腫(MZL)
1の実施態様において、本明細書で提供されるのは、MZLを治療、予防または管理するのに、2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を用いる方法である。
1の実施態様において、MZLはSMZLである。
1の実施態様において、本明細書で提供されるのは、MZLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、MZLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、MZLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、MZLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、MZLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、MZLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、MZLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、MZLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、MZLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、対象は1または複数のラインの療法に失敗したことがある。1の実施態様において、該対象は少なくとも1つの先行療法に失敗したことがある。1の実施態様において、該対象は少なくとも2つの先行療法に失敗したことがある。
1の実施態様において、MZLは新たに診断されたMZLである。1の実施態様において、該MZLは再発性または難治性MZL(R/R MZL)である。1の実施態様において、該SMZLは新たに診断されたSMZLである。1の実施態様において、該SMZLは再発性または難治性SMZL(R/R SMZL)である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたMZLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されたSMZLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたMZLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されたSMZLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたMZLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されたSMZLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されるMZLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されるSMZLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、新たに診断されたMZLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、新たに診断されたSMZLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性MZLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性SMZLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性MZLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性SMZLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性MZLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性SMZLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性MZLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性SMZLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、再発性または難治性MZLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、再発性または難治性SMZLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、完全奏功、部分奏功、または安定疾患を達成する方法であって、治療的に効果的な量の本明細書に記載される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MZLの患者に投与することを含む、方法である。1の実施態様において、完全奏功(CR)の確認のために骨髄の評価を受ける対象にて、微小残存病変(MRD)の検出がなされてもよい。1の実施態様において、本明細書で提供されるのは、患者において微小残存病変(MRD)の陰性を達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MZLの患者に投与することを含む、方法である。1の実施態様において、MRDの陰性は末梢血および/または骨髄において測定される。1の実施態様において、MRDの陰性は最低3カ月続く。もう一つ別の実施態様において、本明細書で提供されるのは、全生存期間、無増悪生存期間、無イベント生存期間、無増悪期間、または無病生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MZLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、全生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MZLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無増悪生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MZLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無イベント生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MZLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無増悪期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MZLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無病生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MZLの患者に投与することを含む、方法である。
2. バーキットリンパ腫(BL)
1の実施態様において、本明細書で提供されるのは、BLを治療、予防または管理するのに、2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を用いる方法である。
1の実施態様において、本明細書で提供されるのは、BLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、BLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、BLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、BLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、BLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、BLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、BLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、BLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、BLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、対象は1または複数のラインの療法に失敗したことがある。1の実施態様において、該対象は少なくとも1つの先行療法に失敗したことがある。1の実施態様において、該対象は少なくとも2つの先行療法に失敗したことがある。
1の実施態様において、BLは新たに診断されたBLである。1の実施態様において、BLは再発性または難治性BL(R/R BL)である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたBLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたBLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたBLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されるBLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、新たに診断されたBLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性BLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性BLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性BLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性BLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、再発性または難治性BLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、完全奏功、部分奏功、または安定疾患を達成する方法であって、治療的に効果的な量の本明細書に記載される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、BLの患者に投与することを含む、方法である。1の実施態様において、完全奏功(CR)の確認のために骨髄の評価を受ける対象にて、微小残存病変(MRD)の検出がなされてもよい。1の実施態様において、本明細書で提供されるのは、患者において微小残存病変(MRD)の陰性を達成する方法であって、治療的に効果的な量の本明細書に記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、BLの患者に投与することを含む、方法である。1の実施態様において、MRDの陰性は末梢血および/または骨髄において測定される。1の実施態様において、MRDの陰性は最低3カ月続く。もう一つ別の実施態様において、本明細書で提供されるのは、全生存期間、無増悪生存期間、無イベント生存期間、無増悪期間、または無病生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で記載される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、BLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、全生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、BLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無増悪生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、BLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無イベント生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、BLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無増悪期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書にて記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、BLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無病生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書に記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、BLの患者に投与することを含む、方法である。
3. T細胞リンパ腫(TCL)
1の実施態様において、本明細書で提供されるのは、TCLを治療、予防または管理するのに、2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を用いる方法である。
特定の実施態様において、TCLはALCL(ALCL)である。特定の実施態様において、TCLはセザリー症候群である。
1の実施態様において、本明細書で提供されるのは、TCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、TCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、TCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、TCLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、TCLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、TCLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、TCLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、TCLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、TCLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、対象は1または複数のラインの療法に失敗したことがある。1の実施態様において、該対象は少なくとも1つの先行療法に失敗したことがある。1の実施態様において、該対象は少なくとも2つの先行療法に失敗したことがある。
1の実施態様において、TCLは新たに診断されたTCLである。1の実施態様において、TCLは再発性または難治性TCL(R/R TCL)である。1の実施態様において、ALCLは新たに診断されたALCLである。1の実施態様において、ALCLは再発性または難治性ALCL(R/R ALCL)である。1の実施態様において、セザリー症候群は新たに診断されたセザリー症候群である。1の実施態様において、セザリー症候群は再発性または難治性セザリー症候群(R/R セザリー症候群)である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたTCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されたALCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されたセザリー症候群を治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたTCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されたALCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されたセザリー症候群を治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたTCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されたALCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されたセザリー症候群を治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されるTCLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されるALCLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されるセザリー症候群を予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、新たに診断されたTCLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、新たに診断されたALCLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、新たに診断されたセザリー症候群を管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性TCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性ALCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性セザリー症候群を治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性TCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性ALCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性セザリー症候群を治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性TCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性ALCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性セザリー症候群を治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性TCLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性ALCLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性セザリー症候群を予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、再発性または難治性TCLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、再発性または難治性ALCLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、再発性または難治性セザリー症候群を管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、完全奏功、部分奏功、または安定疾患を達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、TCLの患者に投与することを含む、方法である。1の実施態様において、完全奏功(CR)の確認のために骨髄の評価を受ける対象にて、微小残存病変(MRD)の検出がなされてもよい。1の実施態様において、本明細書で提供されるのは、患者において微小残存病変(MRD)の陰性を達成する方法であって、治療的に効果的な量の本明細書に記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、TCLの患者に投与することを含む、方法である。1の実施態様において、MRDの陰性は末梢血および/または骨髄において測定される。1の実施態様において、MRDの陰性は最低3カ月続く。もう一つ別の実施態様において、本明細書で提供されるのは、全生存期間、無増悪生存期間、無イベント生存期間、無増悪期間、または無病生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で記載される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、TCLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、全生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、TCLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無増悪生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で記載される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、TCLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無イベント生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で記載される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、TCLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無増悪期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書にて記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、TCLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無病生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書に記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、TCLの患者に投与することを含む、方法である。
4. ホジキンリンパ腫(HL)
1の実施態様において、本明細書で提供されるのは、HLを治療、予防または管理するのに、2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を用いる方法である。
1の実施態様において、本明細書で提供されるのは、HLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、HLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、HLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、HLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、HLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、HLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、HLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、HLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、HLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、対象は1または複数のラインの療法に失敗したことがある。1の実施態様において、該対象は少なくとも1つの先行療法に失敗したことがある。1の実施態様において、該対象は少なくとも2つの先行療法に失敗したことがある。
1の実施態様において、HLは新たに診断されたHLである。1の実施態様において、HLは再発性または難治性HL(R/R HL)である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたHLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたHLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたHLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されるHLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、新たに診断されたHLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性HLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性HLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性HLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性HLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、再発性または難治性HLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、完全奏功、部分奏功、または安定疾患を達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、HLの患者に投与することを含む、方法である。1の実施態様において、完全奏功(CR)の確認のために骨髄の評価を受ける対象にて、微小残存病変(MRD)の検出がなされてもよい。1の実施態様において、本明細書で提供されるのは、患者において微小残存病変(MRD)の陰性を達成する方法であって、治療的に効果的な量の本明細書に記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、HLの患者に投与することを含む、方法である。1の実施態様において、MRDの陰性は末梢血および/または骨髄において測定される。1の実施態様において、MRDの陰性は最低3カ月続く。もう一つ別の実施態様において、本明細書で提供されるのは、全生存期間、無増悪生存期間、無イベント生存期間、無増悪期間、または無病生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で記載される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、HLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、全生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、HLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無増悪生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、HLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無イベント生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、HLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無増悪期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書にて記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、HLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無病生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書に記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、HLの患者に投与することを含む、方法である。
III. 多発性骨髄腫(MM)
1の実施態様において、本明細書で提供されるのは、MMを治療、予防または管理するのに、2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を用いる方法である。
特定の実施態様において、MMはPCLである。
1の実施態様において、本明細書で提供されるのは、MMを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、MMを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、MMを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、MMを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、MMを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、MMを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、MMを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、MMを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、MMを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、対象は1または複数のラインの療法に失敗したことがある。1の実施態様において、該対象は少なくとも1つの先行療法に失敗したことがある。1の実施態様において、該対象は少なくとも2つの先行療法に失敗したことがある。
1の実施態様において、MMは新たに診断されたMMである。1の実施態様において、MMは再発性または難治性MM(R/R MM)である。1の実施態様において、PCLは新たに診断されたPCLである。1の実施態様において、PCLは再発性または難治性PCL(R/R PCL)である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたMMを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されたPCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたMMを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されたPCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたMMを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されたPCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されるMMを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されるPCLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、新たに診断されたMMを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、新たに診断されたPCLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性MMを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性PCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性MMを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性PCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性MMを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性PCLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性MMを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性PCLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、再発性または難治性MMを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、再発性または難治性PCLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、完全奏功、部分奏功、または安定疾患を達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MMの患者に投与することを含む、方法である。1の実施態様において、完全奏功(CR)の確認のために骨髄の評価を受ける対象にて、微小残存病変(MRD)の検出がなされてもよい。1の実施態様において、本明細書で提供されるのは、患者において微小残存病変(MRD)の陰性を達成する方法であって、治療的に効果的な量の本明細書に記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MMの患者に投与することを含む、方法である。1の実施態様において、MRDの陰性は末梢血および/または骨髄において測定される。1の実施態様において、MRDの陰性は最低3カ月続く。もう一つ別の実施態様において、本明細書で提供されるのは、全生存期間、無増悪生存期間、無イベント生存期間、無増悪期間、または無病生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で記載される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MMの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、全生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書に記載される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MMの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無増悪生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MMの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無イベント生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MMの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無増悪期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書にて記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MMの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無病生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書に記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MMの患者に投与することを含む、方法である。
IV. 白血病
1. 急性骨髄性白血病(AML)
1の実施態様において、本明細書で提供されるのは、AMLを治療、予防または管理するのに、2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を用いる方法である。
特定の実施態様において、AMLはB細胞AMLである。
1の実施態様において、本明細書で提供されるのは、AMLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、AMLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、AMLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、AMLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、AMLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、AMLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、AMLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、AMLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、AMLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、対象は1または複数のラインの療法に失敗したことがある。1の実施態様において、該対象は少なくとも1つの先行療法に失敗したことがある。1の実施態様において、該対象は少なくとも2つの先行療法に失敗したことがある。
1の実施態様において、AMLは新たに診断されたAMLである。1の実施態様において、AMLは再発性または難治性AML(R/R AML)である。1の実施態様において、B細胞AMLは新たに診断されたB細胞AMLである。1の実施態様において、B細胞AMLは再発性または難治性B細胞AML(R/R B細胞AML)である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたAMLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されたB細胞AMLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたAMLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されたB細胞AMLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたAMLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されたB細胞AMLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されるAMLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、新たに診断されるB細胞AMLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、新たに診断されたAMLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、新たに診断されたB細胞AMLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性AMLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性B細胞AMLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性AMLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性B細胞AMLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性AMLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性B細胞AMLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性AMLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、再発性または難治性B細胞AMLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、再発性または難治性AMLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、再発性または難治性B細胞AMLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、完全奏功、部分奏功、または安定疾患を達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、AMLの患者に投与することを含む、方法である。1の実施態様において、完全奏功(CR)の確認のために骨髄の評価を受ける対象にて、微小残存病変(MRD)の検出がなされてもよい。1の実施態様において、本明細書で提供されるのは、患者において微小残存病変(MRD)の陰性を達成する方法であって、治療的に効果的な量の本明細書に記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、AMLの患者に投与することを含む、方法である。1の実施態様において、MRDの陰性は末梢血および/または骨髄において測定される。1の実施態様において、MRDの陰性は最低3カ月続く。もう一つ別の実施態様において、本明細書で提供されるのは、全生存期間、無増悪生存期間、無イベント生存期間、無増悪期間、または無病生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で記載される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、AMLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、全生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、AMLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無増悪生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、AMLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無イベント生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書に記載される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、AMLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無増悪期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書にて記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、AMLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無病生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書に記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、AMLの患者に投与することを含む、方法である。
2. 急性リンパ性白血病(ALL)
1の実施態様において、本明細書で提供されるのは、ALLを治療、予防または管理するのに、2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を用いる方法である。
1の実施態様において、本明細書で提供されるのは、ALLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、ALLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、ALLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、ALLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、ALLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、ALLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、ALLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、ALLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、ALLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、対象は1または複数のラインの療法に失敗したことがある。1の実施態様において、該対象は少なくとも1つの先行療法に失敗したことがある。1の実施態様において、該対象は少なくとも2つの先行療法に失敗したことがある。
1の実施態様において、ALLは新たに診断されたALLである。1の実施態様において、ALLは再発性または難治性ALL(R/R ALL)である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたALLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたALLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたALLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されるALLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、新たに診断されたALLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性ALLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性ALLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性ALLを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性ALLを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、再発性または難治性ALLを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、完全奏功、部分奏功、または安定疾患を達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、ALLの患者に投与することを含む、方法である。1の実施態様において、完全奏功(CR)の確認のために骨髄の評価を受ける対象にて、微小残存病変(MRD)の検出がなされてもよい。1の実施態様において、本明細書で提供されるのは、患者において微小残存病変(MRD)の陰性を達成する方法であって、治療的に効果的な量の本明細書に記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、ALLの患者に投与することを含む、方法である。1の実施態様において、MRDの陰性は末梢血および/または骨髄において測定される。1の実施態様において、MRDの陰性は最低3カ月続く。もう一つ別の実施態様において、本明細書で提供されるのは、全生存期間、無増悪生存期間、無イベント生存期間、無増悪期間、または無病生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で記載される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、ALLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、全生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書に記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、ALLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無増悪生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、ALLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無イベント生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、ALLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無増悪期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書にて記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、ALLの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無病生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書に記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、ALLの患者に投与することを含む、方法である。
V. 骨髄異形成症候群(MDS)
1の実施態様において、本明細書で提供されるのは、MDSを治療、予防または管理するのに、2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を用いる方法である。
1の実施態様において、本明細書で提供されるのは、MDSを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、MDSを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、MDSを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の式:
で示される化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、MDSを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、MDSを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、MDSを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、MDSを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、MDSを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。1の実施態様において、本明細書で提供されるのは、MDSを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、対象は1または複数のラインの療法に失敗したことがある。1の実施態様において、該対象は少なくとも1つの先行療法に失敗したことがある。1の実施態様において、該対象は少なくとも2つの先行療法に失敗したことがある。
1の実施態様において、MDSは新たに診断されたMDSである。1の実施態様において、MDSは再発性または難治性MDS(R/R MDS)である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたMDSを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたMDSを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されたMDSを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、新たに診断されるMDSを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、新たに診断されたMDSを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性MDSを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物1、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性MDSを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物2、またはその互変異性体、アイソトポログ、もしくは医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性MDSを治療する方法であって、その治療を必要とする対象に、治療的に効果的な量の化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
1の実施態様において、本明細書で提供されるのは、再発性または難治性MDSを予防する方法であって、その予防を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、再発性または難治性MDSを管理する方法であって、その管理を必要とする対象に、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を投与することを含む、方法である。
もう一つ別の実施態様において、本明細書で提供されるのは、完全奏功、部分奏功、または安定疾患を達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MDSの患者に投与することを含む、方法である。1の実施態様において、完全奏功(CR)の確認のために骨髄の評価を受ける対象にて、微小残存病変(MRD)の検出がなされてもよい。1の実施態様において、本明細書で提供されるのは、患者において微小残存病変(MRD)の陰性を達成する方法であって、治療的に効果的な量の本明細書に記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MDSの患者に投与することを含む、方法である。1の実施態様において、MRDの陰性は末梢血および/または骨髄において測定される。1の実施態様において、MRDの陰性は最低3カ月続く。もう一つ別の実施態様において、本明細書で提供されるのは、全生存期間、無増悪生存期間、無イベント生存期間、無増悪期間、または無病生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で記載される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MDSの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、全生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MDSの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無増悪生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MDSの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無イベント生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書で提供される化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MDSの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無増悪期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書にて記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MDSの患者に投与することを含む、方法である。もう一つ別の実施態様において、本明細書で提供されるのは、無病生存期間の増加を患者にて達成する方法であって、治療的に効果的な量の本明細書に記載の化合物、例えば、化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を、MDSの患者に投与することを含む、方法である。
医薬組成物および投与経路
本明細書で提供される化合物は、対象に、カプセル、マイクロカプセル、錠剤、顆粒、散剤、トローチ、ピル、坐剤、注射液、懸濁液、シロップ、パッチ、クリーム、ローション、軟膏、ゲル、スプレー、液剤およびエマルジョンなどの従来の形態の製剤にて経口的に、局所的に、または非経口的に投与され得る。適切な製剤は、希釈剤(例、シュークロース、澱粉、マンニトール、ソルビトール、ラクトース、グルコース、セルロース、タルク、リン酸カルシウムまたは炭酸カルシウム)、結合剤(例、セルロース、メチルセルロース、ヒドロキシメチルセルロース、ポリプロピルピロリドン、ポリビニルピロリドン、ゼラチン、アラビアガム、ポリエチレングリコール、シュークロースまたは澱粉)、崩壊剤(例、澱粉、カルボキシメチルセルロース、ヒドロキシプロピルスターチ、低置換度ヒドロキシプロピルセルロース、重炭酸ナトリウム、リン酸カルシウムまたはクエン酸カルシウム)、滑沢剤(例、ステアリン酸マグネシウム、軽質無水ケイ酸、タルクまたはラウリル硫酸ナトリウム)、矯味矯臭剤(例、クエン酸、メントール、グリシンまたはオレンジ粉末)、保存剤(例、安息香酸ナトリウム、重亜硫酸ナトリウム、メチルパラベンまたはプロピルパラベン)、安定剤(例、クエン酸、クエン酸ナトリウムまたは酢酸)、沈殿防止剤(例、メチルセルロース、ポリビニルピロリドンまたはステアリン酸アルミニウム)、分散剤(例、ヒドロキシプロピルメチルセルロース)、水、およびベースワックス(例、ココアバター、白色ペトロラクタムまたはポリエチレングリコール)などの従来の有機または無機添加剤を用いて、一般的に利用される方法によって製造され得る。医薬組成物中の化合物の効果的な量は、経口および非経口投与の両方にて、所望の効果を発揮するであろうレベルとすることができる。
本明細書で提供される化合物は経口投与され得る。1の実施態様において、経口投与される場合、本明細書で提供される化合物は食事および水と一緒に投与される。もう一つ別の実施態様において、本明細書で提供される化合物は水または果汁(例、リンゴ果汁またはオレンジ果汁)に分散され、溶液または懸濁液として経口投与される。
本明細書で提供される化合物はまた、皮内、筋肉内、腹腔内、皮膚を通して、静脈内、皮下、経鼻、表皮内、舌下、脳内、膣内、経皮、直腸内、粘膜、吸入により、あるいは耳、鼻、眼または皮膚に局所的に投与され得る。投与方法は医療従事者の裁量に委ねられ、病状の部位にいくらかは依存し得る。
1の実施態様において、本明細書で提供されるのは、付加的な賦形剤なしで本明細書で提供される化合物を含有するカプセルである。もう一つ別の実施態様において、本明細書で提供されるのは、効果的な量の本明細書で提供される化合物および医薬的に許容される賦形剤を含む組成物であって、ここで医薬的に許容される賦形剤は、希釈剤、結合剤、崩壊剤、滑沢剤、潤滑剤またはそれらの混合物を含むことができる、組成物である。1の実施態様において、組成物は医薬組成物である。
組成物は、錠剤、咀嚼錠、カプセル、液剤、非経口溶液、トローチ、坐剤および懸濁液等の形態とすることができる。組成物は、一日量を、または一日量の都合のよい分量を、単一の錠剤またはカプセルと、あるいは都合のよい容量の液体とすることができる、投与単位にて含有するように処方され得る。1の実施態様において、液剤は水溶性の塩から製造される。一般に、すべての組成物は医薬化学における既知の方法に従って製造される。カプセルは、本明細書で提供される化合物を適切な賦形剤と混合し、適量の混合物をカプセルに充填することによって製造され得る。通常の賦形剤には、限定されないが、多くの種類の澱粉、粉末セルロース、特に結晶性および微結晶性セルロースなどの不活性な粉末物質、フルクトース、マンニトールおよびシュークロースなどの糖類、穀物および同様の食用粉末が含まれる。カプセル充填物はまた、湿式造粒または乾式造粒によっても製造され得る。
カプセル製剤では、粉末がピンに粘着するのを防止するために、滑沢剤が必要とされるかもしれない。滑沢剤は、タルク、ステアリン酸マグネシウムおよびカルシウム、ステアリルフマル酸ナトリウム、ステアリン酸、および硬化植物油などの滑りやすい固体から選択され得る。崩壊剤は、水を含むと膨潤し、カプセルスラグを破壊し、化合物を放出させる、物質である。それらは、澱粉、クレイ、セルロース、クロスポビドン、クロスカルメロースナトリウム、澱粉グリコール酸ナトリウム、アルギンおよびガムを包含する。より詳細には、トウモロコシおよびイモ澱粉、メチルセルロース、寒天、ベントナイト、木材セルロース、粉末天然海綿体、カチオン交換樹脂、アルギン酸、グアーガム、シトラスパルプ、およびカルボキシメチルセルロースが、例えば、ラウリル硫酸ナトリウムも同様に、使用され得る。また、二酸化ケイ素、タルク、およびケイ酸カルシウムを含む、滑沢剤も使用され得る。
錠剤は、直接圧縮、湿式造粒または乾式造粒によって製造され得る。それらの製剤には、通常、化合物の他に希釈剤、結合剤、滑沢剤および崩壊剤が配合される。典型的な希釈剤には、例えば、種々の型の澱粉、ラクトース、マンニトール、カオリン、リン酸または硫酸カルシウム、塩化ナトリウムなどの無機塩および粉末糖が含まれる。粉末状のセルロース誘導体も有用である。典型的な錠剤結合剤は、澱粉、ゼラチンおよびラクトース、フルクトース、グルコース等などの糖類などの物質である。アカシア、アルギン酸塩、メチルセルロース、ポリビニルピロリドン等を含む、天然および合成ガムも便利である。ポリエチレングリコール、エチルセルロースおよびワックスも結合剤として供することができる。
錠剤製剤では、錠剤およびパンチがダイにて粘着するのを防止するために、滑沢剤が必要とされるかもしれない。滑沢剤は、タルク、ステアリン酸マグネシウムおよびカルシウム、ステアリルフマル酸ナトリウム、ステアリン酸、および硬化植物油などの滑りやすい固体から選択され得る。錠剤用崩壊剤は、水を含むと膨潤して錠剤を破壊し、化合物を放出させる物質である。それらは、澱粉、クレイ、セルロース、クロスポビドン、クロスカルメロースナトリウム、澱粉グリコール酸ナトリウム、アルギンおよびガムを包含する。より詳細には、トウモロコシおよびイモ澱粉、メチルセルロース、寒天、ベントナイト、木材セルロース、粉末天然海綿体、カチオン交換樹脂、アルギン酸、グアーガム、シトラスパルプ、およびカルボキシメチルセルロースが、例えば、ラウリル硫酸ナトリウムも同様に、使用され得る。二酸化ケイ素、タルク、およびケイ酸カルシウムを含む、滑沢剤も使用され得る。錠剤は、フレーバーおよびシーラントとして糖を用いて、あるいは錠剤の溶解特性を修飾するのにフィルム形成保護剤を用いてコーティングされ得る。該組成物はまた、例えば、マンニトールなどの物質を処方に用いることにより、咀嚼錠として製剤化され得る。
本明細書で提供される化合物を坐剤として投与することが望ましい場合、典型的な基剤が使用され得る。ココアバターは伝統的な坐剤用基剤であり、これはその融点をわずかに上げるためにワックスを添加することにより修飾され得る。特に、様々な分子量のポリエチレングリコールを含む、水混和性坐剤用基剤が広く使用される。
本明細書で提供される化合物の効果は、適切に製剤化することにより遅延または延長させることができる。例えば、本明細書で提供される化合物のゆっくりと可溶化するペレットを製造し、錠剤またはカプセルに配合することができ、あるいは徐放性移植可能装置として製造され得る。この技法はまた、数種の異なる溶解速度のペレットを製造し、カプセルに該ペレットの混合物を充填することを含む。錠剤またはカプセルは予測可能な期間にわたって溶解に抗うフィルムでコーティングされ得る。非経口用製剤でさえ、本明細書で提供される化合物を血清中にゆっくりと分散させる油性または乳化ビヒクルにそれを溶解または懸濁させることにより、長期作用型とすることができる。
治療すべき疾患の状態および対象の状態に応じて、本明細書で提供される化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩は、経口、非経口(例えば、筋肉内、腹腔内、静脈内、CIV、睾丸内注射または注入、皮下注射、または移植片)、吸入、鼻腔、膣、直腸、舌下、または局所(例、経皮または局所)の投与経路によって投与され得る。本明細書で提供される化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩は、単独で、または各投与経路に適切な医薬的に許容される賦形剤、担体、アジュバントおよびビヒクルと一緒になって、適切な投与単位に処方されてもよい。
1の実施態様において、本明細書で提供される化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩は、経口的に投与される。もう一つ別の実施態様において、本明細書で提供される化合物1、化合物2または化合物3の化合物、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩は、非経口的に投与される。さらにもう一つ別の実施態様において、本明細書で提供される化合物1、化合物2または化合物3の化合物、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩は、静脈内に投与される。
本明細書で提供される化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩は、例えば、単一ボーラス注射、または経口カプセル、錠剤またはピルなどの単回投与で送達することも、あるいは、例えば、経時的に連続した注入または経時的に分割されたボーラス投与のように経時的に送達することもできる。本明細書にて記載されるような化合物は、必要に応じて、例えば、患者が安定した疾患または退行を経験するまで、あるいは患者が疾患の進行または許容できない傷害性を経験するまで、繰り返して投与され得る。
本明細書で提供される化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩は、1日1回(QD)で、あるいは1日2回(BID)、1日3回(TID)、および1日4回(QID)のように日用量を複数に分割して投与され得る。加えて、投与は、連続的(すなわち、連日または毎日)、例えば、サイクルにて間欠的(すなわち、薬物のない休息日を数日、数週間、または数か月で含む)とすることができる。本明細書で使用される場合の、「毎日」なる語は、本明細書で提供される化合物1、化合物2または化合物3などの治療用化合物、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩が、例えば、一定期間、1日に1回またはそれ以上の回数投与されることを意味するものとする。「連続的」なる語は、本明細書で提供される化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩などの治療用化合物が、少なくとも7日から52週間の中断のない期間にわたって毎日投与されることを意味するものとする。本明細書で使用される場合の「断続的」または「間欠的」なる語は、規則的または非規則的ないずれかの間隔で停止し、開始することを意味するものとする。例えば、本明細書で提供される化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩の間欠的投与は、週1~6日の投与、サイクルでの投与(2~8週間連続して毎日投与し、ついで最大で1週間投与しない休息期間を設ける)、または隔日での投与である。本明細書で使用される場合の「循環」なる語は、本明細書で提供される化合物1、化合物2または化合物3などの治療用化合物、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩が、毎日投与されるか、連続的であるが、休息期間を設けて投与されることを意味するものとする。
いくつかの実施態様において、投与の頻度は、およその日用量からおよその月用量までの範囲にある。1の実施態様において、投与は1日に1回、1日に2回、1日に3回、1日に4回、隔日に1回、1週間に2回、毎週1回、2週間毎に1回、3週間毎に1回、または4週間毎に1回である。1の実施態様において、本明細書で提供される化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩は1日に1回投与される。もう一つ別の実施態様において、本明細書で提供される化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩は、1日に2回投与される。さらにもう一つ別の実施態様において、本明細書で提供される化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩は、1日に3回投与される。さらにもう一つ別の実施態様において、本明細書で提供される化合物1、化合物2または化合物3、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩は、1日に4回投与される。
1の実施態様において、本明細書で提供される方法は、治療的に効果的な量の化合物1、化合物2または化合物3を、1または複数の7日間の治療サイクルにて投与することを含む。もう一つ別の実施態様において、本明細書で提供される方法は、治療的に効果的な量の化合物1、化合物2または化合物3を、7日間のサイクルの初日~5日目まで投与することを含む。もう一つ別の実施態様において、本明細書で提供される方法は、治療的に効果的な量の化合物1、化合物2または化合物3を、7日間のサイクルの初日~3日目まで投与することを含む。
1の実施態様において、本明細書で提供される方法は、治療的に効果的な量の化合物1、化合物2または化合物3を、1または複数の14日間の治療サイクルにて投与することを含む。もう一つ別の実施態様において、本明細書で提供される方法は、治療的に効果的な量の化合物1、化合物2または化合物3を、14日間のサイクルの初日~7日目まで投与することを含む。もう一つ別の実施態様において、本明細書で提供される方法は、治療的に効果的な量の化合物1、化合物2または化合物3を、14日間のサイクルの初日~10日目まで投与することを含む。
1の実施態様において、本明細書で提供される方法は、治療的に効果的な量の化合物1、化合物2または化合物3を1または複数の28日間の治療サイクルにて投与することを含む。もう一つ別の実施態様において、本明細書で提供される方法は、治療的に効果的な量の化合物1、化合物2または化合物3を、28日間のサイクルの初日~21日目まで投与することを含む。もう一つ別の実施態様において、本明細書で提供される方法は、治療的に効果的な量の化合物1、化合物2または化合物3を、28日間のサイクルの初日~5日目、8日目~12日目、15日目~19日目、および22日目~26日目まで投与することを含む。もう一つ別の実施態様において、本明細書で提供される方法は、治療的に効果的な量の化合物1、化合物2または化合物3を、28日間のサイクルの初日~10日目、および15日目~24日目まで投与することを含む。
1の実施態様において、化合物1、化合物2または化合物3を、5日間にわたって1日に1回投与し、つづいて2日間休息させる。1の実施態様において、化合物1、化合物2または化合物3を、3日間にわたって1日に1回投与し、つづいて4日間休息させる。1の実施態様において、化合物1、化合物2または化合物3を、7日間にわたって1日に1回投与し、つづいて7日間休息させる。1の実施態様において、化合物1、化合物2または化合物3を、10日間にわたって1日に1回投与し、つづいて4日間休息させる。1の実施態様において、化合物1、化合物2または化合物3を、21日間にわたって1日に1回投与し、つづいて7日間休息させる。
本明細書にて記載されるいずれの治療サイクルも、少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26 、27、28、29、30回、またはそれ以上の回数のサイクルで繰り返され得る。特定の例において、本明細書にて記載されるような治療サイクルは、1~約24回のサイクル、約2~約16回のサイクル、または約2~約4回のサイクルを含む。特定の例において、本明細書にて記載されるような治療サイクルは、1~約4回のサイクルを含む。いくつかの実施態様において、治療的に効果的な量の化合物1、化合物2または化合物3を、1~13回の28日間のサイクル(例、約1年)にて投与する。いくつかの実施態様において、治療的に効果的な量の化合物1、化合物2または化合物3を、1~24回の28日間のサイクル(例、約2年)にて投与する。特定の例において、そのサイクル療法では、サイクルの数は限定されず、該療法は疾患が進行するまで続けられる。サイクルは、特定の例にて、本明細書で記載される投与期間および/または休息期間の期間を変更することを含み得る。
実施例
以下の実施例は、説明のために提示されたものであり、限定されるものではない。化合物は、化学構造については系統的に名称付け、立体化学についてはCahn-Ingold-Prelog規則でサポートする、ChemBiodraw Ultra(Cambridgesoft)から提供されるオートマティック・ネーム・ジェネレーティング・ツールを用いて命名される。当業者であれば、所望の生成物を得るために、例示としての実施例にて示される操作を修飾することができる。
実施例1:(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(化合物1)の合成
(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-(ヒドロキシメチル)ベンジル)アミノ)イソインドリン-1,3-ジオン:
(S)-4-アミノ-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン(5.00g、18.3ミリモル)および2-フルオロ-4-(ヒドロキシメチル)ベンズアルデヒド(2.82g、18.30ミリモル)の2:1 ジオキサン-MeOH(75mL)中懸濁液を0℃に冷却し、B10H14(4.92g、40.3ミリモル)を5分間にわたって少しづつ添加した。反応フラスコにセプタムおよびニードルベント(圧力)を取り付け、10分間にわたって激しく撹拌した。該混合物を外界温度に到達させ、3時間撹拌した。混合物を濃縮し、残渣をシリカゲルクロマトグラフィー(0-10%MeOH-DCM)に付して精製し、(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-(ヒドロキシメチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(4.23g、56%)を黄色の固体として得た。LCMS(ESI) m/z 411.8[M+H]+
(S)-4-((4-(クロロメチル)-2-フルオロベンジル)アミノ)-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン
(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-(ヒドロキシメチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(0.727g、1.77ミリモル)の乾燥NMP(6mL)中溶液を0℃に冷却し、塩化メタンスルホニル(0.275mL、3.35ミリモル)およびDIEA(0.617mL、3.53ミリモル)を連続して添加した。反応混合物を外界温度に到達させ、18時間撹拌した。該反応混合物を、激しく混合しながら、0℃に冷却したH2O(60mL)に、ゆっくりと添加した。得られた懸濁液を濾過し、固体を集め、H2OおよびEt2Oで洗浄した。該固体をEtOAcに溶かし、その溶液をMgSO4で乾燥させ、濾過し、濃縮して(S)-4-((4-(クロロメチル)-2-フルオロベンジル)アミノ)-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン(0.600g、79%)を黄色の固体として得た。LCMS(ESI) m/z 430.0[M+H]+
(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン
(S)-4-((4-(クロロメチル)-2-フルオロベンジル)アミノ)-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン(300mg、0.698ミリモル)の乾燥DMSO(1.0mL)中溶液に、4-(アゼチジン-3-イル)モルホリン・塩酸塩(125mg、0.698ミリモル)およびDIEA(0.122mL、0.698ミリモル)を添加した。反応混合物を外界温度で18時間撹拌し、DMSO(1mL)で希釈した。該溶液をキラル逆相クロマトグラフィーに付して精製し、(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(89mg、24%、97%ee)を得た。LCMS(ESI) m/z 536.2[M+H]+
実施例2:(R)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(化合物2)の合成
加えて、実施例1に記載のキラル逆相クロマトグラフィーに付し、(R)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(16mg、97%ee)を得た。LCMS(ESI) m/z 535.6[M+H]+
実施例3:2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(化合物3)の合成
(4-ブロモ-3-フルオロ-フェニル)メタノール:
4-ブロモ-3-フルオロ-安息香酸(15.0g、68.5ミリモル)のTHF(150mL)中溶液を0℃に冷却し、ボラン・ジメチルスルフィド複合体(13.7mL、137ミリモル、THF中10M)を窒素雰囲気下にて滴下して加えた。冷却浴を取り外し、混合物を外界温度で12時間撹拌した。混合物を0℃に冷却し、MeOH(50mL)でクエンチさせ、水(30mL)中に注いだ。該混合物を真空下で濃縮し、残りの水性混合物を酢酸エチル(150mL)および水(150mL)で希釈し、15分間撹拌した。有機相を取り出し、水相を酢酸エチル(150mLx2)で抽出した。有機フラクションを合わせ、無水硫酸ナトリウムで乾燥させ、濾過し、真空下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー(石油エーテル中2-10%酢酸エチル)に付して精製し、(4-ブロモ-3-フルオロ-フェニル)メタノール(13.1g、収率93.3%)を無色の液体として得た。LCMS(ESI) m/z 187.0[MH-18+];1H NMR(400MHz、CDCl3) δ ppm 7.54-7.45(m,1H)、7.14(d,J=9.2Hz,1H)、7.00(d,J=7.9Hz,1H)、4.64(d,J=4.6Hz,2H)、2.20(brs,1H)
(4-ブロモ-3-フルオロ-フェニル)メトキシ-tert-ブチル-ジメチル-シラン:
(4-ブロモ-3-フルオロ-フェニル)メタノール(13.1g、63.9ミリモル)およびイミダゾール(12.2g、179ミリモル)のDMF(150mL)中溶液を0℃に冷却し、tert-ブチルクロロジメチルシラン(14.4g、95.8ミリモル)を添加した。冷却浴を取り外し、混合物を外界温度で16時間撹拌した。反応物を冷水(30mL)中に注ぎ、酢酸エチル(100mL)および水(100mL)で希釈し、15分間撹拌した。有機相を取り出し、水相を酢酸エチル(150mLx2)で抽出した。有機フラクションを合わせ、飽和NaCl(50mLx2)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー(石油エーテル中0-10%酢酸エチル)に付して精製し、(4-ブロモ-3-フルオロ-フェニル)メトキシ-tert-ブチル-ジメチル-シラン(18.6g、収率91.2%)を無色の液体として得た。1H NMR(400MHz、CDCl3) δ ppm 7.49(dd,J=7.1、8.1Hz,1H)、7.18-7.08(m,1H)、7.01-6.92(m,1H)、4.69(s,2H)、0.96(s,9H)、0.12(s,6H)
4-[[tert-ブチル(ジメチル)シリル]オキシメチル]-2-フルオロ-ベンズアルデヒド:
窒素雰囲気下、(4-ブロモ-3-フルオロ-フェニル)メトキシ-tert-ブチル-ジメチル-シラン(18.6g、58.3ミリモル)のTHF(150mL)中溶液を-78℃に冷却し、n-BuLi(25.6mL、64.0ミリモル、ヘキサン中2.5M)を滴下して加えた。混合物を-78℃で5分間撹拌し、DMF(5.83mL、75.7ミリモル)を添加した。該混合物を-78℃で2時間撹拌し、外界温度にまで加温させた。反応混合物を0℃に冷却し、飽和塩化アンモニウム(60mL)および水(30mL)でクエンチさせた。該混合物を酢酸エチル(2x150mL)で抽出し、合わせた抽出液を硫酸ナトリウムで乾燥させ、濾過して濃縮した。残渣をシリカゲルカラムクロマトグラフィー(石油エーテル中0-2%酢酸エチル)に付して精製し、4-[[tert-ブチル(ジメチル)シリル]オキシメチル]-2-フルオロ-ベンズアルデヒド(11.5g、収率73.5%)を黄色の液体として得た。MS(ESI) m/z:269.1[M+1]+
3-((4-(((tert-ブチルジメチルシリル)オキシ)メチル)-2-フルオロベンジル)アミノ)フタル酸:
4-[[tert-ブチル(ジメチル)シリル]オキシメチル]-2-フルオロ-ベンズアルデヒド(7.50g、27.9ミリモル)および3-アミノフタル酸(5.06g、27.9ミリモル)の1:10 酢酸-MeOH(110mL)中溶液を25℃で30分間撹拌し、0℃に冷却した。ボラン 2-メチルピリジン複合体(4.48g、41.9ミリモル)を加え、混合物を外界温度にまで到達させた。該混合物を外界温度で16時間撹拌し、該混合物を減圧下で濃縮した。残渣を水(25mL)および酢酸エチル(25mL)で希釈し、15分間撹拌した。有機層を取り除き、水層を酢酸エチル(30mLx2)で抽出した。有機フラクションを合わせ、無水硫酸ナトリウムで乾燥させ、濾過し、濃縮した。残渣をシリカゲルカラムクロマトグラフィー(石油エーテル中2-5%酢酸エチル)に付して精製し、3-((4-(((tert-ブチルジメチルシリル)オキシ)メチル)-2-フルオロベンジル)アミノ)フタル酸(9.90g、収率81.8%)を白色の固体として得た。LCMS(ESI) m/z:434.1[M+1]+
4-((4-(((tert-ブチルジメチルシリル)オキシ)メチル)-2-フルオロベンジル)アミノ)-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン:
3-((4-(((tert-ブチルジメチルシリル)オキシ)メチル)-2-フルオロベンジル)アミノ)フタル酸(11.8g、27.2ミリモル)および3-アミノピペリジン-2,6-ジオン・塩酸塩(6.72g、40.8ミリモル)のピリジン(150mL)中溶液を窒素雰囲気下にて120℃で12時間撹拌した。混合物を減圧下で濃縮し、残渣をシリカゲルカラムクロマトグラフィー(石油エーテル中2-5%酢酸エチル)に付して精製し、4-((4-(((tert-ブチルジメチルシリル)オキシ)メチル)-2-フルオロベンジル)アミノ)-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン(9.90g、収率69.2%)を黄色の固体として得た。LCMS(ESI) m/z:526.2[M+1]+
2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-(ヒドロキシメチル)ベンジル)アミノ)イソインドリン-1,3-ジオン:
4-((4(((tert-ブチルジメチルシリル)オキシ)メチル)-2-フルオロベンジル)アミノ)-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン(9.90g、18.8ミリモル)のTHF(100mL)中溶液に、濃硫酸(20.0mL、368ミリモル)を加え、該混合物を外界温度で12時間撹拌した。該混合物を真空下で濃縮し、残渣を1:5 酢酸エチル-石油エーテル(20mL)で処理した。得られた懸濁液を30分間撹拌し、濾過した。固体を集め、1:5 酢酸エチル-石油エーテルで洗浄し、真空下で乾燥させ、2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-(ヒドロキシメチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(6.58g、収率85.2%)を黄色の固体として得た。MS(ESI) m/z:412.0[M+1]+;1H NMR(400MHz、DMSO-d6) δ ppm 11.12(s,1H)、7.54(dd,J=7.3、8.4Hz,1H)、7.33(t,J=7.8Hz,1H)、7.16-7.07(m,3H)、7.05(d,J=7.0Hz,1H)、6.99(d,J=8.5Hz,1H)、5.33-5.25(m,1H)、5.07(dd,J=5.3、12.9Hz,1H)、4.59(d,J=6.3Hz,2H)、4.47(d,J=5.8Hz,2H)、2.95-2.84(m,1H)、2.65-2.52(m,2H)、2.09-2.01(m,1H)
4-((4-(クロロメチル)-2-フルオロベンジル)アミノ)-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン:
2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-(ヒドロキシメチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(6.58g、16.0ミリモル)のジクロロメタン(200mL)中溶液を0℃に冷却し、塩化チオニル(20.0mL、276ミリモル)を滴下して加えた。添加の終了した後、冷却浴を取り外し、反応混合物を外界温度で2時間撹拌した。該混合物を真空下で濃縮し、残渣をシリカゲルカラムクロマトグラフィー(ジクロロメタン中1.00-1.25%MeOH)に付して精製し、4-((4-(クロロメチル)-2-フルオロベンジル)アミノ)-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン(3.80g、収率55.4%)を黄色の固体として得た。LCMS(ESI) m/z:430.0[M+1]+;1H NMR(400MHz、DMSO-d6) δ ppm 11.12(s,1H)、7.54(dd,J=7.3、8.4 Hz,1H)、7.38(t,J=7.9Hz,1H)、7.32(dd,J=1.5、11.0Hz,1H)、7.24(dd,J=1.6、7.8Hz,1H)、7.16(t,J=6.3Hz,1H)、7.06(d,J=6.9Hz,1H)、6.98(d,J=8.5Hz,1H)、5.08(dd,J=5.3、12.9Hz,1H)、4.74(s,2H)、4.63(d,J=6.3Hz,2H)、2.95-2.85(m,1H)、2.66-2.53(m,2H)、2.09-2.02(m,1H)
2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン:
4-((4-(クロロメチル)-2-フルオロベンジル)アミノ)-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン(215mg、0.500ミリモル)(本明細書で提供されるように製造される)および4-(アゼチジン-3-イル)モルホリン・塩酸塩(107mg、0.600ミリモル)の乾燥DMSO(1.7mL)中溶液に、DIEA(262μL、1.50ミリモル)を添加し、該混合物を外界温度で48時間撹拌した。該反応混合物をDMSO中20%ギ酸(2.5mL)で希釈し、膜シリンジフィルター(0.45μmナイロン)を通して濾過した。該溶液を標準的方法を用いて精製し、2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(173mg、収率64.6%)を得た。LCMS(ESI) m/z 536.2[M+H]+
実施例4:血液細胞株を用いる細胞増殖および生存能アッセイ
以下は、例示的な血液細胞株(表1)を用いて、本明細書にて記載の化合物の抗増殖活性およびアポトーシス効果を測定するのに使用され得る、細胞ベースのアッセイの例である。本明細書に記載の化合物1のインビトロでの増殖阻害活性を384-ウェルのフローサイトメトリーアッセイを用いて評価した。
表1:血液細胞株
ATCC=アメリカン・タイプ・ティシュー・コレクション(American Type Tissue Collection);DSMZ=ジャーマン・コレクション・オブ・マイクロオーガニズム・アンド・セル・カルチャー(German Collection of Microorganisms and Cell Cultures);FBS=ウシ胎児血清;IMDM=イスコフ改変ダルベッコ培地;JCRB=ジャパニーズ・コレクション・オブ・リサーチ・バイオリソース・セル・バンク(Japanese Collection of Research Bioresources Cell Bank);MM=多発性骨髄腫;NEAA=非必須アミノ酸;RPMI=RPMI1640;X=本明細書にて提供されない
細胞株を、表1に示す条件下で、384ウェルの平底プレートにてプレーティングし、0.00015から10μMまでの範囲で増大する濃度の化合物と一緒に、またはジメチルスルホキシド(DMSO)対照と一緒にインキュベートした。DMSOの最終濃度は0.1%(v/v)であった。化合物1またはDMSOを添加し、120時間インキュベートした後に、アネキシンVおよび生細胞不透過性DNA色素、DRAQ7を用いるフローサイトメトリー(Attune(登録商標)、Thermo Fisher)で、細胞数および細胞死を解析した。ホスファチジルセリンはアポトーシスの初期に細胞膜の内層から外層に移動し、アネキシンVがアポトーシス細胞の表面に見られる露出したホスファチジルセリンと結合する。バイタル色素のDRAQ7は、無傷の生細胞によって排除され、アポトーシスまたは壊死の結果として死亡した細胞だけを染色する。
次にFlow Jo v10ソフトウェアを用いてフローサイトメトリーのデータ解析を行い、各条件における生存細胞(アネキシンVおよびDRAQ7二重陰性染色細胞)の数およびアポトーシス細胞(アネキシンV陽性細胞)のパーセンテージを決定した。あらゆる濃度の生細胞の数をDMSO対照(100%生存細胞とみなす)に対して正規化し、処理後に残っている生存細胞のパーセンテージを算出し、GraphPad Prism7.03を用いてグラフ化した。次に、IC50(50%阻害濃度)およびEmax(達成された最大効力)値は、GraphPad Prism7.03でlog(阻害剤)vs.正規化応答-可変スロープ解析を用いて非線形回帰曲線のフィッティングを行うことにより算定した。曲線下面積(AUC)は、GraphPad Prism7.03で曲線下面積解析を行うことにより算定された。同様に、アポトーシス解析については、DMSOと比べて「前期」(アネキシンV陽性およびDRAQ7陰性)および「後期」アポトーシス(アネキシンVおよびDRAQ7陽性)セルゲートの両方を合わせたアポトーシスのパーセンテージを、GraphPad Prism7.03を用いてグラフにした。アポトーシス曲線からのAUC、EC50(半最大アポトーシス応答を生じさせる化合物1の濃度)およびYmax(達成されるアポトーシスの最大パーセンテージ)値は、GraphPad Prism7.03上で、曲線下面積解析を行い、log(アゴニスト)vs.正規化応答-可変スロープ解析を用いて非線形回帰曲線のフィッティングを行うことにより算定した。
表2に示すように、一連の血液学的細胞株に関する化合物1の用量応答増殖曲線、および非線形曲線フィッティング回帰を用い、IC50、AUC、および生存細胞についてのEmax%(生存割合についてのEmaxは低用量で100と、高用量で0との間で変化し、それはすべての生存細胞の阻害に対応する)を決定し、化合物1の用量応答アポトーシス曲線を用い、EC50、AUC、およびアポトーシス%についてのYmax(アポトーシスについてのYmaxは低用量で0と、高用量で100の間で変化し、それはすべての細胞の死亡に対応する)を決定した。
化合物1は、試験したほぼ全ての血液学的細胞株において、抗増殖活性および/またはアポトーシス作用のあることが判明した(表2)。
表2. 血液学的細胞株における化合物1の抗増殖活性およびアポトーシス作用
AUC=曲線下面積;IC
50=50%阻害濃度(μM);E
max=残存腫瘍細胞のパーセンテージとして表される、腫瘍細胞の排除を達成する最大効力;EC
50=半最大アポトーシス応答を引き出す化合物の濃度(μM);Y
max=化合物1が最大濃度である時のコントロールの算定パーセント
多くの参考文献が引用されており、その各々を全体として出典明示により本明細書に組み込む。
上記した実施態様は単に例示であるに過ぎず、当業者であれば、特定の化合物、材料、および操作の多くの均等物を理解するであろうし、あるいは単なる慣用的な実験を用いるだけでそれらを確認できるであろう。かかるすべての均等物は本発明の範囲内にあり、添付した特許請求の範囲に包含されると考えられる。