JP7522643B2 - 相同組換え欠損を評価するための方法および材料 - Google Patents
相同組換え欠損を評価するための方法および材料 Download PDFInfo
- Publication number
- JP7522643B2 JP7522643B2 JP2020194936A JP2020194936A JP7522643B2 JP 7522643 B2 JP7522643 B2 JP 7522643B2 JP 2020194936 A JP2020194936 A JP 2020194936A JP 2020194936 A JP2020194936 A JP 2020194936A JP 7522643 B2 JP7522643 B2 JP 7522643B2
- Authority
- JP
- Japan
- Prior art keywords
- regions
- indicator
- region
- loh
- tai
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000000034 method Methods 0.000 title claims description 290
- 230000007812 deficiency Effects 0.000 title claims description 39
- 239000000463 material Substances 0.000 title description 11
- 230000006801 homologous recombination Effects 0.000 title description 9
- 238000002744 homologous recombination Methods 0.000 title description 9
- 206010028980 Neoplasm Diseases 0.000 claims description 458
- 201000011510 cancer Diseases 0.000 claims description 432
- 210000004027 cell Anatomy 0.000 claims description 309
- 238000011269 treatment regimen Methods 0.000 claims description 106
- 210000003917 human chromosome Anatomy 0.000 claims description 97
- 210000000349 chromosome Anatomy 0.000 claims description 77
- 239000012661 PARP inhibitor Substances 0.000 claims description 69
- 229940121906 Poly ADP ribose polymerase inhibitor Drugs 0.000 claims description 69
- 239000012623 DNA damaging agent Substances 0.000 claims description 65
- 229940123780 DNA topoisomerase I inhibitor Drugs 0.000 claims description 61
- 239000000365 Topoisomerase I Inhibitor Substances 0.000 claims description 61
- 229940045799 anthracyclines and related substance Drugs 0.000 claims description 61
- 238000012360 testing method Methods 0.000 claims description 56
- 230000035772 mutation Effects 0.000 claims description 52
- 102000036365 BRCA1 Human genes 0.000 claims description 49
- 101150072950 BRCA1 gene Proteins 0.000 claims description 47
- 230000002950 deficient Effects 0.000 claims description 45
- 230000004044 response Effects 0.000 claims description 43
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 claims description 40
- 108700020463 BRCA1 Proteins 0.000 claims description 39
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 claims description 36
- 101150008921 Brca2 gene Proteins 0.000 claims description 35
- 229960004316 cisplatin Drugs 0.000 claims description 28
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 claims description 28
- 108700020462 BRCA2 Proteins 0.000 claims description 27
- 102000052609 BRCA2 Human genes 0.000 claims description 27
- -1 anthracycline Substances 0.000 claims description 21
- 229910052697 platinum Inorganic materials 0.000 claims description 20
- 230000000392 somatic effect Effects 0.000 claims description 20
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical group O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 claims description 18
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 claims description 18
- 229960004679 doxorubicin Drugs 0.000 claims description 18
- 229960001904 epirubicin Drugs 0.000 claims description 18
- 229960004768 irinotecan Drugs 0.000 claims description 18
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 claims description 18
- 229960000303 topotecan Drugs 0.000 claims description 18
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 claims description 18
- 239000002246 antineoplastic agent Substances 0.000 claims description 17
- MDOJTZQKHMAPBK-UHFFFAOYSA-N 4-iodo-3-nitrobenzamide Chemical group NC(=O)C1=CC=C(I)C([N+]([O-])=O)=C1 MDOJTZQKHMAPBK-UHFFFAOYSA-N 0.000 claims description 16
- 229960004562 carboplatin Drugs 0.000 claims description 16
- 190000008236 carboplatin Chemical compound 0.000 claims description 16
- 229950002133 iniparib Drugs 0.000 claims description 16
- FAQDUNYVKQKNLD-UHFFFAOYSA-N olaparib Chemical compound FC1=CC=C(CC2=C3[CH]C=CC=C3C(=O)N=N2)C=C1C(=O)N(CC1)CCN1C(=O)C1CC1 FAQDUNYVKQKNLD-UHFFFAOYSA-N 0.000 claims description 16
- 229960000572 olaparib Drugs 0.000 claims description 16
- 229950005566 picoplatin Drugs 0.000 claims description 16
- IIMIOEBMYPRQGU-UHFFFAOYSA-L picoplatin Chemical compound N.[Cl-].[Cl-].[Pt+2].CC1=CC=CC=N1 IIMIOEBMYPRQGU-UHFFFAOYSA-L 0.000 claims description 16
- 210000002230 centromere Anatomy 0.000 claims description 15
- 230000011987 methylation Effects 0.000 claims description 15
- 238000007069 methylation reaction Methods 0.000 claims description 15
- 229940041181 antineoplastic drug Drugs 0.000 claims description 12
- 230000002939 deleterious effect Effects 0.000 claims description 10
- 238000001914 filtration Methods 0.000 claims description 9
- 230000006607 hypermethylation Effects 0.000 claims description 6
- 238000000338 in vitro Methods 0.000 claims description 6
- 238000004364 calculation method Methods 0.000 claims description 2
- 239000000523 sample Substances 0.000 description 276
- 101150038567 lst gene Proteins 0.000 description 209
- 108020004414 DNA Proteins 0.000 description 82
- 108091007743 BRCA1/2 Proteins 0.000 description 81
- 206010006187 Breast cancer Diseases 0.000 description 57
- 208000026310 Breast neoplasm Diseases 0.000 description 57
- 239000002131 composite material Substances 0.000 description 48
- 238000003556 assay Methods 0.000 description 42
- 238000011282 treatment Methods 0.000 description 42
- 238000004458 analytical method Methods 0.000 description 40
- 108700028369 Alleles Proteins 0.000 description 35
- 238000004590 computer program Methods 0.000 description 35
- 238000012163 sequencing technique Methods 0.000 description 35
- 230000015654 memory Effects 0.000 description 34
- 108090000623 proteins and genes Proteins 0.000 description 33
- 239000013610 patient sample Substances 0.000 description 30
- 230000005855 radiation Effects 0.000 description 30
- 210000004602 germ cell Anatomy 0.000 description 27
- 230000007547 defect Effects 0.000 description 25
- 230000037361 pathway Effects 0.000 description 25
- 239000003795 chemical substances by application Substances 0.000 description 24
- 238000012217 deletion Methods 0.000 description 23
- 230000037430 deletion Effects 0.000 description 23
- 238000004891 communication Methods 0.000 description 18
- 239000003814 drug Substances 0.000 description 18
- 206010033128 Ovarian cancer Diseases 0.000 description 17
- 206010061535 Ovarian neoplasm Diseases 0.000 description 17
- 108700040618 BRCA1 Genes Proteins 0.000 description 16
- 108700010154 BRCA2 Genes Proteins 0.000 description 16
- 238000007477 logistic regression Methods 0.000 description 16
- 230000000875 corresponding effect Effects 0.000 description 15
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 14
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 14
- 201000004101 esophageal cancer Diseases 0.000 description 14
- 238000004393 prognosis Methods 0.000 description 14
- 238000003860 storage Methods 0.000 description 14
- 238000003745 diagnosis Methods 0.000 description 13
- 239000003112 inhibitor Substances 0.000 description 13
- 210000001082 somatic cell Anatomy 0.000 description 13
- 210000001519 tissue Anatomy 0.000 description 13
- 208000003721 Triple Negative Breast Neoplasms Diseases 0.000 description 12
- 229940079593 drug Drugs 0.000 description 12
- 231100000518 lethal Toxicity 0.000 description 12
- 230000001665 lethal effect Effects 0.000 description 12
- 230000008569 process Effects 0.000 description 12
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 11
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 11
- 238000004422 calculation algorithm Methods 0.000 description 11
- 230000000977 initiatory effect Effects 0.000 description 11
- 102000039446 nucleic acids Human genes 0.000 description 11
- 108020004707 nucleic acids Proteins 0.000 description 11
- 150000007523 nucleic acids Chemical class 0.000 description 11
- 210000003765 sex chromosome Anatomy 0.000 description 11
- 208000022679 triple-negative breast carcinoma Diseases 0.000 description 11
- 230000001747 exhibiting effect Effects 0.000 description 10
- 230000007704 transition Effects 0.000 description 10
- 238000002512 chemotherapy Methods 0.000 description 9
- 239000012634 fragment Substances 0.000 description 9
- 230000006870 function Effects 0.000 description 9
- 230000003993 interaction Effects 0.000 description 9
- 208000031404 Chromosome Aberrations Diseases 0.000 description 8
- 238000003491 array Methods 0.000 description 8
- 230000002759 chromosomal effect Effects 0.000 description 8
- 238000004519 manufacturing process Methods 0.000 description 8
- 230000004083 survival effect Effects 0.000 description 8
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 8
- 238000002560 therapeutic procedure Methods 0.000 description 8
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 7
- 108091034117 Oligonucleotide Proteins 0.000 description 7
- 230000002596 correlated effect Effects 0.000 description 7
- 206010008805 Chromosomal abnormalities Diseases 0.000 description 6
- 206010009944 Colon cancer Diseases 0.000 description 6
- 238000009007 Diagnostic Kit Methods 0.000 description 6
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 6
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 6
- 210000000481 breast Anatomy 0.000 description 6
- 238000011109 contamination Methods 0.000 description 6
- 201000010099 disease Diseases 0.000 description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 6
- 201000005202 lung cancer Diseases 0.000 description 6
- 208000020816 lung neoplasm Diseases 0.000 description 6
- 239000000203 mixture Substances 0.000 description 6
- 238000011518 platinum-based chemotherapy Methods 0.000 description 6
- 229930012538 Paclitaxel Natural products 0.000 description 5
- 230000009286 beneficial effect Effects 0.000 description 5
- 230000008859 change Effects 0.000 description 5
- 229940044683 chemotherapy drug Drugs 0.000 description 5
- 238000010586 diagram Methods 0.000 description 5
- 230000003287 optical effect Effects 0.000 description 5
- 229960001592 paclitaxel Drugs 0.000 description 5
- 210000004881 tumor cell Anatomy 0.000 description 5
- 102000009465 Growth Factor Receptors Human genes 0.000 description 4
- 108010009202 Growth Factor Receptors Proteins 0.000 description 4
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 4
- 238000011529 RT qPCR Methods 0.000 description 4
- 229940123237 Taxane Drugs 0.000 description 4
- 208000009956 adenocarcinoma Diseases 0.000 description 4
- 230000000340 anti-metabolite Effects 0.000 description 4
- 229940100197 antimetabolite Drugs 0.000 description 4
- 239000002256 antimetabolite Substances 0.000 description 4
- 238000013459 approach Methods 0.000 description 4
- 238000001514 detection method Methods 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 230000002068 genetic effect Effects 0.000 description 4
- 239000003102 growth factor Substances 0.000 description 4
- 230000008774 maternal effect Effects 0.000 description 4
- 229960000485 methotrexate Drugs 0.000 description 4
- 238000000491 multivariate analysis Methods 0.000 description 4
- 230000008775 paternal effect Effects 0.000 description 4
- 102000004169 proteins and genes Human genes 0.000 description 4
- 230000002829 reductive effect Effects 0.000 description 4
- 230000008439 repair process Effects 0.000 description 4
- 238000012216 screening Methods 0.000 description 4
- 230000008685 targeting Effects 0.000 description 4
- 230000000007 visual effect Effects 0.000 description 4
- 108010012934 Albumin-Bound Paclitaxel Proteins 0.000 description 3
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 3
- 238000007400 DNA extraction Methods 0.000 description 3
- 230000033616 DNA repair Effects 0.000 description 3
- 102100034484 DNA repair protein RAD51 homolog 3 Human genes 0.000 description 3
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 3
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 3
- 101001132271 Homo sapiens DNA repair protein RAD51 homolog 3 Proteins 0.000 description 3
- 239000005411 L01XE02 - Gefitinib Substances 0.000 description 3
- 239000005551 L01XE03 - Erlotinib Substances 0.000 description 3
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 3
- 239000002136 L01XE07 - Lapatinib Substances 0.000 description 3
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 3
- 206010060862 Prostate cancer Diseases 0.000 description 3
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 3
- 208000015634 Rectal Neoplasms Diseases 0.000 description 3
- 230000005856 abnormality Effects 0.000 description 3
- 229940028652 abraxane Drugs 0.000 description 3
- 230000003542 behavioural effect Effects 0.000 description 3
- 229960000397 bevacizumab Drugs 0.000 description 3
- 229960005395 cetuximab Drugs 0.000 description 3
- 208000029742 colonic neoplasm Diseases 0.000 description 3
- 229940127089 cytotoxic agent Drugs 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 230000012361 double-strand break repair Effects 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 229960001433 erlotinib Drugs 0.000 description 3
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 description 3
- 229960002949 fluorouracil Drugs 0.000 description 3
- 229960002584 gefitinib Drugs 0.000 description 3
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 description 3
- 201000010536 head and neck cancer Diseases 0.000 description 3
- 208000014829 head and neck neoplasm Diseases 0.000 description 3
- 238000012165 high-throughput sequencing Methods 0.000 description 3
- 229960004891 lapatinib Drugs 0.000 description 3
- BCFGMOOMADDAQU-UHFFFAOYSA-N lapatinib Chemical compound O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 BCFGMOOMADDAQU-UHFFFAOYSA-N 0.000 description 3
- 201000007270 liver cancer Diseases 0.000 description 3
- 208000014018 liver neoplasm Diseases 0.000 description 3
- 210000004072 lung Anatomy 0.000 description 3
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 3
- 238000002493 microarray Methods 0.000 description 3
- 238000010208 microarray analysis Methods 0.000 description 3
- 239000002773 nucleotide Substances 0.000 description 3
- 125000003729 nucleotide group Chemical group 0.000 description 3
- 230000002611 ovarian Effects 0.000 description 3
- 229960001756 oxaliplatin Drugs 0.000 description 3
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 3
- 201000002528 pancreatic cancer Diseases 0.000 description 3
- 208000008443 pancreatic carcinoma Diseases 0.000 description 3
- 229960001972 panitumumab Drugs 0.000 description 3
- 206010038038 rectal cancer Diseases 0.000 description 3
- 201000001275 rectum cancer Diseases 0.000 description 3
- 230000000391 smoking effect Effects 0.000 description 3
- 229960001796 sunitinib Drugs 0.000 description 3
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 3
- 229940124597 therapeutic agent Drugs 0.000 description 3
- 229960000575 trastuzumab Drugs 0.000 description 3
- 230000001755 vocal effect Effects 0.000 description 3
- 206010069754 Acquired gene mutation Diseases 0.000 description 2
- 230000005971 DNA damage repair Effects 0.000 description 2
- 230000009946 DNA mutation Effects 0.000 description 2
- 208000031448 Genomic Instability Diseases 0.000 description 2
- 208000037396 Intraductal Noninfiltrating Carcinoma Diseases 0.000 description 2
- 206010073094 Intraductal proliferative breast lesion Diseases 0.000 description 2
- 238000001276 Kolmogorov–Smirnov test Methods 0.000 description 2
- 238000001282 Kruskal–Wallis one-way analysis of variance Methods 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 2
- 238000012300 Sequence Analysis Methods 0.000 description 2
- 108700025716 Tumor Suppressor Genes Proteins 0.000 description 2
- 102000044209 Tumor Suppressor Genes Human genes 0.000 description 2
- 208000010572 basal-like breast carcinoma Diseases 0.000 description 2
- 239000011324 bead Substances 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 238000010876 biochemical test Methods 0.000 description 2
- 238000001574 biopsy Methods 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000012830 cancer therapeutic Substances 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 231100000517 death Toxicity 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 229960003668 docetaxel Drugs 0.000 description 2
- 230000034431 double-strand break repair via homologous recombination Effects 0.000 description 2
- 208000028715 ductal breast carcinoma in situ Diseases 0.000 description 2
- 201000007273 ductal carcinoma in situ Diseases 0.000 description 2
- 238000010195 expression analysis Methods 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 238000009396 hybridization Methods 0.000 description 2
- 238000013388 immunohistochemistry analysis Methods 0.000 description 2
- 230000002779 inactivation Effects 0.000 description 2
- 206010073095 invasive ductal breast carcinoma Diseases 0.000 description 2
- 201000010985 invasive ductal carcinoma Diseases 0.000 description 2
- 238000012177 large-scale sequencing Methods 0.000 description 2
- 239000004973 liquid crystal related substance Substances 0.000 description 2
- 201000010879 mucinous adenocarcinoma Diseases 0.000 description 2
- 238000010202 multivariate logistic regression analysis Methods 0.000 description 2
- 238000013188 needle biopsy Methods 0.000 description 2
- 238000007481 next generation sequencing Methods 0.000 description 2
- 201000005163 papillary serous adenocarcinoma Diseases 0.000 description 2
- 238000010837 poor prognosis Methods 0.000 description 2
- 238000007781 pre-processing Methods 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 230000000644 propagated effect Effects 0.000 description 2
- 230000008707 rearrangement Effects 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 230000037439 somatic mutation Effects 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 206010041823 squamous cell carcinoma Diseases 0.000 description 2
- DKPFODGZWDEEBT-QFIAKTPHSA-N taxane Chemical class C([C@]1(C)CCC[C@@H](C)[C@H]1C1)C[C@H]2[C@H](C)CC[C@@H]1C2(C)C DKPFODGZWDEEBT-QFIAKTPHSA-N 0.000 description 2
- 210000003411 telomere Anatomy 0.000 description 2
- 102000055501 telomere Human genes 0.000 description 2
- 108091035539 telomere Proteins 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 238000007473 univariate analysis Methods 0.000 description 2
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 1
- 239000012827 ATM inhibitor Substances 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 108020004705 Codon Proteins 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 230000000970 DNA cross-linking effect Effects 0.000 description 1
- 238000007399 DNA isolation Methods 0.000 description 1
- 102100034157 DNA mismatch repair protein Msh2 Human genes 0.000 description 1
- 102100022204 DNA-dependent protein kinase catalytic subunit Human genes 0.000 description 1
- 101710157074 DNA-dependent protein kinase catalytic subunit Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 101001134036 Homo sapiens DNA mismatch repair protein Msh2 Proteins 0.000 description 1
- 102100032700 Keratin, type I cytoskeletal 20 Human genes 0.000 description 1
- 102100023974 Keratin, type II cytoskeletal 7 Human genes 0.000 description 1
- 108010066370 Keratin-20 Proteins 0.000 description 1
- 108010070507 Keratin-7 Proteins 0.000 description 1
- 229910015837 MSH2 Inorganic materials 0.000 description 1
- 102000014160 PTEN Phosphohydrolase Human genes 0.000 description 1
- 108010011536 PTEN Phosphohydrolase Proteins 0.000 description 1
- 102000012338 Poly(ADP-ribose) Polymerases Human genes 0.000 description 1
- 108010061844 Poly(ADP-ribose) Polymerases Proteins 0.000 description 1
- 229920000776 Poly(Adenosine diphosphate-ribose) polymerase Polymers 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 1
- 208000035199 Tetraploidy Diseases 0.000 description 1
- 210000002593 Y chromosome Anatomy 0.000 description 1
- 230000003432 anti-folate effect Effects 0.000 description 1
- 229940127074 antifolate Drugs 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 230000008236 biological pathway Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 239000012829 chemotherapy agent Substances 0.000 description 1
- 239000013611 chromosomal DNA Substances 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 238000000205 computational method Methods 0.000 description 1
- 239000003431 cross linking reagent Substances 0.000 description 1
- 229960003901 dacarbazine Drugs 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000002224 dissection Methods 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 239000004052 folic acid antagonist Substances 0.000 description 1
- 231100000221 frame shift mutation induction Toxicity 0.000 description 1
- 230000037433 frameshift Effects 0.000 description 1
- 239000012520 frozen sample Substances 0.000 description 1
- 238000012268 genome sequencing Methods 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 231100000225 lethality Toxicity 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 208000037819 metastatic cancer Diseases 0.000 description 1
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 1
- 230000002438 mitochondrial effect Effects 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 238000009099 neoadjuvant therapy Methods 0.000 description 1
- 230000006855 networking Effects 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 238000003499 nucleic acid array Methods 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 102000054765 polymorphisms of proteins Human genes 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 230000002250 progressing effect Effects 0.000 description 1
- 230000001902 propagating effect Effects 0.000 description 1
- 230000005180 public health Effects 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 230000001953 sensory effect Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 229960004964 temozolomide Drugs 0.000 description 1
- 238000011285 therapeutic regimen Methods 0.000 description 1
- 230000004797 therapeutic response Effects 0.000 description 1
- 239000010409 thin film Substances 0.000 description 1
- 150000004654 triazenes Chemical class 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- JNAHVYVRKWKWKQ-CYBMUJFWSA-N veliparib Chemical compound N=1C2=CC=CC(C(N)=O)=C2NC=1[C@@]1(C)CCCN1 JNAHVYVRKWKWKQ-CYBMUJFWSA-N 0.000 description 1
- 229950011257 veliparib Drugs 0.000 description 1
- 238000007482 whole exome sequencing Methods 0.000 description 1
- 238000012070 whole genome sequencing analysis Methods 0.000 description 1
- 238000012049 whole transcriptome sequencing Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
- C12Q1/6886—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material for cancer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/24—Heavy metals; Compounds thereof
- A61K33/243—Platinum; Compounds thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6827—Hybridisation assays for detection of mutation or polymorphism
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6844—Nucleic acid amplification reactions
- C12Q1/6858—Allele-specific amplification
-
- G—PHYSICS
- G16—INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR SPECIFIC APPLICATION FIELDS
- G16B—BIOINFORMATICS, i.e. INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR GENETIC OR PROTEIN-RELATED DATA PROCESSING IN COMPUTATIONAL MOLECULAR BIOLOGY
- G16B20/00—ICT specially adapted for functional genomics or proteomics, e.g. genotype-phenotype associations
- G16B20/20—Allele or variant detection, e.g. single nucleotide polymorphism [SNP] detection
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/106—Pharmacogenomics, i.e. genetic variability in individual responses to drugs and drug metabolism
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/154—Methylation markers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/156—Polymorphic or mutational markers
-
- G—PHYSICS
- G16—INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR SPECIFIC APPLICATION FIELDS
- G16B—BIOINFORMATICS, i.e. INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR GENETIC OR PROTEIN-RELATED DATA PROCESSING IN COMPUTATIONAL MOLECULAR BIOLOGY
- G16B20/00—ICT specially adapted for functional genomics or proteomics, e.g. genotype-phenotype associations
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- General Health & Medical Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Genetics & Genomics (AREA)
- Analytical Chemistry (AREA)
- Physics & Mathematics (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
- Biotechnology (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- General Engineering & Computer Science (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pathology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Inorganic Chemistry (AREA)
- Epidemiology (AREA)
- Oncology (AREA)
- Hospice & Palliative Care (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Bioinformatics & Computational Biology (AREA)
- Evolutionary Biology (AREA)
- Medical Informatics (AREA)
- Theoretical Computer Science (AREA)
- Reproductive Health (AREA)
- Endocrinology (AREA)
Description
本出願は、2013年4月05日に提出された米国仮出願第61/809,105号、および2013年12月09日に提出された第61/913,762号に対する優先権を主張し、それらのすべての内容は参照により本明細書に組み入れられる。
本文書は、試料(例えば、癌細胞またはそれに由来する核酸)を、特定の染色体異常(「CA」)の検出に基づいて、相同組換え欠損(HRD)(例えば、HRDシグネチャー)に関して評価することに関与する方法および材料に関する。例えば、本文書は、細胞(例えば、癌細胞)がHRDを有する(例えば、HRDシグネチャーを呈する)か否かを判定するためにCA領域を検出するための方法および材料を提供する。本文書はまた、特定の癌治療レジメンに反応する可能性が高い癌患者を、HRDの存在、不在または重症度に基づいて同定するための材料および方法も提供する。本文書の全体を通じて、別に指示する場合を除き、HRDおよび相同依存性修復(HDR)欠損は同義に用いられる。
癌は重大な公衆衛生上の問題であり、米国では2009年だけで562,340人が癌で死亡している。American Cancer Society, Cancer Facts & Figures 2009(American Cancer Societyのウェブサイトで入手可能)。癌治療における最も重要な課題の1つは、患者自身の癌の関連する臨床的に有用な特徴を発見し、続いて、これらの特徴に基づいて、患者の癌に最も適した治療計画を施行することである。この個別化医療の分野は進展しているものの、患者の癌を特徴づけるためのさらに優れた分子診断ツールは依然として大いに必要とされている。
全体として、本発明の1つの局面は、癌細胞またはそれに由来するDNA(例えば、ゲノムDNA)におけるHRDを評価するための方法を特徴とする。いくつかの態様において、本方法は、(a)試料もしくはそれに由来するDNAにおいて、試料もしくはそれに由来するDNAの少なくとも1対のヒト染色体(例えば、ヒトX/Y性染色体対以外の任意のヒト染色体対)中のCA領域(本明細書中に定義する通り)を検出する段階、ならびに(b)前記CA領域の数、サイズ(例えば、長さ)、および/または特徴を決定する段階を含むか、またはこれらの段階から本質的になる。いくつかの態様において、CA領域は、ゲノム全体を代表するいくつかの染色体対において分析される(例えば、CA領域の数およびサイズがゲノム全体にわたるCA領域の数およびサイズを代表すると予想されるのに十分な染色体を分析する)。
CA領域スコア=A *(LOH領域スコア)+B *(TAI領域スコア)
CA領域スコア=0.32 *(LOH領域スコア)+0.68 *(TAI領域スコア)
CA領域スコア=A *(LOH領域スコア)+B *(LST領域スコア)
CA領域スコア=A *(TAI領域スコア)+B *(LST領域スコア)
CA領域スコア=A *(LOH領域スコア)+B *(TAI領域スコア)+C *(LST領域スコア)
CA領域スコア=0.21 *(LOH領域スコア)+0.67 *(TAI領域スコア)+0.12 *(LST領域スコア)
全体として、本発明の1つの局面は、癌細胞またはそれに由来するDNA(例えば、ゲノムDNA)におけるHRDを評価するための方法を特徴とする。いくつかの態様において、本方法は、(a)試料またはそれに由来するDNAにおいて、少なくとも1対のヒト染色体またはそれに由来するDNAにおけるCA領域を決定する段階;ならびに(b)前記CA領域の数、サイズ(例えば、長さ)、および/または特徴を決定する段階を含むか、またはこれらの段階から本質的になる。
CA領域スコア=A *(LOH領域スコア)+B *(TAI領域スコア)
CA領域スコア=0.32 *(LOH領域スコア)+0.68 *(TAI領域スコア)
または
CA領域スコア=0.34 *(LOH領域スコア)+0.66 *(TAI領域スコア)
CA領域スコア=A *(LOH領域スコア)+B *(LST領域スコア)
CA領域スコア=0.85 *(LOH領域スコア)+0.15 *(LST領域スコア)
CA領域スコア=A *(TAI領域スコア)+B *(LST領域スコア)
CA領域スコア=A *(LOH領域スコア)+B *(TAI領域スコア)+C *(LST領域スコア)
CA領域スコア=0.21 *(LOH領域スコア)+0.67 *(TAI領域スコア)+0.12 *(LST領域スコア)
または
CA領域スコア=[0.24] *(LOH領域スコア)+[0.65] *(TAI領域スコア)+[0.11] *(LST領域スコア)
または
CA領域スコア=[0.11] *(LOH領域スコア)+[0.25] *(TAI領域スコア)+[0.12] *(LST領域スコア)
以下は、本開示の具体的な態様、すなわち、上記のより一般的な記載による方法およびシステムの、例示的であるが限定的ではない詳細である。
患者試料由来の癌細胞において、前記癌患者の癌細胞の少なくとも1対のヒト染色体におけるインジケーターCA領域(例えば、インジケーターLOH領域、インジケーターTAI領域、インジケーターLST領域、またはそれらの任意の組み合わせ)の数を決定する段階;
患者試料由来の癌細胞が、BRCA1またはBRCA2の欠損(例えば、有害な突然変異、高度のプロモーターメチル化)を有するか否かを判定する段階;および
試料が(a)前記インジケーターCA領域の数が参照数よりも大きい、または(b)BRCA1もしくはBRCA2が欠損しているのいずれか、または(a)と(b)の両方である患者を、前記癌治療レジメンに反応する見込みが高いと診断する段階、
を含む方法を含みうる。
態様1.DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬、またはPARP阻害薬を含む癌治療レジメンに対する患者反応を予測するインビトロ方法であって、
(1)癌細胞を含む試料において、癌患者の癌細胞の少なくとも1対のヒト染色体における、インジケーターLOH領域、インジケーターTAI領域、またはインジケーターLST領域から選択される少なくとも2種類を含むインジケーターCA領域の数を決定する段階;および
(2)その試料におけるインジケーターLOH領域、インジケーターTAI領域、またはインジケーターLST領域の数が参照数よりも多い患者を、該癌治療レジメンに反応する見込みが高いと診断する段階
を含む、方法。
態様2.少なくとも1対のヒト染色体がゲノム全体を代表する、態様1記載の方法。
態様3.インジケーターCA領域が少なくとも2対、3対、4対、5対、6対、7対、8対、9対、10対、11対、12対、13対、14対、15対、16対、17対、18対、19対、20対または21対のヒト染色体において決定される、態様1または態様2記載の方法。
態様4.癌細胞が卵巣癌細胞、乳癌細胞、または食道癌細胞である、態様1~3のいずれか一項記載の方法。
態様5.インジケーターLOH領域の参照数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回り、インジケーターTAI領域の参照数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回り、かつインジケーターLST領域の参照数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40 45、50であるかまたはそれを上回る、態様1~4のいずれか一項記載の方法。
態様6.インジケーターLOH領域が、長さが少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るが完全な染色体または完全な染色体腕のどちらよりも短いLOH領域と定義され、インジケーターTAI領域が、長さが少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るがセントロメアを越えては広がらないTAI領域と定義され、かつインジケーターLST領域が、長さが少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るLST領域と定義される、態様1~5のいずれか一項記載の方法。
態様7.DNA傷害剤がシスプラチン、カルボプラチン、オキサリプラチン(oxalaplatin)もしくはピコプラチンであり、アントラサイクリンがエピルビシン(epirubincin)もしくはドキソルビシンであり、トポイソメラーゼI阻害薬がカンプトテシン(campothecin)、トポテカンもしくはイリノテカンであり、またはPARP阻害薬がイニパリブ、オラパリブもしくはベリパリブ(velapirib)である、態様1~6のいずれか一項記載の方法。
態様8.癌治療レジメンに反応する見込みが高いと診断された患者に癌治療レジメンを施与する段階をさらに含む、態様1~7のいずれか一項記載の方法。
態様9.白金系抗癌剤(platinum agent)を含む癌治療レジメンに対する患者反応を予測するインビトロ方法であって、
(1)癌細胞を含む試料において、癌患者の癌細胞の少なくとも1対のヒト染色体における、インジケーターLOH領域、インジケーターTAI領域、またはインジケーターLST領域から選択される少なくとも2種類を含むインジケーターCA領域の数を決定する段階;
(2)癌細胞を含む試料がBRCA1またはBRCA2が欠損しているか否かを判定する段階;および
(3)その試料において、(a)インジケーターLOH領域、インジケーターTAI領域、もしくはインジケーターLST領域の数が参照数より大きいか、または(b)BRCA1もしくはBRCA2が欠損しているか、または(a)と(b)の両方のいずれかである患者を、該癌治療レジメンに反応する見込みが高いと診断する段階
を含む、方法。
態様10.少なくとも1対のヒト染色体がゲノム全体を代表する、態様9記載の方法。
態様11.インジケーターCA領域が少なくとも2対、3対、4対、5対、6対、7対、8対、9対、10対、11対、12対、13対、14対、15対、16対、17対、18対、19対、20対または21対のヒト染色体において決定される、態様9または態様10記載の方法。
態様12.癌細胞が卵巣癌細胞、乳癌細胞、または食道癌細胞である、態様9~11のいずれか一項記載の方法。
態様13.インジケーターLOH領域の参照数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回り、インジケーターTAI領域の参照数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回り、かつインジケーターLST領域の参照数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回る、態様9~12のいずれか一項記載の方法。
態様14.インジケーターLOH領域が、長さが少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るが完全な染色体または完全な染色体腕のどちらよりも短いLOH領域と定義され、インジケーターTAI領域が、長さが少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るがセントロメアを越えては広がらないTAI領域と定義され、かつインジケーターLST領域が、長さが少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るLST領域と定義される、態様9~13のいずれか一項記載の方法。
態様15.DNA傷害剤がシスプラチン、カルボプラチン、オキサリプラチン(oxalaplatin)もしくはピコプラチンであり、アントラサイクリンがエピルビシン(epirubincin)もしくはドキソルビシンであり、トポイソメラーゼI阻害薬がカンプトテシン(campothecin)、トポテカンもしくはイリノテカンであり、またはPARP阻害薬がイニパリブ、オラパリブもしくはベリパリブ(velapirib)である、態様9~14のいずれか一項記載の方法。
態様16.試料においてBRCA1またはBRCA2のいずれかに有害な突然変異、ヘテロ接合性消失または高度メチル化が検出される場合に、該試料がBRCA1またはBRCA2が欠損している、態様9~15のいずれか一項記載の方法。
態様17.メチル化が、分析したBRCA1またはBRCA2のプロモーターCpGの少なくとも5%、10%、15%、20%、25%、30%、35%、40%、45%、もしくは50%に、またはそれを上回って検出される場合に、高度メチル化が検出される、態様16記載の方法。
態様18.DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬、またはPARP阻害薬を含む癌治療レジメンに対する患者反応を予測するインビトロ方法であって、
(1)癌細胞を含む試料において、癌患者の癌細胞の少なくとも1対のヒト染色体における、インジケーターLOH領域、インジケーターTAI領域、またはインジケーターLST領域から選択される少なくとも2種類を含むインジケーターCA領域の数を決定する段階;
(2)該インジケーターCA領域の数から導き出される試験値を提供する段階;
(3)該試験値を、参照集団における該インジケーターCA領域の数から導き出される1つまたは複数の参照値と比較する段階;および
(4)その試料において該試験値が該1つまたは複数の参照数より大きい患者を、該癌治療レジメンに反応する見込みが高いと診断する段階
を含む、方法。
態様19.少なくとも1対のヒト染色体がゲノム全体を代表する、態様18記載の方法。
態様20.インジケーターCA領域が少なくとも2対、3対、4対、5対、6対、7対、8対、9対、10対、11対、12対、13対、14対、15対、16対、17対、18対、19対、20対または21対のヒト染色体において決定される、態様18または態様19記載の方法。
態様21.癌細胞が卵巣癌細胞、乳癌細胞、または食道癌細胞である、態様18~20のいずれか一項記載の方法。
態様22.インジケーターLOH領域の参照数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回り、インジケーターTAI領域の参照数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回り、かつインジケーターLST領域の参照数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回る、態様18~21のいずれか一項記載の方法。
態様23.インジケーターLOH領域が、長さが少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るが完全な染色体または完全な染色体腕のどちらよりも短いLOH領域と定義され、インジケーターTAI領域が、長さが少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るがセントロメアを越えては広がらないTAI領域と定義され、かつインジケーターLST領域が、長さが少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るLST領域と定義される、態様18~22のいずれか一項記載の方法。
態様24.DNA傷害剤がシスプラチン、カルボプラチン、オキサリプラチン(oxalaplatin)もしくはピコプラチンであり、アントラサイクリンがエピルビシン(epirubincin)もしくはドキソルビシンであり、トポイソメラーゼI阻害薬がカンプトテシン(campothecin)、トポテカンもしくはイリノテカンであり、またはPARP阻害薬がイニパリブ、オラパリブもしくはベリパリブ(velapirib)である、態様18~23のいずれか一項記載の方法。
態様25.その試料において前記試験値が前記1つまたは複数の参照数より大きくない患者を、前記癌治療レジメンに反応する見込みが高くないと診断する段階、および(5)(a)該癌治療レジメンに反応する見込みが高いと診断された患者に、DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬、またはPARP阻害薬を含む治療レジメンを推奨する、処方する、開始する、もしくは継続する段階;または(5)(b)該癌治療レジメンに反応する見込みが高くないと診断された患者に、DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬、またはPARP阻害薬を含まない治療レジメンを推奨する、処方する、開始する、もしくは継続する段階のいずれか、をさらに含む、態様18~24のいずれか一項記載の方法。
態様26.試験値が、以下のように、試料におけるインジケーターLOH領域、インジケーターTAI領域およびインジケーターLST領域の数の算術平均を算出すること:
によって導き出され、かつ、1つまたは複数の参照値が、以下のように、参照集団からの試料におけるインジケーターLOH領域、インジケーターTAI領域およびインジケーターLST領域の数の算術平均を算出すること:
によって導き出される、態様18~25のいずれか一項記載の方法。
態様27.その試料において試験値が、1つまたは複数の参照数の少なくとも2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍もしくは10倍大きいか、少なくとも1標準偏差、2標準偏差、3標準偏差、4標準偏差、5標準偏差、6標準偏差、7標準偏差、8標準偏差、9標準偏差もしくは10標準偏差大きいか、または少なくとも5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%大きい患者を、前記癌治療レジメンに反応する見込みが高いと診断する段階を含む、態様18~26のいずれか一項記載の方法。
態様28.癌患者を治療する方法であって、
(1)癌細胞を含む試料において、該癌患者の癌細胞の少なくとも1対のヒト染色体における、インジケーターLOH領域、インジケーターTAI領域およびインジケーターLST領域を含むインジケーターCA領域の数を決定する段階;
(2)該インジケーターCA領域の数から導き出される試験値を提供する段階;
(3)該試験値を、参照集団における該インジケーターCA領域の数から導き出される1つまたは複数の参照値と比較する段階;および
(4)(a)その試料において試験値が少なくとも1つの該参照値より大きい患者に、DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬もしくはPARP阻害薬を含む治療レジメンを推奨する、処方する、開始する、もしくは継続する段階;または
(4)(b)その試料において試験値が少なくとも1つの該参照値より大きくない患者に、DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬もしくはPARP阻害薬を含む治療レジメンを推奨する、処方する、開始する、もしくは継続する段階、のいずれか
を含む、方法。
態様29.少なくとも1対のヒト染色体がゲノム全体を代表する、態様28記載の方法。
態様30.インジケーターCA領域が少なくとも2対、3対、4対、5対、6対、7対、8対、9対、10対、11対、12対、13対、14対、15対、16対、17対、18対、19対、20対または21対のヒト染色体において決定される、態様28または態様29記載の方法。
態様31.癌細胞が卵巣癌細胞、乳癌細胞、または食道癌細胞である、態様28~30のいずれか一項記載の方法。
態様32.インジケーターLOH領域の参照数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回り、インジケーターTAI領域の参照数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回り、かつインジケーターLST領域の参照数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回る、態様28~31のいずれか一項記載の方法。
態様33.インジケーターLOH領域が、長さが少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るが完全な染色体または完全な染色体腕のどちらよりも短いLOH領域と定義され、インジケーターTAI領域が、長さが少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るがセントロメアを越えては広がらないTAI領域と定義され、かつインジケーターLST領域が、長さが少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るLST領域と定義される、態様28~32のいずれか一項記載の方法。
態様34.DNA傷害剤がシスプラチン、カルボプラチン、オキサリプラチン(oxalaplatin)もしくはピコプラチンであり、アントラサイクリンがエピルビシン(epirubincin)もしくはドキソルビシンであり、トポイソメラーゼI阻害薬がカンプトテシン(campothecin)、トポテカンもしくはイリノテカンであり、またはPARP阻害薬がイニパリブ、オラパリブもしくはベリパリブ(velapirib)である、態様28~33のいずれか一項記載の方法。
態様35.試験値が、以下のように、試料におけるインジケーターLOH領域、インジケーターTAI領域およびインジケーターLST領域の数の算術平均を算出すること:
によって導き出され、かつ、1つまたは複数の参照値が、以下のように、参照集団からの試料におけるインジケーターLOH領域、インジケーターTAI領域およびインジケーターLST領域の数の算術平均を算出すること:
によって導き出される、態様28~34のいずれか一項記載の方法。
態様36.その試料において試験値が、1つまたは複数の参照数の少なくとも2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍もしくは10倍大きいか、少なくとも1標準偏差、2標準偏差、3標準偏差、4標準偏差、5標準偏差、6標準偏差、7標準偏差、8標準偏差、9標準偏差もしくは10標準偏差大きいか、または少なくとも5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%大きい患者を、前記癌治療レジメンに反応する見込みが高いと診断する段階を含む、態様28~35のいずれか一項記載の方法。
態様37.癌細胞またはそのゲノムDNAにおけるHRDを評価するための方法であって、
(a)癌細胞またはそれから導き出されるゲノムDNAにおいて、少なくとも1対のヒト染色体における前記癌細胞のインジケーターCA領域を検出する段階であって、前記少なくとも1対のヒト染色体がヒトX/Y性染色体対でない段階;および
(b)前記少なくとも1対のヒト染色体におけるインジケーターCA領域の総数を決定する段階、
を含む方法。
態様38.癌細胞におけるBRCA1遺伝子およびBRCA2遺伝子の状態を予測する方法であって、
癌細胞において、前記癌細胞の少なくとも1対のヒト染色体におけるインジケーターCA領域の総数を決定する段階;および
癌細胞において前記総数が参照数よりも大きい患者を、BRCA1遺伝子またはBRCA2遺伝子の欠損の見込みが高いと診断する段階、
を含む方法。
態様39.癌細胞におけるHDRの状態を予測する方法であって、
癌細胞において、前記癌細胞の少なくとも1対のヒト染色体におけるインジケーターCA領域の総数を決定する段階;および
癌細胞において前記総数が参照数よりも大きい患者を、HDRの欠損の見込みが高いと診断する段階、
を含む方法。
態様40.DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬、放射線、および/またはPARP阻害薬を含む癌治療レジメンに対する癌患者の反応を予測する方法であって、
前記癌患者由来の癌細胞において、前記癌患者の癌細胞の少なくとも1対のヒト染色体におけるインジケーターCA領域の数を決定する段階;および
癌細胞において前記総数が参照数よりも大きい患者を、前記癌治療レジメンに反応する見込みが高いと診断する段階、
を含む方法。
態様41.治療レジメンに対する癌患者の反応を予測する方法であって、
前記癌患者由来の癌細胞において、前記癌患者の癌細胞の少なくとも1対のヒト染色体におけるインジケーターCA領域の総数を決定する段階;および
癌細胞において前記総数が参照数よりも大きい患者を、パクリタキセルまたはドセタキセルを含む治療レジメンに反応しない見込みが高いと診断する段階、
を含む方法。
態様42.癌を治療する方法であって、
(a)癌患者由来の癌細胞またはそれから得られたゲノムDNAにおいて、癌細胞の少なくとも1対のヒト染色体におけるインジケーターCA領域の総数を決定する段階;および
(b)インジケーターCA領域の前記総数が参照数よりも大きい場合に、前記癌患者に対して、DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬およびPARP阻害薬からなる群より選択される1つまたは複数の薬物を含む癌治療レジメンを施与する段階、
を含む方法。
態様43.合計5つまたはそれを上回るインジケーターCA領域を有すると判定された癌細胞を有すると同定された患者における癌を治療するために有用な医薬を製造するための、DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬およびPARP阻害薬からなる群より選択される1つまたは複数の薬物の使用。
態様44.癌患者の癌細胞のLOH状態を判定するためのシステムであって、
(a)前記癌細胞の少なくとも1対のヒト染色体のゲノムDNAに関する複数のシグナルを生じるように構成された試料分析装置、および
(b)前記複数のシグナルに基づいて、前記少なくとも1対のヒト染色体におけるインジケーターCA領域の数を算出するようにプログラムされているコンピュータサブシステム、
を含むシステム。
態様45.コンピュータサブシステムが、インジケーターCA領域の数を参照数と比較して、
(a)前記癌細胞におけるBRCA1遺伝子および/もしくはBRCA2遺伝子の欠損の見込み、
(b)前記癌細胞におけるHDRの欠損の見込み、または
(c)前記癌患者が、DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬、放射線またはPARP阻害薬を含む癌治療レジメンに反応する見込み、
を判定するようにプログラムされている、態様8記載のシステム。
態様46.コンピュータ上で実行された場合に、
ヒト染色体の1つまたは複数の上に存在する任意のインジケーターCA領域の存在または不在を検出する段階;および
1対または複数対の染色体における前記インジケーターCA領域の総数を決定する段階、
を行う、コンピュータ可読媒体に組み込まれたコンピュータプログラム製品。
態様47.ヒトゲノムDNAの複数の多型領域とハイブリダイズしうる、少なくとも500個のオリゴヌクレオチド;および
態様10記載のコンピュータプログラム製品、
を含む、診断用キット。
態様48.癌患者から得られたヒト癌細胞の少なくとも1つの染色体対におけるインジケーターCA領域の総数を決定するため、および
(a)前記癌細胞におけるBRCA1遺伝子もしくはBRCA2遺伝子の欠損の見込みが高いこと、
(b)前記癌細胞におけるHDRの欠損の見込みが高いこと、または
(c)前記癌患者が、DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬、放射線もしくはPARP阻害薬を含む癌治療レジメンに反応する見込みが高いこと、
を検出するために有用な診断用キットを製造するための、ヒトゲノムDNAの複数の多型領域とハイブリダイズしうる複数のオリゴヌクレオチドの使用。
態様49.インジケーターCA領域がインジケーターLOH領域、インジケーターTAI領域およびインジケーターLST領域であり、任意で、少なくとも2対、5対、10対または21対のヒト染色体において決定される、態様37~42のいずれか一項記載の方法。
態様50.癌細胞が卵巣癌細胞、乳癌細胞、または食道癌細胞である、態様36~42のいずれか一項記載の方法。
態様51.インジケーターLOH領域、インジケーターTAI領域、またはインジケーターLST領域の総数が9、15、20であるかまたはそれを上回る、態様36~42のいずれか一項記載の方法。
態様52.インジケーターLOH領域、インジケーターTAI領域またはインジケーターLST領域が、約6、12もしくは15メガベース、またはそれを上回る長さを有すると定義される、態様36~42のいずれか一項記載の方法。
態様53.参照数が6、7、8、9、10、11、12もしくは13であるかまたはそれを上回る、態様36~42のいずれか一項記載の方法。
態様54.インジケーターCA領域がインジケーターLOH領域、インジケーターTAI領域およびインジケーターLST領域であり、任意で、少なくとも2対、5対、10対または21対のヒト染色体において決定される、態様43または48記載の使用。
態様55.癌細胞が卵巣癌細胞、乳癌細胞、または食道癌細胞である、態様43または48記載の使用。
態様56.インジケーターLOH領域、インジケーターTAI領域、またはインジケーターLST領域の総数が9、15、20であるかまたはそれを上回る、態様43または48記載の使用。
態様57.インジケーターLOH領域、インジケーターTAI領域またはインジケーターLST領域が、約6、12もしくは15メガベース、またはそれを上回る長さを有すると定義される、態様43または48記載の使用。
態様58.インジケーターCA領域がインジケーターLOH領域、インジケーターTAI領域およびインジケーターLST領域であり、任意で、少なくとも2対、5対、10対または21対のヒト染色体において決定される、態様44または45記載のシステム。
態様59.癌細胞が卵巣癌細胞、乳癌細胞、または食道癌細胞である、態様44または45記載のシステム。
態様60.インジケーターLOH領域、インジケーターTAI領域、またはインジケーターLST領域の総数が9、15、20であるかまたはそれを上回る、態様44または45記載のシステム。
態様61.インジケーターLOH領域、インジケーターTAI領域またはインジケーターLST領域が、約6、12もしくは15メガベース、またはそれを上回る長さを有すると定義される、態様44または45記載のシステム。
態様62.インジケーターCA領域がインジケーターLOH領域、インジケーターTAI領域およびインジケーターLST領域であり、任意で、少なくとも2対、5対、10対または21対のヒト染色体において決定される、態様46記載のコンピュータプログラム製品。
態様63.癌細胞が卵巣癌細胞、乳癌細胞、または食道癌細胞である、態様46記載のコンピュータプログラム製品。
態様64.インジケーターLOH領域、インジケーターTAI領域、またはインジケーターLST領域の総数が9、15、20であるかまたはそれを上回る、態様46記載のコンピュータプログラム製品。
態様65.インジケーターLOH領域、インジケーターTAI領域またはインジケーターLST領域が、約6、12もしくは15メガベース、またはそれを上回る長さを有すると定義される、態様46記載のコンピュータプログラム製品。
態様66.少なくとも1対のヒト染色体がヒト17番染色体ではない、態様36~42のいずれか一項記載の方法。
態様67.インジケーターCA領域がヒト17番染色体におけるものではない、態様43または48記載の使用。
態様68.インジケーターCA領域がヒト17番染色体におけるものではない、態様44または45記載のシステム。
態様69.インジケーターCA領域がヒト17番染色体におけるものではない、態様46記載のコンピュータプログラム製品。
態様70.DNA傷害剤がシスプラチン、カルボプラチン、オキサリプラチン(oxalaplatin)もしくはピコプラチンであり、アントラサイクリンがエピルビシン(epirubincin)もしくはドキソルビシンであり、トポイソメラーゼI阻害薬がカンプトテシン(campothecin)、トポテカンもしくはイリノテカンであり、またはPARP阻害薬がイニパリブ、オラパリブもしくはベリパリブ(velapirib)である、態様40または42記載の方法。
態様71.DNA傷害剤が白金系化学療法薬であり、アントラサイクリンがエピルビシン(epirubincin)もしくはドキソルビシンであり、トポイソメラーゼI阻害薬がカンプトテシン(campothecin)、トポテカンもしくはイリノテカンであり、またはPARP阻害薬がイニパリブ、オラパリブもしくはベリパリブ(velapirib)である、態様48記載の使用。
態様72.DNA傷害剤が白金系化学療法薬であり、アントラサイクリンがエピルビシン(epirubincin)もしくはドキソルビシンであり、トポイソメラーゼI阻害薬がカンプトテシン(campothecin)、トポテカンもしくはイリノテカンであり、またはPARP阻害薬がイニパリブ、オラパリブもしくはベリパリブ(velapirib)である、態様45記載のシステム。
態様73.DNA傷害剤が白金系化学療法薬であり、アントラサイクリンがエピルビシン(epirubincin)もしくはドキソルビシンであり、トポイソメラーゼI阻害薬がカンプトテシン(campothecin)、トポテカンもしくはイリノテカンであり、またはPARP阻害薬がイニパリブ、オラパリブもしくはベリパリブ(velapirib)である、態様46記載のコンピュータプログラム製品。
態様74.(a)癌細胞またはそれから導き出されるゲノムDNAにおいて、癌細胞のヒト染色体の代表的な数の対における、インジケーターLOH領域、インジケーターTAI領域、またはインジケーターLST領域から選択される少なくとも2種類を含むインジケーターCA領域を検出する段階;ならびに
(b)前記インジケーターCA領域の数およびサイズを決定する段階、
を含む方法。
態様75.ヒト染色体の代表的な数の対がゲノム全体を代表する、態様74記載の方法。
態様76.特定サイズのインジケーターCA領域の数の増加を、HDRの欠損の見込みの高さと相関づけることをさらに含む、態様74記載の方法。
態様77.特定のサイズが、約1.5、2、2.5、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、75または100メガベースよりも長く、かつインジケーターCA領域を含有する染色体全体の長さよりも短い、態様76記載の方法。
態様78.特定のサイズの6、7、8、9、10、11、12もしくは13またはそれを上回るインジケーターCA領域が、HDRの欠損の見込みが高いことと相関づけられる、態様76または77記載の方法。
態様79.癌患者の予後を判定する方法であって、
(a)癌細胞を含む試料がHRDシグネチャーを有するか否かを判定する段階であって、癌患者の癌細胞の少なくとも1対のヒト染色体における、インジケーターLOH領域、インジケーターTAI領域、またはインジケーターLST領域から選択される少なくとも2種類を含む参照数を上回るインジケーターCA領域の存在により、その癌細胞がHRDシグネチャーを有することが指し示される段階、および
(b)(1)試料においてHRDシグネチャーが検出される患者を比較的良好な予後を有すると診断する段階、または
(b)(2)試料においてHRDシグネチャーが検出されない患者を比較的不良な予後を有すると診断する段階、
を含む方法。
態様80.患者の癌細胞の少なくとも1対のヒト染色体におけるインジケーターCA領域が参照数よりも多い患者において、乳癌、卵巣癌、肝臓癌、食道癌、肺癌、頭頸部癌、前立腺癌、結腸癌、直腸癌、結腸直腸癌および膵癌からなる群より選択される癌である疾患の治療に用いるための、DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬およびPARP阻害薬からなる群より選択される治療薬を含む組成物。
態様81.インジケーターCA領域が少なくとも2対、5対、10対または21対のヒト染色体において決定される、態様80記載の組成物。
態様82.インジケーターCA領域の総数が9、15、20またはそれを上回る、態様80記載の組成物。
態様83.最初の長さが約6、12もしくは15メガベース、またはそれを上回る、態様80記載の組成物。
態様84.参照数が6、7、8、9、10、11、12もしくは13であるかまたはそれを上回る、態様80記載の組成物。
態様85.患者における癌を治療する方法であって、
前記患者由来の試料において、癌患者の癌細胞の少なくとも1対のヒト染色体におけるインジケーターLOH領域、インジケーターTAI領域、またはインジケーターLST領域から選択される少なくとも2種類を含むインジケーターCA領域の数を決定する段階であって、その癌細胞がHRDシグネチャーを有することが指し示される段階;
前記インジケーターCA領域の数から導き出される試験値を提供する段階;
前記試験値を、参照集団における前記インジケーターCA領域の数から導き出される1つまたは複数の参照値(例えば、平均値、中央値、三分位値、四分位値、五分位値など)と比較する段階;および
試験値が、少なくとも1つの前記参照値よりも大きい(例えば、少なくとも2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、または10倍大きい;少なくとも1標準偏差、2標準偏差、3標準偏差、4標準偏差、5標準偏差、6標準偏差、7標準偏差、8標準偏差、9標準偏差、または10標準偏差大きい)ことを明らかにする前記比較する段階に少なくとも部分的に基づいて、前記患者に対して抗癌薬を投与する段階、または化学療法および/もしくは合成致死性薬剤を含む治療レジメンを推奨する、もしくは処方する、もしくは開始する段階;または
試験値が、少なくとも1つの前記参照値より大きくない(例えば、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍または10倍以下;1標準偏差、2標準偏差、3標準偏差、4標準偏差、5標準偏差、6標準偏差、7標準偏差、8標準偏差、9標準偏差、または10標準偏差以下)ことを明らかにする前記比較する段階に少なくとも部分的に基づいて、化学療法および/もしくは合成致死性薬剤を含まない治療レジメンを推奨する、もしくは処方する、もしくは開始する段階、
を含む方法。
態様86.インジケーターCA領域が少なくとも2対、5対、10対または21対のヒト染色体において決定される、態様85記載の方法。
態様87.インジケーターCA領域の総数が9、15、20であるかまたはそれを上回る、態様85記載の方法。
態様88.最初の長さが約6、12もしくは15メガベースであるかまたはそれを上回る、態様85記載の方法。
態様89.参照数が6、7、8、9、10、11、12もしくは13であるかまたはそれを上回る、態様85記載の方法。
態様90.化学療法がDNA傷害剤、アントラサイクリンおよびトポイソメラーゼI阻害薬からなる群より選択され、かつ/または合成致死性薬剤がPARP阻害薬である、態様85記載の方法。
態様91.DNA傷害剤がシスプラチン、カルボプラチン、オキサリプラチン(oxalaplatin)もしくはピコプラチンであり、アントラサイクリンがエピルビシン(epirubincin)もしくはドキソルビシンであり、トポイソメラーゼI阻害薬がカンプトテシン(campothecin)、トポテカンもしくはイリノテカンであり、かつ/またはPARP阻害薬がイニパリブ、オラパリブもしくはベリパリブ(velapirib)である、態様85記載の方法。
態様92.癌細胞またはそのゲノムDNAにおけるHRDを評価するための方法であって、
(a)癌細胞またはそれから導き出されるゲノムDNAにおいて、前記癌細胞の少なくとも1対のヒト染色体におけるインジケーターLOH領域、インジケーターTAI領域またはインジケーターLST領域から選択される少なくとも2種類を含むインジケーターCA領域を検出する段階であって、前記少なくとも1対のヒト染色体がヒトX/Y性染色体対でない段階;および
(b)前記少なくとも1対のヒト染色体において検出された各種のインジケーターCA領域の数の平均を算出することによって、インジケーターCA領域の総数にわたっての平均(例えば、算術平均)を決定する段階(例えば、16のインジケーターLOH領域および18のインジケーターLST領域がある場合、算術平均は17と算出される)、
を含む方法。
態様93.癌細胞におけるBRCA1遺伝子およびBRCA2遺伝子の状態を予測する方法であって、
癌細胞において、前記癌細胞の少なくとも1対のヒト染色体におけるインジケーターLOH領域、インジケーターTAI領域、またはインジケーターLST領域から選択される少なくとも2種類を含むインジケーターCA領域の各種の総数にわたっての平均(例えば、算術平均)を決定する段階;および
参照数よりも大きい、総数にわたっての前記平均(例えば、算術平均)を、BRCA1遺伝子またはBRCA2遺伝子の欠損の見込みの高さと相関づける段階、
を含む方法。
態様94.癌細胞におけるHDRの状態を予測する方法であって、
癌細胞において、前記癌細胞の少なくとも1対のヒト染色体におけるインジケーターLOH領域、インジケーターTAI領域、またはインジケーターLST領域から選択される少なくとも2種類を含むインジケーターCA領域の各種の総数にわたっての平均(例えば、算術平均)を決定する段階;および
参照数よりも大きい、総数にわたっての前記平均(例えば、算術平均)を、HDRの欠損の見込みの高さと相関づける段階、
を含む方法。
態様95.DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬、放射線、および/またはPARP阻害薬を含む癌治療レジメンに対する癌患者の反応を予測する方法であって、
癌細胞を含む試料において、前記試料の少なくとも1対のヒト染色体におけるインジケーターLOH領域、インジケーターTAI領域、またはインジケーターLST領域から選択される少なくとも2種類を含むインジケーターCA領域の各種の総数にわたっての平均(例えば、算術平均)を決定する段階(例えば、16のインジケーターLOH領域および18のインジケーターLST領域がある場合、算術平均は17であると決定される);ならびに
試料において総数にわたっての前記平均(例えば、算術平均)が参照数よりも大きい患者を、前記癌治療レジメンに反応する見込みが高いと判定する段階、
を含む方法。
態様96.治療レジメンに対する癌患者の反応を予測する方法であって、
癌細胞を含む患者試料において、前記患者試料の少なくとも1対のヒト染色体におけるインジケーターLOH領域、インジケーターTAI領域、またはインジケーターLST領域から選択される少なくとも2種類を含むインジケーターCA領域の総数にわたっての平均(例えば、算術平均)を決定する段階;および
試料において総数にわたっての前記平均(例えば、算術平均)が参照数よりも大きい患者を、パクリタキセルまたはドセタキセルを含む治療レジメンに反応しない見込みが高いと診断する段階、
を含む方法。
態様97.癌を治療する方法であって、
(a)癌細胞またはそれから得られたゲノムDNAを含む患者試料において、癌細胞の少なくとも1対のヒト染色体におけるインジケーターLOH領域、インジケーターTAI領域、またはインジケーターLST領域から選択される少なくとも2種類を含むインジケーターCA領域の各種の総数にわたっての平均(例えば、算術平均)を決定する段階;および
(b)試料においてインジケーターCA領域の前記総数が参照数よりも大きい患者に対して、DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬およびPARP阻害薬からなる群より選択される1つまたは複数の薬物を含む癌治療レジメンを施与する段階、
を含む方法。
態様98.DNA傷害剤がシスプラチン、カルボプラチン、オキサリプラチン(oxalaplatin)もしくはピコプラチンであり、アントラサイクリンがエピルビシン(epirubincin)もしくはドキソルビシンであり、トポイソメラーゼI阻害薬がカンプトテシン(campothecin)、トポテカンもしくはイリノテカンであり、またはPARP阻害薬がイニパリブ、オラパリブもしくはベリパリブ(velapirib)である、態様95または97記載の方法。
態様99.患者の癌細胞の少なくとも1対のヒト染色体におけるインジケーターLOH領域、インジケーターTAI領域、またはインジケーターLST領域から選択される少なくとも2種類を含むインジケーターCA領域の各種にわたっての平均(例えば、算術平均)が参照数よりも大きい患者において、乳癌、卵巣癌、肝臓癌、食道癌、肺癌、頭頸部癌、前立腺癌、結腸癌、直腸癌、結腸直腸癌および膵癌からなる群より選択される癌である疾患の治療に用いるための、DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬およびPARP阻害薬からなる群より選択される治療薬を含む組成物。
態様100.患者における癌を治療する方法であって、
前記患者由来の試料において、癌患者の癌細胞の少なくとも1対のヒト染色体におけるインジケーターCA領域の総数の平均(例えば、算術平均)を決定し、その癌細胞がHRDシグネチャーを有することが指し示される段階;
インジケーターLOH領域、インジケーターTAI領域またはインジケーターLST領域から選択される少なくとも2種類を含む前記インジケーターCA領域の各種の数にわたっての平均(例えば、算術平均)から導き出される試験値を提供する段階;
前記試験値を、参照集団におけるインジケーターCA領域の各種にわたっての前記平均(例えば、算術平均)の数から導き出される1つまたは複数の参照値(例えば、平均値、中央値、三分位値、四分位値、五分位値など)と比較する段階;および
試験値が、少なくとも1つの前記参照値よりも大きい(例えば、少なくとも2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、または10倍大きい;少なくとも1標準偏差、2標準偏差、3標準偏差、4標準偏差、5標準偏差、6標準偏差、7標準偏差、8標準偏差、9標準偏差、または10標準偏差大きい)ことを明らかにする前記比較する段階に少なくとも部分的に基づいて、前記患者に対して抗癌薬を投与する段階、または化学療法および/もしくは合成致死性薬剤を含む治療レジメンを推奨する、もしくは処方する、もしくは開始する段階;または
試験値が、少なくとも1つの前記参照値より大きくない(例えば、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍または10倍以下;1標準偏差、2標準偏差、3標準偏差、4標準偏差、5標準偏差、6標準偏差、7標準偏差、8標準偏差、9標準偏差、または10標準偏差以下)ことを明らかにする前記比較する段階に少なくとも部分的に基づいて、化学療法および/もしくは合成致死性薬剤を含まない治療レジメンを推奨する、もしくは処方する、もしくは開始する段階、
を含む方法。
態様101.インジケーターCA領域の各種にわたっての平均(例えば、算術平均)が、少なくとも2対、5対、10対または21対のヒト染色体において決定される、態様100記載の方法。
態様102.化学療法がDNA傷害剤、アントラサイクリンおよびトポイソメラーゼI阻害薬からなる群より選択され、かつ/または合成致死性薬剤がPARP阻害薬である、態様100記載の方法。
態様103.DNA傷害剤がシスプラチン、カルボプラチン、オキサリプラチン(oxalaplatin)もしくはピコプラチンであり、アントラサイクリンがエピルビシン(epirubincin)もしくはドキソルビシンであり、トポイソメラーゼI阻害薬がカンプトテシン(campothecin)、トポテカンもしくはイリノテカンであり、かつ/またはPARP阻害薬がイニパリブ、オラパリブもしくはベリパリブ(velapirib)である、態様100記載の方法。
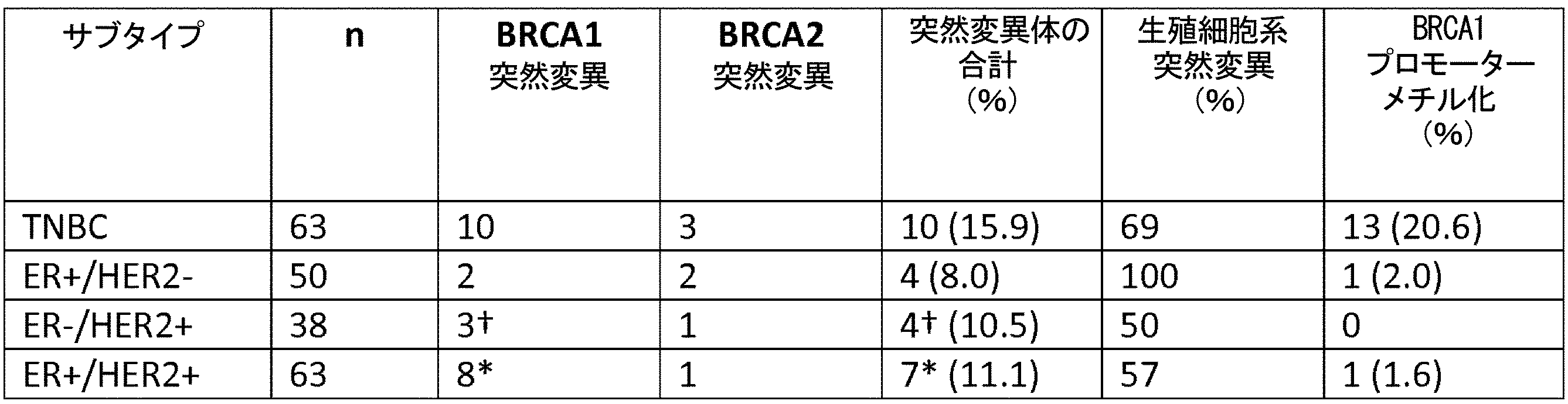
BRCA1/2および卵巣癌における他のHDR経路遺伝子の欠損と高度に相関する、全ゲノム腫瘍LOHプロファイルに基づくLOHシグネチャーが開発されており(Abkevich, et al., Patterns of Genomic Loss of Heterozygosity Predict Homologous Recombination Repair Defects, BR. J. CANCER (2012))、それは乳癌におけるDNA傷害剤(例えば、白金系ネオアジュバント)療法に対する反応を予測する(Telli et al., Homologous Recombination Deficiency (HRD) score predicts response following neoadjuvant platinum-based therapy in triple-negative and BRCA1/2 mutation-associated breast cancer (BC), CANCER RES. (2012))。TAIに基づく第2のスコアも、BRCA1/2欠損との強い相関を示し、トリプルネガティブ乳癌における白金系薬剤治療に対する反応を予測する(Birkbak et al., Telomeric allelic imbalance indicates defective DNA repair and sensitivity to DNA-damaging agents, CANCER DISCOV. (2012))。本研究では、ER/PR/HER2状態によって定義される乳癌サブタイプにわたっての、BRCA1/2欠損の頻度、およびLOH領域スコアまたはTAI領域スコアの増大について検討した。
* 各個体はBRCA1において1つの生殖細胞系突然変異および1つの体細胞突然変異を有した。
実施例1に記載した通りに、SNPアレル頻度の比を求めて、LOH領域スコア、TAI領域スコアおよびLST領域スコアの算出に用いた。LSTスコアは、3メガベースよりも短い領域をふるい落とした後の、安定的なコピー数を有する10メガベースよりも長い領域間の不連続点の数と定義した。本発明者らは、インタクト試料および欠損試料のいずれにおいてもLSTスコアが倍数性とともに増加することを観察した。このため、この実施例2では、倍数性特異的カットオフを用いる代わりに、本発明者らはそれを倍数性によって調整することによってLST領域スコアを改変した:LSTm=LST-kP、式中、Pは倍数性であり、kは定数である。欠損をアウトカムとし、LSTおよびPを予測因子として用いる多変量ロジスティック回帰分析によれば、k=15.5である。
以下の研究は、本明細書に記載される通りのHRDスコアが、BRCA1/2欠損、およびトリプルネガティブ乳癌(TNBC)におけるHR欠損を標的とする薬剤の有効性をいかに予測しうるかを示している。乳癌サブタイプにわたってのBRCA1/2欠損の割合を調べるために、乳房腫瘍試料をBRCA1/2突然変異およびプロモーターメチル化に関してアッセイした。実施例2に記載した3種のHRDスコアを試料に関して決定し、続いてBRCA1/2欠損との関連についてLOH/TAI/LSTスコアの算術平均を用いて検討した。シスプラチンによって治療したネオアジュバントTNBCコホートの分析を、3種のHRDスコアすべてと反応との関係についてさらに行った。
これまでの実施例では相同組換え欠損(HRD)を測定するDNAベースのスコアが記載してきたが、それにより、各スコアがBRCA1/2欠損と有意に関連することが実証され、3種類のHRDスコアの算術平均として定義されるHRD-複合スコアについても同様である。この実施例では、(1)3種のスコアのそれぞれとHRD-複合スコアとの関連、(2)臨床的変数とHRD-複合スコアとの関連、ならびに(3)臨床的変数およびHRD-複合スコアとBRCA1/2欠損との関連を検討することによって、これまでの実施例の結果を拡張する。
HRD-モデル=0.11×(HRD-LOH)+0.25×(HRD-TAI)+0.12×(HRD-LST)
によって与えられる。
本発明をその詳細な記載とともに説明してきたが、前記の記載は本発明の例示を意図しており、制限を意図したものではなく、それは添付の特許請求の範囲によって定められることが理解される必要がある。他の局面、利点および変更は、以下の特許請求の範囲内にある。
Claims (25)
- DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬、またはPARP阻害薬を含む癌治療レジメンに対する患者反応を予測するインビトロ方法であって、
(1)癌細胞を含む試料において、癌患者の癌細胞の少なくとも1対のヒト染色体における、インジケーターCA領域の総数を決定する段階であって、該インジケーターCA領域は、インジケーターLOH領域、インジケーターTAI領域、およびインジケーターLST領域であり、
(a)インジケーターLOH領域は、約10メガベースよりも長いが、そのLOH領域が内部に位置する各々の染色体の全長よりも短いLOH領域であり、
(b)インジケーターTAI領域は、サブテロメアの1つに広がり、セントロメアを越えない、アレル不均衡を伴うTAI領域であり、
(c)インジケーターLST領域は、約2メガベースよりも短い領域をふるい落とした後に、少なくとも3メガベースの長さの2つの領域の間に存在する、染色体の長さに沿った体細胞コピー数の不連続点である、
段階;および
(2A)その試料における該インジケーターCA領域の総数が、参照集団の患者における該インジケーターCA領域の総数から導き出される参照数(参照数)よりも多い患者を、該DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬、またはPARP阻害薬に反応する見込みが高いと判定する段階、若しくは
(2B)その試料における該インジケーターCA領域の総数が、参照集団の患者における該インジケーターCA領域の総数から導き出される参照数よりも多くない患者を、該DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬、またはPARP阻害薬に反応する見込みが高くないと判定する段階、
を含む、方法。 - 少なくとも1対のヒト染色体がゲノム全体を代表する、請求項1記載の方法。
- 該インジケーターCA領域が少なくとも2対、3対、4対、5対、6対、7対、8対、9対、10対、11対、12対、13対、14対、15対、16対、17対、18対、19対、20対または21対のヒト染色体において決定される、請求項1または2記載の方法。
- インジケーターLOH領域の数、インジケーターTAI領域の数、およびインジケーターLST領域の数から導き出される参照数であり、インジケーターLOH領域の数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回り、インジケーターTAI領域の数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回り、かつインジケーターLST領域の数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40 45、50であるかまたはそれを上回る、請求項1~3のいずれか一項記載の方法。
- インジケーターLOH領域が、長さが少なくとも10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るが完全な染色体または完全な染色体腕のどちらよりも短いLOH領域と定義され、インジケーターTAI領域が、長さが少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るがセントロメアを越えては広がらないTAI領域と定義され、かつインジケーターLST領域が、長さが少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るLST領域と定義される、請求項1~4のいずれか一項記載の方法。
- DNA傷害剤がシスプラチン、カルボプラチン、オキサリプラチン(oxalaplatin)もしくはピコプラチンであり、アントラサイクリンがエピルビシン(epirubincin)もしくはドキソルビシンであり、トポイソメラーゼI阻害薬がカンプトテシン(campothecin)、トポテカンもしくはイリノテカンであり、またはPARP阻害薬がイニパリブ、オラパリブもしくはベリパリブ(velapirib)である、請求項1~5のいずれか一項記載の方法。
- 参照数が、10以上である、請求項1~6のいずれか一項記載の方法。
- 白金系抗癌剤(platinum agent)を含む癌治療レジメンに対する患者反応を予測するインビトロ方法であって、
(1)癌細胞を含む試料において、癌患者の癌細胞の少なくとも1対のヒト染色体における、インジケーターCA領域の総数を決定する段階であって、該インジケーターCA領域は、インジケーターLOH領域、インジケーターTAI領域、およびインジケーターLST領域であり、
(a)インジケーターLOH領域は、約10メガベースよりも長いが、そのLOH領域が内部に位置する各々の染色体の全長よりも短いLOH領域であり、
(b)インジケーターTAI領域は、サブテロメアの1つに広がり、セントロメアを越えない、アレル不均衡を伴うTAI領域であり、
(c)インジケーターLST領域は、約2メガベースよりも短い領域をふるい落とした後に、少なくとも3メガベースの長さの2つの領域の間に存在する、染色体の長さに沿った体細胞コピー数の不連続点である、
段階;
(2)癌細胞を含む試料がBRCA1またはBRCA2が欠損しているか否かを判定する段階;および
(3A)その試料が、(a)参照集団の患者における該インジケーターCA領域の総数から導き出される参照数(参照数)よりも大きいインジケーターCA領域の総数を有しているか、または(b)BRCA1もしくはBRCA2が欠損を有しているか、または(a)と(b)の両方のいずれかである場合に、白金系抗癌剤を含む癌治療レジメンに反応する見込みが高いと判定する段階;若しくは
(3B)その試料において、(a)該インジケーターCA領域の総数が前記参照数より大きくなく、および(b)BRCA1もしくはBRCA2が欠損していない場合に、白金系抗癌剤を含む癌治療レジメンに反応する見込みが高くないと判定する段階、
を含む、方法。 - 少なくとも1対のヒト染色体がゲノム全体を代表する、請求項8記載の方法。
- 該インジケーターCA領域が少なくとも2対、3対、4対、5対、6対、7対、8対、9対、10対、11対、12対、13対、14対、15対、16対、17対、18対、19対、20対または21対のヒト染色体において決定される、請求項8または9記載の方法。
- インジケーターLOH領域の数、インジケーターTAI領域の数、およびインジケーターLST領域の数から導き出される参照数であり、インジケーターLOH領域の数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回り、インジケーターTAI領域の数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回り、かつインジケーターLST領域の数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回る、請求項8~10のいずれか一項記載の方法。
- インジケーターLOH領域が、長さが少なくとも10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るが完全な染色体または完全な染色体腕のどちらよりも短いLOH領域と定義され、インジケーターTAI領域が、長さが少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るがセントロメアを越えては広がらないTAI領域と定義され、かつインジケーターLST領域が、長さが少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るLST領域と定義される、請求項8~11のいずれか一項記載の方法。
- 白金系抗癌剤が、シスプラチン、カルボプラチン、オキサリプラチン(oxalaplatin)もしくはピコプラチンである、請求項8~12のいずれか一項記載の方法。
- 試料においてBRCA1またはBRCA2のいずれかに有害な突然変異、ヘテロ接合性消失または高度メチル化が検出される場合に、該試料がBRCA1またはBRCA2が欠損している、請求項8~13のいずれか一項記載の方法。
- メチル化が、分析したBRCA1またはBRCA2のプロモーターCpGの少なくとも5%、10%、15%、20%、25%、30%、35%、40%、45%、もしくは50%に、またはそれを上回って検出される場合に、高度メチル化が検出される、請求項14記載の方法。
- 参照数が、10以上である、請求項8~15のいずれか一項記載の方法。
- DNA傷害剤、アントラサイクリン、トポイソメラーゼI阻害薬、またはPARP阻害薬を含む癌治療レジメンに対する患者反応を予測するインビトロ方法であって、
(1)癌細胞を含む試料において、癌患者の癌細胞の少なくとも1対のヒト染色体における、インジケーターCA領域の総数を決定する段階であって、インジケーターCA領域は、インジケーターLOH領域、インジケーターTAI領域、およびインジケーターLST領域であり、
(a)インジケーターLOH領域は、約10メガベースよりも長いが、そのLOH領域が内部に位置する各々の染色体の全長よりも短いLOH領域であり、
(b)インジケーターTAI領域は、サブテロメアの1つに広がり、セントロメアを越えない、アレル不均衡を伴うTAI領域であり、
(c)インジケーターLST領域は、約2メガベースよりも短い領域をふるい落とした後に、少なくとも3メガベースの長さの2つの領域の間に存在する、染色体の長さに沿った体細胞コピー数の不連続点である、
段階;
(2)該インジケーターCA領域の総数から導き出される試験値(試験値)を提供する段階;
(3)該試験値を、参照集団の患者における該インジケーターCA領域の総数から導き出される1つの参照値(参照値)と比較する段階;および
(4A)その試料において該試験値が該参照値より大きい患者を、該癌治療レジメンに反応する見込みが高いと判定する段階;若しくは
(4B)その試料において該試験値が該参照値より大きくない患者を、該癌治療レジメンに反応する見込みが低いと判定する段階、
を含み、該参照値および該試験値は同じ算出手法により導き出される、方法。 - 少なくとも1対のヒト染色体がゲノム全体を代表する、請求項17記載の方法。
- 該インジケーターCA領域が少なくとも2対、3対、4対、5対、6対、7対、8対、9対、10対、11対、12対、13対、14対、15対、16対、17対、18対、19対、20対または21対のヒト染色体において決定される、請求項17または18記載の方法。
- インジケーターLOH領域の数、インジケーターTAI領域の数、およびインジケーターLST領域の数から導き出される参照値であり、インジケーターLOH領域の数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回り、インジケーターTAI領域の数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回り、かつインジケーターLST領域の数が2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50であるかまたはそれを上回る、請求項17~19のいずれか一項記載の方法。
- インジケーターLOH領域が、長さが少なくとも10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るが完全な染色体または完全な染色体腕のどちらよりも短いLOH領域と定義され、インジケーターTAI領域が、長さが少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るがセントロメアを越えては広がらないTAI領域と定義され、かつインジケーターLST領域が、長さが少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50メガベースであるかまたはそれを上回るLST領域と定義される、請求項17~20のいずれか一項記載の方法。
- DNA傷害剤が、シスプラチン、カルボプラチン、オキサリプラチン(oxalaplatin)もしくはピコプラチンであり、アントラサイクリンが、エピルビシン(epirubincin)もしくはドキソルビシンであり、トポイソメラーゼI阻害薬が、カンプトテシン(campothecin)、トポテカンもしくはイリノテカンであり、またはPARP阻害薬が、イニパリブ、オラパリブもしくはベリパリブ(velapirib)である、請求項17~21のいずれか一項記載の方法。
- その試料において試験値が、該参照値の少なくとも2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍もしくは10倍大きいか、少なくとも1標準偏差、2標準偏差、3標準偏差、4標準偏差、5標準偏差、6標準偏差、7標準偏差、8標準偏差、9標準偏差もしくは10標準偏差大きいか、または少なくとも5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%大きい患者を、前記癌治療レジメンに反応する見込みが高いと判定する段階を含む、請求項17~24のいずれか一項記載の方法。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2022169085A JP7641938B2 (ja) | 2013-04-05 | 2022-10-21 | 相同組換え欠損を評価するための方法および材料 |
| JP2025027653A JP2025090619A (ja) | 2013-04-05 | 2025-02-25 | 相同組換え欠損を評価するための方法および材料 |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361809105P | 2013-04-05 | 2013-04-05 | |
| US61/809,105 | 2013-04-05 | ||
| US201361913762P | 2013-12-09 | 2013-12-09 | |
| US61/913,762 | 2013-12-09 | ||
| JP2019085187A JP7522539B2 (ja) | 2013-04-05 | 2019-04-26 | 相同組換え欠損を評価するための方法および材料 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019085187A Division JP7522539B2 (ja) | 2013-04-05 | 2019-04-26 | 相同組換え欠損を評価するための方法および材料 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022169085A Division JP7641938B2 (ja) | 2013-04-05 | 2022-10-21 | 相同組換え欠損を評価するための方法および材料 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2021036903A JP2021036903A (ja) | 2021-03-11 |
| JP7522643B2 true JP7522643B2 (ja) | 2024-07-25 |
Family
ID=51659359
Family Applications (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016506657A Active JP6625045B2 (ja) | 2013-04-05 | 2014-04-04 | 相同組換え欠損を評価するための方法および材料 |
| JP2019085187A Active JP7522539B2 (ja) | 2013-04-05 | 2019-04-26 | 相同組換え欠損を評価するための方法および材料 |
| JP2020194936A Active JP7522643B2 (ja) | 2013-04-05 | 2020-11-25 | 相同組換え欠損を評価するための方法および材料 |
| JP2022169085A Active JP7641938B2 (ja) | 2013-04-05 | 2022-10-21 | 相同組換え欠損を評価するための方法および材料 |
| JP2025027653A Pending JP2025090619A (ja) | 2013-04-05 | 2025-02-25 | 相同組換え欠損を評価するための方法および材料 |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016506657A Active JP6625045B2 (ja) | 2013-04-05 | 2014-04-04 | 相同組換え欠損を評価するための方法および材料 |
| JP2019085187A Active JP7522539B2 (ja) | 2013-04-05 | 2019-04-26 | 相同組換え欠損を評価するための方法および材料 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022169085A Active JP7641938B2 (ja) | 2013-04-05 | 2022-10-21 | 相同組換え欠損を評価するための方法および材料 |
| JP2025027653A Pending JP2025090619A (ja) | 2013-04-05 | 2025-02-25 | 相同組換え欠損を評価するための方法および材料 |
Country Status (9)
| Country | Link |
|---|---|
| US (4) | US20140363521A1 (ja) |
| EP (2) | EP3693475A1 (ja) |
| JP (5) | JP6625045B2 (ja) |
| AU (3) | AU2014248007B2 (ja) |
| CA (1) | CA2908745C (ja) |
| DK (1) | DK2981624T3 (ja) |
| ES (1) | ES2777228T3 (ja) |
| PT (1) | PT2981624T (ja) |
| WO (1) | WO2014165785A2 (ja) |
Families Citing this family (40)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9512485B2 (en) | 2010-08-24 | 2016-12-06 | Dana-Farber Cancer Institute. Inc. | Methods for predicting anti-cancer response |
| BR112013016708B1 (pt) | 2010-12-30 | 2021-08-17 | Foundation Medicine, Inc | Otimização de análise multigene de amostras de tumor |
| WO2012174378A2 (en) | 2011-06-17 | 2012-12-20 | Myriad Genetics, Inc. | Methods and materials for assessing allelic imbalance |
| DK2794907T4 (da) | 2011-12-21 | 2023-02-27 | Myriad Genetics Inc | Fremgangsmåder og materialer til vurdering af tab af heterozygositet |
| EP2817630B1 (en) | 2012-02-23 | 2018-07-11 | Children's Medical Center Corporation | Methods for predicting anti-cancer response |
| CA3190075A1 (en) | 2012-06-07 | 2013-12-12 | Institut Curie | Methods for detecting inactivation of the homologous recombination pathway (brca1/2) in human tumors |
| EP3693475A1 (en) * | 2013-04-05 | 2020-08-12 | Myriad Genetics, Inc. | Methods and materials for assessing homologous recombination deficiency |
| EP4023765A1 (en) | 2013-12-09 | 2022-07-06 | Institut Curie | Methods for detecting inactivation of the homologous recombination pathway (brca1/2) in human tumors |
| US10545151B2 (en) | 2014-02-21 | 2020-01-28 | Epic Sciences, Inc. | Methods for analyzing rare circulating cells |
| ES2800673T3 (es) | 2014-08-15 | 2021-01-04 | Myriad Genetics Inc | Métodos y materiales para evaluar una deficiencia de recombinación homóloga |
| ES2989276T3 (es) | 2014-12-05 | 2024-11-25 | Found Medicine Inc | Análisis multigénico de muestras tumorales |
| EP3230472A4 (en) * | 2014-12-08 | 2018-06-13 | Myriad Genetics, Inc. | Methods and materials for predicting response to niraparib |
| WO2016185406A1 (en) | 2015-05-19 | 2016-11-24 | Nadathur Estates Pvt. Ltd. | Method for identification of a deficient brca1 function |
| US20180321247A1 (en) | 2015-11-03 | 2018-11-08 | Epic Sciences, Inc. | Single cell genomic profiling of circulating tumor cells (ctcs) in metastatic disease to characterize disease heterogeneity |
| WO2017106365A1 (en) * | 2015-12-14 | 2017-06-22 | Myriad Genetics, Inc. | Methods for measuring mutation load |
| AU2017205443A1 (en) | 2016-01-06 | 2018-07-19 | Epic Sciences, Inc. | Single cell genomic profiling of circulating tumor cells (CTCs) in metastatic disease to characterize disease heterogeneity |
| WO2017165270A1 (en) * | 2016-03-21 | 2017-09-28 | Myriad Genetics, Inc. | Homologous recombination deficiency to predict neoadjuvant chemotherapy necessity in bladder cancer |
| WO2017178509A1 (en) | 2016-04-12 | 2017-10-19 | Xentech | Methods for predicting sensibility to treatment with parp inhibitors in cancerous patients |
| WO2017191076A1 (en) | 2016-05-01 | 2017-11-09 | Genome Research Limited | Method of characterising a dna sample |
| EP3452939B1 (en) * | 2016-05-01 | 2025-08-20 | Genome Research Limited | Method of characterising a dna sample |
| GB2555765A (en) | 2016-05-01 | 2018-05-16 | Genome Res Ltd | Method of detecting a mutational signature in a sample |
| MX394062B (es) * | 2016-06-29 | 2025-03-19 | Tesaro Inc | Métodos para el tratamiento del cáncer ovárico. |
| WO2019241250A1 (en) | 2018-06-11 | 2019-12-19 | Foundation Medicine, Inc. | Compositions and methods for evaluating genomic alterations |
| WO2020137076A1 (ja) * | 2018-12-28 | 2020-07-02 | 国立大学法人 東京大学 | Parp阻害剤に対する癌の感受性の予測方法および相同組換修復不全を有する癌の検出方法 |
| US10975445B2 (en) | 2019-02-12 | 2021-04-13 | Tempus Labs, Inc. | Integrated machine-learning framework to estimate homologous recombination deficiency |
| US11164655B2 (en) | 2019-12-10 | 2021-11-02 | Tempus Labs, Inc. | Systems and methods for predicting homologous recombination deficiency status of a specimen |
| WO2021122620A1 (en) * | 2019-12-16 | 2021-06-24 | Agilent Technologies, Inc. | Genomic scarring assays and related methods |
| EP3945525A1 (en) | 2020-07-27 | 2022-02-02 | Sophia Genetics S.A. | Methods for identifying chromosomal spatial instability such as homologous repair deficiency in low coverage next-generation sequencing data |
| CN111883211B (zh) * | 2020-08-07 | 2021-04-23 | 张哲� | 一种表征hrd同源重组修复缺陷的基因瘢痕及鉴定方法 |
| US11718869B2 (en) * | 2020-08-12 | 2023-08-08 | Zhenyue Biotechnology Jiangsu Co., Ltd. | Method and kit for determining genome instability based on next generation sequencing (NGS) |
| CN112410423B (zh) * | 2020-11-03 | 2021-08-13 | 南京世和基因生物技术股份有限公司 | 同源重组缺失的标志物、检测方法以及检测系统 |
| JP7696647B2 (ja) * | 2021-01-10 | 2025-06-23 | エーシーティー ジェノミックス (アイピー) リミテッド | 相同組換え修復欠損を判定する方法及びそのキット |
| BE1029144B1 (fr) | 2021-02-25 | 2022-09-20 | Oncodna | Méthode de caracterisation d'une tumeur à l'aide d'un séquençage ciblé |
| CN112820351A (zh) * | 2021-03-01 | 2021-05-18 | 江苏医联生物科技有限公司 | 检测肿瘤患者的突变和hrd评分指导用药的方法 |
| JP2024528489A (ja) * | 2021-06-25 | 2024-07-30 | ファウンデーション・メディシン・インコーポレイテッド | 相同修復欠損を分類するシステムおよび方法 |
| JP2025503390A (ja) * | 2021-12-08 | 2025-02-04 | ミリアド ジェネティクス,インコーポレーテッド | 乳がんサブタイプにおける相同組換え欠損を評価するための方法及び材料 |
| KR102523938B1 (ko) * | 2022-02-04 | 2023-04-19 | 가톨릭대학교 산학협력단 | 상동 재조합 결핍증 예측 모델의 모델링 방법 |
| EP4605937A1 (en) | 2022-10-19 | 2025-08-27 | Vib Vzw | Method of determining loss of heterozygosity status of a tumor |
| WO2025078387A1 (en) | 2023-10-10 | 2025-04-17 | Vib Vzw | Method of detecting loss of heterozygosity status of a tumor |
| WO2025078404A1 (en) | 2023-10-10 | 2025-04-17 | Vib Vzw | Methods of determining response of a tumor to dna-damaging agents or to agents inhibiting or impairing dna repair |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20120015050A1 (en) | 2010-06-18 | 2012-01-19 | Myriad Genetics, Incorporated | Methods and materials for assessing loss of heterozygosity |
| WO2012027224A1 (en) | 2010-08-24 | 2012-03-01 | Dana-Farber Cancer Institute, Inc. | Methods for predicting anti-cancer response |
Family Cites Families (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| YU33730B (en) | 1967-04-18 | 1978-02-28 | Farmaceutici Italia | Process for preparing a novel antibiotic substance and salts thereof |
| GB1432562A (en) | 1972-04-10 | 1976-04-22 | Rustenburg Platinum Mines Ltd | Platinum co-ordination compounds |
| GB1432563A (en) | 1972-04-10 | 1976-04-22 | Rustenburg Platinum Mines Ltd | Platinum- co-ordination compounds |
| ES444380A1 (es) | 1976-01-16 | 1977-06-16 | Gosalvez Mario | Un procedimiento para preparar derivados metalicos antraci- clinicos. |
| US4950738A (en) | 1984-09-13 | 1990-08-21 | Cytogen Corporation | Amine derivatives of anthracycline antibiotics |
| US5977082A (en) | 1985-08-02 | 1999-11-02 | Pharmacia & Upjohn Company | Injectable ready-to-use solutions containing an antitumor anthracycline glycoside |
| US5177075A (en) | 1988-08-19 | 1993-01-05 | Warner-Lambert Company | Substituted dihydroisoquinolinones and related compounds as potentiators of the lethal effects of radiation and certain chemotherapeutic agents; selected compounds, analogs and process |
| US5295944A (en) | 1991-05-14 | 1994-03-22 | Dana-Farber Cancer Institute | Method for treating a tumor with ionizing radiation |
| AU671605B2 (en) | 1991-11-15 | 1996-09-05 | Smithkline Beecham Corporation | Combination chemotherapy |
| GB9806324D0 (en) | 1998-03-24 | 1998-05-20 | Pharmacia & Upjohn Spa | Antitumour synergetic composition |
| ES2354249T3 (es) | 2000-12-01 | 2011-03-11 | Eisai Inc. | Derivados de azafenantridona y su uso como inhibidores de parp. |
| GB0121285D0 (en) | 2001-09-03 | 2001-10-24 | Cancer Res Ventures Ltd | Anti-cancer combinations |
| WO2005002508A2 (en) | 2003-06-11 | 2005-01-13 | Access Pharmaceuticals, Inc. | Macromolecular platinum chelates |
| ATE520702T1 (de) | 2003-07-02 | 2011-09-15 | Solux Corp | Thermisch stabiles kristallines epirubicin- hydrochlorid und herstellungsverfahren dafür |
| MXPA06000993A (es) | 2003-07-25 | 2006-08-31 | Cancer Rec Tech Ltd | Inhbidores triciclicos de parp. |
| WO2005023824A2 (en) | 2003-08-13 | 2005-03-17 | University Of South Florida | Methods for inhibiting tumor cell proliferation |
| AU2006266446B2 (en) | 2005-06-30 | 2011-03-10 | Bionumerik Pharmaceuticals, Inc. | Monoazole ligand platinum analogs |
| KR100925337B1 (ko) * | 2009-05-25 | 2009-11-09 | 주식회사 마크로젠 | 염색체 수 이상 검출을 통한 유방암 약물 반응성 예측 |
| EP2817630B1 (en) * | 2012-02-23 | 2018-07-11 | Children's Medical Center Corporation | Methods for predicting anti-cancer response |
| EP3693475A1 (en) * | 2013-04-05 | 2020-08-12 | Myriad Genetics, Inc. | Methods and materials for assessing homologous recombination deficiency |
-
2014
- 2014-04-04 EP EP19216740.1A patent/EP3693475A1/en active Pending
- 2014-04-04 US US14/245,576 patent/US20140363521A1/en not_active Abandoned
- 2014-04-04 CA CA2908745A patent/CA2908745C/en active Active
- 2014-04-04 WO PCT/US2014/033014 patent/WO2014165785A2/en not_active Ceased
- 2014-04-04 PT PT147794036T patent/PT2981624T/pt unknown
- 2014-04-04 ES ES14779403T patent/ES2777228T3/es active Active
- 2014-04-04 AU AU2014248007A patent/AU2014248007B2/en active Active
- 2014-04-04 DK DK14779403.6T patent/DK2981624T3/da active
- 2014-04-04 EP EP14779403.6A patent/EP2981624B1/en active Active
- 2014-04-04 JP JP2016506657A patent/JP6625045B2/ja active Active
-
2017
- 2017-07-17 US US15/651,652 patent/US20180030544A1/en not_active Abandoned
-
2019
- 2019-04-26 JP JP2019085187A patent/JP7522539B2/ja active Active
-
2020
- 2020-06-17 AU AU2020204028A patent/AU2020204028B2/en active Active
- 2020-11-25 JP JP2020194936A patent/JP7522643B2/ja active Active
-
2021
- 2021-06-21 US US17/353,279 patent/US20210310079A1/en active Pending
-
2022
- 2022-08-04 AU AU2022211880A patent/AU2022211880B2/en active Active
- 2022-10-21 JP JP2022169085A patent/JP7641938B2/ja active Active
-
2025
- 2025-02-25 JP JP2025027653A patent/JP2025090619A/ja active Pending
- 2025-03-24 US US19/088,496 patent/US20250223655A1/en active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20120015050A1 (en) | 2010-06-18 | 2012-01-19 | Myriad Genetics, Incorporated | Methods and materials for assessing loss of heterozygosity |
| WO2012027224A1 (en) | 2010-08-24 | 2012-03-01 | Dana-Farber Cancer Institute, Inc. | Methods for predicting anti-cancer response |
Non-Patent Citations (4)
| Title |
|---|
| British Journal of Cancer,2012,Vol.107,pp.1776-1782 |
| Cancer Discovery,2012,Vol.2,pp.366-375 |
| Cancer Research,2012,Vol.72,pp.5454-5462 |
| 日本産科婦人科学会雑誌,2008,Vol.60,pp.1844-1854 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2019165731A (ja) | 2019-10-03 |
| AU2020204028A1 (en) | 2020-07-09 |
| DK2981624T3 (da) | 2020-03-02 |
| US20180030544A1 (en) | 2018-02-01 |
| EP2981624A2 (en) | 2016-02-10 |
| EP2981624B1 (en) | 2019-12-18 |
| WO2014165785A2 (en) | 2014-10-09 |
| JP2023012488A (ja) | 2023-01-25 |
| JP6625045B2 (ja) | 2019-12-25 |
| AU2014248007A1 (en) | 2015-10-15 |
| JP2016523511A (ja) | 2016-08-12 |
| CA2908745C (en) | 2023-03-14 |
| JP7641938B2 (ja) | 2025-03-07 |
| PT2981624T (pt) | 2020-03-23 |
| US20250223655A1 (en) | 2025-07-10 |
| JP2025090619A (ja) | 2025-06-17 |
| AU2020204028B2 (en) | 2022-08-18 |
| JP7522539B2 (ja) | 2024-07-25 |
| EP2981624A4 (en) | 2016-11-30 |
| AU2022211880B2 (en) | 2025-05-29 |
| NZ712663A (en) | 2021-07-30 |
| JP2021036903A (ja) | 2021-03-11 |
| CA2908745A1 (en) | 2014-10-09 |
| EP3693475A1 (en) | 2020-08-12 |
| US20140363521A1 (en) | 2014-12-11 |
| AU2022211880A1 (en) | 2022-09-01 |
| US20210310079A1 (en) | 2021-10-07 |
| ES2777228T3 (es) | 2020-08-04 |
| AU2014248007B2 (en) | 2020-03-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7641938B2 (ja) | 相同組換え欠損を評価するための方法および材料 | |
| JP7680995B2 (ja) | 相同組換え欠損を評価するための方法および材料 | |
| TWI861616B (zh) | 用於評估乳癌亞型中同源重組缺陷之方法及材料 | |
| HK40098329A (en) | Methods and materials for assessing homologous recombination deficiency | |
| HK40098329B (en) | Methods and materials for assessing homologous recombination deficiency |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201215 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20201215 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210204 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20211213 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220311 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20220622 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20221021 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20221021 |
|
| C11 | Written invitation by the commissioner to file amendments |
Free format text: JAPANESE INTERMEDIATE CODE: C11 Effective date: 20221031 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20221130 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20221219 |
|
| C21 | Notice of transfer of a case for reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C21 Effective date: 20221221 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20230203 |
|
| C211 | Notice of termination of reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C211 Effective date: 20230208 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20230821 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230912 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240403 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20240712 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7522643 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |