JP7498564B2 - 急性骨髄性白血病治療のための抗-cd70抗体argx-110の使用 - Google Patents
急性骨髄性白血病治療のための抗-cd70抗体argx-110の使用 Download PDFInfo
- Publication number
- JP7498564B2 JP7498564B2 JP2019569314A JP2019569314A JP7498564B2 JP 7498564 B2 JP7498564 B2 JP 7498564B2 JP 2019569314 A JP2019569314 A JP 2019569314A JP 2019569314 A JP2019569314 A JP 2019569314A JP 7498564 B2 JP7498564 B2 JP 7498564B2
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- antigen
- pharmaceutical composition
- binding fragment
- subject
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/28—Bone marrow; Haematopoietic stem cells; Mesenchymal stem cells of any origin, e.g. adipose-derived stem cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001136—Cytokines
- A61K39/001138—Tumor necrosis factors [TNF] or CD70
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2875—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF/TNF superfamily, e.g. CD70, CD95L, CD153, CD154
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/22—Immunoglobulins specific features characterized by taxonomic origin from camelids, e.g. camel, llama or dromedary
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/40—Immunoglobulins specific features characterized by post-translational modification
- C07K2317/41—Glycosylation, sialylation, or fucosylation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/734—Complement-dependent cytotoxicity [CDC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Epidemiology (AREA)
- Oncology (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Hematology (AREA)
- Biomedical Technology (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Developmental Biology & Embryology (AREA)
- Cell Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biochemistry (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biotechnology (AREA)
- Virology (AREA)
- Zoology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
Description
本発明は、急性骨髄性白血病(AML)及び骨髄異形成症候群(MDS)の治療方法、並びに該方法における使用に適している組成物及び組合せに関する。
急性骨髄性白血病(AML)は、造血前駆細胞の制御できないクローン性増殖により特徴付けられる不均一疾患である。AMLは、成人が罹患する最も一般的な急性白血病であり、欧州における成人の年間発生率は、100,000人あたり5~8症例であり、年齢70歳以上の集団においては急劇に増加し、発生率は年間15~25/100,000に達する。
CD70は、活性化されたBリンパ球及びTリンパ球の小さいサブセットにおいて、並びに成熟樹状細胞上に、通常発現される細胞表面抗原であり、リンパ球分化、及びそのコグネート細胞表面受容体であるCD27への結合時の生存シグナル伝達に関与している。CD27のCD70-誘導したシグナル伝達は、CD27を発現する制御性T細胞の増大した生産及び活性化を生じる。
配列番号:3
配列番号:2
配列番号:1
配列番号:7
配列番号:6
配列番号:5
を含む。
いわゆる“7+3”標準強化化学療法(すなわち、シタラビンの集中投与量が7日間+アントラサイクリンの3日間、典型的にはそれに続けて地固め化学療法又は造血幹細胞移植(HSCT))を用いるAMLの従来の治療が、長年標準療法となっている。しかしこのレジメンの下では、年齢60歳以下のAML患者の大部分は、5年以上の生存に失敗している。標準強化化学療法に適合しないより高齢者において、より強度が低い治療の転帰は治癒的ではなく、HSCTは典型的には適さず、全生存期間の中央値は1年未満である。AMLは、不均一疾患であり、疾患再発は、療法に対し抵抗性である1種以上の白血病幹細胞(LSC)クローンに起因することが多い。代替療法を研究する前臨床試験は多いにもかかわらず、臨床へ移行されることはほとんどない。従って効果的新規AML療法、特に標準強化化学療法に適合しない患者に適している療法が、必要である。理想的には、新規療法は、骨髄及び血液中の芽球負荷の減少により疾患を除去するのみでなはく、不均一なLSC集団を減少するかもしくは根絶しさえもする。
急性骨髄性白血病(AML)は、骨髄細胞に関与する造血系新生物を指す。AMLは、分化能が低下した骨髄前駆体のクローン性増殖により特徴付けられる。AML患者は、骨髄における芽球細胞の蓄積を示す。芽球細胞は典型的には、AML患者の末梢血中にも蓄積する。典型的には、患者が骨髄又は末梢血中に20%以上の芽球細胞を示す場合に、AMLと診断される。
本明細書において明らかにされたように、AML及びMDSなどの骨髄新生物を罹患している患者は、抗-CD70抗体により治療することができる。抗-CD70抗体の単回投与後、対象の骨髄から単離することができる白血病幹細胞の数は、骨髄及び末梢血中に検出される芽球細胞の数と同様に、著しく減少された。この結果は、驚くべきことに低投与量の抗体であっても認められた。
本明細書記載のように、本発明の方法は、骨髄中及び/又は末梢血中の、好ましくは骨髄及び末梢血の両方中の、芽球細胞の数及び/又は割合を減少する。
AMLの芽球の重要なサブセットは、白血病幹細胞(LSC)である。LSCは、白血病を開始することが可能である癌幹細胞である。LSCは、白血病を生じることにより、自己再生することができ、且つ当初の疾患に類似しているが自己再生することができない非LSCの通常の芽球細胞へ部分的に分化することもできる。LSCは、CD34+CD38-、任意に同じくCD45-及び/又はCD123+である細胞として特徴付けられてよい。LSCはまた、CD45dim,SSClo,lin-CD90+CD34+細胞としても特徴付けられてよい。AML患者におけるLSC数の減少は、寛解の見込みを大きく改善し、且つ再発の可能性を低下する。
本明細書に提示された臨床試験からのデータは、CD70抗体により治療された患者は最低の投与量であっても、芽球細胞の割合が減少したことを明らかにしている。この投与量での抗体の患者への投与の強度は、簡単にこの抗体治療の安全性を確認し、且つ用量制限毒性(DLT)を確定した。従って、最低投与量の抗体の単回投与後であっても、芽球細胞の割合が大きく減少されたことは、非常に驚くべきことであった。
本発明による治療は、標準強化化学療法に関連した著しい毒性及び病的状態を伴わずにAMLの寛解(部分又は完全)を誘導する効果的手段を提供するので、これは特に利点がある。これらの副作用を伴わない療法の提供は、本発明の著しい利点である。
本明細書において既に説明したように、抗-CD70抗体による単剤療法は、AML又はMDSの効果的治療を提供し、芽球細胞割合の著しい低下を生じる。本明細書のデータは、効果的単剤療法を提供することに加え、ヌクレオシド代謝阻害剤(NMI)、例えばアザシチジン(本明細書においてアザサイチジン、AZA又はazaとも記す)又はデシタビンなどの低メチル化剤(HMA)との併用療法の一部として投与される場合の、抗-CD70抗体の更なる治療的有効性を明らかにしている。
同じく、本明細書記載の方法において使用するための医薬組成物も、本発明において提供される。従って本発明の更なる態様において、本発明による方法において使用するための、抗-CD70抗体及び医薬として許容し得る賦形剤又は担体を含有する医薬組成物が提供される。好適な医薬として許容し得る担体及び賦形剤を、当業者は熟知しているであろう。本発明の医薬組成物中への含有に適している医薬として許容し得る担体及び賦形剤の例としては、クエン酸ナトリウム、グリシン、ポリソルベート(例えばポリソルベート80)及び食塩水が挙げられる。
本発明による治療は、治療的物質又は緩和的物質(例えば、放射線治療、鎮痛薬又は抗生物質)などの、1以上の追加の活性物質との併用療法へ組込むことができる。そのような活性物質は、療法に対する患者の反応及び/又は患者の生活の質を改善するための治療薬として投与されてよい。従って特定の実施態様において、CD70抗体(任意にNMIとの併用療法において)は、1種以上の追加の活性物質との併用療法において、本発明で投与される。
本明細書記載の本発明の全ての態様において、治療される対象は、抗-CD70抗体又はその抗原結合断片が投与される。本明細書において使用される「抗体」は、関心対象の抗原(例えばヒトCD70)に対する特異的免疫反応活性を有する2本の重鎖及び2本の軽鎖の組合せを有する免疫グロブリンを指す。用語「CD70抗体」又は「抗-CD70抗体」は、ヒトCD70タンパク質に対する免疫特異性を示す抗体を指すよう、本明細書において互換的に使用される。この文脈においてヒトCD70に対する「特異性」は、CD70の種相同体との交差反応性を排除しない。
配列番号:3
配列番号:2
配列番号:1
配列番号:7
配列番号:6
配列番号:5
(実施例1:マウスへ移植されたヒトAML LSCに対する抗-CD70抗体の単剤療法又はデシタビンとの併用の効果)
NSGマウスに、5×106個のCD45dimSSClo ヒトAML細胞を移植した。生着の32日後(PB中生着:14.45±0.95%)、NSGマウスを、ビヒクル(Veh)、aCD70 mAb(aCD70、ARGX-110、10mg/kg)、デシタビン(D、1.5mg/kg/日)又は組合せ(aCD70/D)による5日間の治療に無作為化し、且つ骨髄、脾臓及び血液を分析した。
ヌクレオシド代謝阻害剤(NMI)、例えば低メチル化剤デシタビンと組合せた抗-CD70抗体治療は、マウスにおけるAML芽球生着の減少の増強を生じるという知見を、初代ヒトAML LSCにおいて更に調べた。
第I/II相臨床試験を、AZA治療に適格である、過去未治療のAML及び高リスクMDSを伴う対象において、標準投与量のAZAと組合せた、ARGX-110の有効性/臨床上の恩恵及び安全性及び忍容性を調べるために、開始した。
本治験は、スクリーニング相(-35日目から-14日目の間)、ARGX-110の負荷投与量(-14日目)、及びその間に対象が被験薬投与のために治験施設に来院したオープンラベル治療相(疾患進行までの-14日目)、並びに最終ARGX-110治療後7日以内に実行した治療終了時(EOT)評価を含んだ。追加の経過観察評価は、EOT日以降30日及び60日(±7日)に計画した。60日目の経過観察来院はまた、治験終了時(EOS)来院であった。
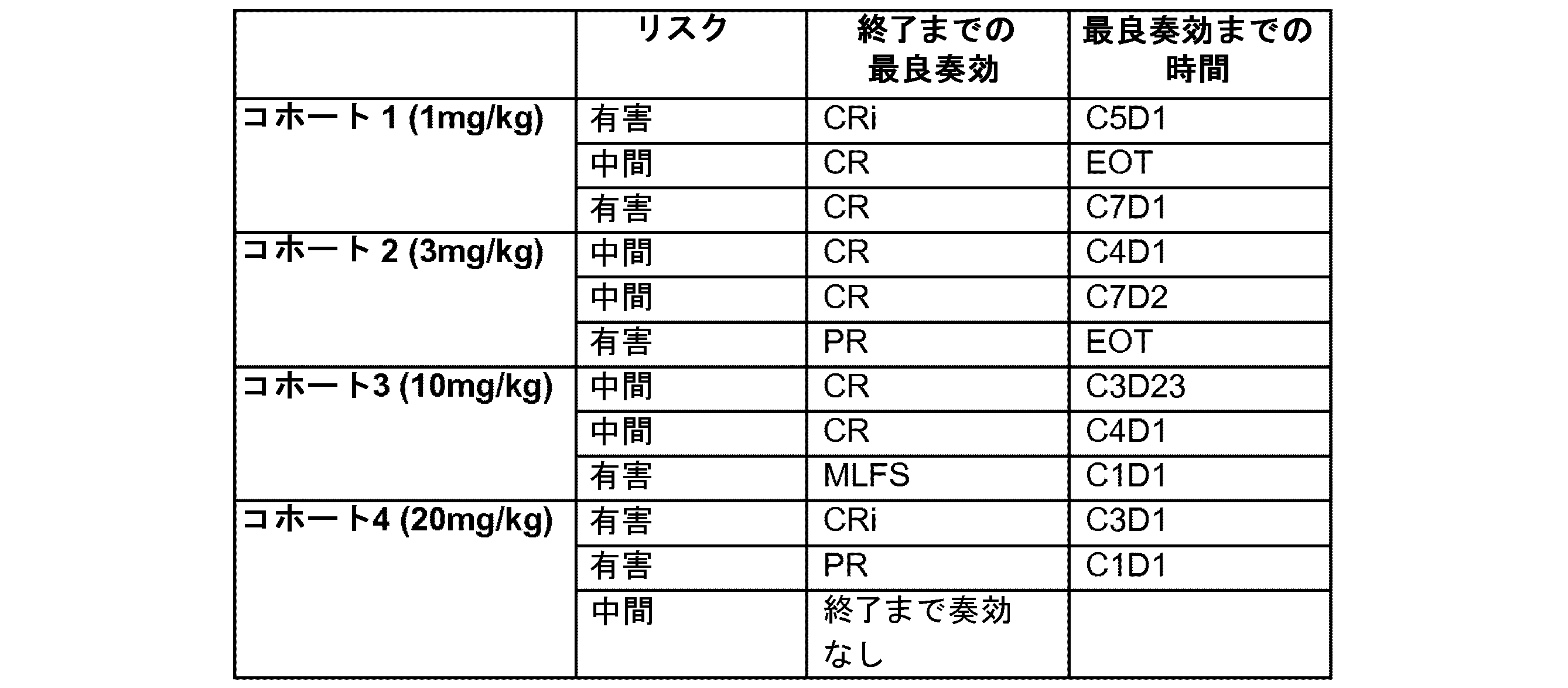
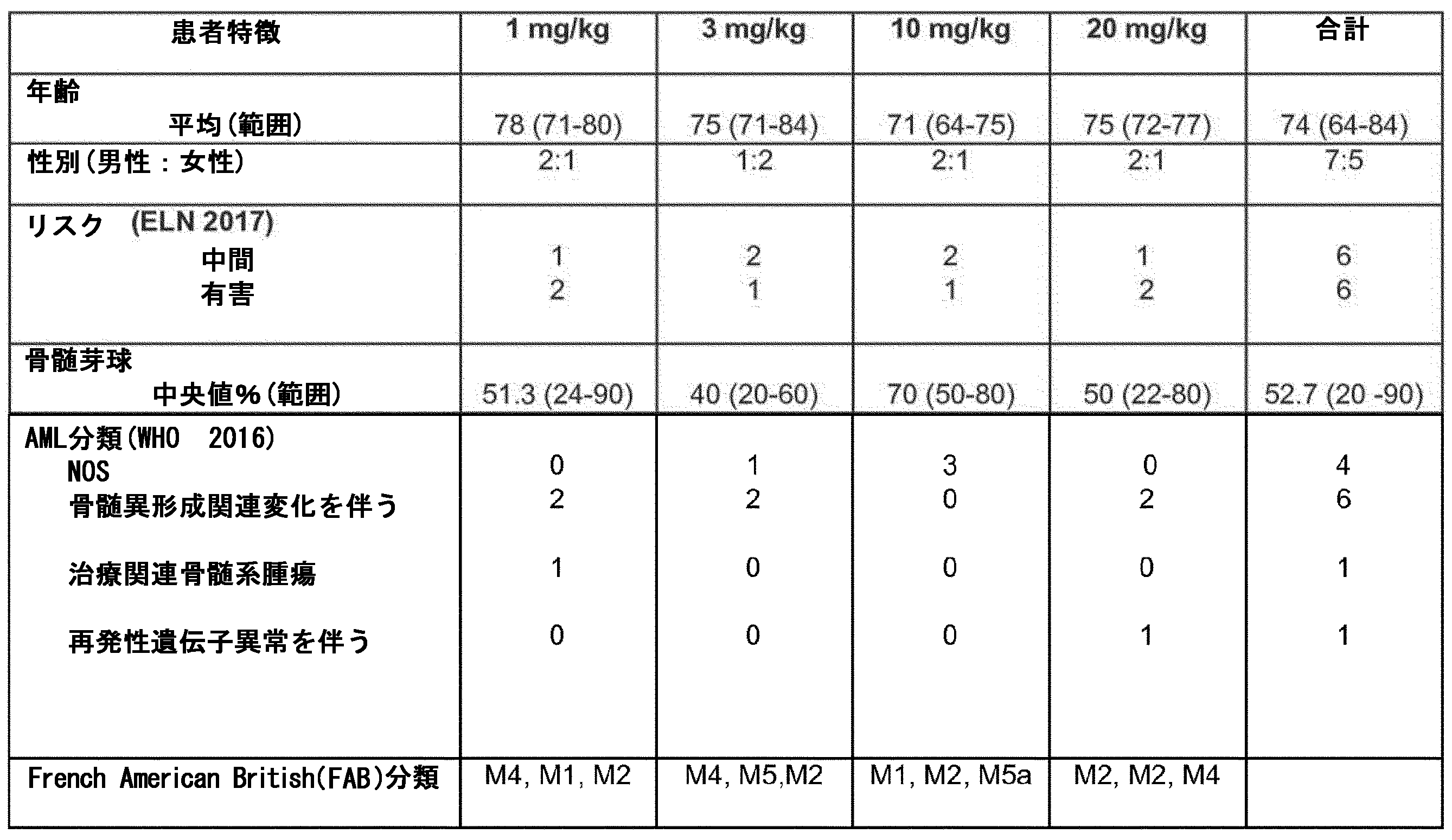
・コホート1:1mg/kg体重、IV、28日サイクルの3日目及び17日目、
・コホート2:3mg/kg体重、IV、28日サイクルの3日目及び17日目、
・コホート3:10mg/kg体重、IV、28日サイクルの3日目及び17日目、
・コホート4:20mg/kg体重、IV、28日サイクルの3日目及び17日目。
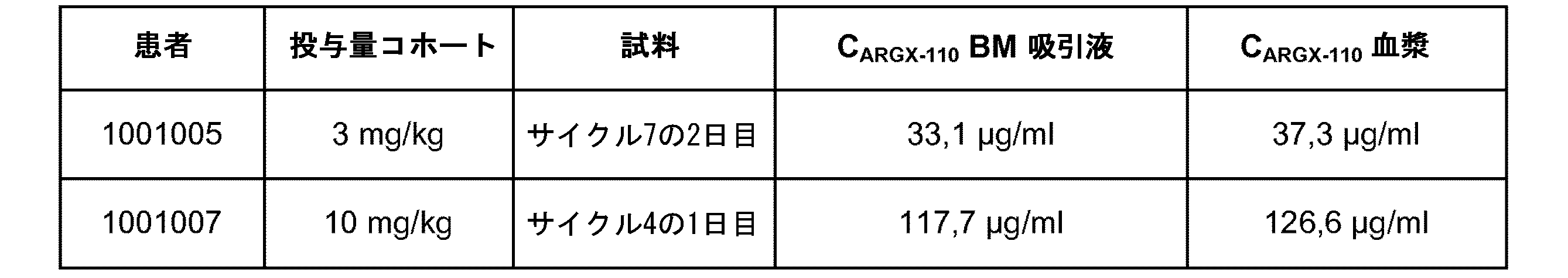
表3
・Cmax:最大測定濃度;Ctrough:トラフ濃度;AUC∞:ゼロから無限までの血清濃度-時間曲線下面積;AUCtau:投薬間隔間の血清濃度-時間曲線下面積;Vd:みかけの分布容積;CL:IV投与後の薬物の全身クリアランス;t1/2:半減期。
分子遺伝学:再発するAMLゲノム異常を同定するため、並びに疾患及び標的病理に対する治療効果のゲノムDNA分析のための、CD70及びCD11aプロモーターメチル化の特徴決定。
遺伝子発現:CD70、疾患及び薬物効果マーカーのmRNAレベルの特徴決定。
フローサイトメトリー(FACS):CD70(例えば、ARGX-110治療前、再発後)及びCD27発現、及び薬物効果(例えば、芽球、NK細胞及びT細胞)の追加の特徴決定、並びに微小残存病変(MRD)分析。
血清タンパク質定量:sCD27、疾患及び薬物効果マーカー(例えばIL-8)の追加の特徴決定。注入-関連反応が、より早期のARGX-110治験における反応よりもより重篤である場合、炎症性サイトカイン分析を評価することができる。
(全般的臨床結果)
重大なことに、本治験に募集された患者の90%より多くは、抗-CD70療法に奏効した(奏効を評価するために十分な時間治療された患者は、11名中10名)。
各患者に関して、骨髄及び末梢血中の芽球の数を、図5に概略したように、様々な時点で評価した。
AMLにおける白血病幹細胞(LSC)の持続性は、AML患者の治療の成功に関する重大な障害を表している。LSCは、AMLにおける疾患再発の原因であり、それらの数は、対称細胞分裂のプロセス-すなわち、各LSCは対称的に分裂し、2個の娘LSCを作製するプロセス-を通じて維持される。そのような対称分裂は、AML増悪及び患者再発の駆動因子である。
患者におけるLSC集団に対する単剤及び併用療法の影響を更に調べるために、エクスビボにおいてFACS選別された単球を使用するメチルセルロースコロニーアッセイを行った。単核細胞(CD45dim)はアネキシンV並びにCD19及びCD4/CD8の抗体を使用し、ダブレット、死滅細胞及びリンパ球を排除することにより、選択的に選別し、且つメチルセルロース上に14日間連続的に播種した。
可溶性CD27(sCD27)は、CD70/CD27相互作用の程度に関するバイオマーカーとして働くことができる。CD70/CD27-媒介性シグナル伝達は、異常な細胞分裂を促進し、且つ高レベルの血清sCD27は、AML患者の予後不良と相関すると考えられる。加えて、sCD27は、骨髄中の芽球細胞の割合に相関し、更には患者の芽球の幹細胞性のマーカーとして働き、増加したsCD27は、幹細胞性の増加したレベルを示すと考えられる(Rietherらの文献、J. Exp. Med. 2017 Feb;214(2):359-380)。
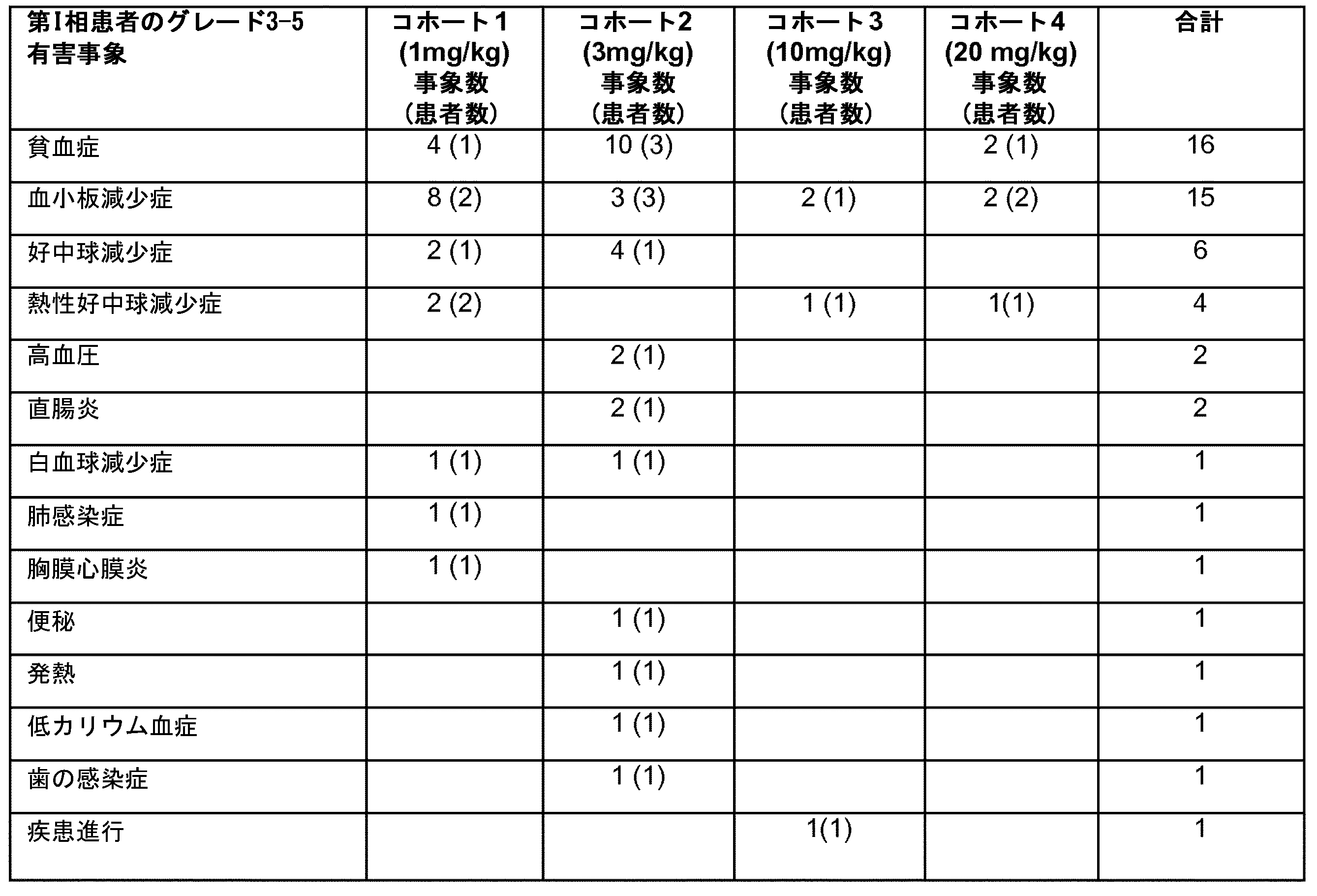
治療的レジメンの適合性における重要な因子は、患者に対する関連のある毒性である。有利なことに、抗-CD70抗体ARGX-110は、単剤療法として、又はazaと併用使用した場合のいずれにおいても、毒性の何らかの観察された増加を生じなかった。
ARGX-110の血清濃度は、バリデートされた酵素結合免疫吸着アッセイ(ELISA)法を用いて分析した。図11は、10mg/kgコホートに関する個々の患者PKプロットを提供する。PKプロットは、ARGX-110のサイクル1(D-14プレ-投与量からサイクル1 D1プレ-投与量まで)に関するデータを表す。
患者1001001は、80歳女性であり、乳癌のアジュバント化学療法後5年で療法に関連したAMLを罹患し、芽球カウントは、骨髄(BM)中90%及び末梢血(PB)中80%であり(39.5 G/L)、FAB亜型:M4骨髄単球性及びWHO 2016分類:暫定病型(Provisional subentity):変異したRUNX1を伴うAMLであった。患者は、1mg/kg療法アームのプロトコールに従い治療した。
本件出願は、以下の態様の発明を提供する。
(態様1)
対象において急性骨髄性白血病(AML)又は骨髄異形成症候群(MDS)を治療する方法であって、対象へ、抗-CD70抗体又はその抗原-結合断片の1以上の投与量を投与することを含む、前記方法。
(態様2)
AML又はMDSの対象の骨髄及び/又は末梢血中の芽球の割合を減少する方法であって、対象へ、抗-CD70抗体又はその抗原-結合断片の1以上の治療有効量を投与することを含む、前記方法。
(態様3)
造血幹細胞移植(HSCT)のためにAML又はMDSの対象を準備する方法であって、対象へ、抗-CD70抗体又はその抗原-結合断片の1以上の投与量を投与することを含む、前記方法。
(態様4)
前記方法が、対象の骨髄中の芽球の割合を減少する、態様1~3のいずれか一項記載の方法。
(態様5)
前記方法が、対象の末梢血中の芽球の割合を減少する、態様1~4のいずれか一項記載の方法。
(態様6)
前記抗-CD70抗体又はその抗原-結合断片が、1回の投与量あたり0.1mg/kg~25mg/kgの範囲の投与量で投与される、態様1~5のいずれか一項記載の方法。
(態様7)
前記抗-CD70抗体又はその抗原-結合断片が、1回の投与量あたり1mg/kg~20mg/kgの範囲の投与量で投与される、態様1~6のいずれか一項記載の方法。
(態様8)
前記抗-CD70抗体又はその抗原-結合断片が、10mg/kgの投与量で投与される、態様1~7のいずれか一項記載の方法。
(態様9)
前記抗-CD70抗体又はその抗原-結合断片の各投与量が、10~20日、任意に12~18日、任意に14~17日隔てられている、態様1~8のいずれか一項記載の方法。
(態様10)
前記対象へヌクレオシド代謝阻害剤を投与することを更に含む、態様1~9のいずれか一項記載の方法。
(態様11)
前記ヌクレオシド代謝阻害剤が、低メチル化剤、任意にアザシチジン又はデシタビンである、態様10記載の方法。
(態様12)
前記ヌクレオシド代謝阻害剤が、アザシチジンである、態様10又は11記載の方法。
(態様13)
前記ヌクレオシド代謝阻害剤が、1日あたり50~100mg/m 2 の範囲の投与量で投与される、態様10~12のいずれか一項記載の方法。
(態様14)
前記ヌクレオシド代謝阻害剤が、5~9日の毎日投与の投薬期間で投与される、態様10~13のいずれか一項記載の方法。
(態様15)
前記ヌクレオシド代謝阻害剤が、反復投薬期間の投薬レジメンに従い投与され、ここで1回の投薬期間の最後及び次の投薬期間の最初が、18~25日隔てられている、態様14記載の方法。
(態様16)
前記ヌクレオシド代謝阻害剤の初回投与量が、抗-CD70抗体又はその抗原結合断片の初回投与量後、7~21日投与される、態様10~15のいずれか一項記載の方法。
(態様17)
前記ヌクレオシド代謝阻害剤の1日量の1つが、抗-CD70抗体又はその抗原-結合断片の投与量と同じ日に投与される、態様10~16のいずれか一項記載の方法。
(態様18)
前記方法が:
i)態様10~17のいずれか一項記載の抗-CD70抗体及びヌクレオシド代謝阻害剤の投与を含む、第一段階、並びに
ii)態様1~9のいずれか一項記載の抗-CD70抗体の投与、及び第一段階で投与されるヌクレオシド代謝阻害剤の投与量よりもより少ない投与量のヌクレオシド代謝阻害剤の投与を含む、第二段階:
を含む、態様10~17のいずれか一項記載の方法。
(態様19)
前記対象が、治療前の標準強化化学療法に適格ではない、態様1~18のいずれか一項記載の方法。
(態様20)
前記対象において造血幹細胞移植を実行する工程を更に含む、態様1~19のいずれか一項記載の方法。
(態様21)
前記対象が、60歳以上、任意に75歳以上である、態様1~20のいずれか一項記載の方法。
(態様22)
前記対象へ、抗-CD33抗体、抗-CD123抗体、E-セレクチン阻害剤、FLT3阻害剤、サイクリン依存性キナーゼ阻害剤、BCL-2阻害剤、アミノペプチダーゼ阻害剤及びJAK/STAT阻害剤から選択された1種以上の活性物質を投与することを更に含む、態様1~21のいずれか一項記載の方法。
(態様23)
前記対象の芽球数をモニタリングすることを更に含む、態様1~22のいずれか一項記載の方法。
(態様24)
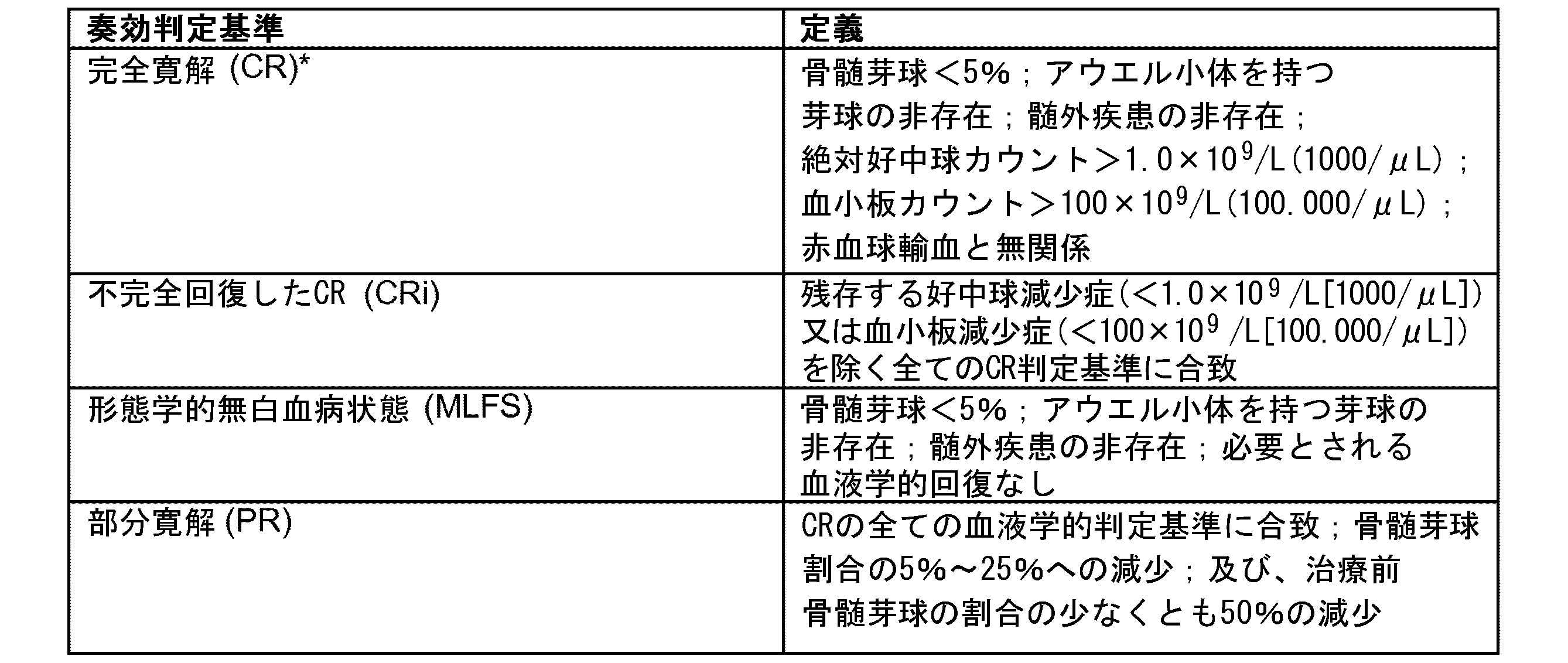
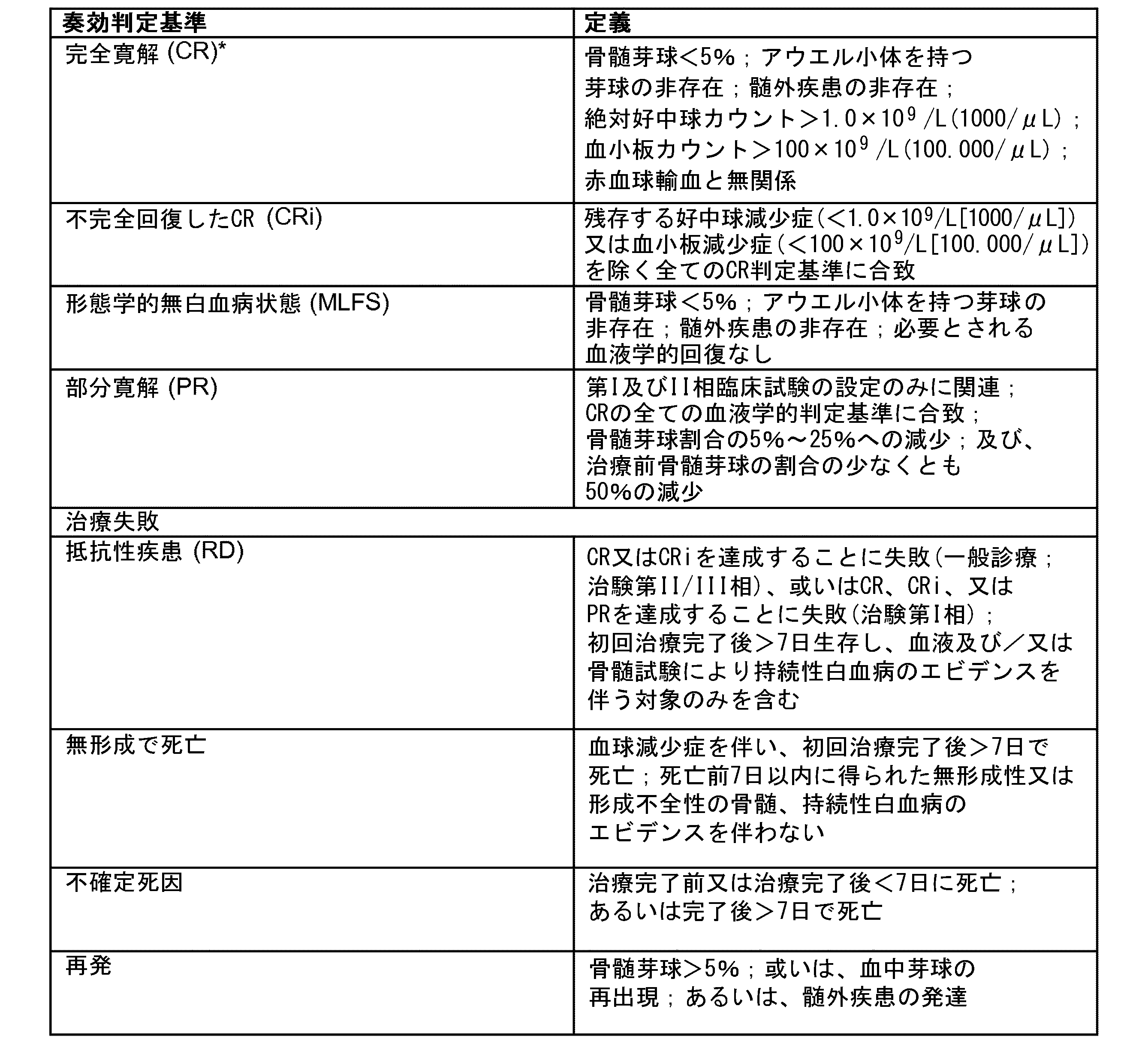
部分奏効(PR)、不完全血液学的回復を伴う完全奏効(CRi)、又は完全奏効(CR)を含む、態様1~23のいずれか一項記載の方法。
(態様25)
陰性である微小残存病変状態を誘導する、態様1~24のいずれか一項記載の方法。
(態様26)
前記対象が適格であるための標準治療物質に対し生存を増加する、態様1~25のいずれか一項記載の方法。
(態様27)
前記抗-CD70抗体又はその抗原-結合断片が、CD70-CD27結合を阻害する、態様1~26のいずれか一項記載の方法。
(態様28)
前記抗-CD70抗体又はその抗原-結合断片が、CD70-発現細胞を除去する、態様1~27のいずれか一項記載の方法。
(態様29)
前記抗-CD70抗体が、重鎖可変ドメイン(VH)及び軽鎖可変ドメイン(VL)を含み、ここでこのVH及びVLドメインが、以下のCDR:
配列番号:3
(化1)
を含む又はこれからなるHCDR3
配列番号:2
(化2)
を含む又はこれからなるHCDR2
配列番号:1
(化3)
を含む又はこれからなるHCDR1
配列番号:7
(化4)
を含む又はこれからなるLCDR3
配列番号:6
(化5)
を含む又はこれからなるLCDR2、及び
配列番号:5
(化6)
を含む又はこれからなるLCDR1:
を含む、態様1~28のいずれか一項記載の方法。
(態様30)
前記抗-CD70抗体又は抗原-結合断片が、配列番号:4と少なくとも80%同一であるVHドメインを含み、及び/又は配列番号:8と少なくとも80%同一であるVLドメインを含む、態様1~29のいずれか一項記載の方法。
(態様31)
前記抗-CD70抗体が、IgG1抗体である、態様1~30のいずれか一項記載の方法。
(態様32)
前記抗-CD70抗体が、ARGX-110である、態様1~31のいずれか一項記載の方法。
(態様33)
態様1~32のいずれか一項記載の方法において使用するための、抗-CD70抗体。
(態様34)
態様1~33のいずれか一項記載の方法において使用するための医薬組成物であって、ここでこの医薬組成物が、抗-CD70抗体及び医薬として許容し得る賦形剤又は担体を含有する、前記医薬組成物。
(態様35)
AMLの治療において使用するための抗-CD70抗体又はその抗原結合断片であって、ここでこの抗体又は抗原結合断片が、低メチル化剤、好ましくはアザシチジンと組合せて投与される、前記抗-CD70抗体又はその抗原結合断片。
(態様36)
前記抗-CD70抗体又はその抗原-結合断片が、CD70-CD27結合を阻害する、態様33~35のいずれか一項記載の使用のための抗体又は医薬組成物。
(態様37)
前記抗-CD70抗体又はその抗原-結合断片が、CD70-発現細胞を枯渇する、態様33~36のいずれか一項記載の使用のための抗体又は医薬組成物。
(態様38)
前記抗-CD70抗体又は抗原-結合断片が、重鎖可変ドメイン(VH)及び軽鎖可変ドメイン(VL)を含み、ここでこのVH及びVLドメインが、以下のCDR:
配列番号:3
(化7)
を含む又はこれからなるHCDR3
配列番号:2
(化8)
を含む又はこれからなるHCDR2
配列番号:1
(化9)
を含む又はこれからなるHCDR1
配列番号:7
(化10)
を含む又はこれからなるLCDR3
配列番号:6
(化11)
を含む又はこれからなるLCDR2、及び
配列番号:5
(化12)
を含む又はこれからなるLCDR1:
を含む、態様33~37のいずれか一項記載の使用のための抗体又は医薬組成物。
(態様39)
前記抗-CD70抗体又は抗原-結合断片が、配列番号:4と少なくとも80%同一であるVHドメインを含み、及び/又は配列番号:8と少なくとも80%同一であるVLドメインを含む、態様33~38のいずれか一項記載の使用のための抗体又は医薬組成物。
(態様40)
前記抗-CD70抗体が、IgG1抗体である、態様33~39のいずれか一項記載の使用のための抗体又は医薬組成物。
(態様41)
前記抗-CD70抗体が、ARGX-110である、態様33~40のいずれか一項記載の使用のための抗体又は医薬組成物。
(態様42)
抗-CD70抗体又はその抗原結合断片及びNMIを含む、組合せ。
(態様43)
前記NMIが、低メチル化剤である、態様42記載の組合せ。
(態様44)
前記低メチル化剤が、アザシチジンである、態様43記載の組合せ。
(態様45)
前記抗-CD70抗体又はその抗原-結合断片が、CD70-CD27結合を阻害する、態様42~44のいずれか一項記載の組合せ。
(態様46)
前記抗-CD70抗体又はその抗原-結合断片が、CD70-発現細胞を枯渇する、態様42~45のいずれか一項記載の組合せ。
(態様47)
前記抗-CD70抗体が、重鎖可変ドメイン(VH)及び軽鎖可変ドメイン(VL)を含み、ここでこのVH及びVLドメインが、以下のCDR:
配列番号:3
(化13)
を含む又はこれからなるHCDR3
配列番号:2
(化14)
を含む又はこれからなるHCDR2
配列番号:1
(化15)
を含む又はこれからなるHCDR1
配列番号:7
(化16)
を含む又はこれからなるLCDR3
配列番号:6
(化17)
を含む又はこれからなるLCDR2、及び
配列番号:5
(化18)
を含む又はこれからなるLCDR1:
を含む、態様42~46のいずれか一項記載の組合せ。
(態様48)
前記抗-CD70抗体又は抗原-結合断片が、配列番号:4と少なくとも80%同一であるVHドメインを含み、及び/又は配列番号:8と少なくとも80%同一であるVLドメインを含む、態様42~47のいずれか一項記載の組合せ。
(態様49)
前記抗-CD70抗体が、IgG1抗体である、態様42~48のいずれか一項記載の組合せ。
(態様50)
前記抗-CD70抗体が、ARGX-110である、態様42~49のいずれか一項記載の組合せ。
(態様51)
AML又はMDSを治療する方法における使用のための、態様42~50のいずれか一項記載の組合せ。
(態様52)
態様1~32のいずれか一項記載の方法において使用するための、態様42~50のいずれか一項記載の組合せ。
Claims (40)
- 対象における急性骨髄性白血病(AML)又は骨髄異形成症候群(MDS)を治療する方法に使用するための、抗-CD70抗体又はその抗原-結合断片を含む医薬組成物であって、該方法は、該対象へ該抗-CD70抗体又はその抗原-結合断片の1以上の投与量を投与すること、及び該対象へアザシチジン又はデシタビンを投与することを含む、前記医薬組成物。
- AML又はMDSの対象の骨髄及び/又は末梢血中の芽球の割合を減少させる方法に使用するための、抗-CD70抗体又はその抗原-結合断片を含む医薬組成物であって、該方法は、該対象へ該抗-CD70抗体又はその抗原-結合断片の1以上の治療有効量を投与すること、及び該対象へアザシチジン又はデシタビンを投与することを含む、前記医薬組成物。
- 造血幹細胞移植(HSCT)に先立ちAML又はMDSの対象を前処置する方法に使用するための、抗-CD70抗体又はその抗原-結合断片を含む医薬組成物であって、該方法は、該対象へ該抗-CD70抗体又はその抗原-結合断片の1以上の投与量を投与すること、及び該対象へアザシチジン又はデシタビンを投与することを含む、前記医薬組成物。
- 対象における急性骨髄性白血病(AML)又は骨髄異形成症候群(MDS)を治療する方法に使用するための、アザシチジン又はデシタビンを含む医薬組成物であって、該方法は、該対象へ抗-CD70抗体又はその抗原-結合断片の1以上の投与量を投与すること、及び該対象へアザシチジン又はデシタビンを投与することを含む、前記医薬組成物。
- AML又はMDSの対象の骨髄及び/又は末梢血中の芽球の割合を減少させる方法に使用するための、アザシチジン又はデシタビンを含む医薬組成物であって、該方法は、該対象へ抗-CD70抗体又はその抗原-結合断片の1以上の治療有効量を投与すること、及び該対象へアザシチジン又はデシタビンを投与することを含む、前記医薬組成物。
- 造血幹細胞移植(HSCT)に先立ちAML又はMDSの対象を前処置する方法に使用するための、アザシチジン又はデシタビンを含む医薬組成物であって、該方法は、該対象へ抗-CD70抗体又はその抗原-結合断片の1以上の投与量を投与すること、及び該対象へアザシチジン又はデシタビンを投与することを含む、前記医薬組成物。
- 前記方法が、前記対象の骨髄中の芽球の割合を減少させる、請求項1~6のいずれか一項記載の医薬組成物。
- 前記方法が、前記対象の末梢血中の芽球の割合を減少させる、請求項1~7のいずれか一項記載の医薬組成物。
- 前記抗-CD70抗体又はその抗原-結合断片が、1回の投薬あたり0.1mg/kg~25mg/kgの範囲の投与量で投与される、請求項1~8のいずれか一項記載の医薬組成物。
- 前記抗-CD70抗体又はその抗原-結合断片の各投薬が、10~20日、任意に12~18日、任意に14~17日隔てられている、請求項1~9のいずれか一項記載の医薬組成物。
- アザシチジン又はデシタビンが、1日あたり50~100mg/m2の範囲の投与量で投与される、請求項1~10のいずれか一項記載の医薬組成物。
- 前記方法が:
i)請求項1~11のいずれか一項記載の抗-CD70抗体又はその抗原-結合断片、及びアザシチジン又はデシタビンの投与を含む、第一段階、並びに
ii)請求項1~9のいずれか一項記載の抗-CD70抗体又はその抗原-結合断片の投与、及び該第一段階で投与されるアザシチジン又はデシタビンの投与量よりもより少ない投与量のアザシチジン又はデシタビンの投与を含む、第二段階:
を含む、請求項1~11のいずれか一項記載の医薬組成物。 - 前記対象が、治療前の標準強化化学療法に適格ではない、請求項1~12のいずれか一項記載の医薬組成物。
- 前記方法が、前記対象において造血幹細胞移植を実行する工程を更に含む、請求項1~13のいずれか一項記載の医薬組成物。
- 前記対象が、60歳以上、任意に75歳以上である、請求項1~14のいずれか一項記載の医薬組成物。
- 前記方法が、前記対象へ、抗-CD33抗体、抗-CD123抗体、E-セレクチン阻害剤、FLT3阻害剤、サイクリン依存性キナーゼ阻害剤、BCL-2阻害剤、アミノペプチダーゼ阻害剤及びJAK/STAT阻害剤から選択された1種以上の活性物質を投与することを更に含む、請求項1~15のいずれか一項記載の医薬組成物。
- 前記方法が、部分奏効(PR)、不完全血液学的回復を伴う完全奏効(CRi)、又は完全奏効(CR)を誘導する、請求項1~16のいずれか一項記載の医薬組成物。
- 前記方法が、陰性である微小残存病変状態を誘導する、請求項1~17のいずれか一項記載の医薬組成物。
- 前記抗-CD70抗体又はその抗原-結合断片が、CD70-CD27結合を阻害する、請求項1~18のいずれか一項記載の医薬組成物。
- 前記抗-CD70抗体又はその抗原-結合断片が、CD70-発現細胞を枯渇する、請求項1~19のいずれか一項記載の医薬組成物。
- 前記抗-CD70抗体又はその抗原-結合断片が、配列番号:4と少なくとも90%同一であるVHドメインを含み、及び/又は配列番号:8と少なくとも90%同一であるVLドメインを含む、請求項21記載の医薬組成物。
- 前記抗-CD70抗体が、IgG1抗体である、請求項1~22のいずれか一項記載の医薬組成物。
- 前記抗-CD70抗体が、ARGX-110である、請求項1~23のいずれか一項記載の医薬組成物。
- 更に医薬として許容し得る賦形剤又は担体を含有する、請求項1~24のいずれか一項記載の医薬組成物。
- 前記抗-CD70抗体又はその抗原-結合断片が、CD70-CD27結合を阻害する、請求項1~25のいずれか一項記載の医薬組成物。
- 前記抗-CD70抗体又はその抗原-結合断片が、CD70-発現細胞を枯渇する、請求項1~26のいずれか一項記載の医薬組成物。
- 前記抗-CD70抗体又はその抗原-結合断片が、配列番号:4と少なくとも90%同一であるVHドメインを含み、及び/又は配列番号:8と少なくとも90%同一であるVLドメインを含む、請求項28記載の医薬組成物。
- 前記抗-CD70抗体が、IgG1抗体である、請求項1~29のいずれか一項記載の医薬組成物。
- 前記抗-CD70抗体が、ARGX-110である、請求項1~30のいずれか一項記載の医薬組成物。
- AMLを治療するための医薬の製造における、抗-CD70抗体又はその抗原-結合断片の使用であって、該抗-CD70抗体又はその抗原-結合断片が、アザシチジン又はデシタビンとの併用投与のためのものである、前記使用。
- AMLを治療するための医薬の製造における、アザシチジン又はデシタビンの使用であって、アザシチジン又はデシタビンが、抗-CD70抗体又はその抗原-結合断片との併用投与のためのものである、前記使用。
- AML又はMDSを治療するための医薬組成物であって、抗-CD70抗体又はその抗原-結合断片及びアザシチジン又はデシタビンを含む、前記医薬組成物。
- 前記抗-CD70抗体又はその抗原-結合断片が、CD70-CD27結合を阻害する、請求項34記載の医薬組成物。
- 前記抗-CD70抗体又はその抗原-結合断片が、CD70-発現細胞を枯渇する、請求項34又は35記載の医薬組成物。
- 前記抗-CD70抗体又はその抗原-結合断片が、配列番号:4と少なくとも90%同一であるVHドメインを含み、及び/又は配列番号:8と少なくとも90%同一であるVLドメインを含む、請求項37記載の医薬組成物。
- 前記抗-CD70抗体が、IgG1抗体である、請求項34~38のいずれか一項記載の医薬組成物。
- 前記抗-CD70抗体が、ARGX-110である、請求項34~39のいずれか一項記載の医薬組成物。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2024088812A JP2024109951A (ja) | 2017-06-16 | 2024-05-31 | 急性骨髄性白血病治療のための抗-cd70抗体argx-110の使用 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB1709677.7A GB2567613A (en) | 2017-06-16 | 2017-06-16 | Treatment for acute myeloid leukaemia |
| GB1709677.7 | 2017-06-16 | ||
| PCT/EP2018/066144 WO2018229303A1 (en) | 2017-06-16 | 2018-06-18 | Use of anti cd70 antibody argx-110 to treat acute myeloid leukaemia |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024088812A Division JP2024109951A (ja) | 2017-06-16 | 2024-05-31 | 急性骨髄性白血病治療のための抗-cd70抗体argx-110の使用 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2020528044A JP2020528044A (ja) | 2020-09-17 |
| JP2020528044A5 JP2020528044A5 (ja) | 2021-08-05 |
| JP7498564B2 true JP7498564B2 (ja) | 2024-06-12 |
Family
ID=59462340
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019569314A Active JP7498564B2 (ja) | 2017-06-16 | 2018-06-18 | 急性骨髄性白血病治療のための抗-cd70抗体argx-110の使用 |
| JP2024088812A Pending JP2024109951A (ja) | 2017-06-16 | 2024-05-31 | 急性骨髄性白血病治療のための抗-cd70抗体argx-110の使用 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024088812A Pending JP2024109951A (ja) | 2017-06-16 | 2024-05-31 | 急性骨髄性白血病治療のための抗-cd70抗体argx-110の使用 |
Country Status (23)
| Country | Link |
|---|---|
| US (2) | US20190106498A1 (ja) |
| EP (2) | EP4389142A3 (ja) |
| JP (2) | JP7498564B2 (ja) |
| KR (1) | KR102799514B1 (ja) |
| CN (1) | CN110730789A (ja) |
| AU (3) | AU2018285731B2 (ja) |
| BR (1) | BR112019026795A2 (ja) |
| CA (1) | CA3063694A1 (ja) |
| DK (1) | DK3638696T5 (ja) |
| EA (1) | EA202090061A1 (ja) |
| ES (1) | ES2974678T3 (ja) |
| FI (1) | FI3638696T3 (ja) |
| GB (2) | GB2567613A (ja) |
| HU (1) | HUE066603T2 (ja) |
| IL (2) | IL321494A (ja) |
| JO (1) | JOP20190285A1 (ja) |
| LT (1) | LT3638696T (ja) |
| MA (1) | MA49377A (ja) |
| MX (1) | MX2019015204A (ja) |
| PH (1) | PH12019502477A1 (ja) |
| PL (1) | PL3638696T3 (ja) |
| PT (1) | PT3638696T (ja) |
| WO (1) | WO2018229303A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2024109951A (ja) * | 2017-06-16 | 2024-08-14 | アルジェニクス ビーブイ | 急性骨髄性白血病治療のための抗-cd70抗体argx-110の使用 |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PL2686347T3 (pl) | 2011-03-16 | 2018-10-31 | Argenx Bvba | Przeciwciała przeciwko CD70 |
| US10391168B1 (en) | 2014-08-22 | 2019-08-27 | University Of Bern | Anti-CD70 combination therapy |
| GB201800649D0 (en) | 2018-01-16 | 2018-02-28 | Argenx Bvba | CD70 Combination Therapy |
| TWI848030B (zh) | 2018-12-18 | 2024-07-11 | 比利時商阿根思公司 | Cd70組合治療 |
| US11911610B2 (en) * | 2019-03-29 | 2024-02-27 | Novocure Gmbh | Methods for restoring sensitivity to TTFields in TTFields-resistant cancer cells with PTGER3 inhibitors |
| CA3137454A1 (en) * | 2019-04-29 | 2020-11-05 | Immunogen, Inc. | Therapeutic combinations comprising anti-cd123 immunoconjugates |
| WO2021055437A1 (en) * | 2019-09-16 | 2021-03-25 | The General Hospital Corporation | Cd70 targeted chimeric antigen receptor (car) t cells and uses thereof |
| TWI877278B (zh) | 2019-12-30 | 2025-03-21 | 美商思進公司 | 以非海藻糖苷化抗-cd70抗體治療癌症之方法 |
| CA3185846A1 (en) * | 2020-06-30 | 2022-01-06 | Jiangsu Hengrui Pharmaceuticals Co., Ltd. | Anti-cd70 antibody and application thereof |
| EP4189395A1 (en) * | 2020-07-28 | 2023-06-07 | Institut National de la Santé et de la Recherche Médicale (INSERM) | Methods and compositions for preventing and treating a cancer |
| CN116249519A (zh) * | 2020-08-29 | 2023-06-09 | 阿根思有限公司 | 治疗对bcl-2抑制剂具有降低的敏感性的患者的方法 |
| CN114685657B (zh) * | 2020-12-31 | 2024-08-16 | 康诺亚生物医药科技(成都)有限公司 | 一种功能增强型抗体阻断剂的开发及其应用 |
| CN114720358B (zh) * | 2022-04-11 | 2022-09-27 | 浙江普罗亭健康科技有限公司 | 一种质谱流式血液肿瘤免疫分型中替代侧向散射光信号的抗体组合及应用 |
| WO2024102954A1 (en) | 2022-11-10 | 2024-05-16 | Massachusetts Institute Of Technology | Activation induced clipping system (aics) |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014509861A (ja) | 2011-03-16 | 2014-04-24 | アルゲン−エックス ビー.ブイ. | Cd70に対する抗体 |
| WO2017079115A1 (en) | 2015-11-03 | 2017-05-11 | Janssen Biotech, Inc. | Antibodies specifically binding tim-3 and their uses |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2289559B1 (en) | 2003-02-20 | 2014-02-12 | Seattle Genetics, Inc. | Anit-CD70 antibody-drug conjugates and their use for the treatment of cancer and immune disorders |
| JP5222559B2 (ja) | 2004-10-15 | 2013-06-26 | シアトル ジェネティックス, インコーポレイテッド | 癌および免疫障害の処置および予防のための抗cd70抗体ならびにその使用 |
| AU2006236225C1 (en) | 2005-04-19 | 2013-05-02 | Seagen Inc. | Humanized anti-CD70 binding agents and uses thereof |
| EP1934261B1 (en) * | 2005-09-26 | 2014-10-29 | Medarex, L.L.C. | Human monoclonal antibodies to cd70 |
| KR20090088946A (ko) | 2006-12-14 | 2009-08-20 | 메다렉스, 인코포레이티드 | 씨디70에 결합하는 인간 항체 및 이의 용도 |
| CN107325164A (zh) * | 2011-05-31 | 2017-11-07 | 和黄生物膜医疗解决方案有限公司 | 细胞聚集体的分散和脱离 |
| EP4406612A3 (en) | 2012-06-19 | 2024-10-16 | Ambrx, Inc. | Anti-cd70 antibody drug conjugates |
| MX356698B (es) * | 2013-02-14 | 2018-06-11 | Bristol Myers Squibb Co | Compuestos de tubulisina, metodos para obtenerlos y uso. |
| GB2567613A (en) * | 2017-06-16 | 2019-04-24 | Argenx Bvba | Treatment for acute myeloid leukaemia |
-
2017
- 2017-06-16 GB GB1709677.7A patent/GB2567613A/en not_active Withdrawn
- 2017-07-31 GB GBGB1712273.0A patent/GB201712273D0/en not_active Ceased
-
2018
- 2018-06-18 FI FIEP18732064.3T patent/FI3638696T3/fi active
- 2018-06-18 LT LTEPPCT/EP2018/066144T patent/LT3638696T/lt unknown
- 2018-06-18 AU AU2018285731A patent/AU2018285731B2/en active Active
- 2018-06-18 MX MX2019015204A patent/MX2019015204A/es unknown
- 2018-06-18 ES ES18732064T patent/ES2974678T3/es active Active
- 2018-06-18 US US16/011,342 patent/US20190106498A1/en not_active Abandoned
- 2018-06-18 KR KR1020207000169A patent/KR102799514B1/ko active Active
- 2018-06-18 WO PCT/EP2018/066144 patent/WO2018229303A1/en not_active Ceased
- 2018-06-18 PT PT187320643T patent/PT3638696T/pt unknown
- 2018-06-18 HU HUE18732064A patent/HUE066603T2/hu unknown
- 2018-06-18 IL IL321494A patent/IL321494A/en unknown
- 2018-06-18 EP EP24160069.1A patent/EP4389142A3/en active Pending
- 2018-06-18 CN CN201880038934.0A patent/CN110730789A/zh active Pending
- 2018-06-18 DK DK18732064.3T patent/DK3638696T5/da active
- 2018-06-18 EA EA202090061A patent/EA202090061A1/ru unknown
- 2018-06-18 JP JP2019569314A patent/JP7498564B2/ja active Active
- 2018-06-18 CA CA3063694A patent/CA3063694A1/en active Pending
- 2018-06-18 BR BR112019026795-6A patent/BR112019026795A2/pt unknown
- 2018-06-18 PL PL18732064.3T patent/PL3638696T3/pl unknown
- 2018-06-18 MA MA049377A patent/MA49377A/fr unknown
- 2018-06-18 EP EP18732064.3A patent/EP3638696B8/en active Active
- 2018-12-16 JO JOP/2019/0285A patent/JOP20190285A1/ar unknown
-
2019
- 2019-11-04 PH PH12019502477A patent/PH12019502477A1/en unknown
- 2019-12-08 IL IL271266A patent/IL271266A/en unknown
-
2022
- 2022-01-27 AU AU2022200521A patent/AU2022200521A1/en not_active Abandoned
-
2024
- 2024-05-31 JP JP2024088812A patent/JP2024109951A/ja active Pending
-
2025
- 2025-01-14 US US19/020,727 patent/US20250230252A1/en active Pending
- 2025-02-25 AU AU2025201328A patent/AU2025201328A1/en active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014509861A (ja) | 2011-03-16 | 2014-04-24 | アルゲン−エックス ビー.ブイ. | Cd70に対する抗体 |
| WO2017079115A1 (en) | 2015-11-03 | 2017-05-11 | Janssen Biotech, Inc. | Antibodies specifically binding tim-3 and their uses |
Non-Patent Citations (3)
| Title |
|---|
| Cell Comuun Signal., 2017 Mar, Vol.15, Article.13(p.1-14) |
| Eur J Cancer., 2017 Feb, Vol.74, p.55-72 |
| Pharm Therap., 2015, Vol.155, p.1-10 |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2024109951A (ja) * | 2017-06-16 | 2024-08-14 | アルジェニクス ビーブイ | 急性骨髄性白血病治療のための抗-cd70抗体argx-110の使用 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7498564B2 (ja) | 急性骨髄性白血病治療のための抗-cd70抗体argx-110の使用 | |
| TWI786044B (zh) | 藉由投予pd-1抑制劑治療皮膚癌之方法 | |
| AU2019409936B2 (en) | CD70 and venetoclax, a BCL-2 inhibitor, combination therapy for treating acute myeloid leukemia | |
| CN108602889A (zh) | 医治急性成淋巴细胞性白血病的双特异性抗cd20/抗cd3抗体 | |
| JP2019503361A (ja) | がんを治療するための抗pd−1抗体と二重特異性抗cd20/抗cd3抗体の組合せ | |
| CN116801889A (zh) | 包含具有多特异性抗体的离体武装t细胞的组合物和其用途 | |
| EP3976080A1 (en) | Treatment of cancers with gm-csf antagonists | |
| JP2023539493A (ja) | Bcl-2阻害剤への低下した感度を有する患者の治療方法 | |
| Krishnamoorthy et al. | Maplirpacept: a CD47 decoy receptor with minimal red blood cell binding and robust anti-tumor efficacy | |
| EP3886866A1 (en) | Methods of treatment using decitabine and a cd123-targeted therapy | |
| CN113993543B (zh) | 使用抗cd38抗体的组合疗法 | |
| HK40112285A (en) | Use of anti cd70 antibody argx-110 to treat acute myeloid leukaemia | |
| EA044996B1 (ru) | Применение антитела против cd70, argx–110 для лечения острого миелоидного лейкоза | |
| HK40014553A (en) | Use of anti cd70 antibody argx-110 to treat acute myeloid leukaemia | |
| EP4494654A1 (en) | Pharmaceutical composition of anti-tim-3 antibody and hypomethylating agent | |
| WO2024149224A1 (zh) | Ccr8抗体的应用 | |
| CN116209466A (zh) | 抗pd-1抗体在治疗鼻咽癌中的用途 | |
| HK40089820A (zh) | 治疗对bcl-2抑制剂具有降低的敏感性的患者的方法 | |
| HK40052961A (en) | Cd70 and venetoclax, a bcl-2 inhibitor, combination therapy for treating acute myeloid leukemia | |
| HK40052961B (en) | Cd70 and venetoclax, a bcl-2 inhibitor, combination therapy for treating acute myeloid leukemia |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200326 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210617 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210617 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220802 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20221031 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230201 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230411 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230710 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20231010 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20240105 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240306 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20240507 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20240531 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7498564 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |