JP7492829B2 - 多重カップリングおよび酸化の方法 - Google Patents
多重カップリングおよび酸化の方法 Download PDFInfo
- Publication number
- JP7492829B2 JP7492829B2 JP2019572465A JP2019572465A JP7492829B2 JP 7492829 B2 JP7492829 B2 JP 7492829B2 JP 2019572465 A JP2019572465 A JP 2019572465A JP 2019572465 A JP2019572465 A JP 2019572465A JP 7492829 B2 JP7492829 B2 JP 7492829B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- alkyl
- lna
- substituted
- monomer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000005859 coupling reaction Methods 0.000 title claims description 156
- 238000010168 coupling process Methods 0.000 title claims description 153
- 230000008878 coupling Effects 0.000 title claims description 152
- 238000000034 method Methods 0.000 title claims description 128
- 230000003647 oxidation Effects 0.000 title description 48
- 238000007254 oxidation reaction Methods 0.000 title description 48
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 claims description 312
- 239000000178 monomer Substances 0.000 claims description 279
- 108091034117 Oligonucleotide Proteins 0.000 claims description 157
- 239000002904 solvent Substances 0.000 claims description 139
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 claims description 124
- 150000008300 phosphoramidites Chemical class 0.000 claims description 122
- 239000002777 nucleoside Substances 0.000 claims description 92
- 125000006615 aromatic heterocyclic group Chemical group 0.000 claims description 78
- -1 phosphite triester Chemical class 0.000 claims description 77
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 claims description 71
- 229910052739 hydrogen Inorganic materials 0.000 claims description 70
- 239000001257 hydrogen Substances 0.000 claims description 70
- 150000003833 nucleoside derivatives Chemical class 0.000 claims description 68
- 125000003118 aryl group Chemical group 0.000 claims description 64
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 claims description 62
- 125000000217 alkyl group Chemical group 0.000 claims description 56
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical group O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 claims description 55
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 42
- 230000015572 biosynthetic process Effects 0.000 claims description 41
- 238000003786 synthesis reaction Methods 0.000 claims description 41
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 claims description 41
- 125000005915 C6-C14 aryl group Chemical group 0.000 claims description 39
- 239000000203 mixture Substances 0.000 claims description 38
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims description 37
- 239000007787 solid Substances 0.000 claims description 36
- 125000001072 heteroaryl group Chemical group 0.000 claims description 34
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 27
- 238000005406 washing Methods 0.000 claims description 27
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 24
- 230000000707 stereoselective effect Effects 0.000 claims description 22
- 125000000623 heterocyclic group Chemical group 0.000 claims description 21
- 125000004432 carbon atom Chemical group C* 0.000 claims description 20
- 150000003457 sulfones Chemical class 0.000 claims description 18
- ITQTTZVARXURQS-UHFFFAOYSA-N 3-methylpyridine Chemical compound CC1=CC=CN=C1 ITQTTZVARXURQS-UHFFFAOYSA-N 0.000 claims description 16
- 125000002252 acyl group Chemical group 0.000 claims description 16
- 239000000074 antisense oligonucleotide Substances 0.000 claims description 16
- 238000012230 antisense oligonucleotides Methods 0.000 claims description 16
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 16
- 125000003107 substituted aryl group Chemical group 0.000 claims description 16
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 claims description 14
- 229910052736 halogen Inorganic materials 0.000 claims description 14
- 150000002367 halogens Chemical class 0.000 claims description 14
- NIHNNTQXNPWCJQ-UHFFFAOYSA-N fluorene Chemical compound C1=CC=C2CC3=CC=CC=C3C2=C1 NIHNNTQXNPWCJQ-UHFFFAOYSA-N 0.000 claims description 12
- 229910052757 nitrogen Inorganic materials 0.000 claims description 12
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 11
- OISVCGZHLKNMSJ-UHFFFAOYSA-N 2,6-dimethylpyridine Chemical compound CC1=CC=CC(C)=N1 OISVCGZHLKNMSJ-UHFFFAOYSA-N 0.000 claims description 10
- BSKHPKMHTQYZBB-UHFFFAOYSA-N 2-methylpyridine Chemical compound CC1=CC=CC=N1 BSKHPKMHTQYZBB-UHFFFAOYSA-N 0.000 claims description 10
- FKNQCJSGGFJEIZ-UHFFFAOYSA-N 4-methylpyridine Chemical compound CC1=CC=NC=C1 FKNQCJSGGFJEIZ-UHFFFAOYSA-N 0.000 claims description 10
- 239000003153 chemical reaction reagent Substances 0.000 claims description 9
- 125000001181 organosilyl group Chemical group [SiH3]* 0.000 claims description 9
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 8
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 8
- 239000002253 acid Substances 0.000 claims description 7
- 229910052731 fluorine Inorganic materials 0.000 claims description 7
- 239000011737 fluorine Substances 0.000 claims description 7
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 7
- 230000001590 oxidative effect Effects 0.000 claims description 7
- 150000002221 fluorine Chemical class 0.000 claims description 6
- 125000000547 substituted alkyl group Chemical group 0.000 claims description 6
- 125000005346 substituted cycloalkyl group Chemical group 0.000 claims description 6
- HPYNZHMRTTWQTB-UHFFFAOYSA-N dimethylpyridine Natural products CC1=CC=CN=C1C HPYNZHMRTTWQTB-UHFFFAOYSA-N 0.000 claims description 5
- 125000000229 (C1-C4)alkoxy group Chemical group 0.000 claims description 2
- 150000002431 hydrogen Chemical class 0.000 claims 1
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 48
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 46
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-dimethylformamide Substances CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 45
- 239000000243 solution Substances 0.000 description 44
- 239000002585 base Substances 0.000 description 38
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 37
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 36
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 36
- MCTWTZJPVLRJOU-UHFFFAOYSA-N 1-methyl-1H-imidazole Chemical compound CN1C=CN=C1 MCTWTZJPVLRJOU-UHFFFAOYSA-N 0.000 description 35
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 32
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 32
- 125000003835 nucleoside group Chemical group 0.000 description 31
- 125000003729 nucleotide group Chemical group 0.000 description 31
- 239000002773 nucleotide Substances 0.000 description 29
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 28
- 229930024421 Adenine Natural products 0.000 description 28
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 28
- 125000003545 alkoxy group Chemical group 0.000 description 27
- LDTCNTTUPVHVJK-UHFFFAOYSA-N aminophosphonous acid oxazaphospholidine Chemical compound NP(O)O.C1CPNO1 LDTCNTTUPVHVJK-UHFFFAOYSA-N 0.000 description 27
- 239000000047 product Substances 0.000 description 27
- 229960000643 adenine Drugs 0.000 description 26
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 24
- 239000000543 intermediate Substances 0.000 description 23
- 238000002515 oligonucleotide synthesis Methods 0.000 description 23
- 239000012190 activator Substances 0.000 description 20
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical group CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 20
- 229940104302 cytosine Drugs 0.000 description 18
- 230000001965 increasing effect Effects 0.000 description 18
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 18
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 16
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 16
- 238000010511 deprotection reaction Methods 0.000 description 16
- 230000003213 activating effect Effects 0.000 description 15
- 238000006243 chemical reaction Methods 0.000 description 15
- 239000003795 chemical substances by application Substances 0.000 description 15
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 14
- 235000019439 ethyl acetate Nutrition 0.000 description 14
- 150000001875 compounds Chemical class 0.000 description 13
- 125000006239 protecting group Chemical group 0.000 description 13
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 12
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 12
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 12
- XVMSFILGAMDHEY-UHFFFAOYSA-N 6-(4-aminophenyl)sulfonylpyridin-3-amine Chemical compound C1=CC(N)=CC=C1S(=O)(=O)C1=CC=C(N)C=N1 XVMSFILGAMDHEY-UHFFFAOYSA-N 0.000 description 11
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 11
- 235000011114 ammonium hydroxide Nutrition 0.000 description 11
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 11
- 230000008901 benefit Effects 0.000 description 11
- 108020004707 nucleic acids Proteins 0.000 description 11
- 102000039446 nucleic acids Human genes 0.000 description 11
- 238000000746 purification Methods 0.000 description 11
- LRSASMSXMSNRBT-UHFFFAOYSA-N 5-methylcytosine Chemical compound CC1=CNC(=O)N=C1N LRSASMSXMSNRBT-UHFFFAOYSA-N 0.000 description 10
- 108020000948 Antisense Oligonucleotides Proteins 0.000 description 10
- JXTHNDFMNIQAHM-UHFFFAOYSA-N dichloroacetic acid Chemical compound OC(=O)C(Cl)Cl JXTHNDFMNIQAHM-UHFFFAOYSA-N 0.000 description 10
- 125000005647 linker group Chemical group 0.000 description 10
- 239000001301 oxygen Substances 0.000 description 10
- 229910052760 oxygen Inorganic materials 0.000 description 10
- 229940113082 thymine Drugs 0.000 description 10
- 125000000304 alkynyl group Chemical group 0.000 description 9
- 239000011541 reaction mixture Substances 0.000 description 9
- XGDRLCRGKUCBQL-UHFFFAOYSA-N 1h-imidazole-4,5-dicarbonitrile Chemical compound N#CC=1N=CNC=1C#N XGDRLCRGKUCBQL-UHFFFAOYSA-N 0.000 description 8
- 238000004679 31P NMR spectroscopy Methods 0.000 description 8
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 8
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 8
- 238000006642 detritylation reaction Methods 0.000 description 8
- 150000007523 nucleic acids Chemical class 0.000 description 8
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 7
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 description 7
- 125000003342 alkenyl group Chemical group 0.000 description 7
- 125000004093 cyano group Chemical group *C#N 0.000 description 7
- 230000008569 process Effects 0.000 description 7
- 230000009257 reactivity Effects 0.000 description 7
- 229920001285 xanthan gum Polymers 0.000 description 7
- KMEMIMRPZGDOMG-UHFFFAOYSA-N 2-cyanoethoxyphosphonamidous acid Chemical class NP(O)OCCC#N KMEMIMRPZGDOMG-UHFFFAOYSA-N 0.000 description 6
- 125000002103 4,4'-dimethoxytriphenylmethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)(C1=C([H])C([H])=C(OC([H])([H])[H])C([H])=C1[H])C1=C([H])C([H])=C(OC([H])([H])[H])C([H])=C1[H] 0.000 description 6
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- 239000007832 Na2SO4 Substances 0.000 description 6
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 6
- 150000001412 amines Chemical class 0.000 description 6
- 125000006620 amino-(C1-C6) alkyl group Chemical group 0.000 description 6
- 239000000908 ammonium hydroxide Substances 0.000 description 6
- 125000004104 aryloxy group Chemical group 0.000 description 6
- 125000004429 atom Chemical group 0.000 description 6
- 239000012267 brine Substances 0.000 description 6
- 229910052799 carbon Inorganic materials 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 6
- FAIAAWCVCHQXDN-UHFFFAOYSA-N phosphorus trichloride Chemical compound ClP(Cl)Cl FAIAAWCVCHQXDN-UHFFFAOYSA-N 0.000 description 6
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 6
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 6
- 235000017557 sodium bicarbonate Nutrition 0.000 description 6
- 229910052938 sodium sulfate Inorganic materials 0.000 description 6
- 235000011152 sodium sulphate Nutrition 0.000 description 6
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 6
- 125000001424 substituent group Chemical group 0.000 description 6
- 238000006467 substitution reaction Methods 0.000 description 6
- 238000005987 sulfurization reaction Methods 0.000 description 6
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 description 5
- GXGKKIPUFAHZIZ-UHFFFAOYSA-N 5-benzylsulfanyl-2h-tetrazole Chemical compound C=1C=CC=CC=1CSC=1N=NNN=1 GXGKKIPUFAHZIZ-UHFFFAOYSA-N 0.000 description 5
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 5
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 5
- KRHYYFGTRYWZRS-UHFFFAOYSA-M Fluoride anion Chemical compound [F-] KRHYYFGTRYWZRS-UHFFFAOYSA-M 0.000 description 5
- 239000006227 byproduct Substances 0.000 description 5
- 150000001721 carbon Chemical group 0.000 description 5
- 238000003776 cleavage reaction Methods 0.000 description 5
- 229960005215 dichloroacetic acid Drugs 0.000 description 5
- 239000003480 eluent Substances 0.000 description 5
- 150000004820 halides Chemical class 0.000 description 5
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 5
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 5
- 230000006872 improvement Effects 0.000 description 5
- 239000002243 precursor Substances 0.000 description 5
- 238000011160 research Methods 0.000 description 5
- 230000007017 scission Effects 0.000 description 5
- 150000003536 tetrazoles Chemical class 0.000 description 5
- 125000004454 (C1-C6) alkoxycarbonyl group Chemical group 0.000 description 4
- 125000004916 (C1-C6) alkylcarbonyl group Chemical group 0.000 description 4
- 125000006700 (C1-C6) alkylthio group Chemical group 0.000 description 4
- 125000006619 (C1-C6) dialkylamino group Chemical group 0.000 description 4
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 4
- IWYHWZTYVNIDAE-UHFFFAOYSA-N 1h-benzimidazol-1-ium;trifluoromethanesulfonate Chemical compound OS(=O)(=O)C(F)(F)F.C1=CC=C2NC=NC2=C1 IWYHWZTYVNIDAE-UHFFFAOYSA-N 0.000 description 4
- LRFVTYWOQMYALW-UHFFFAOYSA-N 9H-xanthine Chemical compound O=C1NC(=O)NC2=C1NC=N2 LRFVTYWOQMYALW-UHFFFAOYSA-N 0.000 description 4
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 4
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 4
- 125000005947 C1-C6 alkylsulfonyloxy group Chemical group 0.000 description 4
- 125000003320 C2-C6 alkenyloxy group Chemical group 0.000 description 4
- RYYWUUFWQRZTIU-UHFFFAOYSA-N Thiophosphoric acid Chemical group OP(O)(S)=O RYYWUUFWQRZTIU-UHFFFAOYSA-N 0.000 description 4
- 125000003277 amino group Chemical group 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 125000005129 aryl carbonyl group Chemical group 0.000 description 4
- 125000005161 aryl oxy carbonyl group Chemical group 0.000 description 4
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 4
- 125000002619 bicyclic group Chemical group 0.000 description 4
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 4
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 4
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 4
- 238000003818 flash chromatography Methods 0.000 description 4
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 description 4
- 125000005223 heteroarylcarbonyl group Chemical group 0.000 description 4
- 125000005553 heteroaryloxy group Chemical group 0.000 description 4
- 125000005226 heteroaryloxycarbonyl group Chemical group 0.000 description 4
- FDGQSTZJBFJUBT-UHFFFAOYSA-N hypoxanthine Chemical compound O=C1NC=NC2=C1NC=N2 FDGQSTZJBFJUBT-UHFFFAOYSA-N 0.000 description 4
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 4
- 230000004048 modification Effects 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- CYFLXLSBHQBMFT-UHFFFAOYSA-N sulfamoxole Chemical group O1C(C)=C(C)N=C1NS(=O)(=O)C1=CC=C(N)C=C1 CYFLXLSBHQBMFT-UHFFFAOYSA-N 0.000 description 4
- 229940104230 thymidine Drugs 0.000 description 4
- 229940035893 uracil Drugs 0.000 description 4
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 3
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 3
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 3
- 239000012300 argon atmosphere Substances 0.000 description 3
- 238000004440 column chromatography Methods 0.000 description 3
- 239000013058 crude material Substances 0.000 description 3
- 239000012043 crude product Substances 0.000 description 3
- 238000013461 design Methods 0.000 description 3
- 230000001627 detrimental effect Effects 0.000 description 3
- 230000002708 enhancing effect Effects 0.000 description 3
- 239000006260 foam Substances 0.000 description 3
- 239000012634 fragment Substances 0.000 description 3
- 238000005342 ion exchange Methods 0.000 description 3
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 3
- 238000005457 optimization Methods 0.000 description 3
- 239000012071 phase Substances 0.000 description 3
- 238000004366 reverse phase liquid chromatography Methods 0.000 description 3
- 238000007086 side reaction Methods 0.000 description 3
- 230000006641 stabilisation Effects 0.000 description 3
- 238000011105 stabilization Methods 0.000 description 3
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 3
- 238000004704 ultra performance liquid chromatography Methods 0.000 description 3
- 239000003039 volatile agent Substances 0.000 description 3
- 125000000008 (C1-C10) alkyl group Chemical group 0.000 description 2
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 description 2
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 2
- FKGZYFHAFBWWPJ-UHFFFAOYSA-N 1-phenyl-1h-imidazol-1-ium;trifluoromethanesulfonate Chemical compound [O-]S(=O)(=O)C(F)(F)F.C1=NC=C[NH+]1C1=CC=CC=C1 FKGZYFHAFBWWPJ-UHFFFAOYSA-N 0.000 description 2
- KJUGUADJHNHALS-UHFFFAOYSA-N 1H-tetrazole Chemical compound C=1N=NNN=1 KJUGUADJHNHALS-UHFFFAOYSA-N 0.000 description 2
- XQCZBXHVTFVIFE-UHFFFAOYSA-N 2-amino-4-hydroxypyrimidine Chemical compound NC1=NC=CC(O)=N1 XQCZBXHVTFVIFE-UHFFFAOYSA-N 0.000 description 2
- MWBWWFOAEOYUST-UHFFFAOYSA-N 2-aminopurine Chemical compound NC1=NC=C2N=CNC2=N1 MWBWWFOAEOYUST-UHFFFAOYSA-N 0.000 description 2
- HBJGQJWNMZDFKL-UHFFFAOYSA-N 2-chloro-7h-purin-6-amine Chemical compound NC1=NC(Cl)=NC2=C1NC=N2 HBJGQJWNMZDFKL-UHFFFAOYSA-N 0.000 description 2
- NJDPBWLDVFCXNP-UHFFFAOYSA-N 2-cyanoethyl dihydrogen phosphate Chemical group OP(O)(=O)OCCC#N NJDPBWLDVFCXNP-UHFFFAOYSA-N 0.000 description 2
- ONSASHBHHZNQQZ-UHFFFAOYSA-N 2-pyrrolidin-1-ium-1-ylacetonitrile;trifluoromethanesulfonate Chemical compound N#CC[NH+]1CCCC1.[O-]S(=O)(=O)C(F)(F)F ONSASHBHHZNQQZ-UHFFFAOYSA-N 0.000 description 2
- LQLQRFGHAALLLE-UHFFFAOYSA-N 5-bromouracil Chemical compound BrC1=CNC(=O)NC1=O LQLQRFGHAALLLE-UHFFFAOYSA-N 0.000 description 2
- UJBCLAXPPIDQEE-UHFFFAOYSA-N 5-prop-1-ynyl-1h-pyrimidine-2,4-dione Chemical compound CC#CC1=CNC(=O)NC1=O UJBCLAXPPIDQEE-UHFFFAOYSA-N 0.000 description 2
- VKKXEIQIGGPMHT-UHFFFAOYSA-N 7h-purine-2,8-diamine Chemical compound NC1=NC=C2NC(N)=NC2=N1 VKKXEIQIGGPMHT-UHFFFAOYSA-N 0.000 description 2
- UGQMRVRMYYASKQ-UHFFFAOYSA-N Hypoxanthine nucleoside Natural products OC1C(O)C(CO)OC1N1C(NC=NC2=O)=C2N=C1 UGQMRVRMYYASKQ-UHFFFAOYSA-N 0.000 description 2
- 229930010555 Inosine Natural products 0.000 description 2
- UGQMRVRMYYASKQ-KQYNXXCUSA-N Inosine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C2=NC=NC(O)=C2N=C1 UGQMRVRMYYASKQ-KQYNXXCUSA-N 0.000 description 2
- 102100034343 Integrase Human genes 0.000 description 2
- 101710203526 Integrase Proteins 0.000 description 2
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 2
- 101710163270 Nuclease Proteins 0.000 description 2
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 2
- 238000002835 absorbance Methods 0.000 description 2
- 238000010306 acid treatment Methods 0.000 description 2
- 125000002877 alkyl aryl group Chemical group 0.000 description 2
- 229910021529 ammonia Inorganic materials 0.000 description 2
- 125000000852 azido group Chemical group *N=[N+]=[N-] 0.000 description 2
- 230000008033 biological extinction Effects 0.000 description 2
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 125000004122 cyclic group Chemical group 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 125000005843 halogen group Chemical group 0.000 description 2
- 238000000589 high-performance liquid chromatography-mass spectrometry Methods 0.000 description 2
- 229960003786 inosine Drugs 0.000 description 2
- 230000010354 integration Effects 0.000 description 2
- 238000011835 investigation Methods 0.000 description 2
- 125000005699 methyleneoxy group Chemical group [H]C([H])([*:1])O[*:2] 0.000 description 2
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 2
- 238000007899 nucleic acid hybridization Methods 0.000 description 2
- 150000004713 phosphodiesters Chemical class 0.000 description 2
- 125000000168 pyrrolyl group Chemical group 0.000 description 2
- 239000011343 solid material Substances 0.000 description 2
- 230000002194 synthesizing effect Effects 0.000 description 2
- 125000001981 tert-butyldimethylsilyl group Chemical group [H]C([H])([H])[Si]([H])(C([H])([H])[H])[*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 125000000037 tert-butyldiphenylsilyl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1[Si]([H])([*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- YNJBWRMUSHSURL-UHFFFAOYSA-N trichloroacetic acid Chemical compound OC(=O)C(Cl)(Cl)Cl YNJBWRMUSHSURL-UHFFFAOYSA-N 0.000 description 2
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 2
- 239000003643 water by type Substances 0.000 description 2
- 229940075420 xanthine Drugs 0.000 description 2
- CCSBNBKMACZDGN-UHFFFAOYSA-N (2-phenoxyacetyl) 2-phenoxyacetate Chemical compound C=1C=CC=CC=1OCC(=O)OC(=O)COC1=CC=CC=C1 CCSBNBKMACZDGN-UHFFFAOYSA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- CDAISMWEOUEBRE-LKPKBOIGSA-N 1D-chiro-inositol Chemical group O[C@H]1[C@@H](O)[C@H](O)[C@H](O)[C@@H](O)[C@@H]1O CDAISMWEOUEBRE-LKPKBOIGSA-N 0.000 description 1
- OVSKIKFHRZPJSS-UHFFFAOYSA-N 2,4-D Chemical compound OC(=O)COC1=CC=C(Cl)C=C1Cl OVSKIKFHRZPJSS-UHFFFAOYSA-N 0.000 description 1
- 125000001731 2-cyanoethyl group Chemical group [H]C([H])(*)C([H])([H])C#N 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- GONFBOIJNUKKST-UHFFFAOYSA-N 5-ethylsulfanyl-2h-tetrazole Chemical compound CCSC=1N=NNN=1 GONFBOIJNUKKST-UHFFFAOYSA-N 0.000 description 1
- ZLAQATDNGLKIEV-UHFFFAOYSA-N 5-methyl-2-sulfanylidene-1h-pyrimidin-4-one Chemical compound CC1=CNC(=S)NC1=O ZLAQATDNGLKIEV-UHFFFAOYSA-N 0.000 description 1
- QNNARSZPGNJZIX-UHFFFAOYSA-N 6-amino-5-prop-1-ynyl-1h-pyrimidin-2-one Chemical compound CC#CC1=CNC(=O)N=C1N QNNARSZPGNJZIX-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- MSSXOMSJDRHRMC-UHFFFAOYSA-N 9H-purine-2,6-diamine Chemical compound NC1=NC(N)=C2NC=NC2=N1 MSSXOMSJDRHRMC-UHFFFAOYSA-N 0.000 description 1
- NLHHRLWOUZZQLW-UHFFFAOYSA-N Acrylonitrile Chemical compound C=CC#N NLHHRLWOUZZQLW-UHFFFAOYSA-N 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- FENPYOFIQFTMRH-UHFFFAOYSA-N C(Sn1ncnn1)c1ccccc1 Chemical compound C(Sn1ncnn1)c1ccccc1 FENPYOFIQFTMRH-UHFFFAOYSA-N 0.000 description 1
- FGUUSXIOTUKUDN-IBGZPJMESA-N C1(=CC=CC=C1)N1C2=C(NC([C@H](C1)NC=1OC(=NN=1)C1=CC=CC=C1)=O)C=CC=C2 Chemical compound C1(=CC=CC=C1)N1C2=C(NC([C@H](C1)NC=1OC(=NN=1)C1=CC=CC=C1)=O)C=CC=C2 FGUUSXIOTUKUDN-IBGZPJMESA-N 0.000 description 1
- 125000000041 C6-C10 aryl group Chemical group 0.000 description 1
- DCERHCFNWRGHLK-UHFFFAOYSA-N C[Si](C)C Chemical compound C[Si](C)C DCERHCFNWRGHLK-UHFFFAOYSA-N 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 108020004394 Complementary RNA Proteins 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- AHVYPIQETPWLSZ-UHFFFAOYSA-N N-methyl-pyrrolidine Natural products CN1CC=CC1 AHVYPIQETPWLSZ-UHFFFAOYSA-N 0.000 description 1
- 238000005481 NMR spectroscopy Methods 0.000 description 1
- 229910003827 NRaRb Inorganic materials 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 108020004459 Small interfering RNA Proteins 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 150000008065 acid anhydrides Chemical class 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 125000003302 alkenyloxy group Chemical group 0.000 description 1
- 125000005133 alkynyloxy group Chemical group 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 125000000732 arylene group Chemical group 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 239000003637 basic solution Substances 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 239000003184 complementary RNA Substances 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 230000001808 coupling effect Effects 0.000 description 1
- 125000004850 cyclobutylmethyl group Chemical group C1(CCC1)C* 0.000 description 1
- 125000004210 cyclohexylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000004851 cyclopentylmethyl group Chemical group C1(CCCC1)C* 0.000 description 1
- 125000004186 cyclopropylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C1([H])[H] 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000011033 desalting Methods 0.000 description 1
- 238000011026 diafiltration Methods 0.000 description 1
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001841 imino group Chemical group [H]N=* 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 238000007689 inspection Methods 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 125000000371 nucleobase group Chemical group 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 125000004043 oxo group Chemical group O=* 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 1
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 1
- PTMHPRAIXMAOOB-UHFFFAOYSA-L phosphoramidate Chemical compound NP([O-])([O-])=O PTMHPRAIXMAOOB-UHFFFAOYSA-L 0.000 description 1
- 238000001394 phosphorus-31 nuclear magnetic resonance spectrum Methods 0.000 description 1
- 108091033319 polynucleotide Proteins 0.000 description 1
- 102000040430 polynucleotide Human genes 0.000 description 1
- 239000002157 polynucleotide Substances 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 125000004219 purine nucleobase group Chemical group 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 150000003222 pyridines Chemical class 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 239000013557 residual solvent Substances 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 238000010532 solid phase synthesis reaction Methods 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 125000005017 substituted alkenyl group Chemical group 0.000 description 1
- 125000004426 substituted alkynyl group Chemical group 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- ISIJQEHRDSCQIU-UHFFFAOYSA-N tert-butyl 2,7-diazaspiro[4.5]decane-7-carboxylate Chemical compound C1N(C(=O)OC(C)(C)C)CCCC11CNCC1 ISIJQEHRDSCQIU-UHFFFAOYSA-N 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- ZEMGGZBWXRYJHK-UHFFFAOYSA-N thiouracil Chemical compound O=C1C=CNC(=S)N1 ZEMGGZBWXRYJHK-UHFFFAOYSA-N 0.000 description 1
- 125000000464 thioxo group Chemical group S=* 0.000 description 1
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 238000001946 ultra-performance liquid chromatography-mass spectrometry Methods 0.000 description 1
- 238000009424 underpinning Methods 0.000 description 1
- 125000004417 unsaturated alkyl group Chemical group 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H1/00—Processes for the preparation of sugar derivatives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H1/00—Processes for the preparation of sugar derivatives
- C07H1/02—Phosphorylation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H19/00—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof
- C07H19/02—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof sharing nitrogen
- C07H19/04—Heterocyclic radicals containing only nitrogen atoms as ring hetero atom
- C07H19/06—Pyrimidine radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H19/00—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof
- C07H19/02—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof sharing nitrogen
- C07H19/04—Heterocyclic radicals containing only nitrogen atoms as ring hetero atom
- C07H19/16—Purine radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/02—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with ribosyl as saccharide radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/04—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with deoxyribosyl as saccharide radical
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Saccharide Compounds (AREA)
Description
本発明は、立体的に規定された(stereodefined)ホスホロチオエートオリゴヌクレオチドの分野に関し、かつ立体的に規定するヌクレオシドモノマー、および該モノマーを用いる立体的に規定されたオリゴヌクレオチドの合成法に関する。本明細書において、単一回の伸長サイクル内でカップリング段階および酸化段階の繰り返しがある、向上したオリゴヌクレオチド合成法が開示される。本方法は、立体的に規定されたホスホロチオエートオリゴヌクレオチドの収率および純度の増大をもたらす。
近年、オリゴヌクレオチドにおける立体的に規定されたホスホロチオエートヌクレオシド間結合の使用は、治療用オリゴヌクレオチドの薬理特性の最適化を可能にすることが明らかになってきた。しかし、立体的に規定されたホスホロチオエートオリゴヌクレオチドの製造は、現在の所、立体的に規定されていないホスホロチオエートオリゴヌクレオチドに比べてかなり非効率的である。したがって、立体的に規定されたオリゴヌクレオチドの合成の効率を改善する必要がある。
本発明は、立体的に規定されたホスホロチオエートオリゴヌクレオチドの改善された合成法を提供する。改善された方法は、単一の伸長段階内で単一のカップリング段階および単一の酸化段階を用いて達成し得るカップリング効果と比較して、単一の伸長段階内のオキサザホスホリジンホスホラミダイトモノマーのカップリング効果の向上をもたらす。改善された方法は、単一の伸長段階内で単一のカップリング段階および単一の酸化段階を用いる立体的規定されたホスホロチオエートオリゴヌクレオチド合成法と比較して、オリゴヌクレオチド収率の増大をもたらす。
(a)固体支持体(例えば、unilinker)に結合されたヌクレオシドまたはオリゴヌクレオチドの保護された5'-ヒドロキシ末端を脱保護する段階、
(b)オキサザホスホリジンホスホラミダイトモノマーをヌクレオシドまたはオリゴヌクレオチドの脱保護された5'-ヒドロキシ末端にカップリングして、亜リン酸トリエステル中間体を形成する段階、
(c)亜リン酸トリエステル中間体を硫化試薬で酸化する段階と、その後に続く任意の洗浄段階、
(d)同じ伸長サイクル内で段階(b)および(c)を繰り返す(すなわち、段階(a)の繰り返なし)段階、
(e)任意で、1回または複数回のさらなる伸長サイクルについて段階(a)~(d)を繰り返す段階、
(f)オリゴヌクレオチドを脱保護して固体支持体から切断する段階
を含む、立体的に規定されたホスホロチオエートオリゴヌクレオチドの合成のための方法を提供する。
[本発明1001]
(a)固体支持体に結合されたヌクレオシドまたはオリゴヌクレオチドの保護された5'-ヒドロキシ末端を脱保護する段階、
(b)オキサザホスホリジンホスホラミダイトモノマーをヌクレオシドまたはオリゴヌクレオチドの脱保護された該5'-ヒドロキシ末端にカップリングして、亜リン酸トリエステル中間体を形成する段階、
(c)該亜リン酸トリエステル中間体を硫化試薬で酸化する段階と、その後に続く任意の洗浄段階、
(d)同じ伸長サイクル内で段階(b)および(c)を繰り返す段階、
(e)任意で、1回または複数回のさらなる伸長サイクルについて段階(a)~(d)を繰り返す段階、ならびに
(f)該オリゴヌクレオチドを脱保護して該固体支持体から切断する段階
を含む、立体的に規定された(stereodefined)ホスホロチオエートオリゴヌクレオチドの合成のための方法。
[本発明1002]
段階(d)を少なくとも2回実施する、本発明1001の方法。
[本発明1003]
カップリング反応がアセトニトリル溶媒組成物中で行われる、本発明1001または1002の方法。
[本発明1004]
前記アセトニトリル溶媒がアセトニトリルおよび芳香族複素環式溶媒を含む、本発明1002の方法。
[本発明1005]
複数回のさらなる伸長サイクル(e)を含む、本発明1001~1004のいずれかの方法。
[本発明1006]
前記立体的に規定されたホスホロチオエートオリゴヌクレオチドがアンチセンスオリゴヌクレオチドである、本発明1001~1005のいずれかの方法。
[本発明1007]
前記芳香族複素環式溶媒が、20℃の水中で4~7または7~17のpKaを有する、本発明1001~1006のいずれかの方法。
[本発明1008]
前記芳香族複素環式溶媒が芳香族複素環式塩基である、本発明1001~1007のいずれかの方法。
[本発明1009]
前記芳香族複素環式溶媒が芳香族複素環式酸である、本発明1001~1007のいずれかの方法。
[本発明1010]
前記芳香族複素環式溶媒が、ピリジン、2-ピコリン、4-ピコリン、3-ピコリン、ルチジン、およびピロールからなる群より選択される、本発明1001~1007のいずれかの方法。
[本発明1011]
前記芳香族複素環式溶媒がピリジンである、本発明1001~1010のいずれかの方法。
[本発明1012]
アセトニトリル中の芳香族複素環式溶媒の濃度(v/v)が、約0.1%(v/v)~約50%(v/v)、例えば約0.5%~約25%である、本発明1001~1011のいずれかの方法。
[本発明1013]
アセトニトリル中の芳香族複素環式溶媒の濃度(v/v)が、約0.5%~約10%、例えば約1%~約5%、例えば約2~4%、例えば約2.5%、または約3.5%である、本発明1001~1011のいずれかの方法。
[本発明1014]
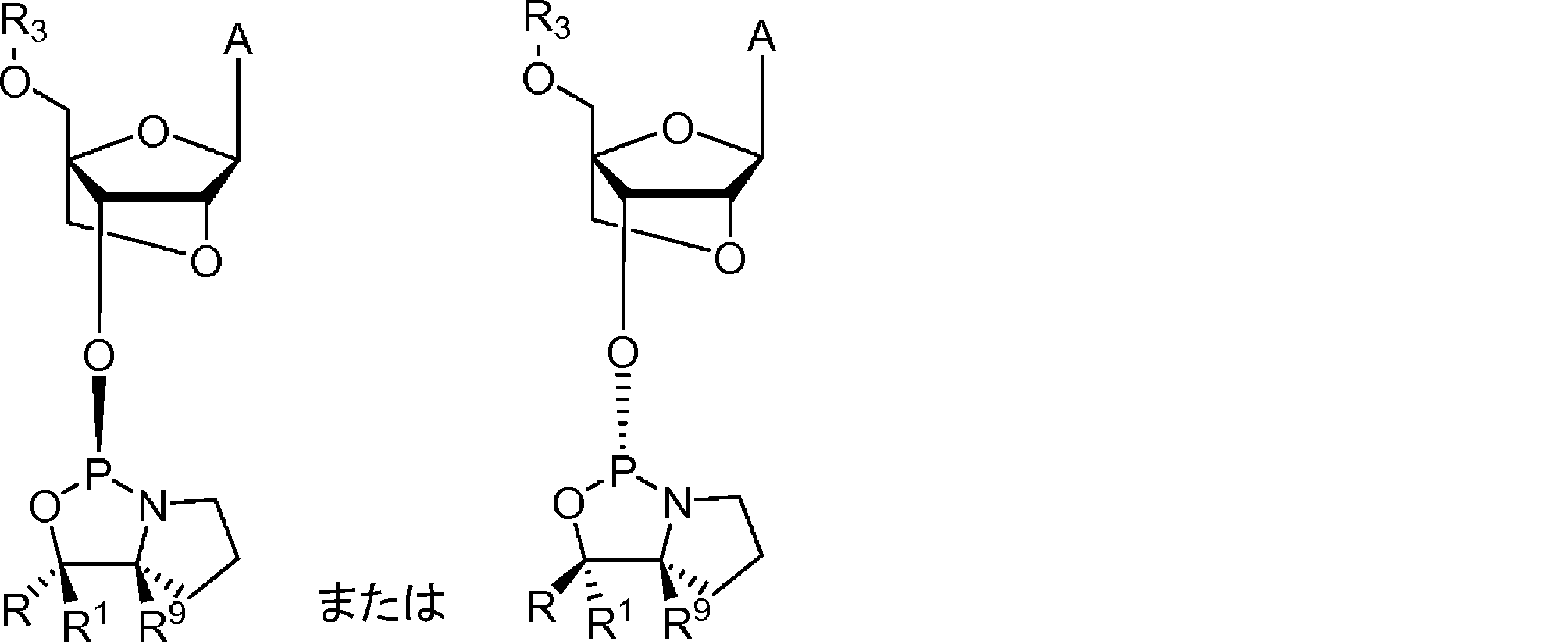
前記オキサザホスホリジンホスホラミダイトモノマーが、式1:
のものであり、
式中、
Zはヌクレオシドであり;
R 5 およびR 6 は独立して、水素、アルキル、シクロアルキル、アリール、ヘテロアリール、置換アルキル、置換シクロアルキル、置換アリール、および置換ヘテロアリールからなる群より選択されるか、または、R 5 およびR 6 は一緒になって式1のN原子と共に、3~16個の炭素原子を含む複素環を形成し;
R 9 は水素であり;
R 1 は、水素およびC 1~3 アルキルからなる群より選択され;かつ、
Rは、アリール、ヘテロアリール、置換アリール、置換ヘテロアリール、ニトロ、ハロゲン、シアノ、シリル、置換シリル、スルホン、置換スルホン(アリール置換スルホン)、フルオレン、および置換フッ素からなる群より選択され;
ここで、置換されている場合、Rは、C 1~4 アルキル基、C 6~14 アリール基 C 1~4 、アルコキシ基、C 7~14 アラルキル基、C 1~4 アルキル、C 6~14 アリール基、C 1~4 アルコキシ、C 6~14 アリール基、またはC 6~14 アリールC 1~4 アルキル基からなる群より選択される基で置換されていてもよく、複数の置換は依存的にまたは独立して、C 1~4 アルキル基、C 6~14 アリール基 C 1~4 、アルコキシ基、C 7~14 アラルキル基、C 1~4 アルキル、C 6~14 アリール基、C 1~4 アルコキシ、C 6~14 アリール基、またはC 6~14 アリールC 1~4 アルキル基からなる群より選択されてもよい、
本発明1001~1013のいずれかの方法。
[本発明1015]
前記オキサザホスホリジンホスホラミダイトモノマーがL-LNAグアニンモノマーであり、グアニン残基における環外窒素が、イソブチリルなどのアシル基で保護されている、本発明1001~1014のいずれかの方法。
本明細書において用いられる「アリール」なる用語は、環を形成する各原子が炭素原子である芳香環を意味する。アリール環は、5、6、7、8、9個、または9個を超える炭素原子によって形成される。アリール基は置換または無置換である。1つの局面において、アリールはフェニルまたはナフタレニルである。構造に応じて、アリール基はモノラジカルまたはジラジカル(すなわち、アリーレン基)であり得る。1つの局面において、アリールはC6~10アリールである。いくつかの態様において、アリールはフェニルである。置換されている場合、アリールは、C1~4アルキル基、C6~14アリール基 C1~4、アルコキシ基、C7~14アラルキル基、C1~4アルキル、C6~14アリ-ル基、C1~4アルコキシ、C6~14アリール基、またはC6~14アリールC1~4アルキル基からなる群より選択される基で置換されていてもよい。複数の置換は依存的にまたは独立して、C1~4アルキル基、C6~14アリール基 C1~4、アルコキシ基、C7~14アラルキル基、C1~4アルキル、C6~14アリール基、C1~4アルコキシ、C6~14アリール基、もしくはC6~14アリールC1~4アルキル基;またはヨウ化物、フッ化物、臭化物もしくは塩化物などのハロゲン化物からなる群より選択される基、例えばヨウ化物、フッ化物、臭化物もしくは塩化物などのハロゲン化物で置換されたフェニルからなる群より選択されてもよい。
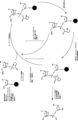
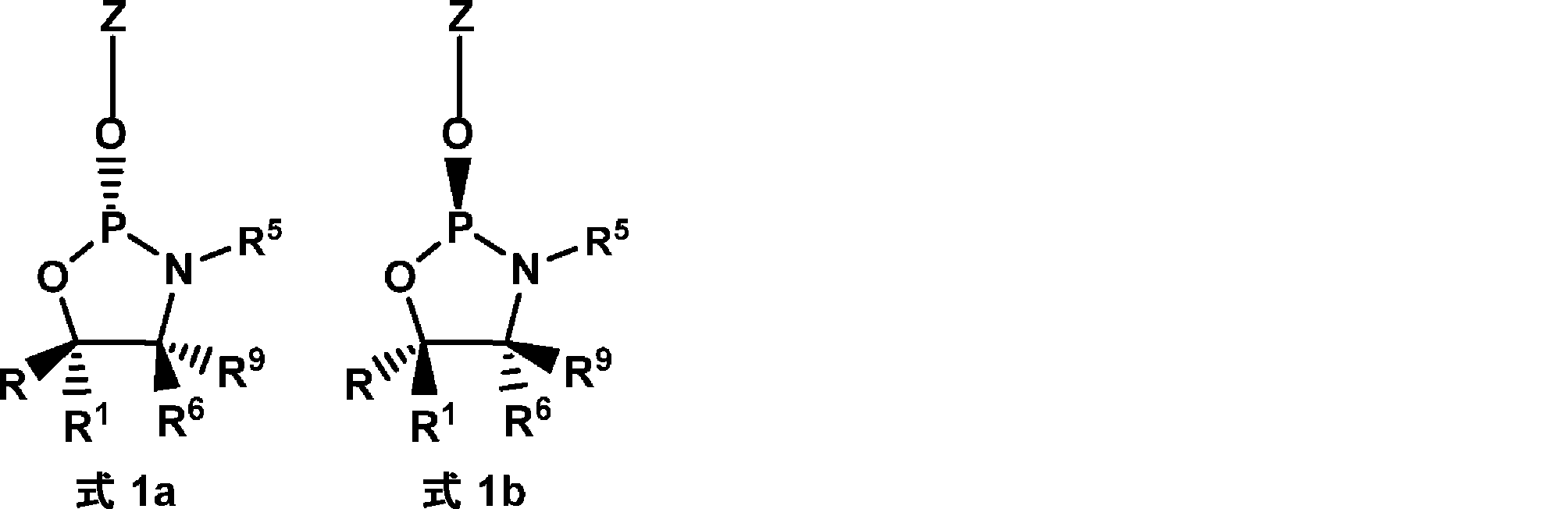
本発明の方法は、オキサザホスホリジンホスホラミダイトをヌクレオシドまたはヌクレオチドにカップリングする段階を含む。いくつかの態様において、オキサザホスホリジンホスホラミダイト(ヌクレオシドモノマーとも呼ばれる)は、式1:
のものであり、
式中、
Zはヌクレオシドであり;
R5およびR6は独立して、水素、アルキル、シクロアルキル、アリール、ヘテロアリール、置換アルキル、置換シクロアルキル、置換アリール、および置換ヘテロアリールからなる群より選択されるか、または、R5およびR6は一緒になって式1のN原子と共に、3~16個の炭素原子を含む複素環を形成し;
R9は水素であり;
R1は、水素およびC1~3アルキルからなる群より選択され;かつ、
Rは、アリール、ヘテロアリール、置換アリール、置換ヘテロアリール、ニトロ、ハロゲン、シアノ、シリル、置換シリル、スルホン、置換スルホン(アリール置換スルホン)、フルオレン、および置換フッ素からなる群より選択され;
ここで、置換されている場合、Rは、C1~4アルキル基、C6~14アリール基 C1~4、アルコキシ基、C7~14アラルキル基、C1~4アルキル、C6~14アリール基、C1~4アルコキシ、C6~14アリール基、またはC6~14アリールC1~4アルキル基からなる群より選択される基で置換されていてもよい。複数の置換は依存的にまたは独立して、C1~4アルキル基、C6~14アリール基 C1~4、アルコキシ基、C7~14アラルキル基、C1~4アルキル、C6~14アリール基、C1~4アルコキシ、C6~14アリール基、またはC6~14アリールC1~4アルキル基からなる群より選択されてもよい。
であり、ここで、G31、G32、およびG33は独立して、C1~4アルキル、C6~14アリールC1~4アルコキシ、C7~14アラルキル、C1~4アルキルC6~14アリール、C1~4アルコキシC6~14アリール、およびC6~14アリールC1~4アルキルからなる群より選択される。
EP17163506.3は、参照により本明細書に組み入れられ、オキサザホスホリジンキラル補助基上に直交性に保護されたアミン基を含むオキサザホスホリジンホスホラミダイトモノマーを提供する。いくつかの態様において、オキサザホスホリジンホスホラミダイトモノマーは直交性に保護されたオキサザホスホリジンホスホラミダイトモノマーである。
いくつかの態様において、モノマーは二環式オキサザホスホリジンホスホラミダイトモノマーであり、例えば、いくつかの態様において、R5およびR6は一緒になって複素環を形成する。いくつかの態様において、R5およびR6は一緒になって複素環(式1に示す環窒素と共に)を形成し、これは4個の炭素原子を含み、複素環中の原子の合計を5個とする(式1に示す4個の炭素および窒素)。例えば、本発明の化合物は、式2aまたは2b:
のものであってもよく、式中、R、R1、R9、およびZは式1のとおりである。
の化合物として表してもよく、
式中、
R、R1、R5、R6、およびR9は本発明の化合物のとおりであり;
Bは核酸塩基である。
R2は、ハロ、例えば-F、アミノ、アジド、-SH、-CN、-OCN、-CF3、-OCF3、-O(Rm)-アルキル、-S(Rm)-アルキル、-N(Rm)-アルキル、-O(Rm)-アルケニル、-S(Rm)-アルケニル、-N(Rm)-アルケニル;-O(Rm)-アルキニル、-S(Rm)-アルキニルまたは-N(Rm)-アルキニル;O-アルキレニル-O-アルキル、アルキニル、アルカリール、アラルキル、O-アルカリール、O-アラルキル、O(CH2)2SCH3、O-(CH2)2-O-N(Rm)(Rn)またはO-CH2C(=O)-N(Rm)(Rn)、-O-(CH2)2OCH3、および-O-CH3からなる群より選択され、ここで、各RmおよびRnは独立して、H、アミノ保護基、または置換もしくは無置換C1~10アルキルであり;
R4は、アルキル、シクロアルキル、シクロヘテロアルキル、O-アルキル、S-アルキル、NH-アルキル、および水素からなる群より選択され;いくつかの態様において、R4は水素である。いくつかの態様において、R4は水素であり、かつR2は、-O-CH3および-O-(CH2)2OCH3からなる群より選択される。
ここで、Raおよび存在する場合にはRbはそれぞれ独立して、水素、置換されていてもよいC1~6-アルキル、置換されていてもよいC2~6-アルケニル、置換されていてもよいC2~6-アルキニル、ヒドロキシ、置換されていてもよいC1~6-アルコキシ、C2~6-アルコキシアルキル、C2~6-アルケニルオキシ、カルボキシ、C1~6-アルコキシカルボニル、C1~6-アルキルカルボニル、ホルミル、アリール、アリールオキシ-カルボニル、アリールオキシ、アリールカルボニル、ヘテロアリール、ヘテロアリールオキシ-カルボニル、ヘテロアリールオキシ、ヘテロアリールカルボニル、アミノ、モノ(C1~6-アルキル)アミノおよびジ(C1~6-アルキル)アミノ、カルバモイル、モノ(C1~6-アルキル)-アミノ-カルボニルおよびジ(C1~6-アルキル)-アミノ-カルボニル、アミノ-C1~6-アルキル-アミノカルボニル、モノ(C1~6-アルキル)アミノ-C1~6-アルキル-アミノカルボニルおよびジ(C1~6-アルキル)アミノ-C1~6-アルキル-アミノカルボニル、C1~6-アルキル-カルボニルアミノ、カルバミド、C1~6-アルカノイルオキシ、スルホノ、C1~6-アルキルスルホニルオキシ、ニトロ、アジド、スルファニル、C1~6-アルキルチオ、ハロゲンより選択され、ここでアリールおよびヘテロアリールは置換されていてもよく、かつここで2つのジェミナルの置換基RaおよびRbは一緒になって、置換されていてもよいメチレン(=CH2)を示してもよく、ここですべてのキラル中心について、不斉基はRまたはS配向のいずれかで見い出されてもよい。
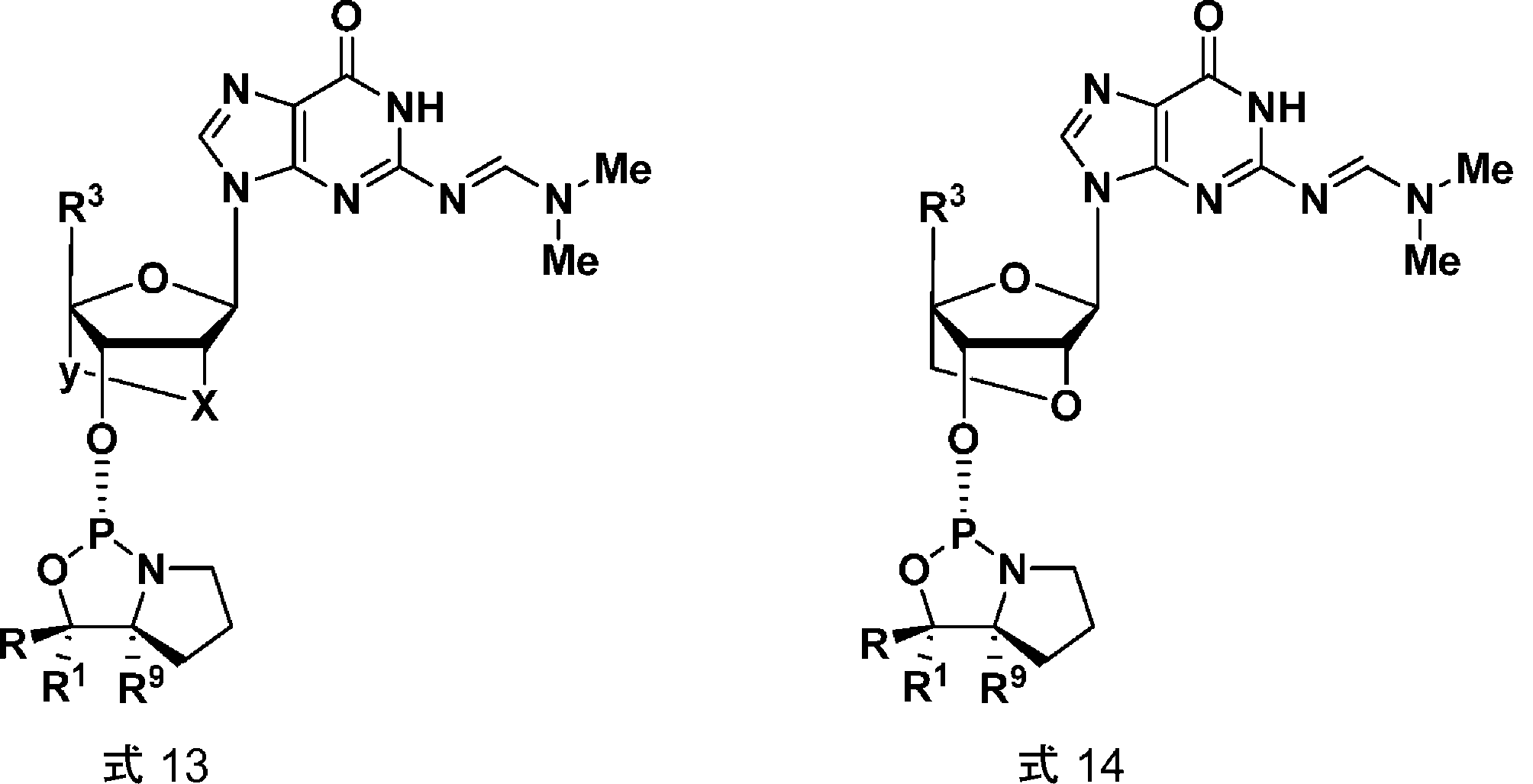
PCT/EP2017/060985に示されるとおり、DMF保護L-LNA-Gモノマーはアセトニトリル溶媒に難溶性である。L-LNAモノマーは、モノマーのキラル補助基の立体化学、またはモノマーがオリゴヌクレオチドに組み込まれた場合に形成するヌクレオシド間連結の立体化学のいずれかによって規定され得る(2つの特徴は構造的に連関し、LモノマーはSpホスホロチオエート連結の生成をもたらす)。L-LNAモノマーは式3aで表され、ここでR4およびR2形態において、R2およびR4は一緒になって二価の架橋を示す。例えば、式4a、5a、8a、および8bのモノマー参照。
のモノマーではなく、式中、R、R1、R3、R5、R6、およびR9は式1のモノマーのとおりであり、かつここで式11のモノマーについて、XおよびYは一緒になって、二価の架橋(例えば、本明細書のR2およびR4のとおり、例えば架橋-C(RaRb)-O-、-C(RaRb)C(RaRb)-O-、-CH2-O-、-CH2CH2-O-、-CH(CH3)-O-からなる群より選択される架橋を示す。いくつかの態様において、XおよびYは、二価の架橋-CH2-O-(メチレン-オキシ、オキシ-LNAとしても公知)または-CH(CH3)-O-(メチル-メチレン-オキシ)を示す。-CH(CH3)-O-架橋は、架橋内の炭素原子でキラル中心を導入し、いくつかの態様において、これはS位である(例えば、当技術分野において(S)cETとして公知のヌクレオシド-EP1984381参照))。いくつかの態様において、XおよびYは二価の架橋-CH2-O-を示し、ここで架橋はβ-D配置(β-D-オキシLNA)である。いくつかの態様において、XおよびYは二価の架橋-CH2-O-を示し、ここで架橋はα-L配置(α-L-D-オキシLNA)である。いくつかの態様において、XおよびYは二価の架橋-CH2-S-(チオLNA)、または-CH2-NH2-(アミノLNA)を示す。XおよびYが一緒になって二価の架橋を示す態様において、R3は、例えば、CH2-O-DMTrまたはCH2-O-MMTrであってもよい。
のモノマーではなく、式中、X、Y、R、R1、R9、およびR3は式11および12のとおりである。グアニン塩基の環外酸素は、例えば、シアノ基で任意で保護されてもよい。
のモノマーではなく、式中、X、Y、R1、およびR3は式11および12のとおりである。グアニン塩基の環外酸素は、例えば、シアノ基で任意で保護してもよい。式15または16のいくつかの態様において、R1は水素である。式15または16のいくつかの態様において、R3はCH2-O-DMTrまたはCH2-O-MMTrである。いくつかの態様において、本発明のオキサザホスホリジンホスホラミダイトモノマーはアシル保護ヌクレオシド(Z)を含む。
実施例に示すとおり、DMF保護L-LNA-Gモノマーはアセトニトリル溶媒に難溶性である。しかし、本発明者らは、L-LNA-Gモノマーのグアニンヌクレオシド上のアシル保護基の使用は、溶解性の問題を克服することを確認した。いくつかの態様において、オキサザホスホリジンホスホラミダイトモノマーは、イソブチリル保護グアニンなどの、アシル保護グアニン核酸塩基を含むL-LNAモノマーである。いくつかの態様において、オキサザホスホリジンホスホラミダイトモノマーは、式23、24、25、26、27、28、29、または30のL-LNA-Gモノマーである。
式中、R、R1、R2、R3、R4、R5、R9、およびR6は本発明の化合物のとおりであり、かつ-C(=O)-R7はグアニン塩基の環外窒素上のアシル保護基であり、かつR8は、存在する場合には、グアニン環外酸素上の保護基である。いくつかの態様において、R8はシアノエチルである。いくつかの態様において、Rはフェニルであり、R1は水素またはメチルであり、かつR3は任意でCH2-O-DMTrまたはCH2-O-MMTrである。いくつかの態様において、R7はイソブチリルである。式31および32において、YおよびXは式11のとおりである。
いくつかの態様において、本発明の方法のカップリング段階(b)は、オキサザホスホリジンホスホラミダイトモノマーとアセトニトリルと芳香族複素環式溶媒とを含むアセトニトリル溶液を用いる。
活性化剤は、固体支持体またはオリゴヌクレオチド鎖に結合した5'末端基にモノマーをカップリングさせるためにホスホラミダイトモノマーを活性化する、オリゴヌクレオチド合成のカップリング段階の前または最中に用いる試薬である。
本発明は、オリゴヌクレオチドの合成のための方法を提供し、該方法は、オキサザホスホリジンホスホラミダイトモノマーを固体支持体、ヌクレオシド、またはオリゴヌクレオチドの5'末端にカップリングして、亜リン酸トリエステル中間体を形成する段階(C)と、その後に続く亜リン酸トリエステル中間体を硫化試薬で酸化する段階(O)を含み、これら2つの段階を少なくとも1回繰り返した(すなわちCOCO・・・)後にさらなるホスホラミダイトモノマーを付加し、任意でそれぞれのカップリング段階とおよび酸化段階との間に洗浄段階が存在(すなわちCOWCOW・・・)する。
(a)固体支持体に結合されたヌクレオシドまたはオリゴヌクレオチドの保護された5'-ヒドロキシ末端を脱保護する段階、
(b)オキサザホスホリジンホスホラミダイトモノマーをヌクレオシドまたはオリゴヌクレオチドの脱保護された5'-ヒドロキシ末端にカップリングして、亜リン酸トリエステル中間体を形成する段階、
(c)亜リン酸トリエステル中間体を硫化試薬で酸化する段階と、その後に続く任意の洗浄段階、
(d)同じ伸長サイクル内で段階(b)および(c)を繰り返す段階、
(e)任意で、1回または複数回のさらなる伸長サイクルについて段階(a)~(d)を繰り返す段階、
(f)オリゴヌクレオチドを脱保護して固体支持体から切断する段階
を含む、立体的に規定されたホスホロチオエートオリゴヌクレオチドの合成のための方法を提供する。
(a)固体支持体に結合されたヌクレオシドまたはオリゴヌクレオチドの保護された5'-ヒドロキシ末端を脱保護する段階、
(b)オキサザホスホリジンホスホラミダイトモノマーをヌクレオシドまたはオリゴヌクレオチドの脱保護された5'-ヒドロキシ末端にカップリングして、亜リン酸トリエステル中間体を形成する段階、および
(c)亜リン酸トリエステル中間体を硫化試薬で酸化する段階、
(d)同じ伸長サイクル内で段階(b)および(c)を繰り返す段階、
(e)任意で、1回または複数回のさらなる伸長サイクルについて段階(a)~(d)を繰り返す段階、
(f)オリゴヌクレオチドを脱保護して固体支持体から切断する段階
を含む、立体的に規定されたホスホロチオエートオリゴヌクレオチドの合成のための方法を提供する。
いくつかの態様において、カップリング段階および酸化段階の繰り返し、例えば段階(d)の後に、キャッピング段階を実施する。カップリング反応の完了後、低いパーセンテージの(例えば、固体支持体結合)5'-OH基(0.1~1%)が未反応のままであり得、これらをさらなる鎖伸長から永久にブロックして、一般に(n-1)ショートマーと呼ばれる内部塩基を欠失したオリゴヌクレオチド形成を防止することができる。キャッピングは典型的には未反応5'-OH基のアセチル化を含む。したがって、キャッピングは次の伸長サイクルの前に任意の未反応5'-OH基をブロックすることになる。いくつかの態様において、キャッピングは、無水酢酸またはフェノキシ酢酸無水物などの酸無水物を用いて実施する。キャッピング段階は、いくつかの場合には、キラル補助基からの二級アミンをキャッピングするために用いることもできる。
カップリング段階(b)は、オキサザホスホリジンホスホラミダイトモノマーをヌクレオシドまたはオリゴヌクレオチドの脱保護された5'-ヒドロキシ末端にカップリングして、亜リン酸トリエステル中間体を形成する段階を含む。酸化前は、亜リン酸トリエステル中間体は不安定であり、したがってオリゴヌクレオチド生成物の収率および純度を著しく制限し得る有害なレベルの副生成物を回避するために、カップリング段階の時間を最適化すべきである。副生成物は切断されたオリゴヌクレオチドの生成を引き起こすようである。本発明の方法に従い、1回の伸長サイクル内でカップリング段階および酸化段階の繰り返しを実施することにより、この問題を低減または回避してもよい。カップリング段階および酸化段階の繰り返しの使用は、酸化により、亜リン酸トリエステル中間体の迅速な安定化をもたらす。したがって、それぞれ個々のカップリング段階の期間を短縮してもよい。本発明は、したがって、オリゴヌクレオチド生成物の収率および/または純度の増大を提供する、オリゴヌクレオチド合成の改善された方法を提供する。各カップリング段階の最適な期間は、当業者であれば、切断されたオリゴヌクレオチド生成物のレベルを測定することにより、容易に最適化することができる。次いで、当業者は、各伸長サイクル内でのカップリング/酸化段階の繰り返しの回数を増やし、改善された収率および/または純度を得ることができる。例として、小規模オリゴヌクレオチド合成(約1μMスケール)のために、2~4分、例えば約3分のカップリング時間が適切であり得る。より大規模の合成のために、より長いカップリング時間、例えば、20μM合成のために約5分を用いてもよい。
のものであり、
式中、
Zはヌクレオシドであり;
R5およびR6は独立して、水素、アルキル、シクロアルキル、アリール、ヘテロアリール、置換アルキル、置換シクロアルキル、置換アリール、および置換ヘテロアリールからなる群より選択されるか、または、R5およびR6は一緒になって式1のN原子と共に3~16個の炭素原子を含む複素環を形成し;
R9は水素であり;
R1は、水素およびC1~3アルキルからなる群より選択され;かつ、
Rは、アリール、ヘテロアリール、置換アリール、置換ヘテロアリール、ニトロ、ハロゲン、シアノ、シリル、置換シリル、スルホン、置換スルホン(アリール置換スルホン)、フルオレン、および置換フッ素からなる群より選択され;
ここで、置換されている場合、Rは、C1~4アルキル基、C6~14アリール基 C1~4、アルコキシ基、C7~14アラルキル基、C1~4アルキル、C6~14アリール基、C1~4アルコキシ、C6~14アリール基、またはC6~14アリールC1~4アルキル基からなる群より選択される基で置換されていてもよい。複数の置換は依存的にまたは独立して、C1~4アルキル基、C6~14アリール基 C1~4、アルコキシ基、C7~14アラルキル基、C1~4アルキル、C6~14アリール基、C1~4アルコキシ、C6~14アリール基、またはC6~14アリールC1~4アルキル基からなる群より選択されてもよい。
(a)遊離5'-OH基を有する固体支持体を提供する段階、
(b)オキサザホスホリジンホスホラミダイトモノマーを活性化する段階、
(c)活性化したオキサザホスホリジンホスホラミダイトモノマーを遊離5'-OHにカップリングして、ホスホトリエステル中間体を形成する段階、
(d)ホスホトリエステル中間体をキサンタンヒドリドなどの硫化試薬で酸化する段階、
(e)例えば無水酢酸を用いて、任意の遊離-OH基をキャッピングする段階、
(f)任意で、段階(b)~(e)を繰り返す段階、
(g)任意の残存保護基を脱保護(包括的脱保護)して、例えば、60℃での水酸化アンモニウム処理により、固体支持体からオリゴヌクレオチドを切断する段階
を含んでもよく、
固体支持体の遊離-OH基は任意で、該固体支持体に結合されたヌクレオシドまたはオリゴヌクレオチド鎖に結合されていてもよく;かつ、段階(c)および(d)を段階(e)の前に少なくとも1回繰り返し、任意で、段階(d)の酸化の後でかつ段階(e)の前に洗浄段階を実施する。いくつかの態様において、段階(c)および段階(d)(CO)ならびに存在する場合には任意の洗浄段階(COW)を段階(e)の前に1回、2回、3回、4回、5回、もしくは6回、またはそれ以上繰り返す。
典型的には、オリゴヌクレオチドホスホロチオエートをRpおよびSpホスホロチオエート連結の無作為混合物(ジアステレオマー混合物とも呼ばれる)として合成する。オリゴヌクレオチドのホスホロチオエート連結の少なくとも1つが立体的に規定されている、すなわち、オリゴヌクレオチド試料中に存在するオリゴヌクレオチド分子の少なくとも75%、例えば少なくとも80%、または少なくとも85%、または少なくとも90%または少なくとも95%、または少なくとも97%、例えば少なくとも98%、例えば少なくとも99%、または(本質的に)すべてにおいてRpまたはSpのいずれかである、ホスホロチオエートオリゴヌクレオチドが本発明の方法において提供される。立体的に規定されたオリゴヌクレオチドは、立体的に規定されている少なくとも1つのホスホロチオエート連結を含む。立体的に規定されたなる用語は、1つもしくは複数のホスホロチオエートヌクレオシド間連結のRpもしくはSpのいずれかとして規定されたキラリティを記載するために用いてもよいか、またはそのような(またはより多くの)ホスホロチオエートヌクレオシド間連結を含むオリゴヌクレオチドを記載するために用いてもよい。立体的に規定されたオリゴヌクレオチドは、任意の1つの位置に少量の代わりの立体異性体を含み得ることが理解され、例えば、WanらはNAR, November 2014において報告したギャップマーに対する98%立体選択性を報告している。
LNAオリゴヌクレオチドは、少なくとも1つのLNAヌクレオシドを含むオリゴヌクレオチドである。LNAオリゴヌクレオチドはアンチセンスオリゴヌクレオチドであってもよい。
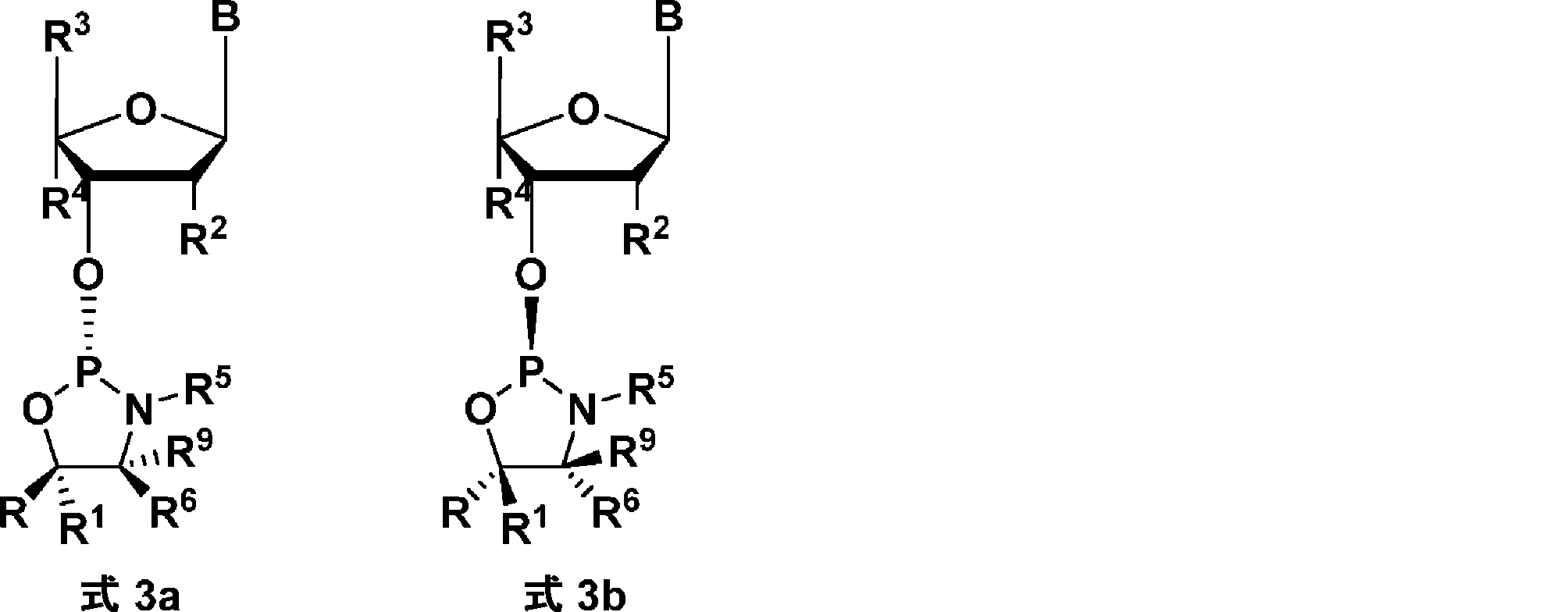
LNAヌクレオシドは、ヌクレオチドのリボース糖環のC2'とC4'との間にリンカー基(ビラジクルまたは架橋と呼ぶ)を含む修飾ヌクレオシド(すなわち、R2およびR4が一緒になって二価の架橋を示す態様)である。
のものであり得、式中、Bは核酸塩基を示し;R、R1、R6、R3、R9、R5は式1のとおりである。
または、-X-Y-は一緒になって、二価のリンカー基(ラディクルとも呼ばれる)を示し、一緒になって、-C(RaRb)-、-C(Ra)=C(Rb)-、-C(Ra)=N-、-O-、-Si(Ra)2-、-S-、-SO2-、-N(Ra)-、および>C=Zからなる群より選択される1、2、または3つの基/原子からなる二価のリンカー基を示す。
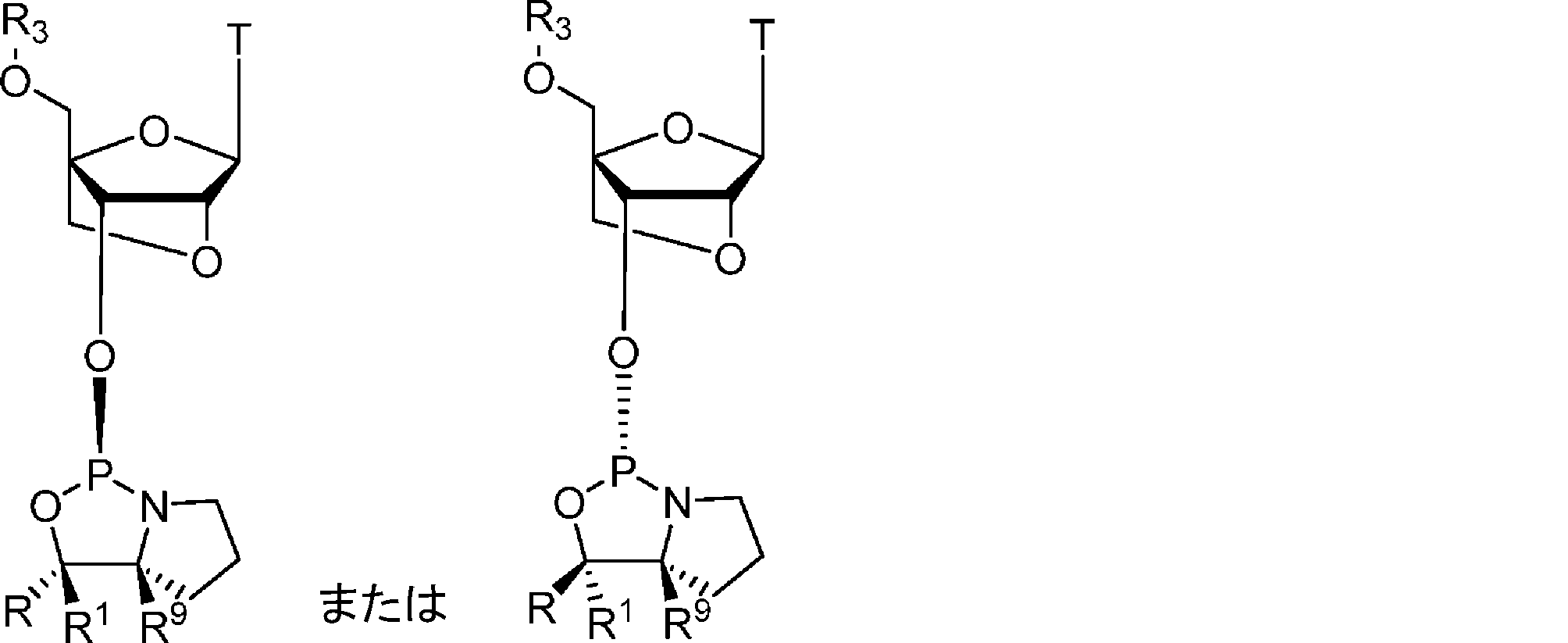
いくつかの態様において、オキサザホスホリジンホスホラミダイトモノマーは、DNAヌクレオシドであるかまたはそれを含み、例えば、モノマーは、式19または式20:
のものであり得、式中、Bは核酸塩基を示し;R、R1、R6、R3、R9、R5は式1のとおりである。式20のいくつかの態様において、Bはアデニン、例えば保護アデニン、例えばBz保護アデニンである。
のとおりであり、式中、Bは核酸塩基を示し;R、R1、R3、R9は式1のとおりである。式20または22のいくつかの態様において、Bはアデニン、例えば保護アデニン、例えばBz保護アデニンである。式19、20、21、または22のモノマーのいくつかの態様において、Rはフェニルであり、かつR1は水素またはメチルのいずれかである。式19、20、21、または22のモノマーのいくつかの態様において、R3はCH2-O-DMTrまたはCH2-O-MMTrである。
いくつかの態様において、オリゴヌクレオチドはDNAホスホロチオエートオリゴヌクレオチドである。DNAホスホロチオエートオリゴヌクレオチドはDNAヌクレオシドだけを含み、かついくつかの態様において、立体的に規定されたホスホロチオエートヌクレオシド間連結だけを含み得る。DNAホスホロチオエートは、例えば、18~25ヌクレオチド長であってもよい。
本明細書において用いられるギャップマーなる用語はアンチセンスオリゴヌクレオチドを意味し、該アンチセンスオリゴヌクレオチドは、1つまたは複数の親和性増大修飾ヌクレオシド(隣接部)が5'および3'で隣接しているRNase H動員オリゴヌクレオチドの領域(ギャップ)を含む。様々なギャップマーデザインを本明細書において記載する。ヘッドマーおよびテイルマーは、隣接部の1つが欠けている、すなわちオリゴヌクレオチドの末端の一方のみが親和性増大修飾ヌクレオシドを含む、RNase Hを動員することができるオリゴヌクレオチドである。ヘッドマーについては、3'隣接部が欠けており(すなわち、5'隣接部が親和性増大修飾ヌクレオシドを含む)、テイルマーについては、5'隣接部が欠けている(すなわち、3'隣接部が親和性増大修飾ヌクレオシドを含む)。いくつかの態様において、立体的に規定されたホスホロチオエートオリゴヌクレオチドは、LNAギャップマーオリゴヌクレオチドなどのギャップマーオリゴヌクレオチドである。
LNAギャップマーなる用語は、親和性増大修飾ヌクレオシドの少なくとも1つがLNAヌクレオシドである、ギャップマーオリゴヌクレオチドである。
混合ウイングギャップマーなる用語は、隣接領域が少なくとも1つのLNAヌクレオシドと、少なくとも1つの非LNA修飾ヌクレオシド、例えば少なくとも1つの2'置換修飾ヌクレオシド、例えば2'-O-アルキル-RNA、2'-O-メチル-RNA、2'-アルコキシ-RNA、2'-O-メトキシエチル-RNA(MOE)、2'-アミノ-DNA、2'-フルオロ-DNA、アラビノ核酸(ANA)、2'-フルオロ-ANAおよび2'-F-ANAヌクレオシドとを含む、LNAギャップマーを意味する。いくつかの態様において、混合ウイングギャップマーは、LNAヌクレオシド(例えば5'または3')を含む一方の隣接部を有し、他方の隣接部(それぞれ3'または5')は2'置換修飾ヌクレオシドを含む。
本明細書において言及するヌクレオチド分子の長さに言及する場合、それらのモノマー単位がヌクレオチドまたはヌクレオチド類似体のいずれであるかに関わらず、長さはモノマー単位、すなわちヌクレオチドの数に対応する。ヌクレオチドに関して、モノマーおよび単位なる用語は、本明細書において交換可能に用いられる。
本発明の方法を用いて合成したオリゴヌクレオチドは、混合配列オリゴヌクレオチドであってもよい。本発明は、混合配列オリゴヌクレオチドの製造の合成のための方法を提供する。混合配列オリゴヌクレオチドは少なくとも2つ、例えば、少なくとも4つの異なる塩基部分(例えば、A、T、C、またはGからなる群より選択され、ここでCは任意で5-メチル-シトシンである)の少なくとも3つを含む。アンチセンスオリゴヌクレオチドは典型的には混合配列オリゴヌクレオチドである。
本発明は以下を提供する。
1. (a)固体支持体に結合されたヌクレオシドまたはオリゴヌクレオチドの保護された5'-ヒドロキシ末端を脱保護する段階、
(b)オキサザホスホリジンホスホラミダイトモノマーをヌクレオシドまたはオリゴヌクレオチドの脱保護された該5'-ヒドロキシ末端にカップリングして、亜リン酸トリエステル中間体を形成する段階(C)であって、任意で、カップリング反応が、アセトニトリルと芳香族複素環式溶媒とを含むアセトニトリル溶媒組成物中で行われる、段階(C)、および
(c)亜リン酸トリエステル中間体を硫化試薬で酸化する段階(O)、
(d)任意で、1回または複数回のさらなる伸長サイクルについて段階(a)~(c)を繰り返す段階、
(e)該オリゴヌクレオチドを脱保護して該固体支持体から切断する段階
を含み、段階(b)および(c)を各伸長サイクルにおいて少なくとも1回繰り返す、
立体的に規定されたホスホロチオエートオリゴヌクレオチドの合成のための方法。
2. 複数回のさらなる伸長サイクル(d)を含む、態様2の方法。
3. 前記立体的に規定されたホスホロチオエートオリゴヌクレオチドがアンチセンスオリゴヌクレオチドである、態様3の方法。
4. 段階(b)および(c)の後に洗浄段階(W)を実施する(すなわち、同じ伸長サイクルにおいて段階COWCOWを含む)、態様1~3のいずれかの方法。
5. 前記芳香族複素環式溶媒が、20℃の水中で4~7または7~17のpKaを有する、態様1~3のいずれかの方法。
6. 前記芳香族複素環式溶媒が芳香族複素環式塩基である、態様1~5のいずれかの方法。
7. 前記芳香族複素環式溶媒が芳香族複素環式酸である、態様1~5のいずれかの方法。
8. 前記芳香族複素環式溶媒が、ピリジン、2-ピコリン、4-ピコリン、3-ピコリン、ルチジン、およびピロールからなる群より選択される、態様1~5のいずれかの方法。
9. 前記芳香族複素環式溶媒がピリジンである、態様1~8のいずれかの方法。
10. アセトニトリル中の芳香族複素環式溶媒の濃度(v/v)が、約0.1%(v/v)~約50%(v/v)、例えば約0.5%~約25%である、態様1~9のいずれかの方法。
11. アセトニトリル中の芳香族複素環式溶媒の濃度(v/v)が、約0.5%~約10%、例えば約1%~約5%、例えば約2~4%、例えば約2.5%、または約3.5%である、態様1~9のいずれかの方法。
12. アセトニトリル溶媒組成物が活性化剤をさらに含む、態様1~11のいずれかの方法。
13. 前記活性化剤が、CMPT(N-(シアノメチル)ピロリジニウムトリフレート(CMPT)、N-(フェニル)イミダゾリウムトリフレート(PhIMT)、ベンズイミダゾリウムトリフレート(BIT)、4,5-ジシアノイミダゾール(DCI)、テトラゾール、および5-(ベンジルチオ)-1H-テトラゾールからなる群より選択される、態様12の方法。
14. 前記活性化剤が4,5-ジシアノイミダゾール(DCI)である、態様13の方法。
15. 前記溶媒組成物が、約0.5~約2M DCI(または態様13の他の活性化剤)、例えば約1M DCI(または態様13の他の活性化剤)を含む、態様1~14のいずれかの方法。
16. 前記溶媒組成物が、N-メチルイミダゾール、例えば、0.01~約1M N-メチルイミダゾールの濃度、例えば約0.1M N-メチルイミダゾールの濃度のN-メチルイミダゾールをさらに含む、態様12~15のいずれかの方法。
17. 前記オキサザホスホリジンホスホラミダイトモノマーが、式I:
の化合物であり、
式中、Zはヌクレオシドであり;
R5およびR6は独立して、水素、アルキル、シクロアルキル、アリール、ヘテロアリール、置換アルキル、置換シクロアルキル、置換アリール、および置換ヘテロアリールからなる群より選択されるか、または、R5およびR6は一緒になって式1のN原子と共に、3~16個の炭素原子を含む複素環を形成し;
R9は水素であり;
R1は、水素およびC1~3アルキルからなる群より選択され;かつ、
Rは、アリール、ヘテロアリール、置換アリール、置換ヘテロアリール、ニトロ、ハロゲン、シアノ、シリル、置換シリル、スルホン、置換スルホン(アリール置換スルホン)、フルオレン、および置換フッ素からなる群より選択され;
ここで、置換されている場合、Rは、C1~4アルキル基、C6~14アリール基 C1~4、アルコキシ基、C7~14アラルキル基、C1~4アルキル、C6~14アリール基、C1~4アルコキシ、C6~14アリール基、またはC6~14アリールC1~4アルキル基からなる群より選択される基で置換されていてもよい。複数の置換は依存的にまたは独立して、C1~4アルキル基、C6~14アリール基 C1~4、アルコキシ基、C7~14アラルキル基、C1~4アルキル、C6~14アリール基、C1~4アルコキシ、C6~14アリール基、またはC6~14アリールC1~4アルキル基からなる群より選択されてもよい、
態様1~16のいずれかの方法。
18. 前記オキサザホスホリジンホスホラミダイトモノマーが、
の化合物であり、Z、R、R1、R6、R9、およびR5がすべて態様17のとおりである、態様1~17のいずれかの方法。
19. Rが、アリール、ヘテロアリール、置換アリール、および置換ヘテロアリールからなる群より選択される、態様17または18の方法。
20. Rが、フェニルなどのアリールである、態様17~19のいずれかの方法。
21. R1が水素である、態様17~20のいずれかの方法。
22. R1が、メチルなどのC1~3アルキルである、態様17~21のいずれかの方法。
23. R5およびR6が一緒になって式(I)、(Ia)、または(1b)のN原子と共に、3~16個(例えば4個)の炭素原子を含む複素環を形成する、態様17~22のいずれかの方法。
24. R5およびR6が一緒になって式(I)、(Ia)、または(1b)のN原子と共に、4個の炭素原子を含む複素環を形成する、態様17~22のいずれかの方法。
25. ホスホラミダイトモノマー化合物が、式2aまたは2b:
のものであり、Z、R、およびR1が態様17~24のいずれかのとおりである、態様1~24のいずれかの方法。
26. オキサザホスホリジンホスホラミダイトモノマー化合物が、式3aまたは3b:
のものであり、
式中、
R、R1、R5、R6、およびR9は態様2~18のいずれかのとおりであり;
Bは核酸塩基であり;
R3は、CH2ODMTr、CH2-アルキル-O-DMTr、CH-Me-O-DMTr、CH2OMMTr、CH2-アルキル-O-MMTr、CH(Me)-O-MMTr、CH-Ra-O-DMTrRb、およびCH-Ra-O-MMTrRbからなる群より選択され;
R2は、ハロ、例えば-F、アミノ、アジド、-SH、-CN、-OCN、-CF3、-OCF3、-O(Rm)-アルキル、-S(Rm)-アルキル、-N(Rm)-アルキル、-O(Rm)-アルケニル、-S(Rm)-アルケニル、-N(Rm)-アルケニル;-O(Rm)-アルキニル、-S(Rm)-アルキニル、または-N(Rm)-アルキニル;O-アルキレニル-O-アルキル、アルキニル、アルカリール、アラルキル、O-アルカリール、O-アラルキル、O(CH2)2SCH3、O-(CH2)2-O-N(Rm)(Rn)またはO-CH2C(=O)-N(Rm)(Rn)、-O-(CH2)2OCH3、および-O-CH3からなる群より選択され、ここで各RmおよびRnは独立して、H、アミノ保護基または置換もしくは無置換C1~10アルキルであり;
R4は、アルキル、シクロアルキル、シクロヘテロアルキル、O-アルキル、S-アルキル、NH-アルキル、および水素からなる群より選択されるか;
または、R2およびR4は一緒になって、-C(RaRb)-、-C(Ra)=C(Rb)、-C(Ra)=N、O、-Si(Ra)2-、S-、-SO2-、-N(Ra)-、および>C=Zからなる群より選択される、1、2、3つの基/原子からなる二価の架橋を示し;
ここで、Raおよび存在する場合にはRbはそれぞれ独立して、水素、置換されていてもよいC1~6-アルキル、置換されていてもよいC2~6-アルケニル、置換されていてもよいC2~6-アルキニル、ヒドロキシ、置換されていてもよいC1~6-アルコキシ、C2~6-アルコキシアルキル、C2~6-アルケニルオキシ、カルボキシ、C1~6-アルコキシカルボニル、C1~6-アルキルカルボニル、ホルミル、アリール、アリールオキシ-カルボニル、アリールオキシ、アリールカルボニル、ヘテロアリール、ヘテロアリールオキシ-カルボニル、ヘテロアリールオキシ、ヘテロアリールカルボニル、アミノ、モノ(C1~6-アルキル)アミノおよびジ(C1~6-アルキル)アミノ、カルバモイル、モノ(C1~6-アルキル)-アミノ-カルボニルおよびジ(C1~6-アルキル)-アミノ-カルボニル、アミノ-C1~6-アルキル-アミノカルボニル、モノ(C1~6-アルキル)アミノ-C1~6-アルキル-アミノカルボニルおよびジ(C1~6-アルキル)アミノ-C1~6-アルキル-アミノカルボニル、C1~6-アルキル-カルボニルアミノ、カルバミド、C1~6-アルカノイルオキシ、スルホノ、C1~6-アルキルスルホニルオキシ、ニトロ、アジド、スルファニル、C1~6-アルキルチオ、ハロゲンより選択され、ここでアリールおよびヘテロアリールは置換されていてもよく、かつここで2つのジェミナルの置換基RaおよびRbは一緒になって、置換されていてもよいメチレン(=CH2)を示してもよく、ここですべてのキラル中心について、不斉基はRまたはS配向のいずれかで見い出されてもよい、
態様1~25のいずれかの方法。
27. 前記オキサザホスホリジンホスホラミダイトモノマーが、式4a、4b、5a、5b、6a、6b、7a、および7b:
からなる群より選択され、R、R1、R3、R9、R5、R6、およびBが態様26のとおりである、態様1~26のいずれかの方法。
28. 前記オキサザホスホリジンホスホラミダイトモノマーが、アデニン、グアニン、ウラシル、チミン、およびシトシン、イソシトシン、プソイドイソシトシン、5-メチルシトシン、5-チオゾロシトシン、5-プロピニルシトシン、5-プロピニルウラシル、5-ブロモウラシル、5-チオゾロウラシル、2-チオウラシル、2'チオチミン、イノシン、ジアミノプリン、6-アミノプリン、2-アミノプリン、2,6-ジアミノプリン、ならびに2-クロロ-6-アミノプリンからなる群より選択される核酸塩基などのプリンまたはピリミジンである核酸塩基部分を含む、態様1~27のいずれかの方法。
29. 前記オキサザホスホリジンホスホラミダイトモノマーが、M1~M40からなる群より選択される、態様1~28のいずれかの方法。
30. 前記オキサザホスホリジンホスホラミダイトモノマーの塩基部分(B)がアデニン塩基を含む、態様1~29のいずれかの方法。
31. 前記オキサザホスホリジンホスホラミダイトモノマーの塩基部分(B)がチミン塩基を含む、態様1~30のいずれかの方法。
32. 前記オキサザホスホリジンホスホラミダイトモノマーの塩基部分(B)がグアニン塩基を含む、態様1~30のいずれかの方法。
33. 前記オキサザホスホリジンホスホラミダイトモノマーの塩基部分(B)がシトシン塩基を含む、態様1~30のいずれかの方法。
34. 前記オキサザホスホリジンホスホラミダイトモノマーがLモノマーである、態様1~33のいずれかの方法。
35. 前記オキサザホスホリジンホスホラミダイトモノマーがDモノマーである、態様1~33のいずれかの方法。
36. 前記オキサザホスホリジンホスホラミダイトモノマーが、β-D-オキシLNAモノマーなどのLNAモノマーである、態様1~35のいずれかの方法。
37. 前記オキサザホスホリジンホスホラミダイトモノマーがDNAモノマーである、態様1~36のいずれかの方法。
38. 前記オキサザホスホリジンホスホラミダイトモノマーが、式8aまたは式8b:
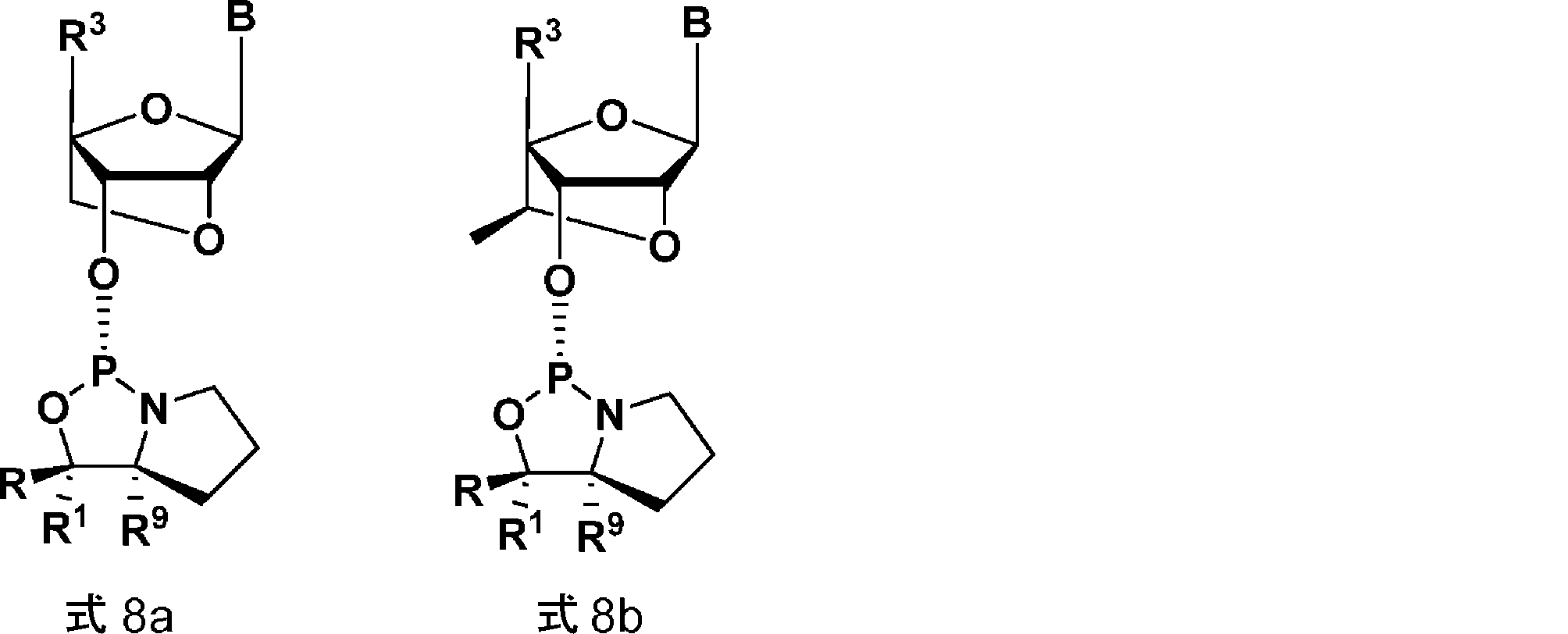
からなる群より選択され、Bがチミンであり、かつR、R1、R3、およびR9が態様17~24のいずれかのとおりである、態様1~28のいずれかの方法。
39. 前記オキサザホスホリジンホスホラミダイトモノマーが、式8aまたは式8b:
からなる群より選択され、Bがアデニンであり、かつR、R1、R3、およびR9が態様17~24のいずれかのとおりであり、アデニンが任意で、例えばベンゾイルで保護されていてもよい、態様1~28のいずれかの方法。
40. 前記オキサザホスホリジンホスホラミダイトモノマーが、式:
のオキサザホスホリジンホスホラミダイトモノマーなどのD-DNA-AまたはL-DNA-Aモノマーからなる群より選択され、Aがアデニンであり、かつR、R1、R3、およびR9が態様1~24のいずれかのとおりであり、塩基アデニンが、例えばベンゾイルで保護されていてもよい、態様1~28のいずれかの方法。
41. 前記オキサザホスホリジンホスホラミダイトモノマーが、式:
のオキサザホスホリジンホスホラミダイトモノマーなどのD-DNA-TまたはL-DNA-Tモノマーからなる群より選択され、Tがチミンであり、かつR、R1、R3、およびR9が態様1~24のいずれかのとおりである、態様1~28のいずれかの方法。
42. 前記オキサザホスホリジンホスホラミダイトモノマーが、式:
のオキサザホスホリジンホスホラミダイトモノマーなどのD-DNA-CまたはL-DNA-Cモノマーからなる群より選択され、Cがシトシンであり、かつR、R1、R3、およびR9が態様1~24のいずれかのとおりであり、かつ塩基シトシンが、例えばアセチルまたはベンゾイルで保護されていてもよく、かつ任意でシトシンが5-メチルシトシンである、態様1~28のいずれかの方法。
43. 前記オキサザホスホリジンホスホラミダイトモノマーが、式:
のオキサザホスホリジンホスホラミダイトモノマーなどのD-DNA-GまたはL-DNA-Gモノマーからなる群より選択され、Gがグアニンであり、かつR、R1、R3、およびR9が態様1~24のいずれかのとおりであり、かつ塩基グアニンが、例えばDMFでまたはiBuなどのアシルで保護されていてもよい、態様1~28のいずれかの方法。
44. 前記オキサザホスホリジンホスホラミダイトモノマーが、式:
のオキサザホスホリジンホスホラミダイトモノマーなどのD-LNA-AまたはL-LNA-Aモノマーからなる群より選択され、Aがアデニンであり、かつR、R1、R3、およびR9が態様1~24のいずれかのとおりであり、塩基アデニンが、例えばベンゾイルで保護されていてもよい、態様1~28のいずれかの方法。
45. 前記オキサザホスホリジンホスホラミダイトモノマーが、式:
のオキサザホスホリジンホスホラミダイトモノマーなどのD-LNA-TまたはL-LNA-Tモノマーからなる群より選択され、Tがチミンであり、かつR、R1、R3、およびR9が態様1~24のいずれかのとおりである、態様1~28のいずれかの方法。
46. 前記オキサザホスホリジンホスホラミダイトモノマーが、式:
のオキサザホスホリジンホスホラミダイトモノマーなどのD-LNA-CまたはL-LNA-Cモノマーからなる群より選択され、Cがシトシンであり、かつR、R1、R3、およびR9が態様1~24のいずれかのとおりであり、かつ塩基シトシンが、例えばベンゾイルまたはアセチルで保護されていてもよく、かつ任意でシトシンが5-メチルシトシンである、態様1~28のいずれかの方法。
47. 前記オキサザホスホリジンホスホラミダイトモノマーが、式:
のオキサザホスホリジンホスホラミダイトモノマーなどのD-LNA-GまたはL-LNA-Gモノマーからなる群より選択され、Gがグアニンであり、かつR、R1、R3、およびR9が態様1~24のいずれかのとおりであり、かつ塩基グアニンが、L-LNA-GモノマーについてはiBuなどのアシルで、またはD-LNA-Gモノマーについてはアシル(iBuなどの)もしくはDMFのいずれかで保護されている、態様1~28のいずれかの方法。
48. 前記オキサザホスホリジンホスホラミダイトモノマーが、DNAモノマーであるか、またはLNA-Aモノマー、LNA-Cモノマー、およびアシル保護L-LNA-Gモノマーからなる群より選択されるLNAモノマーである、態様1~47のいずれかの方法。
49. 前記オキサザホスホリジンホスホラミダイトモノマーが、LNA-Tモノマー、D-LNA-Gモノマー、またはDMF保護L-LNA-Gモノマー以外である、態様1~47のいずれかの方法。
50. Rがフェニルであり、R1が水素またはメチルであり、R9が水素であり、かつR3が、CH2-O-DMTrまたはCH2-O-MMTrなどのCH2ODMTr、CH2-アルキル-O-DMTr、CH-Me-O-DMTr、CH2OMMTr、CH2-アルキル-O-MMTr、CH(Me)-O-MMTr、CH-Ra-O-DMTrRb、およびCH-Ra-O-MMTrRbからなる群より選択される、態様17~49のいずれかの方法。
51. Rがフェニルであり、R1が水素またはメチルであり、R9が水素であり、かつR3が-CH2-O-DMTrである、態様17~49のいずれかの方法。
52. 本発明の方法のカップリング段階における、態様17~51のいずれかのオキサザホスホリジンホスホラミダイトモノマーと、アセトニトリルと、芳香族複素環式溶媒とを含むアセトニトリル溶液の使用。
53. 前記オキサザホスホリジンホスホラミダイトモノマーの濃度が、約0.05M~約2M、例えば約0.1M~約1M、例えば約0.1M~約0.2M、例えば約0.15M、または約0.175M、または約0.2Mである、態様52のアセトニトリル溶液。
54. 前記芳香族複素環式溶媒が態様1~16のいずれかのとおりである、態様52または53のアセトニトリル溶液。
55. アセトニトリル中の芳香族複素環式溶媒の濃度が、約0.1%(v/v)~約50%(v/v)、例えば約0.5%(v/v)~約25%(v/v)である、態様52~54のいずれかのアセトニトリル溶液。
56. アセトニトリル中の芳香族複素環式溶媒の濃度が、約0.5%~約10%、例えば約1%(v/v)~約5%(v/v)、例えば約2~4%、例えば約2.5%、例えば約3.5%である、態様52~55のいずれかのアセトニトリル溶液。
トルエン(50mL)中のN-メチルモルホリンの溶液に、PCl3(2.93mL 33.4mmol)を-70℃で10分かけて加えた。この後、トルエン(50mL)中のプロリン(P5-DまたはP5-L)補助剤(6.24g 35.2mmol)を30分かけて加えた(P5-DおよびP5-Lの合成についてはJ. Am. Chem. Soc., 2008, 130, 16031-16037参照)。得られた混合物を室温で1.5時間撹拌し、その後溶媒および揮発性物質を減圧下で除去した(40℃および15mbar)。次いで、残っている残渣をTHF(50mL)に溶解し、この後-70℃に冷却し、続いてまずNEt3(17.8mL 128mmol)と、次いで、30分かけて、THF(50mL)溶液としての5'-ODMT-DNA-ヌクレオシド(16mmol)を加えた。反応混合物を-77℃で30分間と、次いで室温で2時間撹拌した。この後、冷EtOAc(200mL)を加え、混合物を冷NaHCO3(150mL)、食塩水(150mL)で洗浄し、乾燥(Na2SO4)し、ろ過し、蒸発乾固させた。粗生成物をアルゴン雰囲気下、シリカ(silicia)上での分解を避けるために溶離剤中に7%NEt3を含む、フラッシュカラムクロマトグラフィで精製した。
D-DNA A:31P NMR (160MHz、DMSO-d6):δ150.3
L-DNA A:31P NMR (160MHz、DMSO-d6):δ148.5
D-DNA T:31P NMR (160MHz、DMSO-d6):δ151.0
L-DNA T:31P NMR (160MHz、DMSO-d6):δ149.1
D-DNA C:31P NMR (160MHz、DMSO-d6):δ151.7
L-DNA C:31P NMR (160MHz、DMSO-d6):δ149.8
D-DNA G-DMF:31P NMR (160MHz、DMSO-d6):δ151.7
L-DNA G-DMF:31P NMR (160MHz、DMSO-d6):δ150.3
D-LNA-G-DMFの合成
5'-ODMT-LNA-G(3.51g 5.00mmol)をピリジンと、次いでトルエンと同時蒸発させて、任意の残存水または他の溶媒を除去した。次いで、残渣をピリジン(10mL)およびTHF(10mL)に溶解した。この溶液をD-オキサザホスホリジン(3.51g 5.00mmol)、PCl3(0.88mL 10.0mmol)、およびNEt3(3.50mL 25.0mmol)の溶液に、-77℃で加えた。得られた反応混合物を次いで-77℃で15分間と、次いで室温で1.5時間撹拌した。この後、EtOAc(150mL)を加え、混合物を冷NaHCO3(100mL)および食塩水(100mL)で洗浄し、Na2SO4を用いて乾燥し、ろ過し、最後にトルエンと一緒に蒸発させた。得られた残渣をカラムクロマトグラフィ(溶離剤EtOAc中THF、10%~30%+7%NEt3)で精製して、D-LNA-G-DMFを得た(3.91g、推定収率84%)。
L-LNA-G-DMFの合成
5'-ODMT-LNA-G(4.91g 7.00mmol)をピリジンと、次いでトルエンと同時蒸発させて、任意の残存水または他の溶媒を除去した。次いで、残渣をピリジン(10mL)およびTHF(15mL)に溶解した。この溶液をL-オキサザホスホリジン(2.48g 14.0mmol)、PCl3(1.22mL 14.0mmol)、およびNEt3(4.90mL 35.0mmol)の溶液に、-77℃で加えた。得られた反応混合物を次いで-77℃で15分間と、次いで室温で1.5時間撹拌した。この後、EtOAc(150mL)を加え、混合物を冷NaHCO3(100mL)および食塩水(100mL)で洗浄し、Na2SO4を用いて乾燥し、ろ過し、最後にトルエンと一緒に蒸発させた。得られた残渣をカラムクロマトグラフィ(溶離剤EtOAc/DCM 1:1中THF、15%~25%+7%NEt3の勾配を用いて)で精製して、D-LNA-G-DMFを得た(3.41g、推定収率84%)。生成物をカラムクロマトグラフィで前述のとおりに精製した。
D-DNA G-DMFの合成
トルエン(50mL)中のN-メチルモルホリンの溶液に、PCl3(2.93mL 33.4mmol)を-70℃で10分かけて加えた。この後、トルエン(50mL)中のP5-D(6.24g 35.2mmol)を30分かけて加えた。得られた反応混合物を室温で1.5時間撹拌し、その後溶媒および揮発性物質を減圧下で除去した(40℃および15mbar)。次いで、残っている残渣をTHF(50mL)に溶解し、この後-70℃に冷却し、続いてまずNEt3(17.8mL 128mmol)と、次いで、30分かけて、THF(50mL)溶液としての5'-ODMT-DNA-G(9.99g 16.0mmol)を加えた。反応混合物を-77℃で30分間と、次いで室温で2時間撹拌した。この後、冷EtOAc(200mL)を加え、混合物を冷NaHCO3(150mL)、食塩水(150mL)で洗浄し、乾燥(Na2SO4)し、ろ過し、蒸発乾固させた。粗生成物をアルゴン雰囲気下、フラッシュカラムクロマトグラフィ(溶離剤DCM/EtOAc=2/1+7%NEt3)で精製した。D-DNA-G-DMFを、痕跡量の溶媒不純物(EtOAc、トルエン、およびNEt3)を含む、白色泡状物として単離した(10.6g、72%)。
L-DNA G-DMFの合成
トルエン(25mL)中のN-メチルモルホリンの溶液に、PCl3(1.33mL 15.2mmol)を-55℃で5分の間に加え、続いてトルエン(25mL)中のP5-L(2.84g 16.00mmol)を15分の間に加えた。得られた反応混合物を-55~45℃で10分間と、次いで室温で1.5時間撹拌した。次いで、溶媒および他の揮発性物質を減圧下で除去した(40℃および6mbar)。次いで、残っている残渣をTHF(25mL)に溶解し、-77℃に冷却した。この後、NEt3(8.92mL 64mmol)と、続いてTHF(25mL)中の5'-ODMT-DNA-G-DMF(4.5g 7.2mmol)を15分の間に加えた。反応混合物を-77℃で15分間と、次いで室温で3時間撹拌した。この後、EtOAc(150mL)を加え、混合物を冷NaHCO3(100mL)、食塩水(50mL)で抽出し、乾燥(Na2SO4)し、ろ過し、蒸発させた。
DMSO中の31P-NMR 148.8ppm+1% at 28.8ppm。
生成物の安定性および溶解性の判定
L-LNA G-DMFおよびL-LNA G-i-Buの安定性および溶解性を調べるために、以下の実験法を行った。
モデルシステム: 5'-gcattggtatt(LNA A)cattgttgtttt-3'
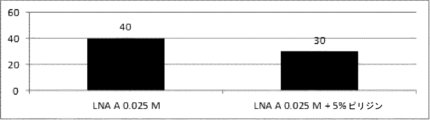
通常のLNAホスホラミダイトのカップリング効率を妨害するために、LNA AをMeCN(5%ピリジンありおよびなし)中で0.025Mに希釈した。この後、アミダイトをモデルシステム(5'-gcattggtatt(LNA A)cattgttgtttt-3')中で用いた。ここで3'隣接部を脱保護後の粗製混合物中で同定し、問題のモノマー、すなわちLNA A 0.025MおよびLNA A 0.025M+5%ピリジンの相対的カップリング効率を得るために、全長生成物と比較した。
ここで、Et3N存在下(アミダイトに比べて5~10当量)でのL-LNA Aの安定性をモニターした。
カップリング段階において耐性のある適切な塩基を見い出すために、関連する窒素含有塩基中のいくつかの異なる添加物をモデルシステム(5'-gcattggtatt(LNA A)cattgttgtttt-3')において調査した。
モノマーの溶媒に加えたピリジンの効果を調べるために、5つのさらなるモノマーの1セットをモデルシステム(5'-gcattggtatt(立体的に規定されたアミダイト)cattgttgtttt-3')を用いて調査した。
以下のモノマーの溶解性を実施例7のとおりに判定した。
DNA AはBz保護され、DNA Cはアセチル(Ac)保護され、DNA Tは保護基なしであり、DNA GはDMFであり、LNA AはBz保護され、LNA CはBzであり、LNA Tは保護基なしであり、LNA GはDMF(D-LNA)およびIbu(L-LNA)である。Bz=ベンゾイル。
モデルシステム5'-Xttttttttttttttt-3'-X=L-LNA Aにおいて得た相対的カップリング変換。未反応断片(5'-ttttttttttttttt-3')と全長生成物(すなわち、5'-(L-LNA-A)ttttttttttttttt-3')を統合し、互いに比較してシステムにおける相対的カップリング効率を得た。異なる濃度の活性化剤を用いて、最適濃度を決定した。ピリジンの添加は、ピリジンが存在しないカップリングに比べて明らかにカップリング効率を高める。結果から明らかなとおり(図8)、活性化剤濃度に関係なく、ピリジン添加は一般に、変換率の増大の点から利点を有する。当技術分野においてはルーチンであるように、活性化剤の濃度を最適化すべきであることは明白でもあり、DCIに関しては典型的には1M DCIの濃度を0.1M NMIと共に用いる。全長生成物への得られた変換を用いて、いくつかの理論収率が算出された。ここで、ピリジンの添加は、創薬に用い得る有用な収率を得るために重大であることは明らかである。実験的に得たカップリング効果データを考慮して、13merオリゴヌクレオチドの理論収率を図9に示すことができ、16merオリゴヌクレオチドについては図10を参照されたい。データを以下の表に示す。
本実施例において、以下に示すLNAオリゴヌクレオチドの立体化学的変種の合成を、標準の条件(アセトニトリルカップリング溶媒)を用い、本発明に従って実施した。
5'-GSpCSpaSptSptSpgSpgSptSpaSptSpTSpCSpA-3'(SEQ ID NO 1)
XはLNAヌクレオチドを示す。
小文字はDNAヌクレオチドを示す。
下付き文字Sp=立体無作為ホスホロチオエートヌクレオシド間連結。
モノマーの溶媒に加えたピリジンの効果を調べるために、7つのさらなるモノマーの1セットをモデルシステム(5'-gcattggtatt(立体的に規定されたアミダイト)cattgttgtttt-3')を用いて調査した。
オリゴヌクレオチドをMerMade12機器によりunylinker CPG固体支持体上、1μmolスケールで合成した。
オリゴヌクレオチドをMerMade12機器によりunylinker CPG固体支持体上、1μmolスケールで合成した。
「COWCOW」サイクルを用いた、完全に立体的に規定されたオリゴヌクレオチドの収率の例
オリゴヌクレオチドをMerMade12機器によりunylinker CPG固体支持体上、1μmolスケールで合成した。
オリゴヌクレオチドをMerMade192機器によりunylinker CPG固体支持体上、1μmolスケールで合成した。
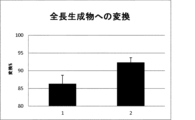
・以前のサイクルの平均収率: 12%
・新規サイクルの平均収率: 17%
・カップリング収率の増大: 50%
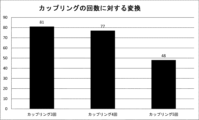
モデルシステム5'-Xttttttttttttttt-3'(X=L-LNA mC)または5'-Xttttttttt-3'(X=L-DNA T)において得られた場合の相対的カップリング変換。tは立体無作為DNA Tである。すべての連結はホスホロチオエートである。未反応断片と全長生成物をUPLC分析後に統合し、互いに比較して、システムにおける相対的カップリング効率を得た。
二重カップリング: カップリング変換84.8%
COWCOW: カップリング変換96%
カップリング効率において全13.2%の増大が見られる。
二重カップリング: カップリング変換47.4%
COWCOW: カップリング変換53.3%
カップリング効率の全12%の増大が見られる。
Claims (13)
- (a)固体支持体に結合されたヌクレオシドまたはオリゴヌクレオチドの保護された5'-ヒドロキシ末端を脱保護する段階、
(b)オキサザホスホリジンホスホラミダイトモノマーをヌクレオシドまたはオリゴヌクレオチドの脱保護された該5'-ヒドロキシ末端にカップリングして、亜リン酸トリエステル中間体を形成する段階、
(c)該亜リン酸トリエステル中間体を硫化試薬で酸化する段階と、その後に続く洗浄段階、
(d)同じ伸長サイクル内で段階(b)および(c)を繰り返す段階、
(e)任意で、1回または複数回のさらなる伸長サイクルについて段階(a)~(d)を繰り返す段階、ならびに
(f)該オリゴヌクレオチドを脱保護して該固体支持体から切断する段階
を含み、
該カップリングがアセトニトリル溶媒組成物中で行われ、
該オキサザホスホリジンホスホラミダイトモノマーがL-LNA-Gモノマーである場合、グアニン残基における環外窒素がアシル基で保護されている、
立体的に規定された(stereodefined)ホスホロチオエートオリゴヌクレオチドの合成のための方法。 - 段階(d)を少なくとも2回実施する、請求項1に記載の方法。
- 前記アセトニトリル溶媒組成物がアセトニトリルおよび芳香族複素環式溶媒を含む、請求項2に記載の方法。
- 複数回のさらなる伸長サイクル(e)を含む、請求項1~3のいずれか一項に記載の方法。
- 前記立体的に規定されたホスホロチオエートオリゴヌクレオチドがアンチセンスオリゴヌクレオチドである、請求項1~4のいずれか一項に記載の方法。
- 前記芳香族複素環式溶媒が、20℃の水中で4~7または7~17のpKaを有する、請求項3に記載の方法。
- 前記芳香族複素環式溶媒が芳香族複素環式塩基である、請求項3または6に記載の方法。
- 前記芳香族複素環式溶媒が芳香族複素環式酸である、請求項3または6に記載の方法。
- 前記芳香族複素環式溶媒が、ピリジン、2-ピコリン、4-ピコリン、3-ピコリン、ルチジン、およびピロールからなる群より選択される、請求項3または6に記載の方法。
- 前記芳香族複素環式溶媒がピリジンである、請求項9に記載の方法。
- 前記アセトニトリル溶媒組成物中の前記芳香族複素環式溶媒の濃度(v/v)が0.1%(v/v)~50%(v/v)である、請求項3および6~10のいずれか一項に記載の方法。
- 前記アセトニトリル溶媒組成物中の前記芳香族複素環式溶媒の濃度(v/v)が0.5%~10%である、請求項3および6~10のいずれか一項に記載の方法。
- 前記オキサザホスホリジンホスホラミダイトモノマーが、式1:
のものであり、
式中、
Zはヌクレオシドであり;
R5およびR6は独立して、水素、アルキル、シクロアルキル、アリール、ヘテロアリール、置換アルキル、置換シクロアルキル、置換アリール、および置換ヘテロアリールからなる群より選択されるか、または、R5およびR6は一緒になって式1のN原子と共に、3~16個の炭素原子を含む複素環を形成し;
R9は水素であり;
R1は、水素およびC1~3アルキルからなる群より選択され;かつ、
Rは、アリール、ヘテロアリール、置換アリール、置換ヘテロアリール、ニトロ、ハロゲン、シアノ、シリル、置換シリル、スルホン、置換スルホン(アリール置換スルホン)、フルオレン、および置換フッ素からなる群より選択され;
ここで、置換されている場合、Rは、C1~4アルキル基、C6~14アリール基、C1~4アルコキシ基、C7~14アラルキル基、およびC6~14アリールC1~4アルキル基からなる群より独立して選択される1つまたは複数の基で置換されていてもよい、
請求項1~12のいずれか一項に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP17178454.9 | 2017-06-28 | ||
| EP17178454 | 2017-06-28 | ||
| PCT/EP2018/067015 WO2019002237A1 (en) | 2017-06-28 | 2018-06-26 | METHOD OF MULTIPLE COUPLING AND OXIDATION |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2020525503A JP2020525503A (ja) | 2020-08-27 |
| JP2020525503A5 JP2020525503A5 (ja) | 2020-10-22 |
| JP7492829B2 true JP7492829B2 (ja) | 2024-05-30 |
Family
ID=62750990
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019572465A Active JP7492829B2 (ja) | 2017-06-28 | 2018-06-26 | 多重カップリングおよび酸化の方法 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US11814407B2 (ja) |
| EP (1) | EP3645544B1 (ja) |
| JP (1) | JP7492829B2 (ja) |
| CN (1) | CN110831951B (ja) |
| WO (1) | WO2019002237A1 (ja) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN112007045A (zh) | 2012-07-13 | 2020-12-01 | 波涛生命科学有限公司 | 手性控制 |
| NZ781029A (en) | 2015-10-09 | 2025-07-25 | Wave Life Sciences Ltd | Oligonucleotide compositions and methods thereof |
| US11407775B2 (en) | 2016-03-13 | 2022-08-09 | Wave Life Sciences Ltd. | Compositions and methods for phosphoramidite and oligonucleotide synthesis |
| MA46905A (fr) | 2016-11-23 | 2019-10-02 | Wave Life Sciences Ltd | Compositions et procédés de synthèse de phosphoramidites et d'oligonucléotides |
| JP7557941B2 (ja) | 2017-06-02 | 2024-09-30 | ウェイブ ライフ サイエンシズ リミテッド | オリゴヌクレオチド組成物及びその使用方法 |
| WO2018223056A1 (en) | 2017-06-02 | 2018-12-06 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods of use thereof |
| WO2018237194A1 (en) | 2017-06-21 | 2018-12-27 | Wave Life Sciences Ltd. | Compounds, compositions and methods for synthesis |
| US11814407B2 (en) | 2017-06-28 | 2023-11-14 | Roche Innovation Center Copenhagen A/S | Multiple coupling and oxidation method |
| CN110996968A (zh) | 2017-08-08 | 2020-04-10 | 波涛生命科学有限公司 | 寡核苷酸组合物及其方法 |
| KR20200052369A (ko) | 2017-09-18 | 2020-05-14 | 웨이브 라이프 사이언시스 리미티드 | 올리고뉴클레오티드 제조 기술 |
| WO2019075357A1 (en) | 2017-10-12 | 2019-04-18 | Wave Life Sciences Ltd. | OLIGONUCLEOTIDE COMPOSITIONS AND RELATED METHODS |
| AU2019265904A1 (en) | 2018-05-11 | 2020-11-12 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods of use thereof |
| WO2020210476A1 (en) * | 2019-04-10 | 2020-10-15 | Nitto Denko Avecia Inc. | Process and apparatus for sequential synthesis of biological polymers |
| JP7751302B2 (ja) * | 2020-06-15 | 2025-10-08 | リードファーマ株式会社 | 架橋型ヌクレオシドおよびヌクレオチド |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005046073A (ja) | 2003-07-29 | 2005-02-24 | National Institute Of Advanced Industrial & Technology | 修飾核酸を用いるrna転写および/または増幅方法 |
| WO2011108682A1 (ja) | 2010-03-05 | 2011-09-09 | 国立大学法人 東京大学 | リボヌクレオシドホスホロチオエートの製造方法 |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU4800197A (en) | 1996-10-15 | 1998-05-11 | Nexstar Pharmaceuticals, Inc. | Improved coupling activators for oligonucleotide synthesis |
| WO2006116476A1 (en) | 2005-04-27 | 2006-11-02 | Sigma-Aldrich Co. | Activators for oligonucleotide and phosphoramidite synthesis |
| EP1984381B1 (en) | 2006-01-27 | 2010-09-29 | Isis Pharmaceuticals, Inc. | 6-modified bicyclic nucleic acid analogs |
| MX2008012219A (es) | 2006-04-03 | 2008-10-02 | Santaris Pharma As | Composicion farmaceutica que comprende oligonucleotidos antisentido anti-miarn. |
| AU2008306327B2 (en) | 2007-10-04 | 2014-05-15 | Roche Innovation Center Copenhagen A/S | Micromirs |
| WO2009124238A1 (en) | 2008-04-04 | 2009-10-08 | Isis Pharmaceuticals, Inc. | Oligomeric compounds comprising neutrally linked terminal bicyclic nucleosides |
| WO2010036698A1 (en) | 2008-09-24 | 2010-04-01 | Isis Pharmaceuticals, Inc. | Substituted alpha-l-bicyclic nucleosides |
| ES2862073T3 (es) | 2012-07-13 | 2021-10-06 | Wave Life Sciences Ltd | Grupo auxiliar asimétrico |
| CN112007045A (zh) * | 2012-07-13 | 2020-12-01 | 波涛生命科学有限公司 | 手性控制 |
| EP3430021A1 (en) * | 2016-03-18 | 2019-01-23 | Roche Innovation Center Copenhagen A/S | Acyl-protected l-lna-guanosine monomers |
| US10072261B1 (en) * | 2016-03-25 | 2018-09-11 | Agilent Technologies, Inc. | Double coupling method for oligonucleotide synthesis |
| WO2017194498A1 (en) | 2016-05-12 | 2017-11-16 | Roche Innovation Center Copenhagen A/S | Enhanced coupling of stereodefined oxazaphospholidine phosphoramidite monomers to nucleoside or oligonucleotide |
| WO2018177825A1 (en) | 2017-03-29 | 2018-10-04 | Roche Innovation Center Copenhagen A/S | Orthogonal protecting groups for the preparation of stereodefined phosphorothioate oligonucleotides |
| US11814407B2 (en) | 2017-06-28 | 2023-11-14 | Roche Innovation Center Copenhagen A/S | Multiple coupling and oxidation method |
| EP3883941A1 (en) * | 2018-11-22 | 2021-09-29 | Roche Innovation Center Copenhagen A/S | Pyridinium salts as activators in the synthesis of stereodefined oligonucleotides |
-
2018
- 2018-06-26 US US16/617,279 patent/US11814407B2/en active Active
- 2018-06-26 WO PCT/EP2018/067015 patent/WO2019002237A1/en not_active Ceased
- 2018-06-26 JP JP2019572465A patent/JP7492829B2/ja active Active
- 2018-06-26 EP EP18734530.1A patent/EP3645544B1/en active Active
- 2018-06-26 CN CN201880043406.4A patent/CN110831951B/zh active Active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005046073A (ja) | 2003-07-29 | 2005-02-24 | National Institute Of Advanced Industrial & Technology | 修飾核酸を用いるrna転写および/または増幅方法 |
| WO2011108682A1 (ja) | 2010-03-05 | 2011-09-09 | 国立大学法人 東京大学 | リボヌクレオシドホスホロチオエートの製造方法 |
Non-Patent Citations (8)
| Title |
|---|
| Eur. J. Chem.,2005年,5216-5223 |
| J. Am. Chem. Soc.,2002年,124,4962-4963 |
| J. Am. Chem. Soc.,2008年,130,16031-16037 |
| J. Org. Chem.,2012年,77,7913-7922 |
| J. Org. Chem.,2016年,81,2753-2762 |
| Nucleosides, Nucleotides & NucleicAcids,2003年,22,1411-1413 |
| Org. Lett.,2009年,11,967-970 |
| Tetrahedron Lett.,1998年,39,2491-2494 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2020525503A (ja) | 2020-08-27 |
| CN110831951B (zh) | 2023-10-27 |
| US11814407B2 (en) | 2023-11-14 |
| US20200148714A1 (en) | 2020-05-14 |
| EP3645544B1 (en) | 2023-05-10 |
| CN110831951A (zh) | 2020-02-21 |
| EP3645544A1 (en) | 2020-05-06 |
| WO2019002237A1 (en) | 2019-01-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7492829B2 (ja) | 多重カップリングおよび酸化の方法 | |
| JP7097820B2 (ja) | ヌクレオシドまたはオリゴヌクレオチドへの、立体的に規定されたオキサザホスホリジンホスホルアミダイト単量体のカップリングの増大法 | |
| JP7017517B2 (ja) | アシル保護l-lna-グアノシンモノマー | |
| CN110475784B (zh) | 用于制备立体限定硫代磷酸酯寡核苷酸的正交保护基 | |
| EP4098655A1 (en) | Method for producing nucleic acid oligomer | |
| JP7698631B2 (ja) | 核酸オリゴマーの製造方法 | |
| JP7759323B2 (ja) | 核酸オリゴマーの製造方法 | |
| EP4097117B1 (en) | Process of preparing nucleic acid oligomer | |
| WO2024019137A1 (ja) | オリゴヌクレオチドの製造方法 | |
| HK40022416A (en) | Multiple coupling & oxidation method | |
| HK40022416B (zh) | 多重偶联和氧化方法 | |
| HK40003927B (en) | Enhanced coupling of stereodefined oxazaphospholidine phosphoramidite monomers to nucleoside or oligonucleotide | |
| HK40003927A (en) | Enhanced coupling of stereodefined oxazaphospholidine phosphoramidite monomers to nucleoside or oligonucleotide | |
| HK40017810A (en) | Orthogonal protecting groups for the preparation of stereodefined phosphorothioate oligonucleotides | |
| HK40017810B (zh) | 用於制备立体限定硫代磷酸酯寡核苷酸的正交保护基 | |
| HK40016121A (en) | Unylinker rapid cleavage | |
| HK1263059A1 (en) | Acyl-protected l-lna-guanosine monomers |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200910 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210304 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210621 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220711 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20221005 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230111 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230407 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20230628 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230809 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20231005 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20231218 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20240319 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240326 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20240509 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20240520 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7492829 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |