JP7223701B2 - 4-ピリミジンスルファミド誘導体の、エンドセリン関連疾患治療用の有効成分との合剤 - Google Patents
4-ピリミジンスルファミド誘導体の、エンドセリン関連疾患治療用の有効成分との合剤 Download PDFInfo
- Publication number
- JP7223701B2 JP7223701B2 JP2019546291A JP2019546291A JP7223701B2 JP 7223701 B2 JP7223701 B2 JP 7223701B2 JP 2019546291 A JP2019546291 A JP 2019546291A JP 2019546291 A JP2019546291 A JP 2019546291A JP 7223701 B2 JP7223701 B2 JP 7223701B2
- Authority
- JP
- Japan
- Prior art keywords
- pharmaceutically acceptable
- acceptable salt
- aprocitentan
- hypertension
- valsartan
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/513—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim having oxo groups directly attached to the heterocyclic ring, e.g. cytosine
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/401—Proline; Derivatives thereof, e.g. captopril
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/403—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with carbocyclic rings, e.g. carbazole
- A61K31/4035—Isoindoles, e.g. phthalimide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4418—Non condensed pyridines; Hydrogenated derivatives thereof having a carbocyclic group directly attached to the heterocyclic ring, e.g. cyproheptadine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4422—1,4-Dihydropyridines, e.g. nifedipine, nicardipine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/54—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame
- A61K31/549—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame having two or more nitrogen atoms in the same ring, e.g. hydrochlorothiazide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/13—Crystalline forms, e.g. polymorphs
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Cardiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Heart & Thoracic Surgery (AREA)
- Hospice & Palliative Care (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Nutrition Science (AREA)
- Physiology (AREA)
Description
くは心筋虚血、腎不全、脳虚血、認知症、偏頭痛、くも膜下出血、レイノー症候群、指潰瘍及び門脈圧亢進症である。それらはまた、アテローム性動脈硬化、バルーン又はステント血管形成術後の再狭窄、炎症、胃潰瘍、十二指腸潰瘍、癌、黒色腫、前立腺癌、前立腺肥大、勃起不全、聴力損失、黒内障、慢性気管支炎、喘息、肺線維症、グラム陰性敗血症、ショック、鎌状赤血球貧血、糸球体腎炎、腎疝痛、緑内障、結合組織病、糖尿病合併症の治療及び予防、血管若しくは心臓外科手術の、又は臓器移植後の合併症、シクロスポリン治療の合併症、疼痛、高脂血症、並びに現在エンドセリンに関連のあることが知られている他の疾患の治療又は予防にも使用することができる。エンドセリン関連疾患の具体例は、治療困難性/抵抗性高血圧を特に含む高血圧を包含する高血圧関連疾患;肺高血圧;慢性心不全を特に含む心不全;心血管リスクを有する患者(例えば、冠動脈疾患を有する患者、及び/又は、うっ血性心不全の臨床症状を示した患者)の主要心血管イベント(例えば、心不全、心筋梗塞、発作又は心血管に起因する死亡)が進行するリスクを減少させること;狭心症;及び拡張機能障害;勃起不全;CKD(特に、Kidney Disease Improving Global Outcomes(KDIGO)Guidelinesに定義されるステージ1~4のCKD(特に、ステージ3のCKD)、とりわけ、本態性高血圧、特に抵抗性高血圧に起因/関連するこれらのステージのCKD);並びに糖尿病及び、糖尿病性動脈疾患、糖尿病性ネフローゼ、糖尿病網膜症、糖尿病性脈管障害等の糖尿病関連疾患;並びに、少なくとも1つの他の心血管危険因子(例えば、高血圧、特に抵抗性高血圧)を伴う糖尿病を有する患者の主要心血管イベント(例えば、心不全、心筋梗塞、発作又は心血管に起因する死亡)が進行するリスクを減少させることである。
アンタゴニストであるボセンタン(bosentan)及びマシテンタン(macitentan)、ETA選択的アンタゴニストであるアンブリセンタン(ambrisentan)等のERAに対する過去における連続的な承認に反映されているように)肺高血圧等の適応症については、ほとんどの場合、ERAを用いた治療に有利であるが、ERAは原発性高血圧の処置には適さず(Laffinら、Seminars in Nephrology 2015、35、168-175)、また、rHT、慢性腎臓疾患又は他の高血圧関連疾患をERAで治療する可能性を考える場合、体液貯留等の副作用の問題が残るであろう。
Nephrol.2010、21(3):527-535。)」と結論づけた。WO2016/073846には、体液貯留が、ERAであるボセンタン、tezosentan、アンブリセンタン及びアトラセンタン(atrasentan)の副作用の増大を引き起こした可能性があるさらなる例が記載されている。WO2016/073846は、結論として、体液貯留の予測装置を用いて、ERAで、特にETA選択的ERAであるアトラセンタンでCKDを治療する方法を提案しており;当該方法は、ERAを対象に投与した場合の体液貯留のリスクを決定する工程;及び、上記リスクが許容レベルである場合に、対象にERAを投与する工程を有する。
B受容体の同時遮断により消失することを示した(Goddardら、J.Am.Soc.Nephrol.2004、15、2601-2610)。
図1は、実施例1から得られた結晶形Aにおける「化合物」の粉末X線回折ダイアグラムを示す。上記X線回折ダイアグラムは、示した屈折角2シータにおける、ダイアグラムにおける最も強いピークと比較して、下記のパーセンテージの相対強度を有するピークを示す(相対的ピーク強度を括弧内に記載する。)(3-33°の範囲の2シータからの、
10%より大きな相対強度を有する選択したピークを報告する。):
9.8°(18%)、9.9°(18%)、11.7°(14%)、14.5°(10%)、15.4°(14%)、15.6°(29%)、16.9°(19%)、17.2°(16%)、17.8°(100%)、18.6°(50%)、19.9°(54%)、20.0°(67%)、21.5°(24%)、21.9°(10%)、22.8°(18%)、23.2°(49%)、23.5°(83%)、24.9°(32%)、25.1°(20%)、25.3°(24%)、25.6°(33%)、25.9°(16%)、27.1°(23%)、27.3°(39%)、28.5°(13%)、29.0°(23%)、29.4°(15%)、30.1°(12%)及び30.6°(10%)。
11.2°(16%)、16.2°(57%)、18.0°(21%)、18.6°(71%)、18.8°(36%)、19.8°(19%)、20.3°(100%)、22.4°(45%)、22.9°(28%)、24.3°(44%)、24.8°(11%)、25.0°(41%)、25.7°(22%)、26.1°(31%)、27.4°(20%)、29.4°(16%)、29.8°(38%)及び32.4°(12%)。
7.8°(23%)、9.7°(42%)、15.7°(37%)、17.2°(16%)、17.8°(15%)、18.8°(26%)、19.8°(71%)、20.1°(51%)、20.6°(15%)、21.6°(15%)、22.0°(100%)、23.4°(27%)、23.6°(40%)、24.1°(23%)、24.5°(16%)、25.1°(13%)、25.3°(39%)、25.7°(28%)、26.8°(19%)、27.1°(16%)、28.5°(31%)、30.8°(13%)及び30.8°(13%)。
4.6°(27%)、8.4°(15%)、8.6°(11%)、16.4°(17%)、16.8°(26%)、17.2°(10%)、18.6°(11%)、18.9°(18%)、19.3°(40%)、19.6°(45%)、20.1°(100%)、20.6°(55%)、20.8°(26%)、22.0°(10%)、22.7°(14%)、23.0°(24%)、23.5°(32%)、23.8°(12%)、24.2°(17%)、24.7°(20%)、25.1°(55%)、25.4°(22%)、25.6°(14%)、26.2°(16%)、26.8°(17%)、27.2°(28%)、28.1°(21%)及び28.1°(19%)。
の粉末X線回折ダイアグラムを示す。上記X線回折ダイアグラムは、示した屈折角2シータにおける、ダイアグラムにおける最も強いピークと比較して、下記のパーセンテージの相対強度を有するピークを示す(相対的ピーク強度を括弧内に記載する。)(3-33°の範囲の2シータからの、10%より大きな相対強度を有する選択したピークを報告する。):
9.0°(21%)、9.5°(56%)、11.3°(61%)、14.5°(41%)、14.8°(15%)、15.6°(47%)、16.0°(26%)、16.5°(100%)、18.2°(84%)、18.7°(73%)、18.9°(56%)、20.2°(20%)、20.7°(56%)、22.8°(96%)、23.9°(22%)、24.5°(70%)、25.3°(77%)、25.6°(29%)、26.0°(14%)、26.6°(66%)、27.5°(27%)、29.6°(31%)、30.2°(66%)及び33.0°(13%)。
4.0°(44%)、4.7°(14%)、6.5°(23%)、9.0°(27%)、16.1°(40%)、17.2°(11%)、18.7°(22%)、19.0°(58%)、19.4°(28%)、19.8°(46%)、20.7°(57%)、21.2°(17%)、21.9°(100%)、22.6°(14%)、23.2°(23%)、24.1°(37%)、24.8°(40%)、25.6°(42%)、27.0°(29%)、28.2°(27%)、29.0°(20%)、30.3°及び30.8°(10%)。
10.9°(16%)、16.9°(18%)、18.2°(26%)、18.4°(30%)、18.6°(29%)、18.7°(55%)、19.3°(100%)、20.8°(35%)、21.2°(47%)、21.9°(26%)、24.3°(21%)、24.8°(24%)、25.4°(29%)、25.8°(22%)、26.7°(34%)、27.7°(13%)、27.8°(14%)、28.6°(15%)、29.4°(18%)、31.5°(23%)及び31.8°(12%)。
9.1°(31%)、9.3°(34%)、11.3°(49%)、12.2°(10%)、14.6°(17%)、14.8°(46%)、15.7°(16%)、16.1°(10%)、16.4°(80%)、17.9°(17%)、18.2°(19%)、18.7°(96%)、20.0°(38%)、20.3°(100%)、22.6°(11%)、22.8°(76%)、23.2°(50%)、24.1°(14%)、24.
5°(56%)、24.7°(68%)、25.4°(46%)、25.9°(32%)、26.4°(14%)、26.8°(22%)、27.7°(38%)、28.2°(12%)、29.7°(11%)、29.5°(64%)、29.8°(14%)、30.3°(14%)、30.5°(13%)及び32.4°(16%)。
Solvatesによる定義)。結晶形A及びCは無水和物又は非溶媒和物形態であり、結晶形BはDCM溶媒和物であり、結晶形EはMeCN溶媒和物であり、結晶形KはDMSO溶媒和物である。
ct)に対する、アプロシテンタン(1mg/kg、3mg/kg、10mg/kg、30mg/kg)の急性用量-反応効果を示す。
1) 第1の態様は、有効成分として、アプロシテンタン又はその薬学的に許容される塩を、特にバルサルタンであるアンジオテンシン受容体ブロッカー又はその薬学的に許容される塩と組み合わせて有し、さらに少なくとも1種の薬学的に許容される賦形剤を有する医薬組成物に関する。
- 特にバルサルタンであるアンジオテンシン受容体ブロッカー又はその薬学的に許容される塩;及び/又は、
- 特にアムロジピンであるカルシウムチャンネルブロッカー又はその薬学的に許容される塩;
と組み合わせて有し、さらに少なくとも1種の薬学的に許容される賦形剤を有する医薬組成物に関する。
- 特にバルサルタンであるアンジオテンシン受容体ブロッカー又はその薬学的に許容される塩;
- 特にアムロジピンであるカルシウムチャンネルブロッカー又はその薬学的に許容される塩;
及び
- サイアザイド様利尿剤である利尿剤(特にヒドロクロロチアジド又はクロルタリドン、とりわけヒドロクロロチアジド)又はその薬学的に許容される塩;
と組み合わせて有し、さらに少なくとも1種の薬学的に許容される賦形剤を有する医薬組成物に関する。
、態様3)に従う医薬組成物に関する。
- アプロシテンタン又はその薬学的に許容される塩を、1日当たり2.5~100mg(特に5又は10~50mg、とりわけ12.5mg、25mg又は50mg、特に12.5mg又は25mg)のアプロシテンタンの経口投与に適切な医薬単位投薬量剤型(a
pharmaceutical unit dosage form)で有し;
- バルサルタン又はその薬学的に許容される塩を、1日当たり100~320mg(特に160又は320mg、とりわけ160mg)のバルサルタンの経口投与に適切な医薬単位投薬量剤型で有し;
- アムロジピン又はその薬学的に許容される塩を、1日当たり2~10mg(特に5又は10mg、とりわけ5mg)のアムロジピンの経口投与に適切な医薬単位投薬量剤型で有し;かつ、
- ヒドロクロロチアジド又はその薬学的に許容される塩を、それを含有する場合には、1日当たり5~25mg(特に12.5又は25mg)のヒドロクロロチアジドの経口投与に適切な医薬単位投薬量剤型で有し;クロルタリドン又はその薬学的に許容される塩を、それを含有する場合には、1日当たり10~150mg(特に15mg又は30mg)のクロルタリドンの経口投与に適切な医薬単位投薬量剤型で有する;
態様3)に従う医薬組成物に関する。
- アプロシテンタン又はその薬学的に許容される塩を、1日当たり2.5~100mg(特に5又は10~50mg、とりわけ12.5mg、25mg又は50mg、特に12.5mg又は25mg)のアプロシテンタンの経口投与に適切な医薬単位投薬量剤型で有し;
- バルサルタン又はその薬学的に許容される塩を、1日当たり100~320mg(特に160又は320mg、とりわけ160mg)のバルサルタンの経口投与に適切な医薬単位投薬量剤型で有し;
- アムロジピン又はその薬学的に許容される塩を、1日当たり2~10mg(特に5又は10mg、とりわけ5mg)のアムロジピンの経口投与に適切な医薬単位投薬量剤型で有し;かつ、
- ヒドロクロロチアジド又はその薬学的に許容される塩を、1日当たり5~25mg(特に12.5又は25mg)のヒドロクロロチアジドの経口投与に適切な医薬単位投薬量剤型で有する;
態様6)に従う医薬組成物に関する。
mg/10mg/12.5mg;12.5mg/160mg/5mg/25mg;12.5mg/160mg/10mg/25mg;25mg/160mg/5mg/12.5mg;25mg/160mg/10mg/12.5mg;25mg/160mg/5mg/25mg;及び25mg/160mg/10mg/25mgを明示的に開示する。
radiation)を用いて得られ;上記2θ値の精度が2θ+/-0.2°の範囲
内である、態様1)~7)のいずれか1つに従う医薬組成物に関する。
Kα1及びKα2照射を用いて得られ;上記2θ値の精度が2θ+/-0.2°の範囲内である、態様1)~7)のいずれか1つに従う医薬組成物に関する。
8°、9.7°、15.7°、19.8°及び22.0°におけるピークの存在により特徴づけられる結晶形Cのアプロシテンタンを有し;当該粉末X線回折ダイアグラムは、Kα2を除去することなく、結合Cu Kα1及びKα2照射を用いて得られ;上記2θ値の精度が2θ+/-0.2°の範囲内である、態様1)~7)のいずれか1つに従う医薬組成物に関する。
Kα1及びKα2照射を用いて得られ;上記2θ値の精度が2θ+/-0.2°の範囲内である、態様1)~7)のいずれか1つに従う医薬組成物に関する。
のポリソルベート)及び/又は潤滑剤/滑剤(例えば、ステアリン酸、ステアリン酸マグネシウム若しくはカルシウム又はタルク)を含んでもよい。さらに、被覆材は、錠剤を着色するために、色素(例えば、酸化鉄(II)、酸化鉄(III)又は酸化チタン)を含んでもよい。
mproving Global Outcomes(KDIGO)Guidelinesに定義されるステージ1~4のCKD(特に、ステージ3のCKD)、とりわけ本態性高血圧に起因するこれらのステージのCKD)からなる群より選択される疾患と定義してもよい特定のエンドセリン関連疾患の治療に有用である。
- 特にバルサルタン又はその薬学的に許容される塩であるアンジオテンシン受容体ブロッカー;及び
- 特にアムロジピン又はその薬学的に許容される塩であるカルシウムチャンネルブロッカー;
と組み合わせて投与されることが意図される。
- 特にバルサルタン又はその薬学的に許容される塩であるアンジオテンシン受容体ブロッカー;
- 特にアムロジピン又はその薬学的に許容される塩であるカルシウムチャンネルブロッカー;及び
- サイアザイド様利尿剤である利尿剤(特にヒドロクロロチアジド又はクロルタリドン、とりわけヒドロクロロチアジド)又はその薬学的に許容される塩;
と組み合わせて投与されることが意図される。
- 特にバルサルタン又はその薬学的に許容される塩であるアンジオテンシン受容体ブロッカー;
- 特にアムロジピン又はその薬学的に許容される塩であるカルシウムチャンネルブロッカー;及び
- サイアザイド様利尿剤である利尿剤(特にヒドロクロロチアジド又はクロルタリドン、とりわけヒドロクロロチアジド)又はその薬学的に許容される塩;
と組み合わせて投与されることが意図される。
Improving Global Outcomes(KDIGO)Guidelinesに定義されるステージ1~4のCKD(特に、ステージ3のCKD)、とりわけ本態性高血圧に起因するこれらのステージのCKDの治療において使用するための、アプロシテンタン又はその薬学的に許容される塩に関する。
とも12時間)に導くが、別々の投与は、対象が一定の時間の間(例えば、少なくとも12時間、特に少なくとも1日)、2種又はより多くの活性成分及び/又は治療の1つにのみ暴露される治療相に導いてもよいものと理解される。別々の投与は、特に、少なくとも1種の有効成分及び/又は治療を、(1日に1回又は2回等の)連日投与とは実質的に異なる周期で与える状況(例えば、1種の有効成分及び/又は治療を1日に1回又は2回与え、別のものを、例えば、隔日、又は1週間に1回、又はより長い間隔で与える。)を意味する。
- 特にバルサルタン又はその薬学的に許容される塩であるアンジオテンシン受容体ブロッカー;又は、
- 特にバルサルタン又はその薬学的に許容される塩であるアンジオテンシン受容体ブロッカー;及び特にアムロジピン又はその薬学的に許容される塩であるカルシウムチャンネルブロッカー;
又は、
- 特にバルサルタン又はその薬学的に許容される塩であるアンジオテンシン受容体ブロッカー;特にアムロジピン又はその薬学的に許容される塩であるカルシウムチャンネルブロッカー;及びサイアザイド様利尿剤である利尿剤(特にヒドロクロロチアジド又はクロルタリドン、とりわけヒドロクロロチアジド)又はその薬学的に許容される塩;
等のさらなる有効成分と組み合わせて投与されることが意図される、特定のエンドセリン関連疾患の治療において使用するためのアプロシテンタン又はその薬学的に許容される塩に関する態様はいずれも、アプロシテンタン又はその薬学的に許容される塩と組み合わせて投与されることが意図されるそのようなさらなる有効成分;アプロシテンタン及び当該さらなる有効成分を有する医薬組成物の製造のためのアプロシテンタンの使用;そのような疾患の治療のための、アプロシテンタン及びそのようなさらなる有効成分を有する医薬組成物の使用に;及び、当該さらなる有効成分と組み合わせて投与されることが意図されるアプロシテンタンの効果的な量を、それを必要とする対象(好ましくはヒト)に投与する工程を有する、又は、アプロシテンタン及び本明細書に開示する当該さらなる有効成分を有する医薬組成物の効果的な量を、それを必要とする対象に投与する工程を有する、当該疾患の治療方法;にも関することが理解されるべきである。
- 薬学的に効果的な量の、特にバルサルタン又はその薬学的に許容される塩であるアンジオテンシン受容体ブロッカー、
- 薬学的に効果的な量の、特にアムロジピン又はその薬学的に許容される塩であるカルシウムチャンネルブロッカー;及び
- 薬学的に効果的な量の、サイアザイド様利尿剤である利尿剤(特にヒドロクロロチアジド又はクロルタリドン、とりわけヒドロクロロチアジド)又はその薬学的に許容される
塩;
と組み合わせて投与する;
薬学的に効果的な量のアプロシテンタン又はその薬学的に許容される塩をそれを必要とする対象に投与する工程を有する、高血圧、肺高血圧、糖尿病性動脈疾患、心不全、勃起不全、狭心症及び慢性腎臓疾患の治療(特に、抵抗性高血圧の治療)のための方法に関する。
- 薬学的に効果的な量の、特にバルサルタン又はその薬学的に許容される塩であるアンジオテンシン受容体ブロッカー、
- 薬学的に効果的な量の、特にアムロジピン又はその薬学的に許容される塩であるカルシウムチャンネルブロッカー;及び
- 薬学的に効果的な量のサイアザイド様利尿剤である利尿剤(特にヒドロクロロチアジド又はクロルタリドン、とりわけヒドロクロロチアジド)又はその薬学的に許容される塩;
と組み合わせて投与される。
略語:
明細書及び実施例を通して以下の略語が使われる:
Ac アセチル
AcOH 酢酸
aq. 水溶液
DCM ジクロロメタン
DMSO ジメチルスルホキシド
EtOAc 酢酸エチル
eq. 当量
FTIR フーリエ変換赤外分光法又はスペクトル
HPLC 高速液体クロマトグラフィー
iPrOAc 酢酸イソプロピル
MeOH メタノール
MIBK メチルイソブチルケトン
org. 有機
rt 室温
THF テトラヒドロフラン
vol. 体積
w/w 重量/重量比
wt. 重量単位
XRPD 粉末X線回折
XRPDパターンの取得方法
本明細書に記載の固体形のすべてのXRPDパターンは、以下に記載の通りに取得した。粉末X線回折パターンは、反射モード(結合2シータ/シータ)においてCuKα-照射で作動するLynxeye検出器を備えたBruker D8 AdvanceX線回折計上で収集した。典型的には、X-線チューブを40kV/40mAで走査させた。3~50°の2θの走査範囲にわたって、0.02°(2θ)のステップサイズ及び76.8秒のステップタイムを適用した。発散スリットは固定的に0.3に設定した。粉末を、0.5mmの深さのシリコン単結晶サンプルホルダー内にわずかにプレスし、測定の間、サンプルをそれ自体のプレイン中で回転させた。回折データは、Kα2を除去することなく、結合Cu Kα1及びKα2照射を用いてレポートされる。これまでに記録された粉末X線回折パターンが一般的にそうであるように、本明細書で提供される2θ値の精度は、+/-0.1~0.2°の範囲内である。
1.1. 3L二重ジャケットリアクター(double jacketed reactor)に、5-(4-ブロモフェニル)-4-(2-((5-ブロモピリミジン-2-イル)オキシ)エトキシ)-6 フルオロピリミジン(100g、0.213mol、1eq.)、スルファミド(40.9g、0.425mol、2.0eq.)、K2CO3(147g、1.06mol、5eq.)及び水(2mL、0.111mol、0.5eq.)を混ぜたDMSO(500mL、5vol.)を仕込んだ。不均一な混合物を70℃に約3hの間加熱した後、完全な変換が観察された。20℃に冷却した後、無機塩の大部分をろ過により除いた。フィルターケークをEtOAc/iPrOAc 1:1(300mL、3vol.)で洗浄した。チャコール層(20g、0.2wt.)を載せたCelite(100g、1wt.)をEtOAc/iPrOAc 1:1(500mL、5vol.)で前処理した(ろ液は廃棄した)。反応混合物をこのケーク上でろ過し、EtOAc/iPrOAc 1:1(300mL、3vol.)でリンスした。次いで、温度を25~35℃に維持しながら、1M NaOAc水溶液(500mL、0.5mol、2.3eq、5vol.)を添加した。水相をEtOAc/iPrOAc 1:1(50
0mL、5vol.)で2回洗浄した。水相に、1M H2SO4(200mL、0.2mol、1eq.、2vol.)を、25-30℃にて1hの間添加した。pH8.5-8.0で結晶化が始まった。粗生成物を、XRPDパターンK形(DMSO溶媒和物)又はA形とK形の混合物としてろ過した。それを水で2回洗浄した(2x1000mL、2x10vol.)。固体を、rtにて3h、水(1000mL、10vol.)中でスラリー化した。固体をろ過し、rtにて3h、水(1000mL、10vol.)中で2回目のスラリー化を行った。水(1000mL、10vol.)で洗浄した後、純粋な生成物を40℃にて真空下で乾燥して、{5-(4-ブロモ-フェニル)-6-[2-(5-ブロモ-ピリミジン-2-イルオキシ)-エトキシ]-ピリミジン-4-イル}-スルファミドを白色から灰白色の固体として得た(75g、収率65%、XRPDパターンA形)。
5-(4-ブロモフェニル)-4-(2-((5-ブロモピリミジン-2-イル)オキシ)エトキシ)-6 フルオロピリミジン(10.0g、21.3mmol、1.00eq.)、スルファミド(4.1g、42.5mmol、2.0eq.)及びK2CO3(14.7g、106mmol、5.0eq.)をDMSO(50mL、5vol.)中に懸濁し、70℃に5h加熱した。混合物をrtに冷却し、EtOAc(40mL、4vol.)、次いで水(100mL、10vol.)を添加した。層を分離した後(有機相は廃棄した。)、水相をDCM(100mL、10vol.)で抽出した。DCM層をpH11.5からpH7.0に、濃AcOH(3mL、52mmol、2.5eq.)で酸性化して、生成物の結晶化を行った。懸濁液を、0℃に1h、次いで-5℃に15min冷却した。固体をろ過し、冷DCMで洗浄し(10mL、1vol.)、乾燥して、B形の{5-(4-ブロモ-フェニル)-6-[2-(5-ブロモ-ピリミジン-2-イルオキシ)-エトキシ]-ピリミジン-4-イル}-スルファミドのDCM溶媒和物を白色の固体として得た(9.8g、収率84%)。
{5-(4-ブロモ-フェニル)-6-[2-(5-ブロモ-ピリミジン-2-イルオキシ)-エトキシ]-ピリミジン-4-イル}-スルファミドをTHF中に50mg/mLにて溶解した0.2mLの保存溶液を、3本のバイアルに分注した。溶媒を、35℃、200mbarで作動させたHettich AG(Baech、スイス)製のCombidancer装置内で、90min蒸発させた。その後速やかに、0.015mLのMeOHを第1のバイアルに、EtOHを第2のバイアルに、iPrOHを第3のバイアルに添加し、蓋をして3日間放置した。C形の{5-(4-ブロモ-フェニル)-6-[2-(5-ブロモ-ピリミジン-2-イルオキシ)-エトキシ]-ピリミジン-4-イル}-スルファミドの固体残差を、これらの溶媒のそれぞれについて得た。
4.1. リアクターに、スルファミド(2.00eq.)、K2CO3(5.00eq.)、5-(4-ブロモフェニル)-4-(2-((5-ブロモピリミジン-2-イル)オキシ)エトキシ)-6-フルオロピリミジン(1.00eq.)、DMSO(5.0vol.)及び水(0.02vol.)を仕込んだ。混合物を75℃に2h加熱した。23℃に冷却した後、懸濁液をろ過し、リアクター内をEtOAc/iPrOAc 1:1(5.5vol.)でリンスした。ろ液をインラインフィルターを通して再びろ過し、EtOAc/iPrOAc 1:1(1.5vol.)でリンスした。1M NaOAc水溶液(5.0vol.)を27℃にて添加し、層を分離した。水相をEtOAc/iPrOAc 1:1(5.0vol.)で洗浄した。水相を、0.5M H2SO4水溶液(2.35vol.)を用いて2.5hにわたってpH5.8に酸性化し、結晶化させた。20℃にて1h撹拌した後、懸濁液をろ過し、水(2x10vol.)で洗浄した。固体を、20℃にて、水中で、それぞれ3時間2回スラリー化し(2x10vol.)、ろ過し、水(10vol.)で洗浄し、乾燥して、D形の{5-(4-ブロモ-フェニル)-6-[2-(5-ブロモ-ピリミジン-2-イルオキシ)-エトキシ]-ピリミジン-4-イル}-スルファミドを得た。
A形の{5-(4-ブロモ-フェニル)-6-[2-(5-ブロモ-ピリミジン-2-イルオキシ)-エトキシ]-ピリミジン-4-イル}-スルファミドを、10体積のMeCN中で加熱還流した。10min後、(加熱浴を除いて)それを1h以内に20℃に冷却した。ろ過し、減圧下、45℃で乾燥した。固体残差は、E形の{5-(4-ブロモ-フェニル)-6-[2-(5-ブロモ-ピリミジン-2-イルオキシ)-エトキシ]-ピリミジン-4-イル}-スルファミドのMeCN溶媒和物であった。
{5-(4-ブロモ-フェニル)-6-[2-(5-ブロモ-ピリミジン-2-イルオキシ)-エトキシ]-ピリミジン-4-イル}-スルファミドのDCM溶媒和物、B形(9.4g、17.2mmol、1.00eq.)を、DMSO(19mL、2vol.)中に溶解した。溶液をH2O(94mL、10vol.)中に添加し、rtにて5min撹拌した。得られた懸濁液をろ過し、H2Oで2回洗浄し(2x94mL、2x10vol
.)、乾燥して、J形の{5-(4-ブロモ-フェニル)-6-[2-(5-ブロモ-ピリミジン-2-イルオキシ)-エトキシ]-ピリミジン-4-イル}-スルファミドを白色の固体として得た(6.8g、収率72%)。
7.1. {5-(4-ブロモ-フェニル)-6-[2-(5-ブロモ-ピリミジン-2-イルオキシ)-エトキシ]-ピリミジン-4-イル}-スルファミド、A形(1.00g、1.83mmol、1.00eq.)をDMSO(2mL、2vol.)中に溶解した。この溶液に、DMSO中の10%H2O(10mL、10vol.)をゆっくりと添加し、次いで純粋なH2O(2mL、2vol.)を添加した。K形でシードすることにより、化合物の結晶化が始まった。懸濁液をろ過し、H2O(5x10mL、5x10vol.)で洗浄し、乾燥して、K形の{5-(4-ブロモ-フェニル)-6-[2-(5-ブロモ-ピリミジン-2-イルオキシ)-エトキシ]-ピリミジン-4-イル}-スルファミド、DMSO溶媒和物を白色の固体として得た(0.95g、収率95%)。
K形の{5-(4-ブロモ-フェニル)-6-[2-(5-ブロモ-ピリミジン-2-イルオキシ)-エトキシ]-ピリミジン-4-イル}-スルファミドのDMSO溶媒和物(100mg、0.183mmol、1.00eq.)を、EtOH(0.5mL、5vol.)中で、rtにて4hスラリー化した。懸濁液をろ過し、H2Oで2回洗浄し(2x0.5mL、2x5vol.)、乾燥して、L形の{5-(4-ブロモ-フェニル)-6-[2-(5-ブロモ-ピリミジン-2-イルオキシ)-エトキシ]-ピリミジン-4-イル}-スルファミドのEtOH溶媒和物を白色の固体として得た(40mg、収率40%)。
それぞれが50mgのACT-132577を含有する錠剤は、湿式造粒法を用いて製造することができる。錠剤の組成は下記の通りである:
実施例9の錠剤は、Aquapolish(登録商標)、白色MS又はAquapolish(登録商標)、白色PVA(被覆材製造元:Biogrund)の層で被覆することができる。
それぞれが50mgのACT-132577を含有する錠剤は、湿式造粒法を用いて製造することができる。錠剤の組成は下記の通りである:
実施例11の錠剤は、Aquapolish(登録商標)、白色MS又はAquapolish(登録商標)、白色PVA(被覆材製造元:Biogrund)の層で被覆することができる。
それぞれが12.5mgのACT-132577を含有する錠剤は、湿式造粒法を用いて製造することができる。錠剤の組成は下記の通りである:
実施例13の錠剤は、Aquapolish(登録商標)、白色MS又はAquapolish(登録商標)、白色PVA(被覆材製造元:Biogrund)の層で被覆することができる。
それぞれが12.5mgのACT-132577を含有する錠剤は、湿式造粒法を用いて製造することができる。錠剤の組成は下記の通りである:
実施例15の錠剤は、Aquapolish(登録商標)、白色MS又はAquapolish(登録商標)、白色PVA(被覆材製造元:Biogrund)の層で被覆することができる。
実施例17:室温での貯蔵
(上記実施例1に従って得られた)「化合物」のA形結晶のサンプルを、20~25℃の温度、92%の相対湿度で2か月間貯蔵した。2か月の終了時にサンプルに対して行った粉末X線回折により、サンプルはなお「化合物」のA形結晶のみからなることがわかった。上記の条件下で8週間貯蔵した後においても同じ結果が得られた。8週間貯蔵した後のサンプルのHPLCコントロールにより、ピーク面積%の有意な変化は観られず、すなわち、そのような条件下において有意な劣化は観察されなかった。
A形は、重量測定蒸気吸着(GVS)による測定から、わずかに吸湿性であると考えられる。実施例1に従って得られたサンプルの質量増加は、40%のr.h.から80%のr.h.の第1サイクルにおいて、0.4%に相当する。95%のr.h.では、2.2%の水分が、乾燥時にヒステリシスを起こすことなく可逆的に吸着された。
実施例A: ダール食塩感受性ラットにおけるACT-132577の急性効果
血圧、特に平均動脈圧(以下、「MAP」と記載する。)、及び心拍数(以下、「HR」と記載する。)に対するACT-132577の急性効果を、覚醒雄性高血圧ダール食塩感受性ラット(以下、「Dahl-Sラット」と記載する。このモデルの詳細については、Rapp、Hypertension(1982)、4、753-763を参照されたい。)内における遠隔測定(telemetry)により評価した。
血圧、特に平均動脈圧(以下、「MAP」と記載する。)、及び心拍数(以下、「HR」と記載する。)に対するACT-132577の急性効果を、覚醒雄性高血圧デオキシコルチコステロンアセタート食塩ラット(以下、「DOCA塩ラット」と記載する。このモデルの詳細については、Gavrasら、Circ.Res.(1975)、36、300-309を参照されたい。)内における遠隔測定により評価した。
血圧、特に平均動脈圧(以下、「MAP」と記載する。)、及び心拍数(以下、「HR」と記載する。)に対するACT-132577の急性効果を、覚醒雄性高血圧自然発症ラット(以下、「SHR」と記載する。このモデルの詳細については、Atanurら、Genome Res.(2010)、20、791-803を参照されたい。)内における遠隔測定により評価した。
10、30、100及び300mg/kg)のそれぞれについて、4~6匹のSHRの群を用いた。ACT-132577のHR及びMAPに対する効果は、投与前の24hの間に対して、個々の動物について算出した。MAPに関して得られた結果(連続する6時間にわたって観察された最大MAP減少)を図11に要約する(データは平均±平均の標準誤差として示す。)。要約すると、100mg/kgの用量で、ACT-132577は、SHRにおいてMAPを18±4mmHg減少させた。MAPとは対照的に、HRは影響を受けなかった。
100mg/kgの用量で単回経口投与した場合の、血圧、特に平均動脈圧(以下、「MAP」と記載する。)、及び心拍数(以下、「HR」と記載する。)に対するACT-132577の急性効果を、ACT-132577を単独で使用した場合、又は、10mg/kgの用量で単回経口投与したバルサルタンと組み合わせて使用した場合について、覚醒雄性高血圧自然発症ラット(以下、「SHR」と記載する。このモデルの詳細については、Atanurら、Genome Res.(2010)、20、791-803を参照されたい。)内における遠隔測定により評価した。
10mg/kgの用量で単回経口投与した場合の、血圧、特に平均動脈圧(以下、「MAP」と記載する。)、及び心拍数(以下、「HR」と記載する。)に対するACT-132577の急性効果を、ACT-132577を単独で使用した場合、又は、30mg/kgの用量で単回経口投与したバルサルタンと組み合わせて使用した場合について、覚醒雄性高血圧デオキシコルチコステロンアセタート食塩ラット(以下、「DOCA塩ラット」と記載する。このモデルの詳細については、Gavrasら、Circ.Res.(1975)、36、300-309を参照されたい。)内における遠隔測定により評価した。
100mg/kgの用量で単回経口投与した場合の、血圧、特に平均動脈圧(以下、「MAP」と記載する。)、及び心拍数(以下、「HR」と記載する。)に対するACT-132577の急性効果を、ACT-132577を単独で使用した場合、又は、3mg/kgの用量で単回経口投与したエナラプリルと組み合わせて使用した場合について、覚醒雄性高血圧自然発症ラット(以下、「SHR」と記載する。このモデルの詳細については、Atanurら、Genome Res.(2010)、20、791-803を参照されたい。)内における遠隔測定により評価した。
10mg/kgの用量で単回経口投与した場合の、血圧、特に平均動脈圧(以下、「MAP」と記載する。)、及び心拍数(以下、「HR」と記載する。)に対するACT-132577の急性効果を、ACT-132577を単独で使用した場合、又は、1mg/kgの用量で単回経口投与したアムロジピンと組み合わせて使用した場合について、覚醒雄性高血圧デオキシコルチコステロンアセタート食塩ラット(以下、「DOCA塩ラット」と記載する。このモデルの詳細については、Gavrasら、Circ.Res.(1975)、36、300-309を参照されたい。)内における遠隔測定により評価した。
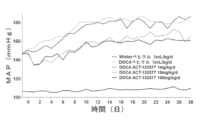
ACT-132577を1、10及び100mg/kg/日の用量で繰り返し投与した場合の慢性効果、特に平均動脈圧(以下、「MAP」と記載する。)及び心拍数(以下、「HR」と記載する。)を、覚醒雄性高血圧デオキシコルチコステロンアセタート食塩ラット(以下、「DOCA塩ラット」と記載する。このモデルの詳細については、Gavrasら、Circ.Res.(1975)、36、300-309を参照されたい。)において評価した。片側腎摘出、鉱質コルチコイドアナログであるDOCAのペレットの移植及び飲料水中への1%の塩化ナトリウムの供給を併用することにより、DOCA塩ラット
に高血圧を誘発する。ACT-132577で処置したDOCA塩ラットの結果を、ベヒクル(4%ゼラチン水溶液)のみを与えられたWistar系ラット又はDOCA塩ラットについて得られた結果と比較した。
- 「*」は、一元配置分散分析(one way ANOVA)、次いでNewmal-Keuls多重比較事後検定(Newmal-Keuls multiple comparisons post-hoc test)を用いた場合の、統計的有意性因子(statistical significance factor)、p<0.05を示す。
ACT-132577の効果は糖尿病のげっ歯類モデルで評価することができる(これに関しては、下記の参考文献に記載のモデルを参照されたい:Senら、Life Sci.(2012)、91(13-14)、658-668;Janiakら、Eur.J.Pharmacol.(2006)、534、271-279;及びIglarzら、J.Pharmacol.Exp.Ther.(2008)、327(3)、736-745)。特に、ACT-132577を単独又は組み合わせて使用した場合の、耐糖能、インスリン血症及び終末器官損傷に対する効果を調べることができる。終末器官損傷は:血管機能、腎機能(例えば、タンパク尿)、心機能及びリモデリング並びに糖尿病により影響を受けるいかなる他の標的器官(例えば、眼)をも包含する。
ヘマトクリット(Hct)又はヘモグロビンの減少が、血漿体積の増大に続いて2次的に起こり、体液貯留のマーカーとして使用することができる。アプロシテンタン(1-30mg/kg)又はベヒクル(ゼラチン)を、雄性Wistar系ラットに、胃管(gavage)により単回経口投与した。投与から24時間後に、イソフルラン誘発麻酔下で、舌下血を採取した。ヘマトクリットを血液分析器を用いて測定した。ACT-132577はヘマトクリット(Hct)に影響を与えなかったため、体液貯留を引き起こす傾向が低いことが示唆される(図18)。
血圧、特に平均動脈圧(以下、「MAP」と記載する。)、及び心拍数(以下、「HR」と記載する。)に対する、バルサルタンと組み合わせた場合のスピロノラクトン(300mg/kg)の急性効果も、それぞれを単回経口投与した場合について、覚醒雄性高血圧自然発症ラット(以下、「SHR」と記載する。このモデルの詳細については、Atanurら、Genome Res.(2010)、20、791-803を参照されたい。)内における遠隔測定により、実施例Dに記載したものと同様のプロトコルを用いて評価した。
血圧、特に平均動脈圧(以下、「MAP」と記載する。)、及び心拍数(以下、「HR」と記載する。)に対する、バルサルタンと組み合わせた場合のスピロノラクトン(300mg/kg)の急性効果も、それぞれを単回経口投与した場合について、覚醒雄性高血圧デオキシコルチコステロンアセタート食塩ラット(以下、「DOCA塩ラット」と記載する。このモデルの詳細については、Gavrasら、Circ.Res.(1975)、36、300-309を参照されたい。)内における遠隔測定により、実施例Eに記載したものと同様のプロトコルを用いて評価した。
血圧、特に平均動脈圧(以下、「MAP」と記載する。)、及び心拍数(以下、「HR」と記載する。)に対する、バルサルタンと組み合わせた場合のスピロノラクトン(300mg/kg)の急性効果も、それぞれを単回経口投与した場合について、覚醒雄性高血圧自然発症ラット(以下、「SHR」と記載する。このモデルの詳細については、Atanurら、Genome Res.(2010)、20、791-803を参照されたい。)内における遠隔測定により、実施例Fに記載したものと同様のプロトコルを用いて評価した。
EXFORGE HCT(登録商標)(すなわち、バルサルタン/アムロジピン/ヒドロクロロチアジドの固定用量合剤;バルサルタン/アムロジピン/ヒドロクロロチアジドを、それぞれ1.6mg/kg/0.1mg/kg/0.25mg/kgの用量に調整)をACT-132577又はスピロノラクトンと併用した場合の、血圧、特に平均動脈圧(以下、「MAP」と記載する。)、及び心拍数(以下、「HR」と記載する。)に対する急性効果も、覚醒雄性高血圧自然発症ラット(以下、「SHR」と記載する。このモデルの詳細については、Atanurら、Genome Res.(2010)、20、791-803を参照されたい。)内における遠隔測定により評価した。
る薬剤の血圧に対する最大効果に適合させるために、EXFORGE HCT(登録商標)mg/kgの3日間の経口投与に続いて、アプロシテンタン100mg/kgを第3日に経口投与し、また、第1日にスピロノラクトン300mg/kgをEXFORGE HCT(登録商標)と同時経口投与した後、EXFORGE HCT(登録商標)を2日間投与した。MAPに関して得られた結果を図19及び20に要約する。データの各点は6時間の平均である。
血圧、特に平均動脈圧(以下、「MAP」と記載する。)、及び心拍数(以下、「HR」と記載する。)に対する、ACT-132577(10mg/kg)又はスピロノラクトン(300mg/kg)と組み合わせた場合の、EXFORGE HCT(登録商標)(バルサルタン/アムロジピン/ヒドロクロロチアジドを、それぞれ3.2mg/kg/0.2mg/kg/0.5mg/kgの用量に調整)の急性効果も、それぞれを単回経口投与した場合について、覚醒雄性高血圧デオキシコルチコステロンアセタート食塩ラット(以下、「DOCA塩ラット」と記載する。このモデルの詳細については、Gavrasら、Circ.Res.(1975)、36、300-309を参照されたい。)内における遠隔測定により評価した。
Claims (11)
- 有効成分として、アプロシテンタン又はその薬学的に許容される塩を、
- バルサルタンであるアンジオテンシン受容体ブロッカー又はその薬学的に許容される塩;
- アムロジピンであるカルシウムチャンネルブロッカー又はその薬学的に許容される塩;及び
- ヒドロクロロチアジドである利尿剤又はその薬学的に許容される塩;
と組み合わせて有し、さらに少なくとも1種の薬学的に許容される賦形剤を有する、
抵抗性高血圧を含む高血圧、
慢性心不全を含む心不全、
拡張機能障害、又は、
本態性高血圧に起因する若しくは関連するステージ3のCKDを含む慢性腎臓疾患(CKD)の治療用の医薬組成物。 - - アプロシテンタン又はその薬学的に許容される塩を、1日当たり2.5~100mgのアプロシテンタンの経口投与に適切な医薬単位投薬量剤型で有し;
- バルサルタン又はその薬学的に許容される塩を、1日当たり100~320mgのバルサルタンの経口投与に適切な医薬単位投薬量剤型で有し;
- アムロジピン又はその薬学的に許容される塩を、1日当たり2~10mgのアムロジピンの経口投与に適切な医薬単位投薬量剤型で有し;かつ、
- ヒドロクロロチアジド又はその薬学的に許容される塩を、1日当たり5~25mgのヒドロクロロチアジドの経口投与に適切な医薬単位投薬量剤型で有する;
請求項1に記載の医薬組成物。 - 粉末X線回折ダイアグラムにおける以下の屈折角2θ:17.8°、18.6°、20.0°、23.2°及び23.5°におけるピークの存在により特徴づけられる結晶形のアプロシテンタンを有し;当該粉末X線回折ダイアグラムは、Kα2を除去することなく、結合Cu Kα1及びKα2照射を用いて得られ;上記2θ値の精度が2θ+/-0.2°の範囲内である、請求項1又は2に記載の医薬組成物。
- 抵抗性高血圧を含む高血圧、
慢性心不全を含む心不全、
拡張機能障害、若しくは、
本態性高血圧に起因する若しくは関連するステージ3のCKDを含む慢性腎臓疾患(CKD)の治療用の医薬、
又は、高血圧を含む少なくとも1つの他の心血管危険因子を伴う糖尿病を有する患者の主要心血管イベントが進行するリスクの減少において使用するための医薬、
の製造のためのアプロシテンタンの使用又はその薬学的に許容される塩の使用であって、前記医薬が、
- バルサルタンであるアンジオテンシン受容体ブロッカー又はその薬学的に許容される塩;
- アムロジピンであるカルシウムチャンネルブロッカー又はその薬学的に許容される塩;及び
- ヒドロクロロチアジドである利尿剤又はその薬学的に許容される塩;
と組み合わせて使用される、アプロシテンタンの使用又はその薬学的に許容される塩の使用。 - 前記医薬は、アプロシテンタンを、1日当たり2.5~100mgのアプロシテンタンの経口投与に適切な医薬単位投薬量剤型で含有し;
前記医薬は、
1日当たり100~320mgのバルサルタンの経口投与に適切な医薬単位投薬量剤型である、バルサルタン又はその薬学的に許容される塩;
1日当たり2~10mgのアムロジピンの経口投与に適切な医薬単位投薬量剤型である、アムロジピン又はその薬学的に許容される塩;及び
1日当たり5~25mgのヒドロクロロチアジドの経口投与に適切な医薬単位投薬量剤型である、ヒドロクロロチアジド又はその薬学的に許容される塩;
と組み合わせて使用される、
請求項4に記載のアプロシテンタンの使用又はその薬学的に許容される塩の使用。 - 前記医薬が高血圧の治療用である、請求項4又は5に記載のアプロシテンタンの使用又はその薬学的に許容される塩の使用。
- 前記医薬が抵抗性高血圧の治療用である、請求項4又は5に記載のアプロシテンタンの使用又はその薬学的に許容される塩の使用。
- 前記医薬が、本態性高血圧に起因する又は関連するCKDを含む慢性腎臓疾患(CKD)の治療用であり、
前記CKDがステージ1~4であり、
又は、高血圧を含む少なくとも1つの他の心血管危険因子を伴う糖尿病を有する患者の主要心血管イベントが進行するリスクの減少において使用される、
請求項4又は5に記載のアプロシテンタンの使用又はその薬学的に許容される塩の使用。 - アプロシテンタン又はその薬学的に許容される塩を含む降圧剤であって、
前記降圧剤は、
- バルサルタンであるアンジオテンシン受容体ブロッカー又はその薬学的に許容される塩;
- アムロジピンであるカルシウムチャンネルブロッカー又はその薬学的に許容される塩;及び
- アムロジピンであるである利尿剤又はその薬学的に許容される塩;
と組み合わせて使用される、降圧剤。 - 前記降圧剤は、アプロシテンタンを、1日当たり2.5~100mgのアプロシテンタンの経口投与に適切な医薬単位投薬量剤型で含有し;
前記降圧剤は、
1日当たり100~320mgのバルサルタンの経口投与に適切な医薬単位投薬量剤型である、バルサルタン又はその薬学的に許容される塩;
1日当たり2~10mgのアムロジピンの経口投与に適切な医薬単位投薬量剤型である、アムロジピン又はその薬学的に許容される塩;及び
1日当たり5~25mgのヒドロクロロチアジドの経口投与に適切な医薬単位投薬量剤型である、ヒドロクロロチアジド又はその薬学的に許容される塩;
と組み合わせて使用される、
請求項9に記載の降圧剤。 - 前記降圧剤が抵抗性高血圧の治療用である、請求項9又は10に記載の降圧剤。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP2017054489 | 2017-02-27 | ||
| EPPCT/EP2017/054489 | 2017-02-27 | ||
| EP2017061487 | 2017-05-12 | ||
| EPPCT/EP2017/061487 | 2017-05-12 | ||
| PCT/EP2017/078371 WO2018153513A1 (en) | 2017-02-27 | 2017-11-06 | Combinations of a 4-pyrimidinesulfamide derivative with active ingredients for the treatment of endothelin related diseases |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2020508339A JP2020508339A (ja) | 2020-03-19 |
| JP2020508339A5 JP2020508339A5 (ja) | 2020-12-17 |
| JP7223701B2 true JP7223701B2 (ja) | 2023-02-16 |
Family
ID=60268369
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019546291A Active JP7223701B2 (ja) | 2017-02-27 | 2017-11-06 | 4-ピリミジンスルファミド誘導体の、エンドセリン関連疾患治療用の有効成分との合剤 |
| JP2019546286A Pending JP2020508338A (ja) | 2017-02-27 | 2018-02-26 | 4−ピリミジンスルファミド誘導体の結晶形 |
| JP2022201112A Pending JP2023027305A (ja) | 2017-02-27 | 2022-12-16 | 4-ピリミジンスルファミド誘導体の結晶形 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019546286A Pending JP2020508338A (ja) | 2017-02-27 | 2018-02-26 | 4−ピリミジンスルファミド誘導体の結晶形 |
| JP2022201112A Pending JP2023027305A (ja) | 2017-02-27 | 2022-12-16 | 4-ピリミジンスルファミド誘導体の結晶形 |
Country Status (17)
| Country | Link |
|---|---|
| US (5) | US11174247B2 (ja) |
| EP (3) | EP3658140A1 (ja) |
| JP (3) | JP7223701B2 (ja) |
| KR (3) | KR102568472B1 (ja) |
| CN (3) | CN110325186A (ja) |
| AU (2) | AU2017400276B2 (ja) |
| BR (2) | BR112019017658A2 (ja) |
| CA (2) | CA3053991A1 (ja) |
| CL (3) | CL2019002464A1 (ja) |
| IL (3) | IL297993A (ja) |
| MA (2) | MA49664A (ja) |
| MX (3) | MX2019010222A (ja) |
| PH (2) | PH12019501937A1 (ja) |
| SG (3) | SG11201907435PA (ja) |
| TW (2) | TW202330502A (ja) |
| UA (1) | UA126122C2 (ja) |
| WO (2) | WO2018153513A1 (ja) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11174247B2 (en) * | 2017-02-27 | 2021-11-16 | Idorsia Pharmaceuticals Ltd | Combinations of a 4-pyrimidinesulfamide derivative with active ingredients for the treatment of endothelin related diseases |
| EA202091324A1 (ru) * | 2017-11-30 | 2020-10-05 | Идорсия Фармасьютиклз Лтд | Комбинация 4-пиримидинсульфамидного производного с ингибитором sglt-2 для лечения заболеваний, связанных с эндотелином |
| MX2021007455A (es) * | 2018-12-21 | 2021-08-05 | Actelion Pharmaceuticals Ltd | Composicion farmaceutica para el tratamiento de hipertension arterial pulmonar. |
| TW202042818A (zh) | 2019-01-25 | 2020-12-01 | 瑞士商艾克泰聯製藥有限公司 | 用於治療慢性血栓性肺高血壓之醫藥組成物 |
| CN112569357B (zh) * | 2019-09-30 | 2023-03-28 | 深圳奥萨制药有限公司 | 双重内皮素受体拮抗剂与利尿剂的组合物 |
| CN112679441A (zh) * | 2019-10-18 | 2021-04-20 | 普济生物科技(台州)有限公司 | 阿普昔腾坦的晶型、制备方法及其用途 |
| WO2021088645A1 (zh) * | 2019-11-07 | 2021-05-14 | 苏州科睿思制药有限公司 | 一种Aprocitentan晶型及其制备方法和用途 |
| US20230167090A1 (en) | 2020-05-21 | 2023-06-01 | Teva Pharmaceuticals International Gmbh | Solid state forms of aprocitentan and process for preparation thereof |
| BR112023000406A2 (pt) | 2020-07-10 | 2023-01-31 | Astrazeneca Ab | Combinação de zibotentan e dapagliflozina |
| WO2023111797A1 (en) * | 2021-12-17 | 2023-06-22 | Janssen Biotech, Inc. | Pyrimidine sulfamide derivatives and process for manufacturing them |
| WO2023227490A1 (en) | 2022-05-22 | 2023-11-30 | Idorsia Pharmaceuticals Ltd | Aprocitentan for the treatment of hypertension |
| WO2023227721A1 (en) | 2022-05-25 | 2023-11-30 | Idorsia Pharmaceuticals Ltd | Crystalline forms of sodium (5-(4-bromophenyl)-6-(2-((5-bromopyrimidin-2-yl)oxy)ethoxy)pyrimidin-4-yl)(sulfamoyl)amide |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010536742A (ja) | 2007-08-17 | 2010-12-02 | アクテリオン ファーマシューティカルズ リミテッド | 4−ピリミジンスルファミド誘導体 |
| JP2010536880A (ja) | 2007-08-22 | 2010-12-02 | ギリード・コロラド・インコーポレーテッド | 糖尿病の合併症のための療法 |
| JP2017505801A (ja) | 2014-02-14 | 2017-02-23 | アクテリオン ファーマシューティカルズ リミテッドActelion Pharmaceuticals Ltd | ピリミジンスルファミド誘導体の製造方法 |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ATE198551T1 (de) * | 1993-07-15 | 2001-01-15 | Hoffmann La Roche | Pharmazeutische kombination, die einen hemmer des renin-angiotensin-systems und einen endothelin- antagonisten enthält |
| US7094781B2 (en) | 2000-12-18 | 2006-08-22 | Actelion Pharmaceuticals Ltd. | Sulfamides and their use as endothelin receptor antagonists |
| EG24716A (en) | 2002-05-17 | 2010-06-07 | Novartis Ag | Combination of organic compounds |
| US20070196510A1 (en) | 2006-02-17 | 2007-08-23 | Gerber Michael J | Method for treating resistant hypertension |
| EP2029137A2 (en) | 2006-06-15 | 2009-03-04 | Gilead Colorado, Inc. | Antihypertensive therapy method |
| AR061627A1 (es) | 2006-06-27 | 2008-09-10 | Novartis Ag | Formas de dosificacion solidas de valsartan, amlodipina, e hidroclorotiazida, y metodo para elaborarlas |
| CN102614189B (zh) * | 2012-04-17 | 2014-10-22 | 北京哈三联科技股份有限公司 | 含缬沙坦、氨氯地平和氢氯噻嗪的微丸药物组合 |
| EP3215138A4 (en) | 2014-11-07 | 2018-11-21 | AbbVie Inc. | Methods of treating ckd using predictors of fluid retention |
| WO2017185142A1 (en) | 2016-04-29 | 2017-11-02 | Adelaide Research & Innovation Pty Ltd | Method for preventing and/or treating atrial fibrillation |
| US11174247B2 (en) * | 2017-02-27 | 2021-11-16 | Idorsia Pharmaceuticals Ltd | Combinations of a 4-pyrimidinesulfamide derivative with active ingredients for the treatment of endothelin related diseases |
| EA202091324A1 (ru) | 2017-11-30 | 2020-10-05 | Идорсия Фармасьютиклз Лтд | Комбинация 4-пиримидинсульфамидного производного с ингибитором sglt-2 для лечения заболеваний, связанных с эндотелином |
| MX2021007455A (es) * | 2018-12-21 | 2021-08-05 | Actelion Pharmaceuticals Ltd | Composicion farmaceutica para el tratamiento de hipertension arterial pulmonar. |
-
2017
- 2017-11-06 US US16/489,227 patent/US11174247B2/en active Active
- 2017-11-06 CA CA3053991A patent/CA3053991A1/en active Pending
- 2017-11-06 UA UAA201909965A patent/UA126122C2/uk unknown
- 2017-11-06 BR BR112019017658-6A patent/BR112019017658A2/pt unknown
- 2017-11-06 SG SG11201907435PA patent/SG11201907435PA/en unknown
- 2017-11-06 KR KR1020197028199A patent/KR102568472B1/ko active IP Right Grant
- 2017-11-06 EP EP17794712.4A patent/EP3658140A1/en active Pending
- 2017-11-06 AU AU2017400276A patent/AU2017400276B2/en active Active
- 2017-11-06 MX MX2019010222A patent/MX2019010222A/es unknown
- 2017-11-06 KR KR1020237016438A patent/KR20230074610A/ko not_active Application Discontinuation
- 2017-11-06 JP JP2019546291A patent/JP7223701B2/ja active Active
- 2017-11-06 WO PCT/EP2017/078371 patent/WO2018153513A1/en active Application Filing
- 2017-11-06 MA MA049664A patent/MA49664A/fr unknown
- 2017-11-06 CN CN201780087445.XA patent/CN110325186A/zh active Pending
-
2018
- 2018-02-26 SG SG10202111695RA patent/SG10202111695RA/en unknown
- 2018-02-26 JP JP2019546286A patent/JP2020508338A/ja active Pending
- 2018-02-26 BR BR112019017644-6A patent/BR112019017644A2/pt unknown
- 2018-02-26 AU AU2018225309A patent/AU2018225309B2/en active Active
- 2018-02-26 CA CA3053994A patent/CA3053994A1/en active Pending
- 2018-02-26 TW TW111142832A patent/TW202330502A/zh unknown
- 2018-02-26 SG SG11201907604UA patent/SG11201907604UA/en unknown
- 2018-02-26 US US16/489,194 patent/US10919881B2/en active Active
- 2018-02-26 EP EP21202979.7A patent/EP4014976A1/en active Pending
- 2018-02-26 TW TW107106403A patent/TWI786089B/zh active
- 2018-02-26 IL IL297993A patent/IL297993A/en unknown
- 2018-02-26 MX MX2019010221A patent/MX2019010221A/es unknown
- 2018-02-26 CN CN201880014146.8A patent/CN110381948A/zh active Pending
- 2018-02-26 MA MA047596A patent/MA47596A/fr unknown
- 2018-02-26 WO PCT/EP2018/054627 patent/WO2018154101A1/en active Application Filing
- 2018-02-26 EP EP18708945.3A patent/EP3585391A1/en not_active Withdrawn
- 2018-02-26 KR KR1020197028200A patent/KR102577375B1/ko active IP Right Grant
- 2018-02-26 CN CN202311718027.XA patent/CN117946011A/zh active Pending
-
2019
- 2019-08-22 PH PH12019501937A patent/PH12019501937A1/en unknown
- 2019-08-22 IL IL26885219A patent/IL268852A/en unknown
- 2019-08-22 PH PH12019501938A patent/PH12019501938A1/en unknown
- 2019-08-22 IL IL26885019A patent/IL268850A/en unknown
- 2019-08-27 MX MX2021007184A patent/MX2021007184A/es unknown
- 2019-08-27 CL CL2019002464A patent/CL2019002464A1/es unknown
- 2019-08-27 CL CL2019002470A patent/CL2019002470A1/es unknown
-
2020
- 2020-06-30 CL CL2020001762A patent/CL2020001762A1/es unknown
-
2021
- 2021-01-12 US US17/146,801 patent/US11680058B2/en active Active
- 2021-09-10 US US17/472,349 patent/US11787782B2/en active Active
-
2022
- 2022-12-16 JP JP2022201112A patent/JP2023027305A/ja active Pending
-
2023
- 2023-05-17 US US18/319,402 patent/US20230391757A1/en active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010536742A (ja) | 2007-08-17 | 2010-12-02 | アクテリオン ファーマシューティカルズ リミテッド | 4−ピリミジンスルファミド誘導体 |
| JP2010536880A (ja) | 2007-08-22 | 2010-12-02 | ギリード・コロラド・インコーポレーテッド | 糖尿病の合併症のための療法 |
| JP2017505801A (ja) | 2014-02-14 | 2017-02-23 | アクテリオン ファーマシューティカルズ リミテッドActelion Pharmaceuticals Ltd | ピリミジンスルファミド誘導体の製造方法 |
Non-Patent Citations (3)
| Title |
|---|
| Hypertension,2009年,Vol.54,pp.32-39 |
| THE LANCET,2009年,VOL:374, NR:9699,PAGE(S):1423 - 1431 |
| Therapeutic Advances in Cardiovascular Disease,2014年,Vol.8,pp.45-55 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7223701B2 (ja) | 4-ピリミジンスルファミド誘導体の、エンドセリン関連疾患治療用の有効成分との合剤 | |
| TWI809009B (zh) | 用於治療內皮素相關疾病之4-嘧啶磺醯胺衍生物與sglt-2抑制劑之組合 | |
| WO2006002983A1 (en) | Combination of organic compounds | |
| EA043547B1 (ru) | Фармацевтическая композиция, содержащая апроцитентан в комбинации с другими активными ингредиентами, применение апроцитентана во время лечения резистентной артериальной гипертензии в комбинации с другими активными ингредиентами |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A80 | Written request to apply exceptions to lack of novelty of invention |
Free format text: JAPANESE INTERMEDIATE CODE: A801 Effective date: 20190826 Free format text: JAPANESE INTERMEDIATE CODE: A80 Effective date: 20190903 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201104 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20201104 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20210831 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210907 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20211130 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220124 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220304 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220802 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20221026 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20221223 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20230117 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20230206 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7223701 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |