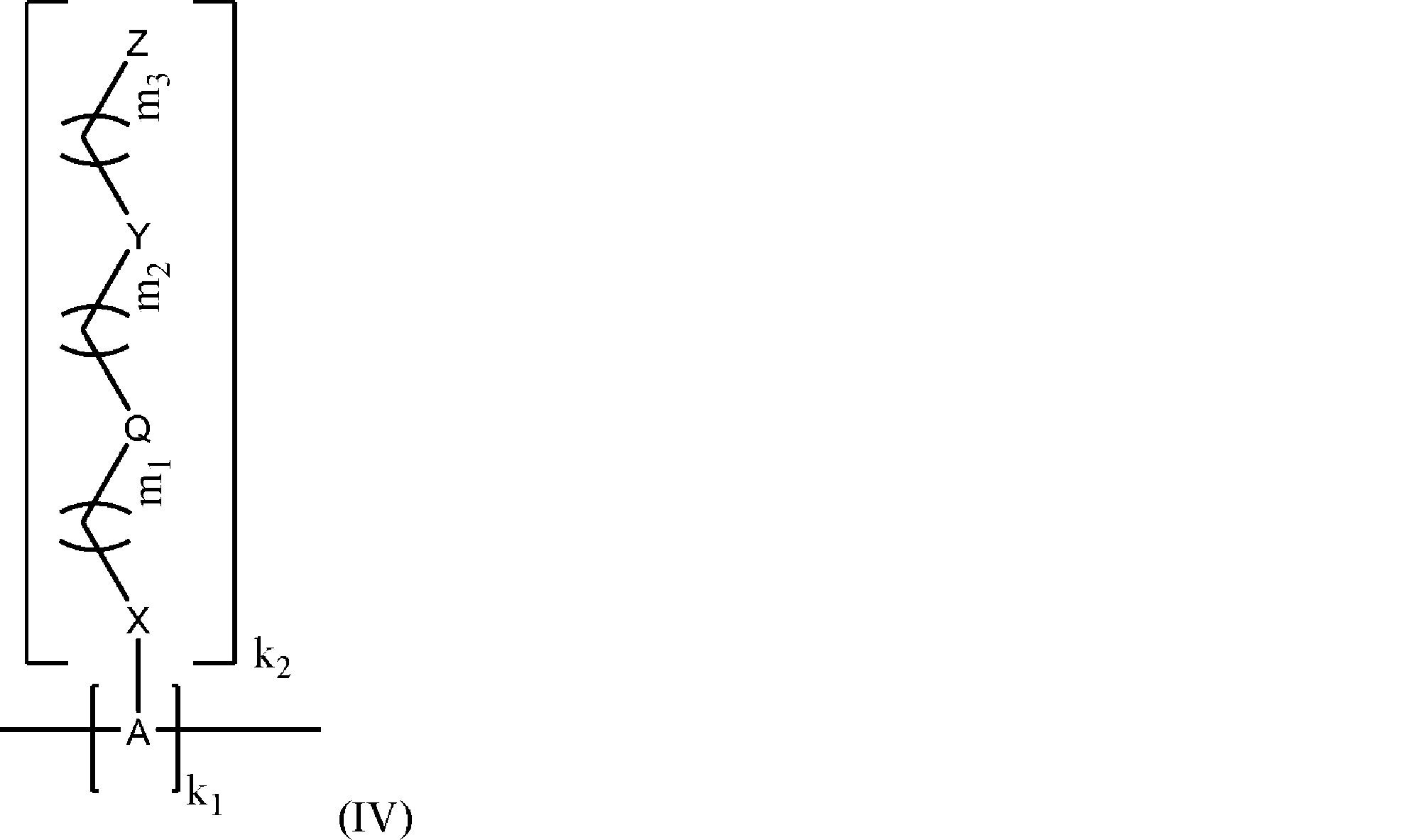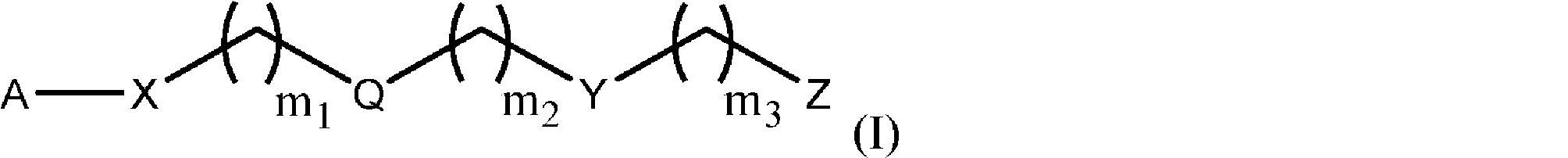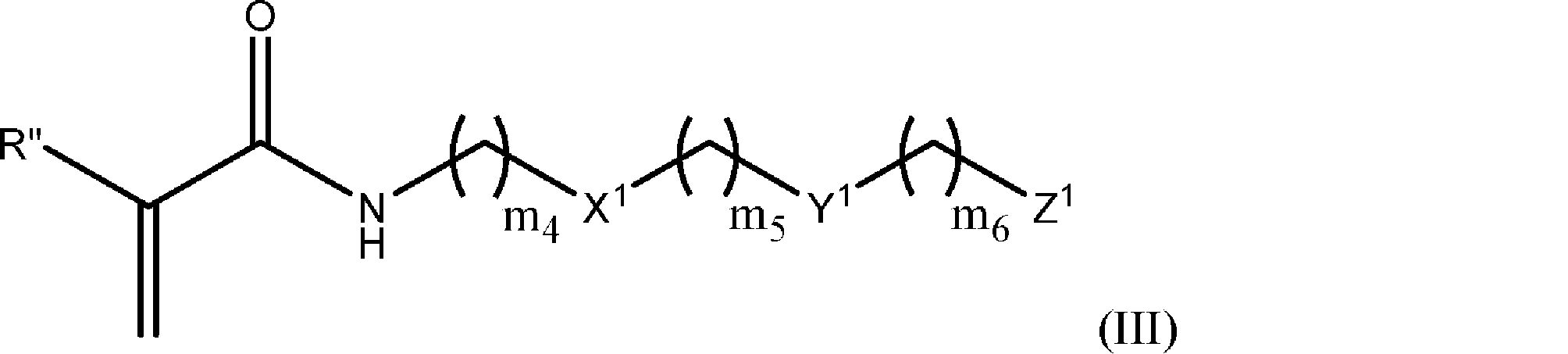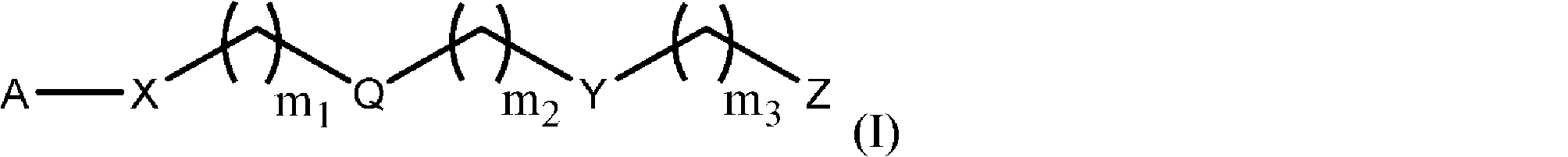JP7198210B2 - 両性イオン性改変ポリマーおよびヒドロゲル - Google Patents
両性イオン性改変ポリマーおよびヒドロゲル Download PDFInfo
- Publication number
- JP7198210B2 JP7198210B2 JP2019540665A JP2019540665A JP7198210B2 JP 7198210 B2 JP7198210 B2 JP 7198210B2 JP 2019540665 A JP2019540665 A JP 2019540665A JP 2019540665 A JP2019540665 A JP 2019540665A JP 7198210 B2 JP7198210 B2 JP 7198210B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- formula
- alkyl
- alkylene
- polymer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/37—Digestive system
- A61K35/39—Pancreas; Islets of Langerhans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/32—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. carbomers, poly(meth)acrylates, or polyvinyl pyrrolidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/34—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyesters, polyamino acids, polysiloxanes, polyphosphazines, copolymers of polyalkylene glycol or poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
- A61K9/0024—Solid, semi-solid or solidifying implants, which are implanted or injected in body tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/06—Ointments; Bases therefor; Other semi-solid forms, e.g. creams, sticks, gels
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4808—Preparations in capsules, e.g. of gelatin, of chocolate characterised by the form of the capsule or the structure of the filling; Capsules containing small tablets; Capsules with outer layer for immediate drug release
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/4866—Organic macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/5021—Organic macromolecular compounds
- A61K9/5031—Organic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, poly(lactide-co-glycolide)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D249/00—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms
- C07D249/02—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms not condensed with other rings
- C07D249/04—1,2,3-Triazoles; Hydrogenated 1,2,3-triazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H15/00—Compounds containing hydrocarbon or substituted hydrocarbon radicals directly attached to hetero atoms of saccharide radicals
- C07H15/02—Acyclic radicals, not substituted by cyclic structures
- C07H15/04—Acyclic radicals, not substituted by cyclic structures attached to an oxygen atom of the saccharide radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H15/00—Compounds containing hydrocarbon or substituted hydrocarbon radicals directly attached to hetero atoms of saccharide radicals
- C07H15/02—Acyclic radicals, not substituted by cyclic structures
- C07H15/04—Acyclic radicals, not substituted by cyclic structures attached to an oxygen atom of the saccharide radical
- C07H15/08—Polyoxyalkylene derivatives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H7/00—Compounds containing non-saccharide radicals linked to saccharide radicals by a carbon-to-carbon bond
- C07H7/02—Acyclic radicals
- C07H7/033—Uronic acids
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08B—POLYSACCHARIDES; DERIVATIVES THEREOF
- C08B37/00—Preparation of polysaccharides not provided for in groups C08B1/00 - C08B35/00; Derivatives thereof
- C08B37/006—Heteroglycans, i.e. polysaccharides having more than one sugar residue in the main chain in either alternating or less regular sequence; Gellans; Succinoglycans; Arabinogalactans; Tragacanth or gum tragacanth or traganth from Astragalus; Gum Karaya from Sterculia urens; Gum Ghatti from Anogeissus latifolia; Derivatives thereof
- C08B37/0084—Guluromannuronans, e.g. alginic acid, i.e. D-mannuronic acid and D-guluronic acid units linked with alternating alpha- and beta-1,4-glycosidic bonds; Derivatives thereof, e.g. alginates
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F116/00—Homopolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and at least one being terminated by an alcohol, ether, aldehydo, ketonic, acetal or ketal radical
- C08F116/02—Homopolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and at least one being terminated by an alcohol, ether, aldehydo, ketonic, acetal or ketal radical by an alcohol radical
- C08F116/04—Acyclic compounds
- C08F116/06—Polyvinyl alcohol ; Vinyl alcohol
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F16/00—Homopolymers and copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and at least one being terminated by an alcohol, ether, aldehydo, ketonic, acetal or ketal radical
- C08F16/02—Homopolymers and copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and at least one being terminated by an alcohol, ether, aldehydo, ketonic, acetal or ketal radical by an alcohol radical
- C08F16/04—Acyclic compounds
- C08F16/06—Polyvinyl alcohol ; Vinyl alcohol
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F220/00—Copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and only one being terminated by only one carboxyl radical or a salt, anhydride ester, amide, imide or nitrile thereof
- C08F220/02—Monocarboxylic acids having less than ten carbon atoms; Derivatives thereof
- C08F220/52—Amides or imides
- C08F220/54—Amides, e.g. N,N-dimethylacrylamide or N-isopropylacrylamide
- C08F220/60—Amides, e.g. N,N-dimethylacrylamide or N-isopropylacrylamide containing nitrogen in addition to the carbonamido nitrogen
- C08F220/603—Amides, e.g. N,N-dimethylacrylamide or N-isopropylacrylamide containing nitrogen in addition to the carbonamido nitrogen and containing oxygen in addition to the carbonamido oxygen and nitrogen
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F220/00—Copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and only one being terminated by only one carboxyl radical or a salt, anhydride ester, amide, imide or nitrile thereof
- C08F220/02—Monocarboxylic acids having less than ten carbon atoms; Derivatives thereof
- C08F220/52—Amides or imides
- C08F220/54—Amides, e.g. N,N-dimethylacrylamide or N-isopropylacrylamide
- C08F220/60—Amides, e.g. N,N-dimethylacrylamide or N-isopropylacrylamide containing nitrogen in addition to the carbonamido nitrogen
- C08F220/606—Amides, e.g. N,N-dimethylacrylamide or N-isopropylacrylamide containing nitrogen in addition to the carbonamido nitrogen and containing other heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F8/00—Chemical modification by after-treatment
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L29/00—Compositions of homopolymers or copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and at least one being terminated by an alcohol, ether, aldehydo, ketonic, acetal or ketal radical; Compositions of hydrolysed polymers of esters of unsaturated alcohols with saturated carboxylic acids; Compositions of derivatives of such polymers
- C08L29/02—Homopolymers or copolymers of unsaturated alcohols
- C08L29/04—Polyvinyl alcohol; Partially hydrolysed homopolymers or copolymers of esters of unsaturated alcohols with saturated carboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L5/00—Compositions of polysaccharides or of their derivatives not provided for in groups C08L1/00 or C08L3/00
- C08L5/04—Alginic acid; Derivatives thereof
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Polymers & Plastics (AREA)
- Diabetes (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Inorganic Chemistry (AREA)
- Biomedical Technology (AREA)
- General Chemical & Material Sciences (AREA)
- Biotechnology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Materials Engineering (AREA)
- Neurosurgery (AREA)
- Dermatology (AREA)
- Endocrinology (AREA)
- Emergency Medicine (AREA)
- Hematology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Obesity (AREA)
- Genetics & Genomics (AREA)
- Crystallography & Structural Chemistry (AREA)
- Cell Biology (AREA)
- Virology (AREA)
- Nutrition Science (AREA)
- Physiology (AREA)
- Developmental Biology & Embryology (AREA)
- Immunology (AREA)
- Gastroenterology & Hepatology (AREA)
Description
本発明は、両性イオン性モノマー、ポリマー、およびヒドロゲル、ならびに、生体材料をコーティングおよび/またはカプセル化するためのこれらの使用に関する。
多くの進歩した治療的細胞処置が近年開発されているが、1型糖尿病(T1D)は、依然として、世界中で100万を超える人々を襲って世界的に蔓延している。ランゲルハンス島移植は、T1Dの処置の代替かつ有望なアプローチとして考えられてきた。しかし、病院での膵島移植は、ドナー膵島の不足および長期の免疫抑制という2つの主な障壁によって制限される。近年、ヒト幹細胞由来のベータ細胞が開発されており、インスリン産生細胞の制限されない供給を生じさせる経路を提供している。そのため、膵島をカプセル化してかかる膵島を宿主免疫反応から効果的に保護する新規の材料または医療デバイスの開発が重要な要求となっている。
のモノマーであって、
式中
Aは、サッカリド含有単位およびポリビニルアルコール含有単位から選択され;
Xは、O、NH、NR’、C(O)、およびC1~20アルキレンからなる群から選択され、ここで、C1~20アルキレンが、OH、ハロゲン、シアノ、-CF3、およびC1~6アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回任意選択的に置換されており;
Qは、存在しないか、またはリンカーであり;
Yは、
からなる群から選択され;
Zは、
からなる群から選択され;
m1は、0~50であり;
m2は、0~50であり;
m3は、0~50であり;
Rは、C1~20アルキルであり;
R’は、-C(O)-C1~6アルケンであり;
R1は、C1~20アルキルであり;
R2は、C1~20アルキルであり;
R3は、C1~20アルキルである;
上記モノマーに関する。
のポリマーであって、
式中
Aは、ポリマーの各モノマー単位について、サッカリド含有単位およびポリビニルアルコール含有単位から独立して選択され;
Xは、O、NH、NR’、C(O)、およびC1~20アルキレンからなる群から選択され、ここで、C1~20アルキレンが、OH、ハロゲン、シアノ、-CF3、およびC1~6アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回任意選択的に置換されており;
Qは、存在しないか、またはリンカーであり;
Yは、
からなる群から選択され;
Zは、
からなる群から選択され;
m1は、0~50であり;
m2は、0~50であり;
m3は、0~50であり;
Rは、C1~20アルキルであり;
R’は、-C(O)-C1~6アルケンであり;
R1は、C1~20アルキルであり;
R2は、C1~20アルキルであり;
R3は、C1~20アルキルであり、
k1は、任意の整数であり;
k2は、各モノマー単位について0または1から独立して選択されるが、ただし、少なくとも1つのk2が1であり;
ポリマーのモノマー単位は、同じまたは異なっている;
上記ポリマーに関する。
の1以上のモノマーを含み、
式(II):
の1以上のモノマーをさらに含み、式中
L1は、O、NH、NR’、C(O)、およびC1~20アルキレンからなる群から選択され、ここで、C1~20アルキレンが、OH、ハロゲン、シアノ、-CF3、およびC1~6アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回任意選択的に置換されており;
L2は、存在しないか、または、C1~20アルキレンであり、ここで、C1~20アルキレンが、OH、ハロゲン、シアノ、-CF3、およびC1~6アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回任意選択的に置換されており;
L3は、C1~20アルキレン、C1~20アルケニレン、C3~12シクロアルケニレン、およびアリーレンからなる群から選択され、ここで、アリーレンが、ヘテロアリーレンおよびヘテロシクリレンからなる群からその各出現において独立して選択される置換基によって1~3回任意選択的に置換されており;
R4は、H、SH、N3、C1~6アルキル、C2~20アルケニル、C2~20アルキニル、C3~12シクロアルケニル、C3~12シクロアルキニル、ヘテロアリール、およびヘテロシクリルからなる群から選択され、ここで、C1~6アルキル、C2~20アルケニル、C2~20アルキニル、C3~12シクロアルケニル、C3~12シクロアルキニル、ヘテロアリール、およびヘテロシクリルが、H、OH、ハロゲン、シアノ、-CF3、およびC1~6アルコキシからなる群からその各出現において独立して選択される置換基によって1~3回任意選択的に置換されている;
上記ポリマーに関する。
のモノマーであって、
式中
X1は、存在しないか、または
であり;
Y1は
であり;
Z1は
であり;
m4は、1~50であり;
m5は、0~10であり;
m6は、1~50であり;
R”は、HまたはC1~6アルキルであり;
R4は、C1~20アルキルであり;
R5は、C1~20アルキルであり;
R6は、C1~20アルキルである、
ただし、X1が存在しないとき、Y1は
ではない;
上記モノマーに関する。
[本発明1001]
式(I):
のモノマーであって、
式中、
Aは、サッカリド含有単位およびポリビニルアルコール含有単位から選択され;
Xは、O、NH、NR’、C(O)、およびC 1~20 アルキレンからなる群から選択され、ここで、C 1~20 アルキレンは、OH、ハロゲン、シアノ、-CF 3 、およびC 1~6 アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回任意選択的に置換されており;
Qは、存在しないか、またはリンカーであり;
Yは、
からなる群から選択され;
Zは、
からなる群から選択され;
m 1 は、0~50であり;
m 2 は、0~50であり;
m 3 は、0~50であり;
Rは、C 1~20 アルキルであり;
R’は、-C(O)-C 1~6 アルケンであり;
R 1 は、C 1~20 アルキルであり;
R 2 は、C 1~20 アルキルであり;
R 3 は、C 1~20 アルキルである、
前記モノマー。
[本発明1002]
Aが、単糖、二糖、三糖、およびオリゴ糖からなる群から選択される、本発明1001のモノマー。
[本発明1003]
Aが、置換または非置換のヘキソース、ヘキスロース、ヘキスロン酸、ペントース、ペンツロース、およびペンツロン酸からなる群から選択される単糖である、本発明1001のモノマー。
[本発明1004]
Aが、
からなる群から選択され、
が、AからXへの結合点である、本発明1001のモノマー。
[本発明1005]
Qが、存在しており、C 1~20 アルキレン、C 3~20 シクロアルキレン、アリーレン、ヘテロアリーレン、ヘテロシクレン、-O-C 1~20 アルキレン、ポリ(エチレングリコール)、およびポリペプチドからなる群から選択され;ここで、C 1~20 アルキレン、C 3~20 シクロアルキレン、アリーレン、ヘテロアリーレン、ヘテロシクリレン、または-O-C 1~20 アルキレンは、-OH、ハロゲン、シアノ、-CF 3 、C 1~6 アルキル、およびC 1~6 アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回任意選択的に置換されており;C 1~20 アルキレンは、酸素、窒素、硫黄、および窒素からなる群から選択される1以上のヘテロ原子によって任意選択的に中断されている、本発明1001のモノマー。
[本発明1006]
Qがヘテロアリーレンである、本発明1001のモノマー。
[本発明1007]
Qが
である、本発明1001のモノマー。
[本発明1008]
式(Ia):
を有する、本発明1001のモノマー。
[本発明1009]
式(Ib):
を有する、本発明1001のモノマー。
[本発明1010]
式(Ic):
を有する、本発明1001のモノマー。
[本発明1011]
式(IV):
のポリマーであって、
式中、
Aは、該ポリマーの各モノマー単位について、サッカリド含有単位およびポリビニルアルコール含有単位から独立して選択され;
Xは、O、NH、NR’、C(O)、およびC 1~20 アルキレンからなる群から選択され、ここで、C 1~20 アルキレンは、OH、ハロゲン、シアノ、-CF 3 、およびC 1~6 アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回任意選択的に置換されており;
Qは、存在しないか、またはリンカーであり;
Yは、
からなる群から選択され;
Zは、
からなる群から選択され;
m 1 は、0~50であり;
m 2 は、0~50であり;
m 3 は、0~50であり;
Rは、C 1~20 アルキルであり;
R’は、-C(O)-C 1~6 アルケンであり;
R 1 は、C 1~20 アルキルであり;
R 2 は、C 1~20 アルキルであり;
R 3 は、C 1~20 アルキルであり
k 1 は、任意の整数であり;
k 2 は、各モノマー単位について0または1から独立して選択されるが、ただし、少なくとも1つのk 2 が1であり;
ポリマーの前記モノマー単位は、同じまたは異なっている、
前記ポリマー。
[本発明1012]
Aが、単糖、二糖、またはオリゴ糖含有単位から各出現において独立して選択されるサッカリドである、本発明1011のポリマー。
[本発明1013]
Aが、置換または非置換のヘキソース、ヘキスロース、ヘキスロン酸、ペントース、ペンツロース、およびペンツロン酸からなる群から選択される単糖である、本発明1011のポリマー。
[本発明1014]
Aが、
からなる群から選択され、
が、AからXへの結合点である、本発明1011のポリマー。
[本発明1015]
Qが、存在しており、C 1~20 アルキレン、C 3~20 シクロアルキレン、アリーレン、ヘテロアリーレン、ヘテロシクレン、-O-C 1~20 アルキレン、ポリ(エチレングリコール)、およびポリペプチドからなる群から選択され;ここで、C 1~20 アルキレン、C 3~20 シクロアルキレン、アリーレン、ヘテロアリーレン、ヘテロシクリレン、または-O-C 1~20 アルキレンは、-OH、ハロゲン、シアノ、-CF 3 、C 1~6 アルキル、およびC 1~6 アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回任意選択的に置換されており;C 1~20 アルキレンは、酸素、窒素、硫黄、および窒素からなる群から選択される1以上のヘテロ原子によって任意選択的に中断されている、本発明1011のポリマー。
[本発明1016]
Qがヘテロアリーレンである、本発明1011のポリマー。
[本発明1017]
Qが
である、本発明1011のポリマー。
[本発明1018]
k 1 が5~10,000である、本発明1011のポリマー。
[本発明1019]
式(IVa):
を有する、本発明1011のポリマー。
[本発明1020]
式(IVb):
を有する、本発明1011のポリマー。
[本発明1021]
式(IVc):
を有する、本発明1011のポリマー。
[本発明1022]
ポリマーの1以上のモノマー単位が、
からなる群から独立して選択される、本発明1011のポリマー。
[本発明1023]
2以上の異なるモノマー単位を含む、本発明1011のポリマー。
[本発明1024]
式(I):
の1以上のモノマー単位を含み、
式(II):
の1以上のモノマー単位をさらに含み、
式中、
L 1 は、O、NH、NR’、C(O)、およびC 1~20 アルキレンからなる群から選択され、ここで、C 1~20 アルキレンは、OH、ハロゲン、シアノ、-CF 3 、およびC 1~6 アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回任意選択的に置換されており;
L 2 は、存在しないか、またはC 1~20 アルキレンであり、ここで、C 1~20 アルキレンは、OH、ハロゲン、シアノ、-CF 3 、およびC 1~6 アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回任意選択的に置換されており;
L 3 は、C 1~20 アルキレン、C 1~20 アルケニレン、C 3~12 シクロアルケニレン、およびアリーレンからなる群から選択され、ここで、アリーレンは、ヘテロアリーレンおよびヘテロシクリレンからなる群からその各出現において独立して選択される置換基によって1~3回任意選択的に置換されており;
R 4 は、H、SH、N 3 、C 1~6 アルキル、C 2~20 アルケニル、C 2~20 アルキニル、C 3~12 シクロアルケニル、C 3~12 シクロアルキニル、ヘテロアリール、およびヘテロシクリルからなる群から選択され、ここで、C 1~6 アルキル、C 2~20 アルケニル、C 2~20 アルキニル、C 3~12 シクロアルケニル、C 3~12 シクロアルキニル、ヘテロアリール、およびヘテロシクリルは、H、OH、ハロゲン、シアノ、-CF 3 、およびC 1~6 アルコキシからなる群からその各出現において独立して選択される置換基によって1~3回任意選択的に置換されている、
本発明1011のポリマー。
[本発明1025]
式(IIa):
を有し、
式中、n 1 、n 2 、およびn 3 は任意の整数である、
本発明1024のポリマー。
[本発明1026]
以下:
からなる群から選択され、
式中、n 1 、n 2 、およびn 3 が任意の整数である、
本発明1025のポリマー。
[本発明1027]
n 1 、n 2 、およびn 3 のそれぞれが、5~10,000の整数から独立して選択される、本発明1025のポリマー。
[本発明1028]
本発明1011~1027のポリマーのいずれか1つを含む、ヒドロゲル。
[本発明1029]
本発明1028のヒドロゲルと
該ヒドロゲル中に封入された治療剤と
を含む、カプセル。
[本発明1030]
前記治療剤が細胞調製物を含む、本発明1029のカプセル。
[本発明1031]
前記ヒドロゲル中に封入された細胞調製物をさらに含み、
前記治療剤が、該細胞調製物から放出される作用物質である、
本発明1029のカプセル。
[本発明1032]
前記細胞調製物が膵島の調製物を含む、本発明1031のカプセル。
[本発明1033]
前記治療剤が、治療用のタンパク質、ペプチド、抗体またはその結合断片、抗体模倣薬、核酸、小分子、ホルモン、成長因子、血管新生因子、サイトカイン、抗炎症薬、およびこれらの任意の組み合わせからなる群から選択される、本発明1029のカプセル。
[本発明1034]
本発明1029のカプセルを対象に投与する工程を含む、治療剤を対象に送達する方法。
[本発明1035]
前記投与する工程が、前記カプセルを前記対象に埋め込むことを含む、本発明1034の方法。
[本発明1036]
本発明1032のカプセルを、糖尿病を有する対象に埋め込む工程を含む、糖尿病対象を処置する方法。
[本発明1037]
式(III):
のモノマーであって、
式中、
X 1 は、存在しないか、または
であり;
Y 1 は
であり;
Z 1 は
であり;
m 4 は、1~50であり;
m 5 は、0~10であり;
m 6 は、1~50であり;
R”は、HまたはC 1~6 アルキルであり;
R 4 は、C 1~20 アルキルであり;
R 5 は、C 1~20 アルキルであり;
R 6 は、C 1~20 アルキルであり、
ただし、X 1 が存在しないとき、Y 1 は
ではない、
前記モノマー。
[本発明1038]
式(IIIa):
を有する、本発明1037のモノマー。
[本発明1039]
式(IIIb):
を有する、本発明1037のモノマー。
[本発明1040]
式(IIIc):
を有する、本発明1037のモノマー。
[本発明1041]
以下:
からなる群から選択される、本発明1037のモノマー。
[本発明1042]
式(III):
の架橋モノマーを含む、ポリマーネットワーク。
[本発明1043]
ネットワークの前記架橋モノマーが同じである、本発明1042のポリマーネットワーク。
[本発明1044]
ネットワークの前記架橋モノマーが異なる、本発明1042のポリマーネットワーク。
[本発明1045]
前記モノマーが、カルボキシベタインジアクリルアミド架橋剤(CBAAX)によって架橋されている、本発明1042のポリマーネットワーク。
[本発明1046]
本発明1042のポリマーネットワークを含む、ヒドロゲル。
[本発明1047]
本発明1046のヒドロゲルと
該ヒドロゲル中に封入された治療剤と
を含む、カプセル。
[本発明1048]
前記治療剤が細胞調製物を含む、本発明1047のカプセル。
[本発明1049]
前記ヒドロゲル中に封入された細胞調製物をさらに含み、
前記治療剤が、該細胞調製物から放出される作用物質である、
本発明1047のカプセル。
[本発明1050]
前記細胞調製物が膵島の調製物を含む、本発明1049のカプセル。
[本発明1051]
前記治療剤が、治療用のタンパク質、ペプチド、抗体またはその結合断片、抗体模倣薬、核酸、小分子、ホルモン、成長因子、血管新生因子、サイトカイン、抗炎症薬、およびこれらの任意の組み合わせからなる群から選択される、本発明1047のカプセル。
[本発明1052]
本発明1047のカプセルを対象に投与する工程を含む、治療剤を対象に送達する方法。
[本発明1053]
前記投与する工程が、前記カプセルを前記対象に埋め込むことを含む、本発明1052の方法。
[本発明1054]
本発明1050のカプセルを、糖尿病を有する対象に埋め込む工程を含む、糖尿病対象を処置する方法。
本発明の一態様は、式(I):
のモノマーであって、
式中
Aは、サッカリド含有単位およびポリビニルアルコール含有単位から選択され;
Xは、O、NH、NR’、C(O)、およびC1~20アルキレンからなる群から選択され、ここで、C1~20アルキレンが、OH、ハロゲン、シアノ、-CF3、およびC1~6アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回任意選択的に置換されており;
Qは、任意選択的であり、存在するとき、リンカーであり;
Yは、
からなる群から選択され;
Zは、
からなる群から選択され;
m1は、0~50であり;
m2は、0~50であり;
m3は、0~50であり;
Rは、C1~20アルキルであり;
R’は、-C(O)-C1~6アルケンであり;
R1は、C1~20アルキルであり;
R2は、C1~20アルキルであり;
R3は、C1~20アルキルである;
上記モノマーに関する。
であってよい。
の化学式を含む単位であり、式中、
は、AからXへの結合点であり、
CH2=CH(OH)および
は、任意選択的に置換されていてよい。
のポリマーであって、
式中
Aは、ポリマーの各モノマー単位について、サッカリド含有単位およびポリビニルアルコール含有単位から独立して選択され;
Xは、O、NH、NR’、C(O)、およびC1~20アルキレンからなる群から選択され、ここで、C1~20アルキレンが、OH、ハロゲン、シアノ、-CF3、およびC1~6アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回任意選択的に置換されており;
Qは、存在しないか、またはリンカーであり;
Yは、
からなる群から選択され;
Zは、
からなる群から選択され;
m1は、0~50であり;
m2は、0~50であり;
m3は、0~50であり;
Rは、C1~20アルキルであり;
R’は、-C(O)-C1~6アルケンであり;
R1は、C1~20アルキルであり;
R2は、C1~20アルキルであり;
R3は、C1~20アルキルであり、
k1は、任意の整数であり;
k2は、各モノマー単位について0または1から独立して選択されるが、ただし、少なくとも1つのk2が1であり;
ポリマーのモノマー単位は、同じまたは異なっている;
上記ポリマーを対象とする。
の化学式を含む単位であり、式中、
は、AからXへの結合点であり、-CH2CH(OH)-および
は、任意選択的に置換されていてよい。
の1以上のモノマーを含み、式(II):
の1以上のモノマーをさらに含み、式中、
L1は、O、NH、NR’、C(O)、およびC1~20アルキレンであり、ここで、C1~20アルキレンが、OH、ハロゲン、シアノ、-CF3、およびC1~6アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回任意選択的に置換されており;
L2は、存在しないか、または、C1~20アルキレンであり、ここで、C1~20アルキレンが、OH、ハロゲン、シアノ、-CF3、およびC1~6アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回任意選択的に置換されており;
L3は、C1~20アルキレン、C1~20アルケニレン、C3~12シクロアルケニレン、およびアリーレンからなる群から選択され、ここで、アリーレンが、ヘテロアリーレンおよびヘテロシクリレンからなる群からその各出現において独立して選択される置換基によって1~3回任意選択的に置換されており;
R4は、H、SH、N3、C1~6アルキル、C2~20アルケニル、C2~20アルキニル、C3~12シクロアルケニル、C3~12シクロアルキニル、ヘテロアリール、およびヘテロシクリルからなる群から選択され、ここで、C1~6アルキル、C2~20アルケニル、C2~20アルキニル、C3~12シクロアルケニル、C3~12シクロアルキニル、ヘテロアリール、およびヘテロシクリルが、H、OH、ハロゲン、シアノ、-CF3、およびC1~6アルコキシからなる群からその各出現において独立して選択される置換基によって1~3回任意選択的に置換されている;
ポリマーに関する。
式中、n1、n2およびn3は、任意の整数である。一実施形態において、n1、n2およびn3は、それぞれ、1~10,000の整数から独立して選択される。
のモノマーであって、
式中
X1は、存在しないか、または
であり;
Y1は
であり;
Z1は
であり;
m4は、1~50であり;
m5は、0~10であり;
m6は、1~50であり;
R”は、HまたはC1~6アルキルであり;
R4は、C1~20アルキルであり;
R5は、C1~20アルキルであり;
R6は、C1~20アルキルである、
ただし、X1が存在しないとき、Y1は
ではない;
上記モノマーに関する。
本発明の別の態様は、本明細書に記載されているモノマーおよびポリマーを調製する方法に関する。
スキーム4
スキーム5
のモノマーの調製のためのプロセスに関し、式中
m4は、1~50であり;
m5は、0~10であり;
m6は、1~50であり;
R5は、C1~20アルキルであり;
R6は、C1~20アルキルである。
このプロセスは、式(V):
(式中、PGは好適な保護基である)の化合物を提供することと
式(V)の化合物から式(IIIa’)のモノマーを形成することと
を含む。
の化合物と、式(V)の化合物を生成するのに有効な条件下で反応させることを含む、式(IIIa’)のモノマーの調製のためのプロセスに関する。
(式中、Halはハロゲンである)の化合物と、式(VI)の化合物を生成するのに有効な条件下で反応させることを含む、式(IIIa’)のモノマーの調製のためのプロセスに関する。
の化合物と、式(VII)の化合物を生成するのに有効な条件下で反応させることを含む、式(IIIa’)のモノマーの調製のためのプロセスに関する。
のモノマーの調製のためのプロセスに関し、式中
m4は、1~50であり;
m5は、0~10であり;
m6は、1~50であり;
R5は、C1~20アルキルであり;
R6は、C1~20アルキルである。
このプロセスは、式(XIII):
の化合物を提供することと
式(XIII)の化合物から式(IIIb’)のモノマーを形成することと
を含む。
の化合物と、式(IIIb’)のモノマーを生成するのに有効な条件下で反応させることを含む、式(IIIb’)のモノマーの調製のためのプロセスに関する。
の化合物と、式(XIII)の化合物を生成するのに有効な条件下で反応させることを含む、式(IIIb’)のモノマーの調製のためのプロセスに関する。
の化合物と、式(VII)の化合物を生成するのに有効な条件下で反応させることを含む、式(IIIb’)のモノマーの調製のためのプロセスに関する。
のモノマーの調製のためのプロセスに関し、式中
m4は、1~50であり;
m6は、1~50であり;
R4は、C1~20アルキルである。
このプロセスは、式(XVI):
(式中、PGは好適な保護基である)の化合物を提供することと、
式(XVI)の化合物から式(IIIc’)のモノマーを形成することと
を含む。
R4Hal(XVIII)
の化合物と、式(XVI)の化合物を生成するのに有効な条件下で反応させることを含む、式(IIIc’)のモノマーの調製のためのプロセスに関する。
の化合物と、式(XVII)の化合物を生成するのに有効な条件下で反応させることを含む、式(IIIc’)のモノマーの調製のためのプロセスに関する。
の化合物と、式(VII)の化合物を生成するのに有効な条件下で反応させることを含む、式(IIIc’)のモノマーの調製のためのプロセスに関する。
の化合物の調製のためのプロセスに関し、式中
m1は、1~50であり;
m2は、1~10であり;
R1は、C1~20アルキルであり;
R2は、C1~20アルキルである。
このプロセスは、式(XXI):
(式中、PGは好適な保護基である)の化合物を提供することと
式(XXI)の化合物から式(XXa)の化合物を形成することと
を含む。
の化合物と、式(XXI)の化合物を生成するのに有効な条件下で反応させることを含む、式(XXa)の化合物の調製のためのプロセスに関する。
の化合物の調製のためのプロセスに関し、式中
m1は、1~50であり;
m2は、1~10であり;
R1は、C1~20アルキルであり;
R2は、C1~20アルキルである。
このプロセスは、式(XXV):
(式中、PG*は好適な保護基であり、R4はC1~6アルキルである)の化合物を提供することと
式(XXV)の化合物から式(XXb)の化合物を形成することと
を含む。
(式中、Zはハロゲンである)の化合物と反応させることを含む、式(XXb)の化合物の調製のためのプロセスに関する。
重炭酸ジ-tert-ブチル、トリエチルアミン、N,N-ジメチルエチレンジアミン、塩化バリウム、硫酸マグネシウム、塩化マグネシウム六水和物、HEPES緩衝液、ジエチルエーテル、エチルアルコール、アセトニトリル、およびジクロロメタン(DCM)を、Sigma-Aldrichから得た。2-クロロ-4,6-ジメトキシ-1,3,5-トリアジン(CDMT)、N-メチルモルホリン(NMM)、1,3-プロパンスルトン、およびトリフルオロ酢酸(TFA)をAlfa Aesarから購入した。VLVG(>60% G、25kDa MW)、SLG20(>60% G、75-220kDa MW)、およびSLG100(>60% G、200-300kDa MW)を含めた全てのアルギン酸ナトリウムをFMC BioPolymer Co.(Philadelphia、PA)から購入した。シアノ官能化シリカをSiliCycleから購入した。
重炭酸ジ-tert-ブチル(10.0g、45.8mmol)およびトリエチルアミン(12.8mL、91.6mmol)を、N,N-ジメチルエチレンジアミン(4.04g、45.8mmol)のエチルアルコール(150mL)溶液に0℃で0.5時間にわたって滴加した。混合物を0℃で1時間、次いで室温で18時間撹拌した。白色析出物を濾去し、濾液を蒸発させて残渣を得た。残渣をジクロロメタン(150mL)に溶解し、溶液を水で連続的に洗浄した。有機層を無水硫酸マグネシウム上で乾燥させ、蒸発させて、N,N-ジメチル-2-((ピバロイルオキシ)アミノ)エタン-1-アミンを得た。
N,N-ジメチル-2-((ピバロイルオキシ)アミノ)エタン-1-アミン(40.0mmol)、1、3-プロパンスルトン(4.9g、40.0mmol)、およびアセトニトリル(150mL)を、250mLの丸底フラスコに添加した。混合物を、窒素雰囲気下、40℃で48時間撹拌した。反応後、溶媒をロータリーエバポレータによって除去した。生成物を無水ジエチルエーテルによって析出させ、無水ジエチルエーテルで洗浄して、白色粉末を得た。最後に、10.0gの得られた生成物を20mLのトリフルオロ酢酸(TFA)および20mLのジクロロメタンの混合物によって室温で一晩処理し、ロータリーエバポレータによって濃縮し、無水ジエチルエーテル中で析出させて、白色粉末(スルホベタイン-NH2材料)を得た。
N,N-ジメチル-2-((ピバロイルオキシ)アミノ)エタン-1-アミン(40.0mmol)、ブロモ酢酸tert-ブチル(40.0mmol)、およびアセトニトリル(150mL)を、250mLの丸底フラスコに添加した。混合物を、窒素雰囲気下、40℃で48時間撹拌した。反応後、溶媒をロータリーエバポレータによって除去した。生成物を無水ジエチルエーテルによって析出させ、無水ジエチルエーテルで洗浄して、白色粉末を得た。最後に、10.0gの得られた生成物を40mLのトリフルオロ酢酸(TFA)および40mLのジクロロメタンの混合物によって室温で一晩処理し、ロータリーエバポレータによって濃縮し、無水ジエチルエーテル中で析出させて、白色粉末(カルボキシベタイン-NH2材料)を得た。
VLVGアルギン酸塩(0.5g)を40mlの混合物溶媒(30mlのDI水および10mlのアセトニトリル)に溶解した。2-クロロ-4,6-ジメトキシ-1,3,5-トリアジン(CDMT)(225mg)およびN-メチルモルホリン(NMM)(280μl)を添加した。次いで、0.84gのスルホベタイン-NH2材料を10mlのDI水に溶解し、混合物中に添加した。反応物を55℃で一晩撹拌した。溶媒を減圧下で除去し、固体生成物をDI水に再溶解した。溶液を、シアノ官能化シリカパッドを通して濾過した。これを次いでDI水中の10,000MWCO膜に3日間透析した。最後に、水を減圧下で除去し、スルホベタイン改変アルギン酸塩を得た。カルボキシベタイン改変アルギン酸塩を、スルホベタイン改変アルギン酸塩の手順と同様の手順を使用して合成した。
アルギン酸塩溶液を調製するために、2%(w/v)アルギン酸塩(VLVG、SLG20、またはSLG100)を0.8%(w/v)NaCl溶液に溶解した。2%(w/v)スルホベタイン系アルギン酸塩共役体を0.8%(w/v)NaCl溶液に溶解した。80%(体積基準)のスルホベタイン系アルギン酸塩共役体および20%(体積基準)のSLG100の混合物をブレンドしてスルホベタイン-アルギン酸塩(またはSA)溶液を得た。
マウスに酸素中3%のイソフルランを使用して麻酔をし、手技を通して同じレートで維持した。マウスの腹部の毛を剃り、ベタジンおよびイソプロピルアルコールによって交互に洗浄して、無菌野を作り出した後に手術野に移した。腹部の正中線に沿って約0.5mmの切り込みを作製し、鈍的切開を使用して腹膜を曝した。腹膜を次いで鉗子でつかみ、0.5~1mmの切り込みを白線に沿って作製した。約300μlの容積のマイクロカプセルを次いで無菌ピペット内に投入し、切り込みを通して腹腔内に埋め込んだ。
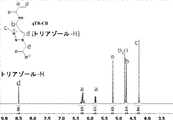
両性イオン性の群の中でも、スルホベタインおよびカルボキシベタインを例として選択した。これらの両性イオン性材料は、優れた付着防止特性を示すことがこれまでに示されている(Zhang et al.,“Superlow Fouling Sulfobetaine and Carboxybetaine Polymers on Glass Slides”,Langmuir 22(24):10072-10077(2006)、全体が参照により本明細書に組み込まれる)。スルホベタイン-NH2およびカルボキシベタイン-NH2モノマーをスキーム6に従って合成した。モノマーの構造を核磁気共鳴(NMR)によって確認し、対応するプロトンの化学シフトを図1A~Bにおいてマーキングした。
スキーム6
プリパルギルアミン、塩化アクリロイル、アジ化ナトリウム、アスコルビン酸ナトリウム、硫酸銅五水和物、ヨードメタン、トリフルオロ酢酸(TFA)、2-クロロ-N,N-ジメチルエチルアミン塩酸塩、1,3-プロパンスルトン、2-ヒドロキシエチルメタクリレート(HEMA)、2-ヒドロキシ-2-メチルプロピオフェノン、リン酸緩衝生理食塩水(PBS)、ジクロロメタン(DCM)、ジメチルスルホキシド(DMSO)、アセトニトリル、ヘキサン、酢酸エチル、ジエチルエーテル、およびエチルアルコールをSigma-Aldrichから購入した。ブロモ酢酸tert-ブチルおよびイオン交換樹脂(Amberlyst A-26、OH形態)をAlfa Aesarから得た。qTR-CB、TR-CB、およびTR-SBモノマーの合成の手順を以下に記載する。カルボキシベタインメタクリレート(CB)(Yang et al.,“Pursuing “Zero” Protein Adsorption of Poly(carboxybetaine) from Undiluted Blood Serum and Plasma“,Langmuir 25(19):11911-11916(2009)、全体が参照により本明細書に組み込まれる)およびカルボキシベタインジアクリルアミド(CBAAX)(Zhang et al.,”Zwitterionic gel Encapsulation Promotes Protein Stability,Enhances Pharmacokinetics,and Reduces Immunogenicity“,Proceedings of the National Academy of Sciences 112(39):12046-12051(2015)、全体が参照により本明細書に組み込まれる)を、これまでに報告されている方法を使用して合成した。
TR-ZWヒドロゲルを、UV照射によって開始されるラジカル重合を介して調製した。ヒドロゲル溶液は、1mLのDI水、600mgのモノマー、4%CBAAX架橋剤(モノマーのモルパーセント)、および3.5mgの2-ヒドロキシ-2-メチルプロピオフェノン光開始剤からなった。得られた溶液を1対のスライドガラス間にキャストし、2mm厚のポリ(テトラフルオロエチレン)(PTFE)スペーサによって分離し、UV(365nm)下で45分間重合した。PHEMAおよびPCBヒドロゲルを、同様の手順を使用して調製した。調製後、全てのヒドロゲルサンプルを無菌のPBS緩衝液中で平衡化し、PBS緩衝液溶液を、5日間、1日に少なくとも3回変更した。埋め込みでは、ヒドロゲルを打ち抜いて6mmの直径を有するディスクにし、これを使用前に無菌のPBS中4℃で保存した。
P(qTR-CB)ポリマーブラシを、これまで報告されている手順に従って、金コーティングされた表面プラズモン共鳴(SPR)センサーチップ上にグラフト化した(Zhang et al.,“Zwitterionic Hydrogels:an in vivo Implantation Study”,Journal of Biomaterials Science,Polymer Edition 20(13):1845-1859(2009)、全体が参照により本明細書に組み込まれる)。P(qTR-CB)グラフト化された金表面におけるタンパク質吸着を、4チャンネルのSPRセンサーを使用して評価した。まず、PBS緩衝液をチャンネルに10分間流入してベースラインを構築した。次いで、1mg/mLのフィブリノゲン溶液または100%のヒト血漿を10分間チャンネルに流通させ、続いて、PBS緩衝液で洗浄して、未結合タンパク質分子を除去した。吸着したタンパク質の量を、吸着前および吸着後のベースライン間の波長シフトの変化によって最終的に定量化した。750nmにおける1nmのSPR波長シフトは、15ng/cm2のタンパク質表面被覆率に相当した(Liu et al.,“Amino Acid-Based Zwitterionic Poly(Serine Methacrylate) as an Antifouling Material”,Biomacromolecules 14(1):226-231(2012)、全体が参照により本明細書に組み込まれる)。P(TR-CB)およびP(TR-SB)表面におけるタンパク質吸着を、同じ手順を使用して評価した。
NIH/3T3細胞を、37℃において5%CO2で、加湿されたインキュベータにおいて培養した。培地は、ダルベッコ改変イーグル培地(DMEM)、10%胎児ウシ血清(FBS)、および2%ペニシリンストレプトマイシンから構成された。直径6mmのヒドロゲルディスクを12ウェルプレート内に個々に置き、無菌のPBS緩衝液で3回洗浄した。細胞懸濁液(2mL)(濃度:105細胞/mL)を次いで各ウェルに移し、これらのヒドロゲルとともに37℃で3日間インキュベートした。インキュベーション後、ヒドロゲルを、各ウェルに無菌のPBSを含む新たな12ウェルプレートに移した。LIVE/DEADアッセイ溶液を各ウェルに添加し、30分間インキュベートした。これらのヒドロゲルを、EVOS AMF4300画像システムを使用することによって最終的に撮像した。
ヒドロゲルサンプルの引張試験をTA instrument DMA Q800動的機械的熱分析(DMTA)において実施した。全ての平衡化したヒドロゲルサンプルを長さ25mm、幅6mm、厚さ2~3mmの矩形状に切断した。ヒドロゲルサンプルを破壊するまで5mm分-1の割合で伸長させた。ヒドロゲルサンプルの圧縮試験および負荷除荷試験を、100NロードセルによるInstron5965において行った。圧縮試験では、直径6mm(PBS緩衝液中で平衡化したとき約2~3mmの厚さ)の各ヒドロゲルディスクを破壊するまで1mm分-1の割合で圧縮した。ヒドロゲルの形状回復特性を0~65%の歪み範囲において1mm分-1の一定のレートで10の連続的な負荷除荷サイクルによって評価した。全てのサンプルを室温で測定した。
骨髄由来マクロファージ(BMDM)を組織培養プレートまたは種々のヒドロゲル表面に106細胞/cm2の細胞密度で播種し、異なる組み合わせ:0.3ng/mL リポ多糖(LPS)(Sigma-Aldrich)、1.0ng/mL IFNγ(R&D systems、Minneapolis、MN)、20ng/mL IL-4(Invitrogen)、および20ng/mL IL-13(Invitrogen)によって刺激した。36時間の刺激後、上清を収集し、製造者の指示(BioLegend、San Diego、CA)に従ってELISA(酵素結合免疫吸着検査法)によってTNF-αおよびIL-10の分泌について分析した。
全ての動物プロトコルは、Cornell Institutional Animal Care and Use Committeeによって承認されたものであった。8週齢の免疫応答性雄性C57BL/6マウスをJackson Laboratoryから得た。平衡化したヒドロゲルディスクを、マウスに、1、2、および3ヶ月間、それぞれ、皮下に埋め込んだ。各マウスについて、異なるモノマーから作製したヒドロゲルディスクをマウスの背部に埋め込み、種々のヒドロゲルサンプルの部位を、埋め込み位置の影響を排除するために変更した。各実験の最後に、マウスをCO2窒息によって安楽死させた。ヒドロゲルディスクを周囲の組織と一緒に切断し、10%中和緩衝ホルマリンで固定した。パラフィンワックスに包埋した後、サンプルを薄片化し、Cornell Histology Core Facilityによるマッソントリクロームによって染色した。染色された組織学的スライドを、Aperio CS2 ScanScope(Leica Biosystems,Nusslock GmbH)を使用して走査した。青色画素密度を、Image Jソフトウェアを使用して測定した。コラーゲン密度を、全ての分析された薄片から求めた平均最大青色画素密度の百分率として定量化した。各サンプルについて、3つの無作為な領域を組織-ヒドロゲル界面から60μm以内の各固定距離(例えば0~10μm;10~20μm;など)において分析した。サンプルサイズはn=5であった。
全てのデータを平均値±標準偏差として提示する。p値が0.05未満であるとき、差を統計的に有意であるとみなした。全ての統計分析にスチューデントt検定を使用した。
N-プロパルギルアクリルアミド(10a)
プリパルギルアミン(3.3g、60mmol)を150mLのDCMに0℃で溶解した。水性NaOH(1.5M、100mL)を次いで溶液中に添加した。塩化アクリロイル(14.9g、165mmol)をより濃厚なジクロロメタン層に30分かけて滴加して、橙黄色溶液を結果として生じた。混合物を0℃で1時間、次いで室温で18時間撹拌した。得られた溶液を水で連続的に洗浄した。有機層を無水硫酸ナトリウム上で乾燥し、蒸発させて黄色油を得た。生成物N-プロパルギルアクリルアミド(4.2g、64%)をシリカゲルカラムクロマトグラフィ(溶出液:酢酸エチル/ヘキサン、1:1、v/v)によって淡黄色固体として得た。
ブロモ酢酸tert-ブチル(15.6g、80mmol)を100mLのDMSOに室温で溶解した。アジ化ナトリウム(NaN3)(6.5g、100mmol)を溶液にゆっくり添加し、70℃で一晩撹拌した。水(150mL)を添加して反応をクエンチし、水層を3×200mLの無水ジエチルエーテルで抽出した。合わせた有機相を塩水によって連続的に洗浄し、無水硫酸ナトリウム上で乾燥させた。有機溶媒を減圧下で除去し、2-アジド酢酸tert-ブチルの生成物(14.2g、90%)を得た。
生成物10a(4.2g、38.4mmol)、生成物15a(6.1g、38.4mmol)、アスコルビン酸ナトリウム(0.76g、3.8mmol)、CuSO4・5H2O(0.96g、3.8mmol)、および100mLのDMSOの混合物を、250mLの丸底フラスコに添加した。混合物を、窒素雰囲気下、60℃で48時間撹拌した。150mLの水を添加して反応をクエンチした。次いで、得られた溶液を酢酸エチルで3回抽出した。合わせた有機層を無水硫酸ナトリウム上で乾燥し、溶媒を減圧下で除去して、粗生成物を得た。生成物16a(8.0g、78%)をシリカゲルカラムクロマトグラフィ(溶出液:酢酸エチル)によってさらに精製した。
生成物16a(8.0g、30mmol)、ヨードメタン(25.6g、180mmol)、およびアセトニトリル(150mL)を、250mLの丸底フラスコに添加した。混合物を、窒素雰囲気下、60℃で48時間撹拌した。反応後、溶媒をロータリーエバポレータによって除去した。得られた生成物を無水ジエチルエーテルによって析出させ、無水ジエチルエーテルで洗浄して、生成物17aの黄褐色の粉末(7.5g、61%)を得た。
得られた生成物17a(7.5g)を15mLのトリフルオロ酢酸(TFA)および15mLのDCMの混合物によって室温で一晩処理し、ロータリーエバポレータによって濃縮し、無水ジエチルエーテル中で析出させ、メタノールに溶解した。イオン交換樹脂(Amberlyst A26、OH形態)をこれに添加し、完全に中和した。残渣を水に溶解し、凍結乾燥機によって凍結乾燥して、生成物qTR-CB(2.2g、54%)を得た。
2-アジド-1-エチル-ジメチルアミン(8a)
NaN3(13.7g、210mmol)を、2-クロロ-N,N-ジメチルエチルアミン塩酸塩(10.0g、70mmol)の100mLの水の溶液に添加し、反応混合物を70℃に一晩加熱した。溶液を4M NaOH溶液によって塩基性化し、無水ジエチルエーテルで3回抽出した。得られた溶液をMgSO4上で乾燥させ、濃縮して、揮発性の無色油(5.9g、74%)を得た。
生成物8a(5.9g、52mmol)、ブロモ酢酸tert-ブチル(12.7g、65mmol)、およびアセトニトリル(100mL)を、250mLの丸底フラスコに添加した。混合物を、窒素雰囲気下、60℃で24時間撹拌した。反応後、溶媒をロータリーエバポレータによって除去した。生成物9aを無水ジエチルエーテルによって析出させ、無水ジエチルエーテルで洗浄して、白色粉末(12.6、79%)を得た。
生成物10a(4.9g、45.1mmol)、生成物9a(12.6g、41.0mmol)、アスコルビン酸ナトリウム(0.8g、4mmol)、CuSO4・5H2O(1.0g、4mmol)、および100mLのメタノールの混合物を、250mLの丸底フラスコに添加した。混合物を、窒素雰囲気下、60℃で48時間撹拌した。反応後、溶媒をロータリーエバポレータによって除去し、粗生成物を無水ジエチルエーテルによって析出させた。生成物11a(11.7g、68%)をシリカゲルカラムクロマトグラフィ(溶出液:メタノール)によってさらに精製した。
得られた生成物11a(8.0g)を16mLのTFAおよび16mLのDCMの混合物によって室温で一晩処理し、ロータリーエバポレータによって濃縮し、無水ジエチルエーテル中で析出させ、メタノールに溶解した。イオン交換樹脂(Amberlyst A26、OH形態)を次いでこれに添加し、完全に中和した。得られた溶液を中性アルミナカラムに添加し、残りの銅イオンを除去した。生成物TR-CB(3.1g、57%)を、メタノール溶媒を除去した後に収集した。
N-((1-(2-(ジメチルアミノ)エチル)-1H-1,2,3-トリアゾール-4-イル)メチル)アクリルアミド(12a)
生成物10a(4.9g、45.1mmol)、生成物8a(4.7g、40mmol)、アスコルビン酸ナトリウム(0.8g、4mmol)、CuSO4・5H2O(1.0g、4mmol)、および100mLのメタノール混合物を、250mLの丸底フラスコに添加した。混合物を、窒素雰囲気下、60℃で48時間撹拌した。反応後、溶媒をロータリーエバポレータによって除去した。生成物12a(8.0g、78%)をシリカゲルカラムクロマトグラフィ(溶出液:酢酸エチル/メタノール、1:1、v/v)によってさらに精製した。
50mLの無水アセトン中の生成物12a(4.5g、20mmol)を室温で撹拌した。1,3-プロパンスルトン(20mmol、2.4g)を溶液に滴加した。反応混合物を、窒素雰囲気下、40℃に6時間加熱した。析出物を収集し、無水アセトンで洗浄して、白色粉末(TR-SB)(2.8g、41%)を得た。
新規の両性イオン性モノマーqTR-CBを設計した(図20A)。このモノマーは、改変アルギン酸塩の抗線維性特性において重要な役割をしかつエネルギー散逸π-πスタッキングを形成するトリアゾール部位を含む。図20Bに示すように、qTR-CBの合成は、いくつかの工程を含んだ。まず、デュアル反応性アルキンおよびビニル基を有するN-プロパルギルアクリルアミドを開発した。次いで、アルキン基をその後アジド-アルキンヒュスゲン環化付加化学を通してトリアゾール基に変換し、続いて、後に4級化した。最後に、qTR-CBモノマーを、カルボン酸の保護基の除去後に得た。qTR-CBモノマーの化学構造を1H NMR(図17)および13C NMRによって確認した。
Claims (19)
- 式(I):
のモノマーであって、
式中、
Aは、サッカリド含有単位およびポリビニルアルコール含有単位から選択され;
Xは、O、NH、NR’、C(O)、およびC1~20アルキレンからなる群から選択され、ここで、C1~20アルキレンは、OH、ハロゲン、シアノ、-CF3、およびC1~6アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回置換されていてもよく;
Qは、存在しないか、またはリンカーであり;
Yは、
であり;
Zは、
からなる群から選択され;
m1は、0~50であり;
m2は、0~50であり;
m3は、0~50であり;
Rは、C1~20アルキルであり;
R’は、-C(O)-C1~6アルケンであり;
R1は、C1~20アルキルであり;
R2は、C1~20アルキルであり;
R3は、C1~20アルキルである、
前記モノマー。 - (a)Aが、単糖、二糖、三糖、およびオリゴ糖からなる群から選択され、
または、Aが、置換または非置換のヘキソース、ヘキスロース、ヘキスロン酸、ペントース、ペンツロース、およびペンツロン酸からなる群から選択される単糖であり、
または、Aが、
からなる群から選択され、
が、AからXへの結合点である;および/または
(b)Qが、存在しており、C1~20アルキレン、C3~20シクロアルキレン、アリーレン、ヘテロアリーレン、ヘテロシクレン、-O-C1~20アルキレン、ポリ(エチレングリコール)、およびポリペプチドからなる群から選択され;ここで、C1~20アルキレン、C3~20シクロアルキレン、アリーレン、ヘテロアリーレン、ヘテロシクリレン、または-O-C1~20アルキレンは、-OH、ハロゲン、シアノ、-CF3、C1~6アルキル、およびC1~6アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回置換されていてもよく;C1~20アルキレンは、酸素、窒素、硫黄、および窒素からなる群から選択される1以上のヘテロ原子によって中断されていてもよく、
または、Qがヘテロアリーレンであり、
または、Qが
である、請求項1に記載のモノマー。 - 式(IV):
のポリマーであって、
式中、
Aは、該ポリマーの各モノマー単位について、サッカリド含有単位およびポリビニルアルコール含有単位から独立して選択され;
Xは、O、NH、NR’、C(O)、およびC1~20アルキレンからなる群から選択され、ここで、C1~20アルキレンは、OH、ハロゲン、シアノ、-CF3、およびC1~6アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回置換されていてもよく;
Qは、存在しないか、またはリンカーであり;
Yは、
であり;
Zは、
からなる群から選択され;
m1は、0~50であり;
m2は、0~50であり;
m3は、0~50であり;
Rは、C1~20アルキルであり;
R’は、-C(O)-C1~6アルケンであり;
R1は、C1~20アルキルであり;
R2は、C1~20アルキルであり;
R3は、C1~20アルキルであり
k1は、任意の整数であり;
k2は、各モノマー単位について0または1から独立して選択されるが、ただし、少なくとも1つのk2が1であり;
ポリマーの前記モノマー単位は、同じまたは異なっている、
前記ポリマー。 - (a)Aが、単糖、二糖、またはオリゴ糖含有単位から各出現において独立して選択されるサッカリドであり、
または、Aが、置換または非置換のヘキソース、ヘキスロース、ヘキスロン酸、ペントース、ペンツロース、およびペンツロン酸からなる群から選択される単糖であり、
または、Aが、
からなる群から選択され、
が、AからXへの結合点である;および/または
(b)Qが、存在しており、C1~20アルキレン、C3~20シクロアルキレン、アリーレン、ヘテロアリーレン、ヘテロシクレン、-O-C1~20アルキレン、ポリ(エチレングリコール)、およびポリペプチドからなる群から選択され;ここで、C1~20アルキレン、C3~20シクロアルキレン、アリーレン、ヘテロアリーレン、ヘテロシクリレン、または-O-C1~20アルキレンは、-OH、ハロゲン、シアノ、-CF3、C1~6アルキル、およびC1~6アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回置換されていてもよく;C1~20アルキレンは、酸素、窒素、硫黄、および窒素からなる群から選択される1以上のヘテロ原子によって中断されていてもよく、
または、Qがヘテロアリーレンであり、
または、Qが
である、請求項4に記載のポリマー。 - 2以上の異なるモノマー単位を含む、および/またはk1が5~10,000である、請求項4~7のいずれか一項に記載のポリマー。
- 式(I):
の1以上のモノマー単位を含み、
式(II):
の1以上のモノマー単位をさらに含み、
式中、
L1は、O、NH、NR’、C(O)、およびC1~20アルキレンからなる群から選択され、ここで、C1~20アルキレンは、OH、ハロゲン、シアノ、-CF3、およびC1~6アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回置換されていてもよく;
L2は、存在しないか、またはC1~20アルキレンであり、ここで、C1~20アルキレンは、OH、ハロゲン、シアノ、-CF3、およびC1~6アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回置換されていてもよく;
L3は、C1~20アルキレン、C1~20アルケニレン、C3~12シクロアルケニレン、およびアリーレンからなる群から選択され、ここで、アリーレンは、ヘテロアリーレンおよびヘテロシクリレンからなる群からその各出現において独立して選択される置換基によって1~3回置換されていてもよく;
R4は、H、SH、N3、C1~6アルキル、C2~20アルケニル、C2~20アルキニル、C3~12シクロアルケニル、C3~12シクロアルキニル、ヘテロアリール、およびヘテロシクリルからなる群から選択され、ここで、C1~6アルキル、C2~20アルケニル、C2~20アルキニル、C3~12シクロアルケニル、C3~12シクロアルキニル、ヘテロアリール、およびヘテロシクリルは、H、OH、ハロゲン、シアノ、-CF3、およびC1~6アルコキシからなる群からその各出現において独立して選択される置換基によって1~3回置換されていてもよく、
または、式(IIa):
を有し、式中、n1、n2、およびn3は任意の整数である、請求項4~8のいずれか一項に記載のポリマー。 - 前記モノマーが、カルボキシベタインジアクリルアミド架橋剤(CBAAX)によって架橋されている、および/または
(i)前記架橋モノマーが同じであるか、もしくは
(ii)前記架橋モノマーが異なる、
請求項13に記載のポリマー。 - 請求項4~9、13および14のいずれか一項に記載のポリマーを含む、ヒドロゲル。
- 請求項15に記載のヒドロゲルと
該ヒドロゲル中に封入された治療剤と
を含む、カプセル。 - (a)前記治療剤が細胞調製物を含む、
または、前記治療剤が、前記ヒドロゲル中に封入された細胞調製物から放出される作用物質である、
または、前記治療剤が細胞調製物を含み、該細胞調製物が膵島の調製物を含む;および/または
(b)前記治療剤が、治療用のタンパク質、ペプチド、抗体またはその結合断片、抗体模倣薬、核酸、小分子、ホルモン、成長因子、血管新生因子、サイトカイン、抗炎症薬、およびこれらの任意の組み合わせからなる群から選択される、
請求項16に記載のカプセル。 - 糖尿病の処置のための薬剤の製造のための、請求項16または17に記載のカプセルの使用。
- 式(IV):
のポリマーであって、
式中、
Aは、該ポリマーの各モノマー単位について、サッカリド含有単位およびポリビニルアルコール含有単位から独立して選択され;
Xは、O、NH、NR’、C(O)、およびC 1~20 アルキレンからなる群から選択され、ここで、C 1~20 アルキレンは、OH、ハロゲン、シアノ、-CF 3 、およびC 1~6 アルコキシからなる群からその各出現において独立して選択される置換基によって1~20回置換されていてもよく;
Qは、リンカーであり;
Yは、
からなる群から選択され;
Zは、
からなる群から選択され;
m 1 は、0~50であり;
m 2 は、0~50であり;
m 3 は、0~50であり;
Rは、C 1~20 アルキルであり;
R’は、-C(O)-C 1~6 アルケンであり;
R 1 は、C 1~20 アルキルであり;
R 2 は、C 1~20 アルキルであり;
R 3 は、C 1~20 アルキルであり
k 1 は、任意の整数であり;
k 2 は、各モノマー単位について0または1から独立して選択されるが、ただし、少なくとも1つのk 2 が1であり;
ポリマーの前記モノマー単位は、同じまたは異なっており、かつ、
からなる群から選択される、前記ポリマー。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762451629P | 2017-01-27 | 2017-01-27 | |
| US62/451,629 | 2017-01-27 | ||
| PCT/US2018/015613 WO2018140834A1 (en) | 2017-01-27 | 2018-01-27 | Zwitterionically modified polymers and hydrogels |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2020506919A JP2020506919A (ja) | 2020-03-05 |
| JP2020506919A5 JP2020506919A5 (ja) | 2021-03-11 |
| JP7198210B2 true JP7198210B2 (ja) | 2022-12-28 |
Family
ID=62978825
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019540665A Active JP7198210B2 (ja) | 2017-01-27 | 2018-01-27 | 両性イオン性改変ポリマーおよびヒドロゲル |
Country Status (14)
| Country | Link |
|---|---|
| US (2) | US11634512B2 (ja) |
| EP (1) | EP3573624B1 (ja) |
| JP (1) | JP7198210B2 (ja) |
| KR (1) | KR102618302B1 (ja) |
| CN (2) | CN118108677A (ja) |
| AU (1) | AU2018212895B2 (ja) |
| BR (1) | BR112019015141A2 (ja) |
| CA (1) | CA3051142A1 (ja) |
| IL (1) | IL267991A (ja) |
| MX (1) | MX2019008388A (ja) |
| RU (1) | RU2019126801A (ja) |
| SG (1) | SG11201906804UA (ja) |
| WO (1) | WO2018140834A1 (ja) |
| ZA (1) | ZA201904624B (ja) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN118108677A (zh) | 2017-01-27 | 2024-05-31 | 康奈尔大学 | 两性离子修饰的聚合物和水凝胶 |
| US20220127421A1 (en) * | 2019-03-05 | 2022-04-28 | University Of Florida Research Foundation, Inc. | Polyurethane copolymers and blends, methods of manufacture thereof and articles containing the same |
| WO2021202945A1 (en) * | 2020-04-02 | 2021-10-07 | Cornell University | Nanofiber-enabled encapsulation devices and uses thereof |
| US12359026B2 (en) * | 2020-05-28 | 2025-07-15 | Mcmaster University | In situ gelling zwitterionic hydrogel compositions, and methods of use thereof |
| KR102413336B1 (ko) * | 2020-07-10 | 2022-06-27 | 부경대학교 산학협력단 | 다공성 알지네이트 기반 하이드로겔, 이의 제조방법 및 이를 이용한 약물 전달체 |
| CN113563267B (zh) * | 2021-07-08 | 2023-05-30 | 深圳华源再生医学有限公司 | 一种磺酸甜菜碱的制备方法及应用 |
| CN113667141B (zh) * | 2021-07-09 | 2023-10-03 | 深圳华源再生医学有限公司 | 抗蛋白粘附的海藻酸盐水凝胶及其制备方法和应用 |
| JP7694952B2 (ja) * | 2021-11-17 | 2025-06-18 | 国立大学法人 奈良先端科学技術大学院大学 | ポリブチレンサクシネート系共重合体 |
| CN114702606A (zh) * | 2022-02-18 | 2022-07-05 | 深圳华源再生医学有限公司 | 一种两性离子修饰的多糖类聚合物及其制备方法与应用 |
| EP4531879A1 (en) | 2022-05-25 | 2025-04-09 | Flagship Pioneering Innovations VI, LLC | Compositions of secretory and/or catalytic cells and methods using the same |
| JP2025520113A (ja) | 2022-06-03 | 2025-07-01 | フラッグシップ パイオニアリング イノベーションズ シックス,エルエルシー | 組成物及び方法 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001510811A (ja) | 1997-07-25 | 2001-08-07 | エスディージー インコーポレイテッド | 生物活性物質を標的に供給するための重合体ベースの薬剤組成物 |
| JP2009514807A (ja) | 2005-10-17 | 2009-04-09 | イサグロ リチェルカ ソシエタ ア レスポンサビリタ リミタータ | 植物病原体の制御のための化合物および関連する使用 |
| JP2012031400A (ja) | 2010-06-30 | 2012-02-16 | Fujifilm Corp | 新規な重合性組成物及びそれに用いる重合性化合物、並びに新規な重合性組成物を用いた画像形成材料及び平版印刷版原版 |
| WO2015057645A1 (en) | 2013-10-14 | 2015-04-23 | The University Of Akron | Zwitterionic polysaccharide polymers having antifouling, antimicrobial and optical transparency properties |
| WO2016138528A1 (en) | 2015-02-27 | 2016-09-01 | Wayne State University | Methods and compositions relating to biocompatible implants |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2744130A (en) * | 1952-04-11 | 1956-05-01 | Du Pont | Quaternary ammonium monomers and polymers thereof |
| US4868121A (en) | 1985-02-07 | 1989-09-19 | Mcdonnell Douglas Corporation | Islet isolation process |
| US5821121A (en) | 1991-06-24 | 1998-10-13 | Pacific Biomedical Research, Inc. | Hormone-secreting cells maintained in long-term culture |
| JPH05148288A (ja) * | 1991-11-29 | 1993-06-15 | Kao Corp | 新規ベタイン化糖化合物 |
| US5273904A (en) | 1992-03-18 | 1993-12-28 | Cobe Laboratories, Inc. | Apparatus for purifying islets of Langerhans |
| DE69739085D1 (de) | 1996-09-19 | 2008-12-18 | Univ Michigan | Polymere enthaltend polysaccharide wie alginate oder modifizierte alginate |
| GB0119665D0 (en) * | 2001-08-10 | 2001-10-03 | Isis Innovation | Conjugates |
| WO2003068357A2 (en) | 2002-02-12 | 2003-08-21 | Cornell Research Foundation, Inc. | Identification and high-yield isolation of human pancreatic islet progenitor and stem cells |
| EP2496550B1 (en) | 2009-11-06 | 2015-08-05 | University Of Washington Through Its Center For Commercialization | Crosslinked zwitterionic hydrogels |
| WO2011160066A1 (en) | 2010-06-17 | 2011-12-22 | Regents Of The University Of Minnesota | Production of insulin producing cells |
| EP2714747B1 (en) | 2011-06-02 | 2020-08-05 | Massachusetts Institute of Technology | Modified alginates for cell encapsulation and cell therapy |
| CZ2012136A3 (cs) | 2012-02-28 | 2013-06-05 | Contipro Biotech S.R.O. | Deriváty na bázi kyseliny hyaluronové schopné tvorit hydrogely, zpusob jejich prípravy, hydrogely na bázi techto derivátu, zpusob jejich prípravy a pouzití |
| US10494538B2 (en) * | 2013-05-30 | 2019-12-03 | The University Of Akron | Switchable antimicrobial and antifouling carboxybetaine-based hydrogels and elastomers with enhanced mechanical properties |
| CN111892589A (zh) * | 2014-01-06 | 2020-11-06 | 理森制药股份公司 | 谷氨酰胺酶抑制剂 |
| KR20240157103A (ko) | 2014-08-01 | 2024-10-31 | 메사추세츠 인스티튜트 오브 테크놀로지 | 항-섬유 물질 및 응용을 위한 변형된 알기네이트 |
| EP3368085B1 (en) | 2015-11-01 | 2024-01-03 | Massachusetts Institute Of Technology | Modified alginates for anti-fibrotic materials and applications |
| CA3027856A1 (en) * | 2016-06-13 | 2017-12-21 | Massachusetts Institute Of Technology | Surface-coated continuous glucose monitors |
| US20190185867A1 (en) | 2016-06-16 | 2019-06-20 | Pioneer Hi-Bred International, Inc. | Compositions and methods to control insect pests |
| CN118108677A (zh) | 2017-01-27 | 2024-05-31 | 康奈尔大学 | 两性离子修饰的聚合物和水凝胶 |
-
2018
- 2018-01-27 CN CN202410053011.XA patent/CN118108677A/zh active Pending
- 2018-01-27 AU AU2018212895A patent/AU2018212895B2/en active Active
- 2018-01-27 CN CN201880017027.8A patent/CN110381956B/zh active Active
- 2018-01-27 WO PCT/US2018/015613 patent/WO2018140834A1/en not_active Ceased
- 2018-01-27 EP EP18744703.2A patent/EP3573624B1/en active Active
- 2018-01-27 SG SG11201906804UA patent/SG11201906804UA/en unknown
- 2018-01-27 BR BR112019015141-9A patent/BR112019015141A2/pt not_active IP Right Cessation
- 2018-01-27 RU RU2019126801A patent/RU2019126801A/ru unknown
- 2018-01-27 CA CA3051142A patent/CA3051142A1/en active Pending
- 2018-01-27 US US16/480,996 patent/US11634512B2/en active Active
- 2018-01-27 KR KR1020197023740A patent/KR102618302B1/ko active Active
- 2018-01-27 MX MX2019008388A patent/MX2019008388A/es unknown
- 2018-01-27 JP JP2019540665A patent/JP7198210B2/ja active Active
-
2019
- 2019-07-11 IL IL267991A patent/IL267991A/en unknown
- 2019-07-15 ZA ZA2019/04624A patent/ZA201904624B/en unknown
-
2023
- 2023-03-16 US US18/122,416 patent/US12378329B2/en active Active
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001510811A (ja) | 1997-07-25 | 2001-08-07 | エスディージー インコーポレイテッド | 生物活性物質を標的に供給するための重合体ベースの薬剤組成物 |
| JP2009514807A (ja) | 2005-10-17 | 2009-04-09 | イサグロ リチェルカ ソシエタ ア レスポンサビリタ リミタータ | 植物病原体の制御のための化合物および関連する使用 |
| JP2012031400A (ja) | 2010-06-30 | 2012-02-16 | Fujifilm Corp | 新規な重合性組成物及びそれに用いる重合性化合物、並びに新規な重合性組成物を用いた画像形成材料及び平版印刷版原版 |
| WO2015057645A1 (en) | 2013-10-14 | 2015-04-23 | The University Of Akron | Zwitterionic polysaccharide polymers having antifouling, antimicrobial and optical transparency properties |
| WO2016138528A1 (en) | 2015-02-27 | 2016-09-01 | Wayne State University | Methods and compositions relating to biocompatible implants |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2018140834A1 (en) | 2018-08-02 |
| RU2019126801A3 (ja) | 2021-05-24 |
| ZA201904624B (en) | 2024-11-27 |
| CN110381956A (zh) | 2019-10-25 |
| KR102618302B1 (ko) | 2023-12-28 |
| EP3573624B1 (en) | 2025-03-19 |
| CA3051142A1 (en) | 2018-08-02 |
| EP3573624A4 (en) | 2020-10-21 |
| IL267991A (en) | 2019-09-26 |
| US20240018276A1 (en) | 2024-01-18 |
| US12378329B2 (en) | 2025-08-05 |
| RU2019126801A (ru) | 2021-03-02 |
| EP3573624A1 (en) | 2019-12-04 |
| MX2019008388A (es) | 2019-12-02 |
| US11634512B2 (en) | 2023-04-25 |
| BR112019015141A2 (pt) | 2020-03-24 |
| CN118108677A (zh) | 2024-05-31 |
| CN110381956B (zh) | 2024-02-02 |
| SG11201906804UA (en) | 2019-08-27 |
| AU2018212895B2 (en) | 2024-02-22 |
| JP2020506919A (ja) | 2020-03-05 |
| US20190389979A1 (en) | 2019-12-26 |
| KR20190109446A (ko) | 2019-09-25 |
| AU2018212895A1 (en) | 2019-08-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7198210B2 (ja) | 両性イオン性改変ポリマーおよびヒドロゲル | |
| AU2019200810B2 (en) | Modified alginates for anti-fibrotic materials and applications | |
| US12053561B2 (en) | Click-crosslinked hydrogels and methods of use | |
| Liu et al. | Developing mechanically robust, triazole-zwitterionic hydrogels to mitigate foreign body response (FBR) for islet encapsulation | |
| Waheed et al. | Cell encapsulation | |
| HK1238663B (en) | Modified alginates for anti-fibrotic materials and applications | |
| HK1238663A1 (en) | Modified alginates for anti-fibrotic materials and applications |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210126 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210126 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210324 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20211216 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20211220 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220301 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220620 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20221026 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20221124 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20221216 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7198210 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |