JP6996772B2 - Icam-1に特異的なiドメインキメラ抗原受容体 - Google Patents
Icam-1に特異的なiドメインキメラ抗原受容体 Download PDFInfo
- Publication number
- JP6996772B2 JP6996772B2 JP2019512782A JP2019512782A JP6996772B2 JP 6996772 B2 JP6996772 B2 JP 6996772B2 JP 2019512782 A JP2019512782 A JP 2019512782A JP 2019512782 A JP2019512782 A JP 2019512782A JP 6996772 B2 JP6996772 B2 JP 6996772B2
- Authority
- JP
- Japan
- Prior art keywords
- cells
- car
- domain
- icam
- cell
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 title claims description 148
- 102000015271 Intercellular Adhesion Molecule-1 Human genes 0.000 title claims 2
- 108010064593 Intercellular Adhesion Molecule-1 Proteins 0.000 title claims 2
- 210000004027 cell Anatomy 0.000 claims description 148
- 206010028980 Neoplasm Diseases 0.000 claims description 91
- 210000001744 T-lymphocyte Anatomy 0.000 claims description 90
- 241000282414 Homo sapiens Species 0.000 claims description 36
- 230000004913 activation Effects 0.000 claims description 24
- 201000011510 cancer Diseases 0.000 claims description 16
- 150000001413 amino acids Chemical class 0.000 claims description 13
- 230000035772 mutation Effects 0.000 claims description 13
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 claims description 10
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 claims description 10
- 108020004707 nucleic acids Proteins 0.000 claims description 7
- 102000039446 nucleic acids Human genes 0.000 claims description 7
- 150000007523 nucleic acids Chemical class 0.000 claims description 7
- 210000004698 lymphocyte Anatomy 0.000 claims description 5
- 210000000822 natural killer cell Anatomy 0.000 claims description 5
- 101710145634 Antigen 1 Proteins 0.000 claims description 4
- -1 ICOS-1 Proteins 0.000 claims description 4
- 101000801234 Homo sapiens Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 claims description 3
- 208000024770 Thyroid neoplasm Diseases 0.000 claims description 3
- 102100033728 Tumor necrosis factor receptor superfamily member 18 Human genes 0.000 claims description 3
- 201000002510 thyroid cancer Diseases 0.000 claims description 3
- 206010006187 Breast cancer Diseases 0.000 claims description 2
- 208000026310 Breast neoplasm Diseases 0.000 claims description 2
- 102100027207 CD27 antigen Human genes 0.000 claims description 2
- 102100029360 Hematopoietic cell signal transducer Human genes 0.000 claims description 2
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 claims description 2
- 101000990188 Homo sapiens Hematopoietic cell signal transducer Proteins 0.000 claims description 2
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 2
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 2
- 238000011467 adoptive cell therapy Methods 0.000 claims description 2
- 206010017758 gastric cancer Diseases 0.000 claims description 2
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 2
- 201000002528 pancreatic cancer Diseases 0.000 claims description 2
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 2
- 201000011549 stomach cancer Diseases 0.000 claims description 2
- 239000008194 pharmaceutical composition Substances 0.000 claims 3
- 108091007741 Chimeric antigen receptor T cells Proteins 0.000 description 60
- 239000000427 antigen Substances 0.000 description 53
- 108091007433 antigens Proteins 0.000 description 53
- 102000036639 antigens Human genes 0.000 description 53
- 230000014509 gene expression Effects 0.000 description 35
- 230000027455 binding Effects 0.000 description 33
- 241000699670 Mus sp. Species 0.000 description 25
- 238000000338 in vitro Methods 0.000 description 25
- 238000011534 incubation Methods 0.000 description 20
- 239000013598 vector Substances 0.000 description 19
- 102000004127 Cytokines Human genes 0.000 description 16
- 108090000695 Cytokines Proteins 0.000 description 16
- 102100025390 Integrin beta-2 Human genes 0.000 description 16
- 230000001965 increasing effect Effects 0.000 description 16
- 230000001988 toxicity Effects 0.000 description 16
- 231100000419 toxicity Toxicity 0.000 description 16
- 108010064548 Lymphocyte Function-Associated Antigen-1 Proteins 0.000 description 15
- 101000599852 Homo sapiens Intercellular adhesion molecule 1 Proteins 0.000 description 14
- 102100025278 Coxsackievirus and adenovirus receptor Human genes 0.000 description 13
- 230000001419 dependent effect Effects 0.000 description 13
- 210000001519 tissue Anatomy 0.000 description 13
- 241000699666 Mus <mouse, genus> Species 0.000 description 12
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 11
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 11
- 102100026878 Interleukin-2 receptor subunit alpha Human genes 0.000 description 11
- 239000011324 bead Substances 0.000 description 11
- 102000006495 integrins Human genes 0.000 description 11
- 108010044426 integrins Proteins 0.000 description 11
- 239000003446 ligand Substances 0.000 description 11
- 238000005259 measurement Methods 0.000 description 11
- 239000002609 medium Substances 0.000 description 11
- 102100037850 Interferon gamma Human genes 0.000 description 10
- 108010074328 Interferon-gamma Proteins 0.000 description 10
- 101000599857 Mus musculus Intercellular adhesion molecule 1 Proteins 0.000 description 10
- 108010076504 Protein Sorting Signals Proteins 0.000 description 10
- 102000043559 human ICAM1 Human genes 0.000 description 10
- 238000003384 imaging method Methods 0.000 description 10
- 230000003993 interaction Effects 0.000 description 10
- 230000002147 killing effect Effects 0.000 description 10
- 108090000623 proteins and genes Proteins 0.000 description 10
- 238000011282 treatment Methods 0.000 description 10
- 241000713666 Lentivirus Species 0.000 description 9
- 239000002158 endotoxin Substances 0.000 description 9
- 238000001727 in vivo Methods 0.000 description 9
- 229920006008 lipopolysaccharide Polymers 0.000 description 9
- 229920001184 polypeptide Polymers 0.000 description 9
- 238000012636 positron electron tomography Methods 0.000 description 9
- 108090000765 processed proteins & peptides Proteins 0.000 description 9
- 102000004196 processed proteins & peptides Human genes 0.000 description 9
- 108090000586 somatostatin receptor 2 Proteins 0.000 description 9
- 102000004052 somatostatin receptor 2 Human genes 0.000 description 9
- 230000008859 change Effects 0.000 description 8
- 238000002347 injection Methods 0.000 description 8
- 239000007924 injection Substances 0.000 description 8
- 238000004020 luminiscence type Methods 0.000 description 8
- 238000000034 method Methods 0.000 description 8
- 230000004083 survival effect Effects 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- 238000004458 analytical method Methods 0.000 description 7
- 230000008901 benefit Effects 0.000 description 7
- 210000004072 lung Anatomy 0.000 description 7
- 238000004806 packaging method and process Methods 0.000 description 7
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- 102100034922 T-cell surface glycoprotein CD8 alpha chain Human genes 0.000 description 6
- 125000000539 amino acid group Chemical group 0.000 description 6
- 231100000135 cytotoxicity Toxicity 0.000 description 6
- 230000003013 cytotoxicity Effects 0.000 description 6
- 238000009826 distribution Methods 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- 102000004169 proteins and genes Human genes 0.000 description 6
- 239000000700 radioactive tracer Substances 0.000 description 6
- 210000002966 serum Anatomy 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
- 230000008685 targeting Effects 0.000 description 6
- 102100025137 Early activation antigen CD69 Human genes 0.000 description 5
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 5
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 description 5
- 108700008625 Reporter Genes Proteins 0.000 description 5
- 230000006044 T cell activation Effects 0.000 description 5
- 239000003814 drug Substances 0.000 description 5
- 239000012091 fetal bovine serum Substances 0.000 description 5
- 238000000684 flow cytometry Methods 0.000 description 5
- 230000006870 function Effects 0.000 description 5
- 239000004816 latex Substances 0.000 description 5
- 229920000126 latex Polymers 0.000 description 5
- 210000004986 primary T-cell Anatomy 0.000 description 5
- 230000001177 retroviral effect Effects 0.000 description 5
- 210000004881 tumor cell Anatomy 0.000 description 5
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 4
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 4
- 108091033409 CRISPR Proteins 0.000 description 4
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 4
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 4
- 238000003556 assay Methods 0.000 description 4
- 210000004369 blood Anatomy 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- 210000004899 c-terminal region Anatomy 0.000 description 4
- 230000022534 cell killing Effects 0.000 description 4
- 230000008029 eradication Effects 0.000 description 4
- 230000003834 intracellular effect Effects 0.000 description 4
- 230000001404 mediated effect Effects 0.000 description 4
- 229960002700 octreotide Drugs 0.000 description 4
- 230000035755 proliferation Effects 0.000 description 4
- 102000005962 receptors Human genes 0.000 description 4
- 108020003175 receptors Proteins 0.000 description 4
- 230000001629 suppression Effects 0.000 description 4
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 4
- 238000010361 transduction Methods 0.000 description 4
- 230000026683 transduction Effects 0.000 description 4
- 239000012114 Alexa Fluor 647 Substances 0.000 description 3
- 102100037877 Intercellular adhesion molecule 1 Human genes 0.000 description 3
- 108010002350 Interleukin-2 Proteins 0.000 description 3
- 102000000588 Interleukin-2 Human genes 0.000 description 3
- 229930182816 L-glutamine Natural products 0.000 description 3
- 241000283973 Oryctolagus cuniculus Species 0.000 description 3
- 238000012879 PET imaging Methods 0.000 description 3
- 230000000259 anti-tumor effect Effects 0.000 description 3
- 238000013459 approach Methods 0.000 description 3
- 238000003501 co-culture Methods 0.000 description 3
- 230000007423 decrease Effects 0.000 description 3
- 229910021645 metal ion Inorganic materials 0.000 description 3
- 239000002245 particle Substances 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- 238000011002 quantification Methods 0.000 description 3
- 230000011664 signaling Effects 0.000 description 3
- 125000006850 spacer group Chemical group 0.000 description 3
- 230000009885 systemic effect Effects 0.000 description 3
- 238000001890 transfection Methods 0.000 description 3
- 241001430294 unidentified retrovirus Species 0.000 description 3
- 210000003462 vein Anatomy 0.000 description 3
- 239000013603 viral vector Substances 0.000 description 3
- 102100025248 C-X-C motif chemokine 10 Human genes 0.000 description 2
- 238000011357 CAR T-cell therapy Methods 0.000 description 2
- 238000010354 CRISPR gene editing Methods 0.000 description 2
- 108010016626 Dipeptides Proteins 0.000 description 2
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 2
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 2
- 108090000331 Firefly luciferases Proteins 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 2
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 2
- 239000012981 Hank's balanced salt solution Substances 0.000 description 2
- 241000545744 Hirudinea Species 0.000 description 2
- 101000858088 Homo sapiens C-X-C motif chemokine 10 Proteins 0.000 description 2
- 101100166600 Homo sapiens CD28 gene Proteins 0.000 description 2
- 108090001005 Interleukin-6 Proteins 0.000 description 2
- 102000004889 Interleukin-6 Human genes 0.000 description 2
- 102000015636 Oligopeptides Human genes 0.000 description 2
- 108010038807 Oligopeptides Proteins 0.000 description 2
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 description 2
- 101150063416 add gene Proteins 0.000 description 2
- 102000006707 alpha-beta T-Cell Antigen Receptors Human genes 0.000 description 2
- 108010087408 alpha-beta T-Cell Antigen Receptors Proteins 0.000 description 2
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium trichloride Chemical compound Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 description 2
- 230000002051 biphasic effect Effects 0.000 description 2
- 230000020411 cell activation Effects 0.000 description 2
- 230000021164 cell adhesion Effects 0.000 description 2
- 238000013170 computed tomography imaging Methods 0.000 description 2
- 230000008602 contraction Effects 0.000 description 2
- 230000000139 costimulatory effect Effects 0.000 description 2
- 230000009260 cross reactivity Effects 0.000 description 2
- 230000009089 cytolysis Effects 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 238000010494 dissociation reaction Methods 0.000 description 2
- 230000005593 dissociations Effects 0.000 description 2
- 239000012636 effector Substances 0.000 description 2
- 210000002889 endothelial cell Anatomy 0.000 description 2
- 210000003743 erythrocyte Anatomy 0.000 description 2
- 230000001747 exhibiting effect Effects 0.000 description 2
- 210000002744 extracellular matrix Anatomy 0.000 description 2
- 239000012467 final product Substances 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 210000004408 hybridoma Anatomy 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- 210000000987 immune system Anatomy 0.000 description 2
- 238000002513 implantation Methods 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000011325 microbead Substances 0.000 description 2
- 210000004925 microvascular endothelial cell Anatomy 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- 238000003752 polymerase chain reaction Methods 0.000 description 2
- XJMOSONTPMZWPB-UHFFFAOYSA-M propidium iodide Chemical compound [I-].[I-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CCC[N+](C)(CC)CC)=C1C1=CC=CC=C1 XJMOSONTPMZWPB-UHFFFAOYSA-M 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 230000008961 swelling Effects 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 231100001274 therapeutic index Toxicity 0.000 description 2
- 108010087967 type I signal peptidase Proteins 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 230000004580 weight loss Effects 0.000 description 2
- 238000002689 xenotransplantation Methods 0.000 description 2
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 1
- DEQANNDTNATYII-OULOTJBUSA-N (4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-19-[[(2r)-2-amino-3-phenylpropanoyl]amino]-16-benzyl-n-[(2r,3r)-1,3-dihydroxybutan-2-yl]-7-[(1r)-1-hydroxyethyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-1,2-dithia-5,8,11,14,17-pentazacycloicosane-4-carboxa Chemical compound C([C@@H](N)C(=O)N[C@H]1CSSC[C@H](NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](CC=2C3=CC=CC=C3NC=2)NC(=O)[C@H](CC=2C=CC=CC=2)NC1=O)C(=O)N[C@H](CO)[C@H](O)C)C1=CC=CC=C1 DEQANNDTNATYII-OULOTJBUSA-N 0.000 description 1
- 101150084750 1 gene Proteins 0.000 description 1
- JHALWMSZGCVVEM-UHFFFAOYSA-N 2-[4,7-bis(carboxymethyl)-1,4,7-triazonan-1-yl]acetic acid Chemical compound OC(=O)CN1CCN(CC(O)=O)CCN(CC(O)=O)CC1 JHALWMSZGCVVEM-UHFFFAOYSA-N 0.000 description 1
- KZMAWJRXKGLWGS-UHFFFAOYSA-N 2-chloro-n-[4-(4-methoxyphenyl)-1,3-thiazol-2-yl]-n-(3-methoxypropyl)acetamide Chemical compound S1C(N(C(=O)CCl)CCCOC)=NC(C=2C=CC(OC)=CC=2)=C1 KZMAWJRXKGLWGS-UHFFFAOYSA-N 0.000 description 1
- HJCMDXDYPOUFDY-WHFBIAKZSA-N Ala-Gln Chemical compound C[C@H](N)C(=O)N[C@H](C(O)=O)CCC(N)=O HJCMDXDYPOUFDY-WHFBIAKZSA-N 0.000 description 1
- 102100038080 B-cell receptor CD22 Human genes 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 102100037904 CD9 antigen Human genes 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- 102000000844 Cell Surface Receptors Human genes 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 206010010071 Coma Diseases 0.000 description 1
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- 241000702421 Dependoparvovirus Species 0.000 description 1
- 101150110503 END3 gene Proteins 0.000 description 1
- 241000623884 Escherichia coli O26 Species 0.000 description 1
- 206010015548 Euthanasia Diseases 0.000 description 1
- 208000009329 Graft vs Host Disease Diseases 0.000 description 1
- 102100026122 High affinity immunoglobulin gamma Fc receptor I Human genes 0.000 description 1
- 101000884305 Homo sapiens B-cell receptor CD22 Proteins 0.000 description 1
- 101000738354 Homo sapiens CD9 antigen Proteins 0.000 description 1
- 101500025419 Homo sapiens Epidermal growth factor Proteins 0.000 description 1
- 101000913074 Homo sapiens High affinity immunoglobulin gamma Fc receptor I Proteins 0.000 description 1
- 101000935040 Homo sapiens Integrin beta-2 Proteins 0.000 description 1
- 101001002657 Homo sapiens Interleukin-2 Proteins 0.000 description 1
- 101001043807 Homo sapiens Interleukin-7 Proteins 0.000 description 1
- 101000777628 Homo sapiens Leukocyte antigen CD37 Proteins 0.000 description 1
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 description 1
- 101000917839 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-B Proteins 0.000 description 1
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 description 1
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 1
- 101000632994 Homo sapiens Somatostatin Proteins 0.000 description 1
- 101000946860 Homo sapiens T-cell surface glycoprotein CD3 epsilon chain Proteins 0.000 description 1
- 101000738335 Homo sapiens T-cell surface glycoprotein CD3 zeta chain Proteins 0.000 description 1
- 101000716102 Homo sapiens T-cell surface glycoprotein CD4 Proteins 0.000 description 1
- 101000934341 Homo sapiens T-cell surface glycoprotein CD5 Proteins 0.000 description 1
- 101000946843 Homo sapiens T-cell surface glycoprotein CD8 alpha chain Proteins 0.000 description 1
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 1
- 108010038453 Interleukin-2 Receptors Proteins 0.000 description 1
- 102000010789 Interleukin-2 Receptors Human genes 0.000 description 1
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 241000254158 Lampyridae Species 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 102100031586 Leukocyte antigen CD37 Human genes 0.000 description 1
- 102100029185 Low affinity immunoglobulin gamma Fc region receptor III-B Human genes 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 241000711408 Murine respirovirus Species 0.000 description 1
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 description 1
- 108010057466 NF-kappa B Proteins 0.000 description 1
- 102000003945 NF-kappa B Human genes 0.000 description 1
- 206010061309 Neoplasm progression Diseases 0.000 description 1
- 108010016076 Octreotide Proteins 0.000 description 1
- 240000007594 Oryza sativa Species 0.000 description 1
- 235000007164 Oryza sativa Nutrition 0.000 description 1
- 229930040373 Paraformaldehyde Natural products 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 101800001295 Putative ATP-dependent helicase Proteins 0.000 description 1
- 101800001006 Putative helicase Proteins 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 102100035794 T-cell surface glycoprotein CD3 epsilon chain Human genes 0.000 description 1
- 102100037906 T-cell surface glycoprotein CD3 zeta chain Human genes 0.000 description 1
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 description 1
- 102100025244 T-cell surface glycoprotein CD5 Human genes 0.000 description 1
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 1
- 206010070863 Toxicity to various agents Diseases 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 241000700618 Vaccinia virus Species 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 102000019997 adhesion receptor Human genes 0.000 description 1
- 108010013985 adhesion receptor Proteins 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 229960002648 alanylglutamine Drugs 0.000 description 1
- 230000003281 allosteric effect Effects 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 230000019552 anatomical structure morphogenesis Effects 0.000 description 1
- 210000000612 antigen-presenting cell Anatomy 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 230000003416 augmentation Effects 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 239000000090 biomarker Substances 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 230000015861 cell surface binding Effects 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 238000002659 cell therapy Methods 0.000 description 1
- 102000008373 cell-cell adhesion mediator activity proteins Human genes 0.000 description 1
- 108040002566 cell-cell adhesion mediator activity proteins Proteins 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 230000009920 chelation Effects 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 231100000313 clinical toxicology Toxicity 0.000 description 1
- 230000004186 co-expression Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 210000000172 cytosol Anatomy 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 230000003828 downregulation Effects 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 230000013020 embryo development Effects 0.000 description 1
- 210000002472 endoplasmic reticulum Anatomy 0.000 description 1
- 210000003038 endothelium Anatomy 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 239000012997 ficoll-paque Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- YCKRFDGAMUMZLT-BJUDXGSMSA-N fluorine-18 atom Chemical compound [18F] YCKRFDGAMUMZLT-BJUDXGSMSA-N 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 210000000232 gallbladder Anatomy 0.000 description 1
- 238000012239 gene modification Methods 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 208000024908 graft versus host disease Diseases 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 230000023597 hemostasis Effects 0.000 description 1
- 231100000171 higher toxicity Toxicity 0.000 description 1
- 102000052622 human IL7 Human genes 0.000 description 1
- 102000045305 human SST Human genes 0.000 description 1
- 229940116978 human epidermal growth factor Drugs 0.000 description 1
- 125000001165 hydrophobic group Chemical group 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 238000012744 immunostaining Methods 0.000 description 1
- 230000001024 immunotherapeutic effect Effects 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 230000004968 inflammatory condition Effects 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 238000011081 inoculation Methods 0.000 description 1
- 230000007154 intracellular accumulation Effects 0.000 description 1
- 230000004068 intracellular signaling Effects 0.000 description 1
- 229960002725 isoflurane Drugs 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 238000001325 log-rank test Methods 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 230000004001 molecular interaction Effects 0.000 description 1
- 230000016864 negative regulation of biological process Effects 0.000 description 1
- GVUGOAYIVIDWIO-UFWWTJHBSA-N nepidermin Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)NC(=O)CNC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@H](CS)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CS)NC(=O)[C@H](C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C(C)C)C(C)C)C1=CC=C(O)C=C1 GVUGOAYIVIDWIO-UFWWTJHBSA-N 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 238000001543 one-way ANOVA Methods 0.000 description 1
- 238000012634 optical imaging Methods 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 229920002866 paraformaldehyde Polymers 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 210000005259 peripheral blood Anatomy 0.000 description 1
- 239000011886 peripheral blood Substances 0.000 description 1
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 230000016919 positive regulation of biological process Effects 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 235000019419 proteases Nutrition 0.000 description 1
- 238000002818 protein evolution Methods 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 230000036647 reaction Effects 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 235000009566 rice Nutrition 0.000 description 1
- 238000013391 scatchard analysis Methods 0.000 description 1
- 231100000161 signs of toxicity Toxicity 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 239000011550 stock solution Substances 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 230000009469 supplementation Effects 0.000 description 1
- 230000002522 swelling effect Effects 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 210000000115 thoracic cavity Anatomy 0.000 description 1
- 208000019179 thyroid gland undifferentiated (anaplastic) carcinoma Diseases 0.000 description 1
- 238000003325 tomography Methods 0.000 description 1
- 210000003437 trachea Anatomy 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 230000002463 transducing effect Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- 102000035160 transmembrane proteins Human genes 0.000 description 1
- 108091005703 transmembrane proteins Proteins 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 230000005751 tumor progression Effects 0.000 description 1
- 238000013414 tumor xenograft model Methods 0.000 description 1
- 238000005199 ultracentrifugation Methods 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 238000012762 unpaired Student’s t-test Methods 0.000 description 1
- 210000003932 urinary bladder Anatomy 0.000 description 1
- 238000002255 vaccination Methods 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 238000012800 visualization Methods 0.000 description 1
- 230000029663 wound healing Effects 0.000 description 1
- 108010065816 zeta chain antigen T cell receptor Proteins 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/72—Receptors; Cell surface antigens; Cell surface determinants for hormones
- C07K14/723—G protein coupled receptor, e.g. TSHR-thyrotropin-receptor, LH/hCG receptor, FSH receptor
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
- A61K38/1796—Receptors; Cell surface antigens; Cell surface determinants for hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001166—Adhesion molecules, e.g. NRCAM, EpCAM or cadherins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/461—Cellular immunotherapy characterised by the cell type used
- A61K39/4611—T-cells, e.g. tumor infiltrating lymphocytes [TIL], lymphokine-activated killer cells [LAK] or regulatory T cells [Treg]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/463—Cellular immunotherapy characterised by recombinant expression
- A61K39/4631—Chimeric Antigen Receptors [CAR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464402—Receptors, cell surface antigens or cell surface determinants
- A61K39/464411—Immunoglobulin superfamily
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/08—Peptides, e.g. proteins, carriers being peptides, polyamino acids, proteins
- A61K51/083—Peptides, e.g. proteins, carriers being peptides, polyamino acids, proteins the peptide being octreotide or a somatostatin-receptor-binding peptide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/08—Peptides, e.g. proteins, carriers being peptides, polyamino acids, proteins
- A61K51/088—Peptides, e.g. proteins, carriers being peptides, polyamino acids, proteins conjugates with carriers being peptides, polyamino acids or proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70521—CD28, CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70546—Integrin superfamily
- C07K14/70553—Integrin beta2-subunit-containing molecules, e.g. CD11, CD18
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/31—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterized by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/38—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterised by the dose, timing or administration schedule
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/70—Fusion polypeptide containing domain for protein-protein interaction
- C07K2319/74—Fusion polypeptide containing domain for protein-protein interaction containing a fusion for binding to a cell surface receptor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2510/00—Genetically modified cells
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Cell Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Zoology (AREA)
- Engineering & Computer Science (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Gastroenterology & Hepatology (AREA)
- Biomedical Technology (AREA)
- Microbiology (AREA)
- Biophysics (AREA)
- Toxicology (AREA)
- Molecular Biology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Mycology (AREA)
- Biotechnology (AREA)
- Wood Science & Technology (AREA)
- Endocrinology (AREA)
- Physics & Mathematics (AREA)
- Optics & Photonics (AREA)
- Hematology (AREA)
- Oncology (AREA)
- General Engineering & Computer Science (AREA)
- Neurology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Virology (AREA)
- Developmental Biology & Embryology (AREA)
Description
配列表は、作成日2017年7月17日、サイズ9.89キロバイトの、「Sequence Listing.txt」というファイル名を有する、EFS-Webを介したASCII形式のテキストファイルとして、本明細書と同時に提出される。EFS-Webを介して提出された配列表は、本明細書の一部であり、その全体が参照により本明細書に組み込まれる。
本明細書で使用する場合、「約」は、列挙された値の±10%を指す。
本発明は、広範な腫瘍のバイオマーカーであるICAM-1の生理的リガンドであるLFA-1を用いて、ICAM-1を標的とする、キメラ抗原受容体を提供する。本発明者らは、ヒトIドメインを含み、ICAM-1に対して1mM~1nMの親和性を有する、親和性変異体CARのパネルを構築した。本発明は、広範な抗腫瘍適用性を有するICAM-1特異的CARを提供する。ICAM-1を標的とするマイクロモルレベルの親和性を有するIドメインを含むCAR T細胞は、はるかに低い密度で正常細胞を節約しながら、標的抗原を過剰発現している細胞を溶解することができるので、従来のCARよりも改善された効能および安全性を有する。
実施例1.細胞株および初代ヒトリンパ球
ヒト皮膚微小血管内皮細胞(HMEC-1)はCenter for Disease Controlから入手し、10%(v/v)ウシ胎児血清(FBS、Atlanta Biologocals)、10mMのL-アラニル-L-グルタミンジペプチド(Gibco)、100単位/mlのペニシリン-ストレプトマイシン(Pen-strep)、1μg/mlのヒドロコルチソーム(MP Biomedical)、および10ng/mlの組換えヒト表皮成長因子(Invitrogen)を補充したMCDB 131培地(Invitrogen)中で培養した。マウス脳微小血管内皮細胞(bEnd.3、ATCC)を、4mMのL-グルタミン、100単位/mlのPen-strep、および10%のFBSを補充した応用Dulbecco変法イーグル培地(ADMEM、Invitrogen)中で維持した。HeLa細胞(ATCC)を、10%FBS、2mMのL-グルタミン、および100単位/mlのPen-strepを含有するADMEM中で培養した。8505C細胞(DSMZ)を、10%FBS、2mMのL-グルタミン、および100単位/mlのPen-strepを含有するRPMI-1640培地(Invitrogen)中で培養した。HMEC-1、bEnd.3、HeLa、および8505c細胞に、ホタルルシフェラーゼ-F2A-GFPをコードするレンチウイルス(Biosettia)を形質導入し、蛍光に基づいて分類した。
ICAM-1に対して様々な親和性のLFA-1のIドメインをコードする遺伝子配列は、先行研究27から得られた。Iドメイン変異体は、CD8ヒンジと、CD28膜貫通ドメインと、CD28、CD137、およびCD3ζの細胞質ドメインを組み込んだ第3世代CAR構造の細胞内部分とに直接的にC末端で融合した。次いで、完全なCARインサートをpLenti骨格へとサブクローニングした29。CAR T細胞撮像のためのレポーター遺伝子であるSSTR2を、「リボソームをスキップする」ブタテッショウウイルス(teschovirus)-1 2A(P2A)配列を用いてN末端のIドメインに連結して、同じmRNAからのCARおよびSSTR2の同程度の産生を確実にした。
レンチウイルスは、リン酸カルシウムを用いてHEK293T細胞を一過性にトランスフェクトすることによって産生した。簡潔には、10μgの伝達遺伝子、7.5μgのpCMV-dR8.2(Addgene)および5μgのpCMV-VSVG(Addgene)を混合し、2MのCaCl2、次いで2×HBSSとともにインキュベートした。得られた溶液を、10mlのDMEM中に3.2×106個のHEK293T細胞を24時間前に播種しておいた10cm2の細胞培養皿へ滴下した。トランスフェクション培地を6時間後に交換した。レンチウイルスを含有する培地をトランスフェクションの48時間後および72時間後に収集し、0.45μmフィルターで濾過し、4℃、75,000×gで2時間の超遠心分離により濃縮した。次に、レンチウイルスを血清含有培地中に再懸濁し、-80℃で凍結した。活性化の24~72時間後に、ヒトT細胞に抗CD3/CD28Dynabeadsを、スピン感染(1,000g、32℃で1時間)またはレンチウイルスとの一晩のインキュベーションのいずれかにより形質導入した。T細胞を初回の形質導入の24時間後にもう一度形質導入した。形質導入中および形質導入後、IL-2を含有する培地を、ヒトIL-7(10ng/ml)およびIL-15(5ng/ml)を含有する培地(Peprotech)と交換した。ジャーカットT細胞をレンチウイルスとの単回の一晩のインキュベーションにより形質導入した。
GFPおよびホタルルシフェラーゼを発現するように安定して形質導入された2×105個の標的細胞(HMEC-1、bEnd.3、HeLa、および8505c)を、非形質導入型またはIドメインCAR T細胞とともに、様々なエフェクター対標的比(E:%)で共培養した。ある特定の条件において、ICAM-1遺伝子は、CRISPR/Cas9(Santa Cruz、#sc-400098)を用いて8505C細胞中で破壊された(8505C/-ICAM-1として示す)か、あるいは8505C細胞を1μg/mlリポ多糖(LPS;大腸菌(Escherichia coli)O26:B6、Sigma)へ12時間曝露して、ICAM-1の過剰発現を誘導した(8505C/LPSと示す)。共培養は、150μg/mlのD-ルシフェリン(Gold Biotechnology)を含有しかつサイトカイン補充のないT細胞培地中で行った。プレートリーダー(TECAN infinite M1000 PRO)を用いて発光を測定し、それぞれのE:T条件での読み取りを、非形質導入T細胞:標的共培養対照に対して正規化した。
7.5×105個の8505C細胞を、尾静脈を介してNSGマウスへと注射した。腫瘍細胞注射の8~10日後に、1~3×106個のT細胞を、尾静脈を介して注射した。異種移植後最長10日間、同様のCAR投与量を用いて腫瘍の除去を実証したR6.5CAR T細胞を用いた従来の研究に基づいて注射のタイミングを選択した29。生きているマウスにおける腫瘍異種移植片の発光撮像は、全身光学撮像装置(In-Vivo Extreme、Bruker)を用いて行った。マウスを2L/分のO2中2%イソフルランで麻酔した。腫瘍量は、胸腔およびマウスの全身にわたる発光の積分によって定量化した。血清サイトカイン分析のために、50~100μlの血液を、尾静脈を介して氷上のエッペンドルフチューブへと回収した。4℃で10分間、2,000gで遠心分離することによって細胞ペレットを除去した後、血漿を直ちに単離し、-80℃で保存した。製造元の説明書により、Bio-Plex MAGPIX(Bio Rad)を用いてヒトサイトカイン(GM-CSF、IL-2、IL-6、IFN-γ、TNF-α、CXCL10)を2つ組で測定した。
腫瘍異種移植片を適切な時点でマウスから摘出した。摘出した腫瘍をさいの目に切って80μmセルストレーナーに流して単細胞懸濁液を得た。赤血球を1×RBC溶解緩衝液(eBiosciences)とのインキュベーションにより溶解した。残存細胞を洗浄し、2%正常ヤギ血清を含有する1×HBSS中に再懸濁し、2μg/mlのマウスIgGで10分間ブロッキングした。これに続いて、2μg/mlのマウス抗ヒトCD3-Alexa Fluor647(Biolegend)または2μg/mlのウサギ抗c-myc-Alexa Fluor647(Biolegend)との組み合わせにおける1μg/mlのヨウ化プロピジウム(Invitrogen)を用いた染色を行った。結果として生じる細胞をGalliosフローサイトメーター(Beckman Coulter)で取得した。初期フローサイトメトリーゲートは、生細胞ゲート処理(ヨウ化プロピジウム陰性)に基づいて決定した。
ハイブリドーマ(ATCC)から得たマウス抗ヒトR6.5モノクローナル抗体(10μg/ml)を用いて、種々の細胞株におけるICAM-1発現を測定した。T細胞上のIドメインCAR発現は、2μg/mlのウサギ抗c-myc-Alexa Fluor647(Biolegend)を用いて検出した。IドメインジャーカットT細胞変異体を、ヒトFcγに融合した10μg/mlの組換えヒトICAM-1(R&D Systems)とともにインキュベートした。次に、細胞を洗浄し、1μg/mlのウサギ抗ヒトPE(Santa Cruz Biotechnology)中に再懸濁した後、フローサイトメトリー分析を行った。
標的細胞を洗浄し、サイトカインを含まないT細胞培地中に1×106個/mlで懸濁した。100μlのそれぞれの標的細胞を96ウェル丸底プレート(Corning)へ3つ組で入れた。T細胞培地中に5×106個/mlで再懸濁したT細胞を適切なウェル中で標的細胞と組み合わせた。プレートを37℃で24~48時間インキュベートした。インキュベーション後、上清をELISAのために回収してIFN-γ(Biolegend)を検出した。
IドメインCARで改変したジャーカット細胞を、96ウェルプレート中で1:1のエフェクター対標的の比(1×105個のエフェクター:1×105個の標的)で標的細胞と共培養した。プレートを37℃で6時間インキュベートした。インキュベーション後、細胞を洗浄した後、氷上で30分間、2μg/mlの抗ヒトCD25-アロフィコシアニン(APC、Biolegend)で標識した。インキュベーション後、試料を洗浄し、フローサイトメトリーによって分析した。ICAM-1発現細胞に対する代替物として、本発明者らは、既知量のICAM-1でコーティングしたマイクロビーズも使用した。1×106個の硫酸塩ラテックスマイクロビーズ(8μm、ThermoFisher Scientific)を、Cy5.5(Sulfo-Cyanine5.5 NHSエステル、Lumiprobe)と結合した指示量のヒトまたはマウス組換えICAM-1-Fcγ(R&D Systems)を含有する100μLのPBS中に、室温で一晩緩徐に混合しながら再懸濁した。タンパク質標識粒子をペレット化し、0.1MグリシンpH7.4を含有する新鮮なPBS中に1時間再懸濁し、その間上清を使用して、蛍光によるビーズ吸着効率を測定した(TECAN infinite M1000 PRO)。グリシンを用いたビーズ表面の飽和の後、ビーズをペレット化し、5mMのMgCl2を含有するPBS中に再懸濁した。それぞれのIドメインCAR変異体で改変したジャーカット細胞を、ICAM-1結合ラテックスビーズとともに1:3(細胞:ビーズ)の比で、37℃で一晩インキュベートした。次いで細胞を収集し、フローサイトメトリーによる分析のために2μg/mlの抗ヒトCD69-APC(Biolegend)で標識した。
V底96ウェルプレート(Corning)を、マウスもしくはヒトICAM-1-Fcγ(PBS中10μg/ml、pH7.4)または2%BSAのいずれかで4℃で一晩コーティングした。次いで、プレートを2%BSAで、37℃で1時間ブロッキングした。製造元のプロトコルにより、IドメインCAR TクローンをまずCellTracker Orangeで染色し、次いで5mMのMgCl2および1%BSAを含有する50μlのPBS中のICAM-1でコーティングしたウェルへ入れた。プレートを直ちに室温で15分間、200gで遠心分離した。V底プレートの底に蓄積した非接着細胞を蛍光プレートリーダー(TECAN infinite M1000 PRO)により定量した。ICAM-1への細胞結合を実験測定の蛍光強度値(FCARおよびFNT)から計算し、BSA単独でコーティングしたウェルからの蛍光(FBSA)に対して正規化した:100×((FBSA-FCAR)/FBSA)/((FBSA-FNT)/FBSA)。
NOTAOCT(1,4,7-トリアザシクロノナン-1,4,7-三酢酸-オクトレオチド30、GMP等級)を1mgの凍結乾燥粉末(カタログ番号9762、ABX Pharmaceuticals)として得た。NOTAOCTバイアル内容物を18MWの水で200μl(5mg/ml溶液)へ希釈し、ストック溶液として4℃で保存した。フッ素-1831を用いたNOTAのキレート化のために、5μlのNOTAOCTを10μlの0.1M酢酸ナトリウム(pH4)、6μlの2mM AlCl3、および約30mCiの18Fを含有する100μlへ添加した。溶液を直ちに100℃のThermomixer(Eppendorf)に入れ、15分間インキュベートした後、室温へ冷却し、15mlのddH2O中に希釈した。Sep-Pak light C18カラムを3mlの100%エタノール中で再生し、毎分10滴の観察された流量で5mlのddH2O中で2回洗浄した。次に、NOTAOCTをSep-Pakカラムへ負荷し、これを後で15mlの18MWの水中で洗浄して、いかなる残存遊離18Fも除去した。捕捉されたNOTAOCTを300μlのエタノールを用いてカラムから溶出し、注射用PBSで1.5mlに希釈し、最終生成物を約15%エタノール等張注射用溶液中に提供した。溶離液を0.2μmフィルターで濾過した。最終生成物の純度を逆相HPLCにより確認した。
登録されたCT画像は、NOTAOCT注射の1~2時間後にマイクロPET/CTスキャナ(Inveon、Siemens)を使用して取得した。投影データは、1度の角度増分でおよそ1秒のステップで、コーンビーム形状で取得した。250~750keVのエネルギーウィンドウおよび6ナノ秒の調時ウィンドウを使用して、1回の試験につき少なくとも1000万件の同時事象をPETについて取得した。生体内でのNOTATOC取り込みの定量化のために、100μlの10%ID/cm3当量を含有する参照チューブ。マウス肺内でのNOTAOCT取り込みを計算するために、楕円形を肺の左右両側に個別に描いて、それらの足跡の大部分を囲んだ。参照チューブに得られた計数に対して計算した%ID/cm3値は、%ID/cm3を4で除することによって標準的な取り込み値(SUV32)へ近似して、100%の注射効率および体重25gを想定した。PET/CT画像の可視化および解析は、AMIDEソフトウェア(http://amide.sourceforge.net)を用いて行った。
安楽死の後、マウスの肺に気管を介して4%パラホルムアルデヒドを灌流し、5つの葉のそれぞれを固定後に分離してパラフィン中に包埋した。組織を切断して5μmの切片を作製した(Microtome、Leica)。パラフィン包埋切片を、CD3およびGFPの免疫染色のために、ヘマトキシリンおよびエオシン(H&E)またはヘマトキシリンのみで染色した(HistoWiz,Inc.により実施)。組織学的解析は経験豊富な病理学者によって行われた。
統計解析
示されたデータにPrism(GraphPad)を用いて、一元配置分散分析、ダネットの多重比較検定、および対応のないスチューデントのt検定を行った。
ICAM-1に特異的なCAR構築物は、Jinら27および米国特許第8,021,668号により、LFA-1由来のIドメインを用いて構築した(図1A~B、表1)。
IドメインCARを発現するジャーカットT細胞を用いて、CAR T細胞活性化が標的細胞におけるCAR親和性およびICAM-1抗原密度によって影響を受ける程度を調べた。ジャーカットT細胞を、異なるICAM-1発現レベルを有する種々の標的細胞株とともにインキュベートした。標的細胞株のICAM-1表面密度は、まず標的細胞株へ結合する抗ICAM-1抗体のレベルをアッセイし、これらのシグナルを、Cy5.5と結合した既知量のR6.5抗体(ビーズ1個当たり103~107の抗体)とカップリングした8μmのラテックスビーズを用いて得られたシグナルと比較することによって調べた。非標識の(灰色)からR6.5(黒色)とともにインキュベートした後のシフトのレベルを使用して、それぞれの指示された標的細胞株におけるICAM-1密度を推定した。
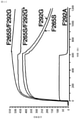
CAR改変ジャーカットT細胞の親和性および抗原依存的活性化を検証した後、試験管内での初代T細胞の活性化および細胞毒性に及ぼすCAR親和性および抗原密度の影響を調べることを試みた。初代T細胞にTM、F292A、F292G、およびWT IドメインのCARを形質導入し、種々の標的細胞へ添加してそれらの試験管内での細胞毒性の有効性を測定した。全体として、標的細胞溶解速度とすべのIドメイン変異体CAR T細胞にわたるICAM-1発現(HeLa>8505C/LPS>8505C>HMEC-1>bEND.3)との間には正の相関があった(図2A)。T細胞がICAM-1に対してより高い親和性を有するCARを発現したとき、殺滅速度もより大きかった(TM>F292G>F292A>WT)。
本発明者らは、試験管内での親和性依存性CAR T細胞の細胞毒性パターンが生体内で腫瘍異種移植モデルにどのように変換されるのかを調べた。固形腫瘍において、CAR T細胞の有効性は、腫瘍部位に移動し、浸透し、腫瘍細胞を連続的に溶解し、腫瘍量に従って膨張および収縮を受ける能力によって影響される。ここでは、0.75×106個の8505C-FLuc+GFP+細胞の全身静脈内注射、続いて異種移植8~10日後(5~20%のCAR発現)の約1~3×106個のIドメインCAR T細胞(WT、F292A、F265S、F292G、およびTM)、SSTR2-R6.5 CAR29、NT(非形質導入)T細胞、およびT細胞なしによる処置によってマウスを異種移植した。腫瘍量は、ホタルルシフェラーゼ活性の全身発光撮像によって評価した。原発腫瘍は肺および肝臓に局在し、遠隔転移巣が全身に明らかであった(図3A)。T細胞を投与しなかったコホートまたはNT T細胞を投与したコホートでは、腫瘍接種の3~4週間以内に腫瘍量に屈した。TM CAR T細胞で処置したマウスは、腫瘍量の急激な初期減少を示したが、T細胞注射のおよそ7日後に、マウスは昏睡および体重減少によって示される全身毒性の症状を示し始め、処置15日後までに死に至った(図3A~B)。F292G CAR T細胞は一貫した毒性の発症がないまま、腫瘍を除去することができたが、これはCAR T細胞処置時の腫瘍量に部分的に依存するように思われた。例えば、F292G(119nM親和性)CAR T細胞の注入の遅延(10日後)または治療時のより多量の腫瘍量のいずれかは、より高頻度の死亡をもたらした。F265S(145nM Kd)CARを発現するT細胞は、観察可能な毒性なしに腫瘍を排除した。これは、約100nMのKdのIドメインCAR親和性がおおよその閾値親和性を定義し、それを超えると(100nM未満、例えば、1~10nMのKd)、処置は、高いおよび低い抗原密度と、オンターゲットオフ腫瘍毒性の尤度の上昇との間の識別の低下をもたらす。試験管内でのWT CAR T細胞による8505Cの殺滅の制限または欠如と一致して、生体内での腫瘍の進行は、NT T細胞と同様に、WT CAR T細胞の処置によって妨げられることはなかった(図3B)。対照的に、より高い親和性の対応物と比較してはるかに低い試験管内での8505C殺滅速度を呈したF292A CAR T細胞は、処置の時期にかかわらず明白な毒性なしに腫瘍量の急速な減少を達成した(図3A~3B)。その上、より高い腫瘍クリアランス速度および腫瘍再発の耐久可能な抑制によって証明されるように、ICAM-1に対する>1,000倍低い親和性にもかかわらず、F292A CAR Tの生体内での有効性は、scFv系のR 6.5 CARよりも優れていた(10nM対20μM)(図3A)。
PET/CTによってリアルタイムでT細胞分布を時空間的に監視するために、本発明者らは、撮像レポーター遺伝子であるSSTR2をIドメインCARベクターへと、リボソームスキップP2A配列を用いて、T細胞表面上でのCARおよびレポーターの等しい発現を確実にした(図4A)。SSTR2の発現は、注入された陽電子放出SSTR2特異的放射性トレーサーである18F-NOTA-オクトレオチド30の結合および細胞内蓄積を可能にした。次いで、マイクロPETスキャナーにより、組織貫通の問題なしに、放出されたシグナルを高解像度で検出した。SSTR2レポーター遺伝子のフローサイトメトリー測定および初代ヒトT細胞表面上のCARを表すMycタグ発現。SSTR2およびMycタグ付きIドメインの発現は、SSTR2レポーター遺伝子のフローサイトメトリー測定による抗体染色、および初代ヒトT細胞の表面上のCARを表すMycタグ発現によって確認された。
参考文献
1.Maher J,Brentjens RJ,Gunset G,Riviere I,Sadelain M.Human T-lymphocyte cytotoxicity and proliferation directed by a single chimeric TCRzeta/CD28 receptor.Nat Biotechnol 20,70-75(2002).
2.Gross G,Waks T,Eshhar Z.Expression of immunoglobulin-T-cell receptor chimeric molecules as functional receptors with antibody-type specificity.Proc Natl Acad Sci USA 86,10024-10028(1989).
3.Hudecek M,et al.Receptor affinity and extracellular domain modifications affect tumor recognition by ROR1-specific chimeric antigen receptor T cells.Clin Cancer Res 19,3153-3164(2013).
4.Watanabe K,et al.Target antigen density governs the efficacy of anti-CD20-CD28-CD3 zeta chimeric antigen receptor-modified effector CD8+ T cells.J Immunol 194,911-920(2015).
5.Kochenderfer JN,et al.Eradication of B-lineage cells and regression of lymphoma in a patient treated with autologous T cells genetically engineered to recognize CD19.Blood 116,4099-4102(2010).
6.Porter DL,Levine BL,Kalos M,Bagg A,June CH.Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia.New England Journal of Medicine 365,725--733(2011).
7.Grupp SA,et al.Chimeric antigen receptor-modified T cells for acute lymphoid leukemia.N Engl J Med 368,1509-1518(2013).
8.Brentjens RJ,et al.CD19-targeted T cells rapidly induce molecular remissions in adults with chemotherapy-refractory acute lymphoblastic leukemia.Sci Transl Med 5,177ra138(2013).
9.Brudno JN,Kochenderfer JN.Toxicities of chimeric antigen receptor T cells:recognition and management.Blood 127,3321-3330(2016).
10.Cheever MA,et al.The prioritization of cancer antigens:a national cancer institute pilot project for the acceleration of translational research.Clin Cancer Res 15,5323-5337(2009).
11.Kakarla S,Gottschalk S.CAR T cells for solid tumors:armed and ready to go? Cancer J 20,151-155(2014).
12.Lamers CH,et al.Treatment of metastatic renal cell carcinoma with autologous T-lymphocytes genetically retargeted against carbonic anhydrase IX:first clinical experience.J Clin Oncol 24,e20-22(2006).
13.Parkhurst MR,et al.T cells targeting carcinoembryonic antigen can mediate regression of metastatic colorectal cancer but induce severe transient colitis.Mol Ther 19,620-626(2011).
14.Morgan RA,Yang JC,Kitano M,Dudley ME,Laurencot CM,Rosenberg SA.Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2.Mol Ther 18,843-851(2010).
15.Tian S,Maile R,Collins EJ,Frelinger JA.CD8+ T cell activation is governed by TCR-peptide/MHC affinity,not dissociation rate.J Immunol 179,2952-2960(2007).
16.Hebeisen M,Allard M,Gannon PO,Schmidt J,Speiser DE,Rufer N.Identifying Individual T Cell Receptors of Optimal Avidity for Tumor Antigens.Front Immunol 6,582(2015).
17.Zhong S,et al.T-cell receptor affinity and avidity defines antitumor response and autoimmunity in T-cell immunotherapy.Proc Natl Acad Sci USA 110,6973-6978(2013).
18.Liu X,et al.Affinity-Tuned ErbB2 or EGFR Chimeric Antigen Receptor T Cells Exhibit an Increased Therapeutic Index against Tumors in Mice.Cancer Res 75,3596-3607(2015).
19.Caruso HG,et al.Tuning Sensitivity of CAR to EGFR Density Limits Recognition of Normal Tissue While Maintaining Potent Antitumor Activity.Cancer Res 75,3505--3518(2015).
20.Arcangeli S,et al.Balance of Anti-CD123 Chimeric Antigen Receptor Binding Affinity and Density for the Targeting of Acute Myeloid Leukemia.Mol Ther,(2017).
21.Chmielewski M,Hombach A,Heuser C,Adams GP,Abken H.T cell activation by antibody-like immunoreceptors:increase in affinity of the single-chain fragment domain above threshold does not increase T cell activation against antigen-positive target cells but decreases selectivity.J Immunol 173,7647-7653(2004).
22.Schmid DA,et al.Evidence for a TCR affinity threshold delimiting maximal CD8 T cell function.J Immunol 184,4936-4946(2010).
23.Corse E,Gottschalk RA,Krogsgaard M,Allison JP.Attenuated T cell responses to a high-potency ligand in vivo.PLoS Biol 8,(2010).
24.Park S,et al.Tumor suppression via paclitaxel-loaded drug carriers that target inflammation marker upregulated in tumor vasculature and macrophages.Biomaterials 34,598--605(2013).
25.Dustin ML,Rothlein R,Bhan AK,Dinarello CA,Springer TA.Induction by IL 1 and interferon-gamma:tissue distribution,biochemistry,and function of a natural adherence molecule(ICAM-1).J Immunol 137,245-254(1986).
26.Shimaoka M,et al.Reversibly locking a protein fold in an active conformation with a disulfide bond:integrin alphaL I domains with high affinity and antagonist activity in vivo.Proc Natl Acad Sci USA 98,6009-6014(2001).
27.Jin M,et al.Directed evolution to probe protein allostery and integrin I domains of 200,000-fold higher affinity.Proc Natl Acad Sci USA 103,5758-5763(2006).
28.Wong R,Chen X,Wang Y,Hu X,Jin MM.Visualizing and Quantifying Acute Inflammation Using ICAM-1 Specific Nanoparticles and MRI Quantitative Susceptibility Mapping.Ann Biomed Eng 40,1328-1338(2011).
29.Vedvyas Y,et al.Longitudinal PET imaging demonstrates biphasic CAR T cell responses in survivors.JCI Insight 1,e90064(2016).
30.Laverman P,et al.A novel facile method of labeling octreotide with(18)F-fluorine.J Nucl Med 51,454-461(2010).
31.McBride WJ,et al.A novel method of 18F radiolabeling for PET.J Nucl Med 50,991-998(2009).
32.Kinahan PE,Fletcher JW.Positron emission tomography-computed tomography standardized uptake values in clinical practice and assessing response to therapy.Semin Ultrasound CT MR 31,496-505(2010).
33.Leelawattanachai J,Kwon KW,Michael P,Ting R,Kim JY,Jin MM.Side-by-Side Comparison of Commonly Used Biomolecules That Differ in Size and Affinity on Tumor Uptake and Internalization.PLoS One 10,e0124440(2015).
34.Poirot L,et al.Multiplex Genome-Edited T-cell Manufacturing Platform for “Off-the-Shelf” Adoptive T-cell Immunotherapies.Cancer Res 75,3853-3864(2015).
35.Kang S,et al.Virus-mimetic polyplex particles for systemic and inflammation-specific targeted delivery of large genetic contents.Gene Ther 20,1042-1052(2013).
36.Hinrichs CS,Restifo NP.Reassessing target antigens for adoptive T-cell therapy.Nat Biotechnol 31,999-1008(2013).
37.Newick K,O’Brien S,Moon E,Albelda SM.CAR T Cell Therapy for Solid Tumors.Annu Rev Med 68,139-152(2017).
38.Ledebur HC,Parks TP.Transcriptional regulation of the intercellular adhesion molecule-1 gene by inflammatory cytokines in human endothelial cells.Essential roles of a variant NF-kappa B site and p65 homodimers.J Biol Chem 270,933-943(1995).
39.Usami Y,et al.Intercellular adhesion molecule-1(ICAM-1) expression correlates with oral cancer progression and induces macrophage/cancer cell adhesion.Int J Cancer 133,568-578(2013).
40.Roland CL,Harken AH,Sarr MG,Barnett CC,Jr.ICAM-1 expression determines malignant potential of cancer.Surgery 141,705-707(2007).
41.Guo P,et al.ICAM-1 as a molecular target for triple negative breast cancer.Proc Natl Acad Sci USA 111,14710-14715(2014).
42.Carman CV,Springer TA.Integrin avidity regulation:are changes in affinity and conformation underemphasized? Curr Opin Cell Biol 15,547-556(2003).
43.Boissonnas A,Fetler L,Zeelenberg IS,Hugues S,Amigorena S.In vivo imaging of cytotoxic T cell infiltration and elimination of a solid tumor.J Exp Med 204,345-356(2007).
44.Porter BB,Harty JT.The onset of CD8+-T-cell contraction is influenced by the peak of Listeria monocytogenes infection and antigen display.Infect Immun 74,1528-1536(2006).
45.Keu KV,et al.Reporter gene imaging of targeted T cell immunotherapy in recurrent glioma.Sci Transl Med 9,(2017).
46.Yaghoubi SS,et al.Noninvasive detection of therapeutic cytolytic T cells with 18F-FHBG PET in a patient with glioma.Nat Clin Pract Oncol 6,53-58(2009).
47.Drent E,et al.A Rational Strategy for Reducing On-Target Off-Tumor Effects of CD38-Chimeric Antigen Receptors by Affinity Optimization.Mol Ther,(2017).
48.Kalergis AM,et al.Efficient T cell activation requires an optimal dwell-time of interaction between the TCR and the pMHC complex.Nat Immunol 2,229-234(2001).
49.Valitutti S.The Serial Engagement Model 17 Years After:From TCR Triggering to Immunotherapy.Front Immunol 3,272(2012).
50.McMahan RH,McWilliams JA,Jordan KR,Dow SW,Wilson DB,Slansky JE.Relating TCR-peptide-MHC affinity to immunogenicity for the design of tumor vaccines.The Journal of clinical investigation 116,2543-2551(2006).
51.Robbins PF,et al.Single and dual amino acid substitutions in TCR CDRs can enhance antigen-specific T cell functions.J Immunol 180,6116-6131(2008).
52.Co MS,Deschamps M,Whitley RJ,Queen C.Humanized antibodies for antiviral therapy.Proc Natl Acad Sci USA 88,2869-2873(1991).
53.Leelawattanachai J,Kwon K-W,Michael P,Ting R,Kim J-Y,Jin MM.Side-by-Side Comparison of Commonly Used Biomolecules That Differ in Size and Affinity on Tumor Uptake and Internalization.PLoS One 10,e0124440(2015).
54.Jin M,et al.Directed evolution to probe protein allostery and integrin I domains of 200,000-fold higher affinity.Proc Natl Acad Sci USA 103,5758-5763(2006).
55.Wong R,Chen X,Wang Y,Hu X,Jin MM.Visualizing and quantifying acute inflammation using ICAM-1 specific nanoparticles and MRI quantitative susceptibility mapping.Ann Biomed Eng 40,1328-1338(2012).
Claims (8)
- N末端からC末端にかけて、
(i)ヒトリンパ球機能関連抗原1のαLサブユニットのIドメインと、
(ii)膜貫通ドメインと、
(iii)少なくとも1つの共刺激ドメインと、
(iv)活性化ドメインと、
を含み、前記Iドメインが、配列番号1の130~310アミノ酸の配列を含み、F292A、F292S、L289G、F292G、またはF265Sのうちの1つの変異を有する、キメラ抗原受容体(CAR)。 - 前記共刺激ドメインが、CD28、4-1BB、ICOS-1、CD27、OX-40、GITR、およびDAP10からなる群より選択される、請求項1に記載のCAR。
- 前記活性化ドメインがCD3ゼータである、請求項1に記載のCAR。
- 請求項1に記載のCARをコードする単離された核酸。
- 請求項1に記載のCARを発現するように改変されたT細胞またはナチュラルキラー細胞。
- 請求項5に記載のCAR-T細胞を含む、癌を治療するための養子細胞療法のための医薬組成物であって、
癌に罹患している対象に投与され、
前記対象の前記癌細胞はICAM-1を過剰発現し、前記CAR-T細胞は、前記癌細胞を死滅させるために、前記癌細胞へ結合する、医薬組成物。 - 前記癌が甲状腺癌、胃癌、膵癌、または乳癌である、請求項6に記載の医薬組成物。
- N末端からC末端にかけて、
(i)ヒトリンパ球機能関連抗原1のα L サブユニットのIドメインと、
(ii)膜貫通ドメインと、
(iii)少なくとも1つの共刺激ドメインと、
(iv)活性化ドメインと、を含み、
前記Iドメインが、配列番号1の130~310アミノ酸の配列を含み、F265S/F292G/G311Cの3つの変異を有する、キメラ抗原受容体(CAR)。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662383139P | 2016-09-02 | 2016-09-02 | |
| US62/383,139 | 2016-09-02 | ||
| US201662419817P | 2016-11-09 | 2016-11-09 | |
| US62/419,817 | 2016-11-09 | ||
| PCT/US2017/046630 WO2018052594A1 (en) | 2016-09-02 | 2017-08-11 | I domain chimeric antigen receptor specific to icam-1 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2019530441A JP2019530441A (ja) | 2019-10-24 |
| JP2019530441A5 JP2019530441A5 (ja) | 2020-09-17 |
| JP6996772B2 true JP6996772B2 (ja) | 2022-02-21 |
Family
ID=61281980
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019512782A Active JP6996772B2 (ja) | 2016-09-02 | 2017-08-11 | Icam-1に特異的なiドメインキメラ抗原受容体 |
Country Status (9)
| Country | Link |
|---|---|
| US (6) | US10577408B2 (ja) |
| EP (1) | EP3522718B1 (ja) |
| JP (1) | JP6996772B2 (ja) |
| KR (1) | KR102613109B1 (ja) |
| CN (1) | CN108697096B (ja) |
| AU (1) | AU2017325678B2 (ja) |
| CA (1) | CA3033846A1 (ja) |
| SG (1) | SG11201901505SA (ja) |
| WO (2) | WO2018052594A1 (ja) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018052594A1 (en) * | 2016-09-02 | 2018-03-22 | Cornell University | I domain chimeric antigen receptor specific to icam-1 |
| MX2019008538A (es) | 2017-01-20 | 2019-11-05 | Juno Therapeutics Gmbh | Conjugados de superficie celular y composiciones y métodos celulares relacionados. |
| CA3056261A1 (en) * | 2017-04-07 | 2018-10-11 | Juno Therapeutics, Inc. | Engineered cells expressing prostate-specific membrane antigen (psma) or a modified form thereof and related methods |
| US11866494B2 (en) * | 2018-08-31 | 2024-01-09 | Innovative Cellular Therapeutics Holdings, Ltd. | CAR T therapy through uses of co-stimulation |
| EP4259285A1 (en) * | 2020-12-09 | 2023-10-18 | Affyimmune Therapeutics, Inc. | Dual chimeric antigen receptor targeting epcam and icam-1 |
| WO2024055075A1 (en) * | 2022-09-14 | 2024-03-21 | Biosceptre (Aust) Pty Ltd | In vivo detection of immune cells |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004503507A (ja) | 2000-06-09 | 2004-02-05 | ブリストル−マイヤーズ スクイブ カンパニー | リンパ球シグナルのブロックおよびlfa−1媒介性接着のブロックによる細胞性免疫応答の調節方法 |
| WO2013051718A1 (ja) | 2011-10-07 | 2013-04-11 | 国立大学法人三重大学 | キメラ抗原受容体 |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2204183A1 (en) | 1994-11-01 | 1996-05-09 | Andrew Lawrence Feldhaus | Chimeric receptors for the generation of selectively-activatable th-independent cytotoxic t cells |
| US5712149A (en) | 1995-02-03 | 1998-01-27 | Cell Genesys, Inc. | Chimeric receptor molecules for delivery of co-stimulatory signals |
| EP1171596A1 (en) | 1999-04-16 | 2002-01-16 | Celltech Therapeutics Limited | Synthetic transmembrane components |
| US7176187B2 (en) | 2001-02-15 | 2007-02-13 | Board Of Regents, The University Of Texas System | Fusion proteins based upon somatostatin receptors |
| WO2007070488A2 (en) * | 2005-12-12 | 2007-06-21 | The Cbr Institute For Biomedical Research, Inc. | Integrin alpha l i domain mutants with increased binding affinity |
| WO2012033901A2 (en) * | 2010-09-08 | 2012-03-15 | The Board Of Regents Of The University Of Texas System | Somatostatin receptor-based cancer therapy |
| US10144770B2 (en) * | 2013-10-17 | 2018-12-04 | National University Of Singapore | Chimeric receptors and uses thereof in immune therapy |
| US11083744B2 (en) * | 2015-03-20 | 2021-08-10 | Mie University | Therapeutic agent associated with suppression of proliferation and metastasis of tumor, which comprises exosomes released from cytotoxic T cells and targets cancer stromal/mesenchymal cells |
| WO2018052594A1 (en) * | 2016-09-02 | 2018-03-22 | Cornell University | I domain chimeric antigen receptor specific to icam-1 |
-
2017
- 2017-08-11 WO PCT/US2017/046630 patent/WO2018052594A1/en unknown
- 2017-08-11 WO PCT/US2017/046618 patent/WO2018044534A1/en active Application Filing
- 2017-08-11 KR KR1020197009375A patent/KR102613109B1/ko active IP Right Grant
- 2017-08-11 US US15/675,419 patent/US10577408B2/en active Active
- 2017-08-11 US US15/675,508 patent/US10428136B2/en active Active
- 2017-08-11 SG SG11201901505SA patent/SG11201901505SA/en unknown
- 2017-08-11 EP EP17851258.8A patent/EP3522718B1/en active Active
- 2017-08-11 CN CN201780004619.1A patent/CN108697096B/zh active Active
- 2017-08-11 AU AU2017325678A patent/AU2017325678B2/en active Active
- 2017-08-11 JP JP2019512782A patent/JP6996772B2/ja active Active
- 2017-08-11 CA CA3033846A patent/CA3033846A1/en active Pending
-
2019
- 2019-09-25 US US16/582,206 patent/US11046748B2/en active Active
-
2020
- 2020-02-11 US US16/787,539 patent/US11634471B2/en active Active
-
2021
- 2021-06-21 US US17/304,412 patent/US20210309721A1/en active Pending
-
2023
- 2023-03-21 US US18/187,268 patent/US20230265165A1/en active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004503507A (ja) | 2000-06-09 | 2004-02-05 | ブリストル−マイヤーズ スクイブ カンパニー | リンパ球シグナルのブロックおよびlfa−1媒介性接着のブロックによる細胞性免疫応答の調節方法 |
| WO2013051718A1 (ja) | 2011-10-07 | 2013-04-11 | 国立大学法人三重大学 | キメラ抗原受容体 |
Non-Patent Citations (3)
| Title |
|---|
| Jin, M., et al.,Directed evolution to probe protein allostery and integrin I domains of 200,000-fold higher affinity,PNAS,2006年,103(15),2758-5763 |
| Kang, S., et al.,Complex Structure of Engineered Modular Domains Defining Molecular Interaction between ICAM-1 and Integrin LFA-1,PLOS ONE,7(8),2012年,e44124 |
| Sadelain, M., et al.,The Basic Principles of Chimeric Antigen Receptor Design,Cancer Discovery,2013年,3,388-398 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2018044534A1 (en) | 2018-03-08 |
| JP2019530441A (ja) | 2019-10-24 |
| US20180066037A1 (en) | 2018-03-08 |
| CA3033846A1 (en) | 2018-03-22 |
| AU2017325678B2 (en) | 2022-03-17 |
| US20230265165A1 (en) | 2023-08-24 |
| EP3522718A1 (en) | 2019-08-14 |
| EP3522718A4 (en) | 2020-02-19 |
| AU2017325678A1 (en) | 2019-03-14 |
| US20200181238A1 (en) | 2020-06-11 |
| US10577408B2 (en) | 2020-03-03 |
| US11046748B2 (en) | 2021-06-29 |
| KR102613109B1 (ko) | 2023-12-13 |
| US10428136B2 (en) | 2019-10-01 |
| US11634471B2 (en) | 2023-04-25 |
| EP3522718B1 (en) | 2023-07-05 |
| KR20190057072A (ko) | 2019-05-27 |
| SG11201901505SA (en) | 2019-03-28 |
| CN108697096B (zh) | 2022-05-03 |
| CN108697096A (zh) | 2018-10-23 |
| US20200017573A1 (en) | 2020-01-16 |
| US20180066035A1 (en) | 2018-03-08 |
| WO2018052594A1 (en) | 2018-03-22 |
| US20210309721A1 (en) | 2021-10-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6996772B2 (ja) | Icam-1に特異的なiドメインキメラ抗原受容体 | |
| JP7048494B2 (ja) | 修飾t細胞に対する条件的活性型キメラ抗原受容体 | |
| US20200115461A1 (en) | Compositions and methods for adoptive cell therapies | |
| US20170296623A1 (en) | INHIBITORY CHIMERIC ANTIGEN RECEPTOR (iCAR OR N-CAR) EXPRESSING NON-T CELL TRANSDUCTION DOMAIN | |
| JP2021525509A (ja) | 細胞療法のための多様な抗原結合ドメイン、新規プラットフォームおよびその他の強化 | |
| BR112019022356A2 (pt) | Reagentes de partícula oligoméricos e métodos de uso dos mesmos | |
| WO2017190100A1 (en) | Nucleic acid constructs for co-expression of chimeric antigen receptor and transcription factor, cells containing and therapeutic use thereof | |
| KR20190025855A (ko) | 개선된 입양 t-세포 요법 | |
| BR112019017629A2 (pt) | receptor de união ao antígeno, polinucleotídeo isolado, vetor, célula t transduzida, métodos para o tratamento de uma doença e para induzir a lise, utilização do receptor e receptor | |
| TW201930342A (zh) | 包含nkg2d結構域的多特異性嵌合受體及其使用方法 | |
| CN115243713A (zh) | 用于递送修饰的淋巴细胞聚集体的方法和组合物 | |
| AU2021236145A1 (en) | Methods for generating engineered memory-like NK cells and compositions thereof | |
| JP2021536256A (ja) | 修飾t細胞に対する条件的活性型キメラ抗原受容体 | |
| CA3150884A1 (en) | Immune synapse-stabilizing chimeric antigen receptor (car) t cell | |
| CN114599785A (zh) | 工程化的t细胞及其产生方法 | |
| TWI840351B (zh) | T細胞受體及表現其之工程化細胞 | |
| WO2023286840A1 (ja) | 抗EGFRviii抗体、ポリペプチド、前記ポリペプチドを発現する細胞、前記細胞を含む医薬組成物、前記細胞の製造方法、及び、前記ポリペプチドをコードする塩基配列を含むポリヌクレオチド又はベクター | |
| US20230242666A1 (en) | Methods and Compositions for the Reduction of Chimeric Antigen Receptor Tonic Signaling | |
| WO2023133398A2 (en) | Chimeric cd40 polypeptides and methods of use in immunotherapy | |
| KR20240055714A (ko) | 돌연변이 il-15 조성물 및 이의 방법 | |
| TW202005658A (zh) | T細胞受體及表現其之工程化細胞 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200807 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200807 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20210607 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210706 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211006 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20211109 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20211209 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6996772 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |