一般に、本開示は、エピトープタグ抗体、並びに生物学的試料、例えば組織試料中の一又は複数の標的を検出するためにエピトープタグ抗体を用いる方法に関する。
ここで使用される場合、「a」、「an」及び「the」という単数形の用語は、文脈が明らかに他の定義を示すものでない限り、複数の指示対象を含む。同様に、「or」という単語は、文脈が明らかに他の定義を示すものでない限り、「and」を含むことが意図される。
ここで使用される場合、「含む(comprising)」、「含む(including)」、「有する(having)」等の用語は交換可能に使用され、同じ意味を有する。同様に、「含む(comprises)」、「含む(includes)」、「有する(has)」等は交換可能に使用され、同じ意味を有する。詳細には、前記用語の各々は、「含む(comprising)」の共通の米国特許法の定義と一致するように定義され、従って、「少なくとも次のもの」を意味するオープンな用語であると解釈され、また更なる特徴、限定、態様等々を排除するものではないと解釈される。従って、例えば、「コンポーネントa、b、及びcを有する装置」は、装置が少なくともコンポーネントa、b及びcを含むことを意味する。同様に、「工程a、b、及びcを含む方法」という語句は、方法が少なくとも工程a、b、及びcを含むことを意味する。更に、工程及びプロセスは、ここでは特定の順序で概説されうるが、当業者は、順序付け工程及びプロセスが変わりうることを認識するであろう。
ここで使用される場合、「親和性」という用語は、2つの分子の非ランダム相互作用を指す。「親和性」という用語は、相互作用の強さを指し、解離定数(KD)として定量的に表すことができる。2つの分子の一方又は両方がペプチド(例えば、抗体)であってもよい。結合親和性(すなわち、KD)は、標準的な技術を使用して決定することができる。例えば、親和性は、個々のエピトープと抗体分子との結合強度の尺度でありうる。
ここで使用される場合、「抗体」という用語は、例を挙げると、限定しないが、IgA、IgD、IgE、IgG及びIgM、それらの組み合わせ、及び任意の脊椎動物(例えば、ヒト、ヤギ、ウサギ及びマウスなどの哺乳類)において免疫応答中に産生される同様の分子、並びに抗体断片(例えば、当該分野で知られているF(ab’)2断片、Fab’断片、Fab’−SH断片及びFab断片)、他の分子への結合を実質的に排除するまで対象の分子(又は対象の非常に類似した分子の群)に特異的に結合する組換え抗体断片(例えばsFv断片、dsFv断片、二重特異性sFv断片、二重特異性dsFv断片、F(ab)’2断片、一本鎖Fvタンパク質(「scFv」)、ジスルフィド安定化Fvタンパク質(「dsFv」)、ダイアボディ、及びトリアボディ(当該技術分野で知られている)、及びラクダ科抗体)を含む、免疫グロブリン又は免疫グロブリン様分子を意味する。抗体は抗原のエピトープを特異的に認識して結合する少なくとも軽鎖又は重鎖の免疫グロブリン可変領域を含むポリペプチドリガンドを更に意味する。抗体は、可変重鎖(VH)領域及び可変軽鎖(VL)領域と呼ばれる可変領域をそれぞれが有する、重鎖と軽鎖から構成されうる。併せて、VH領域とVL領域は、抗体によって認識される抗原の結合に関与する。抗体という用語はまたインタクトな免疫グロブリンと、当該技術分野でよく知られているそれらのバリアント及び部分を含む。
ここで使用される場合、「抗原」とは、抗体分子又はT細胞受容体のような特異的な体液性又は細胞性免疫の産物が特異的に結合しうる化合物、組成物、又は物質を意味する。抗原は、例えば、ハプテン、単純な中間代謝物、糖(例えばオリゴ糖)、脂質、及びホルモン、並びに高分子、例えば複合糖質(例えば、多糖類)、リン脂質、核酸及びタンパク質を含む任意のタイプの分子でありうる。
ここで使用される場合、「結合活性(アビディティー)」という用語は、二つ以上の分子の協同的及び相乗的結合を指す。「結合活性」は、二つ以上の分子集団間の複合体の全体的な安定性、すなわち相互作用の機能的結合強度を指す。
ここで使用される場合、「生物学的試料」又は「組織試料」は、限定されないが、単細胞生物、例えば細菌、酵母、原生動物、及びとりわけアメーバ、多細胞生物(健康な又は見かけ上健康なヒト被験体又はがんなどの診断又は研究される状態又は疾患に罹患したヒト患者由来の試料を含む植物又は動物など)を含む任意の生物から得られ、排泄され又は分泌された任意の固体又は流体試料でありうる。例えば、生物学的試料は、例えば、血液、血漿、血清、尿、胆汁、腹水、唾液、脳脊髄液、眼房水又は硝子体液、又は任意の体分泌物、漏出液、滲出液(例えば、膿瘍又は任意の他の感染又は炎症部位から得られる流体)から得られた生物学的流体、又は関節(例えば、正常な関節又は疾患によって冒された関節)から得られた流体でありうる。生物学的試料はまた(腫瘍生検などの生検又は剖検検体を含む)任意の器官又は組織から得られた試料であり得、あるいは細胞(初代細胞又は培養細胞の何れも)又は任意の細胞、組織又は器官によって条件付けされた培地を含みうる。試料は、メラノーマ、腎細胞癌、及び非小細胞肺がん由来のものを含む腫瘍試料でありうる。幾つかの実施態様では、試料は、組織試料内のバイオマーカー(例えば、タンパク質又は核酸配列)を含む標的を検出することによって、がんについて分析される。開示された方法の記載された実施態様は、「正常」試料又は「対照」試料と称される異常、疾病、疾患等々を有さない試料にもまた適用されうる。例えば、複数の位置から組織試料を採取することによって被験体をがんについて検査することは有用であり得、これらの試料を対照として使用し、後の試料と比較して特定のがんがその原発点を越えて広がったか否かを判定することができる。
ここで使用される場合、「コンジュゲート」は、より大きなコンストラクト中に共有結合的に連結された二以上の分子(及び/又はナノ粒子などの物質)を指す。幾つかの実施態様では、コンジュゲートは、一又は複数の他の分子、例えば一又は複数の他の生体分子に共有結合的に連結された一又は複数の生体分子(例えば、ペプチド、タンパク質、酵素、糖、多糖、脂質、糖タンパク質、及びリポタンパク質)を含む。他の実施態様では、コンジュゲートは、一又は複数の検出可能な標識(例えば、フルオロフォア、発光団、蛍光ナノ粒子、ハプテン、酵素及びそれらの組み合わせ)に共有結合的に連結された一又は複数の特異的結合分子(例えば抗体)を含む。
ここで使用される場合、「検出プローブ」は、特定の標的(例えば、核酸配列、タンパク質等々)に結合する核酸プローブ又は一次抗体を含む。検出プローブは、放射性同位元素、酵素基質、補因子、リガンド、化学発光又は蛍光剤、ハプテン(限定されないがDNPを含む)、及び酵素などの直接検出用の標識を含みうる。あるいは、検出プローブは、標識又はタグを含んでいなくてもよく、間接的に(例えば、検出プローブに特異的な二次抗体を用いて)検出されうる。
ここで使用される場合、「ハプテン」は、抗体と特異的に結合することができるが、典型的には、担体分子との組合わせ以外では実質的に免疫原性であることができない小分子である。幾つかの実施態様では、ハプテンには、限定されないが、ピラゾール(例えば、ニトロピラゾール);ニトロフェニル化合物;ベンゾフラザン;トリテルペン;尿素(例えば、フェニル尿素);チオ尿素(例えば、フェニルチオ尿素);ロテノンとロテノン誘導体;オキサゾール(例えば、オキサゾールスルホンアミド);チアゾール(例えば、チアゾールスルホンアミド);クマリンとクマリン誘導体;及びシクロリグナンが含まれる。ハプテンの更なる非限定的な例には、チアゾール;ニトロアリール;ベンゾフラン;トリペルペン;及びシクロリグナンが含まれる。ハプテンの特定の例には、ジ−ニトロフェニル、ビオチン、ジゴキシゲニン、及びフルオレセイン、並びにそれらの任意の誘導体又はアナログが含まれる。他のハプテンは、その開示の全体が出典明示によりここに援用される米国特許第8846320号;第8618265号;第7695929号;第8481270号;及び第9017954号に記載されている。ハプテン自体は、直接的な検出に適している場合があり、すなわち、ハプテンは検出のための適切なシグナルを発しうる。
ここで使用される場合、ここで使用される「流体力学的半径」という用語は、与えられた構造として等価の流体力学的特性を有する球の半径を示す。流体力学的半径は、ストークス・アインシュタイン方程式による拡散係数から導出される。
ここで使用される場合、「免疫組織化学」は、抗体のような特異的結合剤と抗原の相互作用を検出することによって、試料中の抗原の存在又は分布を決定する方法を指す。試料は、抗体−抗原結合を可能にする条件下で抗体と接触させる。抗体−抗原結合は、抗体にコンジュゲートされた検出可能な標識(直接検出)によって又は一次抗体に特異的に結合する二次抗体にコンジュゲートされた検出可能な標識(間接検出)によって検出することができる。
ここで使用される場合、「多重(マルチプレックス)」、「多重化(マルチプレックスト)」又は「多重化(マルチプレキシング)」は、試料中の複数の標的を同時発生的に、実質的に同時に、又は順次検出することを意味する。多重化は、個々に、また任意かつ全ての組み合わせで、複数の区別される核酸(例えば、DNA、RNA、mRNA、miRNA)及びポリペプチド(例えば、タンパク質)を同定及び/又は定量することを含みうる。
ここで使用される場合、「一次抗体」という用語は、組織試料中の標的タンパク質抗原に特異的に結合する抗体を指す。一次抗体は、一般に免疫組織化学手順において使用される第一抗体である。それぞれここに記載されるエピトープタグ抗体、未修飾抗体、又は抗体コンジュゲートが一次抗体の例である。よって、一次抗体は、組織試料内の標的を検出するための「検出プローブ」となりうる。
ここで使用される場合、ここでの「二次抗体」という用語は、検出プローブ又はその一部(例えば、ハプテン又は一次抗体)に特異的に結合し、それにより検出プローブと存在するならばその後の試薬(例えば、標識、酵素等々)との間に架橋を形成する抗体を意味する。二次抗体を使用して、検出プローブ、例えば一次抗体を間接的に検出することができる。二次抗体の例には、それぞれここに記載される抗タグ抗体、抗種抗体、及び抗標識抗体が含まれる。
ここで使用される場合、「特異的結合体」という用語は、特異的結合対のメンバーを言う。特異的結合対は、それらが他の分子への結合を実質的に排除して互いに結合することを特徴とする分子対である(例えば、特異的結合対は、生物学的試料中の他の分子との結合対の二つのメンバーの何れかに対する結合定数よりも少なくとも103M−1大きく、104M−1大きく又は105M−1大きい結合定数を有しうる)。特異的結合部分の特定の例は、特異的結合タンパク質(例えば、抗体、レクチン、ストレプトアビジンのようなアビジン、及びプロテインA)を含む。特異的結合部分はまたそのような特異的結合タンパク質によって特異的に結合される分子(又はその一部)を含みうる。特異的結合体は、上記の一次抗体、又は核酸プローブを含む。
ここで使用される場合、「標的」とは、存在、位置及び/又は濃度が決定されるか又は決定されうる任意の分子を意味する。標的の例には、ここに開示されるもののような核酸配列及びタンパク質が含まれる。
[エピトープタグ抗体]
本開示の一態様は、一又は複数の分子的に操作されたエピトープタグを発現する組換え抗体(「エピトープタグ抗体」)である。一般に、エピトープタグ(短いアミノ酸配列、すなわち抗原性ペプチド配列)の発現は、エピトープタグ抗体が(例えば、ここに更に記載される抗タグ抗体を用いて)認識され及び/又は検出されることを可能にする。従って、ここに開示されるエピトープタグ抗体は、多重免疫組織化学アッセイを含む免疫組織化学アッセイでの使用に適しており、それにより、組織試料内の標的が検出されうるように一次抗体又は検出プローブとして使用されうる。
エピトープタグ抗体は、任意の天然抗体に由来しうる。従って、天然抗体又は未修飾抗体のように、エピトープタグ抗体は、特定の標的に対して特異性を示す。例えば、エピトープタグ抗体は、分化マーカーのクラスター(例えば、CD3、CD8、CD20、CD68)、HER2、FoxP3、PDL1、及びEGFR2に特異的な抗体に由来しうる。他の非限定的な標的、例えば、エピトープタグ抗体が検出目的のために開発されうるタンパク質標的が、ここに更に開示される。
一般に、エピトープタグ抗体は、少なくとも一つのエピトープタグコンストラクトを含み、エピトープタグコンストラクトは交互のスペーサーとエプトープタグを含む。ここで使用される場合、「エピトープタグコンストラクト」という用語は、交互のエプトープタグとスペーサー、例えばスペーサーにより分離されたタンデムリピートエプトープタグを含むアミノ酸配列を意味する(例えば、図20A参照)。
説明目的のみのために、本開示のエピトープタグ抗体は、次の構造を有しうる:
Ab−([スペーサー]−[エピトープタグ])n−[スペーサー](ここで、nは1〜20の範囲の整数であり、「Ab」は抗体であり、「エピトープタグ」及び「スペーサー」はここで定義された通りであり、各「スペーサー」は同一でも異なっていてもよく、([スペーサー]−[エピトープタグ])はエピトープタグコンストラクトの一例を表す。
エピトープタグ抗体は、エピトープタグとスペーサーが重鎖定常領域の末端、軽鎖定常領域の末端、又は重鎖定常領域と軽鎖定常領域の両末端に取り込まれるように操作される。幾つかの実施態様では、エピトープタグコンストラクトは、抗体の重鎖定常領域のC末端、抗体の軽鎖定常領域のC末端、又は抗体の重鎖及び軽鎖定常領域の両C末端に含まれる。
他の実施態様では、エピトープタグコンストラクトは、抗体の重鎖定常領域のC末端のみに含まれる。他の実施態様では、エピトープタグコンストラクトは、抗体の軽鎖定常領域のC末端のみに含まれる。幾つかの実施態様では、重鎖定常領域はここでは表記「H」によって特定される一方、軽鎖定常領域はここでは表記「K」で特定される。例えば、表記H4K4は、重鎖定常領域の末端に4つのエピトープタグを含み、軽鎖定常領域の末端に更なる4つのエピトープタグを含むエピトープタグ抗体を意味しうる。同様に、表記H4K0は、重鎖定常領域の末端に4つのエピトープタグを含み、軽鎖定常領域の末端にエピトープタグを含まないエピトープタグ抗体を意味しうる。
エピトープタグが抗体の機能を損なわない限り(すなわち、抗体が標的に結合する能力を妨げ、又は抗体が検出されることを妨げない限り)任意のタイプのエピトープタグを抗体に組み込むことができる。幾つかの実施態様では、エピトープタグとIgG上のその構成(タグ数、IgG上のタグの位置)が、組み込まれている抗体の任意の三次構造の破壊を最小限に抑えるように選択中に考慮される。幾つかの実施態様では、エピトープタグは、ヒトタンパク質との交差反応性を有さないように選択される。幾つかの実施態様では、エピトープタグは約6から約20の塩基を含むヌクレオチド配列を有する。他の実施態様では、エピトープタグは、約6から約16の塩基を含むヌクレオチド配列を有する。エピトープタグの配列は、天然に生じる供給源に由来してもよく、又は合成であってもよい。
幾つかの実施態様では、エピトープタグは、VSVエピトープタグ(配列番号:1)、AU5エピトープタグ(配列番号:2)、Eエピトープタグ(配列番号:3)、V5エピトープタグ(配列番号:4)、HAエピトープタグ(配列番号:5)、又はE2エピトープタグ(配列番号:6)から選択される。エピトープタグ抗体内に組み込まれうる他の適切なエピトープタグには、FLAG、AU1(配列番号:8)、OLLAS(配列番号:9)、及びKT3(配列番号:7)が含まれる。当然のことながら、これらの例示されたエピトープタグは、当業者に知られている手順に従って改変されうる。
エピトープタグ抗体(又はエピトープタグ抗体に組み込まれた任意のエピトープタグコンストラクト)は、一つのエピトープタグ又は複数のエピトープタグを含むか又は発現しうる。一般に、本開示のエピトープタグ抗体は、エピトープタグが抗体の機能を妨害しないか、又は低下させない限り、任意の数のエピトープタグを含みうる。幾つかの実施態様では、エピトープタグ抗体は、少なくとも2つのエピトープタグを含む。他の実施態様では、エピトープタグ抗体は、少なくとも3つのエピトープタグを含む。更に他の実施態様では、エピトープタグ抗体は、少なくとも4つのエピトープタグを含む。更なる実施態様では、エピトープタグ抗体は、2〜20のエピトープタグを含む。なお更なる実施態様では、エピトープタグ抗体は、2〜12のエピトープタグを含む。なお更なる実施態様では、エピトープタグ抗体は、3〜9のエピトープタグを含む。特定の一実施態様では、エピトープタグ抗体は、4つのエピトープタグを含む。別の特定の実施態様では、エピトープタグ抗体は、5つのエピトープタグを含む。
幾つかの実施態様では、任意のエピトープタグコンストラクトは2〜10のエピトープタグを含む。幾つかの実施態様では、任意のエピトープタグコンストラクトは2〜8のエピトープタグを含む。他の実施態様では、任意のエピトープタグコンストラクトは2〜5のエピトープタグを含む。更に他の実施態様では、任意のエピトープタグコンストラクトは4又は5のエピトープタグを含む。
幾つかの実施態様では、重鎖定常領域のC末端に組み込まれた(又は「発現された」)エピトープタグの数は、軽鎖定常領域のC末端に組み込まれたエピトープタグの数より多い(すなわち、重鎖定常領域のC末端に組み込まれたエピトープタグコンストラクトを構成するエピトープタグの数は、軽鎖定常領域のC末端に組み込まれたエピトープタグコンストラクトを構成するエピトープタグの数より多い)。他の実施態様では、重鎖定常領域のC末端に組み込まれたエピトープタグの数は、軽鎖定常領域のC末端に組み込まれたエピトープタグの数より少ない(すなわち、重鎖定常領域のC末端にエピトープタグコンストラクトを構成するエピトープタグの数は、軽鎖定常領域のC末端のエピトープタグコンストラクトを構成するエピトープタグの数より少ない)。
幾つかの実施態様では、軽鎖定常領域のC末端に組み込まれたエピトープタグの数に対する重鎖定常領域のC末端に組み込まれたエピトープタグの数の比は、4:1〜約1:4の範囲である。他の実施態様では、軽鎖定常領域のC末端に組み込まれたエピトープタグの数に対する重鎖定常領域のC末端に組み込まれたエピトープタグの数の比は、2:1〜約1:2の範囲である。更に他の実施態様では、軽鎖定常領域のC末端に組み込まれたエピトープタグの数に対する重鎖定常領域のC末端に組み込まれたエピトープタグの数の比は、1.5:1〜約1:1.5の範囲である。更なる実施態様では、軽鎖定常領域のC末端に組み込まれたエピトープタグの数に対する重鎖定常領域のC末端に組み込まれたエピトープタグの数の比は約1:1である。
幾つかの実施態様では、2〜8のエピトープタグが重鎖定常領域のC末端に組み込まれ、2〜8のエピトープタグが軽鎖定常領域のC末端に組み込まれている。幾つかの実施態様では、2〜8のエピトープタグが重鎖定常領域のC末端に組み込まれ、0〜5のエピトープタグが軽鎖定常領域のC末端に組み込まれている。他の実施態様では、2〜6のエピトープタグが重鎖定常領域のC末端に組み込まれ、0〜4のエピトープタグが軽鎖定常領域のC末端に組み込まれている。他の実施態様では、4又は5のエピトープタグが重鎖定常領域のC末端に組み込まれ、2〜5のエピトープタグが軽鎖定常領域のC末端に組み込まれている。更に他の実施態様では、4又は5のエピトープタグが重鎖定常領域のC末端に組み込まれ、0、1、又は2のエピトープタグが軽鎖定常領域のC末端に組み込まれている。更なる実施態様では、4又は5のエピトープタグが重鎖定常領域のC末端に組み込まれ、軽鎖定常領域のC末端にはエピトープタグが組み込まれていない。他の実施態様では、少なくとも2のエピトープタグが軽鎖定常領域のC末端に組み込まれ、少なくとも1のエピトープタグが重鎖定常領域のC末端に組み込まれている。他の実施態様では、少なくとも3のエピトープタグが軽鎖定常領域のC末端に組み込まれ、少なくとも1のエピトープタグが重鎖定常領域のC末端に組み込まれている。
特定の一実施態様では、エピトープタグ抗体は構成H1K0を有する。別の特定の実施態様では、エピトープタグ抗体は構成H2K0を有する。別の特定の実施態様では、エピトープタグ抗体は構成H3K0を有する。別の特定の実施態様では、エピトープタグ抗体は構成H4K0を有する。別の特定の実施態様では、エピトープタグ抗体は構成H5K0を有する。別の特定の実施態様では、エピトープタグ抗体は構成H0K1を有する。別の特定の実施態様では、エピトープタグ抗体は構成H0K2を有する。別の特定の実施態様では、エピトープタグ抗体は構成H0K3を有する。別の特定の実施態様では、エピトープタグ抗体は構成H0K4を有する。別の特定の実施態様では、エピトープタグ抗体は構成H0K4を有する。別の特定の実施態様では、エピトープタグ抗体は構成H2K2を有する。別の特定の実施態様では、エピトープタグ抗体は構成H3K3を有する。別の特定の実施態様では、エピトープタグ抗体は構成H4K4を有する。
ここに記載のように、エピトープタグはスペーサーによって互いに分離されている。幾つかの実施態様では、任意のエピトープタグコンストラクトが各定常領域の末端に直接に結合するのではなくスペーサーに「結合」するように、重鎖及び/又は軽鎖定常領域の末端にスペーサーが提供される。幾つかの実施態様では、更なる配列(例えば、連結又は結合配列)が、重鎖及び/又は軽鎖定常領域の末端の間に提供され、スペーサーと(又はエピトープタグコンストラクトと)末端を架橋する。同様に、幾つかの実施態様では、少なくとも一つの更なるスペーサーが、エピトープタグコンストラクトの末端エピトープタグの後であるが、任意の停止コドン配列の前に提供される。図20A〜20Fは、エピトープタグコンストラクトの構造と、エピトープタグ(四角い枠内に示されている)とスペーサー(エピートータグ間の配列)の間の空間的及び構造的関係とを更に示している。図20A〜20Fは「エピトープタグ遺伝子」(ここで定義)内の制限部位と停止コドンの位置をまた示している。
スペーサー自体は、スペーサーのアミノ酸配列(又はその結果得られる三次構造)が抗体の任意のフォールディングタンパク質ドメインを妨害しないように選択される。幾つかの実施態様では、スペーサーは、約20塩基から約60塩基を有する核酸配列を含む。幾つかの実施態様では、任意のスペーサーのサイズは、エピトープタグ抗体への複数の抗タグ抗体の結合を促進するためにスペーサーがエピトープタグを十分に分離するように選択される。
幾つかの実施態様では、スペーサーは、配列番号:10、配列番号:11、配列番号:12、配列番号:13、配列番号:14、又は配列番号:15から選択されるアミノ酸配列を含む。幾つかの実施態様では、スペーサーは、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14から選択される配列に対して少なくとも75%の同一性を有するアミノ酸配列を含む。幾つかの実施態様では、スペーサーは、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14から選択される配列に対して少なくとも80%の同一性を有するアミノ酸配列を含む。幾つかの実施態様では、スペーサーは、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14から選択される配列に対して少なくとも85%の同一性を有するアミノ酸配列を含む。幾つかの実施態様では、スペーサーは、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14から選択される配列に対して少なくとも90%の同一性を有するアミノ酸配列を含む。幾つかの実施態様では、スペーサーは、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14から選択される配列に対して少なくとも95%の同一性を有するアミノ酸配列を含む。
幾つかの実施態様では、スペーサーを構成するアミノ酸配列の少なくとも一部は、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14の配列を含むアミノ酸配列を含む。幾つかの実施態様では、スペーサーを構成するアミノ酸配列の少なくとも一部は、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14の配列に対して少なくとも75%を有するアミノ酸配列を含む。幾つかの実施態様では、スペーサーを構成するアミノ酸配列の少なくとも一部は、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14の配列を含むアミノ酸配列を含む。幾つかの実施態様では、スペーサーを構成するアミノ酸配列の少なくとも一部は、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14の配列に対して少なくとも80%を有するアミノ酸配列を含む。幾つかの実施態様では、スペーサーを構成するアミノ酸配列の少なくとも一部は、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14の配列を含むアミノ酸配列を含む。幾つかの実施態様では、スペーサーを構成するアミノ酸配列の少なくとも一部は、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14の配列に対して少なくとも85%を有するアミノ酸配列を含む。幾つかの実施態様では、スペーサーを構成するアミノ酸配列の少なくとも一部は、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14の配列を含むアミノ酸配列を含む。幾つかの実施態様では、スペーサーを構成するアミノ酸配列の少なくとも一部は、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14の配列に対して少なくとも90%を有するアミノ酸配列を含む。幾つかの実施態様では、スペーサーを構成するアミノ酸配列の少なくとも一部は、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14の配列を含むアミノ酸配列を含む。幾つかの実施態様では、スペーサーを構成するアミノ酸配列の少なくとも一部は、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14の配列に対して少なくとも95%を有するアミノ酸配列を含む。
エピトープタグを分離するスペーサーは、同じであっても異なっていてもよい。例えば、エピトープタグコンストラクトが5つのエピトープタグを含む場合、コンストラクトの5つのエピトープタグ間のスペーサーは同じでも異なっていてもよい。幾つかの実施態様では、任意のエピトープタグコンストラクトのエピトープタグを分離するスペーサーは全て同じである。他の実施態様では、任意のエピトープタグコンストラクトのエピトープタグを分離するスペーサーは全て互いに異なっている。更に他の実施態様では、任意のエピトープタグコンストラクトのエピトープタグを分離するスペーサーの少なくとも幾つかは同じである。幾つかの実施態様では、任意のスペーサーの一部は別のスペーサーの一部と同じであっても異なっていてもよい。幾つかの実施態様では、任意のスペーサーの任意の配列の一部は、別のスペーサーの配列の一部と同じであってもよい。幾つかの実施態様では、スペーサーの幾つかの少なくとも一部は同じである。
幾つかの実施態様では、任意のエピトープタグコンストラクトは、配列番号:10、配列番号:11、配列番号:12、又は配列番号:13、配列番号:14の配列を含む少なくとも一つのスペーサーを含む(又はスペーサーを構成するアミノ酸配列の少なくとも一部は、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14の配列を含むアミノ酸配列を含む)。他の実施態様では、任意のエピトープタグコンストラクトは、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14の一つの配列を含む少なくとも一つのスペーサー(又はスペーサーを構成するアミノ酸配列の少なくとも一部は、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14の配列を含むアミノ酸配列を含む)と;配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14の別のものの配列を含む少なくとも第二のスペーサーを含む(又はスペーサーを構成するアミノ酸配列の少なくとも一部は、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14の配列を含むアミノ酸配列を含む)。
幾つかの実施態様では、エピトープタグコンストラクトの分子量は、約5g/molから約35g/molの範囲である。他の実施態様では、エピトープタグコンストラクトの分子量は、約5g/molから約30g/molの範囲である。他の実施態様では、エピトープタグコンストラクトの分子量は、約10g/molから約30g/molの範囲である。他の実施態様では、エピトープタグコンストラクトの分子量は、約5g/molから約25g/molの範囲である。他の実施態様では、エピトープタグコンストラクトの分子量は、約5g/molから約20g/molの範囲である。他の実施態様では、エピトープタグコンストラクトの分子量は、約7.5g/molから約15g/molの範囲である。他の実施態様では、エピトープタグコンストラクトの分子量の範囲は20g/molを超えない。他の実施態様では、エピトープタグコンストラクトの分子量の範囲は15g/molを超えない。
幾つかの実施態様では、少なくとも一つのエピトープタグコンストラクトの連続する−[エピトープタグ]−間の距離は約8nmから約18nmの範囲である。幾つかの実施態様では、少なくとも一つのエピトープタグコンストラクトの連続する−[エピトープタグ]−間の距離は18nm未満である。幾つかの実施態様では、少なくとも一つのエピトープタグコンストラクトの連続する−[エピトープタグ]−間の距離は16nm未満である。幾つかの実施態様では、少なくとも一つのエピトープタグコンストラクトの連続する−[エピトープタグ]−間の距離は14nm未満である。幾つかの実施態様では、少なくとも一つのエピトープタグコンストラクトの連続する−[エピトープタグ]−間の距離は12nm未満である。幾つかの実施態様では、少なくとも一つのエピトープタグコンストラクトの連続する−[エピトープタグ]−間の距離は11nm未満である。幾つかの実施態様では、少なくとも一つのエピトープタグコンストラクトの連続する−[エピトープタグ]−間の距離は10nm未満である。幾つかの実施態様では、−[スペーサー]−は、隣接するエピトープタグ間の抗タグ抗体の二価結合を容易にするようなサイズとされている(図35Aを参照)。而して、幾つかの実施態様では、任意の二つの隣接するエピトープタグは、抗タグ抗体の抗原結合部位間の距離を近似する距離だけ互いに離間されている。幾つかの実施態様では、第一抗原結合部位は少なくとも一つのエピトープタグコンストラクトの第一エピトープタグに結合し、第二抗原結合部位は少なくとも一つのエピトープタグコンストラクトの第二の隣接エピトープタグに結合する。
スペーシングが抗体の二価結合を容易にしうるが、当業者は、抗体、例えば抗タグ抗体がエピトープタグを「スキップ」し、非隣接エピトープタグに結合することもまた可能であることを理解するであろう(図35B参照)。例えば、エピトープタグ抗体は、第一及び第二エピトープタグが互いに隣接している(しかし、もちろん、スペーサーによって分離される)第一、第二、及び第三エピトープタグを含みうる。この例では、抗タグ抗体の第一抗原結合部位が第一エピトープタグに結合し得、抗タグ抗体の第二抗原結合部位が第三エピトープタグに結合しうる。当業者であれば、スペーサーの柔軟性と長さの組合せが、約120度から約220度のエルボー角を有する抗タグ抗体の両アームによって到達されうる近接又は非近接エピトープの空間配置を形成しうることをまた理解するであろう。幾つかの実施態様では、エルボー角は約120度から約200度の範囲である。幾つかの実施態様では、エルボー角は約140度から約200度の範囲である。
幾つかの実施態様では、任意のエピトープタグ抗体の全てのエピトープタグコンストラクトの総分子量は約5g/molから約80g/molである。他の実施態様では、任意のエピトープタグ抗体の全てのエピトープタグコンストラクトの総分子量は約5g/molから約50g/molである。更に他の実施態様では、任意のエピトープタグ抗体の全てのエピトープタグコンストラクトの総分子量は約10g/molから約40g/molである。更なる実施態様では、任意のエピトープタグ抗体の全てのエピトープタグコンストラクトの総分子量は約15g/molから約30g/molである。
また更なる実施態様では、任意のエピトープタグ抗体の全てのエピトープタグコンストラクトの総分子量は、天然抗体の分子量(すなわち、同じ特異性及び/又は機能的特性を有する対応する未修飾抗体の分子量)の40%未満である。また更なる実施態様では、任意のエピトープタグ抗体の全てのエピトープタグコンストラクトの総分子量は、天然抗体の分子量の30%未満である。また更なる実施態様では、任意のエピトープタグ抗体の全てのエピトープタグコンストラクトの総分子量は、天然抗体の分子量の25%未満である。
[エピトープタグコンストラクト及びエピトープタグ抗体の操作]
本開示のエピトープタグ抗体は、当業者に知られている方法に従って作製されうる。一般に、スペーサーで分離されたタンデムリピートエピトープタグを含む「エピトープ遺伝子」が合成され、配列が検証される。幾つかの実施態様では、エピトープ遺伝子は、配列番号:15、配列番号:17、配列番号:19、配列番号:21、配列番号:23、配列番号:25、配列番号:27、配列番号:29、又は配列番号:31の任意の核酸配列を含む。他の実施態様では、エピトープ遺伝子は、配列番号:15、配列番号:17、配列番号:19、配列番号:21、配列番号:23、配列番号:25、配列番号:27、配列番号:29、又は配列番号:31の何れかに少なくとも80%の同一性を有する核酸配列を含む。更に他の実施態様では、エピトープ遺伝子は、配列番号:15、配列番号:17、配列番号:19、配列番号:21、配列番号:23、配列番号:25、配列番号:27、配列番号:29、又は配列番号:31の何れかに少なくとも90%の同一性を有する核酸配列を含む。更なる実施態様では、エピトープ遺伝子は、配列番号:15、配列番号:17、配列番号:19、配列番号:21、配列番号:23、配列番号:25、配列番号:27、配列番号:29、又は配列番号:31の何れかに少なくとも95%の同一性を有する核酸配列を含む。また更なる実施態様では、エピトープ遺伝子は、配列番号:15、配列番号:17、配列番号:19、配列番号:21、配列番号:23、配列番号:25、配列番号:27、配列番号:29、又は配列番号:31の何れかに少なくとも約97%の同一性を有する核酸配列を含む。
エピトープ遺伝子合成後、エピトープ遺伝子は、(例えば、配列を保存しベクターによって遺伝子を増やすために)中規模のDNA調製を使用して適切なベクター(例えばpUC57−Kan)中にクローニングされる。ついで、エピトープ遺伝子は、C末端の制限部位(例えば5’Not1及び3’Sfil)によって対象の抗体の重鎖定常領域のC末端又は軽鎖定常領域のC末端にクローニングされ、抗体発現ベクターの多重クローニング部位(MCS)中に挿入される。最終の重鎖定常領域−エピトープタグコンストラクト又は最終の軽鎖定常領域−エピトープタグコンストラクトを作製するために、最大規模のDNA調製が使用される。ついで、DNAコンストラクト(重鎖定常領域−エピトープタグコンストラクト又は最終の軽鎖定常領域−エピトープタグコンストラクト)を、当業者に知られているような常套的な抗体発現及び産生プロセスによってHEK293細胞中に一過性にトランスフェクトする。
別法では、抗体発現ベクターは、抗体発現及び産生において現在使用されているもの、すなわち天然の未修飾抗体を産生するために使用される抗体発現ベクターから選択される。エピトープ遺伝子が合成され、ベクター、例えばpUC57中に挿入された後、エピトープ遺伝子が、正しい読み枠で抗体遺伝子の下流の抗体発現ベクター中に(例えばNot1及びSfi1部位を介して)クローニングされる。このようにして、エピトープベクターのライブラリーが既存の抗体発現ベクターを使用して構築されうる。次に、対象の抗体のIgG H及びK鎖遺伝子配列が、制限部位(例えば、Nhe1及びNot1)を介して抗体発現ベクターから抽出され、同じ制限部位(例えば、Nhe1及びNot1)を介してエピトープベクター中に挿入される。IgG H又はK鎖配列は正しい読み枠でタグ配列の上流に位置させられる。培養系において、エピトープベクターは、IgG H又はK鎖とタグをIgGのC末端に発現する。
[特定のエピトープタグコンストラクト及びエピトープタグ抗体の例]
ここで提供されるのは、操作されて抗体の重鎖及び/又は軽鎖定常領域の末端に組み込まれうるエピトープタグコンストラクトの特定の例である。当業者であれば、多かれ少なかれエピトープタグを有するエピトープコンストラクトを、上述の手順に従って、また当業者に知られている他の方法に従って、エピトープタグ遺伝子を改変することによって産生することができることが分かるであろう。而して、次の例は非限定的な例である。
[4つのVSVエピトープタグを有するエピトープコンストラクトを含むエピトープタグ抗体]
幾つかの実施態様は、VSVエピトープタグを発現するエピトープタグ抗体である。幾つかの実施態様では、エピトープタグ抗体は少なくとも一つのエピトープタグコンストラクトを含み、少なくとも一つのエピトープタグコンストラクトは4つのVSVエピトープタグを含む。幾つかの実施態様では、エピトープタグコンストラクトは、配列番号:1のアミノ酸配列を有する4つのエピトープタグを含む。幾つかの実施態様では、エピトープタグコンストラクトは、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14のアミノ酸配列の少なくとも一つを含む少なくとも一つのスペーサーを有する。幾つかの実施態様では、エピトープタグ抗体は、配列番号:16のアミノ酸配列を含む。幾つかの実施態様では、エピトープタグ抗体は、重鎖定常領域のC末端に配列番号:16のアミノ酸配列を含む。他では軽鎖定常領域のC末端にある。更に他の実施態様では、エピトープタグ抗体は、重鎖定常領域のC末端と軽鎖定常領域のC末端の両方に配列番号:16のアミノ酸配列を含む。幾つかの実施態様では、エピトープタグ抗体は、CD3、CD8、CD20、CD68、HER2、FoxP3、PDL1、及びEGFR2の少なくとも一つに特異的である。幾つかの実施態様では、この特定のエピトープ遺伝子は例えば5つのエピトープタグを有するように改変されうる。
[4つのAU5エピトープタグを有するエピトープコンストラクトを含むエピトープタグ抗体]
幾つかの実施態様は、AU5エピトープタグを発現するエピトープタグ抗体である。幾つかの実施態様では、エピトープタグ抗体は少なくとも一つのエピトープタグコンストラクトを含み、少なくとも一つのエピトープタグコンストラクトは4つのAU5エピトープタグを含む。幾つかの実施態様では、エピトープタグコンストラクトは、配列番号:2のアミノ酸配列を有する4つのエピトープタグを含む。幾つかの実施態様では、エピトープタグコンストラクトは、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14のアミノ酸配列の少なくとも一つを含む少なくとも一つのスペーサーを有する。幾つかの実施態様では、エピトープタグ抗体は、配列番号:18のアミノ酸配列を含む。幾つかの実施態様では、エピトープタグ抗体は、重鎖定常領域のC末端に配列番号:18のアミノ酸配列を含む。他の実施態様では、エピトープタグ抗体は、軽鎖定常領域のC末端に配列番号:18のアミノ酸配列を含む。更に他の実施態様では、エピトープタグ抗体は、重鎖定常領域のC末端と軽鎖定常領域のC末端の両方に配列番号:18のアミノ酸配列を含む。幾つかの実施態様では、エピトープタグ抗体は、CD3、CD8、CD20、CD68、HER2、FoxP3、PDL1、及びEGFR2の少なくとも一つに特異的である。幾つかの実施態様では、この特定のエピトープ遺伝子は、例えば5つのエピトープタグを有するように改変されうる。
[4つのEエピトープタグを有するエピトープコンストラクトを含むエピトープタグ抗体]
幾つかの実施態様は、Eエピトープタグを発現するエピトープタグ抗体である。幾つかの実施態様では、エピトープタグ抗体は、少なくとも一つのエピトープタグコンストラクトを含み、少なくとも一つのエピトープタグコンストラクトは4つのEエピトープタグを含む。幾つかの実施態様では、エピトープタグコンストラクトは、配列番号:3のアミノ酸配列を有する4つのエピトープタグを含む。幾つかの実施態様では、エピトープタグコンストラクトは、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14のアミノ酸配列の少なくとも一つを含む少なくとも一つのスペーサーを有する。幾つかの実施態様では、エピトープタグ抗体は、配列番号:20のアミノ酸配列を含む。幾つかの実施態様では、エピトープタグ抗体は、重鎖定常領域のC末端に配列番号:20のアミノ酸配列を含む。他の実施態様では、エピトープタグ抗体は、軽鎖定常領域のC末端に配列番号:20のアミノ酸配列を含む。更に他の実施態様では、エピトープタグ抗体は、重鎖定常領域のC末端と軽鎖定常領域のC末端の両方に配列番号:20のアミノ酸配列を含む。幾つかの実施態様では、エピトープタグ抗体は、CD3、CD8、CD20、CD68、HER2、FoxP3、PDL1、及びEGFR2の少なくとも一つに特異的である。幾つかの実施態様では、この特定のエピトープ遺伝子は、例えば5つのエピトープタグを有するように改変されうる。
[5つのV5エピトープタグを有するエピトープコンストラクトを含むエピトープタグ抗体]
幾つかの実施態様は、V5エピトープタグを発現するエピトープタグ抗体である。幾つかの実施態様では、エピトープタグ抗体は、少なくとも一つのエピトープタグコンストラクトを含み、少なくとも一つのエピトープタグコンストラクトは5つのV5エピトープタグを含む。幾つかの実施態様では、エピトープタグコンストラクトは、配列番号:4のアミノ酸配列を有する5つのエピトープタグを含む。幾つかの実施態様では、エピトープタグコンストラクトは、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14のアミノ酸配列の少なくとも一つを含む少なくとも一つのスペーサーを有する。幾つかの実施態様では、エピトープタグ抗体は、配列番号:22のアミノ酸配列を含む。幾つかの実施態様では、エピトープタグ抗体は、重鎖定常領域のC末端に配列番号:22のアミノ酸配列を含む。他の実施態様では、エピトープタグ抗体は、軽鎖定常領域のC末端に配列番号:22のアミノ酸配列を含む。更に他の実施態様では、エピトープタグ抗体は、重鎖定常領域のC末端と軽鎖定常領域のC末端の両方に配列番号:22のアミノ酸配列を含む。幾つかの実施態様では、エピトープタグ抗体は、CD3、CD8、CD20、CD68、HER2、FoxP3、PDL1、及びEGFR2の少なくとも一つに特異的である。幾つかの実施態様では、この特定のエピトープ遺伝子は、例えば4つのエピトープタグを有するように改変されうる。
[4つのHAエピトープタグを有するエピトープコンストラクトを含むエピトープタグ抗体]
幾つかの実施態様は、HAエピトープタグを発現するエピトープタグ抗体である。幾つかの実施態様では、エピトープタグ抗体は少なくとも一つのエピトープタグコンストラクトを含み、少なくとも一つのエピトープタグコンストラクトは4つのHAエピトープタグを含む。幾つかの実施態様では、エピトープタグコンストラクトは、配列番号:5のアミノ酸配列を有する4つのエピトープタグを含む。幾つかの実施態様では、エピトープタグコンストラクトは、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14のアミノ酸配列の少なくとも一つを含む少なくとも一つのスペーサーを有する。幾つかの実施態様では、エピトープタグ抗体は、配列番号:24のアミノ酸配列を含む。幾つかの実施態様では、エピトープタグ抗体は、重鎖定常領域のC末端に配列番号:24のアミノ酸配列を含む。他の実施態様では、エピトープタグ抗体は、軽鎖定常領域のC末端に配列番号:24のアミノ酸配列を含む。更に他の実施態様では、エピトープタグ抗体は、重鎖定常領域のC末端と軽鎖定常領域のC末端の両方に配列番号:24のアミノ酸配列を含む。幾つかの実施態様では、エピトープタグ抗体は、CD3、CD8、CD20、CD68、HER2、FoxP3、PDL1、及びEGFR2の少なくとも一つに特異的である。幾つかの実施態様では、この特定のエピトープ遺伝子は、例えば5つのエピトープタグを有するように改変されうる。
[4つのE2エピトープタグを有するエピトープコンストラクトを含むエピトープタグ抗体]
幾つかの実施態様は、E2エピトープタグを発現するエピトープタグ抗体である。幾つかの実施態様では、エピトープタグ抗体は少なくとも一つのエピトープタグコンストラクトを含み、少なくとも一つのエピトープタグコンストラクトは4つのE2エピトープタグを含む。幾つかの実施態様では、エピトープタグコンストラクトは、配列番号:6のアミノ酸配列を有する4つのエピトープタグを含む。幾つかの実施態様では、エピトープタグコンストラクトは、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14のアミノ酸配列の少なくとも一つを含む少なくとも一つのスペーサーを有する。幾つかの実施態様では、エピトープタグ抗体は、配列番号:26のアミノ酸配列を含む。幾つかの実施態様では、エピトープタグ抗体は、重鎖定常領域のC末端に配列番号:26のアミノ酸配列を含む。他の実施態様では、エピトープタグ抗体は、軽鎖定常領域のC末端に配列番号:26のアミノ酸配列を含む。更に他の実施態様では、エピトープタグ抗体は、重鎖定常領域のC末端と軽鎖定常領域のC末端の両方に配列番号:26のアミノ酸配列を含む。幾つかの実施態様では、エピトープタグ抗体は、CD3、CD8、CD20、CD68、HER2、FoxP3、PDL1、及びEGFR2の少なくとも一つに特異的である。幾つかの実施態様では、この特定のエピトープ遺伝子は、例えば5つのエピトープタグを有するように改変されうる。
[4つのKT3エピトープタグを有するエピトープコンストラクトを含むエピトープタグ抗体]
幾つかの実施態様は、KT3エピトープタグを発現するエピトープタグ抗体である。幾つかの実施態様では、エピトープタグ抗体は少なくとも一つのエピトープタグコンストラクトを含み、少なくとも一つのエピトープタグコンストラクトは4つのKT3エピトープタグを含む。幾つかの実施態様では、エピトープタグコンストラクトは、配列番号:7のアミノ酸配列を有する4つのエピトープタグを含む。幾つかの実施態様では、エピトープタグコンストラクトは、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14のアミノ酸配列の少なくとも一つを含む少なくとも一つのスペーサーを有する。幾つかの実施態様では、エピトープタグ抗体は、配列番号:28のアミノ酸配列を含む。幾つかの実施態様では、エピトープタグ抗体は、重鎖定常領域のC末端に配列番号:28のアミノ酸配列を含む。他の実施態様では、エピトープタグ抗体は、軽鎖定常領域のC末端に配列番号:28のアミノ酸配列を含む。更に他の実施態様では、エピトープタグ抗体は、重鎖定常領域のC末端と軽鎖定常領域のC末端の両方に配列番号:28のアミノ酸配列を含む。幾つかの実施態様では、エピトープタグ抗体は、CD3、CD8、CD20、CD68、HER2、FoxP3、PDL1、及びEGFR2の少なくとも一つに特異的である。幾つかの実施態様では、この特定のエピトープ遺伝子は、例えば5つのエピトープタグを有するように改変されうる。
[4つのAU1エピトープタグを有するエピトープコンストラクトを含むエピトープタグ抗体]
幾つかの実施態様は、AU1エピトープタグを発現するエピトープタグ抗体である。幾つかの実施態様では、エピトープタグ抗体は少なくとも一つのエピトープタグコンストラクトを含み、少なくとも一つのエピトープタグコンストラクトは4つのAU1エピトープタグを含む。幾つかの実施態様では、エピトープタグコンストラクトは、配列番号:8のアミノ酸配列を有する4つのエピトープタグを含む。幾つかの実施態様では、エピトープタグコンストラクトは、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14のアミノ酸配列の少なくとも一つを含む少なくとも一つのスペーサーを有する。幾つかの実施態様では、エピトープタグ抗体は、配列番号:32のアミノ酸配列を含む。幾つかの実施態様では、エピトープタグ抗体は、重鎖定常領域のC末端に配列番号:32のアミノ酸配列を含む。他の実施態様では、エピトープタグ抗体は、軽鎖定常領域のC末端に配列番号:32のアミノ酸配列を含む。更に他の実施態様では、エピトープタグ抗体は、重鎖定常領域のC末端と軽鎖定常領域のC末端の両方に配列番号:32のアミノ酸配列を含む。幾つかの実施態様では、エピトープタグ抗体は、CD3、CD8、CD20、CD68、HER2、FoxP3、PDL1、及びEGFR2の少なくとも一つに特異的である。幾つかの実施態様では、この特定のエピトープ遺伝子は、例えば5つのエピトープタグを有するように改変されうる。
[4つのOLLASエピトープタグを有するエピトープコンストラクトを含むエピトープタグ抗体]
幾つかの実施態様は、OLLASエピトープタグを発現するエピトープタグ抗体である。幾つかの実施態様では、エピトープタグ抗体は少なくとも一つのエピトープタグコンストラクトを含み、少なくとも一つのエピトープタグコンストラクトは4つのOLLASエピトープタグを含む。幾つかの実施態様では、エピトープタグコンストラクトは、配列番号:9のアミノ酸配列を有する4つのエピトープタグを含む。幾つかの実施態様では、エピトープタグコンストラクトは、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14のアミノ酸配列の少なくとも一つを含む少なくとも一つのスペーサーを有する。幾つかの実施態様では、エピトープタグ抗体は、配列番号:30のアミノ酸配列を含む。幾つかの実施態様では、エピトープタグ抗体は、重鎖定常領域のC末端に配列番号:30のアミノ酸配列を含む。他の実施態様では、エピトープタグ抗体は、軽鎖定常領域のC末端に配列番号:30のアミノ酸配列を含む。更に他の実施態様では、エピトープタグ抗体は、重鎖定常領域のC末端と軽鎖定常領域のC末端の両方に配列番号:30のアミノ酸配列を含む。幾つかの実施態様では、エピトープタグ抗体は、CD3、CD8、CD20、CD68、HER2、FoxP3、PDL1、及びEGFR2の少なくとも一つに特異的である。幾つかの実施態様では、この特定のエピトープ遺伝子は、例えば5つのエピトープタグを有するように改変されうる。
[特徴付け]
ここに開示されたエピトープタグ抗体、並びにその天然の未修飾対応物は、ELISAとIHCにおいて抗種二次抗体を用いて検出することができる。ELISA研究では、エピトープペプチドをプレート上にコーティングし、エピトープタグ一次抗体を適用し、それに西洋ワサビペルオキシダーゼにコンジュゲートしたヤギ抗ウサギ二次抗体を続け、3,3’−ジアミノベンジジン(DAB)を酵素の発色基質として使用した。IHCでは、エピトープタグ一次抗体をヒト扁桃組織に適用し、それに西洋ワサビペルオキシダーゼにコンジュゲートしたヤギ抗ウサギ二次抗体を続け、3,3’−ジアミノベンジジン(DAB)を酵素の発色基質として使用した。一次抗体(すなわち、エピトープタグ抗体と対応する天然の未修飾抗体)は、両方とも1μg/mLの濃度で試験した(図16A〜16F及び図17A〜17Fを参照)。抗CD3エピトープタグ抗体のみ(図17D参照)が理想的よりは劣るが奏功し、如何なる特定の理論にも縛られることを望むものではないが、重鎖定常領域のC末端の4つのエピトープタグと軽鎖定常領域のC末端の付加的な4つのエピトープタグの存在が、抗体がなお染色アッセイで機能したものの、理想的に機能することを妨げた立体障害を導入したのかも知れないと推察される。
更に、図18に示されるように、本出願人は、抗体のエピトープタギングが、対応する天然抗体の抗体産生の収量と比較して、抗体産生の収量に悪影響を及ぼさないことを実証した。加えて、エピトープタグ抗体は、加速安定性試験において、24ヶ月間安定であることが示された(図19に示す加速安定性試験において4℃の貯蔵に相当する)。より短い期間(例えば5〜10日)の間、高温(すなわち、37℃及び45℃)で収集されたデータに基づいて、意図された保存条件(すなわち4℃)で、試験抗体(希釈剤90103中1ug/ml濃度)のリアルタイム安定性を予測するためにアレニウスモデルに従った。
本出願人はまた抗タグ抗体と開示されたエピトープタグ抗体上に存在するタンデムタグとの間の結合動態を決定するために表面プラズモン共鳴を利用する試験を行った。実施例12に記載したように、本出願人は、動態が、抗タグ抗体とエピトープタグ抗体上のタンデムタグとの間で結合活性が触媒されたことを発見した(図31A〜31Eを参照)。ここに記載したように、「結合活性」は、二つ以上の分子集団(例えば、抗タグ抗体と各タグ)間の複合体の全体的な安定性、すなわち、2つの分子集団間の相互作用の機能的結合強度を意味する。ここでの「結合活性が触媒された」とは、エピトープタグ抗体における、タンデムタグ、おそらくは二つ以上のタグに対する抗タグ抗体の協調的及び相乗的結合を指す。例えば、本開示の組換え抗体、例えばCD68エピトープタグ抗体上のタンデムV5タグへの抗V5抗体の結合は、単一のV5タグに対して少なくとも240倍、結合活性が触媒されたことが見出された(図31A参照)。同様に、本開示の組換え抗体、例えばCD20エピトープタグ抗体上のタンデムHAタグへの抗HA抗体の結合は、単一のHAタグに対して少なくとも2000倍、結合活性が触媒されたことが見出された(図31D参照)。如何なる特定の理論にも束縛されることを望まないが、そのような動態は二次抗体の性能を有意に改善すると考えられる。加えて、本出願人は、抗タグ抗体とエピトープタグ抗体のタグとの間の結合速度が速く、解離速度が、機器の仕様から外れているか、又は研究された全てのタグ構成に対して正にドリフトしていたと考える(図32A〜32Dを参照)。
本出願人はまた(a)(i)溶液中のエピトープタグ抗体の流体力学的半径と(ii)温度誘発凝集とを決定する動的光散乱(DLS)実験;(b)IgGドメインの融解温度に対するエピトープタグの影響を決定する示差走査熱量測定(DSC)実験;及び(c)試料の均一性を決定するSEC実験を行った。DSC実験により、本出願人は、本開示の組換えエピトープタグ抗体が、単量体抗体に対して予想されるDSCパターンと一致して、溶液中の単量体免疫グロブリンG(IgG)として生じることを発見した(図28A〜28Eを参照)。このことから、本出願人は、エピトープタグ抗体のタグは、抗体の適切な折り畳みを全体として妨害しないと結論付けた。而して、エピトープタグ抗体は、それが由来する一次抗体と一致した適切な折り畳みを維持し、同時にタンデムタグに柔軟性を付与し、更にエピトープタグへの到達を可能にした。
DLSは、懸濁液中の小粒子、又は溶液中のポリマー、例えば生体分子のサイズ分布プロファイルを決定するために使用されうる技術である。本出願人によって行われたDLS実験は、エピトープタグ抗体の流体力学的半径が、抗タグ抗体への十分な到達性を可能にする、タグの比較的非構造的で非常に柔軟な性質を示唆していることを示した。本出願人は、70℃より高い温度で、タグなし抗体がかなり大きな凝集体(すなわち、1000nmより大きい)を形成し、沈殿することを示した。その一方、本開示のエピトープタグ抗体は、約7nmから約25nmの流体力学的半径を有する粒子を形成した。これらの粒子は、重鎖のみ又は軽鎖のみにタグを有するエピトープタグ抗体と比較して、重鎖と軽鎖の両方にタグを有するエピトープタグ抗体の場合にはより小さかった。注目すべきことに、本出願人は、ここに開示されたタグのタイプの各々を含む、エピトープタグ抗体に組み込まれた様々なタイプのエピトープタグの間に有意な差がないことを観察した(図26と図29A〜29Eも参照)。
DLS及びDSCデータはまた抗体の軽鎖内へのエピトープタグの取り込みがFab/CH2ドメインを少なくとも部分的に不安定化し、4KまでのTagg値の減少をもたらしたことを示している。幾つかの例では、DLSデータは約1KのTaggの僅かな増加を示しDSC測定値はピーク1の転移温度の増加(0.1K以下)を示唆している(図28A〜28Eを参照)。
上記のように、本出願人は、直角散乱(RALS)による分子量測定に対応するデータを含むSECデータをさらに収集した(例えば、図27A、27B、及び27Cを参照)。このデータはまた試験したタグなし抗体と対応するエピトープタグ抗体の全てが単量体IgGとして溶液中に出現したことを示している。本出願人は、タグなし抗体が約140kDaから約150kDaの範囲の分子量を有していることを見出した。幾つかの実施態様では、重鎖タグのみ又は軽鎖タグのみを有するエピトープタグ抗体は、約170kDaから約210kDaの範囲の分子量を有していた。更に他の実施態様では、重鎖タグのみ又は軽鎖タグのみを有するエピトープタグ抗体は、約185kDaから約205kDaの範囲の分子量を有していた。他の実施態様では、重鎖タグ又は軽鎖タグのみを有するエピトープタグ抗体は、約190kDaの分子量を有していた。幾つかの実施態様では、重鎖タグと軽鎖タグの両方を有するエピトープタグ抗体は、215kDaから約235kDaの範囲の分子量を有していた。幾つかの実施態様では、重鎖タグと軽鎖タグの両方を有するエピトープタグ抗体は、約220kDaから約230kDaの分子量を有していた。加えて、上記のDLSデータのように、SECデータは、エピトープタグ抗体が比較的構造不定で柔軟であることを示唆した。
まとめると、DLS、DSC、及びSEC実験の結果は、エピトープタグ抗体の柔軟性のあるタグが、例えば熱応力に曝された場合に、大きな凝集体の形成を減少させ又は防止することを示した。また、抗体中へのエピトープタグの包含は、抗体の適切な折り畳みをその全体として妨害しないと結論付けることができた。
而して、本出願人は、エピトープタグ抗体が安定であり、それらがその未修飾の天然対応物と比較して染色において有意な差異を示さないことを考えると、IHCアッセイ、特に多重IHCアッセイにおいて使用するのに適していることを示した。加えて、本出願人は、抗体の重鎖の上又は重鎖内へのエピトープの組み込みは、軽鎖上にタグを組み込む場合と比較して、熱安定性及び品質の観点から利点をもたらすことを実証した。ここに更に示されるように、エピトープタグ抗体は、他の天然抗体で観察される交差反応性を伴わずに一緒にプールすることができると考えられる。
[エピトープタグ抗体の検出]
幾つかの実施態様では、任意のエピトープタグ抗体は検出可能部分を含み得、よってエピトープタグ抗体は直接的に検出されうる(例えば、検出可能部分にコンジュゲートされる)。
他の実施態様では、任意のエピトープタグ抗体の検出、よって組織試料中の標的の検出を可能にするために、特定の試薬が利用される。幾つかの実施態様では、エピトープタグ抗体の特定のエピトープタグに特異的な検出試薬が利用される。幾つかの実施態様では、検出試薬は、エピトープタグ抗体の発現されたエピトープタグに特異的な二次抗体を含む。すなわち、二次抗体は抗エピトープ又は抗タグ抗体である。各抗タグ抗体は、特異的エピトープタグ、例えばVSV、V5、HA等々の一つを検出するように設計される。
例えば、一又は複数のVSVエピトープタグを発現するエピトープタグ抗体は、抗VSV抗体、すなわち発現されたVSVエピトープタグに特異的な抗タグ抗体によって検出することができる。同様に、一又は複数のAU5エピトープタグを発現するエピトープタグ抗体は、抗AU5抗体、すなわち発現されたAU5エピトープタグに特異的な抗タグ抗体によって検出することができる。
幾つかの実施態様では、抗タグ抗体を「検出可能部分」にコンジュゲートさせて、エピトープタグ抗体の検出を実現することができる。「検出可能部分」は、試料中のエピトープタグ抗体の存在(すなわち定性分析)及び/又は濃度(すなわち定量分析)を示す検出可能な(例えば、視覚的、電子的又は他の方法で)シグナルを生成しうる分子又は物質である。検出可能なシグナルは、光子(ラジオ周波数、マイクロ波周波数、赤外線周波数、可視周波数及び紫外周波数光子を含む)の吸収、放出及び/又は散乱を含む、任意の既知の又は未発見のメカニズムによって生成されうる。
幾つかの実施態様では、抗タグ抗体の検出可能部分は、発色性、蛍光性、燐光性及び発光性分子及び物質、(例えば、無色物質を有色物質に変換するか又はその逆によって、あるいは沈殿物を生成することによって又は試料濁度を増加させることによって)ある物質を別の物質に変換して検出可能な差異をもたらす触媒(例えば酵素)、更なる検出可能に標識された抗体コンジュゲートを使用して抗体−ハプテン結合相互作用を通して検出されうるハプテン、並びに常磁性及び磁性分子又は物質を含む。当然のことながら、検出可能部分はそれ自体を間接的に検出することもでき、例えば、検出可能部分がハプテンならば、当業者に知られているように、その検出可能部分に特異的な更に別の抗体が、検出可能部分の検出に利用されうる。
幾つかの実施態様では、抗タグ抗体は、DAB;AEC;CN;BCIP/NBT;ファストレッド;ファストブルー;フクシン;NBT;ALK GOLD;カスケードブルー・アセチルアジド;ダポキシルスルホン酸(Dapoxylsulfonic acid)/カルボン酸スクシンイミジルエステル;DY−405;Alexa Fluor405スクシンイミジルエステル;カスケードイエロー・スクシンイミジルエステル;ピリジルオキサゾールスクシンイミジルエステル(PyMPO);パシフィックブルー・スクシンイミジルエステル;DY−415;7−ヒドロキシクマリン−3−カルボン酸スクシンイミジルエステル;DYQ−425;6−FAMホスホラミダイト;ルシファーイエロー;ヨードアセトアミド;Alexa Fluor430スクシンイミジルエステル;ダブシル・スクシンイミジルエステル;NBD塩化物/フッ化物;QSY35スクシンイミジルエステル;DY−485XL;Cy2スクシンイミジルエステル;DY−490;オレゴングリーン488カルボン酸スクシンイミジルエステル;Alexa Fluor488スクシンイミジルエステル;BODIPY493/503 C3スクシンイミジルエステル;DY−480XL;BODIPY FL C3スクシンイミジルエステル;BODIPY FL C5スクシンイミジルエステル; BODIPY FL−Xスクシンイミジルエステル;DYQ−505;オレゴングリーン514カルボン酸スクシンイミジルエステル;DY−510XL;DY−481XL;6−カルボキシ−4’,5’−ジクロロ−2’,7’−ジメトキシフルオレセインスクシンイミジルエステル(JOE);DY−520XL;DY−521XL;BODIPY R6G C3スクシンイミジルエステル;エリスロシンイソチオシアナート;5−カルボキシ−2’,4’,5’,7’−テトラブロモスルホンフルオロセインスクシンイミジルエステル;Alexa Fluor532スクシンイミジルエステル;6−カルボキシ−2’,4,4’,5’7,7’−ヘキサクロロフルオレセインスクシンイミジルエステル(HEX);BODIPY 530/550 C3スクシンイミジルエステル;DY−530;BODIPY TMR−Xスクシンイミジルエステル;DY−555;DYQ−1;DY−556;Cy3スクシンイミジルエステル;DY−547;DY−549;DY−550;Alexa Fluor555スクシンイミジルエステル;Alexa Fluor546スクシンイミジルエステル;DY−548;BODIPY558/568 C3スクシンイミジルエステル;ローダミンレッド−Xスクシンイミジルエステル;QSY7スクシンイミジルエステル; BODIPY564/570 C3スクシンイミジルエステル;BODIPY576/589 C3スクシンイミジルエステル;カルボキシ−X−ローダミン(ROX);スクシンイミジルエステル;Alexa Fluor568スクシンイミジルエステル;DY−590;BODIPY581/591 C3スクシンイミジルエステル;DY−591;BODIPY TR−Xスクシンイミジルエステル;Alexa Fluor594 スクシンイミジルエステル;DY−594;カルボキシナフトフルオレセインスクシンイミジルエステル;DY−605;DY−610;Alexa Fluor610スクシンイミジルエステル;DY−615;BODIPY630/650−Xスクシンイミジルエステル;エリオグラウシン(erioglaucine);Alexa Fluor633スクシンイミジルエステル;Alexa Fluor635スクシンイミジルエステル;DY−634;DY−630;DY−631;DY−632;DY−633;DYQ−2;DY636;BODIPY650/665−Xスクシンイミジルエステル;DY−635;Cy5スクシンイミジルエステル;Alexa Fluor647スクシンイミジルエステル;DY−647;DY−648;DY−650;DY−654;DY−652;DY−649;DY−651;DYQ−660;DYQ−661;Alexa Fluor660スクシンイミジルエステル;Cy5.5スクシンイミジルエステル;DY−677;DY−675;DY−676;DY−678;Alexa Fluor680スクシンイミジルエステル;DY−679;DY−680;DY−682;DY−681;DYQ−3;DYQ−700;Alexa Fluor700スクシンイミジルエステル;DY−703;DY−701;DY−704;DY−700;DY−730;DY−731;DY−732;DY−734;DY−750;Cy7スクシンイミジルエステル;DY−749;DYQ−4;及びCy7.5スクシンイミジルエステルからなる群から選択される検出可能部分を含む。
フルオロフォアは、クマリン、フルオレセイン(又はフルオレセイン誘導体及びアナログ)、ローダミン、レゾルフィン、発光団及びシアニンを含む数種の共通の化学クラスに属する。蛍光分子の更なる例は、Molecular Probes Handbook - A Guide to Fluorescent Probes and Labeling Technologies, Molecular Probes, Eugene, OR, TheroFisher Scientific, 11版に見出すことができる。他の実施態様では、フルオロフォアは、キサンテン誘導体、シアニン誘導体、スクアライン誘導体、ナフタレン誘導体、クマリン誘導体、オキサジアゾール誘導体、アントラセン誘導体、ピレン誘導体、オキサジン誘導体、アクリジン誘導体、アリールメチン誘導体、及びテトラピロール誘導体から選択される。他の実施態様では、蛍光部分は、CF色素(Biotiumから入手可能)、DRAQ及びCyTRAKプローブ(BioStatusから入手可能)、BODIPY(Invitrogenから入手可能)、Alexa Fluor(Invitrogenから入手可能)、DyLight Fluor(例えばDyLight649)(Thermo Scientific,Pierceから入手可能)、Atto及びTracy(Sigma Aldrichから入手可能)、FluoProbes(Interchimから入手可能)、Abberior Dyes(Abberiorから入手可能)、DY及びMegaStokes Dyes(Dyomicsから入手可能)、Sulfo Cy色素(Cyandyeから入手可能)、HiLyte Fluor(AnaSpecから入手可能)、Seta、SeTau及びSquare Dyes(SETA BioMedicalsから入手可能)、Quasar及びCal Fluor色素(Biosearch Technologiesから入手可能)、SureLight Dyes(APC,RPEPerCP,Phycobilisomesから入手可能)(Columbia Biosciences)、及びAPC、APCXL、RPE、BPE(Phyco−Biotech,Greensea,Prozyme,Flogenから入手可能)から選択される。
幾つかの実施態様では、 エピトープタグ抗体は、抗バイオマーカー抗体であり、バイオマーカーの検出は、試料に結合したときに抗バイオマーカー抗体に近接して検出可能部分を沈着させるように適合化された抗タグ特異的結合剤(例えば、抗タグ抗体)と試料を接触させることにより、促進される。幾つかの実施態様では、抗タグ抗体は検出可能部分に直接コンジュゲートされる(以下、「直接法」)。他の実施態様では、検出可能部分は、抗タグ特異的結合剤と間接的に関係付けられる(以下、「間接法」)。幾つかの実施態様では、検出試薬は、検出可能部分が抗バイオマーカー抗体/抗タグ特異的結合剤複合体を介してバイオマーカーに局在化する酵素反応を介して沈着される間接的方法に適している。そのような反応に適した酵素はよく知られており、酸化還元酵素、加水分解酵素、及びペルオキシダーゼが挙げられるが、これらに限定されない。明示的に含められる特定の酵素は、西洋ワサビペルオキシダーゼ(HRP)、アルカリホスファターゼ(AP)、酸性ホスファターゼ、グルコースオキシダーゼ、β−ガラクトシダーゼ、β−グルクロニダーゼ、及びβ−ラクタマーゼである。酵素は、抗タグ抗体に直接コンジュゲートされ得、又は標識コンジュゲートを介して抗タグ抗体と間接的に関係付けられてもよい。ここで使用される場合、「標識コンジュゲート」は次を含む:
(a)特異的検出試薬;及び
(b)特異的検出試薬にコンジュゲートされた酵素であって、適切な反応条件下で発色基質、シグナル伝達コンジュゲート、又は酵素反応性色素と反応して、その場での色素生成及び/又は組織試料上への色素の沈着を達成する酵素。
ここで使用される場合、「特異的検出試薬」という用語は、細胞試料の状況において標的化学構造に特異的に結合することができる任意の物質の組成物を意味するものとする。ここで使用される場合、「特異的結合」、「特異的に結合する」又は「に特異的な」という語句又は他の同様の反復は、標的と特異的検出試薬との間の測定可能で再現性のある相互作用を意味し、生物学的分子を含む分子の異種集団の存在下での標的の存在を決定するものである。例えば、標的に特異的に結合する抗体は、それが他の標的に結合するよりも、より高い親和性、結合活性で、より容易に、及び/又はより長い持続時間でこの標的に結合する抗体である。一実施態様では、特異的検出試薬の非関連標的への結合の程度は、例えばラジオイムノアッセイ(RIA)によって測定して、抗体の標的への結合の約10%未満である。所定の実施態様では、標的に特異的に結合するバイオマーカー特異的試薬は、≦1μM、≦100nM、≦10nM、≦1nM、又は≦0.1nMの解離定数(Kd)を有する。別の実施態様では、特異的結合は排他的結合を含みうるが、それを必要とはしない。例示的な特異的検出試薬には、特定のヌクレオチド配列に特異的な核酸プローブ;抗体及びその抗原結合断片;及びADNECTIN(第10のFN3フィブロネクチンに基づくスカフォールド;Bristol−Myers−Squibb Co.)、AFFIBODY(スタフィロコッカス・アウレウス由来のプロテインAのZドメインに基づくスカフォールド;Affibody AB,Solna,Sweden)、AVIMER(ドメインA/LDL受容体に基づくスカフォールド;Amgen,Thousand Oaks,CA)、dAb(VH又はVL抗体ドメインに基づくスカフォールド;GlaxoSmithKline PLC,Cambridge,UK)、DARPin(Ankyrinリピートタンパク質に基づくスカフォールド;Molecular Partners AG,Zurich,CH)、ANTICALIN(リポカリンに基づくスカフォールド;Pieris AG,Freising,DE)、NANOBODY(VHH(ラクダ科Ig)に基づくスカフォールド;Ablynx N/V,Ghent,BE)、TRANS−BODY(トランスフェリンに基づくスカフォールド;Pfizer Inc.,New York,NY)、SMIP(Emergent Biosolutions,Inc.,Rockville,MD)、及びTETRANECTIN(C型レクチンドメイン(CTLD)に基づくスカフォールド,テトラネクチン;Borean Pharma A/S,Aarhus,DK)を含む、操作された特異的結合組成物が含まれる。そのような操作された特異的結合構造の説明は、その内容が出典明示により援用されるWurch等, Development of Novel Protein Scaffolds as Alternatives to Whole Antibodies for Imaging and Therapy: Status on Discovery Research and Clinical Validation, Current Pharmaceutical Biotechnology, Vol. 9, pp. 502-509 (2008)に概説されている。非限定的な例では、標識用コンジュゲートの特異的検出試薬は、二次検出試薬(例えば、抗タグ抗体に結合された種特異的二次抗体、抗バイオマーカー抗体に特異的なエピトープタグ抗タグ抗体に結合した抗タグ抗体、ハプテンコンジュゲート抗タグ抗体に結合した抗ハプテン抗体、又はビオチン化抗タグ抗体抗体に結合したビオチン結合タンパク質)、又は他のそのような構成でありうる。このようにして試料結合抗バイオマーカー抗体に局在化した酵素は、ついで、検出可能部分を沈着させる多くのスキームにおいて使用されうる。
場合によっては、酵素は発色性化合物/基質と反応する。発色性化合物/基質の特定の非限定的な例には、4−ニトロフェニルホスフェート(pNPP)、ファストレッド、リン酸ブロモクロロインドリル(BCIP)、ニトロブルーテトラゾリウム(NBT)、BCIP/NBT、ファストレッド、APオレンジ、APブルー、テトラメチルベンジジン(TMB)、2,2’−アジノ−ジ−[3−エチルベンゾチアゾリンスルホネート](ABTS)、o−ジアニシジン、4−クロロナフトール(4−CN)、ニトロフェニル−β−D−ガラクトピラノシド(ONPG)、o−フェニレンジアミン(OPD)、5−ブロモ−4−クロロ−3−インドリル−β−ガラクトピラノシド(X−Gal)、メチルウンベリフェリル−β−D−ガラクトピラノシド(MU−Gal)、p−ニトロフェニル−α−D−ガラクトピラノシド(PNP)、5−ブロモ−4−クロロ−インドリル−β−D−グルクロニド(X−Gluc)、3−アミノ−9−エチルカルバゾール(AEC)、フクシン、ヨードニトロテトラゾリウム(INT)、テトラゾリウムブルー、又はテトラゾリウムバイオレットが含まれる。
幾つかの実施態様では、酵素は、金属組織学的検出スキームで使用されうる。金属組織学的検出法には、水溶性金属イオンと組み合わせたアルカリホスファターゼなどの酵素と酵素の酸化還元不活性基質の使用が含まれる。幾つかの実施態様では、基質は酵素によって酸化還元活性剤に変換され、酸化還元活性剤が金属イオンを還元し、検出可能な沈殿物を形成させる。(例えば、2004年12月20日に出願された米国特許出願第11/015646号、PCT公開第2005/003777号及び米国特許出願公開第2004/0265922号を参照のこと;これらの各々は、出典明示によりその全体がここに援用される)。金属組織学的検出法には、また検出可能な沈殿物を形成するために水溶性金属イオン、酸化剤及び還元剤と共にオキシド−レダクターゼ酵素(西洋ワサビペルオキシダーゼなど)を使用することが含まれる。(例えば、出典明示によりその全体がここに援用される米国特許第6670113号を参照のこと)。
幾つかの実施態様では、酵素作用は酵素と色素自体との間で起こり、反応は色素を非結合種から試料上に沈着した種に変換する。例えば、DABとペルオキシダーゼ(西洋ワサビペルオキシダーゼなど)の反応はDABを酸化させて沈殿させる。
更に他の実施態様では、検出可能部分は、酵素と反応して試料又は他の検出成分に結合することができる反応種を形成するように構成された潜在反応性部分を含むシグナル伝達コンジュゲートを介して沈着される。これらの反応種は、それらの生成の近くで、すなわち酵素の近くで試料と反応することができるが、酵素が沈着する部位から遠位の部位にシグナル伝達コンジュゲートが沈着しないように、非反応性種に速やかに転換する。潜在的反応性部分の例には、その各々の全体が出典明示によりここに援用される、国際公開第2015124703A1号に記載されているもののようなキノンメチド(QM)アナログ、及び国際公開第2012003476A2号に記載されているもののようなチラミドコンジュゲートが含まれる。幾つかの例では、潜在的反応性部分は、N,N’−ビスカルボキシペンチル−5,5’−ジスルホナト−インド−ジカルボシアニン(Cy5)、4−(ジメチルアミノ)アゾベンゼン−4’−スルホンアミド(DABSYL)、テトラメチルローダミン(DISCOパープル)、及びローダミン110(ローダミン)のような色素に直接コンジュゲートされる。他の例では、潜在的反応性部分が、特異的結合対の一方のメンバーにコンジュゲートされ、色素が特異的結合対の他方のメンバーに連結される。他の例では、潜在的反応性部分が特異的結合対の一方のメンバーに連結され、酵素が特異的結合対の他のメンバーに連結され、ここで、酵素は(a)発色基質と反応して色素の生成をなすか、又は(b)色素と反応して色素(DABなど)の沈着をもたらす。特異的結合対の例には次のものが含まれる:
(1)潜在的反応性部分に連結されたビオチン又はビオチン誘導体(例えばデスチオビオチン)と、色素又は発色基質と反応性であるかもしくは色素と反応性である酵素(例えば、色素がDABである場合、ビオチン結合タンパク質に連結されたペルオキシダーゼ)に連結されたビオチン結合体(例えば、アビジン、ストレプトアビジン、脱グリコシル化されたアビジン(例えば、ニュートラアビジン)、又はそのビオチン結合部位にニトロ化チロシンを有するビオチン結合タンパク質(例えば、CAPTAVIDIN));
(2)エピトープタグと関連する抗タグ抗体;及び
(2)潜在的反応性部分に連結されたハプテンと、色素又は発色基質と反応性であるかもしくは色素と反応性である酵素(例えば、色素がDABである場合、ビオチン結合タンパク質に連結されたペルオキシダーゼ)に連結された抗ハプテン抗体。
抗タグ抗体と検出試薬の組み合わせの非限定的な例を表1に記載する:
表1において使用される場合、「2°特異的検出試薬」は、抗タグ抗体に特異的に結合することができる任意の実体を指すものとする。よって、例えば、2°特異的検出試薬は、抗タグ抗体が由来する免疫グロブリンの種に特異的に結合する抗種抗体、及び抗タグ抗体にコンジュゲートしたハプテンと免疫反応性の抗ハプテン抗体、又は(抗タグ抗体がエピトープタグ抗体である場合)抗タグ抗体のエピトープタグと反応性の第二の抗タグ抗体でありうる。更に、表1の各例では、抗タグ抗体を、ADNECTIN、AFFIBODY、AVIMER、dAb、DARPin、ANTICALIN、NANOBODY;TRANS−BODY、SMIP、又はTETRANECTINのようなタグに特異的に結合することができる別の特異的検出剤で置き換えることができる。
[エピトープタグ抗体とエピトープタグ抗体を検出するための検出試薬とを含む検出キット]
幾つかの実施態様では、本開示のエピトープタグ抗体は、「検出キット」の一部として利用されうる。一般に、任意の検出キットは、一又は複数のエピトープタグ抗体とその一又は複数のエピトープタグ抗体を検出するための検出試薬とを含みうる。
検出キットは、エピトープタグ抗体が検出キットによって検出されうるように、エピトープタグ抗体を含む第一組成物と第一組成物に特異的な検出試薬を含む第二組成物とを含みうる。幾つかの実施態様では、検出キットは、(例えばバッファー中で混合されるような)複数のエピトープタグ抗体を含み、検出キットは、複数のエピトープタグ抗体のそれぞれに特異的な検出試薬もまた含む。
例として、キットは第一標的に特異的なエピトープタグ抗体であって第一エピトープタグ(例えばVSV)を有するエピトープタグ抗体と、第二エピトープタグ(例えばHA)を有する第二標的に特異的なエピトープタグ抗体とを含み得、第一及び第二のエピトープタグは異なる。キットは、異なるエピトープタグ抗体の各々に特異的な検出試薬を更に含みうる。例えば、異なるエピトープタグ抗体のエピトープタグの各々に特異的な抗タグ抗体を含めてもよい。幾つかの実施態様では、抗タグ抗体は、蛍光性の検出可能部分(例えば、Alexa Fluor IR色素)にコンジュゲートされうる。他の実施態様では、抗タグ抗体は酵素にコンジュゲートされ得、酵素のための発色基質をまた任意のキット内に含めることができる。
もちろん、任意のキットは、手作業又は自動標的検出のために必要に応じて、バッファー;対比染色剤;酵素不活性化組成物;脱パラフィン化溶液等々を含む他の薬剤を含みうる。検出キットはまた他の特異的結合体(例えば、ISHの核酸プローブ;未修飾(天然)抗体、及び抗体コンジュゲート)とその他の特異的結合体を検出する検出試薬とを含みうる。例えば、キットは、一又は複数のエピトープタグ抗体;一又は複数のエピトープタグ抗体を検出するための一又は複数の抗タグ抗体;少なくとも一つの未修飾抗体;及び少なくとも一つの未修飾抗体を検出するための検出試薬を含みうる。幾つかの実施態様では、例えばMIHCアッセイのようなアッセイにおいて使用するため、エピトープタグ抗体とキットの他の構成要素を使用するための説明書が提供される。
[エピトープタグ抗体及び検出試薬を用いて標的を検出する方法]
本開示はまたここに記載されるエピトープタグ抗体の何れかを使用して組織内の一又は複数の標的を検出する方法を提供する。幾つかの実施態様では、エピトープタグ抗体は、組織試料内の特定の標的(例えば、CD68、FoxP3、CD20等々)を検出するシンプレックスアッセイにおいて使用することができ、ここで、エピトープタグ抗体は、対象の標的に特異的であり、組織試料へのエピトープタグ抗体の適用時に、標的−エピトープタグ抗体複合体が形成される。エピトープタグ抗体の適用後、検出試薬(例えば、抗タグ抗体)が、標的−エピトープタグ抗体複合体が検出されうるように適用される。幾つかの実施態様では、検出試薬は、エピトープタグ抗体の特定の発現されたエピトープタグに特異的な抗タグ抗体を含み、抗タグ抗体は検出可能部分を含む。ついで、単一標的が視覚化されるか、又は別の方法で検出されうる。
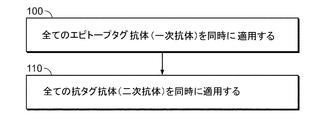
本開示の幾つかの態様では、自動多重検出を含む多重検出方法が提供される。図15Aは、組織試料が複数のエピトープタグ抗体と同時に接触される(工程100)標的の多重検出のための一方法を示すフローチャートを提供し、各エピトープタグ抗体は特定の標的に特異的であり、各エピトープタグ抗体は異なったエピトープタグ(異なる発現されたエピトープタグ)を含む。
幾つかの実施態様では、試料は2つのエピトープタグ抗体と接触させられ得、各エピトープタグ抗体は特定の標的に特異的であり、各エピトープタグ抗体は異なったエピトープタグを含む。他の実施態様では、試料は、3つのエピトープタグ抗体と接触させられ得、各エピトープタグ抗体は特定の標的に特異的であり、各エピトープタグ抗体は異なったエピトープタグを含む(例えば、実施例1及び2を参照)。更に他の実施態様では、試料は4つ以上のエピトープタグ抗体と接触させられ得、各エピトープタグ抗体は特定の標的に特異的であり、各エピトープタグ抗体は異なったエピトープタグを含む(例えば、実施例7を参照)。
エピトープタグ抗体は、特定のアッセイに必要とされるエピトープタグ抗体の各々を含む「プール」又は「カクテル」として組織試料に供給されうる。エピトープタグ抗体は、少なくとも交差反応性が染色性能を妨げる程度までには、互いに交差反応性を示さないので、エピトープタグ抗体のプール化は可能であると考えられる。各エピトープタグ抗体は、その各標的に結合し、検出可能な標的−エピトープタグ抗体複合体を形成する。幾つかの実施態様では、エピトープタグ抗体の適用後にブロッキング工程が実施される(例えば、ブロッキング工程及び/又は他の処理工程の組み入れを例示する実施例1、2、及び7を参照のこと)。
エピトープタグ抗体の同時適用(工程100)に続いて、複数の抗タグ抗体が組織試料に同時に適用され(工程110)、ここで各抗タグ抗体は最初に適用された(工程100)エピトープタグ抗体の一つに特異的であり、各抗タグ抗体が異なる検出可能部分を含む。幾つかの実施態様では、検出可能部分はフルオロフォアである。抗タグ抗体は、標的−エピトープタグ抗体複合体の検出に必要な抗タグ抗体の各々を含むプール又はカクテルとして組織試料に供給されうる。抗タグ抗体の適用後、幾つかの実施態様では、組織試料は対比染色で染色されうる。検出可能部分の各々からのシグナルは、視覚化されうるか、さもなければ検出されうる(例えば、同時に視覚化されるか又は検出される)。
本開示の一態様による多重アッセイの一例として、第一のエピトープタグを含み第一標的に特異的な(例えば、CD68、FoxP3、CD20等々の一つに特異的な)第一のエピトープタグ抗体が組織試料に導入される。幾つかの実施態様では、第一のエピトープタグ抗体は、検出可能な第一標的−エピトープタグ抗体複合体を形成する。同時に、第二のエピトープタグを含み第二標的(例えば、CD68、FoxP3、CD20等々の別のもの)に特異的な第二のエピトープタグ抗体が試料に導入されて第二標的−エピトープタグ抗体複合体を形成する。(「第n」標的−検出プローブ複合体を形成する)他の標的に特異的で異なるエピトープタグを有する第三、第四、及び第nの更なるエピトープタグ抗体が、第一及び第二のエピトープタグ抗体抗体と同時に更に導入されうる。
エピトープタグ抗体が沈着された後、それらは、もちろん、その構成に応じて、直接的か間接的の何れかで検出されうる。幾つかの実施態様では、標的−エピトープタグ抗体複合体のそれぞれの検出を可能にするために抗タグ抗体が導入される。幾つかの実施態様では、抗タグ抗体は、エピトープタグ抗体の異なるエピトープタグに特異的であり、抗タグ抗体はそれぞれ検出可能部分にコンジュゲートされる。幾つかの実施態様では、検出可能な試薬は、それぞれフルオロフォアにコンジュゲートした抗タグ抗体である。幾つかの実施態様では、第一、第二、及び第nの抗タグ抗体が同時に導入され、第一、第二、及び第nの検出試薬の各々が異なるエピトープタグ抗体に特異的であり、抗タグ抗体の各々はフルオロフォアにコンジュゲートされる。他の実施態様では、第一、第二、及び第nの抗タグ抗体が逐次的に導入され、第一、第二、及び第nの検出試薬の各々が異なるエピトープタグ抗体に特異的であり、抗タグ抗体の各々が酵素にコンジュゲートされる。
本開示による多重アッセイの更なる例として、第一標的(例えば、CD3、FoxP3、PD−L1、又は免疫細胞マーカー)に特異的な第一のエピトープタグ抗体を組織試料に導入し、第一のエピトープタグ抗体が第一のエピトープタグを発現する。幾つかの実施態様では、第一のエピトープタグ抗体は、検出可能な第一標的−エピトープタグ抗体コンジュゲート複合体を形成する。同時に又はその後に、第二標的(例えば、CD3、FoxP3、PD−L1の別のもの)に特異的な第二のエピトープタグ抗体を試料に導入して、第二標的−エピトープタグ抗体コンジュゲート複合体を形成し、第二のエピトープタグ抗体が第二のエピトープタグを発現する。それぞれ他の標的に特異的な第三、第四、及び第nの更なるエピトープタグ抗体(「n」個の標的−エピトープタグ抗体コンジュゲート複合体を形成する)を、再び第一及び/又は第二のエピトープタグ抗体と逐次的に又は同時に、更に導入してもよく、第三、第四、及び第nのエピトープタグ抗体がそれぞれまた更に異なるエピトープタグを発現する。エピトープタグ抗体が沈着された後、それらは検出されうる。幾つかの実施態様では、標的の検出を可能にするために更なる検出試薬が導入され、その更なる検出試薬はここに記載のもの(例えば発色性検出試薬)を含む。幾つかの実施態様では、第一、第二及び第nの検出試薬が逐次的に導入され、第一、第二及び第nの検出試薬の各々は(i)エピトープタグ抗体のエピトープタグの各々に特異的な二次抗体、つまり抗タグ抗体であって、酵素にコンジュゲートされている二次抗体と;(ii)発色基質であって;第一、第二及び第nの発色基質の各々が異なるものを含む。
幾つかの実施態様では、多重検出法は、(i)生物学的試料を第一のエピトープタグ抗体と接触させて第一標的−エピトープタグ抗体コンジュゲート複合体を形成する工程;(ii)生物学的試料を、第一の標識用コンジュゲートであって第一の酵素を含む第一の標識用コンジュゲート(ここで第一の標識用コンジュゲートは第一のエピトープタグ抗体に特異的に結合し、標的を酵素で標識するように構成された抗タグ抗体である)と接触させる工程;(iii)生物学的試料を、第一の潜在的反応性部分及び第一の発色性部分を含む第一のシグナル伝達コンジュゲートと接触させる工程(例えば、シグナル伝達コンジュゲートとその構成成分の記載に対してその開示が出典明示によりここに援用される米国特許出願第13/849160号を参照のこと);(iv)試料を第一の酵素不活性化組成物と接触させて、生物学的試料に含まれる第一の酵素を実質的に不活性化又は完全に不活性化させることなどにより、第一の酵素を不活性化する工程を含む。
第一の酵素の不活性化後(任意工程)、多重方法は、(v)生物学的試料を第二のエピトープタグ抗体と接触させて、第二標的−エピトープタグ抗体コンジュゲート複合体を形成する工程;(vi)生物学的試料を、第二の標識用コンジュゲートであって第二の酵素を含む第二の標識用コンジュゲート(ここで第二の標識用コンジュゲートは第二のエピトープタグ抗体に特異的に結合し、標的を酵素で標識するように構成された抗タグ抗体である)と接触させる工程;(vii)生物学的試料を、第二の潜在的反応性部分及び第二の発色性部分を含む第二のシグナル伝達コンジュゲートと接触させる工程;(viii)試料を第一の酵素不活性化組成物と接触させて、生物学的試料に含まれる第一の酵素を実質的に不活性化又は完全に不活性化させることなどにより、第二の第二酵素を不活性化する工程を更に含む。
第二の酵素の不活性化後、前記方法を、他の標的の検出を達成するために、更なるエピトープタグ抗体が更なる検出試薬と共に導入されうるように繰り返すことができる。エピトープタグ抗体(及び他の検出プローブ)及びそれぞれの検出試薬又はキットの全ての導入後、前記方法は、第一、第二、及び第nの発色性部分から(手作業又は自動化方法を介して)試料を対比染色し及び/又はシグナルを検出する工程を更に含み、第一、第二及び第nの発色性部分の各々がそれぞれ異なる。あるいは、エピトープタグ抗体の各々は、同時又は逐次的に加えることができるが、任意の標識用コンジュゲートが添加される前である。別の例として、任意の検出試薬の導入前に、最初に三つのエピトープタグ抗体が逐次的に適用され得、ついで検出試薬の各々が逐次的に加えられる。
複数の標的が逐次的に検出され、検出が酵素の使用を用いる多重アッセイの場合、連続する検出工程間で任意の試薬又は内因性酵素を不活性化させることが望ましい。結果として、何れか一つの検出工程に存在する酵素は、後の検出工程における酵素と干渉しないと考えられる。これはひいては多重アッセイで使用される異なる検出可能部分の視覚化及び検出を改善すると考えられる。当該技術分野で知られている任意の酵素不活性化組成物をこの目的のために使用することができる。幾つかの実施態様では、酵素不活性化組成物を適用して、各検出工程後に試薬又は内因性酵素を不活性化する。例示的な酵素不活性化組成物は、同時係属中の米国特許出願第62/159297号に開示されており、その開示は、その全体が出典明示によりここに援用される。
幾つかの実施態様では、変性工程が、第一の検出試薬セットにおいて使用される酵素が第二の基質に作用するのを防止する。幾つかの実施態様では、変性剤は、第一の検出試薬セット中の酵素を変性させる物質である。幾つかの実施態様では、変性剤は、例えばホルムアミド、アルキル置換アミド、尿素又は尿素系変性剤、チオ尿素、塩酸グアニジン、又はその誘導体である。アルキル置換アミドの例には、N−プロピルホルムアミド、N−ブチルホルムアミド、N−イソブチルホルムアミド、及びN,N−ジプロピルホルムアミドが含まれるが、これらに限定されない。幾つかの実施態様では、変性剤はバッファー中に提供される。例えば、ホルムアミドが、20mMの硫酸デキストラン(50〜57%%ホルムアミド(UltraPureホルムアミドストック)、2×SSC(0.3Mのクエン酸塩及び3MのNaClを含む20×SSCストック)、2.5mMのEDTA(0.5MのEDTAストック)、5mMのトリス,pH7.4(1mMのトリス,pH7.4ストック)、0.05%のBrij−35(ポリオキシエチレン(23)ラウリルエーテルを含む10%ストック),pH7.4を含むハイブリダイゼーションバッファー中に提供されうる。幾つかの実施態様では、第一標的プローブ検出酵素、例えばアルカリホスファターゼを変性させるのに十分な時間及び条件下で、試料を変性剤で処理する。幾つかの実施態様では、試料は約37℃で約15から約30分間、好ましくは約20から24分間、変性剤で処理される。幾つかの実施態様では、試料は、第二の核酸プローブの標的へのハイブリダイゼーションを維持しながら標的酵素を変性させるのに十分な時間及び条件下で変性剤で処理される。
酵素にコンジュゲートされた抗タグ抗体を用いる実施態様では、シグナル伝達コンジュゲート又は発色基質を生物学的試料と共に導入するのに適した条件が使用され、典型的には、過酸化物(例えば、過酸化水素)を含み、酵素がその所望の機能を遂行するのを可能にするか又は容易にするのに適した塩濃度及びpHを有する反応バッファー又は溶液を提供することを含む。一般に、前記方法のこの工程は、約35℃から約40℃の範囲の温度で実施されるが、当業者は、選択された酵素及びシグナル伝達コンジュゲートに適した適当な温度範囲を選択することができるであろう。例えば、これらの条件は、酵素と過酸化物が反応して、シグナル伝達コンジュゲートの潜在的反応性部分上でのラジカル形成を促進することを可能にすると考えられる。潜在的な反応性部分、従ってシグナル伝達コンジュゲート全体は、生物学的試料上、特に固定化酵素コンジュゲートに近接する一又は複数のチロシン残基、酵素コンジュゲートの酵素部分のチロシン残基、及び/又は酵素コンジュゲートの抗体部分のチロシン残基に共有結合的に沈着するであろう。ついで、生物学的試料を光で照らし、標的は、シグナル伝達コンジュゲートの発色性部分によって引き起こされる光の吸光によって検出されうる。
[他の特異的結合体と併せてエピトープタグ抗体を用いた検出法]
本開示の幾つかの態様では、エピトープタグ抗体は、組織試料中の標的の多重検出を達成するために他の特異的結合体と併用される。当業者ならば、上記の方法及び手順の何れかを、エピトープタグ抗体と他の特異的結合体の両方を用いる任意のアッセイに適切に適合させることができることが分かるであろう。
幾つかの実施態様では、特異的結合体には、インサイツハイブリダイゼーションのための核酸、IHCのための未修飾抗体、及び/又はIHCのための抗体コンジュゲートが含まれる。ここで使用される場合、「未修飾抗体(unmodified antibody)」又は「未修飾抗体(unmodified antibodies)」という用語は、エピトープタグを含まない抗体又は任意の他の部分にコンジュゲートしていない抗体を指す。本質的に、「未修飾抗体」は、IHCアッセイにおいて伝統的に使用される天然抗体であり、特定の標的に特異的で(例えば、抗CD3抗体)、例えば抗種二次抗体を用いて検出されうる。例として、ウサギ抗CD3抗体は、ヤギ抗ウサギ抗体で検出することができる。
「抗体コンジュゲート」は、その用語がここで使用される場合、(直接的又は間接的に)一又は複数の標識にコンジュゲートした抗体を意味し、ここで、抗体コンジュゲートは特定の標的に特異的であり、標識は、例えば、二次抗体(抗標識抗体)を用いて、(直接的又は間接的に)検出することができる。例えば、抗体コンジュゲートは、例えば高分子リンカー及び/又はスペーサーを通して、ハプテンに結合されてもよく、ハプテンによる抗体コンジュゲートは間接的に検出されうる。代替的な例として、抗体コンジュゲートは、例えば高分子リンカー及び/又はスペーサーを通して、フルオロフォアに結合され得、抗体コンジュゲートは直接的に検出されうる。抗体コンジュゲートは、米国特許出願公開第2014/0147906号及び米国特許第8658389号;第8686122号;第8618265号;第8846320号;及び第8445191号に更に記載されている。
図15B及び15Cは、組織試料を一又は複数の未修飾一次抗体及び/又は抗体コンジュゲートに(同時に又は逐次的に)接触させ(第一段階、220)、次に続いて一又は複数のエピトープタグ抗体に(同時に又は逐次的に)接触させる(第二段階、250)、標的の多重検出のための一方法を示す。二段階多重アッセイは更にここの実施例3、4、5、及び6に例示される。当業者であれば、エピトープタグ抗体が最初に組織試料に適用され、続いて未修飾抗体及び/又は抗体コンジュゲートが適用されるように、第一段階220と第二段階250を逆にしてもよいことが分かるであろう。当業者であれば、多重アッセイが(任意の順序で)ISH及びIHC工程又は段階の両方を含むように、未修飾抗体及び/又は抗体コンジュゲートの代わりに適切な核酸プローブを使用できることもまた分かるであろう。
幾つかの実施態様では、例えば第15図に示されるように、第一の未修飾一次抗体又は抗体コンジュゲートが組織試料に適用され得、第一標的−一次抗体複合体を形成する(工程200)。次に、未修飾一次抗体又は抗体コンジュゲートに特異的な第一の検出試薬が組織試料に適用されて、第一標的−一次抗体複合体が検出される(工程210)。図15B中の点線205は、未修飾一次抗体及び/又は抗体コンジュゲートによる組織試料内の複数の異なる標的の逐次的な多重検出をもたらすために、第一段階220の工程200及び210を一又は複数回繰り返してもよいことを示している。例えば、第二の未修飾一次抗体又は抗体コンジュゲートが組織試料に適用されて、第二標的−一次抗体複合体が形成され得(200)、続いて第二の未修飾一次抗体又は抗体コンジュゲートに特異的な第二の検出試薬が適用されて、第二標的−一次抗体複合体が検出される(210)。
図15Cは、図15Bに提示されたものと同様の2段階方法を使用する標的の多重検出のための代替方法を表す。図15Cに示す方法では、未修飾抗体及び/又は抗体コンジュゲートの各々が、工程260において組織試料に同時に導入される。次に、試料は、未修飾抗体及び/又は抗体コンジュゲートの検出を達成するために、工程270において検出試薬(例えば、抗種抗体又は抗標識抗体)と接触させられる。別の実施態様では、未修飾一次抗体又は抗体コンジュゲートの全てが逐次的に適用され得(工程260)、これにそれぞれの抗種抗体の逐次的適用が続く(工程270)。
当業者であれば、検出試薬が、利用される未修飾抗体に特異的な抗種抗体を含みうることが分かるであろう。あるいは、検出試薬が、抗体コンジュゲートにコンジュゲートした標識(例えば、ハプテン)に特異的な抗標識抗体を含んでいてもよい。当業者であれば、抗種又は抗標識抗体が検出可能部分を含んでもよく、検出可能部分が酵素である実施態様では、更なる発色基質を第一及び第二の検出試薬と共に供給してもよいことも分かるであろう。
多重アッセイの第一段階220に続いて(図15B又は図15C)、第二段階250が実施され、そこで、組織試料が複数のエピトープタグ抗体と同時に接触させられ(工程230)、ここで、各エピトープタグ抗体は特定の標的に特異的であり、各エピトープタグ抗体は異なるエピトープタグを含む。エピトープタグ抗体は、特定のアッセイに必要とされるエピトープタグ抗体の各々を含む「プール」又は「カクテル」として組織試料に供給されうる。各エピトープタグ抗体は、特定の標的と検出可能な標的−エピトープタグ抗体複合体を形成する。エピトープタグ抗体(一次抗体)の同時適用(工程230)後、抗タグ抗体(二次抗体)が組織試料に同時に適用され(工程240)、ここで、各抗タグ抗体は適用されるエピトープタグ抗体の一つに特異的であり、各抗タグ抗体が異なる検出可能部分を含む。抗タグ抗体は、標的−エピトープタグ抗体複合体の検出に必要な抗タグ抗体の各々を含む「プール」又は「カクテル」として組織試料に供給されうる。
抗タグ抗体の適用後、幾つかの実施態様では、組織試料は対比染色で染色されうる(例えば、何れのワークフローにも組み込んでもよい更なる処理工程を提供する実施例3〜6を参照)。(例えば、抗種、抗標識、及び/又は抗タグ抗体由来の)検出可能部分の各々からのシグナルは、視覚化されうるか、又はそうでなければ検出されうる(例えば、同時に可視化又は検出される)。
(i)未修飾抗体及び/又は抗体コンジュゲート、及び(ii)本開示に係るエピトープタグ抗体の両方を含む多重アッセイの例として、ハプテン標識を含む第一抗体コンジュゲート(例えば、ハプテンに間接的にコンジュゲートした抗CD3抗体)が組織試料に導入されて、標的−抗体コンジュゲート複合体が形成される。同時に、未修飾抗体(例えば、ウサギ抗PDL1抗体)が組織試料に導入されて、標的−未修飾抗体複合体が形成される。次に、形成された標的−抗体コンジュゲート複合体(例えば、抗ハプテン抗体)と形成された標的−未修飾抗体複合体(例えば、ヤギ抗ウサギ抗体)を検出するために検出試薬が導入され(同時に又は連続的に)、ここで、検出試薬の各々が異なるフルオロフォアにコンジュゲートされる。
多重アッセイの第二段階では、第一エピトープタグを含み、第一標的に特異的な(例えば、CD68に特異的な)第一のエピトープタグ抗体が組織試料に導入される。幾つかの実施態様では、第一エピトープタグ抗体が検出可能な第一標的−エピトープタグ抗体複合体を形成する。同時に、第二エピトープタグを含み、第二標的に特異的な(例えば、FoxP3に特異的な)第二のエピトープタグ抗体が試料に導入されて、第二標的−エピトープタグ抗体複合体が形成される。異なるエピトープタグを有し(「第n」の標的−エピトープタグ抗体複合体を形成する)他の標的に特異的な第三、第四、及び第五の更なるエピトープタグ抗体が、第一及び第二エピトープタグ抗体抗体と同時に更に導入されうる。
エピトープタグ抗体が沈着された後、それらは、もちろん、その構成に応じて、直接的か間接的の何れかで検出されうる。幾つかの実施態様では、標的−エピトープタグ抗体複合体のそれぞれの検出を可能にするために抗タグ抗体が導入される。幾つかの実施態様では、第一、第二、及び第nの検出試薬が同時に導入され、第一、第二、及び第nの検出試薬の各々が異なるエピトープタグ抗体に特異的である。幾つかの実施態様では、第一、第二、及び第nの検出試薬が逐次的に導入され、第一、第二、及び第nの検出試薬の各々が異なるエピトープタグ抗体に特異的である。幾つかの実施態様では、検出試薬は、エピトープタグ抗体の異なるエピトープタグに特異的である抗タグ抗体であり、抗タグ抗体はそれぞれ検出可能部分、例えばフルオロフォア又は酵素にコンジュゲートされる。幾つかの実施態様では、検出可能な試薬はそれぞれフルオロフォアにコンジュゲートされた抗タグ抗体である。他の実施態様では、検出可能な試薬はそれぞれ酵素にコンジュゲートされた抗タグ抗体である。更に他の実施態様では、検出可能な試薬は、フルオロフォアにコンジュゲートされた抗タグ抗体と酵素にコンジュゲートされた抗タグ抗体の組合せである。抗タグ抗体が酵素にコンジュゲートされている実施態様では、(ここで先に記載されているように)検出を行うために酵素に対する基質が提供される。
幾つかの実施態様では、多重検出法は、(i)生物学的試料を、未修飾抗体を含む第一の検出用プローブと接触させて第一標的−抗体コンジュゲート複合体を形成する工程;(ii)生物学的試料を、第一の標識用コンジュゲートであって第一の酵素を含む第一の標識用コンジュゲート(ここで第一の標識用コンジュゲートは第一の未修飾抗体に特異的に結合し、標的を酵素で標識するように構成された抗種抗体である)と接触させる工程;(iii)生物学的試料を、第一の潜在的反応性部分及び第一の発色性部分を含む第一のシグナル伝達コンジュゲートと接触させる工程;(iv)試料を第一の酵素不活性化組成物と接触させて、生物学的試料に含まれる第一の酵素を実質的に不活性化又は完全に不活性化させることなどにより、第一の酵素を不活性化する工程を含む。あるいは、未修飾抗体を含む第一の検出プローブは、フルオロフォアに結合した抗種抗体で検出することができる。
第一の酵素の不活性化後(任意工程)、多重方法は、(v)生物学的試料を、エピトープタグ抗体を含む第二の検出プローブと接触させて、第二標的−抗体コンジュゲート複合体を形成する工程;(vi)生物学的試料を、第二の標識用コンジュゲートであって第二の酵素を含む第二の標識用コンジュゲート(ここで第二の標識用コンジュゲートはエピトープタグ抗体を含む第二の検出プローブに特異的に結合し、標的を酵素で標識するように構成された抗タグ抗体である)と接触させる工程;(vii)生物学的試料を、第二の潜在的反応性部分及び第二の発色性部分を含む第二のシグナル伝達コンジュゲートと接触させる工程;(viii)試料を第一の酵素不活性化組成物と接触させて、生物学的試料に含まれる第一の酵素を実質的に不活性化又は完全に不活性化させることなどにより、第二の第二酵素を不活性化する工程を更に含む。
第二の酵素の不活性化後、前記方法を、他の標的の検出を達成するために、更なる検出プローブ(未修飾抗体、抗体コンジュゲート、又はエピトープタグ抗体)が更なる検出試薬と共に導入されうるように繰り返すことができる。例えば、異なるエピトープタグを発現するエピトープタグ抗体を含む第三の検出プローブが導入され、例えばフルオロフォア又は酵素の一つにコンジュゲートした抗タグ抗体を用いて、検出されうる。検出プローブ及びそれぞれの検出試薬又はキットの全ての導入後、前記方法は、第一、第二、及び第nの発色性部分から(手作業又は自動化方法を介して)試料を対比染色し及び/又はシグナルを検出する工程を更に含み、第一、第二、及び第nの発色性部分の各々がそれぞれ異なる。
[自動化]
多重アッセイ及び方法は半自動化又は自動化されうる。例えば、染色プロセスは、自動IHC/ISHスライド染色装置のような組織化学的染色プラットフォーム上で実施されうる。自動IHC/ISHスライド染色装置は、典型的には、少なくとも、染色プロトコルで使用される様々な試薬のリザーバ、スライド上に試薬を分配するためにリザーバと流体連通される試薬分配ユニット、使用済み試薬及び他の廃棄物をスライドから除去するための廃棄物除去システム、及び試薬分配ユニットと廃棄物除去システムの動作を調整する制御システムを備える。染色工程の実施に加えて、多くの自動スライド染色装置は、スライドベーキング(試料をスライドに付着させるため)、脱ワックス(脱パラフィンとも称される)、抗原回復、対比染色、脱水及び清澄化、及び封入処理(カバースリッピング)を含む、染色に付随する工程を実施することもまたできる(又は、そのような補助的工程を実施する別個のシステムと適合性がある)。その全体が出典明示によりここに援用されるPrichard, Overview of Automated Immunohistochemistry, Arch Pathol Lab Med., Vol. 138, pp. 1578-1582 (2014)は、intelliPATH(Biocare Medical)、WAVE(Celerus Diagnostics)、DAKO OMNIS及びDAKO AUTOSTAINER LINK48(Agilent Technologies)、BENCHMARK(Ventana Medical Systems,Inc.)、Leica BOND、及びLab Vision Autostainer(Thermo Scientific)自動スライド染色装置を含む、自動IHC/ISHスライド染色装置とその様々な特徴の数種の特定の例を記載している。加えて、Ventana Medical Systems社は、その各々の全体が出典明示によりここに援用される米国特許第5650327号、第5654200号、第6296809号、第6352861号、第6827901号及び第6943029号、及び米国特許出願公開第20030211630号及び第20040052685号を含む、自動分析を実施するためのシステム及び方法を開示している多くの米国特許の譲受人である。市販の染色ユニットは、典型的には、次の原理のうちの一つで動作する:(1)スライドを水平に配置し、組織試料を含むスライドの表面上に液たまりとして試薬を分配する開放された個々のスライド染色(例えば、DAKO AUTOSTAINER Link48(Agilent Technologies)及びintelliPATH(Biocare Medical)染色装置で実施);(2)試薬を、試料上に沈着した不活性の流体層で覆うか、又は該層を通して分配する液体オーバーレイ技術(例えば、VENTANA BenchMark及びDISCOVERY染色装置で実施);(3)スライド表面を別の表面(別のスライドであるか又はカバープレートでもよい)に近接して配置して狭い間隙をつくり、その間隙を通して毛細管力が液体試薬を吸い上げ試料と接触させるキャピラリー間隙染色(例えば、DAKO TECHMATE、Leica BOND、及びDAKO OMNIS染色装置によって使用される染色原理)。(例えばDAKO TECHMATE及びLeica BONDでは)キャピラリー間隙染色の幾らかの繰り返しは、間隙内の流体を混合しない。動的間隙染色と呼ばれるキャピラリー間隙染色の他の変形態様では、毛細管力がスライドに試料を適用するために使用され、ついで平行表面を互いに平行移動させてインキュベーション中に試薬を攪拌して試薬混合を行う(例えば、DAKO OMNISスライド染色装置(Agilent)で実施される染色原理)。平行移動間隙染色では、平行移動可能なヘッドがスライド上に配置される。ヘッド下面は、スライドの平行移動中にスライド上の液体から液体メニスカスが形成されるのを可能にする十分小さい第一間隙だけスライドから離間している。スライド幅よりも小さい側方寸法を有する混合延長部が、平行移動可能なヘッドの下面から延びて、混合延長部とスライドとの間の第一間隙よりも小さい第二間隙を画定する。ヘッドの平行移動中、混合延長部の側面寸法は、スライド上の液体中に第二間隙から第一間隙までほぼ延びる方向に横方向の動きを生み出すのに十分である。国際公開第2011−139978A1号を参照のこと。最近、インクジェット技術を使用して試薬をスライド上に沈着させることが提案されている。国際公開第2016−170008A1号を参照のこと。この染色技術のリストは網羅的であることを意図しておらず、バイオマーカー染色を実施するための任意の完全又は半自動システムを、組織化学的染色プラットフォーム中に組み込むことができる。
形態学的に染色された試料がまた望ましい場合、自動H&E染色プラットフォームを使用することができる。H&E染色を実施するための自動システムは、典型的には、バッチ染色(「浸漬ダンク(dip'n dunk)」とも呼ばれる)又は個別スライド染色の二種の染色原理の一つで機能する。バッチ染色装置は、多くのスライドが同時に浸漬される試薬槽又は浴を一般に使用する。一方、個別スライド染色装置は、各スライドに直接試薬を適用し、2つのスライドが同じ試薬アリコートを共有することはない。市販のH&E染色装置の例には、RocheのVENTANA SYMPHONY(個別スライド染色装置)及びVENTANA HE600(個別スライド染色装置)シリーズのH&E染色装置;Agilent TechnologiesのDako CoverStainer(バッチ染色装置);Leica Biosystems Nussloch GmbHのLeica ST4020小型リニアステイナー(バッチ染色装置)、Leica ST5020 Multistainer(バッチ染色装置)、Leica ST5010 Autostainer XLシリーズ(バッチ式染色装置)H&E染色装置が含まれる。
検体の染色後、染色された試料は顕微鏡で手作業で分析され得、及び/又は染色された試料のデジタル画像が保存及び/又はデジタル解析のために収集されうる。デジタル画像は、染色されたスライドを20倍、40倍、又は他の倍率でスキャンできるスライドスキャナーのようなスキャニングプラットフォームを介してキャプチャーされ、高解像度の全スライドデジタル画像が作製されうる。基本的なレベルでは、典型的なスライドスキャナーは、少なくとも、(1)対物レンズを有する顕微鏡、(2)(ハロゲン、発光ダイオード、白色光、及び/又は色素に依存するマルチスペクトル光源のような)光源、(3)ガラススライドを移動させるか又はスライドの周りに光学素子を移動させるか又は双方のロボット、(4)画像キャプチャー用の一又は複数のデジタルカメラ、(5)ロボットを制御し、デジタルスライドを操作し、管理し、及び見るコンピューターと関連ソフトウェアを含む。
スライド上の多くの異なるXY位置(場合によっては複数のZ面)のデジタルデータが、カメラの電荷結合素子(CCD)によってキャプチャーされ、画像が互いに結合されて全スキャン面の合成画像が形成される。これを達成するための一般的な方法は次のものを含む:
(1)スライドステージ又は光学素子を非常に小さい増分で移動させて、隣接する正方形が僅かに重なる正方形の画像フレームをキャプチャーする、タイルベースのスキャニング。キャプチャーされた正方形は次に自動的に互いにマッチされて合成画像が構築される;及び
(2)スライドステージが取得中に単一軸において移動し多数の合成画像「ストリップ」をキャプチャーするラインベースのスキャニング。画像ストリップは次に互いにマッチされて、より大きな合成画像を形成することができる。
様々なスキャナー(蛍光及び明視野の両方)の詳細な概要は、その内容の全体が出典明示によりここに援用されるFarahani等, Whole slide imaging in pathology: advantages, limitations, and emerging perspectives, Pathology and Laboratory Medicine Int’l, Vol. 7, p. 23-33 (June 2015)に見出すことができる。市販のスライドスキャナーの例としては、3DHistech PANNORAMIC SCAN II;DigiPath PATHSCOPE;Hamamatsu NANOZOOMER RS、HT、及びXR;Huron TISSUESCOPE 4000、4000XT、及びHS;Leica SCANSCOPE AT、AT2、CS、FL、及びSCN400;Mikroscan D2;Olympus VS120−SL;Omnyx VL4、及びVL120;PerkinElmer LAMINA;Philips ULTRA−FAST SCANNER;Sakura Finetek VISIONTEK;Unic PRECICE 500、及びPRECICE 600x;VENTANA ISCAN COREO及びISCAN HT;及びZeiss AXIO SCAN.Z1が挙げられる。他の例示的なシステム及び特徴は、例えば、その内容の全体が出典明示によりここに援用される、国際公開第20111−049608号又はIMAGING SYSTEMS,CASSETTES,AND METHODS OF USING THE SAMEと題された2011年9月9日出願の米国特許出願第61/533114号に見出すことができる。
場合によっては、画像は画像解析システム上で解析されうる。画像解析システムは、デスクトップコンピュータ、ラップトップコンピュータ、タブレット、スマートフォン、サーバー、アプリケーション特有のコンピューティングデバイス、又はここに記載の技術及び動作を実施することができる任意の他のタイプの電子デバイスなどの一又は複数のコンピューティングデバイスを含みうる。幾つかの実施態様では、画像解析システムは単一のデバイスとして実行されうる。他の実施態様では、画像解析システムは、ここで検討される様々な機能を一緒に達成する二つ以上のデバイスの組み合わせとして実行されうる。例えば、画像解析システムは、一又は複数のサーバーコンピュータと、一又は複数のローカルエリアネットワーク及び/又はインターネットなどの広域ネットワークを介して互いに通信可能に連結された一又は複数のクライアントコンピュータを含みうる。画像解析システムは、典型的には、少なくともメモリ、プロセッサ、及びディスプレイを含む。メモリは、ランダムアクセスメモリ(RAM)、電気的消去可能プログラマブルリードオンリーメモリ(EEPROM)のようなリードオンリーメモリ、フラッシュメモリ、ハードドライブ、半導体ドライブ、光ディスク等々の任意のタイプの揮発性又は不揮発性メモリの任意の組み合わせを含みうる。メモリは、単一の装置に含めることができ、また二つ以上の装置に分配することもできることは理解される。プロセッサは、任意のタイプの一又は複数のプロセッサ、例えば中央処理装置(CPU)、グラフィックス処理装置(GPU)、専用の信号又は画像プロセッサ、フィールドプログラマブルゲートアレイ(FPGA)、テンソル処理装置(TPU)等々を含みうる。プロセッサは、単一の装置に含めることができ、また二つ以上の装置に分配することもできることは理解される。ディスプレイは、LCD、LED、OLED、TFT、プラズマ等々の任意の適切な技術を使用して実装されうる。幾つかの実装では、ディスプレイはタッチセンサー式ディスプレイ(タッチスクリーン)でありうる。画像解析システムはまた典型的にはプロセッサに実装可能な一連の命令を含むメモリ上に記憶されたソフトウェアシステムを含み、命令は、物体認知、染色強度定量化等々の様々な画像解析タスクを含む。ここに開示されるようなモジュールの実装に有用な例示的な市販のソフトウェアパッケージには、VENTANA VIRTUOSO;Definiens TISSUE STUDIO、DEVELOPER XD、及びIMAGE MINER;及びVisopharm BIOTOPIX、ONCOTOPIX、及びSTEREOTOPIXソフトウェアパッケージが含まれる。
自動プロセスは検査室情報システム(LIS)も含みうる。LIS130は、典型的には、試料及びスライド及び試料から得られた画像について実施されたプロセスを記録し追跡すること、試料、スライド、及び/又は画像について特定のプロセスを実施し、及び試料及び又はスライドに適用される特定の試薬に関する情報(例えば、ロット番号、有効期限、分配された容量等々)を追跡するように免疫コンテクストスコアリングシステムの異なった構成要素に指示をすることから選択される一又は複数の機能を実施する。LISは、通常、試料についての情報を含むデータベース;試料、スライド、及び/又は画像ファイルに関連するラベル(例えば、バーコード(1次元バーコード及び2次元バーコードを含む)、無線識別(RFID)タグ、試料に貼り付けられた英数字コード等々);及び試料又はスライド上のラベルを読み取り、及び/又はLISと免疫状況スコアリングシステムの他の構成要素との間のスライドに関する情報を通信する通信装置を少なくとも備える。従って、例えば、通信装置は、試料処理ステーション、自動組織化学的染色装置、H&E染色プラットフォーム、及びスキャニングプラットフォームの各々に配置されうる。試料が最初に切片に加工されると、試料に関する情報(例えば、患者ID、試料タイプ、切片について実施されるプロセス)が通信装置に入力され得、試料から生成された各切片に対してラベルが作成される。後続の各ステーションでは、(バーコード又はRFIDタグをスキャンすることによって、又は英数字コードを手作業で入力することによって)ラベルが通信装置に入力され、ステーションがデータベースと電子的に通信して、例えばステーション又はステーションオペレータに、切片に関する特定のプロセスを実施し、及び/又は切片について実施されているプロセスを記録するように指示する。スキャニングプラットフォームでは、画像が画像解析システムに送られるときに、実施されるべき画像処理工程がLISのデータベースから画像解析システムに送られ得、及び/又は画像解析システムによって画像について実施された画像加工工程がLISのデータベースによって記録されるように、スキャニングプラットフォームが、画像が得られる切片又は試料に戻って相関するコンピュータ可読ラベル又はコードで各デジタル画像をまたエンコードしてもよい。本方法及びシステムに有用な市販のLISシステムには、例えば、VENTANA Vantage Workflowシステム(Roche)が含まれる。
[対比染色]
対比染色は、一又は複数の標的を検出する薬剤で既に染色された後に試料を、それらの構造が顕微鏡下でより容易に視覚化できるように、後処理する方法である。例えば、対比染色が、免疫組織化学的色素をより明瞭にするために封入処理(カバースリッピング)前に任意に使用される。一次染色と色が異なる対比染色が選択されるべきである。ヘマトキシリン、エオシン、メチルグリーン、メチレンブルー、ギムザ、アルシアンブルー、及びヌクレアファストレッドなどの多数の対比染色が周知である。DAPI(4’,6−ジアミジノ−2−フェニルインドール)は、使用されうる蛍光色素である。また、対比染色は、それらが結合する構造とまたそれらが明視野又は蛍光分析に適しているかどうかによって分類することができ、例えば、ヘマトキシリン(青から紫に染色)、メチレンブルー(青に染色)、トルイジンブルー(核は濃い青に多糖類はピンクから赤に染色)、ヌクレアファストレッド(ケルネクトロート色素とも呼ばれ、赤に染色)、及びメチルグリーン(緑に染色)を含む明視野核対比染色;エオシン(ピンクに染色)などの非核明視野染色;4’,6−ジアミジノ−2−フェニルインドール(DAPI、青に染色)、ヨウ化プロピジウム(赤に染色)、ヘキスト染色(青に染色)、核グリーンDCS1(緑に染色)、核イエロー(ヘキストS769121,中性pH下で黄に染色し、酸性pH下で青に染色)、DRAQ5(赤に染色)、DRAQ7(赤に染色)を含む蛍光核染色;フルオロフォア標識ファロイジンのような蛍光非核染色(糸状アクチンで染色、色はコンジュゲートしたフルオロフォアに依存)である。
幾つかの例では、一種を超える色素を一緒に混合して対比染色剤を作製することができる。これは、色素を選ぶ柔軟性と能力をもたらす。例えば、特定の性状を有するが異なる所望の性状を持っていない第一色素を混合物に対して選択することができる。不足している所望の性状を示す第二色素を混合物に加えることができる。例えば、トルイジンブルー、DAPI、及びポンタミンスカイブルーを一緒に混合して対比染色剤を形成することができる。
[イメージング]
開示された実施態様の所定の態様、又は全ては、コンピュータ解析及び/又は画像解析システムによって自動化され、容易にされうる。幾つかの用途では、正確な色彩又は蛍光比が測定される。幾つかの実施態様では、光学顕微鏡が画像解析に利用される。所定の開示された実施態様は、デジタル画像の取得を含む。これは、デジタルカメラを顕微鏡に連結することによって行うことができる。染色された試料から得られたデジタル画像は、画像解析ソフトウェアを使用して解析される。色彩又は蛍光は幾つかの異なる方法で測定することができる。例えば、色彩は、赤、青、緑の色値として;色相、彩度、及び輝度の値として;及び/又はスペクトルイメージングカメラを使用して特定の波長又は波長範囲を測定することによって、測定することができる。試料はまた定性的及び半定量的に評価することができる。定性的評価には、染色強度の評価、陽性染色細胞及び染色に関与する細胞内コンパートメントの同定、並びに試料全体又はスライドクオリティの評価が含まれる。別個の評価が試験試料に対して実施され、この解析は、試料が異常状態を表すかどうかを決定するために既知の平均値と比較することを含みうる。
[試料と標的]
試料は、生物学的成分を含み、一般には一又は複数の対象の標的分子を含む疑いがある。標的分子は細胞の表面にあり得、細胞は懸濁液中にあるか又は組織切片中にありうる。標的分子はまた細胞内にあり得、細胞溶解又はプローブによる細胞穿通の際に検出されうる。当業者であれば、試料中の標的分子を検出する方法は、試料のタイプ及び使用されるプローブに依存して変わることが分かるであろう。試料を収集し調製する方法は、当該技術分野において知られている。
例えば組織又は他の生物学的試料のような、ここに開示された方法の実施態様において組成物と共に使用される試料は、当業者に知られた任意の方法を使用して調製することができる。試料は、常套的なスクリーニングのために被験者から、あるいは遺伝子異常、感染、又は腫瘍などの疾患を有すると疑われる被験者から得ることができる。開示された方法の記載された実施態様は、「正常」試料と呼ばれる遺伝子異常、疾病、疾患等々を有していない試料にもまた適用することができる。このような正常な試料は、とりわけ、他の試料との比較のための対照として有用である。試料は多くの異なる目的のために分析することができる。例えば、試料は科学的研究において又は疑わしい疾患の診断のために、あるいは治療の成功、生存の予後指標等々として使用することができる。
試料は、プローブ又はレポーター分子が特異的に結合することができる複数の標的を含みうる。標的は核酸配列又はタンパク質でありうる。幾つかの例では、標的は、例えばウイルスゲノム由来のような、ウイルス、細菌、又は細胞内寄生体などの病原体に由来するタンパク質又は核酸分子である。例えば、標的タンパク質は、疾患に関連する(例えば、相関する、因果関係に関与する等々)標的核酸配列から産生されうる。
当業者であれば、次の標的の何れかに特異的なエピトープタグ抗体を開発することができることを理解するであろう:
特定の非限定的な例では、標的タンパク質は、新生物(例えば、がん)に関連する標的核酸配列(例えば、ゲノム標的核酸配列)によって産生される。新生物細胞、特にがん細胞、例えばB細胞及びT細胞白血病、リンパ腫、乳がん、結腸がん、神経学的がん等々において、多数の染色体異常(転座及び他の再構成、増幅又は欠失を含む)が同定されている。従って、幾つかの例では、標的分子の少なくとも一部が、試料中の細胞の少なくともサブセットにおいて増幅され又は欠失された核酸配列(例えば、ゲノム標的核酸配列)によって産生される。
他の実施態様では、悪性細胞において欠損(喪失)している腫瘍抑制遺伝子である核酸配列(例えば、ゲノム標的核酸配列)から産生された標的タンパク質である。例えば、染色体9p21上に位置するp16領域(D9S1749、D9S1747、p16(INK4A)、p14(ARF)、D9S1748、p15(INK4B)、及びD9S1752を含む)がある種の膀胱がんにおいて欠失される。1番染色体の短腕の遠位領域(例えば、SHGC57243、TP73、EGFL3、ABL2、ANGPTL1、及びSHGC−1322を包含する)及び19番染色体の動原体周囲領域(例えば、19p13−19q13)(例えば、MAN2B1、ZNF443、ZNF44、CRX、GLTSCR2、及びGLTSCR1を包含する)を含む染色体欠失は、中枢神経系のある種の固形腫瘍の特徴的な分子的特徴である。
腫瘍性形質転換及び/又は増殖と相関する多数の他の細胞遺伝学的異常が当業者に知られている。腫瘍性形質転換と相関があり、開示された方法において有用である、核酸配列(例えば、ゲノム標的核酸配列)によって産生される標的タンパク質には、また、EGFR遺伝子(7p12;例えばGENBANKTM受託番号NC−000007、ヌクレオチド55054219−55242525)、C−MYC遺伝子(8q24.21;例えば、GENBANKTM受託番号NC−000008、ヌクレオチド128817498−128822856)、D5S271(5p15.2)、リポタンパク質リパーゼ(LPL)遺伝子(8p22;例えば、GENBANKTM受託番号NC−000008、ヌクレオチド19841058−19869049)、RBI(13q14;例えば、GENBANKTM受託番号NC−000013、ヌクレオチド47775912−47954023)、p53(17p13.1;例えば、GENBANKTM受託番号NC−000017、補体、ヌクレオチド7512464−7531642))、N−MYC(2p24;例えば、GENBANKTM受託番号NC−000002、補体、ヌクレオチド151835231−151854620)、CHOP(12q13;例えば、GENBANKTM受託番号NC−000012、補体、ヌクレオチド56196638−56200567)、FUS(16p11.2;例えば、GENBANKTM受託番号NC−000016、ヌクレオチド31098954−31110601)、FKHR(13p14;例えば、GENBANKTM受託番号NC−000013、補体、ヌクレオチド40027817−40138734)、並びに、例えば:ALK(2p23;例えば、GENBANKTM受託番号NC−000002、補体、ヌクレオチド29269144−29997936)、Ig重鎖、CCND1(11q13;例えば、GENBANKTM受託番号NC−000011、ヌクレオチド69165054.69178423)、BCL2(18q21.3;例えば、GENBANKTM受託番号NC−000018、補体、ヌクレオチド58941559−59137593)、BCL6(3q27;例えば、GENBANKTM受託番号NC−000003、補体、ヌクレオチド188921859−188946169)、MALF1、AP1(1p32−p31;例えば、GENBANKTM受託番号NC−000001、補体、ヌクレオチド59019051−59022373)、TOP2A(17q21−q22;例えば、GENBANKTM受託番号NC−000017、補体、ヌクレオチド35798321−35827695)、TMPRSS(21q22.3;例えば、GENBANKTM受託番号NC−000021、補体、ヌクレオチド41758351−41801948)、ERG(21q22.3;例えば、GENBANKTM受託番号NC−000021、補体、ヌクレオチド38675671−38955488);ETV1(7p21.3;例えば、GENBANKTM受託番号NC−000007、補体、ヌクレオチド13897379−13995289)、EWS(22q12.2;例えば、GENBANKTM受託番号NC−000022、ヌクレオチド27994271−28026505);FLI1(11q24.1−q24.3;例えば、GENBANKTM受託番号NC−000011、ヌクレオチド128069199−128187521)、PAX3(2q35−q37;例えば、GENBANKTM受託番号NC−000002、補体、ヌクレオチド222772851−222871944)、PAX7(1p36.2−p36.12;例えば、GENBANKTM受託番号NC−000001、ヌクレオチド18830087−18935219)、PTEN(10q23.3;例えば、GENBANKTM受託番号NC−000010、ヌクレオチド89613175−89716382)、AKT2(19q13.1−q13.2;例えば、GENBANKTM受託番号NC−000019、補体、ヌクレオチド45431556−45483036)、MYCL1(1p34.2;例えば、GENBANKTM受託番号NC−000001、補体、ヌクレオチド40133685−40140274)、REL(2p13−p12;例えば、GENBANKTM受託番号NC−000002、ヌクレオチド60962256−61003682)及びCSF1R(5q33−q35;例えば、GENBANKTM受託番号NC−000005、補体、ヌクレオチド149413051−149473128)が含まれる。
[実施例]
ここに提示された非限定的な実施例はそれぞれ、少なくとも一つのエピトープタグ抗体の使用を組み入れる。本出願人は、次の実施例において証明されるように、ここに開示されるエピトープタグ抗体は多重IHC検定を含むIHCアッセイにおける使用に適していると考える。本出願人は次の実施例にもまた示されるように、未修飾抗体又は抗体コンジュゲートと併用して使用されうるとまた考える。当然のことながら、ここに詳述されるように、エピトープタグ抗体は、他の検出可能な特異的結合体と共に使用され得、IHCとISHを組み合わせたアッセイにおいて利用されうる。
次の実施態様及び上記した実施態様では、未結合抗体を除去するなどの一又は複数の洗浄工程を実施することができる。幾つかの実施態様では、過剰の試薬等を除去するために染色手順の各工程間で洗浄工程が実施されうる。もちろん、当業者であれば、任意の洗浄工程に関連するプロセス及び手順を理解しており、任意の試薬、未結合抗体等々を除去するプロセス及び手順に適用することができるであろう。
実施例1:3重免疫組織化学アッセイ
実施例1は、3種の異なるエピトープタグ抗体を組織試料に同時に適用した多重免疫組織化学アッセイを提供する(図1参照)。第一エピトープタグ抗体は、CD68に特異的であり(抗CD68)、VSVエピトープタグ(4つのVSVエピトープタグを含む重鎖)を含んでいた。第二エピトープタグ抗体は、FoxP3に特異的であり(抗FoxP3)、V5エピトープタグ(5つのV5エピトープタグを含む重鎖)を含んでいた。第三エピトープタグ抗体は、CD20に特異的であり(抗CD20)、HAエピトープタグ(4つのH5エピトープタグを含む重鎖)を含んでいた。エピトープタグ抗体は、希釈剤90039中の各エピトープタグ抗体を2μg/mL含む「カクテル」として適用した。
3種のエピトープタグ抗体の同時適用後、3種の抗タグ抗体を組織試料に同時に供給したが(図1参照)、ここで各抗タグ抗体がエピトープタグ抗体の異なるエピトープタグに特異的であった。第一抗VSV抗体をAlexa532とコンジュゲートさせ(「オレンジ色」シグナルを生成);第二抗V5抗体をDyLight649とコンジュゲートさせ(「緑色」シグナルを生成);そして第三抗HA抗体をAlexa594とコンジュゲートさせた(「紫色」シグナルを生成)。抗タグ抗体は、希釈剤90040中に5μg/mLの各抗タグ抗体を含む「カクテル」として適用した。
次の工程を、3重IHCアッセイについて行った(表2参照):
図2A〜2Dは、上記の3重IHCアッセイで染色された組織試料を示す。図2Aは、抗タグ抗体にコンジュゲートしたフルオロフォアの各々からのシグナルを明確に示し、よって、標的−エピトープタグ抗体複合体のそれぞれの位置、すなわちCD68−エピトープタグ抗体複合体(オレンジ色シグナル)、CD20−エピトープタグ抗体複合体(緑色シグナル)、及びFoxp3−エピトープタグ抗体複合体(紫色シグナル)の位置を明らかにしている。DAPI対比染色から生成されたシグナルは、図2A〜2Dのそれぞれに青色で現れている。図2Bは、検出されたCD68−エピトープタグ抗体複合体に対応するシグナルのみを示す。図2Cは、検出されたFoxp3−エピトープタグ抗体複合体に対応するシグナルのみを示す。図2Dは、検出されたCD20−エピトープタグ抗体複合体に対応するシグナルのみを示す。図2A〜2Dは、本開示のエピトープタグ抗体が、(1)それぞれCD68、CD20、及びFoxP3に結合することができたこと;(2)適切な抗タグ抗体によって検出することができたこと;及び(3)互いに干渉することなく、同時に組織試料に(例えば、抗体カクテルとして)適用することができたことを示している。よって、本開示のエピトープタグ抗体は多重アッセイでの使用に適していた。加えて、本実施例の多重アッセイは、4時間以内で完了することができた。伝統的な多重アッセイと比較して、これは当該分野における進歩を表す。幾つかの実施態様では、このパネルは、血液系腫瘍及び固形腫瘍における免疫プロファイリングを助けるために使用されうる。
実施例2:3重免疫組織化学アッセイ
実施例2は、3種の異なるエピトープタグ抗体を同時に組織試料に適用した多重免疫組織化学アッセイを提供する(図3参照)。第一エピトープタグ抗体は、CD68に特異的であり(抗CD68)、VSVエピトープタグ(4つのVSVエピトープタグを含む重鎖)を含んでいた。第二エピトープタグ抗体は、FoxP3に特異的であり(抗FoxP3)、V5エピトープタグ(5つのV5エピトープタグを含む重鎖)を含んでいた。第三エピトープタグ抗体は、CD8に特異的であり(抗CD8)、AU5エピトープタグ(4つのAU5エピトープタグを含む重鎖)を含んでいた。エピトープタグ抗体は、希釈剤90039中に各エピトープタグ抗体を2μg/mL含む「カクテル」として適用した。
3種のエピトープタグ抗体の同時適用後、3種の抗タグ抗体を組織試料に同時に供給したが(図3参照)、ここで各抗タグ抗体がエピトープタグ抗体の異なるエピトープタグに特異的であった。第一抗VSV抗体をAlexa532(JH)にコンジュゲートさせた(「オレンジ色」シグナルを生成)。第二抗V5抗体をDyLight649にコンジュゲートさせた(「緑色」シグナルを生成)。第三抗AU5抗体をAlexa594(JH)にコンジュゲートさせた(「紫色」シグナルを生成)。抗タグ抗体は、希釈剤90040中に5μg/mLの各抗タグ抗体を含む「カクテル」として適用した。
次の工程を3重IHCアッセイのために行った(表4参照):
完全なプロトコルの概要をまた上記の表3に提供する:
図4A〜4Dは、上記の3重IHCアッセイで染色された組織試料を示す。図4A及び4Bは、抗タグ抗体にコンジュゲートしたフルオロフォアの各々からのシグナルを明確に示し、よって、標的−エピトープタグ抗体複合体のそれぞれの位置、すなわちCD68−エピトープタグ抗体複合体(オレンジ色シグナル)、CD8−エピトープタグ抗体複合体(緑色シグナル)、及びFoxp3−エピトープタグ抗体複合体(紫色シグナル)の位置を明らかにしている。DAPI対比染色から生成されたシグナルは、図4A及び4Bのそれぞれに青色で現れている。よって、図4A及び4Bは、本開示のエピトープタグ抗体が、(1)それぞれCD68、CD8、及びFoxP3に結合することができたこと;(2)適切な抗タグ抗体によって検出することができたこと;及び(3)互いに干渉することなく、同時に組織試料に(例えば、抗体カクテルとして)適用することができたことを示している。よって、本開示のエピトープタグ抗体は多重アッセイでの使用に適していた。加えて、本実施例の多重アッセイは、4時間以内で完了することができた。伝統的な多重アッセイと比較して、これは当該分野における進歩を表す。この免疫マーカーのパネルは、血液系腫瘍及び固形腫瘍における免疫プロファイリングを助ける。
実施例3:抗種抗体と抗タグ抗体を組み合わせて使用する4重免疫組織化学アッセイ
実施例3は、4種の異なるエピトープタグ抗体を2段階で組織試料に適用した多重免疫組織化学アッセイを提供する(図5参照)。最初に、未修飾抗体、すなわち抗Pan−CK抗体を組織試料と接触させた。抗Pan−CK抗体の適用後、標的−抗Pan−CK抗体複合体を検出するためにヤギ抗マウス−Alexa488抗体を適用した(希釈剤90040中のヤギ抗マウス−Alexa488(2μg/mL))。
ついで、3種のエピトープタグ抗体が組織試料に同時に供給される第二段階を実施した(図5参照)。この第二段階では、第一エピトープタグ抗体はCD68に特異的であり(抗CD68)、VSVエピトープタグ(4つのVSVエピトープタグを含む重鎖)を含んでいた。第二エピトープタグ抗体はFoxP3に特異的であり(抗FoxP3)、V5エピトープタグ(5つのV5エピトープタグを含む重鎖)を含んでいた。第三エピトープタグ抗体は、CD8に特異的であり(抗CD8)、AU5エピトープタグ(4つのAU5エピトープタグを含む重鎖)を含んでいた。エピトープタグ抗体は、希釈剤90039中に各エピトープタグ抗体を2μg/mL含む「カクテル」として適用した。
3種のエピトープタグ抗体の同時適用後、3種の抗タグ抗体を組織試料に同時に供給したが(図5参照)、ここで、各抗タグ抗体がエピトープタグ抗体の異なるエピトープタグに特異的であった。第一抗VSV抗体をAlexa532(JH)とコンジュゲートさせ;第二抗V5抗体をDyLight649とコンジュゲートさせ;第三抗AU5抗体をAlexa594(JH)とコンジュゲートさせた。抗タグ抗体は、希釈剤90040中に5μg/mLの各抗タグ抗体を含む「カクテル」として適用した。
4重IHCアッセイに対して次の工程を行った(表5参照)。
完全なプロトコルの概要をまた表6B、6C及び6Dに提供する。
図6A〜6Fは、上記の4重IHCアッセイで染色された組織試料を示す。図6Aは、抗種抗体又は抗タグ抗体の何れかにコンジュゲートしたフルオロフォアの各々からのシグナルを明確に示し、よって、標的−抗体複合体のそれぞれの位置、すなわちPan−CK−抗体複合体(「緑色」シグナル)、CD68−エピトープタグ抗体複合体(「オレンジ色」シグナル)、CD8−エピトープタグ抗体複合体(「赤色」シグナル)、及びFoxp3−エピトープタグ抗体複合体(「シアン色」シグナル)の位置を明らかにしている。DAPI対比染色から生成されたシグナルは、図6A〜6Fのそれぞれに青色で現れている。図6Bは、DAPI対比染色に対応するシグナルのみを示す。図6Cは、検出されたCD8−エピトープタグ抗体複合体に対応するシグナルのみを示す。図6Dは、検出されたCD68−エピトープタグ抗体複合体に対応するシグナルのみを示す。図6Eは、検出されたFoxP3−エピトープタグ抗体複合体に対応するシグナルのみを示す。図6Fは、検出されたPan−CK染色に対応するシグナルのみを示す。図6A〜6Eは、本開示のエピトープタグ抗体が、(1)それぞれCD68、CD8、及びFoxP3に結合することができたこと;(2)適切な抗タグ抗体によって検出することができたこと;及び(3)互いに干渉することなく、同時に組織試料に(例えば、抗体カクテルとして)適用することができたことを示している。図6Aはまたエピトープタグ抗体はマウス抗Pan−CK抗体のような未修飾抗体又は抗体コンジュゲートとアッセイにおいて組み合わせることができ、そのような組み合わせが抗種又は抗タグ抗体にコンジュゲートした全てのフルオロフォアの検出を可能にすることを示している。加えて、本実施例の多重アッセイは、4時間以内で完了することができた。伝統的な多重アッセイと比較して、これは当該分野における進歩を表す。このマーカーのパネルは、腫瘍領域内の上述の免疫細胞マーカー及び上皮細胞マーカーの発現と分布を示すのに有用な場合がある。
実施例4:抗種抗体と抗タグ抗体を併用する4重免疫組織化学アッセイ
実施例4は、4種の異なるエピトープタグ抗体を2段階で組織試料に適用した多重免疫組織化学アッセイ(図7参照)を提供する。最初に、未修飾抗体、すなわち抗Pan−CK抗体を組織試料と接触させた。抗Pan−CK抗体の適用後、標的−抗Pan−CK抗体複合体を検出するためにヤギ抗マウス−Alexa488抗体を適用した(希釈剤90040中のヤギ抗マウス−Alexa488(2μg/mL))。
ついで、3種のエピトープタグ抗体が組織試料に同時に供給される第二段階を行った(図7参照)。この第二段階では、第一エピトープタグ抗体はCD68に特異的であり(抗CD68)、VSVエピトープタグ(4つのVSVエピトープタグを含む重鎖)を含んでいた。第二エピトープタグ抗体はFoxP3に特異的であり(抗FoxP3)、V5エピトープタグ(5つのV5エピトープタグを含む重鎖)を含んでいた。第三エピトープタグ抗体は、CD20に特異的であり(抗CD20)、HAエピトープタグ(4つのHAエピトープタグを含む重鎖)を含んでいた。エピトープタグ抗体は、希釈剤90039中に各エピトープタグ抗体を2μg/mL含む「カクテル」として適用した。
3種のエピトープタグ抗体の同時適用後、3種の抗タグ抗体を組織試料に同時に供給したが(図7参照)、ここで、各抗タグ抗体がエピトープタグ抗体の異なるエピトープタグに特異的であった。第一抗VSV抗体をAlexa532(JH)とコンジュゲートさせ;第二抗V5抗体をDyLight649とコンジュゲートさせ;第三抗AU5抗体をクマリン(JH)とコンジュゲートさせた。抗タグ抗体は、希釈剤90040中に5μg/mLの各抗タグ抗体を含む「カクテル」として適用した。
4重IHCアッセイに対して次の工程を行った(表6A参照):
完全なプロトコルの概要を表6B、6C及び6Dに提供する。
図8A及び8Bは、上記の4重IHCアッセイで染色された組織試料を示す。図8Aは4つの画像を提供し、各画像は、検出されたPan−CK、FoxP3、CD68、及びCD20に対応するシグナルを示す。図8Bは、シグナルの各々が検出されたPan−CK、FoxP3、CD68、及びCD20に対応する画像で、上で特定された抗体の4種全てが適用された組織試料に由来する画像を提供する。ここでもまた、図8A及び8Bは、本開示のエピトープタグ抗体が、(1)それぞれCD68、CD20、及びFoxP3に結合することができたこと;(2)適切な抗タグ抗体によって検出することができたこと;及び(3)互いに干渉することなく、同時に組織試料に(例えば、抗体カクテルとして)適用することができたことを示している。図8Bはまたエピトープタグ抗体はマウス抗Pan−CK抗体のような未修飾抗体又は抗体コンジュゲートとアッセイにおいて組み合わせることができ、そのような組み合わせが抗種又は抗タグ抗体にコンジュゲートした全てのフルオロフォアの検出を可能にすることを示している。加えて、本実施例の多重アッセイは、4時間以内で完了することができた。伝統的な多重アッセイと比較して、これは当該分野における進歩を表す。このマーカーのパネルは、腫瘍領域に対する上述の免疫細胞マーカー及び上皮細胞マーカーの発現と分布を示すのに有用な場合がある。
実施例5:抗種抗体と抗タグ抗体を併用する4重免疫組織化学アッセイ
実施例5は、4種の異なるエピトープタグ抗体を2段階で組織試料に適用した多重免疫組織化学アッセイ(図9参照)を提供する。実施例3及び5と比較して、実施例5は、第1段階で2種の抗体を提供し、第2段階で別の2種のエピトープタグ抗体を提供する。
図9に示した第1段階に関して、第一の未修飾抗体、すなわち抗Pan−CK抗体を組織試料と接触させた。第一の未修飾抗体の適用と同時に又はその後に、第二の未修飾抗体、すなわち抗PDL1(SP142)抗体を組織試料と接触させた。第一及び第二の未修飾抗体の適用後、ヤギ抗マウス−Alexa488抗体を適用して標的−抗Pan−CK抗体複合体(希釈剤90040中のヤギ抗マウス−Alexa488(2μg/mL))を検出し、ヤギ抗ウサギ−Alexa594抗体を適用して標的−抗PDL1(SP142)抗体複合体(ヤギ抗ウサギ−Alexa594(2ug/ml))を検出した。
ついで、2種のエピトープタグ抗体が組織試料に同時に供給される第2段階を行った(図9参照)。この第2段階では、第一のエピトープタグ抗体はCD20に特異的であり(抗CD20)、HAエピトープタグ(4つのHAエピトープタグを含む重鎖)を含んでいた。第二のエピトープタグ抗体は、CD68に特異的であり(抗CD68)、VSVエピトープタグ(4つのVSVエピトープタグを含む重鎖)を含んでいた。エピトープタグ抗体は、希釈剤90039中に2μg/mLの各エピトープタグ抗体を含む「カクテル」として適用した。
2種のエピトープタグ抗体の同時適用後、2種の抗タグ抗体を組織試料に同時に供給したが(図9参照)、ここで、各抗タグ抗体がエピトープタグ抗体の異なるエピトープタグに特異的であった。第一の抗HA抗体をクマリンとコンジュゲートさせ;第二の抗VSV抗体をAlexa532とコンジュゲートさせた。抗タグ抗体は、希釈剤90040中に5μg/mLの各抗タグ抗体を含む「カクテル」として適用した。
4重IHCアッセイのために次の工程を行った(表7参照):
図10A〜10Gは、上記の4重IHCアッセイで染色された組織試料を示す。図10Aは、DAPI染色、PDL1染色、CD20染色、及びCD68染色をそれぞれ個別に示す画像を提供する。図10Bは、DAPI染色、PDL1染色、CD20染色、CD68染色、及びPan−CK染色に対応するシグナルを示す画像を提供する。図10Cは、Pan−CK染色及びPDL1染色のそれぞれを示す個々の画像;及びPan−CK染色及びPDL1染色に対応するシグナルを示す画像を提供する。図10Cは、異なる種から産生された2種の未修飾抗体を組み合わせ、抗種抗体を使用して検出できることを示し、シグナルが腫瘍領域(Pan−CK陽性腫瘍上皮細胞)及びPDL1発現腫瘍細胞(Pan−CK及びPDL1の共局在化)又はPDL1発現免疫細胞を示すことを可能にする。図10D及び10Eは、それぞれ、既知の現象であるPDL1をマクロファージ(CD68陽性)が発現するCD68及びPDL1共染色を示す画像を提供する。幾つかの実施態様では、この特定のアッセイは、腫瘍浸潤リンパ球を同定するために使用されうる。従って、図10D及び10Eは、未修飾抗体及びエピトープタグ抗体が、2つの適用段階にわたって首尾よく組み合わされ得、抗体の各々が抗種又は抗タグ抗体によって検出されうることを示す。図10D及び10Eはまた両PDL1を発現しCD68マーカーを有する細胞膜の共局在化を示す。図10F及び10Gは、PDL1、Pan−CK、CD68、及びCD20で染色した組織試料を示す。
再度、図10A〜10Gは、本開示のエピトープタグ抗体が、(1)それぞれCD20及びCD68に結合することができたこと;(2)適切な抗タグ抗体によって検出することができたこと;及び(3)互いに干渉することなく、同時に組織試料に(例えば、抗体カクテルとして)適用することができたことを示している。図10A〜10Gはまたエピトープタグ抗体はマウス抗Pan−CK抗体又はウサギ抗PDL1(SP142)抗体のような2種の未修飾抗体又は抗体コンジュゲートとアッセイにおいて組み合わせることができ、そのような組み合わせが抗種又は抗タグ抗体にコンジュゲートした全てのフルオロフォアの検出を可能にすることを示している。加えて、本実施例の多重アッセイは、4時間以内で完了することができた。伝統的な多重アッセイと比較して、これは当該分野における進歩を表す。このマーカーのパネルは、抗PD−L1処置患者の腫瘍微小環境における腫瘍細胞及び浸潤免疫細胞におけるPD−L1の発現の同定を可能にする]。
実施例6:抗種抗体と抗タグ抗体を併用する4重免疫組織化学アッセイ
実施例6は、4種の異なるエピトープタグ抗体を2段階で組織試料に適用した多重免疫組織化学アッセイ(図11参照)を提供する。実施例3及び5と比較して、実施例5は、第1段階で2種の抗体を提供し、第2段階で別の2種のエピトープタグ抗体を提供する。
図11に示した第一段階に関して、第一の未修飾抗体、すなわち抗Pan−CK抗体を組織試料と接触させた。第一の未修飾抗体の適用と同時に又はその後に、第二の未修飾抗体、すなわち抗CD3(SP162)抗体を組織試料と接触させた。第一及び第二の未修飾抗体の適用後、ヤギ抗マウス−Alexa488抗体を適用して標的−抗Pan−CK抗体複合体(希釈剤90040中のヤギ抗マウス−Alexa488(2μg/mL))を検出し、ヤギ抗ウサギ−Alexa594抗体を適用して標的−抗PDL1(SP142)抗体複合体(ヤギ抗ウサギ−Alexa594(2ug/ml))を検出した。
ついで、2種のエピトープタグ抗体が組織試料に同時に供給される第2段階を行った(図11参照)。この第2段階では、第一のエピトープタグ抗体はCD20に特異的であり(抗CD20)、HAエピトープタグ(4つのHAエピトープタグを含む重鎖)を含んでいた。第二のエピトープタグ抗体は、CD68に特異的であり(抗CD68)、VSVエピトープタグ(4つのVSVエピトープタグを含む重鎖)を含んでいた。エピトープタグ抗体は、希釈剤90039中に2μg/mLの各エピトープタグ抗体を含む「カクテル」として適用した。
2種のエピトープタグ抗体の同時適用後、2種の抗タグ抗体を組織試料に同時に供給したが(図11参照)、ここで、各抗タグ抗体がエピトープタグ抗体の異なるエピトープタグに特異的であった。第一の抗HA抗体をクマリンとコンジュゲートさせ;第二の抗VSV抗体をAlexa532とコンジュゲートさせた。抗タグ抗体は、希釈剤90040中に5μg/mLの各抗タグ抗体を含む「カクテル」として適用した。
4重IHCアッセイのために次の工程を行った(表9参照):
完全なプロトコルの概要を表8に提供する:
図12A〜12Dは、上記の4重IHCアッセイで染色された組織試料を示す。図12Aは、DAPI染色、CD3染色、PanCK染色、及びCD68染色を示す画像を提供する。図12Bは、2種の区別されるB細胞及びT細胞集団を表す、CD20染色及びCD3染色に対応するシグナルを示す画像を提供する。図12Bは、未修飾抗体(抗CD3)及びエピトープタグ抗体(抗CD68)が、二つの適用段階にわたって首尾よく組み合わされ得、抗体の各々がそれぞれ抗種又は抗タグ抗体によって検出されうることを示す。図12C及び12Dは、CD3、Pan−CK、CD68、及びCD20で染色された組織試料を示す。
図12A〜12Dは、本開示のエピトープタグ抗体が、(1)それぞれCD20及びCD68に結合することができたこと;(2)適切な抗タグ抗体によって検出することができたこと;及び(3)互いに干渉することなく、同時に組織試料に(例えば、抗体カクテルとして)適用することができたことを示している。図12A〜12Dはまたエピトープタグ抗体はマウス抗Pan−CK抗体又はウサギ抗CD3(SP162)抗体のような2種の未修飾抗体又は抗体コンジュゲートとアッセイにおいて組み合わせることができ、そのような組み合わせが抗種又は抗タグ抗体にコンジュゲートした全てのフルオロフォアの検出を可能にすることを示している。加えて、本実施例の多重アッセイは、4時間以内で完了することができた。伝統的な多重アッセイと比較して、これは当該分野における進歩を表す。このマーカーのパネルは、免疫細胞マーカー及び腫瘍細胞マーカーを示し、腫瘍微小環境における免疫プロファイルを示すのに役立つ。
実施例7:5重免疫組織化学アッセイ
実施例7は、5つの異なるエピトープタグ抗体を同時に組織試料に適用した多重免疫組織化学アッセイを提供する(図13参照)。第一エピトープタグ抗体はCD3に特異的であり(抗CD3)、Eエピトープタグ(4つのEエピトープタグを含む重鎖)を含んでいた。第二エピトープタグ抗体はCD8に特異的であり(抗CD8)、E2エピトープタグ(4つのE2エピトープタグを含む重鎖)を含んでいた。第三エピトープタグ抗体はCD20に特異的であり(抗CD20)、HAエピトープタグ(4つのHAエピトータグを含む重鎖)を含んでいた。第四エピトープタグ抗体は、CD68に特異的であり(抗CD68)、VSVエピトープタグ(4つのVSVエピトープタグを含む重鎖)を含んでいた。第五エピトープタグ抗体は、FoxP3に特異的であり(抗FoxP3)、V5エピトープタグ(5つのV5エピトープタグを含む重鎖)を含んでいた。エピトープタグ抗体は、希釈剤90039中に各エピトープタグ抗体を2μg/mLを含む「カクテル」として適用した。
3種のエピトープタグ抗体の同時適用後、5種の抗タグ抗体を組織試料に同時に供給したが(図13参照)、ここで、各抗タグ抗体がエピトープタグ抗体の異なるエピトープタグに特異的であった。第一の抗E抗体をAlexa488とコンジュゲートさせ;第二の抗E2抗体をAlexa594とコンジュゲートさせ;第三の抗HA抗体をクマリンとコンジュゲートさせ;第四の抗VSV抗体をAlexa532とコンジュゲートさせ;及び第五の抗V5抗体をAlexa647とコンジュゲートさせた。抗タグ抗体は、希釈剤90040中に5μg/mLの各抗タグ抗体を含む「カクテル」として適用した。
3重IHCアッセイのために次の工程を行った(表10):
完全なプロトコルの概要を表3に提供する。
図14Aは、DAPI、CD20、CD3、CD8、CD68、及びFoxP3染色に対応するシグナルを示す画像を提供する。図14Bは、DAPI、CD3及びCD8染色を示す画像を提供する。とりわけ、図14Bは、CD3の白色シグナルとCD8の赤色シグナルが重複して、重ね合わせされたマゼンタ色のシグナルを提供するように、CD3及びCD8シグナルが(DAPI対比染色の存在下で)重ね合わされた位置を示す。同様に、図14Cは、DAPI対比染色の非存在下で、CD3(緑色)及びCD8(赤色)シグナルの重ね合わせを示す。
図14Dは、重ね合わせが観察されないDAPI、CD8(細胞傷害性T細胞マーカー)及びFoxP3(制御性T細胞マーカー)染色を示す画像を提供する。図14Eは、重ね合わせが観察されないCD8(細胞傷害性T細胞マーカー)及びFoxP3(制御性T細胞マーカー)染色を示す画像を提供する。図14Fは、重ね合わせが観察されるCD3(T細胞マーカー)及びFoxP3(制御性T細胞マーカー)染色を示す画像を提供する。図14Gは、CD68及びFoxP3染色を示す画像を提供し;図14Hは、CD20(B細胞マーカー)及びCD3(T細胞マーカー)染色を示す画像を提供する。図14Iは、CD3、FoxP3、及びCD8染色を示す画像を提供し、CD8(細胞傷害性T細胞マーカー)及びFoxP3(制御性T細胞マーカー)がCD3(T細胞マーカー)に共局在化している。図14Jは、CD3、FoxP3、CD8、及びCD68染色を示す画像を提供する。これらの染色パターンは、免疫細胞の異なる集団とそれらの相互関係を示す。
図14A〜14Iは、本開示の5種のエピトープタグ抗体が、(1)CD20、CD3、CD8、CD68、及びFoxP3に結合することができたこと;(2)適切な抗タグ抗体によって検出することができたこと;及び(3)互いに干渉することなく、同時に組織試料に(例えば、抗体カクテルとして)適用することができたことを示している。5重MIHCアッセイは、4時間以内で完了することができた。このアッセイは、血液系腫瘍及び固形腫瘍における免疫プロファイリングに有用である。
実施例8:HER2+4n1細胞株モデル及び乳がん組織へのHER2/neu(4B5)抗体−V5ペプチドコンジュゲートの評価
この実施例は、HER2+4n1細胞株モデル及びHER2+乳がん組織に対するHER2/neu(4B5)抗体V5ペプチドコンジュゲートの可視化を実証する。扁桃組織切片を含むスライドを、自動染色装置[BenchMark(登録商標)XT,Ventana Medical Systems,Inc,(VMSI)Tucson,AZ]の標準プロトコルを使用して開発した。典型的な自動プロトコルは次の通りである:スライド上のパラフィン被覆組織を75℃で4分間加熱し、容量を75℃で調整したEZPrep(VMSI#950−102)で1回処理した後、液体カバースリップ(LCS,VMSI#650−010)を適用した。スライドを75℃で4分間インキュベートした後、スライドをリンスし、EZPrep容量を調整し、続いてLCSを用いて組織を脱パラフィンした(プロセスは3回反復−合計4サイクル)。スライドを37℃に冷却し、4分間インキュベートした。スライドを細胞コンディショニング溶液(CCI,VMSI#950−124)で完全にリンスし、続いてLCSを適用した。スライドを95℃で8分間加熱した。ついで、スライドを100℃に加熱し、8分間インキュベートした。スライドをCCIでリンスし、続いてLCSを適用し、100℃で8分間インキュベートした。スライドの乾燥を防止するために、4分ごとに16分間、CCI及びLCSを適用した。
スライドを37℃に冷却し、反応バッファー(VMSI#950−300)で2回リンスし、100μLのUVインヒビター(VMSI ultra View DAB検出キット#760−500の成分)をスライドに適用し、4分間インキュベートした。スライドを反応バッファーで1回リンスした後、カゼインを含むVentana抗体希釈剤(VMSI#760−219)中のHER2/neu抗体−VSペプチドコンジュゲート(1μg/mL)100μLを37℃で16分間適用した。スライドを反応バッファーで3回リンスしてから、B5ブロッカーを含むVentanaアビジン希釈剤(VMSI#90040)中1μg/mLのPierce MsAntiV5抗体(Clone EIO/V4RR,Pierce#MAS−15253)100μLを添加した。MsAntiV5抗体を37℃で8分間インキュベートした。スライドを反応バッファーで3回リンスした後、100μLのultra View HRPユニバーサルマルチマー(VMSI ultra View DAB検出キット#760−500の成分)を添加した。反応バッファーで3回リンスした後、ultra View DABとultra View H20 2の両方をスライドに100μL適用し、37℃でLCSと共に8分間インキュベートした。スライドを反応バッファー中で一回リンスした後、ultra View Copper100μLをスライドに適用し、37℃で4分間インキュベートした。ついで、スライドを反応バッファーで2回リンスした後、スライド上でLCSと共に4分間インキュベートしたヘマトキシリンII(VMSI#750−2021)で対比染色した。反応バッファーで2回リンスした後、ブルーイング試薬(VMSI#760−2037)を適用し、対比染色が完了するまで4分間インキュベートした。スライドを機器から取り出し、洗剤洗浄で処理し、水でリンスし、アルコール削減及びキシレンで脱水した後、固体のカバースリップを手作業で適用した。以下に検討される結果は、2+HER2+乳がん組織の場合のIHC染色のものである。スライドを明視野顕微鏡で見た。表11に示す結果は、DAB IHCシグナル強度(例えば、染色の強度)の主観的スコアであり、2がHER2/neu(4B5)標準スライドについて観察された最も強いDAB強度であった。

HOK4 HER2−V5コンジュゲートは、2+乳がん症例でのHER2/neu(4B5)標準対照と同等のIHC DAB染色を提供した。H0K1からH0K3 HER2−V5コンジュゲートは、僅かに劣ったIHC染色を示した。H2K0からH5K0 HER2−V5コンジュゲートは、2+乳がん症例でのHER2/neu(4B5)標準対照と同等であった。H1K0 HER2−V5コンジュゲートもまた僅かに劣ったIHC組織染色を示した。
実施例9:HER2+4111細胞株モデル及び乳がん組織へのHER2/neu(4B5)抗体−V5ペプチドコンジュゲートの評価
この実施例は、HER2+4n1細胞株モデル及びHER2+乳がん組織に対するHER2/neu(4B5)抗体−V5ペプチドコンジュゲートの可視化を実証する。扁桃組織切片を含むスライドを、自動染色装置[BenchMark(登録商標)XT,Ventana Medical Systems,Inc,(VMSI)Tucson,AZ]の標準プロトコルを使用して開発した。典型的な自動プロトコルは次の通りである:スライド上のパラフィン被覆組織を75℃で4分間加熱し、容量を75℃で調整したEZPrep(VMSI#950−102)で1回処理した後、液体カバースリップ(LCS,VMSI#650−010)を適用した。スライドを75℃で4分間インキュベートした後、スライドをリンスし、EZPrep容量を調整し、続いてLCSを用いて組織を脱パラフィンした(プロセスは3回反復−合計4サイクル)。スライドを37℃に冷却し、4分間インキュベートした。スライドを細胞コンディショニング溶液(CCI,VMSI#950−124)で完全にリンスし、続いてLCSを適用した。スライドを95℃で8分間加熱した。ついで、スライドを100℃に加熱し、8分間インキュベートした。スライドをCCIでリンスし、続いてLCSを適用し、100℃で8分間インキュベートした。スライドの乾燥を防止するために、4分ごとに16分間、CCI及びLCSを適用した。
スライドを37℃に冷却し、反応バッファー(VMSI#950−300)で2回リンスし、100μLのUVインヒビター(VMSI ultra View DAB検出キット#760−500の成分)をスライドに適用し、4分間インキュベートした。スライドを反応バッファーで1回洗浄した後、カゼインを含むVentana抗体希釈剤(VMSI#760−219)中のHER2/neu抗体−VSペプチドコンジュゲート(1μg/mL)100μLを37℃で16分間適用した。スライドを反応バッファーで3回リンスしてから、B5ブロッカーを含むVentanaアビジン希釈剤(VMSI#90040)中1μg/mLのPierce MsAntiV5抗体(Clone EIO/V4RR,Pierce#MAS−15253)100μLを添加した。MsAntiV5抗体を37℃で8分間インキュベートした。スライドを反応バッファーで3回リンスした後、100μLのultra View HRPユニバーサルマルチマー(VMSI ultra View DAB検出キット#760−500の成分)を添加した。反応バッファーで3回リンスした後、ultra View DABとultra View H20 2の両方をスライドに100μL適用し、37℃でLCSと共に8分間、共インキュベートした。スライドを反応バッファーで一回リンスした後、ultra View Copper100μLをスライドに適用し、37℃で4分間インキュベートした。ついで、スライドを反応バッファーで2回リンスした後、スライド上でLCSと共に4分間インキュベートしたヘマトキシリンII(VMSI#750−2021)で対比染色した。反応バッファーで2回リンスした後、ブルーイング試薬(VMSI#760−2037)を適用し、対比染色が完了するまで4分間インキュベートした。スライドを機器から取り出し、洗剤洗浄で処理し、水でリンスし、アルコール削減及びキシレンで脱水した後、固体のカバースリップを手作業で適用した。
以下に検討する結果は、2+HER2+乳がん組織の場合のIHC染色のものである。スライドを明視野顕微鏡で見た。表12に示す結果は、DAB IHCシグナル強度(例えば、染色の強度)の主観的スコアであり、2がHER2/neu(485)標準スライドについて観察された最も強いDAB強度であった。
H0K4 HER2−V5コンジュゲートは、2+乳がん症例でのHER2/neu(4B5)標準対照と同等のIHC DAB染色を提供した。H0K1からH0K3 HER2−V5コンジュゲートは、僅かに劣ったIHC染色を示した。H2K0からH5K0 HER2−V5コンジュゲートは、2+乳がん症例でのHER2/neu(4B5)標準対照と同等であった。H1K0 HER2−V5コンジュゲートもまた僅かに劣ったIHC組織染色を示した。
実施例10:HER2/neu(4B5)抗体−VSペプチドコンジュゲートのBioLayer干渉法(BLI)評価:HER2ペプチド抗原のコンジュゲート認識と抗VS抗体によるその後のコンジュゲート認識
全てのBioLayer干渉法実験を、Greiner Bio−one黒色平底96ウェルポリプロピレンマイクロプレート(Greiner Bio−one#655209)中のForteBioアミン反応センサー(ForteBio#18−5001)を使用してForteBio Octet Red BU機器で実施した。全てのBLIアッセイは37℃で実施した。
BLI分析を次のように実施した:
ForteBioアミン反応性バイオセンサー(ForteBio)を、0.1MMES pH5.0[2−(N−モルホリノエタンスルホン酸)]200μL中で水和させた。バイオセンサーを、ddi水中0.4MのEDC(1−エチル−3−[3−ジメチルアミノプロピル]カルボジイミド塩酸塩)、0.1MのNHS(N−ヒドロスルホスクシンイミド)の200μL混合物中での処理により5分間活性化した。BSA−HER2ペプチド免疫原投入は、O.IM MES pH5.0中200μLのBSA−HER2ペプチド免疫原(25μg/mL)で20分間センサーを処理することにより実施した。センサーを1Mのエタノールアミン(pH=8.5)で5分間クエンチした後、ForteBio動態バッファー添加剤(ForteBio#18−5032をIXに希釈)を含む10mMのリン酸(pH=7.4)、134mMのNaCl中で5分間平衡化した。HER2−V5抗体ペプチドコンジュゲート結合を、ForteBio動態バッファー添加剤(ForteBio#18−5032をIXに希釈)を含む10mMのリン酸(pH=7.4)、134mMのNaCl中の3μg/mLのコンジュゲート溶液でおよそ45分間センサーを処理することによって実施した。HER2−V5抗体−ペプチド抗体コンジュゲートを、
ForteBio動態バッファー添加剤(ForteBio#18−5032をIXに希釈)を含む10mMのリン酸(pH=7.4)、134mMのNaCl中で20分間センサーから解離させた。バイオセンサーのMsAntiV5抗体認識を、ForteBio動態バッファー添加剤(ForteBio#18−5032をIXに希釈)を含む10mMのリン酸(pH7.4)、134mMのNaCl中のPierce MsAntiV5抗体(Clone El0/V4RR,Pierce#MAS−15253)の3μg/mL溶液でおよそ45分間センサーを処理することにより実施した。HER2−V5抗体−ペプチド抗体コンジュゲートを、ForteBio動態バッファー添加剤(ForteBio#18−5032をIXに希釈)を含む10mMのリン酸(pH7.4)、134mMのNaCl中でおよそ45分間センサーから解離させた。
結果:
抗体−ペプチドコンジュゲート/抗原認識と続いて二次抗ペプチド抗体/抗体−ペプチドコンジュゲート認識に対するペプチド標識の影響を実証するためにBioLayer干渉法実験を実施した。BLI研究は、抗体重鎖及び軽鎖のペプチド標識が、必要な抗原の抗体認識にほとんど影響しないことを実証した。更なる研究により、ペプチド標識の増加が、二次抗体認識の様式を親和性相互作用から結合活性相互作用へ変化させたことを示した。重鎖及び軽鎖の両方の標識の増加は、少なくとも幾らかのアッセイ層圧縮と結合活性の増加を引き起こしたが、二次抗体解離は大きく最小化された(図24A及び24B参照)。
BLI分析は、(1)全ての抗体認識工程に対する良好なシグナル/ノイズ;(2)反復データ点を用いた一貫したアッセイ応答を示し;(3)天然HER2(4B5)とMsAntiV5に対して交差反応性は観察されなかった。
実施例11:DLS/DSC試験
方法
DLS:流体力学的半径、凝集体、温度誘発凝集
DSC:IgGドメイン融解温度に対するE4タグの影響(表13参照):
全ての試料は、0.1%のアジ化ナトリウム及び1%のBSAを含むPBS中に入れた;E4タグをH及び/又はK鎖のC末端に融合させた(図25A参照)。E4タグの分子量は20kDaであった。
プロテインAクロマトグラフィーによるBSAの除去:
(1)プロテインAクロマトグラフィー−カラム:HiTrap MabSelect SuRe(1ml);バッファーA:50mMのKP、150mMのNaCl,pH7.5;バッファーB:50mMのクエン酸ナトリウム,pH4.0
(2)50mMのKP−Puffer 150mMのKCl,pH7.4に対して4℃で16時間透析する
(3)Pall Macrosep Advance 10kDaで0.5mgのタンパク質/mlに濃縮する
図25Bは、BSAが試料から定量的に除去されたことを示している(SDSページ)。
SECクロマトグラフィー−SEC(YMC200)と組み合わせた屈折率及び直角光散乱検出器から計算した分子量(表15参照):
SECクロマトグラフィーは、分子量が予想通りであることを示した。
DLS測定−分析及び解釈(表16A及び16B参照):
測定の再現性は良好である;
H0K0は、IgGについて予想された通り1rH(5.4nm)を有し、少量の凝集物のみが検出可能であった;
E4タグのC末端融合がrHの有意な増加を引き起こしたが、これはE4タグの非構造的性質によって説明されうる;
E4タグを有する試料では、僅かにより多い凝集体が検出可能であった;そして
H4K0は、他のものより有意に多くの凝集体(約2%(w/w))を有し、ピーク1においてより高い多分散性を有し、オリゴマー(二量体から四量体)に高含有量を示している。
DLS温度勾配(図25D及び25Eを参照)
25℃から80℃の温度範囲にわたって0.1K/分の勾配速度(約10時間)で流体力学的半径(累積的フィット)が追跡される;天然IgG(H0K0)は70℃で非常に大きな(約1μm)凝集体を形成する;温度曲線は、E4タグがこの温度誘発凝集体の形成を低減させることを示唆している。
OnsetTempを用いて凝集開始点を決定した。OnsetTempは、タンパク質構造の安定性の指標である;H鎖のC末端へのE4タグの融合は、OnsetTempに有意な影響を及ぼさない;K鎖のC末端へのE4タグの融合は、2KだけOnsetTempの減少を引き起こす;この効果は、H0K4及びH4K4で観察することができた。K4融合体はIgGに対して不安定化効果を有していた。
DSC分析(図25F参照)−試料の量が限られているため、DSC実験は単一の測定として非常に低い濃度で実施しなければならなかった;K鎖のC末端へのE4タグの融合は、H4K0と比較してTmの有意な減少を引き起こした;DLS実験で示されたIgGに対するK4融合の不安定化効果は、DSCによって確認することができた。
DLS/DSCの概要
全ての実験を、50mMのリン酸カリウムバッファー、150mMの塩化カリウムpH7.4で実施した。バッファー、pH、塩濃度の影響の評価は、この研究の目的ではなかった。
E4タグの観察された影響:
分子量の増加は、154kDa(H0K0)から205kDa(H4K0及びH0K4)及び252kDa(H4K4)までRALSによって決定した。
5.4nm(H0K0)から8nm(H4K0及びH0K4)及び9nm(H4K4)へのrHの増加
H鎖ではなくK鎖のE4タグが、DLS OnsetTemp測定及びDSCによって示されるようにIgGの安定性を低下させた。
E4タグは、高温で大きな凝集体を形成する傾向を低減させた。
実施例12−動態及び結合/解離速度研究
表面プラズモン共鳴分光法の概要
表面プラズモン共鳴(SPR)分光法は、リガンド結合相互作用の研究のための技術である。SPRは、比較的少量の材料を使用して、リガンド分子と相互作用する抗体のリアルタイム定量的結合親和性及び動態を測定することができる。常套的なSPR技術では、センサーチップ上に一方の結合成分を固定する必要があり、溶液中の他方の結合成分はセンサー表面上に流され;センサー表面での屈折率の小さな変化を測定する光学的方法を使用して結合相互作用が検出される。これは、金属薄膜における表面プラズモン生成現象と、溶液中に短距離(300nmまで)延びるエバネッセント波又は電磁膜を生成する表面−溶液界面での光の全反射照明を利用する。
図30は、アナライト分子の受容体分子への結合を測定するための基本的なSPR実験の概略図である。例:A.BIAcoreTM技術に基づくSPR実験のための機器の設定。SPRは、光学的方法を使用してセンサー表面に近い屈折率を測定する;これは、溶液中に短距離(300nmまで)延びるエバネッセント波又は電磁場を生成する表面−溶液界面での光の全反射照明を利用する。表面は、水溶液が連続的に通過する小容量(100nl未満)のフローセルの床を形成するガラス支持体上の金の薄膜である。受容体分子へのアナライト分子の結合を検出するために、受容体分子は通常センサー表面上に固定され、アナライト分子はフローセルを介して水溶液中に注入される。レーザ源からの偏光は、プリズムを通って、入射光の臨界角で表面プラズモンが生成される金膜の下面に向けられる。この光の吸収は、反射光の強度の低下として見られる。臨界角は、金表面の300nm内の媒質の屈折率に依存し、分子が表面に結合するとき、例えばアナライト分子が固定された受容体分子に結合するとき、変化する。B.アナライト分子の受容体分子への結合の際の角度aから角度bへの入射光の臨界角の変化。C.センサーグラムの形でのSPR実験の応答。固定された受容体分子とアナライト分子との間の相互作用が生じると、金膜の表面における屈折率が変化し、これがシグナル強度の増加として見られる。シグナルの増加を記述するには、共鳴又は応答単位(RU)が使用され、1RUは10−4度の臨界角シフトに等しい。実験開始時に、固定された受容体分子は全てアナライト分子に曝されておらず、RUは開始臨界角aに対応する。アナライト分子がフローセルに注入される;それらが固定された受容体分子に結合する場合、結合部位が占有される結合相が存在し、この曲線の形状を使用して結合速度(kon)を測定することができる。定常状態が達成されると(この例では全ての結合部位が占有されると)、RUは変更された最終臨界角bに対応する。この最大RUは、固定された受容体及びアナライト分子の濃度に関係し、よって、結合親和性(KD)を測定するために使用することができる。アナライト分子が連続流から除去されると、結合部位が空になる解離相があり、この曲線の形状を使用して解離速度(koff)を測定することができる。ついで、表面を再生して臨界角aに戻し、実験を再び開始することができる。
[動態研究]
Biacore T200機器(GE Healthcare)を使用して、次の単独で化学的にビオチン化されたペプチド2kDaアナライトに対するウサギモノクローナル抗体の結合挙動を動態的に評価した:E_Tag(1−13)[Glu(Bi−PEG)−1]amid、及びE_Tag(1−13)[Glu(Bi−PEG)−13]amid;E2_Tag(1−12)[Glu(Bi−PEG)−1]amid、及びE2_Tag(1−12)[Glu(Bi−PEG)−12]amid;V5_Tag(1−14)[Glu(Bi−PEG)−1]amid、及びV5_Tag(1−14)[Glu(Bi−PEG)−14]amid;VSV−G_Tag(1−11)[Glu(Bi−PEG)−11]amid;HA_Tag(1−9)[Glu(Bi−PEG)−1]amid、及びHA_Tag(1−9)[Glu(Bi−PEG)−9]amid。
ウサギIgG(150kDa)モノクローナル抗体mAb<E>rRb−J26_wt−IgG及びmAb<E>rRb−J26_H2L5、mAb<E2>rRb−J78_wt−IgG及びmAb<E2>rRb−J78_H5L3、mAb<V5>rRb−J53_wt−IgG及びmAb<V5>rRb−J53_H1L2、mAb<HA>rRb−J15_H2L2、mAb<VSV−G>rRb−J110_H5L2、及びRb−N−IgG(ウサギ正常IgG,Sigma)をその結合動態及び結合化学量論について調べた。CM5シリーズセンサーをシステムに取り付け、HBS−ETバッファー(10mMのHEPES,pH7.4、150mMのNaCl、3mMのEDTA、0.005%w/vのTween20)中で製造者の説明書に従って規準化した。試料バッファーは、1mg/mlのCMD(カルボキシメチルデキストラン,Sigma#86524)を補充したシステムバッファーであった。システムは37℃で作動した。13000RUのGARbFcγ(ヤギ抗ウサギFcγ),コード番号:111−005−046,Jackson Immuno Researchを、4つのフローセル全てについてEDC/NHS化学を使用して製造者の説明書に従って固定化した。センサーを1Mのエタノールアミンを使用して不活性化した。アナライトに対する各抗体の結合活性を動態的に試験した。抗体を、10μl/分で2分間の注入によって30nMの濃度で捕捉した。流量は60μl/分に設定した。アナライトは、0nMのバッファー対照、22nM、67nM、200nMの2回、600nM及び1800nMの異なる濃度段階で3分間注入した。解離を5分間モニターした。各アナライトの注入後に、20μl/分のHBS−ETバッファーを1分25秒間注入し、その後20μl/分で10mMのグリシンバッファー(pH1.5)を1分間注入し、10mMのグリシン(pH1.7)を20μl/分で1分間、2回注入して、抗体捕捉システムを完全に再生した。可能な場合、RMAXローカルを用いたLangmuirフィットに従って動態シグネチャーを評価した。解離速度が明らかでない場合、定常状態アルゴリズムを製造者の評価ソフトウェアに従って適用した。
図31Aは、上述の方法によるSPR実験の結果を示す。特に、図31Aは、Mab<V5>rRb−J53_wtとMab<V5>rRb−J53_H1L2との間の動態の差異を示しており、MRは約1.4であり、よって約1:1の結合化学量論を示している。bi−1位又はbi−14位でビオチンで標識されたペプチドアナライト間に観察可能な動態差はなかった。J53 H1L2(重鎖上に一つのV5タグと軽鎖上に二つのV5タグ)は、J53wtよりも僅かに高い親和性を示した。
図31Bは、上述の方法によるSPR実験の結果を示す。特に、図31Bは、Mab<E>rRb−J26_wtとMab<E>rRb−J26_H2L5との間の動態の差異を示しており、MRは約2までであると決定され、これは約1:2の結合化学量論を意味する。ここでは、決定可能なkd複合体安定性は観察されなかったが、定常状態親和性は認められた。bi−1位にビオチンを含むEエピトープタグは、通常のファストオン/ファストオフ動態を有し、bi−13位にビオチンを含むEエピトープタグは、解離相に非特異的結合を有し、これは抗体の弱い複合体安定性に起因すると考えられた。
図31Cは、上述の方法によるSPR実験の結果を示す。特に、図31Cは、Mab<E2>rRb−J78_wtとMab<E2>rRb−J78_H5Lとの間の動態の差異を示し、MRは約1.4であり、よって約1:1の結合化学量論を示す。位置bi−1又は位置bi−12にビオチンを有するペプチド間に観察可能な動態差は存在しなかった。
図31Dは、上述の方法によるSPR実験の結果を示す。特に、図31Dは、Mab<HA>rRb−J15_H2L2間の動態の差異を示し、MRは約1.4であり、よって約1:1の結合化学量論を示している。位置bi−1又は位置bi−9にビオチンを有するペプチドアナライト間に観察可能な動態差はなかった。
図31Eは、上述の方法によるSPR実験の結果を示す。特に、図31Eは、Mab<VSV−G>rRb−J110_H5L2間の動態差を示し、MRは約2までであり、よって約1:2の結合化学量論を示している。
[結合/解離速度研究]
Biacore T200機器(GE Healthcare)を使用して、次の各タグ抗体アナライトに対するウサギモノクローナル抗体の結合挙動を動態的に評価した:CD68 HLvsv、CD68 HvsvLvsv、CD68 HvsvL、CD68 HL;CD8 HL、CD8 He2L;PD−L1 SP63 He2L、PD−L1 SP63 HLe2、PD−L1 SP63 He2Le2、PD−L1 SP63 HL;_CD20 HL、CD20 HhaL、CD20 HLha、CD20 HhaLha;PD−L1 SP63 HhaL、PD−L1 SP63 HLha、PD−L1 SP63 HhaLha、PD−L1 SP63 HL;FoxP3 HL、FoxP3 H5v5L、FoxP3 HL5v5、FoxP3 H5v5L5v5、FoxP3 H4v5L、FoxP3 HL4v5、FoxP3 H4v5L4v5。
ウサギIgG(150kDa)モノクローナル抗体mAb<E>rRb−J26_wt−IgG及びmAb<E>rRb−J26_H2L5、mAb<E2>rRb−J78_wt−IgG及びmAb<E2>rRb−J78_H5L3、mAb<V5>rRb−J53_wt−IgG及びmAb<V5>rRb−J53_H1L2、mAb<HA>rRb−J15_H2L2、mAb<VSV−G>rRb−J110_H5L2、及びRb−N−IgG(ウサギ正常IgG,Sigma)をその結合動態及び結合化学量論について調べた。CM5シリーズセンサーをシステムに取り付け、HBS−ETバッファー(10mMのHEPES,pH7.4、150mMのNaCl、3mMのEDTA、0.005%w/vのTween20)中で製造者の説明書に従って規準化した。試料バッファーは、1mg/mlのCMD(カルボキシメチルデキストラン,Sigma#86524)を補充したシステムバッファーであった。システムは37℃で作動した。13000RUのGARbFcγ(ヤギ抗ウサギFcγ),コード番号:111−005−046,Jackson Immuno Researchを、4つのフローセル全てについてEDC/NHS化学を使用して製造者の説明書に従って固定化した。センサーを1Mのエタノールアミンを使用して不活性化した。アナライトに対する各抗体の結合活性を動態的に試験した。抗体を、10μl/分で2分間の注入によって約30nMの濃度で捕捉した。流量は60μl/分に設定した。アナライトは、0nMのバッファー対照、22nM、67nM、200nMの2回、600nM及び1800nMの異なる濃度段階で3分間注入した。解離を5分間モニターした。各アナライトの注入後に、20μl/分のHBS−ETバッファーを1分25秒間注入し、その後20μl/分で10mMのグリシンバッファー(pH1.5)を1分間注入し、10mMのグリシン(pH1.7)を20μl/分で1分間、2回注入して、抗体捕捉システムを完全に再生した。可能な場合、RMAXローカルを用いたLangmuirフィットに従って動態シグネチャーを評価した。解離速度が明らかでない場合、定常状態アルゴリズムを製造者の評価ソフトウェアに従って適用した。
この研究によれば、本出願人は、エピトープタグ抗体に抗タグ抗体が全て特異的に結合することを見出した。図32A〜32Dに示されるように、結合速度は速く、解離速度は機器の仕様の範囲外であったか、又は正のドリフトを呈していた。従って、kd(1/s)を1E−05 1/sに設定した。
上記の動態研究(例えば、図31A〜31Eを参照)と比較すると、エピトープタグ抗体と抗タグ抗体との間の動態は結合活性が触媒されたことが明らかであった。エピトープタグ抗体は2つのエピトープを示し親和性を媒介した。従って、動態定量化は結合活性を与えるが親和性は与えないであろう。本出願人はまたアビディティー因子を、データを上記の動態研究と比較することによって計算できることを見出した。例えば、図31Aに示されるように、Mab<V5>rRb−J53_H1L2対bi−14タグ(kd=2.4E−03 1/s)は、結合活性が少なくとも240倍触媒された(2.4E−03 1/s/1E−05 1/s=240)。同様に、図31Cは、Mab<E2>rRb−J78_H5L3(kd=2.0E−02 1/s)は、結合活性が少なくとも2000倍触媒された(2.0E−02 1/s/1E−05 1/s=2000)ことを示している。
実施例13−組換えエピトープタグ抗体とモノクローナル抗タグ抗体を使用する平行多重免疫組織化学検出法のための柔軟で多用途のツールボックス(図33A〜33Eを参照)
[序]
臨床利用のための単一のホルマリン固定パラフィン包埋(FFPE)スライド上での複数のバイオマーカーのコンテクスト検出は未だ満たされていない。現在の多重免疫組織化学(IHC)手順は、抗体適用及びフルオロフォア付着の連続ラウンドに続いて抗体不活性化を伴う。我々は、一連のエピトープタグ抗体とフルオロフォア、ハプテン、又は酵素にコンジュゲートした抗エピトープ抗体を使用する自動化された大きく並列の多重IHCアプローチを開発し、免疫腫瘍学に関連するマーカーの5重蛍光及び二重明視野アッセイにより実現可能性を実証した。
[方法]
哺乳動物細胞における抗CD3、CD8、CD68、FoxP3、及びPDL1抗体の産生のために、ペプチドエピトープタグに対応するDNA配列をウサギモノクローナル抗体cDNAにインフレームで融合させた。組換えタギングは、化学ベースのタギングに付随する潜在的な抗体不活性化をバイパスする。エピトープタグ一次抗体は、タグなし天然抗体と同一のジアミノベンジジン(DAB)染色強度及びパターンを生じた(データは示さず)。抗タグ又は抗ハプテン抗体へのフルオロフォア又はハプテンのコンジュゲーションは、NHSエステル前駆体を使用して実施した。西洋わさびペルオキシダーゼ(HRP)及びアルカリホスファターゼ(AP)を、NHS−マレイミドリンカーを介して還元抗体にコンジュゲートさせた。抗エピトープ抗体の親和性を、バイオレイヤー干渉法を使用して評価した。非小細胞肺がん(NSCLC)患者由来の腫瘍試料を含むFFPE組織切片の自動IHCを、VENTANA BenchMark ULTRAプラットフォームで実施した。
[結果]
5つのエピトープタグのそれぞれに対するウサギモノクローナル抗体の複数のクローンをコンジュゲートし、親和性、安定性、及び適切な染色強度及びパターンの保持についてスクリーニングした。各抗エピトープ抗体の少なくとも一つのクローンが機能要件を満たし、これらをエピトープタグ抗体カクテルと組み合わせてFFPE肺切片を染色するために使用した。エピトープタグ抗体は、感度の順に3つの検出構成の一つを使用して検出した:1)フルオロコンジュゲート抗エピトープ抗体、2)ハプテンコンジュゲート抗タグ抗体とフルオロコンジュゲート抗ハプテン抗体、及び3)HRP又はAPコンジュゲート抗エピトープ抗体を用いた組織検体へのチラミド又はキノンメチドフルオロの付着(図33A)。抗体の滴定及びアッセイの最適化は、検出構成との特定のバイオマーカーの対形成が、タグなし抗体及びHRPコンジュゲート抗種抗体を使用するDAB染色によって生成されるものに匹敵する特異的蛍光パターン及び相対強度を生じさせるようにした(図33B〜33E)。酵素コンジュゲート抗タグ抗体及びHRP及びAP活性化色素原を使用して2色の明視野染色を生成した(データは示さず)。
[結論]
我々は、一連のエピトープタグ抗体及びフルオロ−、ハプテン−、又は酵素−コンジュゲート抗タグ抗体を使用する自動並列多重IHCの実行可能性を実証した。本アプローチには次の利点がある:ワークフローの合理化−タグ抗体と抗タグ抗体プローブをカクテルとして適用すると、アッセイ時間を有意に短縮する。柔軟性と汎用性−ハプテン、エピトープタグ、フルオロフォア、及び酵素のライブラリーを、低含量マーカーと高含量マーカーを適切に検出するように適合させることができ(例えば、低含量マーカーを高感度の酵素媒介フルオロ沈着と対にする)、5重を超える増加した数のバイオーカーに適応できる。エピトープ保存−連続的に適用される抗体に基づくアプローチとは異なり、タグ抗体及び抗タグ抗体を使用することにより、抗体不活性化の複数のサイクルが組織の完全性に及ぼす有害な影響を回避する。
実施例14−ペプチドエピトープタグ抗体と抗エピトープタグ抗体との間の結合化学量論の生化学分析
この研究は、タグ一次抗体に結合する抗タグ二次抗体の化学量論を決定するために開始された。この情報は、タグ一次抗体の検出にフルオロフォア又は酵素コンジュゲート抗タグ抗体を使用することによってもたらされるシグナル増幅の感度及び程度の理解に有用であった。抗タグ抗体を、0.5:1から8:1までモル比が増加する親水性スペーサーセグメントによって分離された4〜5個のタンデムペプチドエピトープタグを有する免疫グロブリン重鎖(IgH)のC末端がタグ化された抗体と共にインキュベートした。結合した複合体を、サイズ排除クロマトグラフィーを使用して未結合抗体から分離した。IgH当たり4タンデムペプチドエピトープタグを有する一次抗体では、1つのタグ抗体に対して6つの抗タグ抗体のモル比に達するまで、未結合の抗タグ抗体は観察されなかった。IgH当たり5つのV5エピトープタグを有する抗FoxP3抗体では、1つのタグ抗体に対して8つの抗タグ抗体のモル比に達するまで、未結合の抗V5抗体は観察されなかった。データは、少なくとも4つの抗タグ免疫グロブリン(IgG)がIgH当たり4つのペプチドエピトープタグ(全IgG当たり8つのタグ)を持つ各IgGと安定して結合しうることを示した。抗タグ抗体が、遊離及び非タンデムタグペプチドよりもタグ抗体に対して有意に高い親和性を有することを示す表面プラズモン共鳴(SPR)の結果と併せて、本研究は、ここに開示されたタグ一次抗体に見出されるペプチドエピトープタグ及びスペーサーの特異的タンデム配置が、立体障害のない複数の抗タグ抗体の強力な二価結合を媒介する空間コンフォメーションを採用することができるという有力な証拠を提供した。
技術の感度を推進する生化学的基礎並びにその制限を理解するためには、タグ抗体がどのように抗タグ抗体と相互作用したかを特徴付けることが重要であった。以前のSPR実験では、抗タグ抗体と遊離ペプチドとの間の結合よりも、抗タグ抗体とタグ抗体との間のより強い結合が示され、抗タグ抗体とタグ抗体との間の結合活性媒介結合を示唆している。しかしながら、これらの研究は、各タグ抗体に結合することができる抗タグ抗体の数を明らかにしておらず、よって、タグ抗体に結合する抗タグ抗体の結合価に関して決定的な解答を提供するには不十分であった。図32A〜32Dに示されるように、抗タグ抗体は迅速な結合動態でタグ抗体に結合し、解離は存在しないか又は機器で確実に測定するには余りに遅かった。そのような堅固な結合は、サイズ排除クロマトグラフィー(SEC)を遊離のタグ抗体又は遊離の抗タグ抗体からの安定なタグ及び抗タグ抗体複合体の分離に使用することを可能にした。この研究の目的は、SECにおいて結合し遊離抗体として溶出する更なる抗タグ抗体がなくなるまで、何倍過剰の抗タグ抗体が安定な複合体においてタグ抗体と結合できるかを決定することであった。抗タグ抗体とタグ抗体の間の結合の化学量論が、結合価の問題に更に明確に取り組むことができると考えられた。加えて、この情報は、抗タグ抗体が検出試薬として提供しうるシグナル増幅の程度についての洞察をもたらした。
[材料]
PBSに溶解させた次のペプチドエピトープタグ抗体を、Spring Bioscienceで作製しプロテインA樹脂により精製した(表17参照)。
*タグ構成中の文字は、Ig重鎖(H)又はκ軽鎖(K)を指し、文字の後の数字は重鎖又は軽鎖のC末端に融合されたタンデムタグリピートの数を指している。例えば、H4K0は、軽鎖上にタグを持たない重鎖上の4つのタンデムタグリピートを指す。
PBSに溶解した次の抗タグ抗体を、Spring Bioscienceで作製しプロテインA樹脂によって精製した(表18参照):
機器−AKTA Explorer FPLC(アセットタグXX,較正不要);Superose6 Increase 10/300 GLサイズ排除カラム;ハイブリダイゼーションオーブン(アセットタグXX,較正不要)。
抗タグ抗体を、約0.75X PBS及び約0.25X 反応バッファー(RB,P/N950−300)中のタグ抗体と共に約37℃で約30分間インキュベートした後、試料を添加した。反応混合物の容量は約0.1mLであり、試料全体を添加した。タグ抗体の濃度を約0.5μMで一定に保つ一方、抗タグ抗体の濃度を約0.25μMから約4μMまで変化させて、約0.5:1、約1:1、約2:1、約4:1、約6:1、そして必要な場合は約8:1のモル抗タグ対タグ抗体比を達成した。対照として、約0.75X PBS及び約0.25X RB中で約0.5μMの抗タグ又はタグ抗体を別々に調製し、約37℃で約30分間インキュベートし、添加した。Superose6カラムでの分画は周囲の室温で実施した。約210、約230、及び約280nmでのUV吸光度を使用してタンパク質溶出をモニターした。
統計的分析−この研究の遂行には統計的分析は必要ないと考えられた。
ペプチドエピトープタグ抗体を様々なモル比で抗タグ抗体と共にインキュベートして、それらの間の結合の化学量論を決定した。一般に、抗タグ抗体に対するタグ抗体のモル比が0.5:1から6:1に増加するにつれて、SEC溶出量が13.5から12mLの益々大きくなる抗体複合体が観察された(図34A〜34G)。4つのタンデムタグ及びスペーサーセグメントが各重鎖のC末端に融合された試験した全てのタグ及び抗タグ対(V5、E2、E、VSV−G、及びAU5)について、4:1以下の抗タグ:タグ抗体のモル比で遊離の抗タグ抗体は観察されなかった(図34A〜34F)。遊離の抗タグ抗体は6:1のモル比でのみ見えるようになった(図34A〜34F)。これらの結果は、安定な結合の最も高い化学量論は、ペプチドエピトープタグのアミノ酸配列にかかわらず、合計8つのペプチドタグ(重鎖当たり4つのタグ及びスペーサー)を含むタグ抗体当たり約4つの抗タグ抗体であったことを示す。抗タグ抗体とタグ抗体との間の相互作用が抗タグ抗体と遊離ペプチドタグとの間の相互作用よりも強いことを示すデータと併せて考えると(図32A〜32D参照)、これらの結果は、各抗タグ抗体が2つのペプチドタグを結合することによって二価の様式でタグ抗体と相互作用しうることを示唆した。
6:1のモル比の抗VSV−G対CD68−VSV−G及び抗AU5対CD8−AU5で、最も大きなタンパク質複合体に対応するピークの後ろに続く有意な量のより遅く溶出するピークが観察された(図34F及び34G)。これらのより遅く溶出するピークは、おそらく、タグ抗体当たり4つ未満の抗タグ抗体からなる複合体を表していた。これらのより小さい複合体がタグ抗体対抗タグ抗体の高い比率でのみ観察されたという事実は、タグ抗体と抗タグ抗体との間のより弱い一価相互作用を生じる限定された数のエピトープタグに対する抗タグ抗体間の競合と一致していた。
5つのタンデムタグ及びスペーサーを有するタグ抗体では、抗タグ抗体対タグ抗体のモル比が8:1に達するまで遊離の抗タグ抗体は観察されなかった(図34G)。加えて、
複合体が一つの主ピーク(E、E2、及びV5タグについては図34A〜34D)又は主ピークの後ろに続く幾つかの小ピーク(VSV−G及びAU5タグについては図34F及び34G)からなる抗タグ抗体とIgH当たり4つのタグを有するタグ抗体(H4K0)
との間の結合とは異なり、抗V5とIgH当たり5つのタグを有する抗FoxP3−V5(H5K0)との間の結合は、11.7mLで溶出した主要複合体よりも有意に大きい少なくとも2つの複合体を生じた(図34G)。8.5mLのピークは、Superose6 Increaseカラムの空隙容量に対応するので、一種を超えるタンパク質複合体を表していると考えられる。これらの結果は、抗V5とH5K0タグ抗FoxP3−V5抗体との間の最も安定な複合体は、タグ抗体当たり5〜6個の抗タグ抗体からなっていたが、更に大きな複合体でさえも形成でき得たことを示唆している。この特定の抗体クローンのその同族タグに対する親和性が全ての抗タグ抗体の中で最も高いため、V5タグ抗体と抗V5抗体クローンJ53_H1L2との間にのみ大きな複合体が形成されたことはありうる(図31A〜31E参照)。V5タグに対するJ53_H1L2の高親和性は、2つのV5タグ抗体の架橋又は安定な一価結合を媒介することができた。
この明細書において言及され、及び/又は出願データシートに列挙された全ての米国特許、米国特許出願公開、米国特許出願、外国特許、外国特許出願及び非特許刊行物は、その全体が出典明示によりここに援用される。実施態様の態様は、必要に応じて様々な特許、出願及び刊行物の概念を用いて別の更なる実施態様を提供するために、変更することができる。
ここの開示は、特定の実施態様を参照して説明されたが、これらの実施態様は、本開示の原理及び応用の単なる例示であることを理解されたい。従って、例示的な実施態様に対して多くの変更がなされうることと、添付の特許請求の範囲によって定まる本開示の精神及び範囲から逸脱することなく他の構成が案出されうることが理解される。
[主題の開示の分野]
本開示は、エピトープタグを含む抗体を提供する。
[産業上の利用性の記述]
本開示は、医学及び診断の分野において産業上の利用性を有している。