[一般的議論]
本発明者らは、小分子の離間した部分に同時に特異結合する、例えば抗体等の、結合パートナーを設計することができることを発見した。これは驚くべき発見である。何故なら、小分子はハプテンであり、ハプテンは、比較的小さな分子(分子量(ダルトン)約2,500未満、又は約2,000未満、又は約1,500未満、又は約1,000未満)であり、抗体が結合できる部位を2つ以上有するとは考えられていないからである。本明細書に記載される原理に従えば、少なくとも2つの異なる結合パートナーを調製でき、これらは小分子の離間した部分に同時に結合する。第1の結合パートナーは、小分子の第1部分に特異的であってこれに結合する。第2の結合パートナーは、小分子の第1部分以外の第2部分で小分子に結合し、第2の結合パートナーは、小分子又は小分子の誘導体ではないハプテンを含有する免疫原から調製され、ここで、この免疫原のハプテンは、小分子の第2部分のそれと構造的に類似した部位を含んでいる。
用語「小分子」は、例えば約150〜約2,500、又は約150〜約2,000、又は約150〜約1,500、又は約150〜約1,000、又は約150〜約500、又は約300〜約2,000、又は約300〜約1,500、又は約300〜約1,000、又は約500〜約2,000、又は約500〜約1,500、又は約500〜約1,000の分子量を有する分子を指す。ほとんどの場合、これらの小分子はそれ自体では免疫応答を誘発しない。
語句「小分子のための結合パートナー」とは、小分子に特異的に結合し、小分子の分析をゆがめ得る他の物質には何ら有意な程度には結合しない分子を指す。更に、小分子のための結合パートナーは、小分子の特定のドメインに特異的に結合する。特異的な結合は、2つの異なる分子又は小分子の2つの異なるドメインのうちの一方の、他の分子又は小分子の他のドメインの実質的により弱い認識と比較した場合の、他方に対する特異的な認識を伴う。一方、非特異的な結合は、特異的な表面構造とは比較的無関係である分子間の非共有結合を伴う。非特異的な結合は、分子間の疎水性の相互関係を始めとする幾つかの要因に起因し得る。結合パートナーは、例えば、モノクローナル抗体を始めとする抗体、類似した化学構造を有する分子の受容体、アルブミン等の血漿輸送タンパク質、及びリポタンパク質であってよいが、これらに限定されない。
語句「小分子に対する抗体」は、小分子に特異的に結合し、小分子の分析をゆがめ得る他の物質には何ら有意な程度には結合しない、抗体を指す。更に、小分子に対する抗体は、小分子の特定の部分又はドメインに特異的に結合する。
本明細書に記載される原理に従う実施例が適用され得る小分子は、空間的に離間された抗体のための結合ドメインを有する。小分子は直線状であってもよく、又は1つ以上の環、例えば2つの環、若しくは3つの環、若しくは4つの環、若しくは5つの環、若しくはそれ以上の環を含んでいてもよい。小分子上の結合ドメインは、2つの異なる結合パートナーが互いの結合に干渉することなく同時に小分子に結合して3員の複合体(又は免疫複合体)を形成できるように、離間されている必要があり、この際、各結合パートナーは2つの結合パートナーと小分子とを含有する十分に安定な複合体が形成されるのに必要な程度で結合する。複合体が、アッセイの間、完全なままであって、その複合体が検出可能であり且つ複合体の量が試料中の小分子被検体の量を正確に反映するとき、複合体は十分に安定であるとみなされる。この安定な複合体によって、小分子被検体のための正確且つ感度のよいアッセイが可能となる。
一部の実施例において、小分子は、例えば15−50員環、又は15−45員環、又は15−40員環、又は15−35員環、又は15−30員環、又は15−25員環、又は15−20員環、又は20−50員環、又は20−45員環、又は20−40員環、又は20−35員環、又は20−30員環、又は20−25員環、又は25−50員環、又は25−45員環、又は25−40員環、又は25−35員環、又は25−30員環、又は30−50員環、又は30−45員環、又は30−40員環である、少なくとも1つの大きな環を含有する。環形成原子は、主に炭素であり、これらに限定されないが、例えば酸素、窒素及び硫黄も含んでよい。この大きな環は、また、1−5個、又は1−4個、又は1−3個、又は1−2個、又は2−5個、又は2−4個、又は2−3個の、5−7員環又は5−6員環である小さな環を含んでいてもよい。この小さな環の原子の幾つかは前記大きな環の一部であってもよい。
一部の実施例では、小分子は、異なる結合パートナーの調製を可能とする1以上の独特の化学官能基を有する三次元立体配座を含み、この際、少なくとも2つの異なる結合パートナーが小分子上の異なる結合ドメインに対し互いに干渉することなく近づき結合することができる。この独特の化学官能基としては、これは例示であってこれらに限定されないが、例えば炭素−炭素二重結合、炭素−炭素三重結合、カルボニル基、イミン基、カルボキシ基、ヒドロキシ基、アミン基、アミド基、エステル基及びエーテル基並びにこれらの2つ以上の組み合わせが挙げられる。化学官能基は共役系であっても共役系でなくてもよい。用語「共役系の」は、電子が隣接原子に亘って非局在化し得るように利用可能なp軌道を有する隣接原子を指す。共役系原子の例としては、例えば、1つ、2つ、3つ、4つ、又は5つ、又はそれ以上の共役炭素−炭素二重結合(ビニル基);1つ、2つ、3つ、4つ、又は5つ、又はそれ以上の共役炭素−炭素三重結合;1つ、2つ、3つ、4つ、又は5つ、又はそれ以上の共役炭素−炭素二重結合、炭素−炭素三重結合、イミン基、カルボニル基及び陰イオンの組み合わせが挙げられる、これらに限定されない。一部の実施例では、これら化学官能基は、小分子に対して特定の空間配座を提供する。
一部の実施例では、小分子はマクロライドである。一部の実施例では、マクロライドは免疫抑制薬である。用語「免疫抑制薬」には、これらに限定されないが、イムノフィリン上で作用するものが含まれる。これらには、例えば(シクロスポリンA、シクロスポリンB、シクロスポリンC、シクロスポリンD、シクロスポリンE、シクロスポリンF、シクロスポリンG、シクロスポリンH、シクロスポリンIを始めとする)シクロスポリン、タクロリムス(FR−900506、FK506、PROGRAF(登録商標))、シロリムス(ラパマイシン、RAPAMUNE(登録商標))、並びに、これらに限定されないがエベロリムス(RAD、CERTICAN(登録商標))等の、上記のものの誘導体等が挙げられる。
上述したように、本明細書に記載される原理に従う一部の実施例は、約500〜約2,500の分子量を有する小分子のためのサンドイッチアッセイのために抗体を設計する方法に関する。本方法は、小分子の部分又はドメインに結合する第1の抗体を調製することと、第1の抗体が結合する部分又はドメイン以外の小分子の部分又はドメインにおいて小分子に結合する第2の抗体を調製することと、を含む。第2の抗体は、小分子でも小分子の誘導体でもないハプテンを含有する免疫原から調製され、前記ハプテンは小分子の第2部分のそれと構造的に類似した部位を含有する。
語句「構造的に類似した」とは、1つの部位が別の部位と同一の又は類似の構造的又は空間的特徴を有し、その結果、両部位が抗体に対して例えば少なくとも105L/mol、又は少なくとも106L/mol、又は少なくとも107L/mol、又は少なくとも108L/mol、又は少なくとも109L/molの結合親和性を示すことを意味する。一部の実施例では、抗体は、各部位に対して実質的に同じ結合親和性を示し、このことは、抗体に対する一方の部位の結合親和性が、他方の部位に対する結合親和性と、例えば103よりも大きく、又は102よりも大きく、又は10よりも大きくは異ならないということを意味する。
語句「小分子ではないハプテン」とは、小分子以外の又は小分子の誘導体以外の化合物を指す。語句「小分子の誘導体」とは、例えばエステル、アミド若しくはエーテルの形成により修飾され、又は例えばエステル、アミド若しくはエーテルの加水分解によって修飾された小分子を指す。小分子ではないハプテンは、第1の抗体が結合する小分子の部分以外の小分子の部分(第2部分)のそれと構造的に類似した部位を含有する。一部の実施例では、小分子はシロリムス又はエベロリムスであり、小分子ではない免疫原のハプテンは、これは、例示であって限定されないが、例えばタクロリムス又はタクロリムスの誘導体である。免疫原は、免疫原性キャリアに連結された小分子ではなく本明細書に記載される原理に従って抗体の調製に使用され得るハプテンを含有する。
小分子上で2つの異なるドメインに同時に結合するモノクローナル抗体を調製することによって、小分子が2つの異なる抗体によって同時に結合され免疫複合体を形成するサンドイッチアッセイにおいて、このような抗体を使用することが可能となる。小分子上でサンドイッチアッセイを実施できるこの能力によって小分子に対するアッセイの感度が向上する。また、支持体に結合された1つのモノクローナル抗体を伴うサンドイッチアッセイの場合には、アッセイは、試料の夾雑物及び干渉物質の存在下で行なわれてもよく、それは、小分子を支持体のモノクローナル抗体に結合させた後であるが第2のモノクローナル抗体を導入する前に、支持体を試料から分離して洗浄することができるためである。
抗体としては、完全な免疫グロブリン又はその断片を挙げてよく、この免疫グロブリンとしては、例えばIgA、IgD、IgE及びIgM等の種々の種類及びアイソタイプが挙げられる。その断片としては、例えば、Fab、Fv及びF(ab’)2、Fab’を挙げてよい。また、特定の分子に対する結合親和性が維持される限り、適切であれば、免疫グロブリン又はそれらの断片の凝集体、ポリマー及び接合体を用いることができる。
本明細書に記載される原理に従う抗体は、これらに限定されないが、例えば、宿主の免疫及び血清の回収(ポリクローナル)や、継代雑種細胞株を調製して分泌タンパク質を回収する(モノクローナル)技術、又は少なくとも、自然抗体の特異的な結合に必要とされる、アミノ酸配列をコードするヌクレオチド配列又はその変異誘発形態をクローニングして発現させる技術を始めとする技術によって調製されてよい。
モノクローナル抗体は、継代雑種細胞株を調製し分泌されたタンパク質を回収する技術(体細胞ハイブリダイゼーション技術)といった当技術分野で周知の技術によって調製することができる。モノクローナル抗体は、Kohler及びMilstein、Nature、265巻、495−497頁(1975年)の標準的な技術に従って作製され得る。モノクローナル抗体技術のレビューは、Lymphocyte hybridomas、Melchers他編、Springer−Verlag(ニューヨーク、1978年)、Nature、266巻、495頁(1977年)、Science、208巻、692頁(1980年)、及びMethods of Enzymology、73巻(Part B)、3−46頁(1981年)に記載されている。
抗体の調製のための別のアプローチでは、抗体結合部位をコードする配列を染色体DNAから切除してクローニングベクターに挿入することができ、このクローニングベクターを細菌中で発現させて、対応する抗体結合部位を有する遺伝子組み換えタンパク質を製造することができる。このアプローチは、少なくとも、天然の抗体の特異的な結合に必要とされる、アミノ酸配列をコードするヌクレオチド配列又はその変異誘発形態のクローニング及び発現を伴う。
モノクローナル抗体の作製のための1つのアプローチでは、第1工程は、本明細書に記載される原理に従う免疫原によるマウス、ラット、ヤギ、ヒツジ又はウシ等の抗体産生動物の免疫を含む。免疫は、完全フロイントアジュバント又はモノホスホリルリピドA及び合成トレハロースジコリノミコラートアジュバント等の他のアジュバントのようなアジュバントを用いて又は用いずに行なうことができる。次の工程は、抗体産生動物から膵臓細胞を単離し、この抗体産生膵臓細胞を、ポリエチレングリコールを使用し又は他の技術により、適切な融合パートナー、典型的にはミエローマ細胞、と融合することを含む。典型的には、使用されるミエローマ細胞は、ヒポキサンチン−チミジン(HT)培地中で正常に増殖するが、融合細胞の選択に使用されるヒポキサンチン−アミノプテリン−チミジン(HAT)培地中では増殖できない細胞である。次の工程は、典型的にはHAT培地中での選択による、融合細胞の選択を含む。次の工程は、酵素結合免疫吸着アッセイ(ELISA)又はスクリーニングに適した他のイムノアッセイ等のイムノアッセイを用いた適切な抗体産生のためのクローニングしたハイブリッドのスクリーニングを含む。
(本明細書に記載される原理に従って免疫原から調製された)必要とされる特異性を有する抗体は、これらは例示であって限定するものではないが、例えば、ELISA、ドットブロット、ウェスタン解析及び表面プラズモン共鳴をはじめとするスクリーニング技法によって選択され得る。このようにして、特定のアッセイにおいて、対象の小分子のドメインに結合し、その小分子の他のドメイン又は対象外の他の分子には何ら検出可能な程度にも結合しない抗体が得られる。本明細書に記載される原理に従う一部の実施例では、対象の小分子のドメインに結合する抗体は、例えば約107〜約1014L/mol、又は約107〜約1011L/mol、又は約107〜約1012L/mol、又は約108〜約1014L/mol、又は約108〜約1011L/mol、又は約108〜約1012L/molの、対象の小分子のドメインに対する結合親和性を有する。語句「何らの検出可能な程度にも」とは、対象の小分子のドメインに特異的に結合する抗体が対象の小分子の他のドメイン又は対象外の他の分子に対して、例えば約104L/mol未満、又は約103L/mol未満、又は約102L/mol未満、又は約10L/mol未満の結合親和性を有することを意味する。
用語「ハプテン」は、抗体を産生させるために免疫応答を誘発する大きな分子又は免疫原性キャリアに結合しない限り、免疫応答を誘発しない化合物を指す。ハプテンは、対応する抗体に特異的に結合可能であるが、それ自体は、抗体の調製のための免疫原(又は抗原)として作用しない化合物である。ハプテンは、約150〜約2,500の分子量を有する。
用語「免疫原性キャリア」とは、ハプテンに接合されて哺乳類に注入されるか又は他の態様で免疫原として利用される場合に、免疫応答を誘起してハプテンに結合する抗体の産生を誘発する基又は部位を意味する。免疫原性キャリアは、抗原性キャリアと呼ばれる場合もある。本明細書に記載される原理に従う一部の実施例では、特定の位置において小分子に連結されるポリ(アミノ酸)及び非ポリ(アミノ酸)免疫原性キャリアを始めとする免疫原性キャリアを含有する免疫原が合成され、本明細書に記載される原理に従う抗体を調製するために使用される。
免疫原性キャリアであるポリ(アミノ酸)のための分子量範囲(ダルトン)は、例えば、分子量約5,000〜約10,000,000、又は約20,000〜約600,000、又は約25,000〜約250,000である。ポリ(アミノ酸)免疫原性キャリアとしては、例えば、アルブミン、血清タンパク質、例えば、グロブリン、眼球水晶体タンパク質及びリポタンパク質等のタンパク質が挙げられる。タンパク質の例としては、これらに限られないが、例えばウシ血清アルブミン(BSA)、キーホールリンペットヘモシアニン(KLH)、卵オボアルブミン、及びウシガンマグロブリン(BGG)、サイログロブリン、オボアルブミン、又はフィブリノゲンが挙げられる。1つの実例においては、タンパク質はKLHである。他の実例では、タンパク質はBSAである。非ポリ(アミノ酸)免疫原性キャリアとしては、多糖、核酸及び(生物学的及び合成材料)粒子が挙げられる。種々の免疫原性キャリアが、Davalian他、米国特許第5,089,390号の第4欄57行〜第5欄5行に開示されている。これは、参照によって本明細書に組み込まれる
上述したように、免疫原性キャリアは、天然により又は合成により調製され、通常は単糖の繰り返し縮合を伴う、単糖の高分子量ポリマーである多糖であってもよい。多糖の例としては、デンプン、グリコーゲン、セルロース、アラビアゴム等の炭化水素ゴム、寒天等がある。多糖は、また、ポリ(アミノ酸)残基及び/又は脂質残基を含有してもよい。
上述したように、本明細書に記載される原理に従う一部の実施例においては、免疫原性キャリアは、前記小分子ではない免疫原の化合物に、該化合物上の予め定められた位置において、連結基を介して連結されてよい。一部の実施例では、連結基は、水素を数に入れないで約2〜約50個の原子又は4〜約30個の原子を含んでいてもよく、また、それぞれ独立して、通常、炭素、酸素、硫黄、窒素及びリンから成る群から選択される2〜約30個の原子又は3〜約20個の原子からなる鎖を含んでいてもよい。連結基の一部又は全部が、これらに限定されないが、例えばポリ(アミノ酸)上のアミノ酸残基等の、化合物に連結されている分子の一部であってよい。一部の実施例では連結基は、オキシム官能性を含有する。
連結基中のヘテロ原子の数は0〜約20、又は1〜約15、又は約2〜約10の範囲であってよい。連結基は脂肪族であっても芳香族であってもよい。ヘテロ原子が存在する場合、酸素は、通常、炭素、硫黄、窒素又はリンに結合したオキソ又はオキシとして存在し、窒素は、通常、炭素、酸素、硫黄又はリンに結合したニトロ、ニトロソ又はアミノとして、通常、存在し、硫黄は、酸素と同様であり、一方、リンは、通常、ホスホネート及びホスフェートモノ又はジエステルとして、炭素、硫黄、酸素又は窒素に結合している。接合される連結基と分子との間で共有結合を形成する際の共通の官能性は、アルキルアミン、アミジン、チオアミド、エーテル、尿素、チオ尿素、グアニジン、アゾ、チオエーテル、並びにカルボキシレート、スルホネート及びホスフェートエステル、アミド及びチオエステルである。ヘテロ原子を含有する連結基の特定の一実施形態は上述したようなオキシム官能性である。
大部分については、連結基が、例えば、窒素及び硫黄類縁体を始めとする非オキソカルボニル基、ホスフェート基、アミノ基や、ハロ又はトシルアルキル、オキシ(ヒドロキシル又は硫黄類縁体、メルカプト)、オキソカルボニル(例えば、アルデヒド又はケトン)又はビニルスルホン若しくはα,β−不飽和エステル等の活性オレフィン等のアルキル化剤のような、連結官能性(部位との反応のための官能性)を有する場合、これらの官能性は、アミン基、カルボキシル基、活性オレフィン、アルキル化剤、例えば、ブロモアセチルに連結される。アミンとカルボン酸若しくはその窒素誘導体又はリン酸とが連結される場合、アミド、アミジン及びホスホルアミドが形成される。メルカプタンと活性化オレフィンとが連結される場合、チオエーテルが形成される。メルカプタンとアルキル化剤とが連結される場合、チオエーテルが形成される。還元条件下でアルデヒドとアミンとが連結される場合、アルキルアミンが形成される。ケトン又はアルデヒドとヒドロキシルアミン(置換基がヒドロキシル基の水素と置換した誘導体を含む)とが連結される場合、オキシム官能性(=N−O−)が形成される。カルボン酸又はリン酸とアルコールとが連結される場合、エステルが形成される。種々の連結基が当技術分野において周知である。例えば、Cautrecasas、J.Biol.Chem.(1970年)245巻、3059頁を参照のこと。
[特定の例としてのシロリムス]
以下の特定の記載は、本発明の範囲の例示であってそれを限定するものではない。免疫抑制薬の選択、特にシロリムス、も、また、例示であって限定ではない。というのも、本発明は、小分子が、小分子以外の免疫原に対する抗体を産生し得る空間的に離間された領域を有し、こうして産生された抗体が、小分子のためのアッセイの間中、空間的に離間された領域に結合する限り、いかなる小分子の検出にも一般に適用されるからである。
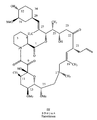
シロリムス分子(図1)の離間した部分に結合するモノクローナル抗体が調製されてよい。モノクローナル抗体が結合するこれらの離間した部分は、例えば、シロリムスの代謝物又は変性シロリムス等を用いた交差反応性の検討によって、決定されてよい。
図4を参照すると、これは例示であって限定されないが、シロリムス分子上の3つの可能な結合ドメインが、D1、D2及びD3として示されている。結合ドメインD1は、概ね、環原子15から環原子21までに延在し、環原子17から環原子22までにトリエン部位を含有する。結合ドメインD2は、概ね、原子11上のメチル基から原子39上のメトキシ基までに延在する。結合ドメインD3は、環原子25上のメチル基から原子41まで延在する。本明細書に記載される原理に従う一実施例では、シロリムス分子のD1に結合する第1の抗体が調製される。第1の抗体が結合する部分以外の小分子の部分−本実施例ではシロリムス分子のドメインD2又はドメインD3のいずれかであるが−でシロリムスに結合する第2の抗体が調製される。第2の抗体は、小分子又は小分子の誘導体ではないハプテンを含有する免疫原から調製される。この免疫原は、小分子の第2部分のそれと構造的に類似した部位を含有するハプテンを含有する。
上記の議論は、また、シロリムスとほぼ同様の構造をもつエベロリムスの検出にも当てはまる。
[シロリムスのサンドイッチアッセイのための抗体の調製]
これは、例示であって限定するものではないが、1つのアプローチでは、抗シロリムス抗体は、シロリムスを含有する免疫原から調製される。この抗シロリムス抗体は、例えば、以下に記載するようなスクリーニングアッセイによって判定できるように、シロリムスのドメイン領域D1に結合する。
一実施例では、これは例示であって限定するものではないが、ドメイン領域D1によって表されるシロリムスの部分に結合する第1のモノクローナル抗体が調製される。この第1のモノクローナル抗体は、後述する抗体産生方法における免疫原として、例えば化合物Va(R5がBSAである)を用いて調製されてよい(図6及び7参照)。
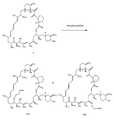
図6を参照すると、シロリムス(I)は、アミノオキシ酢酸と反応して、(C−26におけるオキシムの形成を表す)式IVaのオキシム及び(C−32におけるオキシムの形成を表す)IVbのオキシムの混合物を形成する。この反応は、例えばアルコール(例えば、メタノール又はエタノール)等の有機溶媒中、オキシム形成条件下で行なわれる。幾つかの実施例では、反応中の温度は、約10℃〜約30℃又は約15℃〜約25℃である。反応時間は、約1時間〜約30時間、又は約2時間〜約24時間である。免疫原の調製の次の工程において、化合物IVa及びIVbは分離されてもよく、或いは、化合物IVa及びIVbの混合物が利用されてもよい。IVa及びIVbの分離は、限定するものではないが、例えば、クロマトグラフィ(TLC、HPLC、RPLC、HTLC)及びガスクロマトグラフィによって行なわれてよい。
図7は、例示であって限定するものではないが、化合物IVaからの免疫原の形成を示している。ポリ(アミノ)酸免疫原性キャリア(R5前駆体)をIVaの化合物と組み合わせて式Vaの化合物を形成する。この反応は、pH約5.0〜約7.0、又は約5.5〜約6.5、又は約6の水性緩衝媒体中で行なわれる。Vaのカルボン酸官能基とR5前駆体のアミン基との反応を促進するための活性化剤又はカップリング剤を反応媒体中に含有させる。かかるカップリング剤としては、これらに限定されないが、1−エチル−3−(3−ジメチルアミノプロピル)−カルボジイミド(EDAC)、N−ヒドロキシスクシンイミド(NHS)若しくはΝ,Ν,Ν’,Ν’−テトラメチル−O−(N−スクシンイミジル)ウロニウムテトラフルオロボレート、又はこれらの2つ以上の組み合わせが挙げられる。この反応は、アミド形成条件下で行なわれる。一部の実施例では、反応媒体は、水性媒体であり、水単独であっても0.1〜約40体積パーセントの共溶媒を含んでいてもよい。共溶媒は、例えば、例えばアミン(例えばジメチルホルムアミド(DMF));アルコール(例えばエタノール);又はエーテル(例えばフラン)等の極性有機溶媒であってよい。一部の実施例では、反応中の温度は約15℃〜約25℃である。反応時間は、例えば約3時間〜約24時間、又は約4時間〜約20時間、又は約4時間〜約10時間である。一部の実施例では、これは例示であって限定するものではないが、R5前駆体は、例えばBSA又はKLH等の、タンパク質である。免疫原は、また、免疫原Vaの調製について上述したのと同様にして、化合物IVbから調製されてもよい。また、化合物IVa及びIVbの混合物を使用して免疫原の混合物を調製してもよい。
抗タクロリムス抗体は、タクロリムスとの結合のためだけでなくシロリムスとの交差反応のためにも、調製及び選択される。シロリムスのドメイン領域D1は、タクロリムス中には存在しないため、抗タクロリムス抗体は、抗シロリムス抗体が結合する部分以外のシロリムスの部分と結合する。抗タクロリムス抗体が結合するシロリムスの部分は、ドメイン領域D2であり、この領域D2は、タクロリムスのドメイン領域D2’と構造的に類似している。第2のモノクローナル抗体は、例えば、上述の方法において抗体調製のための免疫原として免疫原性キャリアに連結されたタクロリムスを用いて調製されてよい。三次元分析によってシロリムスの構造を試験することによって、領域D1及びD2の立体配座が明らかになる。
特定の実施例では、これは例示であって限定するものではないが、タクロリムスは、タクロリムス分子のC22位において、結合によって直接又は連結基の仲介を介して、免疫原性キャリアに連結される。特定の実施例では、これは例示であって限定するものではないが、C22位のケト基がアミンと反応してオキシムを生成する。アミンは、例えばカルボキシメトキシルアミンであってよいが、これに限定されない。
1つのアプローチでは、タクロリムスのカルボキシメトキシルアミンとの反応により、カルボキシメチルオキシムが生成する。この特定の実施例では、タクロリムスは、例えばメタノール、エタノール又はプロパノール等のアルコール性媒体中、例えば酢酸ナトリウム等の緩衝塩の存在下で、カルボキシメトキシルアミンと反応してカルボキシメチルオキシムを生じ得る。このオキシムは、高分子量タンパク質等の免疫原性キャリアに連結されていてよい。高分子量タンパク質は、例えば、ウシ血清アルブミン、サイログロブリン、オボアルブミン、フィブリノゲン又はキーホールリンペットヘモシアニンであってよいが、これらに限定されない。一実施例では、タンパク質はキーホールリンペットヘモシアニンである。
一実施例では、高分子量タンパク質とのタクロリムスの接合物の調製方法は、以下のとおりである。(1)上述したようにして、タクロリムスのカルボキシメチルオキシムを調製し、(2)このカルボキシメチルオキシムを活性化して反応性N−ヒドロキシスクシンイミドエステルを生成させ、(3)このN−ヒドロキシスクシンイミドエステルを高分子量タンパク質と反応させて接合物を生成させる。N−ヒドロキシスクシンイミドエステルを生成するためのカルボキシメチルオキシムの活性化は、例えば、例えば3−(3−ジメチルアミノプロピル 1−エチル−3−ジメチルアミノプロピル)カルボジイミド塩酸塩(EDAC)等の水溶性カルボジイミドのようなカップリング剤を用いることによって行なわれる。
タクロリムス及びシロリムスの双方に結合するモノクローナル抗体は、これは例示であって限定されないが、例えば以下のようなスクリーニング法によって、特定され得る。このアッセイは、β−ガラクトシダーゼに接合された抗体(抗体−β−ガラクトシダーゼ接合体)とCrO2磁性粒子の表面に被着されたシロリムス又はタクロリムスの類縁体とを利用した競合アッセイである。このアッセイは、Siemens社のDIMENSION(登録商標)臨床化学システム上で、タクロリムス又はシロリムスを含有する試料を用いて行なわれ得る。試料が反応容器に加えられる。抗体−β−ガラクトシダーゼ接合体試薬を反応容器に加え、試料と混合する。この工程により、タクロリムス又はシロリムスと抗体−β−ガラクトシダーゼ接合体とから成る複合体が形成される。次いで、タクロリムス又はシロリムス類縁体が被着されたCrO2粒子試薬を反応混合物に加える。シロリムスについて、CrO2粒子に被着するために使用される類縁体は、図6に示されるようなシロリムス−C26オキシム誘導体とシロリムス−C32オキシム誘導体との混合物である。タクロリムス検出のためには、使用される類縁体は、FK506−C32−スクシネート(米国特許第5,532,137号及び同第5,164,495号に記載されているように調製される。)であり、それらに関連する開示は、参照によって本明細書に組み込まれる。タクロリムス又はシロリムスの類縁体が被着されたCrO2粒子をインキュベートして、タクロリムス又はシロリムスに結合されていない余剰の抗体−β−ガラクトシダーゼ接合体を掃去させた後、CrO2粒子を容器中の反応混合物から磁気的に分離し、タクロリムス(又はシロリムス)/抗体−β−ガラクトシダーゼ接合体複合体を含有する上清の一部を、反応容器からクロロフェノールレッド−β−D−ガラクトピラノシド(CPRG)を含有する測光用キュベットに移す。CPRGからクロロフェノールレッド(CPR)への変換率を、577及び700nmにおいて二色測定する。この変換率は、試料におけるタクロリムス又はシロリムスの濃度に比例する。アッセイによって得られたタクロリムス又はシロリムスの濃度に基づき、タクロリムス及びシロリムスの双方に対して十分な結合親和性を示すように抗体を選択する。
図5から分かるように、タクロリムスのドメイン領域D2’は、シロリムスのドメイン領域D2と構造的に類似している。タクロリムスは、化合物がシロリムス又はシロリムスの誘導体ではないがシロリムスのドメイン領域D2のそれと構造的に類似した部位(タクロリムスのドメイン領域D2’)を有する場合に、免疫原を形成するために免疫原性キャリアに連結される化合物として利用されてよい。
シロリムスにも結合する抗タクロリムス抗体を得るためのスクリーニングアッセイでは、シロリムスとの高い交差反応性を有する1以上の抗体を特定するためのイムノアッセイにおいて、タクロリムスを含有する免疫原を使用した抗体調製物がスクリーニングされる。このアプローチは、免疫原において使用される分子以外の分子との交差反応性がほとんど又は全くない抗体が選択される抗体選択のためのアプローチとは対照的である。
上述したように、シロリムス及びタクロリムスは、例示として、使用される。上記のアプローチは、小分子のためのサンドイッチアッセイを行なうための第1及び第2の抗体を調製するために、他の小分子に適用されてもよい。競合アッセイフォーマットにおけるアッセイ抗体が小分子の独自のエピトープ又はドメインに結合し、その小分子が別のハプテンとドメインを共有するか別のハプテンにおけるドメインと構造的に類似しているドメインを含有するならば、このようなハプテンを使用して小分子被検体と交差反応する抗体を生成することができる。このようにして、小分子の離間したドメイン領域に結合する2つの抗体を調製して小分子のためのサンドイッチアッセイに使用することができる。
[小分子のためのアッセイの概要]
上述したように、本明細書に記載される原理に従う実施例により、小分子を含有することが疑われる試料中の小分子を判定するためのサンドイッチアッセイが可能となる。以下の説明において、免疫抑制薬は、本明細書で定義される小分子の一例として、これは例示であって限定されるものではないが、使用される。サンドイッチアッセイにおいて、2つのモノクローナル抗体が利用され、そのそれぞれが免疫抑制薬分子の離間した領域に同時に結合して免疫複合体を形成する。免疫複合体を検出することにより試料中における免疫抑制薬の判定が可能となる。
試験される試料は、通常、生物学的試料である。語句「生物学的試料」は、例えば、体液、身体組織、身体化合物及び培養培地等のあらゆる生物学的材料を指す。試料は、あらゆる供給源からの固体、半固体又は流体(液体又は気体)であってよい。一部の実施形態では、試料は、身体排泄物、身体吸引物(aspirant)、身体切除物(excisant)又は身体抽出物(extractant)であってよい。身体は、通常、哺乳類のものであり、及び一部の実施形態では身体はヒトの身体である。身体排泄物は、例えば、尿、糞便、大便、膣粘液、精液、涙、息、汗、水ほう液及び炎症性浸出液等の、身体から排泄される物質である(が、それらは、また、切除物(excision)又は抽出物(extraction)によって得られてもよい)。身体切除物(excisants)は、例えば、皮膚、毛髪、並びに臓器及び他の身体部分からのバイオプシーを始めとする組織試料等の身体から切除された物質である。身体吸引物(aspirants)は、例えば、粘膜、唾液及び痰等の身体から吸引された物質である。身体抽出物(extractants)は、例えば全血、血漿、血清、髄液、脳脊髄液、リンパ液、滑液及び腹水等の身体から抜き取られた物質である。一部の実施例では、試料は全血、血漿又は血清である。
アッセイに先立って又はアッセイ中の幾つかの瞬間において、細胞を溶解し及び/又は内在性の(endogeneous)結合物質から免疫抑制薬を放出するために、試料を1以上の前処理に供してもよい。細胞の溶解は、溶血剤を使用することによって達成されてもよい。溶血剤は、赤血球の膜の一体性を崩壊させることによって、その細胞の細胞内内容物を放出させる化合物又は化合物の混合物である。溶血剤としては、これらに限定されないが、例えば、非イオン性界面活性剤、アニオン性界面活性剤、両性界面活性剤、低イオン強度水溶液(低張液)、細菌剤及び補体依存性溶解を引き起こす抗体が挙げられる。
溶血剤として利用し得る非イオン性界面活性剤としては、合成界面活性剤及び天然界面活性剤の両方が挙げられる。合成界面活性剤の例としては、TRITON(商標)X−100、TRITON(商標)N−101、TRITON(商標)X−114、TRITON(商標)X−405、TRITON(商標)SP−135、TWEEN(登録商標)20(ポリオキシエチレン(20)ソルビタンモノラウレート)、TWEEN(登録商標)80(ポリオキシエチレン(20)ソルビタンモノオレエート)、DOWFAX(登録商標)、ZONYL(登録商標)、ペンタエリスリチルパルミテート、ADOGEN(登録商標)464、ALKANOL(登録商標)6112界面活性剤、アリルアルコール1,2−ブトキシレート−ブロック−エトキシレートHLB6、BRIJ(登録商標)、エチレンジアミンテトラキス(エトキシレート−ブロック−プロポキシレート)テトロール、IGEPAL(登録商標)、MERPOL(登録商標)、ポリ(エチレングリコール)、2−[エチル[(ヘプタデカフルオロオクチル)−スルホニル]アミノ]エチルエーテル、ポリエチレン−ブロック−ポリ(エチレングリコール)、ポリオキシエチレンソルビタンテトラオレエート、ポリオキシエチレンソルビトールヘキサオレエート、TERGITOL(登録商標)NP−9、GAFAC(登録商標)(RHODAFAC(登録商標)、例えば、α−ドデシル−ω−ヒドロキシポリ(オキシ−1,2−エタンジイル)ホスフェート)等のアルキルポリオキシエチレングリコールホスフェートエステル、及びEP110(登録商標)等が挙げられる。溶血剤として利用し得る天然の界面活性剤としては、例えば、サポニン、ナトリウム又はカリウム中和脂肪酸、中和リン脂質、ジアシルグリセロール、中和ホスファチジルセリン、ホスファチデート、中和ホスファチジルエタノールアミン、ホスファチジルコリン、ホスファチジルイノシトール、ホスファチジルコリン、胆汁酸塩、非エステル化コレステロール、中和スフィンゴシン、セラミド等が挙げられる。1以上の合成界面活性剤又は1以上の天然界面活性剤の組み合わせ、及び合成界面活性剤と天然界面活性剤との組み合わせも利用し得る。
利用される溶血剤の性質及び量又は濃度は、例えば、試料の性質、免疫抑制薬の性質、その他の試薬成分の性質及び反応条件のうちの1つ以上に依存する。溶血剤の量は、少なくとも赤血球の溶解を生じさせて細胞の内容物を放出するのに十分な量である。一部の実施例では、溶血剤の量は例えば約0.0001%〜約0.5%、約0.001%〜約0.4%、約0.01%〜約0.3%、約0.01%〜約0.2%、約0.1%〜約0.3%、約0.2%〜約0.5%、又は約0.1%〜約0.2%(パーセントは重量/体積)である。
放出剤は、内在性の結合部位から免疫抑制薬を除去置換する化合物又は化合物の混合物である。放出剤は、内在性の結合部位から免疫抑制薬の代謝物を除去置換することができ、また多くの場合、除去置換する。多くの実施例において、放出剤は、内在性の結合タンパク質に対して高い結合親和性を有し、その結果、放出剤は、内在性の結合タンパク質から免疫抑制薬、及び所望される場合にはその代謝物、を容易に除去置換する。加えて、放出剤は、アッセイに使用される薬物のためのモノクローナル抗体には、なんら有意な程度にまでは結合しない。語句「何ら有意な程度にまで結合しない」は、その結合の程度が、薬物についての正確なアッセイが行なわれ得る程度に十分に低くなければならないということを意図している。従って、放出剤は、アッセイ抗体に対して有意に結合することなく所望の除去置換結果を達成するいずれの部位であっても、単一の化合物又は化合物の混合物のいずれであってもよい。
一部の実施例では、放出剤は、構造的類縁体を始めとする免疫抑制薬の類縁体である。免疫抑制薬類縁体は、結合タンパク質から類縁の免疫抑制薬を除去置換することができるが、その免疫抑制薬のモノクローナル抗体については、何ら実質的な程度にまでは競合しない、修飾された薬物である。修飾によって、免疫抑制薬類縁体を別の分子に結合させるための手段がもたらされる。一実施例では、免疫抑制薬類縁体は、例えば、連結基を介して別の分子に接合された免疫抑制薬であってよい。ヒドロキシ又はカルボン酸官能性を含有する免疫抑制薬については、放出剤は、検出すべき免疫抑制薬に対するよりも内在性の結合タンパク質に対して高い結合親和性を有し且つ免疫抑制薬のための抗体に対して有意な結合親和性を有さない、免疫抑制薬のエステルであってよい。例えばタクロリムスの判定においては、上記の要件を満たす限り、放出剤としてタクロリムスのエステルを利用してよい。構造的類縁体は、免疫抑制薬と同一の又は同様の構造的又は空間的特徴を有する部位であり、免疫抑制薬の類縁体と同じ又は同様の結果をもたらす。構造的類縁体は、例えば免疫抑制薬に関連する別の化合物であってよい。例えば、タクロリムスの判定においては、シロリムスのエステルを放出剤として採用してよい。エステルは、例えば、カルバメート、カーボネート、C1〜C6カルボン酸のエステル等であってよい。例えば米国特許第7,186,518号参照のこと。この特許の関連する開示が参照によって本明細書に組み込まれる。放出剤の他の例としては、シクロスポリンAのための[Thr2、Leu5、D−Hiv8、Leu10]−シクロスポリンA、シロリムスのためのFK506、FK506のためのシロリムス等が挙げられる。例えば米国特許第6,187,547号参照のこと。この特許の関連する開示が参照によって本明細書に組み込まれる。
媒体中の放出剤の濃度は、内在性の結合部位から免疫抑制薬そして幾つかの場合には免疫抑制薬の代謝物を除去置換して、薬物及び代謝物を上述したような薬物のための抗体にアクセス可能として結合するという所望の結果を達成するのに十分な濃度である。利用される放出剤の量又は濃度は、例えば、試料の性質、免疫抑制薬の性質、薬物代謝物の性質、他の試薬成分の性質及び反応条件のうちの1つ以上に依存する。一部の実施形態では、放出剤の量は、約0.000001%〜約0.5%、約0.0001%〜約0.4%、約0.001%〜約0.3%、約0.01%〜約0.2%、約0.1%〜約0.3%、約0.2%〜約0.5%、約0.1%〜約0.2%等(パーセントは重量/体積)である。
アッセイはイムノアッセイであり、アッセイ成分の又は産生物のうちのいずれかの分離なしで(均一系)又は分離を伴って(不均一系)行なわれてよい。均一系又は不均一系のアッセイは、中庸のpH、一般には最適なアッセイ感度を提供するpHの水性緩衝媒体中で行なわれる。水性媒体は、水単独であっても又は0.1〜約40体積%の共溶媒を含んでいてもよい。媒体のpHは、通常、約4〜約11の範囲、又は約5〜約10の範囲、又は約6.5〜約9.5の範囲となる。pHは、通常、モノクローナル抗体と免疫抑制薬との最適な結合と、例えばシグナル生成系の構成要素等の、アッセイの他の試薬のために最適なpHとの間での妥協点となる。
所望のpHを達成し、判定の間、そのpHを維持するために種々の緩衝剤を使用してよい。緩衝剤の例としては、ホウ酸塩、リン酸塩、カルボン酸塩、トリス、バルビタール等が挙げられる。利用される具体的な緩衝剤は、本発明のためには重要ではないが、個々のアッセイにおいて個別の緩衝剤が好ましいこともある。上記の方法においては、種々の補助的な物質を利用してよい。例えば、緩衝剤に加えて、媒体は、媒体のための、そして利用される試薬のための、安定剤を含んでいてもよい。多くの場合は、これらの添加剤に加えて、例えば、アルブミン等のタンパク質;ホルムアミド等の有機溶媒;第四級アンモニウム塩;硫酸デキストラン等のポリアニオン;界面活性剤、特に非イオン性界面活性剤;結合増強剤、例えばポリアルキレングリコールが含まれ得る。
1以上のインキュベーション期間を、上述した種々の試薬の添加の間の任意の間隔を始めとする1種以上の間隔をあけて、媒体に適用してよい。媒体は、通常、試薬の種々の構成成分の結合が起こるのに十分な温度で十分な時間に亘り、インキュベートされる。本方法を行なうために、通常、中庸の温度、そして普通は測定の期間中、一定の温度、好ましくは室温、が採用される。インキュベーション温度は、約5℃〜約99℃、又は約15℃〜約70℃、又は約20℃〜約45℃の範囲である。インキュベーションの期間は、約0.2秒〜約6時間、又は約2秒〜約1時間、又は約1〜約5分、の範囲である。この期間は、媒体の温度と種々の試薬の結合速度とに依存するが、この結合速度は、会合速度定数、濃度、結合定数及び解離速度定数によって決まる。測定中の温度は、約10℃〜約50℃、又は約15℃〜約40℃の範囲である。
検定され得る免疫抑制薬被検体の濃度は、一般に、約10−5〜約10−17M、又は約10−6〜約10−14Mで変動する。通常は、そのアッセイが(試料中に存在する被検体の量に対して)定性的、半定量的又は定量的のいずれであるか、特定の検出技術及び被検体の濃度等を検討することによって、種々の試薬の濃度が決定される。
アッセイ媒体中の種々の試薬の濃度は、一般に、免疫抑制薬被検体の対象濃度範囲によって決定されることになる。しかしながら、各試薬の終濃度は、通常、上記範囲に亘りアッセイの感度を最適化するように経験的に決定される。即ち、有意な被検体の濃度変化によって、正確に測定可能なシグナル差が生じなければならない。シグナル生成系の性質及び免疫抑制剤被検体の性質等を検討することによって、通常、種々の試薬の濃度が決まる。
添加の順序は広く変更されてよいが、アッセイの性質に応じて特定の優先順位が存在するであろう。添加の最も単純な順序は、均一系アッセイの場合のように、全ての材料を同時に添加して、アッセイ媒体がシグナルに与える影響を判定することである。或いは、試薬を順番に組み合わせることもできる。所望により、上述したような各添加の後に、インキュベーション工程を行なってよい。
上記で議論したアッセイにおいて、1以上の標識を利用してもよく、ここで、この標識は、通常、シグナル生成系(「sps」)の一部である。標識の性質は、具体的なアッセイフォーマットによって決まる。spsは、通常、1以上の構成成分を包含し、そのうち少なくとも1つの構成成分が検出可能標識であり、その標識が、結合された及び/又は結合されていない標識の量、即ち、検出すべき免疫抑制薬又は検出すべき免疫抑制薬の量を反映する試薬に結合され又は結合されていない標識の量、に関係する検出可能な信号を生成する。標識は、信号を生成し又は生成するように誘導され得る任意の分子であり、例えば、蛍光体、放射標識、酵素、化学発光体又は光増感剤であってよい。従って、信号は、場合によっては、酵素活性、発光、光吸収又は放射能を検出することによって検出及び/又は測定される。
好適な標識としては、これらは例示であって限定されないが、β−ガラクトシダーゼ、アルカリホスファターゼ、グルコース−6−ホスフェートデヒドロゲナーゼ(「G6PDH」)及び西洋ワサビペルオキシダーゼ等の酵素;リボザイム;QBレプリカーゼ等のレプリカーゼ用基剤;プロモータ;染料;フルオレセイン、イソチオシアネート、ローダミン化合物、フィコエリトリン、フィコシアニン、アロフィコシアニン、o−フタルデヒド及びフルオレサミン等の蛍光体;量子ドットとして知られる半導体ナノ結晶中に存在するCdSe及びZnSから調製されるもののような複合体;イソルミノール等の化学発光体;増感剤;補酵素;酵素基剤;125I、131I、14C、3H、57Co及び75Se等の放射性標識;ラテックス粒子、炭素粒子、例えばクロム粒子等の金属粒子等の磁性粒子等の粒子;金属ゾル;微結晶;リポソーム;細胞等が挙げられる。これらは染料、触媒又は他の検出可能な基で更に標識されてもよい。好適な酵素及び補酵素は、Litman他、米国特許第4,275,149号、第19−28欄、及びBoguslaski他、米国特許第4,318,980号、第10−14欄に開示されている。また、好適な蛍光体及び化学発光体は、Litman他、米国特許第4,275,149号、第30及び31欄に開示されている。これらは参照によって本明細書に組み込まれる。
標識は、直接信号を生成することができ、従って、信号を生成するために追加の構成成分は必要ない。数多くの有機分子、例えば蛍光体、は紫外線及び可視光線を吸収することができ、その際、その光吸収によってエネルギーがこれらの分子に移動して、それらを励起エネルギー状態へと励起させる。こうして吸収されたエネルギーは、第2波長における発光によって散逸される。直接信号を生成するその他の標識としては、放射性アイソトープ及び染料が挙げられる。
或いは、標識は信号を生成するために他の構成成分を必要とし、その場合、シグナル生成系は、測定可能な信号を生成するために必要とされる全ての構成成分を含む。このような他の構成成分としては、基剤、補酵素、増強剤、追加の酵素、酵素生成物と反応する物質、触媒、活性剤、補助因子、阻害剤、捕捉剤、金属イオン、及び信号生成物質の結合に必要な特異的結合物質を挙げてよい。好適なシグナル生成系の詳細な議論は、参照により本明細書に組み込まれる、Ullman他、米国特許第5,185,243号、第11−13欄に見ることができる。
標識若しくは他のsps構成要素、又は1以上のモノクローナル抗体が支持体に結合され得る。モノクローナル抗体は、その結合が免疫抑制薬の領域と結合する能力を実質的に妨げないことを唯一の条件として、当該技術分野において既知のいずれかの態様で固体支持体に結合されてよい。一部の実施例では、標識若しくは他のsps構成要素又はモノクローナル抗体は、固相に被着されるか若しくは直接共有結合されていてもよく、又は血清アルブミン若しくは免疫グロブリン等のタンパク質を始めとするポリ(アミノ酸)、又は例えばデキストラン若しくはデキストラン誘導体等の多糖(炭化水素)等の1以上のキャリア分子の層を有してもよい。また、固体支持体と連結すべき部位とを共有結合で連結するために連結基を使用してもよい。連結基は、免疫原の免疫抑制薬分子への連結のための上述したようなものであってよい。支持体への結合の他の方法もまた利用されてよい。例えば、固体支持体は、例えばアビジン又は抗体等の小分子のための結合剤のコーティングを有していてもよく、この場合、例えばビオチン又はハプテン等の小分子が、連結すべき部位に結合されてもよく、又はその逆でもよい。構成成分の支持体の表面への結合は直接であっても又は間接的であってもよく、共有結合でも非共有結合でもよく、文献において一般に利用可能である周知の技術によって達成され得る。例えば、「Immobilized Enzymes(固定化酵素)」Ichiro Chibata、Halsted Press、ニューヨーク(1978年)及びCautrecasas、I Biol.Chem.245巻、3059頁(1970年)参照のこと。
支持体は、有機又は無機の、固体又は流体の、透明又は部分的に透明であってよい水不溶性材料で構成されてよい。支持体は、例えば、ビーズ等の粒子、フィルム、膜、管、ウェル、ストリップ、棒、例えば板等の平面、及びデンドリマー(DENDRIMERS)のような、様々な形状を有することができる。アッセイの種類によって、支持体は利用される媒体中に懸濁されていてもいなくてもよい。これは例示であって限定されるものではないが、懸濁可能な支持体の例として、例えばラテックス等の高分子材料、脂質二重層又はリポソーム、油滴、細胞、及びヒドロゲル、並びに磁性粒子がある。他の支持体組成物としては、例えばニトロセルロース、酢酸セルロース、ポリ(塩化ビニル)、ポリアクリルアミド、ポリアクリレート、ポリエチレン、ポリプロピレン、ポリ(4−メチルブテン)、ポリスチレン、ポリメタクリレート、ポリ(エチレンテレフタレート)、ナイロン、ポリ(酪酸ビニル)等のポリマーが挙げられ、それらはそれ自体で又は他の材料と接合させて用いられる。
支持体は粒子であってよい。粒子は、約0.02ミクロン以上、約100ミクロン以下の平均直径を有するべきである。一部の実施形態では、粒子は、約0.05ミクロン〜約20ミクロン、又は約0.3ミクロン〜約10ミクロンの平均直径を有する。粒子は、有機又は無機の、膨潤性又は非膨潤性の、多孔質又は非多孔質であり、好ましくは水に近い密度、一般には約0.7g/mL〜約1.5g/mLの密度、を有し、且つ透明、部分的に透明、又は不透明であり得る材料で構成される。粒子は、例えば細胞並びに微生物、例えば赤血球、白血球、リンパ球、雑種細胞、連鎖球菌、黄色ブドウ球菌、及び大腸菌、ウィルス等の生物学的材料であり得る。粒子は、また、有機及び無機ポリマー、リポソーム、ラテックス粒子、磁性又は非磁性粒子、リン脂質小胞、カイロミクロン、リポタンパク質等から構成される粒子であってもよい。一部の実施例では、粒子はクローム粒子又はラテックス粒子である。
ポリマー粒子は、付加ポリマー又は縮合ポリマーから形成されてもよい。このような粒子は、水性媒体に容易に分散可能となり、また、吸着性であることができ、又は免疫抑制薬のためのモノクローナル抗体に対する直接若しくは連結基を介した間接的な接合を可能とするように官能化することが可能である。連結基は、免疫抑制薬分子に対する免疫原の連結のために上述したようなものであってよい。粒子は、また、天然の材料、合成的に修飾された天然の材料及び合成材料から誘導されてもよい。多糖、特に、セファロースとして入手可能なアガロース、セファデックス及びセファクリルとして入手可能なデキストラン、セルロース、デンプン等のような架橋された多糖;ポリスチレン、ポリビニルアルコール、アクリレート及びメタクリレートの誘導体、特にフリーのヒドロキシル官能性を有するエステル及びアミド、のホモポリマー及びコポリマー等の付加ポリマー等が、特に興味深い有機ポリマーとして挙げられる。
標識及び/又は他のsps構成要素は、2つの異なるモノクローナル抗体の一方又は両方に結合され得る。標識のsbp構成要素への結合は、標識の水素原子のモノクローナル抗体に対する結合による置換をもたらす化学反応によって達成されてよく、又は標識とモノクローナル抗体との間の連結基を含んでいてもよい。連結基は、免疫抑制薬分子に対する免疫原の連結のために上述したようなものであってよい。他のsps構成要素も、また、モノクローナル抗体に共有結合されていてよい。例えば、蛍光体及び消光剤のような2つのsps構成要素が、それぞれ、モノクローナル抗体に結合されてよく、この際、蛍光体が一方のモノクローナル抗体に結合し、消光剤が他方のモノクローナル抗体に結合する。2つの異なるモノクローナル抗体が免疫抑制薬に結合する場合、サンドイッチ複合体の形成によって蛍光体及び消光剤が接近させられ、これによって消光剤が蛍光体と相互作用して信号を生成する。接合方法は当該技術分野で周知である。例えば、Rubenstein他、米国特許第3,817,837号を参照のこと。この特許は、参照によって本明細書に組み込まれる。
標識タンパク質として特に興味深い酵素は、酸化還元酵素、特に、グルコース−6−ホスフェートデヒドロゲナーゼ、ラクテートデヒドロゲナーゼ等の脱水素酵素並びに過酸化水素の生成及びその過酸化水素を使用する染料前駆体の染料への酸化に関わる酵素である。具体的な組み合わせとしては、過酸化水素を利用して染料前駆体を酸化する酵素、即ち、西洋ワサビペルオキシダーゼ、ラクトペルオキシダーゼ、又はミクロペルオキシダーゼ等の過酸化酵素、と連結された、糖質酸化酵素、例えばグルコース及びガラクトースオキシダーゼ、又はウリカーゼ及びキサンチンオキシダーゼ等の複素環酸化酵素が挙げられるがこれらに限定されない。更なる酵素組み合わせが当該技術分野で既知である。標識として単一の酵素を使用する場合、加水分解酵素、転移酵素及び酸化還元酵素等の他の酵素、好ましくはアルカリホスファターゼ及びベータガラクトシダーゼ等の加水分解酵素、が用いられてもよい。或いは、ホタルルシフェラーゼ及び細菌ルシフェラーゼ等の発光酵素を使用してもよい。
用いられる補酵素の例としては、NAD[H]、NADP[H]、リン酸ピリドキサール、FAD[H]、FMN[H]等が挙げられ、通常、補酵素は環化反応に関わる。例えば、米国特許第4,318,980号を参照のこと。この特許は、参照によって本明細書に組み込まれる。
シグナル生成系の活性化はシグナル生成系構成要素の性質に依存する。光によって活性化されるこれらのシグナル生成系の構成要素については、その構成要素に光を照射する。粒子の表面に存在するシグナル生成系の構成要素については、塩基の添加が活性化をもたらし得る。他の活性化法は、本明細書における開示を考慮すると、当業者に示唆されるであろう。放射性標識、酵素などの標識に関連する系のような幾つかのシグナル生成系については、活性化のための剤は必要ではない。酵素系については、基剤及び/又は共因子の添加が必要となる場合がある。
信号の存在及び量の試験は、また、一般には単に信号を読み取る工程である、信号の検出も包含する。信号は、通常、機器を使用して読み取られるが、機器の性質は、信号の性質に依存する。機器は、分光光度計、蛍光光度計、吸光光度計、ルミノメータ、化学ルミノメータ、感度計、写真機器等であってよい。検出される信号の存在及び量は、試料中に存在するシロリムス化合物の存在及び量に関連付けられる。測定中の温度は、約10〜約70℃、又は約20〜約45℃、又は約20〜約25℃の範囲であってよい。1つのアプローチでは、既知の濃度のスクリーニングすべき被検体を用いて標準曲線が形成される。上述したように、標準物質及び他の対照物質を使用してもよい。
語句「免疫抑制薬の量を測定すること」とは、免疫抑制薬の定量的、半定量的及び定性的判定を言う。定量的、半定量的及び定性的な方法並びに免疫抑制薬を判定するための他の全ての方法は、免疫抑制薬の量を測定する方法とみなされる。例えば、単にその免疫抑制薬を含有することが疑われる試料における免疫抑制薬の存非を検出する方法は、本開示の範囲内に含まれるものとみなされる。用語「検出すること」及び「判定すること」とは、測定することの他の一般の同義語とともに、本開示の範囲内に含まれることが企図されている。
本明細書に記載される原理に従う一実施例では、免疫抑制薬の領域に特異的なモノクローナル抗体のうちの一方を支持体に結合させ、前記一方のモノクローナル抗体が結合する免疫抑制薬の範囲から空間的に離間された、免疫抑制薬の領域に特異的なモノクローナル抗体の他方を、例えば標識等のsps構成要素に結合させる。免疫抑制薬を含有することが疑われる試料を好適な媒体中で2つの接合モノクローナル抗体と組み合わせて、その媒体をインキュベートする。その後、2つの異なるモノクローナル抗体と試料からの免疫抑制薬とによって形成される免疫複合体の存在及び量のうちの1つ又は両方について、媒体を試験する。支持体は試験に先立って媒体から分離されても分離されなくてもよい。媒体中又は支持体上の標識の存在及び/又は量を判定することによって、免疫複合体の存在及び/又は量が判定される。
特定の一実施例では、捕捉アッセイが利用される。このアッセイフォーマットでは、一方のモノクローナル抗体を、例えばクローム(二酸化クロム)粒子等の磁性粒子に共有結合させる。試料をこれらの粒子とともにインキュベートして、試料中の免疫抑制薬を磁性粒子上の前記モノクローナル抗体に結合させる。その後、例えばβ−ガラクトシダーゼ等の酵素に接合された第2のモノクローナル抗体を磁性粒子とともにインキュベートする。磁力を適用し磁性粒子を洗浄した後、磁性粒子に結合された酵素の量を測定し、試料中の免疫抑制薬の存在及び/又は量に直接関連付ける。このアプローチでは、レポーター酵素の基剤を最終反応容器に加えて、酵素活性を分光光度計により経時的な吸光度の変化として測定する。
代替のアプローチでは、磁性粒子試薬を過剰量で、即ち試料中に存在すると思われる免疫抑制薬の全てと結合するのに必要な量よりも多い量で、加える。その後、磁力を適用して磁性粒子を媒体から分離し、磁性粒子を洗浄し、アッセイ媒体中に再懸濁させる。第2のモノクローナル抗体に接合された酵素を加えて、媒体をインキュベートした後、上述したように信号を判定する。
別の実施例では、これは例示であって限定されるものではないが、粒子中に組み込む又は粒子に付着させるなどによってその粒子に結合された化学発光化合物を含有する化学発光粒子が利用される。免疫抑制薬のためのモノクローナル抗体の一方を、粒子に被着された多糖を介するなどして前記粒子に結合する。免疫抑制薬に結合する他方のモノクローナル抗体はビオチン接合体の一部とする。光増感剤が結合された粒子の第2のセットにストレプトアビジンを接合する。上記化学発光粒子を免疫抑制薬を含有することが疑われる試料及び上記光増感剤粒子と混合する。反応媒体をインキュベートし、モノクローナル抗体の免疫抑制薬への結合によって、それらの粒子を免疫抑制薬に結合させる。その後、媒体に光照射して光増感剤を励起させるが、光増感剤はその励起状態において酸素を一重項状態に活性化させることができる。粒子のセットのうちの一方の化学発光化合物は、このとき、免疫抑制薬の存在によって光増感剤に近接しているため、一重項酸素によって活性化されて発光する。次いで、この媒体を輝度又は発光の存在及び/又は量について試験し、その存在は試料中における免疫抑制薬の存在及び/又は量に関連付けられる。
[アッセイを実施するためのキット]
特定のアッセイを行なうための試薬は、例えば免疫抑制薬被検体等の小分子の判定のためのアッセイを簡便に行なうために有用なキット中に存在してよい。一実施例では、キットは、被検体を分析するための試薬をパッケージングされた組み合わせとして含み、その性質は詳細なアッセイフォーマットに依存する。試薬は、例えば、本明細書に記載される原理に従う1以上のモノクローナル抗体を含んでいてよく、モノクローナル抗体は、標識又は支持体に接合されていてもよい。試薬類の交差反応性及び安定性に依り、試薬は、それぞれ別々の容器中に収容されてもよく、又は種々の試薬が1以上の容器中に組み合わされていてもよい。キットは、更に、追加の結合メンバー及び補助的な試薬等の、アッセイを行なうための、他の別個にパッケージされた試薬を含んでいてもよい。
本方法の間に起こる必要がある反応を実質的に最適化する試薬の濃度を提供し、更にアッセイの感度を実質的に最適化するために、キット中の種々の試薬の相対的な量は様々とすることができる。適切な環境下では、キット中の試薬の1つ以上が、賦形剤を含有し、通常は、凍結乾燥された乾燥粉末として提供され得る。この乾燥粉末は、溶解時に、方法又はアッセイを行なうのに適切な濃度を有する試薬溶液を提供することになる。キットは、更に、上述したような本実施形態に従う方法の説明書を含み得る。
語句「少なくとも」は、本明細書で使用する場合、特定される品目の数が示された数以上であってよいということを意味する。語句「約」は、本明細書で使用する場合、示された数がプラス又はマイナス10%だけ異なる場合があることを意味し、例えば「約5」は4.5〜5.5の範囲を意味する。「第1」及び「第2」の指定は、完全に任意であって、例えば「第1及び第2モノクローナル抗体」、又は「第1のモノクローナル抗体」及び「第2のモノクローナル抗体」のような、上記の言語が関係する群の構成要素内において、何らかの順序又は格付けを示唆することは意図していない。
下記の実施例は、本発明の特定の実施形態を、限定としてではなく例示として、更に説明し、本発明の範囲又は本明細書に添付された特許請求の範囲を限定としてではなく例示として記述することが意図されている。本明細書に開示された部又は百分率は、特に指定のない限り体積基準である。
全ての化学品は特に記述のない限り、シグマアルドリッチ社(Sigma−Aldrich Company)(ミズーリ州セントルイス)から購入した。
試験は、シーメンス社(Siemens)(デラウェア州ニューアーク)から入手可能なDIMENSION(登録商標)RxL分析器を用いて行った。サンドイッチイムノアッセイフォーマットを用いた酵素検出システムを使用して上記の機器を利用した。本明細書で使用し及び下記でより詳細に議論するサンドイッチ法の実施形態では、酵素に接合された標識抗体(Ab)(接合体)と患者試料中のシロリムス薬物(SIRO)との結合及びこれに引き続く得られた免疫複合体とクローム粒子上の捕捉抗体との結合によって、患者試料中のシロリムスの量が判定された。未結合のタグ抗体酵素接合体は、3−4回の混合/洗浄及び磁気分離のサイクルによって自動的に除去された。クローム粒子上に残存する接合体からの酵素活性が測定されたが、これは、患者試料中におけるシロリムスの量と正比例した。
定義
mg=ミリグラム
g=グラム
ng=ナノグラム
mL=ミリリットル
μL=マイクロリットル
mmol=ミリモル
μmol=マイクロモル
℃=摂氏度
min=分
sec=秒
hr=時間
w/v=重量/体積
v/v=体積/体積
TLC=薄層クロマトグラフィ
HPLC=高速液体クロマトグラフィ
UV=紫外線
EtOAc=酢酸エチル
MeOH=メタノール
DMF=ジメチルホルムアミド
DI=脱イオン化された
THF=テトラヒドロフラン
NHS=N−ヒドロキシスクシンイミド
DCC=Ν,Ν−ジシクロヘキシルカルボジイミド
BSA=ウシ血清アルブミン
BGG=ウシガンマグロブリン
MS=質量分析法
SIRO=シロリムス
rotovap=ロータリーエバポレータ
(実施例1)
(シロリムスに対するモノクローナル抗体の調製)
(C−32−シロリムスオキシム及びC−26−シロリムスオキシム(IVa及びIVb)の調製(図6))
シロリムス(I)(653.6mg、0.715mmol)及びカルボキシメトキシアミンヘミ塩酸塩(234.4mg、2.14mmol)のMeOH(20mL)中の溶液に酢酸ナトリウム(181.8mg、3.1mmol)を加える。反応混合物を窒素雰囲気下で室温(23℃)で一晩(18hr)撹拌する。TLC分析により反応の完了が示された(TLC、シリカゲルプレート、CH2Cl2/MeOH=9/1)。CH2C12(80mL)及びDI水(20mL)を混合物に加え、混合物を10分間攪拌する。CH2C12層を分離する。水層をCH2C12(3×30mL)で抽出する。CH2C12溶液を合一してDI水で洗浄し(2×40mL)Na2SO4で乾燥し、濾過しrotovapで濃縮してC−32−シロリムスオキシムとC−26−シロリムスオキシムとの混合物(IVa及びIVb、622mg)を得る。
(C−26−シロリムスオキシム(IVa)の単離(図6))
C−32−シロリムスオキシムとC−26−シロリムスオキシムとを分離するための最適なTLC条件(シリカゲル、EtOAc/ヘキサン/MeOH=5/2/1、RfC−32−オキシム=0.59、RfC−26−オキシム=0.51)を開発し、BIOTAGE(登録商標)ISOLERA(商標)ワンフラッシュクロマトグラフィシステム(John Morris Scientific、ニューサウスウェールズ州チャッツウッド)に成功裡に適用する。C−32−シロリムスオキシムとC−26−シロリムスオキシムとの混合物(IVa及びIVb、622mg)をCH2C12(5mL)中に溶解する。このCH2C12溶液をBIOTAGE(登録商標)ISOLERA(商標)ワンフラッシュクロマトグラフィシステムに付随するカートリッジ(シリカ、50gSNAP Ultra)に溶出させる。このシステムを、混合溶媒を用い25mL/minの流速で、作動させる。カートリッジから回収した全ての画分をTLC(EtOAc/ヘキサン/MeOH=5/2/1)によりチェックする。TLC分析に基づき、より極性の高い純粋な画分(RfC−26−オキシム=0.51)を合一して濃縮し、C−26−シロリムスオキシム(IVa)(197mg)を得る。この化合物のHPLC−UV分析により95%の純度が示される。
(C−26−シロリムスオキシム−BSA接合体(Va)(図7においてR5=BSA)の調製)
IVa(167.97mg、0.17mmol)のTHF/DMF(8mLのTHF、0.4mLのDMF)中溶液に、NHS(41.8mg、0.35mmol)及びDCC(70.9mg、0.34mmol)を加える。反応混合物を窒素雰囲気下、室温で撹拌する。生成物のNHSエステルは、TLC分析において、化合物IVaよりもやや極性が低い。反応中に形成される白色固体を濾過し、次いでEtOAcで洗浄する。溶媒を除去したのち、反応混合物をEtOAcに再溶解して濾過する。溶媒を留去して淡黄色の固体を得、これを高真空下で1時間保持する。
この活性化ハプテンNHSエステル(薄黄色固体)をDMF(1mL)中に溶解し、この溶液を、氷浴中で、ホスフェート緩衝塩水(PBS)バッファ(0.1M NaH2PO4/Na2HPO4、pH8)(14mL)中のBSA(120mg)に滴下添加する。室温で1時間撹拌した後、溶液のpHをNaOH(IN)を用いてpH8に調節し、混合物をコールドルーム(4℃)で一晩撹拌する。BSA接合体を、PBSバッファ(0.1M NaH2PO4/Na2PO4、pH7)で平衡化したSEPHADEX(登録商標)G−25カラム(C26x70)を通して精製し、同じPBSバッファで溶出する。280nmでUV検出器を用いてカラムから溶出された画分をモニタリングする。BSA接合体と非接合ハプテンIVaとの明白な分離が観察される。BSA接合体(Va)含有画分を貯留して、総量が57mLとなった。BCAタンパク質濃度アッセイ(Pierce Biotechnology、イリノイ州ロックフォード)により、Vaの濃度が2.52mg/mLであることが判定される。
(シロリムスのドメインD1に結合するモノクローナル抗体の調製)
シロリムス分子のドメインD1に結合するモノクローナル抗体を以下のように調製する。免疫原は上述のように調製したBSA接合体Vaである。この免疫原を用いてBalb/cマウスを免疫する。1回目の免疫は、腹腔内においてモノホスホリルリピドA及び合成トレハロースジコリノミコラートアジュバント(RIBI MPL+TDMエマルション、RIBI ImmunoChem Research Inc.、モンタナ州ハミルトン)を用い体積200μL中25μgで行なう。5週間後、200μLのモノホスホリルリピドA及び合成トレハロースジコリノミコラートアジュバント中の25μgの免疫原により腹腔内において追加免疫を与える。その後、更に8週間後、静脈内及び腹腔内で200μLのハンクス平衡塩類溶液中25μgの免疫原による融合前追加免疫(prefusion boost)を与える。
3日後、P3x63−AG8.653で示される非分泌マウスミエローマを用いた標準的な方法によって融合を行なう。標準的な方法によってクローニングを行なう。
以下のプロトコルに従う以下の逆ELISAイムノアッセイ手順により、クローンをスクリーニングする。ホスフェート緩衝塩水中5μg/mLのポリクローナルヤギ抗マウスIgG(IgG+IgA+IgM)(Zymed Laboratories、カリフォルニア州サウスサンフランシスコ)を1ウェル当たり100μLでプレートに被着する。プレートの被着は、室温で2時間以上又は約4℃で一晩行なう。次いで、このプレートを指ではじいて乾燥させ、1ウェル当たり300μLのブロッキングバッファ希釈液(PBS中、0.5%ウシ血清アルブミン、0.05%TWEEN(登録商標)20)でブロックする。プレートを振盪しながら室温で15分以上インキュベートすることによってプレートのブロッキングを行なう。次いでプレートを指ではじいて乾燥させる。その後、以下のようにしてスクリーニングすべきモノクローナル抗体を各ウェルに加える:1ウェル当たり50μLのブロッキングバッファ希釈液を、1ウェル当たり50μLの、融合生育プレート中の対応するウェルから移した培養上清とともに加えた。振盪しながら室温で約1時間インキュベーションを行なう。TITERTECK PLUS(登録商標)プレートウォッシャを用いS20スタッカを用いて0.05%のTWEEN(登録商標)20を有するPBSである洗浄バッファで、プレートを洗浄する。ブロッキングバッファ希釈液中1:4,000に希釈された、グルコース−6−ホスフェートデヒドロゲナーゼに共有結合されたシロリムス酵素接合体を、1ウェル当たり100μL加える。振盪しながら室温で約1時間インキュベーションを行なう。次いで、プレートを洗浄し、1ウェル当たり100μLの体積で発色性溶液を加える。この発色性溶液は、0.593mMのp−ヨードニトロテトラゾリウムバイオレット、0.02MのNAD、0.033Mのグルコース−6−ホスフェート、0.055MのTris、0.02%のナトリウムアジド、及び1:4000希釈のジアフォラーゼ(リポイルデヒドロゲナーゼ)を含有する。BSAを1%(v/v)の5%w/vBSA溶液で存在させる。BSAは、還元されたp−ヨードニトロテトラゾリウムバイオレットの急速な沈殿の防止を助けるために使用される。
このスクリーニングによって、シロリムスのドメインD1に結合する好適なモノクローナル抗体を産生するハイブリドーマが選択される。
(溶血性の前処理溶液の調製)
この前処理溶液は、5μg/mLのFK506、6.8mg/mLのPIPES(商標)1.5ナトリウム塩、0.3mg/mLのEDTAジナトリウム、1.0mg/mLのサポニン、0.2%のPROCLIN(登録商標)300、0.024mg/mLのネオマイシン硫酸塩、及び0.99mg/mLのNaN3を含有する(pH6.5)。最終反応混合物中のFK506の濃度は、1.1μg/mLである。
(タクロリムス及びシロリムスに結合するモノクローナル抗体の調製)
(タクロリムス−キーホールリンペットヘモシアニン接合体の調製)
タクロリムスモノオキシム(32.3mg、36.8μmol)の1.05mLの無水ジメチルホルムアミド中の溶液に1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(EDAC)(11mg、57.4μΜ、1.5当量)及びN−ヒドロキシスクシンイミド(7.3mg、63.4μΜ、1.7当量)を加える。タクロリムス分子のC22位で連結が生ずる。この反応液を、アルゴン下、室温で1時間撹拌する。次いで、この混合物をシリンジを介してキーホールリンペットヘモシアニン(74mg、純度54%)の、5.0mLのホスフェート緩衝塩水(0.1M、pH8.0)及び0.25mLのジメチルホルムアミド中溶液に滴下添加する。室温で2時間撹拌した後、得られた懸濁液をPBS(ホスフェート緩衝塩水)(10mM、pH7.0)に対して透析する(1×4L、4℃、2時間)。
次いで、得られた混合物を塩化メチレンで3回抽出して存在し得る痕跡量の未反応タクロリムスモノオキシムを除去する。ビシンコニン酸(BCA)タンパク質アッセイ溶液を用いて混合物の定量分析を行い、8mLのPBS中、50mgの免疫原(10mM、pH7.0)を得る。
TNBS法(A.F.S.A、Habeeb、Anal.Biochem.14巻、328頁(1966年))を用いたハプテン数の判定によってハプテン数1,300が得られる。ドライアイス−アセトン浴を用いて免疫原を瞬時に凍結させ、保存のため、−20℃に保つ。
タクロリムスの3つの位置異性体(C32位でKLHに連結、C24位でKLHに連結、C32位及びC24位でKLHに連結)を含有する免疫原混合物を以下のようにして調製する:タクロリムス(301.3mg)を丸底フラスコ中で1.5時間真空乾燥する。このフラスコに、撹拌子、無水コハク酸(568.2mg)、4−(ジメチルアミノ)ピリジン(46.3mg)、ジクロロメタン(2mL、無水)及びピリジン(2.093mL)を加える。反応混合物を窒素雰囲気下、室温(24℃)で24.5時間撹拌する。この反応の生成物は、3つの位置異性体:タクロリムス−32−スクシネート、タクロリムス−24−スクシネート及びタクロリムス−24,32−ジスクシネートである。反応を停止させて、溶媒をロータリエバポレーションにより除去し生成物を真空ポンプにより更に2時間乾燥する。
バイアル瓶に、上記で得たタクロリムス−スクシネート混合物(2.5mg、2.8μmol)、N−ヒドロキシスクシンイミド(1.0mg、8.7μmol)及び無水アセトニトリル(250μL)を加える。混合物に蓋をして室温で撹拌する。撹拌混合物にN,N−ジシクロヘキシルカルボジイミド(3.0mg、15μmol)を加える。バイアル瓶に蓋をして混合物を室温で撹拌した。
2時間後、混合物を蒸発乾固させる。得られた物質を無水N,N−ジメチルホルムアミド(250μL)中に溶解する。これを活性化FK506−スクシネートの作業溶液とする。
20mLのバイアル瓶中に、KLH(8mg)の10mMホスフェートバッファ(pH8)8mL中溶液及びDMF(1.5mL)を加える。この混合物を約4℃に冷却し、上記で得た作業溶液200μLを上記冷却溶液に撹拌しながら滴下添加する。混合物を4℃で16〜24時間撹拌した後、水で30mLに希釈し、2枚のCENTRICON(登録商標)30フィルタを用いて脱塩し、新鮮な水で更に3回再構成する。最終物質を水で10mLに希釈する。タンパク質濃度をBCAタンパク質アッセイ法により決定する。
(タクロリムス及びシロリムスに対するモノクローナル抗体の調製)
タクロリムス及びシロリムスの両方に結合するモノクローナル抗体を以下のようにして調製する。免疫原は、上述のように調製したタクロリムス−キーホールリンペットヘモシアニン接合体である。この免疫原を使用してBalb/cマウスを免疫する。1回目の免疫は、腹腔内において、モノホスホリルリピドA及び合成トレハロースジコリノミコラートアジュバント(RIBI MPL+TDMエマルション、RIBI ImmunoChem Research Inc.、モンタナ州ハミルトン)を用い体積200μL中、25μgで行なう。5週間後、200μLのモノホスホリルリピドA及び合成トレハロースジコリノミコラートアジュバント中、25μgの免疫原により腹腔内において追加免疫を与える。その後、更に8週間後、静脈内及び腹腔内で200μLのハンクス平衡塩類溶液中、25μgの免疫原による融合前追加免疫(prefusion boost)を与える。
3日後、P3x63−AG8.653で示される非分泌マウスミエローマを用いた標準的な方法によって融合を行なう。標準的な方法によってクローニングを行なう。
以下のプロトコルに従う以下の逆ELISAイムノアッセイ手順により、クローンをスクリーニングする。ホスフェート緩衝塩水中5μg/mLのポリクローナルヤギ抗マウスIgG(IgG+IgA+IgM)(Zymed Laboratories、カリフォルニア州サウスサンフランシスコ)を用いて1ウェル当たり100μLでプレートをコーティングする。プレートのコーティングは室温で2時間以上又は約4℃で一晩行なう。プレートは、フィルムで包んで約4℃で数日間保存し得る。次いで、プレートを指ではじいて乾燥させ、1ウェル当たり300μLのブロッキングバッファ希釈液(PBS中、0.5%ウシ血清アルブミン、0.05%TWEEN(登録商標)20)でブロックする。プレートを振盪しながら、室温で15分以上インキュベートすることによってプレートのブロッキングを行なう。次いで、プレートを指ではじいて乾燥させる。その後、スクリーニングすべきモノクローナル抗体を以下のようにして各ウェルに加える:1ウェル当たり50μLのブロッキングバッファ希釈液を、1ウェル当たり50μLの、融合生育プレート中の対応するウェルから移した培養上清とともに加える。振盪しながら室温で約1時間インキュベーションを行なう。TITERTECK PLUS(登録商標)プレートウォッシャを用いS20スタッカを用いて洗浄バッファでプレートを洗浄する。洗浄バッファは、0.05%のTWEEN(登録商標)20を有するPBSである。ブロッキングバッファ希釈液中1:4,000に希釈された、グルコース−6−ホスフェートデヒドロゲナーゼに共有結合されたタクロリムスの酵素接合体を、1ウェル当たり100μL加える。振盪しながら室温で約1時間インキュベーションを行なう。次いで、プレートを洗浄し、1ウェル当たり100μLの量で発色性溶液を加える。この発色性溶液は、0.593mMのp−ヨードニトロテトラゾリウムバイオレット、0.02MのNAD、0.033Mのグルコース−6−ホスフェート、0.055MのTris、0.02%のナトリウムアジド、及び1:4,000希釈のジアフォラーゼ(リポイルデヒドロゲナーゼ)を含有する。BSAを1(v/v)%の5(w/v)%BSA溶液で存在させる。BSAは還元されたp−ヨードニトロテトラゾリウムバイオレットの急速な沈殿の防止を助けるために使用される。
このスクリーニングによって、好適なモノクローナル抗体を産生するハイブリドーマが選択される。この抗体は、シロリムス及びタクロリムスの両方に結合するので、このモノクローナルをタグ抗体と称する。
(実施例2)
(自動化クローム粒子サンドイッチアッセイを用いたシロリムスの判定)
シロリムスのドメインD1に結合するモノクローナル抗体を用いた抗シロリムスF(ab’)2−β−ガラクトシダーゼ接合体の調製
シロリムスのドメインD1に結合するモノクローナル抗シロリムス抗体(実施例1において上述したように調製した。)を、リジル−エンドペプチダーゼ(Wako、ヴァージニア州リッチモンド)消化を用いてF(ab’)2に断片化した後、既知の技術に従い標準的ヘテロ二機能性SMCC(スクシンイミジルトランス−4−(N−マレイミジルメチル)シクロヘキサン−1−カルボキシレート)リンカーを用いて、β−ガラクトシダーゼに接合する。抗体接合体溶液は、およそ2.0μg/mLの抗シロリムス抗体−β−ガラクトシダーゼ接合体、30mg/mLのプロテアーゼ非含有ウシ血清アルブミン、0.126mg/mLのMgCl2、0.03mL/mLのエチレングリコール、24.5mg/mLのHEPES、38.5mg/mLのNaHEPES、50mg/mLのNaCl及びβ−galムテイン(不活性化ベータガラクトシダーゼ)を含有する(pH7.8)。
(磁性クローム粒子の調製)
シロリムスのドメインD1に結合するモノクローナル抗体(免疫原としてC−26−シロリムスオキシム−BSA接合体(Va)(図6中R5=BSA)を使用して実施例1において上述したようにして調製した。)を、グルタルアルデヒドを被着した二酸化クロム粒子に接合することによって、クローム粒子(イムノアッセイ固相)を調製する。このクローム試薬は、クローム粒子、60.4mg/mLのトレハロース二水和物及び7.2mg/mLのポリエチレングリコール(PEG)8000を含有する。本検討においては、3つのクローム粒子濃度、即ち、5、2.5及び1.67mg/mLを使用する。
(サンドイッチシロリムスアッセイ)
シロリムスのためのサンドイッチアッセイの原理及び操作は以下のとおりである:DIMENSION(登録商標)RxL分析器上の反応容器中で、シロリムス含有全血試料(50μL)を、上述したようにして調製した溶血性の前処理試薬と組み合わせる。この全血は、超音波サンプルプローブを用いて最初に血液を混合することによってスタンダードカップから採取する。全血試料を前処理溶液と混合することにより、全血の溶血及びタンパク質結合シロリムス分子のそれらの結合ドメインからの除去置換が確実に行なわれる。
シロリムスのD1ドメインに結合するモノクローナル抗体を用いて調製された抗シロリムスF(ab’)2−β−ガラクトシダーゼ接合体(50μL)を反応容器に加え、混合物を一定時間(35秒)43℃の温度で保持し、もし存在するならば、シロリムスを抗体酵素接合体と反応させる。タクロリムス及びシロリムスの両方に結合するモノクローナル抗体で固定化されたクローム粒子(50μL)を反応容器に加え、抗シロリムスF(ab’)2−β−ガラクトシダーゼ複合体に結合させてサンドイッチを形成する。この反応混合物を43℃の温度で14分間インキュベートした後、DIMENSION(登録商標)装置上で自動磁気分離、混合及び洗浄のサイクルを開始する。全部で4回の分離/洗浄サイクルを採用して未結合抗シロリムスF(ab’)2−β−ガラクトシダーゼ接合体及びデブリを試料から除去する。HEPESバッファ中のpH8.0の化学洗浄溶液(両方ともDIMENSION(登録商標)不均一系イムノアッセイモジュール用に提供された。)を用いてオンボードで自動化クローム洗浄を行なう。次いで、洗浄されたクローム粒子を、超音波混合によって前記化学洗浄溶液中に再懸濁し、懸濁されたクローム粒子の一部(54μL)を測光用キュベットに移してβ−ガラクトシダーゼ基剤溶液(クロロフェノールレッド−β−D−ガラクトピラノシド、即ち、CPRG)と混合する。CPRGの存在下で接合体の酵素反応率(enzymatic rate)を測定することによって、クローム粒子表面上の抗シロリムスF(ab’)2−β−ガラクトシダーゼ接合体と結合されたシロリムスを検出する。反応容器ごとの反応率(rate)を577nm及び700nmにおいて二色測定する。この結果は、シロリムスの良好な検出を示す。
(実施例3)
(自動化ELISAサンドイッチアッセイを用いたシロリムスの判定)
(シロリムスのためのサンドイッチ酵素結合免疫吸着アッセイ(ELISA))
以下の工程を採用する。工程1:シロリムスのドメインD1に結合する精製モノクローナル抗体(免疫原としてC−26−シロリムスオキシム−BSA接合体(Va)(図6中、R5=BSA)を使用し実施例1において上述したようにして調製した。)(PBS中10μg/mL)50μLを4℃で一晩ELISAプレート上にコーティングする。これらのプレートを、0.05%のTWEEN(登録商標)20を含有するMILLI−Q(登録商標)水(Millipore Corporation、マサチューセッツ州ビレリカ)を用いて洗浄する。工程2:200μLのPCTブロッカー溶液(0.05%のTWEEN(登録商標)20を含有するホスフェートバッファ中の0.5%カゼイン(乳タンパク質))を各ウェルに加えて、媒体を室温で30分間インキュベートする。プレートを0.05%のTWEEN(登録商標)20を含有するMILLI−Q(登録商標)水を用いて洗浄する。工程3:PBS中に希釈した所望の濃度のシロリムス50μLを各ウェルに加えて媒体を室温で30分間インキュベートする。プレートを0.05%のTWEEN(登録商標)20を含有するMILLI−Q(登録商標)水を用いて洗浄する。試験されるシロリムス薬物濃度は、それぞれ0、0.01、0.02、0.04、0.08、0.16、0.31、0.63、1.25、2.50、5.0、及び10.0ng/mLとする。工程4:タクロリムス及びシロリムスの両方に結合するモノクローナル抗体を用いて調製した抗シロリムスF(ab’)2−β−ガラクトシダーゼ接合体(上述したのと同様にして調製した。)(PCTブロッカー溶液中1:300希釈)を加えて、媒体を室温で30分間インキュベートする。プレートを0.05%のTWEEN(登録商標)20を含有するMILLI−Q(登録商標)水を用いて洗浄する。工程5:β−ガラクトシダーゼ基剤溶液CPRGを各ウェルに加える(100μL/ウェル)。工程6:これらのウェルを、プレートリーダーで577nmで1分毎に20分間測定する。結果はシロリムスの良好な検出を示す。
本明細書に引用された全ての刊行物及び特許出願は、各々の個々の刊行物又は特許出願が具体的に及び個々に参照によって組み込まれることが示されているかのように、参照によって本明細書に組み込まれる。
上述の発明が、理解の明確化のために例示及び実施例によってある程度詳細に記載されたが、添付の特許請求の範囲の精神又は範囲から逸脱することなく特定の変更及び修正を加えることができるということは、本発明の教示に照らして当業者には容易に明らかであろう。更に、説明を目的とする上記の記述は、本発明の完全な理解を与えるために特定の用語体系を用いた。しかしながら、発明を実施するためにそれらの特定の詳細内容は必須ではないということが当業者には明らであろう。従って、本発明の特定の実施形態の上記の記述は、例示及び記述の目的のために提示され、それらは本発明に対し排他的であること又は発明を開示された詳細な形態に限定することを意図していない。上述の教示を考慮して多くの修正及び変形形態が可能である。本発明の原理及びその実用的用途を説明し、それによって当業者が本発明を利用できるようにするために、実施形態を選択し記載した。