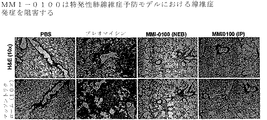
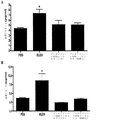
JP6655547B2 - 慢性肺移植片機能不全(clad)および特発性肺線維症(ipf)を予防または処置するための組成物および方法 - Google Patents
慢性肺移植片機能不全(clad)および特発性肺線維症(ipf)を予防または処置するための組成物および方法 Download PDFInfo
- Publication number
- JP6655547B2 JP6655547B2 JP2016557276A JP2016557276A JP6655547B2 JP 6655547 B2 JP6655547 B2 JP 6655547B2 JP 2016557276 A JP2016557276 A JP 2016557276A JP 2016557276 A JP2016557276 A JP 2016557276A JP 6655547 B2 JP6655547 B2 JP 6655547B2
- Authority
- JP
- Japan
- Prior art keywords
- kinase
- pharmaceutical composition
- another embodiment
- lung
- protein
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 239000000203 mixture Substances 0.000 title claims description 31
- 230000001684 chronic effect Effects 0.000 title claims description 15
- 206010010187 Complications of transplanted lung Diseases 0.000 title claims description 12
- 208000036971 interstitial lung disease 2 Diseases 0.000 title description 79
- 201000009794 Idiopathic Pulmonary Fibrosis Diseases 0.000 title description 77
- 238000000034 method Methods 0.000 title description 48
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 149
- 210000004072 lung Anatomy 0.000 claims description 118
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 109
- 229920001184 polypeptide Polymers 0.000 claims description 84
- 210000002950 fibroblast Anatomy 0.000 claims description 76
- 108091000080 Phosphotransferase Proteins 0.000 claims description 72
- 102000020233 phosphotransferase Human genes 0.000 claims description 72
- 210000001519 tissue Anatomy 0.000 claims description 67
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 43
- 102000001253 Protein Kinase Human genes 0.000 claims description 37
- 230000004054 inflammatory process Effects 0.000 claims description 37
- 108060008682 Tumor Necrosis Factor Proteins 0.000 claims description 36
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 claims description 36
- 108060006633 protein kinase Proteins 0.000 claims description 36
- 229940124789 MK2 inhibitor Drugs 0.000 claims description 35
- 206010061218 Inflammation Diseases 0.000 claims description 33
- 230000004913 activation Effects 0.000 claims description 33
- 230000000694 effects Effects 0.000 claims description 30
- 210000000651 myofibroblast Anatomy 0.000 claims description 30
- 108010085238 Actins Proteins 0.000 claims description 28
- 102000007469 Actins Human genes 0.000 claims description 27
- 230000001225 therapeutic effect Effects 0.000 claims description 27
- 230000002159 abnormal effect Effects 0.000 claims description 26
- 230000014509 gene expression Effects 0.000 claims description 25
- 102000004887 Transforming Growth Factor beta Human genes 0.000 claims description 22
- 108090001012 Transforming Growth Factor beta Proteins 0.000 claims description 22
- 238000002054 transplantation Methods 0.000 claims description 20
- 239000003814 drug Substances 0.000 claims description 19
- 239000000843 powder Substances 0.000 claims description 19
- 230000002401 inhibitory effect Effects 0.000 claims description 14
- 238000004519 manufacturing process Methods 0.000 claims description 14
- 238000012384 transportation and delivery Methods 0.000 claims description 13
- 229940112141 dry powder inhaler Drugs 0.000 claims description 12
- 239000008194 pharmaceutical composition Substances 0.000 claims description 12
- 229920002674 hyaluronan Polymers 0.000 claims description 11
- 210000003205 muscle Anatomy 0.000 claims description 11
- 208000034706 Graft dysfunction Diseases 0.000 claims description 10
- 239000006199 nebulizer Substances 0.000 claims description 10
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 claims description 9
- 229960003160 hyaluronic acid Drugs 0.000 claims description 9
- 230000002297 mitogenic effect Effects 0.000 claims description 9
- 208000004530 Primary Graft Dysfunction Diseases 0.000 claims description 8
- 101710092489 Protein kinase 2 Proteins 0.000 claims description 8
- 239000003937 drug carrier Substances 0.000 claims description 7
- 230000001575 pathological effect Effects 0.000 claims description 6
- 102100030412 Matrix metalloproteinase-9 Human genes 0.000 claims description 5
- 230000003111 delayed effect Effects 0.000 claims description 4
- 230000009545 invasion Effects 0.000 claims description 4
- 239000011859 microparticle Substances 0.000 claims description 4
- 238000013270 controlled release Methods 0.000 claims description 3
- 238000013265 extended release Methods 0.000 claims description 3
- 238000013268 sustained release Methods 0.000 claims description 3
- 239000012730 sustained-release form Substances 0.000 claims description 3
- 101000990902 Homo sapiens Matrix metalloproteinase-9 Proteins 0.000 claims description 2
- 230000036470 plasma concentration Effects 0.000 claims description 2
- 230000000699 topical effect Effects 0.000 claims description 2
- 229960003444 immunosuppressant agent Drugs 0.000 claims 2
- 239000003018 immunosuppressive agent Substances 0.000 claims 2
- 108090000623 proteins and genes Proteins 0.000 description 104
- 210000004027 cell Anatomy 0.000 description 100
- 102000004169 proteins and genes Human genes 0.000 description 80
- 235000018102 proteins Nutrition 0.000 description 77
- 206010016654 Fibrosis Diseases 0.000 description 58
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 56
- 230000004761 fibrosis Effects 0.000 description 56
- 235000001014 amino acid Nutrition 0.000 description 53
- 229940024606 amino acid Drugs 0.000 description 52
- 108010035532 Collagen Proteins 0.000 description 50
- 102000008186 Collagen Human genes 0.000 description 50
- 229920001436 collagen Polymers 0.000 description 50
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 50
- 108010006654 Bleomycin Proteins 0.000 description 49
- 102000004190 Enzymes Human genes 0.000 description 49
- 108090000790 Enzymes Proteins 0.000 description 49
- 229960001561 bleomycin Drugs 0.000 description 49
- 229940088598 enzyme Drugs 0.000 description 49
- 150000001413 amino acids Chemical class 0.000 description 48
- 230000006378 damage Effects 0.000 description 47
- 230000003176 fibrotic effect Effects 0.000 description 46
- 102000004127 Cytokines Human genes 0.000 description 45
- 108090000695 Cytokines Proteins 0.000 description 45
- 201000010099 disease Diseases 0.000 description 38
- NXUWTKIOMJSLSV-DEEZXRHXSA-N (2S)-2-[[(2S)-2-[[(2S)-2-[[2-[[(2S)-2-[[(2S)-5-amino-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-6-amino-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-5-amino-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-amino-3-(4-hydroxyphenyl)propanoyl]amino]propanoyl]amino]-5-carbamimidamidopentanoyl]amino]propanoyl]amino]propanoyl]amino]propanoyl]amino]-5-carbamimidamidopentanoyl]amino]-5-oxopentanoyl]amino]propanoyl]amino]-5-carbamimidamidopentanoyl]amino]propanoyl]amino]hexanoyl]amino]propanoyl]amino]-4-methylpentanoyl]amino]propanoyl]amino]-5-carbamimidamidopentanoyl]amino]-5-oxopentanoyl]amino]-4-methylpentanoyl]amino]acetyl]amino]-3-methylbutanoyl]amino]propanoyl]amino]propanoic acid Chemical compound CC(C)C[C@H](NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](C)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](C)NC(=O)[C@@H](N)Cc1ccc(O)cc1)C(=O)NCC(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(O)=O NXUWTKIOMJSLSV-DEEZXRHXSA-N 0.000 description 37
- 108010083015 MMI-0100 Proteins 0.000 description 37
- 230000001965 increasing effect Effects 0.000 description 37
- 208000027418 Wounds and injury Diseases 0.000 description 36
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 35
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 35
- 241000699670 Mus sp. Species 0.000 description 33
- 108010051109 Cell-Penetrating Peptides Proteins 0.000 description 31
- 102000020313 Cell-Penetrating Peptides Human genes 0.000 description 31
- 210000002744 extracellular matrix Anatomy 0.000 description 31
- 102000004889 Interleukin-6 Human genes 0.000 description 30
- 108090001005 Interleukin-6 Proteins 0.000 description 30
- 229940100601 interleukin-6 Drugs 0.000 description 29
- 208000005069 pulmonary fibrosis Diseases 0.000 description 29
- 230000008021 deposition Effects 0.000 description 28
- 230000006870 function Effects 0.000 description 28
- 230000008569 process Effects 0.000 description 28
- 230000027455 binding Effects 0.000 description 27
- 230000002757 inflammatory effect Effects 0.000 description 27
- 239000003112 inhibitor Substances 0.000 description 27
- 230000004044 response Effects 0.000 description 27
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 26
- 208000014674 injury Diseases 0.000 description 26
- 230000026731 phosphorylation Effects 0.000 description 26
- 238000006366 phosphorylation reaction Methods 0.000 description 26
- 230000002829 reductive effect Effects 0.000 description 26
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 24
- 206010069351 acute lung injury Diseases 0.000 description 23
- 210000000265 leukocyte Anatomy 0.000 description 23
- 230000007246 mechanism Effects 0.000 description 23
- 230000035755 proliferation Effects 0.000 description 23
- 239000000758 substrate Substances 0.000 description 23
- 238000011282 treatment Methods 0.000 description 23
- 230000001404 mediated effect Effects 0.000 description 22
- 150000007523 nucleic acids Chemical class 0.000 description 22
- 210000000056 organ Anatomy 0.000 description 22
- 108010067306 Fibronectins Proteins 0.000 description 21
- 102000016359 Fibronectins Human genes 0.000 description 21
- 239000000427 antigen Substances 0.000 description 21
- 108091007433 antigens Proteins 0.000 description 21
- 102000036639 antigens Human genes 0.000 description 21
- 102000039446 nucleic acids Human genes 0.000 description 21
- 108020004707 nucleic acids Proteins 0.000 description 21
- 230000001105 regulatory effect Effects 0.000 description 21
- 239000000126 substance Substances 0.000 description 21
- 239000003570 air Substances 0.000 description 20
- 210000002540 macrophage Anatomy 0.000 description 20
- 102000002574 p38 Mitogen-Activated Protein Kinases Human genes 0.000 description 20
- 108010068338 p38 Mitogen-Activated Protein Kinases Proteins 0.000 description 20
- 230000015572 biosynthetic process Effects 0.000 description 19
- 239000002773 nucleotide Substances 0.000 description 19
- 125000003729 nucleotide group Chemical group 0.000 description 19
- 238000011161 development Methods 0.000 description 18
- 230000018109 developmental process Effects 0.000 description 18
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 17
- 206010014561 Emphysema Diseases 0.000 description 16
- 239000007789 gas Substances 0.000 description 16
- 208000015181 infectious disease Diseases 0.000 description 16
- 238000006467 substitution reaction Methods 0.000 description 16
- 208000024891 symptom Diseases 0.000 description 16
- 102000004890 Interleukin-8 Human genes 0.000 description 15
- 108090001007 Interleukin-8 Proteins 0.000 description 15
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 15
- 210000004969 inflammatory cell Anatomy 0.000 description 15
- 230000005764 inhibitory process Effects 0.000 description 15
- 229940096397 interleukin-8 Drugs 0.000 description 15
- XKTZWUACRZHVAN-VADRZIEHSA-N interleukin-8 Chemical compound C([C@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@@H](NC(C)=O)CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CCSC)C(=O)N1[C@H](CCC1)C(=O)N1[C@H](CCC1)C(=O)N[C@@H](C)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CCC(O)=O)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC=1C=CC(O)=CC=1)C(=O)N[C@H](CO)C(=O)N1[C@H](CCC1)C(N)=O)C1=CC=CC=C1 XKTZWUACRZHVAN-VADRZIEHSA-N 0.000 description 15
- 239000002953 phosphate buffered saline Substances 0.000 description 15
- 210000001744 T-lymphocyte Anatomy 0.000 description 14
- 210000004369 blood Anatomy 0.000 description 14
- 239000008280 blood Substances 0.000 description 14
- 230000003902 lesion Effects 0.000 description 14
- 239000007788 liquid Substances 0.000 description 14
- -1 miners Chemical class 0.000 description 14
- 244000052769 pathogen Species 0.000 description 14
- 208000023504 respiratory system disease Diseases 0.000 description 14
- 230000029663 wound healing Effects 0.000 description 14
- 208000006673 asthma Diseases 0.000 description 13
- 210000000170 cell membrane Anatomy 0.000 description 13
- 210000002808 connective tissue Anatomy 0.000 description 13
- 102000000589 Interleukin-1 Human genes 0.000 description 12
- 108010002352 Interleukin-1 Proteins 0.000 description 12
- 206010052428 Wound Diseases 0.000 description 12
- 230000001419 dependent effect Effects 0.000 description 12
- 238000007912 intraperitoneal administration Methods 0.000 description 12
- 239000000463 material Substances 0.000 description 12
- 108020004999 messenger RNA Proteins 0.000 description 12
- 210000000440 neutrophil Anatomy 0.000 description 12
- 230000009885 systemic effect Effects 0.000 description 12
- 206010020751 Hypersensitivity Diseases 0.000 description 11
- 238000006243 chemical reaction Methods 0.000 description 11
- 208000035475 disorder Diseases 0.000 description 11
- 229940079593 drug Drugs 0.000 description 11
- 108020001507 fusion proteins Proteins 0.000 description 11
- 102000037865 fusion proteins Human genes 0.000 description 11
- 238000000338 in vitro Methods 0.000 description 11
- 238000002347 injection Methods 0.000 description 11
- 239000007924 injection Substances 0.000 description 11
- 239000012071 phase Substances 0.000 description 11
- 230000000770 proinflammatory effect Effects 0.000 description 11
- 230000000391 smoking effect Effects 0.000 description 11
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 10
- 102000002274 Matrix Metalloproteinases Human genes 0.000 description 10
- 108010000684 Matrix Metalloproteinases Proteins 0.000 description 10
- 101800002279 Transforming growth factor beta-1 Proteins 0.000 description 10
- 210000001132 alveolar macrophage Anatomy 0.000 description 10
- 125000000539 amino acid group Chemical group 0.000 description 10
- 210000004204 blood vessel Anatomy 0.000 description 10
- 210000000038 chest Anatomy 0.000 description 10
- 210000000981 epithelium Anatomy 0.000 description 10
- 239000000835 fiber Substances 0.000 description 10
- 230000003993 interaction Effects 0.000 description 10
- 102000040430 polynucleotide Human genes 0.000 description 10
- 108091033319 polynucleotide Proteins 0.000 description 10
- 239000002157 polynucleotide Substances 0.000 description 10
- 230000002685 pulmonary effect Effects 0.000 description 10
- 238000003786 synthesis reaction Methods 0.000 description 10
- 238000009423 ventilation Methods 0.000 description 10
- 102000019034 Chemokines Human genes 0.000 description 9
- 108010012236 Chemokines Proteins 0.000 description 9
- 102000015696 Interleukins Human genes 0.000 description 9
- 108010063738 Interleukins Proteins 0.000 description 9
- 206010028980 Neoplasm Diseases 0.000 description 9
- 206010035664 Pneumonia Diseases 0.000 description 9
- 102000046299 Transforming Growth Factor beta1 Human genes 0.000 description 9
- 206010006451 bronchitis Diseases 0.000 description 9
- 230000002950 deficient Effects 0.000 description 9
- 239000012636 effector Substances 0.000 description 9
- 210000003979 eosinophil Anatomy 0.000 description 9
- 239000012530 fluid Substances 0.000 description 9
- 210000000987 immune system Anatomy 0.000 description 9
- 238000001727 in vivo Methods 0.000 description 9
- 230000028709 inflammatory response Effects 0.000 description 9
- 230000002427 irreversible effect Effects 0.000 description 9
- 230000001717 pathogenic effect Effects 0.000 description 9
- 239000003380 propellant Substances 0.000 description 9
- 210000003491 skin Anatomy 0.000 description 9
- ZKHQWZAMYRWXGA-KQYNXXCUSA-N Adenosine triphosphate Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)[C@@H](O)[C@H]1O ZKHQWZAMYRWXGA-KQYNXXCUSA-N 0.000 description 8
- ZKHQWZAMYRWXGA-UHFFFAOYSA-N Adenosine triphosphate Natural products C1=NC=2C(N)=NC=NC=2N1C1OC(COP(O)(=O)OP(O)(=O)OP(O)(O)=O)C(O)C1O ZKHQWZAMYRWXGA-UHFFFAOYSA-N 0.000 description 8
- 108020004414 DNA Proteins 0.000 description 8
- 101710088791 Elongation factor 2 Proteins 0.000 description 8
- 241000699666 Mus <mouse, genus> Species 0.000 description 8
- 230000001154 acute effect Effects 0.000 description 8
- 229960001456 adenosine triphosphate Drugs 0.000 description 8
- 210000002821 alveolar epithelial cell Anatomy 0.000 description 8
- 230000003197 catalytic effect Effects 0.000 description 8
- 230000004069 differentiation Effects 0.000 description 8
- 239000003102 growth factor Substances 0.000 description 8
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 8
- 210000004698 lymphocyte Anatomy 0.000 description 8
- 230000037390 scarring Effects 0.000 description 8
- 210000002460 smooth muscle Anatomy 0.000 description 8
- 239000002904 solvent Substances 0.000 description 8
- 210000003462 vein Anatomy 0.000 description 8
- 206010006458 Bronchitis chronic Diseases 0.000 description 7
- 201000003883 Cystic fibrosis Diseases 0.000 description 7
- BWGVNKXGVNDBDI-UHFFFAOYSA-N Fibrin monomer Chemical compound CNC(=O)CNC(=O)CN BWGVNKXGVNDBDI-UHFFFAOYSA-N 0.000 description 7
- 108010048671 Homeodomain Proteins Proteins 0.000 description 7
- 102000009331 Homeodomain Proteins Human genes 0.000 description 7
- 208000019693 Lung disease Diseases 0.000 description 7
- 102000043136 MAP kinase family Human genes 0.000 description 7
- 108091054455 MAP kinase family Proteins 0.000 description 7
- 108010029485 Protein Isoforms Proteins 0.000 description 7
- 102000001708 Protein Isoforms Human genes 0.000 description 7
- 206010052779 Transplant rejections Diseases 0.000 description 7
- 238000007792 addition Methods 0.000 description 7
- 238000010171 animal model Methods 0.000 description 7
- 230000000903 blocking effect Effects 0.000 description 7
- 230000010261 cell growth Effects 0.000 description 7
- 230000001413 cellular effect Effects 0.000 description 7
- 208000007451 chronic bronchitis Diseases 0.000 description 7
- 150000001875 compounds Chemical class 0.000 description 7
- 230000034994 death Effects 0.000 description 7
- 231100000517 death Toxicity 0.000 description 7
- 210000002889 endothelial cell Anatomy 0.000 description 7
- 229940047122 interleukins Drugs 0.000 description 7
- 230000004199 lung function Effects 0.000 description 7
- 239000011159 matrix material Substances 0.000 description 7
- 239000002245 particle Substances 0.000 description 7
- 230000037361 pathway Effects 0.000 description 7
- 230000000750 progressive effect Effects 0.000 description 7
- 230000007115 recruitment Effects 0.000 description 7
- 230000011664 signaling Effects 0.000 description 7
- 210000003518 stress fiber Anatomy 0.000 description 7
- 208000011580 syndromic disease Diseases 0.000 description 7
- 230000014616 translation Effects 0.000 description 7
- 108700020469 14-3-3 Proteins 0.000 description 6
- 102000004899 14-3-3 Proteins Human genes 0.000 description 6
- 108010070997 CaMKII inhibitor AIP Proteins 0.000 description 6
- 108010003721 Calcium-Calmodulin-Dependent Protein Kinase Type 2 Proteins 0.000 description 6
- 102000009123 Fibrin Human genes 0.000 description 6
- 108010073385 Fibrin Proteins 0.000 description 6
- 102100025591 Glycerate kinase Human genes 0.000 description 6
- 108060003951 Immunoglobulin Proteins 0.000 description 6
- 102000003816 Interleukin-13 Human genes 0.000 description 6
- 108090000176 Interleukin-13 Proteins 0.000 description 6
- 102000013691 Interleukin-17 Human genes 0.000 description 6
- 108050003558 Interleukin-17 Proteins 0.000 description 6
- 102100034069 MAP kinase-activated protein kinase 2 Human genes 0.000 description 6
- 102000004318 Matrilysin Human genes 0.000 description 6
- 108090000855 Matrilysin Proteins 0.000 description 6
- 108091028043 Nucleic acid sequence Proteins 0.000 description 6
- 102000035195 Peptidases Human genes 0.000 description 6
- 108091005804 Peptidases Proteins 0.000 description 6
- 108010038512 Platelet-Derived Growth Factor Proteins 0.000 description 6
- 102000010780 Platelet-Derived Growth Factor Human genes 0.000 description 6
- 102100029812 Protein S100-A12 Human genes 0.000 description 6
- 108010067787 Proteoglycans Proteins 0.000 description 6
- 102000016611 Proteoglycans Human genes 0.000 description 6
- 208000032056 Radiation Fibrosis Syndrome Diseases 0.000 description 6
- 238000009825 accumulation Methods 0.000 description 6
- 208000038016 acute inflammation Diseases 0.000 description 6
- 230000006907 apoptotic process Effects 0.000 description 6
- 210000002469 basement membrane Anatomy 0.000 description 6
- 210000001772 blood platelet Anatomy 0.000 description 6
- GJPICJJJRGTNOD-UHFFFAOYSA-N bosentan Chemical compound COC1=CC=CC=C1OC(C(=NC(=N1)C=2N=CC=CN=2)OCCO)=C1NS(=O)(=O)C1=CC=C(C(C)(C)C)C=C1 GJPICJJJRGTNOD-UHFFFAOYSA-N 0.000 description 6
- 238000004422 calculation algorithm Methods 0.000 description 6
- 201000011510 cancer Diseases 0.000 description 6
- 229910002092 carbon dioxide Inorganic materials 0.000 description 6
- 230000000295 complement effect Effects 0.000 description 6
- 230000000875 corresponding effect Effects 0.000 description 6
- 230000007423 decrease Effects 0.000 description 6
- 238000012217 deletion Methods 0.000 description 6
- 230000037430 deletion Effects 0.000 description 6
- 238000009826 distribution Methods 0.000 description 6
- 210000004177 elastic tissue Anatomy 0.000 description 6
- 210000002919 epithelial cell Anatomy 0.000 description 6
- 229950003499 fibrin Drugs 0.000 description 6
- 108010086476 glycerate kinase Proteins 0.000 description 6
- 102000018358 immunoglobulin Human genes 0.000 description 6
- 230000008595 infiltration Effects 0.000 description 6
- 238000001764 infiltration Methods 0.000 description 6
- 210000004185 liver Anatomy 0.000 description 6
- 210000004962 mammalian cell Anatomy 0.000 description 6
- 210000004379 membrane Anatomy 0.000 description 6
- 239000012528 membrane Substances 0.000 description 6
- 238000010172 mouse model Methods 0.000 description 6
- 210000003097 mucus Anatomy 0.000 description 6
- 239000002243 precursor Substances 0.000 description 6
- 102000005962 receptors Human genes 0.000 description 6
- 108020003175 receptors Proteins 0.000 description 6
- 230000008439 repair process Effects 0.000 description 6
- 239000007787 solid Substances 0.000 description 6
- 241000894007 species Species 0.000 description 6
- 230000035882 stress Effects 0.000 description 6
- 230000004083 survival effect Effects 0.000 description 6
- 238000010361 transduction Methods 0.000 description 6
- 230000026683 transduction Effects 0.000 description 6
- 238000013519 translation Methods 0.000 description 6
- 230000003612 virological effect Effects 0.000 description 6
- LVGUZGTVOIAKKC-UHFFFAOYSA-N 1,1,1,2-tetrafluoroethane Chemical compound FCC(F)(F)F LVGUZGTVOIAKKC-UHFFFAOYSA-N 0.000 description 5
- 102100026802 72 kDa type IV collagenase Human genes 0.000 description 5
- 101710151806 72 kDa type IV collagenase Proteins 0.000 description 5
- 208000000884 Airway Obstruction Diseases 0.000 description 5
- 102000004506 Blood Proteins Human genes 0.000 description 5
- 108010017384 Blood Proteins Proteins 0.000 description 5
- 102000004657 Calcium-Calmodulin-Dependent Protein Kinase Type 2 Human genes 0.000 description 5
- 229920002683 Glycosaminoglycan Polymers 0.000 description 5
- 108010071021 Inositol-polyphosphate multikinase Proteins 0.000 description 5
- 208000029523 Interstitial Lung disease Diseases 0.000 description 5
- 241001465754 Metazoa Species 0.000 description 5
- 108010066154 Nuclear Export Signals Proteins 0.000 description 5
- 239000004365 Protease Substances 0.000 description 5
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 5
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 5
- 239000004473 Threonine Substances 0.000 description 5
- 208000026062 Tissue disease Diseases 0.000 description 5
- 239000013543 active substance Substances 0.000 description 5
- 230000006022 acute inflammation Effects 0.000 description 5
- 210000003719 b-lymphocyte Anatomy 0.000 description 5
- 230000004888 barrier function Effects 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- 230000033228 biological regulation Effects 0.000 description 5
- 210000001185 bone marrow Anatomy 0.000 description 5
- 229960003065 bosentan Drugs 0.000 description 5
- 239000001569 carbon dioxide Substances 0.000 description 5
- 229960004424 carbon dioxide Drugs 0.000 description 5
- 230000012292 cell migration Effects 0.000 description 5
- 230000008859 change Effects 0.000 description 5
- 208000037976 chronic inflammation Diseases 0.000 description 5
- 230000006020 chronic inflammation Effects 0.000 description 5
- 230000008602 contraction Effects 0.000 description 5
- 210000000630 fibrocyte Anatomy 0.000 description 5
- 230000002068 genetic effect Effects 0.000 description 5
- 230000035876 healing Effects 0.000 description 5
- 210000002216 heart Anatomy 0.000 description 5
- 230000028993 immune response Effects 0.000 description 5
- 230000003834 intracellular effect Effects 0.000 description 5
- 208000028867 ischemia Diseases 0.000 description 5
- 210000003734 kidney Anatomy 0.000 description 5
- 229940071648 metered dose inhaler Drugs 0.000 description 5
- 210000003632 microfilament Anatomy 0.000 description 5
- 230000005012 migration Effects 0.000 description 5
- 238000013508 migration Methods 0.000 description 5
- 210000001616 monocyte Anatomy 0.000 description 5
- 210000005087 mononuclear cell Anatomy 0.000 description 5
- 206010028537 myelofibrosis Diseases 0.000 description 5
- 230000008506 pathogenesis Effects 0.000 description 5
- ISWRGOKTTBVCFA-UHFFFAOYSA-N pirfenidone Chemical compound C1=C(C)C=CC(=O)N1C1=CC=CC=C1 ISWRGOKTTBVCFA-UHFFFAOYSA-N 0.000 description 5
- 229920000642 polymer Polymers 0.000 description 5
- 108020000161 polyphosphate kinase Proteins 0.000 description 5
- 108020001580 protein domains Proteins 0.000 description 5
- 238000001959 radiotherapy Methods 0.000 description 5
- 230000000241 respiratory effect Effects 0.000 description 5
- 210000002345 respiratory system Anatomy 0.000 description 5
- 150000003839 salts Chemical class 0.000 description 5
- 239000000779 smoke Substances 0.000 description 5
- 239000000243 solution Substances 0.000 description 5
- 238000010186 staining Methods 0.000 description 5
- 238000002560 therapeutic procedure Methods 0.000 description 5
- 230000005945 translocation Effects 0.000 description 5
- LOGFVTREOLYCPF-KXNHARMFSA-N (2s,3r)-2-[[(2r)-1-[(2s)-2,6-diaminohexanoyl]pyrrolidine-2-carbonyl]amino]-3-hydroxybutanoic acid Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H]1CCCN1C(=O)[C@@H](N)CCCCN LOGFVTREOLYCPF-KXNHARMFSA-N 0.000 description 4
- YFMFNYKEUDLDTL-UHFFFAOYSA-N 1,1,1,2,3,3,3-heptafluoropropane Chemical compound FC(F)(F)C(F)C(F)(F)F YFMFNYKEUDLDTL-UHFFFAOYSA-N 0.000 description 4
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 4
- 206010001052 Acute respiratory distress syndrome Diseases 0.000 description 4
- 239000004475 Arginine Substances 0.000 description 4
- 241000894006 Bacteria Species 0.000 description 4
- 102000013717 Cyclin-Dependent Kinase 5 Human genes 0.000 description 4
- 108010025454 Cyclin-Dependent Kinase 5 Proteins 0.000 description 4
- 102100029588 Deoxycytidine kinase Human genes 0.000 description 4
- 108010033174 Deoxycytidine kinase Proteins 0.000 description 4
- 108700034280 EC 2.7.1.37 Proteins 0.000 description 4
- 102000016942 Elastin Human genes 0.000 description 4
- 108010014258 Elastin Proteins 0.000 description 4
- 102400000686 Endothelin-1 Human genes 0.000 description 4
- 101800004490 Endothelin-1 Proteins 0.000 description 4
- 108010007457 Extracellular Signal-Regulated MAP Kinases Proteins 0.000 description 4
- 102000007665 Extracellular Signal-Regulated MAP Kinases Human genes 0.000 description 4
- 108090000156 Fructokinases Proteins 0.000 description 4
- 102000030595 Glucokinase Human genes 0.000 description 4
- 108010021582 Glucokinase Proteins 0.000 description 4
- 108010021382 Gluconokinase Proteins 0.000 description 4
- 102000003918 Hyaluronan Synthases Human genes 0.000 description 4
- 108090000320 Hyaluronan Synthases Proteins 0.000 description 4
- 208000014919 IgG4-related retroperitoneal fibrosis Diseases 0.000 description 4
- 102100025479 Inositol polyphosphate multikinase Human genes 0.000 description 4
- 102000004877 Insulin Human genes 0.000 description 4
- 108090001061 Insulin Proteins 0.000 description 4
- 108010064593 Intercellular Adhesion Molecule-1 Proteins 0.000 description 4
- 102100037877 Intercellular adhesion molecule 1 Human genes 0.000 description 4
- 108010074328 Interferon-gamma Proteins 0.000 description 4
- 102000003777 Interleukin-1 beta Human genes 0.000 description 4
- 108090000193 Interleukin-1 beta Proteins 0.000 description 4
- 102000003814 Interleukin-10 Human genes 0.000 description 4
- 108090000174 Interleukin-10 Proteins 0.000 description 4
- 108010065805 Interleukin-12 Proteins 0.000 description 4
- 102000013462 Interleukin-12 Human genes 0.000 description 4
- 102000004388 Interleukin-4 Human genes 0.000 description 4
- 108090000978 Interleukin-4 Proteins 0.000 description 4
- 108010055717 JNK Mitogen-Activated Protein Kinases Proteins 0.000 description 4
- 102100023418 Ketohexokinase Human genes 0.000 description 4
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 4
- 239000004472 Lysine Substances 0.000 description 4
- 108010015302 Matrix metalloproteinase-9 Proteins 0.000 description 4
- 241001529936 Murinae Species 0.000 description 4
- 108010021592 Pantothenate kinase Proteins 0.000 description 4
- 102100024122 Pantothenate kinase 1 Human genes 0.000 description 4
- 102100024279 Phosphomevalonate kinase Human genes 0.000 description 4
- 206010035226 Plasma cell myeloma Diseases 0.000 description 4
- 206010036790 Productive cough Diseases 0.000 description 4
- 101710110949 Protein S100-A12 Proteins 0.000 description 4
- 206010038979 Retroperitoneal fibrosis Diseases 0.000 description 4
- 101710192266 Tegument protein VP22 Proteins 0.000 description 4
- 108091023040 Transcription factor Proteins 0.000 description 4
- 102100040247 Tumor necrosis factor Human genes 0.000 description 4
- 208000026935 allergic disease Diseases 0.000 description 4
- 208000006682 alpha 1-Antitrypsin Deficiency Diseases 0.000 description 4
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 4
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 4
- 238000001574 biopsy Methods 0.000 description 4
- 230000023555 blood coagulation Effects 0.000 description 4
- 210000003123 bronchiole Anatomy 0.000 description 4
- 229940124630 bronchodilator Drugs 0.000 description 4
- 239000000168 bronchodilator agent Substances 0.000 description 4
- 230000024245 cell differentiation Effects 0.000 description 4
- 239000003246 corticosteroid Substances 0.000 description 4
- 230000001186 cumulative effect Effects 0.000 description 4
- 230000004064 dysfunction Effects 0.000 description 4
- 229920002549 elastin Polymers 0.000 description 4
- 230000007613 environmental effect Effects 0.000 description 4
- 239000002532 enzyme inhibitor Substances 0.000 description 4
- 102000034240 fibrous proteins Human genes 0.000 description 4
- 108091005899 fibrous proteins Proteins 0.000 description 4
- 239000012634 fragment Substances 0.000 description 4
- 230000036541 health Effects 0.000 description 4
- 230000002209 hydrophobic effect Effects 0.000 description 4
- JGJLWPGRMCADHB-UHFFFAOYSA-N hypobromite Chemical compound Br[O-] JGJLWPGRMCADHB-UHFFFAOYSA-N 0.000 description 4
- 210000002865 immune cell Anatomy 0.000 description 4
- 239000007943 implant Substances 0.000 description 4
- 229940125396 insulin Drugs 0.000 description 4
- 229940117681 interleukin-12 Drugs 0.000 description 4
- 150000002617 leukotrienes Chemical class 0.000 description 4
- 150000002632 lipids Chemical class 0.000 description 4
- 230000033001 locomotion Effects 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- 238000012423 maintenance Methods 0.000 description 4
- 238000005399 mechanical ventilation Methods 0.000 description 4
- 201000000050 myeloid neoplasm Diseases 0.000 description 4
- 210000004940 nucleus Anatomy 0.000 description 4
- 230000030648 nucleus localization Effects 0.000 description 4
- 230000000414 obstructive effect Effects 0.000 description 4
- 239000001301 oxygen Substances 0.000 description 4
- 229910052760 oxygen Inorganic materials 0.000 description 4
- 108091000116 phosphomevalonate kinase Proteins 0.000 description 4
- 230000009467 reduction Effects 0.000 description 4
- 230000002441 reversible effect Effects 0.000 description 4
- 230000003248 secreting effect Effects 0.000 description 4
- 230000019491 signal transduction Effects 0.000 description 4
- BNRNXUUZRGQAQC-UHFFFAOYSA-N sildenafil Chemical compound CCCC1=NN(C)C(C(N2)=O)=C1N=C2C(C(=CC=1)OCC)=CC=1S(=O)(=O)N1CCN(C)CC1 BNRNXUUZRGQAQC-UHFFFAOYSA-N 0.000 description 4
- 208000024794 sputum Diseases 0.000 description 4
- 210000003802 sputum Anatomy 0.000 description 4
- 150000003431 steroids Chemical class 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- 230000008719 thickening Effects 0.000 description 4
- 230000037314 wound repair Effects 0.000 description 4
- 108010065780 2-amino-4-hydroxy-6-hydroxymethyldihydropteridine pyrophosphokinase Proteins 0.000 description 3
- 108010092060 Acetate kinase Proteins 0.000 description 3
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 3
- 201000001320 Atherosclerosis Diseases 0.000 description 3
- 206010006448 Bronchiolitis Diseases 0.000 description 3
- VOVIALXJUBGFJZ-KWVAZRHASA-N Budesonide Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@@H]2[C@@H]1[C@@H]1C[C@H]3OC(CCC)O[C@@]3(C(=O)CO)[C@@]1(C)C[C@@H]2O VOVIALXJUBGFJZ-KWVAZRHASA-N 0.000 description 3
- 102100021943 C-C motif chemokine 2 Human genes 0.000 description 3
- 102100032912 CD44 antigen Human genes 0.000 description 3
- 102000000584 Calmodulin Human genes 0.000 description 3
- 108010041952 Calmodulin Proteins 0.000 description 3
- 101710132601 Capsid protein Proteins 0.000 description 3
- 102000016289 Cell Adhesion Molecules Human genes 0.000 description 3
- 108010067225 Cell Adhesion Molecules Proteins 0.000 description 3
- 102100031065 Choline kinase alpha Human genes 0.000 description 3
- 102000029816 Collagenase Human genes 0.000 description 3
- 108060005980 Collagenase Proteins 0.000 description 3
- 108700023189 Dolichol kinases Proteins 0.000 description 3
- 102000048188 Dolichol kinases Human genes 0.000 description 3
- 206010013975 Dyspnoeas Diseases 0.000 description 3
- 108010062466 Enzyme Precursors Proteins 0.000 description 3
- 102000010911 Enzyme Precursors Human genes 0.000 description 3
- 101710142246 External core antigen Proteins 0.000 description 3
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 3
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 3
- 108010010803 Gelatin Proteins 0.000 description 3
- 102000003886 Glycoproteins Human genes 0.000 description 3
- 108090000288 Glycoproteins Proteins 0.000 description 3
- 102000005548 Hexokinase Human genes 0.000 description 3
- 108700040460 Hexokinases Proteins 0.000 description 3
- 101000868273 Homo sapiens CD44 antigen Proteins 0.000 description 3
- 206010021143 Hypoxia Diseases 0.000 description 3
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 3
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 3
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 3
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 3
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 3
- 108010074338 Lymphokines Proteins 0.000 description 3
- 102000008072 Lymphokines Human genes 0.000 description 3
- 101710141394 MAP kinase-activated protein kinase 2 Proteins 0.000 description 3
- 108010041955 MAP-kinase-activated kinase 2 Proteins 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 244000061176 Nicotiana tabacum Species 0.000 description 3
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 3
- 102000013901 Nucleoside diphosphate kinase Human genes 0.000 description 3
- 108010044790 Nucleoside-Phosphate Kinase Proteins 0.000 description 3
- 102000005811 Nucleoside-phosphate kinase Human genes 0.000 description 3
- 206010030113 Oedema Diseases 0.000 description 3
- 229910019142 PO4 Inorganic materials 0.000 description 3
- 208000031481 Pathologic Constriction Diseases 0.000 description 3
- 206010057249 Phagocytosis Diseases 0.000 description 3
- 102000011755 Phosphoglycerate Kinase Human genes 0.000 description 3
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 3
- 108091008611 Protein Kinase B Proteins 0.000 description 3
- 108090000315 Protein Kinase C Proteins 0.000 description 3
- 102000003923 Protein Kinase C Human genes 0.000 description 3
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 3
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 3
- 241000700159 Rattus Species 0.000 description 3
- 208000013616 Respiratory Distress Syndrome Diseases 0.000 description 3
- 241000283984 Rodentia Species 0.000 description 3
- 206010039710 Scleroderma Diseases 0.000 description 3
- 206010040047 Sepsis Diseases 0.000 description 3
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- 102000040945 Transcription factor Human genes 0.000 description 3
- 102100022563 Tubulin polymerization-promoting protein Human genes 0.000 description 3
- 108010000134 Vascular Cell Adhesion Molecule-1 Proteins 0.000 description 3
- 102100023543 Vascular cell adhesion protein 1 Human genes 0.000 description 3
- 230000005856 abnormality Effects 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 201000000028 adult respiratory distress syndrome Diseases 0.000 description 3
- 239000000443 aerosol Substances 0.000 description 3
- 230000007815 allergy Effects 0.000 description 3
- 230000000961 alloantigen Effects 0.000 description 3
- 210000002588 alveolar type II cell Anatomy 0.000 description 3
- 210000003484 anatomy Anatomy 0.000 description 3
- 230000003042 antagnostic effect Effects 0.000 description 3
- 230000000890 antigenic effect Effects 0.000 description 3
- 230000001580 bacterial effect Effects 0.000 description 3
- 210000000988 bone and bone Anatomy 0.000 description 3
- 229960004436 budesonide Drugs 0.000 description 3
- 210000004899 c-terminal region Anatomy 0.000 description 3
- 239000011575 calcium Substances 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- 210000000845 cartilage Anatomy 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- CFBUZOUXXHZCFB-OYOVHJISSA-N chembl511115 Chemical compound COC1=CC=C([C@@]2(CC[C@H](CC2)C(O)=O)C#N)C=C1OC1CCCC1 CFBUZOUXXHZCFB-OYOVHJISSA-N 0.000 description 3
- 208000023819 chronic asthma Diseases 0.000 description 3
- 230000015271 coagulation Effects 0.000 description 3
- 238000005345 coagulation Methods 0.000 description 3
- 229960001334 corticosteroids Drugs 0.000 description 3
- 230000000139 costimulatory effect Effects 0.000 description 3
- 125000004122 cyclic group Chemical group 0.000 description 3
- 210000000805 cytoplasm Anatomy 0.000 description 3
- 238000003745 diagnosis Methods 0.000 description 3
- 230000012202 endocytosis Effects 0.000 description 3
- 210000003038 endothelium Anatomy 0.000 description 3
- 239000002158 endotoxin Substances 0.000 description 3
- 229940017733 esbriet Drugs 0.000 description 3
- 210000003527 eukaryotic cell Anatomy 0.000 description 3
- 210000001508 eye Anatomy 0.000 description 3
- 229940126864 fibroblast growth factor Drugs 0.000 description 3
- 230000004927 fusion Effects 0.000 description 3
- 239000008273 gelatin Substances 0.000 description 3
- 229920000159 gelatin Polymers 0.000 description 3
- 235000019322 gelatine Nutrition 0.000 description 3
- 235000011852 gelatine desserts Nutrition 0.000 description 3
- 108010071598 homoserine kinase Proteins 0.000 description 3
- 229940088597 hormone Drugs 0.000 description 3
- 239000005556 hormone Substances 0.000 description 3
- 230000001900 immune effect Effects 0.000 description 3
- 230000001939 inductive effect Effects 0.000 description 3
- 102000006495 integrins Human genes 0.000 description 3
- 108010044426 integrins Proteins 0.000 description 3
- 229940028885 interleukin-4 Drugs 0.000 description 3
- 229960000310 isoleucine Drugs 0.000 description 3
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 3
- 239000008101 lactose Substances 0.000 description 3
- 231100000518 lethal Toxicity 0.000 description 3
- 230000001665 lethal effect Effects 0.000 description 3
- 239000003446 ligand Substances 0.000 description 3
- 229920006008 lipopolysaccharide Polymers 0.000 description 3
- 210000000663 muscle cell Anatomy 0.000 description 3
- 230000035772 mutation Effects 0.000 description 3
- 230000030147 nuclear export Effects 0.000 description 3
- 210000004738 parenchymal cell Anatomy 0.000 description 3
- 210000005259 peripheral blood Anatomy 0.000 description 3
- 239000011886 peripheral blood Substances 0.000 description 3
- 230000002093 peripheral effect Effects 0.000 description 3
- 230000035699 permeability Effects 0.000 description 3
- 230000008782 phagocytosis Effects 0.000 description 3
- 239000010452 phosphate Substances 0.000 description 3
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 3
- LFGREXWGYUGZLY-UHFFFAOYSA-N phosphoryl Chemical group [P]=O LFGREXWGYUGZLY-UHFFFAOYSA-N 0.000 description 3
- USRGIUJOYOXOQJ-GBXIJSLDSA-N phosphothreonine Chemical compound OP(=O)(O)O[C@H](C)[C@H](N)C(O)=O USRGIUJOYOXOQJ-GBXIJSLDSA-N 0.000 description 3
- 238000003752 polymerase chain reaction Methods 0.000 description 3
- 230000005855 radiation Effects 0.000 description 3
- 230000008707 rearrangement Effects 0.000 description 3
- 229940044551 receptor antagonist Drugs 0.000 description 3
- 239000002464 receptor antagonist Substances 0.000 description 3
- 238000007634 remodeling Methods 0.000 description 3
- 230000010076 replication Effects 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 230000029058 respiratory gaseous exchange Effects 0.000 description 3
- 210000003660 reticulum Anatomy 0.000 description 3
- 206010039073 rheumatoid arthritis Diseases 0.000 description 3
- MNDBXUUTURYVHR-UHFFFAOYSA-N roflumilast Chemical compound FC(F)OC1=CC=C(C(=O)NC=2C(=CN=CC=2Cl)Cl)C=C1OCC1CC1 MNDBXUUTURYVHR-UHFFFAOYSA-N 0.000 description 3
- 230000028327 secretion Effects 0.000 description 3
- 108020001482 shikimate kinase Proteins 0.000 description 3
- 150000003384 small molecules Chemical class 0.000 description 3
- 210000000329 smooth muscle myocyte Anatomy 0.000 description 3
- 239000007921 spray Substances 0.000 description 3
- 230000006641 stabilisation Effects 0.000 description 3
- 238000011105 stabilization Methods 0.000 description 3
- 230000036262 stenosis Effects 0.000 description 3
- 208000037804 stenosis Diseases 0.000 description 3
- 230000000638 stimulation Effects 0.000 description 3
- 235000000346 sugar Nutrition 0.000 description 3
- 230000000451 tissue damage Effects 0.000 description 3
- 231100000827 tissue damage Toxicity 0.000 description 3
- 238000006276 transfer reaction Methods 0.000 description 3
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 3
- 239000003981 vehicle Substances 0.000 description 3
- WRSMVHZKPDCKNQ-DBSTUJSUSA-N (2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-[[(2s,3r)-2-[[(2s)-2-[[(2s)-5-amino-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-6-amino-2-[[(2s)-2,6-diaminohexanoyl]amino]hexanoyl]amino]propanoyl]amino]-4-methylpentanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]ami Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)CCCCN WRSMVHZKPDCKNQ-DBSTUJSUSA-N 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- QUNWUDVFRNGTCO-UHFFFAOYSA-N 1,7-dimethylxanthine Chemical compound N1C(=O)N(C)C(=O)C2=C1N=CN2C QUNWUDVFRNGTCO-UHFFFAOYSA-N 0.000 description 2
- UHDGCWIWMRVCDJ-UHFFFAOYSA-N 1-beta-D-Xylofuranosyl-NH-Cytosine Natural products O=C1N=C(N)C=CN1C1C(O)C(O)C(CO)O1 UHDGCWIWMRVCDJ-UHFFFAOYSA-N 0.000 description 2
- HVAUUPRFYPCOCA-AREMUKBSSA-N 2-O-acetyl-1-O-hexadecyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCCOC[C@@H](OC(C)=O)COP([O-])(=O)OCC[N+](C)(C)C HVAUUPRFYPCOCA-AREMUKBSSA-N 0.000 description 2
- 108030003650 6-phosphofructokinases Proteins 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- 102100026381 ADP-dependent glucokinase Human genes 0.000 description 2
- 108010058598 ADP-dependent glucokinase Proteins 0.000 description 2
- 102100025514 ATP-dependent 6-phosphofructokinase, platelet type Human genes 0.000 description 2
- 102100036732 Actin, aortic smooth muscle Human genes 0.000 description 2
- 102100033892 Actin-related protein 2/3 complex subunit 5 Human genes 0.000 description 2
- 102100034540 Adenomatous polyposis coli protein Human genes 0.000 description 2
- 108030003722 Adenosylcobinamide kinases Proteins 0.000 description 2
- 102000002281 Adenylate kinase Human genes 0.000 description 2
- 108020000543 Adenylate kinase Proteins 0.000 description 2
- 102100040149 Adenylyl-sulfate kinase Human genes 0.000 description 2
- 208000036065 Airway Remodeling Diseases 0.000 description 2
- 206010001889 Alveolitis Diseases 0.000 description 2
- 208000024827 Alzheimer disease Diseases 0.000 description 2
- 108010093579 Arachidonate 5-lipoxygenase Proteins 0.000 description 2
- 108010020366 Arginine kinase Proteins 0.000 description 2
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 2
- 108010055400 Aspartate kinase Proteins 0.000 description 2
- 208000023275 Autoimmune disease Diseases 0.000 description 2
- 108010015248 Beta-glucoside kinase Proteins 0.000 description 2
- 102100032367 C-C motif chemokine 5 Human genes 0.000 description 2
- 108010029697 CD40 Ligand Proteins 0.000 description 2
- 102100032937 CD40 ligand Human genes 0.000 description 2
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 2
- 102000019025 Calcium-Calmodulin-Dependent Protein Kinases Human genes 0.000 description 2
- 108010026870 Calcium-Calmodulin-Dependent Protein Kinases Proteins 0.000 description 2
- 108030005456 Calcium/calmodulin-dependent protein kinases Proteins 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 108020004827 Carbamate kinase Proteins 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- 102000052052 Casein Kinase II Human genes 0.000 description 2
- 108010010919 Casein Kinase II Proteins 0.000 description 2
- 102100036158 Ceramide kinase Human genes 0.000 description 2
- 108010017573 Ceramide kinase Proteins 0.000 description 2
- 108010055166 Chemokine CCL5 Proteins 0.000 description 2
- 108010018888 Choline kinase Proteins 0.000 description 2
- 101710094648 Coat protein Proteins 0.000 description 2
- 108020004705 Codon Proteins 0.000 description 2
- 229920002261 Corn starch Polymers 0.000 description 2
- 206010011224 Cough Diseases 0.000 description 2
- 102000004420 Creatine Kinase Human genes 0.000 description 2
- 108010042126 Creatine kinase Proteins 0.000 description 2
- 102000008130 Cyclic AMP-Dependent Protein Kinases Human genes 0.000 description 2
- UHDGCWIWMRVCDJ-PSQAKQOGSA-N Cytidine Natural products O=C1N=C(N)C=CN1[C@@H]1[C@@H](O)[C@@H](O)[C@H](CO)O1 UHDGCWIWMRVCDJ-PSQAKQOGSA-N 0.000 description 2
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 description 2
- 150000008574 D-amino acids Chemical class 0.000 description 2
- 101710088194 Dehydrogenase Proteins 0.000 description 2
- 108010058222 Deoxyguanosine kinase Proteins 0.000 description 2
- 108030003689 Deoxynucleoside kinases Proteins 0.000 description 2
- 102100037458 Dephospho-CoA kinase Human genes 0.000 description 2
- LCGLNKUTAGEVQW-UHFFFAOYSA-N Dimethyl ether Chemical compound COC LCGLNKUTAGEVQW-UHFFFAOYSA-N 0.000 description 2
- 206010061818 Disease progression Diseases 0.000 description 2
- 241000255601 Drosophila melanogaster Species 0.000 description 2
- 108700034618 EC 2.7.2.10 Proteins 0.000 description 2
- 102000002045 Endothelin Human genes 0.000 description 2
- 108050009340 Endothelin Proteins 0.000 description 2
- 229940118365 Endothelin receptor antagonist Drugs 0.000 description 2
- 241000283086 Equidae Species 0.000 description 2
- 206010015866 Extravasation Diseases 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- 102000016621 Focal Adhesion Protein-Tyrosine Kinases Human genes 0.000 description 2
- 108010067715 Focal Adhesion Protein-Tyrosine Kinases Proteins 0.000 description 2
- 102000003793 Fructokinases Human genes 0.000 description 2
- 229940126656 GS-4224 Drugs 0.000 description 2
- 102000048120 Galactokinases Human genes 0.000 description 2
- 108700023157 Galactokinases Proteins 0.000 description 2
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 2
- 102000057621 Glycerol kinases Human genes 0.000 description 2
- 108700016170 Glycerol kinases Proteins 0.000 description 2
- 108010015895 Glycerone kinase Proteins 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 102100021181 Golgi phosphoprotein 3 Human genes 0.000 description 2
- 108020004202 Guanylate Kinase Proteins 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- 229920002971 Heparan sulfate Polymers 0.000 description 2
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 2
- NTYJJOPFIAHURM-UHFFFAOYSA-N Histamine Chemical compound NCCC1=CN=CN1 NTYJJOPFIAHURM-UHFFFAOYSA-N 0.000 description 2
- 108010072039 Histidine kinase Proteins 0.000 description 2
- 101000599951 Homo sapiens Insulin-like growth factor I Proteins 0.000 description 2
- 101001043352 Homo sapiens Lysyl oxidase homolog 2 Proteins 0.000 description 2
- 101000578774 Homo sapiens MAP kinase-activated protein kinase 5 Proteins 0.000 description 2
- 101001059454 Homo sapiens Serine/threonine-protein kinase MARK2 Proteins 0.000 description 2
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 2
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 2
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 2
- 208000026350 Inborn Genetic disease Diseases 0.000 description 2
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 2
- 108010001139 Inosine kinase Proteins 0.000 description 2
- 102100037852 Insulin-like growth factor I Human genes 0.000 description 2
- 102100037850 Interferon gamma Human genes 0.000 description 2
- 102000008070 Interferon-gamma Human genes 0.000 description 2
- 108010002350 Interleukin-2 Proteins 0.000 description 2
- 102000000588 Interleukin-2 Human genes 0.000 description 2
- 102100039897 Interleukin-5 Human genes 0.000 description 2
- 108010002616 Interleukin-5 Proteins 0.000 description 2
- 108010002335 Interleukin-9 Proteins 0.000 description 2
- 102000000585 Interleukin-9 Human genes 0.000 description 2
- 108010062852 Ketohexokinase Proteins 0.000 description 2
- PWKSKIMOESPYIA-BYPYZUCNSA-N L-N-acetyl-Cysteine Chemical compound CC(=O)N[C@@H](CS)C(O)=O PWKSKIMOESPYIA-BYPYZUCNSA-N 0.000 description 2
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 2
- 150000008575 L-amino acids Chemical class 0.000 description 2
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 2
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 2
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 2
- 125000002842 L-seryl group Chemical group O=C([*])[C@](N([H])[H])([H])C([H])([H])O[H] 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 2
- 208000004852 Lung Injury Diseases 0.000 description 2
- 102100021948 Lysyl oxidase homolog 2 Human genes 0.000 description 2
- 102100028396 MAP kinase-activated protein kinase 5 Human genes 0.000 description 2
- 108010043901 Macrolide 2'-kinase Proteins 0.000 description 2
- 101710125418 Major capsid protein Proteins 0.000 description 2
- 108010015328 Mannokinase Proteins 0.000 description 2
- 102000003939 Membrane transport proteins Human genes 0.000 description 2
- 108090000301 Membrane transport proteins Proteins 0.000 description 2
- 206010027476 Metastases Diseases 0.000 description 2
- 108700040132 Mevalonate kinases Proteins 0.000 description 2
- 108090000744 Mitogen-Activated Protein Kinase Kinases Proteins 0.000 description 2
- 102000004232 Mitogen-Activated Protein Kinase Kinases Human genes 0.000 description 2
- 102100028192 Mitogen-activated protein kinase kinase kinase kinase 2 Human genes 0.000 description 2
- 101710144533 Mitogen-activated protein kinase kinase kinase kinase 2 Proteins 0.000 description 2
- 241000699660 Mus musculus Species 0.000 description 2
- 208000007101 Muscle Cramp Diseases 0.000 description 2
- 102000003505 Myosin Human genes 0.000 description 2
- 108060008487 Myosin Proteins 0.000 description 2
- 102100035044 Myosin light chain kinase, smooth muscle Human genes 0.000 description 2
- 108010074596 Myosin-Light-Chain Kinase Proteins 0.000 description 2
- 102100035286 N-acetyl-D-glucosamine kinase Human genes 0.000 description 2
- 108010032040 N-acetylglucosamine kinase Proteins 0.000 description 2
- 108010029147 N-acylmannosamine kinase Proteins 0.000 description 2
- 102100023515 NAD kinase Human genes 0.000 description 2
- 102000011779 Nitric Oxide Synthase Type II Human genes 0.000 description 2
- 108010076864 Nitric Oxide Synthase Type II Proteins 0.000 description 2
- 101710141454 Nucleoprotein Proteins 0.000 description 2
- 108091034117 Oligonucleotide Proteins 0.000 description 2
- 102000004264 Osteopontin Human genes 0.000 description 2
- 108010081689 Osteopontin Proteins 0.000 description 2
- 206010033645 Pancreatitis Diseases 0.000 description 2
- 102000013576 Phosphatidylinositol-4-Phosphate 3-Kinase Human genes 0.000 description 2
- 108010051404 Phosphatidylinositol-4-Phosphate 3-Kinase Proteins 0.000 description 2
- 108010022684 Phosphofructokinase-1 Proteins 0.000 description 2
- 102000012435 Phosphofructokinase-1 Human genes 0.000 description 2
- 108010064071 Phosphorylase Kinase Proteins 0.000 description 2
- 102000014750 Phosphorylase Kinase Human genes 0.000 description 2
- 108010003541 Platelet Activating Factor Proteins 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 108010042149 Polyphosphate-glucose phosphotransferase Proteins 0.000 description 2
- 102100022364 Polyunsaturated fatty acid 5-lipoxygenase Human genes 0.000 description 2
- 101710083689 Probable capsid protein Proteins 0.000 description 2
- 102100024009 Probable gluconokinase Human genes 0.000 description 2
- 108010050808 Procollagen Proteins 0.000 description 2
- ATUOYWHBWRKTHZ-UHFFFAOYSA-N Propane Chemical compound CCC ATUOYWHBWRKTHZ-UHFFFAOYSA-N 0.000 description 2
- 229940096437 Protein S Drugs 0.000 description 2
- 102000029301 Protein S Human genes 0.000 description 2
- 108010066124 Protein S Proteins 0.000 description 2
- 206010037423 Pulmonary oedema Diseases 0.000 description 2
- 108010070648 Pyridoxal Kinase Proteins 0.000 description 2
- 102100038517 Pyridoxal kinase Human genes 0.000 description 2
- 208000012322 Raynaud phenomenon Diseases 0.000 description 2
- 108020004511 Recombinant DNA Proteins 0.000 description 2
- 208000001647 Renal Insufficiency Diseases 0.000 description 2
- 206010063837 Reperfusion injury Diseases 0.000 description 2
- 102000048125 Riboflavin kinases Human genes 0.000 description 2
- 102000046755 Ribokinases Human genes 0.000 description 2
- 108010034782 Ribosomal Protein S6 Kinases Proteins 0.000 description 2
- 102000009738 Ribosomal Protein S6 Kinases Human genes 0.000 description 2
- 102000000395 SH3 domains Human genes 0.000 description 2
- 108050008861 SH3 domains Proteins 0.000 description 2
- 102100031163 Selenide, water dikinase 1 Human genes 0.000 description 2
- 108030002908 Selenide, water dikinases Proteins 0.000 description 2
- 206010070834 Sensitisation Diseases 0.000 description 2
- 206010040070 Septic Shock Diseases 0.000 description 2
- 102100028904 Serine/threonine-protein kinase MARK2 Human genes 0.000 description 2
- 102000004446 Serum Response Factor Human genes 0.000 description 2
- 108010042291 Serum Response Factor Proteins 0.000 description 2
- 206010072170 Skin wound Diseases 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 208000005392 Spasm Diseases 0.000 description 2
- 208000006011 Stroke Diseases 0.000 description 2
- RAHZWNYVWXNFOC-UHFFFAOYSA-N Sulphur dioxide Chemical compound O=S=O RAHZWNYVWXNFOC-UHFFFAOYSA-N 0.000 description 2
- 230000006044 T cell activation Effects 0.000 description 2
- 108091008874 T cell receptors Proteins 0.000 description 2
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 2
- 108010092220 Tetraacyldisaccharide 4'-kinase Proteins 0.000 description 2
- 101001099217 Thermotoga maritima (strain ATCC 43589 / DSM 3109 / JCM 10099 / NBRC 100826 / MSB8) Triosephosphate isomerase Proteins 0.000 description 2
- 108090000190 Thrombin Proteins 0.000 description 2
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 2
- 102000006601 Thymidine Kinase Human genes 0.000 description 2
- 108020004440 Thymidine kinase Proteins 0.000 description 2
- 102100033451 Thyroid hormone receptor beta Human genes 0.000 description 2
- 102400001320 Transforming growth factor alpha Human genes 0.000 description 2
- 101800004564 Transforming growth factor alpha Proteins 0.000 description 2
- 206010069363 Traumatic lung injury Diseases 0.000 description 2
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 2
- 102100031638 Tuberin Human genes 0.000 description 2
- 108050009309 Tuberin Proteins 0.000 description 2
- 206010053613 Type IV hypersensitivity reaction Diseases 0.000 description 2
- 101710100179 UMP-CMP kinase Proteins 0.000 description 2
- 101710119674 UMP-CMP kinase 2, mitochondrial Proteins 0.000 description 2
- 108700024326 Undecaprenol kinases Proteins 0.000 description 2
- 108091023045 Untranslated Region Proteins 0.000 description 2
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 2
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 2
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 2
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 2
- 102100039037 Vascular endothelial growth factor A Human genes 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 2
- XJLXINKUBYWONI-DQQFMEOOSA-N [[(2r,3r,4r,5r)-5-(6-aminopurin-9-yl)-3-hydroxy-4-phosphonooxyoxolan-2-yl]methoxy-hydroxyphosphoryl] [(2s,3r,4s,5s)-5-(3-carbamoylpyridin-1-ium-1-yl)-3,4-dihydroxyoxolan-2-yl]methyl phosphate Chemical compound NC(=O)C1=CC=C[N+]([C@@H]2[C@H]([C@@H](O)[C@H](COP([O-])(=O)OP(O)(=O)OC[C@@H]3[C@H]([C@@H](OP(O)(O)=O)[C@@H](O3)N3C4=NC=NC(N)=C4N=C3)O)O2)O)=C1 XJLXINKUBYWONI-DQQFMEOOSA-N 0.000 description 2
- 230000001594 aberrant effect Effects 0.000 description 2
- 229960004308 acetylcysteine Drugs 0.000 description 2
- 239000012190 activator Substances 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 230000009692 acute damage Effects 0.000 description 2
- 206010001053 acute respiratory failure Diseases 0.000 description 2
- 210000001789 adipocyte Anatomy 0.000 description 2
- UCTWMZQNUQWSLP-UHFFFAOYSA-N adrenaline Chemical compound CNCC(O)C1=CC=C(O)C(O)=C1 UCTWMZQNUQWSLP-UHFFFAOYSA-N 0.000 description 2
- 238000003915 air pollution Methods 0.000 description 2
- 210000004712 air sac Anatomy 0.000 description 2
- 235000004279 alanine Nutrition 0.000 description 2
- 230000001567 anti-fibrinolytic effect Effects 0.000 description 2
- 230000003510 anti-fibrotic effect Effects 0.000 description 2
- 230000003110 anti-inflammatory effect Effects 0.000 description 2
- 230000030741 antigen processing and presentation Effects 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 239000010425 asbestos Substances 0.000 description 2
- 235000009582 asparagine Nutrition 0.000 description 2
- 229960001230 asparagine Drugs 0.000 description 2
- 235000003704 aspartic acid Nutrition 0.000 description 2
- 108010075874 autocamtide-2 Proteins 0.000 description 2
- 210000003651 basophil Anatomy 0.000 description 2
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 2
- 230000003115 biocidal effect Effects 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 230000031018 biological processes and functions Effects 0.000 description 2
- 230000036770 blood supply Effects 0.000 description 2
- 230000036760 body temperature Effects 0.000 description 2
- 208000006218 bradycardia Diseases 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- RYYVLZVUVIJVGH-UHFFFAOYSA-N caffeine Chemical compound CN1C(=O)N(C)C(=O)C2=C1N=CN2C RYYVLZVUVIJVGH-UHFFFAOYSA-N 0.000 description 2
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 2
- 125000002091 cationic group Chemical group 0.000 description 2
- 230000005779 cell damage Effects 0.000 description 2
- 230000011712 cell development Effects 0.000 description 2
- 208000037887 cell injury Diseases 0.000 description 2
- 230000036755 cellular response Effects 0.000 description 2
- 239000004568 cement Substances 0.000 description 2
- 230000035605 chemotaxis Effects 0.000 description 2
- 235000019504 cigarettes Nutrition 0.000 description 2
- 230000007882 cirrhosis Effects 0.000 description 2
- 208000019425 cirrhosis of liver Diseases 0.000 description 2
- 239000003245 coal Substances 0.000 description 2
- 229960002424 collagenase Drugs 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 239000003636 conditioned culture medium Substances 0.000 description 2
- 108091036078 conserved sequence Proteins 0.000 description 2
- 239000000470 constituent Substances 0.000 description 2
- 239000008120 corn starch Substances 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- UHDGCWIWMRVCDJ-ZAKLUEHWSA-N cytidine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O1 UHDGCWIWMRVCDJ-ZAKLUEHWSA-N 0.000 description 2
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 2
- 230000003436 cytoskeletal effect Effects 0.000 description 2
- 210000004292 cytoskeleton Anatomy 0.000 description 2
- 230000001086 cytosolic effect Effects 0.000 description 2
- 230000007547 defect Effects 0.000 description 2
- 230000007123 defense Effects 0.000 description 2
- 230000007812 deficiency Effects 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 108010049285 dephospho-CoA kinase Proteins 0.000 description 2
- 206010012601 diabetes mellitus Diseases 0.000 description 2
- SLPJGDQJLTYWCI-UHFFFAOYSA-N dimethyl-(4,5,6,7-tetrabromo-1h-benzoimidazol-2-yl)-amine Chemical compound BrC1=C(Br)C(Br)=C2NC(N(C)C)=NC2=C1Br SLPJGDQJLTYWCI-UHFFFAOYSA-N 0.000 description 2
- 230000005750 disease progression Effects 0.000 description 2
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 239000000428 dust Substances 0.000 description 2
- 239000002308 endothelin receptor antagonist Substances 0.000 description 2
- ZUBDGKVDJUIMQQ-UBFCDGJISA-N endothelin-1 Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(O)=O)NC(=O)[C@H]1NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@@H](CC=2C=CC(O)=CC=2)NC(=O)[C@H](C(C)C)NC(=O)[C@H]2CSSC[C@@H](C(N[C@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N2)=O)NC(=O)[C@@H](CO)NC(=O)[C@H](N)CSSC1)C1=CNC=N1 ZUBDGKVDJUIMQQ-UBFCDGJISA-N 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 229940125532 enzyme inhibitor Drugs 0.000 description 2
- 108010044215 ethanolamine kinase Proteins 0.000 description 2
- 230000036251 extravasation Effects 0.000 description 2
- 201000001155 extrinsic allergic alveolitis Diseases 0.000 description 2
- 210000000416 exudates and transudate Anatomy 0.000 description 2
- 230000001605 fetal effect Effects 0.000 description 2
- 230000009969 flowable effect Effects 0.000 description 2
- 210000001650 focal adhesion Anatomy 0.000 description 2
- 229960002848 formoterol Drugs 0.000 description 2
- BPZSYCZIITTYBL-UHFFFAOYSA-N formoterol Chemical compound C1=CC(OC)=CC=C1CC(C)NCC(O)C1=CC=C(O)C(NC=O)=C1 BPZSYCZIITTYBL-UHFFFAOYSA-N 0.000 description 2
- ZXQYGBMAQZUVMI-GCMPRSNUSA-N gamma-cyhalothrin Chemical compound CC1(C)[C@@H](\C=C(/Cl)C(F)(F)F)[C@H]1C(=O)O[C@H](C#N)C1=CC=CC(OC=2C=CC=CC=2)=C1 ZXQYGBMAQZUVMI-GCMPRSNUSA-N 0.000 description 2
- 208000016361 genetic disease Diseases 0.000 description 2
- 210000001654 germ layer Anatomy 0.000 description 2
- 235000013922 glutamic acid Nutrition 0.000 description 2
- 239000004220 glutamic acid Substances 0.000 description 2
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- 210000003714 granulocyte Anatomy 0.000 description 2
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 2
- 102000006638 guanylate kinase Human genes 0.000 description 2
- 210000002443 helper t lymphocyte Anatomy 0.000 description 2
- 238000007490 hematoxylin and eosin (H&E) staining Methods 0.000 description 2
- 210000003630 histaminocyte Anatomy 0.000 description 2
- 229940099552 hyaluronan Drugs 0.000 description 2
- KIUKXJAPPMFGSW-MNSSHETKSA-N hyaluronan Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)C1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H](C(O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-MNSSHETKSA-N 0.000 description 2
- 210000004408 hybridoma Anatomy 0.000 description 2
- 150000005828 hydrofluoroalkanes Chemical class 0.000 description 2
- 239000001257 hydrogen Substances 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 229960002591 hydroxyproline Drugs 0.000 description 2
- 206010020718 hyperplasia Diseases 0.000 description 2
- 208000022098 hypersensitivity pneumonitis Diseases 0.000 description 2
- 208000018875 hypoxemia Diseases 0.000 description 2
- HIFJCPQKFCZDDL-ACWOEMLNSA-N iloprost Chemical compound C1\C(=C/CCCC(O)=O)C[C@@H]2[C@@H](/C=C/[C@@H](O)C(C)CC#CC)[C@H](O)C[C@@H]21 HIFJCPQKFCZDDL-ACWOEMLNSA-N 0.000 description 2
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 2
- 230000001771 impaired effect Effects 0.000 description 2
- 230000001976 improved effect Effects 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 208000027866 inflammatory disease Diseases 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 230000000977 initiatory effect Effects 0.000 description 2
- 229940100602 interleukin-5 Drugs 0.000 description 2
- 229940118526 interleukin-9 Drugs 0.000 description 2
- 201000006370 kidney failure Diseases 0.000 description 2
- 229940043355 kinase inhibitor Drugs 0.000 description 2
- 238000011813 knockout mouse model Methods 0.000 description 2
- 210000003041 ligament Anatomy 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 210000005265 lung cell Anatomy 0.000 description 2
- 231100000515 lung injury Toxicity 0.000 description 2
- 210000001165 lymph node Anatomy 0.000 description 2
- 229960001039 macitentan Drugs 0.000 description 2
- JGCMEBMXRHSZKX-UHFFFAOYSA-N macitentan Chemical compound C=1C=C(Br)C=CC=1C=1C(NS(=O)(=O)NCCC)=NC=NC=1OCCOC1=NC=C(Br)C=N1 JGCMEBMXRHSZKX-UHFFFAOYSA-N 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 230000014759 maintenance of location Effects 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 210000003622 mature neutrocyte Anatomy 0.000 description 2
- 230000009061 membrane transport Effects 0.000 description 2
- 230000009401 metastasis Effects 0.000 description 2
- 229930182817 methionine Natural products 0.000 description 2
- 102000002678 mevalonate kinase Human genes 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 238000003032 molecular docking Methods 0.000 description 2
- 229960002744 mometasone furoate Drugs 0.000 description 2
- WOFMFGQZHJDGCX-ZULDAHANSA-N mometasone furoate Chemical compound O([C@]1([C@@]2(C)C[C@H](O)[C@]3(Cl)[C@@]4(C)C=CC(=O)C=C4CC[C@H]3[C@@H]2C[C@H]1C)C(=O)CCl)C(=O)C1=CC=CO1 WOFMFGQZHJDGCX-ZULDAHANSA-N 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 2
- 210000004897 n-terminal region Anatomy 0.000 description 2
- 238000002663 nebulization Methods 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 210000001331 nose Anatomy 0.000 description 2
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 2
- 230000003204 osmotic effect Effects 0.000 description 2
- 230000000242 pagocytic effect Effects 0.000 description 2
- 210000000496 pancreas Anatomy 0.000 description 2
- 244000045947 parasite Species 0.000 description 2
- 230000001991 pathophysiological effect Effects 0.000 description 2
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 2
- 238000010647 peptide synthesis reaction Methods 0.000 description 2
- 239000000816 peptidomimetic Substances 0.000 description 2
- 230000002085 persistent effect Effects 0.000 description 2
- 210000001539 phagocyte Anatomy 0.000 description 2
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 2
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 2
- 229930029653 phosphoenolpyruvate Natural products 0.000 description 2
- DTBNBXWJWCWCIK-UHFFFAOYSA-N phosphoenolpyruvic acid Chemical compound OC(=O)C(=C)OP(O)(O)=O DTBNBXWJWCWCIK-UHFFFAOYSA-N 0.000 description 2
- 150000003906 phosphoinositides Chemical class 0.000 description 2
- 108010080971 phosphoribulokinase Proteins 0.000 description 2
- DHRLEVQXOMLTIM-UHFFFAOYSA-N phosphoric acid;trioxomolybdenum Chemical compound O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.OP(O)(O)=O DHRLEVQXOMLTIM-UHFFFAOYSA-N 0.000 description 2
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 2
- 230000035790 physiological processes and functions Effects 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 238000006116 polymerization reaction Methods 0.000 description 2
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 2
- 201000011461 pre-eclampsia Diseases 0.000 description 2
- 229960004618 prednisone Drugs 0.000 description 2
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 208000003476 primary myelofibrosis Diseases 0.000 description 2
- 230000002206 pro-fibrotic effect Effects 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 238000004393 prognosis Methods 0.000 description 2
- 230000002035 prolonged effect Effects 0.000 description 2
- 150000003180 prostaglandins Chemical class 0.000 description 2
- 210000003456 pulmonary alveoli Anatomy 0.000 description 2
- 208000005333 pulmonary edema Diseases 0.000 description 2
- 208000002815 pulmonary hypertension Diseases 0.000 description 2
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 2
- 201000004193 respiratory failure Diseases 0.000 description 2
- 108091000042 riboflavin kinase Proteins 0.000 description 2
- 210000003705 ribosome Anatomy 0.000 description 2
- 229910052895 riebeckite Inorganic materials 0.000 description 2
- 229960002586 roflumilast Drugs 0.000 description 2
- 201000000306 sarcoidosis Diseases 0.000 description 2
- 230000008313 sensitization Effects 0.000 description 2
- QZAYGJVTTNCVMB-UHFFFAOYSA-N serotonin Chemical compound C1=C(O)C=C2C(CCN)=CNC2=C1 QZAYGJVTTNCVMB-UHFFFAOYSA-N 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 239000007790 solid phase Substances 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 108010041757 streptomycin 6-kinase Proteins 0.000 description 2
- 230000008961 swelling Effects 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- 102000013498 tau Proteins Human genes 0.000 description 2
- 108010026424 tau Proteins Proteins 0.000 description 2
- 210000002435 tendon Anatomy 0.000 description 2
- YAPQBXQYLJRXSA-UHFFFAOYSA-N theobromine Chemical compound CN1C(=O)NC(=O)C2=C1N=CN2C YAPQBXQYLJRXSA-UHFFFAOYSA-N 0.000 description 2
- ZFXYFBGIUFBOJW-UHFFFAOYSA-N theophylline Chemical compound O=C1N(C)C(=O)N(C)C2=C1NC=N2 ZFXYFBGIUFBOJW-UHFFFAOYSA-N 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 229960004072 thrombin Drugs 0.000 description 2
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 2
- 230000017423 tissue regeneration Effects 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- FGMPLJWBKKVCDB-UHFFFAOYSA-N trans-L-hydroxy-proline Natural products ON1CCCC1C(O)=O FGMPLJWBKKVCDB-UHFFFAOYSA-N 0.000 description 2
- 230000002103 transcriptional effect Effects 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- 238000011830 transgenic mouse model Methods 0.000 description 2
- 230000032258 transport Effects 0.000 description 2
- 230000008733 trauma Effects 0.000 description 2
- CYRMSUTZVYGINF-UHFFFAOYSA-N trichlorofluoromethane Chemical compound FC(Cl)(Cl)Cl CYRMSUTZVYGINF-UHFFFAOYSA-N 0.000 description 2
- SZCZSKMCTGEJKI-UHFFFAOYSA-N tuberin Natural products COC1=CC=C(C=CNC=O)C=C1 SZCZSKMCTGEJKI-UHFFFAOYSA-N 0.000 description 2
- 230000005951 type IV hypersensitivity Effects 0.000 description 2
- 208000027930 type IV hypersensitivity disease Diseases 0.000 description 2
- 241000701161 unidentified adenovirus Species 0.000 description 2
- 230000003827 upregulation Effects 0.000 description 2
- 239000004474 valine Substances 0.000 description 2
- 230000002792 vascular Effects 0.000 description 2
- 230000008728 vascular permeability Effects 0.000 description 2
- 210000004509 vascular smooth muscle cell Anatomy 0.000 description 2
- 230000029812 viral genome replication Effects 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 239000000080 wetting agent Substances 0.000 description 2
- 230000010388 wound contraction Effects 0.000 description 2
- XWTYSIMOBUGWOL-UHFFFAOYSA-N (+-)-Terbutaline Chemical compound CC(C)(C)NCC(O)C1=CC(O)=CC(O)=C1 XWTYSIMOBUGWOL-UHFFFAOYSA-N 0.000 description 1
- RAVVEEJGALCVIN-AGVBWZICSA-N (2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-5-amino-2-[[(2s)-2-[[(2s)-2-[[(2s)-6-amino-2-[[(2s)-6-amino-2-[[(2s)-2-[[2-[[(2s)-2-amino-3-(4-hydroxyphenyl)propanoyl]amino]acetyl]amino]-5-(diaminomethylideneamino)pentanoyl]amino]hexanoyl]amino]hexanoyl]amino]-5-(diamino Chemical compound NC(N)=NCCC[C@@H](C(O)=O)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCCN=C(N)N)NC(=O)CNC(=O)[C@@H](N)CC1=CC=C(O)C=C1 RAVVEEJGALCVIN-AGVBWZICSA-N 0.000 description 1
- LJRDOKAZOAKLDU-UDXJMMFXSA-N (2s,3s,4r,5r,6r)-5-amino-2-(aminomethyl)-6-[(2r,3s,4r,5s)-5-[(1r,2r,3s,5r,6s)-3,5-diamino-2-[(2s,3r,4r,5s,6r)-3-amino-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-6-hydroxycyclohexyl]oxy-4-hydroxy-2-(hydroxymethyl)oxolan-3-yl]oxyoxane-3,4-diol;sulfuric ac Chemical compound OS(O)(=O)=O.N[C@@H]1[C@@H](O)[C@H](O)[C@H](CN)O[C@@H]1O[C@H]1[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](N)C[C@@H](N)[C@@H]2O)O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)N)O[C@@H]1CO LJRDOKAZOAKLDU-UDXJMMFXSA-N 0.000 description 1
- NMWKYTGJWUAZPZ-WWHBDHEGSA-N (4S)-4-[[(4R,7S,10S,16S,19S,25S,28S,31R)-31-[[(2S)-2-[[(1R,6R,9S,12S,18S,21S,24S,27S,30S,33S,36S,39S,42R,47R,53S,56S,59S,62S,65S,68S,71S,76S,79S,85S)-47-[[(2S)-2-[[(2S)-4-amino-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-amino-3-methylbutanoyl]amino]-3-methylbutanoyl]amino]-3-hydroxypropanoyl]amino]-3-(1H-imidazol-4-yl)propanoyl]amino]-3-phenylpropanoyl]amino]-4-oxobutanoyl]amino]-3-carboxypropanoyl]amino]-18-(4-aminobutyl)-27,68-bis(3-amino-3-oxopropyl)-36,71,76-tribenzyl-39-(3-carbamimidamidopropyl)-24-(2-carboxyethyl)-21,56-bis(carboxymethyl)-65,85-bis[(1R)-1-hydroxyethyl]-59-(hydroxymethyl)-62,79-bis(1H-imidazol-4-ylmethyl)-9-methyl-33-(2-methylpropyl)-8,11,17,20,23,26,29,32,35,38,41,48,54,57,60,63,66,69,72,74,77,80,83,86-tetracosaoxo-30-propan-2-yl-3,4,44,45-tetrathia-7,10,16,19,22,25,28,31,34,37,40,49,55,58,61,64,67,70,73,75,78,81,84,87-tetracosazatetracyclo[40.31.14.012,16.049,53]heptaoctacontane-6-carbonyl]amino]-3-methylbutanoyl]amino]-7-(3-carbamimidamidopropyl)-25-(hydroxymethyl)-19-[(4-hydroxyphenyl)methyl]-28-(1H-imidazol-4-ylmethyl)-10-methyl-6,9,12,15,18,21,24,27,30-nonaoxo-16-propan-2-yl-1,2-dithia-5,8,11,14,17,20,23,26,29-nonazacyclodotriacontane-4-carbonyl]amino]-5-[[(2S)-1-[[(2S)-1-[[(2S)-3-carboxy-1-[[(2S)-1-[[(2S)-1-[[(1S)-1-carboxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-1-oxopropan-2-yl]amino]-1-oxopropan-2-yl]amino]-3-(1H-imidazol-4-yl)-1-oxopropan-2-yl]amino]-5-oxopentanoic acid Chemical compound CC(C)C[C@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](Cc1c[nH]cn1)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H]1CSSC[C@H](NC(=O)[C@@H](NC(=O)[C@@H]2CSSC[C@@H]3NC(=O)[C@H](Cc4ccccc4)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](Cc4c[nH]cn4)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H]4CCCN4C(=O)[C@H](CSSC[C@H](NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](Cc4c[nH]cn4)NC(=O)[C@H](Cc4ccccc4)NC3=O)[C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](Cc3ccccc3)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N3CCC[C@H]3C(=O)N[C@@H](C)C(=O)N2)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](Cc2ccccc2)NC(=O)[C@H](Cc2c[nH]cn2)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@@H](N)C(C)C)C(C)C)[C@@H](C)O)C(C)C)C(=O)N[C@@H](Cc2c[nH]cn2)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](Cc2ccc(O)cc2)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1)C(=O)N[C@@H](C)C(O)=O NMWKYTGJWUAZPZ-WWHBDHEGSA-N 0.000 description 1
- DHPRQBPJLMKORJ-XRNKAMNCSA-N (4s,4as,5as,6s,12ar)-7-chloro-4-(dimethylamino)-1,6,10,11,12a-pentahydroxy-6-methyl-3,12-dioxo-4,4a,5,5a-tetrahydrotetracene-2-carboxamide Chemical compound C1=CC(Cl)=C2[C@](O)(C)[C@H]3C[C@H]4[C@H](N(C)C)C(=O)C(C(N)=O)=C(O)[C@@]4(O)C(=O)C3=C(O)C2=C1O DHPRQBPJLMKORJ-XRNKAMNCSA-N 0.000 description 1
- 230000006269 (delayed) early viral mRNA transcription Effects 0.000 description 1
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 1
- DDMOUSALMHHKOS-UHFFFAOYSA-N 1,2-dichloro-1,1,2,2-tetrafluoroethane Chemical compound FC(F)(Cl)C(F)(F)Cl DDMOUSALMHHKOS-UHFFFAOYSA-N 0.000 description 1
- 102000001556 1-Phosphatidylinositol 4-Kinase Human genes 0.000 description 1
- 108010029190 1-Phosphatidylinositol 4-Kinase Proteins 0.000 description 1
- 108010052341 1-phosphatidylinositol-4-phosphate 5-kinase Proteins 0.000 description 1
- 108030003684 1-phosphatidylinositol-5-phosphate 4-kinases Proteins 0.000 description 1
- OHMHBGPWCHTMQE-UHFFFAOYSA-N 2,2-dichloro-1,1,1-trifluoroethane Chemical compound FC(F)(F)C(Cl)Cl OHMHBGPWCHTMQE-UHFFFAOYSA-N 0.000 description 1
- VTSWSQGDJQFXHB-UHFFFAOYSA-N 2,4,6-trichloro-5-methylpyrimidine Chemical compound CC1=C(Cl)N=C(Cl)N=C1Cl VTSWSQGDJQFXHB-UHFFFAOYSA-N 0.000 description 1
- YSIHYROEMJSOAS-UHFFFAOYSA-N 2-(5-amino-6-oxo-2-phenylpyrimidin-1-yl)-n-[1-(5-tert-butyl-1,3,4-oxadiazol-2-yl)-3-methyl-1-oxobutan-2-yl]acetamide Chemical compound N=1N=C(C(C)(C)C)OC=1C(=O)C(C(C)C)NC(=O)CN(C(C(N)=CN=1)=O)C=1C1=CC=CC=C1 YSIHYROEMJSOAS-UHFFFAOYSA-N 0.000 description 1
- 108010052911 2-dehydro-3-deoxygalactonokinase Proteins 0.000 description 1
- ASJSAQIRZKANQN-CRCLSJGQSA-N 2-deoxy-D-ribose Chemical compound OC[C@@H](O)[C@@H](O)CC=O ASJSAQIRZKANQN-CRCLSJGQSA-N 0.000 description 1
- MGWGWNFMUOTEHG-UHFFFAOYSA-N 4-(3,5-dimethylphenyl)-1,3-thiazol-2-amine Chemical compound CC1=CC(C)=CC(C=2N=C(N)SC=2)=C1 MGWGWNFMUOTEHG-UHFFFAOYSA-N 0.000 description 1
- 108030003683 4-(cytidine 5'-diphospho)-2-C-methyl-D-erythritol kinases Proteins 0.000 description 1
- SOYAGMVKMXZVNZ-UHFFFAOYSA-N 4-[1-hydroxy-2-(propan-2-ylamino)butyl]benzene-1,2-diol;methanesulfonic acid Chemical compound CS(O)(=O)=O.CC(C)NC(CC)C(O)C1=CC=C(O)C(O)=C1 SOYAGMVKMXZVNZ-UHFFFAOYSA-N 0.000 description 1
- SMCMGLCPSSSOQE-NTZARQNWSA-N 4-n-(4-chlorophenyl)sulfonyl-1-n-[(2s)-3-methyl-1-oxo-1-[[(2s)-1-(1,1,1-trifluoro-4-methyl-2-oxopentan-3-yl)pyrrolidine-2-carbonyl]amino]butan-2-yl]benzene-1,4-dicarboxamide Chemical compound N([C@@H](C(C)C)C(=O)NC(=O)[C@H]1N(CCC1)C(C(C)C)C(=O)C(F)(F)F)C(=O)C(C=C1)=CC=C1C(=O)NS(=O)(=O)C1=CC=C(Cl)C=C1 SMCMGLCPSSSOQE-NTZARQNWSA-N 0.000 description 1
- OOXNYFKPOPJIOT-UHFFFAOYSA-N 5-(3-bromophenyl)-7-(6-morpholin-4-ylpyridin-3-yl)pyrido[2,3-d]pyrimidin-4-amine;dihydrochloride Chemical compound Cl.Cl.C=12C(N)=NC=NC2=NC(C=2C=NC(=CC=2)N2CCOCC2)=CC=1C1=CC=CC(Br)=C1 OOXNYFKPOPJIOT-UHFFFAOYSA-N 0.000 description 1
- SQDAZGGFXASXDW-UHFFFAOYSA-N 5-bromo-2-(trifluoromethoxy)pyridine Chemical compound FC(F)(F)OC1=CC=C(Br)C=N1 SQDAZGGFXASXDW-UHFFFAOYSA-N 0.000 description 1
- 108090000713 5-dehydro-2-deoxygluconokinases Proteins 0.000 description 1
- 108010073577 5-methylthioribose kinase Proteins 0.000 description 1
- 108030003797 6-phosphofructo-2-kinases Proteins 0.000 description 1
- LRFVTYWOQMYALW-UHFFFAOYSA-N 9H-xanthine Chemical class O=C1NC(=O)NC2=C1NC=N2 LRFVTYWOQMYALW-UHFFFAOYSA-N 0.000 description 1
- 108010062854 ADP D-fructose-6-phosphate 1-phosphotransferase Proteins 0.000 description 1
- 230000005730 ADP ribosylation Effects 0.000 description 1
- 108030003685 ADP-specific phosphofructokinases Proteins 0.000 description 1
- 101710157736 ATP-dependent 6-phosphofructokinase Proteins 0.000 description 1
- 101710200244 ATP-dependent 6-phosphofructokinase isozyme 2 Proteins 0.000 description 1
- 206010000050 Abdominal adhesions Diseases 0.000 description 1
- 208000032484 Accidental exposure to product Diseases 0.000 description 1
- 101800001241 Acetylglutamate kinase Proteins 0.000 description 1
- 101710159080 Aconitate hydratase A Proteins 0.000 description 1
- 101710159078 Aconitate hydratase B Proteins 0.000 description 1
- 102100039819 Actin, alpha cardiac muscle 1 Human genes 0.000 description 1
- 101710170648 Actin, alpha cardiac muscle 1 Proteins 0.000 description 1
- 101710192004 Actin, aortic smooth muscle Proteins 0.000 description 1
- 102000004373 Actin-related protein 2 Human genes 0.000 description 1
- 108090000963 Actin-related protein 2 Proteins 0.000 description 1
- 102000003741 Actin-related protein 3 Human genes 0.000 description 1
- 108090000104 Actin-related protein 3 Proteins 0.000 description 1
- 101800001401 Activation peptide Proteins 0.000 description 1
- 102400000069 Activation peptide Human genes 0.000 description 1
- 206010048998 Acute phase reaction Diseases 0.000 description 1
- 206010001029 Acute pulmonary oedema Diseases 0.000 description 1
- 102000011767 Acute-Phase Proteins Human genes 0.000 description 1
- 108010062271 Acute-Phase Proteins Proteins 0.000 description 1
- 229930024421 Adenine Natural products 0.000 description 1
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 1
- 102100032534 Adenosine kinase Human genes 0.000 description 1
- 108010076278 Adenosine kinase Proteins 0.000 description 1
- 108010054404 Adenylyl-sulfate kinase Proteins 0.000 description 1
- 101710194173 Alcohol oxidase 2 Proteins 0.000 description 1
- 208000035285 Allergic Seasonal Rhinitis Diseases 0.000 description 1
- 108030003773 Allose kinases Proteins 0.000 description 1
- 101000852665 Alopecosa marikovskyi Omega-lycotoxin-Gsp2671a Proteins 0.000 description 1
- ITPDYQOUSLNIHG-UHFFFAOYSA-N Amiodarone hydrochloride Chemical compound [Cl-].CCCCC=1OC2=CC=CC=C2C=1C(=O)C1=CC(I)=C(OCC[NH+](CC)CC)C(I)=C1 ITPDYQOUSLNIHG-UHFFFAOYSA-N 0.000 description 1
- 102000013455 Amyloid beta-Peptides Human genes 0.000 description 1
- 108010090849 Amyloid beta-Peptides Proteins 0.000 description 1
- 229920000856 Amylose Polymers 0.000 description 1
- 206010002153 Anal fissure Diseases 0.000 description 1
- 206010002383 Angina Pectoris Diseases 0.000 description 1
- 206010002556 Ankylosing Spondylitis Diseases 0.000 description 1
- 108700031308 Antennapedia Homeodomain Proteins 0.000 description 1
- 101710081722 Antitrypsin Proteins 0.000 description 1
- 101150019028 Antp gene Proteins 0.000 description 1
- 208000016583 Anus disease Diseases 0.000 description 1
- 206010003011 Appendicitis Diseases 0.000 description 1
- 101001027098 Arabidopsis thaliana Fucose-1-phosphate guanylyltransferase Proteins 0.000 description 1
- 101100532518 Arabidopsis thaliana SAHH1 gene Proteins 0.000 description 1
- 208000033116 Asbestos intoxication Diseases 0.000 description 1
- 206010003497 Asphyxia Diseases 0.000 description 1
- 108010035053 B7-1 Antigen Proteins 0.000 description 1
- 102000038504 B7-1 Antigen Human genes 0.000 description 1
- 208000035143 Bacterial infection Diseases 0.000 description 1
- 108010027344 Basic Helix-Loop-Helix Transcription Factors Proteins 0.000 description 1
- 102000018720 Basic Helix-Loop-Helix Transcription Factors Human genes 0.000 description 1
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 1
- 239000002028 Biomass Substances 0.000 description 1
- 208000018240 Bone Marrow Failure disease Diseases 0.000 description 1
- 206010065553 Bone marrow failure Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 206010049765 Bradyarrhythmia Diseases 0.000 description 1
- 108010089895 Branched-chain-fatty-acid kinase Proteins 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 206010006261 Breast infections Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- PJFHZKIDENOSJB-UHFFFAOYSA-N Budesonide/formoterol Chemical compound C1=CC(OC)=CC=C1CC(C)NCC(O)C1=CC=C(O)C(NC=O)=C1.C1CC2=CC(=O)C=CC2(C)C2C1C1CC3OC(CCC)OC3(C(=O)CO)C1(C)CC2O PJFHZKIDENOSJB-UHFFFAOYSA-N 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-M Butyrate Chemical compound CCCC([O-])=O FERIUCNNQQJTOY-UHFFFAOYSA-M 0.000 description 1
- 108700024126 Butyrate kinases Proteins 0.000 description 1
- 102100031151 C-C chemokine receptor type 2 Human genes 0.000 description 1
- 101710149815 C-C chemokine receptor type 2 Proteins 0.000 description 1
- 101710155857 C-C motif chemokine 2 Proteins 0.000 description 1
- 102000001902 CC Chemokines Human genes 0.000 description 1
- 108010040471 CC Chemokines Proteins 0.000 description 1
- 102100031168 CCN family member 2 Human genes 0.000 description 1
- 101150013553 CD40 gene Proteins 0.000 description 1
- 101150029409 CFTR gene Proteins 0.000 description 1
- 101150006084 CHKB gene Proteins 0.000 description 1
- 102100022789 Calcium/calmodulin-dependent protein kinase type IV Human genes 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- UGFAIRIUMAVXCW-UHFFFAOYSA-N Carbon monoxide Chemical compound [O+]#[C-] UGFAIRIUMAVXCW-UHFFFAOYSA-N 0.000 description 1
- 206010007559 Cardiac failure congestive Diseases 0.000 description 1
- 206010007572 Cardiac hypertrophy Diseases 0.000 description 1
- 208000006029 Cardiomegaly Diseases 0.000 description 1
- 208000031229 Cardiomyopathies Diseases 0.000 description 1
- 208000024172 Cardiovascular disease Diseases 0.000 description 1
- 108010078791 Carrier Proteins Proteins 0.000 description 1
- 108010031425 Casein Kinases Proteins 0.000 description 1
- 102000005403 Casein Kinases Human genes 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 101150015280 Cel gene Proteins 0.000 description 1
- 102000000844 Cell Surface Receptors Human genes 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 231100000023 Cell-mediated cytotoxicity Toxicity 0.000 description 1
- 206010057250 Cell-mediated cytotoxicity Diseases 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 229920001287 Chondroitin sulfate Polymers 0.000 description 1
- UNPLRYRWJLTVAE-UHFFFAOYSA-N Cloperastine hydrochloride Chemical compound Cl.C1=CC(Cl)=CC=C1C(C=1C=CC=CC=1)OCCN1CCCCC1 UNPLRYRWJLTVAE-UHFFFAOYSA-N 0.000 description 1
- 102000001187 Collagen Type III Human genes 0.000 description 1
- 108010069502 Collagen Type III Proteins 0.000 description 1
- 102000012432 Collagen Type V Human genes 0.000 description 1
- 108010022514 Collagen Type V Proteins 0.000 description 1
- 102000000989 Complement System Proteins Human genes 0.000 description 1
- 108010069112 Complement System Proteins Proteins 0.000 description 1
- 108010039419 Connective Tissue Growth Factor Proteins 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 208000011231 Crohn disease Diseases 0.000 description 1
- 108010049894 Cyclic AMP-Dependent Protein Kinases Proteins 0.000 description 1
- 102000004654 Cyclic GMP-Dependent Protein Kinases Human genes 0.000 description 1
- 108010003591 Cyclic GMP-Dependent Protein Kinases Proteins 0.000 description 1
- IVOMOUWHDPKRLL-KQYNXXCUSA-N Cyclic adenosine monophosphate Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=CN=C2N)=C2N=C1 IVOMOUWHDPKRLL-KQYNXXCUSA-N 0.000 description 1
- 102000016736 Cyclin Human genes 0.000 description 1
- 108050006400 Cyclin Proteins 0.000 description 1
- 102000013701 Cyclin-Dependent Kinase 4 Human genes 0.000 description 1
- 108010025464 Cyclin-Dependent Kinase 4 Proteins 0.000 description 1
- 101710173364 Cyclin-dependent kinase 5 homolog Proteins 0.000 description 1
- 102100026805 Cyclin-dependent-like kinase 5 Human genes 0.000 description 1
- 101710133745 Cyclin-dependent-like kinase 5 Proteins 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- 102000012605 Cystic Fibrosis Transmembrane Conductance Regulator Human genes 0.000 description 1
- 108010079245 Cystic Fibrosis Transmembrane Conductance Regulator Proteins 0.000 description 1
- 206010011831 Cytomegalovirus infection Diseases 0.000 description 1
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 231100001074 DNA strand break Toxicity 0.000 description 1
- 230000004568 DNA-binding Effects 0.000 description 1
- 101000839787 Danio rerio Homeobox protein Hox-B5a Proteins 0.000 description 1
- 101001077547 Danio rerio Homeobox protein Hox-B6a Proteins 0.000 description 1
- 101001077545 Danio rerio Homeobox protein Hox-B7a Proteins 0.000 description 1
- 206010011968 Decreased immune responsiveness Diseases 0.000 description 1
- 206010051055 Deep vein thrombosis Diseases 0.000 description 1
- 102100036853 Deoxyguanosine kinase, mitochondrial Human genes 0.000 description 1
- 201000004624 Dermatitis Diseases 0.000 description 1
- 102000011107 Diacylglycerol Kinase Human genes 0.000 description 1
- 108010062677 Diacylglycerol Kinase Proteins 0.000 description 1
- 206010052337 Diastolic dysfunction Diseases 0.000 description 1
- 101001031598 Dictyostelium discoideum Probable serine/threonine-protein kinase fhkC Proteins 0.000 description 1
- 235000017274 Diospyros sandwicensis Nutrition 0.000 description 1
- 108010016626 Dipeptides Proteins 0.000 description 1
- 101100339887 Drosophila melanogaster Hsp27 gene Proteins 0.000 description 1
- 101100347633 Drosophila melanogaster Mhc gene Proteins 0.000 description 1
- 208000003870 Drug Overdose Diseases 0.000 description 1
- 208000030453 Drug-Related Side Effects and Adverse reaction Diseases 0.000 description 1
- 206010058314 Dysplasia Diseases 0.000 description 1
- 208000000059 Dyspnea Diseases 0.000 description 1
- 108700034323 EC 2.7.1.112 Proteins 0.000 description 1
- 108700034304 EC 2.7.1.115 Proteins 0.000 description 1
- 108700034320 EC 2.7.1.126 Proteins 0.000 description 1
- 108700034321 EC 2.7.1.129 Proteins 0.000 description 1
- 108700034438 EC 2.7.1.135 Proteins 0.000 description 1
- 108700034437 EC 2.7.1.141 Proteins 0.000 description 1
- 108700034277 EC 2.7.1.38 Proteins 0.000 description 1
- 208000005189 Embolism Diseases 0.000 description 1
- 206010048554 Endothelial dysfunction Diseases 0.000 description 1
- 208000004232 Enteritis Diseases 0.000 description 1
- 108010092408 Eosinophil Peroxidase Proteins 0.000 description 1
- 102100028471 Eosinophil peroxidase Human genes 0.000 description 1
- 206010014950 Eosinophilia Diseases 0.000 description 1
- 208000010228 Erectile Dysfunction Diseases 0.000 description 1
- 208000000289 Esophageal Achalasia Diseases 0.000 description 1
- 108010008165 Etanercept Proteins 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- 102100033166 Ethanolamine kinase 2 Human genes 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- 102100026859 FAD-AMP lyase (cyclizing) Human genes 0.000 description 1
- 108010049003 Fibrinogen Proteins 0.000 description 1
- 102000008946 Fibrinogen Human genes 0.000 description 1
- 241000724791 Filamentous phage Species 0.000 description 1
- 208000009531 Fissure in Ano Diseases 0.000 description 1
- 208000004262 Food Hypersensitivity Diseases 0.000 description 1
- 101001076781 Fructilactobacillus sanfranciscensis (strain ATCC 27651 / DSM 20451 / JCM 5668 / CCUG 30143 / KCTC 3205 / NCIMB 702811 / NRRL B-3934 / L-12) Ribose-5-phosphate isomerase A Proteins 0.000 description 1
- 102100022633 Fructose-2,6-bisphosphatase Human genes 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 102000004437 G-Protein-Coupled Receptor Kinase 1 Human genes 0.000 description 1
- 108091004242 G-Protein-Coupled Receptor Kinase 1 Proteins 0.000 description 1
- 229910052688 Gadolinium Inorganic materials 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 101710198928 Gamma-glutamyl phosphate reductase Proteins 0.000 description 1
- 208000007882 Gastritis Diseases 0.000 description 1
- 108010062679 Gentamicin 2''-nucleotidyltransferase Proteins 0.000 description 1
- 206010018341 Gliosis Diseases 0.000 description 1
- 102000005133 Glutamate 5-kinase Human genes 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- 102100031181 Glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 108010001483 Glycogen Synthase Proteins 0.000 description 1
- 102000002254 Glycogen Synthase Kinase 3 Human genes 0.000 description 1
- 108010014905 Glycogen Synthase Kinase 3 Proteins 0.000 description 1
- 108060003393 Granulin Proteins 0.000 description 1
- 206010018691 Granuloma Diseases 0.000 description 1
- 108010061192 Guanidinoacetate kinase Proteins 0.000 description 1
- 101150096276 HOG1 gene Proteins 0.000 description 1
- 101710134270 HPr kinase/phosphorylase Proteins 0.000 description 1
- 102000005623 HSP27 Heat-Shock Proteins Human genes 0.000 description 1
- 108010045100 HSP27 Heat-Shock Proteins Proteins 0.000 description 1
- 101150096895 HSPB1 gene Proteins 0.000 description 1
- 101710175981 Hamartin Proteins 0.000 description 1
- 206010019233 Headaches Diseases 0.000 description 1
- 206010019280 Heart failures Diseases 0.000 description 1
- 208000032843 Hemorrhage Diseases 0.000 description 1
- 102100023434 Heterogeneous nuclear ribonucleoprotein A0 Human genes 0.000 description 1
- 101710203706 Heterogeneous nuclear ribonucleoprotein A0 Proteins 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 108010027412 Histocompatibility Antigens Class II Proteins 0.000 description 1
- 102000018713 Histocompatibility Antigens Class II Human genes 0.000 description 1
- 201000002563 Histoplasmosis Diseases 0.000 description 1
- 241001272567 Hominoidea Species 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000929319 Homo sapiens Actin, aortic smooth muscle Proteins 0.000 description 1
- 101000974816 Homo sapiens Calcium/calmodulin-dependent protein kinase type IV Proteins 0.000 description 1
- 101000813729 Homo sapiens ETS translocation variant 1 Proteins 0.000 description 1
- 101001046870 Homo sapiens Hypoxia-inducible factor 1-alpha Proteins 0.000 description 1
- 101000840258 Homo sapiens Immunoglobulin J chain Proteins 0.000 description 1
- 101000950710 Homo sapiens Mitogen-activated protein kinase 6 Proteins 0.000 description 1
- 101001092910 Homo sapiens Serum amyloid P-component Proteins 0.000 description 1
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 1
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 1
- 108010064711 Homoserine dehydrogenase Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 241000700588 Human alphaherpesvirus 1 Species 0.000 description 1
- 108700000788 Human immunodeficiency virus 1 tat peptide (47-57) Proteins 0.000 description 1
- 108700003968 Human immunodeficiency virus 1 tat peptide (49-57) Proteins 0.000 description 1
- 108010052919 Hydroxyethylthiazole kinase Proteins 0.000 description 1
- 102000004286 Hydroxymethylglutaryl CoA Reductases Human genes 0.000 description 1
- 108090000895 Hydroxymethylglutaryl CoA Reductases Proteins 0.000 description 1
- 108010027436 Hydroxymethylpyrimidine kinase Proteins 0.000 description 1
- 108030003831 Hygromycin-B 7''-O-kinases Proteins 0.000 description 1
- 241000257303 Hymenoptera Species 0.000 description 1
- 206010020772 Hypertension Diseases 0.000 description 1
- 206010020880 Hypertrophy Diseases 0.000 description 1
- 102100022875 Hypoxia-inducible factor 1-alpha Human genes 0.000 description 1
- 108010084635 ICI 200880 Proteins 0.000 description 1
- 208000024934 IgG4-related mediastinitis Diseases 0.000 description 1
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 1
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 1
- 102100029571 Immunoglobulin J chain Human genes 0.000 description 1
- 101000668058 Infectious salmon anemia virus (isolate Atlantic salmon/Norway/810/9/99) RNA-directed RNA polymerase catalytic subunit Proteins 0.000 description 1
- IMQLKJBTEOYOSI-GPIVLXJGSA-N Inositol-hexakisphosphate Chemical compound OP(O)(=O)O[C@H]1[C@H](OP(O)(O)=O)[C@@H](OP(O)(O)=O)[C@H](OP(O)(O)=O)[C@H](OP(O)(O)=O)[C@@H]1OP(O)(O)=O IMQLKJBTEOYOSI-GPIVLXJGSA-N 0.000 description 1
- 108010066338 Inositol-tetrakisphosphate 1-kinase Proteins 0.000 description 1
- 108030003665 Inositol-tetrakisphosphate 5-kinases Proteins 0.000 description 1
- 102100036403 Inositol-trisphosphate 3-kinase C Human genes 0.000 description 1
- 206010022489 Insulin Resistance Diseases 0.000 description 1
- 102100024392 Insulin gene enhancer protein ISL-1 Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 102000004125 Interleukin-1alpha Human genes 0.000 description 1
- 108010082786 Interleukin-1alpha Proteins 0.000 description 1
- 102000010790 Interleukin-3 Receptors Human genes 0.000 description 1
- 108010038452 Interleukin-3 Receptors Proteins 0.000 description 1
- 206010072877 Intestinal fibrosis Diseases 0.000 description 1
- 206010022998 Irritability Diseases 0.000 description 1
- LPHGQDQBBGAPDZ-UHFFFAOYSA-N Isocaffeine Natural products CN1C(=O)N(C)C(=O)C2=C1N(C)C=N2 LPHGQDQBBGAPDZ-UHFFFAOYSA-N 0.000 description 1
- 108010025815 Kanamycin Kinase Proteins 0.000 description 1
- 102000011782 Keratins Human genes 0.000 description 1
- 108010076876 Keratins Proteins 0.000 description 1
- 108010093008 Kinins Proteins 0.000 description 1
- 102000002397 Kinins Human genes 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- 108030003738 L-arabinokinases Proteins 0.000 description 1
- 102100040648 L-fucose kinase Human genes 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 108030003782 L-xylulokinases Proteins 0.000 description 1
- 241000282838 Lama Species 0.000 description 1
- 108010085895 Laminin Proteins 0.000 description 1
- 102000007547 Laminin Human genes 0.000 description 1
- 201000008197 Laryngitis Diseases 0.000 description 1
- YACHGFWEQXFSBS-UHFFFAOYSA-N Leptomycin B Natural products OC(=O)C=C(C)CC(C)C(O)C(C)C(=O)C(C)C=C(C)C=CCC(C)C=C(CC)C=CC1OC(=O)C=CC1C YACHGFWEQXFSBS-UHFFFAOYSA-N 0.000 description 1
- 241000186779 Listeria monocytogenes Species 0.000 description 1
- 229940110339 Long-acting muscarinic antagonist Drugs 0.000 description 1
- 208000008930 Low Back Pain Diseases 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 102000018247 Lymphocyte-specific proteins Human genes 0.000 description 1
- 108050007388 Lymphocyte-specific proteins Proteins 0.000 description 1
- 102000004083 Lymphotoxin-alpha Human genes 0.000 description 1
- 108090000542 Lymphotoxin-alpha Proteins 0.000 description 1
- 102000001291 MAP Kinase Kinase Kinase Human genes 0.000 description 1
- 108060006687 MAP kinase kinase kinase Proteins 0.000 description 1
- 102000000424 Matrix Metalloproteinase 2 Human genes 0.000 description 1
- 108010016165 Matrix Metalloproteinase 2 Proteins 0.000 description 1
- 102000001776 Matrix metalloproteinase-9 Human genes 0.000 description 1
- 201000005505 Measles Diseases 0.000 description 1
- 208000002805 Mediastinal fibrosis Diseases 0.000 description 1
- 201000009906 Meningitis Diseases 0.000 description 1
- 208000029725 Metabolic bone disease Diseases 0.000 description 1
- 102000005741 Metalloproteases Human genes 0.000 description 1
- 108010006035 Metalloproteases Proteins 0.000 description 1
- 102100039364 Metalloproteinase inhibitor 1 Human genes 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 102000002151 Microfilament Proteins Human genes 0.000 description 1
- 108010040897 Microfilament Proteins Proteins 0.000 description 1
- 102100037801 Mitogen-activated protein kinase 6 Human genes 0.000 description 1
- 102000005431 Molecular Chaperones Human genes 0.000 description 1
- 108010006519 Molecular Chaperones Proteins 0.000 description 1
- UCHDWCPVSPXUMX-TZIWLTJVSA-N Montelukast Chemical compound CC(C)(O)C1=CC=CC=C1CC[C@H](C=1C=C(\C=C\C=2N=C3C=C(Cl)C=CC3=CC=2)C=CC=1)SCC1(CC(O)=O)CC1 UCHDWCPVSPXUMX-TZIWLTJVSA-N 0.000 description 1
- 208000029549 Muscle injury Diseases 0.000 description 1
- 241000282339 Mustela Species 0.000 description 1
- 208000001572 Mycoplasma Pneumonia Diseases 0.000 description 1
- 201000008235 Mycoplasma pneumoniae pneumonia Diseases 0.000 description 1
- 201000003793 Myelodysplastic syndrome Diseases 0.000 description 1
- 208000021908 Myocardial disease Diseases 0.000 description 1
- 206010028594 Myocardial fibrosis Diseases 0.000 description 1
- 102000005640 Myosin Type II Human genes 0.000 description 1
- 108010045128 Myosin Type II Proteins 0.000 description 1
- 102100033341 N-acetylmannosamine kinase Human genes 0.000 description 1
- 108030003682 NAD(+) kinases Proteins 0.000 description 1
- ACFIXJIJDZMPPO-NNYOXOHSSA-N NADPH Chemical compound C1=CCC(C(=O)N)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OC[C@@H]2[C@H]([C@@H](OP(O)(O)=O)[C@@H](O2)N2C3=NC=NC(N)=C3N=C2)O)O1 ACFIXJIJDZMPPO-NNYOXOHSSA-N 0.000 description 1
- 102100021874 NADPH oxidase 3 Human genes 0.000 description 1
- 102000012064 NLR Proteins Human genes 0.000 description 1
- 108091005686 NOD-like receptors Proteins 0.000 description 1
- 206010029098 Neoplasm skin Diseases 0.000 description 1
- 108090000189 Neuropeptides Proteins 0.000 description 1
- 206010029333 Neurosis Diseases 0.000 description 1
- 102100029562 Nicotinamide riboside kinase 1 Human genes 0.000 description 1
- 108010011026 Nucleoside-triphosphate-adenylate kinase Proteins 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 206010030136 Oesophageal achalasia Diseases 0.000 description 1
- 206010053159 Organ failure Diseases 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- 241000289371 Ornithorhynchus anatinus Species 0.000 description 1
- 108010016852 Orthophosphate Dikinase Pyruvate Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 206010049088 Osteopenia Diseases 0.000 description 1
- 208000005141 Otitis Diseases 0.000 description 1
- 206010033296 Overdoses Diseases 0.000 description 1
- CBENFWSGALASAD-UHFFFAOYSA-N Ozone Chemical compound [O-][O+]=O CBENFWSGALASAD-UHFFFAOYSA-N 0.000 description 1
- 108010089484 PRM-151 Proteins 0.000 description 1
- 108010067372 Pancreatic elastase Proteins 0.000 description 1
- 102000016387 Pancreatic elastase Human genes 0.000 description 1
- 206010033647 Pancreatitis acute Diseases 0.000 description 1
- 208000037273 Pathologic Processes Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- BYPFEZZEUUWMEJ-UHFFFAOYSA-N Pentoxifylline Chemical compound O=C1N(CCCCC(=O)C)C(=O)N(C)C2=C1N(C)C=N2 BYPFEZZEUUWMEJ-UHFFFAOYSA-N 0.000 description 1
- 108091093037 Peptide nucleic acid Proteins 0.000 description 1
- 102000003993 Phosphatidylinositol 3-kinases Human genes 0.000 description 1
- 108090000430 Phosphatidylinositol 3-kinases Proteins 0.000 description 1
- 102100032615 Phosphatidylinositol 4-phosphate 5-kinase type-1 alpha Human genes 0.000 description 1
- 102100036137 Phosphatidylinositol 5-phosphate 4-kinase type-2 beta Human genes 0.000 description 1
- 108030003690 Phosphatidylinositol-4,5-bisphosphate 3-kinases Proteins 0.000 description 1
- 102000004138 Phosphoenolpyruvate carboxykinase (GTP) Human genes 0.000 description 1
- 108090000645 Phosphoenolpyruvate carboxykinase (GTP) Proteins 0.000 description 1
- 108700023219 Phosphoglycerate kinases Proteins 0.000 description 1
- 108030005835 Phosphooxymethylpyrimidine kinases Proteins 0.000 description 1
- 102000045595 Phosphoprotein Phosphatases Human genes 0.000 description 1
- 108700019535 Phosphoprotein Phosphatases Proteins 0.000 description 1
- IMQLKJBTEOYOSI-UHFFFAOYSA-N Phytic acid Natural products OP(O)(=O)OC1C(OP(O)(O)=O)C(OP(O)(O)=O)C(OP(O)(O)=O)C(OP(O)(O)=O)C1OP(O)(O)=O IMQLKJBTEOYOSI-UHFFFAOYSA-N 0.000 description 1
- 108010051742 Platelet-Derived Growth Factor beta Receptor Proteins 0.000 description 1
- 102100026547 Platelet-derived growth factor receptor beta Human genes 0.000 description 1
- 108010012887 Poly(A)-Binding Protein I Proteins 0.000 description 1
- 108010021757 Polynucleotide 5'-Hydroxyl-Kinase Proteins 0.000 description 1
- 102000008422 Polynucleotide 5'-hydroxyl-kinase Human genes 0.000 description 1
- 208000005107 Premature Birth Diseases 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 201000001068 Prinzmetal angina Diseases 0.000 description 1
- 108090001084 Propionate kinases Proteins 0.000 description 1
- 108010076504 Protein Sorting Signals Proteins 0.000 description 1
- 101710149951 Protein Tat Proteins 0.000 description 1
- 108030003968 Protein-N(pi)-phosphohistidine-N-acetylmuramate phosphotransferases Proteins 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 206010061924 Pulmonary toxicity Diseases 0.000 description 1
- 101710148009 Putative uracil phosphoribosyltransferase Proteins 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 102000011346 Pyruvate Dehydrogenase (Lipoamide) Human genes 0.000 description 1
- 108010023576 Pyruvate Dehydrogenase (Lipoamide) Proteins 0.000 description 1
- 102000013009 Pyruvate Kinase Human genes 0.000 description 1
- 108020005115 Pyruvate Kinase Proteins 0.000 description 1
- 102100033810 RAC-alpha serine/threonine-protein kinase Human genes 0.000 description 1
- 102000044126 RNA-Binding Proteins Human genes 0.000 description 1
- 101710105008 RNA-binding protein Proteins 0.000 description 1
- 238000011529 RT qPCR Methods 0.000 description 1
- 208000019155 Radiation injury Diseases 0.000 description 1
- 208000003782 Raynaud disease Diseases 0.000 description 1
- 208000018569 Respiratory Tract disease Diseases 0.000 description 1
- 206010057190 Respiratory tract infections Diseases 0.000 description 1
- 108091027981 Response element Proteins 0.000 description 1
- 208000030934 Restrictive pulmonary disease Diseases 0.000 description 1
- 108090000799 Rhodopsin kinases Proteins 0.000 description 1
- 108700006309 Ribokinases Proteins 0.000 description 1
- 108010083644 Ribonucleases Proteins 0.000 description 1
- 102000006382 Ribonucleases Human genes 0.000 description 1
- 102000004389 Ribonucleoproteins Human genes 0.000 description 1
- 108010081734 Ribonucleoproteins Proteins 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 1
- 101150001535 SRC gene Proteins 0.000 description 1
- 101710184528 Scaffolding protein Proteins 0.000 description 1
- 101100395426 Schizosaccharomyces pombe (strain 972 / ATCC 24843) sty1 gene Proteins 0.000 description 1
- 208000034189 Sclerosis Diseases 0.000 description 1
- 102000002255 Secretory Proteinase Inhibitory Proteins Human genes 0.000 description 1
- 108010000303 Secretory Proteinase Inhibitory Proteins Proteins 0.000 description 1
- GIIZNNXWQWCKIB-UHFFFAOYSA-N Serevent Chemical compound C1=C(O)C(CO)=CC(C(O)CNCCCCCCOCCCCC=2C=CC=CC=2)=C1 GIIZNNXWQWCKIB-UHFFFAOYSA-N 0.000 description 1
- 102000012479 Serine Proteases Human genes 0.000 description 1
- 108010022999 Serine Proteases Proteins 0.000 description 1
- 102100027911 Serine/threonine-protein kinase PAK 3 Human genes 0.000 description 1
- 101710148163 Serine/threonine-protein kinase PAK 3 Proteins 0.000 description 1
- 102100023085 Serine/threonine-protein kinase mTOR Human genes 0.000 description 1
- 102100036202 Serum amyloid P-component Human genes 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- 102000008063 Small Heat-Shock Proteins Human genes 0.000 description 1
- 108010088928 Small Heat-Shock Proteins Proteins 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- 241000187747 Streptomyces Species 0.000 description 1
- 241001147844 Streptomyces verticillus Species 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 108010022348 Sulfate adenylyltransferase Proteins 0.000 description 1
- OUUQCZGPVNCOIJ-UHFFFAOYSA-M Superoxide Chemical compound [O-][O] OUUQCZGPVNCOIJ-UHFFFAOYSA-M 0.000 description 1
- 102000019361 Syndecan Human genes 0.000 description 1
- 108050006774 Syndecan Proteins 0.000 description 1
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 1
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 1
- 108010065917 TOR Serine-Threonine Kinases Proteins 0.000 description 1
- 108700023399 Tagatose-6-phosphate kinases Proteins 0.000 description 1
- 102000030766 Thiamin Pyrophosphokinase Human genes 0.000 description 1
- 108010001088 Thiamin pyrophosphokinase Proteins 0.000 description 1
- 102100037495 Thiamin pyrophosphokinase 1 Human genes 0.000 description 1
- 108030007080 Thiamine-phosphate kinases Proteins 0.000 description 1
- 208000001435 Thromboembolism Diseases 0.000 description 1
- 102100037357 Thymidylate kinase Human genes 0.000 description 1
- 108010031374 Tissue Inhibitor of Metalloproteinase-1 Proteins 0.000 description 1
- 102000002689 Toll-like receptor Human genes 0.000 description 1
- 108020000411 Toll-like receptor Proteins 0.000 description 1
- 206010051867 Tracheal injury Diseases 0.000 description 1
- 108090000325 Transferred entry: 2.7.11.14 Proteins 0.000 description 1
- 108090000339 Transferred entry: 2.7.11.17 Proteins 0.000 description 1
- 102000011117 Transforming Growth Factor beta2 Human genes 0.000 description 1
- 108010009583 Transforming Growth Factors Proteins 0.000 description 1
- 102000009618 Transforming Growth Factors Human genes 0.000 description 1
- 101800000304 Transforming growth factor beta-2 Proteins 0.000 description 1
- 102000056172 Transforming growth factor beta-3 Human genes 0.000 description 1
- 108090000097 Transforming growth factor beta-3 Proteins 0.000 description 1
- 206010060872 Transplant failure Diseases 0.000 description 1
- 208000030886 Traumatic Brain injury Diseases 0.000 description 1
- 102000044632 Tuberous Sclerosis Complex 1 Human genes 0.000 description 1
- 102000001742 Tumor Suppressor Proteins Human genes 0.000 description 1
- 108010040002 Tumor Suppressor Proteins Proteins 0.000 description 1
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 1
- 206010054094 Tumour necrosis Diseases 0.000 description 1
- 108091000117 Tyrosine 3-Monooxygenase Proteins 0.000 description 1
- 102000048218 Tyrosine 3-monooxygenases Human genes 0.000 description 1
- 108020000553 UMP kinase Proteins 0.000 description 1
- IVOMOUWHDPKRLL-UHFFFAOYSA-N UNPD107823 Natural products O1C2COP(O)(=O)OC2C(O)C1N1C(N=CN=C2N)=C2N=C1 IVOMOUWHDPKRLL-UHFFFAOYSA-N 0.000 description 1
- 108700023183 UTP-glucose-1-phosphate uridylyltransferases Proteins 0.000 description 1
- LEHOTFFKMJEONL-UHFFFAOYSA-N Uric Acid Chemical compound N1C(=O)NC(=O)C2=C1NC(=O)N2 LEHOTFFKMJEONL-UHFFFAOYSA-N 0.000 description 1
- TVWHNULVHGKJHS-UHFFFAOYSA-N Uric acid Natural products N1C(=O)NC(=O)C2NC(=O)NC21 TVWHNULVHGKJHS-UHFFFAOYSA-N 0.000 description 1
- 102000007410 Uridine kinase Human genes 0.000 description 1
- 208000024780 Urticaria Diseases 0.000 description 1
- 101150117115 V gene Proteins 0.000 description 1
- 238000005411 Van der Waals force Methods 0.000 description 1
- 208000009325 Variant Angina Pectoris Diseases 0.000 description 1
- 206010053648 Vascular occlusion Diseases 0.000 description 1
- 206010072810 Vascular wall hypertrophy Diseases 0.000 description 1
- 206010047115 Vasculitis Diseases 0.000 description 1
- 206010047139 Vasoconstriction Diseases 0.000 description 1
- 206010047249 Venous thrombosis Diseases 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 241000256856 Vespidae Species 0.000 description 1
- 102000013127 Vimentin Human genes 0.000 description 1
- 108010065472 Vimentin Proteins 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 102100029089 Xylulose kinase Human genes 0.000 description 1
- 108010019752 ZD 8321 Proteins 0.000 description 1
- 102000036861 Zinc-dependent endopeptidases Human genes 0.000 description 1
- 108091006982 Zinc-dependent endopeptidases Proteins 0.000 description 1
- 241000981595 Zoysia japonica Species 0.000 description 1
- 108030005443 [Beta-adrenergic-receptor] kinases Proteins 0.000 description 1
- 108030004417 [Myosin heavy-chain] kinases Proteins 0.000 description 1
- 108030005457 [Myosin light-chain] kinases Proteins 0.000 description 1
- BDKZHNJTLHOSDW-UHFFFAOYSA-N [Na].CC(O)=O Chemical compound [Na].CC(O)=O BDKZHNJTLHOSDW-UHFFFAOYSA-N 0.000 description 1
- 108030005451 [RNA-polymerase]-subunit kinases Proteins 0.000 description 1
- 108030005454 [Tau protein] kinases Proteins 0.000 description 1
- 210000000683 abdominal cavity Anatomy 0.000 description 1
- 231100000818 accidental exposure Toxicity 0.000 description 1
- 201000000621 achalasia Diseases 0.000 description 1
- 229940099550 actimmune Drugs 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000009798 acute exacerbation Effects 0.000 description 1
- 201000003229 acute pancreatitis Diseases 0.000 description 1
- 230000004658 acute-phase response Effects 0.000 description 1
- 229960000643 adenine Drugs 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 238000009098 adjuvant therapy Methods 0.000 description 1
- 208000037883 airway inflammation Diseases 0.000 description 1
- NDAUXUAQIAJITI-UHFFFAOYSA-N albuterol Chemical compound CC(C)(C)NCC(O)C1=CC=C(O)C(CO)=C1 NDAUXUAQIAJITI-UHFFFAOYSA-N 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 239000013566 allergen Substances 0.000 description 1
- 208000037884 allergic airway inflammation Diseases 0.000 description 1
- 208000030961 allergic reaction Diseases 0.000 description 1
- 208000028004 allergic respiratory disease Diseases 0.000 description 1
- 102000015395 alpha 1-Antitrypsin Human genes 0.000 description 1
- 108010050122 alpha 1-Antitrypsin Proteins 0.000 description 1
- 229940024142 alpha 1-antitrypsin Drugs 0.000 description 1
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- OUJTZYPIHDYQMC-LJQANCHMSA-N ambrisentan Chemical compound O([C@@H](C(OC)(C=1C=CC=CC=1)C=1C=CC=CC=1)C(O)=O)C1=NC(C)=CC(C)=N1 OUJTZYPIHDYQMC-LJQANCHMSA-N 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- FQPFAHBPWDRTLU-UHFFFAOYSA-N aminophylline Chemical compound NCCN.O=C1N(C)C(=O)N(C)C2=C1NC=N2.O=C1N(C)C(=O)N(C)C2=C1NC=N2 FQPFAHBPWDRTLU-UHFFFAOYSA-N 0.000 description 1
- 229960003556 aminophylline Drugs 0.000 description 1
- 229960005260 amiodarone Drugs 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 238000004873 anchoring Methods 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 230000001078 anti-cholinergic effect Effects 0.000 description 1
- 230000003092 anti-cytokine Effects 0.000 description 1
- 230000001475 anti-trypsic effect Effects 0.000 description 1
- 230000009830 antibody antigen interaction Effects 0.000 description 1
- 239000003146 anticoagulant agent Substances 0.000 description 1
- 229940127219 anticoagulant drug Drugs 0.000 description 1
- 229940082620 antifibrinolytics Drugs 0.000 description 1
- 229940034982 antineoplastic agent Drugs 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 229940045988 antineoplastic drug protein kinase inhibitors Drugs 0.000 description 1
- 210000000709 aorta Anatomy 0.000 description 1
- 230000001640 apoptogenic effect Effects 0.000 description 1
- 230000005735 apoptotic response Effects 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 1
- 206010003441 asbestosis Diseases 0.000 description 1
- 108091061238 aspartokinase family Proteins 0.000 description 1
- 210000001130 astrocyte Anatomy 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 230000003305 autocrine Effects 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- 230000006472 autoimmune response Effects 0.000 description 1
- 229960002170 azathioprine Drugs 0.000 description 1
- LMEKQMALGUDUQG-UHFFFAOYSA-N azathioprine Chemical compound CN1C=NC([N+]([O-])=O)=C1SC1=NC=NC2=C1NC=N2 LMEKQMALGUDUQG-UHFFFAOYSA-N 0.000 description 1
- 208000022362 bacterial infectious disease Diseases 0.000 description 1
- 244000052616 bacterial pathogen Species 0.000 description 1
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 229940053013 bio-mycin Drugs 0.000 description 1
- 208000034158 bleeding Diseases 0.000 description 1
- 230000000740 bleeding effect Effects 0.000 description 1
- 239000010836 blood and blood product Substances 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- 229940125691 blood product Drugs 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 208000015322 bone marrow disease Diseases 0.000 description 1
- 238000010322 bone marrow transplantation Methods 0.000 description 1
- 230000036471 bradycardia Effects 0.000 description 1
- 210000000621 bronchi Anatomy 0.000 description 1
- 201000009267 bronchiectasis Diseases 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 229960002092 busulfan Drugs 0.000 description 1
- 239000001273 butane Substances 0.000 description 1
- 210000001217 buttock Anatomy 0.000 description 1
- 229910052793 cadmium Inorganic materials 0.000 description 1
- BDOSMKKIYDKNTQ-UHFFFAOYSA-N cadmium atom Chemical compound [Cd] BDOSMKKIYDKNTQ-UHFFFAOYSA-N 0.000 description 1
- 229960001948 caffeine Drugs 0.000 description 1
- VJEONQKOZGKCAK-UHFFFAOYSA-N caffeine Natural products CN1C(=O)N(C)C(=O)C2=C1C=CN2C VJEONQKOZGKCAK-UHFFFAOYSA-N 0.000 description 1
- FUFJGUQYACFECW-UHFFFAOYSA-L calcium hydrogenphosphate Chemical compound [Ca+2].OP([O-])([O-])=O FUFJGUQYACFECW-UHFFFAOYSA-L 0.000 description 1
- 235000011132 calcium sulphate Nutrition 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 229940082638 cardiac stimulant phosphodiesterase inhibitors Drugs 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 239000003518 caustics Substances 0.000 description 1
- 230000020411 cell activation Effects 0.000 description 1
- 230000021164 cell adhesion Effects 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 239000013592 cell lysate Substances 0.000 description 1
- 230000009087 cell motility Effects 0.000 description 1
- 230000005890 cell-mediated cytotoxicity Effects 0.000 description 1
- 230000030570 cellular localization Effects 0.000 description 1
- 230000008709 cellular rearrangement Effects 0.000 description 1
- 230000005754 cellular signaling Effects 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 125000003636 chemical group Chemical group 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 230000014564 chemokine production Effects 0.000 description 1
- KYKAJFCTULSVSH-UHFFFAOYSA-N chloro(fluoro)methane Chemical compound F[C]Cl KYKAJFCTULSVSH-UHFFFAOYSA-N 0.000 description 1
- 229940059329 chondroitin sulfate Drugs 0.000 description 1
- 230000002759 chromosomal effect Effects 0.000 description 1
- 208000013116 chronic cough Diseases 0.000 description 1
- 229950001653 cilomilast Drugs 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 230000035602 clotting Effects 0.000 description 1
- 206010009887 colitis Diseases 0.000 description 1
- 229960005188 collagen Drugs 0.000 description 1
- 229940075614 colloidal silicon dioxide Drugs 0.000 description 1
- 238000004883 computer application Methods 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 210000001608 connective tissue cell Anatomy 0.000 description 1
- 208000018631 connective tissue disease Diseases 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 230000037020 contractile activity Effects 0.000 description 1
- 230000009989 contractile response Effects 0.000 description 1
- 208000006111 contracture Diseases 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 238000010411 cooking Methods 0.000 description 1
- 210000004087 cornea Anatomy 0.000 description 1
- 210000003618 cortical neuron Anatomy 0.000 description 1
- 230000004940 costimulation Effects 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 230000009260 cross reactivity Effects 0.000 description 1
- 229940095074 cyclic amp Drugs 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 208000031513 cyst Diseases 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 230000016396 cytokine production Effects 0.000 description 1
- 230000007711 cytoplasmic localization Effects 0.000 description 1
- 229940104302 cytosine Drugs 0.000 description 1
- 108010000742 dTMP kinase Proteins 0.000 description 1
- 230000002354 daily effect Effects 0.000 description 1
- 229940006829 daliresp Drugs 0.000 description 1
- 230000000254 damaging effect Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 238000011257 definitive treatment Methods 0.000 description 1
- 239000003398 denaturant Substances 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 108010007340 deoxyadenosine kinase Proteins 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- 230000001066 destructive effect Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 238000001784 detoxification Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 235000019700 dicalcium phosphate Nutrition 0.000 description 1
- PXBRQCKWGAHEHS-UHFFFAOYSA-N dichlorodifluoromethane Chemical compound FC(F)(Cl)Cl PXBRQCKWGAHEHS-UHFFFAOYSA-N 0.000 description 1
- 235000019404 dichlorodifluoromethane Nutrition 0.000 description 1
- UMNKXPULIDJLSU-UHFFFAOYSA-N dichlorofluoromethane Chemical compound FC(Cl)Cl UMNKXPULIDJLSU-UHFFFAOYSA-N 0.000 description 1
- 229940099364 dichlorofluoromethane Drugs 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000000378 dietary effect Effects 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 125000002228 disulfide group Chemical group 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 231100000725 drug overdose Toxicity 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 208000019258 ear infection Diseases 0.000 description 1
- 208000002296 eclampsia Diseases 0.000 description 1
- 150000002066 eicosanoids Chemical class 0.000 description 1
- 101150000123 elav gene Proteins 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 230000013020 embryo development Effects 0.000 description 1
- 230000002996 emotional effect Effects 0.000 description 1
- 230000002124 endocrine Effects 0.000 description 1
- 230000008694 endothelial dysfunction Effects 0.000 description 1
- 108091007231 endothelial receptors Proteins 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 239000003344 environmental pollutant Substances 0.000 description 1
- 238000003912 environmental pollution Methods 0.000 description 1
- 239000003256 environmental substance Substances 0.000 description 1
- 210000000222 eosinocyte Anatomy 0.000 description 1
- 230000007705 epithelial mesenchymal transition Effects 0.000 description 1
- 230000003628 erosive effect Effects 0.000 description 1
- 108010031246 erythritol kinase Proteins 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 229960000403 etanercept Drugs 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 210000001723 extracellular space Anatomy 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 229940012952 fibrinogen Drugs 0.000 description 1
- 239000003527 fibrinolytic agent Substances 0.000 description 1
- 230000003480 fibrinolytic effect Effects 0.000 description 1
- 230000035161 fibroblast apoptotic process Effects 0.000 description 1
- 230000003352 fibrogenic effect Effects 0.000 description 1
- 230000000893 fibroproliferative effect Effects 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 229960001469 fluticasone furoate Drugs 0.000 description 1
- XTULMSXFIHGYFS-VLSRWLAYSA-N fluticasone furoate Chemical compound O([C@]1([C@@]2(C)C[C@H](O)[C@]3(F)[C@@]4(C)C=CC(=O)C=C4[C@@H](F)C[C@H]3[C@@H]2C[C@H]1C)C(=O)SCF)C(=O)C1=CC=CO1 XTULMSXFIHGYFS-VLSRWLAYSA-N 0.000 description 1
- 229960000289 fluticasone propionate Drugs 0.000 description 1
- WMWTYOKRWGGJOA-CENSZEJFSA-N fluticasone propionate Chemical compound C1([C@@H](F)C2)=CC(=O)C=C[C@]1(C)[C@]1(F)[C@@H]2[C@@H]2C[C@@H](C)[C@@](C(=O)SCF)(OC(=O)CC)[C@@]2(C)C[C@@H]1O WMWTYOKRWGGJOA-CENSZEJFSA-N 0.000 description 1
- 235000020932 food allergy Nutrition 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 239000002803 fossil fuel Substances 0.000 description 1
- 108010083136 fucokinase Proteins 0.000 description 1
- 239000000446 fuel Substances 0.000 description 1
- 230000005714 functional activity Effects 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- UIWYJDYFSGRHKR-UHFFFAOYSA-N gadolinium atom Chemical compound [Gd] UIWYJDYFSGRHKR-UHFFFAOYSA-N 0.000 description 1
- 230000006251 gamma-carboxylation Effects 0.000 description 1
- 229940044627 gamma-interferon Drugs 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 210000004907 gland Anatomy 0.000 description 1
- 229940080856 gleevec Drugs 0.000 description 1
- 230000007387 gliosis Effects 0.000 description 1
- 102000034238 globular proteins Human genes 0.000 description 1
- 108091005896 globular proteins Proteins 0.000 description 1
- 206010061989 glomerulosclerosis Diseases 0.000 description 1
- 239000003862 glucocorticoid Substances 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-L glutamate group Chemical group N[C@@H](CCC(=O)[O-])C(=O)[O-] WHUUTDBJXJRKMK-VKHMYHEASA-L 0.000 description 1
- 125000000291 glutamic acid group Chemical group N[C@@H](CCC(O)=O)C(=O)* 0.000 description 1
- 125000000404 glutamine group Chemical group N[C@@H](CCC(N)=O)C(=O)* 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 108020004445 glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 210000002175 goblet cell Anatomy 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 101150090422 gsk-3 gene Proteins 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 230000009931 harmful effect Effects 0.000 description 1
- 239000000383 hazardous chemical Substances 0.000 description 1
- 231100000869 headache Toxicity 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 229910001385 heavy metal Inorganic materials 0.000 description 1
- 230000002949 hemolytic effect Effects 0.000 description 1
- 230000011132 hemopoiesis Effects 0.000 description 1
- 230000002439 hemostatic effect Effects 0.000 description 1
- 210000003494 hepatocyte Anatomy 0.000 description 1
- 206010019847 hepatosplenomegaly Diseases 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 229960001340 histamine Drugs 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 238000010562 histological examination Methods 0.000 description 1
- 230000007768 histopathological growth pattern Effects 0.000 description 1
- 230000013632 homeostatic process Effects 0.000 description 1
- 239000008240 homogeneous mixture Substances 0.000 description 1
- 229920001519 homopolymer Polymers 0.000 description 1
- 101150003074 hoxa5 gene Proteins 0.000 description 1
- 210000004754 hybrid cell Anatomy 0.000 description 1
- 239000008172 hydrogenated vegetable oil Substances 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 230000033444 hydroxylation Effects 0.000 description 1
- 238000005805 hydroxylation reaction Methods 0.000 description 1
- 229920003063 hydroxymethyl cellulose Polymers 0.000 description 1
- 229940031574 hydroxymethyl cellulose Drugs 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 108010002685 hygromycin-B kinase Proteins 0.000 description 1
- 230000009610 hypersensitivity Effects 0.000 description 1
- 210000003016 hypothalamus Anatomy 0.000 description 1
- 230000007954 hypoxia Effects 0.000 description 1
- 229960002240 iloprost Drugs 0.000 description 1
- 229960002411 imatinib Drugs 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 230000003053 immunization Effects 0.000 description 1
- 238000002649 immunization Methods 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 238000002991 immunohistochemical analysis Methods 0.000 description 1
- 238000002650 immunosuppressive therapy Methods 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 201000001881 impotence Diseases 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- QZZUEBNBZAPZLX-QFIPXVFZSA-N indacaterol Chemical compound N1C(=O)C=CC2=C1C(O)=CC=C2[C@@H](O)CNC1CC(C=C(C(=C2)CC)CC)=C2C1 QZZUEBNBZAPZLX-QFIPXVFZSA-N 0.000 description 1
- 238000003905 indoor air pollution Methods 0.000 description 1
- 239000012678 infectious agent Substances 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 230000003960 inflammatory cascade Effects 0.000 description 1
- 230000004968 inflammatory condition Effects 0.000 description 1
- 208000037797 influenza A Diseases 0.000 description 1
- 230000004941 influx Effects 0.000 description 1
- 238000002664 inhalation therapy Methods 0.000 description 1
- 210000005007 innate immune system Anatomy 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 108010090448 insulin gene enhancer binding protein Isl-1 Proteins 0.000 description 1
- 229960003130 interferon gamma Drugs 0.000 description 1
- 108010042414 interferon gamma-1b Proteins 0.000 description 1
- 229940047124 interferons Drugs 0.000 description 1
- 229940076144 interleukin-10 Drugs 0.000 description 1
- 230000017306 interleukin-6 production Effects 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 230000010262 intracellular communication Effects 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 229960001361 ipratropium bromide Drugs 0.000 description 1
- KEWHKYJURDBRMN-ZEODDXGYSA-M ipratropium bromide hydrate Chemical compound O.[Br-].O([C@H]1C[C@H]2CC[C@@H](C1)[N@@+]2(C)C(C)C)C(=O)C(CO)C1=CC=CC=C1 KEWHKYJURDBRMN-ZEODDXGYSA-M 0.000 description 1
- 239000002085 irritant Substances 0.000 description 1
- 231100000021 irritant Toxicity 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 230000000302 ischemic effect Effects 0.000 description 1
- 238000005304 joining Methods 0.000 description 1
- 210000001503 joint Anatomy 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- YACHGFWEQXFSBS-XYERBDPFSA-N leptomycin B Chemical compound OC(=O)/C=C(C)/C[C@H](C)[C@@H](O)[C@H](C)C(=O)[C@H](C)/C=C(\C)/C=C/C[C@@H](C)/C=C(/CC)\C=C\[C@@H]1OC(=O)C=C[C@@H]1C YACHGFWEQXFSBS-XYERBDPFSA-N 0.000 description 1
- 229940090243 letairis Drugs 0.000 description 1
- 239000003591 leukocyte elastase inhibitor Substances 0.000 description 1
- 230000037356 lipid metabolism Effects 0.000 description 1
- 230000004576 lipid-binding Effects 0.000 description 1
- FCCDDURTIIUXBY-UHFFFAOYSA-N lipoamide Chemical compound NC(=O)CCCCC1CCSS1 FCCDDURTIIUXBY-UHFFFAOYSA-N 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 229940127212 long-acting beta 2 agonist Drugs 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 230000005980 lung dysfunction Effects 0.000 description 1
- 238000013123 lung function test Methods 0.000 description 1
- 230000032646 lung growth Effects 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 239000003580 lung surfactant Substances 0.000 description 1
- 210000002751 lymph Anatomy 0.000 description 1
- 210000004324 lymphatic system Anatomy 0.000 description 1
- 230000000527 lymphocytic effect Effects 0.000 description 1
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 210000003712 lysosome Anatomy 0.000 description 1
- 230000001868 lysosomic effect Effects 0.000 description 1
- 102000033952 mRNA binding proteins Human genes 0.000 description 1
- 108091000373 mRNA binding proteins Proteins 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 210000001161 mammalian embryo Anatomy 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 210000001370 mediastinum Anatomy 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 210000002901 mesenchymal stem cell Anatomy 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 125000001360 methionine group Chemical group N[C@@H](CCSC)C(=O)* 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 238000001000 micrograph Methods 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 239000003595 mist Substances 0.000 description 1
- 230000011278 mitosis Effects 0.000 description 1
- 230000000394 mitotic effect Effects 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 229960005127 montelukast Drugs 0.000 description 1
- 230000000877 morphologic effect Effects 0.000 description 1
- 210000000947 motile cell Anatomy 0.000 description 1
- 230000004899 motility Effects 0.000 description 1
- 230000000420 mucociliary effect Effects 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- 239000000472 muscarinic agonist Substances 0.000 description 1
- 230000003680 myocardial damage Effects 0.000 description 1
- 210000004165 myocardium Anatomy 0.000 description 1
- IJDNQMDRQITEOD-UHFFFAOYSA-N n-butane Chemical compound CCCC IJDNQMDRQITEOD-UHFFFAOYSA-N 0.000 description 1
- DIOQZVSQGTUSAI-UHFFFAOYSA-N n-butylhexane Natural products CCCCCCCCCC DIOQZVSQGTUSAI-UHFFFAOYSA-N 0.000 description 1
- OFBQJSOFQDEBGM-UHFFFAOYSA-N n-pentane Natural products CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 230000001338 necrotic effect Effects 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 210000002569 neuron Anatomy 0.000 description 1
- 230000016273 neuron death Effects 0.000 description 1
- 108010064131 neuronal Cdk5 activator (p25-p35) Proteins 0.000 description 1
- 201000001119 neuropathy Diseases 0.000 description 1
- 230000007823 neuropathy Effects 0.000 description 1
- 208000015238 neurotic disease Diseases 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 210000004493 neutrocyte Anatomy 0.000 description 1
- 230000003448 neutrophilic effect Effects 0.000 description 1
- 239000002547 new drug Substances 0.000 description 1
- 108010021066 nicotinamide riboside kinase Proteins 0.000 description 1
- 229930027945 nicotinamide-adenine dinucleotide Natural products 0.000 description 1
- 229960004378 nintedanib Drugs 0.000 description 1
- XZXHXSATPCNXJR-ZIADKAODSA-N nintedanib Chemical compound O=C1NC2=CC(C(=O)OC)=CC=C2\C1=C(C=1C=CC=CC=1)\NC(C=C1)=CC=C1N(C)C(=O)CN1CCN(C)CC1 XZXHXSATPCNXJR-ZIADKAODSA-N 0.000 description 1
- 229960000564 nitrofurantoin Drugs 0.000 description 1
- NXFQHRVNIOXGAQ-YCRREMRBSA-N nitrofurantoin Chemical compound O1C([N+](=O)[O-])=CC=C1\C=N\N1C(=O)NC(=O)C1 NXFQHRVNIOXGAQ-YCRREMRBSA-N 0.000 description 1
- JCXJVPUVTGWSNB-UHFFFAOYSA-N nitrogen dioxide Inorganic materials O=[N]=O JCXJVPUVTGWSNB-UHFFFAOYSA-N 0.000 description 1
- 206010053219 non-alcoholic steatohepatitis Diseases 0.000 description 1
- 239000012457 nonaqueous media Substances 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 230000006548 oncogenic transformation Effects 0.000 description 1
- 102000027450 oncoproteins Human genes 0.000 description 1
- 108091008819 oncoproteins Proteins 0.000 description 1
- 230000004768 organ dysfunction Effects 0.000 description 1
- 210000004789 organ system Anatomy 0.000 description 1
- 210000003463 organelle Anatomy 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- 201000008482 osteoarthritis Diseases 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 230000036542 oxidative stress Effects 0.000 description 1
- 238000002640 oxygen therapy Methods 0.000 description 1
- 238000006213 oxygenation reaction Methods 0.000 description 1
- 229940094443 oxytocics prostaglandins Drugs 0.000 description 1
- 230000003076 paracrine Effects 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000013618 particulate matter Substances 0.000 description 1
- 231100000915 pathological change Toxicity 0.000 description 1
- 230000036285 pathological change Effects 0.000 description 1
- 230000009054 pathological process Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 230000035778 pathophysiological process Effects 0.000 description 1
- 230000007310 pathophysiology Effects 0.000 description 1
- 235000010987 pectin Nutrition 0.000 description 1
- 239000001814 pectin Substances 0.000 description 1
- 229920001277 pectin Polymers 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 229960001639 penicillamine Drugs 0.000 description 1
- 150000002972 pentoses Chemical group 0.000 description 1
- 229960001476 pentoxifylline Drugs 0.000 description 1
- 108010091748 peptide A Proteins 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 210000005105 peripheral blood lymphocyte Anatomy 0.000 description 1
- 208000033808 peripheral neuropathy Diseases 0.000 description 1
- 150000002978 peroxides Chemical class 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 238000009522 phase III clinical trial Methods 0.000 description 1
- 239000002571 phosphodiesterase inhibitor Substances 0.000 description 1
- 108010064607 phosphoglucokinase Proteins 0.000 description 1
- GWNZDVLCWHAMGQ-RWOHWRPJSA-N phosphono dihydrogen phosphate;[(2r,3r,4s)-2,3,4,6-tetrahydroxy-5-oxohexyl] dihydrogen phosphate Chemical compound OP(O)(=O)OP(O)(O)=O.OCC(=O)[C@@H](O)[C@H](O)[C@H](O)COP(O)(O)=O GWNZDVLCWHAMGQ-RWOHWRPJSA-N 0.000 description 1
- 229940068041 phytic acid Drugs 0.000 description 1
- 229960003073 pirfenidone Drugs 0.000 description 1
- 230000010118 platelet activation Effects 0.000 description 1
- 230000004983 pleiotropic effect Effects 0.000 description 1
- 231100000374 pneumotoxicity Toxicity 0.000 description 1
- 231100000614 poison Toxicity 0.000 description 1
- 231100000719 pollutant Toxicity 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 230000000379 polymerizing effect Effects 0.000 description 1
- 239000003910 polypeptide antibiotic agent Substances 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 208000007232 portal hypertension Diseases 0.000 description 1
- 230000008092 positive effect Effects 0.000 description 1
- 230000001124 posttranscriptional effect Effects 0.000 description 1
- 230000001323 posttranslational effect Effects 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000037452 priming Effects 0.000 description 1
- 230000000861 pro-apoptotic effect Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 239000001294 propane Substances 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 150000003815 prostacyclins Chemical class 0.000 description 1
- 230000004853 protein function Effects 0.000 description 1
- 239000003909 protein kinase inhibitor Substances 0.000 description 1
- 238000001243 protein synthesis Methods 0.000 description 1
- 230000004850 protein–protein interaction Effects 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 210000004879 pulmonary tissue Anatomy 0.000 description 1
- 230000007047 pulmonary toxicity Effects 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- 230000001698 pyrogenic effect Effects 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- 102000009929 raf Kinases Human genes 0.000 description 1
- 108010077182 raf Kinases Proteins 0.000 description 1
- 239000003642 reactive oxygen metabolite Substances 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 230000002468 redox effect Effects 0.000 description 1
- 230000037309 reepithelialization Effects 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 230000011053 regulation of cytokine biosynthetic process Effects 0.000 description 1
- 210000003289 regulatory T cell Anatomy 0.000 description 1
- 230000008844 regulatory mechanism Effects 0.000 description 1
- 206010038464 renal hypertension Diseases 0.000 description 1
- 210000005084 renal tissue Anatomy 0.000 description 1
- 230000008521 reorganization Effects 0.000 description 1
- 239000005871 repellent Substances 0.000 description 1
- 230000002940 repellent Effects 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 230000008458 response to injury Effects 0.000 description 1
- 208000037803 restenosis Diseases 0.000 description 1
- 230000000284 resting effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 108010041788 rho-Associated Kinases Proteins 0.000 description 1
- 102000000568 rho-Associated Kinases Human genes 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- 108020002667 ribulokinase Proteins 0.000 description 1
- 229940121324 romilkimab Drugs 0.000 description 1
- 229960002052 salbutamol Drugs 0.000 description 1
- 229960004017 salmeterol Drugs 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 231100000241 scar Toxicity 0.000 description 1
- 230000036573 scar formation Effects 0.000 description 1
- 239000006152 selective media Substances 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000002864 sequence alignment Methods 0.000 description 1
- 229940076279 serotonin Drugs 0.000 description 1
- 108010090004 serum response factor kinase Proteins 0.000 description 1
- 230000035939 shock Effects 0.000 description 1
- 229940127211 short-acting beta 2 agonist Drugs 0.000 description 1
- 208000013220 shortness of breath Diseases 0.000 description 1
- 229960003310 sildenafil Drugs 0.000 description 1
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 235000012239 silicon dioxide Nutrition 0.000 description 1
- BTGNGJJLZOIYID-UHFFFAOYSA-N sivelestat Chemical compound C1=CC(OC(=O)C(C)(C)C)=CC=C1S(=O)(=O)NC1=CC=CC=C1C(=O)NCC(O)=O BTGNGJJLZOIYID-UHFFFAOYSA-N 0.000 description 1
- 210000002027 skeletal muscle Anatomy 0.000 description 1
- 210000001626 skin fibroblast Anatomy 0.000 description 1
- 206010040882 skin lesion Diseases 0.000 description 1
- 231100000444 skin lesion Toxicity 0.000 description 1
- 238000009936 smoking Methods 0.000 description 1
- 230000005586 smoking cessation Effects 0.000 description 1
- 230000016160 smooth muscle contraction Effects 0.000 description 1
- WXMKPNITSTVMEF-UHFFFAOYSA-M sodium benzoate Chemical compound [Na+].[O-]C(=O)C1=CC=CC=C1 WXMKPNITSTVMEF-UHFFFAOYSA-M 0.000 description 1
- 239000004299 sodium benzoate Substances 0.000 description 1
- 235000010234 sodium benzoate Nutrition 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 229920003109 sodium starch glycolate Polymers 0.000 description 1
- 229940079832 sodium starch glycolate Drugs 0.000 description 1
- 239000008109 sodium starch glycolate Substances 0.000 description 1
- 238000010532 solid phase synthesis reaction Methods 0.000 description 1
- 210000001082 somatic cell Anatomy 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 108010086290 sphinganine kinase Proteins 0.000 description 1
- 208000020431 spinal cord injury Diseases 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 210000004989 spleen cell Anatomy 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 210000004085 squamous epithelial cell Anatomy 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 229940032147 starch Drugs 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 230000002966 stenotic effect Effects 0.000 description 1
- 239000003270 steroid hormone Substances 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 238000005728 strengthening Methods 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 230000006354 stress signaling Effects 0.000 description 1
- 230000004938 stress stimulation Effects 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 230000000153 supplemental effect Effects 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 210000004243 sweat Anatomy 0.000 description 1
- 210000000106 sweat gland Anatomy 0.000 description 1
- 229940035073 symbicort Drugs 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 229920002994 synthetic fiber Polymers 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 229940037128 systemic glucocorticoids Drugs 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 230000028016 temperature homeostasis Effects 0.000 description 1
- 229960000195 terbutaline Drugs 0.000 description 1
- 229960004559 theobromine Drugs 0.000 description 1
- 229960000278 theophylline Drugs 0.000 description 1
- 108091085035 thiamine pyrophosphokinase family Proteins 0.000 description 1
- 102000043145 thiamine pyrophosphokinase family Human genes 0.000 description 1
- 210000000115 thoracic cavity Anatomy 0.000 description 1
- 125000000341 threoninyl group Chemical group [H]OC([H])(C([H])([H])[H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 230000002992 thymic effect Effects 0.000 description 1
- 229940104230 thymidine Drugs 0.000 description 1
- 229940113082 thymine Drugs 0.000 description 1
- LERNTVKEWCAPOY-DZZGSBJMSA-N tiotropium Chemical compound O([C@H]1C[C@@H]2[N+]([C@H](C1)[C@@H]1[C@H]2O1)(C)C)C(=O)C(O)(C=1SC=CC=1)C1=CC=CS1 LERNTVKEWCAPOY-DZZGSBJMSA-N 0.000 description 1
- 229940110309 tiotropium Drugs 0.000 description 1
- 230000007838 tissue remodeling Effects 0.000 description 1
- 239000003440 toxic substance Substances 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- 229940118436 tracleer Drugs 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 229940099456 transforming growth factor beta 1 Drugs 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 230000009529 traumatic brain injury Effects 0.000 description 1
- 230000000472 traumatic effect Effects 0.000 description 1
- 238000011277 treatment modality Methods 0.000 description 1
- 229940029284 trichlorofluoromethane Drugs 0.000 description 1
- 239000002753 trypsin inhibitor Substances 0.000 description 1
- 125000000430 tryptophan group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C2=C([H])C([H])=C([H])C([H])=C12 0.000 description 1
- 230000006433 tumor necrosis factor production Effects 0.000 description 1
- 239000000225 tumor suppressor protein Substances 0.000 description 1
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 1
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 1
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 230000034512 ubiquitination Effects 0.000 description 1
- 238000010798 ubiquitination Methods 0.000 description 1
- 241001529453 unidentified herpesvirus Species 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 229940035893 uracil Drugs 0.000 description 1
- 229940116269 uric acid Drugs 0.000 description 1
- 210000001635 urinary tract Anatomy 0.000 description 1
- 125000002987 valine group Chemical group [H]N([H])C([H])(C(*)=O)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- MYPYJXKWCTUITO-LYRMYLQWSA-N vancomycin Chemical compound O([C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1OC1=C2C=C3C=C1OC1=CC=C(C=C1Cl)[C@@H](O)[C@H](C(N[C@@H](CC(N)=O)C(=O)N[C@H]3C(=O)N[C@H]1C(=O)N[C@H](C(N[C@@H](C3=CC(O)=CC(O)=C3C=3C(O)=CC=C1C=3)C(O)=O)=O)[C@H](O)C1=CC=C(C(=C1)Cl)O2)=O)NC(=O)[C@@H](CC(C)C)NC)[C@H]1C[C@](C)(N)[C@H](O)[C@H](C)O1 MYPYJXKWCTUITO-LYRMYLQWSA-N 0.000 description 1
- 208000021331 vascular occlusion disease Diseases 0.000 description 1
- 230000025033 vasoconstriction Effects 0.000 description 1
- 229940124549 vasodilator Drugs 0.000 description 1
- 239000003071 vasodilator agent Substances 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 239000002435 venom Substances 0.000 description 1
- 210000001048 venom Anatomy 0.000 description 1
- 231100000611 venom Toxicity 0.000 description 1
- 229940105295 ventavis Drugs 0.000 description 1
- 230000002861 ventricular Effects 0.000 description 1
- 229940094720 viagra Drugs 0.000 description 1
- 210000005048 vimentin Anatomy 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 206010047470 viral myocarditis Diseases 0.000 description 1
- 244000052613 viral pathogen Species 0.000 description 1
- 210000002845 virion Anatomy 0.000 description 1
- 210000001835 viscera Anatomy 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 108010062110 water dikinase pyruvate Proteins 0.000 description 1
- 238000003466 welding Methods 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 108091022915 xylulokinase Proteins 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/08—Peptides having 5 to 11 amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/005—Enzyme inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39541—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against normal tissues, cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
- A61K9/0075—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy for inhalation via a dry powder inhaler [DPI], e.g. comprising micronized drug mixed with lactose carrier particles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2884—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against CD44
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
- A61K9/0078—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy for inhalation via a nebulizer such as a jet nebulizer, ultrasonic nebulizer, e.g. in the form of aqueous drug solutions or dispersions
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Immunology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pulmonology (AREA)
- Gastroenterology & Hepatology (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Biomedical Technology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Otolaryngology (AREA)
- Dispersion Chemistry (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Transplantation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Zoology (AREA)
- Endocrinology (AREA)
Description
本出願は、内容が全体として参照により組み入れられる米国特許仮出願第61/953,438号(2014年3月14日出願)の優先権の利益を主張するものである。
記載された本発明は、Moerae Matrix, LLCに認可された中小企業技術革新研究プログラム(Small Business Innovation Research (SBIR))、およびDr.Nobleに授与されたNHLBI PO1からの米国政府支援によってなされた。米国政府は、本発明において特定の権利を有する。
本発明は、細胞分子生物学、ポリペプチド、ならびに治療的使用方法の分野のものである。
1.創傷治癒および線維症のメカニズム
用語「創傷治癒」は、身体組織のいずれかへの外傷、特に物理的手段によって生じた連続性の遮断を有するものを身体が修復する過程を指す。
非限定的に自己免疫もしくはアレルギー反応、環境性微粒子、感染または機械的損傷をはじめとする因子によって引き起こされる損傷は多くの場合、正常な組織構造の破壊をもたらし、治癒応答を開始させる。損傷した上皮および内皮細胞は交換されて、それぞれバリア機能および完全性を維持し、血液の損失が予防されなければならない。内皮細胞に対する急性損傷は、炎症媒介物質を遊離させて抗フィブリン溶解性凝固カスケードを開始させ、損傷した血管を血小板および高フィブリン塊により一過性に閉塞する。例えば、特発性肺線維症(IPF)患者の肺ホモジネート、上皮細胞または気管支肺胞洗浄液は、慢性閉塞性肺疾患(COPD)および対照の患者と比較して、高レベルの血小板分化因子:X−ボックス−結合タンパク質−1を含んでおり、血塊形成応答が持続的に活性化されることが示唆される。加えて、トロンビン(フィブリノゲンをフィブリンに変換するのに必要なセリンプロテアーゼ)もまた、幾つかの肺線維症状態の肺および肺胞内の空間で容易に検出されるため、血液凝固経路の活性化がさらに確認される。トロンビンはまた、線維芽細胞を直接活性化して、増殖を増進し、コラーゲン生成筋線維芽細胞への線維芽細胞分化を促進できる。気道上皮、特に肺胞内肺細胞の損傷は、類似の抗フィブリン溶解性カスケードを惹起して、間質性浮腫、急性炎症領域および基底膜の上皮分離をもたらし得る。
組織損傷部位への接近がなされたら、ケモカイングラジエントによって炎症性細胞が動員される。好中球、好酸球、リンパ球およびマクロファージが、食細胞により浄化された細胞屑および壊死領域と共に急性炎症部位で観察される。
創傷治癒の終期は、フィブリン(創傷部位を覆う血塊を形成する「網状組織」を形成するように重合する線維性タンパク質)に富む足場の形成によって誘導される協調的細胞再編成、創傷収縮、創傷閉鎖および創傷の再上皮形成からなる。創傷修復のこの期間に関与する過程を究明する莫大な数の研究が、皮膚創傷の研究およびインビトロ系から得られている。
線維症は、器官または組織における過剰な線維性結合組織の形成または発達であり、正常または異常な/反応性の創傷治癒応答の結果として形成され、瘢痕を生じる。線維症は、例えば非限定的に、異常な細胞外マトリックスタンパク質の異常な沈着、線維芽細胞増殖の異常な促進、線維芽細胞集団の筋線維芽細胞集団への異常な分化誘発、筋線維芽細胞の細胞外マトリックスへの異常な付着促進、またはそれらの組み合わせを特徴とする。
蓄積しつつある証拠から、様々なリンホカイン、インターロイキン、およびケモカインを含む、サイトカインとして知られるポリペプチド媒介物質が、線維症におけるコラーゲン沈着の重要な刺激であることが示唆されている。サイトカインは、常在する組織細胞および動員された炎症細胞によって放出され、線維芽細胞の増殖およびコラーゲンを含む細胞外マトリックスタンパク質の合成増加を刺激すると考えられる。例えば、特発性肺線維症の発病における初期の特色は、肺胞上皮細胞および/または毛細血管細胞損傷である。これは、循環する免疫細胞、例えば、単球、好中球、リンパ球および好酸球の、肺への動員を促進する。その後、これらのエフェクター細胞は、常在する肺細胞、例えばマクロファージ、肺胞上皮細胞および内皮細胞と一緒に、サイトカインを放出し、サイトカインは、標的細胞、典型的には線維芽細胞を刺激して複製させ、コラーゲンの合成量を増加させる。細胞外マトリックスの分解もまた阻害され、線維化過程に寄与する可能性がある(Coker and Laurent, Eur Respir J, 1998,; 11:1218−1221)。
線維芽細胞から筋線維芽細胞への分化は、創傷修復および線維症をはじめとする多くの症状における重要な事象であると長い間考えられてきた。例えば、筋線維芽細胞は活発な線維症領域で生じ、肺線維症では細胞外マトリックス(ECM)タンパク質の生成および沈着を担うことが報告されている(Liu, T. et al., Am J Respir Cell Mol Biol, 2007, 37:507−517)。
線維症は、非限定的に間質性肺疾患、例えば特発性肺線維症、急性肺損傷(ALI)、放射線誘発性線維症、および移植片拒絶を含む、多数の異質性疾患または症状に関連づけられている。
特発性肺線維症(IPE;原因不明の線維化肺胞炎(CFA)、または特発性線維化間質性肺炎としても公知)は、主として高齢者に発する病因不明の慢性進行性線維化間質性肺炎の特殊形態と定義されており、肺に限定され、かつ通常の間質性肺炎(UIP)の放射線学的および組織学的パターンと関連する(Raghu G. et al., Am J Respir Crit Care Med., 183(6):788−824, 2011;Thannickal, V. et al., Proc Am Thorac Soc., 3(4):350−356, 2006)。IPEは、肺間質の異常かつ過剰な線維症組織沈着を特徴とし得る。高分解能CT(HRCT)画像によれば、UIPは、牽引性気管支拡張症に関連することの多い網状混濁の存在を特徴とする。IPFが進行するにつれ、ハチの巣形状が、より一層際立ってくる(Neininger A. et al., J Biol Chem., 277(5):3065−8, 2002)。肺機能試験の多くは、限定的障害および一酸化炭素拡散能力の低下を明らかにする(Thomas, T. et al., J Neurochem., 105(5): 2039−52, 2008)。複数の研究が、特発性肺線維症(IPF)の患者におけるTNF−αおよびIL−6放出の顕著な増加を報告し(Zhang, Y, et al. J. Immunol. 150(9):4188−4196, 1993)、それは、IL−1βの発現レベルに起因するとされている(Kolb, M., et al. J. Clin. Invest, 107(12):1529−1536, 2001)。IPFの症状である息切れおよび咳の開始は、通常は潜行性であるが徐々に進行し、診断後5年以内に患者の70%が死亡する。この厳しい予後は、乳癌による年間死亡数に類似する(Raghu G. et al., Am J Respir Crit Care Med., 183(6):788−824, 2011)。
発病のメカニズムは完全には理解されていないが、現在受け入れられている理論的枠組では、肺胞上皮への損傷に続いて、正常な組織修復に関連する応答を引き起こす炎症促進性および線維増殖性媒介物質が大量放出されることが提案されている。明確でない理由により、これらの修復過程は消散せず、結果として進行性線維症が起こる(Selman M, et al., Ann Intern Med, 134(2):136−151, 2001;Noble, P. and Homer R., Clin Chest Med, 25(4):749−58, 2004;Strieter, R., Chest, 128 (5 Suppl 1):526S−532S, 2005)。
多数の動物モデルが存在し、有用であり得るが(例えば、TGF−βアデノウイルス形質導入モデルまたは放射線誘発性線維症モデル)、ブレオマイシンモデルは、詳しく記載されており、炎症後/線維化前/線維症予防段階で個々の薬剤またはプロテインキナーゼ阻害剤の有効性を実証するために今日使用されている最もよく特徴づけられたネズミモデルである(Vittal, R. et al., J Pharmacol Exp Ther., 321(1):35−44, 2007;Vittal, R. et al., Am J Pathol., 166(2):367−75, 2005;Hecker L. et al., Nat Med., 15(9):1077−81, 2009)。
急性肺損傷(ALI)およびより重度の形態である急性呼吸窮迫症候群(ARDS)は、急性肺水腫および炎症から生じる急性呼吸不全症候群である。ALI/ARDSは、敗血症(肺性および非肺性)、肺炎(細菌性、ウイルス性および真菌性)、胃および口腔咽頭内容物の吸引、大きな外傷を含む様々な臨床障害、ならびに重度の急性膵炎、薬剤の過剰投与、および血液製剤を含む複数の他の臨床障害から全年齢の患者で発生する急性呼吸不全の原因である(Ware, L. and Matthay, M., N Engl J Med, 342:1334−1349, 2000)。ほとんどの患者は、陽圧による補助換気を必要とする。主要な生理学的異常は、重度の動脈低酸素血症、および肺のデッドスペース部分の急激な増加から派生する微弱換気の顕著な増加である。ALI/ARDSの患者は、バリアの透過性の増加から派生する肺の間質および気腔区画への液体の滲出から生じる高タンパク質性肺水腫を発症する。さらなる病理学的変化は、肺水腫に関与するメカニズムが複雑であり、水腫はALI/ARDSにおける病理生理学的事象の1つに過ぎないことを示す。1つの生理学的結果は、呼吸仕事量の増加をもたらす肺コンプライアンスの顕著な低下であり(Nuckton T. et al., N Engl J Med, 346:1281−1286, 2002)、これがほとんどの患者を支援するために補助換気が必要とされる理由の1つである。
線維症は、放射線療法による癌処置および偶発的被爆の両方に共通の後遺症である。放射線療法に続く線維症病変は、皮膚(Bentzen, S. et al., Radiother. Oncol. 15: 261−214, 1989;Brocheriou, C., et al., Br. J. Radiol. Suppl. 19: 101−108, 1986)、肺(Lopez Cardozo, B. et al., Int. J. Radiat. Oncol. Biol. Phys., 11: 907−914, 1985)、心臓(Fajardo, L. and Stewart, J., Lab. Invest., 29: 244−257, 1973)および肝臓(Ingold, J. et al., Am. J. Roentgenol., 93: 200−208, 1965)を含む多くの組織で記載されている。
移植は、細胞、組織または器官をある部位から別の部位へ移行させる作業である。器官系の機能不全は、ドナーから器官(例えば、腎臓、肝臓、心臓または膵臓)を移植することにより修正され得る。しかし、免疫系は依然として、日常的医療処置としての移植に対する最も恐るべきバリアであり、そのような器官の拒絶は、移植される器官における線維症表現型と多くの場合一致する。免疫系は、外来物質との闘いのために精緻で有効なメカニズムを発達させてきた。これらのメカニズムはまた、宿主の免疫系によって外来物と認識される、移植された器官の拒絶にも関与する。
移植器官に対する免疫応答は、細胞性(リンパ球媒介)および液性(抗体媒介)メカニズムの両方からなる。他の細胞型もまた関与するが、移植片の拒絶ではT細胞が中心的である。拒絶反応は、感作期およびエフェクター期からなる。
この段階では、CD4およびCD8細胞が、それらのT細胞受容体を介して、外来移植片の細胞上で発現されるアロ抗原を認識する。抗原認識には2つのシグナルが必要である:第一は、T細胞受容体とMHC分子によって提示される抗原との相互作用によって提供され、第二は、T細胞/APC表面上での共刺激受容体/リガンド相互作用によって提供される。数多くの共刺激経路のうち、T細胞表面上のCD28とそのAPC表面リガンド、B7−1またはB7−2(それぞれ一般的にCD80またはCD86として公知)との相互作用が最も多く研究されている(Clarkson, M. and Sayegh, M., Transplantation; 80(5): 555−563, 2005)。加えて、細胞傷害性Tリンパ球関連抗原−4(CTLA4)もまた、これらのリガンドに結合し、阻害シグナルを提供する。他の共刺激分子としては、CD40およびそのリガンドCD40L(CD154)が挙げられる。典型的には、MHC分子のヘリックスがペプチド結合溝を形成し、正常な細胞タンパク質由来のペプチドによって占有される。胸腺のまたは中枢の耐容メカニズム(クローン欠失)および末梢の耐容メカニズム(例えばアネルギー)は、これらの自己ペプチドMHC複合体がT細胞によって認識されないことを確実にし、それによって自己免疫応答を予防する。
アロ抗原依存性および非依存性因子が、エフェクターメカニズムに寄与する。最初に、非免疫学的「損傷応答」(虚血)は、非特異的炎症応答を誘導する。このために、接着分子、クラスIIMHC、ケモカインおよびサイトカインの発現がアップレギュレートされると、T細胞への抗原提示が増加する。それはまた、間接的なアロ認識経路を活性化し得るインタクトで可溶性のMHC分子の放出を促進する。活性化後に、CD4−陽性T細胞がマクロファージ媒介遅延型過敏(DTH)応答を開始し、抗体産生のためにB細胞への支援を提供する。
慢性閉塞性肺疾患(COPD)は、慢性閉塞性気管支炎、気腫、および/または慢性喘息の幾つかの組み合わせによる慢性で相対的に不可逆性の呼気気流機能不全によって代表される肺疾患の総称である。COPDは、疾患の一因となる喫煙を含む一連の環境性および遺伝性危険因子によって引き起こされる。
慢性気管支炎は、痰を生じることが認識されている他の疾患の非存在下で連続する2年間のうちの少なくとも3ヶ月間、慢性の咳および痰の生成があることと定義される。慢性気管支炎では、疫学的に気管支上皮が、粘液分泌腺の肥大および杯細胞数の増加と共に慢性炎症を示す。線毛もまた破壊され、粘膜線毛エスカレーターの効率が大きく損なわれる。粘液の粘性および粘液生成が増加し、吐出が困難になる。粘液の貯留が、感染に対する感受性を高める。
気腫は、その病理学的特色に関して定義され、終末細気管支に対し遠位の終末気腔の異常な拡長を特徴とし、それらの壁の破壊および肺弾性の低下を伴う。嚢胞(幅が1cmを超える水疱)が、気腫領域の直径が1cmを超える場合に過剰膨張の結果として発生し得る。異常な気腔の分布によって、2つの主要な気腫パターンに分類される:膨張、および細葉全体(特に肺の下半分)の破壊をもたらす汎細葉性(汎小葉性)気腫。細葉中心部(小葉中心部)気腫は、肺の上葉および下葉上方部分に影響が及ぶ呼気細気管支周囲の損傷を含む。さらに、特定形態の気腫が、線維症に関連することが知られている。
喘息は、自然にまたは治療により逆転できる広範囲で様々な気道閉塞に至る、気道の慢性炎症状態と定義される。慢性喘息を示すいくらかの患者では、特に、喘息と診断されなかったかもしくは管理を誤ったために喘息が未処置である場合、または喘息が特に重度である場合に、この疾患は進行して、不可逆的な気道閉塞に至る。喘息の小児は、10人のうち1人が不可逆的な喘息を発症する可能性があるが、成人の喘息発病のリスクは4人に1人である。複数の研究で、小児および成人で彼らの喘息が適切に、特にコルチコステロイド療法により、処置されなければ、喘息は肺機能の不可逆的悪化に至る可能性があることが見出された。
他のタイプの線維症としては、膵臓および肺の嚢胞性線維症、注射線維症、心内膜心筋線維症、縦隔線維症、骨髄線維症、腹膜後線維症、および腎性全身性線維症が挙げられるが、これらに限定されない。
4.1.主要な危険因子
4.1.1.喫煙
線維症性気道疾患に対して多数の危険因子が同定されているが(それらの幾つかはその因果関係において重要な役割を果たし得る)、タバコの煙は、COPDの第一の最も重要な原因である。喫煙するタバコの数が多いほど、線維症性気道疾患の発症リスクは高くなる。線維症性気道疾患を発症する人の大多数は喫煙者であり、彼らの肺機能は、非喫煙者の肺機能よりも急速に低下する。
この希少な遺伝性症状は、肺における重要なアンチプロテアーゼ防御系の1つの完全な欠如をもたらす。それは、人口の1:4000が罹患する劣性障害である。アルファ−1アンチトリプシン欠乏症の患者は、20〜40歳の間の若年期に気腫を発症するリスクがあり、多くの場合この疾患の明確な家族歴を有する。この欠乏症および気腫を有する患者は、各親から1つの異常な遺伝子を受け継ぎ、いわば両親はこの遺伝子の保持者である。そのような両親は、血中に正常レベルの半分のアンチトリプシンを有し、それは、気腫の発症を防御するのに十分であり得る。同様に、アルファ−1アンチトリプシン欠乏症患者の小児は全て、1つの異常な遺伝子を保有するが、発症しないであろう。アルファ−1アンチトリプシン欠乏症の2つの一般的形態は、アルファ−1アンチトリプシンをコードする遺伝子の点突然変異から生じる。
4.2.1.環境汚染
線維症性気道疾患が大気汚染によって増悪し得るという強力な証拠が存在するが、線維症性気道疾患の疫学における汚染の役割は、喫煙の役割と比較すると小さい。石炭および石油化石燃料の燃焼によって生成される重い粒子物質、炭素、および二酸化硫黄を含む大気汚染は、線維症性気道疾患の発症の重要な原因または補因子である。これらは、主として乗り物の排気ガスに由来し、光化学汚染物質、例えばオゾンは、非難されるべきである。特に女性にとって、発展途上国において、換気の悪い家庭での料理および暖房のために燃焼されるバイオマス燃料由来の室内の空気汚染は、線維症性気道疾患、例えばCOPDの重要な危険因子であり得る。
労働者が石炭、シリカおよび陽イオンに暴露される幾つかの職業、例えば鉱夫、織物職人およびセメント作業員は、線維症性気道疾患のリスク増大と関係する。1950年代以来、カドミウム、重金属、および溶接の煙への暴露は、気腫の原因と認識されている。
生後1年目の胸部感染、例えば肺炎および細気管支炎は、後の人生におけるCOPD発症の素因となり得る。これは、若年成人に肺の成長が終了するまで誕生時の呼吸器系の不完全な発育の結果であり得る。発育中の肺が損傷を受けると、最大の潜在的肺機能が達成されず、若年期にCOPDの症状を発症する。
肺線維症などの線維性気道疾患の因果において役割を果たし、そして/またはこの疾患の初期症状として働く他の危険因子としては、過敏症肺炎(最も多くは細菌、真菌、または動物生成物が混入した埃の吸引からもたらされる)、幾つかの典型的な結合組織疾患(例えば関節リウマチ、全身エリテマトーデス(SLE)および強皮症)、結合組織と関係する他の疾患(例えばサルコイドーシスおよびウェゲナー肉芽腫)、感染、特定の医薬(例えばアミオダロン、ブレオマイシン、ブスルファン、メトトレキサート、およびニトロフラントイン)、および胸部放射線療法が挙げられる。
線維症性疾患の処置に現在用いられている治療薬は、参照により本明細書に組み入れられる、Datta et al., British Journal of Pharmacology, 163: 141−172, 2011に開示される。そのような治療薬の非限定的例としては、精製ウシV型コラーゲン(例えばIW−001;ImmuneWorks;United Therapeutics)、IL−3受容体拮抗薬(例えばQAX576;Novartis)、タンパク質チロシンキナーゼ阻害剤(例えばイマチニブ(Gleevec(登録商標));Craig Daniels/Novartis)、内皮受容体拮抗薬(例えばACT−064992(マシテンタン);Actelion)、二重エンドセリン受容体拮抗薬(例えばボセンタン(Tracleer(登録商標));Actelion)、プロスタサイクリン類似体(吸入イロプロスト、例えば(Ventavis(登録商標));Actelion)、抗CTGFモノクローナル抗体(例えばFG−3019)、エンドセリン受容体拮抗薬(A−選択性)(例えばアンブリセタン(Letairis(登録商標))、Gilead)、AB0024(Arresto)、リシルオキシダーゼ様2(LOXL2)モノクローナル抗体(例えばGS−6624(以前はAB0024);Gilead)、c−Jun N−末端キナーゼ(JNK)阻害剤(例えばCC−930;Celgene)、ピルフェニドン(例えばEsbriet(登録商標)(InterMune)、Pirespa(登録商標)(塩野義))、IFN−γ1b(例えばActimmune(登録商標);InterMune)、3つのTGF−βアイソフォーム全てに対する汎中和IgG4ヒト抗体(例えばGC1008;Genzyme)、TGF−β活性化阻害剤(例えばStromedix(STX−100))、組換えヒトペントラキシン−2タンパク質(rhPTX−2)(例えばPRM151;Promedior)、二重特異性IL4/IL13抗体(例えばSAR156597;Sanofi)、インテグリンαvβ6を標的とするヒト化モノクローナル抗体(BIBF 1120;Boehringer Ingelheim)、N−アセチルシステイン(Zambon SpA)、シルデナフィル(Viagra(登録商標)))、TNF拮抗薬(例えばエタネルセプト(Enbrel(登録商標));Pfizer)、グルココルチコイド(例えばプレドニゾン、ブデソニド、モメタゾンフランカルボン酸エステル、フルチカゾンプロピオン酸エステル、およびフルチカゾンフランカルボン酸エステル)、気管支拡張剤(例えばロイコトリエン変性剤(例えば(モンテルカスト(SINGUAIR(登録商標)))、抗コリン作動性気管支拡張剤(例えばイプラトロピウムブロミドおよびチオトロピウム)、短期作用性β2−作動薬(例えばイソエタリンメシレート(Bronkometer(登録商標))、アドレナリン、サルブタノール/アルブテロール、およびテルブタリン)、長期作用性β2−作動薬(例えばサルメテロール、フォルモテロール、インデカテロール(Onbrez(登録商標))、および非限定的にSYMBICORT(登録商標)(ブデソニドおよびフォルモテロールの両方を含む)を含む気管支拡張剤の組み合わせ、コルチコステロイド(例えばプレドニゾン、ブデソニド、モメタゾンフランカルボン酸エステル)、メチル化キサンチンおよびその誘導体(例えばカフェイン、アミノフィリン、IBMX、パラキサンチン、ペントキシフィリン、テオブロミン、およびテオフィリン)、好中球エラスターゼ阻害剤(例えばONO−5046、MR−889、L−694,458、CE−1037、GW−311616、およびTEI−8362、ならびに遷移状態阻害剤、例えばONO−6818、AE−3763、FK−706、ICI−200,880、ZD−0892およびZD−8321)、ホスホジエステラーゼ阻害剤(例えばロフルミラスト(DAXAS(登録商標);Daliresp(登録商標))、およびシロミラスト(Ariflo(登録商標)、SB−207499))が挙げられるが、これらに限定されない。
キナーゼは、リン酸ドナー(通常はアデノシン−5’−三リン酸(ATP))から受容体基質へのホスホリル転移反応を触媒する遍在的酵素群である。全てのキナーゼは、本質的に同じホスホリル転移反応を触媒するが、それらは、その基質特異性、構造、およびそれらが参加する経路において著しい多様性を示す。全ての利用可能なキナーゼ配列(およそ60,000配列)の近年の分類は、キナーゼが、相同的な(共通の祖先に由来することを意味する)タンパク質の25のファミリーに群分けし得ることを示している。これらのキナーゼファミリーは、構造的折り畳みの類似性に基づいて12の折り畳み群に分類される。さらに、25ファミリーのうち22(全配列のおよそ98.8%)が、構造的折り畳みが既知である10の折り畳み群に属している。他の3つのファミリーのうち、リン酸キナーゼは別個の折り畳み群を形成し、残り2つのファミリーは両方とも膜内在キナーゼであり、最後の折り畳み群を含む。これらの折り畳み群は、最も広範囲に認められるタンパク質折り畳みの幾つか、例えばロスマン様折畳み(トポロジー順序β−α−β−α−βで2つのαヘリックスによって連結される3つ以上のパラレルβ鎖)、フェレドキシン様折畳み(シグネイチャーβαββαβ二次構造をその骨格に沿って有する一般的なα+βタンパク質)、TIMバレル折り畳み(ペプチド骨格に沿って交互に入れ替わる8つのαヘリックスおよび8つのパラレルβ鎖からなる保存されたタンパク質折り畳みを意味する)、およびアンチパラレルβバレル折り畳み(ベータバレルは、ツイストおよびコイルにより閉鎖構造を形成する大きなベータシートであり、第一の鎖が最後の鎖と水素結合する)を含むだけでなく、タンパク質構造の全ての主要なクラス(全てα、全てβ、α+β、α/β)を含む。折り畳み群の中で、各ファミリーのヌクレオチド結合ドメインのコアは同じ構造様式を有し、タンパク質コアのトポロジーは同一であるか、または環の並べ替えによって関連している。折り畳み群内のファミリー間の相同性は意味しない。
MAPK活性化プロテインキナーゼ(MAP−KAPK)の異なる群が、有糸分裂促進プロテインキナーゼ(MAPK)の下流で規定されてきた。これらの酵素は、MAPKの直接的基質ではない標的タンパク質にシグナルを伝達し、それゆえMAPKカスケードによるリン酸化依存性シグナル伝達を多様な細胞機能に中継するように働く。これらの群の1つは、3つのMAPKAPK:即ち、MK2、MK3(3pKとしても公知)およびMK5(PRAKとも称される)によって形成される。有糸分裂促進プロテインキナーゼ活性化プロテインキナーゼ2(「MAPKAPK2」、「MAPKAP−K2」または「MK2」とも称される)は、セリン/トレオニン(Ser/Thr)プロテインキナーゼファミリーのキナーゼである。MK2は、MK3に対して高度に相同である(およそ75%のアミノ酸同一性)。MK2およびMK3のキナーゼドメインは、カルシウム/カルモジュリン依存性プロテインキナーゼ(CaMK)、ホスホリラーゼbキナーゼ、およびリボソームS6キナーゼ(RSK)アイソフォームのC−末端キナーゼドメイン(CTKD)と最も類似する(約35%〜40%同一)。mk2遺伝子は、2つの選択的にスプライスされる転写産物の370アミノ酸(MK2A)および400アミノ酸(MK2B)をコードする。mk3遺伝子は、382アミノ酸の1つの転写産物をコードする。MK2およびMK3タンパク質は高度に相同であるが、MK2Aはより短いC−末端領域を有する。MK2BのC−末端は、より短いMK2Aアイソフォームには存在しない、二つの部分に分かれる機能的な核局在化配列(NLS)(Lys−Lys−Xaa10−Lys−Arg−Arg−Lys−Lys;SEQ ID NO:23)を有しており、選択的スプライシングがMK2アイソフォームの細胞内局在化を決定することを示している。MK3は、類似の核局在化配列を有する。MK2BおよびMK3の両方で見出されるこの核局在化配列は、p38αおよびp38βと、MK2BおよびMK3との特異的な相互作用を媒介することが複数の研究によって示されたDドメイン(Leu−Leu−Lys−Arg−Arg−Lys−Lys;SEQ ID NO:24)を包含する。MK2BおよびMK3はまた、NLSおよびDドメインに対してN−末端に位置する機能的な核外移送シグナル(NES)を有する。MK2B中のNESは、刺激に続く核外移送(レプトマイシンBによって阻害され得る過程)を惹起するのに十分である。MK2およびMK3の触媒ドメインに対してN−末端の配列は、プロリンに富み、1つ(MK3)または2つ(MK2)の推定Src相同性3(SH3)ドメイン−結合部位を含み、複数の研究で、MK2がインビトロでc−Ab1のSH3ドメインへの結合を媒介することが示された。近年の研究は、このドメインがMK2媒介性の細胞遊走に関与することを示唆する。
p38αおよびp38βの様々なアクチベーターが、MK2およびMK3活性を強力に刺激する。p38は、4つのプロリン指定部位(Thr25、Thr222、Ser272およびThr334)でMK2のインビトロおよびインビボリン酸化を媒介する。これらの部位のうち、Thr25のみがMK3で保存されていない。理論に拘束されるわけではないが、リン酸化Thr25の機能は不明であるが、2つのSH3ドメイン結合部位の間でのその位置は、それがタンパク質−タンパク質相互反応を調節する可能性があることを示唆している。MK2中のThr222(MK3ではThr201)は、キナーゼドメインの活性化ループ内に存在し、MK2およびMK3キナーゼ活性のために必須であることが示された。MK2中のThr334(MK3ではThr313)は、触媒ドメインに対してC−末端に位置し、キナーゼ活性に必須である。MK2の結晶構造が解明されており、理論に拘束されるわけではないが、Thr334のリン酸化がMK2の核内外移送のスイッチとして働き得ることを示唆する。Thr334のリン酸化はまた、触媒ドメインへのMK2のC−末端の結合を弱めるかまたは妨害して、NESを露出させて核外移送を促進できる。
さらに別の研究によって、小さな熱ショックタンパク質HSPB1(熱ショックタンパク質27またはHsp27としても公知)、リンパ球特異性タンパク質LSP−1、およびビメンチンがMK2によってリン酸化されることが示された。HSPB1は大きなオリゴマーを形成するため特に興味深く、それは分子シャペロンとして機能し、細胞を熱ショックおよび酸化ストレスから保護する可能性がある。リン酸化されると、HSPB1は大きなオリゴマーを形成するその能力を失い、アクチン重合を阻止できず、このことは、HSPB1のMK2媒介リン酸化が、アクチンの動力学の調節を目的とする恒常性維持機能に役立ち、さもなければストレス時に脱安定化されるであろうことを示唆している。
MK2ノックアウトマウスまたはMK2欠損細胞を用いた過去の研究では、MK2がそのmRNAの翻訳速度を高めることによってTNF−α、IL−1およびIL−6を含む炎症性サイトカインの生成を増加させることが示された。TNF−αの転写、プロセシング、および放出における有意な減少は、MK2欠損マウスでは検出され得なかった。p38経路はmRNA安定性の調節に重要な役割を果たすことが知られており、MK2は、それによってp38がこの機能を媒介するおそらく標的である。MK2欠損マウスを利用する研究で、MK2の触媒活性がサイトカイン生成および遊走への影響に必要であることが示され、理論に拘束されるわけではないが、MK2は、mRNA安定性に関与する標的をリン酸化することが示唆される。これと一致して、MK2は、異種の核リボヌクレオタンパク質(hnRNP)A0、トリステトラプロリン、ポリ(A)−結合タンパク質PABP1、およびHuR(RNA結合タンパク質のelav(ドロソフィラ・メラノガスターでの胚致死性異常の視覚(embryonic−lethal abnormal visual in Drosophila melanogaster)ファミリーの遍在的に発現されるメンバー)に結合および/またはこれらをリン酸化することが示された。これらの基質は、その3’−非翻訳領域に高AU要素を含むmRNAに結合またはそれらと共精製されることが知られており、MK2がTNF−αなどの高AU mRNAの安定性を調節し得ることが示唆される。現在、MK3が類似の機能を果たすか否かは不明であるが、MK2欠損線維芽細胞のLPS処置はhnRNP A0のリン酸化を完全に消失させるため、MK3がMK2の欠損を補填し得ないことが示唆される。
核内MK2は、多くのMKと同様に、cAMP応答配列結合(CREB)、血清応答因子(SRF)、および転写因子ER81のリン酸化に寄与する。野生型細胞およびMK2欠損細胞の比較によって、MK2がストレスによって誘発される主要なSRFキナーゼであることが明らかになり、ストレス媒介性の即時初期応答におけるMK2の役割が示唆される。MK2およびMK3の両方が、インビボで塩基性ヘリックス−ループ−ヘリックス転写因子E47と相互作用し、インビトロでE47をリン酸化する。E47のMK2媒介リン酸化はE47の転写活性を抑制しそれによってE47依存性遺伝子発現を阻害することが見出されており、MK2およびMK3が組織特異性遺伝子発現および細胞分化を調節し得ることが示唆される。
幾つかの生物学的過程におけるMK2およびMK3の多様な機能を反映して、幾つかの他のMK2およびMK3の基質もまた同定されている。足場となるタンパク質14−3−3ζは、生理学的なMK2基質である。複数の研究から、14−3−3ζがプロテインキナーゼ、ホスファターゼ、および転写因子を含む細胞シグナル伝達経路の多数の成分と相互作用することが示される。また別の研究では、Ser58上での14−3−3ζのMK2媒介リン酸化がその結合活性を損なうことが示され、MK2が、通常は14−3−3ζによって調節される幾つかのシグナル伝達分子の調節に影響を及ぼし得ることが示唆される。
真核細胞のプロテインキナーゼは、それらの触媒ドメインのおかげで関係する相同性タンパク質の最大のスーパーファミリーの1つを構成する。最も関係の深いプロテインキナーゼは、セリン/トレオニンリン酸化またはチロシンリン酸化のいずれかに特異的である。プロテインキナーゼは、細胞外刺激に対する細胞応答で不可欠の役割を果たす。したがって、プロテインキナーゼの刺激は、シグナル伝達系における最も一般的な活性化メカニズムの1つと考えられる。多くの基質が多数のプロテインキナーゼによってリン酸化を受けることが知られており、様々なプロテインキナーゼの触媒ドメインの一次配列に関するかなり多くの情報が発表されている。これらの配列は、ATP結合、触媒、および構造的完全性の維持に関与する多数の残基を共有する。ほとんどのプロテインキナーゼは、よく保存された30〜32kDaの触媒ドメインを有する。
酵素阻害剤は酵素と結合し、それによって酵素活性を低下させる分子である。阻害剤の結合は、基質の酵素活性部位への侵入を停止させ、そして/または酵素がその反応を触媒するのを妨害できる。阻害剤の結合は、不可逆性または可逆性である。不可逆的阻害剤は通常、酵素と反応し、酵素がもはやその反応を触媒できないようにその酵素を化学的に変化させる(例えば、酵素活性に必要とされる重要なアミノ酸残基を修飾することによって)。対照的に、可逆性阻害剤は非共有結合によって結合し、これらの阻害剤が酵素、酵素−基質複合体、またはその両方を結合するか否かに応じて異なるタイプの阻害が生成される。
ペプチドは、2つ以上のアミノ酸の鎖で構成され、それによって鎖の中の1つのアミノ酸のカルボキシル基がペプチド結合を介して他のアミノ酸のアミノ基と連結された化合物である。ペプチドは、とりわけタンパク質の構造および機能の研究で用いられてきた。合成ペプチドは、とりわけタンパク質−ペプチド相互作用が生じる場所を知るプローブとして用いられる。阻害性ペプチドは、とりわけプロテインキナーゼ、癌タンパク質および他の障害の阻害に及ぼすペプチドの影響を調べるために臨床研究で用いられる。
細胞貫通ペプチド(CPP)は、哺乳動物細胞の形質膜を貫通し、膜を横断して多くのタイプおよび分子量の化合物を輸送し得るペプチドの一クラスである。これらの化合物には、タンパク質、DNA、コンジュゲートペプチド、オリゴヌクレオチドなどのエフェクター分子、およびリポソームなどの小粒子が含まれる。CPPが、他のタンパク質へと化学的に連結または融合された場合、生じる融合タンパク質は、なおも細胞に侵入できる。形質導入の厳密なメカニズムは不明であるが、これらのタンパク質の内在化は、受容体媒介またはトランスポーター媒介であるとは考えられていない。CPPは一般的に10〜16アミノ酸長であり、例えばアルギニンおよび/またはリジンに富むペプチドなど、それらの組成にしたがって群分けされ得る。
形質導入特性を有するとして記載されるべき第一のタンパク質は、ウイルス起源のものであった。これらのタンパク質はなおも、最も一般的に許容されるCPP作用のモデルである。細胞貫通ペプチドのうち、非限定的にTATペプチドを含む高アルギニン細胞貫通ペプチドが、最も広範囲に研究されている(El−Sayed, A. et al., AAPSJ. 11, 13−22, 2009;Wender, P. et al., Adv. Drug Deliv. Rev. 60, 452−472, 2008)。
ホメオタンパク質は、形態学的過程に関与する高度に保存されたトランス活性化する転写因子である。それらは、60アミノ酸の特異的配列を介してDNAに結合する。このDNA結合ホメオドメインは、ホメオタンパク質の最も高度に保存された配列である。幾つかのホメオタンパク質がCPP様活性を示すことが記載されており、それらは、細胞型特異性なしにエネルギー非依存的なおよびエンドサイトーシス非依存的な様式で細胞膜を介して効率的に転座できる。
ヒトCPPは、ヒト患者への導入時に潜在的免疫原性問題を回避できる。CPS配列を有するペプチドとしては、Hoxa−5、Hox−A4、Hox−B5、Hox−B6、Hox−B7、HOX−D3、GAX、MOX−2、およびFtzCPPが挙げられる。これらのタンパク質は全て、AntpCPP中で見出される配列を共有する。他のCPPとしては、エネルギー−、受容体−およびエンドサイトーシス−非依存性転座が可能な、Islet−1、インターロイキン−1、腫瘍壊死因子、およびカポジ線維芽細胞増殖因子またはEGF−4シグナルペプチド由来の疎水性配列が挙げられる。未確定CPPには、線維芽細胞増殖因子(FGF)ファミリーのメンバーが含まれる。
p38MAPKの下流のセリン/トレオニンキナーゼ基質である、有糸分裂促進プロテインキナーゼ活性化プロテインキナーゼ2(MAPKAPK2またはMK2)は、瘢痕形成および線維症の合併症である多くの炎症性疾患に関係している(Lopes, L. et al., Biochem Biophys Res Commun., 382(3):535−9, 2009)。これらの疾患としては、癌、内膜過形成、器官線維症、腹部癒着、炎症性腸疾患、および慢性関節リウマチが挙げられるが、これらに限定されない。特発性肺線維症(IPE)に加えて、炎症および線維症を伴い肺に影響を及ぼす他の疾患としては、急性肺損傷(ALI)、臓器移植片拒絶(肺の移植片では、IPFの後期処置でもある)、敗血症に続発する臓器不全、急性肺不全、強皮症などの自己免疫障害、および慢性閉塞性肺疾患(COPD)が挙げられる。
一態様によれば、記載された本発明は、抗CD44抗体の治療量を含む抗体成分;およびアミノ酸配列YARAAARQARAKALARQLGVAA(SEQ ID NO:1)のMK2阻害剤(MK2i)ポリペプチドまたはアミノ酸配列KALARQLAVA(SEQ ID NO:8)のポリペプチド、アミノ酸配列KALARQLGVA(SEQ ID NO:9)のポリペプチドおよびアミノ酸配列KALARQLGVAA(SEQ ID NO:1)のポリペプチドから選択されるその治療ドメインと機能的に等しい少なくとも1つのペプチド、またはその機能的均等物の治療量、および薬学的に許容し得る担体を含むMK2阻害剤(MK2i)成分、を含む組成物を投与することを含む、肺移植後の肺移植片機能不全を低減する方法であって;組成物が肺移植片機能不全の少なくとも1つの病理生物学的作用を相乗的に減少させるのに効果的である、方法を提供する。一実施形態によれば、肺移植片機能不全は、通常の健常対照群の対象の組織における有糸分裂促進プロテインキナーゼ活性化プロテインキナーゼ2(MK2)の活性と比較して、組織内の有糸分裂促進プロテインキナーゼ活性化プロテインキナーゼ2(MK2)の異常な活性を特徴とする。別の実施形態によれば、肺移植片機能不全は、原発性の移植片機能不全である。別の実施形態によれば、肺移植片機能不全は、慢性の肺移植片機能不全である。別の実施形態によれば、組成物の抗CD44抗体成分の投与は、全身性である。別の実施形態によれば、MK2i成分の投与は、全身性であるかまたは吸入による。別の実施形態によれば、移植片機能不全は、炎症を特徴とする。別の実施形態によれば、組成物は、(i)TGFβ、CCL2、ヒアルロン酸、およびMMP9のうちの少なくとも1つをモジュレートすること;(ii)TNFα、IL6またはそれらの組み合わせの血漿レベルを低下させること;(iii)α平滑筋アクチンの発現を低減すること;(iiv)TGFβ誘導性の筋線維芽細胞活性化を予防すること;(v)線維芽細胞侵襲を阻害すること、またはそれらの組み合わせを行うことにおいて、対照と比較して効果的である。別の実施形態によれば、ポリペプチドYARAAARQARAKALARQLGVAA(SEQ ID NO:1)の機能的均等物は、アミノ酸配列FAKLAARLYRKALARQLGVAA(SEQ ID NO:3)のものである。別の実施形態によれば、ポリペプチドYARAAARQARAKALARQLGVAA(SEQ ID NO:1)の機能的均等物は、アミノ酸配列KAFAKLAARLYRKALARQLGVAA(SEQ ID NO:4)のものである。別の実施形態によれば、ポリペプチドYARAAARQARAKALARQLGVAA(SEQ ID NO:1)の機能的均等物は、アミノ酸配列YARAAARQARAKALARQLAVA(SEQ ID NO:5)のものである。別の実施形態によれば、ポリペプチドYARAAARQARAKALARQLGVAA(SEQ ID NO:1)の機能的均等物は、アミノ酸配列YARAAARQARAKALARQLGVA(SEQ ID NO:6)のものである。別の実施形態によれば、ポリペプチドYARAAARQARAKALARQLGVAA(SEQ ID NO:1)の機能的均等物は、アミノ酸配列HRRIKAWLKKIKALARQLGVAA(SEQ ID NO:7)のものである。別の実施形態によれば、担体は、制御放出性担体、遅延放出性担体、持続放出性担体、および長期放出性担体からなる群から選択される。別の実施形態によれば、医薬組成物のMK2i成分は、乾燥粉末の形態である。別の実施形態によれば、乾燥粉末は、空気力学的質量中央径(MMAD)が1〜5ミクロンの微粒子を含む。別の実施形態によれば、医薬組成物のMK2i成分の治療量の投与は、吸入装置による。別の実施形態によれば、吸入装置は、ネブライザーである。別の実施形態によれば、吸入装置は、計量吸入装置(MDI)である。別の実施形態によれば、吸入装置は、乾燥粉末吸入装置(DPI)である。別の実施形態によれば、吸入装置は、乾燥粉末ネブライザーである。
記載された本発明は、アミノ酸配列YARAAARQARAKALARQLGVAA(MMI−0100;SEQ ID NO:1)を有するポリペプチドまたはその機能的均等物を含む組成物の治療量を投与することを含む、それを必要とする対象における肺線維症を処置するための組成物および方法を提供する。
本明細書で用いられる用語「気道」は、それを通して空気が体に侵入し、体を離れる通路を指す。肺の気道は、空気が呼吸時に通過する呼吸管部分を含む。
一態様によれば、記載された本発明は、対象の組織における異常な線維芽細胞増殖および細胞外マトリックスの沈着を特徴とする疾患、状態、または過程の処置で使用するための医薬組成物であって、
アミノ酸配列YARAAARQARAKALARQLGVAA(SEQ ID NO:1)のポリペプチドまたはその機能的均等物の治療量と、医薬的に許容し得るその担体と、を含み、
治療量が、対象の組織における線維芽細胞増殖および細胞外マトリックス沈着を減少させるのに効果的である、
組成物を提供する。
別の態様によれば、記載された本発明は、対象の組織における異常な線維芽細胞増殖および細胞外マトリックス沈着を特徴とする疾患、状態または過程を処置する方法であって、
アミノ酸配列YARAAARQARAKALARQLGVAA(SEQ ID NO:1)のポリペプチドまたはその機能的均等物の治療量と、医薬的に許容し得るその担体と、を含む医薬組成物を、対象に投与することを含み、
治療量が、対象の組織における線維芽細胞増殖および細胞外マトリックス沈着を減少させるのに効果的である、
方法を提供する。
別の態様によれば、記載された本発明は、対象の組織における異常な線維芽細胞増殖および細胞外マトリックス沈着を特徴とする疾患、状態または過程を処置する系であって、
医薬組成物が、アミノ酸配列YARAAARQARAKALARQLGVAA(SEQ ID NO:1)のポリペプチドまたはその機能的均等物の治療量と、医薬的に許容し得るその担体と、を含み、
治療量が、対象の組織における線維芽細胞増殖および細胞外マトリックスの沈着を減少させるのに効果的である、
系を提供する。
以下の実施例は、記載された本発明の実施および使用の方法の完全な開示および記載を当業者に提供するために示されるものであり、本発明者らが本発明者らの発明とみなすものの範囲を制限しようとするものでもなく、また下記の実験が全てであること、あるいは実施された実験に過ぎないことを表すものでもない。使用する数値(例えば数、温度など)に関して正確さを確保するために努力を払ったが、若干の実験誤差および偏差が考慮されなければならない。他に断りがなければ、部および重量部であり、分子量は平均分子量であり、温度は摂氏であり、圧は大気圧または大気圧近辺である。
MMI−0100の創薬
MMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)の優良医薬品製造基準(GMP)による製造のために、機械的撹拌装置を備えた50Lのガラス製固相反応合成容器中に、Fmoc−Ala−Wang樹脂およそ1kgを移す。この樹脂をジメチルホルミド(DMF)中で2時間以上(NLT)膨潤させた後、DMFを排出する。その後、樹脂ビーズをDMFの連続すすぎにより洗浄する。N−末端保護基(即ち、Fmoc)を、DMF中の20%ピペリジンで処置することによって除去し(脱ブロックのステップ)、この樹脂をDMFで洗浄する。配列中の次のアミノ酸を、1−ヒドロキシベンゾトリアゾール(HOBt)およびジイソプロピルカルボジイミド(DIC)の存在下でカップリングさせる。一般に、合成スケールに対しFmoc−アミノ酸(Fmoc−AA)2.5〜3.5モル等量を、カップリングに用いる。Fmoc−AAをDMF中に溶解し、HOBtおよびDICの添加によって活性化させる。各カップリングの終了は、ニンヒドリン試験によってモニタリングする。カップリングが不完全である場合、同じアミノ酸による第二のカップリングを、対称無水物法を用いて実施する。一般に、合成スケールに対しFmoc−AA 3.0〜6.0モル等量をカップリングに用いる。Fmoc−AAをジクロロメタン(DCM)および最小容量のDMF中で溶解し、Fmoc−AA/DICモル比=1.0/0.5でDICを添加することにより活性化させる。完全なペプチド配列が完成したら、ペプチド樹脂をDMFおよびMeOHの連続洗浄で徹底してすすぐ。その後、この樹脂をNLT3時間、真空乾燥させる。全乾燥ペプチド樹脂の典型的な回収量はおよそ2800グラムであり、これは約65%のペプチド樹脂収率を表す。
IC50値は、1/2対数稀釈の10点曲線から推定した。ペプチドをジメチルスルホキシド(DMSO)中に供給した。具体的には、ヒト組換えMK2(h)(5〜10mU)を、50mM 3−グリセロリン酸ナトリウム(pH=7.5)、0.1mM EGTA、30μM 基質ペプチド(KKLNRTLSVA(SEQ ID NO:21))、10mM酢酸マグネシウム、および90μM γ−33P−ATP(最終容量25μL)と共に室温で40分間インキュベートした。その後、反応を3%リン酸で停止させた。この混合物10μLをP30フィルターマットにスポットし、75mMリン酸で5分間3回、およびメタノールで1回洗浄した。最後にこの膜を乾燥させ、シンチレーションカウンターを用いた。ATPに対する見かけのKmの15μM以内のATP濃度を選択したが、それはHayessおよびBenndorf(Biochem Pharmacol, 1997, 53(9): 1239−47)が、彼らの本来の阻害剤ペプチド(即ち、ペプチドKKKALNRQLGVAA;SEQ ID NO:22)のメカニズムはATP結合と拮抗しないことを示したからである。
マウスの肺線維症モデルを、C57BL/6マウスへの0.025Uブレオマイシン/PBSの気管内投与によって作製した。MMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)またはMMI−0200(YARAAARQARAKALNRQLGVA;SEQ ID NO:19)(1日あたり50μg/kg、75μg/kg、および100μg/kgの投薬量)を、ブレオマイシン傷害後7日目に開始するか(炎症後/線維化前の分析用;予防モデル)、またはブレオマイシン傷害後14日目に開始し(線維化後の分析用;治療モデル)、腹腔内または霧状化によりブレオマイシン送達後21日または28日まで毎日投与した。ブレオマイシン送達後21日目(予防モデル)または28日目(治療モデル)に、マウスの群をペントバルビタールナトリウム注射(120mg/kg)で殺処分し、胸腔を開いた。右の主気管支を結紮し、右肺を取り出した。気管にカニューレを挿入し、4%ホルムアルデヒドを21cmの水圧で左肺に灌流させた。その後、組織ブロックをパラフィンに包埋し、4mm切片を染色のために調製した。各動物の切片を細胞の視覚化のためにヘマトキシリンおよびエオジン(H&E)で染色するか、またはコラーゲン沈着を強調するためにマッソントリクローム染色で染色した。インキュベーション後に、切片を0.2%酢酸で洗浄し、95%アルコールに浸漬して脱水し、染色皿中でキシレン(3〜4回)により澄明化した。染色された切片を、ラベル付きガラススライドに有機マウント剤でマウントした。
実施例1.MMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)のIC50および特異性
MK2阻害剤ペプチド(MMI−0100;YARAAARQARAKALARQLGVAA(SEQ ID NO:1))のIC50(1/2最大阻害濃度)値を、MilliporeのIC50 Profiler Express serviceを用いて決定した。この定量的アッセイは、所与の生物学的過程または過程の成分(即ち、酵素、細胞、または細胞受容体)の50%を阻害するためにどれほど多くの阻害剤が必要とされるか([IC50])を測定する。具体的には、これらのアッセイでは、キナーゼが阻害剤ペプチドによって阻害されない場合、正電荷の基質がATPからの放射性標識リン酸基でリン酸化される。その後、正電荷の基質は、負電荷のフィルター膜に引きつけられ、シンチレーションカウンターで定量され、100%の活性対照と比較される。
幾つかの実施形態によれば、MMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)およびその機能的均等物は、噴霧乾燥、微粒子化(例えばジェットミル処理)を介する凍結乾燥粉末として、または霧状化用の液体配合剤として配合される。
幾つかの実施形態において、MMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)およびその機能的均等物の調製には、以下の因子を考慮して噴霧乾燥が利用される:
(a)タンパク質およびペプチドは変性しやすい(即ち、三次および時には二次構造が破壊されやすい);
(b)この変性は可逆性または不可逆性である可能性があり、様々な条件、例えば温度上昇、温度低下、極端なpH、溶媒の添加、圧力、および剪断変性(これは微粒子化に適用される)によって引き起こされ得る:
(c)変性タンパク質は、より低い活性であり、治療性がなく、時には完全に不活性である;
(d)噴霧乾燥は、これらの非晶質で大きな分子を特定の粒度分布を有する別個の球状粒子にして、プロセッシングパラメータによって制御でき;
噴霧乾燥粒子は、非常に球状でドーナツ形であり、典型的には中空であり、このことは5μmを超える粒子は依然として呼吸可能でありながら肺のクリアランスメカニズムに耐性を有し得ることを意味する;さらに
(e)噴霧乾燥は、賦形剤の有無にかかわらず、一般にタンパク質の安定性を改善する。
先に記載された定義の工程パラメータで2〜3回の噴霧乾燥運転を実施し、エアロゾル性能評価用の材料を製造する。
幾つかの実施形態によれば、MMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)およびその機能的均等物は、乾燥粉末吸入装置(DPI)を用いて投与され得る。例えば、MicroDose乾燥粉末吸入装置(DPI)は、呼吸により駆動され患者の吸入流速および吸入体積とは無関係に高効率肺送達を達成する、「能動的」な圧駆動エアロゾル発生装置を有する。効率的な肺送達のために40〜60リットル/分(LPM)の規模の気流による強く効果的な吸入を必要とする「受動的」DPIとは異なり、MicroDose DPIは、わずか10LPMから90LPMまでの非常に広い範囲の流速にわたり、同等の性能で効率的な送達が可能なため、MicroDose DPIでは呼吸術は要求されない(図3および4の性能例を参照されたい)。
あるいは、MMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)およびその機能的均等物は、液体の霧状化を介して送達され得る。過去の前臨床試験で、MMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)が、動物での使用に適合させたAeroGen(登録商標)ネブライザーシステムを介してげっ歯類に送達され得ることが示された。
有糸分裂促進プロテインキナーゼ(MAPK)活性化プロテインキナーゼ2(MK2)は、p38MAPK−αおよびβによってストレス時に活性化される。p38MAPKのこれらの2つのアイソフォームがMK2のカルボキシ末端の塩基性ドッキングモチーフに結合し、これが次にその調節部位をリン酸化する。活性化の結果、MK2は核から細胞質へ移送され、この区画へ活性p38MAPKを同時に輸送する。MK2はp38MAPKの局在化を安定化させ、分化、遊走およびサイトカイン生成に必須である(Kotlyarov, A., Mol Cell Biol. 22(13): 4827−4835, 2002)。
特発性肺線維症(IPF)の診断基準の1つは、間葉細胞の活性化およびマトリックス(特にコラーゲン)の旺盛な沈着である。生じた肺でのコラーゲン蓄積は、組織学的技術および生化学的技術の両方によって、最も顕著にはヒドロキシプロリンの蓄積から測定できるが、ヒドロキシプロリンはほぼ全てが肺中のコラーゲンに由来し、したがって全肺コラーゲン量の代用物となる(Umezawa H. et al., Cancer, 20(5):891−895, 1967)。
次に、コラーゲン沈着に及ぼすMK2ペプチド阻害剤の増加増加の影響を、特発性肺線維症のブレオマイシンマウスモデル(予防モデル)を用いてインビボで検査した。簡潔に述べると、C57BL/6マウスを0日目にブレオマイシン傷害に供した。7日目に開始し21日目まで連続で、25、50または75μg/kgのMMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)またはMMI−0200(YARAAARQARAKALNRQLGVA;SEQ ID NO:19)をマウスに、毎日腹腔内(IP)注射により投与した。図13に示す通り、マッソン青色トリクローム染色から、MMI−0100(YARAAARQARAKALARQLGVAA(SEQ ID NO:1))で処置されたブレオマイシン傷害マウスの肺におけるコラーゲンレベルの低下が明らかになり、MMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)が、ブレオマイシン傷害による肺線維症を用量依存的様式で防御し得ることが示唆された。これらのデータから、MMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)はより高用量であっても、線維症防止化合物としてのその能力を保持することが示唆される。
近年の研究で、ブレオマイシン誘発性線維症におけるTリンパ球の重要な役割が強調された(Wilson, M. et al., The Journal of Experimental Medicine, 207(3): 535−552, 2010)。それゆえ、MMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)で処置したブレオマイシン損傷マウスにおける脾臓T細胞(全T細胞)の機能的役割を究明するために、自家混成リンパ球反応(MLR)を過去に報告された通り実施した(参照により本明細書に組み入れられるWilkes, D. et al., Journal of Leukocyte Biology, 64(5):578−586, 1998)。具体的には、C57BL/6精製抗原提示細胞のC57BL/6−Tリンパ球増殖誘発能力を、このアッセイで試験した。
図10に示す通り、従来のブレオマイシンモデルは、文献では任意の介入の有効性を検査するために線維化前の病期で広く用いられてきた。MMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)の霧状化および全身投与は両方とも、ブレオマイシン誘発性線維症から肺を顕著に防御するため、ブレオマイシン傷害肺の処置におけるMMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)の全身(腹腔内)または局所(霧状化)投与の影響を、さらに線維症後の病期において、薬剤介入を14日目(肺が顕著に線維化される時点)に開始して試験した(図15)(参照により本明細書に組み入れられるPottier, N. et al., American Journal of Respiratory and Critical Care Medicine, 176(11): 1098−1107, 2007)。IPF患者の肺が診断時点で既に瘢痕化していることを考慮すると、このモデルで示される瘢痕化肺の救済は、臨床的に意義がある。
先に議論された通り、MMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)およびその機能的均等物の肺における主要な標的の1つは、MK2キナーゼであり、それは罹患した肺で炎症および線維化応答を誘発する。それゆえ、MMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)のインビボにおける効果をさらに立証するために、活性化MK2(ホスホ−Thr334−MAPKAPK2)のレベルを未処置ブレオマイシン傷害マウスおよびMMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)処置マウスで検査した。
MMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)が肺における線維症形成を阻害し得る1つの潜在的メカニズムは、炎症後サイトカインの局所濃度を低下させ、それによって単球動員充および肺マクロファージによる異常な細胞外リモデリング(例えばコラーゲン沈着の増加、細胞接着および遊走の増加、マトリックス分解の減少)を妨害することによる。この可能性を究明するために、炎症促進性サイトカインの生成を阻害するMMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)ペプチドの能力を、腹腔内または液状化によるMMI−0100(YARAAARQARAKALARQLGVAA;SEQ ID NO:1)での処置時にインターロイキン−6(IL−6)および腫瘍壊死因子−アルファ(TNF−α)レベルの変化を測定することによって検査した。
特発性肺線維症(IPF)の診断基準は、線維症病変の筋線維芽細胞の蓄積および多量のアルファ−平滑筋アクチン(α−SMA)(筋線維芽細胞活性化のマーカー)の発現である。さらに、活性化筋線維芽細胞は、肺実質の硬性および肺機能悪化を部分的に担う。
特発性肺線維症(IPF)の主要な診断基準は、極めて多量のマトリックスタンパク質(コラーゲン、フィブロネクチンおよびマトリックスメタロプロテイナーゼを含む)を分泌する活性化筋線維芽細胞と共に、非典型でアポトーシス性の上皮細胞の存在である(Horowitz, J and Thannickal, V., Treatments in Respiratory Medicine, 5(5):325−42, 2006)。正常な創傷治癒過程の下では、一時的足場として臨時のマトリックスが筋線維芽細胞によって形成される。この臨時のマトリックスの収縮が、その後の再上皮形成および最終的な創傷治癒をもたらす。しかし、活性化された筋線維芽細胞がアポトーシスに耐性である場合、生じた極めて多量のコラーゲン沈着は、マトリックスの安定化をもたらす(Tomasek, J. et al., Nature Reviews Molecular Cell Biology, 3(5): 349−63, 2002)。抑制されない筋線維芽細胞増殖、活性化およびアポトーシス耐性の最終結果は、コラーゲン沈着のために安定化したマトリックスを有する線維症病変であり、したがって最終的には肺構造のねじれをもたらす(Yamashita, C. et al., The American Journal of Pathology, 179(4): 1733−45, 2011)。
重度肺線維症(SPF)および慢性肺移植片機能不全(CLAD)は、避け難い肺機能喪失および診断の3〜5年以内の死亡を特徴とする障害である。IPFは、SFPのうちで最も一般的かつ最も重度である。IPFに加えて、SPFは、結合組織疾患(強皮症、関節リウマチ)または慢性過敏性肺炎との関連性など、他の背景で生じ得る。
PGD HAと関連づけられるHAの高濃度のBALFは、ECMの主要成分である(10、21)。それは、典型的には炎症をダウンレギュレートする正常な生理学的条件下では、高分子量ポリマー(HMW−HA)として存在し得る。しかし、組織の痛苦/傷害の際に、HMW−HAは、低分子量種(LMW−HA)を蓄積させる動的変化を受ける場合もあり、それは慢性炎症を恒久化させ得る(12、23〜25)。PGDの際のこの過程を検証するために、肺移植片機能不全の生物学的メカニズムのIRB認可試験の下で、本発明者らの研究室に送付された上記のコホートからの、LT後最初の24時間以内に回収されたBALF標本を評価した。78のBALF試料(PGDなし20、一過性PGD36、および長期PGD14)を、分析に利用できた。LT後最初の24時間以内に測定されたBALF HA濃度は、長期PGDと有意に関連づけられた(図26)。本発明者らは、本明細書で用いられたELISAがLMW−HAとHMA−HAとを識別し得ないことを認識している。しかし今後提案される研究では、濃縮BALFの寒天ゲル電気泳動を利用して、高および低MW−HAを視覚化および半定量するであろう。それでもなおこれらの知見は、傷害の際にIRIがPGDに至る、高度の炎症環境を誘導するHAの潜在的役割を裏づけている。
HAとCD44との相互作用は、複数の細胞型による潜在性のTGF−β発現を増進することが報告されている(10、21、22)。したがって本発明者らは、Luminexにより、酸性化BALF中の活性TGF−βおよびプロコラーゲンのタンパク質濃度を評価し、HAで認められたものと同じ傾向を見出した(図示しない)。重要なことに、TGF−βは、プロコラーゲン(図示しない)およびMMP−9(図示しない)と相関した。PGD試料中のTGF−βの細胞供給源は、気管支上皮細胞、浸潤している単核細胞および肺胞マクロファージ(AM)であった(CIP 図3A&B)。受容体TGF−β R1は、主に線維芽細胞、浸潤している単核細胞、AMおよび気管支上皮細胞上で発現された(図28C、D、E)。術後0日目のBALF試料中のTGF−βのROC分析から、122pg/mlを超えるTGF−βが、CLAD発症に関して感受性=0.70、特異性=0.78を有し、AUCが0.75であることが実証され、バイオマーカーとしてのTGF−βの潜在的有用性が示唆された。122pg/mlを超えるBALF TGF−βを有し、PGDを伴う、または伴わない患者のいずれも、3年目にCLADを発症する機会が、122pg/ml未満のTGF−βを有する患者の45%と比較して、80%であった。TGF−βは、診断能力に加えて、一実施形態によれば、抗CD44および/またはMK2阻害剤処置による利益を最も受けるLTRを同定するバイオマーカーとしても有用であり得る。これらのデータから、TGF−β下流のシグナル伝達と拮抗し得る薬物を開発することの重要性が強調される。
末梢血から単離されLMW−HAで刺激された単球が、HMW−HAまたは非刺激と比較して、CCL2およびCCR2発現の著しい上昇を示すことが、予備的インビトロ試験で実証されている(図示しない)。これにより本発明者らは、術後0日目のBALF CCL2濃度を評価した。HAと同様に、CCL2の増加が、長期PGDと関連づけられた(図示しない)。CCL2の細胞供給源は、気管支上皮細胞、AMおよび浸潤している単核細胞であった(図29A&B)。CCL2の主要な受容体はCCR2であり、それは気道周辺および間質内の浸潤している単核細胞により発現された(図29C)。このことから、HAが、CLADが起こる領域である気道周辺および間質内でCCR2を発現する単核細胞の動員および滞留に重要な、CCR2/リガンド生物学的軸をアップレギュレートしていることが示唆される。重要なことに、メジアン(1.79ng/ml)よりも大きなBALF CCL2濃度は、メジアン未満のものの5年でのCLAD発症の機会42%に比較して、5年で78%のCLAD発症の機会を有した(図示しない)。まとめると、本発明者らのデータから、LTの24時間以内のHA、TGF−β、MMP−9(潜在性のTGF−βを活性TGF−βに変換することにより)、およびCCL2が、一部には、IRIの間に増進してPGDをもたらす高度の炎症環境を担うことが、示唆される。この炎症環境は、PGDからの回復によって「部分的に」解決するが、その持続はLTRをCLADのリスクにする。
本発明者らは、慢性炎症が、一部には、上皮、単核食細胞および線維芽細胞上でのHAとCD44との相互作用から起こるのではないかと疑っている。しかしHAはまた、CD168などの他のHA結合タンパク質と相互作用する(7、26、27)。重要なことに、CD168を介するHAのシグナル伝達経路は、CD44とは異なっており、p−38経路を含む(28)。p−38シグナル伝達の阻害は、線維芽細胞増殖障害への甚大な影響を有するが、そのインビボでの使用は、肝臓毒性により限定される。MK2はp−38の下流にあり、MK2阻害剤の使用は、肝毒性と関連づけられていない(29)。MK2経路はTGF−βを調節し、炎症および線維症に関係するとされている(29)。重要なことに、ヒトPGDの際に、本発明者らは、上皮、AM、浸潤している単核細胞および線維芽細胞がp−MK2の核および細胞質染色を有し(図示しない)、それがPGDおよびCLADの病原性において役割を担う重要な細胞でのこの経路の活性と一致することを見出した。さらに、ヒト生物学の複雑さを前提とすれば、CLADなどの疾患を予防/処置する最も効果的なアプローチは、複数の経路(例えば、HA−CD44および別のHA−CD168→MK2経路)の標的化を必要とし得る。
動物試験に関しては、本発明者らの予備データの一部は、異所性気管移植片(HTT)モデル(C57BL/6(H−2b)マウス(アロ移植片)およびC57BL/6→C57BL/6マウス(イソ移植片)の上背部に皮下移植されたBALB/c(H−2d)の気管に見出される、最もストリンジェントなMHCクラスI/II不同性(disparate)コンビネーションミスマッチを利用する)で作成されている。
ヒトのデータに基づき、類似の生物学的作用が存在するか否かを決定するために、拒絶の動物モデルを探索した。HTTモデルのアロ移植片は最大の炎症および早期線維性閉塞を有し一方で同系対照は正常であるため、HTTモデルを用いて、14日目の時点を評価した。全移植片ホモジネートを用いて、qPCRにより同系対照に比較して、アロ移植片からのHAシンターゼ−2(HAS−2)(HAの生成を担う(31))、CD44、CD168、MMP−9、CCL2、CCR2、TGF−βおよびMK2の増加が見出された(図30)。7日目のmOLTアロ移植片モデルを用いる確証試験で、CD44が浸潤している単核細胞およびAMにより発現され、p−MK2がリンパ球、単核食細胞および上皮細胞中で見い出されることが実証された(図示しない)。
これらの2つの経路がCLADに関連づけられることを示唆する本発明者らのヒトおよび動物モデルに基づいて、ドナー(−2、−1日目)およびレシピエント(−2、−1、0、1、2、3、4日目)に与えられる抗CD44 AbとMK2iとの組み合わせによるインビボ受動免疫を実施して、肺アロ移植片を5日目に、適切な対照処置マウスに比較して評価した。抗CD44+MK2i処置は、A(3/4)級(重度の血管周辺浸潤)からA(1/2)級(軽度の血管周辺浸潤)へと血管拒絶を劇的に減少させ、ならびにB2R級(上皮細胞損傷を有する高度の浸潤)からB0級(本質的な拒絶なし)へと気道拒絶を劇的に減少させ、拒絶の際のこれらの経路の重要性が確認された(図31)。本発明者らが知る限りにおいて、これは、潜在的にヒトで用いられ得る、他の同時使用される免疫抑制薬を用いずにこの攻撃的ネズミモデル系において拒絶を低減する、移行可能な治療を含む最初の試験であろう。
疾患の病原性におけるヒアルロナンシンターゼ2(HAS2)の役割を特徴づけるために、α−平滑筋アクチン(ASMA)発現細胞へヒトHAS2発現を標的化するトランスジェニックマウス株を作製した。ASMA−HAS2トランスジェニックマウスは正常に発達し、ベースラインにおいて太い気道および血管の周辺のHA増加を示す。ブレオマイシンでの傷害に続いて、これらのマウスは、傷害後の肺間質および肺胞空間の両方において高濃度のHAを蓄積させ、死亡率の著しい上昇を示す(7)。
CD44は遍在的に発現される接着分子であり、細胞動員、遊走、および腫瘍細胞転移において重要な役割を有することが示されている(32)。CD44は主要なHA受容体であり、マクロファージが炎症部位からHAを浄化するために必要である(12)。CD44は、ブレオマイシンによる肺損傷後にアップレギュレートされた(7)。抗CD44中和Abでの2種の処置プロトコルを利用した:予防的に(Abをブレオマイシンの12時間前および5日後のいずれかに腹腔内に与えた)(図33A)または治療的に(ブレオマイシン傷害後7、14、および21日目)(図33B)。肺コラーゲン蓄積は、両方のレジメンでASMA−HAS2トランスジェニックマウスにおいて有意に減少した(図33)。
IPFにおけるMK2の臨床関連性を確認するために、活性化されたMK2の発現を、活性化MK2に対する抗体を用いて、IPFおよび非IPF患者生検からの肺組織外移植片における免疫組織化学検査により分析した。IPFを有さない患者からの生検組織よりも高レベルの活性化MK2が、IPF肺で、具体的には線維芽細胞および上皮において発現された(33)。
先に記載された通り、ブレオマイシン傷害マウスのブレオマイシン損傷後の肺における、活性化MK2の一過性発現を検証した。PBSを注入されたマウスに比較して、ブレオマイシン傷害後7および14日目の活性化MK2の安定な発現が観察された(33)。
先の実施例に記載された通り、肺線維症のこのブレオマイシンモデルを用いて、形成された線維症を処置する、または回復に向かわせることにおけるMK2阻害剤MMI−0100の毎日投与の有効性を検証した。C57B1/6マウスは、気管内ブレオマイシン注入を受け(0.025U;0日目)、その後MMI−0100(37.5μg/kg)を局所(吸入)または全身(腹腔内)経路のいずれかにより投与された。MMI−0100またはPBSは、ブレオマイシン傷害後14日目に開始して14日間毎日投与した。局所送達か全身送達かにかかわらず、線維症の進行は、コラーゲン沈着、筋線維芽細胞分化および活性化MK2発現により測定されるように、MMI−0100により阻害された(33)。
ネズミHTTモデルを用いて得られたこれらのデータから、気道のアロ移植片がHAS−2、CD44およびMK2、ならびに下流の媒介物質、CCR2/リガンド生物学的軸、MMP−9およびTGF−βの発現増加を有することが実証された。mOLTモデルは両方の経路(CD44およびMK2)の阻害に伴う拒絶の低減を示し、これらのカスケードが拒絶に関与し、ヒトにおけるCLADを予防/処置する際の治療選択に変換し得ることが示唆される。
線維芽細胞は、組織のリモデリングを媒介する際の重要なエフェクター細胞である。組織損傷およびリモデリングの部位には、筋線維芽細胞の蓄積も存在する(34)。線維芽細胞がαSMAを発現し収縮機能を呈するために必須である、TGF−β(35、36)およびPDGF(37)などの媒介物質を定義するかなり多くの証拠が得られているが、αSMA発現細胞の制御が組織線維症の慢性化を調節するというインビボでの実証は存在しない。本発明者らは、癌転移モデルに基づき、進行性肺線維症の新規モデルを開発した。HAは、間葉細胞および様々な腫瘍細胞により生成され、その同族細胞表面受容体CD44との相互作用を通して腫瘍転移に寄与することが示唆されている(38、39)。本発明者らは、線維化した線維芽細胞が、進行性線維形成に必須である侵襲性表現型を獲得すること、およびCD44がその過程を調節する上で重大な役割を有すること、を仮定した。線維芽細胞が基底膜構成要素との複合体マトリックスであるMatrigelを自発的に侵襲する能力についてそれらを評価する、アッセイシステムを利用した。このアッセイは、癌細胞の転移能力を分析するために用いられてきた(40)。
本発明者らは、IPFの本質的特色が、マトリックス侵襲を促進する遺伝子プログラムを発達させた侵襲性線維芽細胞表現型の発生であると仮定した。重度で進行性かつ破壊性の線維症であるASMA−HAS2トランスジェニックマウスモデルから得られるデータが、ヒトの肺線維症に関連するか否かを決定するために、本発明者らは、IPFの患者から原発性肺線維芽細胞を単離して、それらの侵襲能力を分析した。本発明者らは、正常な肺組織から単離された線維芽細胞と比較して、IPFの線維芽細胞の侵襲能力が著しく高いことを見出した(図34)。
抗CD44遮断抗体またはアイソタイプ適合対照を、肺損傷時に全身投与した。本発明者らは、肺コラーゲン蓄積が、抗CD44 Abの存在下でASMA−HAS2トランスジェニックマウスにおいて有意に減少したことを見出した(図35)。
本発明者らは、IPF線維芽細胞を、ヒトCD44(Hoffman LaRocheにより提供)を認識する抗CD44 Abで処置して、浸潤の著しい減少を実証した(図36)。これらのデータは、間断のない肺線維症が、HAおよびCD44によって調節されるマトリックス侵襲線維芽細胞表現型に依存することを示唆する。
線維芽細胞侵襲におけるCD44の役割を決定するために、本発明者らは、ブレオマイシン処置後のCD44ヌルマウスから単離された線維芽細胞の侵襲能力を調べ、侵襲能力の損傷を見出した(図示しない)。類似の結果が、ASMA−HAS2+/CD44−/−マウスから単離された線維芽細胞から見出された(図37A)。さらにブレオマイシンでチャレンジされた野生型C57Bl/6Jマウスから単離された線維芽細胞を抗CD44 Abで処置すると、線維芽細胞浸潤が鈍化した(図37B)。
線維芽細胞侵襲におけるMK2の役割を決定するために、本発明者らは、WTまたはASMA−HAS2のいずれかからの線維芽細胞をMK2阻害剤(MK2iまたはMMI−0100)で処置した。MK2iは、8μmで線維芽細胞侵襲を有意に減少させた(図41)。
MK2阻害剤(MK2i)は、IPF線維芽細胞の侵襲能力を阻害できた(図39)。
A)浸潤性表現型におけるCD44の役割を決定する:ヒト線維芽細胞を、IPFおよびCLADの患者から単離し、Matrigel侵襲アッセイを実施する。IPF線維芽細胞は、本発明者らが既に所有しており(7、41)、より多くを、外科的肺生検時、または移植の際の肺外移植片のいずれかから得られる。CLAD患者からの線維芽細胞は、過去に記載された通り(42)BALFから得られ、およびCLADの再移植の際に肺外移植片から得られる。ヒト化抗CD44 Abおよびアイソタイプ対照Abを培養物に添加し(上のチャンバー)、線維芽細胞の侵襲を評価する。Abの様々な用量および処置のタイミングをテストして、最適なAb用量および期間を見出す。
肺線維症が上皮間葉障害であることは、現在の定説で示唆されている(18)。上皮細胞が損傷されるとサイトカインおよび他の物質がBAL液に放出されることは、公知である。しかし、損傷された上皮細胞が線維芽細胞および筋線維芽細胞をどのようにして活性化するかについては、ほとんど知られていない。近年の研究から、損傷した上皮細胞が、線維芽細胞を活性化してマトリックスを生成する因子を産生し、進行性肺線維症に寄与し得る破壊的エフェクター機能を潜在的に生じることが示唆された(45)。損傷された腎臓上皮細胞は、TGF−βを含むエキソソームも放出して、線維芽細胞活性化を誘導し得る(46)。電子顕微鏡による初期の古典的な研究から、AEC1細胞は線維芽細胞との接触を有さないが、AEC2細胞は足突起を通して線維芽細胞と相互作用することが明らかとなった(47)。肺が損傷されると、より断続的な基底膜と関連して、上皮−間質細胞接触が増加したことから(47)、一過性の細胞接触の増加がAEC2の完全性および分化に関与する直接的な細胞間シグナルを反映すること、そしてこれが線維芽細胞の活性化のための一手段も提供し得ることが示唆された。損傷された上皮を「和らげること」または「滑らかにすること」ができる薬物を同定することが、この分野における大きな躍進となろう。
損傷された原発性AEC2細胞が線維芽細胞を活性化し得るか否かを決定するために、共培養系が近年になり開発された。最初の実験は、トランスウェルアッセイシステムを用いて実施され、そこでは原発性AEC2細胞をブレオマイシン処置された/処置されていないマウスから単離して(7日目)トランスウェルの上のチャンバーに播種し、WTマウス由来の原発性肺線維芽細胞を下のチャンバーに播種した。損傷されたAEC2は、α−SMA、コラーゲンI、およびフィブロネクチンタンパク質の発現増加により測定されるように、線維芽細胞を活性化できた(図15)。これらのデータは、損傷された腎上皮細胞が、線維芽細胞を活性化するTGF−β含有エキソソームの生成数を増加させる、という近年の報告と一致する(46)。この活性化因子は、未知であるが、このアッセイシステムは、着実である。
マウスにおいてAEC2細胞が幹細胞であることが近年になり実証され、ヒトAEC2細胞を単離するフローソーティングアプローチが開発されており、それが利用されるであろう(46)。
トランスウェル共培養実験では、AEC2細胞を下のチャンバーの線維芽細胞を含むトランスウェル挿入物に播種する。MK2iを、上皮細胞と線維芽細胞の共培養の24時間後に、下のチャンバーに添加する。実験の終了時に、上のチャンバーを取り出し、上清および線維芽細胞を分析用に採取する。マトリックス分子(Col1、ヒアルロナンおよびFN)は、ウェスタンブロットおよび/またはELISAで測定し、筋線維芽細胞分化は、α−SMA免疫蛍光染色およびウェスタンブロットで評価する。
***
本発明のまた別の態様は、以下のとおりであってもよい。
〔1〕a.抗CD44抗体の治療量を含む抗体成分と、
b.アミノ酸配列YARAAARQARAKALARQLGVAA(SEQ ID NO:1)のMK2阻害剤(MK2i)ポリペプチド、またはアミノ酸配列KALARQLAVA(SEQ ID NO:8)のポリペプチド、アミノ酸配列KALARQLGVA(SEQ ID NO:9)のポリペプチドおよびアミノ酸配列KALARQLGVAA(SEQ ID NO:1)のポリペプチドから選択される、その治療ドメインと機能的に等しい少なくとも1つのペプチド、またはその機能的均等物の治療量、および薬学的に許容し得る担体を含むMK2阻害剤(MK2i)成分と、
を含む組成物を投与することを含む、肺移植後の肺移植片機能不全を低減する方法であって、
前記組成物が、前記肺移植片機能不全の少なくとも1つの病理生物学的作用を相乗的に減少させるのに効果的である、方法。
〔2〕前記肺移植片機能不全が、正常な健常対照の対象の組織中の有糸分裂促進プロテインキナーゼ活性化プロテインキナーゼ2(MK2)の活性と比較して、組織中の有糸分裂促進プロテインキナーゼ活性化プロテインキナーゼ2(MK2)の異常な活性を特徴とする、前記〔1〕に記載の方法。
〔3〕前記肺移植片機能不全が、原発性の移植片機能不全である、前記〔1〕に記載の方法。
〔4〕前記肺移植片機能不全が、慢性の肺移植片機能不全である、前記〔1〕に記載の方法。
〔5〕前記組成物の抗CD44抗体成分の前記投与が、全身性である、前記〔1〕に記載の方法。
〔6〕前記MK2i成分の前記投与が、全身性であるか吸入による、前記〔1〕に記載の方法。
〔7〕前記移植片機能不全が、炎症を特徴とする、前記〔1〕に記載の方法。
〔8〕前記組成物が、(i)TGFβ、CCL2、ヒアルロン酸、およびMMP9のうちの少なくとも1つをモジュレートすること;(ii)TNFα、IL6またはそれらの組み合わせの血漿レベルを低下させること;(iii)α平滑筋アクチンの発現を低減すること;(iiv)TGFβ誘導性の筋線維芽細胞活性化を予防すること;(v)線維芽細胞侵襲を阻害すること、またはそれらの組み合わせを行うことにおいて、対照と比較して効果的である、前記〔1〕に記載の方法。
〔9〕ポリペプチドYARAAARQARAKALARQLGVAA(SEQ ID NO:1)の機能的均等物が、アミノ酸配列FAKLAARLYRKALARQLGVAA(SEQ ID NO:3)のものである、前記〔1〕に記載の方法。
〔10〕ポリペプチドYARAAARQARAKALARQLGVAA(SEQ ID NO:1)の機能的均等物が、アミノ酸配列KAFAKLAARLYRKALARQLGVAA(SEQ ID NO:4)のものである、前記〔1〕に記載の方法。
〔11〕ポリペプチドYARAAARQARAKALARQLGVAA(SEQ ID NO:1)の機能的均等物が、アミノ酸配列YARAAARQARAKALARQLAVA(SEQ ID NO:5)のものである、前記〔1〕に記載の方法。
〔12〕ポリペプチドYARAAARQARAKALARQLGVAA(SEQ ID NO:1)の機能的均等物が、アミノ酸配列YARAAARQARAKALARQLGVA(SEQ ID NO:6)のものである、前記〔1〕に記載の方法。
〔13〕ポリペプチドYARAAARQARAKALARQLGVAA(SEQ ID NO:1)の機能的均等物が、アミノ酸配列HRRIKAWLKKIKALARQLGVAA(SEQ ID NO:7)のものである、前記〔1〕に記載の方法。
〔14〕前記担体が、制御放出性担体、遅延放出性担体、持続放出性担体、および長期放出性担体からなる群から選択される、前記〔1〕に記載の方法。
〔15〕前記医薬組成物のMK2i成分が、乾燥粉末の形態である、前記〔1〕に記載の方法。
〔16〕前記乾燥粉末が、1〜5ミクロンの空気力学的質量中央径(MMAD)を有する微粒子を含む、前記〔15〕に記載の方法。
〔17〕前記医薬組成物のMK2i成分の治療量の前記投与が、吸入装置による、前記〔1〕に記載の方法。
〔18〕前記吸入装置が、ネブライザーである、前記〔17〕に記載の方法。
〔19〕前記吸入装置が、計量吸入装置(MDI)である、前記〔17〕に記載の方法。
〔20〕前記吸入装置が、乾燥粉末吸入装置(DPI)である、前記〔17〕に記載の方法。
〔21〕前記吸入装置が、乾燥粉末ネブライザーである、前記〔17〕に記載の方法。
〔22〕対象の組織中の異常な線維芽細胞増殖および細胞外マトリックス沈着を特徴とする重度の肺線維症を処置するための方法であって、
a.抗CD44抗体の治療量を含む抗体成分と、
b.アミノ酸配列YARAAARQARAKALARQLGVAA(SEQ ID NO:1)のMK2阻害剤(MK2i)ポリペプチド、またはアミノ酸配列KALARQLAVA(SEQ ID NO:8)のポリペプチド、アミノ酸配列KALARQLGVA(SEQ ID NO:9)のポリペプチドおよびアミノ酸配列KALARQLGVAA(SEQ ID NO:1)のポリペプチドから選択される、その治療ドメインと機能的に等しい少なくとも1つのペプチド、またはその機能的均等物の治療量、および薬学的に許容し得る担体を含むMK2阻害剤(MK2i)成分と、
を含む医薬組成物を前記対象に投与することを含み、
前記組成物が、前記対象の組織中の線維芽細胞増殖および細胞外マトリックス沈着を相乗的に減少させるのに効果的である、方法。
〔23〕前記重度の肺線維症が、特発性肺線維症である、前記〔22〕に記載の方法。
〔24〕前記重度の肺線維症が、ブレオマイシンの投与によって引き起こされる、前記〔22〕に記載の方法。
〔25〕前記重度の肺線維症が、前記組織の炎症をさらに特徴とする、前記〔22〕に記載の方法。
〔26〕前記炎症が、腫瘍壊死因子−アルファ(TNF−α)、インターロイキン−6(IL−6)、およびインターロイキン−1β(IL−1β)からなる群から選択される少なくとも1種のサイトカインにより媒介される、前記〔25〕に記載の方法。
〔27〕前記組織中の前記異常な線維芽細胞増殖および細胞外マトリックス沈着が、正常な健常対照の対象の組織中の有糸分裂促進プロテインキナーゼ活性化プロテインキナーゼ2(MK2)の活性と比較して、組織中の有糸分裂促進プロテインキナーゼ活性化プロテインキナーゼ2(MK2)の異常な活性を特徴とする、前記〔22〕に記載の方法。
〔28〕前記重度の肺線維症が、正常な健常対照の対象と比較して、肺間質における細胞外マトリックスタンパク質の異常な沈着、肺の線維芽細胞増殖の異常な促進、筋線維芽細胞分化の異常な誘発、および筋線維芽細胞の細胞外マトリックスへの付着の異常な促進からなる群から選択される少なくとも1つの病態を特徴とする、前記〔22〕に記載の方法。
〔29〕前記組成物の抗CD44抗体成分の前記投与が、全身性である、前記〔22〕に記載の方法。
〔30〕前記MK2i成分の前記投与が、全身性または吸入による、前記〔22〕に記載の方法。
〔31〕ポリペプチドYARAAARQARAKALARQLGVAA(SEQ ID NO:1)の機能的均等物が、アミノ酸配列FAKLAARLYRKALARQLGVAA(SEQ ID NO:3)のものである、前記〔22〕に記載の方法。
〔32〕ポリペプチドYARAAARQARAKALARQLGVAA(SEQ ID NO:1)の機能的均等物が、アミノ酸配列KAFAKLAARLYRKALARQLGVAA(SEQ ID NO:4)のものである、前記〔22〕に記載の方法。
〔33〕ポリペプチドYARAAARQARAKALARQLGVAA(SEQ ID NO:1)の機能的均等物が、アミノ酸配列YARAAARQARAKALARQLAVA(SEQ ID NO:5)のものである、前記〔22〕に記載の方法。
〔34〕ポリペプチドYARAAARQARAKALARQLGVAA(SEQ ID NO:1)の機能的均等物が、アミノ酸配列YARAAARQARAKALARQLGVA(SEQ ID NO:6)のものである、前記〔22〕に記載の方法。
〔35〕ポリペプチドYARAAARQARAKALARQLGVAA(SEQ ID NO:1)の機能的均等物が、アミノ酸配列HRRIKAWLKKIKALARQLGVAA(SEQ ID NO:7)のものである、前記〔22〕に記載の方法。
〔36〕前記担体が、制御放出性担体、遅延放出性担体、持続放出性担体、および長期放出性担体からなる群から選択される、前記〔22〕に記載の方法。
〔37〕前記医薬組成物のMK2i成分が、乾燥粉末の形態である、前記〔11〕に記載の方法。
〔38〕前記乾燥粉末が、1〜5ミクロンの空気力学的質量中央径(MMAD)を有する微粒子を含む、前記〔37〕に記載の方法。
〔39〕前記医薬組成物のMK2i成分の治療量の前記投与が、吸入装置による、前記〔22〕に記載の方法。
〔40〕前記吸入装置が、ネブライザーである、前記〔39〕に記載の方法。
〔41〕前記吸入装置が、計量吸入装置(MDI)である、前記〔39〕に記載の方法。
〔42〕前記吸入装置が、乾燥粉末吸入装置(DPI)である、前記〔39〕に記載の方法。
〔43〕前記吸入装置が、乾燥粉末ネブライザーである、前記〔39〕に記載の方法。
***
1. Belperio, J. A., and J. B. Orens. 2010. Evolving concepts and controversies in lung transplantation. Semin Respir Crit Care Med 31: 97−98.
2. Belperio, J. A., S. S. Weigt, M. C. Fishbein, and J. P. Lynch, 3rd. 2009. Chronic lung allograft rejection: mechanisms and therapy. Proc Am Thorac Soc 6: 108−121.
3. Lynch, J. P., 3rd, R. Saggar, S. S. Weigt, D. J. Ross, and J. A. Belperio. 2006. Overview of lung transplantation and criteria for selection of candidates. Semin Respir Crit Care Med 27: 441−469.
4. Weigt, S. S., W. D. Wallace, A. Derhovanessian, R. Saggar, R. Saggar, J. P. Lynch, and J. A. Belperio. 2010. Chronic allograft rejection: epidemiology, diagnosis, pathogenesis, and treatment. Semin Respir Crit Care Med 31: 189−207.
5. Belperio, J. A., and J. D. Christie. 2013. Lung transplantation. Semin Respir Crit Care Med 34: 273−274.
6. Weigt, S. S., A. DerHovanessian, W. D. Wallace, J. P. Lynch, 3rd, and J. A. Belperio. 2013. Bronchiolitis obliterans syndrome: the Achilles’ heel of lung transplantation. Semin Respir Crit Care Med 34: 336−351.
7. Li, Y., D. Jiang, J. Liang, E. B. Meltzer, A. Gray, R. Miura, L. Wogensen, Y. Yamaguchi, and P. W. Noble. 2011. Severe lung fibrosis requires an invasive fibroblast phenotype regulated by hyaluronan and CD44. J Exp Med 208: 1459−1471.
8. Tesar, B. M., D. Jiang, J. Liang, S. M. Palmer, P. W. Noble, and D. R. Goldstein. 2006. The role of hyaluronan degradation products as innate alloimmune agonists. Am J Transplant 6: 2622−2635.
9. Jiang, D., J. Liang, and P. Noble. 2011. Hyaluronan as an Immune Regulator in Human Diseases. Physiol Rev 91: 221−264.
10. Jiang, D., J. Liang, and P. W. Noble. 2007. Hyaluronan in tissue injury and repair. Annu Rev Cell Dev Biol 23: 435−461.
11. DeGrendele, H. C., P. Estess, and M. H. Siegelman. 1997. Requirement for CD44 in activated T cell extravasation into an inflammatory site. Science 278: 672−675.
12. Teder, P., R. W. Vandivier, D. Jiang, J. Liang, L. Cohn, E. Pure, P. M. Henson, and P. W. Noble. 2002. Resolution of lung inflammation by CD44. Science 296: 155−158.
13. Rane, M. J., P. Y. Coxon, D. W. Powell, R. Webster, J. B. Klein, W. Pierce, P. Ping, and K. R. McLesh. 2001. p38 Kinase−dependent MAPKAPK−2 activation functions as 3−phosphoinositide−dependent kinase−2 for Akt in human neutrophils. J Biol Chem 276: 3517−3523.
14. Ronkina, N., A. Kotlyarov, and M. Gaestel. 2008. MK2 and MK3−−a pair of isoenzymes? Front Biosci 13: 5511−5521.
15. Muto, A., A. Panitch, N. Kim, K. Park, P. Komalavilas, C. M. Brophy, and A. Dardik. 2012. Inhibition of Mitogen Activated Protein Kinase Activated Protein Kinase II with MMI−0100 reduces intimal hyperplasia ex vivo and in vivo. Vascular pharmacology 56: 47−55.
16. Ward, B. C., S. Kavalukas, J. Brugnano, A. Barbul, and A. Panitch. 2011. Peptide inhibitors of MK2 show promise for inhibition of abdominal adhesions. The Journal of surgical research 169: e27−36.
17. Lopes, L. B., E. J. Furnish, P. Komalavilas, C. R. Flynn, P. Ashby, A. Hansen, D. P. Ly, G. P. Yang, M. T. Longaker, A. Panitch, and C. M. Brophy. 2009. Cell permeant peptide analogues of the small heat shock protein, HSP20, reduce TGF−beta1−induced CTGF expression in keloid fibroblasts. J Invest Dermatol 129: 590−598.
18. Selman, M., V. J. Thannickal, A. Pardo, D. A. Zisman, F. J. Martinez, and J. P. Lynch, 3rd. 2004. Idiopathic pulmonary fibrosis: pathogenesis and therapeutic approaches. Drugs 64: 405−430.
19. Noble, P. W., C. E. Barkauskas, and D. Jiang. 2012. Pulmonary fibrosis: patterns and perpetrators. J Clin Invest 122: 2756−2762.
20. Huang, H. J., R. D. Yusen, B. F. Meyers, M. J. Walter, T. Mohanakumar, G. A. Patterson, E. P. Trulock, and R. R. Hachem. 2008. Late primary graft dysfunction after lung transplantation and bronchiolitis obliterans syndrome. Am J Transplant 8: 2454−2462.
21. Jiang, D., J. Liang, and P. W. Noble. 2011. Hyaluronan as an immune regulator in human diseases. Physiol Rev 91: 221−264.
22. Jiang, D., J. Liang, and P. W. Noble. 2010. Regulation of non−infectious lung injury, inflammation, and repair by the extracellular matrix glycosaminoglycan hyaluronan. Anat Rec (Hoboken) 293: 982−985.
23. Aytekin, M., S. A. Comhair, C. de la Motte, S. K. Bandyopadhyay, C. F. Farver, V. C. Hascall, S. C. Erzurum, and R. A. Dweik. 2008. High levels of hyaluronan in idiopathic pulmonary arterial hypertension. Am J Physiol Lung Cell Mol Physiol 295: L789−799.
24. Noble, P. W. 2002. Hyaluronan and its catabolic products in tissue injury and repair. Matrix Biol 21: 25−29.
25. Noble, P. W., and D. Jiang. 2006. Matrix regulation of lung injury, inflammation, and repair: the role of innate immunity. Proc Am Thorac Soc 3: 401−404.
26. Garantziotis, S., Z. Li, E. N. Potts, K. Kimata, L. Zhuo, D. L. Morgan, R. C. Savani, P. W. Noble, W. M. Foster, D. A. Schwartz, and J. W. Hollingsworth. 2009. Hyaluronan mediates ozone−induced airway hyperresponsiveness in mice. J Biol Chem 284: 11309−11317.
27. Belperio, J. A., M. D. Burdick, M. P. Keane, Y. Y. Xue, J. P. Lynch, 3rd, B. L. Daugherty, S. L. Kunkel, and R. M. Strieter. 2000. The role of the CC chemokine, RANTES, in acute lung allograft rejection. J Immunol 165: 461−472.
28. Belperio, J. A., B. DiGiovine, M. P. Keane, M. D. Burdick, Y. Ying Xue, D. J. Ross, J. P. Lynch, 3rd, S. L. Kunkel, and R. M. Strieter. 2002. Interleukin−1 receptor antagonist as a biomarker for bronchiolitis obliterans syndrome in lung transplant recipients. Transplantation 73: 591−599.
29. Fyhrquist, N., S. Matikainen, and A. Lauerma. 2010. MK2 signaling: lessons on tissue specificity in modulation of inflammation. J Invest Dermatol 130: 342−344.
30. Belperio, J. A., M. P. Keane, M. D. Burdick, J. P. Lynch, 3rd, Y. Y. Xue, A. Berlin, D. J. Ross, S. L. Kunkel, I. F. Charo, and R. M. Strieter. 2001. Critical role for the chemokine MCP−1/CCR2 in the pathogenesis of bronchiolitis obliterans syndrome. J Clin Invest 108: 547−556.
31. Calve, S., J. Isaac, J. P. Gumucio, and C. L. Mendias. 2012. Hyaluronic acid, HAS1, and HAS2 are significantly upregulated during muscle hypertrophy. Am J Physiol Cell Physiol 303: C577−588.
32. Arch, R., K. Wirth, M. Hofmann, H. Ponta, S. Matzku, P. Herrlich, and M. Zoller. 1992. Participation in normal immune responses of a metastasis−inducing splice variant of CD44. Science 257: 682−685.
33. Vittal, R., A. Fisher, H. Gu, E. A. Mickler, A. Panitch, C. Lander, O. W. Cummings, G. E. Sandusky, and D. S. Wilkes. 2013. Peptide−mediated Inhibition of MK2 Ameliorates Bleomycin−Induced Pulmonary Fibrosis. Am J Respir Cell Mol Biol 49: 47−57.
34. Hinz, B., S. H. Phan, V. J. Thannickal, A. Galli, M. L. Bochaton−Piallat, and G. Gabbiani. 2007. The myofibroblast: one function, multiple origins. Am J Pathol 170: 1807−1816.
35. Liu, X., R. J. Kelm, Jr., and A. R. Strauch. 2009. TGF{beta}1−mediated Activation of the Smooth Muscle {alpha}−Actin Gene in Human Pulmonary Myofibroblasts Is Inhibited by TNF{alpha} via MEK1−dependent Induction of the Egr−1 Transcriptional Repressor. Mol Biol Cell 20: 2174−2185.
36. Wicks, J., H. M. Haitchi, S. T. Holgate, D. E. Davies, and R. M. Powell. 2006. Enhanced upregulation of smooth muscle related transcripts by TGF beta2 in asthmatic (myo)fibroblasts. Thorax 61: 313−319.
37. Bostrom, H., K. Willetts, M. Pekny, P. Leveen, P. Lindahl, H. Hedstrand, M. Pekna, M. Hellstrom, S. Gebre−Medhin, M. Schalling, M. Nilsson, S. Kurland, J. Tornell, J. K. Heath, and C. Betsholtz. 1996. PDGF−A signaling is a critical event in lung alveolar myofibroblast development and alveogenesis. Cell 85: 863−873.
38. Aziz, K. A., K. J. Till, M. Zuzel, and J. C. Cawley. 2000. Involvement of CD44−hyaluronan interaction in malignant cell homing and fibronectin synthesis in hairy cell leukemia. Blood 96: 3161−3167.
39. Toole, B. P. 2004. Hyaluronan: from extracellular glue to pericellular cue. Nat Rev Cancer 4: 528−539.
40. Qian, F., D. L. Vaux, and I. L. Weissman. 1994. Expression of the integrin alpha 4 beta 1 on melanoma cells can inhibit the invasive stage of metastasis formation. Cell 77: 335−347.
41. Meltzer, E. B., W. T. Barry, T. A. D’Amico, R. D. Davis, S. S. Lin, M. W. Onaitis, L. D. Morrison, T. A. Sporn, M. P. Steele, and P. W. Noble. 2011. Bayesian probit regression model for the diagnosis of pulmonary fibrosis: proof−of−principle. BMC Med Genomics 4: 70.
42. Pollock, K., L. Albares, C. Wendt, and A. Hubel. 2013. Isolation of fibroblasts and epithelial cells in bronchoalveolar lavage (BAL). Exp Lung Res 39: 146−154.
43. Trujillo, G., A. Meneghin, K. R. Flaherty, L. M. Sholl, J. L. Myers, E. A. Kazerooni, B. H. Gross, S. R. Oak, A. L. Coelho, H. Evanoff, E. Day, G. B. Toews, A. D. Joshi, M. A. Schaller, B. Waters, G. Jarai, J. Westwick, S. L. Kunkel, F. J. Martinez, and C. M. Hogaboam. 2010. TLR9 differentiates rapidly from slowly progressing forms of idiopathic pulmonary fibrosis. Sci Transl Med 2: 57ra82.
44. Pierce, E. M., K. Carpenter, C. Jakubzick, S. L. Kunkel, K. R. Flaherty, F. J. Martinez, and C. M. Hogaboam. 2007. Therapeutic targeting of CC ligand 21 or CC chemokine receptor 7 abrogates pulmonary fibrosis induced by the adoptive transfer of human pulmonary fibroblasts to immunodeficient mice. Am J Pathol 170: 1152−1164.
45. Yang, J., S. E. Wheeler, M. Velikoff, K. R. Kleavel and, M. J. Lafemina, J. A. Frank, H. A. Chapman, P. J. Christensen, and K. K. Kim. 2013. Activated Alveolar Epithelial Cells Initiate Fibrosis through Secretion of Mesenchymal Proteins. Am J Pathol.
46. Borges, F. T., S. A. Melo, B. C. Ozdemir, N. Kato, I. Revuelta, C. A. Miller, V. H. Gattone, 2nd, V. S. Lebleu, and R. Kalluri. 2013. TGF−beta1−Containing Exosomes from Injured Epithelial Cells Activate Fibroblasts to Initiate Tissue Regenerative Responses and Fibrosis. J Am Soc Nephrol 24: 385−392.
47. Adamson, I. Y., C. Hedgecock, and D. H. Bowden. 1990. Epithelial cell−fibroblast interactions in lung injury and repair. Am J Pathol 137: 385−392.
48. Chen, H., K. Matsumoto, B. L. Brockway, C. R. Rackley, J. Liang, J. H. Lee, D. Jiang, P. W. Noble, S. H. Randell, C. F. Kim, and B. R. Stripp. 2012. Airway epithelial progenitors are region specific and show differential responses to bleomycin−induced lung injury. Stem Cells 30: 1948−1960.
49. Belperio, J. A., M. P. Keane, M. D. Burdick, B. Gomperts, Y. Y. Xue, K. Hong, J. Mestas, A. Ardehali, B. Mehrad, R. Saggar, J. P. Lynch, D. J. Ross, and R. M. Strieter. 2005. Role of CXCR2/CXCR2 ligands in vascular remodeling during bronchiolitis obliterans syndrome. J Clin Invest 115: 1150−1162.
50. Belperio, J. A., M. P. Keane, M. D. Burdick, J. P. Lynch, 3rd, Y. Y. Xue, K. Li, D. J. Ross, and R. M. Strieter. 2002. Critical role for CXCR3 chemokine biology in the pathogenesis of bronchiolitis obliterans syndrome. J Immunol 169: 1037−1049.
51. Belperio, J. A., M. P. Keane, M. D. Burdick, J. P. Lynch, 3rd, D. A. Zisman, Y. Y. Xue, K. Li, A. Ardehali, D. J. Ross, and R. M. Strieter. 2003. Role of CXCL9/CXCR3 chemokine biology during pathogenesis of acute lung allograft rejection. J Immunol 171: 4844−4852.
52. Gregson, A. L., A. Hoji, V. Palchevskiy, S. Hu, S. S. Weigt, E. Liao, A. Derhovanessian, R. Saggar, S. Song, R. Elashoff, O. O. Yang, and J. A. Belperio. Protection against bronchiolitis obliterans syndrome is associated with allograft CCR7+ CD45RA− T regulatory cells. PLoS One 5: e11354.
53. Gregson, A. L., A. Hoji, R. Saggar, D. J. Ross, B. M. Kubak, B. D. Jamieson, S. S. Weigt, J. P. Lynch, 3rd, A. Ardehali, J. A. Belperio, and O. O. Yang. 2008. Bronchoalveolar immunologic profile of acute human lung transplant allograft rejection. Transplantation 85: 1056−1059.
54. Gregson, A. L., X. Wang, S. S. Weigt, V. Palchevskiy, J. P. Lynch, 3rd, D. J. Ross, B. M. Kubak, R. Saggar, M. C. Fishbein, A. Ardehali, G. Li, R. Elashoff, and J. A. Belperio. Interaction between Pseudomonas and CXC chemokines increases risk of bronchiolitis obliterans syndrome and death in lung transplantation. Am J Respir Crit Care Med 187: 518−526.
55. Keane, M. P., B. N. Gomperts, S. Weigt, Y. Y. Xue, M. D. Burdick, H. Nakamura, D. A. Zisman, A. Ardehali, R. Saggar, J. P. Lynch, 3rd, C. Hogaboam, S. L. Kunkel, N. W. Lukacs, D. J. Ross, M. J. Grusby, R. M. Strieter, and J. A. Belperio. 2007. IL−13 is pivotal in the fibro−obliterative process of bronchiolitis obliterans syndrome. J Immunol 178: 511−519.
56. Shino, M. Y., S. S. Weigt, N. Li, V. Palchevskiy, A. Derhovanessian, R. Saggar, D. M. Sayah, A. L. Gregson, M. C. Fishbein, A. Ardehali, D. J. Ross, J. P. Lynch, 3rd, R. M. Elashoff, and J. A. Belperio. CXCR3 Ligands Are Associated with the Continuum of Diffuse Alveolar Damage to Chronic Lung Allograft Dysfunction. Am J Respir Crit Care Med.
57. Weigt, S. S., C. A. Copeland, A. Derhovanessian, M. Y. Shino, W. A. Davis, L. D. Snyder, A. L. Gregson, R. Saggar, J. P. Lynch, 3rd, D. J. Ross, A. Ardehali, R. M. Elashoff, S. M. Palmer, and J. A. Belperio. Colonization with small conidia Aspergillus species is associated with bronchiolitis obliterans syndrome: a two−center validation study. Am J Transplant 13: 919−927.
58. Weigt, S. S., A. Derhovanessian, E. Liao, S. Hu, A. L. Gregson, B. M. Kubak, R. Saggar, V. Plachevskiy, M. C. Fishbein, J. P. Lynch, 3rd, A. Ardehali, D. J. Ross, H. J. Wang, R. M. Elashoff, and J. A. Belperio. CXCR3 chemokine ligands during respiratory viral infections predict lung allograft dysfunction. Am J Transplant 12: 477−484.
59. Weigt, S. S., R. M. Elashoff, C. Huang, A. Ardehali, A. L. Gregson, B. Kubak, M. C. Fishbein, R. Saggar, M. P. Keane, J. P. Lynch, 3rd, D. A. Zisman, D. J. Ross, and J. A. Belperio. 2009. Aspergillus colonization of the lung allograft is a risk factor for bronchiolitis obliterans syndrome. Am J Transplant 9: 1903−1911.
60. Weigt, S. S., R. M. Elashoff, M. P. Keane, R. M. Strieter, B. N. Gomperts, Y. Y. Xue, A. Ardehali, A. L. Gregson, B. Kubak, M. C. Fishbein, R. Saggar, D. J. Ross, J. P. Lynch, 3rd, D. A. Zisman, and J. A. Belperio. 2008. Altered levels of CC chemokines during pulmonary CMV predict BOS and mortality post−lung transplantation. Am J Transplant 8: 1512−1522.
61. Vittal, R., J. C. Horowitz, B. B. Moore, H. Zhang, F. J. Martinez, G. B. Toews, T. J. Standiford, and V. J. Thannickal. 2005. Modulation of prosurvival signaling in fibroblasts by a protein kinase inhibitor protects against fibrotic tissue injury. Am J Pathol 166: 367−375.
62. Vittal, R., H. Zhang, M. K. Han, B. B. Moore, J. C. Horowitz, and V. J. Thannickal. 2007. Effects of the protein kinase inhibitor, imatinib mesylate, on epithelial/mesenchymal phenotypes: implications for treatment of fibrotic diseases. J Pharmacol Exp Ther 321: 35−44.
63. Hecker, L., R. Vittal, T. Jones, R. Jagirdar, T. R. Luckhardt, J. C. Horowitz, S. Pennathur, F. J. Martinez, and V. J. Thannickal. 2009. NADPH oxidase−4 mediates myofibroblast activation and fibrogenic responses to lung injury. Nat Med 15: 1077−1081.
64. Hayashi, H., S. Abdollah, Y. Qiu, J. Cai, Y. Y. Xu, B. W. Grinnell, M. A. Richardson, J. N. Topper, M. A. Gimbrone, Jr., J. L. Wrana, and D. Falb. 1997. The MAD−related protein Smad7 associates with the TGFbeta receptor and functions as an antagonist of TGFbeta signaling. Cell 89: 1165−1173.
65. Warshamana, G. S., D. A. Pociask, K. J. Fisher, J. Y. Liu, P. J. Sime, and A. R. Brody. 2002. Titration of non−replicating adenovirus as a vector for transducing active TGF−beta1 gene expression causing inflammation and fibrogenesis in the lungs of C57BL/6 mice. Int J Exp Pathol 83: 183−201.
66. Sandrini, A., and A. R. Glanville. 2009. The controversial role of surveillance bronchoscopy after lung transplantation. Curr Opin Organ Transplant 14: 494−498.
Claims (14)
- a.抗CD44抗体の治療量を含む抗体成分と、
b.アミノ酸配列YARAAARQARAKALARQLGVAA(SEQ ID NO:1)のMK2阻害剤(MK2i)ポリペプチドの治療量、および薬学的に許容し得る担体を含むMK2阻害剤(MK2i)成分と、
を含む、肺移植後の肺移植片機能不全の処置に使用するための医薬の製造における医薬組成物の使用であって、
前記組成物が、前記肺移植片機能不全の少なくとも1つの病理生物学的作用を他の同時使用される免疫抑制薬なしに減少させるのに効果的である、使用。 - 前記肺移植片機能不全が、(a)正常な健常対照の対象の組織中の有糸分裂促進プロテインキナーゼ活性化プロテインキナーゼ2(MK2)の活性と比較して、組織中の有糸分裂促進プロテインキナーゼ活性化プロテインキナーゼ2(MK2)の異常な活性、又は(b)炎症、を特徴とする、請求項1に記載の使用。
- 前記肺移植片機能不全が、(a) 原発性の移植片機能不全である、または、(b) 慢性の肺移植片機能不全である、請求項1に記載の使用。
- 前記組成物が、(i)TGFβ、CCL2、ヒアルロン酸、およびMMP9のうちの少なくとも1つをモジュレートすること;(ii)TNFα、IL6またはそれらの組み合わせの血漿レベルを低下させること;(iii)α平滑筋アクチンの発現を低減すること;(iv)TGFβ誘導性の筋線維芽細胞活性化を予防すること;(v)線維芽細胞侵襲を阻害すること、またはそれらの組み合わせを行うことにおいて、対照と比較して効果的である、請求項1に記載の使用。
- 前記医薬組成物が、局所的に送達するよう処方される、請求項1に記載の使用。
- 前記医薬組成物が、全身性または吸入によって送達するよう処方される、請求項1に記載の使用。
- 前記担体が、制御放出性担体、遅延放出性担体、持続放出性担体、および長期放出性担体からなる群から選択される、請求項1に記載の使用。
- 前記医薬組成物が、乾燥粉末の形態である、請求項1に記載の使用。
- 前記乾燥粉末が、1〜5ミクロンの空気力学的質量中央径(MMAD)を有する微粒子を含む、請求項8に記載の使用。
- 前記乾燥粉末が、吸入装置によって送達するように処方される、請求項8に記載の使用。
- 前記吸入装置が、乾燥粉末吸入装置(DPI)、または、乾燥粉末ネブライザーである、請求項10に記載の使用。
- 前記医薬組成物が、吸入装置を介して投与される、請求項1に記載の使用。
- 前記吸入装置が、ネブライザーまたは計量吸入装置(MDI)である、請求項12に記載の使用。
- a.抗CD44抗体の治療量を含む抗体成分と、
b.アミノ酸配列YARAAARQARAKALARQLGVAA(SEQ ID NO:1)のMK2阻害剤(MK2i)ポリペプチドの治療量、および薬学的に許容し得る担体を含むMK2阻害剤(MK2i)成分と、
を含む、肺移植後の肺移植片機能不全の処置に使用するための医薬組成物であって、
前記組成物が、前記肺移植片機能不全の少なくとも1つの病理生物学的作用を他の同時使用される免疫抑制薬なしに減少させるのに効果的である、医薬組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201461953438P | 2014-03-14 | 2014-03-14 | |
| US61/953,438 | 2014-03-14 | ||
| PCT/US2015/020263 WO2015138784A2 (en) | 2014-03-14 | 2015-03-12 | Compositions and methods for preventing or treating chronic lung allograft dysfunction (clad) and idiopathic pulmonary fibrosis (ipf) |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2017509633A JP2017509633A (ja) | 2017-04-06 |
| JP2017509633A5 JP2017509633A5 (ja) | 2018-04-19 |
| JP6655547B2 true JP6655547B2 (ja) | 2020-02-26 |
Family
ID=54067793
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016557276A Expired - Fee Related JP6655547B2 (ja) | 2014-03-14 | 2015-03-12 | 慢性肺移植片機能不全(clad)および特発性肺線維症(ipf)を予防または処置するための組成物および方法 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US20150258192A1 (ja) |
| EP (1) | EP3116543A4 (ja) |
| JP (1) | JP6655547B2 (ja) |
| KR (1) | KR20160124236A (ja) |
| CN (1) | CN106456758A (ja) |
| AU (1) | AU2015229251A1 (ja) |
| BR (1) | BR112016021000A2 (ja) |
| CA (1) | CA2942517A1 (ja) |
| MX (1) | MX2016011852A (ja) |
| RU (1) | RU2016140332A (ja) |
| SG (1) | SG11201607627RA (ja) |
| WO (1) | WO2015138784A2 (ja) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2017053952A1 (en) | 2015-09-25 | 2017-03-30 | Cedars-Sinai Medical Center | Targeting fibroblast invasion for pulmonary fibrosis |
| US11725056B2 (en) | 2017-10-03 | 2023-08-15 | Cedars-Sinai Medical Center | Methods for targeting the immune checkpoint PD1 pathway for treating pulmonary fibrosis |
| EP3976759A4 (en) * | 2019-05-30 | 2023-04-12 | National Institute Of Biological Sciences, Beijing | ANIMAL MODEL OF IDIOPATHIC PULMONARY FIBROSIS, METHOD OF PRODUCTION AND USE |
| US20230255979A1 (en) * | 2020-07-24 | 2023-08-17 | Bristol-Myers Squibb Company | Methods of treating acute respiratory disorders |
| CN112575074B (zh) * | 2020-10-09 | 2022-12-27 | 中山大学 | Nestin基因及蛋白在治疗器官纤维化中的应用 |
| US20220202852A1 (en) * | 2020-12-30 | 2022-06-30 | Briotech, Inc. | Methods and compositions of aqueous hypobromous acid for the treatment and prevention of inflammatory conditions |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2560200A1 (en) * | 2004-03-17 | 2005-09-22 | Academisch Ziekenhuis Bij De Universiteit Van Amsterdam | Cd44-targeting for reducing/preventing ischemia-reperfusion-injury |
| US7723336B2 (en) * | 2005-09-22 | 2010-05-25 | Bristol-Myers Squibb Company | Fused heterocyclic compounds useful as kinase modulators |
| US20080199426A1 (en) * | 2007-01-11 | 2008-08-21 | Sukhatme Vikas P | Methods and compositions for the treatment and diagnosis of vascular inflammatory disorders or endothelial cell disorders |
| CN108014340A (zh) * | 2011-04-12 | 2018-05-11 | 莫伊莱麦屈克斯公司 | 用于预防或治疗以成纤维细胞异常增殖及细胞外基质沉积为特征的疾病的组合物和方法 |
| US10232039B2 (en) * | 2011-04-12 | 2019-03-19 | Duke University | Compositions and methods for the treatment of tissue fibrosis |
-
2015
- 2015-03-12 CN CN201580025482.9A patent/CN106456758A/zh active Pending
- 2015-03-12 EP EP15761995.8A patent/EP3116543A4/en not_active Withdrawn
- 2015-03-12 KR KR1020167028395A patent/KR20160124236A/ko not_active Application Discontinuation
- 2015-03-12 CA CA2942517A patent/CA2942517A1/en not_active Abandoned
- 2015-03-12 JP JP2016557276A patent/JP6655547B2/ja not_active Expired - Fee Related
- 2015-03-12 BR BR112016021000A patent/BR112016021000A2/pt not_active Application Discontinuation
- 2015-03-12 AU AU2015229251A patent/AU2015229251A1/en not_active Abandoned
- 2015-03-12 WO PCT/US2015/020263 patent/WO2015138784A2/en active Application Filing
- 2015-03-12 SG SG11201607627RA patent/SG11201607627RA/en unknown
- 2015-03-12 MX MX2016011852A patent/MX2016011852A/es unknown
- 2015-03-12 US US14/656,492 patent/US20150258192A1/en not_active Abandoned
- 2015-03-12 RU RU2016140332A patent/RU2016140332A/ru not_active Application Discontinuation
Also Published As
| Publication number | Publication date |
|---|---|
| MX2016011852A (es) | 2017-05-09 |
| EP3116543A4 (en) | 2017-09-06 |
| JP2017509633A (ja) | 2017-04-06 |
| RU2016140332A3 (ja) | 2018-10-11 |
| BR112016021000A2 (pt) | 2017-10-03 |
| WO2015138784A2 (en) | 2015-09-17 |
| US20150258192A1 (en) | 2015-09-17 |
| WO2015138784A3 (en) | 2015-10-29 |
| CN106456758A (zh) | 2017-02-22 |
| KR20160124236A (ko) | 2016-10-26 |
| RU2016140332A (ru) | 2018-04-16 |
| AU2015229251A1 (en) | 2016-09-22 |
| CA2942517A1 (en) | 2015-09-17 |
| EP3116543A2 (en) | 2017-01-18 |
| SG11201607627RA (en) | 2016-10-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6031510B2 (ja) | 異常な線維芽細胞増殖及び細胞外マトリックスの沈着を特徴とする疾患、症状又はプロセスを予防又は治療する組成物及び方法 | |
| JP6655547B2 (ja) | 慢性肺移植片機能不全(clad)および特発性肺線維症(ipf)を予防または処置するための組成物および方法 | |
| US10500249B2 (en) | Compositions and methods for preventing or treating diseases, conditions, or processes characterized by aberrant fibroblast proliferation and extracellular matrix deposition | |
| US10562947B2 (en) | Compositions and methods for preventing or treating diseases, conditions or processes characterized by aberrant fibroblast proliferation and extracellular matrix deposition | |
| NZ616672B2 (en) | Compositions and methods for preventing or treating diseases, conditions, or processes characterized by aberrant fibroblast proliferation and extracellular matrix deposition |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180312 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20180312 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190207 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20190507 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190807 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20191205 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200106 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20200203 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6655547 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |