JP6645828B2 - 個体の生物学的又は生化学的パラメータを非侵襲的にモニタする方法及びシステム - Google Patents
個体の生物学的又は生化学的パラメータを非侵襲的にモニタする方法及びシステム Download PDFInfo
- Publication number
- JP6645828B2 JP6645828B2 JP2015524904A JP2015524904A JP6645828B2 JP 6645828 B2 JP6645828 B2 JP 6645828B2 JP 2015524904 A JP2015524904 A JP 2015524904A JP 2015524904 A JP2015524904 A JP 2015524904A JP 6645828 B2 JP6645828 B2 JP 6645828B2
- Authority
- JP
- Japan
- Prior art keywords
- measurement system
- time
- spatial
- peak
- blood
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 238000000034 method Methods 0.000 title claims description 61
- 238000012544 monitoring process Methods 0.000 title claims description 33
- 238000005259 measurement Methods 0.000 claims description 194
- 210000004369 blood Anatomy 0.000 claims description 146
- 239000008280 blood Substances 0.000 claims description 146
- 230000008859 change Effects 0.000 claims description 138
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 claims description 134
- 238000005314 correlation function Methods 0.000 claims description 134
- 239000008103 glucose Substances 0.000 claims description 134
- 238000012360 testing method Methods 0.000 claims description 72
- 230000002123 temporal effect Effects 0.000 claims description 69
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 60
- 230000001427 coherent effect Effects 0.000 claims description 33
- 238000003384 imaging method Methods 0.000 claims description 32
- 239000000835 fiber Substances 0.000 claims description 31
- 210000004204 blood vessel Anatomy 0.000 claims description 29
- 238000005070 sampling Methods 0.000 claims description 26
- 239000012530 fluid Substances 0.000 claims description 23
- 210000000056 organ Anatomy 0.000 claims description 19
- 238000012545 processing Methods 0.000 claims description 18
- 210000001835 viscera Anatomy 0.000 claims description 15
- 238000004458 analytical method Methods 0.000 claims description 11
- 230000008569 process Effects 0.000 claims description 11
- 230000035485 pulse pressure Effects 0.000 claims description 11
- 239000000126 substance Substances 0.000 claims description 11
- 230000000694 effects Effects 0.000 claims description 10
- 230000015271 coagulation Effects 0.000 claims description 7
- 238000005345 coagulation Methods 0.000 claims description 7
- 230000010349 pulsation Effects 0.000 claims description 5
- 238000006073 displacement reaction Methods 0.000 claims description 4
- 239000000284 extract Substances 0.000 claims description 4
- 238000009530 blood pressure measurement Methods 0.000 claims description 3
- 238000009826 distribution Methods 0.000 claims description 3
- 239000004038 photonic crystal Substances 0.000 claims description 2
- 230000009278 visceral effect Effects 0.000 claims description 2
- 241000124008 Mammalia Species 0.000 claims 1
- 238000011161 development Methods 0.000 claims 1
- 230000001747 exhibiting effect Effects 0.000 claims 1
- 244000144972 livestock Species 0.000 claims 1
- 238000002474 experimental method Methods 0.000 description 81
- 235000019441 ethanol Nutrition 0.000 description 72
- 230000006870 function Effects 0.000 description 68
- 230000033001 locomotion Effects 0.000 description 54
- 230000003287 optical effect Effects 0.000 description 54
- 230000000875 corresponding effect Effects 0.000 description 45
- 210000001508 eye Anatomy 0.000 description 38
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 34
- 229910052760 oxygen Inorganic materials 0.000 description 34
- 239000001301 oxygen Substances 0.000 description 34
- 210000003491 skin Anatomy 0.000 description 33
- 241000283973 Oryctolagus cuniculus Species 0.000 description 25
- 210000000707 wrist Anatomy 0.000 description 24
- 230000032683 aging Effects 0.000 description 20
- 230000004410 intraocular pressure Effects 0.000 description 20
- 238000010586 diagram Methods 0.000 description 16
- 230000029058 respiratory gaseous exchange Effects 0.000 description 16
- 210000001519 tissue Anatomy 0.000 description 14
- 230000004044 response Effects 0.000 description 13
- 238000013459 approach Methods 0.000 description 12
- 230000036772 blood pressure Effects 0.000 description 12
- 238000005286 illumination Methods 0.000 description 12
- 230000017531 blood circulation Effects 0.000 description 11
- 210000000695 crystalline len Anatomy 0.000 description 11
- 208000010392 Bone Fractures Diseases 0.000 description 10
- 210000001124 body fluid Anatomy 0.000 description 10
- 210000002216 heart Anatomy 0.000 description 10
- 210000000554 iris Anatomy 0.000 description 10
- 206010017076 Fracture Diseases 0.000 description 8
- 239000000523 sample Substances 0.000 description 8
- 210000001742 aqueous humor Anatomy 0.000 description 7
- 230000007774 longterm Effects 0.000 description 7
- 230000010355 oscillation Effects 0.000 description 7
- 230000006399 behavior Effects 0.000 description 6
- 230000023555 blood coagulation Effects 0.000 description 6
- 235000009508 confectionery Nutrition 0.000 description 6
- 230000007423 decrease Effects 0.000 description 6
- 238000001514 detection method Methods 0.000 description 6
- 229910052602 gypsum Inorganic materials 0.000 description 6
- 239000010440 gypsum Substances 0.000 description 6
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 6
- 210000003786 sclera Anatomy 0.000 description 6
- 241000283690 Bos taurus Species 0.000 description 5
- 102000001554 Hemoglobins Human genes 0.000 description 5
- 108010054147 Hemoglobins Proteins 0.000 description 5
- 210000001367 artery Anatomy 0.000 description 5
- 210000000988 bone and bone Anatomy 0.000 description 5
- 230000002596 correlated effect Effects 0.000 description 5
- 239000011159 matrix material Substances 0.000 description 5
- 241001465754 Metazoa Species 0.000 description 4
- 241000282887 Suidae Species 0.000 description 4
- 210000000038 chest Anatomy 0.000 description 4
- 230000035622 drinking Effects 0.000 description 4
- 238000000605 extraction Methods 0.000 description 4
- 238000002496 oximetry Methods 0.000 description 4
- 230000036387 respiratory rate Effects 0.000 description 4
- 206010053567 Coagulopathies Diseases 0.000 description 3
- 208000032843 Hemorrhage Diseases 0.000 description 3
- 102000004877 Insulin Human genes 0.000 description 3
- 108090001061 Insulin Proteins 0.000 description 3
- 108010000499 Thromboplastin Proteins 0.000 description 3
- 102000002262 Thromboplastin Human genes 0.000 description 3
- 208000027418 Wounds and injury Diseases 0.000 description 3
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 3
- 208000034158 bleeding Diseases 0.000 description 3
- 230000000740 bleeding effect Effects 0.000 description 3
- 239000010839 body fluid Substances 0.000 description 3
- 210000004027 cell Anatomy 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 210000004087 cornea Anatomy 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 206010012601 diabetes mellitus Diseases 0.000 description 3
- 230000035487 diastolic blood pressure Effects 0.000 description 3
- 201000010099 disease Diseases 0.000 description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 239000003814 drug Substances 0.000 description 3
- 210000003743 erythrocyte Anatomy 0.000 description 3
- 208000014674 injury Diseases 0.000 description 3
- 229940125396 insulin Drugs 0.000 description 3
- 230000001678 irradiating effect Effects 0.000 description 3
- 238000012014 optical coherence tomography Methods 0.000 description 3
- 230000000241 respiratory effect Effects 0.000 description 3
- 230000008054 signal transmission Effects 0.000 description 3
- 230000003595 spectral effect Effects 0.000 description 3
- 230000035488 systolic blood pressure Effects 0.000 description 3
- 230000002792 vascular Effects 0.000 description 3
- 108010039209 Blood Coagulation Factors Proteins 0.000 description 2
- 102000015081 Blood Coagulation Factors Human genes 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- 208000010412 Glaucoma Diseases 0.000 description 2
- 206010021143 Hypoxia Diseases 0.000 description 2
- 241000282849 Ruminantia Species 0.000 description 2
- UCTWMZQNUQWSLP-UHFFFAOYSA-N adrenaline Chemical compound CNCC(O)C1=CC=C(O)C(O)=C1 UCTWMZQNUQWSLP-UHFFFAOYSA-N 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 239000003114 blood coagulation factor Substances 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 125000004122 cyclic group Chemical group 0.000 description 2
- 230000018044 dehydration Effects 0.000 description 2
- 238000006297 dehydration reaction Methods 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 230000004424 eye movement Effects 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 238000007917 intracranial administration Methods 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 238000000691 measurement method Methods 0.000 description 2
- 230000037323 metabolic rate Effects 0.000 description 2
- 239000002105 nanoparticle Substances 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 230000036391 respiratory frequency Effects 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- 238000004148 unit process Methods 0.000 description 2
- 210000003462 vein Anatomy 0.000 description 2
- 208000007848 Alcoholism Diseases 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 238000012935 Averaging Methods 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- BHPQYMZQTOCNFJ-UHFFFAOYSA-N Calcium cation Chemical compound [Ca+2] BHPQYMZQTOCNFJ-UHFFFAOYSA-N 0.000 description 1
- 208000012661 Dyskinesia Diseases 0.000 description 1
- 102000009123 Fibrin Human genes 0.000 description 1
- 108010073385 Fibrin Proteins 0.000 description 1
- BWGVNKXGVNDBDI-UHFFFAOYSA-N Fibrin monomer Chemical compound CNC(=O)CNC(=O)CN BWGVNKXGVNDBDI-UHFFFAOYSA-N 0.000 description 1
- 206010019114 Hand fracture Diseases 0.000 description 1
- SQUHHTBVTRBESD-UHFFFAOYSA-N Hexa-Ac-myo-Inositol Natural products CC(=O)OC1C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C1OC(C)=O SQUHHTBVTRBESD-UHFFFAOYSA-N 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 208000015592 Involuntary movements Diseases 0.000 description 1
- 125000002066 L-histidyl group Chemical group [H]N1C([H])=NC(C([H])([H])[C@](C(=O)[*])([H])N([H])[H])=C1[H] 0.000 description 1
- 238000004497 NIR spectroscopy Methods 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 208000022873 Ocular disease Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 108010094028 Prothrombin Proteins 0.000 description 1
- 102100027378 Prothrombin Human genes 0.000 description 1
- 238000001069 Raman spectroscopy Methods 0.000 description 1
- 206010038848 Retinal detachment Diseases 0.000 description 1
- 208000017442 Retinal disease Diseases 0.000 description 1
- 208000007536 Thrombosis Diseases 0.000 description 1
- 208000003443 Unconsciousness Diseases 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 230000032900 absorption of visible light Effects 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 230000001133 acceleration Effects 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 201000007930 alcohol dependence Diseases 0.000 description 1
- 125000003158 alcohol group Chemical group 0.000 description 1
- 235000013334 alcoholic beverage Nutrition 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 239000003146 anticoagulant agent Substances 0.000 description 1
- 229940127219 anticoagulant drug Drugs 0.000 description 1
- 238000000149 argon plasma sintering Methods 0.000 description 1
- 238000010342 arterial blood gas test Methods 0.000 description 1
- 238000010009 beating Methods 0.000 description 1
- 239000013060 biological fluid Substances 0.000 description 1
- 230000008827 biological function Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 208000015294 blood coagulation disease Diseases 0.000 description 1
- 230000036770 blood supply Effects 0.000 description 1
- 238000009534 blood test Methods 0.000 description 1
- 238000007664 blowing Methods 0.000 description 1
- 210000000746 body region Anatomy 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 238000009395 breeding Methods 0.000 description 1
- 230000001488 breeding effect Effects 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 229910001424 calcium ion Inorganic materials 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 210000000748 cardiovascular system Anatomy 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 238000005253 cladding Methods 0.000 description 1
- 230000035602 clotting Effects 0.000 description 1
- 230000009852 coagulant defect Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 230000008602 contraction Effects 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 238000007405 data analysis Methods 0.000 description 1
- 238000013500 data storage Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 210000002249 digestive system Anatomy 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 230000002526 effect on cardiovascular system Effects 0.000 description 1
- 210000000744 eyelid Anatomy 0.000 description 1
- 229950003499 fibrin Drugs 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 210000005095 gastrointestinal system Anatomy 0.000 description 1
- 230000004153 glucose metabolism Effects 0.000 description 1
- 210000004247 hand Anatomy 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 238000005210 holographic interferometry Methods 0.000 description 1
- 208000018875 hypoxemia Diseases 0.000 description 1
- 230000001146 hypoxic effect Effects 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 238000002329 infrared spectrum Methods 0.000 description 1
- 229960000367 inositol Drugs 0.000 description 1
- -1 inositol phosphates Chemical class 0.000 description 1
- 238000005305 interferometry Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 201000004614 iritis Diseases 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 1
- 229910052753 mercury Inorganic materials 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 238000012806 monitoring device Methods 0.000 description 1
- 230000017311 musculoskeletal movement, spinal reflex action Effects 0.000 description 1
- 239000000842 neuromuscular blocking agent Substances 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 230000035764 nutrition Effects 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 210000004798 organs belonging to the digestive system Anatomy 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 238000004867 photoacoustic spectroscopy Methods 0.000 description 1
- 239000011505 plaster Substances 0.000 description 1
- 230000010287 polarization Effects 0.000 description 1
- 230000003334 potential effect Effects 0.000 description 1
- 230000000644 propagated effect Effects 0.000 description 1
- 229940039716 prothrombin Drugs 0.000 description 1
- 238000002106 pulse oximetry Methods 0.000 description 1
- 238000005086 pumping Methods 0.000 description 1
- 238000000718 qrs complex Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 210000001525 retina Anatomy 0.000 description 1
- 230000004264 retinal detachment Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 230000000630 rising effect Effects 0.000 description 1
- CDAISMWEOUEBRE-UHFFFAOYSA-N scyllo-inosotol Natural products OC1C(O)C(O)C(O)C(O)C1O CDAISMWEOUEBRE-UHFFFAOYSA-N 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 210000003625 skull Anatomy 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 238000002366 time-of-flight method Methods 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- 210000001585 trabecular meshwork Anatomy 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 210000003454 tympanic membrane Anatomy 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/02—Detecting, measuring or recording pulse, heart rate, blood pressure or blood flow; Combined pulse/heart-rate/blood pressure determination; Evaluating a cardiovascular condition not otherwise provided for, e.g. using combinations of techniques provided for in this group with electrocardiography or electroauscultation; Heart catheters for measuring blood pressure
- A61B5/0205—Simultaneously evaluating both cardiovascular conditions and different types of body conditions, e.g. heart and respiratory condition
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B3/00—Apparatus for testing the eyes; Instruments for examining the eyes
- A61B3/10—Objective types, i.e. instruments for examining the eyes independent of the patients' perceptions or reactions
- A61B3/16—Objective types, i.e. instruments for examining the eyes independent of the patients' perceptions or reactions for measuring intraocular pressure, e.g. tonometers
- A61B3/165—Non-contacting tonometers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B3/00—Apparatus for testing the eyes; Instruments for examining the eyes
- A61B3/0008—Apparatus for testing the eyes; Instruments for examining the eyes provided with illuminating means
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B3/00—Apparatus for testing the eyes; Instruments for examining the eyes
- A61B3/10—Objective types, i.e. instruments for examining the eyes independent of the patients' perceptions or reactions
- A61B3/102—Objective types, i.e. instruments for examining the eyes independent of the patients' perceptions or reactions for optical coherence tomography [OCT]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/0048—Detecting, measuring or recording by applying mechanical forces or stimuli
- A61B5/0051—Detecting, measuring or recording by applying mechanical forces or stimuli by applying vibrations
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/0059—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/0059—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence
- A61B5/0062—Arrangements for scanning
- A61B5/0066—Optical coherence imaging
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/02—Detecting, measuring or recording pulse, heart rate, blood pressure or blood flow; Combined pulse/heart-rate/blood pressure determination; Evaluating a cardiovascular condition not otherwise provided for, e.g. using combinations of techniques provided for in this group with electrocardiography or electroauscultation; Heart catheters for measuring blood pressure
- A61B5/02028—Determining haemodynamic parameters not otherwise provided for, e.g. cardiac contractility or left ventricular ejection fraction
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/02—Detecting, measuring or recording pulse, heart rate, blood pressure or blood flow; Combined pulse/heart-rate/blood pressure determination; Evaluating a cardiovascular condition not otherwise provided for, e.g. using combinations of techniques provided for in this group with electrocardiography or electroauscultation; Heart catheters for measuring blood pressure
- A61B5/0205—Simultaneously evaluating both cardiovascular conditions and different types of body conditions, e.g. heart and respiratory condition
- A61B5/02055—Simultaneously evaluating both cardiovascular condition and temperature
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/02—Detecting, measuring or recording pulse, heart rate, blood pressure or blood flow; Combined pulse/heart-rate/blood pressure determination; Evaluating a cardiovascular condition not otherwise provided for, e.g. using combinations of techniques provided for in this group with electrocardiography or electroauscultation; Heart catheters for measuring blood pressure
- A61B5/021—Measuring pressure in heart or blood vessels
- A61B5/02108—Measuring pressure in heart or blood vessels from analysis of pulse wave characteristics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/02—Detecting, measuring or recording pulse, heart rate, blood pressure or blood flow; Combined pulse/heart-rate/blood pressure determination; Evaluating a cardiovascular condition not otherwise provided for, e.g. using combinations of techniques provided for in this group with electrocardiography or electroauscultation; Heart catheters for measuring blood pressure
- A61B5/021—Measuring pressure in heart or blood vessels
- A61B5/02108—Measuring pressure in heart or blood vessels from analysis of pulse wave characteristics
- A61B5/02116—Measuring pressure in heart or blood vessels from analysis of pulse wave characteristics of pulse wave amplitude
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/02—Detecting, measuring or recording pulse, heart rate, blood pressure or blood flow; Combined pulse/heart-rate/blood pressure determination; Evaluating a cardiovascular condition not otherwise provided for, e.g. using combinations of techniques provided for in this group with electrocardiography or electroauscultation; Heart catheters for measuring blood pressure
- A61B5/024—Detecting, measuring or recording pulse rate or heart rate
- A61B5/02416—Detecting, measuring or recording pulse rate or heart rate using photoplethysmograph signals, e.g. generated by infrared radiation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/02—Detecting, measuring or recording pulse, heart rate, blood pressure or blood flow; Combined pulse/heart-rate/blood pressure determination; Evaluating a cardiovascular condition not otherwise provided for, e.g. using combinations of techniques provided for in this group with electrocardiography or electroauscultation; Heart catheters for measuring blood pressure
- A61B5/026—Measuring blood flow
- A61B5/0261—Measuring blood flow using optical means, e.g. infrared light
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/145—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue
- A61B5/14507—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue specially adapted for measuring characteristics of body fluids other than blood
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/145—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue
- A61B5/14532—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue for measuring glucose, e.g. by tissue impedance measurement
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/145—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue
- A61B5/1455—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue using optical sensors, e.g. spectral photometrical oximeters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/72—Signal processing specially adapted for physiological signals or for diagnostic purposes
- A61B5/7271—Specific aspects of physiological measurement analysis
- A61B5/7275—Determining trends in physiological measurement data; Predicting development of a medical condition based on physiological measurements, e.g. determining a risk factor
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/02—Detecting, measuring or recording pulse, heart rate, blood pressure or blood flow; Combined pulse/heart-rate/blood pressure determination; Evaluating a cardiovascular condition not otherwise provided for, e.g. using combinations of techniques provided for in this group with electrocardiography or electroauscultation; Heart catheters for measuring blood pressure
- A61B5/02028—Determining haemodynamic parameters not otherwise provided for, e.g. cardiac contractility or left ventricular ejection fraction
- A61B5/02035—Determining blood viscosity
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/145—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue
- A61B5/14542—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue for measuring blood gases
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/45—For evaluating or diagnosing the musculoskeletal system or teeth
- A61B5/4504—Bones
Description
として推定されることが可能であり、ここで、βは、スペックルパターンの相対的なシフトδに比例し(すなわち、点Aと点Bとの間の距離)、αは物体の表面の傾斜角であり、λは光学波長である。角度の変化が十分に小さいと仮定すると、相対的なシフトと傾斜の角度との間で線形比例が得られる。
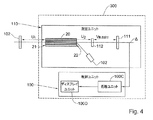
U1は内臓102とマイクロプローブ20の入力端21との間の距離であり、U2はマイクロプローブ20の出力端22の間の距離であり、Vは光学アセンブリ112の光学中心と検出器アレイ10との間の距離であり、Fは光学アセンブリ112の焦点距離である。本開示の焦点ぼけの構成では、上述した関係を用いて得られた光学アセンブリ112の上記位置は、わずかな焦点ぼけが存在するように配慮されていない。例えば、光学アセンブリ112と検出器アレイ111との間の距離は、上述した関係を用いて得られた距離Vとは異なる。
以下のセクションは、血中グルコース濃度と、対象者の手首の皮膚の振動によって引き起こされたスペックルパターンの時間変化(すなわち、空間相関関数の経時変化)を示す時変関数のパラメータとの間の関係を決定するため、本発明者らによって人間の対象者に行われたテストに関して言及する。
で説明され、Cv(t)は時間tにおける静脈中のグルコース濃度であり、Fは血流(血液の量、通常はリットル毎分で表す)であり、q0は、グルコースパルスに対応し、鼓動ごとの血液(Kg)中のグルコースの量(mg)を表し、εは、血液系から抽出されて代謝される(従って、静脈の出口で回収されない)グルコースパルスの断片であり、h(t)は、静脈内のグルコースパルスの出現を遅らせて歪ませる臓器内のグルコースの可逆性脂肪である。
であり、xiがパラメータ値のi番目のサンプルであり、riが参照グルコース測定値のi番目のサンプルであり、Nはサンプルの数である。算出されたサンプルは、すべてのパラメータに関して共通の推定尺度を得るために、RMSE推定量に適用する前に、1のエネルギーを有するように正規化される。
以下のセクションは、血中アルコール濃度と、時間域におけるスペックルパターンの空間相関関数の特徴(例えば相関ピーク及び/又はその値)の経時変化の1以上のパラメータとの間の関係を決定するため、本発明者らによって人間の対象者に実施されたテストに関する。
呼吸は、身体に酸素を供給し、身体から二酸化炭素を除去するプロセスであり、呼吸数は、1分毎になされる呼吸の数である。成人の標準的な数は毎分12〜20呼吸である。
本発明の手法は、血液の凝固条件を決定するためにも用いられ得る。凝固は、出血を止めて負傷を治すために負傷後に血液が凝血塊を形成するプロセスである。プロセスは、凝固因子として知られる血小板及び蛋白質の2つの成分を包含する。血小板は、負傷部位の周辺に生じ、同時に、血漿内の蛋白質が、フィブリンの形成に反応して血小板血栓を増加させる。凝固障害は、凝血因子又は血小板のうちの1つに欠乏又は異常がある時に起きる。過剰な凝固(血栓症)傾向の増大、又は、出血(大出血)のリスクの増大のいずれかがあり得る。血液凝固障害は、遺伝性、又は、別の疾病の結果、又は、薬物の副作用でもあり得る。
で規定される。
血中酸素飽和レベルは、酸素が詰め込まれている赤血球の割合である。赤血球が肺を通過する時、赤血球は、その後身体の臓器に運ばれる酸素で飽和している。酸素が飽和している(酸素飽和)赤血球の正常な割合は95%を超える。酸素飽和度が90%未満に低下する時は、低酸素症であるとみなされる。身体は、血中酸素の適正水準の外側では適切に機能することができない。
図28〜図32を説明する以下のセクションは、眼圧(IOP)と時間域における対象者の眼の振動プロファイルのパラメータとの間の関係を決定するため、本発明者らによってウサギに行われたテストに関する。
と推定することができ、この場合、ρは注入液体の濃度であり、gは重力加速度であり、かつ、Δhが高度差である、式6で得られた圧力値の間のmmHg単位への変換は、以下の変換を用いて算出することができる。
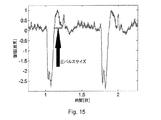
上述したとおり、本発明の手法は、脈圧を決定するために用いることができる。これを行うにあたって、図1Bのシステムと同様のシステムが、血管に隣接する患者の皮膚の領域(例えば手首)を照射するために用いられ得る。スペックルパターンの変動は、上述したとおりに検出されて処理され、相関関数と、相関関数の特徴の時間変動(例えばピーク位置及び/又はピークサイズ)を決定する。空間相関関数の変動は、図6Aに示すプロファイルと同様のプロファイルを有しており、ピークの振幅は、測定(照射)箇所における血流量を示す。本発明者は、測定されたデータ(スペックルパターン)の時間的変動が測定箇所内の血流量(運動)に対応するという事実により、時変空間相関関数の主要ピーク(図6Aのパラメータ1)の振幅が患者の脈圧と良好な相関関係にあることを見出した。
本発明の手法は、反芻動物の生物医学的パラメータを決定するためにも用いることができる。例えば心臓の鼓動のモニタリング、パルスカウント、脈圧及び呼吸カウントなどの反芻動物の生物医学的パラメータのモニタは、この情報が、牛の搾乳及び繁殖のタイミングを最適化するために用いられ得るので、牛の場合には非常に重要であり得る。都合の良いことには、このようなモニタは、動物を扱う時には重要である接触なしに実行される。オプトフォン技術を適用して、主要な動脈に近い位置で牛の皮膚の表面を観察することは、運動のモニタ後及び適切な較正後に、リアルタイムで連続的に上述した生物医学的パラメータの抽出を可能にし得る。
本発明の手法は、生物組織の温度を決定するためにも用いることができる。これを行うにあたって、図1Bのシステムと同様のシステムが、生物組織(例えば身体の皮膚の一部)を照射するために用いられ得る。スペックルパターンの変動は、上述したように検出されて処理され、相関関数と、相関関数の特徴(例えばピーク位置及びピークサイズ)の時間的変動とを決定する。実際には、組織の温度は組織の運動プロファイルに関連している。従って、このプロファイルを抽出することによって、適切な較正後、検査される組織の温度を推定することが可能である。
本発明の手法は、流速及び流量をモニタするためにも用いることができる。流速及び流量は、相関ピークの時間パターンのスペクトル成分の時間的変動に相関しており、相関ピークは、流れをモニタする臓器の表面に生成されたスペックルパターンの連続する焦点ぼけ画像同士の間の相関関数から抽出される。実際には、流れる液体内にナノ粒子を挿入して、それらのナノ粒子からの散乱に起因して生成されたスペックルパターンの経時変化を検査することによって、例えばより早い流れがスペックルパターンのより早い運動を生じさせるので、流速及び流量を推定することができる。従って、流速は、検査されたスペックルパターンの時間的なちらつきに比例する。このちらつきは、相関関係ベースの処理によってリアルタイムで計算することができる。
本発明者らは、骨折の測定/検出を目的とした実験を実施した。この目的を達成するために、ラウドスピーカが、身体の部分、例えば患者の手の近くに配置された。ラウドスピーカは、音響信号、すなわち、患者の手に振動を引き起こす圧力波を生成する。骨折を有する骨の運動は、骨折のないものと異なる。上述したオプトフォン(測定ユニット)は、皮膚及び骨(一連のスペックルパターンを生成する)の運動を検査するために用いられ、制御ユニットは、このデータを処理して、較正された値からの偏差があるかどうかを識別する(第2の骨折していない手であり得る)。スピーカの強度は、スピーカ同士が配置される距離に依存する。患者の手(概して身体部分)から数センチメートルにスピーカを配置すること、及び、約90dBの強度を適用することによって、スピーカが手を振動させ、骨折を有する場合、健康な手がそうであるように振動しない。このことは、適切な較正を行うこと(すなわち、手が骨折する前をマッピングすること)によって、又は、実質的に対称であると仮定される2つの手同士の間の光学応答を比較することによって、識別することができる。従って、骨折を識別/検出するために本発明の手法を実施するには、最初に、振動プロファイル及び周波数領域によって対象者の折れた骨が検査されることである。この測定は基準測定として用いられる。その後、折れた骨(又は、折れたと仮定される骨)が検査され、その振動プロファイル及び周波数が、差異を抽出するため及び骨が折れているかどうかを定義するための基準測定と比較される。骨折の存在を識別するにあたって、レーザスポットが手をスキャンし、手をポイントごとにマッピングする。この手法は、骨折の観察のためのレントゲン画像の代替として又は追加として用いることができる。これは、年配女性などの骨内のカルシウムの不足の兆候であり得る。
Claims (23)
- ヒト及び家畜を含む哺乳類の少なくともグルコース状態のモニタに使用する測定システムであって、前記測定システムは:
身体の一部の焦点ぼけしたコヒーレント画像イメージングを実行し、あるサンプリング時間パターンを有するサンプリング時間中に前記身体の一部から収集されたスペックルパターンのシーケンスを含む焦点ぼけしたコヒーレント画像データを示す、測定した画像データを生成するように構成され動作可能な撮像デバイスと;
身体の一部の皮膚上に置かれるように構成され、磁界を生成するように動作可能な磁石ユニットであって、前記磁石ユニットが前記サンプリング時間期間中に動作している場合、前記測定した画像データが、磁石によって生成される一方で血液脈動によって生成される前記皮膚の振動プロファイルにおける時間的変化の影響を受ける磁界によって、および、ファラデー効果を示す血中のグルコース分子によって生ずる回転の変化によって、変更されるスペックルパターンのシーケンスを含む磁石ユニットと;
を備える測定ユニット;および
前記測定した画像データを受信するための入力ポートと;
1又はそれ以上の既定のモデルを記憶するためのメモリユーティリティであって、前記モデルは、焦点ぼけしたコヒーレント画像データから導出できる1又はそれ以上の測定可能パラメータと前記少なくともグルコース状態との間の関係を示すデータを含む、メモリユーティリティと;
前記画像データを処理し前記身体の少なくともグルコース状態を決定するように構成され動作可能なプロセッサユーティリティであって、前記処理が、
前記シーケンスにおける2つの各連続的なスペックルパターン同士の間で、相関ピークを有する空間相関関数を決定し、それによって前記空間相関関数のシーケンスを取得し、前記サンプリング時間の期間中に前記相関ピークの少なくとも1つの空間的特徴の時間的変動に対応する時変空間相関関数を決定し、前記時変空間相関関数は前記変更スペックルパターンの経時の変化を示し、前記変更スペックルパターンの経時の変化は、前記焦点ぼけしたコヒーレント画像データの収集中の前記皮膚の振動プロファイルおよび血液脈動ピークのシフトを示すものであり、前記少なくとも1つの空間的特徴は、前記相関ピークの空間位置、前記相関ピークの値、および前記相関ピークのサイズのうちの少なくとも1つを備え、前記焦点ぼけしたコヒーレント画像データから算出されたモデルパラメータに対応し、
前記相関ピークの少なくとも1つの空間的特徴を選択し、少なくとも1つの選択されたモデルを使用して前記時変空間相関関数に処理を適用し、前記少なくともグルコース状態を決定し、
前記少なくともグルコース状態を示す出力データを生成する、プロセッサユーティリティと;
を備える制御ユニット;
を備えることを特徴とする測定システム。 - 請求項1に記載の測定システムにおいて、前記グルコース状態は、血中グルコース濃度を含むことを特徴とする測定システム。
- 請求項2に記載の測定システムにおいて、前記時変空間相関関数の選択された少なくとも1つの空間的特徴は、前記相関ピークの正の振幅、及び、前記相関ピークの正の振幅と負の振幅との間の比率のうちの少なくとも1つを含むことを特徴とする測定システム。
- 請求項1〜3のいずれか1項に記載の測定システムが、血中アルコール濃度を含む1以上の追加の身体状態をモニタするようにさらに構成されることを特徴とする測定システム。
- 請求項4に記載の測定システムにおいて、前記時変空間相関関数の選択された少なくとも1つの空間的特徴は、前記相関ピークのサイズ、前記相関ピークの正の部分のサイズ、相関ピーク極性同士の間の距離、主要相関ピーク位置と二次的相関ピーク位置との間の比率、主要相関ピーク振幅と二次的相関ピーク振幅との間の比率、及び、背景雑音の標準偏差のうちの少なくとも1つを含むことを特徴とする測定システム。
- 請求項1〜5のいずれか1項に記載の測定システムが、前記身体状態は、血液の脈圧を含む1以上の追加の身体状態をモニタするようにさらに構成されることを特徴とする測定システム。
- 請求項6に記載の測定システムにおいて、前記時変空間相関関数の選択された少なくとも1つの空間的特徴は:経時変化するスペックルパターンの相対的な空間変位に関連付けられる前記主要相関ピークの振幅と;前記経時変化するスペックルパターンの分布における相対的な変化に関連付けられる相関ピークの値のうちの少なくとも1つ含むことを特徴とする測定システム。
- 請求項1〜7のいずれか1項に記載の測定システムが、血液の凝固、温度、流速及び流量のうちの少なくとも1つの身体状態をモニタするようにさらに構成されることを特徴とする測定システム。
- 請求項1〜8のいずれか1項に記載の測定システムにおいて、前記撮像装置は、前記あるサンプリング時間パターンに従って既定の数の波長によって前記身体の前記少なくとも1つの部分を照射するためのコヒーレント光源と、前記身体の前記照射された部分によって生成された二次的スペックルパターンを検知して、前記二次的スペックルパターンの検出されたシーケンスを示す前記測定した画像データを生成するように構成されて動作可能な画素検出器アレイと、を備えることを特徴とする測定システム。
- 請求項1〜9のいずれか1項に記載の測定システムにおいて、前記測定ユニットは、内臓を検査する内視鏡をさらに備えることを特徴とする測定システム。
- 請求項10に記載の測定システムにおいて、前記内視鏡は、対象の領域に向かって照射された光及び対象の領域から集光された光を案内するための剛性又は可撓性のガイドを備えることを特徴とする測定システム。
- 請求項10又は11に記載の測定システムにおいて、前記内視鏡は、マルチコアファイバの近位端及び遠位端の間で光を伝送するように構成されたマルチコアファイバを備え、前記遠位端は、検査される内臓の近位に配置されることが意図されることを特徴とする測定システム。
- 請求項1〜12のいずれか1項に記載の測定システムにおいて、前記制御ユニットは、
前記時変空間相関関数から、前記相関ピークの少なくとも1つの空間的特徴の時間発展を抽出し、
既定の期間において抽出された空間的特徴の時間発展を処理することによって、抽出された空間的特徴の時間発展の特質を算出することによって、
前記少なくともグルコース状態を決定するように構成されて動作可能であることを特徴とする測定システム。 - 請求項13に記載の測定システムにおいて、前記制御ユニットは、参照モデルを記憶するように構成されたメモリユーティリティを備え、前記参照モデルは、算出された前記空間的特徴の時間発展の特質及び前記1又はそれ以上の身体状態に関連することを特徴とする測定システム。
- 請求項13または14に記載の測定システムにおいて、抽出された前記空間的特徴の時間発展は、相関ピークの位置及び相関ピークの強度のうちの少なくとも1つを含むことを特徴とする測定システム。
- 請求項13〜15のいずれか1項に記載の測定システムにおいて、前記空間的特徴の時間発展の特質は、抽出された前記空間的特徴の時間発展におけるピークの振幅、抽出された前記空間的特徴の時間発展における正ピーク振幅と負ピーク振幅との間の比率、抽出された前記空間的特徴の時間発展におけるピーク同士の間の期間、背景雑音の標準偏差のうちの少なくとも1つを含むことを特徴とする測定システム。
- 請求項13〜15のいずれか1項に記載の測定システムが、血管の内圧をモニタするようにさらに構成され、及び、1又はそれ以上の前記空間的特徴の時間発展の特質は、抽出された前記空間的特徴の時間発展の経時の主要ピークの振幅を含むことを特徴とする測定システム。
- 請求項13〜17のいずれか1項に記載の測定システムが、内臓の流体の流れにおける化学物質の濃度をモニタするようにさらに構成され、1又はそれ以上の前記空間的特徴の時間発展の特質は、抽出された前記空間的特徴の時間発展における経時の正ピーク振幅、及び、抽出された前記空間的特徴の時間発展における経時の正ピーク振幅と負ピーク振幅との間の比率のうちの少なくとも1つを含むことを特徴とする測定システム。
- 請求項1〜18のいずれか1項に記載の測定システムにおいて、前記制御ユニットは、前記少なくともグルコース状態の様々な値に関連する反射に関する前記相関ピークの経時特性を特徴付けて分離するために、成分解析を適用するようにさらに構成されることを特徴とする測定システム。
- 請求項1〜19のいずれか1項に記載の測定システムが、検査される臓器を刺激するように構成された超音波装置をさらに備えることを特徴とする測定システム。
- 請求項12に記載の測定システムにおいて、前記マルチコアファイバは、ファイバ束又はフォトニック結晶であることを特徴とする測定システム。
- 請求項12に記載の測定システムにおいて、前記マルチコアファイバは、2つの対向するほぼ平行なファセットを規定する多角形断面を有することを特徴とする測定システム。
- 請求項1〜22のいずれか1項に記載の測定システムが、前記算出されたモデルパラメータの値を表示するように構成されたディスプレイユニットをさらに備えることを特徴とする測定システム。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261678131P | 2012-08-01 | 2012-08-01 | |
| US13/564,381 | 2012-08-01 | ||
| US61/678,131 | 2012-08-01 | ||
| US13/564,381 US9668672B2 (en) | 2011-01-28 | 2012-08-01 | Method and system for non-invasively monitoring biological or biochemical parameters of individual |
| PCT/IL2013/050658 WO2014020611A1 (en) | 2012-08-01 | 2013-08-01 | Method and system for non-invasively monitoring biological or biochemical parameters of individual |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019142858A Division JP6864185B2 (ja) | 2012-08-01 | 2019-08-02 | 個体の生物学的又は生化学的パラメータを非侵襲的にモニタする方法及びシステム |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2015527132A JP2015527132A (ja) | 2015-09-17 |
| JP2015527132A5 JP2015527132A5 (ja) | 2016-09-23 |
| JP6645828B2 true JP6645828B2 (ja) | 2020-02-14 |
Family
ID=50027363
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015524904A Expired - Fee Related JP6645828B2 (ja) | 2012-08-01 | 2013-08-01 | 個体の生物学的又は生化学的パラメータを非侵襲的にモニタする方法及びシステム |
| JP2019142858A Active JP6864185B2 (ja) | 2012-08-01 | 2019-08-02 | 個体の生物学的又は生化学的パラメータを非侵襲的にモニタする方法及びシステム |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019142858A Active JP6864185B2 (ja) | 2012-08-01 | 2019-08-02 | 個体の生物学的又は生化学的パラメータを非侵襲的にモニタする方法及びシステム |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US10398314B2 (ja) |
| EP (1) | EP2879568A1 (ja) |
| JP (2) | JP6645828B2 (ja) |
| CN (1) | CN104736042B (ja) |
| CA (1) | CA2879255C (ja) |
| HK (1) | HK1210001A1 (ja) |
| IL (1) | IL236742B (ja) |
| WO (1) | WO2014020611A1 (ja) |
Families Citing this family (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9636041B2 (en) * | 2011-01-28 | 2017-05-02 | Bar Ilan University | Method and system for non-invasively monitoring biological or biochemical parameters of individual |
| KR102299361B1 (ko) * | 2014-09-03 | 2021-09-07 | 삼성전자주식회사 | 혈압을 모니터링하는 장치 및 방법, 혈압 모니터링 기능을 갖는 웨어러블 디바이스 |
| WO2016054079A1 (en) | 2014-09-29 | 2016-04-07 | Zyomed Corp. | Systems and methods for blood glucose and other analyte detection and measurement using collision computing |
| KR102411658B1 (ko) | 2015-01-15 | 2022-06-21 | 삼성전자주식회사 | 생체 정보 검출 장치 |
| KR102384225B1 (ko) | 2015-03-06 | 2022-04-07 | 삼성전자주식회사 | 혈압 측정 장치 및 방법 |
| JP6394462B2 (ja) | 2015-03-30 | 2018-09-26 | ソニー株式会社 | 情報処理装置、情報処理方法、及び、プログラム |
| DE102015006406A1 (de) * | 2015-05-19 | 2016-12-08 | SAMTD GmbH & Co. KG | Verfahren und Vorrichtung zur nicht-invasiven Bestimmung einer Messgröße eines Analyten in einem biologischen Körper |
| IL239113A (en) | 2015-06-01 | 2016-12-29 | Elbit Systems Land & C4I Ltd | A system and method for determining audio characteristics from a body |
| KR102434701B1 (ko) | 2015-09-01 | 2022-08-22 | 삼성전자주식회사 | 생체 정보 획득 장치 및 생체 정보 획득 방법과 생체 정보 검사 장치 |
| JP2017116982A (ja) * | 2015-12-21 | 2017-06-29 | ソニー株式会社 | 画像解析装置、画像解析方法及び画像解析システム |
| US10019883B2 (en) * | 2016-01-21 | 2018-07-10 | Htc Corporation | Method for monitoring breathing activity, electronic device, and computer-readable storage medium using the same |
| CN108780004A (zh) * | 2016-02-25 | 2018-11-09 | 康廷尤斯生物测定有限公司 | 用于监测运动对象的参数的方法和系统 |
| US9554738B1 (en) | 2016-03-30 | 2017-01-31 | Zyomed Corp. | Spectroscopic tomography systems and methods for noninvasive detection and measurement of analytes using collision computing |
| CN107260155A (zh) * | 2016-04-07 | 2017-10-20 | 动心医电股份有限公司 | 检测血液流速的方法及其装置 |
| WO2017191639A1 (en) * | 2016-05-05 | 2017-11-09 | ContinUse Biometrics Ltd. | System and method for use in tissue monitoring and analysis |
| JP2019523393A (ja) * | 2016-05-23 | 2019-08-22 | コンティンユーズ バイオメトリクス リミテッドContinUse Biometrics Ltd. | 物体の深さ特性評価に使用するシステム及び方法 |
| KR102655671B1 (ko) | 2016-10-12 | 2024-04-05 | 삼성전자주식회사 | 생체정보 추정 장치 및 방법 |
| US20190274560A1 (en) * | 2016-11-10 | 2019-09-12 | ContinUse Biometrics Ltd. | System and method for monitoring periodic signals |
| CN106419863B (zh) * | 2016-11-23 | 2019-05-17 | 深圳市维亿魄科技有限公司 | 基于脉搏波能量分布监测人体饮酒状态的监测方法及腕带设备 |
| US11576555B2 (en) | 2017-03-29 | 2023-02-14 | Sony Corporation | Medical imaging system, method, and computer program |
| EP3767433A4 (en) * | 2018-03-12 | 2021-07-28 | Sony Group Corporation | INFORMATION PROCESSING DEVICE, INFORMATION PROCESSING PROCESS, AND PROGRAM |
| CN108514403A (zh) * | 2018-05-10 | 2018-09-11 | 爱纳医疗科技股份有限公司 | 一种基于激光散斑图原理的眼内压检测装置及方法 |
| CN109115109A (zh) * | 2018-07-26 | 2019-01-01 | 西安工业大学 | 数字式调频连续波干涉激光驱动与信号处理方法及电路 |
| CN109528268B (zh) * | 2018-11-30 | 2020-12-22 | 广东工业大学 | 一种骨扩孔手术的扩孔工具前进路径的判断系统 |
| JP2020163037A (ja) * | 2019-03-29 | 2020-10-08 | ソニー株式会社 | 医療システム、情報処理装置及び情報処理方法 |
| CN110101373A (zh) * | 2019-06-14 | 2019-08-09 | 杭州电子科技大学 | 一种基于激光散斑的脉搏测量方法及系统 |
| TWI740169B (zh) * | 2019-06-26 | 2021-09-21 | 達爾生技股份有限公司 | 量測裝置及量測方法 |
| CN110859592B (zh) * | 2019-11-27 | 2021-08-10 | 电子科技大学 | 一种无创非接触式相干眼压及颅内压的测量方法与装置 |
| US20230029930A1 (en) | 2020-01-14 | 2023-02-02 | Pxe Computational Imaging Ltd. | System and method for optical imaging and measurement of objects |
| CN113057874B (zh) * | 2021-03-22 | 2022-07-08 | 苏州维伟思医疗科技有限公司 | 胸外按压参数的测量方法、装置、除颤电极组件及自动体外除颤器 |
| US11324406B1 (en) | 2021-06-30 | 2022-05-10 | King Abdulaziz University | Contactless photoplethysmography for physiological parameter measurement |
| WO2024018400A2 (en) * | 2022-07-20 | 2024-01-25 | Q (Cue) Ltd. | Detecting and utilizing facial micromovements |
Family Cites Families (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH01256924A (ja) * | 1988-04-08 | 1989-10-13 | Kowa Co | 眼科診断方法及び装置 |
| FR2756047B1 (fr) | 1996-11-19 | 1999-02-05 | Thomson Csf | Dispositif optique d'analyse de tissu biologique et application a un capteur de glycemie |
| JPH10290791A (ja) * | 1997-04-18 | 1998-11-04 | Advance Co Ltd | レーザー血流計 |
| US6246893B1 (en) | 1997-06-12 | 2001-06-12 | Tecmed Incorporated | Method and device for glucose concentration measurement with special attention to blood glucose determinations |
| JP2002531155A (ja) * | 1998-12-02 | 2002-09-24 | サルザー カーボメディクス インコーポレイテッド | 抗凝固レベル観測方法および装置 |
| AU4063100A (en) | 1999-04-01 | 2000-10-23 | University Of Connecticut, The | Optical glucose sensor apparatus and method |
| WO2001050955A1 (en) * | 2000-01-14 | 2001-07-19 | Flock Stephen T | Improved endoscopic imaging and treatment of anatomic structures |
| US6889075B2 (en) | 2000-05-03 | 2005-05-03 | Rocky Mountain Biosystems, Inc. | Optical imaging of subsurface anatomical structures and biomolecules |
| US6640116B2 (en) | 2000-08-18 | 2003-10-28 | Masimo Corporation | Optical spectroscopy pathlength measurement system |
| JP4241038B2 (ja) | 2000-10-30 | 2009-03-18 | ザ ジェネラル ホスピタル コーポレーション | 組織分析のための光学的な方法及びシステム |
| US20030209834A1 (en) | 2002-05-02 | 2003-11-13 | Grant Hay | Solvent cast films and process made thereby |
| US7123363B2 (en) | 2003-01-03 | 2006-10-17 | Rose-Hulman Institute Of Technology | Speckle pattern analysis method and system |
| US20050049468A1 (en) | 2003-09-03 | 2005-03-03 | Sven-Erik Carlson | Increasing the performance of an optical pulsoximeter |
| JP2006042955A (ja) | 2004-08-02 | 2006-02-16 | Hitachi Ltd | 生体内物質光計測装置 |
| JP2007160108A (ja) * | 2005-12-12 | 2007-06-28 | Siemens Medical Solutions Usa Inc | 循環系機能を画像ベースで生理学的にモニタリングするためのシステムおよび方法 |
| JP4257982B2 (ja) * | 2006-03-14 | 2009-04-30 | 国立大学法人山口大学 | 歪分布計測システムと弾性率分布計測システム及びそれらの方法 |
| JP4336994B2 (ja) | 2006-07-31 | 2009-09-30 | 三菱自動車工業株式会社 | フィルム付き合成板 |
| WO2008053474A2 (en) * | 2006-10-30 | 2008-05-08 | Elfi-Tech Ltd. | System and method for in vivo measurement of biological parameters |
| WO2009008745A2 (en) | 2007-07-06 | 2009-01-15 | Industrial Research Limited | Laser speckle imaging systems and methods |
| IL184868A0 (en) * | 2007-07-26 | 2008-03-20 | Univ Bar Ilan | Motion detection system and method |
| RU2369323C1 (ru) * | 2008-02-20 | 2009-10-10 | Игорь Яковлевич Иммореев | Импульсный сверхширокополосный датчик |
| US9013692B2 (en) | 2008-06-12 | 2015-04-21 | East Carolina University | Flow cytometer apparatus for three dimensional difraction imaging and related methods |
| JP5520540B2 (ja) | 2008-08-19 | 2014-06-11 | 株式会社フジクラ | 内視鏡システム |
| WO2010105197A2 (en) | 2009-03-12 | 2010-09-16 | The General Hospital Corporation | Non-contact optical system, computer-accessible medium and method for measuring at least one mechanical property of tissue using coherent speckle techniques(s) |
| JP5819823B2 (ja) * | 2009-07-14 | 2015-11-24 | ザ ジェネラル ホスピタル コーポレイション | 血管の内部の流れおよび圧力を測定する装置および装置の作動方法 |
| WO2012101644A2 (en) | 2011-01-28 | 2012-08-02 | Bar Ilan University | Method and system for non-invasively monitoring biological or biochemical parameters of individual |
| HUP1300436A2 (en) | 2012-07-20 | 2014-02-28 | Sumitomo Chemical Co | Method for reducing damage by harmful organisms in corn cultivation |
-
2013
- 2013-08-01 CA CA2879255A patent/CA2879255C/en active Active
- 2013-08-01 CN CN201380041088.5A patent/CN104736042B/zh active Active
- 2013-08-01 WO PCT/IL2013/050658 patent/WO2014020611A1/en active Application Filing
- 2013-08-01 EP EP13753907.8A patent/EP2879568A1/en not_active Ceased
- 2013-08-01 JP JP2015524904A patent/JP6645828B2/ja not_active Expired - Fee Related
-
2015
- 2015-01-15 IL IL236742A patent/IL236742B/en active IP Right Grant
- 2015-11-10 HK HK15111056.1A patent/HK1210001A1/xx not_active IP Right Cessation
-
2017
- 2017-04-10 US US15/483,828 patent/US10398314B2/en active Active
-
2019
- 2019-08-02 JP JP2019142858A patent/JP6864185B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| WO2014020611A1 (en) | 2014-02-06 |
| EP2879568A1 (en) | 2015-06-10 |
| CA2879255C (en) | 2020-11-10 |
| CN104736042B (zh) | 2017-09-12 |
| JP2015527132A (ja) | 2015-09-17 |
| JP6864185B2 (ja) | 2021-04-28 |
| IL236742A0 (en) | 2015-02-26 |
| IL236742B (en) | 2020-06-30 |
| US20170209047A1 (en) | 2017-07-27 |
| CN104736042A (zh) | 2015-06-24 |
| JP2020000883A (ja) | 2020-01-09 |
| HK1210001A1 (en) | 2016-04-15 |
| US10398314B2 (en) | 2019-09-03 |
| CA2879255A1 (en) | 2014-02-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6864185B2 (ja) | 個体の生物学的又は生化学的パラメータを非侵襲的にモニタする方法及びシステム | |
| US11129544B2 (en) | Method and system for non-invasively monitoring biological or biochemical parameters of individual | |
| AU2015212330B2 (en) | Method and system for non-invasively monitoring biological or biochemical parameters of individual | |
| US20190150763A1 (en) | Obtaining cardiovascular parameters using arterioles related transient time | |
| US20150216425A1 (en) | Estimations of equivalent inner diameter of arterioles | |
| US8818472B2 (en) | Methods and devices for noninvasive measurement of energy absorbers in blood | |
| Nowara et al. | Seeing beneath the skin with computational photography | |
| Abay | Reflectance photoplethysmography for non-invasive monitoring of tissue perfusion | |
| JP5450029B2 (ja) | 生体光計測装置 | |
| Shi | Photoplethysmography in noninvasive cardiovascular assessment | |
| Ysehak Abay | Reflectance photoplethysmography for non-invasive monitoring of tissue perfusion | |
| Nowara et al. | Seeing Beneath the Skin with Computational Photography Optical imaging technologies hold powerful potential in healthcare. |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160801 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20160801 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20170731 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170815 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20171106 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20180109 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180215 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180807 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20181107 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20190402 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190802 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190918 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20191007 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20191217 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20200109 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6645828 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |