JP6401172B2 - 貧血の治療方法 - Google Patents
貧血の治療方法 Download PDFInfo
- Publication number
- JP6401172B2 JP6401172B2 JP2015539751A JP2015539751A JP6401172B2 JP 6401172 B2 JP6401172 B2 JP 6401172B2 JP 2015539751 A JP2015539751 A JP 2015539751A JP 2015539751 A JP2015539751 A JP 2015539751A JP 6401172 B2 JP6401172 B2 JP 6401172B2
- Authority
- JP
- Japan
- Prior art keywords
- gdf11
- seq
- actriia
- polypeptide
- actriib
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/22—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against growth factors ; against growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/6425—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent the peptide or protein in the drug conjugate being a receptor, e.g. CD4, a cell surface antigen, i.e. not a peptide ligand targeting the antigen, or a cell surface determinant, i.e. a part of the surface of a cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/06—Antianaemics
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/71—Receptors; Cell surface antigens; Cell surface determinants for growth factors; for growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
Description
本明細書に提供されるのは、貧血の治療方法であって、該治療を必要とする対象への成長分化因子11(GDF11;別名、骨形態形成タンパク質11(BMP11))のアンタゴニストの投与を含む、方法である。
貧血とは、血液中の赤血球の数が減少し又はヘモグロビンの量もしくは機能が正常未満になることである。貧血は、最も一般的な血液障害である。
ある実施態様において、本明細書に提供されるのは、患者における貧血、無効造血、βサラセミアを治療し、又は正染性赤芽球(Ery-C)を増加させる方法であって、GDF11のアンタゴニストを投与することを含む、方法である。ある実施態様において、患者は、健常個体と比べて及び/又は貧血の発症前の該患者におけるGDF11レベルと比べて、骨髄、脾臓、肝臓、血清、又は血漿中の上昇したGDF11レベルを有する。
a.GDF11レベルを決定すること;及び
b.GDF11のアンタゴニストの用量を調整すること(ここで、GDF11が正常と比べて増加している場合、該GDF11のアンタゴニストの用量を増加させ、GDF11が正常未満に減少している場合、該GDF11のアンタゴニストの用量を減少させる)をさらに含む。ある実施態様において、該GDF11レベルは、GDF11 mRNAレベル、GDF11タンパク質レベル、又はGDF11タンパク質活性レベルとして決定される。
(5.1 概説)
本明細書に提供されるのは、一態様において、貧血の治療方法であって、成長分化因子11(GDF11;別名、骨形態形成因子11(BMP-11))のアンタゴニストを、治療を必要とする患者に投与することを含む、方法である。ある実施態様において、該方法は、それを必要とする個体、例えば、貧血を有する個体に、治療有効量のGDF11アンタゴニストを投与することを含む。ある具体的な実施態様において、GDF11アンタゴニストは、ActRII受容体でも、ActRII受容体の誘導体でもなく、例えば、ActRIIA-Fc融合タンパク質でも、ActRIIB-Fc融合タンパク質でもない。GDF11のアンタゴニストは、GDF11のどのレベルにおいても作用することができ、すなわち、それは、GDF11発現を低下もしくは消失させ、GDF11安定性を(例えば、GDF11分解を増加させることにより)低下させ、又はGDF11活性に(例えば、その受容体へのGDF11結合を妨げることにより)拮抗することができる。GDF11のアンタゴニストのより詳細な説明は、下記の第5.3節に見出すことができる。
ある実施態様において、本明細書に提供される方法で治療される患者は、貧血と診断される。あるより具体的な実施態様において、貧血は、無効造血によって引き起こされる。ある実施態様において、本明細書に提供されるのは、遺伝性骨髄不全症候群(例えば、限定されないが、無巨核球性血小板減少症、ダイアモンド-ブラックファン貧血、先天性角化異常症、ファンコーニ貧血、ピアソン症候群、重度先天性好中球減少症、シュワックマン-ダイアモンド症候群、血小板減少橈側列無形成)、特に、赤血球に影響を及ぼす遺伝性骨髄不全症候群を治療する方法である。より具体的には、本明細書に提供されるのは、特に赤血球に影響を及ぼす遺伝性骨髄不全症候群を治療する方法である。ある実施態様において、本明細書に提供されるのは、対象がエリスロポエチンの投与に応答しない貧血を治療する方法である。ある実施態様において、本明細書に提供されるのは、対象が、鉄、ビタミンB-12、及び/又は葉酸塩の投与に応答しない貧血を治療する方法である。ある実施態様において、本明細書に提供されるのは、赤血球始原細胞及び前駆細胞がアポトーシスによる死に感受性が高い結果として生じる貧血を治療する方法である。
本明細書に提供される方法とともに使用することができるGDF11アンタゴニストは、以下に記載されている。ある実施態様において、本明細書に提供される方法とともに使用することができるGDF11アンタゴニストは、GDF11の発現を標的とする。他の実施態様において、本明細書に提供される方法とともに使用することができるGDF11アンタゴニストは、GDF11の活性を標的とする。他の実施態様において、本明細書に提供される方法とともに使用することができるGDF11アンタゴニストは、GDF11のタンパク質安定性を標的とする(例えば、分解を増加させる)。本明細書に提供される方法とともに使用することができるGDF11アンタゴニストの好適性は、例えば、下の第5.4節に記載のアッセイを用いて、立証することができる。
ある実施態様において、GDF11に対する抗体を、本明細書に提供される方法とともに使用することができる。ある実施態様において、GDF11に対する抗体は、GDF11に免疫特異的に結合する。特に、ある実施態様において、そのような抗GDF11抗体は、任意の他のタンパク質に対してよりも高い結合親和性でGDF11に結合する。具体的な実施態様において、抗GDF11抗体は、GDF8に対してよりも高い親和性でGDF11に結合する。具体的な実施態様において、抗GDF11抗体は、GDF8と交差反応しない。具体的な実施態様において、抗GDF11抗体は、アクチビンAに対してよりも高い親和性でGDF11に結合する。具体的な実施態様において、抗GDF11抗体は、アクチビンAと交差反応しない。
ある実施態様において、GDF11アンタゴニストは、ActRII受容体、例えば、ActRIIA又はActRIIB、例えば、ヒトActRIIA又はActRIIBの細胞外ドメインの一部を含む。より具体的には、そのようなGDF11アンタゴニストは、ActRII、例えば、ActRIIA又はActRIIBのGDF11結合ドメインを含むポリペプチドであることができる。理論によって束縛されるものではないが、そのようなGDF11結合ドメインを含むポリペプチドは、GDF11を捕捉し、それにより、GDF11シグナル伝達を妨げる。これらのGDF11結合ドメインを含むポリペプチドは、ActRII受容体の細胞外ドメインの全て又は一部(すなわち、ActRIIAの細胞外ドメインの全てもしくは一部又はActRIIBの細胞外ドメインの全てもしくは一部)を含み得る。具体的な実施態様において、ActRII受容体の細胞外ドメインは、可溶性である。
本明細書で使用されるように、「ActRIIA」という用語は、任意の種由来のアクチビン受容体IIa型(ActRIIA)タンパク質のファミリー及び突然変異生成又は他の修飾によってそのようなActRIIAタンパク質から得られた変異体を指す。本明細書中でのActRIIAに対する言及は、現在同定されている形態のいずれか1つに対する言及であると理解される。ActRIIAファミリーのメンバーは、一般に、システインに富む領域を含むリガンド結合細胞外ドメイン、膜貫通ドメイン、及び予想上のセリン/トレオニンキナーゼ活性を有する細胞質ドメインから構成される、膜貫通タンパク質である。
本明細書で使用されるように、「ActRIIB」という用語は、任意の種由来のアクチビン受容体IIb型(ActRIIB)タンパク質のファミリー及び突然変異生成又は他の修飾によってそのようなActRIIBタンパク質から得られた変異体を指す。本明細書中でのActRIIBに対する言及は、現在同定されている形態のいずれか1つに対する言及であると理解される。ActRIIBファミリーのメンバーは、一般に、システインに富む領域を含むリガンド結合細胞外ドメイン、膜貫通ドメイン、及び予想上のセリン/トレオニンキナーゼ活性を有する細胞質ドメインから構成される、膜貫通タンパク質である。
ある実施態様において、GDF11プロペプチドは、本明細書に記載の方法で使用されるGDF11アンタゴニストである。GDFに結合し、その活性、シグナル伝達、受容体結合、発現、プロセシング、又は分泌を阻害する任意のGDF11プロペプチド、その断片又は類似体を本明細書に記載の方法で使用することができる。例えば、GDF11プロペプチドアンタゴニストは、GDF11のその成熟形態への切断を妨げることによるか、成熟GDF11との複合体を形成することによるか、又は他の関連メカニズムによって、GDF11活性を阻害することができる。一実施態様において、GDF11プロペプチドアンタゴニストは、配列番号50の天然のGDF11プロペプチドである。GDF11プロペプチドアンタゴニストは、GDF11結合能及びGDF11阻害活性をも保持又は増強する天然のGDF11プロペプチド(配列番号50)のその任意の断片、変異体、類似体、ホモログ、ムテイン、又は模倣体であることもできる。したがって、別の実施態様において、GDF11プロペプチドアンタゴニストは、改善された薬物動態特性、例えば、延長された循環半減期又は増大したタンパク質分解からの保護を有する修飾型GDF11ポリペプチドである。そのような安定化修飾としては、他のポリペプチド配列(例えば、IgGのFc領域又はアルブミン)への融合、非タンパク質性ポリマーへの結合、グリコシル化部位の修飾(例えば、付加)、炭水化物部分の修飾(例えば、除去)などを挙げることができる。そのような修飾型GDF11プロペプチドの例は、当技術分野で公知であり、例えば、米国特許第7,737,116号及び米国特許第8,236,751号に開示されている。一実施態様において、GDF11プロペプチドアンタゴニストは、例えば、ヒト血清中で、単量体、二量体、又は潜在的複合体として平衡状態で存在することができるGDF11の成熟ヒト形態に結合する。別の実施態様において、該GDF11アンタゴニストは、GDF11のホモ二量体活性形態に結合する。
いくつかの実施態様において、他のGDF11結合タンパク質は、本明細書に記載の方法で使用されるGDF11アンタゴニストである。例えば、フォリスタチンは、高い親和性でGDF11に結合し、インビボでGDF11活性に拮抗する。したがって、一実施態様において、本方法で使用されるフォリスタチンGDF11アンタゴニストは、生物学的源で産生され、それから単離される天然タンパク質、組換え産生されるポリペプチド、又は合成によって作製されるフォリスタチンポリペプチドである。阻害性フォリスタチンポリペプチドは、インビトロで、及び好ましくはインビボで、GDF11に結合し、その活性を阻害する、その任意の断片、変異体、又は突然変異体であることができる。ある実施態様において、該フォリスタチンポリペプチドは、GDF11結合以外のフォリスタチン生体活性を示さない。特に、ある実施態様において、該フォリスタチンポリペプチドは、アクチビンに対する結合を示さない。
GDF11アンタゴニストには、GDF11に結合し、その活性を阻害するGDF11類似体も含まれる。一実施態様において、拮抗性GDF11類似体は、ドミナントネガティブGDF11ポリペプチドであり、これは、GDF11に結合し(GDF11と二量体化し)、その切断、プロセシング、及び/又は修飾を阻害し、それにより、その活性を阻害するGDF11の変異体を包含する。別の実施態様において、GDF11アンタゴニスト類似体は、非ペプチド性である。例えば、非ペプチドGDF11類似体は、GDF11プロペプチドの結合及び機能を模倣する化合物(GDF11プロペプチドペプチド模倣体)又はGDF11結合タンパク質の結合及び機能を模倣する化合物(GDF11結合タンパク質ペプチド模倣体)であることができる。理論によって束縛されるものではないが、ペプチド模倣体分子は、ペプチドの二次構造のエレメントを模倣する。一実施態様において、その場合、GDF11類似体は、配列番号48又は配列番号50のGDF11に結合し、それを阻害する。
GDF11発現(例えば、転写又は翻訳)を阻害するポリヌクレオチドも本明細書に記載の方法において有用であり得る。いくつかの実施態様において、GDF11アンタゴニストは、GDF11アンチセンス分子、干渉RNA(RNAi)、リボ核酸コード酵素(リボザイム)、又は三重鎖形成分子をコードするポリヌクレオチド分子である。GDF11ポリヌクレオチドアンタゴニストは、GDF11標的ヌクレオチド配列(例えば、DNA、RNA、mRNA)に相補的であり(例えば、特異的に結合し)、DNA又はRNAであることができ、かつコード配列又は阻害性配列(例えば、アンチセンス、RNAi)であることができる。一実施態様において、GDF11アンタゴニストポリヌクレオチドは、アンチセンスGDF11分子である。アンチセンス分子は、通常、少なくとも約1〜25ヌクレオチド長であり、GDF11標的配列に特異的にハイブリダイズするように設計される。アンチセンス分子に有用な特異的GDF11アンチセンスヌクレオチド配列は、当技術分野で周知の方法によって同定することができる。
GDF-11のアンタゴニストを、以下に示す様々なアッセイで試験することができる。これらのアッセイを用いて、GDF11アンタゴニストを試験及び同定することができる。さらに、これらのアッセイを用いて、貧血患者の治療又はGDF11アンタゴニストによる治療に対する患者の応答性を追跡調査することができる。例えば、インビトロ細胞培養系を患者の細胞から作出して、GDF11アンタゴニストによる治療に対する特定の患者の応答性を決定することができる。
RBC数は、血液の容積当たりの赤血球の実数のカウントであり、標準的な全血算値の一部として含まれ得る。通常、男性は、1マイクロリットル当たり4,700,000〜6,100,000細胞のRBC数を有し、女性は、1マイクロリットル当たり4,200,000〜5,400,000細胞のRBC数を有する。しかしながら、サラセミア患者は、通常見られるRBC数よりも少ないRBC数を有し得る。したがって、本明細書に提供される方法に従って治療されている貧血患者、例えば、サラセミア患者のRBC数の決定により、そのような治療の効力の決定が可能になる。
CFU-Eを、例えば、コロニー形成アッセイで、細胞の数及び形態によって、及び特定の細胞表面マーカーの有無によってアッセイし、同定することができる。赤血球コロニー形成単位のレベルを、例えば、抗体染色、次いで、フローサイトメトリー解析(FACs)を用いて測定して、マーカー、例えば、分化状態マーカー、例えば、Epo受容体、c-Kit(幹細胞因子受容体)、トランスフェリン受容体(CD71+)、CD36、及びTer119(グリコフォリン-A関連抗原)(CFU-E細胞はTer119(グリコフォリン-A関連抗原)陰性である)の発現を評価することができる(例えば、Terszowskyらの文献、2005を参照されたい)。CFU-E段階の細胞は、エリスロポエチン受容体(EpoR)を発現しており、培養培地中のエリスロポエチンのみの存在下、インビトロで、2〜3日で最終分化するように誘導することができる。CFU-E細胞をメチルセルロース上にプレーティングし、ジアミノベンジジン試薬でヘモグロビンについて染色することができ、その後、CFU-Eコロニーをカウントすることができる。プレーティングの時点から2日目までに、各々のCFU-Eコロニーは、その大部分が赤血球分化の最終段階にある8〜64個のヘモグロビン発現(hemoglobinized)細胞を生じさせることができる。
CFU-eと同様に、BFU-eを、例えば、コロニー形成アッセイで、細胞の数及び形態によって、及び特定の細胞表面マーカーの有無によってアッセイし、同定することができる。具体的には、BFU-eを、いくつかの細胞表面マーカー、例えば、CD33、CD34、及びHLA-DRの発現、並びにグリコフォリン-Aの発現の欠如によって同定することができる。例えば、Wuらの文献に記載されているBFU-eアッセイを利用することができる(Wu H、Liu X、Jaenisch R、Lodish HFの文献(1995)。「運命が決定された赤血球BFU-E及びCFU-E始原細胞の生成は、エリスロポエチンもエリスロポエチン受容体も必要としない(Generation of committed erythroid BFU-E and CFU-E progenitors does not require erythropoietin or the erythropoietin receptor」、Cell 83(1): 59-67)。
ヘマトクリットは、所与の容積の全血中の赤血球の割合を測定するものであり、標準的な全血算値の一部として含まれ得る。ヘマトクリットは、通常、男性では約45%、女性では約40%である。しかしながら、サラセミア患者は、一般に、通常見られるよりも低いヘマトクリットを有する。したがって、本明細書に提供される方法に従って治療されているサラセミア患者のヘマトクリットの決定により、そのような治療の効力の決定が可能になる。
赤血球始原細胞のアポトーシスは、例えば、ターミナルデオキシヌクレオチジルトランスフェラーゼ媒介dUTPニック末端標識(TUNEL)染色を用いることにより決定することができる。TUNEL染色は、インサイチュアポトーシス検出キット(Takara Bio, Otsu, Japan)を用いて実施することができる。
インビボ環境により類似したインビトロ環境での赤血球分化に対する薬剤の効果を試験するために、骨髄細胞とヒトCD36+細胞の共培養系を使用することができる。赤血球始原細胞が高度に濃縮されているヒトCD36+細胞をエリスロポエチン(EPO)補充培地(2U/mL)中で長期骨髄培養物とともに共培養する。6日後、該培養物の細胞出力(例えば、細胞型)を、例えば、フローサイトメトリー(例えば、FACS)解析により評価することができる。様々な赤血球分化レベルの赤血球細胞(例えば、前赤芽球、好塩基球、後期好塩基性/多染性、正染性/網状赤血球、糖タンパク質A+細胞)の数は、試験されている薬剤が赤血球分化を調節する能力を示す。このアッセイをGDF11の存在下及び非存在下で実施する。その後、GDF11のアンタゴニストを、GDF11の効果を逆転させるその能力について試験することができる。
ある実施態様において、転写応答アッセイを用いて、GDF11のアンタゴニストを試験することができる。GDF11シグナル伝達によって、特定の遺伝子の転写が上方調節又は下方調節される。使用される細胞培養系とGDF11に対する転写応答とを(例えば、RT-PCTにより)測定することができる。転写応答に対するGDF11のアンタゴニストの効果は、アンタゴニストとしてのその有効性の尺度である。例えば、C2C12細胞では、GDF11に対する応答としてrunx2/cbfa1が上方調節される(例えば、Bessaの文献、2009 Protein Expression and Purification 63:89-94を参照されたい)。ある実施態様において、GDF11シグナル伝達に応答することが知られているプロモーター領域をレポーター遺伝子の上流にクローニングすることができる。このように、アッセイを、レポーター遺伝子の活性しかアッセイする必要がないように簡略化することができる。
ある実施態様において、GDF11のアンタゴニストは、本明細書に提供される方法とともに使用される医薬として許容される担体とともに製剤化することができる。例えば、GDF11のアンタゴニストは、単独で又は医薬製剤(治療的組成物)の成分として投与することができる。対象化合物は、ヒト又は動物用医薬品で使用される任意の好都合な方法での投与のために製剤化することができる。
本明細書に提示される実施例は、GDF11タンパク質レベルがサラセミアで上昇していること、及びGDF11の阻害がβ-サラセミアのマウスモデルで貧血を治療することができることを示す。
β-サラセミアは、無効造血、赤血球分化の促進、及びアポトーシスと関連し、貧血及び鉄過剰症を引き起こす。無効造血の効果の根底にある分子メカニズムは完全には理解されていない。TGF-βスーパーファミリーのメンバーは赤血球始原細胞の増殖と分化の両方に関係があるとされているが、β-サラセミアで見られる無効造血における多くのTGF-βファミリーメンバーの役割は不明である。
(6.2.1 マウス)
C57BL/6を交配し、INSERM U699のパイロジェンフリーの施設で飼育した。プロトコルは全て、INSERMの動物管理委員会により承認された。Hbbth1/th1モデルは、β-主要遺伝子の天然の欠失から生じた(Skow LCらの文献; Cell 1983)。Hbbth1/th1マウスは、中間型β-サラセミアのモデルに相当する。これらのマウスは、無効な骨髄赤血球産生、前駆細胞アポトーシス、実質内鉄分布、ヘプシジン発現の減少、及び低い骨髄鉄レベルの一方で、肝臓及び脾臓でのレベルが増加していることなどの、ヒトβ-サラセミアを再現するいくつかの臨床パラメーターを有する。
血液試料をEDTAコートチューブに回収し、全血算値をMS9-5 Blood Analyzer(Melet Schloesing Laboratories)で製造業者の指示に従って測定した。選択されたパラメーターは、赤血球(RBC)、ヘマトクリット(Ht)、平均赤血球容積(MCV)、ヘモグロビン(Hb)であった。網状赤血球数は、網状赤血球計数試薬(BD Biosciences Retic-Count(商標)キット)で決定した。
RNAを、RNeasy Plus Mini Kit(Qiagen)を用いて、赤血球始原細胞から抽出した。1マイクログラムの全RNAを、iScript reverse transcription Supermix(Bio-rad)を用いる逆転写に42℃で30分間使用した。その後、酵素を85℃で5分間不活化させた。qPCRのために、cDNA試料をCFX96 PCR System(Bio-rad)で増幅させた。PCR産物を、SsoFast EvaGreen Supermix(Bio-rad)を用いて定量した。
各組織由来の細胞を、2U/mLヒト組換えEpo(Roche)、100ng/mL SCF(PeproTech)、10-6Mデキサメタゾン(D2915; Sigma)、40、及びペニシリン/ストレプトマイシン(Pen/Strep; Invitrogen)を補充したStemPro34+栄養補給剤(Life Technologies Gibco-BRL)のどちらかからなる無血清「赤血球増殖培地」に再懸濁させた。培養から5日後、非接着細胞を、10μg/mlのmActRIIA-Fcを補充した又は補充していない分化培地(1U/ml Epo及び1mg/ml鉄-トランスフェリン(Sigma)を補充したStemPro-34)に2〜3日間移した。生細胞数及び死細胞数をTrypan Blue(Gibco/BRL)排出によって毎日決定し、細胞濃度を部分的な培地交換によって2×106全細胞/mLに毎日調整した。
成獣マウスBM又は脾臓の単一細胞懸濁液をmethocult M3434培地(Stem Cell Technologies)と混合し、35mmディッシュにプレーティングし、5%CO2加湿雰囲気下、37℃で培養した。BFU-Eコロニーを10日目にスコアリングした(いくつかの実験では、マウスBFU-Eを7日目以降10日目までスコアリングし、7日目と10日目のコロニー数に差がなかった)。
統計解析は、GraphPad Prism(バージョン5.0; GraphPad Software)を用いて実施した。別途注記されない限り、データは、N回の測定の平均±SEMとして表されている。スチューデントt-検定又はマン-ホイットニー検定を用いて、2群を比較したのに対し、多群比較は、二元ANOVA検定、次いで、事後解析(ボンフェローニ検定)を用いて行った。差は、0.05未満(*)、0.01未満(**)、又は0.001未満(***)のP値で有意とみなした。
マウス由来の骨髄(BM)及び脾細胞懸濁液について、抗FcγR mAb 2.4G2を用いてIgG受容体のブロッキングを行った。その後、細胞(1×106)を抗TER-119抗体及び抗マウスTfR1抗体で染色した。染色された細胞を、FlowJoソフトウェア(Tree Star)を用いるフローサイトメトリー(FACScalibur; Becton Dickinson)によりさらに解析した。
骨髄及び脾臓を回収し、10%ホルマリン中で固定し、パラフィン包埋し、ヘマトキシリン及びエオシン(H&E)染色用に3〜6μmで薄切した。
血液をヘパリン添加チューブに採取し、遠心分離した(5分、4℃、1,100g)。血漿を新たに遠心分離して(5分、4℃、1,100g)、混入している赤血球を除去した。生化学的パラメーターを、製造業者の指示に従って、Olympus AU400 automatで定量した。
(6.3.1 mActRIIA-Fcはサラセミアマウスにおける血液学的パラメーターを改善する)
β-サラセミアは、赤血球成熟及び産生の障害をもたらすヘモグロビン合成の欠陥を特徴とする疾患である。赤血球の減少は、主として、成熟赤血球産生の全体的な減少をもたらす、赤血球分化の後期好塩基性/多染性赤芽球段階での赤血球分化の異常な促進及びアポトーシスが原因であると考えられている。この疾患は、異常な赤芽球が蓄積し、アポトーシスを経て、全身性貧血を引き起こす、過形成性骨髄区画を特徴とする。
β-サラセミアの無効造血におけるTGF-βスーパーファミリーリガンドの役割をさらに調べるために、脾臓(図2A、図2C)及び骨髄(図2B、図2C)を採取し、赤芽球分化をCD71/TER119染色及び前方散乱/側方散乱(FSC/SSC)分布によるフローサイトメトリーにより評価した。前赤芽球(Pro-E)、好塩基性赤芽球(Ery-A)、後期好塩基性(Ery-B)及び多染性赤芽球、並びに正染性赤芽球(Ery-C)という赤血球分化の進行段階にある細胞のパーセントの経時的解析から、mActRIIA-Fcで処置したマウスが、脾臓における未成熟TER119/CD71細胞(後期好塩基性及び多染性赤芽球、Ery-B)の有意な減少と同時に、正染性赤芽球(Ery-C)の割合の増加を示すことが示された(図2A)。これらの結果は、mActRIIA-Fcによる無効造血の軽減と一致した。mActRIIA-Fcで処置したマウス由来の骨髄ではTER-199+赤芽球とEry-Bの数とが減少していたが(図2B)、成熟赤芽球の量は増加しておらず、サラセミアマウスの骨髄における無効造血が、mActRIIA-Fcによるマウスの処置では解消されないことを示唆している。
赤血球上でのアポトーシス促進タンパク質の発現を、フローサイトメトリーを用いて解析することにより、β-サラセミア関連無効造血におけるアポトーシス過程へのTGF-βファミリーメンバーの関与を調べた。骨髄赤芽球におけるアポトーシスタンパク質の発現に有意な変化はなかったが(図3A)、脾臓赤芽球の解析は、Fas-LがEry-B細胞集団で増加していることを示した(図3B)。PBS及びmActRIIA-Fcで処置したマウス由来の脾臓細胞に対するマルチパラメトリックフローサイトメトリー比較解析は、Fas-L発現が、未成熟後期好塩基性及び多染性赤芽球(Ery-B)で増加し、正染性赤芽球(Ery-C)で減少していることを示した(図3B)。対照的に、Fas-L発現は、BM赤芽球では調節されなかった(図3A)。まとめると、これらの結果は、ActRIIaシグナル伝達が成熟途上の赤芽球でFas/Fas-L経路を調節することを示した。総合すると、これらのデータは、ActRIIaシグナル伝達が、無効造血の方向に向けられた成熟途上の赤芽球の早期の細胞死を誘導することを示唆した。驚くことに、Fas-L発現は、Ery-A及びEry-Cサブセットの細胞で減少しており、ActRIIaシグナル伝達の影響が成熟途上の赤芽球でより顕著であったことを示している(図3B)。tunel陽性細胞の数も、mActRIIA-Fcで処置した動物で増加していた(図3C)。サラセミアの無効造血は、成熟途上の赤芽球の大規模なアポトーシスを特徴とする。アポトーシスに対するmActRIIA-Fcによる処置の影響を調べることにより、mActRIIA-Fcによるマウスの処置が、そのそれぞれの対照と比較したtunnel陽性細胞の数の減少を示すことが示され(図3C)、Smad-2,3活性化を通じたActRIIaシグナル伝達が、成熟途上の赤芽球のアポトーシスレベルを調節することにより、無効造血を制御し得ることが示唆された。
ActRII、アクチビンA、アクチビンB、及びGDF11のRNA(mRNA)発現レベルを、qPCRにより、野生型及びサラセミアマウス由来の脾臓で評価した。ActRII、アクチビンA、アクチビンB、及びGDF11のmRNAレベルは全て増加しており、mActRIIA-Fcが、そのリガンドの1つを通じて、その無効造血の改善において作用し得ることが示唆された(図4A)。mActRIIA-Fcで処置したサラセミアマウス由来の脾臓から得られたタンパク質のウェスタンブロット解析は、PBS処置と比較したGDF11タンパク質レベルの有意な減少を示し(図4B)、GDF11を無効造血に関与するActRIIAリガンドとしてさらに関連付けた。さらなる免疫組織化学的解析は、GDF11タンパク質レベル(及びそれよりはるかに劣る程度に、アクチビンA又はアクチビンB)がサラセミアマウス由来の脾臓生検で大きく増加しており、mActRIIA-Fcで処置した動物で抑制されていることを明らかにした(図3A)。これらの結果は、免疫ブロッティングによりさらに確認された(図4B)。脾臓切片とは対照的に、BMに関するActRIIaリガンドの解析は、サラセミアマウスにおけるGDF11の蓄積を示さなかった(図4B)。それゆえ、サラセミアマウスの脾臓切片におけるGDF11過剰発現を無効造血と関連付けることができた。
どのTGF-βファミリーメンバーがmActRIIA-Fcによるβ-サラセミアの治療に関係があり得るかということを決定するために、アクチビン/GDFシグナル伝達経路のタンパク質の免疫組織化学的解析を行った。サラセミアマウスをPBS又はmActRIIA-Fcで30日間処置し、脾臓を採取し、固定し、アクチビンA、アクチビンB、GDF8、GDF11、ActRII、及びp-Smad2について染色した(図5A)。免疫組織化学染色は、サラセミアマウスにおけるGDF11、ActRII、及びp-Smad2のレベルの増加を示した。アクチビン/GDFシグナル伝達経路のタンパク質が貧血の他のマウスモデルで過剰発現されているかどうかを調べるために、サラセミアマウスにおけるアクチビンA、アクチビンB、及びGDF11の発現を、酸素正常状態マウス、低酸素症マウス、及びαRBCマウスと比較した(図5B)。PBS又はmActRIIA-Fcで48時間処理し、その後、アクチビンA、アクチビンB、GDF11プロペプチド、及びGDF8/GDF11切断ペプチドに対する特異的抗体とともにインキュベートした初期サラセミア前赤芽球のFACS解析は、mActRIIA-Fc処置がGDF11発現を正常化することを示した。GDF11染色の定量は、mActRIIA-Fcによるマウスの処理がGDF11レベルを有意に低下させることを示した(図5C)。サラセミアマウスをmActRIIA-Fcで処置したときのこのGDF11発現の低下は、該マウスの脾臓の免疫組織化学的解析により確認された(図5D)。*p<0.05、N=4。したがって、mActRIIA-Fcがサラセミア組織におけるGDF11過剰発現を減少させるという事実は、mActRIIA-FcがGDF11を標的とすることによって無効造血を解消するというさらなる証拠となった。
GDF11発現の増加が無効造血に関与するかどうかを明らかにするために、サラセミア前赤芽球をアクチビンA及びB及びGDF11に対するブロッキング抗体の存在下で培養した。(アクチビンA及びB抗体ではなく)抗GDF11抗体は、赤血球産生を促進し、これにより、CD71/TER119染色後のフローサイトメトリーにより定量したとき、GDF11が無効造血を誘導することによって赤血球産生を負に調節することがさらに確認された(図6A)。初期前赤芽球分化時のROS発生を、ジクロロジヒドロフルオレセインを用いるフローサイトメトリーにより評価した(図6B)。*p<0.05、N=4。したがって、抗GDF11ブロッキング抗体は、細胞分化を回復させ、サラセミア赤芽球におけるヘモグロビン凝集体を低下させた。
血液血清中に存在するActRIIAリガンド、並びに特に、無効造血と関連する疾患(例えば、サラセミア、骨髄異形成症候群、慢性悪性貧血、及び鎌状赤血球貧血)におけるその異常な発現を検出、同定、及び定量するためのアッセイを開発した。このアッセイは、ActRIIA-Fcコーティングと、それに続く、血清中に存在するActRIIAリガンドの検出に基づくサンドイッチELISAからなる。治療決定の助けとするために及び/又はTGF-βリガンドもしくは受容体レベルを調節するよう設計された治療の有効性を決定するために、ActRIIA ELISAアッセイを実験的に(例えば、動物に)又は臨床的に(例えば、ヒト患者に)用いて、血液血清中のリガンド又は受容体レベルを同定、検出、及び/又は定量することができる。
血清中のGDF11レベルを測定するために、上記のサンドイッチELISAアッセイを開発した。ELISAプレートを5μg/mLのmActRIIA-Fcでコーティングした(図7A)。増加する用量の組換えGDF11をプレートに添加した(0.1ng/マイクロリットル、0.5ng/マイクロリットル、2.5ng/マイクロリットル)。プレートをPBS 0.1%Tweenで洗浄し、結合したタンパク質を、抗GDF8/11抗体を用いて検出し、その後、西洋ワサビペルオキシダーゼ結合抗ウサギIgGを用いて検出した。GDF11は、mActRIIA-Fcでコーティングしたプレートに用量依存的な様式で結合し、これにより、GDF11レベルを検出及び定量するために、このアッセイを効果的に使用することができることが示された(図7B)。mActRIIA-Fcを用いるELISAでは、わずか100pg/mL程度の組換えGDF11が検出された。
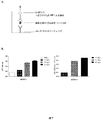
野生型C57BL/6マウスをmActRIIA-Fc(10mg/Kg BW、週2回)又はPBSで30日間処置した。赤血球数(図11A)、ヘマトクリット(図11B)、ヘモグロビン(図11C)の評価は、mActRIIA-Fcによるマウスの処置の結果として、これらのパラメーターのレベルの変化を示さなかった。網状赤血球増加のごくわずかな減少が観察された(図11D)。mActRIIA-Fcは、MCV(図11E)、MCH(図11F)、及びMCHC(図12G)などの赤血球(RBC)パラメーターも変化させなかった。各々の独立した実験について、*p<0.05、N=3〜5。
mActRIIA-Fcが赤血球パラメーターを増加させる細胞メカニズムを調べるために、一連のインビトロ実験を実施した。これらの実験において、コロニー形成アッセイ(図13A)及び液体培養物中での赤血球分化(図13B及び13C)で評価したとき、ヒトCD34+細胞に対するmActRIIA-Fcの直接的な作用を支持する証拠は見つけられなかった。臨床的知見と薬理学的知見の両方がRBCパラメーターの刺激におけるmActRIIA-Fcの明白な役割を示したので、mActRIIA-Fcの作用が骨髄(BM)微小環境のアクセサリー細胞によって媒介され得るという仮説を立てた。赤血球始原細胞が高度に濃縮されているヒトCD36+細胞を長期BM培養物とともに共培養し、その後、EPO(2U/mL)補充培地中で6日間培養した後、その赤血球分化を評価した。6日目に、該培養物の産生物は、主に、EryA(〜好塩基性赤芽球)であると特徴付けられたが、mActRIIA-Fc(50μM)を添加すると、CD36+細胞のかなりの割合がEryB/C細胞(多染色性/正染性赤芽球)に成熟し、これにより、BMアクセサリー細胞によって産生される因子がmActRIIA-Fcの赤血球産生作用を媒介すること、及びEPOとは対照的に、mActRIIA-Fcが赤芽球成熟の後期において役割を果たし得ることを示唆した(図13D〜13F)。mActRIIA-Fcの作用を媒介し得るサイトカインを同定するために、CD36+細胞をいくつかのActRIIAリガンドで処理した。GDF11処理は、分化過程における糖タンパク質A陽性(GPA+)細胞の増殖を有意に減少させ、mActRIIA-Fcは、未処理の細胞に影響を及ぼすことなく、この作用を効果的に逆転させた(図13G及び13H)。これらのデータは、GDF11の阻害がmActRIIA-Fcの赤血球産生刺激作用を媒介することを示している。
まとめると、これらのデータは、アクチビン/BMPシグナル伝達が赤芽球分化を制御すること、及びBMP II型/アクチビンII型受容体の標的化が、β-サラセミアにおいて、無効造血を減少させ、貧血を改善することができることを示している。特に、これらのデータは、β-サラセミア関連貧血におけるGDF11の関与を示し、サラセミア患者のGDF11レベルを抑制し又は減少させることが、無効造血と関連する貧血の有効な治療であることを示している。
(7.配列の記載)
表1:配列情報
本発明は、その具体的な実施態様に関して詳細に記載されているが、機能的に等価であるバリエーションが本発明の範囲内にあることが理解されるであろう。実際、本明細書に示され、記載されたものに加えた本発明の様々な変更は、前述の説明及び付随する図面から当業者に明らかになるであろう。そのような変更は、添付の特許請求の範囲の範囲内に含まれることが意図される。当業者は、本明細書に記載の本発明の具体的な実施態様の多くの等価物を認識するか、又はルーチンの実験だけを用いて、それらを確認することができるであろう。そのような等価物は、以下の特許請求の範囲によって包含されることが意図される。
Claims (7)
- GDF11のアンタゴニストを含む、患者におけるβサラセミアを治療するための医薬組成物であって、該GDF11のアンタゴニストが抗GDF11抗体である、前記医薬組成物。
- 前記患者が、骨髄、脾臓、肝臓、血清、又は血漿中の上昇したGDF11レベルを有する、請求項1記載の医薬組成物。
- 前記GDF11のアンタゴニストが、GDF11の発現を低下させ、GDF11活性を低下させ、又はGDF11タンパク質レベルを低下させる、請求項1記載の医薬組成物。
- a.GDF11レベルを決定し;
b.前記GDF11のアンタゴニストの用量を調整するように用いられることを特徴とし、
ここで、GDF11が正常と比べて増加している場合、該GDF11のアンタゴニストの用量を増加させ、GDF11が正常未満に減少している場合、該GDF11のアンタゴニストの用量を減少させる、請求項1記載の医薬組成物。 - 前記GDF11レベルが、GDF11 mRNAレベル、GDF11タンパク質レベル、又はGDF11タンパク質活性レベルとして決定される、請求項4記載の医薬組成物。
- 前記投与が、患者における後期好塩基性及び多染性赤芽球の細胞数の減少をもたらす、請求項1記載の医薬組成物。
- 前記GDF11のアンタゴニストが、GDF11発現を低下させ、GDF11活性を低下させ、及び/又はGDF11タンパク質レベルを低下させる、請求項1記載の医薬組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261718128P | 2012-10-24 | 2012-10-24 | |
| US61/718,128 | 2012-10-24 | ||
| PCT/US2013/066353 WO2014066487A2 (en) | 2012-10-24 | 2013-10-23 | Methods for treating anemia |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018131952A Division JP2018184430A (ja) | 2012-10-24 | 2018-07-12 | 貧血の治療方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2016503398A JP2016503398A (ja) | 2016-02-04 |
| JP2016503398A5 JP2016503398A5 (ja) | 2016-12-08 |
| JP6401172B2 true JP6401172B2 (ja) | 2018-10-10 |
Family
ID=50545463
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015539751A Active JP6401172B2 (ja) | 2012-10-24 | 2013-10-23 | 貧血の治療方法 |
| JP2018131952A Pending JP2018184430A (ja) | 2012-10-24 | 2018-07-12 | 貧血の治療方法 |
| JP2020108654A Withdrawn JP2020183390A (ja) | 2012-10-24 | 2020-06-24 | 貧血の治療方法 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018131952A Pending JP2018184430A (ja) | 2012-10-24 | 2018-07-12 | 貧血の治療方法 |
| JP2020108654A Withdrawn JP2020183390A (ja) | 2012-10-24 | 2020-06-24 | 貧血の治療方法 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US20150266950A1 (ja) |
| EP (2) | EP2911682A4 (ja) |
| JP (3) | JP6401172B2 (ja) |
| CN (3) | CN104981250A (ja) |
| AU (4) | AU2013334660B2 (ja) |
| CA (1) | CA2889286A1 (ja) |
| HK (1) | HK1214504A1 (ja) |
| NZ (1) | NZ747350A (ja) |
| WO (1) | WO2014066487A2 (ja) |
Families Citing this family (30)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8128933B2 (en) | 2005-11-23 | 2012-03-06 | Acceleron Pharma, Inc. | Method of promoting bone growth by an anti-activin B antibody |
| KR101557375B1 (ko) | 2005-11-23 | 2015-10-08 | 악셀레론 파마 인코포레이티드 | 액티빈-actrⅱa 길항제 및 골 성장을 촉진하기 위한 이들의 용도 |
| US8895016B2 (en) | 2006-12-18 | 2014-11-25 | Acceleron Pharma, Inc. | Antagonists of activin-actriia and uses for increasing red blood cell levels |
| MX2009008222A (es) | 2007-02-01 | 2009-10-12 | Acceleron Pharma Inc | Antagonistas de activina-actriia y usos para tratar o prevenir cancer de mama. |
| TWI432449B (zh) | 2007-02-02 | 2014-04-01 | Acceleron Pharma Inc | 衍生自ActRIIB的變體與其用途 |
| EP2481415B1 (en) | 2007-02-09 | 2019-09-11 | Acceleron Pharma Inc. | Pharmaceutical compositions comprising Activin-ActRIIA antagonists |
| EP3243524A1 (en) | 2007-09-18 | 2017-11-15 | Acceleron Pharma Inc. | Activin-actriia antagonists and uses for decreasing or inhibiting fsh secretion |
| US8216997B2 (en) | 2008-08-14 | 2012-07-10 | Acceleron Pharma, Inc. | Methods for increasing red blood cell levels and treating anemia using a combination of GDF traps and erythropoietin receptor activators |
| TW201803586A (zh) | 2008-08-14 | 2018-02-01 | 艾瑟勒朗法瑪公司 | 使用gdf阱以增加紅血球水平 |
| BRPI1010587A2 (pt) | 2009-06-08 | 2019-04-09 | Acceleron Pharma Inc. | métodos para aumentar adipócitos termogênicos |
| ES2836534T3 (es) | 2009-06-12 | 2021-06-25 | Acceleron Pharma Inc | Proteínas de fusión de ActRIIB-Fc truncadas |
| JP6267425B2 (ja) | 2009-11-17 | 2018-01-24 | アクセルロン ファーマ, インコーポレイテッド | 筋ジストロフィー治療のためのユートロフィン誘導に関するactriibタンパク質およびその改変体およびその使用 |
| JP2014502260A (ja) | 2010-11-08 | 2014-01-30 | アクセルロン ファーマ, インコーポレイテッド | Actriia結合剤およびその使用 |
| MX366336B (es) | 2012-11-02 | 2019-07-05 | Celgene Corp | Antagonistas de activina - actrii y usos para el tratar trastornos oseos y otros. |
| CA2942954A1 (en) * | 2014-03-21 | 2015-09-24 | Acceleron Pharma, Inc. | Methods for increasing red blood cell levels and treating ineffective erythropoiesis |
| TN2016000553A1 (en) | 2014-06-13 | 2018-04-04 | Acceleron Pharma Inc | Methods and compositions for treating ulcers |
| MA41052A (fr) | 2014-10-09 | 2017-08-15 | Celgene Corp | Traitement d'une maladie cardiovasculaire à l'aide de pièges de ligands d'actrii |
| MD4801C1 (ro) * | 2014-12-03 | 2022-10-31 | Celgene Corporation | Antagonişti ai activin-ActRII şi utilizarea lor pentru tratamentul sindroamelor mielodisplazice |
| MA41119A (fr) | 2014-12-03 | 2017-10-10 | Acceleron Pharma Inc | Méthodes de traitement de syndromes myélodysplasiques et d'anémie sidéroblastique |
| WO2016128523A1 (en) * | 2015-02-12 | 2016-08-18 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for predicting the responsiveness of a patient affected with malignant hematological disease to chemotherapy treatment and methods of treatment of such disease |
| TWI762444B (zh) * | 2015-05-13 | 2022-05-01 | 美商西建公司 | 使用ACTRII配位體捕捉以治療β-地中海型貧血 |
| EP3298034A4 (en) | 2015-05-20 | 2019-02-13 | Celgene Corporation | IN VITRO CELL CULTURE PROCEDURE FOR BETA THALASSEMIA BY MEANS OF ACTIVIN TYPE II RECEPTOR LIGANDS |
| EP3370754A4 (en) * | 2015-11-04 | 2019-10-23 | Acceleron Pharma Inc. | METHODS FOR INCREASING ERYTHROCYTE RATES AND TREATING INEFFECTIVE ERYTHROPOISIS |
| PT3496739T (pt) | 2016-07-15 | 2021-06-21 | Acceleron Pharma Inc | Composições compreendendo polipéptidos actriia para uso no tratamento de hipertensão pulmonar |
| CN107011430B (zh) * | 2017-04-07 | 2020-09-01 | 哈尔滨医科大学 | 一种具有生物学活性的截短的生长分化因子11及其制备方法 |
| KR20200085832A (ko) | 2017-11-09 | 2020-07-15 | 케로스 테라퓨틱스, 인크. | 액티빈 수용체 유형 iia 변이체 및 그의 사용 방법 |
| KR20200109330A (ko) | 2018-01-12 | 2020-09-22 | 케로스 테라퓨틱스, 인크. | 액티빈 수용체 유형 iib 변이체 및 그의 사용 방법 |
| JP7405772B2 (ja) * | 2018-05-09 | 2023-12-26 | ケロス セラピューティクス インコーポレイテッド | アクチビンiia型受容体変異体および同変異体を含む医薬組成物 |
| WO2020257587A1 (en) * | 2019-06-19 | 2020-12-24 | Cornell University | Methods of promoting erythropoiesis and overcoming erythropoitein resistance in patients |
| CN113801880A (zh) * | 2021-07-27 | 2021-12-17 | 浙江大学 | 一种通过靶向敲除基因建立的早衰细胞模型及其sgRNA、构建方法和应用 |
Family Cites Families (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5223409A (en) | 1988-09-02 | 1993-06-29 | Protein Engineering Corp. | Directed evolution of novel binding proteins |
| US5198346A (en) | 1989-01-06 | 1993-03-30 | Protein Engineering Corp. | Generation and selection of novel DNA-binding proteins and polypeptides |
| US5096815A (en) | 1989-01-06 | 1992-03-17 | Protein Engineering Corporation | Generation and selection of novel dna-binding proteins and polypeptides |
| EP0776337B1 (en) * | 1994-07-08 | 2005-09-21 | The Johns Hopkins University School Of Medicine | Growth differentiation factor-11 |
| US7795202B2 (en) | 1997-08-04 | 2010-09-14 | Neurorepair, Inc. | Methods for treating a neurological disorder by peripheral administration of a transforming growth factor alpha (TGF-a) |
| WO2000006716A1 (en) * | 1998-07-28 | 2000-02-10 | The Johns Hopkins University School Of Medicine | Growth differentiation factor-11 |
| TWI329129B (en) | 2001-02-08 | 2010-08-21 | Wyeth Corp | Modified and stabilized gdf propeptides and uses thereof |
| US7320789B2 (en) | 2001-09-26 | 2008-01-22 | Wyeth | Antibody inhibitors of GDF-8 and uses thereof |
| WO2003072714A2 (en) | 2002-02-21 | 2003-09-04 | Wyeth | Follistatin domain containing proteins |
| US7261893B2 (en) | 2002-10-22 | 2007-08-28 | Wyeth | Neutralizing antibodies against GDF-8 and uses therefor |
| ES2710048T3 (es) | 2004-07-23 | 2019-04-22 | Acceleron Pharma Inc | Anticuerpos antagonistas del receptor ActRII |
| BRPI0609504A2 (pt) * | 2005-03-30 | 2010-04-13 | Wyeth Corp | métodos para estimular o crescimento capilar administrando proteìnas morfogenéticas ósseas (bmps) |
| WO2007006025A2 (en) * | 2005-07-01 | 2007-01-11 | Acceleron Pharma Inc. | Lefty, lefty derivatives and uses therof |
| UA92504C2 (en) | 2005-10-12 | 2010-11-10 | Эли Лилли Энд Компани | Anti-myostatin monoclonal antibody |
| BRPI0720476B1 (pt) * | 2006-12-18 | 2022-05-31 | Acceleron Pharma Inc | Uso de um polipeptídeo de actrii para tratar anemia em um paciente humano |
| US8895016B2 (en) | 2006-12-18 | 2014-11-25 | Acceleron Pharma, Inc. | Antagonists of activin-actriia and uses for increasing red blood cell levels |
| US20100028332A1 (en) | 2006-12-18 | 2010-02-04 | Acceleron Pharma Inc. | Antagonists of actriib and uses for increasing red blood cell levels |
| TWI432449B (zh) | 2007-02-02 | 2014-04-01 | Acceleron Pharma Inc | 衍生自ActRIIB的變體與其用途 |
| TWI454479B (zh) | 2007-03-06 | 2014-10-01 | Amgen Inc | 變異之活動素受體多肽及其用途 |
| WO2008109779A2 (en) | 2007-03-07 | 2008-09-12 | The Johns Hopkins University | Use of follistatin-like related gene (flrg) to increase muscle mass |
| EP3243524A1 (en) | 2007-09-18 | 2017-11-15 | Acceleron Pharma Inc. | Activin-actriia antagonists and uses for decreasing or inhibiting fsh secretion |
| DK2318028T3 (da) * | 2008-06-26 | 2020-05-04 | Acceleron Pharma Inc | Antagonister af opløselig activin-aktriia og anvendelser til øgning af røde blodcelleniveauer |
| US8216997B2 (en) * | 2008-08-14 | 2012-07-10 | Acceleron Pharma, Inc. | Methods for increasing red blood cell levels and treating anemia using a combination of GDF traps and erythropoietin receptor activators |
| TW201803586A (zh) | 2008-08-14 | 2018-02-01 | 艾瑟勒朗法瑪公司 | 使用gdf阱以增加紅血球水平 |
| NZ623113A (en) * | 2009-08-13 | 2015-10-30 | Acceleron Pharma Inc | Combined use of gdf traps and erythropoietin receptor activators to increase red blood cell levels |
| JO3340B1 (ar) | 2010-05-26 | 2019-03-13 | Regeneron Pharma | مضادات حيوية لـعامل تمايز النمو 8 البشري |
| WO2012027065A2 (en) * | 2010-08-27 | 2012-03-01 | Celgene Corporation | Combination therapy for treatment of disease |
| JP2014502260A (ja) * | 2010-11-08 | 2014-01-30 | アクセルロン ファーマ, インコーポレイテッド | Actriia結合剤およびその使用 |
-
2013
- 2013-10-23 JP JP2015539751A patent/JP6401172B2/ja active Active
- 2013-10-23 NZ NZ747350A patent/NZ747350A/en unknown
- 2013-10-23 CN CN201380067832.9A patent/CN104981250A/zh active Pending
- 2013-10-23 EP EP13849960.3A patent/EP2911682A4/en not_active Withdrawn
- 2013-10-23 CA CA2889286A patent/CA2889286A1/en active Pending
- 2013-10-23 AU AU2013334660A patent/AU2013334660B2/en active Active
- 2013-10-23 CN CN202011542063.1A patent/CN112957462A/zh active Pending
- 2013-10-23 WO PCT/US2013/066353 patent/WO2014066487A2/en active Application Filing
- 2013-10-23 EP EP19151143.5A patent/EP3527219A1/en not_active Withdrawn
- 2013-10-23 US US14/438,127 patent/US20150266950A1/en not_active Abandoned
- 2013-10-23 CN CN202011541918.9A patent/CN112933223A/zh active Pending
-
2016
- 2016-03-01 HK HK16102359.3A patent/HK1214504A1/zh unknown
-
2018
- 2018-07-12 JP JP2018131952A patent/JP2018184430A/ja active Pending
- 2018-11-02 AU AU2018256635A patent/AU2018256635A1/en not_active Abandoned
-
2020
- 2020-05-15 AU AU2020203198A patent/AU2020203198B2/en active Active
- 2020-06-24 JP JP2020108654A patent/JP2020183390A/ja not_active Withdrawn
-
2022
- 2022-03-21 AU AU2022201923A patent/AU2022201923A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| CA2889286A1 (en) | 2014-05-01 |
| JP2018184430A (ja) | 2018-11-22 |
| AU2013334660B2 (en) | 2018-08-09 |
| HK1214504A1 (zh) | 2016-07-29 |
| EP3527219A1 (en) | 2019-08-21 |
| US20150266950A1 (en) | 2015-09-24 |
| CN104981250A (zh) | 2015-10-14 |
| AU2018256635A1 (en) | 2018-11-22 |
| CN112957462A (zh) | 2021-06-15 |
| NZ747350A (en) | 2020-07-31 |
| JP2020183390A (ja) | 2020-11-12 |
| JP2016503398A (ja) | 2016-02-04 |
| CN112933223A (zh) | 2021-06-11 |
| WO2014066487A3 (en) | 2014-06-19 |
| EP2911682A2 (en) | 2015-09-02 |
| WO2014066487A2 (en) | 2014-05-01 |
| EP2911682A4 (en) | 2016-03-23 |
| AU2013334660A1 (en) | 2015-05-14 |
| AU2020203198A1 (en) | 2020-06-11 |
| AU2020203198B2 (en) | 2021-12-23 |
| AU2022201923A1 (en) | 2022-04-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6401172B2 (ja) | 貧血の治療方法 | |
| JP7146850B2 (ja) | 貧血の治療に使用するためのバイオマーカー | |
| JP6643432B2 (ja) | アクチビン−ActRIIaのアンタゴニストおよび赤血球レベルを高めるためのその使用 | |
| JP5778576B2 (ja) | アクチビン−ActRIIaアンタゴニストを投薬する方法および処置される患者をモニターする方法 | |
| JP2018501307A (ja) | アクチビン−ActRIIアンタゴニスト及び貧血を治療するための使用 | |
| NZ743635B2 (en) | Biomarker for use in treating anemia | |
| NZ743635A (en) | Biomarker for use in treating anemia |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20151223 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20161020 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20161020 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170725 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170922 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180124 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20180313 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180712 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20180720 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20180814 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20180906 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6401172 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |