JP6175076B2 - Ad36e4orf1およびakt1阻害剤を使用した血糖コントロールの向上 - Google Patents
Ad36e4orf1およびakt1阻害剤を使用した血糖コントロールの向上 Download PDFInfo
- Publication number
- JP6175076B2 JP6175076B2 JP2014553448A JP2014553448A JP6175076B2 JP 6175076 B2 JP6175076 B2 JP 6175076B2 JP 2014553448 A JP2014553448 A JP 2014553448A JP 2014553448 A JP2014553448 A JP 2014553448A JP 6175076 B2 JP6175076 B2 JP 6175076B2
- Authority
- JP
- Japan
- Prior art keywords
- adenovirus
- pharmaceutical composition
- composition
- seq
- acid sequence
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 102100033810 RAC-alpha serine/threonine-protein kinase Human genes 0.000 title claims description 79
- 101000779418 Homo sapiens RAC-alpha serine/threonine-protein kinase Proteins 0.000 title claims description 68
- 239000003112 inhibitor Substances 0.000 title claims description 39
- 230000002641 glycemic effect Effects 0.000 title claims description 34
- 108090000623 proteins and genes Proteins 0.000 claims description 70
- 102000004169 proteins and genes Human genes 0.000 claims description 64
- 239000000203 mixture Substances 0.000 claims description 46
- 150000007523 nucleic acids Chemical class 0.000 claims description 46
- 102000039446 nucleic acids Human genes 0.000 claims description 37
- 108020004707 nucleic acids Proteins 0.000 claims description 37
- 238000000034 method Methods 0.000 claims description 24
- 230000001965 increasing effect Effects 0.000 claims description 20
- 230000004132 lipogenesis Effects 0.000 claims description 20
- 241000701161 unidentified adenovirus Species 0.000 claims description 18
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 17
- 206010022489 Insulin Resistance Diseases 0.000 claims description 12
- 206010012601 diabetes mellitus Diseases 0.000 claims description 9
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 8
- 238000001415 gene therapy Methods 0.000 claims description 8
- 238000001890 transfection Methods 0.000 claims description 7
- 108020004414 DNA Proteins 0.000 claims description 6
- 230000004927 fusion Effects 0.000 claims description 6
- 238000001727 in vivo Methods 0.000 claims description 6
- 230000011759 adipose tissue development Effects 0.000 claims description 5
- 238000012546 transfer Methods 0.000 claims description 5
- 208000024891 symptom Diseases 0.000 claims description 4
- 239000013603 viral vector Substances 0.000 claims description 4
- 229920002307 Dextran Polymers 0.000 claims description 3
- 108091061960 Naked DNA Proteins 0.000 claims description 3
- 241001068295 Replication defective viruses Species 0.000 claims description 3
- 230000015572 biosynthetic process Effects 0.000 claims description 3
- 229910000389 calcium phosphate Inorganic materials 0.000 claims description 3
- 239000001506 calcium phosphate Substances 0.000 claims description 3
- 235000011010 calcium phosphates Nutrition 0.000 claims description 3
- 125000002091 cationic group Chemical group 0.000 claims description 3
- 230000005684 electric field Effects 0.000 claims description 3
- 238000004520 electroporation Methods 0.000 claims description 3
- 238000002347 injection Methods 0.000 claims description 3
- 239000007924 injection Substances 0.000 claims description 3
- 239000002502 liposome Substances 0.000 claims description 3
- 210000001938 protoplast Anatomy 0.000 claims description 3
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 claims description 3
- KCEKCKYZZHREFI-UHFFFAOYSA-N 3h-thiadiazol-2-amine Chemical group NN1NC=CS1 KCEKCKYZZHREFI-UHFFFAOYSA-N 0.000 claims description 2
- 230000006801 homologous recombination Effects 0.000 claims description 2
- 238000002744 homologous recombination Methods 0.000 claims description 2
- 230000002265 prevention Effects 0.000 claims description 2
- 239000008194 pharmaceutical composition Substances 0.000 claims 18
- 125000003275 alpha amino acid group Chemical group 0.000 claims 13
- 101000798015 Homo sapiens RAC-beta serine/threonine-protein kinase Proteins 0.000 description 39
- 102100032315 RAC-beta serine/threonine-protein kinase Human genes 0.000 description 39
- 210000004027 cell Anatomy 0.000 description 39
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 26
- 208000015181 infectious disease Diseases 0.000 description 24
- 241000699670 Mus sp. Species 0.000 description 21
- 230000004913 activation Effects 0.000 description 20
- 230000004190 glucose uptake Effects 0.000 description 18
- 108010016731 PPAR gamma Proteins 0.000 description 17
- 102000000536 PPAR gamma Human genes 0.000 description 17
- 210000001789 adipocyte Anatomy 0.000 description 16
- 102000004877 Insulin Human genes 0.000 description 13
- 108090001061 Insulin Proteins 0.000 description 13
- 229940125396 insulin Drugs 0.000 description 13
- 150000001413 amino acids Chemical group 0.000 description 12
- 239000013598 vector Substances 0.000 description 12
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 11
- 108091008611 Protein Kinase B Proteins 0.000 description 11
- 108020004459 Small interfering RNA Proteins 0.000 description 9
- 239000012634 fragment Substances 0.000 description 9
- 239000008103 glucose Substances 0.000 description 9
- 230000000694 effects Effects 0.000 description 8
- 102000004196 processed proteins & peptides Human genes 0.000 description 8
- 108090000765 processed proteins & peptides Proteins 0.000 description 8
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 8
- 238000001262 western blot Methods 0.000 description 8
- ZOBPZXTWZATXDG-UHFFFAOYSA-N 1,3-thiazolidine-2,4-dione Chemical compound O=C1CSC(=O)N1 ZOBPZXTWZATXDG-UHFFFAOYSA-N 0.000 description 7
- 108010076365 Adiponectin Proteins 0.000 description 7
- 102000011690 Adiponectin Human genes 0.000 description 7
- 229940123464 Thiazolidinedione Drugs 0.000 description 7
- 201000001421 hyperglycemia Diseases 0.000 description 7
- 230000007863 steatosis Effects 0.000 description 7
- 231100000240 steatosis hepatitis Toxicity 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- 101150107888 AKT2 gene Proteins 0.000 description 6
- 108091007960 PI3Ks Proteins 0.000 description 6
- 102000003993 Phosphatidylinositol 3-kinases Human genes 0.000 description 6
- 108090000430 Phosphatidylinositol 3-kinases Proteins 0.000 description 6
- 108010029485 Protein Isoforms Proteins 0.000 description 6
- 102000001708 Protein Isoforms Human genes 0.000 description 6
- 101150045355 akt1 gene Proteins 0.000 description 6
- 229960003722 doxycycline Drugs 0.000 description 6
- XQTWDDCIUJNLTR-CVHRZJFOSA-N doxycycline monohydrate Chemical compound O.O=C1C2=C(O)C=CC=C2[C@H](C)[C@@H]2C1=C(O)[C@]1(O)C(=O)C(C(N)=O)=C(O)[C@@H](N(C)C)[C@@H]1[C@H]2O XQTWDDCIUJNLTR-CVHRZJFOSA-N 0.000 description 6
- 229920001184 polypeptide Polymers 0.000 description 6
- 206010018429 Glucose tolerance impaired Diseases 0.000 description 5
- 241000124008 Mammalia Species 0.000 description 5
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 5
- 241000700605 Viruses Species 0.000 description 5
- 230000002293 adipogenic effect Effects 0.000 description 5
- 210000000577 adipose tissue Anatomy 0.000 description 5
- 238000012217 deletion Methods 0.000 description 5
- 230000037430 deletion Effects 0.000 description 5
- 230000004069 differentiation Effects 0.000 description 5
- 230000006372 lipid accumulation Effects 0.000 description 5
- 230000035772 mutation Effects 0.000 description 5
- 210000000229 preadipocyte Anatomy 0.000 description 5
- 230000004044 response Effects 0.000 description 5
- VRYALKFFQXWPIH-PBXRRBTRSA-N (3r,4s,5r)-3,4,5,6-tetrahydroxyhexanal Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)CC=O VRYALKFFQXWPIH-PBXRRBTRSA-N 0.000 description 4
- 241000282412 Homo Species 0.000 description 4
- 208000001280 Prediabetic State Diseases 0.000 description 4
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 4
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 4
- PMMURAAUARKVCB-UHFFFAOYSA-N alpha-D-ara-dHexp Natural products OCC1OC(O)CC(O)C1O PMMURAAUARKVCB-UHFFFAOYSA-N 0.000 description 4
- 230000008727 cellular glucose uptake Effects 0.000 description 4
- 238000010217 densitometric analysis Methods 0.000 description 4
- 238000001114 immunoprecipitation Methods 0.000 description 4
- 230000001939 inductive effect Effects 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- 108020004999 messenger RNA Proteins 0.000 description 4
- 230000026731 phosphorylation Effects 0.000 description 4
- 238000006366 phosphorylation reaction Methods 0.000 description 4
- 201000009104 prediabetes syndrome Diseases 0.000 description 4
- 230000006798 recombination Effects 0.000 description 4
- 230000011664 signaling Effects 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- RSNQVABHABAKEZ-UHFFFAOYSA-N 2,3-diphenylquinoxaline Chemical compound C1=CC=CC=C1C1=NC2=CC=CC=C2N=C1C1=CC=CC=C1 RSNQVABHABAKEZ-UHFFFAOYSA-N 0.000 description 3
- 241000288906 Primates Species 0.000 description 3
- 230000005754 cellular signaling Effects 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 239000003623 enhancer Substances 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 239000003550 marker Substances 0.000 description 3
- FKCXKEHHZXEWGP-UHFFFAOYSA-N n-(7-cyclobutyl-3-phenyl-[1,2,4]triazolo[4,3-b]pyridazin-6-yl)-n',n',2,2-tetramethylpropane-1,3-diamine Chemical compound CN(C)CC(C)(C)CNC1=NN2C(C=3C=CC=CC=3)=NN=C2C=C1C1CCC1 FKCXKEHHZXEWGP-UHFFFAOYSA-N 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- 238000005215 recombination Methods 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- 230000010076 replication Effects 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 230000014616 translation Effects 0.000 description 3
- 239000003981 vehicle Substances 0.000 description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- -1 5,6-diphenylpyrazin-2 (1H) -one (pyrazinone) Chemical compound 0.000 description 2
- 108010001857 Cell Surface Receptors Proteins 0.000 description 2
- 108020004705 Codon Proteins 0.000 description 2
- 102000018711 Facilitative Glucose Transport Proteins Human genes 0.000 description 2
- 108091052347 Glucose transporter family Proteins 0.000 description 2
- 101000798007 Homo sapiens RAC-gamma serine/threonine-protein kinase Proteins 0.000 description 2
- 102100032314 RAC-gamma serine/threonine-protein kinase Human genes 0.000 description 2
- 101150110386 SLC2A4 gene Proteins 0.000 description 2
- 125000000539 amino acid group Chemical group 0.000 description 2
- 239000003472 antidiabetic agent Substances 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 239000008121 dextrose Substances 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 230000009977 dual effect Effects 0.000 description 2
- 239000013604 expression vector Substances 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 210000004962 mammalian cell Anatomy 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 102000006240 membrane receptors Human genes 0.000 description 2
- 210000000663 muscle cell Anatomy 0.000 description 2
- 239000006199 nebulizer Substances 0.000 description 2
- 239000013642 negative control Substances 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- 238000003752 polymerase chain reaction Methods 0.000 description 2
- 239000003197 protein kinase B inhibitor Substances 0.000 description 2
- 238000002864 sequence alignment Methods 0.000 description 2
- 238000010186 staining Methods 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 230000003827 upregulation Effects 0.000 description 2
- 229940126638 Akt inhibitor Drugs 0.000 description 1
- 101100322915 Caenorhabditis elegans akt-1 gene Proteins 0.000 description 1
- 150000008574 D-amino acids Chemical class 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- 102100036264 Glucose-6-phosphatase catalytic subunit 1 Human genes 0.000 description 1
- 101710099339 Glucose-6-phosphatase catalytic subunit 1 Proteins 0.000 description 1
- 206010019708 Hepatic steatosis Diseases 0.000 description 1
- 241000598171 Human adenovirus sp. Species 0.000 description 1
- 102000003746 Insulin Receptor Human genes 0.000 description 1
- 108010001127 Insulin Receptor Proteins 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 241001028048 Nicola Species 0.000 description 1
- NPGIHFRTRXVWOY-UHFFFAOYSA-N Oil red O Chemical compound Cc1ccc(C)c(c1)N=Nc1cc(C)c(cc1C)N=Nc1c(O)ccc2ccccc12 NPGIHFRTRXVWOY-UHFFFAOYSA-N 0.000 description 1
- 102000015636 Oligopeptides Human genes 0.000 description 1
- 108010038807 Oligopeptides Proteins 0.000 description 1
- 102000000470 PDZ domains Human genes 0.000 description 1
- 108050008994 PDZ domains Proteins 0.000 description 1
- 238000011529 RT qPCR Methods 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 101150116689 Slc2a2 gene Proteins 0.000 description 1
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 1
- 108700005077 Viral Genes Proteins 0.000 description 1
- 230000035508 accumulation Effects 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 238000007792 addition Methods 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000004479 aerosol dispenser Substances 0.000 description 1
- 229940127003 anti-diabetic drug Drugs 0.000 description 1
- 229940125708 antidiabetic agent Drugs 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 230000002238 attenuated effect Effects 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- BPKIGYQJPYCAOW-FFJTTWKXSA-I calcium;potassium;disodium;(2s)-2-hydroxypropanoate;dichloride;dihydroxide;hydrate Chemical compound O.[OH-].[OH-].[Na+].[Na+].[Cl-].[Cl-].[K+].[Ca+2].C[C@H](O)C([O-])=O BPKIGYQJPYCAOW-FFJTTWKXSA-I 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 108091092328 cellular RNA Proteins 0.000 description 1
- 230000033077 cellular process Effects 0.000 description 1
- 230000004700 cellular uptake Effects 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 230000002222 downregulating effect Effects 0.000 description 1
- 230000003828 downregulation Effects 0.000 description 1
- 230000000667 effect on insulin Effects 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 230000003345 hyperglycaemic effect Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 230000003520 lipogenic effect Effects 0.000 description 1
- 230000003908 liver function Effects 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 230000007102 metabolic function Effects 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- 239000000346 nonvolatile oil Substances 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 230000005195 poor health Effects 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 230000010837 receptor-mediated endocytosis Effects 0.000 description 1
- 238000003259 recombinant expression Methods 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 238000004088 simulation Methods 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 150000001467 thiazolidinediones Chemical class 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/162—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/145—Amines having sulfur, e.g. thiurams (>N—C(S)—S—C(S)—N< and >N—C(S)—S—S—C(S)—N<), Sulfinylamines (—N=SO), Sulfonylamines (—N=SO2)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/433—Thidiazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/005—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'active' part of the composition delivered, i.e. the nucleic acid delivered
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/10011—Adenoviridae
- C12N2710/10311—Mastadenovirus, e.g. human or simian adenoviruses
- C12N2710/10322—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/10011—Adenoviridae
- C12N2710/10311—Mastadenovirus, e.g. human or simian adenoviruses
- C12N2710/10333—Use of viral protein as therapeutic agent other than vaccine, e.g. apoptosis inducing or anti-inflammatory
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Virology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Diabetes (AREA)
- Immunology (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Endocrinology (AREA)
- Hematology (AREA)
- Emergency Medicine (AREA)
- Obesity (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Description
本出願は、2012年1月20日出願の米国仮特許出願第61/588,959号の利益を主張し、その出願の全教示は、参照により本明細書に組み込まれる。
人間における自然Ad36感染は、より良好な血糖コントロールに関連するが、Ad36感染はまた脂肪症を増加させる。本明細書に記載のように、AKT1阻害剤を使用した研究の結果は、AKT1阻害剤と組み合わされたAd36 E4orf1タンパク質またはその類似体もしくは誘導体が、脂質生成を誘導することなく血糖コントロールを向上させることを実証している。
本発明は、脂質生成の増加なしに血糖コントロールを改善するための治療方法を提供する。したがって、本発明は、脂質生成の増加なしに、高血糖、インスリン耐性、前糖尿病または糖尿病(1型もしくは2型)を処置するための方法を提供する。
本発明に従い投与されるAd36組成物は、様々な形態を有し得る。好ましくは、組成物は、E4orf1またはその機能性変異体を含む。例えば、Ad36組成物は、Ad36ウイルスもしくは弱毒変異体、またはAd36の不活性化形態、例えば熱殺菌もしくは漂白殺菌されたAd36、または複製欠損組み換えAd36であってもよい。Ad36組成物は、単離された、または組み換えAd36タンパク質、好ましくはE4orf1タンパク質またはその機能性変異体を含んでもよい。Ad36組成物は、E4orf1タンパク質またはその機能性変異体をコードする核酸を含んでもよい。Ad36組成物は、E4orf1タンパク質の類似体または誘導体、例えば化学的類似体または構造的類似体を含んでもよい。
Ad36組成物は、単離された、または組み換えAd36タンパク質、好ましくはE4orf1タンパク質またはその機能性変異体を含んでもよい。本明細書において「単離された」と言及されるタンパク質またはポリペプチドは、それらが感染した哺乳動物細胞において存在する状態を超える状態まで精製されたタンパク質またはポリペプチドである。E4orf1およびその機能性変異体を含むAd36タンパク質は、周知の方法を使用して、例えば組み換え発現および精製、化学合成(例えば合成ペプチド)、または生物学的および化学的方法の組合せにより、ならびに単離された組み換えタンパク質またはポリペプチドを使用して生成され得る。タンパク質は、少なくとも約50重量%、好ましくは少なくとも約75重量%、より好ましくは本質的に純粋な形態の単離された状態で得ることができる。本明細書において「組み換え」と言及されるタンパク質またはポリペプチドは、組み換え核酸の発現により生成されるタンパク質またはポリペプチドである。
Ad36組成物は、Ad36のタンパク質、好ましくはE4orf1タンパク質またはその機能性変異体をコードする単離された、または組み換え核酸を含み得る。
Ad36組成物は、2−ATD;AKT−I−1(8);2,3−ジフェニルキノキサリン(9);5,6−ジフェニルピラジン−2(1H)−オン(ピラジノン)の位置異性体(9);または8−[4−(1−アミノシクロブチル)フェニル]−9−フェニル[1,2,4]トリアゾロ[3,4−f]−1,6−ナフチリジン−3(2H)−オン(米国特許第7,576,209号)を含む、任意のAKT1阻害剤を含み得る。好ましくは、AKT1阻害剤は、2−ATDである。
必ずしもこれらに限定されないが、非経口(例えば、静脈内、動脈内、筋肉内、皮下注射)、経口(例えば、食事)、局所、吸入(例えば、気管支内、鼻腔内、もしくは経口吸引、点鼻)、または経直腸を含む、様々な投与経路が可能である。
Ad36 E4orf1配列
Ad−36 E4orf1 DNA配列(配列番号1)
ATGGCTGAATCTCTGTATGCTTTCATAGATAGCCCTGGAGG
GATCGCTCCCGTCCAGGAAGGGGCTAGCAATAGATATATCTTCTTTTGCC
CCGAATCTTTCCACATTCCTCCGCATGGGGTGATATTGCTTCACCTCAGA
GTGAGCGTGCTGGTTCCTACTGGATATCAGGGCAGATTTATGGCCTTGAA
TGACTACCATGCCAGGGGCATACTAACCCAGTCCGATGTGATATTTGCCG
GGAGAAGACATGATCTCTCTGTGCTGCTCTTTAACCACACGGACCGATTT
TTGTATGTCCGCGAGGGCCACCCAGTGGGAACCCTGCTGCTGGAGAGA
GTGATTTTTCCTTCAGTGAGAATAGCCACCCTGGTTTAG
Ad−36 E4orf1タンパク質翻訳(配列番号2)
MAESLYAFIDSPGGIAPVQEGASNRYIFFCPESFHIPPHGV
ILLHLRVSVLVPTGYQGRFMALNDYHARGILTQSDVIFAGRRHDLSVLLF
NHTDRFLYVREGHPVGTLLIERVlFPSVRIATLV
本明細書において開示される試験の結果は、人間におけるAd36感染とより良好な血糖コントロールとの間に関連性があることを明らかにした。また、結果は、Ad36 E4orf1タンパク質が、AKT1阻害剤と組み合わされた場合、脂質生成の増加なしにグルコース処理を改善することを実証している。したがって、本明細書において開示されるこれらの試験は、AKT1と組み合わされたAd36、Ad36 E4orf1、および機能性変異体が、脂質生成の増加なしに、高血糖、インスリン耐性、前糖尿病、糖尿病(1型または2型)を処置または予防するために、および血糖コントロールを改善するために使用され得ることを示している。
Ad36は、高脂肪(HF)負荷マウスにおいてAKT2を活性化する
アデノウイルスAd36もしくはAd2(陰性対照ウイルス)による感染または模擬感染から20週間後に致死させたHF負荷マウスの脂肪組織から、タンパク質を単離した(n=3匹のマウス/群)。AKT2タンパク質を、免疫沈降法により、アイソフォーム特異的AKT抗体を使用して単離した。全ての、およびリン酸化したAKT2のレベルを、ウェスタンブロットにより決定した(図2A)。密度測定分析を使用して、タンパク質存在量を定量し、平均±SEと比較した。Ad2感染群ではなく、Ad36感染マウスが、模擬感染と比較して、より高いAKT2活性化を有していた(より高いリン酸化により示されるように)(*p<0.05)(図2B)。
Ad36は、給餌マウスにおいてAKT1およびAKT2を活性化する
Ad36もしくはAd2による感染または模擬感染から12週間後に致死させた給餌マウスの脂肪組織から、タンパク質を単離した(n=3匹のマウス/群)。AKT1およびAKT2タンパク質を、免疫沈降法により、アイソフォーム特異的AKT抗体を使用して単離した。全ての、およびリン酸化したAKT1およびAKT2のレベルを、ウェスタンブロットにより決定した(図3A)。密度測定分析を使用して、タンパク質存在量を定量し、平均±SEと比較した。Ad2感染マウスではなく、Ad36感染マウスが、模擬感染と比較して、より高いAKT1およびAKT2活性化を有していた(より高いリン酸化により示されるように)(*p<0.05またはそれ以上)(図3Bおよび3C)。
Ad36は、分化中の3T3L1細胞においてAKT1およびAKT2を活性化する
3T3L1前脂肪細胞を、Ad36または模擬感染させた(n=3/群)。3T3L1細胞を脂肪細胞に分化するように誘導した。感染から24、48および72時間後に、タンパク質を採取した。AKT1およびAKT2タンパク質を、免疫沈降法により、アイソフォーム特異的AKT抗体を使用して単離した。全ての、およびリン酸化したAKT1およびAKT2のレベルを、ウェスタンブロットにより決定した(図4A)。密度測定分析を使用して、タンパク質存在量を定量し、平均±SEと比較した。Ad36は、模擬感染と比較して、AKT1およびAKT2活性化の増加を有意に誘導した(*p<0.05またはそれより良好)(図4Bおよび4C)。AKTに対するAd36の効果は、インスリンの効果と同様であるか、またはそれより良好である。
Ad36は、脂肪細胞中の3T3L1においてAKT2を活性化する
分化した3T3L1脂肪細胞を、Ad36または模擬感染させた(n=3/群)。感染から24時間後に、タンパク質を採取した。AKT2タンパク質を、免疫沈降法により、アイソフォーム特異的AKT抗体を使用して単離した。全ての、およびリン酸化したAKT2のレベルを、ウェスタンブロットにより決定した(図5A)。密度測定分析を使用して、タンパク質存在量を定量し、平均±SEと比較した。Ad36は、模擬感染と比較して、AKT2活性化を有意に増加させた(*p<0.05)(図5B)。
siRNAによるAKTノックダウン後のグルコース取り込み
3T3−L1前脂肪細胞において、トランスフェクションから3日後に、基礎およびインスリン刺激条件下で2−デオキシグルコース(2DG)取り込みを決定した。NT:非標的化siRNAでトランスフェクトされた細胞。Akt1およびAkt2:Akt1およびAkt2 siRNAでトランスフェクトされた細胞。NT+Ad36:非標的化siRNAでトランスフェクトされ、Ad36に感染した細胞。Akt1+36およびAkt2+36:Akt1およびAkt2 siRNAで別個にトランスフェクトされ、Ad36に感染した細胞。Nt−Ins:非標的化siRNA+インスリンでトランスフェクトされた細胞。Akt1+InsおよびAkt2+Ins:Akt1およびAkt2 siRNA+インスリンでトランスフェクトされた細胞。予期されるように、Ad36はグルコース取り込みを有意に増加させた。結果は、AKT1ではなくAKT2のノックダウンが、Ad36誘導グルコース取り込みを減少させたことを示している(*p<0.05)(図6)。
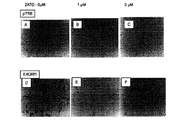
誘導可能なE4orf1安定細胞株における2−ATDを使用したAKT1の化学的阻害
ドキシサイクリン(10)に暴露されるとAd36 E4orf1を発現する3T3−L1細胞を生成した。空ベクター(pTRE)を有し、ドキシサイクリンに応答してE4orf1を発現しない細胞を、対照として使用した。コンフルエントなE4orf1およびpTRE細胞を、脂質生成培地に暴露し、分化を誘導した。さらに、細胞を、0、1または5μΜの2ATD(AKT1シグナリングの特異的阻害剤)で処理した。この培地を、最長9日間、2日おきに補充した。脂質生成分化を、オイルレッドO染色により検証した(図7A〜F)。
誘導可能なE4orf1安定細胞株における2−ATDを使用したAKT1の化学的阻害
コンフルエントなE4orf1およびpTRE細胞を、脂質生成培地に暴露し、分化を誘導した。さらに、細胞を、0または5μΜの2ATD(AKT1シグナリングの特異的阻害剤)で処理した。この培地を、最長9日間、2日おきに補充した。1000ng/mlのドキシサイクリンの存在下でのPPARγおよびアディポネクチン(脂質生成のマーカー)の発現の誘導から24時間後に、基礎およびインスリン刺激2DG取り込みをqRT−PCRにより測定した。予期されるように、E4orf1発現は、PPARγおよびアディポネクチンの発現を有意に増加させ、2−ATD処理は、pTREおよびE4orf1発現細胞におけるPPARγ発現(図8A)、ならびにE4orf1発現細胞(図8B)におけるアディポネクチン発現を有意に低減した。
2−ATDの存在下での基礎およびインスリン刺激グルコース取り込み
E4orf1およびpTRE誘導可能な安定な細胞を、脂質生成培地に暴露して分化を誘導し、0または5μΜの2−ATDで処理した。基礎およびインスリン刺激2DGを、インスリンの存在下または非存在下で、ドキシサイクリン(1000ng/ml)への暴露から24時間後に決定した(*p<0.05)。E4orf1発現は、pTREの場合と比較して、グルコース取り込みを増加させた。2−ATD処理にもかかわらず、E4orf1発現細胞は、有意により高いグルコース取り込みを示し続けた(図9)。
ATDはPPARγタンパク質存在量を阻害する
3T3−L1脂肪細胞をヌルベクターでトランスフェクトして10μΜ TZDに暴露するか、またはE4orf1タンパク質を発現するプラスミドでトランスフェクトした。両方の群を、0、1、または5μΜ ATDに暴露した。ATDは、PPARγタンパク質存在量を低減した。ATD濃度の増加は、TZDの存在下でグルコース取り込みを有意に低減したが、E4orf1でトランスフェクトされた場合有意に低減しなかった(図10)。脂肪細胞におけるグルコース取り込みは、TZDの存在下ではPPARγ依存性であったが、E4orf1により誘導された場合PPARγ依存性ではなかった。したがって、AKT−1シグナリングを下方制御することにより、E4orf1を使用して、それ以上脂質蓄積を増加させることなく脂肪細胞によるグルコース取り込みを向上させることができる。これらのデータは、脂質生成作用のないE4orf1の抗糖尿病薬としての可能性を利用する手法を示している。
1. Lindsley CW. The Akt/PKB family of protein kinases: a review of small molecule inhibitors and progress towards target validation: a 2009 update. Curr Top Med Chem 2010; 10: 458-477.
2. Cho H, Thorvaldsen JL, Chu Q, Feng F, Bimbaum MJ. Akt1/PKBalpha is required for normal growth but dispensable for maintenance of glucose homeostasis in mice. J Biol Chem 2001 ; 276: 38349-38352.
3. Cho H, Mu J, Kim JK, Thorvaldsen JL, Chu Q, Crenshaw EB, 3rd, et al. Insulin resistance and a diabetes mellitus-like syndrome in mice lacking the protein kinase Akt2 (PKB beta). Science 2001 ; 292: 1728-1731.
4. Garofalo RS, Orena SJ, Rafidi K, Torchia AJ, Stock JL, Hildebrandt AL, et al. Severe diabetes, age-dependent loss of adipose tissue, and mild growth deficiency in mice lacking Akt2/PKB beta. J Clin Invest 2003; 112: 197-208.
5. Hill MM, Clark SF, Tucker DF, Birnbaum MJ, James DE, Macaulay SL, A role for protein kinase Bbeta/Akt2 in insulin-stimulated GLUT4 translocation in adipocytes, Mol Cell Biol 1999; 19: 7771 -7781.
6. Easton RM, Cho H, Roovers K, Shineman DW, Mizrahi M, Forman MS, et al. Role for Akt3 / protein kinase Bgamma in attainment of normal brain size. Mol Cell Biol 2005; 25: 1869-1878.
7. Luo J, Manning BD, Cantley LC. Targeting the PI3K-Akt pathway in human cancer: rationale and promise. Cancer Cell 2003; 4: 257-262.
8. Barnett SF, Defeo-Jones D, Fu S, Hancock PJ, Haskell KM, Jones RE, et al. Identification and characterization of pleckstrin-homology-domain-dependent and isoenzyme-specific Akt inhibitors. Biochem J 2005; 385: 399-408.
9. Lindsley CW, Zhao Z, Leister WH, Robinson RG, Barnett SF, Defeo-Jones D, et al. Allosteric Akt (PKB) inhibitors: discovery and SAR of isozyme selective inhibitors. Bioorg Med Chem Lett 2005; 15: 761-764.
Claims (12)
- アデノウイルス36組成物を含む、AKT1阻害剤と組み合わせた使用において個体における血糖コントロールを改善するための医薬組成物であって、前記アデノウイルス36組成物は、配列番号2のアミノ酸配列を有するアデノウイルス36 E4orf1タンパク質またはその機能性変異体を含み、前記機能性変異体は、配列番号2と少なくとも約85%類似したアミノ酸配列を有し、血糖コントロールは、脂質生成の実質的な増加なしに改善される、医薬組成物。
- アデノウイルス36組成物を含む、AKT1阻害剤と組み合わせた使用において個体における血糖コントロールを改善するための医薬組成物であって、前記アデノウイルス36組成物は、配列番号2のアミノ酸配列を有するアデノウイルス36 E4orf1タンパク質またはその機能性変異体を含み、前記機能性変異体は、配列番号2と少なくとも約85%類似したアミノ酸配列を有し、インスリン感受性は、脂質生成の実質的な増加なしに増大される、医薬組成物。
- アデノウイルス36組成物を含む、AKT1阻害剤と組み合わせた使用において個体における糖尿病の症状を治療または予防するための医薬組成物であって、前記アデノウイルス36組成物は、配列番号2のアミノ酸配列を有するアデノウイルス36 E4orf1タンパク質またはその機能性変異体を含み、前記機能性変異体は、配列番号2と少なくとも約85%類似したアミノ酸配列を有し、前記個体の症状は、脂質生成の実質的な増加なしに改善する、医薬組成物。
- 配列番号2のアミノ酸配列を有するアデノウイルス36 E4orf1タンパク質を含むアデノウイルス36組成物およびAKT1阻害剤を含む、個体における血糖コントロールを改善するための医薬組成物。
- アデノウイルス36組成物を含む、AKT1阻害剤と組み合わせた使用において個体における血糖コントロールを改善するための医薬組成物であって、前記アデノウイルス36組成物は、アデノウイルス−36 E4orf1タンパク質またはその機能性変異体をコードする核酸を含み、アデノウイルス−36 E4orf1タンパク質は、配列番号2のアミノ酸配列を有し、前記機能性変異体は、配列番号2と少なくとも約85%類似したアミノ酸配列を有し、血糖コントロールは、脂質生成の実質的な増加なしに改善される、医薬組成物。
- アデノウイルス36組成物を含む、AKT1阻害剤と組み合わせた使用において個体における血糖コントロールを改善するための医薬組成物であって、前記アデノウイルス36組成物は、アデノウイルス−36 E4orf1タンパク質またはその機能性変異体をコードする核酸を含み、アデノウイルス−36 E4orf1タンパク質は、配列番号2のアミノ酸配列を有し、前記機能性変異体は、配列番号2と少なくとも約85%類似したアミノ酸配列を有し、インスリン感受性は、脂質生成の実質的な増加なしに増大される、医薬組成物。
- アデノウイルス36組成物を含む、AKT1阻害剤と組み合わせた使用において個体における糖尿病の症状を治療または予防するための医薬組成物であって、前記アデノウイルス36組成物は、アデノウイルス−36 E4orf1タンパク質またはその機能性変異体をコードする核酸を含み、アデノウイルス−36 E4orf1タンパク質は、配列番号2のアミノ酸配列を有し、前記機能性変異体は、配列番号2と少なくとも約85%類似したアミノ酸配列を有し、前記個体の症状は、脂質生成の実質的な増加なしに改善する、医薬組成物。
- 前記核酸は、アデノウイルス−36 E4orf1タンパク質またはその機能性変異体の発現を可能とする様式で、前記核酸を個体に導入することにより投与される、請求項5〜7のいずれか一項に記載の医薬組成物。
- 前記核酸は、電気穿孔、DEAEデキストラントランスフェクション、リン酸カルシウムトランスフェクション、カチオン性リポソーム融合、原形質体融合、インビボ電場の形成、DNA被覆微粒子銃、組み換え複製欠損ウイルスの注入、相同的組み換え、インビボ遺伝子治療、エキソビボ遺伝子治療、ウイルスベクター、および裸のDNA移入からなる群から選択される方法により導入される、請求項8に記載の医薬組成物。
- 前記核酸は、配列番号1を含む核酸配列を含む、請求項5〜9のいずれか一項に記載の医薬組成物。
- 前記個体は、ヒトである、請求項1〜10のいずれか一項に記載の医薬組成物。
- 前記AKT1阻害剤は、2−アミノチアジアゾール(2−ATD)である、請求項1〜11のいずれか一項に記載の医薬組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261588959P | 2012-01-20 | 2012-01-20 | |
| US61/588,959 | 2012-01-20 | ||
| PCT/US2013/022126 WO2013109876A1 (en) | 2012-01-20 | 2013-01-18 | Enhanced glycemic control using ad36e4orf1 and akt1 inhibitor |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2015505535A JP2015505535A (ja) | 2015-02-23 |
| JP2015505535A5 JP2015505535A5 (ja) | 2016-02-25 |
| JP6175076B2 true JP6175076B2 (ja) | 2017-08-02 |
Family
ID=47664431
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014553448A Expired - Fee Related JP6175076B2 (ja) | 2012-01-20 | 2013-01-18 | Ad36e4orf1およびakt1阻害剤を使用した血糖コントロールの向上 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US9433659B2 (ja) |
| EP (1) | EP2804616B1 (ja) |
| JP (1) | JP6175076B2 (ja) |
| AU (1) | AU2013209580B2 (ja) |
| BR (1) | BR112014017683A2 (ja) |
| CA (1) | CA2865202A1 (ja) |
| HK (1) | HK1204449A1 (ja) |
| WO (1) | WO2013109876A1 (ja) |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8008436B2 (en) * | 2005-11-30 | 2011-08-30 | Wayne State Univeristy | Adenovirus 36 E4 orf 1 gene and protein and their uses |
| AR064010A1 (es) | 2006-12-06 | 2009-03-04 | Merck & Co Inc | Inhibidores de la actividad de la akt |
-
2013
- 2013-01-18 CA CA2865202A patent/CA2865202A1/en not_active Abandoned
- 2013-01-18 WO PCT/US2013/022126 patent/WO2013109876A1/en active Application Filing
- 2013-01-18 JP JP2014553448A patent/JP6175076B2/ja not_active Expired - Fee Related
- 2013-01-18 BR BR112014017683A patent/BR112014017683A2/pt not_active IP Right Cessation
- 2013-01-18 EP EP13702690.2A patent/EP2804616B1/en not_active Not-in-force
- 2013-01-18 AU AU2013209580A patent/AU2013209580B2/en not_active Ceased
- 2013-01-18 US US14/370,317 patent/US9433659B2/en active Active
-
2015
- 2015-05-26 HK HK15105002.8A patent/HK1204449A1/xx not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| HK1204449A1 (en) | 2015-11-20 |
| AU2013209580B2 (en) | 2017-11-30 |
| EP2804616B1 (en) | 2018-07-18 |
| US20150038412A1 (en) | 2015-02-05 |
| CA2865202A1 (en) | 2013-07-25 |
| WO2013109876A1 (en) | 2013-07-25 |
| BR112014017683A2 (pt) | 2017-06-27 |
| AU2013209580A1 (en) | 2014-08-07 |
| US9433659B2 (en) | 2016-09-06 |
| EP2804616A1 (en) | 2014-11-26 |
| JP2015505535A (ja) | 2015-02-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11034962B2 (en) | Inhibitors of CACNA1A/ALPHA1A subunit internal ribosomal entry site (IRES) and methods of treating spinocerebellar ataxia type 6 | |
| EP1828245A2 (en) | Igf-1 isoforms | |
| WO2005074521A2 (en) | C-TERMINAL p53 PALINDROMIC PEPTIDE THAT INDUCES APOPTOSIS OF CELLS WITH ABERRANT p53 AND USES THEREOF | |
| US20240261369A1 (en) | Methods for regulating free fatty acid flux using fat specific protein 27 (fsp27) compositions | |
| WO2018089901A2 (en) | Exosome delivery system | |
| Zhong et al. | Ciliary neurotrophic factor overexpression protects the heart against pathological remodelling in angiotensin II-infused mice | |
| US20230338467A1 (en) | Methods and compositions for treating cardiovascular diseases using fat specific protein 27 (fsp27) compositions | |
| JP6175076B2 (ja) | Ad36e4orf1およびakt1阻害剤を使用した血糖コントロールの向上 | |
| Qi et al. | CSF2RB overexpression promotes the protective effects of mesenchymal stromal cells against ischemic heart injury | |
| US20090214637A1 (en) | Novel Gene Therapy Approach For Treating The Metabolic Disorder Obesity | |
| JP2013531681A (ja) | 非アルコール性脂肪肝疾患の予防および治療のためのアデノウイルスad36e4orf1タンパク質 | |
| KR20200052294A (ko) | Setd2의 저해에 의한 암의 치료 방법 | |
| WO2023053123A1 (en) | A method for treating a disease | |
| CN117083381A (zh) | 用于靶向炎性细胞或活化细胞和治疗或改善炎性病症和疼痛的组合物和方法 | |
| US20100303790A1 (en) | Use of biliverdin reductase (bvr) and bvr peptide fragments to treat coronary disorders | |
| JP2022537928A (ja) | インスリン欠乏状態の治療に使用するための組成物 | |
| KR20100005120A (ko) | 클러스터린을 이용한 체중 조절 장애 관련 질환의 진단, 예방 또는 치료 방법 | |
| KR20060130406A (ko) | Ras 신호전달경로를 표적으로 하는 혈관신생, 세포증식및 세포전이 억제제 | |
| JP2020527132A (ja) | ミエリン障害を治療するための組成物および方法 | |
| JP7525578B2 (ja) | C/EBPα小分子活性化RNA組成物 | |
| WO2024175111A2 (en) | Small interfering rna targeting hbv and uses thereof | |
| CN117959442A (zh) | 预防或治疗肺纤维化的试剂及应用 | |
| US11390854B2 (en) | Human porphobilinogen deaminase derived proteins and polynucleotides and uses thereof | |
| WO2023152369A1 (en) | Nucleic acid mir-9 inhibitor for the treatment of cystic fibrosis | |
| US20200009227A1 (en) | Compositions and methods of controlling expression of thermogenin (ucp-1) in skeletal muscles |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20151229 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20151229 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20161121 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170217 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170418 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20170622 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20170707 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6175076 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |