JP5931442B2 - 操作された抗IL−23p19抗体の凍結乾燥製剤 - Google Patents
操作された抗IL−23p19抗体の凍結乾燥製剤 Download PDFInfo
- Publication number
- JP5931442B2 JP5931442B2 JP2011525134A JP2011525134A JP5931442B2 JP 5931442 B2 JP5931442 B2 JP 5931442B2 JP 2011525134 A JP2011525134 A JP 2011525134A JP 2011525134 A JP2011525134 A JP 2011525134A JP 5931442 B2 JP5931442 B2 JP 5931442B2
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- seq
- antigen
- sequence
- binding fragment
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/19—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles lyophilised, i.e. freeze-dried, solutions or dispersions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39591—Stabilisation, fragmentation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/12—Carboxylic acids; Salts or anhydrides thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/10—Antimycotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Epidemiology (AREA)
- Biochemistry (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Molecular Biology (AREA)
- Oncology (AREA)
- Diabetes (AREA)
- Communicable Diseases (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Rheumatology (AREA)
- Biophysics (AREA)
- Pain & Pain Management (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Dermatology (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Endocrinology (AREA)
- Transplantation (AREA)
- Virology (AREA)
- Ophthalmology & Optometry (AREA)
- Physical Education & Sports Medicine (AREA)
Description
本発明の好ましい実施形態では、例えば以下が提供される:
(項目1)
a)抗ヒトIL−23p19抗体またはその抗原結合断片、
b)クエン酸ナトリウム、
c)ポリソルベート80、および
d)ショ糖
を含む、抗ヒトIL−23p19抗体またはその抗原結合断片の凍結乾燥製剤。
(項目2)
再構成された場合に4.4と5.2との間のpHを有する、項目1に記載の凍結乾燥製剤。
(項目3)
前記抗体またはその抗原結合断片の再構成を100mg/mLの濃度で可能にする、項目1に記載の凍結乾燥製剤。
(項目4)
ポリソルベート80が、前記抗体またはその抗原結合断片と比較しておよそ0.2%の重量比で存在する、項目1に記載の凍結乾燥製剤。
(項目5)
ショ糖が、前記抗体またはその抗原結合断片と比較しておよそ70%の重量比で存在する、項目1に記載の凍結乾燥製剤。
(項目6)
a)5〜25mg/mL抗ヒトIL−23p19抗体またはその抗原結合断片、
b)約50mMショ糖、
c)約0.05mg/mLポリソルベート80、および
d)約2.5mMクエン酸バッファーpH4.4〜5.2
を含む水溶液を凍結乾燥することによって作製される、抗ヒトIL−23p19抗体またはその抗原結合断片の凍結乾燥医薬製剤。
(項目7)
前記抗ヒトIL−23p19抗体またはその抗原結合断片が前記水溶液中に約25mg/mLで存在する、項目6に記載の凍結乾燥医薬製剤。
(項目8)
前記水溶液が約4.8のpHを有する、項目6に記載の凍結乾燥医薬製剤。
(項目9)
再構成された場合に
a)25〜100mg/mL抗ヒトIL−23p19抗体またはその抗原結合断片、
b)約200mMショ糖、
c)約0.2mg/mLポリソルベート80、および
d)約10mMクエン酸バッファーpH4.4〜5.2
を含む、抗ヒトIL−23p19抗体またはその抗原結合断片の凍結乾燥医薬製剤。
(項目10)
前記抗ヒトIL−23p19抗体またはその抗原結合断片が前記再構成溶液中に約100mg/mLで存在する、項目9に記載の凍結乾燥医薬製剤。
(項目11)
前記再構成溶液が約4.8のpHを有する、項目9に記載の凍結乾燥医薬製剤。
(項目12)
抗体またはその抗原結合断片が、配列番号32〜46からなる群から選択される3つのCDR配列を含む軽鎖を含む、項目1、6または9のいずれかに記載の凍結乾燥製剤。
(項目13)
抗体またはその抗原結合断片が、配列番号15〜31からなる群から選択される3つのCDR配列を含む重鎖を含む、項目1、6または9のいずれかに記載の凍結乾燥製剤。
(項目14)
抗体またはその抗原結合断片が
i)配列番号32〜46からなる群から選択される3つのCDR配列を含む軽鎖、およびii)配列番号15〜31からなる群から選択される3つのCDR配列を含む重鎖
を含む、項目1、6または9のいずれかに記載の凍結乾燥製剤。
(項目15)
抗体またはその抗原結合断片が、配列番号14の残基1〜108を含む軽鎖可変ドメインを含む、項目1、6または9のいずれかに記載の凍結乾燥製剤。
(項目16)
抗体またはその抗原結合断片が、配列番号6〜8の残基1〜116からなる群から選択される配列を含む重鎖可変ドメインを含む、項目1、6または9のいずれかに記載の凍結乾燥製剤。
(項目17)
抗体またはその抗原結合断片が
i)配列番号14を含む軽鎖、および
ii)配列番号6〜8からなる群から選択される配列を含む重鎖
を含む、項目1、6または9のいずれかに記載の凍結乾燥製剤。
「増殖活性」は、例えば正常な細胞分裂ならびに癌、腫瘍、異形成、細胞形質転換、転移および新脈管形成を促進する、それらに必要であるまたはそれらに特異的に関連する活性を包含する。
本発明の凍結乾燥製剤は、一般に本明細書において開示するものなどのヒトまたはヒト化抗ヒトIL−23p19抗体を含む抗体を用いて使用されうる。抗ヒトIL−23p19抗体13B8のヒト化形態が提供される。抗体13B8を発現しているハイブリドーマは、ブダペスト条約に従ってAmerican Type Culture Collection(ATCC−Manassas、Virginia、USA)に2006年8月17日に受託番号PTA−7803で寄託された。本明細書において開示する他の抗体のヒト化形態は、ヒト化13B8抗体について開示されたヒトフレームワークを置換することによって構築されうる。ヒト化抗体13B8の一部として本明細書において開示されるヒトフレームワークでの置換は、13B8に類似するCDR配列を有する抗体について最も適している。
皮膚、関節、CNSの炎症性疾患および増殖性障害は、類似する免疫応答を誘発し、したがってIL−23の封鎖は、全身性感染症と闘う宿主の能力を含めることなく、これらの免疫介在性炎症性障害の抑制を提供するはずであろ。IL−23に拮抗することは、炎症性腸疾患、クローン病、潰瘍性大腸炎、関節リウマチ、乾癬性関節炎、乾癬、強直性脊椎炎およびアトピー性皮膚炎に伴う炎症を軽減するはずであろ。IL−23阻害剤の使用は、増殖性障害、例えば癌、および自己免疫障害、例えば多発性硬化症、I型糖尿病ならびにSLEの抑制も提供する。これらの種々の障害におけるIL−23の記載は、以下の公開されたPCT出願:WO04/081190、WO04/071517、WO00/53631およびWO01/18051において見出されうる。IL−23阻害剤は、細菌性、マイコバクテリア性、ウイルス性および真菌性感染症などの慢性感染症を含む感染症の治療における使用も見出しうる。
治療用タンパク質の凍結乾燥製剤は、いくつかの有利点を提供する。一般に凍結乾燥製剤は、溶液製剤よりも良好な化学的安定性を示し、それにより増大した半減期を示す。凍結乾燥製剤は、投与または投薬の経路などの臨床的要因に応じてさまざまな濃度で再構成もされうる。例えば凍結乾燥製剤は、皮下投与用に必要な場合は高濃度で(すなわち少容量で)、または静脈内に投与される場合は、低濃度で再構成されうる。特定の被験体に対して多量の投薬が要求される場合に、具体的には、注射容量が最小化されなければならない皮下に投与される場合にも高濃度が必要であり得る。そのような1つの凍結乾燥抗体製剤は、その全体が参照により本明細書に組み込まれる米国特許第6,267,958号において開示されている。他の治療用タンパク質の凍結乾燥製剤は、その全体が参照により本明細書に組み込まれる米国特許第7,247,707号において開示されている。
本発明は、例えば中枢神経系、末梢神経系および消化管ならびに自己免疫障害および増殖性障害の、炎症性障害および状態の治療に使用するための抗IL−23抗体(およびその断片)の凍結乾燥製剤を提供する。
ヒト化抗IL−23p19抗体の凍結乾燥製剤
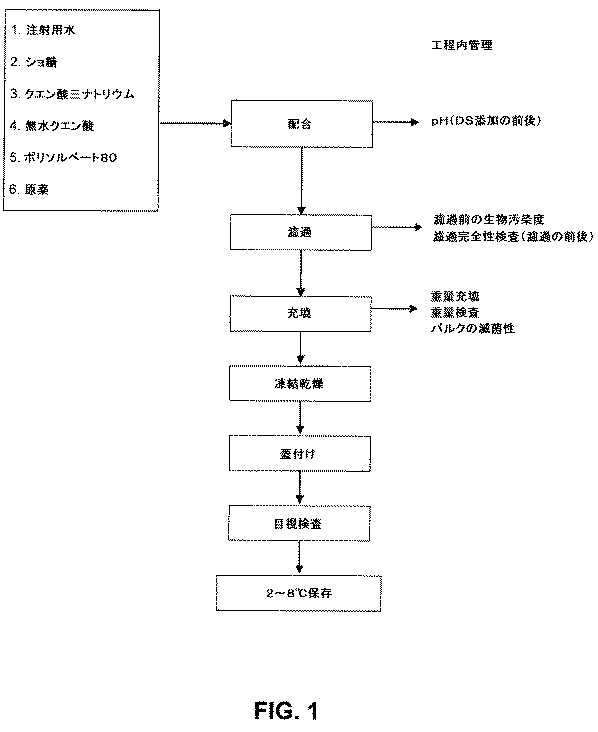
ヒト化抗ヒトIL−23p19抗体の凍結乾燥製剤は、以下のとおり調製される。ヒト化抗IL−23p19抗体についてのバッチ処方は表3に提供されている。ヒト化抗IL−23p19抗体の最終濃度は25mg/mLである。このバッチ製剤は、以下の表4を参照して論じたとおり1バイアル当たり50mg単位の凍結乾燥物を調製するために使用されうる。植物原料由来のポリソルベート80が使用される。追加的クエン酸または水酸化ナトリウムは、pHをおよそ4.8(±0.2)の所望の値に調整するために添加されうる。4.8のpHは、抗体がpH5.5〜5.6のクエン酸バッファーから再構成される際の乳光を減少させるために使用される。成分は、注射用滅菌水(WFI)で最終容量40Lにされる。それに対応してより小さなロットも、当然ながら、表3に列挙する量を比例的に減少させて調製されうる。
ヒト化抗IL−23p19抗体の凍結乾燥製剤の安定性検査
図2〜7は、種々の保存条件下でのヒト化抗ヒトIL−23p19抗体の凍結乾燥製剤の安定性検査の結果を提供する。いくつかのバイアルを、図に示すとおり、直立および倒立の両方の配置で保存した。下により詳細に論じるとおり、図2〜4は、pH5.5(クエン酸バッファー)で凍結乾燥した抗体について少なくとも18カ月間の安定性を示しており、図5〜7は、pH4.8(クエン酸バッファー)で凍結乾燥した抗体について少なくとも12カ月間の安定性を示している、ここで18カ月間および12カ月間は、実験的に決定された安定性の終点ではなく示された最も長い時点である。
Claims (16)
- a)5〜25mg/mL抗ヒトIL−23p19抗体またはその抗原結合断片、
b)50mMショ糖、
c)0.05mg/mLポリソルベート80、および
d)pH4.4〜5.2の2.5mMクエン酸バッファー
を含む水溶液を凍結乾燥することによって作製される、抗ヒトIL−23p19抗体またはその抗原結合断片の凍結乾燥医薬製剤であって、
該抗体またはその抗原結合断片が
i)配列番号36の配列を含むCDRL1、配列番号41の配列を含むCDRL2および配列番号46の配列を含むCDRL3を含む軽鎖、および
ii)配列番号19の配列を含むCDRH1、配列番号25の配列を含むCDRH2および配列番号31の配列を含むCDRH3を含む重鎖
を含む、前記凍結乾燥医薬製剤。 - 前記抗ヒトIL−23p19抗体またはその抗原結合断片が前記水溶液中に25mg/mLで存在する、請求項1に記載の凍結乾燥医薬製剤。
- 前記水溶液が4.8のpHを有する、請求項1に記載の凍結乾燥医薬製剤。
- 再構成された場合に
a)25〜100mg/mL抗ヒトIL−23p19抗体またはその抗原結合断片、
b)200mMショ糖、
c)0.2mg/mLポリソルベート80、および
d)pH4.4〜5.2の10mMクエン酸バッファー
を含む、抗ヒトIL−23p19抗体またはその抗原結合断片の凍結乾燥医薬製剤であって、該抗体またはその抗原結合断片が
iii)配列番号36の配列を含むCDRL1、配列番号41の配列を含むCDRL2および配列番号46の配列を含むCDRL3を含む軽鎖、および
iv)配列番号19の配列を含むCDRH1、配列番号25の配列を含むCDRH2および配列番号31の配列を含むCDRH3を含む、前記凍結乾燥医薬製剤。 - 前記抗ヒトIL−23p19抗体またはその抗原結合断片が前記再構成された溶液中に100mg/mLで存在する、請求項4に記載の凍結乾燥医薬製剤。
- 前記再構成された溶液が4.8のpHを有する、請求項4に記載の凍結乾燥医薬製剤。
- a)抗ヒトIL−23p19抗体またはその抗原結合断片、
b)クエン酸ナトリウム、
c)ポリソルベート80、および
d)ショ糖
を含む、抗ヒトIL−23p19抗体またはその抗原結合断片の凍結乾燥製剤であって
該抗体またはその抗原結合断片が
i)配列番号14を含む軽鎖、および
ii)配列番号6〜8からなる群から選択される配列を含む重鎖
を含む、前記凍結乾燥製剤。 - 再構成された場合に4.4と5.2との間のpHを有する、請求項7に記載の凍結乾燥製剤。
- 100mg/mLの濃度での前記抗体またはその抗原結合断片の再構成を可能にする、請求項7に記載の凍結乾燥製剤。
- ポリソルベート80が、前記抗体またはその抗原結合断片と比較して0.2%の重量比で存在する、請求項7に記載の凍結乾燥製剤。
- ショ糖が、前記抗体またはその抗原結合断片と比較して70%の重量比で存在する、請求項7に記載の凍結乾燥製剤。
- 抗体またはその抗原結合断片が、CDRL1、CDRL2およびCDRL3を含む軽鎖を含み、CDRL1が配列番号36の配列を含み、CDRL2が配列番号41の配列を含み、CDRL3が配列番号46の配列を含む、請求項1、4または7のいずれかに記載の凍結乾燥製剤。
- 抗体またはその抗原結合断片が、CDRH1、CDRH2およびCDRH3を含む重鎖を含み、CDRH1が配列番号19の配列を含み、CDRH2が配列番号25の配列を含み、CDRH3が配列番号31の配列を含む、請求項1、4または7のいずれかに記載の凍結乾燥製剤。
- 抗体またはその抗原結合断片が、配列番号14の残基1〜108を含む軽鎖可変ドメインを含む、請求項1、4または7のいずれかに記載の凍結乾燥製剤。
- 抗体またはその抗原結合断片が、配列番号6〜8の残基1〜116からなる群から選択される配列を含む重鎖可変ドメインを含む、請求項1、4または7のいずれかに記載の凍結乾燥製剤。
- 抗体またはその抗原結合断片が
i)配列番号14を含む軽鎖、および
ii)配列番号6〜8からなる群から選択される配列を含む重鎖
を含む、請求項1または4に記載の凍結乾燥製剤。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US9232608P | 2008-08-27 | 2008-08-27 | |
| US61/092,326 | 2008-08-27 | ||
| PCT/US2009/054842 WO2010027766A1 (en) | 2008-08-27 | 2009-08-25 | Lyophilized formulatons of engineered anti-il-23p19 antibodies |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015184258A Division JP2016028086A (ja) | 2008-08-27 | 2015-09-17 | 操作された抗IL−23p19抗体の凍結乾燥製剤 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2012501332A JP2012501332A (ja) | 2012-01-19 |
| JP2012501332A5 JP2012501332A5 (ja) | 2012-10-04 |
| JP5931442B2 true JP5931442B2 (ja) | 2016-06-08 |
Family
ID=41495339
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011525134A Active JP5931442B2 (ja) | 2008-08-27 | 2009-08-25 | 操作された抗IL−23p19抗体の凍結乾燥製剤 |
| JP2015184258A Pending JP2016028086A (ja) | 2008-08-27 | 2015-09-17 | 操作された抗IL−23p19抗体の凍結乾燥製剤 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015184258A Pending JP2016028086A (ja) | 2008-08-27 | 2015-09-17 | 操作された抗IL−23p19抗体の凍結乾燥製剤 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US8263748B2 (ja) |
| EP (1) | EP2331078B1 (ja) |
| JP (2) | JP5931442B2 (ja) |
| CN (1) | CN102202655B (ja) |
| AU (1) | AU2009288419B2 (ja) |
| CA (1) | CA2734919C (ja) |
| MX (1) | MX2011002159A (ja) |
| WO (1) | WO2010027766A1 (ja) |
Families Citing this family (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JO3244B1 (ar) | 2009-10-26 | 2018-03-08 | Amgen Inc | بروتينات ربط مستضادات il – 23 البشرية |
| EP2596022A4 (en) * | 2010-07-20 | 2014-11-05 | Cephalon Australia Pty Ltd | SPECIFIC ANTIBODIES ANTI-HETERODIMER IL-23 |
| PE20141162A1 (es) | 2010-11-04 | 2014-09-18 | Boehringer Ingelheim Int | Anticuerpos anti-il-23 |
| HK1198689A1 (en) | 2011-10-25 | 2015-05-29 | Prothena Biosciences Limited | Antibody formulations and methods |
| EP2798077A2 (en) | 2011-12-31 | 2014-11-05 | Allergan, Inc. | Highly Sensitive Cell-Based Assay to Detect the Presence of Active Botulinum Neurotoxin Serotype-A |
| WO2013123114A2 (en) * | 2012-02-16 | 2013-08-22 | Santarus, Inc. | Antibody formulations |
| KR102124758B1 (ko) * | 2012-05-03 | 2020-06-19 | 베링거 인겔하임 인터내셔날 게엠베하 | 항-il-23p19 항체 |
| CZ2012829A3 (cs) | 2012-11-23 | 2014-06-11 | Biotechnologický Ústav Av Čr, V.V.I. | Polypeptidy pro léčbu autoimunitních chorob založenou na blokaci receptoru pro lidský cytokin IL-23 |
| UA117466C2 (uk) * | 2012-12-13 | 2018-08-10 | Мерк Шарп Енд Доме Корп. | СТАБІЛЬНИЙ СКЛАД У ВИГЛЯДІ РОЗЧИНУ АНТИТІЛА ДО IL-23p19 |
| HK1219425A1 (zh) | 2013-03-15 | 2017-04-07 | Amgen Inc. | 使用抗il-23抗体治疗银屑病的方法 |
| CN105307675A (zh) | 2013-03-15 | 2016-02-03 | 美国安进公司 | 使用抗il23抗体治疗克罗恩氏病的方法 |
| WO2016014775A1 (en) | 2014-07-24 | 2016-01-28 | Boehringer Ingelheim International Gmbh | Biomarkers useful in the treatment of il-23a related diseases |
| UA123624C2 (uk) | 2014-09-03 | 2021-05-05 | Бьорінґер Інґельхайм Інтернаціональ Ґмбх | Сполука, специфічна до іл-23а та фнп-альфа, та її застосування |
| AR102417A1 (es) | 2014-11-05 | 2017-03-01 | Lilly Co Eli | Anticuerpos biespecíficos anti-tnf- / anti-il-23 |
| SG11201705728RA (en) | 2015-02-04 | 2017-08-30 | Boehringer Ingelheim Int | Methods of treating inflammatory diseases |
| JP6909208B2 (ja) | 2015-09-17 | 2021-07-28 | アムジェン インコーポレイテッド | Il23経路バイオマーカーを使用するil23アンタゴニストに対する臨床応答の予測 |
| HK1255922A1 (zh) | 2015-11-04 | 2019-09-06 | Astrazeneca Ab | 二肽基肽酶-4和骨膜素作为嗜酸性粒细胞疾病中嗜酸性粒细胞靶向治疗药物临床反应的预测因子 |
| AU2016379157A1 (en) | 2015-12-22 | 2018-06-21 | Amgen Inc. | CCL20 as a predictor of clinical response to IL23-antagonists |
| US11021275B2 (en) | 2016-01-22 | 2021-06-01 | Baxter International Inc. | Method and machine for producing sterile solution product bags |
| SI3405161T1 (sl) | 2016-01-22 | 2020-03-31 | Baxter International Inc. | Vrečka za sterilno raztopino |
| WO2018124277A1 (ja) | 2016-12-28 | 2018-07-05 | Jcrファーマ株式会社 | 凍結乾燥製剤 |
| US11845798B2 (en) | 2017-05-02 | 2023-12-19 | Merck Sharp & Dohme Llc | Formulations of anti-LAG3 antibodies and co-formulations of anti-LAG3 antibodies and anti-PD-1 antibodies |
| JOP20190260A1 (ar) | 2017-05-02 | 2019-10-31 | Merck Sharp & Dohme | صيغ ثابتة لأجسام مضادة لمستقبل الموت المبرمج 1 (pd-1) وطرق استخدامها |
| EA202190197A1 (ru) | 2018-07-13 | 2021-04-26 | Астразенека Коллаборэйшн Венчерз, Ллс | Лечение язвенного колита с помощью бразикумаба |
| KR20210089215A (ko) | 2018-11-07 | 2021-07-15 | 머크 샤프 앤드 돔 코포레이션 | 항-lag3 항체 및 항-pd-1 항체의 공동-제제 |
| US12098195B2 (en) | 2018-11-27 | 2024-09-24 | Innovent Biologics (Suzhou) Co., Ltd. | Anti-IL-23p19 antibody and use thereof in treating diseases |
| KR102735988B1 (ko) | 2019-02-18 | 2024-12-03 | 일라이 릴리 앤드 캄파니 | 치료 항체 제제 |
| MX2021012652A (es) * | 2019-04-15 | 2022-01-24 | Sun Pharmaceutical Ind Ltd | Metodos para el tratamiento de sujetos con artritis psoriasica. |
| TW202535466A (zh) * | 2019-09-09 | 2025-09-16 | 德商百靈佳殷格翰國際股份有限公司 | 抗-il-23p19抗體調配物 |
| GB202107153D0 (en) * | 2021-05-19 | 2021-06-30 | UCB Biopharma SRL | Method for filling vials containing liquid drug products |
| CN115785267B (zh) * | 2021-09-10 | 2023-12-15 | 三优生物医药(上海)有限公司 | 一种靶向IL-23p19的抗体或其抗原结合片段及其应用 |
Family Cites Families (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5859205A (en) * | 1989-12-21 | 1999-01-12 | Celltech Limited | Humanised antibodies |
| US6685940B2 (en) * | 1995-07-27 | 2004-02-03 | Genentech, Inc. | Protein formulation |
| US6267958B1 (en) * | 1995-07-27 | 2001-07-31 | Genentech, Inc. | Protein formulation |
| US6171586B1 (en) * | 1997-06-13 | 2001-01-09 | Genentech, Inc. | Antibody formulation |
| US6991790B1 (en) * | 1997-06-13 | 2006-01-31 | Genentech, Inc. | Antibody formulation |
| DK1820516T3 (da) * | 1999-02-22 | 2013-10-28 | Univ Connecticut | Nye albuminfrie faktor VIII-præparater |
| JP4317010B2 (ja) * | 2001-07-25 | 2009-08-19 | ピーディーエル バイオファーマ,インコーポレイティド | IgG抗体の安定な凍結乾燥医薬製剤 |
| EP1592440A4 (en) | 2003-02-10 | 2007-07-11 | Elan Pharm Inc | IMMUNOGLOBULIN PREPARATION AND METHOD OF PRODUCING THE SAME |
| MX342007B (es) * | 2003-05-14 | 2016-09-09 | Immunogen Inc | Composicion de farmaco conjugado. |
| ATE518888T1 (de) * | 2003-10-09 | 2011-08-15 | Chugai Pharmaceutical Co Ltd | Stabilisierte lösung mit hoher igm-konzentration |
| NZ564098A (en) * | 2005-06-15 | 2010-04-30 | Schering Corp | Anti-IGF1R antibody formulations |
| PT1896073E (pt) | 2005-06-30 | 2013-05-28 | Janssen Biotech Inc | Composições, métodos e aplicações de anticorpos anti-il-23 |
| ES2347690T3 (es) | 2005-08-25 | 2010-11-03 | Eli Lilly And Company | Anticuerpos anti-il-23. |
| ME02705B (me) * | 2005-08-31 | 2017-10-20 | Merck Sharp & Dohme | Inženjerisana anti-il-23 antitela |
| PT2548577T (pt) * | 2005-12-29 | 2017-05-29 | Janssen Biotech Inc | Anticorpos humanos anti-il-23, composições, métodos e usos |
| EP2639242A3 (en) * | 2006-03-06 | 2013-10-16 | MedImmune, Inc. | Humanized anti-CD22 antibodies and their use in treatment of oncology, transplantation and autoimmune disease |
| JP2009540018A (ja) | 2006-06-13 | 2009-11-19 | ザイモジェネティクス, インコーポレイテッド | Il−17およびil−23アンタゴニストならびにその使用方法 |
| CA2675233A1 (en) * | 2007-01-16 | 2008-07-24 | Abbott Laboratories | Methods for treating psoriasis |
| SI2426144T1 (sl) | 2007-02-23 | 2019-02-28 | Merck Sharp & Dohme Corp. | Umetno proizvedena anti-IL23P19 antitelesa |
| CN101663320A (zh) | 2007-02-23 | 2010-03-03 | 先灵公司 | 工程改造的抗IL-23p19抗体 |
| AR068723A1 (es) | 2007-10-05 | 2009-12-02 | Glaxo Group Ltd | Proteina que se une a antigenos que se une a il-23 humana y sus usos |
-
2009
- 2009-08-25 EP EP09791868A patent/EP2331078B1/en active Active
- 2009-08-25 CN CN2009801428023A patent/CN102202655B/zh active Active
- 2009-08-25 US US13/061,076 patent/US8263748B2/en active Active
- 2009-08-25 JP JP2011525134A patent/JP5931442B2/ja active Active
- 2009-08-25 AU AU2009288419A patent/AU2009288419B2/en active Active
- 2009-08-25 CA CA2734919A patent/CA2734919C/en active Active
- 2009-08-25 MX MX2011002159A patent/MX2011002159A/es active IP Right Grant
- 2009-08-25 WO PCT/US2009/054842 patent/WO2010027766A1/en not_active Ceased
-
2015
- 2015-09-17 JP JP2015184258A patent/JP2016028086A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| JP2016028086A (ja) | 2016-02-25 |
| EP2331078B1 (en) | 2012-09-19 |
| CA2734919A1 (en) | 2010-03-11 |
| AU2009288419B2 (en) | 2015-08-06 |
| CN102202655A (zh) | 2011-09-28 |
| US8263748B2 (en) | 2012-09-11 |
| MX2011002159A (es) | 2011-03-29 |
| US20110229490A1 (en) | 2011-09-22 |
| EP2331078A1 (en) | 2011-06-15 |
| WO2010027766A1 (en) | 2010-03-11 |
| JP2012501332A (ja) | 2012-01-19 |
| AU2009288419A1 (en) | 2010-03-11 |
| CA2734919C (en) | 2016-08-16 |
| CN102202655B (zh) | 2013-06-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5931442B2 (ja) | 操作された抗IL−23p19抗体の凍結乾燥製剤 | |
| US20240239884A1 (en) | SOLUTION FORMULATIONS OF ENGINEERED ANTI-IL-23p19 ANTIBODIES | |
| CN111315411B (zh) | 高浓度抗c5抗体制剂 | |
| CN109078182B (zh) | 抗体制剂 | |
| MX2014013434A (es) | Formulaciones liofilizadas y acuosas de anticuerpo anti-cd40. | |
| CN113194925B (zh) | 抗体制剂 | |
| US20230173069A1 (en) | Formulation comprising anti-il-23p19 antibody, method for preparing same and use thereof | |
| US20190010224A1 (en) | Formulations of engineered anti-il-10 antibodies | |
| US20240025978A1 (en) | Methods for treating complement-mediated diseases | |
| EP3939611A1 (en) | Pharmaceutical composition containing antibody against il-5 and use thereof | |
| HK40000750B (en) | Antibody formulations | |
| HK40000750A (en) | Antibody formulations | |
| HK1261758A1 (en) | Antibody formulations | |
| HK1215194B (en) | Solution formulations of engineered anti-il-23p19 antibodies | |
| HK1218128B (zh) | 改善药代动力学的具有跨ph范围差异结合的抗tfpi抗体变体 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120814 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20120814 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140130 |
|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20140213 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140428 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140924 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20141210 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20141217 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20150115 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20150519 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150917 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20151105 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20151111 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20151215 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160202 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20160419 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20160427 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5931442 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S201 | Request for registration of exclusive licence |
Free format text: JAPANESE INTERMEDIATE CODE: R314201 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313111 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |