JP5855572B2 - サンプル圧縮機を用いた複数面の側方流動アッセイ - Google Patents
サンプル圧縮機を用いた複数面の側方流動アッセイ Download PDFInfo
- Publication number
- JP5855572B2 JP5855572B2 JP2012542210A JP2012542210A JP5855572B2 JP 5855572 B2 JP5855572 B2 JP 5855572B2 JP 2012542210 A JP2012542210 A JP 2012542210A JP 2012542210 A JP2012542210 A JP 2012542210A JP 5855572 B2 JP5855572 B2 JP 5855572B2
- Authority
- JP
- Japan
- Prior art keywords
- sample
- binding partner
- analyte
- lateral flow
- test strip
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 238000003556 assay Methods 0.000 title claims description 38
- 238000009739 binding Methods 0.000 claims description 484
- 230000027455 binding Effects 0.000 claims description 481
- 238000012360 testing method Methods 0.000 claims description 448
- 239000012491 analyte Substances 0.000 claims description 278
- 239000002131 composite material Substances 0.000 claims description 42
- 238000000034 method Methods 0.000 claims description 39
- 238000004587 chromatography analysis Methods 0.000 claims description 25
- 238000012546 transfer Methods 0.000 claims description 18
- 238000007906 compression Methods 0.000 claims description 17
- 230000006835 compression Effects 0.000 claims description 16
- 230000009969 flowable effect Effects 0.000 claims description 12
- 230000003993 interaction Effects 0.000 claims description 6
- 238000003825 pressing Methods 0.000 claims description 6
- 230000008569 process Effects 0.000 claims description 4
- 230000015572 biosynthetic process Effects 0.000 claims description 2
- 239000000523 sample Substances 0.000 description 777
- 102000004190 Enzymes Human genes 0.000 description 91
- 108090000790 Enzymes Proteins 0.000 description 91
- 229940088598 enzyme Drugs 0.000 description 91
- 238000001514 detection method Methods 0.000 description 80
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical group N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 55
- 241000283973 Oryctolagus cuniculus Species 0.000 description 53
- 238000011144 upstream manufacturing Methods 0.000 description 53
- 239000000463 material Substances 0.000 description 52
- 239000011324 bead Substances 0.000 description 50
- 241000700584 Simplexvirus Species 0.000 description 40
- 238000004458 analytical method Methods 0.000 description 38
- 239000004816 latex Substances 0.000 description 38
- 229920000126 latex Polymers 0.000 description 38
- 239000003153 chemical reaction reagent Substances 0.000 description 37
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 34
- 229910052709 silver Inorganic materials 0.000 description 34
- 239000004332 silver Substances 0.000 description 34
- GGCZERPQGJTIQP-UHFFFAOYSA-N sodium;9,10-dioxoanthracene-2-sulfonic acid Chemical compound [Na+].C1=CC=C2C(=O)C3=CC(S(=O)(=O)O)=CC=C3C(=O)C2=C1 GGCZERPQGJTIQP-UHFFFAOYSA-N 0.000 description 30
- 239000000872 buffer Substances 0.000 description 29
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 28
- 229960002685 biotin Drugs 0.000 description 27
- 235000020958 biotin Nutrition 0.000 description 27
- 239000011616 biotin Substances 0.000 description 27
- 239000000427 antigen Substances 0.000 description 26
- 108091007433 antigens Proteins 0.000 description 26
- 102000036639 antigens Human genes 0.000 description 26
- 230000033001 locomotion Effects 0.000 description 26
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 24
- 108010087904 neutravidin Chemical group 0.000 description 23
- 239000000758 substrate Substances 0.000 description 23
- 108090001008 Avidin Chemical group 0.000 description 22
- 239000012528 membrane Substances 0.000 description 22
- 239000012146 running buffer Substances 0.000 description 22
- 239000002105 nanoparticle Substances 0.000 description 21
- 239000003795 chemical substances by application Substances 0.000 description 20
- 125000003147 glycosyl group Chemical group 0.000 description 20
- 239000000835 fiber Substances 0.000 description 19
- 239000012530 fluid Substances 0.000 description 19
- 150000007523 nucleic acids Chemical class 0.000 description 19
- 239000002904 solvent Substances 0.000 description 19
- 239000007788 liquid Substances 0.000 description 18
- 108020004707 nucleic acids Proteins 0.000 description 18
- 102000039446 nucleic acids Human genes 0.000 description 18
- 108020003175 receptors Proteins 0.000 description 18
- 102000005962 receptors Human genes 0.000 description 18
- 230000003321 amplification Effects 0.000 description 17
- 238000003199 nucleic acid amplification method Methods 0.000 description 17
- 108090001090 Lectins Chemical group 0.000 description 16
- 102000004856 Lectins Human genes 0.000 description 16
- 206010070834 Sensitisation Diseases 0.000 description 16
- 239000002250 absorbent Substances 0.000 description 16
- 230000002745 absorbent Effects 0.000 description 16
- 230000008021 deposition Effects 0.000 description 16
- 238000003018 immunoassay Methods 0.000 description 16
- 239000002523 lectin Chemical group 0.000 description 16
- 230000002934 lysing effect Effects 0.000 description 16
- 230000008313 sensitization Effects 0.000 description 16
- 239000000020 Nitrocellulose Substances 0.000 description 15
- 239000003446 ligand Substances 0.000 description 15
- 210000004379 membrane Anatomy 0.000 description 15
- 229920001220 nitrocellulos Polymers 0.000 description 15
- 238000000159 protein binding assay Methods 0.000 description 15
- 238000010828 elution Methods 0.000 description 14
- 239000002609 medium Substances 0.000 description 13
- 108010090804 Streptavidin Chemical group 0.000 description 12
- 108090000623 proteins and genes Chemical class 0.000 description 12
- 241000894007 species Species 0.000 description 12
- 230000009870 specific binding Effects 0.000 description 12
- 244000052769 pathogen Species 0.000 description 11
- 235000018102 proteins Nutrition 0.000 description 11
- 102000004169 proteins and genes Human genes 0.000 description 11
- -1 immune mediators Proteins 0.000 description 10
- 230000002452 interceptive effect Effects 0.000 description 10
- 238000004090 dissolution Methods 0.000 description 9
- 239000005020 polyethylene terephthalate Substances 0.000 description 9
- 150000003384 small molecules Chemical class 0.000 description 9
- 239000000126 substance Substances 0.000 description 9
- 238000012125 lateral flow test Methods 0.000 description 8
- 229920001778 nylon Polymers 0.000 description 8
- 239000002245 particle Substances 0.000 description 8
- 229920000139 polyethylene terephthalate Polymers 0.000 description 8
- 239000000700 radioactive tracer Substances 0.000 description 8
- 230000000903 blocking effect Effects 0.000 description 7
- 210000001124 body fluid Anatomy 0.000 description 7
- 238000006243 chemical reaction Methods 0.000 description 7
- 210000003743 erythrocyte Anatomy 0.000 description 7
- 230000003014 reinforcing effect Effects 0.000 description 7
- 230000035945 sensitivity Effects 0.000 description 7
- 241000701074 Human alphaherpesvirus 2 Species 0.000 description 6
- 239000010839 body fluid Substances 0.000 description 6
- 210000004027 cell Anatomy 0.000 description 6
- 239000010931 gold Substances 0.000 description 6
- 229910052737 gold Inorganic materials 0.000 description 6
- 238000011065 in-situ storage Methods 0.000 description 6
- 229920000728 polyester Polymers 0.000 description 6
- 230000032258 transport Effects 0.000 description 6
- 239000002699 waste material Substances 0.000 description 6
- 108091023037 Aptamer Proteins 0.000 description 5
- 230000003622 anti-hsv Effects 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- 230000009089 cytolysis Effects 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 210000000416 exudates and transudate Anatomy 0.000 description 5
- 238000005259 measurement Methods 0.000 description 5
- 239000000203 mixture Substances 0.000 description 5
- 230000007935 neutral effect Effects 0.000 description 5
- 230000001717 pathogenic effect Effects 0.000 description 5
- 238000012123 point-of-care testing Methods 0.000 description 5
- 229920000642 polymer Polymers 0.000 description 5
- 238000007781 pre-processing Methods 0.000 description 5
- 238000001525 receptor binding assay Methods 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 239000000243 solution Substances 0.000 description 5
- 229920004934 Dacron® Polymers 0.000 description 4
- 108090000288 Glycoproteins Chemical class 0.000 description 4
- 102000003886 Glycoproteins Human genes 0.000 description 4
- 239000004677 Nylon Substances 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- 230000009471 action Effects 0.000 description 4
- 210000002421 cell wall Anatomy 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 239000003814 drug Substances 0.000 description 4
- 238000012812 general test Methods 0.000 description 4
- 239000000543 intermediate Substances 0.000 description 4
- 239000002563 ionic surfactant Substances 0.000 description 4
- 239000003550 marker Substances 0.000 description 4
- 108091000699 pea lectin Proteins 0.000 description 4
- 238000012545 processing Methods 0.000 description 4
- 238000001429 visible spectrum Methods 0.000 description 4
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 3
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 3
- 241000271566 Aves Species 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- 102000016938 Catalase Human genes 0.000 description 3
- 108010053835 Catalase Proteins 0.000 description 3
- 108010015776 Glucose oxidase Proteins 0.000 description 3
- 239000004366 Glucose oxidase Substances 0.000 description 3
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 239000004743 Polypropylene Substances 0.000 description 3
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 3
- 108010046334 Urease Proteins 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 239000011230 binding agent Substances 0.000 description 3
- 210000000170 cell membrane Anatomy 0.000 description 3
- 229920002301 cellulose acetate Polymers 0.000 description 3
- 238000012875 competitive assay Methods 0.000 description 3
- 238000013461 design Methods 0.000 description 3
- 238000010790 dilution Methods 0.000 description 3
- 239000012895 dilution Substances 0.000 description 3
- 238000001035 drying Methods 0.000 description 3
- 239000010419 fine particle Substances 0.000 description 3
- 239000003365 glass fiber Substances 0.000 description 3
- 229940116332 glucose oxidase Drugs 0.000 description 3
- 235000019420 glucose oxidase Nutrition 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 238000001471 micro-filtration Methods 0.000 description 3
- 229920001155 polypropylene Polymers 0.000 description 3
- 238000011002 quantification Methods 0.000 description 3
- 238000005070 sampling Methods 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- 102100022717 Atypical chemokine receptor 1 Human genes 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- 102000011022 Chorionic Gonadotropin Human genes 0.000 description 2
- 108010062540 Chorionic Gonadotropin Proteins 0.000 description 2
- 206010010741 Conjunctivitis Diseases 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 101000678879 Homo sapiens Atypical chemokine receptor 1 Proteins 0.000 description 2
- 102000014150 Interferons Human genes 0.000 description 2
- 108010050904 Interferons Proteins 0.000 description 2
- 108010052285 Membrane Proteins Proteins 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 2
- 206010052428 Wound Diseases 0.000 description 2
- 208000027418 Wounds and injury Diseases 0.000 description 2
- 238000002835 absorbance Methods 0.000 description 2
- 230000002776 aggregation Effects 0.000 description 2
- 238000004220 aggregation Methods 0.000 description 2
- 239000013566 allergen Substances 0.000 description 2
- 238000013096 assay test Methods 0.000 description 2
- 239000002981 blocking agent Substances 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 229940098773 bovine serum albumin Drugs 0.000 description 2
- 235000008429 bread Nutrition 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 125000002091 cationic group Chemical group 0.000 description 2
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 2
- 238000004140 cleaning Methods 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 230000003111 delayed effect Effects 0.000 description 2
- KXGVEGMKQFWNSR-UHFFFAOYSA-N deoxycholic acid Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 KXGVEGMKQFWNSR-UHFFFAOYSA-N 0.000 description 2
- 239000003599 detergent Substances 0.000 description 2
- 238000007865 diluting Methods 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 230000007613 environmental effect Effects 0.000 description 2
- 239000004744 fabric Substances 0.000 description 2
- 239000006260 foam Substances 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 229940084986 human chorionic gonadotropin Drugs 0.000 description 2
- 230000001900 immune effect Effects 0.000 description 2
- 230000002163 immunogen Effects 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 2
- 239000002736 nonionic surfactant Substances 0.000 description 2
- 230000009871 nonspecific binding Effects 0.000 description 2
- 230000005501 phase interface Effects 0.000 description 2
- 230000010287 polarization Effects 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 2
- 238000002203 pretreatment Methods 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- 239000011669 selenium Substances 0.000 description 2
- 229910052711 selenium Inorganic materials 0.000 description 2
- 150000003378 silver Chemical class 0.000 description 2
- 231100000444 skin lesion Toxicity 0.000 description 2
- 206010040882 skin lesion Diseases 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 230000001954 sterilising effect Effects 0.000 description 2
- 238000004659 sterilization and disinfection Methods 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 238000004448 titration Methods 0.000 description 2
- BHQCQFFYRZLCQQ-UHFFFAOYSA-N (3alpha,5alpha,7alpha,12alpha)-3,7,12-trihydroxy-cholan-24-oic acid Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 BHQCQFFYRZLCQQ-UHFFFAOYSA-N 0.000 description 1
- UMCMPZBLKLEWAF-BCTGSCMUSA-N 3-[(3-cholamidopropyl)dimethylammonio]propane-1-sulfonate Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(=O)NCCC[N+](C)(C)CCCS([O-])(=O)=O)C)[C@@]2(C)[C@@H](O)C1 UMCMPZBLKLEWAF-BCTGSCMUSA-N 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 241000224489 Amoeba Species 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 108010074051 C-Reactive Protein Proteins 0.000 description 1
- 102100032752 C-reactive protein Human genes 0.000 description 1
- 0 CC(C1)C(*)CC1C1CCCCC1 Chemical compound CC(C1)C(*)CC1C1CCCCC1 0.000 description 1
- 102000055006 Calcitonin Human genes 0.000 description 1
- 108060001064 Calcitonin Proteins 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- 239000004380 Cholic acid Substances 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- QRLVDLBMBULFAL-UHFFFAOYSA-N Digitonin Natural products CC1CCC2(OC1)OC3C(O)C4C5CCC6CC(OC7OC(CO)C(OC8OC(CO)C(O)C(OC9OCC(O)C(O)C9OC%10OC(CO)C(O)C(OC%11OC(CO)C(O)C(O)C%11O)C%10O)C8O)C(O)C7O)C(O)CC6(C)C5CCC4(C)C3C2C QRLVDLBMBULFAL-UHFFFAOYSA-N 0.000 description 1
- 206010013654 Drug abuse Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 208000001860 Eye Infections Diseases 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- GVGLGOZIDCSQPN-PVHGPHFFSA-N Heroin Chemical compound O([C@H]1[C@H](C=C[C@H]23)OC(C)=O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4OC(C)=O GVGLGOZIDCSQPN-PVHGPHFFSA-N 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 241000700588 Human alphaherpesvirus 1 Species 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 108090001030 Lipoproteins Proteins 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 102000008072 Lymphokines Human genes 0.000 description 1
- 108010074338 Lymphokines Proteins 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 241000244206 Nematoda Species 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 108091005461 Nucleic proteins Proteins 0.000 description 1
- 229920000297 Rayon Polymers 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 208000019802 Sexually transmitted disease Diseases 0.000 description 1
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 238000002441 X-ray diffraction Methods 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 239000011149 active material Substances 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 230000001745 anti-biotin effect Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 238000003149 assay kit Methods 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- BBBFJLBPOGFECG-VJVYQDLKSA-N calcitonin Chemical compound N([C@H](C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(N)=O)C(C)C)C(=O)[C@@H]1CSSC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1 BBBFJLBPOGFECG-VJVYQDLKSA-N 0.000 description 1
- 229960004015 calcitonin Drugs 0.000 description 1
- 235000010410 calcium alginate Nutrition 0.000 description 1
- 239000000648 calcium alginate Substances 0.000 description 1
- 229960002681 calcium alginate Drugs 0.000 description 1
- OKHHGHGGPDJQHR-YMOPUZKJSA-L calcium;(2s,3s,4s,5s,6r)-6-[(2r,3s,4r,5s,6r)-2-carboxy-6-[(2r,3s,4r,5s,6r)-2-carboxylato-4,5,6-trihydroxyoxan-3-yl]oxy-4,5-dihydroxyoxan-3-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylate Chemical compound [Ca+2].O[C@@H]1[C@H](O)[C@H](O)O[C@@H](C([O-])=O)[C@H]1O[C@H]1[C@@H](O)[C@@H](O)[C@H](O[C@H]2[C@H]([C@@H](O)[C@H](O)[C@H](O2)C([O-])=O)O)[C@H](C(O)=O)O1 OKHHGHGGPDJQHR-YMOPUZKJSA-L 0.000 description 1
- 239000003990 capacitor Substances 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 239000005018 casein Substances 0.000 description 1
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 1
- 235000021240 caseins Nutrition 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000002800 charge carrier Substances 0.000 description 1
- 239000002975 chemoattractant Substances 0.000 description 1
- 235000019416 cholic acid Nutrition 0.000 description 1
- BHQCQFFYRZLCQQ-OELDTZBJSA-N cholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 BHQCQFFYRZLCQQ-OELDTZBJSA-N 0.000 description 1
- 229960002471 cholic acid Drugs 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000004737 colorimetric analysis Methods 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 230000009918 complex formation Effects 0.000 description 1
- 239000012468 concentrated sample Substances 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 230000009260 cross reactivity Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 239000003398 denaturant Substances 0.000 description 1
- 229960003964 deoxycholic acid Drugs 0.000 description 1
- KXGVEGMKQFWNSR-LLQZFEROSA-N deoxycholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 KXGVEGMKQFWNSR-LLQZFEROSA-N 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 229960002069 diamorphine Drugs 0.000 description 1
- 239000003989 dielectric material Substances 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- UVYVLBIGDKGWPX-KUAJCENISA-N digitonin Chemical compound O([C@@H]1[C@@H]([C@]2(CC[C@@H]3[C@@]4(C)C[C@@H](O)[C@H](O[C@H]5[C@@H]([C@@H](O)[C@@H](O[C@H]6[C@@H]([C@@H](O[C@H]7[C@@H]([C@@H](O)[C@H](O)CO7)O)[C@H](O)[C@@H](CO)O6)O[C@H]6[C@@H]([C@@H](O[C@H]7[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O7)O)[C@@H](O)[C@@H](CO)O6)O)[C@@H](CO)O5)O)C[C@@H]4CC[C@H]3[C@@H]2[C@@H]1O)C)[C@@H]1C)[C@]11CC[C@@H](C)CO1 UVYVLBIGDKGWPX-KUAJCENISA-N 0.000 description 1
- UVYVLBIGDKGWPX-UHFFFAOYSA-N digitonine Natural products CC1C(C2(CCC3C4(C)CC(O)C(OC5C(C(O)C(OC6C(C(OC7C(C(O)C(O)CO7)O)C(O)C(CO)O6)OC6C(C(OC7C(C(O)C(O)C(CO)O7)O)C(O)C(CO)O6)O)C(CO)O5)O)CC4CCC3C2C2O)C)C2OC11CCC(C)CO1 UVYVLBIGDKGWPX-UHFFFAOYSA-N 0.000 description 1
- 238000007598 dipping method Methods 0.000 description 1
- 239000012738 dissolution medium Substances 0.000 description 1
- 210000003027 ear inner Anatomy 0.000 description 1
- 239000012149 elution buffer Substances 0.000 description 1
- 239000002158 endotoxin Chemical class 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 208000011323 eye infectious disease Diseases 0.000 description 1
- 210000001559 fluids and secretion Anatomy 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 210000004392 genitalia Anatomy 0.000 description 1
- 210000004907 gland Anatomy 0.000 description 1
- 238000000892 gravimetry Methods 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 230000035876 healing Effects 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- 230000003100 immobilizing effect Effects 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 230000003960 inflammatory cascade Effects 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 229940047124 interferons Drugs 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 229920006008 lipopolysaccharide Chemical class 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 230000005389 magnetism Effects 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 229960001252 methamphetamine Drugs 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- 210000003097 mucus Anatomy 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- YYELLDKEOUKVIQ-UHFFFAOYSA-N octaethyleneglycol monododecyl ether Chemical compound CCCCCCCCCCCCOCCOCCOCCOCCOCCOCCOCCOCCO YYELLDKEOUKVIQ-UHFFFAOYSA-N 0.000 description 1
- HEGSGKPQLMEBJL-RKQHYHRCSA-N octyl beta-D-glucopyranoside Chemical compound CCCCCCCCO[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O HEGSGKPQLMEBJL-RKQHYHRCSA-N 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 230000016087 ovulation Effects 0.000 description 1
- 230000005298 paramagnetic effect Effects 0.000 description 1
- 244000045947 parasite Species 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000013618 particulate matter Substances 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 210000002381 plasma Anatomy 0.000 description 1
- 238000003752 polymerase chain reaction Methods 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- 239000002964 rayon Substances 0.000 description 1
- 239000001044 red dye Substances 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 238000010079 rubber tapping Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 238000002764 solid phase assay Methods 0.000 description 1
- 238000005507 spraying Methods 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 208000011117 substance-related disease Diseases 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 239000008399 tap water Substances 0.000 description 1
- 235000020679 tap water Nutrition 0.000 description 1
- 239000004753 textile Substances 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54366—Apparatus specially adapted for solid-phase testing
- G01N33/54386—Analytical elements
- G01N33/54387—Immunochromatographic test strips
- G01N33/54388—Immunochromatographic test strips based on lateral flow
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6816—Hybridisation assays characterised by the detection means
- C12Q1/6825—Nucleic acid detection involving sensors
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Analytical Chemistry (AREA)
- Biomedical Technology (AREA)
- Organic Chemistry (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- General Health & Medical Sciences (AREA)
- Zoology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Wood Science & Technology (AREA)
- Food Science & Technology (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Cell Biology (AREA)
- Medicinal Chemistry (AREA)
- Biophysics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Sampling And Sample Adjustment (AREA)
Description
この出願は、2009年12月4日に出願された特許文献1(発明の名称「LATERAL FLOW NUCLEIC ACID DETECTOR」)、2010年5月6日に出願された特許文献2(発明の名称「MULTIPLANAR LATERAL FLOW ASSAY WITH SAMPLE COMPRESSOR」)、2010年6月7日に出願された特許文献3(発明の名称「LATERAL FLOW ASSAYS」)、および、2010年10月14日に出願された特許文献4(発明の名称「MULTIPLANAR LATERAL FLOW ASSAY WITH SAMPLE COMPRESSOR」)で開示された1つ以上の発明を主張する。米国仮特許出願のUSC35§119(e)の下での利益は、本明細書によって主張され、前述の出願はこれをもって参照することにより本明細書に組み込まれる。
側方流動アッセイは、1枚のアッセイストリップで様々な試薬と製造工程を組み合わせて、それによって標的分子の検出のための高感度かつ迅速な手段を提供するアッセイの一部である。抗体に基づいた側方流動イムノアッセイは多様な標的分析物に利用可能で、サンドイッチ試験または競合試験の原理のために設計されてもよい。一般的に、複数のエピトープを含む高分子量の分析物はサンドイッチ形式で分析されるが、1つのエピトープのみを表す小分子は競合アッセイによって検出される。最初の試験はヒト絨毛性ゴナドトロピン(hCG)のために行なわれた。今日では、排卵をモニタリングするための、感染症の病原体を検出するための、薬物の乱用を分析するための、および、人間生理学にとって重要な他の分析物を測定するための、市販の試験装置がある。獣医試験、環境試験、および、製品のモニタリングのために様々な製品も導入されている。
好ましくは、方法は、複数の分析物の平行な測定を含む。病原体は、好ましくは、細菌、菌類(例えば、酵母菌またはカビ)、あるいは、寄生虫(例えば、アメーバまたは線虫)のような、ウイルスまたは微生物から選ばれる。免疫メディエーターは炎症カスケードの一部であり、限定されないが、抗体、増殖因子、補体、サイトカイン、リンホカイン、ケモキネス、インターフェロン、および、インターフェロン誘導体、C反応性タンパク質、カルシトニン、アミロイド、接着分子、抗体、および、化学誘引成分を含む。低分子量化合物は、薬物または化学分子または複合物、および、薬物または化学分子によって形成された代謝物を含んでもよい。
試験線の定量化は標準曲線を用いて測定することができる。標準曲線を展開する際に、分析物濃度のいくつかの滴定が作成され、各々の滴定で読み取り装置の出力が記録される。読取り装置は、試験の感度を5乃至10倍上げる。操作時、目に見える試験線を見る検出窓は、直接的な吸光度または反射率の測定が可能となるように、スペクトロメーターの開口部に直接置かれるか、または、その近くに置かれる。
その後、第2の複合物はビオチン標識を介してアビジンによって試験領域で捕獲される。その後、遅らせて放出した抗マウス標識複合体は、試験領域内の第2の複合物でマウス抗体に結合するとともに積み重なる。抗マウス標識複合体は、分析物の複合物が形成された後に試験領域に到達するように、好ましくは配される。抗マウス標識複合体に好ましいいくつかの位置は、サンプル塗布領域内、サンプル塗布領域の上流、予め定義された期間の後にバッファーに加えられること、サンドイッチが形成された後に試験領域に塗布されること、または、流路内であるがその放出を例えば、20〜30秒遅らせるためにカプセルに入れることを含む。この実施形態では、堆積物はアッセイの感度を3乃至5倍高める。
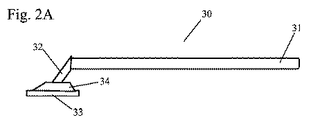
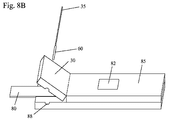
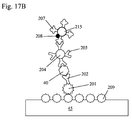
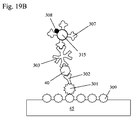
対照領域(46)は、図14に示される検出器のように、固定化されたウサギ抗トリIgY抗体(110)を含む。試験領域(45)は、ニトロセルロース膜上の固定化されたニュートラアビジン(309)を含む。ビオチン化した(301)ポリクローナル抗HSV−1および/またはHSV−2(302)は、サンプル塗布領域(44)上に乾かされる。この図では示されていないが、抗HSV−l/HSV−2(302)は、サンプル塗布領域の上流または下流に位置付けられる。西洋ワサビペルオキシダーゼ(HRP)(308)と結合したウサギ抗マウスIgG(H&L)(307)と、西洋ワサビペルオキシダーゼでコーティングされた赤色ラテックスビーズ(315)と結合したウサギ抗マウスIgG(307)は、好ましくは、サンプル圧縮機のパッド(33)に埋め込まれる。他の実施形態では、西洋ワサビペルオキシダーゼでコーティングされた赤色ラテックスビーズ(315)と結合したウサギ抗マウスIgG(307)だけがある。あるいは、西洋ワサビペルオキシダーゼ(308)と結合したウサギ抗マウスIgG(307)と、西洋ワサビペルオキシダーゼ(308)でコーティングされた赤色ラテックスビーズと結合したウサギ抗マウスIgG(307)とは、試験ストリップ上に位置付けられるか、サンプル塗布領域(44)に重なるか、または、サンプル塗布領域(44)の下流または上流に位置付けられる。サンプル圧縮機(30)上のパッドは好ましくは、遊離型マウスモノクローナル抗gD 1&2(303)が埋め込まれる。前述の実施形態とは異なり、遊離型マウスモノクローナル抗体(303)は、検知可能な標識または酵素とは結合しない。遊離型マウスモノクローナル抗体(303)は好ましくは、対照として役立つ青色で染色したラテックスビーズ(図14に示される)と結合したトリIgY(105)と混合されている。
Claims (20)
- サンプル中の分析物を検出するための側方流動デバイスであって、
前記デバイスは、
パッドを含むサンプル圧縮機、
サンプルの採取のためのサンプル採取部を備えたサンプル採取装置、
サンプル塗布領域とサンプル塗布領域の下流の側方にある試験領域とを備えた側方流動クロマトグラフィ試験ストリップ、
分析物のための第1の結合パートナーと標識とを含む複合体、
分析物のための第2の結合パートナー、および、
サンプル圧縮機のパッド上にある第1の対照結合パートナーを含み、
側方流動クロマトグラフィ試験ストリップは対照領域をさらに含み、対照領域は対照領域で固定化される第2の対照結合パートナーを含み、第1の対照結合パートナーは第2の対照結合パートナーの結合パートナーであり、
サンプル圧縮機、サンプル採取装置、および、側方流動クロマトグラフィ試験ストリップは、圧縮によって側方流動クロマトグラフィ試験ストリップにサンプルを塗布するために垂直な堆積物を形成し、
サンプル採取装置は、垂直な堆積物において、サンプル圧縮機と側方流動クロマトグラフィ試験ストリップの間に位置付けられることを特徴とする側方流動デバイス。 - 複合体、第2の結合パートナー、または、その両方は、側方流動デバイスの使用前にサンプル圧縮機のパッドに位置付けられることを特徴とする請求項1に記載の側方流動デバイス。
- 複合体はパッドに位置付けられ、第2の結合パートナーは外部の媒体に位置付けられることを特徴とする請求項2に記載の側方流動デバイス。
- 第2の結合パートナーはパッドに位置付けられ、複合体は外部の媒体に位置付けられることを特徴とする請求項2に記載の側方流動デバイス。
- 陽性の結果が分析物と第1の結合パートナーと第2の結合パートナーとの間での複合物の形成を介した試験領域での分析物の捕獲によってのみ達成されるように、側方流動デバイスは形成されることを特徴とする請求項1に記載の側方流動デバイス。
- 試験領域は、分析物に特異的に結合する分子をまったく含んでいないことを特徴とする請求項1に記載の側方流動デバイス。
- 第2の結合パートナーはタグを含み、試験領域はタグの固定化された結合パートナーを含むことを特徴とする請求項1に記載の側方流動デバイス。
- 試験ストリップの少なくとも一部を囲むハウジングをさらに含み、
ハウジングの回転可能な部分がサンプル圧縮機を形成することを特徴とする請求項1に記載の側方流動デバイス。 - 試験ストリップの少なくとも一部を囲むハウジングをさらに含み、
挿入可能なカートリッジがサンプル圧縮機を形成することを特徴とする請求項1に記載の側方流動デバイス。 - 側方流動デバイスの側方流動クロマトグラフィ試験ストリップにサンプルを塗布する方法であって、
前記方法は、
a)パッドを含むサンプル圧縮機と側方流動クロマトグラフィ試験ストリップのサンプル塗布領域との間の垂直な堆積物に、サンプルを含むサンプル採取部を備えたサンプル採取装置を置く工程と、
b)サンプル塗布領域にサンプルの少なくとも一部を移すためにサンプル圧縮機を用いてサンプル採取部に圧力を加える工程を含み、
第1の対照結合パートナーはサンプル圧縮機のパッド上に位置付けられ、
側方流動クロマトグラフィ試験ストリップ上の対照領域は、対照領域で固定化された第2の対照結合パートナーを含み、第1の対照結合パートナーは第2の対照結合パートナーの結合パートナーであることを特徴とする方法。 - サンプル圧縮機のパッドは、分析物のための第1の結合パートナー、分析物のための第2の結合パートナー、および、分析物のための第1の結合パートナーと分析物のための第2の結合パートナーの両方からなる群から選択される構成要素をさらに含むことを特徴とする請求項10に記載の方法。
- サンプル採取装置は、垂直な堆積物にサンプル圧縮機を当てる前に、接触によって、または、圧力を介して、試験ストリップにサンプルを受動的に送達することを特徴とする請求項10に記載の方法。
- 工程a)は、垂直な堆積物の上に、分析物のための結合パートナーを含むパッドを置く工程をさらに含み、
工程b)において、結合パートナーの少なくとも一部がサンプル塗布領域に移されることを特徴とする請求項10に記載の方法。 - 工程b)は流動を伴わずに生じることを特徴とする請求項10に記載の方法。
- サンプル中の分析物を検出するための側方流動デバイスであって、
前記デバイスは、
パッドを含むサンプル圧縮機、
サンプルの採取のためのサンプル採取部を備えたサンプル採取装置、
サンプル塗布領域とサンプル塗布領域から下流の側方にある試験領域とを備えた側方流動クロマトグラフィ試験ストリップ、
分析物のための第1の結合パートナーと標識とを含む複合体、および、
分析物のための第2の結合パートナーを含み、
複合体、第2の結合パートナー、および、複合体と第2の結合パートナーの両方からなる群から選択される構成要素は、試験ストリップ、サンプル採取装置、および、サンプル圧縮機、から分離した独立したパッドに位置付けられ、
サンプル圧縮機、サンプル採取装置、および、独立したパッドは、圧縮によって側方流動クロマトグラフィ試験ストリップにサンプルを塗布するために垂直な堆積物を形成し、
サンプル採取装置、および、独立したパッドは、堆積物において、サンプル圧縮機と側方流動クロマトグラフィ試験ストリップの間に位置付けられることを特徴とする側方流動デバイス。 - サンプル圧縮機のパッド上に位置付けられた第1の対照結合パートナーと、固定化された第2の対照結合パートナーを含む側方流動クロマトグラフィ試験ストリップ上の対照領域をさらに含み、
第1の対照結合パートナーは、第2の対照結合パートナーの結合パートナーであることを特徴とする請求項15に記載の側方流動デバイス。 - サンプル中の分析物を検出するための側方流動デバイスであって、
前記デバイスは、
パッドを含むサンプル圧縮機、
サンプルの採取のためのサンプル採取部を備えたサンプル採取装置、
サンプル塗布領域とサンプル塗布領域から下流の側方にある試験領域とを備えた側方流動クロマトグラフィ試験ストリップ、
分析物のための第1の結合パートナーと標識とを含む複合体、および、
分析物のための第2の結合パートナーを含み、
複合体、第2の結合パートナー、および、複合体と第2の結合パートナーの両方からなる群から選択される構成要素は、サンプル圧縮機のパッド上に位置付けられ、
サンプル圧縮機、サンプル採取装置、および、側方流動クロマトグラフィ試験ストリップは、圧縮によって側方流動クロマトグラフィ試験ストリップにサンプルを塗布するために垂直な堆積物を形成し、および、
サンプル採取装置は、垂直な堆積物において、サンプル圧縮機と側方流動クロマトグラフィ試験ストリップの間に位置付けられることを特徴とする側方流動デバイス。 - サンプル中の分析物を検出するための側方流動デバイスであって、
パッドおよびパッド上に位置付けられた第1の対照結合パートナーを含むサンプル圧縮機、
サンプル塗布領域とサンプル塗布領域から下流の側方にある試験領域とを備えた側方流動クロマトグラフィ試験ストリップ、
分析物のための第1の結合パートナーと標識とを含む複合体、
分析物のための第2の結合パートナーを含み、
前記側方流動クロマトグラフィ試験ストリップは対照領域をさらに含み、対照領域は対照領域で固定化される第2の対照結合パートナーを含み、サンプル圧縮機は第1の対照結合パートナーに圧力をかけて側方流動クロマトグラフィ試験ストリップに移動させるものであり、前記第1の対照結合パートナーは前記第2の対照結合パートナーの結合パートナーであることを特徴とする側方流動デバイス。 - 複合体、第2の結合パートナー、または、複合体と第2の結合パートナーの両方は、側方流動デバイスの使用の前に、サンプル圧縮機のパッド上に位置付けられることを特徴とする請求項18に記載の側方流動デバイス。
- パッドと、パッド上の第1の流動性の対照結合パートナーとを含むサンプル圧縮機、および、側方流動クロマトグラフィ試験ストリップを備えた側方流動デバイスの適正動作を確保する方法であって、
側方流動クロマトグラフィ試験ストリップは試験領域および対照領域を含み、対照領域は対照領域で固定化された第2の対照結合パートナーを含み、
a)サンプル圧縮機が第1の流動性の対照結合パートナーに圧力をかけ、側方流動クロマトグラフィ試験ストリップに移動させるように、側方流動デバイス上でアッセイを行う工程を含み、
対照領域における第1の流動性の対照結合パートナーと第2の対照結合パートナーとの相互作用による検知可能な結果が、側方流動デバイス上でのアッセイが正しく行われたことを示すことを特徴とする方法。
Applications Claiming Priority (13)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US26664109P | 2009-12-04 | 2009-12-04 | |
| US61/266,641 | 2009-12-04 | ||
| US33196610P | 2010-05-06 | 2010-05-06 | |
| US61/331,966 | 2010-05-06 | ||
| US35209310P | 2010-06-07 | 2010-06-07 | |
| US61/352,093 | 2010-06-07 | ||
| US39298110P | 2010-10-14 | 2010-10-14 | |
| US61/392,981 | 2010-10-14 | ||
| US12/957,683 | 2010-12-01 | ||
| US12/957,683 US20110086359A1 (en) | 2008-06-10 | 2010-12-01 | Lateral flow assays |
| US12/958,454 | 2010-12-02 | ||
| US12/958,454 US8609433B2 (en) | 2009-12-04 | 2010-12-02 | Multiplanar lateral flow assay with sample compressor |
| PCT/US2010/058827 WO2011069031A2 (en) | 2009-12-04 | 2010-12-03 | Multiplanar lateral flow assay with sample compressor |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2013513113A JP2013513113A (ja) | 2013-04-18 |
| JP2013513113A5 JP2013513113A5 (ja) | 2014-01-23 |
| JP5855572B2 true JP5855572B2 (ja) | 2016-02-09 |
Family
ID=44115509
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012542210A Expired - Fee Related JP5855572B2 (ja) | 2009-12-04 | 2010-12-03 | サンプル圧縮機を用いた複数面の側方流動アッセイ |
Country Status (9)
| Country | Link |
|---|---|
| EP (1) | EP2507632B1 (ja) |
| JP (1) | JP5855572B2 (ja) |
| KR (1) | KR20120102100A (ja) |
| AU (1) | AU2010325893B2 (ja) |
| BR (1) | BR112012012342B1 (ja) |
| CA (2) | CA2897844A1 (ja) |
| ES (1) | ES2523768T3 (ja) |
| RU (1) | RU2564911C2 (ja) |
| WO (2) | WO2011069029A2 (ja) |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2596347B1 (en) | 2010-07-22 | 2017-09-06 | Hach Company | Alkalinity analysis using a lab-on-a-chip |
| JP6335792B2 (ja) * | 2012-01-16 | 2018-05-30 | コーニンクレッカ フィリップス エヌ ヴェKoninklijke Philips N.V. | 細胞を含む体液における標的分子の存在の決定 |
| US9180449B2 (en) | 2012-06-12 | 2015-11-10 | Hach Company | Mobile water analysis |
| KR101409263B1 (ko) | 2012-10-16 | 2014-07-02 | 바디텍메드 주식회사 | 서브패드를 구비한 측방유동 분석용 스트립 및 이에 사용되는 측방유동 분석용 카트리지 |
| KR101523487B1 (ko) * | 2012-11-28 | 2015-05-27 | 후루카와 덴키 고교 가부시키가이샤 | 면역크로마토그래피, 이것에 이용되는 검출 장치 및 시약 |
| USD768872S1 (en) | 2012-12-12 | 2016-10-11 | Hach Company | Cuvette for a water analysis instrument |
| KR102209489B1 (ko) * | 2013-03-07 | 2021-02-02 | 레피드 페써겐 스크리닝, 아이엔씨. | 바이러스 및 박테리아 감염의 복합 검출을 위한 방법 및 장치 |
| CN103235131B (zh) * | 2013-03-22 | 2015-07-01 | 深圳国际旅行卫生保健中心 | 检测黄热病毒的侧向流免疫层析测定产品及其制备方法 |
| JP6496980B2 (ja) * | 2013-03-29 | 2019-04-10 | 東洋紡株式会社 | 免疫測定方法 |
| GB2528657B (en) * | 2014-07-24 | 2019-03-13 | Intelligent Fingerprinting Ltd | Sample analysing device |
| WO2016032404A1 (en) * | 2014-08-30 | 2016-03-03 | Agency For Science, Technology And Research | A test strip for paper-based assay |
| JP6385245B2 (ja) * | 2014-11-04 | 2018-09-05 | Nissha株式会社 | 検出装置及び検出方法 |
| GB201614053D0 (en) * | 2016-08-17 | 2016-09-28 | Microarray Ltd | Determining the condition of a wound |
| WO2018128749A1 (en) * | 2017-01-06 | 2018-07-12 | Dnt Scientific Research, Llc | Rapid diagnostic test device by driven flow technology |
| KR102015360B1 (ko) * | 2017-01-10 | 2019-08-28 | 광주과학기술원 | 측방 유동 분석에서의 신호 증폭 키트 및 그의 제작 방법 |
| CN111164095B (zh) * | 2017-08-08 | 2024-06-04 | 奥瑞许科技公司 | 用于改进分析物检测的测定方法 |
| KR20210021316A (ko) * | 2018-06-18 | 2021-02-25 | 벡톤 디킨슨 앤드 컴퍼니 | 측면 유동 분석기의 신호-증폭을 위한 시스템, 장치, 및 방법 |
| US10928394B2 (en) * | 2019-02-07 | 2021-02-23 | Julian R. K. Kage | Rapid test for lyme bacteria |
Family Cites Families (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5482830A (en) * | 1986-02-25 | 1996-01-09 | Biostar, Inc. | Devices and methods for detection of an analyte based upon light interference |
| US4963325A (en) * | 1988-05-06 | 1990-10-16 | Hygeia Sciences, Inc. | Swab expressor immunoassay device |
| US5877028A (en) * | 1991-05-29 | 1999-03-02 | Smithkline Diagnostics, Inc. | Immunochromatographic assay device |
| WO1996036878A1 (en) * | 1995-05-19 | 1996-11-21 | Universal Healthwatch, Inc. | Rapid self-contained assay format |
| JPH09184840A (ja) * | 1995-12-28 | 1997-07-15 | Wako Pure Chem Ind Ltd | イムノクロマト法用試験用具 |
| US5876944A (en) * | 1996-06-10 | 1999-03-02 | Bayer Corporation | Method for amplification of the response signal in a sandwich immunoassay |
| US5985675A (en) * | 1997-12-31 | 1999-11-16 | Charm Sciences, Inc. | Test device for detection of an analyte |
| US6087184A (en) * | 1997-11-10 | 2000-07-11 | Beckman Coulter, Inc. | Opposable-element chromatographic assay device for detection of analytes |
| DE19816550A1 (de) * | 1997-12-24 | 1999-06-24 | Roche Diagnostics Gmbh | Universell verwendbarer Aufbau eines Analysenelements und dessen Einsatz zur Analytbestimmung |
| GB9929272D0 (en) * | 1999-12-10 | 2000-02-02 | Diagnology Limited | Assay |
| ES2363501T3 (es) * | 2003-05-07 | 2011-08-05 | Coris Bioconcept Sprl | Dispositivo oligocromático de un paso y procedimiento de uso. |
| EP1718973B1 (en) * | 2004-02-09 | 2009-09-09 | Rapid Pathogen Screening Inc. | Method for the rapid diagnosis of targets in human body fluids |
| EP1746419A1 (en) * | 2004-04-30 | 2007-01-24 | Arkray, Inc. | Sample analyzing tool |
| US20060019406A1 (en) * | 2004-07-23 | 2006-01-26 | Ning Wei | Lateral flow device for the detection of large pathogens |
| US20070059682A1 (en) * | 2005-09-13 | 2007-03-15 | Rapid Pathogen Screening Inc. | Method to increase specificity and/or accuracy of lateral flow immunoassays |
| JP2008541009A (ja) * | 2005-04-30 | 2008-11-20 | オークビル・ホンコン・カンパニー・リミテツド | サンプルの採取および分析のための装置および方法 |
| JP4643415B2 (ja) * | 2005-10-21 | 2011-03-02 | ロート製薬株式会社 | 検査具用ケース及び液体試料検査具 |
| ATE425458T1 (de) * | 2006-01-14 | 2009-03-15 | Hoffmann La Roche | Immunologisches testelement mit verbesserter kontrollzone |
| US7879623B2 (en) * | 2006-03-31 | 2011-02-01 | Guirguis Raouf A | Integrated device for analyte, testing, confirmation, and donor identity verification |
| US20090047673A1 (en) * | 2006-08-22 | 2009-02-19 | Cary Robert B | Miniaturized lateral flow device for rapid and sensitive detection of proteins or nucleic acids |
| JP4920553B2 (ja) * | 2006-11-08 | 2012-04-18 | 富士フイルム株式会社 | イムノクロマトグラフキット |
| US20080138842A1 (en) * | 2006-12-11 | 2008-06-12 | Hans Boehringer | Indirect lateral flow sandwich assay |
| JP5340575B2 (ja) * | 2007-09-28 | 2013-11-13 | シスメックス株式会社 | イムノクロマトグラフィー用試験具 |
-
2010
- 2010-12-03 EP EP10835165.1A patent/EP2507632B1/en active Active
- 2010-12-03 KR KR1020127017244A patent/KR20120102100A/ko not_active Application Discontinuation
- 2010-12-03 BR BR112012012342-4A patent/BR112012012342B1/pt not_active IP Right Cessation
- 2010-12-03 WO PCT/US2010/058822 patent/WO2011069029A2/en active Application Filing
- 2010-12-03 AU AU2010325893A patent/AU2010325893B2/en not_active Ceased
- 2010-12-03 JP JP2012542210A patent/JP5855572B2/ja not_active Expired - Fee Related
- 2010-12-03 RU RU2012125201/15A patent/RU2564911C2/ru active
- 2010-12-03 CA CA2897844A patent/CA2897844A1/en not_active Abandoned
- 2010-12-03 CA CA2780751A patent/CA2780751C/en active Active
- 2010-12-03 ES ES10835165.1T patent/ES2523768T3/es active Active
- 2010-12-03 WO PCT/US2010/058827 patent/WO2011069031A2/en active Application Filing
Also Published As
| Publication number | Publication date |
|---|---|
| BR112012012342A2 (pt) | 2020-06-02 |
| BR112012012342B1 (pt) | 2021-11-03 |
| AU2010325893B2 (en) | 2014-05-29 |
| WO2011069031A2 (en) | 2011-06-09 |
| RU2564911C2 (ru) | 2015-10-10 |
| CA2780751C (en) | 2015-11-10 |
| WO2011069029A3 (en) | 2011-10-13 |
| CA2780751A1 (en) | 2011-06-09 |
| WO2011069029A2 (en) | 2011-06-09 |
| CA2897844A1 (en) | 2011-06-09 |
| EP2507632A4 (en) | 2013-05-15 |
| KR20120102100A (ko) | 2012-09-17 |
| AU2010325893A1 (en) | 2012-05-24 |
| WO2011069031A3 (en) | 2012-04-19 |
| EP2507632A2 (en) | 2012-10-10 |
| JP2013513113A (ja) | 2013-04-18 |
| EP2507632B1 (en) | 2014-08-20 |
| RU2012125201A (ru) | 2014-01-20 |
| ES2523768T3 (es) | 2014-12-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5855572B2 (ja) | サンプル圧縮機を用いた複数面の側方流動アッセイ | |
| US9939434B2 (en) | Multiplanar lateral flow assay with sample compressor | |
| JP6293797B2 (ja) | 転換領域を持つ複数面の側方流動アッセイ | |
| US8815609B2 (en) | Multiplanar lateral flow assay with diverting zone | |
| US9250236B2 (en) | Method to increase specificity and/or accuracy of lateral flow immunoassays | |
| US9068981B2 (en) | Lateral flow assays with time delayed components | |
| EP1848999A2 (en) | Fecal sample test device and methods of use |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20131129 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20131129 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20140725 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140728 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20141028 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20141105 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20141125 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20150507 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20150731 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20151009 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20151109 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20151209 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5855572 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |