JP5665271B2 - 骨髄腫の処置のためのhdac阻害剤の使用 - Google Patents
骨髄腫の処置のためのhdac阻害剤の使用 Download PDFInfo
- Publication number
- JP5665271B2 JP5665271B2 JP2008525092A JP2008525092A JP5665271B2 JP 5665271 B2 JP5665271 B2 JP 5665271B2 JP 2008525092 A JP2008525092 A JP 2008525092A JP 2008525092 A JP2008525092 A JP 2008525092A JP 5665271 B2 JP5665271 B2 JP 5665271B2
- Authority
- JP
- Japan
- Prior art keywords
- alkyl
- aryl
- substituents
- cycloalkyl
- myeloma
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/165—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/403—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with carbocyclic rings, e.g. carbazole
- A61K31/404—Indoles, e.g. pindolol
- A61K31/4045—Indole-alkylamines; Amides thereof, e.g. serotonin, melatonin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/4965—Non-condensed pyrazines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/498—Pyrazines or piperazines ortho- and peri-condensed with carbocyclic ring systems, e.g. quinoxaline, phenazine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Indole Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Description
本発明の組合せ剤に使用するためにとりわけ興味深いHDAC阻害剤化合物は、式(I)
R1はH;ハロ;または直鎖C1−C6アルキル、とりわけメチル、エチルもしくはn−プロピルであり、ここでメチル、エチルおよびn−プロピル置換基は非置換であるか、または下記アルキル置換基の1個以上の置換基によって置換されており;
R2はH;C1−C10アルキル、好ましくはC1−C6アルキル、例えばメチル、エチルまたは−CH2CH2−OH;C4−C9シクロアルキル;C4−C9ヘテロシクロアルキル;C4−C9ヘテロシクロアルキルアルキル;シクロアルキルアルキル、例えばシクロプロピルメチル;アリール;ヘテロアリール;アリールアルキル、例えばベンジル;ヘテロアリールアルキル、例えばピリジルメチル;−(CH2)nC(O)R6;−(CH2)nOC(O)R6;アミノアシル;HON−C(O)−CH=C(R1)−アリール−アルキル−;および−(CH2)nR7から選択され;
R3およびR4は同一または異なって、独立して、H;C1−C6アルキル;アシル;orアシルアミノであるか、または
R3およびR4は、それらが結合している炭素と一体となって、C=O、C=SまたはC=NR8を意味するか、または
R2はそれが結合している窒素と一体となって、そしてR3はそれが結合している炭素と一体となって、C4−C9ヘテロシクロアルキル;ヘテロアリール;ポリヘテロアリール;非芳香族性ポリヘテロ環;または混合アリールおよび非アリールポリヘテロ環を形成してもよく
n、n1、n2およびn3は同一または異なって、そして独立して、0〜6から選択され、n1が1−6であるとき、各炭素原子は所望により独立して、R3および/またはR4で置換されていてもよく;
XおよびYは同一または異なって、そして独立して、H;ハロ;C1−C4アルキル、例えばCH3およびCF3;NO2;C(O)R1;OR9;SR9;CN;およびNR10R11であり;
R6はH;C1−C6アルキル;C4−C9シクロアルキル;C4−C9ヘテロシクロアルキル;シクロアルキルアルキル、例えばシクロプロピルメチル;アリール;ヘテロアリール;アリールアルキル、例えばベンジルおよび2−フェニルエテニル;ヘテロアリールアルキル、例えばピリジルメチル;OR12;ならびにNR13R14であり;
R7はOR15;SR15;S(O)R16;SO2R17;NR13R14;およびNR12SO2R6から選択され;
R8はH;OR15;NR13R14;C1−C6アルキル;C4−C9シクロアルキル;C4−C9ヘテロシクロアルキル;アリール;ヘテロアリール;アリールアルキル、例えばベンジル;およびヘテロアリールアルキル、例えばピリジルメチルから選択され;
R9はC1−C4アルキル、例えばCH3およびCF3;C(O)−アルキル、例えばC(O)CH3;ならびにC(O)CF3から選択され;
R12はH;C1−C6アルキル;C4−C9シクロアルキル;C4−C9ヘテロシクロアルキル;C4−C9ヘテロシクロアルキルアルキル;アリール;混合アリールおよび非アリール多環;ヘテロアリール;アリールアルキル、例えばベンジル;ならびにヘテロアリールアルキル、例えばピリジルメチルから選択され;
R13およびR14は同一または異なって、そして独立して、H;C1−C6アルキル;C4−C9シクロアルキル;C4−C9ヘテロシクロアルキル;アリール;ヘテロアリール;アリールアルキル、例えばベンジル;ヘテロアリールアルキル、例えばピリジルメチル;アミノアシルから選択されるか;または
R13およびR14は、それらが結合している窒素と一体となって、C4−C9ヘテロシクロアルキル;ヘテロアリール;ポリヘテロアリール;非芳香族性ポリヘテロ環;または混合アリールおよび非アリールポリヘテロ環であり;
R15はH;C1−C6アルキル;C4−C9シクロアルキル;C4−C9ヘテロシクロアルキル;アリール;ヘテロアリール;アリールアルキル;ヘテロアリールアルキル;および(CH2)mZR12から選択され;
R16はC1−C6アルキル;C4−C9シクロアルキル;C4−C9ヘテロシクロアルキル;アリール;ヘテロアリール;ポリヘテロアリール;アリールアルキル;ヘテロアリールアルキル;および(CH2)mZR12から選択され;
R17はC1−C6アルキル;C4−C9シクロアルキル;C4−C9ヘテロシクロアルキル;アリール;芳香族性多環;ヘテロアリール;アリールアルキル;ヘテロアリールアルキル;ポリヘテロアリールおよびNR13R14から選択され;
mは0〜6から選択される整数であり;そして
ZはO;NR13;S;およびS(O)から選択される〕
に記載のヒドロキサメート化合物またはその薬学的に許容される塩である。
R1がH、ハロまたは直鎖C1−C4アルキルである;
R2がH、C1−C6アルキル、C4−C9シクロアルキル、C4−C9ヘテロシクロアルキル、シクロアルキルアルキル、アリール、ヘテロアリール、アリールアルキル、ヘテロアリールアルキル、−(CH2)nC(O)R6、アミノアシルおよび−(CH2)nR7から選択される;
R3およびR4が同一または異なって、そして独立してHおよびC1−C6アルキルから選択されるか、または
R3およびR4がそれらが結合している炭素と一体となって、C=O、C=SまたはC=NR8を意味する;
R5がH、C1−C6アルキル、C4−C9シクロアルキル、C4−C9ヘテロシクロアルキル、アリール、ヘテロアリール、アリールアルキル、ヘテロアリールアルキル、芳香族性多環、非芳香族性多環、混合アリールおよび非アリール多環、ポリヘテロアリール、非芳香族性ポリヘテロ環、ならびに混合アリールおよび非アリールポリヘテロ環から選択される;
n、n1、n2およびn3が同一または異なって、そして独立して、0〜6から選択され、n1が1〜6であるとき、各炭素原子は非置換であるか、または独立してR3および/またはR4で置換されている;
XおよびYが同一または異なって、そして独立して、H、ハロ、C1−C4アルキル、CF3、NO2、C(O)R1、OR9、SR9、CNおよびNR10R11から選択される;
R6がH、C1−C6アルキル、C4−C9シクロアルキル、C4−C9ヘテロシクロアルキル、アルキルシクロアルキル、アリール、ヘテロアリール、アリールアルキル、ヘテロアリールアルキル、OR12およびNR13R14から選択される;
R8がH、OR15、NR13R14、C1−C6アルキル、C4−C9シクロアルキル、C4−C9ヘテロシクロアルキル、アリール、ヘテロアリール、アリールアルキルおよびヘテロアリールアルキルから選択される;
R9がC1−C4アルキルおよびC(O)−アルキルから選択される;
R10およびR11が同一または異なって、そして独立して、H、C1−C4アルキルおよび−C(O)−アルキルから選択される;
R12がH、C1−C6アルキル、C4−C9シクロアルキル、C4−C9ヘテロシクロアルキル、アリール、ヘテロアリール、アリールアルキルおよびヘテロアリールアルキルから選択される;
R13およびR14が同一または異なって、そして独立して、H、C1−C6アルキル、C4−C9シクロアルキル、C4−C9ヘテロシクロアルキル、アリール、ヘテロアリール、アリールアルキル、ヘテロアリールアルキルおよびアミノアシルから選択される;
R15がH、C1−C6アルキル、C4−C9シクロアルキル、C4−C9ヘテロシクロアルキル、アリール、ヘテロアリール、アリールアルキル、ヘテロアリールアルキルおよび(CH2)mZR12から選択される;
R16がC1−C6アルキル、C4−C9シクロアルキル、C4−C9ヘテロシクロアルキル、アリール、ヘテロアリール、アリールアルキル、ヘテロアリールアルキルおよび(CH2)mZR12から選択される;
R17がC1−C6アルキル、C4−C9シクロアルキル、C4−C9ヘテロシクロアルキル、アリール、ヘテロアリール、アリールアルキル、ヘテロアリールアルキルおよびNR13R14から選択される;
mは0〜6から選択される整数であり;そして
ZがO、NR13、SおよびS(O)から選択される。
R2はH、C1−C6アルキル、C4−C9シクロアルキル、C4−C9ヘテロシクロアルキル、シクロアルキルアルキル、アリール、ヘテロアリール、アリールアルキル、ヘテロアリールアルキル、−(CH2)nC(O)R6、アミノアシルおよび−(CH2)nR7から選択され;そして
R5はヘテロアリール;ヘテロアリールアルキル、例えばピリジルメチル;芳香族性多環;非芳香族性多環;混合アリールおよび非アリール多環;ポリヘテロアリールまたは混合アリール;ならびに非アリールポリヘテロ環である〕
の化合物またはその薬学的に許容される塩である。
R2はH、C1−C6アルキル、C4−C9シクロアルキル、C4−C9ヘテロシクロアルキル、シクロアルキルアルキル、アリール、ヘテロアリール、アリールアルキル、ヘテロアリールアルキル、−(CH2)nC(O)R6、アミノアシルおよび−(CH2)nR7から選択され;そして
R5はアリール;アリールアルキル;芳香族性多環;非芳香族性多環および混合アリール;ならびに非アリール多環、とりわけアリール、例えばp−フルオロフェニル、p−クロロフェニル、p−O−C1−C4アルキルフェニル、例えばp−メトキシフェニル、およびp−C1−C4アルキルフェニル;ならびにアリールアルキル、例えばベンジル、オルト、メタ、またはパラ−フルオロベンジル、オルト、メタ、またはパラ−クロロベンジル、オルト、メタ、またはパラ−モノ、ジまたはトリ−O−C1−C4アルキルベンジル、例えばオルト、メタ、またはパラ−メトキシベンジル、m,p−ジエトキシベンジル、o,m,p−トリイメトキシベンジルおよびオルト、メタ、またはパラ−モノ、ジまたはトリ−C1−C4アルキルフェニル、例えばp−メチル、m,m−ジエチルフェニルである〕
の化合物またはその薬学的に許容される塩である。
R2はH;C1−C6アルキル;C4−C6シクロアルキル;シクロアルキルアルキル、例えばシクロプロピルメチル;(CH2)2−4OR21から選択され、ここでR21はH、メチル、エチル、プロピルおよびi−プロピルであり;そして
R5は非置換1H−インドール−3−イル、ベンゾフラン−3−イルもしくはキノリン−3−イル、または置換1H−インドール−3−イル、例えば5−フルオロ−1H−インドール−3−イルもしくは5−メトキシ−1H−インドール−3−イル、ベンゾフラン−3−イルまたはキノリン−3−イル〕
の化合物またはその薬学的に許容される塩である。
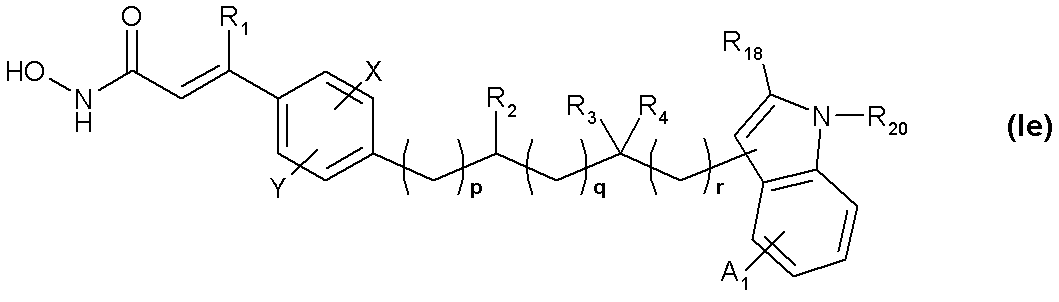
Z1を含む環は芳香族性または非芳香族性であり、ここで非芳香環は飽和または不飽和であり;
Z1はO、SまたはN−R20であり;
R18はH;ハロ;C1−C6アルキル(メチル、エチル、t−ブチル);C3−C7シクロアルキル;アリール、例えば置換されていないフェニルまたは4−OCH3もしくは4−CF3によって置換されているフェニル;またはヘテロアリール、例えば2−フラニル、2−チオフェニルまたは2−、3−もしくは4−ピリジルであり;
R20はH;C1−C6アルキル;C1−C6アルキル−C3−C9シクロアルキル、例えばシクロプロピルメチル;アリール;ヘテロアリール;アリールアルキル、例えばベンジル;ヘテロアリールアルキル、例えばピリジルメチル;アシル、例えばアセチル、プロピオニルおよびベンゾイル;またはスルホニル、例えばメタンスルホニル、エタンスルホニル、ベンゼンスルホニルおよびトルエンスルホニルであり;
A1は独立してH;C1−C6アルキル;−OR19;ハロ;アルキルアミノ;アミノアルキル;ハロ;またはヘテロアリールアルキル、例えばピリジルメチルである1、2または3個の置換基であり;
R19はH;C1−C6アルキル;C4−C9シクロアルキル;C4−C9ヘテロシクロアルキル;アリール;ヘテロアリール;アリールアルキル、例えばベンジル;ヘテロアリールアルキル、例えばピリジルメチルおよび(CH2CH=CH(CH3)(CH2))1−3Hから選択され;
R2はH、C1−C6アルキル、C4−C9シクロアルキル、C4−C9ヘテロシクロアルキル、シクロアルキルアルキル、アリール、ヘテロアリール、アリールアルキル、ヘテロアリールアルキル、−(CH2)nC(O)R6、アミノアシルおよび−(CH2)nR7から選択され;
vは0、1または2であり;
pは0〜3であり;そして
qは1〜5であり、そしてrは0であるか;または
qは0であり、そしてrは1〜5である〕
の化合物またはその薬学的に許容される塩である。他の変化し得る置換基は上記のとおりである。
Z1はO、SまたはN−R20であり;
R18はH;ハロ;C1−C6アルキル(メチル、エチル、t−ブチル);C3−C7シクロアルキル;アリール、例えば置換されていないフェニルまたは4−OCH3もしくは4−CF3によって置換されているフェニル;またはヘテロアリールであり;
R20はH;C1−C6アルキル、C1−C6アルキル−C3−C9シクロアルキル、例えばシクロプロピルメチル;アリール;ヘテロアリール;アリールアルキル、例えばベンジル;ヘテロアリールアルキル、例えばピリジルメチル;アシル、例えばアセチル、プロピオニルおよびベンゾイル;またはスルホニル、例えばメタンスルホニル、エタンスルホニル、ベンゼンスルホニル、トルエンスルホニルであり;
A1は独立してH、C1−C6アルキル、−OR19またはハロである1、2または3個の置換基であり;
R19はH;C1−C6アルキル;C4−C9シクロアルキル;C4−C9ヘテロシクロアルキル;アリール;ヘテロアリール;アリールアルキル、例えばベンジル;およびヘテロアリールアルキル、例えばピリジルメチルから選択され;
pは0〜3であり;そして
qは1〜5であり、そしてrは0であるか;または
qは0であり、そしてrは1〜5である〕
の化合物またはその薬学的に許容される塩である。他の変化し得る置換基は上記のとおりである。
N−ヒドロキシ−3−[4−[(2−ヒドロキシエチル){2−(1H−インドール−3−イル)エチル]−アミノ]メチル]フェニル]−2E−2−プロペンアミド
N−ヒドロキシ−3−[4−[[[2−(2−メチル−1H−インドール−3−イル)−エチル]−アミノ]メチル]フェニル]−2E−2−プロペンアミド
HDAC阻害剤
N−ヒドロキシ−3−[4−[[[2−(2−メチル−1H−インドール−3−イル)−エチル]−アミノ]メチル]フェニル]−2E−2−プロペンアミド、化合物(III)(Novartis Pharma, Basel, Switzerland)を脱イオン水に溶解し、−20℃で保存し、次いで解凍し、細胞培養実験のために培地で希釈した。動物実験のために、薬剤を滅菌水に溶解した後腹膜内注射した。
ボルテゾミブ感受性(MM.1S)およびボルテゾミブ抵抗性(MM.1R)ヒトMM細胞系、ならびにドキソルビシン(Dox40)、ミトキサントロン(MR20)、およびメルファラン(LR5)に抵抗性のRPMI−8226細胞を、10%胎児ウシ血清、2mmol/LのL−グルタミン(GIBCO, Grand Island, NY)、100U/mLのペニシリン、および100mg/mLのストレプトマイシン(GIBCO)と共にRPMI−1640培地(Cellgro, Mediatech, VA)中で培養した。薬剤抵抗性細胞系をドキソルビシン、ミトキサントロン、メルファランまたはボルテゾミブと共に培養してそれらの薬剤感受性の欠如を確認した。MM患者細胞を抗CD138MACSマイクロビーズ(Miltenyi, SanDiego, CA)での正の選択によって精製した(>95% CD138+)。骨髄単核細胞(BMMC)および末梢血単核細胞(PBMC)標本をFicoll-Hipaque密度沈降によって得て、96ウェルプレート中で化合物(III)と共に、またはなしで、インキュベートした。
骨髄標本をMMを有する患者から得た。Ficoll-Hipaque密度沈降によって分離した単核細胞を使用して長期BM培養を確立した。接着細胞単層が発生した後に、細胞を0.25%トリプシンおよび0.02%EDTAを含むHBSS中に収穫し、洗浄し、遠心分離によって回収した。BMSCを平底96ウェルプレートに一晩播種し、3×104MM.1S細胞を48時間加えた。上清150μLを除去し、48時間培養の最後の8時間の間、細胞に[3H]チミジン(0.5μCi/ウェル)を加えた。Duoset ELISA(R&D System)を使用してMM.1S細胞と共に、またはなしで、化合物(III)の存在下、または非存在下でのBMSCの48時間培養物の上清中のIL−6を測定した。
MM細胞(3×104細胞/ウェル)を96ウェル培養プレート(Costar, Cambridge, MA)中で、培地、化合物(III)、および/またはボルテゾミブまたは組み換えIL−6(Genetics Institute, Cambridge, MA)の存在下で、48時間37℃でインキュベートした。DNA合成を3H−チミジン(NEN Products, Boston, MA)取り込みによって測定した。48時間培養の最後の8時間の間、細胞に3H−チミジン(0.5μCi/ウェル)を加えた。全実験を3連で行った。
化合物(III)のMMおよびBMSC増殖に対する阻害効果を、細胞のMTS(Promega, Madison, WI)染料吸収を測定することによって評価した。200μL培地+薬剤中24、48または72時間培養物由来の細胞に、培養の最後の4時間の間、各ウェルに40μLの5mg/mL MTSを加えた。吸収を490nmで、分光光度計(Molecular Devices Corp., Sunnyvale, CA)を使用して測定した。
0、8、12、18、36および42時間、化合物(III)(1μM)、化合物(III)+パン−カスパーゼ阻害剤ZVAD−FMK(20μM)(Calbiochem, San Diego, CA)、または対照培地中で培養したMM細胞型および患者MM細胞を、収穫し、PBSで洗浄し、70%エタノールで固定し、10mg/mL RNase(Roche Diagnostics Corp., Indianapolis, IN)で処置した。細胞を5mg/mLプロピジウムアイオダイド(Sigma)で染色し、細胞サイクルプロファイルをプログラムMソフトフェアを使用してEpicsフロー血球計算器(Coulter Immunology, Hialeah, FL)で測定した。データをPhoenixフローシステムを使用して分析した。
上記細胞サイクル分析を使用してサブG1細胞を同定することに加えて、アポトーシスをまた、アネキシンV染色を使用して確認した。MM細胞を培地のみ、または培地+1μMの化合物(III)で、37℃で24時間培養した。細胞を氷冷PBSで2回洗浄し、結合バッファー(10mmol/L HEPES、pH7.4、140mmol/L NaCl、2.5mmol/L CaCl2)に再懸濁した(1×106細胞/mL)。MM細胞(1×105)をアネキシンV−FITC(5μL;Pharmingen, San Diego, CA)およびPI(5mg/mL)と15分間室温でインキュベートした。アネキシンV+PIアポトーシス細胞をEpics細胞選別機(Coulter)を使用して数えた。
患者MM細胞およびMM.1S細胞を0.01、0.1または1μMの化合物(III)と培養し;収穫し;洗浄し;そして溶解バッファー(RIPAバッファー、2mmol/LのNa3VO4、5mmol/LのNaF、1mmol/Lのフェニルメチルスルホニルフルオリド(PMSF)、5mg/mLのロイペプチンおよび5mg/mLのアプロチニン)を使用して溶解した。細胞溶解物をSDS−PAGEに付し、ポリビニリデンジフルオリド(PVDF)膜に転写し、抗アセチル化ヒストン(Upstate Biotechnology, Lake Placid, NY)、抗p21抗体(Santa Cruz Biotech, Santa Cruz, CA)、抗PARP;抗カスパーゼ−8、抗カスパーゼ−9および抗カスパーゼ−3(Cell Signaling, MA);ならびに抗ポリユビキチン結合体、抗LMP7、抗β5(Affiniti, Mamhead, Exeter, Devon, UK)で免疫ブロットする。膜をはぎ、抗チューブリンまたは抗βアクチン(Sigma, St Louis, MO)で再プローブして等価タンパク質のローディングを確認する。
細胞質抽出物のプロテアソーム活性を蛍光プロテアソーム基質Suc−LLVYAMC(Calbiochem, San Diego, CA)を使用して定量した。簡潔に述べると、細胞質抽出物を抽出し(5μL中タンパク質100μg)、20mMのTris−HCl(pH7.8)、0.5mMのEDTAおよび100μMのSuc−LLVY−AMCを含む反応物200μL中で、室温で90分間インキュベートした。蛍光をマイクロタイタープレートフルオロメーター(励起波長、360nm;放射波長、460nm)で測定した。
核抽出物のEMSAを行った。二本鎖NF−κBコンセンサスオリゴヌクレオチドプローブ(5’−GGGGACTTTCCC−3’、Santa Cruz Biotechnology)を[γ−32P]ATP(222TBq/mMで50μCi;NEN, Boston, MA)で末端標識した。オリゴヌクレオチド1ngおよび核タンパク質5μgを含む結合反応を室温で20分間、全体積10mLの結合バッファー[10mMのTris−HCl(pH7.5)、50mMのNaCl、1mMのMgCl2、0.5mMのEDTA、0.5mMのDTT、4%グリセロール(v/v)および0.5mgのポリ(dI.dC)(Pharmacia, Peapack, NJ)]中で行った。
5〜6週齢のBeige-Nude-Xidマウスに、右側腹に100μLのRPMI1640中3×107MM細胞を、100μLのマトリゲルベース膜マトリックス(Becton Dickinson, Bedford, MA)と共に、既報のとおりに皮下摂取させた。腫瘍が測定可能となったとき、マウスを化合物(III)25mg/kgを毎日腹腔内投与するグループ、または同じスケジュールでビークルのみ(0.9%塩酸ナトリウム)を投与する対照グループに割り当てた。化合物(III)での処置は25mg/kgで行った。最長直行腫瘍径のキャリパー測定を2日ごとに測定して、楕円の三次元体積を意味する下記式:
4π/3×(幅/2)2×(長さ/2)
を使用して評価した。腫瘍が2cmに達したとき動物を屠殺した。生存を処置の第一日目から死亡まで評価した。腫瘍増殖を処置の第一日目から最初の屠殺の日(9日目)まで評価した。
薬剤処置対対照培地において観察された差異の統計的有意をスチューデントt検定を使用して決定した。有意の最小レベルはp<0.05であった。化合物(III)とデキサメタゾンの相乗効果および拮抗作用を分析するために中間用量効果分析を、商業的に入手可能なソフトウェアプログラムCalcusyn(Biosoft, Ferguson, MO, USA)と組み合わせて行った。マウスの生存曲線をKaplan−Meier法を使用して計算した。対照群と処置群の間の生存時間の差をログランク検定を使用して比較した。中間生存時間をFisherの正確確立検定を使用して比較した。2本の腕における腫瘍増殖速度を比較するために、線形混合効果モデル(ランダム係数モデル)をフィットした。
Claims (2)
- 骨髄腫の処置に同時、個別または逐次使用するための、請求項1に記載の組合せ剤。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US70522605P | 2005-08-03 | 2005-08-03 | |
| US60/705,226 | 2005-08-03 | ||
| PCT/US2006/029801 WO2007019116A1 (en) | 2005-08-03 | 2006-08-01 | Use of hdac inhibitors for the treatment of myeloma |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013078867A Division JP5876435B2 (ja) | 2005-08-03 | 2013-04-04 | 骨髄腫の処置のためのhdac阻害剤の使用 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2009503087A JP2009503087A (ja) | 2009-01-29 |
| JP5665271B2 true JP5665271B2 (ja) | 2015-02-04 |
Family
ID=37307336
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008525092A Active JP5665271B2 (ja) | 2005-08-03 | 2006-08-01 | 骨髄腫の処置のためのhdac阻害剤の使用 |
| JP2013078867A Active JP5876435B2 (ja) | 2005-08-03 | 2013-04-04 | 骨髄腫の処置のためのhdac阻害剤の使用 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013078867A Active JP5876435B2 (ja) | 2005-08-03 | 2013-04-04 | 骨髄腫の処置のためのhdac阻害剤の使用 |
Country Status (18)
| Country | Link |
|---|---|
| US (2) | US20080221126A1 (ja) |
| EP (1) | EP1912640B1 (ja) |
| JP (2) | JP5665271B2 (ja) |
| KR (1) | KR101354237B1 (ja) |
| CN (2) | CN104324025A (ja) |
| AU (1) | AU2006278718B2 (ja) |
| BR (1) | BRPI0614090A2 (ja) |
| CA (1) | CA2617274C (ja) |
| DK (1) | DK1912640T3 (ja) |
| ES (1) | ES2545076T3 (ja) |
| HU (1) | HUE028025T2 (ja) |
| LT (1) | LTC1912640I2 (ja) |
| MX (1) | MX2008001610A (ja) |
| PL (1) | PL1912640T3 (ja) |
| PT (1) | PT1912640E (ja) |
| RU (1) | RU2420279C3 (ja) |
| SI (1) | SI1912640T1 (ja) |
| WO (1) | WO2007019116A1 (ja) |
Families Citing this family (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PL1912640T3 (pl) * | 2005-08-03 | 2015-11-30 | Novartis Ag | Zastosowanie inhibitora HDAC panobinostatu w leczeniu szpiczaka |
| BRPI0807812A2 (pt) * | 2007-02-15 | 2020-06-23 | Novartis Ag | Combinações de lbh589 com outros agentes terapêuticos para tratar câncer |
| LT2162129T (lt) * | 2007-05-30 | 2019-06-25 | Novartis Ag | Hdac inhibitorių panaudojimas kaulų destrukcijos gydymui |
| US20120046242A1 (en) * | 2008-12-24 | 2012-02-23 | Massachusetts Institute Of Technology | Molecular activators of the wnt/beta-catenin pathway |
| SMT201800288T1 (it) † | 2009-11-13 | 2018-07-17 | Celgene Int Ii Sarl | Modulatori selettivi del recettore della sfingosina 1 fosfato e metodi di sintesi chirale |
| AU2011296047A1 (en) * | 2010-09-01 | 2013-03-21 | Novartis Ag | Combination of HDAC inhibitors with thrombocytopenia drugs |
| MA41544A (fr) * | 2015-02-19 | 2017-12-26 | Novartis Ag | Dosages de panobinostat pour le traitement du myélome multiple |
| JP6923219B2 (ja) | 2015-11-03 | 2021-08-18 | ホーホシューレ ダルムシュタット | 選択的hdac8阻害剤およびこれらの使用 |
| CN105348169B (zh) * | 2015-11-16 | 2018-03-30 | 青岛大学 | 一种组蛋白去乙酰酶抑制剂(e)‑3‑(2‑(1‑(4‑氯苯甲酰基)‑5‑甲氧基‑2‑甲基‑1氢‑吲哚‑3‑基)乙酰氨基)‑n‑羟基丁‑2‑烯酰胺及其制备方法和应用 |
| CN109705057B (zh) * | 2017-10-25 | 2023-05-30 | 成都先导药物开发股份有限公司 | 组蛋白去乙酰化酶抑制剂及其制备方法与用途 |
| US10537585B2 (en) | 2017-12-18 | 2020-01-21 | Dexcel Pharma Technologies Ltd. | Compositions comprising dexamethasone |
| CA3105731A1 (en) | 2018-07-18 | 2020-01-23 | Hillstream Biopharma Inc. | Polymeric nanoparticles comprising salinomycin |
| WO2022251844A1 (en) | 2021-05-25 | 2022-12-01 | Hillstream Biopharma, Inc. | Polymeric nanoparticles comprising chemotherapeutic compounds and related methods |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PE20020354A1 (es) * | 2000-09-01 | 2002-06-12 | Novartis Ag | Compuestos de hidroxamato como inhibidores de histona-desacetilasa (hda) |
| US20040167134A1 (en) * | 2001-05-16 | 2004-08-26 | Christian Bruns | Combination comprising n-{5-[4-(4-methyl-piperazino-methyl)-benzoylamido]-2-methylphenyl}-4-(3-pyridyl)-2pyrimidine-amine and a chemotherapeutic agent |
| WO2003048774A1 (en) * | 2001-12-07 | 2003-06-12 | Novartis Ag | Use of alpha-tubulin acetylation levels as a biomarker for protein deacetylase inhibitors |
| US20040132825A1 (en) * | 2002-03-04 | 2004-07-08 | Bacopoulos Nicholas G. | Methods of treating cancer with HDAC inhibitors |
| US20050043233A1 (en) | 2003-04-29 | 2005-02-24 | Boehringer Ingelheim International Gmbh | Combinations for the treatment of diseases involving cell proliferation, migration or apoptosis of myeloma cells or angiogenesis |
| BRPI0410648A (pt) * | 2003-05-21 | 2006-07-04 | Novartis Ag | combinação de inibidores de histona desacetilase com agentes quimioterápicos |
| EP1667680A4 (en) * | 2003-08-29 | 2008-10-08 | Aton Pharma Inc | COMBINATION PROCEDURE FOR THE TREATMENT OF CANCER |
| WO2006102557A2 (en) | 2005-03-22 | 2006-09-28 | The President And Fellows Of Harvard College | Treatment of protein degradation disorders |
| PL1912640T3 (pl) * | 2005-08-03 | 2015-11-30 | Novartis Ag | Zastosowanie inhibitora HDAC panobinostatu w leczeniu szpiczaka |
-
2006
- 2006-08-01 PL PL06789025T patent/PL1912640T3/pl unknown
- 2006-08-01 CA CA2617274A patent/CA2617274C/en active Active
- 2006-08-01 EP EP06789025.1A patent/EP1912640B1/en active Active
- 2006-08-01 WO PCT/US2006/029801 patent/WO2007019116A1/en not_active Ceased
- 2006-08-01 CN CN201410610419.9A patent/CN104324025A/zh active Pending
- 2006-08-01 ES ES06789025.1T patent/ES2545076T3/es active Active
- 2006-08-01 KR KR1020087002803A patent/KR101354237B1/ko not_active Expired - Fee Related
- 2006-08-01 AU AU2006278718A patent/AU2006278718B2/en not_active Ceased
- 2006-08-01 JP JP2008525092A patent/JP5665271B2/ja active Active
- 2006-08-01 HU HUE06789025A patent/HUE028025T2/en unknown
- 2006-08-01 BR BRPI0614090-4A patent/BRPI0614090A2/pt not_active Application Discontinuation
- 2006-08-01 US US11/996,323 patent/US20080221126A1/en not_active Abandoned
- 2006-08-01 SI SI200631952T patent/SI1912640T1/sl unknown
- 2006-08-01 CN CNA2006800281244A patent/CN101232880A/zh active Pending
- 2006-08-01 DK DK06789025.1T patent/DK1912640T3/en active
- 2006-08-01 MX MX2008001610A patent/MX2008001610A/es active IP Right Grant
- 2006-08-01 RU RU2008107871A patent/RU2420279C3/ru not_active IP Right Cessation
- 2006-08-01 PT PT67890251T patent/PT1912640E/pt unknown
-
2010
- 2010-03-04 US US12/717,373 patent/US8883842B2/en active Active
-
2013
- 2013-04-04 JP JP2013078867A patent/JP5876435B2/ja active Active
-
2016
- 2016-01-22 LT LTPA2016003C patent/LTC1912640I2/lt unknown
Also Published As
| Publication number | Publication date |
|---|---|
| US20080221126A1 (en) | 2008-09-11 |
| EP1912640B1 (en) | 2015-06-17 |
| WO2007019116A1 (en) | 2007-02-15 |
| DK1912640T3 (en) | 2015-09-14 |
| CN104324025A (zh) | 2015-02-04 |
| RU2420279C3 (ru) | 2017-03-14 |
| EP1912640A1 (en) | 2008-04-23 |
| CN101232880A (zh) | 2008-07-30 |
| US8883842B2 (en) | 2014-11-11 |
| CA2617274A1 (en) | 2007-02-15 |
| AU2006278718B2 (en) | 2010-10-07 |
| BRPI0614090A2 (pt) | 2011-03-09 |
| KR20080031937A (ko) | 2008-04-11 |
| HUE028025T2 (en) | 2016-11-28 |
| MX2008001610A (es) | 2008-02-19 |
| LTC1912640I2 (lt) | 2017-09-11 |
| RU2420279C2 (ru) | 2011-06-10 |
| AU2006278718A1 (en) | 2007-02-15 |
| ES2545076T3 (es) | 2015-09-08 |
| US20100160257A1 (en) | 2010-06-24 |
| JP5876435B2 (ja) | 2016-03-02 |
| PL1912640T3 (pl) | 2015-11-30 |
| KR101354237B1 (ko) | 2014-01-22 |
| CA2617274C (en) | 2017-10-10 |
| JP2009503087A (ja) | 2009-01-29 |
| PT1912640E (pt) | 2015-09-22 |
| SI1912640T1 (sl) | 2015-10-30 |
| RU2008107871A (ru) | 2009-09-10 |
| JP2013173757A (ja) | 2013-09-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5876435B2 (ja) | 骨髄腫の処置のためのhdac阻害剤の使用 | |
| RU2469717C2 (ru) | Комбинация ингибитора гда и антиметаболита | |
| AU2011200155A1 (en) | Combination of histone deacetylase inhibitors and radiation | |
| JP2010526149A (ja) | 消化管がんの処置のためのhdac阻害剤の使用 | |
| US20110034531A1 (en) | Use of hdac inhibitors for the treatment of melanoma |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20090625 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120508 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120808 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120815 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120910 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120918 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20121009 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20121204 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130404 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20130528 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20130614 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140516 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140521 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140617 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140620 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140708 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140711 |
|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20140718 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20140723 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20140820 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20141209 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5665271 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R153 | Grant of patent term extension |
Free format text: JAPANESE INTERMEDIATE CODE: R153 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |