JP5596980B2 - ブラキュリポリペプチドおよび使用方法 - Google Patents
ブラキュリポリペプチドおよび使用方法 Download PDFInfo
- Publication number
- JP5596980B2 JP5596980B2 JP2009551830A JP2009551830A JP5596980B2 JP 5596980 B2 JP5596980 B2 JP 5596980B2 JP 2009551830 A JP2009551830 A JP 2009551830A JP 2009551830 A JP2009551830 A JP 2009551830A JP 5596980 B2 JP5596980 B2 JP 5596980B2
- Authority
- JP
- Japan
- Prior art keywords
- brachyury
- cells
- cancer
- vector
- polypeptide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims description 359
- 102000004196 processed proteins & peptides Human genes 0.000 title claims description 281
- 229920001184 polypeptide Polymers 0.000 title claims description 236
- 238000000034 method Methods 0.000 title claims description 166
- 210000004027 cell Anatomy 0.000 claims description 250
- 206010028980 Neoplasm Diseases 0.000 claims description 190
- 239000013598 vector Substances 0.000 claims description 186
- 150000007523 nucleic acids Chemical class 0.000 claims description 129
- 102000039446 nucleic acids Human genes 0.000 claims description 95
- 108020004707 nucleic acids Proteins 0.000 claims description 95
- 150000001413 amino acids Chemical class 0.000 claims description 80
- 201000011510 cancer Diseases 0.000 claims description 72
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 claims description 69
- 210000003719 b-lymphocyte Anatomy 0.000 claims description 54
- 210000001744 T-lymphocyte Anatomy 0.000 claims description 50
- 230000028993 immune response Effects 0.000 claims description 46
- 208000020816 lung neoplasm Diseases 0.000 claims description 35
- 239000013603 viral vector Substances 0.000 claims description 35
- 206010060862 Prostate cancer Diseases 0.000 claims description 30
- 102000040430 polynucleotide Human genes 0.000 claims description 29
- 108091033319 polynucleotide Proteins 0.000 claims description 29
- 239000002157 polynucleotide Substances 0.000 claims description 29
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 27
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 27
- 201000005202 lung cancer Diseases 0.000 claims description 27
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 26
- 208000029742 colonic neoplasm Diseases 0.000 claims description 26
- 241000700618 Vaccinia virus Species 0.000 claims description 25
- 239000008194 pharmaceutical composition Substances 0.000 claims description 24
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 claims description 23
- 108060008682 Tumor Necrosis Factor Proteins 0.000 claims description 23
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 claims description 23
- 239000002671 adjuvant Substances 0.000 claims description 23
- 208000008839 Kidney Neoplasms Diseases 0.000 claims description 22
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 22
- 108700018351 Major Histocompatibility Complex Proteins 0.000 claims description 21
- 206010009944 Colon cancer Diseases 0.000 claims description 20
- 108010074328 Interferon-gamma Proteins 0.000 claims description 20
- 102100037850 Interferon gamma Human genes 0.000 claims description 19
- 230000001939 inductive effect Effects 0.000 claims description 19
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 claims description 19
- 206010033128 Ovarian cancer Diseases 0.000 claims description 18
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 claims description 17
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 claims description 17
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 claims description 15
- 102000004269 Granulocyte Colony-Stimulating Factor Human genes 0.000 claims description 15
- 208000024313 Testicular Neoplasms Diseases 0.000 claims description 15
- 102000001327 Chemokine CCL5 Human genes 0.000 claims description 14
- 108010055166 Chemokine CCL5 Proteins 0.000 claims description 14
- 240000004808 Saccharomyces cerevisiae Species 0.000 claims description 14
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 14
- 108010064593 Intercellular Adhesion Molecule-1 Proteins 0.000 claims description 13
- 241000701161 unidentified adenovirus Species 0.000 claims description 13
- 241001430294 unidentified retrovirus Species 0.000 claims description 13
- 208000026310 Breast neoplasm Diseases 0.000 claims description 12
- 208000002495 Uterine Neoplasms Diseases 0.000 claims description 12
- 206010006187 Breast cancer Diseases 0.000 claims description 11
- 208000000666 Fowlpox Diseases 0.000 claims description 11
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 11
- 206010057644 Testis cancer Diseases 0.000 claims description 11
- 239000000376 reactant Substances 0.000 claims description 11
- 201000002314 small intestine cancer Diseases 0.000 claims description 11
- 201000003120 testicular cancer Diseases 0.000 claims description 11
- 241001529453 unidentified herpesvirus Species 0.000 claims description 11
- 206010046766 uterine cancer Diseases 0.000 claims description 11
- 102100025218 B-cell differentiation antigen CD72 Human genes 0.000 claims description 10
- 206010005003 Bladder cancer Diseases 0.000 claims description 10
- 108010084313 CD58 Antigens Proteins 0.000 claims description 10
- 101000934359 Homo sapiens B-cell differentiation antigen CD72 Proteins 0.000 claims description 10
- 206010038389 Renal cancer Diseases 0.000 claims description 10
- 230000009089 cytolysis Effects 0.000 claims description 10
- 239000003937 drug carrier Substances 0.000 claims description 10
- 206010017758 gastric cancer Diseases 0.000 claims description 10
- 201000010982 kidney cancer Diseases 0.000 claims description 10
- 201000011549 stomach cancer Diseases 0.000 claims description 10
- 239000013600 plasmid vector Substances 0.000 claims description 9
- 241000894007 species Species 0.000 claims description 9
- 241000701447 unidentified baculovirus Species 0.000 claims description 9
- 241000710929 Alphavirus Species 0.000 claims description 8
- 101000764263 Homo sapiens Tumor necrosis factor ligand superfamily member 4 Proteins 0.000 claims description 8
- 241000710960 Sindbis virus Species 0.000 claims description 8
- 102100026890 Tumor necrosis factor ligand superfamily member 4 Human genes 0.000 claims description 8
- 241000991587 Enterovirus C Species 0.000 claims description 7
- 230000005867 T cell response Effects 0.000 claims description 6
- 230000005907 cancer growth Effects 0.000 claims description 6
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 claims description 5
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 claims description 5
- 108010002350 Interleukin-2 Proteins 0.000 claims description 5
- 102000000588 Interleukin-2 Human genes 0.000 claims description 5
- 102000015271 Intercellular Adhesion Molecule-1 Human genes 0.000 claims description 3
- 108010082808 4-1BB Ligand Proteins 0.000 claims 2
- 102100032101 Tumor necrosis factor ligand superfamily member 9 Human genes 0.000 claims 2
- 230000014509 gene expression Effects 0.000 description 131
- 108090000623 proteins and genes Proteins 0.000 description 116
- 235000001014 amino acid Nutrition 0.000 description 80
- 229940024606 amino acid Drugs 0.000 description 78
- 239000000427 antigen Substances 0.000 description 70
- 102000036639 antigens Human genes 0.000 description 70
- 108091007433 antigens Proteins 0.000 description 70
- 125000003275 alpha amino acid group Chemical group 0.000 description 64
- 241000700605 Viruses Species 0.000 description 62
- 230000002163 immunogen Effects 0.000 description 60
- 108091028043 Nucleic acid sequence Proteins 0.000 description 55
- 108020004414 DNA Proteins 0.000 description 51
- 239000000203 mixture Substances 0.000 description 51
- 235000018102 proteins Nutrition 0.000 description 50
- 102000004169 proteins and genes Human genes 0.000 description 50
- 210000001519 tissue Anatomy 0.000 description 48
- 241000282414 Homo sapiens Species 0.000 description 46
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 42
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 42
- 239000004474 valine Substances 0.000 description 42
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 33
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 33
- 108020004999 messenger RNA Proteins 0.000 description 32
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 29
- -1 tryptophan Amino acid Chemical class 0.000 description 29
- 210000004443 dendritic cell Anatomy 0.000 description 28
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 27
- 210000004881 tumor cell Anatomy 0.000 description 27
- 239000003795 chemical substances by application Substances 0.000 description 26
- 239000002299 complementary DNA Substances 0.000 description 25
- 201000010099 disease Diseases 0.000 description 24
- 239000013612 plasmid Substances 0.000 description 24
- 108020004459 Small interfering RNA Proteins 0.000 description 23
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 22
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 22
- 238000000338 in vitro Methods 0.000 description 22
- 230000027455 binding Effects 0.000 description 21
- 238000003199 nucleic acid amplification method Methods 0.000 description 21
- 239000002773 nucleotide Substances 0.000 description 21
- 125000003729 nucleotide group Chemical group 0.000 description 21
- 239000013615 primer Substances 0.000 description 21
- 230000004044 response Effects 0.000 description 21
- 238000010240 RT-PCR analysis Methods 0.000 description 20
- 230000003321 amplification Effects 0.000 description 20
- 230000000692 anti-sense effect Effects 0.000 description 20
- 239000012634 fragment Substances 0.000 description 20
- 239000000523 sample Substances 0.000 description 20
- 108091027967 Small hairpin RNA Proteins 0.000 description 19
- 210000000612 antigen-presenting cell Anatomy 0.000 description 19
- 238000012384 transportation and delivery Methods 0.000 description 19
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 18
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 18
- 239000004473 Threonine Substances 0.000 description 18
- 210000001072 colon Anatomy 0.000 description 18
- 210000004072 lung Anatomy 0.000 description 18
- 230000003612 virological effect Effects 0.000 description 18
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 17
- 230000001965 increasing effect Effects 0.000 description 17
- 230000002401 inhibitory effect Effects 0.000 description 17
- 210000001550 testis Anatomy 0.000 description 17
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 16
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 16
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 16
- 230000000139 costimulatory effect Effects 0.000 description 16
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 16
- 229960000310 isoleucine Drugs 0.000 description 16
- 210000003734 kidney Anatomy 0.000 description 16
- 210000001672 ovary Anatomy 0.000 description 16
- 210000003932 urinary bladder Anatomy 0.000 description 16
- 210000004291 uterus Anatomy 0.000 description 16
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 15
- 206010027476 Metastases Diseases 0.000 description 15
- 230000000670 limiting effect Effects 0.000 description 15
- 238000003752 polymerase chain reaction Methods 0.000 description 15
- 230000009870 specific binding Effects 0.000 description 15
- 210000002784 stomach Anatomy 0.000 description 15
- 238000011282 treatment Methods 0.000 description 15
- 241000124008 Mammalia Species 0.000 description 14
- 206010046865 Vaccinia virus infection Diseases 0.000 description 14
- 239000000047 product Substances 0.000 description 14
- 239000004055 small Interfering RNA Substances 0.000 description 14
- 230000001225 therapeutic effect Effects 0.000 description 14
- 208000007089 vaccinia Diseases 0.000 description 14
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 13
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 13
- 230000000694 effects Effects 0.000 description 13
- 230000035897 transcription Effects 0.000 description 13
- 238000013518 transcription Methods 0.000 description 13
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 13
- 208000011691 Burkitt lymphomas Diseases 0.000 description 12
- 102000053602 DNA Human genes 0.000 description 12
- 108010088729 HLA-A*02:01 antigen Proteins 0.000 description 12
- 208000017604 Hodgkin disease Diseases 0.000 description 12
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 12
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 12
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 12
- 108020004440 Thymidine kinase Proteins 0.000 description 12
- 238000003556 assay Methods 0.000 description 12
- 239000011230 binding agent Substances 0.000 description 12
- 239000003814 drug Substances 0.000 description 12
- 230000003308 immunostimulating effect Effects 0.000 description 12
- 239000003550 marker Substances 0.000 description 12
- 230000009401 metastasis Effects 0.000 description 12
- 210000002307 prostate Anatomy 0.000 description 12
- 210000000813 small intestine Anatomy 0.000 description 12
- 239000000126 substance Substances 0.000 description 12
- 230000001472 cytotoxic effect Effects 0.000 description 11
- 238000003745 diagnosis Methods 0.000 description 11
- 239000012636 effector Substances 0.000 description 11
- 208000014680 small intestine neoplasm Diseases 0.000 description 11
- 208000025421 tumor of uterus Diseases 0.000 description 11
- 206010061968 Gastric neoplasm Diseases 0.000 description 10
- 102100037877 Intercellular adhesion molecule 1 Human genes 0.000 description 10
- 239000012472 biological sample Substances 0.000 description 10
- 230000036755 cellular response Effects 0.000 description 10
- 229940079593 drug Drugs 0.000 description 10
- 238000002347 injection Methods 0.000 description 10
- 239000007924 injection Substances 0.000 description 10
- 238000003780 insertion Methods 0.000 description 10
- 230000037431 insertion Effects 0.000 description 10
- 239000003921 oil Substances 0.000 description 10
- 239000002245 particle Substances 0.000 description 10
- 208000024891 symptom Diseases 0.000 description 10
- 108091026890 Coding region Proteins 0.000 description 9
- 102000004190 Enzymes Human genes 0.000 description 9
- 108090000790 Enzymes Proteins 0.000 description 9
- 108091054437 MHC class I family Proteins 0.000 description 9
- 108010090804 Streptavidin Proteins 0.000 description 9
- 102000006601 Thymidine Kinase Human genes 0.000 description 9
- 239000002246 antineoplastic agent Substances 0.000 description 9
- 238000004422 calculation algorithm Methods 0.000 description 9
- 230000000295 complement effect Effects 0.000 description 9
- 230000004069 differentiation Effects 0.000 description 9
- 229940088598 enzyme Drugs 0.000 description 9
- 238000009169 immunotherapy Methods 0.000 description 9
- 235000019198 oils Nutrition 0.000 description 9
- 239000003981 vehicle Substances 0.000 description 9
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 8
- 241000588724 Escherichia coli Species 0.000 description 8
- 108010074032 HLA-A2 Antigen Proteins 0.000 description 8
- 102000025850 HLA-A2 Antigen Human genes 0.000 description 8
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 8
- 238000004458 analytical method Methods 0.000 description 8
- 230000000890 antigenic effect Effects 0.000 description 8
- 239000000969 carrier Substances 0.000 description 8
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 8
- 229940127089 cytotoxic agent Drugs 0.000 description 8
- 230000012010 growth Effects 0.000 description 8
- 239000002502 liposome Substances 0.000 description 8
- 239000000463 material Substances 0.000 description 8
- 208000025189 neoplasm of testis Diseases 0.000 description 8
- 208000023958 prostate neoplasm Diseases 0.000 description 8
- 239000004094 surface-active agent Substances 0.000 description 8
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 7
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 7
- 108020004705 Codon Proteins 0.000 description 7
- 102000004127 Cytokines Human genes 0.000 description 7
- 108090000695 Cytokines Proteins 0.000 description 7
- 108060003951 Immunoglobulin Proteins 0.000 description 7
- 108090001005 Interleukin-6 Proteins 0.000 description 7
- 102000004889 Interleukin-6 Human genes 0.000 description 7
- 230000001580 bacterial effect Effects 0.000 description 7
- 150000001875 compounds Chemical class 0.000 description 7
- 239000013604 expression vector Substances 0.000 description 7
- 239000007850 fluorescent dye Substances 0.000 description 7
- 230000002068 genetic effect Effects 0.000 description 7
- 238000009396 hybridization Methods 0.000 description 7
- 102000018358 immunoglobulin Human genes 0.000 description 7
- 230000005764 inhibitory process Effects 0.000 description 7
- 125000005647 linker group Chemical group 0.000 description 7
- 210000004698 lymphocyte Anatomy 0.000 description 7
- 238000004519 manufacturing process Methods 0.000 description 7
- 239000002609 medium Substances 0.000 description 7
- 210000003716 mesoderm Anatomy 0.000 description 7
- 230000010076 replication Effects 0.000 description 7
- 238000013519 translation Methods 0.000 description 7
- 230000004614 tumor growth Effects 0.000 description 7
- 239000004475 Arginine Substances 0.000 description 6
- 108090000994 Catalytic RNA Proteins 0.000 description 6
- 102000053642 Catalytic RNA Human genes 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 102000008949 Histocompatibility Antigens Class I Human genes 0.000 description 6
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 6
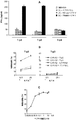
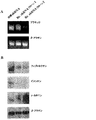
- 102100033130 T-box transcription factor T Human genes 0.000 description 6
- 101710086566 T-box transcription factor T Proteins 0.000 description 6
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 6
- 210000004369 blood Anatomy 0.000 description 6
- 239000008280 blood Substances 0.000 description 6
- 238000001514 detection method Methods 0.000 description 6
- 239000000839 emulsion Substances 0.000 description 6
- 230000007705 epithelial mesenchymal transition Effects 0.000 description 6
- 230000005847 immunogenicity Effects 0.000 description 6
- 208000015181 infectious disease Diseases 0.000 description 6
- 210000000265 leukocyte Anatomy 0.000 description 6
- 150000002632 lipids Chemical class 0.000 description 6
- 230000005012 migration Effects 0.000 description 6
- 239000002243 precursor Substances 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 230000002285 radioactive effect Effects 0.000 description 6
- 230000001105 regulatory effect Effects 0.000 description 6
- 108091092562 ribozyme Proteins 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
- 238000010561 standard procedure Methods 0.000 description 6
- 238000006467 substitution reaction Methods 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- 229960005486 vaccine Drugs 0.000 description 6
- 108020005544 Antisense RNA Proteins 0.000 description 5
- 241000894006 Bacteria Species 0.000 description 5
- 238000002965 ELISA Methods 0.000 description 5
- 241000725303 Human immunodeficiency virus Species 0.000 description 5
- 102000013462 Interleukin-12 Human genes 0.000 description 5
- 108010065805 Interleukin-12 Proteins 0.000 description 5
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 5
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 5
- 239000004472 Lysine Substances 0.000 description 5
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 5
- 239000012980 RPMI-1640 medium Substances 0.000 description 5
- 108020004511 Recombinant DNA Proteins 0.000 description 5
- 102100035071 Vimentin Human genes 0.000 description 5
- 125000000539 amino acid group Chemical group 0.000 description 5
- 239000011324 bead Substances 0.000 description 5
- 238000004113 cell culture Methods 0.000 description 5
- 238000006243 chemical reaction Methods 0.000 description 5
- 238000002512 chemotherapy Methods 0.000 description 5
- 239000003184 complementary RNA Substances 0.000 description 5
- 238000013270 controlled release Methods 0.000 description 5
- 231100000433 cytotoxic Toxicity 0.000 description 5
- 230000007423 decrease Effects 0.000 description 5
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 5
- 239000012091 fetal bovine serum Substances 0.000 description 5
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 5
- 238000009472 formulation Methods 0.000 description 5
- 230000030279 gene silencing Effects 0.000 description 5
- 108020004445 glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 description 5
- 230000003053 immunization Effects 0.000 description 5
- 238000002649 immunization Methods 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 230000002147 killing effect Effects 0.000 description 5
- 239000004005 microsphere Substances 0.000 description 5
- 238000013508 migration Methods 0.000 description 5
- 230000035772 mutation Effects 0.000 description 5
- 230000001575 pathological effect Effects 0.000 description 5
- 239000002953 phosphate buffered saline Substances 0.000 description 5
- 239000013641 positive control Substances 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 230000001629 suppression Effects 0.000 description 5
- 230000009466 transformation Effects 0.000 description 5
- 230000007704 transition Effects 0.000 description 5
- 210000005048 vimentin Anatomy 0.000 description 5
- 229910052727 yttrium Inorganic materials 0.000 description 5
- 102100022900 Actin, cytoplasmic 1 Human genes 0.000 description 4
- 108700028369 Alleles Proteins 0.000 description 4
- 208000003950 B-cell lymphoma Diseases 0.000 description 4
- 102100026189 Beta-galactosidase Human genes 0.000 description 4
- 108700031361 Brachyury Proteins 0.000 description 4
- 108010022366 Carcinoembryonic Antigen Proteins 0.000 description 4
- 102100025475 Carcinoembryonic antigen-related cell adhesion molecule 5 Human genes 0.000 description 4
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 4
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 4
- 241000282412 Homo Species 0.000 description 4
- 102000043129 MHC class I family Human genes 0.000 description 4
- 241000829100 Macaca mulatta polyomavirus 1 Species 0.000 description 4
- 108091005461 Nucleic proteins Proteins 0.000 description 4
- 108091034117 Oligonucleotide Proteins 0.000 description 4
- 102000007066 Prostate-Specific Antigen Human genes 0.000 description 4
- 108010072866 Prostate-Specific Antigen Proteins 0.000 description 4
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 4
- 108010065472 Vimentin Proteins 0.000 description 4
- 238000013459 approach Methods 0.000 description 4
- 108010005774 beta-Galactosidase Proteins 0.000 description 4
- 230000003115 biocidal effect Effects 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 229960002685 biotin Drugs 0.000 description 4
- 235000020958 biotin Nutrition 0.000 description 4
- 239000011616 biotin Substances 0.000 description 4
- 230000010261 cell growth Effects 0.000 description 4
- 238000010367 cloning Methods 0.000 description 4
- 230000004186 co-expression Effects 0.000 description 4
- 230000000875 corresponding effect Effects 0.000 description 4
- 230000018109 developmental process Effects 0.000 description 4
- 238000002405 diagnostic procedure Methods 0.000 description 4
- 238000012377 drug delivery Methods 0.000 description 4
- 210000003527 eukaryotic cell Anatomy 0.000 description 4
- 108020001507 fusion proteins Proteins 0.000 description 4
- 102000037865 fusion proteins Human genes 0.000 description 4
- 208000002672 hepatitis B Diseases 0.000 description 4
- 238000007834 ligase chain reaction Methods 0.000 description 4
- 201000006385 lung benign neoplasm Diseases 0.000 description 4
- 208000037841 lung tumor Diseases 0.000 description 4
- 210000004962 mammalian cell Anatomy 0.000 description 4
- 239000003094 microcapsule Substances 0.000 description 4
- 239000011859 microparticle Substances 0.000 description 4
- 239000002088 nanocapsule Substances 0.000 description 4
- 210000005105 peripheral blood lymphocyte Anatomy 0.000 description 4
- 238000004393 prognosis Methods 0.000 description 4
- 230000006798 recombination Effects 0.000 description 4
- 238000005215 recombination Methods 0.000 description 4
- 230000003362 replicative effect Effects 0.000 description 4
- 150000003839 salts Chemical class 0.000 description 4
- 239000002904 solvent Substances 0.000 description 4
- 230000000087 stabilizing effect Effects 0.000 description 4
- 230000000638 stimulation Effects 0.000 description 4
- 238000002560 therapeutic procedure Methods 0.000 description 4
- 210000003171 tumor-infiltrating lymphocyte Anatomy 0.000 description 4
- 238000001262 western blot Methods 0.000 description 4
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 3
- 108010085238 Actins Proteins 0.000 description 3
- 241000271566 Aves Species 0.000 description 3
- 108050003866 Bifunctional ligase/repressor BirA Proteins 0.000 description 3
- 102100033743 Biotin-[acetyl-CoA-carboxylase] ligase Human genes 0.000 description 3
- 241000702421 Dependoparvovirus Species 0.000 description 3
- 206010015108 Epstein-Barr virus infection Diseases 0.000 description 3
- 108010067306 Fibronectins Proteins 0.000 description 3
- 102000016359 Fibronectins Human genes 0.000 description 3
- 241000700662 Fowlpox virus Species 0.000 description 3
- 241000287828 Gallus gallus Species 0.000 description 3
- 102100031181 Glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 3
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 3
- 241000238631 Hexapoda Species 0.000 description 3
- 102000015696 Interleukins Human genes 0.000 description 3
- 108010063738 Interleukins Proteins 0.000 description 3
- 102000043131 MHC class II family Human genes 0.000 description 3
- 108091054438 MHC class II family Proteins 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 241000699666 Mus <mouse, genus> Species 0.000 description 3
- 241000699670 Mus sp. Species 0.000 description 3
- 108700026244 Open Reading Frames Proteins 0.000 description 3
- 238000011529 RT qPCR Methods 0.000 description 3
- 241000607142 Salmonella Species 0.000 description 3
- 108091023040 Transcription factor Proteins 0.000 description 3
- 102000040945 Transcription factor Human genes 0.000 description 3
- 108020005202 Viral DNA Proteins 0.000 description 3
- 230000001464 adherent effect Effects 0.000 description 3
- 150000001408 amides Chemical class 0.000 description 3
- 238000002869 basic local alignment search tool Methods 0.000 description 3
- 210000000481 breast Anatomy 0.000 description 3
- 229910002091 carbon monoxide Inorganic materials 0.000 description 3
- 230000024245 cell differentiation Effects 0.000 description 3
- 230000004709 cell invasion Effects 0.000 description 3
- 230000012292 cell migration Effects 0.000 description 3
- 238000010276 construction Methods 0.000 description 3
- 238000002784 cytotoxicity assay Methods 0.000 description 3
- 231100000263 cytotoxicity test Toxicity 0.000 description 3
- 230000002950 deficient Effects 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 238000010790 dilution Methods 0.000 description 3
- 239000012895 dilution Substances 0.000 description 3
- 208000035475 disorder Diseases 0.000 description 3
- PRAKJMSDJKAYCZ-UHFFFAOYSA-N dodecahydrosqualene Natural products CC(C)CCCC(C)CCCC(C)CCCCC(C)CCCC(C)CCCC(C)C PRAKJMSDJKAYCZ-UHFFFAOYSA-N 0.000 description 3
- 238000004520 electroporation Methods 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 230000002255 enzymatic effect Effects 0.000 description 3
- 210000000981 epithelium Anatomy 0.000 description 3
- 150000002148 esters Chemical class 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 3
- 230000004927 fusion Effects 0.000 description 3
- 210000002443 helper t lymphocyte Anatomy 0.000 description 3
- 210000002865 immune cell Anatomy 0.000 description 3
- 238000000126 in silico method Methods 0.000 description 3
- 238000011534 incubation Methods 0.000 description 3
- 239000000411 inducer Substances 0.000 description 3
- 230000006698 induction Effects 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 230000009545 invasion Effects 0.000 description 3
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 3
- 210000002540 macrophage Anatomy 0.000 description 3
- 230000036210 malignancy Effects 0.000 description 3
- 210000001161 mammalian embryo Anatomy 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical class ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 3
- 229960004961 mechlorethamine Drugs 0.000 description 3
- 239000012528 membrane Substances 0.000 description 3
- 230000003847 mesoderm development Effects 0.000 description 3
- 150000002736 metal compounds Chemical class 0.000 description 3
- 208000037819 metastatic cancer Diseases 0.000 description 3
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 3
- 239000000693 micelle Substances 0.000 description 3
- 239000002105 nanoparticle Substances 0.000 description 3
- 239000013642 negative control Substances 0.000 description 3
- 239000000816 peptidomimetic Substances 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- 239000002987 primer (paints) Substances 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 230000035755 proliferation Effects 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 230000001177 retroviral effect Effects 0.000 description 3
- 230000035945 sensitivity Effects 0.000 description 3
- 238000012163 sequencing technique Methods 0.000 description 3
- 210000002966 serum Anatomy 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 210000000952 spleen Anatomy 0.000 description 3
- 210000000130 stem cell Anatomy 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- 230000008685 targeting Effects 0.000 description 3
- 208000001608 teratocarcinoma Diseases 0.000 description 3
- 230000035899 viability Effects 0.000 description 3
- 210000005253 yeast cell Anatomy 0.000 description 3
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 2
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 2
- 102100034035 Alcohol dehydrogenase 1A Human genes 0.000 description 2
- 241000700663 Avipoxvirus Species 0.000 description 2
- 108010045634 B7 Antigens Proteins 0.000 description 2
- 102000005738 B7 Antigens Human genes 0.000 description 2
- 101150089247 B7 gene Proteins 0.000 description 2
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 2
- 102000000905 Cadherin Human genes 0.000 description 2
- 108050007957 Cadherin Proteins 0.000 description 2
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 2
- 241000700664 Capripoxvirus Species 0.000 description 2
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 2
- 108010078791 Carrier Proteins Proteins 0.000 description 2
- 101000741396 Chlamydia muridarum (strain MoPn / Nigg) Probable oxidoreductase TC_0900 Proteins 0.000 description 2
- 101000741399 Chlamydia pneumoniae Probable oxidoreductase CPn_0761/CP_1111/CPj0761/CpB0789 Proteins 0.000 description 2
- 101000741400 Chlamydia trachomatis (strain D/UW-3/Cx) Probable oxidoreductase CT_610 Proteins 0.000 description 2
- 201000009047 Chordoma Diseases 0.000 description 2
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 2
- 108020004635 Complementary DNA Proteins 0.000 description 2
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 2
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 2
- 241000450599 DNA viruses Species 0.000 description 2
- 241000701959 Escherichia virus Lambda Species 0.000 description 2
- 101150073066 F13L gene Proteins 0.000 description 2
- 101150112014 Gapdh gene Proteins 0.000 description 2
- 102100041003 Glutamate carboxypeptidase 2 Human genes 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 108010086377 HLA-A3 Antigen Proteins 0.000 description 2
- 101000892862 Homo sapiens Glutamate carboxypeptidase 2 Proteins 0.000 description 2
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 2
- 101100321817 Human parvovirus B19 (strain HV) 7.5K gene Proteins 0.000 description 2
- VSNHCAURESNICA-UHFFFAOYSA-N Hydroxyurea Chemical compound NC(=O)NO VSNHCAURESNICA-UHFFFAOYSA-N 0.000 description 2
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 2
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 2
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 2
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 2
- 108010050904 Interferons Proteins 0.000 description 2
- 102000014150 Interferons Human genes 0.000 description 2
- 102000004388 Interleukin-4 Human genes 0.000 description 2
- 108090000978 Interleukin-4 Proteins 0.000 description 2
- 241001138401 Kluyveromyces lactis Species 0.000 description 2
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 2
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 2
- 102000018697 Membrane Proteins Human genes 0.000 description 2
- 108010052285 Membrane Proteins Proteins 0.000 description 2
- 229930192392 Mitomycin Natural products 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 2
- 238000005481 NMR spectroscopy Methods 0.000 description 2
- 208000034176 Neoplasms, Germ Cell and Embryonal Diseases 0.000 description 2
- 241000700629 Orthopoxvirus Species 0.000 description 2
- 101100054289 Oryza sativa subsp. japonica ABCG34 gene Proteins 0.000 description 2
- 238000012408 PCR amplification Methods 0.000 description 2
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 2
- 102100028251 Phosphoglycerate kinase 1 Human genes 0.000 description 2
- 101710139464 Phosphoglycerate kinase 1 Proteins 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- 241000288906 Primates Species 0.000 description 2
- 101710120463 Prostate stem cell antigen Proteins 0.000 description 2
- 102100036735 Prostate stem cell antigen Human genes 0.000 description 2
- 102220465562 Putative uncharacterized protein OBSCN-AS1_F13L_mutation Human genes 0.000 description 2
- 108091028664 Ribonucleotide Proteins 0.000 description 2
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 2
- 108091081024 Start codon Proteins 0.000 description 2
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 2
- MUMGGOZAMZWBJJ-DYKIIFRCSA-N Testostosterone Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 MUMGGOZAMZWBJJ-DYKIIFRCSA-N 0.000 description 2
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 2
- 108010046334 Urease Proteins 0.000 description 2
- 101100502046 Vaccinia virus (strain Western Reserve) VACWR052 gene Proteins 0.000 description 2
- 101100502047 Variola virus (isolate Human/India/Ind3/1967) C17L gene Proteins 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 125000003545 alkoxy group Chemical group 0.000 description 2
- 125000000217 alkyl group Chemical group 0.000 description 2
- 229940100198 alkylating agent Drugs 0.000 description 2
- 239000002168 alkylating agent Substances 0.000 description 2
- 238000004873 anchoring Methods 0.000 description 2
- 239000005557 antagonist Substances 0.000 description 2
- 230000005875 antibody response Effects 0.000 description 2
- 239000002256 antimetabolite Substances 0.000 description 2
- 230000002238 attenuated effect Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 230000031018 biological processes and functions Effects 0.000 description 2
- 238000001574 biopsy Methods 0.000 description 2
- 210000004204 blood vessel Anatomy 0.000 description 2
- KQNZDYYTLMIZCT-KQPMLPITSA-N brefeldin A Chemical compound O[C@@H]1\C=C\C(=O)O[C@@H](C)CCC\C=C\[C@@H]2C[C@H](O)C[C@H]21 KQNZDYYTLMIZCT-KQPMLPITSA-N 0.000 description 2
- JUMGSHROWPPKFX-UHFFFAOYSA-N brefeldin-A Natural products CC1CCCC=CC2(C)CC(O)CC2(C)C(O)C=CC(=O)O1 JUMGSHROWPPKFX-UHFFFAOYSA-N 0.000 description 2
- 229960002092 busulfan Drugs 0.000 description 2
- 208000035269 cancer or benign tumor Diseases 0.000 description 2
- 239000005018 casein Substances 0.000 description 2
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 2
- 235000021240 caseins Nutrition 0.000 description 2
- 210000000170 cell membrane Anatomy 0.000 description 2
- 230000004663 cell proliferation Effects 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 238000003501 co-culture Methods 0.000 description 2
- 210000002808 connective tissue Anatomy 0.000 description 2
- 239000000599 controlled substance Substances 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 230000001461 cytolytic effect Effects 0.000 description 2
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 2
- 229960000975 daunorubicin Drugs 0.000 description 2
- 239000005547 deoxyribonucleotide Substances 0.000 description 2
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 239000002158 endotoxin Substances 0.000 description 2
- 239000003623 enhancer Substances 0.000 description 2
- 230000002708 enhancing effect Effects 0.000 description 2
- 210000002919 epithelial cell Anatomy 0.000 description 2
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 2
- 229960005420 etoposide Drugs 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 230000001605 fetal effect Effects 0.000 description 2
- 210000003754 fetus Anatomy 0.000 description 2
- 210000002950 fibroblast Anatomy 0.000 description 2
- 238000000684 flow cytometry Methods 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 230000002538 fungal effect Effects 0.000 description 2
- 102000054078 gamma Catenin Human genes 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 238000009650 gentamicin protection assay Methods 0.000 description 2
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 2
- 102000006602 glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 2
- 230000013595 glycosylation Effects 0.000 description 2
- 238000006206 glycosylation reaction Methods 0.000 description 2
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 230000009033 hematopoietic malignancy Effects 0.000 description 2
- 230000006801 homologous recombination Effects 0.000 description 2
- 238000002744 homologous recombination Methods 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 230000008348 humoral response Effects 0.000 description 2
- CBFCDTFDPHXCNY-UHFFFAOYSA-N icosane Chemical compound CCCCCCCCCCCCCCCCCCCC CBFCDTFDPHXCNY-UHFFFAOYSA-N 0.000 description 2
- 210000000987 immune system Anatomy 0.000 description 2
- 230000036039 immunity Effects 0.000 description 2
- 238000003018 immunoassay Methods 0.000 description 2
- 229940072221 immunoglobulins Drugs 0.000 description 2
- 230000002055 immunohistochemical effect Effects 0.000 description 2
- 239000007943 implant Substances 0.000 description 2
- 230000001976 improved effect Effects 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 230000002452 interceptive effect Effects 0.000 description 2
- 229940079322 interferon Drugs 0.000 description 2
- 229940028885 interleukin-4 Drugs 0.000 description 2
- 238000010255 intramuscular injection Methods 0.000 description 2
- 239000007927 intramuscular injection Substances 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 101150066555 lacZ gene Proteins 0.000 description 2
- IZWSFJTYBVKZNK-UHFFFAOYSA-N lauryl sulfobetaine Chemical compound CCCCCCCCCCCC[N+](C)(C)CCCS([O-])(=O)=O IZWSFJTYBVKZNK-UHFFFAOYSA-N 0.000 description 2
- 230000003902 lesion Effects 0.000 description 2
- 229920006008 lipopolysaccharide Polymers 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 238000012423 maintenance Methods 0.000 description 2
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 2
- 210000004379 membrane Anatomy 0.000 description 2
- 229960000485 methotrexate Drugs 0.000 description 2
- 238000010232 migration assay Methods 0.000 description 2
- 229960004857 mitomycin Drugs 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 210000001616 monocyte Anatomy 0.000 description 2
- 239000002077 nanosphere Substances 0.000 description 2
- 229930014626 natural product Natural products 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 238000007899 nucleic acid hybridization Methods 0.000 description 2
- 238000011275 oncology therapy Methods 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 210000003463 organelle Anatomy 0.000 description 2
- 230000008520 organization Effects 0.000 description 2
- 230000002018 overexpression Effects 0.000 description 2
- 201000002528 pancreatic cancer Diseases 0.000 description 2
- 208000008443 pancreatic carcinoma Diseases 0.000 description 2
- 210000005259 peripheral blood Anatomy 0.000 description 2
- 239000011886 peripheral blood Substances 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 230000004983 pleiotropic effect Effects 0.000 description 2
- 239000004417 polycarbonate Substances 0.000 description 2
- 229920000515 polycarbonate Polymers 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 2
- 229920000136 polysorbate Polymers 0.000 description 2
- 230000004481 post-translational protein modification Effects 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 230000002062 proliferating effect Effects 0.000 description 2
- 238000001742 protein purification Methods 0.000 description 2
- 210000001938 protoplast Anatomy 0.000 description 2
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 2
- 238000003127 radioimmunoassay Methods 0.000 description 2
- 238000003156 radioimmunoprecipitation Methods 0.000 description 2
- 230000000284 resting effect Effects 0.000 description 2
- 108091008146 restriction endonucleases Proteins 0.000 description 2
- 230000000717 retained effect Effects 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 239000002336 ribonucleotide Substances 0.000 description 2
- 125000002652 ribonucleotide group Chemical group 0.000 description 2
- FGDZQCVHDSGLHJ-UHFFFAOYSA-M rubidium chloride Chemical compound [Cl-].[Rb+] FGDZQCVHDSGLHJ-UHFFFAOYSA-M 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 229910052709 silver Inorganic materials 0.000 description 2
- 239000004332 silver Substances 0.000 description 2
- 230000002269 spontaneous effect Effects 0.000 description 2
- 238000010186 staining Methods 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 238000010254 subcutaneous injection Methods 0.000 description 2
- 239000007929 subcutaneous injection Substances 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 150000008163 sugars Chemical class 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- KMXFZRSJMDYPPG-UHFFFAOYSA-N tetratetracontane Chemical compound CCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCC KMXFZRSJMDYPPG-UHFFFAOYSA-N 0.000 description 2
- 239000010936 titanium Substances 0.000 description 2
- 229910052719 titanium Inorganic materials 0.000 description 2
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 2
- 230000002103 transcriptional effect Effects 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- JXLYSJRDGCGARV-CFWMRBGOSA-N vinblastine Chemical compound C([C@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-CFWMRBGOSA-N 0.000 description 2
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 2
- 229960004528 vincristine Drugs 0.000 description 2
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- DIGQNXIGRZPYDK-WKSCXVIASA-N (2R)-6-amino-2-[[2-[[(2S)-2-[[2-[[(2R)-2-[[(2S)-2-[[(2R,3S)-2-[[2-[[(2S)-2-[[2-[[(2S)-2-[[(2S)-2-[[(2R)-2-[[(2S,3S)-2-[[(2R)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[2-[[(2S)-2-[[(2R)-2-[[2-[[2-[[2-[(2-amino-1-hydroxyethylidene)amino]-3-carboxy-1-hydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1,5-dihydroxy-5-iminopentylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]hexanoic acid Chemical compound C[C@@H]([C@@H](C(=N[C@@H](CS)C(=N[C@@H](C)C(=N[C@@H](CO)C(=NCC(=N[C@@H](CCC(=N)O)C(=NC(CS)C(=N[C@H]([C@H](C)O)C(=N[C@H](CS)C(=N[C@H](CO)C(=NCC(=N[C@H](CS)C(=NCC(=N[C@H](CCCCN)C(=O)O)O)O)O)O)O)O)O)O)O)O)O)O)O)N=C([C@H](CS)N=C([C@H](CO)N=C([C@H](CO)N=C([C@H](C)N=C(CN=C([C@H](CO)N=C([C@H](CS)N=C(CN=C(C(CS)N=C(C(CC(=O)O)N=C(CN)O)O)O)O)O)O)O)O)O)O)O)O DIGQNXIGRZPYDK-WKSCXVIASA-N 0.000 description 1
- FQVLRGLGWNWPSS-BXBUPLCLSA-N (4r,7s,10s,13s,16r)-16-acetamido-13-(1h-imidazol-5-ylmethyl)-10-methyl-6,9,12,15-tetraoxo-7-propan-2-yl-1,2-dithia-5,8,11,14-tetrazacycloheptadecane-4-carboxamide Chemical compound N1C(=O)[C@@H](NC(C)=O)CSSC[C@@H](C(N)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](C)NC(=O)[C@@H]1CC1=CN=CN1 FQVLRGLGWNWPSS-BXBUPLCLSA-N 0.000 description 1
- YYGNTYWPHWGJRM-UHFFFAOYSA-N (6E,10E,14E,18E)-2,6,10,15,19,23-hexamethyltetracosa-2,6,10,14,18,22-hexaene Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC=C(C)CCC=C(C)CCC=C(C)C YYGNTYWPHWGJRM-UHFFFAOYSA-N 0.000 description 1
- 102100025573 1-alkyl-2-acetylglycerophosphocholine esterase Human genes 0.000 description 1
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 1
- BFPYWIDHMRZLRN-UHFFFAOYSA-N 17alpha-ethynyl estradiol Natural products OC1=CC=C2C3CCC(C)(C(CC4)(O)C#C)C4C3CCC2=C1 BFPYWIDHMRZLRN-UHFFFAOYSA-N 0.000 description 1
- OBYNJKLOYWCXEP-UHFFFAOYSA-N 2-[3-(dimethylamino)-6-dimethylazaniumylidenexanthen-9-yl]-4-isothiocyanatobenzoate Chemical compound C=12C=CC(=[N+](C)C)C=C2OC2=CC(N(C)C)=CC=C2C=1C1=CC(N=C=S)=CC=C1C([O-])=O OBYNJKLOYWCXEP-UHFFFAOYSA-N 0.000 description 1
- IQUPABOKLQSFBK-UHFFFAOYSA-N 2-nitrophenol Chemical compound OC1=CC=CC=C1[N+]([O-])=O IQUPABOKLQSFBK-UHFFFAOYSA-N 0.000 description 1
- NDMPLJNOPCLANR-UHFFFAOYSA-N 3,4-dihydroxy-15-(4-hydroxy-18-methoxycarbonyl-5,18-seco-ibogamin-18-yl)-16-methoxy-1-methyl-6,7-didehydro-aspidospermidine-3-carboxylic acid methyl ester Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 NDMPLJNOPCLANR-UHFFFAOYSA-N 0.000 description 1
- IDPUKCWIGUEADI-UHFFFAOYSA-N 5-[bis(2-chloroethyl)amino]uracil Chemical compound ClCCN(CCCl)C1=CNC(=O)NC1=O IDPUKCWIGUEADI-UHFFFAOYSA-N 0.000 description 1
- WYWHKKSPHMUBEB-UHFFFAOYSA-N 6-Mercaptoguanine Natural products N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 1
- XZIIFPSPUDAGJM-UHFFFAOYSA-N 6-chloro-2-n,2-n-diethylpyrimidine-2,4-diamine Chemical compound CCN(CC)C1=NC(N)=CC(Cl)=N1 XZIIFPSPUDAGJM-UHFFFAOYSA-N 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical group CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 description 1
- 102000005606 Activins Human genes 0.000 description 1
- 108010059616 Activins Proteins 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 101710187578 Alcohol dehydrogenase 1 Proteins 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 208000000058 Anaplasia Diseases 0.000 description 1
- 101100433746 Arabidopsis thaliana ABCG29 gene Proteins 0.000 description 1
- 101100433755 Arabidopsis thaliana ABCG31 gene Proteins 0.000 description 1
- 101100054297 Arabidopsis thaliana ABCG38 gene Proteins 0.000 description 1
- 101100054299 Arabidopsis thaliana ABCG39 gene Proteins 0.000 description 1
- 101100107598 Arabidopsis thaliana ABCG43 gene Proteins 0.000 description 1
- 108010024976 Asparaginase Proteins 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 241001203868 Autographa californica Species 0.000 description 1
- 241000201370 Autographa californica nucleopolyhedrovirus Species 0.000 description 1
- 238000009020 BCA Protein Assay Kit Methods 0.000 description 1
- 241000193830 Bacillus <bacterium> Species 0.000 description 1
- 244000063299 Bacillus subtilis Species 0.000 description 1
- 235000014469 Bacillus subtilis Nutrition 0.000 description 1
- 108091032955 Bacterial small RNA Proteins 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 241000701822 Bovine papillomavirus Species 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- CIUUIPMOFZIWIZ-UHFFFAOYSA-N Bropirimine Chemical compound NC1=NC(O)=C(Br)C(C=2C=CC=CC=2)=N1 CIUUIPMOFZIWIZ-UHFFFAOYSA-N 0.000 description 1
- 210000001239 CD8-positive, alpha-beta cytotoxic T lymphocyte Anatomy 0.000 description 1
- FVLVBPDQNARYJU-XAHDHGMMSA-N C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O Chemical compound C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O FVLVBPDQNARYJU-XAHDHGMMSA-N 0.000 description 1
- 101100327917 Caenorhabditis elegans chup-1 gene Proteins 0.000 description 1
- 241000178270 Canarypox virus Species 0.000 description 1
- 108700000434 Cannabis sativa edestin Proteins 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 208000005623 Carcinogenesis Diseases 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 241000700199 Cavia porcellus Species 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 201000006082 Chickenpox Diseases 0.000 description 1
- JWBOIMRXGHLCPP-UHFFFAOYSA-N Chloditan Chemical compound C=1C=CC=C(Cl)C=1C(C(Cl)Cl)C1=CC=C(Cl)C=C1 JWBOIMRXGHLCPP-UHFFFAOYSA-N 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- PTOAARAWEBMLNO-KVQBGUIXSA-N Cladribine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PTOAARAWEBMLNO-KVQBGUIXSA-N 0.000 description 1
- 241000272201 Columbiformes Species 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 102100021906 Cyclin-O Human genes 0.000 description 1
- 229920000858 Cyclodextrin Polymers 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- 150000008574 D-amino acids Chemical class 0.000 description 1
- 239000003155 DNA primer Substances 0.000 description 1
- 238000001712 DNA sequencing Methods 0.000 description 1
- 230000004568 DNA-binding Effects 0.000 description 1
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 1
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 1
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 1
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- SHIBSTMRCDJXLN-UHFFFAOYSA-N Digoxigenin Natural products C1CC(C2C(C3(C)CCC(O)CC3CC2)CC2O)(O)C2(C)C1C1=CC(=O)OC1 SHIBSTMRCDJXLN-UHFFFAOYSA-N 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 208000006586 Ectromelia Diseases 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 102000005593 Endopeptidases Human genes 0.000 description 1
- 108010059378 Endopeptidases Proteins 0.000 description 1
- 102100030013 Endoribonuclease Human genes 0.000 description 1
- 108010093099 Endoribonucleases Proteins 0.000 description 1
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 1
- BFPYWIDHMRZLRN-SLHNCBLASA-N Ethinyl estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 BFPYWIDHMRZLRN-SLHNCBLASA-N 0.000 description 1
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 1
- 108091029865 Exogenous DNA Proteins 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 108091092566 Extrachromosomal DNA Proteins 0.000 description 1
- 102000008857 Ferritin Human genes 0.000 description 1
- 108050000784 Ferritin Proteins 0.000 description 1
- 238000008416 Ferritin Methods 0.000 description 1
- 229920001917 Ficoll Polymers 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- 101000892220 Geobacillus thermodenitrificans (strain NG80-2) Long-chain-alcohol dehydrogenase 1 Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 206010018691 Granuloma Diseases 0.000 description 1
- 208000031886 HIV Infections Diseases 0.000 description 1
- 208000037357 HIV infectious disease Diseases 0.000 description 1
- 108010013476 HLA-A24 Antigen Proteins 0.000 description 1
- 208000009889 Herpes Simplex Diseases 0.000 description 1
- 102100030483 Histatin-1 Human genes 0.000 description 1
- 108010088652 Histocompatibility Antigens Class I Proteins 0.000 description 1
- 101000756632 Homo sapiens Actin, cytoplasmic 1 Proteins 0.000 description 1
- 101000780443 Homo sapiens Alcohol dehydrogenase 1A Proteins 0.000 description 1
- 101000897441 Homo sapiens Cyclin-O Proteins 0.000 description 1
- 101001027128 Homo sapiens Fibronectin Proteins 0.000 description 1
- 101000746373 Homo sapiens Granulocyte-macrophage colony-stimulating factor Proteins 0.000 description 1
- 101001082500 Homo sapiens Histatin-1 Proteins 0.000 description 1
- 101001002657 Homo sapiens Interleukin-2 Proteins 0.000 description 1
- 101001002709 Homo sapiens Interleukin-4 Proteins 0.000 description 1
- 101000691574 Homo sapiens Junction plakoglobin Proteins 0.000 description 1
- 101001021281 Homo sapiens Protein HEXIM1 Proteins 0.000 description 1
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 1
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 1
- 101100152582 Homo sapiens TBX2 gene Proteins 0.000 description 1
- 101000803403 Homo sapiens Vimentin Proteins 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical class Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- 102000004157 Hydrolases Human genes 0.000 description 1
- 108090000604 Hydrolases Proteins 0.000 description 1
- DOMWKUIIPQCAJU-LJHIYBGHSA-N Hydroxyprogesterone caproate Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)CCCCC)[C@@]1(C)CC2 DOMWKUIIPQCAJU-LJHIYBGHSA-N 0.000 description 1
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 1
- XDXDZDZNSLXDNA-UHFFFAOYSA-N Idarubicin Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XDXDZDZNSLXDNA-UHFFFAOYSA-N 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 102100022339 Integrin alpha-L Human genes 0.000 description 1
- 102100037872 Intercellular adhesion molecule 2 Human genes 0.000 description 1
- 101710148794 Intercellular adhesion molecule 2 Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108090000174 Interleukin-10 Proteins 0.000 description 1
- 108090000172 Interleukin-15 Proteins 0.000 description 1
- 108010002386 Interleukin-3 Proteins 0.000 description 1
- 108091092195 Intron Proteins 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- 150000008575 L-amino acids Chemical class 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 241000713666 Lentivirus Species 0.000 description 1
- HLFSDGLLUJUHTE-SNVBAGLBSA-N Levamisole Chemical compound C1([C@H]2CN3CCSC3=N2)=CC=CC=C1 HLFSDGLLUJUHTE-SNVBAGLBSA-N 0.000 description 1
- 206010024503 Limb reduction defect Diseases 0.000 description 1
- 108090001030 Lipoproteins Proteins 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 108010064548 Lymphocyte Function-Associated Antigen-1 Proteins 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- 101150068888 MET3 gene Proteins 0.000 description 1
- 241000282553 Macaca Species 0.000 description 1
- 108010046938 Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102000007651 Macrophage Colony-Stimulating Factor Human genes 0.000 description 1
- 101710175243 Major antigen Proteins 0.000 description 1
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 102000003792 Metallothionein Human genes 0.000 description 1
- 108090000157 Metallothionein Proteins 0.000 description 1
- 241000700627 Monkeypox virus Species 0.000 description 1
- 101100243377 Mus musculus Pepd gene Proteins 0.000 description 1
- 101710150912 Myc protein Proteins 0.000 description 1
- 241001467552 Mycobacterium bovis BCG Species 0.000 description 1
- 241000204031 Mycoplasma Species 0.000 description 1
- 108050000637 N-cadherin Proteins 0.000 description 1
- 108010046117 N-palmitoyl-5,6-dipalmitoyl-S-glycerylcysteinyl-seryl-serine Proteins 0.000 description 1
- 108091061960 Naked DNA Proteins 0.000 description 1
- 208000002454 Nasopharyngeal Carcinoma Diseases 0.000 description 1
- 206010061306 Nasopharyngeal cancer Diseases 0.000 description 1
- 241000221960 Neurospora Species 0.000 description 1
- 101100022915 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) cys-11 gene Proteins 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 101100054291 Oryza sativa subsp. japonica ABCG35 gene Proteins 0.000 description 1
- 101100054294 Oryza sativa subsp. japonica ABCG36 gene Proteins 0.000 description 1
- 101100054298 Oryza sativa subsp. japonica ABCG38 gene Proteins 0.000 description 1
- 101100107601 Oryza sativa subsp. japonica ABCG45 gene Proteins 0.000 description 1
- 101100107604 Oryza sativa subsp. japonica ABCG48 gene Proteins 0.000 description 1
- 238000010222 PCR analysis Methods 0.000 description 1
- 101150088582 PDR1 gene Proteins 0.000 description 1
- 101150078988 PDR3 gene Proteins 0.000 description 1
- 101150012394 PHO5 gene Proteins 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 241000282577 Pan troglodytes Species 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 241000009328 Perro Species 0.000 description 1
- 241000286209 Phasianidae Species 0.000 description 1
- 108010004729 Phycoerythrin Proteins 0.000 description 1
- 208000000474 Poliomyelitis Diseases 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 229920001214 Polysorbate 60 Polymers 0.000 description 1
- 102100035703 Prostatic acid phosphatase Human genes 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 108010066717 Q beta Replicase Proteins 0.000 description 1
- 230000007022 RNA scission Effects 0.000 description 1
- 108091030071 RNAI Proteins 0.000 description 1
- 239000012979 RPMI medium Substances 0.000 description 1
- 241000700564 Rabbit fibroma virus Species 0.000 description 1
- 241000700638 Raccoonpox virus Species 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 208000007660 Residual Neoplasm Diseases 0.000 description 1
- 101150030513 SNQ2 gene Proteins 0.000 description 1
- 101100386089 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) MET17 gene Proteins 0.000 description 1
- 101100519252 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) PDR10 gene Proteins 0.000 description 1
- 101100519253 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) PDR11 gene Proteins 0.000 description 1
- 101100519255 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) PDR15 gene Proteins 0.000 description 1
- 101100160470 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) YOR1 gene Proteins 0.000 description 1
- 241000293869 Salmonella enterica subsp. enterica serovar Typhimurium Species 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- 101100022918 Schizosaccharomyces pombe (strain 972 / ATCC 24843) sua1 gene Proteins 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- 241000287219 Serinus canaria Species 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- 102000007562 Serum Albumin Human genes 0.000 description 1
- 108020004682 Single-Stranded DNA Proteins 0.000 description 1
- 101710147732 Small envelope protein Proteins 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- PRXRUNOAOLTIEF-ADSICKODSA-N Sorbitan trioleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@@H](OC(=O)CCCCCCC\C=C/CCCCCCCC)[C@H]1OC[C@H](O)[C@H]1OC(=O)CCCCCCC\C=C/CCCCCCCC PRXRUNOAOLTIEF-ADSICKODSA-N 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- 241000700568 Suipoxvirus Species 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- 230000006044 T cell activation Effects 0.000 description 1
- 230000024932 T cell mediated immunity Effects 0.000 description 1
- 108091008874 T cell receptors Proteins 0.000 description 1
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 1
- 102000052935 T-box transcription factor Human genes 0.000 description 1
- 108700035811 T-box transcription factor Proteins 0.000 description 1
- 102100025237 T-cell surface antigen CD2 Human genes 0.000 description 1
- 101710165202 T-cell surface antigen CD2 Proteins 0.000 description 1
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 1
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 1
- 101150003725 TK gene Proteins 0.000 description 1
- 101150084279 TM gene Proteins 0.000 description 1
- 241001365914 Taira Species 0.000 description 1
- 229940123237 Taxane Drugs 0.000 description 1
- GKLVYJBZJHMRIY-OUBTZVSYSA-N Technetium-99 Chemical compound [99Tc] GKLVYJBZJHMRIY-OUBTZVSYSA-N 0.000 description 1
- BHEOSNUKNHRBNM-UHFFFAOYSA-N Tetramethylsqualene Natural products CC(=C)C(C)CCC(=C)C(C)CCC(C)=CCCC=C(C)CCC(C)C(=C)CCC(C)C(C)=C BHEOSNUKNHRBNM-UHFFFAOYSA-N 0.000 description 1
- 229920002359 Tetronic® Polymers 0.000 description 1
- 201000005485 Toxoplasmosis Diseases 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 101100400877 Trichophyton rubrum (strain ATCC MYA-4607 / CBS 118892) MDR1 gene Proteins 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 101710120355 Uncharacterized membrane protein ycf78 Proteins 0.000 description 1
- 206010046980 Varicella Diseases 0.000 description 1
- 241000700647 Variola virus Species 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- 229940122803 Vinca alkaloid Drugs 0.000 description 1
- 108010067390 Viral Proteins Proteins 0.000 description 1
- 241000269370 Xenopus <genus> Species 0.000 description 1
- UZQJVUCHXGYFLQ-AYDHOLPZSA-N [(2s,3r,4s,5r,6r)-4-[(2s,3r,4s,5r,6r)-4-[(2r,3r,4s,5r,6r)-4-[(2s,3r,4s,5r,6r)-3,5-dihydroxy-6-(hydroxymethyl)-4-[(2s,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoxan-2-yl]oxy-3,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-3,5-dihydroxy-6-(hy Chemical compound O([C@H]1[C@H](O)[C@@H](CO)O[C@H]([C@@H]1O)O[C@H]1[C@H](O)[C@@H](CO)O[C@H]([C@@H]1O)O[C@H]1CC[C@]2(C)[C@H]3CC=C4[C@@]([C@@]3(CC[C@H]2[C@@]1(C=O)C)C)(C)CC(O)[C@]1(CCC(CC14)(C)C)C(=O)O[C@H]1[C@@H]([C@@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O[C@H]4[C@@H]([C@@H](O[C@H]5[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O5)O)[C@H](O)[C@@H](CO)O4)O)[C@H](O)[C@@H](CO)O3)O)[C@H](O)[C@@H](CO)O2)O)[C@H](O)[C@@H](CO)O1)O)[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O UZQJVUCHXGYFLQ-AYDHOLPZSA-N 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 206010000210 abortion Diseases 0.000 description 1
- 231100000176 abortion Toxicity 0.000 description 1
- 230000001133 acceleration Effects 0.000 description 1
- 159000000021 acetate salts Chemical class 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000000488 activin Substances 0.000 description 1
- 208000009956 adenocarcinoma Diseases 0.000 description 1
- 210000004404 adrenal cortex Anatomy 0.000 description 1
- 229940009456 adriamycin Drugs 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 229940098174 alkeran Drugs 0.000 description 1
- 125000003282 alkyl amino group Chemical group 0.000 description 1
- 150000008052 alkyl sulfonates Chemical class 0.000 description 1
- 108010004469 allophycocyanin Proteins 0.000 description 1
- 229940037003 alum Drugs 0.000 description 1
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- ILRRQNADMUWWFW-UHFFFAOYSA-K aluminium phosphate Chemical compound O1[Al]2OP1(=O)O2 ILRRQNADMUWWFW-UHFFFAOYSA-K 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- ROBVIMPUHSLWNV-UHFFFAOYSA-N aminoglutethimide Chemical compound C=1C=C(N)C=CC=1C1(CC)CCC(=O)NC1=O ROBVIMPUHSLWNV-UHFFFAOYSA-N 0.000 description 1
- 229960003437 aminoglutethimide Drugs 0.000 description 1
- 230000003698 anagen phase Effects 0.000 description 1
- 239000003098 androgen Substances 0.000 description 1
- 229940030486 androgens Drugs 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 229940046836 anti-estrogen Drugs 0.000 description 1
- 230000001833 anti-estrogenic effect Effects 0.000 description 1
- 230000000340 anti-metabolite Effects 0.000 description 1
- 230000001857 anti-mycotic effect Effects 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 230000006023 anti-tumor response Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 230000030741 antigen processing and presentation Effects 0.000 description 1
- 229940100197 antimetabolite Drugs 0.000 description 1
- 229940045687 antimetabolites folic acid analogs Drugs 0.000 description 1
- 239000002543 antimycotic Substances 0.000 description 1
- 229940034982 antineoplastic agent Drugs 0.000 description 1
- 238000003491 array Methods 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 238000011888 autopsy Methods 0.000 description 1
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 1
- 229960000190 bacillus calmette–guérin vaccine Drugs 0.000 description 1
- 230000010310 bacterial transformation Effects 0.000 description 1
- 239000003855 balanced salt solution Substances 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 150000001558 benzoic acid derivatives Chemical class 0.000 description 1
- 102000015736 beta 2-Microglobulin Human genes 0.000 description 1
- 108010081355 beta 2-Microglobulin Proteins 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 229940108502 bicnu Drugs 0.000 description 1
- 239000000227 bioadhesive Substances 0.000 description 1
- 238000003766 bioinformatics method Methods 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 229920001400 block copolymer Polymers 0.000 description 1
- 238000004820 blood count Methods 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 230000036760 body temperature Effects 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 229950009494 bropirimine Drugs 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 238000010804 cDNA synthesis Methods 0.000 description 1
- GMRQFYUYWCNGIN-NKMMMXOESA-N calcitriol Chemical compound C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@@H](CCCC(C)(C)O)C)=C\C=C1\C[C@@H](O)C[C@H](O)C1=C GMRQFYUYWCNGIN-NKMMMXOESA-N 0.000 description 1
- 229960005084 calcitriol Drugs 0.000 description 1
- 235000020964 calcitriol Nutrition 0.000 description 1
- 239000011612 calcitriol Substances 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 229940088954 camptosar Drugs 0.000 description 1
- 230000036952 cancer formation Effects 0.000 description 1
- 238000002619 cancer immunotherapy Methods 0.000 description 1
- 239000012830 cancer therapeutic Substances 0.000 description 1
- 229940022399 cancer vaccine Drugs 0.000 description 1
- 238000009566 cancer vaccine Methods 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 235000013877 carbamide Nutrition 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 125000002843 carboxylic acid group Chemical group 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- 229960005243 carmustine Drugs 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 230000020411 cell activation Effects 0.000 description 1
- 238000000423 cell based assay Methods 0.000 description 1
- 230000005779 cell damage Effects 0.000 description 1
- 208000037887 cell injury Diseases 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 210000002421 cell wall Anatomy 0.000 description 1
- 230000007969 cellular immunity Effects 0.000 description 1
- 239000004568 cement Substances 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000013043 chemical agent Substances 0.000 description 1
- 125000003636 chemical group Chemical group 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 238000002038 chemiluminescence detection Methods 0.000 description 1
- 229940044683 chemotherapy drug Drugs 0.000 description 1
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 1
- 229960004630 chlorambucil Drugs 0.000 description 1
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 239000003593 chromogenic compound Substances 0.000 description 1
- 239000013611 chromosomal DNA Substances 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- 229960002436 cladribine Drugs 0.000 description 1
- 238000011260 co-administration Methods 0.000 description 1
- 238000000975 co-precipitation Methods 0.000 description 1
- 238000007398 colorimetric assay Methods 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 238000005094 computer simulation Methods 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- 230000004940 costimulation Effects 0.000 description 1
- GICLSALZHXCILJ-UHFFFAOYSA-N ctk5a5089 Chemical compound NCC(O)=O.NCC(O)=O GICLSALZHXCILJ-UHFFFAOYSA-N 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 229940097362 cyclodextrins Drugs 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 229960000684 cytarabine Drugs 0.000 description 1
- 230000016396 cytokine production Effects 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 230000007402 cytotoxic response Effects 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 229960003901 dacarbazine Drugs 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- 238000007418 data mining Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 229920006237 degradable polymer Polymers 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 230000004041 dendritic cell maturation Effects 0.000 description 1
- CFCUWKMKBJTWLW-UHFFFAOYSA-N deoliosyl-3C-alpha-L-digitoxosyl-MTM Natural products CC=1C(O)=C2C(O)=C3C(=O)C(OC4OC(C)C(O)C(OC5OC(C)C(O)C(OC6OC(C)C(O)C(C)(O)C6)C5)C4)C(C(OC)C(=O)C(O)C(C)O)CC3=CC2=CC=1OC(OC(C)C1O)CC1OC1CC(O)C(O)C(C)O1 CFCUWKMKBJTWLW-UHFFFAOYSA-N 0.000 description 1
- 230000002074 deregulated effect Effects 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 125000004663 dialkyl amino group Chemical group 0.000 description 1
- RGLYKWWBQGJZGM-ISLYRVAYSA-N diethylstilbestrol Chemical compound C=1C=C(O)C=CC=1C(/CC)=C(\CC)C1=CC=C(O)C=C1 RGLYKWWBQGJZGM-ISLYRVAYSA-N 0.000 description 1
- 229960000452 diethylstilbestrol Drugs 0.000 description 1
- QONQRTHLHBTMGP-UHFFFAOYSA-N digitoxigenin Natural products CC12CCC(C3(CCC(O)CC3CC3)C)C3C11OC1CC2C1=CC(=O)OC1 QONQRTHLHBTMGP-UHFFFAOYSA-N 0.000 description 1
- SHIBSTMRCDJXLN-KCZCNTNESA-N digoxigenin Chemical compound C1([C@@H]2[C@@]3([C@@](CC2)(O)[C@H]2[C@@H]([C@@]4(C)CC[C@H](O)C[C@H]4CC2)C[C@H]3O)C)=CC(=O)OC1 SHIBSTMRCDJXLN-KCZCNTNESA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 229960003668 docetaxel Drugs 0.000 description 1
- 230000003828 downregulation Effects 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 241001493065 dsRNA viruses Species 0.000 description 1
- 210000003162 effector t lymphocyte Anatomy 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 238000005538 encapsulation Methods 0.000 description 1
- 101150050623 erg-6 gene Proteins 0.000 description 1
- 230000008686 ergosterol biosynthesis Effects 0.000 description 1
- 239000000262 estrogen Substances 0.000 description 1
- 229940011871 estrogen Drugs 0.000 description 1
- 239000000328 estrogen antagonist Substances 0.000 description 1
- 229960002568 ethinylestradiol Drugs 0.000 description 1
- 238000010195 expression analysis Methods 0.000 description 1
- 239000013613 expression plasmid Substances 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 239000012894 fetal calf serum Substances 0.000 description 1
- 238000011049 filling Methods 0.000 description 1
- 108700014844 flt3 ligand Proteins 0.000 description 1
- 229960000390 fludarabine Drugs 0.000 description 1
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 229960001751 fluoxymesterone Drugs 0.000 description 1
- YLRFCQOZQXIBAB-RBZZARIASA-N fluoxymesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1CC[C@](C)(O)[C@@]1(C)C[C@@H]2O YLRFCQOZQXIBAB-RBZZARIASA-N 0.000 description 1
- 150000002224 folic acids Chemical class 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 229930182830 galactose Natural products 0.000 description 1
- 108010084448 gamma Catenin Proteins 0.000 description 1
- 229940044627 gamma-interferon Drugs 0.000 description 1
- 201000006585 gastric adenocarcinoma Diseases 0.000 description 1
- 230000007045 gastrulation Effects 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 230000009368 gene silencing by RNA Effects 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 210000004907 gland Anatomy 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 210000003714 granulocyte Anatomy 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- 230000002489 hematologic effect Effects 0.000 description 1
- 108060003552 hemocyanin Proteins 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 229940022353 herceptin Drugs 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 125000000487 histidyl group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C([H])=N1 0.000 description 1
- 102000046157 human CSF2 Human genes 0.000 description 1
- 102000055229 human IL4 Human genes 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 208000033519 human immunodeficiency virus infectious disease Diseases 0.000 description 1
- 230000028996 humoral immune response Effects 0.000 description 1
- 230000004727 humoral immunity Effects 0.000 description 1
- 229940088013 hycamtin Drugs 0.000 description 1
- 229940096120 hydrea Drugs 0.000 description 1
- 150000003840 hydrochlorides Chemical class 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 229960001330 hydroxycarbamide Drugs 0.000 description 1
- 229910052588 hydroxylapatite Inorganic materials 0.000 description 1
- 229950000801 hydroxyprogesterone caproate Drugs 0.000 description 1
- 206010020718 hyperplasia Diseases 0.000 description 1
- 230000002390 hyperplastic effect Effects 0.000 description 1
- 229960000908 idarubicin Drugs 0.000 description 1
- 229960001101 ifosfamide Drugs 0.000 description 1
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 1
- 229960002411 imatinib Drugs 0.000 description 1
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 1
- 230000014726 immortalization of host cell Effects 0.000 description 1
- 230000007124 immune defense Effects 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000006058 immune tolerance Effects 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 229940121354 immunomodulator Drugs 0.000 description 1
- 230000001024 immunotherapeutic effect Effects 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 230000004941 influx Effects 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 229910052816 inorganic phosphate Inorganic materials 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 108010044426 integrins Proteins 0.000 description 1
- 102000006495 integrins Human genes 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 238000011901 isothermal amplification Methods 0.000 description 1
- 108010045069 keyhole-limpet hemocyanin Proteins 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 229960001614 levamisole Drugs 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 238000012417 linear regression Methods 0.000 description 1
- 238000001638 lipofection Methods 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 229960002247 lomustine Drugs 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 201000009546 lung large cell carcinoma Diseases 0.000 description 1
- 210000004324 lymphatic system Anatomy 0.000 description 1
- 210000001365 lymphatic vessel Anatomy 0.000 description 1
- 210000005210 lymphoid organ Anatomy 0.000 description 1
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 150000002688 maleic acid derivatives Chemical class 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 108010082117 matrigel Proteins 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 229960002985 medroxyprogesterone acetate Drugs 0.000 description 1
- PSGAAPLEWMOORI-PEINSRQWSA-N medroxyprogesterone acetate Chemical compound C([C@@]12C)CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2CC[C@]2(C)[C@@](OC(C)=O)(C(C)=O)CC[C@H]21 PSGAAPLEWMOORI-PEINSRQWSA-N 0.000 description 1
- 229960004296 megestrol acetate Drugs 0.000 description 1
- RQZAXGRLVPAYTJ-GQFGMJRRSA-N megestrol acetate Chemical compound C1=C(C)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 RQZAXGRLVPAYTJ-GQFGMJRRSA-N 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 230000001394 metastastic effect Effects 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 238000000520 microinjection Methods 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 238000005065 mining Methods 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- 229960000350 mitotane Drugs 0.000 description 1
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 1
- 229960001156 mitoxantrone Drugs 0.000 description 1
- 238000007479 molecular analysis Methods 0.000 description 1
- 238000001823 molecular biology technique Methods 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 239000003068 molecular probe Substances 0.000 description 1
- 125000000896 monocarboxylic acid group Chemical group 0.000 description 1
- HDZGCSFEDULWCS-UHFFFAOYSA-N monomethylhydrazine Chemical class CNN HDZGCSFEDULWCS-UHFFFAOYSA-N 0.000 description 1
- 229940031348 multivalent vaccine Drugs 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 210000000066 myeloid cell Anatomy 0.000 description 1
- JXTPJDDICSTXJX-UHFFFAOYSA-N n-Triacontane Natural products CCCCCCCCCCCCCCCCCCCCCCCCCCCCCC JXTPJDDICSTXJX-UHFFFAOYSA-N 0.000 description 1
- 201000011216 nasopharynx carcinoma Diseases 0.000 description 1
- 229940086322 navelbine Drugs 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 230000003472 neutralizing effect Effects 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- OSTGTTZJOCZWJG-UHFFFAOYSA-N nitrosourea Chemical compound NC(=O)N=NO OSTGTTZJOCZWJG-UHFFFAOYSA-N 0.000 description 1
- 210000003458 notochord Anatomy 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 239000007764 o/w emulsion Substances 0.000 description 1
- 230000001151 other effect Effects 0.000 description 1
- 230000002611 ovarian Effects 0.000 description 1
- 229960003540 oxyquinoline Drugs 0.000 description 1
- 239000006179 pH buffering agent Substances 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- IPCSVZSSVZVIGE-UHFFFAOYSA-N palmitic acid group Chemical group C(CCCCCCCCCCCCCCC)(=O)O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 1
- 208000012111 paraneoplastic syndrome Diseases 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 1
- 210000003200 peritoneal cavity Anatomy 0.000 description 1
- 102000013415 peroxidase activity proteins Human genes 0.000 description 1
- 108040007629 peroxidase activity proteins Proteins 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N phenol group Chemical group C1(=CC=CC=C1)O ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 210000005134 plasmacytoid dendritic cell Anatomy 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 229920002523 polyethylene Glycol 1000 Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 235000015277 pork Nutrition 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 1
- 229960004618 prednisone Drugs 0.000 description 1
- 238000004237 preparative chromatography Methods 0.000 description 1
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 1
- 229960000624 procarbazine Drugs 0.000 description 1
- 239000000583 progesterone congener Substances 0.000 description 1
- 230000009465 prokaryotic expression Effects 0.000 description 1
- 210000005267 prostate cell Anatomy 0.000 description 1
- 108010043671 prostatic acid phosphatase Proteins 0.000 description 1
- 125000006239 protecting group Chemical group 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 229950010131 puromycin Drugs 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- 239000001397 quillaja saponaria molina bark Substances 0.000 description 1
- MCJGNVYPOGVAJF-UHFFFAOYSA-N quinolin-8-ol Chemical compound C1=CN=C2C(O)=CC=CC2=C1 MCJGNVYPOGVAJF-UHFFFAOYSA-N 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 238000003753 real-time PCR Methods 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 238000003259 recombinant expression Methods 0.000 description 1
- 230000008439 repair process Effects 0.000 description 1
- 230000000754 repressing effect Effects 0.000 description 1
- 230000001850 reproductive effect Effects 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 238000012340 reverse transcriptase PCR Methods 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 229960004641 rituximab Drugs 0.000 description 1
- 238000005096 rolling process Methods 0.000 description 1
- 229930182490 saponin Natural products 0.000 description 1
- 150000007949 saponins Chemical class 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 229960003440 semustine Drugs 0.000 description 1
- 238000002864 sequence alignment Methods 0.000 description 1
- 230000035939 shock Effects 0.000 description 1
- 230000037432 silent mutation Effects 0.000 description 1
- 208000000649 small cell carcinoma Diseases 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000008247 solid mixture Substances 0.000 description 1
- 229940035044 sorbitan monolaurate Drugs 0.000 description 1
- 229940032094 squalane Drugs 0.000 description 1
- 229940031439 squalene Drugs 0.000 description 1
- TUHBEKDERLKLEC-UHFFFAOYSA-N squalene Natural products CC(=CCCC(=CCCC(=CCCC=C(/C)CCC=C(/C)CC=C(C)C)C)C)C TUHBEKDERLKLEC-UHFFFAOYSA-N 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 239000010907 stover Substances 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229920002994 synthetic fiber Polymers 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- 229960001603 tamoxifen Drugs 0.000 description 1
- 150000003892 tartrate salts Chemical class 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- 229940063683 taxotere Drugs 0.000 description 1
- 229940056501 technetium 99m Drugs 0.000 description 1
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 1
- 229960001278 teniposide Drugs 0.000 description 1
- 229960003604 testosterone Drugs 0.000 description 1
- MPLHNVLQVRSVEE-UHFFFAOYSA-N texas red Chemical compound [O-]S(=O)(=O)C1=CC(S(Cl)(=O)=O)=CC=C1C(C1=CC=2CCCN3CCCC(C=23)=C1O1)=C2C1=C(CCC1)C3=[N+]1CCCC3=C2 MPLHNVLQVRSVEE-UHFFFAOYSA-N 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 150000003573 thiols Chemical class 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- MNRILEROXIRVNJ-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=NC=N[C]21 MNRILEROXIRVNJ-UHFFFAOYSA-N 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-M toluenesulfonate group Chemical class C=1(C(=CC=CC1)S(=O)(=O)[O-])C LBLYYCQCTBFVLH-UHFFFAOYSA-M 0.000 description 1
- 229960000303 topotecan Drugs 0.000 description 1
- 108091006106 transcriptional activators Proteins 0.000 description 1
- 238000010361 transduction Methods 0.000 description 1
- 230000026683 transduction Effects 0.000 description 1
- 238000003151 transfection method Methods 0.000 description 1
- 230000001131 transforming effect Effects 0.000 description 1
- 230000010474 transient expression Effects 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- XVQKZSLOGHBCET-INVHGPFASA-N tripalmitoyl-S-glyceryl-cysteinyl-seryl-serine Chemical compound CCCCCCCCCCCCCCCC(=O)N[C@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O)CSCC(OC(=O)CCCCCCCCCCCCCCC)COC(=O)CCCCCCCCCCCCCCC XVQKZSLOGHBCET-INVHGPFASA-N 0.000 description 1
- 230000005748 tumor development Effects 0.000 description 1
- 231100000402 unacceptable toxicity Toxicity 0.000 description 1
- 230000003827 upregulation Effects 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 229960001055 uracil mustard Drugs 0.000 description 1
- 150000003672 ureas Chemical class 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 229910052720 vanadium Inorganic materials 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- UGGWPQSBPIFKDZ-KOTLKJBCSA-N vindesine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(N)=O)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 UGGWPQSBPIFKDZ-KOTLKJBCSA-N 0.000 description 1
- 229960004355 vindesine Drugs 0.000 description 1
- CILBMBUYJCWATM-PYGJLNRPSA-N vinorelbine ditartrate Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O.OC(=O)[C@H](O)[C@@H](O)C(O)=O.C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC CILBMBUYJCWATM-PYGJLNRPSA-N 0.000 description 1
- 239000007762 w/o emulsion Substances 0.000 description 1
- 230000036266 weeks of gestation Effects 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 229940053867 xeloda Drugs 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4702—Regulators; Modulating activity
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/461—Cellular immunotherapy characterised by the cell type used
- A61K39/4611—T-cells, e.g. tumor infiltrating lymphocytes [TIL], lymphokine-activated killer cells [LAK] or regulatory T cells [Treg]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/82—Translation products from oncogenes
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/569—Immunoassay; Biospecific binding assay; Materials therefor for microorganisms, e.g. protozoa, bacteria, viruses
- G01N33/56966—Animal cells
- G01N33/56972—White blood cells
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/53—DNA (RNA) vaccination
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/70503—Immunoglobulin superfamily, e.g. VCAMs, PECAM, LFA-3
- G01N2333/70517—CD8
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Description
本出願は、参照により本明細書に組み入れられる、2007年2月28日に出願された米国特許仮出願第60/904,236号の恩典を主張する。
本出願は、癌治療物質の分野、具体的には、癌治療のための免疫原性ペプチドおよび阻害性核酸などの分子に関する。
ブラキュリ(Brachyury)(「T」としても公知)は、劣性致死でもある(ホモ接合型のT/T胎仔は、後部中胚葉形成の失敗が原因で妊娠中期に死亡する)優性短尾変異としてマウスにおいて同定された(Chesley, J. Exp. Zool., 70: 429-459, 1935(非特許文献1))。マウスのブラキュリ遺伝子は、ヒトのような他の種におけるホモログと同様に、クローン化されている(Herrmann et al., Nature (Lond.), 343: 617-622, 1990(非特許文献2))。マウスブラキュリのヒトホモログの発現は、妊娠14〜15週目のヒト流産児の脊索遺残である髄核においてRT-PCRによって検出された(Edwards et al., Genome Res., 6: 226-233, 1996(非特許文献3))。
ブラキュリが、ヒト腫瘍において、具体的には、小腸、胃、腎臓、膀胱、子宮、卵巣、および精巣(testes)の腫瘍、ならびに肺癌、結腸癌、および前立腺癌において発現されることが本明細書において開示される。免疫原性ブラキュリポリペプチドが、本明細書において開示される。これらのブラキュリポリペプチドは、ブラキュリに対する免疫応答を誘導するために、ならびにブラキュリ発現に関する診断的アッセイ法において使用することができる。1つの例において、ポリペプチドの長さは、多くても12個の連続したアミノ酸であり、単離されるポリペプチドは、WLLPGTSTX1(SEQ ID NO: 3)(X1はロイシン(L)またはバリン(V)である)として示すアミノ酸配列を含む。
[本発明1001]
多くても12個の連続したアミノ酸を含み、以下のうちの1つとして示すアミノ酸配列を含む、単離されたポリペプチド:
(a)X1はロイシン(L)もしくはバリン(V)である、WLLPGTSTX1(SEQ ID NO: 3);
(b)X2およびX5はバリンもしくはロイシンのいずれかであり、X3はプロリン(P)、セリン(S)、トレオニン(T)、ロイシン(L)、もしくはバリン(V)であり、X4はトリプトファン(W)、バリン(V)、ロイシン(L)、イソロイシン(I)、セリン(S)、もしくはトレオニン(threorine)(T)である、SX2YX3SLX4SX5(SEQ ID NO: 18);
(c)X6はセリン(S)、トレオニン(T)、イソロイシン(I)、バリン(V)であり、X7はロイシン(L)もしくはバリンである、WLLX6GTSTX7(SEQ ID NO: 19)、;
(d)X8はチロシン(Y)もしくはトリプトファン(W)のうち1つである、X8LIASTTPV(SEQ ID NO: 20);
(e)X9はアルギニン(R)、チロシン(Y)、もしくはトリプトファン(W)であり、X10はバリン(V)、リジン(L)、イソロイシン(I)、セリン(S)、もしくはトレオニン(T)である、X9LIASX10TPV(SEQ ID NO: 21);または
(f)ALYSFLLDFV(SEQ ID NO: 22)。
[本発明1002]
X2およびX5はバリンまたはロイシンのいずれかであり、X3はプロリン(P)、セリン(S)、トレオニン(T)、ロイシン(L)、またはバリン(V)であり、X4はトリプトファン(W)、バリン(V)、ロイシン(L)、イソロイシン(I)、セリン(S)、またはトレオニン(T)である、SX2YX3SLX4SX5(SEQ ID NO: 18)として示すアミノ酸配列を含む、本発明1001記載の単離されたポリペプチド。
[本発明1003]
X2およびX5はバリンまたはロイシンのいずれかであり、X3はプロリン(P)、セリン(S)、トレオニン(T)、ロイシン(L)、またはバリン(V)であり、X4はトリプトファン(W)、バリン(V)、ロイシン(L)、イソロイシン(I)、セリン(S)、またはトレオニン(T)である、SX2YX3SLX4SX5(SEQ ID NO: 18)として示すアミノ酸配列を含む、本発明1001記載の単離されたポリペプチド。
[本発明1004]
X6はセリン(S)、トレオニン(T)、イソロイシン(I)、バリン(V)であり、X7はロイシン(L)またはバリン(V)である、WLLX6GTSTX7(SEQ ID NO: 19)として示すアミノ酸配列を含む、本発明1001記載の単離されたポリペプチド。
[本発明1005]
X8はチロシン(Y)またはトリプトファン(W)のうち1つである、X8LIASTTPV(SEQ ID NO: 20)として示すアミノ酸配列を含む、本発明1001記載の単離されたポリペプチド。
[本発明1006]
X9はアルギニン(R)、チロシン(Y)、またはトリプトファン(W)であり、X10はバリン(V)、リジン(L)、イソロイシン(I)、セリン(S)、またはトレオニン(T)である、X9LIASX10TPV(SEQ ID NO: 21)として示すアミノ酸配列を含む、本発明1001記載の単離されたポリペプチド。
[本発明1007]
ALYSFLLDFV(SEQ ID NO: 22)として示すアミノ酸配列を含む、本発明1001記載の単離されたポリペプチド。
[本発明1008]
WLLPGTSTX1(SEQ ID NO: 3)として示すアミノ酸配列を含み、アミノ酸1(X1)がロイシンである、本発明1001記載の単離されたポリペプチド。
[本発明1009]
WLLPGTSTX1(SEQ ID NO: 3)として示すアミノ酸配列を含み、アミノ酸1(X1)がバリンである、本発明1001記載の単離されたポリペプチド。
[本発明1010]
以下のうちの1つとして示すアミノ酸配列から本質的になる、本発明1001記載の単離されたポリペプチド:
(a)X1はロイシン(L)またはバリン(V)である、WLLPGTSTX1(SEQ ID NO: 3);
(b)X2およびX5はバリンまたはロイシンのいずれかであり、X3はプロリン(P)、セリン(S)、トレオニン(T)、ロイシン(L)、またはバリン(V)であり、X4はトリプトファン(W)、バリン(V)、ロイシン(L)、イソロイシン(I)、セリン(S)、またはトレオニン(T)である、SX2YX3SLX4SX5(SEQ ID NO: 18);
(c)X6はセリン(S)、トレオニン(T)、イソロイシン(I)、バリン(V)であり、X7はロイシン(L)またはバリンである、WLLX6GTSTX7(SEQ ID NO: 19);
(d)X8はチロシン(Y)またはトリプトファン(W)のうちの1つである、X8LIASTTPV(SEQ ID NO: 20);
(e)X9はアルギニン(R)、チロシン(Y)、またはトリプトファン(W)であり、X10はバリン(V)、リジン(L)、イソロイシン(I)、セリン(S)、またはトレオニン(T)である、X9LIASX10TPV(SEQ ID NO: 21);および
(f)ALYSFLLDFV(SEQ ID NO: 22)。
[本発明1011]
SEQ ID NO: 3として示すアミノ酸配列からなり、アミノ酸X1がバリン(V)である、本発明1004記載の単離されたポリペプチド。
[本発明1012]
SEQ ID NO: 3として示すアミノ酸配列からなり、アミノ酸X1がロイシンである、本発明1004記載の単離されたポリペプチド。
[本発明1013]
11アミノ酸長である、本発明1001記載の単離されたポリペプチド。
[本発明1014]
9または10アミノ酸長である、本発明1001記載の単離されたポリペプチド。
[本発明1015]
本発明1001〜1014のいずれかに記載のポリペプチドをコードする核酸配列をコードする、単離されたポリヌクレオチド。
[本発明1016]
プロモーターに機能的に連結された、本発明1015記載のポリヌクレオチド。
[本発明1017]
本発明1016記載のポリヌクレオチドを含むベクター。
[本発明1018]
プラスミドベクターである、本発明1017記載のベクター。
[本発明1019]
プラスミドベクターがサルモネラ菌(Salmonella)において発現される、本発明1018記載のベクター。
[本発明1020]
プラスミドベクターが酵母において発現される、本発明1018記載のベクター。
[本発明1021]
ウイルスベクターである、本発明1017記載のベクター。
[本発明1022]
レトロウイルスベクター、オルソポックスベクター、アビポックスベクター、鶏痘ベクター、カプリポックスベクター、スイポックスベクター、アデノウイルスベクター、ヘルペスウイルスベクター、αウイルスベクター、バキュロウイルスベクター、シンドビスウイルスベクター、ワクシニアウイルスベクター、およびポリオウイルスベクターである、本発明1021記載のベクター。
[本発明1023]
本発明1018記載のベクターを含む、単離された宿主細胞。
[本発明1024]
酵母細胞である、本発明1023記載の単離された宿主細胞。
[本発明1025]
本発明1001〜1014のいずれかに記載の単離されたポリペプチドをコードする核酸をウイルスゲノムまたはその感染可能な一部分に組み入れた第1の組換えウイルスと、共刺激分子をコードする1つまたは複数の遺伝子またはDNA配列をウイルスゲノムまたはその感染可能な一部分に組み入れた第2の組換えウイルスとを含む組成物であって、宿主細胞を同時感染させることができ、その結果、該ポリペプチドおよび該共刺激分子をコードする該コード遺伝子またはDNA配列の同時発現をもたらす組成物。
[本発明1026]
共刺激分子が、B7-1、B7-2、LFA、またはICAM-1のうち1種または複数種である、本発明1025記載の組成物。
[本発明1027]
哺乳動物において疾患を改善するのに有効な量の第1のウイルスおよび第2のウイルスを含む、本発明1025記載の組成物。
[本発明1028]
第1の組換えウイルス、第2の組換えウイルス、または第1の組換えウイルスおよび第2の組換えウイルスが、レトロウイルスベクター、オルソポックスベクター、アビポックスベクター、鶏痘ベクター、カプリポックスベクター、スイポックスベクター、アデノウイルスベクター、ヘルペスウイルスベクター、αウイルスベクター、バキュロウイルスベクター、シンドビスウイルスベクター、ワクシニアウイルスベクター、およびポリオウイルスベクターからなる群より選択される、本発明1025記載の組成物。
[本発明1029]
第2の組換えウイルスが、1種または複数種の免疫賦活性分子をコードする1つまたは複数の外因性DNA配列をさらに含み、該免疫賦活性分子が、IL-2、ICAM-1、LFA-3、CD72、GM-CSF、TNF-α、IFN-γ、IL-12、およびIL-6からなる群より選択される、本発明1025記載の組成物。
[本発明1030]
IL-2、GM-CSF、TNF-α、IL-12、およびIL-6からなる群より選択される、免疫を調節するのに有効な量の少なくとも1種の外因性免疫賦活性分子をさらに含む、本発明1025記載の組成物。
[本発明1031]
第1の組換えウイルス、第2の組換えウイルス、または第1の組換えウイルスおよび第2の組換えウイルスがワクシニアウイルスである、本発明1025記載の組成物。
[本発明1032]
本発明1025〜1031のいずれかに記載の組成物および薬学的に許容される担体を含む薬学的組成物。
[本発明1033]
本発明1023記載の宿主細胞の治療的有効量を薬学的に許容される担体中に含む薬学的組成物。
[本発明1034]
本発明1001〜1014のいずれかに記載のポリペプチドの治療的有効量を薬学的に許容される担体中に含む薬学的組成物。
[本発明1035]
本発明1015記載のポリヌクレオチドの治療的有効量を薬学的に許容される担体中に含む薬学的組成物。
[本発明1036]
対象において免疫応答を誘発するための方法であって、本発明1001〜1014のいずれかに記載のポリペプチドまたは該ポリペプチドをコードするポリヌクレオチドの治療的有効量を対象に投与し、それによって該対象において免疫応答を生じさせる段階を含む方法。
[本発明1037]
アジュバントを対象に投与する段階をさらに含む、本発明1036記載の方法。
[本発明1038]
治療的有効量のIL-2、RANTES、GM-CSF、TNF-α、IFN-γ、G-CSF、またはそれらの組合せを対象に投与する段階をさらに含む、本発明1036記載の方法。
[本発明1039]
IL-2、RANTES、GM-CSF、TNF-α、IFN-γ、G-CSF、LFA-3、CD72、B7-1、B7-2、OX-40L、4-1BBL、およびICAM-1のうち1種または複数種をコードする核酸を対象に投与する段階をさらに含む、本発明1036記載の方法。
[本発明1040]
以下の段階を含む、ブラキュリを発現する細胞に対する免疫応答を哺乳動物において増強する方法:
本発明1020〜1026のいずれかに記載の組成物の治療的有効量でインビトロで細胞を感染させて、免疫原性ブラキュリポリペプチドを発現する感染細胞を生じさせる段階、および
治療的有効量の感染細胞を哺乳動物に投与し、それによって免疫応答を増強する段階であって、該哺乳動物が、小腸癌、胃癌、腎臓癌、膀胱癌、子宮癌、卵巣癌、精巣癌、肺癌、乳癌、気管支癌、結腸癌、前立腺癌、慢性リンパ性白血病(CLL)、またはB細胞腫瘍に罹患している段階。
[本発明1041]
細胞が樹状細胞または腫瘍細胞である、本発明1040記載の方法。
[本発明1042]
対象において免疫応答を誘発するための方法であって、本発明1015記載のポリヌクレオチドの治療的有効量を対象に投与し、それによって、該対象において免疫応答を生じさせる段階を含む方法。
[本発明1043]
アジュバントを対象に投与する段階をさらに含む、本発明1042記載の方法。
[本発明1044]
治療的有効量のIL-2、RANTES、GM-CSF、TNF-α、IFN-γ、G-CSF、またはそれらの組合せを対象に投与する段階をさらに含む、本発明1042記載の方法。
[本発明1045]
IL-2、RANTES、GM-CSF、TNF-α、IFN-γ、G-CSF、LFA-3、CD72、B7-1、B7-2、OX-40L、4-1BBL、およびICAM-1のうち1種または複数種をコードする核酸を対象に投与する段階をさらに含む、本発明1042記載の方法。
[本発明1046]
癌に罹患している対象を治療するための方法であって、本発明1017記載のベクターの治療的有効量を該対象に投与し、それによって該対象を治療する段階を含む方法。
[本発明1047]
ベクターが組換えウイルスベクターである、本発明1046記載の方法。
[本発明1048]
組換えウイルスベクターが、レトロウイルスベクター、オルソポックスベクター、アビポックスベクター、鶏痘ベクター、カプリポックスベクター、スイポックスベクター、アデノウイルスベクター、ヘルペスウイルスベクター、αウイルスベクター、バキュロウイルスベクター、シンドビスウイルスベクター、ワクシニアウイルスベクター、またはポリオウイルスベクターである、本発明1047記載の方法。
[本発明1049]
治療的有効量のIL-2、RANTES、GM-CSF、TNF-α、IFN-γ、G-CSF、またはそれらの組合せを対象に投与する段階をさらに含む、本発明1047記載の方法。
[本発明1050]
IL-2、RANTES、GM-CSF、TNF-α、IFN-γ、G-CSF、LFA-3、CD72、B7-1、B7-2、OX-40L、4-1BBL、およびICAM-1のうち1種または複数種をコードする核酸を対象に投与する段階をさらに含む、本発明1047記載の方法。
[本発明1051]
組換えウイルスベクターが、共刺激分子をコードする核酸をさらに含む、本発明1047記載の方法。
[本発明1052]
共刺激分子が、B7-1、B7-2、B7-1 B7-2、LFA、およびICAM-1である、本発明1051記載の方法。
[本発明1053]
B7-1、B7-2、またはB7-1およびB7-2をコードする1つまたは複数の遺伝子またはDNA配列をウイルス核酸に組み入れた第2の組換えウイルスベクターの治療的有効量を対象に投与する段階をさらに含む方法であって、組成物が、宿主細胞を同時感染させることができ、その結果該ポリペプチドならびにB7-1、B7-2、B7-1 B7-2、LFA、およびICAM-1をコードする遺伝子またはDNA配列の同時発現をもたらすことができる、本発明1047記載の方法。
[本発明1054]
第1の組換えウイルスベクター、第2の組換えウイルスベクター、または第1の組換えウイルスベクターおよび第2の組換えウイルスベクターが、レトロウイルスベクター、オルソポックスベクター、アビポックスベクター、鶏痘ベクター、カプリポックスベクター、スイポックスベクター、アデノウイルスベクター、ヘルペスウイルスベクター、αウイルスベクター、バキュロウイルスベクター、シンドビスウイルスベクター、ワクシニアウイルスベクター、およびポリオウイルスベクターからなる群より選択される、本発明1053記載の方法。
[本発明1055]
免疫応答がT細胞応答を含む、本発明1036〜1054のいずれかに記載の方法。
[本発明1056]
免疫応答が、ブラキュリ(SEQ ID NO: 14)を発現する細胞の溶解を誘導する細胞障害性T細胞を誘導することを含む、本発明1036〜1054のいずれかに記載の方法。
[本発明1057]
対象が癌に罹患している、本発明1036〜1056のいずれかに記載の方法。
[本発明1058]
対象が、小腸癌、胃癌、腎臓癌、膀胱癌、子宮癌、卵巣癌、精巣癌、肺癌、乳癌、気管支癌、結腸癌、前立腺癌、慢性リンパ性白血病(CLL)、またはB細胞腫瘍に罹患している、本発明1057記載の方法。
本発明1059]
免疫応答が癌の増殖を減少させる、本発明1058記載の方法。
[本発明1060]
以下の段階を含む、癌細胞の増殖を阻害するための方法:
(i)乳癌または前立腺癌の細胞を認識する活性化CTLまたはCTL前駆体から成熟させたCTLを生じさせるために、本発明1001〜1014のいずれかに記載のポリペプチドおよび抗原提示細胞と共に細胞障害性Tリンパ球(CTL)またはCTL前駆細胞を培養する段階、および
(ii)乳癌または前立腺癌の細胞を該活性化CTLまたはCTL前駆体から成熟させたCTLと接触させ、それによって、該癌細胞の増殖を阻害する段階。
[本発明1061]
癌細胞が対象中に存在し、該対象に細胞障害性Tリンパ球を投与する段階を含む、本発明1060記載の方法。
[本発明1062]
治療的有効量の化学療法剤を対象に投与する段階をさらに含む、本発明1057〜1061のいずれかに記載の方法。
[本発明1063]
以下の段階を含む、対象において癌細胞の増殖を阻害するための方法:
樹状細胞を本発明1001記載のポリペプチドと接触させるか、または本発明1001記載のポリペプチドをコードする核酸を樹状細胞において発現させ、それによって特異的抗原提示細胞を調製する段階、および
該抗原提示細胞を対象に投与し、それによって免疫応答を誘導し、癌細胞の増殖を阻害する段階。
[本発明1064]
癌細胞が、小腸癌、胃癌、腎臓癌、膀胱癌、子宮癌、卵巣癌、精巣癌、肺癌、乳癌、気管支癌、結腸癌、前立腺癌、慢性リンパ性白血病(CLL)、またはB細胞腫瘍に由来する、本発明1063記載の方法。
[本発明1065]
以下の段階を含む、対象において癌細胞の増殖を阻害するための方法:
樹状細胞を本発明1001記載のポリペプチドと接触させるか、または本発明1001記載のポリペプチドをコードする核酸を樹状細胞において発現させ、それによって特異的抗原提示細胞を調製する段階、
該抗原提示細胞を細胞障害性T細胞の集団と接触させ、それによって活性化細胞障害性T細胞を生じさせる段階;および
該活性化細胞障害性T細胞を対象に投与する段階。
[本発明1066]
癌が、小腸癌、胃癌、腎臓癌、膀胱癌、子宮癌、卵巣癌、精巣癌、肺癌、乳癌、気管支癌、結腸癌、前立腺癌、慢性リンパ性白血病(CLL)、またはB細胞腫瘍である、本発明1065記載の方法。
[本発明1067]
以下の段階を含む、対象においてSEQ ID NO: 1を特異的に認識する、CD8を発現するT細胞を検出する方法:
対象から単離された末梢血単核細胞を本発明1001記載のポリペプチドを含む反応物と接触させる段階;
該末梢血単核細胞に結合された反応物の存在を検出し、それによって、SEQ ID NO: 1に特異的に結合する、CD8を発現するT細胞を検出する段階。
[本発明1068]
以下の段階を含む、対象において腫瘍の増殖または転移を阻害する方法:
腫瘍を有する対象を選択する段階;および
腫瘍を有する該対象に、SEQ ID NO: 1をコードするヌクレオチド配列に特異的に結合するアンチセンス分子またはsiRNAの治療的有効量を投与し、それによって該対象における該腫瘍の増殖または転移を阻害する段階。
[本発明1069]
癌細胞が、小腸癌、胃癌、腎臓癌、膀胱癌、子宮癌、卵巣癌、精巣癌、肺癌、乳癌、気管支癌、結腸癌、前立腺癌、慢性リンパ性白血病(CLL)、またはB細胞腫瘍に由来する、本発明1068記載の方法。
[本発明1070]
治療的有効量のsiRNAを対象に投与する段階を含む、本発明1068記載の方法。
[本発明1071]
本発明1001記載の単離されたポリペプチドの治療的有効量を対象に投与する段階をさらに含む、本発明1068記載の方法。
[本発明1072]
腫瘍の診断を確認する方法であって、
小腸、胃、腎臓、膀胱、子宮、卵巣、精巣、肺、結腸、もしくは前立腺の腫瘍を有するか、またはB細胞腫瘍を有する対象を選択する段階;
該対象から試料を得る段階;
該試料をSEQ ID NO: 2に特異的に結合する抗体と接触させる段階;および
該試料への該抗体の結合を検出する段階を含み、
該試料に結合される抗体の存在により、該対象が小腸、胃、腎臓、膀胱、子宮、卵巣、精巣、肺、結腸、もしくは前立腺の腫瘍を有するか、またはB細胞腫瘍を有することが裏付けられる方法。
[本発明1073]
対象がB細胞腫瘍を有する、本発明1072記載の方法。
[本発明1074]
B細胞腫瘍がバーキットリンパ腫またはホジキンリンパ腫である、本発明1073記載の方法。
[本発明1075]
試料が生検試料である、本発明1072記載の方法。
[本発明1076]
腫瘍を有する対象の予後を決定するための方法であって、
腫瘍を有する対象を選択する段階;および
SEQ ID NO: 1として示すアミノ酸配列を含むポリペプチドの発現を該腫瘍において検出する段階を含み、
SEQ ID NO: 1として示すアミノ酸配列を含む該ポリペプチドの発現により、該対象の予後不良が示唆される方法。
[本発明1077]
腫瘍が、小腸、胃、腎臓、膀胱、子宮、卵巣、精巣、肺、結腸、もしくは前立腺、またはB細胞のものである、本発明1076記載の方法。
[本発明1078]
SEQ ID NO: 1として示すアミノ酸配列を含むポリペプチドの発現を検出する段階が、
腫瘍から生物試料を得る段階;
該生物試料をSEQ ID NO: 1として示すアミノ酸配列に特異的に結合する抗体と接触させる段階;および
該抗体とSEQ ID NO: 1として示すアミノ酸配列を含む該ポリペプチドとの免疫複合体の存在を検出する段階を含む、本発明1076記載の方法。
[本発明1079]
SEQ ID NO: 1として示すアミノ酸配列を含むポリペプチドの発現を検出する段階が、
腫瘍から生物試料を得る段階;および
SEQ ID NO: 1として示すアミノ酸配列を含むポリペプチドをコードするmRNAの存在を検出する段階を含む、本発明1076記載の方法。
[本発明1080]
ポリメラーゼ連鎖反応法の使用を含む、本発明1079記載の方法。
[本発明1081]
予後を決定する段階が、腫瘍が転移する可能性を決定することを含み、SEQ ID NO: 1として示すアミノ酸配列を含むポリペプチドの発現により、腫瘍が転移することが示唆される、本発明1076記載の方法。
ブラキュリが、ヒト腫瘍において、具体的には、小腸、胃、腎臓、膀胱、子宮、卵巣、および精巣の腫瘍、ならびに肺癌、結腸癌、および前立腺癌において発現されることが本明細書において開示される。ブラキュリはまた、慢性リンパ性白血病および他のB細胞悪性腫瘍においても発現される。免疫原性ブラキュリポリペプチドが、本明細書において開示される。これらのポリペプチドをコードする核酸、これらの核酸を含むベクター、およびこれらのベクターで形質転換された宿主細胞もまた、開示される。ブラキュリを発現する腫瘍を検出するための方法が開示されるように、ブラキュリを発現する腫瘍細胞に対する免疫応答を誘導するための方法もまた、開示される。また、ブラキュリを発現する腫瘍を治療するための治療方法も本明細書において開示され、この方法は、阻害性核酸を投与する段階を含む。
別段の注記の無い限り、技術用語は、従来の用法に従って使用される。分子生物学における一般的用語の定義は、Benjamin Lewin, Genes V、Oxford University Press出版、1994 (ISBN 0-19-854287-9); Kendrew et al.(編)、The Encyclopedia of Molecular Biology、Blackwell Science Ltd.出版、1994 (ISBN 0-632-02182-9);およびRobert A.Meyers(編)、Molecular Biology and Biotechnology: a Comprehensive Desk Reference、VCH Publishers, Inc.出版、1995 (ISBN 1-56081-569-8)において見出すことができる。
ブラキュリ(「Tタンパク質」としても公知)は、中胚葉中で転写されるポリペプチドである。1つの態様において、このポリペプチドは、以下に示す配列を有する:
(参照により本明細書に組み入れられる、2007年2月23日に利用可能であるGENBANK(登録商標)アクセッション番号NP_003172およびGENBANK(登録商標)アクセッション番号NM_003181も参照されたい)。
T-p1a: SLYPSLWSV(SEQ ID NO: 18、X2はLであり、X3はPであり、X4はWであり、X5はVである)
T-p1b: SLYPSLWSL(SEQ ID NO: 18、X2はLであり、X3はPであり、X4はWであり、X5はLである)
T-p1c: SX2YSSLWSV(SEQ ID NO: 18、X2はQまたはLであり、X3はYであり、X4はWであり、X5はVである)
T-p1d: SX2YTSLWSV(SEQ ID NO: 18、X2はQまたはLであり、X3はTであり、X4はWであり、X5はVである)
T-p1e: SX2YLSLWSV(SEQ ID NO: 18、X2はQまたはLであり、X3はLであり、X4はWであり、X5はVである)
T-p1f: SX2YVSLWSV(SEQ ID NO: 18、X2はQまたはLであり、X3はVであり、X4はWであり、X5はVである)
T-p1g: SX2YPSLVSV(SEQ ID NO: 18、X2はQまたはLであり、X3はPであり、X4はVであり、X5はVである)
T-p1h: SX2YPSLLSV(SEQ ID NO: 18、X2はQまたはLであり、X3はPであり、X4はLであり、X5はVである)
T-p1i: SX2YPSLISV(SEQ ID NO: 18、X2はQまたはLであり、X3はPであり、X4はIであり、X5はVである)
T-p1j: SX2YPSLSSV(SEQ ID NO: 18、X2はQまたはLであり、X3はPであり、X4はSであり、X5はVである)
T-p1k: SX2YPSLTSV(SEQ ID NO: 18、X2はQまたはLであり、X3はPであり、X4はTであり、X5はVである)
Tp2b: WLLSGTSTX7(SEQ ID NO: 19、X6はSであり、X7はLまたはVである)
Tp2c: WLLTGTSTX7(SEQ ID NO: 19、X6はTであり、X7はLまたはVである)
Tp2d: WLLIGTSTX7(SEQ ID NO: 19、X6はIであり、X7はLまたはVである)
Tp2e: WLLVGTSTX7(SEQ ID NO: 19、X6はVであり、X7はLまたはVである)
T-p3a:YLIASWTPV(SEQ ID NO: 20、X8はYである)
T-p3b:WLIASWTPV(SEQ ID NO: 20、X8はWである)
Tp3c: X9LIASVTPV(SEQ ID NO: 21、X9はR、Y、またはWであり、X10はVである)
Tp3d: X9LIASLTPV(SEQ ID NO: 21、X9はR、Y、またはWであり、X10はVである)
Tp3e: X9LIASITPV(SEQ ID NO: 21、X9はR、Y、またはWであり、X10はVである)
Tp3f: X9LIASSTPV(SEQ ID NO: 21、X9はR、Y、またはWであり、X10はVである)
Tp3g: X9LIASTTPV(SEQ ID NO: 21、X9はR、Y、またはWであり、X10はVである)
本明細書において開示されるブラキュリポリペプチドまたはブラキュリポリペプチドをコードする核酸は、対象において免疫応答を生じさせるために使用され得る。いくつかの例において、対象は、ブラキュリを発現する腫瘍を有する。したがって、いくつかの態様において、これらの方法は、免疫応答を生じさせるために、本明細書において開示される1種または複数種のブラキュリポリペプチドの治療的有効量を癌患者に投与する段階を含む。
ブラキュリの発現は、腫瘍細胞の移動および浸潤に関連している。ブラキュリは、小腸、胃、腎臓、膀胱、子宮、卵巣、精巣、肺、結腸、および前立腺の腫瘍において発現されるが、大半の正常組織においては発現されない。さらに、ブラキュリの発現は、上皮間葉移行にも関連している。さらに、ブラキュリは、慢性リンパ性白血病(CLL)、エプスタイン・バーウイルスによって形質転換されたB細胞、バーキットリンパ腫、およびホジキンリンパ腫などB細胞由来の腫瘍においても発現される。ブラキュリの発現を低減させることができる反応物もまた、ブラキュリを発現する腫瘍を治療するために使用することができる。これらの反応物は、単独で使用することができるか、または本明細書において開示される免疫原性ブラキュリポリペプチドと組み合わせて使用することができる。
生物試料中のブラキュリを検出するための方法もまた、本明細書において提供される。この方法は、ブラキュリに特異的に結合して抗体-ブラキュリ複合体を形成する1種または複数種の抗体と試料を接触させる段階を含む。複合体の存在または不在が検出される。これらの方法は、組織診断の信頼性を改善するため、例えば、診断を裏付けるために、または腫瘍の起源を決定するために有用である。したがって、本明細書において開示される方法を用いて、小腸、胃、腎臓、膀胱、子宮、卵巣、精巣、肺、結腸、および前立腺の腫瘍の診断を裏付けることができる。本明細書において開示される方法を用いて、慢性リンパ性白血病(CLL)、エプスタイン・バーウイルスによって形質転換されたB細胞、バーキットリンパ腫、およびホジキンリンパ腫などのB細胞腫瘍の診断を裏付けることができる。また、本明細書において開示される方法を用いて、腫瘍の起源を判定することができ、例えば、ある転移癌が小腸、胃、腎臓、膀胱、子宮、卵巣、精巣、肺、結腸、前立腺、またはB細胞に由来するかを判定することができる。
ブラキュリに特異的に結合するCD8発現細胞を検出するための反応物が本明細書において提供される。これらの反応物は、四量体のMHCクラスI/免疫原性ブラキュリポリペプチド複合体である。これらの四量体複合体は、多くても12個の連続したアミノ酸を含む免疫原性ブラキュリポリペプチドを含み、その際、単離されたポリペプチドは、WLLPGTSTX1(SEQ ID NO: 3)(X1はロイシン(L)またはバリン(V)である)として示すアミノ酸配列を含む。10アミノ酸長である免疫原性ブラキュリポリペプチドの具体的な例は、上記に開示される。本明細書において開示される四量体複合体は、ブラキュリ(SEQ ID NO: 1)のその他の連続したアミノ酸を含まず、その結果、ポリペプチドは、完全長のブラキュリアミノ酸配列を含まない。
実施例1
材料および方法
コンピューターによるディファレンシャルディスプレイ(CDD)解析。以前に説明されているようにしてHSAnalystプログラムを用いて(Baronova et al., FEBS Lett 508(1):143-8, 2001)、ヒトUnigene Built 171(インターネットで閲覧可能なNCBI Unigeneウェブサイトを参照されたい)上のすべてのESTクラスターの比較を実施した。Unigene EST クラスターHs.389457は、アクセッション番号NM_003181に対応する。
PCR産物の予想されるサイズは、それぞれ568bpおよび356bpであった。
PCR産物の予想されるサイズは、それぞれ568bpおよび356bpであった。
コンピューターに基づいた予測
ヒトUnigene Built 171における遺伝子発現のインシリコプロファイリングを、HSANALYST(商標)ソフトウェアツールを用いて、以前に説明されているようにして(Baranova et al., FEBS Lett 508(1):143-8, 2001)実施した。このプログラムによって実行されるアルゴリズムにより、10個超のESTを含む候補ESTクラスターのリストが得られ、これらのESTの90%超は腫瘍ライブラリーに由来した。それらのうちで、クラスターHs.389457は、ヒトブラキュリ遺伝子(マウスブラキュリのホモログ)をコードするmRNA配列全体を含んでいた。このクラスターに含まれていた合計55個のESTのうち、50個のESTは、肺癌細胞株、胚細胞腫瘍、慢性リンパ性白血病B細胞、および乳癌から構築された腫瘍由来ライブラリーに対応していた。クラスターHs.389457中に存在した2つの正常組織由来ESTは、胎児肺、精巣、および正常なB細胞から集めたRNAから構築されたライブラリーに属していた。クラスター中の他の3つのESTは、組織の起源の説明を欠いていたため、「未決定」と呼んだ。
発現の確認
次いで、ブラキュリmRNAの発現に関するコンピューターに基づいた予測を、一連の正常ヒト組織および悪性ヒト組織におけるブラキュリ発現のRT-PCR解析によって検証した。正常組織に由来する大半のcDNA試料は、アルゴリズムによって予測されたように、ブラキュリmRNA発現を示さなかった(図1Aおよび1B)。しかしながら、非常に弱いシグナルが、正常な精巣、脾臓に由来するcDNA(図1A)、および休止中のCD19+精製細胞(図1B)において観察された。これらの結果はまた、クラスター中のEST 55個のうち2個が、集められた精巣、胎児肺、および正常なBリンパ球から調製したライブラリーに属しているというソフトウェアによる予測とも一致していた。
1ブラキュリmRNAの発現は、β-アクチンの発現と比べて陰性(-)、陽性(+)、または強い陽性(++)として示される。(a)この細胞株が結腸に由来する可能性があるという矛盾する証拠がある。Furlong et al., J Natl Cancer Inst 91(15):1327-8, 1999を参照されたい。
MHCに結合するブラキュリ免疫原性ペプチドの作製
次いで、BIMASのコンピューターアルゴリズムを用いて、ブラキュリタンパク質のアミノ酸配列をHLA-A0201ペプチドの結合予測に関して解析した。3つの9量体および1つの10量体(アミノ酸配列およびアルゴリズムスコアを表2に提示する)を含む、このプログラムによって得られたトップクラスの候補ペプチドを、さらに研究するために選択した。
免疫原性
予測されたペプチドがHLA-A02分子に結合する能力が示された後で、それらが特異的CTLをインビトロで誘導する能力を評価することによって、ペプチドT-p2、T-p3、およびT-p4の免疫原性を調査した。25μMの各ペプチドをパルスした放射線照射済DCを用いて、健常なドナーのPBMCに由来する自己T細胞を刺激した。3回のインビトロ刺激(IVS)後、続いて、単離したCD8+T細胞を、自己DCのみまたは各「誘導因子」ペプチド(T-p2、T-p3、もしくはT-p4)もしくは無関係なHIV-ペプチドをパルスしたDCの存在下で24時間刺激した。試験した3種のペプチドのうち、T-p2およびT-p3は、特異的ペプチドで刺激した際にIFN-γを放出することができる抗原特異的CTLを誘導した(図3A)。次いで、ペプチドパルスしたHLA-A0201+標的に対する細胞障害活性に関して、両方のCTL株を試験した。図3Bに示したように、T-p2ペプチドを用いて生じさせたT細胞のみが、ペプチドパルスした標的細胞を特異的に溶解することができ、これは、T-p3およびT-p4と比べて安定なMHC複合体をこのペプチドが形成できることと一致していた。T-p2 CTLの細胞障害活性の測定では、1nMという低いペプチド濃度で細胞障害性応答が示された(図3C)。また、様々な健常なドナーから単離されたCD19+細胞においてブラキュリの低発現が検出可能であったため、正常なBリンパ球の細胞障害性溶解も解析した。5名の異なる健常ドナー由来の解析した正常B細胞のいずれにおいても溶解は観察されなかった。
ブラキュリ発現の安定なノックダウンにより、NCI-H460肺癌癌細胞における間葉上皮移行が誘導される
上皮間葉(EMT)プログラムを調整する際にブラキュリが役割を果たしているかどうかを評価するために、通常は高レベルのブラキュリmRNAを発現するNCI-H460肺癌細胞においてブラキュリ発現を安定に停止させた。RT-PCR解析により、非ターゲティングshRNA対照構築物をトランスフェクトした細胞と比べた、ブラキュリ特異的shRNAクローン1およびクローン2をトランスフェクトした細胞におけるブラキュリ発現のサイレンシングを確認した(図5A)。クローン2は、ブラキュリ発現のより高いレベルのサイレンシングを示した。
ブラキュリの減少により、インビトロでのNCI-H460肺癌細胞の移動特性および浸潤特性に障害が生じる
また、NCI-H460細胞におけるブラキュリ発現がこれらの細胞の移動特徴および浸潤特徴を調整するかどうかを決定するために、ボイデンチャンバートランスウェルアッセイ法も実施した。図6に示すように、ブラキュリ発現を安定に停止された(Br. shRNAクローン2)NCI-H460細胞は、移動能力の有意な低下(図6A)ならびに細胞外基質を分解および浸潤する能力の著しい低下(図6A)を示した。これらの結果により、Tボックス転写因子ブラキュリが腫瘍細胞の間葉系表現型の調節因子として働くことができ、転移に関連した細胞特性をプログラムし得るという結論が裏付けられる。
造血器悪性腫瘍におけるブラキュリの発現
慢性リンパ性白血病(CLL)ならびに他の造血器悪性腫瘍(ホジキンリンパ腫、非ホジキンリンパ腫、バーキットリンパ腫)におけるブラキュリの発現を研究した。CLL患者からCD19+細胞を単離した。ヒトブラキュリおよびGAPDHに対するプライマーを用いた定量的リアルタイムポリメラーゼ連鎖反応法(PCR)によって、CD19+ B細胞におけるブラキュリの相対的発現を評価した。CLL患者から単離したCD19+細胞におけるブラキュリの発現は、0.318+/-0.752であったのに対し、健常ドナーにおけるブラキュリの発現は、0.019+/-0.023であった。ブラキュリがCD5+CD19+白血病細胞において発現されることも実証された。逆転写酵素PCR(RT-PCR)を用いて、EBVで形質転換したB細胞株(B-EBV 701、B-EBV 1383、C1R)、ならびにバーキットリンパ腫(DAUDIおよびRAJI)細胞株およびホジキンリンパ腫(RPMI6666)細胞株においてブラキュリを検出した。
特異的結合物質を用いた、腫瘍の増殖または転移の阻害
本実施例では、上皮由来、例えば、小腸、腎臓、膀胱、子宮、卵巣、もしくは精巣の腫瘍を有する対象において、または肺癌、結腸癌、および前立腺癌などの癌において、またはB細胞由来の腫瘍、例えば、慢性リンパ性白血病、バーキットリンパ腫、もしくはホジキンリンパ腫において腫瘍の増殖または転移を有意に減少させるために使用できる方法を説明する。
レトロスペクティブな研究
ブラキュリ発現と腫瘍の予後の相関を決定するために、前述したように、特に肺、結腸、乳房、および前立腺の癌組織の試料をリアルタイムPCRによって解析して、ブラキュリmRNAの発現を決定する。個々の腫瘍試料から調製されたcDNAを含む市販されているcDNAパネル(TissueScan Real-Time Disease qPCR Arrays, Origene Technologies, Rockville, MD)をブラキュリ特異的PCRプライマーおよびGAPDH特異的PCRプライマーを用いて試験して、各試料におけるブラキュリmRNAの定量的発現を得る。各cDNAパネルは、腫瘍のグレードおよび病期に関する情報を含む(例えば、病期1A〜IVの肺癌、病期I〜IVの前立腺癌、病期I〜IVの結腸癌、および病期0〜IVの乳癌に由来する試料が試験される)。ブラキュリmRNAは、より早期の病期であると診断された患者に由来する腫瘍の試料においてよりも、より後期の病期であると診断された患者に由来する腫瘍の試料において優先的に発現されている。
添付の配列リストに挙げた核酸配列およびアミノ酸配列は、37C.F.R.1.822において定義されているように、ヌクレオチド塩基の標準的な文字略語およびアミノ酸の3文字コードを用いて示す。各核酸配列の1つの鎖のみを示すが、相補鎖は、提示される鎖を任意に参照することにより含まれると理解される。添付の配列リストにおいて:
SEQ ID NO: 1は、ブラキュリタンパク質の例示的なアミノ酸配列である。
SEQ ID NO: 2は、ブラキュリポリペプチドをコードする例示的な核酸配列である。
SEQ ID NO: 3は、免疫原性ブラキュリポリペプチドのアミノ酸配列である。
SEQ ID NO: 4〜11は、プライマーの核酸配列である。
SEQ ID NO: 12は、癌胎児性抗原(CEA)ポリペプチドのアミノ酸配列である。
SEQ ID NO: 13は、ヒト免疫不全ウイルス(HIV)ポリペプチドのアミノ酸配列である。
SEQ ID NO: 14〜22は、例示的なブラキュリポリペプチドのアミノ酸配列である。
Claims (26)
- 多くても12個の連続したアミノ酸を含み、WLLPGTSTL(SEQ ID NO: 15)として示すアミノ酸配列を含み、主要組織適合遺伝子複合体(MHC)クラスI分子に結合し、且つ細胞障害性T細胞を誘導する、単離されたポリペプチド。
- 11アミノ酸長である、請求項1記載の単離されたポリペプチド。
- 9または10アミノ酸長である、請求項1記載の単離されたポリペプチド。
- 請求項1〜3のいずれか一項記載のポリペプチドをコードする、単離されたポリヌクレオチド。
- プロモーターに機能的に連結された、請求項4記載のポリヌクレオチド。
- 請求項5記載のポリヌクレオチドを含むベクター。
- プラスミドベクターである、請求項6記載のベクター。
- プラスミドベクターが酵母において発現される、請求項7記載のベクター。
- ウイルスベクターである、請求項6記載のベクター。
- レトロウイルスベクター、オルソポックスベクター、アビポックスベクター、鶏痘ベクター、カプリポックスベクター、スイポックスベクター、アデノウイルスベクター、ヘルペスウイルスベクター、αウイルスベクター、バキュロウイルスベクター、シンドビスウイルスベクター、ワクシニアウイルスベクター、およびポリオウイルスベクターである、請求項9記載のベクター。
- 請求項7記載のベクターを含む、単離された宿主細胞。
- 請求項1〜3のいずれか一項記載のポリペプチドの治療的有効量を薬学的に許容される担体中に含む薬学的組成物。
- 請求項5記載のポリヌクレオチドまたは請求項6〜10のいずれか一項記載のベクターの治療的有効量を薬学的に許容される担体中に含む薬学的組成物。
- 対象において免疫応答を誘発するための、請求項12または13に記載の薬学的組成物。
- アジュバントをさらに含む、請求項14記載の薬学的組成物。
- IL-2、RANTES、GM-CSF、TNF-α、IFN-γ、G-CSF、またはそれらの組合せと組み合わせて用いられる、請求項14または15に記載の薬学的組成物。
- IL-2、RANTES、GM-CSF、TNF-α、IFN-γ、G-CSF、LFA-3、CD72、B7-1、B7-2、OX-40L、4-1BBL、およびICAM-1のうち1種または複数種をコードする核酸と組み合わせて用いられる、請求項14記載の薬学的組成物。
- 請求項6〜10のいずれか一項記載のベクターの治療学的有効量を含む癌に罹患している対象を治療するための薬学的組成物。
- IL-2、RANTES、GM-CSF、TNF-α、IFN-γ、G-CSF、またはそれらの組合せと組み合わせて用いられる、請求項18記載の薬学的組成物。
- IL-2、RANTES、GM-CSF、TNF-α、IFN-γ、G-CSF、LFA-3、CD72、B7-1、B7-2、OX-40L、4-1BBL、およびICAM-1のうち1種または複数種をコードする核酸と組み合わせて用いられる、請求項18記載の薬学的組成物。
- 免疫応答がT細胞応答を含む、請求項14〜17のいずれか一項記載の薬学的組成物。
- 免疫応答が、ブラキュリ(SEQ ID NO: 14)を発現する細胞の溶解を誘導する細胞障害性T細胞を誘導することを含む、請求項14〜17のいずれか一項記載の薬学的組成物。
- 対象が癌に罹患している、請求項14〜17のいずれか一項記載の薬学的組成物。
- 対象が、小腸癌、胃癌、腎臓癌、膀胱癌、子宮癌、卵巣癌、精巣癌、肺癌、乳癌、結腸癌、前立腺癌、慢性リンパ性白血病(CLL)、またはB細胞腫瘍に罹患している、請求項23記載の薬学的組成物。
- 免疫応答が癌の増殖を減少させる、請求項24記載の薬学的組成物。
- 以下の段階を含む、対象においてSEQ ID NO: 1を特異的に認識する、CD8を発現するT細胞を検出する方法:
対象から単離された末梢血単核細胞を請求項1記載のポリペプチドを含む反応物と接触させる段階;
該末梢血単核細胞に結合された反応物の存在を検出し、それによって、SEQ ID NO: 1に特異的に結合する、CD8を発現するT細胞を検出する段階。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US90423607P | 2007-02-28 | 2007-02-28 | |
| US60/904,236 | 2007-02-28 | ||
| PCT/US2008/055185 WO2008106551A2 (en) | 2007-02-28 | 2008-02-27 | Brachyury polypeptides and methods for use |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014083444A Division JP5767733B2 (ja) | 2007-02-28 | 2014-04-15 | ブラキュリポリペプチドおよび使用方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2010519904A JP2010519904A (ja) | 2010-06-10 |
| JP2010519904A5 JP2010519904A5 (ja) | 2011-04-07 |
| JP5596980B2 true JP5596980B2 (ja) | 2014-10-01 |
Family
ID=39650527
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009551830A Active JP5596980B2 (ja) | 2007-02-28 | 2008-02-27 | ブラキュリポリペプチドおよび使用方法 |
| JP2014083444A Active JP5767733B2 (ja) | 2007-02-28 | 2014-04-15 | ブラキュリポリペプチドおよび使用方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014083444A Active JP5767733B2 (ja) | 2007-02-28 | 2014-04-15 | ブラキュリポリペプチドおよび使用方法 |
Country Status (8)
| Country | Link |
|---|---|
| US (3) | US8188214B2 (ja) |
| EP (3) | EP2918598B1 (ja) |
| JP (2) | JP5596980B2 (ja) |
| AU (1) | AU2008221383B2 (ja) |
| CA (1) | CA2678404C (ja) |
| DK (1) | DK2918598T3 (ja) |
| HK (1) | HK1215036A1 (ja) |
| WO (1) | WO2008106551A2 (ja) |
Families Citing this family (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BR112013014457A8 (pt) * | 2010-12-09 | 2017-12-19 | Pasteur Institut | usos da enzima 6-metilguanina-dna-metiltrasferase (mgmt, ec 2.1.1.63) para aumentar a produção de proteína heteróloga, bem como vetor de expressão, células recombinantes e polipeptídeo de fusão compreendendo sinal de secreção peptídica e proteína snap |
| EP2685995B1 (en) * | 2011-03-17 | 2017-05-03 | Globeimmune, Inc. | Yeast-brachyury immunotherapeutic compositions |
| WO2014043518A1 (en) * | 2012-09-14 | 2014-03-20 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Brachyury protein, non-poxvirus non-yeast vectors encoding brachyury protein, and their use |
| WO2014043535A1 (en) * | 2012-09-14 | 2014-03-20 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Compositions for the treatment of cancer |
| CA2907560C (en) * | 2013-03-19 | 2021-12-07 | Timothy C. Rodell | Yeast-based immunotherapy for chordoma |
| US9725494B2 (en) * | 2013-05-17 | 2017-08-08 | United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Soluble CD27 (sCD27) and the use thereof |
| IL256869B (en) * | 2015-07-31 | 2022-07-01 | Bavarian Nordic As | promoters for increased expression in poxviruses |
| US10550164B2 (en) | 2015-08-03 | 2020-02-04 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Brachyury deletion mutants, non-yeast vectors encoding Brachyury deletion mutants, and their use |
| CA2994272C (en) * | 2015-08-03 | 2023-08-22 | Globeimmune, Inc. | Modified yeast-brachyury immunotherapeutic compositions |
| US20190183870A1 (en) | 2016-01-05 | 2019-06-20 | The United States Of America, As Represented By The Secretary, Dept. Of Health And Human Services | Combination of histone deacetylase inhibitor and immunotherapy |
| WO2017136342A1 (en) | 2016-02-02 | 2017-08-10 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Fulvestrant for inducing immune-mediated cytotoxic lysis of cancer cells |
| CN110114086A (zh) * | 2016-06-03 | 2019-08-09 | 埃特彼塞斯公司 | 用于使用前列腺癌相关抗原肿瘤疫苗接种的组合物和方法 |
| US20190134174A1 (en) * | 2016-06-03 | 2019-05-09 | Etubics Corporation | Compositions and methods for tumor vaccination and immunotherapy involving her2/neu |
| WO2018208720A1 (en) | 2017-05-09 | 2018-11-15 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Combination pdl1 and tgf-beta blockade in patients with hpv+ malignancies |
| US11170872B2 (en) | 2019-11-05 | 2021-11-09 | Apeel Technology, Inc. | Prediction of latent infection in plant products |
| WO2022187963A1 (en) * | 2021-03-10 | 2022-09-15 | Provincial Health Services Authority | Immunotherapy agents targeting brachyury and methods of using same |
Family Cites Families (90)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4235871A (en) | 1978-02-24 | 1980-11-25 | Papahadjopoulos Demetrios P | Method of encapsulating biologically active materials in lipid vesicles |
| US4444487A (en) | 1979-07-02 | 1984-04-24 | Xerox Corporation | Multiple-flash fuser |
| US4603112A (en) | 1981-12-24 | 1986-07-29 | Health Research, Incorporated | Modified vaccinia virus |
| US4722848A (en) | 1982-12-08 | 1988-02-02 | Health Research, Incorporated | Method for immunizing animals with synthetically modified vaccinia virus |
| US7045313B1 (en) | 1982-11-30 | 2006-05-16 | The United States Of America As Represented By The Department Of Health And Human Services | Recombinant vaccinia virus containing a chimeric gene having foreign DNA flanked by vaccinia regulatory DNA |
| US4501728A (en) | 1983-01-06 | 1985-02-26 | Technology Unlimited, Inc. | Masking of liposomes from RES recognition |
| GB8308235D0 (en) | 1983-03-25 | 1983-05-05 | Celltech Ltd | Polypeptides |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4957735A (en) | 1984-06-12 | 1990-09-18 | The University Of Tennessee Research Corporation | Target-sensitive immunoliposomes- preparation and characterization |
| US5019369A (en) | 1984-10-22 | 1991-05-28 | Vestar, Inc. | Method of targeting tumors in humans |
| US4683195A (en) | 1986-01-30 | 1987-07-28 | Cetus Corporation | Process for amplifying, detecting, and/or-cloning nucleic acid sequences |
| US4745055A (en) | 1985-05-07 | 1988-05-17 | California Biotechnology Inc. | Fused protein for enzyme immunoassay system |
| US4895800A (en) | 1985-11-26 | 1990-01-23 | Phillips Petroleum Company | Yeast production of hepatitis B surface antigen |
| US5091309A (en) | 1986-01-16 | 1992-02-25 | Washington University | Sindbis virus vectors |
| CA1340456C (en) | 1986-07-07 | 1999-03-23 | Hubert J.P. Schoemaker | Chimeric rodent/human immunoglobulins specific for tumor-associated antigens |
| US4902505A (en) | 1986-07-30 | 1990-02-20 | Alkermes | Chimeric peptides for neuropeptide delivery through the blood-brain barrier |
| GB8626412D0 (en) | 1986-11-05 | 1986-12-03 | Clark M R | Antibodies |
| US4987071A (en) | 1986-12-03 | 1991-01-22 | University Patents, Inc. | RNA ribozyme polymerases, dephosphorylases, restriction endoribonucleases and methods |
| US4837028A (en) | 1986-12-24 | 1989-06-06 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| EP0278940A3 (en) | 1987-01-30 | 1988-12-07 | Smithkline Biologicals S.A. | Hepatitis b virus surface antigens and hybrid antigens containing them |
| DE3789866T2 (de) | 1987-07-17 | 1994-09-22 | Rhein Biotech Proz & Prod Gmbh | DNA-Moleküle, die für FMDH-Kontrollabschnitte und Strukturgene für ein Protein mit FMDH-Aktivität kodieren, sowie deren Anwendung. |
| US5004697A (en) | 1987-08-17 | 1991-04-02 | Univ. Of Ca | Cationized antibodies for delivery through the blood-brain barrier |
| DE10399031I1 (de) | 1987-08-28 | 2004-01-29 | Health Research Inc | Rekombinante Viren. |
| CA1340203C (en) | 1987-09-16 | 1998-12-15 | Noboru Yanagida | Recombinant apivoxvirus |
| AU622426B2 (en) | 1987-12-11 | 1992-04-09 | Abbott Laboratories | Assay using template-dependent nucleic acid probe reorganization |
| US5543508A (en) | 1987-12-15 | 1996-08-06 | Gene Shears Pty. Limited | Ribozymes |
| EP0425563B1 (en) | 1988-07-20 | 1996-05-15 | David Segev | Process for amplifying and detecting nucleic acid sequences |
| US5093258A (en) | 1988-08-26 | 1992-03-03 | Therion Biologics Corporation | Recombinant fowlpox virus and recombination vector |
| US5217879A (en) | 1989-01-12 | 1993-06-08 | Washington University | Infectious Sindbis virus vectors |
| US5055303A (en) | 1989-01-31 | 1991-10-08 | Kv Pharmaceutical Company | Solid controlled release bioadherent emulsions |
| US5703055A (en) | 1989-03-21 | 1997-12-30 | Wisconsin Alumni Research Foundation | Generation of antibodies through lipid mediated DNA delivery |
| US5270202A (en) | 1989-11-03 | 1993-12-14 | Syamal Raychaudhuri | Anti-idiotypic antibodies to human melanoma-associated proteoglycan antigen |
| US5271961A (en) | 1989-11-06 | 1993-12-21 | Alkermes Controlled Therapeutics, Inc. | Method for producing protein microspheres |
| US5188837A (en) | 1989-11-13 | 1993-02-23 | Nova Pharmaceutical Corporation | Lipsopheres for controlled delivery of substances |
| US5427930A (en) | 1990-01-26 | 1995-06-27 | Abbott Laboratories | Amplification of target nucleic acids using gap filling ligase chain reaction |
| GB9007024D0 (en) | 1990-03-29 | 1990-05-30 | Imperial College | Novel vaccine |
| US5061620A (en) | 1990-03-30 | 1991-10-29 | Systemix, Inc. | Human hematopoietic stem cell |
| US5268164A (en) | 1990-04-23 | 1993-12-07 | Alkermes, Inc. | Increasing blood-brain barrier permeability with permeabilizer peptides |
| WO1991019803A1 (en) | 1990-06-19 | 1991-12-26 | Applied Biotechnology, Incorporated | Self assembled, defective, nonself-propagating viral particles |
| US5709860A (en) | 1991-07-25 | 1998-01-20 | Idec Pharmaceuticals Corporation | Induction of cytotoxic T-lymphocyte responses |
| DK0596032T4 (da) | 1991-07-25 | 2004-07-26 | Idec Pharma Corp | Induktion af cytotoksiske T-lymfocytsvar |
| US5254342A (en) | 1991-09-30 | 1993-10-19 | University Of Southern California | Compositions and methods for enhanced transepithelial and transendothelial transport or active agents |
| US5643578A (en) | 1992-03-23 | 1997-07-01 | University Of Massachusetts Medical Center | Immunization by inoculation of DNA transcription unit |
| DE69311538D1 (de) | 1992-03-12 | 1997-07-17 | Alkermes Inc | Acth enthaltende mikrokugeln mit gesteuerter abgabe |
| WO1993023569A1 (en) | 1992-05-11 | 1993-11-25 | Ribozyme Pharmaceuticals, Inc. | Method and reagent for inhibiting viral replication |
| US5534496A (en) | 1992-07-07 | 1996-07-09 | University Of Southern California | Methods and compositions to enhance epithelial drug transport |
| EP0786522A2 (en) | 1992-07-17 | 1997-07-30 | Ribozyme Pharmaceuticals, Inc. | Enzymatic RNA molecules for treatment of stenotic conditions |
| US5662907A (en) | 1992-08-07 | 1997-09-02 | Cytel Corporation | Induction of anti-tumor cytotoxic T lymphocytes in humans using synthetic peptide epitopes |
| CA2142007C (en) | 1992-08-11 | 2007-10-30 | Robert Glen Urban | Immunomodulatory peptides |
| US5593972A (en) | 1993-01-26 | 1997-01-14 | The Wistar Institute | Genetic immunization |
| US5514670A (en) | 1993-08-13 | 1996-05-07 | Pharmos Corporation | Submicron emulsions for delivery of peptides |
| US5902880A (en) | 1994-08-19 | 1999-05-11 | Ribozyme Pharmaceuticals, Inc. | RNA polymerase III-based expression of therapeutic RNAs |
| US5648211A (en) | 1994-04-18 | 1997-07-15 | Becton, Dickinson And Company | Strand displacement amplification using thermophilic enzymes |
| US6429199B1 (en) | 1994-07-15 | 2002-08-06 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules for activating dendritic cells |
| CA2194761C (en) | 1994-07-15 | 2006-12-19 | Arthur M. Krieg | Immunomodulatory oligonucleotides |
| US6239116B1 (en) | 1994-07-15 | 2001-05-29 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| WO1996002668A1 (en) | 1994-07-15 | 1996-02-01 | Azco Nobel N.V. | Use of rna polymerase to improve nucleic acid amplification process |
| US6207646B1 (en) | 1994-07-15 | 2001-03-27 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| US6146886A (en) | 1994-08-19 | 2000-11-14 | Ribozyme Pharmaceuticals, Inc. | RNA polymerase III-based expression of therapeutic RNAs |
| EP1016418B1 (en) | 1994-10-03 | 2009-12-30 | THE GOVERNMENT OF THE UNITED STATES OF AMERICA, as represented by THE SECRETARY, DEPARTMENT OF HEALTH AND HUMAN SERVICES | Host cell comprising a recombinant virus expressing an antigen and a recombinant virus expressing an immunostimulatory molecule |
| US6045802A (en) | 1994-10-03 | 2000-04-04 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Enhanced immune response to an antigen by a composition of a recombinant virus expressing the antigen with a recombinant virus expressing an immunostimulatory molecule |
| US6045908A (en) | 1995-02-14 | 2000-04-04 | Chisso Corporation | Biodegradable fiber and non-woven fabric |
| US6001349A (en) * | 1995-02-22 | 1999-12-14 | Therion Biologics Corporation | Generation of human cytotoxic T-cells specific for carcinoma self-associated antigens and uses thereof |
| AT402203B (de) | 1995-06-13 | 1997-03-25 | Himmler Gottfried Dipl Ing Dr | Verfahren zur transkriptionsfreien amplifizierung von nucleinsäuren |
| US6165460A (en) | 1995-07-10 | 2000-12-26 | Therion Biologics Corporation | Generation of immune responses to prostate-specific antigen (PSA) |
| CA2282300C (en) * | 1997-02-24 | 2011-08-02 | Therion Biologics Corporation | Recombinant pox virus for immunization against muc1 tumor-associated antigen |
| WO1998037919A1 (en) | 1997-02-28 | 1998-09-03 | University Of Iowa Research Foundation | USE OF NUCLEIC ACIDS CONTAINING UNMETHYLATED CpG DINUCLEOTIDE IN THE TREATMENT OF LPS-ASSOCIATED DISORDERS |
| US6406705B1 (en) | 1997-03-10 | 2002-06-18 | University Of Iowa Research Foundation | Use of nucleic acids containing unmethylated CpG dinucleotide as an adjuvant |
| EP1003531B1 (en) | 1997-05-20 | 2007-08-22 | Ottawa Health Research Institute | Processes for preparing nucleic acid constructs |
| GB0023203D0 (en) * | 2000-09-21 | 2000-11-01 | Isis Innovation | Vaccination method |
| US6395713B1 (en) | 1997-07-23 | 2002-05-28 | Ribozyme Pharmaceuticals, Inc. | Compositions for the delivery of negatively charged molecules |
| CA2301166A1 (en) | 1997-07-24 | 1999-02-04 | Yuan-Peng Zhang | Liposomal compositions for the delivery of nucleic acid catalysts |
| US6969609B1 (en) * | 1998-12-09 | 2005-11-29 | The United States Of America As Represented By The Department Of Health And Human Serivces | Recombinant vector expressing multiple costimulatory molecules and uses thereof |
| AU1606799A (en) * | 1997-12-09 | 1999-06-28 | Virogenetics Corporation | Recombinant vaccinia constructs expressing feline il-2, compositions and methodsof use thereof |
| AU1922999A (en) | 1997-12-16 | 1999-07-05 | Baylor College Of Medicine | Needle-free injection of formulated nucleic acid molecules |
| ES2284247T3 (es) | 1998-04-03 | 2007-11-01 | University Of Iowa Research Foundation | Metodos y productos para estimular el sistema inmunitario usando oligonucleotidos y citoquinas inmunoterapeuticos. |
| US6849255B2 (en) * | 1998-08-18 | 2005-02-01 | Yissum Research Development Company Of The Hebrew University Of Jerusalem | Methods and compositions for enhancing cartilage repair |
| US7399827B1 (en) | 1998-09-01 | 2008-07-15 | The United States Of America As Represented By The Department Of Health And Human Services | Page-4, an x-linked gage-like gene expressed in normal and neoplastic prostate, testis and uterus, and uses therefor |
| RU2237674C2 (ru) * | 1998-09-30 | 2004-10-10 | Корикса Корпорейшн | Композиции и способы wt1-специфичной иммунотерапии |
| US20020131976A1 (en) * | 1998-12-23 | 2002-09-19 | Ajit Lalvani | Tuberculosis vaccine |
| JP2002537828A (ja) | 1999-03-10 | 2002-11-12 | フォゲン リミティド | 細胞への物質のデリバリー |
| RU2002103722A (ru) * | 1999-07-13 | 2003-08-27 | ПРАВИТЕЛЬСТВО СОЕДИНЕННЫХ ШТАТОВ АМЕРИКИ, представл емое СЕКРЕТАРЕМ МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ И СЛУЖБЫ ДЛЯ ЛЮДЕЙ (US) | Белок альтернативной рамки считывания рецептора у Т-клеток(TARP) и его применения |
| EP1218030A4 (en) | 1999-09-10 | 2004-09-15 | Univ Fordham | METHODS AND COMPOSITIONS FOR THE TREATMENT AND PREVENTION OF GRAFT REJECTS USING THERMAL SHOCK PROTEINS |
| WO2001082964A1 (en) * | 2000-04-28 | 2001-11-08 | The Government Of The United States Of America, As Represented By The Secretary Of The Department Of Health And Human Services | Improved immunogenicity using a combination of dna and vaccinia virus vector vaccines |
| AU2002303219A1 (en) * | 2001-03-30 | 2002-10-15 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of cancer |
| US20030108890A1 (en) * | 2001-05-30 | 2003-06-12 | Baranova Anna Vjacheslavovna | In silico screening for phenotype-associated expressed sequences |
| BRPI0311822B8 (pt) * | 2002-06-06 | 2021-05-25 | Oncotherapy Science Inc | composição farmacêutica para o tratamento de câncer |
| WO2004030615A2 (en) * | 2002-10-02 | 2004-04-15 | Genentech, Inc. | Compositions and methods for the diagnosis and treatment of tumor |
| WO2006004182A1 (ja) * | 2004-07-07 | 2006-01-12 | Nec Corporation | 配列予測システム |
| EP1748067A1 (en) * | 2005-07-29 | 2007-01-31 | Institut Pasteur | Polynucleotides encoding MHC class I-restricted hTERT epitopes, analogues thereof or polyepitopes |
-
2008
- 2008-02-27 JP JP2009551830A patent/JP5596980B2/ja active Active
- 2008-02-27 EP EP15162282.6A patent/EP2918598B1/en active Active
- 2008-02-27 EP EP08743578.0A patent/EP2125868B1/en active Active
- 2008-02-27 CA CA2678404A patent/CA2678404C/en active Active
- 2008-02-27 AU AU2008221383A patent/AU2008221383B2/en active Active
- 2008-02-27 DK DK15162282.6T patent/DK2918598T3/en active
- 2008-02-27 WO PCT/US2008/055185 patent/WO2008106551A2/en active Application Filing
- 2008-02-27 US US12/528,796 patent/US8188214B2/en active Active
- 2008-02-27 EP EP11195533A patent/EP2444410A3/en not_active Withdrawn
-
2012
- 2012-04-30 US US13/460,587 patent/US8613933B2/en active Active
-
2013
- 2013-12-23 US US14/138,629 patent/US20140135488A1/en not_active Abandoned
-
2014
- 2014-04-15 JP JP2014083444A patent/JP5767733B2/ja active Active
-
2016
- 2016-03-15 HK HK16103006.8A patent/HK1215036A1/zh unknown
Also Published As
| Publication number | Publication date |
|---|---|
| US20140135488A1 (en) | 2014-05-15 |
| CA2678404A1 (en) | 2008-09-04 |
| AU2008221383B2 (en) | 2012-09-13 |
| US20120230948A1 (en) | 2012-09-13 |
| AU2008221383A1 (en) | 2008-09-04 |
| JP2010519904A (ja) | 2010-06-10 |
| CA2678404C (en) | 2019-03-19 |
| EP2125868A2 (en) | 2009-12-02 |
| WO2008106551A3 (en) | 2009-03-05 |
| JP2014207903A (ja) | 2014-11-06 |
| WO2008106551A8 (en) | 2009-08-06 |
| EP2918598B1 (en) | 2019-01-30 |
| WO2008106551A2 (en) | 2008-09-04 |
| US8613933B2 (en) | 2013-12-24 |
| US8188214B2 (en) | 2012-05-29 |
| EP2918598A1 (en) | 2015-09-16 |
| HK1215036A1 (zh) | 2016-08-12 |
| EP2125868B1 (en) | 2015-06-10 |
| EP2444410A2 (en) | 2012-04-25 |
| DK2918598T3 (en) | 2019-04-29 |
| EP2444410A3 (en) | 2012-08-08 |
| JP5767733B2 (ja) | 2015-08-19 |
| US20100055121A1 (en) | 2010-03-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5767733B2 (ja) | ブラキュリポリペプチドおよび使用方法 | |
| EP1989224B1 (en) | Immunogenic peptides and methods of use | |
| US20090208518A1 (en) | Immunogenic peptides for the treatment of prostate and breast cancer | |
| US9937250B2 (en) | Immunogenic tumor associated stromal cell antigen peptides and methods of their use | |
| AU2012261687B2 (en) | Brachyury polypeptides and methods for use | |
| US9238684B2 (en) | SPANX-B polypeptides and their use | |
| AU2003293677A1 (en) | Ptprk immunogenic peptide |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110221 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110221 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120201 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20120201 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20121210 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130214 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130221 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130514 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20131216 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140415 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20140416 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20140513 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20140710 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20140808 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5596980 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |