JP5289963B2 - 抗addlモノクローナル抗体およびその使用 - Google Patents
抗addlモノクローナル抗体およびその使用 Download PDFInfo
- Publication number
- JP5289963B2 JP5289963B2 JP2008536730A JP2008536730A JP5289963B2 JP 5289963 B2 JP5289963 B2 JP 5289963B2 JP 2008536730 A JP2008536730 A JP 2008536730A JP 2008536730 A JP2008536730 A JP 2008536730A JP 5289963 B2 JP5289963 B2 JP 5289963B2
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- antibodies
- amino acid
- seq
- binding
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 230000027455 binding Effects 0.000 claims description 70
- 238000000034 method Methods 0.000 claims description 63
- 210000002569 neuron Anatomy 0.000 claims description 38
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 37
- 208000024827 Alzheimer disease Diseases 0.000 claims description 34
- 239000003446 ligand Substances 0.000 claims description 29
- 239000000203 mixture Substances 0.000 claims description 22
- 239000012634 fragment Substances 0.000 claims description 21
- 239000003795 chemical substances by application Substances 0.000 claims description 18
- 239000003814 drug Substances 0.000 claims description 14
- 239000008194 pharmaceutical composition Substances 0.000 claims description 14
- 108010026424 tau Proteins Proteins 0.000 claims description 13
- 102000013498 tau Proteins Human genes 0.000 claims description 13
- 239000000178 monomer Substances 0.000 claims description 10
- 230000000903 blocking effect Effects 0.000 claims description 9
- 230000026731 phosphorylation Effects 0.000 claims description 9
- 238000006366 phosphorylation reaction Methods 0.000 claims description 9
- 238000010276 construction Methods 0.000 claims description 8
- 230000002401 inhibitory effect Effects 0.000 claims description 7
- 229940124597 therapeutic agent Drugs 0.000 claims description 6
- 239000003937 drug carrier Substances 0.000 claims description 3
- 102100034004 Gamma-adducin Human genes 0.000 description 129
- 101000799011 Homo sapiens Gamma-adducin Proteins 0.000 description 129
- 241000699666 Mus <mouse, genus> Species 0.000 description 46
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 44
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 44
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 33
- 201000010099 disease Diseases 0.000 description 31
- 108090000765 processed proteins & peptides Proteins 0.000 description 27
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 26
- 239000000427 antigen Substances 0.000 description 26
- 108090000623 proteins and genes Proteins 0.000 description 25
- 101100112922 Candida albicans CDR3 gene Proteins 0.000 description 23
- 108091007433 antigens Proteins 0.000 description 23
- 102000036639 antigens Human genes 0.000 description 23
- 238000011282 treatment Methods 0.000 description 22
- 102000004169 proteins and genes Human genes 0.000 description 20
- 210000004027 cell Anatomy 0.000 description 18
- 238000003752 polymerase chain reaction Methods 0.000 description 16
- 108010064539 amyloid beta-protein (1-42) Proteins 0.000 description 15
- 239000000523 sample Substances 0.000 description 15
- 150000001413 amino acids Chemical class 0.000 description 14
- 238000009825 accumulation Methods 0.000 description 13
- 238000004458 analytical method Methods 0.000 description 13
- 150000007523 nucleic acids Chemical group 0.000 description 13
- 239000000243 solution Substances 0.000 description 13
- 210000004556 brain Anatomy 0.000 description 12
- 239000013598 vector Substances 0.000 description 12
- 108091028043 Nucleic acid sequence Proteins 0.000 description 11
- 238000003556 assay Methods 0.000 description 11
- 239000002773 nucleotide Substances 0.000 description 11
- 125000003729 nucleotide group Chemical group 0.000 description 11
- 239000002671 adjuvant Substances 0.000 description 10
- 238000006243 chemical reaction Methods 0.000 description 10
- 239000002953 phosphate buffered saline Substances 0.000 description 10
- 230000001225 therapeutic effect Effects 0.000 description 10
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 9
- 102000004196 processed proteins & peptides Human genes 0.000 description 9
- 238000002965 ELISA Methods 0.000 description 8
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 8
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 8
- 241000235648 Pichia Species 0.000 description 8
- 125000000539 amino acid group Chemical group 0.000 description 8
- 238000002347 injection Methods 0.000 description 8
- 239000007924 injection Substances 0.000 description 8
- 238000002823 phage display Methods 0.000 description 8
- 238000002360 preparation method Methods 0.000 description 8
- 241001465754 Metazoa Species 0.000 description 7
- 241001529936 Murinae Species 0.000 description 7
- 108010064397 amyloid beta-protein (1-40) Proteins 0.000 description 7
- 238000001514 detection method Methods 0.000 description 7
- 238000009472 formulation Methods 0.000 description 7
- 210000004408 hybridoma Anatomy 0.000 description 7
- 238000003018 immunoassay Methods 0.000 description 7
- 230000001965 increasing effect Effects 0.000 description 7
- 230000035772 mutation Effects 0.000 description 7
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 6
- 208000000044 Amnesia Diseases 0.000 description 6
- 208000026139 Memory disease Diseases 0.000 description 6
- 108010079855 Peptide Aptamers Proteins 0.000 description 6
- 230000000971 hippocampal effect Effects 0.000 description 6
- 230000015654 memory Effects 0.000 description 6
- 230000006984 memory degeneration Effects 0.000 description 6
- 208000023060 memory loss Diseases 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 241000282412 Homo Species 0.000 description 5
- 241000699670 Mus sp. Species 0.000 description 5
- DZHSAHHDTRWUTF-SIQRNXPUSA-N amyloid-beta polypeptide 42 Chemical compound C([C@@H](C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)NCC(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(O)=O)[C@@H](C)CC)C(C)C)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@@H](NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC(O)=O)C(C)C)C(C)C)C1=CC=CC=C1 DZHSAHHDTRWUTF-SIQRNXPUSA-N 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 238000010494 dissociation reaction Methods 0.000 description 5
- 230000005593 dissociations Effects 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- 238000004519 manufacturing process Methods 0.000 description 5
- 238000004091 panning Methods 0.000 description 5
- 238000006467 substitution reaction Methods 0.000 description 5
- 208000024891 symptom Diseases 0.000 description 5
- YYGNTYWPHWGJRM-UHFFFAOYSA-N (6E,10E,14E,18E)-2,6,10,15,19,23-hexamethyltetracosa-2,6,10,14,18,22-hexaene Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC=C(C)CCC=C(C)CCC=C(C)C YYGNTYWPHWGJRM-UHFFFAOYSA-N 0.000 description 4
- 206010012289 Dementia Diseases 0.000 description 4
- 108010090804 Streptavidin Proteins 0.000 description 4
- BHEOSNUKNHRBNM-UHFFFAOYSA-N Tetramethylsqualene Natural products CC(=C)C(C)CCC(=C)C(C)CCC(C)=CCCC=C(C)CCC(C)C(=C)CCC(C)C(C)=C BHEOSNUKNHRBNM-UHFFFAOYSA-N 0.000 description 4
- 239000002299 complementary DNA Substances 0.000 description 4
- 238000013461 design Methods 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 239000003085 diluting agent Substances 0.000 description 4
- PRAKJMSDJKAYCZ-UHFFFAOYSA-N dodecahydrosqualene Natural products CC(C)CCCC(C)CCCC(C)CCCCC(C)CCCC(C)CCCC(C)C PRAKJMSDJKAYCZ-UHFFFAOYSA-N 0.000 description 4
- 239000000839 emulsion Substances 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- 239000000543 intermediate Substances 0.000 description 4
- 238000002844 melting Methods 0.000 description 4
- 230000008018 melting Effects 0.000 description 4
- 108020004707 nucleic acids Proteins 0.000 description 4
- 102000039446 nucleic acids Human genes 0.000 description 4
- 229920000136 polysorbate Polymers 0.000 description 4
- 230000000069 prophylactic effect Effects 0.000 description 4
- 230000002441 reversible effect Effects 0.000 description 4
- 241000894007 species Species 0.000 description 4
- 229940031439 squalene Drugs 0.000 description 4
- TUHBEKDERLKLEC-UHFFFAOYSA-N squalene Natural products CC(=CCCC(=CCCC(=CCCC=C(/C)CCC=C(/C)CC=C(C)C)C)C)C TUHBEKDERLKLEC-UHFFFAOYSA-N 0.000 description 4
- 238000007920 subcutaneous administration Methods 0.000 description 4
- 238000013268 sustained release Methods 0.000 description 4
- 239000012730 sustained-release form Substances 0.000 description 4
- 230000009261 transgenic effect Effects 0.000 description 4
- 239000013638 trimer Substances 0.000 description 4
- 239000003981 vehicle Substances 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- 208000037259 Amyloid Plaque Diseases 0.000 description 3
- 108010090849 Amyloid beta-Peptides Proteins 0.000 description 3
- 102000013455 Amyloid beta-Peptides Human genes 0.000 description 3
- 108020004414 DNA Proteins 0.000 description 3
- 241000588724 Escherichia coli Species 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 108060003951 Immunoglobulin Proteins 0.000 description 3
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 241000283973 Oryctolagus cuniculus Species 0.000 description 3
- 229930040373 Paraformaldehyde Natural products 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 3
- 239000004480 active ingredient Substances 0.000 description 3
- 230000009824 affinity maturation Effects 0.000 description 3
- 210000003719 b-lymphocyte Anatomy 0.000 description 3
- 230000004071 biological effect Effects 0.000 description 3
- 229960002685 biotin Drugs 0.000 description 3
- 235000020958 biotin Nutrition 0.000 description 3
- 239000011616 biotin Substances 0.000 description 3
- 230000037396 body weight Effects 0.000 description 3
- 210000005013 brain tissue Anatomy 0.000 description 3
- 229910052799 carbon Inorganic materials 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- 238000010367 cloning Methods 0.000 description 3
- 229920001577 copolymer Polymers 0.000 description 3
- 230000000875 corresponding effect Effects 0.000 description 3
- 238000010790 dilution Methods 0.000 description 3
- 239000012895 dilution Substances 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 239000000499 gel Substances 0.000 description 3
- 230000002068 genetic effect Effects 0.000 description 3
- 210000004295 hippocampal neuron Anatomy 0.000 description 3
- 230000003053 immunization Effects 0.000 description 3
- 238000003365 immunocytochemistry Methods 0.000 description 3
- 102000018358 immunoglobulin Human genes 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 239000002502 liposome Substances 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 230000035800 maturation Effects 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- 230000016273 neuron death Effects 0.000 description 3
- 230000003472 neutralizing effect Effects 0.000 description 3
- 229920002866 paraformaldehyde Polymers 0.000 description 3
- 230000002093 peripheral effect Effects 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 238000011830 transgenic mouse model Methods 0.000 description 3
- 238000002054 transplantation Methods 0.000 description 3
- 229960005486 vaccine Drugs 0.000 description 3
- OVSKGTONMLKNPZ-UHFFFAOYSA-N 3-(1-methylindol-3-yl)-4-(1-methyl-6-nitroindol-3-yl)pyrrole-2,5-dione Chemical compound C12=CC=CC=C2N(C)C=C1C1=C(C=2C3=CC=C(C=C3N(C)C=2)[N+]([O-])=O)C(=O)NC1=O OVSKGTONMLKNPZ-UHFFFAOYSA-N 0.000 description 2
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 2
- 229920000936 Agarose Polymers 0.000 description 2
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 2
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 2
- 108010048112 Amyloidogenic Proteins Proteins 0.000 description 2
- 102000009091 Amyloidogenic Proteins Human genes 0.000 description 2
- 108091023037 Aptamer Proteins 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 108010039939 Cell Wall Skeleton Proteins 0.000 description 2
- 108091035707 Consensus sequence Proteins 0.000 description 2
- 238000012286 ELISA Assay Methods 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 2
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 2
- 102000007651 Macrophage Colony-Stimulating Factor Human genes 0.000 description 2
- 108010046938 Macrophage Colony-Stimulating Factor Proteins 0.000 description 2
- 241001467552 Mycobacterium bovis BCG Species 0.000 description 2
- 108700020354 N-acetylmuramyl-threonyl-isoglutamine Proteins 0.000 description 2
- 206010029350 Neurotoxicity Diseases 0.000 description 2
- 235000019483 Peanut oil Nutrition 0.000 description 2
- 229920000954 Polyglycolide Polymers 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 238000012300 Sequence Analysis Methods 0.000 description 2
- 206010044221 Toxic encephalopathy Diseases 0.000 description 2
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 2
- NWMHDZMRVUOQGL-CZEIJOLGSA-N almurtide Chemical compound OC(=O)CC[C@H](C(N)=O)NC(=O)[C@H](C)NC(=O)CO[C@@H]([C@H](O)[C@H](O)CO)[C@@H](NC(C)=O)C=O NWMHDZMRVUOQGL-CZEIJOLGSA-N 0.000 description 2
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 2
- 230000003942 amyloidogenic effect Effects 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 229960000190 bacillus calmette–guérin vaccine Drugs 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 230000003542 behavioural effect Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 210000002421 cell wall Anatomy 0.000 description 2
- 210000004520 cell wall skeleton Anatomy 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 210000003169 central nervous system Anatomy 0.000 description 2
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 2
- 230000009137 competitive binding Effects 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- ADEBPBSSDYVVLD-UHFFFAOYSA-N donepezil Chemical compound O=C1C=2C=C(OC)C(OC)=CC=2CC1CC(CC1)CCN1CC1=CC=CC=C1 ADEBPBSSDYVVLD-UHFFFAOYSA-N 0.000 description 2
- 239000012636 effector Substances 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000013604 expression vector Substances 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 230000013595 glycosylation Effects 0.000 description 2
- 238000006206 glycosylation reaction Methods 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 238000002649 immunization Methods 0.000 description 2
- 230000002163 immunogen Effects 0.000 description 2
- 230000003308 immunostimulating effect Effects 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 238000007917 intracranial administration Methods 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 238000010253 intravenous injection Methods 0.000 description 2
- 108010045069 keyhole-limpet hemocyanin Proteins 0.000 description 2
- 238000002372 labelling Methods 0.000 description 2
- 239000004816 latex Substances 0.000 description 2
- 229920000126 latex Polymers 0.000 description 2
- 230000027928 long-term synaptic potentiation Effects 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 229920002521 macromolecule Polymers 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- 239000011859 microparticle Substances 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 239000003068 molecular probe Substances 0.000 description 2
- 229940035032 monophosphoryl lipid a Drugs 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 230000007135 neurotoxicity Effects 0.000 description 2
- 231100000228 neurotoxicity Toxicity 0.000 description 2
- 239000003921 oil Substances 0.000 description 2
- 235000019198 oils Nutrition 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 230000001575 pathological effect Effects 0.000 description 2
- 230000007170 pathology Effects 0.000 description 2
- 239000000312 peanut oil Substances 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 229920001983 poloxamer Polymers 0.000 description 2
- 229920000747 poly(lactic acid) Polymers 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- 238000011533 pre-incubation Methods 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 108091008146 restriction endonucleases Proteins 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 238000007423 screening assay Methods 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 230000009870 specific binding Effects 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 230000007645 synaptic failure Effects 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- 102000003390 tumor necrosis factor Human genes 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- ASWBNKHCZGQVJV-UHFFFAOYSA-N (3-hexadecanoyloxy-2-hydroxypropyl) 2-(trimethylazaniumyl)ethyl phosphate Chemical compound CCCCCCCCCCCCCCCC(=O)OCC(O)COP([O-])(=O)OCC[N+](C)(C)C ASWBNKHCZGQVJV-UHFFFAOYSA-N 0.000 description 1
- UFBJCMHMOXMLKC-UHFFFAOYSA-N 2,4-dinitrophenol Chemical compound OC1=CC=C([N+]([O-])=O)C=C1[N+]([O-])=O UFBJCMHMOXMLKC-UHFFFAOYSA-N 0.000 description 1
- 238000005084 2D-nuclear magnetic resonance Methods 0.000 description 1
- UAIUNKRWKOVEES-UHFFFAOYSA-N 3,3',5,5'-tetramethylbenzidine Chemical compound CC1=C(N)C(C)=CC(C=2C=C(C)C(N)=C(C)C=2)=C1 UAIUNKRWKOVEES-UHFFFAOYSA-N 0.000 description 1
- XMTQQYYKAHVGBJ-UHFFFAOYSA-N 3-(3,4-DICHLOROPHENYL)-1,1-DIMETHYLUREA Chemical compound CN(C)C(=O)NC1=CC=C(Cl)C(Cl)=C1 XMTQQYYKAHVGBJ-UHFFFAOYSA-N 0.000 description 1
- OPIFSICVWOWJMJ-AEOCFKNESA-N 5-bromo-4-chloro-3-indolyl beta-D-galactoside Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1OC1=CNC2=CC=C(Br)C(Cl)=C12 OPIFSICVWOWJMJ-AEOCFKNESA-N 0.000 description 1
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 1
- 239000012099 Alexa Fluor family Substances 0.000 description 1
- 238000008940 Alkaline Phosphatase assay kit Methods 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 101800002011 Amphipathic peptide Proteins 0.000 description 1
- 108010094108 Amyloid Proteins 0.000 description 1
- 102000001049 Amyloid Human genes 0.000 description 1
- 108010060159 Apolipoprotein E4 Proteins 0.000 description 1
- 201000001320 Atherosclerosis Diseases 0.000 description 1
- 231100000699 Bacterial toxin Toxicity 0.000 description 1
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 229920001661 Chitosan Polymers 0.000 description 1
- 102000009016 Cholera Toxin Human genes 0.000 description 1
- 108010049048 Cholera Toxin Proteins 0.000 description 1
- 108020004705 Codon Proteins 0.000 description 1
- 241000186216 Corynebacterium Species 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 102000009109 Fc receptors Human genes 0.000 description 1
- 108010087819 Fc receptors Proteins 0.000 description 1
- 108010008177 Fd immunoglobulins Proteins 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 239000012981 Hank's balanced salt solution Substances 0.000 description 1
- 208000035150 Hypercholesterolemia Diseases 0.000 description 1
- 102100026120 IgG receptor FcRn large subunit p51 Human genes 0.000 description 1
- 101710177940 IgG receptor FcRn large subunit p51 Proteins 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 206010022004 Influenza like illness Diseases 0.000 description 1
- 108010002352 Interleukin-1 Proteins 0.000 description 1
- 108010065805 Interleukin-12 Proteins 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 229930182816 L-glutamine Natural products 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- LRKCBIUDWAXNEG-CSMHCCOUSA-N Leu-Thr Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(O)=O LRKCBIUDWAXNEG-CSMHCCOUSA-N 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- 239000006142 Luria-Bertani Agar Substances 0.000 description 1
- 241000975794 Macropodid alphaherpesvirus 1 Species 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 101710135898 Myc proto-oncogene protein Proteins 0.000 description 1
- 102100038895 Myc proto-oncogene protein Human genes 0.000 description 1
- 125000003047 N-acetyl group Chemical group 0.000 description 1
- 108700015872 N-acetyl-nor-muramyl-L-alanyl-D-isoglutamine Proteins 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 101710138657 Neurotoxin Proteins 0.000 description 1
- 101710163270 Nuclease Proteins 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 102000003992 Peroxidases Human genes 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 241000276498 Pollachius virens Species 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 108010050254 Presenilins Proteins 0.000 description 1
- XSVMFMHYUFZWBK-NSHDSACASA-N Rivastigmine Chemical compound CCN(C)C(=O)OC1=CC=CC([C@H](C)N(C)C)=C1 XSVMFMHYUFZWBK-NSHDSACASA-N 0.000 description 1
- 241000235070 Saccharomyces Species 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- PRXRUNOAOLTIEF-ADSICKODSA-N Sorbitan trioleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@@H](OC(=O)CCCCCCC\C=C/CCCCCCCC)[C@H]1OC[C@H](O)[C@H]1OC(=O)CCCCCCC\C=C/CCCCCCCC PRXRUNOAOLTIEF-ADSICKODSA-N 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 239000008049 TAE buffer Substances 0.000 description 1
- 208000034799 Tauopathies Diseases 0.000 description 1
- 239000004809 Teflon Substances 0.000 description 1
- 229920006362 Teflon® Polymers 0.000 description 1
- 101710150448 Transcriptional regulator Myc Proteins 0.000 description 1
- 108700019146 Transgenes Proteins 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 206010053614 Type III immune complex mediated reaction Diseases 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- HGEVZDLYZYVYHD-UHFFFAOYSA-N acetic acid;2-amino-2-(hydroxymethyl)propane-1,3-diol;2-[2-[bis(carboxymethyl)amino]ethyl-(carboxymethyl)amino]acetic acid Chemical compound CC(O)=O.OCC(N)(CO)CO.OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O HGEVZDLYZYVYHD-UHFFFAOYSA-N 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 238000001261 affinity purification Methods 0.000 description 1
- 238000007818 agglutination assay Methods 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 1
- 229960000723 ampicillin Drugs 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 101150031224 app gene Proteins 0.000 description 1
- 229940039856 aricept Drugs 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 239000000688 bacterial toxin Substances 0.000 description 1
- 238000002869 basic local alignment search tool Methods 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 230000036765 blood level Effects 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- 238000010805 cDNA synthesis kit Methods 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 238000010382 chemical cross-linking Methods 0.000 description 1
- 125000003636 chemical group Chemical group 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 239000000544 cholinesterase inhibitor Substances 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 238000011260 co-administration Methods 0.000 description 1
- 208000010877 cognitive disease Diseases 0.000 description 1
- 230000001149 cognitive effect Effects 0.000 description 1
- 230000007370 cognitive improvement Effects 0.000 description 1
- 238000012875 competitive assay Methods 0.000 description 1
- 230000009918 complex formation Effects 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 238000005094 computer simulation Methods 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 230000003412 degenerative effect Effects 0.000 description 1
- 230000022811 deglycosylation Effects 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 239000002274 desiccant Substances 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 229940042399 direct acting antivirals protease inhibitors Drugs 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- KAKKHKRHCKCAGH-UHFFFAOYSA-L disodium;(4-nitrophenyl) phosphate;hexahydrate Chemical compound O.O.O.O.O.O.[Na+].[Na+].[O-][N+](=O)C1=CC=C(OP([O-])([O-])=O)C=C1 KAKKHKRHCKCAGH-UHFFFAOYSA-L 0.000 description 1
- UKWLRLAKGMZXJC-QIECWBMSSA-L disodium;[4-chloro-3-[(3r,5s)-1-chloro-3'-methoxyspiro[adamantane-4,4'-dioxetane]-3'-yl]phenyl] phosphate Chemical compound [Na+].[Na+].O1OC2([C@@H]3CC4C[C@H]2CC(Cl)(C4)C3)C1(OC)C1=CC(OP([O-])([O-])=O)=CC=C1Cl UKWLRLAKGMZXJC-QIECWBMSSA-L 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 239000003596 drug target Substances 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 238000013399 early diagnosis Methods 0.000 description 1
- 230000002500 effect on skin Effects 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- ZMMJGEGLRURXTF-UHFFFAOYSA-N ethidium bromide Chemical compound [Br-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 ZMMJGEGLRURXTF-UHFFFAOYSA-N 0.000 description 1
- 229960005542 ethidium bromide Drugs 0.000 description 1
- 229940108366 exelon Drugs 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- HJUFTIJOISQSKQ-UHFFFAOYSA-N fenoxycarb Chemical compound C1=CC(OCCNC(=O)OCC)=CC=C1OC1=CC=CC=C1 HJUFTIJOISQSKQ-UHFFFAOYSA-N 0.000 description 1
- 239000010419 fine particle Substances 0.000 description 1
- 239000000834 fixative Substances 0.000 description 1
- 238000002875 fluorescence polarization Methods 0.000 description 1
- 238000002866 fluorescence resonance energy transfer Methods 0.000 description 1
- 230000005714 functional activity Effects 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- ASUTZQLVASHGKV-JDFRZJQESA-N galanthamine Chemical compound O1C(=C23)C(OC)=CC=C2CN(C)CC[C@]23[C@@H]1C[C@@H](O)C=C2 ASUTZQLVASHGKV-JDFRZJQESA-N 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 210000004602 germ cell Anatomy 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 210000001320 hippocampus Anatomy 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 238000011577 humanized mouse model Methods 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 230000016178 immune complex formation Effects 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 230000002998 immunogenetic effect Effects 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 230000002055 immunohistochemical effect Effects 0.000 description 1
- 229960001438 immunostimulant agent Drugs 0.000 description 1
- 239000003022 immunostimulating agent Substances 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 229940047122 interleukins Drugs 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 230000001788 irregular Effects 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- BPHPUYQFMNQIOC-NXRLNHOXSA-N isopropyl beta-D-thiogalactopyranoside Chemical compound CC(C)S[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O BPHPUYQFMNQIOC-NXRLNHOXSA-N 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000006193 liquid solution Substances 0.000 description 1
- 239000006194 liquid suspension Substances 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- ZLNQQNXFFQJAID-UHFFFAOYSA-L magnesium carbonate Chemical compound [Mg+2].[O-]C([O-])=O ZLNQQNXFFQJAID-UHFFFAOYSA-L 0.000 description 1
- 239000001095 magnesium carbonate Substances 0.000 description 1
- 229910000021 magnesium carbonate Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 230000008774 maternal effect Effects 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- BUGYDGFZZOZRHP-UHFFFAOYSA-N memantine Chemical compound C1C(C2)CC3(C)CC1(C)CC2(N)C3 BUGYDGFZZOZRHP-UHFFFAOYSA-N 0.000 description 1
- 206010027175 memory impairment Diseases 0.000 description 1
- 230000006993 memory improvement Effects 0.000 description 1
- 239000000693 micelle Substances 0.000 description 1
- 229960005225 mifamurtide Drugs 0.000 description 1
- JMUHBNWAORSSBD-WKYWBUFDSA-N mifamurtide Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@@H](OC(=O)CCCCCCCCCCCCCCC)COP(O)(=O)OCCNC(=O)[C@H](C)NC(=O)CC[C@H](C(N)=O)NC(=O)[C@H](C)NC(=O)[C@@H](C)O[C@H]1[C@H](O)[C@@H](CO)OC(O)[C@@H]1NC(C)=O JMUHBNWAORSSBD-WKYWBUFDSA-N 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 1
- 125000001446 muramyl group Chemical group N[C@@H](C=O)[C@@H](O[C@@H](C(=O)*)C)[C@H](O)[C@H](O)CO 0.000 description 1
- 239000003471 mutagenic agent Substances 0.000 description 1
- 230000007886 mutagenicity Effects 0.000 description 1
- 231100000299 mutagenicity Toxicity 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 239000003703 n methyl dextro aspartic acid receptor blocking agent Substances 0.000 description 1
- 229940033872 namenda Drugs 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 239000002581 neurotoxin Substances 0.000 description 1
- 231100000618 neurotoxin Toxicity 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 238000006384 oligomerization reaction Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 239000006179 pH buffering agent Substances 0.000 description 1
- 230000005298 paramagnetic effect Effects 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 238000003921 particle size analysis Methods 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 108040007629 peroxidase activity proteins Proteins 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 230000003285 pharmacodynamic effect Effects 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 230000007084 physiological dysfunction Effects 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 230000036470 plasma concentration Effects 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 1
- 229920001515 polyalkylene glycol Polymers 0.000 description 1
- 229920000447 polyanionic polymer Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 210000004896 polypeptide structure Anatomy 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 229950008882 polysorbate Drugs 0.000 description 1
- 238000010149 post-hoc-test Methods 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 210000002243 primary neuron Anatomy 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 230000009822 protein phosphorylation Effects 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 125000000561 purinyl group Chemical class N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- 239000001397 quillaja saponaria molina bark Substances 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 102220002277 rs113994061 Human genes 0.000 description 1
- 102220315697 rs1553622313 Human genes 0.000 description 1
- 102220151348 rs561880652 Human genes 0.000 description 1
- 102220153060 rs761256648 Human genes 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 229930182490 saponin Natural products 0.000 description 1
- 150000007949 saponins Chemical class 0.000 description 1
- 238000001338 self-assembly Methods 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 238000003998 size exclusion chromatography high performance liquid chromatography Methods 0.000 description 1
- 235000020183 skimmed milk Nutrition 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 238000004611 spectroscopical analysis Methods 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 238000003153 stable transfection Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000000946 synaptic effect Effects 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 230000037317 transdermal delivery Effects 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- XETCRXVKJHBPMK-MJSODCSWSA-N trehalose 6,6'-dimycolate Chemical compound C([C@@H]1[C@H]([C@H](O)[C@@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](COC(=O)C(CCCCCCCCCCC3C(C3)CCCCCCCCCCCCCCCCCC)C(O)CCCCCCCCCCCCCCCCCCCCCCCCC)O2)O)O1)O)OC(=O)C(C(O)CCCCCCCCCCCCCCCCCCCCCCCCC)CCCCCCCCCCC1CC1CCCCCCCCCCCCCCCCCC XETCRXVKJHBPMK-MJSODCSWSA-N 0.000 description 1
- 150000003626 triacylglycerols Chemical class 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 238000002255 vaccination Methods 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 238000002424 x-ray crystallography Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/567—Framework region [FR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/71—Decreased effector function due to an Fc-modification
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Neurosurgery (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Animal Behavior & Ethology (AREA)
- General Chemical & Material Sciences (AREA)
- Public Health (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biomedical Technology (AREA)
- Pharmacology & Pharmacy (AREA)
- Neurology (AREA)
- Psychiatry (AREA)
- Hospice & Palliative Care (AREA)
- Immunology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Investigating Or Analysing Biological Materials (AREA)
Description
本出願は、2005年10月21日出願のPCT出願番号PCT/US2005/0038125の一部継続出願である。
アルツハイマー病は、進行性および変性認知症である(Terryら(1991)、Ann. Neurol. 30:572-580;Coyle (1987)、Encyclopedia of Neuroscience, Adelman(編)、Birkhaeuser, Boston-Basel-Stuttgart, 29〜31頁中)。初期段階において、アルツハイマー病は、報告されたところではアミロイドベータ(Aβ)から由来する神経毒のために、新たな記憶の形成の深刻な不能として出現する(Selkoe (2002)、Science 298:789-791)。Aβは、存在量がアルツハイマー病に関連する変異や危険因子により増加する、両親媒性ペプチドである。Aβから形成される原繊維は、アミロイドプラークの核を構成し、これは、アルツハイマー病の脳の特徴である。インビトロで産生された類似する原繊維は、培養した脳ニューロンに対して致命的である。これらの所見により、記憶喪失が、原繊維状Aβにより生じたニューロン死の結果であることが、示される。
本発明は、1種または2種以上のAβ由来拡散性リガンドの多次元立体構造を区別して認識することができる、単離された抗体またはその断片である。特に、本発明の抗体は、Arg−Xaa1−Leu−Xaa2−Xaa3−Xaa4−Xaa5−Xaa6−Asp−Ala−Met−Asp−Tyr(配列番号9)の相補性決定領域(CDR)を有し、ここでXaa1はGlnまたはAlaであり;Xaa2はSerまたはGlyであり;Xaa3はPro、Ala、Lys、ArgまたはThrであり;Xaa4はLysまたはArgであり;Xaa5はGly、SerまたはLysであり;Xaa6はVal、Thr、IleまたはArgである。特別な態様において、本発明の抗体は、薬学的に許容し得る担体との混合物においてである。他の態様において、本発明の抗体は、キットにおいてである。さらに他の態様は、配列番号108および配列番号112に定める重鎖可変領域および軽鎖可変領域の配列を有する抗体を包含する。配列番号138および配列番号140に定める重鎖および軽鎖配列を有する抗体を、また、提供する。
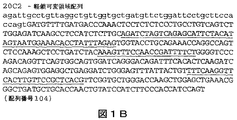
図1は、マウス抗ADDL抗体20C2の重鎖可変領域(図1A)および軽鎖可変領域(図1B)の核酸配列を示す。小文字は、抗体リーダー配列を示し、大文字は、抗体可変領域配列を示す。相補性決定領域(CDR)をコードするヌクレオチドに、下線を付す。
図9は、一次海馬ニューロンに結合するbADDLのHu20C2A3阻害を示す。
図10は、Hu20C2A3の蛍光熱溶融分析を示す。
Aβ由来拡散性リガンド(即ちADDL)の多次元立体構造を差別化的に認識するモノクローナル抗体が、ここで生成された。本発明の抗体は、マウスモノクローナル抗体20C2に由来する。マウス20C2は、当該分野において、以下の特徴を示すものと知られている。マウス20C2は、培養海馬細胞に結合した合成ADDLと内因性ADDLとの両方に結合するIgG1抗体である。さらに、この抗体は、培養した細胞に結合する内因性ADDLと合成ADDLとの両方を遮断し、ビオチン化ADDL(bADDL)のニューロンへの結合を弱め、タウリン酸化を防止し得る。20C2のコアの直線状エピトープは、Glu−Phe−Arg−His−Asp−Ser(配列番号1)であり、これは、Aβ1−42のアミノ酸残基3〜8に相当し、Aβの残基17〜42内からの要素に依存する立体構造的エピトープを有するが、これは、構築された場合のみである。
ADDL調製。F12培地(Biosource, Camarillo, CA)中のADDLを、確立された方法(Lambertら(2001)、上記)により、Aβ1−42から調製した。要するに、Aβ1−42ペプチド(American Peptide Co., Sunnyvale, CAまたはCalifornia Peptide Research, Inc., Napa, CA)を、秤量し、HFIP(1,1,1,3,3,3−ヘキサフルオロ−2−プロパノール)の十分な量を保持することができるガラスバイアル中に配置して、10mg/mLのペプチド濃度を達成した。HFIPを、乾燥ペプチドに加え、バイアルを覆い、温和に回転させて混合し、ペプチド/HFIP溶液を、室温で少なくとも1時間貯蔵した。ペプチド溶液のアリコート(それぞれ50または100μL、0.5または1.0mg)を、一連の1.5mLの円錐形遠心管中に分配した。この管を、SPEEDVAC(登録商標)中に一晩配置して、HFIPを除去した。乾燥ペプチドフィルムを含有する管を覆い、乾燥剤を有する密閉した容器中で−70℃で貯蔵した。
20C2マウス抗体の可変ドメインをコードするcDNAを、クローン化し、ポリメラーゼ連鎖反応法(PCR)に従って、マウス定常領域の5’末端に、およびV領域の上流のマウスリーダー配列にハイブリダイズする特別に設計されたプライマーを用いて配列決定した。これにより、得られたマウス可変領域配列が、完全であり、正確であることが確実になった。要するに、mRNAを、マウスハイブリドーマ細胞系から、QIAGEN(登録商標)OLIGOTEX(登録商標)Direct mRNA Mini Kitを用いて抽出し、その後一本鎖cDNA合成キットを用いてcDNAに変換した。次に、cDNAを、PCR反応における鋳型として用いて、抗体可変領域配列を得た。
マウスハイブリドーマ細胞系20C2から得られたマウス抗体重鎖可変ドメインおよび軽鎖可変ドメイン核酸を、CDR移植方法を用いてヒト化した。当業者は、マウス抗体配列のヒト化は、この血清半減期およびFcエフェクター機能を改善し、これにより抗グロブリン応答を低減することにより、抗体の治療的効力を最大化することができることを、理解する。
親和性成熟を、Hu20C2抗体において実行した。ヒト化Hu20C2バージョンAおよびB可変重鎖のみ、軽鎖のみ、または重鎖バージョンAおよび軽鎖を一緒にコードする核酸分子を、Fabファージ提示ベクターpFab4中でクローン化した。核酸配列分析により、pFab4における配列および配向が確認された。pFab4中の注釈付きのHu20C2 Fab配列を、図4A〜4Cに示し、本明細書中で重鎖バージョンAについて配列番号116で、重鎖バージョンBについて配列番号117で、また軽鎖について配列番号118で定める。pFab4ベクターにおける重鎖バージョンAおよび軽鎖の一緒についてのヌクレオチド配列を、図4D〜4Eに示す。これらの構築を、当該分野において確立されたファージ提示Fabライブラリー法を用いて、Hu20C2成熟プログラムで用いた。
b20C2LC3−2対高分子量10%bADDL。
c20C2LC3−1+20C2LC3−2対高分子量10%bADDL。
*コロニーの合計数あたりのヒット。
IgG2m4抗体誘導体を製造して、Fcレセプター会合、C1q結合、不要な細胞毒性または免疫複合体生成を低減し、同時に典型的なヒト抗体の長い半減期および薬物動態特性を共に維持した。IgG2m4の基本的な抗体様式は、IgG2のものであり、これは、実験的モデルにおいて優れた半減期を有すると示されている(Zuckierら(1994)、Cancer Suppl. 73:794-799)。IgG4配列の選択的な導入により、IgG2の構造を改変して、C1q結合を解消し、一方典型的な低レベルのFcγR結合を維持した(CanfieldおよびMorrison (1991)、J. Exp. Med. 173:1483-1491)。これは、IgG2およびIgG4の配列が同一である交差点を用いることにより達成され、これにより、すべての人工的な突然変異配列よりもむしろ、天然のFc配列を含む抗体が得られた。最小のエフェクター関連活性を示すこのIgG2m4抗体を用いることの利点は、Wilcockら((2006) J. Neurosci. 26:5340-6)により開示されている脱グリコシル抗体に相当する。
aHougsら(2001)、Immunogenetics 52(3-4):242-8。
bWO 97/11971。
cMedgyesiら(2004)、Eur. J. Immunol. 34:1127-1135。
dTaoら(1991)、J. Exp. Med. 173:1025-1028。
eArmourら(1999)、Eur. J. Immunol. 29:2613。
fXuら(1994)、J. Biol. Chem. 269:3469-3474。
gCanfieldおよびMorrison (1991)、J. Exp. Med. 173:1483。
親和性成熟を行って、親和性を改善し、ADDLへの優先的な結合を改善した。ヒト化された抗体のADDL結合親和性を評価するために、BIACORE(登録商標)および滴定ELISAを、本明細書中に開示したように行った。要するに、ストレプトアビジンを塗布した96ウェルマイクロタイタープレート(Sigma, St. Louis, MO)に、10%ビオチン化ADDL抗原(1μM)を塗布した。500ng/mLで開始した、精製した抗体の一連の2倍希釈を、ADDL捕獲プレートに加え、プレートを、2時間25℃でインキュベートした。プレート洗浄機(Bio-Tek, Winooski, VA)を用いてPBS溶液で5回洗浄した後に、ポリクローナルヤギ抗ヒトカッパ軽鎖抗体(Biomeda, Foster City, CA)を、3%脱脂乳ブロッカーでの1/2000の希釈において加え、室温で1時間インキュベートした。次に、ウサギ抗ヤギIgG(H+L)HRP結合(Bethyl Laboratories, Inc., Montgomery, TX)検出抗体を、遮断溶液での1/2000の希釈において加え、室温で1時間インキュベートした。PBSで洗浄した後、HRP基質、3,3’,5’,5−テトラメチルベンジジン(使用可能な状態のTMB;Sigma, St. Louis, MO)を加え、反応を、10分後に0.5NのH2SO4で停止した。450nmの波長における吸光度を、プレートリーダー(モデルVICTOR V; Perkin Elmer, Boston, MA)において読み取り、データを、EXCEL(登録商標)ワークシートを用いて加工した。プレート間のアッセイ変動は、20%以内であると推定された。
ヒト化抗ADDL抗体をさらに、一次海馬ニューロンへのADDL結合を遮断するこれらの能力について、本明細書中に開示した方法を用いて評価した。Hu20C2A3抗体または対照としてのPBSを、種々のモル比でbADDLと混合し、低速ローテータ上で1時間37℃でインキュベートした。プレインキュベーションの後、抗体/bADDL調製物を、一次ニューロン培養物に加え、さらに1時間37℃でインキュベートした。インキュベーション期間の終了時に、bADDL/抗体混合物を除去し、プレートを、培地で6回洗浄した。次に、細胞を、4%パラホルムアルデヒド中で10分間室温で固定し、溶液を除去し、新鮮な固定液を加え、細胞を、さらに10分間固定した。
Hu20C2A3のタンパク質安定性の評価を、SEC−HPLC、蛍光熱溶融分析および粒径分析を用いて評価した。蛍光熱溶融分析により、FcおよびFabのアンフォールディング転移が、それぞれ約70℃および80℃において発生することが示され、これは、許容できる固有のタンパク質安定性と整合する(図10)。
従来技術により、モノクローナル抗Aβ抗体の全身への注射は、Aβの血漿レベルを急速に増大し得、一方脳Aβの測定可能な低下には、慢性投与が必要であることが、示されている。測定可能なAβでの種における受動的な免疫化の結果、脳と末梢分画との間のAβの平衡における変化による血漿Aβの上昇がもたらされることが、示唆されている。この「末梢のシンク」により、最終的に、脳Aβの低下がもたらされる。しかし、認知の改善は、脳Aβにおける顕著な変化の前の急激な抗体の投与に続いて動物において観察され、これは、脳Aβの変化が、これらの変化を既知の手法を用いて測定することができる時点の前に、ある形態で起こり得ることを示す。あるいはまた、血漿Aβの上昇が、抗体の投与の後の末梢Aβの安定化により説明され得る。
Claims (11)
- 1種または2種以上のAβ由来拡散性リガンドをAβ単量体と区別して認識することができる、単離された抗体またはその断片であって、軽鎖可変領域が、
Arg−Ser−Ser−Gln−Ser−Ile−Leu−His−Serのアミノ酸配列と、
Asn−Gly−Asn−Thr−Tyr−Leu−Gluのアミノ酸配列と、
Xaa1−Gln−Xaa2−Thr−Arg−Val−Pro−Leu−Thr(ここで、Xaa1はPheまたはLeuであり、Xaa2はAlaまたはThrである)、配列番号39、52、58、61、63、64、65、67、76、79、86、90および94からなる群から選択されるアミノ酸配列とを含み、
重鎖可変領域が、
Thr−Ser−Gly−Met−Gly−Val−Glyのアミノ酸配列と、
His−Ile−Trp−Trp−Asp−Asp−Asp−Lys−Ser−Tyr−Asn−Pro−Ser−Leu−Lys−Serのアミノ酸配列と、
配列番号3、8、99、142および150からなる群から選択されるアミノ酸配列とを含む、
前記単離された抗体またはその断片。 - 抗体の重鎖可変領域および軽鎖可変領域がそれぞれ、配列番号108および配列番号112で定めるアミノ酸配列を含む、請求項1に記載の単離された抗体。
- 抗体の重鎖および軽鎖がそれぞれ、配列番号138および配列番号140で定めるアミノ酸配列を含む、請求項1に記載の単離された抗体。
- 請求項1〜3のいずれか一項に記載の単離された抗体またはこの断片を、薬学的に許容し得る担体との混合物において含む、医薬組成物。
- Aβ由来拡散性リガンドのニューロンへの結合を防止するための、請求項4に記載の医薬組成物。
- Aβ由来拡散性リガンドの構築を阻害するための、請求項4に記載の医薬組成物。
- タウタンパク質のSer202/Thr205におけるリン酸化を遮断するための、請求項4に記載の医薬組成物。
- アルツハイマー病を予防的に、または治療的に処置するための、請求項4に記載の医薬組成物。
- Aβ由来拡散性リガンドのニューロンへの結合を防止する治療剤を同定するための方法であって、薬剤の存在下でニューロンをAβ由来拡散性リガンドと接触させ、請求項1〜3のいずれか一項に記載の抗体を用いて、前記薬剤の存在下でのAβ由来拡散性リガンドの前記ニューロンへの結合を決定することを含む、前記方法。
- 試料中のAβ由来拡散性リガンドを検出するための方法であって、試料を請求項1〜3のいずれか一項に記載の抗体と接触させて、Aβ由来拡散性リガンドを検出するようにすることを含む、前記方法。
- Aβ由来拡散性リガンドを検出するためのキットであって、請求項1〜3のいずれか一項に記載の単離された抗体またはその断片を含む、前記キット。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US2005381125 | 2005-10-21 | ||
| USPCT/US2005/38125 | 2005-10-21 | ||
| PCT/US2006/040508 WO2007050359A2 (en) | 2005-10-21 | 2006-10-17 | Anti-addl monoclonal antibody and use thereof |
Publications (4)
| Publication Number | Publication Date |
|---|---|
| JP2009519895A JP2009519895A (ja) | 2009-05-21 |
| JP2009519895A6 JP2009519895A6 (ja) | 2009-12-24 |
| JP2009519895A5 JP2009519895A5 (ja) | 2012-04-05 |
| JP5289963B2 true JP5289963B2 (ja) | 2013-09-11 |
Family
ID=39671607
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008536730A Active JP5289963B2 (ja) | 2005-10-21 | 2006-10-17 | 抗addlモノクローナル抗体およびその使用 |
Country Status (8)
| Country | Link |
|---|---|
| EP (1) | EP1940466B1 (ja) |
| JP (1) | JP5289963B2 (ja) |
| CN (1) | CN101291692A (ja) |
| AU (1) | AU2006306553B9 (ja) |
| CA (1) | CA2626783A1 (ja) |
| NO (1) | NO20082288L (ja) |
| RU (1) | RU2008120027A (ja) |
| WO (1) | WO2007050359A2 (ja) |
Families Citing this family (30)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5362164B2 (ja) | 2000-07-07 | 2013-12-11 | バイオアークティック ニューロサイエンス アーベー | アルツハイマー病の予防及び治療 |
| DE10303974A1 (de) | 2003-01-31 | 2004-08-05 | Abbott Gmbh & Co. Kg | Amyloid-β(1-42)-Oligomere, Verfahren zu deren Herstellung und deren Verwendung |
| SE0401601D0 (sv) | 2004-06-21 | 2004-06-21 | Bioarctic Neuroscience Ab | Protofibril specific antibodies and uses thereof |
| WO2007062852A2 (en) | 2005-11-30 | 2007-06-07 | Abbott Laboratories | ANTI-Aβ GLOBULOMER ANTIBODIES, ANTIGEN-BINDING MOIETIES THEREOF, CORRESPONDING HYBRIDOMAS, NUCLEIC ACIDS, VECTORS, HOST CELLS, METHODS OF PRODUCING SAID ANTIBODIES, COMPOSITIONS COMPRISING SAID ANTIBODIES, USES OF SAID ANTIBODIES AND METHODS OF USING SAID ANTIBODIES |
| DK1976877T4 (en) | 2005-11-30 | 2017-01-16 | Abbvie Inc | Monoclonal antibodies to amyloid beta protein and uses thereof |
| BRPI0709050B1 (pt) | 2006-03-23 | 2018-12-26 | Bioarctic Neuroscience Ab | anticorpo ou fragmento do mesmo, composição, métodos para detectar protofibrilas ab in vitro, e, uso do anticorpo |
| US8455626B2 (en) | 2006-11-30 | 2013-06-04 | Abbott Laboratories | Aβ conformer selective anti-aβ globulomer monoclonal antibodies |
| WO2008104386A2 (en) | 2007-02-27 | 2008-09-04 | Abbott Gmbh & Co. Kg | Method for the treatment of amyloidoses |
| US8323654B2 (en) | 2007-05-14 | 2012-12-04 | Medtronic, Inc. | Anti-amyloid beta antibodies conjugated to sialic acid-containing molecules |
| US7931899B2 (en) | 2007-05-14 | 2011-04-26 | Medtronic, Inc | Humanized anti-amyloid beta antibodies |
| US8048420B2 (en) | 2007-06-12 | 2011-11-01 | Ac Immune S.A. | Monoclonal antibody |
| US8613923B2 (en) | 2007-06-12 | 2013-12-24 | Ac Immune S.A. | Monoclonal antibody |
| NZ581834A (en) * | 2007-06-12 | 2012-06-29 | Ac Immune Sa | Humanized antibodies to amyloid beta |
| BRPI0818643A2 (pt) | 2007-10-05 | 2017-05-23 | Ac Immune Sa | composição farmacêutica, e, métodos para reduzir a carga de placa na camada celular de gânglio retinal de um paciente, para reduzir a quantidade de placas na camada celular de gânglio retinal de um paciente, para diminuir a quantidade total de amilóide-beta solúvel na camada celular de gânglio retinal de um paciente, para evitar, tratar ou aliviar os efeitos de uma doença ocular associada com anormalidades patológicas/mudanças nos tecidos do sistema visual, para diagnosticar uma predisposição a uma doença ocular associada com anormalidades patológicas/mudanças nos tecidos dos sistema visual, para monitorar doenças ocular mínima residual associada com anormalidades patológicas/mudanças nos tecidos do sistema visual, para predizer a responsividade de um paciente, e para reter ou diminuir a pressão ocular nos olhos de um paciente |
| EP2586797A3 (en) * | 2007-11-27 | 2013-07-24 | Medtronic, Inc. | Humanized anti-amyloid beta antibodies |
| CA2707309A1 (en) | 2007-12-18 | 2009-06-25 | Acumen Pharmaceuticals, Inc. | Novel addl receptor polypeptides, polynucleotides and host cells for recombinant production |
| US20110144311A1 (en) * | 2008-08-14 | 2011-06-16 | Rebecca Chmielowski | Methods for purifying antibodies using protein a affinity chromatography |
| JP5745531B2 (ja) | 2009-12-11 | 2015-07-08 | アラクロン・ビオテック・エセ・エレ | アミロイドベータペプチドの検出を改善するための方法および試薬 |
| CA2796339C (en) | 2010-04-15 | 2020-03-31 | Abbott Laboratories | Amyloid-beta binding proteins |
| US9176151B2 (en) | 2010-07-14 | 2015-11-03 | Acumen Pharmaceuticals, Inc. | Antibodies, kit and method for detecting amyloid beta oligomers |
| US9320793B2 (en) | 2010-07-14 | 2016-04-26 | Acumen Pharmaceuticals, Inc. | Method for treating a disease associated with soluble, oligomeric species of amyloid beta 1-42 |
| US20130115227A1 (en) * | 2010-07-14 | 2013-05-09 | Renee C. Gaspar | Anti-addl monoclonal antibody and uses thereof |
| EP2598882B1 (en) | 2010-07-30 | 2017-07-26 | AC Immune S.A. | Safe and functional humanized antibodies for use in treating an amyloidosis |
| CN105348387B (zh) | 2010-08-14 | 2020-08-25 | Abbvie 公司 | β淀粉样蛋白结合蛋白 |
| US20140302532A1 (en) | 2011-04-12 | 2014-10-09 | Quanterix Corporation | Methods of determining a treatment protocol for and/or a prognosis of a patient's recovery from a brain injury |
| EP2511296A1 (en) | 2011-04-12 | 2012-10-17 | Araclón Biotech, S. L. | Antibody, kit and method for determination of amyloid peptides |
| ES2666840T3 (es) * | 2011-07-13 | 2018-05-08 | Acumen Pharmaceuticals, Inc. | Anticuerpos, kit y método in vitro para detectar beta-oligómeros amiloides |
| JP6231263B2 (ja) * | 2012-07-17 | 2017-11-15 | 株式会社島津製作所 | アフィニティ支持体及びそれを用いた物質の捕捉方法 |
| UA121550C2 (uk) | 2014-07-10 | 2020-06-25 | ЕЙСАЙ Ар ЕНД Ді МЕНЕДЖМЕНТ КО., ЛТД. | АНТИТІЛО, ЯКЕ ЗВ'ЯЗУЄ A<font face="Symbol">b</font>-ПРОТОФІБРИЛИ |
| WO2018156180A1 (en) * | 2017-02-24 | 2018-08-30 | Kindred Biosciences, Inc. | Anti-il31 antibodies for veterinary use |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ATE239797T1 (de) * | 1993-01-25 | 2003-05-15 | Takeda Chemical Industries Ltd | Antikörper gegen beta-amyloid oder derivative davon und seine verwendung |
| US5786180A (en) * | 1995-02-14 | 1998-07-28 | Bayer Corporation | Monoclonal antibody 369.2B specific for β A4 peptide |
| US20030068316A1 (en) * | 1997-02-05 | 2003-04-10 | Klein William L. | Anti-ADDL antibodies and uses thereof |
| EP2006303A1 (en) * | 1997-04-09 | 2008-12-24 | Intellect Neurosciences, Inc. | Recombinant antibodies specific for Beta-Amyloid ends, DNA encoding and methods of use thereof |
| CA2501091A1 (en) * | 2002-10-01 | 2004-04-15 | Northwestern University | Amyloid beta-derived diffusible ligands (addls), addl-surrogates, addl-binding molecules, and uses thereof |
| TWI374893B (en) * | 2003-05-30 | 2012-10-21 | Janssen Alzheimer Immunotherap | Humanized antibodies that recognize beta amyloid peptide |
| RU2007119382A (ru) * | 2004-10-25 | 2008-11-27 | Мерк энд Ко., Инк. (US) | Антитела против addl и их применение |
-
2006
- 2006-10-17 CA CA002626783A patent/CA2626783A1/en not_active Abandoned
- 2006-10-17 CN CNA2006800392637A patent/CN101291692A/zh active Pending
- 2006-10-17 EP EP06836346A patent/EP1940466B1/en active Active
- 2006-10-17 JP JP2008536730A patent/JP5289963B2/ja active Active
- 2006-10-17 WO PCT/US2006/040508 patent/WO2007050359A2/en active Application Filing
- 2006-10-17 AU AU2006306553A patent/AU2006306553B9/en not_active Expired - Fee Related
- 2006-10-17 RU RU2008120027/13A patent/RU2008120027A/ru not_active Application Discontinuation
-
2008
- 2008-05-19 NO NO20082288A patent/NO20082288L/no not_active Application Discontinuation
Also Published As
| Publication number | Publication date |
|---|---|
| EP1940466A4 (en) | 2010-04-07 |
| EP1940466B1 (en) | 2012-11-28 |
| CN101291692A (zh) | 2008-10-22 |
| AU2006306553B9 (en) | 2011-09-29 |
| CA2626783A1 (en) | 2007-05-03 |
| WO2007050359A8 (en) | 2008-05-08 |
| AU2006306553B2 (en) | 2011-08-25 |
| WO2007050359A3 (en) | 2007-06-21 |
| NO20082288L (no) | 2008-05-19 |
| JP2009519895A (ja) | 2009-05-21 |
| AU2006306553A1 (en) | 2007-05-03 |
| RU2008120027A (ru) | 2009-11-27 |
| WO2007050359A2 (en) | 2007-05-03 |
| EP1940466A2 (en) | 2008-07-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5289963B2 (ja) | 抗addlモノクローナル抗体およびその使用 | |
| US7731962B2 (en) | Anti-ADDL monoclonal antibody and use thereof | |
| JP2009519895A6 (ja) | 抗addlモノクローナル抗体およびその使用 | |
| JP5634975B2 (ja) | 抗addl抗体およびこの使用 | |
| US9309309B2 (en) | Anti-ADDL monoclonal antibody and uses thereof | |
| CA2590337A1 (en) | Humanized amyloid beta antibodies for use in improving cognition | |
| JP6731727B2 (ja) | アミロイドベータ1−42の可溶性オリゴマー種に関連する疾患を治療するための方法 | |
| US8420093B2 (en) | Anti-ADDL monoclonal antibody and use thereof | |
| MX2007004909A (en) | Anti-addl antibodies and uses thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20091015 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20091015 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120207 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120313 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120613 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120620 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120713 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20121030 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130130 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A712 Effective date: 20130223 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20130507 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130605 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5289963 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |