JP5154949B2 - ウイルス感染を治療するための組成物および方法 - Google Patents
ウイルス感染を治療するための組成物および方法 Download PDFInfo
- Publication number
- JP5154949B2 JP5154949B2 JP2007549894A JP2007549894A JP5154949B2 JP 5154949 B2 JP5154949 B2 JP 5154949B2 JP 2007549894 A JP2007549894 A JP 2007549894A JP 2007549894 A JP2007549894 A JP 2007549894A JP 5154949 B2 JP5154949 B2 JP 5154949B2
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- cells
- human
- compound
- virus
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/08—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2896—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against molecules with a "CD"-designation, not provided for elsewhere
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Genetics & Genomics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Virology (AREA)
- Oncology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Communicable Diseases (AREA)
- Epidemiology (AREA)
- Endocrinology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Tropical Medicine & Parasitology (AREA)
- AIDS & HIV (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Description
本発明は、部分的には、HAARTで治療されたHIV患者が、非常に活性な疾患をもつ患者よりも、抗KIR抗体での治療に適しているであろうという発見に基づいている(実施例5を参照されたい)。また、本発明は、部分的には、NK細胞抑制性受容体に対する抗体が、このような治療抗体に対するADCC反応を増強することによって、ウイルス抗原、特にCD16に結合することができる治療抗体に対する治療抗体の有効性を改善するであろうという発見に基づいている。
1)機能的な抑制性KIRを発現する機能的な、活性化可能なNK細胞をもち、前記NK細胞の死滅活性を調節し、これらのKIRを抗KIR mAbによって遮断することができ、これによりHLA-Cを発現する標的に対するこれらのNK細胞による溶解を誘導する一群のHIV感染患者、すなわちHAARTで治療された患者が存在する。対照的に、以前に報告された1つのHIV感染細胞の特徴は、これらがHLA-Aおよび-Bの発現をダウンレギュレートし(または無くし)、T細胞による死滅を回避するが、HLA-Cの発現を保持して、これによりNK細胞による死滅を回避することである。
a)1つまたは複数のNK細胞の抑制性受容体を遮断する、抗体またはこれらの断片などの化合物を対象に投与することと;および、
b)ウイルス感染細胞上に発現された抗原に特異的な治療抗体を対象に投与することと、
を含む方法に関する。
a)NK細胞の抑制性受容体を遮断する、抗体またはこれらの断片などの化合物を対象に投与することと;および、
b)HIV感染症のための特異的な治療抗体を対象に投与することと、
を含む方法に関する。
単純ヘルペス、水痘帯状疱疹ウイルス(VSV)感染に対して:アシクロビル、ファムシクロビル、バラシクロビル、ペンシクロビル。
本発明の状況の範囲内において、「治療抗体」という用語は、より具体的には、患者における標的細胞を減少させるように機能する任意の抗体を称する。このような標的細胞の具体例には、腫瘍細胞、ウイルス感染細胞、同種細胞、アレルギー、自己免疫疾患、同種間反応、その他に関与する病理学的免疫担当細胞(たとえば、Bリンパ球、Tリンパ球、抗原提供細胞、その他)またはさらに健康な細胞(たとえば、抗血管形成の治療ストラテジーにおける内皮細胞)を含む。本発明の状況の範囲内の大部分の好ましい標的細胞は、腫瘍細胞およびウイルス感染細胞である。治療抗体は、たとえば、特に抗体依存的な細胞を媒介した細胞障害性(ADCC)よる細胞毒性または細胞溶解を媒介してもよい。ADCCには、IgGのFc部分(FcγR)のための白血球受容体が必要である。その機能は、IgG感作抗原を、FcγRを有する細胞障害性細胞に連結させて、細胞活性化機構をトリガーすることである。したがって、治療抗体は、免疫複合体を形成することができる。たとえば、免疫複合体は、治療抗体によってカバーされた腫瘍標的(すなわち、細胞)であることができる。より詳細には、抗体は、好ましくはそのFc領域を介してCD16に結合することができる。治療抗体は、ポリクローナルまたは好ましくはモノクローナルによってもよい。これらは、所望の可変ドメインおよび定常ドメインを発現するように操作されたハイブリドーマによって、または組換え細胞によって産生してもよい。抗体は、単鎖抗体または抗原特異性を保持するその他の抗体誘導体およびこれらの低部ヒンジ領域または変異体であってもよい。これらは、多機能性抗体、組換え抗体、ヒト化抗体、これらの断片または変異体であってもよい。これらの断片または誘導体は、好ましくはFab断片、Fab'2断片、CDRおよびScFvから選択される。治療抗体は、表面抗原、たとえば膜抗原に特異的である。本発明において、好ましい膜抗原は、HIV感染細胞上に発現されるものである。これらには、CD4、CD3およびCD28を含む。治療抗体は、好ましくはヒトもしくは非ヒト霊長類IgG1またはIgG3 Fc部分、より好ましくはヒトIgG1を有する。
NK細胞活性は、刺激および抑制性シグナルを含む複合体メカニズムによって調節される。したがって、有効なNK細胞媒介療法は、これらの細胞の刺激または抑制性シグナルの両方の中和によって達成することができる。
Cw1、Cw3、Cw7およびCw8から選択されるHLA-C分子の(または位置80にAsn残基を有するHLA-c分子の)KIR2DL2/3に対する結合;および、
Cw2、Cw4、Cw5およびCw6(から選択されるHLA-C分子のまたは位置80にLys残基を有するHLA-c分子の)KIR2DL1に対する結合、
を変化させる能力として定義される。
KIR2DLポリペプチドを含む免疫原で非ヒト哺乳類を免疫すること;
免疫された動物から、KIR2DLポリペプチドに結合するモノクローナル抗体を調製すること;
KIR2DLポリペプチドの少なくとも2つの異なる血清型と交差反応する(b)のモノクローナル抗体を選択すること、
KIR2DLを媒介したNK細胞の阻害を阻害する(c)のモノクローナル抗体を選択すること。
ライブラリーまたはレパートリーから、KIR2DLポリペプチドの少なくとも2つの異なる血清型と交差反応するモノクローナル抗体またはこれらの断片もしくは誘導体を選択することと、および、
KIR2DLを媒介したNK細胞の阻害を阻害する(a)の抗体を選択することと、
を含む。
もう一つの側面において、本発明は、同族KIRに対する結合について、本発明にしたがったNK細胞の抑制性受容体を遮断する交差反応性抗体および/または中和抗体と競合する能力、および/または本発明の方法に使用するための、このような公知の抗体と同じ抗原決定基領域/エピトープに対して結合する能力によって特徴づけられるNK細胞の抑制性受容体を遮断する抗体を提供する。たとえば、一つの側面において、本発明は、それが抗体NKVSF1、1-7F9および/または抗体DF200と競合する能力によって特徴づけられる抗KIR抗体を提供する。
本発明は、NK細胞の抑制性受容体を遮断する抗体またはこれらの断片などの少なくとも1つの化合物と治療抗体とを含む組成物に、治療抗体の効率を増大するための、治療抗体で治療した対象におけるADCCを増大するための、または疾患、特にターゲットされた細胞、好ましくはウイルス感染した細胞、腫瘍細胞またはその他の病原性細胞などの病気にかかった細胞の枯渇を必要とする疾患を有する対象を治療するための組成物の使用に関する。好ましくは、疾患は、癌、自己免疫疾患、炎症性疾患、ウイルス疾患からなる群より選択される。また、疾患は、移植片拒絶、特に同種異系移植片拒絶反応および移植片対宿主病(GVHD)に関する。
本実施例は、マウスモノクローナル抗KIR抗体の産生およびKIR2DLヒトNK受容体の共通の決定因子に対する新規のモノクローナル抗体であるDF200の同定を記述する。
PBLは、フィコールHypaque勾配およびプラスチック接着細胞の枯渇により、健康なドナーに由来した。濃縮されたNK細胞を得るために、PBLを抗CD3、抗CD4および抗HLA-DRmAbs(4℃の30mns)と、続いてヤギ抗マウス磁気ビーズ(Dynal)(4℃にて30mns)と共にインキュベートし、当該技術分野において既知の方法によって免疫磁気選択した(Pende et al., J Exp Med. 1999;190(10):1505-16)。CD3マイナス、CD4マイナス、DRマイナス細胞を照射支持細胞、100U/mlのインターロイキン2(Proleukin, Chiron Corporation)および1.5ng/mlの植物性血球凝集素A(Gibco BRL)上で培養し、ポリクローナルNK細胞集団を得る。NK細胞を限界希釈によってクローニングし、NK細胞のクローンを細胞表面受容体の発現についてフローサイトメトリーによって特徴づける。
CP11、CN5およびCN505は、KIR2DL1陽性クローンであり、EB6またはXA-141抗体によって染色される。
使用するmAbは、研究室で産生したJT3A(IgG2a、抗CD3)、EB6およびGL183(それぞれIgG1抗KIR2DL1およびKIR2DL3)、XA-141 IgM抗KIR2DL1(EB6、抗CD4(HP2.6)、抗DR(D1.12、IgG2a)と比較して同じ特異性)であった。JT3A、HP2.6およびDR1.12の代わりに、同じ特異性の市販のmAbをたとえばBeckman coulter Inc, Fullerton, CAから使用することができる。EB6およびGL183は、Beckman Coulter Inc , Fullerton, CAで市販されている。XA-141は、市販されていないが、EB6は、Moretta(1993、上記)に記載されているように溶解の対照再構成のために使用することができる。
細胞を適切な抗体(4℃にて30mns)で、続いてPEまたはFITC抱合ポリクローナル抗マウス抗体(Southern Biotechnology Associates Inc)で染色した。試料をFACSの装置(Becton Dickinson, Mountain View, CA)での細胞蛍光測定解析法によって解析した。
NKクローンの細胞溶解活性は、標準的な4時間51Cr放出アッセイ法によって評価し、エフェクターNK細胞をCw3またはCw4陽性株化細胞(これらはNK細胞溶解に感受性であることが知られている)で試験した。全ての標的は、マイクロタイトレーションプレートあたり5000細胞で使用し、標的に対するエフェクターの比率は、通常、標的細胞あたり4エフェクターである。1/2希釈の示されたモノクローナル抗体の上清の有無において細胞溶解アッセイ法を行う。手順は、本質的にMoretta et al.(1993、上記)に記載されているのと同じである。
mAbは、Moretta et al.(J Exp Med. 1990;171(3):695-714および1990;172(6):1589-98、それぞれの開示は、参照により本明細書に援用される)に記載されているように、5週間目のBalb Cマウスを活性化されたポリクローナルまたはモノクローナルNK株化細胞で免疫することによって産生させた。異種細胞融合の後、mAbは、最初にこれらがEB6およびGL183陽性NK株化細胞と交差反応する能力について選択して、クローン化した。陽性モノクローナル抗体を、これらがそれぞれCw4またはCw3陽性標的のEB6陽性またはGL183陽性NKクローンによる溶解を再構成する能力についてさらにスクリーニングした。
モノクローナル抗体(DF200 mAb)のうちの1つは、KIR2DL1、KIR2DL2/3を含むKIRファミリーの種々のメンバーと反応することが見いだされた。DF200mAbでのNK細胞の染色に関して、KIR2DL1+およびKIR2DL2/3+細胞は、明るく染色された。
本実施例は、KIR2DL1およびKIR2DL3に対する結合の際のDF200のそれぞれの親和性の評価を記述する。
KIR 2DL1およびKIR 2DL3組換えタンパク質は、大腸菌(E. coli)において産生した。KIR 2DL1およびKIR2DL3の全細胞外ドメインをコードするcDNAは、以下のプライマーを使用して、それぞれpCDM8クローン47.11ベクター(Biassoni et al, Eur J Immunol. 1993;23(5):1083-7;その開示は、参照により本明細書に援用される)およびRSV(gpt)183クローン6ベクター(Wagtman et al., Immunity 1995 May;2(5):439-49;その開示は、参照により本明細書に援用される)からPCRによって増幅した:
センス:5'-GGAATTCCAGGAGGAATTTAAAATGCATGAGGGAGTCCACAG-3'(配列番号:3)
アンチセンス:5'-CCCAAGCTTGGGTTATGTGACAGAAACAAGCAGTGG-3'(配列番号:4)。
表面プラスモン共鳴測定は、Biacore装置(Biacore)で行った。
組換えKIR 2DL1およびKIR 2DL3タンパク質をセンサチップCM5(Biacore)上のデキストラン層のカルボキシル基に共有結合で固定した。センサチップ表面は、EDC/NHS(N-エチル-N’.-(3-ジメチルアミノプロピル)カルボジイミドヒドロクロリドおよびN-ヒドロキシスクシンイミド、Biacore)で活性化した。タンパク質のカップリング緩衝液(10mMアセテートpH 4.5)溶液を注入した。100mMエタノールアミンpH8(Biacore)を使用して残りの活性化された基の非活性化を行った。
動力学的測定のためには、種々の濃度の可溶性抗体(4×10-7〜10-10M)を固定された試料に適用した。測定は、20μl/分連続流速にて行った。それぞれのサイクルについて、センサチップの表面を5μlの10mM NaOH pH 11の注入によって再生した。
表1
固定されたKIR 2DL1およびKIR 2DL3に対するDF200 mAb結合の BIAcore解析
抗原 Kd(10-9M)
KIR 2DL1 10.9 +/- 3.8
KIR 2DL3 2.0 +/- 1.9
Kd:解離定数。
本実験は、リツキサン単独では、KIR2DL1-陽性NKクローンによるCw4-陽性標的細胞に対するADCCを本質的に媒介しないが、KIR2DL1-陽性クローンのADCCが、抗KIR2DL1抗体の存在下において非常に増強されることを示す。
ネガティブ抗CD3免疫磁気選択(Miltenyi)によってT細胞を枯渇させた血液単核細胞を限界希釈条件下でプレートにまき、植物性血球凝集素(PHA)(Biochrom KG, Berlin, Germany)で活性化して、インターロイキン(IL)-2(Chiron B.V., Amsterdam, Netherlands)および照射支持細胞と共に培養する。クローン生存効率は、全てのドナーにおいて同等であり、5プレートのNK細胞において1つ〜10プレートのNK細胞において1つの間の範囲である。クローン化したNK細胞をエプスタインバーウイルスで形質転換されたHLA型が既知のBリンパ芽球腫株化細胞に対する標準的な51Cr放出細胞障害性によってアロ反応性について、10:1の標的に対するエフェクターの比率にてスクリーニングする。≧30%溶解を示するクローンをアロ反応性と記録した。概して、クローンは、<5%または>40%の溶解を示す。
NKクローンの細胞溶解活性は、標準的な4時間51Cr放出アッセイ法によって評価し、エフェクターNK細胞を、NK細胞溶解に対するそれらの感受性について既知であるHLA-Cw3またはHLA-Cw4陽性EBV株化細胞(CD20陽性)に対して試験した。全ての標的は、マイクロタイトレーションプレートウェルあたり5000細胞にて一定の標的に対するエフェクター(NK細胞クローン)比で使用する。一定の実験において、治療的キメラ抗CD20 リツキシマブ(リツキサン、Idec)を5μg/mlにてエフェクター標的混合物に添加する。一定の実験において、EB6抗体(抗KIR2DL1)を10μg/mlにてエフェクター標的混合物に添加する。
抗KIR mAbを、標準的クロム51(51Cr)放出アッセイ法(細胞障害性アッセイ法)によって、これらがウイルス感染細胞のNKを媒介した死滅を増強する能力について試験した。
NK細胞は、ウイルス感染の制御時に重要である。HIV感染したAIDS患者において、NK細胞の数および機能の減少が報告されていた。以前の研究において、キラーIg様受容体(KIR)の発現増加は、疾患が制御されているHIV患者において見られた。KIRは、NK細胞およびT細胞に発現し、標的細胞上のMHCクラスI分子を認識する。標的細胞上のKIRとこれらのリガンドとの間の相互作用は、KIR分子の型に応じて、NK細胞の阻害または活性化のいずれかを引き起こしうる。KIR-リガンドが不適合なNK細胞は、腫瘍標的を死滅させることができることが以前に示された。
血液は、ストックホルムのSodersjukhusetのVenhalsanから、11人の健康な個体(individuls)並びに10人のHIV-1感染患者から受けとった。患者全員が男性であり、健康な対照のうち3人が男性で7人が女性であった。患者全員が、高活性抗レトロウイルス療法(HAART)治療中で、<50RNAのウイルス負荷を有する患者のうちの6人でウイルス血症が制御され、残りは、77コピー/ml〜200RNA コピー/mlの間のウイルス負荷を有した。HIV-1感染患者についての平均CD4+カウントは、582CD4+細胞/μl(248〜1043の範囲)であった。PBMCは、密度遠心分離によって精製した。
以下の抗体をBD Biosciencesから購入して、FACS染色に使用した、IgG2b抗ヒトCD56(NCAM 16.2)FITC、IgG1抗ヒトCD3(SK7)PerCP、IgG1抗ヒトCD56(B159)APC、抗ヒトCD56(leu-19)PE、抗ヒトKIR(NKB1)FITC、精製したIgG1マウス抗ヒトCD107a(H4A3)およびIgG1マウス抗ヒトCD107a(H4A3)FITC。抗ヒトKIR2DL1(CD158a)および抗ヒトKIR2DL2(CD158b)は、Immunotechから。KIR2DL1、2および-3に対して特異的なヒト抗KIR(1-7F9)mAb、並びにKIR2DS1および-2は、国際公開公報第号2005003168号および国際公開公報第号2005003172号に記述されていた。Southern Biotechからの抗ヒトのIgG4 FITCを1-7F9の検出のための二次抗体として使用した。
500000個の新鮮なPBMCを非標識抗体で4℃にて30分間染色した。細胞を1%、PBS +FCS中で洗浄し、次いで4℃にて10分間二次Abで染色した。洗浄後、細胞をPBS +1%マウス血清でブロックした。次いで、細胞を種々のNK受容体およびCD56およびCD3に対する抱合抗体で4℃にて10分間染色した。細胞を1%のFCSおよび1%のパラホルムアルデヒドを含むPBS中で固定して、4色FACS Caliburにおいて解析するまで4℃にて保存した。結果は、Cell Quest Proによって解析した。
新鮮なPBMCをPESTを補ったRPMI培地中において200U/ml IL-2(Peprotech)で一晩を刺激して、10%のウシ胎児血清(Fc)を96ウェルプレートに添加した。細胞を5μg/mLの標識のない精製したCD107a mAb(BD)を添加することによって、CD107aのバックグランド発現を遮断した。室温で15分インキュベーション後、細胞を完全なRPMI培地で3回洗浄した。いくつかの場合では、PBMCを100g/mLの抗KIR抗体と共にRTにて30分間プレインキュベートした。標的細胞(K562、721.221、721.Cw3、721.Cw4、721.Cw6、CEMまたは自己のCD4+細胞)を2:1のエフェクター:標的比にてウェルあたり500.000エフェクター細胞および250000標的細胞で添加した。ネガティブ対照として、PBMCを完全培地と共にインキュベートした。250μlの総容積に対して、4μl抗ヒトCD107a FITC標識したmAbGolgiStop(BD)を添加した。細胞をエフェクターおよび標的細胞接触を促進するために500rpmにて1分間迅速にスピンダウンした。37℃にて4時間インキュベーション後、細胞を1% PBS +FCSを中で洗浄し、次いで4℃にて10分間表面マーカーCD56およびCD3を染色した。細胞を洗浄して、1%のパラホルムアルデヒドで固定して、次いでFACS Calibur機器で解析した。
CD107aアッセイ法のために使用した標的細胞は、ポジティブ対照としてのMHCクラスI欠陥患者株化細胞K562および721.221、並びに異なるHLA-C対立遺伝子でトランスフェクトした株化細胞721.Cw3、721.Cw4および721.Cw6を発現するMHCクラスIであった。T株化細胞CEMは、HIV-1感染に感受性であったため、これを標的細胞として使用した。全ての株化細胞は、PESTおよび10%のFCSを補ったRPMI培地中で培養した。
CEM細胞には、37℃にて4時間、ゆっくりと100rpmにて振動しながら細胞とウイルスとをインキュベーションすることによって1000×TCID50にてHIV-1 IIIB(LAI))で感染させた。細胞を暖かい培地に懸濁して、1000rpmにて8分間遠心し、洗浄を一度繰り返し、次いで細胞を37℃にて12日間24穴プレート中に保持した。3〜4日毎に新鮮な培地を培養に添加した。細胞が感染したかどうかを決定するために、細胞を細胞内p24発現について染色した。500000細胞をPBS +1% FCSに洗浄し、4℃にて10分間抗ヒトCD4 APCで染色した。洗浄後、細胞を100μl BD Cytofix/Cytoperm溶液と共に4℃にて20分間インキュベーションすることよって固定し、次いで細胞をBD Perm/洗浄溶液中で2回洗浄した。BD Perm/洗浄溶液に1/20希釈したIgG1マウス抗p24 Ab、KC57 FITC(Beckman Coulter)またはアイソタイプ対照を添加した。4℃にて45分インキュベーション後、細胞を再びBD Perm/洗浄溶液中で洗浄し、次いで1%のPFAおよび1%のFCSを含むPBS中で固定した後にFACS Caliburで解析した。
健康な対照およびHIV-1感染患者からの結果を、母数によらないマン-ホウィットニーU検定(ウィルコクソン順位和検定)によって統計学的に比較した。
HIV-1感染個体におけるNK細胞受容体の発現の変化
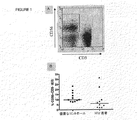
NK細胞上の受容体発現に対するHIV-1感染の効果を調査するために、新たに精製したPBMCをCD56およびCD3(図1a)について、並びにいくつかの異なるNK受容体について染色した。CD56+CD3-NK細胞の比率は、HAART治療したHIV-1感染患者と健康な対照との間に有意な相違はなかったが、(P=0.06)、中央値は、HIV-1感染患者において減少した(図1b)。NK細胞は、CD56brightおよびCD56dim細胞(図1a)に分けることができる。この研究において、HIV-1感染患者について、健康な対照と比較してCD56dimCD3-細胞のわずかな減少を見ることができたが、相違は有意ではなかった。
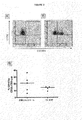
脱顆粒マーカーCD107aの細胞表面密度の増大を引き起こしてNK細胞によるK562標的細胞の死滅を反映するNK感受性K562標的細胞でHIV-1感染患者および健康な対照からのPBMCを刺激した(図3 a、b)。CD107a+ CD56+CD3-細胞の割合の中央値は、K562細胞での刺激後のHIV-1感染患者についてよりも健康な対照についてわずかに高いだけであり、HIV-1感染患者におけるNK細胞の機能のわずかな減少のみを示したが、相違は、統計学的に有意でなかった(図3c)。
HLA-C発現細胞において、抑制性KIR受容体を遮断することに応答して、NKを媒介した死滅の増大を検出するためにCD107アッセイ法を使用することができるかどうかを調査するために、本発明者らは、全ての抑制性KIR2DL受容体と結合するヒト1-7F9抗体(IgG4)でKIR受容体を遮断して、HLA-C陽性腫瘍株に応答してCD107aのアップレギュレーションを測定した。本アッセイ法をKIR受容体の遮断の有無において行った。種々のHLAクラスI分子をトランスフェクトした721.221細胞を標的細胞として使用したときに、CD107aの発現増加をKIR受容体が遮断されるときに見ることができる。
Claims (23)
- HIVによって生じるウイルス疾患を、その必要があるヒト対象において治療するための医薬組成物の調製のためのナチュラルキラー(NK)細胞の抑制性受容体を遮断する化合物の使用方法であって、ヒト対象が、高活性の抗レトロウイルス治療(HAART)で治療され、および前記化合物は、KIR2DL1、KIR2DL2およびKIR2DL3に結合し、かつKIR2DL1-、KIR2DL2-およびKIR2DL3を媒介したNK細胞障害性の阻害を遮断する抗体である方法。
- 請求項1に記載の方法であって、前記抗体は、HLA-C分子のKIR2DL1、KIR2DL2およびKIR2DL3受容体への結合を特異的に遮断する方法。
- 請求項1に記載の方法であって、前記抗体は、KIR2DL1、KIR2DL2およびKIR2DL3の少なくとも1つに対する結合の際に登録番号CNCM I-3224として寄託されたハイブリドーマにより製造された抗体DF200と競合する方法。
- 請求項1に記載の方法であって、前記抗体は、KIR2DL1、KIR2DL2およびKIR2DL3の少なくとも1つに対する結合の際に配列番号1に対応するアミノ酸配列を有する可変重(VH)鎖領域および配列番号2に対応するアミノ酸配列を有する可変軽(VL)鎖領域を含む抗体と競合する方法。
- 請求項4に記載の方法であって、前記抗体は配列番号1に対応するアミノ酸配列を有する可変重(VH)鎖領域および配列番号2に対応するアミノ酸配列を有する可変軽(VL)鎖領域を含む抗体である方法。
- 請求項1に記載の方法であって、前記ヒト対象は、前記第1の化合物を投与する前に、所定レベル以下のHIV血漿レベルを達成するために十分な期間HAARTで治療されている方法。
- 請求項1〜5のいずれか1項に記載の方法であって、CD3、CD28、CD4、CCR5、gp120およびgp41から選択される抗原に結合し、Fc領域を通じてCD16と結合する治療抗体またはFc融合タンパク質である第2の化合物を前記対象に投与することをさらに含む方法。
- 請求項7に記載の方法であって、前記第2の化合物は、治療抗体である方法。
- ウイルス疾患を、その必要があるヒト対象において治療するための医薬組成物の調製のためのNK細胞の抑制性受容体を遮断する第1の化合物とCD3、CD28、CD4、CCR5、gp120およびgp41から選択される抗原に結合する治療抗体またはFc融合タンパク質である第2の化合物の使用であって、第1の化合物が、KIR2DL1、KIR2DL2およびKIR2DL3受容体の共通の決定因子に結合して、KIR2DL1-、KIR2DL2-、KIR2DL3を媒介したNK細胞細胞障害性の阻害を遮断する抗体であり、第2の化合物は、Fc領域を通じてCD16と結合する方法。
- 請求項9に記載に記載の方法であって、前記ウイルス疾患は、HIV(ヒト免疫不全症ウイルス)、RSV(呼吸器合胞体ウイルス)、CMV(サイトメガロウイルス)、エボラウイルス、A型肝炎ウイルス(HAV)、B型肝炎ウイルス(HBV)、C型肝炎ウイルス(HCV)、エプスタインバーウイルス(EBV)、水痘帯状疱疹ウイルス(VZV)、ハンターンウイルス、インフルエンザウイルス、単純ヘルペスウイルス(HSV)、ヒトヘルペスウィルス6(HHV-6)、ヒトヘルペスウィルス8(HHV-8)、ヒト乳頭腫ウイルス(HPV)またはパルボウイルスによって生じる方法。
- 請求項10に記載に記載の方法であって、前記ウイルス疾患は、HIVによって生じる方法。
- 請求項10に記載に記載の方法であって、前記ウイルス疾患は、C型肝炎ウイルスによって生じる方法。
- 請求項9〜12のいずれか1項に記載の方法であって、前記第2の化合物は、治療抗体である方法。
- 請求項9〜13のいずれか1項に記載の方法であって、前記第2の化合物は、ヒトIgG1またはIgG3抗体のFc部分を含む抗体または融合タンパク質である方法。
- 請求項9〜14のいずれか1項に記載の方法であって、前記第1の化合物は、HLA-C分子のKIR2DL1、KIR2DL2およびKIR2DL3受容体への結合を特異的に遮断する方法。
- 請求項15に記載に記載の方法であって、前記第1および第2の化合物は、モノクローナル抗体である方法。
- 請求項15〜16のいずれか1項に記載の方法であって、前記第1および第2の化合物の少なくとも1つは、ヒト抗体、ヒト化抗体またはキメラ抗体である方法。
- 請求項9〜17いずれか1項に記載の方法であって、前記第1の化合物は、CD94、NKG2A/C、KIR2DLおよびKIR3DLヒト受容体の少なくとも1つに結合し、かつそれが結合するヒト受容体によって媒介されるNK細胞細胞障害性の阻害を遮断する方法。
- 請求項18に記載の方法であって、前記第1の化合物は、少なくとも2つのKIR2DLヒト受容体の共通の決定因子に結合し、かつそれが結合するKIR2DLヒト受容体によって媒介されるNK細胞細胞障害性の阻害を遮断する方法。
- 請求項9に記載の方法であって、前記第1の化合物は、KIR2DL1、KIR2DL2およびKIR2DL3の少なくとも1つに結合する際に登録番号CNCM I-3224として寄託されたハイブリドーマにより製造された抗体DF200と競合する抗体である方法。
- 請求項9に記載の方法であって、前記第1の化合物は、KIR2DL1、KIR2DL2およびKIR2DL3の少なくとも1つに結合する際に前記抗体は配列番号1に対応するアミノ酸配列を有する可変重(VH)鎖領域および配列番号2に対応するアミノ酸配列を有する可変軽(VL)鎖領域を含む抗体と競合する抗体である方法。
- 請求項9〜21のいずれか1項に記載の方法であって、前記第1および第2の化合物は、同時に対象に投与される方法。
- 請求項9〜22のいずれか1項に記載の方法であって、前記第2の化合物は、第1の化合物の投与の4週以内に対象に投与される方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DKPA200500027 | 2005-01-06 | ||
| DKPA200500027 | 2005-01-06 | ||
| PCT/EP2006/050071 WO2006072624A2 (en) | 2005-01-06 | 2006-01-06 | Compositions and methods for treating viral infection |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2008526812A JP2008526812A (ja) | 2008-07-24 |
| JP5154949B2 true JP5154949B2 (ja) | 2013-02-27 |
Family
ID=36593628
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007549894A Expired - Fee Related JP5154949B2 (ja) | 2005-01-06 | 2006-01-06 | ウイルス感染を治療するための組成物および方法 |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US8551483B2 (ja) |
| EP (1) | EP1835937B1 (ja) |
| JP (1) | JP5154949B2 (ja) |
| AT (1) | ATE552852T1 (ja) |
| CY (1) | CY1113182T1 (ja) |
| DK (1) | DK1835937T3 (ja) |
| ES (1) | ES2384466T3 (ja) |
| PL (1) | PL1835937T3 (ja) |
| PT (1) | PT1835937E (ja) |
| SI (1) | SI1835937T1 (ja) |
| WO (1) | WO2006072624A2 (ja) |
Families Citing this family (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20090191213A9 (en) * | 2003-07-02 | 2009-07-30 | Novo Nordisk A/S | Compositions and methods for regulating NK cell activity |
| KR101325023B1 (ko) | 2003-07-02 | 2013-11-04 | 노보 노르디스크 에이/에스 | Nk 세포 활성을 조절하기 위한 조성물 및 방법 |
| EP2287195B1 (en) * | 2004-07-01 | 2019-05-15 | Novo Nordisk A/S | Pan-kir2dl nk-receptor antibodies and their use in diagnostik and therapy |
| US10087236B2 (en) | 2009-12-02 | 2018-10-02 | Academia Sinica | Methods for modifying human antibodies by glycan engineering |
| US11377485B2 (en) | 2009-12-02 | 2022-07-05 | Academia Sinica | Methods for modifying human antibodies by glycan engineering |
| US20110280849A1 (en) * | 2010-03-26 | 2011-11-17 | Anthrogenesis Corporation | Tumor suppression using human placenta-derived intermediate natural killer cells and immunomodulatory compounds |
| CA2837184C (en) * | 2011-05-25 | 2021-09-21 | Innate Pharma, S.A. | Anti-kir antibodies for the treatment of inflammatory and autoimmune disorders |
| US20160108122A1 (en) * | 2013-05-23 | 2016-04-21 | Idac Theranostics, Inc. | Therapeutic or prophylactic agent for immunodeficiency virus infection |
| CA2923579C (en) | 2013-09-06 | 2023-09-05 | Academia Sinica | Human inkt cell activation using glycolipids with altered glycosyl groups |
| CA2950440A1 (en) | 2014-05-27 | 2015-12-03 | Academia Sinica | Anti-her2 glycoantibodies and uses thereof |
| WO2015184008A1 (en) * | 2014-05-27 | 2015-12-03 | Academia Sinica | Fucosidase from bacteroides and methods using the same |
| KR20170003720A (ko) | 2014-05-27 | 2017-01-09 | 아카데미아 시니카 | 항-cd20 글리코항체 및 이의 용도 |
| CN106714829A (zh) | 2014-05-28 | 2017-05-24 | 中央研究院 | 抗TNF‑α醣抗体及其用途 |
| EP3187583B1 (en) * | 2014-08-29 | 2023-04-26 | National University Corporation Hokkaido University | Monoclonal antibody against kir2ds1 |
| WO2017159088A1 (ja) * | 2016-03-16 | 2017-09-21 | 国立大学法人京都大学 | 移植用培養細胞または培養組織の調製方法 |
| US10858431B2 (en) * | 2016-06-30 | 2020-12-08 | Trellis Bioscience, Llc | Monoclonal antibodies targeting killer immunoglobulin-like receptor (KIR) family signaling |
| CN109963868B (zh) | 2016-08-22 | 2023-11-14 | 醣基生医股份有限公司 | 抗体、结合片段及使用方法 |
| US20210251994A1 (en) | 2018-06-15 | 2021-08-19 | Flagship Pioneering Innovations V, Inc. | Increasing immune activity through modulation of postcellular signaling factors |
| CN109833480B (zh) * | 2019-03-22 | 2021-09-07 | 中国科学院上海巴斯德研究所 | 靶向nk细胞免疫检查点治疗感染性疾病的方法 |
| MA55805A (fr) | 2019-05-03 | 2022-03-09 | Flagship Pioneering Innovations V Inc | Métodes de modulation de l'activité immunitaire |
| EP4076434A1 (en) | 2019-12-17 | 2022-10-26 | Flagship Pioneering Innovations V, Inc. | Combination anti-cancer therapies with inducers of iron-dependent cellular disassembly |
| CN116096906A (zh) | 2020-06-29 | 2023-05-09 | 旗舰创业创新五公司 | 工程化以促进萨诺传递的病毒及其在治疗癌症中的用途 |
| JP2024512669A (ja) | 2021-03-31 | 2024-03-19 | フラグシップ パイオニアリング イノベーションズ ブイ,インコーポレーテッド | タノトランスミッションポリペプチド及び癌の処置におけるそれらの使用 |
| CA3224374A1 (en) | 2021-06-29 | 2023-01-05 | Flagship Pioneering Innovations V, Inc. | Immune cells engineered to promote thanotransmission and uses thereof |
| WO2024077191A1 (en) | 2022-10-05 | 2024-04-11 | Flagship Pioneering Innovations V, Inc. | Nucleic acid molecules encoding trif and additionalpolypeptides and their use in treating cancer |
| WO2024151687A1 (en) | 2023-01-09 | 2024-07-18 | Flagship Pioneering Innovations V, Inc. | Genetic switches and their use in treating cancer |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US5660827A (en) | 1992-03-05 | 1997-08-26 | Board Of Regents, The University Of Texas System | Antibodies that bind to endoglin |
| US5539094A (en) | 1993-11-12 | 1996-07-23 | La Jolla Cancer Research Foundation | DNA encoding Bcl-2-associated proteins |
| US5583034A (en) | 1994-02-22 | 1996-12-10 | La Jolla Institute For Allergy And Immunology | Enhancement of adoptosis using antisense oligonucleotides |
| US5808028A (en) | 1994-05-24 | 1998-09-15 | The United States Of America As Represented By The Department Of Health And Human Services | Molecular clone of a P58 receptor protein and uses thereof |
| HK1045700B (zh) | 1999-04-28 | 2007-07-27 | 德克萨斯大学董事会 | 用於通过选择性抑制vegf来治疗癌症的组合物和方法 |
| KR100419555B1 (ko) | 2000-05-29 | 2004-02-19 | 주식회사유한양행 | 비형간염바이러스의 에스-표면항원을 인식하는단일클론항체의 가변영역 및 이를 코딩하는 유전자 |
| KR101325023B1 (ko) | 2003-07-02 | 2013-11-04 | 노보 노르디스크 에이/에스 | Nk 세포 활성을 조절하기 위한 조성물 및 방법 |
| CN104645327A (zh) | 2003-07-24 | 2015-05-27 | 依奈特制药公司 | 使用nk细胞增效化合物提高治疗性抗体功效的方法和组合物 |
-
2006
- 2006-01-06 DK DK06700714.6T patent/DK1835937T3/da active
- 2006-01-06 PL PL06700714T patent/PL1835937T3/pl unknown
- 2006-01-06 US US11/813,399 patent/US8551483B2/en not_active Expired - Fee Related
- 2006-01-06 AT AT06700714T patent/ATE552852T1/de active
- 2006-01-06 EP EP06700714A patent/EP1835937B1/en not_active Expired - Lifetime
- 2006-01-06 PT PT06700714T patent/PT1835937E/pt unknown
- 2006-01-06 SI SI200631360T patent/SI1835937T1/sl unknown
- 2006-01-06 ES ES06700714T patent/ES2384466T3/es not_active Expired - Lifetime
- 2006-01-06 WO PCT/EP2006/050071 patent/WO2006072624A2/en not_active Ceased
- 2006-01-06 JP JP2007549894A patent/JP5154949B2/ja not_active Expired - Fee Related
-
2012
- 2012-06-29 CY CY20121100586T patent/CY1113182T1/el unknown
-
2013
- 2013-10-01 US US14/043,402 patent/US9333255B2/en not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| US20140023646A1 (en) | 2014-01-23 |
| SI1835937T1 (sl) | 2012-08-31 |
| DK1835937T3 (da) | 2012-07-23 |
| ATE552852T1 (de) | 2012-04-15 |
| PT1835937E (pt) | 2012-06-25 |
| US8551483B2 (en) | 2013-10-08 |
| WO2006072624A2 (en) | 2006-07-13 |
| EP1835937B1 (en) | 2012-04-11 |
| CY1113182T1 (el) | 2016-04-13 |
| WO2006072624A3 (en) | 2006-11-16 |
| US9333255B2 (en) | 2016-05-10 |
| US20090035305A1 (en) | 2009-02-05 |
| ES2384466T3 (es) | 2012-07-05 |
| JP2008526812A (ja) | 2008-07-24 |
| PL1835937T3 (pl) | 2012-09-28 |
| EP1835937A2 (en) | 2007-09-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5154949B2 (ja) | ウイルス感染を治療するための組成物および方法 | |
| DK1648507T3 (en) | PROCEDURES AND COMPOSITIONS FOR INCREASING THE EFFECTIVENESS OF THERAPEUTIC ANTIBODIES USING COMPOUNDS THAT POTENTATE NK CELLS | |
| US12514923B2 (en) | Methods of inhibiting the T cell receptor by administering a monoclonal antibody that binds TRBV9 | |
| CN113544148B (zh) | 中和乙型肝炎病毒的抗体和其用途 | |
| EP3839044A1 (en) | Bispecific molecules that are immunoreactive with immune effector cells that express an activating receptor | |
| RU2712251C1 (ru) | Гуманизированные антитела против участка бета цепи 9-го семейства TRBV9 TKP человека, и способы их применения | |
| WO2018113258A1 (zh) | 抗pd-1抗体及其用途 | |
| JP2018535650A (ja) | B型肝炎ウイルスを強力に中和する抗体及びその使用 | |
| CN111511760B (zh) | 对btn2具有特异性的抗体及其用途 | |
| JP2019512207A (ja) | Foxp3由来のペプチドに特異的なt細胞受容体様抗体 | |
| CN114630680B (zh) | 用于治疗乙型肝炎病毒感染的抗体组合物和方法 | |
| JP2023504185A (ja) | γδT細胞集団を多価薬剤で増殖させるための方法及びその組成物 | |
| US12221480B2 (en) | Methods for selective expansion of delta-3 gamma delta T-cell populations and compositions thereof | |
| KR20230166096A (ko) | Cldn18.2 항원 결합 단백질 및 이의 적용 | |
| RU2812910C2 (ru) | Антитела к cd38 и комбинации с антителами к cd3 и cd28 | |
| CN117042797A (zh) | 用于治疗乙型肝炎病毒感染的组合物和方法 | |
| JP2024539893A (ja) | 感染性障害を治療する方法で使用するためのブチロフィリン(btn)3a活性化抗体 | |
| CN121293350A (zh) | 抗lilrb1和lilrb2抗体及其应用 | |
| HK40056051A (en) | Antibodies that neutralize hepatitis b virus and uses thereof | |
| HK40073510B (zh) | 用於治疗乙型肝炎病毒感染的抗体组合物和方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20081203 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110823 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110906 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110913 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120223 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20120529 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120626 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120921 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20121106 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20121206 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20151214 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 Ref document number: 5154949 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |