JP4845330B2 - 脆弱性プラークを検出および治療するための凍結療法 - Google Patents
脆弱性プラークを検出および治療するための凍結療法 Download PDFInfo
- Publication number
- JP4845330B2 JP4845330B2 JP2002520722A JP2002520722A JP4845330B2 JP 4845330 B2 JP4845330 B2 JP 4845330B2 JP 2002520722 A JP2002520722 A JP 2002520722A JP 2002520722 A JP2002520722 A JP 2002520722A JP 4845330 B2 JP4845330 B2 JP 4845330B2
- Authority
- JP
- Japan
- Prior art keywords
- balloon
- catheter
- vulnerable plaque
- lumen
- temperature
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 238000000315 cryotherapy Methods 0.000 title claims description 27
- 210000004204 blood vessel Anatomy 0.000 claims abstract description 50
- 239000012530 fluid Substances 0.000 claims abstract description 44
- 239000012809 cooling fluid Substances 0.000 claims description 12
- 238000004891 communication Methods 0.000 claims description 9
- 230000004888 barrier function Effects 0.000 claims description 8
- 238000009529 body temperature measurement Methods 0.000 claims description 8
- 230000002093 peripheral effect Effects 0.000 claims description 5
- 239000011800 void material Substances 0.000 claims 1
- 238000001816 cooling Methods 0.000 abstract description 38
- 238000000034 method Methods 0.000 abstract description 38
- 238000011282 treatment Methods 0.000 abstract description 28
- 230000000717 retained effect Effects 0.000 abstract description 3
- 208000004476 Acute Coronary Syndrome Diseases 0.000 abstract 1
- 150000002632 lipids Chemical class 0.000 description 34
- 239000007788 liquid Substances 0.000 description 26
- 210000004027 cell Anatomy 0.000 description 14
- 230000006837 decompression Effects 0.000 description 11
- 230000002966 stenotic effect Effects 0.000 description 11
- GQPLMRYTRLFLPF-UHFFFAOYSA-N Nitrous Oxide Chemical compound [O-][N+]#N GQPLMRYTRLFLPF-UHFFFAOYSA-N 0.000 description 10
- 238000001514 detection method Methods 0.000 description 10
- 210000001519 tissue Anatomy 0.000 description 10
- 230000007704 transition Effects 0.000 description 10
- 230000002792 vascular Effects 0.000 description 10
- 208000037260 Atherosclerotic Plaque Diseases 0.000 description 9
- 238000002399 angioplasty Methods 0.000 description 8
- 239000000463 material Substances 0.000 description 8
- 206010028851 Necrosis Diseases 0.000 description 6
- 208000031481 Pathologic Constriction Diseases 0.000 description 6
- 230000006907 apoptotic process Effects 0.000 description 6
- 230000008859 change Effects 0.000 description 6
- 230000007246 mechanism Effects 0.000 description 6
- 230000017074 necrotic cell death Effects 0.000 description 6
- 229920000139 polyethylene terephthalate Polymers 0.000 description 6
- 239000005020 polyethylene terephthalate Substances 0.000 description 6
- 230000002829 reductive effect Effects 0.000 description 6
- 239000007787 solid Substances 0.000 description 6
- 230000036262 stenosis Effects 0.000 description 6
- 208000037804 stenosis Diseases 0.000 description 6
- 210000001367 artery Anatomy 0.000 description 5
- 230000014759 maintenance of location Effects 0.000 description 5
- 229960001730 nitrous oxide Drugs 0.000 description 5
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 4
- 208000007536 Thrombosis Diseases 0.000 description 4
- 230000009471 action Effects 0.000 description 4
- 230000001154 acute effect Effects 0.000 description 4
- 230000017531 blood circulation Effects 0.000 description 4
- 238000011221 initial treatment Methods 0.000 description 4
- 239000000203 mixture Substances 0.000 description 4
- 230000004048 modification Effects 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- 239000001272 nitrous oxide Substances 0.000 description 4
- -1 polyethylene Polymers 0.000 description 4
- 230000001960 triggered effect Effects 0.000 description 4
- 238000003466 welding Methods 0.000 description 4
- 208000032843 Hemorrhage Diseases 0.000 description 3
- 206010061218 Inflammation Diseases 0.000 description 3
- 239000004698 Polyethylene Substances 0.000 description 3
- 238000011374 additional therapy Methods 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 210000000692 cap cell Anatomy 0.000 description 3
- 210000004351 coronary vessel Anatomy 0.000 description 3
- 238000010586 diagram Methods 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 230000004054 inflammatory process Effects 0.000 description 3
- 238000013147 laser angioplasty Methods 0.000 description 3
- 229920000573 polyethylene Polymers 0.000 description 3
- 230000035945 sensitivity Effects 0.000 description 3
- 238000003860 storage Methods 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 208000011580 syndromic disease Diseases 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 238000001931 thermography Methods 0.000 description 3
- 230000002885 thrombogenetic effect Effects 0.000 description 3
- 230000001732 thrombotic effect Effects 0.000 description 3
- 238000012546 transfer Methods 0.000 description 3
- 206010003210 Arteriosclerosis Diseases 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 239000000853 adhesive Substances 0.000 description 2
- 238000004026 adhesive bonding Methods 0.000 description 2
- 230000001070 adhesive effect Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 230000000740 bleeding effect Effects 0.000 description 2
- 230000000903 blocking effect Effects 0.000 description 2
- 229910002092 carbon dioxide Inorganic materials 0.000 description 2
- 239000001569 carbon dioxide Substances 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 230000009977 dual effect Effects 0.000 description 2
- 229920001971 elastomer Polymers 0.000 description 2
- 210000004969 inflammatory cell Anatomy 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 238000013507 mapping Methods 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 229920001296 polysiloxane Polymers 0.000 description 2
- 229920002635 polyurethane Polymers 0.000 description 2
- 239000004814 polyurethane Substances 0.000 description 2
- 239000000523 sample Substances 0.000 description 2
- 210000000329 smooth muscle myocyte Anatomy 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 230000035882 stress Effects 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 210000005166 vasculature Anatomy 0.000 description 2
- 206010002388 Angina unstable Diseases 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 238000004566 IR spectroscopy Methods 0.000 description 1
- 206010048620 Intracardiac thrombus Diseases 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 108090001030 Lipoproteins Proteins 0.000 description 1
- 239000004642 Polyimide Substances 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- 206010049418 Sudden Cardiac Death Diseases 0.000 description 1
- 208000007814 Unstable Angina Diseases 0.000 description 1
- 206010047163 Vasospasm Diseases 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 238000002583 angiography Methods 0.000 description 1
- 238000003782 apoptosis assay Methods 0.000 description 1
- 230000003143 atherosclerotic effect Effects 0.000 description 1
- 230000036772 blood pressure Effects 0.000 description 1
- 238000007664 blowing Methods 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 210000001715 carotid artery Anatomy 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 238000002591 computed tomography Methods 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 238000002681 cryosurgery Methods 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 239000013013 elastic material Substances 0.000 description 1
- 238000010894 electron beam technology Methods 0.000 description 1
- 210000002889 endothelial cell Anatomy 0.000 description 1
- 230000003628 erosive effect Effects 0.000 description 1
- 230000005713 exacerbation Effects 0.000 description 1
- 230000006355 external stress Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 210000000497 foam cell Anatomy 0.000 description 1
- 239000003292 glue Substances 0.000 description 1
- 230000010247 heart contraction Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 230000000415 inactivating effect Effects 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 201000004332 intermediate coronary syndrome Diseases 0.000 description 1
- 238000002608 intravascular ultrasound Methods 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 230000006372 lipid accumulation Effects 0.000 description 1
- 230000013190 lipid storage Effects 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 238000002595 magnetic resonance imaging Methods 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 239000012567 medical material Substances 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 238000000386 microscopy Methods 0.000 description 1
- 208000010125 myocardial infarction Diseases 0.000 description 1
- 208000031225 myocardial ischemia Diseases 0.000 description 1
- 230000001338 necrotic effect Effects 0.000 description 1
- 235000013842 nitrous oxide Nutrition 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 238000012014 optical coherence tomography Methods 0.000 description 1
- 239000011112 polyethylene naphthalate Substances 0.000 description 1
- 229920001721 polyimide Polymers 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000005522 programmed cell death Effects 0.000 description 1
- 230000035485 pulse pressure Effects 0.000 description 1
- 230000002787 reinforcement Effects 0.000 description 1
- 230000003014 reinforcing effect Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 208000037803 restenosis Diseases 0.000 description 1
- 230000001568 sexual effect Effects 0.000 description 1
- 238000004611 spectroscopical analysis Methods 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 230000009861 stroke prevention Effects 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 238000009834 vaporization Methods 0.000 description 1
- 230000008016 vaporization Effects 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 230000003313 weakening effect Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B18/02—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body by cooling, e.g. cryogenic techniques
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/01—Measuring temperature of body parts ; Diagnostic temperature sensing, e.g. for malignant or inflamed tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/68—Arrangements of detecting, measuring or recording means, e.g. sensors, in relation to patient
- A61B5/6846—Arrangements of detecting, measuring or recording means, e.g. sensors, in relation to patient specially adapted to be brought in contact with an internal body part, i.e. invasive
- A61B5/6847—Arrangements of detecting, measuring or recording means, e.g. sensors, in relation to patient specially adapted to be brought in contact with an internal body part, i.e. invasive mounted on an invasive device
- A61B5/6852—Catheters
- A61B5/6853—Catheters with a balloon
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B2017/00017—Electrical control of surgical instruments
- A61B2017/00022—Sensing or detecting at the treatment site
- A61B2017/00084—Temperature
- A61B2017/00101—Temperature using an array of thermosensors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/22—Implements for squeezing-off ulcers or the like on the inside of inner organs of the body; Implements for scraping-out cavities of body organs, e.g. bones; Calculus removers; Calculus smashing apparatus; Apparatus for removing obstructions in blood vessels, not otherwise provided for
- A61B2017/22001—Angioplasty, e.g. PCTA
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/22—Implements for squeezing-off ulcers or the like on the inside of inner organs of the body; Implements for scraping-out cavities of body organs, e.g. bones; Calculus removers; Calculus smashing apparatus; Apparatus for removing obstructions in blood vessels, not otherwise provided for
- A61B2017/22001—Angioplasty, e.g. PCTA
- A61B2017/22002—Angioplasty, e.g. PCTA preventing restenosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/22—Implements for squeezing-off ulcers or the like on the inside of inner organs of the body; Implements for scraping-out cavities of body organs, e.g. bones; Calculus removers; Calculus smashing apparatus; Apparatus for removing obstructions in blood vessels, not otherwise provided for
- A61B2017/22051—Implements for squeezing-off ulcers or the like on the inside of inner organs of the body; Implements for scraping-out cavities of body organs, e.g. bones; Calculus removers; Calculus smashing apparatus; Apparatus for removing obstructions in blood vessels, not otherwise provided for with an inflatable part, e.g. balloon, for positioning, blocking, or immobilisation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B2018/00053—Mechanical features of the instrument of device
- A61B2018/00214—Expandable means emitting energy, e.g. by elements carried thereon
- A61B2018/0022—Balloons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B18/02—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body by cooling, e.g. cryogenic techniques
- A61B2018/0212—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body by cooling, e.g. cryogenic techniques using an instrument inserted into a body lumen, e.g. catheter
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B18/02—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body by cooling, e.g. cryogenic techniques
- A61B2018/0231—Characteristics of handpieces or probes
- A61B2018/0262—Characteristics of handpieces or probes using a circulating cryogenic fluid
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Surgery (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Heart & Thoracic Surgery (AREA)
- Medical Informatics (AREA)
- Molecular Biology (AREA)
- Veterinary Medicine (AREA)
- General Health & Medical Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- Pathology (AREA)
- Otolaryngology (AREA)
- Surgical Instruments (AREA)
- Thermotherapy And Cooling Therapy Devices (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Measurement Of The Respiration, Hearing Ability, Form, And Blood Characteristics Of Living Organisms (AREA)
- Media Introduction/Drainage Providing Device (AREA)
- Laser Surgery Devices (AREA)
Description
発明の背景
1.発明の分野
本発明は、一般に、血管を治療するための方法、装置およびキットに関する。より詳細には、本発明は、卒中や不安定狭心症の急性心臓症候群、心筋硬塞、および突然心臓死の原因となり得るもの等の血管内の有害な放出を抑制するために、患者の血管内の病巣、特に脆弱性(vulnerable)アテローム硬化性プラークを治療するための方法、装置およびキットを提供するものである。
【0002】
アテローム硬化性プラークは、大半の成人においてある程度存在する。プラークは、開放血管管腔を狭めることによって、血管を通る血液流を大幅に限定させ得る。この狭め作用、すなわち狭窄は、多くの場合、乏血性心疾患の原因となる。幸運なことに、患者の血管系のアテローム硬化性プラークを治療するために、多くの経皮血管内処置が開発されている。これらの治療法のうちで最も成功しているものは、経皮経管動脈形成術(PTA)である。PTAは、狭窄部位を越えて適切な血液流を回復するように血管の狭窄領域を拡張させるために、通常は膨張可能バルーンとして構成される膨張可能な遠端部を備えるカテーテルを使用する。狭窄領域を開放するための他の処置としては、方向性冠動脈じゅく腫切除、レーザ血管形成術、ステント等がある。単体または組み合わせで使用されることにより、これらの経皮血管内処置は、プラークによって引き起こされる狭窄の治療に大きく役立ってきた。
【0003】
プラーク誘発性狭窄の治療は、ここ数十年の間に大きく進歩してきたが、血管プラークに関連する罹患率と死亡率は相変わらず高い。最近の研究は、プラークは、標準的な狭窄プラークと脆弱性プラークとの二つの一般的タイプのいずれかに大きく分類され得ることを示している。時に、耐血栓症性プラークと称される狭窄プラークは、一般に、上述した血管内管腔開放技術によって効果的に処置可能である。それらによって誘発される狭窄は治療が必要であるかもしれないが、これらのアテローム硬化性プラーク自身は多くの場合良性であって、効果的に治療可能な疾患である。
【0004】
残念ながら、プラークが成熟するにつれて、平滑筋細胞の増殖、細胞間質の合成、および脂質蓄積によって血管が狭まる結果、標準的な狭窄プラークと極めて異なるプラークが形成され得る。このようなアテローム硬化性プラークは、血栓症を引き起こしやすく、極めて危険であり得る。この血栓症性または脆弱性プラークは、急性心臓症候群の頻繁な原因となり得る。
【0005】
これらの脆弱性(そして潜在的に生命を脅かす)プラークの特徴付けが現在研究されている。脆弱性プラークを検出するために多くのストラテジーが提案されている。これらの提案されているストラテジーには、血管造影法、血管内超音波法、血管顕微鏡検査法、磁気共鳴撮像法、磁気共鳴拡散撮像法、分光法、赤外線分光法、シンチグラフィー、光干渉断層撮影法、電子ビーム演算断層撮影スキャニング法、およびサーモグラフィーがあるが、これらはすべてその有効性に限界があった。特に、提案されているサーモグラフィー法は、脆弱性プラークは通常炎症を起こしており、従って標準的な狭窄性プラークよりも多くの熱を発生することから、温度変化を検出するものである。現在のサーモグラフィー法は、非常にその効果が期待されるものではあるが、それらもまだ温度感度が限定されているという欠点があり、それによって多くの場合、脆弱性プラークの検出の精度が低くなる。
【0006】
公知のプラーク治療処置法は広く受け入れられており、標準的な狭窄性プラークの治療に良好な有効性を示しているが、それらは血栓症状態がアテローム硬化性プラークに重なっている場合は有効でない(そして危険でもあり得る)。具体的には、PTAやステント処置などの一次処置によって引き起こされる機械的応力によって、脆弱性プラークから血液流への流体および/または固体の放出が実際にトリガーされ、それによって心臓血栓閉塞を引き起こす可能性がある。
【0007】
これらの理由により、血管中の脆弱性プラークの検出および治療のための方法、装置およびキットを提供することが望まれている。これらの方法および装置は、好ましくは経皮的方法により、血管内および管内導入用に適したものであるべきである。その新規な方法および装置が、脆弱性プラークを精度良く検出することが可能で、および/または隣接する組織に対する悪影響を最小限にしながらその治療を非常に良好に制御されかつ安全な方法で行うことができることが特に望ましい。さらに、それらの治療法、装置およびキットは、最小限の副作用で脆弱性プラークの放出を抑制するのに有効であるべきである。これらの課題の少なくとも一部が本明細書中に記載される本発明によって達成される。
【0008】
2.背景技術の説明
低温外科形成装置および方法がWO98/38934に記載されている。患者の血管内を冷却または加熱するためのバルーンカテーテルが米国特許第5,486,208号とWO91/05528とに記載されている。子宮内摘出を行うための膨張可能ブラダーを備えた冷凍外科用プローブが米国特許第5,501,681号に記載されている。ジュール・トムソン冷却に基づく冷凍外科用プローブが、米国特許第5,275,595号、同第5,190,539号、同第5,147,355号、同第5,078,173号、および同第3,901,241号に記載されている。血管形成術後およびその他の治療用の加熱バルーンを備えたカテーテルが、米国特許第5,196,024号、同第5,191,883号、同第5,151,100号、同第5,106,360号、同第5,092,841号、同第5,041,089号、同第5,019,075号、および同第4,754,752号に記載されている。低温流体源が米国特許第5,644,502号、同第5,617,739号、および同第4,336,691号に記載されている。次の米国特許も本発明に関連し得る(米国特許第5,458,612号、同第5,545,195号、および同第5,733,280号)。
【0009】
サーモグラフィーは、ワード キャッセルズらのザブルネラブルアテロスクレ ロチックプラーク:アンダースタンディング、アイデンティフィケーション、アンドモディフィケーション(The Vulnerable Atherosclerotic Plaque: Understanding, Identification, and Modification),第13章、pp.231−242(1999)、およびL. ディアマントポーラスらのhttp://www.eurekalert.org/releases/aha−ati041499.htlmに記載されている。脂質膜に対する低温の影響は、ジャック クルーブのアドバンスインモレキュラーアンドセルバイオロジー(Advances in Molecular and Cell biology),第19巻、pp.143−192(1997)、P.J.クインのクライオバイオロジー(Cryobiology),第22巻、pp.128−146(1985);およびマイケル J. テイラー博士のバイオロジーオブセルサバイバルインザコールド(ハーウッドアカデミックパブリッシャ、印刷中)(Biology Of Cell Survival In The Cold(Harwood Academic Publishers In Press))に記載されている。
【0010】
上記参考文献それぞれの全開示内容は、本明細書中で参考として援用される。
【0011】
発明の要旨
本発明は、患者の血管内の脆弱性プラークの検出と凍結療法とを提供する。血管は、静脈、動脈(特に、冠状動脈)を含む患者の血管において、いかなる血管であってもよい。血管は通常、脆弱性プラークから少なくとも部分的に一部狭窄されている。特に本発明は、急性心臓症候群を抑制し、体腔の開通性の維持を補助するために、脆弱性プラーク内の保持流体の放出を抑制することができる。本発明はまた、卒中予防のための頸動脈の脆弱性プラークの治療も提供する。患者の血管系は、脆弱性プラークと標準の狭窄性プラークとの両方を有する場合、本明細書に記載の治療技術は、必要に応じて、標準の狭窄性プラークを実質的に冷却することなく、脆弱性プラークに選択的に向けることができる。別実施形態において、両方のタイプのプラークが治療可能である。
【0012】
第1の態様において、本発明は、血管の脆弱性プラークを治療するための方法を提供する。この方法は、脆弱性プラークの近傍の血管をこの脆弱性プラーク内の保持流体の血液流への放出を抑制するのに十分な温度にまで冷却する工程を包含する。冷却治療は、多くの場合、血管の管腔の周部表面の全部または一部に対して向けられ、好ましくは脆弱性プラークによって放出可能に保持された脂質リッチ液体が放出されることを抑制する。
【0013】
血管の冷却は、血管の管腔にカテーテルを導入することによって行うことができる。脆弱性プラークの近傍の血管管腔に第1バルーンが配置される。この第1バルーンに低温冷却流体が導入され、そこから排出される。前記第1バルーン上に配置された第2バルーンを膨張させて、血管管腔に半径方向から密着させる。一般に、前記第1バルーンの内面の温度は、約−55℃〜−75℃の範囲であり、前記第1バルーンの外面は、約−25℃〜−45℃の範囲である。前記第2バルーンの外面の温度は、約10℃〜−40℃の範囲であり、好ましくは、約10℃〜−20℃、より好ましくは、約5℃〜−10℃の範囲である。
【0014】
通常、前記血管管腔の細胞表面の温度は、約10℃〜−40℃、好ましくは、約10℃〜−20℃、より好ましくは、約5℃〜−10℃の範囲である。組織は、通常、その所望の温度に、約15秒〜120秒、好ましくは、30秒〜60秒の時間維持される。冷却を通常は約1〜3サイクル、それらのサイクルを120秒毎に約1サイクルの速度で繰り返すことによって、脆弱性プラークの安定性を高めることができる。
【0015】
驚くべきことに、0℃より高い冷却温度によって脆弱性プラークの脂質コアを、無秩序な結晶状態の流体から秩序のある結晶状態の固体またはゲルへと転移することができる。従って、脂質リッチ液体を通常約10℃〜−10℃の範囲の転移温度で、その脂質リッチ液体の状態から高度に秩序のある六方格子状態に通常変化させるのに十分冷却することによって、脆弱性プラークを安定化することができる。冷却によって、前記脂質リッチ液体の近傍の組織、特に脂質リッチ液体と血管の管腔との間の細胞の帽部(cap)を形成している組織の壊死および/またはアポトーシスを抑制しながら、脆弱性プラークを安定化することができる。冷却処理はまた、脆弱性プラークの炎症および悪化を抑制することができる。冷却処置はさらに、脆弱性プラークの細胞の帽部の破断も抑制することができる。
【0016】
その他の態様において、本発明の脂質リッチ液体の放出を抑制するべく脆弱性プラークを冷却する方法は、追加の治療法と組み合わせることができる。例えば、1つの付属的方法は、冷却された脆弱性プラークを一次処置によって治療する方法を包含し得る。適切な一次処置としては、バルーン血管形成術、じゅく腫切除術、回転じゅく腫切除術、レーザ血管形成術等があり、ここで治療される血管の管腔は、狭窄状態を少なくとも部分的に軽減するために拡張される。前記一次処置は、さらに、ステント配置等の再狭窄を制御するための処置を含んでいてもよい。動脈の場合、一次処置は前記冷却治療の少し前、冷却治療中、好ましくは冷却治療の少し後、好ましくは冷却治療の60秒以内、さらに好ましくは、脂質リッチ液体を所望の温度へ冷却した直後に行われる。あるいは、冷却方法は、さらに、脂質リッチ液体のサイズを縮小し、その脂質リッチ液体の細胞密度または組成を変化させ、前記帽部の構造的完全性(structural integrity)を促進し(例えば、前記帽部の厚みを増加させる)、脆弱性プラークの化学的性質またはライフサイクルを変化させることによって前記帽部の細胞組成または構造特性等を改変することによって脆弱性プラークを不活性化(パッシベーション)する工程を包含することができる。
【0017】
別の態様において、本発明は、流体を放出可能に保持している血管の脆弱性プラークを治療する方法を提供する。この方法は、脆弱性プラークを検出する工程と、脆弱性プラークの近傍において血管を前記保持流体が血管中に放出されることを抑制するのに十分な温度にまで冷却する工程とを包含する。
【0018】
別の態様において、本発明は、血管の脆弱性プラークを検出する方法を提供する。この方法は、プラーク近傍の血管管腔内にバルーンを配置する工程を包含する。前記バルーンは、このバルーンに貼り付けられた複数の温度センサが血管管腔の表面に接続されるように膨張される。管腔表面に沿った温度差を前記センサによって感知する。
【0019】
別の態様において、本発明は、管腔表面を有する血管の脆弱性プラークを検出し治療するための凍結療法用カテーテルを提供する。このカテーテルは一般に、近端部と、遠端部と、それらの間に延出する冷却流体供給管腔および排出管腔とを備えるカテーテル本体を有する。前記カテーテル本体の前記遠端部の近傍に、前記供給管腔および排出管腔と流体連絡して第1バルーンが配設されている。前記第1バルーン上には、それらの間に熱バリアを形成した状態で第2バルーンが配置されている。前記管腔表面の温度測定を提供するべく前記第2バルーンには複数の温度センサが貼り付けられている。
【0020】
別の態様において、本発明は、管腔表面を有する血管の脆弱性プラークを検出するためのカテーテルを提供する。このカテーテルは一般に、近端部と、遠端部と、それらの間に延出する供給管腔および排出管腔とを備えるカテーテル本体を有する。前記カテーテル本体の前記遠端部に、前記供給管腔および排出管腔と流体連絡してバルーンが配設されている。前記管腔表面の温度測定を提供するべく前記バルーンには複数の温度センサが支持されている。
【0021】
別の態様において、本発明はさらに、血管中の脆弱性プラークを治療するためのキットを提供する。このキットは、近端部と、遠端部と、その遠端部の近傍の冷却部材とを備えるカテーテルを有する。前記キットには、前記カテーテルの使用のための取扱説明書が含まれている。これらの取扱説明書は、保持流体が血管に放出されることを防止するために脆弱性プラークの近傍の血管を冷却するステップを含む。このようなキットは、本明細書中に記載される任意の方法のための取扱説明書を含み得る。
【0022】
さらに別の態様では、本発明は、血管の脆弱性プラークを検出するためのキットを提供する。このキットは、近端部と、遠端部と、その遠端部の近傍の複数の温度センサを有するバルーン部材とを有するカテーテルを備える。取扱説明書は、このカテーテルを使用するためのキットに含まれる。これらの取扱説明書は、プラークの近傍の前記血管管腔内にバルーンを配置するステップと、前記バルーンに貼り付けられた複数の温度センサが前記血管管腔の表面に接続されるように前記バルーンを膨張させるステップと、前記管腔表面に沿って温度差を前記センサによって感知するステップとを有する。このようなキットは、本明細書中に記載したいずれの方法のための取扱説明書を含んでもよい。
【0023】
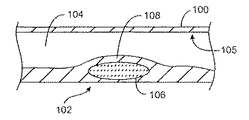
詳細な実施形態の説明
本明細書中で使用されるように、「脆弱性プラーク」および「ホットプラーク」という用語は、血栓症になり易いアテローム硬化性プラークを指す。図1Aおよび1Bは、その血管の管腔104内に成熟した脆弱性プラーク102を含む血管100の断面を図示している。前記脆弱性プラーク102は一般に軟質で、脂質リッチなアテローム性粥状物質(gruel)からなる壊死性コア106と、このコア106をカバーする平滑筋細胞のコラーゲンマトリックスからなる繊維状の硬化帽部108とを含む。前記粥状物質は一般に、前記脆弱性プラーク102によって放出可能な状態で保持されているエステル化コレステロールおよび低濃度リポ蛋白質の液体を含む。前記帽部108の破裂または断裂によって、図2に見られるように、プラーク出血110(破断したプラークを介した高度にトロンボゲンの脂質リッチな液体106の放出)が起こり得る。プラーク出血110により、前記高度にトロンボゲンの脂質リッチな液体106が、血管管腔104の血液流に晒される。図3に図示されているように、前記トロンボゲン液体の放出によって、血管管腔全体の血栓性閉塞112(血塊)が発生し、これによって卒中や急性心臓死等の生命を脅かす状態が発生し得る。
【0024】
脆弱性の三つの決定因子が、図1Aの4−4線に沿った分解断面図である図4に図示されている。脆弱性プラークの破断に対する感受性は、主として、前記アテローム性コアのサイズ114と密度(例えば、コアが大きくなれば破断の可能性が増加する)、前記硬化帽部の厚み116と構造的完全性(例えば、帽部が薄いと破断の可能性が増大する)、および帽部の炎症(例えば、マクロファージ泡沫細胞118の浸潤によって帽部細胞120が弱体化して破断の可能性が増大する)から決定され得る。さらに、脆弱性プラークの破断は、プラークに対してかかる種々の外的な応力によってもトリガーされ得る。例えば、管内血圧の変動、パルス圧、心臓収縮、血管痙攣等によって脆弱性プラークの破断が促進され得る。あるいは、PTAまたはステント処理などの一次処置によって引き起こされる機械的応力によっても破断がトリガーされ得る。
【0025】
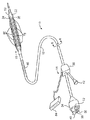
次に、図5および図6を参照して、管腔表面105(図1Aを参照)を有する血管100の脆弱性プラーク102を検出し治療するための凍結療法カテーテル10の一例(これは、2000年7月19日出願の同時係属出願09/619,583(代理人整理番号018468−000610US)により詳細に記載されており、この開示内容が本明細書において参考として開示される)について説明する。このカテーテル10は、近端部14と、遠端部16と、これらの間に延出する冷却流体供給管腔18および排出管腔とを備えたカテーテル本体12を含む。前記カテーテル本体12の前記遠端部の近傍には前記供給および排出管腔と流体連絡して、第1バルーン22が配設されている。そしてこの第1バルーン22上に、その間に熱バリア26を形成した状態で第2バルーン24が配設されている。
【0026】
前記両バルーン22,24は、カテーテル本体12の一体的延出部分として構成することも可能であるが、そのような構造は本発明において必須ではない。これら両バルーン22,24は、カテーテル本体12と同じ材料または異なる材料から形成することができ、後者の場合、適切な接着剤、熱溶接等によってカテーテル本体12の前記遠端部16に付着される。カテーテル本体12は、ポリエチレン、ポリイミド、ならびにそれらのコポリマーおよび誘導物等の従来の材料から形成することができる。前記両バルーン22,24も、血管形成術用の従来の材料、好ましくは、ポリエチレンテレフタレート(PET)、ポリエチレンなどの非弾性材料、または強力な非膨張性バルーンを構成するのに適した他の医用グレードの材料から形成することができる。さらに、これら両バルーン22,24は、より良好な保護を提供するために、互いに異なる材料から形成することも可能である。例えば、第1バルーン22は強度を提供するべくPETから形成し、第2バルーン24は耐久性を提供するべくポリエチレンから形成することができる。これらバルーン22,24の長さは、それぞれ少なくとも1cm、より好ましくは、それぞれ2cm〜5cmの範囲である。これらバルーン22,24は、冠状動脈内ではそれぞれ2mm〜5mm、そして末梢動脈内ではそれぞれ2mm〜10mmの範囲の直径を有する。
【0027】
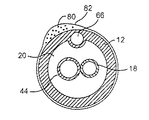
前記熱バリア26は、フィラメントによって両バルーン22,24間に維持される空隙として構成することができる。前記フィラメントは、通常は螺旋巻きされた、編み、編成、または結節モノフィラメントを含む。前記モノフィラメントは、PETまたはポリエチレンナフタレート(PEN)から形成して、接着剤結合、熱溶接、ファスナ等によって前記第1バルーン22に固定することができる。前記熱バリア26も、前記第1バルーン22の外面および/または前記第2バルーン24の内面上に形成された複数のこぶによって両バルーン22,24間に維持される空隙を含み得る。前記複数のこぶは、様々な状態で形成することができる。例えば、これらのこぶは、バルーンに本来備えられたものとして形成したり(バルーンの吹出し中に形成される)、またはこれらのこぶを接着剤結合、熱溶接、ファスナ等を使用してバルーンに対して物理的な「ドット」を固定することによって、バルーンの壁の材料を変形することによっても形成することができる。あるいは、前記熱バリア26は、スリーブによって両バルーン22,24間に維持される空隙を含み得る。前記スリーブは、孔あきとし、PETまたはシリコーンやポリウレタンなどのゴムから形成することができる。
【0028】
前記カテーテル本体12の近端部14にはハブ34,36が固定されている。ハブ34は、前記流体供給管腔18に凍結療法流体源を接続するためのポート38を提供し、この流体供給管腔18は、前記第1バルーン22の内面と流体連絡している。ハブ34はさらに、前記バルーン22から移動する前記凍結療法流体を前記排出管腔20を通って近位方向に排出するためのポート40を提供する。ハブ36は、カテーテル本体12内のガイドワイヤ管腔44を通って延出するガイドワイヤのためのポート42を提供する。通常、前記ガイドワイヤ管腔44は、図6に図示されているように、前記排出管腔20を通って延出することになる。前記ガイドワイヤ管腔44はまた、このガイドワイヤ管腔44を介して低温冷却流体が血液流に流れ込むことを最小限にするために、前記排出管腔20の外側に軸方向に延出してもよい。必要に応じて、前記ガイドワイヤ管腔44は、第1バルーン22の内面の外側に延出したり、このガイドワイヤ管腔44が、ガイドワイヤが両バルーン22,24の外側に延出することを許容するように構成することもできる。さらに、前記第1バルーン22の近傍でカテーテル本体12に沿って補強コイル46を延出させることができる。この補強コイル46は、カテーテル10が血管内で捻れることを防止するべく、通常6cm〜10cmの範囲の長さを有する単純なバネを含み得る。
【0029】
図5の凍結療法カテーテル10はさらに、前記第1および第2バルーン22,24の格納をモニタするための安全機構を示している。前記第1バルーン22は、前記供給および排出管腔と流体連絡する容量を規定している。前記供給管腔18との低温冷却流体供給部には流体遮断装置が接続されている。前記第2バルーン24は、その間に減圧空間52を形成した状態で前記第1バルーン22上に配設されている。前記減圧空間52は、この減圧空間52における変化に応答して、前記第1バルーン22への低温冷却流体の流入を阻止するべく前記流体遮断装置に接続されている。
【0030】
図7は、前記自動流体遮断機構54の作用流れ図を示している。この流体遮断機構54は通常、バッテリ60によって駆動される回路によって、遮断バルブ58に接続された減圧スイッチ56を含む。前記スイッチ56は、所定レベルの減圧空間52が第2バルーン24内に検出される時にのみ閉鎖状態に留まることができる。この閉鎖されたスイッチ56によって、前記低温冷却流体供給部62と流体連絡状態で前記遮断バルブ58は開放することが許容される。あるいは、前記回路は、前記スイッチが開放されている時に前記遮断バルブ58が開放される状態で、前記所定の減圧空間52が存在している時にのみ前記スイッチ56が開放されるように構成することも可能である。前記減圧空間52は、前記第1バルーン22が穿孔されて、凍結療法流体が減圧空間52に流入することが許容される場合、または前記第2バルーン24が穿孔されて血液が減圧空間52に流入することが許容される場合に縮小される。両バルーン22,24の格納のモニタリングに加えて、故障発生時に前記減圧スイッチ56はトリガーされて、追加の凍結療法流体が前記流体供給部62から供給管腔18へと供給されることを防止する。前記第2バルーン24も、第1バルーン22から流出し得る任意の低温冷却流体を含むように作用する。
【0031】
前記減圧空間52は、減圧ポート68(図5を参照)を介して、前記本体12の減圧管腔66で前記減圧空間52に接続される単純な固定減圧チャンバ64によって提供することができる。当該実施形態において、ハンドル74内には正容積式ポンプ(理想的にはシリンジに類似)が配設され、これは図8Aに示されているように、アクチュエータ75によって操作可能である。前記減圧空間52は、この減圧空間52が小さいことで少量の流体の漏出が発生した時における減圧量の変化の検出が容易になることから、1mL〜100mLの範囲、好ましくは10mL以下の小容量を含むべきである。前記凍結療法流体供給部62と前記回路を駆動するためのバッテリ60とは、図8Bに示されているように、1つのエネルギパック70内に共にパッケージ化することができる。このエネルギパック70は、カテーテル本体の近位側ハンドル74から取り外し可能であり、使い捨て式である。複数の別々の交換可能なエネルギパック70によって、複数の凍結冷却サイクルを可能にする。さらに、前記ハンドル74に音声警報またはブザー76を設けて、このブザーによって前記ハンドルが流体供給部62からの流れを許容するべく十分に垂直に維持されていない場合に、音声警告を提供するように構成することができる。前記凍結療法カテーテルはさらに、前記第1バルーン22内の流体の圧力および/または温度を測定するために、前記第1バルーン22またはハンドルに配置されたサーミスタ、熱電対等によって前記容量部に接続された側高計(hypsometer)72を備えることができる。この側高計は、凍結治療の有効性と安全性とに影響する変数(圧力、温度)の正確なリアルタイム測定を可能にする。
【0032】
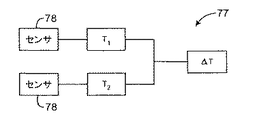
図5の前記デュアルバルーン凍結療法カテーテル10はさらに、脆弱性プラークのサーモグラフ式検出を提供する温度感知機構も示している。管腔表面105の直接温度測定を提供するべく、前記第2バルーン24には複数の温度センサ78が貼り付けられている(図1Aを参照)。これら温度センサ78は、複数の20個以下の熱電対またはサーミスタから構成することができ、0.1℃より大きい温度差を検出可能に構成することができる。これら温度センサ78は、一連の軸心および周方向の位置において第2バルーン24に固定することができる。これら複数の温度センサ78は、図5に図示されているように、接着接続、熱溶接、ファスナ等によって、第2バルーン24の外面に固定することができ、あるいは第2バルーン24の内面に固定することも可能である。カテーテル軸12の長さに沿って、PETまたはシリコーンやポリウレタンなどのゴムから形成される薄いスリーブ82内に、温度センサワイヤ80を固定することができ、後者の場合、これらワイヤ80は、前記減圧管腔66を通ってネジ込むことが可能である。前記温度センサワイヤ80を、管腔表面に沿った温度マッピングのために温度読み取り装置へ接続するために、カテーテル10の前記近端部14にコネクタ84を設けることも可能である。さらに、図9のブロック図に図示されているように、前記温度センサ78によって感知される温度測定値T1およびT2から前記管腔表面に沿った温度差ΔTを測定するために、前記コネクタ84に回路77を取り付けても良い。さらに、閾値温度差より上でトリガーされるインジケータを警告目的で前記コネクタに設けてもよい。
【0033】
脆弱性プラークの検出は、前記凍結療法カテーテル10をガイドワイヤを介して血管100の管腔104に導入することによって行うことができる。前記第1バルーン22は、プラークの近傍の血管管腔104内に配置される。この第1バルーン22を膨張させると、第2バルーン24(膨張時に拡張)に貼り付けられた複数の温度センサ78が管腔の表面に熱的に接続される。前記管腔表面105に沿った温度差を前記センサによって感知する。バルーン22の膨張は、約5psi〜50psiの範囲の圧力の二酸化炭素、一酸化二窒素等のガスによって行うことができる。前記バルーン22は通常、10秒〜120秒の範囲の時間で膨張される。バルーンカテーテルは、静止位置において、またはそれが管腔表面に沿って移動しながら温度差を感知することができる。好適には、管腔表面に沿った特定の位置における直接温度測定を可能にするために、温度センサ78は管腔表面に熱的に接続する。この温度感度の増加によって温度マッピング性が改善され、脆弱性プラーク検出の精度が高まる。次に、図11A−11Cを参照してさらに詳述するように、検出された脆弱性プラークを治療のために凍結療法カテーテル10を使用することができる。
【0034】
図10Aおよび10Bには、管腔表面を有する血管の脆弱性プラークを検出するための別のカテーテル10’が図示されている。この検出カテーテル10’は、近端部14と、遠端部16と、これらの間に延出する供給管腔88および排出管腔88とを備えたカテーテル本体12を含む。前記カテーテル本体12の前記遠端部にはバルーン86が配設されている。このバルーン86は、前記供給管腔および排出管腔に流体連絡する内面を有する。前記管腔表面105の直接温度測定を提供するべく、前記バルーン86の外面には複数の温度センサ78が貼り付けられている(図1Aを参照)。
【0035】
脆弱性プラークの検出は、前記検出カテーテル10’をガイドワイヤを介して血管100の管腔104に導入することによって行うことができる。前記バルーン86は、プラークの近傍の血管管腔104内に配置される。このバルーン86を膨張させると、このバルーンに貼り付けられた複数の温度センサ78が管管腔の表面に熱的に接続される。前記管腔表面に沿った温度差を前記センサによって感知する。バルーン86は通常、コントラスト、生理食塩水等の標準的な膨張媒体によって膨張させることが可能である。膨張媒体供給および/または排出ポート90が前記供給および/または排出管腔88に接続され、この管腔が前記バルーン86の内面と流体連絡している。前記バルーン86は通常、10秒〜120秒の範囲の時間で膨張される。バルーンカテーテルは静止位置において、またはそれが管腔表面に沿って移動しながら温度差を感知することができる。
【0036】
次に、図11A〜図11Cを参照して、脆弱性プラーク102の治療用の図5の凍結治療カテーテル10の使用法について説明する。図11Aおよび11Bに図示されているように、カテーテル10はガイドワイヤGWを介して血管100の管腔104に挿入される。第1バルーン22を脆弱性プラーク102の血管管腔104内に配置する。低温冷却流体を第1バルーン22に導入し(そこで、それは多くの場合気化する)、排出する。図11Cに図示されているように、第2バルーン24を膨張させて管壁に半径方向から密着させる。気化した流体は、バルーン22を膨張させる(そしてバルーン24を膨張させる)作用と、これら両バルーン22,24の外面を冷却する作用との二つの作用を奏する。前記脆弱性プラーク102の近傍の血管100は、脆弱性プラーク102内から保持流体106が血管100へと放出されることを防止するのに十分な温度にまで冷却される。この冷却処置は、血管管腔の周面の全部または一部を対象として行われる。好ましくは、冷却によって脂質リッチ液体106を脂質リッチ固体またはゲル106’(これについては後の図12A−12Bを参照して後に詳述する)へと安定化することによって、この脆弱性プラークによって放出可能な状態で保持されている脂質リッチ液体が放出されることを抑制する。脆弱性プラークの冷却を所望の温度プロファイルに限定するべく、前記熱バリア26によって第1バルーン22と第2バルーン24との間の熱伝達も抑制される。さらに、冷却中、前記流体遮断機構によって第1バルーン22および第2バルーン24の格納がモニタリングされる(図7を参照)。
【0037】
適切な低温冷却流体は、好ましくは非毒性のものであって、液体一酸化二窒素、液体二酸化炭素、冷却生理食塩水等が挙げられ得る。低温冷却流体は、昇圧状態で液体として供給管腔18を流れ、第1バルーン22内の低圧状態で気化する。一酸化二窒素の場合、前記供給管腔18内での供給圧は通常、その沸点より低い温度において600psi〜1000psiの範囲である。気化後、第1バルーン22内のその中心近くの一酸化二窒素ガスは通常、15psi〜100psiの範囲の圧力を有する。好ましくは、一酸化二窒素ガスは、末梢動脈内では50psi〜100psiの範囲の圧力を有し、冠状動脈内では約15psi〜45psiの範囲の圧力を有する。
【0038】
一般に、前記第1バルーンの内面の温度は約−55℃〜−75℃の範囲であり、第1バルーンの外面は約−25℃〜−45℃の範囲である。第2バルーンの外面の温度は約10℃〜−40℃、好ましくは、約10℃〜−20℃、より好ましくは、約5℃〜−10℃の範囲である。これによって、約10℃〜−40℃、好ましくは、約10℃〜−20℃、より好ましくは、約5℃〜−10℃の範囲の所望の治療温度が提供される。組織は通常、この所望の温度に約15秒〜120秒、好ましくは、30秒〜60秒の時間維持される。脆弱性プラークの安定化は、冷却を通常は約1〜3サイクル、それらのサイクルを120秒毎に約1サイクルの速度で繰り返すことによって高めることができる。
【0039】
いくつかの場合において、管の冷却は、前記脂質リッチ液体の近傍の組織、特に脂質リッチ液体106と血管104の管腔との間の細胞の帽部108を規定している組織の壊死および/またはアポトーシスの抑制に限定することができる(図1Aを参照)。アポトーシスまたは細胞壊死は、もしもそれによって細胞の帽部が弱化され、その帽部弱化によって脆弱性プラークの破断と前記脂質リッチ液体の放出が引き起こされるならば望ましくないかもしれない。従って、本発明は、体腔をライニングしている帽部細胞108とその他の細胞の生存能力に影響を与えることなく、血管内への保持流体の放出を抑制することを可能にするものである。
【0040】
他の適用例において、脆弱性プラーク102の炎症細胞(例えば、マクロファージ118、図4を参照)のアポトーシスおよび/またはプログラムされた細胞死を刺激するために、より低い温度で管を冷却することが望ましいかもしれない。このような炎症細胞の存在によって、帽部の弱化または腐食がトリガーされ、それによって前記脂質リッチ液体の脆弱性プラーク放出が発生するかもしれないのでアポトーシスは望ましいかもしれない。約0℃〜−15℃の範囲の温度での冷却によって、脆弱性プラーク、特に細胞帽部108を形成している組織の炎症および悪化を抑制することができる。あるいは、約−20℃より低い冷却温度での帽部細胞108の壊死を提供することが有用であるかもしれない。帽部壊死によって帽部の細胞増殖と厚み増加を刺激し、それによって帽部の破断を抑制することができる。
【0041】
次に図12Aおよび12Bを参照して、脆弱性プラークの脂質リッチ液体コア106の転移について説明する。図12Aは、脂質コア転移を行う転移温度を図示している。主転移点122は、10℃〜−10℃の転移温度範囲内のある時点で起こる。この転移点122において、脂質コアは図12Bに図示されているように、無秩序な結晶状態流体106から秩序的な結晶状態固体またはゲル106’への相変化を受け得る。従って、脆弱性プラークは、前記脂質リッチ液体コア106を、その状態を通常無秩序な脂質から高度に秩序的な六方格子状態に変化させるのに十分冷却することによって安定化することができる。好適には、−5℃より高い上の転移温度はさらに、前記脂質リッチ液体106の近傍の組織、特に前記帽部108の壊死および/またはアポトーシスを抑制する。
【0042】
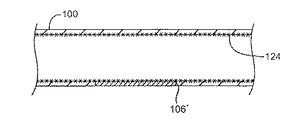
次に図13Aおよび13Bを参照して、前記脆弱性プラークの冷却に関連する追加的治療について説明する。図13Aは、脆弱性プラークが脂質リッチ固体/ゲル106’状態にまで安定化される冷却された血管100の断面を図示している。脂質リッチ流体106の長期保持を提供し、さらに可能であれば、組織の内部成長を介した健全な内皮細胞のための構造的骨格(scaffolding)を提供するべく、プラークを安定化しながら血管管腔内にステント124が配置されている。前記ステントはさらに、プラーク誘発狭窄を軽減し、管腔の開通性を改善することもできる。安定化されたプラークのその他の適切な一次処置としては、バルーン血管形成術、じゅく腫除去術、回転じゅく腫除去術、レーザ血管形成術等が挙げられ、ここで処理された血管の管腔は、狭窄状態を少なくとも部分的に軽減するべく拡大される。動脈の場合、一次処置は、前記冷却治療の少し前、冷却治療中、好ましくは冷却治療の少し後、好ましくは冷却治療の60秒以内、さらに好ましくは脂質リッチ液体を所望の温度へ冷却した直後に行われる。場合によっては、冷却方法は図13Bに図示されているように、脂質リッチ液体106’のサイズをおそらく縮小し、またはその脂質リッチ液体の細胞密度もしくは組成を変化させ、および/または脆弱性プラークの化学的性質もしくはライフサイクルを変化させることによって脆弱性プラークを不活性化を行うことができる。不活性化はさらに、帽部108の構造的完全性の促進(例えば、帽部の厚み、強度、弾性、または硬度の増大)、傷の形成または脆弱性プラークの化学特性の変化を介した帽部の細胞組成または特性の改変および/または等も含むことができる。
【0043】
カテーテル10とその使用のための取扱説明書128とが含まれているキット126が図14に図示されている。カテーテル10は、図14に図示されているように、図5のデュアルバルーンカテーテルであってもよいし、あるいは近端部と遠端部とその遠端部近傍の冷却部材とを備えたカテーテルであってもよい。使用取扱説明書128は、脆弱性プラークの検出および/または治療のための上述した関連方法のステップのセットのいずれかを記載したものとすることができる。使用取扱説明書128は、多くの場合印刷され、必要に応じて少なくとも部分的にバルーンカテーテル10用の殺菌パッケージ130上に示される。別実施形態において、使用取扱説明書128は、脆弱性プラークの検出および/または治療のためのバルーンカテーテル10の使用法を図示または例示した機械読み取り可能コード、デジタルまたはアナログデータを含み得る。使用取扱説明書を、キット126のパッケージ132上に印刷する等のその他の構成も可能である。
【0044】
以上は本発明の好適実施例の完全な説明であるが、当業者には、様々な代替、改変および均等物が自明であろう。従って、上の説明は、特許請求の範囲によって規定される本発明の範囲を限定するものと解釈されてはならない。
【図面の簡単な説明】
【図1A】図1Aは、成熟した脆弱性プラークを含む血管の断面図を示している。
【図1B】図1Bは、成熟した脆弱性プラークを含む血管の断面図を示している。
【図2】図2は、血管内の脆弱性プラークの破断とプラークの出血の断面図を示している。
【図3】図3は、血管内の血栓症閉塞部の断面図を示している。
【図4】図4は、図1Aの4−4線に沿った分解断面図を示している。
【図5】図5は、脆弱性プラークの検出と治療のための凍結療法カテーテルの一例を図示している。
【図6】図6は、図5の6−6線に沿った前記カテーテルの断面図である。
【図7】図7は、図5のカテーテルの自動流体遮断機構の作動を図示する作用流れ図である。
【図8A】図8Aは、図5の凍結療法カテーテルに使用されるハンドルと取り外し可能エネルギパックを図示している。
【図8B】図8Bは、図5の凍結療法カテーテルに使用されるハンドルと取り外し可能エネルギパックを図示している。
【図9】図9は、管腔表面の温度差を測定する回路のブロック図を示している。
【図10A】図10Aは、脆弱性プラークを検出するための別のカテーテルを図示している。
【図10B】図10Bは、図10Aの10B−10B線に沿った前記カテーテルの断面図である。
【図11A】図11Aは、脆弱性プラークの治療用の図5のカテーテルの使用法を図示している。
【図11B】図11Bは、脆弱性プラークの治療用の図5のカテーテルの使用法を図示している。
【図11C】図11Cは、脆弱性プラークの治療用の図5のカテーテルの使用法を図示している。
【図12A】図12Aは、脆弱性プラークの脂質コア転移を行う転移温度を図示するグラフである。
【図12B】図12Bは、液体の無秩序状態から、固体の秩序状態への脂質コアの転移を図示している。
【図13A】図13Aは、前記脆弱性プラークの冷却に関連する追加の治療法を図示している。
【図13B】図13Bは、前記脆弱性プラークの冷却に関連する追加の治療法を図示している。
【図14】図14は、図5の装置と、その使用取扱説明書とを含む脆弱性プラーク治療キットを図示している。
Claims (7)
- 管腔表面を有する血管の脆弱性プラークを検出し治療するための凍結療法カテーテルであって、前記カテーテルは、
近端部と遠端部とこれらの間に延出する冷却流体供給管腔および排出管腔とを有するカテーテル本体と、
前記カテーテル本体の前記遠端部に配置された第1バルーンであって、前記第1バルーンは前記供給管腔および前記排出管腔に流体連絡する内面を有する、第1バルーンと、
前記第1バルーン上にその間に熱バリアを形成した状態で配置される第2バルーンと、
前記管腔表面の温度測定を提供するべく前記第2バルーンに貼り付けられた複数の温度センサとを備え、
ここで、前記熱バリアが、フィラメント、複数のこぶ、またはスリーブによって、前記バルーン間に維持される空隙を備える凍結療法カテーテル。 - 請求項1に記載の凍結療法カテーテルであって、前記複数の温度センサは、前記第2バルーンの外面に貼り付けられている凍結療法カテーテル。
- 請求項2に記載の凍結療法カテーテルであって、前記複数の温度センサは、前記管腔表面の直接温度測定を提供する、凍結療法カテーテル。
- 請求項1に記載の凍結療法カテーテルであって、前記複数の温度センサは前記第2バルーンの内面に貼り付けられている凍結療法カテーテル。
- 請求項1に記載の凍結療法カテーテルであって、前記複数の温度センサは、熱電対またはサーミスタである凍結療法カテーテル。
- 請求項1に記載の凍結療法カテーテルであって、前記複数の温度センサは、前記第2バルーンの周部に貼り付けられている凍結療法カテーテル。
- 請求項1に記載の凍結療法カテーテルであって、さらに、
前記カテーテルの前記近端部に温度読み取り装置へのコネクタを備える凍結療法カテーテル。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US09/641,462 US6602246B1 (en) | 2000-08-18 | 2000-08-18 | Cryotherapy method for detecting and treating vulnerable plaque |
| US09/641,462 | 2000-08-18 | ||
| PCT/US2001/025817 WO2002015807A1 (en) | 2000-08-18 | 2001-08-17 | Cryotherapy method for detecting and treating vulnerable plaque |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2004506470A JP2004506470A (ja) | 2004-03-04 |
| JP2004506470A5 JP2004506470A5 (ja) | 2005-04-07 |
| JP4845330B2 true JP4845330B2 (ja) | 2011-12-28 |
Family
ID=24572497
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002520722A Expired - Lifetime JP4845330B2 (ja) | 2000-08-18 | 2001-08-17 | 脆弱性プラークを検出および治療するための凍結療法 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US6602246B1 (ja) |
| EP (2) | EP1311201B1 (ja) |
| JP (1) | JP4845330B2 (ja) |
| AT (1) | ATE481934T1 (ja) |
| AU (1) | AU2001288295A1 (ja) |
| CA (1) | CA2419645A1 (ja) |
| DE (1) | DE60143119D1 (ja) |
| WO (1) | WO2002015807A1 (ja) |
Families Citing this family (121)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6306166B1 (en) * | 1997-08-13 | 2001-10-23 | Scimed Life Systems, Inc. | Loading and release of water-insoluble drugs |
| US20030009213A1 (en) * | 2000-03-13 | 2003-01-09 | Jun Yang | Stent having cover with drug delivery capability |
| US6955174B2 (en) * | 2000-08-18 | 2005-10-18 | Uryovascular Systems, Inc. | Cryotherapy method for detecting and treating vulnerable plaque |
| US20030149368A1 (en) * | 2000-10-24 | 2003-08-07 | Hennemann Willard W. | Method and apparatus for locating and detecting vascular plaque via impedence and conductivity measurements, and for cryogenically passivating vascular plaque and inhibiting vascular plaque progression and rupture |
| US20040260328A1 (en) * | 2001-09-27 | 2004-12-23 | Roni Zvuloni | Cryoplasty apparatus and method |
| WO2003026476A2 (en) * | 2001-09-27 | 2003-04-03 | Galil Medical Ltd. | Apparatus and method for cryosurgical treatment of tumors of the breast |
| US6972024B1 (en) | 2001-12-21 | 2005-12-06 | Advanced Cardiovascular Systems, Inc. | Method of treating vulnerable plaque |
| US8840608B2 (en) * | 2002-03-15 | 2014-09-23 | The General Hospital Corporation | Methods and devices for selective disruption of fatty tissue by controlled cooling |
| US8347891B2 (en) | 2002-04-08 | 2013-01-08 | Medtronic Ardian Luxembourg S.A.R.L. | Methods and apparatus for performing a non-continuous circumferential treatment of a body lumen |
| US7756583B2 (en) | 2002-04-08 | 2010-07-13 | Ardian, Inc. | Methods and apparatus for intravascularly-induced neuromodulation |
| JP2005534356A (ja) * | 2002-06-13 | 2005-11-17 | リージェンツ オブ ザ ユニバーシティ オブ ミネソタ | 凍結手術組成物と方法 |
| US7273492B2 (en) * | 2002-08-27 | 2007-09-25 | Advanced Cardiovascular Systems Inc. | Stent for treating vulnerable plaque |
| JP2006517117A (ja) * | 2003-01-16 | 2006-07-20 | ガリル メディカル リミテッド | 血管のプラク誘発狭窄を検出し、位置確認し、かつ識別するための装置、システム、及び方法 |
| JP2006516421A (ja) * | 2003-01-16 | 2006-07-06 | ガリル メディカル リミテッド | 血管内の閉塞を検出しかつ位置確認するための装置、システム、及び方法 |
| EP1608225A4 (en) * | 2003-03-26 | 2007-07-04 | Univ Minnesota | HEAT METHOD AND COMPOSITIONS |
| US20040215177A1 (en) | 2003-04-24 | 2004-10-28 | Scimed Life Systems, Inc. | Therapeutic apparatus having insulated region at the insertion area |
| JP2005006779A (ja) * | 2003-06-17 | 2005-01-13 | Terumo Corp | 生体管腔洗浄装置 |
| DE202004021949U1 (de) | 2003-09-12 | 2013-05-27 | Vessix Vascular, Inc. | Auswählbare exzentrische Remodellierung und/oder Ablation von atherosklerotischem Material |
| US7288088B2 (en) * | 2004-05-10 | 2007-10-30 | Boston Scientific Scimed, Inc. | Clamp based low temperature lesion formation apparatus, systems and methods |
| US7582083B2 (en) * | 2004-05-10 | 2009-09-01 | Boston Scientific Scimed, Inc. | Probe based low temperature lesion formation apparatus, systems and methods |
| US7291142B2 (en) | 2004-05-10 | 2007-11-06 | Boston Scientific Scimed, Inc. | Low temperature lesion formation apparatus, systems and methods |
| US9713730B2 (en) | 2004-09-10 | 2017-07-25 | Boston Scientific Scimed, Inc. | Apparatus and method for treatment of in-stent restenosis |
| US8396548B2 (en) | 2008-11-14 | 2013-03-12 | Vessix Vascular, Inc. | Selective drug delivery in a lumen |
| US8019435B2 (en) | 2006-05-02 | 2011-09-13 | Boston Scientific Scimed, Inc. | Control of arterial smooth muscle tone |
| US20070282316A1 (en) * | 2006-06-05 | 2007-12-06 | Cryocath Technologies Inc. | Method of prophylactically treating an artery to make it resistant to the subsequent development of atherosclerosis |
| WO2008049082A2 (en) | 2006-10-18 | 2008-04-24 | Minnow Medical, Inc. | Inducing desirable temperature effects on body tissue |
| EP2076194B1 (en) | 2006-10-18 | 2013-04-24 | Vessix Vascular, Inc. | System for inducing desirable temperature effects on body tissue |
| JP5312337B2 (ja) | 2006-10-18 | 2013-10-09 | べシックス・バスキュラー・インコーポレイテッド | 標的組織の選択的な処置のための調節されたrfエネルギーおよび電気的な組織の特徴付け |
| EP2491962A1 (de) | 2007-01-21 | 2012-08-29 | Hemoteq AG | Medizinprodukt zur Behandlung von Verschlüssen von Körperdurchgängen und zur Prävention drohender Wiederverschlüsse |
| US8496653B2 (en) | 2007-04-23 | 2013-07-30 | Boston Scientific Scimed, Inc. | Thrombus removal |
| US9192697B2 (en) | 2007-07-03 | 2015-11-24 | Hemoteq Ag | Balloon catheter for treating stenosis of body passages and for preventing threatening restenosis |
| US8845627B2 (en) * | 2008-08-22 | 2014-09-30 | Boston Scientific Scimed, Inc. | Regulating pressure to lower temperature in a cryotherapy balloon catheter |
| US9289132B2 (en) * | 2008-10-07 | 2016-03-22 | Mc10, Inc. | Catheter balloon having stretchable integrated circuitry and sensor array |
| CN102271603A (zh) | 2008-11-17 | 2011-12-07 | 明诺医学股份有限公司 | 得知或未得知组织形态的选择性能量积累 |
| US8551096B2 (en) | 2009-05-13 | 2013-10-08 | Boston Scientific Scimed, Inc. | Directional delivery of energy and bioactives |
| ES2550634T3 (es) | 2009-07-10 | 2015-11-11 | Boston Scientific Scimed, Inc. | Uso de nanocristales para un balón de suministro de fármaco |
| US10080821B2 (en) | 2009-07-17 | 2018-09-25 | Boston Scientific Scimed, Inc. | Nucleation of drug delivery balloons to provide improved crystal size and density |
| US20110263921A1 (en) | 2009-12-31 | 2011-10-27 | Anthony Vrba | Patterned Denervation Therapy for Innervated Renal Vasculature |
| US20110270238A1 (en) | 2009-12-31 | 2011-11-03 | Raed Rizq | Compliant Cryoballoon Apparatus for Denervating Ostia of the Renal Arteries |
| JP2013523318A (ja) | 2010-04-09 | 2013-06-17 | べシックス・バスキュラー・インコーポレイテッド | 組織の治療のための発電および制御の装置 |
| US9192790B2 (en) | 2010-04-14 | 2015-11-24 | Boston Scientific Scimed, Inc. | Focused ultrasonic renal denervation |
| US8936592B2 (en) * | 2010-06-03 | 2015-01-20 | Ams Research Corporation | Laser tissue ablation system |
| US8473067B2 (en) | 2010-06-11 | 2013-06-25 | Boston Scientific Scimed, Inc. | Renal denervation and stimulation employing wireless vascular energy transfer arrangement |
| US9463062B2 (en) | 2010-07-30 | 2016-10-11 | Boston Scientific Scimed, Inc. | Cooled conductive balloon RF catheter for renal nerve ablation |
| US9155589B2 (en) | 2010-07-30 | 2015-10-13 | Boston Scientific Scimed, Inc. | Sequential activation RF electrode set for renal nerve ablation |
| US20120029512A1 (en) | 2010-07-30 | 2012-02-02 | Willard Martin R | Balloon with surface electrodes and integral cooling for renal nerve ablation |
| US9358365B2 (en) | 2010-07-30 | 2016-06-07 | Boston Scientific Scimed, Inc. | Precision electrode movement control for renal nerve ablation |
| US9084609B2 (en) | 2010-07-30 | 2015-07-21 | Boston Scientific Scime, Inc. | Spiral balloon catheter for renal nerve ablation |
| US9408661B2 (en) | 2010-07-30 | 2016-08-09 | Patrick A. Haverkost | RF electrodes on multiple flexible wires for renal nerve ablation |
| WO2012019156A1 (en) | 2010-08-05 | 2012-02-09 | Medtronic Ardian Luxembourg S.A.R.L. | Cryoablation apparatuses, systems, and methods for renal neuromodulation |
| US8889211B2 (en) | 2010-09-02 | 2014-11-18 | Boston Scientific Scimed, Inc. | Coating process for drug delivery balloons using heat-induced rewrap memory |
| US8974451B2 (en) | 2010-10-25 | 2015-03-10 | Boston Scientific Scimed, Inc. | Renal nerve ablation using conductive fluid jet and RF energy |
| US20120143294A1 (en) | 2010-10-26 | 2012-06-07 | Medtronic Adrian Luxembourg S.a.r.l. | Neuromodulation cryotherapeutic devices and associated systems and methods |
| US9220558B2 (en) | 2010-10-27 | 2015-12-29 | Boston Scientific Scimed, Inc. | RF renal denervation catheter with multiple independent electrodes |
| US9028485B2 (en) | 2010-11-15 | 2015-05-12 | Boston Scientific Scimed, Inc. | Self-expanding cooling electrode for renal nerve ablation |
| US9668811B2 (en) | 2010-11-16 | 2017-06-06 | Boston Scientific Scimed, Inc. | Minimally invasive access for renal nerve ablation |
| US9089350B2 (en) | 2010-11-16 | 2015-07-28 | Boston Scientific Scimed, Inc. | Renal denervation catheter with RF electrode and integral contrast dye injection arrangement |
| US9326751B2 (en) | 2010-11-17 | 2016-05-03 | Boston Scientific Scimed, Inc. | Catheter guidance of external energy for renal denervation |
| US9060761B2 (en) | 2010-11-18 | 2015-06-23 | Boston Scientific Scime, Inc. | Catheter-focused magnetic field induced renal nerve ablation |
| US9023034B2 (en) | 2010-11-22 | 2015-05-05 | Boston Scientific Scimed, Inc. | Renal ablation electrode with force-activatable conduction apparatus |
| US9192435B2 (en) | 2010-11-22 | 2015-11-24 | Boston Scientific Scimed, Inc. | Renal denervation catheter with cooled RF electrode |
| US20120157993A1 (en) | 2010-12-15 | 2012-06-21 | Jenson Mark L | Bipolar Off-Wall Electrode Device for Renal Nerve Ablation |
| WO2012100095A1 (en) | 2011-01-19 | 2012-07-26 | Boston Scientific Scimed, Inc. | Guide-compatible large-electrode catheter for renal nerve ablation with reduced arterial injury |
| US20120259269A1 (en) | 2011-04-08 | 2012-10-11 | Tyco Healthcare Group Lp | Iontophoresis drug delivery system and method for denervation of the renal sympathetic nerve and iontophoretic drug delivery |
| CA2832803C (en) | 2011-04-13 | 2018-04-03 | Cryotherapeutics Gmbh | Plaque stabilisation using cryoenergy |
| CN103930061B (zh) | 2011-04-25 | 2016-09-14 | 美敦力阿迪安卢森堡有限责任公司 | 用于限制导管壁低温消融的有关低温球囊限制部署的装置及方法 |
| US9579030B2 (en) | 2011-07-20 | 2017-02-28 | Boston Scientific Scimed, Inc. | Percutaneous devices and methods to visualize, target and ablate nerves |
| US9186209B2 (en) | 2011-07-22 | 2015-11-17 | Boston Scientific Scimed, Inc. | Nerve modulation system having helical guide |
| WO2013022458A1 (en) | 2011-08-05 | 2013-02-14 | Boston Scientific Scimed, Inc. | Methods of converting amorphous drug substance into crystalline form |
| WO2013028208A1 (en) | 2011-08-25 | 2013-02-28 | Boston Scientific Scimed, Inc. | Medical device with crystalline drug coating |
| WO2013055826A1 (en) | 2011-10-10 | 2013-04-18 | Boston Scientific Scimed, Inc. | Medical devices including ablation electrodes |
| EP2765940B1 (en) | 2011-10-11 | 2015-08-26 | Boston Scientific Scimed, Inc. | Off-wall electrode device for nerve modulation |
| US9420955B2 (en) | 2011-10-11 | 2016-08-23 | Boston Scientific Scimed, Inc. | Intravascular temperature monitoring system and method |
| US9364284B2 (en) | 2011-10-12 | 2016-06-14 | Boston Scientific Scimed, Inc. | Method of making an off-wall spacer cage |
| US9079000B2 (en) | 2011-10-18 | 2015-07-14 | Boston Scientific Scimed, Inc. | Integrated crossing balloon catheter |
| US9162046B2 (en) | 2011-10-18 | 2015-10-20 | Boston Scientific Scimed, Inc. | Deflectable medical devices |
| EP3366250A1 (en) | 2011-11-08 | 2018-08-29 | Boston Scientific Scimed, Inc. | Ostial renal nerve ablation |
| EP2779929A1 (en) | 2011-11-15 | 2014-09-24 | Boston Scientific Scimed, Inc. | Device and methods for renal nerve modulation monitoring |
| US9119632B2 (en) | 2011-11-21 | 2015-09-01 | Boston Scientific Scimed, Inc. | Deflectable renal nerve ablation catheter |
| US9265969B2 (en) | 2011-12-21 | 2016-02-23 | Cardiac Pacemakers, Inc. | Methods for modulating cell function |
| US9037259B2 (en) | 2011-12-23 | 2015-05-19 | Vessix Vascular, Inc. | Methods and apparatuses for remodeling tissue of or adjacent to a body passage |
| US9433760B2 (en) | 2011-12-28 | 2016-09-06 | Boston Scientific Scimed, Inc. | Device and methods for nerve modulation using a novel ablation catheter with polymeric ablative elements |
| US9050106B2 (en) | 2011-12-29 | 2015-06-09 | Boston Scientific Scimed, Inc. | Off-wall electrode device and methods for nerve modulation |
| US9241752B2 (en) | 2012-04-27 | 2016-01-26 | Medtronic Ardian Luxembourg S.A.R.L. | Shafts with pressure relief in cryotherapeutic catheters and associated devices, systems, and methods |
| EP2840991B1 (en) | 2012-04-27 | 2019-05-15 | Medtronic Ardian Luxembourg S.à.r.l. | Cryotherapeutic devices for renal neuromodulation |
| WO2013169927A1 (en) | 2012-05-08 | 2013-11-14 | Boston Scientific Scimed, Inc. | Renal nerve modulation devices |
| CN104540465A (zh) | 2012-08-24 | 2015-04-22 | 波士顿科学西美德公司 | 带有含单独微孔隙区域的球囊的血管内导管 |
| EP2895095A2 (en) | 2012-09-17 | 2015-07-22 | Boston Scientific Scimed, Inc. | Self-positioning electrode system and method for renal nerve modulation |
| WO2014047411A1 (en) | 2012-09-21 | 2014-03-27 | Boston Scientific Scimed, Inc. | System for nerve modulation and innocuous thermal gradient nerve block |
| WO2014047454A2 (en) | 2012-09-21 | 2014-03-27 | Boston Scientific Scimed, Inc. | Self-cooling ultrasound ablation catheter |
| JP6074051B2 (ja) | 2012-10-10 | 2017-02-01 | ボストン サイエンティフィック サイムド,インコーポレイテッドBoston Scientific Scimed,Inc. | 血管内神経変調システム及び医療用デバイス |
| WO2014143571A1 (en) | 2013-03-11 | 2014-09-18 | Boston Scientific Scimed, Inc. | Medical devices for modulating nerves |
| US9956033B2 (en) | 2013-03-11 | 2018-05-01 | Boston Scientific Scimed, Inc. | Medical devices for modulating nerves |
| US9808311B2 (en) | 2013-03-13 | 2017-11-07 | Boston Scientific Scimed, Inc. | Deflectable medical devices |
| US10265122B2 (en) | 2013-03-15 | 2019-04-23 | Boston Scientific Scimed, Inc. | Nerve ablation devices and related methods of use |
| EP2967725B1 (en) | 2013-03-15 | 2019-12-11 | Boston Scientific Scimed, Inc. | Control unit for detecting electrical leakage between electrode pads and system comprising such a control unit |
| EP2967734B1 (en) | 2013-03-15 | 2019-05-15 | Boston Scientific Scimed, Inc. | Methods and apparatuses for remodeling tissue of or adjacent to a body passage |
| CN105473092B (zh) | 2013-06-21 | 2019-05-17 | 波士顿科学国际有限公司 | 具有可旋转轴的用于肾神经消融的医疗器械 |
| EP3010437A1 (en) | 2013-06-21 | 2016-04-27 | Boston Scientific Scimed, Inc. | Renal denervation balloon catheter with ride along electrode support |
| US9707036B2 (en) | 2013-06-25 | 2017-07-18 | Boston Scientific Scimed, Inc. | Devices and methods for nerve modulation using localized indifferent electrodes |
| WO2015002787A1 (en) | 2013-07-01 | 2015-01-08 | Boston Scientific Scimed, Inc. | Medical devices for renal nerve ablation |
| EP3019105B1 (en) | 2013-07-11 | 2017-09-13 | Boston Scientific Scimed, Inc. | Devices for nerve modulation |
| EP3019106A1 (en) | 2013-07-11 | 2016-05-18 | Boston Scientific Scimed, Inc. | Medical device with stretchable electrode assemblies |
| US9925001B2 (en) | 2013-07-19 | 2018-03-27 | Boston Scientific Scimed, Inc. | Spiral bipolar electrode renal denervation balloon |
| WO2015013205A1 (en) | 2013-07-22 | 2015-01-29 | Boston Scientific Scimed, Inc. | Medical devices for renal nerve ablation |
| JP6122217B2 (ja) | 2013-07-22 | 2017-04-26 | ボストン サイエンティフィック サイムド,インコーポレイテッドBoston Scientific Scimed,Inc. | 腎神経アブレーション用医療器具 |
| EP3035879A1 (en) | 2013-08-22 | 2016-06-29 | Boston Scientific Scimed, Inc. | Flexible circuit having improved adhesion to a renal nerve modulation balloon |
| EP3041425B1 (en) | 2013-09-04 | 2022-04-13 | Boston Scientific Scimed, Inc. | Radio frequency (rf) balloon catheter having flushing and cooling capability |
| WO2015038947A1 (en) | 2013-09-13 | 2015-03-19 | Boston Scientific Scimed, Inc. | Ablation balloon with vapor deposited cover layer |
| US11246654B2 (en) | 2013-10-14 | 2022-02-15 | Boston Scientific Scimed, Inc. | Flexible renal nerve ablation devices and related methods of use and manufacture |
| US9687166B2 (en) | 2013-10-14 | 2017-06-27 | Boston Scientific Scimed, Inc. | High resolution cardiac mapping electrode array catheter |
| US9770606B2 (en) | 2013-10-15 | 2017-09-26 | Boston Scientific Scimed, Inc. | Ultrasound ablation catheter with cooling infusion and centering basket |
| AU2014334574B2 (en) | 2013-10-15 | 2017-07-06 | Boston Scientific Scimed, Inc. | Medical device balloon |
| JP6259099B2 (ja) | 2013-10-18 | 2018-01-10 | ボストン サイエンティフィック サイムド,インコーポレイテッドBoston Scientific Scimed,Inc. | 可撓性を備える導電性ワイヤを備えるバルーン・カテーテル、並びに関連する使用および製造方法 |
| US10271898B2 (en) | 2013-10-25 | 2019-04-30 | Boston Scientific Scimed, Inc. | Embedded thermocouple in denervation flex circuit |
| EP3091922B1 (en) | 2014-01-06 | 2018-10-17 | Boston Scientific Scimed, Inc. | Tear resistant flex circuit assembly |
| US11000679B2 (en) | 2014-02-04 | 2021-05-11 | Boston Scientific Scimed, Inc. | Balloon protection and rewrapping devices and related methods of use |
| WO2015119890A1 (en) | 2014-02-04 | 2015-08-13 | Boston Scientific Scimed, Inc. | Alternative placement of thermal sensors on bipolar electrode |
| WO2015124232A1 (en) | 2014-02-24 | 2015-08-27 | Cryotherapeutics Gmbh | Heat exchanger unity for cryotherapy |
| US10492842B2 (en) | 2014-03-07 | 2019-12-03 | Medtronic Ardian Luxembourg S.A.R.L. | Monitoring and controlling internally administered cryotherapy |
| US10709490B2 (en) | 2014-05-07 | 2020-07-14 | Medtronic Ardian Luxembourg S.A.R.L. | Catheter assemblies comprising a direct heating element for renal neuromodulation and associated systems and methods |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5868735A (en) * | 1997-03-06 | 1999-02-09 | Scimed Life Systems, Inc. | Cryoplasty device and method |
| WO2000027278A1 (en) * | 1998-11-09 | 2000-05-18 | Farallon Medsystems, Inc. | Thermography catheter |
Family Cites Families (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3901241A (en) | 1973-05-31 | 1975-08-26 | Al Corp Du | Disposable cryosurgical instrument |
| US4336691A (en) | 1979-12-13 | 1982-06-29 | The Board Of Trustees Of The Leland Stanford Junior University | Cryojet rapid freezing apparatus |
| US5019075A (en) | 1984-10-24 | 1991-05-28 | The Beth Israel Hospital | Method and apparatus for angioplasty |
| US4754752A (en) | 1986-07-28 | 1988-07-05 | Robert Ginsburg | Vascular catheter |
| JPS6446056U (ja) | 1987-09-17 | 1989-03-22 | ||
| US5041089A (en) | 1987-12-11 | 1991-08-20 | Devices For Vascular Intervention, Inc. | Vascular dilation catheter construction |
| US5147355A (en) | 1988-09-23 | 1992-09-15 | Brigham And Womens Hospital | Cryoablation catheter and method of performing cryoablation |
| US5151100A (en) | 1988-10-28 | 1992-09-29 | Boston Scientific Corporation | Heating catheters |
| US5191883A (en) | 1988-10-28 | 1993-03-09 | Prutech Research And Development Partnership Ii | Device for heating tissue in a patient's body |
| GB2226497B (en) | 1988-12-01 | 1992-07-01 | Spembly Medical Ltd | Cryosurgical probe |
| WO1991005528A1 (en) | 1989-10-19 | 1991-05-02 | Granulab B.V. | Device for cooling or heating a person |
| US5092841A (en) | 1990-05-17 | 1992-03-03 | Wayne State University | Method for treating an arterial wall injured during angioplasty |
| US5196024A (en) | 1990-07-03 | 1993-03-23 | Cedars-Sinai Medical Center | Balloon catheter with cutting edge |
| US5190539A (en) | 1990-07-10 | 1993-03-02 | Texas A & M University System | Micro-heat-pipe catheter |
| US5275595A (en) | 1992-07-06 | 1994-01-04 | Dobak Iii John D | Cryosurgical instrument |
| US5486208A (en) | 1993-02-10 | 1996-01-23 | Ginsburg; Robert | Method and apparatus for controlling a patient's body temperature by in situ blood temperature modification |
| US5501681A (en) | 1993-11-12 | 1996-03-26 | Neuwirth; Robert S. | Intrauterine cryoablation cauterizing apparatus and method |
| US5458612A (en) | 1994-01-06 | 1995-10-17 | Origin Medsystems, Inc. | Prostatic ablation method and apparatus for perineal approach |
| US5545195A (en) | 1994-08-01 | 1996-08-13 | Boston Scientific Corporation | Interstitial heating of tissue |
| US5617739A (en) | 1995-03-29 | 1997-04-08 | Mmr Technologies, Inc. | Self-cleaning low-temperature refrigeration system |
| US5644502A (en) | 1995-05-04 | 1997-07-01 | Mmr Technologies, Inc. | Method for efficient counter-current heat exchange using optimized mixtures |
| US5733280A (en) | 1995-11-15 | 1998-03-31 | Avitall; Boaz | Cryogenic epicardial mapping and ablation |
| US5924997A (en) * | 1996-07-29 | 1999-07-20 | Campbell; Thomas Henderson | Catheter and method for the thermal mapping of hot spots in vascular lesions of the human body |
| US5899898A (en) | 1997-02-27 | 1999-05-04 | Cryocath Technologies Inc. | Cryosurgical linear ablation |
| US7220257B1 (en) | 2000-07-25 | 2007-05-22 | Scimed Life Systems, Inc. | Cryotreatment device and method |
| US5902299A (en) | 1997-07-29 | 1999-05-11 | Jayaraman; Swaminathan | Cryotherapy method for reducing tissue injury after balloon angioplasty or stent implantation |
| US5971979A (en) | 1997-12-02 | 1999-10-26 | Odyssey Technologies, Inc. | Method for cryogenic inhibition of hyperplasia |
| US6383180B1 (en) * | 1999-01-25 | 2002-05-07 | Cryocath Technologies Inc. | Closed loop catheter coolant system |
| US6514245B1 (en) * | 1999-03-15 | 2003-02-04 | Cryovascular Systems, Inc. | Safety cryotherapy catheter |
| JP2003524506A (ja) | 2000-03-01 | 2003-08-19 | イナークール セラピーズ インコーポレイテッド | 再狭窄を伴う血管形成術のための冷却療法及び装置 |
| US6537271B1 (en) | 2000-07-06 | 2003-03-25 | Cryogen, Inc. | Balloon cryogenic catheter |
| US6673066B2 (en) | 2000-11-10 | 2004-01-06 | Cardiostream, Inc. | Apparatus and method to diagnose and treat vulnerable plaque |
-
2000
- 2000-08-18 US US09/641,462 patent/US6602246B1/en not_active Expired - Lifetime
-
2001
- 2001-08-17 AT AT01968016T patent/ATE481934T1/de not_active IP Right Cessation
- 2001-08-17 DE DE60143119T patent/DE60143119D1/de not_active Expired - Lifetime
- 2001-08-17 EP EP01968016A patent/EP1311201B1/en not_active Expired - Lifetime
- 2001-08-17 WO PCT/US2001/025817 patent/WO2002015807A1/en active Application Filing
- 2001-08-17 JP JP2002520722A patent/JP4845330B2/ja not_active Expired - Lifetime
- 2001-08-17 EP EP10176780.4A patent/EP2255740B1/en not_active Expired - Lifetime
- 2001-08-17 AU AU2001288295A patent/AU2001288295A1/en not_active Abandoned
- 2001-08-17 CA CA002419645A patent/CA2419645A1/en not_active Abandoned
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5868735A (en) * | 1997-03-06 | 1999-02-09 | Scimed Life Systems, Inc. | Cryoplasty device and method |
| WO2000027278A1 (en) * | 1998-11-09 | 2000-05-18 | Farallon Medsystems, Inc. | Thermography catheter |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2255740A1 (en) | 2010-12-01 |
| EP2255740B1 (en) | 2018-02-21 |
| CA2419645A1 (en) | 2002-02-28 |
| JP2004506470A (ja) | 2004-03-04 |
| EP1311201B1 (en) | 2010-09-22 |
| EP1311201A4 (en) | 2009-09-09 |
| EP1311201A1 (en) | 2003-05-21 |
| ATE481934T1 (de) | 2010-10-15 |
| AU2001288295A1 (en) | 2002-03-04 |
| DE60143119D1 (de) | 2010-11-04 |
| WO2002015807A1 (en) | 2002-02-28 |
| WO2002015807A9 (en) | 2003-03-27 |
| US6602246B1 (en) | 2003-08-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4845330B2 (ja) | 脆弱性プラークを検出および治療するための凍結療法 | |
| JP4871719B2 (ja) | 脆弱性プラークを検出し治療するための寒冷療法 | |
| US6648879B2 (en) | Safety cryotherapy catheter | |
| JP4833494B2 (ja) | 凍結治療装置および方法 | |
| US6786900B2 (en) | Cryotherapy methods for treating vessel dissections and side branch occlusion | |
| EP1894534B1 (en) | Improved safety cryotherapy catheter | |
| US6811550B2 (en) | Safety cryotherapy catheter | |
| EP3065657B1 (en) | Catheter for plaque stablisation | |
| JP6066217B2 (ja) | システムおよびクライオエネルギーを供給するシステムを動作させる方法 | |
| WO2004000092A2 (en) | Cryotherapy methods for treating vessel dissections and side branch occlusion |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A072 | Dismissal of procedure [no reply to invitation to correct request for examination] |
Free format text: JAPANESE INTERMEDIATE CODE: A072 Effective date: 20040212 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080807 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20090313 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20090313 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20090324 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110221 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110517 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20110915 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20111011 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20141021 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4845330 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |