JP4754698B2 - Cyanine dye - Google Patents
Cyanine dye Download PDFInfo
- Publication number
- JP4754698B2 JP4754698B2 JP2001031916A JP2001031916A JP4754698B2 JP 4754698 B2 JP4754698 B2 JP 4754698B2 JP 2001031916 A JP2001031916 A JP 2001031916A JP 2001031916 A JP2001031916 A JP 2001031916A JP 4754698 B2 JP4754698 B2 JP 4754698B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- cyanine dye
- light
- ring
- optical recording
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 0 CC*(c1c(C2(C)C)c(cccc3)c3cc1)=C2*=CC=C(C1(C)C)N(CC)c2c1c(cccc1)c1cc2 Chemical compound CC*(c1c(C2(C)C)c(cccc3)c3cc1)=C2*=CC=C(C1(C)C)N(CC)c2c1c(cccc1)c1cc2 0.000 description 6
- QEYWBZDFNAQXCT-PVURJMBVSA-N CCN(/C(/C1(C)C)=C/C=C/C(C2(C)C)=CN(C)c3c2ccc2c3cccc2)c2c1ccc1ccccc21 Chemical compound CCN(/C(/C1(C)C)=C/C=C/C(C2(C)C)=CN(C)c3c2ccc2c3cccc2)c2c1ccc1ccccc21 QEYWBZDFNAQXCT-PVURJMBVSA-N 0.000 description 1
Images
Landscapes
- Thermal Transfer Or Thermal Recording In General (AREA)
- Optical Record Carriers And Manufacture Thereof (AREA)
Description
【0001】
【発明の属する技術分野】
この発明は新規な有機色素化合物に関するものであり、とりわけ、高密度光記録媒体において有用なトリメチン系シアニン色素に関するものである。
【0002】
【従来の技術】
マルチメディア時代の到来に伴い、CD−R(コンパクトディスクを利用する追記型メモリ)やDVD−R(デジタルビデオディスクを利用する追記型メモリ)などの光記録媒体が脚光を浴びている。光記録媒体は、テルル、セレン、ロジウム、炭素、硫化水素などの無機物を用いて記録層を構成する無機系光記録媒体と、有機色素化合物を主体とする光吸収剤により記録層を構成する有機系光記録媒体に大別することができる。
【0003】
このうち、有機系光記録媒体は、通常、シアニン色素を2,2,3,3−テトラフルオロ−1−プロパノール(以下、「TFP」と略記する。)などの有機溶剤に溶解し、溶液をポリカーボネートの基板に塗布し、乾燥して記録層を形成した後、金、銀、銅などの金属による反射層及び紫外線硬化樹脂などによる保護層を順次密着させて形成することによって作製される。有機系光記録媒体は、無機系のものと比較して、読取光や自然光などの環境光によって記録層が変化し易いという欠点はあるものの、光吸収剤を溶液にして直接基板に塗布することによって記録層を構成し得ることから、光記録媒体を低廉に作製できる利点がある。加えて、有機系光記録媒体は、有機物を主体に構成されるので、湿気や海水にさらされる環境下でも腐食し難い利点があることと、有機系光記録媒体の一種である熱変形型光記録媒体の出現によって、所定のフォーマットで光記録媒体に記録された情報を市販の読取専用装置を用いて読み取れるようになったことから、今や廉価な光記録媒体の主流になりつつある。
【0004】
有機系光記録媒体における緊急の課題は、マルチメディア時代に対応するためのさらなる高密度化である。現在、斯界において鋭意推進されている高密度化の研究は、主として、情報の書込に用いるレーザー光の波長をGaAlAs系半導体レーザーによる現行の775乃至795nmから700nm以下に短波長化することを目指している。しかしながら、CD−R用として開発されたシアニン色素は、DVD−Rなどの高密度光記録媒体において、その多くが700nmより短波長のレーザー光を用いて情報を適切に書き込んだり読み取ったりできないことから、現状のままでは各方面で希求されている高密度化の要請に応じられないことになる。
【0005】
有機系光記録媒体の高密度化を妨げる別の原因として、色素の熱分解性、耐熱性の問題がある。すなわち、有機系光記録媒体においては、レーザー光を吸収した色素が融解し、分解し、その際に発生する熱を利用してピットを形成しているところ、公知のシアニン色素の多くは分解点が低く、その結果として耐熱性が小さいことから、読取に際しても、レーザー光へ長時間露出させると、蓄積した熱によって記録面におけるピット周辺とピットが形成されていない部分が変形し易いという問題がある。
【0006】
ところで、DVD−Rなどの高密度光記録媒体を紙に代わるマルチメディア時代の情報記録手段として定着させるためには、高品質の製品を大量且つ廉価に提供する必要がある。そのためには、基板へ光吸収剤を塗布する作業を効率化しつつ、記録特性と安定性に優れた光記録媒体を歩留りよく作製することが肝要となる。そこで欠かせないのが有機溶剤に溶解し易い光吸収剤であり、特に、環境を汚染し難い非ハロゲン溶剤に溶解し易い光吸収剤の開発が希求されている。これまで、多種多様の光吸収剤が提案され、その一部はすでに実用化されているけれども、DVD−Rなどの高密度光記録媒体の作製に用いて、光特性と溶解性を同時に満足し得る光吸収剤は未だ実現していない。
【0007】
【発明が解決しようとする課題】
斯かる状況に鑑み、この発明の課題は、高密度光記録媒体において有用な溶解性、耐熱性に優れた有機色素化合物を提供することにある。
【0008】
【課題を解決するための手段】
上述の課題を解決すべく、本発明者が鋭意研究し、検索したところ、活性メチル基を有するベンゾインドレニウム化合物と、適宜の脱離基を有するベンゾインドレニウム化合物とを反応させる工程を経由して得られる特定のトリメチン系シアニン色素は、700nmより短波長の可視光を実質的に吸収するうえに、その多くが、公知の類縁化合物と比較して、光記録媒体の作製に頻用される有機溶剤、とりわけ、非ハロゲン溶剤における溶解度が有意に大きいことを見出した。また、斯かる反応を経由して得られるシアニン色素の多くは、分解点が272℃を上回り、公知の類縁化合物と比較して耐熱性が著しく高いことを見出した。さらに、斯かるトリメチン系シアニン色素は、光記録媒体において、700nmより短波長のレーザー光を照射すると、記録面に微小なピットを高密度に形成することを確認した。この発明は新規な有機色素化合物の創製と、その産業上有用な特性の発見に基づくものである。
【0009】
【発明の実施の形態】
この発明は、前述の課題を、一般式1で表され、かつ、ジアセトンアルコール(以下、「DAA」と略記する。)における20℃の溶解度が50mg/ml以上であるトリメチン系シアニン色素と、一般式1で表され、かつ、分解点が272℃を上回るトリメチン系シアニン色素(以下においては、両トリメチン系シアニン色素を一括して「シアニン色素」と呼称することがある。)を提供することによって解決するものである。
【0010】
【化7】
【0011】
一般式1において、R1及びR2は、それぞれ、脂肪族炭化水素基を表す。個々の脂肪族炭化水素基としては、通常、炭素数8までの、例えば、メチル基、エチル基、エチニル基、プロピル基、イソプロピル基、1−プロペニル基、2−プロペニル基、2−プロピニル基、イソプロペニル基、ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、2−ブテニル基、1,3−ブタジエニル基、ペンチル基、イソペンチル基、ネオペンチル基、tert−ペンチル基、1−メチルペンチル基、2−メチルペンチル基、2−ペンテニル基、2−ペンテン−4−イニル基、ヘキシル基、イソヘキシル基、5−メチルヘキシル基、ヘプチル基、オクチル基などが挙げられる。斯かる脂肪族炭化水素は、その1又は複数が置換基を1又は複数有していてもよく、個々の置換基としては、例えば、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、ペンチル基、イソペンチル基、ネオペンチル基、tert−ペンチル基などの脂肪族炭化水素基、フェニル基、o−トリル基、m−トリル基、p−トリル基、キシリル基、メシチル基、o−クメニル基、m−クメニル基、p−クメニル基、ビフェニル基などの芳香族炭化水素基、メトキシ基、トリフルオルメトキシ基、エトキシ基、プロポキシ基、イソプロポキシ基、ブトキシ基、tert−ブトキシ基、ペンチルオキシ基、フェノキシ基、ベンジルオキシ基などのエーテル基、メトキシカルボニル基、トリフルオロメトキシカルボニル基、エトキシカルボニル基、プロポキシカルボニル基、アセトキシ基、トリフルオロアセトキシ基、ベンゾイルオキシ基などのエステル基、フルオロ基、クロロ基、ブロモ基、ヨード基などのハロゲン基などが挙げられる。シアニン色素全体の構造にもよるけれども、望ましいのは、R1及びR2として、それぞれ、CmH2m+1及びCnH2n+1(m+n≦9)で表される互いに異なる脂肪族炭化水素を有するシアニン色素であり、斯かるシアニン色素の多くは、DAAをはじめとする非ハロゲン溶剤における溶解度が大きいうえに、分解点が高く、その結果として、耐熱性が大きい特徴がある。
【0012】
一般式1におけるZ1及びZ2は、それぞれ、ベンゾインドレニン環を完成するための縮合ナフタレン環を表し、それらのベンゾインドレニン環は、通常、それぞれ独立に、1H−ベンゾ[e]インドール骨格又は3H−ベンゾ[g]インドール骨格のいずれかを有する。斯かる縮合ナフタレン環における水素原子は、その1又は複数が置換基によって置換されていてもよく、個々の置換基としては、例えば、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、ペンチル基、イソペンチル基、ネオペンチル基、tert−ペンチル基などの脂肪族炭化水素基、メトキシ基、トリフルオロメトキシ基、エトキシ基、プロポキシ基、イソプロポキシ基、ブトキシ基、tert−ブトキシ基、ペンチルオキシ基、フェノキシ基、ベンジルオキシ基などのエーテル基、メトキシカルボニル基、トリフルオロメトキシカルボニル基、エトキシカルボニル基、プロポキシカルボニル基、アセトキシ基、トリフルオロアセトキシ基、ベンゾイルオキシ基などのエステル基、メチルスルホニル基、エチルスルホニル基、プロピルスルホニル基、イソプロピルスルホニル基、ブチルスルホニル基、tert−ブチルスルホニル基、ペンチルスルホニル基などのアルキルスルホニル基、メチルスルファモイル基、ジメチルスルファモイル基、エチルスルファモイル基、ジエチルスルファモイル基、プルピルスルファモイル基、ジプロピルスルファモイル基、ブチルスルファモイル基、ジブチルスルファモイル基、ペンチルスルファモイル基、ジペンチルスルファモイル基などのアルキルスルファモイル基、フルオロ基、クロロ基、ブロモ基、ヨード基などのハロゲン基、さらには、ニトロ基、シアノ基などが挙げられる。なお、一般式1で表されるシアニン色素において、構造上、シス/トランス異性体が存在する場合には、いずれの異性体もこの発明に包含されるものとする。
【0013】
一般式1におけるX-は適宜の対イオンを表す。対イオンについては特に制限がなく、用途にもよるけれども、要は、DAAにおける溶解度及び/又は熱分解性を指標に適宜のものとすればよい。光記録媒体に用いる場合には、金属を含有する反射層を変質させ難い対イオン、とりわけ、互いに異なる2種類以上の元素からなるアニオンとするのが望ましく、個々のアニオンとしては、例えば、燐酸イオン、過塩素酸イオン、過沃素酸イオン、六弗化燐酸イオン、六弗化アンチモン酸イオン、六弗化錫酸イオン、硼弗化水素酸イオン、四弗硼素酸イオンなどの無機酸イオンや、チオシアン酸イオン、ベンゼンスルホン酸イオン、ナフタレンスルホン酸イオン、p−トルエンスルホン酸イオン、アルキルスルホン酸イオン、ベンゼンカルボン酸イオン、アルキルカルボン酸イオン、トリハロアルキルカルボン酸イオン、アルキル硫酸イオン、トリハロアルキル硫酸イオン、ニコチン酸イオンなどの有機酸イオン、さらには、アゾ系、ビスフェニルジチオール系、チオカテコールキレート系、チオビスフェノレートキレート系、ビスジオール−α−ジケトン系の有機金属錯体アニオンなどが挙げられる。爆発性などの安定性、取扱い易さなどを勘案すると、特に望ましいのは、弗素と、燐、アンチモン、ビスマスなどの周期律表における第15族の金属元素からなる、例えば、六弗化燐酸イオン、六弗化アンチモン酸イオンなどのアニオンであって、斯かるアニオンを対イオンとするこの発明のシアニン色素は、取扱い易いうえに、DAAをはじめとする諸種の有機溶剤に溶解し易く、耐熱性も大きい特徴がある。
【0014】
対イオンX-について説明を続けると、用途にもよるけれども、この発明のシアニン色素における好ましい有機金属錯体アニオンは耐光性改善能を有する有機金属錯体のアニオン、とりわけ、アゾ系有機金属錯体アニオンである。この発明でいうアゾ系有機金属錯体アニオンとは、金属原子を中心原子とし、その金属原子へ配位子としてのアゾ化合物が1又は複数結合してなる錯体アニオン一般を意味する。この発明においては、いかなるアゾ系有機金属錯体アニオンであろうと、それが、シアニン色素の光吸収特性を実質的に損なうことなく、シアニン色素の耐光性を実用に供し得る程度に改善し得るものであるかぎり、化学構造や調製方法にかかわりなく用いることができる。複数のアゾ化合物が金属原子へ結合する場合、それらのアゾ化合物は互いに同じものであっても異なるものであってもよい。斯かるアゾ系有機金属錯体アニオンの例としては、例えば、一般式6で表されるものが挙げられる。一般式6で表される一群のアゾ系有機金属錯体は、いずれも、シアニン色素の光吸収特性を実質的に損なうことがないので、この発明を実施するうえで極めて有用である。
【0015】
【化8】
【0016】
一般式6におけるZ3乃至Z6は互いに同じか異なる芳香環又は複素環を表し、それらの芳香環及び複素環は置換基を1又は複数有していてもよい。好ましい芳香環は単環式のベンゼン環であり、複素環としては、窒素原子、酸素原子、硫黄原子、セレン原子及びテルル原子から選ばれるヘテロ原子を1又は複数含んでなる、例えば、イソオキサゾロン骨格、インダゾロン骨格、インダンジオン骨格、オキサゾロン骨格、チオナフテン骨格、バルビツル酸骨格、ヒダントイン骨格、ピラゾロン骨格、ロダニン骨格を有するものが望ましい。
【0017】
斯かる芳香環及び複素環は、例えば、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、ペンチル基、イソペンチル基、ネオペンチル基、tert−ペンチル基、1−メチルペンチル基、2−メチルペンチル基、ヘキシル基、イソヘキシル基、5−メチルヘキシル基などの脂肪族炭化水素基、シクロプロピル基、シクロブチル基、シクロペンチル基、シクロヘキシル基、シクロヘキセニル基などの脂環式炭化水素基、フェニル基、ビフェニリル基、o−トリル基、m−トリル基、p−トリル基、o−クメニル基、m−クメニル基、p−クメニル基、キシリル基、メシチル基、スチリル基、シンナモイル基、ナフチル基などの芳香族炭化水素基、メトキシカルボニル基、エトキシカルボニル基、プロポキシカルボニル基、アセトキシ基、ベンゾイルオキシ基などのエステル基、第一級アミノ基、メチルアミノ基、ジメチルアミノ基、エチルアミノ基、ジエチルアミノ基、プロピルアミノ基、ジプロピルアミノ基、イソプロピルアミノ基、ジイソプロピルアミノ基、ブチルアミノ基、ジブチルアミノ基などの置換又は無置換の脂肪族、脂環式若しくは芳香族アミノ基、メチルスルファモイル基、ジメチルスルファモイル基、エチルスルファモイル基、ジエチルスルファモイル基、プロピルスルファモイル基、ジプロピルスルファモイル基、イソプロピルスルファモイル基、ジイソプロピルスルファモイル基、ブチルスルファモイル基、ジブチルスルファモイル基などのアルキルスルファモイル基、さらには、カルバモイル基、カルボキシ基、シアノ基、ニトロ基、ヒドロキシ基、スルホ基、スルホアミノ基、スルホンアミド基などの置換基を1又は複数有していてもよい。
【0018】
用途にもよるけれども、斯かる置換基における水素原子は、その1又は複数が、例えば、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、ペンチル基、イソペンチル基、tert−ペンチル基、1−メチルペンチル基、2−メチルペンチル基、ヘキシル基、イソヘキシル基、5−メチルヘキシル基などの脂肪族炭化水素基、フェニル基、ビフェニリル基、o−トリル基、m−トリル基、p−トリル基、o−クメニル基、m−クメニル基、p−クメニル基、キシリル基、メシチル基、スチリル基、シンナモイル基、ナフチル基などの芳香族炭化水素基、メトキシ基、エトキシ基、プロポキシ基、イソプロポキシ基、ブトキシ基、イソブトキシ基、sec−ブトキシ基、tert−ブトキシ基、ペンチルオキシ基、フェノキシ基、ベンジルオキシ基などのエーテル基、フルオロ基、クロロ基、ブロモ基、ヨード基などのハロゲン基、さらには、カルボキシ基、ヒドロキシ基、シアノ基、ニトロ基などによって置換されていてもよい。
【0019】
一般式6で表されるアゾ系有機金属錯体アニオンは、上記のごとき、互いに同じか異なるアゾ化合物が配位子として中心原子となる金属原子Mへ1又は複数結合してなるものである。金属原子としては、通常、スカンジウム、イットリウム、チタン、ジルコニウム、ハフニウム、バナジウム、ニオブ、タンタル、クロム、モリブデン、タングステン、マンガン、テクネチウム、レニウム、鉄、ルテニウム、オスミウム、コバルト、ロジウム、イリジウム、ニッケル、パラジウム、白金、銅、銀、金、亜鉛、カドミウム、水銀などの周期律表における第3族乃至第12族の金属元素が採用され、光記録媒体の分野においては、入手し易く、取扱い易いことから、通常、コバルト又はニッケルが用いられる。なお、一般式6におけるA及びA´は、金属原子へ電子対を供与することによって配位結合を形成し得る、例えば、酸素原子、硫黄原子、セレン原子、テルル原子などの周期律表における第16族の元素から選ばれる互いに同じか異なるヘテロ原子を表し、それらのヘテロ原子はZ3、Z6へ結合した原子団を構成するものであってもよい。
【0020】
斯かるアゾ系有機金属錯体アニオンの例としては、例えば、化学式1乃至化学式12で表されるものが挙げられる。これらは、いずれも、この発明によるシアニン色素の対イオンとして用いると、可視領域、詳細には、波長350乃至850nmにおいてシアニン色素の耐光性を改善する性質が顕著であるうえに、シアニン色素の望ましい光吸収特性や有機溶剤における溶解性を実質的に損なうことがないので、この発明を実施するうえで極めて有用である。なお、化学式1乃至化学式12で表されるアゾ系有機金属錯体アニオンは、いずれも、アニリン又はアニリン誘導体をジアゾ結合反応へ供し、得られたアゾ化合物を適宜の金属塩及び塩基の存在下で反応させる公知の方法に準じて所望量を得ることができる。また、アゾ系有機金属錯体アニオンを対イオンとするシアニン色素を調製するには、例えば、適宜溶剤中、アゾ系有機金属錯体アニオン以外のアニオンを対イオンとするこの発明のシアニン色素と、上記のごときアゾ系有機金属錯体アニオンの塩とを、攪拌しながら、0.1乃至10時間に亙って周囲温度を上回る温度で加熱する。
【0021】
【化9】
【0022】
【化10】
【0023】
【化11】
【0024】
【化12】
【0025】
【化13】
【0026】
【化14】
【0027】
【化15】
【0028】
【化16】
【0029】
【化17】
【0030】
【化18】
【0031】
【化19】
【0032】
【化20】
【0033】
この発明によるシアニン色素の具体例としては、例えば、化学式13乃至化72で表されるものが挙げられる。これらは、いずれも、溶液状態においては波長580乃至600nmに吸収極大を有し、また、薄膜状態においては、吸収極大の長波長側で700nmより短波長の可視光を実質的に吸収する。したがって、これらのシアニン色素は、書込光として700nmより短波長の可視光を用いる光記録媒体、とりわけ、波長630乃至680nm付近のレーザー光を用いるDVD−Rなどの高密度光記録媒体における光吸収剤として極めて有用である。この発明によるシアニン色素のうちでも、有機金属錯体アニオン、とりわけ、アゾ系有機金属錯体アニオンを対イオンとするものは、他のシアニン色素に対して著明な耐光性改善能を発揮することから、DVD−Rにおける光吸収剤としてのみならず、主として、シアニン色素により記録層を構成し、かつ、書込光として、波長が700nmを越え、800nmを越えない可視光、通常、波長775乃至795nm付近のレーザー光を用いる、例えば、CD−Rにおける耐光性改善剤としても有用である。さらに、有機金属錯体アニオンを対イオンとするこの発明のシアニン色素は、DVD−Rなどの高密度光記録媒体において、有機金属錯体アニオン以外のアニオン、とりわけ、過塩素酸イオンや弗素と、周期律表における第15族の金属元素からなるアニオンを対イオンとするこの発明のシアニン色素と組合せて用いると、光記録媒体の光吸収特性を実質的に変えることなく耐光性を著明に改善することができる。その際、両者の割合は、重量比で、0.1:1乃至1:0.1、望ましくは、0.3:1乃至1:0.3の範囲で加減する。
【0034】
【化21】
【0035】
【化22】
【0036】
【化23】
【0037】
【化24】
【0038】
【化25】
【0039】
【化26】
【0040】
【化27】
【0041】
【化28】
【0042】
【化29】
【0043】
【化30】
【0044】
【化31】
【0045】
【化32】
【0046】
【化33】
【0047】
【化34】
【0048】
【化35】
【0049】
【化36】
【0050】
【化37】
【0051】
【化38】
【0052】
【化39】
【0053】
【化40】
【0054】
【化41】
【0055】
【化42】
【0056】
【化43】
【0057】
【化44】
【0058】
【化45】
【0059】
【化46】
【0060】
【化47】
【0061】
【化48】
【0062】
【化49】
【0063】
【化50】
【0064】
【化51】
【0065】
【化52】
【0066】
【化53】
【0067】
【化54】
【0068】
【化55】
【0069】
【化56】
【0070】
【化57】
【0071】
【化58】
【0072】
【化59】
【0073】
【化60】
【0074】
【化61】
【0075】
【化62】
【0076】
【化63】
【0077】
【化64】
【0078】
【化65】
【0079】
【化66】
【0080】
【化67】
【0081】
【化68】
【0082】
【化69】
【0083】
【化70】
【0084】
【化71】
【0085】
【化72】
【0086】
【化73】
【0087】
【化74】
【0088】
【化75】
【0089】
【化76】
【0090】
【化77】
【0091】
【化78】
【0092】
【化79】
【0093】
【化80】
【0094】
この発明のシアニン色素は種々の方法で製造することができる。経済性を重視するのであれば、活性メチル基を有するベンゾインドレニウム化合物に、適宜の脱離基を有するベンゾインドレニウム化合物を反応させる工程を経由する方法が好適であり、この方法によるときには、例えば、一般式1に対応するR1を有する一般式2で表される化合物と、一般式1に対応するR2を有する一般式3で表される化合物とを反応させるか、あるいは、一般式1に対応するR1を有する一般式4で表される化合物と、一般式1に対応するR2を有する一般式5で表される化合物とを反応させることによって、この発明のシアニン色素が好収量で得られる。
【0095】
【化81】
【0096】
【化82】
【0097】
【化83】
【0098】
【化84】
【0099】
具体的には、反応容器に一般式2及び一般式3で表される化合物か、あるいは、一般式4及び一般式5で表される化合物をそれぞれ適量とり(通常等モル前後)、必要に応じて、適宜溶剤に溶解し、例えば、水酸化ナトリウム、水酸化カリウム、炭酸ナトリウム、炭酸カリウム、炭酸水素ナトリウム、アンモニア、トリエチルアミン、ピペリジン、ピリジン、ピロリジン、モルホリン、アニリン、N,N−ジメチルアニリン、N,N−ジエチルアニリン、N−メチルピロリドン、1,8−ジアザビシクロ[5.4.0]−7−ウンデセンなどの塩基性化合物、塩酸、硫酸、硝酸、メタンスルホン酸、p−トルエンスルホン酸、酢酸、無水酢酸、無水プロピオン酸、トリフルオロ酢酸、トリフルオロスルホン酸などの酸性化合物、塩化アルミニウム、塩化亜鉛、四塩化錫、四塩化チタンなどのルイス酸性化合物を適量加えた後、加熱還流などにより加熱・攪拌しながら周囲温度か周囲温度を上回る温度で反応させる。
【0100】
溶剤としては、例えば、ペンタン、ヘキサン、シクロヘキサン、オクタン、ベンゼン、トルエン、キシレンなどの炭化水素類、四塩化炭素、クロロホルム、1,2−ジクロロエタン、1,2−ジブロモエタン、トリクロロエチレン、テトラクロロエチレン、クロロベンゼン、ブロモベンゼン、α−ジクロロベンゼンなどのハロゲン化物、メタノール、エタノール、1−プロパノール、2−プロパノール、1−ブタノール、2−ブタノール、イソブチルアルコール、イソペンチルアルコール、シクロヘキサノール、エチレングリコール、プロピレングリコール、2−メトキシエタノール、2−エトキシエタノール、フェノール、ベンジルアルコール、クレゾール、ジエチレングリコール、トリエチレングリコール、グリセリンなどのアルコール類及びフェノール類、ジエチルエーテル、ジイソプロピルエーテル、テトラヒドロフラン、テトラヒドロピラン、1,4−ジオキサン、アニソール、1,2−ジメトキシエタン、ジエチレングリコール、ジメチルエーテル、ジシクロヘキシル−18−クラウン−6、メチルカルビトール、エチルカルビトールなどのエーテル類、フルフラール、アセトン、エチルメチルケトン、シクロヘキサノンなどのケトン類、酢酸、無水酢酸、トリクロロ酢酸、トリフルオロ酢酸、無水プロピオン酸、酢酸エチル、炭酸ブチル、炭酸エチレン、炭酸プロピレン、ホルムアミド、N−メチルホルムアミド、N,N−ジメチルホルムアミド、N−メチルアセトアミド、N,N−ジメチルアセトアミド、ヘキサメチル燐酸トリアミド、燐酸トリメチルなどの酸及び酸誘導体、アセトニトリル、プロピオニトリル、スクシノニトリル、ベンゾニトリルなどのニトリル類、ニトロメタン、ニトロベンゼンなどのニトロ化合物、ジメチルスルホキシドなどの含硫化合物、水などが挙げられ、必要に応じて、これらは適宜組合せて用いられる。
【0101】
溶剤を用いる場合、一般に、溶剤の量が多くなると反応の効率が低下し、反対に、少なくなると、均一に加熱・攪拌するのが困難になったり、副反応が起こり易くなる。したがって、溶剤の量を重量比で原料化合物全体の100倍まで、通常、5乃至50倍の範囲にするのが望ましい。原料化合物の種類や反応条件にもよるけれども、反応は10時間以内、通常、0.5乃至5時間で完結する。反応の進行は、例えば、薄層クロマトグラフィー、ガスクロマトグラフィー、高速液体クロマトグラフィーなどの汎用の方法によってモニターすることができる。反応が完結したら、反応混合物のまま、必要に応じて、通常の対イオン交換反応へ供することによって、所望の対イオンを有するこの発明のシアニン色素を得る。化学式13乃至化学式72で表されるシアニン色素は、いずれも、斯かる方法によって所望量を得ることができる。ちなみに、一般式2乃至一般式5で表されるベンゾインドレニウム化合物は、例えば、同じ特許出願人による特開平10−316655号公報に記載された方法により調製することができる。その一般式2乃至一般式5において、X1 -及びX2 -は一般式1におけるX-と同じか異なる対イオンであり、また、Lは適宜の脱離基であって、通常、アニリノ基、p−トルイジノ基、p−メトキシアニリノ基、p−エトキシカルボニルアニリノ基、N−アセチルアニリノ基などのアニリン又はアニリン誘導体の一価基が採用される。
【0102】
斯くして得られるこの発明のシアニン色素は、用途によっては反応混合物のまま用いられることもあるが、通常、使用に先立って、例えば、溶解、抽出、分液、傾斜、濾過、濃縮、薄層クロマトグラフィー、カラムクロマトグラフィー、ガスクロマトグラフィー、高速液体クロマトグラフィー、蒸留、結晶化、昇華などの類縁化合物を精製するための通常一般の方法により精製され、必要に応じて、これらの精製方法は組合せて適用される。なお、この発明のシアニン色素をDVD−Rなどの高密度光記録媒体における光吸収剤として用いる場合には、使用に先立って、蒸留、結晶化及び/又は昇華などの方法によって精製しておくのが望ましい。
【0103】
次に、この発明のシアニン色素の用途について説明すると、この発明のシアニン色素は、DAAにおける20℃の溶解度が50mg/ml以上と、非ハロゲン溶剤における溶解度が大きいという性質か、あるいは、分解点が272℃を上回り、耐熱性が著しく高いという性質により特徴付けられる。しかも、この発明のシアニン色素は、公知の類縁化合物と同様に、薄膜状態において700nmより短波長の可視光、とりわけ、波長630乃至680nm付近の可視光を実質的に吸収する。したがって、この発明のシアニン色素は、斯かる性質を具備する有機色素化合物が必要とされる、例えば、光記録媒体、光化学的重合、太陽電池及び染色をはじめとする諸分野において多種多様の用途を有するものであり、これらの用途のうち、書込光として700nmより短波長の可視光、とりわけ、波長630乃至680nm付近のレーザー光を用いるDVD−Rなどの高密度光記録媒体における光吸収剤として極めて有用である。
【0104】
そこで、この発明のシアニン色素の光記録媒体における用途について説明すると、この発明のシアニン色素は、光記録媒体に用いるに際して特殊な処理や操作を必要としないことから、この発明による光記録媒体は従来公知の光記録媒体に準じて作製することができる。例えば、光吸収剤として、この発明によるシアニン色素へ、必要に応じて、記録層における反射率や光吸収率を調節すべく、可視光を実質的に吸収する他の有機色素化合物の1又は複数を含有せしめたり、さらには、汎用の耐光性改善剤、バインダー、分散剤、難燃剤、滑剤、帯電防止剤、界面活性剤、熱干渉防止剤、可塑剤などを1又は複数添加したうえで有機溶剤に溶解し、溶液を噴霧法、浸漬法、ローラー塗布法、回転塗布法などにより基板の片面へ均一に塗布し、乾燥させて記録層となる光吸収剤による薄膜を形成した後、必要に応じて、反射率が45%以上、望ましくは、55%以上になるように真空蒸着法、化学蒸着法、スパッタリング法、イオンプレーティング法などにより金、銀、銅、白金、アルミニウム、コバルト、錫、ニッケル、鉄、クロムなどの金属か、あるいは、汎用の有機系反射層用材による記録層に密着する反射層を形成したり、傷、埃、汚れなどから記録層を保護する目的で、難燃剤、安定剤、帯電防止剤などを含有せしめた紫外線硬化樹脂や熱硬化樹脂などを回転塗布し、光照射するか加熱して硬化させることによって反射層に密着する保護層を形成する。その後、必要に応じて、上述のようにして記録層、反射層及び保護層を形成した一対の基板を、例えば、接着剤、粘着シートなどにより保護層同士を対向させて貼合せるか、あるいは、保護層に対して基板におけると同様の材料、形状の保護板を貼り付ける。
【0105】
この発明によるシアニン色素と組合せて用いる他の有機色素化合物としては、それが可視光を実質的に吸収し、かつ、光記録媒体の光反射率や光吸収率を調節し得るものであるかぎり、特に制限がない。斯かる有機色素化合物としては、置換基を1又は複数有することあるモノメチン鎖又はジメチン鎖、トリメチン鎖、テトラメチン鎖、ペンタメチン鎖、ヘキサメチン鎖、ヘプタメチン鎖などのポリメチン鎖の両端に置換基を1又は複数有することある、互いに同じか異なるイミダゾリン環、イミダゾール環、ベンゾイミダゾール環、α−ナフトイミダゾール環、β−ナフトイミダゾール環、インドール環、イソインドール環、インドレニン環、イソインドレニン環、ベンゾインドレニン環、ピリジノインドレニン環、オキサゾリン環、オキサゾール環、イソオキサゾール環、ベンゾオキサゾール環、ピリジノオキサゾール環、α−ナフトオキサゾール環、β−ナフトオキサゾール環、セレナゾリン環、セレナゾール環、ベンゾセレナゾール環、α−ナフトセレナゾール環、β−ナフトセレナゾール環、チアゾリン環、チアゾール環、イソチアゾール環、ベンゾチアゾール環、α−ナフトチアゾール環、β−ナフトチアゾール環、テルラゾリン環、テルラゾール環、ベンゾテルラゾール環、α−ナフトテルラゾール環、β−ナフトテルラゾール環、さらには、アクリジン環、アントラセン環、イソキノリン環、イソピロール環、イミダノキサリン環、インダンジオン環、インダゾール環、インダリン環、オキサジアゾール環、カルバゾール環、キサンテン環、キナゾリン環、キノキサリン環、キノリン環、クロマン環、シクロヘキサンジオン環、シクロペンタンジオン環、シンノリン環、チオジアゾール環、チオオキサゾリドン環、チオフェン環、チオナフテン環、チオバルビツール環、チオヒダントイン環、テトラゾール環、トリアジン環、ナフタレン環、ナフチリジン環、ピペラジン環、ピラジン環、ピラゾール環、ピラゾリン環、ピラゾリジン環、ピラゾロン環、ピラン環、ピリジン環、ピリダジン環、ピリミジン環、ピリリウム環、ピロリジン環、ピロリン環、ピロール環、フェナジン環、フェナントリジン環、フェナントレン環、フェナントロリン環、フタラジン環、プテリジン環、フラザン環、フラン環、プリン環、ベンゼン環、ベンゾオキサジン環、ベンゾピラン環、モルホリン環、ロダニン環などの環状核が結合してなるシアニン色素に加えて、アクリジン系、アザアヌレン系、アゾ系、アントラキノン系、インジゴ系、インダンスレン系、オキサジン系、キサンテン系、ジオキサジン系、チアジン系、チオインジゴ系、テトラピラポルフィラジン系、トリフェニルメタン系、トリフェノチアジン系、ナフトキノン系、フタロシアニン系、ベンゾキノン系、ベンゾピラン系、ベンゾフラノン系、ポルフィリン系、ローダミン系の色素が挙げられ、必要に応じて、これらは適宜組合せて用いられる。
【0106】
耐光性改善剤としては、例えば、ニトロソジフェニルアミン、ニトロソアニリン、ニトロソフェノール、ニトロソナフトールなどのニトロソ化合物や、テトラシアノキノジメタン化合物、ジインモニウム化合物、ビス[2´−クロロ−3−メトキシ−4−(2−メトキシエトキシ)ジチオベンジル]ニッケル(商品名『NKX−1199』、株式会社林原生物化学研究所製造)、ホルマザン金属錯体などの金属錯体が用いられ、必要に応じて、これらは適宜組合せて用いられる。好ましい耐光性改善剤はホルマザン金属錯体を含んでなるものであり、特に望ましいのは、同じ特許出願人による特願平11−163036号明細書(発明の名称「ホルマザン金属錯体」)に開示された、ホルマザン骨格における5位の位置にピリジン環を有し、かつ、3位の位置にピリジン環若しくはフラン環が結合してなるホルマザン化合物又はその互変異性体の1又は複数を配位子とする、例えば、ニッケル、亜鉛、コバルト、鉄、銅、パラジウムなどとの金属錯体を含んでなるものである。斯かる耐光性改善剤と併用するときには、有機溶剤におけるこの発明のシアニン色素の溶解性を低下させたり、望ましい光特性を実質的に損なうことなく、読取光や環境光などへの露光によるシアニン色素の劣化、退色、変色、変性などの望ましくない変化を効果的に抑制することができる。特に、ホルマザン金属錯体は、DVD−Rなどの高密度光記録媒体において、既述した有機金属錯体アニオンを対イオンとするこの発明のシアニン色素と、有機金属錯体アニオン以外のアニオンを対イオンとするこの発明のシアニン色素との混合系と組合せて用いることにより、この発明によるシアニン色素の耐光性を効果的に改善するのみならず、光記録媒体の感度、変調特性、解像度及びジッター特性をはじめとする電気特性を著明に改善する。いずれにしても、耐光性改善剤の配合比は、通常、シアニン色素1重量部に対して、耐光性改善剤を0.01乃至1重量部、望ましくは、0.03乃至0.3重量部の範囲で加減しながら含有せしめる。用途によるけれども、有機金属錯体アニオン、とりわけ、アゾ系有機金属錯体アニオンを対イオンとするこの発明のシアニン色素は、自体、耐光性が大きいので、使用に際して、斯かる耐光性改善剤が不用であるか、併用する耐光性改善剤の量を少なくすることができる。
【0107】
この発明のシアニン色素は、諸種の有機溶剤において実用上支障のない溶解性を発揮するので、シアニン色素を基板に塗布するための有機溶剤にも制限がない。したがって、この発明による光記録媒体の作製にあっては、例えば、光記録媒体の作製に頻用されるTFP若しくはDAAか、あるいは、ヘキサン、シクロヘキサン、メチルシクロヘキサン、ジメチルシクロヘキサン、エチルシクロヘキサン、イソプロピルシクロヘキサン、tert−ブチルシクロヘキサン、オクタン、シクロオクタン、ベンゼン、トルエン、キシレンなどの炭化水素類、四塩化炭素、クロロホルム、1,2−ジクロロエタン、1,2−ジブロモエタン、トリクロロエチレン、テトラクロロエチレン、クロロベンゼン、ブロモベンゼン、α−ジクロロベンゼンなどのハロゲン化物、メタノール、エタノール、2,2,2−トリフルオロエタノール、2−メトキシエタノール(メチルセロソルブ)、2−エトキシエタノール(エチルセロソルブ)、2−イソプロポキシ−1−エタノール、1−プロパノール、2−プロパノール、1−メトキシ−2−プロパノール、1−エトキシ−2−プロパノール、1−ブタノール、1−メトキシ−2−ブタノール、3−メトキシ−1−ブタノール、4−メトキシ−1−ブタノール、イソブチルアルコール、ペンチルアルコール、イソペンチルアルコール、シクロヘキサノール、ジエチレングリコール、トリエチレングリコール、プロピレングリコール、グリセリン、フェノール、ベンジルアルコール、クレゾールなどのアルコール類及びフェノール類、ジエチルエーテル、ジイソプロピルエーテル、テトラヒドロフラン、テトラヒドロピラン、1,4−ジオキサン、アニソール、1,2−ジメトキシエタン、ジエチレングリコールジメチルエーテル、ジシクロヘキシル−18−クラウン−6、メチルカルビトール、エチルカルビトールなどのエーテル類、フルフラール、アセトン、エチルメチルケトン、シクロヘキサノンなどのケトン類、酢酸エチル、酢酸ブチル、炭酸エチレン、炭酸プロピレン、燐酸トリメチルなどのエステル類、ホルムアミド、N−メチルホルムアミド、N,N−ジメチルホルムアミド、ヘキサメチル燐酸トリアミドなどのアミド類、アセトニトリル、プロピオニトリル、スクシノニトリルなどのニトリル類、ニトロメタン、ニトロベンゼンなどのニトロ化合物、エチレンジアミン、ピリジン、ピペリジン、モルホリン、N−メチルピロリドンなどのアミン類、ジメチルスルホキシド、スルホランなどの含硫化合物をはじめとするDAAやTFP以外の汎用の有機溶剤から選択し、必要に応じて、これらは適宜組合せて用いられる。
【0108】
とりわけ、この発明のシアニン色素は、例えば、TFP、DAAなどの蒸発し易い有機溶剤における溶解度が大きいので、斯かる溶剤にこの発明のシアニン色素を溶解し、基板へ塗布しても、乾燥後、色素の結晶が出現したり、記録層の膜厚や表面が不均一になることがない。ことに、この発明のシアニン色素をDAAなどのアルコール類に溶解して基板へ塗布するときには、溶剤によって基板を傷めたり、環境を汚染し難くなる。
【0109】
基板も汎用のものでよく、通常、圧出成形法、射出成形法、圧出射出成形法、フォトポリマー法(2P法)、熱硬化一体成形法、光硬化一体成形法などにより適宜の材料を最終用途に応じて、例えば、直径12cm、厚さ0.1乃至1.2mmのディスク状に形成し、これを単板で用いるか、あるいは、粘着シート、接着剤などにより適宜貼合せて用いる。基板の材料としては、実質的に透明で、波長400乃至800nmの範囲で80%以上、望ましくは、90%以上の光透過率を有するものであれば、原理上、材質は問わない。個々の材料としては、例えば、ガラス、セラミックのほかに、ポリアクリレート、ポリメチルメタクリレート、ポリカーボネート、ポリスチレン(スチレン共重合物)、ポリメチルペンテン、ポリエステル、ポリオレフィン、ポリイミド、ポリエーテルイミド、ポリスルホン、ポリエーテルスルホン、ポリアリレート、ポリカーボネート・ポリスチレン−アロイ、ポリエステルカーボネート、ポリフタレートカーボネート、ポリカーボネートアクリレート、非晶性ポリオレフィン、メタクリレート共重合物、ジアリルカーボネートジエチレングリコール、エポキシ樹脂、フェノール樹脂などのプラスチックが挙げられ、通常、ポリカーボネートが頻用される。プラスチック製基板の場合、同期信号並びにトラック及びセクターの番地を表示する凹部は、通常、成形の際にトラック内周に転写される。その凹部は、形状については特に制限はないものの、平均幅が0.3乃至0.8μmの範囲になるように、また、深さが70乃至200nmの範囲になるようにするのが望ましい。
【0110】
この発明によるシアニン色素は、粘度を勘案しながら、前述のごとき有機溶剤における濃度0.5乃至5%(w/w)の溶液にして、乾燥後の記録層の厚みが10乃至1,000nm、望ましくは、50乃至300nmになるように基板へ均一に塗布される。なお、溶液の塗布に先立って、基板の保護や接着性の改善などを目的に、必要に応じて、基板へ下引層を設けてもよく、下引層の材料としては、例えば、イオノマー樹脂、ポリアミド樹脂、ビニル系樹脂、天然樹脂、シリコン、液状ゴムなどの高分子物質が挙げられる。また、バインダーを用いる場合には、ニトロセルロース、燐酸セルロース、硫酸セルロース、酢酸セルロース、プロピオン酸セルロース、酪酸セルロース、パルミチン酸セルロース、酢酸・プロピオン酸セルロースなどのセルロースエステル類、メチルセルロース、エチルセルロース、プロピルセルロース、ブチルセルロースなどのセルロースエーテル類、ポリスチレン、ポリ塩化ビニル、ポリ酢酸ビニル、ポリビニルアセタール、ポリビニルブチラール、ポリビニルホルマール、ポリビニルアルコール、ポリビニルピロリドンなどのビニル樹脂、スチレン−ブタジエンコポリマー、スチレン−アクリロニトリルコポリマー、スチレン−ブタジエン−アクリロニトリルコポリマー、塩化ビニル−酢酸ビニルコポリマー、無水マレイン酸共重合体などの共重合樹脂類、ポリメチルメタクリレート、ポリメチルアクリレート、ポリアクリレート、ポリメタクリレート、ポリアクリルアミド、ポリアクリロニトリルなどのアクリル樹脂類、ポリエチレンテレフタレートなどのポリエステル類、ポリエチレン、塩素化ポリエチレン、ポリプロピレンなどのポリオレフィン類などのポリマーが単独又は組合せて、重量比で、シアニン色素の0.01乃至10倍用いられる。
【0111】
この発明による光記録媒体の使用方法について説明すると、この発明によるDVD−Rなどの高密度光記録媒体は、例えば、AlGaInP系、GaAsP系、GaAlAs系、InGaP系、InGaAsP系若しくはInGaAlP系の半導体レーザー、あるいは、第二高調波発生素子(SHG素子)と組合せたYAGレーザーなどによる700nmより短波長の可視光、とりわけ、波長630乃至680nm付近のレーザー光を用いて諸種の情報を高密度に書き込むことができる。読取には、書込におけると同様の波長か、あるいは、それをやや上回るか下回る波長のレーザー光を用いる。書込、読取の際のレーザー出力について言えば、この発明のシアニン色素と組合せて用いる耐光性改善剤の種類と配合量にもよるけれども、この発明による光記録媒体においては、情報を書き込むときのレーザー出力は、ピットが形成されるエネルギーの閾値を越えて比較的強めに、一方、書き込まれた情報を読み取るときの出力は、その閾値を下回って比較的弱めに設定するのが望ましい。一般的には、5mWを上回る出力、通常、10乃至50mWの範囲で書き込み、読取は5mW以下の出力、通常、0.1乃至5mWの範囲で加減する。記録された情報は、光ピックアップにより、光記録媒体の記録面におけるピットとピットが形成されていない部分の反射光量又は透過光量の変化を検出することによって読み取る。
【0112】
斯くして、この発明による光記録媒体においては、700nmより短波長の可視光、とりわけ、波長630乃至680nm付近のレーザー光による光ピックアップを用いることによって、現行の標準的なCD−Rに採用されている1.6μmを下回るトラックピッチで、0.834μm/ピットを下回るピット長の安定にして微小なピットを高密度に形成することができる。したがって、例えば、直径12cmのディスク状基板を用いる場合には、公知のシアニン色素では容易に達成できなかった、記録容量が片面で0.682GBを遥かに越え、画像情報及び音声情報を約2時間分記録できる極めて高密度の光記録媒体を実現できることとなる。
【0113】
この発明による光記録媒体は、文字情報、画像情報、音声情報及びその他のデジタル情報を高密度に記録することができるので、文書、データ、コンピュータープログラムなどを記録・管理するための民生用及び業務用記録媒体として極めて有用である。この発明による光記録媒体を用い得る個々の業種と情報の形態としては、例えば、建設・土木における建築・土木図面、地図、道路・河川台帳、アパチュアカード、建築物見取図、災害防止資料、配線図、配置図、新聞・雑誌情報、地域情報、工事報告書など、製造における設計図、成分表、処方、商品仕様書、商品価格表、パーツリスト、メンテナンス情報、事故・故障事例集、苦情処理事例集、製造工程表、技術資料、デッサン、ディテール、自社作品集、技術報告書、検査報告書など、販売における顧客情報、取引先情報、会社情報、契約書、新聞・雑誌情報、営業報告書、企業信用調査、在庫一覧など、金融における会社情報、株価記録、統計資料、新聞・雑誌情報、契約書、顧客リスト、各種申請・届出・免許・許認可書類、業務報告書など、不動産・運輸における物件情報、建築物見取図、地図、地域情報、新聞・雑誌情報、リース契約書、会社情報、在庫一覧、交通情報、取引先情報など、電力・ガスにおける配線・配管図、災害防止資料、作業基準表、調査資料、技術報告書など、医療におけるカルテ、病歴・症例ファイル、医療関係図など、塾・予備校におけるテキスト、問題集、教育用資料、統計資料など、大学・研究所における学術論文、学会記録、研究月報、研究データ、文献及び文献のインデックスなど、情報における調査データ、論文、特許公報、天気図、データ解析記録、顧客ファイルなど、法律における判例など、各種団体における会員名簿、過去帳、作品記録、対戦記録、大会記録など、観光における観光情報、交通情報など、マスコミ・出版における自社出版物のインデックス、新聞・雑誌情報、人物ファイル、スポーツ記録、テロップファイル、放送台本など、官庁関係における地図、道路・河川台帳、指紋ファイル、住民票、各種申請・届出・免許・許認可書類、統計資料、公共資料などが挙げられる。とりわけ、1回のみ書き込めるこの発明の光記録媒体は、記録情報が改竄されたり消去されてはならない、例えば、カルテや公文書などの記録保存に加えて、美術館、図書館、博物館、放送局などの電子ライブラリーとして極めて有用である。
【0114】
この発明による光記録媒体のやや特殊な用途としては、コンパクトディスク、デジタルビデオディスク、レーザーディスク、MD(光磁気ディスクを用いる情報記録システム)、CDV(コンパクトディスクを利用するレーザーディスク)、DAT(磁気テープを利用する情報記録システム)、CD−ROM(コンパクトディスクを利用する読取専用メモリ)、DVD−ROM(デジタルビデオディスクを利用する読取専用メモリ)、DVD−RAM(デジタルビデオディスクを利用する書込可能な読取メモリ)、デジタル写真、映画、ビデオソフト、オーディオソフト、コンピューターグラフィック、出版物、放送番組、コマーシャルメッセージ、ゲームソフトなどの編集、校正、さらには、大型コンピューター、カーナビゲーション用の外部プログラム記録手段としての用途が挙げられる。
【0115】
以上においては、この発明によるシアニン色素の光記録媒体の分野における用途として、書込光として700nmより短波長の可視光を用いる有機系光記録媒体への適用例を中心に説明してきた。しかしながら、光記録媒体の分野において、この発明によるシアニン色素の用途はDVD−Rなどの高密度光記録媒体だけではなく、CD−Rなどの現行の光記録媒体において、例えば、波長775乃至795nmのレーザー光を実質的に吸収する他の有機色素化合物の1又は複数と組合せることによって、その光記録媒体における光吸収率や光反射率を調節したり補正するための材料としても有利に用いることができる。また、書込光として700nmより短波長の可視光を用いる有機系光記録媒体へ適用する場合であっても、この発明のシアニン色素をして基板上に直接ピットを形成せしめるのではなく、より長波長の、例えば、775乃至795nmのレーザー光を実質的に吸収する他の有機色素化合物の1又は複数と組合せることによって、波長630乃至680nm付近のレーザー光による励起エネルギーをこの発明のシアニン色素を介してこれらの有機色素化合物へ移動させ、もって、後者の化合物を分解することによって、間接的にピットを形成してもよい。さらに言えば、この発明でいう光記録媒体とは、この発明のシアニン色素が700nmより短波長の可視光を実質的に吸収するという性質を利用する記録媒体全般を意味するものであって、有機系のもの以外に、例えば、有機色素化合物の光吸収に伴う発熱による発色剤と顕色剤との化学反応を利用する感熱発色方式や、基板の表面に設けられた周期的な凹凸パターンが斯かる発熱によって平坦化される現象を利用する、いわゆる、「蛾の目方式」のものであってもよい。
【0116】
既述のとおり、この発明のシアニン色素は、主としてシアニン色素により記録層を構成し、書込光として、波長が700nmを越え、800nmを越えない可視光、通常、波長775乃至795nm付近のレーザー光を用いる、例えば、CD−Rにおける耐光性改善剤としても有用である。斯かる光記録媒体において、この発明によるシアニン色素と組合せて用いるシアニン色素としては、ペンタメチン鎖の両端に互いに同じか異なる1H−ベンゾ[e]インドール骨格又は3H−ベンゾ[g]インドール骨格のいずれかを有する、例えば、同じ特許出願人らによる特開平3−203692号公報、特開平3−203693号公報、特開平5−238149号公報、特開平6−199045号公報などに記載されたペンタメチン系シアニン色素が挙げられる。これらのシアニン色素に対するこの発明のシアニン色素の添加量としては、添加量が少ないと、所期の耐光性改善が得られず、反対に、多いと、光記録媒体の電気特性が悪化することから、通常、他のシアニン色素の0.5乃至50%(w/w)、望ましくは、3乃至30%(w/w)の範囲で加減する。この場合、耐光性改善剤として、この発明によるシアニン色素とともに、必要に応じて、他の耐光性改善剤を1又は複数組合せて用いてもよく、とりわけ、ホルマザン金属錯体は、薄膜状態において、この発明によるシアニン色素や他のシアニン色素と良好なアモルファス性を発揮し、耐熱性も大きいので、特に好ましい。
【0117】
この発明によるシアニン色素を、例えば、CD−Rなどの書込光として700nmより長波長の可視光を用いる耐光性改善剤として用いる場合、必ずしも、この発明のシアニン色素を記録層へ含有せしめる必要はない。例えば、この発明によるシアニン色素を、既述のバインダーの1又は複数とともに下引層へ含有せしめるか、あるいは、必要に応じて、既述のバインダーの1又は複数とともに適宜有機溶剤に溶解し、溶液を基板の外面、すなわち、書込光を照射する面の全体又は一部へ塗布することによって、この発明のシアニン色素による保護膜を形成する。斯かる下引層や保護膜は、基板を透過した自然光や人工光などの環境光から記録層を保護し、光記録媒体の耐久性、とりわけ、ジッター特性、プロックエラー率をはじめとする電気特性を大幅に改善することができる。基板の外面へ溶液を塗布する場合、溶液を印刷材料、塗料として用いることによって、基板の外面へ、例えば、文字、模様、絵、数字、記号などを印刷したり記入することができる。
【0118】
さらに、この発明のシアニン色素は700nmより短波長の可視光を実質的に吸収することから、斯かるシアニン色素を含んでなるこの発明の光吸収剤は、光記録媒体における用途に加えて、例えば、重合性化合物を可視光へ露光させることによって重合させるための材料、太陽電池を増感させるための材料、色素レーザーにおけるレーザー作用物質、さらには、諸種の衣料を染色するための材料としても有用である。また、この発明の光吸収剤を、必要に応じて、紫外領域、可視領域及び/又は赤外領域の光を吸収する他の光吸収剤の1又は複数とともに、衣料一般や、衣料以外の、例えば、ドレープ、レース、ケースメント、プリント、ベネシャンブラインド、ロールスクリーン、シャッター、のれん、毛布、布団、布団側地、布団カバー、布団綿、シーツ、座布団、枕、枕カバー、クッション、マット、カーペット、寝袋、テント、自動車の内装材、ウインドガラス、窓ガラスなどの建寝装用品、紙おむつ、おむつカバー、眼鏡、モノクル、ローネットなどの保健用品、靴の中敷、靴の内張地、鞄地、風呂敷、傘地、パラソル、ぬいぐるみ及び照明装置や、例えば、ブラウン管ディスプレー、液晶ディスプレー、電界発光ディスプレー、プラズマディスプレーなどを用いるテレビジョン受像機やパーソナルコンピューターなどの情報表示装置用のフィルター類、パネル類及びスクリーン類、サングラス、サンルーフ、サンバイザー、PETボトル、貯蔵庫、ビニールハウス、寒冷紗、光ファイバー、プリペイドカード、電子レンジ、オーブンなどの覗き窓、さらには、これらの物品を包装、充填又は収納するための包装用材、充填用材、容器などに用いるときには、生物や物品における自然光や人工光などの環境光による障害や不都合を防止したり低減することができるだけではなく、物品の色彩、色調、風合などを整えたり、物品から反射したり透過する光を所望の色バランスに整えることができる実益がある。
【0119】
この発明の実施の形態につき、以下、実施例に基づいて説明する。
【0120】
【実施例1】
〈シアニン色素〉
反応容器に1−ブチル−3,3−ジメチル−2−[(フェニルアミノ)エテニル]ベンゾインドレニウム=トシレート15g、1−エチル−2,3,3−トリメチルベンゾインドレニウム=トシレート10.4g及びアセトニトリル30mlをとり、室温下で攪拌しながら無水酢酸3.3mlを添加した後、トリエチルアミン9.7mlを滴々加え、1時間反応させた。反応混合物に水を適量加え、暫時静置した後、傾斜により水層を除去し、適量のメタノールを加え、加熱溶解させた。溶液を濾過し、攪拌しながら、濾液に六弗化燐酸アンモニウム11.3gの水溶液20mlを滴々加え、温浴上で70℃で30分間加熱した後、冷却した。その後、析出した結晶を濾取したところ、化学式19で表されるシアニン色素の金緑色結晶が10.5g得られた。
【0121】
この結晶の一部をとり、常法にしたがって測定したところ、融点は245乃至252℃であった。
【0122】
【実施例2】
〈シアニン色素〉
六弗化燐酸アンモニウムの全量を六弗化アンチモン酸カリウム9.14gに変更した以外は実施例1におけると同様にして反応させたところ、化学式20で表されるシアニン色素の金緑色結晶が12.0g得られた。
【0123】
この結晶の一部をとり、常法にしたがって測定したところ、融点は228乃至232℃であった。
【0124】
【実施例3】
〈シアニン色素〉
反応容器にアセトニリル120mlをとり、化学式77で表されるアゾ化合物12.2gと二酢酸コバルト四水和物4.0gとを加え、65℃で加熱・攪拌しながら、トリエチルアミン11.7mlを滴々加えた後、この状態で1時間反応させた。反応混合物を濾過し、濾液からアセトニトリルを略2/3まで留去した後、エタノール100mlを加え、分散させた後、室温下で暫時放置した。析出した結晶を濾取し、エタノールと水とで洗浄した後、乾燥したところ、化学式4で表されるアゾ系有機金属錯体アニオンのトリエチルアンモニウム塩の緑茶色結晶が得られた。結晶の一部をとり、常法にしたがって測定したところ、このトリエチルアンモニウム塩はメタノール溶液において波長479nmに吸収極大を有し、融点は327.8℃であった。
【0125】
【化85】
【0126】
次に、反応容器にアセトニトリル200mlをとり、これに化学式41で表されるシアニン色素5.0gと、上記のようにして得られた化学式4で表されるアゾ系有機金属錯体アニオンのトリエチルアンモニウム塩6.75gのアセトニトリル溶液337mlとを加え、80℃で加熱・攪拌して反応させた後、アセトニトリルを留去し、残渣にエタノール400mlを加え、60℃で約30分間加熱した後、冷却した。析出した結晶を濾取し、水とエタノールで洗浄した後、乾燥したところ、アゾ系有機金属錯体アニオンを対イオンとする、化学式43で表されるシアニン色素の輝緑色結晶9.4gが得られた。
【0127】
【実施例4】
〈シアニン色素〉
反応容器にアセトニリル40mlをとり、これに化学式78で表されるアゾ化合物7.08gと二酢酸コバルト四水和物2.57gとを加え、65℃で加熱・攪拌しながら、トリエチルアミン7.5mlを滴々加えた後、同じ温度で1時間加熱・攪拌して反応させた。反応混合物を濾過し、濾液からアセトニトリルを略2/3まで留去した後、エタノール80mlを加え、分散させた後、室温下で暫時放置した。その後、析出した結晶を濾取し、エタノールと水とで洗浄した後、乾燥したところ、化学式6で表されるアゾ系有機金属錯体アニオンのトリエチルアンモニウム塩の緑茶色結晶が得られた。結晶の一部をとり、常法にしたがって測定したところ、このトリエチルアンモニウム塩はメタノール溶液において波長465nmに吸収極大を有し、融点は270.2℃であった。
【0128】
【化86】
【0129】
次に、反応容器にアセトニトリル200mlをとり、化学式15で表されるシアニン色素6.2gと、上記のようにして得られた化学式6で表されるアゾ系有機金属錯体アニオンのトリエチルアンモニウム塩10gのアセトニトリル溶液1,000mlとを加え、80℃で加熱・攪拌して反応させた後、アセトニトリルを略2/3まで留去し、放冷した。析出した結晶を濾取し、エタノールで洗浄した後、乾燥したところ、アゾ系有機金属錯体アニオンを対イオンとする、化学式22で表されるシアニン色素の輝緑色結晶が4.8g得られた。
【0130】
【実施例5】
〈シアニン色素〉
反応容器にアセトニトリル40mlをとり、化学式79で表されるアゾ化合物10gと二酢酸コバルト四水和物3.98gとを加え、65℃で加熱・攪拌しながら、トリエチルアミン8.47mlを滴々加えた後、この状態で1時間反応させた。その後、反応混合物を実施例3におけると同様に処理したところ、化学式12で表されるアゾ系有機金属錯体アニオンのトリエチルアンモニウム塩の緑茶色結晶が得られた。結晶の一部をとり、常法にしたがって測定したところ、このトリエチルアンモニウム塩はメタノール溶液において波長537nmに吸収極大を有した。
【0131】
【化87】
【0132】
次に、反応容器にアセトニトリル150mlをとり、化学式33で表されるシアニン色素2.3gと、上記のようにして得られた化学式12で表されるアゾ系有機金属錯体アニオンのトリエチルアンモニウム塩2.2gのアセトニトリル溶液500mlとを加え、80℃で加熱・攪拌して反応させた。反応混合物を実施例3におけると同様に処理したところ、化学式35で表されるシアニン色素の輝濃茶緑色結晶9.4gが得られた。
【0133】
この発明のシアニン色素は、構造によって仕込条件や収率に若干の違いはあるものの、化学式13乃至化学式72で表されるものを含めて、いずれも、実施例1乃至実施例5の方法によるか、あるいは、それらの方法に準じて所望量を製造することができる。
【0134】
【実施例6】
〈シアニン色素の光吸収特性〉
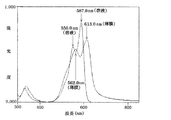
表1に示すこの発明のシアニン色素につき、常法にしたがって、メタノール溶液にしたときと、ガラス板上に製膜したときの可視吸収スペクトルをそれぞれ測定した。併行して、化学式73乃至化学式76で表される公知の類縁化合物につき、同様にして可視吸収スペクトルを測定した。溶液状態及び薄膜状態における各シアニン色素の吸収極大波長を表1に示す。化学式20で表されるこの発明のシアニン色素と、化学式74で表される公知の類縁化合物については、それぞれ、図1及び図2に溶液状態及び薄膜状態における可視吸収スペクトルを示す。
【0135】
【化88】
【0136】
【化89】
【0137】
【化90】
【0138】
【化91】
【0139】
【表1】
【0140】
表1の結果から明らかなように、この発明のシアニン色素は、いずれも、化学式73乃至化学式76で表される公知の類縁化合物と同様、溶液状態においては波長580乃至600nmに、また、薄膜状態においては波長600乃至630nmに吸収極大を示した。また、図1及び図2の可視吸収スペクトルに見られるとおり、化学式20で表されるこの発明によるシアニン色素の長波長側の吸収端は、化学式74で表される公知の類縁化合物と同様、薄膜状態において波長700nm付近まで延展していた。これらの結果は、この発明のシアニン色素が薄膜状態において700nmより短波長の可視光、とりわけ、波長630乃至680nmのレーザー光を実質的に吸収し、DVD−Rなどの高密度光記録媒体において有用であることを物語っている。
【0141】
【実施例7】
〈シアニン色素の溶解性〉
表1に示すこの発明のシアニン色素につき、常法にしたがってDAAにおける20℃の溶解度を測定した。併行して、化学式73乃至化学式76で表される公知の類縁化合物についても同様にして溶解度を測定した。結果を表1に示す。
【0142】
表1の結果から明らかなように、この発明によるシアニン色素の多くは、DAAにおいて、化学式73乃至化学式76で表される公知の類縁化合物を凌駕する溶解度を示した。すなわち、公知の類縁化合物の溶解度が50mg/ml未満であったのに対して、試験に供したこの発明によるシアニン色素は、いずれも、公知の類縁化合物とほぼ同等か、公知の類縁化合物を有意に上回る溶解度を示した。
【0143】
【実施例8】
〈シアニン色素の分解点〉
被検試料として、表1に示すシアニン色素をそれぞれ適量とり、デジタル熱分析計(商品名『TG/DTA220型』、セイコー電子工業株式会社製造)を用いる通常の示差熱分析(以下、「DTA」と略記する。)及び熱重量分析(以下「TGA」と略記する。)に供することによって分解点(TGAにおいて、被検試料の重量が減少し始める温度)を調べた。併行して、化学式73乃至化学式76で表される公知の類縁化合物についても同様の分析をした。結果を表1に示す。化学式19で表されるこの発明のシアニン色素については、図3にDTA及びTGAの分析結果を示す。また、DTA及びTGAにおいて、雰囲気温度は10℃/分の昇温モードに設定した。
【0144】
表1及び図3の結果に見られるとおり、化学式73乃至化学式76で表される公知の類縁化合物が、いずれも、272℃を下回る分解点を示したのに対して、試験に供したこの発明によるシアニン色素の多くは、公知の類縁化合物を有意に上回る分解点を示し、耐熱性がより大きいことを物語っていた。基板のガラス転移温度にもよるけれども、耐熱性の低い色素は、一般に、光記録媒体において光吸収剤として用いると、低出力のレーザー光で情報を書き込める利点がある半面、読取に際して、レーザー光に長時間露光すると、蓄積した熱によって記録面におけるピット周辺やピットが形成されていない部分が変形し、ジッターや読取エラーが発生し易くなる。この発明のシアニン色素の分解点が高いことは、この発明のシアニン色素を光吸収剤として用いることによって、ジッターや読取エラーが少なく、読取光や自然光などの環境光への露光に対して安定な高密度光記録媒体が得られることを物語っている。
【0145】
【実施例9】
〈光記録媒体〉
化学式15、化学式19、化学式20、化学式31又は化学式41のいずれかで表されるシアニン色素を光吸収剤としてTFPに濃度2.0%(w/w)になるように加え、さらに、耐光性改善剤として、中心原子としてのニッケル原子へ化学式80で表されるホルマザン化合物が2分子結合してなるホルマザン金属錯体を濃度0.2%(w/w)になるように添加し、暫時加熱した後、超音波を印加して溶解した。常法にしたがって、この溶液を膜濾過した後、トラックの内周へ同期信号並びにトラック及びセクターの番地を表示する凹部(トラックピッチ0.74μm、幅0.03μm、深さ76nm)を射出成形により転写しておいたポリカーボネート製のディスク状基板(直径12cm、厚さ0.6mm)の片面へ均一に回転塗布し、乾燥して厚さ100nmの記録層を形成した。その後、基板へ銀を100nmの厚さになるように蒸着して記録層に密着する反射層を形成し、さらに、その反射層へ公知の紫外線硬化樹脂(商品名『ダイキュアクリアSD1700』、大日本インキ化学工業株式会社製造)を均一に回転塗布し、光照射して反射層に密着する保護層を形成した後、保護層に密着させてポリカーボネート製のディスク状保護板(直径12cm、厚さ0.6mm)を貼り付けることによって5種類の光記録媒体を作製した。
【0146】
【化92】
【0147】
感度、変調特性、解像度、ジッター特性などの電気特性に優れた本例の光記録媒体は、いずれも、4GBを越える記録容量を有し、700nmより短波長の可視光、とりわけ、波長630乃至680nm付近のレーザー光による光ピックアップを用いることにより、大量の文書情報、画像情報、音声情報及びその他のデジタル情報を高密度に書き込むことができる。なお、発振波長658nmの半導体レーザー素子を用いて情報を書き込んだ本例の光記録媒体の記録面を電子顕微鏡で観察したところ、1μmを下回る微小なピットが1μmを下回るトラックピッチで高密度に形成されていた。
【0148】
【実施例10】
〈光記録媒体〉
実施例9において、ホルマザン金属錯体を汎用のジインモニウム化合物(商品名『IRG022』、日本火薬株式会社製造)に変更した以外は実施例9におけると同様にして、5種類の光記録媒体を作製した。
【0149】
感度、変調特性、解像度、ジッター特性などの電気特性に優れた本例の光記録媒体は、いずれも、4GBを越える記録容量を有し、700nmより短波長の可視光、とりわけ、波長630乃至680nm付近のレーザー光による光ピックアップを用いることにより、大量の文書情報、画像情報、音声情報及びその他のデジタル情報を高密度に書き込むことができる。なお、発振波長658nmの半導体レーザー素子を用いて情報を書き込んだ本例の光記録媒体の記録面を電子顕微鏡で観察したところ、1μmを下回る微小なピットが1μmを下回るトラックピッチで高密度に形成されていた。
【0150】
【実施例11】
〈光記録媒体〉
化学式13、化学式29又は化学式50のいずれかで表されるシアニン色素を光吸収剤としてDAAに濃度2.0%(w/w)になるように加え、暫時加熱した後、超音波を印加して溶解した。常法にしたがって、この溶液を膜濾過した後、トラックの内周へ同期信号並びにトラック及びセクターの番地を表示する凹部(トラックピッチ0.74μm、幅0.03μm、深さ76nm)を射出成形により転写しておいたポリカーボネート製のディスク状基板(直径12cm、厚さ0.6mm)の片面へ均一に回転塗布し、乾燥して厚さ100nmの記録層を形成した。その後、基板へ銀を100nmの厚さになるように蒸着して記録層に密着する反射層を形成し、さらに、その反射層へ公知の紫外線硬化樹脂(商品名『ダイキュアクリアSD1700』、大日本インキ化学工業株式会社製造)を均一に回転塗布し、光照射して反射層に密着する保護層を形成した後、保護層に密着させてポリカーボネート製のディスク状保護板(12cm、厚さ0.6mm)を貼り付けることによって3種類の光記録媒体を作製した。
【0151】
感度、変調特性、解像度、ジッター特性などの電気特性に優れた本例の光記録媒体は、いずれも、4GBを越える記録容量を有し、700nmより短波長の可視光、とりわけ、波長630乃至680nm付近のレーザー光による光ピックアップを用いることにより、大量の文書情報、画像情報、音声情報及びその他のデジタル情報を高密度に書き込むことができる。なお、発振波長658nmの半導体レーザー素子を用いて情報を書き込んだ本例の光記録媒体の記録面を電子顕微鏡で観察したところ、1μmを下回る微小なピットが1μmを下回るトラックピッチで高密度に形成されていた。
【0152】
【実施例12】
〈光記録媒体〉
実施例9において、光吸収剤を化学式15で表されるシアニン色素と化学式16で表されるシアニン色素との混合物(重量比1:1)か、あるいは、化学式41で表されるシアニン色素と化学式43で表されるシアニン色素との混合物(重量比1:1)を用いた以外は実施例9におけると同様にして、2種類の光記録媒体を作製した。
【0153】
感度、変調特性、解像度、ジッター特性などの電気特性が特に優れた本例の光記録媒体は、いずれも、4GBを越える記録容量を有し、700nmより短波長の可視光、とりわけ、波長630乃至680nm付近のレーザー光による光ピックアップを用いることにより、大量の文書情報、画像情報、音声情報及びその他のデジタル情報を高密度に書き込むことができる。なお、発振波長658nmの半導体レーザー素子を用いて情報を書き込んだ本例の光記録媒体の記録面を電子顕微鏡で観察したところ、1μmを下回る微小なピットが1μmを下回るトラックピッチで高密度に形成されていた。
【0154】
【発明の効果】
以上説明したとおり、この発明は新規なシアニン色素の創製と、その産業上有用な諸特性の発見に基づくものである。この発明のシアニン色素は、700nmより短波長の可視光を実質的に吸収するうえに、DAAをはじめとする諸種の有機溶剤に溶解し易く、耐熱性が大きい。したがって、この発明のシアニン色素は、DVD−Rにおけるがごとく、書込光として700nmより短波長の可視光、とりわけ、波長630乃至680nm付近のレーザー光を用い、情報の書込に際して、限られた記録面に安定にして微小なピットを高密度に形成しなければならない光記録媒体の光吸収剤として極めて有用である。
【0155】
斯かるシアニン色素を光吸収剤として用い、700nmより短波長の可視光、とりわけ、波長630乃至680nm付近のレーザー光により情報を書き込むこの発明の有機系光記録媒体は、現行のCD−Rと比較して、安定にしてより微小なピットをより小さなトラックピッチで高密度に形成できることから、文字情報、画像情報、音声情報及びその他のデジタル情報を桁違いに大量且つ高密度に記録できることとなり、その結果として、情報記録に要する1ビット当りの価格を大幅に下げることができる実益がある。
【0156】
さらに、この発明のシアニン色素は、700nmより長波長の可視光を実質的に吸収することなく他のシアニン色素の耐光性を著明に改善するので、DVD−Rなどの高密度光記録媒体における光吸収剤としての用途に加えて、例えば、700nmより長波長の可視光を実質的に吸収する他のシアニン色素により記録層を構成し、かつ、書込光として波長775乃至795nm付近のレーザー光を用いる現行のCD−R、とりわけ、高速書込可能なCD−Rにおける耐光性改善剤としても有利に用いることができる。
【0157】
斯くも有用なシアニン色素は、活性メチル基を有するベンゾインドレニウム化合物と、適宜の脱離基を有するベンゾインドレニウム化合物とを反応させる工程を経由するこの発明の製造方法により、所望量を容易に得ることができる。
【0158】
斯くも顕著な効果を奏するこの発明は、斯界に貢献すること誠に多大な、意義のある発明であると言える。
【図面の簡単な説明】
【図1】この発明によるシアニン色素の可視吸収スペクトルである。
【図2】公知の類縁化合物の可視吸収スペクトルである。
【図3】この発明によるシアニン色素のDTA及びTGAの結果を示す図である。[0001]
BACKGROUND OF THE INVENTION
The present invention relates to a novel organic dye compound, and more particularly to a trimethine cyanine dye useful in a high-density optical recording medium.
[0002]
[Prior art]
With the advent of the multimedia era, optical recording media such as CD-R (write-once memory using a compact disk) and DVD-R (write-once memory using a digital video disk) are in the spotlight. The optical recording medium is composed of an inorganic optical recording medium comprising a recording layer using an inorganic substance such as tellurium, selenium, rhodium, carbon, hydrogen sulfide, and an organic constituting the recording layer by a light absorber mainly composed of an organic dye compound. The optical recording medium can be broadly classified.
[0003]
Among these, in the organic optical recording medium, the cyanine dye is usually dissolved in an organic solvent such as 2,2,3,3-tetrafluoro-1-propanol (hereinafter abbreviated as “TFP”), and the solution is dissolved. The recording layer is formed by coating on a polycarbonate substrate and drying, followed by sequentially forming a reflective layer made of a metal such as gold, silver or copper and a protective layer made of an ultraviolet curable resin. Compared to inorganic media, organic optical recording media have the disadvantage that the recording layer is easily changed by ambient light such as reading light or natural light, but the light absorber is applied directly to the substrate as a solution. Since the recording layer can be configured by the above, there is an advantage that an optical recording medium can be manufactured at low cost. In addition, since organic optical recording media are mainly composed of organic matter, they have the advantage of being resistant to corrosion even in environments exposed to moisture and seawater, and heat-deformable light, a kind of organic optical recording media. With the advent of the recording medium, information recorded on the optical recording medium in a predetermined format can be read using a commercially available read-only device, and it is now becoming the mainstream of inexpensive optical recording media.
[0004]
An urgent problem in the organic optical recording medium is further densification to cope with the multimedia era. At present, the research on high density that is actively promoted in this field mainly aims at shortening the wavelength of laser light used for writing information from the current 775 to 795 nm to 700 nm or less by GaAlAs semiconductor laser. ing. However, many of the cyanine dyes developed for CD-R cannot properly write or read information using a laser beam having a wavelength shorter than 700 nm in a high-density optical recording medium such as DVD-R. In the present situation, it will not be possible to meet the demand for higher density demanded in various directions.
[0005]
Another cause that hinders the increase in the density of organic optical recording media is the problem of thermal decomposability and heat resistance of the dye. That is, in an organic optical recording medium, a dye that has absorbed laser light is melted and decomposed, and pits are formed by utilizing the heat generated at that time. As a result, the heat resistance is low, so when exposed to a laser beam for a long time even during reading, there is a problem that the pit periphery and the portion where the pit is not formed on the recording surface are easily deformed by the accumulated heat. is there.
[0006]
By the way, in order to fix a high-density optical recording medium such as a DVD-R as information recording means in the multimedia era to replace paper, it is necessary to provide high-quality products in large quantities and at low cost. For that purpose, it is important to produce an optical recording medium excellent in recording characteristics and stability with a high yield while improving the efficiency of applying the light absorbent to the substrate. Therefore, what is indispensable is a light absorber that is easily dissolved in an organic solvent. In particular, development of a light absorber that is easily dissolved in a non-halogen solvent that hardly pollutes the environment is desired. So far, a wide variety of light absorbers have been proposed, and some of them have already been put to practical use. However, they are used for the production of high-density optical recording media such as DVD-R, and satisfy both optical characteristics and solubility. The resulting light absorber has not yet been realized.
[0007]
[Problems to be solved by the invention]
In view of such circumstances, an object of the present invention is to provide an organic dye compound having excellent solubility and heat resistance useful in a high-density optical recording medium.
[0008]
[Means for Solving the Problems]
In order to solve the above-mentioned problems, the present inventor has intensively studied and searched, and through a process of reacting a benzoindolenium compound having an active methyl group with a benzoindolenium compound having an appropriate leaving group. The specific trimethine cyanine dyes obtained in this way substantially absorb visible light having a wavelength shorter than 700 nm, and many of them are organic compounds that are frequently used in the production of optical recording media compared to known analogs. It has been found that the solubility in solvents, especially non-halogen solvents, is significantly greater. In addition, it has been found that many of the cyanine dyes obtained through such a reaction have a decomposition point higher than 272 ° C. and have significantly higher heat resistance than known related compounds. Further, it was confirmed that such a trimethine cyanine dye forms minute pits on the recording surface with high density when irradiated with laser light having a wavelength shorter than 700 nm in an optical recording medium. The present invention is based on the creation of a novel organic dye compound and the discovery of its industrially useful properties.
[0009]
DETAILED DESCRIPTION OF THE INVENTION
In the present invention, the above-mentioned problem is represented by the general formula 1, and a trimethine cyanine dye having a solubility at 20 ° C. in diacetone alcohol (hereinafter abbreviated as “DAA”) of 50 mg / ml or more; To provide a trimethine cyanine dye represented by the general formula 1 and having a decomposition point exceeding 272 ° C. (hereinafter, both trimethine cyanine dyes may be collectively referred to as “cyanine dye”). Is the solution.
[0010]
[Chemical 7]
[0011]
In general formula 1, R1And R2Each represents an aliphatic hydrocarbon group. As the individual aliphatic hydrocarbon group, usually up to 8 carbon atoms, for example, methyl group, ethyl group, ethynyl group, propyl group, isopropyl group, 1-propenyl group, 2-propenyl group, 2-propynyl group, Isopropenyl group, butyl group, isobutyl group, sec-butyl group, tert-butyl group, 2-butenyl group, 1,3-butadienyl group, pentyl group, isopentyl group, neopentyl group, tert-pentyl group, 1-methylpentyl group Group, 2-methylpentyl group, 2-pentenyl group, 2-pentene-4-ynyl group, hexyl group, isohexyl group, 5-methylhexyl group, heptyl group, octyl group and the like. One or a plurality of such aliphatic hydrocarbons may have one or a plurality of substituents. Examples of the individual substituents include a methyl group, an ethyl group, a propyl group, an isopropyl group, a butyl group, Isobutyl group, sec-butyl group, tert-butyl group, pentyl group, isopentyl group, neopentyl group, aliphatic hydrocarbon group such as tert-pentyl group, phenyl group, o-tolyl group, m-tolyl group, p-tolyl Group, xylyl group, mesityl group, o-cumenyl group, m-cumenyl group, p-cumenyl group, aromatic hydrocarbon group such as biphenyl group, methoxy group, trifluoromethoxy group, ethoxy group, propoxy group, isopropoxy group , Butoxy group, tert-butoxy group, pentyloxy group, phenoxy group, benzyloxy group and other ether groups, methoxycarbonyl group Trifluoromethoxy group, an ethoxycarbonyl group, propoxycarbonyl group, acetoxy group, trifluoroacetoxy group, an ester group, such as benzoyloxy group, fluoro group, chloro group, bromo group, a halogen group such as iodo groups. Although it depends on the overall structure of the cyanine dye, it is preferable to use R1And R2Respectively, CmH2m + 1And CnH2n + 1Cyanine dyes having different aliphatic hydrocarbons represented by (m + n ≦ 9), and many of such cyanine dyes have high solubility in non-halogen solvents such as DAA, and have a high decomposition point. As a result, there is a feature of high heat resistance.
[0012]
Z in general formula 11And Z2Each represents a condensed naphthalene ring for completing a benzoindolenin ring, and these benzoindolenine rings are usually independently of each other a 1H-benzo [e] indole skeleton or a 3H-benzo [g] indole skeleton. Have one of the following. One or more of the hydrogen atoms in such a condensed naphthalene ring may be substituted with a substituent. Examples of the individual substituents include a methyl group, an ethyl group, a propyl group, an isopropyl group, a butyl group, and an isobutyl group. Group, sec-butyl group, tert-butyl group, pentyl group, isopentyl group, neopentyl group, aliphatic hydrocarbon group such as tert-pentyl group, methoxy group, trifluoromethoxy group, ethoxy group, propoxy group, isopropoxy group , Butoxy group, tert-butoxy group, pentyloxy group, phenoxy group, benzyloxy group and other ether groups, methoxycarbonyl group, trifluoromethoxycarbonyl group, ethoxycarbonyl group, propoxycarbonyl group, acetoxy group, trifluoroacetoxy group, Benzoyloxy group, etc. Ester group, methylsulfonyl group, ethylsulfonyl group, propylsulfonyl group, isopropylsulfonyl group, butylsulfonyl group, tert-butylsulfonyl group, alkylsulfonyl group such as pentylsulfonyl group, methylsulfamoyl group, dimethylsulfamoyl group, Alkyl such as ethylsulfamoyl group, diethylsulfamoyl group, purpylsulfamoyl group, dipropylsulfamoyl group, butylsulfamoyl group, dibutylsulfamoyl group, pentylsulfamoyl group, dipentylsulfamoyl group Halogen groups such as a sulfamoyl group, a fluoro group, a chloro group, a bromo group, and an iodo group, and further a nitro group and a cyano group. In the cyanine dye represented by the general formula 1, when a cis / trans isomer exists in the structure, any isomer is included in the present invention.
[0013]
X in general formula 1-Represents an appropriate counter ion. Although there is no restriction | limiting in particular about a counter ion, Although it is based on a use, what is necessary is just to make it an appropriate thing by using the solubility and / or thermal decomposability in DAA as a parameter | index. When used in an optical recording medium, it is desirable to use a counter ion that hardly alters the reflective layer containing the metal, particularly an anion composed of two or more different elements. Examples of the individual anions include phosphate ions. Inorganic acid ions such as perchlorate ion, periodate ion, hexafluorophosphate ion, hexafluoroantimonate ion, hexafluorostannate ion, borohydrofluoride ion, tetrafluoroborate ion, Thiocyanate ion, benzenesulfonate ion, naphthalenesulfonate ion, p-toluenesulfonate ion, alkylsulfonate ion, benzenecarboxylate ion, alkylcarboxylate ion, trihaloalkylcarboxylate ion, alkylsulfate ion, trihaloalkylsulfate ion , Organic acid ions such as nicotinate ion, azo-based, bisphenol Nirujichioru system, thio catechol chelate, thio bisphenolate chelate, such as an organometallic complex anion of Bisujioru -α- diketone systems. In view of stability such as explosiveness and ease of handling, it is particularly desirable to use fluorine and a group 15 metal element in the periodic table such as phosphorus, antimony and bismuth, for example, hexafluorophosphate ions. The cyanine dyes of the present invention, which are anions such as hexafluoroantimonate ions, which are counterions of such anions, are easy to handle and are easily dissolved in various organic solvents including DAA, and are heat resistant. There is also a big feature.
[0014]
Counter ion X-If the explanation is continued, although it depends on the use, a preferred organometallic complex anion in the cyanine dye of the present invention is an anion of an organometallic complex having an ability to improve light resistance, particularly an azo-based organometallic complex anion. The azo-based organometallic complex anion in the present invention generally means a complex anion having a metal atom as a central atom and one or more azo compounds as ligands bonded to the metal atom. In the present invention, any azo-based organometallic complex anion can improve the light resistance of the cyanine dye to a practical level without substantially impairing the light absorption property of the cyanine dye. As long as it is present, it can be used regardless of chemical structure or preparation method. When a plurality of azo compounds are bonded to a metal atom, these azo compounds may be the same as or different from each other. Examples of such azo-based organometallic complex anions include those represented by general formula 6. Any one of the group of azo-based organometallic complexes represented by the general formula 6 is extremely useful in carrying out the present invention because it does not substantially impair the light absorption property of the cyanine dye.
[0015]
[Chemical 8]
[0016]
Z in general formula 6ThreeThru Z6Represents the same or different aromatic rings or heterocyclic rings, and these aromatic rings and heterocyclic rings may have one or more substituents. A preferred aromatic ring is a monocyclic benzene ring, and the heterocyclic ring includes one or more heteroatoms selected from a nitrogen atom, an oxygen atom, a sulfur atom, a selenium atom, and a tellurium atom. For example, an isoxazolone skeleton Indazolone skeleton, indandione skeleton, oxazolone skeleton, thionaphthene skeleton, barbituric acid skeleton, hydantoin skeleton, pyrazolone skeleton, and rhodanine skeleton are desirable.
[0017]
Such aromatic and heterocyclic rings are, for example, methyl, ethyl, propyl, isopropyl, butyl, isobutyl, sec-butyl, tert-butyl, pentyl, isopentyl, neopentyl, tert- Pentyl group, 1-methylpentyl group, 2-methylpentyl group, hexyl group, isohexyl group, aliphatic hydrocarbon group such as 5-methylhexyl group, cyclopropyl group, cyclobutyl group, cyclopentyl group, cyclohexyl group, cyclohexenyl group Such as alicyclic hydrocarbon group, phenyl group, biphenylyl group, o-tolyl group, m-tolyl group, p-tolyl group, o-cumenyl group, m-cumenyl group, p-cumenyl group, xylyl group, mesityl group , Styryl group, cinnamoyl group, naphthyl group and other aromatic hydrocarbon groups, methoxycarbonyl group, Ester groups such as xycarbonyl group, propoxycarbonyl group, acetoxy group, benzoyloxy group, primary amino group, methylamino group, dimethylamino group, ethylamino group, diethylamino group, propylamino group, dipropylamino group, isopropyl Substituted or unsubstituted aliphatic, alicyclic or aromatic amino groups such as amino group, diisopropylamino group, butylamino group, dibutylamino group, methylsulfamoyl group, dimethylsulfamoyl group, ethylsulfamoyl group Alkylsulfamoyl groups such as diethylsulfamoyl group, propylsulfamoyl group, dipropylsulfamoyl group, isopropylsulfamoyl group, diisopropylsulfamoyl group, butylsulfamoyl group, dibutylsulfamoyl group, Furthermore, carba Yl group, a carboxy group, a cyano group, a nitro group, hydroxy group, sulfo group, sulfoamino group, a substituent such as a sulfonamide group may have one or more.
[0018]
Depending on the application, one or more of the hydrogen atoms in such a substituent may be, for example, a methyl group, an ethyl group, a propyl group, an isopropyl group, a butyl group, an isobutyl group, a sec-butyl group, or a tert-butyl group. , Pentyl group, isopentyl group, tert-pentyl group, 1-methylpentyl group, 2-methylpentyl group, hexyl group, isohexyl group, 5-methylhexyl group and other aliphatic hydrocarbon groups, phenyl group, biphenylyl group, o Aromatic hydrocarbon groups such as -tolyl group, m-tolyl group, p-tolyl group, o-cumenyl group, m-cumenyl group, p-cumenyl group, xylyl group, mesityl group, styryl group, cinnamoyl group, naphthyl group , Methoxy group, ethoxy group, propoxy group, isopropoxy group, butoxy group, isobutoxy group, sec-butoxy group, t Ether groups such as rt-butoxy group, pentyloxy group, phenoxy group and benzyloxy group, halogen groups such as fluoro group, chloro group, bromo group and iodo group, and further carboxy group, hydroxy group, cyano group and nitro group It may be substituted by.
[0019]
The azo-based organometallic complex anion represented by the general formula 6 is formed by bonding one or more azo compounds, which are the same or different from each other, to the metal atom M serving as a central atom as a ligand. As metal atoms, scandium, yttrium, titanium, zirconium, hafnium, vanadium, niobium, tantalum, chromium, molybdenum, tungsten, manganese, technetium, rhenium, iron, ruthenium, osmium, cobalt, rhodium, iridium, nickel, palladium , Platinum, copper, silver, gold, zinc, cadmium, mercury, and other elements of Group 3 to Group 12 in the periodic table are employed, and are easily available and easy to handle in the field of optical recording media. Usually, cobalt or nickel is used. In addition, A and A ′ in the general formula 6 can form a coordination bond by donating an electron pair to a metal atom, for example, in the periodic table of an oxygen atom, a sulfur atom, a selenium atom, a tellurium atom, etc. Represents the same or different heteroatoms selected from Group 16 elements, and these heteroatoms are represented by ZThree, Z6It may constitute an atomic group bonded to.
[0020]
Examples of such azo-based organometallic complex anions include those represented by Chemical Formulas 1 to 12. Any of these, when used as a counter ion of the cyanine dye according to the present invention, has a remarkable property of improving the light resistance of the cyanine dye in the visible region, specifically, at a wavelength of 350 to 850 nm. Since it does not substantially impair the light absorption characteristics and the solubility in an organic solvent, it is extremely useful for carrying out the present invention. The azo-based organometallic complex anions represented by Chemical Formulas 1 to 12 are all prepared by subjecting aniline or an aniline derivative to a diazo bond reaction, and reacting the obtained azo compound in the presence of an appropriate metal salt and base. The desired amount can be obtained according to a known method. In order to prepare a cyanine dye having an azo-based organometallic complex anion as a counter ion, for example, the cyanine dye of the present invention having an anion other than the azo-based organometallic complex anion as a counter ion in a suitable solvent, The salt of the azo-based organometallic complex anion is heated at a temperature exceeding ambient temperature for 0.1 to 10 hours with stirring.
[0021]
[Chemical 9]
[0022]
[Chemical Formula 10]
[0023]
Embedded image
[0024]
Embedded image
[0025]
Embedded image
[0026]
Embedded image
[0027]
Embedded image
[0028]
Embedded image
[0029]
Embedded image
[0030]
Embedded image
[0031]
Embedded image
[0032]
Embedded image
[0033]
Specific examples of the cyanine dye according to the present invention include those represented by chemical formulas 13 to 72. All of these have an absorption maximum at a wavelength of 580 to 600 nm in a solution state, and substantially absorb visible light having a wavelength shorter than 700 nm on the long wavelength side of the absorption maximum in a thin film state. Therefore, these cyanine dyes absorb light in optical recording media that use visible light having a wavelength shorter than 700 nm as writing light, particularly in high-density optical recording media such as DVD-R that use laser light in the vicinity of a wavelength of 630 to 680 nm. It is extremely useful as an agent. Among the cyanine dyes according to the present invention, those having an organic metal complex anion, in particular, an azo organic metal complex anion as a counter ion, exhibit a remarkable light resistance improving ability with respect to other cyanine dyes, Not only as a light absorber in DVD-R, but also a recording layer mainly composed of cyanine dye, and as a writing light, visible light whose wavelength exceeds 700 nm and does not exceed 800 nm, usually around 775 to 795 nm For example, it is also useful as a light resistance improver in CD-R. Furthermore, the cyanine dye of the present invention having an organometallic complex anion as a counter ion is used in a high-density optical recording medium such as a DVD-R, in addition to anions other than the organometallic complex anion, particularly perchlorate ions and fluorine. When used in combination with the cyanine dye of the present invention having an anion composed of a metal element of Group 15 in the table as a counter ion, the light resistance is remarkably improved without substantially changing the light absorption characteristics of the optical recording medium. Can do. At that time, the ratio of the two is adjusted by weight in the range of 0.1: 1 to 1: 0.1, preferably 0.3: 1 to 1: 0.3.
[0034]
Embedded image
[0035]
Embedded image
[0036]
Embedded image
[0037]
Embedded image
[0038]
Embedded image
[0039]
Embedded image
[0040]
Embedded image
[0041]
Embedded image
[0042]
Embedded image
[0043]
Embedded image
[0044]
Embedded image
[0045]
Embedded image
[0046]
Embedded image
[0047]
Embedded image
[0048]
Embedded image
[0049]
Embedded image
[0050]
Embedded image
[0051]
Embedded image
[0052]
Embedded image
[0053]
Embedded image
[0054]
Embedded image
[0055]
Embedded image
[0056]
Embedded image
[0057]
Embedded image
[0058]
Embedded image
[0059]
Embedded image
[0060]
Embedded image
[0061]
Embedded image
[0062]
Embedded image
[0063]
Embedded image
[0064]
Embedded image
[0065]
Embedded image
[0066]
Embedded image
[0067]
Embedded image
[0068]
Embedded image
[0069]
Embedded image
[0070]
Embedded image
[0071]
Embedded image
[0072]
Embedded image
[0073]
Embedded image
[0074]
Embedded image
[0075]
Embedded image
[0076]
Embedded image
[0077]
Embedded image
[0078]
Embedded image
[0079]
Embedded image
[0080]
Embedded image
[0081]
Embedded image
[0082]
Embedded image
[0083]
Embedded image
[0084]
Embedded image
[0085]
Embedded image
[0086]
Embedded image
[0087]
Embedded image
[0088]
Embedded image
[0089]
Embedded image
[0090]
Embedded image
[0091]
Embedded image
[0092]
Embedded image
[0093]
Embedded image
[0094]
The cyanine dye of the present invention can be produced by various methods. If importance is attached to economy, a method of passing a benzoindolenium compound having an appropriate leaving group to a benzoindolenium compound having an active methyl group is preferable. R corresponding to general formula 11A compound represented by the general formula 2 having: R corresponding to the general formula 12Or a compound corresponding to the general formula 1 is reacted with a compound represented by the general formula 3 having1A compound represented by the general formula 4 and R corresponding to the general formula 12The cyanine dye of the present invention can be obtained in good yield by reacting with the compound represented by the general formula 5 having:
[0095]
Embedded image
[0096]
Embedded image
[0097]
Embedded image
[0098]
Embedded image
[0099]
Specifically, an appropriate amount of each of the compounds represented by the general formulas 2 and 3 or the compounds represented by the general formulas 4 and 5 is taken in a reaction vessel (usually around equimolar amounts), and if necessary. For example, sodium hydroxide, potassium hydroxide, sodium carbonate, potassium carbonate, sodium bicarbonate, ammonia, triethylamine, piperidine, pyridine, pyrrolidine, morpholine, aniline, N, N-dimethylaniline, N , N-diethylaniline, N-methylpyrrolidone, basic compounds such as 1,8-diazabicyclo [5.4.0] -7-undecene, hydrochloric acid, sulfuric acid, nitric acid, methanesulfonic acid, p-toluenesulfonic acid, acetic acid , Acidic compounds such as acetic anhydride, propionic anhydride, trifluoroacetic acid, trifluorosulfonic acid, aluminum chloride Arm, zinc chloride, tin tetrachloride, after adding an appropriate amount of Lewis acidic compounds such as titanium chloride is reacted at a temperature above ambient temperature or ambient temperature with heating and stirring by heating to reflux.
[0100]
Examples of the solvent include hydrocarbons such as pentane, hexane, cyclohexane, octane, benzene, toluene, xylene, carbon tetrachloride, chloroform, 1,2-dichloroethane, 1,2-dibromoethane, trichloroethylene, tetrachloroethylene, chlorobenzene, Halogens such as bromobenzene and α-dichlorobenzene, methanol, ethanol, 1-propanol, 2-propanol, 1-butanol, 2-butanol, isobutyl alcohol, isopentyl alcohol, cyclohexanol, ethylene glycol, propylene glycol, 2- Alcohols such as methoxyethanol, 2-ethoxyethanol, phenol, benzyl alcohol, cresol, diethylene glycol, triethylene glycol, glycerin And phenols, diethyl ether, diisopropyl ether, tetrahydrofuran, tetrahydropyran, 1,4-dioxane, anisole, 1,2-dimethoxyethane, diethylene glycol, dimethyl ether, dicyclohexyl-18-crown-6, methyl carbitol, ethyl carbitol, etc. Ethers, furfural, acetone, ethyl methyl ketone, cyclohexanone and other ketones, acetic acid, acetic anhydride, trichloroacetic acid, trifluoroacetic acid, propionic anhydride, ethyl acetate, butyl carbonate, ethylene carbonate, propylene carbonate, formamide, N- Acids such as methylformamide, N, N-dimethylformamide, N-methylacetamide, N, N-dimethylacetamide, hexamethylphosphoric triamide, trimethyl phosphate and the like Examples include acid derivatives, nitriles such as acetonitrile, propionitrile, succinonitrile, and benzonitrile, nitro compounds such as nitromethane and nitrobenzene, sulfur-containing compounds such as dimethyl sulfoxide, water, and the like. Used in combination.
[0101]
In the case of using a solvent, generally, when the amount of the solvent increases, the efficiency of the reaction decreases. On the other hand, when the amount of the solvent decreases, it becomes difficult to uniformly heat and stir or a side reaction tends to occur. Therefore, it is desirable that the amount of the solvent is within a range of usually 5 to 50 times by weight ratio up to 100 times the whole raw material compound. Although depending on the type of raw material compound and reaction conditions, the reaction is completed within 10 hours, usually 0.5 to 5 hours. The progress of the reaction can be monitored by a general method such as thin layer chromatography, gas chromatography, high performance liquid chromatography and the like. When the reaction is completed, the cyanine dye of the present invention having a desired counter ion is obtained by subjecting the reaction mixture to a normal counter ion exchange reaction as necessary. Any of the cyanine dyes represented by Chemical Formula 13 to Chemical Formula 72 can be obtained in a desired amount by such a method. Incidentally, the benzoindolenium compounds represented by the general formulas 2 to 5 can be prepared, for example, by the method described in JP-A-10-316655 by the same patent applicant. In the general formulas 2 to 5, X1 -And X2 -X in general formula 1-And L is an appropriate leaving group, usually an anilino group, p-toluidino group, p-methoxyanilino group, p-ethoxycarbonylanilino group, N-acetyl. A monovalent group of aniline or an aniline derivative such as an anilino group is employed.
[0102]
The cyanine dye of the present invention thus obtained may be used as it is in the reaction mixture depending on the application. However, prior to use, for example, dissolution, extraction, liquid separation, grading, filtration, concentration, thin layer Purified by the usual methods for purifying similar compounds such as chromatography, column chromatography, gas chromatography, high performance liquid chromatography, distillation, crystallization, sublimation, etc., and these purification methods can be combined if necessary Applied. When the cyanine dye of the present invention is used as a light absorber in a high-density optical recording medium such as DVD-R, it is purified by a method such as distillation, crystallization and / or sublimation prior to use. Is desirable.
[0103]
Next, the use of the cyanine dye of the present invention will be described. The cyanine dye of the present invention has a property that the solubility at 20 ° C. in DAA is 50 mg / ml or more and the solubility in a non-halogen solvent is large, or the decomposition point is Characterized by the property of exceeding 272 ° C. and extremely high heat resistance. Moreover, the cyanine dye of the present invention substantially absorbs visible light having a wavelength shorter than 700 nm, particularly visible light having a wavelength in the vicinity of 630 to 680 nm in the thin film state, as in the case of known related compounds. Accordingly, the cyanine dye of the present invention requires an organic dye compound having such properties. For example, the cyanine dye has various uses in various fields including optical recording media, photochemical polymerization, solar cells and dyeing. Among these uses, as a light absorber in a high-density optical recording medium such as a DVD-R that uses visible light having a wavelength shorter than 700 nm as writing light, in particular, laser light having a wavelength near 630 to 680 nm. Very useful.
[0104]
Therefore, the use of the cyanine dye of the present invention in an optical recording medium will be described. Since the cyanine dye of the present invention does not require any special treatment or operation when used in an optical recording medium, the optical recording medium according to the present invention has been conventionally used. It can be produced according to a known optical recording medium. For example, as a light absorber, one or more of other organic dye compounds that substantially absorb visible light in order to adjust the reflectance and light absorption rate in the recording layer as necessary to the cyanine dye according to the present invention. In addition to adding one or more general light resistance improvers, binders, dispersants, flame retardants, lubricants, antistatic agents, surfactants, thermal interference inhibitors, plasticizers, etc., organic Necessary after dissolving in a solvent and forming a thin film with a light absorber that becomes a recording layer by applying the solution uniformly to one side of the substrate by spraying, dipping, roller coating, spin coating, etc. Accordingly, gold, silver, copper, platinum, aluminum, cobalt, tin, etc. are applied by a vacuum deposition method, a chemical vapor deposition method, a sputtering method, an ion plating method or the like so that the reflectance is 45% or more, preferably 55% or more. , In order to protect the recording layer from scratches, dust, dirt, etc., to form a reflective layer that adheres to the recording layer using a metal such as nickel, iron, chrome, or a general organic reflective layer material, a flame retardant, An ultraviolet curable resin or a thermosetting resin containing a stabilizer, an antistatic agent, or the like is spin-coated, and a protective layer that adheres to the reflective layer is formed by light irradiation or heating to cure. Thereafter, if necessary, a pair of substrates on which the recording layer, the reflective layer, and the protective layer are formed as described above are bonded with the protective layers facing each other with an adhesive, an adhesive sheet, or the like, or A protective plate of the same material and shape as in the substrate is attached to the protective layer.
[0105]
As other organic dye compounds used in combination with the cyanine dye according to the present invention, as long as it substantially absorbs visible light and can adjust the light reflectance and light absorption of the optical recording medium, There is no particular limitation. Such an organic dye compound includes one or more substituents at both ends of a polymethine chain such as a monomethine chain or dimethine chain, trimethine chain, tetramethine chain, pentamethine chain, hexamethine chain, and heptamethine chain that may have one or more substituents. The same or different imidazoline ring, imidazole ring, benzimidazole ring, α-naphthimidazole ring, β-naphthimidazole ring, indole ring, isoindole ring, indolenine ring, isoindolenine ring, benzoindolenine ring , Pyridinoindolenin ring, oxazoline ring, oxazole ring, isoxazole ring, benzoxazole ring, pyridinooxazole ring, α-naphthoxazole ring, β-naphthoxazole ring, selenazoline ring, selenazole ring, benzoselenazole ring, α -Naphthoselenazole ring, β-naphthoselenazole ring, thiazoline ring, thiazole ring, isothiazole ring, benzothiazole ring, α-naphthothiazole ring, β-naphthothiazole ring, tellurazoline ring, tellurazole ring, benzotelrazole ring, α-naphthotelrazole ring, β-naphthotelrazole ring, and further, acridine ring, anthracene ring, isoquinoline ring, isopyrrole ring, imidaxaline ring, indandione ring, indazole ring, indalin ring, oxadiazole ring, carbazole ring, Xanthene, quinazoline, quinoxaline, quinoline, chroman, cyclohexanedione, cyclopentanedione, cinnoline, thiodiazole, thiooxazolidone, thiophene, thionaphthene, thiobarbitur, thio Hydantoin ring, tetrazole ring, triazine ring, naphthalene ring, naphthyridine ring, piperazine ring, pyrazine ring, pyrazole ring, pyrazoline ring, pyrazolidine ring, pyrazolone ring, pyran ring, pyridine ring, pyridazine ring, pyrimidine ring, pyrylium ring, pyrrolidine ring , Pyrroline ring, pyrrole ring, phenazine ring, phenanthridine ring, phenanthrene ring, phenanthroline ring, phthalazine ring, pteridine ring, furazane ring, furan ring, purine ring, benzene ring, benzoxazine ring, benzopyran ring, morpholine ring, rhodanine In addition to cyanine dyes formed by bonding of ring nuclei such as rings, acridine, azaannulene, azo, anthraquinone, indigo, indanthrene, oxazine, xanthene, dioxazine, thiazine, thioindine , Tetrapyraporphyrazine, triphenylmethane, triphenothiazine, naphthoquinone, phthalocyanine, benzoquinone, benzopyran, benzofuranone, porphyrin, rhodamine dyes, if necessary, Used in combination as appropriate.
[0106]
Examples of the light fastness improver include nitroso compounds such as nitrosodiphenylamine, nitrosoaniline, nitrosophenol, nitrosonaphthol, tetracyanoquinodimethane compounds, diimmonium compounds, bis [2'-chloro-3-methoxy-4- ( 2-methoxyethoxy) dithiobenzyl] nickel (trade name “NKX-1199”, manufactured by Hayashibara Biochemical Laboratories Co., Ltd.), metal complexes such as formazan metal complexes are used, and these are used in combination as necessary. It is done. A preferred light fastness improving agent is one comprising a formazan metal complex, and particularly desirable is disclosed in Japanese Patent Application No. 11-163036 (name of invention “formazan metal complex”) by the same patent applicant. A formazan compound having a pyridine ring at the 5-position in the formazan skeleton and a pyridine ring or furan ring bonded at the 3-position or one or more of tautomers thereof is used as a ligand. For example, it comprises a metal complex with nickel, zinc, cobalt, iron, copper, palladium or the like. When used in combination with such a light fastness improving agent, the cyanine dye by exposure to reading light, ambient light, etc., without reducing the solubility of the cyanine dye of the present invention in an organic solvent or substantially impairing desirable optical properties Undesirable changes such as deterioration, discoloration, discoloration, and modification can be effectively suppressed. In particular, the formazan metal complex is a high-density optical recording medium such as DVD-R, and the cyanine dye of the present invention having the aforementioned organometallic complex anion as a counter ion and an anion other than the organometallic complex anion as a counter ion. By using in combination with the mixed system with the cyanine dye of the present invention, not only the light resistance of the cyanine dye according to the present invention is effectively improved, but also the sensitivity, modulation characteristics, resolution and jitter characteristics of the optical recording medium are included. To significantly improve electrical characteristics. In any case, the blending ratio of the light resistance improving agent is usually 0.01 to 1 part by weight, preferably 0.03 to 0.3 part by weight with respect to 1 part by weight of the cyanine dye. Add while adjusting in the range of. Although it depends on the application, the cyanine dye of the present invention having an organometallic complex anion, especially an azo-based organometallic complex anion as a counter ion, itself has a high light resistance, so that it does not require such a light resistance improving agent. Or the quantity of the light resistance improving agent used together can be decreased.
[0107]
Since the cyanine dye of the present invention exhibits practically no solubility in various organic solvents, there is no limitation on the organic solvent for applying the cyanine dye to the substrate. Therefore, in the production of the optical recording medium according to the present invention, for example, TFP or DAA frequently used in the production of the optical recording medium, or hexane, cyclohexane, methylcyclohexane, dimethylcyclohexane, ethylcyclohexane, isopropylcyclohexane, tert. -Hydrocarbons such as butylcyclohexane, octane, cyclooctane, benzene, toluene, xylene, carbon tetrachloride, chloroform, 1,2-dichloroethane, 1,2-dibromoethane, trichloroethylene, tetrachloroethylene, chlorobenzene, bromobenzene, α- Halides such as dichlorobenzene, methanol, ethanol, 2,2,2-trifluoroethanol, 2-methoxyethanol (methyl cellosolve), 2-ethoxyethanol ( Tilcellosolve), 2-isopropoxy-1-ethanol, 1-propanol, 2-propanol, 1-methoxy-2-propanol, 1-ethoxy-2-propanol, 1-butanol, 1-methoxy-2-butanol, 3 Alcohols such as methoxy-1-butanol, 4-methoxy-1-butanol, isobutyl alcohol, pentyl alcohol, isopentyl alcohol, cyclohexanol, diethylene glycol, triethylene glycol, propylene glycol, glycerin, phenol, benzyl alcohol, cresol and the like Phenols, diethyl ether, diisopropyl ether, tetrahydrofuran, tetrahydropyran, 1,4-dioxane, anisole, 1,2-dimethoxyethane, diethylene glycol di Ethers such as methyl ether, dicyclohexyl-18-crown-6, methyl carbitol and ethyl carbitol, ketones such as furfural, acetone, ethyl methyl ketone and cyclohexanone, ethyl acetate, butyl acetate, ethylene carbonate, propylene carbonate, phosphoric acid Esters such as trimethyl, amides such as formamide, N-methylformamide, N, N-dimethylformamide, hexamethylphosphoric triamide, nitriles such as acetonitrile, propionitrile, succinonitrile, nitro compounds such as nitromethane, nitrobenzene, Other than DAA and TFP, including amines such as ethylenediamine, pyridine, piperidine, morpholine, N-methylpyrrolidone, and sulfur-containing compounds such as dimethyl sulfoxide and sulfolane Select from common organic solvents, if necessary, it is used in combination as appropriate.
[0108]
In particular, since the cyanine dye of the present invention has a high solubility in an organic solvent that easily evaporates such as TFP and DAA, the cyanine dye of the present invention is dissolved in such a solvent and applied to a substrate. Dye crystals do not appear, and the film thickness and surface of the recording layer do not become uneven. In particular, when the cyanine dye of the present invention is dissolved in an alcohol such as DAA and applied to a substrate, the substrate is hardly damaged by the solvent or the environment is hardly contaminated.
[0109]
The substrate may be a general-purpose one, and usually an appropriate material is obtained by an extrusion molding method, an injection molding method, an extrusion injection molding method, a photopolymer method (2P method), a thermosetting integral molding method, a photocuring integral molding method, or the like. Depending on the final application, for example, it is formed into a disk shape having a diameter of 12 cm and a thickness of 0.1 to 1.2 mm, and this is used as a single plate, or it is used by suitably bonding with an adhesive sheet, an adhesive or the like. The material of the substrate is not particularly limited as long as it is substantially transparent and has a light transmittance of 80% or more, preferably 90% or more in the wavelength range of 400 to 800 nm. Examples of the individual materials include, in addition to glass and ceramic, polyacrylate, polymethyl methacrylate, polycarbonate, polystyrene (styrene copolymer), polymethylpentene, polyester, polyolefin, polyimide, polyetherimide, polysulfone, and polyether. Examples include sulfone, polyarylate, polycarbonate / polystyrene-alloy, polyester carbonate, polyphthalate carbonate, polycarbonate acrylate, amorphous polyolefin, methacrylate copolymer, diallyl carbonate diethylene glycol, epoxy resin, phenol resin, etc., usually polycarbonate Is frequently used. In the case of a plastic substrate, the sync signal and the recess for displaying the track and sector addresses are usually transferred to the track inner circumference during molding. Although the shape of the recess is not particularly limited, it is preferable that the average width is in the range of 0.3 to 0.8 μm and the depth is in the range of 70 to 200 nm.
[0110]
The cyanine dye according to the present invention is a solution having a concentration of 0.5 to 5% (w / w) in an organic solvent as described above in consideration of viscosity, and the recording layer thickness after drying is 10 to 1,000 nm. Desirably, it is uniformly applied to the substrate so as to be 50 to 300 nm. Prior to the application of the solution, an undercoat layer may be provided on the substrate as necessary for the purpose of protecting the substrate or improving adhesion. Examples of the material of the undercoat layer include ionomer resins. , Polymer materials such as polyamide resin, vinyl resin, natural resin, silicon, and liquid rubber. When using a binder, cellulose esters such as nitrocellulose, cellulose phosphate, cellulose sulfate, cellulose acetate, cellulose propionate, cellulose butyrate, cellulose palmitate, cellulose acetate / propionate, methyl cellulose, ethyl cellulose, propyl cellulose, Cellulose ethers such as butyl cellulose, polystyrene, polyvinyl chloride, polyvinyl acetate, polyvinyl acetal, polyvinyl butyral, polyvinyl formal, polyvinyl alcohol, polyvinyl pyrrolidone and other vinyl resins, styrene-butadiene copolymers, styrene-acrylonitrile copolymers, styrene-butadiene -Acrylonitrile copolymer, vinyl chloride-vinyl acetate copolymer, maleic anhydride copolymer Copolymer resins such as polymethyl methacrylate, polymethyl acrylate, polyacrylate, polymethacrylate, polyacrylamide, polyacrylonitrile and other acrylic resins, polyethylene terephthalate and other polyesters, polyethylene, chlorinated polyethylene, polypropylene and other polyolefins Such polymers are used alone or in combination, and 0.01 to 10 times the weight of the cyanine dye.
[0111]
A method of using the optical recording medium according to the present invention will be described. A high-density optical recording medium such as a DVD-R according to the present invention is, for example, an AlGaInP-based, GaAsP-based, GaAlAs-based, InGaP-based, InGaAsP-based, or InGaAlP-based semiconductor laser. Alternatively, various kinds of information are written with high density using visible light having a wavelength shorter than 700 nm, in particular, laser light having a wavelength of about 630 to 680 nm by a YAG laser combined with a second harmonic generation element (SHG element). Can do. For reading, a laser beam having the same wavelength as that for writing or slightly higher or lower wavelength is used. Regarding the laser output at the time of writing and reading, although it depends on the kind and blending amount of the light fastness improving agent used in combination with the cyanine dye of the present invention, the optical recording medium according to the present invention is suitable for writing information. It is desirable that the laser output is set to be relatively strong beyond the threshold of energy for forming pits, while the output when reading written information is set to be relatively weak below the threshold. In general, the output is over 5 mW, usually in the range of 10 to 50 mW, and the reading is moderated in the range of 5 mW or less, usually in the range of 0.1 to 5 mW. The recorded information is read by an optical pickup by detecting a change in reflected light amount or transmitted light amount of a pit and a portion where no pit is formed on the recording surface of the optical recording medium.
[0112]
Thus, in the optical recording medium according to the present invention, an optical pickup using visible light having a wavelength shorter than 700 nm, particularly a laser beam having a wavelength in the vicinity of 630 to 680 nm is used for the current standard CD-R. With a track pitch of less than 1.6 μm, the pit length of less than 0.834 μm / pit can be stabilized and minute pits can be formed with high density. Therefore, for example, when a disk-shaped substrate having a diameter of 12 cm is used, the recording capacity far exceeded 0.682 GB on one side, which could not be easily achieved with a known cyanine dye, and image information and audio information were about 2 hours. An extremely high density optical recording medium capable of minute recording can be realized.
[0113]
The optical recording medium according to the present invention can record character information, image information, audio information, and other digital information with high density, so that it can be used for recording and managing documents, data, computer programs, etc. It is extremely useful as a recording medium. Examples of individual industries that can use the optical recording medium according to the present invention and the form of information include, for example, construction and civil engineering drawings in construction and civil engineering, maps, road and river accounts, aperture cards, architectural sketches, disaster prevention materials, and wiring diagrams. , Layout drawings, newspaper / magazine information, regional information, construction reports, etc., manufacturing drawings, composition tables, prescriptions, product specifications, product price lists, parts lists, maintenance information, accident / failure cases, complaint cases Collection, manufacturing process table, technical data, drawings, details, in-house collection, technical report, inspection report, etc., customer information in sales, business partner information, company information, contract, newspaper / magazine information, sales report, Corporate credit surveys, inventory lists, financial company information, stock price records, statistical materials, newspaper / magazine information, contracts, customer lists, various applications / reports / licenses / licensing documents, operations Wiring and piping in electricity and gas, such as declarations, real estate / transport property information, building sketches, maps, regional information, newspaper / magazine information, lease contracts, company information, inventory lists, traffic information, supplier information, etc. Universities such as charts, disaster prevention materials, work standards tables, survey materials, technical reports, medical records, medical history / case files, medical-related diagrams, textbooks, problem collections, educational materials, statistical materials, etc.・ Academic papers, academic records, research monthly reports, research data, literature and literature indexes at research laboratories, information survey data, papers, patent gazettes, weather maps, data analysis records, customer files, various legal cases, etc. Membership lists, past books, work records, competition records, tournament records in groups, tourism information for tourism, traffic information, etc. In-house publication indexes, newspaper / magazine information, person files, sports records, telop files, broadcast scripts, maps related to government offices, road / river books, fingerprint files, resident's cards, various applications / reports / licenses / licensing documents , Statistical materials, and public materials. In particular, the optical recording medium of the present invention that can be written only once must not have the recorded information altered or erased. For example, in addition to record storage of medical records, official documents, etc., such as art museums, libraries, museums, broadcasting stations, etc. It is extremely useful as an electronic library.
[0114]
The optical recording medium according to the present invention has some special applications such as a compact disk, digital video disk, laser disk, MD (information recording system using a magneto-optical disk), CDV (laser disk using a compact disk), DAT (magnetic). Information recording system using tape), CD-ROM (read-only memory using compact disk), DVD-ROM (read-only memory using digital video disk), DVD-RAM (writing using digital video disk) (Readable memory), digital photos, movies, video software, audio software, computer graphics, publications, broadcast programs, commercial messages, game software, editing, proofreading, and for large computers and car navigation Applications include as a part program storage unit.
[0115]
In the above, as an application in the field of the optical recording medium of the cyanine dye according to the present invention, an example of application to an organic optical recording medium using visible light having a wavelength shorter than 700 nm as writing light has been mainly described. However, in the field of optical recording media, the cyanine dye according to the present invention is used not only in high-density optical recording media such as DVD-R but also in current optical recording media such as CD-R, for example, having a wavelength of 775 to 795 nm. When used in combination with one or more of other organic dye compounds that substantially absorb laser light, it can also be advantageously used as a material for adjusting or correcting the light absorptivity and light reflectance of the optical recording medium. Can do. Even when applied to an organic optical recording medium that uses visible light having a wavelength shorter than 700 nm as writing light, the cyanine dye of the present invention is not used to directly form pits on the substrate. By combining it with one or more of other organic dye compounds that substantially absorb laser light having a long wavelength, for example, 775 to 795 nm, the excitation energy by the laser light in the vicinity of wavelength 630 to 680 nm is used as the cyanine dye of the present invention. The pits may be indirectly formed by decomposing the latter compound by being transferred to these organic dye compounds via the. Furthermore, the optical recording medium referred to in the present invention means all recording media utilizing the property that the cyanine dye of the present invention substantially absorbs visible light having a wavelength shorter than 700 nm, In addition to these, for example, a thermal coloring method using a chemical reaction between a color former and a developer due to heat generation due to light absorption of an organic dye compound, and a periodic uneven pattern provided on the surface of a substrate are used. A so-called “brown-eye method” using a phenomenon of flattening by such heat generation may be used.
[0116]
As described above, the cyanine dye of the present invention comprises a recording layer mainly composed of a cyanine dye. As a writing light, visible light whose wavelength exceeds 700 nm and does not exceed 800 nm, usually laser light having a wavelength of about 775 to 795 nm. For example, it is also useful as a light resistance improver in CD-R. In such an optical recording medium, the cyanine dye used in combination with the cyanine dye according to the present invention is either a 1H-benzo [e] indole skeleton or a 3H-benzo [g] indole skeleton that are the same or different at both ends of the pentamethine chain. For example, the pentamethine cyanine described in JP-A-3-203692, JP-A-3-203669, JP-A-5-238149, JP-A-6-199045 and the like by the same patent applicants Pigments. As the amount of the cyanine dye of the present invention to be added to these cyanine dyes, if the added amount is small, the desired light resistance improvement cannot be obtained. On the other hand, if the added amount is large, the electrical characteristics of the optical recording medium deteriorate. Usually, the amount is adjusted in the range of 0.5 to 50% (w / w), preferably 3 to 30% (w / w) of other cyanine dyes. In this case, as the light resistance improving agent, together with the cyanine dye according to the present invention, if necessary, one or a plurality of other light resistance improving agents may be used in combination. In particular, the formazan metal complex is in a thin film state. It is particularly preferred because it exhibits good amorphous properties with the cyanine dyes according to the invention and other cyanine dyes and has high heat resistance.
[0117]
When the cyanine dye according to the present invention is used as a light fastness improving agent using visible light having a wavelength longer than 700 nm as writing light such as CD-R, it is not always necessary to include the cyanine dye of the present invention in the recording layer. Absent. For example, the cyanine dye according to the present invention is contained in the undercoat layer together with one or more of the binders described above, or, if necessary, dissolved in an organic solvent together with one or more of the binders described above, Is applied to the entire outer surface of the substrate, that is, the entire surface to be irradiated with the writing light, thereby forming the protective film of the cyanine dye of the present invention. Such an undercoat layer or protective film protects the recording layer from ambient light such as natural light or artificial light transmitted through the substrate, and durability of the optical recording medium, in particular, electrical characteristics such as jitter characteristics and block error rate. Can be greatly improved. When the solution is applied to the outer surface of the substrate, for example, characters, patterns, pictures, numbers, symbols, etc. can be printed or written on the outer surface of the substrate by using the solution as a printing material or paint.
[0118]
Further, since the cyanine dye of the present invention substantially absorbs visible light having a wavelength shorter than 700 nm, the light absorber of the present invention comprising such a cyanine dye can be used, for example, in an optical recording medium, for example, Also useful as a material for polymerizing a polymerizable compound by exposing it to visible light, a material for sensitizing a solar cell, a laser acting substance in a dye laser, and a material for dyeing various kinds of clothing It is. In addition, the light absorber of the present invention, if necessary, together with one or a plurality of other light absorbers that absorb light in the ultraviolet region, visible region and / or infrared region, in general, other than clothing, For example, drape, lace, casement, print, venetian blind, roll screen, shutter, goodwill, blanket, futon, futon side, duvet cover, duvet cotton, sheets, cushion, pillow, pillowcase, cushion, mat, carpet , Sleeping bags, tents, automobile interior materials, bedding products such as window glass and window glass, paper diapers, diaper covers, eyeglasses, monocles, lownets and other health supplies, shoe insoles, shoe linings, bags Earth, furoshiki, umbrella, parasol, stuffed animals and lighting devices, such as cathode ray tube displays, liquid crystal displays, electroluminescent displays, plasma displays Filters, panels and screens for information display devices such as television receivers using personal computers, personal computers, etc., sunglasses, sunroofs, sun visors, PET bottles, storages, greenhouses, cold water bottles, optical fibers, prepaid cards, electronics Observation windows such as microwave ovens, ovens, and packaging materials, filling materials, containers, etc. for packaging, filling, or storing these items, obstructions caused by environmental light such as natural light or artificial light in living organisms and articles. In addition to preventing or reducing inconveniences, there is an actual advantage that the color, color tone, and texture of the article can be adjusted, and the light reflected or transmitted from the article can be adjusted to a desired color balance.
[0119]
Hereinafter, embodiments of the present invention will be described based on examples.
[0120]
[Example 1]
<Cyanine dye>
In a reaction vessel, 15 g of 1-butyl-3,3-dimethyl-2-[(phenylamino) ethenyl] benzoindolenium = tosylate, 10.4 g of 1-ethyl-2,3,3-trimethylbenzoindolenium = tosylate and acetonitrile 30 ml was taken and 3.3 ml of acetic anhydride was added with stirring at room temperature, and then 9.7 ml of triethylamine was added dropwise and allowed to react for 1 hour. An appropriate amount of water was added to the reaction mixture and allowed to stand for a while, then the aqueous layer was removed by tilting, an appropriate amount of methanol was added and dissolved by heating. The solution was filtered, and while stirring, 20 ml of an aqueous solution of 11.3 g of ammonium hexafluorophosphate was added dropwise to the filtrate, heated at 70 ° C. for 30 minutes in a warm bath, and then cooled. Thereafter, the precipitated crystals were collected by filtration to obtain 10.5 g of a gold-green crystal of a cyanine dye represented by Chemical Formula 19.
[0121]
A part of this crystal was taken and measured according to a conventional method. The melting point was 245 to 252 ° C.
[0122]
[Example 2]
<Cyanine dye>
When the reaction was carried out in the same manner as in Example 1 except that the total amount of ammonium hexafluorophosphate was changed to 9.14 g of potassium hexafluoroantimonate, the gold-green crystal of the cyanine dye represented by the chemical formula 20 was 12. 0 g was obtained.
[0123]
A part of this crystal was taken and measured according to a conventional method. The melting point was 228 to 232 ° C.
[0124]
[Example 3]
<Cyanine dye>
Take 120 ml of acetonilyl in a reaction vessel, add 12.2 g of azo compound represented by Chemical Formula 77 and 4.0 g of cobalt diacetate tetrahydrate, and drop 11.7 ml of triethylamine dropwise while heating and stirring at 65 ° C. After the addition, the reaction was continued in this state for 1 hour. The reaction mixture was filtered, and acetonitrile was distilled off to about 2/3 from the filtrate. Then, 100 ml of ethanol was added and dispersed, and then allowed to stand at room temperature for a while. The precipitated crystals were collected by filtration, washed with ethanol and water, and dried to obtain green brown crystals of triethylammonium salt of an azo-based organometallic complex anion represented by Chemical Formula 4. When a part of the crystal was taken and measured according to a conventional method, this triethylammonium salt had an absorption maximum at a wavelength of 479 nm in a methanol solution and a melting point of 327.8 ° C.
[0125]
Embedded image
[0126]
Next, 200 ml of acetonitrile is taken in a reaction vessel, and 5.0 g of a cyanine dye represented by the chemical formula 41 and a triethylammonium salt of the azo-based organometallic complex anion represented by the chemical formula 4 obtained as described above are used. After adding 337 ml of 6.75 g of acetonitrile solution and reacting by heating and stirring at 80 ° C., acetonitrile was distilled off, 400 ml of ethanol was added to the residue, and the mixture was heated at 60 ° C. for about 30 minutes and then cooled. The precipitated crystals are collected by filtration, washed with water and ethanol, and dried to obtain 9.4 g of a bright green crystal of a cyanine dye represented by Chemical Formula 43 having an azo-based organometallic complex anion as a counter ion. It was.
[0127]
[Example 4]
<Cyanine dye>
Take 40 ml of acetonilyl in a reaction vessel, add 7.08 g of azo compound represented by chemical formula 78 and 2.57 g of cobalt diacetate tetrahydrate, and add 7.5 ml of triethylamine while heating and stirring at 65 ° C. After dropwise addition, the reaction was carried out by heating and stirring at the same temperature for 1 hour. The reaction mixture was filtered, and acetonitrile was distilled off to about 2/3 from the filtrate. After 80 ml of ethanol was added and dispersed, the mixture was allowed to stand at room temperature for a while. Thereafter, the precipitated crystals were collected by filtration, washed with ethanol and water, and then dried to obtain green brown crystals of triethylammonium salt of an azo-based organometallic complex anion represented by Chemical Formula 6. When a part of the crystal was taken and measured according to a conventional method, this triethylammonium salt had an absorption maximum at a wavelength of 465 nm in a methanol solution and a melting point of 270.2 ° C.
[0128]
[Chemical Formula 86]
[0129]
Next, 200 ml of acetonitrile was placed in a reaction vessel, and 6.2 g of the cyanine dye represented by Chemical Formula 15 and 10 g of the triethylammonium salt of the azo-based organometallic complex anion represented by Chemical Formula 6 obtained as described above were used. After adding 1,000 ml of acetonitrile solution and reacting by heating and stirring at 80 ° C., acetonitrile was distilled off to about 2/3 and allowed to cool. The precipitated crystals were collected by filtration, washed with ethanol, and dried. As a result, 4.8 g of a bright green crystal of a cyanine dye represented by Chemical Formula 22 having an azo-based organometallic complex anion as a counter ion was obtained.
[0130]
[Example 5]
<Cyanine dye>
40 ml of acetonitrile was placed in a reaction vessel, 10 g of an azo compound represented by the chemical formula 79 and 3.98 g of cobalt diacetate tetrahydrate were added, and 8.47 ml of triethylamine was added dropwise while heating and stirring at 65 ° C. Thereafter, the reaction was carried out for 1 hour in this state. Thereafter, the reaction mixture was treated in the same manner as in Example 3. As a result, a greenish brown crystal of a triethylammonium salt of an azo-based organometallic complex anion represented by Chemical Formula 12 was obtained. When a part of the crystal was taken and measured according to a conventional method, this triethylammonium salt had an absorption maximum at a wavelength of 537 nm in a methanol solution.
[0131]
Embedded image
[0132]
Next, 150 ml of acetonitrile is taken in a reaction vessel, 2.3 g of a cyanine dye represented by the chemical formula 33, and a triethylammonium salt 2. of the azo-based organometallic complex anion represented by the chemical formula 12 obtained as described above. 2 g of acetonitrile solution (500 ml) was added and reacted by heating and stirring at 80 ° C. The reaction mixture was treated in the same manner as in Example 3. As a result, 9.4 g of bright green tea green crystals of the cyanine dye represented by Chemical Formula 35 were obtained.
[0133]
Whether the cyanine dyes of the present invention are prepared according to the methods of Examples 1 to 5 including those represented by Chemical Formula 13 to Chemical Formula 72, although there are slight differences in the charging conditions and yield depending on the structure. Alternatively, a desired amount can be produced according to those methods.
[0134]
[Example 6]
<Light absorption characteristics of cyanine dyes>
With respect to the cyanine dyes of the present invention shown in Table 1, the visible absorption spectrum was measured when the solution was made into a methanol solution and formed on a glass plate according to a conventional method. In parallel, the visible absorption spectrum was measured in the same manner for known related compounds represented by Chemical Formula 73 to Chemical Formula 76. Table 1 shows the absorption maximum wavelength of each cyanine dye in the solution state and the thin film state. Regarding the cyanine dye of the present invention represented by Chemical Formula 20 and the known related compound represented by Chemical Formula 74, FIGS. 1 and 2 show visible absorption spectra in a solution state and a thin film state, respectively.
[0135]
Embedded image
[0136]
Embedded image
[0137]
Embedded image
[0138]
Embedded image
[0139]
[Table 1]
[0140]
As is apparent from the results in Table 1, all of the cyanine dyes of the present invention have a wavelength of 580 to 600 nm in a solution state and a thin film state, as well as known related compounds represented by Chemical Formula 73 to Chemical Formula 76. In FIG. 4, the absorption maximum is shown at a wavelength of 600 to 630 nm. Further, as seen in the visible absorption spectra of FIG. 1 and FIG. 2, the absorption edge on the long wavelength side of the cyanine dye of the present invention represented by the chemical formula 20 is a thin film like the known related compound represented by the chemical formula 74 In the state, it extended to a wavelength near 700 nm. These results show that the cyanine dye of the present invention substantially absorbs visible light having a wavelength shorter than 700 nm, particularly laser light having a wavelength of 630 to 680 nm in a thin film state, and is useful in high-density optical recording media such as DVD-R. It tells that it is.
[0141]
[Example 7]
<Solubility of cyanine dye>
About the cyanine dye of this invention shown in Table 1, the solubility at 20 ° C. in DAA was measured according to a conventional method. At the same time, the solubility of the related compounds represented by Chemical Formula 73 to Chemical Formula 76 was measured in the same manner. The results are shown in Table 1.
[0142]
As is apparent from the results in Table 1, many of the cyanine dyes according to the present invention exhibited a solubility in DAA that exceeded that of known analog compounds represented by Chemical Formula 73 to Chemical Formula 76. That is, while the solubility of the known related compound was less than 50 mg / ml, the cyanine dyes according to the present invention used for the test were almost the same as the known related compound or significantly different from the known related compound. The solubility was higher than.
[0143]
[Example 8]
<Decomposition point of cyanine dye>
Normal differential thermal analysis (hereinafter referred to as “DTA”) using a digital thermal analyzer (trade name “TG / DTA220 type”, manufactured by Seiko Denshi Kogyo Co., Ltd.), taking appropriate amounts of the cyanine dyes shown in Table 1 as test samples. And a thermogravimetric analysis (hereinafter abbreviated as “TGA”) to examine the decomposition point (temperature at which the weight of the test sample begins to decrease in TGA). In parallel, the same analysis was performed for known related compounds represented by Chemical Formula 73 to Chemical Formula 76. The results are shown in Table 1. With respect to the cyanine dye of the present invention represented by Chemical Formula 19, the analysis results of DTA and TGA are shown in FIG. Moreover, in DTA and TGA, the atmospheric temperature was set to a temperature rising mode of 10 ° C./min.
[0144]
As can be seen from the results of Table 1 and FIG. 3, the known analogs represented by Chemical Formula 73 to Chemical Formula 76 all showed a decomposition point below 272 ° C., but this invention used for the test. Many of the cyanine dyes according to have exhibited a decomposition point significantly higher than that of a known related compound, indicating that the heat resistance was higher. Although depending on the glass transition temperature of the substrate, dyes with low heat resistance generally have the advantage of being able to write information with a low-power laser beam when used as a light absorber in an optical recording medium, but on the other hand, when reading, If the exposure is performed for a long time, the accumulated heat deforms the pit periphery or the portion where no pit is formed on the recording surface, and jitter and reading errors are likely to occur. The high decomposition point of the cyanine dye of the present invention is that the use of the cyanine dye of the present invention as a light absorber reduces jitter and reading errors and is stable against exposure to ambient light such as reading light and natural light. It shows that high-density optical recording media can be obtained.
[0145]
[Example 9]
<Optical recording medium>
A cyanine dye represented by any one of Chemical Formula 15, Chemical Formula 19, Chemical Formula 20, Chemical Formula 31, or Chemical Formula 41 is added to TFP to a concentration of 2.0% (w / w) as a light absorber, and further, light resistance As a improver, a formazan metal complex formed by bonding two molecules of a formazan compound represented by the chemical formula 80 to a nickel atom as a central atom was added to a concentration of 0.2% (w / w) and heated for a while. Then, it melt | dissolved by applying an ultrasonic wave. According to a conventional method, this solution is subjected to membrane filtration, and then a recess (track pitch: 0.74 μm, width: 0.03 μm, depth: 76 nm) is displayed by injection molding on the inner periphery of the track to display the synchronization signal and the address of the track and sector. The recording layer having a thickness of 100 nm was formed by spin-coating evenly on one side of the transferred polycarbonate disk-shaped substrate (diameter 12 cm, thickness 0.6 mm) and drying. Thereafter, silver is deposited on the substrate to a thickness of 100 nm to form a reflective layer that adheres closely to the recording layer. Further, a known ultraviolet curable resin (trade name “Dicure Clear SD1700”, large size is applied to the reflective layer. Nippon Ink Chemical Co., Ltd.) is uniformly spin-coated, and after forming a protective layer that adheres to the reflective layer by light irradiation, it is adhered to the protective layer and a polycarbonate disk-shaped protective plate (diameter 12 cm, thickness) 0.6 mm) was affixed to produce five types of optical recording media.
[0146]
Embedded image
[0147]
All of the optical recording media of this example having excellent electrical characteristics such as sensitivity, modulation characteristics, resolution, and jitter characteristics have a recording capacity exceeding 4 GB, and visible light having a wavelength shorter than 700 nm, particularly wavelengths of 630 to 680 nm. A large amount of document information, image information, audio information, and other digital information can be written with high density by using an optical pickup using a nearby laser beam. In addition, when the recording surface of the optical recording medium of this example in which information was written using a semiconductor laser element having an oscillation wavelength of 658 nm was observed with an electron microscope, minute pits less than 1 μm were formed at a high density with a track pitch less than 1 μm. It had been.
[0148]
[Example 10]
<Optical recording medium>
In Example 9, five types of optical recording media were produced in the same manner as in Example 9 except that the formazan metal complex was changed to a general-purpose diimmonium compound (trade name “IRG022” manufactured by Nippon Explosives Co., Ltd.).
[0149]
All of the optical recording media of this example having excellent electrical characteristics such as sensitivity, modulation characteristics, resolution, and jitter characteristics have a recording capacity exceeding 4 GB, and visible light having a wavelength shorter than 700 nm, particularly wavelengths of 630 to 680 nm. A large amount of document information, image information, audio information, and other digital information can be written with high density by using an optical pickup using a nearby laser beam. In addition, when the recording surface of the optical recording medium of this example in which information was written using a semiconductor laser element having an oscillation wavelength of 658 nm was observed with an electron microscope, minute pits less than 1 μm were formed at a high density with a track pitch less than 1 μm. It had been.
[0150]
Example 11
<Optical recording medium>
A cyanine dye represented by any one of Chemical Formula 13, Chemical Formula 29, or Chemical Formula 50 is added to DAA to a concentration of 2.0% (w / w) as a light absorber, heated for a while, and then applied with ultrasonic waves. And dissolved. According to a conventional method, this solution is subjected to membrane filtration, and then a recess (track pitch: 0.74 μm, width: 0.03 μm, depth: 76 nm) is displayed by injection molding on the inner periphery of the track to display the synchronization signal and the address of the track and sector. The recording layer having a thickness of 100 nm was formed by spin-coating evenly on one side of the transferred polycarbonate disk-shaped substrate (diameter 12 cm, thickness 0.6 mm) and drying. Thereafter, silver is deposited on the substrate to a thickness of 100 nm to form a reflective layer that adheres closely to the recording layer. Further, a known ultraviolet curable resin (trade name “Dicure Clear SD1700”, large size is applied to the reflective layer. Nippon Ink Chemical Co., Ltd.) is uniformly spin-coated and a light-irradiated protective layer that adheres closely to the reflective layer is formed, and is then adhered to the protective layer to form a polycarbonate disk-shaped protective plate (12 cm, thickness 0) .6 mm) was affixed to produce three types of optical recording media.
[0151]
All of the optical recording media of this example having excellent electrical characteristics such as sensitivity, modulation characteristics, resolution, and jitter characteristics have a recording capacity exceeding 4 GB, and visible light having a wavelength shorter than 700 nm, particularly wavelengths of 630 to 680 nm. A large amount of document information, image information, audio information, and other digital information can be written with high density by using an optical pickup using a nearby laser beam. In addition, when the recording surface of the optical recording medium of this example in which information was written using a semiconductor laser element having an oscillation wavelength of 658 nm was observed with an electron microscope, minute pits less than 1 μm were formed at a high density with a track pitch less than 1 μm. It had been.
[0152]
Example 12
<Optical recording medium>
In Example 9, the light absorber is a mixture of the cyanine dye represented by the chemical formula 15 and the cyanine dye represented by the chemical formula 16 (weight ratio 1: 1), or the cyanine dye represented by the chemical formula 41 and the chemical formula Two types of optical recording media were produced in the same manner as in Example 9 except that the mixture with the cyanine dye represented by 43 (weight ratio 1: 1) was used.
[0153]
All of the optical recording media of the present example, which are particularly excellent in electrical characteristics such as sensitivity, modulation characteristics, resolution, and jitter characteristics, have a recording capacity exceeding 4 GB, and visible light having a wavelength shorter than 700 nm, particularly wavelengths 630 to 630. A large amount of document information, image information, audio information, and other digital information can be written with high density by using an optical pickup with a laser beam of around 680 nm. When the recording surface of the optical recording medium of this example in which information was written using a semiconductor laser element with an oscillation wavelength of 658 nm was observed with an electron microscope, minute pits less than 1 μm were formed with high density at a track pitch of less than 1 μm. It had been.
[0154]
【The invention's effect】
As described above, the present invention is based on the creation of a novel cyanine dye and the discovery of various industrially useful properties. The cyanine dye of the present invention substantially absorbs visible light having a wavelength shorter than 700 nm, is easily dissolved in various organic solvents including DAA, and has high heat resistance. Accordingly, the cyanine dye of the present invention uses visible light having a wavelength shorter than 700 nm as writing light, particularly laser light having a wavelength near 630 to 680 nm, as in DVD-R, and is limited in writing information. It is extremely useful as a light absorber for an optical recording medium in which minute pits must be stably formed on the recording surface at a high density.
[0155]
Using such a cyanine dye as a light absorber, the organic optical recording medium of the present invention, in which information is written by visible light having a wavelength shorter than 700 nm, particularly laser light having a wavelength of about 630 to 680 nm, is compared with the current CD-R. Thus, since stable and finer pits can be formed at a high density with a smaller track pitch, character information, image information, audio information and other digital information can be recorded in an extremely large amount and with a high density. As a result, there is an actual benefit that the price per bit required for information recording can be significantly reduced.
[0156]
Furthermore, since the cyanine dye of the present invention significantly improves the light resistance of other cyanine dyes without substantially absorbing visible light having a wavelength longer than 700 nm, it can be used in high-density optical recording media such as DVD-R. In addition to the use as a light absorber, for example, a recording layer is composed of another cyanine dye that substantially absorbs visible light having a wavelength longer than 700 nm, and laser light having a wavelength of about 775 to 795 nm is used as writing light. The present invention can be advantageously used as a light fastness improver in the current CD-R using, particularly, a CD-R capable of high-speed writing.
[0157]
Such a useful cyanine dye can be easily produced in a desired amount by the production method of the present invention through a process of reacting a benzoindolenium compound having an active methyl group with a benzoindolenium compound having an appropriate leaving group. Obtainable.
[0158]
It can be said that this invention having such remarkable effects is a very significant invention that contributes to the world.
[Brief description of the drawings]
FIG. 1 is a visible absorption spectrum of a cyanine dye according to the present invention.
FIG. 2 is a visible absorption spectrum of a known related compound.
FIG. 3 is a diagram showing DTA and TGA results of a cyanine dye according to the present invention.
Claims (2)
【化1】
一般式1:
一般式1において、R1及びR2は、それぞれ、脂肪族炭化水素基を表し、それらの脂肪族炭化水素基は置換基を有していてもよい。Z1及びZ2は、それぞれ、ベンゾインドレニン環を完成するための縮合ナフタレン環を表し、それらの縮合ナフタレン環は置換基を有していてもよい。X−は化学式3乃至5及び化学式7乃至12のいずれかで表される対イオンを表す。
[Chemical 1]
General formula 1:
In General Formula 1, R 1 and R 2 each represents an aliphatic hydrocarbon group, and these aliphatic hydrocarbon groups may have a substituent. Z 1 and Z 2 each represent a condensed naphthalene ring for completing a benzoindolenine ring, and these condensed naphthalene rings may have a substituent. X − represents a counter ion represented by any one of Chemical Formulas 3 to 5 and Chemical Formulas 7 to 12 .
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2001031916A JP4754698B2 (en) | 2000-02-10 | 2001-02-08 | Cyanine dye |
Applications Claiming Priority (10)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2000032947 | 2000-02-10 | ||
| JP2000032947 | 2000-02-10 | ||
| JP2000041001 | 2000-02-18 | ||
| JP2000041001 | 2000-02-18 | ||
| JP2000-32947 | 2000-11-17 | ||
| JP2000351905 | 2000-11-17 | ||
| JP2000-351905 | 2000-11-17 | ||
| JP2000-41001 | 2000-11-17 | ||
| JP2000351905 | 2000-11-17 | ||
| JP2001031916A JP4754698B2 (en) | 2000-02-10 | 2001-02-08 | Cyanine dye |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2002212454A JP2002212454A (en) | 2002-07-31 |
| JP2002212454A5 JP2002212454A5 (en) | 2008-03-21 |
| JP4754698B2 true JP4754698B2 (en) | 2011-08-24 |
Family
ID=27481020
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2001031916A Expired - Fee Related JP4754698B2 (en) | 2000-02-10 | 2001-02-08 | Cyanine dye |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4754698B2 (en) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4743994B2 (en) * | 2000-10-27 | 2011-08-10 | 株式会社林原生物化学研究所 | Light resistance improver |
| TW200531993A (en) * | 2004-03-26 | 2005-10-01 | Hayashibara Biochem Lab | Cyanine dyes |
| JP2007196661A (en) * | 2005-12-27 | 2007-08-09 | Mitsubishi Kagaku Media Co Ltd | Optical recording medium and azacyanine dye |
| TWI526502B (en) * | 2009-12-25 | 2016-03-21 | Sumitomo Chemical Co | Pyridine ketone compound compounds |
| JP4929391B2 (en) * | 2010-10-25 | 2012-05-09 | 株式会社東芝 | Storage medium, reproducing method and recording method |
| TWI518143B (en) * | 2011-03-31 | 2016-01-21 | Sumitomo Chemical Co | Dye with salt |
| TWI518142B (en) * | 2011-03-31 | 2016-01-21 | 住友化學股份有限公司 | A salt for dye |
Family Cites Families (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0798421B2 (en) * | 1987-06-09 | 1995-10-25 | 富士写真フイルム株式会社 | Optical information recording medium |
| JPS6424499A (en) * | 1987-07-21 | 1989-01-26 | New Japan Radio Co Ltd | Electronic component orienting device |
| JP2686841B2 (en) * | 1990-03-30 | 1997-12-08 | 富士写真フイルム株式会社 | Information recording medium and optical information recording method |
| JP3045404B2 (en) * | 1991-01-30 | 2000-05-29 | 日本化薬株式会社 | Indolenine compound and optical recording medium containing the same |
| JPH06143821A (en) * | 1992-11-02 | 1994-05-24 | Pioneer Electron Corp | Optical recording medium |
| JPH0966671A (en) * | 1995-06-19 | 1997-03-11 | Tdk Corp | Optical record medium |
| JP3503679B2 (en) * | 1996-11-01 | 2004-03-08 | 太陽誘電株式会社 | Optical information recording medium |
| BR9714232A (en) * | 1996-12-20 | 2000-04-18 | Ciba Sc Holding Ag | Complex, unused polymethylene dyes |
| KR100298419B1 (en) * | 1997-02-10 | 2001-11-30 | 사토 히로시 | Photo stabilized cyanine pigment and optical recording medium |
| JP2001328350A (en) * | 1997-04-23 | 2001-11-27 | Sony Corp | Optical recording medium |
| JP3703609B2 (en) * | 1997-07-14 | 2005-10-05 | 富士写真フイルム株式会社 | Optical information recording medium |
| JP3724531B2 (en) * | 1997-07-15 | 2005-12-07 | Tdk株式会社 | Optical recording medium |
| JPH11221963A (en) * | 1998-02-06 | 1999-08-17 | Fuji Photo Film Co Ltd | Optical information recording medium |
| JP2000043420A (en) * | 1998-08-03 | 2000-02-15 | Ricoh Co Ltd | Photo-recording medium |
| JP2000198273A (en) * | 1998-11-05 | 2000-07-18 | Tdk Corp | Optical recording medium |
| JP2001225557A (en) * | 1999-03-05 | 2001-08-21 | Fuji Photo Film Co Ltd | Optical information recording medium and recording method of information |
| JP4821031B2 (en) * | 1999-04-13 | 2011-11-24 | 株式会社林原生物化学研究所 | Cyanine dye |
| JP2000343821A (en) * | 1999-06-04 | 2000-12-12 | Tdk Corp | Optical recording medium |
| JP2001067732A (en) * | 1999-09-01 | 2001-03-16 | Tdk Corp | Optical recording medium |
| JP3673963B2 (en) * | 1999-12-01 | 2005-07-20 | 太陽誘電株式会社 | Optical information recording medium |
| JP4666869B2 (en) * | 2000-02-23 | 2011-04-06 | 株式会社林原生物化学研究所 | Cyanine dye |
-
2001
- 2001-02-08 JP JP2001031916A patent/JP4754698B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2002212454A (en) | 2002-07-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US6743568B2 (en) | Cyanine dyes | |
| JP4702731B2 (en) | Cyanine dye | |
| JP5320411B2 (en) | Styryl dye | |
| JP2002206061A (en) | Styryl dye | |
| JP4743994B2 (en) | Light resistance improver | |
| JP2011052218A (en) | Cyanine dyestuff | |
| JP4173735B2 (en) | Light absorber | |
| JP4702730B2 (en) | Styryl dye | |
| JP4666869B2 (en) | Cyanine dye | |
| US6645594B1 (en) | Formazan metal complex | |
| JP4754698B2 (en) | Cyanine dye | |
| JP4666742B2 (en) | Light absorbers and their applications | |
| EP1090961A1 (en) | Cyanine dyes | |
| JP5426158B2 (en) | Methine dyes and their uses |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080204 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080204 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20110209 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110215 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110415 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20110517 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20110526 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140603 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4754698 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313111 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |