JP4578580B2 - コカインの類似化合物 - Google Patents
コカインの類似化合物 Download PDFInfo
- Publication number
- JP4578580B2 JP4578580B2 JP54311498A JP54311498A JP4578580B2 JP 4578580 B2 JP4578580 B2 JP 4578580B2 JP 54311498 A JP54311498 A JP 54311498A JP 54311498 A JP54311498 A JP 54311498A JP 4578580 B2 JP4578580 B2 JP 4578580B2
- Authority
- JP
- Japan
- Prior art keywords
- compound
- alkyl
- cocaine
- compounds
- compound according
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/60—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/36—Opioid-abuse
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B59/00—Introduction of isotopes of elements into organic compounds ; Labelled organic compounds per se
- C07B59/002—Heterocyclic compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/08—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms
- C07D211/10—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with radicals containing only carbon and hydrogen atoms attached to ring carbon atoms
- C07D211/12—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with radicals containing only carbon and hydrogen atoms attached to ring carbon atoms with only hydrogen atoms attached to the ring nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/08—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms
- C07D211/10—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with radicals containing only carbon and hydrogen atoms attached to ring carbon atoms
- C07D211/14—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with radicals containing only carbon and hydrogen atoms attached to ring carbon atoms with hydrocarbon or substituted hydrocarbon radicals attached to the ring nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/08—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms
- C07D211/18—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D211/20—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms with hydrocarbon radicals, substituted by singly bound oxygen or sulphur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/08—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms
- C07D211/18—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D211/20—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms with hydrocarbon radicals, substituted by singly bound oxygen or sulphur atoms
- C07D211/22—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms with hydrocarbon radicals, substituted by singly bound oxygen or sulphur atoms by oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/07—Optical isomers
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Public Health (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Addiction (AREA)
- Psychiatry (AREA)
- Psychology (AREA)
- Pain & Pain Management (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Steroid Compounds (AREA)
- Oscillators With Electromechanical Resonators (AREA)
- Magnetic Resonance Imaging Apparatus (AREA)
Description
コカインの乱用が、今日、米国の大衆にとって最大の関心事のうちの一つとなっており、したがって、医学界、社交界および政界の指導者の焦点となってきた。コカインは、既知の最も中毒性の強い物質の内の一つであり、中毒患者は、仕事場で、あるいは対人関係の諸状況で役目を果たす能力を失うことがある。薬物依存性およびコカインの流通網に亘り生じる莫大な利益が、米国およびコロンビアにおける薬物関連犯罪の増加に火を注いでいる。偶発的なコカインの使用の発生はここ数年間は実質的に減少してきたけれども、常用者の数は上昇している。このような上昇は、主剤を遊離させる、すなわち、「クラッキング」するのにしばしば用いられる化学形態の変化、および使用する投与経路の変化、すなわち鼻から喫煙または静脈注射による吸入への変化を伴っている。
心理学的および行動的アプローチは、同輩集団圧力および環境的刺激が中毒への逆戻りに密接に関連するので、治療プログラムにおいて重要である。しかしながら、行動観察は、逆戻りする可能性が最大である、コカインの使用をやめてから約10週間後の窓を認識した。この重要な期間に助けとなる薬剤を開発することにより、外来患者の解毒プログラムの成功率を上昇させる必要があるのは明らかである。
現在、多くの治療法が、他の徴候のために開発されたCNS剤を用いることを検討している。試みられている薬剤としては、中でも、間接ドーパミン作用薬のアマンタジン、直接作用薬ブロモクリプチンで部分的ミューアヘン剤レセプタ作用薬のバプレノルフィン(buprenorphine)、および三環抗鬱薬であるデシプラミンが挙げられる。これらの薬剤は、ある状況の元で自己投与またはコカイン「切望」を抑制するように思われるけれども、これらの研究はまだ初期段階にあり、そのような治療の効力は確立されていない。
強化因子として機能する能力を含むコカインの行動特性は、ドーパミン(DA)の再摂取を阻害する能力に起因すると考えられている。コカインはまた、セロトニンおよびノルエピネフリンの摂取の阻害因子として機能し、シグマアヘン剤およびムスカリン様レセプタに結合する能力を有するけれども、自己投与研究におけるコカインおよび類似化合物の有効性は、それらのDA輸送体阻害因子活性と最もよく相関する。残念ながら、コカインがドーパミンの摂取を阻害する正確な機構はまだ確かではない。いくつかの研究所では、線条シナプトソーム中へのドーパミンの摂取のコカイン阻害が、伝統的な完全に競合な機構と一致することが示された。しかしながら、これらのデータは、アロステリックまたは部分的競合を含むより複雑なモデル、および立体障害、異なるが重複した部位および少なくとも一つがコカインとドーパミンの両方の結合に必要とされている多結合部位を含むいくつかの他のものとも一致する。さらに、50msecの分解能で摂取をモニタできる、回転ディスク電極ボルタンメトリーを用いた最近の研究は、コカインが、Na+およびCl-のキャリヤへの結合を競合的に遮断しながら、ドーパミンの摂取を非競合的に阻害することを示唆している。これらのデータは、他の実験アプローチを用いて確認されていないけれども、それらのデータはさらに、コカインおよびドーパミン結合部位が特異的であるという考えを支持している。
N−エチルマレイミド(NE)は、[3H]マチンドールの特異的結合の約95%を阻害することができ、300μMのドーパミンもd−アンフェタミンも著しい保護を与えなかったけれども、10mMのN−エチルマレイミドの効果は、10μMのコカインにより完全に妨げられる。さらに、ドーパミン輸送体の構造の最近の研究により、第一と第七の疎水性で推定の膜範囲領域内にあるアスパラギン酸およびセリンの残基がドーパミン摂取にとっては重要であるが、[3H]CFT(WIN-35428)結合に関してはそれほどではないことが分かった。例えば、第七の疎水性領域における位置356および359でのセリン残基のアラニンまたはグリシンによる置換により[3H]DA摂取が減少したけれども、[3H]CFT(WIN-35428)結合はそれほど影響を受けなかった。DAおよびNE輸送体キメラに関するごく最近の実験により、膜内外ドメイン6−8がコカイン結合を決定し、一方で、ドメイン9−12とカルボキシ尾部がDA結合親和性に影響を与えることが示された。したがって、これらのデータは、ドーパミン輸送体上のコカイン結合ドメインのかなりの部分が、ドーパミンまたはアンフェタミンいずれかのものとは異なるという仮説を支持している。この差異は、適切に処方された薬物が、ドーパミンの摂取を阻害せずにコカイン結合を妨げるのに十分であろう。
コカインの乱用を治療する最も期待できる薬剤は、コカインの効果を部分的にまねて、それにより、個人がコカインから徐々に手を引きながら治療プログラムを続けるのに役立つ能力を有する薬剤であろう。そのような薬剤は、アヘン剤の乱用の治療に広く用いられている薬物であるメタドンのように機能する。コカイン乱用に対するメタドン型活性を有する化合物は、コカインの部分的作用薬、すなわち、コカイン自体と同様の効果の内のいくつかを使用者内に誘発させるが、同程度の陶酔感は生じない物質となるであろう。理想的には、その化合物は、ほとんどまたは全く乱用の傾向がないべきである。
このように、コカイン乱用を治療するのに用いられる治療薬が現在必要とされている。
発明の概要
本発明は、化学式(I)の化合物:
であって、ここで、
YがNR6、−C(R4)(R5)−、または−O−であり;
R1が−C(=O)ORa、シアノ、(C1−C6)アルキル、(C1−C6)アルカノイル、(C2−C6)アルケニル、(C2−C6)アルキニル、またはWにより3の位置で必要に応じて置換された1,2,4−オキサジアゾール−5−イルであり、ここで、いずれの(C1−C6)アルキル、(C1−C6)アルカノイル、(C2−C6)アルケニル、(C2−C6)アルキニルが1,2または3Zにより必要に応じて置換されていてもよく、ここで、各々のZが独立してハロ、ニトロ、シアノ、ヒドロキシ、(C1−C6)アルコキシ、(C2−C6)アシルオキシ、C(=O)ORb、C(=O)NRcRd、NReRf、またはS(=O)nRgであり;そして、R3が(C6−C10)アリール、5−10員のヘテロアリール、(C6−C10)アリール(C1−C6)アルキル、5−10員のヘテロアリール(C1−C6)アルキル、(C6−C10)アリールカルボニル、または5−10員のヘテロアリールカルボニル、ここで、いずれのアリールまたはヘテロアリール置換基が1,2または3Zにより炭素上で必要に応じて置換されていてもよい;
もしくは、
R1が−CH2−、または−CH2CH2−であり、ここで、R1がR3のオルト位置で炭素に結合されており;そしてR3が(C6−C10)アリール、または5−10員のヘテロアリールであり;
R2が水素または(C1−C6)アルキルであり;
R4およびR5が独立して(C1−C6)アルキルであり;
R6が水素、(C1−C6)アルキル、(C1−C6)アルカノイル、またはS(O)2Rhであり;
nが0,1または2であり;
Wが、1,2または3Zにより必要に応じて置換された、(C1−C6)アルキル、またはフェニルであり;
RaからRgが独立して水素または(C1−C6)アルキルであり;そして
RhがH、(C1−C6)アルキル、またはフェニル;もしくは薬学的に受け入れられるそれらの塩である。
意外なことに、化学式(I)の化合物がコカインの結合性に匹敵する結合性でコカイン認識部位に結合でき;さらに、その化合物は、ドーパミン摂取の有力な阻害因子として機能することが分かった。ラットにおける薬物識別研究において、そのような化合物がほんの弱いコカイン様およびアンフェタミン様効果しか示さないことが観察された。このように、本発明の化合物は、コカインの特色のある刺激効果を部分的にまねているように思われる。ラットを用いて行われた静脈の薬物自己投与研究から得られた結果にも留意する。これらの研究において、コカインを自己投与するように訓練された動物は、本発明の化合物を自己投与しなかった。運動活性研究において、この化合物は、弱い運動刺激効果を有することが分かった。これらの特性を有する化合物は、薬物乱用を治療するため、もしくはドーパミンまたはセロトニンの摂取を調節することが望ましい疾患を治療するために有用であろう。
本発明はまた、ここに記載した化学式Iの化合物、または薬学的に受け入れられるその塩を、薬学的に受け入れられる希釈剤またはキャリヤと共に含む薬剤組成物を提供する。
本発明はまた、薬学的に効果的な投与量の化学式Iの化合物;または薬学的に受け入れられるその塩を投与することにより、ヒトにおける薬物(例えば、コカイン)中毒を治療することを含む方法を提供する。
本発明はまた、ドーパミンまたはセロトニンの活性が関係し、ドーパミンまたはセロトニンの再摂取の調節が望ましい哺乳類の病気または状態(例えば、パーキンソン病または鬱病)を治療する方法であって、化学式Iの化合物;または薬学的に受け入れられるその塩を投与することを含む方法を提供する。
本発明はまた、医学治療または診断に使用するための、化学式Iの化合物;または薬学的に受け入れられるその塩を提供する。
本発明はまた、薬物(例えば、コカイン)中毒、パーキンソン病、または鬱病を治療するのに有用な薬剤を調製するための、化学式Iの化合物;または薬学的に受け入れられるその塩の使用法を提供する。
本発明はまた、放射性核種および化学式Iの化合物;または薬学的に受け入れられるその塩を含む放射性標識付き化合物、並びにそのような放射性標識付き化合物をイメージング剤(imaging agent)(例えば、ヒトのような哺乳類の脳内の神経伝達物質結合部位を同定する、またはその機能を評価するためのもの)として使用する方法を提供する。
本発明はまた、化学式Iの化合物を、ドーパミンレセプタを含む哺乳類の組織に、インビボまたはインビトロで、そのレセプタに結合するのに効果的な量の化学式Iの化合物をその組織と接触させることにより結合させる方法を提供する。化学式Iの化合物が結合したドーパミンレセプタを含む組織は、薬物器具として用いられ、ドーパミン機能と関連する病気または状態を治療するための潜在的な治療薬を、この治療薬を組織と接触させ、化学式Iの化合物の置換および/またはこの治療薬の結合の程度を測定することにより、同定することができる。化学式Iの化合物が結合したドーパミンレセプタを含む組織を用いて、概して、神経伝達物質の生理学的機能を解明することができる。
【図面の簡単な説明】
図1−10は、本発明の代表的な化合物の合成を説明している。
発明の詳細な説明
別記しない限り、以下の定義を使用する:ハロは、フルオロ、クロロ、ブロモ、またはヨードである。アルキル、アルコキシ、アルケニル、アルキニル等は、直鎖および枝分れの基の両方を示すが、「プロピル」のような個々の基の言及は直鎖の基のみを包含し、「イソプロピル」のような枝分れ鎖の異性体は特に言及される。アリールは、フェニル基、または少なくとも一つの環が芳香族である、約9から10の環原子を有するオルト縮合二環炭素環式基を示す。ヘテロアリールは、炭素と、非過酸化物の酸素、硫黄、およびXがないかまたはH,O,(C1−C4)アルキル、フェニルまたベンジルであるN(X)からなる群より各々が選択される1から4のヘテロ原子とからなる5または6の環形成原子を含有する単環芳香族環の環形成炭素を介して結合した基、並びにそこから誘導された約8から10の環形成原子のオルト縮合二環ヘテロ環の基、特に、ベンズ誘導体もしくはプロピレン、トリメチレンまたはテトラメチレンのジラジカルをそこに縮合することにより誘導したものを包含する。
キラル中心を有する本発明の化合物は、光学的に活性なラセミ形態にあり、その形態で単離されるかもしれないことが当業者に認識される。ある化合物は、多型性を示すかもしれない。本発明は、ここに記載された有用な特性を有する、本発明の化合物の、いかなるラセミ、光学的活性、多型性、または立体異性形態、またはその混合物も包含し、光学活性形態を調製する方法(例えば、再結晶化技術によるラセミ形態の分割により、光学活性の出発材料からの合成により、キラル合成により、またはキラル固定相を用いたクロマトグラフ分離により)および上述した標準的試験を用いて、または従来技術でよく知られている他の同様な試験を用いて、前記化合物の関連する薬物特性を決定する方法が従来技術でよく知られているのが理解されている。
基、置換、および範囲について上述した値は、説明のためのみであり、それらは、他に定義された値または前記基および置換の定義された範囲内の他の値を排除するものではない。
特に、(C1−C6)アルキルは、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、第二ブチル、ペンチル、3−ペンチル、またはヘキシルであって差し支えなく;(C1−C6)アルコキシは、メトキシ、エトキシ、プロポキシ、イソプロポキシ、ブトキシ、イソブトキシ、第二ブトキシ、ペントキシ、3−ペントキシ、またはヘキソキシであって差し支えなく;(C2−C6)アルケニルは、ビニルまたはアリルであって差し支えなく;(C2−C6)アルキニルは、エチニル、1−プロピニル、または3−プロピニルであって差し支えなく;(C1−C6)アルカノイルは、アセチル、プロパノイルまたはブタノイルであって差し支えなく;(C2−C6)アシルオキシは、アセトキシ、エチルカルボニルオキシまたはプロピルカルボニルオキシであって差し支えない。同様に、アリールは、フェニル、インデニル、またはナフチルであって差し支えない。ヘテロアリールは、フリル、イミダゾリル、テトラゾリル、ピリジル(またはそのN−酸化物)、チエニル、ピリミジニル(またはそのN−酸化物)、インドリル、またはキノリル(またはそのN−酸化物)であって差し支えない。
Yの特定の値はNR6であり、ここで、R6は、水素、(C1−C6)アルキルまたは(C1−C6)アルカノイルである。
R1の特定の値は、1,2または3Zにより必要に応じて置換されていてもよい、(C1−C6)アルキルである。R1の別の特定の値は、−C(=O)ORa、シアノ、(C1−C6)アルキル、(C1−C6)アルカノイル、(C2−C6)アルケニル、(C2−C6)アルキニル、またはWにより3の位置で必要に応じて置換された1,2,4−オキサジアゾール−5−イルである。R1の別の特定の値は、シアノ、(C1−C6)アルキル、(C1−C6)アルカノイル、(C2−C6)アルケニル、(C2−C6)アルキニル、またはWにより3の位置で必要に応じて置換された1,2,4−オキサジアゾール−5−イルである。R1の別の特別な値は、(C1−C6)アルキル、(C2−C6)アルケニル、または(C2−C6)アルキニルである。R1の別の特定の値は−C(=O)ORaであり、ここで、Raは(C1−C4)アルキルである。
R2の特定の値は水素である。
R3の特定の値はベンジルであり、ここで、フェニル環が、1,2または3Zにより炭素上で必要に応じて置換されていてもよい。R3の別の特定の値はフェネチルであり、ここで、フェニル環が、1,2または3Zにより炭素上で必要に応じて置換されていてもよい。R3の別の特定の値は、5−10員のヘテロアリール、または5−10員のヘテロアリール(C1−C4)アルキルであり、ここで、いずれのヘテロアリール置換基が、1,2または3Zにより炭素上で必要に応じて置換されていてもよい。R3の別の特定の値は、(C6−C10)アリール、(C6−C10)アリール(C1−C6)アルキル、または(C6−C10)アリールカルボニルであり、ここで、いずれのアリール置換基が、1,2または3Zにより炭素上で必要に応じて置換されていてもよい。
特に、R4およびR5は各々独立して水素である。
R6の特定の値は、水素、(C1−C6)アルキルまたは(C1−C6)アルカノイルである。R6の別の特定の値はメチルまたはエチルである。R6の別の特定の値は水素である。
Raの特定の値はメチルまたはエチルである。
化合物の特定の群は、R1が、Wにより3の位置で必要に応じて置換された、2,4−オキサジアゾール−5−イルである化学式Iの化合物である。
化合物の別の特定の群は、R1が−C(=O)ORa、シアノ、(C1−C6)アルキル、(C1−C6)アルカノイル、(C2−C6)アルケニル、(C2−C6)アルキニル、またはWにより3の位置で必要に応じて置換された1,2,4−オキサジアゾール−5−イルであり、ここで、いずれの(C1−C6)アルキル、(C1−C6)アルカノイル、(C2−C6)アルケニル、(C2−C6)アルキニルが1,2または3Zにより必要に応じて置換されていてもよく、ここで、各々のZが独立してニトロ、シアノ、(C1−C6)アルコキシ、(C2−C6)アシルオキシ、C(=O)ORb、C(=O)NRcRd、またはS(=O)nRgであり;そして、R3が(C6−C10)アリール、5−10員のヘテロアリール、(C6−C10)アリール(C1−C6)アルキル、5−10員のヘテロアリール(C1−C6)アルキル、(C6−C10)アリールカルボニル、または5−10員のヘテロアリールカルボニル、ここで、いずれのアリールまたはヘテロアリール置換基が1,2または3Zにより炭素上で必要に応じて置換されていてもよく;もしくは、R1が−CH2−、または−CH2CH2−であり、ここで、R1がR3のオルト位置で炭素に結合されており;そしてR3が(C6−C10)アリール、または5−10員のヘテロアリール;または薬学的に受け入れられるその塩;R3がフェニルではないとすると、R1がメトキシカルボニルまたはアセトキシメチルのときに、R2が水素であり、YがNR6であり、R6がメチルである化学式Iの化合物である。
化合物の別の特別な群は、R1が−C(=O)ORa、シアノ、(C1−C6)アルキル、(C1−C6)アルカノイル、(C2−C6)アルケニル、(C2−C6)アルキニル、またはWにより3の位置で必要に応じて置換された1,2,4−オキサジアゾール−5−イルであり、ここで、いずれの(C1−C6)アルカノイル、(C2−C6)アルケニル、(C2−C6)アルキニルが1,2または3Zにより必要に応じて置換されていてもよく、ここで、各々のZが独立してハロ、ニトロ、シアノ、ヒドロキシ、(C1−C6)アルコキシ、(C2−C6)アシルオキシ、C(=O)ORb、C(=O)NRcRd、NReRf、またはS(=O)nRgであり;そして、R3が(C6−C10)アリール、5−10員のヘテロアリール、(C6−C10)アリール(C1−C6)アルキル、5−10員のヘテロアリール(C1−C6)アルキル、(C6−C10)アリールカルボニル、または5−10員のヘテロアリールカルボニル、ここで、いずれのアリールまたはヘテロアリール置換基が1,2または3Zにより炭素上で必要に応じて置換されていてもよく;もしくは、R1が−CH2−、または−CH2CH2−であり、ここで、R1がR3のオルト位置で炭素に結合されており;そしてR3が(C6−C10)アリール、または5−10員のヘテロアリール;または薬学的に受け入れられるその塩;R3がフェニルではないとすると、R1がメトキシカルボニルのときに、R2が水素であり、YがNR6であり、R6がメチルである化学式Iの化合物である。
化合物の別の特定の群は、Yが−C(R4)(R5)−、または−O−である化学式Iの化合物;または薬学的に受け入れられるその塩である。
化合物の別の特定の群は、R1が−C(=O)ORa、シアノ、(C1−C6)アルキル、(C1−C6)アルカノイル、(C2−C6)アルケニル、(C2−C6)アルキニル、またはWにより3の位置で必要に応じて置換された1,2,4−オキサジアゾール−5−イルであり;そして、R3が(C6−C10)アリール、5−10員のヘテロアリール、(C6−C10)アリール(C1−C6)アルキル、5−10員のヘテロアリール(C1−C6)アルキル、(C6−C10)アリールカルボニル、または5−10員のヘテロアリールカルボニル、ここで、いずれのアリールまたはヘテロアリール置換基が1,2または3Zにより炭素上で必要に応じて置換されていてもよく;もしくは、R1が−CH2−、または−CH2CH2−であり、ここで、R1がR3のオルト位置で炭素に結合されており;そしてR3が(C6−C10)アリール、または5−10員のヘテロアリール;または薬学的に受け入れられるその塩;R3がフェニルではないとすると、R1がメトキシカルボニルのときに、R2が水素であり、YがNR6であり、R6がメチルである化学式Iの化合物である。
化合物の特定の群は、R1が−C(=O)ORa、シアノ、(C1−C6)アルキル、(C1−C6)アルカノイル、(C2−C6)アルケニル、または(C2−C6)アルキニルであり、ここで、いずれの(C1−C6)アルキル、(C1−C6)アルカノイル、(C2−C6)アルケニル、(C2−C6)アルキニルが1,2または3Zにより必要に応じて置換されていてもよく、ここで、各々のZが独立してハロ、ニトロ、シアノ、ヒドロキシ、(C1−C6)アルコキシ、(C2−C6)アシルオキシ、C(=O)ORb、C(=O)NRcRd、NReRf、またはS(=O)nRgであり;そしてR3が、1,2または3Zにより炭素上で必要に応じて置換されていてもよいフェニルである化学式Iの化合物である。
R3の好ましい値は、4−クロロフェニル、4−フルオロフェニル、4−メチルフェニル、または4−イソプロペニルフェニルである。
化合物の好ましい群は、R1およびR3がトランス形状にある化学式Iの化合物である。
化合物の好ましい群は、YがNR6であり;R1が、メトキシカルボニル、(C1−C6)アルキル、またはアセトキシメチルであり;R2が水素であり;R3が、4−クロロフェニル、4−フルオロフェニル、4−メチルフェニル、または4−イソプロペニルフェニルであり;R6がメチルである化学式Iの化合物;または薬学的に受け入れられるその塩である。
好ましい化合物は、(+)−メチル4β−(4−クロロフェニル)−1−メチルピペリジン−3α−カルボキシレート;または薬学的に受け入れられるその塩である。
別の好ましい化合物は、(−)4β−(4−クロロフェニル)−1−メチル−3β−n−プロピルピペリジン;または(+)4β−(4−クロロフェニル)−1−メチル−3α−n−プロピルピペリジン;または薬学的に受け入れられるその塩である。
化学式Iの化合物を調製するのに有用な工程および中間体が、本発明のさらなる実施の形態として提供されており、以下の方法により説明される。
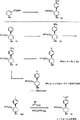
図1に示したように、ラセミピペリジン1および2を、非置換フェニルピペリジン類似化合物の合成に関するPlatiにより報告されたものに類似した化学反応を用いて臭化水素酸アレコリンから出発して調製した(Plati,J.T.; Ingberman,A.K.; Wenner,W.Pyrilinden Derivatives. III. Synthesis from Arecoline. J.Org.Chem. 1957,22,261-265)。
このようにして、アレコリンの臭化水素酸塩を重炭酸ナトリウムにより遊離塩基に転化させ、この中間体に、臭化p−クロロフェニルマグネシウムを用いてグリニャール反応を施した。シスおよびトランスの二置換ピペリジン1および2の混合物を75/25の比率で生成した。このシス誘導体は、溶剤としてEtOAc/ヘキサンを用いて原材料の結晶化により得た。ラセミトランスピペリジンは、母剤の液体のフラッシュクロマトグラフィーにより容易に得られた。
そのシスエステルは、(+)−および(−)−ジベンゾイル酒石酸を用いて溶解させて、純粋な鏡像体(−)−3および(+)−4を得た(Law,H.; Leclerc,G.A.; Neumeyer,J.L. An efficient and inexpensive resolution of the potent dopaminergic substance 3-(3-Hydroxyphenyl)-N-(1-propyl)-piperidine(±)-3-PPP. Tetrahedron Asymm. 1991,2,989-992)。(−)ジベンゾイル酒石酸および1から形成された塩のX線構造決定を用いて、図1に示した(−)−3の絶対立体化学を決定した。明らかなように、(−)−異性体の絶対立体化学は、WIN系の構造に見られるものに対応している。
光学的に純粋な(+)−および(−)−シスエステルを、水素化リチウムアルミニウム反応により、それぞれのアルコール(−)−5および(+)−6に転化し、これらのアルコールをピリジンの存在下で無水酢酸によりアクリル化して、酢酸誘導体(−)−7および(+)−8を得た。R1がプロピルである化合物9をアルコール5から、前記無水物への酸化と、続いて、ウィティッヒ反応および触媒水素化とにより調製した。化合物10を前記シスピペリジン(−)−3から、大気圧でメタノール中の木炭の表面にある10%のパラジウム上での水添分解により調製した。
(±)−2およびジベンゾイル酒石酸から満足な結晶を得るのが難しかったので、化合物(+)−11および(−)−12を、図2に示すように化合物(−)−3および(−)−4の塩基触発エピ化により調製した。より活性的な異性体(+)−11を、テトラヒドロフラン中の水素化リチウムアルミニウムによる還元により、対応するアルコール(+)−13に転化した。アルコール(+)−13の無水酢酸およびピリジンとのアクリル化により酢酸エステル(+)−14を得た。n−プロピル誘導体(+)−15を、アルコール(+)−13の酸化と、それに続いて臭化エチルトリフェニル−ホスホニウムを用いたグリニャール反応と、その後の炭素表面の5%の白金上の水素化により調製した。
図3に示したように、R2が(C1−C6)アルキルであり、R1が−C(=O)ORaまたはシアノである化学式Iの化合物は、R2が水素である化学式Iの対応する化合物から、脱プロトンと、それに続くアルキル化により調製することができる。
図4に示したように、R3が置換フェニルである化学式Iの化合物は、以下の記載された方法と類似の方法を用いて調製することができる:Carroll,F.E., Gao,Y., Rahman,M.A., Abraham,P., Parham,K., Lewin,A.H., Boja,J.W., and Kuhar, M.J.(1991)Synthesis, ligand binding, QSAR and CoMFA study of 3b-(p-substituted phenyl)tropane-2 b-carboxylic acid methyl esters. J.Med.Chem.,34,2719-2725; or Blough,B.E., Abraham,P., Lewin,A.H., Kuhar,M.J., Boja,J.W., and Carroll,F.I.(1996)Synthesis and transporter binding properties of 3b-(4’alkyl-, 4’-alkenyl, and 4’-alkynylphenyl)nortropane-2b-carboxylic acid methyl esters: serotonin transporter selective analogs. J.Med.Chem.,39,4027-4035。アレコリンのエーテル中の臭化4−トリフルオロメチルフェニルマグネシウムによる処理と、それに続く得られた異性体のクロマトグラフ分離により、化合物18が得られる。化合物19のテトラフルオロ臭化ニトロニウムによるニトロ化で、ニトロ化合物20が得られ、これは、ラニー(Rany)Niで還元して、アミン21を得ることができる。アミン21のHONOと、その後の臭化銅(I)、ヨウ化カリウムまたはアジ化ナトリウムによる処理により、化合物22a−cが得られる。アミン21の塩化アセチルまたはクロロギ酸エチルによる処理により、アミド23aまたはカルバメート23bが得られる。さらに、ヨウ化アリール22bをパラジウム触媒の塩化ビス(トリフェニルホスフィン)パラジウム(II)の存在下で塩化イソプロペニル亜鉛により処理して、イソプロペニル化合物24を得ることができる。
図5に示したように、R1が−CH2−、または−CH2CH2−であり、R1がR3のオルト位置にある炭素に結合しており、R3が(C6−C10)アリール、または5−10員のヘテロアリールである化学式Iの化合物は、R1が−C(=O)ORaである対応する化合物から調製することができる。メチルアミン25のクロロギ酸1−クロロエチルおよびメタノールと、それに続くピリジン中の塩化p−トルエンスルホニルによる処理により、トシルアミド26が得られる。このエステルの水素化リチウムアルミニウムによる還元と、それに続くPBr3による処理およびAlCl3による環状化により、HBr/HOAcによる処理により保護を外し、水酸化ナトリウムおよびホルムアルデヒドによる処理と、それに続く、シアノホウ水素化ナトリウムによる還元によりメチルアミン28に転化できる三環化合物が得られる。
図6に示したように、YがCH2−または−O−である化学式Iの化合物は、YがNR6である対応する化合物の調製に関して上述した方法に類似の方法を用いて、適切なジヒドロピラン−3−カルボキシレートまたはシクロヘキサンカルボキシレートから調製できるであろう。
図7に示したように、R6が(C1−C6)アルキルまたは(C1−C6)アルカノイルである化学式Iの化合物(33)は、R6がメチルである化学式Iの化合物から、メタノールを還流して、アミン32を得るACECIによる処理と、標準的な条件を用いたこのアミンのアルキル化またはアクリル化により調製することができる。
図8に示したように、化学式Iの放射性標識付き化合物は、放射性標識付き化合物(例えば、IC[3H])による化学式32のアミンのアルキル化により調製することができる。
図9に示したように、R1が(C1−C6)アルキル、(C2−C6)アルケニル、または(C2−C6)アルキニルである化学式Iの化合物は、Kozikowski,A.P., Saiah,M.K.E., Johnson,K.M., and Bergmann,J.S.(1995)Chemistry and biology of the 2b-alkyl-3b-phenyl analogues of cocaine: subnanomolar affinity ligands that suggest a new pharmacophore model at the C-2 position. J.Med.Chem.,38,3086-3093に記載された方法と同様の方法を用いて調製することができる。エステル11のDIBALによる還元と、その後の酸化により、アルデヒド42が得られる。化合物42のグリニャール試薬による処理により、化学式43のアルケンが得られる。これは、炭素表面の白金上での水素により還元して、化学式44のアルカンが得られる。
図10に示したように、R1がオキサジアゾイルである化学式Iの化合物は、R1が−C(=O)ORaである化学式Iの化合物中のエステル基の酸への転化と、その後の、酸塩化物の形成と、Kotian,P., Mascarella,S.W., Abraham,P., Lewin,A.H., Boja,J.W., Kuhar,M.J. and Carroll,F.I.(1996)Synthesis, ligand binding, and quantitative structure-activity relationship study of 3b-(4’-substituted phenyl)-2b-heterocyclic tropanes: evidence for an electrostatic interaction at the 2b-position. J.Med.Chem.,39,2753-2763に記載された適切なアミドオキシムとの反応により、調製することができる。
上述した合成方法に用いた出発材料は、市販されているか、または技術文献に報告されており、化学式Iのある化合物は、化学式Iの他の化合物を調製するための中間体として有用であることに留意する。
化合物が安定な非毒性の酸または塩基の塩を形成するのに十分に塩基性または酸性である場合には、その化合物の塩としての投与が適切であろう。薬学的に受け入れられる塩の例としては、生理学的に受け入れられる陰イオンを形成する酸により形成された有機酸付加塩、例えば、トシル酸塩、メタンスルホン酸塩、酢酸塩、クエン酸塩、マロン酸塩、酒石酸塩、琥珀酸塩、安息香酸塩、アスコルビン酸塩、α−ケトグルタル酸塩、およびα−グリセロリン酸塩である。塩酸塩、硫酸塩、硝酸塩、重炭酸塩、および炭酸塩を含む無機酸の適切な酸付加塩を形成してもよい。
薬学的に受け入れられる塩は、従来技術でよく知られた標準的な方法を用いて、例えば、アミンのような十分に塩基性の化合物を生理学的に受け入れられる陰イオンを与える適切な酸と反応させることにより得てもよい。カルボン酸のアルカリ金属(例えば、ナトリウム、カリウムまたはリチウム)またはアルカリ土類金属(例えば、カルシウム)の塩を作成しても差し支えない。
この化学式Iの化合物は、薬学的組成物として配合し、ヒトの患者のような哺乳類の宿主に、選択された投与経路、すなわち、経口または静脈、筋肉内、局所または皮下経路による非経口の経路に適合した様々な形態で投与することができる。
したがって、本発明の化合物は、全身に、例えば、不活性希釈剤または吸収性食用キャリヤのような薬学的に受け入れられるビヒクルと共に、経口により投与してもよい。それら化合物は、硬いまたは軟らかい殻のゼラチンカプセル内に包まれても、タブレットに圧縮されていても、または直接的に患者の規定食の食品に含まれていてもよい。経口の治療投与に関しては、活性化合物を一つ以上の賦形剤と組み合わせ、経口摂取可能なタブレット、舌下タブレット、トローチ、カプセル、エリキシール、懸濁液、シロップ、ウエハ等の形態で用いてもよい。そのような組成物および製剤は、少なくとも0.1%の活性化合物を含有すべきである。その組成物および製剤の百分率は、もちろん変更してもよく、都合よく所定の単位供与量形態の重量の約2%から約60%までの間であってよい。そのような治療に有用な組成物中の活性化合物の量は、効果的な供与量レベルが得られるようなものである。
これらのタブレット、トローチ、ピル、カプセル等は、以下のものを含有していてもよい:ガムトラガカント、アカシア、トウモロコシデンプンまたはゼラチンのような結合剤;リン酸二カルシウムのような賦形剤;トウモロコシデンプン、ジャガイモデンプン、アルギン酸等のような崩壊剤;ステアリン酸マグネシウムのような潤滑剤;およびショ糖、果糖、乳糖またはアスペルテームのような甘味剤またはペパーミント、冬緑油の香味、またはチェリー味の調味料を加えてもよい。単位供与量形態がカプセルである場合、上述した材料に加えて、植物油またはポリエチレングリコールのような液体キャリヤを含有してもよい。様々な他の材料が、コーティングとして、または固体の単位供与量形態の物理的形態を別な様式で改良するために存在していてもよい。例えば、タブレット、ピル、またはカプセルを、ゼラチン、ワックス、セラックまたは砂糖等により被覆してもよい。シロップまたはエリキシールは、活性化合物、ショ糖または果糖を甘味剤として、メチルおよびプロピルパラベンを保存剤として、染料およびチェリー味やオレンジ味のような調味料を含有していてもよい。もちろん、いかなる単位供与量形態の調製に使用する材料も、薬学的に受け入れられ、使用する量で実質的に非毒性であるべきである。さらに、活性化合物は、維持放出薬剤および装置中に含まれていてもよい。
活性化合物は、点滴または注射により静脈または腹腔内に投与してもよい。活性化合物またはその塩の溶液を、水中で、必要に応じて非毒性界面活性剤と混合して調製しても差し支えない。分散剤を、グリセロール、液状ポリエチレングリコール、トリアセチン、およびその混合物並びに油中で調製しても差し支えない。通常の貯蔵および使用条件下で、これらの薬剤は、微生物の増殖を防ぐ保存剤を含有する。
注射または点滴に適した薬学供与量形態としては、必要に応じてリポソーム中にカプセル化された、無菌の注射用または点滴用の溶液または分散体の即時調製に適用された活性成分を含む、無菌の水溶液または分散体もしくは無菌の粉末が挙げられる。全ての場合において、最終的な供与量形態は、製造および貯蔵の条件下で、無菌であり、流動性であり、安定でなければならない。液状キャリヤまたはビヒクルは、例えば、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール、液状ポリエチレングリコール等)、植物油、非毒性グリセリルエステル、およびその適切な混合物を含む、溶剤または液状分散媒体であって差し支えない。適切な流動性は、例えば、リポソームの形成により、分散体の場合の必要な粒径の維持により、または界面活性剤の使用により維持することができる。微生物の活動は、様々な抗菌剤および抗真菌剤、例えば、パラベン、クロロブタノール、フェノール、ソルビン酸、チメロサール等により妨げることができる。多くの場合、等張剤、例えば、砂糖、緩衝液または塩化ナトリウムを含むことが好ましい。注射可能な組成物は、吸収を遅らせる薬剤、例えば、モノステアリン酸アルミニウムおよびゼラチンを組成物中に含めることにより、長期に亘り吸収させることができる。
無菌の注射可能な溶液は、適切な溶剤中に必要な量の活性化合物を、必要な場合、上述した他の成分とともに含ませて、その後、フィルタ殺菌を行うことにより調製される。無菌の注射可能な溶液を調製するための無菌粉末の場合には、好ましい調製方法は、真空乾燥と凍結乾燥技術であり、これにより、活性成分に、以前の無菌フィルタ溶液中に存在する追加の所望の成分が加わった粉末が得られる。
局所投与に関して、本発明の化合物を、純粋な形態、すなわち、それらが液体であるときに施してもよい。しかしながら、それら化合物を、固体または液体であってもよい、皮膚科学的に受け入れられるキャリヤと共に、組成物または配合物として皮膚に投与することが、一般的に望ましい。
化学式Iの化合物の有用な供与量は、それらのインビトロの活性、および動物モデル中のインビボの活性を比較することにより決定することができる。マウス、および他の動物中の効果的な供与量のヒトへの外挿法が従来技術において知られている。例えば、米国特許第4,938,949号を参照のこと。
一般的に、ローションのような液体組成物中の化学式Iの化合物の濃度は、約0.1-25重量%、好ましくは約0.5-10重量%である。ゲルまたは粉末のような半固体または固体の組成物中の濃度は、約0.1-5重量%、好ましくは約0.5-2.5重量%である。注射、点滴または経口摂取のための一回の供与量は、一般的に、50-1500mgの間で変動し、一日一回から三回投与して、大人に関して約0.5-50mg/kgのレベルとしてもよい。
本発明の化合物は、放射性核種で標識付けられた場合、イメージング剤として用いてもよい。図9に示したように、放射性核種(トリチウム、ヨウ素-125、ヨウ素-131、ヨウ素-123、アスタチン-210、炭素-11、炭素-14、窒素-13、フッ素-18のような)を、ハロゲン化によるように、コア構造中に含ませるか、または直接その構造に結合させてもよい。あるいは、放射性核種(Tc-99m、Re-186のような)は、結合基に結合しても、後に化学式Iの化合物に直接結合されるキレート基により、またはリンカーを用いて結合させてもよい。これらのような放射性標識付け技術は、放射性医薬品化学において日常的に用いられている。
本発明の放射性標識付き化合物は、一般的に、神経病(例えば、神経退行性変性病)または精神状態を診断するための、もしくは哺乳類(例えば、ヒト)におけるそのような病気または状態の進行または治療を追跡するためのイメージング剤として有用である。本発明の放射性標識付き化合物は、陽電子射出断層撮影(PET)または単一光子射出計算機断層撮影(SPECT)のようなイメージング技術と組み合わせて都合よく用いることができる。
本発明の化合物の薬理学的活性は、従来技術において知られている標準的な薬理学的モデルを用いて示すことができるか、もしくは以下に記載されまたは引用されるモデルを用いて示すことができる。
本発明の代表的な化合物1−15を、Boja et al. Mol Pharmacol. 1991,39,339により以前に記載された処方にしたがって、ネズミ線条体膜からの[3H]WIN-35428結合を置換する能力およびネズミ線条体神経末端(シナプトソーム)中に[3H]ドーパミンの高親和性摂取を阻害する能力について試験した。これらのアッセイの結果が表1に示されている。
神経輸送体(Neurotransporters)で結合する類似化合物
類似化合物のドーパミン、セロトニン、およびノルエピネフリン輸送体での阻害的結合力の測定は、従来技術で知られている標準的な受容体結合アッセイを用いて行うことができる。
A.ドーパミン輸送体結合
ドーパミン輸送体は、Boja,J.W., Rahman,M.A., Philip,A., Lewin,A.H., Carroll,F.I. and Kuhar,M.J.(1991)Isothiocyanate derivatives of cocain: Irreversible of ligand binding at the dopamine tranporter.Mol Pharmacol.,39,339に記載された方法を用いてアッセイすることができる。
B.セロトニン輸送体結合
セロトニン輸送体への[3H]結合の阻害は、以前に発表された方法にしたがってアッセイすることができる:Boja,J.W., Rahman,M.A., Philip,A., Lewin,A.H., Carroll,F.I. and Kuhar,M.J.(1991)Isothiocyanate derivatives of cocain: Irreversible of ligand binding at the dopamine tranporter. Mol Pharmacol.,39,339。
C.ノルエピネフリン輸送体結合
ノルエピネフリン輸送体への結合は、Carroll,F.I., Grey,J., Abraham,P., Kuzemko,M.A., Lewin,A.H., Boja,J.W., and Kuhar,M.J.(1993)3-Aryl-2-(3’-substituted-1’,2’,4’-oxadiazole-5’-yl)tropane analogues of cocaine: Affinities at the cocaine binding site at the dopamine, serotonin, and norepinephrine transporters. J.Med Chem.,36,2886-2890により記載された方法を用いてアッセイすることができる。
摂取研究
A.[ 3 H]ドーパミン摂取研究
[3H]ドーパミン摂取の阻害は、Boja,J.W., Mcneil,R.M., Lewin,A.H., Abraham,P., Carroll,F.I., and Kuhar,M.J.(1992)Selective dopamine transporter inhibition by cocaine analogs. Neuroreport,3,984の方法を用いて測定することができる。
B.[ 3 H]セロトニン摂取研究
[3H]セロトニン摂取の阻害は、新鮮なネズミの後脳組織中で測定することができる。そのアッセイは、いくつかの点を変更して、上述したように行うことができる。最終的な組織濃度は約2mg/mLとなり、最終[3H]セロトニン濃度は5.0nMとなる。[3H]セロトニンの非特異的摂取は、1μMのシターロプラム(citalopram)を用いて定義することができる。
C.[ 3 H]ノルエピネフリン摂取研究
[3H]ノルエピネフリン摂取の阻害は、新鮮なネズミの皮質中で測定することができる。そのアッセイは、いくつかの点を変更して、[3H]ドーパミン摂取の研究について記載したものと同様の様式で行うことができる。最終的な組織濃度は約10mg/mLとなり、最終[3H]ノルエピネフリン濃度は5.0nMとなる。[3H]ノルエピネフリンの非特異的摂取は、1μMのデシプラミンを用いて定義することができる。
静脈安全性
コカインおよび多数の他のトロパン類似化合物は、ノルエピネフリン再摂取の有力な阻害因子であり、局所的な麻酔作用を有している。これらの特性は、心臓血管と中枢神経系の毒性にとって重要な可能性を示すであろう。
ドーパミン輸送体に関して10μMより大きい親和性を有する試験化合物は、以前に発表された方法にしたがって、静脈安全性についてネズミ内で試験することができる:Tella,S.R., Korupolu,G.R., Schindler,C.W., and Goldberg,S.R.(1992)Pathophysiological and pharmacological mechanisms of acute cocaine toxicity in conscious rats. J.Pharmacol.Exp.Ther.,262,936-946。
行動試験
A.行動活性
化合物2の行動効果を、以前に発表された方法にしたがって、オスのSwiss Websterマウスを用いて評価した:Izenwasser,S., Terry,P., Heller,B., Witkin,J.M., and Katz,J.L.(1994)Differential relationships among dopamine transporter affinities and stimulant potencies of various uptake inhibitors. Eur.J.Pharmacol.,263,277-283。
コカイン(10mg/kg,i.p.)は、Sprague-Dawleyネズミにおける生理食塩水の対照応答と比較して、移動した距離および常同挙動が著しく増大した(P<0.05)。コカインとは対照的に、ピペリジン類似化合物2(3-20mg/kg,i.p.)では、移動距離は代わらなかった。しかしながら、ピペリジン2は、10および20mg/kgの供与量で、常同回数がわずかに統計学的に著しくなく増加した。経時データは、常同挙動のこのわずかな増加が、この薬物の注射後90分で永続的であるが、コカインに対する常同応答は、この期間で減少する明白な傾向があったことを示している。したがって、ピペリジン類似化合物に対する小さな挙動応答は、コカインのものよりも長く持続するようである。このピペリジン類似化合物の高供与量の移動効果は、これらの供与量では変動を示したので、試験しなかった。
B.薬物の識別
化合物2を、Callahan,P.M., Bryan,S.K., and Cunningham,K.A.(1995)Discrimination stimulus effects of cocaine: antagonism by dopamine D1 receptor blockade in the amygdala. Pharmacol.Biochem,Behav.,51,759-766に記載された薬物識別方法において評価した。
置換試験において、アンフェタミン投与は、アンフェタミンの識別刺激効果について供与量依存性で完全な置換を生じたが、ピペリジン類似化合物2の投与により、最大で53%のアンフェタミンレバー応答が得られた。応答率は、アンフェタミンおよびピペリジン類似化合物2の全ての試験供与量に亘りかなり安定のままであった。
コカイン(1.25-10mg/kg)の投与により、コカイン特殊応答が供与量に関連して増大したが、ピペリジン類似化合物2(5および20mg/kg)は、最大で40%のコカインレバー応答を生じた。ピペリジン類似化合物2(5および20mg/kg)後の応答率は、コカイン(10mg/kg)投与後に観察された率よりも実質的に低かった。ピペリジン類似化合物2(10mg/kg)とコカイン(1.25および5mg/kg)の共投与(データは示さず)は、1.25および5mg/kgのコカイン単体の投与後に関されたものから、薬物の選択[F(1.7)=1.35,p=0.28]または応答率の成績[F(1.7)=4.84,p=0.06]を著しくは変更しなかった。この結果は、コカインの供与量応答関数において左側へのシフトを生ずることが知られている他のドーパミン摂取阻害因子とは対照的である。これらの結果は、ピペリジン類似化合物は、コカインの識別刺激効果の増大を欠如している点で他の摂取阻害因子とは異なることを示している。
C.静脈薬物自己投与
化合物2および3を、Tella,S.R., Ladenheim,B., Andrew,A.M., Goldberg,S.R., and Cadet,J.L.(1996)Differential reinforcing effects of cocaine and GBR-12909: Biochemical evidence for divergent neuroadaptive changes in the medolimbic dopaminergic system. J.Neurosci.,16,7416-7427により記載された静脈薬物自己投与を用いて評価した。
ネズミを最初に、標準的な操作箱中に食品ペレットのためにテコプレスするように訓練した。テコプレスの訓練の後に、ネズミに、ポリ塩化ビニルのカテーテルをハロタン麻酔(2-3%の医療級の酸素)の元で大腿部の静脈中に埋め込み、静脈薬物自己投与試験を開始する前にさらに7日間に亘り回復させた。薬物自己投与実験の最中に、食品ペレットをもはや提供せず、その代わりに、カテーテルにより、薬物の静脈注射を行った。10回のテコプレス応答を完了するごとに(FR)、1秒間に亘りコカイン(1mg/kg/点滴)を静脈点滴した。
約3週間のコカインの自己投与後、5日間に亘りコカインの代わりに生理食塩水(0.25ml/kg)を置換することにより、消去試験を行った。消去後、コカイン(1mg/kg/点滴)の自己投与の再獲得を5日間に亘り試験した。コカインの自己投与の再獲得後、生理食塩水の消去試験を繰り返した。この二回目の消去試験後、ピペリジン類似化合物2の自己投与を、1,3および0.3mg/kg/点滴の供与量でこの順番に研究した。各々の供与量は、5日間に亘り試験した。全ての再獲得試験の最中に、各々の日の実験の開始時に砂糖水の点滴を与えた。
コカインは、生理食塩水の消去試験の最中の応答と比較して、著しく高い応答率を維持した(P<0.05)。コカインを生理食塩水で置換することにより、応答率が減少した。生理食塩水をピペリジン類似化合物2(0.3-3mg/kg/点滴)で置換することにより、自己投与応答を復元することはできなかった。試験した供与量の全てで供給されたピペリジン類似化合物の点滴の数は、生理食塩水の消去試験の数とは著しくは異なっていなかった。これらのデータは、ピペリジン類似化合物が、コカインとは異なり、陽性の強化効果を欠如していることを示している。これとは対照的に、ピペリジン類似化合物3は、ネズミが確実にこの化合物を自己投与した(0.125-0.5mg/kg/点滴)という事実により証拠付けられるように、この試験においてコカイン様である。
D.食品強化およびコカイン自己投与への試験化合物の効果
コカインの自己投与への試験化合物による前処理の効果を研究することができる。試験化合物の静脈注射から5分後に、コカインの自己投与についてネズミを試験することができる。コカイン供与量と応答の関数の上昇部分と下降部分の両方にある供与量を、試験化合物による前処理後に試験することができる。これにより、コカイン供与量と応答の関数において左または右側へのシフトまたは下方へのシフトがあるか否かを決定することができる。コカインの自己用途において全体的に減少(下方シフト)を示す化合物を、この効果の特異性についてさらに試験することができる。これは、食品のような非薬物強化因子への試験化合物の効果を研究することにより行うことができる。
PET評価
4−(4−クロロフェニル)−3−(カルボメトキシ)ピペリジンのシスおよびトランス異性体をN−メチル化により標識付けた。11C−ヨウ化メチルで、ピペリジン異性体(0.3ccのDMSO中の1.5mgの遊離塩基)の各々の溶液を泡立たせ、その混合物を7分間に亘り110℃で加熱した。生成物を、MeOH:リン酸塩/トリエチルアミン緩衝液、pH7.2(60:40)で溶離したC−18カートリッジ上のHPLCにより精製した。この11Cで標識付けた薬物は、良好な放射性化学収率[約15%@EOS]で産生された。最終生成物の放射性化学純度は98%よりも高く、特異的活性は、常に2,000mCl/μモル[EOS]よりも大きかった。
0.22μmのフィルタを通過させた後、無菌の生成物を3匹のアカゲザルに投与し、動的PET画像を90分間に亘り得た。両方の異性体が線条内に急速に蓄積し、シス異性体がより大きい、皮質内の非特異的蓄積を示した。低特異的活性のトレーサに関する研究は、高特異的活性の製剤と比較して、減少した線条対小脳比を示した。トランス異性体を注射してから60分後に標識付けていないCFTを投与した場合、線条活性の選択的な減少が観察された。これは、ドーパミン輸送体へのインビボ結合と一致する。
これらの結果は、4−(4−クロロフェニル)−3−カルボメトキシ−N−メチルピペリジンのシスおよびトランスの異性体両方が、高いレベルの、線条ドーパミン輸送体部位への特異的結合を有することを確立する。
3−n−プロピル誘導体(−)−9が、3nMの結合親和性を有することが分かった。したがって、化合物9は、結合親和性においてコカインよりも33倍多く効力があり、ドーパミン摂取の阻害において29倍多く効力がある。上述した結果は、化学式Iの代表的な化合物がドーパミン受容体で著しい結合活性を有することを示している。したがって、本発明の化合物は、薬物乱用(例えば、コカイン中毒)の治療のための治療薬として有用であろう。さらに、化学式Iの化合物、特に、R6が水素である化合物は、セロトニン再摂取阻害因子としての活性を有するであろう。したがって、化学式Iの化合物は、セロトニンの再摂取を阻害するのに、それゆえ、パーキンソン病または鬱病の治療に有用であろう。
本発明をここで、非限定的な実施例により説明する。ここで、別記しない限り:出発材料は、アルドリッヒケミカルスまたは他の販売会社から得た;ジエチルエーテルおよびシクロヘキサンを五酸化リンから蒸留した;テトラヒドロフランは、ナトリウム−ベンゾフェノンから窒素下で新たに蒸留した;赤外線(”IR”)スペクトルをATIマットソンジェネシス(ATI Mattson Genesis)分光計に記録した;陽子1Hおよび炭素13Cの核磁気共鳴(”NMR”)スペクトルをヴァリアンユニティーアイノーヴァ(Varian Unity Inova)装置により300および75.46MHzで得た;1H化学シフト(δ)が内部TMSからのppmダウンフィールドで報告されている;13C化学シフトがCDCl3(中央ピーク、δ=77.0ppm)、ベンゼン−d6(中央ピーク、δ=128.0ppm)、またはDMSO−d6(中央ピーク、δ=39.7ppm)に対して参照されている;適切なときに、NMRがCOSY、DEPT、およびHETCORの実験の補助により行われた;融点が、トーマスフーバーユニメルト(Thomas Hoover Unimelt)装置によりパイレックス毛管内で測定された;これは補正されていない;質量スペクトルが70eVのイオン化電位でEIモードで測定された;薄層クロマトグラフィー(”TLC”)がメルクシリカゲル60F254ガラス板上で行われた;カラムクロマトグラフィーがメルクシリカゲル(60-200メッシュ)を用いて行われた;化合物1−15の各々から満足な燃焼分析が得られた;そして、以下の省略形を用いた:DMSO=ジメチルスルホキシド;エーテル=ジエチルエーテル;THF=テトラヒドロフラン;およびDCM=ジクロロメタン。
実施例
実施例1(±)−シス−メチル4−(4−クロロフェニル)−1−メチルピペリジン−3−カルボキシレート(1)
エーテル(700mL)中の臭化4−クロロフェニルマグネシウムの溶液(166mL、エーテル中1.0M)に、エーテル(300mL)中のアレコリン遊離塩基の溶液(12.9g、83mモル、重炭酸ナトリウムによる処理と、塩化メチレン中への抽出により、臭化水素酸塩から得た)を−10℃で滴下して加えた。この混合物を−10℃で30分間に亘り撹拌し、次いで、砕いた氷上に注ぎ、10%のHCl(200mL)でゆっくりと処理した。水性層を分離し、エーテル(200mL)で洗浄し、氷浴中で冷却しながら、重炭酸ナトリウムの飽和溶液(100mL)で処理した。この混合物をエーテル(2×200mL)で抽出し、混合有機相をブライン(200mL)で洗浄し、乾燥させ、減圧下で濃縮した。粗製混合物をEtOAc/ヘキサンから結晶化させて、表題の化合物1(5.0g、22%)を白色固体として得た。母剤液体の濃度が、溶離液としてエーテル/Et3N9/1を用いてシリカゲル上のフラッシュクロマトグラフィーにより分離されて、さらに表題の化合物(合計で12.4g、56%)を与える化合物1および2の混合物を得た:
化合物1を塩酸ガスのメタノール溶液中に溶解させ、得られた固体をエーテルとともに摩砕して、化合物1・HClを得た:
実施例2(±)−シス−メチル4−(4−クロロフェニル)−1−メチルピペリジン−3−カルボキシレート(2)
実施例1からの母剤液体の濃縮物から化合物1および2の混合物を得た。エーテル/Et3NN9/1を溶離液として用いたシリカゲル上のフラッシュクロマトグラフィーにより化合物2(2.0g、18%)を得た:
実施例1に記載したものと同様の方法を用いて、化合物2の塩酸塩を調製した:化合物2・HCl:
実施例3(−)−メチル4β−(4−クロロフェニル)−1−メチルピペリジン−3β−カルボキシレート(3)
MeOH(200mL)中の化合物1(6.4g、24mモル)の溶液に、MeOH(100mL)中のジベンゾイル−L−酒石酸(8.9g、24mモル)の溶液を加えた。得られた混合物を室温で5時間に亘り撹拌し、濾過し、白色の沈殿物をMeOH(20mL)で洗浄した。この酒石酸塩をNaHCO3(150mL)の飽和溶液で処理し、混合物をCHCl3(3×100mL)で抽出した。混合有機相をブライン(150mL)で洗浄し、乾燥させ、減圧下で濃縮して、表題の化合物(2.0g)を白色固体として得た:mp98-99℃;[α]25 D−56°(c1.0、EtOH)。
実施例1に記載した方法と同様の方法を用いて、化合物3の塩酸塩を調製した:化合物・HCl;[α]25 D−130°(c1.0、EtOH)。
単結晶X線分析を以下に記載するように(3)の(−)−ジベンゾイル酒石酸塩に行った。透明な矩形の0.06×0.08×0.52mmの結晶、C14H19OClN+C18H13O8 -、FW=626.04をデータ採集に選択した。データは、理学回転陰極源およびコベルミラーを用いたジーメンスPLATFORMゴニオメータを備えたコンピュータ制御のジーメンスCCD 1Kエリア検出装置(Cu Kα_照射、λ=1.54178オングストローム、T=295K)上に採集した。データ採集は、公称で、異なる2θおよびψの角度で6組の露出を組み合わせることにより、相互空間内の半球を含んだ:各々の露出がωの0.75°の範囲を含んだ。結晶から検出器までの距離は5.09cmであり、特有の組の範囲は、1.0オングストロームの解像度に対して98%完全であった。結晶減衰を、データ採集の最後で50の初期フレームを繰り返すことによりモニタし、2.7%であることが分かった。16.2<2θ<34.4°内の176中心反射を用いた最小平方改善により、斜方晶系P212121セルを得た、a=7.752(3)、b=14.691(5)、c=27.502(8)オングストローム、V=3132.2(17)オングストローム3、Z=4、およびdcalc=1.328g/cm3。合計で8342反射が2θ-max=100°までであり、その内の2923が独立反射であった。ローレンツ効果および偏光効果について補正を行った。実験的吸収補正を、等反射(SADABS)、μ=1.577mm-1を用いて行った。最大および最小の透過率は、それぞれ、0.44および0.88であった。その構造を、プログラムSHELXT1の補助により直接法により解いて、全マトリクス最小平方を有するF2上で精製した。精製された398のパラメータは、全ての非水素原子に関する、座標および異方性熱パラメータを含んでいる。水素は、ライディングモデルを用いて含まれた。Fo>4σ(|Fo|)である2244の観察した反射についての最終R値は、R=0.086およびwR(F2)=0.208であった。適合パラメータは1.07であり、最終的な差分フーリエ逸脱は0.41および-0.27eオングストローム-3であった。絶対形状の決定は、D.Rogersにより提案された方法に基づいた。キラル化の正しい選択については0.0近くであり、正しくない選択については1.0近くであるべきである絶対構造パラメータは、0.04(6)であった。この化合物は、キラル陰イオンの(−)−ジベンゾイル酒石酸も含有していた。
実施例4(+)−メチル4β−(4−クロロフェニル)−1−メチルピペリジン−3β−カルボキシレート(4)
MeOH(150mL)中の実施例3(4.2g、15.7mモル)の母剤液体から由来の鏡像体の混合物に、MeOH(50mL)中のジベンゾイル−D−酒石酸(5.8g、15.7mモル)の溶液を加えた。得られた混合物を室温で5時間に亘り撹拌し、濾過し、白色の沈殿物をMeOH(10mL)で洗浄した。この酒石酸塩をNaHCO3(100mL)の飽和溶液で処理し、混合物をCHCl3(3×70mL)で抽出した。混合有機相をブライン(150mL)で洗浄し、乾燥させ、減圧下で濃縮して、表題の化合物(2.2g)を白色固体として得た:mp98-99℃;[α]25 D−56°(c1.0、EtOH)。
その塩酸塩を、HCl(g)のメタノール溶液中の化合物4の遊離塩基の溶解、濃縮、および粗製塩のエーテルによる最終的な摩砕により調製した:[α]25 D+126°(c1.0、EtOH)。
実施例5(−)−4β−(4−クロロフェニル)−3β−(ヒドロキシメチル)−1−メチルピペリジン(5)
THF(30mL)中の3(1.0g、3.7mモル)の溶液に、LiAlH4(0.3g、7.5mモル)を少しずつ加えた。得られ混合物を室温で2時間に亘り撹拌した。ロッシェル塩の飽和溶液(30mL)を加え、その後、EtOAc(100mL)で抽出した。有機相をブライン(100mL)で洗浄し、乾燥させ、減圧下で濃縮して、表題の化合物(0.9g、98%)を無色の油として得た:[α]25 D−70°(c1.0、EtOH);
実施例6(+)−4β−(4−クロロフェニル)−3β−(ヒドロキシメチル)−1−メチルピペリジン(6)
そこで用いた化合物3を化合物4と置換したことを除いて、実施例5に記載した方法と同様の方法を用いて、表題の化合物6を無色の油として調製した(82%);[α]25 D+67°(c1;EtOH)。
実施例7(−)−3β−(アセトキシメチル)−4β−(4−クロロフェニル)−1−メチルピペリジン(7)
ピリジン(2mL)中の化合物5(90mg、0.38mモル)の溶液に、無水酢酸(0.5mL)を加えた。得られた溶液を室温で15時間に亘り撹拌し、減圧下で濃縮し、EtOAc(30mL)で希釈し、NH4Cl(2×20mL)の飽和溶液で洗浄した。有機溶液を乾燥させ、減圧下で濃縮して、表題の化合物(0.10g、95%)を白色固体として得た:mp76℃;[α]25 D−109°(c0.75;EtOH);
実施例8(+)−3β−(アセトキシメチル)−4β−(4−クロロフェニル)−1−メチルピペリジン(8)
そこで使用した化合物5を化合物6と置換したことを除いて、実施例7に記載した方法と同様の方法を用いて、表題の化合物8を白色固体として調製した(93%):[α]25 D+107°(c0.35;EtOH);MSm/z(%)281(M+,6)。
実施例9(−)4β−(4−クロロフェニル)−1−メチル−3β−n−プロピルピペリジン(9)
塩化オキサリル(0.19mL)を無水CH2Cl2(15mL)中に溶解させ、その溶液を−78℃まで冷却した。ジメチルスルホキシド(0.32mL)を加え、5分後に、アルコール5(0.5g、2.08mモル)をCH2Cl2(5mL)中に加え、30分間に亘り撹拌を続けた。反応混合物を、Et3N(2.84mL)を加えることにより冷却し、得られた溶液を室温まで暖め、CH2Cl2(30mL)で希釈し、NH4Cl(2×30mL)で洗浄し、乾燥させ、減圧下で濃縮して、さらには精製せずに、中間体のアルデヒド(0.45g、91%)を次の工程で使用する無色油として得た:
n−BuLiの溶液(2.28mL、ヘキサン中1M、5.7mモル)をTHF(10m)L中に溶解させ、0℃まで冷却した。臭化エチルトリフェニルホスホニウム(2.1g、5.7mモル)を窒素下でゆっくりと加えた。得られた黄−橙色の溶液を0℃で30分間に亘り撹拌し、冷却浴を取り外した。粗製アルデヒド(0.45g、1.9mモル)をTHF(2mL)中に加え、反応混合物を室温で15時間に亘り撹拌し、EtOAc(20mL)で希釈し、NH4Cl(2×30mL)の飽和溶液で洗浄した。有機相を10%のHCl(3×10mL)で抽出した。混合水性層をEtOAc(30mL)で洗浄し、NaHCO3の飽和溶液で中和し、CH2Cl2(2×30mL)で抽出した。混合有機相を乾燥させ、減圧下で濃縮し、残留物を、エーテル/Et3N9.5/0.5を溶離液として用いてシリカゲル上のフラッシュクロマトグラフィーにより精製して、シスとトランスの異性体の混合物(0.3g、63%)としてオレフィン中間体を得た:MSm/z(%)248(M+,6)、57(100)。
シクロヘキサン(20mL)中のこのオレフィン(0.2g、0.80mモル)の溶液に、5%のPt/C(0.2g)を加えた。この混合物を室温で30分間に亘りH2(40psi)下で撹拌した。この溶液をセライトで濾過し、乾燥するまで蒸発させた。得られた無色の油を、エーテル/Et3N9.5/0.5を溶離液として用いてシリカゲル上のフラッシュクロマトグラフィーにより精製して、表題の化合物9(0.19g、94%)を無色の油として得た:[α]25 D−84°(c0.5;EtOH);
塩酸塩を、HCl(g)のメタノール溶液中の遊離塩基の溶解、濃縮、および粗製塩のエーテルによる最終摩砕により調製した:mp>230℃;[α]25 D−73°(c0.25;EtOH);
実施例10(−)−メチル1−メチル−4β−フェニルピペリジン−3β−カルボキシレート(10)
MeOH(20mL)中の化合物3(0.7g、2.61mモル)および10%Pd/C(0.28g)の混合物を3時間に亘り1気圧のH2下で水素化した。得られた混合物をセライトで濾過し、乾燥するまで蒸発させた。得られた薄い黄色の油を、エーテル/Et3N9.5/0.5を溶離液として用いてシリカゲル上のフラッシュクロマトグラフィーにより精製して、表題の化合物(0.6g、98%)を無色の油として得た:[α]25 D−54°(c1;EtOH);
塩酸塩を、HCl(g)のメタノール溶液中の遊離塩基の溶解、濃縮、および粗製塩のエーテルによる最終摩砕により調製した:[α]25 D−130°(c1.0;EtOH);mp168-169℃;
実施例11(+)−メチル4β−(4−クロロフェニル)−1−メチルピペリジン−3α−カルボキシレート(11)
MeOH(6mL)中の化合物3(0.5g、1.87mモル)の溶液に、ナトリウムメトキシドの30%メタノール溶液(0.04mL)を加えた。得られた溶液を24時間に亘り還流しながら撹拌し、減圧下で濃縮した。CH2Cl2およびブラインを加え、有機相をブラインで洗浄した。混合有機相の濃縮により、化合物3および化合物11が1:32の比率で得られた(GC−MS分析により測定した)。エーテル/Et3N9.8/0.2を溶離液として用いた粗製生成物のシリカゲルフラッシュクロマトグラフィーによる精製で、表題の化合物(0.43g、86%)が無色の油として得られた:[α]25 D+46°(c1.0;EtOH)。
塩酸塩を、HCl(g)のメタノール溶液中の遊離塩基の溶解により調製し、所望の塩が直接的に結晶化された:[α]25 D+55°(c0.5;EtOH);mp>130℃。
実施例12(−)−メチル4β−(4−クロロフェニル)−1−メチルピペリジン−3α−カルボキシレート(12)
MeOH(3mL)中の化合物4(0.4g、1.49mモル)の溶液に、ナトリウムメトキシドの30%メタノール溶液(0.01mL)を加えた。得られた溶液を11時間に亘り還流しながら撹拌し、減圧下で濃縮した。CH2Cl2およびNH4Clの飽和溶液を加えた。有機相をブラインで洗浄し、硫酸ナトリウム上で乾燥させ、減圧下で濃縮して、化合物4および12を1:5.6の比率で得た(GC−MS分析により測定した)。エーテル/Et3N9.8/0.2を溶離液として用いた粗製生成物のシリカゲルフラッシュクロマトグラフィーによる精製で、表題の化合物(0.35g、85%)が無色の油として得られた:[α]25 D−50°(c1.0;EtOH)。
実施例13(+)−4β−(4クロロフェニル)−3α−(ヒドロキシメチル)−1−メチルピペリジン(13)
そこで使用した化合物3を化合物11と置換したことを除いて、実施例5に記載した方法と同様の方法を用いて、表題の化合物を無色の油として得た(84%):[α]25 D+38°(c0.5;EtOH);mp148-150℃;
実施例14(+)−3β−(アセトキシメチル)−4β−(4−クロロフェニル)−1−メチルピペリジン(14)
そこで使用した化合物5を化合物13と置換したことを除いて、実施例7に記載した方法と同様の方法を用いて、表題の化合物を白色の固体として得た(80%):
実施例15(+)4β−(4−クロロフェニル)−1−メチル−3α−n−プロピルピペリジン(15)
そこで使用した化合物5を化合物13と置換したことを除いて、実施例9に記載した方法と同様の方法を用いて、表題の化合物を無色の油として得た(70%):[α]25 D+418°(c1.0;EtOH);
塩酸塩を、HCl(g)のメタノール溶液中の遊離塩基の溶解、濃縮、および粗製塩のエーテルによる最終摩砕により調製した:[α]25 D+348(c0.25;EtOH);mp216℃(EtOAc);
実施例16 以下は、ヒトにおける治療または予防用途のための、化学式Iの化合物(’化合物X’)を含有する、代表的な薬剤供与量形態を示している。
(iv)注射1(1mg/ml) mg/ml
’化合物X’(遊離酸形態) 1.0
二塩基性リン酸ナトリウム 12.0
一塩基性リン酸ナトリウム 0.7
塩化ナトリウム 4.5
1.0Nの水酸化ナトリウム溶液
(7.0-7.5へのpHの調節) 十分な量
注射用の水 1mLに対して十分な量
(v)注射2(1mg/ml) mg/ml
’化合物X’(遊離酸形態) 10.0
一塩基性リン酸ナトリウム 0.3
二塩基性リン酸ナトリウム 1.1
ポリエチレングリコール400 200.0
1.0Nの水酸化ナトリウム溶液
(7.0-7.5へのpHの調節) 十分な量
注射用の水 1mLに対して十分な量
(vi)エアロゾル mg/缶
’化合物X’(遊離酸形態) 20.0
オレイン酸 10.0
トリクロロモノフルオロメタン 5,000.0
ジクロロジフルオロメタン 10,000.0
ジクロロテトラフルオロメタン 5,000.0
上述した配合物は、薬学の従来技術でよく知られた従来の方法により得てもよい。
全ての出版物、特許、および特許文献が、個々に引用されたように、ここにも引用する。本発明を様々な特定の好ましい実施の形態および技術に関して記載してきた。しかしながら、多くの変更および改良が、発明の精神および範囲内に留まりながら行ってもよいことが理解されよう。
Claims (17)
- 下記化学式(I)の化合物または薬学的に受け入れられるその塩。
R2が水素または(C1−C6)アルキルであり;
R3が4−クロロフェニルであり;
R6が水素、(C1−C6)アルキル、(C1−C6)アルカノイル、またはS(O)2Rhであり;および
RhがH、(C1−C4)アルキル、またはフェニルである。) - R1がシアノ、(C1−C6)アルキル、(C1−C6)アルカノイル、(C2−C6)アルケニル、または(C2−C6)アルキニルであることを特徴とする請求項1記載の化合物。
- R1が(C1−C6)アルキル、(C2−C6)アルケニル、または(C2−C6)アルキニルであることを特徴とする請求項1記載の化合物。
- R2が水素であることを特徴とする請求項1から3いずれか1項記載の化合物。
- R6が水素、(C1−C6)アルキルまたは(C1−C6)アルカノイルであることを特徴とする請求項1から4いずれか1項記載の化合物。
- R1およびR2がトランス形態にあることを特徴とする請求項1から5いずれか1項記載の化合物。
- (−)4β−(4−クロロフェニル)−1−メチル−3β−n−プロピルピペリジン;または(+)4β−(4−クロロフェニル)−1−メチル−3α−n−プロピルピペリジンであることを特徴とする請求項1記載の化合物。
- 請求項1から7いずれか1項記載の化合物、ならびに薬学的に受け入れられる希釈剤またはキャリヤを含む薬剤組成物。
- 請求項1から7いずれか1記載の化合物を含む、ドーパミンまたはセロトニンの活性が関連しドーパミンまたはセロトニンの再摂取の調節が望ましい哺乳類における病気または症状を治療するための組成物。
- 前記病気が鬱病であることを特徴とする請求項9記載の組成物。
- 前記病気がパーキンソン病であることを特徴とする請求項9記載の組成物。
- 医学治療または診断に使用されることを特徴とする、請求項1から7いずれか1項記載の化合物。
- 請求項1から7いずれか1項記載の化合物の、薬物中毒、鬱病またはパーキンソン病を治療するのに有用な医薬を調製するための使用。
- 請求項1から7いずれか1項記載の化合物と、放射性核種とを含む放射性標識付け化合物。
- 請求項1から7いずれか1項記載の化合物と放射性核種とを含む放射性標識付け化合物を含み、脳内での放射性標識付け化合物の存在が検出されることを特徴とする、哺乳類の脳をイメージングするのに使用するための組成物。
- 前記放射性標識付け化合物が、陽電子射出断層撮影または単一光子射出計算機断層撮影を用いて検出されることを特徴とする請求項15記載の組成物。
- 請求項1から7いずれか1項記載の化合物と放射性核種とを含む放射性標識付け化合物の、哺乳類の脳をイメージングしおよび脳内での放射性標識付け化合物の存在を検出するのに有用な医薬を調製するための使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US4277597P | 1997-04-07 | 1997-04-07 | |
| US60/042,775 | 1997-04-07 | ||
| PCT/US1998/007081 WO1998045263A1 (en) | 1997-04-07 | 1998-04-07 | Analogs of cocaine |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2001524954A JP2001524954A (ja) | 2001-12-04 |
| JP2001524954A5 JP2001524954A5 (ja) | 2005-11-24 |
| JP4578580B2 true JP4578580B2 (ja) | 2010-11-10 |
Family
ID=21923686
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP54311498A Expired - Fee Related JP4578580B2 (ja) | 1997-04-07 | 1998-04-07 | コカインの類似化合物 |
Country Status (10)
| Country | Link |
|---|---|
| US (3) | US6180648B1 (ja) |
| EP (1) | EP0975595B9 (ja) |
| JP (1) | JP4578580B2 (ja) |
| AT (1) | ATE433959T1 (ja) |
| AU (1) | AU744259B2 (ja) |
| CA (1) | CA2284732C (ja) |
| DE (1) | DE69840909D1 (ja) |
| DK (1) | DK0975595T3 (ja) |
| ES (1) | ES2329739T3 (ja) |
| WO (1) | WO1998045263A1 (ja) |
Families Citing this family (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AP9901698A0 (en) | 1997-05-29 | 1999-12-31 | Smithkline Beecham Corp | Novel process. |
| CA2346537A1 (en) | 1998-10-07 | 2000-04-13 | Gian Luca Araldi | Monomeric and dimeric heterocycles, and therapeutic uses thereof |
| WO2001029002A1 (en) * | 1999-10-20 | 2001-04-26 | Smithkline Beecham Plc | Process for the preparation of 4-(fluorophenyl)piperidine esters |
| GB9924882D0 (en) * | 1999-10-20 | 1999-12-22 | Smithkline Beecham Plc | Novel process |
| CA2395075A1 (en) * | 1999-12-16 | 2001-06-21 | Miles P. Smith | 1,3,4-substituted piperidine analogs and uses thereof in treating addictions |
| US8489176B1 (en) | 2000-08-21 | 2013-07-16 | Spectrum Dynamics Llc | Radioactive emission detector equipped with a position tracking system and utilization thereof with medical systems and in medical procedures |
| US8565860B2 (en) | 2000-08-21 | 2013-10-22 | Biosensors International Group, Ltd. | Radioactive emission detector equipped with a position tracking system |
| US8909325B2 (en) | 2000-08-21 | 2014-12-09 | Biosensors International Group, Ltd. | Radioactive emission detector equipped with a position tracking system and utilization thereof with medical systems and in medical procedures |
| WO2005119025A2 (en) | 2004-06-01 | 2005-12-15 | Spectrum Dynamics Llc | Radioactive-emission-measurement optimization to specific body structures |
| WO2004039778A1 (en) * | 2002-11-01 | 2004-05-13 | Neurosearch A/S | Novel piperidine derivatives and their use as monoamine neurotransmitter re-uptake inhibitors |
| EP3345895B1 (en) | 2003-04-11 | 2019-12-04 | PTC Therapeutics, Inc. | 1,2,4-oxadiazole benzoic acid compound and its use for nonsense suppression and the treatment of disease |
| US9470801B2 (en) | 2004-01-13 | 2016-10-18 | Spectrum Dynamics Llc | Gating with anatomically varying durations |
| US8586932B2 (en) | 2004-11-09 | 2013-11-19 | Spectrum Dynamics Llc | System and method for radioactive emission measurement |
| WO2008010227A2 (en) | 2006-07-19 | 2008-01-24 | Spectrum Dynamics Llc | Imaging protocols |
| US8571881B2 (en) | 2004-11-09 | 2013-10-29 | Spectrum Dynamics, Llc | Radiopharmaceutical dispensing, administration, and imaging |
| US7968851B2 (en) | 2004-01-13 | 2011-06-28 | Spectrum Dynamics Llc | Dynamic spect camera |
| EP1709585B1 (en) | 2004-01-13 | 2020-01-08 | Spectrum Dynamics Medical Limited | Multi-dimensional image reconstruction |
| US9316743B2 (en) | 2004-11-09 | 2016-04-19 | Biosensors International Group, Ltd. | System and method for radioactive emission measurement |
| US8615405B2 (en) | 2004-11-09 | 2013-12-24 | Biosensors International Group, Ltd. | Imaging system customization using data from radiopharmaceutical-associated data carrier |
| US9943274B2 (en) | 2004-11-09 | 2018-04-17 | Spectrum Dynamics Medical Limited | Radioimaging using low dose isotope |
| EP1827505A4 (en) | 2004-11-09 | 2017-07-12 | Biosensors International Group, Ltd. | Radioimaging |
| US8423125B2 (en) * | 2004-11-09 | 2013-04-16 | Spectrum Dynamics Llc | Radioimaging |
| WO2008059489A2 (en) | 2006-11-13 | 2008-05-22 | Spectrum Dynamics Llc | Radioimaging applications of and novel formulations of teboroxime |
| US8837793B2 (en) | 2005-07-19 | 2014-09-16 | Biosensors International Group, Ltd. | Reconstruction stabilizer and active vision |
| EP1909853B1 (en) | 2005-07-19 | 2015-03-18 | Biosensors International Group, Ltd. | Imaging protocols |
| CN101505739A (zh) * | 2006-03-30 | 2009-08-12 | Ptc医疗公司 | 由具有无义突变的dna生产功能蛋白的方法以及相关疾病的治疗 |
| US8894974B2 (en) | 2006-05-11 | 2014-11-25 | Spectrum Dynamics Llc | Radiopharmaceuticals for diagnosis and therapy |
| CA2662538A1 (en) * | 2006-09-11 | 2008-03-20 | Glaxo Group Limited | Azabicyclic compounds as inhibitors of monoamines reuptake |
| US9275451B2 (en) | 2006-12-20 | 2016-03-01 | Biosensors International Group, Ltd. | Method, a system, and an apparatus for using and processing multidimensional data |
| US8521253B2 (en) | 2007-10-29 | 2013-08-27 | Spectrum Dynamics Llc | Prostate imaging |
| US8338788B2 (en) | 2009-07-29 | 2012-12-25 | Spectrum Dynamics Llc | Method and system of optimized volumetric imaging |
| WO2012009263A1 (en) * | 2010-07-12 | 2012-01-19 | Temple University-Of The Commonwealth System Of Higher Education | Cocaine analogs and methods of preparation and uses thereof |
| TWI695717B (zh) | 2014-03-06 | 2020-06-11 | 美商 Ptc 治療公司 | 1,2,4-二唑苯甲酸之鹽及醫藥組合物 |
| KR20180081516A (ko) | 2015-10-30 | 2018-07-16 | 피티씨 테라퓨틱스, 인크. | 간질 치료 방법 |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1422263A (en) * | 1973-01-30 | 1976-01-21 | Ferrosan As | 4-phenyl-piperidine compounds |
| DE3441927A1 (de) | 1984-11-16 | 1986-05-28 | Basf Ag, 6700 Ludwigshafen | Am stickstoff substituierte 4-(p-tert.butyl-phenyl)-3-methyl-piperidine, dessen quartaere salze sowie deren anwendung als fungizide |
| DE3441929A1 (de) | 1984-11-16 | 1986-05-28 | Basf Ag, 6700 Ludwigshafen | Verfahren zur herstellung von substituierten piperidinen |
| GB8520154D0 (en) * | 1985-08-10 | 1985-09-18 | Beecham Group Plc | Chemical process |
| EP0223334B1 (en) * | 1985-08-10 | 1991-07-10 | Beecham Group Plc | Process for the preparation of aryl-piperidine carbinols |
| IE66332B1 (en) * | 1986-11-03 | 1995-12-27 | Novo Nordisk As | Piperidine compounds and their preparation and use |
| US5208232A (en) * | 1986-11-03 | 1993-05-04 | Novo Nordisk A/S | Piperidine compounds and their preparation and use |
| DK231088D0 (da) * | 1988-04-28 | 1988-04-28 | Ferrosan As | Piperidinforbindelser, deres fremstilling og anvendelse |
| DK715988D0 (da) | 1988-12-22 | 1988-12-22 | Ferrosan As | Etherifikation og dealkylering af piperidin-derivater samt intermediater |
| WO1993008166A1 (en) * | 1991-10-24 | 1993-04-29 | The Upjohn Company | Benzo-isoquinoline derivatives and analogs and their use in therapeutics |
| DE4308788A1 (de) * | 1993-03-18 | 1994-09-22 | Bayer Ag | Hetero-tricyclisch-substituierte Phenyl-cyclohexan-carbonsäurederivate |
| DE19529858A1 (de) * | 1995-08-14 | 1997-02-20 | Bayer Ag | Substituierte 4H-Pyrane |
| CA2187257A1 (en) * | 1995-10-12 | 1997-04-13 | Enrique Luis Michelotti | Aryl-substituted cycloalkanes and cycloalkenes and herbicidal use thereof |
| GB9605828D0 (en) | 1996-03-20 | 1996-05-22 | Smithkline Beecham Plc | Treatment method |
-
1998
- 1998-04-07 CA CA002284732A patent/CA2284732C/en not_active Expired - Fee Related
- 1998-04-07 DK DK98915409T patent/DK0975595T3/da active
- 1998-04-07 AT AT98915409T patent/ATE433959T1/de active
- 1998-04-07 WO PCT/US1998/007081 patent/WO1998045263A1/en active IP Right Grant
- 1998-04-07 EP EP98915409A patent/EP0975595B9/en not_active Expired - Lifetime
- 1998-04-07 JP JP54311498A patent/JP4578580B2/ja not_active Expired - Fee Related
- 1998-04-07 ES ES98915409T patent/ES2329739T3/es not_active Expired - Lifetime
- 1998-04-07 DE DE69840909T patent/DE69840909D1/de not_active Expired - Lifetime
- 1998-04-07 AU AU69601/98A patent/AU744259B2/en not_active Ceased
- 1998-04-07 US US09/056,727 patent/US6180648B1/en not_active Expired - Lifetime
-
2001
- 2001-01-25 US US09/769,774 patent/US6472422B2/en not_active Expired - Fee Related
-
2002
- 2002-10-23 US US10/278,758 patent/US6806281B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| EP0975595B1 (en) | 2009-06-17 |
| EP0975595B9 (en) | 2009-09-16 |
| DK0975595T3 (da) | 2009-10-19 |
| US6806281B2 (en) | 2004-10-19 |
| US6180648B1 (en) | 2001-01-30 |
| AU6960198A (en) | 1998-10-30 |
| US20030144322A1 (en) | 2003-07-31 |
| AU744259B2 (en) | 2002-02-21 |
| ES2329739T3 (es) | 2009-11-30 |
| EP0975595A1 (en) | 2000-02-02 |
| CA2284732A1 (en) | 1998-10-15 |
| DE69840909D1 (de) | 2009-07-30 |
| JP2001524954A (ja) | 2001-12-04 |
| ATE433959T1 (de) | 2009-07-15 |
| US6472422B2 (en) | 2002-10-29 |
| WO1998045263A1 (en) | 1998-10-15 |
| CA2284732C (en) | 2008-06-17 |
| US20020055521A1 (en) | 2002-05-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4578580B2 (ja) | コカインの類似化合物 | |
| US5354758A (en) | Benzomorphans useful as NMDA receptor antagonists | |
| US6605621B1 (en) | Monomeric and dimeric heterocycles, and therapeutic uses thereof | |
| LV11738B (en) | Tropane-2-aldoxime derivatives as neurotransmitter reuptake inhibitors | |
| WO1994004146A1 (en) | Cocaine analogues and their use as cocaine drug therapies and therapeutic and imaging agents for neurodegenerative disorders | |
| JP6726200B2 (ja) | 有機化合物 | |
| US5338852A (en) | Azavesamicols | |
| RU2605931C2 (ru) | Фторзамещенные циклические аминосоединения и способы их получения, фармацевтические композиции и их применения | |
| JP5384487B2 (ja) | 新規方法 | |
| EP0850234B1 (en) | Novel heterocyclic compounds for the treatment of pain and use thereof | |
| JP4519204B2 (ja) | 精子形成阻害活性を有するヘキサヒドロインデノピリジン化合物 | |
| US7199132B2 (en) | Tropane analogs and methods for inhibition of monoamine transport | |
| JP2010530900A (ja) | 中枢神経系活性を有する置換ピロリジン化合物 | |
| JP2005529156A (ja) | トロパン化合物 | |
| WO1995011234A1 (en) | Radiolabelled ligands for muscarinic receptors | |
| HU205751B (en) | Process for producing new 1,3-oxazines and pharmaceutical compositions comprising same | |
| US20070244149A1 (en) | Tropane analogs and methods for inhibition of monoamine transport | |
| JPH0583547B2 (ja) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050407 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050407 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070420 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090113 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090413 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090601 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090626 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20091027 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100215 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20100401 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20100727 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20100825 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130903 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |