JP4511090B2 - Dnaプラスミドワクチン用アジュバンド及びその調製方法 - Google Patents
Dnaプラスミドワクチン用アジュバンド及びその調製方法 Download PDFInfo
- Publication number
- JP4511090B2 JP4511090B2 JP2001321828A JP2001321828A JP4511090B2 JP 4511090 B2 JP4511090 B2 JP 4511090B2 JP 2001321828 A JP2001321828 A JP 2001321828A JP 2001321828 A JP2001321828 A JP 2001321828A JP 4511090 B2 JP4511090 B2 JP 4511090B2
- Authority
- JP
- Japan
- Prior art keywords
- pseudovirus
- cells
- plasmid
- mice
- virus
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 239000013612 plasmid Substances 0.000 title claims description 106
- 239000002671 adjuvant Substances 0.000 title claims description 16
- 229960005486 vaccine Drugs 0.000 title claims description 13
- 238000002360 preparation method Methods 0.000 title claims description 8
- 241001112090 Pseudovirus Species 0.000 claims description 173
- 241001631646 Papillomaviridae Species 0.000 claims description 29
- 239000002245 particle Substances 0.000 claims description 18
- 108010002350 Interleukin-2 Proteins 0.000 claims description 16
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 claims description 12
- 238000000034 method Methods 0.000 claims description 12
- 239000000872 buffer Substances 0.000 claims description 11
- 241000701822 Bovine papillomavirus Species 0.000 claims description 8
- 241000700605 Viruses Species 0.000 claims description 7
- 230000006698 induction Effects 0.000 claims description 6
- 239000011780 sodium chloride Substances 0.000 claims description 6
- DEFVIWRASFVYLL-UHFFFAOYSA-N ethylene glycol bis(2-aminoethyl)tetraacetic acid Chemical compound OC(=O)CN(CC(O)=O)CCOCCOCCN(CC(O)=O)CC(O)=O DEFVIWRASFVYLL-UHFFFAOYSA-N 0.000 claims description 5
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 claims description 4
- 230000016379 mucosal immune response Effects 0.000 claims description 4
- -1 DTT Chemical compound 0.000 claims description 3
- 239000012139 lysis buffer Substances 0.000 claims description 3
- 230000002708 enhancing effect Effects 0.000 claims description 2
- 241000358374 Mupapillomavirus 1 Species 0.000 claims 2
- 241000699670 Mus sp. Species 0.000 description 98
- 210000004027 cell Anatomy 0.000 description 94
- 108020004414 DNA Proteins 0.000 description 37
- 108090000623 proteins and genes Proteins 0.000 description 36
- 238000012360 testing method Methods 0.000 description 33
- 230000004044 response Effects 0.000 description 30
- 230000009885 systemic effect Effects 0.000 description 29
- 238000002649 immunization Methods 0.000 description 27
- 230000003053 immunization Effects 0.000 description 27
- 108090000765 processed proteins & peptides Proteins 0.000 description 27
- 102000004169 proteins and genes Human genes 0.000 description 24
- 235000018102 proteins Nutrition 0.000 description 23
- 210000000952 spleen Anatomy 0.000 description 20
- 210000004400 mucous membrane Anatomy 0.000 description 19
- 210000001986 peyer's patch Anatomy 0.000 description 19
- 108010041986 DNA Vaccines Proteins 0.000 description 18
- 229940021995 DNA vaccine Drugs 0.000 description 18
- 210000004698 lymphocyte Anatomy 0.000 description 18
- 102000000588 Interleukin-2 Human genes 0.000 description 15
- 241001465754 Metazoa Species 0.000 description 13
- 210000003563 lymphoid tissue Anatomy 0.000 description 13
- AIYUHDOJVYHVIT-UHFFFAOYSA-M caesium chloride Chemical compound [Cl-].[Cs+] AIYUHDOJVYHVIT-UHFFFAOYSA-M 0.000 description 12
- 210000004877 mucosa Anatomy 0.000 description 12
- 241000341655 Human papillomavirus type 16 Species 0.000 description 11
- 244000052769 pathogen Species 0.000 description 11
- 210000001519 tissue Anatomy 0.000 description 11
- 210000001744 T-lymphocyte Anatomy 0.000 description 10
- 239000000427 antigen Substances 0.000 description 10
- 108091007433 antigens Proteins 0.000 description 10
- 102000036639 antigens Human genes 0.000 description 10
- 239000012636 effector Substances 0.000 description 10
- 210000002443 helper t lymphocyte Anatomy 0.000 description 10
- 208000015181 infectious disease Diseases 0.000 description 10
- 241000388186 Deltapapillomavirus 4 Species 0.000 description 8
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 8
- 102100037850 Interferon gamma Human genes 0.000 description 8
- 108010074328 Interferon-gamma Proteins 0.000 description 8
- 210000001165 lymph node Anatomy 0.000 description 8
- 239000002953 phosphate buffered saline Substances 0.000 description 8
- 239000000047 product Substances 0.000 description 8
- 210000004989 spleen cell Anatomy 0.000 description 8
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 7
- 241000699666 Mus <mouse, genus> Species 0.000 description 7
- 238000006243 chemical reaction Methods 0.000 description 7
- 201000010099 disease Diseases 0.000 description 7
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 7
- 239000012894 fetal calf serum Substances 0.000 description 7
- 239000010410 layer Substances 0.000 description 7
- 238000004519 manufacturing process Methods 0.000 description 7
- 230000035755 proliferation Effects 0.000 description 7
- 210000000813 small intestine Anatomy 0.000 description 7
- 230000003393 splenic effect Effects 0.000 description 7
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 6
- 101800001466 Envelope glycoprotein E1 Proteins 0.000 description 6
- 241000701806 Human papillomavirus Species 0.000 description 6
- 108090000978 Interleukin-4 Proteins 0.000 description 6
- 102000004388 Interleukin-4 Human genes 0.000 description 6
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 6
- 210000004443 dendritic cell Anatomy 0.000 description 6
- 230000028993 immune response Effects 0.000 description 6
- 239000002609 medium Substances 0.000 description 6
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 6
- 101710112752 Cytotoxin Proteins 0.000 description 5
- 102100022297 Integrin alpha-X Human genes 0.000 description 5
- 206010028980 Neoplasm Diseases 0.000 description 5
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 5
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 5
- 230000009089 cytolysis Effects 0.000 description 5
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 5
- 238000003114 enzyme-linked immunosorbent spot assay Methods 0.000 description 5
- 210000002919 epithelial cell Anatomy 0.000 description 5
- 239000000284 extract Substances 0.000 description 5
- 229940027941 immunoglobulin g Drugs 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 238000011534 incubation Methods 0.000 description 5
- 210000004347 intestinal mucosa Anatomy 0.000 description 5
- 239000000243 solution Substances 0.000 description 5
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 5
- 241000701447 unidentified baculovirus Species 0.000 description 5
- 239000013598 vector Substances 0.000 description 5
- 108010067770 Endopeptidase K Proteins 0.000 description 4
- 241000282412 Homo Species 0.000 description 4
- 101001046686 Homo sapiens Integrin alpha-M Proteins 0.000 description 4
- 102100022338 Integrin alpha-M Human genes 0.000 description 4
- 229930182816 L-glutamine Natural products 0.000 description 4
- 108700026244 Open Reading Frames Proteins 0.000 description 4
- 241000283973 Oryctolagus cuniculus Species 0.000 description 4
- 102000003992 Peroxidases Human genes 0.000 description 4
- 108010034546 Serratia marcescens nuclease Proteins 0.000 description 4
- 229910002091 carbon monoxide Inorganic materials 0.000 description 4
- 231100000599 cytotoxic agent Toxicity 0.000 description 4
- 239000002619 cytotoxin Substances 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 239000011536 extraction buffer Substances 0.000 description 4
- 230000000968 intestinal effect Effects 0.000 description 4
- 210000004379 membrane Anatomy 0.000 description 4
- 239000012528 membrane Substances 0.000 description 4
- 239000000203 mixture Substances 0.000 description 4
- 108040007629 peroxidase activity proteins Proteins 0.000 description 4
- 210000000664 rectum Anatomy 0.000 description 4
- 230000003248 secreting effect Effects 0.000 description 4
- 210000002966 serum Anatomy 0.000 description 4
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 4
- 239000000758 substrate Substances 0.000 description 4
- 239000006228 supernatant Substances 0.000 description 4
- 238000010998 test method Methods 0.000 description 4
- 229940104230 thymidine Drugs 0.000 description 4
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 3
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 3
- 238000002965 ELISA Methods 0.000 description 3
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 3
- 108010050904 Interferons Proteins 0.000 description 3
- 102000014150 Interferons Human genes 0.000 description 3
- 108091034117 Oligonucleotide Proteins 0.000 description 3
- 229930182555 Penicillin Natural products 0.000 description 3
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 3
- 239000012980 RPMI-1640 medium Substances 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- 230000024932 T cell mediated immunity Effects 0.000 description 3
- 210000000612 antigen-presenting cell Anatomy 0.000 description 3
- 229960002685 biotin Drugs 0.000 description 3
- 235000020958 biotin Nutrition 0.000 description 3
- 239000011616 biotin Substances 0.000 description 3
- 239000001110 calcium chloride Substances 0.000 description 3
- 229910001628 calcium chloride Inorganic materials 0.000 description 3
- 235000011148 calcium chloride Nutrition 0.000 description 3
- 108020001507 fusion proteins Proteins 0.000 description 3
- 102000037865 fusion proteins Human genes 0.000 description 3
- 210000000987 immune system Anatomy 0.000 description 3
- 230000036039 immunity Effects 0.000 description 3
- 230000001965 increasing effect Effects 0.000 description 3
- 229940079322 interferon Drugs 0.000 description 3
- 229910052746 lanthanum Inorganic materials 0.000 description 3
- FZLIPJUXYLNCLC-UHFFFAOYSA-N lanthanum atom Chemical compound [La] FZLIPJUXYLNCLC-UHFFFAOYSA-N 0.000 description 3
- 210000002540 macrophage Anatomy 0.000 description 3
- 210000003205 muscle Anatomy 0.000 description 3
- 239000013642 negative control Substances 0.000 description 3
- 230000001717 pathogenic effect Effects 0.000 description 3
- 229940049954 penicillin Drugs 0.000 description 3
- 238000003752 polymerase chain reaction Methods 0.000 description 3
- 102000004196 processed proteins & peptides Human genes 0.000 description 3
- 230000001681 protective effect Effects 0.000 description 3
- 210000002784 stomach Anatomy 0.000 description 3
- 229960005322 streptomycin Drugs 0.000 description 3
- 238000010254 subcutaneous injection Methods 0.000 description 3
- 239000007929 subcutaneous injection Substances 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 230000000699 topical effect Effects 0.000 description 3
- 238000011282 treatment Methods 0.000 description 3
- 238000002255 vaccination Methods 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- ZRPAUEVGEGEPFQ-UHFFFAOYSA-N 2-[4-[2-(2,3-dihydro-1H-inden-2-ylamino)pyrimidin-5-yl]pyrazol-1-yl]-1-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)ethanone Chemical compound C1C(CC2=CC=CC=C12)NC1=NC=C(C=N1)C=1C=NN(C=1)CC(=O)N1CC2=C(CC1)NN=N2 ZRPAUEVGEGEPFQ-UHFFFAOYSA-N 0.000 description 2
- JVKRKMWZYMKVTQ-UHFFFAOYSA-N 2-[4-[2-(2,3-dihydro-1H-inden-2-ylamino)pyrimidin-5-yl]pyrazol-1-yl]-N-(2-oxo-3H-1,3-benzoxazol-6-yl)acetamide Chemical compound C1C(CC2=CC=CC=C12)NC1=NC=C(C=N1)C=1C=NN(C=1)CC(=O)NC1=CC2=C(NC(O2)=O)C=C1 JVKRKMWZYMKVTQ-UHFFFAOYSA-N 0.000 description 2
- VXZBYIWNGKSFOJ-UHFFFAOYSA-N 2-[4-[5-(2,3-dihydro-1H-inden-2-ylamino)pyrazin-2-yl]pyrazol-1-yl]-1-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)ethanone Chemical compound C1C(CC2=CC=CC=C12)NC=1N=CC(=NC=1)C=1C=NN(C=1)CC(=O)N1CC2=C(CC1)NN=N2 VXZBYIWNGKSFOJ-UHFFFAOYSA-N 0.000 description 2
- 206010059313 Anogenital warts Diseases 0.000 description 2
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- 238000011510 Elispot assay Methods 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 239000007995 HEPES buffer Substances 0.000 description 2
- 241000238631 Hexapoda Species 0.000 description 2
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 2
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- 102000015696 Interleukins Human genes 0.000 description 2
- 108010063738 Interleukins Proteins 0.000 description 2
- 102100024640 Low-density lipoprotein receptor Human genes 0.000 description 2
- 206010025323 Lymphomas Diseases 0.000 description 2
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 2
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 2
- 108010090804 Streptavidin Proteins 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 230000005867 T cell response Effects 0.000 description 2
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 2
- 238000000246 agarose gel electrophoresis Methods 0.000 description 2
- 235000001014 amino acid Nutrition 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 230000000903 blocking effect Effects 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- 210000000234 capsid Anatomy 0.000 description 2
- 239000006143 cell culture medium Substances 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 238000004624 confocal microscopy Methods 0.000 description 2
- 230000000139 costimulatory effect Effects 0.000 description 2
- 230000001461 cytolytic effect Effects 0.000 description 2
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 230000029087 digestion Effects 0.000 description 2
- 238000001493 electron microscopy Methods 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- 210000000981 epithelium Anatomy 0.000 description 2
- 230000002550 fecal effect Effects 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 238000001415 gene therapy Methods 0.000 description 2
- 210000004392 genitalia Anatomy 0.000 description 2
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 2
- 230000028996 humoral immune response Effects 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 210000000936 intestine Anatomy 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 230000009696 proliferative response Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 238000001338 self-assembly Methods 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 235000011149 sulphuric acid Nutrition 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 2
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- 101710169336 5'-deoxyadenosine deaminase Proteins 0.000 description 1
- OXEUETBFKVCRNP-UHFFFAOYSA-N 9-ethyl-3-carbazolamine Chemical compound NC1=CC=C2N(CC)C3=CC=CC=C3C2=C1 OXEUETBFKVCRNP-UHFFFAOYSA-N 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- 102000055025 Adenosine deaminases Human genes 0.000 description 1
- 208000007860 Anus Neoplasms Diseases 0.000 description 1
- 101100381862 Bacillus subtilis (strain 168) bmr3 gene Proteins 0.000 description 1
- 101100317042 Bovine papillomavirus type 1 L1 gene Proteins 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 1
- 108060001064 Calcitonin Proteins 0.000 description 1
- 102000055006 Calcitonin Human genes 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 108090000565 Capsid Proteins Proteins 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 208000024172 Cardiovascular disease Diseases 0.000 description 1
- 102100025064 Cellular tumor antigen p53 Human genes 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 102100023321 Ceruloplasmin Human genes 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 102000009660 Cholinergic Receptors Human genes 0.000 description 1
- 108010009685 Cholinergic Receptors Proteins 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 208000000907 Condylomata Acuminata Diseases 0.000 description 1
- 206010053138 Congenital aplastic anaemia Diseases 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 208000011231 Crohn disease Diseases 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 206010012438 Dermatitis atopic Diseases 0.000 description 1
- 238000010159 Duncan test Methods 0.000 description 1
- 102000001039 Dystrophin Human genes 0.000 description 1
- 108010069091 Dystrophin Proteins 0.000 description 1
- 102000016942 Elastin Human genes 0.000 description 1
- 108010014258 Elastin Proteins 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 206010014561 Emphysema Diseases 0.000 description 1
- 102000003951 Erythropoietin Human genes 0.000 description 1
- 108090000394 Erythropoietin Proteins 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- 201000004939 Fanconi anemia Diseases 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 208000007842 Fibroepithelial Neoplasms Diseases 0.000 description 1
- 102000016359 Fibronectins Human genes 0.000 description 1
- 108010067306 Fibronectins Proteins 0.000 description 1
- 206010018691 Granuloma Diseases 0.000 description 1
- 108010051696 Growth Hormone Proteins 0.000 description 1
- 108010091938 HLA-B7 Antigen Proteins 0.000 description 1
- 102000001554 Hemoglobins Human genes 0.000 description 1
- 108010054147 Hemoglobins Proteins 0.000 description 1
- 208000031220 Hemophilia Diseases 0.000 description 1
- 208000009292 Hemophilia A Diseases 0.000 description 1
- 208000028782 Hereditary disease Diseases 0.000 description 1
- 101710121996 Hexon protein p72 Proteins 0.000 description 1
- 101000721661 Homo sapiens Cellular tumor antigen p53 Proteins 0.000 description 1
- 101000599951 Homo sapiens Insulin-like growth factor I Proteins 0.000 description 1
- 101001002657 Homo sapiens Interleukin-2 Proteins 0.000 description 1
- 101000611183 Homo sapiens Tumor necrosis factor Proteins 0.000 description 1
- 101000641177 Human papillomavirus type 16 Major capsid protein L1 Proteins 0.000 description 1
- 208000000563 Hyperlipoproteinemia Type II Diseases 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 102100023915 Insulin Human genes 0.000 description 1
- 108010002352 Interleukin-1 Proteins 0.000 description 1
- 102000000589 Interleukin-1 Human genes 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 102000004310 Ion Channels Human genes 0.000 description 1
- 108010001831 LDL receptors Proteins 0.000 description 1
- 206010023849 Laryngeal papilloma Diseases 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 241000712899 Lymphocytic choriomeningitis mammarenavirus Species 0.000 description 1
- 102000043129 MHC class I family Human genes 0.000 description 1
- 108091054437 MHC class I family Proteins 0.000 description 1
- 101710125418 Major capsid protein Proteins 0.000 description 1
- 201000009906 Meningitis Diseases 0.000 description 1
- 206010027406 Mesothelioma Diseases 0.000 description 1
- 206010065764 Mucosal infection Diseases 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 102000016943 Muramidase Human genes 0.000 description 1
- 108010014251 Muramidase Proteins 0.000 description 1
- 101001055320 Myxine glutinosa Insulin-like growth factor Proteins 0.000 description 1
- 108010062010 N-Acetylmuramoyl-L-alanine Amidase Proteins 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 239000004677 Nylon Substances 0.000 description 1
- 208000001132 Osteoporosis Diseases 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 102000003982 Parathyroid hormone Human genes 0.000 description 1
- 108090000445 Parathyroid hormone Proteins 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 208000018262 Peripheral vascular disease Diseases 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 101710101148 Probable 6-oxopurine nucleoside phosphorylase Proteins 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 108010076504 Protein Sorting Signals Proteins 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 108700017801 Purine Nucleoside Phosphorylase Deficiency Proteins 0.000 description 1
- 102000030764 Purine-nucleoside phosphorylase Human genes 0.000 description 1
- 239000012979 RPMI medium Substances 0.000 description 1
- 208000006265 Renal cell carcinoma Diseases 0.000 description 1
- 241000270295 Serpentes Species 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 102100038803 Somatotropin Human genes 0.000 description 1
- 241000256248 Spodoptera Species 0.000 description 1
- 241000256251 Spodoptera frugiperda Species 0.000 description 1
- 101100344811 Starmerella bombicola mdr gene Proteins 0.000 description 1
- 108010006785 Taq Polymerase Proteins 0.000 description 1
- 210000000447 Th1 cell Anatomy 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 101710162629 Trypsin inhibitor Proteins 0.000 description 1
- 229940122618 Trypsin inhibitor Drugs 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 102000044209 Tumor Suppressor Genes Human genes 0.000 description 1
- 108700025716 Tumor Suppressor Genes Proteins 0.000 description 1
- 102100040247 Tumor necrosis factor Human genes 0.000 description 1
- 206010045261 Type IIa hyperlipidaemia Diseases 0.000 description 1
- COQLPRJCUIATTQ-UHFFFAOYSA-N Uranyl acetate Chemical compound O.O.O=[U]=O.CC(O)=O.CC(O)=O COQLPRJCUIATTQ-UHFFFAOYSA-N 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 208000002495 Uterine Neoplasms Diseases 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 208000004354 Vulvar Neoplasms Diseases 0.000 description 1
- 208000000260 Warts Diseases 0.000 description 1
- 206010052428 Wound Diseases 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 208000037919 acquired disease Diseases 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 208000006682 alpha 1-Antitrypsin Deficiency Diseases 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- 238000000540 analysis of variance Methods 0.000 description 1
- 208000025009 anogenital human papillomavirus infection Diseases 0.000 description 1
- 201000004201 anogenital venereal wart Diseases 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 230000005875 antibody response Effects 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 201000008937 atopic dermatitis Diseases 0.000 description 1
- 229940031567 attenuated vaccine Drugs 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 208000012999 benign epithelial neoplasm Diseases 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 239000003114 blood coagulation factor Substances 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- BBBFJLBPOGFECG-VJVYQDLKSA-N calcitonin Chemical compound N([C@H](C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(N)=O)C(C)C)C(=O)[C@@H]1CSSC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1 BBBFJLBPOGFECG-VJVYQDLKSA-N 0.000 description 1
- 229960004015 calcitonin Drugs 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000012876 carrier material Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 230000036755 cellular response Effects 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 210000003161 choroid Anatomy 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 235000009508 confectionery Nutrition 0.000 description 1
- 210000002808 connective tissue Anatomy 0.000 description 1
- 229940028617 conventional vaccine Drugs 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 230000016396 cytokine production Effects 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- SUYVUBYJARFZHO-RRKCRQDMSA-N dATP Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@H]1C[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)O1 SUYVUBYJARFZHO-RRKCRQDMSA-N 0.000 description 1
- SUYVUBYJARFZHO-UHFFFAOYSA-N dATP Natural products C1=NC=2C(N)=NC=NC=2N1C1CC(O)C(COP(O)(=O)OP(O)(=O)OP(O)(O)=O)O1 SUYVUBYJARFZHO-UHFFFAOYSA-N 0.000 description 1
- RGWHQCVHVJXOKC-SHYZEUOFSA-J dCTP(4-) Chemical compound O=C1N=C(N)C=CN1[C@@H]1O[C@H](COP([O-])(=O)OP([O-])(=O)OP([O-])([O-])=O)[C@@H](O)C1 RGWHQCVHVJXOKC-SHYZEUOFSA-J 0.000 description 1
- HAAZLUGHYHWQIW-KVQBGUIXSA-N dGTP Chemical compound C1=NC=2C(=O)NC(N)=NC=2N1[C@H]1C[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)O1 HAAZLUGHYHWQIW-KVQBGUIXSA-N 0.000 description 1
- NHVNXKFIZYSCEB-XLPZGREQSA-N dTTP Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)[C@@H](O)C1 NHVNXKFIZYSCEB-XLPZGREQSA-N 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 230000006806 disease prevention Effects 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 239000006196 drop Substances 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 229920002549 elastin Polymers 0.000 description 1
- 238000000635 electron micrograph Methods 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 210000005081 epithelial layer Anatomy 0.000 description 1
- 229940105423 erythropoietin Drugs 0.000 description 1
- 239000013613 expression plasmid Substances 0.000 description 1
- 201000001386 familial hypercholesterolemia Diseases 0.000 description 1
- 235000013861 fat-free Nutrition 0.000 description 1
- 210000003608 fece Anatomy 0.000 description 1
- 210000001752 female genitalia Anatomy 0.000 description 1
- 206010016629 fibroma Diseases 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 239000000122 growth hormone Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 108091008039 hormone receptors Proteins 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 210000002429 large intestine Anatomy 0.000 description 1
- 201000000089 larynx squamous papilloma Diseases 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 239000000865 liniment Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 210000002751 lymph Anatomy 0.000 description 1
- 230000002132 lysosomal effect Effects 0.000 description 1
- 210000003712 lysosome Anatomy 0.000 description 1
- 230000001868 lysosomic effect Effects 0.000 description 1
- 229960000274 lysozyme Drugs 0.000 description 1
- 239000004325 lysozyme Substances 0.000 description 1
- 235000010335 lysozyme Nutrition 0.000 description 1
- 230000002101 lytic effect Effects 0.000 description 1
- 229910001629 magnesium chloride Inorganic materials 0.000 description 1
- 230000036244 malformation Effects 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 235000013336 milk Nutrition 0.000 description 1
- 239000008267 milk Substances 0.000 description 1
- 210000004080 milk Anatomy 0.000 description 1
- 201000002273 mucopolysaccharidosis II Diseases 0.000 description 1
- 208000022018 mucopolysaccharidosis type 2 Diseases 0.000 description 1
- 201000006938 muscular dystrophy Diseases 0.000 description 1
- 210000003928 nasal cavity Anatomy 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 229920001778 nylon Polymers 0.000 description 1
- 238000003305 oral gavage Methods 0.000 description 1
- 208000003154 papilloma Diseases 0.000 description 1
- 230000024241 parasitism Effects 0.000 description 1
- 229960001319 parathyroid hormone Drugs 0.000 description 1
- 239000000199 parathyroid hormone Substances 0.000 description 1
- 230000007918 pathogenicity Effects 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 210000001289 peyer's patch macrophage Anatomy 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 229920000729 poly(L-lysine) polymer Polymers 0.000 description 1
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000000770 proinflammatory effect Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 208000001917 purine nucleoside phosphorylase deficiency Diseases 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000001172 regenerating effect Effects 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000003362 replicative effect Effects 0.000 description 1
- 210000005000 reproductive tract Anatomy 0.000 description 1
- 210000001533 respiratory mucosa Anatomy 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 239000012266 salt solution Substances 0.000 description 1
- 208000002491 severe combined immunodeficiency Diseases 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 201000010153 skin papilloma Diseases 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 239000002753 trypsin inhibitor Substances 0.000 description 1
- 230000029069 type 2 immune response Effects 0.000 description 1
- 208000013139 vaginal neoplasm Diseases 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/525—Virus
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/20011—Papillomaviridae
- C12N2710/20023—Virus like particles [VLP]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/20011—Papillomaviridae
- C12N2710/20061—Methods of inactivation or attenuation
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Virology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Genetics & Genomics (AREA)
- Oncology (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- General Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Immunology (AREA)
- Biomedical Technology (AREA)
- Communicable Diseases (AREA)
- AIDS & HIV (AREA)
- Hematology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Molecular Biology (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Description
【発明の属する技術分野】
本発明は、DNAプラスミドワクチン用アジュバンド及びその調製方法に係り、その目的は、DNAワクチン単体の投与による免疫化に比べて、より強力なCTL反応を引き起こすことができ、経口投与によっても、パイエル板、粘膜固定層、脾臓に到達することができるパピロマウイルス偽ウイルス及びその調製方法を提供することにある。
【0002】
【従来の技術】
様々な感染性の病原体、例えば病原性ウイルスやバクテリアは、粘膜組織の表面に容易に感染することができる。特に、腸粘膜は病原体が感染しやすい場所である。多くの病原体は、粘膜組織の上皮細胞層における相互作用により感染を引き起こし、その後全身に広がる。このような病原体による感染の進行を防ぐために、病原体に特異的な抗体や細胞傷害性T細胞(以下、CTLsという。)が粘膜の表面において誘導される。病原体は粘膜組織において自己複製を繰り返し行うから、感染の初期や病気の初期段階において病原体を一掃するために粘膜特異的なCTLsを誘導することは重要なことである。
【0003】
腸粘膜のリンパ球細胞は、パイエル板のような器質化したリンパ組織、或いは粘膜固有層のような散在性のリンパ組織に存在する。パイエル板は、病原体が粘膜に感染した後に、免疫反応が誘導される場所と考えられている。通常、ワクチンの皮下接種のような全身性の免疫形成の場合、粘膜における免疫反応の誘導には十分な効果を示さない。それよりも、粘膜の免疫形成は、腸粘膜で免疫反応が生じることが必要とされる。
【0004】
一方、DNA(プラスミド)による免疫形成は、宿主の体液性或いは細胞性の免疫反応を誘導する。プラスミドDNAワクチンにより暗号化された抗原が宿主で生産されるために、変性や修飾された弱毒ワクチンとは異なり、抗原はそれらの本来の形態を保持している。免疫形成された宿主において抗原が発現するので、宿主の免疫系や持続した免疫反応に対して遷延被爆される。
しかしながら、経口投与ではDNAワクチンは腸関連のリンパ球組織に到達することはできない。この理由は、DNAワクチンは腸や胃で分解されてしまうからである。さらに、DNAワクチンを筋肉内に投与した場合、殆どの細胞ではCTLsを生成することができず、CTLsを生成した細胞でも、その量は極めて少量である。
【0005】
一方、パピロマウイルス(以下、単にPVという。)は、エンベロープを有さない小型(50〜60nm)の正20面体二本鎖DNAウイルスである。PVの感染は、ヒト、ヒツジ、イヌ、ネコ、ウサギ、サル、ヘビ、ウシを含む様々な動物で発生している。PVは上皮細胞に感染し、一般的に感染部位に良性上皮腫瘍又は良性線維上皮腫瘍を誘発する。PVは宿主特異性が高いウイルスであり、ヒトパピロマウイルス(以下、単にHPVという。)はヒト以外の動物に感染することはない。また、組織特異性も極めて高く、一部を除いて、粘膜や皮膚などの上皮組織にのみ感染することができる。
【0006】
HPVは、DNA配列の相同性に基づき95を超えるタイプに分類されている(Van Ranst.1996.Human papillomaviruses:A never-ending story? in:Papillomavirus reviews: current research on papillomaviruses.Ed:C.Lacey,Leeds University Press,Leeds,1-19)。それぞれのタイプのHPVは、異なる種類の病気の原因となることが知られている。例えば、HPV1,2,3,4,7,10,26〜29型は、正常のヒト及び免疫が低下したヒトの両方に良性イボを発症する。HPV5,8,9,12,14,15,17,19〜25,36,46〜50型は、免疫が低下したヒトに偏平性病変を発症する。HPV6,11,34,39,41〜44,51〜55型は、性器粘膜又は呼吸器粘膜の非悪性コンジローマを発症する。HPV16,18,31,33,35,45,58型は、生殖器粘膜の上皮形成異常を引き起こし、その場所での侵入性の子宮癌、膣癌、外陰部癌、肛門癌の大部分に関係している。HPV6,11は、コンジローマ(性器いぼ)と喉頭乳頭腫を引き起こす。
【0007】
PVは、最大8個の初期遺伝子と2個の後期遺伝子とをコードする。ウイルスゲノムの読み取り枠(ORF)はE1〜E7及びL1,L2(ここで、「E」は初期を、「L」は後期を表す)と称されている。
L1タンパク質は主要カプシドタンパク質であり、分子量55−60kDaを有する。L2タンパク質は少量のカプシドタンパク質であり、推測分子量55−60kDaを有し、ポリアクリルアミドゲル電気泳動により測定すると見掛けの分子量75−100kDaを有する。
L1タンパク質は自己集合組立能を有するために、昆虫、酵母、バクテリア内で発現した場合、ウイルス様粒子(以下、VLPsという。)を形成することが知られている。
またパピロマウイルスウイルス様粒子(以下、PVVLPsという。)は全身性の免疫化のために使用された時、強い体液性と細胞性の免疫反応を引き起こすことが知られている。さらに、VLPsはPV偽ウイルスを形成する関連性のないプラスミドをパッケージにするために使用される。
【0008】
【発明が解決しようとする課題】
本発明者らは、PVVLPsに関する鋭意研究を行ったところ、PV偽ウイルスは、上記の従来のワクチンの欠点であった、DNAワクチンを筋肉内に投与した場合、殆どの細胞ではCTLsを生成することができず、CTLsを生成した細胞でも、その量は極めて少量であること、また、経口投与では分解されてリンパ組織に到達することができないといった問題を解決することができることを、すなわち、PV偽ウイルスは粘膜免疫系に到達することができ、粘膜の免疫反応を誘導することができることを見出した。また、VLPsに対するヘルパーT細胞反応は偽ウイルス中のプラスミドによって暗号化された抗体に対するCTL反応を同時に高めることができることを見出した。
さらに、経口投与により、PV偽ウイルスはパイエル板、粘膜固定層、脾臓に到達でき、全身性の免疫化によって、PV偽ウイルスはプラスミドDNAワクチンによるものと比べて強力なCTL反応を誘導できることを見出した。
【0009】
【課題を解決するための手段】
すなわち、請求項1に係る発明は、少なくとも、パピロマウイルスウイルス様粒子と該パピロマウイルスウイルス様粒子に包膜されたプラスミドとからなるパピロマウイルス偽ウイルスからなるDNAプラスミドワクチン用アジュバンドであって、該パピロマウイルスウイルス様粒子がヒトパピロマウイルスウイルス16L1生成物又はウシパピロマウイルス1L1生成物であることを特徴とするDNAプラスミドワクチン用アジュバンドに関する。
請求項2に係る発明は、パピロマウイルスウイルス様粒子に包膜されたプラスミドがパピロマウイルス由来のものではない請求項1記載のDNAプラスミドワクチン用アジュバンドに関する。
請求項3に係る発明は、パピロマウイルスウイルス様粒子が分解された後に再構築される際に、パピロマウイルスウイルス様粒子内にプラスミドが包膜されてなるパピロマウイルス偽ウイルスからなる請求項1記載のDNAプラスミドワクチン用アジュバンドに関する。
請求項4に係る発明は、前記プラスミドに病原体の遺伝子が導入されており、病気の治療と予防に用いられる請求項1乃至3のいずれかに記載のパピロマウイルス偽ウイルスからなるDNAプラスミドワクチン用アジュバンドに関する。
請求項5に係る発明は、前記プラスミドにIL−2が導入されている請求項1乃至4のいずれかに記載のパピロマウイルス偽ウイルスからなるDNAプラスミドワクチン用アジュバンドに関する。
請求項6に係る発明は、少なくとも、以下の工程(a)〜(c)よりなるパピロマウイルス偽ウイルスからなるDNAプラスミドワクチン用アジュバンドの調製方法に関する。
(a)パピロマウイルスウイルス様粒子を発現する細胞系において、ヒトパピロマウイルスウイルス16L1生成物又はウシパピロマウイルス1L1生成物を発現する工程。
(b)発現したパピロマウイルスウイルス様粒子がプラスミドを包膜することができる条件を提供して、プラスミドをパピロマウイルスウイルス様粒子中に包膜してパピロマウイルス偽ウイルスを生成する工程。
(c)(b)工程の生成物の中からパピロマウイルス偽ウイルスを分離する工程。
【0010】
【発明の実施の形態】
以下、本発明に係るDNAプラスミドワクチン用アジュバンド及びその調製方法について説明する。本発明で使用するPV偽ウイルスは、PVVLPsとこのPVVLPsに包膜されたプラスミドとから構成される。尚、本発明に係るDNAプラスミドワクチン用アジュバンドはPVのDNAは含まれていない。
PVVLPsは、PVウイルスのカプシドを構成するL1タンパク質から構成され、L1タンパク質とL2タンパク質の双方から構成されても構わない。
このようなPVVLPsの調製方法は特に限定されず、例えば、PVVLPsを発現することができる大腸菌、酵母、植物細胞、ほ乳動物細胞を用いたタンパク質細胞発現系を利用して調製する方法を例示することができる。特に、バキュロウイルスをベクターとして夜蛾の幼虫由来株化細胞を使用した発現系を用いることが好ましい。この理由は、生物活性を保持した形で目的とするタンパク質を大量に発現することができるからである。
【0011】
PVVLPsとしては特に限定されないが、具体的には、ヒトパピロマウイルス又はウシパピロマウイルスを由来とするPVVLPsを例示することができる。具体的には、ヒトパピロマウイルス16やウシパピロマウイルス1を由来とするPVVLPsを使用することが好ましい。より好ましくは、ヒトパピロマウイルス16L1生成物又はウシパピロマウイルス1L1生成物から構成されることが好ましい。
PVVLPsにはプラスミドが包膜されている。プラスミドをPVVLPsにより包膜する方法は特に限定されず、例えば、PVVLPsを破壊した後に、プラスミドの存在下、PVVLPsの自己集合作用によりPVVLPsを再構築する方法を例示することができる。
さらに具体的な調製方法について説明すると、まず、HPV−VLP又はBPV−VLPを、溶解緩衝液(20mM EGTA、40mM DTT、300mM NaCl、100mM Tris−HCl(pH8.0))に、体積比1:1となるように混合する。次に、1/10体積比のプラスミド(0.5〜1.0μg/μL)を加える。停止緩衝液(25mM CaCl2、20%(体積)DMSO)を加える。最後に、一晩、4℃でインキュベートする。BPV1−VLPを使用して調製された偽ウイルスは、2001年3月23日に中華人民共和国のCGMCCに寄託されている(CGMCC 0546)。
【0012】
以上説明した本発明で使用するPV偽ウイルスの特徴の一つは、粘膜及び全身性のリンパ組織に到達することができることである。経口投与の場合、プラスミドそれ自身では、粘膜及び全身性のリンパ組織に到達することはできない。これは、プラスミドは胃や腸のような環境下では生き抜くことができないからである。PVVLPsは、胃のような低いpHの環境下においても、または小腸のようなタンパク質分解が行われるような環境下においても生育することができる。
【0013】
どの細胞が偽ウイルスを集めるのかは定かではないが、小腸に付随する上皮組織のM細胞が、偽ウイルスを集めるとともに、これをパイエル板に運ぶ重要な役割を有しているのではないかと考えられる。さらに、上皮細胞が偽ウイルスを集めると考えられる。なぜならば、後述する試験例において明らかにされるように、グリーンランタンタンパク質(GLP)がエンコードされたPV偽ウイルスを与えたマウスの小腸及び直腸の粘膜固定層におけるGLP発現を見いだしたからである。PVVLPsは他の組織や種からの細胞と結合することが知られている。PV偽ウイルスは、粘膜固有層やパイエル板のマクロファージや樹状細胞と偽感染することができる。このことは、偽ウイルスは上皮層と交差することを示している。どのように、偽ウイルスが上皮細胞を通りぬけて、粘膜固有層やマクロファージに取り付くのかは現在のところ明らかではない。
また、後述する試験例に示されるように、偽ウイルスが主要組織抗体複合体(MLN)や脾臓に到達することを見いだした。粘膜固有層の樹状細胞やマクロファージが偽ウイルスに取り付き、MLNや脾臓に直接移動することが可能である。しかしながら、偽ウイルスが脾臓やMLNに直接到達する可能性を排除することはできなかった。
GLPがエンコードされたPV偽ウイルスをマウスの鼻腔又は膣粘膜に投与したところ、ウサギの粘膜や女性生殖器の管においてGLPが発現することが確認された。粘膜組織における偽ウイルスによる免疫化は、膣粘膜や気道においてCTL反応を生じさせることができる。事実、PVVLPsによる鼻腔内の免疫化は粘膜の抗体反応を引き起こす。このことは、結果として、この場所における粘膜の細胞性の免疫反応が誘導されることを示している。
【0014】
PV偽ウイルスの他の重要な特徴は、全身性の投与により、DNAワクチンよりも強力なCTL反応を誘導することができることである。これにより、PVVLPsとプラスミドDNAをともに皮下注射することで、DNAワクチン単体の投与による免疫化に比べて、より強力なCTL反応を引き起こすことができる。PVVLPsはCTL反応を誘導するためのDNAプラスミドのアジュバンドとして実際に作用することが確かめられた。DNAプラスミドをパッケージするために使用されたVLPsは、VLP特異的T−ヘルパー細胞反応を誘導することができる。これは、このT−ヘルパー細胞はプラスミドによってエンコードされた抗体のための特異的なCTLsの発現を高めることができる。事実、VLPsは強力なTh1反応を誘導することができる。Th1細胞がCTLsの増殖を増幅することによって、インターロイキン(IL)−2の産生に見込みがある。偽ウイルスの取り込みの後、偽ウイルスのVLPsによって抗原提示細胞が活性化される。それによって、CD80やCD86のような、より多くの共刺激の分子を発現する。
実際に、PVVLPsは、ヒトとマウスの樹状細胞に感染し活性化することが知られている。PVVLPsにより活性化されたマウスの樹状細胞は、CD80のような共刺激の分子のレベルを高める発現をすることができる。そして、IL−6やTNFαのような炎症誘発性のサイトカインが産生される。これらの抗原提示細胞の活性化は、プラスミド(DNAワクチン)単体によって形質導入された樹状細胞と比較して、プラスミドによってエンコードされた抗体のための未処置の特異的CTLsを活性化するための能力を高めることができる。
【0015】
PV偽ウイルスの経口投与は、粘膜性及び全身性のCTL反応を誘導することができる。腸粘膜CTLsは、パイエル板から単離された新鮮なリンパ球の中に見出すことができる。これは、パイエル板において多くの特異的なCTLsが発生していることを示している。さらに、偽ウイルスの経口投与は、粘膜性の偽ウイルスの感染からマウスを保護する。偽ウイルスの経口投与は、プロテクティブであることを指し示している。この保護は、BPVの偽ウイルスと交差反応し、それらの取り込みを防ぎ、それらの消去を促進した抗HPV L1 VLPs IgAのありそうもない結果である。なぜならば、これらは、HPV L1 VLPs単独により免疫化されたマウスは、全く保護されていなかったからである。さらに、この保護は、E7特異的抗体反応からはできない。なぜならば、E7は細胞質のタンパク質であり、われわれが使用したこのE7ミュータントは、不安定なタンパク質であり、細胞内で分解されてしまう。このように、プロテクションは、明らかにE7タンパク質特異的CTLsによって媒介されている。パイエル板におけるGLP発現のロスは、マウスにおける粘膜攻撃から1日後にのみ確認されている。これは、粘膜組織における直接の抗原特異的CTLイフェクター活性を示している。このデータは、粘膜のCTL反応が持続して誘発されることを示している。
【0016】
PV偽ウイルスは全身性及び粘膜のリンパ組織に偽感染するから、PV偽ウイルスは遺伝子放出ベクターとして利用することができる。GLPがエンコードされたPV偽ウイルスをマウスに与えてから、3週間までの期間、GLPの発現を確認することができる。このデータは、全身及び粘膜のリンパ組織に運ばれた遺伝子の発現が一過性であることを示している。このように、PV偽ウイルスは、短期間の粘膜系で必要とされる遺伝子を運ぶために使用することができる。例えば、Th1型の粘膜の免疫反応を抑制する、クローン病の腸粘膜のためのIL−10遺伝子、または喘息のための上気道においてTh2免疫反応を抑制するためのIL−12遺伝子、などの免疫調節性のサイトトキシン遺伝子を運ぶために使用することができる。
【0017】
PV偽ウイルスは複製しないベクターである。他の生きたベクターと比較した有利な点は、これらはPVVLPsやプラスミドから構成され、病原性が復帰する危険性がない点である。たとえ、これらは、ホストゲノムへのDNAの組み込みについて関係するといえども、今までにDNAプラスミドに関係する新たな新生物については見いだされていない。L1タンパク質からなるPVVLPsはホストにおいて有害な効果は発見されていない。偽ウイルスに感染した細胞は、偽ウイルスに対するCTL反応を誘導することで、通常、特異的なCTLによって除去される。たとえ、偽ウイルスはホストにおいて複製されないとしても、T細胞に対する抗原の暴露により誘発されたホストの抗原提示細胞において免疫原が発現する。
【0018】
結果として、PV偽ウイルスは、DNAワクチンに比べてより強力なCTL反応を誘発することができる。プロテクティブな粘膜や全身性のCTL反応を誘発する。そして、PV偽ウイルスは、粘膜上皮細胞における病原体による感染を治療または防ぐための通常のワクチンとして使用することができる。
【0019】
上記したプラスミドには様々な遺伝子を導入することができる。プラスミド中に導入される遺伝子の例としては、発現生成物、例えば遺伝子療法又は遺伝子免疫感作に有用なタンパク質、ポリペプチド、およびペプチド(グリコシル化、リン酸化又はアミド化等により修飾される)をコードする遺伝子が挙げられる。それらの発現を制御する配列は、プロモーター(例えば、RSV又はCMV)、エンハンサー、リーダーペプチド、終止およびポリアデニル化シグナル、スプライシングシグナル、ウイルスレプリコンおよび選択可能マーカーをコードする遺伝子を含む。
【0020】
本発明で使用するPV偽ウイルスは、各種の病気の治療に使用することができる。具体的には、遺伝性疾患の治療に、心臓血管性疾患から癌からエイズに及ぶ後天性疾患の治療に適用可能である。癌の例としては、黒色腫、腎細胞癌、卵巣癌、頸部癌、神経芽細胞腫、脳、頭部および頸部の癌、肺癌、肝臓癌、乳癌、結腸癌、前立腺癌、中皮腫、白血病、リンパ腫、多発性骨髄腫および皮膚癌が挙げられる。遺伝子療法を受けることが可能なその他の疾患の例としては、異常ヘモグロビン症、重度複合型免疫欠損、血友病、家族性高コレステロール血症、遺伝性気腫、嚢胞性線維腫、筋ジストロフィー、リソソーム蓄積症、ゴシェ病、プリンヌクレオシドホスホリラーゼ欠損症、α−1抗トリプシン欠損症、ファンコーニ貧血、ハンター症候群、慢性肉芽腫、慢性関節リウマチ、末梢血管性疾患、パーキンソン病、糖尿病、骨粗鬆症、慢性創傷、乾癬およびアトピー性皮膚炎が挙げられる。
【0021】
本発明で使用する偽ウイルス粒子により保有される遺伝子の例は、ヘモグロビンの構成成分、アデノシンデアミナーゼ、血液凝固因子、受容体(例えば、LDL受容体、ACh受容体、ホルモン受容体)、プリンヌクレオシドホスホリラーゼ、α−1抗トリプシン、イオンチャンネル(例えば、CFTR)、ジストロフィン、リソソーム酵素、インスリン、カルシトニン、ホルモン、成長因子、サイトカイン;成長ホルモン、エリスロポイエチン、上皮小体ホルモン、TNF、CSF、IGF、MDR、IL−1、IL−2、IL−4、インターフェロン、p53;抗体およびその断片、MHC複合体の成分(例えば、HLA−B7)およびマイナー組織適合性抗原;アンチセンスおよび三重らせん物質;腫瘍抑制遺伝子;ウイルス性抗原、細菌性抗原、寄生虫性抗原;結合組織タンパク質(例えば、コラーゲン、エラスチンおよびフィブロネクチン)および外来タンパク質(例えば、リゾチームおよびBSA)をコードするものなどを例示することができるが、特に限定はされない。
【0022】
さらに本発明で使用するPV偽ウイルスは、非経口、経腸、経口又は局所的適用に適した医薬上許容可能な有機又は無機担体物質と混合して用いることができる。適切な医薬上許容可能な担体としては、水、塩溶液、アルコール、植物性油、合成脂肪ビヒクル等が挙げられる。非経口適用に関しては、特に適した処方物は、注射可能な滅菌溶液、好ましくは油性又は水性溶液、並びに懸濁液、乳濁液、あるいはインプラントである。
【0023】
経腸的適用に関しては、特に適しているのは、錠剤、糖衣丸剤、液体、ドロップ、座薬又はカプセルである。甘味ビヒクルを用いる場合には、シロップ、エリキシル等が用いられる。局所適用に関しては、これらは、局所適用に適合性の担体を含み、好ましくは水より大きい動的粘度を有する非噴霧可能形態、粘性〜半固体又は固体形態として用いられる。適切な処方物としては、溶液、懸濁液、乳濁液、クリーム、軟膏、粉末、リニメント剤、膏薬、エーロゾル剤等が挙げられる。
【0024】
【実施例】
以下、本発明を実施例に基づき説明するが、本発明はこれらの実施例に何ら限定されるものではない。
【0025】
(1)細胞
RMA細胞(マウスのT−リンパ腫細胞),RMA−neo細胞,RMA−E7細胞は、熱で不活性化した10%−ウシ胎児血清(FCS)、2mMのL−グルタミン、100U/mLのペニシリン、100μg/mLのストレプトマイシンが追加されたRPMI培地(GIBCO−BRL社製)で維持された。
【0026】
(2)プラスミド
プラスミドpCI−neoはPromega社から購入した。グリーンランタンタンパク質(GLP)のための発現カセットは、プラスミドpCI−neoのNotIサイトにGLPのcDNAの全長を導入することで調製した。融合タンパク質である、GLPが融合したリンパ球性脈絡髄膜炎ウイルス(LCMV)gp 33主要組織抗原複合体(MHC)クラスIH−2Db制限的エピトープ(アミノ酸33〜41、KAVYNFATC)のための発現カセットは、テンプレートとしてpCI−GLPを、オリゴヌクレオチド5’プライマーとして「GCCACCATGAGCAAGGGCGAGGAACTGT」(配列番号1)を、オリゴヌクレオチド3’プライマーとして、(GLPとLCMV gp 33エピトープとの間に、下線部のリンカー配列(Gly4Ser3)を有する)「TCAACAGGTGGCAAAATTGTAGACAGCCTTAGATCCGCCGCCACCGCCACCCTTGTACAGCTCGTCCAT」(配列番号2)を、ポリメラーゼ連鎖反応(PCR)を利用して調製された。増量混合物(50μL)には、dGTP,dATP,dTTP,dCTP(それぞれ200μM)オリゴヌクレオチドプライマー(1μM)、テンプレートDNA(25ng)、TaqDNAポリメラーゼ(5μM,Promega社製)が含まれている。反応混合液は94℃で1分間、60℃で1分間、72℃で1分間を30サイクル、最後の10分間は72℃で維持された。増幅されたDNAはゲル濾過されてT−イージーベクター(Promega社製)に結合された。それから、DNAはEcoRIで分解されて、対応する酵素で分解されたpCI−neoに結合された。HPV16E7オープンリーディングフレーム(ORF)は、同じリンカー(Gly4Ser3)を用いたPCRによりGLPに融合された。そのフラグメントは、pCI−GLP−E7を形成するためにpCI−neoに挿入された。E7ORFはpCMVに挿入された。
【0027】
(3)バキュロウイルス組換え体の産生
Spodoptera fugiperda(Sf9)細胞は、10%FCSと2mMのグルタミンを補足したTNMFH培地(シグマ社)において27℃で単層培養された。Sf9細胞に形質移入するための10μgのトランスファープラスミド(PVL1933 BPV-1 L1Δ or PVL1932 HPV-16 L1Δ)が、0.2μgの直線化されたBaculo−Gold DNA(Pharmingen社)とともに使用された。組換えウイルス体は、(Muller,M.,J.Zhou,T.D.Reed,C.Rittmuller,A.Burger,J.Gabelsberger,J.Braspenning,and L.Gissmann.1997. Chimeric papillomavirus-like particles. Virology 234:93-111)や(Paintsil,J.,M.Muller,M.Picken,L.Gissmann,and J.Zhou.1996.Carboxyl terminus of bovine papillomavirus type-1 L1 protein is not required for capsid formation. Virology 223:238-244)に述べられているような方法により生成された。
【0028】
(4)PVVLPsの生成
Sf9細胞は、1〜2×106個の細胞/mLの濃度でスピナフラスコ中で10%FCSと2mMのグルタミンを補足したTNMFH培地で培養された。約2×108個の細胞は、10mLの培地に再懸濁されて、5分間1500gでペレット化された。それから、室温で1時間10mL、2〜5の感染効率でバキュロウイルス組換え体を加えた。125mLの培地を加えた後に、細胞は5個の円形シャーレ(直径150mm)に蒔かれ、27℃で3〜4日間培養された。細胞は回収されて、10mLの抽出緩衝液(5mM MgCl2,5mM CaCl2,150mM NaCl,20mM HEPES,0.01% Triton X−100)で懸濁されてペレット状にされた。この細胞はスピード3で1分間超音波処理され、抽出物は4℃で30分間10,000rpmでペレット状にされた。このペレットは8mLの抽出緩衝液で懸濁されて、スピード4.5で30秒間再び超音波処理されて再び遠心分離された。上澄の合計は、8mLのCsCl溶液(4.6gのCsCl/8mLの抽出緩衝液)の上に14mLの40%ショ糖溶液が接した二段階の勾配の上に層を形成され、Sorvall AH629スイングバケットロータを使用して10℃で二時間、27000rpmで遠心分離された。CsClとショ糖と完全なCsCl層の中間層を回収して、抽出緩衝液が満たされた13.4mLのQuickseal tubeに注いだ。試料は20℃、50000rpmで一晩遠心分離された。21ゲージの針でチューブの上部と下部に孔を開けることによって、勾配が画分された。そして、それぞれの画分5μLを10%SDS−PAGEとウェスタン法によって分析した。
【0029】
(5)ウェスタン法
感染させたインサート細胞からの抽出物は、10%SDS−PAGEで分離されて、セミドライブロティングシステム(Semi−Dry Blotting Unit,Fisher Biotech)を使用してニトロセルロースに転写された。その膜は、5%乾燥無脂肪乳で一晩遮断された。そして、マウス抗HPV 16 L1モノクローナル抗体(PharMingen)又はウサギ抗BPV 1 L1抗体と培養された。それから、その膜は抗マウスIgG−HRPまたは抗ウサギIgG−HRPと培養された。最後に、その膜は、ECL装置(Amersham)で処理された。陽性反応の画分は、電子顕微鏡によるVLPsの存在を確認する試験が行なわれた。
【0030】
(6)PV偽ウイルスの調製
ヒトPV(HPV)16 VLPs又はウシPV(BPV) 1 VLPs組換え体の分解または再構築は、TouzeやCoursaget(Touze,A.,P.Coursaget.1998. In vitro gene transfer using human papillomavirus-like particles.Nucleic Acids Res.26:1317-1323)の改良方法で行った。精製した5μgのHPV16 VLPs又はBPV 1 VLPs(理論上、1.5×1011粒子)は、150mM NaCl、10mM EGTA、20mM DTTを含み、最終の体積が100μLの50mMのTris−HCl緩衝液(pH7.5)で、室温で30分間培養した。このステップで、50mM Tris−HCl緩衝液と150mM NaClに加えられた1μgの発現プラスミドを、分裂したVLPsに加えた。この試料は、室温で一時間、等量のCaCl2(25mm)と20%ジメチルスルホキシド(DMSO)により希釈された。この試料は、室温で1時間10U ベンゾナーセ+プロテナーゼK(1mg/mL)で処理された。そして、プラスミドDNAの存在は、DNAプラスミドがVLPsの中にパッケージされているかどうか証明するために、アガロースゲル電気泳動法で決定された。その結果、0.5μgのDNAプラスミド(約7×1010のプラスミドのコピー)が200μLの偽ウイルスに組み込まれていた。尚、2001年3月23日に中華人民共和国のCGMCCに寄託されている(CGMCC 0546)。
【0031】
(7)電子顕微鏡
CsCl勾配から得られたそれぞれの画分20μLは、フローティングフィルターパット(孔の径0.02μm、Millipore)の上で45分間10mMのHEPESによって透析された。炭素コートされた銅グリッド(200メッシュの大きさ,EM Sciences)は2分間、20μLのポリL−リジン(1mg/mL、Sigma)で処理された。この試料は、2分間そのグリッドの上に置かれた。斑点のあるグリッドは、2分間、30μLのウラニルアセテートで染色された。過剰の染色剤は除去されて、そしてグリッドは、空気乾燥された。検体はZeiss EM 900電子顕微鏡で観察された。
【0032】
(8)マウス
6週齢〜8週齢の雌のC57BL/6系マウス(Jackson Laboratoryから購入した。)を使用した。全てのマウスは病原体フリーの状態に維持された。
【0033】
(9)免疫化
全身の免疫化のために、マウスは100μLのHPV偽ウイルス(約3.5×1010偽ウイルス又は0.25μgのプラスミド)、100μLのHPVVLPs、100μLのPBSに混合した20μgのプラスミド、100μLのIFAに混合した100μgのペプチド(LCMVgp aa 33−41)で免疫された。免疫化の14日後、五匹のマウスのグループは、100μLのBPV偽ウイルス(約3.5×1010偽ウイルス又は0.25μgのプラスミド)、100μLのBPVVLPs、20μgのプラスミド、100μLのペプチド(LCMVgp aa 33−41)で追加免疫された。粘膜の免疫化のために、マウスは100μLのPV偽ウイルス、100μLのVLPs、陰性対照として100μLのPBSに混合した20μgのプラスミドを強制栄養による経口投与によって免疫化された。そして、同じ方法で14日目にも追加免疫された。
【0034】
(10)全身性のCTLsの検出
追加免疫してから二週間の後、マウス(5グループ)は屠殺された。そして、それぞれのマウスから脾臓細胞が単離された。5%CO2、37℃で1時間、ナイロンウールカラムでインキュベーションした後に、濃縮されたT−細胞は、カラムに完全な細胞培養培地(RPMI 1640培地、10%の熱不活性化されたFCS、2mMのL−グルタミン、100U/mLのペニシリン、100μg/mLのストレプトマイシンが含まれている。)を通すことで洗浄された。細胞は、10%の熱不活性化されたFCS、2mMのL−グルタミン、100U/mLのペニシリン、100μg/mLのストレプトマイシン、10U/mLのIL−2、5μg/mLのE7ペプチド(aa 49−57,RAHYNIVTF,H−2Db−制限エピトープ)又はLCMV gp ペプチドが混合されたRPMI 1640培地で37℃、5%CO2で7日間培養された。特異的な細胞溶解活性は、以下の51Cr−遊離試験法によって決定された。
【0035】
(11)パイエル板と、腸間膜のリンパ節細胞の単離
マウスを屠殺した後に、腸間膜のリンパ節細胞(MLN)は腸間膜のリンパ節から分離された。そして、パイエル板を確認して小腸から取り外した。単細胞浮遊液を完全な細胞培養培地で作成した。新たに単離された腸のT−細胞は試験管内でアポトーシスを受けるための、それらの特異的な細胞溶解活性は、直ちに51Cr−遊離試験法によって決定された。
【0036】
(12)試験管内の細胞溶解測定
ターゲット細胞(RMA細胞,RMA−neo細胞,RMA−E7細胞)は37℃で1時間、51Cr(100μCi)で標識され、三回洗浄された。RMA細胞は、細胞に5μg/mLのペプチドを直接に導入することによって、ペプチドによって標識された。それからターゲット細胞(2000個の細胞/ウェル)は、異なる比(イフェクター:ターゲット)でイフェクター細胞とともに、37℃、6時間、V底の96ウェルの微量定量プレートでインキュベートされた。上澄が回収されて、γカウンター(ICN Biomedical Inc.)によって51Cr放出量を定量された。特異的な溶解が以下の計算式(数1)に従って計算された。自然発生した放出は、効果細胞が加えられていない培養培地の51Crで標識されたターゲット細胞を含む微量培養から決定された。また最大の放出は、0.5%(v/v)NP−40を有する51Crで標識されたターゲット細胞の溶解によって決定された。
【0037】
【数1】
【0038】
(13)IFN−γ−分泌細胞のELISPOTアッセイ
田口ら(Taguchi,T.,1990.J.Immunol.Methods 128:65-73)によって述べられているELISPOTアッセイは、CD8Tリンパ球を検出するために改良された。まず、96−ウェルフィルトレーションプレート(Millpore)を抗マウスIFN−γ抗体(Pharmingen)でコートした。10%FCS、L−グルタミン、2−メルカプトエタノール、抗生物質を加えたRPMI1640培地で三倍希釈した脾臓細胞は、1×106γ−線照射(50Gy)された脾臓細胞供給装置で、10Unites/ウェルの組換えヒトIL−2(PharMingen)とともににウェルに加えられた。細胞はペプチド刺激とともに48時間培養された。培養の後、プレートは、ビオチン化された抗マウスIFN−γ抗体(Pharmingen)のインキュベーションで洗浄された。スポットは、新たに調製された基質緩衝液(0.33mg/mLの3−アミノ−9−エチル−カルバゾールと0.1M酢酸ナトリウムに添加された0.015%過酸化水素に、pH5)によって発現された。
【0039】
(14)コンフォーカル顕微鏡
組織のスライド(5〜7μm)は、10分間、2%ホルムアルデヒドが添加されて冷却されたリン酸緩衝食塩水で固定された。そして、Zeiss EM 900コンフォーカル顕微鏡で観察された。画像はZeissにより開発されたソフトウェアを使用して撮影して記録された。
【0040】
(15)統計処理
異なる二つのグループの比較は、分散分析により行った。グループ間の比較は、Duncan試験により行った。α値が0.05を有意義なデータとした。
【0041】
試験例1:PV偽ウイルスの調製
ヒトパピロマウイルス(HPV)16L1VLPs又はウシパピロマウイルス(BPV)1L1VLPsは、バキュロウイルス組換え体を使用したSpodoptera frugiperda(Sf9)昆虫細胞内で調製された。その細胞は、C端欠失のHPV16L1又はBPV1L1の一方をエンコードされた組換えバキュロウイルスによって感染された。C端欠失はPVVLPsの製造の増強作用を有する。感染から三日後、細胞は溶解され、そしてVLPsはCsClとショ糖の勾配により精製された。勾配は(一フラクション当り1mL)分割されて、それぞれのフラクション5μLは、10%ドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動(SDS−PAGE)とウェスタン法により分析された。L1タンパク質の陽性画分は、電子顕微鏡によりVLPsの存在を確認する試験が行なわれた。VLPsを含む画分は、一時間、10mM HEPEs(pH7.5)で透析された。BPV1又はHPV16VLPs(図1a、b参照)は、EGTAとジチオスレイトール(DTT)を含む等体積の緩衝液に加えられ、室温で30分間インキュベーションされた。図1に示されるように、このようなコンディションではVLPsは完全に分裂された(図1のb、e参照)。プラスミドDNA(pCI−GLP)が加えられた。そして、その調製液はVLPs(図1c、f参照)を再生する目的でCaCl2とDMSOを加えてインキュベートした。多くのL1タンパク質はこのコンディションで再構築されるものと思われる。DNAプラスミドがVLPsの内部にパッケージされているか、またはその表面に存在するのかを決定するために、VLPsの表面のDNAを分解するために、再生の後にベンゾナーゼ(Bz)を使用した。それから、この偽ウイルスは、VLPsを破壊するために、プロテナーゼK(pK)で処理された。そして、VLPs内部のプラスミドDNAの存在は、アガロースゲル電気泳動により決定された。BzとpKで処理された偽ウイルス内にDNAプラスミドが存在していた。これにより、DNAプラスミドは、VLPsの内部に取り込まれていることが確かめられた(図2)。
【0042】
試験例2:PV偽ウイルスによるCTL反応の誘導
プラスミドDNAワクチンに比べて、PV偽ウイルスがより強いCTL反応を誘導するかどうか試験した。グリーンランタンタンパク質(GLP)が融合したリンパ球性脈絡髄膜炎ウイルス(LCMV)gp(アミノ酸33〜41)のH−2Db制限的エピトープがエンコードされたプラスミドを含むHPV−16偽ウイルス(HPV−pCI−GLP−LCMV)又はプラスミド単体(pCI−GLP−LCMV)をマウスに皮下注射することで免疫化した。pCI−GLP、HPV−16VLPs、GLP(HPV−pCI−GLP)がエンコードされた偽ウイルスは陰性対照として使用された。不完全フロインドアジュバント中のLCMV gp ペプチド(aa 33−41)は陽性対照として使用された。
免疫接種から14日後、マウスは、GLP−LCMV又はGLPがエンコードされたBPV−1偽ウイルス、pCI−GLP−LCMVプラスミド又はpCI−GLPプラスミド、VLPsBPV−1、或いはgp 33ペプチド、を皮下に追加免疫された。追加免疫から14日後、脾臓細胞が単離されて、LCMV gp 33ペプチド(aa 33−41)とともに、T−Stim培地(ConAを除く)で、1週間、37℃、5%CO2で培養した。標準的な51Cr遊離試験は、LCMVペプチド又はターゲット細胞である対照ペプチド(HPV16E7 aa 49−57)でラベルしたマウスのRMA細胞を使用したLCMV特異的CTLsを検出するために採用された。LCMVエピトープがエンコードされたPV偽ウイルスは、LCMVエピトープがエンコードされたプラスミドに比べて、より強いCTL反応を示すことが分かる(図3参照)。さらに、ELISPOT試験法により、PV偽ウイルスは、プラスミド単体に比べて、LCMVペプチドに特異的なインターフェロン(IFN)−γ−産生CD8+細胞を、3倍以上発現させることが確かめられた(表1参照)。
【0043】
【表1】
マウスが、LCMVgp33エピトープ(aa33−41)が融合したGLPがエンコードされたプラスミドを含むHPV偽ウイルス又はGLP、VLPs単体又はプラスミドpCI−GLP−LCMV、pCI−GLP単体又はLCMVペプチド+IFA(aa33−41)によって免疫化された。それから、BPV偽ウイルス(PV)、VLPs単体又はプラスミド単体で追加免疫された。追加免疫から二週間後、脾臓のリンパ球(五匹)が抗−γ−IFN抗体でコートされたプレートでインキュベートされた。二日後、ビオチン抗−γ−IFN抗体が添加されて一晩インキュベートされた。それから、ストレプタビジン−HRPが添加された。AEC基質による発色の後、スポットがカウントされた。表の数値は、スポットの三倍±標準偏差を意味している。
【0044】
試験例3:CTL反応を誘発するためのPVVLPsのDNAワクチンのアジュバンドとしての作用
VLPsがDNAワクチンによるCTL誘導のアジュバンドとしての効果を有するかどうか試験するために、プラスミド単体(20μg)、BPVVLPs(2.5μg)とプラスミド(2.5μg)、コントロールとしてVLPs(2.5μg)単体、をマウス(一群五匹)に免疫接種した。そして、γ−IFN ELISPOTによってLCMV gp 33特異的CTLsの発現を決定した。プラスミド単体で免疫接種したグループは、LCMV gp 33エピトープが10.7±7.25(SD)/2×104脾臓細胞数観察された。一方、プラスミドに加えてVLPsを免疫接種した場合、23.35±1.26(SD)/2×104脾臓細胞数観察された。VLPs単体では特異的なT細胞は誘発されなかった。このように、プラスミドとVLPsの共同した免疫化はプラスミド単独(p<0.05)による免疫化に比べてより多くのCTLsを誘導するから、VLPsはDNAワクチンによるCTLsの発生のためのアジュバンドとなりえることが示された。
【0045】
試験例4:PV偽ウイルスの粘膜と全身のリンパ球組織に対する偽感染
粘膜及び全身のリンパ組織にPV偽ウイルスが偽感染するかどうか確認するために、GLP(PV−pCI−GLP)がエンコードされたプラスミドを含む偽ウイルスの経口投与により粘膜または全身のリンパ組織にGLPを発現するかどうかを決定した。もし、偽ウイルスが粘膜又は全身のリンパ組織に偽感染すれば、コンフォーカル顕微鏡でGLPの発現を確認することができる。C57/BL6系マウス(一群五匹)にHPV又はBPV偽ウイルス(HPV−pCI−GLP又はBPV−pCI−GLP)、VLPs単体(HPVVLPs又はBPVVLPs)、又はプラスミド単体(pCI−GLP)を与えた。与えてから1日後又は7日後に、マウスを屠殺した。小腸、直腸、脾臓、腸間膜リンパ節(MLN)、筋肉を直ぐに取り出して凍結した。切り取った組織を作成して、そしてGLP反応をコンフォーカル顕微鏡で決定した。一日後(図4A参照)及び七日後にパイエル板、粘膜固有層、直腸、脾臓、MLNにGLPが発現していることが確認された。PV偽ウイルスが皮下注射により与えられた場合、GLPの発現は、リンパ節の排泄管、脾臓で確認されたが、筋肉では確認できなかった(図4B参照)。偽ウイルスによる誘発された細胞であるかどうかを決定するために、CD11b、CD11c、CD3、CD19に対するPEで標識された抗体により組織を染色した。そして、GLPと共存しているかどうかで決定した。CD11b+、CD11c+細胞はGLPと共存していた(図5参照)。これにより、マクロファージ及び樹状突起細胞が、PV偽ウイルスによって偽感染することが確かめられた。一方、CD3+、CD19+細胞はGLPと共存していなかった。
【0046】
試験例5:PV偽ウイルスの経口投与による粘膜又は全身性のリンパ組織の特異的なCTLsの誘発
PV偽ウイルスの経口投与が粘膜又は全身性のCTL反応を誘発するかどうかを確認するために、全身にCTL反応を効果的に誘発することで知られているHPV16E7変異体がエンコードされたプラスミドを使用した。マウス(C57/BL6系、一群五匹)はE7変異体(HPV−pCMV−E7)がエンコードされたHPV−16偽ウイルス、E7変異体(pCMV−E7)がエンコードされたプラスミド、HPV−16VLPs単体が入った餌が与えられた。餌が与えられてから14日後、E7変異体(BPV−pCMV−E7)がエンコードされたBPV−1偽ウイルス、プラスミドpCMV−E7、BPV−1VLPs単体によりマウスは追加免疫された。追加免疫されてから14日後、MLN、パイエル板、脾臓が単離された。MLNとパイエル板からのリンパ球は直ちにE7−特異的CTLsが検出された。脾臓由来のリンパ球は、1週間、E7ペプチド(aa49−57,RAHYNIVTF)で刺激された。標準的な51Cr遊離試験法を行った。PV−pCMV−E7が経口投与されたマウスのT細胞は、E7発現ターゲット細胞に対する粘膜および全身性のCTL反応を有することが分かった(図6参照)。プラスミド単体またはPVVLPsによる経口投与による免疫化は、E7−特異的CTL反応を誘発しなかった。偽ウイルスは、皮下注射による免疫化では、粘膜の免疫反応を誘発しなかった。
【0047】
試験例6:PV偽ウイルスの経口投与による免疫化
可溶性タンパク質の経口投与では、全身の耐性を誘発することが知られている。経口投与によって、PV偽ウイルスが全身の耐性を誘発するかどうか試験を行った。マウス(C57/BL6系、一群五匹)に、HPV−pCMV−E7、pCMV−E7、HPVVLPs単体を与えた。経口投与から14日後、BPV−pCMV−E7を皮下注射した。脾臓のT細胞が単離され、そして、T−stim培地(ConAなし)で、5%CO2、37℃の条件下で一週間、E7タンパク質とともにインキュベートされた。標準的な51Cr遊離試験を行ったところ、RMA−E7、RMA−neoをターゲット細胞として使用した場合、特異的なCTLsが検出された。三グループの全てのマウスは、RMA−E7に対するCTLsを有していた。しかし、RMA−neoに対しては有していなかった。(図7参照)
【0048】
試験例7:PV偽ウイルスの経口投与による粘膜感染に対する免疫性
PV偽ウイルスの経口投与によって、粘膜防御を誘発するかどうかを試験した。E7がエンコードされたHPV−16偽ウイルスを用いてマウスを免疫化した。そして、GLP−E7でエンコードされたBPV−1偽ウイルスを感染させた。もしHPV−16偽ウイルスが防御免疫反応を誘発するのであれば、粘膜の免疫系はBPV−1偽ウイルス感染細胞を駆除することができるのではないかと考えた。そのような反応はコントロールの免疫化された場合よりもHPV−16偽ウイルスで免疫化された場合のウサギの組織におけるGLPの発現が少ないこと又はないことによって検出することができる。HPV−pCMV−E7、pCMV−E7、HPV−16VLPsをマウス(一群五匹)に与えた。経口投与の後、十四日後、HPV−pCMV−E7、pCMV−E7単体、HPV−16VLPsで追加免疫された。追加免疫の後14日後、全ての三グループが、GLP−E7溶解タンパク質をエンコードするBPV−1偽ウイルスにより感染させた。一日後、マウスが屠殺された。そしてパイエル板におけるGLP発現が決定された。GLP発現は、PV偽ウイルス(それぞれの顕微鏡の範囲に平均4緑スポット±1)で免疫化されたマウスのパイエル板では、VLP(それぞれの顕微鏡の範囲に平均20緑スポット±3)又はプラスミド(それぞれの顕微鏡の範囲に平均21緑スポット±4)で免疫化された場合に比べて著しく少なかった(p<0.05)(図8参照)。
【0049】
試験例8
LCMV gp aa33−41がエンコードされたプラスミドがパッケージされたウシパピロマウイルスウイルス様粒子(BPVVLPs)からなる偽ウイルス40μgをB6マウス(12ヶ月齢、3ヶ月齢)に経口投与して免疫化した。いくつかのグループのマウスは、PV偽ウイルス−LCMV(PV偽ウイルスはIL−2がエンコードされている)で免疫化された。マウスは二週間後に追加免疫された。ターゲット細胞としてRMA細胞を使用した51Cr遊離試験により、LCMV gp aa33−41に対する全身性及び粘膜における細胞傷害性T−細胞反応を試験するために、追加免疫から二週間後に、脾臓と粘膜リンパを単離した。さらに、ELISAによって、血清イムノグロブリンg(IgG)及びVLPsに特異的な腸の分泌型IgAを測定した。さらに、ELISPOTによるマウスの免疫化に従って、IL−2、IL−4、IFN−γ、TGF−βのような全身および粘膜性のT細胞インターロイキン産生を測定した。また、3H−細胞の取り込みによって、ヘルパーT細胞の増殖を測定した。以下、この試験例について詳細に説明する。尚、図9〜14中のpsvはPV偽ウイルスのことである。
【0050】
試験例8−1
高齢(12ヶ月齢)B6マウスと若い(3ヶ月齢)B6マウスは、(IL−2エンコードされたPV偽ウイルス又はPBSが加えられた又は加えられていない)100μLのPBSに溶解された40μgのBPV偽ウイルスにより免疫化された(一群5匹)。二週間後、マウスは屠殺されて、小腸は洗浄されて、トリプシン阻害剤で処理された。200ng/100μL/ウェルのBPVVLPs、コントロールとしてのPBSが、室温で96ウェルプレートで培養された。ブロッキング緩衝液が室温で一時間インキュベーションされた。そして、糞抽出物が100μL/ウェルのプレートごとに異なる濃度でインキュベーションされた。糞抽出物は洗浄され、そして、抗−IgA抗体がウェルに添加されて室温で1〜2時間インキュベーションされ、洗浄された。第二の抗体であるHRPは5000倍に希釈されて100μL/ウェルで30分間インキュベートされた。洗浄され、発色緩衝液が添加され、2N H2SO4の添加により反応が停止された。糞抽出物の異なる濃度におけるELISAによるODの平均値の結果に示した。
【0051】
結果を図9に示す。図9に示される結果の通り、高年齢のマウスにおいて、PV偽ウイルスの経口投与では最小限の分泌型IgA反応を誘発した。一方、高年齢のマウスにおいて、IL2がエンコードされたPV偽ウイルスの存在下で、強力な分泌型IgAを発現した。
【0052】
試験例8−2
高齢(12ヶ月齢)B6マウスと若い(3ヶ月齢)B6マウスは、(IL−2エンコードされたPV偽ウイルスが加えられた又は加えられていない)100μLのPBSに溶解された40μgのBPV偽ウイルスが与えられた(一群5匹)。二週間後、マウスは屠殺されて、血液が回収された。100μL/ウェル当たり200ngのBPVVLPs又はコントロールとしてのPBSが、室温で一晩、96ウェルプレートで培養された。ブロッキング緩衝液が室温で一時間インキュベーションされた。血清のサンプルが、100μL/ウェルに異なる濃度で加えられてインキュベーションされた。血清は洗浄され、ウェルに抗マウスIgGが加えられて、室温で1〜2時間インキュベーションされた。そして洗浄された。第二の抗体であるHRPが、5000倍希釈されて100μL/ウェルで30分間インキュベーションされた。そして、洗浄され、発色緩衝液が添加され、反応が2N H2SO4を加えることで停止された。異なる濃度で添加された血清のOD(ELISA)の平均を測定した。
【0053】
結果を図10に示す。図10に示される結果の通り、PV偽ウイルスの経口投与は最小のIgG反応を誘導した。しかし、高齢のマウスにおいてIL2がエンコードされたPV偽ウイルスの存在下で強力な全身性のIgGを誘導した。
【0054】
試験例8−3
高齢(12ヶ月齢)B6マウスと若い(3ヶ月齢)B6マウス(一群5匹)は、PV偽ウイルス−IL−2とともに或いはPV偽ウイルス−IL−2なしで、40μgのLCMV gp aa33−41がエンコードされたPV偽ウイルスが経口投与された。二週間後、追加免疫された。追加免疫から二週間後、マウスは屠殺されて、粘膜固有層とパイエル板のリンパ球が回収された。ターゲット細胞である、RMA細胞が37℃で1時間、51Crでラベリングされ、三回洗浄された。一部のRMA細胞には、さらに、LCMV gp aa33−41ペプチドを5μg/mL直接与えることでラベリングした。ターゲット細胞(2000細胞/ウェル)はイフェクター細胞(イフェクター:ターゲット細胞の比が異なるように添加して)とともに、96ウェルのV字底マイクロタイタープレートで37℃、6時間、インキュベーションされた。上清が回収されて51Cr放出をγ−カウンターで測定した。結果を図11に示す。尚、図11中の横軸はイフェクターとターゲット細胞の比である。
【0055】
図11に示されるとおり、PV偽ウイルスの経口投与は高齢のマウスで最小の粘膜性のCTL反応を誘導する。しかし、IL−2エンコードされたPV偽ウイルスの存在で強力なCTL反応を誘発することができる。
【0056】
試験例8−4
高齢(12ヶ月齢)B6マウスと若い(3ヶ月齢)B6マウス(一群5匹)は、PV偽ウイルス−IL−2とともに或いはPV偽ウイルス−IL−2なしで、40μgのLCMV gp aa33−41がエンコードされたPV偽ウイルスが経口投与された。二週間後、追加免疫された。追加免疫から二週間後、マウスは屠殺されて、脾臓のリンパ球が回収された。ターゲット細胞である、RMA細胞が37℃で1時間、51Crでラベリングされ、三回洗浄された。一部のRMA細胞には、さらに、LCMV gp aa33−41ペプチドを5μg/mL直接与えることでラベリングした。ターゲット細胞(2000細胞/ウェル)はイフェクター細胞(エフェクター:ターゲット細胞の比が異なるように添加して)とともに、96ウェルのV字底マイクロタイタープレートで37℃、6時間、インキュベーションされた。上清が回収されて51Cr放出をγ−カウンターで測定した。結果を図12に示す。尚、図12中の横軸はイフェクターとターゲット細胞の比である。
【0057】
図12に示されるとおり、PV偽ウイルスの経口投与は高齢のマウスで最小の粘膜性のCTL反応を誘導する。しかし、IL−2エンコードされたPV偽ウイルスの存在で強力なCTL反応を誘発することができる。
【0058】
試験例8−5
高齢(12ヶ月齢)B6マウスと若い(3ヶ月齢)B6マウスは、PV偽ウイルス−IL−2とともに或いはPV偽ウイルス−IL−2なしで、PV偽ウイルス−LCMVが経口投与された。二週間後、追加免疫された。追加免疫から二週間後、マウスは屠殺されて、粘膜固有層とパイエル体のリンパ球が回収された。通常のB6マウスからの脾臓のフィーダー細胞が単離されて照射された。粘膜細胞は異なるVLPsの投薬量で培養された。そして脾臓フィーダー細胞により照射された。インキュベーションから三日後、細胞は16時間H3−チミジンで適用された。そしてH3−チミジンの取り込みを測定した。PV偽ウイルス−LCMVで免疫化された高齢マウスからのTヘルパー細胞の増殖は、若いマウスのそれと比較すると、減少した。対照的に、PV偽ウイルス−LCMV+PV偽ウイルス−IL−2で免疫化された高齢マウスのTヘルパー細胞の増殖は、PV偽ウイルス−LCMV単体で免疫化された高齢マウスのそれと比較すると有意な回復を見せた。結果を表2に記載する。表2の結果は、それぞれ一群当り、五匹の平均値(CPM)である。
【0059】
【表2】
【0060】
表2の結果の通り、高齢のマウスにおける粘膜のTヘルパー細胞の増殖は減少するが、IL−2エンコードされたPV偽ウイルスの経口投与により、増殖反応が回復することが分かる。
【0061】
試験例8−6
高齢(12ヶ月齢)B6マウスと若い(3ヶ月齢)B6マウスは、PV偽ウイルス−IL−2とともに或いはPV偽ウイルス−IL−2なしで、PV偽ウイルス−LCMVが経口投与された。二週間後、追加免疫された。追加免疫から二週間後、マウスは屠殺されて、脾臓のリンパ球が回収された。通常のB6マウスからの脾臓のフィーダー細胞が単離されて照射された。T細胞は異なるVLPsの投薬量で培養された。そして脾臓フィーダー細胞で照射された。インキュベーションから三日後、細胞は16時間H3−チミジンで適用された。そしてH3−チミジンの取り込みを測定した。PV偽ウイルス−LCMVで免疫化された高齢マウスからのTヘルパー細胞の増殖は、若いマウスのそれと比較すると、減少した。対照的に、PV偽ウイルス−LCMV+PV偽ウイルス−IL−2で免疫化された高齢マウスのTヘルパー細胞の増殖は、PV偽ウイルス−LCMV単体で免疫化された高齢マウスのそれと比較すると有意な回復を見せた。結果を表3に記載する。表3の結果は、それぞれの群当り、3匹の平均値(CPM)である。
【0062】
【表3】
【0063】
表3の結果の通り、高齢のマウスにおける全身性のTヘルパー細胞の増殖は減少するが、IL−2エンコードされたPV偽ウイルスの経口投与により、増殖反応が回復することが分かる。
【0064】
試験例8−7
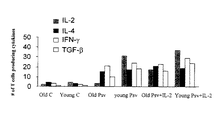
高齢(12ヶ月齢)B6マウスと若い(3ヶ月齢)B6マウスは、PV偽ウイルス−IL−2とともに、或いはなしで、PV偽ウイルス−LCMVが経口投与された。二週間後、追加免疫された。追加免疫から二週間後、マウスは屠殺されて、粘膜固有層とパイエル体のリンパ球が回収された。そして、IL−2、IL−4、IFN−γ、TGF−βに対する抗体がコートされた96ウェルプレートで、120μg/mLのVLPで刺激された。脾臓細胞が単離され、照射されて、37℃で48時間、粘膜細胞とともにインキュベートされた。このプレートは洗浄され、抗−マウスIL−2,IL−4,IFN−γ,TGF−βでラベルされたビオチンが加えられて、4℃で一晩培養された。このプレートは洗浄されて、ストレプタビジンとペルオキシダーゼ結合体が加えられ、AECペロオキシダーゼの基質が加えられ、そしてプレートは二回洗浄された。結果を図13に記載する。図13の結果は、一サンプル三回、一群三匹からの100×103粘膜細胞当りのT−細胞のサイトトキシン産生の平均値を示している。
【0065】
図13に示されるとおり、高齢および若いマウスにおける粘膜のサイトトキシンの生産は、偽ウイルスのワクチン投与に従うことが分かる。
【0066】
試験例8−8
高齢(12ヶ月齢)B6マウスと若い(3ヶ月齢)B6マウスは、PV偽ウイルス−IL−2とともに、或いはなしで、PV偽ウイルス−LCMVが経口投与された。二週間後、追加免疫された。追加免疫から二週間後、マウスは屠殺されて、脾臓のリンパ球が回収された。そして、IL−2,IL−4,IFN−γ,TGF−βに対する抗体がコートされた96ウェルプレートで、120μg/mLのVLPで刺激された。脾臓細胞が単離され、照射されて、37℃で48時間、脾臓のリンパ球とともにインキュベートされた。このプレートは洗浄され、抗−マウスIL−2,IL−4,IFN−γ,TGF−βでラベルされたビオチンが加えられて、4℃で一晩培養された。このプレートは洗浄されて、ストレプタビジンとペルオキシダーゼ結合体が加えられ、AECペロオキシダーゼの基質が加えられ、そしてプレートは二回洗浄された。結果を図14に記載する。図14の結果は、一サンプル三回、一群三匹からの100×103粘膜細胞当りのT−細胞のサイトトキシン生産の平均値を示している。
【0067】
図14に示されるとおり、高齢および若いマウスにおける全身性のサイトトキシンの生産は、偽ウイルスのワクチン投与に従うことが分かる。
【0068】
【発明の効果】
以上詳述した如く、本発明のDNAプラスミドワクチン用アジュバンドは、DNAワクチン単体の投与による免疫化に比べて、より強力なCTL反応を引き起こすことができる。また、パピロマウイルス偽ウイルスは、経口的な投与で免疫反応を誘発することができる。従って、この偽ウイルスは、ウイルスの感染や粘膜の腫瘍などの様々な疾病の治療及び予防に効果を発揮する。またパピロマウイルス偽ウイルスは、経口投与によって、パイエル板、粘膜固定層、脾臓に到達することができ、全身性の免疫化によって、プラスミドDNAワクチンよりも強力なCTL反応を誘導することができる。
【0069】
【配列表】
SEQUENCE LISTING
<110> Liang Qiao; Wei Shi
<120> PAPILLOMA PSEUDO-VIRUS AND PREPARATION
<160> 2
<150> CN 01118003.X
<210> 1
<211> 28
<212> DNA
<213> Artificial Sequence
<400> 1
gccaccatga gcaagggcga ggaactgt 28
<210> 2
<211> 69
<212> DNA
<213> Artificial Sequence
<400> 2
tcaacaggtg gcaaaattgt agacagcctt agatccgccg ccaccgccac ccttgtacag 60
ctcgtccat 69
【図面の簡単な説明】
【図1】 BPV−1L1又はHPV−16L1由来のVLPs、EGTA−及びGTT−粉砕されたVLPs、偽ウイルスの電子顕微鏡写真である。VLPsはEGTAとDTTにより粉砕されて、pCI−GLPプラスミドが加えられた。VLPsはPV偽ウイルスを形成するためにCaCl2の濃度を高めると再構築された。
(a)は、BPVVLPs、(b)は、粉砕されたBPVVLPs、(c)はBPV偽ウイルス、(d)はHPVVLPs、(e)は粉砕されたHPVVLPs、(f)はHPV偽ウイルスである。倍率は84,000倍である。
【図2】 PVVLPsによりカプシドに包まれたプラスミドpCI−GLPDNAである。ベンゾナーゼ(Bz)とプロテナーゼK(pK)により消化された後にPV偽ウイルス中のパッケージされたプラスミドDNAの電気泳動である。この偽ウイルスは、DNAプラスミドがVLPs中に取り込まれているかを証明するために、VLPsの表面のDNAを消化するためにBzとpKにより処理された。1μgのプラスミドDNAが偽ウイルスを作成するために使用された。そして、ベンゾナーゼとプロテナーゼKによる200μgの偽ウイルスの消化の後、0.5μgのプラスミドが残った。
【図3】 PV偽ウイルスは、DNAワクチンに比べて、強力なlcmv−特異的CTL反応を誘発する。マウスは、融合タンパク質GLP−LCMV gp33エピトープ(aa33−41)又はGLPがエンコードされたプラスミドが入った偽ウイルス、VLPs単体又はプラスミド単体(pCI−GLP−LCMV又はpCI−GLP)、パネルごとに示されたIFA中でLCMV gpペプチド(aa33−41)、が皮下注射された。51Cr−遊離試験法は、脾臓のリンパ組織におけるLCMV gp33エピトープ特異的CTLsを決定するために採用された。ターゲット細胞(RMA)は、LCMVペプチド(aa33−41)又はコントロールペプチド(HPV16E7aa49−57)がパルスされた。このデータは、平均±標準偏差(特異的な溶解の%)を示している(一群5匹のマウス)。
【図4】 経口投与により、PV偽ウイルスは、腸粘膜または全身性のリンパ組織に偽感染する。
A:GLPがエンコードされたHPV偽ウイルス又はBPV偽ウイルスは、マウスに経口投与された。GLP発現はコンフォーカル顕微鏡によって示された組織によって決定された。GLPは小腸及び大腸の粘膜固有層、パイエル板、腸間膜リンパ節、直腸、脾臓において発見された。しかしながら筋肉では発見されなかった。これはHPV偽ウイルスの投与されたマウスのデータを示している。
B:GLPがエンコードされたBPV偽ウイルス又はHPV偽ウイルスがマウスに皮下注射された。GLP発現は、排出リンパ節、脾臓で発見されたが、粘膜では発見されなかった。BPV偽ウイルスの投与されたマウスからのデータを示している。直線は5〜10μmを示している。
【図5】 GLPがエンコードされたPV偽ウイルスの経口投与されたマウスの粘膜組織のGLP発現により、腸のCD11b−、CD11c−陽性細胞が突き止められた。GLPがエンコードされた偽ウイルスの経口投薬から一日後、マウスの粘膜組織は取り除かれ、抗マウスCD11b−又はCD11c−抗体で染色された。PEラベルされた第二抗体は洗浄の後に使用された。粘膜組織におけるGLP、CD11b、CD11cの発現は、共焦点顕微鏡によって決定された。粘膜固有層(矢印で示す。)におけるGLP(緑色)、CD11c(パネルA中の赤色)、CD11b(パネルB中の赤)の発現が示されている。
【図6】 E7がエンコードされたPV偽ウイルスの経口投与は、粘膜と全身性のE7特異的CTLsを誘導した。E7ミュータント、VLPs単体、プラスミド単体、がエンコードされたプラスミドを有するHPV16偽ウイルスの経口投与によりマウスが免疫化された。そして、これらは、BPV偽ウイルス、VLPs単体、プラスミド単体、で追加免疫された。
(a)パイエル板と腸間膜リンパ節は単離されて、直ぐに試験管内における再刺激なしのE7−特異的CTLsを試験するために使用された。51Cr遊離反応が、E7特異的CTLsを決定するために使用された。ターゲット細胞はE7抗体を発現したRMA−E7又はRMA−neo(陰性対照細胞)であった。RMAE7とRMAneoは、比較できるMHCクラスIレベルを発現した。プラスミド又はVLPsが与えられたマウスからのリンパ細胞は、RMA−E7細胞を溶解しなかった。
(b)脾臓のリンパ球は単離されて、試験管内でE7ペプチド(aa49−57)とともに再刺激された。51Cr遊離試験は、E7特異的CTLsを決定するために使用された。ターゲット細胞(RMA)は、E7ペプチド(aa49−57)又はコントロールペプチドでパルスされた。このデータは平均±標準偏差(一群五匹の特異的溶解の%)を示す。
【図7】 PV偽ウイルスの経口投与は全身性の耐性を誘発しない。マウスはHPV16E7がエンコードされたプラスミドを有するHPV16偽ウイルス、VLPs単体、プラスミド単体を経口投与された。それから、マウスはE7タンパク質がエンコードされたBPV偽ウイルス(PV)で全身性の免疫化をされた。脾臓のリンパ球は単離されて、試験管内でE7ペプチド(aa49−57)で再刺激された。51Cr遊離試験法は、E7特異的CTLsの存在を決定するために採用された。ターゲット細胞(RMA)は、E7ペプチド(aa49−57)、コントロールペプチドでパルスされた。このデータは平均±標準偏差(一群5匹のマウス特異的溶解%)を示している。
【図8】 偽ウイルスの経口投与は粘膜の攻撃に対してマウスを保護することができた。マウスはE7がエンコードされたプラスミドを持つHPV16偽ウイルス、VLP単体、プラスミド単体を経口投与された。そして、同様の方法で14日後に追加免疫された。28日目にマウスの全ての3群が、GLP−E7融合タンパク質がエンコードされたBPV偽ウイルスで経口的な攻撃をされた。一日後、マウスはパイエル板におけるGLP発現を決定するために屠殺された。GLP発現は、VLP又はプラスミドで免疫化されたマウスに比べて、偽ウイルスで免疫化されたマウスからのパイエル板では、著しく少なかった。
【図9】 試験例8−1の結果を示すグラフである。
【図10】 試験例8−2の結果を示すグラフである。
【図11】 試験例8−3の結果を示すグラフである。
【図12】 試験例8−4の結果を示すグラフである。
【図13】 試験例8−5の結果を示すグラフである。
【図14】 試験例8−6の結果を示すグラフである。
Claims (1)
- 少なくとも、以下の工程からなるパピロマウイルス偽ウイルスからなる、粘膜免疫反応の誘導を増強するための、経口投与用DNAプラスミドワクチン用アジュバントの調製方法。
(a)パピロマウイルスウイルス様粒子を発現する細胞系において、ヒトパピロマウイルス16L1生成物又はウシパピロマウイルス1L1生成物を発現する工程。
(b)発現したパピロマウイルスウイルス様粒子がプラスミドを包膜することができる条件を提供して、プラスミドをパピロマウイルスウイルス様粒子中に包膜してパピロマウイルス偽ウイルスを生成する工程であって、当該プラスミドがインターロイキン−2遺伝子を担持しており、以下の工程を含む工程。
(i)ヒトパピロマウイルス16L1生成物又はウシパピロマウイルス1L1生成物を溶解緩衝液に混合する工程であって、前記溶解緩衝液がEGTA、DTT、NaCl、Tris−HClを含む工程。
(ii)プラスミドを加える工程。
(iii)停止緩衝液を加える工程であって、前記停止緩衝液がCaCl2及びDMSOを含む工程。
(c)(b)工程の生成物の中からパピロマウイルス偽ウイルスを分離する工程。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN01118003A CN1114690C (zh) | 2001-05-15 | 2001-05-15 | 乳头瘤假病毒及其制备方法 |
| CN01118003.X | 2001-05-15 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007124042A Division JP4472724B2 (ja) | 2001-05-15 | 2007-05-09 | パピロマウイルス偽ウイルス及びその調製方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2003024058A JP2003024058A (ja) | 2003-01-28 |
| JP4511090B2 true JP4511090B2 (ja) | 2010-07-28 |
Family
ID=4662911
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2001321828A Expired - Fee Related JP4511090B2 (ja) | 2001-05-15 | 2001-10-19 | Dnaプラスミドワクチン用アジュバンド及びその調製方法 |
| JP2007124042A Expired - Fee Related JP4472724B2 (ja) | 2001-05-15 | 2007-05-09 | パピロマウイルス偽ウイルス及びその調製方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007124042A Expired - Fee Related JP4472724B2 (ja) | 2001-05-15 | 2007-05-09 | パピロマウイルス偽ウイルス及びその調製方法 |
Country Status (4)
| Country | Link |
|---|---|
| US (3) | US6878541B2 (ja) |
| JP (2) | JP4511090B2 (ja) |
| CN (1) | CN1114690C (ja) |
| WO (1) | WO2002092796A1 (ja) |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1114690C (zh) | 2001-05-15 | 2003-07-16 | 乔良 | 乳头瘤假病毒及其制备方法 |
| US20120164173A1 (en) * | 2001-05-15 | 2012-06-28 | Liang Qiao | Papilloma Pseudovirus and Preparation |
| CA2604909A1 (en) | 2005-04-15 | 2006-10-26 | The Government Of The United States Of America, As Represented By The Se Cretary, Department Of Health And Human Services | Methods and compositions for producing an enhanced immune response to a human papillomavirus immunogen |
| HUE030437T2 (en) | 2007-05-08 | 2017-05-29 | Us Health | Papillomavirus pseudoviruses for detection and therapy of tumors |
| CN107252489A (zh) | 2009-04-13 | 2017-10-17 | 法国健康和医学研究院 | Hpv颗粒及其用途 |
| WO2011039646A2 (en) | 2009-09-30 | 2011-04-07 | Inserm (Institut National De La Sante Et De La Recherche Medicale) | Papilloma virus -like particles for targeted gene delivery |
| WO2011053675A2 (en) | 2009-10-30 | 2011-05-05 | Cns Therapeutics, Inc. | Improved neurturin molecules |
| WO2013119877A1 (en) | 2012-02-07 | 2013-08-15 | Aura Biosciences, Inc. | Virion-derived nanospheres for selective delivery of therapeutic and diagnostic agents to cancer cells |
| EP2814514B1 (en) | 2012-02-16 | 2017-09-13 | Atyr Pharma, Inc. | Histidyl-trna synthetases for treating autoimmune and inflammatory diseases |
| ES2729841T3 (es) | 2013-09-18 | 2019-11-06 | Aura Biosciences Inc | Conjugados de partículas similares a virus para tratar tumores |
| EP3368077A4 (en) | 2015-10-30 | 2019-10-16 | Aleta Biotherapeutics Inc. | COMPOSITIONS AND METHODS OF TUMOR TRANSDUCTION |
| CA3003728A1 (en) | 2015-10-30 | 2017-05-04 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Targeted cancer therapy |
| AU2016343809B2 (en) | 2015-10-30 | 2022-08-04 | Aleta Biotherapeutics Inc. | Compositions and methods for treatment of cancer |
| US10751398B2 (en) * | 2016-10-07 | 2020-08-25 | Loyola University Chicago | Inflammasome activators and methods of use to treat tumors |
| MY202196A (en) | 2017-06-23 | 2024-04-16 | Verimmune Inc | Chimeric virus-like particles and uses thereof as antigen-specific redirectors of immune responses |
| EP3706783A1 (en) | 2017-11-06 | 2020-09-16 | The United States of America, as represented by the Secretary, Department of Health and Human Services | Cancer treatment utilizing pre-existing microbial immunity |
| US11946048B2 (en) | 2017-11-14 | 2024-04-02 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | Non-human papillomaviruses for gene delivery in vitro and in vivo |
| CN113396155A (zh) | 2018-12-27 | 2021-09-14 | 维伊木恩股份有限公司 | 偶联病毒样颗粒及其作为抗肿瘤免疫重定向剂的用途 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE19526752C2 (de) * | 1995-07-21 | 1997-08-07 | Lutz Prof Dr Gissmann | Hocheffiziente Bildung von Papillomavirusähnlichen Partikeln |
| FR2749323B1 (fr) * | 1996-06-04 | 1998-07-10 | Pasteur Merieux Serums Vacc | Pseudo-particules virales utiles en tant que vecteur de delivrance d'acide nucleique |
| CA2257822A1 (en) * | 1996-07-17 | 1998-01-22 | The Government Of The United States Of America, Represented By The Secre Tary, Department Of Health And Human Services | Infectious papillomavirus pseudoviral particles |
| DK1015561T3 (da) * | 1997-09-05 | 2006-11-13 | Medimmune Inc | In vitro-fremgangsmåde til adskillelse/gensamling af papillomavirus-lignende partikler (VLP'er) |
| GB9806666D0 (en) * | 1998-03-27 | 1998-05-27 | Stanley Margaret | Antigen preparation and use |
| CN1241636A (zh) * | 1999-07-05 | 2000-01-19 | 第一军医大学珠江医院 | 抗hpv16e6核酶质粒及其在人乳头瘤病毒与肿瘤治疗中的应用 |
| GB0007231D0 (en) * | 2000-03-24 | 2000-05-17 | Chiron Spa | Modified rna for gene delivery |
| CN1114690C (zh) * | 2001-05-15 | 2003-07-16 | 乔良 | 乳头瘤假病毒及其制备方法 |
-
2001
- 2001-05-15 CN CN01118003A patent/CN1114690C/zh not_active Expired - Fee Related
- 2001-10-19 JP JP2001321828A patent/JP4511090B2/ja not_active Expired - Fee Related
-
2002
- 2002-03-22 WO PCT/CN2002/000187 patent/WO2002092796A1/zh not_active Application Discontinuation
- 2002-11-14 US US10/294,087 patent/US6878541B2/en not_active Expired - Lifetime
-
2005
- 2005-02-17 US US11/060,034 patent/US7205126B2/en not_active Expired - Fee Related
-
2007
- 2007-04-09 US US11/784,626 patent/US8129144B2/en not_active Expired - Fee Related
- 2007-05-09 JP JP2007124042A patent/JP4472724B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| WO2002092796A1 (fr) | 2002-11-21 |
| US20100255027A1 (en) | 2010-10-07 |
| CN1114690C (zh) | 2003-07-16 |
| JP2007211026A (ja) | 2007-08-23 |
| US20050142115A1 (en) | 2005-06-30 |
| US20030129728A1 (en) | 2003-07-10 |
| CN1333338A (zh) | 2002-01-30 |
| JP2003024058A (ja) | 2003-01-28 |
| US8129144B2 (en) | 2012-03-06 |
| US7205126B2 (en) | 2007-04-17 |
| JP4472724B2 (ja) | 2010-06-02 |
| US6878541B2 (en) | 2005-04-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4472724B2 (ja) | パピロマウイルス偽ウイルス及びその調製方法 | |
| US7097843B2 (en) | Immunogenic peptides from the HPV E7 protein | |
| Kirnbauer et al. | Virus-like particles of bovine papillomavirus type 4 in prophylactic and therapeutic immunization | |
| Shi et al. | Papillomavirus pseudovirus: a novel vaccine to induce mucosal and systemic cytotoxic T-lymphocyte responses | |
| Jochmus et al. | Chimeric virus-like particles of the human papillomavirus type 16 (HPV 16) as a prophylactic and therapeutic vaccine | |
| Schiller | Papillomavirus-like particle vaccines for cervical cancer | |
| US7754430B2 (en) | Papilloma virus capsomere vaccine formulations and methods of use | |
| CA2305683C (en) | Immunogenic peptides from the hpv e7 protein | |
| US6458368B1 (en) | Attenuated microorganism strains expressing HPV proteins | |
| Da Silva et al. | Effect of preexisting neutralizing antibodies on the anti-tumor immune response induced by chimeric human papillomavirus virus-like particle vaccines | |
| Fernando et al. | Th2-type CD4+ cells neither enhance nor suppress antitumor CTL activity in a mouse tumor model | |
| AU9015498A (en) | In vitro method for disassembly/reassembly of papillomavirus virus-like particles (VLPs) | |
| EP1018555A2 (en) | Chimeric papilomavirus-like particles | |
| US6020309A (en) | Pharmaceuticals based on papillomaviruses | |
| HUT76354A (en) | Papillomavirus vaccines | |
| Dupuy et al. | Cell mediated immunity induced in mice by HPV 16 L1 virus-like particles | |
| JPH08308575A (ja) | 組換アデノウイルス | |
| Oh et al. | Enhanced mucosal and systemic immunogenicity of human papillomavirus-like particles encapsidating interleukin-2 gene adjuvant | |
| JP2002516291A (ja) | パピローマウイルス・ウイルス様粒子による経口免疫感作 | |
| US20020197668A1 (en) | Papilloma virus capsomere vaccine formulations and methods of use | |
| US6458362B1 (en) | Recombinant VP2 parvoviral pseudo-particles encoding CTL or T-helper cell epitopes | |
| KR100904844B1 (ko) | 인유두종 바이러스(hpv)유전자를 포함하는자궁경부암의 치료 또는 예방용 dna 백신 | |
| US20040081661A1 (en) | Papillomavirus truncated L1 protein and fusion protein constructs | |
| KR20020047195A (ko) | 백신 | |
| Hu et al. | Protective cell-mediated immunity by DNA vaccination against papillomavirus L1 capsid protein in the cottontail rabbit papillomavirus model |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20040623 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20040924 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20060116 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20060414 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20060419 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060713 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20070124 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070420 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070620 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070705 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070706 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20070711 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20071109 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100329 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20100506 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130514 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |