JP4266399B2 - 粉末状吸入用医薬品組成物 - Google Patents
粉末状吸入用医薬品組成物 Download PDFInfo
- Publication number
- JP4266399B2 JP4266399B2 JP33414297A JP33414297A JP4266399B2 JP 4266399 B2 JP4266399 B2 JP 4266399B2 JP 33414297 A JP33414297 A JP 33414297A JP 33414297 A JP33414297 A JP 33414297A JP 4266399 B2 JP4266399 B2 JP 4266399B2
- Authority
- JP
- Japan
- Prior art keywords
- drug
- excipient
- pharmaceutical composition
- lactose
- inhalation
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 239000008194 pharmaceutical composition Substances 0.000 title claims description 10
- 239000000843 powder Substances 0.000 title description 21
- 229940079593 drug Drugs 0.000 claims description 62
- 239000003814 drug Substances 0.000 claims description 62
- 239000002245 particle Substances 0.000 claims description 36
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 claims description 28
- 239000010419 fine particle Substances 0.000 claims description 28
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 claims description 27
- 239000008101 lactose Substances 0.000 claims description 27
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 22
- 238000000034 method Methods 0.000 claims description 13
- 238000001694 spray drying Methods 0.000 claims description 6
- GMVPRGQOIOIIMI-DWKJAMRDSA-N prostaglandin E1 Chemical compound CCCCC[C@H](O)\C=C\[C@H]1[C@H](O)CC(=O)[C@@H]1CCCCCCC(O)=O GMVPRGQOIOIIMI-DWKJAMRDSA-N 0.000 claims description 5
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 claims description 3
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 claims description 3
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 claims description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 claims description 2
- 229920002307 Dextran Polymers 0.000 claims description 2
- 229930091371 Fructose Natural products 0.000 claims description 2
- 239000005715 Fructose Substances 0.000 claims description 2
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 claims description 2
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 claims description 2
- 229930195725 Mannitol Natural products 0.000 claims description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 claims description 2
- 229930006000 Sucrose Natural products 0.000 claims description 2
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 claims description 2
- 239000008103 glucose Substances 0.000 claims description 2
- 239000000594 mannitol Substances 0.000 claims description 2
- 235000010355 mannitol Nutrition 0.000 claims description 2
- 239000005720 sucrose Substances 0.000 claims description 2
- KUVIULQEHSCUHY-XYWKZLDCSA-N Beclometasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(Cl)[C@@H]1[C@@H]1C[C@H](C)[C@@](C(=O)COC(=O)CC)(OC(=O)CC)[C@@]1(C)C[C@@H]2O KUVIULQEHSCUHY-XYWKZLDCSA-N 0.000 claims 1
- 229950000210 beclometasone dipropionate Drugs 0.000 claims 1
- FZWBNHMXJMCXLU-BLAUPYHCSA-N isomaltotriose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1 FZWBNHMXJMCXLU-BLAUPYHCSA-N 0.000 claims 1
- 229960001375 lactose Drugs 0.000 description 26
- 239000000203 mixture Substances 0.000 description 26
- 238000002360 preparation method Methods 0.000 description 24
- 238000009472 formulation Methods 0.000 description 17
- 239000002775 capsule Substances 0.000 description 13
- 210000000621 bronchi Anatomy 0.000 description 11
- 210000003437 trachea Anatomy 0.000 description 11
- 210000004072 lung Anatomy 0.000 description 9
- 238000004519 manufacturing process Methods 0.000 description 9
- KYKAJFCTULSVSH-UHFFFAOYSA-N chloro(fluoro)methane Chemical compound F[C]Cl KYKAJFCTULSVSH-UHFFFAOYSA-N 0.000 description 7
- 238000011156 evaluation Methods 0.000 description 7
- 210000002345 respiratory system Anatomy 0.000 description 7
- 230000008021 deposition Effects 0.000 description 6
- 230000000694 effects Effects 0.000 description 5
- 210000003800 pharynx Anatomy 0.000 description 5
- 229910001220 stainless steel Inorganic materials 0.000 description 5
- 239000010935 stainless steel Substances 0.000 description 5
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 4
- 229940092705 beclomethasone Drugs 0.000 description 4
- NBMKJKDGKREAPL-DVTGEIKXSA-N beclomethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(Cl)[C@@H]1[C@@H]1C[C@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O NBMKJKDGKREAPL-DVTGEIKXSA-N 0.000 description 4
- 238000002156 mixing Methods 0.000 description 4
- 210000000214 mouth Anatomy 0.000 description 4
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- 238000004220 aggregation Methods 0.000 description 3
- 230000002776 aggregation Effects 0.000 description 3
- 239000002552 dosage form Substances 0.000 description 3
- 238000004128 high performance liquid chromatography Methods 0.000 description 3
- 230000007721 medicinal effect Effects 0.000 description 3
- 229940071648 metered dose inhaler Drugs 0.000 description 3
- 238000000465 moulding Methods 0.000 description 3
- 239000012798 spherical particle Substances 0.000 description 3
- GMVPRGQOIOIIMI-UHFFFAOYSA-N (8R,11R,12R,13E,15S)-11,15-Dihydroxy-9-oxo-13-prostenoic acid Natural products CCCCCC(O)C=CC1C(O)CC(=O)C1CCCCCCC(O)=O GMVPRGQOIOIIMI-UHFFFAOYSA-N 0.000 description 2
- WSVLPVUVIUVCRA-KPKNDVKVSA-N Alpha-lactose monohydrate Chemical compound O.O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O WSVLPVUVIUVCRA-KPKNDVKVSA-N 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 2
- 238000003917 TEM image Methods 0.000 description 2
- MUMGGOZAMZWBJJ-DYKIIFRCSA-N Testostosterone Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 MUMGGOZAMZWBJJ-DYKIIFRCSA-N 0.000 description 2
- 239000000853 adhesive Substances 0.000 description 2
- 230000001070 adhesive effect Effects 0.000 description 2
- 229960000711 alprostadil Drugs 0.000 description 2
- 239000011612 calcitriol Substances 0.000 description 2
- 238000011109 contamination Methods 0.000 description 2
- 238000011049 filling Methods 0.000 description 2
- NBVXSUQYWXRMNV-UHFFFAOYSA-N fluoromethane Chemical compound FC NBVXSUQYWXRMNV-UHFFFAOYSA-N 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 239000003163 gonadal steroid hormone Substances 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 229940041682 inhalant solution Drugs 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 238000001000 micrograph Methods 0.000 description 2
- 239000011812 mixed powder Substances 0.000 description 2
- 239000006199 nebulizer Substances 0.000 description 2
- 229940094443 oxytocics prostaglandins Drugs 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 150000003180 prostaglandins Chemical class 0.000 description 2
- 239000012488 sample solution Substances 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 238000001179 sorption measurement Methods 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- QYSXJUFSXHHAJI-YRZJJWOYSA-N vitamin D3 Chemical compound C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)CCCC(C)C)=C\C=C1\C[C@@H](O)CCC1=C QYSXJUFSXHHAJI-YRZJJWOYSA-N 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- PXGPLTODNUVGFL-BRIYLRKRSA-N (E,Z)-(1R,2R,3R,5S)-7-(3,5-Dihydroxy-2-((3S)-(3-hydroxy-1-octenyl))cyclopentyl)-5-heptenoic acid Chemical compound CCCCC[C@H](O)C=C[C@H]1[C@H](O)C[C@H](O)[C@@H]1CC=CCCCC(O)=O PXGPLTODNUVGFL-BRIYLRKRSA-N 0.000 description 1
- WMYIVSWWSRCZFA-RWVJFQLJSA-N 1,25-Dihydroxyvitamin D3-26,23-lactone Chemical compound C([C@@H](C)[C@@H]1[C@]2(CCCC(/[C@@H]2CC1)=C\C=C\1C([C@@H](O)C[C@H](O)C/1)=C)C)[C@H]1C[C@@](C)(O)C(=O)O1 WMYIVSWWSRCZFA-RWVJFQLJSA-N 0.000 description 1
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 1
- VOVIALXJUBGFJZ-KWVAZRHASA-N Budesonide Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@@H]2[C@@H]1[C@@H]1C[C@H]3OC(CCC)O[C@@]3(C(=O)CO)[C@@]1(C)C[C@@H]2O VOVIALXJUBGFJZ-KWVAZRHASA-N 0.000 description 1
- 102000055006 Calcitonin Human genes 0.000 description 1
- 108060001064 Calcitonin Proteins 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 206010014561 Emphysema Diseases 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- CBENFWSGALASAD-UHFFFAOYSA-N Ozone Chemical compound [O-][O+]=O CBENFWSGALASAD-UHFFFAOYSA-N 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- MECHNRXZTMCUDQ-UHFFFAOYSA-N Vitamin D2 Natural products C1CCC2(C)C(C(C)C=CC(C)C(C)C)CCC2C1=CC=C1CC(O)CCC1=C MECHNRXZTMCUDQ-UHFFFAOYSA-N 0.000 description 1
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 1
- 239000003470 adrenal cortex hormone Substances 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- PYMYPHUHKUWMLA-WDCZJNDASA-N arabinose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)C=O PYMYPHUHKUWMLA-WDCZJNDASA-N 0.000 description 1
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 229960002890 beraprost Drugs 0.000 description 1
- CTPOHARTNNSRSR-APJZLKAGSA-N beraprost Chemical compound O([C@H]1C[C@@H](O)[C@@H]([C@@H]21)/C=C/[C@@H](O)C(C)CC#CC)C1=C2C=CC=C1CCCC(O)=O CTPOHARTNNSRSR-APJZLKAGSA-N 0.000 description 1
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 description 1
- 230000000975 bioactive effect Effects 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 208000030270 breast disease Diseases 0.000 description 1
- 210000003123 bronchiole Anatomy 0.000 description 1
- 206010006451 bronchitis Diseases 0.000 description 1
- 229960004436 budesonide Drugs 0.000 description 1
- LWQQLNNNIPYSNX-UROSTWAQSA-N calcipotriol Chemical compound C1([C@H](O)/C=C/[C@@H](C)[C@@H]2[C@]3(CCCC(/[C@@H]3CC2)=C\C=C\2C([C@@H](O)C[C@H](O)C/2)=C)C)CC1 LWQQLNNNIPYSNX-UROSTWAQSA-N 0.000 description 1
- 229960002882 calcipotriol Drugs 0.000 description 1
- 229960004015 calcitonin Drugs 0.000 description 1
- BBBFJLBPOGFECG-VJVYQDLKSA-N calcitonin Chemical compound N([C@H](C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(N)=O)C(C)C)C(=O)[C@@H]1CSSC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1 BBBFJLBPOGFECG-VJVYQDLKSA-N 0.000 description 1
- GMRQFYUYWCNGIN-NKMMMXOESA-N calcitriol Chemical compound C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@@H](CCCC(C)(C)O)C)=C\C=C1\C[C@@H](O)C[C@H](O)C1=C GMRQFYUYWCNGIN-NKMMMXOESA-N 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000000779 depleting effect Effects 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 229960001342 dinoprost Drugs 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- KAQKFAOMNZTLHT-VVUHWYTRSA-N epoprostenol Chemical compound O1C(=CCCCC(O)=O)C[C@@H]2[C@@H](/C=C/[C@@H](O)CCCCC)[C@H](O)C[C@@H]21 KAQKFAOMNZTLHT-VVUHWYTRSA-N 0.000 description 1
- 229960001123 epoprostenol Drugs 0.000 description 1
- 229960002061 ergocalciferol Drugs 0.000 description 1
- 229960005309 estradiol Drugs 0.000 description 1
- 229930182833 estradiol Natural products 0.000 description 1
- 229940011871 estrogen Drugs 0.000 description 1
- 239000000262 estrogen Substances 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 229960000676 flunisolide Drugs 0.000 description 1
- 229960000289 fluticasone propionate Drugs 0.000 description 1
- WMWTYOKRWGGJOA-CENSZEJFSA-N fluticasone propionate Chemical compound C1([C@@H](F)C2)=CC(=O)C=C[C@]1(C)[C@]1(F)[C@@H]2[C@@H]2C[C@@H](C)[C@@](C(=O)SCF)(OC(=O)CC)[C@@]2(C)C[C@@H]1O WMWTYOKRWGGJOA-CENSZEJFSA-N 0.000 description 1
- 238000005469 granulation Methods 0.000 description 1
- 230000003179 granulation Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 229960001021 lactose monohydrate Drugs 0.000 description 1
- 210000000867 larynx Anatomy 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 150000004682 monohydrates Chemical class 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 239000004570 mortar (masonry) Substances 0.000 description 1
- 210000003928 nasal cavity Anatomy 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- PXGPLTODNUVGFL-YNNPMVKQSA-N prostaglandin F2alpha Chemical compound CCCCC[C@H](O)\C=C\[C@H]1[C@H](O)C[C@H](O)[C@@H]1C\C=C/CCCC(O)=O PXGPLTODNUVGFL-YNNPMVKQSA-N 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 238000010298 pulverizing process Methods 0.000 description 1
- MIXMJCQRHVAJIO-TZHJZOAOSA-N qk4dys664x Chemical compound O.C1([C@@H](F)C2)=CC(=O)C=C[C@]1(C)[C@@H]1[C@@H]2[C@@H]2C[C@H]3OC(C)(C)O[C@@]3(C(=O)CO)[C@@]2(C)C[C@@H]1O.C1([C@@H](F)C2)=CC(=O)C=C[C@]1(C)[C@@H]1[C@@H]2[C@@H]2C[C@H]3OC(C)(C)O[C@@]3(C(=O)CO)[C@@]2(C)C[C@@H]1O MIXMJCQRHVAJIO-TZHJZOAOSA-N 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 230000029058 respiratory gaseous exchange Effects 0.000 description 1
- 238000010079 rubber tapping Methods 0.000 description 1
- 239000011163 secondary particle Substances 0.000 description 1
- 238000007873 sieving Methods 0.000 description 1
- 239000002195 soluble material Substances 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 238000005507 spraying Methods 0.000 description 1
- 229960003604 testosterone Drugs 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 229940126307 triamcinolone acetate Drugs 0.000 description 1
- 239000011653 vitamin D2 Substances 0.000 description 1
- 235000001892 vitamin D2 Nutrition 0.000 description 1
- MECHNRXZTMCUDQ-RKHKHRCZSA-N vitamin D2 Chemical compound C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)/C=C/[C@H](C)C(C)C)=C\C=C1\C[C@@H](O)CCC1=C MECHNRXZTMCUDQ-RKHKHRCZSA-N 0.000 description 1
- 239000000811 xylitol Substances 0.000 description 1
- 235000010447 xylitol Nutrition 0.000 description 1
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 1
- 229960002675 xylitol Drugs 0.000 description 1
Images
Landscapes
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Description
【発明の属する技術分野】
本発明は薬物の肺内沈着量が増加した新規な粉末状吸入用医薬品組成物に関する。更に詳しくは薬物微粒子を球形に成型することにより薬物微粒子と賦形剤との付着力が調節され、その結果吸入された後の薬物微粒子の肺内沈着量が増加した新規な粉末状吸入用医薬品組成物に関する。
【0002】
【従来の技術】
吸入剤とは、口腔あるいは鼻腔から、気管、気管支、肺胞などの主に下気道へ薬物を投与することを目的とした製剤である。ここでいう下気道とは気道のうち、気管、気管支、細気管支、肺胞等と定義される。
【0003】
吸入剤は、喘息、気管支炎、肺気腫等の胸部疾患に対する局所投与製剤として実用化されており、また近年生理活性ペプチド類、蛋白質等を肺胞から全身血流へ移行させる投与法としても注目を集めている。
【0004】
このような吸入剤の剤型として、吸入液剤、フロンまたは代替フロン製剤、粉末吸入剤の3つがある。吸入液剤は通常薬物の水溶液であり、ネブライザーにより霧化されて微少の液滴となって患者の自発呼吸下で吸入され、気道内に液滴の形で沈着する。フロンまたは代替フロン製剤は、フロンまたは代替フロンに加圧下で薬物が分散または溶解された製剤であり、加圧式定量噴霧吸入器(Metered Dose Inhaler; MDI)と呼ばれる加圧容器に充填されて用いられる。投与時は、加圧下のMDIから開放されるとフロンまたは代替フロンが気化し、溶解・分散していた薬物が通常薬物の微粒子粉末となって気道内に沈着する。また、粉末吸入剤は薬物を主とする微粒子粉末を例えば粉末状組成物として賦形剤などとともにブリスター等の容器に充填し、通常患者自身の吸気により適当な投与器から該容器内の微粒子粉末が粉末エアロゾル化されて吸入され、薬物粉末として気道内に沈着する。
【0005】
これらの吸入剤の剤型のうち、吸入液剤は一般に高価で大きく重いネブライザーでの投与がのため、また薬液をネブライザーに充填する際に細菌等の混入の危険があるため、医療機関以外で患者自身が投与するには適さない。フロンまたは代替フロン製剤は、投与器であるMDIが軽量で携帯性がよく、また密封された容器に製剤が充填されいるが、フロンはオゾン層破壊、代替フロンは温室効果の要因であり、地球環境を考える上ではその使用は控えられるべきである。これらに対して粉末吸入剤は、一般にその投与器は軽量で携帯性がよく、また細菌等の混入を防ぐように構成されており、製剤中に環境破壊に関わるような成分を含まないことから、理想的な吸入剤の剤型であると考えられている。
【0006】
さらに粉末吸入剤には次の3種がある。
(1)薬物微粒子と乳糖等から選ばれる該薬物微粒子より粒径の大きい賦形剤粒子とが均一に混合された混合粒子が適当な容器から気道内に投与されると、賦形剤は口腔、咽頭あるいは喉頭に沈着するが薬物微粒子のみ気管、気管支等の下気道にまで到達、沈着する粉末状組成物。
【0007】
(2)薬物微粒子どうしが柔らかく造粒されて比較的大きな粒径となっている粉末状製剤が、適当な容器から気道内に投与されると飛行中に構成薬物微粒子に解離され、生成した薬物微粒子が気管、気管支等の下気道に到達、沈着する粉末状組成物。
【0008】
(3)薬物微粒子のみからなる粉末状製剤で、適当な容器から気道内に投与されると該薬物微粒子が気管、気管支等の下気道にまで到達、沈着する粉末状組成物。
これらの中でも薬物量が少ない場合は1回分投与量の粉末状薬物を分割することが困難であるために(1)のような薬物と賦形剤との粉末状組成物が使用されることが多い。
【0009】
前述したように(1)のような粉末状組成物は、吸入された後賦形剤と薬物とが分離しより大きい粒径の賦形剤は口腔、咽喉に沈着し、より小さい粒径の薬物のみが気管、気管支、肺にまで到達して沈着し局所で薬効を発揮するか、あるいは肺から血中に吸収されて全身作用を発揮することが期待されている。しかし、粒径の小さい薬物は薬物同士が凝集して粒径の大きい二次粒子を生成することが知られており、吸入されても気管、気管支、肺に到達せず口腔、咽喉に沈着してしまうことがある。この現象は脂溶性の高い薬物で特に多く認められる。また更に、粒径の小さい薬物粒子は粒径の大きい賦形剤表面に付着することが知られており、この付着力が強すぎると薬物は吸入操作中に賦形剤から分離せず口腔、咽喉に沈着してしまい期待された薬効を発揮することができない。一方、この付着力が弱すぎると混合粉体を製造する過程で薬物が混合容器に付着してしまい損失することなどがおきる。特に脂溶性の高い薬物の場合薬物の混合容器への付着は顕著に認められる。
【0010】
【発明が解決しようとする課題】
本発明の目的は、薬物微粒子と賦形剤粒子との間の付着力を最適に設定し、製造効率及び薬効を最大にした粉末状吸入用医薬品組成物を提供することにある。
【0011】
【課題を解決するための手段】
本発明者らは鋭意研究した結果、薬物微粒子を球形に成型することにより薬物微粒子同士の凝集及び薬物微粒子と賦形剤との付着を最適化することに成功し本発明に到達した。
【0012】
【発明の実施の形態】
本発明で「球形」とは、Wadellの球形度ψS(=πxv 2 / S)で粒子を評価して0.90以上のものをいう。なお xvは球体積相当径であるが、本発明では実用上フラウンホーファー回折の原理に基づくレーザー回折型粒度分布測定装置で得られる体積平均径を用いる。Sは粒子の表面積であって、空気透過法またはガス透過法により測定される比表面積から換算する。
また、本発明で「滑らか」とは、空気透過法またはガス透過法により測定される比表面積S0(単位重量あたり)が1.75以下のものをいう。
【0013】
粒子間の相互作用を最小にするために粒子の表面積を最小にすることは当該業者であれば容易に到達する手段である。従って薬物粒子を球形に成型すること自体は新規ではない。例えば、WO96/09814号明細書において「少なくとも90%以上が1から10μmの空力学的平均径を有する球形で滑らかな水溶性材料による治療・診断用マイクロパーティクル」がクレームされている。しかし該特許においては球形であることの定義もなく、また球形であることの効果について明らかにする実施例等の記載もない。粉末状吸入剤において球形に成型された薬物粒子がその気管、気管支、肺への沈着効率を上昇させることは本発明者らによりはじめて知見された。
【0014】
本発明の球形の薬物粒子は気管、気管支、肺に沈着するためにその粒径が0.5-10μmの範囲にある必要から通常の造粒では製造できず、噴霧乾燥法、晶析法、超臨界流体再結晶化法などで製造することができる。この中でも噴霧乾燥法がもっとも一般的である。噴霧乾燥法による本発明の薬物微粒子は、プロピオン酸ベクロメタゾン(以下BDPとする)10gを無水エタノール500mLに溶解してサンプル溶液を調製し、噴霧乾燥機としてGS-31(ヤマトラボテック(株))を用い、ノズル径:0. 4 mm、入口温度:105℃、出口温度:70-80℃、送液速度:6.5g/min、熱風風量:0.6 m3/ min、噴霧圧力:2.5 kg/ cm2、の条件で上記サンプル溶液を噴霧乾燥して製造することが出来る。(製造例1)
このようにして製造された粉体粒子は回収率50%で得られ、図1に示す走査型電子顕微鏡像に見られる球形粒子(ψS>0.90)であり、平均径 1.5μm、85%以上が0.5-10μmの範囲であった。
【0015】
本発明に用いられる薬物は原則としては吸入薬として使用されるものであれば特に限定されないが、特に粒子同士が凝集しやすいものが挙げられる。そのような例としては脂溶性の高い薬物、あるいは特異的に凝集性が高い薬物が挙げられる。
脂溶性の高い薬物としては副腎皮質ホルモン類、性ホルモン類、活性型ビタミンD3類、プロスタグランジン類などが挙げられる。副腎皮質ホルモン類としては、プロピオン酸ベクロメタゾン、酢酸トリアムシノロン、フルニソリド、ブデソニドおよびプロピオン酸フルチカゾンなど、性ホルモン類としては、テストステロン、エストロジェンおよびエストラジオールなど、活性型ビタミンD3類としては、1α, 24-ジヒドロキシビタミンD3、1α, 25-ジヒドロキシビタミンD3(カルシフェロール)、カルシポトリオール、1α-ヒドロキシ- 24-オキソビタミンD3、1α, 25-ジヒドロキシビタミンD3-26,23-ラクトン、1α, 25-ジヒドロキシビタミンD3-26,23-パーオキシラクトンおよび26,26,26,27,27,27-ヘキサフルオロ-1α, 25-ジヒドロキシビタミンD3など、プロスタグランジン類としては、プロスタグランジンE1(アルプロスタジル)、プロスタグランジンF2 α(ジノプロスト)、プロスタグランジンI2(エポプロステノール)、ベラプロストおよびクリンプロストなどをが挙げられる。
特異的に凝集性が高い薬物の例としてはインスリン、カルシトニンなどの高分子量ペプチド類が挙げられる。
【0016】
本発明の賦形剤としては通常吸入剤の賦形剤として使用されるものであれば特に限定されないが、例えば乳糖、ブドウ糖、マンニトール、果糖、蔗糖、アラビノース、キシリトール、デキストロース、麦芽糖およびトレハロースおよびこれらの1水和物や、デキストラン、デキストリン等多糖類が挙げられる。これらの中でも乳糖が最も一般的に使用される。
【0017】
本発明で使用される賦形剤の形状は原則としては口腔、咽喉内に沈着するような粒径であればいずれの形状でもよく、95重量%以上の粒径が、30-150μmの範囲であることが好ましい。つまり、薬物微粒子と同様に球形として成型する場合には薬物微粒子と同様な噴霧乾燥法や特表平4−504427号公報に記載されているような特定の条件での析出法などで造粒される。また、球形に成型しない場合には通常の機械的粉砕法で大きな粒子から所望の範囲の粒径に調製される。しかし、賦形剤が特表平4−504427号公報に記載された表面よりも滑らかでなく、表面にある程度の平面構造を持っていたり、あるいは多孔状で表面積が大きい形状の方がより気管、気管支、肺への沈着率が向上することが本発明者らにより知見されている。
【0018】
本発明で使用される薬物量は薬物の薬効の強さにより変わり、1回分の製剤単位に有効な量が含有される。
【0019】
本発明の薬物と賦形剤との重量比は0.1:99.9-50:50の範囲内であり、この割合は薬物量によって変化する。従って本発明で使用される賦形剤量は薬物量により変化するが、おおよそ10ng-5mgの範囲内である。
【0020】
本発明の医薬品組成物は、上記の製造例1により得たBDP微粒子 1.0g、および微粉砕乳糖(一水和物;Pharmatose 200M; DMV社)を100メッシュパス、400メッシュオンに篩い分けたもの(以下100-400M乳糖)61.5gを、V型混合機にて3.5時間混合して製造することが出来る。(製造例2)このようにして得られた組成物から無作為に30サンプルを抽出してそのBDP含量を測定した結果、CV値が3.1%とほぼ均一に混合されていた。製造された組成物の走査型電子顕微鏡像を図2に示す。
【0021】
【発明の効果】
かくして本発明により気管、気管支、肺への沈着率が良好な粉末吸入用医薬品組成物が提供され、その意義は高い。
【0022】
【実施例】
以下、実施例により本発明を詳述するが、これらは本発明を説明するものであって本発明を限定するものではない。
【0023】
[実施例1]
プロピオン酸ベクロメタゾン球形微粒子製剤の吸入効率評価
本実施例は、製造例1にて得られた球形に成型されたプロピオン酸ベクロメタゾン(以下球形BDP)と100-400M乳糖(比表面積S0>1.75)を含んでなる混合粉体(1)の吸入送達上の効果を、以下の対照製剤との比較評価を実施したものである。
(1) 球形BDP+100-400M乳糖(本発明製剤1)
(2) 球形BDP+吸入用乳糖(本発明製剤2)
(3) 粉砕BDP+100-400M乳糖(対照製剤1)
(4) 粉砕BDP+吸入用乳糖(対照製剤2)
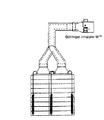
ここでいう粉砕BDPとは日本薬局方BDP(藤川(株))であり、また吸入用乳糖(Pharmatose 325M, DMV社)とは再結晶された乳糖一水和物であって、滑らかな表面(S0<1.75)を有している。(2)から(4)までの製剤は、製造例2に準じてBDP1.0gと乳糖61. 5gをV型混合機にて3-4時間混合することにより得た。これらをゼラチン3号カプセル(各製剤について)30個に、5mgずつ充填した。アンダーセンカスケードインパクター2台に、上記カプセルを充填した投与器Inhalater MTM(ベーリンガー・インゲルハイム社)を2股の インダクションポートを介して据え付けた図3に示す装置を用いて、それぞれのカスケードインパクターを1CFM(=28.3L/min)流量で吸引しながら、15秒間隔で各製剤あたり30個のカプセルを吸引させ評価した。各製剤ごとに、BDPについて、投与器残存量、カプセル残存量、インダクションポート付着量、インパクターのプレセパレーター、プレート沈着量、バックアップフィルター(BUF)沈着量を高速液体クロマトグラフィーにて定量した。
評価の結果を表1・2に示す。なおこの評価は25℃、40%RHの条件で実施した(実施例2〜3も同じ)。得られた値は30カプセルの合計値であり、フラクション(括弧内のカプセル充填量に対する%値)は30カプセルの平均値とみなすことができる。0.65〜5.8μm (Stage2-6)のフラクションは、製剤中含量に対する臨床における下気道沈着分に相当する。このフラクションについては本発明製剤である(1)および(2)は同等であり、これらは対照製剤である(3)および(4)に対して有意に高い値(約1.4倍)を示した。
カプセル残存のフラクションについて(1)および(2)の製剤は、(3)および(4)の製剤より有意に低く、しかも(1)<(2)という結果であった。また、特にカプセル中残存分の粉体の走査型電子顕微鏡観察において、(1)と(2)の製剤では多くの場合、薬物BDP微粒子と乳糖とが分散して存在していたのに対して、(3)および(4)の製剤では薬物微粒子が乳糖に付着したままの粉体、および薬物微粒子同士が凝集している粉体が多くみられた。
【0024】
【表1】
【0025】
【表2】
【0026】
[実施例2]
プロスタグランジンE1球形微粒子製剤の吸入効率評価
プロスタグランジンE1(アルプロスタジル;以下PGE1)をBDPと同じ条件で噴霧乾燥し、球形粒子(ψS>0.9)を得た。対照粒子としてPGE1を酢酸エチル / ヘプタンに溶解させて再結晶させ、得られた結晶を乳鉢で粉砕して球形粒子と同等の粒径(1.9〜2.0μm)の粒子を得た。実施例1と同様に、球形または粉砕したPGE1粒子と100-400M乳糖または吸入用乳糖を、重量比0.4:99.6でV型混合器にて1-2時間混合し、以下の製剤を調製した。
(1) 球形PGE1+100-400M乳糖(本発明製剤3)
(2) 球形PGE1+吸入用乳糖球形乳糖(本発明製剤4)
(3) 粉砕PGE1+100-400M乳糖(対照製剤3)
(4) 粉砕PGE1+吸入用乳糖(対照製剤4)
実施例1と同様に、これら製剤をゼラチン3号カプセル(各製剤について)90個に、5mgずつ充填した。上記カプセルを充填した投与器Inhalater MTM(ベーリンガー・インゲルハイム社)を据え付けた図3に示す装置を用いて、それぞれのカスケードインパクターを1CFM(=28.3L/min)流量で吸引しながら、15秒間隔で各製剤あたり90個のカプセルを吸引させ評価した。各製剤ごとに、各部分でのPGE1定量を高速液体クロマトグラフィーにて実施した。
評価の結果を表3・4に示す。0.65〜5.8μm (Stage2-6)のフラクションは本発明製剤である(1)および(2)は同等であり、これらは対照製剤(3)および(4)に対して有意に高い値を示した。カプセル残存のフラクションについても実施例1と同傾向であり、(1)および(2)の製剤は(3)および(4)の製剤より有意に低く、しかも(1)<(2)という結果であった。
【0027】
【表3】
【0028】
【表4】
【0029】
[実施例3]
BDP球形微粒子製剤のステンレス缶器壁への付着量評価
直径58mm、高さ750mmの円柱状のステンレス缶(円柱の底面の一方は開放されている)に、製造例および実施例1で製造した、(1)球形BDP+100-400M乳糖(本発明製剤1)、(2)球形BDP+吸入用乳糖(本発明製剤2)を各々1. 5gをとり、2時間振盪機によって底面直径方向に振盪した。振盪中はフタをして粉体の飛散を防いだ。振盪後フタをとり、内容物を取り出した。さらにステンレス缶をスパーテルで軽くたたくなどして粉末製剤を排出した。取り出した(排出した)粉体を電子天秤にて正確に秤量して、ステンレス缶への仕込み量から粉体付着・吸着率を算出した。またステンレス缶を5mLのアセトニトリルにて抽出して高速液体クロマトグラフィーにて定量し、同様に仕込み量から付着・吸着率を算出した。重量および抽出により算出した値は同等であり、(1)9%、(2)16%であった。これより球形乳糖より通常の乳糖を用いたほうが、材料への付着が少ないことが示された。
【図面の簡単な説明】
【図1】製造例1で製造したBDP球形微粒子の透過型電子顕微鏡写真を示す。
【図2】製造例2で製造したBDP球形微粒子 / 吸入用乳糖(重量比 1:61.5)の透過型電子顕微鏡写真を示す。
【図3】実施例1〜2で用いた吸入効率評価装置を示す。
Claims (5)
- 球形度0.90以上に成型された薬物のみから構成される薬物微粒子と、賦形剤とを含んで成り、
薬物は、プロピオン酸ベクロメタゾン、またはプロスタグランジンE 1 であり、
賦形剤の95重量%以上は、30-150μmの範囲の粒子径を有し、
賦形剤は、比表面積S0>1.75の滑らかな表面でない、粉末状吸入用医薬品組成物。 - 賦形剤が乳糖、ブドウ糖、果糖、マンニトール、蔗糖、麦芽糖およびデキストランから選ばれた1種あるいは2種以上である請求項1記載の粉末状吸入用医薬品組成物。
- 球形に成型された薬物微粒子が噴霧乾燥法で製造される請求項1記載の粉末状吸入用医薬品組成物。
- 球形に成型された薬物微粒子の80重量%以上が0.5-10μmの範囲の粒子径を有する請求項1記載の粉末状吸入用医薬品組成物。
- 薬物と賦形剤との重量比が0.1:99.9-50:50である請求項1記載の粉末状吸入用医薬品組成物。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP33414297A JP4266399B2 (ja) | 1997-12-04 | 1997-12-04 | 粉末状吸入用医薬品組成物 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP33414297A JP4266399B2 (ja) | 1997-12-04 | 1997-12-04 | 粉末状吸入用医薬品組成物 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH11171760A JPH11171760A (ja) | 1999-06-29 |
| JP4266399B2 true JP4266399B2 (ja) | 2009-05-20 |
Family
ID=18274007
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP33414297A Expired - Fee Related JP4266399B2 (ja) | 1997-12-04 | 1997-12-04 | 粉末状吸入用医薬品組成物 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4266399B2 (ja) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB0004827D0 (en) * | 2000-02-29 | 2000-04-19 | Quadrant Holdings Cambridge | Compositions |
| US20040109827A1 (en) * | 2000-11-29 | 2004-06-10 | Satomi Onoue | Powdery preparations and proecss for producing the same |
| EG24184A (en) | 2001-06-15 | 2008-10-08 | Otsuka Pharma Co Ltd | Dry powder inhalation system for transpulmonary |
| JPWO2004087146A1 (ja) * | 2003-03-31 | 2006-06-29 | 協和醗酵工業株式会社 | 微粒子混合物の製造方法 |
| EP2708225B1 (en) * | 2004-04-23 | 2018-12-26 | CyDex Pharmaceuticals, Inc. | DPI Formulation Containing Sulfoalkyl Ether Cyclodextrin |
| US7629331B2 (en) | 2005-10-26 | 2009-12-08 | Cydex Pharmaceuticals, Inc. | Sulfoalkyl ether cyclodextrin compositions and methods of preparation thereof |
| JP7321096B2 (ja) * | 2017-11-27 | 2023-08-04 | あすか製薬株式会社 | 粉末経鼻投与製剤 |
-
1997
- 1997-12-04 JP JP33414297A patent/JP4266399B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JPH11171760A (ja) | 1999-06-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR100277622B1 (ko) | 흡입용 초미립자 분말 및 그의 제조방법 | |
| JP4378057B2 (ja) | 流動抵抗調節されたエアロゾル化活性薬剤送達 | |
| US6989155B1 (en) | Powders | |
| US6509006B1 (en) | Devices compositions and methods for the pulmonary delivery of aerosolized medicaments | |
| US7097827B2 (en) | Devices, compositions and methods for the pulmonary delivery of aerosolized medicaments | |
| US6780508B1 (en) | Powder particles with smooth surface for use in inhalation therapy | |
| CN104257610A (zh) | 用于制备可吸入干粉所用的载体颗粒的方法 | |
| JP2005507881A (ja) | 乾燥粉末医薬製剤 | |
| JP4266399B2 (ja) | 粉末状吸入用医薬品組成物 | |
| CN111358773B (zh) | 一种帕拉米韦干粉吸入剂及其制备方法 | |
| JP3888753B2 (ja) | 持続性粉末状吸入用医薬品組成物 | |
| EP2340817A1 (en) | Drug carrier manufacturing method | |
| JP2907551B2 (ja) | 吸入用超微粒子粉体及びその製造法 | |
| JPWO1993025198A1 (ja) | 吸入用超微粒子粉体及びその製造法 | |
| JPWO1993025193A1 (ja) | 気道内投与用容器入り製剤 | |
| MXPA01003614A (en) | Flow resistance modulated aerosolized active agent delivery | |
| MXPA01002649A (en) | Dry powder active agent pulmonary delivery |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20040831 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080422 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080619 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080715 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080911 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20081111 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081222 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20090127 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20090217 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120227 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120227 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130227 Year of fee payment: 4 |
|
| LAPS | Cancellation because of no payment of annual fees |