JP4174591B2 - Hiv−2型ヒトレトロウイルスのトランスメンブランエンベロープ糖タンパク質の抗原、及び、該抗原に免疫類似性を有する抗原 - Google Patents
Hiv−2型ヒトレトロウイルスのトランスメンブランエンベロープ糖タンパク質の抗原、及び、該抗原に免疫類似性を有する抗原 Download PDFInfo
- Publication number
- JP4174591B2 JP4174591B2 JP2005375317A JP2005375317A JP4174591B2 JP 4174591 B2 JP4174591 B2 JP 4174591B2 JP 2005375317 A JP2005375317 A JP 2005375317A JP 2005375317 A JP2005375317 A JP 2005375317A JP 4174591 B2 JP4174591 B2 JP 4174591B2
- Authority
- JP
- Japan
- Prior art keywords
- hiv
- glycoprotein
- cells
- virus
- protein
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 208000031886 HIV Infections Diseases 0.000 title claims abstract description 167
- 241000713340 Human immunodeficiency virus 2 Species 0.000 title claims abstract description 164
- 241001430294 unidentified retrovirus Species 0.000 title claims abstract description 51
- 241000282414 Homo sapiens Species 0.000 title claims abstract description 31
- 230000001900 immune effect Effects 0.000 title claims abstract description 5
- 101710121417 Envelope glycoprotein Proteins 0.000 title claims description 31
- 102100021696 Syncytin-1 Human genes 0.000 title claims 2
- 239000000427 antigen Substances 0.000 title description 18
- 108091007433 antigens Proteins 0.000 title description 18
- 102000036639 antigens Human genes 0.000 title description 18
- -1 ntigen Species 0.000 title description 2
- 102100037792 Interleukin-6 receptor subunit alpha Human genes 0.000 claims abstract description 128
- 101800001271 Surface protein Proteins 0.000 claims abstract description 128
- 108090000288 Glycoproteins Proteins 0.000 claims abstract description 87
- 102000003886 Glycoproteins Human genes 0.000 claims abstract description 87
- 101800000385 Transmembrane protein Proteins 0.000 claims abstract description 32
- 102100023935 Transmembrane glycoprotein NMB Human genes 0.000 claims abstract description 25
- 108091007466 transmembrane glycoproteins Proteins 0.000 claims abstract description 25
- 208000030507 AIDS Diseases 0.000 claims abstract description 9
- 210000004027 cell Anatomy 0.000 claims description 134
- 108090000623 proteins and genes Proteins 0.000 claims description 80
- 102000004169 proteins and genes Human genes 0.000 claims description 79
- 239000000284 extract Substances 0.000 claims description 61
- 241000700605 Viruses Species 0.000 claims description 44
- 238000000034 method Methods 0.000 claims description 41
- 241000713772 Human immunodeficiency virus 1 Species 0.000 claims description 39
- 239000002243 precursor Substances 0.000 claims description 27
- 208000015181 infectious disease Diseases 0.000 claims description 18
- 210000004408 hybridoma Anatomy 0.000 claims description 17
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 16
- 238000012360 testing method Methods 0.000 claims description 15
- 238000004519 manufacturing process Methods 0.000 claims description 14
- 239000012472 biological sample Substances 0.000 claims description 13
- 239000002245 particle Substances 0.000 claims description 13
- 150000001413 amino acids Chemical class 0.000 claims description 9
- 238000000338 in vitro Methods 0.000 claims description 8
- 206010003445 Ascites Diseases 0.000 claims description 6
- 241001465754 Metazoa Species 0.000 claims description 5
- 206010035226 Plasma cell myeloma Diseases 0.000 claims description 5
- 230000003053 immunization Effects 0.000 claims description 5
- 201000000050 myeloid neoplasm Diseases 0.000 claims description 5
- 230000003248 secreting effect Effects 0.000 claims description 2
- 238000001042 affinity chromatography Methods 0.000 claims 2
- 230000007910 cell fusion Effects 0.000 claims 2
- 238000012258 culturing Methods 0.000 claims 2
- 210000004988 splenocyte Anatomy 0.000 claims 2
- 241000282412 Homo Species 0.000 claims 1
- 230000000890 antigenic effect Effects 0.000 abstract description 9
- 239000000539 dimer Substances 0.000 abstract description 9
- 238000002255 vaccination Methods 0.000 abstract 1
- 235000018102 proteins Nutrition 0.000 description 75
- 102100034349 Integrase Human genes 0.000 description 31
- 239000000047 product Substances 0.000 description 19
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 18
- 239000000872 buffer Substances 0.000 description 18
- 230000003612 virological effect Effects 0.000 description 18
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 17
- 238000010494 dissociation reaction Methods 0.000 description 17
- 230000005593 dissociations Effects 0.000 description 17
- 210000002966 serum Anatomy 0.000 description 17
- 229920002684 Sepharose Polymers 0.000 description 15
- 239000012139 lysis buffer Substances 0.000 description 15
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 15
- 238000002360 preparation method Methods 0.000 description 14
- MSWZFWKMSRAUBD-IVMDWMLBSA-N 2-amino-2-deoxy-D-glucopyranose Chemical compound N[C@H]1C(O)O[C@H](CO)[C@@H](O)[C@@H]1O MSWZFWKMSRAUBD-IVMDWMLBSA-N 0.000 description 12
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 12
- 241000699670 Mus sp. Species 0.000 description 12
- MSWZFWKMSRAUBD-UHFFFAOYSA-N beta-D-galactosamine Natural products NC1C(O)OC(CO)C(O)C1O MSWZFWKMSRAUBD-UHFFFAOYSA-N 0.000 description 12
- 238000001962 electrophoresis Methods 0.000 description 12
- 229960002442 glucosamine Drugs 0.000 description 12
- 239000002609 medium Substances 0.000 description 12
- 239000000203 mixture Substances 0.000 description 12
- GPRLSGONYQIRFK-MNYXATJNSA-N triton Chemical compound [3H+] GPRLSGONYQIRFK-MNYXATJNSA-N 0.000 description 12
- SHZGCJCMOBCMKK-DHVFOXMCSA-N L-fucopyranose Chemical compound C[C@@H]1OC(O)[C@@H](O)[C@H](O)[C@@H]1O SHZGCJCMOBCMKK-DHVFOXMCSA-N 0.000 description 11
- 230000015572 biosynthetic process Effects 0.000 description 11
- 238000002474 experimental method Methods 0.000 description 11
- 238000001114 immunoprecipitation Methods 0.000 description 10
- ZPNFWUPYTFPOJU-LPYSRVMUSA-N iniprol Chemical compound C([C@H]1C(=O)NCC(=O)NCC(=O)N[C@H]2CSSC[C@H]3C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(N[C@H](C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC=4C=CC=CC=4)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC=4C=CC=CC=4)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC2=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]2N(CCC2)C(=O)[C@@H](N)CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N2[C@@H](CCC2)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N2[C@@H](CCC2)C(=O)N3)C(=O)NCC(=O)NCC(=O)N[C@@H](C)C(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@H](C(=O)N1)C(C)C)[C@@H](C)O)[C@@H](C)CC)=O)[C@@H](C)CC)C1=CC=C(O)C=C1 ZPNFWUPYTFPOJU-LPYSRVMUSA-N 0.000 description 10
- YBYRMVIVWMBXKQ-UHFFFAOYSA-N phenylmethanesulfonyl fluoride Chemical compound FS(=O)(=O)CC1=CC=CC=C1 YBYRMVIVWMBXKQ-UHFFFAOYSA-N 0.000 description 10
- 108010039627 Aprotinin Proteins 0.000 description 9
- SHZGCJCMOBCMKK-UHFFFAOYSA-N D-mannomethylose Natural products CC1OC(O)C(O)C(O)C1O SHZGCJCMOBCMKK-UHFFFAOYSA-N 0.000 description 9
- PNNNRSAQSRJVSB-SLPGGIOYSA-N Fucose Natural products C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)C=O PNNNRSAQSRJVSB-SLPGGIOYSA-N 0.000 description 9
- 238000002372 labelling Methods 0.000 description 9
- 239000011780 sodium chloride Substances 0.000 description 9
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 8
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 8
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 8
- 229960004405 aprotinin Drugs 0.000 description 8
- 230000001177 retroviral effect Effects 0.000 description 8
- JDVVGAQPNNXQDW-WCMLQCRESA-N Castanospermine Natural products O[C@H]1[C@@H](O)[C@H]2[C@@H](O)CCN2C[C@H]1O JDVVGAQPNNXQDW-WCMLQCRESA-N 0.000 description 7
- JDVVGAQPNNXQDW-TVNFTVLESA-N Castinospermine Chemical compound C1[C@H](O)[C@@H](O)[C@H](O)[C@H]2[C@@H](O)CCN21 JDVVGAQPNNXQDW-TVNFTVLESA-N 0.000 description 7
- 239000013504 Triton X-100 Substances 0.000 description 7
- 229920004890 Triton X-100 Polymers 0.000 description 7
- 238000004458 analytical method Methods 0.000 description 7
- 238000005755 formation reaction Methods 0.000 description 7
- 230000008569 process Effects 0.000 description 7
- 239000000523 sample Substances 0.000 description 7
- 210000002845 virion Anatomy 0.000 description 7
- 238000001262 western blot Methods 0.000 description 7
- 241000699666 Mus <mouse, genus> Species 0.000 description 6
- 239000012083 RIPA buffer Substances 0.000 description 6
- 238000012512 characterization method Methods 0.000 description 6
- 238000006243 chemical reaction Methods 0.000 description 6
- 238000006471 dimerization reaction Methods 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- 210000004698 lymphocyte Anatomy 0.000 description 6
- FLNVBBPBGKOJHN-KKAOYSRWSA-N sivmac Chemical compound O=C([C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@@H]1CCCN1C(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CS)NC(=O)[C@@H](N)CCCNC(N)=N)[C@@H](C)O)[C@@H](C)O)[C@@H](C)O)[C@@H](C)O)[C@@H](C)CC)N1CCC[C@H]1C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCCN)C(O)=O FLNVBBPBGKOJHN-KKAOYSRWSA-N 0.000 description 6
- 230000002378 acidificating effect Effects 0.000 description 5
- 238000000211 autoradiogram Methods 0.000 description 5
- 230000002163 immunogen Effects 0.000 description 5
- 238000011534 incubation Methods 0.000 description 5
- 239000002563 ionic surfactant Substances 0.000 description 5
- 238000010814 radioimmunoprecipitation assay Methods 0.000 description 5
- 239000006228 supernatant Substances 0.000 description 5
- 238000003786 synthesis reaction Methods 0.000 description 5
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 4
- 101000689199 Homo sapiens Src-like-adapter Proteins 0.000 description 4
- 239000004202 carbamide Substances 0.000 description 4
- 230000001413 cellular effect Effects 0.000 description 4
- 238000005119 centrifugation Methods 0.000 description 4
- 230000003834 intracellular effect Effects 0.000 description 4
- 238000012546 transfer Methods 0.000 description 4
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 241000725303 Human immunodeficiency virus Species 0.000 description 3
- 108060003951 Immunoglobulin Proteins 0.000 description 3
- 102000000588 Interleukin-2 Human genes 0.000 description 3
- 108010002350 Interleukin-2 Proteins 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 108091034057 RNA (poly(A)) Proteins 0.000 description 3
- 239000012980 RPMI-1640 medium Substances 0.000 description 3
- 208000005074 Retroviridae Infections Diseases 0.000 description 3
- YJQCOFNZVFGCAF-UHFFFAOYSA-N Tunicamycin II Natural products O1C(CC(O)C2C(C(O)C(O2)N2C(NC(=O)C=C2)=O)O)C(O)C(O)C(NC(=O)C=CCCCCCCCCC(C)C)C1OC1OC(CO)C(O)C(O)C1NC(C)=O YJQCOFNZVFGCAF-UHFFFAOYSA-N 0.000 description 3
- 239000012148 binding buffer Substances 0.000 description 3
- 230000000903 blocking effect Effects 0.000 description 3
- 238000004113 cell culture Methods 0.000 description 3
- 239000012228 culture supernatant Substances 0.000 description 3
- KXGVEGMKQFWNSR-LLQZFEROSA-N deoxycholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 KXGVEGMKQFWNSR-LLQZFEROSA-N 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000004927 fusion Effects 0.000 description 3
- 230000013595 glycosylation Effects 0.000 description 3
- 238000006206 glycosylation reaction Methods 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 102000018358 immunoglobulin Human genes 0.000 description 3
- 239000003547 immunosorbent Substances 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 230000035800 maturation Effects 0.000 description 3
- 238000001466 metabolic labeling Methods 0.000 description 3
- ZIUHHBKFKCYYJD-UHFFFAOYSA-N n,n'-methylenebisacrylamide Chemical compound C=CC(=O)NCNC(=O)C=C ZIUHHBKFKCYYJD-UHFFFAOYSA-N 0.000 description 3
- 239000002736 nonionic surfactant Substances 0.000 description 3
- 230000017854 proteolysis Effects 0.000 description 3
- 230000009257 reactivity Effects 0.000 description 3
- 238000000926 separation method Methods 0.000 description 3
- 235000000346 sugar Nutrition 0.000 description 3
- ZHSGGJXRNHWHRS-VIDYELAYSA-N tunicamycin Chemical compound O([C@H]1[C@@H]([C@H]([C@@H](O)[C@@H](CC(O)[C@@H]2[C@H]([C@@H](O)[C@@H](O2)N2C(NC(=O)C=C2)=O)O)O1)O)NC(=O)/C=C/CC(C)C)[C@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1NC(C)=O ZHSGGJXRNHWHRS-VIDYELAYSA-N 0.000 description 3
- MEYZYGMYMLNUHJ-UHFFFAOYSA-N tunicamycin Natural products CC(C)CCCCCCCCCC=CC(=O)NC1C(O)C(O)C(CC(O)C2OC(C(O)C2O)N3C=CC(=O)NC3=O)OC1OC4OC(CO)C(O)C(O)C4NC(=O)C MEYZYGMYMLNUHJ-UHFFFAOYSA-N 0.000 description 3
- 210000004366 CD4-positive T-lymphocyte Anatomy 0.000 description 2
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 2
- 101800001466 Envelope glycoprotein E1 Proteins 0.000 description 2
- 101710091045 Envelope protein Proteins 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 229920000209 Hexadimethrine bromide Polymers 0.000 description 2
- 239000000020 Nitrocellulose Substances 0.000 description 2
- 241000276498 Pollachius virens Species 0.000 description 2
- 101710188315 Protein X Proteins 0.000 description 2
- 101800001690 Transmembrane protein gp41 Proteins 0.000 description 2
- 239000007983 Tris buffer Substances 0.000 description 2
- 108010067390 Viral Proteins Proteins 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 229940098773 bovine serum albumin Drugs 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- ATDGTVJJHBUTRL-UHFFFAOYSA-N cyanogen bromide Chemical group BrC#N ATDGTVJJHBUTRL-UHFFFAOYSA-N 0.000 description 2
- 238000000354 decomposition reaction Methods 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 229940009976 deoxycholate Drugs 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 210000002472 endoplasmic reticulum Anatomy 0.000 description 2
- 108700004025 env Genes Proteins 0.000 description 2
- 101150030339 env gene Proteins 0.000 description 2
- DEFVIWRASFVYLL-UHFFFAOYSA-N ethylene glycol bis(2-aminoethyl)tetraacetic acid Chemical compound OC(=O)CN(CC(O)=O)CCOCCOCCN(CC(O)=O)CC(O)=O DEFVIWRASFVYLL-UHFFFAOYSA-N 0.000 description 2
- 239000012091 fetal bovine serum Substances 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 238000001502 gel electrophoresis Methods 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 102000054415 human SLA Human genes 0.000 description 2
- 238000003119 immunoblot Methods 0.000 description 2
- 239000012133 immunoprecipitate Substances 0.000 description 2
- 230000002458 infectious effect Effects 0.000 description 2
- 239000007928 intraperitoneal injection Substances 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 108010034897 lentil lectin Proteins 0.000 description 2
- 230000002934 lysing effect Effects 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 229960004452 methionine Drugs 0.000 description 2
- 229920001220 nitrocellulos Polymers 0.000 description 2
- 150000002482 oligosaccharides Chemical class 0.000 description 2
- 230000001717 pathogenic effect Effects 0.000 description 2
- 229920002401 polyacrylamide Polymers 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 230000036647 reaction Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 239000001488 sodium phosphate Substances 0.000 description 2
- 229910000162 sodium phosphate Inorganic materials 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 210000004989 spleen cell Anatomy 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 2
- 230000017613 viral reproduction Effects 0.000 description 2
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 2
- NHBKXEKEPDILRR-UHFFFAOYSA-N 2,3-bis(butanoylsulfanyl)propyl butanoate Chemical compound CCCC(=O)OCC(SC(=O)CCC)CSC(=O)CCC NHBKXEKEPDILRR-UHFFFAOYSA-N 0.000 description 1
- FFEARJCKVFRZRR-FOEKBKJKSA-N 3654-96-4 Chemical compound C[35S]CC[C@H](N)C(O)=O FFEARJCKVFRZRR-FOEKBKJKSA-N 0.000 description 1
- 101710122462 65 kDa protein Proteins 0.000 description 1
- 206010001513 AIDS related complex Diseases 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 101001050984 Apple stem grooving virus (strain Korea) Putative movement protein Proteins 0.000 description 1
- 101001050983 Apple stem grooving virus (strain P-209) Probable movement protein Proteins 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- 102000004506 Blood Proteins Human genes 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 101000942696 Canis lupus familiaris Clusterin Proteins 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 102000003846 Carbonic anhydrases Human genes 0.000 description 1
- 108090000209 Carbonic anhydrases Proteins 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- GUBGYTABKSRVRQ-WFVLMXAXSA-N DEAE-cellulose Chemical compound OC1C(O)C(O)C(CO)O[C@H]1O[C@@H]1C(CO)OC(O)C(O)C1O GUBGYTABKSRVRQ-WFVLMXAXSA-N 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 101710177291 Gag polyprotein Proteins 0.000 description 1
- 102000004366 Glucosidases Human genes 0.000 description 1
- 108010056771 Glucosidases Proteins 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 108700010908 HIV-1 proteins Proteins 0.000 description 1
- 101100351324 Homo sapiens PDPN gene Proteins 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 208000029462 Immunodeficiency disease Diseases 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- FFEARJCKVFRZRR-UHFFFAOYSA-N L-Methionine Natural products CSCCC(N)C(O)=O FFEARJCKVFRZRR-UHFFFAOYSA-N 0.000 description 1
- 229930195722 L-methionine Natural products 0.000 description 1
- 101710125418 Major capsid protein Proteins 0.000 description 1
- 101000641834 Mycobacterium phage L5 Gene 80 protein Proteins 0.000 description 1
- 102000003505 Myosin Human genes 0.000 description 1
- 108060008487 Myosin Proteins 0.000 description 1
- OVRNDRQMDRJTHS-UHFFFAOYSA-N N-acelyl-D-glucosamine Natural products CC(=O)NC1C(O)OC(CO)C(O)C1O OVRNDRQMDRJTHS-UHFFFAOYSA-N 0.000 description 1
- OVRNDRQMDRJTHS-FMDGEEDCSA-N N-acetyl-beta-D-glucosamine Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O OVRNDRQMDRJTHS-FMDGEEDCSA-N 0.000 description 1
- MBLBDJOUHNCFQT-LXGUWJNJSA-N N-acetylglucosamine Natural products CC(=O)N[C@@H](C=O)[C@@H](O)[C@H](O)[C@H](O)CO MBLBDJOUHNCFQT-LXGUWJNJSA-N 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 108090001074 Nucleocapsid Proteins Proteins 0.000 description 1
- 108010058846 Ovalbumin Proteins 0.000 description 1
- 108010065081 Phosphorylase b Proteins 0.000 description 1
- 108010047620 Phytohemagglutinins Proteins 0.000 description 1
- 102100037265 Podoplanin Human genes 0.000 description 1
- 102000014961 Protein Precursors Human genes 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 208000006268 Sarcoma 180 Diseases 0.000 description 1
- 239000012506 Sephacryl® Substances 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 206010053614 Type III immune complex mediated reaction Diseases 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 210000003567 ascitic fluid Anatomy 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 125000000613 asparagine group Chemical group N[C@@H](CC(N)=O)C(=O)* 0.000 description 1
- 238000000376 autoradiography Methods 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- MSWZFWKMSRAUBD-QZABAPFNSA-N beta-D-glucosamine Chemical compound N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O MSWZFWKMSRAUBD-QZABAPFNSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- SQVRNKJHWKZAKO-UHFFFAOYSA-N beta-N-Acetyl-D-neuraminic acid Natural products CC(=O)NC1C(O)CC(O)(C(O)=O)OC1C(O)C(O)CO SQVRNKJHWKZAKO-UHFFFAOYSA-N 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 239000013060 biological fluid Substances 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 230000009073 conformational modification Effects 0.000 description 1
- 239000000287 crude extract Substances 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 229960003964 deoxycholic acid Drugs 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 239000012149 elution buffer Substances 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 238000002523 gelfiltration Methods 0.000 description 1
- 125000003147 glycosyl group Chemical group 0.000 description 1
- 102000035122 glycosylated proteins Human genes 0.000 description 1
- 108091005608 glycosylated proteins Proteins 0.000 description 1
- 210000002288 golgi apparatus Anatomy 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 239000000710 homodimer Substances 0.000 description 1
- 230000000521 hyperimmunizing effect Effects 0.000 description 1
- 230000016178 immune complex formation Effects 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 230000007813 immunodeficiency Effects 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- HOVAGTYPODGVJG-VEIUFWFVSA-N methyl alpha-D-mannoside Chemical compound CO[C@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@@H]1O HOVAGTYPODGVJG-VEIUFWFVSA-N 0.000 description 1
- 235000013336 milk Nutrition 0.000 description 1
- 239000008267 milk Substances 0.000 description 1
- 210000004080 milk Anatomy 0.000 description 1
- 229950006780 n-acetylglucosamine Drugs 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 230000003472 neutralizing effect Effects 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 229940092253 ovalbumin Drugs 0.000 description 1
- 210000005105 peripheral blood lymphocyte Anatomy 0.000 description 1
- 230000001885 phytohemagglutinin Effects 0.000 description 1
- 235000008476 powdered milk Nutrition 0.000 description 1
- 230000001376 precipitating effect Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 239000012474 protein marker Substances 0.000 description 1
- 230000002797 proteolythic effect Effects 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 238000000163 radioactive labelling Methods 0.000 description 1
- 239000000700 radioactive tracer Substances 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 239000012266 salt solution Substances 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- SQVRNKJHWKZAKO-OQPLDHBCSA-N sialic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)OC1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-OQPLDHBCSA-N 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 230000003381 solubilizing effect Effects 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 102000004217 thyroid hormone receptors Human genes 0.000 description 1
- 108090000721 thyroid hormone receptors Proteins 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 238000005199 ultracentrifugation Methods 0.000 description 1
- 229960005486 vaccine Drugs 0.000 description 1
- 229940124856 vaccine component Drugs 0.000 description 1
- 210000003934 vacuole Anatomy 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/08—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses
- C07K16/10—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses from RNA viruses
- C07K16/1036—Retroviridae, e.g. leukemia viruses
- C07K16/1045—Lentiviridae, e.g. HIV, FIV, SIV
- C07K16/1063—Lentiviridae, e.g. HIV, FIV, SIV env, e.g. gp41, gp110/120, gp160, V3, PND, CD4 binding site
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/15011—Lentivirus, not HIV, e.g. FIV, SIV
- C12N2740/15022—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/16011—Human Immunodeficiency Virus, HIV
- C12N2740/16111—Human Immunodeficiency Virus, HIV concerning HIV env
- C12N2740/16122—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/16011—Human Immunodeficiency Virus, HIV
- C12N2740/16211—Human Immunodeficiency Virus, HIV concerning HIV gagpol
- C12N2740/16222—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Virology (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Oncology (AREA)
- Veterinary Medicine (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- AIDS & HIV (AREA)
- Genetics & Genomics (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Communicable Diseases (AREA)
- Tropical Medicine & Parasitology (AREA)
- Gastroenterology & Hepatology (AREA)
- Hematology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Description
−分子量約80kDaを有する、
−糖タンパク質gp300に対するポリクローナル抗体によって認識される、
−ヒトのSLAまたはAIDSを発症させ得るHIV−2型ヒトレトロウイルスのゲノムによってコードされたトランスメンブランエンベロープ糖タンパク質gp36の2つの完全体を二量体の形態に会合させて含む、または、
−gp80に対する抗体と共に抗原−抗体型の免疫複合体を形成し得る同程度の分子量のすべての糖タンパク質を含む、ことを特徴とする抗原性糖タンパク質gp80に係る。
−HIV−2型ヒトレトロウイルスに感染した細胞及び/またはHIV−2型のビリオン及び/またはウイルスに会合し得る、
−1%のTriton X−100のような非イオン性界面活性剤の存在下ではin vitroで解離せず、弱酸性pHの1%のSDSのようなイオン性界面活性剤の存在下ではHIV−2型レトロウイルスのトランスメンブラン糖タンパク質を形成すべくin vitroで解離する、
−HIV−2血清−Sepharoseイムノアフィニティカラムで精製でき、(ポリアクリルアミドゲル電気泳動で分析すると)感染細胞の標識開始の3〜4時間後に出現する、
ことである。
VTAIEKYLQDQARLNSWGCAFRQVCH
とに共通のエピトープを認識することである。
−精製した糖タンパク質gp80を必要に応じて複数回腹腔内注射することによってBALB−C型マウスを免疫する、
−免疫マウスの細胞特に脾臓細胞をミエローマ細胞例えばNS1型細胞とKohler & Milstein(10)の方法で融合させる、−所望のモノクローナル抗体を産生するハイブリドーマを選択し回収する。
−HIV−2型レトロウイルス感染後に産生する抗体を含むと予想される生物サンプルと前記に定義した糖タンパク質gp80または前記の抗原性組成物とを抗原−抗体型の免疫複合体が形成され得る適当な条件下に接触させ、
−場合によっては形成される抗原−抗体複合体を検出する段階を含むことである。
−HIV−2ヒトレトロウイルスに感染した細胞を溶解し上清と感染細胞とを分離するか、または調製されたウイルス集塊を遠心によって溶解し、
−細胞抽出物及び/またはウイルス抽出物を、例えばヒトレトロウイルスHIV−2感染患者の血清即ちHIV−2のエンベロープ糖タンパク質と強力に反応する能力を有する血清から得られた精製抗体を好ましくは適当な担体に固定させて含む免疫吸着剤を収容したイムノアファニティカラムで、バッファの存在下に抗原−抗体免疫複合体が形成される十分な時間インキュベートし、
−カラムをバッファで洗浄して担体に保持されなかった分子を除去し、
−所望の抗原性タンパク質を回収する段階を含む。
−イムノアフィニティカラムに固定されたタンパク質を溶出させ、
−分離担体に固定されたgp80認識モノクローナル抗体を含むカラムクロマトグラフィーで溶出産物を精製する手順によって回収する。
−少なくとも1つの抗原性糖タンパク質gp80またはタンパク質組成物、または、上記の種々の成分の混合物と、
−被検生物サンプル中に場合によっては存在する抗体と抗原との間の免疫複合体の形成反応を生じさせる手段、特に必要に応じて1種または複数のインキュベーションバッファと、
−陰性対照サンプルと、
−形成された抗原−抗体複合体の顕示(revelation)手段とを含む。
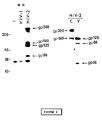
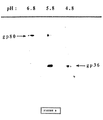
図1:HIV−1に陽性の1つの血清とHIV−2に陽性の3つの血清(A,B,C)とを使用しウェスターン法で分析したHIV−2感染細胞中の80kDaの特異タンパク質の同定。非感染CEM細胞(2列目)、HIV−1感染CEM細胞(1列目)及びHIV−2感染CEM細胞(3列目)の(104細胞の産物に対応する)細胞抽出物をウェスターン法テストの前に7.5%ポリアクリルアミドゲル電気泳動で分析した。オートラジオグラムを示す。左側の矢印は、HIV−1の細胞外糖タンパク質(gp120)及びgag前駆物質p55及びp40の位置を示す。図の右側にHIV−2の特異タンパク質gp300、gp140及びgp80の位置を示す。
(b)gp125及びgp80の産生に対するキャスタノスペルミンの効果。キャスタノスペルミン(1mM)の非存在下(−列)または存在下(+列)にHIV−2感染細胞を[35S]メチオニン(200μCi/ml;4×106細胞/ml)で(16時間)標識した。HIV−2血清−Sepharoseを用いたイムノアフィニティカラムでウイルス粒子を含む培地の抽出物を精製し、精製したタンパク質を12.5%ポリアクリルアミドゲル電気泳動によって試験した。対応するフルオログラムを示す。
材料
L−[35S]メチオニン(比活性>1000μCi/mmol)、L−[6−3H]フコース(比活性:45〜70μCi/mmol)、D−[6−3H]グルコサミン(比活性:20〜40μCi/mmol)はAmersham(Amersham、英国)の製品である。キャスタノスペルミン及びツニカマイシンはBoehringer−Mannheim(Mannheim、西独)の製品である。ポリ(A).ポリ(U)はパリのInstitut Curieから入手し、Hovanessian他の方法(1982,Journal Interferon Researchvol.2−p.209〜216)に従って調製した。
これらの実施例では、1型のヒト免疫不全ウイルスの単離物HIV−1 BRU(12)及び2型のヒト免疫不全ウイルスの単離物HIV−2 ROD(4,5)、及び、サルの免疫不全ウイルスSIV mac142(6)を使用した。
タンパク質の代謝標識のためには、L−メチオニン及び血清を除去し200μCi/mlの[35S]メチオニンを補充したMEM培地(Minimal Essential Medium;最小必須培地)中で、感染細胞を37℃で16時間インキュベートした。糖タンパク質の代謝標識のためには、血清及びグルコースを除去し200μCi/mlの3H−フコースまたは200μCi/mlの3H−グルコサミンを補充したMEM培地で感染細胞を37℃で16時間インキュベートした。
10mMのTris−HCl,pH7.6と150mMのNaClと1mMのEDTAと0.2mMのPMSFと100単位/mlのアプロチニン(Iniprol,Choay)とを含む100μlのバッファに107細胞に対応する細胞集塊を再懸濁させ、次いで2%(v/v)のTriton X−100を含む100μlの同じバッファを添加した。
HIV−2に血清陽性の患者の血清の免疫グロブリンを、20mMのリン酸ナトリウム(pH8.0)に溶解した50%の(NH4)2SO4で沈降させ、次いで、DEAEセルロースカラム(DE52、Whatman)で20mMのリン酸ナトリウム(pH8.0)で溶出させることによって精製した。このようにして精製された免疫グロブリンは純度90%であると考えてよい。次いでBergによって記載された方法(2)に従ってCNBrで活性化したSepharose CL 4Bカラムに抗体を結合させた。Sepharose CL 4B 1mlあたり2mgのIgGが結合した。以後の記載ではこの免疫吸着剤を「HIV−2血清−Sepharose」と呼ぶ。
まず、HIV−2を産生するCEM細胞の細胞抽出物を2倍容の結合バッファ(20mMのTris−HCl,pH7.6、50mMのKCl、150mMのNaCl、1mMのEDTA、20%(v/v)のグリセロール、7mMのβメルカプトエタノール、0.2mMのPMSF、100単位/mlのアプロチニン)に希釈し、等容のHIV−2血清−Sepharoseとインキュベートした。細胞外ウイルスを10倍に濃縮した1/10容の結合バッファでHIV−2産生細胞の上清と同様に処理した。結合処理を1晩継続し、カラムを結合バッファで十分に洗浄した。電気泳動バッファ(125mMのTris−HCl,pH6.8、1%(w/v)のSDS、2Mの尿素、20%のグリセロール、0.5%のβメルカプトエタノール)中で沸騰処理することによってカラムに結合したタンパク質を溶出させた。溶出したタンパク質を、6Mの尿素と0.2%(w/v)でなく0.1%(w/v)のビスアクリルアミドとを含む7.5%SDSポリアクリルアミドゲル電気泳動によって回収した。
アフィニティカラムから溶出したHIV−2の糖タンパク質(gp300及びgp80)を前記同様にポリアクリルアミドゲル電気泳動にかけて回収し、ウイルス糖タンパク質を含むゲルの領域を所定分子量のタンパク質マーカー(BRL)の位置に基づいて切断した。
HIV−2血清−Sepharoseを用いたイムノアフィニティクロマトグラフィー及び分離用電気泳動(13)を順次行なうことによって感染CEM細胞(3×108細胞)の抽出物からHIV−2のエンベロープ糖タンパク質gp300を精製した。gp300の精製調製物を0.5Mの尿素と1mg/mlのマウス血清タンパク質とを含む10mlの150mMのNaClに溶解し、150mMのNaClと0.5Mの尿素とを含む溶液と接触させて24時間透析した。次いで透析産物を遠心し、2mlのアリコートを−80℃で保存した。(8週齢)の5匹のマウスに350μlのgp300調製物(約1μgのgp300含有)を腹腔内注射によって12日おきに5回投与した。各免疫中にポリ(A).ポリ(U)アジュバント(200μg;150mMのNaCl中に1mg/ml)を静注によって投与した(17)。最終注射の5日後にマウスに106サルコーマ180/TG細胞の懸濁液を腹腔内に注射して超免疫腹水を調製した(8)。注射の8日後にマウスを殺し、腹水を収集した。腹水の細胞を遠心(200g、5分間)によって除去し、腹腔液を収集した。
HIV−2ビリオンをCEM細胞中で培養し、ショ糖濃度勾配でバンドを形成させることよって濃縮培養上清から精製した。精製ウイルスを、0.5%のTriton−100、150mMのNaCl、50mMのTris,pH8.0、0.1%のアプロチニン(Sigma)で可溶化し、超遠心によって清澄化した。次いでウイルス抽出物をLen−til−Lectin Sepharose 4B(Pharmacia)アフィニティカラムに通し、カラムを洗浄し、付着した糖タンパク質を0.5Mのメチル−α−D−マンノピラノシド(Sigma)によって溶出させ、リン酸緩衝生理的塩類溶液(PBS)と接触させて1晩透析した。
VTAIEKYLQDQARLNSWGCAFRQVCH
(20μlの)細胞またはウイルスの抽出物(106の感染細胞に対応する産物)をまず倍容のRIPAバッファ(10mMのTris−HCl,pH7.6、150mMのNaCl、1mMのEDTA、1%のTriton X−100(v/v)、0.2%(wt/v)のナトリウムデオキシコレート、0.1%(wt/v)のSDS、7mMの2β−メルカプトエタノール、0.2mMのPMSF、100μ/mlのアプロチニン(Iniprol,Choay)及び20%(v/v)のグリセロール)に希釈した。次に希釈抽出物を、(25μlの)ポリクローナル抗体またはモノクローナル抗体と共に(4℃で45分間)インキュベートした。次いでプロテインA−Sepharoseを添加し、サンプルを4℃で3時間インキュベートした。次にこれらのサンプルをRIPAバッファで洗浄した。免疫沈降によって回収したタンパク質を、電気泳動バッファ(125mMのTris−HCl,pH6.8、1%(wt/v)のSDS、20%(v/v)のグリセロール、0.5%のβ−メルカプトエタノール)中で(95℃で5分間)加熱して溶出させた。溶出したタンパク質を0.2%(wt/v)でなく0.1%(wt/v)のビス−アクリルアミドを含む7.5%または12.5%のSDSポリアクリルアミドゲル電気泳動で回収した。
タンパク質をポリアクリルアミドゲル電気泳動によって分析し、次いで(3)に記載のごとき電極バッファ(20mMのTris塩基、150mMのグリシン、20%(v/v)のメタノール)中で0.45μmのニトロセルロースシート(Schleicher & Schull,Dassel,西独)に電気泳動転移させた。電気泳動斑を、PBSに乳濁させた5%(w/v)の粉末ミルクで飽和した。次いで10%のFCSを含むPBS中のHIV−1陽性血清もしくはHIV−2陽性血清(希釈度1:100)またはマウスのポリクローナル抗体もしくはモノクローナル抗体(希釈度1:200)と共に密封バッグ中で(4℃で1晩)インキュベートした。次いで、シートをPBS、5%のNonidet P−40を含むPBSで洗浄し、(5%の)乳濁ミルクを含むPBSで再度飽和させた。洗浄したシートを、HIV−1血清またはHIV−2血清中のヒトポリクローナル抗体を顕示させるI125で標識したプロテインA製剤(Amersham,>30mCi/mg)、または、I125で標識した抗マウスヤギ免疫グロブリン製剤(Amercham;2〜10μCi/μg)と共に密封バッグにいれて(室温で2時間)インキュベートした。シートをバッグから取り出して再度洗浄し、乾燥して24〜48時間オートラジオグラフ(Kodak RP Royal,X−Ray Films)にかけた。
HIV−2感染細胞及びビリオンにおける80kDaの糖タンパク質の検出
HIV−2の糖タンパク質の前駆物質は140kDaのタンパク質(gp140)であり、これは、成熟産物、即ち細胞外糖タンパク質(gp125)及びトランスメンブラン糖タンパク質(gp36)に変態するときに相同な二量体を形成する必要があることは既に判明していた(13)。本発明では更に、トランスメンブラン糖タンパク質がポリアクリルアミドゲル上の80kDaのタンパク質に対応する位置に電気泳動移動度を有するホモ二量体(homodimere)の形態で存在することを証明した(図1から図6)。このタンパク質はグリコシル化されており、便宜上これをgp80と呼ぶ。
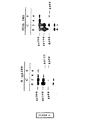
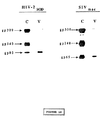
予備実験は、すべてのHIV−2陽性血清が、gp80並びにエンベロープのgag前駆物質gp140及びgp300、並びに細胞外糖タンパク質gp125を免疫沈降させ得ることを証明した。特性決定によってgp80の合成を確認するために、エンベロープタンパク質と強力に反応するHIV−2陽性血清を使用した。この血清から精製した抗体を、エンベロープ糖タンパク質精製用のイムノアフィニティカラムとして使用されるCNBrによって活性化したSepharoseカラム(HIV−2血清−Se−pharose)に結合させた。HIV−2感染細胞を[3H]グルコサミンで標識し、種々の時点(2、3、4、6及び8時間後)に感染細胞抽出物及びウイルス集塊抽出物を調製した。全部のサンプルをHIV−2血清−Sepharoseで精製し、標識タンパク質をポリアクリルアミドゲル電気泳動によって分析した(図2)。2時間後に、感染細胞中の検出可能な標識タンパク質はgp140及びgp300だけであった。gp125及びgp80は標識開始の3または4時間後に検出可能になり、また、培地から調製されたウイルス集塊中でも検出可能になった。標識開始の6から8時間後にはgp125及びgp80がはっきりと検出された。これらの結果は、gp80がウイルス粒子と関連性を有すること、及びgp80が未成熟な前駆物質の成熟産物であることを示唆する。
HIV−2のエンベロープ糖タンパク質の特性決定のために、精製した二量体前駆物質gp300に対するポリクローナル抗体を調製した。このためにgp300をまず、HIV−2血清陽性患者の抗体と共に免疫吸着剤によって部分的に精製し、次いで分離用電気泳動によって精製した。5μgのこの精製gp300調製物を5匹のマウスに10日おきに5回腹腔内投与することによってマウスを免疫した。(200μgの)ポリ(A).ポリ(U)をアジュバントとして使用し、抗原と混合して投与した(材料及び方法の項参照)。全部のマウスでgp300に対する抗体が発生した。これらの抗体はgp300に対するポリクローナル抗体(抗gp300抗体)である。図3は、1匹の免疫マウスの抗体を使用したウェスターン法による分析結果を示す。抗gp300抗体はgp300と特異反応したが、HIV−2感染細胞中に存在するgp140、gp125及びgp80とも反応した。HIV−1に感染したCEM細胞または非感染のCEM細胞中で特異信号は全く観察されなかった。60kDaのタンパク質が抗gp300抗体によって標識されることもしばしば観察されたが、これは、ウイルス感染に無関係な細胞抽出物(図3;細胞セクション「CELL」)中でも観察されいくつかの実験では全く観察されなかったので恐らく非特異的である。これらのポリクローナル抗体はまた、HIV−2感染細胞の抽出物及びウイルス集塊を使用する同様のウェスターン法テストでも使用された。抗体は細胞抽出物中のgp300、gp140及びgp80(図3、セクションHIV−2、列3)を認識した。抗体はまた、ウイルス抽出物中のgp125、gp80及びトランスメンブラン糖タンパク質であろうと推定される36kDaのタンパク質を認識した(図3、セクションHIV−2、列V)。長時間の接触(exposition)によって、細胞抽出物中のgp36の位置に対応する信号を検出することが可能であった。また、ウイルス集塊中のgp80及びgp36のレベルが細胞抽出物中でのレベルに比較してはるかに高かったことにも注目する必要がある。
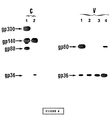
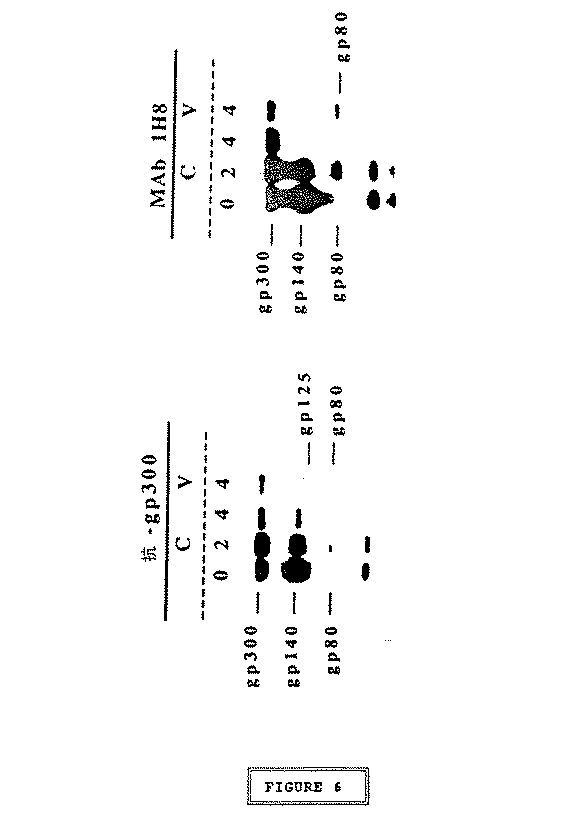
どのウイルス糖タンパク質を認識できるかを決定するために、モノクローナル抗体mAb 1H8を使用したウェスターン法テストを行なった。HIV−2感染細胞中で、mAb 1H8はgp300、gp140及びgp80を認識したが、HIV−2粒子中では主としてgp80を認識し、gp36及びgp300もわずかに認識した(図4)。ウイルス集塊中に少量のgp300が存在する理由は恐らく、gp300が細胞性タンパク質なので溶解した細胞から混入するためであろう(13)。gp36に関する信号が弱い理由は恐らく、このタンパク質のレベルが低いためであろう。mAb 1H8は細胞外糖タンパク質gp125を認識しなかった(図4)。また、HIV−1感染細胞の抽出物またはウイルス集塊のいかなるタンパク質も認識しなかった。これらの結果は、HIV−2のエンベロープ前駆物質(gp140及びgp300)及びトランスメンブラン糖タンパク質(gp36)に対して抗体mAb 1H8が特異性を有することを示す。mAb 1H8の反応性がHIV−2のトランスメンブラン糖タンパク質のアミノ酸配列579〜604に存在することを合成ペプチドp39′を用いて試験した。
ポリクローナル抗体はgp300、gp140、gp125及びgp80を免疫沈降させ、mAb 1H8はgp300、gp140及びgp80を免疫沈降させた(図6)。2つの細胞性タンパク質(60及び45kDa)も、ポリクローナル抗体及びモノクローナル抗体の双方を含む免疫複合体調製物と会合していた(図6、0時間及び2時間の列)。タンパク質60及び45kDaは、プロテインA−Sepharoseに付着することによって免疫複合体調製物中に存在していた。プロテインA−Sepharoseは、種々の抗体と共に形成される免疫複合体を回収するために使用されたものである。
[3H]グルコサミン及び[3H]フコースで代謝的に標識したHIV−2ウイルス感染細胞の抽出物を、抗体mAb 1H8及び抗gp300ポリクローナル抗体を用いて免疫沈降させた。先の結果(図3〜6)と同様に、抗gp300抗体は、糖で標識された糖タンパク質、即ちgp300、gp140、gp125及びgp80を免疫沈降させ、mAb 1H8は、gp300、gp140及びgp80を免疫沈降させた。[3H]グルコサミンはこれらの全部のタンパク質によって取り込まれていたが、[3H]フコースは概してgp125及びgp80によって取り込まれていることが判明した(図7A)。これらの実験で、[3H]フコースで標識されたgp36は長時間露光後のオートラジオグラムにも微弱にしか観察されなかった。gp80はまた、gp300、gp140及びgp125と同様に[3H]マンノースを取り込むことができる。gp80及びその他の糖タンパク質によるこのような標識糖の取込みは、抗生物質であるツニカマイシン(15)によって阻害される。ツニカマイシンは窒素に結合したタンパク質のグリコシル化を阻止する。
gp80の解離に最適な条件を知るための実験を行なった。これらの条件は、極めて生理的塩類溶液に近い培地、酸性pH、イオン性界面活性剤EDTAまたはEGTA、などに対応した。文献(13)に記載された方法を用い、弱酸性バッファ中でのインキュベーションによってgp300の解離試験を行なった。この方法は、6より小さいpH値を有するバッファによるgp80の解離には適しているが、糖タンパク質gp80の大部分が分解(degradation)した。どの実験においても、非イオン性界面活性剤Triton X−100を含む溶菌バッファを使用して感染細胞抽出物またはウイルス集塊を調製した。これらの条件ではgp300及びgp80は解離せず、イオン性界面活性剤SDSを添加した後でも解離しなかった。SDSの効果、即ちTritonの代わりにSDSを使用して抽出物を調製した場合についても試験した。HIV感染細胞を[35S]メチオニンで標識し、1%のTriton X−100または1%のSDSを含む溶菌バッファで可溶化することによって抽出物を調製した。次に、これらの抽出物を、界面活性剤を含まない溶菌バッファで10倍に希釈し、mAb 1H8を用いて免疫沈降させた。Tritonによる抽出物から得られた免疫複合体調製物は、[35S]メチオニンで標識されたバンド、即ちgp300、gp140及びgp80に対応するバンドと、gp36に対応する弱いバンド(図8、セクションCの列1)との存在を示した。更に、抽出物をSDSで調製したとき、gp300及びgp80は実質的に検出不能であったが、gp140及びgp36のレベルは増加していた(図8、セクションC、列2)。従って、イオン性界面活性剤の存在下では二量体形のgp300及びgp80は解離して夫々gp140及びgp36になる。[35S]メチオニンで標識した精製gp300は解離によってgp140だけを産生した(13)。従ってgp36はgp80の解離後にのみ存在する。標識されたタンパク質gp300及びgp80が解離タンパク質から全く回収されなくなると、SDSの存在下ではタンパク質の分解(degradation)が生じることが観察された(図8、セクションC)。200単位/mlのアプロチニン及び0.2mMのPMSFの存在は、SDSとのインキュベーション中のかかる分解(degradation)を妨害しなかった。二量体形のタンパク質がタンパク質分解に抵抗するコンホーメーションを有するとも考えられる。gp300及びgp80の解離はタンパク分解部位をアクセス可能にするコンホーメーション的修飾を生じる。
トランスメンブラン糖タンパク質がSIVサンプル中で二量体形で検出されるか否かを試験した。
gp65はSIVのウイルス粒子と会合していた(図10)。
二量体形タンパク質(gp300及びgp80)の解離は弱酸性pHで生じ得る。従って、gp140の二量体化はpH依存性であり、前駆物質gp140の2分子の融合に有利な小胞体のコンパートメントで生じると推定される。
Claims (9)
- HIV−2型レトロウイルスに感染した細胞中に存在するgp300、gp140、gp125およびgp80を特異的に認識し、且つHIV−2型のレトロウイルスの抽出物中に存在するgp125、gp80およびgp36を特異的に認識するが、健常細胞またはHIV−1型レトロウイルスに感染した細胞中に存在するタンパク質または糖タンパク質を認識しないことを特徴とするポリクローナル抗体。
- 糖タンパク質gp80と特異的に反応し、HIV−1型レトロウイルスに感染した細胞のタンパク質および糖タンパク質またはHIV−1のウイルス集塊とは反応しないことを特徴とするモノクローナル抗体。
- 更にHIV−2の糖タンパク質gp300、gp140およびgp36を認識することを特徴とする請求項2に記載のモノクローナル抗体。
- 請求項2または3に記載されたモノクローナル抗体を産生するハイブリドーマ。
- 請求項1乃至3のいずれかに記載のモノクローナルまたはポリクローナル抗体の製造方法であって、配列VTAIEKYLQDQARLNSWGCAFRQVCHを含むペプチドで非ヒト動物を免疫することを含み、当該モノクローナルまたはポリクローナル抗体が糖タンパク質gp80と反応し、当該糖タンパク質gp80が、
a)約80kDaの分子量を有し、
b)ヒトレトロウイルスHIV−2の糖タンパク質gp300に対するポリクローナル抗体によって認識され、
c)ヒトにおいてSLAまたはAIDSの原因となり得るHIV−2型のヒトレトロウイルスのゲノムにコードされたエンベロープのトランスメンブラン糖タンパク質、gp36の二量体形態の結合体から成る、
との特性を有することを特徴とする前記方法。 - a)HIV−2に感染した細胞の抽出物からHIV−2のエンベロープの前駆体gp300糖タンパク質を精製する工程、
b)工程a)で精製したエンベロープの糖タンパク質の前駆体gp300で非ヒト動物を免疫する工程、および
c)ポリクローナル抗体を含む腹水を採取する工程を含む、請求項1に記載のポリクローナル抗体の製造方法。 - a)HIV−2型のウイルス粒子を溶解する工程、
b)工程a)で得られたウイルス抽出物中に含まれる糖タンパク質をアフィニティークロマトグラフィーによって精製する工程、
c)工程b)において精製した糖タンパク質で非ヒト動物を免疫する工程、
d)免疫した動物から採取した脾細胞をミエローマと細胞融合してハイブリドーマを作製する工程、
e)HIV−2のgp80糖タンパク質と特異的に反応し、HIV−1レトロウイルスに感染した細胞のタンパク質および糖タンパク質またはHIV−1ウイルスの集塊とは反応しないモノクローナル抗体を分泌するハイブリドーマの存在を検出する工程、
f)工程e)で検出されたハイブリドーマを培養する工程、および
g)工程e)で検出されたハイブリドーマによって分泌されたモノクローナル抗体を採取する工程を含む、請求項2に記載のモノクローナル抗体の製造方法。 - a)HIV−2型のウイルス粒子を溶解する工程、
b)工程a)で得られたウイルス抽出物中に含まれる糖タンパク質をアフィニティークロマトグラフィーによって精製する工程、
c)工程b)において精製した糖タンパク質で非ヒト動物を免疫する工程、
d)免疫した動物から採取した脾細胞をミエローマと細胞融合してハイブリドーマを作製する工程、
e)HIV−2のトランスメンブレン糖タンパク質のアミノ酸579−604(VTAIEKYLQDQARLNSWGCAFRQVCH)の配列と特異的に反応するモノクローナル抗体を分泌するハイブリドーマの存在を検出する工程、
f)工程e)で検出されたハイブリドーマを培養する工程、および
g)工程e)で検出されたハイブリドーマによって分泌されたモノクローナル抗体を採取する工程を含む、請求項2または3に記載されたモノクローナル抗体の製造方法。 - −タンパク質が利用可能になるよう生物サンプルをin vitro処理する工程、および
−請求項1に記載のポリクローナル抗体または請求項2もしくは3に記載のモノクローナル抗体を用いる免疫学的試験によってタンパク質gp80の存在を検出する工程を特徴とする、生物サンプル中におけるレトロウイルスHIV−2による感染を検出する方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR8906322A FR2646854A1 (fr) | 1989-05-12 | 1989-05-12 | Antigenes de la glycoproteine transmembranaire d'enveloppe d'un retrovirus humain du type hiv-2 antigenes presentant avec eux une parente immunologique |
| US07/356,459 US5208321A (en) | 1988-06-09 | 1989-05-25 | HIV-2 transmembrane glycoprotein homodimer (GP 80) |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004371350A Division JP3833681B2 (ja) | 1989-05-12 | 2004-12-22 | Hiv−2型ヒトレトロウイルスのトランスメンブランエンベロープ糖タンパク質の抗原、及び、該抗原に免疫類似性を有する抗原 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007313383A Division JP4423374B2 (ja) | 1989-05-12 | 2007-12-04 | Hiv−2型ヒトレトロウイルスのトランスメンブランエンベロープ糖タンパク質の抗原、及び、該抗原に免疫類似性を有する抗原 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006213702A JP2006213702A (ja) | 2006-08-17 |
| JP4174591B2 true JP4174591B2 (ja) | 2008-11-05 |
Family
ID=26227325
Family Applications (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP50772690A Expired - Lifetime JP3534746B2 (ja) | 1989-05-12 | 1990-05-11 | Hiv―2型ヒトレトロウイルスのトランスメンブランエンベロープ糖タンパク質の抗原、及び、該抗原に免疫類似性を有する抗原 |
| JP2002227835A Withdrawn JP2003146999A (ja) | 1989-05-12 | 2002-08-05 | Hiv−2型ヒトレトロウイルスのトランスメンブランエンベロープ糖タンパク質の抗原、及び、該抗原に免疫類似性を有する抗原 |
| JP2004371350A Expired - Lifetime JP3833681B2 (ja) | 1989-05-12 | 2004-12-22 | Hiv−2型ヒトレトロウイルスのトランスメンブランエンベロープ糖タンパク質の抗原、及び、該抗原に免疫類似性を有する抗原 |
| JP2005375317A Expired - Lifetime JP4174591B2 (ja) | 1989-05-12 | 2005-12-27 | Hiv−2型ヒトレトロウイルスのトランスメンブランエンベロープ糖タンパク質の抗原、及び、該抗原に免疫類似性を有する抗原 |
| JP2007313383A Expired - Lifetime JP4423374B2 (ja) | 1989-05-12 | 2007-12-04 | Hiv−2型ヒトレトロウイルスのトランスメンブランエンベロープ糖タンパク質の抗原、及び、該抗原に免疫類似性を有する抗原 |
Family Applications Before (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP50772690A Expired - Lifetime JP3534746B2 (ja) | 1989-05-12 | 1990-05-11 | Hiv―2型ヒトレトロウイルスのトランスメンブランエンベロープ糖タンパク質の抗原、及び、該抗原に免疫類似性を有する抗原 |
| JP2002227835A Withdrawn JP2003146999A (ja) | 1989-05-12 | 2002-08-05 | Hiv−2型ヒトレトロウイルスのトランスメンブランエンベロープ糖タンパク質の抗原、及び、該抗原に免疫類似性を有する抗原 |
| JP2004371350A Expired - Lifetime JP3833681B2 (ja) | 1989-05-12 | 2004-12-22 | Hiv−2型ヒトレトロウイルスのトランスメンブランエンベロープ糖タンパク質の抗原、及び、該抗原に免疫類似性を有する抗原 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007313383A Expired - Lifetime JP4423374B2 (ja) | 1989-05-12 | 2007-12-04 | Hiv−2型ヒトレトロウイルスのトランスメンブランエンベロープ糖タンパク質の抗原、及び、該抗原に免疫類似性を有する抗原 |
Country Status (11)
| Country | Link |
|---|---|
| EP (1) | EP0424519B1 (ja) |
| JP (5) | JP3534746B2 (ja) |
| AT (1) | ATE136789T1 (ja) |
| CA (1) | CA2032505C (ja) |
| DE (1) | DE69026569T2 (ja) |
| DK (1) | DK0424519T3 (ja) |
| ES (1) | ES2085908T3 (ja) |
| HK (1) | HK219796A (ja) |
| OA (1) | OA09634A (ja) |
| SG (1) | SG48125A1 (ja) |
| WO (1) | WO1990013314A2 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5256561A (en) * | 1991-12-20 | 1993-10-26 | Abbott Laboratories | Monoclonal antibody to HIV-2 and uses thereof |
| FR2692898B1 (fr) * | 1992-06-30 | 1995-06-02 | Centre Nat Rech Scient | Procédé d'obtention de protéines membranaires, et utilisation de ces protéines dans un but de diagnostic ou de vaccination. |
| JP2013040148A (ja) * | 2011-08-19 | 2013-02-28 | Asahi Kasei Corp | シアリルオリゴ糖ペプチド固定化ビーズ |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| OA08468A (fr) * | 1986-01-22 | 1988-07-29 | Pasteur Institut | Retrovirus du type HIV-2 susceptible de provoquer le SIDA et ses constituants antigéniques et nucléiques. |
| EP0269520A3 (fr) * | 1986-11-21 | 1988-08-24 | Institut Pasteur | Rétrovirus du type HIV-2 susceptible de provoquer le sida, et ses constituants antigéniques et nucléiques |
| DE3855947T2 (de) * | 1987-01-16 | 1997-12-11 | Pasteur Institut | Peptide mit den immunologischen Eigenschaften von HIV-2 |
| FR2620030B1 (fr) * | 1987-09-07 | 1990-03-23 | Transgene Sa | Vecteur d'expression des proteines du virus hiv-2, un agent causal du sida, culture cellulaire infectee ou transformee par ce vecteur, proteines obtenues, vaccin et anticorps obtenus |
-
1990
- 1990-05-11 ES ES90908240T patent/ES2085908T3/es not_active Expired - Lifetime
- 1990-05-11 DK DK90908240.6T patent/DK0424519T3/da active
- 1990-05-11 CA CA002032505A patent/CA2032505C/fr not_active Expired - Lifetime
- 1990-05-11 JP JP50772690A patent/JP3534746B2/ja not_active Expired - Lifetime
- 1990-05-11 SG SG1996007178A patent/SG48125A1/en unknown
- 1990-05-11 EP EP90908240A patent/EP0424519B1/fr not_active Expired - Lifetime
- 1990-05-11 AT AT90908240T patent/ATE136789T1/de not_active IP Right Cessation
- 1990-05-11 DE DE69026569T patent/DE69026569T2/de not_active Expired - Lifetime
- 1990-05-11 WO PCT/FR1990/000336 patent/WO1990013314A2/fr not_active Ceased
-
1991
- 1991-01-11 OA OA59935A patent/OA09634A/fr unknown
-
1996
- 1996-12-24 HK HK219796A patent/HK219796A/xx not_active IP Right Cessation
-
2002
- 2002-08-05 JP JP2002227835A patent/JP2003146999A/ja not_active Withdrawn
-
2004
- 2004-12-22 JP JP2004371350A patent/JP3833681B2/ja not_active Expired - Lifetime
-
2005
- 2005-12-27 JP JP2005375317A patent/JP4174591B2/ja not_active Expired - Lifetime
-
2007
- 2007-12-04 JP JP2007313383A patent/JP4423374B2/ja not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| JP3833681B2 (ja) | 2006-10-18 |
| JP2006213702A (ja) | 2006-08-17 |
| DE69026569T2 (de) | 1996-09-05 |
| JPH03506042A (ja) | 1991-12-26 |
| DK0424519T3 (da) | 1996-05-13 |
| CA2032505C (fr) | 2001-07-10 |
| EP0424519B1 (fr) | 1996-04-17 |
| ATE136789T1 (de) | 1996-05-15 |
| SG48125A1 (en) | 1998-04-17 |
| DE69026569D1 (de) | 1996-05-23 |
| CA2032505A1 (fr) | 1990-11-13 |
| OA09634A (fr) | 1993-04-30 |
| ES2085908T3 (es) | 1996-06-16 |
| WO1990013314A3 (fr) | 1990-12-27 |
| EP0424519A1 (fr) | 1991-05-02 |
| JP2008156350A (ja) | 2008-07-10 |
| WO1990013314A2 (fr) | 1990-11-15 |
| HK219796A (en) | 1997-01-03 |
| JP4423374B2 (ja) | 2010-03-03 |
| JP2005170949A (ja) | 2005-06-30 |
| JP3534746B2 (ja) | 2004-06-07 |
| JP2003146999A (ja) | 2003-05-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US6335017B1 (en) | Compositions and methods for treating viral infections | |
| US6261571B1 (en) | Immunogenic compositions comprising dimeric forms of the human immunodeficiency virus type 2 (HIV-2) and simian immunodeficiency virus (SIV) envelope glycoproteins | |
| JPH02160800A (ja) | ヒト免疫不全ウイルス(HIV)env‐コードペプチド | |
| US5777074A (en) | Human monoclonal antibodies directed against the transmembrane glycoprotein (GP41) of human immunodeficiency virus-1 (HIV-1) | |
| GB2196634A (en) | Monoclonal antibodies to HIV and related peptides | |
| US6008044A (en) | Human monoclonal antibodies directed against the transmembrane glycoprotein (gp41) of human immunodeficiency virus-1 (HIV-1) and detection of antibodies against epitope (GCSGKLIC) | |
| JP4423374B2 (ja) | Hiv−2型ヒトレトロウイルスのトランスメンブランエンベロープ糖タンパク質の抗原、及び、該抗原に免疫類似性を有する抗原 | |
| US6083504A (en) | Human monoclonal antibodies directed against the transmembrane glycoprotein (GP41) of human immunodeficiency virus-1 (HIV-1) | |
| EP0400245B1 (en) | Proteins and glycoproteins of the HIV-2 EHO retrovirus antibodies directed against them - application for the diagnosis | |
| EP0512023A1 (en) | Medicaments and methods for treating aids and arc employing anti-carbohydrate antibodies and carbohydrate antigens | |
| JP2007534615A (ja) | Hiv免疫原性複合体 | |
| HK212896A (en) | Proteins and glycoproteins of the hiv-2 eho retrovirus antibodies directed against them - application for the diagnosis | |
| JPH10509135A (ja) | 抗−gp48抗体の能動的誘導もしくは受動免疫、および単離されたgp48タンパク | |
| FR2646854A1 (fr) | Antigenes de la glycoproteine transmembranaire d'enveloppe d'un retrovirus humain du type hiv-2 antigenes presentant avec eux une parente immunologique | |
| JPH02119791A (ja) | ヒトレトロウィルスhiv―2の外被糖タンパク質の前駆抗原及びそれと免疫学的同族性をもつ抗原、ならびにこれらの抗原の調製方法及び診断への応用 | |
| AU2006200455A1 (en) | Compositions and methods for treating viral infections | |
| MXPA99003380A (en) | Compositions and methods for treating viral infections | |
| AU6655300A (en) | Compositions and methods for treating infections | |
| AU2004208648A1 (en) | Compositions and methods for treating infections |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A072 | Dismissal of procedure [no reply to invitation to correct request for examination] |
Free format text: JAPANESE INTERMEDIATE CODE: A072 Effective date: 20060822 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20061024 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20070117 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20070123 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070423 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070605 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20070829 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20070903 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20071204 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20080108 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080502 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20080407 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080522 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20080612 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20080701 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20080724 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100829 Year of fee payment: 2 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| EXPY | Cancellation because of completion of term | ||
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100829 Year of fee payment: 2 |