JP3969831B2 - ハイドロキシプロリン誘導体 - Google Patents
ハイドロキシプロリン誘導体 Download PDFInfo
- Publication number
- JP3969831B2 JP3969831B2 JP08796098A JP8796098A JP3969831B2 JP 3969831 B2 JP3969831 B2 JP 3969831B2 JP 08796098 A JP08796098 A JP 08796098A JP 8796098 A JP8796098 A JP 8796098A JP 3969831 B2 JP3969831 B2 JP 3969831B2
- Authority
- JP
- Japan
- Prior art keywords
- compound
- group
- liver
- present
- activity
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- UAMRFGMSFLBFBA-QSHYLMEWSA-N C=CC(C(N(C1)C2C[C@H]1O)O)NC2=O Chemical compound C=CC(C(N(C1)C2C[C@H]1O)O)NC2=O UAMRFGMSFLBFBA-QSHYLMEWSA-N 0.000 description 1
Images
Landscapes
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
Description
【発明の属する技術分野】
本発明はハイドロキシプロリン誘導体又はその塩及び当該化合物を有効成分として含有する臓器・組織障害治療剤に関する。
【0002】
【従来の技術】
従来、ヒト胎盤及びその水解物には種々の生理活性物質が含まれていることが知られている。例えば、フィラトフ法(Filatov's method)はヒト胎盤水解物を用いた組織治療法で、血管壁の弾力線維及び筋線維を再生招来させるといわれており、喘息、リウマチ、肝炎などの慢性難治性疾患の治療又は老化防止などに用いられている。
【0003】
【発明が解決しようとする課題】
上述のように、ヒト胎盤水解物には生理活性物質が含まれていると推察されるが、その本態は不明である。このような問題から、本発明者等は、ヒト胎盤水解物中の生理活性物質を同定するために、ヒト胎盤水解物を分離・精製したところ、細胞増殖作用、細胞保護作用などを有するハイドロキシプロリン誘導体を見出した。本発明はかかる知見に基づいてなされたもので、本発明は細胞増殖を促進する作用を有する新規なハイドロキシプロリン誘導体及びそれを含有する臓器・組織障害治療剤を提供することを目的とする。
【0004】
【課題を解決するための手段】
上記の課題を解決するためになされた本発明の要旨は、
▲1▼下記一般式(1)、(2)又は(3)
【化2】
【0005】
(式中、Rは水素原子又はアルキル基を示し、当該アルキル基は水酸基、アミノ基、カルボキシル基、アミノカルボニル基、グアニジノ基、複素環式基、メルカプト基、アルキルチオ基又は水酸基を有することのあるフェニル基で置換されていてもよい)
で表されるハイドロキシプロリン誘導体又はその塩;
▲2▼Rがハイドロキシメチル基である上記▲1▼記載の化合物;
▲3▼上記▲1▼又は▲2▼記載の化合物を有効成分として含有する臓器・組織障害治療剤;
▲4▼肝障害治療剤である上記▲3▼記載の臓器・組織障害治療剤;
である。
【0006】
上記の一般式(1)、(2)及び(3)で表される化合物において、Rは水素原子又はアルキル基である。当該アルキル基としては炭素数1〜7の低級アルキル基が好ましく、直鎖型、分岐型のいずれでもよい。具体的にはメチル、エチル、n−プロピル、iso−プロピル、n−ブチル、iso−ブチル、tert−ブチル、n−ペンチル、n−ヘキシル、1,2,2−トリメチルプロピル、2−メチルプロピル、1,1−ジメチルプロピル等が例示される。
【0007】
かかるアルキル基は置換基として、水酸基、アミノ基、カルボキシル基、アミノカルボニル基、グアニジノ基、複素環式基、メルカプト基、アルキルチオ基又は水酸基を有することのあるフェニル基を有していてもよく、複素環式基としては例えばイミダゾリル、インドリルなどが例示され、アルキルチオ基としては例えばメチルチオ、エチルチオなどが例示され、水酸基を有することのあるフェニル基としてはフェニル、4−ハイドロキシフェニルなどが例示される。
【0008】
一般式(1)、(2)及び(3)で表される化合物の塩としては、薬理学的に許容され得る無毒性のものであれば特に制限されず、例えば、酸付加塩としては、無機酸との塩(塩酸塩、臭化水素酸塩、リン酸塩、硫酸塩等)、有機酸との塩(酢酸塩、コハク酸塩、マレイン酸塩、フマール酸塩、リンゴ酸塩、酒石酸塩等)などが挙げられ、塩基付加塩としては、無機塩基との塩(例えば、ナトリウム塩、カリウム塩、カルシウム塩、アンモニウム塩等)、有機塩基との塩(例えば、トリエチルアミン塩、アルギニンとの塩等)が挙げられる。
一般式(1)、(2)及び(3)で表される化合物は分子内に不斉炭素及び環構造を有しており、当該不斉炭素及び環構造に基づく光学異性体、幾何異性体、それらの混合物の全てを本発明の化合物は包含するものとする。
【0009】
一般式(1)、(2)及び(3)で表される化合物は、後述の方法によりヒト胎盤水解物から得ることもできるが、一般的には化学的合成法により調製される。かかる調製法としては種々の方法により合成することができ、例えば、下記式に示される方法により得ることができる。
【0010】
【0011】
(反応工程式−1及び2において、Rは前記と同じ、Xは水酸基の保護基、Yはカルボキシル基の保護基、Zはアミノ基の保護基を示す)
【0012】
上記の反応工程式−1において、一般式(6)で表される化合物は、水酸基及びカルボキシル基をそれぞれ慣用の保護基で保護したハイドロキシプロリン(4)と慣用の保護基でアミノ基を保護したα−アミノ酸化合物(5)とを縮合することにより得ることができる。かかる縮合は、ジシクロヘキシルカルボジイミド等の縮合剤を用いる方法、活性エステル化法などの慣用のアミド化法に準じて行うことができる。また、保護基を有する化合物(4)及び(5)も常法に準じて調製することができる。なお、上記のα−アミノ酸化合物としては、例えば、セリン、アラニン、アルギニン、アスパラギン酸、アスパラギン、グルタミン酸、グルタミン、システイン、グリシン、ヒスチジン、ロイシン、イソロイシン、リシン、メチオニン、バリン、オルニチン、トレオニン、フェニルアラニン、チロシン、トリプトファンなどが例示される。
【0013】
かくして得られた一般式(6)で表される化合物は、常法に準じて保護基の脱離反応に付すことにより一般式(1)で表される本発明の化合物が得られる。
また、一般式(6)で表される化合物を、まずカルボキシル基の保護基及びアミノ基の保護基の脱離反応に付し、次いで上記のアミド化法に準じて環化し、さらに水酸基の保護基の脱離反応に付すことにより一般式(3)で表される本発明の化合物が得られる。
【0014】
一般式(2)及び(3)で表される化合物は、反応工程式−2の方法により、一般式(7)で表される化合物と一般式(8)で表される化合物から一般式(9)で表される化合物を得、この化合物を反抗工程式−1と同様にして処理することにより得ることができる。この反応工程式のアミド化反応、環化反応などは反応工程式−1と同様にして行うことができる。
なお、反応工程式−1及び2において、使用するアミド化反応、環化反応の方法によっては、水酸基を保護することなく反応を行うこともできる。
【0015】
本発明の一般式(1)、(2)及び(3)で表される化合物は後記の実施例に示されるように細胞増殖活性及び細胞保護作用を有し、障害を受けた臓器や組織の修復、再生に有用であり、特に肝臓(肝細胞)に対して顕著な効果を奏する。具体的に本発明の化合物が奏し、期待される効果を例示すると、例えば、
▲1▼肝からの逸脱酵素(例えば、GOT、GPT、γ−GTP、ALP、LAP、LDH等)の抑制、
▲2▼ビリルビンの肝取り込み促進、
▲3▼肝の保護(肝実質細胞の変性・壊死の防止及び抑制)、
▲4▼肝線維化の防止、肝線維組織増殖抑制、増殖した肝線維組織・間質結合織の吸収促進、
▲5▼抗脂肝作用(肝への脂肪沈着の減少、肝細胞の脂質変性の改善)、
▲6▼組織呼吸賦活作用(肝のコハク酸脱水素酵素の活性の賦活、組織呼吸の促進、肝細胞の新陳代謝の活性化)、
▲7▼肝細胞膜の安定化作用、
などが挙げられる。
【0016】
本発明の臓器・組織障害治療剤は、上述の作用・効果に基づくもので、一般式(1)、(2)及び(3)で表される化合物又はそれらの塩を有効成分として含有するものである。特に、肝障害に基づく疾患に好適に利用される。より具体的には、肝炎から肝硬変(甲型及び乙型肝硬変)への進行の抑制、肝硬変から肝癌への進行の抑制、肝線維形成の抑制、脂肪肝の抑制などが例示される。
【0017】
本発明の治療剤は、一般式(1)、(2)若しくは(3)で表される化合物又はそれらの塩を、適宜の薬理的に許容される添加剤(例えば、担体、賦形剤、希釈剤等)などの製薬上必要な成分と混合し、粉末、顆粒、錠剤、カプセル剤、注射剤、軟膏などの態様の医薬製剤に調製され、当該製剤は経口的又は非経口的に投与される。上記製剤中に、一般式(1)、(2)若しくは(3)で表される化合物又はそれらの塩はその有効量が配合される。投与量は投与ルート、症状、患者の体重あるいは年令などによって適宜調整される。
【0018】
【発明の効果】
本発明の化合物は細胞増殖活性、細胞保護作用などを有し、障害を受けた臓器や組織の修復、再生などに有用である。本発明の臓器・組織障害治療剤は、上記の特性を有する本発明の化合物を有効成分とするもので、各種臓器・組織の障害、特に肝障害の治療に有用である。
【0019】
【実施例】
以下、実施例及び試験例に基づいて本発明をより詳細に説明するが、本発明はこれらの例に限定されるものではない。
なお、以下の実験に使用した材料、装置は以下のとおりである。
▲1▼ヒト胎盤水解物
ヒト胎盤水解物は、ラエンネック(商品名、日本生物製剤社製)を使用した。なお、ラエンネックはヒト胎盤をアセトンで脱脂し、塩酸で加水分解して調製した製剤である。
▲2▼高速液体クロマトグラフィー(HPLC)分析条件
HPLCによる分析条件は以下のとおりである。
カラム:COSMOSIL 5C18-AR (4.6 I.D. x 150 mm)
検出波長:210,260nm
流速:1.0ml/min
温度:室温(26℃)
三次元クロマト:Waters 991J フォトダイオードアレイ検出器
【0020】
▲3▼分析機器
1H,13C−NMR:JEOL Lamdba 500
旋光度:JASCO DIP-140
FAB−MS:JEOL HX-110, マトリックス(グリセロール)
HR−FAB−MS:JEOL HX-110, マトリックス(トリエチレングリコール)
ペプチドシーケンサー:Model 470-A(アプライド バイオシステム社製)
アミノ酸分析器:835型
▲4▼細胞増殖活性の測定法
試料の細胞増殖活性は、常法に準じて、BHK(baby hamster kidney)−21細胞に対する増殖活性を測定することにより行った(Planta Med. 62, 115-118, 1996など参照)。
より詳細には、BHK−21細胞(1×104個)を5%ウシ胎児血清と2mMグルタミンを含むイーグル最小限培地(Eagle's minimum essential medium)に、試料(μg/ml培地)とともに37℃、pH7.2、5%CO2/空気で3日間培養し、それをトリプシンと0.02%EDTAで処理して細胞を取り出して、その細胞の一定量を0.4%トリパンブルーで染色後、生細胞数をカウントし、対照(medium control)の細胞数を100%としてそれぞれの活性について比較検討した。
【0021】
実施例1
ヒト胎盤水解物からの本発明の化合物の単離・精製
ラエンネックの水溶液をHPLCにより3種の溶離液を用いて3つの画分(Fr.1〜3)に分離した。その結果を図1Aに示す。
得られたFr.1〜3について、BHK−21細胞に対する細胞増殖活性を測定した。その結果を図1Bに示す。図1Bに示されるように、Fr.1に増殖活性が認められた。
【0022】
上記でFr.1に活性が認められたので、当該画分を再度HPLCに付し、水を溶離液に用いて溶出順に10の画分(Fr.1〜10)に分離した。その結果を図2Aに示す。
得られたFr.1〜10について、BHK−21細胞に対する細胞増殖活性を測定した。その結果を図2Bに示す。図2Bに示されるように、Fr.1〜3に低濃度(Dose:6.25, 12.5, 25μg)で増殖活性が認められた。
【0023】
上記でFr.1〜3に活性が認められたので、当該画分を更にHPLCに付し、10-3M酢酸を溶離液に用いて3つの画分(Fr1−3−1〜1−3−3)に分離した。その結果を図3Aに示す。
得られた3つの画分について、BHK−21細胞に対する細胞増殖活性を測定した。その結果を図3Bに示す。図3Bに示されるように、Fr.1−3−3に低濃度(Dose:6.25, 12.5, 25μg)で増殖活性が認められた。
【0024】
以上の結果に基づき、HPLCでモニタリングしながら、細胞増殖活性の認められた保持時間3.1〜3.3分の画分をラエンネック(凍結乾燥:62.7g)からCosmosil 75C18-PREP(カラム:4.6 I.D. x 150 mm,水で溶出)を用いて分取し(9.4g)、次いでSephadex LH-20カラムクロマト(カラム:3 I.D. x 85 mm,水で溶出)で分離し、化合物1(6.2mg)と化合物2(7.6mg)が得られた。
上記の化合物2について、BHK−21細胞に対する細胞増殖活性を測定した。その結果を図4に示す。図4に示されるように、化合物2には細胞増殖活性が認められた。なお、上記の化合物1は機器分析の結果、ウラシルであることが判明した。
【0025】
そこで、化合物2について分析したところ、以下の結果が得られた。
(1)ニンヒドリン反応陽性;
(2)アミノ酸分析からハイドロキシプロリンとセリン(1:1)からなるペプチド;
(3)ペプチドシーケンサーによるアミノ酸配位の検討から、N末端はブロックされていること;
(4)酸加水分解物のChiral HPLC分析により、L−セリン及びトランス−ハイドロキシプロリンを同定;
(5)これらの結果から、化合物2は下記の一般式(3−1)で示される3’−ハイドロキシメチル−4−ハイドロキシピロリド[1,2−f]2’,5’−ピペラジンジオン(3'-Hydroxymethyl-4-hydroxypyrrolido[1,2-f]2',5'-piperazinedione)であると推定された。
【0026】
【0027】
更に、化合物2の機器分析の測定結果は以下のとおりであり、これらの結果は何れも上記の構造式を支持するものであった。
▲6▼FAB−MS m/z 201[M+1]+
▲8▼1H−NMR(DMSO−d6):δ 1.86 (1H, dd, J=12.5, 6.5), 2.05 (1H, dd, J=12.5, 5.0), 3.20 (1H, dd, J=12.5), 3.56 (1H, dd, J=12.5, 4.0), 3.68 (1H, dd, J=10.0, 5.2), 3.70 (1H, dd, J=10.5, 5.2), 4.07 (1H, t, J=4.0), 4.29 (1H, t, J=5.2), 4.36 (1H, dd, J=5.0, 6.0)
▲9▼13C−NMR(DMSO−d6):δ 56.8 (C-2), 37.2 (C-3), 66.7 (C-4), 53.7 (C-5), 56.7 (C-3'), 59.8 (-CH2OH)
【0028】
一般式(1)又は(2)で表される化合物において、Rがハイドロキシメチルの化合物を別途合成し、これらの化合物のBHK−21細胞に対する細胞増殖活性を測定したところ、何れの化合物にも細胞増殖活性が認められた。
【0029】
試験例1
ANIT処理ラット血清中肝逸脱酵素の測定
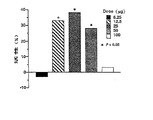
α-ナフチルイソチオシアネート(α-naphthylisothiocyanate、ANIT)50mg/kg(溶媒:オリーブ油)をラット腹腔内に投与する前0.5時間及び投与後8、24、36、46時間に、本発明のハイドロキシプロリン誘導体1.36又は6.25mg/kg(溶媒:生理食塩水)を陰茎静脈(0.25ml、iv)より、6.25又は25mg/kgを経口(2.0ml、po)より投与した。ANIT処理後47時間に腹大動脈より血液を採集し、遠心(3500rpm、15分)した後、採集された血清中の肝逸脱酵素GPT(glutamic-pyruvic transaminase)、ALP(alkalinephosphatase)、LAP(lactate dehydrogenase)及びγ−GTP(γ-glutamyltranferase)濃度並びにビリルビン(bilirubin、BIL)濃度を各測定キット(和光純薬社製)を用いて測定した。なお、本発明のハイドロキシプロリン誘導体として、一般式(3)においてRがハイドロキシメチルの化合物(Hyp Serという、以下同様)と一般式(2)においてRがハイドロキシメチルの化合物(Hyp Ser OHという、以下同様)を用いた。
測定結果を図5(GPT)、図6(ALP)、図7(LAP)、図8(γ−GTP)及び図9(BIL)に示す。図中の測定値は一群3匹の平均値±標準誤差である。有意差検定はstudent t-testにより行い、ANITに対して*はp<0.05、**はp<0.01を意味する。
図に示されるように、本発明のハイドロキシプロリン誘導体を投与することにより、血中肝逸脱酵素量が低減し、本発明のハイドロキシプロリン誘導体は肝保護作用を有することが判明した。
【0030】
試験例2
四塩化炭素 ( CCl 4 ) 処理した初代培養ラット肝細胞培地における肝逸脱酵素の測定
中村らの方法(「初代培養肝細胞実験法」、学会出版センター発行、1987、pp. 29)に準じ、in situ collagenase灌流法により、肝細胞を分離した。得られた遊離肝細胞(生存率88−93%)を培地(WE培地、5%牛血清を含む)で2.5×105細胞/mlに希釈し、コーニング社製24穴培養プレートに0.5mlを加え、37℃で24時間培養を行った。その後無血清培地に交換し、5mMの四塩化炭素(最後濃度)を加え、各濃度のハイドロキシプロリン誘導体(Hyp Ser及びHyp Ser OH)を添加し、さらに24時間培養した。その後、培地を収集し、培地中におけるGOT(glutamic-oxaloacetic transaminase)及びLDH(lactic dehydrogenase)濃度を酵素測定キット(和光純薬社製)を用い測定した。なお、比較例として、肝細胞に対して増殖・保護作用をすることが知られている肝実質細胞増殖因子、HGF)を用い、同様な試験を行った。
試験結果を図10(GOT)及び図11(LDH)に示す。図中の測定値は3サンプルの平均値±標準誤差である。有意差検定はstudent t-testにより行い、コントロールに対して*はp<0.05、**はp<0.01を意味する。
図10及び11に示されるように、本発明のハイドロキシプロリン誘導体を添加することにより、肝逸脱酵素量が低減し、本発明のハイドロキシプロリン誘導体は肝細胞保護作用を有することが判明した。
【図面の簡単な説明】
【図1】ヒト胎盤水解物(ラエンネック)をHPLCで分画した結果(A)及び各画分の細胞増殖活性(B)を示す図である。
【図2】Fr.1をHPLCで分画した結果(A)及び各画分の細胞増殖活性(B)を示す図である。
【図3】Fr.1−3をHPLCで分画した結果(A)及び各画分の細胞増殖活性(B)を示す図である。
【図4】本発明の化合物のBHK−21細胞に対する細胞増殖活性を示す図である。
【図5】本発明の化合物を投与したANIT処理ラットの血清中肝逸脱酵素(GPT)の測定結果を示す図である。
【図6】本発明の化合物を投与したANIT処理ラットの血清中肝逸脱酵素(ALP)の測定結果を示す図である。
【図7】本発明の化合物を投与したANIT処理ラットの血清中肝逸脱酵素(LAP)の測定結果を示す図である。
【図8】本発明の化合物を投与したANIT処理ラットの血清中肝逸脱酵素(γ−GTP)の測定結果を示す図である。
【図9】本発明の化合物を投与したANIT処理ラットの血清中ビリルビン(BIL)の測定結果を示す図である。
【図10】四塩化炭素処理した初代培養ラット肝細胞培地に本発明の化合物又はHGFを添加したときの肝逸脱酵素(GOT)の測定結果を示す図である。
【図11】四塩化炭素処理した初代培養ラット肝細胞培地に本発明の化合物又はHGFを添加したときの肝逸脱酵素(LDH)の測定結果を示す図である。
Claims (3)
Priority Applications (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP08796098A JP3969831B2 (ja) | 1997-03-15 | 1998-03-16 | ハイドロキシプロリン誘導体 |
| EP98941736A EP1067138B1 (en) | 1998-03-16 | 1998-09-04 | Hydroxyproline derivatives |
| CA002323808A CA2323808A1 (en) | 1998-03-16 | 1998-09-04 | Hydroxyproline derivatives |
| US09/646,297 US6635620B1 (en) | 1998-03-16 | 1998-09-04 | Hydroxyproline derivatives |
| PCT/JP1998/003993 WO1999047546A1 (fr) | 1998-03-16 | 1998-09-04 | Derives d'hydroxyproline |
| AU89984/98A AU775091B2 (en) | 1998-03-16 | 1998-09-04 | Hydroxyproline derivatives |
| DE69838303T DE69838303T2 (de) | 1998-03-16 | 1998-09-04 | Derivate hydroxyprolin |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP8223497 | 1997-03-15 | ||
| JP9-82234 | 1997-03-15 | ||
| JP08796098A JP3969831B2 (ja) | 1997-03-15 | 1998-03-16 | ハイドロキシプロリン誘導体 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH1121295A JPH1121295A (ja) | 1999-01-26 |
| JP3969831B2 true JP3969831B2 (ja) | 2007-09-05 |
Family
ID=26423246
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP08796098A Expired - Lifetime JP3969831B2 (ja) | 1997-03-15 | 1998-03-16 | ハイドロキシプロリン誘導体 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP3969831B2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014010281A1 (ja) | 2012-07-09 | 2014-01-16 | 株式会社日本生物製剤 | 眼疾患の予防・治療薬 |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001206897A (ja) * | 2000-01-26 | 2001-07-31 | Nippon Seibutsu Seizai:Kk | ハイドロキシプロリン誘導体 |
| JP4601118B2 (ja) * | 2000-04-10 | 2010-12-22 | 株式会社日本生物製剤 | 炎症性疾患治療剤 |
| JP2006176499A (ja) * | 2004-11-25 | 2006-07-06 | Nippon Seibutsu Seizai:Kk | 眼疾患治療剤 |
-
1998
- 1998-03-16 JP JP08796098A patent/JP3969831B2/ja not_active Expired - Lifetime
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014010281A1 (ja) | 2012-07-09 | 2014-01-16 | 株式会社日本生物製剤 | 眼疾患の予防・治療薬 |
| KR20150100603A (ko) | 2012-07-09 | 2015-09-02 | 가부시끼가이샤니혼세이부쯔세이자이 | 안질환의 예방·치료약 |
| US9555028B2 (en) | 2012-07-09 | 2017-01-31 | Japan Bio Products Co., Ltd | Drug for preventing/treating ocular disease |
Also Published As
| Publication number | Publication date |
|---|---|
| JPH1121295A (ja) | 1999-01-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4691419B2 (ja) | 置換イソキノリン−3−カルボキサミド、その製法および薬剤としてのその使用 | |
| AU651196B2 (en) | Amidinophenylalanine derivatives, a process for the preparation thereof, use thereof and agents containing these as anticoagulants | |
| US5686423A (en) | Di-and tri-peptide mimetic compounds for Parkinson's disease | |
| JPH05500061A (ja) | 甲状腺刺激ホルモン放出ホルモンのプロドラッグ誘導体 | |
| JP3969831B2 (ja) | ハイドロキシプロリン誘導体 | |
| JP7132855B2 (ja) | ペプチドエポキシケトン免疫プロテアソーム阻害剤の結晶塩 | |
| US6635620B1 (en) | Hydroxyproline derivatives | |
| CN102174084B (zh) | 胸腺素α1活性片段环肽类似物及其聚乙二醇化衍生物 | |
| JPH02270895A (ja) | T―リンパ球の成熟及びマクロファージの活性を阻害する新規ペプチド、それらを含む医薬組成物及びそれらの調製方法 | |
| JPS6033854B2 (ja) | 中枢神経系作用を有するトリペプチド誘導体およびその製法 | |
| EP0513388A1 (en) | Peptide with activity of inhibiting cancer cell infiltration, composite thereof, and cancer metastasis inhibitor | |
| EP3653639B1 (en) | Polypeptide and composition thereof for treating diseases of metabolic system | |
| AU2003231331A1 (en) | Compounds which can block the response to chemical substances or thermal stimuli or mediators of inflammation of nociceptors, production method thereof and compositions containing same | |
| RU2166957C1 (ru) | Тетрапептид, стимулирующий функциональную активность гепатоцитов, фармакологическое средство на его основе и способ его применения | |
| JP3009718B2 (ja) | 新規ペプチド、その製造法及び用途 | |
| CN116693625A (zh) | 一种长效肝炎病毒进入抑制剂 | |
| CN116621943A (zh) | 一种长效肝炎病毒进入抑制剂 | |
| CN116621944A (zh) | 一种长效肝炎病毒进入抑制剂 | |
| JP2001206897A (ja) | ハイドロキシプロリン誘導体 | |
| WO2023020485A1 (zh) | 具有新颖结构的多肽药物偶联物及其应用 | |
| JP2003192607A (ja) | 降圧ジペプチド | |
| JP3009719B2 (ja) | 新規ペプチド、その製造法及び用途 | |
| RU2297239C1 (ru) | Пептид, стимулирующий регенерацию ткани печени, фармацевтическая композиция на его основе и способ ее применения | |
| JP2965682B2 (ja) | 新規ペプチド、その製造法及び用途 | |
| CN114478709A (zh) | 一种长效肝炎病毒进入抑制剂 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20041004 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20041004 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050106 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070409 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20070525 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20070605 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100615 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110615 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120615 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120615 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130615 Year of fee payment: 6 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: R3D02 |
|
| EXPY | Cancellation because of completion of term |